Este texto não substitui o publicado no Diário Oficial da União

Secretaria de Atenção à Saúde
CONSULTA PÚBLICA Nº 1, DE 15 DE JANEIRO DE 2010
O Secretário de Atenção à Saúde, no uso de suas atribuições,
Considerando a importância do papel que desempenham os Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) para a melhoria da qualidade da atenção à saúde, para a prescrição segura e eficaz, para a atualização e democratização do conhecimento, para a melhoria da qualidade da informação prestada aos doentes e para a melhoria dos processos gerenciais dos programas assistenciais;
Considerando a necessidade de se estabelecer critérios de diagnóstico e tratamento de enfermidades e, observando ética e tecnicamente a prescrição médica, promover o uso racional dos medicamentos para o tratamento de doenças por meio de regulamentação de indicações e esquemas terapêuticos;
Considerando que os Protocolos Clínicos e Diretrizes Terapêuticas são resultado de consenso técnico-científico e são formulados dentro de rigorosos parâmetros de qualidade, precisão de indicação e posologia;
Considerando a necessidade de estabelecer mecanismos de acompanhamento de uso e de avaliação de resultados, garantindo assim a prescrição segura e eficaz;
Considerando a necessidade de se promover ampla discussão desses Protocolos Clínicos e Diretrizes Terapêuticas, possibilitando a participação efetiva, na sua formulação, da comunidade técnico-científica, associações médicas, profissionais da saúde, associações de pacientes, usuários e gestores do Sistema Único de Saúde (SUS) e da população em geral;
Considerando a necessidade de atualizar o Protocolo Clínico e Diretrizes Terapêuticas - Hepatite Autoimune, estabelecido pela Portaria SCTIE/MS nº 70, de 06 de novembro de 2006; e
Considerando a Portaria SAS/MS nº 375, de 10 de novembro de 2009, que aprova o roteiro a ser utilizado na elaboração de PCDT, no âmbito da Secretaria de Atenção à Saúde - SAS, resolve:
Art. 1º Submeter à Consulta Pública o PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS - HEPATITE AUTOIMUNE, constante do Anexo deste Ato e o Termo de Esclarecimento e Responsabilidade dele integrante.
Parágrafo único. O Protocolo Clínico e o Termo de Esclarecimento e Responsabilidade, de que trata este Artigo, encontram-se disponíveis, também, no sítio: www.saude.gov.br/sas - legislação.
Art. 2º Estabelecer o prazo de 30 (trinta) dias, a contar da data da publicação desta Consulta Pública, para que sejam apresentadas sugestões, devidamente fundamentadas, relativas ao Protocolo Clínico e Diretrizes Terapêuticas de que trata o Artigo 1º desta Consulta Pública.
§ 1º As sugestões devem ser encaminhadas, exclusivamente, para o seguinte endereço eletrônico: pcdt.consulta2010@saude.gov.br, especificando o número da Consulta Pública e o nome do Protocolo no título da mensagem;
§ 2º As sugestões enviadas deverão, obrigatoriamente, estar fundamentadas em:
I. Estudos Clínicos de fase III - realizados no Brasil ou
exterior; e
II. Meta-análises de Ensaios Clínicos.
Art. 3º Determinar que o Departamento de Atenção Especializada - Secretaria de Atenção à Saúde coordene a avaliação das proposições apresentadas, elaborando a versão final consolidada do Protocolo Clínico e Diretrizes Terapêuticas ora submetido à Consulta Pública, para que, findo o prazo estabelecido no Artigo 2º deste Ato, seja aprovado e publicado, passando a vigorar em todo o território nacional.
Parágrafo único. O novo Protocolo passará a vigorar em todo o território nacional após a devida aprovação e publicação por meio de Portaria específica.
Art. 4º Esta Consulta Pública entra em vigor na data de sua publicação.
ALBERTO BELTRAME
SECRETÁRIO
PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS
HEPATITE AUTOIMUNE
1. METODOLOGIA DE BUSCA DA LITERATURA
Para a análise de eficácia dos tratamentos específicos da Hepatite autoimune atualmente registrados na ANVISA e, portanto, disponíveis para utilização e comercialização no Brasil, foram realizadas as buscas nas bases descritas abaixo. Foram avaliados todos os estudos disponíveis nas bases descritas e selecionadas para avaliação metanálises e ensaios clínicos randomizados, controlados e duplo-cegos publicados até a data limite de 01/11/2009, além da consulta em livros-texto e no UpToDate.
Na base Medline/Pubmed:
- (("hepatitis"[MeSH Terms] OR "hepatitis"[All Fields]) AND autoimmune[All Fields]) AND ("humans"[MeSH Terms] AND (Clinical Trial[ptyp] OR Meta-Analysis[ptyp] OR Randomized Controlled Trial[ptyp])).
Na base Cochrane:
- "autoimmune hepatitis"
2. INTRODUÇÃO
Em 1950 foi descrita por Waldenström uma série de casos de mulheres jovens com uma forma de hepatite grave, associada a "rash" acneiforme, aranhas vasculares, amenorréia e uma elevação marcada das concentrações séricas de gama-globulina. Após ter se estabelecido a origem imunológica da doença, ela passou a ser conhecida por "hepatite lupóide" ou "hepatite autoimune crônica ativa". Em dois encontros internacionais de especialistas, em 1992 em Brighton no Reino Unido e em 1994 em Los Angeles nos Estados Unidos, foi reconhecido que os termos crônica e ativa eram desnecessários, pois a doença é a priori crônica e nem sempre é ativa, devido ao seu caráter flutuante. Desse modo foi recomendada a utilização do termo "Hepatite autoimune" para a sua designação (1).
A prevalência dessa doença, baseada em estatísticas internacionais realizadas na Europa setentrional, situa-se em cerca de 17 casos por 100.000 habitantes, com uma incidência anual de 1,9 casos por 100.000 habitantes (1). No Brasil a incidência não é plenamente conhecida. Em um Inquérito Nacional sobre Hepatite Autoimune, apresentado no XVI Congresso Brasileiro de Hepatologia em 2001, dentre as causas de hepatopatia crônica, sua prevalência foi de 3,3% (2). As principais características da hepatite autoimune são um quadro histológico de hepatite de interface (periportal ou periseptal), a hipergamaglobulinemia, a presença de autoanticorpos tissulares e a responsividade a terapia imunossupressora na maioria dos casos (1). Na hepatite autoimune tipo 1, os principais anticorpos são o fator antinuclear (FAN), o anti-músculo liso (AML), o pANCA e o anti-SLA/LP. O anti-LKM1 e o anti-citosol hepático 1 (ALC-1), isoladamente ou em associação, caracterizam a hepatite autoimune tipo 2 (3).
Em cerca de 50% dos casos o início da doença é insidioso, com os pacientes apresentando fadiga, náuseas, anorexia, perda de peso, dor ou desconforto abdominais, icterícia, rash cutâneo, artralgias e mialgias. No exame físico podem estar presentes hepatoesplenomegalia, ascite, eritema palmar, aranhas vasculares, edema periférico e encefalopatia (1,4). Cerca de 30% dos pacientes apresentam-se com um quadro agudo, com icterícia marcada, sendo essencial a identificação precoce e tratamento adequado para evitar-se progressão para insuficiência hepática. O restante dos casos são assintomáticos e são identificados pelo achado incidental de aumento de transaminases (1).
A história natural e o prognóstico da hepatite autoimune dependem do grau de atividade da doença e da presença ou não de cirrose (4). Elevação sustentada de aminotransferase séricas (ALT ou AST) acima de 10 vezes o limite superior da normalidade ou elevação de 5 vezes das mesmas enzimas associada a elevação de 2 vezes o normal nos valores de gamaglobulina, associam-se com aumento na mortalidade, que pode chegar a 90% em 10 anos (5) (6). A mortalidade chega a 40% nos primeiros seis meses para pacientes com doença grave que não recebem terapia imunossupressora (6). A mortalidade em pacientes com cirrose não tratados é de 58% em cinco anos, sendo que a presença de cirrose parece não influenciar na resposta terapêutica (7).
3. CLASSIFICAÇÃO ESTATÍSTICA INTERNACIONAL DE DOENÇAS E PROBLEMAS RELACIONADOS À SAÚDE (CID-10)
- K75.4 Hepatite autoimune
4. DIAGNÓSTICO
O diagnóstico da hepatite autoimune é feito pela soma de informações clínicas, bioquímicas, histológicas e de resposta ao tratamento. É obrigatório que sejam afastadas causas virais, tóxicas e metabólicas antes que se possa firmar o diagnóstico. Corrobora o diagnóstico a presença de aumento expressivo nas gamaglobulinas, grau de elevação das aminotransferases maior do que o grau de elevação da fosfatase alcalina, presença de FAN, AML ou anti-LKM1 positivos, ausência de anti-mitocôndria e histologia com hepatite de interface com ausência de lesões biliares, granulomas, ou alterações proeminentes sugestivas de outra doença.
Em 1992 foi realizado um painel com 27 médicos especialistas em hepatites autoimunes em que os critérios diagnósticos dessa doença foram discutidos, tendo sido criado um escore diagnóstico, com a finalidade de padronização da doença (11). Este escore foi estudado em uma série de contextos. Com base nestes estudos, em 1998 nova reunião foi realizada, sendo os critérios revisados e o escore levemente modificado, principalmente com a finalidade de excluir com maior precisão as doenças colestáticas e que continuam válidos atualmente.
Os critérios modificados podem ser vistos na tabela 1.
Tabela 1. Escore revisado para o diagnóstico de hepatite autoimune (ERDHAI) (12)
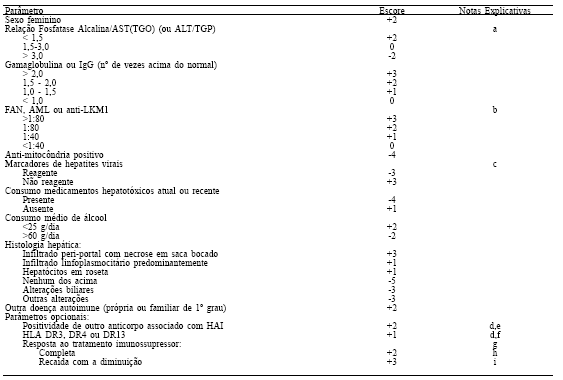
A) Calculado com número de vezes acima do limite superior da normalidade da FA dividido pelo número de vezes acima do limite superior da normalidade da AST.
b) Títulos medidos por imunofluorescência indireta em tecidos de roedores ou para o FAN em células Hep-2. Títulos mais baixos em crianças podem ser significantes e devem pontuar pelo menos 1 ponto (especialmente de anti-LKM1).
c) Considera-se como resultados laboratorias não reagentes de todos a seguir: anti-HAV IgM, HBsAg, anti-HBc Total, anti-HCV e HCV-RNA qualitativo. Se uma etiologia viral é suspeitada, pode ser necesssária a exclusão de citomegalovírus e do vírus Epstein-Barr.
d) Válidos para pontuação apenas se FAN, AML e anti-LKM1 negativos.
e) Incluem anti-SLA/LP, p-ANCA, anti-ASGPR, anti-LC1 e anti-sulfatide.
f) HLA DR13 incluído no escore original de acordo com resultados de estudo realizado em São Paulo (13).
g) Se paciente ainda não foi tratado, desconsiderar e utilizar ponto de corte pré-tratamento (ver a seguir). Incluir a pontuação apropriada após inicio da terapia.
h) Resposta completa (pelo menos 1 das seguintes situações): 1- melhora importante dos sintomas associada a normalização da AST, ALT, bilirrubinas e gamaglobulinas no prazo de 1 ano do início do tratamento e mantido por 6 meses; 2- melhora dos sintomas com melhora de 50% da AST, ALT e bilirrubinas no primeiro mês de tratamento e com AST e ALT permanecendo no máximo 2 vezes o limite superior da normalidade durante os primeiros seis meses da terapia de manutenção; 3- biópsia durante este período mostrando no máximo atividade mínima.
i) Recaída (uma das seguintes situações após resposta completa): 1- aumento da AST ou ALT acima de 2x o limite superior da normalidade; 2- biópsia hepática mostrando doença ativa; 3- retorno de sintomas que necessitem aumento da imunossupressão acompanhado de aumento na AST ou ALT.
A partir do escore obtido, o diagnóstico de hepatite autoimune é feito da seguinte forma:
a) Pacientes que ainda não tenham sido tratados com imunossupressores:
- ERDHAI de 10 a 15 (diagnóstico provável de hepatite
autoimune);
- EEDHAI acima de 15 (diagnóstico definido de hepatite
autoimune).
b) Paciente já tratados com imunossupressores:
- ERDHAI de 12 a 17 (diagnóstico provável de hepatite
autoimune);
- EEDHAI acima de 17 (diagnóstico definido de hepatite
autoimune).
Nota: Pacientes sem resposta prévia a imunossupressores não exclui a possibilidade do diagnóstico de hepatite autoimune, contudo recomenda-se que esses pacientes realizem investigação complementar para exclusão de outras doenças, especialmente se eles apresentarem alterações colestáticas no perfil bioquímico.
5. CRITÉRIOS DE INCLUSÃO
Serão incluídos neste protocolo os pacientes que preencherem os 2 requisitos abaixo (14):
- Diagnóstico definido ou provável de hepatite autoimune segundo escala ERDHAI e;
- Pelo menos um dos itens abaixo:
a) AST 10x acima do normal (6);
b) AST 5x acima do normal associado a gamaglobulina duas
vezes acima do normal (6);
c) Presença de necrose em ponte ou multilobular à histologia
(15);
d) Cirrose com atividade inflamatória presente (9);
e) Presença de sintomas constitucionais incapacitantes.
6. CRITÉRIOS DE EXCLUSÃO
- Biópsia hepática com ausência de infiltrado inflamatório
(ausência de atividade), mesmo com cirrose, pois não há evidência de
benefício de terapia imunossupressora nestes casos;
- Pacientes com contra-indicação à utilização de prednisona
ou azatioprina;
- Evidência de causas infecciosas, tóxicas ou metabólicas.
7. CASOS ESPECIAIS
- Crianças: o tratamento preconizado para crianças é semelhante ao de adultos, tanto com prednisona monoterapia quanto com prednisona e azatioprina, mas o tratamento é menos estudado nessa faixa etária do que em adultos. Com a intenção de diminuir os efeitos deletérios sobre o crescimento, desenvolvimento ósseo e aparência física é comum o uso de corticóide em dias alternados nesse grupo de pacientes (16). Pacientes pediátricos podem se apresentar com mais gravidade do que os adultos, com menor probabilidade de remissão sustentada sem o uso de medicamentos e maiores taxas de recidiva.
- Mulheres pós-menopáusicas e pacientes idosos: estes pacientes não diferem quanto ao benefício alcançado com a terapia ou quanto à gravidade da apresentação clínica, tendo as mesmas indicações de tratamento dos outros pacientes. Entretanto, apresentam um risco aumentado para osteopenia, osteoporose e fraturas com o uso de corticóide, especialmente com o uso prolongado. Estes pacientes devem receber regimes de manutenção com doses baixas de corticóide ou com azatioprina, caso tenham múltiplas recaídas. Também deve ser oferecido profilaxia para osteoporose quando os pacientes estiverem recebendo mais de 5mg de prednisona por mais de 3 meses, conforme protocolo estabelecido para Osteoporose.
- Portadores de cirrose: pacientes com cirrose respondem ao tratamento tão bem quanto os não cirróticos (7). Pacientes com ascite e encefalopatia hepática têm um pior prognóstico, mas podem ter estabilização com terapia específica para a descompensação hepática associada a imunossupressores. A decisão de transplante deve ser adiada, se possível, por 2 semanas, a fim de se observar a resposta terapêutica. Pode haver maior incidência de efeitos adversos do corticóide, secundária à hipoalbuminemia e hiperbilirrubinemia, motivo pelo qual preconiza-se uso de doses baixas de corticóide ou associação com azatioprina.
- Gestantes: pacientes com hepatite autoimune, mesmo com cirrose, não têm contraindicação para gestação, mesmo que cirróticas, embora haja maior risco de parto prematuro, baixo peso ao nascimento e necessidade de cesariana. Pacientes com quadros de cirrose avançados podem complicar durante a gestação pelas alterações hemodinâmicas que ocorrem durante este período, estando indicado contracepção se estiverem menstruando. A maioria das mulheres com cirrose avançada já estão em amenorréia, não precisando de anticoncepção. Existe preocupação com o potencial teratogênico da azatioprina. Mesmo que este risco seja baixo, recomenda-se durante a gestação tratamento com monoterapia com corticóide, que elimina esta apreensão (16).
- Hepatite autoimune com apresentação aguda: os pacientes podem se apresentar com hepatite aguda, e, raramente, com hepatite autoimune fulminante. Estes pacientes devem ser tratados prontamente com corticóides sendo a taxa de resposta semelhante a de outros pacientes com hepatite autoimune;
- Sobreposição (Overlap): algumas características da Hepatite autoimune, como hipergamaglobulinemia, autoanticorpos e hepatite de interface podem estar presentes em outras doenças hepáticas. Em alguns casos, pode haver uma sobreposição de manifestações em que duas doenças possam coexistir. Existem diversos relatos de sobreposição de hepatite autoimune com doenças colestáticas, principalmente cirrose biliar primária (CBP) e colangite esclerosante (CE). Não existe uma nomenclatura unificada internacionalmente para essas situações, sendo freqüentemente denominadas de HAI/CBP, CBP com anticorpo antimitocondrial (AMA) negativo, HAI com AMA positivo, HAI colestática, HAI/CE, colangite autoimune e colangiopatia autoimune. Estas síndromes são denominadas de Hepatite autoimune com "overlap". Pacientes com AMA (especialmente o subtipo M2) devem ser considerados, segundo o conhecimento atual, como portadores de cirrose biliar primária e tratados como tal (12). Pacientes com HAI colestática são considerados atualmente como tendo a mesma evolução da hepatite autoimune clássica, respondendo bem a imunossupressores da mesma maneira. Overlap de HAI com CE são mais comuns em crianças, normalmente respondendo bem a corticóides.
8. TRATAMENTO
Três ensaios clínicos clássicos avaliaram a utilidade da terapia imunossupressora na Hepatite autoimune. O primeiro, publicado em 1971, avaliou 49 pacientes com o diagnóstico de "Hepatite Crônica Ativa". Os pacientes foram randomizados para receberem 15mg de prednisolona ou permanecerem em acompanhamento sem tratamento. Houve diminuição significativa na bilirrubina sérica e globulinas totais com aumento na albumina sérica dos pacientes recebendo prednisolona em relação aos controles. Após 6 anos de acompanhamento, 3 (13,6%) dos 22 pacientes do grupo prednisolona morreram em comparação com 15 (55,6%) dos 27 pacientes no grupo controle (p<0,01) (8).
Um segundo estudo realizado em 63 pacientes com "doença hepática crônica ativa acentuada" comparou o tratamento com o prednisona 20mg por dia, prednisona 10mg por dia associado a azatioprina 50mg, azatioprina 100mg por dia ou placebo. O estudo foi duplo-cego, mas não fica claro na publicação se os grupos foram randomizados. Houve aumento na sobrevida, resolução dos exames de bioquímica hepática e melhora histológica nos pacientes recebendo prednisona ou associação de prednisona e azatioprina em relação ao grupo azatioprina monoterapia e ao grupo placebo (6).
Um terceiro estudo randomizado com 47 pacientes comparou a eficácia da prednisona 15mg por dia em relação a azatioprina 75mg na terapia de manutenção de pacientes com "hepatite crônica ativa" após tratamento de indução com prednisona 30mg por dia e azatioprina 112,5mg por dia por 4 semanas. O estudo foi interrompido após 2 anos de seguimento pois a sobrevida no grupo prednisona neste momento era de 95% e no grupo azatioprina era de 72%. Os autores não calcularam a significância estatística exata pois os dados não tinham uma distribuição normal (9). Analisando-se os resultados desses estudos, fica claro o benefício da prednisona monoterapia ou associada a azatioprina, mas não da azatioprina isoladamente, em aumentar a expectativa de vida desses pacientes.
Havia uma dúvida quanto ao impacto da insuficiência hepática na biotransformação de prednisona a prednisolona, que é o seu metabólito ativo, o que poderia diminuir a eficácia da prednisona em pacientes hepatopatas. Um estudo avaliou os parâmetros farmacocinéticos da prednisona em comparação com os mesmos parâmetros em voluntários sadios. Não foi encontrada nenhuma diferença no metabolismo da prednisona em pacientes com doença hepática crônica ativa (10), concluindo-se que ela pode ser utilizada com segurança em pacientes com hepatite autoimune.
Prednisona isoladamente ou em dose baixa associada a azatioprina é a base do tratamento da hepatite autoimune (16). Ambos esquemas de tratamento são eqüieficazes na indução da remissão, sendo que a terapia combinada permite uso de metade das doses de prednisona. A combinação de prednisona e azatioprina é preferida pela menor freqüência de efeitos adversos secundários ao corticóide (incidência de 10% versus 44%) (17). O uso da azatioprina isoladamente é uma alternativa (ver abaixo), como forma de tratamento de manutenção, para pacientes com resposta incompleta ao tratamento indutor de remissão ou com múltiplas recaídas.
Tabela 2 - Indicações ideais para monoterapia com prednisona ou associação prednisona e azatioprina (16)
| Prednisona e azatioprina | Prednisona monoterapia |
| Mulheres pós-menopáusicas Osteoporose Diabete Hipertensão arterial sistêmica Labilidade emocional/depressão Obesidade Acne |
Citopenias Gestação Doença maligna atual Curto período de tratamento (< 6 meses) Deficiência de tiopurina metiltransferase |
O tratamento é iniciado conforme as doses preconizadas na Tabela 3 e mantido até a remissão, falha terapêutica, resposta incompleta ou toxicidade por medicamentos, sendo estas definidas da seguinte forma (16):
- Remissão: ausência de sintomas, normalização das bilirrubinas e gamaglobulina, ALT e AST no máximo duas vezes o limite superior da normalidade e melhora histológica com no máximo infiltrado portal e ausência de hepatite de interface. A melhora clínica e bioquímica precede a melhora histológica em 3 a 6 meses, sendo essencial a comprovação da remissão histológica antes da interrupção do tratamento.
- Falha terapêutica: aumento da AST em dois terços do valor pré-tratamento, piora da atividade histológica ou surgimento de encefalopatia ou de ascite a despeito de uma adequada adesão ao tratamento. Estes pacientes devem ser tratados com as doses preconizadas para falha do tratamento de indução da remissão (ver item 8.2). Apenas 20% desses pacientes alcançarão remissão histológica, sendo que os demais necessitarão de tratamento continuado. Não havendo resposta adequada, com insuficiência hepática irreversível, deverá ser indicado o transplante hepático, com resultados excelentes e sobrevida de 10 anos de 75%. A recorrência pós-transplante pode ocorrer em 40% dos casos, sendo mais histológica do que clínica (3).
- Resposta incompleta: melhora clínica, bioquímica e histológica, contudo sem resposta completa após três anos de tratamento contínuo. Esses pacientes devem ser mantidos em tratamento de manutenção com prednisona dose baixa ou azatioprina (ver item 8.2) (18,19).
- Toxicidade por medicamentos: toxicidade que necessita redução ou interrupção temporária ou definitiva do uso do medicamento. O medicamento que mais frequentemente causa é a prednisona. Se o paciente ainda não está em uso de azatioprina e existe condições de fazê-lo, esta pode ser utilizada para redução da dose do corticóide. Quando os efeitos adversos são intensos, reduz-se à dose mínima possível para evitar-se estes efeitos, sendo em alguns casos necessário interromper o tratamento. Na presença de hepatite colestática, pancreatite, "rash" ou citopenia importante secundários à azatioprina, a interrupção desse medicamento é mandatório.
- Recaída: pacientes com recaída após a retirada da imunossupressão que se segue à remissão histológica devem ser novamente tratados com tratamento de indução da remissão (tabela 3). A recaída é caracterizada pela recrudescência dos sintomas clínicos com aumento de ALT acima de 3 vezes o limite superior da normalidade. A taxa de recaída é da ordem de 20% após comprovada remissão histológica, enquanto chega a 80% quando existe atividade periportal no momento da retirada da imunossupressão, o que enfatiza a necessidade de comprovação histológica da remissão antes de se suspender a imunossupressão. Após uma segunda recaída a probabilidade de alcançar-se uma remissão duradoura sem imunossupressão é muito baixa, devendo-se manter o paciente em regime de doses baixas de prednisona ou de monoterapia com azatioprina (ver item 8.2).
8.1 Fármacos
a) Prednisona: comprimidos de 5 e 20mg.
b) Azatioprina: comprimidos de 50mg.
8.2 ESQUEMAS DE ADMINISTRAÇÃO
Os esquemas de administração de imunossupressores são o seguintes:
- Indução da remissão: em adultos utilizam-se as doses preconizadas na tabela 3. Em crianças as doses iniciais recomendadas são de 2mg/kg de prednisona (dose máxima de 60 mg por dia), sendo possível a associação de azatioprina como medida para redução da dose de corticóide (16).
Tabela 3 - Doses utilizadas em adultos do tratamento de indução da remissão (16)
| Tratamento combinado | Prednisona monoterapia | ||
| Semanas em tratamento | Prednisona (mg/dia) |
Azatioprina (mg/dia) |
Prednisona (mg/dia) |
| 1 | 30 | 50 | 60 |
| 1 | 20 | 50 | 40 |
| 2 | 15 | 50 | 30 |
| Manutenção até desfecho do tratamento | 10 | 50 | 20 |
- Esquema para falha do tratamento de indução da remissão: devem iniciar com prednisona monoterapia 60mg por dia ou prednisona 30mg associado a azatioprina 150mg. As doses são reduzidas mensalmente enquanto houver melhora laboratorial (redução de 10 mg por mês para prednisona e de 50mg por mês para azatioprina) até chegar-se a dose de 10mg de prednisona e 50mg de azatioprina ou 20mg de prednisona monoterapia, sendo então manejados conforme pacientes em regimes de tratamento convencional.
- Manutenção com prednisona dose baixa: preconizado para resposta incompleta ou a partir da segunda recaída. Após remissão clínica e bioquímica com a terapia de indução, reduz-se a dose de prednisona 2,5mg enquanto houver estabilidade clínico laboratorial até encontrar-se a dose mínima eficaz para manter o paciente assintomático e com AST abaixo de 5x o limite superior da normalidade. A maior vantagem da estratégia de monoterapia corticóide em doses baixas é a prevenção da teratogenicidade da azatioprina em mulheres em idade fértil.
- Manutenção com azatioprina monoterapia: tem as mesmas indicações da manutenção com prednisona dose baixa. Após remissão clínica e bioquímica com a terapia de indução, a dose de azatioprina é aumentada gradualmente até 2mg/kg.dia-1, permitindo redução na dose de corticóide. A maior vantagem da estratégia de monoterapia com azatioprina é a prevenção dos efeitos adversos dos corticosteróides, em especial nas pacientes pós-menopáusicas.
8.3 TEMPO DE TRATAMENTO - CRITÉRIOS DE INTERRUPÇÃO
O tratamento deve ser mantido por tempo indeterminado, havendo reduções de dose ou interrupção de acordo com a resposta ao tratamento conforme item 8.2 Esquema de administração.
8.4 BENEFÍCIOS ESPERADOS
- aumento na expectativa de vida;
- melhora na qualidade de vida;
- melhora nos sintomas clínicos;
- diminuição da atividade inflamatória à biópsia hepática;
- normalização das aminotransferases;
- prevenção de recaídas.
9. MONITORIZAÇÃO
Para pacientes em uso de corticóides, recomendam-se dosagens de potássio e sódio séricos e glicemia de jejum. Para pacientes em uso de corticóides por períodos superiores a 6 semanas, recomenda-se avaliação oftalmológica (20).
A azatioprina pode acarretar anemia, leucopenia ou trombocitopenia, e hemograma completo deve ser realizado semanalmente no primeiro mês, quinzenalmente no segundo e terceiro meses e, após, mensalmente (21). Também sugere-se hemogramas se houver mudança na dose. Deve ser realizado controle AST e ALT, na mesma periodicidade dos hemogramas nos primeiros 6 meses e depois trimestralmente.
10. REGULAÇÃO/CONTROLE/AVALIAÇÃO PELO GESTOR
Há de se observar os critérios de inclusão e exclusão de doentes neste Protocolo, a duração e a monitorização do tratamento, bem como para a verificação periódica das doses de medicamento(s) prescritas e dispensadas, e da adequação de uso.
11. TERMO DE ESCLARECIMENTO E RESPONSABILIDADE - TER
É obrigatória a cientificação do paciente ou de seu responsável legal dos potenciais riscos, benefícios e efeitos colaterais ao uso dos medicamentos preconizados neste Protocolo. O TER é obrigatório ao se prescrever medicamento do Componente Especializado da Assistência Farmacêutica.
12. REFERÊNCIAS BIBLIOGRÁFICAS
1. McFarlane IG. Definition and classification of autoimmune hepatitis. Semin Liver Dis 2002; 22(4):317-324.
2. Inquérito Nacional sobre Hepatite Autoimune (HAI) - Sociedade Brasileira de Hepatologia (1997-1999). Disponível em: http://www.sbhepatologia.org.br/nacional/inquer.htm. Consultado em 30/07/2003.
3. Krawitt EL. Autoimune Hepatitis. N Engl J Méd 2006; 5(354) 54-66.-
4. Manns MP, Strassburg CP. Autoimmune hepatitis: clinical challenges. Gastroenterology 2001; 120(6):1502-1517.
5. Geall MG, Schoenfield LJ, Summerskill WH. Calssification and Treatment of Chronic Active Liver Disease. Gastroenterology 1968; 55(6):724-729.
6. Soloway RD, Summerskill WH, Baggenstoss AH, Geall MG, Gitnick GL, Elveback LR et al. Clinica, Biochemical, and Histological Remission of Severe Chronic Active Liver Disease: A Controlled Study of Treatments and Early Prognosis. Gastroenterology 1972; 63(5):820-833.
7. Roberts SK, Therneau TM, Czaja AJ. Prognosis of histological cirrhosis in type 1 autoimmune hepatitis. Gastroenterology 1996; 110(3):848-857.
8. Cook GC, Mulligan R, Sherlock S. Controlled prospective trial of corticosteroid therapy in active chronic hepatitis. Q J Med 1971; 40:159-185.
9. Murray-Lyon IM, Stern RB, Williams R. Controlled trial of prednisone and azathioprine in active chronic hepatitis. Lancet 1973; 1(7806):735-737.
10. Schalm SW, Summerskill WH, Go VL. Prednisone for chronic active liver disease: pharmacokinetics, including conversion to prednisolone. Gastroenterology 1977; 72(5 Pt 1):910-913.
11. Johnson PJ, McFarlane IG. Meeting report: International Autoimmune Hepatitis Group. Hepatology 1993; 18(4):998-1005.
12. Alvarez F, Berg PA, Bianchi FB, Bianchi L, Burroughs AK, Cancado EL et al. International Autoimmune Hepatitis Group Report: review of criteria for diagnosis of autoimmune hepatitis. J Hepatol 1999; 31(5):929-938.
13. Czaja AJ, Souto EO, Bittencourt PL, Cancado EL, Porta G, Goldberg AC et al. Clinical distinctions and pathogenic implications of type 1 autoimmune hepatitis in Brazil and the United States. J Hepatol 2002; 37(3):302-308.
14. Czaja AJ, Freese DK. Diagnosis and treatment of autoimmune hepatitis. Hepatology 2002; 36(2):479-497.
15. Schalm SW, Korman MG, Summerskill WH, Czaja AJ, Baggenstoss AH. Severe chronic active liver disease. Prognostic significance of initial morphologic patterns. Am J Dig Dis 1977; 22( 11): 973- 980.
16. Czaja AJ. Treatment of autoimmune hepatitis. Semin Liver Dis 2002; 22(4):365-378.
17. Summerskill WH, Korman MG, Ammon HV, Baggenstoss AH. Prednisone for chronic active liver disease: dose titration, standard dose, and combination with azathioprine compared. Gut 1975; 16(11):876-883.
18. Stellon AJ, Keating JJ, Johnson PJ, McFarlane IG, Williams R. Maintenance of remission in autoimmune chronic active hepatitis with azathioprine after corticosteroid withdrawal. Hepatology 1988; 8(4):781-784.
19. Johnson PJ, McFarlane IG, Williams R. Azathioprine for long-term maintenance of remission in autoimmune hepatitis. N Engl J Med 1995; 333(15):958-963.
20. USP DI(R) Drug Information for the Health Care Professional. Tauton: Micromedex Thomson Healthcare, 2007.
21. Physicians' Desk Reference. 63th ed. Montvale: Medical Economics Thomson Healthcare, 2009.
TERMO DE ESCLARECIMENTO E RESPONSABILIDADE
AZATIOPRINA
Eu, _________________________________________ (nome do(a) paciente), declaro ter sido informado(a) claramente sobre os benefícios, riscos, contra-indicações e principais efeitos adversos relacionados ao uso do medicamento azatioprina, indicado para o tratamento da hepatite autoimune.
Os termos médicos foram explicados e todas as minhas dúvidas foram resolvidas pelo médico ______________________(nome do médico que prescreve).
Assim declaro que:
Fui claramente informado(a) de que o medicamento que passo a receber pode trazer as seguintes melhorias:
- aumento na expectativa de vida;
- melhora na qualidade de vida;
- melhora nos sintomas clínicos;
- diminuição da atividade inflamatória à biópsia hepática;
- normalização das aminotransferases;
- prevenção de recaídas.
Fui também claramente informado a respeito das seguintes contra-indicações, potenciais efeitos adversos e riscos:
- há evidências de riscos ao feto, mas um benefício potencial pode ser maior que os riscos. Caso engravide, devo avisar imediatamente ao meu médico;
- o medicamento é distribuído no leite materno. Mães em uso deste medicamento não devem amamentar, devido ao potencial risco de efeitos adversos no bebê;
- os principais efeitos adversos incluem o sistema hematológico e gastrointestinal. Risco de ocorrência dos seguintes efeitos: hematológicos: anemia, diminuição das células brancas, vermelhas e plaquetas do sangue; gastrointestinais: náuseas, vômitos, diarréia, dor abdominal, fezes com sangue, toxicidade para o fígado; diversos: febre, calafrios, diminuição de apetite, vermelhidão de pele, perda de cabelo, aftas, dores articulares, problemas nos olhos (retinopatia), falta de ar, pressão baixa e reações de hipersensibilidade.
- medicamento está contra-indicado em caso de hipersensibilidade (alergia) conhecida ao fármaco ou componentes da fórmula;
Estou ciente de que este medicamento somente pode ser utilizado por mim, comprometendo-me a devolvê-lo caso não queira ou não possa utilizá-lo ou se o tratamento for interrompido. Sei também que continuarei ser assistido, inclusive em caso de eu desistir de usar o medicamento.
Autorizo o Ministério da Saúde e as Secretarias de Saúde a fazer uso de informações relativas ao meu tratamento, desde que assegurado o anonimato.
| Local: Data: | ||
| Nome do paciente: | ||
| Cartão Nacional de Saúde: | ||
| Nome do responsável legal: | ||
| Documento de identificação do responsável legal: | ||
| ___________________________________ Assinatura do paciente ou do responsável legal |
||
| Médico Responsável: | CRM: | UF: |
| ___________________________________ Assinatura e carimbo do médico Data:____________________ |
||
Observação: Este Termo é obrigatório ao se solicitar o fornecimento de medicamento do Componente Especializado da Assistência Farmacêutica e deverá ser preenchido em duas vias, ficando uma arquivada na farmácia e a outra entregue ao usuário ou seu responsável legal.