Este texto não substitui o publicado no Diário Oficial da União

Secretaria de Atenção à Saúde
CONSULTA PÚBLICA Nº 15, DE 31 DE MARÇO DE 2010
O Secretário de Atenção à Saúde, no uso de suas atribuições,
Considerando a importância do papel que desempenham os Protocolos Clínicos e Diretrizes Terapêuticas (PCDT) para a melhoria da qualidade da atenção à saúde, para a prescrição segura e eficaz, para a atualização e democratização do conhecimento, para a melhoria da qualidade da informação prestada aos doentes e para a melhoria dos processos gerenciais dos programas assistenciais;
Considerando a necessidade de se estabelecer critérios de diagnóstico e tratamento de enfermidades, e, observando ética e tecnicamente a prescrição médica, promover o uso racional dos medicamentos para o tratamento de doenças por meio de regulamentação de indicações e esquemas terapêuticos;
Considerando que os Protocolos Clínicos e Diretrizes Terapêuticas são resultado de consenso técnico-científico e são formulados dentro de rigorosos parâmetros de qualidade, precisão de indicação e posologia;
Considerando a necessidade de estabelecer mecanismos de acompanhamento de uso e de avaliação de resultados, garantindo assim a prescrição segura e eficaz;
Considerando a necessidade de se promover ampla discussão desses Protocolos Clínicos e Diretrizes Terapêuticas, possibilitando a participação efetiva, na sua formulação, da comunidade técnico-científica, associações médicas, profissionais da saúde, associações de pacientes, usuários e gestores do Sistema Único de Saúde (SUS) e da população em geral;
Considerando a necessidade de atualizar o Protocolo Clínico e Diretrizes Terapêuticas - Doença de Alzheimer, estabelecidos pela Portaria SAS/MS Nº 843, de 31 de outubro de 2002; e
Considerando a Portaria SAS/MS Nº 375, de 10 de novembro de 2009, que aprova o roteiro a ser utilizado na elaboração de PCDT, no âmbito da Secretaria de Atenção à Saúde - SAS, resolve:
Art. 1º Submeter à Consulta Pública o PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS - DOENÇA DE ALZHEIMER, constante do Anexo deste Ato e o Termo de Esclarecimento e Responsabilidade dele integrante.
Parágrafo único. O Protocolo Clínico e o Termo de Esclarecimento e Responsabilidade, de que trata este Artigo, encontramse disponíveis, também, no sítio: www.saude.gov.br/sas - legislação.
Art. 2º Estabelecer o prazo de 30 (trinta) dias, a contar da data da publicação desta Consulta Pública, para que sejam apresentadas sugestões, devidamente fundamentadas, relativas ao Protocolo Clínico e Diretrizes Terapêuticas de que trata o Artigo 1º desta Consulta Pública.
§ 1º As sugestões devem ser encaminhadas, exclusivamente, para o seguinte endereço eletrônico: pcdt.consulta2010@saude. gov.br, especificando o número da Consulta Pública e o nome do Protocolo no título da mensagem;
§ 2º As sugestões enviadas deverão, obrigatoriamente, estar fundamentadas em:
I. Estudos Clínicos de fase III - realizados no Brasil ou exterior; e
II. Meta-análises de Ensaios Clínicos.
Art. 3º Determinar que o Departamento de Atenção Especializada - Secretaria de Atenção à Saúde coordene a avaliação das proposições apresentadas, elaborando a versão final consolidada do Protocolo Clínico e Diretrizes Terapêuticas ora submetido à Consulta Pública, para que, findo o prazo estabelecido no Artigo 2º deste Ato, seja aprovado e publicado, passando a vigorar em todo o território nacional.
Parágrafo único. O novo Protocolo passará a vigorar em todo o território nacional após a devida aprovação e publicação por meio de Portaria específica.
Art. 4º Esta Consulta Pública entra em vigor na data de sua publicação.
ALBERTO BELTRAME
ANEXO
PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS
DOENÇA DE ALZHEIMER
1 - METODOLOGIA DE BUSCA DA LITERATURA
Foram utilizadas as bases de dados Medline/Pubmed, EMBASE, livros-texto de Medicina e o UpToDate (www.uptodateonline.com, versão 17.3).
Busca na base de dados Medline/Pubmed (acesso em 25/02/2010):
Utilizando-se os termos "Alzheimer Disease"[Mesh] AND "Drug Therapy"[Mesh] restringindo-se para artigos em humanos publicados de 2002 a 2010 e utilizando-se os filtros "Clinical Trial", "Meta-Analysis", "Randomized Controlled Trial" obteve-se 140 artigos.
Busca na base de dados EMBASE (acesso em 25/02/2010):
Utilizando-se os termos 'alzheimer disease'/exp AND 'drug therapy'/exp restringindo-se para artigos em humanos, na língua inglesa, publicados de 2002 a 2010 e utilizando-se os filtros [cochrane review]/lim OR [meta analysis]/lim OR [randomized controlled trial]/lim OR [systematic review]/lim, obteve-se 221 artigos.
Escolha dos artigos para inclusão no PCDT:
Todos os artigos foram revisados e, quando analisados individualmente, a maioria foi excluida por avaliar desfechos sem relevância ou por trata-se de medicamentos não registrados na ANVISA. Os artigos identificados como revisões sistemáticas, consensos ou estudos clínicos sobre o tema, foram selecionados para a elaboração do protocolo, e incluídos no texto.
2 – INTRODUÇÃO
Doença de Alzheimer (DA) é um transtorno neurodegenerativo progressivo e fatal que se manifesta por deterioração cognitiva e da memória, comprometimento progressivo das atividades de vida diária e uma variedade de sintomas neuropsiquiátricos e alterações comportamentais.
Estudos de prevalência sugerem que no ano 2000 o número de pessoas com doença de Alzheimer nos Estados Unidos era de 4,5 milhões(1). A porcentagem de pessoas com DA duplica aproximadamente em cada 5 anos de idade a partir dos 60 anos, representando 1% aos 60 anos e em torno de 30% aos 85 anos(2). Sem avanços no tratamento, a previsão do número de casos sintomáticos nos EUA é aumentar para 13,2 milhões em 2050 (1). O custo do cuidado dos pacientes com DA é extraordinário(3).
As taxas de incidência de doença de Alzheimer tem mostrado grande variabilidade, desde 3,2 por 1.000 pessoas-ano na Índia a 25,2 em Indianópolis nos EUA (4,5). No Brasil, 3 estudos investigaram prevalência e incidência de doença de Alzheimer utilizando amostras de idosos de base comunitária e critérios diagnósticos atuais(6,7,8). A prevalência de demência na população acima dos 65 anos foi de 7,1% sendo que doença de Alzheimer foi responsável por 55% dos casos(6). A taxa de incidência foi 7,7 por 1.000 pessoas-ano no estudo de São Paulo (7) e 14,8 por 1.000 pessoas-ano no outro estudo do Rio Grande do Sul(8). Considerando a prevalência de demência no Brasil e a população de idosos de aproximadamente 15 milhões de pessoas, a estimativa para demência é de 1,1 milhão.
A doença de Alzheimer se instala, em geral, de modo insidioso e se desenvolve lenta e continuamente por um período de vários anos. As alterações neuropatológicas e bioquímicas da doença de Alzheimer podem ser divididas em duas áreas gerais: mudanças estruturais e alterações nos neurotransmissores ou sistemas neurotransmissores. As mudanças estruturais incluem os enovelados neurofibrilares, as placas neuríticas e as alterações do metabolismo amilóide, bem como as perdas sinápticas e a morte neuronal.
As alterações nos sistemas neurotransmissores estão ligadas às mudanças estruturais (patológicas) que ocorrem de forma desordenada na doença. Alguns neurotransmissores são significativamente afetados ou relativamente afetados indicando um padrão de degeneração de sistemas. Porém sistemas neurotransmissores podem estar afetados em algumas áreas cerebrais, mas não em outras, como no caso da perda do sistema colinérgico córtico-basal e da ausência de efeito sobre o sistema colinérgico do tronco cerebral. Efeitos similares são observados no sistema noradrenérgico.
Os fatores de risco bem estabelecidos para doença de Alzheimer são idade e história familiar de DA (risco aumenta com o número crescente de familiares de primeiro grau afetados)(9). A etiologia da doença de Alzheimer permanece indefinida, embora progresso considerável tenha sido feito na compreensão de seus mecanismos bioquímicos e genéticos. É sabido que o fragmento de 42 aminoácidos da proteína precursora ß-amilóide é extremamente importante para a patogênese das placas senis e que a maioria das formas familiais da doença de Alzheimer é associada à superprodução de proteína precursora beta-amilóide(10,11). Algumas proteínas que compõem os enovelados neurofibrilares, mais especialmente a proteína tau hiperfosforilada e ubiquitina foram identificadas, mas a relação entre a formação das placas, a formação do enovelado neurofibrilar e a lesão celular permanece incerta(10). Sabemos que o alelo e (4) do gene da apolipoproteína E encontra-se em torno de 3 vezes mais freqüente nas pessoas com doença de Alzheimer do que nos sujeitos controle pareados por idade e que pessoas homozigotas para o gene apresentam maior risco para a doença do que os que não são homozigotos. Entretanto, a especificidade e sensibilidade do teste da ApoE4 são muito baixas para permitir seu uso como teste de rastreio na população geral(12). O ritmo da investigação nestas áreas é rápido, e é provável que as direções destas pesquisas levem a tratamentos mais efetivos no futuro.
Embora não haja cura para DA, a descoberta de que é caracterizada por déficit colinégico resultou no desenvolvimento de tratamentos farmacológicos que aliviam os sintomas e assim, no contexto de alguns países onde esta questão é extremamente relevante, retardam a transferência para clínicas de idosos ("nursing homes")( 13,14,15). Inibidores da acetilcolinesterase são a principal linha de tratamento da DA, tratamento de curto prazo com estes agentes tem mostrado melhorar a cognição e outros sintomas nos pacientes com DA leve a moderada(16,17,18,19).
3 - CLASSIFICAÇÃO ESTATÍSTICA INTERNACIONAL DE DOENÇAS E PROBLEMAS RELACIONADOS À SAÚDE (CID-10)
- G300 Doença de Alzheimer de início precoce
- G301 Doença de Alzheimer de início tardio
- G308 Outras formas de doença de Alzheimer
4 – DIAGNÓSTICO
4.1. DIAGNÓSTICO CLÍNICO
O diagnóstico da DA é de exclusão. O rastreamento inicial deve incluir avaliação de depressão e exames de laboratório com ênfase especial na função da tireóide e níveis séricos de vitamina B12. A abordagem clínica para o diagnóstico de DA no paciente que apresenta problemas de memória é baseado na identificação das modificações cognitivas específicas, como descrito nos critérios do National Institute of Neurologic and Communicative Disorders and Stroke and the Alzheimer Disease and Related Disorders Association (NINCDS-ADRDA)20 (Quadro 1). Exame físico e neurológico cuidadosos acompanhados de avaliação do estado mental para identificar os déficits de memória, linguagem, e viso-espaciais, bem como outros sintomas cognitivos e não cognitivos são fundamentais na avaliação do paciente com suspeita de demência.
Quadro 1. Elementos chave dos critérios para doença de Alzheimer do National Institute of Neurologic and Communicative Disorders and Stroke and the Alzheimer Disease and Related Disorders Association (NINCDS-ADRDA) Criteria for Alzheimer Disease - NINCDS-ADRDA
Diagnóstico de doença de Alzheimer provável (é necessário a presença de todos estes achados)
- Presença de síndrome demencial
- Déficits em 2 ou mais áreas da cognição
- Piora progressiva da memória e outra função cognitiva
- Início entre os 40 e 90 anos de idade
- Ausência de doenças sistêmicas que podem causar a síndrome
Achados que sustentam o doença de Alzheimer provável (estes achados reforçam o diagnóstico pois são mais frequentes, no entanto, a ausência não exclui o diagnóstico)
- Afasia, apraxia, agnosia progresivas (incluindo disfunção viso-espacial)
- Atividades de vida diária (AVDs) comprometidas e alteração comportamental
- História familiar positiva
- Achados inespecíficos (ou exames normais) de liquor, EEG e TC de crânio
Achados consistentes com diagnóstico de doença de Alzheimer provável (estes achados são menos frequentes, no entanto a ausência não exclui o diagnóstico)
- Platô no curso da progressão da doença
- Sintomas psiquiátricos e vegetativos associados (depressão, insônia, delírio, alucinações, problemas de controle comportamental, transtorno de sono e perda de peso)
- outras anormalidades neurológicas na doença avançada (aumento do tono muscular, mioclonia, ou distúrbios da marcha)
- convulsões na doença avançada
- TC normal para idade
Doença de Alzheimer provável é improvável com as seguintes características: (a presença de um destes achados praticamente exclui o diagnóstico)
- Início súbito, apoplético
- Convulsões ou distúrbios da marcha precoce no curso da Doença
Diagnóstico clínico de doença de Alzheimer possível
- Pode ser feito com base na síndrome demencial quando as seguintes condições são preenchidas:
- outros transtornos neurológicos, psiquiátricos, ou sistêmicos suficiente para causar demência estão ausentes
- achados atípicos estão presentes no início, apresentação, ou curso clínico
- Pode ser feito na presença de um segundo transtorno que possa levar à demência, mas que não seja provável de ser a única causa de demência.
4.2. DIAGNÓSTICO DIFERENCIAL
O diagnóstico de Doença de Exclusão se dá por exclusão. Segundo as diretrizes da Academia Americana de Neurologia( 21), depressão é uma comorbidade comum e tratável em pacientes com demência e deve ser rastreada. A deficiência de vitamina B12 é comum no idoso, e dosagem de nível sérico de B12 deve ser incluída na rotina de avaliação do idoso. Devido à freqüência, o hipotireoidismo deve ser pesquisado nos pacientes idosos.
Um exame de imagem cerebral (Tomografia Computaorizada -TC ou Ressonância Magnética - RM) é útil para excluir lesões estruturais que podem contribuir para demência como infarto cerebral, neoplasia, coleções de líquido extracerebral. O processo de investigação diagnóstica para preencher os critérios inclui história completa (com paciente e familiar ou cuidador), avaliação clínica (incluindo a escala de avaliação clínica da demência - CDR(22,23)), rastreio cognitivo (testes cognitivos como o Mini Exame do Estado Mental -MEEM) e exames laboratoriais (hemograma, eletrólitos, glicemia, uréia e creatinina, TSH e ALT/AST), sorologia para Lues (VDRL), eletrocardiograma, radiografia de tórax e exame de imagem cerebral (TC sem contraste ou RM).
No momento não há evidência suficiente que justifique a indicação de uso dos seguintes testes(21): medidas lineares ou volumétricas pela RM ou TC; SPECT (tomografia coputadorizada por emissão simples de fotons); testes genéticos para Demência de Corpos de Lewy ou doença de Creutzfeld-Jakob; genotipagem da APoE para DA; EEG; punção lombar (exceto na presença de câncer metastático, suspeita de infecção do SNC, sorologia sérica para sífilis reativa, hidrocefalia, idade menor doque 55 anos, demência rapidamente progressiva ou não usual, imunossupressão, ou suspeita de vasculite do SNC); PET (tomografia por emissão de pósitrons); marcadores genéticos para DA não listados acima; marcadores biológicos no LQR ou outros para DA; mutações da proteína Tau em pacientes com demência frontotemporal; mutações gênicas da DA em pacientes com demência frontotemporal.
O diagnóstico definitivo de doença de Alzheimer só pode ser realizado por necropsia (ou biopsia) com identificação do número apropriado de placas e enovelados em regiões específicas do cérebro, na presença de história clínica consistente com demência. Biopsia não é recomendada para diagnóstico.
5 - CRITÉRIOS DE INCLUSÃO
Serão incluídos neste protocolo pacientes que preencherem todos os critérios abaixo:
- ter o diagnóstico de doença de Alzheimer provável, segundo os critérios do National Institute of Neurologic and Communicative Disorders and Stroke and the Alzheimer Disease and Related Disorders Association (NINCDS-ADRDA) Criteria for Alzheimer Disease - NINCDS-ADRDA20 (vide Quadro 1);
- apresentar MEEM com escore entre 12 e 24 para pacientes com mais de 4 anos de escolaridade ou entre 8 e 17 para pacientes com até 4 anos de escolaridade;
- apresentar Escala CDR 1 ou 2 (demência leve ou moderada);
- TC ou RM do encéfalo e exames laboratoriais que afastam outras doenças frequentes nos idosos e podem provocar disfunção cognitiva: hemograma, bioquímica (sódio, potássio, cloretos, glicemia, uréia e creatinina), sorologia para Lues (VDRL) e dosagem de TSH e de vitamina B12.
6 - CRITÉRIOS DE EXCLUSÃO
Não serão incluídos neste Protocolo de tratamento pacientes que apresentarem pelo menos um dos itens abaixo:
- identificação de incapacidade de adesão ao tratamento;
- evidência de lesão cerebral orgânica ou metabólica simultâneas não compensadas (conforme exames do item critérios de inclusão);
- insuficiência cardíaca ou arritmia cardíaca graves;
- hipersensibilidade ou intolerância aos medicamentos.
Além dos citados acima o uso de galantamina está contraindicada em disfunção hepática ou renal graves.
7 – TRATAMENTO
A abordagem do tratamento da DA deve ser multidisciplinar, envolvendo os diversos sinais sintomas da doença e suas peculiaridades de manejo.
O objetivo do tratamento da doença de Alzheimer com estes medicamentos é propiciar estabilização do comprometimento cognitivo, do comportamento e das atividades da vida diária (ou modificar as manifestações da doença), com um mínimo de efeitos adversos.
Desde a introdução do primeiro inibidor da acetilcolinesterase, os fármacos colinérgicos, donepezila, galantamina e rivastigmina são considerados como a primeira linha farmacoterápica para a doença de Alzheimer. Estes fármacos estão todos recomendados para uso na doença de Alzheimer de leve a moderada.
O fundamento para o uso de fármacos colinérgicos para pacientes com doença de Alzheimer recai no aumento da secreção ou prolongamento da meia-vida da acetilcolina na fenda sináptica em áreas relevantes do cérebro. É sabido há muitos anos que a degeneração das vias colinérgicas cerebrais desencadeia algumas das manifestações da doença de Alzheimer avançada e em particular contribui para os déficits característicos na cognição. Diversas abordagens colinérgicas, como agonistas muscarínicos e nicotínicos e compostos para aumentar a liberação da acetilcolina foram experimentados como tratamento na doença de Alzheimer, mas sem efeitos clínicos úteis. Alguns compostos foram muito efêmeros em seus efeitos farmacológicos e um problema comum e previsível foi a incidência de efeitos adversos devido à ação colinérgica periférica.
Os inibidores da colinesterase, que retardam a degradação da acetilcolina naturalmente secretada, ofereceram um avanço mais significativo. Mas para ser útil tal fármaco deve cruzar a barreira hemato-encefálica e para minimizar os efeitos adversos deve inibir a degradação da acetilcolina a um menor grau no resto do corpo do que no cérebro. O primeiro dos inibidores a ser comercializado para o tratamento da doença de Alzheimer foi a tacrina, a qual embora tenha mostrado ser efetiva em ensaios clínicos(24) tem uma alta incidência de efeitos adversos potencialmente sérios e já foi superada pelos fármacos mais novos.
Os três medicamentos presentes no protocolo são donepezila, rivastigmina e a galantamina. Estes fármacos têm propriedades farmacológicas levemente diferentes, mas todas agem inibindo a degradação da molécula de acetilcolina, o neurotransmissor classicamente associado à função de memória, por bloquear a enzima acetilcolinesterase. Ao contrário da donepezila, rivastigmina inibe a butilcolinesterase bem como a acetilcolinesterase. A galantamina além de inibir a acetilcolinesterase, tem atividade agonista nicotínica. A significância clínica destas diferenças ainda não foi estabelecida. A donepezila tem meia-vida mais longa, sendo a administração feita 1 vez ao dia.
A doença de Alzheimer provoca comprometimento cognitivo, do comportamento e das atividades da vida diária, podendo ocasionar estresse ao cuidador. Essas alterações são o alvo do tratamento (25). O efeito comprovado destes medicamentos é o de modificar as manifestações da doença de Alzheimer.
Revisões da Cochrane Collaboration de cada um dos inibidores da colinesterase já foram completadas e publicadas (26,27,28). Nestas revisões, todas as evidências disponíveis, publicadas e não publicadas, relatando os estudos dos inibidores foram identificadas, avaliadas e descritas. Há 23 estudos incluídos com donepezila (5.272 pacientes randomizados), 9 com rivastigmina (3.449 pacientes randomizados) e 9 com galantamina (5.194 pacientes randomizados) nas revisões da Cochrane. O objetivo da maioria destes estudos é avaliar a eficácia e tolerabilidade do inibidor da colinesterase detectando diferenças entre a taxa de deterioração da função cognitiva entre os grupos tratados e placebo ao longo de 3 ou 6 meses. A função cognitiva é geralmente avaliada pelas medidas da ADAS-Cog (a sub-escala cognitiva da Escala da Doença de Alzheimer de Doenças Associadas - Alzheimer´s Disease and Associated Disorders) 29 ou do Mini Exame do Estado Mental – MEEM (30,31).
O diagnóstico de doença de Alzheimer, de acordo com os critérios padrão do National Institute of Neurological, Communicative Disorders and Stroke and Alzheimer's Disease and Related Disorders Association - NINCDS-ADRDA 20 e o DSM-III R 32 de leve a moderado que é geralmente definido por Mini Exame do Estado Mental entre 10 ou 11 e 24 ou 26. Há dois estudos de pacientes com doenças mais graves (MEEM 5 a 17) e um com mais doença leve. A maioria dos estudos é patrocinada pelas companhias farmacêuticas que fabricam e comercializam os medicamentos.
As três revisões chegam a conclusões similares, que em certas doses testadas, nas mais altas do que nas mais baixas, os inibidores da colinesterase mostram eficácia sobre a função cognitiva, atividades de vida diária, comportamento e estado clínico global comparado ao placebo e houve mais efeitos adversos como náusea, anorexia, vômitos, cefaléia e dor abdominal associado com o inibidor da colinesterase do que com placebo. Um período de escalonamento de dose de aproximadamente 3 meses é necessário para desenvolver tolerância e minimizar os efeitos adversos. Os efeitos adversos dos inibidores da acetilcolinesterase foram, em geral, bem tolerados (25,33,34,35,36).
Os inibidores da colinesterase mostram efeitos consistentes nos domínios da cognição e avaliação global, mas a estimativa resumida mostrou pequenos tamanhos de efeito. Desfechos nos domínios de comportamento e qualidade de vida foram menos freqüentemente avaliados e mostraram efeitos menos consistentes (37,38,39,40). A maioria dos estudos avalia os desfechos cognitivos com a escala ADAS-cog (Alzheimer's disease assessment scale-cognitive subscale) de 70 pontos e mostra diferenças significativas de 1,5 a 3,9 pontos a favor dos inibidores da colinesterase.
Apenas 46% dos ensaios clínicos randomizados discutem a significância clínica dos seus resultados, sendo que a maioria das medidas de significância clínica são baseadas em opinião(40).
A revisão encomendada pelo NICE (National Institute for Clinical Excellence)(41) sobre os efeitos dos inibidores da colinesterase sobre a cognição, qualidade de vida, e efeitos adversos em pacientes com doença de Alzheimer leve, moderada e grave com objetivo de fornecer critérios clínicos para a Inglaterra(40) concluiu que os três inibidores nas doses mais elevadas nas quais são prescritos mostraram benefício na função cogntiva, mas os efeitos do tratamento eram pequenos na faixa de 3 a 4 pontos na escala ADAScog de 70 pontos29.
A conclusão geral das revisões sistemáticas, mesmo considerando as limitações e os tamanhos de efeito, é de que para o tratamento da doença de Alzheimer os inibidores da colinesterase podem melhorar os sintomas, primariamente nos domínios cognitivos e função global, sendo indicados em demência leve a moderada. Não há diferença de eficácia entre os três medicamentos. A substituição de um medicamento por outro só se justifica pela intolerância e não pela falta de resposta terapêutica.
8.1. FÁRMACOS
Donepezila: comprimidos de 5 e 10mg.
Rivastigmina: cápsulas de 1,5; 3; 4,5 e 6mg; sol oral de 2mg/mL.
Galantamina: cápsulas de liberação prolongada de 8, 16 e 24mg.
8.2. ESQUEMA DE ADMINISTRAÇÃO
Donepezila: iniciar com 5mg/dia por via oral. A dose pode ser aumentada para 10mg/dia após 4-6 semanas. Administrar ao deitar. Os comprimidos podem ser ingeridos com ou sem alimentos.
Galantamina: iniciar com 8mg/dia por via oral durante 4 semanas. A dose de manutenção é de 16mg/dia por no mínimo 12 meses. A dose máxima é de 24mg/dia. As doses devem ser divididas em duas adminitrações. Ingerir os comprimidos com as refeições da manhã e da noite. Em insuficiência hepática ou renal moderada a dose deve ser ajustada considerando dose máxima de 16mg/dia.
Rivastigmina: iniciar com 3mg/dia por via oral; a dose pode ser aumentada para 6mg/dia após duas semanas. Aumentos subseqüentes para 9 e então para 12mg/dia devem ser feitos de acordo com a tolerabilidade e após um intervalo de 2 semanas. A dose máxima é de 12mg/dia. Administrar com as refeições. As doses diárias devem ser divididas em duas administrações. Não é necessário realizar ajuste nas insuficiências hepática ou renal, mas utilizar com cautela na insuficiência hepática (nas menores doses possíveis)
8.3. TEMPO DE TRATAMENTO - CRITÉRIOS DE INTERRUPÇÃO
O tratamento deve ser suspenso em três situações distintas42:
- Após 3-4 meses do início do tratamento, o paciente deverá ser reavaliado; não havendo melhora ou estabilização da deterioração do quadro o tratamento deve ser suspenso por falta de benefício;
- Mesmo que em tratamento continuado, este deve ser mantido apenas enquanto o MEEM estiver acima de 12 para pacientes com mais de 4 anos de escolaridade e acima de 8 para pacientes com menos de 4 anos de estudo, abaixo do que não existe nenhuma evidência de benefício de tratamento e este deve ser suspenso; de forma semelhante, somente devem ser mantidos em tratamento pacientes com Escala CDR igual ou inferior a 2;
- Intolerância ao medicamento, situação única em que se justifica a substituição de um medicamento por outro.
8.4. BENEFÍCIOS ESPERADOS
- Redução na velocidade de progressão da doença
- Melhora da memória e da atenção
8 – MONITORIZAÇÃO
Três a quatro meses após o início do tratamento, o paciente deve fazer uma reavaliação. Após este período, as reavaliações devem ocorrer a cada 6 meses, para avaliar o benefício e a necessidade de continuidade do tratamento através de avaliação clínica e realização do MEEM e da Escala CDR.
Para donepezila:
Os efeitos adversos mais comuns são insônia, náusea, vômito, diarréia, anorexia, dispepsia, câimbras musculares, fadiga. Menos comumente pode ocorrer cefaléia, sonolência, tontura, depressão, perda de peso, sonhos anormais, aumento da freqüência urinária, síncope, bradicardia, artrite, equimoses.
Como a donepezila é metabolizado (eliminado) por enzimas hepáticas, a taxa do metabolismo pode ser aumentada por medicamentos que elevam as quantidades destas enzimas, como a carbamazepina, dexametasona, fenobarbital, fenitoína e rifampicina. Ao aumentar sua eliminação, estes fármacos podem reduzir os efeitos da donepezila. O cetoconazol mostrou bloquear as enzimas hepáticas que metabolizam a donepezila. Desta forma, o uso concomitante do cetoconazol e donepezila pode resultar no aumento das concentrações da donepezila e possivelmente levar à maior ocorrência de efeitos adversos. A quinidina também demonstrou inibir as enzimas que metabolizam a donepezila e podem piorar o perfil de efeitos adversos.
A donepezila deve ser usada com cautela em indivíduos com anormalidades supraventriculares da condução cardíaca ou naqueles em uso de medicamentos que reduzem significativamente a freqüência cardíaca, história de convulsões, em risco de úlcera e com história de asma ou DPOC.
Para galantamina:
Os efeitos adversos mais comuns incluem náusea, vômito, diarréia, anorexia, perda de peso, dor abdominal, dispepsia, flatulência, tontura, cefaléia, depressão, fadiga, insônia, sonolência. Menos comuns são infecção do trato urinário, hematúria, incontinência, anemia, tremor, rinite, aumento da fosfatase alcalina. Monitorar a função renal (pela dosagem de creatinina) e hepática (pela dosagem de ALT/ AST).
Succinilcolina aumenta o bloqueio neuromuscular. Agentes colinérgicos podem apresentar efeitos sinérgicos. Inibidores centrais da acetilcolinesterase podem aumentar o risco de sintomas piramidais relacionados aos antipsicóticos.
A galantamina deve ser usada com cautela em pacientes com atraso da condução cardíaca ou em uso de fármacos que atrasam a condução no nodo AS ou AV, com história de úlcera péptica, convulsão, doenças respiratórias graves e obstrução urinária.
Para rivastigmina:
Os efeitos mais comuns são tontura, cefaléia, náusea, vômito, diarréia, anorexia, fadiga, insônia, confusão e dor abdominal. Menos comumente pode ocorrer depressão, ansiedade, sonolência, alucinações, síncope, hipertensão, dispepsia, constipação, flatulência, perda de peso, infecção do trato urinário, fraqueza, tremor, angina, úlcera gástrica ou duodenal, erupções cutâneas.
Os agentes anticolinérgicos podem reduzir os seus efeitos. Outras interações significativas não foram observadas.
A rivastigmina deve ser usar com precaução em pacientes com úlcera péptica, história de convulsão, alterações da condução cardíaca e história de asma.
9 - REGULAÇÃO/CONTROLE/AVALIAÇÃO PELO GESTOR
Os pacientes com suspeita de DA devem ser encaminhados para serviço especializado em neurologia, geriatria, psiquiatria ou médico com treinamento na avaliação de demências, para diagnóstico da doença. Há de se observar os critérios de inclusão e exclusão de doentes neste Protocolo, a duração e a monitorização do tratamento, bem como para a verificação periódica das doses de medicamento(s) prescritas e dispensadas e da adequação de uso.
Para dispensação dos medicamentos é necessário relatório médico com descrição da apresentação da doença, evolução, sintomas neuropsiquiátricos apresentados, e medicamentos empregados.
10 - TERMO DE ESCLARECIMENTO E RESPONSABILIDADE - TER
É obrigatório a cientificação do paciente ou de seu responsável legal dos potenciais riscos, benefícios e efeitos colaterais ao uso dos medicamentos preconizados neste protocolo. O TER é obrigatório ao se prescrever medicamento do Componente Especializado da Assistência Farmacêutica.
11 - REFERÊNCIAS BIBLIOGRÁFICAS
1. Hebert LE, Scherr PA, Bienias JL, Bennett DA, Evans DA. Alzheimer disease in the US population: prevalence estimates using the 2000 Census. Arch Neurol 2003;60:1119-22.
2. Jorm AF. Cross-national comparisons of the occurrence of Alzheimer's and vascular dementias. Eur Arch Psychiatry Clin Neurosci 1991;240:218-22.
3. Wimo A, Winblad B. Health economical aspects of Alzheimer disease and its treatment. Psychogeriatrics 2001;1:189-93.
4. Chandra V, Pandav R, Dodge HH, et al. Incidence of Alzheimer's disease in a rural community in India: the Indo-US study. Neurology 2001; 57:985-989.
5. Hendrie HC, Ogunniyi A, Hall KS, et al. Incidence of dementia and Alzheimer disease in 2 communities: Yoruba residing in Ibadan, Nigeria, and African Americans residing in Indianapolis, Indiana. JAMA 2001; 285:739-747.
6. Herrera E Jr, Caramelli P, Silveira AS, et al. Epidemiologic survey of dementia in a community-dwelling Brazilian population. Alzheimer Dis Assoc Disord 2002;16:103-108.
7. Nitrini R, Caramelli P, Herrera E Jr, et al. Incidence of Dementia in a Community-Dwelling Brazilian Population. Alzheimer Dis Assoc Disord 2004;18:241-246.
8. Chaves ML, Camozzato AL, Godinho C, et al. Incidence of Mild Cognitive Impairment and Alzheimer Disease in Southern Brazil. J Geriatr Psychiatry Neurol 2009; 22(3):181-7.
9. Agency for Health Care Policy and Research. Recognition and initial assessment of Alzheimer's disease and related dementias. Clinical practice guideline no. 19. Rockville, Md.: Dept. of Health and Human Services, Public Health Services, 1996; AHCPR publication no. 97-0702.
10. Whitehouse PJ. Genesis of Alzheimer's disease. Neurology 1997;48(5 Suppl 7):S2-7.
11. Selkoe DJ. Alzheimer's disease: genotypes, phenotypes, and treatments. Science 1997;275:630-1.
12. Apolipoprotein E genotyping in Alzheimer's disease. National Institute on Aging/Alzheimer's Association Working Group. Lancet 1996;347:1091-5.
13. Hake AM. The treatment of Alzheimer's disease: the approach from a clinical specialist in the trenches. Semin Neurol. 2002;22:71-74.
14. Doody RS, Stevens JC, Beck C, et al. Practice parameter: management of dementia (an evidence-based review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology. 2001;56:1154-1166.
15. Fillit H, Cummings J. Practice guidelines for the diagnosis and treatment of Alzheimer's disease in a managed care setting: Part II-Pharmacologic therapy. Alzheimer's Disease (AD) Managed Care Advisory Council. Manag Care Interface. 2000;13:51-56.
16. Doody RS. Clinical profile of donepezil in the treatment of Alzheimer's disease. Gerontology. 1999;45(suppl 1):23-32.
17. Birks J, Grimley EJ, Iakovidou V, et al. Rivastigmine for Alzheimer's disease. Cochrane Database Syst Rev. 2000:CD001191.
18. Lilienfeld S. Galantamine-a novel cholinergic drug with a unique dual mode of action for the treatment of patients with Alzheimer's disease. CNS Drug Rev. 2002;8:159-176.
19. Tariot P. Current status and new developments with galantamine in the treatment of Alzheimer's disease. Expert Opin Pharmacother. 2001;2:2027-2049.
20. McKhann G, Dracman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer's disease: Report of the NINCDS-ADRDA Work Group under the auspices of Department of Health and Human Services Task Force on Alzheimer's disease. Neurology 1984;34:939-44.
21. Knopman DS, DeKosky ST, Cummings JL, Chui H, Corey-Bloom J, Relkin N, Small GW, Miller B, Stevens JC. Practice parameter: Diagnosis of dementia (an evidence-based review) Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2001;56:1143-1153.
22. Hughes CP, Berg L, Danziger WL, et al. A new clinical scale for the staging of dementia. Br J Psychiatry. 1982;140:566- 572.
23. Chaves ML, Camozzato AL, Godinho C, et al. Validity of the Clinical Dementia Rating Scale for the Detection and Staging of Dementia in Brazilian Patients. Alzheimer Dis Assoc Disord 2007;21:210-217.
24. Qizilbash N, Whitehead A, Higgins J, Wilcock G, Schneider L, Farlow M. Cholinesterase inhibition for Alzheimer's disease: a meta-analysis of the tacrine trials Dementia Trialists' Collaboration. JAMA 1998;280:1777-82.
25. Qaseem A, Snow V, Cross JT Jr, et al. Current pharmacologic treatment of dementia: a clinical practice guideline from the American College of Physicians and the American Academy of Family Physicians. Ann Intern Med. 2008;148(5):370-8.
26. Birks J, Grimley Evans J, Iakovidou V, Tsolaki M. Rivastigmine for Alzheimer's disease. Cochrane Database Syst Rev. 2000;( 4): CD001191.
27. Birks J, Harvey RJ. Donepezil for dementia due to Alzheimer's disease. Cochrane Database Syst Rev. 2006;( 1): CD001190.
28. Loy C, Schneider L. Galantamine for Alzheimer's disease and mild cognitive impairment. Cochrane Database Syst Ver 2006;(1): CD001747.
29. Rosen WG, Mohs RC, Davis KL. A new rating scale for Alzheimer's disease. American Journal of Psychiatry 1984;41:356- 64.
30. Folstein MF, Folstein SE, McHugh PR. 'Mini-Mental State' : a practical method for grading the cognitive state of patients for the clinician. J Psychiatric Res 1975;12:189-98.
31. Brucki SM, Nitrini R, Caramelli P, Bertolucci PH, Okamoto IH. Sugestões para o uso do Mini-Exame do Estado Mental no Brasil. Arq Neuropsiquiatr 2003; 61:777-781.
32. APA. Diagnostic and Statistical Manual of Mental Disorders (3rd ed). Washington, DC: American Psychiatric Association, 1987.
33. Wilkison D, Murray J. Galantamine: a randomized Double- blind dose comparision in patients with Alzheimer's disease. Int J Geriatr Psychiatry. 2001;16:852-7.
34. Wood PC, Castlden CM. A Double-blind placebo controlled multicentre study of tacrina for Alzheimer's disease. Int Geriatr Psychiatry. 1994;9:649-54.
35. Agid Y, Dubbois B, Anad R et al. International Rivastigmine Investigators. Efficacy and tolerability of rivastigmine in patients with dementia of the Alzheimer type. Curr Ther Res Clin Exp. 1998;59:837-45.
36. Courtney C, Farrell D, Gray R et al. Long-term donepezil treatment in 565 patients with Alzheimer's disease: randomised Double-blind trial. Lancet. 2004;363:2105-15.
37. Raina P, Santaguida P, Ismaila A, Patterson C, Cowan D, Levine M, Booker L, Oremus M. Effectiveness of Cholinesterase Inhibitors and Memantine for Treating Dementia: Evidence Review for a Clinical Practice Guideline. Ann Intern Med. 2008;148:379- 397.
38. Kaduszkiewicz H, Zimmermann T, Beck-Bornholdt HP, and van den Bussche H. Cholinesterase inhibitors for patients with Alzheimer's disease: systematic review of randomised clinical trials. BMJ 2005;331;321-327.
39. Molnar FJ, Man-Son-Hing M, Fergusson D. Systematic Review of Measures of Clinical Significance Employed in Randomized Controlled Trials of Drugs for Dementia. JAGS 57:536-546, 2009
40. Takeda A, Loveman E, Clegg A, Kirby J, Picot J, Payne E, Green C. A systematic review of the clinical effectiveness of donepesil, rivastigmine and galantamine on cognition, quality of life and adverse events in Alzheimer's disease. Int J Geriatr Psychiatry. 2006;21(1):17-28.
41. National Institute for Clinical Excellence (NICE). TA111 Alzheimer's disease - donepezil, galantamine, rivastigmine (review) and memantine: guidance (amended August 2009).
42. Evans JG, Wilcock G, Birks J. Evidence-based pharmacotherapy of Alzheimer's disease. Int J Neuropsychopharmacol 2004;7:351-369.
TERMO DE ESCLARECIMENTO E RESPONSABILIDADE
Donepezila, Galantamina e Rivastigmina
Eu, _________________________________________ (nome do(a) paciente), declaro ter sido informado(a) claramente sobre os benefícios, riscos, contra-indicações e principais efeitos adversos relacionados ao uso do medicamento donepezila, galantamina e rivastigmina, indicado para o tratamento do doença de Alzheimer.
Os termos médicos foram explicados e todas as minhas dúvidas foram resolvidas pelo médico ___________________________ (nome do médico que prescreve).
Assim declaro que:
Fui claramente informado(a) de que o medicamento que passo a receber pode trazer as seguintes melhorias:
- redução na velocidade de progressão da doença;
- melhora da memória e da atenção.
Fui também claramente informado a respeito das seguintes contra-indicações, potenciais efeitos adversos e riscos:
- não se sabe ao certo os riscos do uso destes medicamentos na gravidez, portanto, caso engravide, o médico deverá ser avisado imediatamente;
- os efeitos adversos já relatados são os seguintes:
- donepezila: os efeitos adversos mais comuns são insônia, náusea, vômito, diarréia, perda de apetite, dispepsia, câimbras musculares, cansaço. Menos comumente pode ocorrer dor de cabeça, sonolência, tontura, depressão, perda de peso, sonhos anormais, aumento da freqüência urinária, desmaios, bradicardia, artrite, roxões na pele.
- galantamina: os efeitos adversos mais comuns incluem náusea, vômito, diarréia, perda de apetite, perda de peso, dor abdominal, dispepsia, gases, tontura, dor de cabeça, depressão, cansaço, insônia, sonolência. Menos comuns incluem infecção do trato urinário, com sangue na urina, incontinência urinária, anemia, tremor, rinite, problemas hepáticos.
- rivastigmina: os efeitos mais comuns são tontura, dor de cabeça, náusea, vômito, diarréia, perda de apetite, cansaço, insônia, confusão mental e dor abdominal. Menos comumente pode ocorrer depressão, ansiedade, sonolência, alucinações, desmaios, hipertensão, dispepsia, prisão de ventre, gases, perda de peso, infecção do trato urinário, fraqueza, tremor, angina, úlcera gástrica ou duodenal, erupções cutâneas.
- medicamentos estão contra-indicados em casos de hipersensibilidade (alergia) conhecida aos fármacos;
- o risco da ocorrência de efeitos adversos aumenta com a superdosagem.
Estou ciente de que este medicamento somente pode ser utilizado por mim, comprometendo-me a devolvê-lo caso não queiraou não possa utilizá-lo ou se o tratamento for interrompido. Sei também que continuarei ser atendido, inclusive em caso de eu desistir de usar o medicamento.
Autorizo o Ministério da Saúde e as Secretarias de Saúde a fazer uso de informações relativas ao meu tratamento, desde que assegurado o anonimato.
O meu tratamento constará do seguinte medicamento:
( ) donepezila
( ) galantamina
( ) rivastigmina
Local: Data: |
||
Nome do paciente: |
||
Cartão Nacional de Saúde: |
||
Nome do responsável legal: |
||
Documento de identificação do responsável legal: |
||
Assinatura do paciente ou do responsável legal |
||
Médico Responsável: |
CRM: | UF: |
Assinatura e carimbo do médico |
||
Observação: Este Termo é obrigatório ao se solicitar o fornecimento de medicamento do Componente Especializado da Assistência Farmacêutica (CEAF) e deverá ser preenchido em duas vias, ficando uma arquivada na farmácia e a outra entregue ao usuário ou seu responsável legal.
MINI EXAME DO ESTADO MENTAL – MEEM
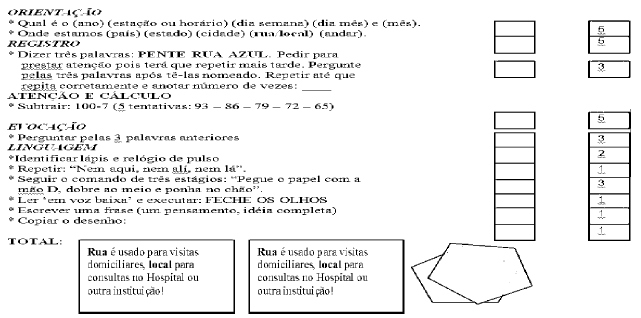
Estação do ano é utilizada no sul do Brasil. Horário (com tolerância de 1 hora para mais e para menos) é utilizado nas demais regiões.
Rua é usado para visitas domiciliares.
Local para consultas no Hospital ou outra instituição!
ESCALA CDR: CAIXA DE ESCORES PARA ESCORE FINAL
Saudável CDR 0 |
Dem. questionável CDR 0,5 |
Demência leve CDR 1 |
Demência moderada CDR 2 |
Demência grave CDR 3 |
|
MEMÓRIA |
Sem perda de memória, ou apenas esquecimento discreto e inconsistente. |
Esquecimento leve e consistente; lembrança parcial de eventos; "esquecimento |
Perda de memória moderada, mais acentuada para |
Perda de memória grave; apenas material mui- |
Perda de memória grave; apenas fragmentos permanecem. |
ORIENTAÇÃO |
Plenamente orientado. |
Plenamente orientado. |
Dificuldade moderada com as relações de tempo; |
Geralmente desorientado. |
Orientação pessoal apenas. |
JULGAMENTO E SOLUÇÃO DE PROBLEMAS |
Resolve bem problemas do dia-a-dia, juízo |
Leve comprometimento na solução de problemas, semelhanças e diferenças. |
Dificuldade moderada na solução de problemas, semelhanças e diferenças; julgamento social geralmente |
Gravemente comprometido para solução de |
Incapaz de resolver problemas ou de ter qualquer juízo crítico. |
ASSUNTOS NA COMUNIDADE |
Função independente na função habitual |
Leve dificuldade nestas atividades. |
Incapaz de funcionar independentete nestas ativid. embora ainda possa desempenhar algumas; pode parecer normal à avaliação superficial |
Sem possibilidade de desempenho fora de casa. Parece suficientemente bem para ser levado |
Sem possibilidade de desempenho fora de casa. Parece muito doente para ser |
LAR E PASSATEMPO |
Vida em casa, passatempos, e interesses |
Vida em casa, passatempos, e interesses |
Comp. leve, mas evidente em casa; abandono das tarefas + difíceis; passatempos e interesses mais complicados são também abandonados. |
Só realiza as tarefas mais simples. Interesses |
Sem qualquer atividade significativa em |
CUIDADOS PESSOAIS |
Plenamente capaz. |
Plenamente capaz. |
Necessita assistência ocasional. |
Requer assistência no vestir e na higiene. |
Muito auxílio nos CP. Em geral incontinente. |