Este texto não substitui o publicado no Diário Oficial da União

Secretaria de Vigilância em Saúde
PORTARIA Nº 34, DE 28 DE JULHO DE 2005
Regulamenta o uso de testes rápidos para diagnóstico da infecção pelo HIV em situações especiais.
O SECRETÁRIO DE VIGILÂNCIA EM SÁUDE, no uso das atribuições que lhe confere o Art.36 do Decreto nº 4.726, de 9 de junho de 2003,e
Considerando que o conhecimento do status sorológico da infecção pelo HIV e a precocidade do diagnóstico torna possível à adoção de medidas que possibilitam a interrupção da cadeia de transmissão, além de permitir uma atenção adequada para os indivíduos infectados;
Considerando que, em alguns locais do país, há a ausência de uma rede de laboratórios que permita um atendimento eficiente e integral da demanda de testes anti-HIV existente;
Considerando que o Ministério da Saúde promoveu uma avaliação do uso dos testes rápidos, que validou o seu uso para o diagnóstico da infecção do HIV; e
Considerando a necessidade de buscar alternativas para a ampliação do acesso ao diagnóstico da infecção pelo HIV, em atendimento aos princípios da eqüidade e da integralidade da assistência, bem como da universalidade de acesso aos serviços de saúde do Sistema Único de Saúde, resolve:
Art. 1º - Regulamentar a realização de testes rápidos para diagnóstico de infecção pelo HIV em serviços de saúde e maternidades, como estratégia de ampliação do acesso ao diagnóstico da infecção pelo HIV.
Art. 2º - O diagnóstico da infecção pelo HIV poderá ser realizado em serviços de saúde localizados em áreas de difícil acesso e maternidades, em parturientes que não tenham sido testadas para o anti-HIV no pré-natal.
Parágrafo único. Nos demais casos em que haja necessidade da implantação dessa estratégia, de acordo com a definição da Secretaria de Vigilância em Saúde - SVS/MS, utilizar-se-á os testes rápidos para detecção de anticorpos anti-HIV.
Art. 3º - O procedimento de realização dos testes rápidos somente poderá ser feito de acordo com normatização definida pela SVS/MS, a partir do resultado do estudo de avaliação dos referidos testes, conforme disposto no Anexo desta portaria.
Parágrafo único. Os procedimentos seqüenciados de que trata o Anexo desta Portaria, somente poderão ser aplicados em serviços de saúde e de acordo com cronograma de implantação estabelecido pela SVS/MS.
Art. 4º - Os testes rápidos para o diagnóstico da infecção pelo HIV serão realizado exclusivamente por profissionais de saúde capacitados, segundo programa de treinamento a ser definido pela SVS/MS.
Art. 5º - O diagnóstico da infecção pelo HIV utilizando-se testes rápidos somente poderá ser utilizado em indivíduos com idade acima de 18 (dezoito) meses.
Art. 6º - Todos os laboratórios públicos, privados e conveniados que realizam testes para detecção de anticorpos anti-HIV deverão seguir, obrigatoriamente, o disposto na Portaria nº 59/GM, de 28 de janeiro de 2003.
Art. 7º - As instituições privadas poderão realizar os testes rápidos com recursos próprios, desde que:
I. Adquiram os testes definidos pela SVS/MS;
II. Desenvolvam programa de treinamento para a realização dos testes rápidos, que deverá ser submetido para apreciação e aprovação da SVS/MS; e
III. Atendam ao disposto no Anexo desta Portaria.
Art. 8º - O Ministério da Saúde, por meio da SVS, responsabilizar- se-á pela aquisição e distribuição dos testes rápidos aos serviços de saúde e maternidades públicas, onde achar pertinente a aplicação destes.
§ 1º Os testes rápidos deverão ser submetidos a uma análise de controle no Instituto Nacional de Controle de Qualidade em Saúde - INCQS/FIOCRUZ, antes da conclusão do processo licitatório para a sua aquisição.
§ 2º A aquisição será efetivada após atender:
a) aprovação do INCQS/FIOCRUZ; e
b) registro no Ministério da Saúde.
Art. 9º - Esta Portaria entra em vigor na data de sua publicação.
JARBAS BARBOSA DA SILVA JÚNIOR
ANEXO
PROCEDIMENTOS SEQÜENCIADOS PARA REALIZAÇÃO DO DIAGNÓSTICO DA INFECÇÃO PELO HIV UTILIZANDO-SE TESTES RÁPIDOS EM INDIVÍDUOS COM IDADE ACIMA DE 18 (DEZOITO) MESES
Com o objetivo de realizar o diagnóstico da infecção pelo HIV, utilizando-se os testes rápidos, é exigido o cumprimento rigoroso dos procedimentos seqüenciados de acordo com o seguinte algoritmo:
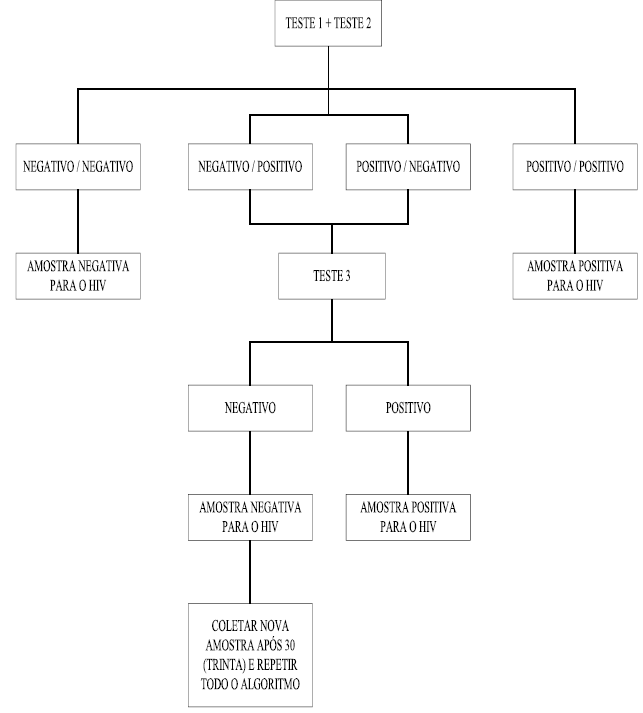
Todos os conjuntos de diagnóstico utilizados deverão estar obrigatoriamente registrados no Ministério da Saúde e deverão ter sido submetidos a uma análise de controle.
Os serviços de saúde que realizam testes rápidos para o diagnóstico da infecção pelo HIV deverão adotar, obrigatoriamente, a realização de dois testes - T1 e T2 - em paralelo, nesta primeira etapa de testes de qualquer amostra de sangue total, soro ou plasma. Os dois primeiros imunoensaios deverão apresentar valores de sensibilidade de 100% na análise de controle a ser realizada no INCQS/FIOCRUZ.
a) As amostras negativas nos dois testes rápidos
terão seu resultado definido como “Amostra negativa para HIV”;
b) As amostras que apresentarem resultados positivos nos dois testes rápidos
terão seu resultado definido como “Amostra positiva para HIV”;
Em caso de resultados discordantes nos dois primeiros ensaios, a amostra deverá ser submetida a um terceiro teste rápido - T3, que deverá apresentar valor igual ou superior a 99,5% de especificidade na análise de controle a ser realizada no INCQS.
a) Quando o terceiro teste apresentar resultado positivo,
a amostra será considerada “positiva para HIV”;
b) Quando o terceiro teste apresentar resultado negativo, a amostra será
considerada “negativa para o HIV”. Nesse caso, recomenda- se proceder
à coleta de uma segunda amostra, 30 dias após a emissão
do resultado da primeira amostra e repetir todo o conjunto de procedimentos
seqüenciados.
OBSERVAÇÕES:
1) A detecção de anticorpos anti-HIV em crianças com idade inferior a 18 meses não caracteriza infecção, devido à transferência dos anticorpos maternos anti-HIV através da placenta, sendo necessária a realização de outros testes complementares para a confirmação do diagnóstico.
2) Deverão constar dos laudos do diagnóstico da infecção pelo HIV o nome do ensaio e as metodologias de cada conjunto de diagnóstico.
3) Todos os conjuntos de diagnóstico deverão ser capazes de detectar anticorpos anti-HIV-1 e anti-HIV-2.