Este texto não substitui o publicado no Diário Oficial da União

Secretaria de Vigilância Sanitária
PORTARIA Nº 977, DE 5 DE DEZEMBRO DE 1998(*)
O Secretário de Vigilância Sanitária do Ministério da Saúde,
no uso de suas atribuições legais e considerando a necessidade de
constante aperfeiçoamento das ações de controle sanitário na área de
alimentos visando a proteção à saúde da população e a necessidade de
fixar a identidade e as características mínimas de qualidade a que
devem obedecer as Fórmulas Infantis para Lactentes e as Fórmulas
Infantis de Seguimento, resolve:
Art.1° Aprovar o Regulamento Técnico referente às Fórmulas Infantis para Lactentes e às Fórmulas Infantis de Seguimento, conforme os anexos 1 e 2 desta Portaria.
Art. 2° O descumprimento dos termos desta Portaria constitui infração sanitária sujeita aos dispositivos da Lei n.° 6437, de 20 de agosto de 1977 e demais disposições aplicáveis.
Art. 3º Esta Portaria entrará 'em vigor da data de sua publicação, revogando-se as disposições em contrário.
GONZALO VECINA NETO
ANEXO I
REGULAMENTO TÉCNICO PARA FIXAÇÃO DE IDENTIDADE
E QUALIDADE DE
FÓRMULAS INFANTIS PARA LACTENTES
1. ALCANCE
1.1. Objetivo
Fixar a identidade e as características mínimas de qualidade a que devem obedecer as Fórmulas Infantis para Lactentes.
1.2. Âmbito de Aplicação
Aplica-se às Fórmulas Infantis para Lactentes.
2. DESCRIÇÃO
2.1. Definições
2.1.1. Considera-se Fórmula Infantil para Lactentes o produto em forma líquida ou em pó, destinado a alimentação de lactentes, sob prescrição, em substituição total ou parcial do leite humano, para satisfação das necessidades nutricionais deste grupo etário. Excetuamse as fórmulas destinadas a satisfazer necessidades dietoterápicas específicas.
2.1.2. Lactente é a criança de zero a doze meses de idade incompletos (11 meses 0 29 dias)
2.2. Classificação
Quanto à forma de apresentação:
2.2.1. Líquida pronta para o consumo, não necessitando de diluição.
2.2.2. Líquida concentrada, necessitando de diluição em água, conforme instruções do fabricante.
2.2.3. Em p6, necessitando de água para o preparo, de acordo com as instruções do fabricante.
2.3. Designação
São designados como Fórmula Infantil ou Leite Infantil devendo constar o termo Lactente para os produtos definidos em 2.1.1.
3. REFERÊNCIAS
3.1. Codex Alimentarius Commission. JOINT FAO/WHO Food Standards Prograrnme. Codex Standard for Infant Formula - Codex STAN 72 - 1981 (amended 1983, 1985, 1987), vol. 4, 2nd ed., Rome, 1994.
3.2. The Commission of lhe European Communitics. Commission
Directiva of 14 may 1991 os Infant Formular and Follow - on
Formulae (91/321/EEC/ Official Journal of lhe European Communities
n.° L 175135-49, 1991.
3.3. Codex Alimentarias Commission. JOINT FAO/WHO Food Standards Programme. Advisory List of Mineral Salta and Vitamin Compounds for Use in Foods for Infanta and Children CAC/GL 10 - 1979 (amended 1983, 1991), vol. 4 , 2nd ed., Rome, 1994.
3.4. Codex Alimentarias Commission. Joint FAO/WHO. Recommended International Cede of Hygicnic Practice for Foods for Infanta and Children. CAC/RCP 21-1979, vol. 4., 2 nd ed., Rome, 1994.
3.5. Norma Brasileira para Comercialização de Alimentos para lactentes - Resolução n.° 31, de 12 de outubro de 1992. - Conselho Nacional de Saúde - Ministério da Saúde (DOU 13110192).
3.6. Portaria n.° 29, de 13/01/98 - Secretaria de Vigilância Sanitária (DOU de 30/03/98)
4. CARACTERÍSTICAS DE COMPOSIÇÃO E QUALIDADE.
4.1. Composição Essencial
A composição essencial das Fórniulas Infantis para Lactentes é à base de leite de vaca ou de outros animais e/ou de outros componentes comestíveis de origem animal e vegetal que se consideram adequados para a alimentação de lactentes.
4.1.1. Proteínas.
a) Deve conter no mínimo 1,8g por 100 kcal disponíveis ( ou 0,43g por 100 kJ disponíveis) de proteína de qualidade nutricional equivalente à da caseína ou maior quantidade de outra proteína em proporção inversa ao seu valor biológico. A qualidade da proteína não deve ser inferior a 85% da caseína. A quantidade total de proteína não deve exceder a 4g por 100 kcal disponíveis (ou 0,96g por 100 kl disponíveis) .
b) Podem ser adicionados aminoácidos isolados somente para me- 'hom. o valor nutricional da fórmula para lactentes. Aminoácidos essenciais podem ser adicionados para melhorar a qualidade protéica , somente em quantidades necessárias para este propósito e nas formas naturais L de aminoácidos.
4.1.2. Gordura
O produto deve conter ácido linoléico (em forma de triglicerídios) em quantidade não inferior a 300 mg por 100 kcal disponíveis (ou 70 mg por 100 kl disponíveis) e gordura em quantidade não inferior a 3,3 g e nem superior a 6,0g por 100 kcal disponíveis (ou não inferior a 0,8g nem superior a 1,5 g por 100 kJ disponíveis).
4.1.3. Vitaminas, Minerais e Colina
O produto deverá conter os teores mínimos c máximos de vitaminas, minerais biodisponíveis e colina, por 100 kcal disponíveis ( ou por 100 kJ disponíveis) conforme Anexo A.
4.2. Ingredientes Opcionais
a) Além das vitaminas e minerais listados no anexo A, outros nutrientes podem ser adicionados quando necessários para proporcionar aqueles normalmente encontrados no leite materno e para garantir que a formulação seja adequada como única fonte de nutrientes para o lactente.
b) A utilidade desses nutrientes deve ser cientificamente demonstrada.
c) Quando qualquer desses nutrientes for adicionado, a fórmula deverá conter quantidades significativas dos mesmos, baseados nas quantidades presentes no leite materno.
4.3. Compostos Vitamínicos e Sais Minerais
As vitaminas e minerais adicionados de acordo com o disposto no anexo A devem ser selecionados das listas de Referências de Sais Minerais e Compostos Vitamínicos para uso em Alimentos para Lactentes e Crianças -,CAC/GL 10 - 1979.
4.4. Quantidades de Sódio e Potássio
As quantidades de sódio e potássio derivados dos minerais eiou vitaminas adicionados ficarão dentro do limite estabelecido para sódio c potássio constante no Anexo A.
4.5. Consistência e Tamanho das Partículas
Quando preparado de acordo com as instruções do fabricante, o produto deverá ser isento de grurnos e partículas grossas, passível de escoamento através de bico plástico ou de borracha macia.
4.6. Requisitos de Pureza
Todos os ingredientes devem ser limpos, de boa qualidade, seguros e adequados para serem ingeridos por lactentes. Devem ajustar-se aos requisitos normais de qualidade, como cor, odor e sabor.
4.7. Proibição Específica
O produto e seus componentes não podem ser irradiados.
5. ADITIVOS E COADJUVANTES DE TECNOLOGIA
É permitida a utilização de aditivos intencionais e coadjuvantes de tecnologia conforme legislação específica.
6. CONTAMINANTES
6.1. Resíduos de agrotóxicos
Devem estar em consonância com os níveis toleráveis nas matériasprimas empregadas, estabelecidos pela legislação específica.
6.2. Resíduos de aditivos dos ingredientes
Os remanescentes dos aditivos somente serão tolerados quando em correspondência com a quantidade de ingredientes empregados, obedecida a tolerância fixada para os mesmos.
6.3. Contaminantes inorgânicos
Devem obedecer aos limites estabelecidos pela legislação específica.
6.4. Outros Contaminantes
O alimento não pode conter resíduos de hormónios, nem de antibióticos, determinados por meio de métodos de análise apropriados, bem como resíduos de substâncias farmacologicamente ativas.
7. HIGIENE
7.1. Condições Gerais
O produto deve ser preparado, embalado c'manipulado sob condições sanitárias adequadas, devendo ainda cumprir com o Código de Prática de Higiene para Fórmulas Infantis para Lactentes e de Seguimento (Codex Alimentarias CAC/RCP 21-1979), até que haja legislação específica sobre o assunto.
Os padrões microbiológicos, microscópicos e físico-químicos devem estar de acordo com a legislação específica.
8. EMBALAGEM
O produto deve ser embalado cm recipientes seguros e apropriados que garantam a higiene e outras qualidades do alimento.
Quando na forma líquida, o produto deve ser embalado em recipientes hermeticamente selados. Pode ser usado nitrogênio e di6xido de carbono como barreira de proteção para o produto.
9. ROTULAGEM
Na rotulagem das Fórmulas Infantis para Lactentes, além dos preceitos exigidos para os alimentos em geral, para os alimentos para fins especiais e pela Norma Brasileira para Comercialização de Alimentos para Lactentes devem constar:
9.1. No painel principal, a designação conforme item 2.3.
9.1.1. Quando no mínimo 90% da fonte protéica é derivada de leite integral ou leite desnatado como tal, ou com-pequena modificação, o produto pode ser designado como Fórmula Infantil à Base de Leite.
9.1.2. Quando 100% da fonte protéica é derivada de leite integral ou leite desnatado, como tal, ou com pequena modificação, o produto pode ser designado como Leite Infantil.
9.1.3. As fontes protéicas do produto devem ser claramente indicadas no rótulo.
9.1.4. Quando o produto não contiver leite ou qualquer derivado lácteo, deve constar no rótulo: "não contém leite ou produtos lácteos" ou uma frase equivalente.
9.1.5. Quando o produto for destinado a lactentes com necessidades nutricionais especiais, deve ser claramente identificada no rótulo a propriedade ou propriedades dietéticas nas quais está baseada, não podendo indicar condições de saúde para as quais a fórmula possa ser utilizada.
9.1.6. O produto contendo 1 mg ou mais de ferro por 100 kcal disponíveis deve ser designado "Fórmula Infantil com Ferro", "Leite Infantil com Ferro" ou "Fórmula Infantil com Ferro à Base de Leite".
9.1.7. É vedada nas embalagens e/ou rótulos, a utilização de ilustrações, fotos ou imagens de bebê ou outras formas que possam sugerir a utilização do produto como sendo o ideal para a alimentação do lactente, bens como a utilização de frases do tipo "quando não for possível" ou similares que possam por em dúvida a capacidade das mães de amamentarem seus filhos.
10. REGISTRO
As fórmulas Infantis para Lactentes estão sujeitas aos mesmos procedimentos administrativos exigidos para o registro de alimentos em geral.
ANEXO A
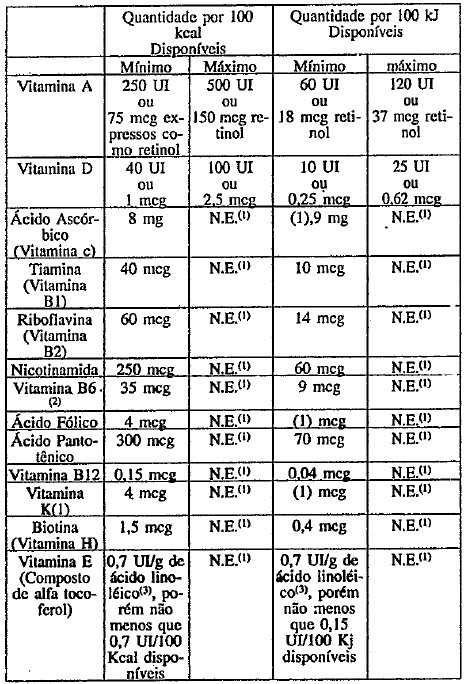
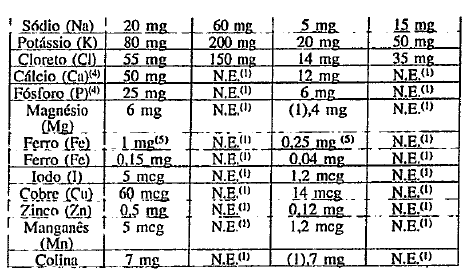
1. NE = não especificado
2. Fórmulas com teor de conter um mínimo de 15
3. Ou por gramas de ácidos graxos poliinsaturados, expressos comoácido linoléico.
4. A relação Ca: P não deve ser menor que 1,2 e nem maior que 2,0
5. Conforme item
ANEXO 2
REGULAMENTO TÉCNICO PARA FIXAÇÃO DE IDENTIDADE
E QUALIDADE DE
FÓRMULAS INFANTIS DE SEGUIMENTO
I. ALCANCE
1.1. Objetivo
Fixar a identidade e as características mínimas de qualidade a que devem obedecer as Fórmulas Infantis de Seguimento.
1.2. Âmbito de Aplicação
Aplica-se as Fórmulas Infantis de Seguimento.
2. DESCRIÇÃO
2.1. Definições
2.1.1. Considera-se Fórmula Infantil de Seguimento o produto em forma líquida ou em pó utilizado como substituto do leite materno a partir do 6° mês, quando indicado, e para crianças de primeira infância.
2.1.2. Lactente é a criança de zero a doze meses de idade incompletos (II meses e 29 dias).
2.1.3. Criança de primeira infância é a criança de doze meses a três anos de idade.
2.2 Classificação
Quanto à forma de apresentação:
2.2.1. Líquida pronta para o consumo, não necessitando de diluição.
2.2.2. Líquida concentrada, necessitando de diluição em água, conforme instruções do fabricante.
2.2.3. Em Pó, necessitando de água para o preparo, de acordo com as instruções do fabricante.
2.3. Designação
São designados como Fórmula Infantil ou Leite Infantil devendo constar o termo Seguimento, conforme definidos em 2.1.1.
3. REFERÊNCIAS
3.1. Codex Alimentarias Commission. JOINT FAO/WHO Food Standards Programe. Codex Standard for Follow - up Formula - Codex STAN 156 - 1987 (amcnded 1989), vol. 4, 2nd ed., Rome 1994.
3.2. The Commission of lhe European Communities. Commission Directive of 14 may 1991 on Infant Formulas and Follow - on Formulae (91/321/EEC/ Officio! Journal of the European Communities n° L 175/35-49, 1991.
3.3. Codex Alimentarias Commission, JOINT FAO/WHO Food Standards Programme. Advisory List of Mineral Salta and Vitamin Compounds for Use is Foods for Infanta and Children - CAC/GL 10 - 1979 (amended 1983, 1991), vol. 4 , 2nd ed., Rome, 1994.
3.4. Codcx Alimentarias Commission. Joint FAO/WHO. Recommended International Code of Hygienic Practice for Foods for Infanta and Children. CAC/RCP 21-1979, vol. 4., 2 nd ed., Rome, 1994.
3.5. Norma Brasileira para Comercialização de Alimentos para Lactentes• Resolução n° 31, de 12 de outubro de 1992. - Conselho Nacional de Saúde Ministério da Saúde (DOU 13/10/92).
4. CARACTERÍSTICAS DE COMPOSIÇÃO E QUALIDADE
4.1. Composição Essencial
a A composição essencial das Fórmulas Infantis de Seguimento é à base de leite de vaca ou de outros animais e/ou de outros componentes comestíveis de origem animal e vegetal, que se consideram adequados para a alimentação de lactentes e de crianças de primeira infância.
b. Quando a Fórmula de Seguimento for elaborada à base de leite deve ser preparada a partir de ingredientes como estabelecido no item 4.1 , ressalvado que um mínimo de 3g 1100 kcal disponíveis (ou 0,7g/ 100 k.1 disponíveis) de proteína devem ser derivadas de leite integral ou leite desnatado, como tal, ou com mínima modificação que não prejudique substancialmente o conteúdo de vitaminas ou minerais do leite c que represente um mínimo de 90% do total protéico.
4.1.1. Energia
Quando preparado de acordo com as instruções para uso, 1(X) ml do produto pronto para o ,onsuniu não devem fornecer menos do que 60 kcal ( ou 250 k.1) e não mais do que 85 kcal (ou 355 kJ).
4.1.2. Proteína
a. Deve conter no mínimo 3 .g por 100 kcal disponíveis ( ou 0,7 g por 100 k.1 disponíveis) de proteína de qualidade nutricional equivalente à da caseína ou maior quantidade de outra proteína em proporção inversa ao seu valor biológico. A qualidade da proteína não deve ser interior a 85% da caseína. A quantidade total de proteína não deve exceder a 5,5 g por 100 kcal disponíveis ( ou 1,3 g por kl disponíveis).
b. Podem ser adicionados aminoácidos isolados somente para melhorar o valor nutricional da fórmula de seguimento. Aminoácidos essenciais podem ser adicionados para melhorar a qualidade protéica, somente em quantidades necessárias para este propósito e nas formas naturais L de aminoácidos.
4.1.3. Gordura
a. O produto não deve conter menos que 3g e não mais que 6g por 100 kcal (0,7g e 1,4g por 100 kJ ).
b. O nível de ácido linoléico ( em forma de triglicerídeos) não deve ser menor que 300mg por 100 kcal (ou 7I,7mg por 100kJ).
4.1.4. Carboidratos
O produto deve conter Carboidratos nutricionalmente disponíveis adequados para alimentação de lactentes após o 6° mês e de crianças de primeira infância em quantidade suficiente para ajustar o produto à densidade energética de acordo com as necessidades estabelecidas no item 4.1.1.
4.1.5. Vitaminas e Minerais
O produto deverá conter os teores mínimos e máximos de vitaminas e minerais biodisponíveis por 100 kcal disponíveis ( ou por 100 Id disponíveis) conforme Anexo A.
4.2. Ingredientes Opcionais
4.2.1. Além das vitaminas e minerais listados no anexo A, outros nutrientes podem ser adicionados quando necessário para assegurar que o produto seja adequado como fonte para um esquema alimentar misto, destinado para utilização a partir do 6° mês.
4.2.2. A utilidade desses nutrientes deve ser cientificamente demonstrada.
4.2.3. Quando qualquer desses nutrientes for adicionado, a fórmula deverá conter quantidades significativas dos mesmos, baseadas nas necessidades de lactentes a partir do 6° mês e nas de crianças de primeira infância.
4.3. Compostos Vitamínicos e Sais Minerais
As vitaminas e minerais adicionados de acordo com o disposto no anexo A devem ser selecionados das listas de Referências de Sais Minerais e Compostos Vitamínicos para uso em Alimentos para Lactentes e Crianças - CAC/GL 10 - 1979.
4.4. Quantidades de Sódio e Potássio
As quantidades de sódio derivados dos ingredientes vitamínicos e minerais devem estar dentro do limite para sódio estabelecido no Anexo A.
4.5. Consistência e Tamanho das Partículas
Quando preparado de acordo com as instruções do fabricante, o produto deve ser isento de grunnos e partículas grossas.
4.6. Requisitos de Pureza
Todos os ingredientes devem ser limpos, de boa qualidade, seguros e adequados para serem ingeridos por lactentes a partir do 6° mês e por crianças de primeira infância. Devem ajustar-se aos requisitos normais de qualidade, como cor, odor e sabor.
4.7. Proibição Específica
O produto e seus componentes não podem ser irradiados.
5. ADITIVOS E COADJUVANTES DE TECNOLOGIA
É permitida a utilização de aditivos intencionais e coadjuvantes de tecnologia conforme legislação específica.
6. CONTAMINANTES
6.1. Resíduos de agrotáxicos
Devem estar em consonância com os níveis toleráveis nas matérias primas empregadas, estabelecidos pela legislação específica.
6.2. Resíduos de aditivos dos ingredientes
Os remanescentes dos aditivos somente serão tolerados quando em correspondência com a quantidade de ingredientes empregados, obedecida" a tolerância fixada para os mesmos.
6.3. Contaminantes inorgânicos
Devem obedecer aos limites estabelecidos pela legislação específica.
6.4. Outros contaminantes
O alimento não pode conter resíduos de hormônios, nem de antibióticos, determinados por meio de métodos de análise apropriados, bem como resíduos de substâncias famtacologicamente ativas.
7. HIGIENE
7.1. Condições Gerais
O produto deve ser preparado, embalado e manipulado sob condições sanitárias adequadas, devendo ainda cumprir com o Código de Prática de Higiene para Fórmulas Infantis para Lactentes e de Seguimento (Codex Alimentarias CAC/RCP 21-1979), até que haja legislação específica sobre o assunto.
Os padrões inicrobiológicos, microscópicos e físico-químicos devem estar de acordo com a legislação específica.
8. EMBALAGEM
O produto deve ser embalado em recipientes seguros e apropriados que garantam a higiene e outras qualidades do alimento. Quando na forma líquida, o produto deve ser embaladô em recipientes hermeticamente selados; pode ser usado nitrogênio e diáxido de carbono como barreira de proteção para o produto.
9. ROTULAGEM
Na rotulagent das Fórmulas Infantis para Lactentes, além dos preceitos exigidos para os alimentos em geral, para os alimentos para fins especiais c pela Norma Brasileira para Comercialização de Alimentos para Lactentes devem constar:
9.1. No painel principal, a designação conforme item 2.3.
9.1.1. Quando no mínimo 90% da fonte protéica é derivada de leite integral ou desnatado, como tal, ou com pequena modificação, o produto pode ser designado como Fórmula Infantil à Base de Leite.
9.1.2. Quando 100% da fonte protéica é derivada de leite integral ou desnatado, como tal, ou com pequena modificação, o produto pode ser designado como Leite Infantil.
9.1.3. As fontes protéicas do produto devem ser claramente indicadas no rótulo.
9.1.4. Quando o produto não contiver leite ou qualquer derivado lácteo, deve constar no rótulo: "não contém leite ou produtos lácteos" ou uma frase equivalente.
9.1.5. Quando o produto for destinado a lactentes com necessidades nutricionais especiais, deve ser claramente identificada no rótulo a propriedade ou propriedades dietéticas nas quais está baseada, não podendo indicar condições de saúde para as quais a fórmula possa ser utilizada.
9.1.6. Produto contendo 1 mg ou mais de ferro por 100 kcal disponíveis deve ser designado "Fórmula Infantil com Ferro", "Leite Infantil com Ferro" ou "Fórmula Infantil com Ferro à Base de Leite".
9:1.7. É vedada nas embalagens e/ou rótulos, a utilização de ilustrações, fotos ou imagens de bebé ou outras formas que possam sugerir a utilização do produto como sendo o ideal para a alimentação do lactente, bem como a utilização de frases do tipo "quando não for possível" ou similares que possam por em dúvida a capacidade das mães de amamentarem seus filhos.
10.REGISTRO
As Fórmulas Infantis para Seguimento estão sujeitas aos mesmos procedimentos administrativos exigidos para o registro de alimentos em geral.
ANEXO A
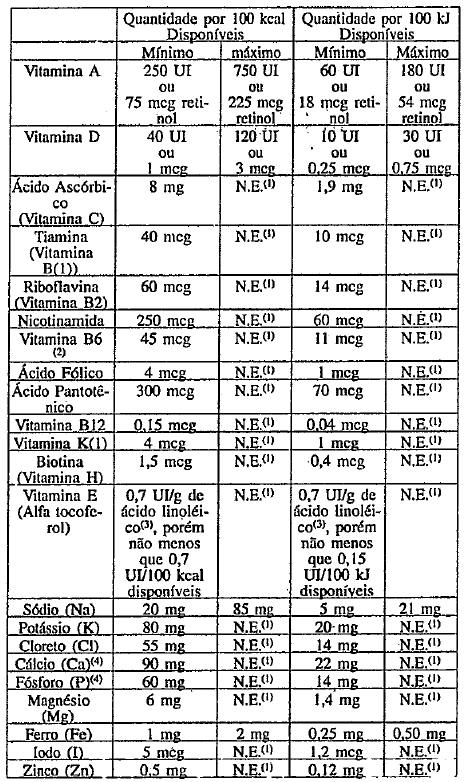
1. NE = não especificado
2. Mínimo de 15 meg de vitamina B6 por grama de proteína
3. Ou por gramas de ácidos gnoma poliinsaturados, expressos comoácido linoléico.
4. A relação Ca: P não deve ser menor que 1,2 e nem maior que 2,0.
(*) Republicada por ter saído com incorreção, do original, no D.O. nº 249-E, de 29-12-98, Seção 1, pág. 19.