Este texto não substitui o publicado no Diário Oficial da União

Agência Nacional de Vigilância Sanitária
RESOLUÇÃO-RDC Nº 214, DE 30 DE JULHO DE 2002 (*)
(Republicado pelo DOU Nº 160 de 20-08-2002, seção 1, pág. 27)
Estabelece condições para importação, comercialização,
exposição ao consumo dos
produtos incluídos na RDC nº 118 de 11 de
junho de 2001.
A Diretoria Colegiada da Agência Nacional de Vigilância
Sanitária, no uso da atribuição que lhe confere o art. 11, inciso IV, do
Regulamento da ANVISA, aprovado pelo Decreto nº 3.029, de 16 de
abril de 1999, c/c o § 1º do art. 111, do Regimento Interno aprovado
pela Portaria nº 593, de 25 de agosto de 2000, republicada em 22 de
dezembro de 2000, em reunião realizada em 17 de julho de 2002,
considerando as recomendações da Organização Mundial de
Saúde (OMS) sobre a prevenção das encefalopatias espongiformes
transmissíveis(TSE);
considerando a necessidade de padronizar dados sobre matéria-prima definida no Decreto nº 3.961, de 10 de outubro de
2001;
considerando a necessidade de informação sobre componentes
de produtos para uso em seres humanos;
considerando também o disposto na Resolução RDC nº 213,
de 30 de julho de 2002;
considerando a necessidade de promover a fiscalização sanitária
da importação de mercadorias de que trata a RDC ANVISA nº
213, de 30 de julho de 2002;
considerando a necessidade de garantir a introdução no território
nacional de mercadorias importadas que atendam aos padrões
de identidade e qualidade exigidos pela legislação sanitária vigente;
considerando a necessidade de estabelecer procedimentos a
serem cumpridos pelos importadores no tocante à importação de
mercadorias de que trata a RDC ANVISA nº 213, de 30 de julho de
2002;
considerando a necessidade de uniformizar procedimentos de
fiscalização sanitária relativos à internalização no território nacional ,
de mercadorias importadas, fica determinado:
Adotou a seguinte Resolução da Diretoria Colegiada e eu,
Diretor-Presidente, determino a sua publicação:
Art. 1º Para o cumprimento do artigo 2º da RDC ANVISA nº
213, de 30 de julho de 2002, é obrigatória a apresentação das informações
conforme disposto no anexo desta Resolução específica,
quanto ao ingresso, à comercialização e à exposição ao consumo, dos
produtos para uso em seres humanos, contendo matéria-prima cujo
material de partida seja obtido de tecidos/fluidos de animais das
espécies, bovina, ovina, caprina, bubalina e de ruminantes silvestres,
além dos documentos já previstos na legislação vigente.
Paragrafo único: As informações a que se refere este artigo
são pré-requisitos para efetuar a emissão da licença de importação.
Art. 2º A embalagem externa da mercadoria deverá portar
símile dos Quadros Q1 e Q2 do anexo desta Resolução em local
visível,com leitura e acesso fáceis para a inspeção sanitária.
Art. 3º A documentação comprobatória referente aos dados
do quadro Q3 deverá ser apresentada a cada importação.
Art. 4º Para a importação de produtos cujo material de partida
sejam tecidos/fluidos das categorias I, II, III, descrita no anexo 4
da RDC ANVISA nº 213, de 30 de julho de 2002, a documentação
referente ao quadro Q3 deverá ser analisada previamente ao embarque
pela área tecnica competente da ANVISA, em Brasília.
Art. 5º Para a importação de produtos cujo material de partida
sejam tecidos/fluidos apenas da categoria IV, descrita no anexo 4
da RDC ANVISA nº 213, de 30 de julho de 2002, a documentação
referente ao quadro Q3 deverá ser analisada previamente ao embarque
pela autoridade sanitária da ANVISA em exercício no local de desembaraço
da mercadoria.
Art. 6º A documentação comprobatória do quadro Q2, do
anexo dessa RE, será exigida:
1 nos momentos da solicitação de registro, da revalidação de
registro ou isenção de registro de produtos na ANVISA
2 nas alterações que impliquem em mudanças na composição
do produto, na origem ou nas características da matéria prima.
3 nas inspeções de rotina, incluindo inspeções para certificação
de boas práticas de fabricação e controle ( CBPFC).
4 A qualquer momento julgado pertinente pela autoridade
sanitária federal.
§1º as informações constantes nos quadros Q2 e Q3, deverão
ser sublinhadas nos respectivos documentos comprobatórios, contendo
os dados discriminados para todos os componentes da fórmula.
obedecendo à ordem e ao conteúdo.
§2º Para os tecidos obtidos de animais de espécies não incluídas
na RDC nº 213, de 30 de julho de 2002, será suficiente
apresentar o Certificado Veterinário Internacional.
Art. 7º Para produtos acabados importados relacionados nos
Arts. 1º, 3º ou 4º da RDC nº 213, de 30 de julho de 2002, deverá ser
apresentado Registro e Certificado de Livre Comércio do Produto no
País de Origem, devendo:
I - Declarar expressamente em seu texto a autorização de uso
ou livre comércio do produto no país de origem da fabricação do
produto, ou alternativamente referenciar o cumprimento de legislação
com este significado, devendo, neste caso, o solicitante comprovar
esta vinculação;
II - Ser firmado por dirigente do órgão federal de saúde
competente ou de outra instituição com competência legal para emitir
esses documentos, devendo, neste caso, o solicitante comprovar essa
competência;
Ill - Em casos excepcionais, a ANVISA poderá solicitar a
avaliação do caso pela câmara técnica específica;
Art. 8º Quando se tratar de matéria-prima ou produto importados,
somente serão válidos documentos consulares, com respectiva
tradução juramentada em língua portuguesa.
Art. 9º As pessoas físicas ou jurídicas que operem importações
de mercadorias através de remessas postal ou expressa, ficam
sujeitas às exigências constantes desta Resolução;
Art. 10 O deferimento da importação no SISCOMEX dar-seá
pela autoridade sanitária da ANVISA em exercício no local de
desembaraço da mercadoria importada, mediante a apresentação dos
documentos constantes do anexo da RDC ANVISA nº 213, de 30 de
julho de 2002 e de inspeção física satisfatória.
Art. 11 As pessoas físicas ou jurídicas que operem importação
de mercadorias através do Sistema Integrado de Comércio Exterior
- SISCOMEX receberão o resultado da análise do pleito de
importação "on line", através da autorização ou não da anuência
prévia em Licença de Importação - LI ou em Licença Simplificada de
Importação - LSI.
Art. 12 A empresa importadora deverá, previamente ao embarque
da mercadoria no exterior, solicitar autorização de embarque
no Sistema Integrado de Comércio Exterior/ SISCOMEX - Módulo
Importação.
I. A solicitação de embarque que trata este artigo deverá ser
encaminhada conforme legislação pertinente da área de Portos, Aeroportos
e Fronteiras.
II. Os produtos não incluídos na Resolução RDC 19/02,
também deverão obter validação dos dados Q1 e Q2 do anexo da
RDC ANVISA nº 213, de 30 de julho de 2002.
Art. 13 As mercadorias importadas de que trata esta Resolução
quando da chegada no território nacional deverão apresentarse
embaladas, identificadas, com prazo de validade em vigência e
dentro da expectativa de consumo no território nacional e dentro dos
padrões de identidade e qualidade exigidos pela legislação sanitária
vigente;
Art. 14 À chegada da mercadoria no território nacional, o
importador deverá apresentar ainda à autoridade sanitária em exercíci
no local de desembaraço, os seguintes documentos:
a) fatura comercial;
b) conhecimento de carga;
c) identificação de lote ou partida;
d) certificado de Controle de Qualidade expedido pelo fabricante.
Art 15 Poderão ser solicitadas informações adicionais pelo órgão regulatório em qualquer momento;
Art. 16 Esta Resolução entra em vigor 90 (noventa) dias
após sua publicação.
GONZALO VECINA NETO
ANEXO
DOCUMENTOS OBRIGATÓRIOS PARA O CUMPRIMENTO DA RDC nº 213 de 30 de julho de 2002
QUADRO Q1
Preenchimento do quadro 1:
*ALI: Alimentos, COS: Cosméticos, MED: Medicamentos, TEC: Produtos de tecnologia,
OTR: Outros, necessário especificar.
** Informações relativas às condições ambientais para manutenção da integridade e qualidade da
mercadoria importada (temperatura, umidade, luminosidade e outras julgadas necessárias).
Identificação do produto:
Identificação da empresa:
Preenchimento do quadro 2:
A impressão deverá estar no modo 'Paisagem' ou equivalente do programa processador de
texto.
1.No caso de medicamentos deverá ser encaminhado um quadro por forma farmacêutica.
QUADRO 2
a. Para ingredientes compostos por mais de uma substância, descrever no campo 2 como
ingredientes diferentes, utilizando linhas separadas para cada uma. Detalhar todos os demais campos
para cada uma delas. O nome da mistura deve ser repetida no campo 1.
b. Ingredientes tais como cápsulas gelatinosas, revestimentos e outras misturas também deverão
ter discriminadas as substâncias presentes.
c. Preenchimento do campo 5 de acordo com o quadro abaixo:
d. Quando a natureza (campo 5) for "síntese química total (código 1) ou mineral" (código 2),
preencher os campos 6, 7 ,8 e 9 com "NA" (não se aplica).
e. No campo 6, preencher no formato: nome científico (nome popular); no caso de espécie de
animal superior, o termo previsto é 'nome popular'.
Quadro Q 3
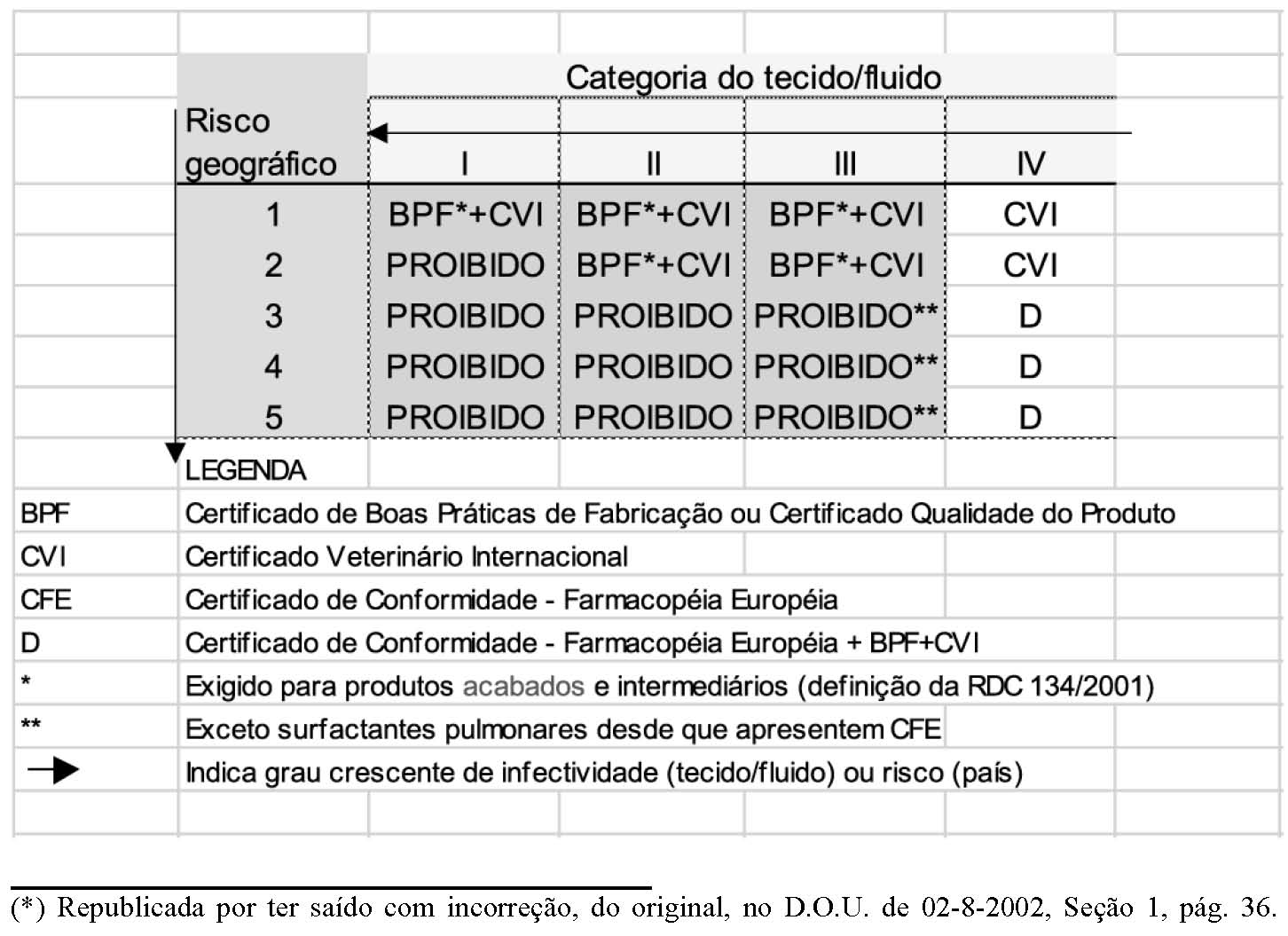
2. Apresentação de Certificados conforme descrito no quadro Q3 , respeitadas as proibições
descritas no artigo 1 da RDC nº 213 de 30 de julho de 2002.

Estabelece condições para importação, comercialização, exposição ao consumo dos produtos incluídos na RDC nº 213 de 30 de julho de 2002.
A Diretoria Colegiada da Agência Nacional de Vigilância
Sanitária, no uso da atribuição que lhe confere o art. 11, inciso IV, do
Regulamento da ANVISA, aprovado pelo Decreto nº 3.029, de 16 deabril de 1999, c/c o § 1º do art. 111, do Regimento Interno aprovado
pela Portaria nº 593, de 25 de agosto de 2000, republicada em 22 de
dezembro de 2000, em reunião realizada em 17 de julho de 2002,
considerando as recomendações da Organização Mundial de
Saúde (OMS) sobre a prevenção das encefalopatias espongiformes
transmissíveis(TSE);
considerando a necessidade de padronizar dados sobre matéria-prima definida no Decreto nº 3.961, de 10 de outubro de 2001;
considerando a necessidade de informação sobre componentes de produtos para uso em seres humanos;
considerando também o disposto na Resolução RDC nº 213, de 30 de julho de 2002;
considerando a necessidade de promover a fiscalização sanitária da importação de mercadorias de que trata a RDC ANVISA nº 213, de 30 de julho de 2002;
considerando a necessidade de garantir a introdução no território nacional de mercadorias importadas que atendam aos padrões de identidade e qualidade exigidos pela legislação sanitária vigente;
considerando a necessidade de estabelecer procedimentos a serem cumpridos pelos importadores no tocante à importação de mercadorias de que trata a RDC ANVISA nº 213, de 30 de julho de 2002;
considerando a necessidade de uniformizar procedimentos de fiscalização sanitária relativos à internalização no território nacional , de mercadorias importadas,
Adotou a seguinte Resolução da Diretoria Colegiada e eu, Diretor-Presidente, determino a sua publicação:
Art. 1º Para o cumprimento do artigo 2º da RDC nº 213, de 30 de julho de 2002, é obrigatória a apresentação das informações conforme disposto no anexo desta Resolução,quanto ao ingresso, à comercialização e à exposição ao consumo, dos produtos para uso em seres humanos, contendo matéria-prima cujo material de partida seja obtido de tecidos/fluidos de animais das espécies, bovina, ovina, caprina, bubalina e de ruminantes silvestres, além dos documentos já previstos na legislação vigente.
Paragrafo único: As informações a que se refere este artigo são pré-requisitos para efetuar a emissão da licença de importação.
Art. 2º A embalagem externa da mercadoria deverá portar símile dos Quadros Q1 e Q2 do anexo desta Resolução em local visível,com leitura e acesso fáceis para a inspeção sanitária.
Art. 3º A documentação comprobatória referente aos dados do quadro Q3 deverá ser apresentada a cada importação.
Art. 4º Para a importação de produtos cujo material de partida sejam tecidos/fluidos das categorias I, II, III, descrita no anexo 4 da RDC ANVISA nº 213, de 30 de julho de 2002, a documentação referente ao quadro Q3 deverá ser analisada previamente ao embarque pela área técnica competente da ANVISA, em Brasília.
Art. 5º Para a importação de produtos cujo material de partida
sejam tecidos/fluidos apenas da categoria IV, descrita no anexo 4
da RDC ANVISA nº 213, de 30 de julho de 2002, a documentação
referente ao quadro Q3 deverá ser analisada previamente ao embarque
pela autoridade sanitária da ANVISA em exercício no local de desembaraço
da mercadoria.
Art. 6º A documentação comprobatória do quadro Q2, do anexo dessa RE, será exigida:
1. nos momentos da solicitação de registro, da revalidação de registro ou isenção de registro de produtos na ANVISA
2. nas alterações que impliquem em mudanças na composiçãodo produto, na origem ou nas características da matéria prima.
3. nas inspeções de rotina, incluindo inspeções para certificação de boas práticas de fabricação e controle ( CBPFC).
4. A qualquer momento julgado pertinente pela autoridade sanitária federal.
§1º as informações constantes nos quadros Q2 e Q3, deverão ser sublinhadas nos respectivos documentos comprobatórios, contendo os dados discriminados para todos os componentes da fórmula. obedecendo à ordem e ao conteúdo.
§2º Para os tecidos obtidos de animais de espécies não incluídas na RDC nº 213, de 30 de julho de 2002, será suficiente apresentar o Certificado Veterinário Internacional.
Art. 7º Para produtos acabados importados relacionados nos Arts. 1º, 3º ou 4º da RDC nº 213, de 30 de julho de 2002, deverá ser apresentado Registro e Certificado de Livre Comércio do Produto no País de Origem, devendo:
I - Declarar expressamente em seu texto a autorização de uso ou livre comércio do produto no país de origem da fabricação do produto, ou alternativamente referenciar o cumprimento de legislação com este significado, devendo, neste caso, o solicitante comprovar esta vinculação;
II - Ser firmado por dirigente do órgão federal de saúde competente ou de outra instituição com competência legal para emitir esses documentos, devendo, neste caso, o solicitante comprovar essa competência;
Ill - Em casos excepcionais, a ANVISA poderá solicitar a avaliação do caso pela câmara técnica específica;
Art. 8º Quando se tratar de matéria-prima ou produto importados, somente serão válidos documentos consularizados, com respectiva tradução juramentada em língua portuguesa.
Art. 9º As pessoas físicas ou jurídicas que operem importações de mercadorias através de remessas postal ou expressa, ficam sujeitas às exigências constantes desta Resolução;
Art. 10 O deferimento da importação no SISCOMEX dar-seá pela autoridade sanitária da ANVISA em exercício no local de desembaraço da mercadoria importada, mediante a apresentação dos documentos constantes do anexo desta Resolução e de inspeção física satisfatória.
Art. 11 As pessoas físicas ou jurídicas que operem importação de mercadorias através do Sistema Integrado de Comércio Exterior - SISCOMEX receberão o resultado da análise do pleito de importação "on line", através da autorização ou não da anuência prévia em Licença de Importação - LI ou em Licença Simplificada de Importação - LSI.
Art. 12 A empresa importadora deverá, previamente ao embarque da mercadoria no exterior, solicitar autorização de embarque no Sistema Integrado de Comércio Exterior/ SISCOMEX - Módulo Importação.
I. A solicitação de embarque que trata este artigo deverá ser encaminhada conforme legislação pertinente da área de Portos, Aeroportos e Fronteiras.
II. Os produtos não incluídos na Resolução RDC 19/02, também deverão atender as isposições desta Resolução.
Art. 13 As mercadorias importadas de que trata esta Resolução quando da chegada no território nacional deverão apresentarse embaladas, identificadas, com prazo de validade em vigência e dentro da expectativa de consumo no território nacional e dentro dos padrões de identidade e qualidade exigidos pela legislação sanitária vigente;
Art. 14 À chegada da mercadoria no território nacional, o importador deverá apresentar ainda à autoridade sanitária em exercício no local de desembaraço, os seguintes documentos:
a) fatura comercial;
b) conhecimento de carga;c) identificação de lote ou partida;
d) certificado de Controle de Qualidade expedido pelo fabricante.
Art 15 Poderão ser solicitadas informações adicionais pelo órgão regulatório em qualquer momento;
Art. 16 Esta Resolução entra em vigor 90 (noventa) dias após sua publicação.
GONZALO VECINA NETO
Diretor
ANEXO
DOCUMENTOS OBRIGATÓRIOS PARA O CUMPRIMENTO DA RDC Nº 213 DE 30 DE JULHO DE 2002
QUADRO Q1
Preenchimento :
| Número do lote : |
|---|
| Nome do Fabricante : |
| Endereço: |
| Cidade: País: | ||
| ( ) P. acabado, finalidade <descrição>: __________________ (ALI/COS/MED/TEC/OTR) :_____ ( ) P. Semi-elaborado, finalidade <descrição>: __________________ (ALI/COS/MED/TEC/OTR) :_____ ( ) Insumo, finalidade <descrição>: ______________ finalidade, grupo* (ALI/COS/MED/TEC/OTR):_____ Nome comercial:__________________ | finalidade, finalidade, | grupo* grupo* |
| Concentração: ___________________ | ||
| Unidade: ________________________ | ||
| Quantidade (em unidades):____________________ |
| Forma física/farmacêutica ____________________ |
|---|
| Respectivo Quadro Q2 |
| Cuidados de conservação **: ________________ |
| Data de fabricação: ____________ Prazo de validade: _____________ |
* ALI: Alimentos, COS: Cosméticos, MED: Medicamentos, TEC: Produtos de tecnologia,
OTR: Outros, necessário especificar.
** Informações relativas às condições ambientais para manutenção da integridade e qualidade da mercadoria importada (temperatura, umidade, luminosidade e outras julgadas necessárias).
QUADRO Q2
Identificação do produto:
Identificação da empresa:
Preenchimento :
A impressão deverá estar no modo Paisagem` ou equivalente do programa processador de texto.
1.No caso de medicamentos deverá ser encaminhado um quadro por forma farmacêutica.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
| Nome comercial | Substância /ingrediente(a) | Sinônimos e fonte da sinonímia | Função na fórmula (incluir co-rantes e a ro m a t i zantes) | Natureza (d) | Gênero e Espécie vegetal ou microrg.(nome científico) (f) | Nome popular da espécie | Te c i d o / fluido e categoria conforme anexo Res. RDC nº 213/02 | Linhagem de células | Nome do fornecedor | País (fornecedor) (g) | País (origem do Tecido/Célula) |
a. Para ingredientes compostos por mais de uma substância, descrever no campo 2 como ingredientes diferentes, utilizando linhas separadas para cada uma. Detalhar todos os demais campos para cada uma delas. O nome da mistura deve ser repetida no campo 1.
b. Ingredientes tais como cápsulas gelatinosas, revestimentos e outras misturas também deverão ter discriminadas as substâncias presentes.
c. Preenchimento do campo 5 de acordo com o quadro abaixo:
| NATUREZA (para preenchimento do campo 5) | Código |
| SINTESE QUÍMICA TOTAL | 1 |
| MINERAL | 2 |
| ANIMAL SUPERIOR - EXTRAÇÃO | 3A |
| ANIMAL SUPERIOR - EXTRAÇÃO/SEMI-SÍNTESE | 3AS |
| ANIMAL SUPERIOR - CULTURA CELULAR | 3B |
| ANIMAL SUPERIOR - CULTURA CELULAR/SEMI-SÍNTESE | 3BS |
| VEGETAL - EXTRAÇÃO | 4A |
| VEGETAL - EXTRAÇÃO/ SEMI-SÍNTESE | 4AS |
| VEGETAL - CULTURA CELULAR | 4B |
| VEGETAL - CULTURA CELULAR/SEMI-SÍNTESE | 4BS |
| MICROORGANISMO - NÃO TRANSFORMADO | 5A |
| MICROORGANISMO - NÃO TRANSFORMADO/SEMI-SÍNTESE | 5AS |
| MICROORGANISMO - TRANSGÊNICO | 5B |
| MICROORGANISMO - TRANSGÊNICO/SEMI-SÍNTESE | 5BS |
d. Quando a natureza (campo 5) for "síntese química total (código 1) ou mineral" (código 2), preencher os campos 6, 7 ,8 e 9 com "NA" (não se aplica).
e. No campo 6, preencher no formato: nome científico (nome popular); no caso de espécie de animal superior, o termo previsto é nome popular`.
QUADRO Q 3
A apresentação de Certificados conforme descrito no quadro Q3, respeitadas as proibições descritas no artigo 1 da RDC nº 213 de 30 de julho de 2002.