Este texto não substitui o publicado no Diário Oficial da União

Agência Nacional de Vigilância Sanitária
RESOLUÇÃO -RDC Nº 346, DE 16 DE DEZEMBRO DE 2002
O Diretor-Presidente da Agência Nacional de Vigilância Sanitária, no uso da atribuição que lhe confere o inciso IV do art. 13 do Regulamento da ANVISA aprovado pelo Decreto nº 3.029, de 16 de abril de 1999,
considerando a necessidade de estabelecer as diretrizes técnicas para concessão, renovação, alteração e cancelamento de Autorização de Funcionamento ou de Autorização Especial de Funcionamento de Empresas que prestem serviços de armazenagem de mercadorias sob vigilância sanitária em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados;
considerando a necessidade de estabelecer as diretrizes técnicas para as Boas Práticas de Armazenagem a serem cumpridas pelas empresas que prestem serviços de armazenagem de mercadorias sob vigilância sanitária em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados;
considerando a necessidade de dar cumprimento às diretrizes técnicas relacionadas às Boas Práticas de Manipulação e Dispensação definidas em legislação sanitária pertinente para drogarias e farmácias;
considerando a necessidade de estabelecer a documentação a ser apresentada à autoridade sanitária para fins de concessão, renovação, alteração e cancelamento de Autorização de Funcionamento ou de Autorização Especial de Funcionamento de Empresas que prestem serviços de armazenagem de mercadorias sob vigilância sanitária em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados;
considerando a necessidade de uniformizar procedimentos relacionados à análise técnica documental para fins de concessão, alteração, renovação ou cancelamento de Autorização de Funcionamento ou da Autorização Especial de Funcionamento de Empresa;
considerando a urgência do assunto, adoto, ad referendum, a seguinte Resolução de Diretoria Colegiada e determino a sua publicação:
Art.1º Aprovar, conforme Anexo I, o Regulamento Técnico para a Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas interessadas em operar a atividade de armazenar mercadorias sob vigilância sanitária em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados.
Art.2º Aprovar, conforme Anexo II, As Orientações Técnicas para a Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas interessadas em prestar serviços de dispensação em drogarias e farmácias e manipulação em farmácias instaladas, em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira.
Art.3º Aprovar, conforme Anexo III, o Regulamento Técnico para as Boas Práticas de Armazenagem de mercadorias sob vigilância sanitária em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira, Recintos Alfandegados e áreas físicas cedidas a terceiros através de contrato de locação destinadas à armazenagem de mercadorias sob vigilância sanitária, integrantes de estabelecimentos sob jurisdição de empresas com permissão ou concessão do órgão competente do Ministério da Fazenda para operar como Estações Aduaneiras de Fronteira – EAF, Terminais Retroportuários Alfandegados – TRA ou Estações Aduaneiras Interiores – EADI.
Art.4º Instituir e aprovar conforme Anexo IV, o Relatório de Inspeção, a ser observado pelas Coordenações e Postos de Vigilância Sanitária de Portos, Aeroportos e Fronteiras da ANVISA, com vistas a organizar as informações obtidas na aplicação dos Roteiros de Inspeção dispostos nos Regulamentos anexos desta Resolução e em legislação sanitária pertinente.
Art.5º Caberá à Gerência Geral de Portos, Aeroportos e Fronteiras:
I - coordenar em nível nacional as ações de vigilância sanitária relacionadas à Autorização de Funcionamento ou Autorização Especial de Funcionamento de Empresas que operem a prestação de serviços de que tratam os Regulamentos Técnicos anexos desta Resolução;
II - proceder a emissão dos Certificados de Autorização de Funcionamento, Autorização Especial de Funcionamento e de Boas Práticas de Armazenagem;
III - propor a publicação em Diário Oficial da União, da concessão, alteração, renovação ou cancelamento de:
a) Autorização de Funcionamento de Empresa para atividade de armazenagem;
b) Autorização Especial de Funcionamento para atividade de armazenagem;
c) Certificação de Boas Práticas de Armazenagem.
Art. 6º Caberá às Coordenações e Postos de Vigilância Sanitária de Portos, Aeroportos e Fronteiras da ANVISA proceder a:
I - proceder a análise técnica documental e a emissão de parecer conclusivo dos pleitos relacionados à concessão, alteração, renovação ou cancelamento da Autorização de Funcionamento ou Autorização Especial de Funcionamento;
II - fiscalização sanitária dos estabelecimentos e das demais áreas físicas envolvidas com a armazenagem de mercadorias sob vigilância sanitária em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados;
III - fiscalização sanitária de áreas físicas cedidas a terceiros através de contrato de locação destinadas à armazenagem de mercadorias sob vigilância sanitária, integrantes de estabelecimentos sob jurisdição de empresas com permissão ou concessão do órgão competente do Ministério da Fazenda para operar como Estações Aduaneiras de Fronteira – EAF, Terminais Retroportuários Alfandegados – TRA ou Estações Aduaneiras Interiores – EADI; IV - fiscalização sanitária das farmácias e drogarias, instaladas em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteiras.
Art. 7º As alterações dos Regulamentos Técnicos anexos desta Resolução, devem ser aprovadas por esta Diretoria, ficando condicionadas à publicação em Diário Oficial da União – DOU.
Art. 8º A inobservância do disposto nesta Resolução e seus Anexos configuram infração de natureza sanitária, sujeitando os infratores às penalidades previstas na Lei nº6.437/77, sem prejuízo de outras sanções de natureza civil ou penal cabíveis.
Art. 9º Esta Resolução entrará em vigor trinta dias após a data de sua publicação em Diário Oficial da União, revogada a Resolução RDC n º 15, de 12 de janeiro de 2001.
GONZALO VECINA NETO
ANEXO I
REGULAMENTO TÉCNICO PARA FINS DE AUTORIZAÇÃO DE FUNCIONAMENTO E AUTORIZAÇÃO ESPECIAL DE FUNCIONAMENTO DE EMPRESA QUE OPERE A ATIVIDADE DE ARMAZENAR MERCADORIAS SOB VIGILÂNCIA SANITÁRIA EM ESTABELECIMENTOS INSTALADOS EM TERMINAIS AQUAVIÁRIOS, PORTOS ORGANIZADOS, AEROPORTOS, POSTOS DE FRONTEIRA, RECINTOS ALFANDEGADOS E ÁREAS FÍSICAS INTEGRANTES DE ESTABELECIMENTOS SOB JURISDIÇÃO DE EMPRESAS COM PERMISSÃO OU CONCESSÃO DE ESTAÇÕES ADUANEIRAS DE FRONTEIRA – EAF, TERMINAIS RETROPORTUÁRIOS ALFANDEGADOS – TRA OU ESTAÇÕES ADUANEIRAS INTERIORES – EADI, CEDIDAS À TERCEIROS ATRAVÉS DE CONTRATO DE LOCAÇÃO
Capítulo I
Terminologia Básica
Art. 1º Para efeito deste Regulamento, define-se por:
I - aferição: é o conjunto de atividades, que objetiva a conferência dos resultados analíticos de um equipamento em operação a partir de um padrão legal;
II - armazenagem: procedimento que possibilita o estoque ordenado e racional de várias classes de produtos e de matérias-primas;
III - autorização de funcionamento de empresa: autorização obrigatória a ser concedida pela autoridade sanitária competente às empresas prestadoras de serviços de interesse da saúde pública de que trata este regulamento;
IV - autorização especial de funcionamento de empresa: autorização obrigatória a ser concedida pela autoridade sanitária competente às empresas, instituições e órgãos, para o exercício da atividade de armazenagem de substâncias constantes das listas anexas a Portaria SVS/MS nº 344, de 12 de maio de 1998, e suas alterações e os medicamentos que as contenham;
V - drogaria: estabelecimento de dispensação e comércio de drogas, medicamentos, insumos farmacêuticos e correlatos em suas embalagens originais;
VI - farmácia: estabelecimento de manipulação de fórmulas magistrais e oficinais, de comércio de drogas, medicamentos e insumos farmacêuticos e correlatos, compreendendo o de dispensação e o de atendimento privativo de unidade hospitalar ou de qualquer outra equivalente de assistência médica;
VII - mercadorias sob vigilância sanitária: para efeito deste regulamento considerar-se-á as seguintes:
1- alimento: toda substância ou mistura de substâncias, no estado sólido, líquido, pastoso ou qualquer outra forma adequada, destinada a fornecer ao organismo humano os elementos normais, essenciais à sua formação, manutenção e desenvolvimento;
2- cosmético: o produto de uso externo, destinado à proteção ou ao embelezamento das diferentes partes do corpo, tais como, pós faciais, talcos, cremes de beleza, creme para as mãos e similares, máscaras faciais, loções de beleza, soluções leitosas, cremosas e adstringentes, loções para as mãos, base de maquilagem e óleos cosméticos, rouges, blushes, batons, lápis labiais, preparados anti-solares, bronzeadores e simulatórios, rímeis, sombras, delineadores, tinturas capilares, agentes clareadores de cabelos, fixadores, laquês, brilhantinas e similares, tônicos capilares, depilatórios ou epilatórios, preparados para as unhas e outros;
3- perfume: o produto de composição aromática à base de substâncias naturais ou sintéticas, que em concentração e veículos apropriados, tenha como principal finalidade a odorização de pessoas ou ambientes, incluindo os extratos, as águas perfumadas, os perfumes cremosos, preparados para banhos, e os odorizantes de ambientes, apresentados em forma líquida, geleificada, pastosa ou sólida;
4- produto de higiene: o produto de uso externo, antisséptico ou não, destinado ao asseio ou à desinfecção corporal, compreendendo os sabonetes, xampus, dentifrícios, enxaguatórios bucais, antiperspirantes, desodorantes, produtos para barbear e após barbear, estípticos e outros;
5- saneante domissanitário: substância ou preparação destinada à higienização, desinfestação ou desinfecção domiciliar em ambientes coletivos ou públicos, em lugares de uso comum e no tratamento da água, compreendendo: inseticida, raticida, desinfetante e detergente;
6- produto para diagnóstico: produto exclusivo para saúde, que transforma informações obtidas diretamente do organismo humano em dados utilizados para identificar condição fisiológica ou funcional deste organismo, conforme indicado pelo fornecedor;
7- produtos para saúde: aparelhos, instrumentos e acessórios usados em medicina, odontologia e atividades afins, bem como nas de educação física, embelezamento ou correção estética.
8- medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico;
9- matéria-prima: substâncias ativas ou inativas que se empregam para a fabricação de medicamentos e demais produtos de que trata o Decreto 3961, de 10 de outubro de 2001, mesmo que permaneçam inalteradas, experimentem modificações ou sejam eliminadas durante o processo de fabricação;
10- matéria-prima alimentar: toda substância de origem vegetal ou animal, em estado bruto, que para ser utilizada como alimento precise sofrer tratamento e/ou transformação de natureza física, química ou biológica;
11- insumo: droga ou matéria-prima aditiva ou complementar de qualquer natureza, destinada ao emprego em produtos e seus recipientes;
12- produto acabado: produto que tenha passado por todas as fases de produção e acondicionamento, pronto para a venda;
13- produto a granel (“bulk”): material processado que se encontra em sua forma definitiva, e que só requeira ser acondicionado ou embalado antes de converter-se em produto terminado. Os injetáveis na sua embalagem primária, para efeito deste Regulamento, serão considerados produtos a granel;
14- produto in natura: todo alimento de origem vegetal ou animal, para cujo consumo imediato se exija, apenas, a remoção da parte não comestível e os tratamentos indicados para a sua perfeita higienização e conservação;
15- produto semi-elaborado/intermediário: substância ou mistura de substâncias que requeira posteriores processos de produção, a fim de converter-se em produtos a granel;
VIII - Recintos Alfandegados entende-se por aqueles:
a) de zona primária: lojas franca, os pátios, armazéns, terminais e outros locais destinados à movimentação e ao depósito de mercadorias importadas ou destinadas à exportação que devam movimentar-se ou permanecer sob controle aduaneiro, assim como as áreas reservadas à verificação de bagagens destinadas ao exterior ou dele procedente;
b) zona secundária: os entrepostos, depósitos, terminais ou outras unidades destinadas ao armazenamento de mercadorias nas condições da alínea anterior, bem como, às dependências destinadas ao depósito de remessas postais internacionais e remessas expressas;
IX - responsável técnico: profissional legalmente habilitado, com inscrição em autarquia profissional, responsável pelas atividades integrantes do artigo 2º da Lei nº 6.360, de 23 de setembro de 1976 e artigo 45 do Decreto Lei nº 986, de 21 de outubro de 1969 ou pela tecnologia do produto final;
X - terminais alfandegados de uso público: são instalações destinadas à prestação dos serviços públicos de movimentação e armazenagem de mercadorias que estejam sob controle aduaneiro, não localizadas em área de porto ou aeroporto; São terminais alfandegados de uso público:
a) estações aduaneiras de fronteira - EAF, quando situados em zona primária de ponto alfandegado de fronteira ou em área contígua;
b) terminais retroportuários alfandegados – TRA, quando situados em zona contígua à de porto organizado ou instalação portuária, alfandegados;
c) estações aduaneiras interiores – EADI, quando situados em zona secundária.
Entende-se por área contígua:
a) no caso de EAF, aquela localizada no município onde se situa o ponto de fronteira;
b) no caso de TRA, aquela localizada no perímetro de 05 (cinco) quilômetros dos limites da zona primária demarcada pela autoridade aduaneira local. Capítulo II Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas que operem a Atividade de Armazenar Mercadorias sob Vigilância Sanitária
Art. 2º Ficam sujeitas à Autorização de Funcionamento, as empresas que prestem serviços de armazenagem de mercadorias sob vigilância sanitária, em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados.
§ 1º Inclui-se às disposições deste artigo às empresas que prestem serviços de armazenagem instaladas em áreas físicas cedidas à terceiros através de contrato de locação destinadas à armazenagem de mercadorias sob vigilância sanitária, integrantes de estabelecimentos sob jurisdição de empresas com permissão ou concessão do órgão competente do Ministério da Fazenda para operar como Estações Aduaneiras de Fronteira – EAF, Terminais Retroportuários Alfandegados – TRA ou Estações Aduaneiras Interiores – EADI.
§2º Inclui-se às disposições deste artigo as empresas que prestem serviços de armazenagem em embarcações flutuantes, barcaças, balsa, dique flutuante,chatas, plataformas ou outras embarcações.
Art. 3º Ficam sujeitas à Autorização Especial de Funcionamento as empresas que prestem serviços de armazenagem de substâncias constantes das listas anexas à Portaria SVS/MS nº 344, de 12 de maio de 1998, e suas alterações e os medicamentos que as contenham, em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados.
§. 1º Fica proibida a armazenagem substâncias integrantes das listas A1, A2, A3, B1, B2, C3, D1, E, F1, F2 e F3 da Portaria SVS/MS nº 344, de 12 maio de 1998, e os medicamentos que as contenham em Estações Aduaneiras de Fronteira – EAF, Terminais Retroportuários Alfandegados – TRA ou Estações Aduaneiras Interiores – EADI
§ 2º Fica proibida a armazenagem substâncias integrantes das listas A1, A2, A3, B1, B2, C3 e D1 da Portaria SVS/MS nº 344, de 12 maio de 1998 e os medicamentos que as contenham em áreas físicas cedidas à terceiros através de contrato de locação destinadas à armazenagem de mercadorias sob vigilância sanitária, integrantes de estabelecimentos sob jurisdição de empresas com permissão ou concessão do órgão competente do Ministério da Fazenda para operar como Estações Aduaneiras de Fronteira – EAF, Terminais Retroportuários Alfandegados – TRA ou Estações Aduaneiras Interiores – EADI.
Seção I
Abrangência da Autorização de Funcionamento e da Autorização Especial de Funcionamento de Empresa
Art. 4º A Autorização de Funcionamento de Empresa de que trata este Capítulo, será única e válida para todo território nacional. Parágrafo único. A unidade filial da empresa de que trata o artigo 2º, instalada em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados, que opere a armazenagem de mercadorias sob vigilância sanitária, deve submeter-se previamente à sua entrada em funcionamento, a cadastramento na Coordenação de Vigilância Sanitária de Portos, Aeroportos e Fronteiras da ANVISA, na(s) unidade(s) federada(s), onde se encontre instalado o estabelecimento filial prestador de serviço, acompanhado da documentação de que trata o art. 7º.
Art. 5º A Autorização Especial de Funcionamento concedida à empresa que opere atividade de armazenagem de substâncias sujeitas a controle especial e os medicamentos que as contenham, deve ser solicitada para cada estabelecimento onde ocorre a prestação de serviço.
Seção II
Petição para a Concessão, Renovação, Alteração ou Cancelamento de Autorização de Funcionamento, Autorização Especial de Funcionamento e Cadastro de Empresa Filial
Art. 6º As empresas de que tratam os artigos 2º e 3º, devem pleitear a concessão, renovação, alteração ou cancelamento da Autorização de Funcionamento e da Autorização Especial de Funcionamento para a atividade de armazenar mercadorias sob vigilância sanitária, bem como o cadastro de empresa filial, através da Petição de Autorização de Funcionamento de Empresa Prestadora de Serviço de Armazenagem em Portos, Aeroportos, Fronteiras e Recintos Alfandegados, conforme Anexo I.
Seção III
Documentação Exigida
Art. 7º Instituir e aprovar, conforme Anexo II, a lista de documentos a serem apresentados à autoridade sanitária competente, quando se tratar de pleito relacionado à concessão de:
I - Autorização de Funcionamento de Empresa interessada em armazenar mercadorias sob vigilância sanitária;
II - Autorização Especial de Funcionamento de Empresa interessada em armazenar substâncias sujeitas a controle especial e os medicamentos que as contenham;
III – Cadastro de Empresa Filial.
Art. 8º Os documentos de que tratam o Anexo II deste Regulamento, relativos aos pleitos de empresas de que trata o artigo 7º, devem apresentar-se à autoridade sanitária assinados pelo representante legal da empresa.
Parágrafo único: Os documentos técnicos em destaque no Anexo II, devem apresentar-se à autoridade sanitária assinados também, pelo responsável técnico da empresa.
Seção IV
Responsável técnico
Art. 9º. A formação profissional do responsável técnico da empresa que opere a atividade de armazenar as mercadorias sob vigilância sanitária de que trata os artigos 2º e 3º, deve atender às exigências para essa finalidade, constantes da legislação sanitária pertinente relacionada à classe de produto que se pretende armazenar.
Art. 10. A empresa que tem como pleito armazenar duas ou mais classes de produtos sob vigilância sanitária, em armazéns instalados em área geográfica sob circunscrição de uma mesma empresa, será facultada a cobertura da responsabilidade técnica exigida para fins de Autorização de Funcionamento e de Autorização Especial de Funcionamento de Empresa, a um único profissional; observado as exigências para essa responsabilidade, constantes da legislação sanitária pertinente relacionada à classe de produto que se pretende armazenar.
Seção V
Taxa de Fiscalização de Vigilância Sanitária
Art. 11. O comprovante de efetivação do pagamento da taxa de fiscalização de vigilância sanitária relacionado à Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresa que opere prestação de serviço de armazenagem, deve ser exigido por classe(s) de produto(s).
Seção VI
Concessão de Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresa
Art. 12. A concessão da Autorização de Funcionamento ou Autorização Especial de Funcionamento de empresa, dar-se-á mediante ao cumprimento das exigências sanitárias constantes deste Regulamento e das demais legislações sanitárias pertinentes.
Parágrafo único. Não deve ser concedida a Autorização de Funcionamento ou Autorização Especial de Funcionamento às empresas que já explorem a atividade de armazenagem de mercadoria sob vigilância sanitária, que apresentarem irregularidades sanitárias em suas instalações físicas, equipamentos ou em suas condutas operacionais que possam comprometer a saúde dos indivíduos expostos ou a manutenção da qualidade e a integridade das mercadorias armazenadas.
Art. 13. Fica desobrigada da Autorização de Funcionamento e da Autorização Especial de Funcionamento de que tratam este Capítulo, a empresa integrante da administração pública ou por ela instituída.
§ 1º A empresa de que trata este artigo deve atender as exigências técnicas previstas neste Regulamento e as Boas Práticas de Armazenagem.
§ 2º A empresa matriz de que trata este artigo ou a sua filial, devem previamente à prestação de serviço, submeter-se a cadastramento na Coordenação de Vigilância Sanitária de Portos, Aeroportos e Fronteiras da ANVISA, nas unidades federadas, onde preste serviço, a partir do preenchimento da Petição de que trata a Seção II deste Capítulo, acompanhada da documentação de que trata o art. 7º.
Seção VII
Inspeção para Concessão da Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas que operem a Atividade de Armazenar Mercadorias sob Vigilância Sanitária
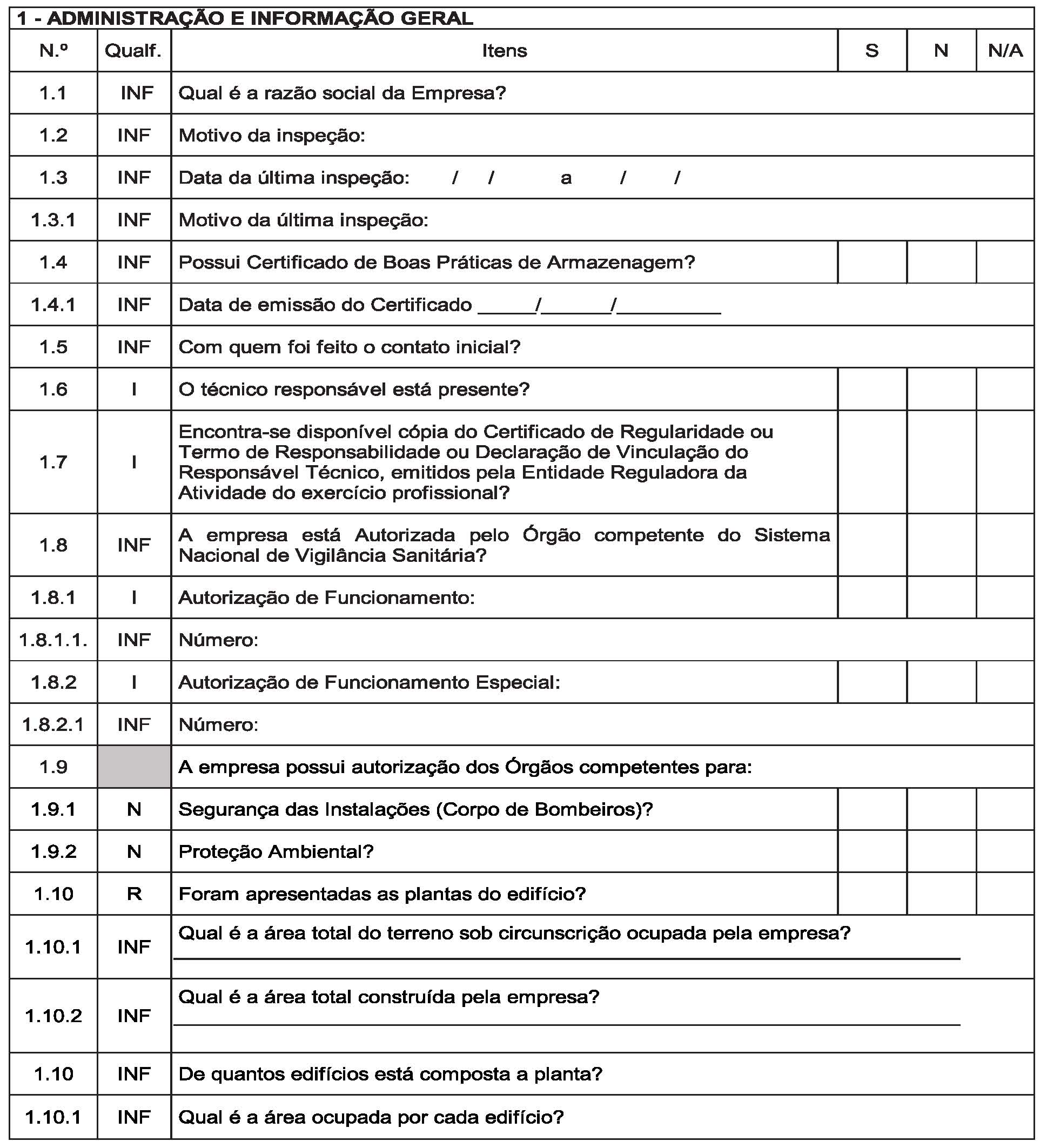
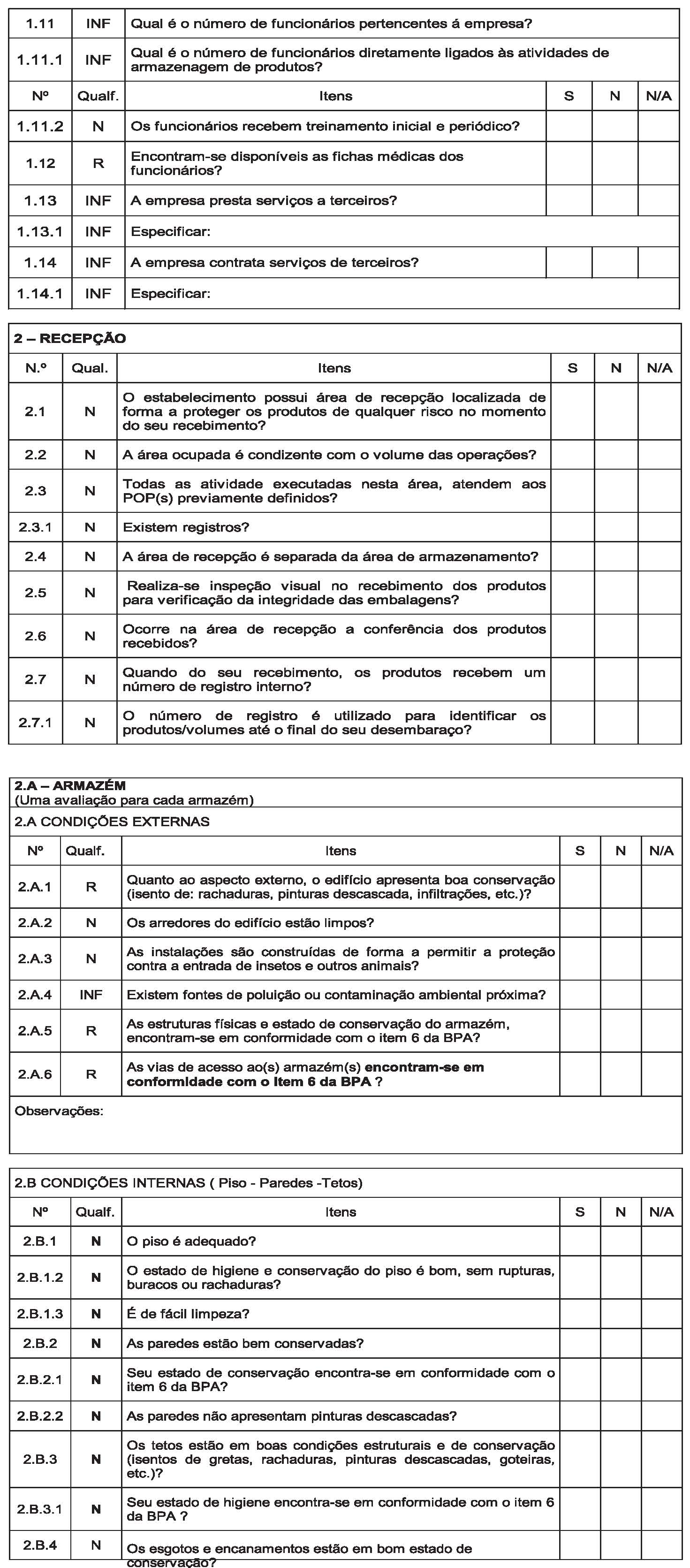
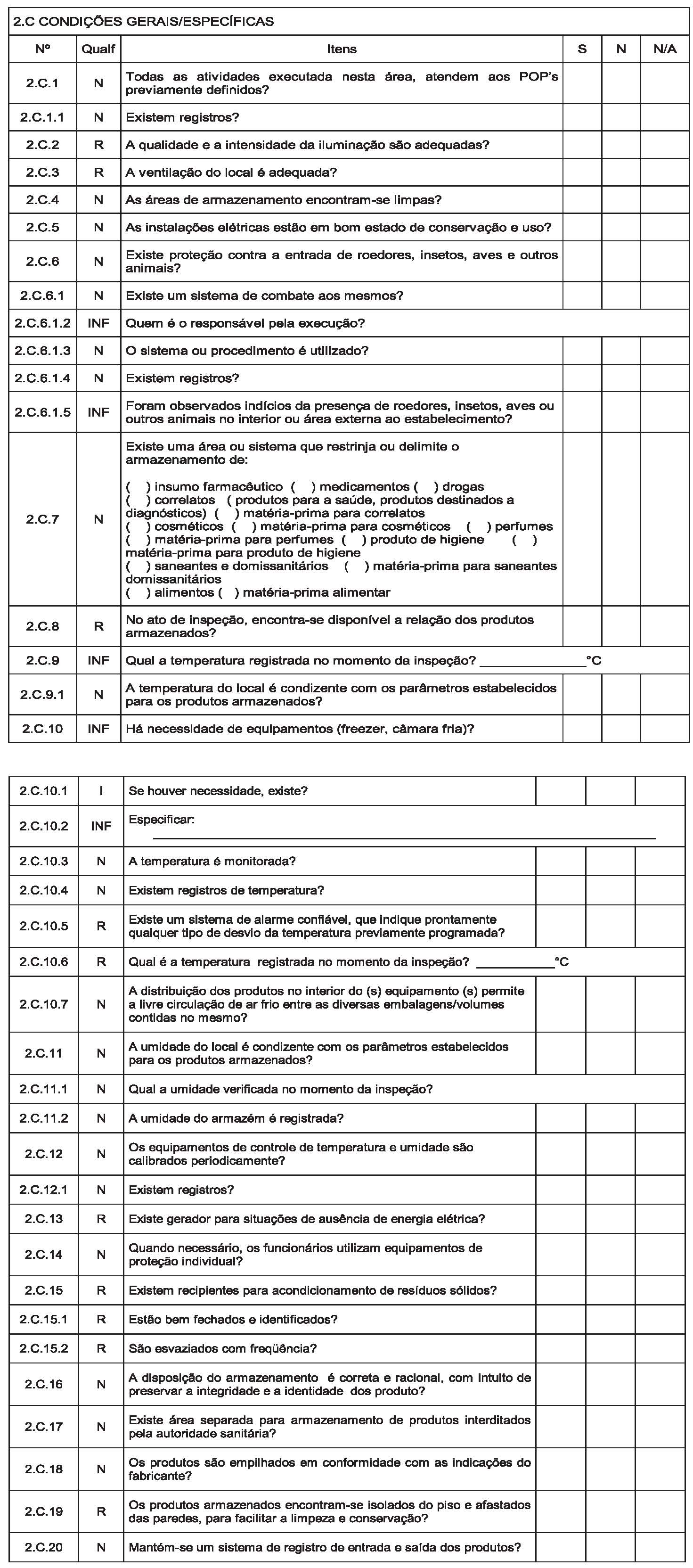
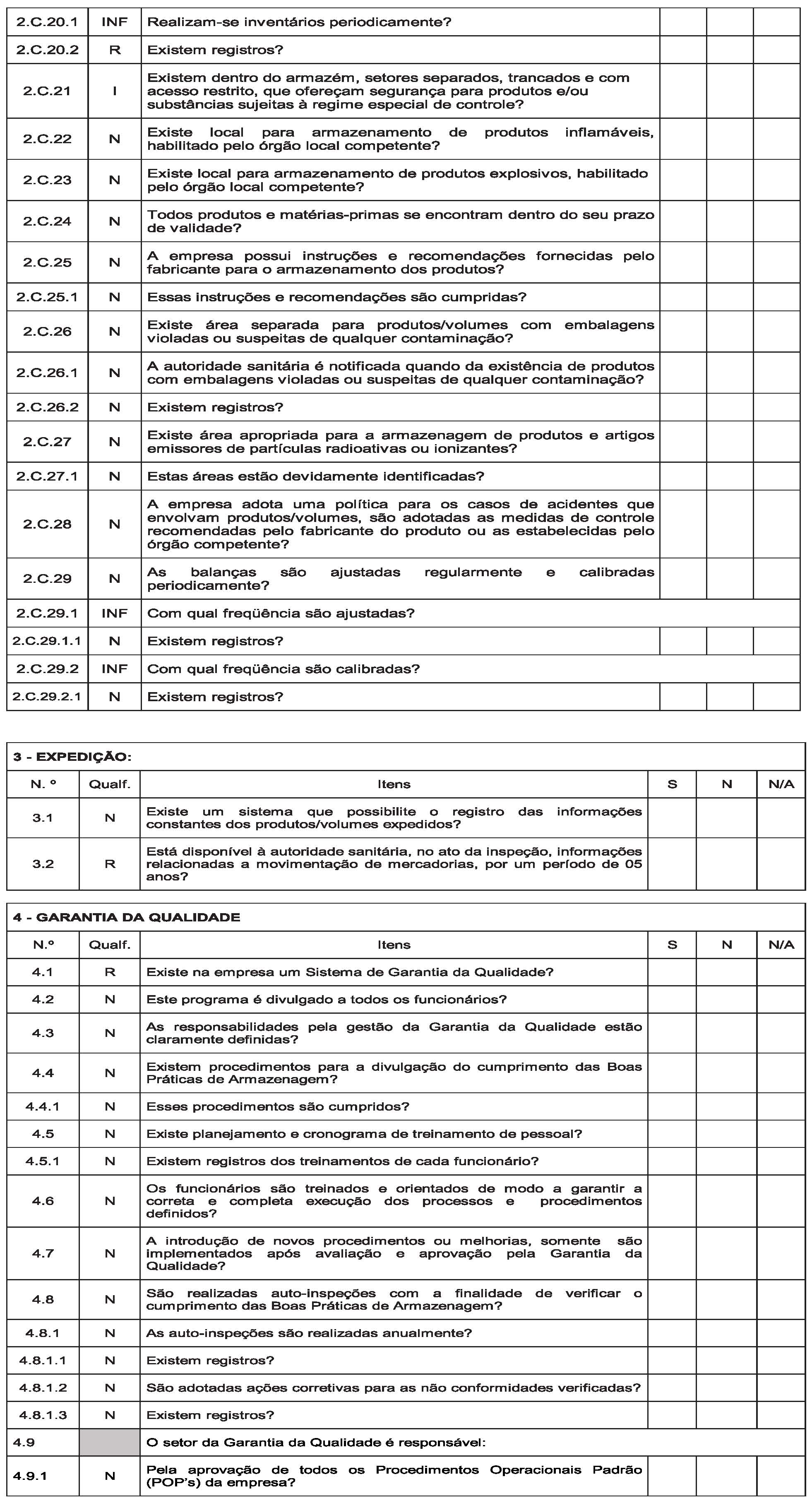
Art. 14. Instituir, conforme o Anexo III, o Roteiro de Inspeção para fins de Autorização de Funcionamento e Autorização Especial de Funcionamento para a atividade de armazenar mercadorias sob vigilância sanitária em Portos, Aeroportos, Fronteiras e Recintos Alfandegados – RIAF/PAF, a ser utilizado pela autoridade sanitária competente no desenvolvimento das ações de fiscalização sanitária em empresas que apresentaram pleito de Autorização de Funcionamento ou Autorização Especial de Funcionamento.
§ 1º Devem ser registradas no RIAF/PAF as informações relacionadas às inspeções sanitárias dos estabelecimentos de que trata este Regulamento;
§ 2º A cada inspeção física de estabelecimento de que trata o parágrafo anterior deve ser aplicado e emitido um RIAF/PAF;
§ 3º Nas reinspeções com vistas à verificação do cumprimento de não conformidades, devem ser aplicado o RIAF/PAF no que couber;
§ 4º O(s) RIAF/PAF emitido(s) relativo(s) ao pleito de Autorização de Funcionamento de Empresa, deve(em) constituir em documento(s) de instrução do processo administrativo único de Autorização de Funcionamento ou Autorização Especial de Funcionamento de Empresa.
Art. 15. A cada inspeção física de estabelecimento de que trata este Regulamento, deve ser emitido um Relatório de Inspeção.
§ 1º Devem ser registradas no Relatório de Inspeção de que trata este artigo, as informações relacionadas às inspeções sanitárias dos estabelecimentos;
§ 2º O Relatório de Inspeção, deve apresentar-se com parecer conclusivo da autoridade sanitária, quanto às condições técnico-operacionais, relacionadas à concessão de Autorização de Funcionamento e Autorização Especial de Autorização de Funcionamento para a atividade de armazenar mercadorias sob Vigilância Sanitária.
Seção VIII
Alteração na Autorização de Funcionamento de Empresa e Autorização Especial de Funcionamento de Empresa
Art. 16. Será obrigatória a comunicação imediata, ao órgão de vigilância sanitária competente de Portos, Aeroportos e Fronteiras nas unidades federadas, onde se encontra localizada a sede da empresa detentora de Autorização de Funcionamento ou Autorização Especial de Funcionamento, das ocorrências de:
I - alteração da razão social;
II - mudança de endereço;
III - alteração de responsável técnico ou representante legal;
IV - ampliação ou exclusão de classes de produtos;
V - inclusão ou exclusão de pessoas legalmente habilitadas a protocolarem documentos e receberem de termos legais expedidos pela autoridade sanitária.
Parágrafo único. As exigências deste artigo aplicam-se às unidades filiais de empresas detentoras de Autorização de Funcionamento de que trata o parágrafo único do artigo 4º, bem como às empresas de que trata o artigo 13, deste Regulamento.
Seção IX
Renovação da Autorização de Funcionamento e Autorização Especial de Funcionamento
Art. 17. A Autorização de Funcionamento de Empresa que opere a armazenagem de medicamentos e matérias-primas que os integrarão, em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados, deve ser renovada anualmente.
Art. 18. A empresa detentora de Autorização Especial de Funcionamento para a atividade de armazenar substâncias constantes das listas anexas a Portaria SVS/MS nº 344, de 12 de maio de 1998, e suas alterações e medicamentos que as integram; em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos e Recintos Alfandegados; deve ter sua Autorização Especial de Funcionamento, renovada anualmente.
Art. 19. A empresa detentora de Autorização de Funcionamento para a atividade de armazenar produtos e matérias-primas pertencentes às classes de cosméticos, perfumes, produtos de higiene, saneantes domissanitários, produtos médicos e produtos destinados para diagnóstico em estabelecimentos instalados em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira, está desobrigada de renovação anual.
Art. 20. A Autorização de Funcionamento de Empresa que opere armazenagem de alimentos, cosméticos, perfumes, produtos de higiene, saneantes domissanitários, produtos médicos e produtos para diagnóstico e matérias-primas que os integrarão em recintos alfandegados, deve ser renovada anualmente.
Seção X
Documentação Exigida para Fins de Alteração, Renovação e Cancelamento de Autorização de Funcionamento ou Autorização Especial de Funcionamento de Empresa
Art. 21. A empresa que tem como pleito a renovação, alteração da razão social, mudança de endereço, ampliação ou exclusão de classes de produtos, mudança de responsável técnico, mudança de representante legal e cancelamento da Autorização de Funcionamento e Autorização Especial de Funcionamento, deve atender as exigências documentais dispostas no Anexo II deste Regulamento.
§ 1º A solicitação formal de mudança de CNPJ, pela empresa, deve ser considerada como cancelamento da Autorização de Funcionamento e Autorização Especial de Funcionamento, cuja relação de documentos encontra-se descrita no Anexo II;
§ 2º Os documentos de que trata este artigo, devem apresentar-se à autoridade sanitária, assinados pelo representante legal da empresa;
§ 3° Os documentos técnicos, quando destacados no Anexo II, devem apresentar-se à autoridade sanitária, também assinados pelo responsável técnico da empresa.
Seção XI
Certificados de Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas Prestadoras de Serviços de Armazenagem de Mercadorias sob Vigilância Sanitária em Portos, Aeroportos, Fronteiras e Recintos Alfandegados
Art. 22. Instituir e aprovar, conforme Anexo IV, o Certificado de Autorização de Funcionamento de Empresas Prestadoras de Serviços de Armazenagem de mercadorias sob vigilância sanitária em Portos, Aeroportos, Postos de Fronteiras e Recintos Alfandegados.
Art. 23. Instituir e aprovar, conforme Anexo V, o Certificado de Autorização Especial de Funcionamento de Empresas Prestadoras de Serviços de Armazenagem de mercadorias sob vigilância sanitária em Portos, Aeroportos, Postos de Fronteiras e Recintos Alfandegados.
Art. 24. A 2ª via dos Certificados de que tratam este Capítulo, dar-se-á a partir de petição encaminhada à Coordenação de Vigilância Sanitária de Portos, Aeroportos e Fronteiras da Unidade Federada, onde a empresa opere sua prestação de serviço.
Seção XII
Armazenamento e Movimentação de Mercadoria sob Vigilância Sanitária
Art. 25. As matérias-primas ou os produtos (semi-elaborado, a granel e acabado), inclusive os nacionais, sob vigilância sanitária armazenados em área externa ou interna de estabelecimentos de que tratam os artigos 2º e 3º deste Regulamento, devem estar submetidos às condições ambientais de armazenagem determinadas pelo seu fabricante, com vistas à manutenção de suas integridades.
Seção XIII
Controle Sanitário de Resíduos Sólidos em Terminais Alfandegados de Uso Público
Art. 26. É obrigatório que, os Terminais Alfandegados de Uso Público que operem a atividade de armazenar mercadorias sob vigilância sanitária, disponham de Plano de Gerenciamento de Resíduos Sólidos - PGRS.
§ 1º Compete à Coordenação de Portos, Aeroportos e Fronteiras em exercício na unidade federada onde se encontra instalado o estabelecimento que opere a atividade de armazenar mercadorias sob vigilância sanitária, a fiscalização do PGRS;
§ 2º É obrigatório o cumprimento do disposto no PGRS aprovado pela autoridade sanitária competente;
§ 3º A elaboração do PGRS pela empresa administradora do estabelecimento deve atender às disposições constantes de Regulamento Técnico pertinente relacionado ao Gerenciamento de Resíduos Sólidos – PGRS, em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira e Recintos Alfandegados;
§ 4º A empresa deve dispor de Plano de Contingência para situações emergenciais relacionadas ao manejo de resíduos sólidos;
§ 5º A empresa administradora dos terminais alfandegados de uso público, contará com 180 (cento e oitenta) dias a partir da data de publicação deste Regulamento em Diário Oficial da União, para atender ao disposto neste artigo.
Seção XIV
Potabilidade da Água Ofertada para Consumo Humano em Terminais Alfandegados de Uso Público
Art. 27. A empresa detentora de Autorização de Funcionamento ou Autorização Especial de Funcionamento para armazenar mercadorias sob vigilância sanitária de que trata este Regulamento, caberá garantir a oferta de água potável em conformidade com as normas e padrões de potabilidade da água destinada ao consumo humano definidas na legislação sanitária pertinente.
§ 1º A empresa de que trata este artigo deve apresentar-se à autoridade sanitária, quando solicitado e com base nos intervalos de tempo abaixo descritos, as seguintes informações:
a) laudos de natureza microbiológica, a cada intervalo mensal;
b) laudos de natureza físico-química, a cada intervalo de seis meses;
c) medição de cloro residual, diariamente;
II - garantir a existência de padrões de arquitetura e engenharia nos pontos de oferta, captação, armazenamento e distribuição de água potável instalados em toda extensão da área sob circunscrição da empresa, de modo a evitar a ocorrência de contaminação cruzada;
III - disponibilizar, quando solicitado pela autoridade sanitária, a planta hidráulica atualizada do sistema de captação, tratamento, armazenamento e distribuição de água potável da área sob circunscrição da empresa;
IV - apresentar os Certificados ou os registros válidos resultantes dos procedimentos de Limpeza e Desinfecção de Reservatórios de Água Potável instalados;
§ 2º Em atendimento ao inciso I do § 1º deste artigo, a autoridade sanitária a partir de critérios epidemiológicos, de demanda de consumo ou da presença de fatores de risco, identificará os pontos de oferta ou reservatórios de água potável onde devem ser colhidas amostras a serem encaminhadas à análise laboratorial;
§ 3º A empresa, no atendimento ao parágrafo anterior, deve comunicar à autoridade sanitária, com antecedência de 48 (quarenta e oito) horas, a data e a hora da realização da coleta e respectiva metodologia;
§ 4º O sistema de armazenamento e distribuição de água potável, instalado na área sob circunscrição da empresa deve ser submetido a procedimentos de limpeza e desinfecção a cada intervalo de 180 (cento e oitenta) dias;
5º É obrigatória a limpeza e desinfecção do sistema de armazenamento e distribuição de água potável, sempre que houver suspeita de contaminação e ou após a realização de obras de reparos;
§ 6º A empresa de que trata o parágrafo anterior, ao término de cada prestação de serviço, deve emitir certificado próprio contendo informações referentes aos produtos utilizados, procedimentos de limpeza e desinfecção empregados.
7º Será facultado à empresa administradora do terminal alfandegado de uso público proceder os procedimentos de limpeza e desinfecção de que trata o parágrafo 4º deste artigo, para tal deve disponibilizar, à autoridade sanitária, quando solicitado as seguintes informações:
a) a metodologia empregada nas operações de limpeza e desinfecção;
b) o(s) produto(s) utilizado(s);
c) documento que registre as operações de limpeza e desinfecção, onde constem a data da realização das operações de limpeza e desinfecção , o(s) nome(s) do executor(es) e o nome do responsável por cada operação.
Seção XV
Controle de Vetores e Reservatórios de Doenças Transmissíveis e Animais Peçonhentos em Terminais Alfandegados de Uso Público
Art. 28. A empresa detentora de Autorização de Funcionamento ou Autorização Especial de Funcionamento para armazenar mercadorias sob vigilância sanitária de que trata este Regulamento, caberá manter a área administrativa sob sua responsabilidade, isenta de criadouros de formas evolutivas de insetos e insetos adultos; roedores; animais domésticos; pássaros e quaisquer outros vetores ou reservatórios de doenças transmissíveis; bem como de animais peçonhentos cuja presença implique em risco à saúde individual ou coletiva.
Parágrafo único. Para fins de dar cumprimento ao disposto neste artigo, deve ser implantado para cada estabelecimento destinado à armazenagem de mercadorias sob vigilância sanitária, um Plano de Controle de Vetores e Reservatórios de Doenças Transmissíveis e Animais Peçonhentos.
Seção XVI
Dos Efluentes Sanitários
Art. 29. A empresa de que trata este Regulamento deve manter os dutos de drenagem de dejetos e águas servidas originários da produção de bens ou da prestação de serviços sob manutenção, conservação e vazão adequados de modo a impedir vazamentos na área física externa sob responsabilidade e circunscrição da administração das empresas autorizadas para a atividade de armazenar mercadorias sob vigilância sanitária.
Seção XVII
Sistemas de Climatização
Art. 30. Devem ser cumpridas as exigências constantes da legislação sanitária pertinente, no tocante ao funcionamento e manutenção de equipamentos de climatização instalados em edificações sob responsabilidade e circunscrição da área administrativa de empresas autorizadas a funcionar como armazém de mercadorias sob vigilância sanitária.





ANEXO II
REGULAMENTO TÉCNICO OPERACIONAL PARA FINS DE AUTORIZAÇÃO DE FUNCIONAMENTO E AUTORIZAÇÃO ESPECIAL DE FUNCIONAMENTO DE EMPRESAS QUE PRESTEM SERVIÇOS DE DISPENSAÇÃO EM FARMÁCIAS E DROGARIAS E MANIPULAÇÃO EM FARMÁCIAS INSTALADAS EM TERMINAIS AQUAVIÁRIOS, PORTOS ORGANIZADOS, AEROPORTOS E POSTOS DE FRONTEIRAS
Capítulo I
Autorização de Funcionamento e Autorização Especial de Funcionamento de Farmácia e Drogaria Instalados em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira
Seção I
Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas
Art.1º Ficam submetidas à Autorização de Funcionamento, as farmácias e drogarias, instaladas em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira, que prestem serviços de dispensação de medicamentos.
Art.2º Ficam submetidas à Autorização de Funcionamento as farmácias, instaladas em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira, que prestem serviço de manipulação de medicamentos.
Art.3º Ficam submetidas à Autorização Especial de Funcionamento, as farmácias instaladas em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira, que prestem serviço de manipulação de substâncias constantes das listas anexas à Portaria SVS/MS nº 344, de 12 de maio de 1998, e suas alterações.
Art.4º A concessão, renovação e alterações da Autorização de Funcionamento e da Autorização Especial de Funcionamento de que tratam os artigos 1º, 2º e 3º desta Seção, devem ser concedidos às empresas que atendam as exigências constantes deste Regulamento.
Seção II
Abrangência da Autorização de Funcionamento e da Autorização Especial de Funcionamento
Art.5º A Autorização de Funcionamento e Autorização Especial de Funcionamento concedida à empresa detentora de farmácia deve ser única, solicitada para cada estabelecimento a ser instalado e em conformidade com o cronograma definido em legislação sanitária pertinente.
Art.6º A Autorização de Funcionamento concedida a empresa detentora de drogaria, deve ser única e solicitada para cada estabelecimento a ser instalado.
Seção III
Petição para a Concessão, Renovação, Alteração ou Cancelamento de Autorização de Funcionamento e Autorização Especial de Funcionamento de Farmácia e Drogaria
Art. 7º As empresas de que tratam este Regulamento devem pleitear a concessão, renovação, alteração ou cancelamento da Autorização de Funcionamento e da Autorização Especial de Funcionamento para a prestação de serviço de dispensação de medicamentos em farmácia e drogaria e manipulação em farmácia, através da Petição de Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas Detentoras de Farmácia e Drogaria, conforme Anexo I.
Seção IV
Documentação Exigida
Art.8º A documentação a ser apresentada à autoridade sanitária competente, quando se tratar de pleitos relacionados aos incisos abaixo, deve atender ao disposto na legislação sanitária pertinente:
I - concessão de Autorização de Funcionamento de Empresa detentora de estabelecimento de farmácia ou drogaria.
II - concessão da Autorização Especial de Funcionamento de Empresa detentora de estabelecimento de farmácia.
III - renovação; alteração da razão social; mudança de endereço; ampliação ou exclusão de atividades; ampliação ou exclusão de classes de produtos; mudança de responsável técnico; mudança de representante legal e Cancelamento de Autorização de Funcionamento e Autorização Especial de Funcionamento.
§ 1º A solicitação formal de mudança de CNPJ, pela empresa, deve ser considerada como cancelamento da Autorização de Funcionamento e Autorização Especial de Funcionamento, cuja relação de documentos encontra-se descrita no Anexo II.
§ 2º Os documentos de que trata este artigo devem apresentar-se à autoridade sanitária assinados pelo representante legal da empresa.
Seção V
Responsável Técnico
Art.9º A formação profissional do responsável técnico pela atividade de que trata este Regulamento, é a de Farmacêutico.
Seção VI
Taxa de Fiscalização de Vigilância Sanitária
Art.10. O comprovante de efetivação do pagamento da taxa de fiscalização de vigilância sanitária relacionado à Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas de que trata este Regulamento, deve ser exigido por atividade pleiteada.
Seção VII
Inspeção para Concessão da Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas que prestem serviços de Dispensação em Drogarias e Farmácias e Manipulação em Farmácias
Art. 11. Devem ser observadas pelas Coordenações e Postos de Vigilância Sanitária de Portos, Aeroportos e Fronteiras, quando do desenvolvimento das inspeções físicas, as exigências técnicas previstas em legislação sanitária pertinente relacionado à concessão da Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas que prestem serviços de Dispensação em Drogarias e Farmácias e Manipulação em Farmácias;
§ 1º Devem ser registradas no Relatório de Inspeção as informações relacionadas às inspeções sanitárias dos estabelecimentos;
§ 2º O Relatório de Inspeção, deve apresentar-se com parecer conclusivo da autoridade sanitária, quanto às condições técnico-operacionais, relacionadas à concessão de Autorização de Funcionamento e Autorização Especial de Funcionamento para as atividades de dispensação em farmácias e drogarias e manipulação em farmácias.
Seção VIII
Alterações na Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresa
Art.12. Será obrigatória a comunicação imediata, ao órgão de vigilância sanitária competente de Portos, Aeroportos e Fronteiras em exercício na unidade federada, onde se encontra localizada a empresa detentora de Autorização de Funcionamento ou Autorização Especial de Funcionamento de que tratam os artigos 1º, 2º e 3º, das ocorrências de:
I - alteração da razão social;
II - mudança de endereço;
III - alteração de responsável técnico ou representante legal;
IV - ampliação ou exclusão de classes de produtos;
V - inclusão ou exclusão de pessoas legalmente habilitadas a protocolarem documentos e receberem de termos legais expedidos pela autoridade sanitária; VI – ampliação ou exclusão de atividades.
Seção IX
Renovação da Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresa
Art.13. A Autorização de Funcionamento e Autorização Especial de Funcionamento de empresa que opere a prestação de serviço de dispensação de medicamentos em farmácia e drogaria e manipulação em farmácias instaladas em Terminais Aquaviários, Portos Organizados, Aeroportos e Postos de Fronteira, devem ser renovadas anualmente.
Seção X
Certificados de Autorização de Funcionamento e Autorização Especial de Funcionamento de Empresas Prestadoras de Serviços de Dispensação em Drogarias e Farmácias e Manipulação em Farmácias instaladas em Portos, Aeroportos e Postos de Fronteiras.
Art.14. Os Certificados de que trata esta Seção serão emitidos pela Gerencia de inspeção e Controle de Medicamentos e Produtos em conformidade com o disposto em legislação sanitária pertinente e após inspeção e relatórios conclusivos expedidos pela autoridade sanitária de Portos, Aeroportos e Fronteiras da ANVISA em exercício na Unidade Federada onde encontra-se instalado o estabelecimento.
Parágrafo único. A emissão da 2ª via dos Certificados de que trata este artigo, dar-se-á a partir de petição encaminhada à Coordenação de Vigilância Sanitária de Portos, Aeroportos e Fronteiras da Unidade Federada, onde a empresa opere sua prestação de serviço.

ANEXO III
REGULAMENTO TÉCNICO PARA AS BOAS PRÁTICAS DE ARMAZENAGEM DE MERCADORIAS SOB VIGILÂNCIA SANITÁRIA EM ESTABELECIMENTOS INSTALADOS EM TERMINAIS AQUAVIÁRIOS, PORTOS ORGANIZADOS, AEROPORTOS, POSTOS DE FRONTEIRAS, RECINTOS ALFANDEGADOS E ÁREAS FÍSICAS INTEGRANTES DE ESTABELECIMENTOS SOB JURISDIÇÃO DE EMPRESAS COM PERMISSÃO OU CONCESSÃO DE ESTAÇÕES ADUANEIRAS DE FRONTEIRA – EAF, TERMINAIS RETROPORTUÁRIOS ALFANDEGADOS – TRA OU ESTAÇÕES ADUANEIRAS INTERIORES – EADI, CEDIDAS À TERCEIROS ATRAVÉS DE CONTRATO DE LOCAÇÃO
Art. 1º Determinar a todos estabelecimentos e demais áreas físicas envolvidas com a atividade de armazenar mercadorias sob vigilância sanitária, instalados em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de Fronteira, Recintos Alfandegados e áreas físicas envolvidas com a armazenagem de mercadorias sob vigilância sanitária, integrantes de estabelecimentos sob jurisdição de empresas com permissão ou concessão do órgão competente do Ministério da Fazenda para operar como estações aduaneiras de fronteira – EAF, terminais retroportuários alfandegados – TRA ou estações aduaneiras interiores – EADI, cedidas à terceiros através de contrato de locação, o cumprimento de Boas Práticas de Armazenagem de que trata o Anexo I deste Regulamento.
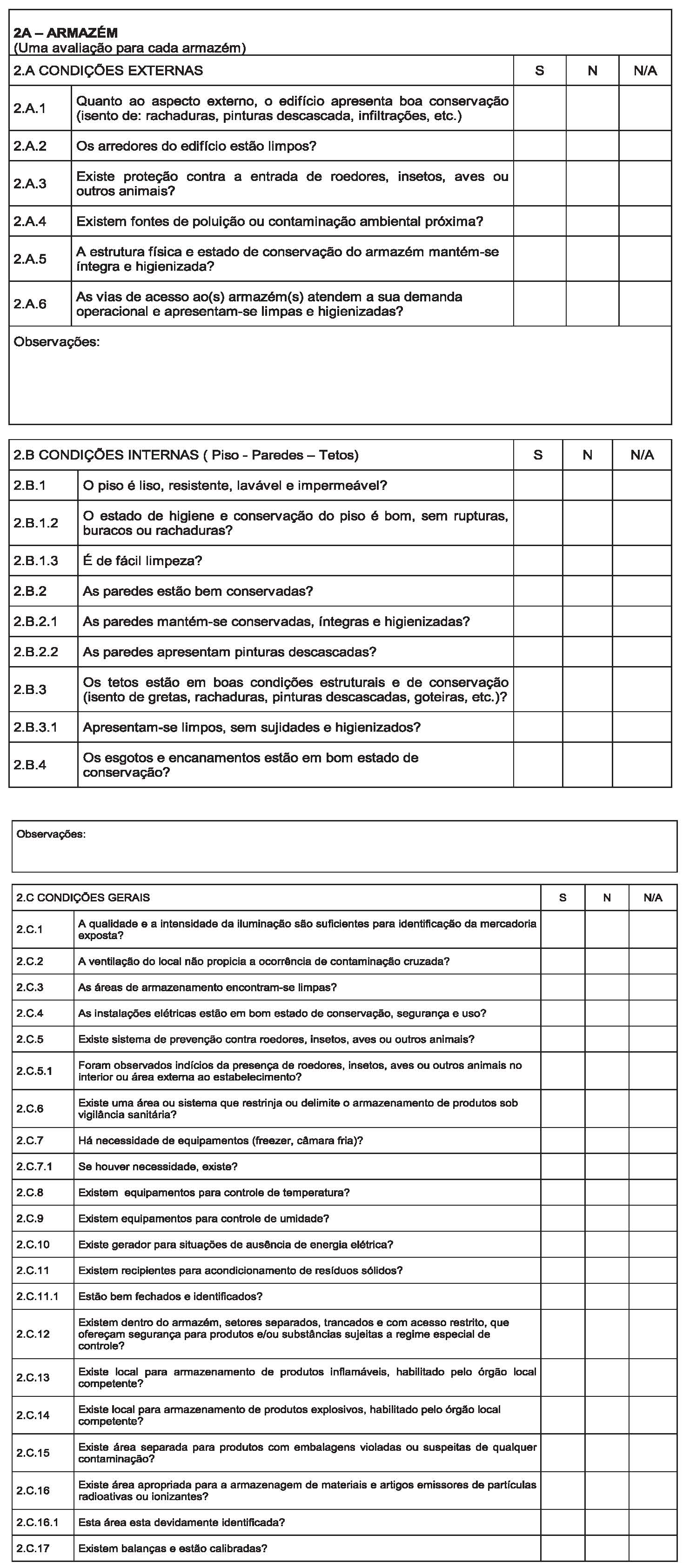
Art. 2º Instituir como norma de inspeção para fins da verificação do cumprimento das Boas Práticas para a atividade de armazenar as mercadorias sob vigilância sanitária de que trata este Regulamento, o Roteiro de Inspeção para Fins de Verificação das Boas Práticas de Armazenagem, conforme Anexo II.
§ 1º Devem ser registradas no Roteiro de Inspeção para Fins de Verificação das Boas Práticas de Armazenagem, as informações relacionadas às inspeções sanitárias dos estabelecimentos de que trata este Regulamento;
§ 2º A cada inspeção física do estabelecimento de que trata o parágrafo anterior deve ser aplicado e emitido um Roteiro;
§ 3º Nas reinspeções com vistas à verificação do cumprimento de não conformidades, deve ser aplicado o roteiro no que couber;
Art.3º A cada inspeção física de estabelecimento de que trata este Regulamento, deve ser emitido um Relatório de Inspeção.
§ 1º Devem ser registradas nos Relatórios, as informações relacionadas às inspeções sanitárias dos estabelecimentos de que trata este Regulamento;
§ 2º O Relatório de Inspeção emitido pela autoridade sanitária competente, deve apresentar-se com parecer conclusivo sobre a empresa, frente ao cumprimento das Boas Práticas de Armazenagem;
Art. 4º Instituir e aprovar a Classificação e Critérios de Avaliação dos itens constantes do Roteiro de Inspeção para Fins de Verificação das Boas Práticas de Armazenagem de mercadorias sob vigilância sanitária de que trata este Regulamento, com base no risco potencial de qualidade e segurança, conforme Anexo III.
Art. 5º Instituir e aprovar o Certificado de Boas Práticas de Armazenagem, conforme anexo IV.
§ 1º A concessão do Certificado de que trata este artigo, dependerá da comprovação, pela autoridade sanitária competente, do cumprimento de Boas Práticas de Armazenagem pela empresa solicitante;
§ 2º A concessão do Certificado de que trata este artigo, será negada sempre que não atendidas as exigências sanitárias relacionadas às Boas Práticas de Armazenagem;
§ 3º O Certificado de que trata este artigo terá validade de 1 hum) ano, a contar da data de sua publicação em Diário Oficial da União;
§ 4º O Certificado de que trata o parágrafo anterior poderá ser cancelado, a critério da autoridade sanitária fiscal, desde que observado em inspeção física o não cumprimento das Boas Práticas de Armazenagem e a existência de pontos críticos que coloquem em risco a integridade das mercadorias armazenadas ou a saúde dos usuários, que impliquem em resolubilidade de médio e longo prazo;
§ 5º A empresa detentora do Certificado de Boas Práticas de Armazenagem, não está desobrigada da fiscalização sanitária com vistas à verificação do cumprimento das Boas Práticas de Armazenagem.
Art. 6° A empresa que desenvolva a atividade de armazenagem de mercadorias sob vigilância sanitária, deve proceder auto-inspeções, em conformidade com o disposto neste Regulamento Técnico.
Art. 7º As empresas que já explorem a atividade de armazenagem de mercadorias sob vigilância sanitária, terão 180 (cento e oitenta) dias a contar da data de sua vigência para adequar-se às exigências de que trata este Regulamento.
ANEXO I
BOAS PRÁTICAS DE ARMAZENAGEM DE MERCADORIAS SOB VIGILÂNCIA SANITÁRIA
1. Objetivo Fixar os requisitos mínimos exigidos para as Boas Práticas de Armazenagem de mercadorias sob vigilância sanitária em estabelecimentos instalados em terminais aquaviários, portos organizados, aeroportos, postos de fronteiras, recintos alfandegados e áreas físicas integrantes de estabelecimentos sob jurisdição de empresas com permissão ou concessão de estações aduaneiras de fronteira – EAF, terminais retroportuários alfandegados – TRA ou estações aduaneiras interiores – EADI, cedidas à terceiros através de contrato de locação
2. Referências
Good Storage Practice. Working document QAS/00.001/Rev.1.Geneva, World Health Organization, 2000.
Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução nº 328, de 22 de julho de 1999. Dispõe sobre requisitos exigidos para a dispensação de produtos de interesse à saúde em farmácias e drogarias. Diário Oficial da União, Brasília, 26 jul. 1999.
Brasil. Ministério da Saúde. Secretaria de Vigilância Sanitária. Portaria nº 802, de 08 de outubro de 1998. Diário Oficial da União, Brasília, 07 de abril de 1999. Brasil. Ministério da Saúde. Secretaria de Vigilância Sanitária. Boas Práticas para a Fabricação de Produtos Farmacêuticos. Brasília, 1994.
Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Portaria nº 272, de 8 de abril de 1998. Aprova o Regulamento Técnico que fixa os quesitos mínimos exigidos para a Terapia de Nutrição Parenteral. Diário Oficial da União, Brasília, nº 71-E, p.78, 15 de abril de 1999.
Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Resolução RDC nº 134, de 13 de julho de 2001. Aprova normas para as Boas Práticas de Fabricação de Medicamentos. Diário Oficial da União, Brasília, 16 jul. 2001 3. Definições Para efeito deste Regulamento Técnico são adotadas as seguintes definições:
3.1 - armazenamento/estocagem:- procedimento que possibilita o estoque ordenado e racional de várias categorias de materiais e produtos;
3.4 - boas práticas de armazenagem - BPA: é a parte da garantia da qualidade onde assegura que os serviços prestados sejam controlados de modo consistente, com padrões de qualidade apropriados para o desenvolvimento de todas as etapas de armazenagem de produtos;
3.5 - calibração: conjunto de operações que estabelecem, sob condições especificadas, a relação entre os valores indicados por um instrumento de medida, sistema, ou valores apresentados por um material de medida, comparados àqueles obtidos com um padrão de referência correspondente;
3.6 - contaminação-cruzada: contaminação de determinada matéria-prima, produto intermediário, produto a granel ou produto terminado com outra matéria-prima, produto intermediário, produto a granel ou produto terminado, durante o período de armazenagem.
3.7 - embalagem: todas as operações incluindo o envase e a rotulagem, pelas quais o produto a granel deverá passar a fim de tornar-se produto acabado;
3.8 - garantia da qualidade: é a totalidade das providências tomadas com o objetivo de garantir a manutenção da integridade dos produtos sob vigilância sanitária, durante o desenvolvimento de todas as operações de sua armazenagem;
3.9 - lote: quantidade definida de matéria-prima, material de embalagem ou produto terminado fabricado em um único processo ou série de processos, cuja característica essencial é a homogeneidade e qualidade dentro dos limites especificados;
3.10 - procedimento operacional padrão (POP) - procedimentos escritos e autorizados que dão instruções detalhadas para a realização de operações específicas no desenvolvimento das operações de armazenagem de produtos e outras atividades de natureza geral;
3.11 - validação: ato documentado onde ateste que qualquer procedimento, processo, equipamento, material, atividade ou sistema esteja realmente conduzindo aos resultados esperados.
4 - Considerações Gerais Este Regulamento de Boas Práticas de Armazenagem (BPA), deve ser tomado como referência na inspeção das instalações destinada a armazenagem de produtos e como material de treinamento dos inspetores, assim como, no treinamento de profissionais responsáveis pelo processo de armazenagem de produtos nas empresas que desenvolvam estas atividades em Terminais Aquaviários, Portos Organizados, Aeroportos, Postos de fronteira e Recintos Alfandegados de uso público;
As BPA não abrangem aspectos ligados à segurança do pessoal envolvido nas atividades de que trata este regulamento, tais aspectos são regulamentados por legislação especifica, entretanto, é de responsabilidade das empresas garantir a segurança de seus trabalhadores.
O gerenciamento da qualidade é o aspecto da função de gerenciamento que determina e implementa a "Política da Qualidade", ou seja, as intenções e direções globais relativas à qualidade formalmente expressa e autorizada pela administração superior da empresa.
Os elementos básicos do gerenciamento da qualidade são: uma infra-estrutura apropriada ou "sistema de qualidade", englobando a estrutura organizacional, os procedimentos, os processos e os recursos; ações sistemáticas e precisas para assegurar que determinado produto (ou serviço) satisfaça as exigências quanto a sua qualidade.
Dentro de uma organização, a Garantia da Qualidade serve como ferramenta de gerenciamento.
5. Pessoal: A empresa deve ter um número suficiente de funcionários com as qualificações e experiências práticas necessárias ao desenvolvimento de todas as operações, pelas quais a empresa for responsável.
5.1 Responsabilidade
5.1.1 As atribuições e responsabilidades individuais devem estar formalmente descritas e perfeitamente compreendidas pelos envolvidos que devem possuir autoridade suficiente para desempenhá-las.
5.1.2 Compete ao responsável técnico
a) supervisão de todas as operações relacionadas com a armazenagem dos produtos deste regulamento;
b) aprovar os procedimentos relativos às operações de armazenagem e garantir a implementação dos mesmos;
c) garantir que os ajustes e a calibração dos equipamentos sejam executados e registrados e que os relatórios sejam colocados à disposição;
d) garantir que seja realizado treinamento inicial e contínuo dos funcionários e que os mesmos sejam adaptados conforme as necessidades.
e) garantir que somente as pessoas autorizadas e devidamente paramentadas entrem nas áreas de armazenagem;
f) verificar manutenção das instalações e dos equipamentos.
5.2 - Treinamento
5.2.1 Deve haver um programa de treinamento, com os respectivos registros, para todo o pessoal envolvido nas atividades que possam afetar a qualidade dos produtos armazenados.
5.2.2 Os funcionários devem receber treinamento inicial e contínuo, inclusive instruções de higiene relevantes às suas atividades, além de motivação para a manutenção dos padrões de qualidade.
5.2.3 Todo pessoal deve conhecer os princípios das BPA.
5.3 - Saúde, Higiene e Conduta.
5.3.1. A admissão dos funcionários deve ser precedida de exames médicos, sendo obrigatória a realização de avaliações médicas periódicas.
5.3.2 O acesso de pessoas às áreas de armazenagem deve ser restrito aos funcionários diretamente envolvidos com as atividades de armazenar produtos.
5.3.3 Todos os funcionários devem ser orientados quanto às práticas de higiene pessoal.
5.3.4 Não é permitido fumar, comer, beber ou manter plantas, alimentos, bebidas, fumos pessoais nas áreas de armazenagem.
5.3.5 Todos os funcionários devem ser instruídos e incentivados a reportar aos seus superiores imediatos quaisquer condições relativas ao ambiente, equipamento ou pessoal que considerem prejudiciais à qualidade e integridade dos produtos.
6. Instalações
6.1. Generalidades
6.1.1. As instalações devem ser localizadas, projetadas, construídas, adaptadas e mantidas de forma que sejam adequadas às operações a serem executadas. Seu projeto deve minimizar o risco de erros e possibilitar a limpeza e manutenção, de modo a evitar a contaminação cruzada, o acúmulo de poeira e sujeira ou qualquer efeito adverso que possa afetar a qualidade dos produtos.
6.1.2. As instalações devem possuir ambientes que quando considerados em conjunto com as medidas destinadas a proteger as operações de armazenagem, apresentem risco mínimo de avarias ou contaminação dos produtos.
6.1.3. As instalações utilizadas na armazenagem dos produtos devem ser projetadas e construídas de forma a possibilitar a limpeza adequada.
6.1.4. As instalações devem ser mantidas em bom estado de conservação, higiene e limpeza. Deve ser assegurado que as operações de manutenção e reparo não representem qualquer risco à qualidade dos produtos.
6.1.5. O fornecimento de energia elétrica, iluminação, ar acondicionado (temperatura e umidade) e ventilação, devem ser apropriados, de modo a não afetar direta ou indiretamente, os produtos durante os processos de armazenamento.
6.1.6. As instalações devem ser projetadas e equipadas de forma a permitirem a máxima proteção contra a entrada de insetos e outros animais.
6.2. Áreas auxiliares
6.2.1. As salas de descanso e refeitório devem ser separadas das demais áreas.
6.2.2. Os vestiários, lavatórios e os sanitários devem ser de fácil acesso e apropriados para o número de usuários. Os sanitários não devem ter comunicação direta com as áreas de armazenamento.
6.2.3. As áreas de manutenção devem estar situadas em locais separados das áreas de armazenamento. 6.3. Áreas de armazenamento
6.3.1. As áreas de armazenamento devem ter capacidade suficiente para possibilitar o estoque ordenado de várias categorias de produtos.
6.3.2. As áreas de armazenamento devem ser projetadas de forma que assegurem condições ideais de estocagem. Devem ser limpas, secas e mantidas em temperaturas compatíveis com os produtos armazenados. Quando forem exigidas condições especiais de armazenamento, temperatura e umidade, tais condições devem ser providenciadas, verificadas, monitoradas e registradas.
6.3.3. Nas áreas de recepção e expedição os produtos devem ser protegidos das variações climáticas. As áreas de recebimento devem ser projetadas de forma a permitir a conferência dos produtos recebidos antes de serem estocados.
6.3.4. A área de armazenamento deve dispor de recintos segregados para armazenar produtos com suspeita de comprometimento de qualidade e/ou interditados pelas autoridades sanitárias.
6.3.5. Os materiais altamente ativos, narcóticos, substâncias controladas, produtos, que apresentem risco de incêndio ou explosão e outros produtos perigosos devem ser estocados em áreas seguras e protegidas, devidamente segregados e identificados, de acordo com legislação especifica vigente.
6.3.6. Os ralos devem ser de tamanho adequado, para evitar os refluxos de líquidos ou gás e mantidos fechados. Devem sofrer manutenção e monitoramento constante. Se necessários, devem ser rasos para facilitar a limpeza e a desinfecção.
7. Documentação A documentação constitui parte essencial do sistema de Garantia da Qualidade e, deve estar relacionada com todos os aspectos das BPA. Tem como objetivo assegurar que todo pessoal envolvido com as operações relacionadas com a armazenagem de produtos saiba decidir o que fazer e quando faze-lo. Além disso, tem a finalidade de garantir, que a empresa, tenha todas as informações necessárias que possibilite a investigação da história de qualquer produto por ela armazenado. Todos os documentos podem ser reunidos em uma única pasta, ou permanecerem separados, facilmente disponíveis, constituindo o registro de todas as informações da história do produto armazenado.
7.1 Aspectos Gerais
7.1.1 Os documentos devem ser redigidos, revistos e distribuídos somente a pessoas designadas. Eles devem atender a todas as operações de armazenagem.
7.1.2. Os documentos originais devem ser aprovados, assinados e datados pelo responsável técnico. Nenhum documento deve ser modificado sem Autorização prévia.
7.1.3. O conteúdo dos documentos não pode ser ambíguo: o título, a natureza e o seu objetivo devem ser apresentados de forma clara, precisa e correta. Além disso, devem ser dispostos de forma ordenada e serem de fácil verificação. Os documentos reproduzidos devem ser legíveis e ter garantida a sua fidelidade em relação ao original.
7.1.4. As instruções e os procedimentos devem ser escritos em linguagem clara, inequívoca e aplicáveis de forma específica às instalações utilizadas.
7.1.5. Os documentos devem ser regularmente revistos e atualizados. Quando determinado documento for revisto, deve haver um sistema que impeça o uso inadvertido da versão substituída.
7.1.6. Quando os documentos exigirem a entrada de dados, estes devem ser claros, legíveis e indeléveis. Deve ser deixado espaço suficiente para cada entrada de dados.
7.1.7 Toda alteração efetuada em qualquer documento deve ser assinada e datada, a alteração deve possibilitar a leitura da informação original. Quando for o caso, deve ser registrado o motivo da alteração.
7.1.8. Deve ser mantido registro de todas as operações realizadas, de tal forma que todas as atividades referentes a armazenagem de produtos, possam ser rastreadas. Todos os registros, incluindo os referentes aos Procedimentos Operacionais Padrão (POP) devem ser retidos por, pelo menos, 05 anos. Quaisquer adversidades significativas ocorridas durante a armazenagem dos produtos devem ser registradas.
7.1.9. Os dados podem ser registrados através de sistema de processamento eletrônico ou por meios fotográficos ou outros meios confiáveis. Se o registro dos dados for feito através de processamento eletrônico, somente pessoas designadas podem modificar os dados contidos nos computadores. Deve haver registro das alterações realizadas. O acesso aos computadores deve ser restrito por senhas ou outros meios. A entrada de dados considerados críticos deve ser conferida por outra pessoa designada.
8 - Garantia da Qualidade
É a totalidade das providências tomadas com o objetivo de garantir a manutenção da integridade dos produtos sob vigilância sanitária, durante o desenvolvimento de todas as operações de sua armazenagem. Para que o objetivo de qualidade seja atingido de forma confiável, deve haver um sistema da Garantia da Qualidade totalmente estruturado e corretamente implementado, que incorpore as BPA. O cumprimento deste objetivo é responsabilidade da administração superior da empresa e exige a participação e o compromisso dos funcionários dos mais diversos departamentos dentro de todos os níveis. Todas as partes do sistema de Garantia da Qualidade devem ser constituídas por pessoal competente e habilitado, além de possuir espaço adequado, e instalações suficientes.
8.1- Um sistema apropriado da Garantia da Qualidade, aplicado à armazenagem de matérias-primas e produtos sob vigilância sanitária, deve assegurar que:
a) sejam fornecidas instruções e tomadas as providências necessárias para garantir, que os produtos sob vigilância sanitária sejam armazenados e manuseados de forma que estas atividades não interfiram na qualidade dos mesmos;
b) todas as atividades e operações sejam devidamente documentada e a sua efetividade monitorada;
c) haja procedimento de auto-inspeção e/ou auditoria interna de qualidade que avalie regularmente a efetividade e a aplicação dosistema de Garantia da Qualidade.