Este texto não substitui o publicado no Diário Oficial da União

Secretaria de Vigilância em Saúde
PORTARIA Nº 24, DE 16 DE JUNHO DE 2005
Dispõe sobre Protocolo Clínico e Diretrizes Terapêuticas para Hepatite Viral C.
O SECRETÁRIO DE VIGILÂNCIA EM SAÚDE, no uso das atribuições que lhe confere o Art. 36 do Decreto nº. 4.726, de 9 de junho de2003, e
Considerando a necessidade de restabelecer Protocolo Clínico e Diretrizes Terapêuticas para o tratamento da Hepatite Viral Crônica C, que contenha critérios de diagnóstico e tratamento, observando ética e tecnicamente a prescrição médica, racionalize a dispensação dos medicamentos preconizados para o tratamento da doença, regulamente suas indicações e seus esquemas terapêuticos e estabeleça mecanismos de acompanhamento de uso e de avaliação de resultados, garantindo assim a prescrição segura e eficaz;
Considerando a Consulta Pública a que foi submetido o Protocolo Clínico e Diretrizes Terapêuticas - Hepatite Viral Crônica C, por meio da Consulta Pública GM/MS nº. 01, de 23 de julho de 2002, Anexo VII, e a 3ª reunião do Comitê Assessor do Programa Nacional para o Controle e a Prevenção das Hepatites Virais - PNHV, ocorrida nos dias 24 e 25 de agosto de 2004, que promoveu sua ampla discussão e possibilitou a participação efetiva da comunidade técnico científica, sociedades médicas, profissionais de saúde e gestores do Sistema Único de Saúde na sua formulação, e
Considerando o disposto na Portaria nº 892/GM, de 10 de junho de 2005, resolve:
Art. 1º - Aprovar, na forma do Anexo I desta Portaria,o Protocolo Clínico e Diretrizes Terapêuticas - Hepatite Viral C - Interferon-alfa, Interferon-alfa peguilado, Ribavirina.
§ 1º Este Protocolo é de caráter nacional, devendo ser utilizado pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios, na regulação da dispensação dos medicamentos nele previstos e contém:
a) Conceito geral da doença;
b) Critérios de inclusão/exclusão de pacientes no tratamento;
c) Critérios de diagnóstico;
d) Esquema terapêutico preconizado;
e) Mecanismos de acompanhamento; e
f) avaliação deste tratamento.
§ 2º As Secretarias de Saúde que já tenham definido Protocolo próprio com a mesma finalidade, deverão adequá-lo de forma a observar a totalidade dos critérios técnicos estabelecidos no Protocolo aprovado pela presente Portaria.
§ 3º É obrigatória a observância deste Protocolo para fins de dispensação dos medicamentos nele previstos.
§ 4º É obrigatória a cientificação do paciente, ou de seu responsável legal, dos potenciais riscos e efeitos colaterais relacionados ao uso dos medicamentos preconizados para o tratamento da Hepatite Viral Crônica C, o que deverá ser formalizado através da assinatura do respectivo Termo de Responsabilidade, conforme disposto no Anexo II desta Portaria.
Art. 2º - Esta Portaria entra em vigor na data de sua publicação.
Art. 4º - Fica revogada a Portaria nº. 863/SAS/MS, de 04 de novembro de 2002, publicada no DOU nº. 217, de 08 de novembro de 2002, Seção 1, pág. 160.
JARBAS BARBOSA DA SILVA JÚNIOR
ANEXO I
PROTOCOLO CLÍNICO E DIRETRIZES TERAPÊUTICAS HEPATITE VIRAL C
1. Introdução
A hepatite viral C é um importante problema de saúde pública no Brasil e no mundo. Estima-se em 170 milhões o número de portadores do Vírus C no mundo. No Brasil, a freqüência de marcador antiHCV em pré-doadores de banco de sangue no ano de 2002 foi de 0,67% (ANVISA 2002). No momento, o Ministério da Saúde (MS) está conduzindo um inquérito nacional de base populacional nas capitais brasileiras, que irá fornecer a real dimensão sobre a prevalência desta infecção, por macro regional destes locais.
A hepatite viral C, pela sua magnitude, diversidade virológica, formas de transmissão, evolução clínica, além da sua complexidade diagnóstica e terapêutica, demanda, por parte dos gestores do Sistema Único de Saúde (SUS), políticas específicas no campo da saúde pública.
O MS vem desenvolvendo diversas ações no campo da prevenção, controle, diagnóstico e tratamento das hepatites virais, que abrangem em grande parte a infecção pelo vírus C. Estas ações tem sido conduzidas pelas diversas esferas do MS (Secretaria de Vigilância em Saúde, Secretaria de Atenção à Saúde, Secretaria de Ciência Tecnologia e Insumos Estratégicos, Fundação Nacional de Saúde), além da ANVISA.
O Programa Nacional de Hepatites Virais (PNHV/DEVEP/SVS - criado em 2002 através da portaria 263, modificada pela 2080 de 31 de outubro de 2003, além de desenvolver e executar ações específicas referentes às hepatites virais, tem como objetivo coordenar as ações desenvolvidas nas outras esferas do MS. Desta forma, o PNHV, por meio desta portaria, após consulta ao seu comitê assessor (composto de membro das diversas sociedades científicas afins ao tema, bem como representantes das diversas secretarias do MS), promove a atualização do protocolo clínico-terapêutico para hepatite crônica C (publicado na portaria nº 863/SAS/MS de 04 de Novembro de 2002), em vista dos novos conhecimentos científicos surgidos nos últimos dois anos na área de conhecimento sobre a hepatite viral C.
2. Classificação CID 10
B17. 1 - Hepatite viral aguda C
B18. 2 - Hepatite viral crônica C
3. Critérios de inclusão no protocolo de tratamento
3.1. Critérios Gerais de Inclusão
Serão incluídos no Protocolo de Tratamento aqueles pacientes que possuam todas as seguintes características:
3.1.1 - Hepatite viral aguda C
a) exposição ao HCV nos 3 (três) meses
prévios a soroconversão documentada (de anti-HCV negativo para
positivo); ou
b) quadro de hepatite aguda pelo vírus C sem data de exposição
conhecida. Deve-se ter o cuidado, nesses casos, de excluir outras causas de
elevação de transaminases com icterícia; ou
c) exposição comprovada ao HCV, que apresente anti-HCV negativo
com HCV-RNA positivo 90 dias após a exposição.
3.1.2 - Hepatite viral crônica C
a) ser portador do vírus da hepatite C (HCV) identificado
por detecção do RNA por técnicas moleculares de amplificação;
b) ter realizado, nos últimos 24 meses, biópsia hepática
onde tenha sido evidenciada atividade necroinflamatória de moderada
a intensa (maior ou igual a A2 pela classificação Metavir ou
atividade portal ou peri-septal grau 2 da classificação da Sociedade
Brasileira de Patologia) e presença de fibrose de moderada a intensa
(maior ou igual a F2 pelas classificações Metavir ou Sociedade
Brasileira de Patologia);
c) ter entre 12 e 70 anos;
d) ter contagem de plaquetas acima de 50.000/mm 3 e de neutrófilos
acima de 1.500/mm 3 .
3.2. Critérios de Inclusão para Tratamento com Interferon Alfa Peguilado
Os pacientes poderão ser candidatos ao tratamento com interferon peguilado se estiverem enquadrados, além dos critérios gerais mencionados nas alíneas "a + b" do subitem 3.1, nos seguintes critérios:
a) ser portador do vírus da hepatite C do genótipo 1, utilizando-se técnicas de amplificação do RNA do HCV e posterior caracterização genotípica;
b) ter realizado, nos últimos 24 meses, biópsia hepática onde tenha sido evidenciada atividade necroinflamatória de moderada a intensa (maior ou igual a A2 pela classificação Metavir ou atividade portal ou peri-septal grau 2 da classificação da Sociedade Brasileira de Patologia) e presença de fibrose de moderada a intensa (maior ou igual a F2 pelas classificações Metavir ou Sociedade Brasileira de Patologia);
c) ter entre 18 e 70 anos;
d) ter contagem de plaquetas acima de 75.000/mm 3 e de neutrófilos
acima de 1.500/mm 3 .
4. Critérios de Exclusão do protocolo de tratamento
Não deverão ser incluídos no Protocolo de Tratamento, tanto com intereferon-alfa como também com interferon peguilado, pacientes com as seguintes características:
a) tratamento prévio com interferon peguilado (associado
ou não à ribavirina);
b) consumo abusivo de álcool nos últimos 6 meses;
c) hepatopatia descompensada;
d) cardiopatia grave;
e) doença da tireóide descompensada;
f) neoplasias;
g) diabete melito tipo 1 de difícil controle ou descompensada;
h) convulsões não controladas;
i) imunodeficiências primárias;
j) homens e mulheres sem adequado controle contraceptivo;
k) gravidez (beta-HCG positivo);
l) não concordância com o Termo de Responsabilidade.
O tratamento do HCV em transplantado será tema de discussões nas reuniões do Comitê Assessor do PNHV e seguirá para posterior regulamentação.
5. Situações Especiais
a) pacientes com co-infecção HIV-HCV: os pacientes com HIV estáveis clínica e laboratorialmente (ausência de infecção oportunista ativa ou nos últimos 06 (seis) meses e com contagem de linfócitos TCD4 + > 200 céls/mm 3 e com carga viral menor que 5.000 cópias/mm 3 , ou contagem de linfócitos TCD4 + > 500 céls/mm 3 , independentemente da carga viral) poderão ser tratados.
Em pacientes infectados pelo HIV com doença oportunista em atividade ou sem estabilidade clínicolaboratorial, o tratamento da doença oportunista e/ou HIV é prioridade.
Pacientes co-infectados pelo HIV/HCV deverão receber tratamento com interferon peguilado associado ou não à ribavirina independente do genótipo, atividade portal ou peri-septal grau 2 da classificação da Sociedade Brasileira de Patologia) e presença de fibrose de leve a intensa (maior ou igual a F1 pelas classificações Metavir ou Sociedade Brasileira de Patologia)
Deve haver cautela no uso simultâneo de ribavirina e DDI, que pode aumentar o risco de acidose lática e pancreatite. Também, sugere-se cautela na associação de zidovudina com ribavirina, pois as duas drogas tem como efeito adverso a anemia. Sempre que possível, durante o tratamento com ribavirina, deve-se utilizar esquema antiretroviral que não contenha essas drogas.
b) pacientes recidivantes após tratamento com interferon
convencional e ribavirina, independente do genótipo e/ou da alteração
histológica, poderão ser tratados com interferon peguilado e
ribavirina.
c) pacientes não-respondedores após tratamento com interferon
convencional e ribavirina, independente do genótipo/ou da alteração
histológica, poderão ser tratados com interferon peguilado e
ribavirina.
d) pacientes pediátricos: o tratamento em populações
pediátricas ainda é controverso e será tema de discussões
nas reuniões do Comitê Assessor do PNHV e seguirá para
posterior regulamentação. No momento, pacientes abaixo de 12
anos de idade, em que se considere o tratamento para hepatite C, devem ser
encaminhados para Serviços de Pediatria em Centros de Referência
do SUS, para avaliar o uso de interferon convencional ou peguilado associado
ou não a ribavirina.
e) paciente com distúrbios psiquiátricos: devem ter a sua condição
psiquiátrica estabilizada, estando realizando tratamento psiquiátrico
regular e com avaliação de especialista em psiquiatria, liberando
o paciente para o tratamento. Sugere-se nesses casos avaliar a relação
risco-benefício.
f) paciente com doença cerebrovascular, coronária ou insuficiência
cardíaca: devem ter a sua condição clínica estabilizada.
Esses pacientes são mais sujeitos a efeitos adversos e sugere-se, nesses
casos, avaliar a relação risco-benefício.
g) pacientes com insuficiência renal crônica: pacientes com depuração
da creatinina endógena (DCE) abaixo de 50 ml/min e/ou em hemodiálise
devem ser tratados em Serviços de Alta Complexidade do SUS. A ribavirina
não deve ser utilizada em pacientes com clearance < 50 ou sob hemodiálise.
Taxas de resposta viral sustentada com interferon mais alta do que em pacientes sem insuficiência renal são alcançadas nesses pacientes, possivelmente pelo aumento da meia vida do medicamento nessa situação.
A atividade do interferon peguilado é diminuída em pacientes com insuficiência renal crônica e não existem estudos nessa população mostrando se o interferon peguilado é seguro e mais eficaz do que interferon convencional.
h) hemólise, hemoglobinopatias e supressão
de medula óssea: nestas situações pode ser considerada
a possibilidade de monoterapia com interferon peguilado-alfa.
i) pacientes com hemofilia podem realizar o tratamento sem a necessidade da
biópsia hepática.
j) pacientes com cirrose compensada diagnosticada clinicamente e/ou através
de exames laboratoriais, e que apresentem varizes de esôfago e indícios
ecográficos dessa situação, também podem realizar
o tratamento sem a necessidade de biópsia hepática.
k) pacientes usuários de drogas: o tratamento para usuários
de drogas deverá ser individualizado, sendo necessária avaliação
periódica em relação ao consumo de substâncias
e sua interação com o tratamento indicado.
6. Tratamento
6.1. Fármacos e Apresentações
a) interferon alfa-2a recombinante: frasco-ampola com 3.000.000
UI, 4.500.000 UI e 9.000.000 UI para uso subcutâneo.
b) interferon alfa-2b recombinante: frasco-ampola com 3.000.000 UI, 4.500.000
UI, 5.000.000 UI, 9.000.000 UI e 10.000.000 UI para uso subcutâneo.
c) interferon peguilado alfa-2a: frasco-ampola com 135 (apesar de estar registrada
na ANVISA, não está sendo comercializada atualmente no Brasil)
e 180 mcg.
d) interferon peguilado alfa-2b: frasco-ampola de 50 (apesar de estar registrada
na ANVISA, não está sendo comercializada atualmente no Brasil),
80, 100, 120 e 150 (apesar de estar registrada na ANVISA, não está
sendo comercializada atualmente no Brasil) mcg - as ampolas de 80, 100 e 120
mcg contém, respectivamente, segundo informações da bula
do medicamento registrada na ANVISA, 112, 140 e 168 mcg de interferon peguilado.
e) ribavirina: cápsulas com 250 mg.
6.2. Esquemas de Administração
a) interferon-alfa:
a.1. - Hepatite viral aguda C - 5.000.000 UI por dia durante 4 (quatro) semanas e, após 3.000.000 UI por dia durante 20 (vinte) semanas.
a.2. - Hepatite viral crônica C - 3.000.000 UI a 5.000.000 UI SC, 03 (três) vezes por semana, associado ou não à ribavirina, 1000 mg por dia para pacientes com menos de 75 kg e 1.250 mg por dia para pacientes com 75 kg ou mais. A dose para pacientes com menos de 40 kg é de 3.000.000 UI/m 2 de superfície corporal (não exceder 3.000.000 UI) e a dose de ribavirina é de 15 mg/kg.
b) interferon peguilado alfa-2a: 180 mcg SC por semana,
associado ou não à ribavirina, 1000-1250 mg por dia para pacientes
com genótipo tipo 1 (1000 mg por dia para pacientes com menos de 75
kg e 1250 mg por dia para pacientes com 75 kg ou mais).
c) interferon peguilado alfa 2a ou alfa-2b em monoterapia (quando não
associada à ribavirina): a dose preconizada é respectivamente
180 mcg SC e 1,5 mcg/kg SC por semana.
Tabela 1
Modo de administração interferon peguilado alfa-2b em monoterapia (adaptado conforme apresentações comerciais disponíveis)
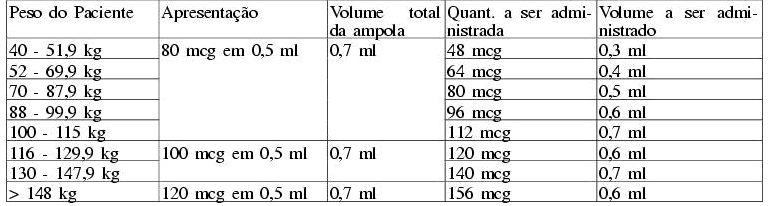
d) interferon peguilado alfa-2b associado à ribavirina: 1,5 mcg/kg SC por semana, 1000-1250 mg por dia para pacientes com genótipo tipo 1 (1000mg por dia para pacientes com menos de 75 kg e 1250 mg por dia para pacientes com 75 kg ou mais).
Tabela 2
Modo de administração interferon peguilado alfa-2b combinado com ribavirina (adaptado conforme apresentações comerciais disponíveis)

6.3 Esquema e tempo de tratamento
6.3.1. Primeiro tratamento
6.3.1.1. Interferon não peguilado
a) pacientes portadores de genótipo 2 e 3 deverão
completar 24 (vinte e quatro) semanas de tratamento.
b) pacientes portadores de genótipo 4 e 5 deverão completar
48 (quarenta e oito) semanas de tratamento.
6.3.1.2. Interferon peguilado
a) pacientes portadores de genótipo 1 deverão completar 48 (quarenta e oito) semanas, desde que após 12 (doze) semanas de tratamento com interferon peguilado associado à ribavirina, tenham negativado o exame HCV - detecção por tecnologia biomolecular de ácido ribonucléico (teste quantitativo) ou que tenham obtido uma redução maior ou igual a 100 vezes (2 logs) no número de cópias virais em relação à carga viral pré-tratamento.
b) pacientes co-infectados pelo HIV/HCV deverão completar o tratamento com interferon peguilado associado ou não à ribavirina por 48 (quarenta oito) semanas, independentemente do genótipo.
6.3.2. Retratamento
6.3.2.1. Interferon peguilado
a) pacientes recidivantes ou não respondedores ao
interferon convencional associado à ribavirina com genótipo
1 deverão fazer o retratamento com interferon peguilado + ribavirina,
devendo completar o esquema até a 48ª(quadragésima oitava)
semana, desde que na 12ª (décima segunda) semana de tratamento
tenham negativado o exame HCV - detecção por tecnologia biomolecular
de ácido ribonucléico (teste quantitativo) ou que tenham obtido
uma redução maior ou igual a 100 vezes (2 logs) no número
de cópias virais em relação à carga viral no tempo
zero do retratamento.
b) pacientes com genótipo 2 e 3, recidivantes ou não respondedores
ao tratamento com interferon convencional associado à ribavirina deverão
receber retratamento com interferon peguilado + ribavirina, por 24 (vinte
e quatro) semanas.
c) pacientes portadores de genótipos 4 e 5, recidivantes ou não
respondedores ao interferon convencional deverão receber re-tratamento
com interferon peguilado + ribavirina, devendo completar o tratamento por
48 (quarenta e oito) semanas, desde na 24ª (vigésima quarta) semana
de tratamento tenham negativado o exame HCV detecção por tecnologia
biomolecular de ácido ribonucléico (teste qualitativo).
6.4. Interrupção do Tratamento
6.4.1.Interferon não peguilado
a) pacientes com efeitos adversos sérios.
b) pacientes intolerantes ao tratamento.
6.4.2. Interferon-alfa peguilado
a) pacientes com efeitos adversos sérios.
b) pacientes intolerantes ao tratamento.
c) pacientes com HCV genótipo tipo 1, que após 12 (doze) semanas
de tratamento com interferon peguilado associado à ribavirina, não
tenham negativado o exame HCV - detecção por tecnologia biomolecular
de ácido ribonucléico (teste quantitativo) ou que não
tenham obtido uma redução maior ou igual a 100 vezes (2 logs)
no número de cópias virais em relação à
carga viral pré-tratamento.
d) pacientes com HCV genótipo tipo 1, que após (doze) 12 semanas
de tratamento com interferon peguilado monoterapia, não tenham negativado
o exame HCV - detecção por tecnologia biomolecular de ácido
ribonucléico (teste quantitativo) ou que não tenham obtido uma
redução maior ou igual a 100 vezes (2 logs) no número
de cópias virais em relação à carga viral pré-tratamento.
e) pacientes portadores de genótipos 4 e 5 que após 24 (vinte
e quatro) semanas de tratamento com interferon peguilado associado à
ribavirina, não tenham negativado o exame HCV - detecção
por tecnologia biomolecular de ácido ribonucléico (teste qualitativo)
6.5. Logística
Aqueles pacientes que estiverem em tratamento com interferon peguilado devem ter suas doses semanais aplicadas em Serviços de Tratamento Assistido ou em serviço especialmente identificado para tal fim pelas Secretarias Estaduais e/ou Municipais de Saúde. Assim, as ampolas ficarão em poder dos serviços já mencionados e não dos pacientes em tratamento. Para facilitar o trabalho dos serviços identificados, sugere-se que os pacientes sejam agrupados e previamente agendados para a aplicação do medicamento. Dependendo da apresentação comercial disponível na Secretaria, indicação e peso do paciente, o uso das ampolas do medicamento poderá ser compartilhado, adotadas as medidas técnicas de segurança de manipulação e aplicação do medicamento.
Os Serviços de Tratamento Assistido ou os serviços especialmente identificados para tal fim pelas Secretarias Estaduais e/ou Municipais de Saúde, deverão possuir equipe multidisciplinar com o objetivo de facilitar e aumentar a adesão do paciente ao tratamento.
Tendo em vista que o interferon peguilado é atualmente comercializado no país por dois laboratórios e que estes apresentam a mesma eficácia, recomenda-se às Secretarias de Saúde dos estados e municípios que orientem os médicos a prescreverem a forma genérica do imunobiológico e que as Secretarias procurem garantir o tratamento do seu início ao fim com o mesmo produto.
7. Monitoramento
7.1. Avaliação Inicial
Os pacientes com hepatite C, que são candidatos a tratamento, devem ser submetidos a uma avaliação inicial. Nessa avaliação devem constar anamnese completa, exame físico e os seguintes exames complementares:
a) hemograma completo com contagem de plaquetas;
b) ALT, AST;
c) tempo de protrombina, bilirrubinas, albumina;
d) creatinina, ácido úrico, glicemia de jejum;
e) TSH;
f) anti-HIV;
g) HBsAg;
h) para mulheres em idade fértil que usarão ribavirina: beta-HCG;
i) biópsia hepática dos últimos 02 (dois) anos, salvo
nos casos definidos nas alíneas "i" e "j" do item
5 deste Protocolo;
j) genotipagem do HCV - Biologia Molecular: o exame de genotipagem só se justifica após o paciente já ter preenchido todos os critérios de inclusão, realizado a biópsia hepática (salvo nos casos definidos nas alíneas "i" e "j" do item 5 deste Protocolo), e não apresentar critérios de exclusão;
k) pacientes com genótipo tipo 1 e que estejam sendo avaliados para o uso de interferon peguiladoalfa associado à ribavirina ou pacientes que estejam sendo avaliados para o uso de interferon peguiladoalfa monoterapia, já tendo preenchido todos outros critérios de inclusão e não apresentem critérios de exclusão, deverão realizar o exame HCV - Detecção por Tecnologia Biomolecular de Ácido Ribonucléico (teste quantitativo) antes do início do tratamento.
7.2. Monitorização Durante o Tratamento
Aqueles pacientes que, após a realização da avaliação inicial, se enquadrarem nos critérios de inclusão e não apresentarem critérios de exclusão, poderão iniciar com um dos tratamentos propostos nas alíneas de "a" a "d" do item 6.2, deste Protocolo.
Os pacientes em uso da medicação deverão ser monitorizados, principalmente nas fases iniciais do tratamento. Os exames mínimos que o paciente deverá realizar durante o tratamento são:
a) hemograma, plaquetas, ALT, AST, creatinina a cada 15
(quinze) dias no primeiro mês, sendo que após esse período,
os exames devem ser realizados mensalmente;
b) TSH a cada 03 (três) meses;
c) para mulheres em idade fértil em uso de ribavirina: beta-HCG a cada
03 (três) meses.
7.3. Monitorização da Resposta Virológica
7.3.1. Interferon não-peguilado associado à ribavirina nos genótipo tipo 2 e 3
Os pacientes que estiverem em uso de interferon não-peguilado associado à ribavirina com genótipo tipo 2 e 3 deverão realizar os seguintes exames de monitorização da resposta virológica:
a) HCV - detecção por tecnologia biomolecular de ácido ribonucléico (teste qualitativo) na 24ª (vigésima quarta) semana, quando deverão interromper o tratamento. Pacientes que tiverem o exame da HCV - detecção por tecnologia biomolecular de ácido ribonucléico (teste qualitativo) positiva na 24ª (vigésima quarta) semana de tratamento serão considerados não-respondedores. Os pacientes com esse exame negativo ao final do tratamento (24ª semana) devem repetí-lo após 24 (vinte e quatro) semanas para avaliar resposta virológica sustentada.
7.3.2. Interferon peguilado associado à ribavirina ou interferon peguilado monoterapia no genótipo 1
Os pacientes que estiverem em uso de interferon peguilado associado à ribavirina ou interferon peguilado monoterapia deverão realizar os seguintes exames de monitorização da resposta virológica:
a) HCV - detecção por tecnologia biomolecular de ácido ribonucléico (teste quantitativo) na 12ª (décima segunda) semana de tratamento. Pacientes que não tenham negativado o exame de carga viral ou que não tenham obtido uma redução de 100x no número de cópias virais em relação à carga viral prétratamento deverão interromper o tratamento. Caso contrário, deverão manter o tratamento, realizando HCV - detecção por tecnologia biomolecular de ácido ribonucléico (teste qualitativo) na 48ª (quadragésima oitava) semana, momento em que o tratamento será interrompido. Caso o exame na 48ª semana seja negativo, o exame será repetido após 24 semanas para avaliação da resposta virológica sustentada.
ANEXO II
TERMO DE RESPONSABILIDADE
Interferon alfa, Interferon alfa Peguilado e Ribavirina
Eu, _____________________ (nome do(a) paciente), abaixo identificado(a) e firmado(a), declaro ter sido informado(a) claramente sobre todas as indicações, contra-indicações, principais efeitos colaterais e riscos relacionados ao uso de interferon alfa ou interferon alfa peguilado, associados ou não com ribavirina, preconizados para o tratamento da Hepatite viral C.
Estou ciente de que este(s) medicamento(s) somente poderá ser utilizado por mim, comprometendome a devolvê-lo(s) caso o tratamento seja interrompido.
Os termos médicos foram explicados e todas as minhas dúvidas foram esclarecidas pelo médico ___________________ (nome do médico que prescreve).
Expresso também minha concordância e espontânea vontade em submeter-me ao referido tratamento, assumindo a responsabilidade e os riscos por eventuais efeitos indesejáveis decorrentes.
Assim, declaro que:
Fui claramente informado que a associação de ribavirina + interferon alfa ou ribavirina + Iinterferon peguilado podem trazer os seguintes benefícios no tratamento da Hepatite viral C:
1) Redução da replicação viral;
2) Melhora da inflamação e fibrose hepáticas;
Fui também claramente informado a respeito das seguintes contra-indicações, potenciais efeitos adversos, riscos e advertências a respeito da associação de ribavirina + interferon alfa ou ribavirina + interferon peguilado no tratamento da Hepatite Viral Crônica C:
1) Medicações classificadas na gestação como fator de risco X para ribavirina (contra-indicada durante a gestação por causar graves defeitos, efeitos teratogênicos, oncogênicos, mutagênicos e embriotóxicos significativos nos bebês) e fator de risco C para interferon alfa e interferon peguilado (estudos em animais mostraram anormalidades nos descendentes, porém não há estudos em humanos; o risco para o bebê não pode ser descartado, mas um benefício potencial pode ser maior que os riscos);
2) É contra-indicado o uso da ribavirina em pacientes de ambos os sexos nos quais o controle da contracepção não pode ser feito de maneira adequada e rigorosa, devendo ser utilizado método seguro de contracepção para pacientes em idade fértil até seis meses do final do tratamento;
3) Não é recomendada a amamentação durante o tratamento com ribavirina, interferon alfa e interferon peguilado;
4) Deve-se evitar a gravidez durante a vigência do tratamento e por 6 meses após seu término;
5) O paciente não deve doar sangue;
6) Os principais efeitos adversos relatados para o interferon alfa e interferon peguilado são dor de cabeça, fadiga, depressão, ansiedade, irritabilidade, insônia, febre, tontura, dor torácica dificuldade de concentração, dor, perda de cabelo, coceiras, secura na pele, borramento da visão, alteração no paladar gosto metálico na boca, estomatite, náuseas, perda de apetite, diarréia, dor abdominal, perda de peso, dor muscular, infecções virais, reações alérgicas de pele, hipertireoidismo e hipotireoidismo, vômitos, indigestão, diminuição das células do sangue (plaquetas, neutrófilos, hemácias), tosse, faringite, sinusite. Os efeitos adversos menos freqüentes incluem comportamento agressivo, aumento da atividade de doenças auto-imunes, infarto do miocárdio, pneumonia, arritmias, isquemias;
7) Os principais efeitos adversos relatados para ribavirina incluem cansaço, fadiga, dor de cabeça, insônia, náuseas, perda de apetite, anemia. Os efeitos adversos menos freqüentes são dificuldade na respiração, conjuntivite, pressão baixa, alergias de pele, rinite, faringite, lacrimejamento;
8) É necessária a realização de exames hematológicos, especialmente durante as 4 primeiras semanas de tratamento, para detecção de alterações nas células do sangue e, desta forma, quando for necessário, proceder ajuste de dose;
9) Estes medicamentos podem interagir com vários outros medicamentos. Por isso, em caso de uso de outros medicamentos, comunique ao médico.
Estou ciente de que posso suspender o tratamento a qualquer momento, sem que este fato implique qualquer forma de constrangimento entre mim e meu médico.
Autorizo o Ministério da Saúde e as Secretarias de Saúde a fazer uso de informações relativas ao meu tratamento desde que assegurado o anonimato.
Declaro ter compreendido e concordado com todos os termos deste Termo de Responsabilidade.
Assim, o faço por livre e espontânea vontade e por decisão conjunta, minha e de meu médico.

Observações: a) o preenchimento completo deste Termo e sua respectiva assinatura são imprescindíveis para o fornecimento do medicamento;
b) este Termo ficará arquivado na farmácia responsável pela dispensação dos medicamentos.