Este texto não substitui o publicado no Diário Oficial da União

Secretaria de Vigilância em Saúde
PORTARIA Nº 151, DE 14 DE OUTUBRO DE 2009
A SECRETÁRIA DE VIGILÂNCIA EM SAÚDE SUBSTITUTA, no uso das atribuições que lhe confere o Art. 45, do Decreto nº. 6.860, de 27 de maio de 2009,
Considerando a necessidade de se criar alternativas para a ampliação do acesso ao diagnóstico da infecção pelo HIV, em atendimento aos princípios da equidade e da integralidade da assistência, bem como da universalidade de acesso aos serviços de saúde do Sistema Único de Saúde - SUS;
Considerando a necessidade do diagnóstico rápido da infecção pelo HIV em situações especiais;
Considerando que a identificação dos indivíduos infectados pelo HIV é importante porque permite o acompanhamento precoce nos serviços de saúde e possibilita a melhora na qualidade de vida;
Considerando que a definição do estado sorológico de um indivíduo infectado pelo HIV é fundamental para a sua maior proteção e para o controle da infecção e da disseminação do vírus; e
Considerando que o diagnóstico sorológico da infecção pelo HIV deve ser realizado em indivíduos com idade acima de 18 meses, resolve:
Art. 1º Aprovar, na forma dos Anexos a esta Portaria, etapas sequenciadas e o Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em indivíduos com idade acima de 18 (dezoito) meses, de uso obrigatório pelas instituições de saúde públicas e privadas.
Art. 2º Determinar o uso do teste rápido para o diagnóstico da infecção pelo HIV em situações especiais, conforme disposto no Anexo II a esta portaria.
Art. 3º Definir que as amostras podem ser de soro, plasma, sangue total ou sangue seco em papel filtro e devem ser coletadas em conformidade com o que é preconizado pelo fabricante do teste a ser utilizado.
Parágrafo Único. Fica vedada a mistura de amostras (pool) para a utilização em qualquer teste laboratorial, com o objetivo de diagnosticar a infecção pelo HIV.
Art. 4º Estabelecer que todos os reagentes utilizados para o diagnóstico da infecção pelo HIV devem ter registros vigentes na Agência Nacional de Vigilância Sanitária, de acordo com o disposto na Resolução RDC nº. 302/ANVISA, de 13 de outubro de 2005, suas alterações, ou outro instrumento legal que venha a substituí-la.
Art. 5º O Ministério da Saúde, por intermédio do Departamento de Vigilância, Prevenção e Controle das Doenças Sexual-mente Transmissíveis e Síndrome da Imunodeficiência Adquirida, da Secretaria de Vigilância em Saúde, do Ministério da Saúde -DDSTAIDS/SVS/MS, definirá as normas técnicas necessárias aos pro-gramas de validação de reagentes para uso no diagnóstico da infecção pelo HIV.
Art. 6º Esta Portaria entra em vigor na data de sua publicação.
Art. 7º Revogar a Portaria nº. 34/SVS de 28 de julho de 2005, publicada no Diário Oficial da União nº. 145, Seção 1, pág. 77, de 29 de julho de 2005.
HELOIZA MACHADO DE SOUZA
ANEXO I
Diagnóstico Laboratorial da Infecção pelo HIV
1 - Da Etapa I : Triagem - TESTE 1 (T1)
Para a Etapa I de triagem deverá ser utilizado um teste capaz de detectar anticorpos anti-HIV-1, incluindo o grupo O e anticorpos anti-HIV-2. Poderão ainda ser utilizados, nessa etapa, testes que combinem a detecção simultânea desses anticorpos e de antígeno.
É permitida a utilização das seguintes metodologias, no teste da Etapa I:
a) Ensaio imunoenzimático - ELISA;
b) Ensaio imunoenzimático de micropartículas - MEIA;
c) Ensaio imunológico com revelação quimioluminescente e suas derivações - EQL;
d) Ensaio imunológico fluorescente ligado a enzima - ELFA ;
e) Ensaio imunológico quimioluminescente magnético CMIA;
f) Testes rápidos: imunocromatografia, aglutinação de partículas em látex ou imunoconcentração;
g) Novas metodologias registradas na ANVISA e validadas pelo Departamento de Vigilância, Prevenção e Controle das Doenças Sexualmente Transmissíveis e Síndrome da Imunodeficiência Adquirida.
1.1 - Resultado da Etapa I - Triagem - TESTE 1 (T1)
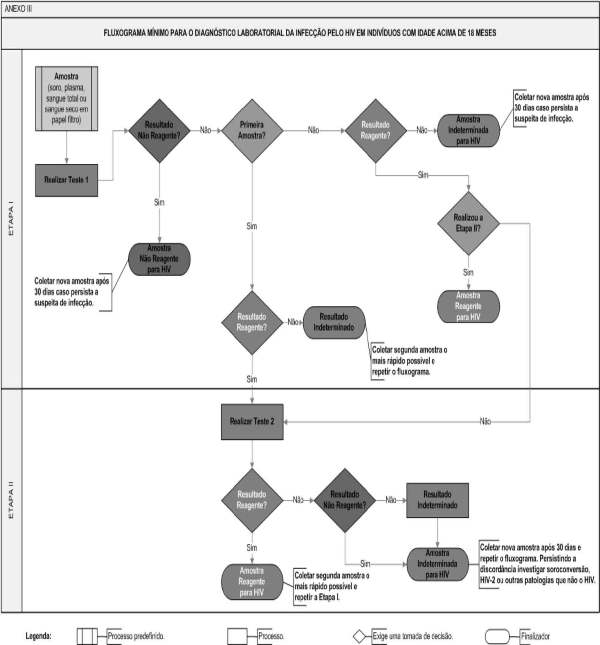
1.1.1 - O resultado da amostra será definido a partir da interpretação de um ou mais testes cujos resultados deverão ser expressos em laudo laboratorial, conforme estabelecido no fluxograma do Anexo III a esta Portaria.
1.1.2 - A amostra com resultado reagente, no teste da Etapa I, deverá ser submetida à Etapa II do Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses.
1.1.3 - A amostra com resultado não reagente, no teste da Etapa I, será definida como: "Amostra Não Reagente para HIV".
1.1.3.1 - O laudo laboratorial deverá incluir a seguinte ressalva: "Em caso de suspeita de infecção pelo HIV, uma nova amostra deverá ser coletada 30 dias após a data da coleta desta amostra".
1.1.4 - A amostra com resultado indeterminado, no teste da Etapa I, não terá resultado definido. Nesse caso, o laudo não será liberado e uma segunda amostra deverá ser coletada, o mais breve possível, e submetida ao Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses.
1.1.4.1 - Caso a paciente seja gestante, deverá ser solicitada segunda amostra para ser submetida ao Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses e nova amostra para realização de teste molecular, conforme orientações do item 4 do ANEXO I desta portaria.
1.1.4.2 - Caso o resultado com a segunda amostra persista indeterminado, o laudo deverá ser liberado como "Amostra Indeterminada para HIV".
1.1.4.3 - É obrigatória a liberação desse resultado.
1.1.4.4 - O laudo laboratorial deverá incluir a seguinte ressalva: "Persistindo a suspeita clínica de infecção pelo HIV, uma nova amostra deverá ser coletada, após 30 dias, para esclarecimento do diagnóstico sorológico".
1.1.4.5 - Caso o resultado com a segunda amostra seja não reagente, o laudo deve ser liberado como "Amostra Não Reagente para HIV".
1.1.4.5.1 - O laudo laboratorial deverá incluir a seguinte ressalva: "Em caso de suspeita de infecção pelo HIV, uma nova amostra deverá ser coletada 30 dias após a data da coleta desta amostra".
1.1.4.6 - Caso o resultado com a segunda amostra seja reagente, esta deverá ser submetida à Etapa II do Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses.
2 - Da Utilização dos Testes Rápidos na Etapa I
2.1 - As amostras deverão ser coletadas de acordo com as instruções dos fabricantes dos conjuntos diagnósticos.
2.2 - O teste rápido deve detectar anticorpos anti-HIV 1, incluindo o grupo O e anticorpos anti-HIV 2.
2.3 - Caso o resultado do teste rápido seja positivo na Etapa I, uma nova amostra deverá ser coletada, imediatamente, para a realização da Etapa II desta Portaria.
2.4 - Caso o resultado do teste rápido seja inválido, deve-se repetir o teste imediatamente com o mesmo conjunto diagnóstico, se possível com um lote distinto do que foi utilizado inicialmente.
2.5 - Persistindo o resultado inválido no teste rápido, deve-se utilizar outra metodologia dentre as definidas no item 1, do Anexo I desta Portaria.
3 - Da Etapa II - Complementar - Teste 2 (T2)
É permitida a utilização das seguintes metodologias no teste da Etapa II:
a)Imunofluorescência indireta - IFI;
b)Imunoblot - IB;
c)Imunoblot rápido - IBR;
d)Western Blot - WB;
e)Outras metodologias registradas na ANVISA e validadas
pelo Departamento de Vigilância, Prevenção e Controle das Doenças
Sexualmente Transmissíveis e Síndrome da Imunodeficiência Adquirida.
3.1 - Resultados da Etapa II - Complementar - Teste 2 (T2)
3.1.1 - Para a interpretação dos resultados e liberação do laudo, deverão ser analisados, conjuntamente, os resultados obtidos nos testes das Etapas I e II. Estes poderão ser encontrados com as seguintes combinações, nos testes sequenciais das duas etapas:
A) Resultados reagentes, nos testes das Etapas I e II: a amostra é positiva para HIV;
3.1.1.1 - Esse resultado deverá ser liberado como: "Amostra Reagente para HIV".
3.1.1.2 - O laudo laboratorial deverá incluir a seguinte ressalva: "Para comprovação do diagnóstico laboratorial, uma segunda amostra deverá ser coletada e submetida à Etapa I do Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses".
3.1.1.3 - Esta segunda amostra deverá ser colhida o mais rapidamente possível, e submetida à Etapa I do Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses, preferencialmente no mesmo local em que se realizaram os testes com a primeira amostra.
3.1.1.4 - É responsabilidade do profissional de saúde que atender o indivíduo solicitar e identificar o pedido do exame como segunda amostra, e do laboratório ou do serviço de saúde registrá-la como tal para a finalização do Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses.
3.1.1.5 - Quando o resultado do teste com a segunda amostra for reagente, o resultado deverá ser liberado como: "Amostra Reagente para o HIV".
3.1.1.6 - O laudo laboratorial deverá incluir a seguinte ressalva: "Resultado definido com a segunda amostra, conforme estabelecido pela Portaria número e data".
B) Resultados indeterminados ou discordantes entre as Etapas I e II:
Reagente, na Etapa I, e não reagente ou indeterminado, na Etapa II, deverão ser liberados como "Amostra Indeterminada para HIV".
3.1.1.7. - É obrigatória a liberação desse resultado e o laudo laboratorial deverá incluir a seguinte ressalva: "Persistindo a suspeita de infecção pelo HIV, uma nova amostra deverá ser coletada, 30 dias após a data da coleta desta amostra"
3.1.1.8 - A nova amostra deverá ser colhida e submetida ao fluxograma do Anexo III a esta Portaria, preferencialmente no mesmo local em que se realizou o teste com a primeira amostra, e o resultado deve ser interpretado de acordo com o Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses.
3.1.1.9 - Caso o resultado com a nova amostra permaneça indeterminado, deve-se considerar a possibilidade da realização de testes moleculares (RNA e/ou DNA), para auxiliar na definição do diagnóstico.
3.1.1.10 - A ocorrência de resultados indeterminados ou falso-positivos é maior em gestantes ou portadores de algumas enfermidades. Nessas situações, a avaliação conjunta da história clínica, do risco de exposição do indivíduo à infecção pelo HIV e o resultado laboratorial devem orientar as decisões.
3.1.1.11 Havendo persistência de resultado indeterminado nos testes e suspeita clínica ou epidemiológica de infecção, pode-se coletar uma nova amostra para investigação da infecção pelo HIV-2 ou, ainda, para realização de outros testes indicados para o diagnóstico.
4 - Da Utilização dos testes moleculares para amostras indeterminadas em gestantes
4.1 - Os testes moleculares serão utilizados para auxiliar a definição do diagnóstico da infecção do HIV-1 em gestantes que apresentarem resultado indeterminado na primeira amostra.
4.2 - O laboratório deverá encaminhar ao médico uma solicitação de segunda amostra, que será submetida ao Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses, e a solicitação de uma nova amostra para a realização de teste molecular, devendo seguir o modelo de solicitação conforme anexo V a esta Portaria.
4.3 - O médico deverá encaminhar a solicitação de teste molecular, vinda do laboratório, juntamente com o Boletim de Produção Ambulatorial - BPA-I ao Laboratório da Rede Nacional de Carga Viral, seguindo as recomendações de coleta de amostras para testes moleculares.
4.4 - É obrigatório o envio dos dois formulários (solicitação de nova amostra e BPA-I), devidamente preenchidos, para a realização do teste molecular.
5 - Da Interpretação dos Testes Western Blot
5.1 - A interpretação do teste de Western Blot deverá seguir os critérios:
a)Amostra negativa: ausência de reatividade (bandas), com
qualquer proteína viral utilizada no ensaio;
b)Amostra positiva: reatividade (bandas), em pelo menos
duas das seguintes proteínas: p24; gp41; gp120/gp160;
c)Amostra indeterminada: qualquer padrão de reatividade
(bandas) diferente do item anterior.
5.2 - A interpretação dos testes Imunoblot e Imunoblot rápido deverão seguir o disposto nas instruções dos fabricantes dos conjuntos diagnósticos.
6 - Do Laudo
6.1 - Deverá ser legível, sem rasuras na sua transcrição, escrito em língua portuguesa, datado e assinado por profissional de nível superior legalmente habilitado.
6.2 - Deverá estar de acordo com o disposto na Resolução RDC nº 302/ANVISA, de 13 de outubro de 2005, suas alterações, ou outro instrumento legal que venha a substituí-la.
6.3 - Deverá constar do laudo a interpretação final do resultado da amostra que será: Amostra Reagente para HIV, ou Amostra Não Reagente para HIV ou Amostra Indeterminada para HIV.
6.4 - Deverão constar do laudo, igualmente, os resultados de todos os testes realizados, inclusive quando em número superior ao determinado pelo Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses.
6.5 - Deverão ser expressos: o resultado numérico da amostra, o ponto de corte (cut-off) e a unidade de medição do método utilizado, quando os resultados forem positivos ou indeterminados, excetuando-se os resultados obtidos por testes cuja leitura é visual.
6.6 - Deverá ser reportado o resultado de todas as bandas reativas encontradas nos testes Western Blot, Imunoblot e Imunoblot Rápido.
ANEXO II
Diagnóstico da infecção pelo HIV por Testes Rápidos
1 - Do Diagnóstico Rápido
O diagnóstico rápido da infecção pelo HIV é feito exclusivamente com testes rápidos validados pelo Departamento de Vigilância, Prevenção e Controle das Doenças Sexualmente Transmissíveis e Síndrome da Imunodeficiência Adquirida.
As instituições de saúde públicas e privadas que utilizem testes rápidos devem promover e manter os processos de qualificação e educação permanente para os profissionais de saúde em conformidade com as diretrizes do Ministério da Saúde.
1.1 - O diagnóstico rápido poderá ser realizado nas seguintes situações especiais:
a)Rede de serviços de saúde sem infraestrutura laboratorial
ou localizada em regiões de difícil acesso;
b)Centro de Testagem e Aconselhamento - CTA;
c)Segmentos populacionais flutuantes;
d)Segmentos populacionais mais vulneráveis;
e)Parceiros de pessoas vivendo com HIV/AIDS;
f)Acidentes biológicos ocupacionais, para teste no paciente
fonte;
g)Gestantes que não tenham sido testadas durante o pré-natal
ou cuja idade gestacional não assegure o recebimento do resultado do
teste antes do parto;
h)Parturientes e puérperas que não tenham sido testadas no
pré-natal ou quando não é conhecido o resultado do teste no momento
do parto;
i)Abortamento espontâneo, independentemente da idade gestacional;
j)Outras situações especiais definidas pelo Departamento de
Vigilância, Prevenção e Controle das Doenças Sexualmente Transmissíveis
e Síndrome da Imunodeficiência Adquirida.
1.2 - As amostras deverão ser coletadas de acordo com as instruções dos fabricantes dos conjuntos diagnósticos.
2 - Da Realização do Teste Rápido
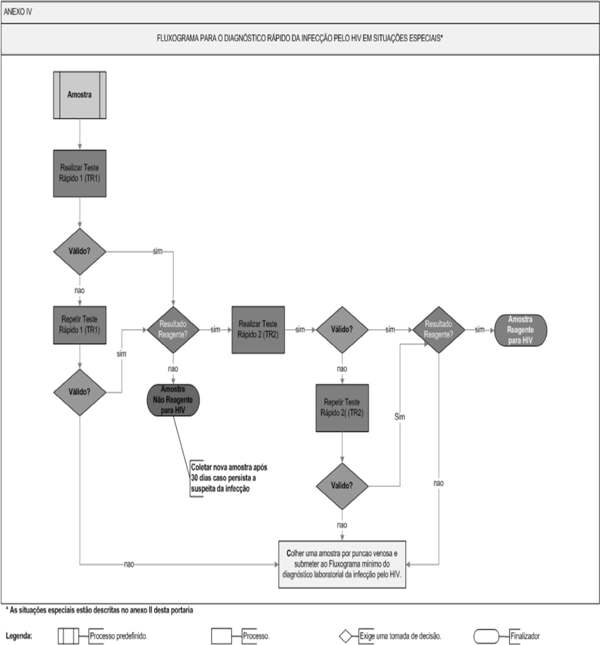
O diagnóstico rápido da infecção pelo HIV deve ser realizado com testes rápidos (TR) capazes de detectar anticorpos anti-HIV 1, incluindo o grupo O e anticorpos anti-HIV 2, de acordo com o fluxograma do Anexo IV.
2.1 - Os testes rápidos devem ser realizados imediatamente após a coleta da amostra e o indivíduo orientado a aguardar o resultado no local.
3- Do resultado dos testes rápidos
3.1 - A amostra com resultado não reagente no teste rápido 1 (TR1) será definida como: "Amostra Não Reagente para HIV".
3.1.1 - O laudo deverá incluir a seguinte ressalva: "Em caso de suspeita de infecção pelo HIV, uma nova amostra deverá ser coletada 30 dias após a data da coleta desta amostra".
3.2 - A amostra com resultado reagente no TR1 deverá ser submetida ao teste rápido 2 (TR2). Quando disponível no serviço de saúde, o Imunoblot rápido também poderá ser utilizado como TR2.
3.2.1 - A amostra com resultados reagentes no TR1 e no TR2 terá seu resultado definido como: "Amostra Reagente para HIV".
3.3 - A amostra com resultados discordantes entre TR1 e TR2 não terá seu resultado definido. Nesse caso, o laudo não será liberado. Uma amostra deverá ser coletada por punção venosa e submetida ao Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses, de acordo com o Anexo III a esta Portaria.
3. 4 - Caso o resultado do TR1 ou do TR2 seja inválido, deve-se repetir o teste com o mesmo conjunto diagnóstico, se possível com um lote distinto do que foi utilizado inicialmente.
3. 5 - Persistindo o resultado inválido, uma amostra deverá ser coletada por punção venosa e submetida ao Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em Indivíduos com Idade acima de 18 Meses, de acordo com o Anexo III a esta Portaria.
4 - Do Laudo
4.1 - Deverá constar, no laudo do diagnóstico rápido da infecção pelo HIV, o nome do ensaio e as metodologias de cada conjunto diagnóstico utilizado.
4.2 - Deverá constar, no mesmo laudo, a interpretação final do resultado da amostra, que será: Amostra Reagente para HIV ou Amostra Não Reagente para HIV.
4.3 - O laudo deverá estar de acordo com o disposto na Resolução RDC nº 302/ANVISA, de 13 de outubro de 2005, suas alterações, ou outro instrumento legal que venha a substituí-la.
5 - Considerações e Recomendações
1 - Não existem testes laboratoriais que apresentem 100% de sensibilidade e 100% de especificidade. Em decorrência disso, resultados falso-negativos, falso-positivos, indeterminados ou discrepantes entre os testes distintos podem ocorrer na rotina do laboratório clínico.
2 - Janela imunológica é o tempo entre a exposição do indivíduo ao vírus e o surgimento de marcadores detectáveis no organismo (antígeno ou anticorpo). O diagnóstico laboratorial é dependente do tempo decorrido entre a infecção do indivíduo e sua resposta imunológica.
3 - Os testes de triagem que combinam em sua metodologia antígeno e anticorpo permitem a detecção precoce da infecção pelo HIV, quando comparados aos testes confirmatórios que detectam apenas anticorpos. Portanto, resultados falso-negativos na Etapa II podem ocorrer quando da utilização dos testes que detectam apenas anticorpos na Etapa II.
4 - O resultado laboratorial indica o estado sorológico do indivíduo e deve ser associado à história clínica e/ou epidemiológica do indivíduo.
5 - Testes moleculares RNA e/ou DNA, embora não sejam preconizados para o diagnóstico da infecção pelo HIV, podem ser úteis para auxiliar a definição de casos indeterminados, principalmente em gestantes.
6 - Quando houver a necessidade de investigação de soroconversão, recomenda-se proceder à coleta de uma nova amostra 30 dias após a coleta da primeira amostra, e repetir o conjunto de procedimentos sequenciados descritos nesta Portaria.
7 - A detecção de anticorpos anti-HIV, em crianças com idade inferior a 18 meses, não caracteriza infecção, devido à transferência dos anticorpos maternos anti-HIV pela placenta, sendo necessária a realização de outros testes complementares para a confirmação do diagnóstico.
8 - É obrigatória a solicitação de um documento oficial de identificação do indivíduo que será submetido à coleta. Esse documento deve ser conferido, tanto no momento do registro no serviço de saúde, quanto no momento da coleta da amostra.
Parágrafo único. Essa exigência não se aplica aos serviços que realizam o diagnóstico anônimo da infecção pelo HIV. Nesse caso, deve-se comunicar ao indivíduo, no momento do aconselhamento pré-teste, que não será entregue cópia do laudo por escrito.
9 - É de responsabilidade dos serviços de saúde que ofertam o diagnóstico do HIV realizar o aconselhamento, informar sobre os procedimentos a serem realizados e os possíveis resultados e garantir o sigilo e confidencialidade.
ANEXO III
Fluxograma Mínimo para o Diagnóstico Laboratorial da Infecção pelo HIV em indivíduos com idade acima de 18 (dezoito) meses
ANEXO IV
Fluxograma para Diagnóstico Rápido da Infecção pelo HIV em Situações Especiais
ANEXO V
Modelo de Solicitação de Teste Molecular para Gestante com Amostra Indeterminada
Timbre da Unidade Solicitante
SOLICITAÇÃO DE TESTE MOLECULAR PARA GESTANTE
Nome da gestante: _____________________________________
Data de Nascimento: ___________________________________
Laboratório Solicitante: _________________________________
Material biológico: SANGUE TOTAL
Data da Coleta da Primeira amostra para sorologia do HIV -
Data do Resultado da Primeira amostra para sorologia do HIV -
Data da Coleta da Segunda amostra para sorologia do HIV -
Médico Solicitante: _____________________________________
Assinatura: ___________________________________________
CARIMBO: __________________________________________
Nota: Esta solicitação de teste molecular para detecção do RNA e/ou DNA do HIV-1 - Pró Viral, visa auxiliar a definição do diagnóstico da infecção pelo HIV-1 para resultado indeterminado. Sendo assim, deverá ser analisada com especial atenção e a interpretação feita juntamente com os dados clínicos e outros achados laboratoriais.
Data da Solicitação
_____/_____/_____