Este texto não substitui o publicado no Diário Oficial da União

Gabinete do Ministro
[Acesso à Matriz de Consolidação: Compêndio com informações estruturadas em abas - Atual. até 28.09.2017]
Portaria de ConsolidaÇÃo nº 5, de 28 de Setembro de 2017
Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde.
O MINISTRO DE ESTADO DA SAÚDE, no uso das atribuições que lhe confere o art. 87, parágrafo único, incisos I e II, da Constituição, resolve:
Art. 1º As ações e serviços de saúde do Sistema Único de Saúde (SUS) obedecerão ao disposto nesta Portaria.
TÍTULO I
DA PROMOÇÃO, PROTEÇÃO E RECUPERAÇÃO DA SAÚDE
CAPÍTULO I
DA PROMOÇÃO DA SAÚDE
Seção I
Do Programa Academia da Saúde
Art. 2º Fica instituído o Programa Academia da Saúde no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2681/2013, Art. 1º)
Art. 3º O Programa Academia da Saúde tem como objetivo principal contribuir para a promoção da saúde e produção do cuidado e de modos de vida saudáveis da população a partir da implantação de polos com infraestrutura e profissionais qualificados. (Origem: PRT MS/GM 2681/2013, Art. 2º)
Parágrafo Único. Os polos do Programa Academia da Saúde são espaços públicos construídos para o desenvolvimento das ações do programa, segundo os eixos descritos no art. 7º e em conformidade com os objetivos, princípios e diretrizes previstos nesta Seção. (Origem: PRT MS/GM 2681/2013, Art. 2º, Parágrafo Único)
Art. 4º São diretrizes do Programa Academia da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 3º)
I - configurar-se como ponto de atenção da Rede de Atenção à Saúde, complementar e potencializador das ações de cuidados individuais e coletivos na atenção básica; (Origem: PRT MS/GM 2681/2013, Art. 3º, I)
II - referenciar-se como um programa de promoção da saúde, prevenção e atenção das doenças crônicas não transmissíveis; e (Origem: PRT MS/GM 2681/2013, Art. 3º, II)
III - estabelecer-se como espaço de produção, ressignificação e vivência de conhecimentos favoráveis à construção coletiva de modos de vida saudáveis. (Origem: PRT MS/GM 2681/2013, Art. 3º, III)
Art. 5º São princípios do Programa Academia da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 4º)
I - participação popular e construção coletiva de saberes e práticas em promoção da saúde; (Origem: PRT MS/GM 2681/2013, Art. 4º, I)
II - intersetorialidade na construção e desenvolvimento das ações; (Origem: PRT MS/GM 2681/2013, Art. 4º, II)
III - interdisciplinaridade na produção do conhecimento e do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 4º, III)
IV - integralidade do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 4º, IV)
V - intergeracionalidade, promovendo o diálogo e troca entre gerações; e (Origem: PRT MS/GM 2681/2013, Art. 4º, V)
VI - territorialidade, reconhecendo o espaço como local de produção da saúde. (Origem: PRT MS/GM 2681/2013, Art. 4º, VI)
Parágrafo Único. O Programa Academia da Saúde também segue os princípios, diretrizes e objetivos da Política Nacional de Promoção da Saúde (PNPS) e da Política Nacional de Atenção Básica (PNAB). (Origem: PRT MS/GM 2681/2013, Art. 4º, Parágrafo Único)
Art. 6º São objetivos específicos do Programa Academia da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 5º)
I - ampliar o acesso da população às políticas públicas de promoção da saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, I)
II - fortalecer a promoção da saúde como estratégia de produção de saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, II)
III - desenvolver a atenção à saúde nas linhas de cuidado, a fim de promover o cuidado integral; (Origem: PRT MS/GM 2681/2013, Art. 5º, III)
IV - promover práticas de educação em saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, IV)
V - promover ações intersetoriais com outros pontos de atenção da Rede de Atenção à Saúde e outros equipamentos sociais do território; (Origem: PRT MS/GM 2681/2013, Art. 5º, V)
VI - potencializar as ações nos âmbitos da atenção básica, da vigilância em saúde e da promoção da saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, VI)
VII - promover a integração multiprofissional na construção e na execução das ações; (Origem: PRT MS/GM 2681/2013, Art. 5º, VII)
VIII - promover a convergência de projetos ou programas nos âmbitos da saúde, educação, cultura, assistência social, esporte e lazer; (Origem: PRT MS/GM 2681/2013, Art. 5º, VIII)
IX - ampliar a autonomia dos indivíduos sobre as escolhas de modos de vida mais saudáveis; (Origem: PRT MS/GM 2681/2013, Art. 5º, IX)
X - aumentar o nível de atividade física da população; (Origem: PRT MS/GM 2681/2013, Art. 5º, X)
XI - promover hábitos alimentares saudáveis; (Origem: PRT MS/GM 2681/2013, Art. 5º, XI)
XII - promover mobilização comunitária com a constituição de redes sociais de apoio e ambientes de convivência e solidariedade; (Origem: PRT MS/GM 2681/2013, Art. 5º, XII)
XIII - potencializar as manifestações culturais locais e o conhecimento popular na construção de alternativas individuais e coletivas que favoreçam a promoção da saúde; e (Origem: PRT MS/GM 2681/2013, Art. 5º, XIII)
XIV - contribuir para ampliação e valorização da utilização dos espaços públicos de lazer, como proposta de inclusão social, enfrentamento das violências e melhoria das condições de saúde e qualidade de vida da população. (Origem: PRT MS/GM 2681/2013, Art. 5º, XIV)
Art. 7º As atividades desenvolvidas no âmbito do Programa Academia da Saúde serão desenvolvidas conforme os seguintes eixos: (Origem: PRT MS/GM 2681/2013, Art. 6º)
I - práticas corporais e atividades físicas; (Origem: PRT MS/GM 2681/2013, Art. 6º, I)
II - produção do cuidado e de modos de vida saudáveis; (Origem: PRT MS/GM 2681/2013, Art. 6º, II)
III - promoção da alimentação saudável; (Origem: PRT MS/GM 2681/2013, Art. 6º, III)
IV - práticas integrativas e complementares; (Origem: PRT MS/GM 2681/2013, Art. 6º, IV)
V - práticas artísticas e culturais; (Origem: PRT MS/GM 2681/2013, Art. 6º, V)
VI - educação em saúde; (Origem: PRT MS/GM 2681/2013, Art. 6º, VI)
VII - planejamento e gestão; e (Origem: PRT MS/GM 2681/2013, Art. 6º, VII)
VIII - mobilização da comunidade. (Origem: PRT MS/GM 2681/2013, Art. 6º, VIII)
Art. 8º O Programa Academia da Saúde será implantado pelas Secretarias de Saúde do Distrito Federal e dos Municípios, com o apoio das Secretarias Estaduais de Saúde e do Ministério da Saúde. (Origem: PRT MS/GM 2681/2013, Art. 7º)
Art. 9º Compete ao Ministério da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 8º)
I - elaborar diretrizes para implantação e funcionamento do Programa Academia da Saúde em âmbito nacional no SUS; (Origem: PRT MS/GM 2681/2013, Art. 8º, I)
II - elaborar normas técnicas do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, II)
III - definir recursos orçamentários e financeiros para a implantação do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, III)
IV - estimular pesquisas nas áreas de interesse para o Programa Academia da Saúde, em especial aquelas consideradas estratégicas para formação e desenvolvimento tecnológico para a promoção da saúde e produção do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 8º, IV)
V - estabelecer diretrizes para a educação permanente na área da promoção da saúde e da produção do cuidado, em consonância com as políticas de saúde vigentes; (Origem: PRT MS/GM 2681/2013, Art. 8º, V)
VI - manter articulação com os Estados para estimular a implantação de apoio aos Municípios para execução do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, VI)
VII - apoiar os Estados e o Distrito Federal no âmbito do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, VII)
VIII - promover articulação intersetorial para a efetivação do Programa Academia da Saúde com as outras políticas correlatas em âmbito nacional; (Origem: PRT MS/GM 2681/2013, Art. 8º, VIII)
IX - realizar monitoramento das propostas habilitadas para construção de polos do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, IX)
X - propor instrumentos e indicadores para acompanhamento e avaliação do impacto da implantação do Programa Academia da Saúde no Distrito Federal e nos Municípios; (Origem: PRT MS/GM 2681/2013, Art. 8º, X)
XI - divulgar o Programa Academia da Saúde nos diferentes espaços colegiados do SUS e da sociedade; (Origem: PRT MS/GM 2681/2013, Art. 8º, XI)
XII - identificar experiências exitosas e promover o intercâmbio das tecnologias produzidas entre o Distrito Federal e os Municípios com o Programa Academia da Saúde; e (Origem: PRT MS/GM 2681/2013, Art. 8º, XII)
XIII - fortalecer a construção de Comunidade de Práticas no SUS. (Origem: PRT MS/GM 2681/2013, Art. 8º, XIII)
Art. 10. Compete às Secretarias de Saúde dos Estados e do Distrito Federal: (Origem: PRT MS/GM 2681/2013, Art. 9º)
I - apoiar os Municípios situados no respectivo Estado na implantação e no desenvolvimento do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 9º, I)
II - promover articulação intersetorial para a implantação do Programa Academia da Saúde no âmbito estadual; (Origem: PRT MS/GM 2681/2013, Art. 9º, II)
III - definir recursos orçamentários e financeiros para a construção de polos e para a manutenção do Programa Academia da Saúde, conforme pactuação e quando necessário; (Origem: PRT MS/GM 2681/2013, Art. 9º, III)
IV - pactuar, junto aos Municípios, os instrumentos e indicadores complementares para o acompanhamento e avaliação do impacto da implantação do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 9º, IV)
V - estimular pesquisas nas áreas de interesse para o Programa Academia da Saúde, em especial aquelas consideradas estratégicas para formação e desenvolvimento tecnológico para a promoção da saúde e produção do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 9º, V)
VI - identificar experiências exitosas e promover o intercâmbio das tecnologias produzidas entre os Municípios; (Origem: PRT MS/GM 2681/2013, Art. 9º, VI)
VII - monitorar e avaliar o Programa Academia da Saúde no âmbito distrital e estadual junto aos Municípios; e (Origem: PRT MS/GM 2681/2013, Art. 9º, VII)
VIII - divulgar o Programa Academia da Saúde nos diferentes espaços colegiados do SUS e da sociedade. (Origem: PRT MS/GM 2681/2013, Art. 9º, VIII)
Art. 11. Compete às Secretarias de Saúde do Distrito Federal e dos Municípios: (Origem: PRT MS/GM 2681/2013, Art. 10)
I - implantar o Programa Academia da Saúde no âmbito distrital e municipal; (Origem: PRT MS/GM 2681/2013, Art. 10, I)
II - executar os recursos financeiros de investimento repassados pelo Ministério da Saúde para a construção de polos do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, II)
III - inserir o Programa Academia da Saúde no Plano Municipal de Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, III)
IV - definir recursos orçamentários e financeiros para a construção de polos e manutenção do Programa Academia da Saúde, conforme pactuação e quando necessário; (Origem: PRT MS/GM 2681/2013, Art. 10, IV)
V - apresentar o Programa Academia da Saúde ao respectivo Conselho de Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, V)
VI - elaborar fluxos para o funcionamento do Programa Academia da Saúde na rede distrital ou municipal e propor fluxos regionais de saúde na Comissão Intergestores Regional; (Origem: PRT MS/GM 2681/2013, Art. 10, VI)
VII - promover articulação intersetorial para a efetivação do Programa Academia da Saúde no âmbito distrital e municipal; (Origem: PRT MS/GM 2681/2013, Art. 10, VII)
VIII - estimular alternativas inovadoras e socialmente contributivas ao desenvolvimento sustentável de comunidades; (Origem: PRT MS/GM 2681/2013, Art. 10, VIII)
IX - estabelecer mecanismos para a qualificação dos profissionais do sistema local de saúde na área da promoção da saúde e produção do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 10, IX)
X - estabelecer instrumentos de gestão e indicadores complementares para o acompanhamento e avaliação do impacto da implantação do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, X)
XI - garantir o registro das atividades desenvolvidas no Programa; (Origem: PRT MS/GM 2681/2013, Art. 10, XI)
XII - utilizar o Sistema de Informação em Saúde para a Atenção Básica (SISAB) para envio de informações das atividades ao Ministério da Saúde ou outro sistema de informação vigente, observando-se os prazos determinados na Seção IV do Capítulo III do Título VII da Portaria de Consolidação nº 1; (Origem: PRT MS/GM 2681/2013, Art. 10, XII)
XIII - estimular pesquisas nas áreas de interesse para o Programa Academia da Saúde, em especial aquelas consideradas estratégicas para a formação e o desenvolvimento tecnológico para a promoção da saúde e produção do cuidado; e (Origem: PRT MS/GM 2681/2013, Art. 10, XIII)
XIV - divulgar o Programa Academia da Saúde nos diferentes espaços colegiados do SUS e da sociedade. (Origem: PRT MS/GM 2681/2013, Art. 10, XIV)
Art. 12. O Programa Academia da Saúde é um serviço da Atenção Básica e deve promover a articulação com toda a rede de atenção à saúde do SUS, bem como com outros serviços sociais realizados na respectiva região. (Origem: PRT MS/GM 2681/2013, Art. 11)
Art. 13. As atividades do Programa Academia da Saúde também serão desenvolvidas por profissionais da Atenção Básica, inclusive aqueles que atuam na Estratégia Saúde da Família e nos Núcleos de Apoio à Saúde da Família, quando houver. (Origem: PRT MS/GM 2681/2013, Art. 12)
Parágrafo Único. Além dos profissionais mínimos da equipe, o Distrito Federal e os Municípios poderão acrescentar profissional(ais) de outras áreas de conhecimento para o desenvolvimento de atividades afins aos objetivos, princípios e diretrizes do Programa Academia da Saúde. (Origem: PRT MS/GM 2681/2013, Art. 12, Parágrafo Único)
Art. 14. Fica recomendado ao Distrito Federal e aos Municípios a constituição de grupo de apoio à gestão para cada polo implantado, formado pelos profissionais que atuam no Programa Academia da Saúde e na Atenção Básica da área de abrangência do polo, por representantes do controle social e por profissionais de outras áreas envolvidas no Programa, a fim de garantir a gestão compartilhada do espaço e a organização das atividades. (Origem: PRT MS/GM 2681/2013, Art. 13)
Art. 15. O Programa Academia da Saúde será desenvolvido nos espaços dos polos, não havendo impedimento para extensão das atividades a outros equipamentos da saúde ou sociais. (Origem: PRT MS/GM 2681/2013, Art. 14)
Art. 16. Os recursos destinados à infraestrutura do polo do Programa Academia da Saúde poderão ser provenientes de recursos próprios da União, dos Estados, do Distrito Federal e dos Municípios, conforme pactuação. (Origem: PRT MS/GM 2681/2013, Art. 15)
Art. 17. É livre à iniciativa privada a reprodução total ou parcial de quaisquer das modalidades dos polos do Programa Academia da Saúde em espaços próprios, não havendo, porém, disponibilização de recursos financeiros de investimento e de custeio do Poder Público para tais fins. (Origem: PRT MS/GM 2681/2013, Art. 16)
Subseção I
Das Disposições Gerais
(Origem: PRT MS/GM 1707/2016, CAPÍTULO I)
Subseção I
Das Disposições Gerais
(Origem: PRT MS/GM 1707/2016, CAPÍTULO I)
Art. 18. Ficam definidos as regras e os critérios referentes aos incentivos financeiros de investimento para construção de polos; fica unificado o repasse do incentivo financeiro de custeio por meio do Piso Variável da Atenção Básica (PAB Variável); e ficam definidos os critérios de similaridade entre Programas em desenvolvimento no Distrito Federal e nos municípios e o Programa Academia da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 1º)
Art. 19. O Programa Academia da Saúde será desenvolvido nas seguintes modalidades de polos, a serem construídas pelo Distrito Federal e pelos municípios interessados, observadas as estruturas do Anexo I : (Origem: PRT MS/GM 1707/2016, Art. 2º)
I - Modalidade Básica; (Origem: PRT MS/GM 1707/2016, Art. 2º, I)
II - Modalidade Intermediária; e (Origem: PRT MS/GM 1707/2016, Art. 2º, II)
III - Modalidade Ampliada. (Origem: PRT MS/GM 1707/2016, Art. 2º, III)
§ 1º Os polos do Programa Academia da Saúde serão construídos pelo município ou Distrito Federal interessado, em conformidade com as estruturas físicas mínimas definidas no Anexo I . (Origem: PRT MS/GM 1707/2016, Art. 2º, § 1º)
§ 2º É facultada aos municípios e Distrito Federal a inclusão de equipamentos na área descoberta, dispostos no Anexo II , não podendo os mesmos serem substituídos por outros tipos. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 2º)
§ 3º É vedada a substituição dos equipamentos previstos no Anexo II por outros não previstos na regulamentação do Programa Academia da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 3º)
§ 4º Os polos do Programa Academia da Saúde deverão ser construídos na área de abrangência territorial do estabelecimento de saúde de referência no âmbito da Atenção Básica. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 4º)
§ 5º Para fins do disposto no § 4º, o polo da Modalidade Básica, tendo em vista sua estrutura reduzida, deverá ser construído em um raio de até 100 (cem) metros do estabelecimento de saúde de referência. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 5º)
§ 6º O polo do Programa Academia da Saúde deverá ser identificado utilizando padrões visuais do Programa Academia da Saúde, apresentados no Manual de Identidade Visual (MIV) do Programa Academia da Saúde, disponível no endereço eletrônico www.saude.gov.br/academiadasaude. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 6º)
Art. 20. As ações desenvolvidas em cada polo do Programa Academia da Saúde deverão somar, no mínimo, 40 (quarenta) horas semanais, com garantia de funcionamento do polo em, pelo menos, 2 (dois) turnos diários, em horários definidos a partir da necessidade da população e do território. (Origem: PRT MS/GM 1707/2016, Art. 3º)
Art. 21. O gestor de saúde poderá ampliar, a qualquer momento, o número de profissionais vinculados ao Programa Academia da Saúde, respeitando a lista do Anexo III . (Origem: PRT MS/GM 1707/2016, Art. 4º)
Art. 22. O gestor de saúde deverá estimular que as equipes da Atenção Básica, especialmente as equipes do NASF, quando houver, desenvolvam ações no polo de forma compartilhada com o(s) profissional(is) do Programa Academia da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 5º)
Art. 23. Os municípios e Distrito Federal interessados em implantar o Programa Academia da Saúde, a partir da data de publicação da Portaria nº 1707/GM/MS, de 23 de setembro de 2016, farão jus aos seguintes incentivos financeiros: (Origem: PRT MS/GM 1707/2016, Art. 6º)
I - de investimento, para construção de polos do Programa Academia da Saúde, regido pela Subseção II da Seção I do Capítulo I do Título I; e (Origem: PRT MS/GM 1707/2016, Art. 6º, I)
II - de custeio, para a manutenção dos polos do Programa Academia da Saúde, regido pelo Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 6º, II)
Subseção II
Do Incentivo Financeiro de Investimento do Programa Academia da Saúde
(Origem: PRT MS/GM 1707/2016, CAPÍTULO II)
Art. 24. O ente federativo habilitado poderá solicitar ao DAB/SAS/MS a alteração do local ou endereço da construção do polo do Programa Academia da Saúde, desde que: (Origem: PRT MS/GM 1707/2016, Art. 13)
I - o pedido de alteração de endereço seja efetuado antes do recebimento da 2ª parcela do incentivo de investimento; (Origem: PRT MS/GM 1707/2016, Art. 13, I)
II - realize a inserção no SISMOB dos documentos e informações relativas aos novos endereços; e (Origem: PRT MS/GM 1707/2016, Art. 13, II)
III - realize a inserção no SISMOB, caso o novo endereço de construção do polo do Programa Academia da Saúde acarrete também a mudança do seu estabelecimento de referência no âmbito da Atenção Básica, dos seguintes documentos e informações: (Origem: PRT MS/GM 1707/2016, Art. 13, III)
a) novo número de habitantes a serem cobertos pelo polo do Programa Academia da Saúde; e (Origem: PRT MS/GM 1707/2016, Art. 13, III, a)
b) número registrado no SCNES do novo estabelecimento de referência no âmbito da Atenção Básica da área de abrangência do polo. (Origem: PRT MS/GM 1707/2016, Art. 13, III, b)
Parágrafo Único. O novo local ou endereço para o qual é solicitada a construção do polo do Programa Academia da Saúde deverá estar em conformidade com as estruturas e respectivas áreas definidas no Anexo I e com a modalidade contemplada na proposta. (Origem: PRT MS/GM 1707/2016, Art. 13, Parágrafo Único)
Art. 25. As informações de monitoramento sobre o início, a execução, o andamento e a conclusão da obra do polo do Programa Academia da Saúde serão inseridas no SISMOB pelo ente federativo habilitado, sendo de responsabilidade do gestor de saúde a permanente e contínua atualização desses dados no mínimo uma vez a cada 30 (trinta) dias, responsabilizando-se ainda pela veracidade e qualidade dos dados fornecidos. (Origem: PRT MS/GM 1707/2016, Art. 14)
§ 1º Na hipótese de inexistência de modificação das informações descritas neste artigo até 60 (sessenta) dias após a última inserção de dados, o ente federativo habilitado, ainda assim, fica obrigado a acessar o SISMOB para registro dessa atividade pelo próprio sistema informatizado. (Origem: PRT MS/GM 1707/2016, Art. 14, § 1º)
§ 2º O monitoramento de que trata o "caput" não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 1707/2016, Art. 14, § 2º)
Art. 26. Caso o gestor de saúde responsável não providenciar a regularização da alimentação ou atualização das informações no SISMOB por 60 (sessenta) dias consecutivos, o DAB/SAS/MS adotará as medidas necessárias à suspensão do repasse dos recursos financeiros do Ministério da Saúde ao respectivo ente federativo para a execução do respectivo programa ou estratégia, a qual perdurará até o saneamento da mencionada irregularidade. (Origem: PRT MS/GM 1707/2016, Art. 15)
Parágrafo Único. Regularizada a causa que ensejou a suspensão do repasse de recursos financeiros de que trata o "caput", o DAB/SAS/MS providenciará a regularização das transferências dos recursos. (Origem: PRT MS/GM 1707/2016, Art. 15, Parágrafo Único)
Art. 27. Com o término da obra objeto do incentivo financeiro de investimento de que trata esta Subseção, o ente federativo habilitado assumirá a manutenção preventiva do respectivo polo do Programa Academia da Saúde pelo prazo mínimo de 5 (cinco) anos, como condição para continuar no Programa e, depois desse prazo, para receber eventuais novos recursos financeiros. (Origem: PRT MS/GM 1707/2016, Art. 16)
Art. 28. As despesas para construção dos polos do Programa Academia da Saúde são de responsabilidade compartilhada, de forma tripartite, entre a União, os estados, o Distrito Federal e os municípios. (Origem: PRT MS/GM 1707/2016, Art. 17)
§ 1º A complementação dos recursos financeiros repassados pelo Ministério da Saúde é de responsabilidade conjunta dos estados e dos municípios, em conformidade com a pactuação estabelecida na respectiva CIB. (Origem: PRT MS/GM 1707/2016, Art. 17, § 1º)
§ 2º Caso o custo final da construção do polo do Programa Academia da Saúde seja superior ao incentivo financeiro de investimento repassado pelo Ministério da Saúde para cada modalidade, nos termos desta Subseção, a respectiva diferença de valores deverá ser custeada pelo próprio município, pelo Distrito Federal ou pelo estado, conforme pactuação. (Origem: PRT MS/GM 1707/2016, Art. 17, § 2º)
Subseção III
Dos Critérios de Similaridade entre Programa em Desenvolvimento no Distrito Federal e nos Municípios e o Programa Academia da Saúde
(Origem: PRT MS/GM 1707/2016, CAPÍTULO IV)
Art. 29. Poderão pleitear o credenciamento ao recebimento do incentivo financeiro de custeio de que trata a Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6, na condição de programa similar ao Programa Academia da Saúde, conforme disposto no art. 136, III da Portaria de Consolidação nº 6, as iniciativas locais que: (Origem: PRT MS/GM 1707/2016, Art. 25)
I - estejam em desenvolvimento sob a gestão da Secretaria Municipal de Saúde ou da Secretaria de Saúde do Distrito Federal; (Origem: PRT MS/GM 1707/2016, Art. 25, I)
II - possuam profissional(is) em atuação no programa similar conforme lista de códigos da CBO descrita no Anexo III, sendo pelo menos 1 (um) profissional com carga horária de 40 (quarenta) horas semanais ou 2 (dois) profissionais com carga horária mínima de 20 (vinte) horas semanais cada, o(s) qual(is) desenvolverá(ão) atividades no programa similar ao Programa Academia da Saúde; (Origem: PRT MS/GM 1707/2016, Art. 25, II)
III - desenvolvam as ações previstas no art. 7º; (Origem: PRT MS/GM 1707/2016, Art. 25, III)
IV - possuam estrutura física construída ou adaptada exclusivamente para o Programa, semelhante ou igual a uma das modalidades de polo do Programa Academia da Saúde prevista no art. 19 e localizada em território coberto pelas ações da Atenção Básica; e (Origem: PRT MS/GM 1707/2016, Art. 25, IV)
V - ofertem ações por, no mínimo, 40 (quarenta) horas semanais, com garantia de funcionamento do polo em, pelo menos, 2 (dois) turnos diários, em horários definidos a partir da necessidade da população e do território. (Origem: PRT MS/GM 1707/2016, Art. 25, V)
Parágrafo Único. Não serão consideradas estruturas físicas semelhantes às modalidades de polo do Programa Academia da Saúde: (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único)
I - estabelecimentos de ensino; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, I)
II - locais de práticas religiosas; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, II)
III - equipamentos esportivos, tais como ginásios, quadras esportivas e poliesportivas; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, III)
IV - clubes municipais ou comunitários de esporte, lazer e recreação; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, IV)
V - centro de treinamento desportivo; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, V)
VI - centro social urbano; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, VI)
VII - conjunto de equipamentos para exercícios físicos resistidos dispostos em praças, parques e clubes; e (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, VII)
VIII - parques, praças e clubes em geral. (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, VIII)
Art. 30. Para pleitear o credenciamento ao recebimento do incentivo financeiro de custeio de que trata a Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6 destinado ao custeio de polos similares aos do Programa Academia da Saúde, serão observados os procedimentos dispostos no art. 137 da Portaria de Consolidação nº 6, no que couber. (Origem: PRT MS/GM 1707/2016, Art. 26)
Parágrafo Único. No momento da solicitação de recebimento do incentivo financeiro de custeio, na forma do "caput", o município ou Distrito Federal deverá informar o(s) SCNES do(s) polo(s) ou ao Estabelecimento de Atenção Básica onde a estrutura de apoio ao Programa esteja localizada. (Origem: PRT MS/GM 1707/2016, Art. 26, Parágrafo Único)
Art. 31. A habilitação ao credenciamento do incentivo financeiro de custeio de polos similares aos do Programa Academia da Saúde ocorrerá nos moldes do Anexo LXXV . (Origem: PRT MS/GM 1707/2016, Art. 27)
Art. 32. Para a manutenção do recebimento do incentivo financeiro de custeio, pelo Distrito Federal e municípios, destinado aos polos similares aos do Programa Academia da Saúde, será observado o disposto nos arts. 140 e 141 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 28)
Subseção IV
Das Disposições Transitórias
(Origem: PRT MS/GM 1707/2016, CAPÍTULO V)
Art. 33. Para as propostas de construção, ainda não concluídas, de polos do Programa Academia da Saúde habilitadas em 2013, 2014 e 2015, nos termos da Portaria nº 2.684/GM/MS, de 2013, serão observados os prazos dispostos no art. 805 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 29)
Art. 34. Para as propostas de construção de polos do Programa Academia da Saúde habilitadas em 2011 e 2012, nos termos da Portaria nº 2.684/GM/MS, de 8 de novembro de 2013, o repasse dos recursos financeiros será realizado mediante cumprimento § 4º do art. 19, das alíneas "c" e "d" do inciso II, alíneas "c" e "d" do inciso III e § 2º, todos do art. 804 da Portaria de Consolidação nº 6, bem como o art. 806 da Portaria de Consolidação nº 6 e os arts. 24, 25, 26, 27 e 28 , e, ainda, inserir no Sistema de Cadastro de Propostas Fundo a Fundo, disponível no endereço eletrônico www.fns.saude.gov.br, os seguintes documentos: (Origem: PRT MS/GM 1707/2016, Art. 30)
I - ordem de Serviço, assinada por profissional habilitado pelo CREA ou CAU, ratificada pelo gestor local e encaminhada à CIB ou CGSES/DF através de oficio, para solicitar a segunda parcela; e (Origem: PRT MS/GM 1707/2016, Art. 30, I)
II - atestado de Conclusão da Edificação, assinada por profissional habilitado pelo CREA ou CAU, ratificada pelo gestor local e encaminhada à CIB ou CGSES/DF através de Oficio, para solicitação da terceira parcela. (Origem: PRT MS/GM 1707/2016, Art. 30, II)
Parágrafo Único. O repasse da segunda e terceira parcelas de que tratam os incisos II e III do art. 804 da Portaria de Consolidação nº 6 apenas ocorrerá após análise e aprovação pelo DAB/SAS/MS das informações e dos documentos inseridos no Sistema do Fundo Nacional de Saúde e no SISMOB pelo ente federativo. (Origem: PRT MS/GM 1707/2016, Art. 30, Parágrafo Único)
Art. 35. Os polos do Programa da Academia da Saúde habilitados ao recebimento do incentivo de custeio nos termos da Portaria nº 2.684/GM/MS, de 8 de novembro de 2013 e da Portaria nº 183/GM/MS, de 30 de janeiro de 2014, serão regidos nos termos da regulamentação inaugurada com a publicação da Portaria nº 1.707/GM/MS, de 23 de setembro de 2016. (Origem: PRT MS/GM 1707/2016, Art. 31)
§ 1º Todos os polos custeados e habilitados nos termos da Portaria nº 2.684/GM/MS, de 2013, e da Portaria nº 183/GM/MS, de 30 de janeiro de 2014, passarão a receber, a partir da publicação da Portaria nº 1.707/GM/MS, de 23 de setembro de 2016, o incentivo financeiro de custeio de que trata a Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 31, § 1º)
§ 2º Os entes federativos com polos custeados fundo a fundo no Piso Varável da Vigilância em Saúde deverão proceder com o cadastro de proposta de custeio no sistema do Ministério da Saúde informado no endereço eletrônico www.saude.gov.br/academiadasaude, para fins de unificação do banco de informação. (Origem: PRT MS/GM 1707/2016, Art. 31, § 2º)
§ 3º O Distrito Federal e os municípios que se enquadrem na hipótese do § 2º e possuam mais de um polo custeados, nos termos da Portaria nº 2.684/GM/MS, de 2013, poderão cadastrar proposta de custeio para os demais polos, observado o disposto nos arts. 137, 138 e 139 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 31, § 3º)
Subseção V
Das Disposições Finais
(Origem: PRT MS/GM 1707/2016, CAPÍTULO VI)
Art. 36. O Distrito Federal e os municípios observarão o prazo que consta na Seção IV do Capítulo III do Título VII da Portaria de Consolidação nº 1, e suas alterações, para a operacionalização da estratégia e-SUSAB, por meio da utilização dos sistemas Coleta de Dados Simplificados (e-SUS CDS) e Prontuário Eletrônico do Cidadão (e-SUSAB PEC) e do Sistema de Informação em Saúde para a Atenção Básica (SISAB), para fins de financiamento e de adesão aos programas e estratégias da Política Nacional de Atenção Básica. (Origem: PRT MS/GM 1707/2016, Art. 32)
Art. 37. O monitoramento e a avaliação das atividades realizadas no âmbito do Programa Academia da Saúde ficarão a cargo do Ministério da Saúde, por meio da SAS/MS e da Secretaria de Vigilância em Saúde (SVS/MS), e das Secretarias de Saúde dos Estados, do Distrito Federal e dos municípios, podendo essas ações serem realizadas por meio de: (Origem: PRT MS/GM 1707/2016, Art. 33)
I - indicadores e instrumentos de gestão do SUS; (Origem: PRT MS/GM 1707/2016, Art. 33, I)
II - registro da produção dos profissionais de saúde no desenvolvimento de ações do Programa Academia da Saúde nos sistemas de informação do SUS; (Origem: PRT MS/GM 1707/2016, Art. 33, II)
III - instrumentos para identificar o grau de satisfação e adesão dos usuários; e (Origem: PRT MS/GM 1707/2016, Art. 33, III)
IV - inquéritos de base populacional. (Origem: PRT MS/GM 1707/2016, Art. 33, IV)
Art. 38. Na hipótese de execução integral do objeto originalmente pactuado e verificada sobra de recursos financeiros, o ente federativo poderá efetuar o remanejamento dos recursos e a sua aplicação nos termos da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 34)
Art. 39. Nos casos em que for verificada a não execução integral do objeto originalmente pactuado e a existência de recursos financeiros repassados pelo Fundo Nacional de Saúde para os fundos de saúde estaduais, distrital e municipais não executados, seja parcial ou totalmente, o ente federativo estará sujeito à devolução dos recursos financeiros transferidos e não executados, acrescidos da correção monetária prevista em lei, observado o regular processo administrativo. (Origem: PRT MS/GM 1707/2016, Art. 35)
Art. 40. Nos casos em que se verificar que não houve a execução do objeto originalmente pactuado e que os recursos financeiros transferidos pelo Fundo Nacional de Saúde foram executados, total ou parcialmente, em objeto distinto ao originalmente pactuado, aplicar-se-á o regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Origem: PRT MS/GM 1707/2016, Art. 36)
Art. 41. Os recursos financeiros para a execução das atividades previstas no âmbito do Programa Academia da Saúde são oriundos do orçamento do Ministério da Saúde, podendo onerar uma ou mais das seguintes fontes orçamentárias abaixo: (Origem: PRT MS/GM 1707/2016, Art. 37)
I - em relação ao incentivo financeiro de investimento para construção de polos do Programa Academia da Saúde, o Programa de Trabalho 10.301.2015.20YL - Estruturação das Academias da Saúde; e (Origem: PRT MS/GM 1707/2016, Art. 37, I)
II - em relação ao incentivo financeiro de custeio dos polos do Programa Academia da Saúde e dos polos habilitados em programa em desenvolvimento no Distrito Federal e no município identificado como similar ao Programa Academia da Saúde, o Programa de Trabalho 10.301.2015.20AD - Piso de Atenção Básica Variável - Saúde da Família. (Origem: PRT MS/GM 1707/2016, Art. 37, II)
Art. 42. O repasse dos recursos financeiros referentes ao Programa Academia da Saúde ficará condicionado à existência de disponibilidade orçamentária anual do Ministério da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 38)
CAPÍTULO II
DO SANGUE, COMPONENTES E HEMODERIVADOS
Art. 43. Os procedimentos operacionais pertinentes ao sangue, componentes e hemoderivados observarão o disposto no Anexo IV;
Seção I
Do Ressarcimento de Custos Operacionais de Sangue e Hemocomponentes ao SUS, Quando Houver Fornecimento aos Não-Usuários do SUS e Instituições Privadas de Saúde
Art. 44. Fica aprovada, na forma do Anexo V , a tabela de referência para fins de ressarcimento aos serviços de hemoterapia públicos do Sistema Único de Saúde (SUS), de procedimentos para atendimento hemoterápico aos não-usuários do SUS e instituições privadas de saúde. (Origem: PRT MS/GM 1469/2006, Art. 1º)
Art. 45. Ficam aprovados, na forma do Anexo VI , os instrumentos/indicadores de controle e avaliação de serviços prestados aos não usuários do SUS e a instituições privadas de saúde. (Origem: PRT MS/GM 1469/2006, Art. 2º)
Art. 46. Fica estabelecido, em conformidade com o Anexo VII , o formato de abatimento da produção direcionada para atendimento hemoterápico aos não-usuários do SUS e a instituições privadas de saúde daquela apresentada mensalmente ao SUS. (Origem: PRT MS/GM 1469/2006, Art. 3º)
Art. 47. Os Serviços de Hemoterapia Públicos que prestam ou venham prestar atendimento não-SUS apresentarão, mensalmente, à Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Hospitalar e de Urgência (CGSH/DAHU/SAS/MS), o demonstrativo de que trata o Anexo VII . (Origem: PRT MS/GM 1469/2006, Art. 4º)
Parágrafo Único. Em conformidade com a Resolução RDC nº 151, de 21 de agosto de 2001, da Agência Nacional de Vigilância Sanitária, para efetivação do atendimento hemoterápico aos não-usuários do SUS e a instituições privadas de saúde pelos serviços de hemoterapia públicos, deverão ser firmados contratos interinstitucionais considerando os níveis de complexidade da unidade contratante. (Origem: PRT MS/GM 1469/2006, Art. 4º, Parágrafo Único)
CAPÍTULO III
DA SAÚDE MENTAL
Seção I
Do Programa De Volta Para Casa e Comissão de Acompanhamento
Art. 48. São considerados egressos e possíveis beneficiários para efeito da Lei nº 10.708, todas as pessoas portadoras de transtorno mental que estejam comprovadamente internadas em hospital psiquiátrico por período ininterrupto igual ou superior a dois anos, as quais deverão estar incluídas no Cadastro de Beneficiários Potenciais do Programa "De Volta Para Casa". (Origem: PRT MS/GM 2077/2003, Art. 1º)
Parágrafo Único. Este critério aplica-se também às situações previstas nos § 1º e § 3º, do artigo 3º, da Lei nº 10.708/2003. (Origem: PRT MS/GM 2077/2003, Art. 1º, Parágrafo Único)
Art. 49. São documentos e procedimentos necessários para inclusão no Cadastro de Beneficiários Potenciais do Programa "De Volta Para Casa": (Origem: PRT MS/GM 2077/2003, Art. 2º)
I - relação de beneficiários potenciais colhidas pelo gestor local nas unidades prestadoras, num prazo de 30 (trinta) dias, a contar da data da publicação da Portaria nº 2077/GM/MS, de 31 de outubro de 2003; (Origem: PRT MS/GM 2077/2003, Art. 2º, I)
II - relatório da área de controle e avaliação atestando a conferência dos dados constantes na relação do Inciso I; e (Origem: PRT MS/GM 2077/2003, Art. 2º, II)
III - relação de possíveis beneficiários encaminhados pelos Hospitais de Custódia e Tratamento Psiquiátrico, num prazo de 30 (trinta) dias, para Secretaria Estadual de Saúde a contar da data de publicação da Portaria nº 2077/GM/MS, de 31 de outubro de 2003. (Origem: PRT MS/GM 2077/2003, Art. 2º, III)
§ 1º As relações referidas nos incisos I e III deverão conter as seguintes informações: nome e CNPJ da instituição, nome do paciente, data de nascimento, RG ou certidão de nascimento (se houver), CPF (se houver), diagnóstico, data de início da internação. (Origem: PRT MS/GM 2077/2003, Art. 2º, § 1º)
§ 2º As relações acima referidas deverão ser encaminhadas à Secretaria de Estado da Saúde/Coordenação de Saúde Mental para conhecimento e registro, e à Secretaria de Atenção à Saúde, do Ministério da Saúde, para análise e validação pela Comissão de Acompanhamento do Programa "De Volta Para Casa" (CAP-MS), de que trata o art. 58. (Origem: PRT MS/GM 2077/2003, Art. 2º, § 2º)
Art. 50. Da habilitação dos Municípios, tendo em vista atender ao inciso IV do art. 3º, da Lei nº 10.708/2003, são pré-condições cumulativas: (Origem: PRT MS/GM 2077/2003, Art. 3º)
I - o Município ofertar ações de saúde que atendam às necessidades dos beneficiários, conforme certificação pela Comissão Estadual pela comissão de acompanhamento (CAP-SES), de que trata o art. 58; (Origem: PRT MS/GM 2077/2003, Art. 3º, I)
II - os Municípios terem aderido formalmente ao Programa, por meio de envio de Termo de Adesão Anexo VIII ; e (Origem: PRT MS/GM 2077/2003, Art. 3º, II)
III - formalização da habilitação pelo Ministério da Saúde por meio de portaria. (Origem: PRT MS/GM 2077/2003, Art. 3º, III)
Art. 51. Serão considerados Municípios prioritários para habilitação no Programa aqueles que possuem ações desenvolvidas, ou em desenvolvimento, de reintegração social para pessoas acometidas por transtorno mental, que tenham moradores em serviços residenciais terapêuticos, e equipe de saúde estruturada para apoiar esta ação e que cumpram as seguintes condições: (Origem: PRT MS/GM 2077/2003, Art. 4º)
I - apresentam alta concentração de pessoas internadas em hospitais psiquiátricos que atendem aos requisitos de temporalidade do tratamento; (Origem: PRT MS/GM 2077/2003, Art. 4º, I)
II - tenham hospitais em processo de descredenciamento do SUS; e (Origem: PRT MS/GM 2077/2003, Art. 4º, II)
III - que estejam destinados a acolher pacientes de programas de desinstitucionalização egressos de hospitais localizados em outros Municípios. (Origem: PRT MS/GM 2077/2003, Art. 4º, III)
Art. 52. A solicitação de inclusão no Programa "De Volta Para Casa", preenchida e assinada pelo paciente Anexo IX ou seu representante legal, quando necessário Anexo X é documento indispensável para iniciar o processo, e será dirigido à Secretaria Municipal de Saúde, de Município habilitado; (Origem: PRT MS/GM 2077/2003, Art. 5º)
Parágrafo Único. O fluxo da solicitação à Secretaria Municipal de Saúde obedecerá à seguinte sequência: (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único)
I - avaliação da solicitação por parte de uma equipe de saúde designada pelo gestor municipal conforme Instrução Normativa Anexo XI e utilizando como base roteiro específico para avaliação proposto em manual do Programa "De Volta Para Casa" a ser expedido pela Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único, I)
II - se o parecer for favorável, será preenchido Formulário de Inclusão do Solicitante Anexo XII , contendo informações necessárias e obrigatórias que deverá ser enviado ao Ministério da Saúde/Secretaria de Atenção à Saúde (CAP-MS); e (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único, II)
III - se a solicitação de inclusão não for aprovada, é facultado ao solicitante recurso junto à Secretaria Estadual de Saúde e, em última instância, ao Ministério da Saúde. (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único, III)
Art. 53. São requisitos necessários para a solicitação de inclusão do beneficiário no Programa "De Volta Para Casa": (Origem: PRT MS/GM 2077/2003, Art. 6º)
I - a habilitação do Município responsável pela atenção continuada; (Origem: PRT MS/GM 2077/2003, Art. 6º, I)
II - o beneficiário deverá possuir a documentação exigida: Documento de Identidade /Registro Geral ou Certidão de Nascimento; e (Origem: PRT MS/GM 2077/2003, Art. 6º, II)
III - Formulário de Inclusão no Programa preenchido pelo Município. (Origem: PRT MS/GM 2077/2003, Art. 6º, III)
Parágrafo Único. O Departamento de Ações Programáticas Estratégicas - Saúde Mental, da Secretaria de Atenção à Saúde, deste Ministério, poderá solicitar informações complementares, para validação da inclusão, de acordo com o caso. (Origem: PRT MS/GM 2077/2003, Art. 6º, Parágrafo Único)
Art. 54. Para efeito de pagamento, de acordo com artigo 2º da Lei nº 10.708/2003: (Origem: PRT MS/GM 2077/2003, Art. 7º)
§ 1º O recebimento do benefício pelo paciente se dará após a sua saída da instituição hospitalar e de sua inserção no Programa "De Volta Para Casa" no âmbito local; (Origem: PRT MS/GM 2077/2003, Art. 7º, § 1º)
§ 2º Quando for o caso, se o beneficiário do Programa necessitar de representante legal, este deverá firmar termo de compromisso de fielmente zelar pelos direitos e deveres do beneficiário no âmbito do referido Programa Anexo XIII ; (Origem: PRT MS/GM 2077/2003, Art. 7º, § 2º)
§ 3º Para os beneficiários contemplados nos § 1º e § 3º, do art 3º, da Lei nº 10.708/2003, os repasses serão efetuados quando aprovados os processos de inclusão; e (Origem: PRT MS/GM 2077/2003, Art. 7º, § 3º)
§ 4º A operacionalização do pagamento será descrita em manual do Programa "De Volta Para Casa" a ser expedido pela Secretaria de Atenção à Saúde - SAS/MS; (Origem: PRT MS/GM 2077/2003, Art. 7º, § 4º)
Art. 55. A saída do paciente da instituição hospitalar implicará a exclusão do leito do cadastro SIH/SUS e transferência dos recursos correspondentes para ações extra-hospitalares de Saúde Mental por meio de mecanismos a ser regulamentado pela Secretaria de Atenção à Saúde - SAS/MS. (Origem: PRT MS/GM 2077/2003, Art. 8º)
Art. 56. A suspensão do benefício, nos termos do artigo 4º, da Lei nº 10.708/2003, ocorrerá: (Origem: PRT MS/GM 2077/2003, Art. 9º)
§ 1º A qualquer momento, por solicitação do beneficiário ou seu representante legal; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 1º)
§ 2º Quando ocorrer reinternação do beneficiário em hospital psiquiátrico, por período igual ou superior a 30 (trinta) dias ao ano; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 2º)
§ 3º Quando o beneficiário, de acordo com relatório trimestral de avaliação individual, realizado pela coordenação local, não reunir condições de permanecer inserido no Programa, conforme inciso II, do artigo 4º, da supracitada Lei; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 3º)
§ 4º Quando a coordenação local do Programa identificar que o representante legal não cumpre com as exigências contidas no termo de compromisso, enquanto não seja definido um novo representante legal; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 4º)
§ 5º Quando o gestor local descumprir com os compromissos firmados no Termo de Adesão municipal ao Programa; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 5º)
§ 6º Quando o paradeiro do beneficiário for desconhecido por mais de 40 (quarenta dias). (Origem: PRT MS/GM 2077/2003, Art. 9º, § 6º)
§ 7º Nos casos previstos nos § 2º e § 3º, é facultado recurso, pelo beneficiário ou seu representante legal, à Secretaria Estadual de Saúde e, em última instância, ao Ministério da Saúde; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 7º)
§ 8º Nos casos previstos no § 4º, é facultado recurso do Município ao Ministério da Saúde; e. (Origem: PRT MS/GM 2077/2003, Art. 9º, § 8º)
§ 9º Cabe à Secretaria Municipal de Saúde a notificação imediata à Secretaria de Estado da Saúde (CAP-SES), dos casos de reinternação dos beneficiários em hospital psiquiátrico ou Hospital de Custódia e Tratamento Psiquiátrico. (Origem: PRT MS/GM 2077/2003, Art. 9º, § 9º)
Art. 57. Para a renovação do benefício será necessário: (Origem: PRT MS/GM 2077/2003, Art. 10)
§ 1º Apresentação de relatório do gestor local ao Ministério da Saúde, contendo parecer da equipe de saúde que indicará necessidade de permanência do beneficiário no Programa, com antecedência de 60 dias do término de um ano do recebimento do auxílio; e (Origem: PRT MS/GM 2077/2003, Art. 10, § 1º)
§ 2º Parecer favorável da Comissão de Acompanhamento do Programa "De Volta Para Casa" (CAP-SES). (Origem: PRT MS/GM 2077/2003, Art. 10, § 2º)
Art. 58. Cabe ao Departamento de Ações Programáticas Estratégicas - Saúde Mental, da Secretaria de Atenção à Saúde, deste Ministério, ouvida a Comissão de Acompanhamento do Programa "De Volta Para Casa": (Origem: PRT MS/GM 2077/2003, Art. 11)
I - conceder o auxílio-reabilitação psicossocial; (Origem: PRT MS/GM 2077/2003, Art. 11, I)
II - decidir sobre inclusão e exclusão de beneficiário no Programa; (Origem: PRT MS/GM 2077/2003, Art. 11, II)
III - decidir sobre o pedido de renovação e homologá-lo ou não; (Origem: PRT MS/GM 2077/2003, Art. 11, III)
IV - gerar informação à instituição financeira quanto à renovação por mais 1 (um) ano; (Origem: PRT MS/GM 2077/2003, Art. 11, IV)
V - garantir recurso orçamentário para este fim; e (Origem: PRT MS/GM 2077/2003, Art. 11, V)
VI - decidir sobre habilitação de Município no Programa "De Volta Para Casa". (Origem: PRT MS/GM 2077/2003, Art. 11, VI)
Art. 59. O acompanhamento do auxílio-reabilitação psicossocial será efetuado através de Comissão de Acompanhamento do Programa "De Volta Para Casa" (CAP-MS), constituída pelo Ministério da Saúde, por meio de Portaria, que terá as seguintes atribuições: (Origem: PRT MS/GM 2077/2003, Art. 12)
I - emitir parecer sobre a habilitação de Municípios; (Origem: PRT MS/GM 2077/2003, Art. 12, I)
II - emitir parecer sobre inclusão e exclusão de beneficiário no Programa; (Origem: PRT MS/GM 2077/2003, Art. 12, II)
III - emitir parecer sobre renovação do auxílio-reabilitação psicossocial ao beneficiário; (Origem: PRT MS/GM 2077/2003, Art. 12, III)
IV - elaborar e pactuar as normas aplicáveis ao programa e submetê-las ao Ministério da Saúde; (Origem: PRT MS/GM 2077/2003, Art. 12, IV)
V - ratificar o levantamento nacional de clientela de beneficiários em potencial do Programa "De Volta Para Casa"; e (Origem: PRT MS/GM 2077/2003, Art. 12, V)
VI - acompanhar e assessorar a implantação e avaliação do Programa. (Origem: PRT MS/GM 2077/2003, Art. 12, VI)
Parágrafo Único. No âmbito Estadual deverá ser constituída Comissão Estadual de Acompanhamento do Programa "De Volta Para Casa" (CAP-SES) que terá as funções de emitir parecer sobre exclusão do Programa e renovação do benefício, bem como outras ações necessárias ao acompanhamento do Programa. (Origem: PRT MS/GM 2077/2003, Art. 12, Parágrafo Único)
Art. 60. Casos omissos serão decididos pela Secretaria de Atenção à Saúde - Departamento de Ações Programáticas Estratégicas - Saúde Mental, ouvida a Comissão de Acompanhamento do Programa "De Volta Para Casa". (Origem: PRT MS/GM 2077/2003, Art. 13)
Art. 61. Fica instituída a Comissão de Acompanhamento do "De Volta Para Casa" que será composta pelos representantes das seguintes instâncias/instituições, sob a coordenação do primeiro: (Origem: PRT MS/GM 2078/2003, Art. 1º)
I - Secretaria de Atenção à Saúde - Departamento de Ações Programáticas Estratégicas - Saúde Mental; (Origem: PRT MS/GM 2078/2003, Art. 1º, I)
II - Conselho Nacional dos Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2078/2003, Art. 1º, II)
III - Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); e (Origem: PRT MS/GM 2078/2003, Art. 1º, III)
IV - Comissão Intersetorial de Saúde Mental do Conselho Nacional de Saúde. (Origem: PRT MS/GM 2078/2003, Art. 1º, IV)
Art. 62. Ficam atribuídas à referida Comissão as seguintes responsabilidades: (Origem: PRT MS/GM 2078/2003, Art. 2º)
I - emitir parecer sobre a habilitação de Municípios; (Origem: PRT MS/GM 2078/2003, Art. 2º, I)
II - emitir parecer sobre inclusão e exclusão de beneficiário no Programa; (Origem: PRT MS/GM 2078/2003, Art. 2º, II)
III - emitir parecer sobre renovação do auxílio-reabilitação psicossocial ao beneficiário; (Origem: PRT MS/GM 2078/2003, Art. 2º, III)
IV - elaborar e pactuar as normas aplicáveis ao programa e submetê-las ao Ministério da Saúde; (Origem: PRT MS/GM 2078/2003, Art. 2º, IV)
V - pactuar a definição de Municípios prioritários para habilitação no programa; (Origem: PRT MS/GM 2078/2003, Art. 2º, V)
VI - ratificar o levantamento nacional de clientela de beneficiários em potencial do Programa "De Volta Para Casa"; e (Origem: PRT MS/GM 2078/2003, Art. 2º, VI)
VII - acompanhar e assessorar a implantação e avaliação do programa. (Origem: PRT MS/GM 2078/2003, Art. 2º, VII)
Art. 63. Fica atribuída à Secretaria de Atenção à Saúde (SAS/MS) a constituição de Grupo Técnico para assessorar a Comissão de Acompanhamento do Programa. (Origem: PRT MS/GM 2078/2003, Art. 3º)
Seção II
Do Programa de Desinstitucionalização Integrante do Componente Estratégias de Desinstitucionalização da Rede de Atenção Psicossocial (RAPS)
Art. 64. Fica criado o Programa de Desinstitucionalização como integrante do componente Estratégias de Desinstitucionalização da Rede de Atenção Psicossocial (RAPS), no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2840/2014, Art. 1º)
Art. 65. O componente Estratégias de Desinstitucionalização da RAPS é constituído por iniciativas que visam garantir às pessoas com sofrimento ou transtorno mental, e com necessidades decorrentes do uso de crack, álcool e outras drogas, em situação de internação de longa permanência, o cuidado integral por meio de estratégias substitutivas, na perspectiva da garantia de direitos com a promoção de autonomia e o exercício de cidadania, buscando-se sua progressiva inclusão social. (Origem: PRT MS/GM 2840/2014, Art. 2º)
Art. 66. O Programa de Desinstitucionalização tem como objetivos: (Origem: PRT MS/GM 2840/2014, Art. 3º)
I - apoiar e desenvolver ações de desinstitucionalização de pessoas com sofrimento ou transtorno mental e com necessidades decorrentes do uso de crack, álcool e outras drogas em situação de internação de longa permanência em hospitais psiquiátricos no âmbito do SUS; e (Origem: PRT MS/GM 2840/2014, Art. 3º, I)
II - apoiar e desenvolver ações e estratégias nos processos de reabilitação psicossocial no território das pessoas desinstitucionalizadas, favorecendo-se os percursos de produção de autonomia e da contratualidade social, de forma a garantir seus direitos e a efetiva participação e inclusão social, fortalecendo a RAPS. (Origem: PRT MS/GM 2840/2014, Art. 3º, II)
Parágrafo Único. Para fins desta Seção, considera-se a internação de longa permanência de que trata o inciso I do "caput" aquela superior a 1 (um) ano, de forma ininterrupta. (Origem: PRT MS/GM 2840/2014, Art. 3º, Parágrafo Único)
Art. 67. Para a consecução dos objetivos estabelecidos pelo art. 66 fica criada, no âmbito do Programa de Desinstitucionalização, a Equipe de Desinstitucionalização. (Origem: PRT MS/GM 2840/2014, Art. 4º)
Art. 68. Compete à Equipe de Desinstitucionalização: (Origem: PRT MS/GM 2840/2014, Art. 5º)
I - apoiar as equipes profissionais de hospital psiquiátrico e realizar, quando necessária, a avaliação clínica, psiquiátrica e psicossocial das pessoas em situação de internação de longa permanência em hospitais psiquiátricos, objetivando a elaboração de Projeto Terapêutico Singular (PTS), orientado para a desinstitucionalização e reabilitação psicossocial no território; (Origem: PRT MS/GM 2840/2014, Art. 5º, I)
II - apoiar as equipes de profissionais de hospital psiquiátrico na transformação da organização institucional, com vistas à reabilitação psicossocial, garantindo-se o respeito aos direitos humanos das pessoas internadas; (Origem: PRT MS/GM 2840/2014, Art. 5º, II)
III - apoiar as equipes de profissionais de hospital psiquiátrico na reestruturação do funcionamento técnico operacional da instituição, com implementação e fortalecimento do trabalho em equipe multiprofissional, e a reorganização das enfermarias de acordo com a procedência das pessoas internadas e/ou municípios de residência atual dos familiares, respeitando-se, sempre que possível, os vínculos estabelecidos entre as pessoas internadas no ambiente hospitalar; (Origem: PRT MS/GM 2840/2014, Art. 5º, III)
IV - apoiar as equipes de profissionais de hospital psiquiátrico no desenvolvimento de estratégias ou ações que favoreçam a construção de protagonismo das pessoas internadas, tais como assembleias, espaços coletivos de encontros e trocas, reapropriação do uso dos objetos pessoais; (Origem: PRT MS/GM 2840/2014, Art. 5º, IV)
V - apoiar as equipes de profissionais de hospital psiquiátrico no desenvolvimento de estratégias que garantam o cuidado cotidiano na perspectiva da desinstitucionalização e da reabilitação psicossocial, incluídas as questões clínicas, com redimensionamento da atenção orientada para a construção de autonomia e o acesso aos direitos de cidadania; (Origem: PRT MS/GM 2840/2014, Art. 5º, V)
VI - desenvolver ações nos contextos dos projetos terapêuticos singulares que viabilizem a obtenção de documentação e o acesso a benefícios previdenciários e assistenciais, assim como o auxílio-reabilitação psicossocial do Programa De Volta Para Casa; (Origem: PRT MS/GM 2840/2014, Art. 5º, VI)
VII - identificar situação de curatela e procurações existentes com o devido acionamento dos órgãos competentes para as providências necessárias; (Origem: PRT MS/GM 2840/2014, Art. 5º, VII)
VIII - desenvolver estratégias de rearticulação de vínculos familiares e/ou sociais e de promoção da participação dos familiares e/ou pessoas das redes sociais das pessoas internadas no processo de desinstitucionalização, tais como atenção familiar, visita domiciliar, reunião de familiares, assembleias, além de ações conjuntas com os familiares e as pessoas internadas; (Origem: PRT MS/GM 2840/2014, Art. 5º, VIII)
IX - desenvolver ações que propiciem a interação das pessoas internadas com seus familiares e pessoas da cidade, com criação de espaços para promoção de encontros dentro do hospital e nos territórios da cidade; (Origem: PRT MS/GM 2840/2014, Art. 5º, IX)
X - articular recursos, instituições e pontos de atenção da RAPS no território para acolhimento, cuidado e reabilitação psicossocial das pessoas com internação de longa permanência, visando à desinstitucionalização, respeitando-se, sempre que possível, os vínculos criados pelas pessoas durante o período em que estiveram internadas, de acordo com os seguintes critérios: (Origem: PRT MS/GM 2840/2014, Art. 5º, X)
a) retorno à família, quando houver possibilidade de coabitação e convivência, de acordo com projetos terapêuticos singulares; (Origem: PRT MS/GM 2840/2014, Art. 5º, X, a)
b) inserção nos Serviços Residenciais Terapêuticos (SRT); e (Origem: PRT MS/GM 2840/2014, Art. 5º, X, b)
c) para as pessoas com deficiência, quando indicado, encaminhamento para as residências inclusivas, estabelecidas pela Portaria Interministerial nº 03/MDS/MS, de 21 de setembro de 2012; (Origem: PRT MS/GM 2840/2014, Art. 5º, X, c)
XI - desenvolver estratégias para educação permanente dos atores institucionais e comunitários implicados no projeto; (Origem: PRT MS/GM 2840/2014, Art. 5º, XI)
XII - avaliar os casos de internação psiquiátrica compulsória ou em cumprimento de medida de segurança e articular com os órgãos competentes para abordagem destas situações; e (Origem: PRT MS/GM 2840/2014, Art. 5º, XII)
XIII - compor as equipes multiprofissionais dos pontos de atenção das RAPS, de acordo com os critérios definidos nos arts. 69 e 70 e no art. 1057 da Portaria de Consolidação nº 6, visando à qualificação das ações e estratégias desenvolvidas nestes pontos de atenção, em especial o apoio aos processos de reabilitação psicossocial no território das pessoas desinstitucionalizadas, favorecendo-se os percursos de produção de autonomia e de fortalecimento da contratualidade social, de forma a garantir seus direitos e efetiva participação e inclusão social. (Origem: PRT MS/GM 2840/2014, Art. 5º, XIII)
Parágrafo Único. As orientações e instrumentos para o desenvolvimento das ações indicadas no inciso I do "caput" serão disponibilizados na página da Coordenação-Geral de Saúde Mental, Álcool e Outras Drogas, do Ministério da Saúde (CGMAD/DAET/SAS/MS) por meio do endereço eletrônico www.saude.gov.br/mental, num prazo de 30 (trinta) dias a contar da data da publicação da Portaria nº 2840/GM/MS, de 29 de dezembro de 2014. (Origem: PRT MS/GM 2840/2014, Art. 5º, Parágrafo Único)
Art. 69. A Equipe de Desinstitucionalização poderá ser de duas modalidades: (Origem: PRT MS/GM 2840/2014, Art. 6º)
I - modalidade A; e (Origem: PRT MS/GM 2840/2014, Art. 6º, I)
II - modalidade B. (Origem: PRT MS/GM 2840/2014, Art. 6º, II)
§ 1º A modalidade A será composta pelos seguintes profissionais da área de saúde: (Origem: PRT MS/GM 2840/2014, Art. 6º, § 1º)
I - 1 (um) médico com formação e experiência em saúde mental ou psiquiatra; e (Origem: PRT MS/GM 2840/2014, Art. 6º, § 1º, I)
II - 1 (um) profissional, dentre psicólogo, assistente social, terapeuta ocupacional e enfermeiro. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 1º, II)
§ 2º A modalidade B será composta pelos seguintes profissionais da área de saúde: (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º)
I - 1 (um) médico com formação e experiência em saúde mental ou psiquiatra; (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º, I)
II - 1 (um) enfermeiro; e (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º, II)
III - 3 (três) profissionais, dentre psicólogo, assistente social e terapeuta ocupacional, sendo preferencialmente 1 (um) profissional de cada categoria citada neste inciso. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º, III)
§ 3º No caso da equipe modalidade A, a carga horaria mínima será de 50 (cinquenta) horas semanais, devendo o médico apresentar carga horaria semanal mínima de 10 (dez) horas. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 3º)
§ 4º O somatório da carga horária dos integrantes da Equipe de Desinstitucionalização modalidade B será de, no mínimo, 170 (cento e setenta) horas semanais. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 4º)
§ 5º A Equipe de Desinstitucionalização das modalidades A e B terão sua carga horária de trabalho distribuída de segunda a sexta-feira, em regime diário de até 8 (oito) horas, podendo, se necessário, desenvolver atividades nos finais de semana e feriados. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 5º)
§ 6º Os profissionais mencionados no § 2º do "caput" terão carga horária mínima de 20 (vinte) horas semanais de trabalho. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 6º)
§ 7º A Equipe de Desinstitucionalização de modalidades A e B serão viabilizadas e geridas pelo gestor público municipal de saúde, respeitando-se a legislação vigente referente à contratação de recursos humanos. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 7º)
§ 8º A Equipe de Desinstitucionalização deverá ser incluída no Sistema Cadastro Nacional de Estabelecimentos de Saúde (SCNES) pelo Município responsável. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 8º)
Art. 70. A Equipe de Desinstitucionalização desenvolverá suas ações conforme previsto no art. 68, devendo cumprir as metas e os prazos estabelecidos nas "Ações de Desinstitucionalização e de Fortalecimento da RAPS" previstas no Anexo XXXVII . (Origem: PRT MS/GM 2840/2014, Art. 7º)
Art. 71. Caberá às Secretarias Estaduais de Saúde promover o desenvolvimento de ações de articulação dos Municípios e de cooperação técnica e financeira, quando couber, objetivando-se a desinstitucionalização das pessoas com internação de longa permanência em hospitais psiquiátricos e implantação e qualificação da RAPS. (Origem: PRT MS/GM 2840/2014, Art. 16)
Art. 72. Uma vez cumpridas as recomendações previstas no art. 1058 da Portaria de Consolidação nº 6, o gestor encaminhará ofício, conforme modelo constante do Anexo XLII , informando a redução dos leitos psiquiátricos e, quando for o caso, a imediata reclassificação do hospital, de acordo com a Portaria nº 52/GM/MS, de 20 de janeiro de 2004, e a Seção V do Capítulo III do Título VIII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 2840/2014, Art. 19)
Art. 73. A avaliação e o monitoramento do Programa de Desinstitucionalização serão realizados pode meio de: (Origem: PRT MS/GM 2840/2014, Art. 20)
I - constituição de Comissão de Acompanhamento da execução das "Ações de Desinstitucionalização e de Fortalecimento da RAPS", com cooperação técnica federal, estadual e municipal, e com representações das respectivas áreas de saúde mental; e (Origem: PRT MS/GM 2840/2014, Art. 20, I)
II - Grupo Condutor Regional da RAPS já constituído, que realizará o acompanhamento da execução das "Ações de Desinstitucionalização e de Fortalecimento da RAPS", com cooperação técnica federal, estadual e municipal e com representações das respectivas áreas de saúde mental. (Origem: PRT MS/GM 2840/2014, Art. 20, II)
§ 1º As estratégias de avaliação e de monitoramento da execução das "Ações de Desinstitucionalização e de Fortalecimento da RAPS" serão definidas e desenvolvidas pela Comissão de Acompanhamento ou Grupo Condutor Regional da RAPS. (Origem: PRT MS/GM 2840/2014, Art. 20, § 1º)
§ 2º A Comissão de Acompanhamento e Grupo Condutor Estadual da RAPS acompanharão o processo de avaliação e monitoramento das "Ações de Desinstitucionalização e de Fortalecimento da RAPS", bem como zelarão pelo seu cumprimento. (Origem: PRT MS/GM 2840/2014, Art. 20, § 2º)
Art. 74. O monitoramento de que trata esta Seção não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 2840/2014, Art. 21)
Seção III
Do Programa de Atenção Integral a Usuários de Álcool e Outras Drogas
Art. 75. Fica instituído, no âmbito do SUS, o Programa de Atenção Integral a Usuários de Álcool e outras Drogas, a ser desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios. (Origem: PRT MS/GM 2197/2004, Art. 1º)
Art. 76. O Programa de Atenção Integral a Usuários de Álcool e outras Drogas terá como seus principais componentes: (Origem: PRT MS/GM 2197/2004, Art. 2º)
I - componente da atenção básica; (Origem: PRT MS/GM 2197/2004, Art. 2º, I)
II - componente da atenção nos CAPS-AD, ambulatórios e outras unidades extra-hospitalares especializadas; (Origem: PRT MS/GM 2197/2004, Art. 2º, II)
III - componente da atenção hospitalar de referência; e (Origem: PRT MS/GM 2197/2004, Art. 2º, III)
IV - componente da rede de suporte social (associações de ajuda mútua e entidades da sociedade civil), complementar à rede de serviços disponibilizados pelo SUS. (Origem: PRT MS/GM 2197/2004, Art. 2º, IV)
Art. 77. O componente da atenção básica, de que trata o art. 76, I refere-se à atenção integral aos usuários de álcool e outras drogas em unidades de atenção básica, ambulatórios não-especializados, Programa Saúde da Família e Programa de Agentes Comunitários de Saúde, entre outros dispositivos de cuidados possíveis, no âmbito da atenção básica, e deve ter como principais características: (Origem: PRT MS/GM 2197/2004, Art. 3º)
I - atuação articulada ao restante da rede de atenção integral aos usuários de álcool e outras drogas, bem como à rede de cuidados em saúde mental, devendo ainda ser implicada a rede de cuidados em DST/AIDS; (Origem: PRT MS/GM 2197/2004, Art. 3º, I)
II - atuação e inserção comunitárias, em maior nível de capilaridade para ações como detecção precoce de casos de uso nocivo e/ou dependência de álcool e outras drogas, de forma articulada a práticas terapêuticas/preventivas/educativas, tais como aconselhamento breve e intervenções breves voltadas para a redução ou o cessar do consumo, contemplando ainda o encaminhamento precoce para intervenções mais especializadas, ou para a abordagem de complicações clínicas e/ou psiquiátricas decorrentes de tal consumo; e (Origem: PRT MS/GM 2197/2004, Art. 3º, II)
III - adoção da lógica de redução de danos, que é estratégica para o êxito das ações desenvolvidas por essas unidades. (Origem: PRT MS/GM 2197/2004, Art. 3º, III)
Art. 78. O componente da atenção nos CAPSad, ambulatórios e outras unidades especializadas, objeto do art. 76, II, obedece a uma lógica de oferta de cuidados baseados na atenção integral, devendo ter como principais características: (Origem: PRT MS/GM 2197/2004, Art. 4º)
I - oferta aos usuários de álcool e outras drogas e seus familiares, de acolhimento, atenção integral (práticas terapêuticas/preventivas/de promoção de saúde/educativas/de reabilitação psicossocial) e estímulo à sua integração social e familiar; (Origem: PRT MS/GM 2197/2004, Art. 4º, I)
II - inserção comunitária de práticas e serviços, os quais devem atender a uma população referida a um território específico; (Origem: PRT MS/GM 2197/2004, Art. 4º, II)
III - funcionamento, especialmente para os CAPSad, segundo normas expressas na Portaria n° 189/SAS, de 20 de março de 2002, na Portaria n° 305/SAS, de 3 de maio de 2002, no Capítulo I do Título II do Anexo V da Portaria de Consolidação nº 3 e na Seção IV do Capítulo III do Título I; (Origem: PRT MS/GM 2197/2004, Art. 4º, III)
IV - articulação de todas estas unidades ao restante da rede de atenção integral aos usuários de álcool e outras drogas, bem como à rede de cuidados em saúde mental, devendo ainda ser considerada a rede de cuidados em DST/AIDS; e (Origem: PRT MS/GM 2197/2004, Art. 4º, IV)
V - adoção da lógica de redução de danos, como estratégica para o êxito das ações desenvolvidas por estas unidades. (Origem: PRT MS/GM 2197/2004, Art. 4º, V)
§ 1º As outras unidades ambulatoriais mencionadas devem trabalhar seguindo orientação específica, porém, dentro de sistemática similar à utilizada para os CAPSad, quanto à proposta de atenção integral a usuários e familiares, à inserção comunitária e à lógica territorial desses serviços. (Origem: PRT MS/GM 2197/2004, Art. 4º, § 1º)
§ 2º A criação do Serviço Hospitalar de Referência para a Atenção Integral aos Usuários de Álcool e outras Drogas (SHR-ad) não exclui a obrigatoriedade da existência de leitos para desintoxicação e repouso, conforme previsto pela Capítulo I do Título II do Anexo V da Portaria de Consolidação nº 3, mencionada anteriormente. (Origem: PRT MS/GM 2197/2004, Art. 4º, § 2º)
Art. 79. O componente de atenção hospitalar de referência, objeto do art. 76, III, define que os Serviços Hospitalares de Referência para a Atenção Integral aos Usuários de Álcool e outras Drogas (SHR-ad) serão instalados em Hospitais Gerais, e têm como objetivos: (Origem: PRT MS/GM 2197/2004, Art. 5º)
I - compor rede de atenção integral a usuários de álcool e outras drogas, participando do sistema de organização e regulação das demandas e fluxos assistenciais, em área geográfica definida, respeitando as atribuições e competências das instâncias do SUS para a sua implantação e gerenciamento; (Origem: PRT MS/GM 2197/2004, Art. 5º, I)
II - compor, na rede assistencial, e em sua estrutura de atendimento hospitalar de urgência e emergência, a rede hospitalar de retaguarda aos usuários de álcool e outras drogas; (Origem: PRT MS/GM 2197/2004, Art. 5º, II)
III - atuar respeitando as premissas do SUS e a lógica territorial, salvo em casos de ausência de recursos assistenciais similares, onde a clientela atendida poderá ultrapassar os limites territoriais previstos para a abrangência do serviço; (Origem: PRT MS/GM 2197/2004, Art. 5º, III)
IV - dar suporte à demanda assistencial caracterizada por situações de urgência/emergência que sejam decorrentes do consumo ou abstinência de álcool e/ou outras drogas, advindas da rede dos Centros de Atenção Psicossocial para a Atenção a Usuários de Álcool e outras Drogas (CAPSad), da rede básica de cuidados em saúde (Programa Saúde da Família, e Unidades Básicas de Saúde), e de serviços ambulatoriais especializados e não-especializados; (Origem: PRT MS/GM 2197/2004, Art. 5º, IV)
V - oferecer suporte hospitalar, por meio de internações de curta duração para usuários de álcool e/ou outras drogas, em situações assistenciais para as quais os recursos extra-hospitalares disponíveis não tenham obtido a devida resolutividade, ou ainda em casos de necessidade imediata de intervenção em ambiente hospitalar, sempre respeitadas as determinações da Lei nº 10.216, e sempre acolhendo os pacientes em regime de curtíssima e curta permanência; (Origem: PRT MS/GM 2197/2004, Art. 5º, V)
VI - oferecer, nas situações descritas no art. 76, incisos III e IV II , abordagem, suporte e encaminhamento adequado aos usuários que, mediante avaliação geral, evidenciarem indicativos de ocorrência de comorbidades de ordem clínica e/ou psíquica; e (Origem: PRT MS/GM 2197/2004, Art. 5º, VI)
VII - evitar a internação de usuários de álcool e outras drogas em hospitais psiquiátricos. (Origem: PRT MS/GM 2197/2004, Art. 5º, VII)
Art. 80. O componente da rede de suporte social, objeto do art. 76, II inclui dispositivos comunitários de acolhida e cuidados, que devem ter as seguintes características: (Origem: PRT MS/GM 2197/2004, Art. 6º)
I - estar articulados à rede de cuidados do SUS (não sendo, porém, componentes dessa rede, mas instância complementar), são exemplos os grupos de mútua ajuda, entidades congregadoras de usuários, associações comunitárias e demais entidades da sociedade civil organizada; (Origem: PRT MS/GM 2197/2004, Art. 6º, I)
II - configurar, assim, estrutura complementar à rede de serviços disponibilizados pelo SUS; e (Origem: PRT MS/GM 2197/2004, Art. 6º, II)
III - respeitar as determinações da Lei nº 10.216, para unidades, não componentes da rede do SUS, que trabalham com a permanência de pacientes em regime fechado. (Origem: PRT MS/GM 2197/2004, Art. 6º, III)
Art. 81. Os objetivos descritos no art. 79 serão direcionados prioritariamente a pessoas que fazem uso prejudicial de álcool, em face da magnitude epidemiológica do seu uso e de suas consequências, porém, contemplando igualmente o conjunto de usuários de álcool e outras drogas que apresente a maior demanda por cuidados, no território de abrangência de cada serviço. (Origem: PRT MS/GM 2197/2004, Art. 7º)
Parágrafo Único. O componente hospitalar do Programa de Atenção Integral a Usuários de Álcool e outras Drogas obedece às determinações da Lei nº 10.216/2001 que são relativas à internação hospitalar, considerando em sua lógica de funcionamento somente internações hospitalares que demandem por curta permanência dos usuários, em suas unidades de referência. (Origem: PRT MS/GM 2197/2004, Art. 7º, Parágrafo Único)
Art. 82. Em função da existência de diferentes níveis de organização para as redes assistenciais locais e da variação da incidência e da gravidade dos transtornos decorrentes do uso de álcool e outras drogas, e, como primeira etapa do programa, deverão ser habilitados Serviços Hospitalares de Atenção Integral aos Usuários de Álcool e outras Drogas (SRH-ad), de acordo com as prioridades abaixo estabelecidas: (Origem: PRT MS/GM 2197/2004, Art. 9º)
I - regiões metropolitanas; (Origem: PRT MS/GM 2197/2004, Art. 9º, I)
II - municípios acima de 200.000 habitantes; (Origem: PRT MS/GM 2197/2004, Art. 9º, II)
III - municípios que já possuam CAPSad em funcionamento; e (Origem: PRT MS/GM 2197/2004, Art. 9º, III)
IV - municípios onde já esteja implantado o Serviço de Atendimento Móvel de Urgência - SAMU/192. (Origem: PRT MS/GM 2197/2004, Art. 9º, IV)
Parágrafo Único. Deverão, também, ser levadas em consideração outras necessidades de ordem epidemiológica e estratégica para a consolidação da rede assistencial aos usuários de álcool e outras drogas. (Origem: PRT MS/GM 2197/2004, Art. 9º, Parágrafo Único)
Art. 83. A Secretaria de Atenção à Saúde adotará as providências necessárias ao cumprimento e à regulamentação do Programa de Atenção Integral a Usuários de Álcool e outras Drogas, no que se refere aos procedimentos a serem realizados pelos Serviços Hospitalares de Referência para a Atenção Integral aos Usuários de Álcool e outras Drogas (SHR-ad), critérios para habilitação e normas de funcionamento. (Origem: PRT MS/GM 2197/2004, Art. 11)
Seção IV
Do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas
Art. 84. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas, a ser desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, Distrito Federal e municípios, tendo por objetivos: (Origem: PRT MS/GM 816/2002, Art. 1º)
I - articular as ações desenvolvidas pelas três esferas de governo destinadas a promover a atenção aos pacientes com dependência e/ou uso prejudicial de álcool ou outras drogas; (Origem: PRT MS/GM 816/2002, Art. 1º, I)
II - organizar e implantar rede estratégica de serviços extra-hospitalares de atenção aos pacientes com esse tipo de transtorno, articulada à rede de atenção psicossocial; (Origem: PRT MS/GM 816/2002, Art. 1º, II)
III - aperfeiçoar as intervenções preventivas como forma de reduzir os danos sociais e à saúde representados pelo uso prejudicial de álcool e outras drogas; (Origem: PRT MS/GM 816/2002, Art. 1º, III)
IV - realizar ações de atenção/assistência aos pacientes e familiares, de forma integral e abrangente, com atendimento individual, em grupo, atividades comunitárias, orientação profissional, suporte medicamentoso, psicoterápico, de orientação e outros; (Origem: PRT MS/GM 816/2002, Art. 1º, IV)
V - organizar/regular as demandas e os fluxos assistenciais; (Origem: PRT MS/GM 816/2002, Art. 1º, V)
VI - promover, em articulação com instituições formadoras, a capacitação e supervisão das equipes de atenção básica, serviços e programas de saúde mental locais. (Origem: PRT MS/GM 816/2002, Art. 1º, VI)
Art. 85. Ficam definidas, na forma do Anexo XVIII , as competências e atribuições relativas à implantação/gestão do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas de cada nível de gestão do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 816/2002, Art. 2º)
Art. 86. Os procedimentos realizados pelos CAPS e NAPS existentes, após o seu recadastramento, assim como os novos serviços que vierem a ser criados e cadastrados em conformidade com o estabelecido na regulamentação do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas, serão remunerados através do Sistema APAC/SIA, conforme estabelecido Capítulo I do Título II do Anexo V da Portaria de Consolidação nº 3 e SAS/MS N° 189, de 20 de março de 2002. (Origem: PRT MS/GM 816/2002, Art. 5º)
Art. 87. Fica instituído o Programa Permanente de Capacitação de Recursos Humanos da rede SUS para os Serviços de Atenção aos Pacientes com Transtornos causados pelo Uso Prejudicial e/ou Dependência de Álcool e Outras Drogas, a ser regulamentado em ato específico da Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 816/2002, Art. 7º)
Art. 88. A Secretaria de Atenção à Saúde adotará as providências necessárias ao cumprimento do disposto nesta Seção, procedendo a sua respectiva regulamentação. (Origem: PRT MS/GM 816/2002, Art. 9º)
Seção V
Das Ações que Visam à Redução de Danos Sociais e à Saúde, Decorrentes do Uso de Produtos, Substâncias ou Drogas que Causem Dependência
Art. 89. As ações que visam à redução de danos sociais e à saúde, decorrentes do uso de produtos, substâncias ou drogas que causem dependência, são reguladas por esta Seção. (Origem: PRT MS/GM 1028/2005, Art. 1º)
Art. 90. A redução de danos sociais e à saúde, decorrentes do uso de produtos, substâncias ou drogas que causem dependência, desenvolver-se-á por meio de ações de saúde dirigidas a usuários ou a dependentes que não podem, não conseguem ou não querem interromper o referido uso, tendo como objetivo reduzir os riscos associados sem, necessariamente, intervir na oferta ou no consumo. (Origem: PRT MS/GM 1028/2005, Art. 2º)
Art. 91. As ações de redução de danos sociais e à saúde, decorrentes do uso de produtos, substâncias ou drogas que causem dependência, compreenderão uma ou mais das medidas de atenção integral à saúde, listadas a seguir, praticadas respeitando as necessidades do público alvo e da comunidade: (Origem: PRT MS/GM 1028/2005, Art. 3º)
I - informação, educação e aconselhamento; (Origem: PRT MS/GM 1028/2005, Art. 3º, I)
II - assistência social e à saúde; e (Origem: PRT MS/GM 1028/2005, Art. 3º, II)
III - disponibilização de insumos de proteção à saúde e de prevenção ao HIV/Aids e Hepatites. (Origem: PRT MS/GM 1028/2005, Art. 3º, III)
Art. 92. As ações de informação, educação e aconselhamento terão por objetivo o estímulo à adoção de comportamentos mais seguros no consumo de produtos, substâncias ou drogas que causem dependência, e nas práticas sexuais de seus consumidores e parceiros sexuais. (Origem: PRT MS/GM 1028/2005, Art. 4º)
§ 1º São conteúdos necessários das ações de informação, educação e aconselhamento: (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º)
I - informações sobre os possíveis riscos e danos relacionados ao consumo de produtos, substâncias ou drogas que causem dependência; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, I)
II - desestímulo ao compartilhamento de instrumentos utilizados para consumo de produtos, substâncias ou drogas que causem dependência; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, II)
III - orientação sobre prevenção e conduta em caso de intoxicação aguda ("overdose"); (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, III)
IV - prevenção das infecções pelo HIV, hepatites, endocardites e outras patologias de padrão de transmissão similar; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, IV)
V - orientação para prática do sexo seguro; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, V)
VI - divulgação dos serviços públicos e de interesse público, nas áreas de assistência social e de saúde; e (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, VI)
VII - divulgação dos princípios e garantias fundamentais assegurados na Constituição Federal e nas declarações universais de direitos. (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, VII)
§ 2º As ações de informação, educação e aconselhamento devem, necessariamente, ser acompanhadas da distribuição dos insumos destinados a minimizar os riscos decorrentes do consumo de produtos, substâncias e drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 4º, § 2º)
Art. 93. A oferta de assistência social e à saúde, na comunidade e em serviços, objetivará a garantia de assistência integral ao usuário ou ao dependente de produtos, substâncias ou drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 5º)
Parágrafo Único. São ações necessárias na oferta de assistência social e à saúde, quando requeridas pelo usuário ou pelo dependente: (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único)
I - o tratamento à dependência causada por produtos, substâncias ou drogas; (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, I)
II - o diagnóstico da infecção pelo HIV e o tratamento da infecção pelo HIV e da AIDS; (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, II)
III - a imunização, o diagnóstico e o tratamento das hepatites virais; (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, III)
IV - o diagnóstico e o tratamento das doenças sexualmente transmissíveis (DST); e (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, IV)
V - a orientação para o exercício dos direitos e garantias fundamentais previstos na Constituição Federal e quaisquer outros relativos à manutenção de qualidade digna da vida. (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, V)
Art. 94. As estratégias de redução de danos incluirão a disponibilização de insumos de prevenção ao HIV/Aids e as estratégias da saúde pública dirigidas à proteção da vida e ao tratamento dos dependentes de produtos, substâncias e drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 6º)
Art. 95. As iniciativas relacionadas ao consumo de bebidas alcoólicas serão incluídas nas estratégias de redução de danos, dados os agravos relacionados a esta substância na população geral e que devam ser articuladas intersetorialmente de forma a potencializar os efeitos de promoção à saúde. (Origem: PRT MS/GM 1028/2005, Art. 7º)
Art. 96. As ações de redução de danos deverão ser desenvolvidas em todos os espaços de interesse público em que ocorra ou possa ocorrer o consumo de produtos, substâncias ou drogas que causem dependência, ou para onde se reportem os seus usuários. (Origem: PRT MS/GM 1028/2005, Art. 8º)
Parágrafo Único. As disposições desta Seção aplicam-se no âmbito do sistema penitenciário, das cadeias públicas, dos estabelecimentos educacionais destinados à internação de adolescentes, dos hospitais psiquiátricos, dos abrigos, dos estabelecimentos destinados ao tratamento de usuários ou dependentes ou de quaisquer outras instituições que mantenham pessoas submetidas à privação ou à restrição da liberdade. (Origem: PRT MS/GM 1028/2005, Art. 8º, Parágrafo Único)
Art. 97. As ações de redução de danos deverão ser desenvolvidas em consonância com a promoção dos direitos humanos, tendo especialmente em conta o respeito à diversidade dos usuários ou dependentes de produtos, substâncias ou drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 9º)
§ 1º Em todas as ações de redução de danos, devem ser preservadas a identidade e a liberdade da decisão do usuário ou dependente ou pessoas tomadas como tais, sobre qualquer procedimento relacionado à prevenção, ao diagnóstico e ao tratamento. (Origem: PRT MS/GM 1028/2005, Art. 9º, § 1º)
§ 2º A contratação de pessoal para o trabalho com redução de danos, de que trata esta Seção deve dar prioridade aos membros da comunidade onde as ações serão desenvolvidas, observadas, no âmbito da Administração Pública, as normas de acesso a cargos ou empregos públicos, levando-se em conta principalmente o acesso à população alvo, independentemente do nível de instrução formal. (Origem: PRT MS/GM 1028/2005, Art. 9º, § 2º)
Seção VI
Do Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental
Art. 98. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental. (Origem: PRT MS/GM 799/2000, Art. 1º)
Parágrafo Único. O Programa de que trata este Artigo deverá contemplar as seguintes atividades: (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único)
I - avaliação da assistência à saúde mental no País, dentro do contexto de sistema global de atenção, promoção e recuperação da saúde mental; (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, a)
II - supervisão e avaliação, in loco, dos hospitais psiquiátricos que compõem a rede assistencial do Sistema Único de Saúde, tendo em vista a adoção de medidas que reforcem a continuidade do processo de reversão do modelo de atenção à saúde mental instituído no País; (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, b)
III - análise, avaliação e proposição de alternativas assistenciais na área de saúde mental; (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, c)
IV - elaboração e proposição de protocolos de regulação e de mecanismos de implementação de módulo de regulação da assistência à saúde mental que venha a compor as Centrais de Regulação, com o objetivo de regular, ordenar e orientar esta assistência e com o princípio fundamental de incrementar a capacidade do poder público de gerir o sistema de saúde e de responder, de forma qualificada e integrada, às demandas de saúde de toda a população. (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, d)
Art. 99. A Secretaria de Atenção à Saúde (SAS) estruturará Grupo Técnico de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental e designará os membros que dele farão parte. (Origem: PRT MS/GM 799/2000, Art. 2º)
§ 1º A convite deste Ministério da Saúde, a Comissão de Direitos Humanos da Câmara dos Deputados indicará um dos seus componentes para acompanhar os trabalhos do Grupo Técnico de que trata este Artigo. (Origem: PRT MS/GM 799/2000, Art. 2º, § 1º)
§ 2º O Grupo Técnico terá as seguintes atribuições e competências: (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º)
I - coordenar a implementação do Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental; (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, a)
II - coordenar e articular as ações que serão desenvolvidas pelos Grupos Técnicos designados, com a mesma finalidade, pelos estados, Distrito federal e municípios em Gestão Plena do Sistema Municipal; (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, b)
III - promover a capacitação dos profissionais que desenvolverão as atividades inerentes ao Programa instituído, especialmente daqueles integrantes dos Grupos Técnicos estaduais e municipais; (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, c)
IV - emitir relatórios técnicos contendo as análises, avaliações e acompanhamentos realizados e propondo medidas corretivas e de aperfeiçoamento do sistema de assistência em saúde mental. (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, d)
§ 3º As atividades dos Grupos Técnicos, tanto da Secretaria de Atenção à Saúde quanto dos estados e municípios, não substituem as ações e competências de supervisão, controle, avaliação e auditoria dos gestores do Sistema Único de Saúde - federal, estaduais e municipais. (Origem: PRT MS/GM 799/2000, Art. 2º, § 3º)
Art. 100. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema Municipal estruturarão, em seus respectivos âmbitos de atuação, Grupo Técnico de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental e designarão os membros que dele farão parte. (Origem: PRT MS/GM 799/2000, Art. 3º)
§ 1º Os Grupos Técnicos de que trata este Artigo deverão ser compostos, no mínimo, pelos seguintes técnicos: (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º)
I - Nos estados e no Distrito Federal: (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I)
a) 01 (um) representante da equipe da saúde mental; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I, a)
b) 01 (um) representante da equipe de vigilância sanitária; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I, b)
c) 01 (um) representante da equipe de controle e avaliação; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I, c)
II - Nos municípios em Gestão Plena do Sistema Municipal: (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II)
a) 02 (dois) :representantes da equipe da saúde mental (01 do estado e 01 do município); (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II, a)
b) 02 (dois) representantes da equipe de vigilância sanitária (01 do estado e 01 do município); (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II, b)
c) 01 (um) representante da equipe de controle e avaliação; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II, c)
§ 2º Estes Grupos Técnicos terão as seguintes atribuições e competências: (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º)
I - realizar, nos seus respectivos âmbitos de atuação e sob a coordenação do Grupo Técnico estruturado pela Secretaria de Atenção à Saúde, as atividades inerentes ao Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental; (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º, a)
II - no caso dos Grupos Técnicos de estados, articular as ações que serão desenvolvidas pelos Grupos Técnicos designados, com a mesma finalidade, pelos municípios em Gestão Plena do Sistema Municipal; (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º, b)
III - emitir relatórios técnicos contendo as análises, avaliações e acompanhamentos realizados e propondo medidas corretivas e de aperfeiçoamento de seu respectivo sistema de assistência em saúde mental. (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º, c)
Art. 101. A constatação de irregularidades ou o não cumprimento das normas vigentes implicará, de conformidade com o caso apresentado, em instauração de auditoria pelo Ministério da Saúde e oferecimento de denúncia ao Ministério Público. (Origem: PRT MS/GM 799/2000, Art. 4º)
Art. 102. A Secretaria de Atenção à Saúde adotará as medidas necessárias ao pleno cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 799/2000, Art. 5º)
Seção VII
Programa Nacional de Avaliação do Sistema Hospitalar/Psiquiatria (PNASH)
Art. 103. Ficam estabelecidas, na forma do Anexo XXV , as diretrizes e normas para a regulamentação da assistência hospitalar em psiquiatria no Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 251/2002, Art. 1º)
Art. 104. Fica estabelecida a seguinte classificação para os hospitais psiquiátricos integrantes da rede do SUS, apurada pelos indicadores de qualidade aferidos pelo Programa Nacional de Avaliação do Sistema Hospitalar/Psiquiatria (PNASH) e o número de leitos do hospital, constante no cadastro do Ministério da Saúde. (Origem: PRT MS/GM 251/2002, Art. 2º)
I - Classe I: Pontuação do PNASH: 81 - 100 %, Número de Leitos: 20-80; (Origem: PRT MS/GM 251/2002, Art. 2º, I)
II - Classe II: (Origem: PRT MS/GM 251/2002, Art. 2º, II)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 20-80; (Origem: PRT MS/GM 251/2002, Art. 2º, II, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 81-120; (Origem: PRT MS/GM 251/2002, Art. 2º, II, b)
III - Classe III: (Origem: PRT MS/GM 251/2002, Art. 2º, III)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 81-120; (Origem: PRT MS/GM 251/2002, Art. 2º, III, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 121-160; (Origem: PRT MS/GM 251/2002, Art. 2º, III, b)
IV - Classe IV: (Origem: PRT MS/GM 251/2002, Art. 2º, IV)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 121-160; (Origem: PRT MS/GM 251/2002, Art. 2º, IV, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 161-200; (Origem: PRT MS/GM 251/2002, Art. 2º, IV, b)
V - Classe V: (Origem: PRT MS/GM 251/2002, Art. 2º, V)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 161-200; (Origem: PRT MS/GM 251/2002, Art. 2º, V, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 201-240; (Origem: PRT MS/GM 251/2002, Art. 2º, V, b)
VI - Classe VI: (Origem: PRT MS/GM 251/2002, Art. 2º, VI)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 201-240; (Origem: PRT MS/GM 251/2002, Art. 2º, VI, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 241-400; (Origem: PRT MS/GM 251/2002, Art. 2º, VI, b)
VII - Classe VII: (Origem: PRT MS/GM 251/2002, Art. 2º, VII)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 241-400; (Origem: PRT MS/GM 251/2002, Art. 2º, VII, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: Acima de 400; (Origem: PRT MS/GM 251/2002, Art. 2º, VII, b)
VIII - Classe VIII: Pontuação do PNASH: 61- 80%, Número de Leitos: Acima de 400. (Origem: PRT MS/GM 251/2002, Art. 2º, VIII)
Art. 105. Os hospitais que obtiverem índice inferior a 40% do PNASH, assim como os hospitais que não alcançarem o índice mínimo de 61% do PNASH, após o processo de reavaliação, não serão classificados conforme o estabelecido nesta Seção. (Origem: PRT MS/GM 251/2002, Art. 4º, Parágrafo Único)
Art. 106. O gestor local deverá adotar as providências necessárias para a suspensão de novas internações e a substituição planificada do atendimento aos pacientes dos hospitais que não obtiveram pontuação suficiente para a sua classificação. (Origem: PRT MS/GM 251/2002, Art. 5º)
Parágrafo Único. O gestor local, em conjunto com a Secretaria de Estado da Saúde, elaborará um projeto técnico para a substituição do atendimento aos pacientes dos hospitais não classificados, preferencialmente em serviços extra-hospitalares, determinando o seu descredenciamento do Sistema. (Origem: PRT MS/GM 251/2002, Art. 5º, Parágrafo Único)
Art. 107. A Secretaria de Atenção à Saúde promoverá a atualização dos procedimentos de atendimento em psiquiatria, de acordo com a classificação definida neste Anexo, em substituição ao estabelecido na Portaria GM/MS n° 469, de 03 de abril de 2001. (Origem: PRT MS/GM 251/2002, Art. 6º)
Art. 108. A Secretaria de Atenção à Saúde incluirá, na Tabela do Sistema de Informações Hospitalares do Sistema Único de Saúde (SIH-SUS), procedimento específico para o processamento das Autorizações de Internação Hospitalar (AIH) dos hospitais não classificados de acordo com os indicadores de qualidade aferidos pelo PNASH/Psiquiatria, até a transferência de todos os pacientes para outras unidades hospitalares ou serviços extra-hospitalares, definidas pelo gestor local do SUS. (Origem: PRT MS/GM 251/2002, Art. 7º)
Art. 109. É atribuição intransferível do gestor local do Sistema Único de Saúde estabelecer o limite das internações em psiquiatria e o controle da porta de entrada das internações hospitalares, estabelecendo instrumentos e mecanismos específicos e resolutivos de atendimento nas situações de urgência/emergência, preferencialmente em serviços extra-hospitalares ou na rede hospitalar não especializada. (Origem: PRT MS/GM 251/2002, Art. 8º)
§ 1º Para a organização da porta de entrada, devem ser seguidas as recomendações contidas no MANUAL DO GESTOR PARA ATENDIMENTO TERRITORIAL EM SAÚDE MENTAL. (Origem: PRT MS/GM 251/2002, Art. 8º, § 1º)
§ 2º O número mensal de internações e o limite de internações para cada município ou região, estimadas de acordo com as metas estabelecidas, deverão constar do Plano Diretor de Regionalização (PDR). (Origem: PRT MS/GM 251/2002, Art. 8º, § 2º)
CAPÍTULO IV
DA ALIMENTAÇÃO E NUTRIÇÃO
Seção I
Do Programa Nacional de Suplementação de Ferro (PNSF) da Política Nacional de Alimentação e Nutrição (PNAN)
Art. 110. Esta Seção atualiza as diretrizes nacionais do Programa Nacional de Suplementação de Ferro (PNSF) da Política Nacional de Alimentação e Nutrição (PNAN). (Origem: PRT MS/GM 1977/2014, Art. 1º)
Art. 111. O PNSF tem como objetivo prevenir e controlar a anemia por deficiência de ferro e deverá ser implantado nas Unidades Básicas de Saúde (UBS) de todos os Municípios brasileiros. (Origem: PRT MS/GM 1977/2014, Art. 2º)
Parágrafo Único. O público a ser atendido serão as crianças entre 6 (seis) e 24 (vinte e quatro) meses de idade, gestantes e mulheres até o 3º mês pós-parto e pós-aborto, que deverão ser suplementadas de forma profilática e universal, observando-se o Manual de Condutas Gerais do Programa Nacional de Suplementação de Ferro, definido pela Coordenação-Geral de Alimentação e Nutrição (CGAN/DAB/SAS/MS), disponível no endereço eletrônico
http://dab.saude.gov.br/portaldab/biblioteca.php?conteudo=publicacoes/manual_ferro2013. (Origem: PRT MS/GM 1977/2014, Art. 2º, Parágrafo Único)
Art. 112. São atribuições da União, por intermédio do Ministério da Saúde, no âmbito do Programa Nacional de Suplementação de Ferro: (Origem: PRT MS/GM 1977/2014, Art. 3º)
I - estimular e assessorar, tecnicamente, os Estados, o Distrito Federal e os Municípios para a implantação e a implementação do Programa, em nível nacional; (Origem: PRT MS/GM 1977/2014, Art. 3º, I)
II - elaborar materiais e divulgar as normas operacionais do Programa aos Estados, Distrito Federal e Municípios; (Origem: PRT MS/GM 1977/2014, Art. 3º, II)
III - monitorar, em nível nacional, a implantação, a operacionalização, o desempenho e o impacto do programa; (Origem: PRT MS/GM 1977/2014, Art. 3º, III)
IV - cooperar tecnicamente com os Estados, o Distrito Federal e os Municípios para o monitoramento da implantação, da operacionalização, do desempenho e do impacto no programa, em seus territórios; e (Origem: PRT MS/GM 1977/2014, Art. 3º, IV)
V - estabelecer parcerias com outras instâncias, órgãos e instituições, governamentais e não governamentais, para o fomento de atividades complementares, com o objetivo de promover a alimentação adequada e saudável. (Origem: PRT MS/GM 1977/2014, Art. 3º, V)
Art. 113. Para a implantação do Programa Nacional de Suplementação de Ferro, os Estados e o Distrito Federal deverão observar, nos seus respectivos territórios, as seguintes condições: (Origem: PRT MS/GM 1977/2014, Art. 4º)
I - definir a área técnica responsável pelo acompanhamento do Programa, sendo, de preferência, a que já seja responsável pelas ações de alimentação e nutrição em seu território; (Origem: PRT MS/GM 1977/2014, Art. 4º, I)
II - articular as áreas técnicas da respectiva Secretaria de Saúde, tais como alimentação e nutrição, atenção básica, saúde da criança, saúde da mulher, assistência farmacêutica, dentre outras, considerando as redes de atenção à saúde, para que o Programa seja implantado de forma integrada nos Municípios sediados em seus territórios; (Origem: PRT MS/GM 1977/2014, Art. 4º, II)
III - estimular e assessorar, tecnicamente, os Municípios localizados nas suas esferas de gestão, na implantação e na implementação do Programa; (Origem: PRT MS/GM 1977/2014, Art. 4º, III)
IV - monitorar, em nível estadual, a implantação, a operacionalização, o desempenho e o impacto do Programa, mediante a realização de visitas técnicas e auditorias; (Origem: PRT MS/GM 1977/2014, Art. 4º, IV)
V - auxiliar os Municípios sediados em seu território para o monitoramento referido no art. 113, IV; (Origem: PRT MS/GM 1977/2014, Art. 4º, V)
VI - divulgar os materiais e as normas operacionais do Programa aos Municípios; e (Origem: PRT MS/GM 1977/2014, Art. 4º, VI)
VII - capacitar os coordenadores municipais para a operacionalização do Programa de acordo com as orientações descritas no Manual de Condutas Gerais do Programa, definido pela CGAN/DAB/SAS/MS, nos termos do art. 111, parágrafo único. (Origem: PRT MS/GM 1977/2014, Art. 4º, VII)
Art. 114. Para a implantação do Programa Nacional de Suplementação de Ferro, o Distrito Federal e os Municípios deverão observar, em seus territórios, as seguintes condições: (Origem: PRT MS/GM 1977/2014, Art. 5º)
I - indicar um profissional técnico, devidamente capacitado, para coordenar o Programa, sendo, de preferência, o que já seja responsável pelas ações de alimentação e nutrição no Distrito Federal ou no respectivo Município; (Origem: PRT MS/GM 1977/2014, Art. 5º, I)
II - planejar, programar, adquirir, armazenar, controlar os estoques, os prazos de validade, distribuir e dispensar os suplementos de sulfato ferroso e ácido fólico, previstos no Componente Básico da Assistência Farmacêutica; (Origem: PRT MS/GM 1977/2014, Art. 5º, II)
III - estimular ações complementares de promoção do aleitamento materno e de alimentação adequada e saudável do público alvo; (Origem: PRT MS/GM 1977/2014, Art. 5º, III)
IV - identificar o público específico a ser atendido pelo programa de acordo com as recomendações do Manual de Condutas Gerais definido pela CGAN/DAB/SAS/MS, nos termos do art. 111, parágrafo único; (Origem: PRT MS/GM 1977/2014, Art. 5º, IV)
V - realizar o monitoramento do Programa por meio dos sistemas da Atenção Básica, da Assistência Farmacêutica ou de outro sistema municipal compatível; e (Origem: PRT MS/GM 1977/2014, Art. 5º, V)
VI - avaliar o desempenho do Programa em seu território. (Origem: PRT MS/GM 1977/2014, Art. 5º, VI)
Art. 115. O planejamento do Programa Nacional de Suplementação de Ferro deverá constar no Plano de Saúde e na respectiva Programação Anual de Saúde das Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios. (Origem: PRT MS/GM 1977/2014, Art. 6º)
Art. 116. O monitoramento de que trata esta Seção não dispensa o ente federativo beneficiário de comprovação da implementação do Programa Nacional de Suplementação de Ferro por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 1977/2014, Art. 7º)
Seção II
Do Programa Nacional de Suplementação de Vitamina A
Art. 117. Fica instituído o Programa Nacional de Suplementação de Vitamina A, destinado a prevenir e/ou controlar essa deficiência nutricional mediante a suplementação com megadoses de vitamina A, em crianças de seis a cinquenta e nove meses de idade e puérperas no pós-parto imediato, pertencentes à Região Nordeste, ao Vale do Jequitinhonha em Minas Gerais e ao Vale do Ribeira em São Paulo. (Origem: PRT MS/GM 729/2005, Art. 1º)
§ 1º Outras áreas ou regiões que detectem sinais da deficiência em crianças ou identifiquem, por meio de pesquisa científica, evidências da deficiência direta ou indireta poderão ser incorporados ao Programa a qualquer tempo. (Origem: PRT MS/GM 729/2005, Art. 1º, § 1º)
§ 2º O produto utilizado na suplementação de crianças e puérperas é a vitamina A na forma líquida, nas concentrações de 100.000 UI e 200.000 UI, diluída em óleo de soja e acrescida de vitamina E. (Origem: PRT MS/GM 729/2005, Art. 1º, § 2º)
§ 3º A suplementação da puérpera no pós-parto imediato é recomendada somente antes da alta hospitalar, conforme o Manual de Condutas Gerais do Programa definido pela Coordenação Geral da Política de Alimentação e Nutrição. (Origem: PRT MS/GM 729/2005, Art. 1º, § 3º)
Art. 118. O suplemento de vitamina A será enviado, conforme logística definida entre a Secretaria de Atenção à Saúde, por intermédio do Departamento de Atenção Básica da área técnica da política de alimentação e nutrição, e a Secretaria de Ciência, Tecnologia e Insumos Estratégicos por intermédio do Departamento de Assistência Farmacêutica e Insumos Estratégicos, do Ministério da Saúde, cujo quantitativo será calculado previamente com base no censo do Instituto Brasileiro de Geografia e Estatística (IBGE). (Origem: PRT MS/GM 729/2005, Art. 2º)
§ 1º O quantitativo de megadoses de vitamina A, necessário para o atendimento das puérperas no pós-parto imediato, será calculado com base no Sistema Nacional de Nascidos Vivos (SI-NASC). (Origem: PRT MS/GM 729/2005, Art. 2º, § 1º)
§ 2º Para o cálculo do quantitativo da megadose de vitamina A utilizada no exercício seguinte, o Ministério da Saúde deduzirá o saldo de produtos ainda disponíveis no município. (Origem: PRT MS/GM 729/2005, Art. 2º, § 2º)
§ 3º Caso seja necessário, o Ministério da Saúde avaliará a pertinência e a factibilidade de enviar quantitativo adicional da megadose de vitamina A ao município desde que haja solicitação formal do gestor municipal do SUS, devidamente fundamentada. (Origem: PRT MS/GM 729/2005, Art. 2º, § 3º)
Art. 119. As famílias que têm crianças de seis a cinquenta e nove meses deverão ser identificadas e assistidas por uma equipe de saúde da família ou por unidades básicas de saúde. (Origem: PRT MS/GM 729/2005, Art. 3º)
Parágrafo Único. As puérperas deverão ser suplementadas ainda nas maternidades e acompanhadas pelas unidades básicas de saúde. (Origem: PRT MS/GM 729/2005, Art. 3º, Parágrafo Único)
Art. 120. São atribuições do Ministério da Saúde: (Origem: PRT MS/GM 729/2005, Art. 4º)
I - a aquisição e o envio do suplemento de vitamina A, cuja responsabilidade fica a cargo da Assistência Farmacêutica, área técnica competente do Ministério da Saúde, conforme a logística definida e pactuada em conjunto com as Coordenações Estaduais de Alimentação e Nutrição; (Origem: PRT MS/GM 729/2005, Art. 4º, I)
II - o acompanhamento e o monitoramento da situação dos estados e dos municípios quanto ao nível de implantação e operacionalização do Programa e à cobertura populacional; (Origem: PRT MS/GM 729/2005, Art. 4º, II)
III - a avaliação do desempenho e o impacto do Programa em nível nacional e apoio das ações da mesma natureza nos estados e municípios; (Origem: PRT MS/GM 729/2005, Art. 4º, III)
IV - o delineamento e o apoio a estudos e pesquisas para avaliação de processos relativos ao Programa; (Origem: PRT MS/GM 729/2005, Art. 4º, IV)
V - a realização, por intermédio do Sistema Nacional de Auditoria (SNA), de auditorias em municípios alvo de denúncias e irregularidades na condução do Programa; (Origem: PRT MS/GM 729/2005, Art. 4º, V)
VI - o estabelecimento de parcerias com outras instâncias, órgãos e instituições, governamentais e não-governamentais para o fomento de atividades complementares, com o objetivo de promoção da alimentação saudável e prevenção de deficiência de vitamina A; e (Origem: PRT MS/GM 729/2005, Art. 4º, VI)
VII - a elaboração de materiais e a divulgação das normas operacionais do Programa aos estados. (Origem: PRT MS/GM 729/2005, Art. 4º, VII)
Art. 121. São condições necessárias, a serem observadas pelos estados, para implantação do Programa, citado no art. 117: (Origem: PRT MS/GM 729/2005, Art. 5º)
I - a indicação de área técnica responsável para coordenar, em âmbito estadual, a operacionalização do Programa, de preferência aquela já responsável pelas ações de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 5º, I)
II - a divulgação da norma operacional do Programa aos municípios, bem como o apoio na implantação dessas condições; (Origem: PRT MS/GM 729/2005, Art. 5º, II)
III - o acompanhamento e o monitoramento da situação dos municípios quanto ao nível de implantação e implementação do Programa; (Origem: PRT MS/GM 729/2005, Art. 5º, III)
IV - o remanejamento do quantitativo de suplemento entre municípios, se necessário; (Origem: PRT MS/GM 729/2005, Art. 5º, IV)
V - o estímulo, o auxílio e o monitoramento da implantação da Vigilância Alimentar e Nutricional nos municípios, de acordo com as normas estabelecidas em legislação própria; (Origem: PRT MS/GM 729/2005, Art. 5º, V)
VI - a implantação e a implementação do Programa Nacional de Suplementação de Vitamina A em todas as maternidades estaduais; (Origem: PRT MS/GM 729/2005, Art. 5º, VI)
VII - o apoio e o assessoramento aos municípios para a implantação e a manutenção da distribuição da megadose de vitamina A nas maternidades municipais; (Origem: PRT MS/GM 729/2005, Art. 5º, VII)
VIII - o assessoramento dos municípios na identificação da estratégia de ação para suplementação das crianças entre seis e cinquenta e nove meses de idade, de forma periódica e regular; (Origem: PRT MS/GM 729/2005, Art. 5º, VIII)
IX - o apoio à capacitação de recursos humanos nas ações de saúde inerentes ao controle e à prevenção das carências nutricionais, fortalecendo as atividades educativas de orientação alimentar e nutricional, com ênfase na promoção da alimentação saudável; (Origem: PRT MS/GM 729/2005, Art. 5º, IX)
X - a avaliação do desempenho e do impacto do Programa em nível estadual e do apoio ao município para o desenvolvimento dessas ações; e (Origem: PRT MS/GM 729/2005, Art. 5º, X)
XI - a apuração das denúncias de irregularidades na condução do Programa, mediante a realização de visitas técnicas e auditorias. (Origem: PRT MS/GM 729/2005, Art. 5º, XI)
Parágrafo Único. Além das atribuições descritas anteriormente, recomenda-se às Secretarias Estaduais de Saúde a criação de um grupo de trabalho com representantes das áreas técnicas afins para acompanhamento, monitoramento e avaliação do Programa e planejamento das ações necessárias a sua execução. (Origem: PRT MS/GM 729/2005, Art. 5º, Parágrafo Único)
Art. 122. São condições necessárias à implantação do Programa na respectiva localidade, a serem observadas pelos municípios dos estados citados no art. 117: (Origem: PRT MS/GM 729/2005, Art. 6º)
I - a indicação de um profissional técnico devidamente capacitado para coordenar o Programa, de preferência aquele já responsável pelas ações de alimentação e nutrição do município; (Origem: PRT MS/GM 729/2005, Art. 6º, I)
II - a identificação das famílias que tenham crianças de seis a cinquenta e nove meses e a administração da megadose de vitamina A, conforme o Manual de Condutas Gerais do Programa definido pela área técnica da política de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 6º, II)
III - a identificação, nas maternidades, das puérperas no pós-parto imediato para administração da megadose de vitamina A; (Origem: PRT MS/GM 729/2005, Art. 6º, III)
IV - o provimento das ações básicas de saúde e atividades educativas em alimentação e nutrição necessárias para que as famílias reconheçam a deficiência de vitamina A como problema de saúde e adotem hábitos alimentares saudáveis; (Origem: PRT MS/GM 729/2005, Art. 6º, IV)
V - o estímulo para que os responsáveis por crianças de seis a cinquenta e nove meses levem seus filhos aos serviços de saúde para dar seguimento às administrações das megadose de vitamina A; (Origem: PRT MS/GM 729/2005, Art. 6º, V)
VI - o recebimento e o armazenamento da megadose de vitamina A em local apropriado, bem como a utilização, em tempo hábil, de acordo com o prazo de validade; (Origem: PRT MS/GM 729/2005, Art. 6º, VI)
VII - o monitoramento das famílias assistidas pelo Programa por meio da Vigilância Alimentar e Nutricional, de acordo com as normas estabelecidas em legislação própria; (Origem: PRT MS/GM 729/2005, Art. 6º, VII)
VIII - a manutenção atualizada dos dados de controle do estoque e de distribuição da megadose de vitamina A, enviando mensalmente as informações para o nível federal e estadual, conforme a estratégia preconizada no Manual de Condutas Gerais do Programa definido pela área técnica da política de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 6º, VIII)
IX - o envio das informações à Coordenação Estadual do Programa quando os estoques de vitamina A estiverem excedendo as necessidades do município, possibilitando o remanejamento do suplemento para municípios vizinhos, ou quando os estoques estiverem aquém das necessidades, solicitando, nesse caso, quantitativo adicional, em tempo hábil, para não ocasionar descontinuidade do Programa, ou ainda quando o lote estiver com prazo de validade próximo da data a expirar; (Origem: PRT MS/GM 729/2005, Art. 6º, IX)
X - a capacitação de profissionais de saúde para operacionalização do Programa, de acordo com as orientações especificadas no Manual de Condutas Gerais do Programa definido pela área técnica da política de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 6º, X)
XI - a implantação e a implementação do Programa Nacional de Suplementação de Vitamina A em todas as maternidades municipais; e (Origem: PRT MS/GM 729/2005, Art. 6º, XI)
XII - a avaliação do desempenho e, se possível, do impacto do Programa em nível municipal. (Origem: PRT MS/GM 729/2005, Art. 6º, XII)
Parágrafo Único. Além das atribuições descritas anteriormente, recomenda-se às Secretarias Municipais de Saúde: (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único)
I - o estabelecimento de parcerias com outras instituições que atuem na prevenção e no controle dos distúrbios nutricionais em nível local para a identificação e o acompanhamento das crianças em risco no município; (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único, I)
II - a promoção de ações voltadas à intensificação do aleitamento materno exclusivo até os seis meses e complementar até os dois anos ou mais de idade; e (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único, II)
III - a instituição de grupo de trabalho, com representantes das áreas técnicas afins para acompanhar, monitorar e avaliar o Programa e planejar ações necessárias a sua execução. (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único, III)
Art. 123. A estratégia para o atendimento da população indígena aldeada no Programa Nacional de Suplementação de Vitamina A deve ser pactuada com a CGAPSI/DASI/SESAI, de forma a garantir o acesso e o adequado atendimento, observando-se a pertinência dessa ação frente às características culturais dessa população. (Origem: PRT MS/GM 729/2005, Art. 7º)
Art. 124. Os Centros Colaboradores em Alimentação e Nutrição prestam apoio técnico ao Ministério da Saúde e às Secretarias Estaduais de Saúde no desenvolvimento das ações da Política Nacional de Alimentação e Nutrição, inclusive na capacitação de recursos humanos, no acompanhamento e na avaliação do Programa Nacional de Suplementação de Vitamina A. (Origem: PRT MS/GM 729/2005, Art. 8º)
Parágrafo Único. Para fins do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios com os referidos Centros Colaboradores e de Referência em Alimentação e Nutrição, bem como com instituições de ensino e pesquisa com conhecimento técnico. (Origem: PRT MS/GM 729/2005, Art. 8º, Parágrafo Único)
Art. 125. A avaliação de impacto do Programa Nacional de Suplementação de Vitamina A deve contemplar a análise de sua eficácia, eficiência, efetividade e seus efeitos a curto, médio e longo prazo. (Origem: PRT MS/GM 729/2005, Art. 9º)
Parágrafo Único. Para fins do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios com Centros ou Universidade de referência para a avaliação do Programa. (Origem: PRT MS/GM 729/2005, Art. 9º, Parágrafo Único)
Art. 126. Cabe aos Conselhos Municipais, Estaduais e Nacional de Saúde, neste último por intermédio da Comissão Intersetorial de Alimentação e Nutrição, realizar o controle social, bem como acompanhar o processo de implantação e operacionalização do Programa Nacional de Suplementação de Vitamina A, nos respectivos níveis de atuação. (Origem: PRT MS/GM 729/2005, Art. 10)
Parágrafo Único. Para que esse controle seja efetuado, as informações sobre a operacionalização do Programa deverão ser disponibilizadas aos respectivos conselhos. (Origem: PRT MS/GM 729/2005, Art. 10, Parágrafo Único)
Art. 127. Poderá estar sujeito a penalidades o município que, por ação ou omissão de seus agentes, incorrer em fraudes conforme base legal da Agência Nacional de Vigilância Sanitária, segundo as Leis nº 6.360, de 23 de setembro de 1976 e nº 6.437, de 20 de agosto de 1977. (Origem: PRT MS/GM 729/2005, Art. 11)
CAPÍTULO V
DA VIGILÂNCIA EM SAÚDE
Seção I
Do Plano Diretor de Vigilância Sanitária
Art. 128. Fica aprovado o Plano Diretor de Vigilância Sanitária, na forma do Anexo XIX , e determinada sua divulgação. (Origem: PRT MS/GM 1052/2007, Art. 1º)
Seção II
Do Controle e da Vigilância da Qualidade da Água para Consumo Humano e seu Padrão de Potabilidade
Art. 129. O Anexo XX dispõe sobre o controle e vigilância da qualidade da água para consumo humano e seu padrão de potabilidade.
Art. 130. O Anexo XXI aprova as normas e padrões sobre fluoretação da água dos sistemas públicos de abastecimento, destinada ao consumo humano.
Seção III
Da Comissão Gestora e do Comitê Executivo do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas
Art. 131. Fica instituída a Comissão Gestora do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas, de caráter permanente e cunho deliberativo, com o objetivo de promover a articulação dos órgãos e entidades públicas para compatibilizar a Política Nacional sobre Mudança do Clima com as políticas públicas de saúde. (Origem: PRT MS/GM 3244/2011, Art. 1º)
Art. 132. Compete à Comissão Gestora de que trata o art. 131: (Origem: PRT MS/GM 3244/2011, Art. 2º)
I - assessorar o Ministro de Estado da Saúde nos temas relacionados à Política Nacional de Mudança do Clima (PNMC); (Origem: PRT MS/GM 3244/2011, Art. 2º, I)
II - assessorar o Ministro de Estado da Saúde nas ações relativas ao Comitê Interministerial sobre Mudança do Clima (CIM); (Origem: PRT MS/GM 3244/2011, Art. 2º, II)
III - elaborar e aprovar o Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas, em consonância com a PNMC e o Plano Nacional de Saúde; (Origem: PRT MS/GM 3244/2011, Art. 2º, III)
IV - articular, monitorar e avaliar a implementação do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas nas esferas federal, estadual, distrital e municipal do Sistema Único de Saúde (SUS); (Origem: PRT MS/GM 3244/2011, Art. 2º, IV)
V - identificar fontes de recursos para a elaboração, a implementação e o monitoramento do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas; (Origem: PRT MS/GM 3244/2011, Art. 2º, V)
VI - aprovar a constituição e o regimento interno da Comissão Gestora e de seus subcomitês temáticos; e (Origem: PRT MS/GM 3244/2011, Art. 2º, VI)
VII - instituir subcomitês temáticos. (Origem: PRT MS/GM 3244/2011, Art. 2º, VII)
Art. 133. A Comissão Gestora de que trata esta Seção será composta pelos dirigentes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 3244/2011, Art. 3º)
I - Secretaria-Executiva (SE/MS), que a coordenará; (Origem: PRT MS/GM 3244/2011, Art. 3º, I)
II - Gabinete do Ministro (GM/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, II)
III - Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, III)
IV - Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, IV)
V - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, V)
VI - Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, VI)
VII - Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, VII)
VIII - Secretaria Especial de Saúde Indígena (SESAI/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, VIII)
IX - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 3244/2011, Art. 3º, IX)
X - Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 3244/2011, Art. 3º, X)
XI - Fundação Oswaldo Cruz (FIOCRUZ); e (Origem: PRT MS/GM 3244/2011, Art. 3º, XI)
XII - Fundação Nacional de Saúde (FUNASA). (Origem: PRT MS/GM 3244/2011, Art. 3º, XII)
§ 1º Aos dirigentes de que trata este artigo compete indicar os seus respectivos representantes suplentes à Coordenação da Comissão Gestora no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº 3244/GM/MS, de 30 de dezembro de 2011. (Origem: PRT MS/GM 3244/2011, Art. 3º, § 1º)
§ 2º Fica assegurada a participação do Conselho Nacional de Secretários de Saúde (CONASS), Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS) e do Conselho Nacional de Saúde (CNS) na Comissão Gestora. (Origem: PRT MS/GM 3244/2011, Art. 3º, § 2º)
§ 3º Para os fins do disposto no art. 133, § 2º , ao CONASS, ao CONASEMS e ao CNS compete indicar os respectivos representantes, titular e suplente, à Coordenação da Comissão Gestora no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº 3244/GM/MS, de 30 de dezembro de 2011. (Origem: PRT MS/GM 3244/2011, Art. 3º, § 3º)
Art. 134. A Comissão Gestora poderá convidar representantes de órgãos e entidades públicas e privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 3244/2011, Art. 4º)
Art. 135. Fica instituído o Comitê Executivo do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas, de caráter permanente e cunho técnico-consultivo, para realização das atividades de apoio à execução das atribuições da Comissão Gestora. (Origem: PRT MS/GM 3244/2011, Art. 5º)
Art. 136. O Comitê Executivo de que trata o art. 135 será composto pelos representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 3244/2011, Art. 6º)
I - SVS/MS, que o coordenará; (Origem: PRT MS/GM 3244/2011, Art. 6º, I)
II - SE/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, II)
III - SAS/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, III)
IV - SCTIE/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, IV)
V - SGEP/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, V)
VI - SGTES/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, VI)
VII - SESAI/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, VII)
VIII - ANVISA; (Origem: PRT MS/GM 3244/2011, Art. 6º, VIII)
IX - ANS; (Origem: PRT MS/GM 3244/2011, Art. 6º, IX)
X - FIOCRUZ; e (Origem: PRT MS/GM 3244/2011, Art. 6º, X)
XI - FUNASA. (Origem: PRT MS/GM 3244/2011, Art. 6º, XI)
§ 1º Aos dirigentes dos órgãos e entidades de que trata este artigo compete indicar os respectivos representantes, titular e suplente, à Coordenação do Comitê Executivo no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº 3244/GM/MS, de 30 de dezembro de 2011. (Origem: PRT MS/GM 3244/2011, Art. 6º, § 1º)
§ 2º A Coordenação do Comitê Executivo poderá convidar representantes de outros órgãos e entidades públicas, de entidades não-governamentais, bem como especialistas em assuntos ligados ao tema, cuja presença seja considerada necessária para o cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 3244/2011, Art. 6º, § 2º)
Art. 137. O Comitê Executivo poderá convidar entidades ou pessoas do setor público e privado, que atuem profissionalmente em atividades relacionadas ao tema, sempre que entender necessária a sua colaboração para o pleno alcance dos seus objetivos. (Origem: PRT MS/GM 3244/2011, Art. 7º)
Art. 138. O apoio administrativo e os meios necessários à execução dos trabalhos da Comissão Gestora e do Comitê Executivo de que tratam esta Seção serão fornecidos pela SE/MS. (Origem: PRT MS/GM 3244/2011, Art. 8º)
Parágrafo Único. As despesas de deslocamento para participação das reuniões da Comissão Gestora e do Comitê Executivo de que tratam esta Seção correrão por conta de cada órgão ou entidade partícipe. (Origem: PRT MS/GM 3244/2011, Art. 8º, Parágrafo Único)
Art. 139. A Comissão Gestora de que trata esta Seção aprovará o Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas e a sua revisão em períodos regulares não superiores a 2 (dois) anos. (Origem: PRT MS/GM 3244/2011, Art. 9º)
Art. 140. A Comissão Gestora e o Comitê Executivo de que tratam esta Seção se reunirão em reuniões distintas, ordinariamente em periodicidade a ser estabelecida em regimento interno, e extraordinariamente a critério da respectiva coordenação, a pedido de qualquer de seus membros. (Origem: PRT MS/GM 3244/2011, Art. 10)
Art. 141. As funções dos membros da Comissão Gestora e do Comitê Executivo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 3244/2011, Art. 11)
CAPÍTULO VI
DA TRIAGEM NEONATAL
Seção I
Do Programa Nacional de Triagem Neonatal (PNTN)
Art. 142. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa Nacional de Triagem Neonatal (PNTN). (Origem: PRT MS/GM 822/2001, Art. 1º)
§ 1º O Programa ora instituído deve ser executado de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, Distrito Federal e municípios e tem por objetivo o desenvolvimento de ações de triagem neonatal em fase pré-sintomática, acompanhamento e tratamento das doenças congênitas detectadas inseridas no Programa em todos os nascidos-vivos, promovendo o acesso, o incremento da qualidade e da capacidade instalada dos laboratórios especializados e serviços de atendimento, bem como organizar e regular o conjunto destas ações de saúde. (Origem: PRT MS/GM 822/2001, Art. 1º, § 1º)
§ 2º O Programa Nacional de Triagem Neonatal se ocupará da triagem com detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados nas seguintes doenças congênitas, de acordo com a respectiva Fase de Implantação do Programa: (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º)
I - fenilcetonúria; (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, a)
II - hipotireoidismo congênito; (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, b)
III - doenças falciformes e outras hemoglobinopatias; (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, c)
IV - fibrose cística. (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, d)
§ 3º Em virtude dos diferentes níveis de organização das redes assistenciais existentes nos estados e no Distrito Federal, da variação percentual de cobertura dos nascidos-vivos da atual triagem neonatal e da diversidade das características populacionais existentes no País, o Programa Nacional de Triagem Neonatal será implantado em fases, estabelecidas nesta Seção. (Origem: PRT MS/GM 822/2001, Art. 1º, § 3º)
Art. 143. Ficam configuradas as seguintes Fases de Implantação do Programa Nacional de Triagem Neonatal: (Origem: PRT MS/GM 822/2001, Art. 2º)
I - Fase I - Fenilcetonúria e Hipotireoidismo Congênito: Compreende a realização de triagem neonatal para fenilcetonúria e hipotireoidismo congênito, com a detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados. Os estados e o Distrito Federal deverão garantir a execução de todas as etapas do processo, devendo, para tanto, organizar uma Rede de Coleta de material para exame (envolvendo os municípios) e organizar/cadastrar o(s) Serviço(s) Tipo I de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas que garantam a realização da triagem, a confirmação diagnóstica e ainda o adequado acompanhamento e tratamento dos pacientes triados; (Origem: PRT MS/GM 822/2001, Art. 2º, I)
II - Fase II - Fenilcetonúria e Hipotireoidismo Congênito + Doenças Falciformes e outras Hemoglobinopatias: Compreende a realização de triagem neonatal para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias, com a detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamentos dos casos identificados. Os estados e o Distrito Federal deverão garantir a execução de todas as etapas do processo, devendo, para tanto, utilizar a rede de coleta organizada/definida na Fase I e organizar/cadastrar o(s) Serviço(s) Tipo II de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas que garantam a realização da triagem, a confirmação diagnóstica e ainda o adequado acompanhamento e tratamento dos pacientes triados; (Origem: PRT MS/GM 822/2001, Art. 2º, II)
III - Fase III - Fenilcetonúria, Hipotireoidismo Congênito, Doenças Falciformes e outras Hemoglobinopatias + Fibrose Cística: Compreende a realização de triagem neonatal para fenicetonúria, hipotireoidismo congênito, doenças falciformes, outras hemoglobinopatias e fibrose cística com a detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados. Os estados e o Distrito Federal deverão garantir a execução de todas as etapas do processo, devendo, para tanto, utilizar a rede de coleta organizada na Fase I e organizar/cadastrar o(s) Serviço(s) Tipo III de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas que garantam a realização da triagem, a confirmação diagnóstica e ainda o adequado acompanhamento e tratamento dos pacientes triados. (Origem: PRT MS/GM 822/2001, Art. 2º, III)
Art. 144. Ficam estabelecidas, na forma do Anexo XXII , as competências e atribuições relativas à implantação/gestão do Programa Nacional de Triagem Neonatal de cada nível de gestão do Sistema Único de Saúde. (Origem: PRT MS/GM 822/2001, Art. 3º)
Art. 145. Ficam estabelecidos, na forma do Anexo XXIII , os critérios/exigências a serem cumpridos pelos estados e pelo Distrito Federal para habilitação nas Fases de Implantação do Programa Nacional de Triagem Neonatal definidas no art. 143. (Origem: PRT MS/GM 822/2001, Art. 4º)
Art. 146. As Secretarias de Saúde dos estados, Distrito Federal e dos municípios, de acordo com seu nível de responsabilidade no Programa, organizarão Redes Estaduais de Triagem Neonatal que serão integradas por: (Origem: PRT MS/GM 822/2001, Art. 5º)
I - Postos de Coleta; (Origem: PRT MS/GM 822/2001, Art. 5º, a)
II - Serviços de Referência em Triagem Neonatal/ Acompanhamento e Tratamento de Doenças Congênitas Tipo I, II ou III. (Origem: PRT MS/GM 822/2001, Art. 5º, b)
§ 1º Compete aos municípios a organização/estruturação/ cadastramento de tantos postos de coleta quantos forem necessários para a adequada cobertura e acesso de suas respectivas populações, sendo obrigatória a implantação de pelo menos 01 (um) Posto de Coleta por município (municípios em que ocorram partos), em conformidade com o estabelecido no Anexo XXIV . (Origem: PRT MS/GM 822/2001, Art. 5º, § 1º)
§ 2º Compete aos estados e ao Distrito Federal a organização das Redes Estaduais de Triagem Neonatal, designando um Coordenador Estadual do Programa Nacional de Triagem Neonatal, articulando os Postos de Coleta Municipais com o(s) Serviço(s) de Referência, os fluxos de exames, a referência e contra-referência dos pacientes triados. (Origem: PRT MS/GM 822/2001, Art. 5º, § 2º)
§ 3º Compete, ainda, aos estados e ao Distrito Federal a organização/estruturação/cadastramento de Serviço(s) de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas, de acordo com a Fase de implantação do Programa, respectivamente de Tipo I, II ou III, que estejam aptos a realizar a triagem, a confirmação diagnóstica, o acompanhamento e tratamento das doenças triadas na Fase de Implantação do Programa em que o estado estiver, em conformidade com o estabelecido no Anexo XXIV , sendo obrigatória a implantação de pelo menos 01 (um) Serviço de Referência por estado no tipo adequado à sua Fase de Implantação do Programa. (Origem: PRT MS/GM 822/2001, Art. 5º, § 3º)
Art. 147. Ficam aprovadas, na forma do Anexo XXIV , as Normas de Funcionamento e Cadastramento de Postos de Coleta e de Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas. (Origem: PRT MS/GM 822/2001, Art. 6º)
Art. 148. A Secretaria de Atenção à Saúde elaborará e publicará o Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal e adotará as demais medidas necessárias ao fiel cumprimento do disposto nesta Seção, definindo, se for o caso, a inclusão/alteração de procedimentos/medicamentos nas Tabelas do SIA/SUS e SIH/SUS, pertinentes à adequada assistência aos pacientes, determinação extensiva às disposições constantes deste ato. (Origem: PRT MS/GM 822/2001, Art. 11)
Seção II
Dos Mecanismos que Possibilitem a Ampliação do Acesso dos Portadores Triados no Programa Nacional de Triagem Neonatal (PNTN) ao Tratamento e Acompanhamento das Doenças Diagnosticadas
Art. 149. Ficam definidos, no âmbito do Sistema Único de Saúde, mecanismos que possibilitem a ampliação do acesso dos portadores triados no Programa Nacional de Triagem Neonatal (PNTN) ao tratamento e acompanhamento das doenças diagnosticadas. (Origem: PRT MS/GM 1069/2002, Art. 1º)
Parágrafo Único. Estes mecanismos serão adotados de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em cooperação com as respectivas Redes Estaduais de Triagem Neonatal e seus Serviços de Referência em Triagem Neonatal. (Origem: PRT MS/GM 1069/2002, Art. 1º, Parágrafo Único)
Art. 150. A Secretaria de Atenção à Saúde estabelecerá os Protocolos Clínicos e Diretrizes Terapêuticas para o tratamento da Fenilcetonúria, Hipotireoidismo Congênito e Doença Falciforme e adotará as medidas necessárias à implementação das disposições deles constantes. (Origem: PRT MS/GM 1069/2002, Art. 2º)
CAPÍTULO VII
DO ALEITAMENTO MATERNO
Seção I
Do Comitê Nacional de Aleitamento Materno (CNAM)
Art. 151. Fica instituído o Comitê Nacional de Aleitamento Materno (CNAM). (Origem: PRT MS/GM 111/2012, Art. 1º)
Art. 152. O CNAM terá como objetivo assessorar a Área Técnica de Saúde da Criança e Aleitamento Materno, do Departamento de Ações Programáticas Estratégicas, da Secretaria de Atenção à Saúde (DAPES/SAS/MS), em assuntos relativos à promoção, proteção e apoio ao aleitamento materno. (Origem: PRT MS/GM 111/2012, Art. 2º)
Art. 153. O CNAM apoiará o processo de articulação da Área Técnica de Saúde da Criança e Aleitamento Materno, mobilizando e sensibilizando setores do governo e da sociedade civil para o desenvolvimento de ações inerentes ao aleitamento materno. (Origem: PRT MS/GM 111/2012, Art. 3º)
Art. 154. O CNAM será composto por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 111/2012, Art. 4º)
I - Área Técnica de Saúde da Criança e Aleitamento Materno (DAPES/SAS/MS), que o coordenará; (Origem: PRT MS/GM 111/2012, Art. 4º, I)
II - Área Técnica de Saúde da Mulher (DAPES/SAS/MS); (Origem: PRT MS/GM 111/2012, Art. 4º, II)
III - Departamento de Atenção Básica (DAB/SAS/MS); (Origem: PRT MS/GM 111/2012, Art. 4º, III)
IV - Rede Brasileira de Bancos de Leite Humano; (Origem: PRT MS/GM 111/2012, Art. 4º, IV)
V - Sociedade Brasileira de Pediatria (SBP); (Origem: PRT MS/GM 111/2012, Art. 4º, V)
VI - Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO); (Origem: PRT MS/GM 111/2012, Art. 4º, VI)
VII - Associação Brasileira de Obstetrizes e Enfermeiros Obstetras (ABENFO); (Origem: PRT MS/GM 111/2012, Art. 4º, VII)
VIII - Rede Internacional em Defesa do Direito de Amamentar IBFAN-Brasil; (Origem: PRT MS/GM 111/2012, Art. 4º, VIII)
IX - Conselho Federal de Nutricionistas; (Origem: PRT MS/GM 111/2012, Art. 4º, IX)
X - Entidades Não Governamentais Ligadas à Defesa e Promoção do Aleitamento Materno; e (Origem: PRT MS/GM 111/2012, Art. 4º, X)
XI - Universidades e/ou Institutos de Pesquisa. (Origem: PRT MS/GM 111/2012, Art. 4º, XI)
Parágrafo Único. Os representantes titulares e suplentes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Coordenação do Comitê, exceto os referentes aos incisos X e XI do "caput" deste artigo, que serão indicados pelo próprio CNAM. (Origem: PRT MS/GM 111/2012, Art. 4º, Parágrafo Único)
Art. 155. O CNAM poderá convidar representantes de órgãos e entidades públicas e de entidades não governamentais, bem como especialistas em assuntos ligados ao tema, cuja presença seja considerada necessária ao cumprimento do dispositivo nesta Seção. (Origem: PRT MS/GM 111/2012, Art. 5º)
Art. 156. A participação do CNAM não será remunerada e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 111/2012, Art. 6º)
CAPÍTULO VIII
DA SEGURANÇA DO PACIENTE
Seção I
Do Programa Nacional de Segurança do Paciente (PNSP)
Art. 157. Fica instituído o Programa Nacional de Segurança do Paciente (PNSP). (Origem: PRT MS/GM 529/2013, Art. 1º)
Art. 158. O PNSP tem por objetivo geral contribuir para a qualificação do cuidado em saúde em todos os estabelecimentos de saúde do território nacional. (Origem: PRT MS/GM 529/2013, Art. 2º)
Art. 159. Constituem-se objetivos específicos do PNSP: (Origem: PRT MS/GM 529/2013, Art. 3º)
I - promover e apoiar a implementação de iniciativas voltadas à segurança do paciente em diferentes áreas da atenção, organização e gestão de serviços de saúde, por meio da implantação da gestão de risco e de Núcleos de Segurança do Paciente nos estabelecimentos de saúde; (Origem: PRT MS/GM 529/2013, Art. 3º, I)
II - envolver os pacientes e familiares nas ações de segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 3º, II)
III - ampliar o acesso da sociedade às informações relativas à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 3º, III)
IV - produzir, sistematizar e difundir conhecimentos sobre segurança do paciente; e (Origem: PRT MS/GM 529/2013, Art. 3º, IV)
V - fomentar a inclusão do tema segurança do paciente no ensino técnico e de graduação e pós-graduação na área da saúde. (Origem: PRT MS/GM 529/2013, Art. 3º, V)
Art. 160. Para fins desta Seção, são adotadas as seguintes definições: (Origem: PRT MS/GM 529/2013, Art. 4º)
I - Segurança do Paciente: redução, a um mínimo aceitável, do risco de dano desnecessário associado ao cuidado de saúde; (Origem: PRT MS/GM 529/2013, Art. 4º, I)
II - dano: comprometimento da estrutura ou função do corpo e/ou qualquer efeito dele oriundo, incluindo-se doenças, lesão, sofrimento, morte, incapacidade ou disfunção, podendo, assim, ser físico, social ou psicológico; (Origem: PRT MS/GM 529/2013, Art. 4º, II)
III - incidente: evento ou circunstância que poderia ter resultado, ou resultou, em dano desnecessário ao paciente; (Origem: PRT MS/GM 529/2013, Art. 4º, III)
IV - Evento adverso: incidente que resulta em dano ao paciente; (Origem: PRT MS/GM 529/2013, Art. 4º, IV)
V - Cultura de Segurança: configura-se a partir de cinco características operacionalizadas pela gestão de segurança da organização: (Origem: PRT MS/GM 529/2013, Art. 4º, V)
a) cultura na qual todos os trabalhadores, incluindo profissionais envolvidos no cuidado e gestores, assumem responsabilidade pela sua própria segurança, pela segurança de seus colegas, pacientes e familiares; (Origem: PRT MS/GM 529/2013, Art. 4º, V, a)
b) cultura que prioriza a segurança acima de metas financeiras e operacionais; (Origem: PRT MS/GM 529/2013, Art. 4º, V, b)
c) cultura que encoraja e recompensa a identificação, a notificação e a resolução dos problemas relacionados à segurança; (Origem: PRT MS/GM 529/2013, Art. 4º, V, c)
d) cultura que, a partir da ocorrência de incidentes, promove o aprendizado organizacional; e (Origem: PRT MS/GM 529/2013, Art. 4º, V, d)
e) cultura que proporciona recursos, estrutura e responsabilização para a manutenção efetiva da segurança. (Origem: PRT MS/GM 529/2013, Art. 4º, V, e)
VI - gestão de risco: aplicação sistêmica e contínua de iniciativas, procedimentos, condutas e recursos na avaliação e controle de riscos e eventos adversos que afetam a segurança, a saúde humana, a integridade profissional, o meio ambiente e a imagem institucional. (Origem: PRT MS/GM 529/2013, Art. 4º, VI)
Art. 161. Constituem-se estratégias de implementação do PNSP: (Origem: PRT MS/GM 529/2013, Art. 5º)
I - elaboração e apoio à implementação de protocolos, guias e manuais de segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 5º, I)
II - promoção de processos de capacitação de gerentes, profissionais e equipes de saúde em segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 5º, II)
III - inclusão, nos processos de contratualização e avaliação de serviços, de metas, indicadores e padrões de conformidade relativos à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 5º, III)
IV - implementação de campanha de comunicação social sobre segurança do paciente, voltada aos profissionais, gestores e usuários de saúde e sociedade; (Origem: PRT MS/GM 529/2013, Art. 5º, IV)
V - implementação de sistemática de vigilância e monitoramento de incidentes na assistência à saúde, com garantia de retorno às unidades notificantes; (Origem: PRT MS/GM 529/2013, Art. 5º, V)
VI - promoção da cultura de segurança com ênfase no aprendizado e aprimoramento organizacional, engajamento dos profissionais e dos pacientes na prevenção de incidentes, com ênfase em sistemas seguros, evitando-se os processos de responsabilização individual; e (Origem: PRT MS/GM 529/2013, Art. 5º, VI)
VII - articulação, com o Ministério da Educação e com o Conselho Nacional de Educação, para inclusão do tema segurança do paciente nos currículos dos cursos de formação em saúde de nível técnico, superior e de pós-graduação. (Origem: PRT MS/GM 529/2013, Art. 5º, VII)
Art. 162. Fica instituído, no âmbito do Ministério da Saúde, o Comitê de Implementação do Programa Nacional de Segurança do Paciente (CIPNSP), instância colegiada, de caráter consultivo, com a finalidade de promover ações que visem à melhoria da segurança do cuidado em saúde através de processo de construção consensual entre os diversos atores que dele participam. (Origem: PRT MS/GM 529/2013, Art. 6º)
Art. 163. Compete ao CIPNSP: (Origem: PRT MS/GM 529/2013, Art. 7º)
I - propor e validar protocolos, guias e manuais voltados à segurança do paciente em diferentes áreas, tais como: (Origem: PRT MS/GM 529/2013, Art. 7º, I)
a) infecções relacionadas à assistência à saúde; (Origem: PRT MS/GM 529/2013, Art. 7º, I, a)
b) procedimentos cirúrgicos e de anestesiologia; (Origem: PRT MS/GM 529/2013, Art. 7º, I, b)
c) prescrição, transcrição, dispensação e administração de medicamentos, sangue e hemoderivados; (Origem: PRT MS/GM 529/2013, Art. 7º, I, c)
d) processos de identificação de pacientes; (Origem: PRT MS/GM 529/2013, Art. 7º, I, d)
e) comunicação no ambiente dos serviços de saúde; (Origem: PRT MS/GM 529/2013, Art. 7º, I, e)
f) prevenção de quedas; (Origem: PRT MS/GM 529/2013, Art. 7º, I, f)
g) úlceras por pressão; (Origem: PRT MS/GM 529/2013, Art. 7º, I, g)
h) transferência de pacientes entre pontos de cuidado; e (Origem: PRT MS/GM 529/2013, Art. 7º, I, h)
i) uso seguro de equipamentos e materiais. (Origem: PRT MS/GM 529/2013, Art. 7º, I, i)
II - aprovar o Documento de Referência do PNSP; (Origem: PRT MS/GM 529/2013, Art. 7º, II)
III - incentivar e difundir inovações técnicas e operacionais que visem à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 7º, III)
IV - propor e validar projetos de capacitação em Segurança do Paciente; (Origem: PRT MS/GM 529/2013, Art. 7º, IV)
V - analisar quadrimestralmente os dados do Sistema de Monitoramento incidentes no cuidado de saúde e propor ações de melhoria; (Origem: PRT MS/GM 529/2013, Art. 7º, V)
VI - recomendar estudos e pesquisas relacionados à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 7º, VI)
VII - avaliar periodicamente o desempenho do PNSP; e (Origem: PRT MS/GM 529/2013, Art. 7º, VII)
VIII - elaborar seu regimento interno e submetê-lo à aprovação do Ministro de Estado da Saúde. (Origem: PRT MS/GM 529/2013, Art. 7º, VIII)
Art. 164. O CIPNSP instituições é composto por representantes, titular e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 529/2013, Art. 8º)
I - do Ministério da Saúde: (Origem: PRT MS/GM 529/2013, Art. 8º, I)
a) um da Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, a)
b) um da Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, b)
c) um da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, c)
d) um da Secretaria de Vigilância em Saúde (SVS/MS); e (Origem: PRT MS/GM 529/2013, Art. 8º, I, d)
e) um da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, e)
II - um da Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 529/2013, Art. 8º, II)
III - um da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 529/2013, Art. 8º, III)
IV - um da Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 529/2013, Art. 8º, IV)
V - um do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 529/2013, Art. 8º, V)
VI - um do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 529/2013, Art. 8º, VI)
VII - um do Conselho Federal de Medicina (CFM); (Origem: PRT MS/GM 529/2013, Art. 8º, VII)
VIII - um do Conselho Federal de Enfermagem (COFEN); (Origem: PRT MS/GM 529/2013, Art. 8º, VIII)
IX - um do Conselho Federal de Odontologia (CFO); (Origem: PRT MS/GM 529/2013, Art. 8º, IX)
X - um do Conselho Federal de Farmácia (CFF); (Origem: PRT MS/GM 529/2013, Art. 8º, X)
XI - um da Organização Pan Americana de Saúde (OPAS); (Origem: PRT MS/GM 529/2013, Art. 8º, XI)
XII - quatro de Instituições Superiores de Ensino e Pesquisa com notório saber no tema Segurança do Paciente; (Origem: PRT MS/GM 529/2013, Art. 8º, XII)
XIII - um do Conselho Nacional de Saúde; e (Origem: PRT MS/GM 529/2013, Art. 8º, XIII)
XIV - um da Confederação Nacional de Saúde. (Origem: PRT MS/GM 529/2013, Art. 8º, XIV)
§ 1º A coordenação do CIPNSP será realizada pela ANVISA, que fornecerá em conjunto com a SAS/MS e a FIOCRUZ os apoios técnico e administrativo necessários para o seu funcionamento. (Origem: PRT MS/GM 529/2013, Art. 8º, § 1º)
§ 2º A participação das entidades de que tratam os incisos V a XIV do "caput" será formalizada após resposta a convite a eles encaminhado pela Coordenação do CIPNSP, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 529/2013, Art. 8º, § 2º)
§ 3º Os representantes titulares e os respectivos suplentes serão indicados pelos dirigentes dos respectivos órgãos e entidades à Coordenação do CIPNSP no prazo de 10 (dez) dias a contar da data da data de publicação da Portaria nº 529/GM/MS, de 01 de abril de 2013. (Origem: PRT MS/GM 529/2013, Art. 8º, § 3º)
§ 4º O CIPNSP poderá convocar representantes de órgãos e entidades, públicas e privadas, além de especialistas nos assuntos relacionados às suas atividades, quando entender necessário para o cumprimento dos objetivos previstos nesta Seção. (Origem: PRT MS/GM 529/2013, Art. 8º, § 4º)
§ 5º O CIPNSP poderá instituir grupos de trabalho para a execução de atividades específicas que entender necessárias para o cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 529/2013, Art. 8º, § 5º)
Art. 165. As funções dos membros do CIPNSP não serão remuneradas e seu exercício será considerado de relevante interesse público. (Origem: PRT MS/GM 529/2013, Art. 9º)
Art. 166. O Ministério da Saúde instituirá incentivos financeiros para a execução de ações e atividades no âmbito do PNSP, conforme normatização específica, mediante prévia pactuação na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 529/2013, Art. 10)
CAPÍTULO IX
DA SEMANA DE MOBILIZAÇÃO SAÚDE NA ESCOLA (SEMANA SAÚDE NA ESCOLA)
Art. 167. Fica definida a Semana de Mobilização Saúde na Escola (Semana Saúde na Escola), de periodicidade anual, como componente das ações do Programa Saúde na Escola. (Origem: PRT MS/GM 798/2015, Art. 1º)
Art. 168. A Semana Saúde na Escola é constituída por ações de promoção e de prevenção de agravos à saúde realizadas em estabelecimentos públicos de ensino em todo o território nacional com participação das equipes da Atenção Básica e das equipes das escolas. (Origem: PRT MS/GM 798/2015, Art. 2º)
Parágrafo Único. Os Ministros de Estado da Saúde e da Educação definirão, anualmente, os temas principais que nortearão a execução das ações de que trata o "caput". (Origem: PRT MS/GM 798/2015, Art. 2º, Parágrafo Único)
Art. 169. Poderão participar da Semana Saúde na Escola todos os estabelecimentos públicos de ensino do Distrito Federal, dos Estados e dos Municípios. (Origem: PRT MS/GM 798/2015, Art. 3º)
Parágrafo Único. É livre a iniciativa dos entes federados interessados em participar da mobilização, sem necessidade de prévia adesão. (Origem: PRT MS/GM 798/2015, Art. 3º, Parágrafo Único)
Art. 170. Para os Municípios aderidos ao PSE, as ações realizadas durante a Semana Saúde na Escola serão contabilizadas para o alcance das metas pactuadas no Termo de Compromisso do Programa, definido em ato conjunto dos Ministros de Estado da Saúde e da Educação. (Origem: PRT MS/GM 798/2015, Art. 4º)
Parágrafo Único. A contabilização das ações realizadas durante a Semana Saúde na Escola fica condicionada ao seu registro nos sistemas de monitoramento do PSE. (Origem: PRT MS/GM 798/2015, Art. 4º, Parágrafo Único)
Art. 171. O período de realização e o tema principal da Semana Saúde na Escola serão divulgados, anualmente, nos canais de comunicação do Ministério da Saúde e também por meios eletrônicos e/ou impressos de ampla circulação. (Origem: PRT MS/GM 798/2015, Art. 5º)
TÍTULO II
DO CONTROLE DE DOENÇAS E ENFRENTAMENTO DE AGRAVOS DE SAÚDE
CAPÍTULO I
DA ELIMINAÇÃO DA HANSENÍASE
Seção I
Do Conjunto de Ações e Medidas Coordenadas para a Eliminação da Hanseníase
Art. 172. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), um conjunto de ações e medidas coordenadas para a eliminação da hanseníase, a serem promovidas de forma compartilhada entre o Ministério da Saúde e as Secretarias de Saúde dos Estados, dos Municípios e do Distrito Federal, com a finalidade de fortalecer o desenvolvimento das ações de prevenção, diagnóstico, tratamento, reabilitação e controle da hanseníase, tendo por objetivos: (Origem: PRT MS/GM 586/2004, Art. 1º)
I - ampliar o acesso ao diagnóstico e ao tratamento nos municípios de maior endemicidade; (Origem: PRT MS/GM 586/2004, Art. 1º, I)
II - garantir atenção integral aos pacientes em todos os níveis de complexidade; (Origem: PRT MS/GM 586/2004, Art. 1º, II)
III - assegurar, nas unidades de saúde, tratamento completo para as formas paucibacilar e multibacilar; (Origem: PRT MS/GM 586/2004, Art. 1º, III)
IV - desenvolver ações de promoção à saúde e vigilância epidemiológica, bem como de diagnóstico e acompanhamento, tratamento e reabilitação das pessoas atingidas pela doença; (Origem: PRT MS/GM 586/2004, Art. 1º, IV)
V - promover a organização, a regulação, o acompanhamento e a avaliação do conjunto de ações de saúde para a efetiva eliminação da hanseníase; (Origem: PRT MS/GM 586/2004, Art. 1º, V)
VI - garantir informação acessível, atualizada e confiável, como ferramenta de avaliação, acompanhamento do estágio da eliminação para tomada de decisão; (Origem: PRT MS/GM 586/2004, Art. 1º, VI)
VII - responsabilizar os gestores e mobilizar a sociedade civil, na promoção do conhecimento sobre os sinais e sintomas da hanseníase; e (Origem: PRT MS/GM 586/2004, Art. 1º, VII)
VIII - ampliar a oferta de procedimentos de reabilitação física aos pacientes portadores de incapacidades/deformidades decorrentes da hanseníase. (Origem: PRT MS/GM 586/2004, Art. 1º, VIII)
Art. 173. Ficam integradas as ações de eliminação da hanseníase - diagnóstico e tratamento - na Atenção Básica, com o objetivo de promover o maior acesso das pessoas atingidas pela doença, em especial nos municípios endêmicos. (Origem: PRT MS/GM 586/2004, Art. 2º)
Art. 174. A Secretaria de Vigilância em Saúde e a Secretaria de Atenção à Saúde adotarão as medidas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 586/2004, Art. 3º)
Seção II
Dos Centros Colaboradores Nacionais, Macrorregionais e Estaduais para o Programa Nacional de Controle e Eliminação da Hanseníase e de Outras Dermatoses de Interesse Sanitário
Art. 175. Ficam aprovados os pré-requisitos, as atividades e demais orientações, constantes desta Seção, para o reconhecimento de instituições como Centros Colaboradores Nacionais, Macrorregionais e Estaduais para o Programa Nacional de Controle e Eliminação da Hanseníase e de outras dermatoses de interesse sanitário. (Origem: PRT MS/GM 814/2000, Art. 1º)
Parágrafo Único. Os Centros Colaboradores Nacionais e Macrorregionais serão reconhecidos por meio de portaria ministerial específica e os Centros Colaboradores Estaduais pela respectiva Secretaria de Estado da Saúde. (Origem: PRT MS/GM 814/2000, Art. 1º, Parágrafo Único)
Art. 176. São atividades dos Centros Colaboradores Nacionais: (Origem: PRT MS/GM 814/2000, Art. 2º)
I - o desenvolvimento de pesquisas de interesse do Programa Nacional de Controle e Eliminação da Hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 2º, I)
II - a capacitação de recursos humanos especializados na atenção básica e em outras de maior complexidade para o Programa Nacional mencionado; e (Origem: PRT MS/GM 814/2000, Art. 2º, II)
III - a realização de estudos de interesse do Programa Nacional de Controle e Eliminação da Hanseníase, com ênfase em epidemiologia, aspectos operacionais, resistência medicamentosa, efeitos colaterais e recidivas e monitoramento de eventos sentinelas. (Origem: PRT MS/GM 814/2000, Art. 2º, III)
Art. 177. Ficam definidos os pré-requisitos mínimos obrigatórios para o reconhecimento de Unidades de Saúde como Centros Colaboradores Estaduais, Macrorregionais ou Nacionais na área de dermatologia sanitária. (Origem: PRT MS/GM 814/2000, Art. 3º)
§ 1º São os seguintes os pré-requisitos para o reconhecimento de instituições como Centro Colaborador Estadual ou Macrorregional; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º)
I - dispor de equipe multidisciplinar capacitada para a assistência em dermatologia sanitária,com enfoque nas ações de controle da hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, I)
II - assessorar tecnicamente as demais Unidades de Saúde da rede do SUS na área de hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, II)
III - realizar e apoiar a capacitação técnica nas atividades de controle e eliminação da hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, III)
IV - esclarecer diagnósticos, inclusive de recidivas e de outras intercorrências; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, IV)
V - desenvolver e apoiar o desenvolvimento de pesquisas de interesse do Programa de Controle e Eliminação da Hanseníase; e (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, V)
VI - estar vinculado formalmente a comitê de ética em pesquisa. (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, VI)
§ 2º São os seguintes os pré-requisitos para o reconhecimento de instituições como Centro Colaborador Nacional, além dos constantes no §1° precedente; (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º)
I - dispor de, pelo menos, um terço da equipe com titulação em nível de pós graduação; (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º, I)
II - possuir laboratório de pesquisa; e (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º, II)
III - apresentar produção científica regular. (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º, III)
§ 3º Os Centros Colaboradores Nacionais deverão subsidiar o Ministério da Saúde nas decisões referentes à política de controle e eliminação da hanseníase e de outras dermatoses de direito sanitário. (Origem: PRT MS/GM 814/2000, Art. 3º, § 3º)
Art. 178. Os Centros Colaboradores Nacionais, Macrorregionais e Estaduais deverão trabalhar de forma integrada e assessorar as gerências de hanseníase, de acordo com a sua capacidade organizacional e em consonância com as normas técnicas nacionais. (Origem: PRT MS/GM 814/2000, Art. 4º)
Seção III
Dos Mecanismos para a Organização e a Implantação de Redes Estaduais/Municipais de Atenção à Hanseníase
Art. 179. Ficam estabelecidos os mecanismos para a organização e a implantação de Redes Estaduais/Municipais de Atenção à Hanseníase. (Origem: PRT MS/GM 587/2004, Art. 1º)
Art. 180. As Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios, de acordo com as respectivas condições de gestão e divisão de responsabilidades, adotarão as providências necessárias à organização e implantação das Redes Estaduais de Atenção à Hanseníase, que serão integradas por Serviços de Atenção à Hanseníase, a seguir discriminados: (Origem: PRT MS/GM 587/2004, Art. 2º)
I - Ações de Saúde na Atenção Básica; (Origem: PRT MS/GM 587/2004, Art. 2º, a)
II - Serviços de Atenção a Hanseníase na Média Complexidade; e (Origem: PRT MS/GM 587/2004, Art. 2º, b)
III - Serviços de Atenção a Hanseníase na alta Complexidade; (Origem: PRT MS/GM 587/2004, Art. 2º, c)
§ 1º As Ações de Saúde na Atenção Básica compreendem ações de caráter individual e coletivo de promoção e prevenção de incapacidade, resultantes da Hanseníase que possam ser realizadas neste nível de atenção, assim como ações informativas e educativas junto a comunidade de orientação familiar e encaminhamentos quando necessário para o Serviço de Atenção à Hanseníase na Média Complexidade. (Origem: PRT MS/GM 587/2004, Art. 2º, § 1º)
§ 2º Os Serviços de Atenção à Hanseníase na Média Complexidade compreendem ações de atenção diagnóstica e terapêutica especializadas, garantidas a partir do processo de referência e contrareferência do paciente afetado pela Hanseníase e que devem ser organizadas de acordo com o Plano Diretor de Regionalização (PDR) de cada Unidade Federada. (Origem: PRT MS/GM 587/2004, Art. 2º, § 2º)
§ 3º Os Serviços de Atenção à Hanseníase na Alta Complexidade caracterizam-se como serviços de maior nível de atenção e tem como finalidade prestar assistência multiprofissional e multidisciplinar especializada para o atendimento às pessoas portadoras de Hanseníase, incluindo as cirurgias reparadoras das sequelas de Hanseníase. (Origem: PRT MS/GM 587/2004, Art. 2º, § 3º)
Art. 181. A Secretaria de Atenção a Saúde, em conjunto com a Secretaria de Vigilância em Saúde, adotará as medidas necessárias à implementação do disposto nesta Seção. (Origem: PRT MS/GM 587/2004, Art. 3º)
CAPÍTULO II
DA REDUÇÃO DA MORBIMORTALIDADE POR ACIDENTES E VIOLÊNCIA
Seção I
Do Projeto de Vida no Trânsito
Art. 182. O Projeto Vida no Trânsito tem como objetivo subsidiar gestores no fortalecimento de políticas de prevenção de lesões e mortes no trânsito por meio do planejamento, monitoramento, acompanhamento e avaliação das ações. (Origem: PRT MS/GM 183/2014, Art. 35)
Art. 183. Para a execução das ações do Projeto Vida no Trânsito, o ente federativo habilitado ao recebimento do incentivo financeiro assumirá as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 36)
I - instituir Comitê Intersetorial Estadual, do Distrito Federal ou Municipal, de execução e acompanhamento do Projeto Vida no Trânsito ou tema similar; (Origem: PRT MS/GM 183/2014, Art. 36, I)
II - instituir Comissão ou Subcomissão de Coleta de Dados, Análise e Gestão da Informação; (Origem: PRT MS/GM 183/2014, Art. 36, II)
III - enviar anualmente à SVS/MS relatório com informações qualificadas sobre as lesões e mortes causadas no trânsito, utilizando banco de dados da segurança pública, trânsito e saúde sobre acidentes e vítimas; e (Origem: PRT MS/GM 183/2014, Art. 36, III)
IV - promover o desenvolvimento de ações de intervenção baseadas nas evidências obtidas após análise de dados e informações, por meio de planejamento integrado e intersetorial, com projetos de intervenção focados a partir dos fatores de risco prioritários de ocorrência dos acidentes de trânsito, nos grupos de vítimas e nos pontos críticos de ocorrência de acidentes nos Municípios. (Origem: PRT MS/GM 183/2014, Art. 36, IV)
Art. 184. O ente federativo será desabilitado do Projeto Vida no Trânsito nas seguintes hipóteses: (Origem: PRT MS/GM 183/2014, Art. 38)
I - ausência de institucionalização do Comitê Intersetorial de execução e acompanhamento do Projeto Vida no Trânsito; ou (Origem: PRT MS/GM 183/2014, Art. 38, I)
II - não envio do relatório anual da Comissão ou Subcomissão de Coleta de Dados, Análise e Gestão da Informação à SVS/MS. (Origem: PRT MS/GM 183/2014, Art. 38, II)
Art. 185. A avaliação das ações do Projeto Vida no Trânsito será efetuada anualmente pela SVS/MS, a partir do ano subsequente ao da habilitação, por intermédio do relatório anual referido no art. 183, III. (Origem: PRT MS/GM 183/2014, Art. 39)
Seção II
Do Projeto de Redução de Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde, no âmbito do Sistema Único de Saúde
Art. 186. Fica aprovado, na forma dos Anexos XV, XVI e XVII , o "Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde", no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 344/2002, Art. 1º)
Parágrafo Único. O referido Projeto tem como objetivo reduzir a morbimortalidade por acidentes de trânsito no País, mediante o desenvolvimento de um conjunto de ações sistematizadas de prevenção de acidentes de trânsito. (Origem: PRT MS/GM 344/2002, Art. 1º, Parágrafo Único)
Art. 187. O Projeto Nacional ora aprovado será desenvolvido em parceria com os gestores dos três níveis de direção do SUS e com os órgãos e entidades de trânsito nacionais, estaduais e municipais. (Origem: PRT MS/GM 344/2002, Art. 2º)
Art. 188. Fica criada a Comissão Técnica de Acompanhamento, coordenada pela Secretaria de Políticas de Saúde, encarregada de assessorar, planejar, avaliar e supervisionar as ações levadas a efeito no âmbito dos estados e municípios. (Origem: PRT MS/GM 344/2002, Art. 3º)
CAPÍTULO III
DA PREVENÇÃO E CONTROLE DO CÂNCER
Seção I
Do Registro de Câncer de Base Populacional (RCBP)
Art. 189. O RCBP constitui-se de ferramenta de vigilância e monitoramento de neoplasias destinado a estimar incidências, taxas de mortalidade e de sobrevida, por meio da coleta, análise, interpretação e divulgação sistemática em uma população e períodos de tempo específicos. (Origem: PRT MS/GM 183/2014, Art. 20)
§ 1º O RCBP coletará informações de pessoas residentes nos Municípios onde estão localizados, as quais constituirão subsídio para o planejamento, a implementação de programas e de ações de prevenção e de atenção à população doente. (Origem: PRT MS/GM 183/2014, Art. 20, § 1º)
§ 2º O Ministério da Saúde disponibilizará no endereço eletrônico http://bvsms.saude. gov.br/bvs/ publicacoes/inca/manual_registros_cancer_base_populacional_2ed.pdf o Manual de Rotinas e Procedimentos para RCBP. (Origem: PRT MS/GM 183/2014, Art. 20, § 2º)
Art. 190. Para a execução de ações de RCBP, o estabelecimento assumirá as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 22)
I - encaminhamento anual ao Instituto Nacional de Câncer (INCA) e à SVS/MS da base de dados atualizada, consolidada e em meio digital, com defasagem máxima de 2 (dois) anos calendário, para avaliação de consistência e divulgação das informações; (Origem: PRT MS/GM 183/2014, Art. 22, I)
II - utilização, preferencialmente, do Sistema Informatizado para RCBP, desenvolvido pelo INCA para registros dos dados coletados; e (Origem: PRT MS/GM 183/2014, Art. 22, II)
III - fornecimento anual da base de dados, de informações e análise sobre perfil da incidência de câncer na localidade para as respectivas Secretarias Estaduais e Municipais de Saúde. (Origem: PRT MS/GM 183/2014, Art. 22, III)
Art. 191. O ente federativo será desabilitado das ações de RCBP nas seguintes hipóteses: (Origem: PRT MS/GM 183/2014, Art. 24)
I - deixar de encaminhar anualmente, até o mês de junho, a base de dados consolidada e atualizada em meio digital, de pelo menos um novo ano calendário para avaliação de consistência e divulgação das informações ao INCA, à SVS/MS e às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios; (Origem: PRT MS/GM 183/2014, Art. 24, I)
II - manter base de dados não atualizadas, com defasagem superior a 2 (dois) anos calendários; ou (Origem: PRT MS/GM 183/2014, Art. 24, II)
III - deixar de comprovar a formalização do contrato do serviço de RCBP, quando este for gerenciado por instituição pública ou filantrópica não vinculada às Secretarias de Saúde. (Origem: PRT MS/GM 183/2014, Art. 24, III)
Art. 192. A avaliação do RCBP será efetuada anualmente pela SVS/MS, a partir do ano seguinte ao da habilitação, por intermédio da base de dados a ela encaminhada. (Origem: PRT MS/GM 183/2014, Art. 25)
Seção II
Do Controle de Câncer de Mama
Subseção I
Do Programa de Mamografia Móvel
Art. 193. Fica instituído o Programa de Mamografia Móvel no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2304/2012, Art. 1º)
Art. 194. Para fins do disposto nesta Subseção, considera-se Mamografia Móvel o exame mamográfico realizado por unidade móvel de saúde com o objetivo de identificar e rastrear alterações relacionadas ao câncer de mama em todo território nacional. (Origem: PRT MS/GM 2304/2012, Art. 2º)
Art. 195. O Programa de Mamografia Móvel tem os seguintes objetivos: (Origem: PRT MS/GM 2304/2012, Art. 3º)
I - articular ações que visem ao aumento da cobertura mamográfica em todo território nacional, prioritariamente em favor das mulheres na faixa etária elegível, entre cinquenta e sessenta e nove anos de idade, para o rastreamento do câncer de mama; (Origem: PRT MS/GM 2304/2012, Art. 3º, I)
II - desenvolver ações coordenadas que visem à garantia do fornecimento regular do exame mamográfico às mulheres na faixa etária elegível para o rastreamento do câncer de mama, bienalmente; (Origem: PRT MS/GM 2304/2012, Art. 3º, II)
III - fortalecer ações de prevenção secundária para o câncer de mama, com favorecimento para o seu diagnóstico precoce e o encaminhamento em tempo adequado para a confirmação diagnóstica e o tratamento especializado; e (Origem: PRT MS/GM 2304/2012, Art. 3º, III)
IV - prestar ações de fortalecimento do desenvolvimento regional da rede de atendimento à população nos três níveis de atenção à saúde. (Origem: PRT MS/GM 2304/2012, Art. 3º, IV)
Art. 196. O Programa de Mamografia Móvel contemplará: (Origem: PRT MS/GM 2304/2012, Art. 4º)
I - prioritariamente, as mulheres na faixa etária elegível, entre cinquenta e sessenta e nove anos de idade, para o rastreamento do câncer de mama, conforme dados disponibilizados no Censo 2010 do Instituto Brasileiro de Geografia e Estatística (IBGE); e (Origem: PRT MS/GM 2304/2012, Art. 4º, I)
II - os entes federativos que se encontrarem com os menores percentuais de realização de exames de mamografia, segundo o Índice de Desempenho do SUS (IDSUS). (Origem: PRT MS/GM 2304/2012, Art. 4º, II)
Art. 197. O Programa de Mamografia Móvel será executado: (Origem: PRT MS/GM 2304/2012, Art. 5º)
I - por meio de parceria entre a União, por meio do Ministério da Saúde, os Estados, o Distrito Federal e os Municípios; e (Origem: PRT MS/GM 2304/2012, Art. 5º, I)
II - pela prestação de serviços de diagnóstico por imagem por estabelecimentos públicos ou privados de saúde, contratados ou conveniados, por meio de unidades móveis de saúde, interessados em realizar exames de mamografia. (Origem: PRT MS/GM 2304/2012, Art. 5º, II)
Art. 198. Para participação no Programa Mamografia Móvel, os entes federativos interessados devem cumprir os seguintes requisitos: (Origem: PRT MS/GM 2304/2012, Art. 6º)
I - cumprir com os objetivos do Programa de Mamografia Móvel de que trata o art. 195; (Origem: PRT MS/GM 2304/2012, Art. 6º, I)
II - identificar e convocar as mulheres elegíveis para o Programa; (Origem: PRT MS/GM 2304/2012, Art. 6º, II)
III - realizar agendamento regulado e organizado das mulheres elegíveis para o Programa; e (Origem: PRT MS/GM 2304/2012, Art. 6º, III)
IV - prover o atendimento nos serviços da atenção especializada de média e alta complexidade, para os casos que necessitarem de intervenções e cuidado por alterações no exame mamográfico. (Origem: PRT MS/GM 2304/2012, Art. 6º, IV)
Art. 199. Para fins de habilitação no Programa de Mamografia Móvel, os entes federativos interessados deverão encaminhar à Coordenação-Geral de Média e Alta Complexidade (CGMAC/DAET/SAS/MS) a seguinte documentação: (Origem: PRT MS/GM 2304/2012, Art. 7º)
I - estimativa do público-alvo total a ser coberto pelos serviços contratados, considerando-se a faixa etária prioritária definida no art. 196, I; (Origem: PRT MS/GM 2304/2012, Art. 7º, I)
II - relação dos estabelecimentos de saúde e respectivas unidades móveis que foram contratualizados para a realização de exames de mamografia no âmbito do Programa de Mamografia Móvel; (Origem: PRT MS/GM 2304/2012, Art. 7º, II)
III - proposta para a execução dos serviços, com os seguintes requisitos mínimos: (Origem: PRT MS/GM 2304/2012, Art. 7º, III)
a) área territorial de abrangência dos serviços previstos, conforme a capacidade de cada unidade móvel de saúde a ser autorizada; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, a)
b) fluxos micro e macrorregionais de encaminhamento; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, b)
c) indicação de estratégias que garantam o acesso da população triada residente em locais de difícil acesso; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, c)
d) metas físicas e financeiras a serem alcançadas, conforme a estimativa de público-alvo e a capacidade instalada de cada unidade móvel de saúde a ser autorizada; e (Origem: PRT MS/GM 2304/2012, Art. 7º, III, d)
e) declaração do gestor de saúde de que assume a responsabilidade, de acordo com a conformação da Região de Saúde, de: (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e)
1. encaminhamento das mulheres com alterações mamárias para serviços de confirmação diagnóstica e tratamento, quando indicados; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e, 1)
2. encaminhamento das mulheres com confirmação diagnóstica de câncer de mama para tratamento nas unidades de tratamento especializado; e (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e, 2)
3. definição da unidade de atendimento especializado para a qual serão encaminhadas as mulheres identificadas com confirmação diagnóstica de câncer de mama; e (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e, 3)
IV - expediente que comprove o envio à Comissão Intergestores Regional (CIR), à Comissão Intergestores Bipartite (CIB) ou, quando for o caso, ao Colegiado de Gestão da Secretaria de Saúde do Distrito Federal (CGSES/DF) sobre a participação no Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 7º, IV)
Parágrafo Único. A habilitação no Programa de Mamografia Móvel terá validade por 24 (vinte quatro) meses. (Origem: PRT MS/GM 2304/2012, Art. 7º, Parágrafo Único)
Art. 200. Para participação no Programa Mamografia Móvel, os estabelecimentos de saúde e respectivas unidades móveis devem cumprir os seguintes requisitos: (Origem: PRT MS/GM 2304/2012, Art. 8º)
I - dispor de alvará da vigilância sanitária local para a unidade móvel de saúde que realizará os exames de mamografia no território de atuação; (Origem: PRT MS/GM 2304/2012, Art. 8º, I)
II - ter registro no Sistema Cadastro Nacional de Estabelecimentos de Saúde (SCNES) para cada unidade móvel de saúde no seu respectivo território de atuação; (Origem: PRT MS/GM 2304/2012, Art. 8º, II)
III - dispor de áreas e instalações necessárias, suficientes e adequadas para a recepção dos pacientes e realização do exame de mamografia, com observância dos instrumentos normativos do Ministério da Saúde, especialmente a Portaria nº 453/SVS/MS, de 2 de junho de 1998; (Origem: PRT MS/GM 2304/2012, Art. 8º, III)
IV - dispor da presença de profissional médico radiologista, legalmente habilitado, no caso da emissão dos laudos na unidade móvel que realiza o exame, com respectivo registro ou inscrição no Conselho Regional de Medicina e cadastrado no respectivo estabelecimento de saúde móvel; (Origem: PRT MS/GM 2304/2012, Art. 8º, IV)
V - no caso de não possuir profissional médico radiologista na unidade móvel de saúde para emissão do laudo radiológico, garantir o respectivo laudo médico através de outra unidade de saúde disponível; (Origem: PRT MS/GM 2304/2012, Art. 8º, V)
VI - no caso de emissão de laudos por telerradiologia, dispor de: (Origem: PRT MS/GM 2304/2012, Art. 8º, VI)
a) profissional médico radiologista ou empresa especializada com central de laudos com capacidade instalada comprovada para emissão de laudos, observando-se os termos da Resolução nº 1.890, de 15 de janeiro de 2009, do Conselho Federal de Medicina (CFM); (Origem: PRT MS/GM 2304/2012, Art. 8º, VI, a)
b) canal de comunicação com capacidade de transmissão da informação necessária para o laudo radiológico; e (Origem: PRT MS/GM 2304/2012, Art. 8º, VI, b)
c) dispor de capacidade para envio dos laudos e imagens dos exames por meio digital ao órgão designado pelo gestor local de saúde; (Origem: PRT MS/GM 2304/2012, Art. 8º, VI, c)
VII - dispor de capacidade para envio de relatório sintético do atendimento realizado mensalmente ao(s) gestor(es) municipal(ais) do seu território de atuação; (Origem: PRT MS/GM 2304/2012, Art. 8º, VII)
VIII - dispor de equipe técnica para prévia vistoria dos locais por onde percorrerá a unidade móvel de saúde a fim de verificar condições de adequabilidade e logística necessárias; (Origem: PRT MS/GM 2304/2012, Art. 8º, VIII)
IX - garantir a integridade física dos pacientes e dos funcionários durante o procedimento, protegendo-os de situações de risco; (Origem: PRT MS/GM 2304/2012, Art. 8º, IX)
X - garantir igualdade de tratamento, sem quaisquer discriminações; (Origem: PRT MS/GM 2304/2012, Art. 8º, X)
XI - prestar atendimento de qualidade, observando-se as questões de sigilo profissional; (Origem: PRT MS/GM 2304/2012, Art. 8º, XI)
XII - utilizar os recursos tecnológicos e equipamentos necessários de acordo com a legislação e normas vigentes; e (Origem: PRT MS/GM 2304/2012, Art. 8º, XII)
XIII - observar os protocolos clínicos recomendados pelo Programa Nacional de Qualidade em Mamografia (PNQM) para a correta prestação dos serviços. (Origem: PRT MS/GM 2304/2012, Art. 8º, XIII)
§ 1º A participação de que trata este artigo não gera vínculo dos estabelecimentos de saúde, inclusive de seus funcionários ou prestadores de serviço, com o Ministério da Saúde ou direito à contratação pelos entes federativos que participarem do Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 8º, § 1º)
§ 2º A Secretaria de Atenção à Saúde (SAS/MS) publicará edital de cadastramento dos estabelecimentos de saúde interessados em participar do Programa Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 8º, § 2º)
Art. 201. Os entes federativos habilitados no Programa de Mamografia Móvel deverão: (Origem: PRT MS/GM 2304/2012, Art. 9º)
I - credenciar e cadastrar cada unidade móvel como estabelecimento de saúde; (Origem: PRT MS/GM 2304/2012, Art. 9º, I)
II - contratualizar e/ou monitorar em todas as suas etapas o projeto sob sua responsabilidade; e (Origem: PRT MS/GM 2304/2012, Art. 9º, II)
III - avaliar o alcance das metas definidas no âmbito do Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 9º, III)
Art. 202. Os procedimentos executados no âmbito do Programa de Mamografia Móvel serão informados pelos entes federativos participantes, conforme estabelecido em Portaria da SAS/MS. (Origem: PRT MS/GM 2304/2012, Art. 10)
Art. 203. Compete à Coordenação-Geral dos Sistemas de Informação (CGSI/DRAC/SAS/MS) providenciar junto ao Departamento de Informática do SUS (DATASUS) as adequações necessárias no Sistema de Informação Ambulatorial (SIA/SUS), ou em outro que vier a substituí-lo, para cumprimento do disposto nesta Subseção. (Origem: PRT MS/GM 2304/2012, Art. 12)
Art. 204. Caberá aos órgãos de controle interno, especialmente à área finalística, sem prejuízo das atribuições dos órgãos de controle externo previstas na legislação vigente, o monitoramento da correta aplicação dos recursos financeiros envolvidos no Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 14)
Art. 205. A SAS/MS adotará as medidas necessárias para o cumprimento do disposto nesta Subseção. (Origem: PRT MS/GM 2304/2012, Art. 15)
Subseção II
Do Programa Nacional de Qualidade em Mamografia (PNQM)
Art. 206. Fica instituído o Programa Nacional de Qualidade em Mamografia (PNQM). (Origem: PRT MS/GM 2898/2013, Art. 1º)
Art. 207. O PNQM tem por objetivo avaliar o desempenho da prestação dos serviços de diagnóstico por imagem que realizam mamografia, com base em critérios e parâmetros referentes à qualidade da estrutura, do processo, dos resultados, da imagem clínica e do laudo. (Origem: PRT MS/GM 2898/2013, Art. 2º)
Art. 208. O PNQM tem abrangência nacional e se aplica a todos os estabelecimentos de saúde públicos e privados que realizam mamografia e que sejam vinculados ou não ao Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2898/2013, Art. 3º)
Art. 209. O PNQM será executado pelo Sistema Nacional de Vigilância Sanitária (SNVS), pela Secretaria de Atenção à Saúde (SAS/MS), pelo Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS/MS) e por todos os serviços de diagnósticos por imagem que realizam mamografia. (Origem: PRT MS/GM 2898/2013, Art. 4º)
Art. 210. Compete à SAS/MS: (Origem: PRT MS/GM 2898/2013, Art. 5º)
I - avaliar e monitorar a implantação e operacionalização do PNQM em todo o território nacional; (Origem: PRT MS/GM 2898/2013, Art. 5º, I)
II - analisar os resultados das avaliações do PNQM; (Origem: PRT MS/GM 2898/2013, Art. 5º, II)
III - divulgar os resultados do PNQM, anualmente, por meio do relatório final, no endereço eletrônico www.saude.gov.br/sas; e (Origem: PRT MS/GM 2898/2013, Art. 5º, III)
IV - monitorar, analisar e disponibilizar as informações referentes aos resultados dos exames mamográficos inseridos no Sistema de Informação do Câncer (SISCAN) pelos serviços de mamografia e dos indicadores de qualidade de que trata o Anexo XXIX . (Origem: PRT MS/GM 2898/2013, Art. 5º, IV)
Art. 211. Compete ao INCA/SAS/MS: (Origem: PRT MS/GM 2898/2013, Art. 6º)
I - coordenar e realizar a avaliação da qualidade das imagens clínicas das mamas e do laudo das mamografias de uma amostra encaminhada trienalmente pelos serviços aprovados pela Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2898/2013, Art. 6º, I)
II - solicitar aos serviços aprovados pela ANVISA o envio da amostra referida no inciso I, quando estes serviços ainda não tiverem enviado imagens clínicas das mamas e laudos para o INCA/SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 6º, II)
III - consolidar, monitorar e disponibilizar as informações referentes à avaliação das análises das imagens e laudos mamográficos; e (Origem: PRT MS/GM 2898/2013, Art. 6º, III)
IV - manter atualizados os dados de qualidade das imagens clínicas e dos laudos das mamografias, por meio do Sistema de Informação da Qualidade da Imagem e Interpretação Diagnóstica (QIID), disponibilizado no endereço eletrônico https://qiid.inca.gov.br, ou em outro sistema de informação definido pelo Ministério da Saúde. (Origem: PRT MS/GM 2898/2013, Art. 6º, IV)
§ 1º A amostra de que trata o inciso I deverá conter 5 (cinco) exames completos (imagem radiográfica e laudo) realizados em sistema digital ou 5 (cinco) incidências para os sistemas convencionais, sendo 2 (duas) incidências em crânio-caudal e 3 (três) incidências em médio-lateral oblíqua. (Origem: PRT MS/GM 2898/2013, Art. 6º, § 1º)
§ 2º É facultado ao INCA/SAS/MS receber o apoio de entidades profissionais e de especialistas que possuam comprovada qualificação técnica a respeito da matéria para realização da avaliação de que trata o inciso I. (Origem: PRT MS/GM 2898/2013, Art. 6º, § 2º)
§ 3º Os Requisitos de Qualidade dos Exames e dos Laudos em Mamografia, que deverão ser utilizados para a avaliação da qualidade da imagem clínica das mamas e dos laudos de mamografia, estão dispostos no Anexo XXVIII . (Origem: PRT MS/GM 2898/2013, Art. 6º, § 3º)
Art. 212. Compete à ANVISA: (Origem: PRT MS/GM 2898/2013, Art. 7º)
I - coordenar a avaliação dos Programas de Garantia da Qualidade (PGQ) dos serviços de diagnóstico por imagem que realizam mamografia; (Origem: PRT MS/GM 2898/2013, Art. 7º, I)
II - consolidar, monitorar e disponibilizar, anualmente, as informações referentes às avaliações dos PGQ realizadas pelo SNVS; (Origem: PRT MS/GM 2898/2013, Art. 7º, II)
III - manter atualizados os dados das análises dos PGQ, por meio do sistema de informação disponibilizado no endereço eletrônico www.mamografia.unifei.edu.br, ou em outro sistema de informação definido pela ANVISA; e (Origem: PRT MS/GM 2898/2013, Art. 7º, III)
IV - credenciar os Centros de Referência de que trata o art. 217. (Origem: PRT MS/GM 2898/2013, Art. 7º, IV)
Art. 213. Compete à Agência Nacional de Saúde Suplementar (ANS) dispor acerca da obrigatoriedade das operadoras de planos de saúde de somente contratar ou manter contratados serviços de diagnóstico por imagem que realizam mamografia que cumpram integralmente o PNQM. (Origem: PRT MS/GM 2898/2013, Art. 8º)
Art. 214. Compete aos gestores estaduais, distrital e municipais: (Origem: PRT MS/GM 2898/2013, Art. 9º)
I - apoiar a organização e a execução do PNQM no seu âmbito de atuação; (Origem: PRT MS/GM 2898/2013, Art. 9º, I)
II - monitorar a implementação do PNQM nos prestadores de serviço de diagnóstico por imagem que realizam mamografia; (Origem: PRT MS/GM 2898/2013, Art. 9º, II)
III - estimular e priorizar as visitas anuais das vigilâncias sanitárias estaduais, distrital e municipais nos serviços de diagnóstico por imagem que realizam mamografia visando o cumprimento do PGQ; e (Origem: PRT MS/GM 2898/2013, Art. 9º, III)
IV - monitorar os indicadores de que trata Anexo XXIX . (Origem: PRT MS/GM 2898/2013, Art. 9º, IV)
Parágrafo Único. Para fins do disposto no inciso III, as vigilâncias sanitárias estaduais, distrital e municipais poderão, eventualmente, contar com o apoio técnico dos Centros de Referência de que trata o art. 217. (Origem: PRT MS/GM 2898/2013, Art. 9º, Parágrafo Único)
Art. 215. Compete às vigilâncias sanitárias estaduais, distrital e municipais: (Origem: PRT MS/GM 2898/2013, Art. 10)
I - preencher os formulários constantes dos Anexos XXVI e XXVII ; e (Origem: PRT MS/GM 2898/2013, Art. 10, I)
II - avaliar os relatórios do PGQ, sendo-lhes facultado o apoio técnico pelos Centros de Referência de que trata o art. 217. (Origem: PRT MS/GM 2898/2013, Art. 10, II)
Parágrafo Único. O preenchimento de que trata o inciso I será realizado "in loco" e, pelo menos, uma vez ao ano. (Origem: PRT MS/GM 2898/2013, Art. 10, Parágrafo Único)
Art. 216. Compete aos serviços de diagnóstico por imagem que realizam mamografia, públicos e privados, participantes ou não do SUS: (Origem: PRT MS/GM 2898/2013, Art. 11)
I - participar do PNQM; (Origem: PRT MS/GM 2898/2013, Art. 11, I)
II - inserir no SISCAN ou no sistema de informação vigente definido pelo Ministério da Saúde as informações sobre os exames mamográficos realizados; (Origem: PRT MS/GM 2898/2013, Art. 11, II)
III - enviar anualmente ao órgão de vigilância sanitária competente o relatório do PGQ definido na legislação sanitária vigente, contemplando todos os testes de aceitação, constância e desempenho realizados no período; e (Origem: PRT MS/GM 2898/2013, Art. 11, III)
IV - enviar trienalmente para o INCA/SAS/MS uma amostra de exames para a análise de que trata o art. 211, I. (Origem: PRT MS/GM 2898/2013, Art. 11, IV)
Parágrafo Único. Os serviços de diagnóstico por imagem que realizam mamografia que não sejam participantes do SUS disporão de procedimento simplificado no SISCAN ou no sistema de informação vigente para a inserção das informações sobre os exames mamográficos realizados mensalmente. (Origem: PRT MS/GM 2898/2013, Art. 11, Parágrafo Único)
Art. 217. Poderão ser credenciadas como Centros de Referência as entidades que atendam aos seguintes critérios: (Origem: PRT MS/GM 2898/2013, Art. 12)
I - ser instituição pública de ensino e pesquisa ou entidade profissional ou de especialistas; (Origem: PRT MS/GM 2898/2013, Art. 12, I)
II - ter comprovada qualificação técnica reconhecida; e (Origem: PRT MS/GM 2898/2013, Art. 12, II)
III - ser indicado para habilitação pelo gestor estadual e pactuação na Comissão Intergestores Bipartite (CIB). (Origem: PRT MS/GM 2898/2013, Art. 12, III)
Art. 218. O PNQM contará com um Comitê de Avaliação constituído por 5 (cinco) membros, sendo: (Origem: PRT MS/GM 2898/2013, Art. 13)
I - 1 (um) da SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 13, I)
II - 1 (um) do INCA/SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 13, II)
III - 1 (um) da ANVISA; (Origem: PRT MS/GM 2898/2013, Art. 13, III)
IV - 1 (um) da ANS; e (Origem: PRT MS/GM 2898/2013, Art. 13, IV)
V - 1 (um) do Comitê de Especialistas para o fortalecimento das ações de prevenção e qualificação do diagnóstico e tratamento dos cânceres do colo do útero e de mama, instituído pela Portaria nº 1.472/GM/MS, de 24 de junho de 2011, cuja indicação deve ser feita consensualmente pelo Comitê de Especialistas. (Origem: PRT MS/GM 2898/2013, Art. 13, V)
§ 1º O Comitê de Avaliação do PNQM será coordenado pela SAS/MS, que fornecerá o apoio técnico-administrativo necessário ao funcionamento do Comitê. (Origem: PRT MS/GM 2898/2013, Art. 13, § 1º)
§ 2º Os membros do Comitê de Avaliação do PNQM serão indicados pelos respectivos órgãos ou entidades à SAS/MS e serão designados por meio de ato do Secretário da SAS/MS. (Origem: PRT MS/GM 2898/2013, Art. 13, § 2º)
§ 3º Para cada membro titular será indicado um membro suplente. (Origem: PRT MS/GM 2898/2013, Art. 13, § 3º)
§ 4º Compete ao Comitê de Avaliação do PNQM sugerir melhorias no processo de implantação e operacionalização do PNQM. (Origem: PRT MS/GM 2898/2013, Art. 13, § 4º)
§ 5º A regulamentação do funcionamento do Comitê de Avaliação se dará por meio da publicação de Regimento Interno. (Origem: PRT MS/GM 2898/2013, Art. 13, § 5º)
Art. 219. Para a realização da avaliação da qualidade dos serviços de diagnóstico por imagem que realizam mamografia será observado o seguinte fluxo: (Origem: PRT MS/GM 2898/2013, Art. 14)
I - as vigilâncias sanitárias estaduais, distrital ou municipais ou Centros de Referência preencherão os formulários de avaliação do PGQ, disponíveis nos Anexos XXVI e XXVII , e os enviarão para a ANVISA; (Origem: PRT MS/GM 2898/2013, Art. 14, I)
II - a ANVISA elaborará o relatório com a consolidação dos dados captados por meio dos formulários, indicando os serviços cujas imagens e laudos serão avaliados e enviará, mensalmente, à SAS/MS e ao INCA/SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 14, II)
III - o INCA/SAS/MS coordenará e realizará a avaliação das imagens clínicas e dos laudos dos serviços aprovados pela ANVISA; (Origem: PRT MS/GM 2898/2013, Art. 14, III)
IV - o INCA/SAS/MS enviará, mensalmente, à SAS/MS, relatório consolidado da avaliação das imagens clínicas e dos laudos; (Origem: PRT MS/GM 2898/2013, Art. 14, IV)
V - a SAS/MS analisará os resultados da avaliação do PGQ e da qualidade das imagens clínicas e laudos e elaborará o relatório final referente à avaliação dos serviços; (Origem: PRT MS/GM 2898/2013, Art. 14, V)
VI - a SAS/MS encaminhará o relatório final para a ANVISA e para o INCA/SAS/MS para ciência; e (Origem: PRT MS/GM 2898/2013, Art. 14, VI)
VII - a SAS/MS disponibilizará, anualmente, o relatório final no endereço eletrônicos www.saude.gov.br/sas. (Origem: PRT MS/GM 2898/2013, Art. 14, VII)
Art. 220. Os serviços de diagnóstico por imagem que realizam mamografia serão avaliados continuamente, e o resultado da avaliação será disponibilizado anualmente no endereço eletrônico www.saude.gov.br/sas. (Origem: PRT MS/GM 2898/2013, Art. 15)
Art. 221. Representantes das vigilâncias sanitárias estaduais, distrital e municipais, da ANVISA, do INCA/SAS/MS e da SAS/MS poderão realizar visitas "in loco" nos serviços de diagnóstico por imagem que realizam mamografia abrangidos pelo PNQM para: (Origem: PRT MS/GM 2898/2013, Art. 16)
I - realização de testes de desempenho do equipamento; e (Origem: PRT MS/GM 2898/2013, Art. 16, I)
II - orientação quanto à execução do PGQ dos serviços e dos procedimentos que garantam uma imagem clínica de qualidade. (Origem: PRT MS/GM 2898/2013, Art. 16, II)
Art. 222. A avaliação e o monitoramento do PNQM incluem a análise do processo de sua implantação em todo o território nacional e a análise dos resultados referentes à qualidade dos serviços de diagnóstico por imagem que realizam mamografia. (Origem: PRT MS/GM 2898/2013, Art. 17)
Parágrafo Único. O monitoramento dos resultados referentes à qualidade do exame mamográfico inclui a adoção dos indicadores de que trata o Anexo XXIX . (Origem: PRT MS/GM 2898/2013, Art. 17, Parágrafo Único)
Art. 223. A avaliação e o monitoramento do PNQM serão realizados pela SAS/MS, anualmente, a partir das informações fornecidas e pela ANVISA e pelo INCA/SAS/MS no exercício das atribuições de que trata esta Subseção, sendo que a validade da avaliação pela ANVISA é anual e a do INCA trienal. (Origem: PRT MS/GM 2898/2013, Art. 18)
Art. 224. O serviço de diagnóstico por imagem que realiza mamografia será considerado aprovado pelo PNQM se demonstrar o cumprimento dos critérios de aprovação relativos ao PGQ e à qualidade da imagem clínica e laudo, definidos nos Anexos XXVI e XXVII . (Origem: PRT MS/GM 2898/2013, Art. 19)
Seção III
Do Programa Nacional de Combate ao Câncer de Colo Uterino
Art. 225. Ficam aprovadas as Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero. (Origem: PRT MS/GM 2508/2011, Art. 1º)
Parágrafo Único. As Diretrizes de que trata o caput deste artigo estão consubstanciadas na obra "Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero", do Instituto Nacional de Câncer, ano 2011, ISBN 978-85-7318-184-5. (Origem: PRT MS/GM 2508/2011, Art. 1º, Parágrafo Único)
Art. 226. A obra de que trata esta Seção constitui-se o documento oficial adotado pelo Ministério da Saúde para o rastreamento do câncer do colo do útero no território nacional. (Origem: PRT MS/GM 2508/2011, Art. 2º)
Art. 227. A obra "Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero" ficará disponível no portal do Ministério da Saúde, no endereço eletrônico http://bvsms.saude.gov.br/bvs/publicacoes/inca/rastreamento_cancer_colo_utero.pdf. (Origem: PRT MS/GM 2508/2011, Art. 3º)
Art. 228. Findo o prazo definido pelo art. 149 do Anexo IV da Portaria de Consolidação nº 3, o financiamento do procedimento 02.03.01.008-6 - EXAME CITOPATOLÓGICO CERVICO VAGINAL/MICROFLORA-RASTREAMENTO continuará a ser via Fundo de Ações Estratégicas e Compensação (FAEC). (Origem: PRT MS/GM 613/2017, Art. 3º)
CAPÍTULO IV
DO PROGRAMA DE CONTROLE DE PÊNFIGO FOLIÁCEO ENDÊMICO
Art. 229. Ficam expedidas as instruções normativas para diagnóstico, tratamento e controle do Pênfigo Foliáceo Endêmico (fogo selvagem), na forma do Anexo XXX . (Origem: PRT MS/GM 1400/1991, Art. 1º)
CAPÍTULO V
DAS AÇÕES E SERVIÇOS DE SAÚDE VOLTADOS PARA VIGILÂNCIA, PREVENÇÃO E CONTROLE DE ZOONOSES E DE ACIDENTES CAUSADOS POR ANIMAIS PEÇONHENTOS E VENENOSOS, DE RELEVÂNCIA PARA A SAÚDE PÚBLICA
Seção I
Disposições Gerais
Art. 230. Esta Seção define as ações e os serviços de saúde voltados para vigilância, prevenção e controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública. (Origem: PRT MS/GM 1138/2014, Art. 1º)
Art. 231. Para fins desta Seção, considera-se animais de relevância para a saúde pública todo aquele que se apresenta como: (Origem: PRT MS/GM 1138/2014, Art. 2º)
I - vetor, hospedeiro, reservatório, portador, amplificador ou suspeito para alguma zoonose de relevância para a saúde pública, quanto à transmissão de agente etiológico para humanos; (Origem: PRT MS/GM 1138/2014, Art. 2º, I)
II - suscetível para alguma zoonose de relevância para a saúde pública, quando em situações de risco quanto à transmissão de agente etiológico para humanos; (Origem: PRT MS/GM 1138/2014, Art. 2º, II)
III - venenoso ou peçonhento de relevância para a saúde pública; ou (Origem: PRT MS/GM 1138/2014, Art. 2º, III)
IV - causador de agravo que represente risco de transmissão de doença para a população humana. (Origem: PRT MS/GM 1138/2014, Art. 2º, IV)
Art. 232. São consideradas ações e serviços públicos de saúde voltados para a vigilância, a prevenção e o controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública: (Origem: PRT MS/GM 1138/2014, Art. 3º)
I - desenvolvimento e execução de atividades, ações e estratégias relacionadas a animais de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, I)
II - desenvolvimento e execução de ações, atividades e estratégias de educação em saúde visando à guarda ou à posse responsável de animais para a prevenção das zoonoses; (Origem: PRT MS/GM 1138/2014, Art. 3º, II)
III - coordenação, execução e avaliação das ações de vacinação animal contra zoonoses de relevância para a saúde pública, normatizadas pelo Ministério da Saúde, bem como notificação e investigação de eventos adversos temporalmente associados a essas vacinações; (Origem: PRT MS/GM 1138/2014, Art. 3º, III)
IV - realização de diagnóstico laboratorial de zoonoses e identificação das espécies de animais, de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, IV)
V - recomendação e adoção de medidas de biossegurança que impeçam ou minimizem o risco de transmissão de zoonoses e da ocorrência de acidentes causados por animais peçonhentos e venenosos relacionados à execução das atividades de vigilância de zoonoses dispostas neste artigo; (Origem: PRT MS/GM 1138/2014, Art. 3º, V)
VI - desenvolvimento e execução de ações, atividades e estratégias de controle da população de animais, que devam ser executadas em situações excepcionais, em áreas determinadas, por tempo definido, para o controle da propagação de zoonoses de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, VI)
VII - coleta, recebimento, acondicionamento, conservação e transporte de espécimes ou amostras biológicas de animais para encaminhamento aos laboratórios, com vistas à identificação ou diagnóstico laboratorial de zoonoses de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, VII)
VIII - gerenciamento de resíduos de serviços de saúde gerados pelas ações de vigilância de zoonoses de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, VIII)
IX - eutanásia, quando indicado, de animais de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, IX)
X - recolhimento e transporte de animais, quando couber, de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, X)
XI - recepção de animais vivos e de cadáveres de animais quando forem de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, XI)
XII - manutenção e cuidados básicos de animais recolhidos em estabelecimento responsável por vigilância de zoonoses pertencente ao Sistema Único de Saúde (SUS), observando normatização vigente quanto aos prazos estipulados de permanência do animal, quando houver; (Origem: PRT MS/GM 1138/2014, Art. 3º, XII)
XIII - destinação adequada dos animais recolhidos; e (Origem: PRT MS/GM 1138/2014, Art. 3º, XIII)
XIV - investigação, por meio de necropsia, coleta e encaminhamento de amostras laboratoriais ou outros procedimentos pertinentes, de morte de animais suspeitos de zoonoses de relevância para saúde pública. (Origem: PRT MS/GM 1138/2014, Art. 3º, XIV)
Art. 233. Os estabelecimentos responsáveis por vigilância de zoonoses pertencentes ao SUS e os serviços voltados para a vigilância, a prevenção e o controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para saúde pública, deverão ser inscritos no Sistema de Cadastro Nacional de Estabelecimento de Saúde (SCNES), utilizando critérios de cadastramento que serão regulamentados em portaria específica do Secretário de Vigilância em Saúde do Ministério da Saúde. (Origem: PRT MS/GM 1138/2014, Art. 4º)
§ 1º Os estabelecimentos de que trata o "caput" têm por objetivos: (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
I - gerais: realizar ações, atividades e estratégias de vigilância, de prevenção, de controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública; e (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
II - específicos: realizar ações, atividades e estratégias de: (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
a) vigilância, de forma contínua e sistemática, de populações de animais potencialmente ou sabidamente de relevância para a saúde pública; (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
b) prevenção, de forma sistemática, de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública; e (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
c) controle, quando pertinente e necessário, de animais peçonhentos, venenosos, vetores, hospedeiros, reservatórios, amplificadores, portadores, suspeitos ou suscetíveis às zoonoses, quando estes forem de relevância para a saúde pública (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
§ 2º Os estabelecimentos responsáveis por vigilância de zoonoses pertencentes ao SUS deverão observar o Manual de Normas Técnicas para Estruturas Físicas de Unidades de Vigilância de Zoonoses, disponível no endereço eletrônico www.saude.gov.br/svs (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
Art. 234. As ações e os serviços de saúde voltados para a vigilância, a prevenção e o controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para saúde pública, serão financiadas com os recursos do Piso Fixo de Vigilância em Saúde (PFVS), bem como com recursos próprios dos Estados, do Distrito Federal e dos Municípios, observando-se as disposições contidas na legislação vigente. (Origem: PRT MS/GM 1138/2014, Art. 5º)
Art. 235. As ações de vigilância, prevenção e controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para saúde pública, deverão ser inseridas na Programação Anual de Saúde (PAS), observadas as diretrizes constantes nos Planos de Saúde. (Origem: PRT MS/GM 1138/2014, Art. 6º)
Art. 236. Os demonstrativos das ações e resultados alcançados comporão o Relatório Anual de Gestão (RAG), submetido ao respectivo Conselho de Saúde. (Origem: PRT MS/GM 1138/2014, Art. 7º)
Art. 237. A Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS) editará normatização técnica complementar esta Seção. (Origem: PRT MS/GM 1138/2014, Art. 8º)
Seção II
Das Atribuições do Agente Comunitário de Saúde (ACS)
Art. 238. Ficam definidas as atribuições do Agente Comunitário de Saúde (ACS) na prevenção e no controle da malária e da dengue. (Origem: PRT MS/GM 44/2002, Art. 1º)
Art. 239. São atribuições do ACS na prevenção e controle da malária: (Origem: PRT MS/GM 44/2002, Art. 2º)
I - em zona urbana: (Origem: PRT MS/GM 44/2002, Art. 2º, I)
a) realizar ações de educação em saúde e de mobilização social; (Origem: PRT MS/GM 44/2002, Art. 2º, I, a)
b) orientar o uso de medidas de proteção individual e coletiva; (Origem: PRT MS/GM 44/2002, Art. 2º, I, b)
c) mobilizar a comunidade para desenvolver medidas simples de manejo ambiental para o controle de vetores; (Origem: PRT MS/GM 44/2002, Art. 2º, I, c)
d) identificar sintomas da malária e encaminhar o paciente à unidade de saúde para diagnóstico e tratamento; (Origem: PRT MS/GM 44/2002, Art. 2º, I, d)
e) promover o acompanhamento dos pacientes em tratamento, ressaltando a importância de sua conclusão; (Origem: PRT MS/GM 44/2002, Art. 2º, I, e)
f) investigar a existência de casos na comunidade, a partir de sintomático; (Origem: PRT MS/GM 44/2002, Art. 2º, I, f)
g) preencher e encaminhar à Secretaria Municipal de Saúde a ficha de notificação dos casos ocorridos. (Origem: PRT MS/GM 44/2002, Art. 2º, I, g)
II - em área rural, além das atribuições relacionadas no item I deste artigo: (Origem: PRT MS/GM 44/2002, Art. 2º, II)
a) proceder à aplicação de imunotestes, conforme orientação da coordenação municipal do Pacs e PSF; (Origem: PRT MS/GM 44/2002, Art. 2º, II, a)
b) coletar lâminas de sintomáticos e enviá-las para leitura ao profissional responsável e, quando não for possível esta coleta de lâmina, encaminhar as pessoas para a unidade de referência; (Origem: PRT MS/GM 44/2002, Art. 2º, II, b)
c) receber o resultado dos exames e providenciar o acesso ao tratamento imediato e adequado, de acordo com as orientações da Secretaria Municipal de Saúde da Fundação Nacional de Saúde (FUNASA); (Origem: PRT MS/GM 44/2002, Art. 2º, II, c)
d) coletar lâmina para verificação de cura (LVC), após conclusão do tratamento, e encaminhá-la para leitura, de acordo com a estratégia local; (Origem: PRT MS/GM 44/2002, Art. 2º, II, d)
Art. 240. São atribuições do ACS na prevenção e no controle da dengue: (Origem: PRT MS/GM 44/2002, Art. 3º)
I - atuar junto aos domicílios informando os seus moradores sobre a doença - seus sintomas e riscos - e o agente transmissor; (Origem: PRT MS/GM 44/2002, Art. 3º, a)
II - informar o morador sobre a importância da verificação da existência de larvas ou mosquitos transmissores da dengue na casa ou redondezas; (Origem: PRT MS/GM 44/2002, Art. 3º, b)
III - vistoriar os cômodos da casa, acompanhado pelo morador, para identificar locais de existência de larvas ou mosquito transmissor da dengue; (Origem: PRT MS/GM 44/2002, Art. 3º, c)
IV - orientar a população sobre a forma de evitar e eliminar locais que possam oferecer risco para a formação de criadouros do Aedes aegypti; (Origem: PRT MS/GM 44/2002, Art. 3º, d)
V - promover reuniões com a comunidade para mobilizá-la para as ações de prevenção e controle da dengue; (Origem: PRT MS/GM 44/2002, Art. 3º, e)
VI - comunicar ao instrutor supervisor do Pacs/PSF a existência de criadouros de larvas e ou mosquitos transmissor da dengue, que dependam de tratamento químico, da interveniência da vigilância sanitária ou de outras intervenções do poder público; (Origem: PRT MS/GM 44/2002, Art. 3º, f)
VII - encaminhar os casos suspeitos de dengue à unidade de saúde mais próxima, de acordo com as orientações da Secretaria Municipal de Saúde; (Origem: PRT MS/GM 44/2002, Art. 3º, g)
CAPÍTULO VI
DO PLANO NACIONAL DE CONTENÇÃO DO POLIOVÍRUS
Seção I
Do Processo de Contenção Definitiva do Poliovírus Selvagem e Vacinal
Art. 241. Esta Seção dispõe sobre o preenchimento do Inquérito Nacional do poliovírus pelos laboratórios, públicos e privados, visando ao cumprimento do processo de contenção definitiva do poliovírus selvagem e vacinal. (Origem: PRT MS/GM 451/2017, Art. 1º)
Art. 242. Os laboratórios públicos e privados que atuam na área da saúde, educação, defesa, meio ambiente, agricultura, pesquisa e outras, bem como os laboratórios sediados em indústrias, deverão responder o Inquérito nacional do poliovírus contido no link: http://formsus.datasus.gov.br/site/formulario.php?id_aplicacao=23898. (Origem: PRT MS/GM 451/2017, Art. 2º)
Art. 243. Para os efeitos desta Portaria entende-se por: (Origem: PRT MS/GM 451/2017, Art. 3º)
I - materiais infectantes para poliovírus selvagem ou vacinal: materiais clínicos de casos confirmados de infecção por poliovírus selvagem e VDPV (Poliovirus Derivado da Vacina), amostras ambientais com água de esgoto ou in natura em que esses vírus estejam presentes, e produtos de replicação desses vírus, incluindo: (Origem: PRT MS/GM 451/2017, Art. 3º, I)
a) poliovírus isolados em cultivos celulares, cepas de referência, cepas para vacinas inativadas; (Origem: PRT MS/GM 451/2017, Art. 3º, I, a)
b) animais infectados com poliovírus ou materiais clínicos oriundos desses animais; (Origem: PRT MS/GM 451/2017, Art. 3º, I, b)
c) produtos de pesquisa em laboratório que possam conter as sequências do capsídeo do poliovírus selvagem; (Origem: PRT MS/GM 451/2017, Art. 3º, I, c)
d) estrutura total do RNA ou DNA que contêm sequências de capsídeos derivadas de poliovírus selvagem; e (Origem: PRT MS/GM 451/2017, Art. 3º, I, d)
e) células continuamente infectadas com cepas de poliovírus, cujas sequências do capsídeo derivam de poliovírus selvagem. (Origem: PRT MS/GM 451/2017, Art. 3º, I, e)
II - materiais potencialmente infectantes para poliovírus selvagem ou vacinal: (Origem: PRT MS/GM 451/2017, Art. 3º, II)
a) amostras de fezes ou secreções respiratórias coletadas para qualquer finalidade em uma área geográfica de circulação do poliovírus selvagem (incluindo VDPV) ou de uso da OPV (Vacina Oral da Polio); (Origem: PRT MS/GM 451/2017, Art. 3º, II, a)
b) produtos destes materiais em animais ou células permissivas para o poliovírus; (Origem: PRT MS/GM 451/2017, Art. 3º, II, b)
c) isolamentos de culturas de células semelhantes a enterovírus descaracterizados em países onde se sabe ou se suspeita da circulação do poliovírus selvagem ou VDPV no momento da coleta; (Origem: PRT MS/GM 451/2017, Art. 3º, II, c)
d) estoques de vírus entéricos e respiratórios manipulados em condições onde a replicação de poliovírus ou a contaminação é possível. (Origem: PRT MS/GM 451/2017, Art. 3º, II, d)
Art. 244. Caberá aos laboratórios que armazenam amostras de materiais infectantes e potencialmente infectantes para poliovírus selvagem e vacinal, a destruição, a contenção ou a transferência desses materiais para instalação essencial. (Origem: PRT MS/GM 451/2017, Art. 4º)
Parágrafo Único. Os laboratórios que optarem por conter as amostras infectantes e potencialmente infectantes para poliovirus selvagem e vacinal deverão cumprir com critérios de instalação essencial para poliovírus. (Origem: PRT MS/GM 451/2017, Art. 4º, Parágrafo Único)
Art. 245. Para fins desta Seção, instalação essencial para poliovírus são os laboratórios que cumprem com todos os critérios estabelecidos pelo Plano de Ação Global da Poliomielite - Documento GAP III, de acordo com a certificação dada pelas autoridades nacional ou internacional. (Origem: PRT MS/GM 451/2017, Art. 5º)
Art. 246. O descumprimento das disposições contidas nesta Seção constitui infração sanitária, nos termos da Lei nº 6.437, de 20 de agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e penal cabíveis. (Origem: PRT MS/GM 451/2017, Art. 6º)
Seção II
Do Comitê Técnico para Contenção de Poliovírus em Laboratórios Brasileiros
Art. 247. Fica instituído o Comitê Técnico para contenção de Poliovírus em Laboratórios brasileiros com a finalidade de assessorar a Secretaria de Vigilância em Saúde na implementação do Plano Nacional de Contenção do Poliovírus. (Origem: PRT MS/GM 1398/2008, Art. 1º)
Art. 248. Compete ao Comitê Técnico: (Origem: PRT MS/GM 1398/2008, Art. 2º)
I - assessorar a Secretaria de Vigilância em Saúde na implementação do Plano Nacional de Contenção de Poliovírus Selvagem nos Laboratórios; (Origem: PRT MS/GM 1398/2008, Art. 2º, I)
II - verificar e avaliar a informação recebida das instituições e laboratórios; (Origem: PRT MS/GM 1398/2008, Art. 2º, II)
III - realizar o inventário de laboratório contendo poliovírus ou material potencialmente infectante: (Origem: PRT MS/GM 1398/2008, Art. 2º, III)
a) são considerados materiais potencialmente infectantes para o poliovírus: fezes, secreções de orofaringe e amostras de águas de esgoto ou in natura, de origens desconhecidas, ou coletadas para qualquer finalidade no Brasil, ou demais países da América Latina, até 1991, em regiões onde se suspeitava da presença dos poliovírus selvagens ou PVDV; e (Origem: PRT MS/GM 1398/2008, Art. 2º, III, a)
b) estão também incluídos nesta categoria os cultivos virais ainda não testados para poliovírus e/ou enterovírus isolados em cultivos celulares possuindo características de enterovírus; e cepas de poliovírus não diferenciadas; (Origem: PRT MS/GM 1398/2008, Art. 2º, III, b)
IV - identificar mecanismos e realizar atividades para captação de informações de instituições e laboratórios que não responderem ao inquérito no prazo estipulado pelo Plano Nacional; (Origem: PRT MS/GM 1398/2008, Art. 2º, IV)
V - elaborar informes periódicos do progresso das atividades de contenção do poliovírus em laboratórios à Comissão de Certificação Regional; (Origem: PRT MS/GM 1398/2008, Art. 2º, V)
VI - planejamento de atividades de destinação final de materiais identificados no inventário; e (Origem: PRT MS/GM 1398/2008, Art. 2º, VI)
VII - aprovar o relatório de progressos e relatórios finais do processo de contenção a ser apresentados para a Comissão Global de Avaliação do Processo de Erradicação da Poliomielite. (Origem: PRT MS/GM 1398/2008, Art. 2º, VII)
Art. 249. O Comitê Técnico será composto por um representante titular e um suplente, designados por ato especifico do Ministro da Saúde, de cada órgão e entidade do setor público e privado a seguir indicados: (Origem: PRT MS/GM 1398/2008, Art. 3º)
I - Secretaria de Vigilância em Saúde (SVS/MS): (Origem: PRT MS/GM 1398/2008, Art. 3º, I)
a) Departamento de Vigilância das Doenças Transmissíveis (DEVIT/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, a)
b) Coordenação-Geral de Laboratórios de Saúde Pública (CGLAB/DEGEVS/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, b)
c) Coordenação-Geral do Programa Nacional de Imunizações (CGPNI/DEVIT/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, c)
d) Coordenação-Geral de Doenças Transmissíveis (CGDT/DEVIT/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, d)
II - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS): (Origem: PRT MS/GM 1398/2008, Art. 3º, II)
a) Departamento de Ciência e Tecnologia (DECIT/SCTIE/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, II, a)
III - Fundação Oswaldo Cruz (FIOCRUZ): (Origem: PRT MS/GM 1398/2008, Art. 3º, III)
a) Departamento de Virologia; (Origem: PRT MS/GM 1398/2008, Art. 3º, III, a)
b) Instituto de Tecnologia em Imunobiológicos (Biomanguinhos); (Origem: PRT MS/GM 1398/2008, Art. 3º, III, b)
IV - Sociedade Brasileira de Infectologia; (Origem: PRT MS/GM 1398/2008, Art. 3º, IV)
V - Sociedade Brasileira de Virologia; (Origem: PRT MS/GM 1398/2008, Art. 3º, V)
VI - Sociedade Brasileira de Patologia Clínica; (Origem: PRT MS/GM 1398/2008, Art. 3º, VI)
VII - Sociedade Brasileira de Análises Clínicas; (Origem: PRT MS/GM 1398/2008, Art. 3º, VII)
VIII - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1398/2008, Art. 3º, VIII)
IX - Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 1398/2008, Art. 3º, IX)
X - Conselho Nacional de Secretários Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 1398/2008, Art. 3º, X)
Parágrafo Único. Sempre que necessário, o Comitê convidará, para participar das reuniões, representantes de órgãos e entidades com a finalidade de contribuir no desenvolvimento e aprimoramento dos trabalhos. (Origem: PRT MS/GM 1398/2008, Art. 3º, Parágrafo Único)
Art. 250. Os membros deverão declarar a inexistência de conflito de interesses com suas atividades no debate dos temas pertinentes ao Comitê, sendo que na eventualidade de existência de conflito de interesses, os mesmos deverão abster-se de participar da discussão e deliberação do tema. (Origem: PRT MS/GM 1398/2008, Art. 4º)
Art. 251. O Comitê Técnico será coordenado pelo Diretor do Departamento de Vigilância das Doenças Transmissíveis (DEVIT/SVS/MS) ou seu substituto, que terá as seguintes competências: (Origem: PRT MS/GM 1398/2008, Art. 5º)
I - coordenar as reuniões do Comitê; (Origem: PRT MS/GM 1398/2008, Art. 5º, I)
II - indicar um técnico da área para desenvolver atividades necessárias ao funcionamento do Comitê; (Origem: PRT MS/GM 1398/2008, Art. 5º, II)
III - encaminhar atas e relatórios para apreciação do Secretário de Vigilância em Saúde; (Origem: PRT MS/GM 1398/2008, Art. 5º, III)
IV - submeter à apreciação e aprovação do Secretário de Vigilância em Saúde as recomendações do comitê. (Origem: PRT MS/GM 1398/2008, Art. 5º, IV)
Art. 252. Aos membros do Comitê Técnico competirá: (Origem: PRT MS/GM 1398/2008, Art. 6º)
I - participar das reuniões ordinárias e extraordinárias do Comitê; (Origem: PRT MS/GM 1398/2008, Art. 6º, I)
II - identificar, analisar e apresentar materiais técnicos, bem como discutir e deliberar as matérias submetidas ao Comitê; (Origem: PRT MS/GM 1398/2008, Art. 6º, II)
III - propor ao Coordenador, com antecedência mínima de 10 (dez) dias, a convocação de reuniões extraordinárias, com objetivo de tratar de assuntos relevantes ou de urgência, que não possam aguardar a realização da reunião ordinária; e (Origem: PRT MS/GM 1398/2008, Art. 6º, III)
IV - indicar ao Coordenador, quando pertinente e relevante, pessoas ou representantes de entidades públicas ou privadas, a fim de compor grupos técnicos para temas específicos. (Origem: PRT MS/GM 1398/2008, Art. 6º, IV)
Art. 253. O Comitê Técnico reunir-se-á ordinariamente a cada seis meses ou extraordinariamente quando convocado pelo seu Coordenador, sendo que suas reuniões serão realizadas somente com a presença de, no mínimo, cinquenta por cento dos seus membros. (Origem: PRT MS/GM 1398/2008, Art. 7º)
§ 1º Os membros poderão deixar de integrá-lo a qualquer tempo a pedido do membro integrante, mediante formalização da solicitação de desligamento feita pelo Coordenador do Comitê ao Secretário de Vigilância em Saúde. (Origem: PRT MS/GM 1398/2008, Art. 7º, § 1º)
§ 2º Será desligado de suas funções o membro que, sem motivo justificado, deixar de comparecer a duas reuniões consecutivas. (Origem: PRT MS/GM 1398/2008, Art. 7º, § 2º)
Art. 254. As reuniões ordinárias e extraordinárias serão realizadas no Ministério da Saúde, situado em Brasília-DF, ou em local a ser definido por decisão do coordenador. (Origem: PRT MS/GM 1398/2008, Art. 8º)
Parágrafo Único. A decisão do coordenador que determinar a ocorrência de reuniões em local distinto do Ministério da Saúde, situado em Brasília-DF, deve ser devidamente motivada, incluindo entre seus argumentos os fatos e fundamentos que comprovam a impossibilidade de realização da reunião em Brasília-DF, com necessidade de aprovação dessa decisão pelo Secretário de Vigilância em Saúde (SVS/MS) ou por autoridade e ele hierarquicamente superior. (Origem: PRT MS/GM 1398/2008, Art. 8º, Parágrafo Único)
Art. 255. As funções dos membros do Comitê Técnico não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1398/2008, Art. 9º)
CAPÍTULO VII
DO DIAGNÓSTICO E TRATAMENTO E CONTROLE DA LEISHMANIOSE TEGUMENTAR AMERICANA
Art. 256. Ficam expedidas instruções normativas para diagnóstico e tratamento e controle da Leishmaniose Tegumentar Americana, na forma do Anexo XXXII . (Origem: PRT MS/GM 1402/1991, Art. 1º)
CAPÍTULO VIII
DO PROGRAMA NACIONAL DE CONTROLE DA DENGUE (PNCD) E SEU COMITÊ TÉCNICO DE ACOMPANHAMENTO E ASSESSORAMENTO
Art. 257. Fica instituído o Programa Nacional de Controle da Dengue (PNCD), com as seguintes diretrizes: (Origem: PRT MS/GM 1933/2003, Art. 1º)
I - desenvolver campanhas de informação e de mobilização das pessoas, de maneira a criar-se uma maior responsabilização de cada família na manutenção de seu ambiente doméstico livre de potenciais criadouros do vetor; (Origem: PRT MS/GM 1933/2003, Art. 1º, I)
II - fortalecer a vigilância epidemiológica e entomológica para ampliar a capacidade de predição e de detecção precoce de surtos da doença; (Origem: PRT MS/GM 1933/2003, Art. 1º, II)
III - melhorar a qualidade do trabalho de campo de combate ao vetor; (Origem: PRT MS/GM 1933/2003, Art. 1º, III)
IV - integrar as ações de controle da dengue na atenção básica, com a mobilização do Programa de Agentes Comunitários de Saúde e Programa de Saúde da Família; (Origem: PRT MS/GM 1933/2003, Art. 1º, IV)
V - utilizar instrumentos legais que facilitem o trabalho do poder público na eliminação de criadouros em imóveis comerciais, casas abandonadas, dentre outros; (Origem: PRT MS/GM 1933/2003, Art. 1º, V)
VI - atuar multisetorialmente por meio do fomento à destinação adequada de resíduos sólidos e a utilização de recipientes seguros para armazenagem de água; (Origem: PRT MS/GM 1933/2003, Art. 1º, VI)
VII - desenvolver instrumentos mais eficazes de acompanhamento e supervisão das ações desenvolvidas pelo Ministério da Saúde, Estados e Municípios. (Origem: PRT MS/GM 1933/2003, Art. 1º, VI-A)
Art. 258. Fica criado o Comitê Técnico de Acompanhamento e Assessoramento do PNCD com a finalidade de coordenar a implementação, em nível nacional, das ações previstas no Programa Nacional de Controle da Dengue. (Origem: PRT MS/GM 1933/2003, Art. 2º)
Parágrafo Único. O Comitê Técnico de que trata o caput deste artigo será coordenado pela Secretaria de Vigilância em Saúde e contará com representantes da Secretaria de Atenção à Saúde/MS, da Secretaria de Gestão do Trabalho e da Educação na Saúde/MS, da Secretaria de Ciência, Tecnologia e Insumos Estratégicos/MS, da Agência Nacional de Vigilância Sanitária (ANVISA) e da Agência Nacional de Saúde Suplementar (ANS). (Origem: PRT MS/GM 1933/2003, Art. 2º, Parágrafo Único)
Art. 259. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, editar normas regulamentadoras deste Capítulo. (Origem: PRT MS/GM 1933/2003, Art. 3º)
Seção I
Do Comitê Nacional de Mobilização Contra a Dengue
Art. 260. Fica instituído o Comitê Nacional de Mobilização contra a Dengue. (Origem: PRT MS/GM 2001/2003, Art. 1º)
Art. 261. O Comitê será composto por representantes das instituições designadas abaixo, sob a Coordenação do primeiro: (Origem: PRT MS/GM 2001/2003, Art. 2º)
I - Secretaria de Vigilância em Saúde/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, I)
II - Gabinete do Ministro da Saúde; (Origem: PRT MS/GM 2001/2003, Art. 2º, II)
III - Secretaria-Executiva/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, III)
IV - Secretaria de Atenção à Saúde/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, IV)
V - Secretaria de Gestão do Trabalho e da Educação na Saúde/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, V)
VI - Secretaria de Ciência, Tecnologia e Insumos Estratégicos/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, VI)
VII - Secretaria de Gestão Participativa/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, VII)
VIII - Fundação Nacional de Saúde (FUNASA); (Origem: PRT MS/GM 2001/2003, Art. 2º, VIII)
IX - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2001/2003, Art. 2º, IX)
X - Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 2001/2003, Art. 2º, X)
XI - Conselho Nacional de Saúde (CNS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XI)
XII - Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XII)
XIII - Conselho Nacional dos Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XIII)
XIV - Conferência Nacional dos Bispos do Brasil (CNBB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XIV)
XV - Conselho das Igrejas Cristãs do Brasil; (Origem: PRT MS/GM 2001/2003, Art. 2º, XV)
XVI - Central Única dos Trabalhadores (CUT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XVI)
XVII - Associação Brasileira de Organizações Não Governamentais (ABONG); (Origem: PRT MS/GM 2001/2003, Art. 2º, XVII)
XVIII - Secretaria Nacional de Defesa Civil (SEDEC/MI); (Origem: PRT MS/GM 2001/2003, Art. 2º, XVIII)
XIX - Organização das Cooperativas Brasileiras (OCB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XIX)
XX - Confederação Nacional dos Transportes (CNT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XX)
XXI - Confederação Nacional das Indústrias (CNI); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXI)
XXII - Associação Brasileira de Imprensa (ABI); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXII)
XXIII - Confederação Brasileira de Futebol (CBF); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXIII)
XXIV - Confederação das Mulheres do Brasil (CMB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXIV)
XXV - Conselho de Reitores das Universidades Brasileiras (CRUB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXV)
XXVI - Associação Nacional de Jornais (ANJ); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXVI)
XXVII - União Nacional dos Dirigentes Municipais da Educação (UNDIME); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXVII)
XXVIII - Confederação Nacional dos Trabalhadores em Educação (CNTE); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXVIII)
XXIX - Associação Brasileira de Supermercados (ABRAS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXIX)
XXX - Confederação Nacional do Comércio (CNC); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXX)
XXXI - Federação Nacional dos Jornalistas (FENAJ); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXI)
XXXII - Confederação Geral dos Trabalhadores (CGT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXII)
XXXIII - Força Sindical; (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXIII)
XXXIV - Instituto Brasileiro de Administração Municipal (IBAM); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXIV)
XXXV - Associação Brasileira das Emissoras de Rádio e TV (ABERT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXV)
XXXVI - Comitê Olímpico Brasileiro (COB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXVI)
XXXVII - Ministério da Defesa; (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXVII)
XXXVIII - Fundação Cultural Palmares - Ministério da Cultura; (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXVIII)
XXXIX - Confederação Nacional das Donas de Casa e Consumidores; e (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXIX)
XL - Conselho Nacional dos Comandantes Gerais da Policia Militar e Bombeiro Militar (CNCG). (Origem: PRT MS/GM 2001/2003, Art. 2º, XL)
Art. 262. Fica instituído o Comitê Nacional de Mobilização contra a Dengue com a finalidade de coordenar a implementação, em nível nacional, das ações de educação em saúde e mobilização social voltadas ao combate à doença, em especial as relativas ao Dia Nacional de Mobilização Contra a Dengue. (Origem: PRT MS/GM 1934/2003, Art. 2º)
Art. 263. O Comitê Nacional será composto por membros que representarão os segmentos do poder público e da sociedade civil, com mandato de 2 (dois) anos. (Origem: PRT MS/GM 1934/2003, Art. 3º)
§ 1º Os membros do Comitê Nacional de Mobilização contra a Dengue deverão declarar a inexistência de conflito de interesses com suas atividades públicas ou privadas no debate dos temas pertinentes. (Origem: PRT MS/GM 1934/2003, Art. 3º, § 1º)
§ 2º A participação no Comitê é considerada de relevante interesse nacional e não será remunerada. (Origem: PRT MS/GM 1934/2003, Art. 3º, § 2º)
Art. 264. Compete ao Comitê Nacional de Mobilização contra a Dengue: (Origem: PRT MS/GM 1934/2003, Art. 4º)
I - propor ações de educação em saúde e mobilização social para o combate à dengue; (Origem: PRT MS/GM 1934/2003, Art. 4º, I)
II - acompanhar e avaliar a implementação das ações previstas para o combate à doença. (Origem: PRT MS/GM 1934/2003, Art. 4º, II)
Art. 265. O Comitê Nacional será coordenado pelo representante da Secretaria de Vigilância em Saúde e/ou seu substituto, que terá as seguintes competências: (Origem: PRT MS/GM 1934/2003, Art. 5º)
I - coordenar as reuniões do Comitê; (Origem: PRT MS/GM 1934/2003, Art. 5º, I)
II - encaminhar atas e relatórios para apreciação do responsável pelas ações do Programa Nacional de Combate à Dengue, da Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1934/2003, Art. 5º, II)
III - submeter a apreciação e aprovação do Secretário de Vigilância em Saúde as deliberações oriundas das reuniões do Comitê Nacional. (Origem: PRT MS/GM 1934/2003, Art. 5º, III)
Art. 266. O Comitê Nacional reunir-se-á quando convocado pelo seu Coordenador. (Origem: PRT MS/GM 1934/2003, Art. 6º)
Art. 267. A Secretaria de Vigilância em Saúde orientará os estados e municípios para que instituam, por intermédio de suas secretarias de saúde, respectivamente, comitês estaduais e municipais de mobilização contra a dengue visando incentivar a articulação dos órgãos federais, estaduais e municipais, bem como das entidades civis, com o objetivo de implementar as ações de educação em saúde e mobilização social, em especial as relativas ao Dia Nacional de Mobilização Contra a Dengue. (Origem: PRT MS/GM 1934/2003, Art. 7º)
Art. 268. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, editar normas regulamentadoras do Comitê Nacional de Mobilização contra a Dengue. (Origem: PRT MS/GM 1934/2003, Art. 8º)
Seção II
Do Grupo Executivo com a Finalidade de Acompanhar e Propor as Medidas Necessárias para a Efetiva Implementação das Ações do Programa Nacional de Controle da Dengue (PNCD)
Art. 269. Fica instituído Grupo Executivo, no âmbito do Ministério da Saúde, com a finalidade de acompanhar e propor as medidas necessárias para a efetiva implementação das ações do Programa Nacional de Controle da Dengue (PNCD), visando a sua prevenção e controle em todo o território nacional. (Origem: PRT MS/GM 335/2007, Art. 1º)
Art. 270. O Grupo Executivo do PNCD é composto por representantes das secretarias subordinadas e órgãos vinculados: (Origem: PRT MS/GM 335/2007, Art. 2º)
I - Gabinete do Ministro; (Origem: PRT MS/GM 335/2007, Art. 2º, I) (com redação dada pela PRT MS/GM 767/2008)
a) Assessoria de Comunicação Social. (Origem: PRT MS/GM 335/2007, Art. 2º, I, a)
II - Secretaria Executiva; (Origem: PRT MS/GM 335/2007, Art. 2º, II) (com redação dada pela PRT MS/GM 767/2008)
III - Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 335/2007, Art. 2º, III) (com redação dada pela PRT MS/GM 767/2008)
IV - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 335/2007, Art. 2º, IV) (com redação dada pela PRT MS/GM 767/2008)
a) Departamento de Atenção Especializada; (Origem: PRT MS/GM 335/2007, Art. 2º, IV, a)
b) Departamento de Atenção Básica; e (Origem: PRT MS/GM 335/2007, Art. 2º, IV, b)
c) Departamento de Regulação, Avaliação e Controle. (Origem: PRT MS/GM 335/2007, Art. 2º, IV, c)
V - Secretaria de Gestão Estratégica e Participativa; (Origem: PRT MS/GM 335/2007, Art. 2º, V) (com redação dada pela PRT MS/GM 767/2008)
VI - Secretaria de Gestão do Trabalho e da Educação na Saúde; (Origem: PRT MS/GM 335/2007, Art. 2º, VI) (com redação dada pela PRT MS/GM 767/2008)
VII - Secretaria de Ciência, Tecnologia e Insumos Estratégicos; (Origem: PRT MS/GM 335/2007, Art. 2º, VII) (com redação dada pela PRT MS/GM 767/2008)
VIII - Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 335/2007, Art. 2º, VIII) (com redação dada pela PRT MS/GM 767/2008)
IX - Agência Nacional de Saúde Suplementar; (Origem: PRT MS/GM 335/2007, Art. 2º, IX) (com redação dada pela PRT MS/GM 767/2008)
X - Fundação Nacional de Saúde; e (Origem: PRT MS/GM 335/2007, Art. 2º, X) (com redação dada pela PRT MS/GM 767/2008)
XI - Fundação Oswaldo Cruz. (Origem: PRT MS/GM 335/2007, Art. 2º, XI) (dispositivo acrescentado pela PRT MS/GM 767/2008)
§ 1º O Grupo Executivo do PNCD será coordenado e designado pelo Secretário de Vigilância em Saúde e cada órgão indicará um representante e respectivo suplente, preferencialmente o titular ou seu substituto. (Origem: PRT MS/GM 335/2007, Art. 2º, § 1º)
§ 2º O Coordenador do Grupo Executivo poderá convidar representantes de outros órgãos e entidades, públicos ou privados, para participarem das reuniões por ele organizadas. (Origem: PRT MS/GM 335/2007, Art. 2º, § 2º)
Art. 271. Compete ao Grupo Executivo do PNCD: (Origem: PRT MS/GM 335/2007, Art. 3º)
I - acompanhar a execução das ações previstas pelo PNCD; (Origem: PRT MS/GM 335/2007, Art. 3º, I)
II - promover as articulações necessárias para a eficaz implementação das ações de prevenção e controle da dengue, assim como a assistência aos pacientes, inclusive com Estados e Municípios; (Origem: PRT MS/GM 335/2007, Art. 3º, II)
III - atuar nas restrições identificadas para adoção das medidas integrantes dos planos de combate à dengue; (Origem: PRT MS/GM 335/2007, Art. 3º, III)
IV - acompanhar a alocação dos recursos orçamentário- financeiros necessários para implementação das ações. (Origem: PRT MS/GM 335/2007, Art. 3º, IV)
Art. 272. Ficam os integrantes do Grupo Executivo responsáveis pelo desenvolvimento das ações previstas nos componentes do PNCD, dentre elas: (Origem: PRT MS/GM 335/2007, Art. 4º)
I - Vigilância epidemiológica; (Origem: PRT MS/GM 335/2007, Art. 4º, a)
II - Combate ao vetor; (Origem: PRT MS/GM 335/2007, Art. 4º, b)
III - Ações de saneamento ambiental; (Origem: PRT MS/GM 335/2007, Art. 4º, c)
IV - Ações integradas de educação em saúde, comunicação e mobilização social; (Origem: PRT MS/GM 335/2007, Art. 4º, d)
V - Capacitação de recursos humanos; (Origem: PRT MS/GM 335/2007, Art. 4º, e)
VI - Assistência básica, média e alta complexidade; (Origem: PRT MS/GM 335/2007, Art. 4º, f)
VII - Legislação; e (Origem: PRT MS/GM 335/2007, Art. 4º, g)
VIII - Sustentação político-social. (Origem: PRT MS/GM 335/2007, Art. 4º, h)
Art. 273. A participação no Grupo Executivo não ensejará remuneração e será considerada serviço público relevante. (Origem: PRT MS/GM 335/2007, Art. 5º)
§ 1º O Coordenador do Grupo Executivo será substituído, em suas ausências, pelo Coordenador do PNCD. (Origem: PRT MS/GM 335/2007, Art. 5º, § 1º)
§ 2º O Grupo Executivo reunir-se-á, mensalmente, por convocação de seu Coordenador, com registro em ata dos assuntos deliberados. (Origem: PRT MS/GM 335/2007, Art. 5º, § 2º)
CAPÍTULO IX
DO PROGRAMA NACIONAL DE VIGILÂNCIA, PREVENÇÃO E CONTROLE DAS IST E DO HIV/AIDS
Art. 274. Fica instituído o Programa Nacional de Vigilância, Prevenção e Controle das IST e do HIV/AIDS. (Origem: PRT MS/GM 236/1985, Art. 1º)
Art. 275. O Programa coordenará, a nível nacional, ações de vigilância epidemiológica das IST e do HIV/AIDS. (Origem: PRT MS/GM 236/1985, Art. 2º)
Art. 276. Compete ao Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS) a coordenação, a nível nacional, do Programa. (Origem: PRT MS/GM 236/1985, Art. 3º)
Art. 277. As medidas de prevenção das IST e do HIV/AIDS, no país, serão realizadas de forma articulado pelo Ministério da Saúde e pelas Secretaria de Saúdes dos Estados, Municípios e Distrito Federal. (Origem: PRT MS/GM 236/1985, Art. 4º)
Art. 278. As linhas básicas para operacionalização das ações de investigação e controle da síndrome de imunodeficiência adquirida constam do Anexo XXXIII . (Origem: PRT MS/GM 236/1985, Art. 5º)
CAPÍTULO X
DO PROGRAMA NACIONAL PARA PREVENÇÃO E CONTROLE DAS HEPATITES VIRAIS
Art. 279. Fica instituído, no âmbito do SUS, o Programa Nacional para a Prevenção e o Controle das Hepatites Virais, a ser desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos Estados, Municípios e Distrito Federal, tendo por objetivos: (Origem: PRT MS/GM 2080/2003, Art. 1º)
I - o desenvolvimento de ações de promoção da saúde, prevenção, diagnóstico, vigilância epidemiológica e sanitária das hepatites virais, acompanhamento e tratamento dos portadores de hepatites virais detectadas e inseridas no Programa; (Origem: PRT MS/GM 2080/2003, Art. 1º, I)
II - a ampliação do acesso, o incremento da qualidade e da capacidade instalada dos serviços de saúde em todos os seus níveis de complexidade, bem como de centros de referência para o tratamento das hepatites; e (Origem: PRT MS/GM 2080/2003, Art. 1º, II)
III - a organização, regulação, acompanhamento e avaliação do conjunto destas ações de saúde para o efetivo controle das hepatites virais. (Origem: PRT MS/GM 2080/2003, Art. 1º, III)
Parágrafo Único. O Programa Nacional para a Prevenção e o Controle das Hepatites Virais, criado através deste Capítulo ficará subordinado ao Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS). (Origem: PRT MS/GM 2080/2003, Art. 1º, Parágrafo Único)
Art. 280. O Programa Nacional para a Prevenção e o Controle das Hepatites Virais envolverá todos os aspectos relacionados à prevenção, vigilância e assistência aos pacientes portadores de hepatites virais, com ênfase nas Hepatites A, B, C, D e E. (Origem: PRT MS/GM 2080/2003, Art. 2º)
Art. 281. O do Anexo XXXIV define as competências e atribuições relativas à implantação/gestão do Programa Nacional para a Prevenção e o Controle das Hepatites Virais de cada nível de direção do SUS. (Origem: PRT MS/GM 2080/2003, Art. 3º)
Art. 282. Em virtude dos diferentes níveis de organização das redes assistenciais existentes nos Estados e no Distrito Federal, da diversidade das características populacionais existentes no País, da variação da incidência das hepatites nas diversas regiões e dos diferentes graus de necessidades assistenciais requeridos pelos portadores, o Programa Nacional para a Prevenção e o Controle das Hepatites Virais será constituído por três níveis assistenciais, a saber: (Origem: PRT MS/GM 2080/2003, Art. 4º)
I - Nível I - Atenção Básica; (Origem: PRT MS/GM 2080/2003, Art. 4º, I)
II - Nível II - Assistência Ambulatorial e Hospitalar de Média Complexidade; e (Origem: PRT MS/GM 2080/2003, Art. 4º, II)
III - Nível III - Assistência Ambulatorial e Hospitalar de Alta Complexidade. (Origem: PRT MS/GM 2080/2003, Art. 4º, III)
Art. 283. O Nível I - Atenção Básica - compreende a realização de ações básicas de saúde voltadas para as hepatites virais, relativas a sua prevenção e à promoção da saúde para toda a população, bem como os processos de identificação de portadores de hepatites virais e de assistência básica dos casos identificados. (Origem: PRT MS/GM 2080/2003, Art. 5º)
Parágrafo Único. A atenção básica de que trata o caput deste artigo será prestada por meio das equipes de saúde da família e postos/centros de saúde e centros de testagem e aconselhamento, na forma estabelecida no Plano Operacional do Programa Nacional de Hepatites Virais, os quais deverão articular-se com serviços de saúde de Nível II para que seja garantida a referência e contra-referência dos pacientes cuja situação clínica assim o requeira, bem como serviços de diagnóstico, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Origem: PRT MS/GM 2080/2003, Art. 5º, Parágrafo Único)
Art. 284. O Nível II - Assistência Ambulatorial e Hospitalar de Média Complexidade - compreende a execução de ações de diagnóstico e tratamento dos portadores de hepatites virais, de acordo com o previsto para seu nível de complexidade assistencial estabelecidas nos Protocolos Clínicos e Diretrizes Terapêuticas já elaborados/publicados ou a serem elaborados/publicados pela Secretaria de Vigilância em Saúde/Secretaria de Atenção à Saúde/Secretaria de Ciência, Tecnologia e Insumos Estratégicos/Ministério da Saúde. (Origem: PRT MS/GM 2080/2003, Art. 6º)
Parágrafo Único. As ações assistenciais definidas no caput deste artigo serão desenvolvidas por hospitais/ambulatórios de média complexidade, devidamente cadastrados para tal, em conformidade com o estabelecido no Plano Operacional do Programa Nacional, os quais deverão articular-se com serviços de saúde de Nível I e III para que seja garantida a referência e contra-referência dos pacientes cuja situação clínica assim o requeira, bem como serviços de diagnóstico de maior complexidade, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Origem: PRT MS/GM 2080/2003, Art. 6º, Parágrafo Único)
Art. 285. O Nível III - Assistência Ambulatorial e Hospitalar de Alta Complexidade - compreende a execução de ações de diagnóstico e tratamento dos portadores de hepatites virais, de acordo com o previsto para seu nível de complexidade assistencial estabelecidas nos Protocolos Clínicos e Diretrizes Terapêuticas elaborados/publicados ou a serem elaborados/publicados pela Secretaria de Vigilância em Saúde/Secretaria de Atenção à Saúde/Secretaria de Ciência, Tecnologia e Insumos Estratégicos/Ministério da Saúde. (Origem: PRT MS/GM 2080/2003, Art. 7º)
Parágrafo Único. As ações assistenciais definidas no caput deste artigo serão desenvolvidas por Centros de Referência em Assistência aos Portadores de Hepatites Virais, devidamente cadastrados para tal, em conformidade com o estabelecido Plano Operacional do Programa Nacional, os quais constituirão a referência assistencial para a rede composta pelos diferentes níveis assistenciais integrantes do Programa, articulando-se com serviços de saúde de Nível II, garantindo assim a referência e contra-referência dos pacientes, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Origem: PRT MS/GM 2080/2003, Art. 7º, Parágrafo Único)
Art. 286. Caberá às Secretarias de Saúde dos Estados, Municípios e Distrito Federal, de acordo com o seu nível de responsabilidade no Programa, na forma do Anexo XXXIV , a organização das Redes Estaduais de Assistência aos Portadores de Hepatites Virais, que serão integradas por: (Origem: PRT MS/GM 2080/2003, Art. 8º)
I - Serviços de Nível I - Atenção Básica; (Origem: PRT MS/GM 2080/2003, Art. 8º, I)
II - Serviços de Nível II - Assistência Ambulatorial e Hospitalar de Média Complexidade; e (Origem: PRT MS/GM 2080/2003, Art. 8º, II)
III - Serviços de Nível III - (Centros de Referência em Assistência aos Portadores de Hepatites Virais) - Assistência Ambulatorial e Hospitalar de Alta Complexidade. (Origem: PRT MS/GM 2080/2003, Art. 8º, III)
Art. 287. A Secretaria de Vigilância em Saúde definirá a estrutura básica para o funcionamento do Programa Nacional para a Prevenção e o Controle das Hepatites Virais no nível central, organizará a estrutura operacional básica e adotará as providências necessárias à plena implementação deste Programa em todos os níveis de gestão do SUS. (Origem: PRT MS/GM 2080/2003, Art. 9º)
Art. 288. Fica instituído o Comitê Técnico de Acompanhamento e Assessoramento do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, com a finalidade de acompanhar e assessorar a implementação das ações previstas no Programa. (Origem: PRT MS/GM 2080/2003, Art. 10)
Art. 289. Fica instituído o Comitê Assessor do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, com as atribuições de assessorar o Programa na atualização dos assuntos técnicos e científicos envolvidos na apreciação das recomendações, auxiliar na elaboração das normas técnicas, do Plano Operacional, dos Protocolos de diagnóstico, tratamento e acompanhamento das hepatites virais e ainda na avaliação epidemiológica destas hepatites. (Origem: PRT MS/GM 2080/2003, Art. 12)
Art. 290. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, proceder às alterações que, eventualmente, se façam necessárias neste Capítulo, bem como editar normas regulamentadoras provenientes deste Capítulo. (Origem: PRT MS/GM 2080/2003, Art. 13)
Art. 291. A Secretaria de Atenção à Saúde, a Fundação Nacional de Saúde, a Agência Nacional de Vigilância Sanitária e a Secretaria de Ciência, Tecnologia e Insumos Estratégicos devem se articular com a Secretaria de Vigilância em Saúde para as providências necessárias, em suas respectivas áreas de atuação, para a plena implementação do Programa instituído por este Capítulo e pelo seu Plano Operacional, no que diz respeito à assistência de atenção básica, média/alta complexidade, vigilância epidemiológica e vigilância sanitária das hepatites virais. (Origem: PRT MS/GM 2080/2003, Art. 14)
CAPÍTULO XI
DO PROGRAMA NACIONAL DE PREVENÇÃO E CONTROLE DA MALÁRIA (PNCM)
Art. 292. Fica instituído o Programa Nacional de Prevenção e Controle da Malária (PNCM), com as seguintes diretrizes: (Origem: PRT MS/GM 1932/2003, Art. 1º)
I - desenvolver atividades de informação e de mobilização político-social, com o objetivo de aumentar a participação da população nas ações de prevenção e controle da malária; (Origem: PRT MS/GM 1932/2003, Art. 1º, I)
II - fortalecer a vigilância em saúde para ampliar a capacidade de predição e de detecção precoce de surtos da doença; (Origem: PRT MS/GM 1932/2003, Art. 1º, II)
III - melhorar a qualidade do trabalho de campo no controle vetorial; (Origem: PRT MS/GM 1932/2003, Art. 1º, III)
IV - integrar as ações de controle da malária na atenção básica, com a efetiva participação dos Programas de Agentes Comunitários de Saúde e do Programa Saúde da Família; (Origem: PRT MS/GM 1932/2003, Art. 1º, IV)
V - utilizar os instrumentos legais que facilitem o trabalho do poder público no controle do meio ambiente para evitar surtos da doença; (Origem: PRT MS/GM 1932/2003, Art. 1º, V)
VI - atuar com o Instituto Nacional de Colonização e Reforma Agrária - INCRA e o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis - IBAMA, nas regiões endêmicas de malária, visando à promoção de ações de prevenção e controle da doença para evitar surgimento de epidemias decorrentes de atividades antrópicas; (Origem: PRT MS/GM 1932/2003, Art. 1º, VI)
VII - desenvolver instrumentos de programação, acompanhamento e supervisão das ações desenvolvidas pelos gestores federal, estaduais e municipais. (Origem: PRT MS/GM 1932/2003, Art. 1º, VII)
Art. 293. Fica criado o Comitê Técnico de Acompanhamento e Assessoramento do PNCM, que será coordenado pela Secretaria de Vigilância em Saúde do Ministério da Saúde e contará com representantes do Ministério da Saúde; da Organização Pan-Americana da Saúde (OPAS); de Universidades, de Institutos de Pesquisas; da Sociedade Brasileira de Medicina Tropical (SBMT); da Associação Brasileira de Saúde Coletiva (ABRASCO); do Instituto Nacional de Colonização e Reforma Agrária (INCRA); e do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA). (Origem: PRT MS/GM 1932/2003, Art. 2º)
Art. 294. Ficam criadas Câmaras Técnicas Específicas do PNCM com a finalidade de implementarem, em nível nacional, os componentes do programa que se fizerem necessários. (Origem: PRT MS/GM 1932/2003, Art. 3º)
Parágrafo Único. As Câmaras Técnicas de que trata o caput deste artigo serão coordenadas pela Secretaria de Vigilância em Saúde e contarão com técnicos de notório conhecimento nas áreas inerentes a cada Câmara. (Origem: PRT MS/GM 1932/2003, Art. 3º, Parágrafo Único)
Art. 295. O Secretário de Vigilância em Saúde definirá a composição do Comitê Técnico e das Câmaras Técnicas. (Origem: PRT MS/GM 1932/2003, Art. 4º)
Art. 296. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, editar normas regulamentadoras deste Capítulo. (Origem: PRT MS/GM 1932/2003, Art. 5º)
CAPÍTULO XII
DO PROGRAMA NACIONAL DE PREVENÇÃO E CONTROLE DOS DISTÚRBIOS POR DEFICIÊNCIA DE IODO (PRÓ-IODO)
Art. 297. Fica instituído o Programa Nacional de Prevenção e Controle dos Distúrbios por Deficiência de Iodo (DDI), designado por Pró-Iodo, e ficam estabelecidas instruções para sua implementação. (Origem: PRT MS/GM 2362/2005, Art. 1º)
Art. 298. O Pró-Iodo destina-se a promover a eliminação virtual sustentável dos DDI mediante a obrigatoriedade de iodação do sal destinado ao consumo humano em todo o território nacional. (Origem: PRT MS/GM 2362/2005, Art. 2º)
Art. 299. O Pró-Iodo será executado de acordo com as seguintes linhas de ação: (Origem: PRT MS/GM 2362/2005, Art. 3º)
I - monitoramento do teor de iodo do sal para consumo humano; (Origem: PRT MS/GM 2362/2005, Art. 3º, I)
II - monitoramento do impacto da iodação do sal na saúde da população; (Origem: PRT MS/GM 2362/2005, Art. 3º, II)
III - atualização dos parâmetros legais dos teores de iodo do sal destinado ao consumo humano; e (Origem: PRT MS/GM 2362/2005, Art. 3º, III)
IV - implementação contínua de estratégias de informação, educação, comunicação e mobilização social. (Origem: PRT MS/GM 2362/2005, Art. 3º, IV)
§ 1º A Comissão Interinstitucional para a Prevenção e o Controle dos Distúrbios por Deficiência de Iodo - CIPCDDI, instituída no âmbito da Secretaria de Atenção à Saúde, terá a incumbência de acompanhar e avaliar o Programa. (Origem: PRT MS/GM 2362/2005, Art. 3º, § 1º)
§ 2º Os objetivos, indicadores de processo e de resultados, metas e atribuições dos entes governamentais e outros agentes envolvidos no Programa Nacional de Controle dos Distúrbios por Deficiência de Iodo serão detalhados na norma técnico-operacional específica, elaborada pela CIPCDDI. (Origem: PRT MS/GM 2362/2005, Art. 3º, § 2º)
Art. 300. São atribuições do Ministério da Saúde: (Origem: PRT MS/GM 2362/2005, Art. 4º)
I - estabelecer as diretrizes técnico-operacionais do Pró-Iodo e definir estratégia de divulgação aos estados e aos municípios; (Origem: PRT MS/GM 2362/2005, Art. 4º, I)
II - capacitar os responsáveis técnicos estaduais para prestar apoio aos municípios na operacionalização, na avaliação e no monitoramento do Pró-Iodo, bem como aos laboratórios de análises clínicas oficiais; (Origem: PRT MS/GM 2362/2005, Art. 4º, II)
III - elaborar manual técnico-operacional e materiais de apoio para execução e acompanhamento de ações específicas para a prevenção e o controle dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, III)
IV - promover a produção e a distribuição de materiais educativos e informativos, para profissionais de saúde e da educação, indústrias produtoras de sal e para população em geral, com apoio dos componentes da CIPCDDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, IV)
V - promover ações educativas e de comunicação, com vistas a esclarecer a população sobre a importância do consumo de iodo, bem como sobre o seu papel na prevenção dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, V)
VI - identificar as áreas caracterizadas como críticas e intensificar as linhas de ação do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 4º, VI)
VII - delinear, desenvolver e apoiar estudos e pesquisas que avaliem os processos e os resultados de impacto do Pró-Iodo em nível nacional, regional e local; (Origem: PRT MS/GM 2362/2005, Art. 4º, VII)
VIII - apoiar e fomentar a realização de inquéritos e levantamentos epidemiológicos referentes às patologias decorrentes dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, VIII)
IX - estabelecer parcerias com outras instâncias do Ministério da Saúde, órgãos e instituições governamentais e não-governamentais, para o fomento de atividades complementares, com o objetivo de promover ações destinadas à prevenção e ao controle dos DDI; e (Origem: PRT MS/GM 2362/2005, Art. 4º, IX)
X - acompanhar a implantação e a implementação do Pró-Iodo, e monitorar seus resultados em âmbito nacional. (Origem: PRT MS/GM 2362/2005, Art. 4º, X)
Art. 301. São atribuições da Agência Nacional de Vigilância Sanitária (ANVISA): (Origem: PRT MS/GM 2362/2005, Art. 5º)
I - participar da coordenação, em âmbito nacional, do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 5º, I)
II - coordenar e regulamentar as ações de controle higiênico-sanitário dos estabelecimentos beneficiadores de sal e do produto exposto à comercialização; (Origem: PRT MS/GM 2362/2005, Art. 5º, II)
III - analisar e divulgar, sistematicamente, os resultados do controle e do monitoramento de iodação do sal para consumo humano; (Origem: PRT MS/GM 2362/2005, Art. 5º, III)
IV - definir estratégias de intervenção para promover, no comércio, a oferta de sal devidamente iodado; (Origem: PRT MS/GM 2362/2005, Art. 5º, IV)
V - promover a inserção dos laboratórios oficiais de bromatologia em programas de controle de qualidade analítica; e (Origem: PRT MS/GM 2362/2005, Art. 5º, V)
VI - promover a sensibilização do setor produtivo com vistas a atender à legislação sanitária vigente. (Origem: PRT MS/GM 2362/2005, Art. 5º, VI)
Art. 302. São atribuições comuns da Secretaria Estadual de Saúde e do órgão responsável pela vigilância sanitária estadual: (Origem: PRT MS/GM 2362/2005, Art. 6º)
I - designar uma área técnica responsável para coordenar, em âmbito estadual, as atividades relacionadas ao Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 6º, I)
II - divulgar as normas operacionais do Pró-Iodo aos municípios; (Origem: PRT MS/GM 2362/2005, Art. 6º, II)
III - acompanhar a implementação das ações do Pró-Iodo nos municípios; (Origem: PRT MS/GM 2362/2005, Art. 6º, III)
IV - integrar os laboratórios oficiais no programa de controle de qualidade analítica; (Origem: PRT MS/GM 2362/2005, Art. 6º, IV)
V - promover a sensibilização do setor produtivo com vistas a atender à legislação sanitária vigente; e (Origem: PRT MS/GM 2362/2005, Art. 6º, V)
VI - capacitar permanentemente os técnicos das Vigilâncias Sanitárias Estaduais na inspeção de indústrias beneficiadoras de sal e na aplicação sistematizada da legislação higiênico-sanitária. (Origem: PRT MS/GM 2362/2005, Art. 6º, VI)
Art. 303. São atribuições específicas da Secretaria Estadual de Saúde: (Origem: PRT MS/GM 2362/2005, Art. 7º)
I - capacitar os técnicos municipais no que se refere à operacionalização, à avaliação e ao monitoramento do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 7º, I)
II - elaborar materiais educativos e informativos sobre a prevenção e o controle dos DDI para profissionais de saúde e da educação e para a população em geral; (Origem: PRT MS/GM 2362/2005, Art. 7º, II)
III - participar do monitoramento do estado nutricional de iodo, que será promovido e coordenado pelo nível federal; e (Origem: PRT MS/GM 2362/2005, Art. 7º, III)
IV - avaliar o desempenho e o impacto do Pró-Iodo em nível estadual. (Origem: PRT MS/GM 2362/2005, Art. 7º, IV)
Parágrafo Único. Para o cumprimento do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios de cooperação com os estados. (Origem: PRT MS/GM 2362/2005, Art. 7º, Parágrafo Único)
Art. 304. São atribuições específicas do órgão responsável pela vigilância sanitária estadual: (Origem: PRT MS/GM 2362/2005, Art. 8º)
I - efetuar o controle higiênico-sanitário dos estabelecimentos beneficiadores de sal, com base nos critérios estabelecidos na legislação específica; (Origem: PRT MS/GM 2362/2005, Art. 8º, I)
II - realizar o monitoramento do sal para o consumo humano exposto à comercialização; e (Origem: PRT MS/GM 2362/2005, Art. 8º, II)
III - divulgar os resultados estaduais do Pró-Iodo e remetê-los à ANVISA. (Origem: PRT MS/GM 2362/2005, Art. 8º, III)
Art. 305. São atribuições comuns da Secretaria Municipal de Saúde e do órgão responsável pela vigilância sanitária municipal: (Origem: PRT MS/GM 2362/2005, Art. 9º)
I - designar uma área técnica responsável para coordenar, em âmbito municipal, o Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 9º, I)
II - implementar as normas técnico-operacionais do Pró-Iodo tanto na rotina dos serviços de saúde como nas visitas domiciliares da Equipe de Saúde da Família; e (Origem: PRT MS/GM 2362/2005, Art. 9º, II)
III - promover a sensibilização do setor produtivo e do comércio com vistas a atender à legislação sanitária vigente. (Origem: PRT MS/GM 2362/2005, Art. 9º, III)
Parágrafo Único. O órgão responsável pela vigilância sanitária municipal terá as suas atribuições definidas pelo órgão responsável pela vigilância sanitária estadual, em consonância com o tipo de gestão do Sistema Único de Saúde do município. (Origem: PRT MS/GM 2362/2005, Art. 9º, Parágrafo Único)
Art. 306. São atribuições específicas da Secretaria Municipal de Saúde: (Origem: PRT MS/GM 2362/2005, Art. 10)
I - garantir a capacitação de pessoal para a operacionalização, a avaliação e o monitoramento do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 10, I)
II - desenvolver ações educativas e de comunicação, com vistas a esclarecer a população sobre a importância do consumo de sal iodado, bem como sobre o seu papel na prevenção dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 10, II)
III - garantir a distribuição de materiais educativos e informativos para profissionais de saúde e da educação e para a população em geral; (Origem: PRT MS/GM 2362/2005, Art. 10, III)
IV - promover esforços intra e interinstitucionais para a confecção de materiais educativos e informativos, com vistas a fomentar a nutrição ótima de Iodo na população local; e (Origem: PRT MS/GM 2362/2005, Art. 10, IV)
V - participar das ações de monitoramento do impacto da iodação do sal na saúde da população. (Origem: PRT MS/GM 2362/2005, Art. 10, V)
Parágrafo Único. Fica facultado às Secretarias Municipais de Saúde o estabelecimento de parcerias com outras instituições. (Origem: PRT MS/GM 2362/2005, Art. 10, Parágrafo Único)
Art. 307. O órgão responsável pela vigilância sanitária municipal terá suas atribuições definidas pelo órgão responsável pela vigilância sanitária estadual, em consonância com o tipo de gestão do Sistema Único de Saúde do município. (Origem: PRT MS/GM 2362/2005, Art. 11)
Art. 308. Compete aos Conselhos Estaduais e Municipais de Saúde realizar o controle social do Programa, bem como acompanhar todo o processo operacional dele no seu âmbito de atuação. (Origem: PRT MS/GM 2362/2005, Art. 12)
Parágrafo Único. Para que esse controle seja efetuado, os estados e os municípios deverão tornar disponíveis as informações sobre a operacionalização do Programa. (Origem: PRT MS/GM 2362/2005, Art. 12, Parágrafo Único)
Art. 309. Compete ao Conselho Nacional de Saúde, por intermédio da Comissão Intersetorial de Alimentação e Nutrição, realizar o controle social do Programa em nível nacional. (Origem: PRT MS/GM 2362/2005, Art. 13)
Art. 310. Compete aos entes governamentais e não-governamentais empenharem-se na articulação necessária para o cumprimento dos objetivos e metas estabelecidos para o Pró- Iodo. (Origem: PRT MS/GM 2362/2005, Art. 14)
Art. 311. Fica definido que a cada três anos será realizado o monitoramento do impacto da iodação do sal na saúde da população, conforme o que for estabelecido em Protocolo Específico para Monitoramento do Impacto da Iodação do Sal na Saúde da População. (Origem: PRT MS/GM 2362/2005, Art. 15)
§ 1º A avaliação de impacto do Pró-Iodo deverá contemplar a análise de sua eficácia, efetividade e eficiência a curto, médio e longos prazos. (Origem: PRT MS/GM 2362/2005, Art. 15, § 1º)
§ 2º Para fins do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios com os referidos Centros Colaboradores em Alimentação e Nutrição, bem como com instituições de ensino e pesquisa com conhecimento técnico-científico. (Origem: PRT MS/GM 2362/2005, Art. 15, § 2º)
Art. 312. A Secretaria de Atenção à Saúde, do Ministério da Saúde, adotará as providências necessárias ao cumprimento das disposições constantes neste Capítulo. (Origem: PRT MS/GM 2362/2005, Art. 16)
Seção I
Da Comissão Interinstitucional para a Prevenção e o Controle dos Distúrbios por Deficiência de Iodo
Art. 313. Fica instituída Comissão Interinstitucional para a Prevenção e o Controle dos Distúrbios por Deficiência de Iodo. (Origem: PRT MS/GM 520/2005, Art. 1º)
Art. 314. A Comissão Interinstitucional de que trata o art. 313 será composta por representantes dos órgãos/entidades abaixo relacionados e atuará sob a coordenação da Secretaria de Atenção à Saúde/MS: (Origem: PRT MS/GM 520/2005, Art. 2º)
I - Ministério da Saúde: (Origem: PRT MS/GM 520/2005, Art. 2º, I)
a) Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 520/2005, Art. 2º, I, a)
b) Secretaria de Vigilância em Saúde; e (Origem: PRT MS/GM 520/2005, Art. 2º, I, b)
c) Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 520/2005, Art. 2º, I, c)
II - Ministério da Agricultura, Pecuária e Abastecimento; (Origem: PRT MS/GM 520/2005, Art. 2º, II)
III - Ministério da Educação; (Origem: PRT MS/GM 520/2005, Art. 2º, III)
IV - Organização Pan-Americana da Saúde/Organização Mundial da Saúde; (Origem: PRT MS/GM 520/2005, Art. 2º, IV)
V - Fundo das Nações Unidas para a Infância; (Origem: PRT MS/GM 520/2005, Art. 2º, V)
VI - Vigilância Sanitária Estadual do Rio Grande do Norte; (Origem: PRT MS/GM 520/2005, Art. 2º, VI)
VII - Vigilância Sanitária Estadual do Rio de Janeiro; (Origem: PRT MS/GM 520/2005, Art. 2º, VII)
VIII - Associação Brasileira de Extratores e Refinadores de Sal; (Origem: PRT MS/GM 520/2005, Art. 2º, VIII)
IX - Sindicato dos Moageiros e Refinadores de Sal do Rio Grande do Norte; (Origem: PRT MS/GM 520/2005, Art. 2º, IX)
X - Sindicato da Indústria de Extração de Sal do Rio Grande do Norte; (Origem: PRT MS/GM 520/2005, Art. 2º, X)
XI - Sindicato da Indústria de Refino de Sal do Rio de Janeiro; (Origem: PRT MS/GM 520/2005, Art. 2º, XI)
XII - Associação Brasileira das Indústrias de Alimentação; e (Origem: PRT MS/GM 520/2005, Art. 2º, XII)
XIII - Instituto Brasileiro de Defesa do Consumidor. (Origem: PRT MS/GM 520/2005, Art. 2º, XIII)
Art. 315. A Comissão terá as seguintes atribuições: (Origem: PRT MS/GM 520/2005, Art. 3º)
I - acompanhar e avaliar o Programa Nacional de Prevenção e Controle dos Distúrbios por Deficiência de Iodo, designado por Pró-Iodo, bem como discutir a efetividade das ações adotadas; e (Origem: PRT MS/GM 520/2005, Art. 3º, I)
II - estabelecer estratégias de informação, de comunicação, de educação e de mobilização social com vistas à garantia da nutrição ótima de iodo. (Origem: PRT MS/GM 520/2005, Art. 3º, II)
Parágrafo Único. Cada um dos membros da Comissão Interinstitucional deverá compilar e fornecer toda informação necessária a ser analisada em conjunto para o acompanhamento e avaliação periódica dos resultados do Programa. (Origem: PRT MS/GM 520/2005, Art. 3º, Parágrafo Único)
Art. 316. A Comissão Interinstitucional ora instituída poderá convidar cientistas, especialistas ou pesquisadores de instituições acadêmicas ou científicas, de organismos internacionais, bem como representantes da sociedade civil para colaborarem na análise de assuntos específicos. (Origem: PRT MS/GM 520/2005, Art. 4º)
Art. 317. A Comissão Interinstitucional reunir-se-á, ordinariamente, duas vezes por ano, e, extraordinariamente, quando convocada por seu coordenador ou por solicitação de qualquer um de seus membros, cabendo neste último caso a apreciação do coordenador. (Origem: PRT MS/GM 520/2005, Art. 5º)
Art. 318. As competências e atribuições de cada componente da Comissão serão estabelecidas na norma técnico-operacional do Pró-Iodo. (Origem: PRT MS/GM 520/2005, Art. 6º)
Art. 319. As deliberações decorrentes da Comissão serão submetidas à aprovação do Secretário de Atenção à Saúde, do Ministério da Saúde. (Origem: PRT MS/GM 520/2005, Art. 7º)
CAPÍTULO XIII
DA VIGILÂNCIA EPIDEMIOLÓGICA
Seção I
Da Lista Nacional de Doenças e Agravos a Serem Monitorados por meio da Estratégia de Vigilância em Unidades Sentinelas e suas Diretrizes
Art. 320. Esta Seção define a lista nacional de doenças e agravos, na forma do Anexo XLIII , a serem monitorados por meio da estratégia de vigilância em unidades sentinelas e suas diretrizes. (Origem: PRT MS/GM 205/2016, Art. 1º)
Art. 321. Para efeito desta Seção considera-se vigilância sentinela o modelo de vigilância realizada a partir de estabelecimento de saúde estratégico para a vigilância de morbidade, mortalidade ou agentes etiológicos de interesse para a saúde pública, com participação facultativa, segundo norma técnica específica estabelecida pela Secretaria de Vigilância em Saúde (SVS/MS). (Origem: PRT MS/GM 205/2016, Art. 2º)
Art. 322. As autoridades de saúde garantirão o sigilo das informações pessoais integrantes da notificação compulsória, que estejam sob sua responsabilidade, conforme preconiza a Lei nº 12.527, de 18 de novembro de 2011. (Origem: PRT MS/GM 205/2016, Art. 3º)
Art. 323. As autoridades de saúde garantirão a divulgação atualizada dos dados públicos da notificação compulsória para profissionais de saúde, órgãos de controle social e população em geral. (Origem: PRT MS/GM 205/2016, Art. 4º)
Art. 324. A SVS/MS, as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios divulgarão, em endereço eletrônico oficial, o número de telefone, fax, endereço de e-mail institucional ou formulário para notificação compulsória. (Origem: PRT MS/GM 205/2016, Art. 5º)
Seção II
Da Vigilância Sentinela da Influenza
Art. 325. A Vigilância Sentinela da Influenza tem como objetivo fortalecer a vigilância epidemiológica da influenza através da identificação da circulação dos vírus influenza e de outros vírus respiratórios, de acordo com a patogenicidade, a virulência em cada período sazonal, a existência de situações inusitadas ou o surgimento de novo subtipo viral. (Origem: PRT MS/GM 183/2014, Art. 26)
Parágrafo Único. A Vigilância Sentinela da Influenza também tem por finalidade o isolamento de espécimes virais e o respectivo envio oportuno ao Centro Colaborador de Influenza (CCI) de referência para as Américas e para a Organização Mundial da Saúde (OMS), visando à adequação da vacina da influenza sazonal. (Origem: PRT MS/GM 183/2014, Art. 26, Parágrafo Único)
Art. 326. A Vigilância Sentinela da Influenza possuirá 2 (dois) componentes, definidos de acordo com a população: (Origem: PRT MS/GM 183/2014, Art. 27)
I - Vigilância Sentinela de Síndrome Gripal (SG), com monitoramento da vigilância agregada por Semana Epidemiológica (SE) dos atendimentos por SG; e (Origem: PRT MS/GM 183/2014, Art. 27, I)
II - Vigilância Sentinela de Síndrome Respiratória Aguda Grave (SRAG) em UTI, com monitoramento da vigilância agregada por Semana Epidemiológica (SE) pelo CID 10: J09 a J18. (Origem: PRT MS/GM 183/2014, Art. 27, II)
Art. 327. Para a execução das ações de Vigilância Sentinela de SG, o ente federativo habilitado ao recebimento do incentivo financeiro deverá assumir as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 29)
I - coletar 5 (cinco) amostras clínicas dos casos de SG por semana, de modo a atingir o mínimo de 80% (oitenta por cento) de coleta de material da meta semanal, com oportuna digitação; e (Origem: PRT MS/GM 183/2014, Art. 29, I)
II - digitar no Sistema de Informação da Vigilância Epidemiológica da Gripe (SIVEP-Gripe) agregado semanal por sexo e faixa etária dos atendimentos de SG e do total de atendimentos da Unidade Sentinela em, no mínimo, 90% (noventa por cento) das semanas epidemiológicas do ano. (Origem: PRT MS/GM 183/2014, Art. 29, II)
Art. 328. Para a execução de ações de Vigilância Sentinela de SRAG, o ente federativo habilitado ao recebimento do incentivo financeiro deverá assumir as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 30)
I - coletar amostras de no mínimo 80% (oitenta por cento) dos casos de SRAG notificados nas UTI incluídas na Vigilância da SRAG, com o devido envio de amostra aos LACEN e incluir os casos no sistema de informação SIVEP-Gripe; e (Origem: PRT MS/GM 183/2014, Art. 30, I)
II - digitar semanalmente os dados do número de internações do CID 10: J09 a J18, de forma agregada, das UTI participantes, no SIVEP-Gripe, com uma regularidade de no mínimo 90% (noventa por cento) das semanas epidemiológicas do ano. (Origem: PRT MS/GM 183/2014, Art. 30, II)
Art. 329. Para a implantação da Vigilância da SG e da SRAG, os entes federativos observarão o parâmetro populacional descrito no Anexo XLVI . (Origem: PRT MS/GM 183/2014, Art. 31)
Art. 330. O ente federativo será desabilitado das ações de Vigilância Sentinela de SG e de SRAG na hipótese de descumprimento das metas estabelecidas nos arts. 327 e 328 , por 2 (dois) semestres consecutivos. (Origem: PRT MS/GM 183/2014, Art. 33)
Art. 331. A avaliação das ações de Vigilância Sentinela de SG e de SRAG será efetuada semestralmente pela SVS/MS, a partir do ano da habilitação, por intermédio do SIVEP-Gripe. (Origem: PRT MS/GM 183/2014, Art. 34)
Seção III
Do Serviço de Verificação de Óbito (SVO)
Art. 332. O SVO tem por atribuição promover ações que proporcionem, via autópsia, o esclarecimento da causa mortis de todos os óbitos, com ou sem assistência médica, sem elucidação diagnóstica, e em especial aqueles sob investigação epidemiológica. (Origem: PRT MS/GM 183/2014, Art. 14)
§ 1º Os SVOs estaduais e municipais compõem a Rede Nacional de Serviços de Verificação de Óbito e Esclarecimento da Causa Mortis, que integra o Sistema Nacional de Vigilância em Saúde. (Origem: PRT MS/GM 183/2014, Art. 14, § 1º)
§ 2º Os SVOs serão de abrangência regional, cuja classificação será indicada em resolução da CIB. (Origem: PRT MS/GM 183/2014, Art. 14, § 2º)
Art. 333. Para a execução de ações de SVO, o estabelecimento de saúde atenderá aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 16)
I - ter equipe composta por médico especialista em patologia como responsável técnico e auxiliar em patologia; e (Origem: PRT MS/GM 183/2014, Art. 16, I)
II - contar com suporte laboratorial para exames complementares. (Origem: PRT MS/GM 183/2014, Art. 16, II)
Art. 334. O ente federativo será desabilitado das ações e serviços de SVO, total ou parcialmente, caso seus SVO habilitados deixem de notificar, no Sistema de Informações sobre Mortalidade (SIM), registro como atestante da Declaração de Óbito (DO), pelo prazo de 6 (seis) meses consecutivos. (Origem: PRT MS/GM 183/2014, Art. 18)
§ 1º A desabilitação será total quando todos os SVOs habilitados não cumprirem o estabelecido no "caput". (Origem: PRT MS/GM 183/2014, Art. 18, § 1º)
§ 2º A desabilitação será parcial quando o descumprimento do estabelecido no "caput" não abranger todos os SVO habilitados. (Origem: PRT MS/GM 183/2014, Art. 18, § 2º)
§ 3º A desabilitação parcial será realizada de forma proporcional ao número total de SVO do ente federativo habilitado. (Origem: PRT MS/GM 183/2014, Art. 18, § 3º)
Art. 335. A avaliação do SVO será efetuada semestralmente pela SVS/MS por meio do SIM, a partir do ano seguinte ao da habilitação. (Origem: PRT MS/GM 183/2014, Art. 19)
Seção IV
Programa de Treinamento em Epidemiologia Aplicada aos Serviços do Sistema Único de Saúde - Programa EpiSUS.
(Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-A. Fica instituído o Programa de Treinamento em Epidemiologia Aplicada aos Serviços do Sistema Único de Saúde - Programa EpiSUS. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-B. O Programa EpiSUS tem como objetivo geral aprimorar a capacidade técnica de profissionais de nível superior, por meio de treinamento em serviço para atuar frente às investigações epidemiológicas, tais como surtos e emergências em saúde pública no âmbito dos serviços do Sistema Único de Saúde. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-C. São objetivos específicos do Programa EpiSUS: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
I - capacitar profissionais de nível superior em epidemiologia de campo e vigilância em saúde; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
II - desenvolver capacidade técnica-científica para colaborar na resolução de problemas de saúde pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
III - colaborar na resposta às emergências em saúde pública, principalmente em investigações de surtos; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
IV - contribuir para a difusão do conhecimento técnico-científico, por meio da comunicação científica escrita e oral, da divulgação de resultados de investigações de surtos e de outros estudos desenvolvidos durante o treinamento; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
V - colaborar no planejamento e condução de investigações epidemiológicas de surtos/epidemias e outros eventos de saúde pública, incluindo a coleta, a análise, a descrição e a interpretação de dados para orientar a rápida tomada de decisão; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
VI - direcionar as ações de prevenção e controle de eventos de importância em saúde pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
VII - colaborar e conduzir avaliações de sistemas de vigilância em saúde ou programas específicos de saúde pública e análise de dados gerados pelos sistemas de informação; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
VIII - conduzir pesquisas direcionadas às necessidades das áreas de vigilância em saúde, desenvolvendo estudos de caráter técnico-científico; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
IX - colaborar no planejamento e execução de estudos epidemiológicos, incluindo a coleta, a análise, a descrição e a interpretação de dados para orientar a tomada de decisão, de forma rápida. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-D. Para o alcance dos objetivos do Programa EpiSUS, serão realizados processos seletivos para a escolha dos participantes de cada turma de treinamento. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Parágrafo único. Os processos seletivos de que trata o caput serão realizados por meio de editais de chamada pública específicos, que estabelecerão, entre outras disposições, as condições e requisitos para a participação, a manutenção e a conclusão dos interessados no treinamento ofertado. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-E. As atividades de gestão do Programa EpiSUS ficarão a cargo do Centro de Informações Estratégicas em Vigilância em Saúde - CIEVS, instituído pela Portaria nº 30/SVS/MS, de 7 de julho de 2005, ao qual competirá: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
I - coordenar o processo seletivo dos candidatos ao Programa EpiSUS; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
II - coordenar e desenvolver as atividades formativas de acordo com a grade curricular padronizada para os programas de treinamento em epidemiologia de campo, considerando os indicadores de qualidade definidos no âmbito da Rede de Programas de Treinamento em Epidemiologia e Intervenções em Saúde Pública - TEPHINET; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
III - assegurar a participação dos profissionais em treinamento em investigações de surtos e epidemias ou situações de risco para a saúde pública com relevância local, regional, nacional ou internacional, de modo complementar ou suplementar, em articulação com as demais unidades competentes e, quando necessário, em missões do Ministério da Saúde; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
IV - propiciar oportunidades para a capacitação em investigação de surtos ou outros eventos de saúde pública. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-F. O acompanhamento e a execução de todas as etapas de realização do processo seletivo serão realizados pela Equipe de Seleção do Programa EpiSUS. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Parágrafo único. A equipe de que trata o caput será instituída por ato da Secretaria de Vigilância em Saúde - SVS/MS. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-G. Poderão se candidatar ao processo seletivo para o treinamento no EpiSUS profissionais de nível superior das seguintes áreas: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
I - Biologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
II - Biomedicina; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
III - Educação Física; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
IV - Enfermagem; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
V - Farmácia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
VI - Fisioterapia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
VII - Fonoaudiologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
VIII - Medicina; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
IX - Medicina Veterinária; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
X - Nutrição; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
XI - Odontologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
XII - Psicologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
XIII - Saúde Coletiva/Saúde Pública; ou (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
XIV - Terapia Ocupacional. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-H. Os candidatos do processo seletivo para o treinamento do Programa EpiSUS deverão preencher, além de outras disposições constantes no edital, os seguintes requisitos: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
I - possuir, pelo menos, 1 (um) curso de pós-graduação, compreendendo cursos de especialização, com carga horária igual ou superior a 360 (trezentos e sessenta) horas, residência médica, residência multidisciplinar, mestrado ou doutorado em uma das seguintes áreas: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
a) epidemiologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
b) infecção hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
c) infectologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
d) medicina preventiva e social; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
e) saúde coletiva/pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
f) saúde da família, saúde do trabalhador; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
g) vigilância em saúde; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
h) vigilância epidemiológica; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
i) vigilância hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
j) vigilância sanitária; ou (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
k) vigilância em saúde ambiental; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
II - comprovar, pelo menos, 1 (um) ano de experiência profissional em cargos de nível superior, em uma das áreas listadas no art. 335-H; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
III - estar registrado no conselho da categoria profissional correspondente (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-I. Os profissionais de áreas não elencadas no art. 335-H poderão participar do processo seletivo para o treinamento do Programa EpiSUS, desde que preencham os seguintes requisitos: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
I - possuir formação de nível superior; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
II - possuir doutorado concluído e comprovar, pelo menos, 1 (um) ano de experiência profissional em cargos de nível superior, ambos nas seguintes áreas: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
a) epidemiologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
b) infecção hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
c) infectologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
d) medicina preventiva e social; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
e) saúde coletiva/pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
f) saúde da família, saúde do trabalhador; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
g) vigilância em saúde; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
h) vigilância epidemiológica; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
i) vigilância hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
j) vigilância sanitária; ou (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
k) vigilância em saúde ambiental. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Art. 335-J. As atividades desenvolvidas no âmbito do Programa EpiSUS poderão ser compartilhadas e aprimoradas por meio da participação em eventos e cooperações internacionais relacionados à sua área de atuação. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
Parágrafo único. A participação do Ministério da Saúde em cooperações internacionais deve observar o disposto no Art. 49, inciso I, da Constituição, quando acarretar encargos ou compromissos gravosos ao patrimônio nacional. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
CAPÍTULO XIV
DA MORTALIDADE MATERNA E NEONATAL
Seção I
Da Comissão Nacional de Mortalidade Materna
Art. 336. Fica instituída a Comissão Nacional de Mortalidade Materna, de caráter técnico-consultivo, com os seguintes objetivos: (Origem: PRT MS/GM 652/2003, Art. 1º)
I - realizar diagnóstico permanente da situação da Mortalidade Materna no Brasil, enfocando todos os seus múltiplos aspectos: sociais, econômicos, políticos, jurídicos e outros que facultem ações específicas para a sua solução; (Origem: PRT MS/GM 652/2003, Art. 1º, a)
II - propor diretrizes, instrumentos legais e princípios éticos que concretizem estratégias de redução da mortalidade materna; (Origem: PRT MS/GM 652/2003, Art. 1º, b)
III - acompanhar as ações do Ministério da Saúde no processo de articulação e integração das diferentes instituições e instâncias envolvidas na questão; (Origem: PRT MS/GM 652/2003, Art. 1º, c)
IV - oferecer subsídios para aperfeiçoamento da Política Nacional de Redução da Mortalidade Materna, estabelecendo correlações com os Comitês Estaduais, Regionais e Municipais; (Origem: PRT MS/GM 652/2003, Art. 1º, d)
V - mobilizar os diversos setores da sociedade afetos à questão, com finalidade de melhorar a saúde da mulher. (Origem: PRT MS/GM 652/2003, Art. 1º, e)
Art. 337. Serão membros da Comissão Nacional de Mortalidade Materna, sob a presidência do primeiro: (Origem: PRT MS/GM 652/2003, Art. 2º)
I - Coordenador da Área Técnica Saúde da Mulher, do Departamento de Ações Programáticas Estratégicas, do Ministério da Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, a)
II - um representante do Ministério da Saúde, como Secretário Executivo; (Origem: PRT MS/GM 652/2003, Art. 2º, b)
III - um representante do Centro Nacional de Epidemiologia, da Fundação Nacional de Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, c)
IV - um representante da Secretaria Especial de Políticas para as Mulheres; (Origem: PRT MS/GM 652/2003, Art. 2º, d)
V - um representante do Ministério Público da União; (Origem: PRT MS/GM 652/2003, Art. 2º, e)
VI - um representante do Conselho Nacional de Secretários Estaduais de Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, f)
VII - um representante do Conselho Nacional de Secretários Municipais de Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, g)
VIII - um representante do Conselho Federal de Medicina; (Origem: PRT MS/GM 652/2003, Art. 2º, h)
IX - um representante do Conselho Federal de Enfermagem; (Origem: PRT MS/GM 652/2003, Art. 2º, i)
X - um representante da Federação Brasileira das Sociedades de Ginecologia e Obstetrícia; (Origem: PRT MS/GM 652/2003, Art. 2º, j)
XI - um representante da Associação Brasileira de Enfermagem Obstétrica; (Origem: PRT MS/GM 652/2003, Art. 2º, k)
XII - um representante da Rede Nacional Feminista de Saúde e Direitos Reprodutivos; (Origem: PRT MS/GM 652/2003, Art. 2º, l)
XIII - um representante do Comitê de Perinatologia da Sociedade Brasileira de Pediatria; (Origem: PRT MS/GM 652/2003, Art. 2º, m)
XIV - um técnico do notório saber e reconhecida atuação no campo de estudo, vigilância e prevenção da Mortalidade Materna, a ser escolhido pelo Ministério da Saúde. (Origem: PRT MS/GM 652/2003, Art. 2º, n)
Art. 338. Serão membros convidados da Comissão Nacional de Mortalidade Materna técnicos de organizações nacionais e internacionais com atuação no campo de saúde da mulher. (Origem: PRT MS/GM 652/2003, Art. 3º)
Seção II
Da Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal
Art. 339. Instituir a Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal, de caráter técnico-consultivo, que atuará alinhada com o período proposto para se alcançar os Objetivos do Desenvolvimento do Milênio, com os seguintes objetivos: (Origem: PRT MS/GM 427/2005, Art. 1º) (com redação dada pela PRT MS/GM 2801/2008)
I - avaliar, sistematicamente, a implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal no Brasil; (Origem: PRT MS/GM 427/2005, Art. 1º, I)
II - propor estratégias de ação, diretrizes, instrumentos legais e princípios éticos que concretizem a implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal; (Origem: PRT MS/GM 427/2005, Art. 1º, II)
III - acompanhar as ações dos gestores em esfera federal, estadual e municipal no processo de implementação dos compromissos assumidos e na articulação e integração das diferentes instituições e instâncias envolvidas na implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal; e (Origem: PRT MS/GM 427/2005, Art. 1º, III)
IV - divulgar as ações desenvolvidas com o objetivo de efetivar o Pacto em questão. (Origem: PRT MS/GM 427/2005, Art. 1º, IV)
Art. 340. A Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal será coordenada pela Secretaria de Atenção à Saúde, e terá a seguinte composição: (Origem: PRT MS/GM 427/2005, Art. 2º)
I - Ministério da Saúde: (Origem: PRT MS/GM 427/2005, Art. 2º, I)
a) Departamento de Ações Programáticas Estratégicas da Secretaria de Atenção à Saúde (DAPES/SAS/MS) - 4 (quatro) representantes; (Origem: PRT MS/GM 427/2005, Art. 2º, I, a)
b) Secretaria de Vigilância em Saúde (SVS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, b)
c) Secretaria de Gestão Estratégica e Participativa (SGEP/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, c)
d) Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, d)
e) Secretaria Especial de Saúde Indígena (SESAI/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, f) (com redação dada pela PRT MS/GM 2801/2008)
f) Agência Nacional de Saúde Suplementar (ANS) - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, I, g)
g) Departamento de Atenção Básica da Secretaria de Atenção à Saúde (DAB/SAS/MS) - 1 (um) representante; e (Origem: PRT MS/GM 427/2005, Art. 2º, I, h) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
h) Departamento de Atenção Especializada e Temática da Secretaria de Atenção à Saúde (DAET/SAS/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, i) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
II - Secretaria Especial de Políticas para as Mulheres - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, II)
III - Secretaria Especial para Políticas de Promoção da Igualdade Racial - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, III)
IV - Secretaria Especial dos Direitos Humanos - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, IV)
V - Conselho Nacional de Secretários de Saúde - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, V)
VI - Conselho Nacional de Secretários Municipais de Saúde - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, VI)
VII - Conselho Nacional dos Direitos da Criança e do Adolescente - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, VII)
VIII - Conselho Federal de Medicina - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, VIII)
IX - Associação Médica Brasileira - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, IX)
X - Federação Brasileira das Associações de Ginecologia e Obstetrícia - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, X)
XI - Sociedade Brasileira de Pediatria - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XI)
XII - Rede Nacional de Bancos de Leite Humano - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XII)
XIII - Pastoral da Criança - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XIII)
XIV - Associação Brasileira de Enfermagem - 1 (um) representante (Origem: PRT MS/GM 427/2005, Art. 2º, XIV)
XV - Associação Brasileira de Enfermagem Obstétrica - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XV)
XVI - Rede Nacional Feminista de Saúde e Direitos Reprodutivos - um representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XVI)
XVII - Articulação de Mulheres do Brasil - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XVII)
XVIII - Confederação de Mulheres do Brasil - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XVIII)
XIX - Articulação de ONG de mulheres Negras - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XIX)
XX - Rede pela Humanização do Parto e Nascimento - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XX)
XXI - Rede Nacional de Parteiras Tradicionais - 1 (um) representante; e (Origem: PRT MS/GM 427/2005, Art. 2º, XXI)
XXII - Associação Brasileira de Pós-Graduação em Saúde Coletiva - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, XXII)
XXIII - Ministério da Defesa - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXIII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXIV - Ministério do Desenvolvimento Social e Agrário - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXIV) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXV - Ministério da Educação - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXV) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXVI - Secretaria Nacional de Juventude - um representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXVI) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXVII - Federação Nacional dos Médicos - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXVII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXVIII - Senado Federal - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXVIII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXIX - Câmara dos Deputados - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXIX) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXX - Conselho Federal de Psicologia - um representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXX) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXI - União Brasileira dos Estudantes Secundaristas - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXXI) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXII - União Nacional dos Estudantes - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXXII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXIII - Rede de Saúde Perinatal Norte e Nordeste - um representante; e (Origem: PRT MS/GM 427/2005, Art. 2º, XXXIII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXIV - Rede Amamenta Brasil - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, XXXIV) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXV - Coordenação da Política Nacional de Humanização (HumanizaSUS) - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, XXXV) (dispositivo acrescentado pela )
Art. 341. Serão membros convidados da Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal os seguintes representantes: (Origem: PRT MS/GM 427/2005, Art. 3º)
I - do Fundo das Nações Unidas para a População (FNUAP), da Organização Pan Americana da Saúde (OPAS); (Origem: PRT MS/GM 427/2005, Art. 3º, I)
II - do Fundo das Nações Unidas para a Infância (UNICEF), do Centro Cochrane do Brasil/UNIFESP; e (Origem: PRT MS/GM 427/2005, Art. 3º, II)
III - da Rede Internacional em defesa do Direito de Amamentar e da Aliança Mundial para o Aleitamento Materno. (Origem: PRT MS/GM 427/2005, Art. 3º, III)
Art. 342. O Regimento Interno da Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal será publicado em ato da Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 427/2005, Art. 4º)
CAPÍTULO XV
DOS COMITÊS PARA PREVENÇÃO E CONTROLE DA RESISTÊNCIA AOS ANTIMICROBIANOS E USO RACIONAL DE ANTIMICROBIANOS
Seção I
Do Comitê para Elaboração e Condução do Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos (CIPAN)
Art. 343. Fica instituído o Comitê encarregado da elaboração e condução do componente do setor saúde do Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos (CIPAN), no âmbito do Ministério da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 1º)
Art. 344. O CIPAN é uma instância colegiada de caráter deliberativo e permanente, vinculado tecnicamente à Secretaria de Vigilância em Saúde, do Ministério da Saúde (SVS/MS), que contará com respaldo da Secretaria-Executiva na articulação e mobilização dos demais órgãos do Ministério da Saúde para o pleno desenvolvimento de suas funções. (Origem: PRT MS/GM 2775/2016, Art. 2º)
Art. 345. Compete ao Comitê: (Origem: PRT MS/GM 2775/2016, Art. 3º)
I - coordenar as ações para a elaboração do componente do setor saúde do Plano de Ação Nacional (PAN), no âmbito do Ministério da Saúde, em conformidade com o Plano de Ação Global sobre Resistência Antimicrobiana (WHA 68.7) aprovado na 68ª Assembleia Mundial de Saúde; (Origem: PRT MS/GM 2775/2016, Art. 3º, I)
II - propor ações de vigilância, proteção, monitoramento, controle e prevenção da resistência microbiana, bem como acompanhar políticas, sugerir e elaborar propostas ao Ministro da Saúde, em assuntos relacionados a essa temática; e (Origem: PRT MS/GM 2775/2016, Art. 3º, II)
III - coordenar e avaliar as ações para a implementação e execução do PAN, no âmbito do Ministério da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 3º, III)
Art. 346. O Comitê será composto por representantes, titular e suplente, do Ministério da Saúde: (Origem: PRT MS/GM 2775/2016, Art. 4º)
I - Secretaria de Vigilância em Saúde (SVS/MS): (Origem: PRT MS/GM 2775/2016, Art. 4º, I)
a) Departamento de Vigilância das Doenças Transmissíveis (DEVIT), que o coordenará; (Origem: PRT MS/GM 2775/2016, Art. 4º, I, a)
b) Coordenação-Geral de Laboratórios de Saúde Pública (CGLAB/DEGEVS); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, b)
c) Coordenação-Geral de Doenças Transmissíveis (CGDT/DEVIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, c)
d) Coordenação-Geral do Programa Nacional de Controle da Tuberculose (CGPNCT/DEVIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, d)
e) Coordenação-Geral dos Programas Nacionais de Controle e Prevenção da Malária e das Doenças Transmitidas pelo Aedes (CGPNC/DEVIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, e)
f) Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DDAHV); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, f)
g) Departamento de Vigilância de Doenças e Agravos Não Transmissíveis e Promoção da Saúde (DANTPS); e (Origem: PRT MS/GM 2775/2016, Art. 4º, I, g)
h) Coordenação-Geral de Vigilância em Saúde Ambiental (CGVAM/DSAST); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, h)
II - Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 2775/2016, Art. 4º, II)
III - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS): (Origem: PRT MS/GM 2775/2016, Art. 4º, III)
a) Departamento de Ciência e Tecnologia (DECIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, III, a)
b) Departamento de Assistência Farmacêutica e Insumos Estratégicos(DAF); e (Origem: PRT MS/GM 2775/2016, Art. 4º, III, b)
c) Departamento de Gestão e Incorporação de Tecnologias em Saúde (DGITS); (Origem: PRT MS/GM 2775/2016, Art. 4º, III, c)
IV - Secretaria de Atenção à Saúde (SAS/MS): (Origem: PRT MS/GM 2775/2016, Art. 4º, IV)
a) Departamento de Atenção Especializada e Temática (DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, a)
b) Coordenação-Geral de Atenção Especializada (CGAE/DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, b)
c) Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, c)
d) Coordenação-Geral de Urgência e Emergência (CGUE/DAHU); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, d)
e) Coordenação-Geral do Sistema Nacional de Transplantes (CGSNT/DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, e)
f) Departamento de Atenção Hospitalar e de Urgência (DAHU): (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, f)
g) Coordenação-Geral de Atenção Hospitalar (CGHOSP/DAHU); e (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, g)
h) Departamento de Atenção Básica (DAB); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, h)
V - Gabinete do Ministro; (Origem: PRT MS/GM 2775/2016, Art. 4º, V)
a) Assessoria de Assuntos Internacionais de Saúde (AISA); e (Origem: PRT MS/GM 2775/2016, Art. 4º, V, a)
b) Assessoria de Comunicação Social (ASCOM); (Origem: PRT MS/GM 2775/2016, Art. 4º, V, b)
VI - Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2775/2016, Art. 4º, VI)
§ 1º Nos afastamentos dos titulares que integram o Comitê estes serão substituídos pelos respectivos suplentes. (Origem: PRT MS/GM 2775/2016, Art. 4º, § 2º)
§ 2º Os integrantes da CIPAN serão designados em ato específico do Ministro da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 4º, § 3º)
Art. 347. Caberá ao Coordenador Executivo planejar e organizar as atividades do Comitê. (Origem: PRT MS/GM 2775/2016, Art. 5º)
Art. 348. O Comitê poderá solicitar a contribuição de servidores dos órgãos do Ministério da Saúde e entidades a ele vinculadas, bem como servidores de outros órgãos e entidades da Administração Pública Federal, especialistas em assuntos ligados ao tema e representantes dos movimentos sociais, cuja presença seja considerada de relevância, nesta Seção. (Origem: PRT MS/GM 2775/2016, Art. 6º)
Art. 349. O CIPAN, no desenvolvimento de suas atribuições, poderá constituir grupos técnicos para tratar de temas específicos. (Origem: PRT MS/GM 2775/2016, Art. 7º)
Art. 350. As despesas decorrentes da execução das atividades do CIPAN correrão à conta das dotações orçamentárias das Secretarias envolvidas que fornecerão o apoio técnico e administrativo necessário ao funcionamento do comitê. (Origem: PRT MS/GM 2775/2016, Art. 8º)
Art. 351. O Comitê fará proposta de regimento interno, no prazo máximo de 30 (trinta) dias, contados a partir da data de publicação da Portaria nº 2775/GM/MS, de 22 de dezembro de 2016. (Origem: PRT MS/GM 2775/2016, Art. 9º)
Parágrafo Único. O regimento interno de que trata o "caput" será homologado por ato específico do Ministro de Estado da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 9º, Parágrafo Único)
Art. 352. As funções desempenhadas no âmbito do Comitê de que trata esta Seção não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2775/2016, Art. 10)
Seção II
Do Comitê Técnico Assessor para Uso Racional de Antimicrobiano e Resistência Microbiana (Curarem)
Art. 353. Fica instituído o Comitê Técnico Assessor para Uso Racional de Antimicrobiano e Resistência Microbiana (Curarem), com caráter consultivo sobre aspectos técnicos e científicos necessários à definição de diretrizes nacionais para a vigilância, prevenção e controle da disseminação da resistência microbiana, comunitária e hospitalar, bem como no acompanhamento e avaliação das ações desenvolvidas pelo Ministério da Saúde. (Origem: PRT MS/GM 1133/2005, Art. 1º)
Art. 354. O Curarem será composto pelas seguintes instituições: (Origem: PRT MS/GM 1133/2005, Art. 2º)
I - Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, I)
II - Agência Nacional de Vigilância Sanitária (ANVISA/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, II)
III - Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, III)
IV - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, IV) (com redação dada pela )
V - Associação Brasileira de Pós-Graduação em Saúde Coletiva (Abrasco); (Origem: PRT MS/GM 1133/2005, Art. 2º, V) (com redação dada pela )
VI - Associação Brasileira dos Profissionais em Controle de Infecção e Epidemiologia Hospitalar (ABIH); (Origem: PRT MS/GM 1133/2005, Art. 2º, VI) (com redação dada pela )
VII - Sociedade Brasileira de Infectologia (SBI); (Origem: PRT MS/GM 1133/2005, Art. 2º, VII) (com redação dada pela )
VIII - Sociedade Brasileira de Medicina Tropical (SBMT); (Origem: PRT MS/GM 1133/2005, Art. 2º, VIII) (com redação dada pela )
IX - Sociedade Brasileira de Patologia Clínica (SBPC); (Origem: PRT MS/GM 1133/2005, Art. 2º, IX) (com redação dada pela )
X - Sociedade Brasileira de Microbiologia (SBM); (Origem: PRT MS/GM 1133/2005, Art. 2º, X) (com redação dada pela )
XI - Sociedade Brasileira de Farmácia Hospitalar (SBRAFH); (Origem: PRT MS/GM 1133/2005, Art. 2º, XI) (com redação dada pela )
XII - Associação Brasileira de Odontologia (ABO); (Origem: PRT MS/GM 1133/2005, Art. 2º, XII) (com redação dada pela )
§ 1º No desenvolvimento de suas atribuições, o Comitê poderá, a seu critério, solicitar apoio aos seguintes Ministérios e organizações de abrangência internacional: (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º)
I - Ministério da Agricultura, Pecuária e Abastecimento (MAPA); (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, I)
II - Ministério da Educação (MEC); (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, II)
III - Organização Pan-Americana da Saúde (OPAS); (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, III)
IV - Sociedade Pan Americana de Infectologia; e (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, IV)
V - Sociedade Pan Americana de Controle de Infecção Hospitalar. (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, V)
§ 2º Os membros do Curarem deverão declarar a existência de conflito de interesses com suas atividades públicas ou privadas no debate dos temas pertinentes ao comitê, sendo que, na eventualidade da existência de conflito de interesses, os membros deverão abster-se de participar da discussão sobre o tema. (Origem: PRT MS/GM 1133/2005, Art. 2º, § 2º)
Art. 355. As instituições deverão indicar formalmente 1 (um) representante titular e 1 (um) representante suplente. (Origem: PRT MS/GM 1133/2005, Art. 3º)
Parágrafo Único. Sempre que houver mudança de representante, do mandato ou do dirigente das instituições, as indicações devem ser refeitas conforme o disposto no caput deste artigo. (Origem: PRT MS/GM 1133/2005, Art. 3º, Parágrafo Único)
Art. 356. Compete ao Curarem: (Origem: PRT MS/GM 1133/2005, Art. 4º)
I - assessorar o Ministério da Saúde no estabelecimento de diretrizes e definições de estratégias de atuação para a vigilância, a prevenção e o controle da emergência e disseminação da resistência microbiana comunitária e hospitalar; (Origem: PRT MS/GM 1133/2005, Art. 4º, I)
II - avaliar o impacto das ações de vigilância, prevenção e controle da emergência e disseminação da resistência microbiana no País; (Origem: PRT MS/GM 1133/2005, Art. 4º, II)
III - recomendar temas para pesquisas no campo da resistência microbiana comunitária e hospitalar; (Origem: PRT MS/GM 1133/2005, Art. 4º, III)
IV - avaliar estratégias para vigilância, prevenção e controle da emergência e disseminação da resistência microbiana no País; (Origem: PRT MS/GM 1133/2005, Art. 4º, IV)
V - subsidiar a implantação da Rede Nacional de Monitoramento de Resistência Microbiana; (Origem: PRT MS/GM 1133/2005, Art. 4º, V)
VI - analisar informações sobre a existência de produtos no mercado que favorecem a emergência e a disseminação da resistência microbiana no País com emissão de recomendação para a Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 1133/2005, Art. 4º, VI)
VII - sugerir a composição de comissões técnicas especiais para apreciações e pareceres que exigirem estudos específicos e mais aprofundados; e (Origem: PRT MS/GM 1133/2005, Art. 4º, VII)
VIII - contribuir na elaboração e/ou na revisão das normas técnicas relativas à resistência microbiana. (Origem: PRT MS/GM 1133/2005, Art. 4º, VIII)
Art. 357. O Curarem será coordenado pelo representante do Ministério da Saúde e/ou por seu substituto, que terá as seguintes competências: (Origem: PRT MS/GM 1133/2005, Art. 5º)
I - coordenar as reuniões; (Origem: PRT MS/GM 1133/2005, Art. 5º, I)
II - indicar um técnico para desenvolver atividades da secretaria-executiva; (Origem: PRT MS/GM 1133/2005, Art. 5º, II)
III - encaminhar atas e relatórios para apreciação dos membros do Curarem; (Origem: PRT MS/GM 1133/2005, Art. 5º, III)
IV - submeter à apreciação e aprovação das instituições do Ministério da Saúde as recomendações oriundas das reuniões ordinárias e extraordinárias; e (Origem: PRT MS/GM 1133/2005, Art. 5º, IV)
V - convocar reuniões extraordinárias e de caráter emergencial. (Origem: PRT MS/GM 1133/2005, Art. 5º, V)
Art. 358. Os membros do Curarem terão as seguintes competências: (Origem: PRT MS/GM 1133/2005, Art. 6º)
I - representar sua instituição nas reuniões ordinárias e extraordinárias do Curarem; (Origem: PRT MS/GM 1133/2005, Art. 6º, I)
II - discutir, nas suas instituições, os temas pautados no comitê; (Origem: PRT MS/GM 1133/2005, Art. 6º, II)
III - identificar, analisar a apresentar materiais técnicos científicos, bem como discutir as matérias submetidas ao Curarem; (Origem: PRT MS/GM 1133/2005, Art. 6º, III)
IV - propor ao Coordenador, com antecedência mínima de 20 (vinte) dias, a convocação de reuniões extraordinárias, com o objetivo de tratar de assuntos relevantes ou de urgência que não possam aguardar a ordinária; (Origem: PRT MS/GM 1133/2005, Art. 6º, IV)
V - indicar ao Coordenador, quando pertinente e relevante, pessoas ou representantes de entidades públicas ou privadas, a fim de compor grupos técnicos para temas específicos; (Origem: PRT MS/GM 1133/2005, Art. 6º, V)
VI - acompanhar a situação epidemiológica da disseminação da resistência microbiana no País; e (Origem: PRT MS/GM 1133/2005, Art. 6º, VI)
VII - promover a discussão e a articulação institucional no processo de aperfeiçoamento das ações de vigilância, de prevenção e de controle da disseminação da resistência microbiana comunitária e hospitalar no País. (Origem: PRT MS/GM 1133/2005, Art. 6º, VII)
Art. 359. O Curarem reunir-se-á ordinariamente três vezes por ano ou, extraordinariamente quando convocado pelo seu Coordenador, sendo que a reuniões serão realizadas somente com a presença de, no mínimo, cinquenta por cento mais um dos seus membros. (Origem: PRT MS/GM 1133/2005, Art. 7º)
§ 1º Em situações de impossibilidade de comparecimento às reuniões ordinárias ou extraordinárias, os representantes titulares e suplentes do Curarem não poderão enviar substitutos. (Origem: PRT MS/GM 1133/2005, Art. 7º, § 1º)
§ 2º As instituições faltosas poderão ser destituídas do Curarem, a partir da segunda ausência sem justificativa formal. (Origem: PRT MS/GM 1133/2005, Art. 7º, § 2º)
Art. 360. As reuniões ordinárias e extraordinárias serão realizadas em Brasília ou em local a ser definido por decisão do coordenador. (Origem: PRT MS/GM 1133/2005, Art. 8º)
CAPÍTULO XVI
DO PLANO NACIONAL DE ASSISTÊNCIA À CRIANÇA COM CARDIOPATIA CONGÊNITA
Art. 361. Fica aprovado o Plano Nacional de Assistência à Criança com Cardiopatia Congênita, com o objetivo de estabelecer diretrizes e integrar ações que favoreçam o acesso ao diagnóstico, ao tratamento e à reabilitação da criança e do adolescente com cardiopatia congênita, bem como a redução da morbimortalidade desse público. (Origem: PRT MS/GM 1727/2017, Art. 1º)
Parágrafo Único. O Plano será disponibilizado no endereço eletrônico www.saude.gov.br/sas. (Origem: PRT MS/GM 1727/2017, Art. 1º, Parágrafo Único)
Art. 362. O Plano visa orientar a organização da assistência à criança com cardiopatia congênita, de modo a proporcionar o cuidado integral da criança em todas as etapas: pré-natal, nascimento, assistência cardiovascular e seguimento. (Origem: PRT MS/GM 1727/2017, Art. 2º)
Parágrafo Único. O Plano está estruturado nos seguintes eixos: (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único)
I - diagnóstico pré-natal; (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, I)
II - diagnóstico no período neonatal; (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, II)
III - transporte seguro de recém-nascidos e crianças cardiopatas; (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, III)
IV - assistência cirúrgica; e (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, IV)
V - assistência multidisciplinar. (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, V)
Art. 363. Para assegurar a sua implementação, o Plano: (Origem: PRT MS/GM 1727/2017, Art. 3º)
I - define as responsabilidades dos gestores do SUS envolvidos; (Origem: PRT MS/GM 1727/2017, Art. 3º, I)
II - determina diretrizes de financiamento; (Origem: PRT MS/GM 1727/2017, Art. 3º, II)
III - estabelece estratégias para o monitoramento, avaliação e controle; e (Origem: PRT MS/GM 1727/2017, Art. 3º, II-A)
IV - propõe recomendações para formação e capacitação. (Origem: PRT MS/GM 1727/2017, Art. 3º, III)
TÍTULO III
DA SAÚDE DE SEGMENTOS POPULACIONAIS
CAPÍTULO I
DA SAÚDE DOS POVOS INDÍGENAS
Seção I
Da Estratégia Atenção Integrada às Doenças Prevalentes na Infância (Estratégia AIDPI) e sua Implementação e Execução no Âmbito do Subsistema de Atenção à Saúde Indígena (SasiSUS)
Subseção I
Das Disposições Preliminares
(Origem: PRT MS/GM 1397/2017, CAPÍTULO I)
Art. 364. Esta Seção dispõe sobre a Estratégia Atenção Integrada às Doenças Prevalentes na Infância (Estratégia AIDPI), sua implementação e execução no âmbito do Subsistema de Atenção à Saúde Indígena SasiSUS. (Origem: PRT MS/GM 1397/2017, Art. 1º)
Art. 365. A Estratégia AIDPI, desenvolvida originalmente pela Organização Mundial da Saúde (OMS) e pelo Fundo das Nações Unidas para a Infância e a Adolescência (UNICEF), caracteriza-se pela consideração da atenção à saúde na infância, simultânea e integrada do conjunto de doenças de maior prevalência na infância. (Origem: PRT MS/GM 1397/2017, Art. 2º)
Art. 366. A Estratégia AIDPI tem por objetivo: (Origem: PRT MS/GM 1397/2017, Art. 3º)
I - identificar sinais clínicos que permitam fazer uma triagem rápida quanto à natureza da atenção requerida pela criança, como encaminhamento urgente a um hospital, tratamento ambulatorial ou orientação para cuidados e vigilância no domicílio; (Origem: PRT MS/GM 1397/2017, Art. 3º, I)
II - ampliar e qualificar as ações de atenção integral à saúde das crianças; e (Origem: PRT MS/GM 1397/2017, Art. 3º, II)
III - diminuir a morbimortalidade de crianças de 0 (zero) a 4 (quatro) anos 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 1397/2017, Art. 3º, III)
Art. 367. São pilares básicos da Estratégia AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 4º)
I - educação permanente dos profissionais de saúde indígena no nível da Atenção Básica; (Origem: PRT MS/GM 1397/2017, Art. 4º, I)
II - reorganização e adaptação dos serviços de saúde e processos de trabalhos em áreas indígenas; e (Origem: PRT MS/GM 1397/2017, Art. 4º, II)
III - educação em saúde na família e nas comunidades. (Origem: PRT MS/GM 1397/2017, Art. 4º, III)
Art. 368. As condutas preconizadas pela Estratégia AIDPI incorporam as normas do Ministério da Saúde relativas à promoção, à prevenção e ao tratamento dos problemas infantis mais frequentes, a saber: (Origem: PRT MS/GM 1397/2017, Art. 5º)
I - aleitamento materno; (Origem: PRT MS/GM 1397/2017, Art. 5º, I)
II - promoção de alimentação saudável; (Origem: PRT MS/GM 1397/2017, Art. 5º, II)
III - crescimento e desenvolvimento infantil; (Origem: PRT MS/GM 1397/2017, Art. 5º, III)
IV - imunização; e (Origem: PRT MS/GM 1397/2017, Art. 5º, IV)
V - desnutrição, anemia, doenças diarreicas, infecções respiratórias agudas, malária, problemas de ouvido, dor de garganta, prevenção da violência, dentre outros. (Origem: PRT MS/GM 1397/2017, Art. 5º, V)
§ 1º O acompanhamento do crescimento e desenvolvimento infantil deve ser priorizado pelas Equipes Multidisciplinares de Saúde Indígena, pois compreende todas as atividades relacionadas à promoção do desenvolvimento saudável da criança e à detecção de problemas no atraso do desenvolvimento neuropsicomotor. (Origem: PRT MS/GM 1397/2017, Art. 5º, § 1º)
§ 2º Para dar seguimento aos tratamentos dos problemas infantis, cabe as Equipes Multidisciplinares de Saúde Indígena fazer os arranjos necessários para que as consultas de retorno ou visitas domiciliares de acompanhamento da criança doente sejam realizadas. (Origem: PRT MS/GM 1397/2017, Art. 5º, § 2º)
Subseção II
Da Implementação da Estratégia AIDPI
(Origem: PRT MS/GM 1397/2017, CAPÍTULO II)
Art. 369. A implementação da Estratégia AIDPI no âmbito do Distritos Sanitários Especiais Indígenas DSEI/SESAI/MS, será realizada por meio das seguintes etapas: (Origem: PRT MS/GM 1397/2017, Art. 6º)
I - ações de capacitação de profissionais de saúde; (Origem: PRT MS/GM 1397/2017, Art. 6º, I)
II - reorganização dos serviços de saúde e processos de trabalho das Equipes Multidisciplinares de Saúde Indígena - EMSI; e (Origem: PRT MS/GM 1397/2017, Art. 6º, II)
III - realização das visitas de seguimento e avaliação da implementação da estratégia. (Origem: PRT MS/GM 1397/2017, Art. 6º, III)
Parágrafo Único. A visita de seguimento permite a análise e os encaminhamentos para a resolução dos problemas encontrados pelos profissionais de saúde na aplicação da estratégia. (Origem: PRT MS/GM 1397/2017, Art. 6º, Parágrafo Único)
Art. 370. A implementação da Estratégia AIDPI será: (Origem: PRT MS/GM 1397/2017, Art. 7º)
I - coordenada pela Coordenação-Geral de Atenção Primária à Saúde Indígena (CGAPSI/DASI/SESAI/MS); (Origem: PRT MS/GM 1397/2017, Art. 7º, I)
II - apoiada pela Coordenação-Geral de Saúde da Criança e Aleitamento Materno (CGSCAM/DAPES/SAS); e (Origem: PRT MS/GM 1397/2017, Art. 7º, II)
III - executada pelos DSEI/SESAI/MS. (Origem: PRT MS/GM 1397/2017, Art. 7º, III)
Subseção III
Dos Profissionais e sua Capacitação
(Origem: PRT MS/GM 1397/2017, CAPÍTULO III)
Art. 371. São profissionais envolvidos na AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 8º)
I - profissional do nível operacional: médico ou enfermeiro que atua nos serviços de saúde, priorizando os integrantes da Equipe Multidisciplinar de Saúde Indígena - EMSI; (Origem: PRT MS/GM 1397/2017, Art. 8º, I)
II - docente: profissional que é professor de escolas de Medicina ou de Enfermagem, que participa de cursos de AIDPI; (Origem: PRT MS/GM 1397/2017, Art. 8º, II)
III - multiplicador/facilitador: profissional que atua como professor nos diversos cursos da Estratégia ADIPI Criança, AIDPI Neonatal e AIDPI Comunitário Materno Infantil, devidamente capacitado por meio de curso específico; e (Origem: PRT MS/GM 1397/2017, Art. 8º, III)
IV - cofacilitador: profissional capacitado em curso de multiplicador, mas que não atuou em nenhum curso. (Origem: PRT MS/GM 1397/2017, Art. 8º, IV)
Parágrafo Único. Além dos multiplicadores/facilitadores, os demais profissionais de saúde, devidamente capacitados, a exemplo dos nutricionistas e farmacêuticos, poderão atuar de forma complementar para atenção integral às crianças. (Origem: PRT MS/GM 1397/2017, Art. 8º, Parágrafo Único)
Art. 372. Os profissionais envolvidos na AIDPI deverão realizar curso de capacitação, pelos multiplicadores/facilitadores, recebendo os materiais pedagógicos e as devidas orientações referentes à metodologia a ser utilizada durante a capacitação. (Origem: PRT MS/GM 1397/2017, Art. 9º)
Subseção IV
Das Atribuições dos Órgãos e Agentes Envolvidos
(Origem: PRT MS/GM 1397/2017, CAPÍTULO IV)
Art. 373. São atribuições da CGAPSI/SESAI/MS em parceria com a CGSCAM/DAPES/SAS/MS: (Origem: PRT MS/GM 1397/2017, Art. 10)
I - estimular e assessorar os DSEI/SESAI/MS na implantação e implementação da Estratégia AIDPI; (Origem: PRT MS/GM 1397/2017, Art. 10, I)
II - promover oficinas de revisão técnica, atualização e adaptações do material didático utilizado nos cursos de capacitação, pela equipe AIDPI nacional de referência; (Origem: PRT MS/GM 1397/2017, Art. 10, II)
III - monitorar a implantação da estratégia e acompanhar os indicadores de atenção à saúde da criança estabelecidos pactuados no Plano Nacional de Saúde Indígena; e (Origem: PRT MS/GM 1397/2017, Art. 10, III)
IV - formar e atualizar multiplicadores da AIDPI. (Origem: PRT MS/GM 1397/2017, Art. 10, IV)
Art. 374. São atribuições dos DSEI/SESAI/MS: (Origem: PRT MS/GM 1397/2017, Art. 11)
I - executar a AIDPI em conformidade com o perfil epidemiológico, priorizando-se áreas de maior vulnerabilidade para implementação da estratégia; (Origem: PRT MS/GM 1397/2017, Art. 11, I)
II - priorizar a Estratégia AIDPI como ferramenta para reorganização do serviço e a redução da morbimortalidade infantil; (Origem: PRT MS/GM 1397/2017, Art. 11, II)
III - garantir insumos e medicamentos essenciais recomendados para a implementação da Estratégia AIDPI; (Origem: PRT MS/GM 1397/2017, Art. 11, III)
IV - garantir recursos financeiros e logísticos para a capacitação de profissionais; (Origem: PRT MS/GM 1397/2017, Art. 11, IV)
V - apoiar os multiplicadores da estratégia ou profissionais capacitados para realização de visitas periódicas de monitoramento; (Origem: PRT MS/GM 1397/2017, Art. 11, V)
VI - apoiar os profissionais da EMSI na resolução dos problemas identificados durante a utilização da estratégia; (Origem: PRT MS/GM 1397/2017, Art. 11, VI)
VII - inserir e manter atualizados os dados necessários para o cálculo dos indicadores de atenção à saúde da criança indígena estabelecidos nos instrumentos de gestão; e (Origem: PRT MS/GM 1397/2017, Art. 11, VII)
VIII - manter articulação com a rede de serviços de saúde com o objetivo de garantir a atenção de média e alta complexidade. (Origem: PRT MS/GM 1397/2017, Art. 11, VIII)
Parágrafo Único. O DSEI/SESAI/MS deverá se articular, para a garantia da atenção integral à saúde das crianças indígenas, com a rede de saúde levando-se em consideração a organização regional e a hierarquização da rede assistencial, com a participação complementar dos Estados, Distrito Federal e Municípios e das demais instâncias de gestão e controle social do SUS. (Origem: PRT MS/GM 1397/2017, Art. 11, Parágrafo Único)
Art. 375. São atribuições dos profissionais multiplicadores/facilitadores na Estratégia AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 12)
I - apoiar o planejamento para implantação e implementação da estratégia; (Origem: PRT MS/GM 1397/2017, Art. 12, I)
II - promover, com apoio da DASI/SESAI/MS, a capacitação das equipes multidisciplinares de saúde indígena; e (Origem: PRT MS/GM 1397/2017, Art. 12, II)
III - realizar visitas de seguimento para avaliação da estratégia. (Origem: PRT MS/GM 1397/2017, Art. 12, III)
Subseção V
Da Composição da AIDIPI
(Origem: PRT MS/GM 1397/2017, CAPÍTULO V)
Art. 376. Para fins da implementação, a Estratégia AIDPI é composta por três componentes: (Origem: PRT MS/GM 1397/2017, Art. 13)
I - AIDPI Neonatal; (Origem: PRT MS/GM 1397/2017, Art. 13, I)
II - AIDPI Criança; e (Origem: PRT MS/GM 1397/2017, Art. 13, II)
III - AIDPI Comunitário Materno Infantil (Origem: PRT MS/GM 1397/2017, Art. 13, III)
Art. 377. A AIDPI Neonatal compreende a atenção à mulher antes da gestação até a criança menor que 2 (dois) meses. (Origem: PRT MS/GM 1397/2017, Art. 14)
Parágrafo Único. A estratégia AIDPI Neonatal pode ser utilizada por médicos e enfermeiros, devidamente capacitados, que trabalham com gestantes, lactentes e crianças, desde o nascimento até 5 (cinco) anos (59 meses e 29 dias) de idade, na Atenção Básica. (Origem: PRT MS/GM 1397/2017, Art. 14, Parágrafo Único)
Art. 378. A AIDPI Criança compreende a atenção a criança de 2 (dois) meses a menores de 4 (quatro) anos 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 1397/2017, Art. 15)
Parágrafo Único. A estratégia AIDPI Criança pode ser utilizada por médicos e enfermeiros, devidamente capacitados, que trabalham com gestantes, lactentes e crianças, desde o nascimento até 5 (cinco) anos (59 meses e 29 dias) de idade, na Atenção Básica. (Origem: PRT MS/GM 1397/2017, Art. 15, Parágrafo Único)
Art. 379. A AIDPI Comunitário Materno Infantil compreende a atenção à mulher antes da gestação até as crianças menores de 4 (quatro) anos 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 1397/2017, Art. 16)
Parágrafo Único. A estratégia AIDPI Comunitário Materno Infantil pode ser utilizada por agentes indígenas de saúde e técnicos de enfermagem devidamente capacitados. (Origem: PRT MS/GM 1397/2017, Art. 16, Parágrafo Único)
Subseção VI
Das Disposições Finais
(Origem: PRT MS/GM 1397/2017, CAPÍTULO VI)
Art. 380. São indicadores estratégicos para acompanhamento dos resultados da implementação da AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 17)
I - taxa de mortalidade infantil; (Origem: PRT MS/GM 1397/2017, Art. 17, I)
II - taxa de mortalidade neonatal; (Origem: PRT MS/GM 1397/2017, Art. 17, II)
III - taxa de mortalidade materna; (Origem: PRT MS/GM 1397/2017, Art. 17, III)
IV - incidência de déficit nutricional em menores de 5 (cinco) anos; (Origem: PRT MS/GM 1397/2017, Art. 17, IV)
V - incidência de baixo peso em gestantes; (Origem: PRT MS/GM 1397/2017, Art. 17, V)
VI - proporção de crianças indígenas de 1 (um) a 4 (quatro) anos com esquema vacinal completo; (Origem: PRT MS/GM 1397/2017, Art. 17, VI)
VII - proporção de crianças indígenas menores de 1 (um) ano com esquema vacinal completo; (Origem: PRT MS/GM 1397/2017, Art. 17, VII)
VIII - proporção de atendimentos de pré-natal; (Origem: PRT MS/GM 1397/2017, Art. 17, VIII)
IX - proporção de óbitos infantis investigados; e (Origem: PRT MS/GM 1397/2017, Art. 17, IX)
X - proporção de óbitos maternos investigados. (Origem: PRT MS/GM 1397/2017, Art. 17, X)
Art. 381. A Estratégia AIDPI será detalhada em manual específico disponibilizado pelo Ministério da Saúde. (Origem: PRT MS/GM 1397/2017, Art. 18)
Art. 382. Os insumos e medicamentos essenciais para a implementação da Estratégia AIDPI serão os listados nos Anexos XLVII e XLVIII . (Origem: PRT MS/GM 1397/2017, Art. 19)
Seção II
Do Calendário Nacional de Vacinação, o Calendário Nacional de Vacinação dos Povos Indígenas e as Campanhas Nacionais de Vacinação
Art. 383. Esta Seção define o Calendário Nacional de Vacinação, o Calendário Nacional de Vacinação dos Povos Indígenas e as Campanhas Nacionais de Vacinação, no âmbito do Programa Nacional de Imunizações (PNI), em todo o território nacional. (Origem: PRT MS/GM 1533/2016, Art. 1º)
Art. 384. Os Calendários e as Campanhas Nacionais de Vacinação têm por objetivo o controle, a eliminação e a erradicação de doenças imunopreveníveis. (Origem: PRT MS/GM 1533/2016, Art. 2º)
§ 1º O Calendário Nacional de Vacinação será adotado de acordo com o disposto no Anexo LVIII , observada a Instrução Normativa do Calendário Nacional de Vacinação de que trata o Anexo LXI . (Origem: PRT MS/GM 1533/2016, Art. 2º, § 1º)
§ 2º O Calendário Nacional de Vacinação dos Povos Indígenas será adotado de acordo com o disposto no Anexo LIX , observada a Instrução Normativa do Calendário Nacional de Vacinação dos Povos Indígenas de que trata o Anexo LXII . (Origem: PRT MS/GM 1533/2016, Art. 2º, § 2º)
§ 3º As Campanhas Nacionais de Vacinação serão adotadas de acordo com o disposto no Anexo LX . (Origem: PRT MS/GM 1533/2016, Art. 2º, § 3º)
Art. 385. As Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios adotarão os Calendários Nacionais de Vacinação para execução das ações de vacinação. (Origem: PRT MS/GM 1533/2016, Art. 3º)
Art. 386. Compete à Secretaria Especial de Saúde Indígena (SESAI/MS) a execução das ações de vacinação nas áreas indígenas. (Origem: PRT MS/GM 1533/2016, Art. 4º)
Art. 387. O Ministério da Saúde será responsável pela aquisição e pelo fornecimento às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios das vacinas preconizadas nos Calendários e nas Campanhas Nacionais de Vacinação de que trata esta Seção. (Origem: PRT MS/GM 1533/2016, Art. 5º)
Parágrafo Único. Os insumos necessários ao atendimento dos Calendários e das Campanhas Nacionais de Vacinação, quais sejam seringas, agulhas e impressos para registro das atividades de vacinação, serão fornecidos às unidades de saúde do Sistema Único de Saúde (SUS) de acordo com as competências de cada esfera dedireção do SUS. (Origem: PRT MS/GM 1533/2016, Art. 5º, Parágrafo Único)
Art. 388. Compete às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios a gestão da Rede de Frio, observado o disposto no Capítulo III do Título VII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1533/2016, Art. 6º)
Parágrafo Único. Para fins do disposto nesta Seção, consideram-se: (Origem: PRT MS/GM 1533/2016, Art. 6º, Parágrafo Único)
I - Rede de Frio: sistema dotado de estrutura física e técnicoadministrativa, orientado pelo Programa Nacional de Imunizações (PNI), por meio de normatização (coordenação), planejamento, avaliação e financiamento, visando à manutenção adequada da Cadeia de Frio; e (Origem: PRT MS/GM 1533/2016, Art. 6º, Parágrafo Único, I)
II - Cadeia de Frio: processo logístico da Rede de Frio para conservação dos imunobiológicos, incluindo-se as etapas de recebimento, armazenamento, distribuição e transporte, de forma oportuna e eficiente, para assegurar a preservação de suas características originais. (Origem: PRT MS/GM 1533/2016, Art. 6º, Parágrafo Único, II)
Art. 389. O registro das informações quanto às vacinas administradas será feito nos instrumentos padronizados no âmbito do PNI, obedecendo-se ao fluxo e à periodicidade ali definidos, sendo responsabilidade: (Origem: PRT MS/GM 1533/2016, Art. 7º)
I - das Secretarias de Saúde do Distrito Federal e dos Municípios, no que se refere ao registro no Sistema de Informação do Programa Nacional de Imunizações (SIPNI); e (Origem: PRT MS/GM 1533/2016, Art. 7º, I)
II - da SESAI/MS, no que se refere ao registro no Sistema de Informação de Atenção à Saúde Indígena (SIASI). (Origem: PRT MS/GM 1533/2016, Art. 7º, II)
Art. 390. A comprovação da vacinação será feita por meio do cartão ou caderneta de vacinação, emitido pelas unidades de saúde públicas e privadas, devidamente credenciadas no âmbito do SUS, contendo as seguintes informações: (Origem: PRT MS/GM 1533/2016, Art. 8º)
I - dados pessoais: nome completo, data de nascimento e endereço; (Origem: PRT MS/GM 1533/2016, Art. 8º, I)
II - nome da vacina; (Origem: PRT MS/GM 1533/2016, Art. 8º, II)
III - data; (Origem: PRT MS/GM 1533/2016, Art. 8º, III)
IV - número do lote; (Origem: PRT MS/GM 1533/2016, Art. 8º, IV)
V - laboratório produtor; (Origem: PRT MS/GM 1533/2016, Art. 8º, V)
VI - unidade vacinadora; e (Origem: PRT MS/GM 1533/2016, Art. 8º, VI)
VII - nome do vacinador. (Origem: PRT MS/GM 1533/2016, Art. 8º, VII)
Parágrafo Único. O cartão ou caderneta de vacinação é um documento de caráter pessoal e intransferível, válido em todo o território nacional, sendo que sua atualização deve ser feita em conformidade com as indicações do Calendário Nacional de Vacinação. (Origem: PRT MS/GM 1533/2016, Art. 8º, Parágrafo Único)
Art. 391. Fica a Secretaria de Vigilância em Saúde (SVS/MS) autorizada a editar normas complementares esta Seção e adotar as medidas necessárias para a implantação e o cumprimento do Calendário Nacional de Vacinação, do Calendário Nacional de Vacinação dos Povos Indígenas e das Campanhas Nacionais de Vacinação. (Origem: PRT MS/GM 1533/2016, Art. 9º)
Art. 392. O Ministério da Saúde disponibilizará manual instrutivo com normatizações técnicas sobre o Calendário Nacional de Vacinação, o Calendário Nacional de Vacinação dos Povos Indígenas e as Campanhas Nacionais de Vacinação, cujo conteúdo estará disponível no endereço eletrônico www.saude.gov.br/svs. (Origem: PRT MS/GM 1533/2016, Art. 10)
CAPÍTULO II
DA SAÚDE DA PESSOA COM DEFICIÊNCIA
Seção I
Do Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência
Art. 393. Fica instituído o Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência, de caráter técnico-consultivo, com a finalidade de subsidiar o Ministério da Saúde na implementação do Plano Nacional para Pessoas com Deficiência. (Origem: PRT MS/GM 2672/2011, Art. 1º)
Art. 394. Compete ao Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência: (Origem: PRT MS/GM 2672/2011, Art. 2º)
I - estabelecer os padrões de qualidade dos serviços de reabilitação; (Origem: PRT MS/GM 2672/2011, Art. 2º, I)
II - definir os critérios de organização e de funcionamento dos serviços da rede de reabilitação, do modelo de cuidado e de gestão, por meio de transferência de tecnologia; (Origem: PRT MS/GM 2672/2011, Art. 2º, II)
III - propor e apoiar tecnicamente o Processo de Qualificação dos serviços de reabilitação; (Origem: PRT MS/GM 2672/2011, Art. 2º, III)
IV - estabelecer parâmetros para a Certificação de Qualidade dos novos serviços de reabilitação visual, auditiva, física e intelectual, bem como aos serviços já existentes, que aderirem ao Processo de Qualificação; e (Origem: PRT MS/GM 2672/2011, Art. 2º, IV)
V - propor e apoiar processos de formação e qualificação dos profissionais da rede de reabilitação, em parceria com serviços de referência definidos por critérios técnicos. (Origem: PRT MS/GM 2672/2011, Art. 2º, V)
Art. 395. Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência será composto por membros, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2672/2011, Art. 3º)
I - Gabinete do Ministro da Saúde (GM/MS); (Origem: PRT MS/GM 2672/2011, Art. 3º, I)
II - Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 2672/2011, Art. 3º, II)
III - Secretaria de Atenção à Saúde (SAS/MS): (Origem: PRT MS/GM 2672/2011, Art. 3º, III)
a) Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS); (Origem: PRT MS/GM 2672/2011, Art. 3º, III, a)
b) Departamento de Atenção Básica (DAB/SAS/MS); e (Origem: PRT MS/GM 2672/2011, Art. 3º, III, b)
c) Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 2672/2011, Art. 3º, III, c)
IV - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2672/2011, Art. 3º, IV)
V - Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2672/2011, Art. 3º, V)
VI - Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2672/2011, Art. 3º, VI)
VII - Secretaria Especial de Direitos Humanos da Presidência da República (SEDH-PR), por meio da Secretaria Nacional de Promoção dos Direitos da Pessoa com Deficiência; (Origem: PRT MS/GM 2672/2011, Art. 3º, VII)
VIII - entidades prestadoras de serviços de reabilitação auditiva: (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII)
a) Fundação de São Paulo/Centro Auditivo da Criança (DERDIC/PUC/SP); (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, a)
b) Hospital de Reabilitação de Anomalias Crânio-faciais/Centro de Pesquisas Audiológicas (Centrinho de Bauru/SP); (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, b)
c) Fundação Faculdade de Medicina (MEC/MPAS/HC); (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, c)
d) Hospital de Clinicas da Universidade de Campinas (CEPRE/Unicamp de Campinas); e (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, d)
e) Hospital de Clinicas de Porto Alegre (HC/RS). (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, e)
IX - entidades prestadoras de serviços de reabilitação física: (Origem: PRT MS/GM 2672/2011, Art. 3º, IX)
a) Associação das Pioneiras Sociais (SARAH/DF); (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, a)
b) Instituto Nacional de Traumatologia e Ortopedia (INTO/MS/ RJ); (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, b)
c) Associação de Assistência à Criança Deficiente (AACD); (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, c)
d) Associação Pestalozzi de Niterói/RJ; e (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, d)
e) Instituto de Ortopedia e Traumatologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (IOT/HC/FM/USP). (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, e)
X - entidades prestadoras de serviços de reabilitação visual: (Origem: PRT MS/GM 2672/2011, Art. 3º, X)
a) Serviço de Oftalmologia da Universidade Federal de São Paulo (UNIFESP); (Origem: PRT MS/GM 2672/2011, Art. 3º, X, a)
b) Fundação Catarinense de Educação Especial/SC; (Origem: PRT MS/GM 2672/2011, Art. 3º, X, b)
c) Fundação Dorina Nowill para Cegos/SP; e (Origem: PRT MS/GM 2672/2011, Art. 3º, X, c)
d) Associação Brasileira de Assistência ao Deficiente Visual (LARAMARA/SP). (Origem: PRT MS/GM 2672/2011, Art. 3º, X, d)
XI - entidades prestadoras de serviços de reabilitação intelectual: (Origem: PRT MS/GM 2672/2011, Art. 3º, XI)
a) Fundação Síndrome de Down de Campinas/SP; (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, a)
b) Núcleo de Assistência Integral ao Paciente Especial de Santa Catarina (NAIPE/SC); (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, b)
c) Associação de Pais e Amigos dos Excepcionais de São Paulo (APAE/SP); e (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, c)
d) Núcleo de Neurodesenvolvimento Professor Mário Coutinho, da Universidade Federal de Pelotas (UFPel/RS). (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, d)
§ 1º Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência será coordenado pelo DAPES/SAS/MS. (Origem: PRT MS/GM 2672/2011, Art. 3º, § 1º)
§ 2º A adesão dos órgãos e entidades ao Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência será realizada mediante a celebração de termo de compromisso específico. (Origem: PRT MS/GM 2672/2011, Art. 3º, § 2º)
§ 3º Desde que haja consenso entre os membros, o Comitê poderá convidar servidores de outros órgãos e entidades públicas, de entidades não-governamentais, bem como especialistas em assuntos ligados ao tema, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 2672/2011, Art. 3º, § 3º)
Art. 396. Ao DAPES/SAS/MS, na qualidade de coordenador do Comitê de que trata esta Seção, compete: (Origem: PRT MS/GM 2672/2011, Art. 4º)
I - convocar e coordenar as reuniões e organizar suas pautas; (Origem: PRT MS/GM 2672/2011, Art. 4º, I)
II - disponibilizar os recursos necessários para a viabilização dos trabalhos do Comitê e seus Grupos de Trabalho; (Origem: PRT MS/GM 2672/2011, Art. 4º, II)
III - dar conhecimento à população, por meio de pronunciamentos e/ou documentos oficiais, das decisões e ações do Comitê; e (Origem: PRT MS/GM 2672/2011, Art. 4º, III)
IV - indicar e realizar as formulações técnicas do Comitê para as subsequentes deliberações junto às instâncias internas e Comissões Intergestores do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2672/2011, Art. 4º, IV)
Art. 397. O Comitê se reunirá ordinariamente duas vezes ao ano e extraordinariamente por convocação da Coordenação. (Origem: PRT MS/GM 2672/2011, Art. 5º)
Art. 398. O Comitê será constituído por 4 (quatro) Grupos de Trabalho (GTs). (Origem: PRT MS/GM 2672/2011, Art. 6º)
Parágrafo Único. Os GTs terão o objetivo de aprofundar as discussões sobre temas específicos e apresentar proposições atinentes a cada uma das áreas de reabilitação - visual, auditiva, física e intelectual -, incluindo as deficiências múltiplas, que serão consideradas em cada um dos GTs específicos. (Origem: PRT MS/GM 2672/2011, Art. 6º, Parágrafo Único)
Art. 399. Os GTs serão denominados da seguinte forma: (Origem: PRT MS/GM 2672/2011, Art. 7º)
I - Grupo de Trabalho da Deficiência Física; (Origem: PRT MS/GM 2672/2011, Art. 7º, I)
II - Grupo de Trabalho da Deficiência Auditiva; (Origem: PRT MS/GM 2672/2011, Art. 7º, II)
III - Grupo de Trabalho da Deficiência Visual; e (Origem: PRT MS/GM 2672/2011, Art. 7º, III)
IV - Grupo de Trabalho da Deficiência Intelectual. (Origem: PRT MS/GM 2672/2011, Art. 7º, IV)
Art. 400. Compete aos GTs: (Origem: PRT MS/GM 2672/2011, Art. 8º)
I - realizar estudos e elaborar documentos técnicos para subsidiar os trabalhos da Comissão; (Origem: PRT MS/GM 2672/2011, Art. 8º, I)
II - desenvolver as ações deliberadas pelo Comitê concernentes à área específica de sua atuação; e (Origem: PRT MS/GM 2672/2011, Art. 8º, II)
III - contribuir com o processo de apoio in loco aos serviços da rede de reabilitação para a observância dos critérios e parâmetros de qualidade, de organização e de funcionamentos dos serviços, atuando ativamente nos processos da Qualificação e de Certificação. (Origem: PRT MS/GM 2672/2011, Art. 8º, III)
Parágrafo Único. A participação dos GTs nos processos da Qualificação e de Certificação dos serviços poderá contar com a contribuição de instituições e centros de excelência escolhidos por critérios técnicos e observará a estratégia de apoio desenvolvida pelo Ministério da Saúde. (Origem: PRT MS/GM 2672/2011, Art. 8º, Parágrafo Único)
Art. 401. Cada GT será composto por: (Origem: PRT MS/GM 2672/2011, Art. 9º)
I - representantes das respectivas entidades de reabilitação que compõem o Comitê; (Origem: PRT MS/GM 2672/2011, Art. 9º, I)
II - 1 (um) integrante designado entre os membros do Comitê; e (Origem: PRT MS/GM 2672/2011, Art. 9º, II)
III - 2 (dois) representantes do DAPES/SAS/MS. (Origem: PRT MS/GM 2672/2011, Art. 9º, III)
Parágrafo Único. A participação de outros especialistas e/ou profissionais de referência para subsidiar as discussões e produção técnica do GT poderá ocorrer tanto na forma presencial, em reuniões, como por meio de consultoria à distância. (Origem: PRT MS/GM 2672/2011, Art. 9º, Parágrafo Único)
Art. 402. Os GTs serão coordenados pelo DAPES/SAS/MS, que indicará entre seus membros um especialista para cada GT. (Origem: PRT MS/GM 2672/2011, Art. 10)
Art. 403. Os GTs se reunirão trimestralmente ou em caráter extraordinário sempre que a Coordenação entender necessário. (Origem: PRT MS/GM 2672/2011, Art. 11)
Art. 404. Poderão ser instituídos, em caráter transitório, outros GTs para a discussão de temas específicos, de acordo com as demandas e mediante indicação do Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência, a fim de se alcançar a execução plena das atribuições do Comitê. (Origem: PRT MS/GM 2672/2011, Art. 12)
Art. 405. As funções exercidas pelos membros e convidados no âmbito do Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência e seus respectivos GTs não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2672/2011, Art. 13)
Art. 406. O Comitê definirá, em sua primeira reunião, o cronograma de trabalho e sua agenda de atividades. (Origem: PRT MS/GM 2672/2011, Art. 14)
CAPÍTULO III
DA SAÚDE DO TRABALHADOR E DA TRABALHADORA
Seção I
Do Comitê Nacional de Promoção da Saúde do Trabalhador do SUS
Art. 407. Fica instituído o Comitê Nacional de Promoção da Saúde do Trabalhador do Sistema Único de Saúde, objetivando: (Origem: PRT MS/GM 2871/2009, Art. 1º)
I - formular as Diretrizes da Política Nacional de Promoção da Saúde do Trabalhador do SUS, contendo programas e ações que tenham como objetivo aperfeiçoar, garantir e (ou) recuperar as condições e ambientes de trabalho no SUS; (Origem: PRT MS/GM 2871/2009, Art. 1º, I)
II - harmonizar a Política Nacional de Promoção da Saúde do Trabalhador do SUS com as políticas de gestão do trabalho, gestão da educação e saúde do trabalhador implementadas pelo Ministério da Saúde; (Origem: PRT MS/GM 2871/2009, Art. 1º, II)
III - propor estratégias de vigilância e monitoramento dos riscos e da morbidade ligados aos ambientes de trabalho; (Origem: PRT MS/GM 2871/2009, Art. 1º, III)
IV - indicar estratégias de comunicação e participação dos trabalhadores do SUS para garantir o acompanhamento e a adoção das ações e programas constantes da Política; (Origem: PRT MS/GM 2871/2009, Art. 1º, IV)
V - articular instituições de pesquisa e universidades para a execução de estudos e pesquisas em saúde do trabalhador, integrando uma rede de colaboradores para o desenvolvimento técnico-científico na área; (Origem: PRT MS/GM 2871/2009, Art. 1º, V)
VI - propor linhas de financiamento para ações e produção de conhecimento na área; (Origem: PRT MS/GM 2871/2009, Art. 1º, VI)
VII - elaborar instrumentos informativos e desenvolver processos de formação sobre saúde do trabalhador e políticas de saúde para entidades e lideranças sindicais, profissionais, gestores e conselheiros de saúde; e (Origem: PRT MS/GM 2871/2009, Art. 1º, VII)
VIII - manter articulação com a Rede Nacional de Atenção Integral à Saúde do Trabalhador (RENAST). (Origem: PRT MS/GM 2871/2009, Art. 1º, VIII)
Art. 408. O Comitê terá a seguinte composição: (Origem: PRT MS/GM 2871/2009, Art. 2º)
I - seis representantes do Ministério da Saúde, quais sejam: (Origem: PRT MS/GM 2871/2009, Art. 2º, I)
a) um representante do Departamento de Gestão e da Regulação do Trabalho em Saúde, da Secretaria de Gestão do Trabalho e da Educação na Saúde (DEGERTS/SGTES); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, a)
b) um representante da Coordenação-Geral da Regulação e Negociação do Trabalho em Saúde, do DEGERTS/SGTES; (Origem: PRT MS/GM 2871/2009, Art. 2º, I, b)
c) um representante do Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador, da Secretaria de Vigilância em Saúde (DSAST/SVS); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, c)
d) um representante da Coordenação-Geral de Saúde do Trabalhador, da SVS; (Origem: PRT MS/GM 2871/2009, Art. 2º, I, d)
e) um representante da Coordenação de Recursos Humanos, da Subsecretaria de Assuntos Administrativos, da Secretaria-Executiva (CGRH/SAA/SE); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, e)
f) um representante da área da Política Nacional de Humanização, da Secretaria de Atenção à Saúde (SAS); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, f)
II - um representante do Ministério do Planejamento, Desenvolvimento e Gestão; (Origem: PRT MS/GM 2871/2009, Art. 2º, II)
III - um representante do Ministério do Trabalho; (Origem: PRT MS/GM 2871/2009, Art. 2º, III)
IV - um representante do Conselho Nacional dos Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2871/2009, Art. 2º, IV)
V - um representante do Conselho Nacional dos Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2871/2009, Art. 2º, V)
VI - onze representantes da bancada dos trabalhadores da Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS); e (Origem: PRT MS/GM 2871/2009, Art. 2º, VI) (com redação dada pela PRT MS/GM 238/2010)
VII - um representante de entidade patronal do setor privado da saúde. (Origem: PRT MS/GM 2871/2009, Art. 2º, VII) (dispositivo acrescentado pela PRT MS/GM 238/2010)
§ 1º À exceção dos representantes do Ministério da Saúde, os demais integrantes do Comitê serão livremente designados por meio de expediente subscrito pelos representantes legais dos órgãos e instituições representadas. (Origem: PRT MS/GM 2871/2009, Art. 2º, § 1º)
§ 2º Serão designados suplentes que, na ausência do titular, deverão participar das reuniões. (Origem: PRT MS/GM 2871/2009, Art. 2º, § 2º)
§ 3º A Organização Pan-Americana da Saúde (OPAS), a Agência Nacional de Vigilância Sanitária (ANVISA), a Fundação Oswaldo Cruz (FIOCRUZ) e a Rede de Observatório em Recursos Humanos em Saúde (ROREHS) terão assento no Comitê como convidados permanentes. (Origem: PRT MS/GM 2871/2009, Art. 2º, § 3º)
Art. 409. O Comitê Nacional de Promoção da Saúde do Trabalhador do SUS deverá, no prazo de 120 dias, a contar da data de designação de seus integrantes, formular proposta das Diretrizes para a Política Nacional de Promoção da Saúde do Trabalhador do SUS. (Origem: PRT MS/GM 2871/2009, Art. 3º)
§ 1º Após o prazo acima referido, a proposta elaborada será apresentada e pactuada na Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS) e, em seguida, levada para aprovação do Conselho Nacional de Saúde (CNS) e na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 2871/2009, Art. 3º, § 1º)
§ 2º Para a elaboração das Diretrizes, o Comitê reunir-se-á, ordinariamente, de acordo com cronograma elaborado na reunião de instalação do Comitê e, extraordinariamente, sempre que convocado pela Coordenação-Geral. (Origem: PRT MS/GM 2871/2009, Art. 3º, § 2º) (com redação dada pela PRT MS/GM 238/2010)
§ 3º Após a publicação das Diretrizes, o Comitê reunir-se-á, ordinariamente, uma vez a cada 2 (dois) meses e, extraordinariamente, sempre que convocada pela Coordenação Geral, atendendo convocação enviada por ofício, via correio eletrônico, com antecedência mínima de 20 (dias) dias. (Origem: PRT MS/GM 2871/2009, Art. 3º, § 3º)
Art. 410. O Comitê será constituído pelas seguintes instâncias: (Origem: PRT MS/GM 2871/2009, Art. 4º)
I - Plenário; (Origem: PRT MS/GM 2871/2009, Art. 4º, I)
II - Coordenação-Geral; (Origem: PRT MS/GM 2871/2009, Art. 4º, II)
III - Coordenação-Adjunta; e (Origem: PRT MS/GM 2871/2009, Art. 4º, III)
IV - Secretaria-Executiva. (Origem: PRT MS/GM 2871/2009, Art. 4º, IV)
§ 1º A Coordenação-Geral e a Secretaria-Executiva serão compartilhadas pelo Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS) e o Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador (DSAST/SVS/MS). (Origem: PRT MS/GM 2871/2009, Art. 4º, § 1º)
§ 2º A Coordenação Adjunta será indicada pela bancada de trabalhadores da MNNP-SUS. (Origem: PRT MS/GM 2871/2009, Art. 4º, § 2º)
§ 3º Os técnicos responsáveis pela Secretaria Executiva serão livremente designados pelos Diretores referidos no § 1º. (Origem: PRT MS/GM 2871/2009, Art. 4º, § 3º)
§ 4º O Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS) e o Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador (DSAST/SVS/MS) fornecerão o necessário suporte administrativo para o regular funcionamento do Comitê. (Origem: PRT MS/GM 2871/2009, Art. 4º, § 4º)
Art. 411. O Comitê poderá constituir grupos de trabalho e convidar profissionais de notório saber na matéria, ou especialistas de outros órgãos ou entidades, para prestar assessoria as suas atividades. (Origem: PRT MS/GM 2871/2009, Art. 5º)
Art. 412. As decisões do Plenário do Comitê serão tomadas por consenso. (Origem: PRT MS/GM 2871/2009, Art. 6º)
Art. 413. A participação no Comitê Nacional de Promoção da Saúde do Trabalhador do SUS é considerada prestação de serviço público relevante, não sendo remunerada. (Origem: PRT MS/GM 2871/2009, Art. 7º)
Seção II
Do Preenchimento de Autorização de Internação Hospitalar (AIH), em Casos de Quadro Compatível com Causas Externas e com Doenças e Acidentes Relacionados ao Trabalho
Art. 414. É obrigatório para todas as instituições de assistência à saúde do Sistema Único de Saúde (SUS), para fins de vigilância epidemiológica e sanitária, o preenchimento dos campos CID principal e CID secundário para os registros de causas externas e de agravos à saúde do trabalhador na Autorização de Internação Hospitalar (AIH) de acordo com a Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde (CID), em vigor. (Origem: PRT MS/GM 1969/2001, Art. 1º)
Parágrafo Único. O registro de causas externas e de agravos à saúde relacionados ao trabalho deverão ser detalhados no Laudo Médico para Emissão de AIH de acordo com o roteiro disposto no Anexo XLIX . (Origem: PRT MS/GM 1969/2001, Art. 1º, Parágrafo Único)
Art. 415. Fica criado e tornado obrigatório o preenchimento na Autorização de Internação Hospitalar (AIH), do campo Ocupação, segundo a Classificação Brasileira de Ocupações Resumida (CBO-R), na identificação do paciente, nos casos de acidentes e doenças relacionados ao trabalho em conformidade com os Anexos L e LI . (Origem: PRT MS/GM 1969/2001, Art. 2º)
Art. 416. Fica criado e tornado obrigatório o preenchimento, na Autorização de Internação Hospitalar (AIH), do campo Classificação Nacional de Atividades Econômicas Resumida (CNAE-R) no item referente aos dados do empregador. (Origem: PRT MS/GM 1969/2001, Art. 3º)
Art. 417. É obrigatório o preenchimento, na Autorização de Internação Hospitalar (AIH), do campo Vínculo com a Previdência em relação à atividade formal e CGC/CNPJ da Empresa, atividade autônoma, desempregado, aposentado ou não segurado. (Origem: PRT MS/GM 1969/2001, Art. 4º)
Art. 418. Fica definido como de responsabilidade do Responsável Técnico da Unidade de Atendimento Hospitalar que prestou assistência ao paciente, a notificação, por escrito, à Vigilância Epidemiológica e Sanitária do estado, município ou do Distrito Federal e Delegacia Regional do Trabalho, nos casos comprovados ou suspeitos, de agravos à saúde relacionados ao trabalho, cuja fonte de exposição represente riscos a outros trabalhadores e/ou ao meio ambiente. (Origem: PRT MS/GM 1969/2001, Art. 5º)
Art. 419. Deverão constar do Laudo Médico para Emissão de Autorização de Internação Hospitalar (AIH) as informações a serem prestadas em conformidade com Anexo LII . (Origem: PRT MS/GM 1969/2001, Art. 6º)
Art. 420. A Secretaria de Atenção à Saúde adotará as medidas complementares para a operacionalização e cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1969/2001, Art. 7º)
Art. 421. O Departamento de Informática do SUS (DATASUS) implementará, na Autorização de Internação Hospitalar (AIH), as alterações pertinentes, visando assegurar o cumprimento das disposições constantes nesta Seção. (Origem: PRT MS/GM 1969/2001, Art. 8º)
Seção III
Da Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS
Art. 422. Fica aprovada a Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS, na forma do Anexo LXXIX , com a finalidade de definir procedimentos básicos para o desenvolvimento das ações correspondentes. (Origem: PRT MS/GM 3120/1998, Art. 1º)
Seção IV
Da Lista de Doenças Relacionadas ao Trabalho, a Ser Adotada como Referência dos Agravos Originados no Processo de Trabalho no SUS
Art. 423. Fica instituída a Lista de Doenças relacionadas ao Trabalho, a ser adotada como referência dos agravos originados no processo de trabalho no Sistema Único de Saúde, para uso clínico e epidemiológico, constante no Anexo LXXX . (Origem: PRT MS/GM 1339/1999, Art. 1º)
Art. 424. Esta lista poderá ser revisada anualmente. (Origem: PRT MS/GM 1339/1999, Art. 2º)
Seção V
Da Regulamentação dos Procedimentos Relativos à Vigilância da Saúde dos Trabalhadores Expostos ao Benzeno
Art. 425. Ficam instituídas, na forma dos Anexos LXVIII, LXIX, LXX e LXXI , as Normas de Vigilância à Saúde dos Trabalhadores expostos ao Benzeno nos processos de trabalho que produzem, utilizam, transportam, armazenam ou manipulam benzeno e, ou suas misturas líquidas. (Origem: PRT MS/GM 776/2004, Art. 1º)
Seção VI
Dos Procedimentos e Critérios para Envio de Listagem de Trabalhadores Expostos e Ex-expostos ao Asbesto/Amianto nas Atividades de Extração, Industrialização, Utilização, Manipulação, Comercialização, Transporte e Destinação Final de Resíduos, bem como aos Produtos e Equipamentos que o Contenham
Art. 426. Ficam aprovados, na forma do Anexo LXXII , os procedimentos para envio ao Sistema Único de Saúde (SUS) da listagem de trabalhadores expostos e ex-expostos ao asbesto/amianto e/ou a produtos/equipamentos que o contenham e às atividades discriminadas na ementa desta Seção. (Origem: PRT MS/GM 1851/2006, Art. 1º)
Art. 427. Todas as empresas, que desenvolvem ou desenvolveram atividades descritas na Seção VI do Capítulo III do Título III, encaminharão anualmente ao órgão responsável pela gestão do SUS, em nível municipal ou, na sua ausência, ao órgão regional, listagem de trabalhadores expostos e ex-expostos ao asbesto/amianto. (Origem: PRT MS/GM 1851/2006, Art. 2º)
§ 1º A listagem e as informações referentes aos trabalhadores expostos e ex-expostos ao asbesto/amianto em atividade, independentemente de notificação por parte do SUS, deverão ser encaminhadas, preferencialmente, por meio eletrônico, impreterivelmente, até o primeiro dia útil do mês de julho, devidamente protocoladas na Secretaria Municipal de Saúde (SMS) ou no Centro de Referência em Saúde do Trabalhador ou no Serviço de Vigilância à Saúde do Trabalhador, da Secretaria Estadual de Saúde, ou, na inexistência dos órgãos citados, no Serviço de Vigilância à Saúde do SUS, onde a empresa está situada. (Origem: PRT MS/GM 1851/2006, Art. 2º, § 1º)
§ 2º A listagem referente ao exercício de anos anteriores, a contar do dia 1º de junho de 1995, poderá ser requisitada por meio de notificação pelo órgão competente, tendo a empresa até 30 (trinta) dias úteis para sua entrega. (Origem: PRT MS/GM 1851/2006, Art. 2º, § 2º)
§ 3º No que se refere às empresas que substituíram o asbesto/amianto, as obrigações previstas neste artigo e parágrafos anteriores limitam-se aos trabalhadores expostos no período em que elas utilizaram ou manipularam o asbesto/amianto ou produtos/equipamentos que o continham. (Origem: PRT MS/GM 1851/2006, Art. 2º, § 3º)
Art. 428. A listagem dos trabalhadores expostos e ex-expostos ao asbesto/amianto, conforme o Anexo LXXII , deverá conter, entre outras, as seguintes informações: (Origem: PRT MS/GM 1851/2006, Art. 3º)
I - identificação; (Origem: PRT MS/GM 1851/2006, Art. 3º, I)
II - diagnósticos de radiografias de tórax - raio X-, de acordo com padrão da Organização Internacional do Trabalho (OIT) para diagnóstico de pneumoconioses, OIT/2000; (Origem: PRT MS/GM 1851/2006, Art. 3º, II)
III - resultados de provas de função pulmonar, com valores em percentual teórico para: (Origem: PRT MS/GM 1851/2006, Art. 3º, III)
a) Capacidade Vital Forçada - CVF; (Origem: PRT MS/GM 1851/2006, Art. 3º, III, a)
b) Volume Expiratório no 1º segundo - VEF1; (Origem: PRT MS/GM 1851/2006, Art. 3º, III, b)
c) Índice de Tiffenau - VEF1/CVF; e (Origem: PRT MS/GM 1851/2006, Art. 3º, III, c)
d) fluxo expiratório forçado em 25% e 75%. (Origem: PRT MS/GM 1851/2006, Art. 3º, III, d)
Art. 429. A cada diagnóstico ou suspeita de doença relacionada ao asbesto/amianto, os trabalhadores expostos e ex-expostos serão encaminhados ao SUS, acompanhados de uma via da respectiva Comunicação de Acidente de Trabalho (CAT), para notificação do caso à vigilância epidemiológica do SUS/SINAN. (Origem: PRT MS/GM 1851/2006, Art. 4º)
Art. 430. O não-cumprimento do disposto nesta Seção sujeitará as empresas às penalidades previstas na legislação pertinente. (Origem: PRT MS/GM 1851/2006, Art. 5º)
Seção VII
Da Vacinação Obrigatória dos Trabalhadores das Áreas Portuárias, Aeroportuárias, de Terminais e Passagens de Fronteira
Art. 431. É obrigatória a vacinação dos trabalhadores das áreas portuárias, aeroportuárias, de terminais e passagens de fronteira. (Origem: PRT MS/GM 1986/2001, Art. 1º)
Art. 432. É obrigatória a vacinação dos tripulantes ou pessoal dos meios de transporte que procedam de áreas endêmicas e de países com transmissão de febre amarela, segundo a situação epidemiológica e avaliação de risco. (Origem: PRT MS/GM 1986/2001, Art. 2º)
Art. 433. Fica recomendada a vacinação para viajantes que se dirigem às áreas endêmicas e aos países com transmissão de febre amarela, segundo a situação epidemiológica e avaliação de risco. A vacinação deve ter antecedência mínima de 10 dias antes da viagem. (Origem: PRT MS/GM 1986/2001, Art. 3º)
Art. 434. Fica adotada a exigência do certificado internacional de vacinação válido para os viajantes que chegam de países com transmissão de febre amarela, segundo a situação epidemiológica e avaliação de risco. A vacinação deve ter antecedência mínima de 10 dias antes da viagem, exceto se o viajante for revacinado antes do fim do período de validade do certificado. Nesta situação, a validade do certificado será imediata. (Origem: PRT MS/GM 1986/2001, Art. 4º)
Art. 435. Nas áreas endêmicas do território nacional, as autoridades sanitárias estaduais e municipais deverão prover certificado de vacinação para os indivíduos vacinados, devendo manter registros ativos para eventuais verificações. (Origem: PRT MS/GM 1986/2001, Art. 5º)
Art. 436. O Ministério da Saúde, através de seus órgãos competentes, FUNASA e ANVISA, editará normas regulamentadoras desta Seção. (Origem: PRT MS/GM 1986/2001, Art. 6º)
CAPÍTULO IV
DA ATENÇÃO INTEGRAL À SAÚDE DA CRIANÇA
Seção I
Do Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância no âmbito do SUS
Art. 437. Fica instituído Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2362/2012, Art. 1º)
Art. 438. Ao Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância compete: (Origem: PRT MS/GM 2362/2012, Art. 2º)
I - subsidiar a formulação de conteúdos programáticos, normas técnico-gerenciais, métodos e instrumentos para o aprimoramento das políticas de saúde voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, I)
II - apresentar proposições de aprimoramento das ações e estratégias para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, II)
III - ampliar a discussão sobre o desenvolvimento integral da primeira infância, com participação da sociedade civil, com o objetivo de favorecer o acesso, a equidade e a integralidade das ações e serviços prestados no âmbito do SUS; (Origem: PRT MS/GM 2362/2012, Art. 2º, III)
IV - desenvolver estratégias de articulação intersetorial das políticas públicas sociais básicas, que permitam a qualificação dos serviços de atenção integral à primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, IV)
V - contribuir na sensibilização e na mobilização social com o objetivo de facilitar e promover a implementação das diretrizes das políticas públicas de saúde voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, V)
VI - realizar o balanço semestral do andamento da implementação e dos resultados das políticas públicas de saúde voltadas para o desenvolvimento da primeira infância; e (Origem: PRT MS/GM 2362/2012, Art. 2º, VI)
VII - funcionar como um espaço de articulação intersetorial e discussão permanente sobre as políticas públicas de saúde em construção e execução para o desenvolvimento integral da primeira infância. (Origem: PRT MS/GM 2362/2012, Art. 2º, VII)
Art. 439. O Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância será composto por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2362/2012, Art. 3º)
I - 5 (cinco) do Ministério da Saúde (MS); (Origem: PRT MS/GM 2362/2012, Art. 3º, I)
II - 1 (um) do Ministério da Educação (MEC); (Origem: PRT MS/GM 2362/2012, Art. 3º, II)
III - 1 (um) do Ministério do Desenvolvimento Social e Agrário; (Origem: PRT MS/GM 2362/2012, Art. 3º, III)
IV - 1 (um) da Secretaria de Direitos Humanos da Presidência da República (SDH-PR); (Origem: PRT MS/GM 2362/2012, Art. 3º, IV)
V - 1 (um) do Conselho Nacional de Saúde (CNS); (Origem: PRT MS/GM 2362/2012, Art. 3º, V)
VI - 1 (um) do Conselho Nacional de Educação (CNE); e (Origem: PRT MS/GM 2362/2012, Art. 3º, VI)
VII - 1 (um) do Conselho Nacional de Assistência Social (CNAS). (Origem: PRT MS/GM 2362/2012, Art. 3º, VII)
§ 1º O Comitê será coordenado pelo Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS). (Origem: PRT MS/GM 2362/2012, Art. 3º, § 1º)
§ 2º A participação dos órgãos e entidades de que tratam os incisos II, III, IV, VI e VII do "caput", será formalizada após resposta a convite a eles encaminhado pela Coordenação do Comitê, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 2362/2012, Art. 3º, § 2º)
§ 3º Para fins do disposto no inciso I do caput, a Coordenação do Comitê efetuará a indicação dos representantes do Ministério da Saúde. (Origem: PRT MS/GM 2362/2012, Art. 3º, § 3º)
§ 4º O Comitê se reunirá semestralmente ou, quando solicitado, em caráter extraordinário. (Origem: PRT MS/GM 2362/2012, Art. 3º, § 4º)
Art. 440. Serão convidados para participar do Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância: (Origem: PRT MS/GM 2362/2012, Art. 4º)
I - 2 (dois) representantes dos Poderes Legislativo e Judiciário; (Origem: PRT MS/GM 2362/2012, Art. 4º, I)
II - 10 (dez) representantes de movimentos sociais, fóruns e redes constituídos pela sociedade civil que atuem na área da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 4º, II)
III - 10 (dez) representantes de universidades e instituições de ensino e pesquisa que atuem na área da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 4º, III)
IV - 5 (cinco) profissionais de notório saber no tema da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 4º, IV)
V - 2 (dois) representantes de organismos internacionais, sendo: (Origem: PRT MS/GM 2362/2012, Art. 4º, V)
a) 1 (um) do Fundo das Nações Unidas para Infância e Adolescência (UNICEF); e (Origem: PRT MS/GM 2362/2012, Art. 4º, V, a)
b) 1 (um) da Organização Pan-americana de Saúde (OPAS); e (Origem: PRT MS/GM 2362/2012, Art. 4º, V, b)
VI - convidados especiais, profissionais da área de comunicação, artistas e intelectuais, entre outros que o Comitê entenda relevantes para o cumprimento de suas finalidades. (Origem: PRT MS/GM 2362/2012, Art. 4º, VI)
Parágrafo Único. Os representantes de que trata o caput do artigo serão convidados pela Coordenação do Comitê. (Origem: PRT MS/GM 2362/2012, Art. 4º, Parágrafo Único)
Art. 441. Na qualidade de Coordenador do Comitê, além de fornecer os apoios técnico e administrativo necessários para o seu funcionamento, compete ao Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS): (Origem: PRT MS/GM 2362/2012, Art. 5º)
I - organizar a pauta das reuniões; (Origem: PRT MS/GM 2362/2012, Art. 5º, I)
II - promover a articulação entre os membros do Comitê e subsidiá-los com as informações por ele demandadas; (Origem: PRT MS/GM 2362/2012, Art. 5º, II)
III - promover a divulgação dos relatórios de acompanhamento dos trabalhos e resultados alcançados; (Origem: PRT MS/GM 2362/2012, Art. 5º, III)
IV - articular os órgãos do Ministério da Saúde envolvidos com as demandas nas ações e estratégias voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 5º, IV)
V - elaborar a memória e sistematizar os produtos e documentos produzidos pelo Comitê; e (Origem: PRT MS/GM 2362/2012, Art. 5º, V)
VI - manter o Comitê informado sobre os processos de implantação das políticas públicas de saúde da criança. (Origem: PRT MS/GM 2362/2012, Art. 5º, VI)
Art. 442. Para o desenvolvimento integral da primeira infância, compete ao DAPES/SAS/MS: (Origem: PRT MS/GM 2362/2012, Art. 6º)
I - identificar necessidades e buscar alternativas para a educação, capacitação e qualificação dos profissionais de saúde responsáveis pela implementação das ações e estratégias voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 6º, I)
II - propor ações voltadas para a educação e formação para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 6º, II)
III - identificar necessidades, buscar alternativas e propor ações para o financiamento da política para a primeira infância e propor meios de sua regulação; e (Origem: PRT MS/GM 2362/2012, Art. 6º, III)
IV - identificar as necessidades e propor instrumentos para viabilizar a articulação e pactuação entre os entes federados e pontos de atenção das redes temáticas prioritárias. (Origem: PRT MS/GM 2362/2012, Art. 6º, IV)
Art. 443. A participação no Comitê não será remunerada e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2362/2012, Art. 7º)
Seção II
Da Estratégia Brasileirinhas e Brasileirinhos Saudáveis
Art. 444. Fica instituída a Estratégia Brasileirinhas e Brasileirinhos Saudáveis com o objetivo de construir novas ofertas de cuidado humanizado à saúde e fortalecer aquelas tradicionalmente dirigidas a mulheres e crianças, na perspectiva do vínculo, crescimento e desenvolvimento integral da criança de zero a cinco anos. (Origem: PRT MS/GM 2395/2009, Art. 1º)
Parágrafo Único. A estratégia será implantada a partir de projeto piloto contemplando uma cidade com mais de cem mil habitantes de cada macrorregião, a saber: região Norte, Rio Branco; região Nordeste, Recife; região Centro-Oeste, Campo Grande; região Sudeste, Rio de Janeiro; e região Sul, Florianópolis. (Origem: PRT MS/GM 2395/2009, Art. 1º, Parágrafo Único)
Art. 445. Fica instituído o Comitê Técnico-Consultivo para assessorar, monitorar e avaliar a implantação/implementação da estratégia. (Origem: PRT MS/GM 2395/2009, Art. 2º)
§ 1º O Comitê Técnico-Consultivo terá a seguinte composição: (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º)
I - três representantes da Secretaria de Atenção à Saúde (SAS/MS); a saber: (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I)
a) Área Técnica de Saúde da Criança e Aleitamento Materno; (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I, a)
b) Área Técnica de Saúde da Mulher; e (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I, b)
c) Política Nacional de Humanização; (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I, c)
II - um representante da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, II)
III - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, III)
IV - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, IV)
V - um representante da Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, V)
VI - um representante da Secretaria-Executiva (SE/MS) (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, VI)
VII - um representante da Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, VII)
VIII - um representante do Instituto Fernandes Figueira (IFF/FIOCRUZ); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, VIII)
IX - um representante da Rede Brasileira de Bancos de Leite Humano (REDEBLH/FIOCRUZ); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, IX)
X - um representante da Rede Norte-Nordeste de Saúde Perinatal (RENOSP); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, X)
XI - um representante da Fundação Nacional de Saúde (FUNASA); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XI)
XII - um representante da Sociedade Brasileira de Pediatria (SBP); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XII)
XIII - um representante da Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XIII)
XIV - um representante da Associação Brasileira de Enfermagem (ABEn); e (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XIV)
XV - um representante da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XV)
§ 2º A Coordenação do Comitê Técnico-Consultivo ficará a cargo da Fundação Oswaldo Cruz (FIOCRUZ). (Origem: PRT MS/GM 2395/2009, Art. 2º, § 2º)
Art. 446. Os recursos para o funcionamento do Comitê Técnico-Consultivo e a implementação da Estratégia serão de responsabilidade da Área Técnica de Saúde da Criança e Aleitamento Materno/DAPES/SAS, correrão por conta da funcional programática 10.301.2015.20YI.0001 - Implementação de Políticas de Atenção à Saúde. (Origem: PRT MS/GM 2395/2009, Art. 3º)
TÍTULO IV
DA ORGANIZAÇÃO DA ATENÇÃO À SAÚDE
CAPÍTULO I
DA ATENÇÃO BÁSICA
Seção I
Do Programa Nacional Telessaúde Brasil Redes (Telessaúde Brasil Redes)
Art. 447. Fica instituído o Programa Nacional Telessaúde Brasil Redes (Telessaúde Brasil Redes). (Origem: PRT MS/GM 2546/2011, Art. 1º)
Parágrafo Único. O Telessaúde tem por objetivo apoiar a consolidação das Redes de Atenção à Saúde ordenadas pela Atenção Básica no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2546/2011, Art. 1º, Parágrafo Único)
Subseção I
Da Estrutura
(Origem: PRT MS/GM 2546/2011, CAPÍTULO I)
Art. 448. O Telessaúde Brasil Redes fornecerá aos profissionais e trabalhadores das Redes de Atenção à Saúde no SUS os seguintes serviços: (Origem: PRT MS/GM 2546/2011, Art. 2º)
I - Teleconsultoria: consulta registrada e realizada entre trabalhadores, profissionais e gestores da área de saúde, por meio de instrumentos de telecomunicação bidirecional, com o fim de esclarecer dúvidas sobre procedimentos clínicos, ações de saúde e questões relativas ao processo de trabalho, podendo ser de dois tipos: (Origem: PRT MS/GM 2546/2011, Art. 2º, I)
a) síncrona - teleconsultoria realizada em tempo real, geralmente por chat, web ou videoconferência; ou (Origem: PRT MS/GM 2546/2011, Art. 2º, I, a)
b) assíncrona - teleconsultoria realizada por meio de mensagens offline. (Origem: PRT MS/GM 2546/2011, Art. 2º, I, b)
II - Telediagnóstico: serviço autônomo que utiliza as tecnologias da informação e comunicação para realizar serviços de apoio ao diagnóstico através de distâncias geográfica e temporal; (Origem: PRT MS/GM 2546/2011, Art. 2º, II)
III - Segunda Opinião Formativa: resposta sistematizada, construída com base em revisão bibliográfica, nas melhores evidências científicas e clínicas e no papel ordenador da atenção básica à saúde, a perguntas originadas das teleconsultorias, e selecionadas a partir de critérios de relevância e pertinência em relação às diretrizes do SUS; e (Origem: PRT MS/GM 2546/2011, Art. 2º, III)
IV - Tele-educação: conferências, aulas e cursos, ministrados por meio da utilização das tecnologias de informação e comunicação. (Origem: PRT MS/GM 2546/2011, Art. 2º, IV)
Art. 449. O Telessaúde Brasil Redes é integrado por gestores da saúde, instituições formadoras de profissionais de saúde e serviços de saúde do SUS, sendo constituído por: (Origem: PRT MS/GM 2546/2011, Art. 3º)
I - Núcleo de Telessaúde Técnico-Científico: instituições formadoras e de gestão e/ou serviços de saúde responsáveis pela formulação e gestão de Teleconsultorias, Telediagnósticos e Segunda Opinião Formativa; e (Origem: PRT MS/GM 2546/2011, Art. 3º, I)
II - Ponto de Telessaúde: serviços de saúde a partir dos quais os trabalhadores e profissionais do SUS demandam Teleconsultorias e/ou Telediagnósticos. (Origem: PRT MS/GM 2546/2011, Art. 3º, II)
Parágrafo Único. As Teleconsultorias, os Telediagnósticos, as Segundas Opiniões Formativas e as ações de Tele-educação demandadas pelos profissionais de saúde do SUS poderão ser elaborados e respondidos por Teleconsultores a partir de qualquer Núcleo de Telessaúde Técnico-Científico ou Ponto de Telessaúde. (Origem: PRT MS/GM 2546/2011, Art. 3º, Parágrafo Único)
Art. 450. As Teleconsultorias, os Telediagnósticos e a Segunda Opinião Formativa serão respondidos pelos Núcleos Técnico-Científicos com base na melhor e na mais atualizada evidência clínica e científica disponível, adequada e pertinente ao contexto de origem da solicitação. (Origem: PRT MS/GM 2546/2011, Art. 4º)
Parágrafo Único. A resposta deverá ressaltar o conhecimento inerente à resolução do problema e que venha a contribuir com a educação permanente dos profissionais envolvidos, com vistas à ampliação de sua capacidade e autonomia na resolução de casos semelhantes. (Origem: PRT MS/GM 2546/2011, Art. 4º, Parágrafo Único)
Art. 451. O prazo regular para envio da resposta à Teleconsultoria Assíncrona será fixado em protocolos estabelecidos por cada Núcleo Técnico-Científico, em comum acordo com o Comitê Gestor Estadual, não devendo exceder o prazo máximo de 72 (setenta e duas) horas a contar do recebimento da consulta. (Origem: PRT MS/GM 2546/2011, Art. 5º)
Subseção II
Da Gestão e do Funcionamento
(Origem: PRT MS/GM 2546/2011, CAPÍTULO II)
Art. 452. A gestão do Telessaúde Brasil Redes é estruturada da seguinte forma: (Origem: PRT MS/GM 2546/2011, Art. 6º)
I - Coordenação Nacional, exercida pelo Ministério da Saúde por meio da Secretaria de Gestão do Trabalho e Educação na Saúde (SGTES/MS) e da Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 2546/2011, Art. 6º, I)
II - Coordenação Estadual, exercida pela Secretaria de Saúde do Estado ou do Distrito Federal ou por outra instância integrante do comitê gestor estadual, conforme aprovação da Comissão Intergestores Bipartite (CIB); (Origem: PRT MS/GM 2546/2011, Art. 6º, II)
III - Comitê Gestor Estadual; (Origem: PRT MS/GM 2546/2011, Art. 6º, III)
IV - Núcleo Técnico-Científico de Telessaúde; e (Origem: PRT MS/GM 2546/2011, Art. 6º, IV)
V - gestor municipal de saúde. (Origem: PRT MS/GM 2546/2011, Art. 6º, V)
Art. 453. Compete à Coordenação Nacional do Telessaúde Brasil Redes: (Origem: PRT MS/GM 2546/2011, Art. 7º)
I - monitorar a implementação e o funcionamento do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, I)
II - avaliar e zelar pelo alcance dos objetivos e metas do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, II)
III - manter a Biblioteca Virtual Telessaúde Brasil, disponível em www.telessaudebrasil.org.br, como referência e identidade do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, III)
IV - disponibilizar as diretrizes para a operacionalização e os referenciais nacionais de avaliação do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, IV)
V - definir os padrões tecnológicos de interoperabilidade, conteúdo e segurança que permitirão a troca de informações entre os sistemas que viabilizam a operação do Telessaúde Brasil Redes e os diferentes sistemas de informação do SUS, incluídos o Cartão Nacional de Saúde e o Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SCNES); (Origem: PRT MS/GM 2546/2011, Art. 7º, V)
VI - definir o conjunto de dados que fará parte do Registro Eletrônico de Saúde (RES) a partir das Teleconsultorias realizadas, visando à implementação de um registro nacional e longitudinal, conforme Capítulo I do Título VII da Portaria de Consolidação nº 1; e (Origem: PRT MS/GM 2546/2011, Art. 7º, VI)
VII - aprovar o Projeto para implementação do Telessaúde Brasil Redes no respectivo Estado, conforme descrito no art. 457. (Origem: PRT MS/GM 2546/2011, Art. 7º, VII)
Parágrafo Único. A Coordenação Nacional constituirá Comissão de Monitoramento e Avaliação, com representação das Secretarias do Ministério da Saúde, do Conselho Nacional de Secretários de Saúde (CONASS), do Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS) e de outros Ministérios e entidades que desenvolvam ações e iniciativas relacionadas ao Telessaúde Brasil Redes. (Origem: PRT MS/GM 2546/2011, Art. 7º, Parágrafo Único)
Art. 454. Compete à Coordenação Estadual do Telessaúde Brasil Redes: (Origem: PRT MS/GM 2546/2011, Art. 8º)
I - coordenar em âmbito estadual as ações do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 8º, I)
II - promover a articulação entre as instâncias de gestão do SUS e os demais integrantes do Telessaúde Brasil Redes; e (Origem: PRT MS/GM 2546/2011, Art. 8º, II)
III - criar condições necessárias de infraestrutura e gestão, visando garantir o funcionamento do Telessaúde Brasil Redes; e (Origem: PRT MS/GM 2546/2011, Art. 8º, III)
IV - promover a articulação do Telessaúde Brasil Redes à regulação da oferta de serviços e à Central de Regulação Médica das Urgências, em parceria com a gestão municipal e federal de saúde, de forma compartilhada e articulada com os pontos de atenção da rede. (Origem: PRT MS/GM 2546/2011, Art. 8º, IV)
Art. 455. O Comitê Gestor Estadual será vinculado à CIB e composto por: (Origem: PRT MS/GM 2546/2011, Art. 9º)
I - um representante da Secretaria de Saúde do Estado ou do Distrito Federal; (Origem: PRT MS/GM 2546/2011, Art. 9º, I)
II - um representante da Comissão de Integração Ensino Serviço (CIES); (Origem: PRT MS/GM 2546/2011, Art. 9º, II)
III - dois representantes do Conselho de Secretários Municipais de Saúde (COSEMS); (Origem: PRT MS/GM 2546/2011, Art. 9º, III)
IV - um representante dos Coordenadores de Núcleos Técnico-Científicos no Estado; e (Origem: PRT MS/GM 2546/2011, Art. 9º, IV)
V - um representante das Escolas Técnicas do SUS no Estado ou Distrito Federal. (Origem: PRT MS/GM 2546/2011, Art. 9º, V)
§ 1º Compete ao Comitê Gestor Estadual: (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º)
I - promover a articulação entre as instâncias de gestão estadual, municipal e de instituições de ensino, tendo em vista a gestão do programa no âmbito estadual; (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º, I)
II - integrar a rede colaborativa entre os Pontos e Núcleos Estaduais de Telessaúde Técnico-Científicos, em âmbito regional e nacional; e (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º, II)
III - elaborar e implementar projetos contemplando as necessidades loco-regionais. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º, III)
§ 2º A constituição e a composição do Comitê Gestor Estadual será pactuada na CIB, que poderá incluir outras representações além daquelas previstas no § 1º deste artigo. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 2º)
§ 3º O Comitê Gestor Estadual elaborará o Projeto para implementação do Telessaúde Brasil Redes no respectivo Estado, enviando-o à Coordenação Nacional do Programa. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 3º)
§ 4º O Projeto referido no art. 455, § 3º conterá Plano de Trabalho pactuado na CIB e Plano Operativo Anual, este último contendo as seguintes informações: (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º)
I - definição das metas físicas das unidades, dos atendimentos e dos serviços de apoio diagnóstico e terapêutico, com os respectivos quantitativos e fluxos; (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º, I)
II - definição das metas de qualidade e dos parâmetros e indicadores de avaliação; e (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º, II)
III - descrição das atividades de aprimoramento e aperfeiçoamento da gestão. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º, III)
§ 5º A Coordenação Nacional fará a análise e as readequações técnicas necessárias do Projeto, de acordo com as diretrizes nacionais do Telessaúde Brasil Redes e com a disponibilidade orçamentária. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 5º)
§ 6º O relatório anual das atividades deverá demonstrar o alcance das metas estabelecidas no Plano Operativo ou, em caso de não alcance, a justificativa e as medidas de saneamento que foram adotadas. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 6º)
§ 7º Para aprovação do Projeto de implantação do Telessaúde Brasil Redes, a Coordenação Nacional contará com a cooperação técnica do Comitê Consultivo, constituído por docentes, pesquisadores, profissionais de saúde e gestores, com reconhecida experiência, nomeados pelo Secretário de Gestão do Trabalho e da Educação na Saúde do Ministério da Saúde. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 7º)
§ 8º As funções dos membros do Comitê Consultivo previsto no art. 455, § 7º não serão remuneradas e seu exercício será considerado serviço público relevante (Origem: PRT MS/GM 2546/2011, Art. 9º, § 8º)
Art. 456. Compete ao Núcleo Técnico-Científico de Telessaúde: (Origem: PRT MS/GM 2546/2011, Art. 10)
I - responsabilizar-se pela oferta de Teleconsultoria, Telediagnóstico e Segunda Opinião Formativa. (Origem: PRT MS/GM 2546/2011, Art. 10, I)
II - compor e manter equipe de Teleconsultores e corpo clínico de especialistas de referência, compatível com a demanda pelos serviços descritos no art. 456, I; (Origem: PRT MS/GM 2546/2011, Art. 10, II)
III - promover e apoiar a formação de Teleconsultores no âmbito do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 10, III)
IV - atualizar as informações e inserir dados no sistema nacional de informações do Telessaúde Brasil Redes, junto ao Ministério da Saúde, devendo apresentar relatório anual de atividades que comprove o alcance das metas previstas no Plano de Trabalho; (Origem: PRT MS/GM 2546/2011, Art. 10, IV)
V - garantir a adequação aos padrões de interoperabilidade propostos pelo Telessaúde Brasil Rede; (Origem: PRT MS/GM 2546/2011, Art. 10, V)
VI - apoiar o desenvolvimento de protocolos que incluam a solicitação prévia de Teleconsultorias sobre procedimentos, para avaliação da necessidade de encaminhamento ou de solicitação para a Central de Regulação Médica das Urgências; (Origem: PRT MS/GM 2546/2011, Art. 10, VI)
VII - monitorar e avaliar o Telessaúde Brasil Redes no seu âmbito de atuação, incluindo a análise do número de solicitações de Teleconsultorias, do tempo de resposta para os usuários do serviço, do número e da pertinência dos encaminhamentos e solicitações de exames complementares, com vistas à ampliação do acesso aos serviços e à melhoria da resolubilidade da atenção à saúde dos usuários do SUS; e (Origem: PRT MS/GM 2546/2011, Art. 10, VII)
VIII - desenvolver ações de tele-educação, com base nas necessidades loco-regionais identificadas e em consonância com as prioridades da política nacional de saúde. (Origem: PRT MS/GM 2546/2011, Art. 10, VIII)
Art. 457. Compete ao gestor municipal de saúde dos Municípios que integram o Telessaúde Brasil Rede: (Origem: PRT MS/GM 2546/2011, Art. 11)
I - comprometer-se com a implementação, monitoramento e avaliação do Telessaúde Brasil Redes no seu respectivo Município, em articulação com o Comitê Gestor Estadual e com a respectiva instância intermunicipal; e (Origem: PRT MS/GM 2546/2011, Art. 11, I)
II - promover a integração dos profissionais de saúde com as ações do Telessaúde Brasil Redes, de acordo com a carga-horária e conforme a legislação vigente. (Origem: PRT MS/GM 2546/2011, Art. 11, II)
Subseção III
Das Disposições Finais
(Origem: PRT MS/GM 2546/2011, CAPÍTULO III)
Art. 458. Fica criado o código 75 - Telessaúde na Tabela de Estabelecimentos do Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SNCES) e o tipo tipo de estabelecimento 75 - Telessaúde, com os subtipos Núcleo Técnico-Científico e Unidade de Telessaúde, conforme Tabela 1 do Anexo LXXIII . (Origem: PRT MS/GM 2546/2011, Art. 12)
§ 1º Entende-se por Telessaúde o estabelecimento autônomo que utiliza as tecnologias de informação e comunicação para realizar assistência e educação em saúde através de distâncias geográficas e temporais. (Origem: PRT MS/GM 2546/2011, Art. 12, § 1º)
§ 2º Entende-se por Núcleo Científico-Tecnológico a instituição integrante do Telessaúde Brasil Redes que ofereça Teleconsultoria e Segunda Opinião Formativa, com o objetivo de qualificar, ampliar e fortalecer o SUS. (Origem: PRT MS/GM 2546/2011, Art. 12, § 2º)
§ 3º Entende-se por Unidade de Telessaúde o estabelecimento autônomo e não vinculado ao Telessaúde Brasil Redes que utiliza as tecnologias de informação e comunicação para realizar serviços de Teleconsultoria e de Apoio ao Diagnóstico através de distâncias geográficas e temporais. (Origem: PRT MS/GM 2546/2011, Art. 12, § 3º)
Art. 459. Fica criado o campo "Vinculação dos Núcleos Técnico-Científicos Telessaúde Brasil Redes aos Pontos de Telessaúde" no Módulo Básico do SCNES. (Origem: PRT MS/GM 2546/2011, Art. 14)
Parágrafo Único. Os Núcleos de Telessaúde Técnico-Científicos do Telessaúde Brasil Redes deverão informar os respectivos códigos do SCNES dos estabelecimentos de saúde onde estiverem implantados Pontos de Telessaúde. (Origem: PRT MS/GM 2546/2011, Art. 14, § 1º)
Art. 460. Caberá à Coordenação-Geral dos Sistemas de Informação do Departamento de Regulação, Avaliação e Controle de Sistemas (CGSI/DRAC/SAS/MS) adotar as providências necessárias junto ao Departamento de Informática do SUS (DATASUS) para o cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 2546/2011, Art. 15)
Art. 461. Caberá ao Ministério da Saúde financiar a fase inicial da implementação da etapa de expansão dos novos Núcleos de Telessaúde Técnico-Científicos e oferecer cooperação técnica, reservado o direito de suspender os repasses de recursos e a cooperação diante do não cumprimento do disposto nesta Seção e do não alcance das metas estabelecidas no Plano de Trabalho. (Origem: PRT MS/GM 2546/2011, Art. 16)
§ 1º O financiamento previsto no caput deste artigo será regulado por atos específicos do Ministério da Saúde. (Origem: PRT MS/GM 2546/2011, Art. 16, § 1º)
§ 2º Uma vez implementado no Estado, as três esferas de governo serão responsáveis por garantir a sustentabilidade técnico-financeira do Programa Nacional Telessaúde Brasil Redes. (Origem: PRT MS/GM 2546/2011, Art. 16, § 2º)
Subseção IV
Da Comissão Permanente de Telessaúde
Art. 462. Fica instituída, no âmbito do Ministério da Saúde, a Comissão Permanente de Telessaúde, com as seguintes atribuições: (Origem: PRT MS/GM 452/2010, Art. 1º)
I - assessoramento de projetos em Telessaúde em andamento no Ministério da Saúde; (Origem: PRT MS/GM 452/2010, Art. 1º, I)
II - elaboração de proposta para estabelecer padrões de intercâmbio de informações, avaliação de qualidade de projetos de Telemedicina e Telessaúde; (Origem: PRT MS/GM 452/2010, Art. 1º, II)
III - estudo e avaliação de propostas para reembolso de serviços desenvolvidos por instituições universitárias e hospitalares, na área de saúde, por meio do uso de recursos de Telemedicina e Telessaúde; (Origem: PRT MS/GM 452/2010, Art. 1º, III)
IV - acompanhamento de sistemática para atualização profissional continuada por Telessaúde; (Origem: PRT MS/GM 452/2010, Art. 1º, IV)
V - formação de base de informação estratégica sobre implementação de Telemedicina e Telessaúde: (Origem: PRT MS/GM 452/2010, Art. 1º, V)
VI - desenvolvimento de trabalhos cooperados com diversos órgãos governamentais e privados para facilitar a estruturação de Telemedicina e Telessaúde no País; (Origem: PRT MS/GM 452/2010, Art. 1º, VI)
VII - constituição de Conselho Assessor de Telemedicina e Telessaúde; e (Origem: PRT MS/GM 452/2010, Art. 1º, VII)
VIII - identificação e formação de grupo de Centros Colaboradores. (Origem: PRT MS/GM 452/2010, Art. 1º, VIII)
Art. 463. A Comissão terá a seguinte composição: (Origem: PRT MS/GM 452/2010, Art. 2º)
I - 3 (três) representantes do Ministério da Saúde; (Origem: PRT MS/GM 452/2010, Art. 2º, I)
II - 2 (dois) representantes do Ministério da Ciência, Tecnologia, Inovações e Comunicações; (Origem: PRT MS/GM 452/2010, Art. 2º, II)
III - 2 (dois) representantes do Ministério da Educação; (Origem: PRT MS/GM 452/2010, Art. 2º, IV)
IV - 1 (um) representante do Ministério da Defesa; (Origem: PRT MS/GM 452/2010, Art. 2º, V)
V - 1 (um) representante da Organização Pan-Americana da Saúde; (Origem: PRT MS/GM 452/2010, Art. 2º, VI)
VI - 1 (um) representante do Conselho Federal de Medicina; (Origem: PRT MS/GM 452/2010, Art. 2º, VII)
VII - 1 (um) representante da Universidade de São Paulo; (Origem: PRT MS/GM 452/2010, Art. 2º, VIII)
VIII - 1 (um) representante da Universidade Estadual do Amazonas; (Origem: PRT MS/GM 452/2010, Art. 2º, IX)
IX - 1 (um) representante da Universidade Estadual do Rio de Janeiro; (Origem: PRT MS/GM 452/2010, Art. 2º, X)
X - 1 (um) representante da Universidade Federal de Minas Gerais; (Origem: PRT MS/GM 452/2010, Art. 2º, XI)
XI - 1 (um) representante da Universidade Federal de Pernambuco; (Origem: PRT MS/GM 452/2010, Art. 2º, XII)
XII - 1 (um) representante da Universidade Federal de Santa Catarina; (Origem: PRT MS/GM 452/2010, Art. 2º, XIII)
XIII - 1 (um) representante da Universidade Federal de São Paulo; (Origem: PRT MS/GM 452/2010, Art. 2º, XIV)
XIV - 1 (um) representante da Universidade Federal do Ceará; (Origem: PRT MS/GM 452/2010, Art. 2º, XV)
XV - 1 (um) representante do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 452/2010, Art. 2º, XVI)
XVI - 1 (um) representante do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 452/2010, Art. 2º, XVII)
XVII - 1 (um) representante do Centro Gestor e Operacional do Sistema de Proteção da Amazônia (CENSIPAM), da Casa Civil, da Presidência da República; (Origem: PRT MS/GM 452/2010, Art. 2º, XVIII)
XVIII - 1 (um) representante do Conselho Brasileiro de Telemedicina e Telessaúde (CBTms); e (Origem: PRT MS/GM 452/2010, Art. 2º, XIX)
XIX - 1 (um) representante da Universidade Federal do Rio Grande do Sul. (Origem: PRT MS/GM 452/2010, Art. 2º, XX)
Subseção V
Da Requalificação das Unidades Básicas de Saúde (UBS), o Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, integrado ao Programa Nacional Telessaúde Brasil Redes
Art. 464. Fica instituído, no âmbito do Programa de Requalificação das Unidades Básicas de Saúde (UBS), o Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, integrado ao Programa Nacional Telessaúde Brasil Redes. (Origem: PRT MS/GM 2554/2011, Art. 1º)
Parágrafo Único. O Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica tem como objetivos ampliar a resolutividade da Atenção Básica e promover sua integração com o conjunto da Rede de Atenção à Saúde. (Origem: PRT MS/GM 2554/2011, Art. 1º, Parágrafo Único)
Art. 465. Para os fins desta Subseção, informatizar a Unidade Básica de Saúde (UBS) significa dotá-la de equipamentos de informática e garantir a conectividade e o uso de tecnologias de informação dirigidas: (Origem: PRT MS/GM 2554/2011, Art. 2º)
I - à qualificação das ações e serviços ofertados por este ponto de atenção; (Origem: PRT MS/GM 2554/2011, Art. 2º, I)
II - à integração deste ponto de atenção com os demais pontos de atenção integrantes da Rede de Atenção à Saúde; e (Origem: PRT MS/GM 2554/2011, Art. 2º, II)
III - ao desenvolvimento de ações de telessaúde, apoio matricial, formação e educação permanente. (Origem: PRT MS/GM 2554/2011, Art. 2º, III)
Parágrafo Único. A informatização prevista no caput deverá assegurar a participação das UBS no Telessaúde Brasil Redes. (Origem: PRT MS/GM 2554/2011, Art. 2º, Parágrafo Único)
Art. 466. O Telessaúde Brasil Redes na Atenção Básica tem como objetivo desenvolver ações de apoio à atenção à saúde e de educação permanente das equipes de atenção básica, visando à educação para o trabalho, na perspectiva da melhoria da qualidade do atendimento, da ampliação do escopo de ações ofertadas por essas equipes, da mudança das práticas de atenção e da organização do processo de trabalho, por meio da oferta de Teleconsultoria, Segunda Opinião Formativa e Telediagnóstico. (Origem: PRT MS/GM 2554/2011, Art. 3º)
Art. 467. O Telessaúde Brasil Redes na Atenção Básica será estruturado na forma de uma rede de serviços que prevê a criação de projetos intermunicipais ou de regiões de saúde, geridos de maneira compartilhada, com a possibilidade de participação das Secretarias Estaduais de Saúde, instituições de ensino e serviços de saúde, que garantam o uso da tecnologia como ferramenta de ampliação das ações da atenção básica e de melhoria do acesso e da qualidade da atenção à saúde ao cidadão. (Origem: PRT MS/GM 2554/2011, Art. 4º)
Parágrafo Único. No caso do Distrito Federal, os projetos apresentados poderão contemplar a Região Integrada de Desenvolvimento do Distrito Federal e Entorno (RIDE DF e Entorno). (Origem: PRT MS/GM 2554/2011, Art. 4º, Parágrafo Único)
Art. 468. Será priorizada a articulação com os 12 (doze) Núcleos do Telessaúde Brasil já implantados e os demais em processo de expansão quando da publicação da Portaria nº 2554/GM/MS, de 28 de outubro de 2011, ou que venham a ser implantados depois disso, apoiados nas gestões municipais, estaduais e universidades públicas, para que estes garantam apoio matricial e preparação das equipes dos novos Núcleos, além de outras formas de cooperação que venham a ser pactuadas no âmbito de cada projeto intermunicipal ou de região de saúde. (Origem: PRT MS/GM 2554/2011, Art. 5º)
Art. 469. O Telessaúde Brasil Redes na Atenção Básica será composto por: (Origem: PRT MS/GM 2554/2011, Art. 6º)
I - Núcleo(s) de Telessaúde Técnico-Científico na Atenção Básica; (Origem: PRT MS/GM 2554/2011, Art. 6º, I)
II - Pontos do Telessaúde Brasil Redes na Atenção Básica; (Origem: PRT MS/GM 2554/2011, Art. 6º, II)
III - unidade de gestão intermunicipal ou de região de saúde do projeto; e (Origem: PRT MS/GM 2554/2011, Art. 6º, III)
IV - coordenação municipal do projeto. (Origem: PRT MS/GM 2554/2011, Art. 6º, IV)
Art. 470. O Núcleo de Telessaúde Técnico-Científico na Atenção Básica deve possuir sede física e ser composto por equipe e equipamentos que garantam a coordenação e execução das ações cotidianas de: (Origem: PRT MS/GM 2554/2011, Art. 7º)
I - Teleconsultoria; (Origem: PRT MS/GM 2554/2011, Art. 7º, I)
II - educação permanente; (Origem: PRT MS/GM 2554/2011, Art. 7º, II)
III - apoio matricial; (Origem: PRT MS/GM 2554/2011, Art. 7º, III)
IV - preparação de pessoal e das equipes para o uso do serviço; (Origem: PRT MS/GM 2554/2011, Art. 7º, IV)
V - resolução de problemas relacionados ao uso do serviço; (Origem: PRT MS/GM 2554/2011, Art. 7º, V)
VI - monitoramento e avaliação do uso e da qualidade do serviço; e (Origem: PRT MS/GM 2554/2011, Art. 7º, VI)
VII - monitoramento e avaliação do impacto do Telessaúde Brasil Redes na Atenção Básica e seus resultados na atenção à saúde da população. (Origem: PRT MS/GM 2554/2011, Art. 7º, VII)
Art. 471. Compete aos Núcleos de Telessaúde Técnico-Científicos na Atenção Básica: (Origem: PRT MS/GM 2554/2011, Art. 8º)
I - organizar, ofertar e regular a Segunda Opinião Formativa, Teleconsultoria e Telediagnóstico, além de outras ações e serviços ofertados; (Origem: PRT MS/GM 2554/2011, Art. 8º, I)
II - estabelecer fluxos, prazos e protocolos, com base na melhor evidência científica disponível, e adscrição de equipes de atenção básica de modo que facilite o uso dos serviços e as solicitações das equipes; (Origem: PRT MS/GM 2554/2011, Art. 8º, II)
III - possuir equipe de teleconsultores que garanta, minimamente, a oferta de Teleconsultoria e Segunda Opinião Formativa; (Origem: PRT MS/GM 2554/2011, Art. 8º, III)
IV - articular o Telessaúde à regulação da oferta de serviços; (Origem: PRT MS/GM 2554/2011, Art. 8º, IV)
V - propiciar a elaboração, de forma compartilhada e pactuada com os pontos de atenção da rede, de fluxograma e protocolos clínicos que incluam a solicitação prévia de Segunda Opinião Formativa e/ou Teleconsultoria antes do encaminhamento ou da solicitação para a central de regulação; e (Origem: PRT MS/GM 2554/2011, Art. 8º, V)
VI - monitorar e avaliar o projeto, incluindo-se a avaliação do número de solicitações de Segunda Opinião Formativa e Teleconsultorias, do tempo de resposta para os usuários, do número e da qualidade dos encaminhamentos e solicitações de exames realizados e da ampliação da resolutividade da atenção básica. (Origem: PRT MS/GM 2554/2011, Art. 8º, VI)
Parágrafo Único. Os Núcleos de Telessaúde Técnico-Científicos na Atenção Básica são classificados como: (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 2859/2014)
I - Estadual: quando a sede do Núcleo está vinculada à gestão Estadual, tendo um conjunto de Municípios integrantes; (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único, I)
II - Municipal: quando a sede do Núcleo está vinculada à gestão Municipal, tendo abrangência apenas no próprio Município; ou (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único, II)
III - Intermunicipal: quando a sede do Núcleo está vinculada à gestão Municipal, tendo um conjunto de Municípios integrantes. (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único, III)
Art. 472. Os Pontos do Telessaúde Brasil Redes na Atenção Básica serão implementados em UBS equipadas e com pontos conectados e deverão ter seu processo de trabalho definido junto à equipe de atenção básica usuária. (Origem: PRT MS/GM 2554/2011, Art. 9º)
Art. 473. A unidade de gestão intermunicipal ou de região de saúde do projeto deverá responder pelo conjunto do projeto e tomar as decisões necessárias à sua operacionalização (Origem: PRT MS/GM 2554/2011, Art. 10)
Art. 474. Compete à unidade de gestão intermunicipal ou de região de saúde do projeto: (Origem: PRT MS/GM 2554/2011, Art. 11)
I - informar sobre o andamento do projeto; (Origem: PRT MS/GM 2554/2011, Art. 11, I)
II - gerenciar ações para a formação dos profissionais dos Núcleos de Telessaúde Técnico-Científicos vinculados aos serviços de saúde dos Municípios integrantes do Telessaúde Brasil Redes na Atenção Básica; (Origem: PRT MS/GM 2554/2011, Art. 11, II)
III - apoiar todos os Municípios que fazem parte do projeto; e (Origem: PRT MS/GM 2554/2011, Art. 11, III)
IV - garantir condições para a participação de todos os profissionais das equipes de atenção básica nas ações oferecidas pelo Programa Telessaúde Brasil Redes na Atenção Básica. (Origem: PRT MS/GM 2554/2011, Art. 11, IV)
Art. 475. A coordenação municipal do projeto será responsável pela gestão do projeto no âmbito de cada Município. (Origem: PRT MS/GM 2554/2011, Art. 12)
Art. 476. A Teleconsultoria é ação primordial do Telessaúde Brasil Redes na Atenção Básica e será instituída nos projetos a serem apresentados a partir das disposições do Programa Nacional Telessaúde Brasil Redes. (Origem: PRT MS/GM 2554/2011, Art. 13)
Art. 477. Para a execução das ações de que trata esta Subseção, serão priorizadas as Equipes de Saúde da Família (ESF) que já participem de programas de formação, educação permanente e de estímulo ao provimento e fixação de profissionais de saúde desenvolvidos ou financiados pelo Ministério da Saúde. (Origem: PRT MS/GM 2554/2011, Art. 14)
Art. 478. Os profissionais ligados ao Núcleo de Telessaúde Técnico-Científico que realizam Teleconsultoria e Segunda Opinião Formativa a partir dos Pontos do Telessaúde Brasil Redes na Atenção Básica serão, preferencialmente, trabalhadores da própria rede de serviços dos Municípios participantes. (Origem: PRT MS/GM 2554/2011, Art. 15)
Parágrafo Único. A preferência por profissionais trabalhadores da rede de serviços do Município participante visa à capacitação progressiva desses profissionais, que já atuam na área, para as funções do Telessaúde Brasil Redes, com vistas à acumulação de inteligência e expertise para sustentabilidade do Programa. (Origem: PRT MS/GM 2554/2011, Art. 15, Parágrafo Único)
Art. 479. Para implementação do Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, os Estados, o Distrito Federal e os Municípios deverão apresentar ao Ministério da Saúde o Projeto de Informatização e Telessaúde Brasil Redes na Atenção Básica, respeitada a data-limite definida pelo Ministério da Saúde. (Origem: PRT MS/GM 2554/2011, Art. 16)
Parágrafo Único. O projeto de que trata o caput será homologado pela Comissão Intergestores Bipartite (CIB) ou pelo Colegiado de Gestão da Secretaria de Saúde do Distrito Federal e, posteriormente, enviado para o Ministério da Saúde. (Origem: PRT MS/GM 2554/2011, Art. 16, § 1º)
Art. 480. O Ministério da Saúde, por intermédio do Departamento de Atenção Básica da Secretaria de Atenção à Saúde (DAB/SAS/MS), publicará no endereço eletrônico www.saude.gov.br/dab o manual instrutivo que detalhará os requisitos a serem cumpridos no projeto, tais como conteúdo, cronograma, informações, e definições, incluindo aquelas que versam sobre a distribuição dos recursos financeiros para os Fundos Municipais e/ou Distrital e Estaduais de Saúde. (Origem: PRT MS/GM 2554/2011, Art. 17)
Art. 481. Serão publicados periodicamente, em portaria específica da Secretaria de Atenção à Saúde (SAS/MS), os valores relativos ao repasse de recursos financeiros aos Municípios, por Estado, para os Projetos do Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, no âmbito do Programa de Requalificação das Unidades Básicas de Saúde. (Origem: PRT MS/GM 2554/2011, Art. 18)
Art. 482. Compete ao Ministério da Saúde fazer a análise técnica dos Projetos de Informatização e Telessaúde Brasil Redes na Atenção Básica, segundo diretrizes e critérios de adequação ao programa, tais como: (Origem: PRT MS/GM 2554/2011, Art. 19)
I - impacto; (Origem: PRT MS/GM 2554/2011, Art. 19, I)
II - exequibilidade; (Origem: PRT MS/GM 2554/2011, Art. 19, II)
III - conectividade; (Origem: PRT MS/GM 2554/2011, Art. 19, III)
IV - sustentabilidade; (Origem: PRT MS/GM 2554/2011, Art. 19, IV)
V - custo-efetividade; (Origem: PRT MS/GM 2554/2011, Art. 19, V)
VI - abrangência; (Origem: PRT MS/GM 2554/2011, Art. 19, VI)
VII - cobertura do projeto; e (Origem: PRT MS/GM 2554/2011, Art. 19, VII)
VIII - disponibilidade financeira. (Origem: PRT MS/GM 2554/2011, Art. 19, VIII)
Art. 483. O Ministério da Saúde editará, posteriormente, ato específico que disponha sobre o repasse de recursos para o custeio das atividades para o período posterior ao de que trata o "caput" deste artigo. (Origem: PRT MS/GM 2525/2013, Art. 2º)
Subseção VI
Dos Núcleos Intermunicipais e Estaduais de Telessaúde do Programa Nacional de Telessaúde Brasil Redes na Atenção Básica
Art. 484. As equipes da Atenção Básica de que trata esta Subseção incluem: (Origem: PRT MS/GM 2859/2014, Art. 9º)
I - as Equipes de Saúde da Família; (Origem: PRT MS/GM 2859/2014, Art. 9º, I)
II - as Equipes de Atenção Básica; (Origem: PRT MS/GM 2859/2014, Art. 9º, II)
III - as Equipes de Atenção Domiciliar; (Origem: PRT MS/GM 2859/2014, Art. 9º, III)
IV - os Núcleos de Apoio à Saúde da Família (NASF); (Origem: PRT MS/GM 2859/2014, Art. 9º, IV)
V - as Equipes de Saúde da Família Ribeirinhas (ESFR); (Origem: PRT MS/GM 2859/2014, Art. 9º, V)
VI - as Equipes de Saúde da Família Fluviais (ESFF); (Origem: PRT MS/GM 2859/2014, Art. 9º, VI)
VII - as equipes dos Consultórios na Rua; e (Origem: PRT MS/GM 2859/2014, Art. 9º, VII)
VIII - todas as demais equipes previstas ou que venham a ser previstas na Política Nacional de Atenção Básica (PNAB). (Origem: PRT MS/GM 2859/2014, Art. 9º, VIII)
Art. 485. O porte dos Núcleos de Telessaúde está relacionado à quantidade de equipes da Atenção Básica participantes, observada a seguinte gradação: (Origem: PRT MS/GM 2859/2014, Art. 10)
I - porte I: 80 (oitenta) a 199 (cento e noventa e nove) equipes da Atenção Básica participantes; (Origem: PRT MS/GM 2859/2014, Art. 10, I)
II - porte II: 200 (duzentas) a 399 (trezentas e noventa e nove) equipes da Atenção Básica participantes; (Origem: PRT MS/GM 2859/2014, Art. 10, II)
III - porte III: 400 (quatrocentas) a 599 (quinhentas e noventa e nove) equipes da Atenção Básica participantes; e (Origem: PRT MS/GM 2859/2014, Art. 10, III)
IV - porte IV: a partir de 600 (seiscentas) equipes da Atenção Básica participantes. (Origem: PRT MS/GM 2859/2014, Art. 10, IV)
Art. 486. O monitoramento dos Núcleos de Telessaúde por parte do Ministério da Saúde será mensal e a avaliação das informações que embasarão os valores do incentivo financeiro de custeio mensal a serem repassados será trimestral. (Origem: PRT MS/GM 2859/2014, Art. 11)
§ 1º Os indicadores dispostos nesta Subseção poderão ser revistos, a qualquer tempo, quando necessária repactuação, com objetivo de atualização e incremento. (Origem: PRT MS/GM 2859/2014, Art. 11, § 1º)
§ 2º A constatação, a qualquer tempo, do descumprimento das exigências e condições para o recebimento do incentivo financeiro de custeio mensal de que trata esta Subseção implicará na suspensão do repasse correspondente, até a regularização da situação do Núcleo de Telessaúde. (Origem: PRT MS/GM 2859/2014, Art. 11, § 2º)
§ 3º No caso da ocorrência da hipótese descrita no art. 486, § 2º , não serão devidos os valores do incentivo financeiro de custeio mensal desde a sua suspensão até a regularização da situação. (Origem: PRT MS/GM 2859/2014, Art. 11, § 3º)
Art. 487. Será disponibilizado manual instrutivo, no endereço eletrônico do Departamento de Atenção Básica (DAB/SAS/MS), disponível no Portal da Saúde em http://dab.saude.gov.br/portaldab/, contendo as orientações sobre os componentes do custeio e a forma de monitoramento dos indicadores previstos nesta Subseção. (Origem: PRT MS/GM 2859/2014, Art. 12)
Art. 488. Ato específico do Ministro de Estado da Saúde, após pactuação na Comissão Intergestores Tripartite (CIT), definirá os valores do incentivo financeiro de custeio mensal de que trata esta Subseção. (Origem: PRT MS/GM 2859/2014, Art. 13)
Art. 489. Ato específico do Ministro de Estado da Saúde habilitará os respectivos entes federativos beneficiários ao recebimento do incentivo financeiro de custeio mensal de que trata esta Subseção. (Origem: PRT MS/GM 2859/2014, Art. 14)
Parágrafo Único. Após a publicação do ato específico de que trata o "caput", o incentivo financeiro de custeio mensal será repassado pelo Fundo Nacional de Saúde ao fundo de saúde do ente beneficiário. (Origem: PRT MS/GM 2859/2014, Art. 14, Parágrafo Único)
Art. 490. Será permitido mudar o perfil do núcleo de Estadual para Intermunicipal ou vice-versa, desde que encaminhado documento com resolução da CIB solicitando tal alteração ao DAB/SAS/MS. (Origem: PRT MS/GM 2859/2014, Art. 15)
Parágrafo Único. Após análise e aprovação pelo DAB/SAS/MS do documento de que trata o "caput", será editado ato específico do Ministro de Estado da Saúde para adequar o perfil do Núcleo de Telessaúde do ente federativo previamente habilitado ao pactuado na CIB. (Origem: PRT MS/GM 2859/2014, Art. 15, Parágrafo Único)
Art. 491. A comprovação da aplicação dos recursos financeiros transferidos por força desta Subseção será apresentada no Relatório Anual de Gestão (RAG), previsto na Lei nº 8.142, de 28 de dezembro de 1990, e no Decreto nº 1.651, de 28 de setembro de 1995, e assinado pelo respectivo Conselho de Saúde. (Origem: PRT MS/GM 2859/2014, Art. 16)
Art. 492. O Sistema Nacional de Auditoria (SNA), com fundamento nos relatórios de gestão, acompanhará a conformidade da aplicação dos recursos transferidos, nos termos do disposto no art. 5º do Decreto nº 1.232, de 30 de agosto de 1994. (Origem: PRT MS/GM 2859/2014, Art. 17)
Subseção VII
Do Programa Nacional Telessaúde Brasil Redes para Apoiar a Implantação da Estratégia e-SUS AB
Art. 493. Fica instituído o incentivo financeiro de custeio destinado aos Municípios, Estados e Distrito Federal com núcleos de Telessaúde do Programa Nacional Telessaúde Brasil Redes para apoio à implantação da estratégia e-SUS AB. (Origem: PRT MS/GM 58/2015, Art. 1º)
Art. 494. O cálculo do valor do incentivo a ser repassado para cada Município, Estado e Distrito Federal com núcleo de telessaúde considerará a abrangência de implantação (número de equipes de Atenção Básica apoiadas) e o sistema de "software" (Coleta de Dados Simplificado - CDS e o Prontuário Eletrônico do Cidadão - PEC) que será implantado nas Unidades Básicas de Saúde as quais as equipes apoiadas estão vinculadas e que deverão constar no projeto enviado ao DAB/SAS/MS). (Origem: PRT MS/GM 58/2015, Art. 3º)
Parágrafo Único. Caberá ao Ministério da Saúde estipular os valores mínimos e máximos do incentivo financeiro previsto nesta Subseção aos quais cada Estado, Distrito Federal e Município, sedes de Núcleo de Telessaúde estarão habilitados ao recebimento, após pactuação na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 58/2015, Art. 3º, Parágrafo Único)
Art. 495. Para fins de acompanhamento das atividades dos Núcleos de Telessaúde serão consideradas as atividades desenvolvidas pelos Núcleos de Telessaúde na implantação do CDS e/ou PEC, quais sejam: (Origem: PRT MS/GM 58/2015, Art. 4º)
I - realizar web conferências sobre a estratégia e-SUS AB no período de vigência do plano de trabalho; (Origem: PRT MS/GM 58/2015, Art. 4º, I)
II - realizar oficinas de trabalho sobre a estratégia e-SUS AB no período de vigência do plano de trabalho; (Origem: PRT MS/GM 58/2015, Art. 4º, II)
III - realizar visitas em Unidades Básicas de Saúde para implantação do PEC, no período de vigência do plano de trabalho; e (Origem: PRT MS/GM 58/2015, Art. 4º, III)
IV - monitorar a evolução do estágio de implantação do e-SUS AB e envio dos dados nos Municípios vinculados ao plano de trabalho. (Origem: PRT MS/GM 58/2015, Art. 4º, IV)
Parágrafo Único. O monitoramento das informações descritas no art. 4º, ocorrerá periodicamente, através de envio de relatório das atividades pelos Núcleos de Telessaúde ao Ministério da Saúde. (Origem: PRT MS/GM 58/2015, Art. 4º, Parágrafo Único)
Art. 496. O incentivo financeiro de custeio de que trata esta Subseção será repassado em (duas) parcelas ao Município sede do Núcleo de Telessaúde para os projetos intermunicipais e ao Estado sede do Núcleo de Telessaúde para os Projetos Estaduais. (Origem: PRT MS/GM 58/2015, Art. 5º)
§ 1º A primeira parcela corresponderá a 50% (cinquenta por cento) do valor total a ser repassado, após aprovação de Plano de Trabalho encaminhado ao Departamento de Atenção Básica. (Origem: PRT MS/GM 58/2015, Art. 5º, § 1º)
§ 2º A segunda parcela corresponderá a 50% (cinquenta por cento) do valor total a ser repassado e será liberada quando, no mínimo, 60% dos Municípios identificados nos planos de trabalhos encaminhados pelos núcleos de Telessaúde estiverem com status de implantação intermediário e/ou implantado. (Origem: PRT MS/GM 58/2015, Art. 5º, § 2º)
§ 3º Os recursos federais referentes ao incentivo financeiro de custeio de que trata esta Subseção poderão ser transferidos pelo Fundo Nacional de Saúde diretamente aos Fundos de Saúde Estaduais, conforme pactuação na Comissão Intergestores Bipartite (CIB). (Origem: PRT MS/GM 58/2015, Art. 5º, § 3º)
Art. 497. Para acompanhamento do andamento da implantação nas Unidades Básicas de Saúde serão considerados, a partir do relatório de envio de dados ao SISAB, os seguintes estágios de implantação: (Origem: PRT MS/GM 58/2015, Art. 6º)
I - somente envio de informações de Atividade Coletiva; (Origem: PRT MS/GM 58/2015, Art. 6º, I)
II - envio de Informações de outras ações; e (Origem: PRT MS/GM 58/2015, Art. 6º, II)
III - envio de informações de, pelo menos, Cadastro Individual, Atendimento Individual e visita domiciliar. (Origem: PRT MS/GM 58/2015, Art. 6º, III)
Parágrafo Único. O estágio da implantação nas Unidades Básicas de Saúde será considerado como: (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único)
I - não Iniciado - Nenhuma UBS iniciou a implantação; (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, I)
II - incipiente - Ao menos uma UBS iniciou implantação; (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, II)
III - intermediário - 30% e < 60% das UBS em Estágio II ou III; e (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, III)
IV - implantado - 60% das UBS em Estágio II ou III. (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, IV)
Art. 498. Na hipótese de execução integral do objeto originalmente pactuado e verificada sobra de recursos financeiros, o ente federativo poderá efetuar o remanejamento dos recursos e a sua aplicação nos termos da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 58/2015, Art. 7º)
Art. 499. A comprovação da aplicação dos recursos financeiros transferidos por força desta Subseção será apresentada no Relatório Anual de Gestão (RAG), previsto na Lei nº 8.142, de 28 de dezembro de 1990, e no Decreto nº 1.651, de 28 de setembro de 1995, e assinado pelo respectivo Conselho de Saúde. (Origem: PRT MS/GM 58/2015, Art. 8º)
Art. 500. O Sistema Nacional de Auditoria (SNA), com fundamento nos relatórios de gestão, acompanhará a conformidade da aplicação dos recursos transferidos, nos termos do disposto no art. 5º do Decreto nº 1.232, de 30 de agosto de 1994. (Origem: PRT MS/GM 58/2015, Art. 9º)
Art. 501. Nos casos em que for verificada a não execução integral do objeto originalmente pactuado e a existência de recursos financeiros repassados pelo Fundo Nacional de Saúde para os Fundos de Saúde Estaduais, Distrital e Municipais não executados, seja parcial ou totalmente, o ente federativo estará sujeito à devolução dos recursos financeiros transferidos e não executados, acrescidos da correção monetária prevista em lei, observado o regular processo administrativo. (Origem: PRT MS/GM 58/2015, Art. 10)
Art. 502. Nos casos em que for verificado que os recursos financeiros transferidos pelo Fundo Nacional de Saúde foram executados, total ou parcialmente, em objeto distinto ao originalmente pactuado, aplicar-se-á o regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Origem: PRT MS/GM 58/2015, Art. 11)
Art. 503. Os recursos financeiros para execução do objeto, de que trata esta Subseção, para os Núcleos Municipais e Intermunicipais, são oriundos do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.301.2015.8577 - Piso de Atenção Básica Fixo. (Origem: PRT MS/GM 58/2015, Art. 12)
Art. 504. Os recursos financeiros para execução do objeto, de que trata esta Subseção, para os Núcleos Estaduais, são oriundos do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.302.2015.8585 - Atenção à Saúde da População para Procedimentos em Média e Alta Complexidade. (Origem: PRT MS/GM 58/2015, Art. 13)
(Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Seção I-A
Do Programa de Informatização das Unidades Básicas de
Saúde (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Art. 504-A. Fica instituído o Programa de Informatização das Unidades Básicas de Saúde - PIUBS, no âmbito da Política Nacional de Atenção Básica - PNAB e da Política Nacional de Informação e Informática em Saúde - PNIIS. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 1º O PIUBS consiste no fornecimento de infraestrutura tecnológica, além de serviços de Tecnologia da Informação, que possibilite a implantação e a manutenção de prontuário eletrônico nas Unidades Básicas de Saúde - UBS dos Municípios e do Distrito Federal. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 2º As regras sobre o custeio do PIUBS estão definidas nos arts. 172-A a 172-D da Portaria de Consolidação nº 6/GM/MS, de 28 de setembro de 2017. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Art. 504-B. A participação dos Municípios e do Distrito Federal no PIUBS, que ocorrerá mediante a assinatura de termo de adesão, permitirá ao ente escolher: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
I - a contratação de empresas pelo Ministério da Saúde, após processo de credenciamento, para a implantação e manutenção de prontuário eletrônico de paciente em suas UBS; ou (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
II - nos casos em que contar com prontuários eletrônicos em funcionamento, a solicitação de transferência de recursos financeiros para o custeio desses serviços já implantados, desde que atendam aos requisitos técnicos definidos por ato do Departamento de Atenção Básica. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 1º O Ministério da Saúde disponibilizará portal eletrônico para acesso pelos Municípios e Distrito Federal ao PIUBS. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 2° O termo de adesão de que trata o caput será disponibilizado no portal eletrônico referido no § 1º e deverá prever detalhadamente as responsabilidades do município ou do Distrito Federal aderente, inclusive no que concerne: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
I - à escolha de uma das alternativas previstas nos incisos do caput; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
II - às informações a serem prestadas regularmente ao Ministério da Saúde na execução do PIUBS; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
III - à necessidade de motivação da opção por uma das soluções das empresas credenciadas disponíveis no portal eletrônico referido no § 1º, na hipótese de ter sido escolhida a alternativa prevista no inciso I do caput; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
IV - ao provimento dos meios necessários para que a empresa contratada possa desempenhar os seus serviços, na hipótese de ter sido escolhida a alternativa prevista no inciso I do caput; e (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
V - ao acompanhamento dos serviços desempenhados pela empresa contratada, na hipótese de ter sido escolhida a alternativa prevista no inciso I do caput. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 3º A escolha da contratação prevista no inciso I do caput poderá ocorrer mesmo nos casos em que os municípios e o Distrito Federal possuam prontuário eletrônico em funcionamento em suas UBS, desde que devidamente justificada. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 4º A adesão de município ou do Distrito federal ao PIUBS não isentará o ente e suas equipes de Atenção Básica de transmitir os dados de produção mensal para a base nacional do Sistema de Informação em Saúde para a Atenção Básica - SISAB em qualquer fase do programa (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 5º O processo de credenciamento e contratação de que trata o inciso I do caput será regido por regras previstas em edital a ser publicado pelo Ministério da Saúde. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 6º Para fins da opção de que trata o inciso III do § 2º, as soluções das empresas credenciadas serão apresentadas aos municípios e Distrito Federal por meio do portal eletrônico referido no § 1º, com a descrição das características de cada solução e sem a identificação das empresas credenciadas. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Art. 504-C. Fica instituído o Comitê Gestor do PIUBS - CGPIUBS, com a seguinte composição: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
I - um representante, titular e suplente, do Departamento de Monitoramento e Avaliação do SUS da Secretaria-Executiva - DEMAS/SE, que o coordenará; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
II - um representante, titular e suplente, do Departamento de Atenção Básica da Secretaria de Atenção à Saúde - DAB/SAS; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
III - um representante, titular e suplente, do Departamento de Informática do SUS da Secretaria-Executiva - DATASUS/SE; e (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
IV - um representante, titular e suplente, da Subsecretaria de Assuntos Administrativos da Secretaria-Executiva - SAA/SE. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 1º Os representantes deverão ser escolhidos entre servidores dos órgãos mencionados nos incisos do caput e serão indicados pelo Secretário de Atenção à Saúde, no caso do incisoII do caput, e pelo Secretário-Executivo, no caso dos incisos I, III e IV do caput. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 2º Os órgãos participantes do CGPIUBS fornecerão o apoio técnico e administrativo necessário às atividades desse comitê. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Art. 504-D. Compete ao CGPIUBS: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
I - planejar, articular e gerir o PIUBS, com base em diretrizes definidas pelo Comitê Gestor da Estratégia de e-Saúde; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
II - definir, monitorar e avaliar a execução das ações a serem desenvolvidas no âmbito do PIUBS; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
III - deliberar sobre a suspensão dos repasses dos valores do programa em face do descumprimento das obrigações assumidas pelos municípios e Distrito Federal no PIUBS, observada a necessidade de notificação prévia e prazo para resposta do ente aderente, nos termos do art. 172-D da Portaria de Consolidação nº 6/GM/MS, de 2017; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
V - dispor sobre os casos omissos nesta Portaria e nos instrumentos de adesão, credenciamento e contratação e sobre as demais medidas necessárias para garantir a plena execução do programa; e (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
VI - fornecer o apoio técnico e administrativo necessário para a plena execução do programa. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 1º As reuniões ordinárias do CGPIUBS serão quinzenais, podendo ser convocadas reuniões extraordinárias pelo coordenador. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 2º As deliberações do CGPIUBS serão tomadas por maioria simples, cabendo ao coordenador a decisão final em caso de empate, e serão formalizadas por meio de atas. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
§ 3º A participação no CGPIUBS será considerada prestação de serviço público relevante, não remunerada. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Seção II
Do Programa Nacional de Melhoria do Acesso e da Qualidade da Atenção Básica (PMAQ-AB)
Art. 505. Fica instituído o Programa Nacional de Melhoria do Acesso e da Qualidade da Atenção Básica (PMAQ-AB). (Origem: PRT MS/GM 1645/2015, Art. 1º)
Art. 506. O PMAQ-AB tem como objetivo induzir a ampliação do acesso e a melhoria da qualidade da atenção básica, com garantia de um padrão de qualidade comparável nacional, regional e localmente,de maneira a permitir maior transparência e efetividade das ações governamentais direcionadas à Atenção Básica em Saúde. (Origem: PRT MS/GM 1645/2015, Art. 2º)
Art. 507. São diretrizes do PMAQ-AB: (Origem: PRT MS/GM 1645/2015, Art. 3º)
I - definir parâmetro de qualidade, considerando-se as diferentes realidades de saúde, de maneira a promover uma maior resolutividade das equipes de saúde da atenção básica; (Origem: PRT MS/GM 1645/2015, Art. 3º, I)
II - estimular processo contínuo e progressivo de melhoramento dos padrões e indicadores de acesso e de qualidade que envolva a gestão, o processo de trabalho e os resultados alcançados pelas equipes de saúde da atenção básica; (Origem: PRT MS/GM 1645/2015, Art. 3º, II)
III - transparência em todas as suas etapas, permitindo-se o contínuo acompanhamento de suas ações e resultados pela sociedade; (Origem: PRT MS/GM 1645/2015, Art. 3º, III)
IV - envolver e mobilizar os gestores federal, estaduais, do Distrito Federal e municipais, as equipes de saúde de atenção básica e os usuários em um processo de mudança de cultura de gestão e qualificação da atenção básica; (Origem: PRT MS/GM 1645/2015, Art. 3º, IV)
V - desenvolver cultura de planejamento, negociação e contratualização, que implique na gestão dos recursos em função dos compromissos e resultados pactuados e alcançados; (Origem: PRT MS/GM 1645/2015, Art. 3º, V)
VI - estimular o fortalecimento do modelo de atenção previsto na Política Nacional de Atenção Básica, o desenvolvimento dos trabalhadores e a orientação dos serviços em função das necessidades e da satisfação dos usuários; e (Origem: PRT MS/GM 1645/2015, Art. 3º, VI)
VII - caráter voluntário para a adesão tanto pelas equipes de saúde da atenção básica quanto pelos gestores municipais, a partir do pressuposto de que o seu êxito depende da motivação e proatividade dos atores envolvidos. (Origem: PRT MS/GM 1645/2015, Art. 3º, VII)
Art. 508. O PMAQ-AB é composto por 3 (três) Fases e um Eixo Estratégico Transversal de Desenvolvimento que compõem um ciclo. (Origem: PRT MS/GM 1645/2015, Art. 4º)
§ 1º O PMAQ-AB se refere a processos e fases que se sucedem para o desenvolvimento e a melhoria contínua da qualidade da atenção básica. (Origem: PRT MS/GM 1645/2015, Art. 4º, § 1º)
§ 2º Cada ciclo do PMAQ-AB ocorrerá a cada 24 (vinte e quatro) meses. (Origem: PRT MS/GM 1645/2015, Art. 4º, § 2º)
Art. 509. A Fase 1 do PMAQ-AB é denominada Adesão e Contratualização. (Origem: PRT MS/GM 1645/2015, Art. 5º)
§ 1º Na Fase 1, todas as equipes de saúde da atenção básica, incluindo as equipes de saúde bucal e Núcleos de Apoio ao Saúde da Família, independente do modelo pelo qual se organizam, poderão aderir ao PMAQ-AB, desde que se encontrem em conformidade com os princípios da atenção básica e com os critérios a serem definidos no Manual Instrutivo do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 1º)
§ 2º O Distrito Federal ou o Município poderá incluir todas ou apenas parte das suas equipes de saúde da atenção básica na adesão ao PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 2º)
§ 3º Na Fase 1 serão observadas as seguintes etapas: (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º)
I - formalização da adesão pelo Distrito Federal ou Município,que será feita por intermédio do preenchimento de formulário eletrônico específico a ser indicado pelo Ministério da Saúde; (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º, I)
II - contratualização da equipe de saúde da atenção básica e do gestor do Distrito Federal ou municipal, de acordo com as diretrizes e critérios definidos do Manual Instrutivo do PMAQ-AB; e (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º, II)
III - informação sobre a adesão do Município ao Conselho Municipal de Saúde e à Comissão Intergestores Regional. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º, III)
§ 4º Para os fins do disposto no inciso III do § 3º, o Distrito Federal informará a adesão ao respectivo Conselho de Saúde. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 4º)
§ 5º A Fase 1 será realizada pelas equipes que ingressarem no PMAQ-AB pela primeira vez a cada ciclo. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 5º)
Art. 510. A Fase 2 do PMAQ-AB é denominada Certificação e será composta por: (Origem: PRT MS/GM 1645/2015, Art. 6º)
I - avaliação externa de desempenho das equipes de saúde e gestão da atenção básica, que será coordenada de forma tripartite e realizada por instituições de ensino e/ou pesquisa, por meio da verificação de evidências para um conjunto de padrões previamente determinados; (Origem: PRT MS/GM 1645/2015, Art. 6º, I)
II - avaliação de desempenho dos indicadores contratualizados na etapa de adesão e contratualização, conforme disposto no art. 509; e (Origem: PRT MS/GM 1645/2015, Art. 6º, II)
III - verificação da realização de momento autoavaliativo pelos profissionais das equipes de atenção básica. (Origem: PRT MS/GM 1645/2015, Art. 6º, III)
§ 1º As equipes contratualizadas avaliadas nos termos deste artigo receberão as seguintes classificações de desempenho: (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º)
I - Ótimo; (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, I)
II - Muito Bom; (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, II)
III - Bom; (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, III)
IV - Regular; e (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, IV)
V - Ruim. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, V)
§ 2º Caso a equipe contratualizada não alcance um conjunto de padrões mínimos de qualidade considerados essenciais, nos termos do Manual Instrutivo do PMAQ-AB, ela será automaticamente certificada com desempenho ruim. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 2º)
§ 3º Para que a equipe seja classificada com o desempenho ótimo, além de obter uma nota mínima, deverá alcançar um conjunto de padrões considerados estratégicos, nos termos do Manual Instrutivo do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 3º)
§ 4º O conjunto das classificações de desempenho das equipes contratualizadas comporá o Fator de Desempenho do Distrito Federal e de cada Município. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 4º)
Art. 511. A Fase 3 do PMAQ-AB é denominada Recontratualização, que se caracteriza pela pactuação singular do Distrito Federal e dos Municípios com incremento de novos padrões e indicadores de qualidade, estimulando a institucionalização de um processo cíclico e sistemático a partir dos resultados verificados na fase 2 do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 7º)
Parágrafo Único. A Fase 3 será realizada pelas equipes que participaram do PMAQ-AB em ciclo anterior. (Origem: PRT MS/GM 1645/2015, Art. 7º, Parágrafo Único)
Art. 512. O Eixo Estratégico Transversal de Desenvolvimento do PMAQ-AB é composto pelos seguintes elementos: (Origem: PRT MS/GM 1645/2015, Art. 8º)
I - autoavaliação, a ser feita pela equipe de saúde da atenção básica a partir de instrumentos ofertados pelo PMAQ-AB ou outros definidos e pactuados pelo Estado, Distrito Federal, Município ou Região de Saúde; (Origem: PRT MS/GM 1645/2015, Art. 8º, I)
II - monitoramento, a ser realizado pelas equipes de saúde da atenção básica, pela Secretaria Municipal de Saúde e pela Secretaria de Estado da Saúde do Distrito Federal, pela Secretaria de Estado da Saúde e pelo Ministério da Saúde em parceria com as Comissões Intergestores Regionais (CIR), a partir dos indicadores de saúde contratualizados na Fase 1 do PMAQ-AB; (Origem: PRT MS/GM 1645/2015, Art. 8º, II)
III - educação permanente, por meio de ações dos gestores municipais, do Distrito Federal, estaduais e federal, considerando-se as necessidades de educação permanente das equipes; (Origem: PRT MS/GM 1645/2015, Art. 8º, III)
IV - apoio institucional, a partir de estratégia de suporte às equipes de saúde da atenção básica pelos Municípios e à gestão municipal pelas Secretarias de Estado da Saúde e Conselho de Secretarias Municipais de Saúde (COSEMS); e (Origem: PRT MS/GM 1645/2015, Art. 8º, IV)
V - cooperação horizontal presencial e/ou virtual, que deverá ocorrer entre equipes de atenção básica e entre gestores, com o intuito de permitir a troca de experiências e práticas promotoras de melhoria da qualidade da atenção básica. (Origem: PRT MS/GM 1645/2015, Art. 8º, V)
Parágrafo Único. O Eixo Estratégico Transversal de Desenvolvimento deve ser entendido como transversal a todas as Fases, de maneira a assegurar que as ações de promoção da melhoria da qualidade possam ser desenvolvidas em todas as etapas do ciclo do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 8º, Parágrafo Único)
Art. 513. O Grupo de Trabalho de Atenção à Saúde da Comissão Intergestores Tripartite (CIT) acompanhará o desenvolvimento do PMAQ-AB, com avaliação e definição, inclusive, dos instrumentos utilizados no Programa. (Origem: PRT MS/GM 1645/2015, Art. 11)
Parágrafo Único. O Grupo de Trabalho de que trata o "caput" poderá convidar especialistas para discussão e manifestação acerca de elementos do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 11, Parágrafo Único)
Art. 514. O Ministério da Saúde, por meio do Departamento de Atenção Básica da Secretaria de Atenção à Saúde (DAB/SAS/MS), publicará o Manual Instrutivo do PMAQ-AB, com a metodologia pactuada e outros detalhamentos do Programa. (Origem: PRT MS/GM 1645/2015, Art. 12)
Seção III
Do Grupo de Trabalho para Mapeamento, Avaliação e Monitoramento dos Dados Judiciários e Propositura de Atuações Estratégicas em Face da Judicialização no Âmbito do Projeto Mais Médicos para o Brasil
Art. 515. Fica instituído Grupo de Trabalho para mapeamento, avaliação e monitoramento dos dados judiciários e propositura de atuações estratégicas em face da judicialização no âmbito do Projeto Mais Médicos para o Brasil, com os seguintes objetivos: (Origem: PRT MS/GM 1560/2017, Art. 1º)
I - diagnóstico para reforço das estratégias judiciais que viabilizem a reversão das decisões favoráveis aos médicos cooperados, e mitigação dos efeitos da judicialização inclusive no âmbito das instâncias especiais do Poder Judiciário no Brasil; (Origem: PRT MS/GM 1560/2017, Art. 1º, I)
II - buscar diálogo e interação com o sistema judiciário brasileiro para apresentação dos impactos negativos das citadas demandas aos propósitos do Projeto Mais Médicos para o Brasil, notadamente a desassistência aos usuários do serviço de Atenção Básica em regiões de extrema vulnerabilidade no Brasil; (Origem: PRT MS/GM 1560/2017, Art. 1º, II)
III - interação com os órgãos de assessoramento jurídico da União e com o Ministério das Relações Exteriores para tratamento conjuntural das demandas; (Origem: PRT MS/GM 1560/2017, Art. 1º, III)
IV - monitoramento e avaliação dos pleitos e do tratamento judiciário das demandas, inclusive para atuação preventiva; (Origem: PRT MS/GM 1560/2017, Art. 1º, IV)
V - apresentar propostas de interlocuções com a Organização Panamericana de Saúde (OPAS), para estratégias de cumprimento das decisões judiciais até que sejam revertidas; e (Origem: PRT MS/GM 1560/2017, Art. 1º, V)
VI - outras medidas que entendam cabíveis. (Origem: PRT MS/GM 1560/2017, Art. 1º, VI)
Art. 516. O Grupo de Trabalho será composto por 6 (seis) membros representantes do Ministério da Saúde, contemplando as seguintes representações, com respectivas suplências em igual quantitativo: (Origem: PRT MS/GM 1560/2017, Art. 2º)
I - Gabinete da Secretaria de Gestão do Trabalho e da Educação na Saúde (GAB/SGTES/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, I)
II - Departamento de Planejamento e Regulação da Provisão de Profissionais de Saúde da Secretaria de Gestão do Trabalho e da Educação na Saúde (DEPREPS/SGTES/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, II)
III - Coordenação-Geral de Planejamento e Orçamento da Secretaria de Gestão do Trabalho e da Educação na Saúde (CGPLAN/SGTES/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, III)
IV - Secretaria-Executiva do Ministério da Saúde (SE/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, IV)
V - Consultoria Jurídica do Ministério da Saúde (CONJUR/MS); e (Origem: PRT MS/GM 1560/2017, Art. 2º, V)
VI - Assessoria para Assuntos Internacionais em Saúde, do Gabinete do Ministro (AISA/GM/MS). (Origem: PRT MS/GM 1560/2017, Art. 2º, VI)
§ 1º A coordenação dos trabalhos será exercida pela Secretaria-Executiva do Ministério da Saúde, cabendo ao seu representante a função de secretariar as atividades e manter registro de todas as convocações, pautas e atas. (Origem: PRT MS/GM 1560/2017, Art. 2º, § 1º)
§ 2º Serão convidados a integrar o grupo de trabalho, como membros colaborativos: (Origem: PRT MS/GM 1560/2017, Art. 2º, § 2º)
I - o Ministério das Relações Exteriores; e (Origem: PRT MS/GM 1560/2017, Art. 2º, § 2º, I)
II - a Advocacia-Geral da União, nas representações da Secretaria-Geral de Contencioso e da Procuradoria-Geral da União. (Origem: PRT MS/GM 1560/2017, Art. 2º, § 2º, II)
Art. 517. As atividades desempenhadas no Grupo de Trabalho não serão remuneradas na medida em que são afins às funções ordinárias dos membros, reconhecida a relevância dessa atuação para a Administração Pública Federal. (Origem: PRT MS/GM 1560/2017, Art. 3º)
Art. 518. Pela imprevisibilidade de esgotamento do objeto, o Grupo de Trabalho exercerá suas atividades por prazo indeterminado. (Origem: PRT MS/GM 1560/2017, Art. 4º)
Art. 519. O Grupo de Trabalho poderá expedir relatórios, recomendações, manuais, cartilhas e quaisquer outros produtos, assim como pleitear reuniões para discussão dos temas e encaminhamentos que entenda como essenciais e colaborativos ao cumprimento dos seus objetivos, reportando-se à Secretaria-Executiva. (Origem: PRT MS/GM 1560/2017, Art. 5º)
CAPÍTULO II
DA ATENÇÃO HOSPITALAR
Art. 520. As ações de Vigilância Epidemiológica Hospitalar (VEH) terão por objetivo detectar, de modo oportuno, as doenças transmissíveis e os agravos de importância nacional ou internacional, bem como a alteração do padrão epidemiológico em regiões estratégicas do país, desenvolvida em estabelecimentos de saúde hospitalares, que atuarão como unidades sentinelas para a Rede de Vigilância Epidemiológica Hospitalar de Interesse Nacional (REVEH). (Origem: PRT MS/GM 183/2014, Art. 5º)
§ 1º A atuação da VEH tomará por base protocolos e procedimentos padronizados, que permitam a identificação oportuna, a notificação imediata, a investigação inicial ou complementar e o registro ou a atualização de informações no SINAN e em outros sistemas oficiais, quando disponíveis. (Origem: PRT MS/GM 183/2014, Art. 5º, § 1º)
§ 2º A VEH será realizada de modo articulado com o Núcleo de Segurança do Paciente (NSP), instituído pela Portaria nº 529/GM/MS, de 1º de abril de 2013, e demais estruturas ou setores integrantes do sistema hospitalar que visem contribuir para a qualificação do cuidado em saúde ou vigilância das doenças e agravos. (Origem: PRT MS/GM 183/2014, Art. 5º, § 2º)
§ 3º Os valores destinados aos hospitais federais integrantes do sistema VEH não serão incorporados ao incentivo financeiro de custeio para implantação e manutenção de ações e serviços públicos estratégicos de vigilância em saúde, sendo financiados de forma direta pelo Ministério da Saúde, conforme procedimento que será regulamentado em ato específico do Ministro de Estado da Saúde. (Origem: PRT MS/GM 183/2014, Art. 5º, § 3º)
Art. 521. Para desenvolver as ações de VEH, os entes federativos devem possuir hospitais que tenham sido habilitados como estratégicos para a composição da REVEH. (Origem: PRT MS/GM 183/2014, Art. 6º)
Parágrafo Único. Para compor a REVEH, o estabelecimento de saúde deverá ser credenciado para a instalação, registro e atualização das informações no SINAN junto à Secretaria de Saúde do Distrito Federal ou do Município, devendo-se atender ao SUS na proporção de 1 (um) hospital com 50 (cinquenta) ou mais leitos para cada 1.000.000 (um milhão) de habitantes, ou, no mínimo, 1 (um) hospital por Estado, independentemente do número de habitantes, e que seja: (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único)
I - hospital geral de referência nacional, regional, estadual, distrital ou municipal; (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, I)
II - hospital especializado em doenças transmissíveis de referência nacional, regional, estadual, distrital ou municipal; (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, II)
III - hospital participante de estratégia de vigilância sentinela de doenças e agravos de interesse da SVS/MS; ou (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, III)
IV - hospital participante de estratégias gerenciadas por outras Secretarias do Ministério da Saúde ou pela Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, IV)
Art. 522. Para a execução de ações de VEH, o estabelecimento de saúde deverá atender aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 7º)
I - designar profissional de saúde de nível superior, preferencialmente com experiência em vigilância epidemiológica, como responsável pelas atividades de vigilância epidemiológica hospitalar; (Origem: PRT MS/GM 183/2014, Art. 7º, I)
II - promover, em até 24 (vinte e quatro) horas, a notificação compulsória imediata de todos os casos e óbitos por doenças ou agravos identificados, segundo legislação vigente; (Origem: PRT MS/GM 183/2014, Art. 7º, II)
III - realizar investigação complementar dos casos e óbitos hospitalizados já notificados por outros estabelecimentos de saúde, registrando-se a informação no instrumento ou sistema de informação correspondente, quando disponível; e (Origem: PRT MS/GM 183/2014, Art. 7º, III)
IV - elaborar relatório trimestral com o perfil de morbidade e mortalidade hospitalar das doenças de notificação compulsória, a ser encaminhado à Secretaria Municipal de Saúde em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 7º, IV)
Art. 523. Para a execução de ações de VEH, as Secretarias de Saúde dos Estados deverão atender aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 8º)
I - designar profissional ou setor de referência para implementar e gerir a estratégia de vigilância epidemiológica hospitalar em seu âmbito de gestão; (Origem: PRT MS/GM 183/2014, Art. 8º, I)
II - consolidar os relatórios encaminhados pelas Secretarias Municipais de Saúde participantes da REVEH de sua área de abrangência, independente da gestão hospitalar, federal, estadual ou municipal, para conhecimento e análise do perfil de morbidade e mortalidade hospitalar, das doenças de notificação compulsória do seu território; e (Origem: PRT MS/GM 183/2014, Art. 8º, II)
III - encaminhar relatório semestral consolidado à SVS/MS, em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 8º, III)
Art. 524. Para a execução de ações de VEH, as Secretarias de Saúde dos Municípios deverão atender aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 9º)
I - designar profissional ou setor de referência para implementar e gerir a estratégia de vigilância epidemiológica hospitalar em seu âmbito de gestão; (Origem: PRT MS/GM 183/2014, Art. 9º, I)
II - consolidar os relatórios encaminhados pelos estabelecimentos de saúde participantes da REVEH de sua área de abrangência, independentemente da gestão hospitalar federal, estadual ou municipal, para conhecimento e análise do perfil de morbidade e mortalidade hospitalar das doenças de notificação compulsória de seu território; e (Origem: PRT MS/GM 183/2014, Art. 9º, II)
III - encaminhar relatório trimestral consolidado à Secretaria de Saúde Estadual, em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 9º, III)
Art. 525. Compete à Secretaria de Saúde do Distrito Federal as mesmas atribuições das Secretarias de Saúde Municipais descritas no art. 524, ressalvando-se o disposto no art. 524, III. (Origem: PRT MS/GM 183/2014, Art. 10)
Parágrafo Único. A Secretaria de Saúde do Distrito Federal deverá encaminhar semestralmente relatório consolidado à SVS/MS em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 10, Parágrafo Único)
Art. 526. O ente federativo será desabilitado das ações de VEH, total ou parcialmente, tendo em vista o número de seus estabelecimentos de saúde habilitados como estratégicos para a composição da REVEH, cadastrados no SCNES, quando: (Origem: PRT MS/GM 183/2014, Art. 12)
I - o tempo entre a notificação e a digitação dos registros de notificação compulsória imediata seja superior a 7 (sete) dias em mais de 50% (cinquenta por cento) dos casos ou óbitos identificados pelo componente da REVEH, por três meses consecutivos; ou (Origem: PRT MS/GM 183/2014, Art. 12, I)
II - deixar de promover a notificação negativa registrada no SINAN por mais de 4 (quatro) semanas epidemiológicas consecutivas, quando da ausência de notificação compulsória. (Origem: PRT MS/GM 183/2014, Art. 12, II)
§ 1º A desabilitação será total quando todos os estabelecimentos de saúde do ente federativo, habilitados como estratégicos para a composição da REVEH e cadastrados no SCNES, enquadrarem-se no disposto no inciso I ou II do "caput". (Origem: PRT MS/GM 183/2014, Art. 12, § 1º)
§ 2º A desabilitação será parcial quando o enquadramento no disposto no inciso I ou II do "caput" não abranger todos os estabelecimentos de saúde do ente federativo habilitados como estratégicos para a composição da REVEH. (Origem: PRT MS/GM 183/2014, Art. 12, § 2º)
§ 3º A desabilitação parcial será realizada de forma proporcional ao número total de estabelecimentos de saúde do ente federativo habilitados como estratégicos para a composição da REVEH, cadastrados no SCNES e aqueles, dentre estes, que se enquadrarem no disposto no inciso I ou II do "caput". (Origem: PRT MS/GM 183/2014, Art. 12, § 3º)
Art. 527. A avaliação das ações de VEH será efetuada semestralmente pela SVS/MS por meio do SINAN, a partir do ano seguinte ao da habilitação. (Origem: PRT MS/GM 183/2014, Art. 13)
Seção I
Do Programa Nacional de Incentivo à Parceria entre os Hospitais Filantrópicos Sem Fins Lucrativos
Art. 528. Fica instituído o Programa Nacional de Incentivo à Parceria entre os Hospitais Filantrópicos sem fins lucrativos e o Sistema Único de Saúde. (Origem: PRT MS/GM 878/2002, Art. 1º)
Art. 529. Ficam estabelecidos os seguintes requisitos mínimos para habilitação de hospitais filantrópicos e sem fins lucrativos à adesão ao Programa Nacional de Incentivo à Parceria entre os Hospitais Filantrópicos sem fins lucrativos com o Sistema Único de Saúde: (Origem: PRT MS/GM 878/2002, Art. 2º)
I - possuir registro nos órgãos competentes federais, estaduais ou municipais incumbidos do cadastro de instituições de assistência social beneficente, educacional ou de saúde; (Origem: PRT MS/GM 878/2002, Art. 2º, a)
II - possuir Certificado de Filantropia emitido pelo Conselho Nacional de Assistência Social (CNAS); (Origem: PRT MS/GM 878/2002, Art. 2º, b)
III - ter sido submetido à avaliação do Programa Nacional de Avaliação dos Serviços Hospitalares (PNASH) e obtido, no mínimo, 60% de aproveitamento; (Origem: PRT MS/GM 878/2002, Art. 2º, c)
IV - informar, por meio da Comunicação de Internação Hospitalar e Ambulatorial (CIHA), na sua totalidade, as internações de pacientes não usuários do SUS; (Origem: PRT MS/GM 878/2002, Art. 2º, d)
V - apresentar percentual de devolução das cartas enviadas pelo Ministério da Saúde (por erro no preenchimento na identificação do paciente), de no máximo 10%, a partir da competência março 2002; (Origem: PRT MS/GM 878/2002, Art. 2º, e)
VI - não ter denúncias comprovadas de cobranças indevidas ou de mau atendimento a usuários do SUS. (Origem: PRT MS/GM 878/2002, Art. 2º, f)
Art. 530. Os hospitais habilitados ao INTEGRASUS que, a qualquer tempo, deixarem de cumprir com quaisquer dos requisitos listados no art. 529 sofrerão penalidades de advertência ou de desabilitação mediante avaliação da Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 878/2002, Art. 3º)
CAPÍTULO III
DO ATENDIMENTO E INTERNAÇÃO DOMICILIAR
Seção I
Das Disposições Gerais
(Origem: PRT MS/GM 825/2016, CAPÍTULO I)
Art. 531. Este Capítulo define a Atenção Domiciliar (AD) no âmbito do SUS e atualiza as equipes habilitadas. (Origem: PRT MS/GM 825/2016, Art. 1º)
Art. 532. Para efeitos deste Capítulo considera-se: (Origem: PRT MS/GM 825/2016, Art. 2º)
I - Atenção Domiciliar (AD): modalidade de atenção à saúde integrada às Rede de Atenção à Saúde (RAS), caracterizada por um conjunto de ações de prevenção e tratamento de doenças, reabilitação, paliação e promoção à saúde, prestadas em domicílio, garantindo continuidade de cuidados; (Origem: PRT MS/GM 825/2016, Art. 2º, I)
II - Serviço de Atenção Domiciliar (SAD): serviço complementar aos cuidados realizados na atenção básica e em serviços de urgência, substitutivo ou complementar à internação hospitalar, responsável pelo gerenciamento e operacionalização das Equipes Multiprofissionais de Atenção Domiciliar (EMAD) e Equipes Multiprofissionais de Apoio (EMAP); e (Origem: PRT MS/GM 825/2016, Art. 2º, II)
III - cuidador: pessoa(s), com ou sem vínculo familiar com o usuário, apta(s) para auxiliá-lo em suas necessidades e atividades da vida cotidiana e que, dependendo da condição funcional e clínica do usuário, deverá(ão) estar presente(s) no atendimento domiciliar. (Origem: PRT MS/GM 825/2016, Art. 2º, III)
Art. 533. O SAD tem como objetivos: (Origem: PRT MS/GM 825/2016, Art. 3º)
I - redução da demanda por atendimento hospitalar; (Origem: PRT MS/GM 825/2016, Art. 3º, I)
II - redução do período de permanência de usuários internados; (Origem: PRT MS/GM 825/2016, Art. 3º, II)
III - humanização da atenção à saúde, com a ampliação da autonomia dos usuários; e (Origem: PRT MS/GM 825/2016, Art. 3º, III)
IV - a desinstitucionalização e a otimização dos recursos financeiros e estruturais da RAS. (Origem: PRT MS/GM 825/2016, Art. 3º, IV)
Art. 534. A AD seguirá as seguintes diretrizes: (Origem: PRT MS/GM 825/2016, Art. 4º)
I - ser estruturada de acordo com os princípios de ampliação e equidade do acesso, acolhimento, humanização e integralidade da assistência, na perspectiva da RAS; (Origem: PRT MS/GM 825/2016, Art. 4º, I)
II - estar incorporada ao sistema de regulação, articulando-se com os outros pontos de atenção à saúde; (Origem: PRT MS/GM 825/2016, Art. 4º, II)
III - adotar linhas de cuidado por meio de práticas clínicas cuidadoras baseadas nas necessidades do usuário, reduzindo a fragmentação da assistência e valorizando o trabalho em equipes multiprofissionais e interdisciplinares; e (Origem: PRT MS/GM 825/2016, Art. 4º, III)
IV - estimular a participação ativa dos profissionais de saúde envolvidos, do usuário, da família e do(s) cuidador(es). (Origem: PRT MS/GM 825/2016, Art. 4º, IV)
Seção II
Da Indicação e Organização da Atenção Domiciliar
(Origem: PRT MS/GM 825/2016, CAPÍTULO II)
Subseção I
Da indicação e das modalidades de Atenção Domiciliar
(Origem: PRT MS/GM 825/2016, CAPÍTULO II, Seção I)
Art. 535. A AD é indicada para pessoas que, estando em estabilidade clínica, necessitam de atenção à saúde em situação de restrição ao leito ou ao lar de maneira temporária ou definitiva ou em grau de vulnerabilidade na qual a atenção domiciliar é considerada a oferta mais oportuna para tratamento, paliação, reabilitação e prevenção de agravos, tendo em vista a ampliação de autonomia do usuário, família e cuidador. (Origem: PRT MS/GM 825/2016, Art. 5º)
Art. 536. A AD será organizada em três modalidades: (Origem: PRT MS/GM 825/2016, Art. 6º)
I - Atenção Domiciliar 1 (AD 1); (Origem: PRT MS/GM 825/2016, Art. 6º, I)
II - Atenção Domiciliar 2 (AD 2); e (Origem: PRT MS/GM 825/2016, Art. 6º, II)
III - Atenção Domiciliar 3 (AD 3). (Origem: PRT MS/GM 825/2016, Art. 6º, III)
§ 1º A determinação da modalidade está atrelada às necessidades de cuidado peculiares a cada caso, em relação à periodicidade indicada das visitas, à intensidade do cuidado multiprofissional e ao uso de equipamentos. (Origem: PRT MS/GM 825/2016, Art. 6º, § 1º)
§ 2º A divisão em modalidades é importante para a compreensão do perfil de atendimento prevalente, e, consequentemente, para adequado planejamento e gestão dos recursos humanos, materiais necessários, e fluxos intra e intersetoriais. (Origem: PRT MS/GM 825/2016, Art. 6º, § 2º)
Art. 537. Nas três modalidades de AD, as equipes responsáveis pela assistência têm como atribuição: (Origem: PRT MS/GM 825/2016, Art. 7º)
I - trabalhar em equipe multiprofissional integrada à RAS; (Origem: PRT MS/GM 825/2016, Art. 7º, I)
II - identificar, orientar e capacitar o(s) cuidador(es) do usuário em atendimento, envolvendo-o(s) na realização de cuidados, respeitando seus limites e potencialidades, considerando-o(s) como sujeito(s) do processo; (Origem: PRT MS/GM 825/2016, Art. 7º, II)
III - acolher demanda de dúvidas e queixas dos usuários, familiares ou cuidadores; (Origem: PRT MS/GM 825/2016, Art. 7º, III)
IV - promover espaços de cuidado e de trocas de experiências para cuidadores e familiares; (Origem: PRT MS/GM 825/2016, Art. 7º, IV)
V - utilizar linguagem acessível, considerando o contexto; (Origem: PRT MS/GM 825/2016, Art. 7º, V)
VI - pactuar fluxos para atestado de óbito, devendo ser preferencialmente emitido por médico da EMAD ou da Equipe de Atenção Básica do respectivo território; (Origem: PRT MS/GM 825/2016, Art. 7º, VI)
VII - articular, com os demais estabelecimentos da RAS, fluxos para admissão e alta dos usuários em AD, por meio de ações como busca ativa e reuniões periódicas; e (Origem: PRT MS/GM 825/2016, Art. 7º, VII)
VIII - participar dos processos de educação permanente e capacitações pertinentes. (Origem: PRT MS/GM 825/2016, Art. 7º, VIII)
Art. 538. Considera-se elegível, na modalidade AD 1, o usuário que, tendo indicação de AD, requeira cuidados com menor frequência e com menor necessidade de intervenções multiprofissionais, uma vez que se pressupõe estabilidade e cuidados satisfatórios pelos cuidadores. (Origem: PRT MS/GM 825/2016, Art. 8º)
§ 1º A prestação da assistência à saúde na modalidade AD 1 é de responsabilidade das equipes de atenção básica, por meio de acompanhamento regular em domicílio, de acordo com as especificidades de cada caso. (Origem: PRT MS/GM 825/2016, Art. 8º, § 1º)
§ 2º As equipes de atenção básica que executarem as ações na modalidade AD 1 devem ser apoiadas pelos Núcleos de Apoio à Saúde da Família, ambulatórios de especialidades e centros de reabilitação. (Origem: PRT MS/GM 825/2016, Art. 8º, § 2º)
Art. 539. Considera-se elegível na modalidade AD 2 o usuário que, tendo indicação de AD, e com o fim de abreviar ou evitar hospitalização, apresente: (Origem: PRT MS/GM 825/2016, Art. 9º)
I - afecções agudas ou crônicas agudizadas, com necessidade de cuidados intensificados e sequenciais, como tratamentos parenterais ou reabilitação; (Origem: PRT MS/GM 825/2016, Art. 9º, I)
II - afecções crônico-degenerativas, considerando o grau de comprometimento causado pela doença, que demande atendimento no mínimo semanal; (Origem: PRT MS/GM 825/2016, Art. 9º, II)
III - necessidade de cuidados paliativos com acompanhamento clínico no mínimo semanal, com o fim de controlar a dor e o sofrimento do usuário; ou (Origem: PRT MS/GM 825/2016, Art. 9º, III)
IV - prematuridade e baixo peso em bebês com necessidade de ganho ponderal. (Origem: PRT MS/GM 825/2016, Art. 9º, IV)
Art. 540. Considera-se elegível, na modalidade AD 3, usuário com qualquer das situações listadas na modalidade AD 2, quando necessitar de cuidado multiprofissional mais frequente, uso de equipamento(s) ou agregação de procedimento(s) de maior complexidade (por exemplo, ventilação mecânica, paracentese de repetição, nutrição parenteral e transfusão sanguínea), usualmente demandando períodos maiores de acompanhamento domiciliar. (Origem: PRT MS/GM 825/2016, Art. 10)
Art. 541. O atendimento aos usuários elegíveis nas modalidades AD 2 e AD 3 é de responsabilidade do SAD. (Origem: PRT MS/GM 825/2016, Art. 11)
Parágrafo Único. Fica facultado à EMAD Tipo 2 prestar assistência apenas na modalidade AD 2, caso não possua condições técnicas e operacionais para a execução da modalidade AD 3. (Origem: PRT MS/GM 825/2016, Art. 11, Parágrafo Único)
Art. 542. Ao usuário em AD acometido de intercorrências agudas será garantido atendimento, transporte e retaguarda para as unidades assistenciais de funcionamento 24 (vinte e quatro) horas/dia, previamente definidas como referência para o usuário. (Origem: PRT MS/GM 825/2016, Art. 12)
Art. 543. A admissão de usuários dependentes funcionalmente, segundo a Classificação Internacional de Funcionalidade, Incapacidade e Saúde (CIF), será condicionada à presença de cuidador(es) identificado(s). (Origem: PRT MS/GM 825/2016, Art. 13)
Art. 544. Será inelegível para a AD o usuário que apresentar pelo menos uma das seguintes situações: (Origem: PRT MS/GM 825/2016, Art. 14)
I - necessidade de monitorização contínua; (Origem: PRT MS/GM 825/2016, Art. 14, I)
II - necessidade de assistência contínua de enfermagem; (Origem: PRT MS/GM 825/2016, Art. 14, II)
III - necessidade de propedêutica complementar, com demanda potencial para a realização de vários procedimentos diagnósticos, em sequência, com urgência; (Origem: PRT MS/GM 825/2016, Art. 14, III)
IV - necessidade de tratamento cirúrgico em caráter de urgência; ou (Origem: PRT MS/GM 825/2016, Art. 14, IV)
V - necessidade de uso de ventilação mecânica invasiva, nos casos em que a equipe não estiver apta a realizar tal procedimento. (Origem: PRT MS/GM 825/2016, Art. 14, V)
Art. 545. O descumprimento dos acordos assistenciais entre a equipe multiprofissional e o usuário, familiar(es) ou cuidador(es) poderá acarretar a exclusão do usuário do SAD, ocasião na qual o atendimento do usuário se dará em outro serviço adequado ao seu caso, conforme regulação local. (Origem: PRT MS/GM 825/2016, Art. 15)
Subseção II
Do Serviço de Atenção Domiciliar (SAD)
(Origem: PRT MS/GM 825/2016, CAPÍTULO II, Seção II)
Art. 546. As equipes que compõem o SAD são: (Origem: PRT MS/GM 825/2016, Art. 16)
I - Equipes Multiprofissionais de Atenção Domiciliar (EMAD), que pode ser constituída como: (Origem: PRT MS/GM 825/2016, Art. 16, I)
a) EMAD Tipo 1; ou (Origem: PRT MS/GM 825/2016, Art. 16, I, a)
b) EMAD Tipo 2; e (Origem: PRT MS/GM 825/2016, Art. 16, I, b)
II - Equipe Multiprofissional de Apoio (EMAP). (Origem: PRT MS/GM 825/2016, Art. 16, II)
§ 1º A EMAD e a EMAP devem ser cadastradas no Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SCNES), conforme as normativas de cadastramento vigentes. (Origem: PRT MS/GM 825/2016, Art. 16, § 1º)
§ 2º A EMAD é pré-requisito para constituição de um SAD, não sendo possível a implantação de uma EMAP sem a existência prévia de uma EMAD. (Origem: PRT MS/GM 825/2016, Art. 16, § 2º)
Art. 547. A EMAD terá a seguinte composição mínima: (Origem: PRT MS/GM 825/2016, Art. 17)
I - EMAD Tipo 1: (Origem: PRT MS/GM 825/2016, Art. 17, I)
a) profissional(is) médico(s) com somatório de carga horária semanal (CHS) de, no mínimo, 40 (quarenta) horas de trabalho por equipe; (Origem: PRT MS/GM 825/2016, Art. 17, I, a)
b) profissional(is) enfermeiro(s) com somatório de CHS de, no mínimo, 40 (quarenta) horas de trabalho por equipe; (Origem: PRT MS/GM 825/2016, Art. 17, I, b)
c) profissional(is) fisioterapeuta(s) ou assistente(s) social(is) com somatório de CHS de, no mínimo, 30 (trinta) horas de trabalho por equipe; e (Origem: PRT MS/GM 825/2016, Art. 17, I, c)
d) profissionais auxiliares ou técnicos de enfermagem, com somatório de CHS de, no mínimo, 120 (cento e vinte) horas de trabalho por equipe; (Origem: PRT MS/GM 825/2016, Art. 17, I, d)
II - EMAD Tipo 2: (Origem: PRT MS/GM 825/2016, Art. 17, II)
a) profissional médico com CHS de, no mínimo, 20 (vinte) horas de trabalho; (Origem: PRT MS/GM 825/2016, Art. 17, II, a)
b) profissional enfermeiro com CHS de, no mínimo, 30 (trinta) horas de trabalho; (Origem: PRT MS/GM 825/2016, Art. 17, II, b)
c) profissional fisioterapeuta ou assistente social com somatório de CHS de, no mínimo, 30 (trinta) horas de trabalho; e (Origem: PRT MS/GM 825/2016, Art. 17, II, c)
d) profissionais auxiliares ou técnicos de enfermagem, com somatório de CHS de, no mínimo, 120 (cento e vinte) horas de trabalho. (Origem: PRT MS/GM 825/2016, Art. 17, II, d)
Parágrafo Único. Nenhum profissional componente de EMAD poderá ter CHS inferior a 20 (vinte) horas de trabalho. (Origem: PRT MS/GM 825/2016, Art. 17, Parágrafo Único)
Art. 548. A EMAP terá composição mínima de 3 (três) profissionais de nível superior, escolhidos entre as ocupações listadas a seguir, cuja soma das CHS de seus componentes será de, no mínimo, 90 (noventa) horas de trabalho: (Origem: PRT MS/GM 825/2016, Art. 18)
I - assistente social; (Origem: PRT MS/GM 825/2016, Art. 18, I)
II - fisioterapeuta; (Origem: PRT MS/GM 825/2016, Art. 18, II)
III - fonoaudiólogo; (Origem: PRT MS/GM 825/2016, Art. 18, III)
IV - nutricionista; (Origem: PRT MS/GM 825/2016, Art. 18, IV)
V - odontólogo; (Origem: PRT MS/GM 825/2016, Art. 18, V)
VI - psicólogo; (Origem: PRT MS/GM 825/2016, Art. 18, VI)
VII - farmacêutico; ou (Origem: PRT MS/GM 825/2016, Art. 18, VII)
VIII - terapeuta ocupacional. (Origem: PRT MS/GM 825/2016, Art. 18, VIII)
Parágrafo Único. Nenhum profissional componente da EMAP poderá ter CHS inferior a 20 (vinte) horas de trabalho. (Origem: PRT MS/GM 825/2016, Art. 18, Parágrafo Único)
Subseção III
Do Funcionamento do SAD
(Origem: PRT MS/GM 825/2016, CAPÍTULO II, Seção III)
Art. 549. O SAD será organizado a partir de uma base territorial, sendo referência em atenção domiciliar para uma população definida e se relacionará com os demais serviços de saúde que compõem a RAS, em especial com a atenção básica, atuando como matriciadores dessas equipes, quando necessário. (Origem: PRT MS/GM 825/2016, Art. 19)
§ 1º A EMAD realizará atendimento, no mínimo, 1 (uma) vez por semana a cada usuário. (Origem: PRT MS/GM 825/2016, Art. 19, § 1º)
§ 2º A EMAP será acionada somente a partir da indicação clínica da EMAD, para dar suporte e complementar suas ações. (Origem: PRT MS/GM 825/2016, Art. 19, § 2º)
§ 3º Durante o período em que o usuário estiver sob os cuidados do SAD, a equipe de atenção básica de sua referência deverá compartilhar o cuidado, participando na elaboração do Projeto Terapêutico Singular (PTS) daquele usuário. (Origem: PRT MS/GM 825/2016, Art. 19, § 3º)
§ 4º O SAD deverá articular-se com os outros serviços da RAS, principalmente hospitais, serviços de urgência e Atenção Básica, buscando evitar demanda direta dos usuários. (Origem: PRT MS/GM 825/2016, Art. 19, § 4º)
Art. 550. A admissão do usuário ao SAD exigirá a sua prévia concordância e de seu familiar ou, na inexistência de familiar, de seu cuidador, com assinatura de termo de esclarecimento e responsabilidade. (Origem: PRT MS/GM 825/2016, Art. 20)
Art. 551. Em municípios com porte populacional que permita a implantação de mais de 1 (uma) EMAD, fica facultada a organização do SAD a partir de arranjos diferenciados compostos por EMAD responsável pelo cuidado de pacientes com características específicas, tais como equipes voltadas para o atendimento infantil e neonatal. (Origem: PRT MS/GM 825/2016, Art. 21)
Art. 552. Estima-se, em média, o atendimento de 60 (sessenta) usuários para cada EMAD Tipo 1 e 30 (trinta) usuários para cada EMAD Tipo 2, mensalmente. (Origem: PRT MS/GM 825/2016, Art. 22)
Art. 553. O SAD ofertará, no mínimo, 12 (doze) horas/dia de funcionamento, de modo que o trabalho da EMAD seja no formato de cuidado horizontal (diarista) em dias úteis e nos finais de semana e feriados, de forma a assegurar a continuidade da atenção em saúde, podendo utilizar, nestas ocasiões, o regime de plantão. (Origem: PRT MS/GM 825/2016, Art. 23)
Parágrafo Único. A EMAP deverá apoiar a EMAD nos dias úteis e, quando necessário, ter escala especial para finais de semana e feriados. (Origem: PRT MS/GM 825/2016, Art. 23, Parágrafo Único)
Art. 554. As equipes contarão com infraestrutura especificamente destinada para o seu funcionamento que contemple: (Origem: PRT MS/GM 825/2016, Art. 24)
I - equipamentos; (Origem: PRT MS/GM 825/2016, Art. 24, I)
II - material permanente e de consumo; (Origem: PRT MS/GM 825/2016, Art. 24, II)
III - aparelho telefônico; e (Origem: PRT MS/GM 825/2016, Art. 24, III)
IV - veículo(s) para locomoção das equipes. (Origem: PRT MS/GM 825/2016, Art. 24, IV)
§ 1º Os equipamentos e os materiais citados no "caput", bem como os prontuários dos usuários atendidos pelo SAD serão instalados na estrutura física de unidade de saúde municipal, estadual ou do Distrito Federal, a critério do gestor de saúde local. (Origem: PRT MS/GM 825/2016, Art. 24, § 1º)
§ 2º Não é obrigatório que o SAD possua sede própria, podendo estar sediado em estabelecimento de saúde, conforme regras definidas em normativa específica. (Origem: PRT MS/GM 825/2016, Art. 24, § 2º)
Seção III
Dos Requisitos e Fluxos para Habilitação do SAD
(Origem: PRT MS/GM 825/2016, CAPÍTULO III)
Subseção I
Dos Requisitos para Habilitação
(Origem: PRT MS/GM 825/2016, CAPÍTULO III, Seção I)
Art. 555. São requisitos para habilitação do SAD: (Origem: PRT MS/GM 825/2016, Art. 25)
I - população municipal igual ou superior a 20.000 (vinte mil) habitantes, com base na população mais recente estimada pela Fundação Instituto Brasileiro de Geografia e Estatística (IBGE); (Origem: PRT MS/GM 825/2016, Art. 25, I)
II - hospital de referência no município ou região a qual integra; e (Origem: PRT MS/GM 825/2016, Art. 25, II)
III - cobertura de Serviço de Atendimento Móvel de Urgência (SAMU 192) habilitado e em funcionamento. (Origem: PRT MS/GM 825/2016, Art. 25, III)
§ 1º A população mínima referida no inciso I do "caput" pode ser atingida por um município, isoladamente, ou por meio de agrupamento de Municípios cuja população seja inferior a 20.000 (vinte mil) habitantes, devendo ocorrer, nesse caso, prévia pactuação na Comissão Intergestores Bipartite (CIB) e, se houver, na Comissão Intergestores Regional (CIR); (Origem: PRT MS/GM 825/2016, Art. 25, § 1º)
§ 2º Em municípios com população igual ou superior a 40.000 (quarenta mil) habitantes será aceito serviço de atendimento móvel de urgência equivalente ao SAMU. (Origem: PRT MS/GM 825/2016, Art. 25, § 2º)
§ 3º Os municípios com proposta de SAD por meio de agrupamento deverão celebrar convênio, pactuar Contrato Organizativo de Ação Pública de Saúde (COAP) ou estabelecer outro formato jurídico interfederativo responsável por registrar as atribuições e responsabilidades entre os entes federativos. (Origem: PRT MS/GM 825/2016, Art. 25, § 3º)
§ 4º Os municípios referidos no § 3º deverão aprovar os acordos celebrados entre si na respectiva CIB ou na CIR, se houver, e enviá-los ao Departamento de Atenção Hospitalar e de Urgência da Secretaria de Atenção à Saúde do Ministério da Saúde (DAHU/SAS/MS), juntamente com o projeto referido na Subseção II da Seção II do Capítulo III do Título IV. (Origem: PRT MS/GM 825/2016, Art. 25, § 4º)
§ 5º No caso de o proponente do SAD ser a Secretaria Estadual de Saúde, o projeto deverá ser pactuado com o gestor municipal de saúde do(s) município(s) em que o SAD atuará, aprovado na CIB, não sendo permitida a duplicidade de proponentes para um mesmo município. (Origem: PRT MS/GM 825/2016, Art. 25, § 5º)
§ 6º No caso do § 5º, o documento com o registro da pactuação deverá ser enviado ao DAHU/SAS/MS juntamente com o projeto referido na Subseção II da Seção III do Capítulo III do Título IV. (Origem: PRT MS/GM 825/2016, Art. 25, § 6º)
Art. 556. Os municípios com população igual ou superior a 40.000 (quarenta mil) habitantes poderão solicitar habilitação de EMAD Tipo 1. (Origem: PRT MS/GM 825/2016, Art. 26)
Art. 557. Municípios com população inferior a 40.000 (quarenta mil) habitantes poderão solicitar habilitação de EMAD Tipo 2, individualmente, se tiverem população entre 20.000 (vinte mil) e 39.999 (trinta e nove mil e novecentos e noventa e nove) habitantes ou por meio de agrupamento, no caso daqueles com menos de 20.000 (vinte mil) habitantes. (Origem: PRT MS/GM 825/2016, Art. 27)
Art. 558. Municípios com população igual ou maior que 150.000 (cento e cinquenta mil) habitantes, poderão solicitar a segunda EMAD e, sucessivamente, 1 (uma) nova EMAD a cada 100.000 (cem mil) novos habitantes. (Origem: PRT MS/GM 825/2016, Art. 28)
Art. 559. Todos os municípios com uma EMAD, tipo 1 ou tipo 2, poderão solicitar 1 (uma) EMAP, sendo possível a implantação de mais 1 (uma) EMAP a cada 3 (três) EMAD a mais implantadas. (Origem: PRT MS/GM 825/2016, Art. 29)
Subseção II
Do Conteúdo e Fluxo do Projeto para Criação ou Ampliação do SAD
(Origem: PRT MS/GM 825/2016, CAPÍTULO III, Seção II)
Art. 560. O gestor de saúde do Município, Estado ou Distrito Federal deverá elaborar projeto para criação ou ampliação do SAD, contemplando os seguintes requisitos: (Origem: PRT MS/GM 825/2016, Art. 30)
I - quadro resumo que contenha os seguintes dados: Município, Unidade Federativa, população, nome e contatos (telefone e e-mail) do Coordenador ou Referência Técnica da Atenção Domiciliar, proponente (Município, Estado ou Distrito Federal), número de equipes por tipo, confirmação de SAMU ou serviço equivalente e confirmação de hospital de referência no Município ou região; (Origem: PRT MS/GM 825/2016, Art. 30, I)
II - objetivos do projeto; (Origem: PRT MS/GM 825/2016, Art. 30, II)
III - caracterização do(s) ente(s) federativo(s) proponentes, a partir de dados sócio-demográficos, da descrição dos serviços de saúde existentes e perfil epidemiológico, com problematização e justificativas para a implantação da política; (Origem: PRT MS/GM 825/2016, Art. 30, III)
IV - especificação do número de equipes (EMAD e EMAP) previstas, observados os critérios e os prazos descritos neste Capítulo, incluindo os territórios de abrangência; (Origem: PRT MS/GM 825/2016, Art. 30, IV)
V - quadro de profissionais, mencionando as CHS; (Origem: PRT MS/GM 825/2016, Art. 30, V)
VI - descrição da inserção do SAD na RAS, incluindo serviços de referência, de forma a assegurar fluxos para: (Origem: PRT MS/GM 825/2016, Art. 30, VI)
a) admissão, alta e intercorrências com a rede básica, de urgências e hospitalar; (Origem: PRT MS/GM 825/2016, Art. 30, VI, a)
b) encaminhamentos para especialidades e para métodos complementares de diagnóstico tanto para situações eletivas quanto de urgência; (Origem: PRT MS/GM 825/2016, Art. 30, VI, b)
c) confirmação e expedição de atestado de óbito domiciliar; e (Origem: PRT MS/GM 825/2016, Art. 30, VI, c)
d) transporte e remoção do usuário, dentro das especificidades locais, tanto em situações eletivas indicadas pelo SAD, quanto de urgência; (Origem: PRT MS/GM 825/2016, Art. 30, VI, d)
VII - descrição da infraestrutura para o SAD, incluindo-se área física, mobiliário, telefone, equipamentos, veículo(s) para locomoção da(s) EMAD e EMAP; (Origem: PRT MS/GM 825/2016, Art. 30, VII)
VIII - descrição do funcionamento do SAD, com garantia de cobertura de 12 (doze) horas diárias, inclusive nos finais de semana e feriados; (Origem: PRT MS/GM 825/2016, Art. 30, VIII)
IX - proposta de educação permanente e capacitação para profissionais do SAD e cuidadores, indicando periodicidade e temáticas; e (Origem: PRT MS/GM 825/2016, Art. 30, IX)
X - descrição de estratégias de monitoramento e avaliação do SAD, tomando como referência os indicadores propostos no Manual de Monitoramento e Avaliação: Programa Melhor em Casa, disponível no endereço eletrônico do Ministério da Saúde. (Origem: PRT MS/GM 825/2016, Art. 30, X)
§ 1º Para Municípios com menos de 20.000 habitantes agrupados para proposta de SAD, o projeto deve observar requisitos adicionais descritos no Manual Instrutivo do SAD, bem como o documento previsto no art. 555, § 2º . (Origem: PRT MS/GM 825/2016, Art. 30, § 1º)
§ 2º O gestor de saúde local enviará o projeto para criação ou ampliação do SAD ao DAHU/SAS/MS, , por meio do Sistema de Apoio à Implementação de Políticas em Saúde. (SAIPS). (Origem: PRT MS/GM 825/2016, Art. 30, § 2º)
Art. 561. O DAHU/SAS/MS fará a análise do projeto de criação ou ampliação do SAD, considerando-se as diretrizes e critérios previstos neste Capítulo e a disponibilidade orçamentária, bem como providenciará o devido encaminhamento interno com vistas à publicação de ato normativo de habilitação dos entes federativos beneficiários. (Origem: PRT MS/GM 825/2016, Art. 31)
§ 1º Publicada a portaria de habilitação, o gestor local deverá implantar a(s) equipe(s) solicitada(s), promovendo o cadastramento destas no SCNES em até 3 (três) meses, a contar da data de publicação da sua portaria de habilitação, sob pena de perder sua respectiva habilitação. (Origem: PRT MS/GM 825/2016, Art. 31, § 1º)
§ 2º Equipes descadastradas do SCNES por 6 (seis) competências seguidas ou com suspensão de repasse de recursos de custeio por mais de 6 (seis) competências seguidas em função das irregularidades previstas no art. 307 da Portaria de Consolidação nº 6, terão suas habilitações automaticamente revogadas. (Origem: PRT MS/GM 825/2016, Art. 31, § 2º)
Art. 562. O cadastramento das EMAD e EMAP, no SCNES, deverá ser feito em unidades cujas mantenedoras sejam as secretarias de saúde estaduais, do Distrito Federal ou municipais ou, ainda, unidades que façam parte da rede conveniada ao SUS, conforme as regras de cadastramento publicadas em ato específico. (Origem: PRT MS/GM 825/2016, Art. 32)
Art. 563. Os estabelecimentos de saúde credenciados no código 13.01 (Internação Domiciliar) até a data de publicação da Portaria nº 825/GM/MS, de 25 de abril de 2016 permanecerão habilitados e continuarão recebendo os recursos financeiros devidos por meio de Autorização de Internação Hospitalar (AIH), informadas no SIH-SUS. (Origem: PRT MS/GM 825/2016, Art. 33)
§ 1º Após a publicação da Portaria nº 825/GM/MS, de 25 de abril de 2016, não poderão ser habilitados novos estabelecimentos de saúde no código 13.01. (Origem: PRT MS/GM 825/2016, Art. 33, § 1º)
§ 2º Não será permitido o registro concomitante de usuário em serviço com habilitação 13.01 e em SAD, sendo considerado faturamento duplicado. (Origem: PRT MS/GM 825/2016, Art. 33, § 2º)
Seção IV
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 825/2016, CAPÍTULO V)
Art. 564. Fica atualizado o quantitativo de habilitações de equipes de EMAD e EMAP, com base nas equipes cadastradas no SCNES na competência definitiva de dezembro de 2015, considerando-se as proporções e os prazos previstos nos arts. 559 e 561 . (Origem: PRT MS/GM 825/2016, Art. 42)
§ 1º As equipes cadastradas no SCNES até a publicação da Portaria nº 825/GM/MS, de 25 de abril de 2016, previamente habilitadas, serão consideradas vigentes e automaticamente inclusas na relação constante do Anexo XXVIII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 825/2016, Art. 42, § 1º)
§ 2º Desde a competência financeira de janeiro/2016, fica autorizada a transferência do custeio mensal de 1/12 (um doze avos) do valor anual aos entes beneficiários, conforme detalhado no Anexo XXVIII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 825/2016, Art. 42, § 2º)
§ 3º Novas habilitações ocorrerão por meio de portarias com esta finalidade, observando-se o disposto neste Capítulo e as disponibilidades orçamentárias e financeiras de cada exercício. (Origem: PRT MS/GM 825/2016, Art. 42, § 3º)
CAPÍTULO IV
DA ASSISTÊNCIA FARMACÊUTICA
Seção I
Do Grupo Executivo para o Programa Nacional de Plantas Medicinais e Fitoterápicos
Art. 565. Fica instituído, no âmbito do Ministério da Saúde, Grupo Executivo para o Programa Nacional de Plantas Medicinais e Fitoterápicos. (Origem: PRT MS/GM 1274/2008, Art. 1º)
Art. 566. O Grupo Executivo terá a seguinte composição: (Origem: PRT MS/GM 1274/2008, Art. 2º)
I - dois representantes da Secretaria de Ciência, Tecnologia e Insumos Estratégicos: (Origem: PRT MS/GM 1274/2008, Art. 2º, I)
a) Departamento de Assistência Farmacêutica e Insumos Estratégicos (DAF/SCTIE/MS); (Origem: PRT MS/GM 1274/2008, Art. 2º, I, a)
b) Departamento de Economia em Saúde (DES/SCTIE/MS); (Origem: PRT MS/GM 1274/2008, Art. 2º, I, b)
II - um representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1274/2008, Art. 2º, II)
III - um representante da Fundação Oswaldo Cruz (FIOCRUZ), do Núcleo de Gestão em Biodiversidade e Saúde/Centro de Produtos Naturais/Instituto de Tecnologia em Fármacos (Farmanguinhos); e (Origem: PRT MS/GM 1274/2008, Art. 2º, III)
IV - um representante do Grupo Hospitalar Conceição (GHC/MS), do Núcleo de Estudos e Pesquisas de Plantas Medicinais e Fitoterapia. (Origem: PRT MS/GM 1274/2008, Art. 2º, IV)
Art. 567. O Grupo Executivo deverá apoiar o Ministério da Saúde na coordenação do Programa Nacional de Plantas Medicinais e Fitoterápicos (PNPMF). (Origem: PRT MS/GM 1274/2008, Art. 3º)
Art. 568. O Grupo Executivo será assessorado por uma Secretaria-Executiva, que ficará encarregada de organizar, acompanhar e encaminhar as deliberações do Grupo Executivo. (Origem: PRT MS/GM 1274/2008, Art. 4º)
Art. 569. O Grupo Executivo poderá convidar outros representantes do Ministério da Saúde, e de entidades vinculadas ao setor público e privado que atuem profissionalmente em atividades relacionadas ao tema desta Seção, sempre que entenda necessária a sua colaboração para o pleno alcance dos seus objetivos. (Origem: PRT MS/GM 1274/2008, Art. 5º)
Seção II
Da Farmácia Viva
Art. 570. Fica instituída, no âmbito do Sistema Único de Saúde (SUS), sob gestão estadual, municipal ou do Distrito Federal, a Farmácia Viva. (Origem: PRT MS/GM 886/2010, Art. 1º)
§ 1º A Farmácia viva, no contexto da Política Nacional de Assistência Farmacêutica, deverá realizar todas as etapas, desde o cultivo, a coleta, o processamento, o armazenamento de plantas medicinais, a manipulação e a dispensação de preparações magistrais e oficinais de plantas medicinais e fitoterápicos. (Origem: PRT MS/GM 886/2010, Art. 1º, § 1º)
§ 2º Fica vedada a comercialização de plantas medicinais e fitoterápicos elaborados a partir das etapas mencionadas no parágrafo primeiro. (Origem: PRT MS/GM 886/2010, Art. 1º, § 2º)
Art. 571. A Farmácia Viva fica sujeita ao disposto em regulamentação sanitária e ambiental específicas, a serem emanadas pelos órgãos regulamentadores afins. (Origem: PRT MS/GM 886/2010, Art. 2º)
Seção III
Do Programa Farmácia Popular do Brasil (PFPB)
Art. 572. O Anexo LXXVII dispõe sobre o Programa Farmácia Popular do Brasil (PFPB).
Art. 573. O Anexo LXXVIII dispõe sobre as Normas Operacionais do Programa Farmácia Popular do Brasil (PFPB).
Seção IV
Do Programa Nacional de Qualificação da Assistência Farmacêutica (QUALIFAR-SUS)
Art. 574. Esta Seção institui o Programa Nacional de Qualificação da Assistência Farmacêutica no âmbito do Sistema Único de Saúde (QUALIFAR-SUS). (Origem: PRT MS/GM 1214/2012, Art. 1º)
Art. 575. O QUALIFAR-SUS tem por finalidade contribuir para o processo de aprimoramento, implementação e integração sistêmica das atividades da Assistência Farmacêutica nas ações e serviços de saúde, visando a uma atenção contínua, integral, segura responsável e humanizada. (Origem: PRT MS/GM 1214/2012, Art. 2º)
Art. 576. São diretrizes do QUALIFAR-SUS: (Origem: PRT MS/GM 1214/2012, Art. 3º)
I - promover condições favoráveis para a estruturação dos serviços farmacêuticos no Sistema Único de Saúde (SUS) como estratégia de qualificação do acesso aos medicamentos e da gestão do cuidado; (Origem: PRT MS/GM 1214/2012, Art. 3º, I)
II - contribuir para garantia e ampliação do acesso da população a medicamentos eficazes, seguros, de qualidade e o seu uso racional, visando à integralidade do cuidado, resolutividade e o monitoramento dos resultados terapêuticos desejados; (Origem: PRT MS/GM 1214/2012, Art. 3º, II)
III - estimular a elaboração de normas, procedimentos, recomendações e outros documentos que possam orientar e sistematizar as ações e os serviços farmacêuticos, com foco na integralidade, na promoção, proteção e recuperação da saúde; (Origem: PRT MS/GM 1214/2012, Art. 3º, III)
IV - promover a educação permanente e fortalecer a capacitação para os profissionais de saúde em todos os âmbitos da atenção, visando ao desenvolvimento das ações da Assistência Farmacêutica no SUS; e (Origem: PRT MS/GM 1214/2012, Art. 3º, IV)
V - favorecer o processo contínuo e progressivo de obtenção de dados, que possibilitem acompanhar, avaliar e monitorar a gestão da Assistência farmacêutica, o planejamento, programação, controle, a disseminação das informações e a construção e acompanhamento de indicadores da Assistência Farmacêutica. (Origem: PRT MS/GM 1214/2012, Art. 3º, V)
Art. 577. O QUALIFAR-SUS está organizado em 4 (quatro) eixos, com os seguintes objetivos: (Origem: PRT MS/GM 1214/2012, Art. 4º)
I - Eixo Estrutura: contribuir para a estruturação dos serviços farmacêuticos no SUS, de modo que estes sejam compatíveis com as atividades desenvolvidas na Assistência Farmacêutica, considerando a área física, os equipamentos, mobiliários e recursos humanos; (Origem: PRT MS/GM 1214/2012, Art. 4º, I)
II - Eixo Educação: promover a educação permanente e capacitação dos profissionais de saúde para qualificação das ações da Assistência Farmacêutica voltadas ao aprimoramento das práticas profissionais no contexto das Redes de Atenção à Saúde; (Origem: PRT MS/GM 1214/2012, Art. 4º, II)
III - Eixo Informação: produzir documentos técnicos e disponibilizar informações que possibilitem o acompanhamento, monitoramento e avaliação das ações e serviços da Assistência Farmacêutica; e (Origem: PRT MS/GM 1214/2012, Art. 4º, III)
IV - Eixo Cuidado: inserir a Assistência Farmacêutica nas práticas clínicas visando a resolutividade das ações em saúde, otimizando os benefícios e minimizando os riscos relacionados à farmacoterapia. (Origem: PRT MS/GM 1214/2012, Art. 4º, IV)
Art. 578. A operacionalização dos eixos do QUALIFAR-SUS de que trata esta Seção será regulada em atos específicos, mediante pactuação prévia no âmbito da Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 1214/2012, Art. 5º)
CAPÍTULO V
CENTRO DE ESPECIALIDADES ODONTOLÓGICAS (CEOS) E LABORATÓRIOS REGIONAIS DE PRÓTESES DENTÁRIAS (LRPDS)
Seção I
Disposições Gerais
Art. 579. Ficam instituídos os Centros de Especialidades Odontológicas (CEOs) e de Laboratórios Regionais de Próteses Dentárias (LRPDs), e estabelecidos os critérios, normas e requisitos para seu credenciamento. (Origem: PRT MS/GM 599/2006, Art. 1º)
§ 1º Os CEOs são estabelecimentos de saúde registrados no Cadastro Nacional de Estabelecimentos de Saúde (CNES), classificados como Tipo Clínica Especializada/Ambulatório de Especialidade, com serviço especializado de Odontologia para realizar, no mínimo, as seguintes atividades: (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º)
I - diagnóstico bucal, com ênfase no diagnóstico e detecção do câncer bucal; (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, I)
II - periodontia especializada; (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, II)
III - cirurgia oral menor dos tecidos moles e duros; (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, III)
IV - endodontia; e (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, IV)
V - atendimento a portadores de necessidades especiais. (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, V)
§ 2º O LRPD é o estabelecimento cadastrado no CNES como Unidade de Saúde de Serviço de Apoio Diagnóstico Terapêutico (SADT) para realizar, no mínimo, o serviço de prótese dentária total e/ou prótese parcial removível. (Origem: PRT MS/GM 599/2006, Art. 1º, § 2º)
§ 3º O cadastramento nas modalidades estabelecidas nesta Seção, CEO Tipo 1, CEO Tipo 2, CEO Tipo 3 e LRPD e a verificação das informações das Unidades de Saúde serão efetuados pelo Sistema de Informação Ambulatorial (SIA) e o Cadastro Nacional de Estabelecimentos de Saúde (CNES), por meio de serviço e classificação específicos, sem o prejuízo de outras formas. (Origem: PRT MS/GM 599/2006, Art. 1º, § 3º)
§ 4º Unidades de Saúde que disponham das condições estabelecidas nesta Seção poderão credenciar-se conforme o estabelecido no § 3º e de acordo com o fluxo definido no art. 585. (Origem: PRT MS/GM 599/2006, Art. 1º, § 4º)
Art. 580. A Unidade de Saúde a ser habilitada nas modalidades de CEO e/ou de LRPD atenderá às seguintes condições: (Origem: PRT MS/GM 599/2006, Art. 2º)
I - ser referência para o próprio município, região ou microrregião de saúde, de acordo com o Plano Diretor de Regionalização (PDR); (Origem: PRT MS/GM 599/2006, Art. 2º, I)
II - ser Unidade de Saúde cadastrada no CNES; e (Origem: PRT MS/GM 599/2006, Art. 2º, II)
III - dispor dos equipamentos e dos recursos mínimos exigidos nesta Seção que estejam exclusivamente a serviço do SUS e dos serviços mínimos exigidos nesta Seção. (Origem: PRT MS/GM 599/2006, Art. 2º, III)
Art. 581. Ficam definidas, na forma do Anexo XIV , as características das modalidades de CEO estabelecidas no art. 579. (Origem: PRT MS/GM 599/2006, Art. 3º)
Art. 582. O não atendimento às condições e características definidas nesta Seção pelos municípios pleiteantes, bem como pelas Unidades de Saúde, a qualquer tempo, implicará o descredenciamento da Unidade de Saúde. (Origem: PRT MS/GM 599/2006, Art. 5º)
Parágrafo Único. Caberá às CIBs e/ou ao Ministério da Saúde encaminhar a solicitação ao DAB/SAS/MS, para posterior publicação. (Origem: PRT MS/GM 599/2006, Art. 5º, Parágrafo Único)
Art. 583. Em relação aos tipos de prestadores fica estabelecido que: (Origem: PRT MS/GM 599/2006, Art. 6º)
I - somente as Unidades de Saúde de natureza jurídica pública, universidades de qualquer natureza jurídica, consórcios públicos de saúde de qualquer natureza jurídica e serviços sociais autônomos poderão credenciar-se como CEO; e (Origem: PRT MS/GM 599/2006, Art. 6º, I)
II - não haverá restrição quanto à natureza jurídica para as Unidades de Saúde credenciarem-se como LRPD. (Origem: PRT MS/GM 599/2006, Art. 6º, II)
Art. 584. Os gestores deverão providenciar a adequação visual da Unidade de Saúde à qual está sendo pleiteado o credenciamento, para os itens considerados obrigatórios, do Manual de Inserção de Logotipo disponibilizado pelo Ministério da Saúde em seu endereço eletrônico. (Origem: PRT MS/GM 599/2006, Art. 7º)
Art. 585. Ficam definidas as condições gerais e o fluxo de credenciamento para os Centros de Especialidades Odontológicas (CEOs) e os Laboratórios Regionais de Próteses Dentárias (LRPDs). (Origem: PRT MS/GM 599/2006, Art. 4º)
§ 1º O gestor poderá credenciar como CEO e LRPD quantos estabelecimentos forem necessários para atendimento à demanda da população da região/microrregião de saúde, limitado à disponibilidade financeira do Ministério da Saúde. (Origem: PRT MS/GM 599/2006, Art. 4º, § 1º)
§ 2º O gestor também poderá credenciar CEO e LRPD com recursos próprios. (Origem: PRT MS/GM 599/2006, Art. 4º, § 2º)
§ 3º O gestor municipal e o estadual interessados em implantar CEO ou em credenciar algum estabelecimento de saúde deverá apresentar sua proposta à Comissão Intergestores Bipartite (CIB) do respectivo Estado, indicando se o pleito é para CEO Tipo 1, CEO Tipo 2 ou CEO Tipo 3. (Origem: PRT MS/GM 599/2006, Art. 4º, § 3º)
§ 4º A partir da proposta do pleiteante, a Comissão Intergestores Bipartite (CIB) informará o Ministério da Saúde - Secretaria de Atenção à Saúde, Departamento de Atenção Básica, Área de Saúde Bucal (DAB/SAS/MS) - sobre o(s) Município(s) e o(s) estabelecimento(s) de saúde aprovado(s). (Origem: PRT MS/GM 599/2006, Art. 4º, § 4º)
§ 5º A proposta de que trata o § 4º deste artigo deverá contemplar minimamente os seguintes elementos: (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º)
I - identificação do Município ou do Estado pleiteante e do estabelecimento de saúde, com cópia do registro no Cadastro Nacional de Estabelecimentos de Saúde (CNES); (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, a)
II - descrição dos serviços que serão ofertados; (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, b)
III - demonstração da coerência com o Plano Diretor de Regionalização; (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, c)
IV - identificação da área de abrangência do CEO, indicando para qual município, região ou microrregião é referência, mencionando, inclusive, a população coberta; e (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, d)
V - emissão de documento, pelos gestores, atestando que atendem aos requisitos estabelecidos na Seção I do Capítulo V do Título IV, com prazo de 30 (trinta) dias, a contar do credenciamento do CEO, para providenciar a atualização, caso necessário, dos sistemas de informação relacionados. (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, e)
§ 6º Deverá ser adotado como critério de seleção o maior percentual de cobertura das Equipes de Saúde Bucal do Programa Saúde da Família. (Origem: PRT MS/GM 599/2006, Art. 4º, § 6º)
§ 7º Caberá às respectivas CIB encaminhar solicitação de habilitação dos CEO, conforme o fluxo estabelecido no parágrafo 4º deste artigo e à Secretaria de Atenção à Saúde a formalização em portaria específica. (Origem: PRT MS/GM 599/2006, Art. 4º, § 7º)
§ 8º O LRPD é o estabelecimento cadastrado no CNES com o tipo de estabelecimento 39 - Unidade de Saúde de Serviço de Apoio Diagnóstico Terapêutico (SADT) e subtipo de estabelecimento 39.03 para realizar, no mínimo, um dos procedimentos definidos na Seção V do Capítulo I do Título III da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 599/2006, Art. 4º, § 8º)
I - os Municípios com qualquer base populacional poderão cadastrar o(s) LRPD; e (Origem: PRT MS/GM 599/2006, Art. 4º, § 8º, a)
II - não há restrição quanto à natureza jurídica para os estabelecimentos a serem cadastrados por esses Municípios como LRPD. (Origem: PRT MS/GM 599/2006, Art. 4º, § 8º, b)
§ 9º O gestor municipal ou estadual, interessado em credenciar/contratar um ou mais LRPD, encaminhará a proposta por intermédio de ofício à Área Técnica de Saúde Bucal - Departamento de Atenção Básica - Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 599/2006, Art. 4º, § 9º)
§ 10. A proposta que trata da implantação dos LRPD deverá contemplar, minimamente, os seguintes elementos: (Origem: PRT MS/GM 599/2006, Art. 4º, § 10)
I - identificação do Município ou do Estado pleiteante e do Estabelecimento de Saúde, com cópia do CNES; (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, a)
II - identificação da área de abrangência do serviço que irá ser ofertado, indicando qual Município, região ou microrregião é referência, mencionando, inclusive, a população coberta; (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, b)
III - descrição dos procedimentos que serão ofertados; e (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, c)
IV - emissão de documento, pelo gestor, informando a capacidade de produção, por mês, do estabelecimento a ser credenciado/contratado. (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, d)
§ 11. O Departamento de Atenção Básica, da Secretaria de Atenção à Saúde (DAB/SAS) realizará avaliação trimestral da produção total realizada pelo Município, com base nos dados extraídos dos sistemas de informação e de disseminação de dados, referentes aos procedimentos definidos no art. 196 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 599/2006, Art. 4º, § 11)
§ 12. A verificação e a análise das informações dos procedimentos realizados nos LRPD será por meio do Sistema de Informação Ambulatorial do SUS (SIA/SUS). (Origem: PRT MS/GM 599/2006, Art. 4º, § 12)
Seção II
Do Programa de Melhoria do Acesso e Qualidade dos Centros de Especialidades Odontológicas (PMAQ-CEO)
Art. 586. Esta Seção dispõe sobre o Programa de Melhoria do Acesso e Qualidade dos Centros de Especialidades Odontológicas (PMAQ-CEO). (Origem: PRT MS/GM 1599/2015, Art. 1º)
Art. 587. O PMAQ-CEO tem como objetivo induzir a ampliação do acesso e a melhoria da qualidade nos CEO, com garantia de um padrão de qualidade comparável nacional, regional e localmente, de maneira a permitir maior transparência e efetividade das ações governamentais direcionadas à atenção especializada em saúde bucal. (Origem: PRT MS/GM 1599/2015, Art. 2º)
Art. 588. Constituem-se diretrizes do PMAQ-CEO: (Origem: PRT MS/GM 1599/2015, Art. 3º)
I - definir parâmetros de qualidade dos CEO, considerando as diferentes realidades de saúde, de maneira a promover uma maior resolutividade dos serviços especializados em saúde bucal; (Origem: PRT MS/GM 1599/2015, Art. 3º, I)
II - fortalecer o processo de referência e contra referência de saúde bucal; (Origem: PRT MS/GM 1599/2015, Art. 3º, II)
III - estimular processo contínuo e progressivo de melhoramento dos padrões e indicadores de acesso e de qualidade que envolva a gestão, o processo de trabalho e os resultados alcançados pelos CEO; (Origem: PRT MS/GM 1599/2015, Art. 3º, III)
IV - transparência em todas as suas etapas, permitindo-se o contínuo acompanhamento de suas ações e resultados pela sociedade; (Origem: PRT MS/GM 1599/2015, Art. 3º, IV)
V - envolver e mobilizar os gestores federal, estaduais, do Distrito Federal e municipais, as equipes dos CEO e os usuários num processo de mudança de cultura de gestão e qualificação da atenção especializada em saúde bucal; (Origem: PRT MS/GM 1599/2015, Art. 3º, V)
VI - desenvolver cultura de planejamento, negociação e contratualização, que implique na gestão dos recursos em função dos compromissos e resultados pactuados e alcançados; (Origem: PRT MS/GM 1599/2015, Art. 3º, VI)
VII - estimular a efetiva mudança do modelo de atenção em saúde bucal, o desenvolvimento dos trabalhadores e a orientação dos serviços em função das necessidades e da satisfação dos usuários; e (Origem: PRT MS/GM 1599/2015, Art. 3º, VII)
VIII - caráter voluntário para a adesão tanto pelos profissionais do CEO quanto pelos gestores municipais, a partir do pressuposto de que o seu êxito depende da motivação e proatividade dos atores envolvidos. (Origem: PRT MS/GM 1599/2015, Art. 3º, VIII)
Art. 589. O PMAQ-CEO será composto por 3 (três) fases e um Eixo Estratégico Transversal de Desenvolvimento que compõem um ciclo. (Origem: PRT MS/GM 1599/2015, Art. 4º)
§ 1º O PMAQ-CEO se refere a processos e fases que se sucedem para o desenvolvimento e a melhoria contínua da qualidade da atenção especializada em saúde bucal. (Origem: PRT MS/GM 1599/2015, Art. 4º, § 1º)
§ 2º Cada ciclo do PMAQ-CEO ocorrerá a cada 24 (vinte e quatro) meses. (Origem: PRT MS/GM 1599/2015, Art. 4º, § 2º)
Art. 590. A Fase 1 do PMAQ-CEO é denominada Adesão e Contratualização. (Origem: PRT MS/GM 1599/2015, Art. 5º)
§ 1º Na Fase 1, todos os CEO habilitados pelo Ministério da Saúde através de portaria específica, independente do Tipo, I, II ou III, poderão aderir ao PMAQ-CEO desde que se encontrem em conformidade com os critérios a serem definidos no Manual Instrutivo do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 5º, § 1º)
§ 2º O estado, o município ou o Distrito Federal poderá incluir no Programa um ou mais CEO sob sua gestão. (Origem: PRT MS/GM 1599/2015, Art. 5º, § 2º)
§ 3º Nesta Fase 1 serão observadas as seguintes etapas: (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º)
I - formalização da adesão pelo estado, município ou Distrito Federal, por intermédio do preenchimento de formulário eletrônico específico a ser indicado pelo Ministério da Saúde; (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º, I)
II - contratualização da equipe do CEO e do gestor Estadual, Municipal ou do Distrito Federal, de acordo com as diretrizes e critérios definidos do Manual Instrutivo do PMAQ-CEO; e (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º, II)
III - informação sobre a adesão do município deve ser encaminhada ao Conselho Municipal de Saúde, à CIR e à CIB. No caso do estado, a Comissão Intergestores Bipartite e o Distrito Federal deve encaminhar informação sobre a adesão ao respectivo Conselho de Saúde. (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º, III)
§ 4º A Fase 1 será realizada pelos CEO que ingressarem no PMAQ-CEO pela primeira vez a cada ciclo. (Origem: PRT MS/GM 1599/2015, Art. 5º, Parágrafo Único)
Art. 591. A Fase 2 do PMAQ-CEO é denominada Certificação e será composta por: (Origem: PRT MS/GM 1599/2015, Art. 6º)
I - avaliação externa de desempenho dos CEO e da gestão da atenção especializada em saúde bucal, que será coordenada de forma tripartite e realizada por instituições de ensino e/ou pesquisa, por meio da verificação de evidências para um conjunto de padrões previamente determinados e pesquisa de satisfação do usuário; (Origem: PRT MS/GM 1599/2015, Art. 6º, I)
II - avaliação de desempenho dos indicadores contratualizados na etapa de adesão e contratualização, conforme disposto no art. 590; e (Origem: PRT MS/GM 1599/2015, Art. 6º, II)
III - verificação da realização de momento autoavaliativo pelos profissionais dos CEO. (Origem: PRT MS/GM 1599/2015, Art. 6º, III)
§ 1º Os CEOs contratualizados avaliados nos termos deste artigo receberão as seguintes classificações de desempenho: (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º)
I - ótimo; (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, I)
II - muito bom; (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, II)
III - bom; (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, III)
IV - regular; e (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, IV)
V - ruim. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, V)
§ 2º Caso o CEO contratualizado não alcance um conjunto de padrões mínimos de qualidade considerados essenciais, nos termos do Manual Instrutivo do PMAQ-CEO, ele será automaticamente certificado com desempenho ruim. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 2º)
§ 3º Para que o CEO seja classificada com o desempenho ótimo, além de obter uma nota mínima, deverá alcançar um conjunto de padrões considerados estratégicos, nos termos do Manual Instrutivo do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 3º)
§ 4º O conjunto das classificações de desempenho dos CEOs contratualizados comporá o Fator de Desempenho do Distrito Federal, do estado e de cada município. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 4º)
Art. 592. A Fase 3 do PMAQ-CEO é denominada Recontratualização, que se caracteriza pela pactuação singular dos estados, municípios e do Distrito Federal com incremento de novos padrões e indicadores de qualidade, estimulando a institucionalização de um processo cíclico e sistemático a partir dos resultados verificados nas Fases 2 do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 7º)
Parágrafo Único. A Fase 3 será realizada pelos CEO que participaram do PMAQ-CEO em ciclo anterior. (Origem: PRT MS/GM 1599/2015, Art. 7º, Parágrafo Único)
Art. 593. O Eixo Estratégico Transversal de Desenvolvimento do PMAQ-CEO é composto pelos seguintes elementos: (Origem: PRT MS/GM 1599/2015, Art. 8º)
I - autoavaliação, a ser feita pela equipe do CEO a partir de instrumentos ofertados pelo PMAQ-CEO ou outros definidos e pactuados pelo município, Distrito Federal, estado ou Região de Saúde; (Origem: PRT MS/GM 1599/2015, Art. 8º, I)
II - monitoramento, a ser realizado pela equipe do CEO, pela Secretaria Municipal de Saúde e pela Secretaria de Estado da Saúde do Distrito Federal, pela Secretaria de Estado da Saúde e pelo Ministério da Saúde em parceria com as CIR, a partir dos indicadores de saúde contratualizados na Fase 1 do PMAQ-CEO; (Origem: PRT MS/GM 1599/2015, Art. 8º, II)
III - educação permanente, por meio de ações dos gestores municipais, do Distrito Federal, estaduais e federal, considerando-se as necessidades de educação permanente das equipes dos CEO; (Origem: PRT MS/GM 1599/2015, Art. 8º, III)
IV - apoio institucional, a partir de estratégia de suporte aos CEO pelos gestores municipais e à gestão municipal pelas Secretarias de Estado da Saúde (SES), Conselhos de Secretarias Municipais de Saúde (COSEMS), CIR, CIB e Ministério da Saúde (MS); e (Origem: PRT MS/GM 1599/2015, Art. 8º, IV)
V - cooperação horizontal (presencial e/ou virtual), que deverá ocorrer entre equipes do CEO e entre gestores, com o intuito de permitir a troca de experiências e práticas promotoras de melhoria da qualidade da atenção especializada em saúde bucal. (Origem: PRT MS/GM 1599/2015, Art. 8º, V)
Parágrafo Único. O Eixo Estratégico Transversal de Desenvolvimento deve ser entendido como transversal em todas as Fases, de maneira a assegurar que as ações de promoção da melhoria da qualidade possam ser desenvolvidas em todas as etapas do ciclo do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 8º, Parágrafo Único)
Art. 594. O Grupo de Trabalho de Atenção à Saúde da CIT acompanhará o desenvolvimento do PMAQ-CEO, com avaliação e definição, inclusive, dos instrumentos utilizados no Programa. (Origem: PRT MS/GM 1599/2015, Art. 11)
Parágrafo Único. O Grupo de Trabalho de que trata o "caput" poderá convidar especialistas para discussão e manifestação acerca de elementos do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 11, Parágrafo Único)
Art. 595. O Ministério da Saúde, por meio do DAB/SAS/MS, publicará o Manual Instrutivo do PMAQ-CEO, com a metodologia pactuada e outros detalhamentos do Programa. (Origem: PRT MS/GM 1599/2015, Art. 12)
CAPÍTULO VI
DO PROGRAMA DE HUMANIZAÇÃO NO PRÉ-NATAL E NASCIMENTO
Art. 596. Fica instituído o Programa de Humanização no Pré-natal e Nascimento, no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 569/2000, Art. 1º)
Parágrafo Único. O Programa objeto deste Artigo será executado de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, municípios e do Distrito Federal e tem por objetivo o desenvolvimento de ações de promoção, prevenção e assistência à saúde de gestantes e recém-nascidos, promovendo a ampliação do acesso a estas ações, o incremento da qualidade e da capacidade instalada da assistência obstétrica e neonatal bem como sua organização e regulação no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 569/2000, Art. 1º, Parágrafo Único)
Art. 597. São princípios e diretrizes para a estruturação do Programa de Humanização no Pré-natal e Nascimento: (Origem: PRT MS/GM 569/2000, Art. 2º)
I - toda gestante tem direito ao acesso a atendimento digno e de qualidade no decorrer da gestação, parto e puerpério; (Origem: PRT MS/GM 569/2000, Art. 2º, a)
II - toda gestante tem direito ao acompanhamento pré-natal adequado de acordo com os princípios gerais e condições estabelecida no Anexo LXXXI ; (Origem: PRT MS/GM 569/2000, Art. 2º, b)
III - toda gestante tem direito de saber e ter assegurado o acesso à maternidade em que será atendida no momento do parto; (Origem: PRT MS/GM 569/2000, Art. 2º, c)
IV - toda gestante tem direito à assistência ao parto e ao puerpério e que esta seja realizada de forma humanizada e segura, de acordo com os princípios gerais e condições estabelecidas no Anexo LXXXII ; . (Origem: PRT MS/GM 569/2000, Art. 2º, d)
V - todo recém-nascido tem direito à assistência neonatal de forma humanizada e segura; (Origem: PRT MS/GM 569/2000, Art. 2º, e)
VI - as autoridades sanitárias dos âmbitos federal, estadual e municipal são responsáveis pela garantia dos direitos enunciados nas alíneas acima. (Origem: PRT MS/GM 569/2000, Art. 2º, f)
Art. 598. O Programa de Humanização no Pré-natal e Nascimento será constituído pelos seguintes componentes, regulamentados em ato próprio do Ministério da Saúde: (Origem: PRT MS/GM 569/2000, Art. 3º)
I - Componente I - Incentivo à Assistência Pré-natal; (Origem: PRT MS/GM 569/2000, Art. 3º, a)
II - Componente II - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal; (Origem: PRT MS/GM 569/2000, Art. 3º, b)
III - Componente III - Nova Sistemática de Pagamento da Assistência ao Parto. (Origem: PRT MS/GM 569/2000, Art. 3º, c)
§ 1º O Componente I - Incentivo à Assistência Pré-natal, tem o objetivo de estimular os estados e municípios, de acordo com os princípios e critérios estabelecidos, a realizarem o acompanhamento pré-natal completo e o cadastramento das gestantes; (Origem: PRT MS/GM 569/2000, Art. 3º, § 1º)
§ 2º O Componente II - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal terá dois componentes; (Origem: PRT MS/GM 569/2000, Art. 3º, § 2º)
I - criação de condições técnicas, financeiras e operacionais que permitam o desenvolvimento de mecanismos destinados à organização e regulação da assistência obstétrica e neonatal por meio do estabelecimento de protocolos de regulação, da estruturação de Centrais de Regulação e estruturação de sistemas móveis de atendimento pré e inter-hospitalares, e (Origem: PRT MS/GM 569/2000, Art. 3º, § 2º, a)
II - financiamento do incremento da qualidade assistencial e da capacidade instalada obstétrica e neonatal de hospitais públicos e filantrópicos integrantes do Sistema Único de Saúde que prestem este tipo de assistência e que cumpram os requisitos e critérios de elegibilidade estabelecidos. (Origem: PRT MS/GM 569/2000, Art. 3º, § 2º, b)
§ 3º O Componente III-A nova sistemática de pagamento da assistência ao parto, tem a finalidade de melhorar as condições do custeio desta assistência nos hospitais cadastrados no Sistema de Informações Hospitalares do Sistema Único de Saúde SIH/SUS e terá dois componentes: (Origem: PRT MS/GM 569/2000, Art. 3º, § 3º)
I - alteração do valor e forma de remuneração da assistência ao parto, e (Origem: PRT MS/GM 569/2000, Art. 3º, § 3º, a)
II - pagamento de um adicional sobre o valor de que trata a alínea "a" para aqueles hospitais que prestarem assistência ao parto a gestantes cadastradas no Programa de Incentivo à Assistência Pré-natal e que tenham o acompanhamento pré-natal completo. (Origem: PRT MS/GM 569/2000, Art. 3º, § 3º, b)
Art. 599. Ficam estabelecidas, para cada nível de gestão do Sistema Único de Saúde, as seguintes competências/atribuições na implementação do Programa de Humanização no Pré-natal e Nascimento: (Origem: PRT MS/GM 569/2000, Art. 5º)
§ 1º São competências/atribuições do Ministério da Saúde: (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º)
I - articular com estados, municípios e Distrito Federal a implantação do Programa e estabelecer mecanismos de controle, avaliação e acompanhamento do processo; (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, a)
II - assessorar os estados, municípios e o Distrito Federal na elaboração de seus respectivos Programas Estaduais de Humanização no Pré-natal e Nascimento, na estruturação das Centrais de Regulação Obstétrica e Neonatal e na implantação dos sistemas móveis de atendimento; (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, b)
III - estabelecer normas técnicas e critérios de elegibilidade para inclusão no Programa; (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, c)
IV - alocar recursos destinados ao co-financiamento dos componentes integrantes do Programa. (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, d)
§ 2º São competências/atribuições das Secretarias de Saúde dos Estados e do Distrito Federal: (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º)
I - elaborar, em articulação com as respectivas Secretarias Municipais de Saúde e como condição indispensável à implantação do Programa Nacional,os Programas Estaduais de Humanização no Pré-natal e Nascimento, organizando seus sistemas estaduais/regionais de assistência obstétrica e neonatal que contemplem ações voltadas para a atenção básica, o apoio laboratorial, a atenção ambulatorial especializada e a assistência hospitalar obstétrica e neonatal, explicitando as unidades de referência para o diagnóstico, a atenção ambulatorial à gestação de alto risco e a assistência ao parto de baixo e alto risco; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, a)
II - coordenar e executar, em articulação com as Secretarias Municipais de Saúde, a programação física e financeira da assistência obstétrica e neonatal; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, b)
III - estruturar e garantir o funcionamento das Centrais Estaduais de Regulação Obstétrica e Neonatal; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, c)
IV - assessorar os municípios na estruturação de suas respectivas Centrais Municipais de Regulação Obstétrica e Neonatal e na implantação dos sistemas móveis de atendimento; . (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, d)
V - assessorar os municípios no processo de implementação do Programa e seus respectivos componentes e no desenvolvimento de mecanismos destinados a seu controle, avaliação e acompanhamento; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, e)
VI - alocar, complementarmente, recursos financeiros próprios para o desenvolvimento do Programa; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, f)
VII - monitorar o desempenho do respectivo programa e os resultados alcançados, mediante o acompanhamento de indicadores de morbimortalidade materna e neonatal, no âmbito estadual; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, g)
VIII - manter atualizados os bancos de dados que estejam sob sua responsabilidade SIM, SINASC, SIPAC. (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, h)
§ 3º São competências/atribuições das Secretarias Municipais de Saúde: (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º)
I - participar da elaboração do Programa Estadual de Humanização no Pré-natal e Nascimento; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, a)
II - estruturar e garantir o funcionamento da Central Municipal de Regulação Obstétrica e Neonatal, naqueles municípios que cumpram os critérios de elegibilidade estabelecidos; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, b)
III - estruturar e garantir o funcionamento do sistema móvel de atendimento pré e inter-hospitalar, naqueles municípios que cumpram os critérios de elegibilidade estabelecidos; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, c)
IV - garantir o atendimento pré-natal e do puerpério em seu próprio território e realizar o cadastro de suas gestantes; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, d)
V - identificar laboratórios e garantir a realização dos exames básicos e o acesso aos exames de seguimento do pré-natal, em seu próprio território ou em outro município, mediante programação regional; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, e)
VI - estabelecer a referência para a assistência ambulatorial e hospitalar à gestante de alto risco, em seu próprio território ou em outro município, mediante programação regional; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, f)
VII - alocar, complementarmente, recursos financeiros próprios para o desenvolvimento do Programa; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, g)
VIII - monitorar o desempenho do respectivo programa e os resultados alcançados mediante o acompanhamento de indicadores de morbimortalidade materna e neonatal, no âmbito municipal; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, h)
IX - manter atualizados os bancos de dados que estejam sob sua responsabilidade SIM, SINASC, SIPAC. (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, i)
Seção IDo Componente I do Programa de Humanização no Pré-natal e Nascimento - Incentivo à Assistência Pré-natal no âmbito do SUS
Art. 600. Fica instituído o Componente I do Programa de Humanização no Pré-natal e Nascimento - Incentivo à Assistência Pré-natal no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 570/2000, Art. 1º)
Parágrafo Único. O Componente objeto deste artigo tem o objetivo de estimular os estados e municípios a incrementar a qualidade do acompanhamento pré-natal, promovendo o cadastramento de suas gestantes, organizando seus sistemas assistenciais, municipais e estaduais, garantindo a realização do acompanhamento pré-natal completo e a articulação deste com a assistência ao parto e puerpério. (Origem: PRT MS/GM 570/2000, Art. 1º, Parágrafo Único)
Art. 601. A adesão ao Componente I - Incentivo à Assistência Pré-natal será condicionada ao cumprimento, pelos municípios pleiteantes, dos seguintes requisitos: (Origem: PRT MS/GM 570/2000, Art. 4º)
I - dispor de sistema de assistência pré-natal, ao parto; puerpério e neonatal devidamente organizado, com definição de unidades de referência para o diagnóstico, assistência ambulatorial e hospitalar; (Origem: PRT MS/GM 570/2000, Art. 4º, I)
II - dispor de rede ambulatorial para realização do pré-natal e consulta no puerpério; (Origem: PRT MS/GM 570/2000, Art. 4º, II)
III - dispor de laboratórios vinculados à sua rede para realização dos exames básicos ou garantir acesso; (Origem: PRT MS/GM 570/2000, Art. 4º, III)
IV - dispor de Unidade(s) de Referência para o Atendimento Ambulatorial e Hospitalar à Gestante de Alto Risco ou garantir acesso; (Origem: PRT MS/GM 570/2000, Art. 4º, IV)
V - estabelecer mecanismos de vinculação pré-natal/parto; (Origem: PRT MS/GM 570/2000, Art. 4º, V)
VI - estabelecer mecanismos de cadastramento no pré-natal das gestantes até o 4° mês da gestação e garantir, de acordo com os princípios gerais e condições para o acompanhamento pré-natal estabelecidos no Anexo LXXXI , a realização dos seguintes procedimentos: (Origem: PRT MS/GM 570/2000, Art. 4º, VI)
a) realizar a primeira consulta de pré-natal até o 4° mês da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VI, a)
b) Realizar, no mínimo, 06 (seis) consultas de acompanhamento pré-natal, sendo, preferencialmente, uma no primeiro trimestre, duas no segundo e três no terceiro trimestre da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VI, b)
c) Realizar 01 (uma) consulta no puerpério, até 42 dias após o nascimento; (Origem: PRT MS/GM 570/2000, Art. 4º, VI, c)
VII - realizar os seguintes exames laboratoriais: (Origem: PRT MS/GM 570/2000, Art. 4º, VII)
a) ABO-Rh, na primeira consulta; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, a)
b) VDRL, um exame na primeira consulta e um na 30ª semana da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, b)
c) urina - rotina, (elementos anormais e sedimentos) - um exame na primeira consulta e um na 30ª semana da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, c)
d) glicemia de jejum, um exame na primeira consulta e um na 30ª semana da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, d)
e) HB/Ht, na primeira consulta. (Origem: PRT MS/GM 570/2000, Art. 4º, VII, e)
VIII - oferta de testagem anti-HIV, com um exame na primeira consulta, naqueles municípios com população acima de 50 mil habitantes; (Origem: PRT MS/GM 570/2000, Art. 4º, VIII)
IX - aplicação de vacina antitetânica dose imunizante (segunda do esquema recomendado) ou dose de reforço em mulheres já imunizadas; (Origem: PRT MS/GM 570/2000, Art. 4º, IX)
X - realização de atividades educativas; (Origem: PRT MS/GM 570/2000, Art. 4º, X)
XI - classificação de risco gestacional a ser realizada na primeira consulta e nas subsequentes; (Origem: PRT MS/GM 570/2000, Art. 4º, XI)
XII - garantir às gestantes classificadas como de risco, atendimento ou acesso à unidade de referência para atendimento ambulatorial e/ou hospitalar à gestação de alto risco. (Origem: PRT MS/GM 570/2000, Art. 4º, XII)
Art. 602. Para ser incluído no Componente I - Incentivo à Assistência Pré-natal, o município pleiteante deverá apresentar o TERMO DE ADESÃO, e integraremos Planos Regionais para a Assistência à Gestação, ao Parto e ao Recém-Nascido, a serem articulados pela respectiva Secretaria Estadual de Saúde/SES, a seguir encaminhando-os à Secretaria de Políticas de Saúde, para fins de publicação. (Origem: PRT MS/GM 570/2000, Art. 5º)
Art. 603. O Incentivo à Assistência Pré-natal a ser pago pelo Ministério da Saúde aos municípios que aderirem ao Componente será operacionalizado da seguinte forma: (Origem: PRT MS/GM 570/2000, Art. 8º)
§ 1º O município cadastrará as gestantes na 1ª consulta de pré-natal (até o 4° mês de gravidez), através da Ficha de Cadastramento da Gestante-do Componente I Incentivo à Assistência Pré-natal, constante do Anexo LXXXIII ; (Origem: PRT MS/GM 570/2000, Art. 8º, § 1º)
§ 2º A Ficha de Cadastramento da Gestante deverá alimentar o SISPRENATAL, programa a ser disponibilizado pelo DATASUS; (Origem: PRT MS/GM 570/2000, Art. 8º, § 2º)
§ 3º A Ficha de Cadastramento da Gestante conterá os seguintes dados de alimentação obrigatória: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º)
I - dados de cadastramento: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I)
a) nome da unidade de saúde; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, a)
b) código da unidade no SIA; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, b)
c) nome do município; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, c)
d) código do município no IBGE; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, d)
e) sigla da UF; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, e)
f) código da UF no IBGE. (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, f)
II - identificação da gestante: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II)
a) número da gestante no SISPRENATAL; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, a)
b) gestante acompanhada pelo PSF e código da área e da microárea; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, b)
c) nome da Gestante; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, c)
d) data do nascimento da gestante - dia/mês/ano; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, d)
e) nome da mãe da gestante; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, e)
f) endereço residencial; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, f)
g) número do cartão SUS; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, g)
h) Número do CPF; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, h)
i) Certidão de Nascimento ou Casamento; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, i)
j) Identidade; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, j)
k) carteira de trabalho. (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, k)
III - dados assistenciais: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III)
a) data da 1ª consulta pré-natal; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III, a)
b) data da última menstruação; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III, b)
c) responsável pela primeira consulta pré-natal. (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III, c)
§ 4º A Ficha de Cadastramento da Gestante referente ao Componente I - Incentivo à Assistência Pré-Natal, será emitida em 02 (duas) vias, devendo 01 (uma) via ser arquivada no prontuário da gestante na unidade onde a mesma realizou a primeira consulta pré-natal ou consulta de cadastramento, e a segunda deve ser encaminhada para digitação das informações no SISPRENATAL, para possibilitar o recebimento do valor do incentivo. (Origem: PRT MS/GM 570/2000, Art. 8º, § 4º)
§ 5º Após a alimentação do SISPRENATAL com a Ficha de Cadastramento da Gestante, o próprio sistema gerará automaticamente um BPA magnético específico, para importação no SIA/SUS, com o código de procedimento 07.071.02.7 - ADESÃO AO COMPONENTE I - INCENTIVO A ASSISTÊNCIA PRÉ NATAL, que passa a integrar a Tabela do SIA-SUS no Subgrupo 07.070.00.4 - Procedimento de Assistência Pré-Natal. É considerado executado quando realizado o preenchimento e a alimentação do SISPRENATAL com todos os campos da Ficha de Cadastramento da Gestante - Componente I - Incentivo à Assistência Pré-Natal: Nível de Hierarquia: 01, 02 ,03, 04; 05, 06,07. 08; Serviço/classificação: 32/122, 32/123; Atividade profissional: 01, 22, 29, 59, 60, 73, 74, 76, 79, 84; Tipo de Prestador: 05, 15, 04,14; Tipo de Atendimento: 00; Grupo de Atendimento: 00; Faixa Etária: 00; Valor: 10,00. (Origem: PRT MS/GM 570/2000, Art. 8º, § 5º)
I - o procedimento Adesão ao Componente I - Incentivo à Assistência Pré-natal só será efetuado pelo SIA/SUS a unidades públicas municipais ou estaduais; (Origem: PRT MS/GM 570/2000, Art. 8º, § 5º, I)
§ 6º O SISPRENATAL terá duas saídas, sendo uma delas para alimentação do SIA/SUS e outra para formação da Base de Dados Nacional do próprio sistema. (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º)
I - Para alimentação do SIA/SUS, as Secretarias Municipais de Saúde deverão observar o cronograma definido pelo DATASUS para aquele sistema; (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, I)
II - A saída do SISPRENATAL com os dados exclusivos do programa deverá ser apresentada pelas Secretarias Municipais de Saúde, por meio magnético, com a evolução aos atendimentos à Secretaria Estadual de Saúde/SES para transmissão ao DATASUS, na área de conferência 38, até o dia 15 de cada mês; (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, II)
III - O DATASUS remeterá à SES o recibo de entrada dos dados na Base Nacional SISPRENATAL; (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, III)
IV - O DATASUS atualizará a Base Nacional do SISPRENATAL, até o 5° dia útil, a contar da data de transferência dos dados pela SES. (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, IV)
§ 7º No término do pré-natal, após a realização do parto e da consulta do puerpério, e quando devidamente alimentado, o SISPRENATAL gerará BPA magnético específico, lançando o código de procedimento abaixo discriminado, que passa a integrar a tabela do SIA/SUS: 07.071.03.5 - CONCLUSÃO DA ASSISTÊNCIA PRENATAL. É considerado executado o procedimento quando realizadas as 6 (seis) consultas de pré-natal, todos os exames obrigatórios, a imunização anti-tetânica, a realização do parto e da consulta do puerpério nas gestantes cadastradas no SISPRENATAL: Nível de Hierarquia: 01, 02, 03, 04, 05, 06, 07, 08; Serviço/classificação: 32/122; 32/123; Tipo de Prestador: 05, 15, 04, 14; Atividade profissional: 01 22 29 59 60 73 74 76 79 84; Tipo de Atendimento: 00; Grupo de Atendimento: 00; Faixa Etária: 00;Valor: 40,00. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º)
I - A cada consulta pré-natal realizada pela gestante acompanhada pelo Programa de Humanização no Pré-natal e Nascimento, o profissional responsável pela consulta, deverá preencher a FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES NO SISPRENATAL, que alimentará o sistema. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º, II)
II - Os dados referentes a cada gestante, constantes da FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES NO SISPRENATAL, constante do Anexo LXXXIV , serão consolidados pelo próprio sistema que emitirá BPA magnético específico, para importação no SIA/SUS, possibilitando o pagamento do incentivo 07.071.035 - Conclusão da Assistência Pré-natal. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º, III)
III - O SISPRENATAL, será integrado ao SGAIH permitindo cruzamento de informações e disponibilizando um relatório constando o número de cadastramento da gestante no SISPRENATAL e o número da AIH utilizada no parto da mesma gestante. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º, IV)
Art. 604. As Secretarias Estaduais de Saúde, em articulação com as Secretarias Municipais de Saúde, deverão elaborar os Planos Regionais para a Assistência à Gestação, Parto e ao Recém-nascido. (Origem: PRT MS/GM 570/2000, Art. 9º)
Art. 605. A Secretaria de Atenção à Saúde adotará as medidas necessárias ao fiel cumprimento do disposto nesta Seção, ficando autorizada a realizar as alterações de códigos de procedimento bem como sua descrição e valor, quando pertinente. (Origem: PRT MS/GM 570/2000, Art. 12)
Seção II
Do Componente II do Programa de Humanização no Pré-natal e Nascimento - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal, no âmbito do SUS
Art. 606. Fica instituído o Componente II do Programa de Humanização no Pré-natal e Nascimento - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal, no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 571/2000, Art. 1º)
Art. 607. A Secretaria de Atenção à Saúde estabelecerá os requisitos para a participação de estados, municípios e Distrito Federal no componente de que trata esta Seção, os critérios de elegibilidade de municípios e hospitais a serem contemplados, os quantitativos de recursos do montante global a serem destinados a cada atividade, os componentes de despesa que serão autorizados para cada tipo de atividade, bem como adote as demais medidas necessárias ao fiel cumprimento desta Seção. (Origem: PRT MS/GM 571/2000, Art. 3º)
Parágrafo Único. As Secretarias de Saúde dos estados, municípios e do Distrito Federal e os hospitais que cumprirem com os requisitos e critérios estabelecidos, deverão elaborar projeto de investimentos específico, plano de trabalho e cronograma de desembolso a serem submetidos à apreciação da Secretaria de Atenção à Saúde, que após aprovação, os enviará à Secretaria-Executiva para a celebração dos respectivos convênios. (Origem: PRT MS/GM 571/2000, Art. 3º, Parágrafo Único)
Seção III
Do Componente III do Programa de Humanização no Pré-natal e Nascimento - Nova Sistemática de Pagamento à Assistência ao Parto
Art. 608. Fica instituído o Componente III do Programa de Humanização no Pré-natal e Nascimento Nova Sistemática de Pagamento à Assistência ao Parto. (Origem: PRT MS/GM 572/2000, Art. 1º)
Parágrafo Único. O Componente objeto deste artigo estabelecerá alterações na sistemática de pagamento da assistência ao parto, possibilitando a melhoria da Qualidade assistencial. (Origem: PRT MS/GM 572/2000, Art. 1º, Parágrafo Único)
Art. 609. A assistência pré-natal deverá ser realizada de acordo com os princípios gerais e condições para o acompanhamento pré-natal estabelecidas no Capítulo VI do Título IV e ser efetuada, preferencialmente, nos termos da Seção I do Capítulo VI do Título IV da mesma data, que institui o Componente I do Programa de Humanização no Pré-natal e Nascimento - Incentivo à Assistência Pré-natal no âmbito do Sistema Único de Saúde; (Origem: PRT MS/GM 572/2000, Art. 2º, § 2º)
§ 1º A assistência ao parto e puerpério deverá ser realizada de acordo com os princípios gerais e condições estabelecidas no Anexo LXXXII ; (Origem: PRT MS/GM 572/2000, Art. 2º, § 3º)
§ 2º As unidades prestadoras de serviços do Sistema Único de Saúde deverão integrar-se ao sistema de saúde local, no sentido de possibilitar a adequada organização e regulação assistencial, a ampliação do acesso e da qualidade do atendimento e viabilizando a atenção ao pré-natal, parto, puerpério e assistência ao recém-nascido de forma mais humanizada; (Origem: PRT MS/GM 572/2000, Art. 2º, § 4º)
§ 3º Os Centros de Parto Normal, Casas de Parto, Hospitais e Maternidades integrantes do Sistema único de Saúde deverão estar vinculadas às Unidades Básicas e de Saúde da Família de sua área de abrangência. (Origem: PRT MS/GM 572/2000, Art. 2º, § 5º)
Art. 610. Determina que a Secretaria de Atenção à Saúde priorize o envio de cartas, às pacientes submetidas aos procedimentos de parto nas Unidades prestadoras de serviços do SUS, com questionário de avaliação das condições e da qualidade do atendimento prestado. (Origem: PRT MS/GM 572/2000, Art. 5º)
Art. 611. É de responsabilidade dos gestores estaduais e municipais, dependendo das prerrogativas e competências compatíveis com o nível de gestão, efetuar o acompanhamento, controle, avaliação e auditoria que garantam o cumprimento das regras do Componente III do Programa de Humanização no Pré-natal e Nascimento. (Origem: PRT MS/GM 572/2000, Art. 8º)
Art. 612. A Secretaria de Atenção à Saúde adotará as medidas necessárias ao fiel cumprimento das regras do Componente III do Programa de Humanização no Pré-natal e Nascimento, ficando autorizada a realizar as alterações de códigos de procedimento bem como sua descrição e valor quando pertinente. (Origem: PRT MS/GM 572/2000, Art. 10)
Seção IV
Da Atenção Integral e Humanizada à Mulher e ao Recém-nascido no Alojamento Conjunto
Art. 613. Ficam instituídas as diretrizes para atenção integral e humanizada à mulher e ao recém-nascido no Alojamento Conjunto. (Origem: PRT MS/GM 2068/2016, Art. 1º)
Parágrafo Único. As diretrizes dispostas nesta Seção aplicam-se ao Alojamento Conjunto de serviços de saúde, públicos e privados, inclusive das Forças Armadas, de hospitais universitários e de ensino. (Origem: PRT MS/GM 2068/2016, Art. 1º, Parágrafo Único)
Art. 614. O Alojamento Conjunto é o local em que a mulher e o recém-nascido sadio, logo após o nascimento, permanecem juntos, em tempo integral, até a alta. (Origem: PRT MS/GM 2068/2016, Art. 2º)
Parágrafo Único. O Alojamento Conjunto possibilita a atenção integral à saúde da mulher e do recém-nascido, por parte do serviço de saúde. (Origem: PRT MS/GM 2068/2016, Art. 2º, Parágrafo Único)
Art. 615. A manutenção da mulher e do recém-nascido em Alojamento Conjunto apresenta as seguintes vantagens: (Origem: PRT MS/GM 2068/2016, Art. 3º)
I - favorece e fortalece o estabelecimento do vínculo afetivo entre pai, mãe e filho; (Origem: PRT MS/GM 2068/2016, Art. 3º, I)
II - propicia a interação de outros membros da família com o recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 3º, II)
III - favorece o estabelecimento efetivo do aleitamento materno com o apoio, promoção e proteção, de acordo com as necessidades da mulher e do recém-nascido, respeitando as características individuais; (Origem: PRT MS/GM 2068/2016, Art. 3º, III)
IV - propicia aos pais e acompanhantes a observação e cuidados constantes ao recém-nascido, possibilitando a comunicação imediata de qualquer anormalidade; (Origem: PRT MS/GM 2068/2016, Art. 3º, IV)
V - fortalece o autocuidado e os cuidados com o recém nascido, a partir de atividades de educação em saúde desenvolvidas pela equipe multiprofissional; (Origem: PRT MS/GM 2068/2016, Art. 3º, V)
VI - diminui o risco de infecção relacionada à assistência em serviços de saúde; e (Origem: PRT MS/GM 2068/2016, Art. 3º, VI)
VII - propicia o contato dos pais e familiares com a equipe multiprofissional por ocasião da avaliação da mulher e do recém nascido, e durante a realização de outros cuidados. (Origem: PRT MS/GM 2068/2016, Art. 3º, VII)
Art. 616. O Alojamento Conjunto destina-se a: (Origem: PRT MS/GM 2068/2016, Art. 4º)
I - mulheres clinicamente estáveis e sem contraindicações para a permanência junto ao seu bebê; (Origem: PRT MS/GM 2068/2016, Art. 4º, I)
II - recém-nascidos clinicamente estáveis, com boa vitalidade, capacidade de sucção e controle térmico; peso maior ou igual a 1800 gramas e idade gestacional maior ou igual a 34 semanas; (Origem: PRT MS/GM 2068/2016, Art. 4º, II)
III - recém-nascidos com acometimentos sem gravidade, como por exemplo: icterícia, necessitando de fototerapia, malformações menores, investigação de infecções congênitas sem acometimento clínico, com ou sem microcefalia; e (Origem: PRT MS/GM 2068/2016, Art. 4º, III)
IV - recém-nascidos em complementação de antibioticoterapia para tratamento de sífilis ou sepse neonatal após estabilização clínica na UTI ou UCI neonatal. (Origem: PRT MS/GM 2068/2016, Art. 4º, IV)
§ 1º Cabe ao serviço de saúde realizar a gestão eficiente de leitos de forma que mulheres em outras situações ginecológicas e obstétricas, especialmente em situação de perda gestacional, não permaneçam no mesmo quarto ou enfermaria com puérperas e recémnascidos. (Origem: PRT MS/GM 2068/2016, Art. 4º, § 1º)
§ 2º Incumbe ao serviço de saúde evitar que puérperas que não podem amamentar por doença de base ou uso de medicamentos, permaneçam junto com mulheres que amamentam. (Origem: PRT MS/GM 2068/2016, Art. 4º, § 2º)
Art. 617. O Alojamento Conjunto contará com os seguintes recursos humanos mínimos: (Origem: PRT MS/GM 2068/2016, Art. 5º)
I - Enfermagem: (Origem: PRT MS/GM 2068/2016, Art. 5º, I)
a) profissional de nível superior para função de coordenação, preferencialmente com habilitação em neonatologia/obstetrícia ou 2 (dois) anos de experiência profissional comprovada na área, com jornada horizontal diária mínima de quatro horas; (Origem: PRT MS/GM 2068/2016, Art. 5º, I, a)
b) profissional de nível superior para assistência, preferencialmente com habilitação em neonatologia/obstetrícia ou 2 (dois) anos de experiência profissional comprovada na área para cada 20 binômios mãe-RN ou fração em cada turno; e (Origem: PRT MS/GM 2068/2016, Art. 5º, I, b)
c) profissional de nível técnico para cada oito binômios mãe RN ou fração em cada turno. (Origem: PRT MS/GM 2068/2016, Art. 5º, I, c)
II - Pediatria: (Origem: PRT MS/GM 2068/2016, Art. 5º, II)
a) profissional médico para função de responsabilidade técnica com jornada horizontal diária mínima de 4 (quatro) horas, preferencialmente com habilitação em neonatologia ou título de especialista em pediatria fornecido pela Sociedade Brasileira de Pediatria ou residência médica em pediatria ou em neonatologia, reconhecida pelo Ministério da Educação; (Origem: PRT MS/GM 2068/2016, Art. 5º, II, a)
b) profissional médico para assistência com jornada horizontal diária mínima de quatro horas, preferencialmente com habilitação em neonatologia ou título de especialista em pediatria fornecido pela Sociedade Brasileira de Pediatria ou residência médica em pediatria ou em neonatologia, reconhecida pelo Ministério da Educação para cada 20 recém-nascidos ou fração; e (Origem: PRT MS/GM 2068/2016, Art. 5º, II, b)
c) profissional médico plantonista preferencialmente com habilitação em neonatologia ou título de especialista em pediatria fornecido pela Sociedade Brasileira de Pediatria ou residência médica em neonatologia ou residência médica em pediatria, reconhecida pelo Ministério da Educação para cada 20 recém-nascidos ou fração. Plantonista do alojamento conjunto poderá ser profissional da equipe da Unidade de Cuidados Intermediários Convencional ou Canguru (UCINCo ou UCINCa), prevista no Título IV do Anexo II da Portaria de Consolidação nº 3, ou, ainda, da equipe de assistência ao recém-nascido no nascimento quando o estabelecimento não disponibilizar de leitos UCINCo/UCINCa; (Origem: PRT MS/GM 2068/2016, Art. 5º, II, c)
III - Obstetrícia: (Origem: PRT MS/GM 2068/2016, Art. 5º, III)
a) profissional médico para função de responsabilidade técnica com jornada horizontal diária mínima de quatro horas, preferencialmente com habilitação em Ginecologia e Obstetrícia, ou título de especialista ou residência médica em Ginecologia e Obstetrícia; (Origem: PRT MS/GM 2068/2016, Art. 5º, III, a)
b) profissional médico para assistência, com jornada horizontal diária mínima de quatro horas, preferencialmente com habilitação em Ginecologia e Obstetrícia, ou título de especialista ou residência médica em Ginecologia e Obstetrícia para cada 20 puérperas ou fração; e (Origem: PRT MS/GM 2068/2016, Art. 5º, III, b)
c) profissional médico plantonista, preferencialmente com habilitação em Ginecologia e Obstetrícia, ou título de especialista ou residência médica em Ginecologia e Obstetrícia. Plantonista do Alojamento Conjunto poderá ser profissional da equipe de obstetras de plantão. (Origem: PRT MS/GM 2068/2016, Art. 5º, III, c)
§ 1º O profissional de Enfermagem de nível superior e o médico poderão acumular as funções de responsabilidade técnica e assistência. (Origem: PRT MS/GM 2068/2016, Art. 5º, § 1º)
§ 2º Os serviços de saúde que realizam 500 partos por ano ou menos poderão estabelecer outros arranjos de jornadas de trabalho, desde que seja garantida assistência integral e presencial à mulher e ao recém-nascido pelas equipes multiprofissionais. (Origem: PRT MS/GM 2068/2016, Art. 5º, § 2º)
§ 3º Outras categorias profissionais poderão ser necessárias na assistência à mulher e ao recém-nascido no Alojamento Conjunto, conforme necessidades específicas, tais como profissionais de ortopedia, neurologia, oftalmologia, cirurgia geral e infantil, assistente social, psicologia, nutrição, fisioterapia e fonoaudiologia. (Origem: PRT MS/GM 2068/2016, Art. 5º, § 3º)
Art. 618. Cabe à equipe multiprofissional no Alojamento Conjunto: (Origem: PRT MS/GM 2068/2016, Art. 6º)
I - avaliar as puérperas diariamente, com atenção aos sinais de alerta para complicações no período pós-parto, tais como sangramento vaginal aumentado, febre, dor exacerbada, edema assimétrico de extremidades, sinais inflamatórios de ferida cirúrgica, sinais de sofrimento psíquico e depressão pós-parto; (Origem: PRT MS/GM 2068/2016, Art. 6º, I)
II - promover e proteger o aleitamento materno sob livre demanda, apoiando a puérpera na superação de possíveis dificuldades de acordo com suas necessidades específicas e respeitando suas características individuais; (Origem: PRT MS/GM 2068/2016, Art. 6º, II)
III - garantir à mulher o direito a acompanhante, de sua livre escolha, durante toda a internação e a receber visitas diárias, inclusive de filhos menores; (Origem: PRT MS/GM 2068/2016, Art. 6º, III)
IV - estimular e facilitar a presença do pai sem restrição de horário, inclusive de genitor sócio-afetivo; (Origem: PRT MS/GM 2068/2016, Art. 6º, IV)
V - oferecer à mulher orientações relativas à importância de não ofertar ao recém-nascido nenhum outro alimento ou bebida, além do leite materno, exceto em situações especiais com prescrição médica ou de nutricionista, destacando que, nesses casos, deverá ser oferecido, preferencialmente, leite humano pasteurizado de Banco de Leite Humano; (Origem: PRT MS/GM 2068/2016, Art. 6º, V)
VI - oferecer à mulher orientações relativas à importância de não usar protetores de mamilo e não oferecer bicos artificiais ou chupetas ao recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 6º, VI)
VII - oferecer à mulher orientações sobre os riscos da amamentação cruzada amamentar outro recém-nascido que não seja o próprio filho, e da proibição desta prática no Alojamento Conjunto; (Origem: PRT MS/GM 2068/2016, Art. 6º, VII)
VIII - apoiar, incentivar e orientar a participação da mãe e do pai nos cuidados ao recém-nascido, bem como de outros familiares, de acordo com o desejo dos pais da criança; (Origem: PRT MS/GM 2068/2016, Art. 6º, VIII)
IX - orientar e estimular o contato pele a pele, posição canguru, pelo tempo que a mãe e o pai considerarem oportuno e prazeroso, especialmente quando se tratar de recém-nascido com peso inferior a 2500g; (Origem: PRT MS/GM 2068/2016, Art. 6º, IX)
X - realizar o exame clínico do recém-nascido em seu próprio berço ou no leito materno, preferencialmente na presença da mãe e do pai; (Origem: PRT MS/GM 2068/2016, Art. 6º, X)
XI - realizar o banho do recém-nascido na cuba de seu próprio berço ou banheira e assegurar a limpeza e a desinfecção entre o uso de acordo com padronização da Comissão de Controle de Infecção Hospitalar das respectivas maternidades. Durante o banho, orientar os cuidados necessários para a prevenção de hipotermia, incentivando a participação materna e paterna ou de outro acompanhante; (Origem: PRT MS/GM 2068/2016, Art. 6º, XI)
XII - avaliar o peso do recém-nascido de acordo com necessidades individuais; (Origem: PRT MS/GM 2068/2016, Art. 6º, XII)
XIII - adotar técnicas não farmacológicas de prevenção/redução da dor para a coleta de sangue e outros procedimentos dolorosos. Recomenda-se a sucção ao seio materno previamente, durante a realização de procedimentos; (Origem: PRT MS/GM 2068/2016, Art. 6º, XIII)
XIV - identificar e enfatizar os recursos disponíveis na comunidade e na rede de saúde local para atendimento continuado das mulheres e das crianças, referindo-as ou agendando-as para acompanhamento no serviço de saúde na primeira semana após o parto; (Origem: PRT MS/GM 2068/2016, Art. 6º, XIV)
XV - realizar atividades de educação em saúde, preferencialmente em grupo, com o objetivo de: (Origem: PRT MS/GM 2068/2016, Art. 6º, XV)
a) ampliar o autocuidado das mulheres e de cuidados com os recém-nascidos; (Origem: PRT MS/GM 2068/2016, Art. 6º, XV, a)
b) desfazer mitos relacionados à maternidade, à paternidade, ao aleitamento materno, ao puerpério, ao retorno à vida sexual, entre outros; e (Origem: PRT MS/GM 2068/2016, Art. 6º, XV, b)
c) oferecer orientações quanto aos cuidados de saúde, nutrição, higiene, saúde sexual e reprodutiva, destacando o direito a uma vida sexual livre, prazerosa e segura e o direito à escolha sobre a reprodução se, quando e quantas vezes engravidar, com esclarecimento sobre métodos contraceptivos disponíveis e importância do uso do preservativo masculino ou feminino. (Origem: PRT MS/GM 2068/2016, Art. 6º, XV, c)
XVI - ofertar a inserção de método contraceptivo de longa duração e alta eficácia antes da alta, caso seja escolha da mulher. (Origem: PRT MS/GM 2068/2016, Art. 6º, XVI)
Parágrafo Único. A equipe de saúde deverá conferir atenção ao estabelecimento de vínculo entre a mãe e o recém-nascido, a riscos e a vulnerabilidades particulares, bem como manter observação e escuta qualificada para esclarecer dúvidas e apoiar a mulher nesse período. (Origem: PRT MS/GM 2068/2016, Art. 6º, Parágrafo Único)
Art. 619. O Alojamento Conjunto contará com os seguintes recursos físicos: (Origem: PRT MS/GM 2068/2016, Art. 7º)
I - os quartos devem ser ambientes destinados à assistência à puérpera e ao recém-nascido com capacidade para um ou dois leitos, com banheiro anexo; (Origem: PRT MS/GM 2068/2016, Art. 7º, I)
II - as enfermarias devem ser ambientes destinados à assistência à puérpera e ao recém-nascido com capacidade para três a seis leitos, com banheiro anexo, conforme normativas vigentes da ANVISA; (Origem: PRT MS/GM 2068/2016, Art. 7º, II)
III - para cada leito materno, deve ser disponibilizado um berço para o recém-nascido e uma poltrona para acompanhante. O berço do recém-nascido deve ficar ao lado do leito da mãe e deve ser respeitada a distância mínima de um metro entre leitos ocupados; e (Origem: PRT MS/GM 2068/2016, Art. 7º, III)
IV - os quartos devem ter tamanho adequado para acomodar mulher e recém-nascido, de acordo com as normas vigentes da ANVISA. (Origem: PRT MS/GM 2068/2016, Art. 7º, IV)
Parágrafo Único. Medidas que assegurem a privacidade da mulher devem ser adotadas, assim como a observação do conforto luminoso para as puérperas os recém-nascidos e acompanhantes, quando instalados em quartos ou enfermarias com mais de um leito. (Origem: PRT MS/GM 2068/2016, Art. 7º, Parágrafo Único)
Art. 620. O serviço de saúde responsável pelo Alojamento Conjunto deverá dispor dos seguintes equipamentos, materiais e medicamentos para atendimento à mulher e ao recém-nascido: (Origem: PRT MS/GM 2068/2016, Art. 8º)
I - berço de material de fácil limpeza, desinfecção e que permita a visualização lateral; (Origem: PRT MS/GM 2068/2016, Art. 8º, I)
II - bandeja individualizada com termômetro, material de higiene e curativo umbilical; (Origem: PRT MS/GM 2068/2016, Art. 8º, II)
III - estetoscópio clínico e esfigmomanômetro; (Origem: PRT MS/GM 2068/2016, Art. 8º, III)
IV - balança; (Origem: PRT MS/GM 2068/2016, Art. 8º, IV)
V - balança para recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 8º, V)
VI - régua antropométrica e fita métrica inelástica de plástico; (Origem: PRT MS/GM 2068/2016, Art. 8º, VI)
VII - aparelho de fototerapia, um para cada 10 berços; (Origem: PRT MS/GM 2068/2016, Art. 8º, VII)
VIII - oftalmoscópio; (Origem: PRT MS/GM 2068/2016, Art. 8º, VIII)
IX - otoscópio; (Origem: PRT MS/GM 2068/2016, Art. 8º, IX)
X - aspirador com manômetro e oxigênio; (Origem: PRT MS/GM 2068/2016, Art. 8º, X)
XI - glicosímetro; (Origem: PRT MS/GM 2068/2016, Art. 8º, XI)
XII - analgésicos, anti-inflamatórios, antibióticos, anti-hipertensivos e outras medicações de uso comum no puerpério e no período neonatal; e de enfermagem, composto por desfibrilador, carro ou maleta contendo medicamentos, ressuscitador manual com reservatório, máscaras, laringoscópio completo, tubos endotraqueais, conectores, cânulas de Guedel e fio guia estéril, apropriados para adultos e recém nascidos. O carro ou maleta de emergência pode ser único para atendimento materno e ao recém-nascido. (Origem: PRT MS/GM 2068/2016, Art. 8º, XII)
Art. 621. A alta da mulher e do recém-nascido deverá ser realizada mediante elaboração de projeto terapêutico singular, considerando-se, para o tempo de alta, as necessidades individuais. (Origem: PRT MS/GM 2068/2016, Art. 9º)
Parágrafo Único. Recomenda-se a permanência mínima de 24 horas em Alojamento Conjunto, momento a partir do qual a alta pode ser considerada, desde que preenchidos os critérios abaixo listados: (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único)
I - puérpera: (i) em bom estado geral, com exame físico normal, sem sinais de infecção puerperal/sítio cirúrgico, com loquiação fisiológica; (ii) sem intercorrências mamárias como fissura, escoriação, ingurgitamento ou sinais de mastite, e orientada nas práticas de massagem circular e ordenha do leite materno; (iii) com recuperação adequada, comorbidades compensadas ou com encaminhamento assegurado para seguimento ambulatorial de acordo com as necessidades; (iv) bem orientada para continuidade dos cuidados em ambiente domiciliar e referenciada para Unidade Básica de Saúde (retorno assegurado até o 7º dia após o parto); (v) estabelecimento de vínculo entre mãe e bebê; (vi) com encaminhamento para unidade de referência para acesso a ações de saúde sexual e reprodutiva e escolha de método anticoncepcional, caso a mulher não receba alta já em uso de algum método contraceptivo, ou para seguimento pela atenção básica da prescrição ou inserção de método pela equipe da maternidade; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, I)
II - recém-nascido: (i) a termo e com peso adequado para a idade gestacional, sem comorbidades e com exame físico normal. (ii) com ausência de icterícia nas primeiras 24 horas de vida; (iii) com avaliação de icterícia, preferencialmente transcutânea, e utilização do normograma de Bhutani para avaliar a necessidade de acompanhamento dos níveis de bilirrubina quando necessário; (iv) apresentando diurese e eliminação de mecônio espontâneo e controle térmico adequado; (v) com sucção ao seio com pega e posicionamento adequados, com boa coordenação sucção/deglutição, salvo em situações em que há restrições ao aleitamento materno; (vi) em uso de substituto do leite humano/formula láctea para situações em que a amamentação é contra-indicada de acordo com atualização OMS/2009 "Razões médicas aceitáveis para uso de substitutos do leite". (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, II)
III - revisão das sorologias da mulher realizadas durante a gestação ou no momento da internação para o parto, assim como investigação de infecções congênitas no recém-nascido, conforme necessidade. Entre as sorologias, merecem destaque: sífilis, HIV, toxoplasmose e hepatite B. Outras doenças infectocontagiosas, como citomegalovírus, herpes simplex e infecções por arbovírus deverão ser investigadas se houver história sugestiva durante a gestação e/ou sinais clínicos sugestivos no recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, III)
IV - realização de tipagem sanguínea, Coombs da mãe e do recém-nascido, quando indicado; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, IV)
V - oximetria de pulso (teste do coraçãozinho) e Triagem Ocular (Teste do Reflexo Vermelho ou teste do olhinho) realizados; Triagem Auditiva (teste da orelhinha) assegurada no primeiro mês de vida e Triagem Biológica (teste do pezinho) assegurada preferencialmente entre o 3º e 5º dia de vida; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, V)
VI - avaliação e vigilância adequadas dos recém-nascidos para sepse neonatal precoce com base nos fatores de risco da mãe e de acordo com as diretrizes atuais do Ministério da Saúde para a prevenção de infecção pelo estreptococo do grupo B; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, VI)
VII - a mãe, o pai e outros cuidadores devem ter conhecimento e habilidade para dispensar cuidados adequados ao recém nascido, e reconhecer situações de risco como a ingestão inadequada de alimento, o agravamento da icterícia e eventual desidratação nos primeiros sete dias de vida; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, VII)
VIII - avaliação do serviço social para os fatores de risco psíquicos, sociais e ambientais, como o uso de drogas ilícitas, alcoolismo, tabagismo, antecedentes de negligência, violência doméstica, doença mental, doenças transmissíveis e situações de vulnerabilidade social; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, VIII)
IX - agenda com a Atenção Básica, o retorno da mulher e do recém-nascido entre o terceiro e o quinto dia de vida (5º Dia de Saúde Integral); e (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, IX)
X - preenchimento de todos os dados na Caderneta da Gestante e na Caderneta de Saúde da Criança. (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, X)
Art. 622. No momento da alta, a equipe multiprofissional fornecerá à mulher as seguintes orientações: (Origem: PRT MS/GM 2068/2016, Art. 10)
I - procurar a Unidade Básica de Saúde ou o pronto-atendimento caso a mulher apresente sinais de infecção (febre, secreção purulenta vaginal, por ferida operatória ou nas mamas), sangramento com odor fétido ou com volume aumentado, edema assimétrico de extremidades, dor refratária a analgésicos, sofrimento emocional, astenia exacerbada ou outros desconfortos; (Origem: PRT MS/GM 2068/2016, Art. 10, I)
II - procurar a Unidade Básica de Saúde se o recém-nascido apresentar problemas com aleitamento materno, icterícia ou qualquer outra alteração; (Origem: PRT MS/GM 2068/2016, Art. 10, II)
III - em caso de intercorrências com as mamas, os Bancos de Leite Humano poderão oferecer a assistência referente às boas práticas da amamentação, e orientações sobre a doação de leite humano; (Origem: PRT MS/GM 2068/2016, Art. 10, III)
IV - realizar vacinação conforme calendário vacinal; (Origem: PRT MS/GM 2068/2016, Art. 10, IV)
V - higienizar as mãos antes e após o cuidado com o recém nascido; (Origem: PRT MS/GM 2068/2016, Art. 10, V)
VI - evitar ambientes aglomerados ou com pessoas apresentando sinais e sintomas de doenças infectocontagiosas, como gripe e resfriado; (Origem: PRT MS/GM 2068/2016, Art. 10, VI)
VII - prevenir a morte súbita do recém-nascido por meio dos seguintes cuidados: deixar a criança em posição supina, manter a amamentação ao seio e evitar o tabagismo materno ou outra forma de exposição da criança ao fumo; (Origem: PRT MS/GM 2068/2016, Art. 10, VII)
VIII - transportar o recém-nascido de forma segura e prevenir acidentes domésticos; e (Origem: PRT MS/GM 2068/2016, Art. 10, VIII)
IX - para crianças filhos de mães cuja amamentação é contraindicada de acordo com razões médicas aceitáveis/OMS/2009, orientar o preparo correto da formula láctea e higienização dos utensílios utilizados para preparo e oferta desse alimento. (Origem: PRT MS/GM 2068/2016, Art. 10, IX)
CAPÍTULO VII
DO CONTROLE DA DOR E CUIDADOS PALIATIVOS
Seção I
Da Câmara Técnica em Controle da Dor e Cuidados Paliativos
Art. 623. Fica instituída a Câmara Técnica em Controle da Dor e Cuidados Paliativos, com a seguinte composição: (Origem: PRT MS/GM 3150/2006, Art. 1º)
I - três representantes da Secretaria de Atenção à Saúde - SAS/MS; (Origem: PRT MS/GM 3150/2006, Art. 1º, I)
II - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde - SGTES/MS; (Origem: PRT MS/GM 3150/2006, Art. 1º, II)
III - um representante do Instituto Nacional de Câncer - INCA/MS; (Origem: PRT MS/GM 3150/2006, Art. 1º, III)
IV - um representante da Sociedade Brasileira para o Estudo da Dor - SBED; (Origem: PRT MS/GM 3150/2006, Art. 1º, IV)
V - um representante da Academia Nacional de Cuidados Paliativos - ANCP; (Origem: PRT MS/GM 3150/2006, Art. 1º, V)
VI - um representante da Sociedade Brasileira de Anestesiologia - SBA; (Origem: PRT MS/GM 3150/2006, Art. 1º, VI)
VII - um representante da Sociedade Brasileira de Neurocirurgia - SBN; (Origem: PRT MS/GM 3150/2006, Art. 1º, VII)
VIII - um representante do Conselho Nacional de Secretários de Saúde - CONASS; e (Origem: PRT MS/GM 3150/2006, Art. 1º, VIII)
IX - um representante do Conselho Nacional de Secretários Municipais de Saúde - CONASEMS. (Origem: PRT MS/GM 3150/2006, Art. 1º, IX)
§ 1º Os representantes acima mencionados deverão ser formalmente indicados pelas respectivas instituições, devendo a indicação ser renovada anualmente. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 1º)
§ 2º A Câmara Técnica em Controle da Dor e Cuidados Paliativos será coordenada pela Secretaria de Atenção à Saúde - SAS/MS. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 2º)
§ 3º A Câmara Técnica em Controle da Dor e Cuidados Paliativos, quando julgar necessário, poderá convidar participantes ad hoc, sempre de caráter institucional, interno ou externo ao Ministério da Saúde, nas áreas correlacionadas. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 3º)
§ 4º À Câmara Técnica em Controle da Dor e Cuidados Paliativos cabe pronunciar-se sobre: (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º)
I - as diretrizes nacionais sobre controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, a)
II - as ações de controle da dor e cuidados paliativos, levadas a cabo no âmbito coletivo ou individual na assistência pública; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, b)
III - as recomendações para o desenvolvimento dessas ações nas entidades públicas e privadas que integram o SUS e, quando solicitado, o sistema de saúde suplementar; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, c)
IV - a atualização das normas e procedimentos do SUS referentes ao controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, d)
V - a incorporação tecnológica para ações de controle da dor e cuidados paliativos, encaminhando parecer para a Comissão para Incorporação de Tecnologias do Ministério da Saúde - CITEC; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, e)
VI - projetos de incentivo para ações de controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, f)
VII - a estruturação de redes de atenção na área de controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, g)
VIII - a formação e qualificação de profissionais para atuação em controle da dor e cuidados paliativos; e (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, h)
IX - a avaliação de estudos e pesquisas na área de controle da dor e cuidados paliativos. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, i)
Art. 624. A Secretaria de Atenção à Saúde tomará as providências cabíveis para a operacionalização dos trabalhos da referida Câmara. (Origem: PRT MS/GM 3150/2006, Art. 2º)
Seção II
Dos Centros de Referência em Tratamento da Dor Crônica
Art. 625. Ficam criados, no âmbito do Sistema Único de Saúde, os Centros de Referência em Tratamento da Dor Crônica. (Origem: PRT MS/GM 1319/2002, Art. 1º)
Parágrafo Único. Entende-se por Centros de Referência em Tratamento da Dor Crônica aqueles hospitais cadastrados pela Secretaria de Atenção à Saúde como Centro de Alta Complexidade em Oncologia de Tipo I, II ou III e ainda aqueles hospitais gerais que, devidamente cadastrados como tal, disponham de ambulatório para tratamento da dor crônica e de condições técnicas, instalações físicas, equipamentos e recursos humanos específicos e adequados para a prestação de assistência aos portadores de dor crônica de forma integral e integrada e tenham capacidade de se constituir em referência para a rede assistencial do estado na área de tratamento da dor crônica. (Origem: PRT MS/GM 1319/2002, Art. 1º, Parágrafo Único)
Art. 626. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema Municipal de Saúde, de acordo com as respectivas condições de gestão e a divisão de responsabilidades definida na regulamentação, adotarão as providências necessárias à implantação/organização/habilitação e cadastramento dos Centros de Referência em Tratamento da Dor Crônica. (Origem: PRT MS/GM 1319/2002, Art. 2º)
Art. 627. Na definição dos quantitativos e distribuição geográfica dos Centros de Referência de que trata o art. 625, as Secretarias de Saúde dos estados e do Distrito Federal utilizarão os seguintes critérios: (Origem: PRT MS/GM 1319/2002, Art. 3º)
I - população; (Origem: PRT MS/GM 1319/2002, Art. 3º, a)
II - necessidades de cobertura assistencial; (Origem: PRT MS/GM 1319/2002, Art. 3º, b)
III - mecanismos de acesso e fluxos de referência e contra-referência; (Origem: PRT MS/GM 1319/2002, Art. 3º, c)
IV - nível de complexidade dos serviços; (Origem: PRT MS/GM 1319/2002, Art. 3º, d)
V - distribuição geográfica dos serviços; e (Origem: PRT MS/GM 1319/2002, Art. 3º, e)
VI - integração com a rede de atenção básica e programa de saúde da família. (Origem: PRT MS/GM 1319/2002, Art. 3º, f)
§ 1º O quantitativo máximo de Centros de Referência em Tratamento da Dor Crônica, por estado, encontra-se definido no Anexo LXXXV ; (Origem: PRT MS/GM 1319/2002, Art. 3º, § 1º)
§ 2º A este quantitativo agregam-se os Centros de Alta Complexidade em Oncologia já cadastrados ou a serem cadastrados pela Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1319/2002, Art. 3º, § 2º)
Art. 628. A Secretaria de Atenção à Saúde definirá as Normas de Cadastramento de Centros de Referência em Tratamento da Dor Crônica, bem como adotará as providências necessárias ao fiel cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1319/2002, Art. 4º)
Art. 629. Serão automaticamente cadastrados como Centros de Referência em Tratamento da Dor Crônica aqueles hospitais que venham a ser cadastrados como Centro de Alta Complexidade em Oncologia (CACON) pela Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1319/2002, Art. 5º, Parágrafo Único)
CAPÍTULO VIII
DA PROGRAMAÇÃO PACTUADA E INTEGRADA DA ASSISTÊNCIA EM SAÚDE
Art. 630. A Programação Pactuada e Integrada da Assistência em Saúde seja um processo instituído no âmbito do Sistema Único de Saúde (SUS) onde, em consonância com o processo de planejamento, são definidas e quantificadas as ações de saúde para a população residente em cada território, bem como efetuados os pactos intergestores para garantia de acesso da população aos serviços de saúde. (Origem: PRT MS/GM 1097/2006, Art. 1º)
Parágrafo Único. A Programação Pactuada e Integrada da Assistência em Saúde tem por objetivo organizar a rede de serviços, dando transparência aos fluxos estabelecidos, e definir, a partir de critérios e parâmetros pactuados, os limites financeiros destinados à assistência da população própria e das referências recebidas de outros municípios. (Origem: PRT MS/GM 1097/2006, Art. 1º, Parágrafo Único)
Art. 631. A Programação Pactuada e Integrada da Assistência em Saúde orientar-se-á pelo Manual de "Diretrizes para a Programação Pactuada e Integrada da Assistência em Saúde", a ser disponibilizado pelo Ministério da Saúde. (Origem: PRT MS/GM 1097/2006, Art. 2º)
Art. 632. Os objetivos gerais do processo de Programação Pactuada e Integrada da Assistência em Saúde são: (Origem: PRT MS/GM 1097/2006, Art. 3º)
I - buscar a equidade de acesso da população brasileira às ações e aos serviços de saúde em todos os níveis de complexidade; (Origem: PRT MS/GM 1097/2006, Art. 3º, I)
II - orientar a alocação dos recursos financeiros de custeio da assistência à saúde pela lógica de atendimento às necessidades de saúde da população; (Origem: PRT MS/GM 1097/2006, Art. 3º, II)
III - definir os limites financeiros federais para a assistência de média e alta complexidade de todos os municípios, compostos por parcela destinada ao atendimento da população do próprio município em seu território e pela parcela correspondente à programação das referências recebidas de outros municípios; (Origem: PRT MS/GM 1097/2006, Art. 3º, III)
IV - possibilitar a visualização da parcela dos recursos federais, estaduais e municipais, destinados ao custeio de ações de assistência à saúde; (Origem: PRT MS/GM 1097/2006, Art. 3º, IV)
V - fornecer subsídios para os processos de regulação do acesso aos serviços de saúde; (Origem: PRT MS/GM 1097/2006, Art. 3º, V)
VI - contribuir na organização das redes de serviços de saúde; e (Origem: PRT MS/GM 1097/2006, Art. 3º, VI)
VII - possibilitar a transparência dos pactos intergestores resultantes do processo de Programação Pactuada e Integrada da Assistência e assegurar que estejam explicitados no "Termo Compromisso para Garantia de Acesso", conforme Anexo LVI . (Origem: PRT MS/GM 1097/2006, Art. 3º, VII)
§ 1º O Termo de Compromisso para Garantia de Acesso, de que trata o art. 632, VII, é o documento que, com base no processo de Programação Pactuada e Integrada, deve conter as metas físicas e orçamentárias das ações a serem ofertadas nos municípios de referência, que assumem o compromisso de atender aos encaminhamentos acordados entre os gestores para atendimento da população residente em outros municípios. (Origem: PRT MS/GM 1097/2006, Art. 3º, § 1º)
§ 2º O Termo de Compromisso para Garantia de Acesso entre municípios de uma mesma Unidade Federada deve ser aprovado na respectiva Comissão Intergestores Bipartite - CIB. (Origem: PRT MS/GM 1097/2006, Art. 3º, § 2º)
§ 3º O Termo de Compromisso para Garantia de Acesso interestadual deve ser aprovado nas Comissões Intergestores Bipartite dos Estados envolvidos. (Origem: PRT MS/GM 1097/2006, Art. 3º, § 3º)
Art. 633. Os pressupostos gerais que deverão nortear a Programação Pactuada e Integrada (PPI) da Assistência são os seguintes: (Origem: PRT MS/GM 1097/2006, Art. 4º)
I - integrar o processo geral de planejamento em saúde de cada Estado e município, de forma ascendente, coerente com os Planos de Saúde em cada esfera de gestão; (Origem: PRT MS/GM 1097/2006, Art. 4º, I)
II - orientar-se pelo diagnóstico dos principais problemas de saúde, como base para a definição das prioridades; (Origem: PRT MS/GM 1097/2006, Art. 4º, II)
III - ser coordenado pelo gestor estadual com seus métodos, processos e resultados aprovados pela Comissão Intergestores Bipartite. (CIB), em cada unidade federada; e (Origem: PRT MS/GM 1097/2006, Art. 4º, III)
IV - estar em consonância com o processo de construção da regionalização. (Origem: PRT MS/GM 1097/2006, Art. 4º, IV)
Art. 634. Os eixos orientadores do processo de Programação Pactuada e Integrada (PPI) da assistência são os seguintes: (Origem: PRT MS/GM 1097/2006, Art. 5º)
I - Centralidade da Atenção Básica - a programação da assistência deve partir das ações básicas em saúde, para compor o rol de ações de maior complexidade tecnológica, estabelecendo os patamares mínimos de demanda orientada pelos problemas e estratégias da atenção básica, não apenas na sua dimensão assistencial, como também na de promoção e prevenção; (Origem: PRT MS/GM 1097/2006, Art. 5º, I)
II - Conformação das Aberturas Programáticas: (Origem: PRT MS/GM 1097/2006, Art. 5º, II)
a) a programação da atenção básica e da média complexidade ambulatorial deve partir de áreas estratégicas; (Origem: PRT MS/GM 1097/2006, Art. 5º, II, a)
b) a programação das ações ambulatoriais que não estão organizadas por áreas estratégicas deve ser orientada pela estrutura da Tabela de Procedimentos, com flexibilidade no seu nível de agregação, permitindo, inclusive, a programação de procedimentos que não estão previstos na tabela; (Origem: PRT MS/GM 1097/2006, Art. 5º, II, b)
c) a programação hospitalar deve ser orientada pelas clínicas de acordo com a distribuição de leitos do Cadastro Nacional de Estabelecimentos de Saúde (CNES); e (Origem: PRT MS/GM 1097/2006, Art. 5º, II, c)
d) os procedimentos financiados pelo Fundo de Ações Estratégicas e Compensação (FAEC) devem ser programados de acordo com as aberturas programáticas definidas, bem como as ações executadas pelos serviços financiados por valores globais; (Origem: PRT MS/GM 1097/2006, Art. 5º, II, d)
III - Parâmetros para Programação de Ações de Saúde: (Origem: PRT MS/GM 1097/2006, Art. 5º, III)
a) a programação das ações de atenção básica e média complexidade ambulatorial serão orientadas a partir de parâmetros de concentração e cobertura populacional, sugeridos pelo Ministério da Saúde, conforme portaria específica a ser publicada; (Origem: PRT MS/GM 1097/2006, Art. 5º, III, a)
b) a programação das ações de alta complexidade dar-se-á, conforme parâmetros já definidos para a estruturação das redes de serviços de alta complexidade; (Origem: PRT MS/GM 1097/2006, Art. 5º, III, b)
IV - Integração das Programações - os agravos de relevância para a Vigilância em Saúde serão incorporados nas áreas estratégicas previstas na PPI da Assistência, considerando as metas traçadas anualmente na PPI da Vigilância em Saúde; (Origem: PRT MS/GM 1097/2006, Art. 5º, IV)
V - Composição das Fontes de Recursos Financeiros a serem Programados - visualização da parcela dos recursos federais, estaduais e municipais, destinados ao custeio de ações de assistência à saúde; e (Origem: PRT MS/GM 1097/2006, Art. 5º, V)
VI - Processo de Programação e Relação Intergestores - definição das seguintes etapas no processo de programação: (Origem: PRT MS/GM 1097/2006, Art. 5º, VI)
a) Etapa Preliminar de Programação; (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, a)
b) Programação Municipal; (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, b)
c) Pactuação Regional; e (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, c)
d) Consolidação da PPI Estadual. (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, d)
§ 1º Quando necessário, será realizada a programação interestadual, com a participação dos Estados e dos municípios envolvidos, com mediação do gestor federal e aprovação nas respectivas Comissões Intergestores Bipartite, mantendo consonância com o processo de construção da regionalização. (Origem: PRT MS/GM 1097/2006, Art. 5º, § 1º)
§ 2º A programação de estados, de municípios e do Distrito Federal deve ser refletida na programação dos estabelecimentos de saúde sob sua gestão. (Origem: PRT MS/GM 1097/2006, Art. 5º, § 2º)
§ 3º Dar flexibilidade aos gestores estaduais e municipais na definição de parâmetros e prioridades que irão orientar a programação, respeitando as pactuações nas Comissões Intergestores Bipartite (CIB) e na Comissão Intergestores Tripartite (CIT); (Origem: PRT MS/GM 1097/2006, Art. 5º, § 3º)
Art. 635. A programação nas regiões de fronteiras internacionais deve respeitar o Sistema Integrado de Saúde nas Fronteiras (SIS Fronteiras), instituído pela Portaria nº 1.120/GM, de 6 de julho de 2005. (Origem: PRT MS/GM 1097/2006, Art. 6º)
Art. 636. A Programação Pactuada e Integrada deve ser realizada no mínimo a cada gestão estadual, respeitando as pactuações nas Comissões Intergestores Bipartite, e revisada periodicamente, sempre que necessário, em decorrência de alterações de fluxo no atendimento ao usuário, de oferta de serviços, na tabela de procedimentos, nos limites financeiros, entre outras. (Origem: PRT MS/GM 1097/2006, Art. 7º)
Parágrafo Único. Estabelecer que no início da gestão municipal seja efetuada uma revisão da PPI estadual para face dos novos Planos Municipais de Saúde. (Origem: PRT MS/GM 1097/2006, Art. 7º, Parágrafo Único)
Art. 637. Ao final do processo de Programação Pactuada e Integrada da Assistência, a Secretaria de Estado da Saúde e do Distrito Federal encaminhará à Secretaria de Atenção à Saúde, do Ministério da Saúde, a seguinte documentação acompanhada de ofício devidamente assinado pelos Coordenadores Estadual e Municipal da CIB: (Origem: PRT MS/GM 1097/2006, Art. 8º)
I - cópia da resolução CIB que aprova a nova programação; (Origem: PRT MS/GM 1097/2006, Art. 8º, I)
II - quadros com os Limites Financeiros da Assistência de Média e Alta Complexidade, conforme Anexo LVII , devidamente assinados pelos Coordenadores Estadual e Municipal da CIB; (Origem: PRT MS/GM 1097/2006, Art. 8º, II)
III - quadro síntese dos critérios e parâmetros adotados; e (Origem: PRT MS/GM 1097/2006, Art. 8º, III)
IV - memória dos pactos municipais realizados com explicitação das metas físicas e financeiras. (Origem: PRT MS/GM 1097/2006, Art. 8º, IV)
§ 1º As Secretarias de Saúde dos Estados e do Distrito Federal podem dispor de instrumentos próprios de programação, respeitando os padrões estabelecidos por este Capítulo. (Origem: PRT MS/GM 1097/2006, Art. 8º, § 1º)
§ 2º Os incisos III e IV deste artigo podem ser substituídos pelo envio da base do sistema informatizado do Ministério da Saúde, para os Estados que optarem pela sua utilização. (Origem: PRT MS/GM 1097/2006, Art. 8º, § 2º)
Art. 638. Alterações periódicas físicas e/ou financeiras que repercutam em modificações nos Limites Financeiros da Assistência de Média e Alta Complexidade Ambulatorial e Hospitalar dos estados, dos municípios e do Distrito Federal, serão aprovadas pelas respectivas Comissões Intergestores Bipartite (CIB) e encaminhadas à Secretaria de Atenção à Saúde, pela Secretaria de Estado da Saúde e do Distrito Federal, mediante ofício devidamente assinado pelos Coordenadores Estadual e Municipal da CIB, acompanhado da seguinte documentação: (Origem: PRT MS/GM 1097/2006, Art. 9º) (com redação dada pela PRT MS/GM 1699/2011)
I - cópia da Resolução da CIB que altera o(s) limite(s) financeiro(s), justificando e explicitando os valores anuais do Estado e dos Municípios envolvidos; e (Origem: PRT MS/GM 1097/2006, Art. 9º, I)
II - quadros com os Limites Financeiros da Assistência de Média e Alta Complexidade conforme o Anexo LVII , devidamente assinados pelos Coordenadores Estadual e Municipal da CIB. (Origem: PRT MS/GM 1097/2006, Art. 9º, II)
Parágrafo Único. Deve ser anexada à resolução da CIB, memória das alterações realizadas explicitando quantitativos físicos e financeiros. (Origem: PRT MS/GM 1097/2006, Art. 9º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 1699/2011)
Art. 639. Os documentos discriminados nos incisos dos arts. 637 e 638 deverão ser postados à Secretaria de Atenção à Saúde, até o dia 25 do mês anterior à competência em que vigorará o novo limite financeiro de Média e Alta Complexidade (MAC). (Origem: PRT MS/GM 1097/2006, Art. 10)
Parágrafo Único. Os quadros referentes Anexo LVII também deverão ser encaminhados em meio magnético à Secretaria de Atenção à Saúde, Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS), por meio do endereço eletrônico ppiassistencial@saude.gov.br, até o dia 25 do mês anterior à competência em que vigorará o novo limite financeiro MAC. (Origem: PRT MS/GM 1097/2006, Art. 10, Parágrafo Único)
Art. 640. Compete à Secretaria de Atenção à Saúde, por intermédio do Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS), a conferência e a validação da documentação encaminhada pelos Estados e o Distrito Federal, bem como a devida orientação às Secretarias Estaduais quanto ao seu correto preenchimento. (Origem: PRT MS/GM 1097/2006, Art. 11)
Art. 641. As alterações de limites financeiros, cumpridos os trâmites e prazos estabelecidos neste Capítulo, entrerão em vigor a partir da competência subsequente ao envio da documentação pela CIB, por intermédio de portaria da Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1097/2006, Art. 12)
§ 1º Quando ocorrerem erros no preenchimento da documentação, o Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS) deverá comunicar à CIB, viabilizando um prazo para regularização pela SES, não superior a cinco dias úteis, objetivando que a vigência da publicação não seja prejudicada. (Origem: PRT MS/GM 1097/2006, Art. 12, § 1º)
§ 2º Não serão realizadas alterações de limites financeiros, com efeitos retroativos em relação ao prazo estabelecido no art. 639, excetuando os casos excepcionais, devidamente justificados. (Origem: PRT MS/GM 1097/2006, Art. 12, § 2º)
§ 3º Os casos excepcionais deverão ser enviados à Secretaria de Atenção à Saúde (SAS/MS), com as devidas justificativas pela CIB Estadual e estarão condicionados à aprovação do Secretário de Atenção à Saúde, para posterior processamento pelo Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS). (Origem: PRT MS/GM 1097/2006, Art. 12, § 3º)
§ 4º As mudanças operacionais/gerenciais, em relação aos limites financeiros, adotadas por Secretarias Estaduais e/ou Municipais de Saúde ou ainda por Comissões Intergestores Bipartite, antes da vigência da publicação de portaria da SAS/MS, serão de exclusiva responsabilidade do gestor do SUS que as adotar. (Origem: PRT MS/GM 1097/2006, Art. 12, § 4º)
§ 5º Nas situações em que não houver acordo na Comissão Intergestores Bipartite, vale o disposto no regulamento do Pacto de Gestão, publicado pela Portaria nº 699/GM, de 30 de março de 2006. (Origem: PRT MS/GM 1097/2006, Art. 12, § 5º)
Art. 642. A Secretaria de Atenção à Saúde/MS adotará as medidas necessárias à publicação de portaria com Parâmetros para Programação de Ações de Assistência à Saúde. (Origem: PRT MS/GM 1097/2006, Art. 13)
TÍTULO V
DA ATENÇÃO A AGRAVOS ESPECÍFICOS
CAPÍTULO I
DO PROGRAMA SOS EMERGÊNCIAS NO ÂMBITO DA REDE DE ATENÇÃO ÀS URGÊNCIAS E EMERGÊNCIAS (RUE)
Art. 643. Este Capítulo dispõe sobre o Programa SOS Emergência, no âmbito da Rede de Atenção às Urgências e Emergências (RUE). (Origem: PRT MS/GM 1663/2012, Art. 1º)
Parágrafo Único. O Programa SOS Emergências é uma ação estratégia prioritária para a implementação do Componente Hospitalar da RUE, realizada em conjunto com os Estados, Distrito Federal e Municípios para a qualificação da gestão e do atendimento de usuários do Sistema Único de Saúde (SUS) nas maiores e mais complexas Portas de Entrada Hospitalares de Urgência do SUS. (Origem: PRT MS/GM 1663/2012, Art. 1º, Parágrafo Único)
Seção I
DOS OBJETIVOS E REQUISITOS PARA PARTICIPAÇÃO
(Origem: PRT MS/GM 1663/2012, CAPÍTULO I)
Art. 644. São objetivos do Programa SOS Emergências: (Origem: PRT MS/GM 1663/2012, Art. 2º)
I - estimular a organização e a implantação da RUE, buscando um pacto cooperativo entre as instâncias de gestão do SUS para garantir os investimentos e recursos necessários a esta mudança de modelo de atenção nos grandes prontos-socorros dos estabelecimentos hospitalares integrados ao SUS; (Origem: PRT MS/GM 1663/2012, Art. 2º, I)
II - intervir de forma mais organizada, ágil e efetiva sobre a oferta do cuidado nas grandes emergências hospitalares do SUS; (Origem: PRT MS/GM 1663/2012, Art. 2º, II)
III - assessorar tecnicamente a equipe do hospital participante do Programa e oferecer capacitação para aprimoramento da gestão do cuidado ao paciente em situação de urgência e emergência; (Origem: PRT MS/GM 1663/2012, Art. 2º, III)
IV - apoiar as unidades hospitalares para a melhoria da gestão e da qualidade assistencial, por meio da implantação de dispositivos como a classificação de risco, gestão de leitos, implantação de protocolos clínico-assistenciais e administrativos, adequação da estrutura e ambiência hospitalar, regulação e articulação com o sistema de saúde; e (Origem: PRT MS/GM 1663/2012, Art. 2º, IV)
V - possibilitar a readequação física e tecnológica dos serviços de urgência e emergência da unidade hospitalar. (Origem: PRT MS/GM 1663/2012, Art. 2º, V)
Art. 645. O Programa SOS Emergências será integrado por Portas de Entradas Hospitalares de Urgência selecionadas pelo Ministério da Saúde, em conjunto com as Secretarias de Saúde estaduais, distrital e municipais. (Origem: PRT MS/GM 1663/2012, Art. 3º)
Parágrafo Único. Serão consideradas Portas de Entradas Hospitalares de Urgência prioritárias para o Programa SOS Emergências aquelas que cumprirem os seguintes requisitos: (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único)
I - ser referência regional, realizando no mínimo dez por cento dos atendimentos aos usuários do SUS em situação de urgência e emergência oriundos de outros Municípios, conforme registro no Sistema de Informação Hospitalar (SIH/SUS); (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, I)
II - ter, no mínimo, cem leitos cadastrados no Sistema de Cadastro Nacional de Estabelecimentos (SCNES); (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, II)
III - estar habilitada em pelo menos uma das seguintes linhas de cuidado: (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III)
a) cardiovascular; (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, a)
b) neurologia/neurocirurgia; (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, b)
c) traumato-ortopedia; ou (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, c)
d) ser referência em pediatria; (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, d)
IV - ter maior volume de produção de procedimentos ambulatoriais e de internação, conforme registro no SIH/SUS e no Sistema de Informação Ambulatorial (SIA/SUS), ou outro(s) que vierem a substituí-lo(s); e (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, IV)
V - ter a aprovação do(s) gestor(es) estadual(is), municipal(is), distrital de saúde e do Ministério da Saúde, de acordo com o território abrangido pelo referenciamento dos usuários do SUS em situação de urgência e emergência para ingresso do estabelecimento hospitalar no Programa. (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, V)
Art. 646. O estabelecimento hospitalar selecionado para o Programa SOS Emergências deverá se adequar aos critérios de qualificação dispostos no art. 861 da Portaria de Consolidação nº 6, e cumprir as seguintes exigências: (Origem: PRT MS/GM 1663/2012, Art. 4º)
I - construir processo seguro e qualificado de gestão das emergências por meio da criação do Núcleo de Acesso e Qualidade Hospitalar (NAQH), observado o disposto nos arts. 35 e 36 do Anexo III da Portaria de Consolidação nº 3; (Origem: PRT MS/GM 1663/2012, Art. 4º, I)
II - elaborar o diagnóstico situacional acerca do papel do estabelecimento hospitalar na Região de Saúde, com análise dos processos internos de trabalho e da gestão interna; (Origem: PRT MS/GM 1663/2012, Art. 4º, II)
III - elaborar o plano de ação para melhoria do acesso e qualidade assistencial; (Origem: PRT MS/GM 1663/2012, Art. 4º, III)
IV - monitorar e avaliar os produtos e resultados das ações previstas no plano de ação; (Origem: PRT MS/GM 1663/2012, Art. 4º, IV)
V - criar mecanismos seguros de gestão do acesso pelo risco por meio da implantação do Acolhimento e Classificação de Risco (ACCR); (Origem: PRT MS/GM 1663/2012, Art. 4º, V)
VI - implantar programa de qualificação dos profissionais para atendimento ao paciente em situação de urgência e emergência; (Origem: PRT MS/GM 1663/2012, Art. 4º, VI)
VII - instituir espaços de discussão coletiva com os trabalhadores; (Origem: PRT MS/GM 1663/2012, Art. 4º, VII)
VIII - induzir melhorias no gerenciamento da Unidade de Emergência por meio da readequação e/ou implantação de sistemas de gestão hospitalar para o monitoramento contínuo da qualidade assistencial; (Origem: PRT MS/GM 1663/2012, Art. 4º, VIII)
IX - participar, por meio de representantes do NAQH, da construção do Plano Regional da Rede de Atenção às Urgências do seu território; e (Origem: PRT MS/GM 1663/2012, Art. 4º, IX)
X - atuar de forma conjunta desenvolvendo estratégias que envolvam a articulação e integração do estabelecimento hospitalar ao SUS e suas redes de atenção. (Origem: PRT MS/GM 1663/2012, Art. 4º, X)
Art. 647. Para o cumprimento das exigências dispostas no art. 646, o estabelecimento hospitalar selecionado para o Programa SOS Emergências contará com o apoio técnico do Ministério da Saúde, por meio do Departamento de Atenção Especializada e Temática (DAET/SAS/MS), com o objetivo de fornecer apoio local à equipe do NAQH e de direção do hospital, com vistas: (Origem: PRT MS/GM 1663/2012, Art. 5º)
I - ao desenvolvimento de atividades cotidianas relativas à atenção às urgências no ambiente hospitalar; (Origem: PRT MS/GM 1663/2012, Art. 5º, I)
II - à qualificação da gestão hospitalar; e (Origem: PRT MS/GM 1663/2012, Art. 5º, II)
III - à sua integração à Rede de Atenção à Saúde. (Origem: PRT MS/GM 1663/2012, Art. 5º, III)
Art. 648. O Ministério da Saúde, por meio do Programa de Apoio ao Desenvolvimento Institucional do SUS (PROADI-SUS), promoverá a capacitação e formação dos profissionais das instituições hospitalares selecionadas para o Programa SOS Emergências na área de Urgência e Emergência, além de participar na oferta de tecnologias oferecendo a estrutura necessária para o seu desenvolvimento e para a qualificação do cuidado e da gestão. (Origem: PRT MS/GM 1663/2012, Art. 6º)
Seção II
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 1663/2012, CAPÍTULO III)
Art. 649. O Programa SOS Emergências será monitorado e acompanhado pelo DAET/SAS/MS, com o apoio do Comitê Nacional de Apoio e Acompanhamento do Programa SOS Emergências, instituído por meio do Termo de Cooperação Técnica nº 12/2011, de 8 de novembro de 2011, publicado no Diário Oficial da União do dia 10 de novembro de 2011, Seção 3, p. 132. (Origem: PRT MS/GM 1663/2012, Art. 13)
CAPÍTULO II
DO PROGRAMA DE ASSISTÊNCIA VENTILATÓRIA NÃO INVASIVA AOS PORTADORES DE DOENÇAS NEUROMUSCULARES
Art. 650. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa de Assistência Ventilatória Não Invasiva aos Portadores de Doenças Neuromusculares. (Origem: PRT MS/GM 1370/2008, Art. 1º)
§ 1º O Programa ora instituído tem por objetivo melhorar a atenção à saúde dos portadores de doenças neuromusculares, adotar medidas que permitam retardar a perda da função vital destes pacientes ou mesmo evitá-la, promover a melhoria da sua qualidade e expectativa de vida e, ainda, ampliar o acesso à ventilação nasal intermitente de pressão positiva quando a mesma estiver indicada. (Origem: PRT MS/GM 1370/2008, Art. 1º, § 1º)
§ 2º O rol das doenças neuromusculares a ser contemplado pelo Programa será definido, em ato próprio, pela Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1370/2008, Art. 1º, § 2º)
§ 3º Pelo seu escopo restrito à distrofia muscular progressiva, fica extinto o Programa de Assistência Ventilatória Não Invasiva aos Pacientes Portadores de Distrofia Muscular Progressiva instituído pela Portaria nº 1.531/GM, de 4 de setembro de 2001. (Origem: PRT MS/GM 1370/2008, Art. 1º, § 3º)
Art. 651. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema adotarão as medidas necessárias à organização e implantação do Programa de Assistência Ventilatória Não Invasiva aos Portadores de Doenças Neuromusculares ora instituído. (Origem: PRT MS/GM 1370/2008, Art. 2º)
Art. 652. A Secretaria de Atenção à Saúde (SAS/MS) estabelecerá os critérios técnicos para a implantação do Programa, o rol de doenças a serem contempladas, bem como adotará as medidas necessárias ao fiel cumprimento do disposto neste Capítulo. (Origem: PRT MS/GM 1370/2008, Art. 3º)
CAPÍTULO III
DO PROJETO DE ESTRUTURAÇÃO E QUALIFICAÇÃO DOS SERVIÇOS EXISTENTES DE ORTOPEDIA, TRAUMATOLOGIA E REABILITAÇÃO PÓS-OPERATÓRIA (PROJETO SUPORTE)
Art. 653. Fica criado o Projeto de Estruturação e Qualificação dos Serviços Existentes de Ortopedia, Traumatologia e Reabilitação Pós-Operatória no Sistema Único de Saúde (PROJETO SUPORTE). (Origem: PRT MS/GM 401/2005, Art. 1º)
Parágrafo Único. O objetivo do Projeto é promover a estruturação de serviços de tráumato-ortopedia e de reabilitação pós-operatória, por meio do apoio técnico e financeiro às Secretarias Estaduais e às Municipais de Saúde na implantação e implementação de serviços de ortopedia, traumatologia e reabilitação pós-operatória de média e alta complexidade, prioritariamente nas regiões com baixa capacidade de oferta e de produção nas referidas especialidades. (Origem: PRT MS/GM 401/2005, Art. 1º, Parágrafo Único)
Art. 654. As ações serão desenvolvidas de forma integrada e pactuada entre os gestores do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 401/2005, Art. 2º)
Art. 655. As parcerias entre o Ministério da Saúde e as Secretarias Estaduais e as Municipais serão firmadas por instrumento legal específico. (Origem: PRT MS/GM 401/2005, Art. 3º)
Art. 656. Caberá ao Ministério da Saúde, representado pelo Instituto Nacional de Tráumato-Ortopedia (INTO), na medida das disponibilidades materiais e financeiro-orçamentária, a assessoria e execução do Projeto SUPORTE para: (Origem: PRT MS/GM 401/2005, Art. 4º)
I - apoiar a organização da rede de atenção em tráumato-ortopedia e reabilitação de forma hierarquizada, contemplando os três níveis de atenção, e fomentar a sua estruturação, de acordo com os princípios do SUS; (Origem: PRT MS/GM 401/2005, Art. 4º, I)
II - elaborar protocolos operacionais de referência e contrareferência e protocolos técnicos de procedimentos; (Origem: PRT MS/GM 401/2005, Art. 4º, II)
III - realizar diagnóstico da oferta de serviços, que inclui instalações físicas, equipamentos e profissionais de saúde; (Origem: PRT MS/GM 401/2005, Art. 4º, III)
IV - realizar diagnóstico da demanda e dos serviços prestados, a partir da avaliação da fila de Tratamento Fora de Domicílio (TFD), dos dados disponíveis na Central Nacional de Regulação de Alta Complexidade (CNRAC) e de outros instrumentos congêneres, bem como da produção ambulatorial e hospitalar registrada no SIA/SUS e no SIH/SUS; (Origem: PRT MS/GM 401/2005, Art. 4º, IV)
V - apoiar financeiramente a estruturação dos serviços de tráumato-ortopedia e de reabilitação pós-operatória, na aquisição de equipamentos hospitalares e insumos especializados para realização de cirurgias ortopédicas, que serão disponibilizados aos Estados e aos Municípios por meio de instrumento legal próprio; (Origem: PRT MS/GM 401/2005, Art. 4º, V) (com redação dada pela PRT MS/GM 490/2010)
VI - apoiar a realização de procedimentos cirúrgicos em tráumato-ortopedia preferencialmente em alta complexidade - disponibilizando equipe multiprofissional, e insumos especializados. (Origem: PRT MS/GM 401/2005, Art. 4º, VI) (com redação dada pela PRT MS/GM 490/2010)
VII - deslocar a equipe e viabilizar o transporte dos materiais para realização dos procedimentos cirúrgicos do inciso V; (Origem: PRT MS/GM 401/2005, Art. 4º, VII)
VIII - promover a educação permanente durante a realização dos procedimentos cirúrgicos em tráumato-ortopedia por meio de cursos teórico-práticos; (Origem: PRT MS/GM 401/2005, Art. 4º, VIII)
IX - realizar assessoria a distância, via internet, para avaliação de casos clínicos; (Origem: PRT MS/GM 401/2005, Art. 4º, IX)
X - promover educação permanente a distância, por meio de vídeoconferência; (Origem: PRT MS/GM 401/2005, Art. 4º, X)
XI - assessorar a implantação de programas de residência médica em tráumato-ortopedia e residência em enfermagem ortopédica das unidades da região; (Origem: PRT MS/GM 401/2005, Art. 4º, XI)
XII - assessorar os programas de residência médica em tráumato-ortopedia e de especialização em enfermagem ortopédica das unidades da região; (Origem: PRT MS/GM 401/2005, Art. 4º, XII)
XIII - disponibilizar bolsas para programas em conjunto de residência médica em tráumato-ortopedia e de especialização em enfermagem ortopédica; e (Origem: PRT MS/GM 401/2005, Art. 4º, XIII)
XIV - assessorar a padronização e aquisição de implantes ortopédicos. (Origem: PRT MS/GM 401/2005, Art. 4º, XIV)
Art. 657. A Secretaria de Atenção à Saúde avaliará a execução da implementação dos serviços de que trata o art. 653, parágrafo único por meio de termos de compromisso e/ou convênios. (Origem: PRT MS/GM 401/2005, Art. 5º)
Art. 658. Deverão constar dos termos de compromissos e/ou convênios, quando da adesão, que caberá às Secretarias Estaduais e Municipais de Saúde: (Origem: PRT MS/GM 401/2005, Art. 6º)
I - garantir o acesso às informações para realização dos diagnósticos de oferta e de demanda; (Origem: PRT MS/GM 401/2005, Art. 6º, I)
II - implementar, quando necessário, instrumentos de registro e de sistematização de informações; (Origem: PRT MS/GM 401/2005, Art. 6º, II)
III - garantir a adequação da área física para implantação dos serviços de média e alta complexidade em tráumato-ortopedia, de acordo com a normalização vigente; (Origem: PRT MS/GM 401/2005, Art. 6º, III)
IV - garantir a manutenção e o funcionamento dos equipamentos hospitalares de que trata o art. 656, V; (Origem: PRT MS/GM 401/2005, Art. 6º, IV)
V - garantir quantitativo suficiente de profissionais de saúde para o desenvolvimento das atividades dos serviços de média e alta complexidade em tráumato-ortopedia e reabilitação pós-operatória; (Origem: PRT MS/GM 401/2005, Art. 6º, V)
VI - garantir os recursos logísticos na unidade para a realização de procedimentos cirúrgicos em tráumato-ortopedia pela equipe do INTO, disponibilizando equipe multiprofissional, salas de cirurgia, leitos hospitalares e de terapia intensiva, central de material e esterilização, Serviço de Apoio Diagnóstico Terapêuticos - SADT, insumos e demais recursos necessários à adequada consecução dos procedimentos supramencionados; (Origem: PRT MS/GM 401/2005, Art. 6º, VI)
VII - garantir a hospedagem individual, alimentação no local de trabalho para a equipe do INTO; (Origem: PRT MS/GM 401/2005, Art. 6º, VII)
VIII - garantir o pagamento integral da ajuda de custo para os profissionais do INTO, no prazo máximo de 15 (quinze) dias, após a realização dos procedimentos cirúrgicos; (Origem: PRT MS/GM 401/2005, Art. 6º, VIII)
IX - selecionar, indicar e garantir a participação dos profissionais de saúde que atuam nas áreas de tráumato-ortopedia, anestesiologia, terapia intensiva, reabilitação pós-operatória e enfermagem ortopédica nos programas de educação permanente tanto na região como no INTO, conforme cronograma estabelecido; (Origem: PRT MS/GM 401/2005, Art. 6º, IX)
X - garantir o deslocamento e a hospedagem dos profissionais da região para os eventos de educação permanente, conforme cronograma estabelecido; e (Origem: PRT MS/GM 401/2005, Art. 6º, X)
XI - garantir os recursos logísticos na região para a realização dos eventos teóricos, tais como auditório, recursos áudiovisuais e outros. (Origem: PRT MS/GM 401/2005, Art. 6º, XI)
Art. 659. As Secretarias Estaduais de Saúde e às Secretarias Municipais de Saúde deverão apresentar à Secretaria de Atenção à Saúde as necessidades quanto à estruturação de serviços de tráumato-ortopedia e reabilitação pós-operatória, de acordo com o art. 653 acompanhadas de parecer favorável da Comissão Intergestores Bipartite. (Origem: PRT MS/GM 401/2005, Art. 7º)
§ 1º Serão priorizadas pela Secretaria de Atenção à Saúde as demandas para a realização das ações de caráter estrutural, organizativo e operacional provenientes dos Estados que compõem a Amazônia Legal. (Origem: PRT MS/GM 401/2005, Art. 7º, § 1º)
§ 2º As solicitações das demais regiões serão analisadas pela Secretaria de Atenção à Saúde de acordo com prioridades e disponibilidade orçamentária e financeira. (Origem: PRT MS/GM 401/2005, Art. 7º, § 2º)
Art. 660. Os recursos orçamentários para a estruturação desses serviços correrão por conta do Programa de Trabalho 10.302.2015.8535 - Estruturação de Unidades de Atenção Especializada em Saúde. (Origem: PRT MS/GM 401/2005, Art. 8º)
CAPÍTULO IV
DA COMISSÃO NACIONAL COM A FINALIDADE DE AVALIAR E DEFINIR DIRETRIZES POLÍTICAS PARA A PROMOÇÃO DA SAÚDE, PREVENÇÃO E CONTROLE DAS DOENÇAS E AGRAVOS NÃO TRANSMISSÍVEIS
Art. 661. Constituir Comissão Nacional com a finalidade de avaliar e definir diretrizes políticas para a promoção da saúde, prevenção e controle das doenças e agravos não-transmissíveis, integrada por representante de cada uma das unidades do Ministério da Saúde e entidade vinculada e das instituições, a seguir indicadas: (Origem: PRT MS/GM 1359/2003, Art. 1º)
I - Secretaria-Executiva; (Origem: PRT MS/GM 1359/2003, Art. 1º, I)
II - Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, II)
III - Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, III)
IV - Instituto Nacional de Câncer; (Origem: PRT MS/GM 1359/2003, Art. 1º, IV)
V - Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 1359/2003, Art. 1º, V)
VI - Conselho Nacional de Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, VI)
VII - Conselho Nacional de Secretários Estaduais de Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, VII)
VIII - Conselho Nacional de Secretários Municipais de Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, VIII)
IX - Organização Pan-Americana da Saúde. (Origem: PRT MS/GM 1359/2003, Art. 1º, IX)
Parágrafo Único. A coordenação da Comissão será exercida pela Secretaria de Vigilância em Saúde do Ministério da Saúde. (Origem: PRT MS/GM 1359/2003, Art. 1º, Parágrafo Único)
Art. 662. A política de redução das doenças e agravos não-transmissíveis deverá objetivar: (Origem: PRT MS/GM 1359/2003, Art. 2º)
I - a articulação de todas as ações em desenvolvimento no País para seu controle, visando reorientá-las sob o enfoque da promoção da saúde; (Origem: PRT MS/GM 1359/2003, Art. 2º, I)
II - o desenvolvimento da cultura institucional baseada na prevenção, para diminuir a morbidade, mortalidade e incapacidade que causam; (Origem: PRT MS/GM 1359/2003, Art. 2º, II)
III - a associação das ações individuais, especialmente a detecção precoce e o tratamento oportuno de casos, com as de caráter coletivo; (Origem: PRT MS/GM 1359/2003, Art. 2º, III)
IV - o apoio ao ordenamento dos serviços de saúde, segundo as estratégias de atenção à saúde da família, da participação da população e do controle social. (Origem: PRT MS/GM 1359/2003, Art. 2º, IV)
Art. 663. Consideram-se objetivos específicos das ações dirigidas à prevenção e ao controle das doenças e agravos não-transmissíveis: (Origem: PRT MS/GM 1359/2003, Art. 3º)
I - a melhoria da situação de saúde da população brasileira, no que diz respeito à implementação de intervenções que busquem diminuir a presença de fatores de risco, incluindo hábitos alimentares inadequados, sedentarismo, obesidade, tabagismo, alcoolismo e outros; (Origem: PRT MS/GM 1359/2003, Art. 3º, I)
II - o estabelecimento de intervenções integrais precoces e adequadas para controle da hipertensão, diabetes e arterioesclerose, a fim de diminuir as deficiências físicas resultantes de enfermidades cerebrovasculares, assim como reduzir as patologias do comportamento; (Origem: PRT MS/GM 1359/2003, Art. 3º, II)
III - a incorporação, nos serviços de saúde, de práticas preventivas dos fatores de riscos e promocionais de estilos de vida saudáveis para a família, dentro de uma percepção integrada, que compreenda os ciclos biológicos, com ênfase nas relações psíquicas, sociais e culturais; (Origem: PRT MS/GM 1359/2003, Art. 3º, III)
IV - o estímulo à participação comunitária, por meio da comunicação social, com o sentido de gerar opinião favorável à adoção de comportamentos, atitudes e hábitos protetores da saúde, mediante alianças para a ação da população diante de determinados fatores de risco e para o desenvolvimento social, descentralizado e intersetorial; (Origem: PRT MS/GM 1359/2003, Art. 3º, IV)
V - a realização de estudos e análises da situação dessas doenças e de avaliação de impacto das ações, programas e políticas para acompanhamento das ações destinadas à sua prevenção e ao seu controle; (Origem: PRT MS/GM 1359/2003, Art. 3º, V)
VI - a implantação de projetos e atividades com a finalidade de prevenir acidentes, especialmente de trânsito, e violências, com repercussão na demanda dos serviços de saúde. (Origem: PRT MS/GM 1359/2003, Art. 3º, VI)
CAPÍTULO V
DA CÂMARA TÉCNICA EM REUMATOLOGIA
Art. 664. Fica instituída a Câmara Técnica em Reumatologia com a finalidade elaborar as diretrizes para à atenção à saúde da pessoa com doenças reumatológicas, bem como acompanhar, avaliar e atualizar as normas, parâmetros e procedimentos da Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materias Especiais do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 3443/2010, Art. 1º)
Parágrafo Único. A Câmara Técnica de que trata o caput será composta pelos membros a seguir relacionados e atuará sob a coordenação do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde (DAET/SAS/MS): (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único) (com redação dada pela PRT MS/GM 1256/2014)
I - um representante do Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, I)
II - um representante do Departamento de Atenção Especializada e Temática (DAET/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, II)
III - um representante do Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, III)
IV - um representante do Departamento de Atenção Básica (DAB/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, IV)
V - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, V)
VI - um representante da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, VI)
VII - um representante da Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, VII)
VIII - um representante do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, VIII)
IX - um representante do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, IX)
X - um representante do Hospital Universitário indicado pela Associação Brasileira dos Hospitais Universitários e de Ensino (ABRAHUE); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, X)
XI - um representante da Sociedade Brasileira de Reumatologia; e (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, XI)
XII - um representante da Associação Nacional de Pacientes com Reumatismo (ANAPAR). (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, XII)
Art. 665. São atribuições da Câmara Técnica em Reumatologia: (Origem: PRT MS/GM 3443/2010, Art. 2º)
I - a elaboração de Diretrizes para a atenção à saúde da pessoa com doença reumatológica; (Origem: PRT MS/GM 3443/2010, Art. 2º, I)
II - as ações de promoção da saúde, da prevenção, de diagnóstico e do tratamento de doenças e agravos levadas a cabo no âmbito coletivo ou individual na assistência pública e privada; (Origem: PRT MS/GM 3443/2010, Art. 2º, II)
III - as recomendações para o desenvolvimento das ações das entidades públicas e privadas que integram o SUS e, quando solicitado, o sistema de saúde suplementar; (Origem: PRT MS/GM 3443/2010, Art. 2º, III)
IV - acompanhar , monitorar e sugerir revisão, quando indicado, da tabela de procedimentos relativos à Atenção Á Saúde da pessoa com doença reumatológica; (Origem: PRT MS/GM 3443/2010, Art. 2º, IV)
V - a estruturação de redes de atenção na área de reumatologia; e (Origem: PRT MS/GM 3443/2010, Art. 2º, V)
VI - a avaliação de estudos e pesquisas na área de reumatologia. (Origem: PRT MS/GM 3443/2010, Art. 2º, VI)
Art. 666. A Câmara Técnica se reunirá, periodicamente, conforme cronograma a ser estabelecido pelo Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde (DAET/SAS/MS). (Origem: PRT MS/GM 3443/2010, Art. 3º) (com redação dada pela PRT MS/GM 1256/2014)
Parágrafo Único. A Câmara Técnica em Reumatologia, quando julgar necessário, poderá convidar participantes ad hoc, sempre de caráter institucional, internos ou externos ao Ministério da Saúde, nas áreas correlacionadas com a reumatologia. (Origem: PRT MS/GM 3443/2010, Art. 3º, Parágrafo Único)
CAPÍTULO VI
DA ATENÇÃO ONCOLÓGICA
Seção I
Das Regras e Critérios para o Credenciamento de Instituições e para Apresentação, Recebimento, Análise, Aprovação, Execução, Acompanhamento, Prestação de Contas e Avaliação de Resultados de Projetos no âmbito do Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD)
Art. 667. O Anexo LXXXVI dispõe sobre as regras e critérios para o credenciamento de instituições e para apresentação, recebimento, análise, aprovação, execução, acompanhamento, prestação de contas e avaliação de resultados de projetos no âmbito do Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD).
Seção II
Do Plano de Expansão da Radioterapia
Art. 668. Fica instituído o Plano de Expansão da Radioterapia no Sistema Único de Saúde (SUS), com o objetivo de articular projetos de ampliação e qualificação de hospitais habilitados em oncologia, em consonância com os vazios assistenciais, as demandas regionais de assistência oncológica e as demandas tecnológicas do SUS. (Origem: PRT MS/GM 931/2012, Art. 1º)
Art. 669. São objetivos do Plano de Expansão da Radioterapia no SUS: (Origem: PRT MS/GM 931/2012, Art. 2º)
I - definir, coordenar e aplicar método de criação de novos serviços de radioterapia em hospitais habilitados no SUS como Unidade de Assistência de Alta Complexidade em Oncologia (UNACON); (Origem: PRT MS/GM 931/2012, Art. 2º, I)
II - definir, coordenar e aplicar método de ampliação de serviços existentes de radioterapia em hospitais habilitados no SUS como UNACON com Serviço de Radioterapia ou como Centro de Assistência de Alta Complexidade em Oncologia (CACON); (Origem: PRT MS/GM 931/2012, Art. 2º, II)
III - desenvolver o Plano de Ações para Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 2º, III)
IV - definir, em parceria com as Secretarias Municipais e Estaduais de Saúde, a expansão adequada à Rede de Atenção à Saúde, especificamente quanto à atenção oncológica; (Origem: PRT MS/GM 931/2012, Art. 2º, IV)
V - coordenar e monitorar visitas técnicas de diagnóstico necessárias durante a implantação do projeto e coordenação do processo de obras e de aquisição de equipamentos de diagnóstico e tratamento; (Origem: PRT MS/GM 931/2012, Art. 2º, V)
VI - coordenar a elaboração de pareceres técnicos relacionados ao Plano, em resposta a solicitações do Ministério da Saúde, dos Poderes Legislativo e Judiciário, organizações da sociedade civil, órgãos de controle estatais, Secretarias de Saúde, Hospitais e outros; (Origem: PRT MS/GM 931/2012, Art. 2º, VI)
VII - subsidiar programas de capacitação de profissionais; (Origem: PRT MS/GM 931/2012, Art. 2º, VII)
VIII - gerenciar todos os projetos de criação ou ampliação nos hospitais habilitados na alta complexidade em oncologia com recursos do Ministério da Saúde; e (Origem: PRT MS/GM 931/2012, Art. 2º, VIII)
IX - articular as demandas tecnológicas do SUS com as iniciativas do Plano Brasil Maior para o estímulo à produção e desenvolvimento tecnológico nacional, por intermédio da internalização da produção dos equipamentos. (Origem: PRT MS/GM 931/2012, Art. 2º, IX)
Art. 670. O Plano de Expansão da Radioterapia no SUS será executado por criação ou ampliação de serviços de radioterapia ofertados ao SUS, mediante a formalização de convênio para doação de equipamentos de radioterapia devidamente instalados, com a apresentação de todos os documentos exigidos no instrumento referido. (Origem: PRT MS/GM 931/2012, Art. 3º)
Art. 670 - O Plano de Expansão da Radioterapia no SUS - PER/SUS tem por escopo expandir, atualizar e melhorar a prestação do serviço de radioterapia no SUS, ao promover as seguintes ações nas unidades hospitalares habilitadas no SUS, para a assistência de alta complexidade em oncologia, que a ele aderirem: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - criar serviços de radioterapia, incluindo a entrega de projetos básico e executivo, a execução de obras, o apoio técnico ao processo de avaliação, monitoramento e fiscalização dos projetos e obras e a entrega de um conjunto de equipamentos de radioterapia, incluindo ou não de braquiterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - ampliar os serviços de radioterapia existentes, incluindo a entrega de projetos básico e executivos, a execução de obras, o apoio técnico ao processo de avaliação, monitoramento e fiscalização dos projetos e obras e a entrega de equipamentos para radioterapia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - disponibilizar equipamentos de radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - realizar a atualização tecnológica de equipamentos de radioterapia existentes; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - promover a compensação tecnológica ao País. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1º A adesão de hospital ao PER/SUS dar-se-á por meio da celebração de Termo de Compromisso a ser firmado com o Ministério da Saúde, que conterá, entre outras, cláusulas com as seguintes obrigações ao hospital convenente: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - disponibilizar área física desimpedida, compatível com a modalidade de sua inserção no Plano; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - acompanhar a instalação do(s) equipamento(s) e seu comissionamento, emitindo parecer de responsável técnico para o Ministério da Saúde quanto à sua execução; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - assegurar boas condições das instalações do serviço de radioterapia e o correto funcionamento do(s) equipamentos; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - prestar serviços de radioterapia à população, nos termos da Portaria n° 140/SAS/MS, de 27 de fevereiro de 2014, ou de norma congênere que a complemente ou substitua. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - colaborar com o gestor público nas atividades necessárias à regulação do acesso ao serviço de radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VI - garantir recursos humanos necessários para o atendimento radioterápico, em observância às normativas da CNEN e da Resolução RDC/Anvisa nº 20, de 2 de fevereiro de 2006, ou de normas congêneres que as complementem ou substituam; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VII - colaborar no treinamento de recursos humanos especializados para prestação de serviços em radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VIII - assegurar, por meio de contratos de manutenção preventiva e corretiva, boas condições de funcionamento para o(s) equipamento(s) cedido(s) após o término do período de garantia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IX - ofertar ao gestor público vagas para atendimentos em radioterapia compatíveis com a capacidade de atendimento do novo equipamento, de, no mínimo, 50 (cinquenta) pacientes tratados em radioterapia em base mensal ou 600 pacientes em base anual; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
X - aceitar a doação do(s) equipamento(s) contemplado(s) após o prazo de 3 (três) anos contados a partir da concessão de licença de operação pela CNEN; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
XI - manter atualizada a Certificação de Entidades Beneficentes de Assistência Social - CEBAS e a regularização fiscal; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
XII - devolver os recursos financeiros atualizados ao Tesouro Nacional, referentes às despesas incorridas pelo Ministério da Saúde com as atividades do Plano de Expansão relativas ao estabelecimento, em caso de desligamento do hospital do PER-SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2° A doação do(s) equipamento(s) aos hospitais contemplados pelas soluções de radioterapia no âmbito do PER-SUS de que trata o inciso X do § 1º, ocorrerá somente após o cumprimento integral das demais cláusulas pactuadas. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 671. O convênio a que se refere o art. 670 somente será assinado mediante a apresentação de declaração emitida pela respectiva Secretaria de Saúde Estadual, constando os seguintes compromissos mínimos: (Origem: PRT MS/GM 931/2012, Art. 4º)
I - priorização dos processos para aprovação de projetos, licenciamento e credenciamento de serviços de radioterapia no âmbito da Secretaria de Saúde Estadual; (Origem: PRT MS/GM 931/2012, Art. 4º, I)
II - regulação do acesso de pacientes para os serviços de radioterapia criados ou ampliados no âmbito deste Plano; e (Origem: PRT MS/GM 931/2012, Art. 4º, II)
III - garantia de apoio técnico e financeiro ao hospital, quando a Secretaria Estadual de Saúde julgar pertinente e necessário. (Origem: PRT MS/GM 931/2012, Art. 4º, III)
Parágrafo Único. Para os fins do estabelecido no "caput" deste artigo, o hospital e a respectiva Secretaria Estadual de Saúde terão responsabilidade solidária. (Origem: PRT MS/GM 931/2012, Art. 4º, Parágrafo Único)
Art. 671 - O desligamento de hospital do PER/SUS deverá ser apreciado pelo Comitê Gestor do Plano de Expansão de Radioterapia do SUS - CGPER/SUS, após formalização do pleito: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - pelo hospital que pleiteia a sua exclusão; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - pela Secretaria Estadual ou Municipal de Saúde gestora do serviço; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - pela área técnica do Ministério da Saúde que tenha interface com a temática, em virtude do descumprimento do convênio firmado ou das normas aplicáveis à alta-complexidade em oncologia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1° A decisão sobre o desligamento de hospital do PER/SUS deverá considerar os termos da pactuação realizada e as normas aplicáveis à alta-complexidade em oncologia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º Da decisão sobre o desligamento caberá recurso, no prazo de 30 (trinta) dias contados da ciência do interessado, ao qual se atribuirá efeito suspensivo, ao Ministro de Estado da Saúde, que decidirá em última instância. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 3° Esgotadas as vias administrativas, o CGPER/SUS oficiará a entidade hospitalar beneficiada para proceder à devolução dos recursos financeiros, atualizados, devidos ao Tesouro Nacional e referentes às despesas incorridas pelo Ministério da Saúde com as atividades do PER/SUS relativas ao estabelecimento, consoante os termos da pactuação realizada. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 4° Findo o processo de desligamento de hospital do Plano de Expansão de Radioterapia do SUS, deverá o CGPER/SUS indicar outro hospital, em observância aos arts. 672 e 673 desta Portaria, para integrar o PER/SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 672. A assinatura de convênios no âmbito do Plano de Expansão da Radioterapia no SUS será feita com a observância de ordem de classificação e de prioridade para os hospitais interessados, observada a pontuação fixada no Anexo XXXV . (Origem: PRT MS/GM 931/2012, Art. 5º)
§ 1º As Secretarias de Saúde Estaduais poderão, mediante justificativa técnica, propor nova ordem de classificação e de prioridade para os hospitais pontuados e classificados em seu Estado, bem como propor a inclusão de outros estabelecimentos de saúde na listagem. (Origem: PRT MS/GM 931/2012, Art. 5º, § 1º)
§ 2º O pedido de nova ordem de classificação ou de inclusão de novos estabelecimentos de saúde, conforme § 1º, somente poderá ser formulado se as Secretarias de Saúde Estaduais promoverem, previamente, chamamento público para seleção de potenciais interessados. (Origem: PRT MS/GM 931/2012, Art. 5º, § 2º)
Art. 672 - A inclusão de hospital no PER/SUS observará o déficit regional de oferta de radioterapia e os equipamentos e instalações de radioterapia existentes no estabelecimento hospitalar elegível. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1º A inclusão ou substituição de hospital observará priorização baseada em: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - oferta regional de radioterapia nos estados e Distrito Federal, estimada pelo número de equipamentos de teleterapia (acelerador linear e unidade de cobalto) que prestam serviços ao SUS, segundo o SCNES em 31 de dezembro de 2016 e os parâmetros estabelecidos na Portaria n° 140/SAS/MS, de 2014, habilitados na atenção especializada em oncologia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - número de equipamentos de teleterapia (unidade de cobalto ou acelerador linear) instalados conforme informado no SCNES em 31 de dezembro de 2016; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - necessidade assistencial no hospital, caracterizada pela relação entre a produção de cirurgia oncológica, quimioterapia e radioterapia aprovada nos últimos 12 meses e o esperado segundo a Portaria n° 140/SAS/MS, de 2014. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º A inclusão de hospital para fins apenas de disponibilização de equipamento de radioterapia será condicionada: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - à informação ao Ministério da Saúde, nos termos do Anexo I, sobre a disponibilidade de casamata compatível com acelerador linear especificado no PER/SUS, não utilizada ou ocupada por unidade de Cobalto ou acelerador linear obsoleto, assim considerado aquele que está fora do período de suporte pelo fabricante do equipamento original; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - à declaração de capacidade financeira para execução de obra física de adequação da casamata ao equipamento disponibilizado pelo Plano de Expansão da Radioterapia, quando essa obra for necessária; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - ao compromisso em realizar a obra física de adequação e disponibilizar casamata desimpedida para receber o equipamento de radioterapia em prazo não superior a 6 (seis) meses, quando essa obra for necessária; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - à priorização baseada nos critérios definidos no § 1º deste artigo (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 3º A inclusão de hospital para fins apenas de atualização de equipamento de radioterapia será condicionada: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - a estudo de viabilidade técnica e econômica demonstrando vantagem em termos de eficiência e economicidade para a atualização tecnológica frente à alternativa de substituição do equipamento; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - à declaração de capacidade financeira do hospital para execução de obra física de adequação da casamata para atualização do equipamento pelo Plano de Expansão da Radioterapia, quando essa obra for necessária; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - ao compromisso do hospital em realizar a obra física em prazo não superior a 6 (seis) meses, quando essa obra for necessária; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - à priorização baseada nos critérios definidos no § 1º deste artigo. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 673. Para fins de criação ou ampliação de serviços de radioterapia, são elegíveis para adesão ao Plano de Expansão da Radioterapia no SUS os estabelecimentos hospitalares públicos ou privados sem fins lucrativos que sejam habilitados como: (Origem: PRT MS/GM 931/2012, Art. 6º)
I - UNACON; (Origem: PRT MS/GM 931/2012, Art. 6º, I)
II - UNACON com Serviço de Radioterapia; (Origem: PRT MS/GM 931/2012, Art. 6º, II)
III - UNACON com Serviço de Hematologia; (Origem: PRT MS/GM 931/2012, Art. 6º, III)
IV - UNACON com Serviço de Oncologia Pediátrica; (Origem: PRT MS/GM 931/2012, Art. 6º, IV)
V - CACON; e (Origem: PRT MS/GM 931/2012, Art. 6º, V)
VI - CACON com Serviço de Oncologia Pediátrica. (Origem: PRT MS/GM 931/2012, Art. 6º, VI)
Art. 673 - São elegíveis, para inclusão no PER/SUS, os hospitais públicos ou privados sem fins lucrativos que estejam habilitados como: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - UNACON; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - UNACON com Serviço de Radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - UNACON com Serviço de Hematologia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - UNACON com Serviço de Oncologia Pediátrica; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - CACON; ou (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VI - CACON com Serviço de Oncologia Pediátrica. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1° O CGPER/SUS poderá apreciar a solicitação de inclusão no PER/SUS de hospitais credenciados ao SUS em processo de habilitação para atendimento em alta complexidade em oncologia, mas apenas deliberará após deferimento da habilitação de que trata o caput deste artigo. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2° A inclusão de hospitais no PER/SUS requer aprovação pela Comissão Intergestores Bipartite (CIB). (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 3° A contar da publicação desta Portaria, o hospital terá o prazo de 30 (trinta) dias para informar ao Ministério da Saúde, mediante ofício, o interesse em aderir ao PER/SUS e apresentar a documentação pertinente, conforme anexo I; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 4° Na hipótese de não ter recebido pedidos suficientes de adesão no prazo estipulado no parágrafo anterior, poderá o Ministério da Saúde conceder igual prazo para novas candidaturas. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§5° Os hospitais que solicitarem adesão ao PER/SUS no prazo previsto no § 4° concorrerão às vagas que não tiverem sido preenchidas pelos hospitais que solicitaram adesão no prazo previsto no § 3º. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 674. Para fins de criação de serviços de radioterapia, são elegíveis para adesão ao Plano de Expansão da Radioterapia no SUS os hospitais públicos ou privados sem fins lucrativos associados a serviço isolado de radioterapia com fins lucrativos. (Origem: PRT MS/GM 931/2012, Art. 7º) (Revogado pela pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 675. Fica instituído o Comitê Gestor do Plano de Expansão da Radioterapia no SUS, que será composto pelos seguintes membros: (Origem: PRT MS/GM 931/2012, Art. 8º)
I - Secretário(a) Executivo(a) do Ministério da Saúde (SE), que o coordenará; (Origem: PRT MS/GM 931/2012, Art. 8º, I)
II - Secretário(a) de Atenção à Saúde do Ministério da Saúde (SAS); (Origem: PRT MS/GM 931/2012, Art. 8º, II)
III - Secretário(a) de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE); e (Origem: PRT MS/GM 931/2012, Art. 8º, III)
IV - Diretor-Geral do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS). (Origem: PRT MS/GM 931/2012, Art. 8º, IV)
Art. 676. Compete ao Comitê Gestor: (Origem: PRT MS/GM 931/2012, Art. 9º)
I - aprovar as diretrizes estratégicas do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 9º, I)
II - aprovar o Plano de Ações elaborado pelo Comitê Executivo; (Origem: PRT MS/GM 931/2012, Art. 9º, II)
III - aprovar outras ações propostas pelo Comitê Executivo; (Origem: PRT MS/GM 931/2012, Art. 9º, III)
IV - propor os locais e hospitais, em consonância com as respectivas Secretarias Estaduais de Saúde, onde serão implementados os projetos de criação ou ampliação de serviços de radioterapia; e (Origem: PRT MS/GM 931/2012, Art. 9º, IV)
V - avaliar as propostas das Secretarias Estaduais de Saúde para nova ordem de classificação e de prioridade para os hospitais pontuados e classificados em seu Estado. (Origem: PRT MS/GM 931/2012, Art. 9º, V)
Parágrafo Único. O Comitê Gestor reunir-se-á semestralmente com o objetivo de acompanhar a execução do Plano de Ações aprovado. (Origem: PRT MS/GM 931/2012, Art. 9º, Parágrafo Único)
Art. 676 - Compete ao CGPER/SUS: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - deliberar sobre diretrizes estratégicas para o PER/SUS; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - deliberar sobre ações recomendadas pelo Comitê Executivo para consecução do PER/SUS; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - deliberar sobre a inclusão e o desligamento de hospitais no PER/SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1º O CGPER/SUS reunir-se-á, ordinariamente, em periodicidade semestral, com o objetivo de acompanhar a execução das ações aprovadas. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º O coordenador do CGPER/SUS poderá, quando entender necessário, convocar reuniões extraordinárias. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 677. Fica instituído o Comitê Executivo do Plano de Expansão da Radioterapia no SUS, que será composto por representantes dos seguintes órgãos do Ministério da Saúde: (Origem: PRT MS/GM 931/2012, Art. 10)
I - Departamento do Complexo Industrial e Inovação em Saúde (DECIIS/SCTIE/MS), que o coordenará; (Origem: PRT MS/GM 931/2012, Art. 10, I)
II - Departamento de Atenção Especializada e Temática (DAET/SAS/MS); (Origem: PRT MS/GM 931/2012, Art. 10, II)
III - Departamento de Logística em Saúde (DLOG/SE/MS); (Origem: PRT MS/GM 931/2012, Art. 10, III)
IV - Subsecretaria de Assuntos Administrativos (SAA/SE/MS); e (Origem: PRT MS/GM 931/2012, Art. 10, IV)
V - Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS/MS). (Origem: PRT MS/GM 931/2012, Art. 10, V)
Art. 678. Compete ao Comitê Executivo: (Origem: PRT MS/GM 931/2012, Art. 11)
I - propor ao Comitê Gestor as diretrizes estratégicas do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, I)
II - elaborar o Plano de Ações, que conterá, entre outras, as linhas estratégicas que orientarão o emprego de esforços e recursos, materiais e financeiros, necessários à execução do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, II)
III - propor outras ações ao Comitê Gestor; (Origem: PRT MS/GM 931/2012, Art. 11, III)
I - propor ao CGPER/SUS as diretrizes estratégicas para o PER/SUS; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - gerenciar e monitorar as ações necessárias à execução do PER/SUS; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - propor ao ao CGPER/SUS a inclusão ou o desligamento de hospitais no PER/SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - gerenciar e monitorar a implantação das ações estabelecidas no Plano de Ações; e (Origem: PRT MS/GM 931/2012, Art. 11, IV)
V - propor ao Comitê Gestor a listagem dos locais e hospitais onde serão implementados os projetos de criação ou ampliação de serviços de radioterapia. (Origem: PRT MS/GM 931/2012, Art. 11, V)
§ 1º O Comitê Executivo contará com: (Origem: PRT MS/GM 931/2012, Art. 11, § 1º)
I - Gerência de Projeto, exercida pela Coordenação-Geral de Equipamentos e Materiais de Uso em Saúde (CGEMS/DECIIS/SCTIE/MS), com apoio do DAET/SAS/MS e do INCA/SAS/MS; (Origem: PRT MS/GM 931/2012, Art. 11, § 1º, I)
II - Apoio Logístico, exercido em conjunto pela SAA/SE/MS, pelo DLOG/SE/MS e pela Secretaria de Planejamento e Orçamento (SPO/SE/MS), no âmbito de suas competências; e (Origem: PRT MS/GM 931/2012, Art. 11, § 1º, II)
III - Coordenação Técnica, exercida pelo INCA/SAS/MS. (Origem: PRT MS/GM 931/2012, Art. 11, § 1º, III)
III - Coordenação Técnica, exercida pela Coordenação-Geral de Atenção Especializada CGAE/DAET/SAS/MS, com apoio do INCA/SAS/MS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º O Comitê Executivo reunir-se-á mensalmente com o objetivo de acompanhar a execução o Plano de Expansão de Radioterapia no SUS. (Origem: PRT MS/GM 931/2012, Art. 11, § 2º)
§ 3º Compete à Gerência de Projeto do Comitê Executivo: (Origem: PRT MS/GM 931/2012, Art. 11, § 3º)
I - acompanhar as ações que integram o Plano de Expansão de Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, I)
II - subsidiar tecnicamente o Comitê Executivo; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, II)
III - analisar a adesão ao Plano de Expansão de Radioterapia no SUS, bem como futuras alterações; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, III)
IV - avaliar e acompanhar os projetos de criação e ampliação de serviços de radioterapia, considerando aspectos de estrutura e assistenciais; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, IV)
V - acompanhar a execução do cronograma de obras para criação ou ampliação dos serviços de radioterapia; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, V)
IV - avaliar e acompanhar os projetos de criação e ampliação ou disponibilização de equipamento, considerando os aspectos de estrutura. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - acompanhar a execução do cronograma de obras para criação, ampliação ou de adequação da casamata, bem como a instalação dos equipamentos de radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VI - acompanhar a execução do cronograma de compensação tecnológica previsto na aquisição das tecnologias previstas no Plano de Expansão de Radioterapia no SUS, em consonância com o objetivo previsto no art. 669, IX; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, VI)
VII - participar de visitas técnicas; e (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, VII)
VIII - acompanhar, por meio de indicadores específicos, a implantação e produção assistencial dos serviços criados e ampliados. (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, VIII)
§ 4º A Gerência de Projeto poderá convocar reuniões e solicitar técnicos e relatórios de qualquer área do Ministério da Saúde, para acompanhar e monitorar a implantação das ações que integram o Plano de Ações. (Origem: PRT MS/GM 931/2012, Art. 11, Parágrafo Único)
§ 5º Compete ao Apoio Logístico: (Origem: PRT MS/GM 931/2012, Art. 11, § 4º)
I - colaborar na elaboração e execução do Plano de Ações para a Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, § 4º, I)
II - orientar, implementar e avaliar os processos e as ações de compra de bens e de contratação de serviços relativos ao Plano de Ações; e (Origem: PRT MS/GM 931/2012, Art. 11, § 4º, II)
III - orientar e avaliar os processos de orçamento, finanças e contabilidade das compras de bens e contratações de serviços relativos ao Plano de Ações. (Origem: PRT MS/GM 931/2012, Art. 11, § 4º, III)
III - apoiar tecnicamente o Comitê Gestor do Plano de Expansão; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - elaborar e consolidar relatórios semestrais que subsidiarão as reuniões do Comitê Gestor do Plano de Expansão; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - acompanhar por meio de indicadores específicos a implantação e produção assistencial dos serviços contemplados neste Plano após início de operação dos equipamentos de radioterapia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 6º Compete à Coordenação Técnica: (Origem: PRT MS/GM 931/2012, Art. 11, § 5º)
I - atuar como facilitadora da implantação do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, I)
II - contribuir para a implementação das diretrizes do Plano de Ações; (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, II)
III - apoiar tecnicamente o Comitê Gestor do Plano de Expansão; e (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, III)
IV - elaborar e consolidar relatórios semestrais que subsidiarão as reuniões do Comitê Gestor do Plano de Expansão. (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, IV)
§ 7º As funções dos membros do Comitê Gestor e do Comitê Executivo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 931/2012, Art. 11, § 6º)
CAPÍTULO VII
DO SERVIÇO DE ATENÇÃO ÀS PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL
Seção I
Da Organização do Serviço de Atenção às Pessoas em Situação de Violência Sexual
Art. 679. Esta Seção define o funcionamento do Serviço de Atenção às Pessoas em Situação de Violência Sexual no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 485/2014, Art. 1º)
Art. 680. O Serviço de Atenção às Pessoas em Situação de Violência Sexual no âmbito do SUS integra as redes intersetoriais de enfrentamento da violência contra mulheres, homens, crianças, adolescentes e pessoas idosas e tem como funções precípuas preservar a vida, ofertar atenção integral em saúde e fomentar o cuidado em rede. (Origem: PRT MS/GM 485/2014, Art. 2º)
Art. 681. O Serviço de Atenção às Pessoas em Situação de Violência Sexual poderá ser organizado em todos os estabelecimentos de saúde integrantes do SUS, conforme as especificidades e atribuições de cada estabelecimento. (Origem: PRT MS/GM 485/2014, Art. 3º)
Art. 682. O Serviço de Atenção às Pessoas em Situação de Violência Sexual poderá abranger as seguintes classificações: (Origem: PRT MS/GM 485/2014, Art. 4º)
I - Serviço de Referência para Atenção Integral às Mulheres em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, I)
II - Serviço de Referência para Atenção Integral a Adolescentes em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, II)
III - Serviço de Referência para Atenção Integral às Crianças em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, III)
IV - Serviço de Referência para Atenção Integral aos Homens em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, IV)
V - Serviço de Referência para Atenção Integral às Pessoas Idosas em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, V)
VI - Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei; e (Origem: PRT MS/GM 485/2014, Art. 4º, VI)
VII - Serviços ambulatoriais com atendimento a pessoas em situação de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 4º, VII)
§ 1º Os Serviços de Referência para Atenção Integral às Mulheres, Adolescentes, Crianças, Homens e Pessoas Idosas em situação de violência sexual e o Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei poderão ser organizados em hospitais gerais e maternidades, prontos-socorros, Unidades de Pronto-Atendimento (UPA) e no conjunto de serviços de urgência não hospitalares. (Origem: PRT MS/GM 485/2014, Art. 4º, § 1º)
§ 2º Os serviços ambulatoriais, como Unidades Básicas de Saúde (UBS), Centros de Atenção Psicossocial (CAPS), ambulatórios de especialidades e outros, compõem a rede de cuidado a pessoas em situação de violência sexual, devendo realizar o atendimento conforme suas especificidades e atribuições. (Origem: PRT MS/GM 485/2014, Art. 4º, § 2º)
Art. 683. Os Serviços de Referência para Atenção Integral às Mulheres, Adolescentes, Crianças, Homens e Pessoas Idosas em Situação de Violência Sexual terão suas ações desenvolvidas em conformidade com a Norma Técnica de Prevenção e Tratamento dos Agravos resultantes da Violência Sexual contra Mulheres e Adolescentes do Ministério da Saúde, realizando: (Origem: PRT MS/GM 485/2014, Art. 5º)
I - acolhimento; (Origem: PRT MS/GM 485/2014, Art. 5º, I)
II - atendimento humanizado, observados os princípios do respeito da dignidade da pessoa humana, da não discriminação, do sigilo e da privacidade; (Origem: PRT MS/GM 485/2014, Art. 5º, II)
III - escuta qualificada, propiciando ambiente de confiança e respeito; (Origem: PRT MS/GM 485/2014, Art. 5º, III)
IV - informação prévia ao paciente, assegurada sua compreensão sobre o que será realizado em cada etapa do atendimento e a importância das condutas médicas, multiprofissionais e policiais, respeitada sua decisão sobre a realização de qualquer procedimento; (Origem: PRT MS/GM 485/2014, Art. 5º, IV)
V - atendimento clínico; (Origem: PRT MS/GM 485/2014, Art. 5º, V)
VI - atendimento psicológico; (Origem: PRT MS/GM 485/2014, Art. 5º, VI)
VII - realização de anamnese e preenchimento de prontuário onde conste, entre outras, as seguintes informações: (Origem: PRT MS/GM 485/2014, Art. 5º, VII)
a) data e hora do atendimento; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, a)
b) história clínica detalhada, com dados sobre a violência sofrida; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, b)
c) exame físico completo, inclusive exame ginecológico, se for necessário; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, c)
d) descrição minuciosa das lesões, com indicação da temporalidade e localização específica;e (Origem: PRT MS/GM 485/2014, Art. 5º, VII, d)
e) identificação dos profissionais que atenderam a pessoa em situação de violência; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, e)
VIII - dispensação e administração de medicamentos para profilaxias indicadas conforme as normas, regras e diretrizes técnicas do Ministério da Saúde; (Origem: PRT MS/GM 485/2014, Art. 5º, VIII)
IX - exames laboratoriais necessários; (Origem: PRT MS/GM 485/2014, Art. 5º, IX)
X - preenchimento da ficha de notificação compulsória de violência doméstica, sexual e outras violências; (Origem: PRT MS/GM 485/2014, Art. 5º, X)
XI - orientação e agendamento ou encaminhamento para acompanhamento clínico e psicossocial; e (Origem: PRT MS/GM 485/2014, Art. 5º, XI)
XII - orientação às pessoas em situação de violência ou aos seus responsáveis a respeito de seus direitos e sobre a existência de outros serviços para atendimento a pessoas em situação de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 5º, XII)
§ 1º Sem prejuízo da atuação do Instituto Médico Legal (IML), os estabelecimentos de saúde poderão realizar, no âmbito dos serviços de referência dispostos no "caput", a coleta, guarda provisória, preservação e entrega de material com vestígios de violência sexual, conforme o disposto no Decreto nº 7.958, de 13 de março de 2013. (Origem: PRT MS/GM 485/2014, Art. 5º, § 1º)
§ 2º Os estabelecimentos de saúde que organizarem a oferta dos serviços de referência dispostos no "caput" funcionarão em regime integral, 24 (vinte e quatro) horas por dia, nos 7 (sete) dias da semana e sem interrupção da continuidade entre os turnos, sendo de competência do gestor local de saúde a regulação do acesso aos leitos em casos de internação. (Origem: PRT MS/GM 485/2014, Art. 5º, § 2º)
Art. 684. O Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei terá suas ações desenvolvidas em conformidade com a Norma Técnica de Atenção Humanizada ao Abortamento do Ministério da Saúde, realizando: (Origem: PRT MS/GM 485/2014, Art. 6º)
I - atendimento clínico, ginecológico, cirúrgico e psicossocial, contando com serviço de apoio laboratorial; (Origem: PRT MS/GM 485/2014, Art. 6º, I)
II - apoio diagnóstico e assistência farmacêutica; e (Origem: PRT MS/GM 485/2014, Art. 6º, II)
III - coleta e guarda de material genético. (Origem: PRT MS/GM 485/2014, Art. 6º, III)
Parágrafo Único. Os estabelecimentos de saúde que organizarem a oferta do serviço de referência disposto no "caput" funcionarão em regime integral, 24 (vinte e quatro) horas por dia, nos 7 (sete) dias da semana e sem interrupção da continuidade entre os turnos, sendo de competência do gestor local de saúde a regulação do acesso aos leitos em casos de internação. (Origem: PRT MS/GM 485/2014, Art. 6º, Parágrafo Único)
Art. 685. A equipe dos Serviços de Referência para Atenção Integral às Mulheres, Adolescentes, Crianças, Homens e Pessoas Idosas em Situação de Violência Sexual e do Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei possuirá a seguinte composição de referência: (Origem: PRT MS/GM 485/2014, Art. 7º)
I - 1 (um) médico clínico ou 1 (um) médico em especialidades cirúrgicas; (Origem: PRT MS/GM 485/2014, Art. 7º, I)
II - 1 (um) enfermeiro; (Origem: PRT MS/GM 485/2014, Art. 7º, II)
III - 1 (um) técnico em enfermagem; (Origem: PRT MS/GM 485/2014, Art. 7º, III)
IV - 1 (um) psicólogo; (Origem: PRT MS/GM 485/2014, Art. 7º, IV)
V - 1 (um) assistente social; e (Origem: PRT MS/GM 485/2014, Art. 7º, V)
VI - 1 (um) farmacêutico. (Origem: PRT MS/GM 485/2014, Art. 7º, VI)
§ 1º Equipamentos e outros materiais necessários para o funcionamento adequado dos serviços de referência deverão estar organizados e disponíveis para os profissionais em escala de atendimento, de acordo com as normas, regras e diretrizes técnicas estabelecidas pelo Ministério da Saúde. (Origem: PRT MS/GM 485/2014, Art. 7º, § 1º)
§ 2º Os serviços de referência assegurarão a continuidade do cuidado e do acompanhamento, incluindo-se a realização dos exames regulares, de acordo com os protocolos clínicos e diretrizes técnicas em vigor. (Origem: PRT MS/GM 485/2014, Art. 7º, § 2º)
Art. 686. Os Serviços de Referência para Atenção Integral a Adolescentes e às Crianças em Situação de Violência Sexual comunicarão imediatamente ao Conselho Tutelar da respectiva localidade a suspeita ou confirmação de maus tratos contra criança ou adolescente, de acordo com o art. 13 da Lei nº 8.069, de 13 de julho de 1990 (Estatuto da Criança e do Adolescente). (Origem: PRT MS/GM 485/2014, Art. 8º)
Art. 687. O Serviço de Referência para Atenção Integral às Pessoas Idosas em Situação de Violência Sexual subsidiará com informações à rede intersetorial de serviços de saúde e assistência social de que trata a Lei nº 10.741, de 1º de outubro de 2003 (Estatuto do Idoso). (Origem: PRT MS/GM 485/2014, Art. 9º)
Art. 688. Os serviços ambulatoriais com atendimento a pessoas em situação de violência sexual deverão oferecer acolhimento, atendimento humanizado e multidisciplinar e encaminhamento, sempre que necessário, aos serviços referência na Saúde, serviços de assistência social ou de outras políticas públicas voltadas ao enfrentamento da violência e órgãos e entidades de defesa de direitos. (Origem: PRT MS/GM 485/2014, Art. 10)
Parágrafo Único. Os medicamentos para profilaxias indicadas, inclusive anticoncepção de emergência, deverão ser dispensados e administrados nos serviços ambulatoriais às vítimas de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 10, Parágrafo Único)
Art. 689. O Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações realizará a notificação compulsória das situações atendidas através da Ficha de Notificação/Investigação Individual de Violências Doméstica, Sexual e/ou outras Violências, disponível no Sistema de Informação de Agravos de Notificação (SINAN). (Origem: PRT MS/GM 485/2014, Art. 11)
Art. 690. O monitoramento e a avaliação do Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações constituem responsabilidade do Ministério da Saúde e das respectivas Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios. (Origem: PRT MS/GM 485/2014, Art. 12)
§ 1º O Ministério da Saúde, por meio do Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS), em parceria com demais áreas do Ministério da Saúde, estabelecerá em conjunto com as Secretarias de Saúde dos estados, do Distrito Federal e dos municípios, o apoio técnico para a implementação, o monitoramento e a avaliação do Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações. (Origem: PRT MS/GM 485/2014, Art. 12, § 1º)
§ 2º O Ministério da Saúde e as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios desenvolverão mecanismos de informação e comunicação à população sobre os endereços em que estejam situados os Serviços de Referência para Atenção Integral às Pessoas em Situação de Violência Sexual, de acordo com os dados registrados no Sistema do Cadastro Nacional de Estabelecimentos de Saúde (SCNES). (Origem: PRT MS/GM 485/2014, Art. 12, § 2º)
Art. 691. Compete ao Ministério da Saúde: (Origem: PRT MS/GM 485/2014, Art. 13)
I - financiar, de acordo com a sua disponibilidade orçamentária e financeira, a adequação dos espaços físicos, equipamentos e insumos para atendimento às pessoas em situação de violência sexual com coleta de informações e vestígios; (Origem: PRT MS/GM 485/2014, Art. 13, I)
II - criar procedimento específico na Tabela de Procedimentos, Medicamentos e OPM do SUS para atendimento multiprofissional e interdisciplinar às vítimas de violência sexual em serviços de referência; e (Origem: PRT MS/GM 485/2014, Art. 13, II)
III - cofinanciar as ações de atenção integral às pessoas em situação de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 13, III)
Art. 692. Compete às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios: (Origem: PRT MS/GM 485/2014, Art. 14)
I - adotar as providências necessárias para a organização do Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações; (Origem: PRT MS/GM 485/2014, Art. 14, I)
II - orientar o cadastramento dos estabelecimentos de saúde no SCNES, de acordo com as classificações descritas no Anexo LV ; (Origem: PRT MS/GM 485/2014, Art. 14, II)
III - estabelecer fluxos e mecanismos de referência e contrarreferência entre os serviços, de forma que o acesso seja ampliado e o atendimento adequado e humanizado, observada a organização das redes regionalizadas de atenção; (Origem: PRT MS/GM 485/2014, Art. 14, III)
IV - realizar o acompanhamento, o controle e a avaliação das ações e serviços para o fortalecimento das políticas de atenção às pessoas em situação de violência sexual no âmbito dos Estados, do Distrito Federal e dos Municípios em parceria com o Ministério da Saúde; e (Origem: PRT MS/GM 485/2014, Art. 14, IV)
V - implementar ações e estratégias de apoio intersetorial ao enfrentamento da violência sexual previstas nas normas, regras e diretrizes técnicas para prevenção e tratamento dos agravos resultantes da violência sexual em vigor, incluindo-se: (Origem: PRT MS/GM 485/2014, Art. 14, V)
a) a qualificação periódica de equipes multiprofissionais; (Origem: PRT MS/GM 485/2014, Art. 14, V, a)
b) o desenvolvimento de mecanismos de supervisão, apoio técnico e incorporação de tecnologias que favoreçam a qualificação e expansão do número de Serviços de Atenção às Pessoas em Situação de Violência Sexual, de acordo com as potencialidades regionais e locais; e (Origem: PRT MS/GM 485/2014, Art. 14, V, b)
c) a articulação dos diversos serviços de saúde a outros recursos públicos no sentido de garantir o acesso, o cuidado e os encaminhamentos necessários para a proteção, defesa de direitos e responsabilização das pessoas que cometem violências. (Origem: PRT MS/GM 485/2014, Art. 14, V, c)
Art. 693. Caberá ao Ministério da Saúde, em conjunto com as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios, tornar pública, inclusive no endereço eletrônico do Ministério da Saúde, a relação de estabelecimentos de saúde que atenderão pessoas em situação de violência sexual no âmbito do SUS, de acordo com suas especificidades. (Origem: PRT MS/GM 485/2014, Art. 15)
Seção II
Do Procedimento de Justificação e Autorização da Interrupção da Gravidez nos Casos Previstos em Lei
Art. 694. O Procedimento de Justificação e Autorização da Interrupção da Gravidez nos casos previstos em lei é condição necessária para adoção de qualquer medida de interrupção da gravidez no âmbito do Sistema Único de Saúde, excetuados os casos que envolvem riscos de morte à mulher. (Origem: PRT MS/GM 1508/2005, Art. 1º)
Art. 695. O Procedimento de Justificação e Autorização da Interrupção da Gravidez nos casos previstos em lei compõe-se de quatro fases que deverão ser registradas no formato de Termos, arquivados anexos ao prontuário médico, garantida a confidencialidade desses termos. (Origem: PRT MS/GM 1508/2005, Art. 2º)
Art. 696. A primeira fase é constituída pelo relato circunstanciado do evento, realizado pela própria gestante, perante dois profissionais de saúde do serviço. (Origem: PRT MS/GM 1508/2005, Art. 3º)
Parágrafo Único. O Termo de Relato Circunstanciado deverá ser assinado pela gestante ou, quando incapaz, também por seu representante legal, bem como por dois profissionais de saúde do serviço, e conterá: (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único)
I - local, dia e hora aproximada do fato; (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, I)
II - tipo e forma de violência; (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, II)
III - descrição dos agentes da conduta, se possível; e (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, III)
IV - identificação de testemunhas, se houver. (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, IV)
Art. 697. A segunda fase dá-se com a intervenção do médico que emitirá parecer técnico após detalhada anamnese, exame físico geral, exame ginecológico, avaliação do laudo ultrassonográfico e dos demais exames complementares que porventura houver. (Origem: PRT MS/GM 1508/2005, Art. 4º)
§ 1º Paralelamente, a mulher receberá atenção e avaliação especializada por parte da equipe de saúde multiprofissional, que anotará suas avaliações em documentos específicos. (Origem: PRT MS/GM 1508/2005, Art. 4º, § 1º)
§ 2º Três integrantes, no mínimo, da equipe de saúde multiprofissional subscreverão o Termo de Aprovação de Procedimento de Interrupção da Gravidez, não podendo haver desconformidade com a conclusão do parecer técnico. (Origem: PRT MS/GM 1508/2005, Art. 4º, § 2º)
§ 3º A equipe de saúde multiprofissional deve ser composta, no mínimo, por obstetra, anestesista, enfermeiro, assistente social e/ou psicólogo. (Origem: PRT MS/GM 1508/2005, Art. 4º, § 3º)
Art. 698. A terceira fase verifica-se com a assinatura da gestante no Termo de Responsabilidade ou, se for incapaz, também de seu representante legal, e esse Termo conterá advertência expressa sobre a previsão dos crimes de falsidade ideológica (art. 299 do Código Penal) e de aborto (art. 124 do Código Penal), caso não tenha sido vítima de violência sexual. (Origem: PRT MS/GM 1508/2005, Art. 5º)
Art. 699. A quarta fase se encerra com o Termo de Consentimento Livre e Esclarecido, que obedecerá aos seguintes requisitos: (Origem: PRT MS/GM 1508/2005, Art. 6º)
I - o esclarecimento à mulher deve ser realizado em linguagem acessível, especialmente sobre: (Origem: PRT MS/GM 1508/2005, Art. 6º, I)
a) os desconfortos e riscos possíveis à sua saúde; (Origem: PRT MS/GM 1508/2005, Art. 6º, I, a)
b) os procedimentos que serão adotados quando da realização da intervenção médica; (Origem: PRT MS/GM 1508/2005, Art. 6º, I, b)
c) a forma de acompanhamento e assistência, assim como os profissionais responsáveis; e (Origem: PRT MS/GM 1508/2005, Art. 6º, I, c)
d) a garantia do sigilo que assegure sua privacidade quanto aos dados confidenciais envolvidos, exceto quanto aos documentos subscritos por ela em caso de requisição judicial; (Origem: PRT MS/GM 1508/2005, Art. 6º, I, d)
II - deverá ser assinado ou identificado por impressão datiloscópica, pela gestante ou, se for incapaz, também por seu representante legal; e (Origem: PRT MS/GM 1508/2005, Art. 6º, II)
III - deverá conter declaração expressa sobre a decisão voluntária e consciente de interromper a gravidez. (Origem: PRT MS/GM 1508/2005, Art. 6º, III)
Art. 700. Todos os documentos que integram o Procedimento de Justificação e Autorização da Interrupção da Gravidez nos casos previstos em lei, conforme Modelos dos Anexos LXIII, LXIV, LXV, LXVI e LXVII desta Seção, deverão ser assinados pela gestante, ou, se for incapaz, também por seu representante legal, elaborados em duas vias, sendo uma fornecida para a gestante. (Origem: PRT MS/GM 1508/2005, Art. 7º)
CAPÍTULO VIII
DO PROGRAMA DE ASSISTÊNCIA AOS PORTADORES DA DOENÇA ALZHEIMER
Art. 701. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa de Assistência aos Portadores da Doença de Alzheimer. (Origem: PRT MS/GM 703/2002, Art. 1º)
Art. 702. O Programa ora instituído será desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em cooperação com as respectivas Redes Estaduais de Assistência à Saúde do Idoso e seus Centros de Referência em Assistência à Saúde do Idoso. (Origem: PRT MS/GM 703/2002, Art. 2º)
Parágrafo Único. Os Centros de Referência integrantes da Rede mencionada no caput deste Artigo são os responsáveis pelo diagnóstico, tratamento e acompanhamento dos pacientes, orientação a familiares e cuidadores e o que mais for necessário à adequada atenção aos pacientes portadores da Doença de Alzheimer. (Origem: PRT MS/GM 703/2002, Art. 2º, Parágrafo Único)
Art. 703. A Secretaria de Atenção à Saúde deverá estabelecer o Protocolo Clínico e Diretrizes Terapêuticas para o tratamento da demência por Doença de Alzheimer, incluir os medicamentos utilizados neste tratamento no rol dos Medicamentos Excepcionais e adotar as demais medidas que forem necessárias ao fiel cumprimento do disposto neste Capítulo. (Origem: PRT MS/GM 703/2002, Art. 3º)
CAPÍTULO IX
DA ASSISTÊNCIA DE ALTA COMPLEXIDADE EM TERAPIA NUTRICIONAL
Art. 704. Ficam instituídos, no âmbito do Sistema Único de Saúde, mecanismos para a organização e implantação da assistência de Alta Complexidade em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 1º)
Parágrafo Único. A assistência de Alta Complexidade em Terapia Nutricional será composta por: (Origem: PRT MS/GM 343/2005, Art. 1º, Parágrafo Único)
I - Unidades de Assistência de Alta Complexidade em Terapia Nutricional; e (Origem: PRT MS/GM 343/2005, Art. 1º, Parágrafo Único, I)
II - Centros de Referência de Alta Complexidade em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 1º, Parágrafo Único, II)
Art. 705. As Unidades de Assistência de Alta Complexidade em Terapia Nutricional e os Centros de Referência de Alta Complexidade em Terapia Nutricional proporcionarão condições técnicas, instalações físicas, equipamentos e recursos humanos adequados à prestação de assistência hospitalar e especializada a pacientes em risco nutricional ou desnutridos, incluindo, na sua solicitação de credenciamento, os critérios da Política Nacional de Humanização. (Origem: PRT MS/GM 343/2005, Art. 2º)
Parágrafo Único. As aptidões e atribuições das Unidades e dos Centros de Referência de Alta Complexidade em Terapia Nutricional serão regulamentadas pela Secretaria de Atenção à Saúde - SAS em ato próprio. (Origem: PRT MS/GM 343/2005, Art. 2º, Parágrafo Único)
Art. 706. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema Municipal de Saúde, de acordo com as respectivas condições de gestão e a divisão de responsabilidades definida na regulamentação, adotarão as providências necessárias ao credenciamento das Unidades de Assistência de Alta Complexidade em Terapia Nutricional e dos Centros de Referência de Alta Complexidade em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 3º)
Art. 707. Fica instituída a "Câmara Técnica em Terapia Nutricional", subordinada à Secretaria de Atenção à Saúde, com o objetivo de acompanhar a implantação e implementação do disposto neste Capítulo. (Origem: PRT MS/GM 343/2005, Art. 4º)
Art. 708. Os seguintes instrumentos de gestão devem ser regulamentados: (Origem: PRT MS/GM 343/2005, Art. 5º)
I - Banco de Dados dos Usuários de Terapia Nutricional; e (Origem: PRT MS/GM 343/2005, Art. 5º, I)
II - Protocolos de Triagem e Avaliação Nutricional, Protocolos de Indicação de Terapia Nutricional e de Protocolos para o Acompanhamento dos Pacientes em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 5º, II)
Art. 709. A Secretaria de Atenção à Saúde adotará as medidas necessárias à implantação do disposto neste Capítulo. (Origem: PRT MS/GM 343/2005, Art. 6º)
Art. 710. Os processos de solicitação de habilitação dos estabelecimentos de saúde para realização dos procedimentos em Terapia Nutricional deverão ser aprovados pela Comissão Intergestores Bipartite (CIB) e encaminhados para apreciação da Coordenação-Geral de Alta Complexidade, do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 343/2005, Art. 7º)
Art. 711. Os recursos orçamentários de que trata este Capítulo correrão por conta do orçamento do Ministério da Saúde, devendo onerar os Programas de Trabalho: (Origem: PRT MS/GM 343/2005, Art. 8º)
I - 10.302.1220.8585 - Atenção à Saúde da População nos Municípios habilitados em Gestão Plena do Sistema e nos Estados habilitados em Gestão Plena/Avançada; e (Origem: PRT MS/GM 343/2005, Art. 8º, I)
II - 10.302.1220.8587 - Atenção à Saúde da População nos Municípios não-habilitados em Gestão Plena do Sistema e nos estados não-habilitados em Gestão Plena/Avançada. (Origem: PRT MS/GM 343/2005, Art. 8º, II)
CAPÍTULO X
DA ATENÇÃO AOS PORTADORES DE HIPERTENSÃO ARTERIAL E DE DIABETES MELLITUS
Seção I
Do Elenco de Medicamentos e Insumos Disponibilizados pelo SUS, nos Termos da Lei nº. 11.347, de 2006, aos Usuários Portadores de Diabetes Mellitus
Art. 712. Fica definido o elenco de medicamentos e insumos que devem ser disponibilizados na rede do Sistema Único de Saúde, destinados ao monitoramento da glicemia capilar dos portadores de diabetes mellitus, nos termos da Lei Federal nº 11.347, de 2006. (Origem: PRT MS/GM 2583/2007, Art. 1º)
I - MEDICAMENTOS: (Origem: PRT MS/GM 2583/2007, Art. 1º, I)
a) glibenclamida 5 mg comprimido; (Origem: PRT MS/GM 2583/2007, Art. 1º, I, a)
b) cloridrato de metformina 500 mg e 850 mg comprimido; (Origem: PRT MS/GM 2583/2007, Art. 1º, I, b)
c) glicazida 80 mg comprimido; (Origem: PRT MS/GM 2583/2007, Art. 1º, I, c)
d) insulina humana NPH - suspensão injetável 100 UI/mL; e (Origem: PRT MS/GM 2583/2007, Art. 1º, I, d)
e) insulina humana regular - suspensão injetável 100 UI/mL. (Origem: PRT MS/GM 2583/2007, Art. 1º, I, e)
II - INSUMOS: (Origem: PRT MS/GM 2583/2007, Art. 1º, II)
a) seringas com agulha acoplada para aplicação de insulina; (Origem: PRT MS/GM 2583/2007, Art. 1º, II, a)
b) tiras reagentes de medida de glicemia capilar; e (Origem: PRT MS/GM 2583/2007, Art. 1º, II, b)
c) lancetas para punção digital. (Origem: PRT MS/GM 2583/2007, Art. 1º, II, c)
Art. 713. Os insumos do art. 712, II devem ser disponibilizados aos usuários do SUS, portadores de diabetes mellitus insulino-dependentes e que estejam cadastrados no cartão SUS e/ou no Programa de Hipertensão e Diabetes (Hiperdia). (Origem: PRT MS/GM 2583/2007, Art. 2º)
§ 1º As tiras reagentes de medida de glicemia capilar serão fornecidas mediante a disponibilidade de aparelhos medidores (glicosímetros). (Origem: PRT MS/GM 2583/2007, Art. 2º, § 1º)
§ 2º A prescrição para o automonitoramento será feita a critério da Equipe de Saúde responsável pelo acompanhamento do usuário portador de diabetes mellitus, observadas as normas estabelecidas no Anexo LXXXVII . (Origem: PRT MS/GM 2583/2007, Art. 2º, § 2º)
§ 3º O fornecimento de seringas e agulhas para administração de insulina deve seguir o protocolo estabelecido para o manejo e tratamento do diabetes mellitus contido no nº 16 da série "Cadernos da Atenção Básica - Ministério da Saúde, disponível em versões impressa e eletrônica no endereço http://dab.saude.gov.br/portaldab/biblioteca.php. (Origem: PRT MS/GM 2583/2007, Art. 2º, § 3º)
Art. 714. Os usuários portadores de diabetes mellitus insulino-dependentes devem estar inscritos nos Programas de Educação para Diabéticos, promovidos pelas unidades de saúde do SUS, executados conforme descrito: (Origem: PRT MS/GM 2583/2007, Art. 3º)
I - a participação de portadores de diabetes mellitus pressupõe vínculo com a unidade de saúde do SUS responsável pela oferta do Programa de Educação, que deve estar inserido no processo terapêutico individual e coletivo, incluindo acompanhamento clínico e seguimento terapêutico, formalizados por meio dos devidos registros em prontuário; (Origem: PRT MS/GM 2583/2007, Art. 3º, I)
II - as ações programáticas abordarão componentes do cuidado clínico, incluindo a promoção da saúde, o gerenciamento do cuidado e as atualizações técnicas relativas a diabetes mellitus; (Origem: PRT MS/GM 2583/2007, Art. 3º, II)
III - as ações devem ter como objetivos o desenvolvimento da autonomia para o autocuidado, a construção de habilidades e o desenvolvimento de atitudes que conduzam à contínua melhoria do controle sobre a doença, objetivando o progressivo aumento da qualidade de vida e a redução das complicações do diabetes mellitus. (Origem: PRT MS/GM 2583/2007, Art. 3º, III)
Art. 715. A aquisição, a distribuição, a dispensação e o financiamento dos medicamentos e insumos de que trata esta Seção são de responsabilidade da União, dos Estados, do Distrito Federal e dos Municípios, conforme pactuação Tripartite e as normas do Componente Básico da Assistência Farmacêutica. (Origem: PRT MS/GM 2583/2007, Art. 4º)
TÍTULO VI
DA ORGANIZAÇÃO DO SUS
CAPÍTULO I
DA EDUCAÇÃO PERMANENTE EM SAÚDE
Seção I
Programa de Formação de Profissional de Nível Médio para a Saúde (PROFAPS)
Art. 716. Ficam definidas as diretrizes e estratégias para a implementação do Programa de Formação de Profissional de Nível Médio para a Saúde (PROFAPS). (Origem: PRT MS/GM 3189/2009, Art. 1º)
§ 1º A educação profissional a que se refere esta Seção será desenvolvida por meio de cursos e programas de formação inicial e continuada de trabalhadores, incluídos a capacitação, o aperfeiçoamento, a especialização e a atualização em todos os níveis de escolaridade, e a educação profissional técnica de nível médio desenvolvida, de forma articulada, com o ensino médio. (Origem: PRT MS/GM 3189/2009, Art. 1º, § 1º)
§ 2º O programa de formação profissional técnica de nível médio em áreas estratégicas para a saúde deve considerar as especificidades regionais, as necessidades de formação e a capacidade de oferta institucional de ações técnicas de educação de nível médio na saúde. (Origem: PRT MS/GM 3189/2009, Art. 1º, § 2º)
Art. 717. A proposição das ações de formação profissional técnica de nível médio em áreas estratégicas para a saúde será conduzida pelos Colegiados de Gestão Regional, com a participação das Comissões de Integração Ensino-Serviço (CIES). (Origem: PRT MS/GM 3189/2009, Art. 2º)
§ 1º Os Colegiados de Gestão Regional, considerando as especificidades locais, as necessidades de formação técnica de nível médio identificadas na região de saúde observadas no Plano Estadual de Educação Permanente em Saúde definirão os cursos de formação profissional técnica de nível médio, contemplando as prioridades constantes na medida 4.5 do Programa MAIS SAÚDE: Direito de Todos, instituído pelo Governo Federal por meio do Ministério da Saúde. (Origem: PRT MS/GM 3189/2009, Art. 2º, § 1º)
§ 2º As CIES deverão participar da formulação e do desenvolvimento dos programas de formação profissional técnica de nível médio com vistas a atender às demandas de áreas estratégicas para a saúde. (Origem: PRT MS/GM 3189/2009, Art. 2º, § 2º)
Art. 718. As áreas técnicas estratégicas prioritárias para a educação profissional técnica de nível médio na saúde são: Radiologia, Patologia Clínica e Citotécnico, Hemoterapia, Manutenção de Equipamentos, Saúde Bucal, Prótese Dentária, Vigilância em Saúde e Enfermagem. (Origem: PRT MS/GM 3189/2009, Art. 3º)
Art. 719. As áreas estratégicas para o nível de aperfeiçoamento/capacitação são: Saúde do Idoso para as equipes da Estratégia Saúde da Família e equipes de enfermagem das instituições de longa permanência, e a formação dos Agentes Comunitários de Saúde. (Origem: PRT MS/GM 3189/2009, Art. 4º)
Parágrafo Único. A formação dos Agentes Comunitários de Saúde obedecerá as disposições da Seção V do Capítulo I do Título VI da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 3189/2009, Art. 4º, Parágrafo Único)
Art. 720. Terão prioridade na formulação e execução técnicapedagógica dos cursos do PROFAPS as Escolas Técnicas de Saúde do SUS, as Escolas de Saúde Pública e os Centros Formadores vinculados aos gestores estaduais e municipais de saúde, como um componente para seu fortalecimento institucional e pedagógico. (Origem: PRT MS/GM 3189/2009, Art. 5º)
Parágrafo Único. A pactuação dos projetos na CIB poderá contemplar outras instituições formadoras, desde que legalmente reconhecidas e habilitadas para este fim, quando, no seu âmbito regional, não houver instituições formadoras citadas no caput do artigo ou quando a capacidade da mesma apresentar-se insuficiente para a demanda de formação. (Origem: PRT MS/GM 3189/2009, Art. 5º, Parágrafo Único)
Art. 721. O Ministério da Saúde e as Secretarias de Saúde Estaduais, Municipais e do Distrito Federal serão responsáveis por: (Origem: PRT MS/GM 3189/2009, Art. 6º)
I - planejar o PROFAPS, no seu âmbito de gestão, contando com a colaboração das CIES; e (Origem: PRT MS/GM 3189/2009, Art. 6º, I)
II - estimular, acompanhar e regular a utilização dos serviços de saúde, em seu âmbito de gestão, para atividades curriculares e extracurriculares dos cursos de formação técnica de nível médio. (Origem: PRT MS/GM 3189/2009, Art. 6º, II)
Art. 722. Os projetos a serem encaminhados à Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS), para liberação dos recursos do PROFAPS, deverão seguir as diretrizes da Política Nacional de Educação Permanente em Saúde e as orientações para a elaboração dos projetos constantes dos Anexos XCIII e XCIV da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 3189/2009, Art. 7º)
Art. 723. A SGTES/MS deverá monitorar, acompanhar e supervisionar as ações previstas no PROFAPS estabelecendo cooperação técnica com as instituições formadoras na formulação e execução dos cursos. (Origem: PRT MS/GM 3189/2009, Art. 8º)
Art. 724. As secretarias de saúde dos estados, dos municípios e do Distrito Federal manterão, à disposição da SGTES/MS e dos órgãos de fiscalização e controle, todas as informações relativas à execução das atividades de implementação do PROFAPS. (Origem: PRT MS/GM 3189/2009, Art. 9º)
Seção II
Da Implementação e Execução do Programa de Bolsas para a Educação pelo Trabalho, de Responsabilidade Técnico-administrativa do Ministério da Saúde
Art. 725. Ficam aprovadas as normas para a implementação e a execução do Programa de Bolsas para a Educação pelo Trabalho, de responsabilidade técnico-administrativa do Ministério da Saúde. (Origem: PRT MS/GM 1111/2005, Art. 1º)
Art. 726. O Programa de Bolsas para a Educação pelo Trabalho é uma estratégia para provimento e fixação de profissionais em programas, projetos, ações e atividades em regiões prioritárias para o Sistema Único de Saúde (SUS), destinado aos estudantes de graduação dos cursos da área da saúde, profissionais de nível superior e trabalhadores da área da saúde e tem como objetivo promover a vivência, estágios, aperfeiçoamentos, formação e especialização de nível superior e médio em áreas prioritárias. (Origem: PRT MS/GM 1111/2005, Art. 2º) (com redação dada pela PRT MS/GM 754/2012)
I - possibilitar que o Ministério da Saúde cumpra seu papel constitucional de ordenador da formação de profissionais de saúde por meio da indução e do apoio ao desenvolvimento dos processos formativos necessários em todo o País, de acordo com características sociais e regionais; (Origem: PRT MS/GM 1111/2005, Art. 2º, I)
II - contribuir para a formação de profissionais de saúde com perfil adequado às necessidades e políticas de saúde do País; (Origem: PRT MS/GM 1111/2005, Art. 2º, II)
III - sensibilizar e preparar estudantes e profissionais de saúde para o adequado enfrentamento das diferentes realidades de vida e de saúde da população brasileira em todo o território nacional; (Origem: PRT MS/GM 1111/2005, Art. 2º, III)
IV - induzir o provimento e favorecer a fixação de profissionais de saúde no âmbito da atenção em saúde com qualidade em todo o território nacional; e (Origem: PRT MS/GM 1111/2005, Art. 2º, IV)
V - contribuir para a universalidade e a equidade no acesso à atenção em saúde. (Origem: PRT MS/GM 1111/2005, Art. 2º, V)
Art. 727. Para a mais adequada execução e implementação do presente Programa, o Ministério da Saúde poderá estabelecer cooperação técnica, financeira ou operacional com instituições de ensino, de pesquisa e de desenvolvimento científico e tecnológico e com as secretarias estaduais e as secretarias municipais de saúde. (Origem: PRT MS/GM 1111/2005, Art. 3º)
Art. 728. O Programa de Bolsas para a Educação pelo Trabalho terá as seguintes abrangências: (Origem: PRT MS/GM 1111/2005, Art. 4º)
I - bolsas para acadêmicos, modalidade iniciação ao trabalho; (Origem: PRT MS/GM 1111/2005, Art. 4º, I)
II - bolsas para profissionais em educação em serviço, sob supervisão docente-assistencial, orientadas ao aperfeiçoamento e à especialização ou modalidade residente; e (Origem: PRT MS/GM 1111/2005, Art. 4º, II)
III - bolsas para corpo docente da educação em serviço, sob supervisão docente-assistencial, orientadas ao aperfeiçoamento e à especialização, modalidade preceptor, tutor e/ou orientador de serviço. (Origem: PRT MS/GM 1111/2005, Art. 4º, III)
IV - bolsa destinada ao trabalhador-estudante. (Origem: PRT MS/GM 1111/2005, Art. 4º, IV) (dispositivo acrescentado pela PRT MS/GM 754/2012)
Parágrafo Único. Para a instituição do Programa estabelecido no art. 725, é obrigatória a figura do preceptor, ficando facultada a inserção do tutor ou do orientador de serviço, caso não haja possibilidade de garantir ambos, conforme as peculiaridades de cada realidade local. (Origem: PRT MS/GM 1111/2005, Art. 4º, Parágrafo Único)
Art. 729. A Bolsa para a Iniciação ao Trabalho é dirigida aos estudantes de graduação da área da saúde que estejam participando regularmente de atividades curriculares ou de extensão que proporcionem vivência ou estágio no SUS, realizados em áreas temáticas, em regiões geográficas ou em serviços assistenciais prioritários ao sistema de saúde. (Origem: PRT MS/GM 1111/2005, Art. 5º)
Art. 730. A Bolsa para o Aperfeiçoamento e Especialização é dirigida aos profissionais de saúde que estejam cursando programas de aperfeiçoamento e especialização em serviço, sob supervisão docente assistencial ou de residência em área profissional da saúde, credenciados junto à Comissão Nacional de Residência Multiprofissional em Saúde (CNRMS), e a médicos que estejam cursando programas de residência médica, credenciados junto à CNRM, dando-se preferência, em qualquer caso, às áreas temáticas de regiões geográficas ou aos serviços assistenciais prioritários ao sistema de saúde. (Origem: PRT MS/GM 1111/2005, Art. 6º)
Art. 731. A Bolsa para o Corpo Docente é dirigida àqueles que exercem funções de preceptoria, de tutoria e de orientação em serviço, conforme as seguintes determinações: (Origem: PRT MS/GM 1111/2005, Art. 7º)
I - preceptoria: função de supervisão docente-assistencial por área específica de atuação ou de especialidade profissional, dirigida aos profissionais de saúde com curso de graduação e mínimo de três anos de experiência em área de aperfeiçoamento ou especialidade ou titulação acadêmica de especialização ou de residência, que exerçam atividade de organização do processo de aprendizagem especializado e de orientação técnica aos profissionais ou estudantes, respectivamente em aperfeiçoamento ou especialização ou em estágio ou vivência de graduação ou de extensão; (Origem: PRT MS/GM 1111/2005, Art. 7º, I)
II - tutoria: função de supervisão docente-assistencial no campo de aprendizagens profissionais da área da saúde, exercida em campo, dirigida aos profissionais de saúde com curso de graduação e mínimo de três anos de atuação profissional, que exerçam papel de orientadores de referência para os profissionais ou estudantes, respectivamente, em aperfeiçoamento ou especialização ou em estágio ou vivência de graduação ou de extensão, devendo pertencer à equipe local de assistência e estar diariamente presente nos ambientes onde se desenvolvem as aprendizagens em serviço; e (Origem: PRT MS/GM 1111/2005, Art. 7º, II)
III - orientação de serviço: função de supervisão docente-assistencial de caráter ampliado, exercida em campo, dirigida aos trabalhadores de saúde de quaisquer níveis de formação, atuantes nos ambientes em que se desenvolvem programas de aperfeiçoamento e especialização em serviço, bem como de iniciação ao trabalho, estágios e vivências, respectivamente, para profissionais e estudantes da área da saúde, e que exerçam atuação específica de instrutoria, devendo reportar-se ao tutor, sempre que necessário, respeitando a legislação em vigor. (Origem: PRT MS/GM 1111/2005, Art. 7º, III)
Art. 732. A bolsa para o trabalhador-estudante será dirigida a profissionais que estejam realizando curso de pós-graduação lato ou stricto sensu e que integrem programas, projetos, ações e atividades em regiões prioritárias para o Sistema Único de Saúde, observadas as estratégias do Ministério da Saúde para o provimento e a fixação de profissionais de saúde. (Origem: PRT MS/GM 1111/2005, Art. 7º-A)
Art. 733. As Bolsas para a Educação pelo Trabalho que constituem o Programa terão como valores mínimos os seguintes padrões de referência: (Origem: PRT MS/GM 1111/2005, Art. 8º)
I - para as Bolsas de Iniciação ao Trabalho, a Bolsa para a Iniciação Tecnológica, nível A (ITI-A), do Quadro de Níveis de Bolsas de Fomento Tecnológico e Extensão Inovadora de Longa Duração, do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq); (Origem: PRT MS/GM 1111/2005, Art. 8º, I)
II - para as Bolsas de Aperfeiçoamento e Especialização, a Bolsa de Residência Médica, regulamentada por lei específica, com a qual essa modalidade guarda simetria e isonomia; e (Origem: PRT MS/GM 1111/2005, Art. 8º, II)
III - para as Bolsas do Corpo Docente, as Bolsas para o Desenvolvimento Tecnológico, nível DTI-ID, para Preceptores e Tutores, Apoio Técnico, níveis ATP-A ou ATP-B, para Orientadores de Serviço, respectivamente para trabalhadores detentores ou não de formação superior, conforme o Quadro de Níveis de Bolsas de Fomento Tecnológico e Extensão Inovadora de Longa Duração, do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). (Origem: PRT MS/GM 1111/2005, Art. 8º, III)
Parágrafo Único. O valor da bolsa para trabalhador-estudante será fixado pelo Ministério da Saúde a cada programa, projeto, ação ou atividade a que estiver vinculada. (Origem: PRT MS/GM 1111/2005, Art. 8º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 754/2012)
Art. 734. O Ministério da Saúde poderá majorar os valores estabelecidos para as bolsas, considerando as necessidades de provimento e fixação de profissionais de saúde nas diferentes temáticas e serviços assistenciais ou relativos à dificuldade de acesso e locomoção nos diferentes locais e regiões do País. (Origem: PRT MS/GM 1111/2005, Art. 9º)
Art. 735. A seleção dos participantes do Programa de Bolsas para a Educação pelo Trabalho será realizada mediante seleção pública com ampla divulgação, de acordo com as normas que regulamentam os processos de formação de nível superior e médio, estágios e vivências de graduação e extensão universitária, o aperfeiçoamento e a especialização em área profissional, os programas de residência e programas, projetos, ações e atividades que visem ao provimento e à fixação de profissionais de saúde em regiões prioritárias para o SUS, devendo explicitar, sempre que possível: (Origem: PRT MS/GM 1111/2005, Art. 10) (com redação dada pela PRT MS/GM 754/2012)
I - o número de vagas disponibilizadas para cada modalidade de bolsas; (Origem: PRT MS/GM 1111/2005, Art. 10, I) (dispositivo acrescentado pela PRT MS/GM 754/2012)
II - a área temática; e (Origem: PRT MS/GM 1111/2005, Art. 10, II) (dispositivo acrescentado pela PRT MS/GM 754/2012)
III - a região geográfica e o ambiente onde se desenvolverão as atividades de aprendizagem em serviço. (Origem: PRT MS/GM 1111/2005, Art. 10, III) (dispositivo acrescentado pela PRT MS/GM 754/2012)
Parágrafo Único. As atividades de educação pelo trabalho serão desenvolvidas exclusivamente no âmbito do SUS. (Origem: PRT MS/GM 1111/2005, Art. 10, Parágrafo Único) (com redação dada pela PRT MS/GM 754/2012)
Art. 736. O Ministério da Saúde tem a responsabilidade técnico-administrativa do Programa, resguardado o papel da Comissão Intersetorial de Recursos Humanos, do Conselho Nacional de Saúde, atendendo ao disposto no art. 12 da Lei nº 8.080, de 19 de setembro de 1990 (Lei Orgânica da Saúde), e do Ministério da Educação nas áreas de competências. (Origem: PRT MS/GM 1111/2005, Art. 11)
Art. 737. Os recursos orçamentários de que trata esta Seção correrão por conta do orçamento do Ministério da Saúde, devendo onerar o seguinte Programa de Trabalho: (Origem: PRT MS/GM 1111/2005, Art. 12)
I - 10.128.2015.20YD - Educação e Formação em Saúde; e (Origem: PRT MS/GM 1111/2005, Art. 12, I)
Seção III
Do Programas de Residência Médica em Medicina de Família e Comunidade (PRM-MFC), por meio do Programa de Bolsas para a Educação pelo Trabalho
Art. 738. Os programas de residência médica em medicina de família e comunidade (PRM-MFC) serão apoiados por meio do Programa de Bolsas para a Educação pelo Trabalho, do Ministério da Saúde. (Origem: PRT MS/GM 1143/2005, Art. 1º)
Parágrafo Único. Os programas deverão ter como campo central de práticas da especialidade os ambientes e os territórios de atuação das equipes de saúde da família que atuam nas áreas mais carentes dos municípios, complementado pelas demais unidades assistenciais da cidade e região, tendo em vista o conjunto das aprendizagens necessárias à especialidade. (Origem: PRT MS/GM 1143/2005, Art. 1º, Parágrafo Único)
Art. 739. Os programas de residência médica em medicina de família e comunidade devem ser construídos mediante cooperação entre Instituições Formadoras, Secretarias Municipais e Estaduais de Saúde. (Origem: PRT MS/GM 1143/2005, Art. 2º)
Parágrafo Único. A cooperação deve incluir a definição do itinerário de formação, considerando a situação de saúde e a realidade de trabalho existente na região, bem como a oferta das condições necessárias para a realização do processo de formação. (Origem: PRT MS/GM 1143/2005, Art. 2º, Parágrafo Único)
Art. 740. À Instituição Formadora participante dos PRM-MCF, apoiada pelo Ministério da Saúde, compete: (Origem: PRT MS/GM 1143/2005, Art. 6º)
I - credenciamento do programa de residência médica em medicina de família e comunidade junto à Comissão Nacional de Residência Médica; (Origem: PRT MS/GM 1143/2005, Art. 6º, I)
II - promover oferta de programa de preparação e educação permanente em saúde para os preceptores e tutores que tomarem parte da residência; e (Origem: PRT MS/GM 1143/2005, Art. 6º, II)
III - cooperar com o município participante no desenvolvimento das capacidades pedagógicas, assistenciais e tecnológicas locais e regionais. (Origem: PRT MS/GM 1143/2005, Art. 6º, III)
Art. 741. À Secretaria Municipal ou Estadual de Saúde participante dos PRM-MCF apoiada pelo Ministério da Saúde, compete: (Origem: PRT MS/GM 1143/2005, Art. 7º)
I - cumprir as metas estabelecidas no Programa de Expansão da Estratégia de Saúde da Família - PROESF/ atenção básica; (Origem: PRT MS/GM 1143/2005, Art. 7º, I)
II - cooperar com a Instituição Formadora na montagem da residência médica e na identificação e liberação de médicos da rede para o cumprimento dos papéis de preceptor e de tutor; (Origem: PRT MS/GM 1143/2005, Art. 7º, II)
III - complementar a bolsa para o residente, conforme o art. 614 da Portaria de Consolidação nº 6; (Origem: PRT MS/GM 1143/2005, Art. 7º, III)
IV - eleger as áreas comprovadamente mais carentes do município para a inserção dos médicos em formação, junto às equipes de saúde da família; e (Origem: PRT MS/GM 1143/2005, Art. 7º, IV)
V - assegurar as condições para a participação do médico residente em todas as atividades pertinentes à sua formação, bem como para o desenvolvimento da educação permanente em saúde de todos os profissionais envolvidos no processo. (Origem: PRT MS/GM 1143/2005, Art. 7º, V)
Seção IV
Da Estratégia de Qualificação das Redes de Atenção à Saúde (RAS) por meio do Incentivo à Formação de Especialistas na Modalidade Residência Médica em Áreas Estratégicas do SUS
Subseção I
Disposições Gerais
(Origem: PRT MS/GM 1248/2013, CAPÍTULO I)
Art. 742. Fica instituída a Estratégia de Qualificação das Redes de Atenção à Saúde (RAS) por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 1248/2013, Art. 1º)
Art. 743. A Estratégia de Qualificação da RAS por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do SUS tem por objetivos: (Origem: PRT MS/GM 1248/2013, Art. 2º)
I - reforçar financeiramente o custeio das RAS e dos estabelecimentos hospitalares beneficiários, considerando-se as despesas adicionais necessárias à qualificação da assistência para o ensino; (Origem: PRT MS/GM 1248/2013, Art. 2º, I)
II - garantir a melhoria da estrutura hospitalar e da organização e funcionamento das RAS, de forma a aprimorar o funcionamento dos Programas de Residência Médica; (Origem: PRT MS/GM 1248/2013, Art. 2º, II)
III - garantir aos residentes ambientes de formação adequadas, como sala com computadores com acesso à internet e sala de estudo com materiais didáticos disponíveis e atualizados, como livros e revistas científicas; (Origem: PRT MS/GM 1248/2013, Art. 2º, III)
IV - garantir o aprimoramento técnico-científico necessário para qualificar a atuação dos profissionais envolvidos na assistência que tenham função de preceptoria, estimulando sua formação em cursos de pós-graduação, cursos de formação de preceptores e disseminando o acesso a bibliotecas virtuais e a outras fontes de publicações de artigos científicos; (Origem: PRT MS/GM 1248/2013, Art. 2º, IV)
V - estimular a inserção articulada e integrada dos estabelecimentos hospitalares participantes da RAS no âmbito do SUS por meio de Programa de Residência Médica em rede; (Origem: PRT MS/GM 1248/2013, Art. 2º, V)
VI - estimular a participação dos hospitais e demais estabelecimentos que compõem as RAS em atividades de pesquisa, desenvolvimento e gestão de tecnologias em saúde, de acordo com as necessidades do SUS; (Origem: PRT MS/GM 1248/2013, Art. 2º, VI)
VII - incentivar a qualificação do processo de gestão para favorecer que as instituições responsáveis pela formação de especialistas atuem com maior eficiência e efetividade; (Origem: PRT MS/GM 1248/2013, Art. 2º, VII)
VIII - estimular o papel dos estabelecimentos de saúde na formação de novos profissionais de saúde e na capacitação dos profissionais que atuem nos diversos segmentos que compõem o SUS, privilegiando as funções e especialidades requeridas para suprir as necessidades das RAS; (Origem: PRT MS/GM 1248/2013, Art. 2º, VIII)
IX - ampliar e qualificar Programa de Residência Médica em áreas estratégicas e regiões prioritárias do SUS por meio da abertura de novas vagas e qualificação das vagas existentes para formação de especialistas no país; (Origem: PRT MS/GM 1248/2013, Art. 2º, IX)
X - aprimorar o processo de gestão dos Programas de Residência Médica por meio das Comissões Estaduais de Residência Médica (CEREM) e das Comissões de Residência Médica (COREME), fortalecendo o seu papel previsto na legislação vigente; e (Origem: PRT MS/GM 1248/2013, Art. 2º, X)
XI - assegurar a participação das CEREM e das COREME na gestão dos recursos financeiros e no monitoramento e avaliação dos objetivos dispostos nesta Seção. (Origem: PRT MS/GM 1248/2013, Art. 2º, XI)
Parágrafo Único. Para fins do disposto no inciso V do "caput", considera-se Programa de Residência Médica em rede o programa que contemplar as demandas das redes temáticas prioritárias do SUS, tais como Rede Cegonha, Rede de Urgência e Emergência, Rede de Atenção Psicossocial, por meio de linhas de cuidado estabelecidas nas portarias específicas e entre os serviços que compõem as respectivas redes. (Origem: PRT MS/GM 1248/2013, Art. 2º, Parágrafo Único)
Subseção II
Dos Critérios de Elegibilidade
(Origem: PRT MS/GM 1248/2013, CAPÍTULO II)
Art. 744. Poderão aderir à Estratégia de Qualificação da RAS por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do SUS: (Origem: PRT MS/GM 1248/2013, Art. 3º)
I - entidades públicas estaduais, distrital ou municipais de saúde; (Origem: PRT MS/GM 1248/2013, Art. 3º, I)
II - entidades públicas federais vinculadas ao Ministério da Educação (MEC); e (Origem: PRT MS/GM 1248/2013, Art. 3º, II)
III - estabelecimentos hospitalares privados sem fins lucrativos que atuem de forma complementar ao SUS, excetuando-se entidades certificadas nos termos do art. 11 da Lei nº 12.101, de 27 de novembro de 2009, e seus regulamentos. (Origem: PRT MS/GM 1248/2013, Art. 3º, III)
Art. 745. Para admissão na Estratégia de Qualificação da RAS por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do SUS, as entidades e estabelecimentos de que trata o art. 744 deverão conter Programa de Residência Médica que cumpra os seguintes critérios: (Origem: PRT MS/GM 1248/2013, Art. 4º)
I - estar vinculado a um estabelecimento hospitalar integrante do SUS ou a uma Secretaria de Saúde do Estado, Distrito Federal ou do Município, com oferecimento de, no mínimo, 5 (cinco) novas vagas nas especialidades listadas nos termos dos Anexos em Programa de Residência Médica com início no ano em curso da apresentação da proposta; (Origem: PRT MS/GM 1248/2013, Art. 4º, I)
II - cumprir pré-requisitos descritos nos termos dos Anexos LIII e LIV ; (Origem: PRT MS/GM 1248/2013, Art. 4º, II)
III - estar localizado em instituição contratualizada pelo gestor estadual, distrital ou municipal do SUS quando se tratar de estabelecimento hospitalar, nos termos da legislação vigente; (Origem: PRT MS/GM 1248/2013, Art. 4º, III)
IV - estar localizado em instituição que realiza atividades de ensino, podendo ou não ser certificada como hospital de ensino; (Origem: PRT MS/GM 1248/2013, Art. 4º, IV)
V - estar localizado em Município com mais de 50.000 (cinquenta mil) habitantes ou constituir-se como referência em região de saúde com mais de 50.000 (cinquenta mil) habitantes; (Origem: PRT MS/GM 1248/2013, Art. 4º, V)
VI - atender ao parâmetro de, no mínimo, 5 (cinco) leitos para cada residente, quando em ambiente hospitalar; (Origem: PRT MS/GM 1248/2013, Art. 4º, VI)
VII - dispor de instalações físicas adequadas para as atividades do Programa de Residência Médica; (Origem: PRT MS/GM 1248/2013, Art. 4º, VII)
VIII - dispor de Programa de Educação Permanente para os preceptores; e (Origem: PRT MS/GM 1248/2013, Art. 4º, VIII)
IX - ter autorizada a solicitação de credenciamento provisório ou aumento de vagas para o seu respectivo Programa de Residência Médica pela Comissão Nacional de Residência Médica (CNRM) para inicio das atividades do programa de residência no ano em curso da apresentação da proposta. (Origem: PRT MS/GM 1248/2013, Art. 4º, IX)
Subseção III
Do Monitoramento, Avaliação, Acompanhamento e Controle
(Origem: PRT MS/GM 1248/2013, CAPÍTULO IV)
Art. 746. Para fins de monitoramento, avaliação, acompanhamento e controle da aplicação dos recursos repassados por meio do Fundo Nacional de Saúde, ficam estabelecidos os seguintes prazos máximos a serem cumpridos pelos entes federativos e pelos estabelecimentos hospitalares privados beneficiários: (Origem: PRT MS/GM 1248/2013, Art. 22)
I - 6 (seis) meses, a contar da data da liberação do incentivo financeiro, para conclusão da reforma e/ou ampliação dos ambientes; e (Origem: PRT MS/GM 1248/2013, Art. 22, I)
II - 90 (noventa) dias após a conclusão da reforma e/ou ampliação para início do efetivo funcionamento dos ambientes reformados e/ou ampliados. (Origem: PRT MS/GM 1248/2013, Art. 22, II)
§ 1º Caso sejam descumpridos quaisquer prazos definidos neste artigo, os entes federativos e os estabelecimentos hospitalares privados beneficiários deverão encaminhar, no prazo de 30 (trinta) dias do término dos citados prazos, as justificativas ao Ministério da Saúde especialmente ao DRAC/SAS/MS e ao DEGES/SGTES/MS, para análise. (Origem: PRT MS/GM 1248/2013, Art. 22, § 1º)
§ 2º Caso aceitas as justificativas, o Ministério da Saúde poderá prorrogar o prazo de que trata o inciso I do "caput" por até 6 (seis) meses e o prazo de que trata o inciso II do "caput" por até 90 (noventa) dias. (Origem: PRT MS/GM 1248/2013, Art. 22, § 2º)
§ 3º Caso não haja apresentação de justificativas pelos estabelecimentos hospitalares privados beneficiários ou o Ministério da Saúde não aceite as que forem apresentadas, o estabelecimento estará sujeito à devolução imediata dos recursos financeiros repassados, acrescidos da correção monetária prevista em lei. (Origem: PRT MS/GM 1248/2013, Art. 22, § 3º)
§ 4º Caso não haja apresentação de justificativas pelos entes federativos beneficiários ou o Ministério da Saúde não aceite as que forem apresentadas, o ente federativo beneficiário estará sujeito, no que for pertinente, à devolução imediata dos recursos financeiros repassados, acrescidos da correção monetária prevista em lei, ou ao regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Origem: PRT MS/GM 1248/2013, Art. 22, § 4º)
§ 5º O monitoramento de que trata este artigo não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 1248/2013, Art. 22, § 5º)
Art. 747. Além do disposto no art. 746, caberá aos órgãos de controle interno, especialmente à área finalística, o monitoramento da correta aplicação dos recursos oriundos dos incentivos financeiros previstos nesta Seção. (Origem: PRT MS/GM 1248/2013, Art. 23)
Art. 748. Compete às Secretarias de Saúde dos estados, do Distrito Federal e dos municípios o monitoramento e a avaliação direta e continuada dos Programas de Residência Médica, em articulação com as instituições formadoras e as COREME, por meio dos contratos, convênios ou instrumentos congêneres firmados e de visitas técnicas para avaliação do seu funcionamento. (Origem: PRT MS/GM 1248/2013, Art. 24)
Parágrafo Único. Caberá às Secretarias de Saúde dos estados, do Distrito Federal e dos municípios, em articulação com as instituições formadoras e as COREME, informar, periodicamente, ao DEGES/SGTES/MS sobre o monitoramento e avaliação dos Programas beneficiados pelos recursos definidos nesta Seção, por meio de relatório anual. (Origem: PRT MS/GM 1248/2013, Art. 24, Parágrafo Único)
Art. 749. Os entes federativos e estabelecimentos hospitalares privados beneficiários enviarão relatórios semestrais ao DRAC/SAS/MS e ao DEGES/SGTES/MS com a descrição analítica da aplicação dos recursos dos incentivos financeiros percebidos, assinado pelo gestor do estabelecimento hospitalar e pelo coordenador da COREME local. (Origem: PRT MS/GM 1248/2013, Art. 25)
Seção V
Do Programa de Valorização do Profissional da Atenção Básica (PROVAB)
Art. 750. Esta Seção dispõe sobre a criação das Comissões de Coordenação Estadual e do Distrito Federal do Programa de Valorização do Profissional da Atenção Básica (PROVAB) e cria incentivo financeiro para manutenção e execução de suas atividades no ano de 2013. (Origem: PRT MS/GM 568/2013, Art. 1º)
Art. 751. As Comissões de Coordenação Estadual e do Distrito Federal do PROVAB constituem-se instâncias de coordenação, orientação e execução das atividades necessárias à execução do PROVAB no âmbito do respectivo ente federativo. (Origem: PRT MS/GM 568/2013, Art. 2º)
§ 1º As Secretarias de Saúde dos Estados e do Distrito Federal são responsáveis pela implantação da respectiva Comissão de Coordenação Estadual ou do Distrito Federal do PROVAB e pela indicação do Coordenador Estadual. (Origem: PRT MS/GM 568/2013, Art. 2º, § 1º)
§ 2º As Comissões de Coordenação Estadual e do Distrito Federal do PROVAB atenderão às regras e diretrizes técnicas fixadas pela Comissão Coordenadora do PROVAB de que trata a Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011. (Origem: PRT MS/GM 568/2013, Art. 2º, § 2º)
Art. 752. As Comissões de Coordenação Estadual e do Distrito Federal do PROVAB terão a seguinte composição mínima: (Origem: PRT MS/GM 568/2013, Art. 3º)
I - Representação do Ministério da Saúde; (Origem: PRT MS/GM 568/2013, Art. 3º, I)
II - Representação da Secretaria Estadual de Saúde; (Origem: PRT MS/GM 568/2013, Art. 3º, II)
III - Conselho de Secretários Municipais de Saúde - COSEMS; e (Origem: PRT MS/GM 568/2013, Art. 3º, III)
IV - Representação das Instituições Supervisoras. (Origem: PRT MS/GM 568/2013, Art. 3º, IV)
Parágrafo Único. O Coordenador Estadual será indicado pelas Secretarias de Saúde dos Estados e do Distrito Federal entre os membros da Comissão de Coordenação Estadual e do Distrito Federal. (Origem: PRT MS/GM 568/2013, Art. 3º, Parágrafo Único)
Seção VI
Do Comitê Estratégico para o Aperfeiçoamento da Qualidade da Formação de Profissionais de Saúde e de Estudos de Necessidade de Profissionais de Saúde e de Especialistas para o SUS
Art. 753. Fica constituído o Comitê Estratégico, no âmbito do Ministério da Saúde, que deverá subsidiar o planejamento de iniciativas com o objetivo de aperfeiçoar a qualidade da formação dos profissionais de saúde e de especialistas de acordo com as necessidades do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 266/2012, Art. 1º)
Art. 754. O Comitê de que trata o art. 753 será composto por: (Origem: PRT MS/GM 266/2012, Art. 2º)
I - Ministro de Estado da Saúde, que o presidirá; (Origem: PRT MS/GM 266/2012, Art. 2º, I)
II - Coordenador-Executivo do Conselho Técnico-Consultivo, designado pelo Ministro de Estado da Saúde; (Origem: PRT MS/GM 266/2012, Art. 2º, II)
III - Secretária-Executiva do Ministério da Saúde; (Origem: PRT MS/GM 266/2012, Art. 2º, III)
IV - Secretário de Atenção à Saúde do Ministério da Saúde; e (Origem: PRT MS/GM 266/2012, Art. 2º, IV)
V - Secretário de Gestão do Trabalho e da Educação na Saúde do Ministério da Saúde. (Origem: PRT MS/GM 266/2012, Art. 2º, V)
Art. 755. O Comitê Estratégico será assessorado por um Conselho Técnico-Consultivo, composto por quinze membros, sendo especialistas de notório saber nas áreas de que trata o art. 753, representantes de entidades profissionais ou de ensino ou gestores da área da saúde. (Origem: PRT MS/GM 266/2012, Art. 3º)
§ 1º Os representantes do Conselho Técnico-Consultivo serão indicados pelo Coordenador-Executivo do Conselho Técnico-Consultivo e designados pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 266/2012, Art. 3º, § 1º)
§ 2º O Coordenador-Executivo encaminhará ao Comitê Estratégico os resultados dos trabalhos e as propostas técnicas do Conselho. (Origem: PRT MS/GM 266/2012, Art. 3º, § 2º)
Art. 756. Compete ao Comitê Estratégico: (Origem: PRT MS/GM 266/2012, Art. 4º)
I - elaborar projetos de apoio ao aperfeiçoamento da qualidade da formação dos profissionais de saúde e identificação da necessidade de oferta de formação de profissionais de saúde e de especialistas; (Origem: PRT MS/GM 266/2012, Art. 4º, I)
II - sugerir estudos de avaliação do impacto das medidas adotadas; e (Origem: PRT MS/GM 266/2012, Art. 4º, II)
III - apresentar propostas de ações dirigidas ao provimento e fixação de profissionais de saúde em localidades e populações desassistidas de atenção à saúde. (Origem: PRT MS/GM 266/2012, Art. 4º, III)
§ 1º O Comitê Estratégico terá, no mínimo, 4 (quatro) reuniões ordinárias anualmente e reuniões extraordinárias, convocadas pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 266/2012, Art. 4º, § 1º)
§ 2º O Conselho Técnico-Consultivo se reunirá, a qualquer tempo, mediante provocação do seu Coordenador-Executivo. (Origem: PRT MS/GM 266/2012, Art. 4º, § 2º)
§ 3º O membro impossibilitado de participar em reunião do Comitê Estratégico ou do Conselho Técnico-Consultivo deverá comunicar a sua ausência ao Gabinete do Ministro com antecedência mínima de 2 (dois) dias úteis. (Origem: PRT MS/GM 266/2012, Art. 4º, § 3º)
§ 4º As reuniões do Conselho Técnico-Consultivo acontecerão preferencialmente em Brasília-DF. (Origem: PRT MS/GM 266/2012, Art. 4º, § 4º)
Art. 757. O Comitê Estratégico e o Conselho Técnico-Consultivo terão o apoio administrativo do Gabinete do Ministro para o desempenho de suas atividades. (Origem: PRT MS/GM 266/2012, Art. 5º)
Art. 758. As funções dos membros do Comitê Estratégico e dos representantes do Conselho Técnico-Consultivo não serão remuneradas e seu exercício será considerado de relevância para o serviço público. (Origem: PRT MS/GM 266/2012, Art. 6º)
Art. 759. O Gabinete do Ministro adotará as providências necessárias para a operacionalização das atividades de que tratam esta Seção. (Origem: PRT MS/GM 266/2012, Art. 7º)
Seção VII
Do Programa de Qualificação e Estruturação da Gestão do Trabalho e da Educação no SUS (PROGESUS)
Art. 760. Fica instituído o Programa de Qualificação e Estruturação da Gestão do Trabalho e da Educação no SUS (ProgeSUS), para colaborar técnica e financeiramente com a execução de projetos voltados ao fortalecimento dos Setores de Gestão do Trabalho e da Educação na Saúde de Secretarias de Saúde de estados, do Distrito Federal e de municípios. (Origem: PRT MS/GM 2261/2006, Art. 1º)
Art. 761. O ProgeSUS tem os seguintes componentes: (Origem: PRT MS/GM 2261/2006, Art. 2º)
I - componente I: financiamento para a modernização dos Setores de Gestão do Trabalho e da Educação na Saúde de Secretarias de Saúde de Estados, do Distrito Federal e de Municípios por meio da aquisição de mobiliário e de equipamentos de informática; (Origem: PRT MS/GM 2261/2006, Art. 2º, I)
II - componente II: disponibilização, pelo Ministério da Saúde, de Sistema de Informação Gerencial para o Setor de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde que desejarem adotá-lo; (Origem: PRT MS/GM 2261/2006, Art. 2º, II)
III - componente III: capacitação de equipes dos Setores de Gestão do Trabalho e da Educação na Saúde de Secretarias de Saúde de Estados, do Distrito Federal e de Municípios; e (Origem: PRT MS/GM 2261/2006, Art. 2º, III)
IV - componente IV: participação no Sistema Nacional de Informações em Gestão do Trabalho do SUS (InforSUS). (Origem: PRT MS/GM 2261/2006, Art. 2º, IV)
§ 1º O financiamento de que trata o art. 761, I não se destina à aquisição de computadores portáteis. (Origem: PRT MS/GM 2261/2006, Art. 2º, § 1º)
§ 2º O InforSUS, instituído e gerenciado pelo Ministério da Saúde, e alimentado periodicamente pelos seus participantes, será integrado por um conjunto de dados sobre a gestão do trabalho, definidos pela Comissão Intergestores do ProgeSUS(CIP). (Origem: PRT MS/GM 2261/2006, Art. 2º, § 2º)
Art. 762. O componente I do ProgeSUS será disponibilizado nas seguintes etapas: (Origem: PRT MS/GM 2261/2006, Art. 3º)
I - 1ª etapa: para estados, Distrito Federal e capitais; (Origem: PRT MS/GM 2261/2006, Art. 3º, I)
II - 2ª etapa: para municípios que tenham mais de 1.000 postos de trabalho público em saúde, conforme o Anexo LXXXIX ; (Origem: PRT MS/GM 2261/2006, Art. 3º, II)
III - 3ª etapa: para municípios que tenham entre 500 e 1.000 postos de trabalho público em saúde, conforme o Anexo XC ; e (Origem: PRT MS/GM 2261/2006, Art. 3º, III)
IV - 4ª etapa: para municípios que tenham menos de 500 postos de trabalho público em saúde. (Origem: PRT MS/GM 2261/2006, Art. 3º, IV)
§ 1º O número de postos de trabalho público em saúde dos municípios citados nos incisos II a IV do caput deste artigo tem por base a pesquisa IBGE/AMS, realizada em 2002. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 1º)
§ 2º Em cada etapa, o Secretário de Gestão do Trabalho e da Educação na Saúde publicará edital convocando as Secretarias de Saúde a apresentar projetos voltados ao fortalecimento de seus Setores de Gestão do Trabalho e da Educação na Saúde, fixando os necessários prazos, o valor máximo do financiamento e os critérios de seleção e classificação, os desta, exclusivamente, para a 4ª etapa. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 2º)
§ 3º O edital de convocação será disponibilizado no endereço eletrônico www.saude.gov.br/degerts, a partir da data da publicação do seu extrato no Diário Oficial da União. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 3º)
§ 4º As etapas de que tratam os incisos I a IV do caput deste artigo poderão ser executadas concomitantemente. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 4º)
Art. 763. Para participar do componente I do ProgeSUS, os estados, o Distrito Federal e os municípios deverão observar os seguintes requisitos: (Origem: PRT MS/GM 2261/2006, Art. 4º)
I - possuir setor de gestão do trabalho e da educação na saúde na própria estrutura organizacional da Secretaria de Saúde ou comprometer-se a inseri-lo em prazo certo, especificado no próprio Projeto; (Origem: PRT MS/GM 2261/2006, Art. 4º, I)
II - possuir área física adequada para o setor nas dependências da própria Secretaria de Saúde, funcionando com equipe específica, ou comprometer-se a instalá-lo em prazo certo, especificado no próprio Projeto; (Origem: PRT MS/GM 2261/2006, Art. 4º, II)
III - aderir aos componentes III e IV do ProgeSUS; e (Origem: PRT MS/GM 2261/2006, Art. 4º, III)
IV - atender às demais exigências previstas em normas que regulem o repasse de recursos para o financiamento do Sistema Único de Saúde. (Origem: PRT MS/GM 2261/2006, Art. 4º, IV)
Art. 764. Para participar exclusivamente dos componentes II e/ou III do ProgeSUS, os estados, o Distrito Federal ou os municípios deverão encaminhar sua solicitação diretamente à Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES), do Ministério da Saúde. (Origem: PRT MS/GM 2261/2006, Art. 5º)
§ 1º O deferimento da solicitação dependerá da observância dos seguintes requisitos: (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º)
I - para o componente II: (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, I)
a) existência de equipamentos de informática com configuração adequada às exigências do Sistema de Informação Gerencial; e (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, I, a)
b) disponibilização de profissional do Setor de Gestão do Trabalho e da Educação na Saúde para ser capacitado a operar o Sistema de Informação Gerencial; (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, I, b)
II - para o componente III: (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, II)
a) disponibilização de profissional do Setor para participar de processo de capacitação; e (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, II, a)
b) atendimento das exigências metodológicas do processo de capacitação oferecido. (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, II, b)
§ 2º Em relação art. 764, § 1º , II, o atendimento da solicitação observará o previsto em portaria específica, expedida pelo Secretário de Gestão do Trabalho e da Educação na Saúde. (Origem: PRT MS/GM 2261/2006, Art. 5º, § 2º)
Art. 765. Os projetos deverão ser encaminhados à SGTES, contendo: (Origem: PRT MS/GM 2261/2006, Art. 6º)
I - o Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde da Secretaria de Saúde; e (Origem: PRT MS/GM 2261/2006, Art. 6º, I)
II - o Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde da Secretaria de Saúde. (Origem: PRT MS/GM 2261/2006, Art. 6º, II)
Art. 766. O Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde deverá conter: (Origem: PRT MS/GM 2261/2006, Art. 7º)
I - justificativa; (Origem: PRT MS/GM 2261/2006, Art. 7º, I)
II - objetivos (geral e específico); (Origem: PRT MS/GM 2261/2006, Art. 7º, II)
III - planejamento das ações estruturantes; e (Origem: PRT MS/GM 2261/2006, Art. 7º, III)
IV - Planilha de Custo. (Origem: PRT MS/GM 2261/2006, Art. 7º, IV)
Parágrafo Único. A Planilha de Custo deverá apresentar o valor total do projeto, no que se refere ao Componente I do ProgeSUS, detalhando os itens de mobiliário e de equipamentos de informática que serão adquiridos. (Origem: PRT MS/GM 2261/2006, Art. 7º, Parágrafo Único)
Art. 767. O Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde deverá conter: (Origem: PRT MS/GM 2261/2006, Art. 8º)
I - justificativa; (Origem: PRT MS/GM 2261/2006, Art. 8º, I)
II - objetivos (geral e específico); e (Origem: PRT MS/GM 2261/2006, Art. 8º, II)
III - planejamento das ações de qualificação. (Origem: PRT MS/GM 2261/2006, Art. 8º, III)
Parágrafo Único. O Plano deverá apresentar as ações necessárias ao enfrentamento das principais dificuldades encontradas no campo da gestão, da negociação e da educação na saúde, e os seus respectivos prazos de execução. (Origem: PRT MS/GM 2261/2006, Art. 8º, Parágrafo Único)
Art. 768. Os projetos deverão ser encaminhados juntamente com os seguintes documentos, após sua aprovação na Comissão Intergestores Bipartite (CIB): (Origem: PRT MS/GM 2261/2006, Art. 9º)
I - ofício assinado pelo gestor de saúde ( Anexo XCI ); (Origem: PRT MS/GM 2261/2006, Art. 9º, I)
II - declaração de adesão, alimentação e atualização do InforSUS ( Anexo XCII ); (Origem: PRT MS/GM 2261/2006, Art. 9º, II)
III - ato formal da instituição do Setor de Gestão do Trabalho e da Educação na Saúde vinculado à estrutura da Secretaria de Saúde, quando existente; e (Origem: PRT MS/GM 2261/2006, Art. 9º, III)
IV - cópia da ata ou da resolução de sua aprovação na CIB. (Origem: PRT MS/GM 2261/2006, Art. 9º, IV)
§ 1º Em 30 (trinta) dias, contados do término do prazo indicado para a conclusão do componente I do ProgeSUS, o gestor de saúde deverá apresentar à SGTES o relatório de sua execução. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 1º)
§ 2º A homologação de projetos, em cada etapa do componente I, compete ao Secretário de Gestão do Trabalho e da Educação na Saúde e será formalizada por meio de portaria publicada imediatamente após o encerramento da fase de análise e verificação de atendimento de exigências para o repasse de recursos para o financiamento do SUS. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 2º)
§ 3º A portaria de que trata o art. 768, § 2º deverá conter: (Origem: PRT MS/GM 2261/2006, Art. 9º, § 3º)
I - a relação das Secretarias de Saúde cujos projetos foram homologados; e (Origem: PRT MS/GM 2261/2006, Art. 9º, § 3º, I)
II - a relação das Secretarias de Saúde cuja homologação dos projetos encontra-se pendente de alguma adequação, indicando-se esta e o prazo para sua apresentação. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 3º, II)
§ 4º Após o transcurso do prazo de que trata o art. 768, § 3º , II, o Secretário de Gestão do Trabalho e da Educação na Saúde publicará nova portaria, contendo: (Origem: PRT MS/GM 2261/2006, Art. 9º, § 4º)
I - a relação das Secretarias de Saúde cujos projetos foram homologados; e (Origem: PRT MS/GM 2261/2006, Art. 9º, § 4º, I)
II - a relação das Secretarias de Saúde cujos projetos deixaram de ser homologados porque não sofreram as necessárias adequações. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 4º, II)
Art. 769. A gestão do ProgeSUS e a verificação da adequação dos projetos competem ao Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS). (Origem: PRT MS/GM 2261/2006, Art. 10)
Parágrafo Único. A gestão do ProgeSUS será exercida pelo Diretor do Departamento de Gestão e da Regulação do Trabalho em Saúde e, em seu impedimento, pelo Coordenador-Geral da Gestão do Trabalho em Saúde. (Origem: PRT MS/GM 2261/2006, Art. 10, Parágrafo Único)
Art. 770. Fica constituída a Comissão Intergestores do ProgeSUS (CIP), com a seguinte composição: (Origem: PRT MS/GM 2261/2006, Art. 11)
I - três representantes do Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS); (Origem: PRT MS/GM 2261/2006, Art. 11, I)
II - dois representantes do Departamento de Gestão da Educação na Saúde (DEGES/SGTES/MS); (Origem: PRT MS/GM 2261/2006, Art. 11, II)
III - um representante da Coordenação-Geral de Recursos Humanos (CGRH), da Secretaria-Executiva do Ministério da Saúde; (Origem: PRT MS/GM 2261/2006, Art. 11, III)
IV - um representante do Departamento de Informação e Informática do SUS (DATASUS), da Secretaria-Executiva do Ministério da Saúde; (Origem: PRT MS/GM 2261/2006, Art. 11, IV)
V - dois representantes do Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 2261/2006, Art. 11, V)
VI - dois representantes do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 2261/2006, Art. 11, VI)
§ 1º Incumbe aos órgãos e às entidades relacionadas neste artigo a indicação de seus respectivos representantes. (Origem: PRT MS/GM 2261/2006, Art. 11, § 1º)
§ 2º A indicação de que trata o art. 770, § 1º deverá ser feita por escrito e dirigida ao Diretor do Departamento de Gestão e da Regulação do Trabalho em Saúde. (Origem: PRT MS/GM 2261/2006, Art. 11, § 2º)
Art. 771. Compete à CIP: (Origem: PRT MS/GM 2261/2006, Art. 12)
I - apresentar proposições sobre o conteúdo e a metodologia das ações de cronograma de desenvolvimento de cada ação; (Origem: PRT MS/GM 2261/2006, Art. 12, I)
II - apresentar proposições de melhoria para o funcionamento dos Setores de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde de estados, do Distrito Federal e de municípios; (Origem: PRT MS/GM 2261/2006, Art. 12, II)
III - apresentar proposição referente aos indicadores que serão usados na avaliação do impacto do ProgeSUS no que tange ao fortalecimento dos Setores de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde de estados, do Distrito Federal e de municípios; (Origem: PRT MS/GM 2261/2006, Art. 12, III)
IV - acompanhar e apresentar proposições que contribuam para a eficaz execução do ProgeSUS; (Origem: PRT MS/GM 2261/2006, Art. 12, IV)
V - avaliar e classificar os projetos apresentados pelas Secretarias Municipais de Saúde na 4ª etapa do componente I do ProgeSUS; e (Origem: PRT MS/GM 2261/2006, Art. 12, V)
VI - definir o conjunto de dados que conformarão o Sistema Nacional de Informações em Gestão do Trabalho do SUS e a forma como os Setores de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde irão alimentá-lo. (Origem: PRT MS/GM 2261/2006, Art. 12, VI)
Art. 772. A CIP será coordenada pelo Diretor do DEGERTS, ou, por sua delegação, por qualquer outro membro. (Origem: PRT MS/GM 2261/2006, Art. 13)
Art. 773. A CIP contará com assessores técnicos, indicados pelo seu Coordenador, e poderá convidar especialista ou instituições para contribuir com a execução dos seus trabalhos. (Origem: PRT MS/GM 2261/2006, Art. 14)
Art. 774. Ao DEGERTS incumbe garantir os meios necessários à consecução das atribuições da CIP. (Origem: PRT MS/GM 2261/2006, Art. 15)
Art. 775. A CIP reunir-se-á periodicamente ou sempre que convocada pelo seu Coordenador. (Origem: PRT MS/GM 2261/2006, Art. 16)
Art. 776. Os Municípios compreendidos nas etapas 3ª e 4ª previstas no art. 762 deverão observar os seguintes requisitos para participar do componente I do ProgeSUS: (Origem: PRT MS/GM 2261/2006, Art. 4º-A)
I - designação, de ofício, pelo gestor municipal de saúde, de técnico responsável pela área da Gestão do Trabalho e da Educação na Saúde (RH); (Origem: PRT MS/GM 2261/2006, Art. 4º-A, I)
II - estabelecimento de espaço físico na Secretaria de Saúde, para desenvolvimento das atividades da área; (Origem: PRT MS/GM 2261/2006, Art. 4º-A, II)
III - compromisso de liberar o técnico responsável pelas atividades da área para participar dos processos de capacitação desenvolvidos no âmbito do ProgeSUS; (Origem: PRT MS/GM 2261/2006, Art. 4º-A, III)
IV - declaração de adesão ao Sistema Nacional de Informações em Gestão do Trabalho no SUS (art. 761, IV) e compromisso com sua alimentação e atualização; e (Origem: PRT MS/GM 2261/2006, Art. 4º-A, IV)
V - apresentar cópia das atribuições e responsabilidades sanitárias referentes aos eixos 5 e 6 (Gestão do Trabalho e Educação na Saúde, respectivamente) do Termo de Compromisso de Gestão Municipal, publicado em Portaria do Ministério da Saúde após sua homologação na CIT. (Origem: PRT MS/GM 2261/2006, Art. 4º-A, V)
Parágrafo Único. Os incisos I, II, III e IV devem estar contemplados no Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde e o inciso V no Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde. (Origem: PRT MS/GM 2261/2006, Art. 4º-A, Parágrafo Único)
Art. 777. O projeto contendo o Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde e o Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde deve ser encaminhado à Secretaria de Gestão do Trabalho e da Educação na Saúde juntamente com os seguintes documentos: (Origem: PRT MS/GM 2261/2006, Art. 4º-B)
I - ofício assinado pelo gestor de saúde; (Origem: PRT MS/GM 2261/2006, Art. 4º-B, I)
II - declaração de adesão, alimentação e atualização do InforSUS; (Origem: PRT MS/GM 2261/2006, Art. 4º-B, II)
III - ofício do gestor municipal de saúde designando técnico responsável pelas atividades da área da Gestão do Trabalho e da Educação na Saúde (RH), bem como informando a instalação de espaço físico, dentro da Secretaria de Saúde, para desenvolvimento das atividades da área; (Origem: PRT MS/GM 2261/2006, Art. 4º-B, III)
IV - cópia da ata ou da resolução de sua aprovação na CIB; e (Origem: PRT MS/GM 2261/2006, Art. 4º-B, IV)
V - cópia das atribuições e responsabilidades sanitárias referentes aos eixos 5 e 6 (Gestão do Trabalho e Educação na Saúde, respectivamente) do Termo de Compromisso de Gestão Municipal, publicado em Portaria do Ministério da Saúde após sua homologação na CIT. (Origem: PRT MS/GM 2261/2006, Art. 4º-B, V)
Parágrafo Único. Os projetos aprovados serão priorizados nas ações de qualificação do ProgeSUS, bem como será oferecido à Secretaria de Saúde o Sistema de Informação Gerencial específico para a Gestão do Trabalho e capacitação em sua instalação e operação. (Origem: PRT MS/GM 2261/2006, Art. 4º-B, Parágrafo Único)
CAPÍTULO II
DA DESPRECARIZAÇÃO DO TRABALHO NO SUS
Seção I
Do Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS
Art. 778. Fica criado o Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS, vinculado à Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS), objetivando: (Origem: PRT MS/GM 2430/2003, Art. 1º) (com redação dada pela PRT MS/GM 2729/2013)
I - fixar as diretrizes para o recadastramento nacional dos trabalhadores com vínculo de trabalho precário, e estabelecer, para este, o cronograma de sua realização; (Origem: PRT MS/GM 2430/2003, Art. 1º, I)
II - definir um modelo de cadastro mínimo para ser aplicado em todo o País, o qual poderá ser adaptado para atender as necessidades e interesses locais; (Origem: PRT MS/GM 2430/2003, Art. 1º, II)
III - monitorar as formas de substituição do trabalho precário nas três esferas de governo (federal, estadual e municipal); (Origem: PRT MS/GM 2430/2003, Art. 1º, III)
IV - dimensionar e estimular a realização de concurso público nas três esferas de governo, em cumprimento de princípio constitucional e de recomendações de resoluções das últimas Conferências Nacionais de Saúde e de Recursos Humanos; (Origem: PRT MS/GM 2430/2003, Art. 1º, IV)
V - realizar o levantamento das formas de precarização do trabalho no SUS; (Origem: PRT MS/GM 2430/2003, Art. 1º, V)
VI - indicar as formas legais de contratação, quando for o caso, e apresentar as iniciativas requeridas para sua implementação, tendo em conta a política de preservação do emprego e da renda dos ocupados no setor; (Origem: PRT MS/GM 2430/2003, Art. 1º, VI)
VII - avaliar os impactos financeiros das medidas propostas e suas repercussões em face da Lei Complementar nº 101, de 4 de maio de 2000 (D.O.U. de 05/05/2000), que estabelece normas de finanças públicas voltadas para a responsabilidade na gestão fiscal e dá outras providências; (Origem: PRT MS/GM 2430/2003, Art. 1º, VII)
VIII - monitorar as decisões judiciais e os acordos extrajudiciais sobre finanças públicas e gestão fiscal que versem sobre o disposto no inciso VII deste artigo, buscando formular alternativas para superar possíveis entraves legais e fiscais com gestores do SUS; (Origem: PRT MS/GM 2430/2003, Art. 1º, VIII)
IX - induzir, por meio de cooperação com os demais entes federados, a adoção de uma nova concepção de relações estáveis de trabalho no SUS - que erradique os vínculos precários e valorize o trabalhador -, em benefício de melhorias na qualidade do acesso e do atendimento dispensado aos usuários do SUS; (Origem: PRT MS/GM 2430/2003, Art. 1º, IX)
X - propor mecanismos de financiamento pelo Governo Federal que estimulem as formas legais de relações de trabalho no SUS, com especial ênfase para a organização das equipes de saúde da família; (Origem: PRT MS/GM 2430/2003, Art. 1º, X)
XI - divulgar iniciativas adotadas na gestão do trabalho no SUS, de enfoque multiprofissional, que dignifiquem o trabalho humano e a consequente melhoria dos serviços de saúde no País; (Origem: PRT MS/GM 2430/2003, Art. 1º, XI)
XII - apoiar e estimular a criação de Comitês Estaduais e Municipais de Desprecarização do Trabalho no SUS; e (Origem: PRT MS/GM 2430/2003, Art. 1º, XII)
XIII - elaborar políticas e formular diretrizes para a desprecarização do trabalho no SUS. (Origem: PRT MS/GM 2430/2003, Art. 1º, XIII)
Art. 779. O Comitê terá a seguinte composição: (Origem: PRT MS/GM 2430/2003, Art. 2º)
I - 7 (sete) representantes do Ministério da Saúde, quais sejam: (Origem: PRT MS/GM 2430/2003, Art. 2º, I)
a) a Secretária de Gestão do Trabalho e da Educação na Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, a)
b) a Diretora do Departamento de Gestão e da Regulação do Trabalho em Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, b)
c) o Coordenador-Geral de Gestão do Trabalho em Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, c)
d) o Coordenador-Geral da Regulação e Negociação do Trabalho em Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, d)
e) a Diretora do Departamento de Atenção Básica da Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, e)
f) o Diretor do Departamento de Regulação, Avaliação e Controle de Sistemas da Secretaria de Atenção à Saúde; e (Origem: PRT MS/GM 2430/2003, Art. 2º, I, f)
g) o Coordenador-Geral de Recursos Humanos do Ministério da Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, g)
II - 1 (um) representante do Ministério do Planejamento, Desenvolvimento e Gestão; (Origem: PRT MS/GM 2430/2003, Art. 2º, II)
III - 1 (um) representante do Ministério do Trabalho; (Origem: PRT MS/GM 2430/2003, Art. 2º, III)
IV - 1 (um) representante do Conselho Nacional dos Secretários Estaduais de Saúde (CONASS); (Origem: PRT MS/GM 2430/2003, Art. 2º, IV)
V - 1 (um) representante do Conselho Nacional dos Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2430/2003, Art. 2º, V)
VI - 1 (um) representante de empregador privado que integre a Mesa Nacional de Negociação Permanente do SUS; e (Origem: PRT MS/GM 2430/2003, Art. 2º, VI)
VII - 6 (seis) representantes de trabalhadores indicados pela Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS). (Origem: PRT MS/GM 2430/2003, Art. 2º, VII) (com redação dada pela PRT MS/GM 2729/2013)
Parágrafo Único. A exceção dos representantes do Ministério da Saúde, os demais integrantes do Comitê serão livremente designados por meio de expediente subscrito pelos representantes legais dos órgãos e instituições representadas. (Origem: PRT MS/GM 2430/2003, Art. 2º, Parágrafo Único)
Art. 780. Os trabalhos do Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS serão coordenados por um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS), que garantirá apoio técnico e de pessoal necessários para o seu regular funcionamento. (Origem: PRT MS/GM 2430/2003, Art. 3º) (com redação dada pela PRT MS/GM 2729/2013)
§ 1º Um representante dos trabalhadores de que trata o art. 779, VII será escolhido por sua bancada para exercer a subcoordenação do Comitê. (Origem: PRT MS/GM 2430/2003, Art. 3º, § 1º) (dispositivo acrescentado pela PRT MS/GM 2729/2013)
§ 2º Caberá ao coordenador de que trata o "caput" encaminhar à MNNP-SUS as atas de reunião e demais atos exarados pelo Comitê, no prazo de 20 (vinte) dias úteis. (Origem: PRT MS/GM 2430/2003, Art. 3º, § 2º) (dispositivo acrescentado pela PRT MS/GM 2729/2013)
Art. 781. Os acordos realizados no âmbito do Comitê Nacional Interinstitucional de Desprecarização deverão ser homologados pela MNP-SUS, cuja Secretaria-Executiva efetuará os encaminhamentos necessários. (Origem: PRT MS/GM 2430/2003, Art. 3º-A)
Art. 782. Respeitado os limites impostos por seu objeto, o Comitê atuará da forma mais ampla possível, gozando de autonomia para constituir grupos de trabalho, se isso entender seja necessário. (Origem: PRT MS/GM 2430/2003, Art. 4º)
Seção II
Da Rede de Apoio à Desprecarização do Trabalho no Âmbito do SUS
Art. 783. Fica instituída a Rede de Apoio a Desprecarização do Trabalho no âmbito do Sistema Único de Saúde, para propiciar o intercâmbio de informações entre o Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS e os comitês estaduais e municipais que dela participarem. (Origem: PRT MS/GM 928/2006, Art. 1º)
Parágrafo Único. Poderão se integrar à Rede de Apoio as instituições ou entidades que desenvolvam ações na área de gestão do trabalho. (Origem: PRT MS/GM 928/2006, Art. 1º, Parágrafo Único)
Art. 784. A solicitação de adesão à Rede de Apoio a Desprecarização do Trabalho, dirigida à Coordenação dos Trabalhos do Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS, e subscrita pelo representante legal do requerente, deverá trazer, anexo, o ato formal de constituição deste. (Origem: PRT MS/GM 928/2006, Art. 2º)
Parágrafo Único. O não encaminhamento do meio de prova especificado pelo caput deste artigo acarretará o indeferimento da solicitação caso a ausência não seja remediada no prazo de dez dias. (Origem: PRT MS/GM 928/2006, Art. 2º, Parágrafo Único)
Art. 785. A coordenação e subcoordenação dos trabalhos da Rede serão exercidas, respectivamente, pelo Secretário de Gestão do Trabalho e da Educação na Saúde e pelo Diretor do Departamento de Gestão e da Regulação do Trabalho em Saúde. (Origem: PRT MS/GM 928/2006, Art. 3º)
Art. 786. A Secretaria de Gestão do Trabalho e da Educação na Saúde assegurará os recursos necessários para o funcionamento da Rede, incluindo a comunicação permanente entre os seus componentes, através de fóruns presenciais e/ou meio eletrônico. (Origem: PRT MS/GM 928/2006, Art. 4º)
CAPÍTULO III
DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SUS (PROADI-SUS)
Art. 787. O Anexo XCIII dispõe sobre o Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (PROADI-SUS).
CAPÍTULO IV
DAS TECNOLOGIAS EM SAÚDE
Seção I
Do Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde
Art. 788. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde, que passa a integrar um conjunto de políticas adotadas para estimular a eficiência produtiva no Complexo Industrial da Saúde, constituindo uma prioridade tanto do Sistema Único de Saúde quanto da Política Industrial, Tecnológica e de Comércio Exterior (PITCE). (Origem: PRT MS/GM 374/2008, Art. 1º)
Art. 789. O Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde tem como objetivo promover o fortalecimento e a modernização do conjunto de laboratórios públicos encarregados da produção de medicamentos e imunobiológicos de relevância estratégica para o Sistema Único de Saúde, por intermédio da ampliação da participação no Complexo Produtivo da Saúde, do aumento da capacidade inovadora e da mudança de patamar competitivo, contribuindo para a redução da defasagem tecnológica existente e o desenvolvimento econômico, científico e tecnológico do País. (Origem: PRT MS/GM 374/2008, Art. 2º)
Art. 790. São objetivos específicos do Programa, segundo os segmentos que compõem a produção do conjunto de laboratórios públicos: (Origem: PRT MS/GM 374/2008, Art. 3º)
I - Segmento Farmacêutico: (Origem: PRT MS/GM 374/2008, Art. 3º, I)
a) estimular a internalização da produção de farmoquímicos e medicamentos de maior impacto para o Sistema Único de Saúde; (Origem: PRT MS/GM 374/2008, Art. 3º, I, a)
b) modernizar os Laboratórios Farmacêuticos Oficiais em termos tecnológicos e organizacionais e capacitá-los para estabelecer parcerias com o setor produtivo privado; (Origem: PRT MS/GM 374/2008, Art. 3º, I, b)
c) estimular a produção de medicamentos para doenças negligenciadas e de suas matérias-primas, superando o hiato entre o esforço de produção e inovação dos países desenvolvidos e as necessidades nacionais; e (Origem: PRT MS/GM 374/2008, Art. 3º, I, c)
d) apoiar a implementação da Política Nacional de Plantas Medicinais e Fitoterápicos. (Origem: PRT MS/GM 374/2008, Art. 3º, I, d)
II - Segmento Biotecnológico (imunobiológicos, biofármacos, hemoderivados e reagentes para diagnóstico): (Origem: PRT MS/GM 374/2008, Art. 3º, II)
a) capacitar os produtores públicos do País para a produção da matéria-prima ativa com recursos às novas biotecnologias; (Origem: PRT MS/GM 374/2008, Art. 3º, II, a)
b) modernizar os produtores públicos em termos tecnológicos e organizacionais e capacitá-los para estabelecer parcerias com o setor produtivo privado; (Origem: PRT MS/GM 374/2008, Art. 3º, II, b)
c) estruturar o País para exportar produtos que atendam às demandas articuladas pela Organização Mundial da Saúde para as regiões menos desenvolvidas; (Origem: PRT MS/GM 374/2008, Art. 3º, II, c)
d) implementar a Política de Desenvolvimento da Biotecnologia na área de Saúde Humana; (Origem: PRT MS/GM 374/2008, Art. 3º, II, d)
e) priorizar a produção, no País, de reagentes para o diagnóstico de doenças transmissíveis utilizados pelo SUS com recursos às novas biotecnologias; (Origem: PRT MS/GM 374/2008, Art. 3º, II, e)
f) consolidar a produção pública de reagentes biológicos para diagnóstico e estabelecer parcerias com o setor privado e instituições científicas para o desenvolvimento e a comercialização de novos produtos e insumos para diagnóstico; (Origem: PRT MS/GM 374/2008, Art. 3º, II, f)
g) internalizar, no País, a produção de hemoderivados, atendendo aos preceitos constitucionais, associada com a capacitação tecnológica; (Origem: PRT MS/GM 374/2008, Art. 3º, II, g)
h) favorecer a consolidação do produtor estatal nacional (Hemobras) como uma empresa pública eficiente, comprometida com resultados e tecnologicamente qualificada; e (Origem: PRT MS/GM 374/2008, Art. 3º, II, h)
i) fomentar o desenvolvimento de hemoderivados produzidos por tecnologia recombinante e outras rotas tecnológicas. (Origem: PRT MS/GM 374/2008, Art. 3º, II, i)
Art. 791. São diretrizes estabelecidas para o Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde: (Origem: PRT MS/GM 374/2008, Art. 4º)
I - fortalecer, ampliar e qualificar a participação dos produtores públicos no Complexo Industrial da Saúde, de modo a contribuir no processo de transformação da estrutura produtiva do País, tornando-a compatível com um novo padrão de consumo em saúde e com novos padrões tecnológicos; (Origem: PRT MS/GM 374/2008, Art. 4º, I)
II - fomentar as atividades de PD&I no âmbito dos produtores públicos, tornando-os competitivos e capacitados a enfrentar a concorrência global em bases permanentes num contexto de incessante mudança tecnológica; (Origem: PRT MS/GM 374/2008, Art. 4º, II)
III - promover melhorias na gestão dos produtores públicos, estimulando o planejamento estratégico e a adoção de estruturas organizacionais e modelos de gestão capazes de dotá-los de maior agilidade, flexibilidade e eficiência; (Origem: PRT MS/GM 374/2008, Art. 4º, III)
IV - promover a articulação entre os produtores públicos buscando atuação coordenada e cooperada em todas as áreas, mediante a estratégia de organização em rede; (Origem: PRT MS/GM 374/2008, Art. 4º, IV)
V - promover a substituição de importações de produtos e insumos de uso em saúde, priorizando os que possuem maior densidade de conhecimento e de inovação e que sejam considerados estratégicos para o SUS; (Origem: PRT MS/GM 374/2008, Art. 4º, V)
VI - utilizar estrategicamente o poder de compra do Estado na área da saúde em articulação com políticas de fomento ao desenvolvimento industrial; (Origem: PRT MS/GM 374/2008, Art. 4º, VI)
VII - promover a articulação entre os produtores públicos e a indústria privada com vistas à realização de ações complementares e sinérgicas em benefício do mercado público de saúde; (Origem: PRT MS/GM 374/2008, Art. 4º, VII)
VIII - propor, no âmbito do SUS, alterações na legislação de compras de forma a permitir o uso estratégico do poder de compra do Estado para produtos inovadores de alta essencialidade para a saúde; e (Origem: PRT MS/GM 374/2008, Art. 4º, VIII)
IX - promover a articulação dos produtores públicos com a infra-estrutura científica e tecnológica no País para atender aos requerimentos da inovação, viabilizando o desenvolvimento de produtos e processos e a adequação da produção pública aos requerimentos de saúde e de competitividade. (Origem: PRT MS/GM 374/2008, Art. 4º, IX)
Art. 792. O presente Programa será executado, no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, de forma integrada e coordenada com as ações de Assistência Farmacêutica. (Origem: PRT MS/GM 374/2008, Art. 5º)
Art. 793. O Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde contará com um Comitê Gestor e uma Secretaria-Executiva, a serem instituídos no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde. (Origem: PRT MS/GM 374/2008, Art. 6º)
§ 1º Compete ao Comitê Gestor deliberar sobre a estrutura organizacional e o funcionamento do Programa, com vistas a permitir uma discussão permanente dos problemas e a reavaliação constante das prioridades, instrumentos e ações do Programa. O Comitê Gestor será presidido pelo Diretor do Departamento de Economia da Saúde, Investimentos e Desenvolvimento e será integrado por representantes do Departamento de Economia da Saúde, Investimentos e Desenvolvimento e do Departamento de Assistência Farmacêutica e Insumos Estratégicos, da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (DAF/SCTIE/MS). (Origem: PRT MS/GM 374/2008, Art. 6º, § 1º)
§ 2º A Secretaria-Executiva será operada pela Coordenação-Geral de Estudos e Projetos, do Departamento de Economia da Saúde, Investimentos e Desenvolvimento e terá a atribuição de prestar apoio técnico e administrativo para execução do Programa. (Origem: PRT MS/GM 374/2008, Art. 6º, § 2º)
Seção II
Do Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde
Art. 794. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde, que passa a integrar um conjunto de políticas adotadas para estimular a eficiência produtiva no Complexo Industrial da Saúde, constituindo uma prioridade tanto do Sistema Único de Saúde quanto da Política Industrial, Tecnológica e de Comércio Exterior (PITCE). (Origem: PRT MS/GM 375/2008, Art. 1º)
Art. 795. O Programa ora instituído tem como objetivo fortalecer e modernizar o setor de equipamentos e materiais de uso em saúde visando à ampliação da capacidade inovadora das empresas e a mudança de seu patamar competitivo, contribuindo para a redução da defasagem tecnológica existente e o desenvolvimento econômico, científico e tecnológico do País. (Origem: PRT MS/GM 375/2008, Art. 2º)
Art. 796. São objetivos específicos estabelecidos para o Programa: (Origem: PRT MS/GM 375/2008, Art. 3º)
I - definir prioridades considerando as demandas tecnológicas do SUS, os mercados alvo do setor produtivo e a competência técnica instalada no País; (Origem: PRT MS/GM 375/2008, Art. 3º, I)
II - estimular a interação entre empresas universidades e ICT's com o setor produtivo e incentivar o intercâmbio tecnológico entre os setores industriais; (Origem: PRT MS/GM 375/2008, Art. 3º, II)
III - articular para garantir estabilidade regulatória em parceria com a ANVISA e o INMETRO; (Origem: PRT MS/GM 375/2008, Art. 3º, III)
IV - estimular a certificação de produtos como instrumento promotor da inovação e desenvolvimento do setor; (Origem: PRT MS/GM 375/2008, Art. 3º, IV)
V - estimular a ampliação dos investimentos públicos e privados em P,D&I.; (Origem: PRT MS/GM 375/2008, Art. 3º, V)
VI - estimular o setor privado a utilizar os instrumentos de apoio existentes para ampliar o desenvolvimento tecnológico no setor público e privado; (Origem: PRT MS/GM 375/2008, Art. 3º, VI)
VII - estimular a formação e capacitação de recursos humanos nas áreas biomédicas; (Origem: PRT MS/GM 375/2008, Art. 3º, VII)
VIII - expandir e modernizar a infraestrutura de Tecnologia Indústria Básica (TIB) para o setor; e (Origem: PRT MS/GM 375/2008, Art. 3º, VIII)
IX - propor a adoção de políticas de compra governamentais baseadas na qualidade dos insumos e na transferência de tecnologia. (Origem: PRT MS/GM 375/2008, Art. 3º, IX)
Art. 797. São diretrizes estabelecidas para o Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde: (Origem: PRT MS/GM 375/2008, Art. 4º)
I - promover a articulação da cadeia produtiva com a infra-estrutura científica e tecnológica no País para atender aos requerimentos da inovação, viabilizando o desenvolvimento de produtos e processos e a adequação do setor produtivo em consonância com os programas do Ministério da Saúde, em especial os da Secretaria de Atenção a Saúde - SAS; (Origem: PRT MS/GM 375/2008, Art. 4º, I)
II - participar da formulação, implementação e avaliação de políticas, diretrizes e metas para as áreas e temas estratégicos necessários ao desenvolvimento do Complexo Industrial da Saúde no âmbito do SUS; (Origem: PRT MS/GM 375/2008, Art. 4º, II)
III - estabelecer métodos e mecanismos para a análise da viabilidade econômico-sanitária de empreendimentos em saúde; (Origem: PRT MS/GM 375/2008, Art. 4º, III)
IV - formular, avaliar, elaborar normas e participar na execução da política nacional e na produção de insumos estratégicos e equipamentos para a saúde, em articulação com os demais órgãos governamentais; (Origem: PRT MS/GM 375/2008, Art. 4º, IV)
V - consolidar programas e ações, no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos, que permitam a definição de uma estratégia nacional de fomento, desenvolvimento, transferência de tecnologia e inovação para os produtos estratégicos na área da saúde; (Origem: PRT MS/GM 375/2008, Art. 4º, V)
VI - coordenar a organização e o desenvolvimento de programas, projetos e ações que visem induzir o desenvolvimento, a difusão e a incorporação de novas tecnologias no Sistema Único de Saúde; (Origem: PRT MS/GM 375/2008, Art. 4º, VI)
VII - articular a substituição de importações de produtos e insumos de uso em saúde, priorizando os que possuem maior densidade de conhecimento e de inovação e que sejam considerados estratégicos para o SUS; (Origem: PRT MS/GM 375/2008, Art. 4º, VII)
VIII - formular, propor diretrizes e coordenar o desenvolvimento de ações intersetoriais e regulatórias voltadas à produção de equipamentos e materiais para a saúde de interesse nacional; e (Origem: PRT MS/GM 375/2008, Art. 4º, VIII)
IX - propor, no âmbito do SUS, alterações na legislação de compras de forma a permitir o uso estratégico do poder de compra do Estado para produtos inovadores de alta essencialidade para a saúde. (Origem: PRT MS/GM 375/2008, Art. 4º, IX)
Art. 798. O presente Programa será executado no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, de forma integrada e coordenada com as ações da Secretaria de Atenção a Saúde (SAS) e outras instâncias do Ministério da Saúde envolvidas com o tema. (Origem: PRT MS/GM 375/2008, Art. 5º)
Art. 799. O Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde contará com um Comitê Gestor e uma Secretaria-Executiva, a serem instituídos no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde. (Origem: PRT MS/GM 375/2008, Art. 6º)
§ 1º Compete ao Comitê Gestor deliberar sobre a estrutura organizacional e o funcionamento do Programa, com vistas a permitir uma discussão permanente dos problemas e a reavaliação constante das prioridades, instrumentos e ações do Programa. O Comitê Gestor será presidido pelo Diretor do Departamento de Economia da Saúde e será integrado por representantes da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE) e da Secretaria de Atenção a Saúde (SAS). (Origem: PRT MS/GM 375/2008, Art. 6º, § 1º)
§ 2º A Secretaria-Executiva será operada pela Coordenação-Geral de Economia da Saúde do Departamento de Economia da Saúde e terá a atribuição de prestar apoio técnico e administrativo para execução do Programa. (Origem: PRT MS/GM 375/2008, Art. 6º, § 2º)
Art. 800. Ficam estabelecidas, na forma do Anexo XCIV , as estratégias de ação do Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde. (Origem: PRT MS/GM 375/2008, Art. 7º)
Seção III
Do Programa para o Desenvolvimento do Complexo Industrial da Saúde (PROCIS)
Art. 801. Fica instituído o Programa para o Desenvolvimento do Complexo Industrial da Saúde (PROCIS), com o objetivo de fortalecer os produtores públicos e a infraestrutura de produção e inovação em saúde do setor público. (Origem: PRT MS/GM 506/2012, Art. 1º)
Parágrafo Único. Para efeitos desta Seção são considerados produtores públicos os órgãos ou entidades que integrem a administração pública e sejam responsáveis pela produção de fármacos, biofármacos, medicamentos, imunobiológicos, produtos médicos, equipamentos e materiais de uso em saúde e "kits" para diagnóstico de uso "in vitro", primordialmente destinados aos programas estratégicos de saúde pública. (Origem: PRT MS/GM 506/2012, Art. 1º, Parágrafo Único)
Art. 802. O PROCIS tem os seguintes objetivos: (Origem: PRT MS/GM 506/2012, Art. 2º)
I - apoiar a modernização e estruturação produtiva e gerencial; (Origem: PRT MS/GM 506/2012, Art. 2º, I)
II - apoiar a qualificação da produção e manter vigente o Certificado de Boas Práticas de Fabricação (CBPF) emitido pela Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 506/2012, Art. 2º, II)
III - fortalecer as parcerias para o desenvolvimento produtivo visando desenvolver e absorver produtos estratégicos para o Sistema Único de Saúde; (Origem: PRT MS/GM 506/2012, Art. 2º, III)
IV - apoiar a qualificação da gestão com vistas a promover maior eficiência e efetividade; (Origem: PRT MS/GM 506/2012, Art. 2º, IV)
V - apoiar o desenvolvimento tecnológico e a transferência de tecnologias, estratégicos para o Sistema Único de Saúde (SUS); (Origem: PRT MS/GM 506/2012, Art. 2º, V)
VI - manter o aproveitamento das complementariedades entre os laboratórios e respeitar as vocações e o perfil produtivo; e (Origem: PRT MS/GM 506/2012, Art. 2º, VI)
VII - apoiar a infraestrutura pública de tecnologia e inovação para suporte à produção no país de produtos estratégicos para o SUS. (Origem: PRT MS/GM 506/2012, Art. 2º, VII)
Art. 803. O PROCIS será operacionalizado mediante a assinatura de instrumentos específicos a serem firmados entre o Ministério da Saúde e os produtores públicos. (Origem: PRT MS/GM 506/2012, Art. 3º)
§ 1º Os instrumentos de que trata o caput observarão as disposições do Decreto nº 6.170, de 25 de julho de 2007, e da Portaria Interministerial nº 127/MP/MF/MCT, de 29 de maio de 2008, e serão acompanhados de Plano de Trabalho que contenha os seguintes detalhamentos mínimos: (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º)
I - objetivos e meios de execução do projeto; (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º, I)
II - contrapartidas econômica, financeira e/ou de recursos humanos; e (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º, II)
III - orçamento envolvido e respectivo cronograma de desembolso e de execução. (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º, III)
§ 2º Caberá à Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS) a aprovação dos Planos de Trabalho encaminhados pelos produtores públicos para adesão ao PROCIS. (Origem: PRT MS/GM 506/2012, Art. 3º, § 2º)
Art. 804. O produtor público elegível ao PROCIS deverá se comprometer a implementar ações para atender às seguintes exigências mínimas: (Origem: PRT MS/GM 506/2012, Art. 4º)
I - implantação de sistema eficiente de gestão que assegure o efetivo cumprimento dos objetivos estabelecidos no PROCIS; (Origem: PRT MS/GM 506/2012, Art. 4º, I)
II - manutenção de estrutura de gestão compatível com o projeto a ser desenvolvido, que contemple as seguintes áreas: (Origem: PRT MS/GM 506/2012, Art. 4º, II)
a) planejamento; (Origem: PRT MS/GM 506/2012, Art. 4º, II, a)
b) regulatória; (Origem: PRT MS/GM 506/2012, Art. 4º, II, b)
c) controle e garantia de qualidade; (Origem: PRT MS/GM 506/2012, Art. 4º, II, c)
d) produtiva; (Origem: PRT MS/GM 506/2012, Art. 4º, II, d)
e) suprimentos; e (Origem: PRT MS/GM 506/2012, Art. 4º, II, e)
f) jurídica; (Origem: PRT MS/GM 506/2012, Art. 4º, II, f)
III - designação de responsável técnico em cada uma das áreas descritas no inciso II, para interlocução regular com o Comitê Gestor do PROCIS; (Origem: PRT MS/GM 506/2012, Art. 4º, III)
IV - observância estrita dos seguintes itens: (Origem: PRT MS/GM 506/2012, Art. 4º, IV)
a) cronograma físico e financeiro dos termos de cooperação ou convênios celebrados no âmbito do PROCIS; (Origem: PRT MS/GM 506/2012, Art. 4º, IV, a)
b) cronograma de entrega dos produtos fixado nos instrumentos de compras firmados com o Ministério da Saúde; (Origem: PRT MS/GM 506/2012, Art. 4º, IV, b)
c) cronograma de atendimento aos requisitos regulatórios da ANVISA; e (Origem: PRT MS/GM 506/2012, Art. 4º, IV, c)
d) atendimento às normativas da Câmara de Regulação do Mercado de Medicamentos (CMED). (Origem: PRT MS/GM 506/2012, Art. 4º, IV, d)
§ 1º O cumprimento das exigências listadas neste artigo é requisito condicionante para efetivação dos repasses financeiros afetos ao PROCIS. (Origem: PRT MS/GM 506/2012, Art. 4º, § 1º)
§ 2º Os produtores públicos elegíveis ou beneficiados pelo PROCIS deverão garantir livre acesso às suas instalações ao Ministério da Saúde. (Origem: PRT MS/GM 506/2012, Art. 4º, § 2º)
Art. 805. Caberá ao Ministério da Saúde a assinatura de instrumentos de cooperação com outros Ministérios e entes federados, com vistas à integração das ações de todas as esferas de governo direcionadas à temática do PROCIS. (Origem: PRT MS/GM 506/2012, Art. 5º)
Art. 806. Fica instituído o Comitê Gestor do PROCIS, composto pelos seguintes órgãos e entidade: (Origem: PRT MS/GM 506/2012, Art. 6º)
I - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS), que o coordenará; (Origem: PRT MS/GM 506/2012, Art. 6º, I)
II - Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 506/2012, Art. 6º, II)
III - Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 506/2012, Art. 6º, III)
IV - Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 506/2012, Art. 6º, IV)
V - Fundo Nacional de Saúde (FNS/SE/MS); e (Origem: PRT MS/GM 506/2012, Art. 6º, V)
VI - Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 506/2012, Art. 6º, VI)
§ 1º Cada órgão ou entidade indicará um membro titular e um suplente à Coordenação do Comitê. (Origem: PRT MS/GM 506/2012, Art. 6º, § 1º)
§ 2º A coordenação do Comitê Gestor será exercida pelo Secretário da SCTIE/MS, que será substituído, em suas ausências, pelo Diretor do Departamento do Complexo Industrial e Inovação em Saúde (DECIIS/SCTIE/MS). (Origem: PRT MS/GM 506/2012, Art. 6º, § 2º)
Art. 807. Compete ao Comitê Gestor: (Origem: PRT MS/GM 506/2012, Art. 7º)
I - gerenciar e monitorar a implantação das ações do PROCIS; (Origem: PRT MS/GM 506/2012, Art. 7º, I)
II - assegurar o cumprimento dos Planos de Trabalho aprovados; e (Origem: PRT MS/GM 506/2012, Art. 7º, II)
III - avaliar o cumprimento das exigências contidas no art. 804. (Origem: PRT MS/GM 506/2012, Art. 7º, III)
Parágrafo Único. Para fins do disposto no "caput", caberá ao DECIIS/SCTIE/MS verificar o adequado cumprimento de cada Plano de Trabalho aprovado, com a elaboração de relatórios trimestrais, a partir da realização de reuniões e visitas técnicas. (Origem: PRT MS/GM 506/2012, Art. 7º, Parágrafo Único)
Art. 808. Caberá à SE/MS, à SAS/MS, à SVS/MS e à ANVISA oferecer à SCTIE/MS os subsídios necessários ao desenvolvimento e ao acompanhamento do PROCIS, observadas as respectivas competências regimentais. (Origem: PRT MS/GM 506/2012, Art. 8º)
Art. 809. Caberá ao FNS/SE/MS o apoio institucional e técnico necessário para o efetivo cumprimento dos instrumentos específicos firmados com os produtores públicos beneficiados pelo PROCIS. (Origem: PRT MS/GM 506/2012, Art. 9º)
Parágrafo Único. O FNS/SE/MS, com o apoio da SE/MS e da SCTIE/MS, publicará orientação, na forma de Manual Técnico, específica para os Termos de Cooperação ou Convênios firmados no âmbito do PROCIS. (Origem: PRT MS/GM 506/2012, Art. 9º, Parágrafo Único)
Seção IV
Dos Produtos Estratégicos para o SUS
Art. 810. O Anexo XCV, Capítulo II, dispõe sobre os critérios para a definição da lista de produtos estratégicos para o SUS, em consonância com o Decreto 7.807/2012.
Seção V
Das Parcerias para o Desenvolvimento Produtivo (PDP)
Art. 811. O Anexo XCV, Capítulos I e III a VII, estabelece as Parcerias para o Desenvolvimento Produtivo (PDP) e disciplina os respectivos processos de submissão, instrução, decisão, transferência e absorção de tecnologia, aquisição de produtos estratégicos para o SUS no âmbito das PDP e o respectivo monitoramento e avaliação.
Subseção I
Do Comitê Deliberativo para Análise e Avaliação de Parcerias para o Desenvolvimento Produtivo (PDP)
Art. 812. Fica constituído o Comitê Deliberativo para análise e avaliação de Parcerias para o Desenvolvimento Produtivo (PDP). (Origem: PRT MS/GM 918/2015, Art. 1º)
Art. 813. O Comitê Deliberativo será composto pelos seguintes membros: (Origem: PRT MS/GM 918/2015, Art. 2º)
I - Ministério da Saúde (MS); (Origem: PRT MS/GM 918/2015, Art. 2º, I)
II - Ministério da Ciência, Tecnologia, Inovações e Comunicações; (Origem: PRT MS/GM 918/2015, Art. 2º, II)
III - Ministério da Indústria, Comércio Exterior e Serviços; (Origem: PRT MS/GM 918/2015, Art. 2º, III)
IV - Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 918/2015, Art. 2º, IV) (dispositivo acrescentado pela PRT MS/GM 1020/2015)
§ 1º O membro suplente substituirá o membro titular em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 918/2015, Art. 2º, § 1º)
§ 2º As funções dos membros do Comitê Deliberativo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 918/2015, Art. 2º, § 2º)
Art. 814. A coordenação do Comitê Deliberativo será exercida pelo membro titular do Ministério da Saúde e quando do seu impedimento, será assumida pelo seu membro suplente. (Origem: PRT MS/GM 918/2015, Art. 3º)
Art. 815. Os objetos de trabalho do Comitê Deliberativo (CD) são: (Origem: PRT MS/GM 918/2015, Art. 4º)
I - Propostas de projeto de PDP; (Origem: PRT MS/GM 918/2015, Art. 4º, I)
II - Projetos de PDP; e (Origem: PRT MS/GM 918/2015, Art. 4º, II)
III - PDP. (Origem: PRT MS/GM 918/2015, Art. 4º, III)
Art. 816. Compete ao Comitê Deliberativo (CD): (Origem: PRT MS/GM 918/2015, Art. 5º)
I - analisar e validar os relatórios das Comissões Técnicas de Avaliação; (Origem: PRT MS/GM 918/2015, Art. 5º, I)
II - aprovar ou reprovar as propostas de projeto de PDP, mediante parecer conclusivo; (Origem: PRT MS/GM 918/2015, Art. 5º, II)
III - definir os prazos, critérios e condicionantes específicos para execução das propostas de projetos de PDP, dos projetos de PDP e das PDP; (Origem: PRT MS/GM 918/2015, Art. 5º, III)
IV - analisar e validar o grau de integração produtiva em território nacional do produto objeto de PDP para aplicação das regras previstas no Anexo XCV ; (Origem: PRT MS/GM 918/2015, Art. 5º, IV)
V - analisar e validar os prazos do desenvolvimento e absorção tecnológica, incluindo-se as etapas regulatórias, compatíveis com o cronograma proposto; (Origem: PRT MS/GM 918/2015, Art. 5º, V)
VI - estabelecer as condições de economicidade e vantajosidade da PDP; (Origem: PRT MS/GM 918/2015, Art. 5º, VI)
VII - indicar, motivadamente, a necessidade de submissão das propostas de projeto de PDP à nova avaliação por Comissão Técnica de Avaliação "ad hoc", cujos membros serão designados mediante ato do Secretário de Ciência, Tecnologia e Insumos Estratégicos, com definição de seu objeto e prazo de duração; (Origem: PRT MS/GM 918/2015, Art. 5º, VII)
VIII - avaliar as propostas de alterações das tecnologias do projeto de PDP ou dos parceiros envolvidos no projeto de PDP; (Origem: PRT MS/GM 918/2015, Art. 5º, VIII)
IX - avaliar as propostas de alteração do cronograma da PDP apresentadas pela instituição publica, quando iniciado o processo de aquisição, nos casos da proposta de alteração impactar na ampliação do período de aquisição do produto objeto da PDP conforme previsto no cronograma vigente; e (Origem: PRT MS/GM 918/2015, Art. 5º, IX)
X - outras competências que lhe forem atribuídas. (Origem: PRT MS/GM 918/2015, Art. 5º, X)
Art. 817. A coordenação do Comitê Deliberativo poderá convidar representantes de outros órgãos e entidades, públicas ou privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária. (Origem: PRT MS/GM 918/2015, Art. 6º)
Art. 818. Todos os participantes e convidados deverão assinar termo de confidencialidade e declaração de inexistência de conflito de interesses para participação nas atividades do Comitê Deliberativo. (Origem: PRT MS/GM 918/2015, Art. 7º)
Art. 819. O Comitê Deliberativo elaborará seu regimento interno e o das Comissões Técnicas de Avaliação, a serem aprovados por ato do Ministro do Estado da Saúde. (Origem: PRT MS/GM 918/2015, Art. 8º)
Seção VI
Do Programa Nacional de Competitividade em Vacinas (INOVACINA)
Art. 820. Fica instituído o Programa Nacional de Competitividade em Vacinas (INOVACINA), que integra o conjunto de políticas adotada para estimular a eficiência produtiva considerada como vetor dinâmico da atividade industrial pelas "Diretrizes de Política Industrial, Tecnológica e de Comércio Exterior". (Origem: PRT MS/GM 972/2006, Art. 1º)
Art. 821. O Programa INOVACINA tem por finalidade criar condições para alcançar a auto-suficiência nacional na produção das vacinas incluídas no Programa Nacional de Imunização (PNI), por meio das seguintes ações: (Origem: PRT MS/GM 972/2006, Art. 2º)
I - investir na infra-estrutura e no custeio da pesquisa e desenvolvimento em vacinas, incluindo bolsas de pesquisa; (Origem: PRT MS/GM 972/2006, Art. 2º, I)
II - investir no estabelecimento de condições de Boas Práticas de Produção (BPP) nos laboratórios públicos e privados sem fins lucrativos, produtores de vacinas no País; (Origem: PRT MS/GM 972/2006, Art. 2º, II)
III - aperfeiçoar o sistema de regulação de vacinas, com especial atenção aos mecanismos desenvolvidos pela Agência Nacional de Vigilância Sanitária (ANVISA); e (Origem: PRT MS/GM 972/2006, Art. 2º, III)
IV - investir no estabelecimento de uma Rede Pública de Ensaios pré-clínicos e clínicos de vacinas, destinada a avaliar a segurança, a eficácia e efetividade das vacinas produzidas. (Origem: PRT MS/GM 972/2006, Art. 2º, IV)
Art. 822. O Programa INOVACINA deverá seguir as diretrizes de uma Câmara Técnica de Imunobiológicos que orientará, em última instância, sua estrutura organizacional, composição e funcionamento. (Origem: PRT MS/GM 972/2006, Art. 3º)
Art. 823. Fica aprovada a Estrutura Organizacional do Programa INOVACINA, na forma Anexo XCVI . (Origem: PRT MS/GM 972/2006, Art. 4º)
Seção VII
Do Comitê Gestor das Vacinas Pentavalente e Heptavalente
Art. 824. Fica instituído, no âmbito do Ministério da Saúde, o Comitê Gestor das vacinas pentavalente e heptavalente, com a missão de promover, coordenar e acompanhar a execução das atividades de desenvolvimento tecnológico e de produção das vacinas pentavalente e heptavalente junto aos laboratórios públicos produtores de imunobiológicos e seus parceiros, para atender prioritariamente ao Programa Nacional de Imunizações (PNI). (Origem: PRT MS/GM 2691/2011, Art. 1º)
Art. 825. O Comitê Gestor atuará sob a coordenação da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS) e será composto por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2691/2011, Art. 2º)
I - Departamento do Complexo Industrial e Inovação em Saúde da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (DECIIS/SCTIE/MS); (Origem: PRT MS/GM 2691/2011, Art. 2º, I)
II - Departamento de Vigilância das Doenças Transmissíveis da Secretaria de Vigilância em Saúde do Ministério da Saúde (DEVIT/SVS/MS); (Origem: PRT MS/GM 2691/2011, Art. 2º, II)
III - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2691/2011, Art. 2º, III)
IV - Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos); (Origem: PRT MS/GM 2691/2011, Art. 2º, IV)
V - Instituto Butantan; e (Origem: PRT MS/GM 2691/2011, Art. 2º, V)
VI - Fundação Ezequiel Dias (Funed). (Origem: PRT MS/GM 2691/2011, Art. 2º, VI)
§ 1º Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos e entidades à coordenação do Comitê Gestor. (Origem: PRT MS/GM 2691/2011, Art. 2º, § 1º)
§ 2º As funções dos membros do Comitê Gestor não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2691/2011, Art. 2º, § 2º)
Art. 826. Compete ao Comitê Gestor: (Origem: PRT MS/GM 2691/2011, Art. 3º)
I - analisar e validar a adoção das rotas tecnológicas e das parcerias propostas para o desenvolvimento das vacinas pentavalente e heptavalente; (Origem: PRT MS/GM 2691/2011, Art. 3º, I)
II - pactuar compromissos mútuos e o plano de ação, contendo metas, responsabilidades, cronograma de atividades e prazos para o desenvolvimento, a produção e a implementação das vacinas pentavalente e heptavalente no País; e (Origem: PRT MS/GM 2691/2011, Art. 3º, II)
III - realizar a gestão e acompanhamento da execução do plano de ação pactuado. (Origem: PRT MS/GM 2691/2011, Art. 3º, III)
Art. 827. Compete à Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS): (Origem: PRT MS/GM 2691/2011, Art. 4º)
I - coordenar as ações de fomento ao fortalecimento da infraestrutura e à qualificação da produção dos laboratórios públicos produtres de imunobiológicos; (Origem: PRT MS/GM 2691/2011, Art. 4º, I)
II - estimular parcerias público-privadas de transferência de tecnologia visando desenvolvimento tecnológico e inovação na produção de insumos estratégicos na área da saúde; (Origem: PRT MS/GM 2691/2011, Art. 4º, II)
III - orientar os requisitos mínimos que regerá a transferência de tecnologia entre os laboratórios públicos produtores de imunobiológicos e seus parceiros privados; e (Origem: PRT MS/GM 2691/2011, Art. 4º, III)
IV - coordenar o processo de avaliação e incorporação de tecnologias em saúde. (Origem: PRT MS/GM 2691/2011, Art. 4º, IV)
Art. 828. Compete à Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS): (Origem: PRT MS/GM 2691/2011, Art. 5º)
I - fornecer as especificações técnicas das rotas tecnológicas, as definições de parâmetros de programação e padrões de qualidade relativos às vacinas pentavalente e heptavalente destinadas ao PNI; e (Origem: PRT MS/GM 2691/2011, Art. 5º, I)
II - coordenar os processos relativos à aquisição e à distribuição das vacinas pentavalente e heptavalente em âmbito nacional. (Origem: PRT MS/GM 2691/2011, Art. 5º, II)
Art. 829. Compete à Agência Nacional de Vigilância Sanitária (ANVISA) acompanhar as atividades relativas ao desenvolvimento, produção, registro e pós-registro das vacinas pentavalente e heptavalente junto aos laboratórios públicos produtores de imunobiológicos por meio de Comitês Técnico-Regulatórios específicos, conforme disposto na Resolução RDC Nº 2, de 2 de fevereiro de 2011. (Origem: PRT MS/GM 2691/2011, Art. 6º)
Art. 830. Compete aos laboratórios públicos produtores de imunobiológicos celebrar contratos, convênios e/ou acordos de cooperação entre si ou com seus parceiros privados para o desenvolvimento tecnológico e a produção das vacinas pentavalente e heptavalente. (Origem: PRT MS/GM 2691/2011, Art. 7º)
Art. 831. O Comitê Gestor poderá convocar entidades, bem como especialistas, a compor o Comitê quando necessário ao pleno alcance dos objetivos propostos. (Origem: PRT MS/GM 2691/2011, Art. 8º)
Seção VIII
Da Câmara Técnica de Imunobiológicos
Art. 832. Fica instituída a Câmara Técnica de Imunobiológicos, para discussão permanente dos problemas e da reavaliação constante das prioridades e das políticas na área de vacinas com vistas à dinamização do crescimento e à competitividade do segmento e ao aumento da capacidade tecnológica e do sinergismo entre os produtores. (Origem: PRT MS/GM 973/2006, Art. 1º)
Art. 833. A Câmara Técnica de Imunobiológicos tem por finalidade atuar nos espaços que constituem as vertentes centrais para a ampliação da competitividade no setor, em: (Origem: PRT MS/GM 973/2006, Art. 2º)
I - pesquisa, desenvolvimento e inovação em saúde; (Origem: PRT MS/GM 973/2006, Art. 2º, I)
II - produção, comercialização e preços de imunobiológicos; e (Origem: PRT MS/GM 973/2006, Art. 2º, II)
III - qualidade e sustentabilidade econômica. (Origem: PRT MS/GM 973/2006, Art. 2º, III)
Art. 834. A Câmara Técnica de Imunobiológicos terá as seguintes atribuições: (Origem: PRT MS/GM 973/2006, Art. 3º)
I - definir as diretrizes estratégicas do Programa Brasileiro de Competitividade em Vacinas (INOVACINA); (Origem: PRT MS/GM 973/2006, Art. 3º, I)
II - definir estratégias para inovação, incluindo acordos de transferência de tecnologia e desenvolvimento interno; (Origem: PRT MS/GM 973/2006, Art. 3º, II)
III - definir políticas de pesquisa e desenvolvimento, com planejamento a longo prazo, envolvendo propriedade intelectual, recursos humanos e ensaios clínicos; (Origem: PRT MS/GM 973/2006, Art. 3º, III)
IV - propor a definição de produtos prioritários atuais e futuros; (Origem: PRT MS/GM 973/2006, Art. 3º, IV)
V - definir mecanismos para ampliar a articulação entre os produtores; (Origem: PRT MS/GM 973/2006, Art. 3º, V)
VI - definir critérios para seleção e definição de nichos de mercado entre os produtores; (Origem: PRT MS/GM 973/2006, Art. 3º, VI)
VII - desenvolver estudos para acompanhamento da dinâmica do mercado internacional e nacional; (Origem: PRT MS/GM 973/2006, Art. 3º, VII)
VIII - desenvolver propostas de transformação de formas de gestão dos laboratórios oficiais, considerando a auto-sustentabilidade como um pré-requisito; (Origem: PRT MS/GM 973/2006, Art. 3º, VIII)
IX - propor políticas de financiamento abrangentes, multiinstitucionais (FINEP, BNDES, CNPq, CAPES), para capital de giro, modernização da produção, certificação das plantas de produção para cumprimento das normas de Boas Práticas de Fabricação, investimento em desenvolvimento e inovação tecnológica e na formação de especialistas; (Origem: PRT MS/GM 973/2006, Art. 3º, IX)
X - propor uma política de preços e financiamento da produção que permita a auto-sustentabilidade dos produtores; (Origem: PRT MS/GM 973/2006, Art. 3º, X)
XI - revisar os aspectos regulatórios incluindo uma visão de desenvolvimento econômico e tecnológico; e (Origem: PRT MS/GM 973/2006, Art. 3º, XI)
XII - outras atividades correlacionadas como sistemas de controle de qualidade e a produção de animais de laboratório. (Origem: PRT MS/GM 973/2006, Art. 3º, XII)
Parágrafo Único. Caberá à Câmara elaborar proposta de cronograma de trabalho e de regimento interno. (Origem: PRT MS/GM 973/2006, Art. 3º, Parágrafo Único)
Art. 835. A Câmara Técnica de Imunobiológicos será um corpo colegiado constituído por membros e respectivos suplentes designados pelo Ministro da Saúde, formado por titulares ou por representantes das seguintes unidades integrantes da estrutura organizacional do Ministério da Saúde e entidades vinculadas: (Origem: PRT MS/GM 973/2006, Art. 4º)
I - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE); (Origem: PRT MS/GM 973/2006, Art. 4º, I)
II - Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 973/2006, Art. 4º, II)
III - Secretaria de Vigilância em Saúde (SVS); (Origem: PRT MS/GM 973/2006, Art. 4º, III)
IV - Secretaria de Atenção à Saúde (SAS); (Origem: PRT MS/GM 973/2006, Art. 4º, IV)
V - Agência Nacional de Vigilância Sanitária (ANVISA); e (Origem: PRT MS/GM 973/2006, Art. 4º, V)
VI - 3 Três representantes dos Laboratórios Produtores Oficiais. (Origem: PRT MS/GM 973/2006, Art. 4º, VI)
Parágrafo Único. A Presidência da Câmara caberá ao representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE); (Origem: PRT MS/GM 973/2006, Art. 4º, Parágrafo Único)
Art. 836. Caberá ao colegiado solicitar o apoio de servidores dos órgãos e entidades do Ministério da Saúde, bem como convidar representantes de outros órgãos da administração pública e de outros Ministérios, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 973/2006, Art. 5º)
Parágrafo Único. A participação de pessoas externas ao Ministério da Saúde é considerada atividade de relevante interesse nacional e não será remunerada. (Origem: PRT MS/GM 973/2006, Art. 5º, Parágrafo Único)
Art. 837. A Câmara Técnica de Imunobiológicos terá o apoio de Grupos Técnicos de Trabalho formados por especialistas em cada área para subsidiar e orientar suas decisões. (Origem: PRT MS/GM 973/2006, Art. 6º)
§ 1º Deverão ter caráter permanente: (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º)
I - Grupo Técnico de Trabalho para a área de Recursos Humanos; (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º, I)
II - Grupo Técnico de Trabalho para a área de Produção; (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º, II)
III - Grupo Técnico de Trabalho para Pesquisa & Desenvolvimento. (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º, III)
§ 2º A Câmara reunir-se-á ordinariamente a cada dois meses e extraordinariamente, sempre que necessário, por convocação do Presidente. (Origem: PRT MS/GM 973/2006, Art. 6º, § 2º)
Seção IX
Do Plano de Ação de Pesquisa Clínica no Brasil
Art. 837-A. Fica instituído o Plano de Ação de Pesquisa Clínica no Brasil, com a finalidade de aumentar a capacidade do País em desenvolver e atrair ensaios clínicos. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Parágrafo único. O Plano será disponibilizado no sítio eletrônico http://portalms.saude.gov.br/ciencia-e-tecnologia-e-complexo-industrial. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Art. 837-B. São objetivos do Plano de Ação de Pesquisa Clínica no Brasil: (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
I - aperfeiçoar o sistema de análise ética em pesquisas envolvendo seres humanos; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
II - apoiar a Agência Nacional de Vigilância Sanitária - Anvisa no aprimoramento do sistema regulatório para pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
III - aprimorar a capacidade científica instalada em pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
IV - promover a formação continuada de recursos humanos em pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
V - aprimorar a governança da Rede Nacional de Pesquisa Clínica - RNCP; e (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
VI - apoiar a translação e a difusão do conhecimento em pesquisa clínica. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Art. 837-C. O Plano de Ação de Pesquisa Clínica no Brasil está estruturado em seis eixos estratégicos: (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
I - regulação ética; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
II - regulação sanitária; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
III - fomento científico e tecnológico; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
IV - formação em pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
V - Rede Nacional de Pesquisa Clínica - RNPC; e (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
VI - gestão do conhecimento. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Art. 837-D. Caberá ao Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde - DECIT/SCTIE/MS coordenar, implementar, monitorar e avaliar as ações que compõem o Plano de Ação de Pesquisa Clínica no Brasil. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
§ 1º O DECIT/SCTIE/MS será responsável pela articulação com as demais Secretarias do Ministério da Saúde, a Anvisa, a Comissão Nacional de Ética em Pesquisa do Conselho Nacional de Saúde - CONEP/CNS, o Ministério da Ciência, Tecnologia, Inovações e Comunicações, o Ministério da Educação, o Ministério da Indústria, Comércio Exterior e Serviços e outros órgãos e entidades da administração pública direta e indireta e da sociedade civil organizada atuantes no campo da ciência, tecnologia e inovação, para participarem das atividades do Plano, sempre que essa participação for pertinente em razão de sua área de atuação. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
§ 2º Para o alcance dos objetivos do Plano, o DECIT/SCTIE/MS poderá ainda: (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
I - articular para promover a aproximação do setor regulado com órgãos e entidades da administração pública direta e indireta; e (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
II - constituir grupos de trabalho para o cumprimento de finalidades específicas relacionadas ao Plano e convidar, para fazerem parte de sua composição, representantes de outros órgãos e entidades da administração pública direta e indireta, da sociedade civil organizada e do setor regulado. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
CAPÍTULO V
DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (PQA-VS)
Art. 838. Este Capítulo regulamenta o Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS), com a definição de suas diretrizes, financiamento, metodologia de adesão e critérios de avaliação dos estados, Distrito Federal e municípios. (Origem: PRT MS/GM 1708/2013, Art. 1º)
Art. 839. O PQA-VS tem como objetivo induzir o aperfeiçoamento das ações de vigilância em saúde nos âmbitos estadual, distrital e municipal e é composto por Fase de Adesão e Fase de Avaliação. (Origem: PRT MS/GM 1708/2013, Art. 2º)
Art. 840. São diretrizes do PQA-VS: (Origem: PRT MS/GM 1708/2013, Art. 3º)
I - o processo contínuo e progressivo de melhoria das ações de vigilância em saúde que envolva a gestão, o processo de trabalho e os resultados alcançados pelos Estados, Distrito Federal e Municípios; (Origem: PRT MS/GM 1708/2013, Art. 3º, I)
II - a gestão baseada em compromissos e resultados, expressos em metas de indicadores pactuados, constantes do Anexos XCVIII e XCIX ; e (Origem: PRT MS/GM 1708/2013, Art. 3º, II)
III - adesão voluntária de Estados, Distrito Federal e Municípios. (Origem: PRT MS/GM 1708/2013, Art. 3º, III)
Art. 841. A Fase de Adesão ao PQA-VS é composta pelas seguintes etapas: (Origem: PRT MS/GM 1708/2013, Art. 5º)
I - assinatura do Termo de Adesão ao PQA-VS pelos Municípios, com o preenchimento do modelo apresentado no Anexo XCVII ; (Origem: PRT MS/GM 1708/2013, Art. 5º, I)
II - encaminhamento pelo Município do Termo de Adesão à Comissão Intergestores Regional (CIR), para conhecimento, e envio à Comissão Intergestores Bipartite (CIB) para homologação; e (Origem: PRT MS/GM 1708/2013, Art. 5º, II)
III - encaminhamento pela CIB à Secretaria de Vigilância em Saúde (SVS/MS) de Resolução com a relação dos Municípios que aderiram ao PQA-VS. (Origem: PRT MS/GM 1708/2013, Art. 5º, III)
§ 1º A Secretaria de Saúde do Distrito Federal, após a assinatura do Termo de Adesão, o encaminhará a seu Colegiado de Gestão para conhecimento e posterior envio à SVS/MS. (Origem: PRT MS/GM 1708/2013, Art. 5º, § 1º)
§ 2º A adesão das Secretarias Estaduais de Saúde somente ocorrerá quando, pelo menos, 60% (sessenta por cento) dos Municípios de seu território tiverem formalizado o Termo de Adesão de que trata o inciso I do "caput", exigindo, para a formalização de sua adesão, a assinatura do Modelo constante do Anexo XCVII e posterior envio à SVS/MS. (Origem: PRT MS/GM 1708/2013, Art. 5º, § 2º)
Art. 842. A adesão de novos entes federativos ao PQA-VS ocorrerá até o final do primeiro trimestre de cada ano. (Origem: PRT MS/GM 1708/2013, Art. 7º)
Parágrafo Único. O Ministério da Saúde divulgará a relação dos Estados, Distrito Federal e Municípios que aderirem ao PQA-VS por meio de ato publicado no Diário Oficial da União. (Origem: PRT MS/GM 1708/2013, Art. 7º, § 2º)
Art. 843. A Fase de Avaliação do PQA-VS é composta pelas seguintes etapas: (Origem: PRT MS/GM 1708/2013, Art. 8º)
I - extração dos dados existentes no banco nacional do sistema de informação correspondente referentes a cada indicador pactuado; (Origem: PRT MS/GM 1708/2013, Art. 8º, I)
II - comparação entre os resultados obtido s e a metas estabelecidas; e (Origem: PRT MS/GM 1708/2013, Art. 8º, II)
III - quantificação do número de metas alcançadas de acordo com a estratificação estabelecida pelo PQA-VS com base na população residente em cada Município, de acordo com os dados da Fundação Instituto Brasileiro de Geografia e Estatística (IBGE). (Origem: PRT MS/GM 1708/2013, Art. 8º, III)
§ 1º A quantificação de que trata o inciso III do "caput" será a base para a definição do recurso financeiro a ser repassado para os Municípios aderidos ao PQA-VS. (Origem: PRT MS/GM 1708/2013, Art. 8º, § 1º)
§ 2º A Fase de Avaliação ocorrerá anualmente no segundo trimestre do ano subsequente ao da adesão do ente federativo. (Origem: PRT MS/GM 1708/2013, Art. 8º, § 2º)
Art. 844. O Ministério da Saúde divulgará o resultado da Fase de Avaliação do PQA-VS e os valores a serem transferidos aos Estados, Distrito Federal e Municípios que aderirem ao Programa por meio de ato publicado no Diário Oficial da União. (Origem: PRT MS/GM 1708/2013, Art. 12)
Art. 845. A relação de metas, com seus respectivos indicadores, e a metodologia para a Fase de Avaliação, estabelecidas por este Capítulo, poderão ser revisadas anualmente pela SVS/MS. (Origem: PRT MS/GM 1708/2013, Art. 14)
Parágrafo Único. Na hipótese de ocorrer a revisão de que trata o "caput", o Ministério da Saúde a submeterá à CIT para aprovação. (Origem: PRT MS/GM 1708/2013, Art. 14, Parágrafo Único)
Art. 846. Ficam definidos a relação de metas e seus respectivos indicadores do Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS). (Origem: PRT MS/GM 2984/2016, Art. 1º)
Art. 847. A relação das metas, com seus respectivos indicadores, que expressam os compromissos e responsabilidades de estados, Distrito Federal e municípios, no âmbito do PQA-VS, consta do Anexo C . (Origem: PRT MS/GM 2984/2016, Art. 2º)
§ 1º O valor das metas definidas não poderá ser alterado pelo ente federado aderido ao Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS). (Origem: PRT MS/GM 2984/2016, Art. 2º, § 1º)
§ 2º Anexo CI apresenta o Caderno de Indicadores do PQA-VS, referente às metas de que trata o "caput" deste artigo. (Origem: PRT MS/GM 2984/2016, Art. 2º, § 2º)
CAPÍTULO VI
DO PROGRAMA NACIONAL DE DESENVOLVIMENTO GERENCIAL NO SUS
Art. 848. Fica instituído o Programa Nacional de Desenvolvimento Gerencial no Sistema Único de Saúde (PNDG), com o objetivo de incentivar os processos de qualificação para a gestão e gerência do Sistema Único de Saúde. (Origem: PRT MS/GM 1311/2010, Art. 1º)
§ 1º São diretrizes do PNDG: (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º)
I - orientar-se pelos princípios e práticas da gestão democrática e participativa; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, I)
II - fortalecer a capacidade de desenvolver novos conhecimentos, habilidades e atitudes gerenciais centrados nas necessidades e demandas dos usuários; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, II)
III - desenvolver o programa em estreita articulação com a Política de Educação Permanente em Saúde (EPS); (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, III)
IV - estabelecer parcerias com os gestores do SUS quanto aos processos de formação adequados às diversas realidades locais, regionais e estaduais, bem como em relação ao nível instrucional do profissional de saúde a ser atingido pelo PNDG; e (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, IV)
V - consolidar o eixo da gestão do trabalho e educação na saúde do Pacto de Gestão. (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, V)
§ 2º São objetivos do PNDG: (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º)
I - garantir a integralidade e a qualidade das práticas de saúde, no âmbito do SUS; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, I)
II - qualificar os profissionais de saúde para o exercício da função gerencial em todos os pontos do SUS; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, II)
III - estabelecer instrumentos de cooperação entre os gestores do SUS e as instituições de educação superior da área da saúde, visando à melhoria da qualidade e resolutividade da atenção à saúde prestada ao usuário e à integração da rede na educação permanente; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, III)
IV - promover articulação entre as diversas iniciativas de formação e de capacitação dos gestores nos diversos níveis de governo; e (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, IV)
V - buscar integração com as instituições de ensino, principalmente em relação às universidades, escolas de saúde pública, institutos de saúde coletiva. (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, V)
Art. 849. O PNDG será composto pela Comissão Consultiva, responsável por definir as linhas e áreas prioritárias para a execução do presente programa, e será constituída por: (Origem: PRT MS/GM 1311/2010, Art. 2º)
I - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde; (Origem: PRT MS/GM 1311/2010, Art. 2º, I)
II - um representante da Secretaria-Executiva; (Origem: PRT MS/GM 1311/2010, Art. 2º, II)
III - um representante da Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1311/2010, Art. 2º, III)
IV - um representante da Secretaria de Gestão Estratégica e Participativa; (Origem: PRT MS/GM 1311/2010, Art. 2º, IV)
V - um representante da Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 1311/2010, Art. 2º, V)
VI - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos; (Origem: PRT MS/GM 1311/2010, Art. 2º, VI)
VII - um membro titular e um suplente do Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 1311/2010, Art. 2º, VII)
VIII - um membro titular e um suplente do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 1311/2010, Art. 2º, VIII)
Parágrafo Único. Compete à Secretaria de Gestão do Trabalho e da Educação na Saúde, do Ministério da Saúde, a coordenação da Comissão prevista no caput deste artigo. (Origem: PRT MS/GM 1311/2010, Art. 2º, Parágrafo Único)
Art. 850. O Ministério da Saúde destinará recursos orçamentários da Funcional Programática nº 10.128.1436.8630.0001 para atender ao Programa Nacional de Desenvolvimento Gerencial no SUS (PNDG). (Origem: PRT MS/GM 1311/2010, Art. 3º)
CAPÍTULO VII
DO MONITORAMENTO DAS AÇÕES E SERVIÇOS PÚBLICOS ESTRATÉGICOS DE VIGILÂNCIA EM SAÚDE
Art. 851. O Ministério da Saúde, por meio da SVS/MS, efetuará o monitoramento sistemático e regular das ações e serviços públicos estratégicos de vigilância em saúde, para fins de manutenção do recebimento do incentivo financeiro de custeio mensal correspondente. (Origem: PRT MS/GM 183/2014, Art. 45)
Parágrafo Único. A manutenção do repasse dos recursos do incentivo financeiro está condicionada à alimentação regular dos sistemas de informação de base nacional, previstos no art. 454 da Portaria de Consolidação nº 6, mediante monitoramento regular e sistemático pela SVS/MS. (Origem: PRT MS/GM 183/2014, Art. 45, Parágrafo Único)
Art. 852. O cancelamento do repasse do recurso se dará de forma parcial ou total, a depender do número de ações ou serviços desabilitados e dos recursos destinados ao ente. (Origem: PRT MS/GM 183/2014, Art. 46)
Parágrafo Único. O ente poderá pleitear nova habilitação à ação ou ao serviço para qual tenha sido desabilitado, desde que apresente novo termo de compromisso previsto no art. 505, § 1º , I da Portaria de Consolidação nº 6, e se comprometa com as responsabilidades relacionadas à respectiva ação ou serviço público estratégicos de vigilância em saúde, o que será avaliado e aprovado ou não pela SVS/MS. (Origem: PRT MS/GM 183/2014, Art. 46, Parágrafo Único)
Art. 853. O monitoramento do incentivo financeiro de custeio para implantação e manutenção de ações e serviços públicos estratégicos de vigilância em saúde não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 183/2014, Art. 48)
Art. 854. O detalhamento das ações específicas e serviços públicos estratégicos de vigilância em saúde será inserido na Programação Anual de Saúde (PAS), observadas as diretrizes constantes nos Planos de Saúde dos entes federativos. (Origem: PRT MS/GM 183/2014, Art. 51)
CAPÍTULO VIII
DO PROGRAMA NACIONAL DE AVALIAÇÃO DE SERVIÇOS DE SAÚDE (PNASS)
Art. 855. Fica instituído o Programa Nacional de Avaliação de Serviços de Saúde (PNASS). (Origem: PRT MS/GM 28/2015, Art. 1º)
Art. 856. O PNASS tem como objetivo geral avaliar a eficiência, eficácia e efetividade das estruturas, processos e resultados relacionados ao risco, acesso e satisfação dos cidadãos frente aos serviços de saúde do Sistema Único de Saúde (SUS), buscando a apreensão mais completa e abrangente possível da suas realidades, em suas diferentes dimensões, na busca da resolubilidade e qualidade. (Origem: PRT MS/GM 28/2015, Art. 2º)
Art. 857. O PNASS tem como objetivos específicos: (Origem: PRT MS/GM 28/2015, Art. 3º)
I - incentivar a cultura avaliativa dos gestores para os serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, I)
II - fomentar a cultura avaliativa nos estabelecimentos de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, II)
III - ser instrumento de apoio à gestão do SUS; (Origem: PRT MS/GM 28/2015, Art. 3º, III)
IV - produzir conhecimento qualitativo da rede de serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, IV)
V - implementar padrões de conformidade dos serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, V)
VI - incorporar indicadores de produção para avaliação de serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, VI)
VII - aferir a satisfação dos usuários do SUS; (Origem: PRT MS/GM 28/2015, Art. 3º, VII)
VIII - conhecer as condições e relações de trabalho dos profissionais nos estabelecimentos de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, VIII)
IX - identificar oportunidades e possibilidades de melhoria; (Origem: PRT MS/GM 28/2015, Art. 3º, IX)
X - possibilitar a observação de experiências exitosas para melhoria da qualidade local; e (Origem: PRT MS/GM 28/2015, Art. 3º, X)
XI - disponibilizar os resultados para conhecimento público. (Origem: PRT MS/GM 28/2015, Art. 3º, XI)
Art. 858. O PNASS será executado por meio de instrumentos avaliativos, como roteiros de verificação e questionários de pesquisa, estabelecidos pelo Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS), que avaliarão os estabelecimentos de atenção especializada em saúde, ambulatorial e hospitalar, quanto as seguintes dimensões: (Origem: PRT MS/GM 28/2015, Art. 4º)
I - estrutura; (Origem: PRT MS/GM 28/2015, Art. 4º, I)
II - processos de trabalho; (Origem: PRT MS/GM 28/2015, Art. 4º, II)
III - resultados relacionados ao risco; e (Origem: PRT MS/GM 28/2015, Art. 4º, III)
IV - satisfação dos usuários em relação ao atendimento recebido. (Origem: PRT MS/GM 28/2015, Art. 4º, IV)
Art. 859. O PNASS será aplicado periodicamente nos estabelecimentos de atenção especializada em saúde, ambulatorial e hospitalar, contemplados com recursos financeiros provenientes de programas, políticas e incentivos do Ministério da Saúde. (Origem: PRT MS/GM 28/2015, Art. 5º)
§ 1º Os estabelecimentos de atenção especializada em saúde a serem avaliados pelo PNASS serão indicados a partir de critérios estabelecidos pelo Ministério da Saúde. (Origem: PRT MS/GM 28/2015, Art. 5º, § 1º)
§ 2º O Ministério da Saúde poderá firmar termo de cooperação com Instituições de Ensino Superior Federais para a aplicação dos instrumentos avaliativos do PNASS. (Origem: PRT MS/GM 28/2015, Art. 5º, § 2º)
Art. 860. Fica instituído o Sistema de Informação do PNASS (SIPNASS), sistema informatizado com a finalidade de armazenar os dados coletados, gerenciar o fluxo a partir da aplicação dos instrumentos avaliativos e subsidiar a análise e a produção dos resultados do PNASS, para divulgação. (Origem: PRT MS/GM 28/2015, Art. 6º)
Art. 861. O DRAC/SAS/MS será responsável pela coordenação e monitoramento do PNASS. (Origem: PRT MS/GM 28/2015, Art. 7º)
Art. 862. Os recursos orçamentários, objeto deste Capítulo, correrão por conta do Programa de Trabalho 10.302.2015.8721 - Implementação da Regulação, Controle e Avaliação da Atenção à Saúde. (Origem: PRT MS/GM 28/2015, Art. 8º)
CAPÍTULO IX
DO PLANEJAMENTO, EXECUÇÃO E AVALIAÇÃO DAS AÇÕES DE VIGILÂNCIA E ASSISTÊNCIA À SAÚDE EM EVENTOS DE MASSA
Art. 863. O Anexo CII dispõe sobre o planejamento, execução e avaliação das ações de vigilância e assistência à saúde em eventos de massa.
TÍTULO VII
DAS DISPOSIÇÕES FINAIS
Art. 864. Ficam revogadas, por consolidação, as seguintes normas:
I - Portaria nº 2681/GM/MS, de 7 de novembro de 2013, publicada no Diário Oficial da União, Seção 1, de 8 de novembro de 2013, p. 37;
II - arts. 1º a 6º, 13 a 17, 25 a 38 da Portaria nº 1707/GM/MS, de 23 de setembro de 2016, publicada no Diário Oficial da União, Seção 1, de 26 de setembro de 2016, p. 36;
III - arts. 1º a 4º da Portaria nº 1469/GM/MS, de 10 de julho de 2006, publicada no Diário Oficial da União, Seção 1, de 11 de julho de 2006, p. 41;
IV - Portaria nº 2077/GM/MS, de 31 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 4 de novembro de 2003, p. 43;
V - Portaria nº 2078/GM/MS, de 31 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 4 de novembro de 2003, p. 45;
VI - arts. 1º a 7º, 16, 19 a 21 da Portaria nº 2840/GM/MS, de 29 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 30 de dezembro de 2014, p. 54;
VII - arts. 1º a 7º, 9º e 11 da Portaria nº 2197/GM/MS, de 14 de outubro de 2004, publicada no Diário Oficial da União, Seção 1, de 15 de outubro de 2004, p. 49;
VIII - arts. 1º, 2º, 5º, 7º e 9º da Portaria nº 816/GM/MS, de 30 de abril de 2002, publicada no Diário Oficial da União, Seção 1, de 3 de maio de 2002, p. 29;
IX - Portaria nº 1028/GM/MS, de 1 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 4 de julho de 2005, p. 55;
X - Portaria nº 799/GM/MS, de 19 de julho de 2000, publicada no Diário Oficial da União, Seção 1, de 20 de julho de 2000, p. 13;
XI - Portaria nº 251/GM/MS, de 31 de janeiro de 2002, publicada no Diário Oficial da União, Seção 1, de 4 de fevereiro de 2002, p. 52;
XII - Portaria nº 1977/GM/MS, de 12 de setembro de 2014, publicada no Diário Oficial da União, Seção 1, de 15 de setembro de 2014, p. 53;
XIII - Portaria nº 729/GM/MS, de 13 de maio de 2005, publicada no Diário Oficial da União, Seção 1, de 16 de maio de 2005, p. 60;
XIV - Portaria nº 1052/GM/MS, de 8 de maio de 2007, publicada no Diário Oficial da União, Seção 1, de 9 de maio de 2007, p. 33;
XV - Portaria nº 3244/GM/MS, de 30 de dezembro de 2011, publicada no Diário Oficial da União, Seção 1, de 2 de janeiro de 2012, p. 52;
XVI - arts. 1º a 6º e 11 da Portaria nº 822/GM/MS, de 6 de junho de 2001, publicada no Diário Oficial da União, Seção 1, de 7 de junho de 2001, p. 33;
XVII - Portaria nº 1069/GM/MS, de 5 de junho de 2002, publicada no Diário Oficial da União, Seção 1, de 10 de junho de 2002, p. 28;
XVIII - Portaria nº 111/GM/MS, de 19 de janeiro de 2012, publicada no Diário Oficial da União, Seção 1, de 20 de janeiro de 2012, p. 40;
XIX - Portaria nº 529/GM/MS, de 1 de abril de 2013, publicada no Diário Oficial da União, Seção 1, de 2 de abril de 2013, p. 43;
XX - Portaria nº 798/GM/MS, de 17 de junho de 2015, publicada no Diário Oficial da União, Seção 1, de 19 de junho de 2015, p. 32;
XXI - Portaria nº 586/GM/MS, de 6 de abril de 2004, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2004, p. 87;
XXII - Portaria nº 814/GM/MS, de 26 de julho de 2000, publicada no Diário Oficial da União, Seção 1, de 27 de julho de 2000, p. 26;
XXIII - Portaria nº 587/GM/MS, de 6 de abril de 2004, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2004, p. 87;
XXIV - Portaria nº 183/GM/MS, de 30 de janeiro de 2014, publicada no Diário Oficial da União, Seção 1, de 31 de janeiro de 2014, p. 59;
XXV - Portaria nº 344/GM/MS, de 19 de fevereiro de 2002, publicada no Diário Oficial da União, Seção 1, de 20 de fevereiro de 2002, p. 29;
XXVI - arts. 1º a 10, 12, 14 e 15 da Portaria nº 2304/GM/MS, de 4 de outubro de 2012, publicada no Diário Oficial da União, Seção 1, de 5 de outubro de 2012, p. 86;
XXVII - Portaria nº 2898/GM/MS, de 28 de novembro de 2013, publicada no Diário Oficial da União, Seção 1, de 29 de novembro de 2013, p. 119;
XXVIII - Portaria nº 2508/GM/MS, de 27 de outubro de 2011, publicada no Diário Oficial da União, Seção 1, de 28 de outubro de 2011, p. 40;
XXIX - Portaria nº 613/GM/MS, de 3 de março de 2017, publicada no Diário Oficial da União, Seção 1, de 6 de março de 2017, p. 73;
XXX - Portaria nº 1400/GM/MS, de 14 de agosto de 1991, publicada no Diário Oficial da União, Seção 1, de 16 de agosto de 1991, p. 14;
XXXI - Portaria nº 1138/GM/MS, de 23 de maio de 2014, publicada no Diário Oficial da União, Seção 1, de 26 de maio de 2014, p. 83;
XXXII - Portaria nº 44/GM/MS, de 3 de janeiro de 2002, publicada no Diário Oficial da União, Seção 1, de 8 de janeiro de 2002, p. 77;
XXXIII - Portaria nº 451/GM/MS, de 13 de fevereiro de 2017, publicada no Diário Oficial da União, Seção 1, de 14 de fevereiro de 2017, p. 31;
XXXIV - Portaria nº 1398/GM/MS, de 8 de julho de 2008, publicada no Diário Oficial da União, Seção 1, de 9 de julho de 2008, p. 42;
XXXV - Portaria nº 1402/GM/MS, de 14 de agosto de 1991, publicada no Diário Oficial da União, Seção 1, de 16 de agosto de 1991, p. 19;
XXXVI - Portaria nº 1933/GM/MS, de 9 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 10 de outubro de 2003, p. 58;
XXXVII - Portaria nº 2001/GM/MS, de 17 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 20 de outubro de 2003, p. 81;
XXXVIII - arts. 2º a 8º da Portaria nº 1934/GM/MS, de 9 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 10 de outubro de 2003, p. 58;
XXXIX - Portaria nº 335/GM/MS, de 12 de fevereiro de 2007, publicada no Diário Oficial da União, Seção 1, de 13 de fevereiro de 2007, p. 56;
XL - Portaria nº 236/GM/MS, de 2 de maio de 1985, publicada no Diário Oficial da União, Seção 1, de 6 de maio de 1985, p. 6856;
XLI - Portaria nº 2080/GM/MS, de 31 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 4 de novembro de 2003, p. 45;
XLII - Portaria nº 1932/GM/MS, de 9 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 10 de outubro de 2003, p. 58;
XLIII - Portaria nº 2362/GM/MS, de 1 de dezembro de 2005, publicada no Diário Oficial da União, Seção 1, de 2 de dezembro de 2005, p. 59;
XLIV - Portaria nº 520/GM/MS, de 6 de abril de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2005, p. 39;
XLV - Portaria nº 205/GM/MS, de 17 de fevereiro de 2016, publicada no Diário Oficial da União, Seção 1, de 18 de fevereiro de 2016, p. 24;
XLVI - Portaria nº 652/GM/MS, de 28 de maio de 2003, publicada no Diário Oficial da União, Seção 1, de 30 de maio de 2003, p. 78;
XLVII - Portaria nº 427/GM/MS, de 22 de março de 2005, publicada no Diário Oficial da União, Seção 1, de 23 de março de 2005, p. 23;
XLVIII - Portaria nº 2775/GM/MS, de 22 de dezembro de 2016, publicada no Diário Oficial da União, Seção 1, de 23 de dezembro de 2016, p. 164;
XLIX - Portaria nº 1133/GM/MS, de 6 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2005, p. 23;
L - Portaria nº 1727/GM/MS, de 11 de julho de 2017, publicada no Diário Oficial da União, Seção 1, de 12 de julho de 2017, p. 47;
LI - Portaria nº 1397/GM/MS, de 7 de junho de 2017, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2017, p. 87;
LII - Portaria nº 1533/GM/MS, de 18 de agosto de 2016, publicada no Diário Oficial da União, Seção 1, de 19 de agosto de 2016, p. 55;
LIII - Portaria nº 2672/GM/MS, de 16 de novembro de 2011, publicada no Diário Oficial da União, Seção 1, de 17 de novembro de 2011, p. 84;
LIV - Portaria nº 2871/GM/MS, de 19 de novembro de 2009, publicada no Diário Oficial da União, Seção 1, de 20 de novembro de 2009, p. 119;
LV - Portaria nº 1969/GM/MS, de 25 de outubro de 2001, publicada no Diário Oficial da União, Seção 1, de 26 de outubro de 2001, p. 87;
LVI - Portaria nº 3120/GM/MS, de 1 de julho de 1998, publicada no Diário Oficial da União, Seção 1, de 2 de julho de 1998, p. 36;
LVII - Portaria nº 1339/GM/MS, de 18 de novembro de 1999, publicada no Diário Oficial da União, Seção 1, de 19 de novembro de 1999, p. 21;
LVIII - Portaria nº 776/GM/MS, de 28 de abril de 2004, publicada no Diário Oficial da União, Seção 1, de 29 de abril de 2004, p. 34;
LIX - Portaria nº 1851/GM/MS, de 9 de agosto de 2006, publicada no Diário Oficial da União, Seção 1, de 10 de agosto de 2006, p. 34;
LX - Portaria nº 1986/GM/MS, de 25 de outubro de 2001, publicada no Diário Oficial da União, Seção 1, de 26 de outubro de 2001, p. 93;
LXI - Portaria nº 2362/GM/MS, de 17 de outubro de 2012, publicada no Diário Oficial da União, Seção 1, de 18 de outubro de 2012, p. 45;
LXII - Portaria nº 2395/GM/MS, de 7 de outubro de 2009, publicada no Diário Oficial da União, Seção 1, de 9 de outubro de 2009, p. 115;
LXIII - Portaria nº 2546/GM/MS, de 27 de outubro de 2011, publicada no Diário Oficial da União, Seção 1, de 28 de outubro de 2011, p. 50;
LXIV - Portaria nº 452/GM/MS, de 4 de março de 2010, publicada no Diário Oficial da União, Seção 1, de 5 de março de 2010, p. 53;
LXV - arts. 1º a 19 da Portaria nº 2554/GM/MS, de 28 de outubro de 2011, publicada no Diário Oficial da União, Seção 1, de 31 de outubro de 2011, p. 28;
LXVI - Portaria nº 2525/GM/MS, de 29 de outubro de 2013, publicada no Diário Oficial da União, Seção 1, de 30 de outubro de 2013, p. 45;
LXVII - arts. 9º a 17 da Portaria nº 2859/GM/MS, de 29 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 30 de dezembro de 2014, p. 61;
LXVIII - Portaria nº 58/GM/MS, de 29 de janeiro de 2015, publicada no Diário Oficial da União, Seção 1, de 30 de janeiro de 2015, p. 100;
LXIX - arts. 1º a 8º, 11 e 12 da Portaria nº 1645/GM/MS, de 2 de outubro de 2015, publicada no Diário Oficial da União, Seção 1, de 5 de outubro de 2015, p. 668;
LXX - Portaria nº 1560/GM/MS, de 21 de junho de 2017, publicada no Diário Oficial da União, Seção 1, de 22 de junho de 2017, p. 31;
LXXI - arts. 1º a 3º da Portaria nº 878/GM/MS, de 8 de maio de 2002, publicada no Diário Oficial da União, Seção 1, de 10 de maio de 2002, p. 72;
LXXII - arts. 1º a 33 e 42 da Portaria nº 825/GM/MS, de 25 de abril de 2016, publicada no Diário Oficial da União, Seção 1, de 26 de abril de 2016, p. 33;
LXXIII - Portaria nº 1274/GM/MS, de 25 de junho de 2008, publicada no Diário Oficial da União, Seção 1, de 26 de junho de 2008, p. 41;
LXXIV - Portaria nº 886/GM/MS, de 20 de abril de 2010, publicada no Diário Oficial da União, Seção 1, de 22 de abril de 2010, p. 75;
LXXV - Portaria nº 1214/GM/MS, de 13 de junho de 2012, publicada no Diário Oficial da União, Seção 1, de 14 de junho de 2012, p. 29;
LXXVI - Portaria nº 599/GM/MS, de 23 de março de 2006, publicada no Diário Oficial da União, Seção 1, de 24 de março de 2006, p. 51;
LXXVII - arts. 1º a 8º, 11 e 12 da Portaria nº 1599/GM/MS, de 30 de setembro de 2015, publicada no Diário Oficial da União, Seção 1, de 2 de outubro de 2015, p. 31;
LXXVIII - arts. 1º a 3º e 5º da Portaria nº 569/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 4;
LXXIX - arts. 1º, 4º, 5º, 8º, 9º e 12 da Portaria nº 570/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 6;
LXXX - arts. 1º e 3º da Portaria nº 571/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 8;
LXXXI - arts. 1º, 2º, 5º, 8º e 10 da Portaria nº 572/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 8;
LXXXII - Portaria nº 2068/GM/MS, de 21 de outubro de 2016, publicada no Diário Oficial da União, Seção 1, de 24 de outubro de 2016, p. 120;
LXXXIII - Portaria nº 3150/GM/MS, de 12 de dezembro de 2006, publicada no Diário Oficial da União, Seção 1, de 13 de dezembro de 2006, p. 111;
LXXXIV - Portaria nº 1319/GM/MS, de 23 de julho de 2002, publicada no Diário Oficial da União, Seção 1, de 24 de julho de 2002, p. 81;
LXXXV - Portaria nº 1097/GM/MS, de 22 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 23 de maio de 2006, p. 40;
LXXXVI - arts. 1º a 6º e 13 da Portaria nº 1663/GM/MS, de 6 de agosto de 2012, publicada no Diário Oficial da União, Seção 1, de 7 de agosto de 2012, p. 32;
LXXXVII - Portaria nº 1370/GM/MS, de 3 de julho de 2008, publicada no Diário Oficial da União, Seção 1, de 4 de julho de 2008, p. 192;
LXXXVIII - Portaria nº 401/GM/MS, de 16 de março de 2005, publicada no Diário Oficial da União, Seção 1, de 17 de março de 2005, p. 28;
LXXXIX - Portaria nº 1359/GM/MS, de 21 de julho de 2003, publicada no Diário Oficial da União, Seção 1, de 23 de julho de 2003, p. 45;
XC - Portaria nº 3443/GM/MS, de 11 de novembro de 2010, publicada no Diário Oficial da União, Seção 1, de 12 de novembro de 2010, p. 38;
XCI - Portaria nº 931/GM/MS, de 10 de maio de 2012, publicada no Diário Oficial da União, Seção 1, de 11 de maio de 2012, p. 140;
XCII - Portaria nº 485/GM/MS, de 1 de abril de 2014, publicada no Diário Oficial da União, Seção 1, de 2 de abril de 2014, p. 53;
XCIII - Portaria nº 1508/GM/MS, de 1 de setembro de 2005, publicada no Diário Oficial da União, Seção 1, de 2 de setembro de 2005, p. 125;
XCIV - Portaria nº 703/GM/MS, de 12 de abril de 2002, publicada no Diário Oficial da União, Seção 1, de 16 de abril de 2002, p. 28;
XCV - Portaria nº 343/GM/MS, de 7 de março de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de março de 2005, p. 39;
XCVI - Portaria nº 2583/GM/MS, de 10 de outubro de 2007, publicada no Diário Oficial da União, Seção 1, de 15 de outubro de 2007, p. 49;
XCVII - arts. 1º a 9º da Portaria nº 3189/GM/MS, de 18 de dezembro de 2009, publicada no Diário Oficial da União, Seção 1, de 23 de dezembro de 2009, p. 59;
XCVIII - Portaria nº 1111/GM/MS, de 5 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 7 de julho de 2005, p. 47;
XCIX - arts. 1º, 2º, 6º e 7º da Portaria nº 1143/GM/MS, de 7 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2005, p. 30;
C - arts. 1º a 4º, 22 a 25 da Portaria nº 1248/GM/MS, de 24 de junho de 2013, publicada no Diário Oficial da União, Seção 1, de 25 de junho de 2013, p. 31;
CI - Portaria nº 568/GM/MS, de 5 de abril de 2013, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2013, p. 55;
CII - Portaria nº 266/GM/MS, de 15 de fevereiro de 2012, publicada no Diário Oficial da União, Seção 1, de 16 de fevereiro de 2012, p. 26;
CIII - Portaria nº 2261/GM/MS, de 22 de setembro de 2006, publicada no Diário Oficial da União, Seção 1, de 26 de setembro de 2006, p. 34;
CIV - Portaria nº 2430/GM/MS, de 23 de dezembro de 2003, publicada no Diário Oficial da União, Seção 1, de 26 de dezembro de 2003, p. 26;
CV - Portaria nº 928/GM/MS, de 2 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 3 de maio de 2006, p. 44;
CVI - Portaria nº 374/GM/MS, de 28 de fevereiro de 2008, publicada no Diário Oficial da União, Seção 1, de 29 de fevereiro de 2008, p. 118;
CVII - Portaria nº 375/GM/MS, de 28 de fevereiro de 2008, publicada no Diário Oficial da União, Seção 1, de 29 de fevereiro de 2008, p. 119;
CVIII - arts. 1º a 9º da Portaria nº 506/GM/MS, de 21 de março de 2012, publicada no Diário Oficial da União, Seção 1, de 22 de março de 2012, p. 38;
CIX - Portaria nº 918/GM/MS, de 6 de julho de 2015, publicada no Diário Oficial da União, Seção 2, de 7 de julho de 2015, p. 41;
CX - Portaria nº 972/GM/MS, de 3 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 4 de maio de 2006, p. 25;
CXI - Portaria nº 2691/GM/MS, de 16 de novembro de 2011, publicada no Diário Oficial da União, Seção 1, de 17 de novembro de 2011, p. 88;
CXII - Portaria nº 973/GM/MS, de 3 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 4 de maio de 2006, p. 26;
CXIII - arts. 1º a 3º, 5º, 7º, 8º, 12 e 14 da Portaria nº 1708/GM/MS, de 16 de agosto de 2013, publicada no Diário Oficial da União, Seção 1, de 19 de agosto de 2013, p. 44;
CXIV - arts. 1º e 2º da Portaria nº 2984/GM/MS, de 27 de dezembro de 2016, publicada no Diário Oficial da União, Seção 1, de 28 de dezembro de 2016, p. 109;
CXV - Portaria nº 1311/GM/MS, de 27 de maio de 2010, publicada no Diário Oficial da União, Seção 1, de 2 de junho de 2010, p. 65;
CXVI - Portaria nº 28/GM/MS, de 8 de janeiro de 2015, publicada no Diário Oficial da União, Seção 1, de 9 de janeiro de 2015, p. 739;
CXVII - Portaria nº 158/GM/MS, de 4 de fevereiro de 2016, publicada no Diário Oficial da União, Seção 1, de 5 de fevereiro de 2016, p. 37;
CXVIII - Portaria nº 1840/GM/MS, de 13 de setembro de 1996, publicada no Diário Oficial da União, Seção 1, de 16 de setembro de 1996, p. 43;
CXIX - Portaria nº 1544/GM/MS, de 15 de outubro de 1997, publicada no Diário Oficial da União, Seção 1, de 16 de outubro de 1997, p. 92;
CXX - Portaria nº 1589/GM/MS, de 7 de julho de 2011, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2011, p. 68;
CXXI - Portaria nº 1588/GM/MS, de 7 de julho de 2011, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2011, p. 68;
CXXII - Portaria nº 1587/GM/MS, de 7 de julho de 2011, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2011, p. 67;
CXXIII - Portaria nº 1880/GM/MS, de 3 de setembro de 2012, publicada no Diário Oficial da União, Seção 1, de 4 de setembro de 2012, p. 130;
CXXIV - Portaria nº 2543/GM/MS, de 12 de novembro de 2014, publicada no Diário Oficial da União, Seção 1, de 14 de novembro de 2014, p. 145;
CXXV - Portaria nº 2545/GM/MS, de 12 de novembro de 2014, publicada no Diário Oficial da União, Seção 1, de 14 de novembro de 2014, p. 147;
CXXVI - Portaria nº 158/GM/MS, de 12 de fevereiro de 2015, publicada no Diário Oficial da União, Seção 1, de 13 de fevereiro de 2015, p. 29;
CXXVII - Portaria nº 475/GM/MS, de 17 de abril de 2015, publicada no Diário Oficial da União, Seção 1, de 20 de abril de 2015, p. 62;
CXXVIII - Portaria nº 795/GM/MS, de 17 de junho de 2015, publicada no Diário Oficial da União, Seção 1, de 19 de junho de 2015, p. 31;
CXXIX - Portaria nº 1440/GM/MS, de 18 de setembro de 2015, publicada no Diário Oficial da União, Seção 1, de 21 de setembro de 2015, p. 32;
CXXX - Portaria nº 2612/GM/MS, de 19 de novembro de 2012, publicada no Diário Oficial da União, Seção 1, de 20 de novembro de 2012, p. 24;
CXXXI - Portaria nº 1737/GM/MS, de 19 de agosto de 2004, publicada no Diário Oficial da União, Seção 1, de 23 de agosto de 2004, p. 40;
CXXXII - Portaria nº 2264/GM/MS, de 16 de outubro de 2014, publicada no Diário Oficial da União, Seção 1, de 17 de outubro de 2014, p. 52;
CXXXIII - Portaria nº 2914/GM/MS, de 12 de dezembro de 2011, publicada no Diário Oficial da União, Seção 1, de 14 de dezembro de 2011, p. 39;
CXXXIV - Portaria nº 635/GM/MS, de 26 de dezembro de 1975, publicada no Diário Oficial da União, Seção 1, de 30 de janeiro de 1976, p. 1455;
CXXXV - Portaria nº 111/GM/MS, de 28 de janeiro de 2016, publicada no Diário Oficial da União, Seção 1, de 29 de janeiro de 2016, p. 104;
CXXXVI - Portaria nº 937/GM/MS, de 7 de abril de 2017, publicada no Diário Oficial da União, Seção 1, de 10 de abril de 2017, p. 27;
CXXXVII - arts. 1º a 68, 70 a 73 da Portaria nº 184/GM/MS, de 3 de fevereiro de 2011, publicada no Diário Oficial da União, Seção 1, de 4 de fevereiro de 2011, p. 35;
CXXXVIII - Portaria nº 1550/GM/MS, de 29 de julho de 2014, publicada no Diário Oficial da União, Seção 1, de 30 de julho de 2014, p. 37;
CXXXIX - Portaria nº 2814/GM/MS, de 22 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 24 de dezembro de 2014, p. 58;
CXL - Portaria nº 2531/GM/MS, de 12 de novembro de 2014, publicada no Diário Oficial da União, Seção 1, de 13 de novembro de 2014, p. 102;
CXLI - Portaria nº 2778/GM/MS, de 18 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 19 de dezembro de 2014, p. 200;
CXLII - Portaria nº 1139/GM/MS, de 10 de junho de 2013, publicada no Diário Oficial da União, Seção 1, de 11 de junho de 2013, p. 22.
Art. 865. Esta Portaria entra em vigor na data de sua publicação.
RICARDO BARROS
ANEXO I
PROGRAMA DE NECESSIDADES DA ESTRUTURA FÍSICA MÍNIMA DOS POLOS DA ACADEMIA DA SAÚDE (Origem: PRT MS/GM 1707/2016, Anexo 1)
Programa de Necessidades da Estrutura Física Mínima dos Polos da Academia da Saúde
MODALIDADE BÁSICA
Constituída por área coberta de apoio, área descoberta e área de acessos, circulação e paisagismo.
| Ambientes | Quantidade mínima (unid.) | Área unitária (m²) | Área total (m²) | |
| 1 | Área coberta de apoio | 1 | 50,00 | 50,00 |
| 2 | Área descoberta | 1 | 150,00 | 150,00 |
| 3 | Área de acessos, circulação e paisagismo | 1 | 50,00 | 50,00 |
| Total | 250,00 | |||
MODALIDADE INTERMEDIÁRIA
Constituída por edificação de apoio, área descoberta e área de acessos, circulação e paisagismo.
| Ambientes | Quantidade mínima (unid.) | Área Unitária (m²) | Área Total (m²) | |
| 1 | Edificação de apoio | 1 | 63,20 | 63,20 |
| 1.1 | Sala de vivência | 1 | 45,00 | 45,00 |
| 1.2 | Depósito | 1 | 5,60 | 5,60 |
| 1.3 | Sanitário masculino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.4 | Sanitário feminino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.5 | Paredes e circulação interna | - | - | 6,20 |
| 2 | Área descoberta | 1 | 150,00 | 150,00 |
| 3 | Área de acessos, circulação e paisagismo | 1 | 50,00 | 50,00 |
| Área total | 263,20 | |||
MODALIDADE AMPLIADA
Constituída por edificação de apoio, área descoberta e área de acessos, circulação e paisagismo.
| Ambientes | Quantidade mínima (unid.) | Área Unitária (m²) | Área Total (m² | |
| 1 | Edificação de apoio | 1 | 101,20 | 101,20 |
| 1.1 | Sala de vivência | 1 | 50,00 | 50,00 |
| 1.2 | Sala de orientação | 1 | 9,00 | 9,00 |
| 1.2 | Depósito | 1 | 10,80 | 10,80 |
| 1.3 | Sanitário masculino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.4 | Sanitário feminino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.5 | Depósito de material de limpeza | 1 | 2,00 | 2,00 |
| 1.6 | Copa | 1 | 3,00 | 3,00 |
| 1.5 | Paredes e circulação interna | - | - | 20,00 |
| 2 | Área descoberta | 1 | 250,00 | 250,00 |
| 3 | Área de acessos, circulação e paisagismo | 1 | 100,00 | 100,00 |
| Área Total | 451,20 | |||
ANEXO II
PROGRAMA DE NECESSIDADES DOS POLOS DA ACADEMIA DA SAÚDE EQUIPAMENTOS DA ÁREA DESCOBERTA (Origem: PRT MS/GM 1707/2016, Anexo 2)
Programa de Necessidades dos Polos da Academia da Saúde Equipamentos da Área Descoberta
| Equipamentos de alvenaria* | Quantidade mínima (unid.) | |
| 1 | Barras paralelas | 1** |
| 2 | Espaldar simples | 1 |
| 3 | Banco | 3 |
| 4 | Prancha para abdominal | 2 |
| 5 | Barra horizontal tripla | 1 |
| 6 | Barras marinheiro | 2*** |
| 7 | Barra fixa de apoio | 2 |
* Os croquis dos equipamentos listados podem ser visualizados no Manual de Infraestrutura do Programa Academia da Saúde.
**Cada unidade equivale a um par de barras paralelas.
***Cada unidade equivale a um par de barras marinheiro
ANEXO III
LISTA DOS CBOS DOS PROFISSIONAIS DO PROGRAMA ACADEMIA DA SAÚDE (Origem: PRT MS/GM 1707/2016, Anexo 3)
Lista dos CBOS dos Profissionais do Programa Academia da Saúde
De acordo com a legislação vigente do Código Brasileiro de Ocupação o(s) profissional (is) do Programa Academia da Saúde deverá(ão) ser dos seguintes CBOs:
| CÓD. CBO | DESCRIÇÃO DA OCUPAÇÃO |
| 2241-E1 | PROFISSIONAL DE EDUCAÇÃO FISICA NA SAÚDE |
| 2516-05 | ASSISTENTE SOCIAL |
| 2239-05 | TERAPEUTA OCUPACIONAL |
| 2236-05 | FISIOTERAPEUTA GERAL |
| 2238-10 | FONOAUDIOLOGO GERAL |
| 2237-10 | NUTRICIONISTA |
| 2515-10 | PSICOLOGO |
| 1312-C1 | SANITARISTA |
| 5153-05 | EDUCADOR SOCIAL |
| 2263-05 | MUSICOTERAPEUTA |
| 2263-10 | ARTETERAPEUTA |
| 2628* | ARTISTAS DA DANÇA (EXCETO DANÇA TRADICIONAL E POPULAR) |
| 3761* | DANÇARINOS TRADICIONAIS E POPULARES |
Obs.: *Possibilidade de inclusão de qualquer CBO da respectiva família.
ANEXO IV
DO SANGUE, COMPONENTES E DERIVADOS (Origem: PRT MS/GM 158/2016)
TÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 158/2016, TÍTULO I)
Art. 1º Fica instituído o regulamento técnico de procedimentos hemoterápicos, nos termos do Título II. (Origem: PRT MS/GM 158/2016, Art. 1º)
Art. 2º O regulamento técnico de que trata este Anexo tem o objetivo de regulamentar a atividade hemoterápica no País, de acordo com os princípios e diretrizes da Política Nacional de Sangue, Componentes e Derivados, no que se refere à captação, proteção ao doador e ao receptor, coleta, processamento, estocagem, distribuição e transfusão do sangue, de seus componentes e derivados, originados do sangue humano venoso e arterial, para diagnóstico, prevenção e tratamento de doenças. (Origem: PRT MS/GM 158/2016, Art. 2º)
§ 1º É de observância obrigatória o presente regulamento técnico e respectivos Anexos 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 e 11 do Anexo IV por todos os órgãos e entidades, públicas e privadas, que executam atividades hemoterápicas em todo o território nacional no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN). (Origem: PRT MS/GM 158/2016, Art. 2º, § 1º)
§ 2º A manutenção de toda a cadeia produtiva do sangue depende dos valores voluntários e altruístas da sociedade para o ato da doação, devendo o candidato à doação de sangue ser atendido sob os princípios da universalidade, integralidade e equidade no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 158/2016, Art. 2º, § 2º)
§ 3º Os serviços de hemoterapia promoverão a melhoria da atenção e acolhimento aos candidatos à doação, realizando a triagem clínica com vistas à segurança do receptor, porém com isenção de manifestações de juízo de valor, preconceito e discriminação por orientação sexual, identidade de gênero, hábitos de vida, atividade profissional, condição socioeconômica, cor ou etnia, dentre outras, sem prejuízo à segurança do receptor. (Origem: PRT MS/GM 158/2016, Art. 2º, § 3º)
Art. 3º A execução das ações de vigilância sanitária, controle de qualidade e vigilância epidemiológica no território nacional fica a cargo dos órgãos de apoio do SINASAN de que trata o art. 9º da Lei nº 10.205, de 21 de março de 2001, aos quais cabe a definição e estabelecimento da forma de realização dessas ações por meio de regulamentos próprios. (Origem: PRT MS/GM 158/2016, Art. 3º)
Art. 4º Além do cumprimento do regulamento técnico constante deste Anexo, os órgãos e entidades que executem atividades hemoterápicas observarão ainda, os requisitos sanitários para funcionamento de serviços de hemoterapia definidos pela Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 158/2016, Art. 4º)
Art. 5º Para fins deste Anexo, considera-se: (Origem: PRT MS/GM 158/2016, Art. 5º)
I - ação corretiva: atividade realizada para eliminar a causa de uma não conformidade existente ou outra situação indesejável a fim de prevenir recorrência; (Origem: PRT MS/GM 158/2016, Art. 5º, I)
II - ação preventiva: ação tomada para reduzir o potencial de não conformidades ou outras situações indesejáveis; (Origem: PRT MS/GM 158/2016, Art. 5º, II)
III - calibração: comparação das medidas realizadas por um instrumento com aquelas feitas por outro instrumento mais exato ou padrão, com o propósito de detectar, relatar e eliminar erros em medições, sendo que o instrumento padrão deve ser rastreável; (Origem: PRT MS/GM 158/2016, Art. 5º, III)
IV - camada leucoplaquetária: denominação dada à camada de células localizada na parte superior de uma amostra ou bolsa de sangue total submetida à centrifugação; (Origem: PRT MS/GM 158/2016, Art. 5º, IV)
V - cirurgia de grande porte: cirurgia com grande probabilidade de perda de fluido e sangue; (Origem: PRT MS/GM 158/2016, Art. 5º, V)
VI - contato sexual, fazer sexo ou ter relação sexual: termos que se aplicam a qualquer das seguintes atividades: (Origem: PRT MS/GM 158/2016, Art. 5º, VI)
a) sexo anal: contato entre pênis e ânus; (Origem: PRT MS/GM 158/2016, Art. 5º, VI, a)
b) sexo oral: contato entre boca ou língua com vagina, pênis ou ânus de outro/outra; e (Origem: PRT MS/GM 158/2016, Art. 5º, VI, b)
c) sexo vaginal: contato entre pênis e vagina; (Origem: PRT MS/GM 158/2016, Art. 5º, VI, c)
VII - doação autóloga: doação do próprio paciente para seu uso exclusivo; (Origem: PRT MS/GM 158/2016, Art. 5º, VIII)
VIII - doação de reposição: doação advinda do indivíduo que doa para atender à necessidade de um paciente, feitas por pessoas motivadas pelo próprio serviço, família ou amigos dos receptores de sangue para repor o estoque de componentes sanguíneos do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, IX)
IX - doação espontânea: doação feita por pessoas motivadas para manter o estoque de sangue do serviço de hemoterapia, decorrente de um ato de altruísmo, sem identificação do nome do possível receptor; (Origem: PRT MS/GM 158/2016, Art. 5º, X)
X - doador apto: doador cujos dados pessoais, condições clínicas, laboratoriais e epidemiológicas se encontram em conformidade com os critérios de aceitação vigentes para doação de sangue; (Origem: PRT MS/GM 158/2016, Art. 5º, XI)
XI - doador associado com TRALI: o doador cujo componente sanguíneo foi transfundido durante as 6 (seis) horas precedentes à primeira manifestação clínica de TRALI; (Origem: PRT MS/GM 158/2016, Art. 5º, XII)
XII - doador de primeira vez: é aquele indivíduo que doa pela primeira vez naquele serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, XIII)
XIII - doador de repetição: doador que realiza 2 (duas) ou mais doações no período de 12 (doze) meses; (Origem: PRT MS/GM 158/2016, Art. 5º, XIV)
XIV - doador esporádico: doador que repete a doação após intervalo superior a 12 (doze) meses da última doação; (Origem: PRT MS/GM 158/2016, Art. 5º, XV)
XV - doador implicado em TRALI: doador no qual são encontrados anticorpos anti-HLA classe I ou II ou anti-HNA ou ambos, sendo que este anticorpo deve ter especificidade para um antígeno presente nos leucócitos do receptor ou deve haver uma reação positiva entre o soro do doador e os leucócitos do receptor (prova cruzada positiva); (Origem: PRT MS/GM 158/2016, Art. 5º, XVI)
XVI - doador inapto definitivo: doador que nunca poderá doar sangue para outra pessoa, podendo, em alguns casos, realizar doação autóloga; (Origem: PRT MS/GM 158/2016, Art. 5º, XVII)
XVII - doador inapto por tempo indeterminado: doador que se encontra impedido de doar sangue para outra pessoa por um período indefinido de tempo segundo as normas regulatórias vigentes, mas apto a realizar doação autóloga; (Origem: PRT MS/GM 158/2016, Art. 5º, XVIII)
XVIII - doador inapto temporário: doador que se encontra impedido de doar sangue para outra pessoa por determinado período de tempo, podendo realizar doação autóloga quando possível e necessário; (Origem: PRT MS/GM 158/2016, Art. 5º, XIX)
XIX - documento oficial com fotografia: diz respeito à Carteira de Identidade, Carteira Nacional de Habilitação, Carteira de Trabalho, Passaporte, Registro Nacional de Estrangeiro, Certificado de Reservista e Carteira Profissional emitida por classe, sendo aceitas fotocópias autenticadas desde que as fotos e inscrições estejam legíveis e as imagens permitam a identificação do portador; (Origem: PRT MS/GM 158/2016, Art. 5º, XX)
XX - equipamento crítico: equipamento que pode afetar a qualidade dos produtos ou serviços críticos do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, XXI)
XXI - fornecedor: pessoa física ou jurídica que fornece um produto ou serviço à organização; (Origem: PRT MS/GM 158/2016, Art. 5º, XXII)
XXII - manutenção corretiva: são reparos de defeitos funcionais ocorridos durante a utilização do equipamento; (Origem: PRT MS/GM 158/2016, Art. 5º, XXIII)
XXIII - manutenção preventiva: é a manutenção que visa manter o equipamento dentro de condições normais de utilização com o objetivo de serem reduzidas as possibilidades de ocorrência de defeitos por desgaste ou envelhecimento de seus componentes; (Origem: PRT MS/GM 158/2016, Art. 5º, XXIV)
XXIV - material ou insumo crítico: item de material ou insumo que pode afetar a qualidade dos produtos ou serviços críticos da instituição; (Origem: PRT MS/GM 158/2016, Art. 5º, XXV)
XXV - não conformidade: falha em atingir requisitos previamente especificados; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVI)
XXVI - procedimentos operacionais (PO): documentos detalhados baseados em processos e procedimentos que refletem a prática atual da instituição e visam sua padronização, apresentados, geralmente, em módulos, além de incluírem as atividades de "Boas Práticas de Fabricação (BPF)" e as especificações necessárias; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVII)
XXVII - qualificação: etapa do processo de validação que corresponde à ação de verificação que uma pessoa, equipamento ou material trabalha corretamente e produz os resultados esperados; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVIII)
XXVIII - qualificação de pessoas: aspectos da educação, treinamento e experiência de um indivíduo, necessários para preencher com sucesso os requisitos de determinada função; (Origem: PRT MS/GM 158/2016, Art. 5º, XXIX)
XXIX - qualificação de fornecedores: método de avaliação utilizado para assegurar que os materiais, equipamentos, insumos ou serviços obtidos de determinado fornecedor atendem a requisitos especificados pela instituição; (Origem: PRT MS/GM 158/2016, Art. 5º, XXX)
XXX - rastreabilidade: habilidade de seguir a história, aplicação ou localização de um produto ou serviço por meio da identificação de registros; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXI)
XXXI - registros obrigatórios: registros relacionados diretamente com o cadastro e triagem de doadores de sangue, procedimentos de coleta, preparo e modificação dos componentes sanguíneos, exames de qualificação do sangue do doador e dos procedimentos pré-transfusionais, da transfusão e das complicações relacionadas a transfusões, permitindo, desta forma, a completa rastreabilidade do processo; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXII)
XXXII - remessa de insumo ou reagente: cada entrega do insumo ou reagente recebida pelo serviço de hemoterapia, podendo ser composta por 1 (um) ou mais lotes de um mesmo produto; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXIII)
XXXIII - retrovigilância: parte da hemovigilância que trata da investigação retrospectiva relacionada à rastreabilidade das bolsas de doações anteriores de um doador que apresentou viragem de um marcador (soroconversão) ou relacionada a um receptor de sangue que veio a apresentar marcador positivo para uma doença transmissível, termo também aplicável em casos de detecção de positividade em análises microbiológicas de componentes sanguíneos e investigação de quadros infecciosos bacterianos em receptores, sem manifestação imediata, mas potencialmente imputados à transfusão; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXIV)
XXXIV - serviço crítico: serviço que pode afetar a qualidade dos produtos ou serviços críticos da instituição; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXV)
XXXV - serviço de hemoterapia: estabelecimento de saúde que desenvolve atividades de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXVI)
XXXVI - serviços de saúde ou instituição de assistência à saúde: todos os serviços relacionados ao atendimento à saúde; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXVII)
XXXVII - sistema ou circuito aberto: sistema que não permite a preparação e separação de componentes sanguíneos sem a exposição de seu conteúdo ao ar ou a elementos externos; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXVIII)
XXXVIII - sistema ou circuito fechado: sistema que permite a preparação e separação de componentes sanguíneos sem a exposição de seu conteúdo ao ar ou a elementos externos; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXIX)
XXXIX - sistema de qualidade: estrutura organizacional, responsabilidades, políticas, processos, procedimentos e recursos estabelecidos pela diretoria-executiva da instituição para atingir a política de qualidade; (Origem: PRT MS/GM 158/2016, Art. 5º, XL)
XL - solução aditiva: solução adicionada a componentes celulares para manutenção de suas propriedades durante o armazenamento; (Origem: PRT MS/GM 158/2016, Art. 5º, XLI)
XLI - temperatura ambiente: é a temperatura situada entre 15°C e 30°C; (Origem: PRT MS/GM 158/2016, Art. 5º, XLII)
XLII - teste de proficiência: avaliação externa estruturada a partir dos métodos de laboratório que verifica a "adequabilidade" de processos, procedimentos, equipamentos, fornecedores e reagentes; (Origem: PRT MS/GM 158/2016, Art. 5º, XLIII)
XLIII - TRALI: sigla em inglês para "transfusional related acute lung injury", que significa lesão pulmonar aguda associada à transfusão; e (Origem: PRT MS/GM 158/2016, Art. 5º, XLIV)
XLIV - validação: demonstração por meio de documentação e evidências objetivas em que requisitos pré-definidos para procedimentos ou processos específicos são consistentemente atendidos. (Origem: PRT MS/GM 158/2016, Art. 5º, XLV)
TÍTULO II
DO REGULAMENTO TÉCNICO DE PROCEDIMENTOS HEMOTERÁPICOS
(Origem: PRT MS/GM 158/2016, TÍTULO II)
CAPÍTULO I
DO SANGUE E SEUS COMPONENTES
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I)
Seção I
Dos Princípios Gerais
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção I)
Art. 6º A transfusão de sangue e seus componentes deve ser utilizada criteriosamente na medicina, uma vez que toda transfusão traz em si um risco ao receptor, seja imediato ou tardio, devendo ser indicada de forma criteriosa. (Origem: PRT MS/GM 158/2016, Art. 6º)
Parágrafo Único. A indicação de transfusão de sangue poderá ser objeto de análise e aprovação pela equipe médica do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 6º, Parágrafo Único)
Art. 7º Nas cirurgias eletivas deverão ser consideradas ações que reduzam o consumo de componentes sanguíneos alogênicos, como métodos que diminuam o sangramento no intraoperatório ou a realização de transfusão autóloga. (Origem: PRT MS/GM 158/2016, Art. 7º)
Art. 8º A responsabilidade técnica pelo serviço de hemoterapia ficará a cargo de um médico especialista em hemoterapia e/ou hematologia ou qualificado por órgão competente devidamente reconhecido para este fim pelo Coordenador do Sistema Estadual de Sangue, Componentes e Derivados. (Origem: PRT MS/GM 158/2016, Art. 8º)
Parágrafo Único. Cabe ao médico responsável técnico a responsabilidade final por todas as atividades médicas e técnicas que incluam o cumprimento das normas técnicas e a determinação da adequação das indicações da transfusão de sangue e de componentes. (Origem: PRT MS/GM 158/2016, Art. 8º, Parágrafo Único)
Art. 9º As atividades técnicas realizadas no serviço de hemoterapia que não estejam especificamente consideradas por este Anexo serão aprovadas pelo responsável técnico da instituição de assistência à saúde. (Origem: PRT MS/GM 158/2016, Art. 9º)
Art. 10. Nos serviços de hemoterapia de maior complexidade, como o Hemocentro Coordenador, a responsabilidade administrativa será de profissional qualificado. (Origem: PRT MS/GM 158/2016, Art. 10)
Parágrafo Único. O profissional qualificado de que trata o "caput" possuirá, preferencialmente, formação de nível superior em qualquer área de conhecimento e com experiência em administração ou gestão de serviços de saúde. (Origem: PRT MS/GM 158/2016, Art. 10, Parágrafo Único)
Art. 11. As instituições de assistência à saúde que realizem intervenções cirúrgicas de grande porte, atendimentos de urgência e emergência ou que efetuem mais de 60 (sessenta) transfusões por mês devem contar com, pelo menos, uma Agência Transfusional (AT). (Origem: PRT MS/GM 158/2016, Art. 11)
§ 1º As instituições de assistência à saúde que não se enquadrem nos critérios estabelecidos no "caput", mas cujo tempo de viabilização do procedimento transfusional, a exemplo do tempo entre coleta de amostra, preparo e instalação do componente sanguíneo, comprometer a assistência ao paciente, deverão buscar alternativas para minimizar esse risco e garantir o suporte hemoterápico necessário. (Origem: PRT MS/GM 158/2016, Art. 11, § 1º)
§ 2º A mesma conduta de que trata o § 1º deverá ser tomada em unidades de assistência à saúde que realizam procedimentos obstétricos. (Origem: PRT MS/GM 158/2016, Art. 11, § 2º)
§ 3º Toda instituição de assistência à saúde que possa, potencialmente, utilizar sangue e componentes sanguíneos terá convênio, contrato ou termo de compromisso formalizado com um serviço de hemoterapia de referência para assistência hemoterápica, conforme descrito no art. 272, sem prejuízo de outras normas aplicáveis. (Origem: PRT MS/GM 158/2016, Art. 11, § 3º)
Art. 12. Toda instituição de assistência à saúde que realiza transfusão de sangue e componentes sanguíneos comporá ou fará parte de um Comitê Transfusional. (Origem: PRT MS/GM 158/2016, Art. 12)
§ 1º É competência do Comitê Transfusional o monitoramento da prática hemoterápica na instituição de assistência à saúde visando o uso racional do sangue, a atividade educacional continuada em hemoterapia, a hemovigilância e a elaboração de protocolos de atendimento da rotina hemoterápica. (Origem: PRT MS/GM 158/2016, Art. 12, § 1º)
§ 2º Os serviços de hemoterapia e as instituições de assistência à saúde que possuam Agências Transfusionais constituirão seus próprios Comitês Transfusionais. (Origem: PRT MS/GM 158/2016, Art. 12, § 2º)
§ 3º A constituição do Comitê Transfusional será compatível e adequar-se-á às necessidades e complexidades de cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 12, § 3º)
§ 4º As instituições de assistência à saúde que não possuam Agência Transfusional participarão das atividades do Comitê Transfusional do serviço de hemoterapia que as assiste ou constituirão Comitê Transfusional próprio. (Origem: PRT MS/GM 158/2016, Art. 12, § 4º)
Art. 13. O serviço de hemoterapia colaborará com as atividades dos Comitês Transfusionais das instituições de assistência à saúde para as quais forneça componentes sanguíneos para atividade transfusional, de elaboração e implementação de protocolos para controlar as indicações, o uso e o descarte dos componentes sanguíneos, quando solicitado. (Origem: PRT MS/GM 158/2016, Art. 13)
Art. 14. O serviço de hemoterapia possuirá equipe profissional, constituída por pessoal técnico e administrativo, suficiente e competente, sob a supervisão do responsável técnico e administrativo. (Origem: PRT MS/GM 158/2016, Art. 14)
Parágrafo Único. A equipe profissional de que trata o "caput" adequar-se-á às necessidades e complexidades de cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 14, Parágrafo Único)
Art. 15. Os supervisores técnicos das áreas do serviço de hemoterapia possuirão registro profissional no respectivo conselho de classe, requisito para o exercício da profissão. (Origem: PRT MS/GM 158/2016, Art. 15)
Art. 16. O serviço de hemoterapia possuirá ambiente e equipamentos adequados para que as diferentes atividades possam ser realizadas segundo as boas práticas de produção e/ou manipulação. (Origem: PRT MS/GM 158/2016, Art. 16)
Art. 17. O serviço de hemoterapia implementará programas destinados a minimizar os riscos para a saúde e garantir a segurança dos receptores, dos doadores e dos seus funcionários. (Origem: PRT MS/GM 158/2016, Art. 17)
Art. 18. Cada serviço de hemoterapia manterá um conjunto de procedimentos operacionais, técnicos e administrativos para cada área técnica e administrativa. (Origem: PRT MS/GM 158/2016, Art. 18)
§ 1º Os procedimentos operacionais serão elaborados pelas áreas técnicas e administrativas pertinentes, incluindo as medidas de biossegurança. (Origem: PRT MS/GM 158/2016, Art. 18, § 1º)
§ 2º Os procedimentos operacionais deverão ser aprovados pelos responsáveis técnicos dos setores relacionados e pelo responsável técnico do serviço de hemoterapia ou conforme determinado pelo programa de garantia de qualidade de cada instituição de saúde, em conformidade com o manual da qualidade válido da própria instituição. (Origem: PRT MS/GM 158/2016, Art. 18, § 2º)
§ 3º Os procedimentos operacionais de que trata o "caput" serão disponibilizados a todos os funcionários do respectivo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 18, § 3º)
§ 4º O cumprimento das disposições contidas nos procedimentos operacionais de que trata o "caput" é obrigatório a todo o pessoal atuante no serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 18, § 4º)
§ 5º Os procedimentos operacionais de que trata o "caput" serão avaliados anualmente quanto à adequação e à atualização, quando apropriado. (Origem: PRT MS/GM 158/2016, Art. 18, § 5º)
§ 6º A introdução de novas técnicas no serviço de hemoterapia será precedida de avaliação e validação dos procedimentos para assegurar os critérios de qualidade. (Origem: PRT MS/GM 158/2016, Art. 18, § 6º)
Art. 19. Os responsáveis, técnicos e administrativos, com apoio da direção do serviço de hemoterapia, assegurarão que todas as normas e procedimentos sejam apropriadamente divulgados e executados. (Origem: PRT MS/GM 158/2016, Art. 19)
Parágrafo Único. Deverá ser garantido o aprovisionamento no serviço de hemoterapia de todos os insumos necessários para a realização das suas atividades. (Origem: PRT MS/GM 158/2016, Art. 19, Parágrafo Único)
Art. 20. Os materiais e substâncias que entrarem diretamente em contato com o sangue ou componentes a serem transfundidos em humanos serão estéreis, apirogênicos e descartáveis. (Origem: PRT MS/GM 158/2016, Art. 20)
Parágrafo Único. Os materiais, equipamentos, substâncias e insumos industrializados, como bolsas, equipos de transfusão, seringas, filtros, conjuntos de aférese, agulhas, anticoagulantes, dentre outros, utilizados para a coleta, preservação, processamento, armazenamento e transfusão do sangue e seus componentes, assim como os reagentes usados para a triagem de infecções transmissíveis pelo sangue e para os testes imuno-hematológicos, devem satisfazer as normas vigentes e estarem registrados ou autorizados para uso pela autoridade sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 20, Parágrafo Único)
Art. 21. É permitida ao serviço de hemoterapia a produção e utilização de reagentes para testes imuno-hematológicos, desde que exista autorização da ANVISA, conforme dispõe o art. 6º da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Art. 21)
Parágrafo Único. A autorização da ANVISA a que se refere o "caput" não se aplica aos reagentes de controles laboratoriais internos e soros raros. (Origem: PRT MS/GM 158/2016, Art. 21, Parágrafo Único)
Art. 22. O serviço de hemoterapia estabelecerá um programa laboratorial de controle de qualidade interno e participará de programa laboratorial de controle de qualidade externo (proficiência), para assegurar que as normas e os procedimentos sejam apropriadamente executados e que os equipamentos, materiais e reagentes funcionem corretamente. (Origem: PRT MS/GM 158/2016, Art. 22)
Art. 23. Os registros obrigatórios definidos por este Anexo serão guardados pela instituição de saúde por um período mínimo de 20 (vinte) anos. (Origem: PRT MS/GM 158/2016, Art. 23)
Art. 24. Os registros e documentos referentes às atividades desenvolvidas pelo serviço de hemoterapia deverão possibilitar a identificação do técnico responsável pela execução da atividade. (Origem: PRT MS/GM 158/2016, Art. 24)
Art. 25. O serviço de hemoterapia informará à autoridade sanitária competente, obrigatoriamente, qualquer ocorrência de investigação decorrente de casos de soroconversão. (Origem: PRT MS/GM 158/2016, Art. 25)
Art. 26. Os dados de produção dos serviços de hemoterapia referentes às atividades hemoterápicas serão disponibilizados nos respectivos serviços de hemoterapia e ao Ministério da Saúde, aos órgãos de controle e aos órgãos e entidades públicas de vigilância sanitária, na forma definida por esses órgãos e entidades. (Origem: PRT MS/GM 158/2016, Art. 26)
Art. 27. Compete ao coordenador do SINASAN definir a forma de utilização do plasma congelado excedente do uso terapêutico dos serviços de hemoterapia públicos e privados, com vistas ao atendimento de interesse nacional, conforme previsto no § 2º do art. 14 da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Art. 27)
§ 1º Não é permitida ao serviço de hemoterapia, público ou privado, a disponibilização de plasma para indústria de hemoderivados ou de componentes sanguíneos especiais, nacional ou internacional, sem a autorização expressa, por escrito, do Ministério da Saúde. (Origem: PRT MS/GM 158/2016, Art. 27, § 1º)
§ 2º Para o envio de plasma excedente do uso terapêutico e obtido por plasmaférese para indústria de hemoderivados, deve existir autorização do Ministério da Saúde, conforme o disposto no Anexo 11 do Anexo IV e outras determinações deste Anexo. (Origem: PRT MS/GM 158/2016, Art. 27, § 2º)
§ 3º Serão estabelecidos, nas formas definidas no Anexo 11 do Anexo IV , por meio de critérios técnicos, os serviços de hemoterapia que serão fornecedores de plasma para a indústria de hemoderivados, conforme a viabilidade e a capacidade operacional, além da competência técnica do serviço de hemoterapia para fornecer matéria-prima. (Origem: PRT MS/GM 158/2016, Art. 27, § 3º)
§ 4º Caso não haja solicitação do serviço de hemoterapia ou autorização do Ministério da Saúde nos termos deste artigo para disponibilização dos estoques excedentes de plasma para a produção industrial por um período de 1 (um) ano, a partir da sua produção, o serviço de hemoterapia definirá medidas quanto à manutenção ou eliminação dos componentes sanguíneos em seus estoques. (Origem: PRT MS/GM 158/2016, Art. 27, § 4º)
Art. 28. Em caso de envio do plasma para beneficiamento no exterior, conforme estabelecido no inciso VIII do art. 16 da Lei nº 10.205, de 2001, a indústria produtora deverá obter, junto à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS), autorização para exportação do plasma, observando, ainda, o disposto no § 1º do art. 14 e no parágrafo único do art. 22 do referido diploma legal. (Origem: PRT MS/GM 158/2016, Art. 28)
Art. 29. Não é permitido o envio de sangue, componentes e derivados como matéria-prima para a utilização na produção de reagentes de diagnóstico ou painéis de controle de qualidade, para indústria nacional ou internacional, de natureza pública ou privada, ou laboratório sem autorização formal prévia da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 158/2016, Art. 29)
§ 1º A autorização de que trata o "caput" observará às seguintes medidas: (Origem: PRT MS/GM 158/2016, Art. 29, § 1º)
I - o serviço de hemoterapia componente do SINASAN, público ou privado, que pretende enviar sangue, componentes e derivados para a produção de reagentes de diagnóstico ou painéis para indústria ou laboratórios, deve solicitar à CGSH/DAET/SAS/MS autorização para o fornecimento, informando previsão da quantidade a ser enviada no ano e destino, para fins de cadastro e credenciamento; (Origem: PRT MS/GM 158/2016, Art. 29, § 1º, I)
II - a CGSH/DAET/SAS/MS avaliará a solicitação e, se pertinente, credenciará o serviço de hemoterapia e emitirá autorização anual de fornecimento de matéria-prima para a produção de reagentes de diagnóstico e painéis de controle de qualidade à indústria ou laboratório informado, por ofício; e (Origem: PRT MS/GM 158/2016, Art. 29, § 1º, II)
III - anualmente, o serviço de hemoterapia apresentará à CGSH/DAET/SAS/MS relatório dos fornecimentos, que será requisito para a renovação da autorização para o ano seguinte. (Origem: PRT MS/GM 158/2016, Art. 29, § 1º, III)
§ 2º O envio de sangue, componentes e derivados pelo serviço de hemoterapia, como insumo para a utilização em pesquisa, será notificado à CGSH/DAET/SAS/MS, informando o número das bolsas, instituição a que foram enviadas e a finalidade a que se destinam. (Origem: PRT MS/GM 158/2016, Art. 29, § 2º)
§ 3º Os fornecimentos citados nos §§ 1º e 2º poderão ser encaminhados à ANVISA a fim de realizar os procedimentos de vigilância sanitária cabíveis. (Origem: PRT MS/GM 158/2016, Art. 29, § 3º)
Seção II
Da Doação de Sangue
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção II)
Art. 30. A doação de sangue deve ser voluntária, anônima e altruísta, não devendo o doador, de forma direta ou indireta, receber qualquer remuneração ou benefício em virtude da sua realização. (Origem: PRT MS/GM 158/2016, Art. 30)
Art. 31. O sigilo das informações prestadas pelo doador antes, durante e depois do processo de doação de sangue deve ser absolutamente preservado, respeitadas outras determinações previstas na legislação vigente. (Origem: PRT MS/GM 158/2016, Art. 31)
§ 1º Os resultados dos testes de triagem laboratorial serão fornecidos mediante solicitação do doador. (Origem: PRT MS/GM 158/2016, Art. 31, § 1º)
§ 2º Os resultados dos testes de triagem laboratorial somente poderão ser entregues ao próprio doador ou, mediante apresentação de procuração, a terceiros. (Origem: PRT MS/GM 158/2016, Art. 31, § 2º)
Art. 32. O candidato à doação de sangue deve assinar termo de consentimento livre e esclarecido, no qual declara expressamente consentir: (Origem: PRT MS/GM 158/2016, Art. 32)
I - em doar o seu sangue para utilização em qualquer paciente que dele necessite; (Origem: PRT MS/GM 158/2016, Art. 32, I)
II - a realização de todos os testes de laboratório exigidos pelas leis e normas técnicas vigentes; (Origem: PRT MS/GM 158/2016, Art. 32, II)
III - que o seu nome seja incorporado a arquivo de doadores, local e nacional; (Origem: PRT MS/GM 158/2016, Art. 32, III)
IV - que em caso de resultados reagentes ou inconclusivos nas triagens laboratoriais, ou em situações de retrovigilância, seja permitida a "busca ativa" pelo serviço de hemoterapia ou por órgão de vigilância em saúde para repetição de testes ou testes confirmatórios e de diagnóstico; e (Origem: PRT MS/GM 158/2016, Art. 32, IV)
V - que os componentes sanguíneos produzidos a partir da sua doação, quando não utilizado em transfusão, possam ser utilizados em produção de reagentes e hemoderivados ou como insumos para outros procedimentos, autorizados legalmente. (Origem: PRT MS/GM 158/2016, Art. 32, V)
§ 1º A utilização de qualquer material proveniente da doação de sangue para pesquisas somente será permitida segundo as normas que regulamentam a ética em pesquisa no Brasil. (Origem: PRT MS/GM 158/2016, Art. 32, § 1º)
§ 2º Previamente à assinatura do termo de consentimento, devem ser prestadas informações ao candidato à doação, com linguagem compreensível, sobre as características do processo de doação, o destino do sangue doado, os riscos associados à doação, os testes que serão realizados em seu sangue para detectar infecções e a possibilidade da ocorrência de resultados falsos-reagentes nesses testes de triagem. (Origem: PRT MS/GM 158/2016, Art. 32, § 2º)
§ 3º Ao candidato à doação deve ser oferecida a oportunidade de fazer todas as perguntas que julgar necessárias para esclarecer suas dúvidas a respeito do procedimento e negar seu consentimento, se assim lhe aprouver. (Origem: PRT MS/GM 158/2016, Art. 32, § 3º)
Art. 33. É obrigatória a disponibilização ao candidato à doação de material informativo sobre as condições básicas para a doação e sobre as infecções transmissíveis pelo sangue. (Origem: PRT MS/GM 158/2016, Art. 33)
Parágrafo Único. O material de que trata o "caput" explicitará a importância de suas respostas na triagem clínica e os riscos de transmissão de enfermidades infecciosas pela transfusão de sangue. (Origem: PRT MS/GM 158/2016, Art. 33, Parágrafo Único)
Art. 34. O serviço de hemoterapia deve garantir o acesso à doação de sangue aos portadores de necessidades especiais segundo as normas gerais para doadores de sangue estabelecidas neste Anexo, inclusive com a disponibilização de materiais informativos e questionários adaptados a essas necessidades, proporcionando condições de entendimento na triagem clínica e outras medidas que se fizerem necessárias. (Origem: PRT MS/GM 158/2016, Art. 34)
Art. 35. Como critério para a seleção dos doadores, no dia da doação o profissional de saúde de nível superior, qualificado, capacitado, conhecedor das regras previstas neste Anexo e sob supervisão médica, avaliará os antecedentes e o estado atual do candidato a doador para determinar se a coleta pode ser realizada sem causar prejuízo ao doador e se a transfusão dos componentes sanguíneos preparados a partir dessa doação pode vir a causar risco para os receptores. (Origem: PRT MS/GM 158/2016, Art. 35)
Parágrafo Único. A avaliação de que trata o "caput" será realizada por meio de entrevista individual, em ambiente que garanta a privacidade e o sigilo das informações prestadas, sendo mantido o registro em meio eletrônico ou físico da entrevista. (Origem: PRT MS/GM 158/2016, Art. 35, Parágrafo Único)
Art. 36. Com a finalidade de proteger os doadores, serão adotadas, tanto no momento da seleção de candidatos quanto no momento da doação, as seguintes medidas e critérios estabelecidos neste regulamento: (Origem: PRT MS/GM 158/2016, Art. 36)
I - a frequência anual máxima de doações e o intervalo mínimo entre as doações; (Origem: PRT MS/GM 158/2016, Art. 36, I)
II - as idades mínima e máxima para doação; (Origem: PRT MS/GM 158/2016, Art. 36, II)
III - a massa corpórea mínima; (Origem: PRT MS/GM 158/2016, Art. 36, III)
IV - a aferição do pulso; (Origem: PRT MS/GM 158/2016, Art. 36, IV)
V - a aferição da pressão arterial; (Origem: PRT MS/GM 158/2016, Art. 36, V)
VI - os níveis de hematócrito/hemoglobina; (Origem: PRT MS/GM 158/2016, Art. 36, VI)
VII - a história médica e os antecedentes patológicos do doador; (Origem: PRT MS/GM 158/2016, Art. 36, VII)
VIII - a utilização de medicamentos; (Origem: PRT MS/GM 158/2016, Art. 36, VIII)
IX - as hipóteses de gestação, lactação, abortamento e menstruação; (Origem: PRT MS/GM 158/2016, Art. 36, IX)
X - o jejum e a alimentação adequada; (Origem: PRT MS/GM 158/2016, Art. 36, X)
XI - o consumo de bebidas alcoólicas; (Origem: PRT MS/GM 158/2016, Art. 36, XI)
XII - os episódios alérgicos; (Origem: PRT MS/GM 158/2016, Art. 36, XII)
XIII - as ocupações habituais; e (Origem: PRT MS/GM 158/2016, Art. 36, XIII)
XIV - o volume a ser coletado. (Origem: PRT MS/GM 158/2016, Art. 36, XIV)
Art. 37. A frequência máxima admitida é de 4 (quatro) doações anuais para o homem e de 3 (três) doações anuais para a mulher, exceto em circunstâncias especiais, que devem ser avaliadas e aprovadas pelo responsável técnico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 37)
§ 1º O intervalo mínimo entre doações deve ser de 2 (dois) meses para os homens e de 3 (três) meses para as mulheres. (Origem: PRT MS/GM 158/2016, Art. 37, § 1º)
§ 2º Em caso de doador autólogo, a frequência e o intervalo entre as doações devem ser programados de acordo com o protocolo aprovado pelo responsável técnico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 37, § 2º)
Art. 38. O doador de sangue ou componentes deverá ter idade entre 16 (dezesseis) anos completos e 69 (sessenta e nove) anos, 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 158/2016, Art. 38)
§ 1º Os candidatos à doação de sangue com idade entre 16 (dezesseis) e 17 (dezessete) anos devem possuir consentimento formal, por escrito, do seu responsável legal para cada doação que realizar. (Origem: PRT MS/GM 158/2016, Art. 38, § 1º)
§ 2º O consentimento do responsável legal de que trata o § 1º deve incluir a autorização para o cumprimento de todas as exigências e responsabilidades estabelecidas aos demais doadores na Seção II do Capítulo I do Título II, bem como para submeter-se a triagem clínica e realizar e receber os resultados da triagem laboratorial na forma prevista nos arts. 67 e 68 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 38, § 2º)
§ 3º Os resultados dos testes de triagem laboratorial do doador somente serão entregues ao próprio doador, na forma prevista neste Anexo, não sendo permitida a entrega a terceiros, mesmo aos responsáveis legais, exceto quando houver procuração, nos termos do art. 31, § 2º . (Origem: PRT MS/GM 158/2016, Art. 38, § 3º)
§ 4º Em casos de necessidades tecnicamente justificáveis, o candidato cuja idade seja inferior a 16 (dezesseis) anos ou igual ou superior a 70 (setenta) anos será aceito para fins de doação após análise pelo médico do serviço de hemoterapia, com avaliação dos riscos e benefícios e apresentação de relatório que justifique a necessidade da doação, registrando-a na ficha do doador. (Origem: PRT MS/GM 158/2016, Art. 38, § 4º)
§ 5º O limite para a primeira doação será de 60 (sessenta) anos, 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 158/2016, Art. 38, § 5º)
Art. 39. Para ser selecionado para doação, o candidato deve ter, no mínimo, peso de 50 kg (cinquenta quilogramas). (Origem: PRT MS/GM 158/2016, Art. 39)
§ 1º Candidatos com peso abaixo de 50 kg (cinquenta quilogramas) poderão ser aceitos para fins de doação, após avaliação médica, desde que o volume do anticoagulante na bolsa de coleta seja proporcional ao volume a ser coletado, respeitadas as demais determinações da Seção III do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 39, § 1º)
§ 2º Não serão selecionados os candidatos à doação que apresentarem perda de peso inexplicável superior a 10% (dez por cento) da massa corporal nos 3 (três) meses que antecederem à doação. (Origem: PRT MS/GM 158/2016, Art. 39, § 2º)
Art. 40. Na aferição do pulso do candidato, a pulsação deverá apresentar características normais, ser regular e sua frequência não deve ser menor que 50 (cinquenta) nem maior que 100 (cem) batimentos por minuto. (Origem: PRT MS/GM 158/2016, Art. 40)
Parágrafo Único. A aceitação de doadores com pulso irregular ou com frequência fora dos limites estabelecidos no "caput" dependerá de avaliação médica. (Origem: PRT MS/GM 158/2016, Art. 40, Parágrafo Único)
Art. 41. Na aferição da pressão arterial do candidato, a pressão sistólica não deve ser maior que 180 mmHg (cento e oitenta milímetros de mercúrio) e a pressão diastólica não deve ser maior que 100 mmHg (cem milímetros de mercúrio). (Origem: PRT MS/GM 158/2016, Art. 41)
Parágrafo Único. Doadores com limite de pressão arterial fora dos parâmetros estabelecidos no "caput" somente serão considerados aptos para doação após avaliação médica qualificada. (Origem: PRT MS/GM 158/2016, Art. 41, Parágrafo Único)
Art. 42. No momento da seleção, será determinada a concentração de hemoglobina (Hb) ou de hematócrito (Ht) em amostra de sangue do candidato à doação obtida por punção digital ou por venopunção ou por método validado que possa vir a substituí-los. (Origem: PRT MS/GM 158/2016, Art. 42)
§ 1º Os valores mínimos aceitáveis do nível de hemoglobina/hematócrito são: (Origem: PRT MS/GM 158/2016, Art. 42, § 1º)
I - mulheres: Hb =12,5g/dL ou Ht =38%; e (Origem: PRT MS/GM 158/2016, Art. 42, § 1º, I)
II - homens: Hb =13,0g/dL ou Ht =39%. (Origem: PRT MS/GM 158/2016, Art. 42, § 1º, II)
§ 2º O candidato que apresente níveis de Hb igual ou maior que 18,0g/dL ou Ht igual ou maior que 54% será impedido de doar e encaminhado para investigação clínica. (Origem: PRT MS/GM 158/2016, Art. 42, § 2º)
Art. 43. Serão avaliados a história médica e os antecedentes patológicos do doador segundo as doenças e antecedentes que contraindicam definitiva ou temporariamente a doação de sangue constantes dos Anexos 1 e 2 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 43)
Art. 44. A história terapêutica recente, em relação ao uso de medicamentos pelo candidato, receberá avaliação especial por parte do médico, uma vez que a indicação quanto ao próprio tratamento pode motivar a inaptidão do candidato à doação. (Origem: PRT MS/GM 158/2016, Art. 44)
§ 1º Cada medicamento será avaliado individualmente e em conjunto e, sempre que possa apresentar alguma correlação com a doação de sangue, registrado na ficha de triagem. (Origem: PRT MS/GM 158/2016, Art. 44, § 1º)
§ 2º Será observada a lista detalhada de medicamentos que contraindicam a doação ou exijam cuidados especiais, nos termos do Anexo 3 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 44, § 2º)
§ 3º A ingestão do ácido acetilsalicílico (aspirina) e/ou outros anti-inflamatórios não esteroides (AINE) que interfiram na função plaquetária, nos 3 (três) dias anteriores à doação, exclui a preparação de plaquetas para esta doação, mas não implica a inaptidão do candidato. (Origem: PRT MS/GM 158/2016, Art. 44, § 3º)
Art. 45. A gestação é motivo de inaptidão temporária para doação de sangue até 12 (doze) semanas após o parto ou abortamento. (Origem: PRT MS/GM 158/2016, Art. 45)
§ 1º Não serão aceitas como doadoras as mulheres em período de lactação, a menos que o parto tenha ocorrido há mais de 12 (doze) meses. (Origem: PRT MS/GM 158/2016, Art. 45, § 1º)
§ 2º Em caso de necessidade técnica, a doação da mãe para o recém-nascido poderá ser realizada, desde que haja consentimento por escrito do hemoterapeuta e do médico obstetra, com apresentação de relatório médico que a justifique. (Origem: PRT MS/GM 158/2016, Art. 45, § 2º)
§ 3º A doação autóloga de gestantes será aceita se contar com a aprovação formal do obstetra responsável e do médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 45, § 3º)
§ 4º A aprovação de que trata o § 3º será registrada em prontuário médico com assinatura dos profissionais envolvidos. (Origem: PRT MS/GM 158/2016, Art. 45, § 4º)
Art. 46. A menstruação não é contraindicação para a doação. (Origem: PRT MS/GM 158/2016, Art. 46)
Parágrafo Único. A hipermenorreia ou outras alterações menstruais serão avaliadas pelo médico. (Origem: PRT MS/GM 158/2016, Art. 46, Parágrafo Único)
Art. 47. Será oferecida ao doador a possibilidade de hidratação oral antes da doação e os doadores que se apresentarem em jejum prolongado receberão um lanche antes da doação. (Origem: PRT MS/GM 158/2016, Art. 47)
§ 1º Não será coletado sangue de candidatos que tenham feito refeição copiosa e rica em substâncias gordurosas há menos de 3 (três) horas da coleta. (Origem: PRT MS/GM 158/2016, Art. 47, § 1º)
§ 2º Após a doação, é obrigatória a oferta de hidratação oral adequada ao doador, objetivando a reposição de líquidos. (Origem: PRT MS/GM 158/2016, Art. 47, § 2º)
§ 3º É recomendável que o doador permaneça por 15 (quinze) minutos no serviço de hemoterapia após a doação. (Origem: PRT MS/GM 158/2016, Art. 47, § 3º)
Art. 48. Qualquer evidência de alcoolismo crônico é motivo para caracterizar o candidato como doador inapto definitivo. (Origem: PRT MS/GM 158/2016, Art. 48)
Parágrafo Único. A ingestão de bebidas alcoólicas contraindica a doação por 12 (doze) horas após o consumo. (Origem: PRT MS/GM 158/2016, Art. 48, Parágrafo Único)
Art. 49. O doador alérgico somente será aceito se estiver assintomático no momento da doação. (Origem: PRT MS/GM 158/2016, Art. 49)
§ 1º São doadores inaptos definitivos aqueles que referem enfermidades atópicas graves, como asma brônquica grave e antecedente de choque anafilático. (Origem: PRT MS/GM 158/2016, Art. 49, § 1º)
§ 2º Os tratamentos dessensibilizantes contraindicam a doação até 72 (setenta e duas) horas depois da última aplicação. (Origem: PRT MS/GM 158/2016, Art. 49, § 2º)
Art. 50. Os candidatos à doação de sangue que exerçam ocupações, "hobbies" ou esportes que ofereçam riscos para si ou para outrem somente serão selecionados caso possam interromper tais atividades pelo período mínimo de 12 (doze) horas após a doação. (Origem: PRT MS/GM 158/2016, Art. 50)
§ 1º Consideram-se ocupações, "hobbies" ou esportes de risco, dentre outros: (Origem: PRT MS/GM 158/2016, Art. 50, § 1º)
I - pilotagem de avião ou helicóptero; (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, I)
II - condução de veículos de grande porte, como ônibus, caminhões e trens; (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, II)
III - operação de maquinário de alto risco, como na indústria e construção civil; (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, III)
IV - trabalho em andaimes; e (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, IV)
V - prática de paraquedismo ou mergulho. (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, V)
§ 2º Atividades não contempladas no § 1º serão avaliadas pelo médico do serviço de hemoterapia para fins de seleção de candidatos à doação. (Origem: PRT MS/GM 158/2016, Art. 50, § 2º)
Art. 51. O volume de sangue total a ser coletado deve ser, no máximo, de 8 (oito) mL/kg de peso para as mulheres e de 9 (nove) mL/kg de peso para os homens. (Origem: PRT MS/GM 158/2016, Art. 51)
Parágrafo Único. O volume admitido por doação é de 450 mL ± 45 mL, aos quais podem ser acrescidos até 30 mL para a realização dos exames laboratoriais exigidos pelas leis e normas técnicas. (Origem: PRT MS/GM 158/2016, Art. 51, Parágrafo Único)
Art. 52. Com a finalidade de proteger os receptores, serão adotadas, tanto no momento da seleção de candidatos quanto no momento da doação, a avaliação das seguintes medidas e critérios, de acordo com os parâmetros estabelecidos por este regulamento: (Origem: PRT MS/GM 158/2016, Art. 52)
I - aspectos gerais do candidato, que deve ter aspecto saudável à ectoscopia e declarar bem-estar geral; (Origem: PRT MS/GM 158/2016, Art. 52, I)
II - temperatura corpórea do candidato, que não deve ser superior a 37ºC (trinta e sete graus Celsius); (Origem: PRT MS/GM 158/2016, Art. 52, II)
III - condição de imunizações e vacinações do candidato, nos termos do Anexo 4 do Anexo IV ; (Origem: PRT MS/GM 158/2016, Art. 52, III)
IV - local da punção venosa em relação à presença de lesões de pele e características que permitam a punção adequada; (Origem: PRT MS/GM 158/2016, Art. 52, IV)
V - histórico de transfusões recebidas pelo doador, uma vez que os candidatos que tenham recebido transfusões de sangue, componentes sanguíneos ou hemoderivados nos últimos 12 (doze) meses devem ser excluídos da doação; (Origem: PRT MS/GM 158/2016, Art. 52, V)
VI - histórico de doenças infecciosas; (Origem: PRT MS/GM 158/2016, Art. 52, VI)
VII - histórico de enfermidades virais; (Origem: PRT MS/GM 158/2016, Art. 52, VII)
VIII - histórico de doenças parasitárias; (Origem: PRT MS/GM 158/2016, Art. 52, VIII)
IX - histórico de enfermidades bacterianas; (Origem: PRT MS/GM 158/2016, Art. 52, IX)
X - estilo de vida do candidato a doação; (Origem: PRT MS/GM 158/2016, Art. 52, X)
XI - situações de risco vivenciadas pelo candidato; e (Origem: PRT MS/GM 158/2016, Art. 52, XI)
XII - histórico de cirurgias e procedimentos invasivos. (Origem: PRT MS/GM 158/2016, Art. 52, XII)
Art. 53. Em relação ao histórico de doenças infecciosas, o candidato à doação não deve apresentar enfermidade infecciosa aguda nem deve ter antecedentes de infecções transmissíveis pelo sangue. (Origem: PRT MS/GM 158/2016, Art. 53)
§ 1º No caso de infecções e uso de antibióticos, o candidato estará apto à doação 2 (duas) semanas após o fim do tratamento e desaparecimento dos sintomas. (Origem: PRT MS/GM 158/2016, Art. 53, § 1º)
§ 2º Candidatos à doação que tenham se deslocado ou que sejam procedentes de regiões, nacionais ou internacionais, endêmicas ou com epidemias confirmadas de doenças infecciosas que não sejam prevalentes na região da doação (não endêmicas) serão considerados aptos somente após 30 dias da saída dessas regiões, excetuando-se os casos contemplados no art. 57. (Origem: PRT MS/GM 158/2016, Art. 53, § 2º)
§ 3º Em situações especiais, como emergências em saúde pública, surtos epidêmicos, entre outros, os serviços de hemoterapia, em cooperação com as autoridades sanitárias, podem adequar critérios técnicos para seleção de doadores. (Origem: PRT MS/GM 158/2016, Art. 53, § 3º)
Art. 54. Quanto ao histórico de enfermidades virais, é considerado definitivamente inapto para a doação de sangue o indivíduo que: (Origem: PRT MS/GM 158/2016, Art. 54)
I - tenha antecedente de hepatite viral após os 11 (onze) anos de idade, exceto para caso de comprovação de infecção aguda de hepatite A (IgM reagente) à época do diagnóstico clínico, hipótese em que o doador poderá ser considerado apto após avaliação do resultado pelo médico do serviço de hemoterapia; ou (Origem: PRT MS/GM 158/2016, Art. 54, I)
II - tenha antecedente clínico, laboratorial ou história atual de infecção pelos agentes HBV, HCV, HIV ou HTLV. (Origem: PRT MS/GM 158/2016, Art. 54, II)
§ 1º O candidato com sintoma de gripe ou resfriado associado à temperatura corporal maior ou igual 38°C (trinta e oito graus Celsius) é inapto por 2 (duas) semanas após o desaparecimento dos sintomas. (Origem: PRT MS/GM 158/2016, Art. 54, § 1º)
§ 2º Aquele que relatar resfriado comum, mas não se enquadrar nas condições descritas no § 1º, poderá ser aceito desde que assintomático no momento da doação. (Origem: PRT MS/GM 158/2016, Art. 54, § 2º)
Art. 55. Todos os doadores serão questionados sobre situações ou comportamentos que levem a risco acrescido para infecções sexualmente transmissíveis, devendo ser excluídos da seleção quem os apresentar. (Origem: PRT MS/GM 158/2016, Art. 55)
Parágrafo Único. A entrevista do doador deve incluir, ainda, perguntas vinculadas aos sintomas e sinais sugestivos de Síndrome de Imunodeficiência Adquirida (SIDA) como: (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único)
I - perda de peso inexplicada; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, I)
II - suores noturnos; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, II)
III - manchas azuladas ou purpúricas mucocutâneas (sarcoma de Kaposi); (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, III)
IV - aumento de linfonodos com duração superior a 30 (trinta) dias; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, IV)
V - manchas brancas ou lesões ulceradas não usuais na boca; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, V)
VI - febre inexplicada por mais de 10 (dez) dias; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, VI)
VII - tosse persistente ou dispneia; e (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, VII)
VIII - diarreia persistente. (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, VIII)
Art. 56. Serão observadas as hipóteses de inaptidão para doação em virtude do histórico das seguintes doenças parasitárias: (Origem: PRT MS/GM 158/2016, Art. 56)
I - malária; (Origem: PRT MS/GM 158/2016, Art. 56, I)
II - doença de Chagas; e (Origem: PRT MS/GM 158/2016, Art. 56, II)
III - Encefalopatia Espongiforme Humana ou Doença de Creutzfeldt-Jakob (DCJ) e suas variantes. (Origem: PRT MS/GM 158/2016, Art. 56, III)
Art. 57. Para malária, a inaptidão de candidato à doação de sangue deve ocorrer usando-se, como critério de referência, a Incidência Parasitária Anual (IPA) do Município. (Origem: PRT MS/GM 158/2016, Art. 57)
§ 1º Em áreas endêmicas com antecedentes epidemiológicos de malária, considerar-se-á inapto o candidato: (Origem: PRT MS/GM 158/2016, Art. 57, § 1º)
I - que tenha tido malária nos 12 (doze) meses que antecedem a doação; (Origem: PRT MS/GM 158/2016, Art. 57, § 1º, I)
II - com febre ou suspeita de malária nos últimos 30 (trinta) dias; e (Origem: PRT MS/GM 158/2016, Art. 57, § 1º, II)
III - que tenha se deslocado ou procedente de área de alto risco (IPA maior que 49,9) há menos de 30 (trinta) dias. (Origem: PRT MS/GM 158/2016, Art. 57, § 1º, III)
§ 2º Em áreas não endêmicas de malária, considerar-se-á inapto o candidato que tenha se deslocado ou que seja procedente de Municípios localizados em áreas endêmicas há menos de 30 (trinta) dias. (Origem: PRT MS/GM 158/2016, Art. 57, § 2º)
§ 3º Em áreas não endêmicas de malária, considerar-se-á apto o candidato: (Origem: PRT MS/GM 158/2016, Art. 57, § 3º)
I - procedente de Municípios localizados em áreas endêmicas, após 30 (trinta) dias e até 12 (doze) meses do deslocamento, sendo que, nesse período, é necessária a realização de testes de detecção do plasmódio ou de antígenos plasmodiais, conforme art. 131; (Origem: PRT MS/GM 158/2016, Art. 57, § 3º, I)
II - procedente de Municípios localizados em áreas endêmicas, após 12 (doze) meses do deslocamento, sem necessidade de realização de testes de detecção; e (Origem: PRT MS/GM 158/2016, Art. 57, § 3º, II)
III - que tenha manifestado malária após 12 (doze) meses do tratamento e comprovação de cura. (Origem: PRT MS/GM 158/2016, Art. 57, § 3º, III)
§ 4º Independentemente da endemicidade da área, será considerado inapto definitivo o candidato que teve infecção por "Plasmodium malariae" (Febre Quartã). (Origem: PRT MS/GM 158/2016, Art. 57, § 4º)
§ 5º Em casos de surtos de malária, a decisão quanto aos critérios de inaptidão deve ser tomada após avaliação conjunta com a autoridade epidemiológica competente. (Origem: PRT MS/GM 158/2016, Art. 57, § 5º)
Art. 58. Para Doença de Chagas, o candidato com antecedente epidemiológico de contato domiciliar com Triatomíneo em área endêmica ou com diagnóstico clínico ou laboratorial de Doença de Chagas deve ser excluído de forma permanente, sendo considerado doador inapto definitivo. (Origem: PRT MS/GM 158/2016, Art. 58)
Parágrafo Único. Os casos de contato em área não endêmica deverão ser submetidos a teste sorológico pré-doação, utilizando-se métodos de alta sensibilidade. (Origem: PRT MS/GM 158/2016, Art. 58, Parágrafo Único)
Art. 59. Para casos de Encefalopatia Espongiforme Humana e suas variantes, causadores da Doença de Creutzfeldt-Jakob (DCJ), será definitivamente excluído como doador o candidato que se enquadre em uma das seguintes situações: (Origem: PRT MS/GM 158/2016, Art. 59)
I - tenha tido diagnóstico de Encefalopatia Espongiforme Humana ou qualquer outra forma da doença; (Origem: PRT MS/GM 158/2016, Art. 59, I)
II - tenha história familiar de Encefalopatia Espongiforme Humana; (Origem: PRT MS/GM 158/2016, Art. 59, II)
III - tenha permanecido no Reino Unido e/ou na República da Irlanda por mais de 3 (três) meses, de forma cumulativa, após o ano de 1980 até 31 de dezembro de 1996; (Origem: PRT MS/GM 158/2016, Art. 59, III)
IV - tenha permanecido 5 (cinco) anos ou mais, consecutivos ou intermitentes, na Europa após 1980 até os dias atuais; (Origem: PRT MS/GM 158/2016, Art. 59, IV)
V - tenha recebido hormônio de crescimento ou outros medicamentos de origem hipofisária não recombinante; (Origem: PRT MS/GM 158/2016, Art. 59, V)
VI - tenha feito uso de insulina bovina; (Origem: PRT MS/GM 158/2016, Art. 59, VI)
VII - tenha recebido transplante de córnea ou implante de material biológico à base de dura-máter; e (Origem: PRT MS/GM 158/2016, Art. 59, VII)
VIII - tenha recebido transfusão de sangue ou componentes no Reino Unido após 1980. (Origem: PRT MS/GM 158/2016, Art. 59, VIII)
Art. 60. Quanto ao histórico de enfermidades bacterianas, os doadores portadores de enfermidades agudas serão excluídos temporariamente, até a cura definitiva, observado o disposto no Anexo 1 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 60)
Art. 61. Quanto ao estilo de vida do candidato a doação, a história atual ou pregressa de uso de drogas injetáveis ilícitas é contraindicação definitiva para a doação de sangue. (Origem: PRT MS/GM 158/2016, Art. 61)
§ 1º Serão inspecionados ambos os braços dos candidatos para detectar evidências de uso repetido de drogas parenterais ilícitas, sendo que a presença desses sinais determina a inaptidão definitiva do doador. (Origem: PRT MS/GM 158/2016, Art. 61, § 1º)
§ 2º O uso de anabolizantes injetáveis sem prescrição médica, crack ou cocaína por via nasal (inalação) é causa de exclusão da doação por um período de 12 (doze) meses, contados a partir da data da última utilização. (Origem: PRT MS/GM 158/2016, Art. 61, § 2º)
§ 3º O uso de maconha impede a doação por 12 (doze) horas. (Origem: PRT MS/GM 158/2016, Art. 61, § 3º)
§ 4º A evidência de uso de qualquer outro tipo de droga deve ser avaliada. (Origem: PRT MS/GM 158/2016, Art. 61, § 4º)
§ 5º No caso do uso de drogas ilícitas, deve ser realizada também a avaliação criteriosa do comportamento individual do candidato e do grau de dependência, dando foco à exposição a situações de risco acrescido de transmissão de infecções por transfusão, e especial atenção à utilização compartilhada de seringas e agulhas no uso de substâncias injetáveis. (Origem: PRT MS/GM 158/2016, Art. 61, § 5º)
Art. 62. Em situações de risco acrescido vivenciadas pelos candidatos, considerar-se-á inapto definitivo o candidato que apresente qualquer uma das situações abaixo: (Origem: PRT MS/GM 158/2016, Art. 62)
I - ter evidência clínica ou laboratorial de infecções transmissíveis por transfusão de sangue; (Origem: PRT MS/GM 158/2016, Art. 62, I)
II - ter sido o único doador de sangue de um paciente que tenha apresentado soroconversão para hepatite B ou C, HIV ou HTLV na ausência de qualquer outra causa provável para a infecção; (Origem: PRT MS/GM 158/2016, Art. 62, II)
III - possuir "piercing" na cavidade oral e/ou na região genital, devido ao risco permanente de infecção, podendo candidatar-se a nova doação 12 (doze) meses após a retirada; e (Origem: PRT MS/GM 158/2016, Art. 62, III)
IV - ter antecedente de compartilhamento de seringas ou agulhas. (Origem: PRT MS/GM 158/2016, Art. 62, IV)
Art. 63. Considerar-se-á inapto temporário, por 12 (doze) meses após a cura, o candidato a doador que teve alguma Doença Sexualmente Transmissível (DST). (Origem: PRT MS/GM 158/2016, Art. 63)
Parágrafo Único. Nos casos em que se evidenciem infecções repetidas por DST e consequente maior risco de reinfecção, o candidato deve ser considerado inapto definitivamente. (Origem: PRT MS/GM 158/2016, Art. 63, Parágrafo Único)
Art. 64. Considerar-se-á inapto temporário por 12 (doze) meses o candidato que tenha sido exposto a qualquer uma das situações abaixo: (Origem: PRT MS/GM 158/2016, Art. 64)
I - que tenha feito sexo em troca de dinheiro ou de drogas ou seus respectivos parceiros sexuais; (Origem: PRT MS/GM 158/2016, Art. 64, I)
II - que tenha feito sexo com um ou mais parceiros ocasionais ou desconhecidos ou seus respectivos parceiros sexuais; (Origem: PRT MS/GM 158/2016, Art. 64, II)
III - que tenha sido vítima de violência sexual ou seus respectivos parceiros sexuais; (Origem: PRT MS/GM 158/2016, Art. 64, III)
IV - homens que tiveram relações sexuais com outros homens e/ou as parceiras sexuais destes; (Origem: PRT MS/GM 158/2016, Art. 64, IV)
V - que tenha tido relação sexual com pessoa portadora de infecção pelo HIV, hepatite B, hepatite C ou outra infecção de transmissão sexual e sanguínea; (Origem: PRT MS/GM 158/2016, Art. 64, V)
VI - que tenha vivido situação de encarceramento ou de confinamento obrigatório não domiciliar superior a 72 (setenta e duas) horas, durante os últimos 12 (doze) meses, ou os parceiros sexuais dessas pessoas; (Origem: PRT MS/GM 158/2016, Art. 64, VI)
VII - que tenha feito "piercing", tatuagem ou maquiagem definitiva, sem condições de avaliação quanto à segurança do procedimento realizado; (Origem: PRT MS/GM 158/2016, Art. 64, VII)
VIII - que seja parceiro sexual de pacientes em programa de terapia renal substitutiva e de pacientes com história de transfusão de componentes sanguíneos ou derivados; e (Origem: PRT MS/GM 158/2016, Art. 64, VIII)
IX - que teve acidente com material biológico e em consequência apresentou contato de mucosa e/ou pele não íntegra com o referido material biológico. (Origem: PRT MS/GM 158/2016, Art. 64, IX)
Art. 65. Quanto ao histórico de cirurgias e procedimentos invasivos, deve ser observado o disposto no Anexo 2 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 65)
§ 1º O candidato submetido a cirurgia deve ser considerado inapto por tempo variável de acordo com o porte do procedimento e a evolução clínica. (Origem: PRT MS/GM 158/2016, Art. 65, § 1º)
§ 2º O candidato submetido a procedimento odontológico deve ser considerado inapto por tempo variável de acordo com o procedimento e a evolução clínica. (Origem: PRT MS/GM 158/2016, Art. 65, § 2º)
§ 3º Qualquer procedimento endoscópico leva a uma inaptidão à doação de sangue por 6 (seis) meses. (Origem: PRT MS/GM 158/2016, Art. 65, § 3º)
Art. 66. Os registros dos doadores serão mantidos com a finalidade de garantir a segurança do processo da doação de sangue e a sua rastreabilidade. (Origem: PRT MS/GM 158/2016, Art. 66)
§ 1º Para doação de sangue, é obrigatório apresentar documento de identificação com fotografia, emitido por órgão oficial, sendo aceita fotocópia autenticada do documento, desde que as fotos e inscrições estejam legíveis e as imagens permitam a identificação do portador. (Origem: PRT MS/GM 158/2016, Art. 66, § 1º)
§ 2º Todo candidato a doação deve ter um registro no serviço de hemoterapia, que será, preferencialmente, em arquivo eletrônico. (Origem: PRT MS/GM 158/2016, Art. 66, § 2º)
§ 3º Serão adotadas ações que garantam a confiabilidade, o sigilo e a segurança das informações constantes do registro dos doadores. (Origem: PRT MS/GM 158/2016, Art. 66, § 3º)
§ 4º Constarão do registro dos doadores as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 66, § 4º)
I - nome completo do candidato; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, I)
II - sexo; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, II)
III - data de nascimento; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, III)
IV - número e órgão expedidor do documento de identificação; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, IV)
V - nacionalidade e naturalidade; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, V)
VI - filiação; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, VI)
VII - ocupação habitual; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, VII)
VIII - endereço e telefone para contato; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, VIII)
IX - número do registro do candidato no serviço de hemoterapia ou no programa de doação de sangue; e (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, IX)
X - registro da data de comparecimento. (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, X)
§ 5º O serviço de hemoterapia, a seu critério, poderá oferecer ao doador a oportunidade de se auto excluir por motivos de risco acrescidos não informados ou deliberadamente omitidos durante a triagem, de forma confidencial. (Origem: PRT MS/GM 158/2016, Art. 66, § 5º)
§ 6º Antes de assinar o termo de consentimento, o doador será informado sobre os cuidados a serem observados durante e após a coleta e orientado sobre as possíveis reações adversas. (Origem: PRT MS/GM 158/2016, Art. 66, § 6º)
Art. 67. O doador deverá ser informado sobre os motivos de inaptidão temporária ou definitiva para doação de sangue, identificados na triagem clínica. (Origem: PRT MS/GM 158/2016, Art. 67)
§ 1º O motivo da inaptidão identificada na triagem clínica será registrado na ficha de triagem. (Origem: PRT MS/GM 158/2016, Art. 67, § 1º)
§ 2º O serviço de hemoterapia disporá de um sistema de comunicação ao doador. (Origem: PRT MS/GM 158/2016, Art. 67, § 2º)
§ 3º A inaptidão identificada na triagem laboratorial será comunicada ao doador com objetivo de esclarecimento e encaminhamento do caso. (Origem: PRT MS/GM 158/2016, Art. 67, § 3º)
§ 4º Antes da comunicação ao doador, o serviço de hemoterapia realizará repetição em duplicata dos testes com resultados inicialmente reagentes, conforme algoritmo de que trata o Anexo 5 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 67, § 4º)
Art. 68. O serviço de hemoterapia informará, mensalmente, à autoridade sanitária competente, os dados dos doadores com resultados dos testes laboratoriais para doenças transmissíveis pelo sangue, reagentes nas repetições em duplicata, e as ausências dos doadores convocados para a coleta de novas amostras ou recebimento de orientações, conforme padronização definida pelas instâncias competentes e pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 68)
Seção III
Da Coleta de Sangue do Doador
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção III)
Art. 69. A coleta de sangue será realizada em condições assépticas, sob a supervisão de médico ou enfermeiro, através de uma única punção venosa, em bolsas plásticas com sistema fechado e estéril destinado especificamente para este fim. (Origem: PRT MS/GM 158/2016, Art. 69)
Art. 70. A sala da coleta de sangue será limpa, iluminada, confortável e agradável. (Origem: PRT MS/GM 158/2016, Art. 70)
Art. 71. Será garantida a identificação correta e segura do doador durante todo o processo de coleta de sangue. (Origem: PRT MS/GM 158/2016, Art. 71)
§ 1º A ficha do doador, a bolsa de sangue e os tubos-pilotos contendo as amostras de sangue serão adequadamente identificados, de modo que as bolsas e os tubos correspondam efetivamente ao respectivo doador. (Origem: PRT MS/GM 158/2016, Art. 71, § 1º)
§ 2º O nome do doador não constará na etiqueta das bolsas de sangue, com exceção daquelas destinadas à transfusão autóloga. (Origem: PRT MS/GM 158/2016, Art. 71, § 2º)
§ 3º A identificação dos tubos para exames laboratoriais e das bolsas, principal e satélites, será feita por código de barras ou etiqueta impressa que permita a vinculação dos tubos e bolsas com a doação. (Origem: PRT MS/GM 158/2016, Art. 71, § 3º)
Art. 72. As bolsas utilizadas na coleta de sangue conterão anticoagulantes, nas quantidades prescritas e recomendadas pelos fabricantes das bolsas e em função do volume de sangue a ser coletado. (Origem: PRT MS/GM 158/2016, Art. 72)
§ 1º A quantidade habitual de anticoagulante em uma bolsa de coleta é de 60-65 mL. (Origem: PRT MS/GM 158/2016, Art. 72, § 1º)
§ 2º Para a quantidade de anticoagulante de que trata o § 1º, o volume ideal de coletas de bolsas é de 450 ± 45 mL de sangue total. (Origem: PRT MS/GM 158/2016, Art. 72, § 2º)
§ 3º Para a quantidade de anticoagulante de que trata o § 1º, o concentrado de hemácias produzido em bolsas com 300 a 404 mL de sangue total pode ser usado para transfusão, desde que seja aplicado um rótulo que indique "unidade de baixo volume de concentrado de hemácias". (Origem: PRT MS/GM 158/2016, Art. 72, § 3º)
§ 4º Não serão preparados outros componentes a partir de unidades de baixo volume que não estejam abrangidos pelo § 3º. (Origem: PRT MS/GM 158/2016, Art. 72, § 4º)
§ 5º As coletas especiais de bolsas de sangue de doadores com volume total inferior a 300 mL para fins transfusionais somente podem ser obtidas com a utilização de bolsas específicas produzidas para este fim ou manipuladas em sistema estéril, não sendo permitida a abertura do sistema de conexões para correção do volume de anticoagulante, sem prejuízo das orientações contidas no "caput" e respectivos parágrafos. (Origem: PRT MS/GM 158/2016, Art. 72, § 5º)
§ 6º Coletas de bolsas com volume total inferior a 300 mL serão desprezadas, com exceção do disposto no § 5º. (Origem: PRT MS/GM 158/2016, Art. 72, § 6º)
Art. 73. Para a realização da coleta de sangue, deve-se inspecionar e palpar a fossa antecubital do braço do doador para a escolha da veia a ser puncionada, dando-se preferência à veia cubital mediana. (Origem: PRT MS/GM 158/2016, Art. 73)
Parágrafo Único. Deve-se evitar punção em locais com lesões dermatológicas ou cicatriciais, inclusive as relacionadas com punções anteriores. (Origem: PRT MS/GM 158/2016, Art. 73, Parágrafo Único)
Art. 74. A área da pele para punção venosa para coleta deve ser cuidadosamente preparada. (Origem: PRT MS/GM 158/2016, Art. 74)
§ 1º A área escolhida para a punção venosa deve ser submetida a uma cuidadosa higienização que deve contemplar duas etapas de antissepsia. (Origem: PRT MS/GM 158/2016, Art. 74, § 1º)
§ 2º A veia a puncionar não deverá ser palpada após a preparação da pele. (Origem: PRT MS/GM 158/2016, Art. 74, § 2º)
§ 3º Caso não seja possível observar o disposto no § 2º, todo o procedimento de higienização deverá ser repetido. (Origem: PRT MS/GM 158/2016, Art. 74, § 3º)
Art. 75. O procedimento da coleta de sangue garantirá a segurança do doador e do processo de doação. (Origem: PRT MS/GM 158/2016, Art. 75)
§ 1º O procedimento de coleta de sangue será realizado por profissionais de saúde treinados e capacitados, trabalhando sob a supervisão de enfermeiro ou médico. (Origem: PRT MS/GM 158/2016, Art. 75, § 1º)
§ 2º Todo o material utilizado no procedimento será descartável, estéril e apirogênico. (Origem: PRT MS/GM 158/2016, Art. 75, § 2º)
§ 3º O tempo de coleta não será superior a 15 (quinze) minutos, sendo o tempo ideal de até 12 (doze) minutos. (Origem: PRT MS/GM 158/2016, Art. 75, § 3º)
§ 4º O tubo coletor ("segmento de coleta", "macarrão" ou "rabicho") da bolsa deve estar fechado por pinça, logo abaixo da agulha. (Origem: PRT MS/GM 158/2016, Art. 75, § 4º)
§ 5º Observado o disposto no § 4º, somente depois que a agulha transfixar a pele do doador é que a pinça deve ser retirada ou aberta. (Origem: PRT MS/GM 158/2016, Art. 75, § 5º)
§ 6º Caso seja necessária a realização de mais de uma punção, será utilizada nova bolsa de coleta. (Origem: PRT MS/GM 158/2016, Art. 75, § 6º)
§ 7º Ao término da coleta da bolsa, o tubo coletor será lacrado utilizando-se dois nós apertados, previamente preparados até o processamento da bolsa de sangue total, sendo preferível a utilização de seladoras dielétricas apropriadas. (Origem: PRT MS/GM 158/2016, Art. 75, § 7º)
Art. 76. Serão adotados cuidados com o doador após a doação, a fim de garantir sua integridade. (Origem: PRT MS/GM 158/2016, Art. 76)
§ 1º Será ofertada hidratação oral ao doador depois da doação, antes que o mesmo se retire da instituição. (Origem: PRT MS/GM 158/2016, Art. 76, § 1º)
§ 2º É aconselhável a oferta de lanche ao doador. (Origem: PRT MS/GM 158/2016, Art. 76, § 2º)
§ 3º É recomendável que o doador permaneça, no mínimo, 15 (quinze) minutos no serviço de hemoterapia antes de ser liberado. (Origem: PRT MS/GM 158/2016, Art. 76, § 3º)
§ 4º Os doadores serão instruídos para que: (Origem: PRT MS/GM 158/2016, Art. 76, § 4º)
I - façam o veículo parar imediatamente no caso de, após deixarem o serviço de hemoterapia, ocorrer mal estar ao serem transportados por motocicletas ou conduzirem veículos automotores; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, I)
II - aguardem, pelo menos, 60 (sessenta) minutos antes de consumir cigarros, cigarrilhas, charutos, cachimbos ou quaisquer outros produtos fumígenos, derivados ou não do tabaco; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, II)
III - aguardem aproximadamente 12 (doze) horas antes de realizar qualquer esforço físico, especialmente com o membro relacionado à doação; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, III)
IV - mantenham a compressão no local da punção em caso de sangramento ou hematomas; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, IV)
V - comuniquem ao serviço de hemoterapia caso apresentem qualquer sinal ou sintoma de processo infeccioso, como febre ou diarreia, ou que tenham tido o diagnóstico de alguma doença infectocontagiosa até 7 (sete) dias após a doação; e (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, V)
VI - comuniquem ao serviço de hemoterapia caso tenham obtido o diagnóstico de malária até 30 dias após a doação. (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, VI)
Art. 77. Durante o processo de coleta de sangue, serão recolhidas amostras para realização dos exames laboratoriais necessários. (Origem: PRT MS/GM 158/2016, Art. 77)
§ 1º As amostras de que trata o "caput" serão coletadas a cada doação, devendo os rótulos da bolsa e dos tubos serem idênticos. (Origem: PRT MS/GM 158/2016, Art. 77, § 1º)
§ 2º As amostras serão coletadas por meio de dispositivos próprios integrados ao sistema de bolsa que permitam a coleta das amostras no início da doação, sem a abertura do sistema. (Origem: PRT MS/GM 158/2016, Art. 77, § 2º)
§ 3º É recomendado que o sistema de bolsa utilizado para coleta de amostras possibilite o desvio do primeiro fluxo de sangue da doação, reduzindo o risco de contaminação bacteriana dos componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 77, § 3º)
Art. 78. O serviço de hemoterapia que realiza coleta de sangue deve estar preparado para o atendimento a reações adversas à doação. (Origem: PRT MS/GM 158/2016, Art. 78)
§ 1º Para cumprimento do disposto no "caput", serão observados, no mínimo, os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 78, § 1º)
I - a existência de procedimentos operacionais com instruções específicas para a prevenção, identificação e tratamento das reações adversas nos doadores; (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, I)
II - a disponibilidade de medicamentos e equipamentos necessários para oferecer assistência médica ao doador que apresente reações adversas; (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, II)
III - a garantia de privacidade para o atendimento do doador em caso de necessidade; e (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, III)
IV - a manutenção de registro das reações adversas à doação. (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, IV)
§ 2º O doador permanecerá nas dependências do serviço de hemoterapia durante o tempo necessário para sua completa recuperação, caso apresente alguma reação adversa. (Origem: PRT MS/GM 158/2016, Art. 78, § 2º)
§ 3º O serviço de hemoterapia terá uma referência para atendimento de urgências ou emergências que porventura venham a ocorrer com o doador. (Origem: PRT MS/GM 158/2016, Art. 78, § 3º)
§ 4º Serão oferecidas informações e esclarecimentos ao doador sobre os possíveis efeitos adversos da doação e orientações de como proceder na hipótese de ocorrência dos mesmos. (Origem: PRT MS/GM 158/2016, Art. 78, § 4º)
§ 5º Para o atendimento de emergências relacionadas ao doador, a equipe profissional possuirá treinamento adequado e terá equipamento específico disponível no local da coleta, inclusive na coleta externa. (Origem: PRT MS/GM 158/2016, Art. 78, § 5º)
§ 6º Os equipamentos, medicamentos e demais especificações técnicas para estruturação do serviço de hemoterapia para atenção de emergência seguirão as normas do Sistema Nacional de Urgência e Emergência do Ministério da Saúde e demais regulamentos técnicos. (Origem: PRT MS/GM 158/2016, Art. 78, § 6º)
§ 7º O treinamento e padronização dos procedimentos para atendimento de situações de emergência seguirão as diretrizes de apoio ao suporte avançado de vida, da Sociedade Brasileira de Cardiologia, inclusive para montagem de carro de emergência, considerando a característica da atividade. (Origem: PRT MS/GM 158/2016, Art. 78, § 7º)
Art. 79. As bolsas de sangue total resultantes do processo de coleta serão adequadamente acondicionadas. (Origem: PRT MS/GM 158/2016, Art. 79)
§ 1º Para a produção apenas de Concentrado de Hemácias (CH) e plasma fresco congelado (PFC), as bolsas de sangue total serão acondicionadas o mais brevemente possível, após a coleta, a 4 ±2 °C. (Origem: PRT MS/GM 158/2016, Art. 79, § 1º)
§ 2º Se a produção de Concentrado de Plaquetas (CP) também for programada, as bolsas de sangue serão acondicionadas a temperaturas entre 20 a 24ºC (vinte a vinte e quatro graus Celsius), nunca devendo ser inferior a 20°C (vinte), preferencialmente dentro das primeiras 8 (oito) horas e não excedendo o máximo de 24 (vinte quatro) horas, até que as plaquetas sejam separadas. (Origem: PRT MS/GM 158/2016, Art. 79, § 2º)
Art. 80. Para a realização de coletas externas, serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 80)
I - o procedimento para avaliar a adequação do local e da estrutura; (Origem: PRT MS/GM 158/2016, Art. 80, I)
II - a compatibilidade entre a equipe e o número de doadores esperado; e (Origem: PRT MS/GM 158/2016, Art. 80, II)
III - a presença de, pelo menos, um médico e um enfermeiro para a constituição da equipe de coleta externa. (Origem: PRT MS/GM 158/2016, Art. 80, III)
§ 1º No procedimento para avaliar a adequação do local e da estrutura para a realização das coletas externas, verificar-se-á: (Origem: PRT MS/GM 158/2016, Art. 80, § 1º)
I - a compatibilidade da infraestrutura com o processo de coleta, a fim de permitir o fluxo adequado; (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, I)
II - a iluminação e ventilação da área física para coleta de sangue; (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, II)
III - a privacidade para a triagem clínica; (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, III)
IV - as condições adequadas para o atendimento de intercorrências clínicas dos doadores; e (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, IV)
V - as condições para oferta de hidratação oral e descanso após a doação. (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, V)
§ 2º O serviço de hemoterapia informará regularmente a programação de coletas externas à Vigilância Sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 80, § 2º)
§ 3º É obrigatória a informação à Vigilância Sanitária competente dos locais para coleta externa, para eventual avaliação da adequação e operacionalidade. (Origem: PRT MS/GM 158/2016, Art. 80, § 3º)
§ 4º Para as coletas externas, o serviço de hemoterapia terá referência para atendimento de urgência ou emergência que porventura ocorra ao doador, observadas as determinações do art. 78. (Origem: PRT MS/GM 158/2016, Art. 80, § 4º)
Art. 81. O manuseio de resíduos do serviço de hemoterapia e a higienização da área de coleta externa obedecerão às normas específicas e à legislação vigente. (Origem: PRT MS/GM 158/2016, Art. 81)
Seção IV
Da Preparação de Componentes Sanguíneos
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção IV)
Art. 82. A bolsa de sangue total coletada, tecnicamente satisfatória, poderá ser processada para a obtenção de um ou mais dos seguintes componentes: (Origem: PRT MS/GM 158/2016, Art. 82)
I - eritrocitários; (Origem: PRT MS/GM 158/2016, Art. 82, I)
II - plasmáticos; e (Origem: PRT MS/GM 158/2016, Art. 82, II)
III - plaquetários. (Origem: PRT MS/GM 158/2016, Art. 82, III)
§ 1º Os componentes sanguíneos também poderão ser coletados por aférese. (Origem: PRT MS/GM 158/2016, Art. 82, § 1º)
§ 2º O sangue total coletado em solução CPDA-1 terá validade de 35 (trinta e cinco) dias contados a partir da coleta e de 21 (vinte e um) dias quando coletado em ACD, CPD e CP2D, sempre devendo ser armazenado a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 82, § 2º)
§ 3º As especificações técnicas dos componentes de que trata o "caput" e que deverão ser observados pelo serviço de hemoterapia estão descritas no Anexo 6 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 82, § 3º)
Art. 83. Para o processo de produção e liberação de componentes sanguíneos, o serviço de hemoterapia terá uma política de avaliação dos doadores para prevenção de TRALI, que levará em consideração o sexo do doador e o número de gestações das doadoras. (Origem: PRT MS/GM 158/2016, Art. 83)
Art. 84. A esterilidade do componente será mantida durante o processamento, mediante o emprego de métodos assépticos, equipos e soluções estéreis e livres de pirogênios. (Origem: PRT MS/GM 158/2016, Art. 84)
Art. 85. A transferência de componente da bolsa-matriz para a bolsa-satélite, ou de uma bolsa-satélite para a outra, será realizada em circuito fechado. (Origem: PRT MS/GM 158/2016, Art. 85)
Art. 86. A manipulação do componente sanguíneo que exija a abertura do circuito será realizada em cabine de segurança biológica. (Origem: PRT MS/GM 158/2016, Art. 86)
Parágrafo Único. Se o circuito for aberto durante o processamento, os componentes serão descartados se não forem utilizados em até 24 (vinte quatro) horas após a produção, para componentes cuja temperatura de armazenamento seja 4 ± 2 °C, e em até 4 (quatro) horas, para concentrado de plaquetas (CP). (Origem: PRT MS/GM 158/2016, Art. 86, Parágrafo Único)
Art. 87. Os componentes eritrocitários serão produzidos de acordo com os critérios técnicos definidos neste Anexo, e são definidos como: (Origem: PRT MS/GM 158/2016, Art. 87)
I - concentrado de hemácias (CH); (Origem: PRT MS/GM 158/2016, Art. 87, I)
II - concentrado de hemácias lavadas; (Origem: PRT MS/GM 158/2016, Art. 87, II)
III - concentrado de hemácias com camada leucoplaquetária removida; (Origem: PRT MS/GM 158/2016, Art. 87, III)
IV - concentrado de hemácias desleucocitado; (Origem: PRT MS/GM 158/2016, Art. 87, IV)
V - concentrado de hemácias congeladas; e (Origem: PRT MS/GM 158/2016, Art. 87, V)
VI - hemácias rejuvenescidas. (Origem: PRT MS/GM 158/2016, Art. 87, VI)
Art. 88. Os concentrados de hemácias são os eritrócitos que permanecem na bolsa depois que esta é centrifugada e o plasma extraído para uma bolsa-satélite. (Origem: PRT MS/GM 158/2016, Art. 88)
§ 1º Os concentrados de hemácias sem solução aditiva devem ter hematócrito entre 65% e 80%. (Origem: PRT MS/GM 158/2016, Art. 88, § 1º)
§ 2º No caso de bolsas com solução aditiva, o hematócrito pode variar de 50 a 70%. (Origem: PRT MS/GM 158/2016, Art. 88, § 2º)
§ 3º Todos os componentes eritrocitários devem ser armazenados à temperatura de 4 ± 2 °C, exceto hemácias congeladas. (Origem: PRT MS/GM 158/2016, Art. 88, § 3º)
§ 4º Os glóbulos vermelhos separados em sistema fechado devem ser armazenados a 4 ± 2 °C e têm validade de: (Origem: PRT MS/GM 158/2016, Art. 88, § 4º)
I - em ACD/CPD/CP2D: 21 dias; (Origem: PRT MS/GM 158/2016, Art. 88, § 4º, I)
II - em CPDA-1: 35 (trinta e cinco) dias; e (Origem: PRT MS/GM 158/2016, Art. 88, § 4º, II)
III - em solução aditiva: 42 (quarenta e dois) dias. (Origem: PRT MS/GM 158/2016, Art. 88, § 4º, III)
Art. 89. Os concentrados de hemácias lavados são obtidos após lavagens com solução compatível estéril em quantidade suficiente (1 a 3 litros), de modo que sua quantidade final de proteínas totais seja inferior a 500 mg/unidade, devendo a temperatura de armazenamento ser de 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 89)
§ 1º A indicação dos componentes de que trata o "caput" está relacionada com a profilaxia de reações alérgicas ou com a utilização em pacientes deficientes de proteínas específicas, a exemplo de deficientes de IgA. (Origem: PRT MS/GM 158/2016, Art. 89, § 1º)
§ 2º Em função do método utilizado, o produto de que trata o "caput" pode conter quantidades variáveis dos leucócitos e plaquetas originalmente presentes na unidade, porém não é indicado para evitar aloimunização contra antígenos leucoplaquetários. (Origem: PRT MS/GM 158/2016, Art. 89, § 2º)
§ 3º A validade dos componentes de que trata o "caput" é de 24 (vinte quatro) horas depois de sua obtenção. (Origem: PRT MS/GM 158/2016, Art. 89, § 3º)
Art. 90. Os concentrados de hemácias com camada leucoplaquetária removida são concentrados de hemácias que devem ser preparados por um método que, por meio da remoção da camada leucoplaquetária, reduza o número de leucócitos no componente final a menos de 1,2 x 10e9 por unidade. (Origem: PRT MS/GM 158/2016, Art. 90)
§ 1º Os componentes de que trata o "caput" podem ser destinados à prevenção de reações transfusionais febris não hemolíticas e não são adequados para profilaxia de aloimunização leucoplaquetária, programas de transfusão crônica e prevenção de infecção por citomegalovírus (CMV). (Origem: PRT MS/GM 158/2016, Art. 90, § 1º)
§ 2º Os concentrados de hemácias com camada leucoplaquetária removida devem ser armazenados a 4 ± 2 °C e sua validade é de 24 (vinte quatro) horas depois de aberto o sistema. (Origem: PRT MS/GM 158/2016, Art. 90, § 2º)
§ 3º A validade dos concentrados de que trata o § 2º é definida pela solução de conservação/aditiva utilizada, conforme disposto no art. 88, § 4º . (Origem: PRT MS/GM 158/2016, Art. 90, § 3º)
Art. 91. Os concentrados de hemácias desleucocitados são concentrados de hemácias contendo menos que 5,0 x 10e6 leucócitos por unidade. (Origem: PRT MS/GM 158/2016, Art. 91)
§ 1º Quando for realizada antes do armazenamento, a desleucocitação deve ser feita em até 48 horas após a coleta. (Origem: PRT MS/GM 158/2016, Art. 91, § 1º)
§ 2º Na desleucocitação, pode ser utilizado sistema de conexão estéril ou conjuntos de coleta com filtro, sendo que, nesse caso, o tempo de validade corresponde ao original do componente. (Origem: PRT MS/GM 158/2016, Art. 91, § 2º)
§ 3º Não é recomendada a utilização de filtros de desleucocitação em beira de leito. (Origem: PRT MS/GM 158/2016, Art. 91, § 3º)
§ 4º Caso o concentrado de que trata o "caput" seja preparado em sistema aberto, a validade será de 24 (vinte e quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 91, § 4º)
§ 5º Os concentrados de que trata o "caput" são indicados para prevenção de reação transfusional febril não hemolítica e profilaxia de aloimunização leucocitária, aplicando-se, principalmente, a pacientes em programa de transfusão crônica, como pessoas com talassemia e com doença falciforme. (Origem: PRT MS/GM 158/2016, Art. 91, § 5º)
§ 6º Os concentrados de que trata o "caput" podem ser utilizados como alternativa para a redução da transmissão de citomegalovírus (CMV) em substituição a componentes soronegativos para CMV. (Origem: PRT MS/GM 158/2016, Art. 91, § 6º)
Art. 92. Os concentrados de hemácias congeladas são concentrados de hemácias conservadas em temperaturas iguais ou inferiores a -65°C (65°C negativos), na presença de um agente crioprotetor. (Origem: PRT MS/GM 158/2016, Art. 92)
§ 1º São agentes crioprotetores: (Origem: PRT MS/GM 158/2016, Art. 92, § 1º)
I - glicerol; e (Origem: PRT MS/GM 158/2016, Art. 92, § 1º, I)
II - amido hidroxilado. (Origem: PRT MS/GM 158/2016, Art. 92, § 1º, II)
§ 2º O glicerol será removido por meio de lavagem, depois que as hemácias forem descongeladas, caso seja o agente crioprotetor utilizado. (Origem: PRT MS/GM 158/2016, Art. 92, § 2º)
§ 3º As hemácias conservadas sem solução aditiva serão congeladas dentro do período de até 6 (seis) dias depois da coleta do sangue, exceto quando forem rejuvenescidas. (Origem: PRT MS/GM 158/2016, Art. 92, § 3º)
§ 4º As unidades raras de concentrado de hemácias poderão ser congeladas sem rejuvenescimento até a data do vencimento. (Origem: PRT MS/GM 158/2016, Art. 92, § 4º)
§ 5º As hemácias processadas com solução aditiva serão congeladas antes da data de vencimento do concentrado de hemácias. (Origem: PRT MS/GM 158/2016, Art. 92, § 5º)
§ 6º A bolsa de concentrado de hemácias deverá ser aberta sob fluxo laminar e armazenada no congelador até o período máximo de 4 (quatro) horas após a abertura do circuito para a inclusão do glicerol. (Origem: PRT MS/GM 158/2016, Art. 92, § 6º)
§ 7º O método de deglicerolização assegurará: (Origem: PRT MS/GM 158/2016, Art. 92, § 7º)
I - a remoção adequada do glicerol; (Origem: PRT MS/GM 158/2016, Art. 92, § 7º, I)
II - o nível de hemoglobina livre na solução sobrenadante inferior a 0,2 g por unidade; e (Origem: PRT MS/GM 158/2016, Art. 92, § 7º, II)
III - a recuperação de, pelo menos, 80% dos glóbulos vermelhos originalmente presentes na unidade. (Origem: PRT MS/GM 158/2016, Art. 92, § 7º, III)
§ 8º Na preparação do componente final destinado à transfusão, o tubo conectado à bolsa será preenchido com uma alíquota do componente, de forma que haja hemácias disponíveis para subsequentes provas de compatibilidade. (Origem: PRT MS/GM 158/2016, Art. 92, § 8º)
§ 9º A validade dos concentrados de hemácias congeladas é de 10 (dez) anos, contados da data da doação do sangue. (Origem: PRT MS/GM 158/2016, Art. 92, § 9º)
§ 10. Após o descongelamento, as hemácias devem ser usadas em até 24 (vinte quatro) horas se a deglicerolização for realizada em sistema aberto ou 14 (quatorze) dias se em sistema fechado, devendo sempre ser conservadas a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 92, § 10)
Art. 93. As hemácias rejuvenescidas são as hemácias tratadas por um método que restabeleça os níveis normais de 2,3 DPG e ATP. (Origem: PRT MS/GM 158/2016, Art. 93)
§ 1º Depois de rejuvenescidos, os concentrados de hemácias serão lavados e transfundidos dentro de 24 (vinte e quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 93, § 1º)
§ 2º Os rótulos indicarão a utilização de soluções de rejuvenescimento. (Origem: PRT MS/GM 158/2016, Art. 93, § 2º)
Art. 94. Os componentes plasmáticos serão produzidos utilizando-se os critérios técnicos definidos neste Anexo e são definidos como: (Origem: PRT MS/GM 158/2016, Art. 94)
I - plasma fresco congelado (PFC); (Origem: PRT MS/GM 158/2016, Art. 94, I)
II - plasma fresco congelado dentro de 24 (vinte quatro) horas (PFC24); (Origem: PRT MS/GM 158/2016, Art. 94, II)
III - plasma isento do crioprecipitado (PIC); (Origem: PRT MS/GM 158/2016, Art. 94, III)
IV - plasma comum, não fresco, normal ou simples (PC); e (Origem: PRT MS/GM 158/2016, Art. 94, IV)
V - crioprecipitado (CRIO). (Origem: PRT MS/GM 158/2016, Art. 94, V)
Art. 95. O PFC é o plasma separado de uma unidade de sangue total por centrifugação ou por aférese e congelado completamente em até 8 (oito) horas depois da coleta, atingindo temperaturas iguais ou inferiores a -30ºC (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 95)
§ 1º O tempo máximo para a separação do plasma de que trata o "caput" é de 6 (seis) horas depois da coleta. (Origem: PRT MS/GM 158/2016, Art. 95, § 1º)
§ 2º O PFC será armazenado à temperatura de, no mínimo, - 20°C (vinte graus Celsius negativos), sendo, porém, recomendada a temperatura igual ou inferior a -30°C (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 95, § 2º)
§ 3º Quando for utilizada a técnica de congelamento em banho de imersão em álcool, a bolsa plástica de plasma será protegida de alteração química, derrames e contaminação. (Origem: PRT MS/GM 158/2016, Art. 95, § 3º)
§ 4º O PFC tem, a partir da data da doação, a validade de: (Origem: PRT MS/GM 158/2016, Art. 95, § 4º)
I - 12 (doze) meses, se armazenado em temperatura entre -20°C (vinte graus Celsius negativos) e -30°C (trinta graus Celsius negativos); e (Origem: PRT MS/GM 158/2016, Art. 95, § 4º, I)
II - 24 (vinte quatro) meses, se armazenado à temperatura de -30°C (trinta graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 95, § 4º, II)
Art. 96. PFC24 é o plasma separado de uma unidade de sangue total por centrifugação e congelado completamente entre 8 (oito) e 24 (vinte quatro) horas após a coleta, atingindo temperaturas iguais ou inferiores a -30°C (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 96)
§ 1º O tempo máximo para a separação de que trata o "caput" é de 18 (dezoito) horas depois da coleta se a unidade de sangue total for mantida refrigerada (4 ± 2 °C). (Origem: PRT MS/GM 158/2016, Art. 96, § 1º)
§ 2º No caso do sangue total ser rapidamente resfriado logo após a coleta até a temperatura de 22 ± 2 °C, utilizando-se sistemas especiais validados de refrigeração, o tempo máximo para o congelamento é de 24 (vinte quatro) horas depois da coleta. (Origem: PRT MS/GM 158/2016, Art. 96, § 2º)
§ 3º O PFC24 deve ser armazenado à temperatura de, no mínimo, -20°C (vinte graus Celsius negativos), sendo, porém, recomendada a temperatura igual ou inferior a -30°C (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 96, § 3º)
§ 4º O PFC24 tem, a partir da data da doação, a validade de: (Origem: PRT MS/GM 158/2016, Art. 96, § 4º)
I - 12 (doze) meses, se armazenado em temperatura entre - 20°C (vinte graus Celsius negativos) e -30°C (trinta graus Celsius negativos); e (Origem: PRT MS/GM 158/2016, Art. 96, § 4º, I)
II - 24 (vinte e quatro) meses, se armazenado à temperatura de -30°C (trinta graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 96, § 4º, II)
Art. 97. Os PFC e PFC24 podem ser utilizados em pacientes para fins terapêuticos com o objetivo de reposição de fatores de coagulação deficientes (deficiências múltiplas ou específicas na ausência do fator purificado). (Origem: PRT MS/GM 158/2016, Art. 97)
Art. 98. O PIC é o plasma do qual foi retirado, em sistema fechado, o crioprecipitado. (Origem: PRT MS/GM 158/2016, Art. 98)
§ 1º O PIC tem, a partir da data da doação, a validade de 12 (doze) meses a partir da coleta, devendo ser armazenado à temperatura de -20°C (vinte graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 98, § 1º)
§ 2º A Púrpura Trombocitopênica Trombótica (PTT) é a única indicação clínica possível para o PIC. (Origem: PRT MS/GM 158/2016, Art. 98, § 2º)
Art. 99. O PC é o plasma cujo congelamento não se deu dentro das especificações técnicas assinaladas nos arts. 95 e 96 do Anexo IV , ou, ainda, resultado da transformação de um PFC, de um PFC24 ou de um PIC cujo período de validade expirou. (Origem: PRT MS/GM 158/2016, Art. 99)
§ 1º O PC será armazenado em temperatura igual ou inferior a -20°C (vinte graus Celsius negativos), e tem a validade de 5 (cinco) anos a partir da data de coleta. (Origem: PRT MS/GM 158/2016, Art. 99, § 1º)
§ 2º O PC não pode ser utilizado para transfusão, devendo ser exclusivamente destinado à produção de hemoderivados. (Origem: PRT MS/GM 158/2016, Art. 99, § 2º)
Art. 100. Os PFC, PFC24 e PIC a serem utilizados exclusivamente com finalidade terapêutica poderão ser mantidos em temperatura igual ou inferior a -18°C (dezoito graus Celsius negativos), por até 12 (doze) meses, sendo este o prazo de validade. (Origem: PRT MS/GM 158/2016, Art. 100)
Art. 101. O plasma excedente do uso terapêutico, considerado a ser destinado para fracionamento industrial, deve ser armazenado em temperatura igual ou inferior a -20°C (vinte graus Celsius negativos), observando, ainda, demais determinações deste Anexo. (Origem: PRT MS/GM 158/2016, Art. 101)
Art. 102. O CRIO é a fração de plasma insolúvel em frio, obtida a partir do plasma fresco congelado, contendo glicoproteínas de alto peso molecular, principalmente fator VIII, fator de von Willebrand, fator XIII e fibrinogênio. (Origem: PRT MS/GM 158/2016, Art. 102)
§ 1º Para a obtenção do CRIO, o PFC deve ser descongelado a 4 ± 2 °C e imediatamente centrifugado nessa mesma temperatura. (Origem: PRT MS/GM 158/2016, Art. 102, § 1º)
§ 2º O sobrenadante pobre em crioprecipitado (plasma isento de crioprecipitado) deve ser extraído, em circuito fechado, permanecendo um volume de até 40 mL junto ao material insolúvel em frio. (Origem: PRT MS/GM 158/2016, Art. 102, § 2º)
§ 3º O crioprecipitado resultante deve ser recongelado em até 1(uma) hora após a sua obtenção. (Origem: PRT MS/GM 158/2016, Art. 102, § 3º)
§ 4º O produto final deve conter, no mínimo, 150mg de fibrinogênio por unidade em, pelo menos, 75% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 102, § 4º)
§ 5º O CRIO tem, a partir da data da doação, a validade de: (Origem: PRT MS/GM 158/2016, Art. 102, § 5º)
I - 12 (doze) meses, se armazenado em temperatura entre - 20°C (vinte graus Celsius negativos) e -30°C (trinta graus Celsius negativos); e (Origem: PRT MS/GM 158/2016, Art. 102, § 5º, I)
II - 24 (vinte e quatro) meses, se armazenado à temperatura de -30°C (trinta graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 102, § 5º, II)
§ 6º O CRIO pode ser indicado a portadores de deficiência de fibrinogênio (quantitativa ou qualitativa) e na deficiência de fator XIII, quando o fator purificado não estiver disponível. (Origem: PRT MS/GM 158/2016, Art. 102, § 6º)
§ 7º O crioprecipitado também pode ser utilizado na produção de cola de fibrina. (Origem: PRT MS/GM 158/2016, Art. 102, § 7º)
Art. 103. O tubo coletor da bolsa do plasma deve estar totalmente preenchido e ter uma extensão mínima de 15 cm (quinze centímetros) e máxima de 20 cm (vinte centímetros) entre as duas soldaduras, uma proximal e uma distal. (Origem: PRT MS/GM 158/2016, Art. 103)
Art. 104. A ocorrência de uso excepcional de crioprecipitado em pacientes hemofílicos e portadores de doença de Von Willebrand deve ser imediatamente relatada à CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 158/2016, Art. 104)
Art. 105. A realização de procedimento de plasmaférese para obtenção de insumos para indústria de hemoderivados é atividade exclusiva dos serviços de hemoterapia públicos. (Origem: PRT MS/GM 158/2016, Art. 105)
§ 1º Os serviços de hemoterapia que forem fornecedores na modalidade de que trata o "caput" solicitarão autorização à CGSH/DAET/SAS/MS para realização do procedimento e envio do plasma para a indústria. (Origem: PRT MS/GM 158/2016, Art. 105, § 1º)
§ 2º Serão observados, ainda, os critérios estabelecidos na Seção IX do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 105, § 2º)
§ 3º O envio do plasma para indústria deve obedecer aos requisitos definidos no Anexo 11 do Anexo IV e demais determinações deste Anexo. (Origem: PRT MS/GM 158/2016, Art. 105, § 3º)
§ 4º Somente plantas de produção de hemoderivados nacional de natureza pública receberão o plasma dos serviços de hemoterapia brasileiros obtido por plasmaférese, obedecendo, ainda, o estabelecido na Seção VI do Capítulo II do Título II. (Origem: PRT MS/GM 158/2016, Art. 105, § 4º)
§ 5º A plasmaférese para uso terapêutico obedecerá ao disposto na Seção IX do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 105, § 5º)
Art. 106. Quando o serviço de hemoterapia for fornecedor de PFC, PFC24 ou PC como matéria prima para a indústria de hemoderivados serão observadas as normas técnico-sanitárias específicas para a produção e armazenamento do plasma, sem prejuízo das normas estabelecidas neste Anexo. (Origem: PRT MS/GM 158/2016, Art. 106)
Art. 107. Os Concentrados de Plaquetas (CP) serão produzidos utilizando critérios técnicos definidos neste Anexo e são definidos como: (Origem: PRT MS/GM 158/2016, Art. 108)
I - CP obtido de sangue total; (Origem: PRT MS/GM 158/2016, Art. 108, I)
II - CP obtido por aférese; (Origem: PRT MS/GM 158/2016, Art. 108, II)
III - CP desleucocitados; e (Origem: PRT MS/GM 158/2016, Art. 108, III)
IV - Pool de plaquetas. (Origem: PRT MS/GM 158/2016, Art. 108, IV)
§ 1º O CP obtido a partir do sangue total é uma suspensão de plaquetas em plasma, preparado mediante dupla centrifugação de uma unidade de sangue total, coletada em tempo não maior que 15 (quinze) minutos e preferencialmente em até 12 (doze) minutos. (Origem: PRT MS/GM 158/2016, Art. 108, § 1º)
§ 2º O CP também pode ser obtido por aférese. (Origem: PRT MS/GM 158/2016, Art. 108, § 2º)
§ 3º As unidades com agregados plaquetários grosseiramente visíveis não serão empregadas na transfusão. (Origem: PRT MS/GM 158/2016, Art. 108, § 3º)
§ 4º Os CP devem ser conservados a 22 ± 2 oC, sob agitação constante em agitador próprio para este fim. (Origem: PRT MS/GM 158/2016, Art. 108, § 4º)
§ 5º A validade dos CP é de 3 (três) a 5 (cinco) dias, dependendo do plastificante da bolsa de conservação. (Origem: PRT MS/GM 158/2016, Art. 108, § 5º)
§ 6º As indicações de transfusão de CP levarão em consideração não somente a contagem, mas também: (Origem: PRT MS/GM 158/2016, Art. 108, § 6º)
I - a existência de fatores de risco; (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, I)
II - a realização de procedimentos invasivos; (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, II)
III - a presença de sangramentos clinicamente significativos; e (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, III)
IV - alterações da função plaquetária. (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, IV)
Art. 108. Os CPs obtidos de sangue total conterão, no mínimo, 5,5 x 10e10 plaquetas por bolsa em, pelo menos, 75% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 109)
§ 1º As plaquetas devem estar suspensas em volume suficiente de plasma (40 a 70 mL), de tal maneira que o pH seja maior ou igual a 6,4 no último dia de validade do produto. (Origem: PRT MS/GM 158/2016, Art. 109, § 1º)
§ 2º Os CP obtidos de sangue total podem ser produzidos a partir: (Origem: PRT MS/GM 158/2016, Art. 109, § 2º)
I - de plasma rico em plaquetas; ou (Origem: PRT MS/GM 158/2016, Art. 109, § 2º, I)
II - da camada leucoplaquetária de sangue total, que apresenta contaminação leucocitária menor. (Origem: PRT MS/GM 158/2016, Art. 109, § 2º, II)
§ 3º A produção do plasma rico em plaquetas ou da camada leucoplaquetária e dos respectivos CP poderá ser realizada até 24 (vinte e quatro) horas após a coleta se o sangue total for mantido em condições validadas para manter a temperatura de 22 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 109, § 3º)
§ 4º A quantidade de plaquetas em uma dose padrão para indivíduos adultos é equivalente a quantidade obtida a partir de 4 (quatro) a 6 (seis) unidades de sangue total. (Origem: PRT MS/GM 158/2016, Art. 109, § 4º)
Art. 109. O CP obtido por aférese, de um único doador, deve conter, no mínimo, 3,0 x 10e11 plaquetas em, pelo menos, 90% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 110)
§ 1º No caso de obtenção de componentes duplos, a contagem deve ser superior ou igual a 6,0 x 10e11 plaquetas em, pelo menos, 90% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 110, § 1º)
§ 2º As plaquetas obtidas mediante procedimentos de aférese em circuito fechado têm validade de até 5 (cinco) dias e exigem as mesmas condições de conservação que as plaquetas de sangue total. (Origem: PRT MS/GM 158/2016, Art. 110, § 2º)
§ 3º O componente de que trata o "caput" caracteriza-se por uma baixa contaminação leucocitária. (Origem: PRT MS/GM 158/2016, Art. 110, § 3º)
Art. 110. Os CP desleucocitados são obtidos pela remoção de leucócitos por meio de filtros para este fim ou por meio de equipamento de aférese. (Origem: PRT MS/GM 158/2016, Art. 111)
§ 1º O pool de CP desleucocitado, obtido de sangue total, deve conter menos que 5,0 x 10e6 leucócitos ou cada unidade deve conter abaixo de 0,83 x 10e6 leucócitos. (Origem: PRT MS/GM 158/2016, Art. 111, § 1º)
§ 2º O CP obtido por aférese deve preencher o mesmo requisito definido para o pool de concentrado de plaquetas. (Origem: PRT MS/GM 158/2016, Art. 111, § 2º)
§ 3º A validade do CP obtido por aférese é de 4 (quatro) horas, quando preparado em sistema aberto. (Origem: PRT MS/GM 158/2016, Art. 111, § 3º)
§ 4º Se a preparação do CP obtido por aférese ocorrer em sistema fechado, a unidade conserva a validade original do concentrado de plaquetas, desde que a bolsa utilizada para armazenamento seja compatível com o volume. (Origem: PRT MS/GM 158/2016, Art. 111, § 4º)
§ 5º O CP obtido por aférese será utilizado em pacientes que possuam antecedentes de reação febril não hemolítica ou quando estiver indicada a profilaxia da aloimunização a antígenos leucocitários. (Origem: PRT MS/GM 158/2016, Art. 111, § 5º)
§ 6º O CP obtido por aférese pode ser utilizado como alternativa para evitar a transmissão de Citomegalovirus (CMV) em substituição a componentes soronegativos para CMV. (Origem: PRT MS/GM 158/2016, Art. 111, § 6º)
Art. 111. O pool de concentrados de plaquetas obtidos de sangue total é um produto que pode ser separado a partir de concentrados de plaquetas randômicos preparados pelo plasma rico em plaquetas ou a partir de pool de camada leucoplaquetária (buffy coat). (Origem: PRT MS/GM 158/2016, Art. 112)
Art. 112. Os Concentrados de Granulócitos (CG) são suspensões de granulócitos em plasma, obtidas por aférese de doador único. (Origem: PRT MS/GM 158/2016, Art. 113)
§ 1º O CG deve conter, no mínimo, 1,0 x 10e10 granulócitos em todas as unidades coletadas, a menos que seja preparado para recém-nascidos. (Origem: PRT MS/GM 158/2016, Art. 113, § 1º)
§ 2º A validade do CG é de 24 (vinte quatro) horas, devendo ser administrado o mais rapidamente possível depois que a sua coleta for concluída, obrigatoriamente em ambiente hospitalar. (Origem: PRT MS/GM 158/2016, Art. 113, § 2º)
§ 3º A temperatura de conservação do CG é de 22 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 113, § 3º)
§ 4º A indicação terapêutica do CG restringe-se a pacientes gravemente neutropênicos com infecção comprovada, refratários à terapêutica antimicrobiana adequada. (Origem: PRT MS/GM 158/2016, Art. 113, § 4º)
Art. 113. Os componentes sanguíneos irradiados são componentes celulares que devem ser produzidos utilizando-se procedimentos que garantam que a irradiação tenha ocorrido e que a dose mínima tenha sido de 25 Gy (2.500 cGy) sobre o plano médio da unidade irradiada. (Origem: PRT MS/GM 158/2016, Art. 114)
§ 1º A dose em qualquer ponto do componente de que trata o "caput" não deve ser inferior a 15 Gy (1.500 cGy) e nem superior a 50 Gy (5.000 cGy). (Origem: PRT MS/GM 158/2016, Art. 114, § 1º)
§ 2º O procedimento de que trata o § 1º tem como objetivo inativar funcionalmente linfócitos viáveis dos produtos sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 114, § 2º)
§ 3º As unidades irradiadas devem ser adequadamente rotuladas e identificadas e o processo de irradiação deve ser validado periodicamente. (Origem: PRT MS/GM 158/2016, Art. 114, § 3º)
§ 4º A irradiação será feita em irradiador de células próprio para irradiação de sangue e componentes. (Origem: PRT MS/GM 158/2016, Art. 114, § 4º)
§ 5º Quando o aparelho de que trata o § 4º não estiver disponível, a irradiação poderá ser feita em acelerador linear usado para tratamento de radioterapia, sob supervisão de profissional qualificado. (Origem: PRT MS/GM 158/2016, Art. 114, § 5º)
§ 6º O controle de qualidade da fonte radioativa do equipamento de que trata o § 4º deve ser realizado e documentado, no mínimo anualmente. (Origem: PRT MS/GM 158/2016, Art. 114, § 6º)
§ 7º A irradiação pode ser realizada no próprio serviço de hemoterapia ou em centros contratados. (Origem: PRT MS/GM 158/2016, Art. 114, § 7º)
§ 8º A validade dos componentes celulares irradiados difere pela lesão de membrana, portanto, o concentrado de hemácias irradiado deve, preferencialmente, ser produzido até 14 (quatorze) dias após a coleta e obrigatoriamente armazenado até no máximo 28 (vinte oito) dias após a irradiação observando a data de validade original do componente. (Origem: PRT MS/GM 158/2016, Art. 114, § 8º)
§ 9º Nos casos em que exista justificativa para a irradiação de componentes com mais de 14 (quatorze) dias de coleta, a transfusão deve ocorrer em 48 (quarenta e oito) horas. (Origem: PRT MS/GM 158/2016, Art. 114, § 9º)
§ 10. O concentrado de hemácias irradiado para uso em transfusão intrauterina ou transfusão neonatal maciça deve ser utilizado até no máximo 24 (vinte e quatro) horas da irradiação e 5 (cinco) dias após a data da coleta. (Origem: PRT MS/GM 158/2016, Art. 114, § 10)
§ 11. A indicação de componentes celulares irradiados tem como objetivo reduzir o risco de Doença do Enxerto Contra Hospedeiro associada à Transfusão (DECH-AT), em situações como: (Origem: PRT MS/GM 158/2016, Art. 114, § 11)
I - transfusão intrauterina; (Origem: PRT MS/GM 158/2016, Art. 114, § 11, I)
II - recém-nascidos de baixo peso (inferior a 1.200 g) e/ou prematuros (inferior a 28 (vinte e oito) semanas); (Origem: PRT MS/GM 158/2016, Art. 114, § 11, II)
III - portadores de imunodeficiências congênitas graves; (Origem: PRT MS/GM 158/2016, Art. 114, § 11, III)
IV - pacientes recebendo terapia imunossupressora como pós transplante de medula óssea; (Origem: PRT MS/GM 158/2016, Art. 114, § 11, IV)
V - transfusão de componentes HLA compatíveis; e (Origem: PRT MS/GM 158/2016, Art. 114, § 11, V)
VI - quando o receptor for parente em primeiro grau do doador. (Origem: PRT MS/GM 158/2016, Art. 114, § 11, VI)
§ 12. Nas demais situações clínicas não abrangidas no § 11, a decisão de irradiar os componentes ficará sujeita à avaliação e protocolos de cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 114, § 12)
Art. 114. Os CP e os concentrados de granulócitos irradiados mantêm as suas datas de validade original. (Origem: PRT MS/GM 158/2016, Art. 115)
Seção V
Do Controle de Qualidade dos Componentes Sanguíneos
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção V)
Art. 115. Os serviços de hemoterapia realizarão o controle de qualidade sistemático de todos os tipos de componentes sanguíneos que produzirem. (Origem: PRT MS/GM 158/2016, Art. 116)
§ 1º O controle de qualidade dos concentrados de hemácias e dos concentrados de plaquetas deve ser realizado em, pelo menos, 1% da produção ou 10 (dez) unidades por mês, o que for maior. (Origem: PRT MS/GM 158/2016, Art. 116, § 1º)
§ 2º O controle de qualidade dos plasmas e dos crioprecipitados deve ser feito em amostragem definida no Anexo 6 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 116, § 2º)
§ 3º O serviço de hemoterapia deve ter protocolos escritos, definindo: (Origem: PRT MS/GM 158/2016, Art. 116, § 3º)
I - o tipo de controle a ser feito em cada componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 116, § 3º, I)
II - a amostragem; e (Origem: PRT MS/GM 158/2016, Art. 116, § 3º, II)
III - os parâmetros mínimos esperados para cada item controlado. (Origem: PRT MS/GM 158/2016, Art. 116, § 3º, III)
§ 4º Cada item verificado pelo controle de qualidade deve apresentar um percentual de conformidade igual ou superior a 75%. (Origem: PRT MS/GM 158/2016, Art. 116, § 4º)
§ 5º Com relação à produção de concentrado de plaquetas por aférese e contagem de leucócitos em componentes celulares desleucocitados a conformidade considerada deve ser igual ou superior a 90%. (Origem: PRT MS/GM 158/2016, Art. 116, § 5º)
§ 6º A avaliação da contaminação microbiológica dos componentes sanguíneos celulares será realizada utilizando-se amostragem igual ou superior a 1% da produção ou 10 (dez) unidades por mês, o que for maior. (Origem: PRT MS/GM 158/2016, Art. 116, § 6º)
§ 7º Na hipótese do § 6º, todos os casos positivos devem ser devidamente investigados na busca de uma causa corrigível. (Origem: PRT MS/GM 158/2016, Art. 116, § 7º)
§ 8º Pelo alto risco de contaminação microbiológica dos concentrados de plaquetas pela sua condição de armazenamento, recomenda-se realização de avaliação de contaminação microbiológica em 100% desta produção. (Origem: PRT MS/GM 158/2016, Art. 116, § 8º)
§ 9º Serão observados os parâmetros mínimos a serem verificados em cada componente sanguíneo, nos termos do Anexo 6 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 116, § 9º)
Art. 116. Os serviços de hemoterapia realizarão avaliações periódicas dos resultados do controle de qualidade, de forma que tais resultados sejam revisados e analisados, e ações corretivas sejam propostas para as não conformidades observadas. (Origem: PRT MS/GM 158/2016, Art. 117)
Seção VI
Dos Exames de Qualificação no Sangue do Doador
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção VI)
Art. 117. O serviço de hemoterapia realizará os seguintes exames imuno-hematológicos para qualificação do sangue do doador, a fim de garantir a eficácia terapêutica e a segurança da futura doação: (Origem: PRT MS/GM 158/2016, Art. 118)
I - tipagem ABO; (Origem: PRT MS/GM 158/2016, Art. 118, I)
II - tipagem RhD; e (Origem: PRT MS/GM 158/2016, Art. 118, II)
III - pesquisa de anticorpos antieritrocitários irregulares. (Origem: PRT MS/GM 158/2016, Art. 118, III)
Art. 118. A tipagem ABO será realizada testando-se as hemácias com reagentes anti-A, anti-B e anti-AB, sendo que, no caso de serem usados antissoros monoclonais, a utilização do soro anti-AB não é obrigatória. (Origem: PRT MS/GM 158/2016, Art. 119)
§ 1º A tipagem reversa deve ser sempre realizada, testando-se o soro ou plasma de amostra da doação com suspensões de hemácias conhecidas A1 e B e, opcionalmente, A2 e O. (Origem: PRT MS/GM 158/2016, Art. 119, § 1º)
§ 2º Nenhum componente sanguíneo será rotulado e liberado para utilização até que qualquer discrepância entre a tipagem direta e reversa tenha sido resolvida. (Origem: PRT MS/GM 158/2016, Art. 119, § 2º)
Art. 119. O antígeno RhD será determinado colocando-se as hemácias com antissoro anti-RhD (Anti-D). (Origem: PRT MS/GM 158/2016, Art. 120)
§ 1º Paralelamente ao procedimento previsto no "caput" deve ser sempre efetuado um controle da tipagem RhD, utilizando-se soro-controle compatível com o antissoro utilizado e do mesmo fabricante do anti-D. (Origem: PRT MS/GM 158/2016, Art. 120, § 1º)
§ 2º No caso de utilização de antissoros anti-D produzido em meio salino, o uso do soro-controle na reação é dispensável. (Origem: PRT MS/GM 158/2016, Art. 120, § 2º)
§ 3º Se a reação for negativa para a presença do antígeno RhD, será efetuada a pesquisa do antígeno D-fraco. (Origem: PRT MS/GM 158/2016, Art. 120, § 3º)
§ 4º Para a realização da pesquisa de antígeno D-fraco, recomenda-se a utilização de, no mínimo, dois antissoros anti-RhD (anti-D), sendo que, pelo menos um desses antissoros contenha anticorpos da classe IgG. (Origem: PRT MS/GM 158/2016, Art. 120, § 4º)
§ 5º Os antissoros de que trata o § 4º devem ser obtidos de linhagens celulares distintas incluindo a fase da antiglobulina humana. (Origem: PRT MS/GM 158/2016, Art. 120, § 5º)
§ 6º Quando a tipagem RhD ou a pesquisa do antígeno D-fraco resultar positiva, o sangue deve ser rotulado como "RhD positivo". (Origem: PRT MS/GM 158/2016, Art. 120, § 6º)
§ 7º Quando ambas as provas de que trata o § 4º resultarem negativas, o sangue deve ser rotulado como "RhD negativo". (Origem: PRT MS/GM 158/2016, Art. 120, § 7º)
§ 8º Em doadores de sangue tipados como RhD negativo, recomenda-se a pesquisa dos antígenos C (maiúsculo) e E (maiúsculo) e os componentes sanguíneos devem ser devidamente identificados. (Origem: PRT MS/GM 158/2016, Art. 120, § 8º)
§ 9º A utilização dos concentrados de hemácias RhD negativo C ou E positivos deve obedecer a protocolos escritos específicos da instituição ou seguir critérios do responsável técnico de cada local. (Origem: PRT MS/GM 158/2016, Art. 120, § 9º)
§ 10. Se a reação com o soro-controle de RhD for positiva, a tipagem RhD é considerada inválida e o componente sanguíneo só deve ser rotulado e liberado para uso após a resolução do problema. (Origem: PRT MS/GM 158/2016, Art. 120, § 10)
Art. 120. O registro de uma tipagem ABO e RhD prévia de um doador não serve para a identificação das unidades de sangue subsequentemente doadas pelo mesmo doador. (Origem: PRT MS/GM 158/2016, Art. 121)
§ 1º Novas determinações devem ser realizadas a cada doação. (Origem: PRT MS/GM 158/2016, Art. 121, § 1º)
§ 2º Em caso de doações prévias, deve ser comparada a tipagem ABO e RhD com o último registro disponível. (Origem: PRT MS/GM 158/2016, Art. 121, § 2º)
§ 3º Qualquer discrepância nos resultados das tipagens sanguíneas de que trata o "caput" será resolvida antes de se rotular e liberar para uso os componentes sanguíneos produzidos. (Origem: PRT MS/GM 158/2016, Art. 121, § 3º)
Art. 121. Deve ser realizada no sangue dos doadores a pesquisa de anticorpos antieritrocitários irregulares, empregando-se métodos que evidenciem a presença de anticorpos clinicamente significativos. (Origem: PRT MS/GM 158/2016, Art. 122)
§ 1º Os componentes sanguíneos que contenham anticorpos antieritrocitários irregulares devem ser rotulados como tais. (Origem: PRT MS/GM 158/2016, Art. 122, § 1º)
§ 2º As condições e situações nas quais os componentes de que trata o § 1º podem ser utilizados ficarão a critério do responsável técnico de cada local, sendo, porém, recomendável que os componentes plasmáticos e os concentrados de plaquetas não sejam utilizados para transfusão. (Origem: PRT MS/GM 158/2016, Art. 122, § 2º)
Art. 122. É recomendada a realização do teste de hemolisina para transfusões de plaquetas não isogrupo utilizando-se um método qualitativo com incubação a 37ºC (trinta e sete graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 123)
Parágrafo Único. Componentes sanguíneos com resultados de hemólise total ou parcial devem ser evitados em transfusões não isogrupo. (Origem: PRT MS/GM 158/2016, Art. 123, Parágrafo Único)
Art. 123. É recomendada a realização da fenotipagem de antígenos eritrocitários dos sistemas Rh (D, C, c, E, e) e Kell (K1) nas amostras de sangue de doadores, conforme as demandas do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 124)
Art. 124. É recomendada a realização da investigação de subgrupo de A em doadores de sangue, quando houver resultados discrepantes entre as provas ABO direta e reversa ou na busca de concentrado de hemácias de subgrupo A2 para pacientes que apresentam anticorpo anti-A1 clinicamente significante. (Origem: PRT MS/GM 158/2016, Art. 125)
Art. 125. Os testes de que tratam os arts. 118, 119, 120, 121, 122 e 123 do Anexo IV devem ser realizados em laboratórios cuja rotina seja adequada para triagem imuno-hematológica de doadores de sangue, com reagentes registrados ou autorizados pela ANVISA. (Origem: PRT MS/GM 158/2016, Art. 126)
Art. 126. Será realizado o controle de qualidade de reagentes em imuno-hematologia. (Origem: PRT MS/GM 158/2016, Art. 127)
§ 1º Os reagentes devem ser armazenados de acordo com as instruções do fabricante, devendo ser evitada, ao máximo, a permanência do reagente fora das temperaturas indicadas para seu armazenamento. (Origem: PRT MS/GM 158/2016, Art. 127, § 1º)
§ 2º O serviço de hemoterapia realizará controles de qualidade em cada lote e remessa recebidos para comprovar que os reagentes estão dentro dos padrões estabelecidos e que não foram alterados durante o transporte. (Origem: PRT MS/GM 158/2016, Art. 127, § 2º)
§ 3º Para as análises do controle de qualidade, recomenda-se seguir os padrões presentes no Anexo 7 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 127, § 3º)
§ 4º No caso de antissoros de origem monoclonal, é indispensável a identificação na bula, do clone celular utilizado para produção pelo fabricante. (Origem: PRT MS/GM 158/2016, Art. 127, § 4º)
§ 5º Serão verificadas, periodicamente, possíveis alterações durante a manipulação ou armazenamento dos reagentes no serviço de hemoterapia, utilizando protocolos definidos pelo serviço. (Origem: PRT MS/GM 158/2016, Art. 127, § 5º)
§ 6º Os resultados dos controles devem ser registrados para acompanhamento do desempenho dos produtos. (Origem: PRT MS/GM 158/2016, Art. 127, § 6º)
§ 7º Serão estabelecidas medidas corretivas quando forem detectadas anormalidades no processo do controle de qualidade em imuno-hematologia. (Origem: PRT MS/GM 158/2016, Art. 127, § 7º)
Art. 127. Será realizado, ainda, o controle de qualidade das técnicas empregadas, utilizando-se sistematicamente e durante o procedimento técnico, controles negativos e positivos para confirmar os resultados obtidos. (Origem: PRT MS/GM 158/2016, Art. 128)
Art. 128. O serviço de hemoterapia realizará testes para infecções transmissíveis pelo sangue, a fim de reduzir riscos de transmissão de doenças e em prol da qualidade do sangue doado. (Origem: PRT MS/GM 158/2016, Art. 129)
Art. 129. É obrigatória a realização de exames laboratoriais de alta sensibilidade a cada doação, para detecção de marcadores para as seguintes infecções transmissíveis pelo sangue, cumprindo-se ainda, os algoritmos descritos no Anexo 5 do Anexo IV para cada marcador: (Origem: PRT MS/GM 158/2016, Art. 130)
I - sífilis; (Origem: PRT MS/GM 158/2016, Art. 130, I)
II - doença de Chagas; (Origem: PRT MS/GM 158/2016, Art. 130, II)
III - hepatite B; (Origem: PRT MS/GM 158/2016, Art. 130, III)
IV - hepatite C; (Origem: PRT MS/GM 158/2016, Art. 130, IV)
V - AIDS; e (Origem: PRT MS/GM 158/2016, Art. 130, V)
VI - HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 130, VI)
§ 1º Os exames de que trata o "caput" devem ser feitos em amostra colhida no ato da doação. (Origem: PRT MS/GM 158/2016, Art. 130, § 1º)
§ 2º Os exames serão realizados em laboratórios específicos para triagem laboratorial de doadores de sangue, com conjuntos diagnósticos (kits) próprios para esta finalidade, registrados na ANVISA. (Origem: PRT MS/GM 158/2016, Art. 130, § 2º)
§ 3º Fica vedada a realização de exames sorológicos em pool de amostras de sangue. (Origem: PRT MS/GM 158/2016, Art. 130, § 3º)
§ 4º É permitido o emprego de pool de amostras para testes de pesquisa de ácido nucléicos (NAT) para detecção de infecções transmissíveis pelo sangue. (Origem: PRT MS/GM 158/2016, Art. 130, § 4º)
§ 5º O sangue total e seus componentes não serão transfundidos antes da obtenção de resultados finais não reagentes/negativos, nos testes de detecção para: (Origem: PRT MS/GM 158/2016, Art. 130, § 5º)
I - hepatite B; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, I)
II - hepatite C; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, II)
III - AIDS; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, III)
IV - doença de Chagas; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, IV)
V - sífilis; e (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, V)
VI - infecção por HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, VI)
§ 6º São os testes para detecção de hepatite B: (Origem: PRT MS/GM 158/2016, Art. 130, § 6º)
I - detecção do antígeno de superfície do vírus da hepatite B (HBV) - HBsAg; (Origem: PRT MS/GM 158/2016, Art. 130, § 6º, I)
II - detecção de anticorpos contra o capsídeo do HBV - anti- HBc (IgG ou IgG + IgM); e (Origem: PRT MS/GM 158/2016, Art. 130, § 6º, II)
III - detecção de ácido nucleico (NAT) do HBV. (Origem: PRT MS/GM 158/2016, Art. 130, § 6º, III)
§ 7º São os testes para detecção de hepatite C: (Origem: PRT MS/GM 158/2016, Art. 130, § 7º)
I - detecção do anticorpo contra o vírus da hepatite C (HCV) ou detecção combinada de anticorpo + antígeno do HCV; e (Origem: PRT MS/GM 158/2016, Art. 130, § 7º, I)
II - detecção de ácido nucleico (NAT) do HCV. (Origem: PRT MS/GM 158/2016, Art. 130, § 7º, II)
§ 8º São os testes para detecção de AIDS: (Origem: PRT MS/GM 158/2016, Art. 130, § 8º)
I - detecção de anticorpo contra o HIV ou detecção combinada do anticorpo contra o HIV + antígeno p24 do HIV; e (Origem: PRT MS/GM 158/2016, Art. 130, § 8º, I)
II - detecção de ácido nucleico (NAT) do HIV. (Origem: PRT MS/GM 158/2016, Art. 130, § 8º, II)
§ 9º O teste de que trata o inciso I do § 8º incluirá, obrigatoriamente, a pesquisa de anticorpos contra os subtipos 1, 2 e O. (Origem: PRT MS/GM 158/2016, Art. 130, § 9º)
§ 10. O teste para doença de Chagas será por meio da detecção de anticorpo anti-T cruzi por método de ensaio imunoenzimático (EIE) ou quimioiluminescência (QLM). (Origem: PRT MS/GM 158/2016, Art. 130, § 10)
§ 11. O teste para sífilis será por intermédio da detecção de anticorpo anti-treponêmico ou não-treponêmico. (Origem: PRT MS/GM 158/2016, Art. 130, § 11)
§ 12. O teste para infecção por HTLV I/II será mediante a detecção de anticorpo contra o HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 130, § 12)
§ 13. Somente podem ser liberadas as bolsas com resultados não reagentes/negativos tanto para os testes sorológicos quanto para os testes de detecção de ácido nucleico. (Origem: PRT MS/GM 158/2016, Art. 130, § 13)
§ 14. Deverão ser excluídos como doadores, temporária ou definitivamente, e, se necessário, encaminhados a um serviço de referência, os que apresentarem resultados reagentes. (Origem: PRT MS/GM 158/2016, Art. 130, § 14)
§ 15. No caso da realização dos testes NAT em pool, o grupo de amostras que apresentar resultado positivo deve ser desmembrado e suas amostras testadas individualmente para identificação do(s) agente(s) infeccioso(s) em questão, considerando a possibilidade de desmembramento cruzado. (Origem: PRT MS/GM 158/2016, Art. 130, § 15)
§ 16. As bolsas cujas amostras individuais forem positivas ou inconclusivas nos testes NAT ou que tenham resultados discrepantes com os testes sorológicos serão descartadas, e o doador será convocado para repetição dos testes em nova amostra e/ou orientação. (Origem: PRT MS/GM 158/2016, Art. 130, § 16)
§ 17. As amostras de doadores com resultado NAT HIV e/ou HCV negativo em pool e teste sorológico positivo ou inconclusivo serão testadas individualmente pelo teste NAT. (Origem: PRT MS/GM 158/2016, Art. 130, § 17)
§ 18. As amostras de doadores com resultado NAT HBV negativo em pool e teste sorológico HBsAg positivo ou inconclusivo serão testadas individualmente pelo teste NAT. (Origem: PRT MS/GM 158/2016, Art. 130, § 18)
Art. 130. O serviço de hemoterapia realizará exames laboratoriais de alta sensibilidade a cada doação, para detecção de citomegalovírus (CMV) em todas as unidades de sangue ou componentes destinados aos pacientes nas seguintes situações: (Origem: PRT MS/GM 158/2016, Art. 131)
I - submetidos a transplantes de célula progenitora e de órgãos, com sorologia não reagente para CMV; (Origem: PRT MS/GM 158/2016, Art. 131, I)
II - recém-nascidos de mães CMV negativo ou com resultados sorológicos desconhecidos que tenham peso ao nascimento inferior a 1.200g; e (Origem: PRT MS/GM 158/2016, Art. 131, II)
III - transfusão intrauterina. (Origem: PRT MS/GM 158/2016, Art. 131, III)
§ 1º Componentes celulares desleucocitados, segundo definição constante do Anexo 6 do Anexo IV , podem substituir a utilização de componentes soronegativos para CMV. (Origem: PRT MS/GM 158/2016, Art. 131, § 1º)
§ 2º Sempre que a sorologia para CMV for realizada, o resultado constará do rótulo das bolsas de componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 131, § 2º)
Art. 131. Nas regiões endêmicas de malária, com transmissão ativa, independente da incidência parasitária da doença, será realizado teste para detecção do plasmódio ou de antígenos plasmodiais. (Origem: PRT MS/GM 158/2016, Art. 132)
Art. 132. O serviço de hemoterapia que realiza exames para detecção de infecções transmissíveis pelo sangue para qualificação no sangue do doador, participará regularmente de, pelo menos, um programa de controle de qualidade externo (proficiência), realizará controle de qualidade interno e disporá de sistema de garantia da qualidade na realização dos testes. (Origem: PRT MS/GM 158/2016, Art. 133)
Parágrafo Único. O controle de qualidade interno e o sistema de garantia da qualidade compreendem os seguintes itens: (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único)
I - validação de cada lote/remessa de conjunto diagnóstico antes da sua colocação na rotina de trabalho; (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, I)
II - validação das baterias de testes utilizando controles positivos diferentes dos fornecidos pelo fabricante; (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, II)
III - análise periódica dos coeficientes de variação (CV) dos testes de detecção de infecções transmissíveis por transfusão de sangue; (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, III)
IV - qualificação de novos produtos e/ou metodologias por meio da testagem e validação destes em seu serviço de hemoterapia antes da implantação na rotina; e (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, IV)
V - rastreabilidade dos dados. (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, V)
Art. 133. Os laboratórios de triagem de doadores de sangue para infecções passíveis de transmissão sanguínea trabalharão com os tubos primários, colhidos diretamente do doador, até a fase de pipetagem das amostras nas placas ou nos tubos das estantes para a reação. (Origem: PRT MS/GM 158/2016, Art. 134)
Art. 134. Quando os testes de triagem forem reagentes (positivo ou inconclusivo) em um doador de sangue que em doações prévias apresentava testes não reagentes/negativos, o que configura soroconversão ou viragem, o serviço de hemoterapia adotará procedimentos de retrovigilância. (Origem: PRT MS/GM 158/2016, Art. 135)
§ 1º Quando a soroconversão/viragem for detectada pelo teste de detecção de ácido nucleico (NAT) do HIV, HCV e/ou HBV, isoladamente ou em associação com o teste sorológico, não é necessária a realização de testes para confirmação do resultado inicial. (Origem: PRT MS/GM 158/2016, Art. 135, § 1º)
§ 2º Quando a soroconversão/viragem for detectada somente pelo teste sorológico, é necessária a realização de testes com a mesma amostra, para confirmação do resultado inicial, conforme o caso: (Origem: PRT MS/GM 158/2016, Art. 135, § 2º)
I - HBsAg: realizar teste de neutralização, ou 1 (um) segundo teste com reagente de outra origem ou de outro fabricante ou com outra metodologia; (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, I)
II - Anti-HBc: realizar 1 (um) segundo teste com reagente de outra origem ou de outro fabricante ou com outra metodologia; (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, II)
III - Anti-HCV: realizar 1 (um) segundo teste de detecção de anticorpo com reagente de outra origem ou de outro fabricante ou com outra metodologia, ou teste com reagente que detecte de maneira combinada antígeno e anticorpo do HCV; (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, III)
IV - Anti-HIV: realizar 1 (um) segundo teste de detecção de anticorpo ou detecção combinada do anticorpo contra o HIV + antígeno p24 do HIV, com reagente de outra origem ou de outro fabricante ou com outra metodologia; e (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, IV)
V - Anti-HTLV I/II: realizar 1 (um) segundo teste de detecção de anticorpo com reagente de outra origem ou de outro fabricante ou com outra metodologia, ou teste de detecção de ácido nucléico (NAT) do HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, V)
§ 3º Caso o laboratório que realizou os testes de triagem não faça o teste de confirmação de resultado inicial, a mesma amostra será encaminhada a outro laboratório no prazo de 10 (dez) dias úteis para a sua realização ou o processo de retrovigilância será desencadeado mesmo sem a confirmação do resultado inicial. (Origem: PRT MS/GM 158/2016, Art. 135, § 3º)
§ 4º Na hipótese do § 3º, o laboratório que realizar o teste de confirmação de resultado inicial remeterá o resultado do exame ao serviço de hemoterapia no prazo máximo de 30 (trinta) dias. (Origem: PRT MS/GM 158/2016, Art. 135, § 4º)
Art. 135. No caso do teste de confirmação do resultado inicial apontar resultado reagente (positivo ou inconclusivo), o serviço de hemoterapia verificará o destino de todos os componentes sanguíneos da(s) doação(ões) anterior(es), adotando os seguintes procedimentos: (Origem: PRT MS/GM 158/2016, Art. 136)
I - nos casos de soroconversão com confirmação dos resultados iniciais reagentes (positivo ou inconclusivo) para Anti-HIV, Anti-HCV, HBsAg ou Anti-HTLV I/II, realizar-se-á a investigação de retrovigilância da última doação com triagem sorológica não reagente e todas as doações realizadas até 6 (seis) meses antes desta; (Origem: PRT MS/GM 158/2016, Art. 136, I)
II - nos casos de soroconversão com confirmação do resultado inicial reagente (positivo ou inconclusivo) para Anti-HBc, realizar-se-á a investigação de retrovigilância para a última doação (mais recente) com triagem sorológica não reagente, caso esta tenha ocorrido menos de 12 (doze) meses antes da soroconversão; e (Origem: PRT MS/GM 158/2016, Art. 136, II)
III - nos casos de soroconversão para teste de detecção de ácido nucleico (NAT) para HIV, HCV e/ou HBV, com teste de triagem sorológica não reagente realizar-se-á a investigação de retrovigilância da última doação com triagem laboratorial negativa e todas as doações realizadas até 3 (três) meses antes desta. (Origem: PRT MS/GM 158/2016, Art. 136, III)
§ 1º O teste de detecção de ácido nucléico (NAT) do agente infeccioso que estiver sendo investigado pode ser realizado na amostra da doação anterior à soroconversão, utilizando amostra da plasmateca/soroteca ou da unidade de plasma armazenado. (Origem: PRT MS/GM 158/2016, Art. 136, § 1º)
§ 2º Na hipótese do § 1º, o procedimento de retrovigilância deve ser realizado, independentemente do resultado obtido. (Origem: PRT MS/GM 158/2016, Art. 136, § 2º)
§ 3º Caso ainda haja algum componente sanguíneo envolvido no procedimento de retrovigilância armazenado em qualquer serviço de hemoterapia, realizar-se-á a devolução para o serviço produtor para as providências cabíveis. (Origem: PRT MS/GM 158/2016, Art. 136, § 3º)
§ 4º O serviço de hemoterapia comunicará, simultaneamente e por escrito, à indústria que recebeu o plasma, à ANVISA e à CGSH/DAHU/SAS/MS quando as unidades de plasma das doações envolvidas no procedimento de retrovigilância já tiverem sido enviadas para o fracionamento industrial. (Origem: PRT MS/GM 158/2016, Art. 136, § 4º)
Art. 136. Compete ao serviço de hemoterapia: (Origem: PRT MS/GM 158/2016, Art. 137)
I - cumprir o algoritmo para cada marcador, conforme Anexo 5 do Anexo IV ; (Origem: PRT MS/GM 158/2016, Art. 137, I)
II - descartar as bolsas de componentes sanguíneos que tenham resultado reagente em qualquer um dos testes obrigatórios para infecções transmissíveis pelo sangue realizados na triagem laboratorial, segundo os preceitos estabelecidos na legislação pertinente; (Origem: PRT MS/GM 158/2016, Art. 137, II)
III - bloquear os doadores considerados inaptos nos testes para infecções transmissíveis pelo sangue; e (Origem: PRT MS/GM 158/2016, Art. 137, III)
IV - convocar e orientar o doador com resultados de testes reagentes (positivo ou inconclusivo), encaminhando-o a serviços assistenciais para confirmação do diagnóstico e/ou acompanhamento e tratamento. (Origem: PRT MS/GM 158/2016, Art. 137, IV)
Parágrafo Único. Caso o doador com resultados de testes reagentes (positivo ou inconclusivo) não compareça para a coleta de segunda amostra e/ou orientações, o serviço de hemoterapia comunicará ao órgão de vigilância em saúde competente, conforme as legislações sanitárias vigentes. (Origem: PRT MS/GM 158/2016, Art. 137, Parágrafo Único)
Art. 137. Os resultados dos exames de triagem dos doadores são absolutamente sigilosos. (Origem: PRT MS/GM 158/2016, Art. 138)
§ 1º Quando os exames forem feitos em serviço de hemoterapia diferente daquela em que ocorreu a doação, o envio dos resultados será feito de modo a assegurar a não identificação do doador, sendo vedada a transmissão verbal ou por via telefônica dos resultados. (Origem: PRT MS/GM 158/2016, Art. 138, § 1º)
§ 2º O envio dos resultados por fax ou por meio eletrônico é permitido, sem a identificação do nome por extenso do doador. (Origem: PRT MS/GM 158/2016, Art. 138, § 2º)
Art. 138. Não é obrigatório que o serviço de hemoterapia firme o diagnóstico da doença ou testes confirmatórios de infecções biológicas. (Origem: PRT MS/GM 158/2016, Art. 139)
Art. 139. Pelo menos durante os 6 (seis) próximos meses após a doação, será conservada (plasmateca ou soroteca) uma alíquota da amostra de plasma ou soro de cada doação de sangue em temperatura igual ou inferior a -20° C (vinte graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 140)
Art. 140. O descarte ou a liberação do sangue, em função dos resultados da testagem das amostras para os vários marcadores que deverão ser observados, seguirá o disposto no algoritmo de que trata o Anexo 5 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 141)
Art. 141. É obrigatória a pesquisa de hemoglobina S nos doadores de sangue, pelo menos, na primeira doação. (Origem: PRT MS/GM 158/2016, Art. 142)
§ 1º Os componentes eritrocitários de doadores com pesquisa de hemoglobina S positiva conterão esta informação no seu rótulo, sem necessidade de descarte dos mesmos. (Origem: PRT MS/GM 158/2016, Art. 142, § 1º)
§ 2º Os componentes de que trata o § 1º não serão desleucocitados e nem utilizados em pacientes: (Origem: PRT MS/GM 158/2016, Art. 142, § 2º)
I - com hemoglobinopatias; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, I)
II - com acidose grave; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, II)
III - recém-nascidos; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, III)
IV - de transfusão intrauterina; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, IV)
V - de procedimentos cirúrgicos com circulação extracorpórea; ou (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, V)
VI - com hipotermia. (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, VI)
§ 3º O doador que apresentar pesquisa de hemoglobina S positiva será orientado e encaminhado a serviço assistencial para avaliação clínica, se for o caso. (Origem: PRT MS/GM 158/2016, Art. 142, § 3º)
Seção VII
Da Rotulagem do Sangue do Doador
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção VII)
Art. 142. É obrigatória a fixação de rótulos e etiquetas em cada unidade de sangue, que ficarão firmemente aderidos à bolsa plástica. (Origem: PRT MS/GM 158/2016, Art. 143)
§ 1º Os rótulos de que trata o "caput" não serão adulterados. (Origem: PRT MS/GM 158/2016, Art. 143, § 1º)
§ 2º As informações contidas nos rótulos e etiquetas finais das bolsas serão impressas de forma legível. (Origem: PRT MS/GM 158/2016, Art. 143, § 2º)
Art. 143. É obrigatório o controle de rotulagem de cada unidade por duas pessoas diferentes, a menos que seja utilizada a tecnologia de código de barras ou alguma outra forma eletrônica de verificação devidamente validada. (Origem: PRT MS/GM 158/2016, Art. 144)
Art. 144. A identificação das bolsas na coleta permitirá a rastreabilidade da bolsa desde a sua obtenção até o término do ato transfusional, permitindo, inclusive, a investigação de eventos adversos que eventualmente possam ocorrer durante ou após o ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 145)
Art. 145. A identificação das bolsas de coleta será realizada por sistema numérico ou alfanumérico, sendo acompanhada de código de barras. (Origem: PRT MS/GM 158/2016, Art. 146)
Parágrafo Único. No momento da coleta, a identificação a que se refere o "caput" será feita nas bolsas principais e satélites, não devendo ser raspada, removida ou coberta posteriormente. (Origem: PRT MS/GM 158/2016, Art. 146, Parágrafo Único)
Art. 146. Todos os rótulos que identificam as bolsas de sangue e os tubos das amostras para testes laboratoriais terão identificação adicional por código de barras. (Origem: PRT MS/GM 158/2016, Art. 147)
Art. 147. Serão incluídos no rótulo do tubo com amostra para os testes de triagem os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 148)
I - nome ou sigla do serviço de hemoterapia coletor; (Origem: PRT MS/GM 158/2016, Art. 148, I)
II - data da coleta; e (Origem: PRT MS/GM 158/2016, Art. 148, II)
III - identificação numérica ou alfanumérica da amostra. (Origem: PRT MS/GM 158/2016, Art. 148, III)
Parágrafo Único. Outros sistemas de identificação não abrangidos pelos incisos I a III do "caput" poderão ser utilizados, desde que estas informações possam ser recuperadas. (Origem: PRT MS/GM 158/2016, Art. 148, Parágrafo Único)
Art. 148. Os rótulos dos componentes sanguíneos liberados para uso conterão as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 149)
I - nome e endereço do serviço de hemoterapia coletor; (Origem: PRT MS/GM 158/2016, Art. 149, I)
II - data da coleta; (Origem: PRT MS/GM 158/2016, Art. 149, II)
III - nome do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 149, III)
IV - volume aproximado do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 149, IV)
V - identificação numérica ou alfanumérica que permita a rastreabilidade do doador e da doação; (Origem: PRT MS/GM 158/2016, Art. 149, V)
VI - nome do anticoagulante ou outra solução preservativa (exceto nos componentes obtidos por aférese); (Origem: PRT MS/GM 158/2016, Art. 149, VI)
VII - temperatura adequada para a conservação; (Origem: PRT MS/GM 158/2016, Art. 149, VII)
VIII - data de vencimento do produto; (Origem: PRT MS/GM 158/2016, Art. 149, VIII)
IX - o grupo ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 149, IX)
X - o resultado da pesquisa de anticorpos antieritrocitários irregulares, quando esta for positiva, de preferência com o nome do anticorpo identificado; (Origem: PRT MS/GM 158/2016, Art. 149, X)
XI - o resultado dos testes não reagentes para triagem de infecções transmissíveis pelo sangue; e (Origem: PRT MS/GM 158/2016, Art. 149, XI)
XII - a inscrição "doação autóloga", quando for o caso. (Origem: PRT MS/GM 158/2016, Art. 149, XII)
Parágrafo Único. Nos componentes nos quais o tempo de armazenamento é fator crítico para a qualidade destes, será considerada a hora de coleta na determinação do prazo de vencimento. (Origem: PRT MS/GM 158/2016, Art. 149, Parágrafo Único)
Art. 149. Os rótulos de componentes liberados, submetidos a procedimentos de modificação para formação de pool (concentrados de plaquetas e crioprecipitados), conterão as informações: (Origem: PRT MS/GM 158/2016, Art. 150)
I - a indicação de que se trata de um pool e o número do pool; (Origem: PRT MS/GM 158/2016, Art. 150, I)
II - nome do serviço de hemoterapia responsável pela preparação do pool; (Origem: PRT MS/GM 158/2016, Art. 150, II)
III - grupo ABO e RhD das unidades do pool; (Origem: PRT MS/GM 158/2016, Art. 150, III)
IV - volume aproximado do pool; e (Origem: PRT MS/GM 158/2016, Art. 150, IV)
V - data e horário de vencimento do pool. (Origem: PRT MS/GM 158/2016, Art. 150, V)
§ 1º Será informado nos rótulos dos componentes de que trata o "caput", ainda, quando o mesmo for irradiado ou CMV negativo. (Origem: PRT MS/GM 158/2016, Art. 150, § 1º)
§ 2º O serviço de hemoterapia que preparou o pool terá um sistema que permita a rastreabilidade de todas as unidades que o compõe. (Origem: PRT MS/GM 158/2016, Art. 150, § 2º)
Seção VIII
Da Conservação do Sangue e Componentes
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção VIII)
Art. 150. As câmaras de conservação em que se armazenam o sangue, os componentes sanguíneos e os hemoderivados serão apropriadas para esta finalidade e de uso exclusivo. (Origem: PRT MS/GM 158/2016, Art. 151)
Art. 151. É permitida a utilização da mesma câmara de conservação para armazenamento de reagentes e amostras envolvidos nos testes pré-transfusionais. (Origem: PRT MS/GM 158/2016, Art. 152)
§ 1º A localização e identificação dos compartimentos serão evidentes e distintas dentro da câmara. (Origem: PRT MS/GM 158/2016, Art. 152, § 1º)
§ 2º Em serviço de hemoterapia de pequeno porte, é permitida a utilização de uma mesma câmara de conservação para armazenamento dos componentes sanguíneos, reagentes e amostras, sem prejuízo do descrito no "caput". (Origem: PRT MS/GM 158/2016, Art. 152, § 2º)
Art. 152. Os componentes sanguíneos serão armazenados à temperatura que resulte ótima para sua função e para a segurança do produto, de acordo com o disposto na Seção IV do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 153)
§ 1º As câmaras de conservação que são utilizadas para conservar o sangue e seus componentes terão um sistema de ventilação para circulação de ar e temperatura uniformemente distribuída em todos os compartimentos. (Origem: PRT MS/GM 158/2016, Art. 153, § 1º)
§ 2º É recomendável que as câmaras de conservação para concentrado de hemácias, plaquetas e plasma possuam registrador gráfico contínuo de temperatura. (Origem: PRT MS/GM 158/2016, Art. 153, § 2º)
§ 3º Em situações em que não esteja disponível o recurso citado no § 2º, a verificação e o registro da temperatura serão realizados a cada 4 (quatro) horas, se os equipamentos estiverem em uso rotineiro, isto é, com abertura constante das portas. (Origem: PRT MS/GM 158/2016, Art. 153, § 3º)
§ 4º Em situações em que as portas estiverem permanentemente fechadas, o monitoramento pode ser feito, no máximo, a cada 12 (doze) horas, sendo obrigatória a instalação de um termômetro de registro de temperatura máxima e mínima. (Origem: PRT MS/GM 158/2016, Art. 153, § 4º)
§ 5º Os registros de temperatura serão periodicamente revisados por uma pessoa qualificada. (Origem: PRT MS/GM 158/2016, Art. 153, § 5º)
Art. 153. As câmaras de conservação de componentes sanguíneos terão sistema de alarme sonoro e visual que serão ativados a uma temperatura que permita a execução das condutas apropriadas para evitar que o sangue e os componentes sofram danos devido a temperaturas incorretas. (Origem: PRT MS/GM 158/2016, Art. 154)
§ 1º As câmaras de conservação de concentrados de hemácias e plaquetas serão dotadas de alarmes de alta e de baixa temperatura. (Origem: PRT MS/GM 158/2016, Art. 154, § 1º)
§ 2º As câmaras de conservação de plasma não precisam de alarmes de baixa temperatura. (Origem: PRT MS/GM 158/2016, Art. 154, § 2º)
Art. 154. No serviço de hemoterapia haverá planos de contingência com procedimentos escritos, facilmente disponíveis, que contenham instruções sobre como proceder em casos de cortes de energia elétrica ou em casos de defeitos na cadeia do frio. (Origem: PRT MS/GM 158/2016, Art. 155)
Seção IX
Da Doação de Componentes por Aférese
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção IX)
Art. 155. Aplicam-se à seleção e ao cuidado dos doadores por aférese as normas estabelecidas para a doação de sangue total. (Origem: PRT MS/GM 158/2016, Art. 156)
Parágrafo Único. A coleta de granulócitos, linfócitos e células progenitoras hematopoiéticas por aférese será precedida de avaliação médica. (Origem: PRT MS/GM 158/2016, Art. 156, Parágrafo Único)
Art. 156. A coleta por aférese em doadores que não cumpram os requisitos habituais só será realizada se o componente a ser coletado tiver uma aplicação especial para um determinado receptor, e se um hemoterapeuta autorizar formalmente o procedimento. (Origem: PRT MS/GM 158/2016, Art. 157)
Parágrafo Único. Os procedimentos de aférese serão realizados com uso de equipamentos próprios para este fim. (Origem: PRT MS/GM 158/2016, Art. 157, Parágrafo Único)
Art. 157. Para realizar a doação por aférese, o doador deve concordar com o procedimento por meio da assinatura de um termo de consentimento livre e esclarecido. (Origem: PRT MS/GM 158/2016, Art. 158)
§ 1º Para o cumprimento do disposto no "caput", serão aplicadas as regras estabelecidas no art. 32. (Origem: PRT MS/GM 158/2016, Art. 158, § 1º)
§ 2º O termo de consentimento para a doação por aférese explicará, de maneira clara: (Origem: PRT MS/GM 158/2016, Art. 158, § 2º)
I - o procedimento de coleta; (Origem: PRT MS/GM 158/2016, Art. 158, § 2º, I)
II - as possíveis complicações; e (Origem: PRT MS/GM 158/2016, Art. 158, § 2º, II)
III - os riscos para o doador. (Origem: PRT MS/GM 158/2016, Art. 158, § 2º, III)
Art. 158. O médico hemoterapeuta será o responsável pelo procedimento de aférese. (Origem: PRT MS/GM 158/2016, Art. 159)
Parágrafo Único. Durante o procedimento de aférese, o doador será acompanhado pela equipe do serviço de hemoterapia, que disporá de cuidados médicos de emergência para o caso de reações adversas. (Origem: PRT MS/GM 158/2016, Art. 159, Parágrafo Único)
Art. 159. O volume sanguíneo extracorpóreo não deve superar 15% da volemia do doador. (Origem: PRT MS/GM 158/2016, Art. 160)
Art. 160. A doação de plasma por aférese poderá ser feita em situações especiais, com o objetivo de suprir a necessidade transfusional de determinados pacientes. (Origem: PRT MS/GM 158/2016, Art. 161)
§ 1º O intervalo mínimo entre duas plasmaféreses em um doador é de 48 (quarenta e oito) horas, podendo um mesmo doador realizar doações, no máximo, 2 (duas) vezes em um período de 7 (sete) dias e 4 (quatro) vezes em um período de 2 (dois) meses. (Origem: PRT MS/GM 158/2016, Art. 161, § 1º)
§ 2º Depois da quarta doação efetuada em menos de 60 (sessenta) dias, haverá um intervalo de, no mínimo, 2 (dois) meses até a doação subsequente. (Origem: PRT MS/GM 158/2016, Art. 161, § 2º)
§ 3º O número máximo anual de doações de plasma por aférese, por doador, não será maior que 12 (doze). (Origem: PRT MS/GM 158/2016, Art. 161, § 3º)
§ 4º A dosagem de proteína total sérica e de IgG e IgM serão monitoradas em intervalos de 4 (quatro) meses para doadores em que o intervalo entre as doações seja inferior a 4 (quatro) semanas. (Origem: PRT MS/GM 158/2016, Art. 161, § 4º)
§ 5º O volume de plasma por coleta não excederá 10 mL por Kg de peso até o máximo de 600 mL. (Origem: PRT MS/GM 158/2016, Art. 161, § 5º)
§ 6º Se um doador de plasma por aférese doar uma unidade de sangue total, ou se a perda de hemácias durante o procedimento for superior a 200 mL, devem transcorrer, pelo menos, 8 (oito) semanas antes que um novo procedimento de plasmaférese seja realizado. (Origem: PRT MS/GM 158/2016, Art. 161, § 6º)
Art. 161. O serviço de hemoterapia que possui programa de doação de plasma por aférese para obtenção de matéria-prima para produção de componentes sanguíneos especiais e hemoderivados obedecerá a todos os requisitos definidos neste Anexo para seleção do doador e coleta de sangue. (Origem: PRT MS/GM 158/2016, Art. 162)
§ 1º O serviço de hemoterapia manterá cadastro especial de doadores que se encontrem na condição descrita no "caput". (Origem: PRT MS/GM 158/2016, Art. 162, § 1º)
§ 2º O doador de plasma por aférese para fins industriais receberá todas as informações referentes ao procedimento a que será submetido. (Origem: PRT MS/GM 158/2016, Art. 162, § 2º)
§ 3º A ciência e consentimento especial do doador serão registrados para o fim proposto no "caput". (Origem: PRT MS/GM 158/2016, Art. 162, § 3º)
Art. 162. Será realizada a contagem de plaquetas em todos os candidatos à doação por plaquetaférese. (Origem: PRT MS/GM 158/2016, Art. 163)
§ 1º A contagem de plaquetas a que se refere o "caput" será realizada no dia da doação ou nos 3 (três) dias que a antecedem, desde que não tenha havido outra doação de plaquetas no período. (Origem: PRT MS/GM 158/2016, Art. 163, § 1º)
§ 2º O candidato a doador não deve ser submetido a uma plaquetaférese se a sua contagem de plaquetas for inferior a 150 x 10e3 plaquetas/µL. (Origem: PRT MS/GM 158/2016, Art. 163, § 2º)
§ 3º A estimativa de contagem de plaquetas do doador no final do procedimento de coleta não pode ser inferior a 100 x 10e3 plaquetas/µL. (Origem: PRT MS/GM 158/2016, Art. 163, § 3º)
§ 4º O intervalo mínimo entre duas plaquetaféreses em um doador é de 48 (quarenta e oito) horas, podendo um mesmo doador realizar doações, no máximo, 4 (quatro) vezes por mês e 24 (vinte quatro) vezes por ano. (Origem: PRT MS/GM 158/2016, Art. 163, § 4º)
§ 5º Se um doador de plaquetas por aférese doar uma unidade de sangue total, ou se a perda de hemácias durante o procedimento for superior a 200 mL, deverão transcorrer, pelo menos, 4 (quatro) semanas antes que um novo procedimento de plaquetaférese seja realizado. (Origem: PRT MS/GM 158/2016, Art. 163, § 5º)
Art. 163. A coleta de leucócitos por leucocitaférese será objeto de protocolo especialmente elaborado pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 164)
§ 1º É permitida a utilização de agentes mobilizadores de granulócitos, tais como G-CSF e/ou corticosteroides, quando não contraindicados, e de agentes hemossedimentantes nos doadores que deverão estar especificados no protocolo. (Origem: PRT MS/GM 158/2016, Art. 164, § 1º)
§ 2º A coleta de que trata o "caput" só poderá ser feita se a contagem de leucócitos no doador for superior a 5,0 x 10e3/µL. (Origem: PRT MS/GM 158/2016, Art. 164, § 2º)
§ 3º É obrigatória a realização de contagem de granulócitos em todos os concentrados de granulócitos coletados. (Origem: PRT MS/GM 158/2016, Art. 164, § 3º)
§ 4º Serão incluídos no termo de consentimento livre e esclarecido para coleta de granulócitos as complicações e riscos relacionados ao uso das medicações mobilizadoras e do agente hemossedimentante. (Origem: PRT MS/GM 158/2016, Art. 164, § 4º)
§ 5º A seleção de doadores de linfócitos seguirá critérios específicos e pré-definidos em protocolo terapêutico de transplante de células progenitoras alogênicas. (Origem: PRT MS/GM 158/2016, Art. 164, § 5º)
Art. 164. A coleta de múltiplos componentes por aférese será objeto de protocolo especial a ser elaborado pelo serviço de hemoterapia, e poderá ser realizada através das seguintes opções: (Origem: PRT MS/GM 158/2016, Art. 165)
I - 1 (um) concentrado de plaquetas com, no mínimo, 3,0 x 10e11 plaquetas e um concentrado de hemácias, com no mínimo 45g de hemoglobina; e (Origem: PRT MS/GM 158/2016, Art. 165, I)
II - 2 (duas) unidades de concentrados de hemácias, cada uma com, no mínimo, 45g de hemoglobina. (Origem: PRT MS/GM 158/2016, Art. 165, II)
§ 1º Para a coleta de que trata o inciso I do "caput", serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 165, § 1º)
I - o intervalo mínimo entre cada doação e o número máximo de coletas por ano são os mesmos estabelecidos para a doação de sangue total; (Origem: PRT MS/GM 158/2016, Art. 165, § 1º, I)
II - o doador deve ter contagem de plaquetas igual ou superior a 150 x 10e3/µL, dosagem de hemoglobina superior a 13g/dL e peso superior a 60 kg; e (Origem: PRT MS/GM 158/2016, Art. 165, § 1º, II)
III - o volume total dos componentes coletados deve ser inferior a 8 mL/kg de peso do doador do sexo feminino e 9 mL/kg do sexo masculino. (Origem: PRT MS/GM 158/2016, Art. 165, § 1º, III)
§ 2º Para a coleta de que trata o inciso II do "caput", serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 165, § 2º)
I - o doador deve pesar, no mínimo, 70 kg, e ter uma dosagem de hemoglobina superior a 14g/dL; (Origem: PRT MS/GM 158/2016, Art. 165, § 2º, I)
II - o intervalo mínimo entre as doações será de 4 (quatro) meses para os homens e de 6 (seis) meses para as mulheres; e (Origem: PRT MS/GM 158/2016, Art. 165, § 2º, II)
III - o volume total dos componentes coletados deve ser inferior a 8 mL/kg de peso do doador do sexo feminino e 9 mL/kg do sexo masculino. (Origem: PRT MS/GM 158/2016, Art. 165, § 2º, III)
Art. 165. Os doadores de componentes sanguíneos por aférese serão submetidos aos mesmos exames de qualificação do doador de sangue total, além dos exames específicos para cada tipo de doação. (Origem: PRT MS/GM 158/2016, Art. 166)
§ 1º Os exames de triagem laboratorial para infecções transmissíveis pelo sangue serão realizados em amostra colhida no mesmo dia do procedimento. (Origem: PRT MS/GM 158/2016, Art. 166, § 1º)
§ 2º Para coleta de granulócitos, linfócitos e células pro-genitoras hematopoiéticas, os exames de que trata o "caput" poderão ser realizados em amostras colhidas até 72 (setenta e duas) horas antes da doação. (Origem: PRT MS/GM 158/2016, Art. 166, § 2º)
Art. 166. Será mantido registro de cada procedimento de aférese, no qual constará as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 167)
I - a identidade do doador; (Origem: PRT MS/GM 158/2016, Art. 167, I)
II - o tipo de componente sanguíneo(s) produzido(s); (Origem: PRT MS/GM 158/2016, Art. 167, II)
III - o volume de componente(s) produzido(s); (Origem: PRT MS/GM 158/2016, Art. 167, III)
IV - o anticoagulante empregado; (Origem: PRT MS/GM 158/2016, Art. 167, IV)
V - a duração da coleta; (Origem: PRT MS/GM 158/2016, Art. 167, V)
VI - as drogas administradas e respectivas doses; e (Origem: PRT MS/GM 158/2016, Art. 167, VI)
VII - as reações adversas ocorridas durante a coleta e o tratamento aplicado. (Origem: PRT MS/GM 158/2016, Art. 167, VII)
Art. 167. A aférese terapêutica será efetuada apenas mediante a solicitação escrita do médico do paciente e com a concordância do médico hemoterapeuta. (Origem: PRT MS/GM 158/2016, Art. 168)
§ 1º O médico hemoterapeuta responsável pelo procedimento determinará o volume de sangue a ser processado, a frequência do procedimento e a necessidade de cuidados especiais. (Origem: PRT MS/GM 158/2016, Art. 168, § 1º)
§ 2º O serviço de hemoterapia terá protocolo escrito para a execução dos procedimentos de aférese terapêutica, descrevendo a metodologia empregada. (Origem: PRT MS/GM 158/2016, Art. 168, § 2º)
§ 3º Os registros do procedimento serão mantidos e conterão as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 168, § 3º)
I - a identificação do paciente; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, I)
II - o diagnóstico; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, II)
III - o tipo de procedimento terapêutico; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, III)
IV - o método empregado; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, IV)
V - o volume sanguíneo extracorpóreo processado; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, V)
VI - o tipo e quantidade do componente removido ou tratado; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, VI)
VII - o tipo e quantidade dos líquidos utilizados; e (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, VII)
VIII - qualquer reação adversa ocorrida e medicação administrada. (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, VIII)
§ 4º Aplicam-se à aférese terapêutica os cuidados de emergência estabelecidos no art. 158, os quais poderão ser acrescidos por outros em função do quadro clínico de cada paciente. (Origem: PRT MS/GM 158/2016, Art. 168, § 4º)
Seção X
Da Transfusão Sanguínea
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção X)
Art. 168. As solicitações para transfusão de sangue ou componentes serão feitas exclusivamente por médicos, em formulário de requisição específico que contenha informações suficientes para a correta identificação do receptor. (Origem: PRT MS/GM 158/2016, Art. 169)
§ 1º Devem constar no formulário de que trata o "caput", no mínimo, os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 169, § 1º)
I - nome completo do paciente sem abreviaturas; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, I)
II - data de nascimento; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, II)
III - sexo; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, III)
IV - idade; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, IV)
V - número do prontuário ou registro do paciente; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, V)
VI - número do leito (no caso de paciente internado); (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, VI)
VII - diagnóstico; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, VII)
VIII - componente sanguíneo solicitado (com o respectivo volume ou quantidade); (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, VIII)
IX - modalidade da transfusão; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, IX)
X - resultados laboratoriais que justifiquem a indicação do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, X)
XI - data; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XI)
XII - dados do médico solicitante (nome completo, assinatura e número do CRM); (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XII)
XIII - peso do paciente (quando indicado); e (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XIII)
XIV - antecedentes transfusionais, gestacionais e de reações à transfusão quando relatados pelo paciente. (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XIV)
§ 2º Não serão aceitas pelo serviço de hemoterapia requisições de transfusão fora dos padrões descritos no § 1º, incompletas, ilegíveis ou rasuradas. (Origem: PRT MS/GM 158/2016, Art. 169, § 2º)
§ 3º Em situação clinicamente justificável, a requisição de transfusão poderá ser aceita conforme protocolo estabelecido pelo serviço de hemoterapia, não eximida a necessidade de coletar as informações previstas no § 1º na sequência do evento transfusional. (Origem: PRT MS/GM 158/2016, Art. 169, § 3º)
§ 4º As instituições de assistência à saúde e os serviços de hemoterapia que disponham de tecnologia para emissão de prontuário eletrônico poderão estabelecer rotinas para prescrição eletrônica de componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 169, § 4º)
Art. 169. São as modalidades de transfusão: (Origem: PRT MS/GM 158/2016, Art. 170)
I - programada para determinado dia e hora; (Origem: PRT MS/GM 158/2016, Art. 170, I)
II - de rotina a se realizar dentro das 24 (vinte e quatro) horas; (Origem: PRT MS/GM 158/2016, Art. 170, II)
III - de urgência a se realizar dentro das 3 (três) horas; ou (Origem: PRT MS/GM 158/2016, Art. 170, III)
IV - de emergência quando o retardo da transfusão puder acarretar risco para a vida do paciente. (Origem: PRT MS/GM 158/2016, Art. 170, IV)
Parágrafo Único. As transfusões serão realizadas, preferencialmente, no período diurno. (Origem: PRT MS/GM 158/2016, Art. 170, Parágrafo Único)
Art. 170. Na hipótese de transfusão de urgência ou emergência, a liberação de sangue total ou concentrado de hemácias antes do término dos testes pré-transfusionais poderá ser feita, desde que obedecidas às seguintes condições: (Origem: PRT MS/GM 158/2016, Art. 171)
I - o quadro clínico do paciente justifique a emergência, isto é, quando o retardo no início da transfusão coloque em risco a vida do paciente; (Origem: PRT MS/GM 158/2016, Art. 171, I)
II - existência de procedimento escrito no serviço de hemoterapia, estipulando o modo como esta liberação será realizada; (Origem: PRT MS/GM 158/2016, Art. 171, II)
III - termo de responsabilidade assinado pelo médico responsável pelo paciente no qual afirme expressamente o conhecimento do risco e concorde com o procedimento; e (Origem: PRT MS/GM 158/2016, Art. 171, III)
IV - as provas pré-transfusionais devem ser finalizadas, mesmo que a transfusão já tenha sido completada. (Origem: PRT MS/GM 158/2016, Art. 171, IV)
§ 1º A indicação de transfusões de emergência deve ser previamente definida em protocolo elaborado pelo Comitê Transfusional da instituição de assistência à saúde em que esta ocorrerá, sem prejuízo do disposto no inciso II do "caput". (Origem: PRT MS/GM 158/2016, Art. 171, § 1º)
§ 2º O médico solicitante deve estar ciente dos riscos das transfusões de urgência ou emergência e será responsável pelas consequências do ato transfusional, se esta situação houver sido criada por seu esquecimento, omissão ou pela indicação da transfusão sem aprovação prévia nos protocolos definidos pelo Comitê Transfusional. (Origem: PRT MS/GM 158/2016, Art. 171, § 2º)
§ 3º Se não houver amostra do paciente no serviço de hemoterapia, esta será colhida assim que possível. (Origem: PRT MS/GM 158/2016, Art. 171, § 3º)
§ 4º Nos casos de transfusão na modalidade de emergência, em que não houver tempo para tipagem do sangue do receptor, é recomendável o uso de hemácias O RhD negativo. (Origem: PRT MS/GM 158/2016, Art. 171, § 4º)
§ 5º Na hipótese de ocorrência do disposto no § 4º, caso não haja o tipo de sangue em estoque suficiente no serviço de hemoterapia, poderá ser usado O RhD positivo, sobretudo em pacientes do sexo masculino ou em pacientes de qualquer sexo com mais de 45 (quarenta e cinco) anos de idade. (Origem: PRT MS/GM 158/2016, Art. 171, § 5º)
§ 6º As amostras de pacientes submetidos a transfusão de emergência devem ser colhidas antes da transfusão ou pelo menos antes da administração de grande quantidade de componentes sanguíneos, pois isto pode comprometer o resultado dos testes pré-transfusionais. (Origem: PRT MS/GM 158/2016, Art. 171, § 6º)
§ 7º A equipe médica deve observar que na maioria das emergências é possível realizar a tipagem ABO do receptor, possibilitando o uso de sangue isogrupo. (Origem: PRT MS/GM 158/2016, Art. 171, § 7º)
§ 8º Em situações de emergências concomitantes, recomendam-se cuidados adicionais na identificação dos pacientes e preconiza-se a utilização de hemácias O, reduzindo, assim, o risco de incompatibilidade ABO por erro de identificação. (Origem: PRT MS/GM 158/2016, Art. 171, § 8º)
§ 9º Constará dos rótulos dos componentes sanguíneos, de forma clara, a informação de que foram liberados sem a finalização dos testes pré-transfusiosnais, quando for o caso. (Origem: PRT MS/GM 158/2016, Art. 171, § 9º)
§ 10. A opção pelo tipo sanguíneo a ser transfundido nas situações de emergência fará parte de protocolo específico mencionado no inciso II do "caput", a ser mantido por cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 171, § 10)
Art. 171. O envio do componente sanguíneo não implica a interrupção dos testes pré-transfusionais, que continuarão sendo realizados. (Origem: PRT MS/GM 158/2016, Art. 172)
Parágrafo Único. Em caso de anormalidade nos testes de que trata o "caput", o médico assistente será imediatamente notificado, e a decisão sobre a suspensão ou continuação da transfusão será tomada em conjunto com o médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 172, Parágrafo Único)
Art. 172. A liberação de uma unidade de sangue ou componente sanguíneo para estoque em outro serviço de hemoterapia será feita: (Origem: PRT MS/GM 158/2016, Art. 173)
I - para serviço de hemoterapia que tenha contrato, convênio ou termo de compromisso com o serviço de hemoterapia distribuidor, definindo as responsabilidades entre as partes, para o fornecimento de unidades de sangue ou componentes sanguíneos; (Origem: PRT MS/GM 158/2016, Art. 173, I)
II - mediante solicitação por escrito do médico do serviço de hemoterapia ao qual se destina, com aposição de sua assinatura, nome legível e CRM do solicitante; (Origem: PRT MS/GM 158/2016, Art. 173, II)
III - após verificação das condições de segurança necessárias para o correto acondicionamento e transporte do produto; e (Origem: PRT MS/GM 158/2016, Art. 173, III)
IV - respeitados os demais critérios para a liberação de sangue e componentes sanguíneos citados neste Anexo. (Origem: PRT MS/GM 158/2016, Art. 173, IV)
Parágrafo Único. O serviço de hemoterapia que receber uma unidade de sangue ou componente sanguíneo de outro serviço de hemoterapia registrará o recebimento, obedecendo aos mesmos critérios estabelecidos para a sua liberação. (Origem: PRT MS/GM 158/2016, Art. 173, Parágrafo Único)
Art. 173. Em relação às amostras de sangue para testes pré-transfusionais, todos os tubos devem ser rotulados no momento da coleta, com o nome completo do receptor sem abreviaturas, seu número de identificação, identificação do coletador e data da coleta, sendo recomendável a identificação por código de barras ou etiqueta impressa. (Origem: PRT MS/GM 158/2016, Art. 174)
Parágrafo Único. Tubos que não estejam corretamente identificados não serão aceitos pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 174, Parágrafo Único)
Art. 174. As amostras usadas para os testes pré-transfusionais serão coletadas para este fim específico, tendo uma validade de até 72 (setenta e duas) horas. (Origem: PRT MS/GM 158/2016, Art. 175)
Art. 175. Antes que uma amostra de sangue seja utilizada para realizar os testes pré-transfusionais, será confirmado se os dados contidos na solicitação transfusional estão de acordo com os dados que constam do tubo da amostra. (Origem: PRT MS/GM 158/2016, Art. 176)
Parágrafo Único. Em casos de dúvidas ou discrepâncias, será obtida uma nova amostra. (Origem: PRT MS/GM 158/2016, Art. 176, Parágrafo Único)
Art. 176. Os testes pré-transfusionais incluirão: (Origem: PRT MS/GM 158/2016, Art. 177)
I - para sangue total e concentrado de hemácias: (Origem: PRT MS/GM 158/2016, Art. 177, I)
a) a tipagem ABO (direta e reversa) e RhD e a pesquisa de anticorpos antieritrocitários irregulares no sangue do receptor; (Origem: PRT MS/GM 158/2016, Art. 177, I, a)
b) a retipagem ABO (direta) e RhD do componente sanguíneo; e (Origem: PRT MS/GM 158/2016, Art. 177, I, b)
c) a realização de uma prova de compatibilidade entre as hemácias do doador e o soro ou plasma do receptor (prova de compatibilidade maior), nos casos especificados no art. 178; (Origem: PRT MS/GM 158/2016, Art. 177, I, c)
II - para concentrado de granulócitos: (Origem: PRT MS/GM 158/2016, Art. 177, II)
a) a tipagem ABO (direta e reversa) e RhD e a pesquisa de anticorpos antieritrocitários irregulares no sangue do receptor; (Origem: PRT MS/GM 158/2016, Art. 177, II, a)
b) a retipagem ABO (direta) e RhD do sangue do doador (amostra coletada no dia de coleta do concentrado de granulócitos); e (Origem: PRT MS/GM 158/2016, Art. 177, II, b)
c) a realização de prova de compatibilidade entre as hemácias do doador (amostra coletada no dia da coleta do concentrado de granulócitos ) e o soro ou plasma do receptor (prova de compatibilidade maior), nos casos especificados no art. 178; (Origem: PRT MS/GM 158/2016, Art. 177, II, c)
III - para concentrado de plaquetas: (Origem: PRT MS/GM 158/2016, Art. 177, III)
a) a tipagem ABO (direta e reversa) e RhD no sangue do receptor; e (Origem: PRT MS/GM 158/2016, Art. 177, III, a)
b) a pesquisa de anticorpos antieritrocitários irregulares no sangue do receptor; (Origem: PRT MS/GM 158/2016, Art. 177, III, b)
IV - para plasma e crioprecipitado: tipagem ABO (direta e reversa) e RhD no sangue do receptor. (Origem: PRT MS/GM 158/2016, Art. 177, IV)
Parágrafo Único. Na repetição dos testes no sangue do doador, serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único)
I - a tipagem ABO será repetida em todos os componentes eritrocitários a serem compatibilizados usando uma amostra obtida de um segmento do tubo-coletor da bolsa; (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único, I)
II - a repetição da tipagem RhD será realizada em bolsas rotuladas como "RhD negativo"; e (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único, II)
III - não é necessário repetir o teste para pesquisa do antígeno D fraco da bolsa de componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único, III)
Art. 177. Nos exames de sangue do receptor, a tipagem ABO e RhD e a pesquisa de anticorpos antieritrocitários irregulares serão realizadas nas amostras de sangue do receptor de componentes eritrocitários. (Origem: PRT MS/GM 158/2016, Art. 178)
§ 1º Se nos 3 (três) meses que antecedem a transfusão, o paciente tiver sido transfundido com sangue ou componentes contendo hemácias (concentrados de hemácias, concentrados de plaquetas e concentrados de granulócitos) ou tiver história de gestação, as amostras para os testes pré-transfusionais serão obtidas dentro das 72 (setenta e duas) horas que antecedem o ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 178, § 1º)
§ 2º A conduta estabelecida no § 1º será aplicada mesmo na falta de informações fidedignas acerca dos antecedentes. (Origem: PRT MS/GM 158/2016, Art. 178, § 2º)
§ 3º A tipagem ABO será realizada testando-se as hemácias com reagentes anti-A, anti-B e anti-AB. (Origem: PRT MS/GM 158/2016, Art. 178, § 3º)
§ 4º Na hipótese do § 3º, caso sejam usados antissoros monoclonais, a utilização do soro anti-AB não é obrigatória. (Origem: PRT MS/GM 158/2016, Art. 178, § 4º)
§ 5º A tipagem reversa sempre será realizada, testando-se o soro ou plasma com suspensão de hemácias conhecidas A1 e B e, opcionalmente, A2 e O. (Origem: PRT MS/GM 158/2016, Art. 178, § 5º)
§ 6º Nenhum resultado de tipagem ABO será concluído até a resolução das discrepâncias entre a tipagem direta e reversa. (Origem: PRT MS/GM 158/2016, Art. 178, § 6º)
§ 7º O antígeno RhD será determinado colocando-se as hemácias com antissoro anti-RhD (anti-D). (Origem: PRT MS/GM 158/2016, Art. 178, § 7º)
§ 8º Paralelamente ao estabelecido no § 7º, sempre será efetuado um controle da tipagem RhD, utilizando-se soro-controle compatível com o antissoro utilizado e do mesmo fabricante do anti-D. (Origem: PRT MS/GM 158/2016, Art. 178, § 8º)
§ 9º No caso de utilização de antissoros anti-D produzidos em meio salino o uso do soro-controle na reação é dispensável. (Origem: PRT MS/GM 158/2016, Art. 178, § 9º)
§ 10. Se a reação com o soro-controle RhD for positiva, decorrente da presença eventual de anticorpos aderidos às hemácias ou proteínas séricas anormais, a tipagem RhD é considerada inválida e pode ser definida empregando-se antissoro anti-D produzido em meio salino. (Origem: PRT MS/GM 158/2016, Art. 178, § 10)
§ 11. Se a reação for negativa para a presença do antígeno RhD, recomenda-se a realização da pesquisa do antígeno D-fraco. (Origem: PRT MS/GM 158/2016, Art. 178, § 11)
§ 12. Se a pesquisa de que trata o § 11 não for realizada, o paciente será considerado RhD negativo para fins transfusionais. (Origem: PRT MS/GM 158/2016, Art. 178, § 12)
§ 13. Quando a tipagem RhD ou a pesquisa do antígeno D-fraco resultar positiva, o paciente pode ser considerado "RhD-positivo". (Origem: PRT MS/GM 158/2016, Art. 178, § 13)
§ 14. Quando ambas as provas resultarem negativas, o paciente será considerado "RhD-negativo". (Origem: PRT MS/GM 158/2016, Art. 178, § 14)
§ 15. Recomenda-se a utilização de um antissoro monoclonal que detecta o antígeno D parcial categoria VI (DVI+ / positivo) e um antissoro que não detecta o antígeno D parcial categoria VI (DVI- / negativo). (Origem: PRT MS/GM 158/2016, Art. 178, § 15)
§ 16. Na hipótese do § 15, quando houver discrepância nos resultados entre os dois antissoros utilizados, deve-se investigar a presença dos antígenos D-fraco e D parcial na amostra. (Origem: PRT MS/GM 158/2016, Art. 178, § 16)
§ 17. Em pacientes "RhD-negativo" recomenda-se ser realizada a pesquisa dos antígenos C (maiúsculo) e E (maiúsculo). (Origem: PRT MS/GM 158/2016, Art. 178, § 17)
§ 18. Recomenda-se a realização da fenotipagem para os antígenos eritrocitários no sangue do receptor, dos sistemas Rh (E, e, C, c), Kell (K), Duffy (Fya, Fyb), Kidd (Jka, Jkb) e MNS (S, s), para pacientes aloimunizados contra antígenos eritrocitários ou que estão ou poderão entrar em esquema de transfusão crônica, com o objetivo de auxiliar a identificação de possíveis anticorpos antieritrocitários irregulares. (Origem: PRT MS/GM 158/2016, Art. 178, § 18)
§ 19. Nos casos abrangidos pelo § 18, recomenda-se a realização de transfusões fenótipo compatível, quando possível. (Origem: PRT MS/GM 158/2016, Art. 178, § 19)
§ 20. A pesquisa de anticorpos antieritrocitários irregulares será realizada obedecendo aos seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 178, § 20)
I - os métodos usados para pesquisa de anticorpos antieritrocitários irregulares no soro ou plasma devem ser capazes de detectar anticorpos clinicamente significativos e devem incluir incubação a 37 °C e o uso do soro antiglobulina humana (anti-IgG ou poliespecífico); e (Origem: PRT MS/GM 158/2016, Art. 178, § 20, I)
II - para evitar resultados falsos negativos nas técnicas em tubo na fase da antiglobulina, será utilizado um reagente controle contendo hemácias sensibilizadas com anticorpos IgG. (Origem: PRT MS/GM 158/2016, Art. 178, § 20, II)
Art. 178. Será realizado teste de compatibilidade entre o sangue do receptor e amostras das bolsas a serem utilizadas no ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 179)
§ 1º A prova de compatibilidade maior será realizada antes da administração de sangue total ou concentrado de hemácias utilizando-se hemácias obtidas do tubo coletor da bolsa a ser transfundida e o soro ou plasma do receptor. (Origem: PRT MS/GM 158/2016, Art. 179, § 1º)
§ 2º Se a pesquisa de anticorpos antieritrocitários irregulares for negativa e não existirem antecedentes transfusionais ou gestacionais, a fase da antiglobulina do teste de compatibilidade poderá ser omitida. (Origem: PRT MS/GM 158/2016, Art. 179, § 2º)
§ 3º Quando a pesquisa de anticorpos antieritrocitários irregulares mostrar resultados positivos, recomenda-se a identificação da especificidade do(s) anticorpo(s) detectado(s) para seleção segura de concentrados de hemácias fenotipados a serem transfundidos. (Origem: PRT MS/GM 158/2016, Art. 179, § 3º)
§ 4º Se o serviço não realizar a identificação de que trata o §3º, recomenda-se que amostras do paciente sejam encaminhadas a um serviço de imuno-hematologia eritrocitário de referência para completar a investigação laboratorial. (Origem: PRT MS/GM 158/2016, Art. 179, § 4º)
§ 5º Quando os resultados dos testes pré-transfusionais demonstrarem que não há concentrado de hemácias compatível para o receptor, o serviço de hemoterapia comunicará este fato ao médico solicitante e, em conjunto com este, realizará a avaliação clínica do paciente. (Origem: PRT MS/GM 158/2016, Art. 179, § 5º)
§ 6º A decisão de transfundir concentrado de hemácias incompatível será justificada por escrito, em termo assinado pelo hemoterapeuta e/ou pelo médico assistente do paciente e, quando possível, pelo paciente ou seu responsável legal. (Origem: PRT MS/GM 158/2016, Art. 179, § 6º)
Art. 179. O serviço de hemoterapia que realiza atendimento de emergência terá protocolo escrito que defina a sua conduta nas transfusões maciças. (Origem: PRT MS/GM 158/2016, Art. 180)
§ 1º Para efeito deste Anexo, entende-se por transfusão maciça: (Origem: PRT MS/GM 158/2016, Art. 180, § 1º)
I - paciente que tiver recebido uma quantidade de sangue total ou concentrado de hemácias aproximadamente igual à sua volemia em período inferior a 24 (vinte e quatro) horas; e (Origem: PRT MS/GM 158/2016, Art. 180, § 1º, I)
II - paciente que tiver recebido uma quantidade de sangue total ou concentrado de hemácias superior a 10 unidades em período inferior a 24 (vinte e quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 180, § 1º, II)
§ 2º A reposição de componentes sanguíneos deve ser indicada à medida que se identificam alterações específicas por meio de avaliação clínica e laboratorial ou baseada em protocolos pré-estabelecidos pela instituição. (Origem: PRT MS/GM 158/2016, Art. 180, § 2º)
§ 3º Os testes pré-transfusionais poderão ser abreviados após a troca de uma volemia sanguínea. (Origem: PRT MS/GM 158/2016, Art. 180, § 3º)
Art. 180. O serviço de hemoterapia abrirá registro para cada receptor de transfusão, o qual conterá todas as informações relativas aos exames pré-transfusionais, antecedentes de reações adversas à transfusão, data das transfusões e relação dos componentes sanguíneos transfundidos, com os respectivos tipos e identificação. (Origem: PRT MS/GM 158/2016, Art. 181)
Parágrafo Único. O registro de que trata o "caput" será consultado e atualizado a cada transfusão e a cada exame imuno-hematológico realizado. (Origem: PRT MS/GM 158/2016, Art. 181, Parágrafo Único)
Art. 181. O sangue total e os concentrados de hemácias serão ABO compatíveis. (Origem: PRT MS/GM 158/2016, Art. 182)
§ 1º Os receptores "RhD-positivo" poderão receber sangue total ou concentrado de hemácias "RhD-positivo" ou "RhD-negativo". (Origem: PRT MS/GM 158/2016, Art. 182, § 1º)
§ 2º Os receptores "RhD-negativo" receberão sangue total ou hemácias "RhD-negativo", exceto em circunstâncias justificadas e desde que não apresentem sensibilização prévia. (Origem: PRT MS/GM 158/2016, Art. 182, § 2º)
§ 3º Quando um receptor apresentar anticorpos antieritrocitários irregulares clinicamente significativos nos testes dispostos no art. 177, § 20, ou tiver antecedentes de presença de tais anticorpos, o sangue total ou concentrado de hemácias a serem transfundidos serão compatíveis e não possuirão os antígenos correspondentes. (Origem: PRT MS/GM 158/2016, Art. 182, § 3º)
§ 4º Na hipótese do § 3º, recomenda-se a profilaxia para aloimunização contra outros antígenos utilizando-se concentrados de hemácias fenotipadas. (Origem: PRT MS/GM 158/2016, Art. 182, § 4º)
§ 5º Para pacientes que não apresentam anticorpos antieritrocitários que estão ou poderão entrar em esquema de transfusão crônica, recomenda-se a utilização de concentrado de hemácias fenotipadas compatíveis, principalmente para os sistemas mais imunogênicos (Rh, Kell, Duffy, Kidd e MNS), sob avaliação médica. (Origem: PRT MS/GM 158/2016, Art. 182, § 5º)
§ 6º As transfusões de plasma devem ser ABO compatíveis com as hemácias do receptor e não necessitam de provas de compatibilidade. (Origem: PRT MS/GM 158/2016, Art. 182, § 6º)
§ 7º As transfusões de crioprecipitado não necessitam de provas de compatibilidade e, em crianças de até 10 (dez) anos ou 35 kg, serão isogrupo ou ABO compatíveis. (Origem: PRT MS/GM 158/2016, Art. 182, § 7º)
§ 8º O plasma contido nos concentrados de plaquetas será ABO compatível com as hemácias do receptor. (Origem: PRT MS/GM 158/2016, Art. 182, § 8º)
§ 9º Caso não seja possível o cumprimento do determinado no § 8º, recomenda-se avaliar o volume de plasma do componente sanguíneo e a presença de anti-A e anti-B de relevância clínica (hemolisina) na decisão de transfundir concentrado de plaquetas não isogrupo. (Origem: PRT MS/GM 158/2016, Art. 182, § 9º)
§ 10. As hemácias presentes nos concentrados de granulócitos serão ABO compatíveis com o plasma do receptor. (Origem: PRT MS/GM 158/2016, Art. 182, § 10)
§ 11. Para as transfusões de concentrados de granulócitos colhidos em doadores estimulados pelo G-CSF, será feita uma prova de compatibilidade maior com o soro do receptor e as hemácias do doador antes de se iniciar a administração do G-CSF ao doador. (Origem: PRT MS/GM 158/2016, Art. 182, § 11)
§ 12. Na hipótese do § 11, caso a prova de compatibilidade resulte incompatível, a doação não deve ser efetuada. (Origem: PRT MS/GM 158/2016, Art. 182, § 12)
§ 13. O médico do serviço de hemoterapia pode suspender ou modificar uma transfusão quando considerá-la desnecessária, registrando de maneira clara a alteração e os motivos desta decisão. (Origem: PRT MS/GM 158/2016, Art. 182, § 13)
Art. 182. Na amostra pré-transfusional inicial para transfusão em neonatos e crianças de até 4 (quatro) meses de vida será realizada a tipagem ABO direta. (Origem: PRT MS/GM 158/2016, Art. 183)
§ 1º Não será realizada a tipagem reversa. (Origem: PRT MS/GM 158/2016, Art. 183, § 1º)
§ 2º O antígeno RhD será determinado colocando-se as hemácias com antissoro anti-RhD (Anti-D). (Origem: PRT MS/GM 158/2016, Art. 183, § 2º)
§ 3º Paralelamente ao procedimento disposto no § 2º, será efetuado o controle da tipagem RhD através de soro controle compatível com o antissoro utilizado e do mesmo fabricante do anti-D. (Origem: PRT MS/GM 158/2016, Art. 183, § 3º)
§ 4º No caso de utilização de antissoros anti-D produzido em meio salino, o uso do soro controle na reação será dispensável. (Origem: PRT MS/GM 158/2016, Art. 183, § 4º)
§ 5º Se a reação com o soro-controle RhD for positiva, decorrente da presença de alo-anticorpos maternos aderidos às hemácias do recém-nascido, a tipagem RhD será considerada inválida e poderá ser definida empregando-se antissoro anti-D produzido em meio salino. (Origem: PRT MS/GM 158/2016, Art. 183, § 5º)
§ 6º Se as hemácias selecionadas para transfusão não forem do grupo O, será investigada, no soro ou plasma do neonato e das crianças até 4 (quatro) meses de vida, a presença de anti-A ou anti-B, com métodos que incluam uma fase de antiglobulina. (Origem: PRT MS/GM 158/2016, Art. 183, § 6º)
§ 7º O teste a que se refere o § 6º não precisa ser realizado se houver disponibilidade de uma amostra do sangue da mãe para tipagem ABO e se a tipagem ABO da mãe for a mesma do recém-nascido. (Origem: PRT MS/GM 158/2016, Art. 183, § 7º)
§ 8º Se ocorrer detecção da presença de anti-A ou anti-B, será transfundido concentrado de hemácias "O" até que o anticorpo deixe de ser demonstrável no soro do neonato ou das crianças com até 4 (quatro) meses de vida. (Origem: PRT MS/GM 158/2016, Art. 183, § 8º)
§ 9º Na amostra pré-transfusional inicial, será realizada a pesquisa de anticorpos antieritrocitários irregulares utilizando-se, preferencialmente, o soro da mãe ou eluato do recém-nascido. (Origem: PRT MS/GM 158/2016, Art. 183, § 9º)
§ 10. Se a pesquisa de anticorpos irregulares for negativa, não será necessário compatibilizar as hemácias para a primeira transfusão nem para as transfusões subsequentes dentro do período neonatal, desde que as hemácias sejam do grupo "O". (Origem: PRT MS/GM 158/2016, Art. 183, § 10)
§ 11. Se a pesquisa de anticorpos irregulares demonstrar a presença de anticorpos clinicamente significativos, a transfusão será feita com unidades que não contenham os antígenos correspondentes. (Origem: PRT MS/GM 158/2016, Art. 183, § 11)
§ 12. As unidades a que se refere o § 11 devem ser compatibilizadas com soro do neonato ou com soro da sua mãe. (Origem: PRT MS/GM 158/2016, Art. 183, § 12)
§ 13. Os neonatos não serão transfundidos com sangue total, plasma ou outros componentes sanguíneos que contenham anticorpos irregulares clinicamente significativos. (Origem: PRT MS/GM 158/2016, Art. 183, § 13)
§ 14. A transfusão de componentes celulares em recém-nascidos com menos de 1.200 g de peso será feita com produtos desleucocitados ou não reagentes para CMV. (Origem: PRT MS/GM 158/2016, Art. 183, § 14)
Art. 183. Em caso de exsanguíneo transfusão, para a seleção do componente sanguíneo, será utilizado em recém-nascidos sangue total colhido há menos de 5 (cinco) dias. (Origem: PRT MS/GM 158/2016, Art. 184)
§ 1º Caso não haja disponibilidade de sangue recente, será utilizado sangue colhido há mais de 5 (cinco) dias, sendo, para isto, necessária uma autorização escrita do médico assistente e do médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 184, § 1º)
§ 2º É recomendado o uso de plasma compatível com as hemácias do paciente. (Origem: PRT MS/GM 158/2016, Art. 184, § 2º)
§ 3º Os casos de incompatibilidade pelo sistema Rh ou por outros sistemas, as hemácias serão compatíveis com o soro da mãe e desprovidas do(s) antígeno(s) contra o(s) qual (is) a mãe está imunizada. (Origem: PRT MS/GM 158/2016, Art. 184, § 3º)
§ 4º Nos exames imuno-hematológicos, serão realizados, rotineiramente, a tipagem ABO e RhD, a pesquisa de D fraco e o teste direto da antiglobulina humana nos recém-nascidos de mães RhD negativo. (Origem: PRT MS/GM 158/2016, Art. 184, § 4º)
§ 5º Na transfusão intrauterina serão utilizados concentrados de hemácias do grupo "O" compatíveis com os anticorpos maternos e componentes desleucocitados ou não reagentes para CMV irradiados. (Origem: PRT MS/GM 158/2016, Art. 184, § 5º)
Seção XI
Da Liberação de Sangue para Transfusão
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XI)
Art. 184. Será afixado, em toda bolsa de componente sanguíneo a ser transfundida, um cartão de transfusão (rótulo ou etiqueta) que indique: (Origem: PRT MS/GM 158/2016, Art. 185)
I - o nome completo do receptor; (Origem: PRT MS/GM 158/2016, Art. 185, I)
II - a instituição de assistência à saúde, enfermaria ou leito em que se encontra o receptor; (Origem: PRT MS/GM 158/2016, Art. 185, II)
III - o registro e a tipagem ABO e RhD do receptor; (Origem: PRT MS/GM 158/2016, Art. 185, III)
IV - o número de identificação da bolsa de componente sanguíneo e sua tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 185, IV)
V - a conclusão do teste de compatibilidade maior; (Origem: PRT MS/GM 158/2016, Art. 185, V)
VI - a data do envio do componente sanguíneo para a transfusão; e (Origem: PRT MS/GM 158/2016, Art. 185, VI)
VII - o nome do responsável pela realização dos testes pré-transfusionais e pela liberação do componente sanguíneo. (Origem: PRT MS/GM 158/2016, Art. 185, VII)
Art. 185. Serão conservadas a 4 ± 2 °C, durante pelo menos 3 (três) dias após a transfusão, uma amostra do concentrado de hemácias (segmento do tubo coletor) e uma amostra de soro ou plasma do receptor (retenção de amostras de sangue e componentes sanguíneos). (Origem: PRT MS/GM 158/2016, Art. 186)
Art. 186. Serão avaliados, antes da liberação para a transfusão, o aspecto do componente sanguíneo e o respectivo cartão de transfusão. (Origem: PRT MS/GM 158/2016, Art. 187)
§ 1º Na avaliação de que trata o "caput", serão verificados: (Origem: PRT MS/GM 158/2016, Art. 187, § 1º)
I - a coloração; (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, I)
II - a integridade do sistema; (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, II)
III - a presença de hemólise ou de coágulos; e (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, III)
IV - a data de validade. (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, IV)
§ 2º O componente sanguíneo não será liberado na constatação, através da avaliação de que trata o "caput", de anormalidades ou se não contiver no cartão de transfusão as informações necessárias. (Origem: PRT MS/GM 158/2016, Art. 187, § 2º)
Art. 187. O cartão de transfusão do componente sanguíneo conterá, ainda, as seguintes instruções de procedimento ao transfusionista: (Origem: PRT MS/GM 158/2016, Art. 188)
I - identificar adequadamente o receptor; (Origem: PRT MS/GM 158/2016, Art. 188, I)
II - transfundir somente mediante prescrição médica; (Origem: PRT MS/GM 158/2016, Art. 188, II)
III - conferir os resultados dos exames que aparecem no rótulo da bolsa; (Origem: PRT MS/GM 158/2016, Art. 188, III)
IV - utilizar equipo de infusão específico para transfusão; (Origem: PRT MS/GM 158/2016, Art. 188, IV)
V - não adicionar e nem infundir conjuntamente com medicamentos ou soluções não isotônicas; e (Origem: PRT MS/GM 158/2016, Art. 188, V)
VI - verificar e informar o serviço de hemoterapia sobre qualquer efeito adverso imediato. (Origem: PRT MS/GM 158/2016, Art. 188, VI)
Art. 188. Os componentes liberados para transfusão, mas não utilizados, podem ser reintegrados ao estoque se as condições de transporte e armazenamento forem conhecidas e adequadas, sendo que tais componentes devem ser submetidos à inspeção visual antes da reintegração. (Origem: PRT MS/GM 158/2016, Art. 189)
§ 1º Não serão reintegradas ao estoque unidades violadas. (Origem: PRT MS/GM 158/2016, Art. 189, § 1º)
§ 2º O profissional do serviço de hemoterapia que receber a devolução de uma bolsa de componente sanguíneo não utilizada deverá inspecioná-la, retirar a identificação do receptor e registrar a devolução. (Origem: PRT MS/GM 158/2016, Art. 189, § 2º)
§ 3º São condições indispensáveis para que o componente sanguíneo possa ser reintegrado ao estoque: (Origem: PRT MS/GM 158/2016, Art. 189, § 3º)
I - o sistema de acondicionamento não estar aberto; (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, I)
II - o componente ter sido mantido em temperatura apropriada durante todo o tempo de permanência fora do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, II)
III - a trajetória da bolsa estar devidamente documentada; (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, III)
IV - existir um segmento ou tubo conectado à bolsa de concentrado de hemácias de tamanho suficiente para permitir a realização de outros testes de compatibilidade; e (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, IV)
V - novo cumprimento dos requisitos que regem a liberação de toda unidade de sangue. (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, V)
Seção XII
Do Ato Transfusional
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XII)
Art. 189. A transfusão será prescrita por médico e registrada no prontuário do paciente. (Origem: PRT MS/GM 158/2016, Art. 190)
Parágrafo Único. É obrigatório que fiquem registrados, no prontuário do paciente, a data da transfusão, os números e a origem dos componentes sanguíneos transfundidos. (Origem: PRT MS/GM 158/2016, Art. 190, Parágrafo Único)
Art. 190. As transfusões serão realizadas por médico ou profissional de saúde habilitado, qualificado e conhecedor das normas constantes deste Anexo, e serão realizadas apenas sob supervisão médica, isto é, em local em que haja, pelo menos, um médico presente que possa intervir em casos de reações transfusionais. (Origem: PRT MS/GM 158/2016, Art. 191)
§ 1º O paciente deve ter os seus sinais vitais (temperatura, pressão arterial e pulso) verificados e registrados, pelo menos, imediatamente antes do início e após o término da transfusão. (Origem: PRT MS/GM 158/2016, Art. 191, § 1º)
§ 2º Os primeiros 10 (dez) minutos de transfusão serão acompanhados pelo médico ou profissional de saúde qualificado para tal atividade, que permanecerá ao lado do paciente durante este intervalo de tempo. (Origem: PRT MS/GM 158/2016, Art. 191, § 2º)
§ 3º Durante o transcurso do ato transfusional o paciente será periodicamente monitorado para possibilitar a detecção precoce de eventuais reações adversas. (Origem: PRT MS/GM 158/2016, Art. 191, § 3º)
§ 4º Se houver alguma reação adversa o médico será comunicado imediatamente. (Origem: PRT MS/GM 158/2016, Art. 191, § 4º)
Art. 191. O receptor será identificado imediatamente antes da transfusão por meio da informação de seu nome completo, prestada pelo próprio receptor ou por profissional da equipe médica e/ou de enfermagem responsável pela assistência direta ao paciente. (Origem: PRT MS/GM 158/2016, Art. 192)
§ 1º Havendo qualquer discrepância entre a identificação do receptor e a constante da bolsa, a transfusão será suspensa até o esclarecimento do fato. (Origem: PRT MS/GM 158/2016, Art. 192, § 1º)
§ 2º Haverá mecanismos, tais como pulseiras ou braceletes, que reduzam a possibilidade de erro na identificação do receptor na hipótese de receptores inconscientes ou desorientados. (Origem: PRT MS/GM 158/2016, Art. 192, § 2º)
Art. 192. Antes do início da transfusão, os componentes eritrocitários não permanecerão à temperatura ambiente por mais de 30 (trinta) minutos. (Origem: PRT MS/GM 158/2016, Art. 193)
§ 1º Caso o tempo de que trata o "caput" seja atingindo, o componente será recolocado, imediatamente, em temperatura adequada de armazenamento. (Origem: PRT MS/GM 158/2016, Art. 193, § 1º)
§ 2º O componente será descartado na hipótese de não cumprimento do procedimento de que trata o § 1º. (Origem: PRT MS/GM 158/2016, Art. 193, § 2º)
Art. 193. As unidades de plasma serão transfundidas o mais brevemente possível após seu descongelamento, não devendo exceder 24 (vinte e quatro) horas se armazenadas a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 194)
Art. 194. Os componentes plaquetários serão mantidos em agitação contínua e transfundidos em até 24 (vinte e quatro) horas depois de saírem do agitador contínuo de plaquetas, desde que agitados antes do uso. (Origem: PRT MS/GM 158/2016, Art. 195)
Art. 195. Todas as transfusões de componentes sanguíneos serão administradas por meio de equipos livres de pirógenos e descartáveis, que incluam filtro que retenha coágulos e agregados alternativamente. (Origem: PRT MS/GM 158/2016, Art. 196)
§ 1º Poderá ser utilizado filtro de leucócitos. (Origem: PRT MS/GM 158/2016, Art. 196, § 1º)
§ 2º A utilização de filtros para desleucocitação à beira do leito dispensa o uso de filtros padrão. (Origem: PRT MS/GM 158/2016, Art. 196, § 2º)
Art. 196. Os componentes sanguíneos serão infundidos em, no máximo, 4 (quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 197)
Parágrafo Único. Quando o período estabelecido no "caput" for atingindo, a transfusão será interrompida e as bolsas descartadas. (Origem: PRT MS/GM 158/2016, Art. 197, Parágrafo Único)
Art. 197. O aquecimento do sangue antes da transfusão, quando indicado, será realizado de forma controlada, em aquecedores próprios para este fim. (Origem: PRT MS/GM 158/2016, Art. 198)
§ 1º Os aquecedores de que trata o "caput" serão dotados de termômetro visível e alarme sonoro e visual. (Origem: PRT MS/GM 158/2016, Art. 198, § 1º)
§ 2º Haverá protocolo escrito, elaborado pelo serviço de hemoterapia, que defina as indicações e os procedimentos para o aquecimento de sangue. (Origem: PRT MS/GM 158/2016, Art. 198, § 2º)
Art. 198. Nenhum medicamento será adicionado à bolsa do componente sanguíneo ou infundido na mesma linha venosa, exceto a solução de cloreto de sódio a 0,9%, em casos excepcionais. (Origem: PRT MS/GM 158/2016, Art. 199)
Art. 199. O plasma fresco congelado e o plasma isento de crioprecipitado serão descongelados à temperatura de 37ºC (trinta e sete graus Celsius) em dispositivo devidamente qualificado. (Origem: PRT MS/GM 158/2016, Art. 200)
§ 1º Para evitar contaminação, a bolsa será protegida por invólucro plástico durante o descongelamento em banho-maria. (Origem: PRT MS/GM 158/2016, Art. 200, § 1º)
§ 2º As unidades de plasma serão transfundidas o mais brevemente possível após seu descongelamento, não excedendo 24 (vinte e quatro) horas, quando armazenadas a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 200, § 2º)
§ 3º É proibido o recongelamento das unidades de plasma não transfundidas. (Origem: PRT MS/GM 158/2016, Art. 200, § 3º)
Art. 200. O crioprecipitado será descongelado à temperatura de 37°C (trinta e sete graus Celsius) devendo-se observar os mesmos procedimentos constantes do "caput" e §§ 1º e 3º do art. 199. (Origem: PRT MS/GM 158/2016, Art. 201)
Parágrafo Único. O crioprecipitado será transfundido o mais brevemente possível após o seu descongelamento, não excedendo 6 (seis) horas, quando mantido à temperatura de 22 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 201, Parágrafo Único)
Art. 201. Nas transfusões de concentrados de plaquetas obtidos de sangue total em receptores RhD negativo, do sexo feminino, com menos de 45 (quarenta e cinco) anos de idade, serão transfundidos, preferencialmente, concentrados de plaquetas RhD negativo. (Origem: PRT MS/GM 158/2016, Art. 202)
§ 1º Caso as plaquetas a serem transfundidas sejam RhD positivo, será realizada uma pesquisa de anticorpos antieritrocitários irregulares pré-transfusional na receptora. (Origem: PRT MS/GM 158/2016, Art. 202, § 1º)
§ 2º Caso a receptora de que trata o "caput" não possua anti-RhD, recomenda-se a administração de imunoglobulina anti-RhD por via parenteral, até 72 (setenta e duas) horas após a transfusão. (Origem: PRT MS/GM 158/2016, Art. 202, § 2º)
§ 3º Nas transfusões subsequentes será repetida a pesquisa de anticorpos antieritrocitários irregulares e se não for detectado o anticorpo anti-RhD, recomenda-se repetir a dose de imunoglobulina anti-RhD. (Origem: PRT MS/GM 158/2016, Art. 202, § 3º)
Art. 202. Os concentrados de granulócitos serão transfundidos utilizando equipos livres de pirógenos e descartáveis, que incluam um filtro capaz de reter coágulos e agregados. (Origem: PRT MS/GM 158/2016, Art. 203)
Parágrafo Único. A transfusão de concentrados de granulócitos será objeto de protocolo elaborado pelo serviço de hemoterapia que contemple tanto as unidades como o procedimento de mobilização e coleta. (Origem: PRT MS/GM 158/2016, Art. 203, Parágrafo Único)
Art. 203. As transfusões em pacientes ambulatoriais serão realizadas em local apropriado destinado a tal fim. (Origem: PRT MS/GM 158/2016, Art. 204)
Parágrafo Único. Nas transfusões em pacientes ambulatoriais serão observadas as mesmas normas que regem as transfusões em pacientes internados. (Origem: PRT MS/GM 158/2016, Art. 204, Parágrafo Único)
Art. 204. Em casos especiais, a transfusão será realizada no domicílio do receptor, desde que todo ato transfusional seja realizado sob supervisão médica. (Origem: PRT MS/GM 158/2016, Art. 205)
Parágrafo Único. O médico que acompanha o ato transfusional em domicílio será o responsável pela garantia do cumprimento de todas as normas de medicina transfusional e disporá de medicamentos, materiais e equipamentos para atendimento de eventuais situações de emergência derivadas do ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 205, Parágrafo Único)
Seção XIII
Das Reações Transfusionais
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XIII)
Art. 205. A instituição de assistência à saúde que realiza transfusões terá um sistema para detecção, notificação e avaliação das reações transfusionais. (Origem: PRT MS/GM 158/2016, Art. 206)
§ 1º Na suspeita de reação transfusional o paciente receberá atendimento imediato e tanto o médico assistente quanto o serviço de hemoterapia que preparou a transfusão deverão ser comunicados. (Origem: PRT MS/GM 158/2016, Art. 206, § 1º)
§ 2º A instituição de assistência à saúde manterá os registros no prontuário do paciente referentes à investigação e à conduta adotadas nas reações transfusionais. (Origem: PRT MS/GM 158/2016, Art. 206, § 2º)
§ 3º O comitê transfusional do serviço de hemoterapia ou da instituição de assistência à saúde será informado e monitorará as reações transfusionais ocorridas zelando pelo atendimento e notificação dessas reações. (Origem: PRT MS/GM 158/2016, Art. 206, § 3º)
Art. 206. As reações transfusionais imediatas serão avaliadas e acompanhadas pelo serviço que realizou a transfusão. (Origem: PRT MS/GM 158/2016, Art. 207)
§ 1º Consideram-se reações transfusionais imediatas aquelas que ocorrem até 24 (vinte e quatro) horas depois de iniciada a transfusão. (Origem: PRT MS/GM 158/2016, Art. 207, § 1º)
§ 2º Em caso de reações transfusionais imediatas, serão adotadas, entre outras, as seguintes medidas: (Origem: PRT MS/GM 158/2016, Art. 207, § 2º)
I - interromper a transfusão, exceto em caso de reações alérgicas leves (urticária) nas quais a transfusão do componente sanguíneo não precisa ser suspensa; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, I)
II - manter acesso venoso; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, II)
III - examinar rótulos das bolsas e de todos os registros relacionados à transfusão para verificar se houve erro na identificação do paciente ou das bolsas transfundidas; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, III)
IV - não desprezar as bolsas de componentes sanguíneos transfundidas e encaminhá-las ao serviço de hemoterapia, quando pertinente; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, IV)
V - comunicar ao médico assistente e/ou médico do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, V)
VI - informar ao comitê transfusional; e (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, VI)
VII - notificar a ocorrência à autoridade sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, VII)
Art. 207. No caso de suspeita de reação hemolítica serão coletadas novas amostras de sangue do receptor. (Origem: PRT MS/GM 158/2016, Art. 208)
§ 1º As amostras de que trata o "caput" serão rotuladas apropriadamente e, juntamente com a bolsa do componente sanguíneo em questão, mesmo vazia, serão imediatamente remetidas ao serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 208, § 1º)
§ 2º Os testes pré-transfusionais serão repetidos com as amostras pré e pós-reação tranfusional. (Origem: PRT MS/GM 158/2016, Art. 208, § 2º)
§ 3º Na amostra pós-reação transfusional serão realizados, no mínimo, os seguintes testes: (Origem: PRT MS/GM 158/2016, Art. 208, § 3º)
I - inspeção visual do soro ou plasma para detecção de hemólise; (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, I)
II - tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, II)
III - Teste Direto da Antiglobulina (TDA); (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, III)
IV - prova de compatibilidade maior com o resíduo de hemácias da bolsa; e (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, IV)
V - pesquisa de anticorpos antieritrocitários irregulares, utilizando técnicas que aumentem a sensibilidade do método. (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, V)
§ 4º Os resultados dos testes realizados com amostra pós-reação transfusional serão confrontados com os obtidos com a amostra pré-transfusão. (Origem: PRT MS/GM 158/2016, Art. 208, § 4º)
Art. 208. Os casos de suspeita de reação por contaminação microbiana ou lesão pulmonar aguda relacionada à transfusão (TRALI) serão comunicados ao serviço de hemoterapia produtor do componente sanguíneo para rastreamento do(s) provável(veis) doador(es) envolvido(s) e dos demais componentes sanguíneos dele(s) porventura coletado(s), de acordo com o procedimento operacional do serviço. (Origem: PRT MS/GM 158/2016, Art. 209)
§ 1º Nos casos de suspeita de contaminação microbiana é necessária cultura microbiológica da bolsa e do paciente. (Origem: PRT MS/GM 158/2016, Art. 209, § 1º)
§ 2º Os doadores associados ou implicados com caso de TRALI serão liberados para doação de sangue total, mas não para doação de plaquetas por aférese. (Origem: PRT MS/GM 158/2016, Art. 209, § 2º)
§ 3º O concentrado de hemácias obtido da doação de que trata o § 2º será liberado para transfusão após o procedimento de lavagem e o plasma será utilizado apenas para fracionamento industrial. (Origem: PRT MS/GM 158/2016, Art. 209, § 3º)
Art. 209. Em caso de febre relacionada à transfusão com elevação da temperatura corporal acima de 1ºC (grau Celsius) após o início da transfusão e atingindo temperatura superior 38°C (graus Celsius), a transfusão será interrompida imediatamente e o componente sanguíneo não será mais infundido no paciente. (Origem: PRT MS/GM 158/2016, Art. 210)
Art. 210. As complicações ou reações transfusionais tardias serão avaliadas e acompanhadas. (Origem: PRT MS/GM 158/2016, Art. 211)
§ 1º Todos os casos em que haja suspeita de transmissão de infecção por transfusão serão avaliados. (Origem: PRT MS/GM 158/2016, Art. 211, § 1º)
§ 2º Novo estudo dos doadores dos componentes sanguíneos suspeitos será realizado, incluindo a convocação e a repetição dos testes para infecções transmissíveis de todos os doadores envolvidos. (Origem: PRT MS/GM 158/2016, Art. 211, § 2º)
§ 3º Depois da investigação do caso, os seguintes procedimentos devem ser realizados: (Origem: PRT MS/GM 158/2016, Art. 211, § 3º)
I - comunicar ao médico do paciente a eventual soroconversão de um ou mais doadores envolvidos no caso; (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, I)
II - após identificar o doador, encaminhá-lo para tratamento especializado e excluí-lo do arquivo de doadores do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, II)
III - registrar as medidas efetuadas para o diagnóstico, notificação e encaminhamento; e (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, III)
IV - notificar a ocorrência à autoridade sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, IV)
Seção XIV
Do Sangue Autólogo
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XIV)
Art. 211. O procedimento de doação autóloga pré-operatória dependerá da solicitação do médico assistente e requer a aprovação do médico hemoterapeuta. (Origem: PRT MS/GM 158/2016, Art. 212)
Art. 212. A unidade de componente sanguíneo a ser utilizada será rotulada com os dizeres "Doação Autóloga" e será segregada e utilizada apenas para transfusão autóloga. (Origem: PRT MS/GM 158/2016, Art. 213)
Art. 213. Não é permitida a migração de bolsas de componentes sanguíneos autólogos para uso alogênico. (Origem: PRT MS/GM 158/2016, Art. 214)
Art. 214. As doações autólogas serão submetidas aos mesmos testes imuno-hematológicos e testes para detecção de infecções transmissíveis pelo sangue realizados nas doações alogênicas. (Origem: PRT MS/GM 158/2016, Art. 215)
Art. 215. Os pacientes que possuam testes para infecções transmissíveis pelo sangue reagentes para qualquer das infecções testadas poderão ser aceitos nos programas de autotransfusão. (Origem: PRT MS/GM 158/2016, Art. 216)
Parágrafo Único. No caso tratado no "caput" será necessária a identificação com etiqueta especial, indicando a situação de risco de contaminação da bolsa e haverá concordância explícita do procedimento, por escrito, do médico assistente do paciente e do médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 216, Parágrafo Único)
Art. 216. O serviço de hemoterapia deve definir os critérios para aceitação e rejeição de doadores autólogos, sendo contraindicações absolutas: (Origem: PRT MS/GM 158/2016, Art. 217)
I - insuficiência cardíaca descompensada; (Origem: PRT MS/GM 158/2016, Art. 217, I)
II - estenose aórtica grave; (Origem: PRT MS/GM 158/2016, Art. 217, II)
III - angina pectoris instável; (Origem: PRT MS/GM 158/2016, Art. 217, III)
IV - infarto do miocárdio nos últimos 6 (seis) meses; (Origem: PRT MS/GM 158/2016, Art. 217, IV)
V - acidente vascular cerebral isquêmico nos últimos 6 (seis) meses; (Origem: PRT MS/GM 158/2016, Art. 217, V)
VI - alto grau de obstrução da artéria coronária esquerda; (Origem: PRT MS/GM 158/2016, Art. 217, VI)
VII - cardiopatia cianótica; e (Origem: PRT MS/GM 158/2016, Art. 217, VII)
VIII - presença de infecção ativa ou tratamento antimicrobiano. (Origem: PRT MS/GM 158/2016, Art. 217, VIII)
§ 1º As demais contraindicações serão avaliadas caso a caso, de acordo com o protocolo do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 217, § 1º)
§ 2º O volume de sangue a ser coletado respeitará o estabelecido no art. 51. (Origem: PRT MS/GM 158/2016, Art. 217, § 2º)
§ 3º Não há limites de idade para as doações autólogas. (Origem: PRT MS/GM 158/2016, Art. 217, § 3º)
§ 4º A concentração de hemoglobina ou hematócrito do doador-paciente não deve ser inferior a 11g/dL e 33%, respectivamente. (Origem: PRT MS/GM 158/2016, Art. 217, § 4º)
§ 5º A frequência das doações autólogas será determinada pelo médico hemoterapeuta. (Origem: PRT MS/GM 158/2016, Art. 217, § 5º)
§ 6º Não será colhido sangue do doador-paciente dentro das 72 (setenta e duas) horas anteriores à cirurgia, sendo que o intervalo entre cada doação autóloga não será inferior a 7 (sete) dias, a não ser em situações excepcionais, devidamente justificadas por um médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 217, § 6º)
Art. 217. Serão realizados exames nas unidades coletadas, a fim de determinar o grupo ABO e RhD conforme especificado nos arts. 119 do Anexo IV , respectivamente. (Origem: PRT MS/GM 158/2016, Art. 218)
§ 1º No sangue autólogo, obtido de um doador-paciente, será realizado teste para detecção de anticorpos antieritrocitários irregulares, conforme especificado no art. 121, bem como os testes para infecções transmissíveis, de acordo com o disposto nos arts. 129 e 130 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 218, § 1º)
§ 2º O doador-paciente e o seu médico serão notificados sobre qualquer anormalidade nos exames realizados. (Origem: PRT MS/GM 158/2016, Art. 218, § 2º)
Art. 218. Além do estabelecido na Seção VII do Capítulo I do Título II, o rótulo da unidade autóloga conterá, pelo menos, as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 219)
I - nome completo do doador-paciente; (Origem: PRT MS/GM 158/2016, Art. 219, I)
II - nome da unidade de assistência à saúde de origem e número de registro do doador-paciente no serviço de hemoterapia; e (Origem: PRT MS/GM 158/2016, Art. 219, II)
III - legenda "Doação Autóloga", conforme mencionado no art. 212. (Origem: PRT MS/GM 158/2016, Art. 219, III)
Art. 219. Antes da transfusão dos componentes autólogos no doador-paciente, serão realizadas as determinações estabelecidas no art. 177. (Origem: PRT MS/GM 158/2016, Art. 220)
Parágrafo Único. Na doação autóloga, é opcional a realização do teste de compatibilidade de que trata o art. 178, § 1º . (Origem: PRT MS/GM 158/2016, Art. 220, Parágrafo Único)
Art. 220. O sangue autólogo, em situações excepcionais, poderá ser coletado do paciente imediatamente antes da cirurgia (hemodiluição normovolêmica) ou recuperado do campo cirúrgico ou de um circuito extracorpóreo (recuperação intraoperatória). (Origem: PRT MS/GM 158/2016, Art. 221)
Art. 221. As unidades de sangue obtidas no pré-operatório imediato, por hemodiluição normovolêmica, permanecerão na sala de cirurgia em que o paciente está sendo operado durante todo o ato cirúrgico. (Origem: PRT MS/GM 158/2016, Art. 222)
§ 1º As unidades de sangue de que trata o "caput" poderão ser utilizadas no doador-paciente em até 24 (vinte e quatro) horas depois da coleta, desde que mantidas à temperatura de 4 ± 2 °C, ou em até 8 (oito) horas, se as bolsas forem mantidas à temperatura entre 20°C e 24°C. (Origem: PRT MS/GM 158/2016, Art. 222, § 1º)
§ 2º A transfusão das bolsas autólogas depois que o doador-paciente deixou a sala de cirurgia poderá ser realizada, desde que haja protocolo escrito que defina como serão feitos a identificação e o armazenamento destas bolsas. (Origem: PRT MS/GM 158/2016, Art. 222, § 2º)
§ 3º O procedimento de hemodiluição pré-operatória poderá ser realizado mesmo em unidades de assistência à saúde que não disponham de serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 222, § 3º)
Art. 222. A recuperação intraoperatória de sangue será feita por meio de máquinas especialmente destinadas a este fim. (Origem: PRT MS/GM 158/2016, Art. 223)
§ 1º Não é permitida a recuperação intraoperatória quando existirem riscos de veiculação ou disseminação de agentes infecciosos e/ou células neoplásicas. (Origem: PRT MS/GM 158/2016, Art. 223, § 1º)
§ 2º O sangue recuperado no intraoperatório não será transfundido em outros pacientes. (Origem: PRT MS/GM 158/2016, Art. 223, § 2º)
§ 3º O sangue recuperado no intraoperatório será transfundido em até 4 (quatro) horas após a coleta. (Origem: PRT MS/GM 158/2016, Art. 223, § 3º)
Art. 223. O serviço de hemoterapia manterá protocolo escrito acerca dos procedimentos relativos à doação autóloga, incluindo a seleção de anticoagulantes e soluções usadas no processamento; os aspectos ligados à identificação das bolsas e a sua preservação; bem como os aspectos concernentes às reações adversas. (Origem: PRT MS/GM 158/2016, Art. 224)
Art. 224. No serviço de hemoterapia haverá um médico responsável pelo programa de transfusão autóloga pré-operatória e de recuperação intraoperatória. (Origem: PRT MS/GM 158/2016, Art. 225)
Art. 225. O doador-paciente ou seu responsável assinará termo de consentimento previamente à realização dos procedimentos de coleta autóloga. (Origem: PRT MS/GM 158/2016, Art. 226)
Art. 226. O serviço de hemoterapia estabelecerá protocolos para atendimento: (Origem: PRT MS/GM 158/2016, Art. 227)
I - de pacientes aloimunizados (anticorpos específicos para antígenos eritrocitários ou do sistema HLA/HPA); (Origem: PRT MS/GM 158/2016, Art. 227, I)
II - para sangria terapêutica; e (Origem: PRT MS/GM 158/2016, Art. 227, II)
III - para transfusão de substituição em adultos (exsanguineotransfusão). (Origem: PRT MS/GM 158/2016, Art. 227, III)
Parágrafo Único. Os procedimentos constantes dos protocolos de que trata o "caput" serão aprovados pelo responsável técnico da unidade e serão mantidos registros relativos a estes procedimentos realizados. (Origem: PRT MS/GM 158/2016, Art. 227, Parágrafo Único)
Seção XV
Dos Registros
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XV)
Art. 227. O serviço de hemoterapia terá um sistema de registro apropriado que permita a rastreabilidade da unidade de sangue ou componente, desde a sua obtenção até o seu destino final, incluindo-se os resultados dos exames de laboratório referentes a este produto. (Origem: PRT MS/GM 158/2016, Art. 228)
Art. 228. Os registros referentes à doação e à transfusão serão armazenados por, pelo menos, 20 (vinte) anos. (Origem: PRT MS/GM 158/2016, Art. 229)
§ 1º Será garantida a inviolabilidade dos registros. (Origem: PRT MS/GM 158/2016, Art. 229, § 1º)
§ 2º Quando os registros constarem de arquivos informatizados serão feitas cópias de segurança a serem arquivadas em locais distintos do arquivo original. (Origem: PRT MS/GM 158/2016, Art. 229, § 2º)
Art. 229. Os registros referentes à doação e à transfusão serão, preferencialmente, informatizados. (Origem: PRT MS/GM 158/2016, Art. 230)
Art. 230. Todos os registros do serviço de hemoterapia são absolutamente confidenciais. (Origem: PRT MS/GM 158/2016, Art. 231)
Art. 231. O serviço de hemoterapia, quando solicitado, informará os dados de seus registros às autoridades sanitárias e estas garantirão a confidencialidade destas informações, conforme a legislação vigente. (Origem: PRT MS/GM 158/2016, Art. 232)
Art. 232. Os registros relativos à doação conterão: (Origem: PRT MS/GM 158/2016, Art. 233)
I - a identificação da doação, numérica ou alfanumérica, que permita a rastreabilidade do doador e da doação; (Origem: PRT MS/GM 158/2016, Art. 233, I)
II - os dados pessoais (documento de identidade) do doador que permita sua correta identificação; (Origem: PRT MS/GM 158/2016, Art. 233, II)
III - a reação adversa durante a coleta, se houver ocorrido; (Origem: PRT MS/GM 158/2016, Art. 233, III)
IV - o peso, o pulso, a pressão arterial, a temperatura e o valor de hemoglobina ou hematócrito; (Origem: PRT MS/GM 158/2016, Art. 233, IV)
V - o documento assinado pelo doador a cada doação, declarando a veracidade das informações prestadas na triagem clínica e autorizando a utilização do sangue de acordo com o art. 32; e (Origem: PRT MS/GM 158/2016, Art. 233, V)
VI - as razões pelas quais a doação foi recusada. (Origem: PRT MS/GM 158/2016, Art. 233, VI)
Art. 233. Os registros de produção dos componentes sanguíneos conterão os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 234)
I - a data da coleta; (Origem: PRT MS/GM 158/2016, Art. 234, I)
II - o número ou alfanúmero de identificação da unidade coletada; (Origem: PRT MS/GM 158/2016, Art. 234, II)
III - o volume de sangue coletado; (Origem: PRT MS/GM 158/2016, Art. 234, III)
IV - a tipagem ABO e RhD do doador; (Origem: PRT MS/GM 158/2016, Art. 234, IV)
V - o resultado de fenotipagem eritrocitária, se realizada; (Origem: PRT MS/GM 158/2016, Art. 234, V)
VI - o resultado dos testes para infecções transmissíveis pelo sangue, de acordo com os arts. 129 e 130 do Anexo IV , e outros porventura realizados; (Origem: PRT MS/GM 158/2016, Art. 234, VI)
VII - a pesquisa de hemoglobina S; e (Origem: PRT MS/GM 158/2016, Art. 234, VII)
VIII - o destino do sangue coletado e dos componentes produzidos. (Origem: PRT MS/GM 158/2016, Art. 234, VIII)
Art. 234. Os registros de distribuição dos componentes sanguíneos liberados conterão os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 235)
I - data; (Origem: PRT MS/GM 158/2016, Art. 235, I)
II - número ou alfanúmero de identificação da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 235, II)
III - especificação da unidade de componente sanguíneo distribuída; (Origem: PRT MS/GM 158/2016, Art. 235, III)
IV - volume da unidade de componente sanguíneo distribuída; (Origem: PRT MS/GM 158/2016, Art. 235, IV)
V - tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 235, V)
VI - conclusão dos testes para infecções transmissíveis pelo sangue; e (Origem: PRT MS/GM 158/2016, Art. 235, VI)
VII - identificação do local de destino. (Origem: PRT MS/GM 158/2016, Art. 235, VII)
Art. 235. Os registros dos componentes sanguíneos liberados para transfusão conterão os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 236)
I - data de entrada dos componentes sanguíneos no serviço de hemoterapia que realizou a liberação para transfusão; (Origem: PRT MS/GM 158/2016, Art. 236, I)
II - número ou alfanúmero de identificação do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, II)
III - especificação da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, III)
IV - volume da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, IV)
V - tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 236, V)
VI - data de validade da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, VI)
VII - data da transfusão; (Origem: PRT MS/GM 158/2016, Art. 236, VII)
VIII - nome completo do receptor; (Origem: PRT MS/GM 158/2016, Art. 236, VIII)
IX - número de registro e localização do receptor; (Origem: PRT MS/GM 158/2016, Art. 236, IX)
X - tipagem ABO e RhD do receptor; (Origem: PRT MS/GM 158/2016, Art. 236, X)
XI - resultado da pesquisa de anticorpos antieritrocitários; e (Origem: PRT MS/GM 158/2016, Art. 236, XI)
XII - resultado das provas de compatibilidade. (Origem: PRT MS/GM 158/2016, Art. 236, XII)
§ 1º As unidades de componentes sanguíneos que não forem utilizadas para transfusões terão registro do seu destino final e do motivo da não utilização. (Origem: PRT MS/GM 158/2016, Art. 236, § 1º)
§ 2º Outros testes laboratoriais que forem necessários serão devidamente registrados. (Origem: PRT MS/GM 158/2016, Art. 236, § 2º)
Art. 236. Serão registrados os números das unidades transfundidas e as reações imediatas associadas a transfusões no prontuário médico do paciente. (Origem: PRT MS/GM 158/2016, Art. 237)
CAPÍTULO II
DA GARANTIA DA QUALIDADE
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II)
Seção I
Dos Princípios Gerais do Sistema da Qualidade
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção I)
Art. 237. O serviço de hemoterapia possuirá manuais de procedimentos operacionais acerca das seguintes atividades do ciclo do sangue: (Origem: PRT MS/GM 158/2016, Art. 238)
I - captação; (Origem: PRT MS/GM 158/2016, Art. 238, I)
II - registro; (Origem: PRT MS/GM 158/2016, Art. 238, II)
III - triagem clínica; (Origem: PRT MS/GM 158/2016, Art. 238, III)
IV - coleta; (Origem: PRT MS/GM 158/2016, Art. 238, IV)
V - triagem laboratorial; (Origem: PRT MS/GM 158/2016, Art. 238, V)
VI - processamento; (Origem: PRT MS/GM 158/2016, Art. 238, VI)
VII - armazenamento; (Origem: PRT MS/GM 158/2016, Art. 238, VII)
VIII - distribuição; (Origem: PRT MS/GM 158/2016, Art. 238, VIII)
IX - transporte; (Origem: PRT MS/GM 158/2016, Art. 238, IX)
X - transfusão; (Origem: PRT MS/GM 158/2016, Art. 238, X)
XI - controle de qualidade dos componentes sanguíneos, insumos críticos e processos; e (Origem: PRT MS/GM 158/2016, Art. 238, XI)
XII - descarte de resíduos. (Origem: PRT MS/GM 158/2016, Art. 238, XII)
§ 1º Os procedimentos operacionais de cada atividade citada serão disponibilizados a todo o pessoal envolvido na atividade. (Origem: PRT MS/GM 158/2016, Art. 238, § 1º)
§ 2º O serviço de hemoterapia avaliará anualmente os procedimentos operacionais tratados no "caput" quanto à necessidade de revisão ou descrição dos processos a serem atualizados, sendo que todas as revisões/atualizações deverão ser registradas. (Origem: PRT MS/GM 158/2016, Art. 238, § 2º)
Art. 238. O serviço de hemoterapia determinará formalmente as atribuições e responsabilidades técnicas e administrativas por processos e/ou áreas. (Origem: PRT MS/GM 158/2016, Art. 239)
Parágrafo Único. O serviço de hemoterapia definirá e divulgará sua missão e sua política da qualidade, considerando os requisitos dos usuários. (Origem: PRT MS/GM 158/2016, Art. 239, Parágrafo Único)
Art. 239. O serviço de hemoterapia disporá de políticas e ações que assegurem a qualidade dos produtos e serviços garantindo que os procedimentos e processos ocorram sob condições controladas. (Origem: PRT MS/GM 158/2016, Art. 240)
§ 1º São, entre outras, as ações de que trata o "caput": (Origem: PRT MS/GM 158/2016, Art. 240, § 1º)
I - métodos e ferramentas de melhoria contínua; (Origem: PRT MS/GM 158/2016, Art. 240, § 1º, I)
II - processos de proposição de ações preventivas e corretivas; e (Origem: PRT MS/GM 158/2016, Art. 240, § 1º, II)
III - tratamento das reclamações e sugestões dos usuários. (Origem: PRT MS/GM 158/2016, Art. 240, § 1º, III)
§ 2º O desempenho dos processos será acompanhado por meio de indicadores e definição de metas. (Origem: PRT MS/GM 158/2016, Art. 240, § 2º)
Art. 240. O serviço de hemoterapia criará processo para identificação, investigação e análise dos desvios, com proposição de ações corretivas e verificação da eficácia das ações. (Origem: PRT MS/GM 158/2016, Art. 241)
Art. 241. O serviço de hemoterapia possuirá o número adequado de profissionais qualificados para a realização das atividades e os pré-requisitos para a realização das funções e tarefas serão formalmente documentados. (Origem: PRT MS/GM 158/2016, Art. 242)
§ 1º O serviço de hemoterapia possuirá programa de treinamento e capacitação de pessoal, constituído de treinamento inicial e continuado relacionado com as tarefas específicas que são realizadas pelo profissional, além de noções sobre medicina transfusional, boas práticas de laboratório e biossegurança. (Origem: PRT MS/GM 158/2016, Art. 242, § 1º)
§ 2º Os treinamentos serão documentados e será realizado procedimento de avaliação de eficácia deles, quando considerado relevante pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 242, § 2º)
§ 3º O serviço de hemoterapia implantará indicadores relacionados com as atividades de treinamento, que serão acompanhados continuamente por sua direção. (Origem: PRT MS/GM 158/2016, Art. 242, § 3º)
Art. 242. O serviço de hemoterapia identificará os equipamentos que são críticos para suas atividades e criará programa baseado em políticas, definição de processos e procedimentos que garanta a adequação destes às atividades relacionadas. (Origem: PRT MS/GM 158/2016, Art. 243)
§ 1º O serviço de hemoterapia possuirá processo de qualificação dos equipamentos baseado em: (Origem: PRT MS/GM 158/2016, Art. 243, § 1º)
I - definição de requisitos exigidos; (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, I)
II - adequação às atividades a que se destinam; (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, II)
III - compatibilização com a infraestrutura disponível; e (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, III)
IV - suporte técnico do fornecedor. (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, IV)
§ 2º Os equipamentos utilizados para coleta, processamento, testes laboratoriais, armazenamento e transfusão do sangue serão objeto de programas de controle, que incluirão a qualificação inicial, a calibração periódica e as manutenções preventiva e corretiva. (Origem: PRT MS/GM 158/2016, Art. 243, § 2º)
§ 3º O serviço de hemoterapia observará os seguintes itens para eleição e qualificação de equipamentos para suas atividades: (Origem: PRT MS/GM 158/2016, Art. 243, § 3º)
I - seleção do equipamento: (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I)
a) especificação do equipamento; (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I, a)
b) compatibilização com infraestrutura do serviço de hemoterapia; e (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I, b)
c) instalação; (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I, c)
II - qualificação dos equipamentos: os equipamentos devem ser qualificados para o uso pretendido, incluindo verificação dos registros pertinentes e do risco para doadores, operadores ou comunidade; e (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, II)
III - uso do equipamento: qualificação dos equipamentos nas condições de utilização na rotina de trabalho. (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, III)
Art. 243. Todos os equipamentos críticos possuirão uma identificação única que permita sua completa rastreabilidade nos processos e procedimentos envolvidos. (Origem: PRT MS/GM 158/2016, Art. 244)
Art. 244. Os equipamentos serão qualificados anteriormente à utilização ou implementação na rotina do serviço de hemoterapia e operados de acordo com as normas especificadas pelo fabricante. (Origem: PRT MS/GM 158/2016, Art. 245)
Art. 245. A calibração e a manutenção preventiva dos equipamentos serão efetuadas em intervalos pré-determinados, utilizando-se métodos definidos e adequados e critérios de aceitação. (Origem: PRT MS/GM 158/2016, Art. 246)
§ 1º Os parâmetros de calibração e de manutenção variam com as características de cada equipamento, conforme especificação técnica do fabricante. (Origem: PRT MS/GM 158/2016, Art. 246, § 1º)
§ 2º Todas as operações de que trata este artigo serão registradas no momento em que serão feitas. (Origem: PRT MS/GM 158/2016, Art. 246, § 2º)
§ 3º Quando forem verificadas irregularidades, serão aplicadas medidas corretivas envolvendo o próprio equipamento e/ou os produtos relacionados a ele. (Origem: PRT MS/GM 158/2016, Art. 246, § 3º)
Art. 246. As não conformidades observadas durante a qualificação, a calibração e a manutenção preventiva dos equipamentos serão adequadamente documentadas, assim como as correções efetuadas, registrando-se os defeitos apresentados pelo equipamento, com a respectiva data do reparo. (Origem: PRT MS/GM 158/2016, Art. 247)
Art. 247. A investigação e o seguimento das falhas dos equipamentos incluirão: (Origem: PRT MS/GM 158/2016, Art. 248)
I - avaliação dos produtos ou serviços fornecidos envolvidos com o equipamento em questão; (Origem: PRT MS/GM 158/2016, Art. 248, I)
II - garantia da segregação do equipamento; (Origem: PRT MS/GM 158/2016, Art. 248, II)
III - investigação do evento; (Origem: PRT MS/GM 158/2016, Art. 248, III)
IV - ações para requalificação do equipamento; e (Origem: PRT MS/GM 158/2016, Art. 248, IV)
V - notificação do evento ao fabricante e às autoridades sanitárias, quando indicado. (Origem: PRT MS/GM 158/2016, Art. 248, V)
Art. 248. O serviço de hemoterapia possuirá programa de manutenção preventiva e calibração de equipamentos, que contemple, entre outros, os requisitos mínimos de manutenção preventiva e calibração periódica, conforme a frequência de ocorrências, do tempo de uso do equipamento ou do padrão de desempenho em avaliações anteriores. (Origem: PRT MS/GM 158/2016, Art. 249)
§ 1º Equipamentos não contemplados em orientações técnicas propostas pelo Ministério da Saúde terão seu programa definido pelo responsável técnico do serviço de hemoterapia utilizando informações do fabricante. (Origem: PRT MS/GM 158/2016, Art. 249, § 1º)
§ 2º Será realizada nova calibração após cada manutenção corretiva que impacte nos parâmetros críticos do equipamento. (Origem: PRT MS/GM 158/2016, Art. 249, § 2º)
Art. 249. O serviço de hemoterapia possuirá câmaras de conservação (cadeia do frio) específicas para componentes sanguíneos, exceto nas situações previstas no art. 151. (Origem: PRT MS/GM 158/2016, Art. 250)
§ 1º As câmaras de conservação serão equipadas com sistema de alarme sonoro e visual. (Origem: PRT MS/GM 158/2016, Art. 250, § 1º)
§ 2º Os alarmes de que trata o § 1º serão testados, pelo menos, a cada 3 (três) meses. (Origem: PRT MS/GM 158/2016, Art. 250, § 2º)
§ 3º Haverá, por escrito, a conduta a ser tomada em relação ao armazenamento dos componentes na hipótese de ocorrência de falta de energia ou defeito nos equipamentos de estocagem. (Origem: PRT MS/GM 158/2016, Art. 250, § 3º)
§ 4º As câmaras de conservação em que se armazenam os componentes sanguíneos serão qualificadas para esta finalidade. (Origem: PRT MS/GM 158/2016, Art. 250, § 4º)
§ 5º As câmaras de conservação para concentrado de hemácias terão um sistema de ventilação para circulação de ar e temperatura uniformemente distribuída em todos os compartimentos. (Origem: PRT MS/GM 158/2016, Art. 250, § 5º)
§ 6º Será disponibilizado um plano de contingência formal para as situações de não conformidades na temperatura de armazenamento que descreva as medidas a serem tomadas em tais situações, para garantir a adequada preservação dos componentes armazenados. (Origem: PRT MS/GM 158/2016, Art. 250, § 6º)
Art. 250. A faixa de temperatura de armazenamento das amostras e reagentes é de 2ºC (dois graus Celsius) a 8ºC (oito graus Celsius), ressalvadas as orientações específicas de fabricantes ou ensaios laboratoriais. (Origem: PRT MS/GM 158/2016, Art. 251)
§ 1º É recomendável que as câmaras de conservação utilizadas para armazenamento de reagentes e amostras de sangue de doadores e pacientes tenham registrador contínuo de temperatura. (Origem: PRT MS/GM 158/2016, Art. 251, § 1º)
§ 2º Caso o serviço de hemoterapia não possua o registrador de que trata o § 1º, as câmaras de conservação deverão possuir termômetro de registro de temperatura máxima e mínima, e a temperatura será verificada e registrada a cada 12 (doze) horas. (Origem: PRT MS/GM 158/2016, Art. 251, § 2º)
Art. 251. Os banhos termostatizados (banhos-maria) ou incubadoras possuirão termômetro de uso exclusivo. (Origem: PRT MS/GM 158/2016, Art. 252)
Parágrafo Único. A temperatura será registrada a cada 24 (vinte e quatro) horas e conferida imediatamente antes do uso do equipamento. (Origem: PRT MS/GM 158/2016, Art. 252, Parágrafo Único)
Art. 252. A direção do serviço de hemoterapia implantará processos de controle interno com o objetivo de verificar o cumprimento dos requisitos pré-definidos. (Origem: PRT MS/GM 158/2016, Art. 253)
Parágrafo Único. Os resultados serão registrados e revisados pela direção do serviço de hemoterapia e pela área auditada com proposição de ações corretivas e preventivas. (Origem: PRT MS/GM 158/2016, Art. 253, Parágrafo Único)
Art. 253. O serviço de hemoterapia manterá um sistema de controle e qualificação de produtos e serviços críticos, o que inclui a inspeção dos produtos quando do recebimento e da sua utilização e o monitoramento dos resultados obtidos com o insumo (gestão de fornecedores e insumos). (Origem: PRT MS/GM 158/2016, Art. 254)
§ 1º A lista de materiais e serviços críticos será definida pelo responsável técnico do serviço de hemoterapia, que conterá entre outros: (Origem: PRT MS/GM 158/2016, Art. 254, § 1º)
I - os conjuntos diagnósticos de sorologia e de imuno-hematologia; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, I)
II - filtros de desleucocitação; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, II)
III - conjuntos para aférese; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, III)
IV - bolsas para coleta e conservação de componentes; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, IV)
V - equipo de transfusão; e (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, V)
VI - bolsas. (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, VI)
§ 2º O serviço de hemoterapia criará um sistema que permita a rastreabilidade de lote e validade de todos os insumos considerados críticos. (Origem: PRT MS/GM 158/2016, Art. 254, § 2º)
§ 3º O serviço de hemoterapia implantará programa de qualificação de fornecedores e de produtos e serviços críticos e acompanhará o desempenho destes durante a utilização. (Origem: PRT MS/GM 158/2016, Art. 254, § 3º)
§ 4º O serviço de hemoterapia possuirá condições adequadas para armazenamentos dos insumos respeitando orientações dos fabricantes. (Origem: PRT MS/GM 158/2016, Art. 254, § 4º)
§ 5º O manuseio dos produtos de que trata o § 4º deverá evitar inversões (trocas), danos, deterioração ou outros efeitos adversos. (Origem: PRT MS/GM 158/2016, Art. 254, § 5º)
§ 6º Antes da inspeção inicial, os insumos críticos recém-recebidos permanecerão identificados até a sua liberação para uso. (Origem: PRT MS/GM 158/2016, Art. 254, § 6º)
§ 7º O armazenamento será realizado de maneira a facilitar a rotatividade dos estoques. (Origem: PRT MS/GM 158/2016, Art. 254, § 7º)
§ 8º As condições de armazenamento serão avaliadas periodicamente. (Origem: PRT MS/GM 158/2016, Art. 254, § 8º)
§ 9º Para evitar perdas serão considerados os prazos de validade dos produtos no momento de liberação para uso. (Origem: PRT MS/GM 158/2016, Art. 254, § 9º)
Seção II
Da Infraestrutura
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção II)
Art. 254. Áreas e equipamentos serão distribuídos, construídos ou adaptados para facilitar as atividades realizadas no serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 255)
§ 1º A disposição dos equipamentos e o fluxo de trabalho terão como objetivo a minimização de erros. (Origem: PRT MS/GM 158/2016, Art. 255, § 1º)
§ 2º No processo de gestão de infraestrutura será considerada a legislação específica vigente. (Origem: PRT MS/GM 158/2016, Art. 255, § 2º)
Art. 255. O serviço de hemoterapia possuirá programa de manutenção preventiva para equipamentos e instalações relacionados com infraestrutura como, entre outros: (Origem: PRT MS/GM 158/2016, Art. 256)
I - grupo gerador de emergência; (Origem: PRT MS/GM 158/2016, Art. 256, I)
II - quadro de distribuição de energia; (Origem: PRT MS/GM 158/2016, Art. 256, II)
III - Sistema de Proteção Contra Descarga Atmosférica (SPDA) e aterramento; (Origem: PRT MS/GM 158/2016, Art. 256, III)
IV - sistema de ar condicionado; e (Origem: PRT MS/GM 158/2016, Art. 256, IV)
V - caixas d'água. (Origem: PRT MS/GM 158/2016, Art. 256, V)
Art. 256. O serviço de hemoterapia possuirá programa de manutenção preventiva para sistemas de proteção e combate a incêndios e Equipamentos de Proteção Coletiva (EPC). (Origem: PRT MS/GM 158/2016, Art. 257)
Seção III
Da Biossegurança
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção III)
Art. 257. O serviço de hemoterapia manterá procedimentos escritos a respeito das normas de biossegurança a serem seguidas por todos os funcionários. (Origem: PRT MS/GM 158/2016, Art. 258)
Parágrafo Único. Haverá capacitação e educação continuada de toda a equipe acerca dos procedimentos de biossegurança. (Origem: PRT MS/GM 158/2016, Art. 258, Parágrafo Único)
Art. 258. O serviço de hemoterapia disponibilizará os Equipamentos de Proteção Individual (EPI) e Coletiva (EPC) necessários para a segurança dos seus funcionários. (Origem: PRT MS/GM 158/2016, Art. 259)
Parágrafo Único. As áreas e procedimentos desenvolvidos serão mapeados para identificação dos riscos presentes e os EPI e EPC necessários. (Origem: PRT MS/GM 158/2016, Art. 259, Parágrafo Único)
Art. 259. Áreas, equipamentos e superfícies de trabalho com risco de contaminação por sangue ou outros elementos receberão limpeza diária e desinfecção. (Origem: PRT MS/GM 158/2016, Art. 260)
§ 1º Respingos visíveis serão limpos imediatamente. (Origem: PRT MS/GM 158/2016, Art. 260, § 1º)
§ 2º Os procedimentos de que trata o "caput" serão descritos em procedimentos operacionais específicos. (Origem: PRT MS/GM 158/2016, Art. 260, § 2º)
Art. 260. Os profissionais envolvidos com processos de risco trajarão roupas e sapatos que assegurem a sua proteção. (Origem: PRT MS/GM 158/2016, Art. 261)
Seção IV
Do Descarte de Resíduos
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção IV)
Art. 261. No descarte de sangue total, componentes e resíduos de laboratório será observado o disposto no Plano de Gerenciamento de Resíduos de Serviços de Saúde (PGRSS) e serão respeitadas as demais normas técnico-sanitárias pertinentes editadas pela ANVISA e outros órgãos reguladores. (Origem: PRT MS/GM 158/2016, Art. 262)
Art. 262. O serviço de hemoterapia indicará o profissional de nível superior de seu quadro que será responsável pela elaboração e implantação do PGRSS da instituição. (Origem: PRT MS/GM 158/2016, Art. 263)
Art. 263. O serviço de hemoterapia possuirá programa decapacitação e educação continuada envolvendo todos os profissionais, inclusive os funcionários de empresas contratadas (terceirizadas) no manuseio de resíduos de serviços de saúde (RSS). (Origem: PRT MS/GM 158/2016, Art. 264)
Art. 264. Se o serviço de hemoterapia optar pelo tratamento interno de seus resíduos, este será realizado em equipamento qualificado e procedimento validado. (Origem: PRT MS/GM 158/2016, Art. 265)
Parágrafo Único. Será assegurado que a empresa contratada para transporte, tratamento e destinação final seja licenciada pelos órgãos ambientais. (Origem: PRT MS/GM 158/2016, Art. 265, Parágrafo Único)
Seção V
Do Transporte
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção V)
Art. 265. O envio de sangue e componentes para uso terapêutico e amostras para realização de exames laboratoriais em outra instituição de assistência à saúde obedecerá à legislação relacionada vigente, às normas de biossegurança e às exigências técnicas relacionadas à sua conservação. (Origem: PRT MS/GM 158/2016, Art. 266)
Parágrafo Único. A orientação técnica quanto às condições de transporte ficará a cargo do serviço de hemoterapia fornecedor e será formalizada no contrato, convênio ou termo de compromisso. (Origem: PRT MS/GM 158/2016, Art. 266, Parágrafo Único)
Art. 266. O envio de bolsas de componentes sanguíneos para finalidades não terapêuticas, como matéria-prima para a utilização em pesquisa, produção de reagentes ou painéis de controle de qualidade pelo serviço de hemoterapia, será informado à autoridade de vigilância sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 267)
Art. 267. O envio de plasma fresco congelado e plasma não fresco para indústria de hemoderivados será definido e autorizado pelo Ministério da Saúde, quando houver destino viável para uso em interesse nacional para produção de medicamentos hemoderivados e ou medicamentos estratégicos. (Origem: PRT MS/GM 158/2016, Art. 268)
Parágrafo Único. As especificações técnicas do plasma, armazenamento e transporte serão normatizadas pela ANVISA, sem prejuízo do disposto neste Anexo. (Origem: PRT MS/GM 158/2016, Art. 268, Parágrafo Único)
Art. 268. O envio de componentes sanguíneos será acompanhado por documento que contenha os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 269)
I - nome, endereço e telefone de contato do serviço de hemoterapia remetente do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 269, I)
II - nome, endereço e telefone de contato do serviço de hemoterapia de destino do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 269, II)
III - relação dos componentes sanguíneos enviados, com os seus respectivos números de identificação; (Origem: PRT MS/GM 158/2016, Art. 269, III)
IV - condições de conservação; (Origem: PRT MS/GM 158/2016, Art. 269, IV)
V - data e hora da retirada; e (Origem: PRT MS/GM 158/2016, Art. 269, V)
VI - identificação do responsável pelo transporte dos componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 269, VI)
Art. 269. O componente sanguíneo será transportado em temperaturas adequadas para a manutenção das suas propriedades biológicas. (Origem: PRT MS/GM 158/2016, Art. 270)
§ 1º Os recipientes de transporte serão resistentes, impedirão vazamentos e possibilitarão a lavagem e desinfecção regular. (Origem: PRT MS/GM 158/2016, Art. 270, § 1º)
§ 2º O sangue total coletado em locais diferentes daqueles em que será processado será transportado à temperatura de 22 ± 2°C (vinte a vinte e quatro graus Celsius), sendo que para produção de concentrado de plaquetas a temperatura de transporte não poderá ser inferior a 20°C (vinte graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 2º)
§ 3º Se o sangue total não for destinado à produção de concentrado de plaquetas, ele poderá ser transportado à temperatura de 1°C (um grau Celsius) a 10°C (dez graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 3º)
§ 4º Os concentrados de hemácias serão transportados de forma a assegurar a manutenção da temperatura entre 1 °C (um grau Celsius) e 10°C (dez graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 4º)
§ 5º Os concentrados de plaquetas e de granulócitos serão conservados e transportados à temperatura de 22±2 °C (vinte a vinte e quatro graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 5º)
§ 6º É recomendado que os concentrados de plaquetas sejam agitados antes do uso se a agitação não for mantida durante o transporte. (Origem: PRT MS/GM 158/2016, Art. 270, § 6º)
§ 7º Os componentes serão mantidos congelados durante o transporte, quando for o caso. (Origem: PRT MS/GM 158/2016, Art. 270, § 7º)
§ 8º Os componentes descongelados serão transportados em temperaturas entre 1°C (um grau Celsius) e 10°C (dez graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 8º)
§ 9º O aspecto de cada unidade será inspecionado no momento do envio e no momento da recepção, sendo descartadas todas as unidades que apresentem alterações à inspeção visual. (Origem: PRT MS/GM 158/2016, Art. 270, § 9º)
Art. 270. Os componentes sanguíneos serão transportados por profissionais orientados quanto às condições de transporte e os procedimentos a serem realizados em eventuais intercorrências. (Origem: PRT MS/GM 158/2016, Art. 271)
Art. 271. As condições de transporte e acondicionamento de sangue total e componente sanguíneos, relativo à capacidade máxima de bolsas por embalagem, quantitativo de material refrigerante, capacidade de empilhamento e sistema de monitoramento da temperatura, serão validadas a fim de garantir a integridade do produto durante todo o percurso previsto. (Origem: PRT MS/GM 158/2016, Art. 272)
Parágrafo Único. Recomenda-se, no mínimo, a execução das atividades de transporte conforme descrito no Anexo 10 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 272, Parágrafo Único)
Seção VI
Dos Contratos, Convênios e Termos de Compromisso
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção VI)
Art. 272. O serviço de hemoterapia que distribui componentes sanguíneos para estoque formalizará por escrito com o serviço de hemoterapia receptor, um contrato, convênio ou termo de compromisso no qual constará: (Origem: PRT MS/GM 158/2016, Art. 273)
I - nomes e dados jurídicos das instituições envolvidas; (Origem: PRT MS/GM 158/2016, Art. 273, I)
II - responsabilidades técnicas e financeiras de cada uma das partes, respeitando-se todas as normas técnicas constantes deste Anexo; (Origem: PRT MS/GM 158/2016, Art. 273, II)
III - responsabilidade pelo transporte adequado do sangue e seus componentes; (Origem: PRT MS/GM 158/2016, Art. 273, III)
IV - penalidades para o não cumprimento das obrigações; e (Origem: PRT MS/GM 158/2016, Art. 273, IV)
V - vigência. (Origem: PRT MS/GM 158/2016, Art. 273, V)
Art. 273. Outras situações não contempladas neste Anexo quanto aos Contratos, Convênios e Termo de Compromisso ficarão a critério das partes envolvidas. (Origem: PRT MS/GM 158/2016, Art. 274)
CAPÍTULO III
DO PROGRAMA NACIONAL DE CONTROLE DE QUALIDADE EXTERNO EM SOROLOGIA E IMUNO-HEMATOLOGIA
Art. 274. Fica instituído o Programa Nacional de Controle de Qualidade Externo em Sorologia e lmunohematologia para Unidades Hemoterápicas (PNCQES), ao qual estão sujeitos todos os serviços de hemoterapia, públicos e privados, em todo Território Nacional. (Origem: PRT MS/GM 1840/1996, Art. 1º)
Parágrafo Único. Caberá ao Sistema único de Saúde, por meio de seus órgãos competentes, fiscalizar e coordenar o cumprimento das normas estabelecidas neste Capítulo e Anexo 12 do Anexo IV . (Origem: PRT MS/GM 1840/1996, Art. 1º, Parágrafo Único)
Art. 275. Todas as Unidades Hemoterápicas públicas e privadas, existentes no País, que executam testes acrológicos para triagem de doadores de sangue, por si ou por meio de terceiros, então sujeitas ao PNCQES. (Origem: PRT MS/GM 1840/1996, Art. 4º)
§ 1º Entende-se por Unidades Hemoterápicas aquelas enquadradas ou definidas na Portaria-SVS nº 121. de 24 de novembro de 1995 (anexo I), excetuando-se, para enquadramento neste Capítulo, as agências transfusionais. (Origem: PRT MS/GM 1840/1996, Art. 4º, § 1º)
§ 2º Em especifico, os Postos de Coleta, Unidades de Coleta e Transfusão, ou qualquer serviço de hemoterapia que colete o sangue destinado à transfusão, deverá obrigatoriamente certificar-se, acompanhar e possuir cópias dos laudos técnicos e das medidas corretivas, se houverem, provando que o laboratório ou Unidade Hemoterápica aonde os testes sorológicos são executados, estão regulares no PNCQES, conforme exigências deste Capítulo. (Origem: PRT MS/GM 1840/1996, Art. 4º, § 2º)
Art. 276. O cumprimento deste Capítulo será condição precípua para a obtenção e revalidação do licenciamento junto às Secretarias de Saúde dos Estados e do Distrito Federal. (Origem: PRT MS/GM 1840/1996, Art. 5º)
Art. 277. O não cumprimento das normas estabelecidas por este Capítulo será considerado falta grave e resultará no descredenciamento do serviço junto ao SUS e aplicação das sanções previstas na Lei nº 6.437. de 20 de agosto de 1977. (Origem: PRT MS/GM 1840/1996, Art. 6º)
Art. 278. O PNCQES será coordenado pela Secretaria de Vigilância Sanitária do Ministério da Saúde em consonância com as diretrizes e procedimentos estabelecidos pela Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1544/1997, Art. 2º)
Art. 279. Os serviços de hemoterapia, públicos e privados, autônomos ou integrantes da estrutura de estabelecimentos de saúde, ficam sujeitos às normas fixadas na Lei n.º 7649, de 25 de janeiro de 1988, no seu Regulamento, aprovado pelo Decreto n.º 95721, de 11 de janeiro de 1988, à regulamentação do Programa Nacional de Controle de Qualidade Externo em Sorologia para Unidades Hemoterápicas (PNCQES), bem como às demais constantes na legislação de vigilância sanitária. (Origem: PRT MS/GM 1544/1997, Art. 3º)
§ 1º O disposto no caput aplica-se, inclusive, aos estabelecimentos de saúde que realizem procedimentos médico-cirúrgicos para os quais seja necessária a utilização de sangue para transfusão. (Origem: PRT MS/GM 1544/1997, Art. 3º, § 1º)
§ 2º Os estabelecimentos referidos no art. 279, § 1º , quando não dispuserem de serviços hemoterápicos próprios, deverão comprovar, para esse fim, a contratação de serviços hemoterápicos com instituição licenciada pelo órgão de vigilância sanitária competente. (Origem: PRT MS/GM 1544/1997, Art. 3º, § 2º)
Art. 280. Os painéis de soros e hemácias para controle, certificação e garantia de qualidade, utilizados no país, serão registrados na Secretaria de Vigilância Sanitária do Ministério da Saúde. (Origem: PRT MS/GM 1544/1997, Art. 4º)
Art. 281. Caberá à Secretaria de Vigilância Sanitária do Ministério da Saúde estabelecer, em conjunto com os órgãos de Vigilância Sanitária Estaduais, a programação anual das inspeções, bem como a demanda e o suprimento de painéis de soros e hemácias, os procedimentos de avaliação dos sistemas de controle dos serviços hemoterápicos e as medidas corretivas pertinentes. (Origem: PRT MS/GM 1544/1997, Art. 5º)
Parágrafo Único. Caberá ao Ministério da Saúde a aquisição dos painéis de soros e hemácias para distribuição às Vigilâncias Sanitárias Estaduais. (Origem: PRT MS/GM 1544/1997, Art. 5º, Parágrafo Único)
Art. 282. A análise de referência dos conjuntos e reagentes diagnósticos registrados e comercializados no país, utilizados nos serviços hemoterápicos, será executada pelos laboratórios oficiais de controle de qualidade, Integrantes da Rede Nacional de Laboratórios Oficiais de Saúde Pública. (Origem: PRT MS/GM 1544/1997, Art. 6º)
CAPÍTULO IV
DOS GRUPOS DE ASSESSORAMENTO TÉCNICO (GAT)
Seção I
Do Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Sorologia (AEQ - Sorologia)
Art. 283. Fica instituído o Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Sorologia (AEQ - Sorologia), com a finalidade de assessorar a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1589/2011, Art. 1º)
Art. 284. Competirá ao GAT: (Origem: PRT MS/GM 1589/2011, Art. 2º)
I - assessorar tecnicamente a CGSH/DAET/SAS/MS em assuntos relacionados ao AEQ - Sorologia, visando analisar resultados; (Origem: PRT MS/GM 1589/2011, Art. 2º, I)
II - determinar ações a serem tomadas; e (Origem: PRT MS/GM 1589/2011, Art. 2º, II)
III - participar da produção científica/educativa do Programa e de consultorias. (Origem: PRT MS/GM 1589/2011, Art. 2º, III)
Art. 285. O GAT será constituído por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1589/2011, Art. 3º)
I - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 1589/2011, Art. 3º, I)
a) CGSH/DAET/SAS/MS, que o coordenará; (Origem: PRT MS/GM 1589/2011, Art. 3º, I, a)
II - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1589/2011, Art. 3º, II)
III - Hemocentro da Universidade Estadual de Campinas (UNICAMP); (Origem: PRT MS/GM 1589/2011, Art. 3º, III)
IV - Hemocentro Coordenador do Rio de Janeiro (HEMORIO); (Origem: PRT MS/GM 1589/2011, Art. 3º, IV)
V - Hemocentro Coordenador de Santa Catarina (HEMOSC); (Origem: PRT MS/GM 1589/2011, Art. 3º, V)
VI - Fundação Pró-Sangue - Hemocentro de São Paulo; (Origem: PRT MS/GM 1589/2011, Art. 3º, VI)
VII - Instituto de Tecnologia em Imunobiológicos da Fundação Oswaldo Cruz (Biomanguinhos/FIOCRUZ); (Origem: PRT MS/GM 1589/2011, Art. 3º, VII)
VIII - Universidade Federal de Goiás (UFG); e (Origem: PRT MS/GM 1589/2011, Art. 3º, VIII)
IX - Instituto Nacional de Controle de Qualidade em Saúde da Fundação Oswaldo Cruz (INCQS/FIOCRUZ). (Origem: PRT MS/GM 1589/2011, Art. 3º, IX)
Parágrafo Único. Os representantes, titulares e suplentes, serão indicados, pelos dirigentes de seus respectivos órgãos e entidades à Coordenação do GAT. (Origem: PRT MS/GM 1589/2011, Art. 3º, Parágrafo Único)
Art. 286. O GAT poderá convidar servidores dos órgãos e entidades do Ministério da Saúde, de outros órgãos da Administração Pública Federal, de entidades não-governamentais, bem como especialistas em assuntos ligados ao tema, cujas presenças sejam consideradas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1589/2011, Art. 4º)
Art. 287. As funções dos membros do GAT não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1589/2011, Art. 5º)
Seção II
Do Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Imuno-hematologia (AEQ Imuno-hematologia)
Art. 288. Fica instituído o Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Imunohematologia (AEQ Imunohematologia), com a finalidade de assessorar a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1588/2011, Art. 1º)
Art. 289. Competirá ao GAT: (Origem: PRT MS/GM 1588/2011, Art. 2º)
I - assessorar tecnicamente a CGSH/DAET/SAS/MS em assuntos relacionados ao AEQ Imunohematologia, visando analisar resultados; (Origem: PRT MS/GM 1588/2011, Art. 2º, I)
II - determinar ações a serem tomadas; e (Origem: PRT MS/GM 1588/2011, Art. 2º, II)
III - participar da produção científica/educativa do Programa e de consultorias. (Origem: PRT MS/GM 1588/2011, Art. 2º, III)
Art. 290. O GAT será constituído por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1588/2011, Art. 3º)
I - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 1588/2011, Art. 3º, I)
a) CGSH/DAET/SAS/MS, que o coordenará; (Origem: PRT MS/GM 1588/2011, Art. 3º, I, a)
II - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1588/2011, Art. 3º, II)
III - Hemocentro Coordenador do Rio de Janeiro (HEMORIO); (Origem: PRT MS/GM 1588/2011, Art. 3º, III)
IV - Hemocentro Coordenador de Santa Catarina (HEMOSC); (Origem: PRT MS/GM 1588/2011, Art. 3º, IV)
V - Hemocentro da Universidade Estadual de Campinas (UNICAMP); (Origem: PRT MS/GM 1588/2011, Art. 3º, V)
VI - Hemocentro de Botucatu (UNESP); (Origem: PRT MS/GM 1588/2011, Art. 3º, VI)
VII - Fundação de Hematologia e Hemoterapia do Amazonas (HEMOAM); (Origem: PRT MS/GM 1588/2011, Art. 3º, VII)
VIII - Fundação Centro de Hemoterapia e Hematologia do Pará (HEMOPA); (Origem: PRT MS/GM 1588/2011, Art. 3º, VIII)
IX - Hemocentro Coordenador de Pernambuco (Fundação HEMOPE); e (Origem: PRT MS/GM 1588/2011, Art. 3º, IX)
X - Fundação Centro de Hematologia e Hemoterapia de Minas Gerais (HEMOMINAS). (Origem: PRT MS/GM 1588/2011, Art. 3º, X)
Parágrafo Único. Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos e entidades, à Coordenação do GAT. (Origem: PRT MS/GM 1588/2011, Art. 3º, Parágrafo Único)
Art. 291. O GAT poderá convidar servidores dos órgãos e entidades do Ministério da Saúde, de outros órgãos da Administração Pública Federal, de entidades não governamentais, bem como especialistas em assuntos ligados ao tema, cujas presenças sejam consideradas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1588/2011, Art. 4º)
Art. 292. As funções dos membros do GAT não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1588/2011, Art. 5º)
Seção III
Do Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Hemocomponentes (AEQ - Hemocomponentes)
Art. 293. Fica instituído o Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Hemocomponentes (AEQ - Hemocomponentes), com a finalidade de assessorar a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1587/2011, Art. 1º)
Art. 294. Competirá ao GAT: (Origem: PRT MS/GM 1587/2011, Art. 2º)
I - assessorar tecnicamente a CGSH/DAET/SAS/MS em assuntos relacionados ao AEQ - Hemocomponentes, visando analisar resultados; (Origem: PRT MS/GM 1587/2011, Art. 2º, I)
II - determinar ações a serem tomadas; e (Origem: PRT MS/GM 1587/2011, Art. 2º, II)
III - participar da produção cientifica/educativa do Programa e de consultorias. (Origem: PRT MS/GM 1587/2011, Art. 2º, III)
Art. 295. O GAT será constituído por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1587/2011, Art. 3º)
I - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 1587/2011, Art. 3º, I)
a) CGSH/DAET/SAS/MS, que o coordenará; (Origem: PRT MS/GM 1587/2011, Art. 3º, I, a)
II - Hemocentro Coordenador do Rio de Janeiro (HEMORIO); (Origem: PRT MS/GM 1587/2011, Art. 3º, II)
III - Hemocentro Coordenador de Santa Catarina (HEMOSC); (Origem: PRT MS/GM 1587/2011, Art. 3º, III)
IV - Fundação Pró-Sangue - Hemocentro de São Paulo; (Origem: PRT MS/GM 1587/2011, Art. 3º, IV)
V - Fundação Hemocentro de Brasília; (Origem: PRT MS/GM 1587/2011, Art. 3º, V)
VI - Hemocentro Coordenador de Pernambuco (Fundação HEMOPE); e (Origem: PRT MS/GM 1587/2011, Art. 3º, VI)
VII - Fundação de Hematologia e Hemoterapia de Minas Gerais (HEMOMINAS). (Origem: PRT MS/GM 1587/2011, Art. 3º, VII)
Parágrafo Único. Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos e entidades, à Coordenação do GAT. (Origem: PRT MS/GM 1587/2011, Art. 3º, Parágrafo Único)
Art. 296. O GAT poderá convidar servidores dos órgãos e entidades do Ministério da Saúde, de outros órgãos da Administração Pública Federal, de entidades nãogovernamentais, bem como especialistas em assuntos ligados ao tema, cujas presenças sejam consideradas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1587/2011, Art. 4º)
Art. 297. As funções dos membros do GAT não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1587/2011, Art. 5º)
CAPÍTULO V
DAS COMISSÕES DE ASSESSORAMENTO TÉCNICO
Seção I
Das Comissões de Assessoramento Técnico às Coagulopatias, outras Doenças Hemorrágicas Hereditárias e Plaquetopatias (CAT - Coagulopatias) e ao Diagnóstico Laboratorial em Hemostasia (CAT-Hemostasia)
Art. 298. Ficam instituídas, no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN), a Comissão de Assessoramento Técnico às Coagulopatias, outras Doenças Hemorrágicas Hereditárias e Plaquetopatias (CAT-Coagulopatias) e a Comissão de Assessoramento Técnico ao Diagnóstico Laboratorial em Hemostasia (CAT-Hemostasia). (Origem: PRT MS/GM 1880/2012, Art. 1º)
Art. 299. A CAT-Coagulopatias tem por finalidades: (Origem: PRT MS/GM 1880/2012, Art. 2º)
I - contribuir com a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS) na formulação da política nacional para a atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 2º, I)
II - acompanhar as ações e atividades do Programa Nacional de Coagulopatias Hereditárias, no âmbito do Sistema Único de Saúde (SUS), a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de tratamento e atenção à saúde dos pacientes, sob responsabilidade do SINASAN; (Origem: PRT MS/GM 1880/2012, Art. 2º, II)
III - propor à CGSH/DAET/SAS/MS políticas, ações e atividades para o referido Programa Nacional de Coagulopatias Hereditárias e para o desenvolvimento das ações de atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 2º, III)
IV - sugerir à CGSH/DAET/SAS/MS publicações referentes ao Programa Nacional de Coagulopatias Hereditárias; e (Origem: PRT MS/GM 1880/2012, Art. 2º, IV)
V - instituir Grupos de Trabalho para o desenvolvimento de atividades específicas relacionadas ao cumprimento de suas finalidades. (Origem: PRT MS/GM 1880/2012, Art. 2º, V)
Art. 300. A CAT-Coagulopatias é composta por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1880/2012, Art. 3º)
I - um representante da CGSH/DAET/SAS/MS, que a coordenará; (Origem: PRT MS/GM 1880/2012, Art. 3º, I)
II - cinco representantes da área de hematologia clínica com ênfase em hemostasia e trombose e que desenvolvam atividades no âmbito do SUS; e (Origem: PRT MS/GM 1880/2012, Art. 3º, II)
III - um representante dos usuários do Programa Nacional de Coagulopatias Hereditárias. (Origem: PRT MS/GM 1880/2012, Art. 3º, III)
§ 1º Os representantes de que tratam os incisos I e II do caput serão indicados pela Secretaria de Atenção à Saúde (SAS/MS) à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 1º)
§ 2º O representante de que trata o inciso III do caput será indicado pela Federação Brasileira de Hemofilia à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 2º)
§ 3º Os órgãos e entidades integrantes do CAT-Coagulopatias deverão revisar e indicar, a cada dois anos, os seus representantes no âmbito da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 3º)
§ 4º Para os fins do art. 300, § 3º , a substituição dos membros de que trata o inciso II do "caput" não poderá ser superior a um terço dos citados representantes. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 4º)
Art. 301. A CAT-Hemostasia tem por finalidades: (Origem: PRT MS/GM 1880/2012, Art. 4º)
I - contribuir com a CGSH/DAET/SAS/MS na formulação da política nacional para a atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 4º, I)
II - acompanhar as ações e atividades do Programa Nacional de Coagulopatias Hereditárias no âmbito do SUS, a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de diagnóstico clínico e laboratorial para a atenção à saúde dos pacientes, sob responsabilidade do SINASAN; (Origem: PRT MS/GM 1880/2012, Art. 4º, II)
III - propor à CGSH/DAET/SAS/MS políticas, ações e atividades para o referido Programa Nacional de Coagulopatias Hereditárias e para o desenvolvimento das ações de atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 4º, III)
IV - sugerir à CGSH/DAET/SAS/MS publicações referentes ao Programa Nacional de Coagulopatias Hereditárias; e (Origem: PRT MS/GM 1880/2012, Art. 4º, IV)
V - instituir Grupos de Trabalho específicos para o desenvolvimento de atividades específicas relacionadas ao cumprimento de suas finalidades. (Origem: PRT MS/GM 1880/2012, Art. 4º, V)
Art. 302. A CAT-Hemostasia é composta por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1880/2012, Art. 5º)
I - um representante da CGSH/DAET/SAS/MS, que a coordenará; e (Origem: PRT MS/GM 1880/2012, Art. 5º, I)
II - seis representantes da área de diagnóstico laboratorial em hemostasia e trombose e que desenvolvam atividades no âmbito do SUS; e (Origem: PRT MS/GM 1880/2012, Art. 5º, II)
III - um representante dos usuários do Programa Nacional de Coagulopatias Hereditárias. (Origem: PRT MS/GM 1880/2012, Art. 5º, III)
§ 1º Os representantes de que tratam os incisos I e II do caput serão indicados pela Secretaria de Atenção à Saúde (SAS/MS) à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 1º)
§ 2º O representante de que trata o inciso III do caput será indicado pela Federação Brasileira de Hemofilia à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 2º)
§ 3º Os órgãos e entidades integrantes do CAT-Hemostasia deverão revisar e indicar, a cada dois anos, os seus representantes no âmbito da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 3º)
§ 4º Para os fins do art. 302, § 3º , a substituição dos membros de que trata o inciso II do "caput" não poderá ser superior a um terço dos citados representantes. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 4º)
Art. 303. A participação na CAT-Coagulopatias e na CAT- Hemostasia é considerada como de relevante interesse público e não será remunerada. (Origem: PRT MS/GM 1880/2012, Art. 6º)
Parágrafo Único. As Comissões poderão convidar entidades ou pessoas do setor público e privado, que atuem profissionalmente em atividades relacionadas ao tema, sempre que entender necessária a sua colaboração para o pleno alcance das suas finalidades. (Origem: PRT MS/GM 1880/2012, Art. 6º, Parágrafo Único)
Art. 304. Os membros da CAT-Coagulopatias e da CAT-Hemostasia devem subscrever as seguintes declarações por ocasião do início de suas atividades nas Comissões: (Origem: PRT MS/GM 1880/2012, Art. 7º)
I - declaração de conflito de interesse; e (Origem: PRT MS/GM 1880/2012, Art. 7º, I)
II - declaração de confidencialidade. (Origem: PRT MS/GM 1880/2012, Art. 7º, II)
§ 1º Em caso de conflito de interesse por qualquer dos membros das Comissões, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) avaliar a conveniência ou não da manutenção do representante na Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 1880/2012, Art. 7º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros das Comissões, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) efetuar a imediata retirada do representante da Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 1880/2012, Art. 7º, § 2º)
Art. 305. A CAT-Coagulopatias e a CAT-Hemostasia reunir-se-ão por convocação da Coordenação ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 1880/2012, Art. 8º)
§ 1º Compete à CGSH/DAET/SAS/MS a convocação dos membros, a organização das reuniões, a elaboração e divulgação da pauta e atas de reunião e o arquivo dos documentos elaborados. (Origem: PRT MS/GM 1880/2012, Art. 8º, § 1º)
§ 2º Os temas a serem incluídos na pauta de reunião serão propostos pela CGSH/DAET/SAS/MS ou pelos membros das comissões. (Origem: PRT MS/GM 1880/2012, Art. 8º, § 2º)
§ 3º O Ministério da Saúde custeará despesas de passagens e diárias para participação de membros ou convidados nas reuniões da CAT-Coagulopatias e da CAT-Hemostasia. (Origem: PRT MS/GM 1880/2012, Art. 8º, § 3º)
Art. 306. A ausência do titular ou suplente, sem justificativa, a duas reuniões consecutivas da Comissão acarretará a sua exclusão. (Origem: PRT MS/GM 1880/2012, Art. 9º)
Parágrafo Único. Compete à CGSH/DAET/SAS/MS adotar as providências necessárias para o cumprimento do disposto neste artigo, inclusive requerer ao órgão ou à entidade interessada que efetive a indicação de novo representante para recompor a Comissão. (Origem: PRT MS/GM 1880/2012, Art. 9º, Parágrafo Único)
Seção II
Da Comissão de Assessoramento Técnico em Gestão de Equipamentos (CAT-Gestão de Equipamentos), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
Art. 307. Fica instituída a Comissão de Assessoramento Técnico em Gestão de Equipamentos (CAT-Gestão de Equipamentos), no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN). (Origem: PRT MS/GM 2543/2014, Art. 1º)
Art. 308. A CAT-Gestão de Equipamentos tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 2543/2014, Art. 2º)
I - elaborar propostas na área de Gestão de Equipamentos, visando minimizar as desigualdades regionais, otimizando a aplicação de recursos, adequação e incorporação de novas tecnologias em saúde, na segurança dos trabalhadores e na qualificação de produtos e serviços na área de sangue e derivados; (Origem: PRT MS/GM 2543/2014, Art. 2º, I)
II - contribuir com a CGSH/DAHU/SAS/MS no acompanhamento e monitoramento das ações e atividades da área de Gestão de Equipamentos, no âmbito dos serviços de hematologia e hemoterapia do Sistema Único de Saúde (SUS), a fim de atender a legislação vigente e qualificar a Hemorrede Pública Nacional, sob responsabilidade do SINASAN; e (Origem: PRT MS/GM 2543/2014, Art. 2º, II)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de Gestão de Equipamentos. (Origem: PRT MS/GM 2543/2014, Art. 2º, III)
Art. 309. A CAT-Gestão de Equipamentos é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2543/2014, Art. 3º) (com redação dada pela PRT MS/GM 325/2015)
I - 4 (quatro) representantes da CGSH/DAHU/SAS/MS; (Origem: PRT MS/GM 2543/2014, Art. 3º, I)
II - 1 (um) representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2543/2014, Art. 3º, II)
III - 5 (cinco) representantes dos serviços de saúde públicos, preferencialmente vinculados a serviços de hematologia e hemoterapia; e (Origem: PRT MS/GM 2543/2014, Art. 3º, III)
IV - 3 (três) representantes de instituições de ensino superior público. (Origem: PRT MS/GM 2543/2014, Art. 3º, IV)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 2543/2014, Art. 3º, § 1º) (com redação dada pela PRT MS/GM 325/2015)
§ 2º A participação das entidades ou órgãos de que tratam os incisos III e IV do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 2º)
§ 3º Um dos representantes da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-Gestão de Equipamentos. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 4º)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas do CAT-Gestão de Equipamentos determina a exclusão do membro, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 5º) (com redação dada pela PRT MS/GM 325/2015)
§ 5º A indicação nominal de representantes na CAT-Gestão de Equipamentos será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 6º)
Art. 310. Os membros da CAT-Gestão de Equipamentos promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 2543/2014, Art. 4º)
Art. 311. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-Gestão de Equipamentos, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 2543/2014, Art. 5º)
Art. 312. Os membros do CAT-Gestão de Equipamentos e os convidados de que trata o art. 311 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 2543/2014, Art. 6º)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 15 do Anexo IV ; e (Origem: PRT MS/GM 2543/2014, Art. 6º, I)
II - declaração de confidencialidade, conforme modelo constante do Anexo 16 do Anexo IV . (Origem: PRT MS/GM 2543/2014, Art. 6º, II)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Gestão de Equipamentos, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2543/2014, Art. 6º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Gestão de Equipamentos, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 2543/2014, Art. 6º, § 2º)
Art. 313. A CAT-Gestão de Equipamentos reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 2543/2014, Art. 7º)
§ 1º Compete à coordenação do CAT-Gestão de Equipamentos organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 1º)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e pelos membros das Comissão. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 2º)
§ 3º A convocação e a organização das reuniões do CAT-Gestão de Equipamentos são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 3º)
§ 4º Cabe à coordenação da CAT-Gestão de Equipamentos organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 4º)
Art. 314. As despesas de passagens e diárias dos membros e convidados da CAT-Gestão de Equipamentos serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 2543/2014, Art. 8º)
Art. 315. As atividades desenvolvidas no âmbito da CAT-Gestão de Equipamentos não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2543/2014, Art. 9º)
Seção III
Da Comissão de Assessoramento Técnico em Gestão Ambiental (CAT-Gestão Ambiental), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
Art. 316. Fica instituída a Comissão de Assessoramento Técnico em Gestão Ambiental (CAT-Gestão Ambiental), no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN). (Origem: PRT MS/GM 2545/2014, Art. 1º)
Art. 317. A CAT-Gestão Ambiental tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 2545/2014, Art. 2º)
I - elaborar propostas e propor ações na área de gestão ambiental, visando minimizar as desigualdades regionais, otimizando a aplicação de recursos, preservando o meio ambiente, a saúde da população e a segurança dos trabalhadores; (Origem: PRT MS/GM 2545/2014, Art. 2º, I)
II - contribuir com a CGSH/DAHU/SAS/MS no acompanhamento e monitoramento das ações e atividades da área de gestão ambiental, no âmbito dos serviços de hematologia e hemoterapia do Sistema Único de Saúde (SUS), a fim de atender a legislação vigente e qualificar a Hemorrede Pública Nacional, sob responsabilidade do SINASAN; e (Origem: PRT MS/GM 2545/2014, Art. 2º, II)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de gestão ambiental. (Origem: PRT MS/GM 2545/2014, Art. 2º, III)
Parágrafo Único. As ações de assessoramento para a qualificação técnica e gerencial da Hemorrede a serem desenvolvidas pelo CAT-Gestão Ambiental ocorrerão no âmbito da CGSH/DAHU/SAS/MS e dos serviços de hematologia e hemoterapia públicos. (Origem: PRT MS/GM 2545/2014, Art. 2º, Parágrafo Único)
Art. 318. A CAT-Gestão Ambiental é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2545/2014, Art. 3º) (com redação dada pela PRT MS/GM 326/2015)
I - 2 (dois) representantes da CGSH/DAHU/SAS/MS; (Origem: PRT MS/GM 2545/2014, Art. 3º, I)
II - 1 (um) representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2545/2014, Art. 3º, II)
III - 4 (quatro) representantes dos serviços de hematologia e hemoterapia públicos; e (Origem: PRT MS/GM 2545/2014, Art. 3º, III)
IV - 2 (dois) representantes de instituições de ensino superior público. (Origem: PRT MS/GM 2545/2014, Art. 3º, IV)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 2545/2014, Art. 3º, § 1º) (com redação dada pela PRT MS/GM 326/2015)
§ 2º A participação das entidades ou órgãos de que tratam os incisos III e IV do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 2º)
§ 3º Um dos representantes da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-Gestão Ambiental. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 4º)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas do CAT-Gestão Ambiental determina a exclusão do membro, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 5º) (com redação dada pela PRT MS/GM 326/2015)
§ 5º A indicação nominal de representantes da CAT-Gestão Ambiental será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 6º)
Art. 319. Os membros da CAT-Gestão Ambiental promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultantes de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 2545/2014, Art. 4º)
Art. 320. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-Gestão Ambiental, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 2545/2014, Art. 5º)
Art. 321. Os membros do CAT-Gestão Ambiental e os convidados de que trata o art. 320 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 2545/2014, Art. 6º)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 17 do Anexo IV ; e (Origem: PRT MS/GM 2545/2014, Art. 6º, I)
II - declaração de confidencialidade, conforme modelo constante do Anexo 18 do Anexo IV . (Origem: PRT MS/GM 2545/2014, Art. 6º, II)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Gestão Ambiental, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2545/2014, Art. 6º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Gestão Ambiental, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 2545/2014, Art. 6º, § 2º)
Art. 322. A CAT-Gestão Ambiental reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 2545/2014, Art. 7º)
§ 1º Compete à coordenação do CAT-Gestão Ambiental organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 1º)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e/ou pelos membros da Comissão. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 2º)
§ 3º A convocação e a organização das reuniões do CAT-Gestão Ambiental são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 3º)
§ 4º Cabe à coordenação da CAT-Gestão Ambiental organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 4º)
Art. 323. As despesas de passagens e diárias dos membros e convidados da CAT-Gestão Ambiental serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 2545/2014, Art. 8º)
Art. 324. As atividades desenvolvidas no âmbito da CAT-Gestão Ambiental não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2545/2014, Art. 9º)
Seção IV
Da Comissão de Assessoramento Técnico à Política Nacional de Atenção Integral às Pessoas com Doença Falciforme (CAT-Doença Falciforme), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
Art. 325. Fica instituída a Comissão de Assessoramento Técnico à Política Nacional de Atenção Integral às Pessoas com Doença Falciforme (CAT-Doença Falciforme), no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN). (Origem: PRT MS/GM 158/2015, Art. 1º)
Art. 326. A CAT-Doença Falciforme tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 158/2015, Art. 2º)
I - contribuir e assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS) na implementação da Política Nacional de Atenção Integral às Pessoas com Doença Falciforme; (Origem: PRT MS/GM 158/2015, Art. 2º, I)
II - acompanhar as ações e atividades da Política Nacional de Atenção Integral às Pessoas com Doença Falciforme no âmbito do Sistema Único de Saúde (SUS), a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de tratamento e atenção à saúde dos pacientes sob responsabilidade do SINASAN; (Origem: PRT MS/GM 158/2015, Art. 2º, II)
III - propor à CGSH/DAHU/SAS/MS a realização de ações e atividades para a Política Nacional de Atenção Integral às Pessoas com Doença Falciforme; (Origem: PRT MS/GM 158/2015, Art. 2º, III)
IV - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que dêem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de atenção às pessoas com doença falciforme; e (Origem: PRT MS/GM 158/2015, Art. 2º, IV)
V - recomendar à CGSH/DAHU/SAS/MS publicações referentes à Política Nacional de Atenção Integral às Pessoas com Doença Falciforme. (Origem: PRT MS/GM 158/2015, Art. 2º, V)
Art. 327. A CAT-Doença Falciforme será composta por representantes, titulares e respectivos suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 158/2015, Art. 3º)
I - 1 (um) da CGSH/DAHU/SAS/MS; (Origem: PRT MS/GM 158/2015, Art. 3º, I)
II - 6 (seis) da área de saúde multiprofissional, com atividades desenvolvidas em serviços do SUS; e (Origem: PRT MS/GM 158/2015, Art. 3º, II)
III - 1 (um) de usuários da atenção a essa doença. (Origem: PRT MS/GM 158/2015, Art. 3º, III)
§ 1º Os representantes, titulares e respectivos suplente, serão indicados pelo Secretário de Atenção à Saúde em ato específico (SAS/MS). (Origem: PRT MS/GM 158/2015, Art. 3º, § 1º)
§ 2º Os representantes suplentes substituirão os titulares em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 158/2015, Art. 3º, § 2º)
§ 3º O representante da CGSH/DAHU/SAS/MS exercerá a coordenação da CAT-Doença Falciforme. (Origem: PRT MS/GM 158/2015, Art. 3º, § 3º)
§ 4º A composição da CAT-Doença Falciforme, titulares e respectivos suplentes, será revista a cada 2 (dois) anos. (Origem: PRT MS/GM 158/2015, Art. 3º, § 4º)
§ 5º A CGSH/DAHU/SAS/MS pode sugerir à SAS/MS nomes para composição da CAT-Doença Falciforme, respeitada a composição definida no "caput". (Origem: PRT MS/GM 158/2015, Art. 3º, § 5º)
§ 6º Aos representantes da CAT-Doença Falciforme referidos no inciso II do "caput" será garantida a renovação de pelo menos um terço dos membros, a cada dois anos. (Origem: PRT MS/GM 158/2015, Art. 3º, § 6º)
§ 7º A ausência, sem justificativa, a 2 (duas) reuniões consecutivas da CAT-Doença Falciforme determina a exclusão do membro e seu substituto, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 158/2015, Art. 3º, § 7º)
Art. 328. Os membros da CAT-Doença Falciforme promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 158/2015, Art. 4º)
Art. 329. Poderão ser convidados, a critérios da CGSH/DAHU/SAS/MS ou da CAT-Doença Falciforme, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 158/2015, Art. 5º)
Art. 330. Os membros da CAT-Doença Falciforme e os convidados de que trata o art. 329 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 158/2015, Art. 6º)
I - declaração de conflito de interesse, conforme modelo do Anexo 19 do Anexo IV ; e (Origem: PRT MS/GM 158/2015, Art. 6º, I)
II - declaração de confidencialidade, conforme modelo do Anexo 20 do Anexo IV . (Origem: PRT MS/GM 158/2015, Art. 6º, II)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Doença Falciforme, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 158/2015, Art. 6º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Doença Falciforme, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 158/2015, Art. 6º, § 2º)
Art. 331. A CAT-Doença Falciforme reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 158/2015, Art. 7º)
§ 1º Compete à coordenação da CAT-Doença Falciforme organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 158/2015, Art. 7º, § 1º)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS ou pelos representantes da CAT-Doença Falciforme. (Origem: PRT MS/GM 158/2015, Art. 7º, § 2º)
§ 3º A convocação e a organização das reuniões da CAT-Doença Falciforme são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 158/2015, Art. 7º, § 3º)
§ 4º Cabe à coordenação da CAT-Doença Falciforme organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 158/2015, Art. 7º, § 4º)
Art. 332. As despesas de passagens e diárias dos membros e convidados da CAT-Doença Falciforme serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 158/2015, Art. 8º)
Art. 333. As atividades desenvolvidas no âmbito da CAT-Doença Falciforme não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 158/2015, Art. 9º)
Seção V
Da Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública (CAT-QNHP), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
Art. 334. Fica instituída a Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública (CATQNHP), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN). (Origem: PRT MS/GM 475/2015, Art. 1º)
Art. 335. A CAT-QNHP tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Hospitalar e de Urgência (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 475/2015, Art. 2º)
I - elaborar proposta à CGSH/DAHU/SAS/MS de estratégias para qualificação técnica e gerencial, visando minimizar as desigualdades regionais, fortalecer o desenvolvimento institucional e o funcionamento da hemorrede pública nacional; (Origem: PRT MS/GM 475/2015, Art. 2º, I)
II - contribuir com a CGSH/DAHU/SAS/MS no monitoramento das ações e atividades para o desenvolvimento da Qualificação Técnica e Gerencial da Hemorrede Nacional, incluindo a análise de resultados de avaliações e a proposição de ações para melhoria dos serviços de hematologia e hemoterapia; e (Origem: PRT MS/GM 475/2015, Art. 2º, II)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, manuais, protocolos e diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de qualificação técnica e gerencial da hemorrede. (Origem: PRT MS/GM 475/2015, Art. 2º, III)
Art. 336. A CAT-QNHP é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 475/2015, Art. 3º)
I - 6 (seis) representantes da CGSH/DAHU/SAS/MS; e (Origem: PRT MS/GM 475/2015, Art. 3º, I)
II - 6 (seis) representantes dos serviços de saúde públicos, preferencialmente vinculados aos serviços de hematologia e hemoterapia. (Origem: PRT MS/GM 475/2015, Art. 3º, II)
§ 1º Os representantes serão indicados pela CGSH/DAHU/SAS/MS à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 475/2015, Art. 3º, § 1º)
§ 2º A participação das entidades ou órgãos de que trata o inciso II do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 475/2015, Art. 3º, § 2º)
§ 3º Um dos representantes da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-QNHP. (Origem: PRT MS/GM 475/2015, Art. 3º, § 3º)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas da CAT-QNHP determina a exclusão do membro, cabendo à CGSH/DAHU/SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 475/2015, Art. 3º, § 4º)
§ 5º A indicação nominal de representantes na CAT-QNHP será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 475/2015, Art. 3º, § 5º)
Art. 337. Os membros da CAT-QNHP promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria n° 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 475/2015, Art. 4º)
Art. 338. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-QNHP, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 475/2015, Art. 5º)
Art. 339. Os membros da CAT-QNHP e os convidados de que trata o art. 338 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 475/2015, Art. 6º)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 25 do Anexo IV ; e (Origem: PRT MS/GM 475/2015, Art. 6º, I)
II - declaração de confidencialidade, conforme modelo constante do Anexo 26 do Anexo IV . (Origem: PRT MS/GM 475/2015, Art. 6º, II)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe a CAT-QNHP, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 475/2015, Art. 6º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-QNHP, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 475/2015, Art. 6º, § 2º)
Art. 340. A CAT-QNHP reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou por requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 475/2015, Art. 7º)
§ 1º Compete à coordenação da CAT-QNHP organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 475/2015, Art. 7º, § 1º)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e pelos membros da Comissão. (Origem: PRT MS/GM 475/2015, Art. 7º, § 2º)
§ 3º A convocação e a organização das reuniões da CATQNHP são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 475/2015, Art. 7º, § 3º)
§ 4º Cabe à coordenação da CAT-QNHP organizar e divulgar aos seus membros as atas e outros documentos pertinentes às suas atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 475/2015, Art. 7º, § 4º)
Art. 341. As despesas de passagens e diárias dos membros e convidados da CAT-QNHP serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 475/2015, Art. 8º)
Art. 342. As atividades desenvolvidas no âmbito da CATQNHP não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 475/2015, Art. 9º)
Seção VI
Da Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue (CAT-PDVS), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
Art. 343. Fica instituída a Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue (CAT-PDVS), no âmbito do Sistema Nacional de Sangue, Componentes e derivados (SINASAN). (Origem: PRT MS/GM 795/2015, Art. 1º)
Art. 344. A CAT-PDVS tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo ainda as seguintes atribuições: (Origem: PRT MS/GM 795/2015, Art. 2º)
I - elaborar propostas à CGSH/DAHU/SAS/MS de estratégias voltadas para a promoção da doação voluntária de sangue, como de ações e atividades que visem à captação de doadores; (Origem: PRT MS/GM 795/2015, Art. 2º, I)
II - contribuir com a CGSH/DAHU/SAS/MS no acompanhamento e monitoramento das ações, atividades e estratégias para a promoção da doação de sangue no âmbito nacional; e (Origem: PRT MS/GM 795/2015, Art. 2º, II)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas, além de capacitações junto à Hemorrede Nacional voltadas para a promoção da doação voluntária de sangue. (Origem: PRT MS/GM 795/2015, Art. 2º, III)
Art. 345. A CAT-PDVS é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 795/2015, Art. 3º)
I - 1 (um) representante da CGSH/DAHU/SAS/MS; e (Origem: PRT MS/GM 795/2015, Art. 3º, I)
II - 6 (seis) representantes dos serviços de saúde públicos, preferencialmente vinculados a serviços de hematologia e hemoterapia, atuantes nas áreas relacionadas à promoção da doação voluntária de sangue nos hemocentros, considerando os setores de captação e comunicação social, dentre outros. (Origem: PRT MS/GM 795/2015, Art. 3º, II)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 795/2015, Art. 3º, § 1º)
§ 2º A participação das entidades ou órgãos de que trata o inciso II do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 795/2015, Art. 3º, § 2º)
§ 3º O representante da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-PDVS. (Origem: PRT MS/GM 795/2015, Art. 3º, § 3º)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas do CAT-PDVS determina a exclusão do membro, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 795/2015, Art. 3º, § 4º)
§ 5º A indicação nominal de representantes na CAT-PDVS será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 795/2015, Art. 3º, § 5º)
Art. 346. Os membros da CAT-PDVS promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 795/2015, Art. 4º)
Art. 347. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-PDVS, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 795/2015, Art. 5º)
Art. 348. Os membros do CAT-PDVS e os convidados de que trata o art. 347 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 795/2015, Art. 6º)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 21 do Anexo IV ; e (Origem: PRT MS/GM 795/2015, Art. 6º, I)
II - declaração de confidencialidade, conforme modelo constante do Anexo 22 do Anexo IV . (Origem: PRT MS/GM 795/2015, Art. 6º, II)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-PDVS, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 795/2015, Art. 6º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-PDVS, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 795/2015, Art. 6º, § 2º)
Art. 349. A CAT-PDVS reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 795/2015, Art. 7º)
§ 1º Compete à coordenação da CAT-PDVS organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 795/2015, Art. 7º, § 1º)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e pelos membros da Comissão. (Origem: PRT MS/GM 795/2015, Art. 7º, § 2º)
§ 3º A convocação e a organização das reuniões da CAT-PDVS são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 795/2015, Art. 7º, § 3º)
§ 4º Cabe à coordenação da CAT-PDVS organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 795/2015, Art. 7º, § 4º)
Art. 350. As despesas de passagens e diárias dos membros e convidados da CAT-PDVS serão garantidas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 795/2015, Art. 8º)
Art. 351. As atividades desenvolvidas no âmbito da CAT- PDVS não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 795/2015, Art. 9º)
Seção VII
Da Comissão de Assessoramento Técnico em Sangue Raro (CAT-Sangue Raro), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
Art. 352. Fica instituída a Comissão de Assessoramento Técnico em Sangue Raro (CAT-Sangue Raro), no âmbito do Sistema Nacional de Sangue, Componentes e derivados (SINASAN). (Origem: PRT MS/GM 1440/2015, Art. 1º)
Art. 353. A CAT-Sangue Raro tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS), tendo ainda as seguintes atribuições: (Origem: PRT MS/GM 1440/2015, Art. 2º)
I - elaborar e apresentar propostas na área de Hemoterapia à CGSH/DAET/SAS/MS, visando estabelecer ações e mecanismos que garantam a captação e reserva de sangue e componentes com fenótipos raros, bem como sua mobilização para a atenção hemoterápica; (Origem: PRT MS/GM 1440/2015, Art. 2º, I)
II - contribuir com a CGSH/DAET/SAS/MS na formulação, avaliação e normatização das atividades relacionadas aos bancos de sangue de hemácias e plaquetas raras, com vistas à estruturação de uma Rede de Bancos de Sangue Raro, no âmbito da Hemorrede Nacional; (Origem: PRT MS/GM 1440/2015, Art. 2º, II)
III - contribuir com a CGSH/DAET/SAS/MS no acompanhamento e monitoramento das ações e atividades relacionadas à temática, junto aos serviços de hematologia e hemoterapia do Sistema Único de Saúde (SUS), a fim de atender a legislação vigente e qualificar a Hemorrede Pública Nacional para a oferta dos serviços; e (Origem: PRT MS/GM 1440/2015, Art. 2º, III)
IV - sugerir à CGSH/DAET/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações voltadas para a assistência hemoterápica qualificada a pacientes que necessitem de sangue raro. (Origem: PRT MS/GM 1440/2015, Art. 2º, IV)
Art. 354. A CAT-Sangue Raro é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1440/2015, Art. 3º)
I - 2 (dois) representantes da CGSH/DAET/SAS/MS; (Origem: PRT MS/GM 1440/2015, Art. 3º, I)
II - 1 (um) representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1440/2015, Art. 3º, II)
III - 4 (quatro) representantes dos serviços de hematologia e hemoterapia públicos; (Origem: PRT MS/GM 1440/2015, Art. 3º, III)
IV - 1 (um) representante da Associação Brasileira de Hematologia, Hemoterapia e Terapia Celular; e (Origem: PRT MS/GM 1440/2015, Art. 3º, IV)
V - 2 (dois) representantes dos serviços de saúde, pesquisa e/ou ensino, que desenvolvam atividades na área de imuno-hematologia eritrocitária e plaquetária. (Origem: PRT MS/GM 1440/2015, Art. 3º, V)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 1440/2015, Art. 3º, § 1º)
§ 2º A participação das entidades ou órgãos de que trata o inciso II a V será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 2º)
§ 3º Um dos representantes da CGSH/DAET/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-Sangue Raro. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 3º)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas da CAT-Sangue Raro, determina a exclusão do membro, cabendo à CGSH/DAET/SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 4º)
§ 5º A indicação nominal de representantes na CAT-Sangue Raro será revista a cada 2 (dois) anos, devendo a CGSH/DAET/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 5º)
Art. 355. Os membros da CAT-Sangue Raro promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 1440/2015, Art. 4º)
Art. 356. Poderão ser convidados, a critério da CGSH/DAET/SAS/MS ou da CAT-Sangue Raro, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos. (Origem: PRT MS/GM 1440/2015, Art. 5º)
Art. 357. Os membros da CAT-Sangue Raro e os convidados devem encaminhar as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 1440/2015, Art. 6º)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 23 do Anexo IV ; e (Origem: PRT MS/GM 1440/2015, Art. 6º, I)
II - declaração de confidencialidade, conforme modelo constante do Anexo 24 do Anexo IV . (Origem: PRT MS/GM 1440/2015, Art. 6º, II)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Sangue Raro, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 1440/2015, Art. 6º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Sangue Raro, cabe à CGSH/DAET/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 1440/2015, Art. 6º, § 2º)
Art. 358. A CAT-Sangue Raro reunir-se-á por convocação da CGSH/DAET/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 1440/2015, Art. 7º)
§ 1º Compete à coordenação da CAT-Sangue Raro organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 1º)
§ 2º Os temas a serem abordados na pauta devem ser propostos pela CGSH/DAET/SAS/MS e pelos membros das Comissão. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 2º)
§ 3º A convocação e a organização das reuniões da CAT- Sangue Raro são de responsabilidade da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 3º)
§ 4º Cabe à coordenação da CAT-Sangue Raro organizar e divulgar aos seus membros as atas e outros documentos pertinentes às suas atividades, os quais, após assinados pelos participantes, devem ser arquivadas sob a responsabilidade da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 4º)
Art. 359. As despesas de passagens e diárias dos membros e convidados da CAT-Sangue Raro serão custeadas pela CGSH/DAET/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 1440/2015, Art. 8º)
Art. 360. As atividades desenvolvidas no âmbito da CAT-Sangue Raro não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1440/2015, Art. 9º)
Seção VIII
Da Comisssão de Assessoramento Técnico às Talassemias (CAT-Talassemias)
Art. 361. Fica instituída, no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN), a Comissão de Assessoramento Técnico às Talassemias. (Origem: PRT MS/GM 2612/2012, Art. 1º)
Parágrafo Único. Para fins desta Seção, a Comissão de Assessoramento Técnico às Talassemias doravante será denominada CAT-Talassemias. (Origem: PRT MS/GM 2612/2012, Art. 1º, Parágrafo Único)
Art. 362. A CAT-Talassemias tem por finalidades: (Origem: PRT MS/GM 2612/2012, Art. 2º)
I - contribuir e assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS) na formulação da política nacional para atenção às pessoas com Talassemias; (Origem: PRT MS/GM 2612/2012, Art. 2º, I)
II - acompanhar as ações e atividades do Programa Nacional de Talassemias, no âmbito do Sistema Único de Saúde (SUS), a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de tratamento e atenção à saúde dos pacientes, sob responsabilidade do SINASAN; (Origem: PRT MS/GM 2612/2012, Art. 2º, II)
III - propor à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) políticas, ações e atividades para o referido Programa Nacional de Talassemias, elaborar documentos, pareceres, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que dêem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de atenção às pessoas com Talassemias; (Origem: PRT MS/GM 2612/2012, Art. 2º, III)
IV - recomendar à CGSH/DAET/SAS/MS publicações referentes ao Programa Nacional de Talassemias; e (Origem: PRT MS/GM 2612/2012, Art. 2º, IV)
V - instituir Grupos de Trabalho para o desenvolvimento de atividades específicas relacionadas ao cumprimento de suas finalidades. (Origem: PRT MS/GM 2612/2012, Art. 2º, V)
Art. 363. A CAT-Talassemias é composta por representantes, titular e suplente: (Origem: PRT MS/GM 2612/2012, Art. 3º)
I - um representante da CGSH/DAET/SAS/MS, que a coordenará; (Origem: PRT MS/GM 2612/2012, Art. 3º, I)
II - sete representantes da área de hematologia clínica com ênfase em Talassemias, com atividades desenvolvidas em serviços do Sistema Único de Saúde; (Origem: PRT MS/GM 2612/2012, Art. 3º, II)
III - um representante dos usuários da atenção às Talassemias, sendo substituído, em sua ausência, por seu suplente. (Origem: PRT MS/GM 2612/2012, Art. 3º, III)
§ 1º Os representantes de que tratam os incisos I, II e III do caput serão indicados pela Secretaria de Atenção à Saúde (SAS/MS) à Coordenação da Comissão. (Origem: PRT MS/GM 2612/2012, Art. 3º, § 1º)
§ 2º A indicação nominal de representantes na CAT-Talassemias citados no caput deve ser revista a cada dois anos, devendo a CGSH/DAET/SAS/MS sugerir à SAS a indicação nominal desses representantes. (Origem: PRT MS/GM 2612/2012, Art. 3º, § 2º)
§ 3º Para os fins do art. 363, § 2º , a substituição dos membros de que trata o inciso II do caput não poderá ser superior a um terço dos citados representantes. (Origem: PRT MS/GM 2612/2012, Art. 3º, § 3º)
Art. 364. A participação na CAT-Talassemias é considerada como de relevante interesse público, não será remunerada e não terá ressarcimento pecuniário ou de qualquer outra natureza pelos trabalhos desenvolvidos, inclusive publicações técnicas, manuais, protocolos, entre outras publicações técnicas. (Origem: PRT MS/GM 2612/2012, Art. 4º)
Parágrafo Único. A CAT-Talassemias poderá convidar entidades ou pessoas do setor público e privado que atuem profissionalmente em atividades relacionadas ao tema sempre que entender necessária a sua colaboração para o pleno alcance das suas finalidades. (Origem: PRT MS/GM 2612/2012, Art. 4º, Parágrafo Único)
Art. 365. Os membros da CAT-Talassemias devem subscrever as seguintes declarações por ocasião do início de suas atividades na Comissão: (Origem: PRT MS/GM 2612/2012, Art. 5º)
I - declaração de conflito de interesse, conforme modelo do Anexo 13 do Anexo IV ; e (Origem: PRT MS/GM 2612/2012, Art. 5º, I)
II - declaração de confidencialidade, conforme modelo do Anexo 14 do Anexo IV . (Origem: PRT MS/GM 2612/2012, Art. 5º, II)
§ 1º Em caso de conflito de interesse por qualquer dos membros das Comissões, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) avaliar a conveniência ou não da manutenção do representante na Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 2612/2012, Art. 5º, § 1º)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da Comissão, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) efetuar a imediata retirada do representante da Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 2612/2012, Art. 5º, § 2º)
Art. 366. A CAT-Talassemias reunir-se-á por convocação da Coordenação ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 2612/2012, Art. 6º)
§ 1º Compete à CGSH/DAET/SAS/MS a convocação dos membros, a organização das reuniões, a elaboração e a divulgação da pauta e atas de reunião e o arquivo dos documentos elaborados. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 1º)
§ 2º Os temas a serem incluídos na pauta de reunião serão propostos pela CGSH/DAET/SAS/MS ou pelos membros da comissão. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 2º)
§ 3º Os suplentes devem substituir os titulares na ausência destes nas reuniões. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 3º)
§ 4º O Ministério da Saúde custeará despesas de passagens e diárias para participação de membros ou convidados nas reuniões da CAT-Talassemias ou a participação de seus membros em eventos, ações e atividades de interesse da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 4º)
§ 5º Cabe ao representante da CGSH/DAET/SAS/MS organizar e divulgar aos membros da comissão as atas e outros documentos pertinentes às atividades da CAT-Talassemias, os quais, após assinados pelos participantes, devem ser arquivados, sob a responsabilidade da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 5º)
Art. 367. A ausência do titular ou suplente, sem justificativa, a duas reuniões consecutivas da CAT-Talassemias acarretará a sua exclusão. (Origem: PRT MS/GM 2612/2012, Art. 7º)
Parágrafo Único. Compete à CGSH/DAET/SAS/MS adotar as providências necessárias para o cumprimento do disposto neste artigo, efetivando a indicação de novo representante para recompor a Comissão. (Origem: PRT MS/GM 2612/2012, Art. 7º, Parágrafo Único)
TÍTULO III
DO FORNECIMENTO DE SANGUE E HEMOCOMPONENTES NO SISTEMA ÚNICO DE SAÚDE (SUS)
Art. 368. O sangue e os hemocomponentes obtidos pelo SUS, diretamente nos serviços públicos ou em serviços privados contratados, serão destinados prioritariamente ao atendimento de usuários do próprio SUS. (Origem: PRT MS/GM 1737/2004, Art. 1º)
§ 1º Os serviços públicos de hemoterapia do SUS deverão ser capacitados e estruturados para atender integralmente à demanda de fornecimento de hemocomponentes para o próprio SUS. (Origem: PRT MS/GM 1737/2004, Art. 1º, § 1º)
§ 2º A contratação pelo SUS de serviços privados de hemoterapia para complementação da rede pública somente será admitida quando comprovada pelo gestor local a insuficiência dos serviços públicos, devendo ser autorizada pelos respectivos Conselhos Estaduais/Municipais de Saúde, ouvido o coordenador estadual da hemorrede. (Origem: PRT MS/GM 1737/2004, Art. 1º, § 2º)
§ 3º Os gestores estaduais e municipais deverão reavaliar a necessidade de manutenção dos contratos com serviços privados, bem como a respectiva programação físico-orçamentária dos serviços privados contratados, limitando-a ao estritamente necessário ao atendimento da demanda do SUS não absorvida pelos serviços de hemoterapia da rede pública, submetendo-a à aprovação do respectivo Conselho de Saúde, conforme Sistema Estadual de Sangue, Componentes e Derivados. (Origem: PRT MS/GM 1737/2004, Art. 1º, § 3º)
Art. 369. Os serviços de hemoterapia públicos ou privados contratados pelo SUS poderão fornecer sangue e hemocomponentes destinados a pacientes e serviços assistenciais privados nas seguintes hipóteses: (Origem: PRT MS/GM 1737/2004, Art. 2º)
I - quando a rede assistencial do SUS não possuir demanda para a utilização de todos os hemocomponentes produzidos e tiver sido garantida a manutenção no serviço de hemoterapia de um estoque mínimo de segurança; (Origem: PRT MS/GM 1737/2004, Art. 2º, I)
II - em situação de emergência, calamidade pública ou outra necessidade imprevisível, devidamente atestada pelo gestor público responsável; ou (Origem: PRT MS/GM 1737/2004, Art. 2º, II)
III - quando houver a necessidade de sangue ou hemocomponente raro. (Origem: PRT MS/GM 1737/2004, Art. 2º, III)
§ 1º O estoque mínimo referido no inciso I deste artigo será definido pelo gestor estadual ou municipal do SUS em conjunto com as direções de cada um dos serviços de hemoterapia e aprovação do Conselho Estadual ou Municipal de Saúde. (Origem: PRT MS/GM 1737/2004, Art. 2º, § 1º)
§ 2º Em qualquer caso, deverá existir um estoque mínimo de segurança para cada espécie de hemocomponente a ser definido pelo responsável técnico do serviço de hemoterapia baseado na média mensal de utilização desse hemocomponente na rede do SUS nos últimos 6 (seis) meses. (Origem: PRT MS/GM 1737/2004, Art. 2º, § 2º)
Art. 370. O fornecimento de hemocomponentes por serviços públicos de hemoterapia a outros serviços, de hemoterapia ou assistenciais, deverá ocorrer mediante a celebração de contrato/convênio estabelecido entre o Gestor Estadual do SUS e o Serviço de Hemoterapia Público Estadual e deste com o interessado, e que: (Origem: PRT MS/GM 1737/2004, Art. 3º)
I - seja reproduzido o disposto no art. 369; (Origem: PRT MS/GM 1737/2004, Art. 3º, I)
II - sejam introduzidos controles para a rastreabilidade das bolsas de hemocomponentes fornecidas, especialmente, para a identificação do paciente em que foi transfundida e a natureza de seu vínculo com a instituição (SUS, saúde suplementar ou assistência particular); e (Origem: PRT MS/GM 1737/2004, Art. 3º, II)
III - sejam estipuladas sanções, inclusive pecuniárias, para o não fornecimento de informações sobre o destino das bolsas de hemocomponentes, ou informações incorretas e/ou incompletas conforme o previsto no art. 371, § 3º . (Origem: PRT MS/GM 1737/2004, Art. 3º, III)
Parágrafo Único. A Secretaria de Atenção à Saúde (SAS/MS), por meio do Departamento de Atenção Especializada e Temática (DAET/SAS/MS), definirá regras específicas a serem observadas nos contratos ou convênios de fornecimento de hemocomponentes. (Origem: PRT MS/GM 1737/2004, Art. 3º, Parágrafo Único)
Art. 371. Os custos referentes à coleta, ao processamento, à realização de exames de triagem incorridos pelo SUS na obtenção dos hemocomponentes fornecidos a serviços de hemoterapia ou assistenciais para aplicação em pacientes privados, inclusive da saúde suplementar, serão ressarcidos ao Fundo Estadual ou Municipal de Saúde, da seguinte forma: (Origem: PRT MS/GM 1737/2004, Art. 4º)
I - em serviço de hemoterapia da administração pública, onde existam mecanismos de ressarcimento direto, esse deve ser feito ao serviço fornecedor; e (Origem: PRT MS/GM 1737/2004, Art. 4º, I)
II - os procedimentos referentes à produção dos hemocomponentes em questão não serão faturados ao SUS. (Origem: PRT MS/GM 1737/2004, Art. 4º, II)
§ 1º Caberá à Agência Nacional de Saúde Suplementar (ANS), à Agência Nacional de Vigilância Sanitária (ANVISA) e à Secretaria de Atenção à Saúde (SAS), do Ministério da Saúde, definir os valores e a forma de identificação dos procedimentos a serem ressarcidos. (Origem: PRT MS/GM 1737/2004, Art. 4º, § 1º)
§ 2º Os serviços de saúde que atendam a pacientes do SUS e a pacientes privados, inclusive da saúde suplementar, deverão manter estrito controle do destino das bolsas de hemocomponentes recebidas de serviços de hemoterapia do SUS, sejam públicos ou privados contratados, devendo, para tanto: (Origem: PRT MS/GM 1737/2004, Art. 4º, § 2º)
I - mensalmente, em data a ser fixada pelo gestor estadual ou municipal, apresentar à Secretaria de Saúde, ao órgão local da vigilância sanitária e ao serviço de hemoterapia fornecedor demonstrativo que indique, para cada hemocomponente, o saldo inicial do seu estoque no mês, as bolsas recebidas, as bolsas transfundidas por categoria de paciente (SUS, saúde suplementar e particular), as bolsas descartadas e o saldo final; e (Origem: PRT MS/GM 1737/2004, Art. 4º, § 2º, I)
II - fornecer aos mesmos órgãos ou instituições mencionados no inciso I deste parágrafo relação nominal dos pacientes que receberam as bolsas de hemocomponentes. (Origem: PRT MS/GM 1737/2004, Art. 4º, § 2º, II)
§ 3º Na hipótese de não fornecimento dos demonstrativos e relatórios mencionados no § 2º, o gestor estadual ou municipal deverá adotar providências para imediata auditoria e fiscalização no serviço de saúde inadimplente, adotando as medidas para o ressarcimento e aplicação das sanções mencionadas no art. 370, III. (Origem: PRT MS/GM 1737/2004, Art. 4º, § 3º)
Art. 372. Os serviços de hemoterapia privados contratados pelo SUS deverão transferir ao serviço de hemoterapia público designado pelo gestor estadual ou municipal do SUS os concentrados de hemácias e sangue total produzidos e não utilizados na assistência a pacientes do SUS, com o prazo de 7 (sete) dias antes do seu vencimento. (Origem: PRT MS/GM 1737/2004, Art. 5º) (com redação dada pela PRT MS/GM 373/2005)
Parágrafo Único. Com relação ao plasma, os serviços de hemoterapia privados contratados pelo SUS deverão observar o disposto na Resolução da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária nº 73, de 3 de agosto de 2000. (Origem: PRT MS/GM 1737/2004, Art. 5º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 373/2005)
Art. 373. O serviço de hemoterapia ou de assistência à saúde que cobre de seus pacientes ou das instituições de saúde suplementar qualquer custo pelo fornecimento ou transfusão de bolsas de sangue e hemocomponentes deverá informar ao paciente o custo específico dos insumos, materiais, exames laboratoriais, sorológicos, de ácidos nucléicos e imunoematológicos incorridos, bem como dos honorários por serviços médicos, conforme o previsto no artigo 2º, parágrafo único, da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 1737/2004, Art. 6º)
Parágrafo Único. No caso da bolsa de sangue ou hemocomponente ser originária de serviço de hemoterapia do SUS, inclusive contratado, o paciente deverá ser informado do custo assumido perante o poder público, além dos demais itens mencionados no caput deste artigo, acrescidos na própria instituição, se for o caso. (Origem: PRT MS/GM 1737/2004, Art. 6º, Parágrafo Único)
TÍTULO IV
DOS CRITÉRIOS PARA A HABILITAÇÃO DOS ESTABELECIMENTOS DE HEMOTERAPIA PARA REALIZAÇÃO DO PROCEDIMENTO TESTES DE ÁCIDOS NUCLEICOS EM AMOSTRAS DE SANGUE NA TRIAGEM DE DOADOR
Art. 374. Ficam definidos os seguintes critérios para que os estabelecimentos de hemoterapia sejam habilitados como Sítios Testadores NAT: (Origem: PRT MS/GM 2264/2014, Art. 1º)
I - centralização de maior quantitativo de amostras processadas; (Origem: PRT MS/GM 2264/2014, Art. 1º, I)
II - maior número de doações; (Origem: PRT MS/GM 2264/2014, Art. 1º, II)
III - melhor acesso logístico regional; (Origem: PRT MS/GM 2264/2014, Art. 1º, III)
IV - critérios epidemiológicos e sanitários regionais; (Origem: PRT MS/GM 2264/2014, Art. 1º, IV)
V - área física disponível para os equipamentos da plataforma NAT; (Origem: PRT MS/GM 2264/2014, Art. 1º, V)
VI - sistema informatizado que permita transcrição automática dos resultados; e (Origem: PRT MS/GM 2264/2014, Art. 1º, VI)
VII - profissionais capacitados para realização do NAT. (Origem: PRT MS/GM 2264/2014, Art. 1º, VII)
ANEXO 1 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Doenças (Origem: PRT MS/GM 158/2016, Anexo 1)
ANEXO I
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - DOENÇAS
| A - PRINCIPAIS CAUSAS DE INAPTIDÃO DEFINITIVA PARA DOAÇÃO DE SANGUE | ||
| Alcoolismo crônico | ||
| Anafilaxia (choque anafilático) | ||
| Antecedentes de acidente vascular cerebral (AVC) | ||
| Bronquite e asma (crises com intervalos de 3 meses ou menos, sem controle com medicamentos por via inalatória) | ||
| Babesiose | ||
| Blastomicose sistêmica | ||
| Câncer (inclusive leucemia). Antecedentes de carcinoma in situ de cérvix uterina e de carcinoma basocelular de pele não impedem a doação de sangue | ||
| Doença cardiovascular grave. Especial atenção para doença coronariana, angina, arritmia cardíaca grave, insuficiência cardíaca, doença valvular, aneurismas, má formações arteriovenosas, endocardite com sequela, miocardite com sequela, trombose arterial, trombose venosa recorrente e trombofilia. | ||
| Diabetes tipo I, diabetes tipo II, insulino-dependente. | ||
| Doença de Chagas | ||
| Doenças autoimunes que comprometam mais de um órgão. Por exemplo: lúpus eritematoso sistêmico, tireoidites imunes, artrite reumatoide, etc. | ||
| Doença pulmonar grave: especial atenção à enfisema, doença pulmonar obstrutiva crônica (DPOC), história de embolia pulmonar | ||
| Doenças endócrinas: hiperaldosteronismo, hiperfunção hipofisária, hiperlipoproteinemias essenciais, hipertireoidismo, hipopituitarismo, insuficiência suprarrenal, síndrome de Cushing | ||
| Doenças gastrointestinais: cirrose hepática, retocolite ulcerativa crônica, doença de Crohn, hepatopatia crônica de origem desc onhecida, hipertensão porta, pancreatite crônica | ||
| Doenças neurológicas: esclerose em placa, esclerose lateral amiotrófica, esclerose múltipla, hematoma extra ou subdural com sequela, leucoencefalopatia multifocal progressiva, neurofibromatose forma maior, miastenia gravis | ||
| Doença renal crônica | ||
| Doenças hemorrágicas congênitas ou adquiridas | ||
| Doença de Creustzfeldt Jakob (vaca louca) ou histórico familiar de encefalopatia espongiforme humana e suas variantes, transplante de córnea e implante a base de dura-matér | ||
| Elefantíase (filariose) | ||
| Esquistossomose hepatoesplênica | ||
| Feocromocitoma | ||
| Hanseníase | ||
| Hepatite viral após 11 anos de idade (exceto para caso de comprovação de hepatite A aguda com IgM reagente, a época do diagnóstico clínico) | ||
| Infecção por HBV, HCV, HIV, HTLV I/II | ||
| Intoxicações por metais pesados | ||
| Leishmaniose visceral (Calazar) | ||
| Malária (Febre quartã - Plasmodium malarie) | ||
| Doença psiquiátrica que gere inimputabilidade jurídica (incapacidade) | ||
| Pênfigo foliáceo | ||
| Psoríase extensa ou com outras manifestações associadas | ||
| Reação adversa grave em doação anterior | ||
| Tuberculose extrapulmonar |
| B. PRINCIPAIS CAUSAS DE INAPTIDÃO TEMPORÁRIA PARA A DOAÇÃO DE SANGUE | ||
| Causas de inaptidão temporária | Tempo de inaptidão | |
| Atraso menstrual em mulheres em idade fértil | Até que se afaste a possibilidade de gravidez ou de outro problema que impeça a doação | |
| Adenomegalia a esclarecer | Avaliação caso a caso | |
| Alergias (tratamento de dessensibilização) | 3 dias após o fim do tratamento | |
| Alergias (urticária, rinite, dermatite e outras) | Na fase aguda e durante o tratamento | |
| Blastomicose pulmonar | 5 | anos depois da cura |
| Brucelose | 1 | ano após o tratamento ou 8 semanas após a potencial exposição |
| Caxumba | 3 | semanas após a cura |
| Citomegalovírus | 3 | meses após desaparecimento dos sintomas |
| Cólera | 3 | meses após a cura |
| Conjuntivite | 1 | semana após a cura |
| Dengue | 4 | semanas após a cura |
| Dengue hemorrágico | 6 | meses após a cura |
| Diarreia | 1 | semana após a cura |
| Epilepsia | 3 anos após suspensão do tratamento e sem relato de crise convulsiva | |
| Erisipela | 2 | semanas após a cura |
| Gripes ou resfriados | 1 | semana após cessarem os sintomas |
| Herpes simplex genital, Herpes simplex oral, etc. | Após o desaparecimento das lesões | |
| Herpes Zoster | 6 | meses após desaparecimento de sintomas |
| Infecções bacterianas comuns não complicadas (por exemplo: sinusite, amigdalite, otite, infecção urinária baixa) | 2 semanas após o fim do tratamento | |
| Leptospirose | 3 | meses após a cura |
| Lesões de pele no local da punção venosa | Até a cura | |
| Lesões dermatológicas: eritema polimorfo, eritrodermias, líquen plano | 6 meses após a cura | |
| Meningite infecciosa | 6 | meses após a cura |
| Mononucleose infecciosa | 6 | meses após a cura |
| Osteomielite aguda | 2 | meses após a cura |
| Osteomielite crônica | Definitivo | |
| Pericardite infecciosa (exceto tuberculosa) | 12 meses após a cura | |
| Pielonefrite | 1 | mês após a cura |
| Piercing, tatuagem ou maquiagem definitiva | 6 meses após realização; 12 meses se não houver condição de avaliação da segurança do procedimento realizado; se na cavidade oral e/ou na região genital, devido ao risco permanente de infecção, a inaptidão é de 12 meses da retirada. | |
| Rubéola | 2 | semanas após a cura |
| Retirada de verrugas, unhas, manchas e outros pequenos procedimentos dermatológicos | Após a cicatrização | |
| Síndrome vestibular periférica (labirintite) | 30 dias após a crise e sem uso de medicamento | |
| Sífilis | 12 meses o tratamento | |
| Tromboflebite isolada | 6 | meses após a cura |
| Toxoplasmose comprovada laboratorialmente | 1 | ano após a cura |
| Tuberculose pulmonar | 5 | anos depois da cura |
| Ulcera péptica | 12 meses após a cura | |
| Varicela | 3 | semanas após a cura |
ANEXO 2 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Cirurgias e Procedimentos Invasivos (Origem: PRT MS/GM 158/2016, Anexo 2)
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - CIRURGIAS E PROCEDIMENTOS INVASIVOS
| A - PRINCIPAIS CIRURGIAS E SUA CORRELAÇÃO COM A DOAÇÃO DE SANGUE | |
| Cirurgias | Tempo de inaptidão |
| Cirurgia cardíaca | Definitivo |
| Gastrectomia total | Definitivo |
| Pneumectomia ou lobectomia | Definitivo |
| Esplenectomia | Definitivo, exceto se for pós-trauma |
| Cirurgias de miopia ou catarata | Após alta oftalmológica |
| Nefrolitotomia extracorpórea | 1 mês |
| Apendicectomia | 3 meses |
| Hemorroidectomia | |
| Hernioplastia | |
| Ressecção de varizes | |
| Cirurgia plástica sob anestesia local | |
| Amigdalectomia | |
| Colecistectomia | 6 meses |
| Vagotomia super-seletiva | |
| Histerectomia | |
| Laminectomia | |
| Artrodese de coluna | |
| Tireoidectomia | |
| Nódulo de mama | |
| Cirurgia plástica sob anestesia com bloqueio peridural ou raquimedular ou geral | |
| Ortopédicas em geral | |
| Cirurgia de politrauma | 12 meses |
| Colectomia | |
| Esplenectomia pós-trauma | |
| Nefrectomia | |
| Ressecção de aneurisma | |
| Procedimentos endoscópicos inclusive cirurgias laparoscópicas | 6 meses |
| B - CIRURGIAS E PROCEDIMENTOS ODONTOLÓGICOS | |
| Tratamento de canal, drenagem de abscesso, gengivites e cirurgias com anestesia local | 1 semana após o procedimento ou uma semana após o término do anti-inflamatório e/ou do antibiótico |
| Extração dentária | 7 dias após o procedimento |
| Procedimentos sem anestesia e sangramento (por exemplo: pequenas cáries e ajuste de aparelhos) | 1 dia após o procedimento |
| Remoção de tártaro e outros procedimentos com anestesia local (por exemplo: obturações) | 3 dias após o procedimento |
| Cirurgias odontológicas com anestesia geral | 1 mês após o término do tratamento |
ANEXO 3 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Medicamentos (Origem: PRT MS/GM 158/2016, Anexo 3)
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - MEDICAMENTOS
| PRINCIPAIS MEDICAMENTOS E SUA CORRELAÇÃO COM A DOAÇÃO DE SANGUE | |
| Medicamento | Tempo de inaptidão |
| Antibióticos e quimioterápicos antibacterianos ou antifúngicos | Temporário de acordo com a vida média da droga |
| Corticosteroides sistêmicos | Depende da doença para a qual foi utilizado. Inaptidão mínima de 48 horas após a suspensão |
| Corticosteroides tópicos | Só contraindicam a doação se a doença de base o fizer |
| Anticoagulantes | 10 dias após a interrupção do medicamento |
| Anticonvulsivantes | Enquanto estiver usando o medicamento |
| Analgésicos: paracetamol, dipirona sódica ou similares | Não contraindicam a doação, mesmo que tenham sido utilizados no dia da doação |
| Anorexígenos | 7 dias após a interrupção do medicamento |
| Anti-inflamatórios: ácido acetilsalicílico, diclo-fenacos, meloxicam, piroxicam, fenilbutazona, etc. (com efeito na função plaquetária) | Não contraindicam a doação, porém não deve ser preparado concentrado de plaquetas a partir daquela doação, se o remédio foi usado nos últimos 3 dias |
| ANTI-HIPERTENSIVOS E OUTROS MEDICAMENTOS CARDIOLÓGICOS | |
| Medicamento | Tempo de inaptidão |
| Ação Central: metildopa, clonidina, reserpina | 48 horas após a suspensão do medicamento pelo médico assistente e avaliado caso a caso |
| Beta-bloqueadores: propranolol, atenolol, oxprenolol ou similares | |
| Bloqueadores alfa-adrenérgicos: prazosina, etc. | |
| Diuréticos | Não há contraindicação. Orientar o doador a fazer uma hidratação oral prévia mais rigorosa |
| Inibidores de enzima conversora de angiotensina: captopril, enalapril, etc. | Não há contraindicação |
| Antagonistas de angiotensina II: losartana, etc. | |
| Bloqueadores de canais de cálcio: nifedipina, etc. | |
| Vasodilatadores: hidralazina, minoxidil,etc. | 5 dias após a suspensão do remédio |
| Antiarrítmicos: amiodarona, etc. | Enquanto estiver usando o medicamento |
| MEDICAMENTOS PSIQUIÁTRICOS | |
| Medicamento | Tempo de inaptidão |
| Antidepressivos | Não contraindicam a doação, porém o doador deve ser avaliado pelo médico. |
| Antipsicóticos: haloperidol, clorpromazina, etc | 7 dias após a suspensão do medicamento pelo médico assistente e avaliado caso a caso |
| Ansiolíticos e soníferos | Só contraindicam a doação se a dose for elevada |
| HORMÔNIOS E ANTIMETABÓLICOS | |
| Medicamento | Tempo de inaptidão |
| Hormônio do crescimento hipofisário humano | Definitivo |
| Hormônio gonadotrófico hipofisário humano | |
| Hormônio do crescimento recombinante | Não há contraindicação |
| Anticoncepcionais | |
| Testosterona | 6 meses após a suspensão da medicação |
| Danazol | 6 meses após a suspensão da medicação |
| Hormônios femininos | Não há contraindicação, a menos que estejam sendo usados para tratamento do câncer |
| Outros hormônios hipofisários recombinantes | Depende do motivo pelo qual o medicamento foi usado |
| Antitireoidianos de síntese: propiltiouracila, tiamazol, etc. | Avaliação caso a caso |
| Anticolesterolinemicos: clofibrato, estatinas, etc | Não contraindicam a doação a menos que estejam sendo usados para tratamento de hiperlipidemia familiar |
| MEDICAMENTOS TERATOGÊNICOS | |
| Medicamento | Tempo de inaptidão |
| Isotretinoína | 1 mês de inaptidão após a última dose |
| Finasterida | 1 mês após a interrupção do medicamento |
| Dutasterida | 6 meses após a interrupção do medicamento |
| Acitretina | 3 anos após a interrupção do medicamento |
| Etretionato | Inaptidão definitiva |
ANEXO 4 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Vacinas (Origem: PRT MS/GM 158/2016, Anexo 4)
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - VACINAS
| PRINCIPAIS VACINAS E SUA CORRELAÇÃO COM A DOAÇÃO DE SANGUE | |
| Vacinas de vírus ou bactérias vivos e atenuados | |
| Vacina | Tempo de inaptidão |
| Pólio oral (Sabin) | 4 semanas |
| Febre tifóide oral | |
| Caxumba (Parotidite) | |
| Tríplice viral [Caxumba (Parotidite), Sarampo e Rubéola] | |
| Dupla viral (Sarampo e Rubéola) | |
| Febre amarela | |
| Sarampo | |
| BCG | |
| Rubéola | |
| Varicela (Catapora)/Herpes zoster | |
| Varíola* | |
| Rotavírus | |
| Influenza | |
| Outras vacinas produzidas a partir de micro-organismos vivos ou atenuados contra infecções não relacionadas acima deverão obedecer ao tempo de inaptidão de 4 semanas, ou outras recomendações dos fabricantes. | |
| * Doença erradicada. No entanto, manter esta restrição por situações excepcionais. | |
| Vacinas de vírus ou bactérias inativados, toxoides ou recombinantes | |
| Vacina | Tempo de inaptidão |
| Cólera | 48 horas |
| Pólio (Salk) | |
| Dupla do tipo adulto - dT(Difteria e Tétano) | |
| DTPa (Difteria,Tétano e Coqueluche acelular) | |
| Tetra (Difteria,Tétano, Coqueluche e Hemophillus influenzae do tipo b) | |
| Tétano | |
| Febre tifoide (injetável) | |
| Meningite | |
| Coqueluche | |
| Peste | |
| Pneumococo | |
| Leptospirose | |
| Brucelose | |
| Hemophillus influenzae do tipo b, hepatite A | |
| Hepatite B recombinante | |
| HPV (Human Papiloma Vírus) | |
| Influenza | |
| Vacina Antirrábica (vacina inativada proveniente de cultivos celulares) | 48 horas 12 (doze) meses se após exposição animal |
| Outras vacinas produzidas a partir de micro-organismos inativados, toxoides ou recombinantes contra infecções não relacionadas acima, deverão obedecer ao tempo de inaptidão de 48 horas, ou outras recomendações dos fabricantes. | |
| Imunoterapia passiva | |
| Soro | Tempo de inaptidão |
| Imunoterapia passiva heteróloga (soro) | 4 semanas |
| Imunoterapia passiva homóloga (soro humano) | 1 ano |
| Observações: | |
| Vacinação para hepatite A (inativada) e B (recombinante) considerar inapto por 48 horas, se não relacionado com exposição ao vírus. No caso de utilização de vacinas em situação de bloqueio de surto, o período de inaptidão estará relacionado com o período de incubação da doença. Em caso de indivíduos que estejam participando de estudos clínicos para vacinas considerar inapto por 1 (um) ano após o término do protocolo de vacinação. | |
| No caso de uso de vacinas que ainda estejam em processo de registro, considerar inapto por 1 (um) ano após o término do protocolo de vacinação. | |
ANEXO 5 DO ANEXO IV
Do Algoritmo para a Testagem Obrigatória e Liberação de Bolsas de Sangue (Origem: PRT MS/GM 158/2016, Anexo 5)
DO ALGORITMO PARA A TESTAGEM OBRIGATÓRIA E LIBERAÇÃO DE BOLSAS DE SANGUE
Serão disponibilizados no endereço www.saude.gov.br/sangue os algoritmos:
I - para testagem e liberação de bolsas de sangue (HBsAg, anti HBc, anti-HTLVI/II, sífilis e doença de chagas; e
II - para testagem e liberação de bolsas de sangue (HIV, HCV e HBV, testes sorológicos e NAT ).
Parágrafo único. Entende-se por NAT positivo a positividade em amostra já testada individualmente.
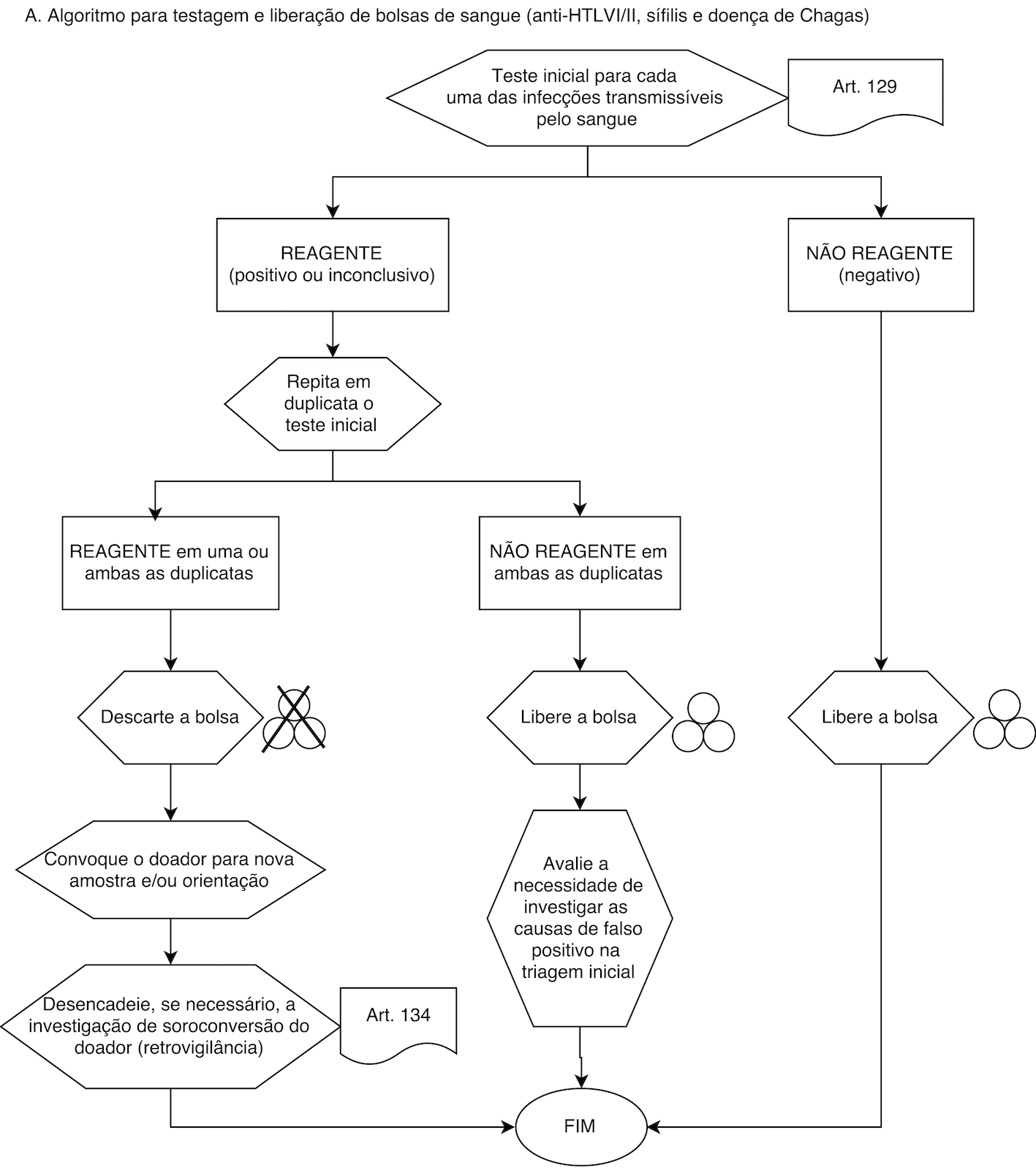
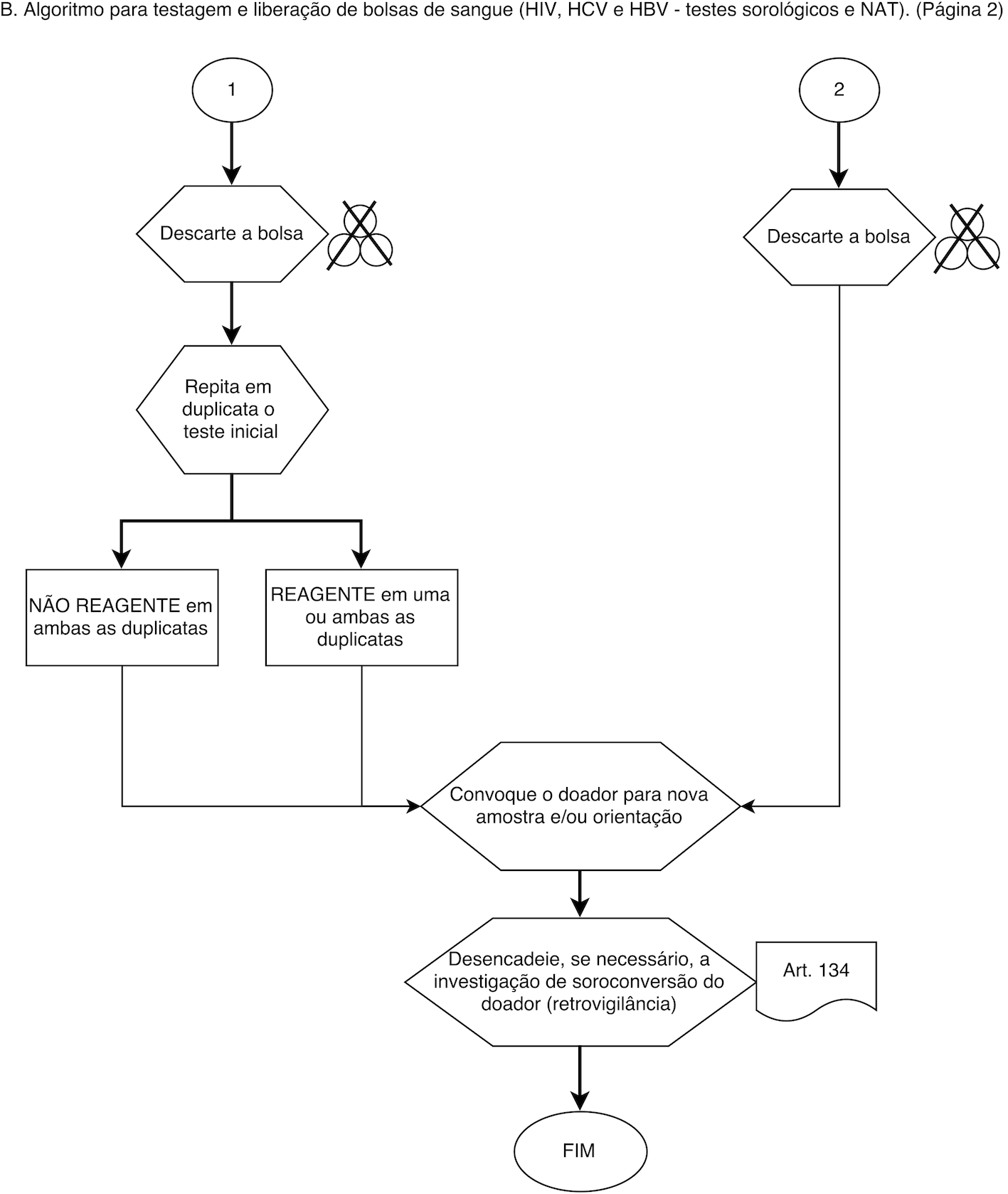
ANEXO 6 DO ANEXO IV
Especificações dos Componentes Sanguíneos - Controle de Qualidade (Origem: PRT MS/GM 158/2016, Anexo 6)
ESPECIFICAÇÕES DOS COMPONENTES SANGUÍNEOS - CONTROLE DE QUALIDADE
| Concentrado de hemácias | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 45g/unidade |
| Hematócrito | 50 a 80% * |
| Grau de hemólise | menor que 0,8% da massa eritrocitária (no último dia de armazenamento) |
| Microbiológica | Negativa |
| * O hematócrito esperado depende do tipo de solução preservativa utilizada na bolsa, sendo de 50 a 70% para os concentrados de hemácias com soluções aditivas e de 65 a 80% para com CPDA-1. | |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias lavadas | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 40g/unidade |
| Hematócrito | 50 a 75% |
| Grau de hemólise | menor que 0,8% da massa eritrocitária |
| Recuperação | maior que 80% da massa eritrocitária |
| Proteína residual | menor que 0,5g/unidade |
| Microbiológica | Negativa |
| OBS.: em todas as unidades produzidas deve ser testado o teor residual de proteína, os demais parâmetros devem ser testados em 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias desleucocitadas | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 40g/unidade |
| Grau de hemólise | menor que 0,8% da massa eritrocitária |
| Leucócitos residuais | menor que 5,0 x 10e6/unidade |
| Microbiológica | Negativa |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias com camada leucoplaquetária removida | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 43g/unidade |
| Hematócrito | 50 a 80%* |
| Grau de hemólise | menor que 0,8% da massa eritrocitária (no último dia de armazenamento) |
| Leucócitos | menor que 1,2 x 10e9/unidade |
| Microbiológica | Negativa |
| * O hematócrito esperado depende do tipo de solução preservativa utilizada na bolsa, sendo de 50 a 70% para os concentrados de hemácias com soluções aditivas e de 65 a 80% para com CPDA-1. | |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias congeladas | |
| Análises | Valores esperados |
| Volume | maior que 185mL* |
| Hemoglobina no sobrenadante | menor que 0,2g/unidade* |
| Teor de hemoglobina | maior que 36g/unidade* |
| Hematócrito | 50 a 75%* e ** |
| Recuperação | maior que 80% da massa eritrocitária |
| Osmolaridade | menor que 340 mOsm/L |
| Contagem de leucócitos | menor que 0,1 x 10e9/unidade |
| Microbiológica | Negativa |
* Os parâmetros de volume, hemoglobina sobrenadante, teor de hemoglobina e hematócrito devem ser avaliados em todas as unidades produzidas, os demais em 1% da produção ou 10 unidades por mês (o que for maior). |
|
| Concentrado de plaquetas obtido de sangue total | |
| Análises | Valores esperados |
| Volume | 40 – 70ml |
| Contagem de plaquetas | maior igual que 5,5 x 10e10/unidade |
| Contagem de leucócitos | |
| Preparado de plasma rico em plaquetas | menor que 2,0 x 10e8/unidade |
| Preparado de camada leucocitária | menor que 0,5 x 10e8/unidade |
| pH | maior que 6,4 (no último dia de armazenamento) |
| Microbiológica | Negativa |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
Concentrado de plaquetas por aférese |
|
Análises |
Valores esperados |
Volume |
maior igual que 200mL* |
Contagem de plaquetas |
maior que= 3,0 x 10e11/unidade (plaquetaférese simples) |
maior que= 6,0 x 10e11/unidade (plaquetaférese dupla) |
|
Contagem de leucócitos |
menor que 5,0 x 10e6/unidade |
pH |
maior que 6,4 (no último dia de armazenamento) |
Microbiológica |
Negativa |
* Deve ser garantido um volume mínimo de plasma ou solução aditiva de 40 mL por 5,5 x 10 e 10 plaquetas. |
|
| Concentrado de plaquetas desleucocitadas | |
| Análises | Valores esperados |
| Contagem de plaquetas | maior que= 5,5 x 10e10/unidade |
| Contagem de leucócitos: | |
| no pool | menor que 5,0 x 10e6/pool |
| por unidade | menor que 0,83 x 10e6/unidade |
| pH | maior que 6,4* (no último dia de armazenamento) |
| Microbiológica | Negativa |
| * A medida do pH só deve ser feita se a desleucocitação for realizada pré-armazenamento. | |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de granulócitos por aférese* | |
| Análises | Valores esperados |
| Volume | menor que 500mL |
| Contagem de granulócitos | maior que= 1,0 x 10e10/unidade |
| * Estes parâmetros devem ser testados em todas as unidades produzidas. | |
| Plasma comum (plasma não fresco, plasma normal ou plasma simples)* | |
| Análises | Valores esperados |
| Volume | maior que= 150mL |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas. | |
| Plasma isento de crioprecipitado (PIC)* | |
| Análises | Valores esperados |
| Volume | maior que= 140 mL |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas. | |
| Plasma fresco congelado (PFC) e Plasma fresco congelado dentro de 24 horas (PFC24)* | |
| Análises | Valores esperados |
| Volume | maior que= 150mL |
| TTPA 1; 2 | Até valor do pool controle + 20% |
| Fator VIII:C 1; 2; 3 | maior que= a 0,7UI/mL |
| Fator V 1; 2; 3 | maior que= a 0,7UI/mL |
| Leucócitos residuais 4 | menor que 0,1 x 10e6/mL |
| Hemácias residuais 4 | menor que 6,0 x 10e6/mL |
| Plaquetas residuais 4 | menor que 50 x 10e6/mL |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas, os demais em 1% da produção ou 4 (quatro) unidades (o que for maior) mensalmente. 1 - O serviço de hemoterapia pode optar por apenas um destes parâmetros utilizando unidades com até 30 (trinta) dias de armazenamento. O serviço de hemoterapia deve realizar dosagem de Fator VIII | |
| quando fornecer plasma excedente para fracionamento. 2 - A análise deve ser feita utilizando amostras de PFC e PFC24 conjuntamente e em proporção definida pelo serviço baseado na produção. 3 - As dosagens de Fator VIII:C e Fator V podem ser realizados em pools de até 10 (dez) amostras de | |
| bolsas de plasma, com um mínimo de 4 (quatro) pools mensais. 4 - As células residuais devem ser contadas antes do congelamento. | |
| Crioprecipitado* | |
| Análises | Valores esperados |
| Volume | 10 a 40mL (em todas a unidade produzidas) |
| Fibrinogênio | maior que150mg/unidade |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas, os demais em 1% da produção ou 4 unidades (o que for maior), em unidades com até 30 (trinta) dias de armazenamento, nos meses em que houver produção. | |
ANEXO 7 DO ANEXO IV
Controle de Qualidade dos Reagentes de Imuno-Hematologia - Parâmetros Recomendados (Origem: PRT MS/GM 158/2016, Anexo 7)
CONTROLE DE QUALIDADE DOS REAGENTES DE IMUNO-HEMATOLOGIA - PARÂMETROS RECOMENDADOS
A.Inspeção dos reagentes:
| Parâmetros | Especificações | Frequência |
| Avaliação do rótulo | Nome do fabricante, nome e origem do produto, data de validade, | A cada lote/remessa |
| número do lote, volume, temperatura de estocagem, número de registro na ANVISA, firmemente afixado ao frasco e que permita a inspeção visual do conteúdo. | ||
| Avaliação das instruções de uso | Nome e composição do reagente, descrição dos procedimentos técnicos, informações claras e legíveis e em português. | A cada lote/remessa |
| Avaliação da embalagem / frasco | Embalagem íntegra e bem vedada e frascos conta-gotas transparentes. | A cada lote/remessa |
B. Inspeção visual dos reagentes
| Reagentes | Especificações | Frequência |
| Antissoros, potencializadores, soluções e enzimas proteolíticas | Ausência de precipitados, gelatina, partículas, fungos, turvação e hemólise. | Diária |
| Reagentes de hemácias | Ausência de hemólise, turvação do líquido sobrenadante ou escurecimento da hemácia. | Diária |
C - Inspeção laboratorial dos reagentes: Hemácias "A" e "B"
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Pode ser avaliada pela intensidade de aglutinação obtida com plas- mas ou soros que possuam os anticorpos complementares aos an- tígenos presentes nas hemácias | A cada lote/remessa |
| testadas. Testar hemácias "A" (suspensão a 3-5%) com plasma "B" e hemácias "B" (suspensão a 3-5%) com plasma "A". A intensidade mínima de aglutinação obtida | ||
| para qualificar o reagente de hemácias é de 2+. Não deve ocorrer a formação de empilhamento ("rouleaux"). | ||
| Especificidade | Pode ser avaliada pela capacidade do anticorpo reconhecer apenas seus antígenos eritrocitários complementares. Testar hemácias "A" e "B" (suspensão a 3-5%) | A cada lote/remessa |
| com plasmas "AB". Não deve haver aglutinação, visto que não há anticorpo específico para promovê-la no teste | ||
| realizado. Não deve ocorrer a formação de empilhamento ("rou- leaux"). |
D - Inspeção laboratorial dos reagentes: Antissoros anti-A, -B e -AB
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Deve ser avaliada por meio da intensidade da aglutinação do soro não diluído com hemácia contendo o antígeno | A cada lote/remessa |
| correspondente. Testar os soros anti-A, -B, -AB com hemácias (suspensão a 3-5%) que contenham os antígenos correspondentes. Ver padrão de avaliação dos resultados no | ||
| quadro D.1. | ||
| Potência: título | É determinado utilizando diluições em série dos antissoros (1/1 até 1/2048) colocando-os em contato com hemácias que contenham os antígenos correspondentes | A cada lote/remessa |
| Testar os soros anti-A, -B, -AB com hemácias (suspensão a 3-5%) que contenham os antígenos correspondentes. Ver padrão de avaliação dos resultados no | ||
| quadro D.1. | ||
| Potência: avidez | É avaliada pela medida do tempo entre a adição do soro e hemácias testes e a identificação macroscópica inicial da aglutinação. Testar os soros anti-A, -B, -AB | A cada lote/remessa |
| com hemácias (suspensão a 10-20%) que contenham os antígenos correspondentes. Ver padrão de avaliação dos resultados no quadro D.1. | ||
| Especificidade | Pode ser avaliada pela capacidade do anticorpo reconhecer apenas seus antígenos eritrocitários complementares. Testar os soros anti-A, - B e -AB com hemácias "O" | A cada lote/remessa |
| (suspensão a 3-5%). Não deve haver aglutinação, visto que não há antígeno específico para promovê-la nos testes realizados. |
D.1. Parâmetros de Intensidade de aglutinação e título esperados para os antissoros anti-A, -B e -AB
| Antissoro | Reagentes de hemácias utilizados* | Intensidade mínima de aglutinação sem diluição do antissoro | Avidez (suspensão de hemácias a 20%) | Título |
| Anti-A | A1 | 3+ | até 15'' | 256 |
| Cor: Azul | ||||
| A2 | 2+ | até 30'' | 128 | |
| A1B | 3+ | até 30'' | 128 | |
| A2B | 2+ | até 45'' | 64 | |
| Anti-B | B | 3+ | até 15'' | 256 |
| Cor: Amarela | ||||
| A1B | 3+ | até 15'' | 256 | |
| Anti-AB | A1 | 3+ | até 15'' | 256 |
| Cor: Incolor | ||||
| A1B | 3+ | até 15'' | 256 | |
| B | 3+ | até 15'' | 256 | |
| A2 | 3+ | até 30'' | 128 |
* no mínimo 3 hemácias de cada fenótipo.
E. Inspeção laboratorial dos reagentes: Antissoros anti-RhD
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Pode ser avaliada por meio da intensidade de aglutinação do soro não di- luído com hemácias contendo os antígenos correspondentes. Testar o | A cada lote/remessa |
| soro anti-RhD com hemácias "O" positivo (suspensão 3-5%). Ver padrão de avaliação dos resultados no quadro E. 1 | ||
| Potência: título | É determinado por meio de diluições em série dos antissoros(1/1 até 1/2048) colocando-os em contato com hemácias que contenham os antí- genos correspondentes. Testar os soros anti | A cada lote/remessa |
| RhD com hemácias "O" positivo (suspensão a 3-5%). Ver padrão de avaliação dos resultados no quadro E. 1 | ||
| Potência: avidez | É avaliada pela medida do tempo entre a adição do soro e hemácias testes e a identificação macroscópica inicial da aglutinação. Testar os soros antiRhD com hemácias "O" positivo | A cada lote/remessa |
| (suspensão a 40-50%). Ver padrão de avaliação dos resultados no quadro E. 1. | ||
| Especificidade | Pode ser avaliada pela capacidade do anticorpo reconhecer apenas seus an- tígenos eritrocitários complementares. Testar os soros anti-RhD com hemá- cias "O" RhD negativo (suspensão a 3- | A cada lote/remessa |
| 5%). Não deve haver aglutinação, visto que não há antígeno específico para promovê-la nos testes realizados. |
E.1. Parâmetros de intensidade de aglutinação e título esperados para os antissoros anti-RhD
| Antissoro | Fenótipos das hemácias utilizados | Intensidade mínima de aglutinação sem diluição | Avidez (suspensão de hemácias a 40- 50%) | Título |
| Anti-RhD | "O" R0r (Dccee) | 3+ | até 30'' | 32 |
| Cor: incolor | ||||
| "O" R1r (DCcee) | 3+ | até 30'' | 32 | |
| "O" R2r (DccEe) | 3+ | até 30'' | 32 |
*Deve-se utilizar no mínimo 3 hemácias de cada fenótipo
F. Inspeção laboratorial dos reagentes: Antiglobulina Humana (AGH)
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Pode ser avaliada pela intensidade da aglutinação da AGH com hemácias RhD positivas (preferencialmente R0r Dccee) sensibilizadas com anticorpos da classe IgG após adsorção (plasma | a cada lote/remessa |
| humano com anti-RhD ou soro comercial anti-RhD policlonal).Testar a AGH realizando o teste de antiglobulina direto (Coombs direto) com as | ||
| hemácias sensibilizadas "O" RhD positivo (suspensão a 3-5%). A intensidade mínima de aglutinação esperada é de 3+ | ||
| Especificidade | O antissoro não deve reagir com hemácias que não estejam sensibilizadas com anticorpos IgG e/ou complemento. Testar a AGH realizando o teste de antiglobulina direto (Coombs direto) com 3 | a cada lote/remessa |
| hemácias distintas (suspensão a 3-5%) não sensibilizadas. Não deve haver aglutinação ou hemólise. |
G. Inspeção laboratorial dos reagentes: Salina, LISS, albumina bovina e enzimas proteolíticas
| Reagentes | Especificações | Frequência |
| Salina | Não pode promover hemólise e aglutinação de hemácias não sensibilizadas nos testes imuno-hematológicos. Estas características deverão ser observadas quando este reagente estiver em uso. | diária |
| Verificar pH cujos valores permitidos são de 6,0 a 8,0 | a cada lote/remessa diária | |
| LISS | Não pode promover hemólise e aglutinação de hemácias não sensibilizadas nos testes imuno-hematológicos. Estas características deve- rão ser observadas quando este reagente estiver em uso. | |
| Verificar pH cujos valores permitidos são de 6,5 a 7,0 | a cada lote/remessa |
H. Inspeção visual das colunas de aglutinação:
| Indicadores | Especificações | Frequência |
| Microtubos com gel ou pérolas | Totalmente sedimentados, aspecto homogêneo e solução tampão acima da coluna. Não devem apresentar sinais de ressecamento, partículas em suspensão e bolhas de ar. O nível do gel ou das | diária |
| pérolas em todos os microtubos deve ser de 2/3. O nível do tampão deve estar entre 1 a 2 mm acima do gel ou pérola de vidro. | ||
| Lacres de alumínio | Sem perfurações ou irregularidades. Na retirada do lacre é preciso observar, na parte inferior da folha de alumínio, as marcas impressas das bordas dos | diária |
| orifícios dos microtubos que indicam o fechamento correto. |
Observações:
1) todos os testes de controle de qualidade de reagentes devem ser registrados em formulários específicos. Estes devem informar o nome do reagente, fabricante, lote, validade, resultados dos testes e responsável pela execução do teste;
2) os reagentes que estiverem fora das especificações técnicas descritas acima não devem ser utilizados na rotina. Registrar as não conformidades e investigar as causas das inadequações; e
3) recomenda-se que serviços de hemoterapia que utilizarem outros reagentes elaborem procedimentos de controle de qualidade, porém sem caráter obrigatório.
ANEXO 8 DO ANEXO IV
Controle de Qualidade de Reagentes de Sorologia (Origem: PRT MS/GM 158/2016, Anexo 8)
Art. 1º O serviço de hemoterapia adotará ferramentas de boas práticas para a avaliação, manipulação e monitoração que garantam a qualidade dos serviços prestados. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º)
Parágrafo Único. O controle do processo da triagem sorológica compreenderá: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único)
I - a qualificação inicial; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, I)
II - a qualificação dos lotes/remessa de reagentes; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, II)
III - o monitoramento diário; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, III)
IV - a calibração periódica de equipamentos; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, IV)
V - a manutenção preventiva e corretiva. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, V)
Art. 2º Os kits de conjuntos diagnósticos serão aprovados antes da aquisição ou do início de utilização. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º)
§ 1º Durante a avaliação será utilizado, no mínimo, um lote do reagente em teste. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 1º)
§ 2º Serão testados os equipamentos e "software", verificando se apresentam segurança em todo o processo. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 2º)
§ 3º Serão utilizadas amostras de sangue com resultados conhecidos e caracterizadas laboratorialmente ou painéis comerciais. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 3º)
§ 4º Para a aprovação dos conjuntos diagnósticos serão avaliados: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 4º)
I - a sensibilidade, que deverá ter valor mínimo de 100%, não sendo aceito nenhum falso negativo; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 4º, I)
II - a especificidade, que deverá ser acima de 99%. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 4º, II)
§ 5º No momento da aquisição ou início de utilização dos kits, equipamentos ou "softwares", os fornecedores apresentarão: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º)
I - certificado de registro de produto e equipamento, quando aplicável; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º, I)
II - plano continuado de capacitação teórico-prática de recursos humanos; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º, II)
III - plano de manutenção corretiva, preventiva e de calibração para cada equipamento em comodato. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º, III)
§ 6º No momento do recebimento dos kits, equipamentos e "softwares", será realizada, em cada lote e em cada remessa, inspeção com o objetivo de verificar a conformidade com o solicitado antes da aquisição ou início da utilização. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 6º)
§ 7º Na inspeção de que trata o § 6º serão avaliados: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º)
I - os reagentes; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, I)
II - a integridade da embalagem; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, II)
III - a bula; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, III)
IV - o nome dos reagentes; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, IV)
V - as condições de acondicionamento e transporte; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, V)
VI - o lote; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, VI)
VII - a validade. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, VII)
§ 8º No controle de lotes e remessas serão utilizadas amostras com resultados conhecidos e caracterizados laboratorialmente ou painéis comerciais. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 8º)
§ 9º Os equipamentos e "softwares" deverão estar em conformidade com a avaliação realizada antes da aquisição. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 9º)
Art. 3º O Controle de Qualidade Interno (CQI) será realizado com a finalidade de evidenciar a perda da sensibilidade dos ensaios, identificar variações lote a lote e remessa a remessa e detectar erros aleatórios ou sistemáticos. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º)
§ 1º O Controle de Qualidade Interno Positivo (CQIP) será adquirido ou produzido obedecendo-se os critérios de boas práticas. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 1º)
§ 2º O CQIP será caracterizado e validado previamente quando for de produção interna. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 2º)
§ 3º Em cada corrida será usado, no mínimo, 1 (um) CQIP e os resultados não conformes dessa análise invalidarão os ensaios. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 3º)
§ 4º A produção de CQIP para métodos imunoenzimáticos (EIE) de quimioluminescência (QLM) e métodos de floculação (VDRL/RPR) par a os ensaios de anti-HIV1/2, HBsAg, anti-HBc, anti-HCV, anti-HTLV I/II, Chagas e Sífilis será específica para cada metodologia. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 4º)
§ 5º Nas ações para caracterização das bolsas de plasma positivo para produção do CQIP, a validação deste compreenderá a testagem por, no mínimo, duas metodologias diferentes em que pelo menos uma seja diferente da utilizada na rotina. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 5º)
§ 6º É recomendável a utilização de uma metodologia confirmatória na validação do CQIP se disponível. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 6º)
§ 7º É recomendado que a determinação do coeficiente de variação (CV) específico para cada sistema analítico seja aferido intra e interensaios. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 7º)
§ 8º O valor de leitura (DO ou RLU) do CQIP deve estar na faixa de 1,5 a 4,5 vezes o valor do ponto de corte do ensaio (cut off) testado na metodologia específica. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 8º)
§ 9º No caso de CQIP para métodos de floculação (VDRL/RPR), será utilizado plasma com resultado reagente na triagem sorológica para sífilis, com título mínimo de 1/16 e teste treponêmico positivo. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 9º)
§ 10. Os CQIP serão armazenados em temperatura igual ou inferior a -20ºC (vinte graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 10)
§ 11. As alíquotas do CQIP a serem utilizadas serão descongeladas uma única vez, em virtude da possibilidade de ocorrência de precipitação de imunoglobulinas e consequente alteração do padrão de reatividade. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 11)
Art. 4º A participação em programas de proficiência (Controle de Qualidade Externo) tem como finalidade a verificação da proficiência da triagem sorológica do laboratório. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º)
§ 1º É esperado nos programas de proficiência a completa conformidade dos resultados (100% de acerto). (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º, § 1º)
§ 2º Resultados discrepantes dos esperados terão as causas analisadas (erros técnicos, equipamentos, reagentes, dentre outros) e medidas corretivas serão implementadas, quando cabíveis. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º, § 2º)
§ 3º As testagens das amostras dos painéis de controle externo serão realizadas nas mesmas condições e com os mesmos procedimentos adotados na rotina, atendidas as orientações do fornecedor. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º, § 3º)
ANEXO 9 DO ANEXO IV
Controle de Qualidade de Reagentes de Teste de Detecção de Ácido Nucleico (NAT) para HIV, HCV e HBV (Origem: PRT MS/GM 158/2016, Anexo 9)
CONTROLE DE QUALIDADE DE REAGENTES DE TESTE DE DETECÇÃO DE ÁCIDO NUCLEICO (NAT) PARA HIV, HCV E HBV
Art. 1º O serviço de hemoterapia adotará ferramentas de boas práticas para a avaliação, manipulação e monitoração dos testes de detecção de ácido nucleico, que garantam a qualidade dos serviços prestados.
Art. 2º O controle do processo da triagem NAT compreenderá:
I - a qualificação inicial;
II - a qualificação dos lotes/remessas de reagentes;
III - o monitoramento diário;
IV - a calibração periódica; e
V - a manutenção preventiva e corretiva de equipamentos.
Art. 3º O NAT para HIV, HCV e HBV, a ser utilizado pelo serviço de hemoterapia, deve ser capaz de detectar em 95% das vezes 600 UI/mL para HCV, 600 cópias/mL para HIV e 300 UI/mL para HBV na amostra do doador.
Parágrafo único. A sensibilidade do teste e o número de amostras do pool serão definidos em conjunto para atender à sensibilidade da amostra do doador.
A. Disposições Gerais.
Os kits (conjuntos diagnósticos) deverão ser aprovados antes da aquisição ou início de utilização:
-durante a avaliação deve ser utilizado, no mínimo, um lote do reagente em teste;
-devem-se testar os equipamentos e "software", verificando se apresentam segurança em todo o processo; e
-devem ser utilizadas amostras de sangue com resultados conhecidos e caracterizadas laboratorialmente ou painéis comerciais.
A.1. Critérios para a aprovação:
-devem ser avaliadas: sensibilidade e especificidade; e
-valores mínimos de aceitação:
a)sensibilidade de 100% (não é aceitável nenhum falso negativo); e
b)especificidade: acima de 99%.
A.2. No momento da aquisição ou início de utilização dos kits/equipamentos/"software"os fornecedores deverão apresentar:
-certificado de registro de produto e equipamento (quando aplicável);
-plano continuado de capacitação teórico-prática de recursos humanos; e
-plano de manutenção corretiva, preventiva e de calibração para cada equipamento em comodato.
A.3. Inspeção no recebimento dos "kits"/equipamentos/"software":
-objetivos: verificar se estão em conformidade com o solicitado antes da aquisição ou início de utilização. Deve ser realizada para cada lote e em cada remessa;
- avaliar: reagentes, integridade da embalagem, bula, nome dos reagentes, condições de acondicionamento e transporte, lote e validade;
-controle de lote/remessa: utilizar amostras com resultados conhecidos e caracterizadas laboratorialmente ou painéis comerciais; e
-equipamentos e "software": deverão estar em conformidade com a avaliação que foi realizada antes da aquisição.
B. Controle de Qualidade Interno (CQI).
O CQI tem a finalidade de: evidenciar a perda da sensibilidade dos ensaios, identificar variações lote a lote/remessa a remessa e detectar erros aleatórios ou sistemáticos.
O controle de qualidade interno positivo (CQIP) poderá ser produzido, obedecendo aos critérios das boas práticas, ou adquirido. Quando a produção for interna este controle deve ser caracterizado e validado previamente.
- o controle de qualidade interno positivo (CQIP) pode ser obtido através de diluições seriadas de plasma com resultados sorológicos e de NAT positivos (pool e single) para os marcadores empregados na detecção. Deverá ser estabelecido um valor de corte para o CQIP, considerando a diluição utilizada. A produção de CQIP deve ser específica para cada metodologia;
- as amostras do CQIP devem ser armazenadas em condições que garantam a sua estabilidade; e
- o CQIP deve ser testado em todas as rotinas, nas mesmas condições das amostras e com os mesmos procedimentos adotados na rotina. Os resultados do CQIP deverão ser monitorados em todas as rotinas e atender aos critérios de aceitação pré-definidos.
C. Participação em programas de proficiência (Controle de Qualidade Externo).
Têm como finalidade verificar a proficiência da triagem NAT do laboratório. Espera-se completa conformidade dos resultados (100 % de acerto). Resultados discrepantes dos esperados deverão ter suas causas analisadas (erros técnicos, equipamentos, reagentes, entre outros) e medidas corretivas deverão ser implementadas, se pertinentes.
As testagens das amostras dos painéis de controle externo devem ser realizadas nas mesmas condições e com os mesmos procedimentos adotados na rotina, atendendo orientações do fornecedor.
ANEXO 10 DO ANEXO IV
Condições para Transporte de Sangue Total e Componentes Sanguíneos (Origem: PRT MS/GM 158/2016, Anexo 10)
CONDIÇÕES PARA TRANSPORTE DE SANGUE TOTAL E COMPONENTES SANGUÍNEOS
| Condições de transporte | Sangue total para processamento | Concentrado de hemácias | Plasma fresco congelado | Crioprecipitado | Concentrado de plaquetas |
| Temperatura de transporte | 20o a 24oC (para produção de CP) ou 1° a 10°C (não for destinado à produção de CP). | 1 a 10ºC | Manter estado congelado | Manter estado congelado | A temperaturas próximas das de armazenamento |
| Substância resfriadora recomenda- da | Placas de 1,4-butanediol Gelo reciclável | Gelo reciclável | Gelo seco ou gelo reciclável | Gelo seco ou gelo reciclável | Somente em condições de alta temperatura: gelo reciclável |
| Tempo máximo de transporte | 18 horas | 24 horas | 24 horas | 24 horas | 24 horas |
ANEXO 11 DO ANEXO IV
Do Envio do Plasma para Indústria de Hemoderivados (Origem: PRT MS/GM 158/2016, Anexo 11)
Art. 1º O coordenador do SINASAN definirá quanto à utilização de todo plasma congelado excedente do uso terapêutico existente em qualquer serviço de hemoterapia público ou privado com vistas ao atendimento de interesse nacional, conforme previsto no § 1º do art. 14 da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 1º)
Art. 2º Não é permitida aos serviços de hemoterapia, públicos ou privados, a disponibilização de plasma para indústria de hemoderivados, nacional ou internacional, sem a autorização escrita do Ministério da Saúde. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 2º)
Art. 3º A realização de procedimento de plasmaférese obedecerá ao disposto no art. 101 do Anexo IV . (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 3º)
Parágrafo Único. A obtenção de insumos para indústria de hemoderivados é atividade exclusiva dos serviços de hemoterapia públicos, sendo que os serviços de hemoterapia que forem fornecedores nesta modalidade deverão solicitar autorização escrita da CGSH/DAHU/SAS/MS para coleta e envio do plasma com este fim. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 3º, Parágrafo Único)
Art. 4º Somente plantas industriais nacionais de natureza pública receberão o plasma dos serviços de hemoterapia brasileiros obtido por plasmaférese. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 4º)
Parágrafo Único. A CGSH/DAHU/SAS/MS acompanhará os resultados das atividades de certificação dos serviços de hemoterapia e beneficiamento do plasma pelas plantas industriais de hemoderivados, a fim de garantir o estabelecido nos inciso VIII, XII e XIV do art. 16 da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 4º, Parágrafo Único)
Art. 5º A CGSH/DAHU/SAS/MS verificará, oportunamente, por meio de critérios técnicos, os serviços de hemoterapia que serão fornecedores de plasma para a indústria de hemoderivados, conforme a viabilidade e capacidade operacional, além de competência técnica do serviço de hemoterapia para fornecer matéria-prima. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 5º)
Art. 6º A CGSH/DAHU/SAS/MS emitirá documento ao serviço de hemoterapia certificado e aprovado pela indústria de hemoderivados para fornecimento de plasma autorizando o serviço de hemoterapia a fornecer plasma como matéria-prima para a indústria certificadora pelo período de um ano ou até a expiração da validade da certificação anterior (conforme normativas sanitárias vigentes) que se baseará nas informações prestadas pela indústria produtora. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º)
§ 1º A autorização de que trata o "caput" será dada ao serviço de hemoterapia anualmente para fornecimento do plasma excedente do uso terapêutico à indústria que o certificou, devendo, ainda, acordar com esta os demais procedimentos necessários à execução do beneficiamento do plasma. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 1º)
§ 2º Para cumprimento do disposto no § 1º, a indústria produtora de hemoderivados que atua no âmbito do SINASAN deverá: (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 2º)
I - certificar os fornecedores de matéria-prima, quanto aos procedimentos operacionais adotados pelos serviços de hemoterapia, conforme critérios estabelecidos pela legislação vigente, obedecendo à periodicidade prevista na legislação sanitária vigente; e (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 2º, I)
II - apresentar relatório circunstanciado da avaliação dos serviços de hemoterapia à CGSH/DAHU/SAS/MS para ciência e autorização de fornecimento em até 30 (trinta) dias após a visita. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 2º, II)
§ 3º O relatório de aprovação servirá para concessão da autorização de fornecimento do plasma. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 3º)
§ 4º O relatório da não aprovação servirá para adoção de medidas para melhoria pelos serviços de hemoterapia para qualificação do plasma. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 4º)
§ 5º Para recolhimento do plasma dos serviços de hemoterapia autorizados, a indústria produtora definirá junto ao fornecedor o cronograma de recolhimento do plasma excedente do uso terapêutico. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 5º)
§ 6º A indústria apresentará à CGSH/DAHU/SAS/MS, ao décimo quinto dia de cada mês, relatório de suas atividades de auditorias de certificação de fornecedores, recolhimento do plasma, informando: (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º)
I - quais serviços de hemoterapia foram auditados no mês e resultados; (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º, I)
II - em quais serviços de hemoterapia ocorreu o recolhimento de plasma, data e quantidades recolhidas; e (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º, III)
III - intercorrências que demandem intervenção dessa Coordenação. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º, IV)
§ 7º A indústria produtora apresentará semestralmente o relatório de produção de hemoderivados, para ciência e acompanhamento das atividades desenvolvidas no âmbito do SINASAN, e no qual constará: (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º)
I - a quantidade de plasma recolhido, enviado para fábrica, beneficiado, descartado e principais motivos de descarte; (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º, I)
II - os rendimentos dos fracionamentos; e (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º, II)
III - a quantidade de hemoderivados produzidos. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º, III)
Art. 7º O SINASAN fomentará que os serviços de hemoterapia busquem qualificação de sua produção de plasma para atender ao interesse nacional na produção de hemoderivados, sem prejuízo à terapêutica. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 7º)
Art. 8º Quando houver a necessidade de exportação temporária do plasma para fins de beneficiamento no exterior, a indústria que executará a operação deve solicitar autorização de exportação temporária do plasma à CGSH/DAHU/SAS/MS, anteriormente à solicitação de licenças sanitárias e demais providências necessárias. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 8º)
ANEXO 12 DO ANEXO IV
PROGRAMA NACIONAL DE CONTROLE DE QUALIDADE EXTERNO EM SOROLOGIA (PNCQES) (Origem: PRT MS/GM 1840/1996, Anexo 1)
1. Definições
1.1 Programa Nacional de Controle de Qualidade Externo em Sorologia - PNCQES - É um Programa de amplitude nacional, implantado pelo Ministério da Saúde, com o objetivo de avaliar a qualidade e o desempenho dos resultados doa testes sorológicos realizados nas Unidades Hemoterápicas. Esta avaliação será realizada no mínimo semestralmente, utilizando painéis de soros conhecidos (multipaineis), produzidos pela instituição credenciada.
1 2. Testes de Proficiência em Laboratórios de Sorologia - É uma avaliação do desempenho do laboratório, envolvendo a utilização de painéis, para determinar a qualidade dos resultados, por intermédio da comparação dos resultados obtidos pelo avaliado com os resultados conhecidos.
1.3. Painel de soros - É um conjunto de amostras de soros estáveis e bem caracterizadas quanto à sua negatividade ou positividade para sífilis, doença de Chagas, HBV, HCV, HTLV I e II, e HIV. A caracterização é feita por meio de ensaios de diferentes procedências e características e também pela utilização de métodos complementares/confirmatórios. O resultado dos testes somente será conhecido pelo laboratório produtor (instituição de referência).
1.4 Laboratório de referência e produtor - É o laboratório credenciado pelo Ministério da Saúde, em função de competência especifica, para produzir painéis de soros conhecidos e avaliar os resultados obtidos pelas Unidades Hemoterápicas por intermédio de laudos técnicos.
ITEM 2 (Suprimido pela Portaria GM/MS1544, de 1997).
3. Critérios de Avaliação
3.1 A Portaria MS nº 1376 de 19 de novembro de 1993 identifica a obrigatoriedade da utilização de técnicas de alta sensibilidade para triagem sorológica de doadores de sangue, em função dos riscos da liberação de resultados falsos negativos. Portanto, o PNCQES considerará como falta grave a não detecção da positividade nos soros contidos nos multipaineis, exigindo-se 100% de sensibilidade em relação ao número total de amostras. Quando assim detectado e por sua inteira responsabilidade, a unidade avaliada deverá corrigir, de imediato, os fatores responsáveis pelo(s) resultado(s) inadequado(s), comunicando obrigatoriamente o fato ao órgão de vigilância sanitária do Sistema Único de Saúde da unidade federada. Neste caso, a unidade avaliada deverá repetir o teste de proficiência, no prazo máximo de 30 dias.
3.2. A especificidade dos resultados, deverá também ser avaliada, em função de que os resultados falsos positivos indicam a qualidade dos testes realizados. Os critérios utilizados serão:
- de 75% a 100% de acertos por tipo de teste (os doença) e no total do número de determinações será considerado como desempenho ótimo.
- abaixo de 75% de acertos será considerado como desempenho insatisfatório, devendo a unidade avaliada identificar e corrigir o(s) fator(es) responsável(eis) de imediato. Deverá também, neste caso, comunicar ao órgão de vigilância sanitária do Sistema Único de Saúde da unidade federada, assim como, quais foram as medidas corretivas. Deverá tombem repetir o teste de proficiência no prazo máximo de 30 dias.
4. Laudos Técnicos
4.1 Os laudos serão emitidos pelo Laboratório Credenciado conforme formulários abaixo.
| Instituição |
| Data:___/___/___ |
Assinalar com "X" a positividade encontrada em cada amostra.
| Amostra | Resultados obtidos | AMS093596 |
1- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
2- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
3- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
4- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
5- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
6- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
7- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
8- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
9- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
10- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
11- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
12- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
13- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
14- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
Responsável (Nome): |
||
Data: ___/___/___ |
Assinatura: |
|
AVALIAÇÃO
|
|
| Responsável (Nome): | |
| Data: ___/___/___ | Assinatura: |
| Instituição: | |
| Data: ___/___/___ | |||||
| Método | Marca | Geração | Lote | Vencimento | |
| SÍFILIS | V.D.R.L | / / | |||
| Hemaglutinação | / / | ||||
| ELISA | / / | ||||
| FTAabs | / / | ||||
| Outros | / / | ||||
| anti-HIV | ELISA (Lisado Viral) | / / | |||
| ELISA 1+2 | / / | ||||
| IFI | / / | ||||
| Western Blot | / / | ||||
| Outros | / / | ||||
| anti HTL VVII | ELISA | / / | |||
| Western Blot | / / | ||||
| Outros | / / | ||||
| anti-HCV | ELISA | / / | |||
| ImunoBlot | / / | ||||
| Outros | / / | ||||
| AgHBs | ELISA | / / | |||
| Outros | / / | ||||
| anti-HBc | ELISA | / / | |||
| Outros | / / | ||||
Doença de Chagas |
ELISA | / / | |||
| Hemaglutinação | / / | ||||
| IFI | / / | ||||
| Outros | / / | ||||
| Responsável (Nome): | |||||
| Data: ___/___/__ | Assinatura: | ||||
ANEXO 13 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Talassemias) (Origem: PRT MS/GM 2612/2012, Anexo 1)
DECLARAÇÃO DE CONFLITO DE INTERESSE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº <nº do CPF>, declaro junto à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAE/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico às Talassemias (CAT-Talassemias), que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar)_____________________________________________.
( ) Consultoria técnica em andamento: (citar)______________________________________________.
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar)_________________________________________________.
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na CAT-Talassemias: (citar) _________________________________________________.
( ) Outro: (especificar)_____________________________________________.
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/DAE/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________________________
Assinatura
ANEXO 14 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Talassemias) (Origem: PRT MS/GM 2612/2012, Anexo 2)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº <nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas ao Programa de Talassemias, coordenado pela Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAE/SAS/MS) e à Comissão de Assessoramento Técnico às Talassemias (CAT-Talassemias), do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1.Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2.Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH/DAE/SAS/MS ou direção dos serviços de saúde sob os quais há a atuação da CAT-Talassemias;
3.Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4.Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_________________________________________________
Assinatura
ANEXO 15 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Gestão de Equipamentos) (Origem: PRT MS/GM 2543/2014, Anexo 1)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº < nº do CPF?, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão de Equipamento, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Gestão de Equipamento, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão de Equipamento;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 16 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Gestão de Equipamentos) (Origem: PRT MS/GM 2543/2014, Anexo 2)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº < nº do CPF?, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão de Equipamento, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Gestão de Equipamento, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão de Equipamento;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 17 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Gestão Ambiental) (Origem: PRT MS/GM 2545/2014, Anexo 1)
DECLARAÇÃO DE CONFLITO DE INTERESSE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº ? nº do CPF?, declaro junto á Coordenação Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico em Gestão Ambiental, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar) ________ .
( ) Consultoria técnica em andamento: (citar)__________________________ .
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ____________________ .
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na Gestão Ambiental: (citar)_________________________ .
( ) Outro: (especificar)____________________________________________ .
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 18 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Gestão Ambiental) (Origem: PRT MS/GM 2545/2014, Anexo 2)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº ? nº do CPF?, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão Ambiental, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Gestão Ambiental, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão Ambiental;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 19 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Doença Falciforme) (Origem: PRT MS/GM 158/2015, Anexo 1)
Eu, nome completo, nacionalidade, estado civil, profissão, inscrito (a) no CPF/MF sob o nº nº do CPF, declaro, junto à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAHU/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico à Doença Falciforme (CAT-Doença Falciforme), que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar)
______________________________________________.
( ) Consultoria técnica em andamento: (citar)
______________________________________________.
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar)
__________________________________________________
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na CAT-Talassemias: (citar)
__________________________________________________
( ) Outro: (especificar)
_____________________________________________
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/DAHU/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________________________
Assinatura
ANEXO 20 DO ANEXO IV
TERMO DE CONFIDENCIALIDADE (CAT-Doença Falciforme) (Origem: PRT MS/GM 158/2015, Anexo 2)
Eu, nome completo, nacionalidade, estado civil, profissão, inscrito (a) no CPF/MF sob o nº nº do CPF, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas à Política Nacional de Atenção às Pessoas com Doença Falciforme, coordenada pela Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAHU/SAS/MS) e à Comissão de Assessoramento Técnico às Doença Falciforme (CAT-Doença Falciforme), do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionado ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH/DAHU/SAS/MS ou direção dos serviços de saúde sob os quais há a atuação da CAT-Doença Falciforme;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4.Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_________________________________________________
Assinatura
ANEXO 21 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-PDVS) (Origem: PRT MS/GM 795/2015, Anexo 1)
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, declaro junto á Coordenação Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar) .
_______________________________________________________
( ) Consultoria técnica em andamento: (citar)
___________________ .
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ______________.
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na Gestão de Equipamento: (citar).
______________________________________________________
( ) Outro: (especificar)
___________________________________
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 22 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-PDVS) (Origem: PRT MS/GM 795/2015, Anexo 2)
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão de Equipamento, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1.Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2.Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão de Equipamento;
3.Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4.Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 23 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Sangue Raro) (Origem: PRT MS/GM 1440/2015, Anexo 1)
DECLARAÇÃO DE CONFLITO DE INTERESSE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, declaro junto à Coordenação-Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico em Sangue Raro, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar) ________ .
( ) Consultoria técnica em andamento: (citar)__________________________ .
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ____________________ .
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na CAT-Sangue Raro : (citar) _________________________ .
( ) Outro: (especificar)____________________________________________ .
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 24 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Sangue Raro) (Origem: PRT MS/GM 1440/2015, Anexo 2)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Sangue Raro, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Sangue Raro, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1 Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2 Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação da CAT-Sangue Raro;
3 Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4 Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 25 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (Origem: PRT MS/GM 475/2015, Anexo 1)
Eu, <nome completo>, <nacionalidade>, <estado civil>,<profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, declaro junto à Coordenação-Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAHU/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) vínculo empregatício com instituição de natureza privada:(citar) _______________
( ) consultoria técnica em andamento: (citar) ________
( ) membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ________________________________
( ) vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na Qualificação Técnica e Gerencial da Hemorrede Pública Nacional: (citar)_________________________
( ) outro: (especificar) _________________________
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
ANEXO 26 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (Origem: PRT MS/GM 475/2015, Anexo 2)
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Qualificação Técnica e Gerencial da Hemorrede Pública Nacional, no âmbito da Coordenação-Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas a Qualificação Técnica e Gerencial da Hemorrede Pública Nacional mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação da CAT a Qualificação Nacional da Hemorrede Pública;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível por meio da Qualificação Técnica e Gerencial da Hemorrede Pública Nacional mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
____________________________
Assinatura
ANEXO V
TABELA DE REFERÊNCIA PARA O RESSARCIMENTO ENTRE SERVIÇOS DE HEMOTERAPIA SUS/INSTITUIÇÕES PRIVADAS DE SAÚDE PARA O CUMPRIMENTO DA PORTARIA Nº 1.737/GM, DE 19 DE AGOSTO DE 2004 (Origem: PRT MS/GM 1469/2006, Anexo 1)
| Hemocomponentes ou procedimentos | Valor referência em reais |
|---|---|
| Custos operacionais do Sangue Total* | 285 |
| Custos operacionais do Concentrado de Hemácias* | 150 |
| Custos operacionais do Concentrado de Plaquetas Randômico* | 135 |
| Custos operacionais do Concentrado de plaquetas de Aférese (8 unid)* | 900 |
| Custos operacionais do Plasma Fresco Congelado* | 125 |
| Custos operacionais do Crioprecipitado* | 100 |
| Custos operacionais do Concentrado de Leucócitos de Aférese* | 1750 |
| Deleucotização de concentrado de Hemácias | 80 |
| Deleucotização de concentrado de plaquetas | 85 |
| Irradiação (por bolsa) | 20 |
| Lavagem de componentes celulares (Sistema aberto) | 10 |
| Lavagem de componentes celulares (Sistema fechado) | 110 |
| Fenotipagem para dois sistemas (Rh e Kell) | 45 |
| Fenotipagem de três ou mais sistemas | 65 |
| Aliquotagem de componente | 25 |
| Programa Auto-transfusão pré-depósito (por bolsa) | 350 |
| Seleção Pré-Transfusional I (ABO/Rh/PAI) | 30 |
| Seleção Pré-Transfusional II (Prova de compatibilidade) | 15 |
| Seleção Pré-Transfusional III (Recém-nascido) | 30 |
| Painel de Hemácias para identificação de anticorpos irregulares | 43 |
Obsevação:
*Entende-se por custos operacionais: valores referentes a insumos, materiais, exames sorológicos, imuno-hematológicos e demais exames laboratoriais, realizados para a seleção dos referidos materiais biológicos, bem como honorários por serviços médicos.
ANEXO VI
INSTRUMENTO DE CONTROLE E AVALIAÇÃO DE SERVIÇOS PRESTADOS NÃO-SUS (INDICADORES) (Origem: PRT MS/GM 1469/2006, Anexo 2)
Instrumento de controle e avaliação de serviços prestados não-SUS (indicadores)
Indicadores de acompanhamento do fornecimento de sangue por unidades públicas a pacientes não-SUS.
1 - Taxa de estoque de segurança.
[Nº de CH liberados] - [Nº de CH trans- X 100 fundidos]
________________________________________
Nº de CH transfundidos
Avaliação de período de 180 dias.
O serviço público pode absorver demandas de atendimento não-SUS se apresentar taxa 10% de acordo com o número de coletas no último ano,
Valor inferior a 10% deverá ser plenamente justificado no relatório de avaliação e controle (Anexo III).
2 - Percentual de coletas na população da região de abrangência
Nº de Coletas de ST realizadas na região de abran- X 100 gência em 12 meses
_________________________________________________________________
População estimada na região de abrangência no último mês do mesmo período
O serviço público para absorver novas demandas deverá ter a porcentagem < 3%.
3 - Percentual de Transfusões realizadas em pacientes não- SUS
Total de hemocomponentes transfundidos não- X 100 SUS
_______________________________________________
Total de hemocomponentes transfundidos no período
Indicador de acompanhamento do atendimento não-SUS pela hemorrede pública brasileira (regional e geral).
ANEXO VII
ABATIMENTO DOS SERVIÇOS PRESTADOS A NÃO-SUS DOS SERVIÇOS PRESTADOS AO SUS (Origem: PRT MS/GM 1469/2006, Anexo 3)
Abatimento dos serviços prestados a não-SUS dos serviços prestados ao SUS.
1. Proposta
Componentes obtidos a partir de unidade de Sangue Total (± 450 mL)
| Componente | Fração de abatimento de cada módulo da tabela SUS |
| Concentrado de Hemácias | 0,5 |
| Concentrado de Plaquetas Randômico | 0,2 |
| Plasma | 0,3 |
| Crioprecipitado | 0,2 |
| Coleta por aférese | 1 |
| Alíquotas de concentrados de Hemácias | 0,5 |
2. Procedimentos que devem ser abatidos:
| Módulo a serem descontados | |
| 37.011.01-4 | Triagem |
| 37.011.02-2 | Coleta de Sangue |
| 37.011.03-0 | Coleta por Processadora de Sangue |
| 37.021.01-0 | Exames de Imuno-hematologia |
| 37.031.01-5 | Sorologia I |
| 37.041.01-0 | Processamento de Sangue |
OBS. Os Códigos de referencia são da atual tabela SAI/SUS e deverão ser atualizados sempre que necessário
3. Modelo de demonstrativo de abatimento do Faturamento SUS
Demonstrativo de Prestação de Serviços não-SUS
I - Identificação
HEMOCENTRO
Endereço:
CNPJ nº:
Inscrição Estadual nº:
Dirigente:
| II. Produção (1) | |
| Módulos | Quantitativo |
| 37.011.01-4 - Triagem Clinica | |
| 37.011.02-2 - Coleta de Sangue | |
| 37.011.03-0 - Coleta processadora automática | |
| 37.021.01-0 - Exames Imuno-hematológicos | |
| 37.031.01-5 - Sorologia I | |
| 37.041.01-0 - Processamento | |
| III. Atendimento (não-SUS) | |||
| Hemocomponentes | Quantitativo | Índice de Abatimento | Quantitativo abatido |
| Sangue Total | X 1,0 | 0 | |
| Concentrado de Hemácias | X 0,5 | 0 | |
| Concentrado de Plaquetas | X 0,2 | 0 | |
| Plasma | X 0,3 | 0 | |
| Crioprecipitado | X 0,3 | 0 | |
| TOTAL (2) | 0 | ||
| Plaquetaférese (3) | 0 | X 1,0 | 0 |
| IV. FATURAMENTO SUS apresentado (1) - (2 e 3) | |
| Módulos | Quantitativo |
| 37.011.01-4 - Triagem Clinica | 0 |
| 37.011.02-2 - Coleta de Sangue | 0 |
| 37.011.03-0 - Coleta Plaquetaférese | 0 |
| 37.021.01-0 - Exames Imuno-hematológicos | 0 |
| 37.031.01-5 - Sorologia I | 0 |
| 37.041.01-0 - Processamento | 0 |
4. Caso Exemplo
Exemplo:
No mês de abril de 2005 o hemocentro forneceu à rede não- SUS 250 CH, 50 Plasmas e 30 concentrados plaquetários. O que se deve abater da fatura apresentada ao SUS?
| Componente | Fração de abatimento de cada módulo da tabela SUS | Exemplo |
| Concentrado de Hemácias | 0,5 | 250 x 0,5 = 125 |
| Concentrado de Plaquetas Randômico | 0,2 | 30 x 0,2 = 6 |
| Plasma | 0,3 | 50 x 0,3 = 15 |
| Crioprecipitado | 0,2 | 0 |
| TOTAL | 146 coletas | |
No exemplo deverão ser abatidos da fatura apresentada ao SUS 146 cobranças nos módulos de Triagem Clínica, Coleta ST, Exames Imuno-hematológicos, Exames Sorológicos e Processamento.
ANEXO VIII
TERMO DE ADESÃO MUNICIPAL AO PROGRAMA DE VOLTA PARA CASA (Origem: PRT MS/GM 2077/2003, Anexo 1)
MUNICÍPIO: _________________________________ UF:______
ENDEREÇO: ______________________________ CEP:_______
NOME DO PREFEITO:___________________________________
NOME DO SECRETÁRIO MUNICIPAL DE SAÚDE: _________________ RG:_______
A Prefeitura Municipal de_________________________________solicita adesão ao Programa “De Volta Para Casa”, que se destina à assistência, acompanhamento e integração social, fora de unidade hospitalar, de pacientes acometidos de transtornos mentais, egressos de longa internação em hospitais ou unidades psiquiátricas, sendo o auxílio parte integrante de um programa de ressocialização de pessoas com transtorno mental e excluídas do convívio social, conforme definido em Lei nº 10.708 de 31 de julho de 2003 e em Portaria GM/Nº 2077/GM, de 31 de outubro de 2003.
Ao aderir ao Programa, esta Prefeitura Municipal, por intermédio de sua Secretaria de Saúde, assume os seguintes compromissos:
-ser responsável pela atenção integral em saúde e assegurar a continuidade de cuidados em saúde mental, em programas extra- hospitalares, para os beneficiários do Programa:
-seleção, avaliação, preenchimento e encaminhamento de ficha cadastral e demais documentações exigidas dos beneficiários a
serem incluídos no Programa;
-realizar o acompanhamento dos beneficiários inseridos no programa;
-avaliar o desempenho e implantação do programa em nível municipal; e
- submeter ao Conselho Municipal de Saúde informações sobre o desenvolvimento contínuo das ações realizadas pelo Município quanto à implementação e resultados do programa, aos beneficiários atendidos.
O(A) Coordenador(a) Responsável pelo Programa “De Volta para Casa” neste Município será:
NOME COMPLETO:___________________________________________
REG: ___________________________
Assinatura do(a) Coordenador(a) do Programa:
Local e Data: __________________, _______ de _______ de _____
________________________________________________________
Assinatura do Secretário Municipal de Saúde
________________________________________________________
Assinatura do Prefeito Municipal
ANEXO IX
SOLICITAÇÃO DE AUXÍLIO-REABILITAÇÃO PSICOSSOCIAL (Origem: PRT MS/GM 2077/2003, Anexo 2)
Eu _____________________________________________, solicito, enquanto um direito a mim facultado no inciso 1º, do artigo 3º, da Portaria GM Nº 2077/GM de 31 de outubro de 2003, a inclusão para recebimento do auxílio-reabilitação psicossocial criado pela Lei Nº 10.708, de 31 de julho de 2003.
Local e Data:_________________, ____de _____________ de_____
________________________________________________________
Assinatura/Impressão digital do Beneficiário Solicitante
HOSPITAL (com CNPJ) OU SERVIÇO RESIDENCIAL TERAPÊUTICO DE ORIGEM DO SOLICITANTE:
________________________________________________________
ANEXO X
SOLICITAÇÃO DE AUXÍLIO-REABILITAÇÃO PSICOSSOCIAL PELO REPRESENTANTE LEGAL (Origem: PRT MS/GM 2077/2003, Anexo 3)
Eu___________________________________, representante legal de_________________________________________________, enquanto direito facultado no inciso 1º do artigo 3º, da Portaria GM Nº 2077/GM de 31 de outubro de 2003, e atendendo às condições legais para tanto, solicito a inclusão da pessoa, à qual represento, para ser beneficiária do recebimento do auxílio-reabilitação psicossocial, criado pela Lei nº 10.708, de 31 de julho de 2003.
ANEXO XI
INSTRUÇÃO NORMATIVA (Origem: PRT MS/GM 2077/2003, Anexo 4)
Esta Instrução Normativa da portaria do Programa “De Volta Para Casa”, criado pelo Ministério da Saúde, visa oferecer orientações importantes que complementam assuntos referidos em artigos desta portaria para auxiliar na implantação deste programa.
1 - RESPONSABILIDADE DOS GESTORES DO SUS COM O PROGRAMA
I - Ao nível municipal compete:
-ser responsável pela atenção integral em saúde e assegurar a continuidade de cuidados em saúde mental, em programas extra-hospitalares para os beneficiários do programa;
-seleção, avaliação, preenchimento e encaminhamento ao Ministério da Saúde de informações cadastrais necessárias dos beneficiários a serem incluídos no Programa; e
-acompanhamento dos beneficiários inseridos no programa.
II - Ao nível estadual compete:
-acompanhar as ações dos Municípios vinculados ao programa;
-confirmar o Município como apto a se inserir no programa;
-analisar os recursos provenientes das solicitações indeferidas pelos Municípios; e
-ter papel articulador entre os Hospitais de Custódia e Tratamento Psiquiátrico e Município, quanto da indicação de pessoas em condições de serem beneficiadas pelo programa.
III - Ao nível federal compete:
-cadastrar os beneficiários dos Municípios habilitados no programa, que não estão em Gestão Plena do Sistema;
-organizar e consolidar os cadastros dos beneficiários e dos Municípios inseridos no programa;
-zelar pelo monitoramento e avaliação do programa;
-definir critérios de prioridade de inclusão de beneficiários por Municípios;
-julgar os recursos provenientes do âmbito municipal ou estadual;
-o processamento mensal da folha de pagamento aos beneficiários do programa; e
-constituir Comissão Gestora do Programa “De Volta Para Casa”.
2 - BENEFICIÁRIOS
Para fins de cálculo de tempo de internação, períodos de alta por transferência para outros serviços, em razão de intercorrências clínicas ou cirúrgicas, não serão considerados interrupções de internação para fins de contabilizar a temporalidade de internação exigida.
3 - QUANTO A INCLUSÃO DE BENEFICIÁRIOS NO PROGRAMA
O Município deverá preencher cadastro de inclusão de beneficiário para o programa e enviá-lo ao Ministério da Saúde, quando:
-da solicitação de inclusão no programa por parte do beneficiário, ou seu representante legal;
-a avaliação de equipe de saúde local confirmar os requisitos exigidas na Lei nº 10.708/2003, para inclusão no programa; e da habilitação do Município pelo Ministério da Saúde no Programa.
Será necessário que a pessoa incluída no programa esteja de alta hospitalar ou morando em residência terapêutica; com suas famílias de origem ou famílias substitutas, ou formas alternativas de moradia e de convívio social.
4 - ATENÇÃO CONTINUADA EM SAÚDE MENTAL NO MUNICÍPIO
O Município habilitado designará equipe de saúde específica de apoio direto aos beneficiários, para garantir ao beneficiado a atenção continuada em saúde mental, na rede de saúde local ou regional. Esta equipe deverá ter suas ações baseadas em proposta de reabilitação psicossocial assistida, a serem explicitadas em programa de saúde mental municipal, o qual deverá conter estratégia de acompanhamento dos beneficiários e de avaliação regular do processo de reintegração social destes.
5 - RESPONSABILIDADES DO REPRESENTANTE LEGAL
O representante legal do beneficiário do programa terá sua indicação e desempenho supervisionados pela equipe de saúde do Município. Se for identificado caso de inadequado e ilícito uso, por parte do representante legal, do benefício recebido, deverão ser tomadas medidas cabíveis no âmbito municipal, em primeira instância, para intervenção e responsabilização quanto aos atos infligidos, podendo vir a ser necessário o recurso a outras instâncias.
6 - CONTROLE E AVALIAÇÃO DO PROGRAMA
6.1 - MINISTÉRIO DA SAÚDE
Compete à Comissão de Acompanhamento do Programa “De Volta Para Casa” definir estratégias de acompanhamento e avaliação da implantação do programa junto aos Municípios. Caberá auditoria interna para apuração de irregularidade quanto ao pagamento indevido, inclusão e exclusão de beneficiários.
6.2 - ESTADO
Acompanhar e apoiar a implementação do programa junto aos Municípios habilitados de seu Estado;
Constituir Comissão de acompanhamento do Programa em âmbito estadual, quando houver Municípios do Estados habilitados no programa.
6.3 - MUNICÍPIO
O Município habilitado assegurará atenção continuada de saúde mental na rede de saúde e promoverá avaliações do processo de implantação do programa, cabendo ao mesmo enviá-las para o Ministério da Saúde, através instrumento específico, a ser determinado pela Comissão de Acompanhamento do Programa e divulgado pelo Ministério da Saúde.
7 - COMISSÃO DE ACOMPANHAMENTO DO PROGRAMA
A Comissão de Acompanhamento do Programa deverá ser constituída em portaria e terá dentre seus membros: representante do Conass, representante do Conasems, representante da Comissão Intersetorial de Saúde Mental do Conselho Nacional de Saúde e Departamento de Ações Programáticas Estratégicas - Saúde Mental - Secretaria de Atenção à Saúde do Ministério da Saúde.
8 - RESPONSABILIDADE DA INSTITUIÇÃO FINANCEIRA OFICIAL
A instituição financeira oficial deverá, mediante remuneração e condições a serem pactuadas com o Ministério da Saúde, obedecidas as formulações legais: organizar e operar a logística de pagamento dos benefícios; elaborar os relatórios financeiros necessários ao acompanhamento, à avaliação e à auditoria da execução do programa por parte do Ministério da Saúde.
ANEXO XII
FORMULÁRIO DE INCLUSÃO DO SOLICITANTE (Origem: PRT MS/GM 2077/2003, Anexo 5)
FORMULÁRIO DE INCLUSÃO DO SOLICITANTE
1. DADOS DO ESTABELECIMENTO:
-Inclusão ou Alteração (DADO OBRIGATÓRIO)
-Nº CNES Estabelecimento (DADO OBRIGATÓRIO)
-Nome do Estabelecimento (DADO OBRIGATÓRIO)
-Código IBGE (DADO OBRIGATÓRIO)
-Data de Preenchimento (DADO OBRIGATÓRIO)
2. DADOS RESIDENCIAIS:
-UF (DADO OBRIGATÓRIO)
-Número do IBGE (DADO OBRIGATÓRIO)
-Nome do Município (DADO NÃO OBRIGATÓRIO)
-Tipo do Logradouro (DADO OBRIGATÓRIO)
-Nome do Logradouro (DADO OBRIGATÓRIO); Número (DADO OBRIGATÓRIO); Complemento (DADO NÃO OBRIGA- TÓRIO); Bairro/Distrito (DADO OBRIGATÓRIO); CEP (DADO OBRIGATÓRIO); DDD-Telefone (DADO NÃO OBRIGATÓRIO)
3. DADOS PESSOAIS:
- Nome Completo - sem abreviaturas (DADO OBRIGATÓRIO)
- Nome da Mãe - sem abreviaturas (DADO OBRIGATÓRIO)
-Nome do Pai (DADO NÃO OBRIGATÓRIO)
-Sexo (DADO OBRIGATÓRIO)
-Raça/Cor (DADO NÃO OBRIGATÓRIO)
-Situação Familiar (DADO NÃO OBRIGATÓRIO)
-Nacionalidade (DADO OBRIGATÓRIO)
-Data de Nascimento dd/mm/aaaa (DADO OBRIGATÓRIO)
-UF de Nascimento (DADO OBRIGATÓRIO)
-Município de Nascimento (DADO OBRIGATÓRIO)
-Nome do Município (DADO NÃO OBRIGATÓRIO)
-Escolaridade (DADO NÃO OBRIGATÓRIO)
-Freqüenta Escola? Sim ou Não (DADO OBRIGATÓRIO)
-CBOR - Código Brasileiro de Ocupação-reduzido (DADO NÃO OBRIGATÓRIO)
-Ocupação (DADO NÃO OBRIGATÓRIO)
-PIS/PASEP (DADO NÃO OBRIGATÓRIO)
-CPF (DADO NÃO OBRIGATÓRIO)
-CERTIDÃO/TIPO (DADO OBRIGATÓRIO) - ou RG (Identidade)
-Identidade ((DADO OBRIGATÓRIO) - ou Certidão/Tipo
-Data de Emissão da Identidade (DADO NÃO OBRIGATÓRIO)
-UF da Identidade (DADO NÃO OBRIGATÓRIO)
-Órgão Expedidor (DADO NÃO OBRIGATÓRIO)
4. DADOS ESPECÍFICOS QUANTO AO PROGRAMA DE VOLTA PARA CASA (DADOS NÃO OBRIGATÓRIOS)
-Tipo de Moradia: Serviço Residencial Terapêutico; Moradia com Familiares; Mora Sozinho ou Outro.
-Procedência (instituição de origem do beneficiário): Serviço Residencial Terapêutico; Hospital Psiquiátrico; Hospital de Custódia e Tratamento Psiquiátrico.
-Tempo de internação: 2 anos; entre 2 e 5 anos; entre 5 e 10 anos; acima de 10 anos.
INFORMAÇÃO IMPORTANTE: Se o beneficiário possuir representante legal também serão necessárias as mesmas informações, acima descritas, deste representante, exceto tipo de moradia e tempo de internação e procedência. O nº do CNES deverá ser o mesmo do beneficiário.
ANEXO XIII
TERMO DE COMPROMISSO (Origem: PRT MS/GM 2077/2003, Anexo 6)
Eu,____________________________________________, na qualidade de representante legal de ___________________________, beneficiário do “De Volta Para Casa”, comprometo-me a receber o benefício criado pela Lei Nº 10.708, de 31 de julho de 2003, e a:
-zelar fielmente pelos direitos e deveres do beneficiário no âmbito do referido Programa;
-incumbir-me do dever de representar os interesses de um paciente em qualquer matéria especificada, ou de direitos específicos em seu nome, nos termos dos princípios para a Proteção de Pessoas Acometidas de Transtornos Mentais (ONU, 1991); e
-Prestar todas as informações que me forem solicitadas pela equipe de Saúde Mental responsável pelo acompanhamento do beneficiário.
Local e Data: ______________, ____ de ________ de _____
________________________________________________
Assinatura/Impressão digital do Solicitante
ANEXO XIV
MODALIDADES DE CENTROS DE ESPECIALIDADES ODONTOLÓGICAS (CEOS) TIPO 1, 2 E 3 (Origem: PRT MS/GM 599/2006, Anexo 1)
Modalidades de Centros de Especialidades Odontológicas (CEOs) Tipo 1, 2 e 3
| CEO I | CEO II | CEO III | |
| Atividades | Diagnóstico bucal, com ênfase ao câncer; periodontia especializada; cirurgia oral menor dos tecidos moles e duros; endodontia; atendimento a portadores de necessidades especiais. | Idem | Idem |
| Equipamentos e materiais | Aparelho de raios-X dentário; equipo odontológico; canetas de alta e baixa rotação; amalgamador; fotopolimerizador; compressor compatível com os serviços; instrumentais compatíveis com os serviços; e 3 consultórios odontológicos completos (cadeira, unidade auxiliar, equipo e refletor) | Aparelho de raios-X dentário; equipo odontológico; canetas de alta e baixa rotação;amalgamador; fotopolimerizador; compressor compatível com os serviços; instrumentais compatíveis com os serviços; e 4 a 6 consultórios odontológicos completos (cadeira, unidade auxiliar, equipo e refletor). | Aparelho de raios-X dentário; equipo odontológico; canetas de alta e baixa rotação; amalgamador; fotopolimerizador; compressor compatível com os serviços; instrumentais compatíveis com os serviços; e 7 ou mais consultórios odontológicos completos (cadeira, unidade auxiliar, equipo e refletor) |
| Outros recursos | Mobiliário e espaço físico compatível com os serviços ofertados. | Mobiliário e espaço físico compatível com os serviços ofertados. | Mobiliário e espaço físico compatível com os serviços ofertados |
| Recursos humanos | 3 ou mais cirurgiões dentistas e 1 auxiliar de consultório dentário por consultório odontológico. Obs: cada um dos consultórios odontológicos deve ser utilizado para a realização de procedimentos clínicos por, no mínimo, 40 horas semanais, independente do número de cirurgiões dentistas que nele atuem. No mínimo de pessoal de apoio administrativo - recepcionista, auxiliar de serviços gerais e auxiliar administrativo. |
4 ou mais cirurgiões dentistas e 1 auxiliar de consultório dentário por consultório odontológico. Obs: cada um dos consultórios odontológicos deve ser utilizado para a realização de procedimentos clínicos por, no mínimo, 40 horas semanais, independente do número de cirurgiões dentistas que nele atuem. No mínimo de pessoal de apoio administrativo - recepcionista, auxiliar de serviços gerais e auxiliar administrativo. |
7 ou mais cirurgiões dentistas e 1 auxiliar de consultório dentário por consultório odontológico. Obs: cada um dos consultórios odontológicos deve ser utilizado para a realização de procedimentos clínicos por, no mínimo, 40 horas semanais, independente do número de cirurgiões dentistas que nele atuem. No mínimo de pessoal de apoio administrativo - recepcionista, auxiliar de serviços gerais e auxiliar administrativo. |
ANEXO XV
PROJETO DE REDUÇÃO DA MORBIMORTALIDADE POR ACIDENTES DE TRÂNSITO - MOBILIZANDO A SOCIEDADE E PROMOVENDO A SAÚDE (Origem: PRT MS/GM 344/2002, Anexo 1)
Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde
APRESENTAÇÃO
O Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde, a seguir apresentado, tem como fundamentação:
a) a Lei N.° 9503, de 23 de setembro de 1997, que institui o Código de Trânsito Brasileiro o qual, em seu Art. 78 e parágrafo único, estabelece o desenvolvimento e a implementação de programas destinados à prevenção de acidentes por parte dos Ministérios da Saúde, Educação e do Desporto, do Trabalho, dos Transportes e da Justiça, por intermédio do Conselho Nacional de Trânsito (Contran);
b) o disposto na Portaria N.º 737 MS/GM, de 16 de maio de 2001, que determina aos órgãos e entidades do Ministério da Saúde a promoção, a elaboração ou a readequação de seus planos, programas, projetos e atividades em conformidade com as diretrizes e responsabilidades estabelecidas na Política Nacional de Redução da Morbimortalidade por Acidentes e Violência; e
c) a diretriz da referida Política Nacional relativa à promoção da adoção de comportamentos e de ambientes seguros e saudáveis.
1. JUSTIFICATIVA
Os acidentes de trânsito são um importante problema de saúde pública no País. Visando articular ações de prevenção da morbimortalidade por tais agravos, no âmbito do sistema de saúde, o Ministério da Saúde apresenta o Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde, com destaque para as medidas a serem implementadas nos aglomerados urbanos onde se concentra a maior parte da malha viária e as ocorrências de casos e óbitos.
Atualmente, os acidentes de trânsito constituem, entre as causas externas, a maior causa de internação, além gerar altos custos hospitalares, perdas materiais, despesas previdenciárias e grande sofrimento para as vítimas e os seus familiares. Em 1998, ocorreram 30.994 óbitos por acidentes de transporte, coeficiente de 19,16 por 100 mil habitantes, o que, por si só, expressa a relevância epidemiológica e social do tema e a necessidade de uma articulação intersetorial entre as áreas de saúde e trânsito. Tais conseqüências demonstram o significativo peso econômico e social dos acidentes de trânsito, reforçando sobremaneira a importância desta proposta de intervenção.
O novo Código de Trânsito Brasileiro, vigente desde 21 de janeiro de 1998 - Lei N.º 9.503 -, confere atribuições do Ministério da Saúde em relação aos acidentes de trânsito, estabelecendo, por intermédio do Conselho Nacional de Trânsito, financiamento para a implementação de programas, no âmbito do SUS, destinados à prevenção de acidentes. Como eixos operacionais, o presente Projeto visa sensibilizar prioritariamente os gestores estaduais e municipais da área da saúde, da educação e de trânsito; capacitar equipes de profissionais de saúde dos serviços de emergência para a melhoria das informações; e mobilizar a sociedade para atitudes positivas em relação às medidas preventivas no trânsito, mediante a capacitação de representantes de sindicatos de empregadores e condutores de veículos de grande e pequeno porte, profissionais da mídia e representantes de organizações da sociedade civil comprometidas com as questões de cidadania, os quais atuarão como multiplicadores de informações e de medidas sobre prevenção de acidentes.
Adicionalmente, outro grande eixo é a melhoria da qualidade das informações sobre os eventos relacionados aos acidentes de trânsito, no âmbito dos vários órgãos e instituições que atuam na área. Essas informações não apenas auxiliarão o planejamento e a execução de políticas públicas no setor, como também permitirão acompanhar resultados e avaliar projetos de prevenção de acidentes de trânsito.
O projeto será coordenado pelo Ministério da Saúde e executado pelos governos estaduais e municipais, o que viabiliza sua execução com capilaridade. Prevê um trabalho intersetorial e com participação social, garantindo que a questão seja tratada de forma abrangente e compartilhada, facilitando assim o alcance de seu objetivo: reduzir a morbimortalidade por acidentes de trânsito.
2. ÁREAS PRIORITÁRIAS PARA O DESENVOLVIMENTO DO PROJETO
A distribuição territorial da população brasileira apresenta marcante concentração em aglomerados urbanos situados, em sua maioria, na região Sudeste e no litoral. Existem no País, atualmente, 49 aglomerados urbanos nos quais concentram-se 48% da população brasileira. Além disso, segundo dados do Denatran, a maior parte da malha viária faz a ligação entre esses grandes aglomerados, que são, ainda, os pólos de atividade econômica. A população flutuante que circula por essas estradas, vinda de outras localidades, é também elevada, ainda que dados mais precisos não estejam disponíveis.
A definição das áreas prioritárias de atuação do projeto, obedeceu a dois critérios: óbito - por acidente de trânsito - como marcador (SIM/MS-98) e o conceito de aglomerados urbanos*. Foram enumerados todos os aglomerados urbanos brasileiros, metropolitanos e não - metropolitanos, e capitais. Estudou-se a freqüência dos óbitos, o coeficiente de mortalidade específico e a mortalidade proporcional por acidentes de transporte. A partir da ponderação desses três indicadores, foi construído um índice que leva em conta a magnitude, o risco e a importância dos acidentes de transporte na mortalidade geral e sua distribuição nesses aglomerados.
*Caracterização e tendências da rede urbana no Brasil. Campinas, SP: Unicamp.IE, (Coleção Pesquisas, 3 ) v.2.IPEA/Unicamp.IE.Nessur/IBGE,1999.
O Gráfico Índice para Acidentes de Trânsito (Anexo II) mostra o índice construído e aplicado às cidades e aglomerados urbanos priorizados no Projeto, que abrangerá 84 municípios em 26 áreas metropolitanas de 14 unidades da federação, atingindo uma população total de 46.365.905 habitantes, conforme mostra o Quadro Áreas Metropolitanas priorizadas (Anexo I).
A exceção ao critério aglomerado urbano foi a inclusão de três capitais (Boa Vista, Porto Velho e Macapá) as quais, apesar de não constituírem aglomerados, apresentam isoladamente risco elevado para óbitos por acidentes de trânsito.
3. OBJETIVOS
3.1 OBJETIVO GERAL
Implementar, em aglomerados urbanos selecionados, ações de promoção da saúde e de prevenção de acidentes de trânsito, mediante a mobilização do setor saúde, prefeituras e sociedade civil organizada, no sentido de promover mudança de hábitos, atitudes, valores culturais e situações ambientais que interferem na ocorrência dos acidentes de trânsito, melhorando a qualidade da informação e reduzindo as taxas de morbimortalidade por estes eventos.
3.2 OBJETIVOS ESPECÍFICOS
- Sensibilizar e capacitar gestores estaduais e municipais para a realização de ações de promoção da saúde e de prevenção de acidentes de trânsito.
- Formular, em parceria com órgãos e entidades do Ministério da Saúde e com o Denatran, proposta para a elaboração de um sistema de notificação compulsória de agravos por causas externas em geral, e de acidentes de trânsito em particular, nas regiões escolhidas, bem como estabelecer e definir fluxo de informações entre os parceiros.
- Mobilizar e capacitar as equipes de profissionais de saúde dos serviços de emergência para a melhoria das informações.
- Construir banco de dados epidemiológicos para identificar grupos de risco e subsidiar as ações de intervenção, o qual possibilitar tanto a identificação de áreas críticas para acidentes de trânsito, quanto a integração de ações com os órgãos locais de trânsito, transporte e saúde.
- Capacitar profissionais da mídia local e representantes de organizações da sociedade civil, comprometidas com as questões de cidadania, para atuarem como agentes multiplicadores de informações sobre prevenção de acidentes.
- Mobilizar e capacitar representantes de empregadores e condutores de veículos de grande e pequeno porte.
- Tornar disponível e direcionar ao Contran/Denatran as bases de dados, indicadores, parâmetros de intervenção, relatórios de experiências e resultados.
- Produzir e apoiar a produção de materiais educativos e de suporte para o desenvolvimento das ações do Projeto.
4. ESTRATÉGIAS OPERACIONAIS
4.1 Constituir Comissão Técnica de Acompanhamento do Projeto, sob a coordenação da Secretaria de Políticas de Saúde/MS, composta por representantes do Ministério da Saúde, que ficará responsável pela assessoria, planejamento, avaliação e supervisão das ações levadas a efeito pelos estados e municípios.
4.2 Sensibilizar os gestores municipais para que incorporem os conteúdos deste Projeto às realidades, interesses e valores culturais locais, e estimular a formulação de estratégias intersetoriais para a redução da morbimortalidade por acidentes de trânsito e a melhoria do sistema de informação.
4.3 Capacitar, segundo os pressupostos deste Projeto, os condutores de veículos de grande e pequeno porte, com sede nos municípios selecionados, sensibilizando-os para as questões de violência no trânsito, suas causas, agravos e seqüelas. Tal ação objetiva qualificá-los como agentes multiplicadores das informações junto aos demais associados.
4.4 Sensibilizar os profissionais de comunicação, mediante a realização de oficinas, para utilizarem os espaços da mídia como fonte de disseminação de informações sobre a questão da violência no trânsito e suas estratégias de redução, mobilizando a sociedade e promovendo a saúde.
4.5 Sensibilizar os membros de ONGs e sociedade civil organizada para atuarem como mobilizadores que possam advogar em favor da prevenção de acidentes.
4.6 Capacitar, mediante a realização de oficinas nos aglomerados urbanos e capitais selecionadas, os profissionais de saúde, gerentes de serviços de urgência e emergência para:
- participarem da construção de sistema de notificação compulsória de agravos por causas externas;
- trabalharem para qualificar a informação;
- construirem, a partir da ficha de notificação elaborada, bancos de dados padronizados nos municípios, que possam servir de instrumento de avaliação e acompanhamento das ações de intervenção;
- tornar disponíveis para o Contran/Denatran e demais parceiros os dados consolidados a partir dos bancos municipais.
4.7 Produzir 100% dos materiais de apoio às oficinas e apoiar a produção dos materiais promocionais contendo as logomarcas do Ministério da Saúde, do Ministério da Justiça e dos municípios conveniados:
- produzir materiais de apoio à campanha: cartazes, bottons, chaveiros, adesivos, banners, outdoors etc.
- identificar espaços de veiculação alternativos e oficiais, como pontos de encontro de caminhoneiros e de táxis, estações rodoferroviárias, postos de gasolina, lojas de conveniência, oficinas mecânicas, bares, restaurantes, cafés virtuais etc.
- elaborar material específico sobre a temática para veiculação na homepage do Ministério da Saúde, estimulando a população a buscar informações também por meio do Disque Saúde e de correio eletrônico.
4.8 Adequar e aprovar os projetos municipais para repasse de recursos aos aglomerados urbanos e capitais selecionadas, levando em conta a proporcionalidade populacional e o índice encontrado.
5. METODOLOGIA
Todo o processo de desenvolvimento deste Projeto está pautado nas seguintes diretrizes:
- o planejamento participativo, em que os diversos atores sociais, incluindo a própria população, possam construir seus planos locais e regionais, atendendo às suas especificidades e particularidades;
- a descentralização administrativa, diretriz constitucional do SUS, que permeia a implementação de todas as políticas de saúde;
- a intersetorialidade, concebida como estratégia de envolvimento de múltiplos atores, organizados em torno de um objetivo comum, o que implica o estabelecimento de parcerias, com responsabilidades compartilhadas nas ações de prevenção e de promoção da redução da morbimortalidade por acidentes de trânsito.
Deve-se ainda ressaltar que, após o segundo ano de execução deste Projeto, a expectativa é de que os municípios e as regiões priorizadas possam garantir a sustentabilidade das ações iniciadas, com recursos próprios, possibilitando assim que o Ministério da Saúde invista em ações semelhantes nas demais áreas de risco no País.
6. MONITORAMENTO E AVALIAÇÃO
O monitoramento e a avaliação ficarão a cargo da Secretaria de Políticas de Saúde/MS e do Denatran/MJ e compreenderão indicadores de processo e de resultados. Os indicadores de processo serão desenvolvidos mediante a participação de uma equipe técnica multiprofissional, sob a coordenação da Secretaria de Políticas de Saúde/MS. Os indicadores de resultados estarão voltados para avaliar o impacto das ações, por intermédio de uma série de instrumentos já existentes ou gerados por essa intervenção.
O indicador escolhido para acompanhamento dos resultados é o coeficiente de mortalidade por acidentes de trânsito.
ANEXO XVI
QUADRO - ÁREAS METROPOLITANAS PRIORIZADAS (Origem: PRT MS/GM 344/2002, Anexo 2)
Quadro - Áreas metropolitanas priorizadas
| Região | UF | Área metropolitana | Total População |
| Norte | Roraima | Boa Vista | 163.024 |
| Rondônia | Porto Velho | 304.585 | |
| Amapá | Macapá | 244.972 | |
| Nordeste | Alagoas | Maceió | 766.498 |
| Pernambuco | Recife | 2.890.829 | |
| Caruaru | 259.725 | ||
| Sudeste | Rio de Janeiro | Rio de Janeiro | 10.247.097 |
| Cabo Frio | 113.813 | ||
| São Paulo | São Paulo | 16.393.741 | |
| Limeira | 401.067 | ||
| Ribeirão Preto | 467.908 | ||
| S. J. dos Campos | 1.021.975 | ||
| Minas Gerais | Belo Horizonte | 3.529.886 | |
| Espírito Santo | Vitória | 1.187.144 | |
| Sul | Paraná | Curitiba | 1.908.659 |
| Londrina | 530.455 | ||
| Cascavel | 231.901 | ||
| Maringá | 280.644 | ||
| Santa Catarina | Florianópolis | 431.310 | |
| Joinville | 418.569 | ||
| Blumenau | 240.302 | ||
| Itajaí | 141.976 | ||
| Criciúma | 164.973 | ||
| Centro Oeste | Goiás | Goiânia | 1.345.942 |
| Distrito Federal | Brasília | 2.043.007 | |
| Mato Grosso | Cuiabá | 655.236 | |
| Total geral | 14 | 26 | 46.365.905 |
ANEXO XVII
GRÁFICO: ÍNDICE* PARA ACIDENTES DE TRÂNSITO - CIDADES E AGLOMERADOS URBANOS PRIORIZADOS - BRASIL, 1998. (Origem: PRT MS/GM 344/2002, Anexo 3)
*Índice – composto pelos indicadores; freqüência de óbitos, coeficiente de mortalidade proporcional para acidentes de transporte.
** Capital exclusiva.
*** Cidade pólo e respectivo aglomerado.
ANEXO XVIII
COMPETÊNCIAS E ATRIBUIÇÕES RELATIVAS À IMPLANTAÇÃO/GESTÃO DO PROGRAMA NACIONAL DE ATENÇÃO COMUNITÁRIA INTEGRADA A USUÁRIOS DE ÁLCOOL E OUTRAS DROGAS (Origem: PRT MS/GM 816/2002, Anexo 1)
COMPETÊNCIAS
1. Compete ao Ministério da Saúde:
a - Instituir o Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e outras Drogas, seus princípios e diretrizes de implantação e funcionamento, estabelecendo critérios/exigências de habilitação de serviços, critérios de implantação das redes de assistência aos portadores de transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas e critérios técnicos de desenvolvimento do trabalho;
b - Atribuir à Assessoria Técnica da Secretaria de Assistência à Saúde (ASTEC/SAS/MS) a coordenação do Programa em âmbito nacional;
c - Definir e implementar ações de vigilância epidemiológica e sanitária no que se refere aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e drogas;
d - Definir e implementar planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos pacientes com dependência e/ou uso prejudicial de álcool e outras drogas, estabelecendo convênios de cooperação técnica com as instituições formadoras ou serviços;
e - Estabelecer as normas de funcionamento e cadastramento de serviços que integrarão as redes assistenciais;
f - Articular com os estados, municípios e o Distrito Federal a implantação do Programa e o estabelecimento de mecanismos de controle, avaliação e acompanhamento do processo;
g - Assessorar os estados e o Distrito Federal na implantação, em seus respectivos âmbitos de atuação, do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e outras Drogas e na organização de suas respectivas Redes Estaduais;
h - Utilizar os sistemas de informação epidemiológica e assistencial para constituir um banco de dados que permita acompanhar e avaliar o desenvolvimento do Programa, definindo seus indicadores;
i - Apoiar a realização de estudos de prevalência de base populacional para o conhecimento da distribuição dos pacientes portadores de transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas e outras pesquisas relevantes;
j - Alocar recursos financeiros destinados ao co-financiamento das atividades do Programa;
l - Divulgar o Programa de maneira a conscientizar e informar a população e os profissionais de saúde sobre a importância da realização das ações preventivas e assistenciais previstas no Programa.
2. Compete às Secretarias de Saúde dos Estados e do Distrito Federal:
a - Elaborar, em parceria com as Secretarias Municipais de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas;
b - Designar um Coordenador Estadual do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas, em articulação com o Programa de Saúde Mental do Estado;
c - Organizar e implantar rede estadual estratégica de serviços extra-hospitalares de atenção aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas, identificando os serviços delas integrantes, os Centros de Atenção Psicossocial, estabelecendo os fluxos de referência e contra-referência entre estes serviços e garantindo a execução de todas as fases do processo assistencial previsto no Programa;
d - Criar as condições para a estruturação/criação/implantação/cadastramento dos Centros de Atenção Psicossocial para Atendimento de Pacientes com dependência e/ou uso prejudicial de Álcool e outras Drogas;
e - Definir e implementar ações de vigilância epidemiológica e sanitária no que se refere aos transtornos causados pelo uso prejudicial ou dependência de álcool e drogas;
f - Definir e implementar planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos portadores de transtornos causados pelo uso abusivo de álcool e drogas;
g - Assessorar os municípios no processo de implementação do Programa, no desenvolvimento das atividades e na adoção de mecanismos destinados ao controle, avaliação e acompanhamento do processo;
h - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento/incremento do Programa;
i - Monitorar o desempenho do Programa em seu estado e os resultados alcançados;
j - Manter atualizados os bancos de dados que estejam sob sua responsabilidade.
3. Compete às Secretarias Municipais de Saúde:
a - Elaborar, em parceria com a respectiva Secretaria estadual de Saúde, por intermédio da Comissão Intergestores Bipartite, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e outras Drogas;
b - Criar as condições para a estruturação/criação/implantação/cadastramento de Centros de Atenção Psicossocial e adotar as providências necessárias para integrá-lo(s) na rede estadual estratégica de serviços extra-hospitalares de atenção aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas;
c - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento/incremento do Programa;
d - Monitorar o desempenho do Programa em seu município e os resultados alcançados;
e - Executar ações de vigilância epidemiológica e sanitária no que se refere aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e drogas;
f - Executar programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos pacientes com dependência e/ou uso prejudicial de álcool e outras drogas;
g - Manter atualizados os bancos de dados que estejam sob sua responsabilidade, que deverão ser notificados ao gestor estadual do SUS;
ANEXO XIX
PLANO DIRETOR DE VIGILÂNCIA SANITÁRIA - PDVISA (Origem: PRT MS/GM 1052/2007, Anexo 1)
ANEXO
PLANO DIRETOR DE VIGILÂNCIA SANITÁRIA - PDVISA
EIXO I -
ORGANIZAÇÃO E GESTÃO DO SISTEMA NACIONAL DE VIGILÂNCIA SANITÁRIA NO ÂMBITO DO SUS
O reconhecimento da Vigilância Sanitária - Visa como responsabilidade indelegável do Estado e como um componente indissociável do SUS é a base estratégica do Sistema Nacional de Vigilância Sanitária - SNVS. Nesse sentido, tem-se o entendimento de que esse campo da saúde pública é, também, uma arena de conflitos e um espaço privilegiado de intervenção para a defesa dos interesses sanitários e coletivos. Portanto, cabe à Vigilância Sanitária, em articulação com as demais práticas de saúde, atuar no âmbito da proteção contra danos, riscos e determinantes dos problemas de saúde que afetam a população.
Assim, a intersetorialidade é adotada, prioritariamente, como prática de gestão, permitindo o estabelecimento de espaços compartilhados para o desenvolvimento das ações e serviços de saúde, tanto no âmbito da saúde como na relação com outros setores governamentais e não-governamentais.
No processo de fortalecimento do SNVS, os princípios e diretrizes do SUS estão permanentemente presentes. A busca, na atenção à saúde, pelos princípios da universalidade, integralidade, eqüidade, descentralização da gestão e das ações, regionalização e hierarquização dos serviços de saúde e participação social orientarão sempre o estabelecimento de políticas e a pauta de negociação entre os gestores das três esferas de governo.
Nesse sentido, a descentralização das ações de Vigilância Sanitária é, além de um princípio norteador, uma estratégia de fortalecimento desse setor nas três esferas de governo. Por isso, a revisão das responsabilidades dos gestores do Sistema ultrapassa o campo das intenções normativas e incorpora o estabelecimento de metas de cobertura e definição de indicadores de desempenho, acompanhados por processos que viabilizem o controle social. O redirecionamento pretendido ajusta-se à capacidade de gestão de cada esfera de governo e à adoção do princípio da autoridade territorial, equilibrado pelo compromisso com a avaliação e o gerenciamento do risco sanitário.
A heterogeneidade decorrente das especificidades locais implicará a construção de pactos que expressem tal diversidade, abolindo-se a utilização exclusiva da classificação das ações por níveis de complexidade. Nesse sentido, estabelece-se como ação essencial a revisão do processo de planejamento e execução das ações de Vigilância Sanitária sob uma nova ótica, a da responsabilidade sanitária, por meio da definição de um elenco norteador de ações que permita assimilar as diversidades locais, os problemas de saúde e as necessidades de intervenção diante da estrutura existente. Dessa forma, o elenco de ações deverá ser pactuado locorregionalmente como parte integrante de um processo de desenvolvimento dos serviços de Vigilância Sanitária capaz de subsidiar a descentralização e de gerar ações mais efetivas para a promoção e a proteção da saúde da população.
Há de se considerar também, no delineamento do processo de descentralização, o princípio da complementaridade das ações, sempre que o nível de execução preferencial não contar com as condições necessárias para seu desempenho.
Na lógica da descentralização, as pactuações e as programações das ações de Vigilância Sanitária devem levar em consideração o aporte de recursos financeiros dos entes federados e as novas perspectivas do financiamento setorial.
Assim, o financiamento das ações de Vigilância Sanitária acompanha as diretrizes do Pacto de Gestão para o financiamento do SUS. Nessa perspectiva compõe junto com o componente "Vigilância Epidemiológica e Ambiental" o Bloco da Vigilância em Saúde. O objetivo é que os recursos sejam alocados com vistas à superação das desigualdades de acesso e à garantia da integralidade da atenção à saúde.
Na área de organização do SNVS, as diretrizes preconizadas visam incrementar a capacidade de gestão dos órgãos que o integram nas esferas municipal, estadual e federal, por meio do delineamento das relações entre seus componentes, do estabelecimento das responsabilidades sanitárias respectivas e da adoção de instrumentos e mecanismos que garantam maior eficácia, eficiência e efetividade.
Nesse contexto, determinadas diretrizes visam à superação das deficiências de estrutura ainda observadas, como aquelas relativas à organização dos serviços e dos processos de trabalho em Vigilância Sanitária, ao estabelecimento de suporte jurídico e à gestão do trabalho, em termos qualitativos e quantitativos, assim como à implantação do Sistema Nacional de Informação em Vigilância Sanitária - Visa, que se articule com os sistemas de informações de base nacional do SUS.
Além disso, deve-se destacar a necessária articulação efetiva das políticas e práticas de Vigilância Sanitária, Vigilância Epidemiológica, Vigilância Ambiental e Saúde do Trabalhador, enfatizando-se o princípio da integralidade.
Ainda a discussão sobre o papel da rede laboratorial integrante do SNVS deve ser aprofundada na perspectiva da estruturação e manutenção de uma rede regionalizada e hierarquizada, com tecnologias adequadas aos diversos objetos de regulação da Vigilância Sanitária e com a perspectiva da retroalimentação dos conhecimentos e informações nela produzida aos demais componentes do Sistema. Para isso, é urgente a implementação de uma linha de financiamento específica para custear a estruturação e a execução das ações laboratoriais em Vigilância Sanitária, como também a definição de uma rede complementar que garanta a execução de ações laboratoriais de interesse da Vigilância Sanitária não existentes nos laboratórios de Saúde Pública.
A concretização dessas diretrizes parte dos Planos de Ação realizados em cada esfera de governo como um componente do processo de planejamento e formulação de seus Planos de Saúde, com o propósito precípuo de consolidar o Sistema Nacional de Vigilância Sanitária no âmbito do Sistema Único de Saúde.
Diretrizes do Eixo I
1. Reafirmação do caráter indissociável da Vigilância Sanitária, como componente do SUS, respeitando seus princípios e diretrizes:
a) adequação dos processos de trabalho de Vigilância Sanitária visando à integração com as demais políticas e práticas de saúde;
b) estímulo à construção de práticas de gestão que incentivem a intersetorialidade, institucionalizadas formalmente, compartilhando espaços de ações e serviços com outros setores governamentais e não governamentais que possuam interface com o campo de atuação da Vigilância Sanitária e respeitando as especificidades locais; e
c) desenvolvimento, na esfera federal, de mecanismos que garantam a integração da ANVISA com as demais áreas responsáveis por ações de promoção e proteção à saúde.
2. Revisão do processo de planejamento e execução das ações de Vigilância Sanitária, sob a ótica da responsabilidade sanitária, com a definição do elenco norteador para subsidiar a descentralização da gestão e das ações, mediante:
a) a análise dos riscos sanitários, da situação de saúde e das necessidades sociais;
b) o levantamento e análise dos recursos físicos, financeiros e humanos existentes e os necessários ao desenvolvimento das ações de Vigilância Sanitária; e
c) a definição de agendas de prioridades locorregionais, com vistas a intervenções.
3. Definição das relações e responsabilidades sanitárias das três esferas de governo, estabelecendo formas de articulação e execução de ações de Vigilância Sanitária de maneira integrada e consoante com os princípios do SUS:
a) articulação, cooperação e apoio efetivo entre Ministério da Saúde, ANVISA, Estados, Distrito Federal e Municípios, visando à consolidação do processo de estruturação do SNVS, por meio da pactuação entre as três esferas de governo;
b) definição e implementação de instrumentos de pactuação e gestão que favoreçam maior eficiência, eficácia e efetividade à ação de Vigilância Sanitária, reconhecendo e respeitando a diversidade e especificidade locorregional; e
c) aprofundamento da estruturação do SNVS para o gerenciamento dos riscos e controle sanitário de portos, aeroportos e fronteiras, por meio da pactuação e do fortalecimento da articulação entre as esferas de governo.
4. Fortalecimento da Vigilância Sanitária em todas as esferas de governo:
a) indução política da estruturação da Vigilância Sanitária a fim de que cada esfera de governo tenha estrutura e estratégias para o gerenciamento do risco sanitário local;
b) promoção da qualificação dos profissionais que atuam em Vigilância Sanitária;
c) estímulo à introdução da temática de Vigilância Sanitária na pauta dos espaços colegiados de gestão, discussão técnica e pactuação do SUS; e
d) apoio jurídico à Vigilância Sanitária, fortalecendo suas ações locais.
5. Desenvolvimento de processos de planejamento, monitoramento, avaliação e auditoria compartilhados e contínuos, nas três esferas de governo, para melhor apoiá-las no processo de assunção de suas responsabilidades:
a) desenvolvimento de processos e instrumentos de avaliação dos serviços e das ações de Vigilância Sanitária - expressos nos Relatórios de Gestão das três esferas de governo - visando à redução dos riscos e agravos à saúde; e
b) definição de metas de cobertura e de indicadores de desempenho e incorporação dos resultados das avaliações ao processo decisório nas três esferas de governo.
6. Constituição de uma política de financiamento para investimento e custeio, em consonância com as diretrizes do Pacto pela Saúde, por parte das três esferas de governo, com vistas à estruturação dos serviços e à operacionalização das ações de Vigilância Sanitária - Visa, adotando a eqüidade e a transparência na aplicação dos recursos como princípios norteadores.
7. Estruturação e implantação de um Sistema Nacional de Informação, que promova transparência e subsidie o processo de gestão do SNVS, integrado aos sistemas de base nacional do Ministério da Saúde.
8. Harmonização da Gestão do Trabalho e Educação em Vigilância Sanitária com as diretrizes da Política Nacional de Gestão do Trabalho e Educação na Saúde.
9. Articulação do Sistema Nacional de Laboratórios de Saúde Publica como suporte das ações de Vigilância Sanitária:
a) desenvolvimento de tecnologias de comunicação, para permitir a troca ágil de informações referentes à comunicação do risco sanitário;
b) definição de uma linha de financiamento para custeio e investimento; e
c) reestruturação da rede complementar de laboratórios.
10. Articulação efetiva das políticas e práticas de Vigilância Sanitária, Vigilância Epidemiológica, Vigilância Ambiental e Vigilância da Saúde do Trabalhador.
11. Consolidação da responsabilidade dos componentes do Sistema Nacional de Vigilância Sanitária de exercer seu poder de polícia em relação às condições e ambientes de trabalho.
EIXO II
AÇÃO REGULATÓRIA: VIGILÂNCIA DE PRODUTOS, DE SERVIÇOS E DE AMBIENTES
A reconfiguração da ordem econômica mundial recente e, principalmente, as expectativas de contínuas mudanças decorrentes da globalização e da rapidez da circulação de informações tornam as práticas de Vigilância Sanitária crescentemente relevantes. Os novos padrões de produção e circulação de mercadorias e seus possíveis efeitos sobre a saúde das populações têm levado à necessidade de adoção de medidas de proteção da saúde ao mesmo tempo ágeis, firmes e criativas por parte dos órgãos públicos, privados e da sociedade em geral.
No que tange à Vigilância Sanitária, a reorientação das ações de regulação constituirá medida fundamental para responder às novas exigências sociais e políticas geradas com a expansão do mercado de consumo e a diversificação dos produtos e dos serviços ofertados pelos setores produtivos.
A Vigilância Sanitária pode ser vista como espaço de intervenção do Estado, cujo objetivo é adequar o sistema produtivo de bens e de serviços de interesse sanitário, bem como os ambientes, às demandas sociais e às necessidades do sistema de saúde. Sua principal função é atuar no sentido de prevenir, eliminar ou minimizar o risco sanitário envolvido em suas áreas de atuação, promovendo e protegendo a saúde da população.
Desse modo, suas ações têm o propósito de implementar concepções e atitudes éticas a respeito da qualidade das relações, dos processos produtivos, do ambiente e dos serviços. Em virtude de seu papel regulador, essas ações representam uma importante possibilidade de articular os poderes governamentais, impulsionar a participação social e aperfeiçoar as relações sociais.
O processo de estruturação da Vigilância Sanitária acompanhou as mudanças e as reformas do Estado. A partir do início da década de 1990, a reforma do Estado visava, sobretudo, à redução do tamanho do Estado e à mudança de regras macroeconômicas. O foco estava na agilização administrativa e no atendimento das demandas do setor produtivo. Com a criação do Mercosul, em 1991, a Secretaria Nacional de Vigilância Sanitária passou a se responsabilizar também pelos processos de harmonização da regulamentação sanitária. Na segunda metade dessa mesma década, ocorreu nova onda de reformas e foi criada a Agência Nacional de Vigilância Sanitária.
Pode-se afirmar que em cada época foi adotado um conceito e um modelo de regulação, embora esse termo seja relativamente recente. Classicamente, o termo regulação tem uma carga conceitual pautada nos processos econômicos e de reestruturação do papel do Estado, capitaneada pela reforma neoliberal produzida nas últimas décadas. A partir desse conceito, limita-se o papel do Estado no processo de produção e consumo de bens, produtos e serviços, a "regulador" do mercado. Utilizado sem muitos problemas nos campos abarcados pelas agências criadas para regular as atividades econômicas privatizadas (energia elétrica, telefonia etc.), mostra-se limitado quando aplicado aos objetos de trabalho da saúde e, mais especificamente, da Vigilância Sanitária. Diante dessa constatação, tornase necessário que seja traduzido para essa área que, idealmente, deve estar voltada à gestão do risco sanitário.
Para grande parte dos autores, o processo de regulação abrange: aprovação de regras pertinentes (regulamentos, normas, resoluções etc.); implementação concreta desses regulamentos (autorizações, licenças, registros etc.); fiscalização de seu cumprimento e imposição de sanções ou penalidades perante as infrações. Portanto, regulação conjuga os três tipos de poder: normativo, executivo e parajudicial. Ela cumpre vários objetivos: restringir práticas empresariais, regular mercados, controlar qualidade e preço, afastar a concorrência desleal e, ainda, corrigir informações aos consumidores. Esse processo também merece uma reflexão profunda para sua transposição para a área da Vigilância Sanitária.
Assim, a regulação nessa área ganha um complemento ao conceito. Trata-se aqui não apenas de regulação, mas regulação sanitária. Esta não se limita apenas a uma função de árbitro entre produtores e consumidores, diferencia-se por vários aspectos:
a) as características particulares dos produtos, bens e serviços que, ao ser utilizados, podem ter efeitos danosos à saúde;
b) são, muitas vezes, objetos de difícil materialização (o meio ambiente, o ar que respiramos, a fonte de água que bebemos), ou que são consumidos à medida que são produzidos (serviços de saúde);
c) necessidade de se conhecer ampla e previamente a realidade social e sanitária na qual esses produtos e serviços se inserem ou serão consumidos; e
d) não se trata de processo de consumo como os demais, mas de processo que envolve sujeitos e cidadãos ou coletividades que consomem bens ou serviços essenciais à sua vida.
Um segundo conceito deve ser considerado para a correta compreensão da regulação e sua aplicação na área da Vigilância Sanitária. Ele está explícito na própria definição da função dessa área, que é a de atuar no sentido de prevenir, eliminar ou minimizar risco sanitário. O conceito de risco tem sido objeto de muitas reflexões, pois, mais uma vez, sua transposição para a Vigilância Sanitária não pode se dar de forma direta e linear. O termo risco não deve ser tomado apenas na sua concepção estatística no sentido de probabilidade de ocorrência de eventos danosos. Muitas vezes o risco coloca-se como possibilidade, sem que haja, de fato, dados quantitativos, mas sim indícios, baseados na racionalidade e nos conhecimentos científicos disponíveis. Essa concepção, aliada ao contexto de incertezas produzido pelas rápidas mudanças no sistema produtivo, é base, até mesmo, para que a Vigilância Sanitária adote em seu processo de regulação o princípio da precaução. Assim, além dos objetivos acima descritos no conceito mais clássico de regulação, na Vigilância Sanitária ele ganha outro objetivo fundamental - o de preservar e promover a saúde dos indivíduos, do meio ambiente e dos locais de trabalho.
A partir desses conceitos, pode-se pensar no modelo de regulação sanitária do País, que deve estar orientado pela identificação e avaliação dos riscos e busca de mecanismos que garantam a segurança sanitária e a proteção da saúde. A escolha entre alternativas para a regulação, diante das análises produzidas e das situações de incerteza científica, significa gerenciar os riscos, e estas escolhas não podem estar reduzidas a atos administrativos de natureza cartorial ou fiscalizatória. Também é preciso reconhecer que o processo de regulação se dá num contexto de conflitos de interesses, que podem gerar embates. Para minimizar suas fragilidades, é fundamental que as decisões estejam baseadas em conhecimentos científicos sólidos e ampla divulgação de informações, para que a sociedade organizada possa interferir no processo.
Com esse sentido ampliado de regulação, estratégias como o aprimoramento dos processos produtivos e do controle da qualidade dos produtos e serviços oferecidos, bem como a comunicação do risco e o estímulo ao consumo consciente são algumas das possibilidades de implementação da regulação com o objetivo de proteger a saúde da população. Nesse sentido, essas práticas deverão ser continuamente promovidas e aprimoradas para tornar as ações de vigilância mais efetivas, o que implica repensar os instrumentos e a incorporação adequada dos conhecimentos e tecnologias constantemente produzidos.
Dessa forma, a atribuição legal da Vigilância Sanitária diz respeito aos processos de regulação do risco sanitário, mas não deve se restringir apenas a uma perspectiva fiscalizatória e sim ampliar, a partir de uma visão que permita incorporar às práticas de proteção, aquelas de promoção da saúde. Importantes ações, hoje ainda incipientes na Vigilância Sanitária, tais como o monitoramento da propaganda, as notificações pós-comercialização, a comunicação do risco (alertas sanitários para a sociedade em geral), o monitoramento e a avaliação dos produtos e medicamentos registrados, em especial os novos ou com novas indicações, ao longo de sua comercialização e a educação em saúde visando ao consumo seguro de produtos e medicamentos poderiam ser exemplificadas como ações de promoção da saúde.
Outro aspecto considerado essencial para o adequado desenvolvimento da função de regulação é o reconhecimento do caráter intersetorial dos objetos das ações de Vigilância Sanitária, o que torna necessária a articulação com os diversos órgãos e instituições responsáveis pela normatização e acompanhamento de produtos, serviços e ações. Portanto, a criação de estratégias de integração e discussão com os diferentes atores envolvidos com a temática da Vigilância Sanitária constituem estratégias fundamentais de trabalho.
Entretanto, tendo em vista que a Vigilância Sanitária está organizada como um sistema em todo o território nacional, a regulação deve ser concebida considerando o papel dos três componentes do sistema - federal, estadual e municipal - potencializando seu caráter universal e de integralidade.
Ainda sobre o princípio constitucional da integralidade no SUS, é importante que ele seja aplicado, nas atribuições de regulação em Vigilância Sanitária, para compreender todo o ciclo produtivo de bens e serviços de interesse à saúde, desde a garantia da qualidade dos insumos importados, passando pela garantia dos procedimentos de produção ou de processamentos internos até o monitoramento da propaganda para seu consumo, sejam eles produtos ou serviços.
Uma outra importante diretriz para a Vigilância Sanitária diz respeito à sua articulação com a política de saúde do País. As ações de regulação devem se pautar por prioridades definidas nessa política, considerando programas e projetos desenvolvidos pelo Sistema Único de Saúde.
De forma geral, a circulação de informações e dos novos conhecimentos tem sido enormemente amplificada com a revolução tecnológica produzida pela informática. A incorporação desses conhecimentos e de evidências científicas bem embasadas é fundamental para dar consistência à regulação de áreas importantes como a de medicamentos e de produtos para a saúde. Portanto, são fundamentais investimentos vigorosos e ininterruptos em pesquisas e na capacitação de profissionais para acessar e analisar criticamente seus resultados.
O desenvolvimento e a implantação de um sistema de informação é hoje uma necessidade que deve ser vista como prioridade para o fortalecimento do SNVS. Seu papel seria o de consolidar as informações produzidas no próprio sistema, produzir alertas e auxiliar na tomada de decisões e definição de prioridades para a Vigilância Sanitária, além disso, deverá ter a capacidade de interoperabilidade com os sistemas e bancos de dados nacionais do Ministério da Saúde.
No aspecto do trabalho respaldado por evidências científicas, a discussão sobre o papel dos laboratórios deve ser aprofundada na perspectiva da estruturação e manutenção de uma rede com tecnologias recentes e adequadas aos diversos objetos de regulação e da retroalimentação dos conhecimentos e informações neles produzidas aos demais componentes do Sistema Nacional de Vigilância Sanitária - Visa.
Por fim, deve-se ressaltar que a Vigilância Sanitária, em sua função reguladora, é muitas vezes vista, equivocadamente, como um entrave à produção local. No entanto, é importante destacar que o papel regulador, adequadamente conduzido, constitui-se em um instrumento de promoção da qualidade dos produtos e serviços, recebendo, até mesmo, o reconhecimento internacional e contribuindo para o desenvolvimento nacional.
Diretrizes do Eixo II:
1. Institucionalização de ações de caráter intersetorial com os diversos órgãos que tenham interface com ações de Vigilância Sanitária - VISA
a) articulação com outros órgãos responsáveis por ações regulatórias, reconhecendo seus limites de competência;
b) articulação das ações de Vigilância Sanitária com as prioridades das demais políticas públicas, nas três esferas de governo;
c) articulação com os diversos órgãos e entidades de proteção do consumidor, defesa da cidadania, regulação econômica e monitoramento de mercado, bem como com os órgãos responsáveis pelo controle de qualidade e avaliação de conformidade; e
d) articulação com as empresas empregadoras, sindicatos, estabelecimentos privados de prestação de servicos de saúde, operadoras de planos de saúde e Agência Nacional de Saúde Suplementar (ANS) para a redução de riscos sanitários e melhoria das condições de vida e saúde.
2. Aprimoramento da aplicação do princípio da precaução como um valor fundamental para as ações de Vigilância Sanitária, para a avaliação de novas tecnologias e para a tomada de decisões, de forma que proteja e promova a saúde da população.
3. Sistematização e incorporação dos conhecimentos produzidos no próprio SNVS às práticas de Vigilância Sanitária, a partir das ações de registro, fiscalização e monitoramento, dentre outras.
4. Promoção do acesso aos conhecimentos científicos pertinentes às ações de regulação para os profissionais do Sistema Nacional de Vigilância Sanitária.
5. Promoção de mecanismos de disseminação efetiva das comunicações de risco sanitário à população.
6. Articulação entre as diversas esferas de governo para a definição de prioridades da regulação sanitária e execução das ações de Vigilância Sanitária.
7. Articulação com a rede de Laboratórios de Saúde Pública nas diversas esferas de governo, como componente essencial ao exercício da ação regulatória.
8. Elaboração e revisão da legislação, do marco regulatório, dos regulamentos técnicos e dos processos de trabalho em Vigilância Sanitária, de forma participativa e tripartite, à luz dos conhecimentos recentes e das referências internacionais:
a) harmonização das ações e instrumentos de controle sanitário e adoção de procedimentos operacionais padronizados em Vigilância Sanitária; e
b) aprimoramento dos instrumentos inerentes ao processo regulatório, visando à racionalização das atividades da Vigilância Sanitária.
9. Consolidação e ampliação, em âmbito nacional, da estratégia de vigilância e monitoramento de eventos adversos e queixas técnicas relacionadas ao uso de produtos e serviços de saúde.
10. Articulação da ação regulatória da Visa com as diretrizes e estratégias da política de desenvolvimento nacional, levando em consideração os riscos sanitários, contribuindo para o aprimoramento da qualidade de produtos, processos e serviços.
EIXO III
A VIGILÂNCIA SANITÁRIA NO CONTEXTO DA ATENÇÃO INTEGRAL À SAÚDE
A Vigilância Sanitária, concebida como campo de saúde coletiva, é indissociável do conjunto de ações que integram as políticas de saúde. Nessa dimensão, há a necessidade de articulação permanente das ações de Vigilância Sanitária nas distintas esferas de governo e destas com as ações de saúde desenvolvidas no âmbito do SUS. A adoção de práticas de saúde resolutivas, seguras, éticas e humanizadas, acompanhadas de iniciativas para a qualificação dos trabalhadores de saúde e a consolidação do controle social, constituirão dimensões essenciais para a qualidade e a integralidade da atenção à saúde prestada à população.
A integralidade pode refletir três grandes sentidos diferentes: o primeiro, refere-se às práticas dos profissionais de saúde; o segundo, refere-se à organização dos serviços e o terceiro, aplica-se às respostas governamentais aos problemas de saúde.
O avanço para a integralidade na atenção deverá estar expresso prioritariamente na estrutura e na organização dos serviços, nos instrumentos de planejamento e gestão adotados nos três níveis de governo, nos processos de trabalho e qualificação dos trabalhadores de saúde e no estímulo ao desenvolvimento de políticas intersetoriais. Essas diretrizes devem gerar as condições necessárias para a inserção da Vigilância Sanitária nos distintos níveis de complexidade da atenção à saúde do SUS.
Na atenção básica, a busca pela reestruturação da prática focada no atendimento integral e por serviços de qualidade, eficientes e resolutivos, deve ser objetivo norteador da Vigilância Sanitária em sua inserção nesse nível de atenção. Espera-se que além das ações assistenciais, sejam realizadas ações de promoção de saúde e de prevenção de agravos - incluindo aqueles relativos ao consumo de bens e serviços e as interações com o ambiente de trabalho e de vida, ações típicas do campo da Vigilância Sanitária - pelas equipes de saúde da família e das unidades básicas de saúde, com destaque para o agente de saúde.
Contudo, não se propõe que os profissionais de atenção básica devam incorporar a atribuição de polícia administrativa inerente aos profissionais de Vigilância Sanitária. A atenção básica em sua responsabilidade local deve incorporar o olhar que configura as ações de Vigilância Sanitária na história natural dos agravos e determinantes de saúde, desenvolvendo tecnologias de cuidado no contexto da integralidade.
Os profissionais de saúde, de forma geral, devem estar preparados para realizar ações próprias de assistência à saúde, para atuar na identificação de riscos sanitários potenciais e danos à saúde da população de seu território, bem como saber agir de forma multidisciplinar e intersetorial na proteção e promoção da saúde.
A Vigilância Sanitária deverá, também, articular-se às ações e aos programas desenvolvidos pelo SUS, destinados aos grupos vulneráveis de nossa sociedade, em virtude da necessidade de ações de promoção e proteção à saúde.
Trabalhar a integralidade no SUS não é apenas favorecer o trabalho conjunto de setores nos diferentes níveis de complexidade da assistência, mas descompartimentalizar as diversas ações locais, desenvolvendo um processo de trabalho condizente com a realidade local que ao mesmo tempo preserve as especificidades dos setores e compartilhe suas tecnologias, na constituição da qualidade de vida e da cidadania.
Diretrizes do Eixo III
1. Articulação permanente entre as ações de Vigilância Sanitária e os demais serviços e ações de saúde desenvolvidos no âmbito do SUS, garantindo a transversalidade nos diversos níveis de atenção à saúde.
2. Articulação das ações de Vigilância Sanitária, Epidemiológica, Ambiental e de Saúde do Trabalhador, no sentido de consolidar a vigilância dos determinantes do processo saúde-doença, com vistas à atenção integral à saúde.
3. Promoção e fortalecimento do trabalho conjunto da Vigilância Sanitária com a atenção básica, contribuindo para a reflexão de saberes e práticas multidisciplinares e intersetoriais, favorecendo a integralidade das ações de saúde, nas três esferas de governo:
a) desenvolvimento de novos processos de trabalho que incorporem as tecnologias de Vigilância Sanitária às ações básicas de saúde, com enfoque no risco sanitário; e
b) descompartimentalização dos processos de trabalho nas ações locais, preservando especificidades e compartilhando tecnologias, conhecimentos e experiências.
4. Revisão do processo de planejamento e execução das ações de Vigilância Sanitária, considerando a responsabilidade sanitária, o território, o risco sanitário, a transcendência de eventos de interesse da saúde e as prioridades nacionais e locorregionais de saúde, visando à integralidade das ações de atenção à saúde.
5. Articulação na definição de políticas de formação de trabalhadores do SUS para promover a integração da Vigilância Sanitária com as demais áreas da saúde no cumprimento do princípio da integralidade.
EIXO IV
PRODUÇÃO DO CONHECIMENTO, PESQUISA E DESENVOLVIMENTO TECNOLÓGICO
A pesquisa e o desenvolvimento tecnológico em Vigilância Sanitária assumem caráter importante na construção de uma agenda de atuação, devidamente articulada com a Política Nacional de Ciência, Tecnologia e Inovação em Saúde (PNCTIS) do Ministério da Saúde.
No entanto, verifica-se uma lacuna no campo da produção do conhecimento em Vigilância Sanitária que precisa ser preenchida, quer seja por estratégias como o desenvolvimento de estudos sobre a função regulatória e seus impactos nos problemas de saúde, quer seja no controle de inúmeros riscos à saúde relacionados a processos produtivos e a bens de consumo e dos potenciais efeitos adversos de numerosas e complexas exposições relacionadas às diversas tecnologias utilizadas nos serviços de saúde.
É consenso que a pesquisa é ferramenta importante para a tomada de decisões na definição de políticas e no planejamento em saúde, contribuindo para a melhoria das ações de promoção, proteção e recuperação da saúde e a diminuição das desigualdades sociais.Nesse sentido, e em consonância com a PNCTIS, a Vigilância Sanitária incorpora como princípios básicos: o respeito à vida e à dignidade humana das pessoas, a melhoria da saúde da população brasileira, a busca da eqüidade em saúde, a inclusão e o controle social e o respeito à pluralidade filosófica e metodológica. A Vigilância Sanitária incorpora também as estratégias de ação da PNCTIS para a produção de conhecimento, pesquisas e desenvolvimento tecnológico no setor, como: a sustentação e o fortalecimento do esforço nacional em ciência, tecnologia e inovação em saúde, a criação do sistema nacional de inovação em saúde, a superação das desigualdades regionais, o aprimoramento da capacidade regulatória, a difusão dos avanços científicos e tecnológicos, bem como a formação e a capacitação de recursos humanos.
Observa-se também que as rotinas dos profissionais de Vigilância Sanitária são baseadas não só no aparato legal da legislação vigente, mas num somatório entre este e o conhecimento implícito das questões que perpassam as atividades relacionadas a produtos, serviços e ambientes.
A sistematização dessa prática profissional, realizada por meio de diversas abordagens metodológicas, possibilita avanços importantes para a melhoria dos processos de trabalho.
A busca de mecanismos de disseminação e intercâmbio da produção de conhecimento em Visa também tem sido bastante discutida pelo SNVS. Destacam-se, nesse sentido, os Simpósios Brasileiros de Vigilância Sanitária (Simbravisa), realizados pela Associação Brasileira de Pós-Graduação em Saúde Coletiva (Abrasco), que demonstram claramente as contribuições dos profissionais de Vigilância Sanitária para o acúmulo de conhecimentos relativos às ações desenvolvidas nesse campo.
O acelerado avanço tecnológico na área da saúde, paralelo à alta velocidade de incorporação dessas novas tecnologias no mercado, tende a provocar um déficit de conhecimento por parte dos gestores e dos profissionais que, muitas vezes, desconhecem a eficácia, a efetividade e a segurança na escolha da tecnologia apropriada para determinada situação. Para tanto, há necessidade de articulação com a Política Nacional de Gestão de Tecnologias em Saúde (PNGTS), a qual contempla os aspectos referentes à avaliação de tecnologia em saúde, desencadeando um amplo processo de produção, atualização, revisão e disseminação desses conhecimentos e sua aplicabilidade no setor, proporcionando informações úteis e adequadas para a tomada de decisão.
Outra questão de relevância é o desenvolvimento de padrões de ética nos estudos e pesquisas realizados. O crescimento acentuado das pesquisas no Brasil, se por um lado representa um avanço no desenvolvimento científico e tecnológico, por outro, aumenta as possibilidades de risco, engendrando novas formas de ameaças à saúde humana. Portanto, requer um cuidadoso acompanhamento dos centros de pesquisa, dos protocolos de pesquisa e o estabelecimento de critérios rigorosos de credenciamento e acompanhamento pelas comissões de ética.
A disseminação e difusão dos avanços científicos e tecnológicos por meio do estabelecimento de mecanismos de comunicação social apresentam-se como um meio para a apropriação dos conhecimentos produzidos e dos benefícios decorrentes dos estudos desenvolvidos por parte dos pesquisadores, setor regulado, gestores e trabalhadores do SUS e sociedade civil. Para tanto, faz-se necessária a constituição de canais de divulgação que permitam a introdução de formas de comunicação acessíveis e compreensíveis para o público em geral.
Além disso, entende-se como questão de importância fundamental para consolidação do Sistema Nacional de Vigilância Sanitária, o desenvolvimento de estratégias para a formação, a qualificação e a capacitação de profissionais que atuam no âmbito do Sistema de Saúde. Essas estratégias deverão contemplar o desenvolvimento de competências dos profissionais para uma atuação crítica e autônoma, minimizando-se, assim, a importação acrítica de padrões, modelos, protocolos de avaliação, critérios científicos e normas.
Desse modo, considera-se essencial a necessidade do desenvolvimento de estudos e pesquisas, de forma contínua e sistemática, acerca das tecnologias, produtos, serviços e ambientes de interesse à saúde, considerando a relação risco-custo-benefício, acompanhando seus efeitos adversos e promovendo estratégias continuadas para seu uso racional.
Diretrizes do Eixo IV
1. Estímulo à Produção de Conhecimento em Vigilância Sanitária, buscando integrá-la à Política Nacional de Ciência, Tecnologia e Inovação em Saúde do SUS:
a) produção e disseminação do conhecimento em Vigilância Sanitária, com a participação de outros atores sociais, tais como: segmentos da sociedade civil organizada, setor regulado, instituições de ensino e pesquisa, profissionais de saúde etc.;
b) consolidação e ampliação dos Centros Colaboradores em Vigilância Sanitária, de acordo com as potencialidades regionais, articulando-os com os demais órgãos do SNVS, para o apoio ao desenvolvimento da Vigilância Sanitária; e
c) aprimoramento dos instrumentos de disseminação do conhecimento, para tornar mais efetiva a comunicação entre o SNVS e a população.
2. Consolidação do campo da Vigilância Sanitária nos espaços acadêmicos de formação e de produção científica, ensino e pesquisa e reconhecimento dela como campo de pesquisa, inerente ao campo da Saúde Coletiva, ressaltando a necessidade de interlocução com outras áreas, tendo em vista seu caráter interdisciplinar, multiprofissional e intersetorial.
3. Fomento à produção de conhecimento e ao desenvolvimento tecnológico voltados para o aprimoramento do SNVS, na perspectiva da diversidade de abordagens metodológicas:
a) participação com outros setores governamentais envolvidos na Política Nacional de Ciência, Tecnologia e Inovação em Saúde para a elaboração de um plano de incorporação tecnológica a partir da identificação das necessidades de aquisição de equipamentos e tecnologias, com vistas à avaliação do impacto social, econômico, ambiental e sanitário decorrente de sua utilização;
b) aporte de recursos de forma contínua e sistemática ao desenvolvimento de pesquisas e tecnologia nos serviços de Vigilância Sanitária;
c) fomento à efetivação de estudos sobre os determinantes dos riscos sanitários decorrentes dos novos arranjos demográficos e epidemiológicos e dos modos de produção e consumo, objetivando a ampliar a efetividade na proteção da saúde;
d) estímulo à realização de estudos sobre a função regulatória e seus impactos nos problemas de saúde e no controle de inúmeros riscos à saúde relacionados a processos produtivos, bens de consumo, serviços e ambientes;
e) fomento à efetivação de parcerias entre o SNVS e instituições de ensino e pesquisa - nacionais e internacionais - para o desenvolvimento de projetos em Vigilância Sanitária, de forma que aprimore suas práticas e bases de ação; e
f) incentivo à produção de pesquisa pelos serviços de Vigilância Sanitária.
4. Contribuição da Vigilância Sanitária no processo de identificação das necessidades de aquisição de equipamentos e tecnologias e na definição de mecanismos de incorporação tecnológica e de pesquisas, que contemplem as singularidades regionais, para avaliação do impacto social, econômico, ambiental e sanitário decorrente de seu uso.
5. Utilização das diretrizes e definições estabelecidas na Política Nacional de Gestão de Tecnologias em Saúde (PNGTS) como base para a avaliação de tecnologia em saúde, envolvendo as três esferas de governo, com vistas a subsidiar a tomada de decisão acerca da incorporação crítica e independente de produtos e processos.
6. Incorporação e utilização do conhecimento acerca dos avanços tecnológicos e biotecnológicos em saúde, com ênfase na biossegurança, considerando as implicações e repercussões no campo da bioética e da ética em pesquisa:
a) utilização de mecanismos e critérios para avaliação do uso de produtos e serviços sujeitos à Vigilância Sanitária e outras inovações tecnológicas, visando ao desenvolvimento de pesquisas, considerando a avaliação de impactos e suas conseqüências para a saúde.
7. Promoção sistemática de eventos para a ampla difusão de conhecimentos sobre os determinantes do processo saúde-doença, fatores de risco e situação de saúde da população.
EIXO V
CONSTRUÇÃO DA CONSCIÊNCIA SANITÁRIA: MOBILIZAÇÃO, PARTICIPAÇÃO E CONTROLE SOCIAL
A Constituição Federal de 1988 possibilitou novas experiências de exercício da cidadania na medida em que criou espaços de participação representativos e democráticos para elaboração de políticas públicas e instrumentos de controle em sua implementação.
A Lei n° 8.142/90 dispõe sobre as instâncias de participação e controle social no Sistema Único de Saúde, regulamentando preceitos constitucionais no bojo da reforma democrática do Estado brasileiro. O Ministério Público, o Poder Legislativo e o Judiciário têm também atribuições relacionadas à defesa da cidadania em seus diversos aspectos, incluindo o que se refere ao direito à saúde.
No que diz respeito ao entendimento entre o que é participação e controle social não se tem como preocupação um aprofundamento conceitual desses objetos neste texto. Entretanto, é válido apontar que alguns autores definem controle social como a forma e os mecanismos com os quais a sociedade organizada fiscaliza e controla o poder público em relação às suas ações e gastos financeiros, exercendo assim seu direito de cidadãos em requererem do Estado a definição de prioridades. Por sua vez, outros autores consideram que a participação social deve também ser considerada como um exercício pleno de cidadania e de direito, descrita na Constituição, na qual a lógica não se restringe apenas à fiscalização, mas amplia sua contribuição à política pública que o Governo vem estabelecendo em suas ações de Estado. considerando as prerrogativas legais da Vigilância Sanitária - de interferir no espaço em que atuam forças de mercado e no jogo de interesses econômicos, cujos resultados influenciam diretamente as condições de vida e de saúde das pessoas -, os mecanismos de participação e controle social são essenciais para que todos os agentes que atuam na saúde e na produção de produtos e bens de consumo não comprometam as ações de Vigilância Sanitária fundamentais para o cumprimento da missão legal do Sistema Nacional de Vigilancia Sanitaria. Torna-se fundamental o debate público das decisões que possam afetar a segurança das pessoas e da coletividade, até mesmo na feitura das normas administrativas.
Observa-se que a Vigilância Sanitária esteve, em alguns momentos, na pauta das discussões dos mecanismos de participação e controle social, como: a I Conferência Nacional de Saúde do Consumidor, em 1986; a 11ª Conferência Nacional de Saúde, em 2000, na qual se apontou a necessidade de realização da conferência temática de Vigilância Sanitária; e a I Conferência Nacional de Vigilância Sanitária, realizada em 2001, cujo tema central tratou da efetivação do Sistema Nacional de Vigilância Sanitária, com vistas à proteção e à promoção da saúde, assim como à construção da cidadania.
Outro espaço de participação e controle social que hoje se encontra em funcionamento no Conselho Nacional de Saúde é a Comissão Intersetorial de Vigilância Sanitária e Farmacoepidemiologia, descrita no artigo 13, inciso III, da Lei nº 8.080/90, que tem por finalidade a articulação das políticas e programas de interface da Vigilância Sanitária com as demais áreas da saúde.
A exemplo das demais áreas da Saúde Coletiva, já existem, hoje, instâncias formais de participação e controle social direcionadas à Vigilância Sanitária. Entretanto, igualmente às demais áreas da saúde, tal participação e controle só podem ser exercidos mediante o conhecimento pela sociedade do que é Vigilância Sanitária e mediante o reconhecimento de sua importância como campo de promoção e proteção da saúde. Assim, entendendo que essa discussão atualmente é frágil, é importante enfatizar a necessidade de se promover ações que elevem a consciência sanitária da população de forma que tal participação e controle se efetivem.
Por sua natureza, a Vigilância Sanitária pode ser concebida igualmente como espaço de exercício da cidadania e do controle social, que, por sua capacidade transformadora da qualidade dos produtos, dos processos e das relações sociais, exige ação interdisciplinar e interinstitucional.
É importante, ainda, ressaltar a necessidade de mediação entre diferentes instâncias, para envolver o Executivo, o Legislativo, o Judiciário e outros setores do Estado e da sociedade, ampliando o compromisso desses com a concretização do SUS.
A Vigilância Sanitária entende que a parceria com a sociedade é fundamental para a concretização de suas ações visto que esta tem seu campo de atuação relacionado à defesa do consumidor real ou potencial de produtos e serviços, garantindo o direito do cidadão a uma vida saudável. Assim sendo, faz-se necessário desenvolver atividades de educação para a saúde, de democratização da informação, de transparência das suas ações e o estabelecimento de mecanismos de escuta da sociedade, possibilitando assim o incremento da consciência sanitária
ANEXO XX
DO CONTROLE E DA VIGILÂNCIA DA QUALIDADE DA ÁGUA PARA CONSUMO HUMANO E SEU PADRÃO DE POTABILIDADE (Origem: PRT MS/GM 2914/2011)
Art. 1º Ficam definidos os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. (Origem: PRT MS/GM 2914/2011, Art. 1º)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 2914/2011, CAPÍTULO I)
Art. 2º Este Anexo se aplica à água destinada ao consumo humano proveniente de sistema e solução alternativa de abastecimento de água. (Origem: PRT MS/GM 2914/2011, Art. 2º)
Parágrafo Único. As disposições deste Anexo não se aplicam à água mineral natural, à água natural e às águas adicionadas de sais destinadas ao consumo humano após o envasamento, e a outras águas utilizadas como matéria-prima para elaboração de produtos, conforme Resolução (RDC) nº 274, de 22 de setembro de 2005, da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2914/2011, Art. 2º, Parágrafo Único)
Art. 3º Toda água destinada ao consumo humano, distribuída coletivamente por meio de sistema ou solução alternativa coletiva de abastecimento de água, deve ser objeto de controle e vigilância da qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 3º)
Art. 4º Toda água destinada ao consumo humano proveniente de solução alternativa individual de abastecimento de água, independentemente da forma de acesso da população, está sujeita à vigilância da qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 4º)
CAPÍTULO II
DAS DEFINIÇÕES
(Origem: PRT MS/GM 2914/2011, CAPÍTULO II)
Art. 5º Para os fins deste Anexo, são adotadas as seguintes definições: (Origem: PRT MS/GM 2914/2011, Art. 5º)
I - água para consumo humano: água potável destinada à ingestão, preparação e produção de alimentos e à higiene pessoal, independentemente da sua origem; (Origem: PRT MS/GM 2914/2011, Art. 5º, I)
II - água potável: água que atenda ao padrão de potabilidade estabelecido neste Anexo e que não ofereça riscos à saúde; (Origem: PRT MS/GM 2914/2011, Art. 5º, II)
III - padrão de potabilidade: conjunto de valores permitidos como parâmetro da qualidade da água para consumo humano, conforme definido neste Anexo; (Origem: PRT MS/GM 2914/2011, Art. 5º, III)
IV - padrão organoléptico: conjunto de parâmetros caracterizados por provocar estímulos sensoriais que afetam a aceitação para consumo humano, mas que não necessariamente implicam risco à saúde; (Origem: PRT MS/GM 2914/2011, Art. 5º, IV)
V - água tratada: água submetida a processos físicos, químicos ou combinação destes, visando atender ao padrão de potabilidade; (Origem: PRT MS/GM 2914/2011, Art. 5º, V)
VI - sistema de abastecimento de água para consumo humano: instalação composta por um conjunto de obras civis, materiais e equipamentos, desde a zona de captação até as ligações prediais, destinada à produção e ao fornecimento coletivo de água potável, por meio de rede de distribuição; (Origem: PRT MS/GM 2914/2011, Art. 5º, VI)
VII - solução alternativa coletiva de abastecimento de água para consumo humano: modalidade de abastecimento coletivo destinada a fornecer água potável, com captação subterrânea ou superficial, com ou sem canalização e sem rede de distribuição; (Origem: PRT MS/GM 2914/2011, Art. 5º, VII)
VIII - solução alternativa individual de abastecimento de água para consumo humano: modalidade de abastecimento de água para consumo humano que atenda a domicílios residenciais com uma única família, incluindo seus agregados familiares; (Origem: PRT MS/GM 2914/2011, Art. 5º, VIII)
IX - rede de distribuição: parte do sistema de abastecimento formada por tubulações e seus acessórios, destinados a distribuir água potável até as ligações prediais; (Origem: PRT MS/GM 2914/2011, Art. 5º, IX)
X - ligações prediais: conjunto de tubulações e peças especiais, situado entre a rede de distribuição de água e o cavalete, este incluído; (Origem: PRT MS/GM 2914/2011, Art. 5º, X)
XI - cavalete: kit formado por tubos e conexões destinados à instalação do hidrômetro para realização da ligação de água; (Origem: PRT MS/GM 2914/2011, Art. 5º, XI)
XII - interrupção: situação na qual o serviço de abastecimento de água é interrompido temporariamente, de forma programada ou emergencial, em razão da necessidade de se efetuar reparos, modificações ou melhorias no respectivo sistema; (Origem: PRT MS/GM 2914/2011, Art. 5º, XII)
XIII - intermitência: é a interrupção do serviço de abastecimento de água, sistemática ou não, que se repete ao longo de determinado período, com duração igual ou superior a seis horas em cada ocorrência; (Origem: PRT MS/GM 2914/2011, Art. 5º, XIII)
XIV - integridade do sistema de distribuição: condição de operação e manutenção do sistema de distribuição (reservatório e rede) de água potável em que a qualidade da água produzida pelos processos de tratamento seja preservada até as ligações prediais; (Origem: PRT MS/GM 2914/2011, Art. 5º, XIV)
XV - controle da qualidade da água para consumo humano: conjunto de atividades exercidas regularmente pelo responsável pelo sistema ou por solução alternativa coletiva de abastecimento de água, destinado a verificar se a água fornecida à população é potável, de forma a assegurar a manutenção desta condição; (Origem: PRT MS/GM 2914/2011, Art. 5º, XV)
XVI - vigilância da qualidade da água para consumo humano: conjunto de ações adotadas regularmente pela autoridade de saúde pública para verificar o atendimento a este Anexo, considerados os aspectos socioambientais e a realidade local, para avaliar se a água consumida pela população apresenta risco à saúde humana; (Origem: PRT MS/GM 2914/2011, Art. 5º, XVI)
XVII - garantia da qualidade: procedimento de controle da qualidade para monitorar a validade dos ensaios realizados; (Origem: PRT MS/GM 2914/2011, Art. 5º, XVII)
XVIII - recoleta: ação de coletar nova amostra de água para consumo humano no ponto de coleta que apresentou alteração em algum parâmetro analítico; e (Origem: PRT MS/GM 2914/2011, Art. 5º, XVIII)
XIX - passagem de fronteira terrestre: local para entrada ou saída internacional de viajantes, bagagens, cargas, contêineres, veículos rodoviários e encomendas postais. (Origem: PRT MS/GM 2914/2011, Art. 5º, XIX)
CAPÍTULO III
DAS COMPETÊNCIAS E RESPONSABILIDADES
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III)
Seção I
Das Competências da União
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção I)
Art. 6º Para os fins deste Anexo, as competências atribuídas à União serão exercidas pelo Ministério da Saúde (MS) e entidades a ele vinculadas, conforme estabelecido nesta Seção. (Origem: PRT MS/GM 2914/2011, Art. 6º)
Art. 7º Compete à Secretaria de Vigilância em Saúde (SVS/MS): (Origem: PRT MS/GM 2914/2011, Art. 7º)
I - promover e acompanhar a vigilância da qualidade da água para consumo humano, em articulação com as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios e respectivos responsáveis pelo controle da qualidade da água; (Origem: PRT MS/GM 2914/2011, Art. 7º, I)
II - estabelecer ações especificadas no Programa Nacional de Vigilância da Qualidade da Água para Consumo Humano (VIGIAGUA); (Origem: PRT MS/GM 2914/2011, Art. 7º, II)
III - estabelecer as ações próprias dos laboratórios de saúde pública, especificadas na Seção V do Capítulo III; (Origem: PRT MS/GM 2914/2011, Art. 7º, III)
IV - estabelecer diretrizes da vigilância da qualidade da água para consumo humano a serem implementadas pelos Estados, Distrito Federal e Municípios, respeitados os princípios do SUS; (Origem: PRT MS/GM 2914/2011, Art. 7º, IV)
V - estabelecer prioridades, objetivos, metas e indicadores de vigilância da qualidade da água para consumo humano a serem pactuados na Comissão Intergestores Tripartite; e (Origem: PRT MS/GM 2914/2011, Art. 7º, V)
VI - executar ações de vigilância da qualidade da água para consumo humano, de forma complementar à atuação dos Estados, do Distrito Federal e dos Municípios. (Origem: PRT MS/GM 2914/2011, Art. 7º, VI)
Art. 8º Compete à Secretaria Especial de Saúde Indígena (SESAI/MS) executar, diretamente ou mediante parcerias, incluída a contratação de prestadores de serviços, as ações de vigilância e controle da qualidade da água para consumo humano nos sistemas e soluções alternativas de abastecimento de água das aldeias indígenas. (Origem: PRT MS/GM 2914/2011, Art. 8º)
Art. 9º Compete à Fundação Nacional de Saúde (FUNASA) apoiar as ações de controle da qualidade da água para consumo humano proveniente de sistema ou solução alternativa de abastecimento de água para consumo humano, em seu âmbito de atuação, conforme os critérios e parâmetros estabelecidos neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 9º)
Art. 10. Compete à ANVISA exercer a vigilância da qualidade da água nas áreas de portos, aeroportos e passagens de fronteiras terrestres, conforme os critérios e parâmetros estabelecidos neste Anexo, bem como diretrizes específicas pertinentes. (Origem: PRT MS/GM 2914/2011, Art. 10)
Seção II
Das Competências dos Estados
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção II)
Art. 11. Compete às Secretarias de Saúde dos Estados: (Origem: PRT MS/GM 2914/2011, Art. 11)
I - promover e acompanhar a vigilância da qualidade da água, em articulação com os Municípios e com os responsáveis pelo controle da qualidade da água; (Origem: PRT MS/GM 2914/2011, Art. 11, I)
II - desenvolver as ações especificadas no VIGIAGUA, consideradas as peculiaridades regionais e locais; (Origem: PRT MS/GM 2914/2011, Art. 11, II)
III - desenvolver as ações inerentes aos laboratórios de saúde pública, especificadas na Seção V do Capítulo III; (Origem: PRT MS/GM 2914/2011, Art. 11, III)
IV - implementar as diretrizes de vigilância da qualidade da água para consumo humano definidas no âmbito nacional; (Origem: PRT MS/GM 2914/2011, Art. 11, IV)
V - estabelecer as prioridades, objetivos, metas e indicadores de vigilância da qualidade da água para consumo humano a serem pactuados na Comissão Intergestores Bipartite; (Origem: PRT MS/GM 2914/2011, Art. 11, V)
VI - encaminhar aos responsáveis pelo abastecimento de água quaisquer informações referentes a investigações de surto relacionado à qualidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 11, VI)
VII - realizar, em parceria com os Municípios, nas situações de surto de doença diarréica aguda ou outro agravo de transmissão fecal-oral, os seguintes procedimentos: (Origem: PRT MS/GM 2914/2011, Art. 11, VII)
a) análise microbiológica completa, de modo a apoiar a investigação epidemiológica e a identificação, sempre que possível, do gênero ou espécie de micro-organismos; (Origem: PRT MS/GM 2914/2011, Art. 11, VII, a)
b) análise para pesquisa de vírus e protozoários, no que couber, ou encaminhamento das amostras para laboratórios de referência nacional, quando as amostras clínicas forem confirmadas para esses agentes e os dados epidemiológicos apontarem a água como via de transmissão; e (Origem: PRT MS/GM 2914/2011, Art. 11, VII, b)
c) envio das cepas de Escherichia coli aos laboratórios de referência nacional para identificação sorológica. (Origem: PRT MS/GM 2914/2011, Art. 11, VII, c)
VIII - executar as ações de vigilância da qualidade da água para consumo humano, de forma complementar à atuação dos Municípios, nos termos da regulamentação do SUS. (Origem: PRT MS/GM 2914/2011, Art. 11, VIII)
Seção III
Das Competências dos Municípios
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção III)
Art. 12. Compete às Secretarias de Saúde dos Municípios: (Origem: PRT MS/GM 2914/2011, Art. 12)
I - exercer a vigilância da qualidade da água em sua área de competência, em articulação com os responsáveis pelo controle da qualidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 12, I)
II - executar ações estabelecidas no VIGIAGUA, consideradas as peculiaridades regionais e locais, nos termos da legislação do SUS; (Origem: PRT MS/GM 2914/2011, Art. 12, II)
III - inspecionar o controle da qualidade da água produzida e distribuída e as práticas operacionais adotadas no sistema ou solução alternativa coletiva de abastecimento de água, notificando seus respectivos responsáveis para sanar a(s) irregularidade(s) identificada(s); (Origem: PRT MS/GM 2914/2011, Art. 12, III)
IV - manter articulação com as entidades de regulação quando detectadas falhas relativas à qualidade dos serviços de abastecimento de água, a fim de que sejam adotadas as providências concernentes a sua área de competência; (Origem: PRT MS/GM 2914/2011, Art. 12, IV)
V - garantir informações à população sobre a qualidade da água para consumo humano e os riscos à saúde associados, de acordo com mecanismos e os instrumentos disciplinados no Decreto nº 5.440, de 4 de maio de 2005; (Origem: PRT MS/GM 2914/2011, Art. 12, V)
VI - encaminhar ao responsável pelo sistema ou solução alternativa coletiva de abastecimento de água para consumo humano informações sobre surtos e agravos à saúde relacionados à qualidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 12, VI)
VII - estabelecer mecanismos de comunicação e informação com os responsáveis pelo sistema ou solução alternativa coletiva de abastecimento de água sobre os resultados das ações de controle realizadas; (Origem: PRT MS/GM 2914/2011, Art. 12, VII)
VIII - executar as diretrizes de vigilância da qualidade da água para consumo humano definidas no âmbito nacional e estadual; (Origem: PRT MS/GM 2914/2011, Art. 12, VIII)
IX - realizar, em parceria com os Estados, nas situações de surto de doença diarréica aguda ou outro agravo de transmissão fecal-oral, os seguintes procedimentos: (Origem: PRT MS/GM 2914/2011, Art. 12, IX)
a) análise microbiológica completa, de modo a apoiar a investigação epidemiológica e a identificação, sempre que possível, do gênero ou espécie de micro-organismos; (Origem: PRT MS/GM 2914/2011, Art. 12, IX, a)
b) análise para pesquisa de vírus e protozoários, quando for o caso, ou encaminhamento das amostras para laboratórios de referência nacional quando as amostras clínicas forem confirmadas para esses agentes e os dados epidemiológicos apontarem a água como via de transmissão; e (Origem: PRT MS/GM 2914/2011, Art. 12, IX, b)
c) envio das cepas de Escherichia coli aos laboratórios de referência nacional para identificação sorológica. (Origem: PRT MS/GM 2914/2011, Art. 12, IX, c)
X - cadastrar e autorizar o fornecimento de água tratada, por meio de solução alternativa coletiva, mediante avaliação e aprovação dos documentos exigidos no art. 14. (Origem: PRT MS/GM 2914/2011, Art. 12, X)
Parágrafo Único. A autoridade municipal de saúde pública não autorizará o fornecimento de água para consumo humano, por meio de solução alternativa coletiva, quando houver rede de distribuição de água, exceto em situação de emergência e intermitência. (Origem: PRT MS/GM 2914/2011, Art. 12, Parágrafo Único)
Seção IV
Do Responsável pelo Sistema ou Solução Alternativa Coletiva de Abastecimento de Água para Consumo Humano
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção IV)
Art. 13. Compete ao responsável pelo sistema ou solução alternativa coletiva de abastecimento de água para consumo humano: (Origem: PRT MS/GM 2914/2011, Art. 13)
I - exercer o controle da qualidade da água; (Origem: PRT MS/GM 2914/2011, Art. 13, I)
II - garantir a operação e a manutenção das instalações destinadas ao abastecimento de água potável em conformidade com as normas técnicas da Associação Brasileira de Normas Técnicas (ABNT) e das demais normas pertinentes; (Origem: PRT MS/GM 2914/2011, Art. 13, II)
III - manter e controlar a qualidade da água produzida e distribuída, nos termos deste Anexo, por meio de: (Origem: PRT MS/GM 2914/2011, Art. 13, III)
a) controle operacional do(s) ponto(s) de captação, adução, tratamento, reservação e distribuição, quando aplicável; (Origem: PRT MS/GM 2914/2011, Art. 13, III, a)
b) exigência, junto aos fornecedores, do laudo de atendimento dos requisitos de saúde estabelecidos em norma técnica da ABNT para o controle de qualidade dos produtos químicos utilizados no tratamento de água; (Origem: PRT MS/GM 2914/2011, Art. 13, III, b)
c) exigência, junto aos fornecedores, do laudo de inocuidade dos materiais utilizados na produção e distribuição que tenham contato com a água; (Origem: PRT MS/GM 2914/2011, Art. 13, III, c)
d) capacitação e atualização técnica de todos os profissionais que atuam de forma direta no fornecimento e controle da qualidade da água para consumo humano; e (Origem: PRT MS/GM 2914/2011, Art. 13, III, d)
e) análises laboratoriais da água, em amostras provenientes das diversas partes dos sistemas e das soluções alternativas coletivas, conforme plano de amostragem estabelecido neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 13, III, e)
IV - manter avaliação sistemática do sistema ou solução alternativa coletiva de abastecimento de água, sob a perspectiva dos riscos à saúde, com base nos seguintes critérios: (Origem: PRT MS/GM 2914/2011, Art. 13, IV)
a) ocupação da bacia contribuinte ao manancial; (Origem: PRT MS/GM 2914/2011, Art. 13, IV, a)
b) histórico das características das águas; (Origem: PRT MS/GM 2914/2011, Art. 13, IV, b)
c) características físicas do sistema; (Origem: PRT MS/GM 2914/2011, Art. 13, IV, c)
d) práticas operacionais; e (Origem: PRT MS/GM 2914/2011, Art. 13, IV, d)
e) na qualidade da água distribuída, conforme os princípios dos Planos de Segurança da Água (PSA) recomendados pela Organização Mundial de Saúde (OMS) ou definidos em diretrizes vigentes no País. (Origem: PRT MS/GM 2914/2011, Art. 13, IV, e)
V - encaminhar à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios relatórios das análises dos parâmetros mensais, trimestrais e semestrais com informações sobre o controle da qualidade da água, conforme o modelo estabelecido pela referida autoridade; (Origem: PRT MS/GM 2914/2011, Art. 13, V)
VI - fornecer à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios os dados de controle da qualidade da água para consumo humano, quando solicitado; (Origem: PRT MS/GM 2914/2011, Art. 13, VI)
VII - monitorar a qualidade da água no ponto de captação, conforme estabelece o art. 40; (Origem: PRT MS/GM 2914/2011, Art. 13, VII)
VIII - comunicar aos órgãos ambientais, aos gestores de recursos hídricos e ao órgão de saúde pública dos Estados, do Distrito Federal e dos Municípios qualquer alteração da qualidade da água no ponto de captação que comprometa a tratabilidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 13, VIII)
IX - contribuir com os órgãos ambientais e gestores de recursos hídricos, por meio de ações cabíveis para proteção do(s) manancial(ais) de abastecimento(s) e das bacia(s) hidrográfica(s); (Origem: PRT MS/GM 2914/2011, Art. 13, IX)
X - proporcionar mecanismos para recebimento de reclamações e manter registros atualizados sobre a qualidade da água distribuída, sistematizando-os de forma compreensível aos consumidores e disponibilizando-os para pronto acesso e consulta pública, em atendimento às legislações específicas de defesa do consumidor; (Origem: PRT MS/GM 2914/2011, Art. 13, X)
XI - comunicar imediatamente à autoridade de saúde pública municipal e informar adequadamente à população a detecção de qualquer risco à saúde, ocasionado por anomalia operacional no sistema e solução alternativa coletiva de abastecimento de água para consumo humano ou por não-conformidade na qualidade da água tratada, adotando-se as medidas previstas no art. 44; e (Origem: PRT MS/GM 2914/2011, Art. 13, XI)
XII - assegurar pontos de coleta de água na saída de tratamento e na rede de distribuição, para o controle e a vigilância da qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 13, XII)
Art. 14. O responsável pela solução alternativa coletiva de abastecimento de água deve requerer, junto à autoridade municipal de saúde pública, autorização para o fornecimento de água tratada, mediante a apresentação dos seguintes documentos: (Origem: PRT MS/GM 2914/2011, Art. 14)
I - nomeação do responsável técnico habilitado pela operação da solução alternativa coletiva; (Origem: PRT MS/GM 2914/2011, Art. 14, I)
II - outorga de uso, emitida por órgão competente, quando aplicável; e (Origem: PRT MS/GM 2914/2011, Art. 14, II)
III - laudo de análise dos parâmetros de qualidade da água previstos neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 14, III)
Art. 15. Compete ao responsável pelo fornecimento de água para consumo humano por meio de veículo transportador: (Origem: PRT MS/GM 2914/2011, Art. 15)
I - garantir que tanques, válvulas e equipamentos dos veículos transportadores sejam apropriados e de uso exclusivo para o armazenamento e transporte de água potável; (Origem: PRT MS/GM 2914/2011, Art. 15, I)
II - manter registro com dados atualizados sobre o fornecedor e a fonte de água; (Origem: PRT MS/GM 2914/2011, Art. 15, II)
III - manter registro atualizado das análises de controle da qualidade da água, previstos neste Anexo; (Origem: PRT MS/GM 2914/2011, Art. 15, III)
IV - assegurar que a água fornecida contenha um teor mínimo de cloro residual livre de 0,5 mg/L; e (Origem: PRT MS/GM 2914/2011, Art. 15, IV)
V - garantir que o veículo utilizado para fornecimento de água contenha, de forma visível, a inscrição "ÁGUA POTÁVEL" e os dados de endereço e telefone para contato. (Origem: PRT MS/GM 2914/2011, Art. 15, V)
Art. 16. A água proveniente de solução alternativa coletiva ou individual, para fins de consumo humano, não poderá ser misturada com a água da rede de distribuição. (Origem: PRT MS/GM 2914/2011, Art. 16)
Seção V
Dos Laboratórios de Controle e Vigilância
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção V)
Art. 17. Compete ao Ministério da Saúde: (Origem: PRT MS/GM 2914/2011, Art. 17)
I - habilitar os laboratórios de referência regional e nacional para operacionalização das análises de maior complexidade na vigilância da qualidade da água para consumo humano, de acordo com os critérios estabelecidos na Portaria nº 70/SVS/MS, de 23 de dezembro de 2004; (Origem: PRT MS/GM 2914/2011, Art. 17, I)
II - estabelecer as diretrizes para operacionalização das atividades analíticas de vigilância da qualidade da água para consumo humano; e (Origem: PRT MS/GM 2914/2011, Art. 17, II)
III - definir os critérios e os procedimentos para adotar metodologias analíticas modificadas e não contempladas nas referências citadas no art. 22. (Origem: PRT MS/GM 2914/2011, Art. 17, III)
Art. 18. Compete às Secretarias de Saúde dos Estados habilitar os laboratórios de referência regional e municipal para operacionalização das análises de vigilância da qualidade da água para consumo humano. (Origem: PRT MS/GM 2914/2011, Art. 18)
Art. 19. Compete às Secretarias de Saúde dos Municípios indicar, para as Secretarias de Saúde dos Estados, outros laboratórios de referência municipal para operacionalização das análises de vigilância da qualidade da água para consumo humano, quando for o caso. (Origem: PRT MS/GM 2914/2011, Art. 19)
Art. 20. Compete aos responsáveis pelo fornecimento de água para consumo humano estruturar laboratórios próprios e, quando necessário, identificar outros para realização das análises dos parâmetros estabelecidos neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 20)
Art. 21. As análises laboratoriais para controle e vigilância da qualidade da água para consumo humano podem ser realizadas em laboratório próprio, conveniado ou subcontratado, desde que se comprove a existência de sistema de gestão da qualidade, conforme os requisitos especificados na NBR ISO/IEC 17025:2005. (Origem: PRT MS/GM 2914/2011, Art. 21)
Art. 22. As metodologias analíticas para determinação dos parâmetros previstos neste Anexo devem atender às normas nacionais ou internacionais mais recentes, tais como: (Origem: PRT MS/GM 2914/2011, Art. 22)
I - Standard Methods for the Examination of Water and Wastewater, de autoria das instituições American Public Health Association (APHA), American Water Works Association (AWWA) e Water Environment Federation (WEF); (Origem: PRT MS/GM 2914/2011, Art. 22, I)
II - United States Environmental Protection Agency (USEPA); (Origem: PRT MS/GM 2914/2011, Art. 22, II)
III - Normas publicadas pela International Standartization Organization (ISO); e (Origem: PRT MS/GM 2914/2011, Art. 22, III)
IV - Metodologias propostas pela Organização Mundial à Saúde (OMS). (Origem: PRT MS/GM 2914/2011, Art. 22, IV)
CAPÍTULO IV
DAS EXIGÊNCIAS APLICÁVEIS AOS SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA PARA CONSUMO HUMANO
(Origem: PRT MS/GM 2914/2011, CAPÍTULO IV)
Art. 23. Os sistemas e as soluções alternativas coletivas de abastecimento de água para consumo humano devem contar com responsável técnico habilitado. (Origem: PRT MS/GM 2914/2011, Art. 23)
Art. 24. Toda água para consumo humano, fornecida coletivamente, deverá passar por processo de desinfecção ou cloração. (Origem: PRT MS/GM 2914/2011, Art. 24)
Parágrafo Único. As águas provenientes de manancial superficial devem ser submetidas a processo de filtração. (Origem: PRT MS/GM 2914/2011, Art. 24, Parágrafo Único)
Art. 25. A rede de distribuição de água para consumo humano deve ser operada sempre com pressão positiva em toda sua extensão. (Origem: PRT MS/GM 2914/2011, Art. 25)
Art. 26. Compete ao responsável pela operação do sistema de abastecimento de água para consumo humano notificar à autoridade de saúde pública e informar à respectiva entidade reguladora e à população, identificando períodos e locais, sempre que houver: (Origem: PRT MS/GM 2914/2011, Art. 26)
I - situações de emergência com potencial para atingir a segurança de pessoas e bens; (Origem: PRT MS/GM 2914/2011, Art. 26, I)
II - interrupção, pressão negativa ou intermitência no sistema de abastecimento; (Origem: PRT MS/GM 2914/2011, Art. 26, II)
III - necessidade de realizar operação programada na rede de distribuição, que possa submeter trechos a pressão negativa; (Origem: PRT MS/GM 2914/2011, Art. 26, III)
IV - modificações ou melhorias de qualquer natureza nos sistemas de abastecimento; e (Origem: PRT MS/GM 2914/2011, Art. 26, IV)
V - situações que possam oferecer risco à saúde. (Origem: PRT MS/GM 2914/2011, Art. 26, V)
CAPÍTULO V
DO PADRÃO DE POTABILIDADE
(Origem: PRT MS/GM 2914/2011, CAPÍTULO V)
Art. 27. A água potável deve estar em conformidade com padrão microbiológico, conforme disposto no Anexo 1 do Anexo XX e demais disposições deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 27)
§ 1º No controle da qualidade da água, quando forem detectadas amostras com resultado positivo para coliformes totais, mesmo em ensaios presuntivos, ações corretivas devem ser adotadas e novas amostras devem ser coletadas em dias imediatamente sucessivos até que revelem resultados satisfatórios. (Origem: PRT MS/GM 2914/2011, Art. 27, § 1º)
§ 2º Nos sistemas de distribuição, as novas amostras devem incluir no mínimo uma recoleta no ponto onde foi constatado o resultado positivo para coliformes totais e duas amostras extras, sendo uma à montante e outra à jusante do local da recoleta. (Origem: PRT MS/GM 2914/2011, Art. 27, § 2º)
§ 3º Para verificação do percentual mensal das amostras com resultados positivos de coliformes totais, as recoletas não devem ser consideradas no cálculo. (Origem: PRT MS/GM 2914/2011, Art. 27, § 3º)
§ 4º O resultado negativo para coliformes totais das recoletas não anula o resultado originalmente positivo no cálculo dos percentuais de amostras com resultado positivo. (Origem: PRT MS/GM 2914/2011, Art. 27, § 4º)
§ 5º Na proporção de amostras com resultado positivo admitidas mensalmente para coliformes totais no sistema de distribuição, expressa no Anexo 1 do Anexo XX , não são tolerados resultados positivos que ocorram em recoleta, nos termos do art. 27, § 1º . (Origem: PRT MS/GM 2914/2011, Art. 27, § 5º)
§ 6º Quando o padrão microbiológico estabelecido no Anexo 1 do Anexo XX for violado, os responsáveis pelos sistemas e soluções alternativas coletivas de abastecimento de água para consumo humano devem informar à autoridade de saúde pública as medidas corretivas tomadas. (Origem: PRT MS/GM 2914/2011, Art. 27, § 6º)
§ 7º Quando houver interpretação duvidosa nas reações típicas dos ensaios analíticos na determinação de coliformes totais e Escherichia coli, deve-se fazer a recoleta. (Origem: PRT MS/GM 2914/2011, Art. 27, § 7º)
Art. 28. A determinação de bactérias heterotróficas deve ser realizada como um dos parâmetros para avaliar a integridade do sistema de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 28)
§ 1º A contagem de bactérias heterotróficas deve ser realizada em 20% (vinte por cento) das amostras mensais para análise de coliformes totais nos sistemas de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 28, § 1º)
§ 2º Na seleção dos locais para coleta de amostras devem ser priorizadas pontas de rede e locais que alberguem grupos populacionais de risco. (Origem: PRT MS/GM 2914/2011, Art. 28, § 2º)
§ 3º Alterações bruscas ou acima do usual na contagem de bactérias heterotróficas devem ser investigadas para identificação de irregularidade e providências devem ser adotadas para o restabelecimento da integridade do sistema de distribuição (reservatório e rede), recomendando-se que não se ultrapasse o limite de 500 UFC/mL. (Origem: PRT MS/GM 2914/2011, Art. 28, § 3º)
Art. 29. Recomenda-se a inclusão de monitoramento de vírus entéricos no(s) ponto(s) de captação de água proveniente(s) de manancial(is) superficial(is) de abastecimento, com o objetivo de subsidiar estudos de avaliação de risco microbiológico. (Origem: PRT MS/GM 2914/2011, Art. 29)
Art. 30. Para a garantia da qualidade microbiológica da água, em complementação às exigências relativas aos indicadores microbiológicos, deve ser atendido o padrão de turbidez expresso no Anexo 2 do Anexo XX e devem ser observadas as demais exigências contidas neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 30)
§ 1º Entre os 5% (cinco por cento) dos valores permitidos de turbidez superiores ao VMP estabelecido no Anexo 2 do Anexo XX , para água subterrânea com desinfecção, o limite máximo para qualquer amostra pontual deve ser de 5,0 uT, assegurado, simultaneamente, o atendimento ao VMP de 5,0 uT em toda a extensão do sistema de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 30, § 1º)
§ 2º O valor máximo permitido de 0,5 uT para água filtrada por filtração rápida (tratamento completo ou filtração direta), assim como o valor máximo permitido de 1,0 uT para água filtrada por filtração lenta, estabelecidos no Anexo 2 do Anexo XX , deverão ser atingidos conforme as metas progressivas definidas no Anexo 3 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 30, § 2º)
§ 3º O atendimento do percentual de aceitação do limite de turbidez, expresso no Anexo 2 do Anexo XX , deve ser verificado mensalmente com base em amostras, preferencialmente no efluente individual de cada unidade de filtração, no mínimo diariamente para desinfecção ou filtração lenta e no mínimo a cada duas horas para filtração rápida. (Origem: PRT MS/GM 2914/2011, Art. 30, § 3º)
Art. 31. Os sistemas de abastecimento e soluções alternativas coletivas de abastecimento de água que utilizam mananciais superficiais devem realizar monitoramento mensal de Escherichia coli no(s) ponto(s) de captação de água. (Origem: PRT MS/GM 2914/2011, Art. 31)
§ 1º Quando for identificada média geométrica anual maior ou igual a 1.000 Escherichia coli/100mL deve-se realizar monitoramento de cistos de Giardia spp. e oocistos de Cryptosporidium spp. no(s) ponto(s) de captação de água. (Origem: PRT MS/GM 2914/2011, Art. 31, § 1º)
§ 2º Quando a média aritmética da concentração de oocistos de Cryptosporidium spp. for maior ou igual a 3,0 oocistos/L no(s) pontos(s) de captação de água, recomenda-se a obtenção de efluente em filtração rápida com valor de turbidez menor ou igual a 0,3 uT em 95% (noventa e cinco por cento) das amostras mensais ou uso de processo de desinfecção que comprovadamente alcance a mesma eficiência de remoção de oocistos de Cryptosporidium spp. (Origem: PRT MS/GM 2914/2011, Art. 31, § 2º)
§ 3º Entre os 5% (cinco por cento) das amostras que podem apresentar valores de turbidez superiores ao VMP estabelecido no art. 30, § 2º , o limite máximo para qualquer amostra pontual deve ser menor ou igual a 1,0 uT, para filtração rápida e menor ou igual a 2,0 uT para filtração lenta. (Origem: PRT MS/GM 2914/2011, Art. 31, § 3º)
§ 4º A concentração média de oocistos de Cryptosporidium spp. referida no art. 31, § 2º deve ser calculada considerando um número mínino de 24 (vinte e quatro) amostras uniformemente coletadas ao longo de um período mínimo de um ano e máximo de dois anos. (Origem: PRT MS/GM 2914/2011, Art. 31, § 4º)
Art. 32. No controle do processo de desinfecção da água por meio da cloração, cloraminação ou da aplicação de dióxido de cloro devem ser observados os tempos de contato e os valores de concentrações residuais de desinfetante na saída do tanque de contato expressos nos Anexos 4, 5 e 6 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 32)
§ 1º Para aplicação dos Anexos 4, 5 e 6 do Anexo XX deve-se considerar a temperatura média mensal da água. (Origem: PRT MS/GM 2914/2011, Art. 32, § 1º)
§ 2º No caso da desinfecção com o uso de ozônio, deve ser observado o produto, concentração e tempo de contato (CT) de 0,16 mg.min/L para temperatura média da água igual a 15º C. (Origem: PRT MS/GM 2914/2011, Art. 32, § 2º)
§ 3º Para valores de temperatura média da água diferentes de 15º C, deve-se proceder aos seguintes cálculos: (Origem: PRT MS/GM 2914/2011, Art. 32, § 3º)
I - para valores de temperatura média abaixo de 15ºC: duplicar o valor de CT a cada decréscimo de 10ºC; e (Origem: PRT MS/GM 2914/2011, Art. 32, § 3º, I)
II - para valores de temperatura média acima de 15ºC: dividir por dois o valor de CT a cada acréscimo de 10ºC. (Origem: PRT MS/GM 2914/2011, Art. 32, § 3º, II)
§ 4º No caso da desinfecção por radiação ultravioleta, deve ser observada a dose mínima de 1,5 mJ/cm2 para 0,5 log de inativação de cisto de Giardia spp. (Origem: PRT MS/GM 2914/2011, Art. 32, § 4º)
Art. 33. Os sistemas ou soluções alternativas coletivas de abastecimento de água supridas por manancial subterrâneo com ausência de contaminação por Escherichia coli devem realizar cloração da água mantendo o residual mínimo do sistema de distribuição (reservatório e rede), conforme as disposições contidas no art. 34. (Origem: PRT MS/GM 2914/2011, Art. 33)
§ 1º Quando o manancial subterrâneo apresentar contaminação por Escherichia coli, no controle do processo de desinfecção da água, devem ser observados os valores do produto de concentração residual de desinfetante na saída do tanque de contato e o tempo de contato expressos nos Anexos 4, 5 e 6 do Anexo XX ou a dose mínima de radiação ultravioleta expressa no art. 32, § 4º . (Origem: PRT MS/GM 2914/2011, Art. 33, § 1º)
§ 2º A avaliação da contaminação por Escherichia coli no manancial subterrâneo deve ser feita mediante coleta mensal de uma amostra de água em ponto anterior ao local de desinfecção. (Origem: PRT MS/GM 2914/2011, Art. 33, § 2º)
§ 3º Na ausência de tanque de contato, a coleta de amostras de água para a verificação da presença/ausência de coliformes totais em sistemas de abastecimento e soluções alternativas coletivas de abastecimento de águas, supridas por manancial subterrâneo, deverá ser realizada em local à montante ao primeiro ponto de consumo. (Origem: PRT MS/GM 2914/2011, Art. 33, § 3º)
Art. 34. É obrigatória a manutenção de, no mínimo, 0,2 mg/L de cloro residual livre ou 2 mg/L de cloro residual combinado ou de 0,2 mg/L de dióxido de cloro em toda a extensão do sistema de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 34)
Art. 35. No caso do uso de ozônio ou radiação ultravioleta como desinfetante, deverá ser adicionado cloro ou dióxido de cloro, de forma a manter residual mínimo no sistema de distribuição (reservatório e rede), de acordo com as disposições do art. 34. (Origem: PRT MS/GM 2914/2011, Art. 35)
Art. 36. Para a utilização de outro agente desinfetante, além dos citados neste Anexo, deve-se consultar o Ministério da Saúde, por intermédio da SVS/MS. (Origem: PRT MS/GM 2914/2011, Art. 36)
Art. 37. A água potável deve estar em conformidade com o padrão de substâncias químicas que representam risco à saúde e cianotoxinas, expressos nos Anexos 7 e 8 do Anexo XX e demais disposições deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 37)
§ 1º No caso de adição de flúor (fluoretação), os valores recomendados para concentração de íon fluoreto devem observar a Portaria nº 635/GM/MS de 26 de dezembro de 1975, não podendo ultrapassar o VMP expresso na Tabela do Anexo 7 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 37, § 1º)
§ 2º As concentrações de cianotoxinas referidas no Anexo 8 do Anexo XX devem representar as contribuições da fração intracelular e da fração extracelular na amostra analisada. (Origem: PRT MS/GM 2914/2011, Art. 37, § 2º)
§ 3º Em complementação ao previsto no Anexo 8 do Anexo XX , quando for detectada a presença de gêneros potencialmente produtores de cilindrospermopsinas no monitoramento de cianobactérias previsto no art. 40, § 1º , recomenda-se a análise dessas cianotoxinas, observando o valor máximo aceitável de 1,0 µg/L. (Origem: PRT MS/GM 2914/2011, Art. 37, § 3º)
§ 4º Em complementação ao previsto no Anexo 8 do Anexo XX , quando for detectada a presença de gêneros de cianobactérias potencialmente produtores de anatoxina-a(s) no monitoramento de cianobactérias previsto no art. 40, § 1º , recomenda-se a análise da presença desta cianotoxina. (Origem: PRT MS/GM 2914/2011, Art. 37, § 4º)
Art. 38. Os níveis de triagem que conferem potabilidade da água do ponto de vista radiológico são valores de concentração de atividade que não excedem 0,5 Bq/L para atividade alfa total e 1Bq/L para beta total. (Origem: PRT MS/GM 2914/2011, Art. 38)
Parágrafo Único. Caso os níveis de triagem citados neste artigo sejam superados, deve ser realizada análise específica para os radionuclídeos presentes e o resultado deve ser comparado com os níveis de referência do Anexo 9 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 38, Parágrafo Único)
Art. 39. A água potável deve estar em conformidade com o padrão organoléptico de potabilidade expresso no Anexo 10 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 39)
§ 1º Recomenda-se que, no sistema de distribuição, o pH da água seja mantido na faixa de 6,0 a 9,5. (Origem: PRT MS/GM 2914/2011, Art. 39, § 1º)
§ 2º Recomenda-se que o teor máximo de cloro residual livre em qualquer ponto do sistema de abastecimento seja de 2 mg/L. (Origem: PRT MS/GM 2914/2011, Art. 39, § 2º)
§ 3º Na verificação do atendimento ao padrão de potabilidade expresso nos Anexos 7, 8, 9 e 10 do Anexo XX , eventuais ocorrências de resultados acima do VMP devem ser analisadas em conjunto com o histórico do controle de qualidade da água e não de forma pontual. (Origem: PRT MS/GM 2914/2011, Art. 39, § 3º)
§ 4º Para os parâmetros ferro e manganês são permitidos valores superiores ao VMPs estabelecidos no Anexo 10 do Anexo XX , desde que sejam observados os seguintes critérios: (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º)
I - os elementos ferro e manganês estejam complexados com produtos químicos comprovadamente de baixo risco à saúde, conforme preconizado no art. 13 e nas normas da ABNT; (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º, I)
II - os VMPs dos demais parâmetros do padrão de potabilidade não sejam violados; e (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º, II)
III - as concentrações de ferro e manganês não ultrapassem 2,4 e 0,4 mg/L, respectivamente. (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º, III)
§ 5º O responsável pelo sistema ou solução alternativa coletiva de abastecimento de água deve encaminhar à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios informações sobre os produtos químicos utilizados e a comprovação de baixo risco à saúde, conforme preconizado no art. 13 e nas normas da ABNT. (Origem: PRT MS/GM 2914/2011, Art. 39, § 5º)
CAPÍTULO VI
DOS PLANOS DE AMOSTRAGEM
(Origem: PRT MS/GM 2914/2011, CAPÍTULO VI)
Art. 40. Os responsáveis pelo controle da qualidade da água de sistemas ou soluções alternativas coletivas de abastecimento de água para consumo humano, supridos por manancial superficial e subterrâneo, devem coletar amostras semestrais da água bruta, no ponto de captação, para análise de acordo com os parâmetros exigidos nas legislações específicas, com a finalidade de avaliação de risco à saúde humana. (Origem: PRT MS/GM 2914/2011, Art. 40)
§ 1º Para minimizar os riscos de contaminação da água para consumo humano com cianotoxinas, deve ser realizado o monitoramento de cianobactérias, buscando-se identificar os diferentes gêneros, no ponto de captação do manancial superficial, de acordo com a Tabela do Anexo 11 do Anexo XX , considerando, para efeito de alteração da frequência de monitoramento, o resultado da última amostragem. (Origem: PRT MS/GM 2914/2011, Art. 40, § 1º)
§ 2º Em complementação ao monitoramento do Anexo 11 do Anexo XX , recomenda-se a análise de clorofila-a no manancial, com frequência semanal, como indicador de potencial aumento da densidade de cianobactérias. (Origem: PRT MS/GM 2914/2011, Art. 40, § 2º)
§ 3º Quando os resultados da análise prevista no § 2° deste artigo revelarem que a concentração de clorofila-a em duas semanas consecutivas tiver seu valor duplicado ou mais, deve-se proceder nova coleta de amostra para quantificação de cianobactérias no ponto de captação do manancial, para reavaliação da frequência de amostragem de cianobactérias. (Origem: PRT MS/GM 2914/2011, Art. 40, § 3º)
§ 4º Quando a densidade de cianobactérias exceder 20.000 células/ml, deve-se realizar análise de cianotoxinas na água do manancial, no ponto de captação, com frequência semanal. (Origem: PRT MS/GM 2914/2011, Art. 40, § 4º)
§ 5º Quando as concentrações de cianotoxinas no manancial forem menores que seus respectivos VMPs para água tratada, será dispensada análise de cianotoxinas na saída do tratamento de que trata o Anexo 12 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 40, § 5º)
§ 6º Em função dos riscos à saúde associados às cianotoxinas, é vedado o uso de algicidas para o controle do crescimento de microalgas e cianobactérias no manancial de abastecimento ou qualquer intervenção que provoque a lise das células. (Origem: PRT MS/GM 2914/2011, Art. 40, § 6º)
§ 7º As autoridades ambientais e de recursos hídricos definirão a regulamentação das excepcionalidades sobre o uso de algicidas nos cursos d'água superficiais. (Origem: PRT MS/GM 2914/2011, Art. 40, § 7º)
Art. 41. Os responsáveis pelo controle da qualidade da água de sistema e solução alternativa coletiva de abastecimento de água para consumo humano devem elaborar e submeter para análise da autoridade municipal de saúde pública, o plano de amostragem de cada sistema e solução, respeitando os planos mínimos de amostragem expressos nos Anexos 11, 12, 13 e 14 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 41)
§ 1º A amostragem deve obedecer aos seguintes requisitos: (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º)
I - distribuição uniforme das coletas ao longo do período; (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, I)
II - representatividade dos pontos de coleta no sistema de distribuição (reservatórios e rede), combinando critérios de abrangência espacial e pontos estratégicos, entendidos como: (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II)
a) aqueles próximos a grande circulação de pessoas: terminais rodoviários, terminais ferroviários, entre outros; (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, a)
b) edifícios que alberguem grupos populacionais de risco, tais como hospitais, creches e asilos; (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, b)
c) aqueles localizados em trechos vulneráveis do sistema de distribuição como pontas de rede, pontos de queda de pressão, locais afetados por manobras, sujeitos à intermitência de abastecimento, reservatórios, entre outros; e (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, c)
d) locais com sistemáticas notificações de agravos à saúde tendo como possíveis causas os agentes de veiculação hídrica. (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, d)
§ 2º No número mínimo de amostras coletadas na rede de distribuição, previsto no Anexo 12 do Anexo XX , não se incluem as amostras extras (recoletas). (Origem: PRT MS/GM 2914/2011, Art. 41, § 2º)
§ 3º Em todas as amostras coletadas para análises microbiológicas, deve ser efetuada medição de turbidez e de cloro residual livre ou de outro composto residual ativo, caso o agente desinfetante utilizado não seja o cloro. (Origem: PRT MS/GM 2914/2011, Art. 41, § 3º)
§ 4º Quando detectada a presença de cianotoxinas na água tratada, na saída do tratamento, será obrigatória a comunicação imediata às clínicas de hemodiálise e às indústrias de injetáveis. (Origem: PRT MS/GM 2914/2011, Art. 41, § 4º)
§ 5º O plano de amostragem para os parâmetros de agrotóxicos deverá considerar a avaliação dos seus usos na bacia hidrográfica do manancial de contribuição, bem como a sazonalidade das culturas. (Origem: PRT MS/GM 2914/2011, Art. 41, § 5º)
§ 6º Na verificação do atendimento ao padrão de potabilidade expressos nos Anexos 7, 8, 9 e 10 do Anexo XX , a detecção de eventuais ocorrências de resultados acima do VMP devem ser analisadas em conjunto com o histórico do controle de qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 41, § 6º)
§ 7º Para populações residentes em áreas indígenas, populações tradicionais, dentre outras, o plano de amostragem para o controle da qualidade da água deverá ser elaborado de acordo com as diretrizes específicas aplicáveis a cada situação. (Origem: PRT MS/GM 2914/2011, Art. 41, § 7º)
CAPÍTULO VII
DAS PENALIDADES
(Origem: PRT MS/GM 2914/2011, CAPÍTULO VII)
Art. 42. Serão aplicadas as sanções administrativas previstas na Lei nº 6.437, de 20 de agosto de 1977, aos responsáveis pela operação dos sistemas ou soluções alternativas de abastecimento de água que não observarem as determinações constantes deste Anexo, sem prejuízo das sanções de natureza civil ou penal cabíveis. (Origem: PRT MS/GM 2914/2011, Art. 42)
Art. 43. Cabe ao Ministério da Saúde, por intermédio da SVS/MS, e às Secretarias de Saúde dos Estados, do Distrito Federal dos Municípios, ou órgãos equivalentes, assegurar o cumprimento deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 43)
CAPÍTULO VIII
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
(Origem: PRT MS/GM 2914/2011, CAPÍTULO VIII)
Art. 44. Sempre que forem identificadas situações de risco à saúde, o responsável pelo sistema ou solução alternativa coletiva de abastecimento de água e as autoridades de saúde pública devem, em conjunto, elaborar um plano de ação e tomar as medidas cabíveis, incluindo a eficaz comunicação à população, sem prejuízo das providências imediatas para a correção da anormalidade. (Origem: PRT MS/GM 2914/2011, Art. 44)
Art. 45. É facultado ao responsável pelo sistema ou solução alternativa coletiva de abastecimento de água solicitar à autoridade de saúde pública a alteração na frequência mínima de amostragem de parâmetros estabelecidos neste Anexo, mediante justificativa fundamentada. (Origem: PRT MS/GM 2914/2011, Art. 45)
Parágrafo Único. Uma vez formulada a solicitação prevista no caput deste artigo, a autoridade de saúde pública decidirá no prazo máximo de 60 (sessenta) dias, com base em análise fundamentada no histórico mínimo de dois anos do controle da qualidade da água considerando os respectivos planos de amostragens e de avaliação de riscos à saúde, da zona de captação e do sistema de distribuição. (Origem: PRT MS/GM 2914/2011, Art. 45, Parágrafo Único)
Art. 46. Verificadas características desconformes com o padrão de potabilidade da água ou de outros fatores de risco à saúde, conforme relatório técnico, a autoridade de saúde pública competente determinará ao responsável pela operação do sistema ou solução alternativa coletiva de abastecimento de água para consumo humano que: (Origem: PRT MS/GM 2914/2011, Art. 46)
I - amplie o número mínimo de amostras; (Origem: PRT MS/GM 2914/2011, Art. 46, I)
II - aumente a frequência de amostragem; e (Origem: PRT MS/GM 2914/2011, Art. 46, II)
III - realize análises laboratoriais de parâmetros adicionais. (Origem: PRT MS/GM 2914/2011, Art. 46, III)
Art. 47. Constatada a inexistência de setor responsável pela qualidade da água na Secretaria de Saúde dos Estados, do Distrito Federal e dos Municípios, os deveres e responsabilidades previstos, respectivamente, nos arts. 11 e 12 do Anexo XX serão cumpridos pelo órgão equivalente. (Origem: PRT MS/GM 2914/2011, Art. 47)
Art. 48. O Ministério da Saúde promoverá, por intermédio da SVS/MS, a revisão deste Anexo no prazo de 5 (cinco) anos ou a qualquer tempo. (Origem: PRT MS/GM 2914/2011, Art. 48)
Parágrafo Único. Os órgãos governamentais e não-governamentais, de reconhecida capacidade técnica nos setores objeto desta regulamentação, poderão requerer a revisão deste Anexo, mediante solicitação justificada, sujeita a análise técnica da SVS/MS. (Origem: PRT MS/GM 2914/2011, Art. 48, Parágrafo Único)
Art. 49. A União, os Estados, o Distrito Federal e os Municípios deverão adotar as medidas necessárias ao fiel cumprimento deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 50)
Art. 50. Ao Distrito Federal competem as atribuições reservadas aos Estados e aos Municípios. (Origem: PRT MS/GM 2914/2011, Art. 51)
ANEXO 1 DO ANEXO XX
TABELA DE PADRÃO MICROBIOLÓGICO DA ÁGUA PARA CONSUMO HUMANO (Origem: PRT MS/GM 2914/2011, Anexo 1)
| Tipo de água | Parâmetro | VMP(1) | ||
|---|---|---|---|---|
| Água para consumo humano | Escherichia coli(2) | Ausência em 100 mL | ||
| Água tratada | Na saída do tratamento | Coliformes totais (3) | Ausência em 100 mL | |
| No sistema de distribuição (reservatórios e rede) | Escherichia coli | Ausência em 100 mL | ||
| Coliformes totais (4) | Sistemas ou soluções alternativas coletivas que abastecem menos de 20.000 habitantes | Apenas uma amostra, entre as amostras examinadas no mês, poderá apresentar resultado positivo | ||
| Sistemas ou soluções alternativas coletivas que abastecem a partir de 20.000 habitantes | Ausência em 100 mL em 95% das amostras examinadas no mês. | |||
NOTAS: (1) Valor Máximo Permitido.
(2) Indicador de contaminação fecal.
(3) Indicador de eficiência de tratamento.
(4) Indicador de integridade do sistema de distribuição (reservatório e rede).
ANEXO 2 DO ANEXO XX
TABELA DE PADRÃO DE TURBIDEZ PARA ÁGUA PÓS-FILTRAÇÃO OU PRÉ-DESINFECÇÃO (Origem: PRT MS/GM 2914/2011, Anexo 2)
| Tratamento da água | VMP(1) |
| Desinfecção (para águas subterrâneas) | 1,0 uT(2) em 95% das amostras |
| Filtração rápida (tratamento completo ou filtração direta) | 0,5(3)uT(2) em 95% das amostras |
| Filtração lenta | 1,0(3)uT(2) em 95% das amostras |
NOTAS: (1) Valor Máximo Permitido.
(2) Unidade de Turbidez.
(3) Este valor deve atender ao padrão de turbidez de acordo com o especificado no § 2º do art. 30.
ANEXO 3 DO ANEXO XX
TABELA DE METAS PROGRESSIVAS PARA ATENDIMENTO AO VALOR MÁXIMO PERMITIDO DE 0,5 UT PARA FILTRAÇÃO RÁPIDA E DE 1,0 UT PARA FILTRAÇÃO LENTA (Origem: PRT MS/GM 2914/2011, Anexo 3)
| Filtração rápida (tratamento completo ou filtração direta) | ||
| Período após a publicação da Portaria | Turbidez £ 0,5 uT | Turbidez £ 1,0 uT |
| Final do 1º ano | Em no mínimo 25% das amostras mensais coletadas | No restante das amostras mensais coletadas |
| Final do 2º ano | Em no mínimo 50% das amostras mensais coletadas | |
| Final do 3º ano | Em no mínimo 75% das amostras mensais coletadas | |
| Final do 4º ano | Em no mínimo 95% das amostras mensais coletadas | |
| Filtração Lenta | ||
| Período após a publicação da Portaria | Turbidez £ 1,0uT | Turbidez £ 2,0 uT |
| Final do 1º ano | Em no mínimo 25% das amostras mensais coletadas | No restante das amostras mensais coletadas |
| Final do 2º ano | Em no mínimo 50% das amostras mensais coletadas | |
| Final do 3º ano | Em no mínimo 75% das amostras mensais coletadas | |
| Final do 4º ano | Em no mínimo 95% das amostras mensais coletadas | |
ANEXO 4 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO POR MEIO DA CLORAÇÃO, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL LIVRE, COM A TEMPERATURA E O PH DA ÁGUA(¹) (Origem: PRT MS/GM 2914/2011, Anexo 4)
| C (²) | Temperatura = 5ºC | Temperatura = 10ºC | Temperatura = 15ºC | ||||||||||||||||||
| Valores de pH | Valores de pH | Valores de pH | |||||||||||||||||||
| ≤6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | ≤6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | ≤6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | |
| ≤ 0,4 | 38 | 47 | 58 | 70 | 83 | 98 | 114 | 27 | 33 | 41 | 49 | 58 | 70 | 80 | 19 | 24 | 29 | 35 | 41 | 48 | 57 |
| 0,6 | 27 | 34 | 41 | 49 | 59 | 69 | 80 | 19 | 24 | 29 | 35 | 41 | 49 | 57 | 13 | 17 | 20 | 25 | 29 | 34 | 40 |
| 0,8 | 21 | 26 | 32 | 39 | 46 | 54 | 63 | 15 | 19 | 23 | 27 | 32 | 38 | 45 | 11 | 13 | 16 | 19 | 23 | 27 | 31 |
| 1,0 | 17 | 22 | 26 | 32 | 38 | 45 | 52 | 12 | 15 | 19 | 23 | 27 | 32 | 37 | 9 | 11 | 13 | 16 | 19 | 22 | 26 |
| 1,2 | 15 | 19 | 23 | 27 | 32 | 38 | 45 | 11 | 13 | 16 | 19 | 23 | 27 | 32 | 7 | 9 | 11 | 14 | 16 | 19 | 22 |
| 1,4 | 13 | 16 | 20 | 24 | 28 | 34 | 39 | 9 | 11 | 14 | 17 | 20 | 24 | 28 | 7 | 8 | 10 | 12 | 14 | 17 | 20 |
| 1,6 | 12 | 15 | 18 | 21 | 25 | 30 | 35 | 8 | 10 | 16 | 15 | 18 | 21 | 25 | 6 | 7 | 9 | 11 | 13 | 15 | 17 |
| 1,8 | 11 | 13 | 16 | 19 | 23 | 27 | 32 | 7 | 9 | 11 | 14 | 16 | 19 | 22 | 5, | 7 | 8 | 10 | 11 | 14 | 16 |
| 2,0 | 10 | 12 | 15 | 18 | 21 | 25 | 29 | 7 | 8 | 10 | 12 | 15 | 17 | 20 | 5 | 6 | 7 | 9 | 10 | 12 | 14 |
| 2,2 | 9 | 11 | 14 | 16 | 19 | 23 | 27 | 6 | 8 | 10 | 12 | 14 | 16 | 19 | 5 | 6 | 7 | 8 | 10 | 11 | 13 |
| 2,4 | 8 | 10 | 13 | 15 | 18 | 21 | 25 | 6 | 7 | 9 | 11 | 13 | 15 | 17 | 4 | 5 | 6 | 8 | 9 | 11 | 12 |
| 2,6 | 8 | 10 | 12 | 14 | 17 | 20 | 23 | 5 | 7 | 8 | 10 | 12 | 14 | 16 | 4 | 5 | 6 | 7 | 8 | 10 | 12 |
| 2,8 | 7 | 9 | 11 | 13 | 15 | 19 | 22 | 5 | 6 | 8 | 9 | 11 | 13 | 15 | 4 | 4 | 5 | 7 | 8 | 9 | 11 |
| 3,0 | 7 | 9 | 10 | 13 | 15 | 18 | 20 | 5 | 6 | 7 | 9 | 11 | 12 | 14 | 3 | 4 | 5 | 6 | 8 | 9 | 10 |
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de cloro livre na saída do tanque de contato (mg/L).
Tabela de tempo de contato mínimo (minutos) a ser observado para a desinfecção por meio da cloração, de acordo com concentração de cloro residual livre, com a temperatura e o pH da água(¹)
| C (²) | Temperatura = 20ºC | Temperatura = 25ºC | Temperatura = 30ºC | ||||||||||||||||||
| Valores de pH | Valores de pH | Valores de pH | |||||||||||||||||||
| 6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | ≤6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | ≤6,0 | 6,5 | 7,0 | 7,5 | 8,0 | 8,5 | 9,0 | |
| ≤ 0,4 | 14 | 17 | 20 | 25 | 29 | 34 | 40 | 9 | 12 | 14 | 18 | 21 | 24 | 28 | 6 | 8 | 10 | 12 | 15 | 17 | 20 |
| 0,6 | 10 | 12 | 14 | 17 | 21 | 24 | 28 | 7 | 8 | 10 | 12 | 15 | 17 | 20 | 5 | 6 | 7 | 9 | 10 | 12 | 14 |
| 0,8 | 7 | 9 | 11 | 14 | 16 | 19 | 22 | 5 | 6 | 8 | 10 | 11 | 13 | 16 | 3 | 5 | 6 | 7 | 8 | 10 | 11 |
| 1,0 | 6 | 8 | 9 | 11 | 13 | 16 | 18 | 4 | 5 | 6 | 8 | 9 | 11 | 13 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1,2 | 5 | 7 | 8 | 10 | 11 | 13 | 16 | 4 | 5 | 5 | 7 | 8 | 10 | 11 | 3 | 3 | 3 | 5 | 6 | 7 | 8 |
| 1,4 | 5 | 6 | 7 | 9 | 10 | 11 | 14 | 3 | 4 | 5 | 6 | 7 | 8 | 10 | 2 | 3 | 3 | 4 | 5 | 6 | 7 |
| 1,6 | 4 | 5 | 6 | 8 | 9 | 11 | 12 | 3 | 4 | 4 | 5 | 6 | 7 | 9 | 2 | 3 | 3 | 4 | 4 | 5 | 6 |
| 1,8 | 4 | 5 | 6 | 7 | 8 | 10 | 12 | 3 | 3 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 3 | 4 | 5 | 6 |
| 2,0 | 3 | 4 | 5 | 6 | 7 | 9 | 10 | 2 | 3 | 4 | 4 | 5 | 6 | 7 | 2 | 2 | 3 | 3 | 4 | 4 | 5 |
| 2,2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 2 | 3 | 3 | 4 | 5 | 6 | 7 | 2 | 2 | 2 | 3 | 3 | 4 | 5 |
| 2,4 | 3 | 4 | 4 | 5 | 6 | 8 | 9 | 2 | 3 | 3 | 4 | 4 | 5 | 6 | 2 | 2 | 2 | 3 | 3 | 4 | 4 |
| 2,6 | 3 | 3 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 3 | 4 | 5 | 6 | 1 | 2 | 2 | 3 | 3 | 4 | 4 |
| 2,8 | 3 | 3 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 3 | 4 | 5 | 5 | 1 | 2 | 2 | 2 | 3 | 3 | 4 |
| 3,0 | 2 | 3 | 4 | 4 | 5 | 6 | 7 | 2 | 2 | 3 | 3 | 4 | 4 | 5 | 1 | 2 | 2 | 3 | 3 | 3 | 4 |
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de cloro livre na saída do tanque de contato (mg/L).
ANEXO 5 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO POR MEIO DE CLORAMINAÇÃO, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL COMBINADO (CLORAMINAS) E COM A TEMPERATURA DA ÁGUA, PARA VALORES DE PH DA ÁGUA ENTRE 6 E 9(¹) (Origem: PRT MS/GM 2914/2011, Anexo 5)
| C (²) | Temperatura (ºC) | |||||
| 5 | 10 | 15 | 20 | 25 | 30 | |
| ≤ 0,4 | 923 | 773 | 623 | 473 | 323 | 173 |
| 0,6 | 615 | 515 | 415 | 315 | 215 | 115 |
| 0,8 | 462 | 387 | 312 | 237 | 162 | 87 |
| 1,0 | 369 | 309 | 249 | 189 | 130 | 69 |
| 1,2 | 308 | 258 | 208 | 158 | 108 | 58 |
| 1,4 | 264 | 221 | 178 | 135 | 92 | 50 |
| 1,6 | 231 | 193 | 156 | 118 | 81 | 43 |
| 1,8 | 205 | 172 | 139 | 105 | 72 | 39 |
| 2,0 | 185 | 155 | 125 | 95 | 64 | 35 |
| 2,2 | 168 | 141 | 113 | 86 | 59 | 32 |
| 2,4 | 154 | 129 | 104 | 79 | 54 | 29 |
| 2,6 | 142 | 119 | 96 | 73 | 50 | 27 |
| 2,8 | 132 | 110 | 89 | 67 | 46 | 25 |
| 3,0 | 123 | 103 | 83 | 63 | 43 | 23 |
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de cloro combinado na saída do tanque de contato (mg/L).
ANEXO 6 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO COM DIÓXIDO DE CLORO, DE ACORDO COM CONCENTRAÇÃO DE DIÓXIDO DE CLORO E COM A TEMPERATURA DA ÁGUA, PARA VALORES DE PH DA ÁGUA ENTRE 6 E 9(¹) (Origem: PRT MS/GM 2914/2011, Anexo 6)
| C (²) | Temperatura (ºC) | |||||
| 5 | 10 | 15 | 20 | 25 | 30 | |
| ≤ 0,4 | 13 | 9 | 8 | 7 | 6 | 6 |
| 0,6 | 9 | 6 | 5 | 6 | 4 | 4 |
| 0,8 | 7 | 5 | 4 | 4 | 3 | 3 |
| 1,0 | 5 | 4 | 3 | 3 | 3 | 2 |
| 1,2 | 4 | 3 | 3 | 3 | 2 | 2 |
| 1,4 | 4 | 3 | 2 | 2 | 2 | 2 |
| 1,6 | 3 | 2 | 2 | 2 | 2 | 1 |
| 1,8 | 3 | 2 | 2 | 2 | 1 | 1 |
| 2,0 | 3 | 2 | 2 | 2 | 1 | 1 |
| 2,2 | 2 | 2 | 2 | 1 | 1 | 1 |
| 2,4 | 2 | 2 | 1 | 1 | 1 | 1 |
| 2,6 | 2 | 2 | 1 | 1 | 1 | 1 |
| 2,8 | 2 | 1 | 1 | 1 | 1 | 1 |
| 3,0 | 2 | 1 | 1 | 1 | 1 | 1 |
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de dióxido de cloro na saída do tanque de contato (mg/L).
ANEXO 7 DO ANEXO XX
TABELA DE PADRÃO DE POTABILIDADE PARA SUBSTÂNCIAS QUÍMICAS QUE REPRESENTAM RISCO À SAÚDE (Origem: PRT MS/GM 2914/2011, Anexo 7)
| Parâmetro | CAS(1) | Unidade | VMP(2) |
| INORGÂNICAS | |||
| Antimônio | 7440-36-0 | mg/L | 0,005 |
| Arsênio | 7440-38-2 | mg/L | 0,01 |
| Bário | 7440-39-3 | mg/L | 0,7 |
| Cádmio | 7440-43-9 | mg/L | 0,005 |
| Chumbo | 7439-92-1 | mg/L | 0,01 |
| Cianeto | 57-12-5 | mg/L | 0,07 |
| Cobre | 7440-50-8 | mg/L | 2 |
| Cromo | 7440-47-3 | mg/L | 0,05 |
| Fluoreto | 7782-41-4 | mg/L | 1,5 |
| Mercúrio | 7439-97-6 | mg/L | 0,001 |
| Níquel | 7440-02-0 | mg/L | 0,07 |
| Nitrato (como N) | 14797-55-8 | mg/L | 10 |
| Nitrito (como N) | 14797-65-0 | mg/L | 1 |
| Selênio | 7782-49-2 | mg/L | 0,01 |
| Urânio | 7440-61-1 | mg/L | 0,03 |
| ORGÂNICAS | |||
| Acrilamida | 79-06-1 | µg/L | 0,5 |
| Benzeno | 71-43-2 | µg/L | 5 |
| Benzo[a]pireno | 50-32-8 | µg/L | 0,7 |
| Cloreto de Vinila | 75-01-4 | µg/L | 2 |
| 1,2 Dicloroetano | 107-06-2 | µg/L | 10 |
| 1,1 Dicloroeteno | 75-35-4 | µg/L | 30 |
| 1,2 Dicloroeteno (cis + trans) | 156-59-2 (cis) 156-60-5 (trans) | µg/L | 50 |
| Diclorometano | 75-09-2 | µg/L | 20 |
| Di(2-etilhexil) ftalato | 117-81-7 | µg/L | 8 |
| Estireno | 100-42-5 | µg/L | 20 |
| Pentaclorofenol | 87-86-5 | µg/L | 9 |
| Tetracloreto de Carbono | 56-23-5 | µg/L | 4 |
| Tetracloroeteno | 127-18-4 | µg/L | 40 |
| Triclorobenzenos | 1,2,4-TCB (120-82-1) | µg/L | 20 |
| 1,3,5-TCB (108-70-3 1,2,3- TCB | |||
| (87-61-6) | |||
| Tricloroeteno | 79-01-6 | µg/L | 20 |
| AGROTÓXICOS | µg/L | ||
| 2,4 D + 2,4,5 T | 94-75-7 (2,4 D) 93-76-5 (2,4,5 T) | µg/L | 30 |
| Alaclor | 15972-60-8 | µg/L | 20 |
| Aldicarbe + Aldicarbesulfona +Aldicarbesulfóxido | 116-06-3 (aldicarbe) 1646-88-4 (aldicarbesulfona) 1646-87-3 (aldicarbe sulfóxido) | µg/L | 10 |
| Aldrin + Dieldrin | 309-00-2 (aldrin) 60-57-1 (dieldrin) | µg/L | 0,03 |
| Atrazina | 1912-24-9 | µg/L | 2 |
| Carbendazim + benomil | 10605-21-7 (carbendazim) 17804-35-2 (benomil) | µg/L | 120 |
| Carbofurano | 1563-66-2 | µg/L | 7 |
| Clordano | 5103-74-2 | µg/L | 0,2 |
| Clorpirifós + clorpirifós-oxon | 2921-88-2 (clorpirifós) 5598-15-2 (clorpirifós-oxon) | µg/L | 30 |
| DDT+DDD+DDE | p,p'-DDT (50-29-3) p,p'-DDD (72-54-8) p,p'-DDE (72-55-9) | µg/L | 1 |
| Diuron | 330-54-1 | µg/L | 90 |
| Endossulfan (a b e sais) (3) | 115-29-7; I (959-98-8); II | µg/L | 20 |
| (33213-65-9); sulfato (1031-07-8) | |||
| Endrin | 72-20-8 | µg/L | 0,6 |
| Glifosato + AMPA | 1071-83-6 (glifosato) 1066-51-9 (AMPA) | µg/L | 500 |
| Lindano (gama HCH) (4) | 58-89-9 | µg/L | 2 |
| Mancozebe | 8018-01-7 | µg/L | 180 |
| Metamidofós | 10265-92-6 | µg/L | 12 |
| Metolacloro | 51218-45-2 | µg/L | 10 |
| Molinato | 2212-67-1 | µg/L | 6 |
| Parationa Metílica | 298-00-0 | µg/L | 9 |
| Pendimentalina | 40487-42-1 | µg/L | 20 |
| Permetrina | 52645-53-1 | µg/L | 20 |
| Profenofós | 41198-08-7 | µg/L | 60 |
| Simazina | 122-34-9 | µg/L | 2 |
| Tebuconazol | 107534-96-3 | µg/L | 180 |
| Terbufós | 13071-79-9 | µg/L | 1,2 |
| Trifluralina | 1582-09-8 | µg/L | 20 |
| DESINFETANTES E PRODUTOS SECUNDÁRIOS DA DESINFECÇÃO(5) | |||
| Ácidos haloacéticos total | (6) | mg/L | 0,08 |
| Bromato | 15541-45-4 | mg/L | 0.01 |
| Clorito | 7758-19-2 | mg/L | 1 |
| Cloro residual livre | 7782-50-5 | mg/L | 5 |
| Cloraminas Total | 10599-903 | mg/L | 4,0 |
| 2,4,6 Triclorofenol | 88-06-2 | mg/L | 0,2 |
| Trihalometanos Total | (7) | mg/L | 0,1 |
NOTAS:
(1) CAS é o número de referência de compostos e substâncias químicas adotado pelo Chemical Abstract Service.
(2) Valor Máximo Permitido.
(3) Somatório dos isômeros alfa, beta e os sais de endossulfan, como exemplo o sulfato de endossulfan,
(4) Esse parâmetro é usualmente e equivocadamente, conhecido como BHC.
(5) Análise exigida de acordo com o desinfetante utilizado.
(6) Ácidos haloacéticos: Ácido monocloroacético (MCAA) - CAS = 79-11-8, Ácido monobromoacético (MBAA) - CAS = 79-08-3, Ácido dicloroacético (DCAA) - CAS = 79-43-6, Ácido 2,2 - dicloropropiônico (DALAPON) - CAS = 75-99-0, Ácido tricloroacético (TCAA) - CAS = 76-03-9, Ácido bromocloroacético (BCAA) CAS = 5589-96-3, 1,2,3, tricloropropano (PI) - CAS = 96-18-4, Ácido dibromoacético (DBAA) - CAS = 631-64-1, e Ácido bromodicloroacético (BDCAA) - CAS = 7113-314-7.
(7) Trihalometanos: Triclorometano ou Clorofórmio (TCM) - CAS = 67-66-3, Bromodiclorometano (BDCM) - CAS = 75-27-4, Dibromoclorometano (DBCM) - CAS = 124-48-1, Tribromometano ou Bromofórmio (TBM) - CAS = 75-25-2.
ANEXO 8 DO ANEXO XX
TABELA DE PADRÃO DE CIANOTOXINAS DA ÁGUA PARA CONSUMO HUMANO (Origem: PRT MS/GM 2914/2011, Anexo 8)
| CIANOTOXINAS | ||
| Parâmetro(1) | Unidade | VMP(²) |
| Microcistinas | µg/L | 1,0 (³) |
| Saxitoxinas | µg equivalente STX/L | 3,0 |
NOTAS:
(1) A frequência para o controle de cianotoxinas está prevista na tabela do Anexo XII.
(2) Valor Máximo Permitido.
(3) O valor representa o somatório das concentrações de todas as variantes de microcistinas.
ANEXO 9 DO ANEXO XX
TABELA DE PADRÃO DE RADIOATIVIDADE DA ÁGUA PARA CONSUMO HUMANO (Origem: PRT MS/GM 2914/2011, Anexo 9)
| Parâmetro(¹) | Unidade | VMP |
| Rádio-226 | Bq/L | 1 |
| Rádio-228 | Bq/L | 0,1 |
NOTAS: (1) Sob solicitação da Comissão Nacional de Energia Nuclear, outros radionuclídeos devem ser investigados.
ANEXO 10 DO ANEXO XX
TABELA DE PADRÃO ORGANOLÉPTICO DE POTABILIDADE (Origem: PRT MS/GM 2914/2011, Anexo 10)
| Parâmetro | CAS | Unidade | VMP(¹) |
| Alumínio | 7429-90-5 | mg/L | 0,2 |
| Amônia (como NH3) | 7664-41-7 | mg/L | 1,5 |
| Cloreto | 16887-00-6 | mg/L | 250 |
| Cor Aparente (²) | uH | 15 | |
| 1,2 diclorobenzeno | 95-50-1 | mg/L | 0,01 |
| 1,4 diclorobenzeno | 106-46-7 | mg/L | 0,03 |
| Dureza total | mg/L | 500 | |
| Etilbenzeno | 100-41-4 | mg/L | 0,2 |
| Ferro | 7439-89-6 | mg/L | 0,3 |
| Gosto e odor (³) | Intensidade | 6 | |
| Manganês | 7439-96-5 | mg/L | 0,1 |
| Monoclorobenzeno | 108-90-7 | mg/L | 0,12 |
| Sódio | 7440-23-5 | mg/L | 200 |
| Sólidos dissolvidos totais | mg/L | 1000 | |
| Sulfato | 14808-79-8 | mg/L | 250 |
| Sulfeto de hidrogênio | 7783-06-4 | mg/L | 0,1 |
| Surfactantes (como LAS) | mg/L | 0,5 | |
| Tolueno | 108-88-3 | mg/L | 0,17 |
| Turbidez (4) | uT | 5 | |
| Zinco | 7440-66-6 | mg/L | 5 |
| Xilenos | 1330-20-7 | mg/L | 0,3 |
NOTAS:
(1) Valor máximo permitido.
(2) Unidade Hazen (mgPt-Co/L).
(3) Intensidade máxima de percepção para qualquer característica de gosto e odor com exceção do cloro livre, nesse caso por ser uma característica desejável em água tratada.
(4) Unidade de turbidez.
ANEXO 11 DO ANEXO XX
TABELA DE FREQUÊNCIA DE MONITORAMENTO DE CIANOBACTÉRIAS NO MANANCIAL DE ABASTECIMENTO DE ÁGUA (Origem: PRT MS/GM 2914/2011, Anexo 11)
| Quando a densidade de cianobactérias (células/mL) for: | Frequência |
| £ 10.000 | Mensal |
| > 10.000 | Semanal |
ANEXO 12 DO ANEXO XX
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES FÍSICAS, QUÍMICAS E DE RADIOATIVIDADE, EM FUNÇÃO DO PONTO DE AMOSTRAGEM, DA POPULAÇÃO ABASTECIDA E DO TIPO DE MANANCIAL. (Origem: PRT MS/GM 2914/2011, Anexo 12)
| Parâmetro | Tipo de Manancial | Saída do Tratamento | Sistema de distribuição (reservatórios e redes) | ||||||
| Nº Amostras | Frequência | Número de amostras | Frequência | ||||||
| População abastecida | |||||||||
| <50.000 hab. | 50.000 a 250.000 hab. | >250.000 hab. | <50.000 hab. | 50.000 a 250.000 hab. | >250.000 hab. | ||||
| Cor | Superficial | 1 | A cada 2horas | 10 | 1 para cada 5mil hab | 40 + (1 para cada 25 mil hab) | Mensal | ||
| Subterrâneo | 1 | Semanal | 5 | 1 para cada 10 mil hab | 20 + (1 para cada 50 mil hab) | Mensal | |||
| Turbidez, Cloro Residual Livre(¹), Cloraminas(¹), Dióxido de Cloro(¹) | Superficial | 1 | A cada 2 horas | Conforme § 3º do Artigo 41 | Conforme § 3º do Artigo 41 | ||||
| Subterrâneo | 1 | 2 vezes por semana | |||||||
| pH e fluoreto | Superficial | 1 | A cada 2 horas | Dispensada a análise | Dispensada a análise | ||||
| Subterrâneo | 1 | 2 vezes por semana | |||||||
| Gosto e odor | Superficial | 1 | Trimestral | Dispensada a análise | Dispensada a análise | ||||
| Subterrâneo | 1 | Semestral | |||||||
| Cianotoxinas | Superficial | 1 | Semanal quando n° de cianobactérias 20.000 células/mL | Dispensada a análise | Dispensada a análise | ||||
| Produtos secundários da desinfecção | Superficial | 1 | Trimestral | 1(²) | 4(²) | 4(²) | Trimestral | ||
| Subterrâneo | Dispensada a análise | Dispensada a análise | 1(²) | 1(²) | 1(²) | Anual | Semestral | Semestral | |
| Demais parâmetros (³)(4) | Superficial ou Subterrâneo | 1 | Semestral | 1(5) | 1(5) | 1(5) | Semestral | ||
NOTAS:
(1) Análise exigida de acordo com o desinfetante utilizado.
(2) As amostras devem ser coletadas, preferencialmente, em pontos de maior tempo de detenção da água no sistema de distribuição.
(3) A definição da periodicidade de amostragem para o quesito de radioatividade será definido após o inventário inicial, realizado semestralmente no período de 2 anos, respeitando a sazonalidade pluviométrica.
(4) Para agrotóxicos, observar o disposto no parágrafo 5º do artigo 41.
(5) Dispensada análise na rede de distribuição quando o parâmetro não for detectado na saída do tratamento e, ou, no manancial, à exceção de substâncias que potencialmente possam ser introduzidas no sistema ao longo da distribuição.
ANEXO 13 DO ANEXO XX
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS MENSAIS PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES MICROBIOLÓGICAS, EM FUNÇÃO DA POPULAÇÃO ABASTECIDA (Origem: PRT MS/GM 2914/2011, Anexo 13)
| Parâmetro | Saída do Tratamento (Número de amostras por unidade de tratamento) | Sistema de distribuição (reservatórios e rede) | |||
| População abastecida | |||||
| < 5.000 hab. | 5.000 a 20.000 hab. | 20.000 a 250.000 hab. | > 250.000 hab. | ||
| Coliformes totais | Duas amostras semanais(¹) | 10 | 1 para cada 500 hab. | 30 + (1 para cada 2.000 hab.) | 105 + (1 para cada 5.000 hab.) Máximo de 1.000 |
| Escherichia coli | |||||
NOTA:
(1) Recomenda-se a coleta de, no mínimo, quatro amostras semanais.
ANEXO 14 DO ANEXO XX
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA MÍNIMA DE AMOSTRAGEM PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SOLUÇÃO ALTERNATIVA COLETIVA, PARA FINS DE ANÁLISES FÍSICAS, QUÍMICAS E MICROBIOLÓGICAS, EM FUNÇÃO DO TIPO DE MANANCIAL E DO PONTO DE AMOSTRAGEM (Origem: PRT MS/GM 2914/2011, Anexo 14)
| Parâmetro | Tipo de manancial | Saída do tratamento (para água canalizada) | Número de amostras retiradas no ponto de consumo (para cada 500 hab.) | Frequência de amostragem |
| Cor, turbidez, pH e coliformes totais(¹) e (²) | Superficial | 1 | 1 | Semanal |
| Subterrâneo | 1 | 1 | Mensal | |
| Cloro residual livre(¹) | Superficial ou Subterrâneo | 1 | 1 | Diário |
NOTAS:
(1) Para veículos transportadores de água para consumo humano, deve ser realizada uma análise de cloro residual livre em cada carga e uma análise, na fonte de fornecimento, de cor, turbidez, pH e coliformes totais com freqüência mensal, ou outra amostragem determinada pela autoridade de saúde pública.
(2) O número e a frequência de amostras coletadas no sistema de distribuição para pesquisa de Escherichia coli devem seguir o determinado para coliformes totais.
ANEXO XXI
Normas e Padrões sobre Fluoretação da Água dos Sistemas Públicos de Abastecimento, Destinada ao Consumo Humano (Origem: PRT MS/GM 635/1975)
Art. 1º Aprovar as Normas e Padrões, a seguir, sobre a fluoretação da água dos sistemas públicos de abastecimento, destinada ao consumo humano. (Origem: PRT MS/GM 635/1975, Art. 1º)
Art. 2º Para efeito de fluoretação da água dos sistemas públicos de abastecimento, destinada ao consumo humano, são adotadas as seguintes definições: (Origem: PRT MS/GM 635/1975, Art. 2º)
I - Fluoretação: Teor de concentração do íon fluoreto presente na água destinada ao consumo humano, apto a produzir os efeitos desejados à prevenção da cárie dental. (Origem: PRT MS/GM 635/1975, Art. 2º, I)
II - Íon: Átomos ou grupos de átomos dotados de carga elétrica. (Origem: PRT MS/GM 635/1975, Art. 2º, II)
III - Concentração de íon Fluoreto: Relação entre a massa do íon fluoreto dissolvida na água e a massa da solução, geralmente expressa em partes por milhão (ppm) que representa miligramas de íon flúor por quilograma de solução. Para efeito desta norma admite-se que 1 litro de água, pesa 1 quilograma; portanto 1 ppm é 1 mg/litro. (Origem: PRT MS/GM 635/1975, Art. 2º, III)
IV - Composto Fluoretado: Qualquer composto químico que contenha em sua composição o íon fluoreto (F). (Origem: PRT MS/GM 635/1975, Art. 2º, IV)
V - Dosador de Produtos Químicos: Equipamento que lança na água quantidades pré-determinadas de produtos químicos. (Origem: PRT MS/GM 635/1975, Art. 2º, V)
VI - Dosagem por Solução: Aquela na qual o produto químico é medido como volume de solução. (Origem: PRT MS/GM 635/1975, Art. 2º, VI)
VII - Dosagem a seco: Aquela na qual uma quantidade medida de um composto químico seco é descarregada por um dosador durante um determinado intervalo de tempo. (Origem: PRT MS/GM 635/1975, Art. 2º, VII)
VIII - Dosador a Seco Volumétrico: Equipamento que descarrega volume específico (cm3, dm3, etc.) e de produto químico, durante um determinado intervalo de tempo. (Origem: PRT MS/GM 635/1975, Art. 2º, VIII)
IX - Dosador a Seco Gravimétrico: Equipamento que descarrega um certo peso (g, kg, etc.) de produto químico durante um determinado intervalo de tempo. (Origem: PRT MS/GM 635/1975, Art. 2º, IX)
X - Prevalência de Cárie Dental: Quantidade desta afecção existente numa comunidade ou num indivíduo em dado momento. (Origem: PRT MS/GM 635/1975, Art. 2º, X)
Art. 3º Os sistemas públicos de abastecimento de água fluoretada deverão obedecer aos seguintes requisitos mínimos: (Origem: PRT MS/GM 635/1975, Art. 3º)
I - Abastecimento contínuo da água distribuída à população, em caráter regular e sem interrupção. (Origem: PRT MS/GM 635/1975, Art. 3º, I)
II - A água distribuída deve atender os padrões de potabilidade. (Origem: PRT MS/GM 635/1975, Art. 3º, II)
III - Sistemas de operação e manutenção adequados. (Origem: PRT MS/GM 635/1975, Art. 3º, III)
IV - Sistema de controle rotineiro da qualidade da água distribuída. (Origem: PRT MS/GM 635/1975, Art. 3º, IV)
Art. 4º A concentração recomendada de íon fluoreto nas águas de abastecimento público é obtida pela fórmula constante no Anexo 2 do Anexo XXI . (Origem: PRT MS/GM 635/1975, Art. 4º)
Art. 5º Os limites recomendados para a concentração do íon fluoreto em função da média das Temperaturas máximas diárias são os indicados no Quadro I constante no Anexo 1 do Anexo XXI . (Origem: PRT MS/GM 635/1975, Art. 5º)
Art. 6º Os compostos químicos de flúor que podem ser empregados nos sistemas públicos de abastecimento de água são os indicados no Quadro II constante no Anexo 1 do Anexo XXI (Origem: PRT MS/GM 635/1975, Art. 6º)
Art. 7º Os métodos de análise e procedimentos para determinação da concentração do íon fluoreto na água são os indicados nos subítens seguintes, e a descrição dos mesmos as constantes do Anexo 1 do Anexo XXI , sua Tabela e Figura. (Origem: PRT MS/GM 635/1975, Art. 7º)
I - Métodos analíticos: (Origem: PRT MS/GM 635/1975, Art. 7º, I)
a) Eletrométrico. (Origem: PRT MS/GM 635/1975, Art. 7º, I, a)
b) SPADNS (fotométrico). (Origem: PRT MS/GM 635/1975, Art. 7º, I, b)
c) Visual da Alizarina. (Origem: PRT MS/GM 635/1975, Art. 7º, I, c)
II - Procedimentos: (Origem: PRT MS/GM 635/1975, Art. 7º, II)
a) Para a determinação do teor de íon fluoreto, as águas brutas e fluoretadas deverão ser analisadas por um dos métodos discriminados no Anexo 1 do Anexo XXI . (Origem: PRT MS/GM 635/1975, Art. 7º, II, a)
b) A frequência diária das análises a serem efetuadas dependerá da complexidade e porte do sistema de água. (Origem: PRT MS/GM 635/1975, Art. 7º, II, b)
c) O controle (diário e mensal) a ser exercido sobre a água, conterá obrigatoriamente, os seguintes elementos: (Origem: PRT MS/GM 635/1975, Art. 7º, II, c)
1. Cidade. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 1)
2. Estado. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 2)
3. Dia, mês e ano. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 3)
4. Responsável pela análise. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 4)
5. Dose ótima de flúor. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 5)
6. Método de análise (com ou sem destilação). (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 6)
7. Composto de flúor empregado. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 7)
8. Vazão do sistema. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 8)
9. Teor do íon fluoreto natural. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 9)
10. Quantidade de composto de flúor agregado (diário); (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 10)
11. Teor diário de íon fluoreto na água fluoretada. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 11)
Parágrafo Único. Para os métodos analíticos de SPADNS (fotométrico) e Visual da Alizarina, deverão ser realizadas a destilação prévia das amostras (Anexo 3 do Anexo XXI) com o objetivo de eliminar os interferentes, caso seja necessário. (Origem: PRT MS/GM 635/1975, Art. 7º, Parágrafo Único)
Art. 8º Os tipos e precisão dos equipamentos tolerados para dosagem dos compostos de flúor são os seguintes: (Origem: PRT MS/GM 635/1975, Art. 8º)
I - Tipos: (Origem: PRT MS/GM 635/1975, Art. 8º, I)
a) De Solução. (Origem: PRT MS/GM 635/1975, Art. 8º, I, a)
b) A seco (volumétrico e gravimétrico). (Origem: PRT MS/GM 635/1975, Art. 8º, I, b)
II - Precisão: (Origem: PRT MS/GM 635/1975, Art. 8º, II)
a) O equipamento para dosagem dos compostos fluoretados por via úmida deverão permitir no máximo um erro de 0,1 mg/l a um nível de 1 mg/l, ou seja 10% para mais ou menos. (Origem: PRT MS/GM 635/1975, Art. 8º, II, a)
b) Nos equipamentos para dosagem dos compostos fluoretados por via seca será tolerada uma oscilação para mais ou menos de no máximo 3 a 5% no tipo volumétrico e de 1 a 2% no tipo gravimétrico. (Origem: PRT MS/GM 635/1975, Art. 8º, II, b)
Art. 9º As técnicas de fluoretação de acordo com o composto químico a utilizar, em função da vazão do sistema com a dosagem a seco ou por via úmida, são as descritas no Quadro III, do Anexo 1 do Anexo XXI , indicativos dos compostos químicos, vazão 1 l/s, equipamentos requeridos, espécies de produtos químicos, manuseio, pontos de aplicação e cuidados especiais. (Origem: PRT MS/GM 635/1975, Art. 9º)
ANEXO 1 DO ANEXO XXI
MÉTODOS DE ANÁLISES E PROCEDIMENTOS PARA A DETERMINAÇÃO DE ÍON FLUORETO NA ÁGUA (Origem: PRT MS/GM 635/1975, Anexo 1)
1. Considerações Gerais.
Entre os diversos métodos para determinação do íon fluoreto na água, os eletrométricos e os colorimétricos são atualmente considerados os mais satisfatórios. Os métodos colorimétricos são baseados na reação entre o fluoreto e a laca de zircônio com um corante orgânico. O fluoreto forma um complexo Zr F - que é incolor. A proporção que a quantidade de íons fluoreto cresce, a coloração da Laca decresce ou modifica seu matiz.
Como todos os métodos colorimétricos estão sujeitos a erros provocados por íons interferentes existentes na amostra é necessário destilá-la antes de se fazer a determinação do fluoreto. Se os interferentes presentes na amostra estão em concentrações baixas, não será necessário destilá-la podendo-se passar diretamente aos métodos colorimétricos.
2. Seleção do Método.
A adição de um tampão de citrato, livra o método eletrométrico de interferentes tais como íons de alumínio, hexametafosfato, ferro e ortofosfato, que nos métodos colorimétricos são eliminados por destilação preliminar.
Ambos os métodos colorimétricos são aplicáveis a amostras contendo teores de fluoreto na faixa de 0,05 a 1,4 mg/l, enquanto que o método eletrométrico é aplicável para teores de 0,1 a 5 mg/l.
Com a aplicação dos métodos SPADNS e eletrométrico os resultados são lidos imediatamente, enquanto que, com o de alizarina, é necessário esperar 1 hora após a adição do corante para o desenvolvimento da cor.
Os métodos SPADNS . e eletrométrico necessitam equipamentos, enquanto o visual de alizarina necessita apenas vidraria de laboratório. Padrões permanentes para o método visual poderão ser usados, mas precauções especiais deverão ser tomadas pelo analista.
3. Interferentes nos métodos colorimétricos.
Em geral os métodos colorimétricos estão sujeitos aos mesmos interferentes, variando apenas os graus. A tabela indica as substâncias que comumente interferem nos dois métodos. Estas interferências não são aditivas. A amostra deverá ser previamente destilada quando qualquer substância presente cause interferência, cujo erro seja de 0,1 mg/l, ou quando houver dúvida no efeito. A destilação também é recomendada para as amostras coloridas ou turvas. Algumas vezes pode-se diluir a amostra ou neutralizá-la, quando for o caso, para diminuir os efeitos interferentes.
O cloro interfere em todos os métodos colorimétricos e deverá ser removido.
Nos métodos colorimétricos volumes e temperaturas são críticos e devem ser medidos com precisão, pois deles dependem os resultados.
4. Amostragem
Frascos de polietileno são preferíveis na coleta de amostras de água para análise de fluoretos. Frascos de vidro são satisfatórios desde que se evite usar frascos que contiveram soluções concentradas de fluoretos. Em todos os casos, deverá ser adotada a prática de lavar inicialmente os frascos com a água que vai ser analisada.
Caso se aproveitem na determinação de fluoretos amostras colhidas para exames bacteriológicos, deve-se tomar precauções quanto às substâncias usadas para eliminar o cloro, pois o tiosulfato, em concentrações de 100 mg/l, interfere produzindo precipitado.
5. Tabela
Substâncias interferentes nos métodos colorimétricos
Substância Interferente |
MétodoSpands |
Método Visual de Alizarina |
||
Conc. mg/L |
Tipo de Erro |
Conc. mg/L |
Tipo de Erro |
|
Alcalinidade (CaCO3) |
5.000 |
- |
400 |
- |
Alumínio (AI+++) |
0,1 |
- |
0,25 |
- |
Cloreto (Cl--) |
7.000 |
+ |
2.000 |
- |
Ferro (Fe+++) |
10 |
- |
2 |
+ |
Hexametafosfato (NaPO3)6 |
1,0 |
+ |
1,0 |
+ |
Fosfato (PO4 -) |
16 |
+ |
5 |
+ |
Sulfato (SO4-) |
200 |
+ |
300 |
+ |
6. Destilação preliminar
6.1. Discussão - Por meio de destilação, o íon fluoreto pode ser separado dos outros elementos existentes nas águas, na forma de ácido fluossilíco ou fluorídrico. A recuperação quantitativa do fluoreto se obtém usando amostras relativamente grandes e sob altas temperaturas.
6.2. Equipamento - O aparelho de destilação (figura) consiste: de um balão de vidro pirex, com capacidade de um litro, fundo redondo e pescoço longo, de um tubo de conexão; de um condensador eficiente; e de um termômetro com escala de 0º a 200ºC. Qualquer outro destilador semelhante ao da figura poderá ser usado. Os pontos críticos a serem observados são aqueles que afetam a completa recuperação dos fluoretos, tais como obstruções na passagem do vapor etc., e condições que podem aumentar o arraste do sulfato. Deste modo, pode-se usar anteparos de asbesto para proteger da chama a parte superior do balão de destilação. Pode-se modificar este aparelho de modo a desligar automaticamente quando a destilação acabar.
6.3. Reagentes:
a) ácido sulfúrico concentrado. b) sulfato de prata cristalizado.
6.4. Procedimento:
a) Coloque 400 ml de água no frasco de destilação e cuidadosamente acione 200 ml de ácido sulfúrico concentrado.
Agite até homogeneizar o conteúdo do frasco. Adicione 25 a 35 pérolas de vidro e ligue o aparelho como mostra a figura, certificando-se que todas as juntas estão ajustadas. Comece a aquecer lentamente, passando aos poucos a um aquecimento tão rápido quando permitir o condensador (o destilado deverá sair frio) até que a temperatura do líquido contido no frasco atinja exatamente 180º C. Neste instante pare a destilação e elimine o destilado. Este processo serve para remover qualquer contaminação de fluoreto e ajustar a relação ácido-água para destilações subsequentes.
b) Após esfriar a mistura de ácido remanescente do item anterior ou de destilações prévias, até 120º C ou abaixo, adiciona 300 ml da amostra, misture cuidadosamente, e destile corno descrito anteriormente até a temperatura atingir 180º C. Para prevenir o arraste de sulfato, não permita que a temperatura ultrapasse l8Oº C.
c) Adicione sulfato de prata ao frasco de destilação, na proporção de 5 mg por miligrama de cloreto, quando amostras de alto conteúdo em cloretos são analisadas.
d) Use a solução de ácido sulfúrico repetidamente até que os contaminantes das amostras de água, acumuladas no frasco de destilação, comecem a interferir no destilado. Verifique a possibilidade de uso do ácido periodicamente, destilando amostras conhecidas de fluoretos. Após a destilação de amostras com altos teores de fluoretos, adicione 300 ml de água e continue a destilação combinando os destilados. Se necessário repita a operação até que o conteúdo de fluoretos no destilado seja mínimo. Adicione ao primeiro destilado, os destilados subseqüentes. Após períodos de inatividade, destile água e elimine o destilado, antes de destilar a amostra.
6.5. Interpretação dos Resultados - O fluoreto recuperado na destilação está quantitativamente dentro da precisão dos métodos usados para a determinação.
7. Método Eletrométrico:
7.1. Interferentes - Cátions polivalentes tais como AI(+++), Fe(+++) e Si(+++) formam complexos o íon fluoreto. A formação dos complexos depende do pH da solução e dos níveis de relação entre o fluoreto e os tipos de complexos. Em presença de concentrações de alumínio acima de 2 mg/l, o íon citrato numa solução tampão, preferentemente formará complexos com o alumínio, libertando o íon fluoreto.
Em soluções ácidas, o íon hidrogênio forma complexos com o íon fluoreto, mas o complexo é desprezível se o pH for ajustado acima de 5. Em soluções alcalinas o íon hidroxila interfere com a resposta do eletrodo em função de íon fluoreto, sempre que o nível de hidroxila for maior do que um décimo do nível do íon fluoreto presente. Entretanto, a um pH igual ou menor que 8, a concentração de hidroxila é igual ou menor que 10-6 molar e neste caso não haverá interferência para qualquer concentração de fluoretos detectáveis.
7.2. Equipamento:
a) Potenciômetro com escala de pH ampliada ou um medidor específico de íons que possuam um milivoltímetro ou outra escala apropriada além da de pH.
b) Eletrodo tipo Beckman n.º 40.463 ou Corning n.º 476.012 ou Orion n.º 900.100 ou outro semelhante.
c) Eletrodo especial para fluoretos.
d) Agitador magnético com barra agitadora revestida de teflon. e) Cronômetro.
7.3. Reagentes:
a) Solução de Fluoreto de 100 ug/ml - Dissolva 221,0 mg de fluoreto de sódio anidro (N-F), em água destilada e leva o volume para 1.000 ml. Cada ml da solução contém 100 ug de F.
b) Solução Padrão de Fluoreto - Dilua 100 ml da solução de fluoreto de 100 ug/ml para 1.000 ml com água destilada. Cada ml conterá 10 ug de F.
c) Solução Tampão (TISAB) - Coloque aproximadamente 500 ml de água destilada em um becker de 1.000 ml. Adicione 57 ml de ácido acético glacial, 58 g de cloreto de sadio (NaCI) e 12 g de citrato de sódio bi-hidratado. (Na3C6H5O72H2O). Agite até dissolver. Coloque o becker em um banho de água para esfriar, coloque o eletrodo de pH e o de referência e leve o pH 5,0 a 5,5 com hidróxido de sódio 6N (125 ml aproximadamente). Esfrie para a temperatura ambiente. Coloque num balão volumétrico de 1.000 ml e leve o volume até a marca com água destilada.
7.4. Procedimento:
a) Calibração do instrumento - Não é necessário fazer calibrações nos potenciômetros quando a faixa de fluoreto é de 0,2 a 2,0 mg/l;
b) Preparação de Padrões de Fluoreto - Pipete 2,00; 4,00; 6,00; 8,00; 10,00; 16,00; 20,00 ml da solução padrão do fluoreto em urna série de balões volumétricos de 100 ml. A cada balão adicione 50 ml de solução tampão e leve os volumes a 100 ml com água destilada. Misture bem. Cada balão conterá respectivamente 0,20; 0,40; 0,60; 0,80; 1,00; 1,20; 1,60 e 2,00 mg/litro.
c) Tratamento da amostra - Coloque 50 ml da amostra em um balão volumétrico de 100 ml e complete o volume com a solução tampão. Misture bem. Mantenha os padrões e amostra na mesma temperatura, preferentemente na de calibração dos balões.
d) Medida com o eletrodo - Transfira os padrões e a amostra para uma série de beckers de 150 ml. Mergulhe os eletrodos em cada becker e meça o potencial desenvolvido enquanto a agitação é mantida por meio de um agitador magnético. Evite agitar a solução antes da imersão dos eletrodos porque se bolhas de ar aderirem ao eletrodo poderão produzir leituras errôneas ou fluoração dos ponteiros. Espere 3 minutos antes de ler no milivoltímetro. Lave os eletrodos com água destilada e enxágue entre cada leitura.
Quando usar um potenciômetro de escala ampliada ou um medidor específico, recalibre freqüentemente o eletrodo verificando a leitura de 1,00 mg/l (50 ug F) da solução padrão e ajustando o controle de calibração.
Faça um gráfico em papel de 3 ciclos a leitura em milivolts contra ug F da solução padrão.
7.5. Cálculos: mg/l F = ug F/ ml da amostra
8. Método SPADNS
8.1. Equipamento:
a) Espectrofotômetro que possa usar o comprimento de onda de 510 mu e tenha uma passagem de luz de pelos menos 1 cm.
b) Fotômetro de filtro com passagem de luz de pelo menos 1 cm equipado com filtro amarelo esverdeado tendo transmitância máxima em 550 a 580 mu.
8.2. Reagentes:
a) Solução padrão de fluoreto - deverá ser preparada na forma indicada em 7.4.5. do método eletrométrico.
b) Solução SPADNS - dissolva 958 mg SPADNS, 2 - parasulfofenilazo -1,8 dihidroxi - 3,6-naftaleno disulfonato de sódio, também chamado 4,5 dihidroxi - 3- parasulfofenilazo - 2,7 naftaleno disulfonato trissódico, em água destilada e dilua para 500 ml. Esta solução é estável indefinidamente se protegida da luz solar direta.
c) Reagente ácido de zirconila - dissolva 133 mg de cloreto de zirconio octahidratado, ZrOCI2. 8H20 em cerca de 25 ml de água destilada. Adicione 350 ml de HCI concentrado e dilua para 500 ml com água destilada.
d) Reagente ácido de zirconila - SPADNS - misture volumes iguais de soluções SPADNS e ácida de zirconila. Esta solução é estável por 2 anos.
e) Solução de Referência - adicione 10 ml da solução de SPADNS a 100 ml de água destilada. Dilua 7 ml de HCI concentrado para 10 ml com água destilada e adicione à solução SPADNS diluída. Esta solução é estável indefinidamente e será usada como ponto de referência para o espectrofotômetro ou o fotômetro. Esta solução poderá ser substituída por um dos padrões de fluoreto.
f) Solução de arsenito de sódio - dissolva 5,0 g. de NaAsO2 e dilua para 1.000 ml com água destilada.
8.3. Procedimento:
a) Preparação da curva padrão - prepare padrões de fluoretos na faixa de 0 a 1,40 mg/l diluindo quantidades apropriadas da solução padrão de fluoreto para 50 ml com água destilada. Pipete 5 ml do reagente ácido de zirconila e 5 ml do reagente. SPADNS ou 10 ml do reagente misto de zirconila ácida SPADNS em cada padrão e misture bem Ajuste o fotômetro ou o espectrofotômetro ao zero de absorção com a solução de referência e imediatamente faça a leitura da absorção em cada um dos padrões. Faça um gráfico da curva da concentração em fluoretos versus absorção. Prepare nova curva padrão sempre que novos reagentes tenham que ser preparados. Se não for usada solução de referência, calibre o espectrofotômetro ou fotômetro para algum ponto da curva com um padrão de fluoreto.
b) Pré-tratamento da amostra - se a amostra contém cloro residual, remova-o pela adição de 1 gota (0,05 ml) da solução de arsenito de sódio para cada 0,1 mg de Cl e misture. Concentrações de arsenito de sódio de 1.300 mg/l produzem erros de 0,1 mg/l de F.
c) Desenvolvimento da cor - use amostra de 50 ml ou uma alíquota diluída para 50 ml. Ajuste a temperatura para a mesma da curva padrão. Adicione 5 ml da solução SPADNS e 5 ml da solução ácida de zirconila ou 10 ml da solução mista de zirconila ácida - SPADNS. Misture bem e leia imediatamente a absorção, ajustando primeiro o fotômetro ou espectrofotômetro ao ponto de referência. Se a absorção estiver fora da curva padrão, repita a operação diluindo a amostra.
8.4. Cálculos:
mg/l F = A/(ml amostra) x B/C
onde
A = mg de fluoreto determinado fotometricamente.
B/C = é aplicado somente quando a amostra for diluída para um volume B e uma alíquota C for tomada para o desenvolvimento da cor.
9. Método Visual da Alizarina.
9.1. Equipamento:
a) Série de tubos Nessler de 100 ml, ou b) Comparador visual de cor.
9.2. Reagentes:
a) Solução de Fluoretos - deverá ser preparada como indicada para o método eletrométrico.
b) Reagente Zircônio-Alizarina - dissolva 300 mg de cloreto de zircônio octahidratado, ZrOCl2. 8 H20, em 50 ml de água destilada e coloque em balão volumétrico de 1.000 ml. Dissolva 70 mg de 3-alizarinassulfonato de sódio, também conhecida por vermelho de alizarina S, em 50 ml de água destilada e adicione ao frasco de 1.000 ml que já contém a solução de cloreto de zircônio. Deixe em repouso para clarear.
c) Solução ácida - dilua 101 ml de HCI concentrado para, aproximadamente, 400 ml com água destilada. Dilua, cuidadosamente, 33,3 ml de H2S04 concentrado para 400 ml com água destilada. Após esfriar, misture as duas soluções.
d) Reagente ácido de Zircônio-Alizarina - adicione à solução ácida do item C a de Zircônio-Alizarina contida no balão de 1.000 ml. Complete o volume com água destilada e misture. O reagente muda de cor do vermelho ao amarelo em aproximadamente uma hora. Guardado e protegido da luz solar direta, é estável por 6 meses.
e) Solução de arsenito de sódio - deverá ser preparada do mesmo modo como indicado para método - SPADNS
9.3. Procedimento:
a) Pré-tratamento da amostra - se a amostra contém cloro residual, remova-o adicionando 1 gota (0,05 ml) da solução de arsenito de sódio para cada 0,1 mg de Cl.
b) Preparação dos Padrões - Prepare uma série de padrões diluindo volumes conhecidos da solução padrão de fluoreto de 10 ug para 100 ml nos tubos Nessler. Escolha a faixa de padrões de modo a atingir a concentração da amostra. Quanto menor o intervalo entre as concentrações dos padrões, maior a precisão na análise. Geralmente usa-se intervalos de 50 ug/l.
d) Desenvolvimento da cor - encha um tubo Nessler de 100 ml com a amostra ou uma diluição desta quando for necessário e iguale as temperaturas desta com a dos padrões. Adicione, a cada tubo 5,00 ml do reagente ácido de zircônio-alizarina. Misture e compare as amostras com os padrões após 1 hora de repouso.
9.4. Cálculos:
Mg/l F = A/(ml amostra) x B/C
onde
A = mg de F determinada visualmente. A razão B/C é aplicada quando houver necessidade de diluir o volume C da amostra para o volume B final.
QUADRO I
Limites recomendados para a concentração do íon fluoreto em função da média das temperaturas máximas diárias.
Média das temperaturas máximas diárias do ar (ºC) |
Limites recomendados para a concentração do íon fluoreto (mg/l) |
||
mínimo |
máximo |
ótimo |
|
10,0 - 12,1 |
0,9 |
1,7 |
1,2 |
12,2 - 14,6 |
0,8 |
1,5 |
1,1 |
14,7 - 17,7 |
0,8 |
1,3 |
1,0 |
17,8 - 21,4 |
0,7 |
1,2 |
0,9 |
21,5 - 26,3 |
0,7 |
1,0 |
0,8 |
26,4 - 32,5 |
0,6 |
0,8 |
0,7 |
QUADRO II
Compostos de Flúor
Podem ser empregados:
| Características | Fluoreto de Cálcio (Fluorita) CaF2 | Fluossilicato deSódio Na2 SiF6 | Fluoreto do sódio NaF | Ácido FluossilícicoH2SiF6 |
| Forma | Pó | Pó ou cristais finos | Pó ou cristal | Líquido |
| Peso Molecular | 78,08 | 188,05 | 42,0 | 144,08 |
| Pureza Comercial % | 85 a 98 | 98 a 99 | 90 a 98 | 22 a 30 |
| Solubilidade gr/100gr(25ºC) | 0,0016 | 0,762 | 4,05 | |
| pH da solução saturada | 6,7 | 3,5 | 7,6 | 1,2 (solução l%) |
| Íon Fluoreto em % (100% puro) | 48,8 | 60,7 | 42,25 | 79,2 |
Os compostos de flúor especificados são os de uso corrente no Brasil, entretanto outros compostos poderão ser utilizados desde que existentes no mercado.
QUADRO III
Técnicas de Fluoretação
De acordo com o composto químico a utilizar e em função da vazão do sistema, podem ser:
| Composto Químico | Vazão l/s | Equipamento Requerido | Especificação do Produto Químico | Manuseio | Ponto de Aplicação | Cuidados |
| Com dosagem à seco | ||||||
| Fluossilicato de Sódio ou Fluoreto de Sódio | 6 a 90 | Dosador volumétrico Balança Tremonha (tegão) Câmara de dissolução | Pó, em sacos, tambores ou a granel | Alimentação direta do saco Equipamento de manejo a granel | Canal aberto Afluente do filtro Reservatório de água filtrada | Poeira Respingos Efeito de arco na tremonha |
| > 90 | Dosador gravimétrico Tremonha Câmara de dissolução | |||||
| Com dosagem por via úmida | ||||||
| Fluoreto de Cálcio(Fluorita) | < 1.000 | Tanque de solução de sulfato de alumínio misturador | Fluorita 100% passando na peneira 350 mesh pureza > 98% | Pesagem Mistura Constante Medição deVazão | Na entrada da ETA juntamente com Al2 (SO4)3 | |
| Fluoreto de Sódio | < 30 | Dosador de Solução Tanque de Mistura Balança Agitador | Cristalino e isento de poeira em sacos ou tambores | Pesagem Mistura Medição | Efluente do Filtro | Poeira Respingos Preparo daSolução |
| 30 a 130 | Dosador de Solução Saturador Medidor de Vazão | a) Saturador descendente:Cristal grosso, em tambores ou sacos. b) Saturadorascendente: Cristal fino | Esvaziamento completo da embalagem | Reservatório de água filtrada | Poeira Respingo | |
| Ácido | < 30 | Dosador de Solução Balança Tanque Calibrado Tanque de Mistura Misturador | Ácido fortificado (pouca Sílica) em tambores ou bombonas | Despejo ouSifonamento Medição Mistura Pesagem | Efluente do Filtro Reservatório de água filtrada | Corrosão Vapores Respingos Preparo deSolução |
| Fluossilícico | > 30 | Dosador de Solução Tanque Diário Balança Bomba para Transferência | S. Granel em vagões ou caminhões | bombeamento | Corrosão Vapores Vazamentos | |
ANEXO 2 DO ANEXO XXI
FÓRMULA DA CONCENTRAÇÃO RECOMENDADA DE ÍON FLUORETO NAS ÁGUAS DE ABASTECIMENTO PÚBLICO (Origem: PRT MS/GM 635/1975, Anexo 2)

onde
E = 10,3 + 0,725 T
T = média de Temperaturas máximas diárias observadas durante um período mínimo de 1 ano (recomendado 5 anos) em graus centígrados.
ANEXO 3 DO ANEXO XXI
FIGURA (Origem: PRT MS/GM 635/1975, Anexo 3)
ANEXO XXII
IMPLANTAÇÃO DO PROGRAMA NACIONAL DE TRIAGEM NEONATAL (Origem: PRT MS/GM 822/2001, Anexo 1)
ANEXO I
IMPLANTAÇÃO DO PROGRAMA NACIONAL DE TRIAGEM NEONATAL
COMPETÊNCIAS E ATRIBUIÇÕES:
1 - MINISTÉRIO DA SAÚDE
a - Instituir o Programa Nacional de Triagem Neonatal, o rol das doenças a serem triadas, os princípios e diretrizes da implantação do Programa, o estabelecimento de critérios/exigências de habilitação nas fases de implantação, critérios de implantação das redes de triagem neonatal e os critérios técnicos de desenvolvimento do trabalho;
b - Elaborar e publicar Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal e Protocolos Clínicos e Diretrizes Terapêuticas a serem adotados pelo Programa Nacional de Triagem Neonatal;
c - Estabelecer as normas de funcionamento e cadastramento de Postos de Coleta e de Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas;
d - Articular com os estados, municípios e o Distrito Federal a implantação do Programa e o estabelecimento de mecanismos de controle, avaliação e acompanhamento do processo;
e - Assessorar os estados e o Distrito Federal na implantação, em seus respectivos âmbitos de atuação, do Programa Nacional de Triagem Neonatal e na organização de suas respectivas Redes Estaduais de Triagem Neonatal;
f - Avaliar as condições de habilitação dos estados e do Distrito Federal nas Fases de Implantação do Programa;
g - Criar um banco de dados que permita acompanhar e avaliar o desenvolvimento do Programa, definindo seus indicadores;
h - Alocar recursos financeiros destinados ao co-financiamento das atividades do Programa;
i - Divulgar o Programa de maneira a conscientizar e informar a população e os profissionais de saúde sobre a importância da realização da Triagem Neonatal.
2 - SECRETARIAS DE SAÚDE DOS ESTADOS E DO DISTRITO FEDERAL
a - Elaborar, em parceria com as Secretarias Municipais de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Triagem Neonatal;
b - Designar um Coordenador Estadual do Programa Nacional de Triagem Neonatal;
c - Organizar a Rede Estadual de Triagem Neonatal, identificando os Postos de Coleta, estabelecendo os fluxos de referência e contra-referência entre os Postos e os Serviços de Referência e garantindo a execução de todas as fases do processo de sua respectiva fase de implantação do Programa – triagem, confirmação diagnóstica, acompanhamento e tratamento dos pacientes identificados como portadores das patologias triadas;
d - Criar as condições para a estruturação/criação/implantação/cadastramento dos Serviços de Referência em Triagem Neonatal/ Acompanhamento e Tratamento de Doenças Congênitas de Tipo I, II ou III, conforme sua respectiva fase de implantação do Programa;
e - Articular com os demais gestores estaduais as eventuais referências laboratoriais dos Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas, conforme previsto no Anexo III desta Portaria;
f - Organizar a rede assistencial complementar – ambulatorial e hospitalar, destinada a garantir a retaguarda dos Serviços de Referência de Triagem Neonatal no atendimento dos pacientes triados, em conformidade com o estabelecido no Anexo III desta Portaria;
g - Assessorar os municípios no processo de implementação do Programa, na estruturação/criação/implantação/cadastramento dos Postos de Coleta, no desenvolvimento das atividades e na adoção de mecanismos destinados ao controle, avaliação e acompanhamento do processo;
h - Avaliar as condições epidemiológicas de seu estado para eventual implantação da Fase III do Programa;
i - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento / incremento do Programa;
j - Monitorar o desempenho do Programa em seu estado e os resultados alcançados, mediante o acompanhamento de indicadores de cobertura da Triagem em termos de porcentual de cobertura dos recém-nascidos no estado;
k - Manter atualizados os bancos de dados que estejam sob sua responsabilidade, integrando, inclusive, os dados de Triagem Neonatal provenientes da rede privada de laboratórios, que deverão ser notificados ao gestor estadual do SUS.
3 - SECRETARIAS MUNICIPAIS DE SAÚDE
a - Elaborar, em parceria com a respectiva Secretaria estadual de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Triagem Neonatal;
b- Criar as condições para a estruturação/criação/implantação/cadastramento do(s) Posto(s) de Coleta e adotar as providencias necessárias para integrá-lo(s) na Rede Estadual de Triagem Neonatal;
c - Apoiar a estruturação/manutenção/funcionamento dos Serviços de Referência em Triagem Neonatal que estejam instalados em seu município;
d - Organizar a rede assistencial complementar – ambulatorial e hospitalar, destinada a garantir a retaguarda dos Serviços de Referência de Triagem Neonatal no atendimento dos pacientes triados, em conformidade com o estabelecido no Anexo III desta Portaria;
e - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento/incremento do Programa;
f - Monitorar o desempenho do Programa em seu município e os resultados alcançados, mediante o acompanhamento de indicadores de cobertura da Triagem em termos de percentual de cobertura dos recém -nascidos no município;
g - Manter atualizados os bancos de dados que estejam sob sua responsabilidade, integrando, inclusive, os dados de Triagem Neonatal provenientes da rede privada de laboratórios, que deverão ser notificados ao gestor estadual do SUS.
ANEXO XXIII
PROGRAMA NACIONAL DE TRIAGEM NEONATAL (Origem: PRT MS/GM 822/2001, Anexo 2)
ANEXO II
PROGRAMA NACIONAL DE TRIAGEM NEONATAL
PRINCÍPIOS E DIRETRIZES, CRITÉRIOS/EXIGÊNCIAS PARA HABILITAÇÃO NAS FASES DE IMPLANTAÇÃO
O Programa Nacional de Triagem Neonatal tem por objetivo o desenvolvimento de ações de triagem neonatal, diagnóstico, acompanhamento e tratamento das seguintes doenças congênitas:
- Fenilcetonúria;
- Hipotireodismo Congênito;
- Doenças Falciformes e outras Hemoglobinopatias;
- Fibrose Cística.
A - PRINCÍPIOS E DIRETRIZES
A implantação do Programa deverá seguir os seguintes Princípios e Diretrizes:
1 - Todo recém-nascido tem direito ao acesso à realização de testes de Triagem Neonatal, em conformidade com o disposto nesta Portaria. Os testes deverão ser realizados até o 30º dia de vida (preferencialmente entre o 2º e o 7º dia de vida), com coleta do material efetuada de acordo com os critérios técnicos estabelecidos no Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal a ser elaborado e publicado pela Secretaria de Assistência à Saúde/SAS/MS;
2 - O Programa Nacional de Triagem Neonatal deverá ser organizado de maneira a garantir plenamente o acesso aos recém-nascidos não só à realização dos exames preconizados e à confirmação diagnóstica, mas também ao acompanhamento e tratamento das doenças detectadas. Devem ser estruturados os fluxos de referência e contra-referência, os Postos de Coleta adequados e os respectivos Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de acordo com a Fase de Implantação do Programa, em conformidade com o estabelecido no Anexo III desta Portaria.
3 - Todo recém-nascido suspeito de ser portador de uma das patologias triadas deverá ser reconvocado para a realização dos exames complementares confirmatórios, de acordo com o estabelecido no Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal a ser elaborado e publicado pela Secretaria de Assistência à Saúde/SAS/MS;
4 - Todo recém-nascido vivo identificado/confirmado como portador de uma das patologias triadas tem direito ao acompanhamento, orientação e tratamento adequado, conforme descrito no Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal e nos respectivos Protocolos Clínicos e Diretrizes Terapêuticas a serem elaborados e publicados pela Secretaria de Assistência à Saúde;
5 - As autoridades sanitárias nos níveis federal, estadual e municipal, de acordo as respectivas competências e atribuições estabelecidas no Artigo 5º desta Portaria, serão responsáveis pela adoção das medidas pertinentes e adequadas à garantia dos direitos enunciados nas alíneas acima.
B – CRITÉRIOS/EXIGÊNCIAS PARA HABILITAÇÃO
Os estados e o Distrito Federal deverão cumprir, de acordo com a Fase de Implantação, os seguintes critérios/exigências de habilitação:
1 – FASE I – Triagem, confirmação diagnóstica, acompanhamento e tratamento da fenilcetonúria e hipotireoidismo congênito:
Para se habilitar na Fase I de Implantação do Programa Nacional de Triagem Neonatal, os estados e o Distrito Federal deverão enviar à Secretaria de Assistência à Saúde uma solicitação de habilitação na Fase I que deverá ser instruída com:
1.1 - Rede Estadual de Coleta – informar nominalmente e por município a relação dos Postos de Coleta (pelo menos 1 por município em que sejam realizados partos) que foram organizados/cadastrados no estado, em conformidade com as Normas de Funcionamento e Cadastramento estabelecidas no Anexo III desta Portaria.
1.2 - Serviço(s) Tipo I de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas – identificar/organizar e enviar a SAS a documentação necessária para cadastramento do(s) Serviço(s) de Referência (pelo menos 1 por estado), de acordo com as Normas de Funcionamento e Cadastramento de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo I, estabelecidas no Anexo III desta Portaria;
1.3 - Nome do Coordenador Estadual do Programa Nacional de Triagem Neonatal;
1.4 - Compromisso formal, firmado pelo Secretário da Saúde, de que o estado buscará a cobertura de 100% de seus nascidos-vivos no que diz respeito à triagem neonatal da fenilcetonúria e hipotireoidismo congênito bem como a garantia da confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados com estas doenças congênitas.
Obs.: Aqueles estados/Distrito Federal que já estejam realizando os exames de triagem neonatal para Fenilcetonúria e Hipotireoidismo Congênito previstos nas Fase I, deverão adotar as providências necessárias para consolidar seu processo de triagem neonatal, organizando a rede de coleta e definindo o(s) Serviço(s) de Referência, garantido, desta forma, além da realização dos exames preconizados, o adequado acompanhamento e tratamento dos pacientes triados e identificados como portadores destas doenças, devendo cumprir os mesmos passos de habilitação descritos acima.
2 - Fase II - Triagem, confirmação diagnóstica, acompanhamento e tratamento da fenilcetonúria, hipotireoidismo congênito + doenças falciformes e outras hemoglobinopatias:
Para se habilitar na Fase II de Implantação do Programa Nacional de Triagem Neonatal, os estados e o Distrito Federal deverão enviar à Secretaria de Assistência à Saúde uma solicitação de habilitação na Fase II que deverá ser instruída com:
2.1 - Habilitação na Fase I – informar a habilitação
2.2 - Rede Estadual de Coleta – informar nominalmente e por município a relação dos Postos de Coleta (pelo menos 1 por município em que sejam realizados partos) que foram organizados/cadastrados no estado, em conformidade com as Normas de Funcionamento e Cadastramento estabelecidas no Anexo III desta Portaria – mesma Rede informada na habilitação na Fase I;
2.3 - Serviço(s) Tipo II de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas– identificar/organizar e enviar à SAS a documentação necessária para cadastramento do(s) Serviço(s) de Referência (pelo menos 1 por estado), de acordo com as Normas de Funcionamento e Cadastramento de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo II, estabelecidas no Anexo III desta Portaria;
2.4 - Nome do Coordenador Estadual do Programa Nacional de Triagem Neonatal – o mesmo da Fase I;
2.5 - Compromisso formal, firmado pelo Secretário da Saúde, de que o estado buscará a cobertura de 100% de seus nascidos-vivos no que diz respeito à triagem neonatal da fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias bem como a garantia da confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados com estas doenças congênitas.
Obs.: Aqueles estados/Distrito Federal que já cumpram integralmente os critérios/exigências estabelecidos nas Fases I e II poderão solicitar, diretamente, habilitação na Fase II.
3 - Fase III - Triagem, confirmação diagnóstica, acompanhamento e tratamento da fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias + fibrose cística:
Para se habilitar na Fase III de Implantação do Programa Nacional de Triagem Neonatal, os estados e o Distrito Federal deverão enviar à Secretaria de Assistência à Saúde uma solicitação de habilitação na Fase III que deverá ser instruída com:
3.1 - Habilitação na Fase II – informar a habilitação;
3.2 - Comprovação de que o estado já tenha garantido uma cobertura igual ou superior a 70% dos nascidos vivos nas doenças definidas nas Fases I e II;
3.3 – Informações a respeito das características populacionais e incidência fibrose cística no estado que indiquem a necessidade e que apresentem adequada relação custo-benefício para a realização deste tipo de triagem;
3.4 - Rede Estadual de Coleta – informar nominalmente e por município a relação dos Postos de Coleta (pelo menos 1 por município em que sejam realizados partos) que foram organizados/cadastrados no estado, em conformidade com as Normas de Funcionamento e Cadastramento estabelecidas no Anexo III desta Portaria – a mesma Rede informada na habilitação das Fases I e II;
3.5 - Serviço(s) Tipo III de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas – identificar/organizar e enviar à SAS a documentação necessária para cadastramento do(s) Serviço(s) de Referência (pelo menos 1 por estado), de acordo com as Normas de Funcionamento e Cadastramento de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo III, estabelecidas no Anexo III desta Portaria;
3.6 - Nome do Coordenador Estadual do Programa Nacional de Triagem Neonatal – o mesmo das Fases I e II;
3.7 - Compromisso formal, firmado pelo Secretário da Saúde, de que o estado buscará a cobertura de 100% de seus nascidos-vivos no que diz respeito à triagem neonatal da fenilcetonúria, hipotireoidismo congênito, doenças falciforme, outras hemoglobinopatias e fibrose cística bem como a garantia da confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados com estas doenças congênitas.
Obs.: Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverão ser, preferencialmente, os mesmos serviços em todas as fases. Assim o de Tipo I (na Fase I) deve ser adequadamente adaptado e incrementada sua capacidade operacional para transformá-lo em Tipo II quando o estado pretender a habilitação na Fase II. Da mesma forma, o de Tipo II deverá ser adequado para o Tipo III quando o estado pretender a habilitação na Fase III de Implantação do Programa.
ANEXO XXIV
NORMAS PARA FUNCIONAMENTO E CADASTRAMENTO DE POSTOS DE COLETA E DE SERVIÇOS DE REFERÊNCIA EM TRIAGEM NEONATAL/ACOMPANHAMENTO E TRATAMENTO DE DOENÇAS CONGÊNITAS(Origem:PRT MS/GM 822/2001,Anexo3)
ANEXO III
NORMAS PARA FUNCIONAMENTO E CADASTRAMENTO DE POSTOS DE COLETA E DE SERVIÇOS DE REFERÊNCIA EM TRIAGEM NEONATAL/ACOMPANHAMENTO E TRATAMENTO DE DOENÇAS CONGÊNITAS
A - POSTOS DE COLETA
Os municípios devem organizar/estruturar/implantar e cadastrar tantos Postos de Coleta quantos forem necessários para a cobertura/acesso de sua população à realização da coleta de material para a realização dos exames relativos à Triagem Neonatal. É obrigatória a instalação de pelo menos um (01) Posto de Coleta por Município (naqueles em que são realizados partos).
1 - Processo de Cadastramento
1.1 - Município em Gestão Plena do Sistema Municipal:
A Secretaria Municipal de Saúde deverá criar as condições para a organização / estruturação / implantação / cadastramento do(s) Posto(s) de Coleta de seu município e adotar as providências necessárias para integrá-lo(s) à Rede Estadual de Coleta e referenciá-lo(s) ao Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas ao qual estiver vinculado (providência a ser adotada junto à Secretaria Estadual de Saúde).
Uma vez definido(s) o(s) Posto(s) de Coleta e se cumpridas as exigências abaixo mencionadas, a Secretaria Municipal de Saúde deverá adotar as providências necessárias ao seu cadastramento junto ao Departamento de Informática do SUS/DATASUS. Feito o cadastramento, a SMS deverá informar à Secretaria Estadual de Saúde, em documento próprio, a relação de seu(s) Posto(s) na qual constem: nome do município, nome do(s) estabelecimento(s) cadastrados e nome da pessoa responsável pela atividade.
1.2 - Município que não esteja em Gestão Plena do Sistema Municipal
A Secretaria Municipal de Saúde deverá criar as condições para a organização/estruturação/ implantação do(s) Posto(s) de Coleta de seu município e adotar as providências necessárias para integrá-lo(s) à Rede Estadual de Coleta e referenciá-lo(s) ao Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas ao qual estiver vinculado (providência a ser adotada junto à Secretaria Estadual de Saúde).
Uma vez definido(s) o(s) Posto(s) de Coleta e se cumpridas as exigências abaixo mencionadas, a Secretaria Municipal de Saúde deverá formalizar junto à Secretaria Estadual de Saúde o pedido de cadastramento de seu(s) Posto(s), que após a devida análise, adotará as providências necessárias ao seu cadastramento junto ao DATASUS.
1.3 – Secretaria Estadual de Saúde
A Secretaria Estadual de Saúde é a responsável pela organização de Rede Estadual de Coleta e sua vinculação ao(s) Serviço(s) de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas. Para isso, deverá cadastrar o(s) Postos(s) de Coleta dos municípios que não estejam em Gestão Plena do Sistema Municipal e consolidar a relação total de Postos de Coleta cadastrados (de todos os municípios em que sejam realizados partos, em gestão plena ou não) organizando-os por município e identificando, para cada um deles, a referência para o seu respectivo Serviço de Referência em Triagem Neonatal. Esta relação consolidada deverá ser enviada para a Secretaria de Assistência à Saúde por ocasião da solicitação de habilitação do estado em uma das Fases de Implantação do Programa, conforme estabelecido no Anexo II desta Portaria. A Secretaria Estadual de Saúde deverá informar às Secretarias Municipais de Saúde e a seus respectivos Postos de Coleta o nome do Serviço de Referência em Triagem Neonatal ao qual deverão ser enviadas as amostras coletadas.
2 - Exigência para Cadastramento de Postos de Coleta
2.1 - Características Gerais
A escolha do local para instalação do Posto de Coleta, a critério da Secretaria Estadual/Municipal de Saúde, poderá recair sobre uma unidade de saúde já existente, um local específico para o desenvolvimento desta atividade ou ainda sobre o(s) hospital(is)/maternidade(s) em que tenha ocorrido o parto. Nesta última hipótese, deverá ficar bastante claro que a coleta do material será realizada somente após o 2º dia de vida recém-nascido (freqüentemente na alta hospitalar). Nas situações onde a coleta não é realizada nas maternidades, as mesmas deverão dispor de um formulário contendo orientação de local e data para a coleta (modelo existente no Manual de Normas Técnicas e Rotinas Operacionais do PNTN, a ser publicado pela SAS/MS). Neste caso, a unidade coletora deverá, também, assumir, formalmente, o compromisso de que a coleta ocorrerá nos primeiros 30 (trinta) dias de vida do bebê, preferencialmente na 1ª semana.
O material coletado, dentro das normas estabelecidas no Manual de Normas Técnicas e Rotinas Operacionais do PNTN, será enviado ao Laboratório do Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas indicado pelo gestor do SUS, num prazo nunca superior a 05 (cinco) dias úteis.
2.2 - Instalações Físicas
Os Postos de Coleta deverão dispor, no mínimo, do seguinte:
- Recepção e sala de espera para acompanhantes e entrega de resultados;
- Sala de coleta;
- Área adequada para guarda de material e armazenamento de amostras (conforme descrito no Manual do PNTN) e arquivamento de resultados
2.3 - Recursos Humanos
Os Postos de Coleta deverão dispor, no mínimo, dos seguintes recursos humanos:
- Recepcionista ou auxiliar administrativo;
- Profissional da área de saúde com, no mínimo, formação de nível médio comprovada.
2.4 - Materiais e Equipamentos
Os Postos de Coleta deverão dispor, no mínimo, do seguinte:
- Papel filtro, lancetas e formulários (comprovantes de coleta), fornecidas pelo Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas (que foi identificado e informado pela Secretaria Estadual de Saúde);
- Algodão e álcool para assepsia (não pode ser usado álcool iodado);
- Luvas descartáveis;
- Material para curativo;
- Bancada de trabalho;
- Cadeiras;
- Armário;
- Arquivo;
- Geladeira
2.5 - Rotinas de Funcionamento e Atendimento
Os Postos deverão possuir manual técnico em que todos os procedimentos estejam descritos pormenorizadamente, contemplando o estabelecido no Manual de Normas Técnicas e Rotinas Operacionais do PNTN, com no mínimo, os seguintes itens:
- Horário de funcionamento;
- Fluxo de atendimento do paciente;
- Registro da(s) data(s) de treinamento(s) de todos os seus funcionários técnicos e administrativos;
- Fluxo de recebimento de material e envio de amostras ao laboratório do Serviço de Referência, especificando claramente os procedimentos utilizados para evitar a troca de amostras;
- Descrição de cada uma das atividades;
Técnica de Coleta utilizada, indicando claramente o modo de coleta para cada exame, especificando as normas de biossegurança utilizadas tanto para o paciente como para o coletor;
- Registro do intervalo médio de tempo entre a coleta e envio de amostras ao laboratório;
- Registro da realização da coleta e arquivamento do comprovante assinado pelo responsável pelo RN;
- Registro da entrega de resultados e arquivamento do comprovante ao responsável pelo RN;
- Registro do intervalo médio de tempo entre a coleta e entrega/retirada dos resultados às famílias;
- Fluxo de busca ativa de reconvocados;
- Registro das ações de busca ativa dos casos reconvocados, assim como do intervalo de tempo entre a data da reconvocação e comparecimento para nova coleta;
- Registro das rotinas de armazenamento, manipulação e dejeto de materiais orgânicos, que devem seguir às normas vigentes.
B - SERVIÇOS DE REFERÊNCIA EM TRIAGEM NEONATAL / ACOMPANHAMENTO E TRATAMENTO DE DOENÇAS CONGÊNITAS
As Secretarias de Saúde dos Estados e do Distrito Federal devem cadastrar (pelo menos um) Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas para a cobertura e acesso de sua população à realização da triagem neonatal, confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados.
1 – Cadastramento
1.1 - Planejamento/Distribuição de Serviços
As Secretarias de Saúde dos estados e do Distrito Federal deverão, em conformidade com o quantitativo de nascidos vivos do estado e respeitados os critérios técnicos, as garantias de adequado fluxo operacional do Serviço e adequada relação custo-benefício, estabelecer um planejamento de distribuição regional dos Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de maneira a facilitar o acesso dos usuários e a cobertura assistencial.
1.2 - Processo de Cadastramento
1.2.1 - A abertura de qualquer Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverá ser precedida de consulta ao Gestor do SUS – Secretaria de Saúde do estado, do Distrito Federal ou do município em Gestão Plena do Sistema Municipal, sobre as normas vigentes, a necessidade de sua criação, o planejamento/distribuição regional e a possibilidade de cadastramento, sem a qual o SUS não se obriga ao cadastramento. Cabe à Secretaria Estadual de Saúde, conforme já enunciado, o planejamento da rede e a definição do quantitativo de Serviços necessários de acordo com os critérios estabelecidos por esta Portaria;
1.2.2 – Uma vez confirmada a necessidade do cadastramento e conduzido o processo de seleção de prestadores de serviços pelo Gestor do SUS, o processo de cadastramento deverá ser formalizado pela Secretaria de Saúde do estado, do Distrito Federal ou do município em Gestão Plena do Sistema Municipal, de acordo com as respectivas condições de gestão e a divisão de responsabilidades estabelecida na Norma Operacional de Assistência à Saúde – NOAS/SUS 01/2001;
1.2.3 - O Processo de Cadastramento deverá ser instruído com:
a - Documentação comprobatória do cumprimento das exigências estabelecidas por esta Portaria;
b - Relatório de Vistoria – a vistoria deverá ser realizada “in loco” pela Secretaria de Saúde responsável pela formalização do Processo de Cadastramento que avaliará as condições de funcionamento do Serviço para fins de cadastramento: área física, recursos humanos, responsabilidade técnica e demais exigências estabelecidas nesta Portaria;
c - Parecer Conclusivo do Gestor – manifestação expressa, firmada pelo Secretário da Saúde, em relação ao cadastramento. No caso de Processo formalizado por Secretaria Municipal de município em Gestão Plena do Sistema Municipal de Saúde, deverá constar, além do parecer do gestor local, o parecer do gestor estadual do SUS, que será responsável pela integração do novo Serviço à rede de referência estadual e a definição da relação do Serviço cadastrado com a rede de coleta.
1.2.4 - Uma vez emitido o parecer a respeito do cadastramento, pelo(s) Gestor(es) do SUS, e se o mesmo for favorável, o Processo deverá ser encaminhado ao Ministério da Saúde / SAS, para análise;
1.2.5 - O Ministério da Saúde / SAS avaliará o Processo de Cadastramento e determinará a realização de vistoria “in loco” do Serviço pelo Grupo Técnico de Assessoramento em Triagem Neonatal. Uma vez aprovado o cadastramento, a Secretaria de Assistência à Saúde tomará as providências necessárias à sua publicação.
2 - Exigências para Cadastramento de Serviços de Referência em Triagem Neonatal / Acompanhamento e Tratamento de Doenças Congênitas
2.1 - Exigências Gerais
2.1.1 – Características Gerais
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas são destinados à operacionalização, execução e controle do Programa Nacional de Triagem Neonatal, na sua área de abrangência. Estes serviços são responsáveis pelo cumprimento de todo o processo referente à triagem neonatal, desde a coleta, realização dos exames, busca ativa, confirmação diagnóstica, acompanhamento e tratamento dos casos positivos detectados, conforme definido no PNTN e portanto devem englobar:
- Rede de Coleta – composta pelos Postos de Coleta dos municípios/estado. A rede deve ser organizada pela Secretaria Estadual de Saúde, que vinculará, conforme estabelecido nesta Portaria, os Postos ao respectivo Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas. O Serviço de Referência e seu laboratório deverão ter, formalmente estabelecida, a relação nominal (por município) dos Postos de Coleta a eles vinculados e ter rotinas estabelecidas de envio de material para coleta para estes Postos (lancetas, papel filtro), recepção das amostras e reconvocação de pacientes.
- Laboratório Especializado em Triagem Neonatal – Laboratório/Biologia Molecular (conforme estabelecido no Subitem 2.2.1 e 2.2.2 deste Anexo);
- Ambulatório Multidisciplinar Especializado (conforme estabelecido no Subitem 2.2.3 deste Anexo);
- Sistema de Registro de Informações Automatizado (conforme estabelecido no Subitem 2.2.4 deste Anexo)
- Rede Assistencial Complementar (conforme estabelecido no subitem 2.2.5 deste Anexo);
Os Serviços de Referência deverão ser organizados a fim de atender a totalidade dos recém-nascidos vivos de sua respectiva área de abrangência.
2.1.2 – Tipos de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas
Os Serviços de Referência em Triagem Neonatal serão classificados de acordo com sua capacidade operacional no que diz respeito ao acompanhamento e tratamento das doenças congênitas estabelecidas nas Fases de Implantação do Programa e com os exames que são capazes de realizar - capacidade técnica do laboratório especializado – próprio ou terceirizado, em:
- Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo I - Unidade que disponha de equipe multiprofissional especializada nos atendimentos ao recém-nascido triado para fenilcetonúria e hipotireoidismo congênito. A realização dos exames de triagem e confirmação diagnóstica deverão ser realizados em laboratório especializado, próprio ou terceirizado, apto à realização destes exames e em conformidade com estabelecido neste Anexo.
- Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo II - Unidade que disponha de equipe multiprofissional especializada nos atendimentos ao recém-nascido triado para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias. A realização dos exames de triagem e confirmação diagnóstica deverão ser realizados em laboratório especializado, próprio ou terceirizado, apto à realização destes exames e em conformidade com estabelecido neste Anexo. Deve-se atentar para o fato que o laboratório deve ser apto a realizar exames confirmatórios para as doenças falciformes e outras hemoglobinopatias, por biologia molecular.
- Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo III - Unidade que disponha de equipe multiprofissional especializada nos atendimentos ao recém-nascido triado para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias e fibrose cística. A realização dos exames de triagem e confirmação diagnóstica deverão ser realizados em laboratório especializado, próprio ou terceirizado, apto à realização destes exames e em conformidade com estabelecido neste Anexo. Deve-se atentar para o fato que o laboratório deve ser apto a realizar exames confirmatórios para as doenças falciformes, outras hemoglobinopatias e fibrose cística, por biologia molecular.
Obs.: Somente poderão cadastrar Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de tipo I, II ou III aqueles estados que estiverem habilitados, respectivamente, nas Fases I, II ou III de Implantação do Programa.
2.1.3 - Manutenção do Cadastro e Descadastramento
Para manutenção do cadastramento, os Serviços de Referência deverão, além de cumprir as normas estabelecidas pela presente Portaria, enviar à Secretaria de Assistência à Saúde/MS, até o dia 15 do mês subseqüente a cada mês de competência, os relatórios de acompanhamento do Programa, especificados no Manual de Normas Técnicas e Rotinas Operacionais do PNTN . Se o Serviço não enviar, no prazo estipulado e por 03 (três) meses consecutivos, estes relatórios, a Secretaria de Assistência à Saúde descadastrará o Serviço faltoso.
O descadastramento também poderá ocorrer se, após avaliação de funcionamento do Serviço por meio de auditorias periódicas (MS/SMS/SES) o Serviço de Referência deixar de cumprir qualquer um dos critérios estabelecidos nesta Portaria.
2.2 – Exigências Específicas
Além das exigência gerais, o Serviço de Referência deverá cumprir com as seguintes exigências específicas:
2.2.1 - Laboratório Especializado em Triagem Neonatal
O Serviço de Referência deverá dispor, próprio ou terceirizado, de um Laboratório Especializado em Triagem Neonatal.
No caso de laboratório terceirizado, o Serviço de Referência deverá apresentar cópia de contrato/convênio celebrado com o laboratório em que fiquem claramente estabelecidas as garantias de realização de todos os exames preconizados na Fase de Implantação em que o estado esteja habilitado e o fiel cumprimento de todas as normas e critérios estabelecidos pela presente Portaria.
Serviço de Referência Tipo I - o laboratório deverá cumprir as exigências de funcionamento e cadastramento estabelecidas nesta Portaria, inserir-se no Programa Nacional de Triagem Neonatal cumprindo suas atribuições/obrigações e ser capaz de realizar exames de triagem e confirmação diagnóstica para fenilcetonúria e hipotireoidismo congênito.
Serviço de Referência Tipo II - o laboratório deverá cumprir as exigências de funcionamento e cadastramento estabelecidas nesta Portaria, inserir-se no Programa Nacional de Triagem Neonatal cumprindo suas atribuições/obrigações e ser capaz de realizar exames de triagem e confirmação diagnóstica para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias. Deverá ser apto a realizar, por biologia molecular, os exames confirmatórios das doenças falciformes e outras hemoglobinopatias.
Serviço de Referência Tipo III - o laboratório deverá cumprir as exigências de funcionamento e cadastramento estabelecidas nesta Portaria, inserir-se no Programa Nacional de Triagem Neonatal cumprindo suas atribuições/obrigações e ser capaz de realizar exames de triagem e confirmação diagnóstica para fenilcetonúria, hipotireoidismo congênito, doenças falciformes, outras hemoglobinopatias e fibrose cística. Deverá ser apto a realizar, por biologia molecular, os exames confirmatórios das doenças falciformes, outras hemoglobinopatias e fibrose cística.
Obs.:
1 – Se o Serviço de Referência não dispuser de Laboratório próprio, poderá contratar/conveniar a realização dos exames necessários de um laboratório terceirizado. A escolha deste laboratório, dentro ou fora do estado, deverá recair sobre aquele laboratório que se enquadre e cumpra com as exigências estabelecidas nesta Portaria.
2 - Na hipótese de laboratório próprio do Serviço de Referência ou de laboratório terceirizado não serem capazes de realizar exames por biologia molecular, poderá ser contratado/conveniado outro laboratório para realizar estes exames.
Em qualquer hipótese, o laboratório deverá apresentar Licença de Funcionamento emitida pela Coordenadoria de Fiscalização Sanitária da Secretaria de Saúde do estado ou DF, que poderá ser revogada, a qualquer momento, em caso de descumprimento das normas estabelecidas por esta Portaria. Igualmente, o Laboratório deverá ter/apresentar certificação de Controle de Qualidade Internacional em Triagem Neonatal, devidamente atualizado.
2.2.1.1 – Características do Laboratório Especializado
O laboratório especializado em Triagem Neonatal tem características próprias que o distinguem de um laboratório de Análises Clínicas tradicional:
GERAIS:
- nele se analisam grandes quantidades de amostras para um mesmo parâmetro, enquanto num laboratório de análises clínicas, se analisam menor quantidade de amostras para uma variedade de parâmetros;
- além disso, tendo em vista a característica populacional da triagem e as variações normalmente encontradas em ensaios consecutivos realizados em dias diferentes, é importante que a rotina do laboratório de triagem, manuseie um número mínimo diário de amostras em cada técnica utilizada, para haver coerência e uniformidade dos resultados individuais e populacionais;
- laboratórios de triagem neonatal utilizam amostras de sangue obtidas por meio de punção no calcanhar, impregnadas em papel filtro padronizado, especialmente desenvolvidos para este fim. Estas amostras são de fácil transporte através do correio, de fácil armazenagem e podem ser analisadas por uma grande variedade de técnicas.
ESPECÍFICAS:
- deve possuir manual técnico em que todos os procedimentos estejam descritos pormenorizadamente;
- todos os procedimentos devem ser objeto de Controle periódico de Qualidade Interno;
- realizar análise laboratorial para todos os ensaios ao menos 05 (cinco) vezes por semana, visando o devido domínio técnico;
- ter equipe técnica treinada com capacitação específica para análise de amostras em sangue seco;
- utilizar técnicas adequadas e de recomendação internacional em Triagem Neonatal;
- ser responsável pela distribuição de lancetas e papel filtro padronizado (PNTN), de maneira a não haver solução de continuidade na rede de coleta. Se for próprio do Serviço de Referência, o laboratório enviará o material citado diretamente aos Postos de Coleta.
No caso de laboratório terceirizado, deverá fornecer o material ao Serviço de Referência contratante, que se responsabilizará pela distribuição aos Postos.
2.2.1.2 - Instalações Físicas
A área física do laboratório deverá se enquadrar nos critérios e normas estabelecidos pela legislação em vigor ou outros ditames legais que venham a substituí-los ou complementar, a saber:
- Portaria GM/MS nº 1884, de 11 de novembro de 1994 – Normas para Projetos Físicos de Estabelecimentos Assistenciais de Saúde;
- Resolução nº 05, de 05 de agosto de 1993, do CONAMA – Conselho Nacional de Meio Ambiente.
A área física deve ser adequada, permitindo que os exames sejam desenvolvidos com organização e segurança e ser convenientemente, iluminada e ventilada.
A temperatura ambiente deve ser adequada para a realização dos testes que exigem uma temperatura específica. Deve ainda ser permanentemente monitorada para assegurar que está dentro da faixa aceitável.
A energia elétrica deve ser adequada e suficiente para os equipamentos em uso.
Para o preparo de reagentes é necessário a utilização de água purificada por método de reconhecida eficiência.
O laboratório deve estar de acordo com os códigos de biossegurança, incluindo provisões para o manuseio seguro de amostras de sangue, reagentes e despejo correto do lixo.
Área de Apoio – esta área deverá ser composta por, no mínimo, as seguintes instalações:
- Sala de espera e recepção para recebimento e entrega de resultados;
- Área de apoio administrativo;
- Área de seleção e encaminhamento de amostras;
- Área refrigerada adequada para guarda de material e armazenamento de amostras.
Área técnica isolada da área de apoio
- Sala para o desenvolvimento de atividades laboratoriais, compatível com o número de exames em rotina.
2.2.1.3 - Recursos Humanos
A equipe enumerada a seguir se constitui na equipe mínima capaz para realização de testes em 100.000 amostras/ano. Esta equipe deve ser modificada para ser compatível com o número de exames realizados pelo laboratório.
- 01 (um) responsável técnico: médico/biomédico/bioquímico, devidamente habilitado, com experiência mínima de dois anos em triagem neonatal, declarada e comprovada por ele. É o responsável, em última instância, pelos resultados de todos os exames realizados em seu laboratório;
- 02 (dois) técnicos de nível superior: biomédico/bioquímico/biólogo, com treinamento específico e orientação na área de triagem, tanto em relação à execução das técnicas laboratoriais, como em relação à interpretação dos resultados, controles de qualidade e finalidades dos diferentes exames;
- 01 (um) supervisor técnico, quando houver três ou mais técnicos de nível superior, que será responsável pela supervisão direta dos demais técnicos e que, juntamente com o responsável técnico, participará das demais tarefas de organização do laboratório;
- 02 (dois) técnicos de nível médio com habilitação comprovada, com treinamento específico na área de triagem neonatal;
- 02 (dois) profissionais de nível médio para área administrativa, devendo um deles estar capacitado a realizar as funções descritas em Recursos Humanos do Sistema de Registro e Informações Automatizado;
- 01 (um) profissional de apoio em serviços gerais, com primeiro grau completo, treinado.
2.2.1.4 - Materiais e Equipamentos
Os materiais e equipamentos técnicos deverão ser selecionados de acordo com as metodologias escolhidas entre as reconhecidas e disponíveis no mercado nacional/internacional e referendadas nos programas de Controle de Qualidade Internacionais para Triagem Neonatal. Os fornecedores escolhidos deverão se responsabilizar, por meio de contratos, por manter estoques de segurança correspondentes, no mínimo, a 01 (um) mês de atividade, para suprir eventuais problemas com importação.
Os equipamentos técnicos deverão ser automatizados ou semi-automatizados.
O laboratório deve possuir:
- todos os equipamentos necessários em perfeito estado de conservação para assegurar a qualidade dos exames que realiza;
- programa de controle de qualidade de desempenho dos equipamentos, assim como de manutenção dos mesmos.
- todos os kits e reagentes necessários para as metodologias em uso, devendo ser armazenados em quantidade suficiente para a sua rotina e utilizados de acordo com as instruções do fabricante.
As informações sobre todos os reagentes e Kits utilizados devem ser convenientemente protocoladas. Estas informações compreendem:
- produtos adquiridos comercialmente: o nome do fabricante, do lote, data de validade, data de aquisição, condições de armazenamento e outras informações consideradas pertinentes para o produto em questão;
- reagentes preparados no laboratório: data do preparo, nome do técnico que preparou, condições de armazenamento e outras informações consideradas pertinentes para o reagente em questão.
2.2.1.5 - Laudos
Os laudos dos exames devem ser claros e conter informações sobre o método empregado para cada exame, com a assinatura ou chancela eletrônica do Responsável Técnico e acompanhado de observações, quando necessário, que os tornem mais compreensíveis.
Os resultados das dosagens de Fenilalanina e T4neo/TSHneo devem ser quantitativos.
Se HPLC for a metodologia escolhida para triagem de doenças falciformes e hemoglobinopatias, os casos alterados nesta metodologia, deverão ser confirmados por Focalização Isoelétrica e ser igualmente reportados.
2.2.1.6 - Rotinas de Funcionamento e Atendimento
O laboratório deve possuir Rotinas de Funcionamento escritas, atualizadas a cada 04 (quatro) anos e assinadas pelo Responsável técnico pelo Laboratório de Referência em Triagem Neonatal, contemplando, no mínimo, os seguintes itens:
- Horário de funcionamento;
- Identificação do responsável técnico (ou substituto) presente durante todo o intervalo de funcionamento do laboratório;
- Registro da(s) data(s) de treinamento(s) de todos os seus funcionários;
- Fluxo de atividades no laboratório: do recebimento da amostra até o envio de resultados;
-Descrição de cada uma das atividades;
- Registro do intervalo médio de tempo entre o recebimento da amostra e liberação de resultados.
2.2.1.7 - Relatórios de Acompanhamento
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverão enviar à Secretaria de Assistência à Saúde, até o dia 15 do mês subseqüente a cada mês de referência, relatório de acompanhamento do laboratório (próprio ou terceirizado), contendo no mínimo:
- Número de amostras analisadas para cada uma das patologias triadas;
- Número de casos suspeitos detectados para cada uma das patologias triadas;
- Número de casos positivos confirmados para cada uma das patologias triadas;
- Dados de identificação e resultados dos casos positivos detectados, para inclusão no Banco de Dados - PNTN/MS.
2.2.2 – Laboratório – Biologia Molecular
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de Tipo II e III deverão contar com Laboratório apto a realizar os testes de detecção de mutações de doenças falciformes, outras hemoglobinopatias e fibrose cística. Este Laboratório poderá ser próprio do Serviço de Referência, do Laboratório Especializado em Triagem Neonatal terceirizado ou ainda um outro laboratório contratado/conveniado especificamente para realizar os testes de biologia molecular. Em qualquer destas hipóteses, o laboratório de biologia molecular deverá cumprir todas as especificações já descritas para Laboratório Especializado em Triagem Neonatal e as seguintes especificações adicionais:
- Responsável Técnico:
O responsável técnico pelo laboratório de biologia molecular deverá estar devidamente habilitado nesta área.
- Área Física:
Para os procedimentos de biologia molecular, deve haver três áreas bem definidas, aqui designadas como áreas 1, 2 e 3, distribuídas em pelo menos duas salas. As áreas 1 e 2 podem ser combinadas em uma única sala. Cada área deve ter seu equipamento adequado e exclusivo. A utilização de luvas é sempre necessária.
Fluxo reagentes/amostras deve ser: área 1 » área 2 » área 3.
Área 1: é destinada aos procedimentos que envolvam preparo de reagentes ("pré-mix"). Nesta área deve haver os materiais e equipamentos necessários para a atividade. Recomenda-se que nesta área haja fluxo laminar com luz ultra-violeta e que as soluções sejam mantidas em congelador próprio. Recomenda-se restrição ao tráfego de pessoas e utilização de aventais exclusivos.
Área 2: é destinada à extração de DNA e adição do DNA à reação de PCR. Deve ser mantida limpa, com o uso de reagentes químicos (p.ex., HCl 1N) e/ou de luz ultravioleta (UV). Nesta área também deve haver os materiais e equipamentos necessários para a atividade. Recomenda-se restrição ao tráfego de pessoas e utilização de aventais exclusivos.
Área 3: é destinada aos procedimentos de amplificação e pós-amplificação. É a única sala em que se deve manipular o produto amplificado. Procedimentos químicos (p.ex., HCl 1N) e/ou utilização de luz ultra-violeta (UV), podem ser utilizados para inativar produtos amplificados. O termociclador pode ser mantido nesta área, ou numa outra área diferente das áreas 1 e 2.
- Reagentes:
O laboratório de biologia molecular deve possuir todos os reagentes necessários para as metodologias em uso, devendo ser armazenados e utilizados de acordo com as instruções do fabricante.
As informações sobre todos os reagentes utilizados devem ser convenientemente protocoladas. Estas informações compreendem: em caso de produtos adquiridos comercialmente, o nome do fabricante, do lote, a data de validade, a data de aquisição, condições de armazenamento e outras informações consideradas pertinentes para o produto em questão; em caso de reagentes preparados no laboratório: data do preparo, nome do técnico que preparou o reagente, condições de armazenamento e outras informações consideradas pertinentes para o reagente em questão.
- Amostras:
No caso do material ser colhido no Serviço de Referência, a amostra deve ser encaminhada ao laboratório de biologia molecular com a indicação do anti-coagulante utilizado (se for o caso), do nome da pessoa responsável pela coleta e identificação da amostra, assim como data e hora da coleta.
2.2.3 - Ambulatório Multidisciplinar Especializado:
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverão contar, em suas próprias instalações, com Ambulatório Multidisciplinar Especializado.
Serviço de Referência Tipo I – Ambulatório Multidisciplinar Especializado capaz de realizar a orientação familiar, o acompanhamento e tratamento dos pacientes triados em fenilcetonúria e hipotireoidismo congênito. Deverá contar, adicionalmente, com uma rede de serviços complementares.
Serviço de Referência Tipo II – Ambulatório Multidisciplinar Especializado capaz de realizar a orientação familiar, o acompanhamento e tratamento dos pacientes triados em fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias. Deverá contar, adicionalmente, com uma rede de serviços complementares. No caso das doenças falciformes e outras hemoglobinopatias poderá manter um acordo operacional com outros serviços (como Hemocentros, por exemplo) para o acompanhamento/tratamento destas doenças.
Serviço de Referência Tipo III– Ambulatório Multidisciplinar Especializado capaz de realizar a orientação familiar, o acompanhamento e tratamento dos pacientes triados em fenilcetonúria, hipotireodismo congênito, doenças falciformes, outras hemoglobinopatias e fibrose cística. Deverá contar, adicionalmente, com uma rede de serviços complementares. No caso das doenças falciformes e outras hemoglobinopataias poderá manter um acordo operacional com outros serviços (como Hemocentros, por exemplo) para o acompanhamento/tratamento destas doenças. Esta mesma situação é válida para a fibrose cística.
Após confirmação diagnóstica, conforme descrito nos protocolos e diretrizes terapêuticas para tratamento das doenças, todos os pacientes triados no PNTN deverão ser prontamente atendidos por equipe multidisciplinar do Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas.
2.2.3.1 – Instalações Físicas:
O Ambulatório Multidisciplinar deve contar, no mínimo, com o seguinte:
- Sala de espera e recepção;
- Sala de consultas;
- Sala de reuniões para integração da equipe multidisciplinar com a equipe do laboratório.
2.2.3.2 - Recursos Humanos
Deverá ser composto por uma equipe multidisciplinar mínima que contenha:
- 01 (um) médico pediatra;
- 01 (um) médico endocrinologista ou endocrinologista pediátrico;
- 01 (um) nutricionista;
- 01 (um) psicólogo;
- 01 (um) assistente social.
Observação: Um dos profissionais da equipe, preferencialmente um profissional médico, deverá ter recebido uma capacitação técnica em “Aconselhamento Genético específico para Triagem Neonatal” em um serviço reconhecido de Genética Médica.
2.2.3.3 – Materiais e Equipamentos
- Balcão para recepção;
- Cadeiras para a espera;
- Escrivaninha e cadeiras para o(s) consultório(s);
- Mesa de exames;
- Duas balanças: uma para bebê (capacidade até 15 Kg), e outra para pacientes maiores (com medida de estatura acoplada);
- Uma régua para medir estatura de bebês;
- Fita métrica;
- Estetoscópio;
- Material necessário para realização de testes psicométricos.
2.2.3.4 - Rotinas de funcionamento e atendimento:
O Ambulatório deve ter Rotinas de Funcionamento e Atendimento escritas. Sugere-se como horário para os profissionais, inicialmente, um turno dos dias úteis para cada profissional da equipe, com facilidades para sobreaviso caso haja urgência de atendimento para algum caso suspeito. Além disso, um turno específico por semana para reuniões da equipe multidisciplinar. Conforme aumento dos casos detectados, extensão do período de atendimento para novos turnos.
Quando algum caso suspeito é detectado no laboratório, o mesmo deverá imediatamente acionar a Busca Ativa do Serviço de Referência.
- Fenilcetonúria
Os pacientes com fenilcetonúria terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico pediatra, nutricionista, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica, orientação nutricional e aconselhamento genético específico para a patologia quanto ao risco de recorrência. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento da fenilcetonúria.
- Hipotireoidismo Congênito
Os pacientes com hipotireoidismo congênito terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico endocrinologista, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica e aconselhamento genético específico para a patologia quanto ao risco de recorrência, quando necessário. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento do hipotireoidismo congênito.
- Doenças Falciformes e outras Hemoglobinopatias
Os pacientes com doenças falciformes e outras hemoglobinopatias terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico pediatra, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica e aconselhamento genético específico para a patologia quanto ao risco de recorrência. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento das doenças falciformes e outras hemoglobinopatias, no Serviço de Referência em Triagem Neonatal ou em outro serviço (Hemocentro, por exemplo), conforme acordo operacional.
- Fibrose Cística
Os pacientes com fibrose cística terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico pediatra, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica e aconselhamento genético específico para a patologia quanto ao risco de recorrência. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento da fibrose cística, no Serviço de Referência em Triagem Neonatal ou em outro serviço, conforme acordo operacional.
2.2.4 - Sistema de Registro e Informações Automatizado
2.2.4.1 - Descrição Geral
O Serviço de Referência – Tipo I, II ou III, deverá manter registro e controle dos trabalhos e dos resultados, incluindo as amostras, folhas de leitura/documentação originais, por um período de no mínimo 05 (cinco) anos. Para isto deverá dispor de um sistema informatizado de controle de todas as atividades do Serviço, dando agilidade aos procedimentos, rastreabilidade das informações, e segurança na transcrição e emissão de laudos automáticos. Além disso deverá dispor de facilidades de comunicação de dados para troca de informações.
Registro de Pacientes - O Serviço deve possuir um prontuário para cada paciente com as informações completas do quadro clínico e sua evolução, todas devidamente escritas, de forma clara e precisa, datadas e assinadas pelo profissional responsável pelo atendimento. Os prontuários deverão estar devidamente ordenados no Serviço de Arquivo Médico.
2.2.4.2- Funcionamento
Funcionalmente o Sistema de Registro e Informações deverá:
- Identificar univocamente cada amostra recebida (PNTN/MS), com a data de recebimento, origem, e os resultados finais, permitindo sua rastreabilidade;
- Fazer o encaminhamento ordenado das amostras ao laboratório, de forma a manter relação com a identificação original;
- Registrar de forma segura e unívoca os resultados dos testes de cada amostra, registrando através de senhas, o responsável técnico pela liberação dos mesmos;
- Identificar automaticamente os casos que deverão ser reconvocados;
- Receber do laboratório e disponibilizar automaticamente os resultados dos exames realizados, de forma a evitar erros de transcrição;
- Exigir do laboratório que disponibilize rapidamente os resultados, no máximo em 5 dias úteis após o recebimento da amostra, remetendo-os à rede de coleta de forma segura e auditável;
- Receber do laboratório e emitir os resultados por computador em formulários impressos e/ou Internet, devendo constar no mínimo de:
§Resultados individuais para serem entregues aos responsáveis pelo Recém - Nascido;
§Relação de exames processados, para cada remessa feita pelo Posto de Coleta, com os resultados obtidos;
§Relação de amostras que devem ser colhidas novamente, para cada remessa feita pelo Posto de Coleta;
- Manter mecanismos de controle quantitativo e qualitativo do retorno dos casos reconvocados e devolvidos como inadequados da rede de coleta, até o diagnóstico final;
- Manter atualizado os Cadastros de Casos Positivos de cada uma das patologias detectadas, montando um prontuário para cada paciente;
- Fazer a interface com os demais serviços complementares em termos de solicitação de exames, consultas, procedimentos e resultados de exames específicos para os pacientes positivos, fornecendo e recebendo as informações necessárias ao atendimento;
- Manter os arquivos de dados dos exames realizados, para efeito de rastreamento e estatísticas, pelo período mínimo de 05 (cinco) anos;
- Facilitar a comunicação de dados, sugerindo-se a conexão das estações de trabalho em rede local, para compartilhamento de programas e dados; e conexão à Internet por transmissão de banda larga (modem de alta velocidade, cable, DSL, etc.);
- Manter procedimentos especiais de segurança, devendo para tanto, manter no local, cópias diárias de segurança dos arquivos e programas instalados, e em armazenamento externo, cópias semanais dos mesmos arquivos e programas;
- Enviar, periodicamente, quaisquer dados solicitados pela SAS/MS, para composição do Banco de Dados de Triagem Neonatal;
2.2.4.3 – Equipamentos Básicos
Os equipamentos de informática deverão ser em número suficiente para prover agilidade à rotina, permitindo a liberação rápida de resultados. Tipicamente deverão ser microcomputadores conectados em rede a um servidor central. Assim sugere-se a seguinte composição:
- Um servidor central que armazenará os dados;
- Um servidor de reserva, de capacidade similar a do servidor principal, com imagem do disco do servidor central, de forma a poder assumir o processamento em 15 minutos após a falha do servidor principal;
-Estações de trabalho individuais, em número adequado, instaladas nos postos de trabalho do Serviço de Referência, como: Seleção de Amostras, Secretaria, Laboratório, Impressão e Remessa de Resultados, Atendimento de Reconvocados, Ambulatório e outros.
2.2.4.4 – Instalações Físicas
Os servidores de dados, principal e reserva, deverão ser instalados em local isolado, de acesso restrito, em ambiente com temperatura constante em torno de 25 graus centígrados e livre de poeira.
Todos os equipamentos deverão receber alimentação elétrica com tensão e freqüência constantes, sendo todos conectados a um circuito terra, comum e específico a todos eles.
Os servidores deverão ser alimentados por uma fonte de energia sem interrupção, com bateria de capacidade de 15 minutos após a falha de energia.
Todos os equipamentos de rede e servidores deverão ser adquiridos de boas fontes de fornecimento.
2.2.4.5 – Recursos Humanos
Para a operação dos sistemas e primeiro suporte em emergências, o Serviço de Referência deve contar com, no mínimo, um operador técnico de nível médio, capaz de:
- operar todas as rotinas do sistema;
- permitir e controlar o acesso dos usuários às rotinas e dados do sistema;
- diagnosticar falhas na rede, equipamentos e sistemas operativos, dando o primeiro atendimento em situações anormais;
- executar os procedimentos rotineiros de segurança.
2.2.5 – Rede Assistencial Complementar
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de Tipo I, II e III devem contar, segundo suas necessidades e de acordo com as doenças triadas/acompanhadas/tratadas relativas a seu Tipo e à Fase de Implantação do Programa em que o estado esteja habilitado, com uma rede assistencial complementar. Esta rede tem o objetivo de garantir o atendimento integral e integrado aos pacientes triados no Serviço de Referência e de garantir o acesso dos pacientes a procedimentos não disponíveis no Serviço de Referência.
2.2.5.1 – Estruturação da Rede
Cabe à Secretaria de Saúde dos estados e do Distrito Federal articular, em conjunto com seu(s) respectivo(s) Serviço(s) de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas a rede assistencial complementar. A unidades hospitalares, ambulatoriais e laboratoriais, pertencentes à rede estadual e/ou municipal, deverão ser disponibilizadas pelos gestores locais do SUS.
Na estruturação da rede complementar, deverão ser considerados os seguintes aspectos:
- Qualidade, resolutividade dos serviços com capacidade instalada para atendimento da demanda esperada;
- Regionalização dos serviços, permitindo a facilidade de deslocamento dos pacientes ou envio das amostras.
Na eventual necessidade de constituir a rede complementar com serviços/hospitais de outro estado que não o daquele do Serviço de Referência, os gestores estaduais do SUS dos estados envolvidos deverão articular a relação entre o Serviço de Referência e o(s) serviço(s)/hospital(is) complementares.
- Formalização da Rede Assistencial Complementar – a relação entre o Serviço de Referência em Triagem Neonatal e as unidades integrantes da rede assistencial complementar deverá ser devidamente formalizada, em documento escrito e assinado pelas partes, com a interveniência do(s) respectivo(s) gestor(es) estadual(is) do SUS, onde fique mínima e claramente expresso o seguinte:
- tipo de assistência complementar a ser prestada;
- a concordância do serviço complementar em receber os pacientes referenciados pelo Serviço de Referência em Triagem Neonatal;
- declaração do serviço complementar de que prestará os serviços pelo SUS e que os mesmos não acarretarão ônus de qualquer espécie, ao paciente e/ou a seus familiares;
2.2.5.2 - Composição da Rede
A rede deverá prover acesso, conforme a necessidade do Serviço de Referência em Triagem Neonatal, em uma unidade ou mais aos seguintes serviços:
- Serviço Ambulatorial Especializado em Doenças Falciformes (DF) e Hemoglobinopatias (Hbpatias):
O Serviço deverá dispor de uma equipe mínima composta de um hematologista pediátrico e um hematologista de adulto, ambos com título de especialista.
- Serviço Ambulatorial Especializado em Fibrose Cística (FC):
O Serviço deverá dispor de uma equipe mínima composta de um pneumologista pediátrico e um pneumologista de adulto, ambos com título de especialista além de um fisioterapeuta e serviço de radiologia.
- Rede Hospitalar de retaguarda credenciada para o atendimento emergencial, internamento e UTI para pacientes portadores de Doenças Falciformes, Hemoglobinopatias e Fibrose Cística - O Hospital de referência deverá ser um Hospital Geral/Especializado, com UTI infantil e de adulto, serviço de emergência e internação.
ANEXO XXV
ASSISTÊNCIA HOSPITALAR EM PSIQUIATRIA NO SUS (Origem: PRT MS/GM 251/2002, Anexo 1)
1. DIRETRIZES:
2. NORMAS PARA O ATENDIMENTO HOSPITALAR
2.1 Entende-se como hospital psiquiátrico aquele cuja maioria de leitos se destine ao tratamento especializado de clientela psiquiátrica em regime de internação.
2.2 - Determinações gerais:
2.2.1. o hospital deve articular-se com a rede comunitária de saúde mental, estando a porta-de-entrada do sistema de internação situada no serviço territorial de referência para o hospital;
2.2.2.está proibida a existência de espaços restritivos (celas fortes);
2.2.3.deve ser resguardada a inviolabilidade da correspondência dos pacientes internados;
2.2.4.deve haver registro adequado, em prontuário único, dos procedimentos diagnósticos e terapêuticos nos pacientes, ficando garantida, no mínimo, a seguinte periodicidade:
2.3 - Estes serviços devem oferecer, de acordo com a necessidade de cada paciente, as seguintes atividades:
a) avaliação médico-psicológica e social;
b) garantia do atendimento diário ao paciente por, no mínimo, um membro da equipe multiprofissional, de acordo com o projeto terapêutico individual;
c) atendimento individual (medicamentoso, psicoterapia breve, terapia ocupacional, dentre outros);
d) atendimento grupal (grupo operativo, psicoterapia em grupo, atividades socioterápicas);
e) preparação do paciente para a alta hospitalar, garantindo sua referência para a continuidade do tratamento em serviço territorial com programa de atenção compatível com sua necessidade (ambulatório, hospital-dia, núcleo/centro de atenção psicossocial), e para residência terapêutica quando indicado, sempre com o objetivo de promover a reintegração social e familiar do paciente e visando prevenir a ocorrência de outras internações;
f) essas atividades deverão constituir o projeto terapêutico da instituição, definido como o conjunto de objetivos e ações, estabelecidos e executados pela equipe multiprofissional, voltados para a recuperação do paciente, desde a admissão até a alta. Inclui o desenvolvimento de programas específicos e interdisciplinares, adequados à característica da clientela, e compatibiliza a proposta de tratamento com a necessidade de cada usuário e de sua família. Envolve, ainda, a existência de um sistema de referência e contra-referência que permite o encaminhamento do paciente após a alta, para a continuidade do tratamento. Representa, enfim, a existência de uma filosofia que norteia e permeia todo o trabalho institucional, imprimindo qualidade à assistência prestada. O referido projeto deverá ser apresentado por escrito;
g) desenvolvimento de projeto terapêutico específico para pacientes de longa permanência - aqueles com mais de 01 (um) ano ininterrupto de internação. O projeto deve conter a preparação para o retorno à própria moradia ou a serviços residenciais terapêuticos, ou a outra forma de inserção domiciliar;
h) desenvolvimento de projetos terapêuticos específicos para pacientes com deficiência física e mental grave e grande dependência;
i) abordagem à família: orientação sobre o diagnóstico, o programa de tratamento, a alta hospitalar e a continuidade do tratamento.
2.4 Com vistas a garantir condições físicas adequadas ao atendimento da clientela psiquiátrica internada, deverão ser observados os parâmetros das Normas Específicas referentes à área de engenharia e arquitetura e vigilância sanitária em vigor, Portaria GM/MS N° 1884, de 11 de novembro de 1994, ou a que vier substituí-la, expedidas pelo Ministério da Saúde.
2.5 O hospital psiquiátrico especializado deverá destinar 1 enfermaria para intercorrências clínicas, com um mínimo de 6m2/leito e número de leitos igual a 1/50 do total do hospital, com camas "Fowler", oxigênio, aspirador de secreção, vaporizador, nebulizador e bandeja ou carro de parada, e ainda:
2.6 O hospital psiquiátrico especializado deverá ter sala(s) de estar, jogos, etc., com um mínimo de 40 m2, mais 20m2 para cada 100 leitos a mais ou fração, com televisão e música ambiente nas salas de estar.
2.7 .Recursos Humanos
Os hospitais psiquiátricos especializados deverão contar com, no mínimo:
E ainda:
O psiquiatra plantonista poderá, também, compor uma das equipes básicas como psiquiatra assistente, desde que, além de seu horário de plantonista cumpra 15 horas semanais em, pelo menos três outros dias da semana.
A composição dos recursos humanos deve garantir a continuidade do quantitativo necessário em situações de férias, licenças e outros eventos.
ANEXO XXVI
PROGRAMA NACIONAL DE QUALIDADE EM MAMOGRAFIA (PNQM) E PROGRAMA DE GARANTIA DE QUALIDADE (PGQ) - FORMULÁRIO DE AVALIAÇÃO (Origem: PRT MS/GM 2898/2013, Anexo 1)
| PROGRAMA NACIONAL DE QUALIDADE EM MAMOGRAFIA - PNQM PROGRAMA DE GARANTIA DE QUALIDADE- PGQ | |||
| Formulário de Avaliação | |||
| Número do CNES do estabelecimento: | |||
| ITEM | QUESTÃO | SIM | NÃO |
| 1 | O serviço possui um Programa de Garantia da Qualidade (PGQ). | ||
| 2 | O PGQ contempla ações que envolvam a gestão da estrutura, do processo e dos resultados. | ||
| 3 | Os objetivos e as atividades do PGQ são divulgados aos profissionais do serviço. | ||
| 4 | Há um representante da administração formalmente designado com autoridade e responsabilidade para assegurar que as ações relativas ao PGQ sejam estabelecidas e mantidas. | ||
| 5 | O PGQ está descrito em um manual ou em documento equivalente. | ||
| 6 | O desempenho do PGQ é avaliado periodicamente pelos responsáveis. | ||
| 7 | A avaliação do desempenho do PGQ é documentada. | ||
| 8 | O serviço tem procedimentos de auditorias internas para verificar se o PGQ está conforme os requisitos estabelecidos. | ||
| 9 | Existem relatórios de auditoria interna da qualidade indicando as não conformidades encontradas. | ||
| 10 | Existem registros da implementação das ações corretivas recomendadas nos relatórios de auditoria interna. | ||
| 11 | Os profissionais do serviço são capacitados para executar adequadamente as tarefas a eles designadas. | ||
| 12 | São mantidos registros dessas capacitações. | ||
| 13 | O serviço toma as medidas necessárias para assegurar que nenhum paciente seja submetido a uma exposição médica sem que seja solicitada por um médico. | ||
| 14 | Existem mecanismos para garantir que as doses administradas nos pacientes em decorrência dos exames sejam as menores possíveis, conforme os níveis de referência estabelecidos na normatização vigente. | ||
| 15 | Existe registro das medidas preventivas adotadas pelo serviço para evitar falhas no processo de trabalho. | ||
| 16 | Existe registro das medidas corretivas adotadas pelo serviço quando identificadas falhas nos processos de trabalho. | ||
| 17 | Os profissionais são informados quando da ocorrência de erros relacionados ao desempenho incorreto de suas funções. | ||
| 18 | O serviço possui Plano de Gerenciamento de Tecnologias implantado. | ||
| 19 | Existe um programa documentado de manutenção preventiva dos equipamentos. | ||
| 20 | Existe um programa documentado de manutenção corretiva dos equipamentos. | ||
| 21 | Existe um programa documentado de limpeza dos equipamentos. | ||
| 22 | Existem mecanismos para garantir a adequação da calibração e das condições de operação dos instrumentos de monitoração e de dosimetria do feixe. | ||
| 23 | O responsável pelo serviço participa do processo de compra dos produtos e insumos utilizados. | ||
| 24 | Existem especificações de compras de produtos e insumos definindo claramente os requisitos a serem atendidos pelo fornecedor. | ||
| 25 | O serviço notifica os eventos adversos relacionados ao uso dos equipamentos aos órgãos competentes. | ||
| 26 | O serviço executa os testes de desempenho dos equipamentos periodicamente (Controle de Qualidade - CQ). | ||
ANEXO XXVII
TESTES DE CONTROLE DE QUALIDADE (Origem: PRT MS/GM 2898/2013, Anexo 2)
Seção 1 - Dados Pessoais
1. Nome completo (insira aqui o seu nome completo)
2. Endereço eletrônico (insira aqui o seu e-mail. Ex: ciclano@provedor.com)
3. Telefones (insira aqui o(s) seu(s) telefones)
4. Instituição (nome da instituição em que você trabalha)
Seção 2 - Dados Profissionais
5. Vínculo com a vigilância sanitária
Seção 3 - Informações Gerais
6. Razão social do estabelecimento
7. Nome fantasia do estabelecimento
8. CNPJ (digite o número do CNPJ com os caracteres)
9. Endereço
10. Número de inscrição no Cadastro Nacional de Estabelecimentos de Saúde (CNES)
11. Atividade
12. Telefone
13. Responsável técnico
14. Quantos mamógrafos existem no serviço? (informe apenas números)
15. Data (data do preenchimento)
Seção 4 - Outros Dados
16. Qual é o número de série do mamógrafo?
17. O mamógrafo possui registro atualizado na Anvisa? Deve-se verificar se o equipamento estava com registro válido na Anvisa na data da sua compra. Não se aplica aos mamógrafos comprados antes de 2001.
18. O serviço apresentou os testes de aceitação do mamógrafo? Na aceitação do equipamento, devem ser realizados todos os testes pertinentes descritos na Portaria SVS/MS nº. 453/98. As medidas de atenuação da bandeja de compressão e do receptor de imagem são realizadas apenas na aceitação e, portanto, não devem ser exigidas periodicamente.
19. Como estão os resultados do levantamento radiométrico? O levantamento radiométrico deve ser realizado a cada quatro anos OU após a realização de modificações autorizadas OU quando houver mudança na carga de trabalho semanal ou nas características ou ocupação das áreas circunvizinhas.
20. O serviço enviou o relatório do Programa de Garantia de Qualidade?
21. Como estão os valores representativos de dose? Estas medidas devem ser realizadas a cada 2 (dois) anos.
22. Como está a exatidão do indicador de tensão do tubo (KVp)? Este teste deve ser realizado anualmente.
23. Como está a reprodutibilidade da tensão do tubo (KVp)? Recomenda-se a realização anual deste teste.
24. Como está a exatidão do tempo de exposição? Este teste deve ser realizado anualmente.
25. Como está a reprodutibilidade do tempo de exposição? Recomenda-se a realização anual deste teste.
26. Como está a reprodutibilidade da exposição (taxa de kerma no ar)? Este teste deve ser realizado anualmente.
27. Como está a medida da camada semi-redutora (CSR ou HVL, em inglês)? A medida da CSR deve ser realizada anualmente.
28. Como está a linearidade da taxa de kerma no ar com o mAs? Este teste deve ser realizado anualmente.
29. O mamógrafo possui sistema automático de exposição?
30. Como está a reprodutibilidade do sistema automático de exposição? Este teste deve ser realizado anualmente.
31. Como está o tamanho do ponto focal? Esta medida deve ser realizada anualmente.
32. Como está a integridade dos EPI? Essa avaliação deve ser realizada anualmente.
33. Como está a vedação da câmara escura? Este teste deve ser realizado anualmente.
34. Como está a exatidão do sistema de colimação? Este teste deve ser realizado semestralmente.
35. Como estão o contato tela-filme e a integridade das telas e chassis? Estes testes devem ser realizados semestralmente.
36. O mamógrafo possui grade antidifusora?
37. A luminância do(s) negatoscópio(s) está entre 3.000 e 3.500 nit? Essas medidas devem ser realizadas semestralmente.
38. O serviço apresentou o índice de rejeição de mamografias? Este índice deve ser apresentado semestralmente.
39. Qual é o percentual de mamografias rejeitadas? Ex: Se o percentual de mamografias rejeitadas for de 10%, digite 10.
40. A qualidade da imagem, avaliada no simulador, está adequada? Em cada equipamento de mamografia, deve ser realizada, mensalmente, uma avaliação da qualidade de imagem com um simulador mamográfico equivalente ao adotado pelo Colégio Americano de Radiologia (ACR), e com registro válido junto à Anvisa.
41. O mamógrafo possui sistema automático de compressão? O sistema de compressão possibilita compressão apenas entre 11 e 18 kgf?
42. Como está a sensitometria do sistema de processamento? Este teste deve ser realizado diariamente.
Tabela auxiliar
| Testes de Controle de Qualidade | |||
| Testes | Periodicidade | Tolerância | |
| 1 | Dose de entrada na pele | Bienal | < 10 mGy (Grade) |
| 2 | Exatidão do indicador de tensão do tubo | Anual | 2kV |
| 3 | Reprodutibilidade da tensão do tubo | Anual (recomendado) | 10% |
| 4 | Exatidão do tempo de exposição | Anual | 10% |
| 5 | Reprodutibilidade do tempo de exposição | Anual (recomendado) | 10% |
| 6 | Reprodutibilidade da exposição (taxa de kerma no ar) | Anual | 10% |
| 7 | Camada semirredutora | Anual | (kVp/100)<CSR<(kVp/100 + 0,1) |
| 8 | Linearidade da taxa de kerma com mAs | Anual | 20% |
| 9 | Reprodutibilidade do sistema automático de exposição | Anual | 10% |
| 10 | Tamanho do ponto focal | Anual | < 0,4 mm |
| 11 | Integridade dos acessórios e vestimentas (EPI) | Anual | Visual |
| 12 | Vedação da câmara escura | Anual | Visual |
| 13 | Exatidão do sistema de colimação | Semestral | 2% DFF |
| 14 | Contato tela filme/integridade dos chassis | Semestral | Visual |
| 15 | Condições dos negatoscópios | Semestral | Entre 3.000 e 3.500 nit |
| 16 | Índice de rejeição de mamografias | Semestral | - |
| 17 | Imagem do simulador tipo ACR | Mensal | Fibra de 0,75 mm; massas de 0,75 mm e microcalcificações de 0,32mm |
| 18 | Força de compressão | Anual | entre 11 e 18 Kgf |
| 19 | Alinhamento da placa de compressão | Anual (recomendado) | Visual |
| 20 | Sensitometria | Diária | - |
| 21 | Transmissão do suporte receptor | Aceitação/Manutenção | < 1µGya 5 cm |
| 22 | Gerador trifásico ou alta frequência | Aceitação/Manutenção | - |
| 23 | Distância foco-pele | Aceitação/Manutenção | > 30 cm |
Observação:
No caso dos equipamentos de mamografia digital (CR ou DR), aplicam-se todos os testes previstos na Portaria nº 453/SVS/MS, 1º de junho de 1998, exceto aqueles relacionados ao processamento da imagem. Lembramos que o serviço deve realizar todos os testes recomendados pelos fabricantes dos equipamentos, inclusive avaliação dos monitores utilizados nos laudos, quando houver.
ANEXO XXVIII
DOS CRITÉRIOS DE QUALIDADE PARA A AVALIAÇÃO DA QUALIDADE DAS IMAGENS CLÍNICAS DAS MAMAS E DO LAUDO D (Origem: PRT MS/GM 2898/2013, Anexo 3)
DOS CRITÉRIOS DE QUALIDADE PARA A AVALIAÇÃO DA QUALIDADE DAS IMAGENS CLÍNICAS DAS MAMAS E DO LAUDO DAS MAMOGRAFIAS DO PNQM
Das Imagens Radiográficas
Os serviços de diagnóstico por imagem que realizam mamografia deverão atender aos seguintes requisitos de qualidade das imagens radiográficas:
I - nas imagens, devem constar:
a) a identificação do exame;
b) a identificação do serviço de diagnóstico por imagem;
c) o registro do paciente;
d) a data do exame;
e) a abreviatura da incidência radiográfica;
f) a lateralidade da mama;
II - cada uma das imagens que compõem o exame deve conter uma identificação legível, que não se sobreponha às estruturas anatômicas;
III - a identificação do exame deve ser feita por uma legenda posicionada nos quadrantes laterais da imagem, quando se tratar de uma incidência axial, e nos quadrantes superiores da imagem, quando se tratar de uma incidência lateral;
IV - a abreviatura da incidência radiográfica deve sempre estar acompanhada da indicação da lateralidade da mama representada pela letra E para a mama esquerda e pela letra D ou R E ou L para a mama direita, observadas as seguintes abreviaturas:
a) crânio-caudal: CC-D e CC-E;
b) médio-lateral oblíqua: MLO-D e MLO-E;
c) crânio-caudal exagerada: XCC-D e XCC-E
d) cleavage: CV-D e CV-E;
e) perfil ou médio-lateral: ML-D e ML-E;
f) perfil medial ou látero-medial: LM-D e LM-E;
g) caudo-cranial: RCC-D e RCC-E;
h) ampliação: AMP;
i) axila: AXI-D e AXI-E;
j) incidência com utilização da manobra de Eklund: EKL;
V - o exame deve ser composto por, no mínimo, duas incidências básicas de cada mama: a crânio-caudal e a médio-lateraloblíqua, observado o seguinte:
a) se as imagens forem analógicas, devem ser feitas em filmes separados;
b) se as imagens forem digitais, devem ser impressas em filme específico, sem redução, ou gravadas em meio magnético;
VI - a critério do médico interpretador do exame, devem ser realizadas incidências radiográficas complementares ou manobras, sempre que forem detectadas alterações nas incidências básicas que mereçam melhor avaliação;
VII - sempre que possível, nas mulheres com implantes mamários devem ser realizadas, para cada mama, as duas incidências básicas e duas incidências com a manobra de deslocamento posterior da prótese (manobra de Eklund), salvo quando impossível a manobra, caso em que fica recomendada a realização de incidências em perfil complementares bilaterais;
VIII - para a realização do exame, a mama deve ser comprimida com o objetivo de reduzir os efeitos de imagem causados pela sobreposição dos tecidos mamários, e não deve ser introduzido nenhum artefato de imagem originado durante a compressão da mama, inclusive dobra de tecido cutâneo;
IX - o nível de exposição da mama aos raios-X deve ser estabelecido, na rotina dos exames, pelo dispositivo de controle automático do mamógrafo, de modo que as imagens para interpretação apresentem uma escala de contraste que permita uma boa diferenciação das diversas densidades dos tecidos mamários;
X - os contornos das estruturas normais e patológicas da mama devem se apresentar na imagem radiográfica com perda mínima de definição, sem borramento;
XI - o ruído presente na imagem deve ser imperceptível, de modo a não dificultar a visualização das estruturas normais da mama, evitando a simulação de achados radiológicos inexistentes que simulem lesões;
XII - a imagem radiográfica deve estar livre de artefatos de qualquer origem; e
XIII - nas imagens digitais, deve haver:
a) visualização da linha da pele, dos ligamentos de Cooper e das estruturas vasculares nas áreas claras e escuras;
b) ausência de ruído perceptível nas áreas claras e escuras;
c) contraste suficiente nas áreas claras e escuras, com tecido glandular claro e área de fundo escura e sem saturação dos tons de cinza, tanto nas áreas claras como nas áreas escuras das imagens;
d) na incidência crânio-caudal, também devem-se observar os seguintes critérios:
1. as mamas devem estar simétricas, havendo boa visibilidade dos quadrantes mediais e laterais, sem favorecer um quadrante em detrimento do outro;
2. o músculo peitoral deve ser visto em cerca de 30% (trinta por cento) dos exames;
3. a gordura retromamária deve ser vista em todos os exames, demonstrando que a parte glandular da mama foi radiografada, as estruturas vasculares devem ser vistas em regiões de parênquima denso; e
4. a papila deve estar paralela ao filme e posicionada no raio de 12 (doze) horas; e
e) na incidência médio-lateral oblíqua, também devem-se observar os seguintes requisitos:
1. as mamas devem estar simétricas;
2. o músculo grande peitoral deve ser visto, no mínimo, até a altura da papila, com borda anterior convexa;
3. o sulco inframamário deve ser visto na borda inferior da imagem;
4. a gordura retromamária deve ser vista em todos os exames, demonstrando que a parte glandular da mama foi radiografada; e
5. a papila deve estar paralela ao filme, as estruturas vasculares devem ser vistas em regiões de parênquima denso e a mama não deve estar pêndula.
Do Laudo Radiográfico
Os serviços de diagnóstico por imagem que realizam mamografia devem atender aos critérios de qualidade para a leitura dos exames e a expedição dos laudos radiográficos, nos seguintes termos:
I a leitura dos exames em filmes fica reservada aos exames que não utilizam tecnologia digital e a leitura dos exames realizados em equipamentos com tecnologia digital deve ser feita, preferencialmente, em monitores específicos para interpretação das imagens das mamas; e
II o laudo radiográfico deve conter as seguintes informações:
a) identificação do serviço, da idade do examinado e data do exame;
b) se exame de rastreamento ou de diagnóstico;
c) número de filmes ou imagens;
d) padrão mamário;
e) achados radiográficos;
f) classificação BI-RADS®;
g) recomendação de conduta; e
h) nome e assinatura do médico interpretador do exame.
ANEXO XXIX
INDICADORES PARA MONITORAMENTO DOS RESULTADOS REFERENTES À QUALIDADE DO EXAME MAMOGRÁFICO (Origem: PRT MS/GM 2898/2013, Anexo 4)
INDICADORES PARA MONITORAMENTO DOS RESULTADOS REFERENTES À QUALIDADE DO EXAME MAMOGRÁFICO
a) Percentual de mamografias de rastreamento positivas na população entre 50-69 anos.
Fórmula de cálculo:
Nº de mamografias de rastreamento (50-69 anos) BI-RADS® 0, 4, 5 / Nº total de mamografias de rastreamento (50-69 anos) X 100.
b) Percentual de mamografias diagnósticas positivas com achados no exame clínico.
Fórmulas de cálculo:
Nº de mamografias diagnósticas positivas BI-RADS® 4 ou 5/Nº total de mamografias diagnósticas com informação de "achados no exame clínico" X 100.
c) Taxa de detecção de câncer em mamografias de rastreamento
Fórmula de cálculo:
Nº de mulheres na faixa etária de 50-69 anos com exame histopatológico positivo com data posterior à realização da mamografia de rastreamento no período de 12 meses/ Nº de mulheres na faixa etária de 50-69 anos com mamografia de rastreamento no período de 12 meses p/ 1.000 mulheres.
d) Valor preditivo positivo em mamografias de rastreamento com recomendação de biópsia
Fórmula de cálculo:
Nº de mulheres com BI-RADS® 4 e 5 em mamografia de rastreamento na faixa etária de 50-69 anos com recomendação de biópsia e histopatológico positivo /Total de mulheres com mamografia de rastreamento com BI-RADS® 4 e 5 na faixa etária de 50-69 anos com recomendação de biópsia X 100.
e) Valor preditivo positivo em mamografias diagnósticas por "achados no exame clínico" com recomendação de biópsia.
Fórmula de cálculo:
Nº de mulheres com BI-RADS® 4 e 5 em mamografia diagnóstica por "achados no exame clínico" e histopatológico positivo / Total de mulheres com mamografia diagnóstica por "achados no exame clínico" e BI-RADS® 4 e 5 com recomendação de biópsia X 100.
ANEXO XXX
INSTRUÇÕES NORMATIVAS PARA DIAGNÓSTICO, TRATAMENTO E CONTROLE DO PÊNFIGO FOLIÁCEO ENDÊMICO (FOGO SELVAGEM) (Origem: PRT MS/GM 1400/1991, Anexo 1)
O Controle de Pênfigo Foliáceo Endêmico, devido a sua endemicidade em algumas regiões do Brasil, baseia-se no:
1- DIAGNÓSTICO - O diagnóstico do Pênfigo Foliáceo Endêmico baseia-se em suas características clínicas e em exames laboratoriais.
1.1- Exame clínico - Deve-se valorizar as lesões bolhosas e erosivas e suas localizações preferenciais, o sinal de Nikolsky e a procedência do doente.
As lesões características estão representadas por bolhas de teto frouxo que rapidamente se rompem para deixar áreas erosadas, inicialmente eritematosas e que se tornam escamo-crostosas. É frequente o doente não perceber a existência de bolhas íntegras, mas, apenas o aparecimento das áreas erosadas, que determinam a sensação de prurido e ardência. As lesões podem permanecer localizadas por longo tempo, ou podem evoluir e invadir parte, ou mesmo, todo o tegumento (eritrodermia).
É frequente a ocorrência de infecção secundária sobre estas lesões, exalando odor característico.
As lesões iniciais distribuem-se preferencialmente pelas áreas ditas seborréicas, como couro cabeludo, face, região pré-esternal e interescapular.
O sinal de Nikolsky é precoce e de grande utilidade, e deve ser pesquisado em pele aparentemente sã, fazendo-se pressão digital e movimento de deslizamento - é positivo quando há erosão da área pesquisada.
Epidemiologicamente, a procedência do paciente de áreas reconhecidamente endêmicas é um dado muito importante para o diagnóstico.
1.2- Exames Laboratoriais - A confirmação diagnóstica deve ser feita através de exame histopatológico de material obtido de biópsia de pele, o qual deve ser colhido preferencialmente, em lesão bolhosa recente ou em sua ausência, na borda de uma lesão erosada.
Histopatologicamente a bolha está situada nas camadas mais superficiais da epiderme, logo abaixo da camada córnea, e, em seu interior, são encontradas células acantolíticas.
O citodiagnóstico e a imunofluorescência são úteis, porém representam recursos complementares somente utilizáveis em centros especializados.
2- TRATAMENTO - Baseia-se na corticoterapia por via oral, que representa, até o momento o principal recurso efetivo para a remissão clínica da doença, sendo de primeira escolha a prednisona e, de segunda escolha, a triancinolona na dose equivalente.
2.1- Prednisona
a) Dose de ataque - Se faz com 1 a 1,5mg/Kg/dia, em dose única, no café da manhã, até o desaparecimento do quadro erosivo bolhoso, o que ocorre na maioria das vezes, após 30 a 40 dias de tratamento.
b) Redução progressiva - Deve ser feita com a diminuição de 10mg de 10 em 10 dias, até conseguir a dose mínima que mantenha o doente sem lesão.
c) Dose de manutenção - Geralmente deve ser feita com dose em torno de 10 a 20mg ao dia, por um período de 3 meses. Mantendo-se a remissão dos sintomas, esta dose poderá ser dada em dias alternados. Após 6 a 12 meses, sem lesões, pode-se tentar administrar a dose de manutenção de 3 em 3 dias.
d) Retirada do corticosteróide - Somente quando o doente se mantém, pelo menos, de 1 a 3 anos livre de sintomas.
e) Em casos frustos (formas benignas ou localizadas da doença), a dose de ataque pode ser de 20 a 40mg de prednisona ao dia.
f) Tratamento local- deve ser feito com banhos de permanganato de potássio (KMnO4) na diluição de 1:30.000 para as exsudativas; a medida que as lesões vão se tornando menos úmidas, faz-se o uso de cremes de corticosteróides associados a antibióticos. Para as fases secas, usa-se pomadas de corticosteróides.
É de fundamental importância evitar complicações secundárias, que podem ser responsáveis pela evolução desfavorável do quadro clínico.
A antibioticoterapia deve ser instituída, em caso de ocorrência de infecção secundária.
2.2- Recomendações
a) na fase de diagnóstico e início da terapêutica, o doente deve permanecer internado, sob assistência de serviços especializados e rigorosa vigilância médica, exceto na forma frusta, quando o mesmo pode ser mantido em regime ambulatorial sob acompanhamento médico.
b) em zonas endêmicas dever-se-á capacitar hospitais gerais regionais para diagnóstico e tratamento.
c) os doentes em fase de remissão da moléstia, recebendo dose de manutenção do corticosteróide, deverão ser encaminhados para acompanhamento ambulatorial na unidade de saúde mais próxima ao seu domicílio.
3- PROFILAXIA
3.1- Ainda não se pode padronizar medidas de caráter preventivo, porque a etiopatogenia do Pênfigo Foliáceo Endêmico ainda está em fase de elucidação.
3.2- A doença não se transmite de homem para homem.
3.3- Sabe-se que a moléstia envolve a formação de autoanticorpos, dirigidos para os espaços intercelulares da epiderme (anticorpos antiepiteliais), o que parece filiar o Pênfigo Foliáceo Endêmico (fogo-selvagem) ao grupo das moléstias autoimunes.
3.4- Contudo, pouco se sabe e nada se pode afirmar seguintes aspectos:
a) a existência de algum agente infeccioso;
b) a participação de vetores alados borrachudo
c) o mecanismo pelo qual se deflagra o processo de auto-anticorpos.
3.5- Nos estados endêmicos, a notificação de casos diagnósticados à unidade sanitária mais próxima representa elemento fundamental para a avaliação da gravidade do problema, e, deverá ser feita no formulário próprio, já existente, para as doenças de notificação compulsória.
Estas instruções normativas estão detalhadas no guia para controle do Pênfigo Foliáceo.
ANEXO XXXI
MODELO DE PLANO DE TRABALHO PARA APOIO À IMPLANTAÇÃO DA ESTRATÉGIA E-SUS AB (Origem: PRT MS/GM 58/2015, Anexo 1)
I.Abrangência da Oferta
| MUNICÍPIOS CONTEMPLADOS | Nº DE UNIDADES DE SAÚDE DE ACORDO COM OS POSSÍVEIS CENÁRIOS DE IMPLANTAÇÃO | Nº TOTAL DE EQUIPES CONTEMPLADAS | ||||||
| Nº | % EM RELAÇÃO AO TOTAL | CDS-UBS | CDS-SMS | PEC CDS | PEC | TOTAL | Nº | % EM RELAÇÃO AO TOTAL |
II.Planejamento detalhado das ações
| EIXOS | RESULTADOS ESPERADOS | AÇÕES | DESCRIÇÃO/DETALHAMENTO | PRAZO DA ATIVIDADE | RESPONSÁVEIS | CRONOGRAMA |
| Materiais didáticos e de apoio à implantação | ||||||
| Formação de Multiplicadores | ||||||
| Apoio presencial | ||||||
| Monitoramento de implantação | ||||||
| Contratação de recursos humanos | ||||||
| Outros |
III.Planejamento orçamentário
| ITEM | QUANTIDADE | VALOR | CRITÉRIO | PRAZO | VALOR TOTAL |
| ... | |||||
| ... | |||||
| TOTAL | R$ 00000,00 |
ANEXO XXXII
NORMAS TÉCNICAS PARA DIAGNÓSTICO, TRATAMENTO E CONTROLE DA LEISHMANIOSE TEGUMENTAR AMERICANA (Origem: PRT MS/GM 1402/1991, Anexo 1)
NORMAS TÉCNICAS PARA DIAGNÓSTICO, TRATAMENTO E CONTROLE DA LEISHMANIOSE TEGUMENTAR AMERICANA
O controle da Leishmaniose Tegumentar será orientado para os seguintes objetivos:
- O diagnóstico do doente, através do atendimento de demanda, fornecimento de insumos para diagnóstico complementar, investigação de focos e recebimento de notificações;
- orientação terapêutica padronizada, com o fornecimento da medicação e acompanhamento do doente;
- a investigação epidemiológica dos focos e adoção de medidas profiláticas pertinentes;
- a educação em saúde, através da ação participativa envolvendo os usuários dos serviços de saúde, equipes técnicas e a população em geral, de modo a fomentar a percepção do problema e a necessidade dos recursos a serem aplicados em cada realidade.
1. DIAGNÓSTICO - Para qualquer das formas deve ser clínico, epidemiológico e laboratorial, exceto nas áreas onde não se dispõe de recursos laboratoriais.
1.1- Diagnóstico clínico - A forma ulcerada franca é a mais comum, caracteriza-se por úlcera, com bordas elevadas em moldura, fundo granuloso com ou sem exsudação e indolor. Outras formas encontradas são a úlcero-crostosa, impetigoide, úlcero-vegetante, verrucosa, tuberosa, liquenóide ou framboesiforme. Na fase inicial é frequente a linfangite e/ou a adenopatia satélite às lesões. Quando existem lesões mucosas as queixas são de obstrução e eliminação de crostas nasais, epistaxes, e ao exame, ulceração de septo nasal.
1.2- Diagnóstico epidemiológico - Baseia-se em informações sobre residência e procedência do paciente, residências anteriores, e atividades profissionais relacionadas com desmatamento. Em presença de lesões suspeitas de mucosas deve-se investigar a preexistência de lesão cutânea, e a procedência e atividade profissional do paciente, naquela ocasião.
1.3- Diagnóstico laboratorial - Baseia-se na evidenciação do parasita e em provas imunológicas.
1.3.1- Diagnóstico parasitológico
A evidenciação do parasita é feita através de exames direto e indireto. Para a pesquisa direta são utilizados os seguintes procedimentos: escarificação, punção aspirativa, impressão por aposição e biopsia. O material deve ser colhido na superfície ou na borda interna de lesões novas; é raro o encontro de parasitas em lesões com mais do um ano. A identificação e tipagem do parasita através dos métodos abaixo é de grande utilidade na indicação terapêutica adequada. Entretanto, a tipagem só é possível em alguns centros de referência.
Para o cultivo o meio de escolha é o NNN, enriquecido com uma fase líquida de LIT-BHI, e o material pode ser obtido por punção-aspirativa ou por biopsia.
A inoculação em animais de laboratório é feita em hamster, principalmente nas patas posteriores.
Na histopatologia o diagnóstico de certeza só é dado quando se identifica o parasita nos tecidos.
1.3.2- O diagnóstico imunológico pode ser feito através de:
a) Intradermoreação de Montenegro, que traduz a resposta alérgica de hipersensibilidade celular retardada. É da grande valor presuntivo, dada a sua sensibilidade e especificidade, sendo positiva em mais de 90% dos casos de LTA. Nas lesões mucosas a reação é quase sempre positiva. Geralmente permanece positiva após o tratamento ou cicatrização espontânea da lesão, negativando nos indivíduos pouco reatores e nos precocemente tratados. Em áreas endêmicas deve ser valorizado, levando em consideração uma leishmaniose anterior ou, apenas exposição ao parasita sem doença.
Essa reação pode estar negativa de 1 a 4 meses após o inicia de lesão. É negativa na Leishmaniose anérgica.
b) Imunofluorescência indireta (IFI).
c) Testes imunoenzimáticos (ELISA).
As reações sorológicas de imunofluorescência indireta e os testes imunoenzimáticos (ELISA) são muitos úteis, principalmente nos casos com lesões extensas e múltiplas e no diagnóstico precoce das lesões mucosas secundárias ou primárias. A IFI apresenta reação cruzada com a leishmaniose visceral e a doença de Chagas.
Após o tratamento e cura clínica da forma cutânea, os títulos caem ou desaparecem com alguns meses, podendo ser de utilidade no critério de cura.
Estes testes, são exigíveis em alguns centros de referência.
2. TRATAMENTO - A droga de primeira escolha é o antimonial pentavalente - antimoniato de N. Metil-glucamina (Glucantime). Atualmente não se recomenda a interrupção do Glucantime.
A Organização Mundial da Saúde (OMS) recomenda que a dose deste antimonial seja calculada em mg/SbV/Kg/dia,(SbV significa antimônio puro).
As apresentações comerciais são em ampolas de 5ml, que contém 425mg do antimônio puro. Portanto, cada ml contém 85mg do antimônio puro.
É indicado para tratamento de todas as formas de leishmanioese tegumentar, embora as formas mucosas e cutâneo-mucosa exijam maior cuidado, por apresentarem respostas mais lentas e maior possibilidade de recidivas.
Não havendo resposta satisfatória com o tratamento pelo antimonial pentavalente, as drogas de segunda escolha são as Anfotericina B e a Pentamidina, esta última em fase de introdução no Brasil.
2.1- Antimoniato de N-Metil-Glucamina (Glucantime)
a) Forma cutânea - a dose recomendada pela OMS varia entre 10mg a 20mg/SbV/Kg/dia - sugere-se 15mg SbV/Kg/dia (Ex.: 2amp. para um paciente de 60Kg) durante 20 dias seguidos, por via intramuscular ou endovenosa, no final do dia, para possibilitar o repouso após a aplicação. Se não houver cicatrização completa após duas semanas do término do tratamento, o esquema deverá ser repetido. Persistindo o insucesso, o diagnóstico deverá ser reavaliado em serviço especializado.
Não deve ser administrada em gestantes.
A administração do Glucantime em pacientes com mais de 50 anos, ou ainda em portadores de cardiopatias, nefropatias, hepatopatias e doença de Chagas, pode desencadear toxicidade, exigindo vigilância permanente quanto ao eletrocardiograma, provas de função renal e provas de função hepática. O tratamento deverá ser suspenso uma vez constatados alterações eletrocardiográficas persistentes ou progressivas, ou ainda alterações importantes nas provas de funções renal e hepática.
A medicação pode produzir alguns efeitos colaterais, as vezes exigindo a suspensão do tratamento. Entre eles temas: artralgia, mialgia, inapetência, náuseas, vômitos, plenitude gástrica, epigastralgia, pirose, dor abdominal, prurido, febre, fraqueza, cefaléia, tontura, palpitação, insônia, nervosismo, choque pirogênico, edema, herpes zoster e insuficiência renal aguda.
b) Forma mucosa deve ser tratada com 20mg SbV/Kg/dia durante 30 dias, ou pode prolongar-se até a cura clínica, com rigorosa vigilância do paciente, e sempre que possível deve ser feito em âmbito hospitalar.
- Não se obtendo resposta satisfatória, adotar uma das medicações alternativas - Anfotericina B ou Pentamidina.
2.2- Anfotericina B (Fungizon)
É a droga de segunda escolha, empregada quando não se obtém resposta ao tratamento com antimonial. É a mais eficaz nas manifestações mucosas da leishmaniose, sendo as recidivas menos freqüentes.
Apresentação: 1 frasco = 50mg
Dose/Modo de Aplicação
Inicia-se com 0,5mg/Kg/dia em dias alternados, aumentando gradualmente até a dose total de 1mg/Kg, sem ultrapassar 50mg. Administração é feita por via endovenosa, gota a gota, lentamente (4 horas de infusão) diluída em soro glicosado a 5%, utilizando equipo em Y, sendo um frasco com anfotericina e outro com 50 a 100mg de hidrocortizona, para evitar a flebite. Deve ser administrada em dias alternados até a cura clínica, o que deve ocorrer quando atingir as seguintes doses totais: na forma cutânea, 1 a 1,5gr; nas formas mucosas e cutâneo-mucosa, 2,5 a 3gr.
Se necessário, esta dose total poderá ser elevada desde que o paciente esteja sob vigilância clínica rigorosa, acompanhada das provas laboratoriais que permitam avaliar, principalmente, a função renal.
Recomenda-se realizar avaliação clínica e laboratorial antes do início do tratamento, fazendo-se avaliação cardiológica, exames bioquímicos para avaliação das funções renal (dosagem de uréia, creatinina e k). Avaliação da função hepática (dosagem de bilirrubinas, transaminases e fosfatase alcalina) e hemograma. Essas avaliações deverão ser feitas semanalmente.
Em idosos a reavaliação da função renal e cardíaca deve ser feita 2 vezes por semana, desde que haja alterações.
É importante enfatizar que a medicação deve ser feita sob vigilância em serviços especializados, com o paciente hospitalizado.
Os efeitos colaterais de ocorrência mais frequente (febre,anorexia, náuseas, vômitos e flebite) podem ser atenuados ou evitados com o uso de antipiréticos, antieméticos ou de 50 a 100mg de hidrocortisona, acrescentados ao soro.
É contra indicada para administração em gestantes, cardiopatas, nefropatas e hepatopatas.
2.3- Isotionato de Pentamidina (Pentacarinat)
Apresentação: cada frasco contém 200mg
A OMS recomenda, para todas as formas, administrar 4mg/Kg/dia, via intramuscular, durante 5 ou mais semanas, dependendo da resposta clínica.
Experiência brasileira tem mostrado que, para a forma cutânea, ocasionada por Leishmania guyanensis obtem-se bons resultados terapêuticos, com poucos efeitos colaterais, utilizando-se a mesma dose e via de administração, porém, com apenas 3 aplicações e intervalo de dois dias entre cada aplicação.
A Pentamidina, face o seu efeito hipoglicemiante, deverá ser administrada após uma refeição.
As reações adversas mais frequentes são dor, induração e abcessos estéreis no local da aplicação, além de náuseas, vômitos, tonturas, adinamias, mialgias, cefaléia, hipotensão, lipotímias, síncope, hiperglicemia e hipoglicemia. Diabetes mellitus pode ocorrer a partir da administração da dose total de 1 grama.
Nas doses recomendas pela OMS, sugere-se a realização do exame bioquímico para avaliação das funções renal (dosagem da uréia e da creatinina) hepática (dosagem das transaminases, bilirrubinas e fosfatase alcalina) e glicemia periodicamente, no curso do tratamento. O acompanhamento eletrocardiográfico, antes, durante e no final do tratamento é também recomendado.
É contra-indicada para gestantes, e para portadores de diabetes, insuficiência renal, insuficiência hepática, doenças cardíacas e crianças com menos de 8Kg de peso.
3- CONTROLE DO TRATAMENTO - é feito principalmente pelo aspecto clínico das lesões, reepitelização das lesões ulceradas e regressão, nas formas mucosas a regressão de todos os sinais deve se comprovada pelo exame otorrinolaringológico.
No tratamento com 3 doses de Pentamidina verifica-se a cicatrização das lesões, em média, 25 dias após a última injeção.
Laboratorialmente devemos considerar que a imunofluorescência indireta e útil para o diagnóstico, principalmente, na forma mucosa.
Títulos positivos persistentes são encontrados em pacientes com freqüentes recidivas, com potencialidade de desenvolver a forma secundária mucosa, ou em indivíduos que permanecem em áreas endêmicas.
Ainda não está suficientemente estabelecido um critério de cura parasitológica para a LTA.
4- MEDIDAS GERAIS DE CONTROLE DA LTA
4.1- Medidas de atuação na cadeia de transmissão
Para a elaboração de um programa de controle torna-se necessária a integração das diversas instituições que atuam na área, evitando-se duplicidade de ações e gastos desnecessários.
As características peculiares da LTA - a diversidade de agentes, reservatórios, vetores e situações epidemiológicas, indicam que as estratégias de controle devem ser flexíveis e distintas, de aplicação restrita, adequadas a cada região ou foco particular. A complexidade do controle se evidencia quando se consideram as inúmeras lacunas ainda existentes no conhecimento destes aspectos.
Para a seleção de estratégias adequadas a cada região geográfica deverá ser considerada a análise epidemiológica dos dados referentes a:
1) Notificação dos casos humanos quanto à forma clínica, sexo, idade, profissão e procedência;
2) Estudos entomológicos para definir as espécies vetoras, sua dispersão, graus de antropofilia e exofilia, infecção natural;
3) Estudos parasitológicos para definir a espécie do agente etiológico circulante no foco;
4) Estudos ecológicos para determinação dos reservatórios animais envolvidos.
Como resultados dessa análise, poderão ser desenvolvidas as seguintes ações:
a) Diagnóstico precoce e tratamento adequado dos casos humanos, cuja competência é da rede básica de saúde, através do atendimento à demanda passiva, notificações e busca ativa em áreas de maior morbidade ou onde o acesso da população à rede é dificultada por diversos fatores.
b) Diagnóstico animal precoce e seguro para controle e/ou eliminação dos infectados.
c) Medidas de redução do contato homem-vetor, através de:
- medidas educativas - educação da comunidade;
- ampliação de inseticidas;
- medidas de proteção individual; e
- controle de reservatórios.
4.2- Vacina
Com relação a utilização da vacina para Leishmaniose Tegumentar Americana quer para imunoprofilaxia quer para imunoterapia, em virtude dos resultadas apresentados até o momento não serem conclusivos, sua utilização no território nacional, fica condicionada à autorização prévia do Ministério da Saúde.
5- DEFINIÇÃO DE RESPONSABILIDADES DAS INSTITUIÇÕES DE SAÚDE NOS DIFERENTES NÍVEIS
As ações de controle serão desenvolvidas a partir dos trabalhos conjunto entre a Fundação Nacional de Saúde (controle de vetores, reservatórios e busca ativa) e a Rede Básica de Saúde (controle de doentes e busca ativa).
Tradicionalmente a SUCAM se responsabilizou por todas as atividades de vigilância epidemiológica, não só da Leishmaniose Visceral como também da Leishmaniose Tegumentar, em todos os níveis; trabalho que hoje está incorporado à Fundação Nacional de Saúde (FNS).
Entretanto, o processo de descentralização em andamento no Sistema único de Saúde (SUS), impõe a revisão das atribuições de cada instituição, com vistas à atuação conjunta e hierarquizada de todas as instituições de saúde.
Considerando as interfaces das instâncias técnicas da Fundação Nacional de Saúde, no que tange à normalização para o controle da Leishmaniose Tegumentar, faz-se necessário o planejamento e acompanhamento conjunto a nível nacional, desempenhando as seguintes atribuições:
- Normalização da vigilância epidemiológica, investigação e controle dos focos, através de inquérito e intervenções na cadeia epidemiológica.
- Distribuição de insumos críticos.
- Normalização em diagnóstico, tratamento e acompanhamento dos doentes de LTA, para a rede básica dos serviços de saúde.
Sendo assim, faz-se necessário que as Secretarias de Saúde Estaduais e Municipais assumam gradualmente as suas funções de vigilância epidemiológica, aos agravos prevalentes nas respectivas regiões e de assistência aos portadores de Leishmaniose Tegumentar.
Do mesmo modo, a atuação do Estado requer que as estratégias de controle sejam estabelecidas de acordo com realidade de cada Unidade Federada.
Implementar as atividades de referência da Leishmaniose Tegumentar Americana nos Centros de Zoonoses e Serviços de Referência de Dermatologia Sanitária com vistas a obtenção do impacto epidemiológico necessário.
ANEXO XXXIII
INFORMAÇÕES SOBRE A SÍNDROME DE IMUNODEFICIÊNCIA ADQUIRIDA E SUAS MEDIDAS DE CONTROLE (Origem: PRT MS/GM 236/1985, Anexo 1)
I) CONCEITOS BÁSICOS:
a) Síndrome de Imunodeficiência Adquirida: Atualmente, para efeitos epidemiológicos, identifica-se a síndrome como o conjunto de alterações provocadas pela perda de imunidade medida por células, a partir da ação de um agente viral, provavelmente o HTLV-III ou LAV e que se manifestam pelo aparecimento de infecções oportunistas e/ou neoplasias, particularmente o Sarcoma de Kaposi.
b) Grupos em risco: São considerados grupos em risco para a doença:
. homossexuais e bissexuais masculinos;
. usuários de drogas injetáveis;
. hemofílicos ou politransfundidos.
c) Caso Suspeito: É aquele que, pertencendo a um grupo de risco, apresenta um ou mais dos sintomas prodrômicos de SIDA ou AIDS: poliadenopatia, diarréia , febre, cansaço e perda de peso.
d) Caso Confirmado: É o indívíduo que, pertencendo a algum grupo de risco, apresente uma ou mais das seguintes entidades mórbidas:
1- Sarcoma de Kaposi, em indivíduos com menos de sessenta anos de idade;
2- Linfoma limitado ao cérebro;
3- Pneumonia por Pneumocystis carinii;
4- Toxoplasmose, causando pneumonia, ou infecção do sistema nervoso central;
5- Strongiloidíase, causando pneumonia , infecção do sistema nervoso central, ou infecção generalizada;
6- Candidíase, causando esofagite;
7- Criptococose, causando infecção pulmonar, do sistema nervoso central, ou disseminada;
8- Micobacterioses atípicas, comprovadas através da cultura;
9- Infecções causadas por citomegalovirus no pulmão, no trato gastrointestinal, sistema nervoso central, suprarenal e pâncreas;
10- Infecções por virus herpes, tipo um ou dois, muco-cutâneas (com úlceras que persistem por mais de um mês), pulmonares, do aparelho digestivo, ou disseminadas;
11- Leucoencefalopatia multifocal progressiva.
Devem-se usar como critérios de exclusão:
a)- História recente de terapia imunossupressora anterior ao aparecimento da doença.
b)- Presença de alguma outra enfermidade pré-existente associada com imunossuspenssão, como imunodeficiência congênita, processo de malignidade linfo-reticular ou subnutrição grave.
e) Comunicantes: Deverão ser considerados como tais os parceiros sexuais de casos confirmados de SIDA ou AIDS.
II- MEDIDAS DE CONTROLE
As medidas de controle e prevenção do AIDS consistem na execução de um conjunto de ações sobre os Casos confirmados, Casos suspeitos, Comunicantes, e Grupos em risco, quais sejam:
1) Os casos suspeitos ou confirmados devem ser submetidos a investigação epidemiológica, clínica, laboratorial e educação sanitária.
1.1 A investigação epidemiológica consta da identificação do grupo em risco, meio de transmissão e identificação de comunicantes.
1.2 A investigação clínica consta da identificação de sinais e sintomas de suspeita, tais como fadiga, febre persistente, sudorese noturna, calafrios, perda de peso acentuada, diarréia persistente, linfadenopatia generalizada, depressão e apatia, ou de confirmação, como infecção por germes oportunistas (pneumonia por Pneumocystis carinii, criptococose, candidíase, strongiloidíase, etc.), e/ou sarcoma de kaposi, e alguns tipos de linfomas de formas clínicas atípicas, quando à idade de incidência, ou gravidade e peculiaridade do quadro clínico.
1.3 A investigação laboratorial consiste na identificação, dos germes causadores das infecções oportunistas, realização de hemograma e de perfil imunológico, que consiste de testes intra-dérmicos (PPD, estreptoquinase, estreptodornase, candidina, tricofitina e DNCB), dosagem de linfócitos T e B, quantificação e relação dos linfócitos T-auxiliadores (OCT4) e T-surpressores (OKT8) e cultura de linfócitos.
A utilização de testes sorológicos, como dosagem da beta-dois-microglobulina anti-HTLV não tem indicação de utilização extensiva no País.
1.4 A educação sanitária constará de informação, aos pacientes, dos meios simples de diminuir a transmissibilidade da doença, tendentes a evitar a promiscuidade sexual e à doação de sangue.
2) Os comunicantes devem ser submetidos à investigação epidemiológica, clinica e educação sanitária conforme o descrito no parágrafo anterior.
3) Para os indivíduos pertencentes aos grupos em risco realizar-se-ão apenas programas de educação sanitária.
3.1 O AIDS, como doença sexualmente transmissível, deve ser prevenida através da informação aos indivíduos dos grupos em risco (homossexuais ou bissexuais do sexo masculino) sobre a maior incidência da doença com a multiplicidade de parceiros sexuais, esclarecendo-se que o risco aumenta proporcionalmente ao número de parceiros. Há indícios, de que o uso de preservativos, no ato sexual, diminue a transmissibilidade da síndrome.
3.2 Os viciados em drogas injetadas intravenosamente devem ser orientados para a interrupção desta prática ou, no mínimo, para a utilização de material descartável de uso exclusivo e individual.
3.3 A Prevenção do AIDS transfusional deve ser enfocada sob diversos aspectos:
- Orientação ao doador de sangue, submetendo-se previamente à leitura de material explicativo sobre ítens que impedem a doação de sangue, incluindo dados sobre AIDS.
- O item anterior deve ser seguido de todos os procedimentos habituais, prévios à doação de sangue (anamnese, exame clínico e hematimétrico).
- Após a realização de exames sorológicos para detecção de lues, doença de Chagas e hepatite, as unidades positivas devem ser desprezadas.
- No tratamento do hemofílico devem ser utilizados os crioprecipitados preparados a partir de unidades individuais de sangue coletado. Os concentrados de fator VIII ou IX, industrializados ou oficinais só devem ser utilizados, após tratamento pelo calor ou por método químicos que inviabilizem a sua infectividade, proibindo-se gradual e rapidamente a utilização daqueles não tratados (pelo seu maior risco potencial de transmitir AIDS).
- Visando a autosuficiência do país em homo-derivados, há que se incentivar as indústrias nacionais e produzirem produtos tratados, visando à eliminação do risco de transmissão do AIDS.
- Considerando que o AIDS é um problema recente , sobretudo no âmbito da Hemoterapia , inexistindo portanto normas sanitárias federais a respeito, devem-se estabelecer, no Ministério da Saúde, mecanismos para que se procedam a tais medidas.
- Deve-se incluir na tabela de procedimentos do INAMPS os concentrados de fator VIII e IX tratados.
3.4 A prevenção junto ao pessoal da área de saúde deve ser realizada através de normas de precaução no manejo de sangue, fluídos, secreções e excreções .
O pessoal da área de saúde deve estar ciente de que não há nenhuma evidência de contágio através de contatos puramente sociais e ocupacionais, bem como através do ar, da comida ou objetos. Estudos realizados em países com maior experiência com o gravo revelam que sua ocorrência entre profissionais de saúde é praticamente nula.
. A necessidade de se observar precauções apropriadas para prevenir a disseminação da doença deve ser contrabalançada pela necessidade de se assegurar ao paciente discrição sobre seu estado.
. As medidas a serem tomadas devem ser semelhantes às recomendadas para prevenção de hepatite B, ou seja:
. As pessoas que têm contato com sangue, tecido, secreções, excreções ou objetos e superfícies potencialmente por eles contaminados devem usar luvas e, em seguida, lavar bem as mãos com água e sabão.
. Antes de entrar e sair do quarto de um paciente com AIDS, ou suspeita de AIDS, a lavagem das mãos é indispensável. As amostras destes pacientes devem ter rótulo especiais de identificação, sem mencionar especificamente a doença, e devem ser transportados em sacos plásticos ou em outro tipo de recipiente fechado. As superfícies contaminadas com sangue ou secreções devem ser desinfetadas imediatamente com diluição 1:10 de solução de hipoclorito de sódio a 5% ou álcool a 25%.
. As pessoas que têm contato direto com o sangue, secreções ou excreções desses pacientes, devem usar aventais.
. Não é necessário o uso rotineiro de máscaras para os pacientes com AIDS, a não ser aqueles que têm tosse, e só quando deixam o quarto. Os funcionários e visitas, que têm contato direto com pacientes com tosse, devem também usar máscaras.
. Seringas e agulhas devem ser colocadas em recipiente rígidos, não passíveis de perfuração. Sempre que possível deve ser usado material descartável.
A descontaminação de equipamento clínico-cirúrgico deve ser feita com as mesmas técnicas de esterilização recomendadas para pacientes com hepatite B.
III - MEDIDAS OPERACIONAIS
O controle da Síndrome de Imunodeficiência Adquirida no Brasil se fará através da execução das seguintes medidas operacionais:
1 . COORDENAÇÃO E EXECUÇÃO
A Divisão Nacional de Dermatologia Sanitária da Secretaria Nacional de Programas Especiais de Saúde, coordenará as ações de controle do SIDA ou AIDS, com as seguintes atribuições:
a - Consolidação do mecanismo de obtenção, análise e difusão das informações técnicas, particularmente, as epidemiológicas;
b - Fomento ao desenvolvimento de ciência e tecnologia e de recursos humanos para a área;
c - Produção de materiais educativos e normativos;
d - Apoio de recursos técnicos humanos e logísticos ao nível executor;
e - Definição, conjuntamente com as Secretarias de Estado de Saúde, das instituições de saúde que darão suporte regional ao programa;
f - Definição das instituições públicas que atuarão como centros de referência para o programa.
De igual forma, o nível executor será assumido pelas Secretarias do Estado de Saúde, através de uma estratégia gradual que contemple, prioritariamente, as áreas metropolitanas das Unidades Federadas que já contam com casos notificados da moléstia.
2. ACOMPANHAMENTO DO PROBLEMA
2.1 – A notificação dos casos será realizada diretamente das Secretarias Estaduais de Saúde ao órgão coordenador nacional (DNDS/MS). Cabe-lhes, nas diversas UFS, coletar os dados em todas as fontes sob a sua jurisdição. A informação deverá ser remetida até quinto dia útil do mês seguinte ao que corresponde a informação. Em termos de notificação, deverão incluir-se os seguintes ítens: iniciais do nome, idade, sexo, município de residência e enquadramento do caso (suspeito ou confirmado). Ademais, se recomenda a elaboração de uma ficha de investigação epidemiológica, da qual deverá ser anexada uma cópia à informação mensal de cada caso confirmado. Recomenda-se também que, a nível de Secretarias Estaduais, estabeleçam-se os mecanismo adequados para a obtenção de dados necessários. Podem-se concluir:
a – Caracterização de um órgão coordenador responsável, a nível da Secretaria de Saúde;
b – Solicitação da notificação telefônica imediata de todo caso suspeito ou confirmado;
c – Procura de notificações de casos novos nos centros geradores de dados.
O Ministério da Saúde remeterá, com periodicidade trimestral, um relatório acerca da evolução e da situação epidemiológica da doença no país.
Esta informação será difundida para as instituições oficiais de saúde do país e seletivamente, à instituições privadas e para os órgãos internacionais de saúde.
2.2 – Todo óbito em cujo atestado médico constar (parte IV da Declaração de Óbito) um dos diagnósticos a seguir relacionados deverá ser informado, pelo setor da Secretaria que manipule inicialmente dados de mortalidade, ao setor que coordena as ações referentes a SIDA ou AIDS, para as seguintes medidas:
a – Verificar se o caso já era conhecido, investigando-o se for o caso;
b – Confirmação (ou alteração) do (s) diagnóstico (s) definitivo (s).
Da mesma forma, o setor que coordena as ações referentes a SIDA ou AIDS deverá informar ao setor de mortalidade todo o óbito por este síndrome que for conhecido, para que seja identificada a respectiva declaração de óbito (D.O.), para as seguintes medidas:
a – Verificar o procedimento da D.O., complementando-o se for o caso;
b – Verificar o (s) diagnóstico (s), corrigindo-o (s), se for o caso.
Relação de diagnósticos ou termos que devem ser considerados:
a. Pneumonia por Pneumocystis carini ;
b. Toxoplasmose provocado pneumonia ou infecção do sistema nervoso central;
c. Esofagite por cândida;
d. Pneumonia por cândida;
e. Criptococose pulmonar, do sistema nervoso central ou disseminada;
f. Aspergilose pulmonar;
g. Micobacterioses atípicas;
h. Turberculose disseminada;
i. Infecções por citomegalovirus;
j. Infecções prolongadas ou disseminadas por herpes simples;
l . Varicela em adultos;
m. Sarcoma de Kaposi;
n. Linfoma limitado ao cérebro;
o. Linfoma de Burkit;
p. SIDA;
q. AIDS;
r. Imonodeficiência;
s. Deficiência imunitária;
t. Deficiência de imunidade celular;
u. Infecção oportunista.
3. DIFUSÃO DA INFORMAÇÃO
3.1. Educação técnica continuada
Os Serviços de saúde implementarão medidas de educação continuada destinadas aos profissionais que atendem diretamente à população, nos diversos níveis de atuação. Nesse sentido o Ministério da Saúde acionará, para o seu enfrentamento, o envolvimento de todas as estruturas governamentais, e no aspecto educativo, a articulação interinstitucional MS/MEC é imperiosa.
3.2. EDUCAÇÃO SANITÁRIA
Os Serviços de Saúde aplicação, de modo amplo e permanente, medidas de Educação Sanitária aos grupos de riscos do SIDA ou AIDS (Síndrome de Imunodeficiência Adquirida), de acordo com os seguintes princípios técnicos, respectivamente, para com:
a) Aspectos:
1 – Restringir a atividade sexual a um único parceiro;
2 – Evitar a doação de sangue;
3 – Procurar os serviços de saúde em caso de suspeita da doença.
b) Os comunicantes:
1 – Restringir a atividade sexual a um único parceiro;
2 – Evitar a doação de sangue;
3 – Procurar os serviços de saúde em caso de suspeita da doença.
c) Os homossexuais:
1 – Restringir a atividade sexual a um único parceiro;
2 – Evitar a doação de sangue;
3 – Procurar os serviços de saúde em caso de suspeita da doença.
d) Os tóxico-dependentes:
1 – Abandonar o uso de drogas;
2 – Utilizar, ao menos, seringas exclusivas ou descartáveis;
3 – Evitar a doação de sangue;
4 – Procurar os serviços de saúde em caso de suspeita da doença.
e) Os hemofílicos ou politransfundidos;
1 – Utilizar crioprecipitados artesanais ou concentrados industriais ou oficinais tratados;
2 – Procurar os serviços de saúde em caso de suspeita da doença.
§ 1. Os casos suspeitos ou confirmados serão submetidos a investigação epidemiológica, clínica, laboratorial e educação sanitária.
§ 2. Os comunicantes serão submetidos à investigação epidemiológica, clínica e educação sanitária.
§ 3. Os indivíduos pertencentes aos grupos em risco serão submetidos apenas à educação sanitária.
§ 4. Segundo o grupo em risco da síndrome, deve-se considerar a SIDA ou AIDS, sob os seguintes aspectos epidemiológicos.
a) doença sexualmente transmissível;
b) doença transmitida através de agulhas e seringas contaminadas, utilizadas em injeção intravenosa de drogas por tóxico-dependentes;
c) doença transmitida através de transfusão de sangue, componentes e derivados;
d) risco limitado para o pessoal da área de saúde.
ANEXO XXXIV
PROGRAMA NACIONAL PARA A PREVENÇÃO E O CONTROLE DAS HEPATITES VIRAIS(Origem:PRT MS/GM 2080/2003,Anexo1)
COMPETÊNCIAS E ATRIBUIÇÕES
I - Compete ao Ministério da Saúde:
a) instituir o Programa Nacional para a Prevenção e o Controle das Hepatites Virais, os princípios e diretrizes da implantação do Programa, bem como estabelecer critérios/exigências de habilitação de serviços, critérios de implantação das redes de assistência aos portadores de hepatites virais e os critérios técnicos de desenvolvimento do trabalho;
b) designar um Coordenador Nacional do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, subordinado ao Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS);
c) definir e implementar, por meio da Secretaria de Vigilância em Saúde as ações de vigilância epidemiológica e sanitária no âmbito das hepatites virais;
d) elaborar e publicar sob coordenação do Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS) em parceria com a Secretaria de Atenção à Saúde e a Secretaria de Ciência, Tecnologia e Insumos Estratégicos os Protocolos Clínicos e Diretrizes Terapêuticas a serem adotados pelo Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
e) definir e implementar planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos portadores de hepatites virais;
f) estabelecer as normas de funcionamento e cadastramento de serviços que integrarão as redes assistenciais, em seus respectivos níveis de complexidade;
g) articular com os estados, municípios e o Distrito Federal a implantação do Programa e o estabelecimento de mecanismos de controle, avaliação e acompanhamento do processo;
h) assessorar os estados e o Distrito Federal na implantação, em seus respectivos âmbitos de atuação, do Programa Nacional para a Prevenção e o Controle das Hepatites Virais e na organização de suas respectivas Redes Estaduais de Assistência aos Portadores de Hepatites Virais;
i) utilizar os sistemas de informação epidemiológica e assistencial para constituir um banco de dados que permita acompanhar e avaliar o desenvolvimento do Programa, definindo seus indicadores;
j) apoiar a realização de estudos de prevalência de base populacional para o conhecimento da distribuição das hepatites virais no País e outras pesquisas sobre a relevância de cada um dos fatores de risco;
k) alocar recursos financeiros destinados ao co-financiamento das atividades do Programa; e
l) divulgar o Programa de maneira a conscientizar e informar a população e os profissionais de saúde sobre a importância da realização das ações assistenciais previstas no Programa.
II - Compete às Secretarias de Saúde dos Estados e do Distrito Federal:
a) elaborar, em parceria com as Secretarias Municipais de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
b) designar um Coordenador Estadual do Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
c) instituir Comitê de Coordenação integrado pelos órgãos estaduais que possuem as atribuições, relativas às hepatites virais, de acompanhamento epidemiológico, prevenção, controle e assistência;
d) organizar a Rede Estadual de Assistência aos Portadores de Hepatites Virais, identificando os serviços dela integrantes, em seus respectivos níveis de complexidade, estabelecendo os fluxos de referência e contra-referência entre estes serviços e garantindo a execução de todas as fases do processo assistencial previsto no Programa;
e) criar as condições para a estruturação/criação/implantação/cadastramento dos Centros de Referência em Assistência aos Portadores de Hepatites Virais;
f) implementar ações de vigilância epidemiológica e sanitária no âmbito das hepatites virais;
g) desenvolver planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos portadores de hepatites virais;
h) articular com os demais gestores estaduais as eventuais referências interestaduais de pacientes cujas necessidades assistenciais não encontrem capacidade técnica instalada para o seu atendimento no Estado de origem;
i) assessorar os municípios no processo de implementação do Programa, no desenvolvimento das atividades e na adoção de mecanismos destinados ao controle, avaliação e acompanhamento do processo;
j) alocar, complementarmente, recursos financeiros próprios para o desenvolvimento /incremento do Programa;
k) monitorar o desempenho do Programa em seu Estado e os resultados alcançados; e
l) manter atualizados os bancos de dados que estejam sob a sua responsabilidade.
III - Compete às Secretarias Municipais de Saúde:
a) elaborar, em parceria com a respectiva Secretaria Estadual de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
b) criar as condições para a estruturação/criação/implantação/cadastramento de serviço(s) de Nível I e adotar as providencias necessárias para integrá-lo(s) à Rede Estadual Assistência aos Portadores de Hepatites Virais;
c) apoiar a estruturação/manutenção/funcionamento dos Serviços de Nível II e dos Centros de Referência em Assistência aos Portadores de Hepatites Virais que estejam instalados em seu Município;
d) alocar, complementarmente, recursos financeiros próprios para o desenvolvimento /incremento do Programa;
e) monitorar o desempenho do Programa em seu Município e os resultados alcançados;
f) executar ações de vigilância epidemiológica das hepatites virais;
g) realizar capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência dos portadores de hepatites virais;
h) manter atualizados os bancos de dados que estejam sob sua responsabilidade, que deverão ser notificados ao gestor estadual do SUS; e
i) promover a mobilização da comunidade, dos grupos de risco e profissionais de saúde visando a efetiva participação nas ações de prevenção e controle das hepatites.
ANEXO XXXV
CRITÉRIOS PARA PONTUAÇÃO, CLASSIFICAÇÃO E RELAÇÃO DOS HOSPITAIS (Origem: PRT MS/GM 931/2012, Anexo 1)
| Critérios para pontuação dos Hospitais | |
|---|---|
| 1) Hospitais inseridos em UFs com capacidade instalada, em radioterapia, inferior a demanda estimada de casos novos de câncer (suboferta), sendo adotada a relação de um equipamento (acelerador linear ou unidade de telecobaltoterapia) para cada mil casos .novos de câncer, conforme parâmetro estabelecido pela Portaria SAS/MS nº 741/2005. | |
| Critério | Pontuação |
| Apresentar déficit em serviço de radioterapia, igual a 1 (um), na UF onde se encontra o hospital | 1 (um) ponto |
| Apresentar déficit de radioterapia, igual a 2 (dois), na UF onde se encontra o hospital | 2 (dois) pontos |
| Apresentar déficit de radioterapia, igual a 3 (três), na UF onde se encontra o hospital | 3 (três) pontos |
| Apresentar déficit de radioterapia, maior que 3 (três), na UF onde se encontra o hospital | 4 (quatro) pontos |
| 2)As UFs que não apresentaram déficit em RT, porém em suas macrorregiões existe capacidade instalada, em radioterapia, inferior a demanda estimada de casos novos de câncer (suboferta), foi adotada a mesma relação de um equipamento (acelerador linear ou unidade de telecobaltoterapia) para cada mil casos novos de câncer, conforme parâmetro estabelecido pela Portaria SAS/MS nº 741/2005: | |
| Critério | Pontuação |
| Apresentar déficit em serviço de radioterapia, igual a 1 (um), na macrorregião onde se encontra o hospital | 1 (um) ponto |
| Apresentar déficit de radioterapia, igual a 2 (dois), na macrorregião onde se encontra o hospital | 2 (dois) pontos |
| Apresentar déficit de radioterapia, igual a 3 (três), na macrorregião onde se encontra o hospital | 3 (três) pontos |
| Apresentar déficit de radioterapia, maior que 3 (três), na macrorregião onde se encontra o hospital | 4 (quatro) pontos |
| 3)Natureza jurídica da instituição: | |
| Critério | Pontuação |
| Ser hospital filantrópico | 0 (zero) ponto |
| Ser hospital público | 1 (um) ponto |
| 4) Possuir número total de leitos, exceto os obstétricos, conforme intervalos | |
| Critério | Pontuação |
| 0 a 50 | 0 (zero) ponto |
| 51 a 100 | 3 (três) pontos |
| 101 a 150 | 6 (seis) pontos |
| Maior que 151 | 10 (dez) pontos |
| 5) Hospitais que atendam aos parâmetros mínimos de produção, estabelecidos pela Portaria SAS/MS nº 741/2005 para cada uma das principais modalidades terapêuticas, respeitada sua habilitação* | |
| 5.1) Cirurgia oncológica (CO) | |
| Critério | Pontuação |
| Proporcional à capacidade instalada (0 a 25%) | 0 (zero) ponto |
| Proporcional à capacidade instalada (26 a 50%) | 3 (três) pontos |
| Proporcional à capacidade instalada (51 a 75%) | 6 (seis) pontos |
| Proporcional à capacidade instalada (maior que 75%) | 10 (dez) pontos |
| 5.2) Quimioterapia (QT) | |
| Critério | Pontuação |
| Proporcional à capacidade instalada (0 a 25%) | 0 (zero) ponto |
| Proporcional à capacidade instalada (26 a 50%) | 3 (três) pontos |
| Proporcional à capacidade instalada (51 a 75%) | 6 (seis) pontos |
| Proporcional à capacidade instalada (maior que 75%) | 10 (dez) pontos |
| 5.3) Radioterapia (RT) | |
| Proporcional à capacidade instalada (0 a 25%) | 0 (zero) ponto |
| Proporcional à capacidade instalada (26 a 50%) | 3 (três) pontos |
| Proporcional à capacidade instalada (51 a 75%) | 6 (seis) pontos |
| Proporcional à capacidade instalada (maior que 75%) | 10 (dez) pontos |
| 6) Participação no Sistema de Registro Hospitalar de Câncer - SisRHC | |
| Critério | Pontuação |
| Não participar do sistema de informação SisRHC | 0 (zero) ponto |
| Instituição participante do Sistema de Registro Hospitalar de Câncer e não enviando informações regulares ao SisRHC | 5 (cinco) pontos |
| Instituição participante do Sistema de Registro Hospitalar de Câncer e enviando informações regulares ao SisRHC | 10 (dez) pontos |
| Critérios para classificação dos Hospitais |
| Déficit macrorregional. |
| Pontuação hospitalar |
| Critérios para relacionar os Hospitais |
| Ampliação |
| Hospital com serviço de radioterapia com um só equipamento de megavoltagem |
| Obsolescência dos equipamentos existentes. |
| Produção radioterápica. |
| Estruturação em redes de atenção e produção dos serviços existentes, buscando o acesso assistencial. |
| Necessidade macrorregional - já computados os projetos em andamento. |
| Criação |
| Estruturação em redes de atenção, buscando o acesso assistencial. |
| Necessidade macrorregional - já computados os projetos em andamento |
| Critérios de desempate |
| Natureza Jurídica - Público |
| Estar em UF com déficit em serviço de radioterapia. |
| Uso racional de RH (ampliação > criação)**. |
*Computada toda a produção para o hospital quando habilitado como complexo hospitalar ou terceiriza o serviço de radioterapia, quimioterapia ou cirurgia com outro estabelecimento.
**Utilização máxima dos recursos humanos especializados de nível técnico e superior disponíveis em um determinado município ou estado.
ANEXO XXXVI
MODALIDADES DE EQUIPES DE DESINSTITUCIONALIZAÇÃO (Origem: PRT MS/GM 2840/2014, Anexo 1)
| Modalidade | Número de pessoas com internação acima de um ano deforma ininterrupta | Número de "Equipes de Desinstitucionalização" | Valor mensal do incentivo de custeio(R$) |
| A | 08 a 19 | 02 profissionais | 10.000,00 |
| B.I | 20 a 60 | 01 | 35.000,00 |
| B.II | 61 a 120 | 02 | 70.000,00 |
| B.III | 121 a 180 | 03 | 105.000,00 |
| B.IV | 181 a 240 | 04 | 140.000,00 |
| B.V | 241 a 300 | 05 | 175.000,00 |
| B.VI | 301 a 360 | 06 | 210.000,00 |
| B.VII | A partir de 361 | 07 | 245.000,00 |
ANEXO XXXVII
"AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS" (Origem: PRT MS/GM 2840/2014, Anexo 2)
EQUIPE DE DESINSTITUCIONALIZAÇÃO -
MODALIDADE: ________________________
VALOR DO PROJETO: _____________
1. DADOS GERAIS:
1.1 ESTADO: _________________________
1.2 MUNICÍPIO: ____CNES Secretaria Municipal de Saúde: ___
1.3 HOSPITAL: ___________CNES: __________________
N. DE LEITOS SUS: ______PÚBLICO ( ) PRIVADO ( )
GESTÃO MUNICIPAL ( ) ESTADUAL ( )
1.4 NÚMERO DE PESSOAS COM INTERNAÇÃO DE LONGA PERMANÊNCIA: ________________________
2. DIAGNÓSTICO SITUACIONAL
2.1 RAPS EXISTENTE NO MUNICÍPIO
2.2 SITUAÇÃO E CONDIÇÕES GERAIS DO HOSPITAL PSIQUIÁTRICO
2.3 SITUAÇÃO E CONDIÇÕES GERAIS DAS PESSOAS COM INTERNAÇÃO DE LONGA PERMANÊNCIA
2.4 LEVANTAMENTO INICIAL DA PROCEDÊNCIA E DOS MUNICÍPIOS DE RESIDÊNCIA ATUAL DAS FAMÍLIAS DAS PESSOAS, COM INTERNAÇÃO DE LONGA PERMANÊNCIA, A SER ATUALIZADO DURANTE O PROCESSO. (COM OBSERVAÇÃO DAS RECOMENDAÇÕES DO PARAGRAFO ÚNICO DO ART 5º)
3. "AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS" (COM OBSERVAÇÃO DAS RECOMENDAÇÕES DOS ART. 5º, 6º, 7º. 9º e 17º):
3.1 ATUAÇÃO DA EQUIPE DE DESINSTITUCIONALIZAÇÃO: AÇÕES - META - CRONOGRAMA
3.2 ESTRATÉGIAS E PONTOS DE ATENÇÃO A SEREM DESENVOLVIDOS NA RAPS (DE ACORDO COM A MATRIZ DIAGNÓSTICA DA PORTARIA Nº 3.088/GM/MS DE 23 DE DEZEMBRO DE 2011, REPUBLICADA NO DOU DE 21 DE MAIO DE 2013)
AÇÕES - META - CRONOGRAMA
3.3. PARCERIAS PROPOSTAS:
- OUTROS MUNICÍPIOS? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
_____________________________________________________________________________
- UNIVERSIDADES? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
- ENTIDADES DE DEFESA DOS DIREITOS HUMANOS?
( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
- MOVIMENTOS SOCIAIS? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
- INSTITUIÇÕES DO CAMPO DO DIREITO E NÚCLEOS DE ASSESSORIA JURÍDICA VINCULADOS ÀS FACULDADES DE
DIREITO? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
4. ESTRATÉGIAS DE MONITORAMENTO E AVALIAÇÃO DAS "AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS" (COM OBSERVAÇÃO DAS RECOMENDAÇÕES DO ART 20º e 21º)
______________________________________________________________________________
5. PLANEJAMENTO DA REALOCAÇÃO DOS PROFISSIONAIS DA(S) EQUIPE(S) DE DESINSTITUCIONALIZAÇÃO PARA A QUALIFICAÇÃO DOS PONTOS DE ATENÇÃO E COMPONENTES DA RAPS
______________________________________________________________________________
ANEXO XXXVIII
OFICIO DE SOLICITAÇÃO DE INCENTIVO FINANCEIRO (Origem: PRT MS/GM 2840/2014, Anexo 3)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretario(a) Municipal de Saúde, ____________________, vem por meio deste solicitar o recurso financeiro a ser incorporado no teto de média e alta complexidade para a implantação da modalidade ___________________ do Programa de Desinstitucionalização.
_____________________________________________
Secretário(a) Municipal de Saúde
ANEXO XXXIX
TERMO DE COMPROMISSO (Origem: PRT MS/GM 2840/2014, Anexo 4)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretario(a) Municipal de Saúde, ____________________, vem por meio deste, assegurar a criação do Programa de Desinstitucionalização integrante do componente "Estratégias de Desinstitucionalização" da RAPS, e a realização de todas as etapas previstas nas "Ações de Desinstitucionalização e de Fortalecimento da RAPS" conforme o cronograma apresentado, assim como o desenvolvimento dos investimentos necessários para a efetividade do trabalho proposto.
_____________________________________________
Secretário(a) Municipal de Saúde
ANEXO XL
OFÍCIO REFERENTE A REALOCAÇÃO DA EQUIPE DE DESINSTITUCIONALIZAÇÃO (Origem: PRT MS/GM 2840/2014, Anexo 5)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretário(a) Municipal de Saúde, ____________________, vem por meio deste informar a realocação da Equipe de Desinstitucionalização para qualificação dos pontos de atenção da RAPS, de acordo com os Art. 7º e 17°, desta Portaria. A descrição da realocação da equipe será apresentada no Anexo VI.
_____________________________________________
Secretário(a) Municipal de Saúde
ANEXO XLI
DESCRIÇÃO DA REALOCAÇÃO FINAL DA(S) EQUIPE(S) DE DESINSTITUCIONALIZAÇÃO(Origem:PRT MS/GM 2840/2014,Anexo 6)
| NOME DO PROFISSIONAL | CNES DO PROFISSIONAL | CATEGORIA PROFISSIONAL | CARGA HORARIA SEMANAL QUE CUMPRIU NA EQUIPE DESISNTITUCIONALIZAÇÃO | PONTO DE ATENÇÃO | CNES PONTO DE ATENÇÃO | CARGA HORARIA SEMANAL QUE CUMPRIRÁ NO PONTO DE ATENÇÃO |
ANEXO XLII
OFICIO REFERENTE A REDUÇÃO DO NÚMERO DE LEITOS E RECLASSIFICAÇÃO DO HOSPITAL PSIQUIÁTRICO (Origem: PRT MS/GM 2840/2014, Anexo 7)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretário(a) Municipal de Saúde, ____________________, vem por meio deste informar que foram fechados _____ leito(s) do Hospital Psiquiátrico __________________________________________ com CNES __________. Informo, ainda, que os referidos leitos foram excluídos do CNES do Hospital _______________________________________________________________.
(Se necessário) Dessa forma, solicito a reclassificação do hospital psiquiátrico _______________________________________ de acordo com o Programa Anual de Reestruturação da Assistência Psiquiátrica Hospitalar no SUS (PRH), instituído pela Portaria Nº 52/GM/MS de 20 de janeiro de 2004 e alterada pela Portaria N°2644 GM/MS de 28 de outubro de 2009 tendo em vista que o referido hospital apresenta, na atualidade _________ leitos.
_____________________________________________
Secretário(a) Municipal de Saúde
ANEXO XLIII
LISTA NACIONAL DE DOENÇAS E AGRAVOS A SEREM MONITORADOS PELA ESTRATÉGIA DE VIGILÂNCIA SENTINELA (Origem: PRT MS/GM 205/2016, Anexo 1)
ANEXO
Lista Nacional de Doenças e Agravos a serem monitorados pela Estratégia de Vigilância Sentinela
| I. | Vigilância em Saúde do Trabalhador |
|---|---|
| 1 | Câncer relacionado |
| 2 | Dermatose ocupacionais |
| 3 | Lesões por Esforços Repetitivos/ Distúrbios Osteomusculares Relacionados ao Trabalho (LER/DORT) |
| 4 | Perda Auditiva Induzida por Ruído - PAIR relacionada ao trabalho |
| 5 | Pneumoconioses relacionadas ao trabalho |
| 6 | Transtornos mentais relacionados ao trabalho |
| II. | Vigilância de doenças de transmissão respiratória |
| 1 | Doença pneumocócica invasiva |
| 2 | Síndrome Respiratória Aguda Grave (SRAG) |
| 3 | Síndrome Gripal (SG) |
| III. | Vigilância de doenças de transmissão hídrica e/ou alimentar |
| 1 | Rotavírus |
| 2 | Doença Diarreica Aguda |
| 3 | Síndrome Hemolítica Urêmica |
| IV. | Vigilância de doenças sexualmente transmissíveis |
| 1 | Síndrome de Corrimento Uretral Masculino |
| V. | Síndrome neurológica pós infecção febril exantemática |
ANEXO XLIV
VIGILÂNCIA EPIDEMIOLÓGICA HOSPITALAR - VEH (Origem: PRT MS/GM 183/2014, Anexo 3)
VIGILÂNCIA EPIDEMIOLÓGICA HOSPITALAR - VEH
O montante do recurso a ser repassado para os entes federativos habilitados à Rede de Vigilância Epidemiológica Hospitalar de interesse nacional, do qual será deduzido o montante de recursos dos hospitais de gestão federal que vierem a ser definidos pelo ente federado para compor a rede em seu território, será de:
| UF | Nº DE UNIDADES | VALOR MENSAL (R$) | TOTAL ANO (R$) |
| AC | 1 | 5.000,00 | 60.000,00 |
| AL | 3 | 15.000,00 | 180.000,00 |
| AM | 5 | 25.000,00 | 300.000,00 |
| AP | 1 | 5.000,00 | 60.000,00 |
| BA | 14 | 70.000,00 | 840.000,00 |
| CE | 8 | 40.000,00 | 480.000,00 |
| DF | 3 | 15.000,00 | 180.000,00 |
| ES | 4 | 20.000,00 | 240.000,00 |
| GO | 6 | 30.000,00 | 360.000,00 |
| MA | 7 | 35.000,00 | 420.000,00 |
| MG | 20 | 100.000,00 | 1.200.000,00 |
| MS | 3 | 15.000,00 | 180.000,00 |
| MT | 3 | 15.000,00 | 180.000,00 |
| PA | 8 | 40.000,00 | 480.000,00 |
| PB | 4 | 20.000,00 | 240.000,00 |
| PE | 9 | 45.000,00 | 540.000,00 |
| PI | 4 | 20.000,00 | 240.000,00 |
| PR | 10 | 50.000,00 | 600.000,00 |
| RJ | 16 | 80.000,00 | 960.000,00 |
| RN | 3 | 15.000,00 | 180.000,00 |
| RO | 2 | 10.000,00 | 120.000,00 |
| RR | 1 | 5.000,00 | 60.000,00 |
| RS | 11 | 55.000,00 | 660.000,00 |
| SC | 6 | 30.000,00 | 360.000,00 |
| SE | 2 | 10.000,00 | 120.000,00 |
| SP | 41 | 205.000,00 | 2.460.000,00 |
| TO | 2 | 10.000,00 | 120.000,00 |
| TOTAL | 197 | 985.000,00 | 11.820.000,00 |
ANEXO XLV
REGISTRO DE CÂNCER DE BASE POLULACIONAL - RCBP (Origem: PRT MS/GM 183/2014, Anexo 4)
REGISTRO DE CÂNCER DE BASE POLULACIONAL - RCBP
A habilitação ao recebimento do recurso referente ao Registro de Câncer de Base Populacional será destinado aos seguintes entes federativos:
| UF | Nome do RCBP | Área de Cobertura do RCBP |
| SE | Aracaju | Aracaju |
| PA | Belém | Belém Ananindeua |
| MG | Belo Horizonte | Belo Horizonte |
| DF | Distrito Federal | Distrito Federal |
| SP | Campinas | Campinas |
| MS | Campo Grande | Campo Grande |
| MT | Cuiabá | Cuiabá Várzea Grande |
| PR | Curitiba | Curitiba |
| CE | Fortaleza | Fortaleza |
| GO | Goiânia | Goiânia |
| PB | João Pessoa | João Pessoa |
| SP | Jaú | Jaú |
| AM | Manaus | Manaus |
| RN | Natal | Natal |
| TO | Palmas | Palmas |
| RS | Porto Alegre | Porto Alegre |
| PE | Recife | Recife |
| BA | Salvador | Salvador |
| SP | São Paulo | São Paulo |
ANEXO XLVI
VIGILÂNCIA SENTINELA DA INFLUENZA (Origem: PRT MS/GM 183/2014, Anexo 5)
VIGILÂNCIA SENTINELA DA INFLUENZA
O financiamento da Vigilância Sentinela da Influenza obedecerá ao seguinte parâmetro populacional:
| População até 1 milhão: | 1UTI pública e 1 UTI privada conveniada ou não ao SUS. | 1 a 2 Vigilâncias da SG * |
| de 1 a 2 milhões: | 2 UTI públicas e 2 UTI privada conveniada ou não ao SUS | 3 a 4 VSG |
| de 2 a 3 milhões: | 3 UTI públicas e 2 UTI privada conveniada ou não ao SUS | 5 a 6 VSG |
| de 3 a 4 milhões: | 4 UTI públicas e 3 UTI privada conveniada ou não ao SUS | 7 a 8 VSG |
| de 4 a 5 milhões: | 5 UTI públicas e 3 UTI privada conveniada ou não ao SUS | 9 a 10 VSG |
| de 5 a 6 milhões: | 6 UTI públicas e 4 UTI privada conveniada ou não ao SUS | 11 a 12 VSG |
| de 6 a 7 milhões: | 7 UTI públicas e 4 UTI privada conveniada ou não ao SUS | 13 a 14 VSG |
| de 7 a 8 milhões: | 8 UTI públicas e 5 UTI privada conveniada ou não ao SUS | 15 a 16 VSG |
| de 8 a 9 milhões: | 9 UTI públicas e 5 UTI privada conveniada ou não ao SUS | 16 a 17 VSG |
| de 9 a 10 milhões: | 10 UTI públicas e 6 UTI privada conveniada ou não ao SUS | 18 a 19 VSG |
| de 10 a 11 milhões: | 11 UTI públicas e 6 UTI privada conveniada ou não ao SUS | 20 a 21 VSG |
| 11 milhões e mais: | 12 públicas e 6 privada conveniada ou não ao SUS | 22 a 23 VSG |
*A cada intervalo populacional de 500.000 habitantes deve-se implantar 01 Vigilância da SG
ANEXO XLVII
INSUMOS ESSENCIAIS PARA IMPLEMENTAÇÃO DA ESTRATÉGIA AIDPI (Origem: PRT MS/GM 1397/2017, Anexo 1)
1. Aparelho de pressão infantil
2. Espaçador infantil para inalação
3. Estetoscópio infantil
4. Hemoglobinômetro
5. Jarra e copos descartáveis para terapia de reidratação oral
6. Máscara infantil para inalação
7. Oxímetro de pulso
8. Abaixador de língua
9. Aparelho de nebulização
10. Balança infantil
11. Caderneta de Saúde da Criança
12. Fita métrica
13. Formulários de atendimento da criança
14. Otoscópio
15. Régua antropométrica
16. Termômetro clínico
ANEXO XLVIII
MEDICAMENTOS ESSENCIAIS PARA A IMPLEMENTAÇÃO DA ESTRATÉGIA AIDPI (Origem: PRT MS/GM 1397/2017, Anexo 2)
1. Acetato de betametasona injetável 3mg/ml
2. Ácido fólico comprimido 5mg ou suspensão 0.2 mg/ml
3. Albendazol suspensão 40mg/ml
4. Amoxicílina comprimido de 250 mg ou suspensão 250mg/5m
5. Amoxixilina + clavulanato de potássio suspensão 250mg/5ml
6. Antimalárico oral, em áreas endémicas
7. Azitromicina suspensão 40mg/ml
8. Cefalexina suspensão 250mg/5ml
9. Dipirona comprimido de 500mg ou gotas
10. Eritromicina suspensão 250mg/5ml
11. Ibuprofeno suspensão 50mg/ml
12. Mebendazol comprimido de 100mg ou suspensão
13. Nistatina suspensão 100.000 UI
14. Ondansentrona comprimido de 4mg
15. Paracetamol comprimido de 500mg ou gotas
16. Penicilina benzatina 1.200.000 ou 600.000 UI
17. Penicilina G procaína frasco de 400 000 UI
18. Predinisolona suspensão 3mg/ml
19. Prednisona comprimidos 5mg e 20mg
20. Sais de reidratação oral (SRO)
21. Salbutamol ou Fenoterol 100 mcg/dose, aerossol (bombinha)
22. Solução de ringer + lactato
23. Solução Fisiológica 0,9%
24. Soro Glicosado 5%
25. Sulfametoxazol + Trimetoprima suspensão 40 mg/ml + 8mg/ml
26. Sulfato de zinco xarope 4mg/ml
27. Sulfato ferroso gotas 25mg/ml ou xarope 5mg/ml
28. Vitamina A cápsulas com 100.000UI e 200.000UI
ANEXO XLIX
ROTEIRO (Origem: PRT MS/GM 1969/2001, Anexo 1)
ROTEIRO
A) PARA O REGISTRO DE CAUSAS EXTERNAS
Descrever o tipo de causa externa segundo a Classificação Estatística Internacional de Doencas e Problemas Relacionados à Saúde em vigor.
I - COMPREENDE-SE COMO CAUSAS EXTERNAS
Um conjunto de agravos à saúde decorrentes de acidentes de trânsito, quedas, envenenamentos, afogamentos e outras ocorrências provocadas por circunstâncias ambientais e causas acidentais ou intencionais tais como homicídios, agressões e lesões autoprovocadas e/ou acidentes e doenças relacionadas ao trabalho.
II - PREENCHIMENTO DO LAUDO MÉDICO PARA EMISSÃO DE AIH
O preenchimento de todas as informações solicitadas no Laudo Médico para emissão de AIH facilita a compreensão do agrave sofrido pela pessoa, dos dados a: partir do atendimento, da conduta, orientação; acompanhamento e destino dado ao paciente, apoiando o correto preenchimento da Autorização de Internação Hospitalar - AIH, que será utilizada posteriormente para fins epidemiológicos, sanitários, administrativos e previdenciários.
O preenchimento completo e preciso do CID principal e do CID secundário representa uma síntese desse conjunto de informação de forma codificada.
III- RESPONSABILIDADES
1 - Quem registra a entrada do paciente: serviço de registro da unidade que prestou atendimento, que colhe o máximo possível de informações pessoais e sobre a ocorrência.
2 - Quem registra o atendimento: médico (a) que atende o paciente.
3 - Onde registrar: no Laudo Médico para Emissão de AIH conforme modelo disposto Anexo IV desta Portaria.
4 - Registrar no Laudo Médico para Emissão de AIH:
- o tipo de causa externa, a natureza da lesão,
- a parte do corpo atingida,
- o agente causador do agravo,
- o local de ocorrência,
- a atividade da vítima (no momento do ocorrido).
5 - O Laudo Médico para Emissão de AIH deverá ser preenchido em 03 (três) vias, sendo a primeira via anexada ao prontuário do paciente, a segunda via encaminhada ao gestor local de saúde e a terceira via, entregue ao paciente ou responsável, para fins previdenciários junto ao empregador, em casos de Acidentes ou Doenças relacionadas ao Trabalho.
INFORMAÇÕES IMPORTANTES:
A notificação dos casos é responsabilidade da unidade como um todo, e não apenas dos profissionais que fizeram o atendimento, portanto todos devem estar atentos à identificação das causas e comprometidos com o acompanhamento do paciente.
E importante que a gerência local de saúde conheça o número e a natureza dos casos atendidos, de forma a definir as estratégias de intervenção adequadas.
E fundamental que todos os setores e profissionais da unidade recebam este roteiro instrutivo e compreendam a importância do adequado preenchimento das informações solicitadas.
B) PARA O REGISTRO DE AGRAVOS RELACIONADOS AO TRABALHO
O conjunto das informações sobre os agravos à saúde relacionados ao trabalho visa atender a especificidades e necessidades da área de saúde do trabalhador no que diz respeito ao SIH/SUS. A atenção integral à saúde do trabalhador requer articulação do SUS em todos os níveis de complexidade e nas três esferas de governo: União, Estados e Municípios, no sentido de aperfeiçoar o atendimento que já vem sendo realizado, e ao mesmo tempo comprovar as ações realizadas, disponibilizar informações necessárias à vigilância da saúde, à fiscalização do trabalho e à área previdenciária.
Informações Básicas que deverão constar da AIH - Autorização de Internação Hospitalar e do respectivo Laudo Médico para Emissão de AIH (ANEXO I )
- Acidente de Trabalho de trajeto - (ocorrido no trajeto de ida ou volta do trabalho)
- Acidente de Trabalho típico (ocorrido no próprio local de trabalho)
- Doença Relacionada ao trabalho
- CID Principal
- CID Secundário
- Descrição da Natureza da Lesão
- Classificação Brasileira de Ocupações - CBO-R
- Classificação Nacional de Atividades Econômicas - CNAE-R
O referido Laudo Médico para Emissão de AIH - uma vez preenchido deverá ter uma cópia disponibilizada ao paciente e/ou familiares; possibilitando ao trabalhador acidentado ou portador de doença relacionada ao trabalho, comprovar o atendimento realizado no SUS e obter junto ao empregador, a emissão da CAT - Comunicação de Acidente do Trabalho - a qual dará acesso ao benefício previdenciário a que tem, de acordo com a legislação vigente.
Preencher o campo - CID - com o(s) diagnóstico(s) correspondentes ao tipo de acidente ou doença relacionada ao trabalho, de acordo com a CID - Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde em vigor.
Descrever no espaço destinado ao Laudo Técnico: o agente causador do agravo, a situação geradora do acidente ou doença, a natureza lesão; parte do corpo atingida (em caso e acidente) ou o sistema/aparelho atingido (em caso de doença relacionada ao trabalho) e o(s) respectivo(s) diagnóstico(s).
OBS. Caso não seja possível obter no momento da emissão do Laudo Médico para Emissão de AIH as informações sobre a CNAE do empregador e a CBO do trabalhador, tais informações deverão ser registradas posteriormente na própria AIH.
I - IDENTIFICAÇÃO DO TRABALHADOR
a. Registro do nome completo do paciente, sem abreviaturas
b. Cadastro de Pessoa Física/CPF
c. Endereço completo, Município, UF, CEP, Telefone
d. Número do Cartão Nacional do SUS
e. Ocupação/CBO - Código Brasileiro de Atividades Econômicas
f. Número do Cartão Nacional do SUS do trabalhador
II - IDENTIFICAÇÃO DO EMPREGADOR
a. Registro do Ramo de Atividade Econômica da Empresa segundo a CNAE - Classificação Nacional de Atividade Econômica
b. Registro do CGC/CNPJ da empresa
CNAE - informar o código relativo à atividade principal do estabelecimento em conformidade com aquela que determina o Grau de Risco para fins de contribuição para os benefícios concedidos em razão do grau de incidência da incapacidade laborativa decorrente dos riscos ambientais do trabalho. O código CNAE (Classificação Nacional de Atividade Econômica) encontra-se no documento de CGC ou CNPJ da empresa ou no Anexo I desta portaria.
CGC/CNPJ - informar o número da matrícula no Cadastro Geral de Contribuintes - CGC ou da mat. Área - informar a natureza da prestação de serviço, se urbana ou rural.
III - CARACTERIZAÇAO DO AGRAVO A SAÚDE RELACIONADO AO TRABALHO
Acidente do trabalho é o que ocorre pelo exercício do trabalho a serviço da empresa, com o segurado empregado, trabalhador avulso, médico residente, bem como com o segurado especial no exercício de suas atividades, provocando lesão corporal ou perturbação funcional que cause a morte, a perda ou redução, temporária ou permanente, da capacidade para o trabalho.
Consideram-se como acidente do trabalho:
- doença profissional, assim entendida a produzida ou desencadeada pelo exercício do trabalho peculiar a determinada atividade e constante da relação elaborada pelo Ministério do Trabalho e da Previdência Social.
- doença do trabalho, assim entendida a adquirida ou desencadeada em função de condições especiais em que o trabalho é realizado e com ele se relacione diretamente.
Equiparam-se também ao acidente do trabalho:
- o acidente ligado ao trabalho que, embora não tenha sido a causa única, haja contribuído diretamente para a morte do segurado, para redução ou perda da sua capacidade para o trabalho, ou produzido lesão que exija atenção médica para a sua recuperação;
- o acidente sofrido no local e no horário do trabalho em consequência de:
a. ato de agressão, sabotagem ou terrorismo praticado por terceiros ou companheiros de trabalho;
b. ofensa física intencional, inclusive de terceiro, por motivo de disputa relacionada ao trabalho;
c. ato de imprudência, de negligência ou de imperícia de terceiros ou de companheiro de trabalho;
d. ato de pessoa privada do uso da razão;
e. desabamento, inundações, incêndio e outros casos fortuitos ou decorrentes de força maior;
- a doença proveniente de contaminação acidental do empregado no exercício de sua atividade;
- o acidente sofrido pelo segurado, ainda que fora do local e horário de trabalho:
a. na execução de ordem ou na realização de serviço sob a autoridade da empresa;
b. na prestação espontânea de qualquer serviço à empresa para lhe evitar prejuízo ou proporcionar proveito;
c. em viagem a serviço da empresa, inclusive para estudo quando financiada por estar dentro de seus planos para melhor capacitação da mão-de-obra, independentemente do meio de locomoção utilizado, inclusive veículo de propriedade do segurado;
d. no percurso da residência para o local de trabalho ou deste para aquela, qualquer que seja o meio de locomoção, inclusive veículo de propriedade do segurado.
- A comunicação de acidente do trabalho deverá ser feita pela empresa, ou na falta desta o próprio acidentado, seus dependentes, a entidade sindical competente, o médico assistente ou qualquer autoridade pública.
- O prazo para a comunicação do acidente de trabalho é o primeiro dia útil seguinte ao da ocorrência e, em caso de morte, de imediato.
INFORMAÇÕES IMPORTANTES
Relativas ao ACIDENTE OU DOENÇA
Agente causador - informar o agente diretamente relacionado ao acidente, podendo ser máquina, equipamento ou ferramenta, como uma prensa ou uma injetora de plásticos; ou produtos químicos, agentes físicos ou biológicos como benzeno, sílica, ruído ou sal- monela. Pode ainda ser consignada uma situação específica como queda, choque elétrico, atropelamento (Tratando-se de acidente do trabalho, de doenças profissionais ou do trabalho).
Descrição da situação geradora do acidente ou doença - descrever a situação ou a atividade de trabalho desenvolvida pelo acidentado e por outros diretamente relacionados ao acidente. Tratando- se de acidente de trajeto, especificar o deslocamento e informar se o percurso foi ou não alterado ou interrompido por motivos alheios ao trabalho. No caso de doença, descrever a atividade de trabalho, o ambiente ou as condições em que o trabalho era realizado.
Obs.: Evitar consignar neste campo diagnóstico da doença ou lesão (Exemplo: indicar a exposição continuada a níveis acentuados de benzeno em função da atividade de pintar motores com tintas contendo solventes orgânicos, e não benzenismo).
LAUDO MÉDICO
Descrição e natureza da lesão - fazer relato claro e sucinto informando a natureza, tipo da lesão e/ou quadro clínico da doença citando a parte do corpo atingida, sistemas ou aparelhos.
Exemplos:
a) edema, equimose e limitação dos movimentos na articulação tíbio társica direita;
b) sinais flogísticos, edema no antebraço esquerdo e dor à movimentação da flexão do punho esquerdo.
Diagnóstico provável - informar, objetivamente, o diagnóstico.
Exemplos:
a) entorse tornozelo. direito;
b) tendinite dos flexores do carpo.
CID - 10 - Classificar conforme a Classificação Internacional de Doenças - CID - 10.
Exemplos:
a) S93.4- entorse e distensão do tornozelo;
b) M65.9 - sinovite ou tendinite não especificada.
Observações - citar qualquer tipo de informação médica adicional, como condições patológicas pré-existentes, com causas, se há compatibilidade entre o estágio evolutivo das lesões e a data do acidentes declarada, se há recomendação especial para permanência no trabalho, etc.
ANEXO L
CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕES - ESTRUTURA AGREGADA NA ORDEM DE 3 DIGITOS (Origem: PRT MS/GM 1969/2001, Anexo 2)
| CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕESESTRUTURA AGREGADA NA ORDEM DE 3 DÍGITOSDESCRIÇÃO DOS GRANDES GRUPOS DE OCUPAÇÕES | |
| CÓDIGO MATRIZ | GRANDE GRUPO |
| 1 | TRABALHADORES DAS PROFISSÕES CIENTÍFICAS, TÉCNICAS, ARTÍSTICAS E TRABALHADORES ASSEMELHADOS Os trabalhadores deste grande grupo realizam pesquisas e aplicam conhecimentos científicos na solução de problemas de ordem técnica, econômica, artística, social e empresarial e desenvolvem outras atividades de caráter profissional nos campos da química e física; da engenharia e arquitetura; da aviação e marinha; da biologia e agronomia; da medicina, odontologia e veterinária; da estatística, das matemáticas e análises de sistemas; da economia, administração e ciências contábeis; do direito; do ensino; da literatura, artes e comunicação social e do esporte. |
| 2 | MEMBROS DOS PODERES LEGISLATIVO, EXECUTIVO E JUDICIÁRIO, FUNCIONÁRIOS PÚBLICOS SUPERIORES, DIRETORES DE EMPRESAS E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo desempenham funções de caráter legislativo, desenvolvem atividades de direção e assessoramento do Poder Executivo e processam e julgam assuntos legais e jurídicos como membros do Poder Judiciário; exercem funções de caráter diplomático, desempenham, em empresas governamentais ou privadas, atividades diretivas de alto nível; planejam, organizam e controlam os trabalhos dessas empresas; dirigem e coordenam órgãos específicos da administração superior. |
| 3 | TRABALHADORES DE SERVIÇOS ADMINISTRATIVOS E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo aplicam leis, decretos e regulamentos promulgados pelos governos federal, estaduais, municipais ou por autoridades locais; controlam o trabalho dos empregados de escritório e atividades afins e os serviços de transportes e comunicações; mantêm os registros das operações financeiras e outras transações comerciais realizadas pelas empresas; manejam fundos em nome da organização ou de sua clientela; reproduzem, em estenografia, datilografia ou por outros meios, textos orais ou escritos; operam máquina de escritório ou instalações telefônicas e telegráficas; chefiam os sistemas de transportes e comunicações e controlam as operações relativas aos mesmos; exercem funções nas empresas de serviços postais e telegráficos; realizam outras tarefas similares. |
| 4 | TRABALHADORES DE COMÉRCIO E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo exercem o comércio atacadista e varejista, por conta própria, em empresas de pequeno porte; dedicam-se à compra e venda de toda a classe de bens e serviços ou cumprem funções diretamente relacionadas com essas atividades. Os trabalhadores que dirigem, como representantes dos proprietários ou acionistas, as atividades de empresas que se dedicam ao comércio atacadista e varejista e ao ramo hoteleiro estão classificados no grupo de base 2-43, gerentes financeiros, comerciais e de publicidade. |
| 5 | TRABALHADORES DE SERVIÇOS DE TURISMO, HOSPEDAGEM, SERVENTIA, HIGIENE E EMBELEZAMENTO, SEGURANÇA AUXILIARES DE SAÚDE E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo administram, organizam, supervisionam ou desempenham serviços de turismo, hospedagem, doméstico, pessoais, de proteção e outros similares. |
| 6 | TRABALHADORES AGROPECUÁRIOS, FLORESTAIS, DA PESCA E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo chefiam unidades de explorações agropecuárias e florestais e grupos de trabalhadores encarregados da execução de atividades pertinentes a essas explorações; exploram, por conta própria, estabelecimentos agropecuários de tipo familiar; executam os trabalhos próprios dos cultivos agrícolas, da criação de animais e da exploração de florestas; pescam e realizam tarefas análogas; operam máquinas e implementos utilizados na agricultura, pecuária e explorações florestais. |
| 7,8,9 | TRABALHADORES DA PRODUÇÃO INDUSTRIAL, OPERADORES DE MÁQUINAS, CONDUTORES DE VEÍCULOS E TRABALHADORES ASSEMELHADOS Os trabalhadores deste grande grupo desempenham tarefas diretamente ligadas aos trabalhos de extração de minerais, petróleo e gás; beneficiamento e transformação de matérias-primas e fabricação e reparação de produtos industriais; construção, manutenção e reparação de edifícios, estradas e outras obras civis; operação de máquinas; condução de veículos de transporte e de equipamento de terraplanagem; manipulação de mercadorias e materiais, e outras tarefas relacionadas com produção industrial que requeiram, fundamentalmente, esforço físico. |
| 10 | MEMBROS DAS FORÇAS ARMADAS, POLICIAIS E BOMBEIROS MILITARES Estão compreendidas neste grande grupo as pessoas que servem voluntária ou obrigatoriamente às milícias e que, dedicando-se exclusivamente a esse serviço, não podem aceitar um emprego civil, só o fazendo no interesse público. Abrange os membros permanentes das Forças Armadas de terra, mar e ar, assim como o pessoal que se acha temporariamente em serviço ativo por período estabelecido nas leis ou regulamentos específicos, para seguir cursos e programas de treinamento ou prestar serviços auxiliares, bem como exercer outra atividade de conveniência nacional. Incluem-se ainda policiais e bombeiros militares que se dedicam à garantia de segurança municipal, estadual e nacional. Excluem-se deste grupo os empregados civis que trabalham nos departamentos administrativos do governo relacionados com questões de defesa; os membros das polícias civil e federal; os empregados de alfândegas e outros serviços civis das Forças Armadas; os membros da reserva militar que não estão integralmente dedicados ao serviço ativo e as pessoas que foram chamadas às Forças Armadas, provisoriamente, para efetuar um curto período de treinamento. |
| CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕESESTRUTURA AGREGADA NA ORDEM DE 3 DÍGITOS | |
| CÓDIGO | GRUPO DE OCUPAÇÕES |
| 0-11 | Químicos |
| 0-12 | Físicos |
| 0-19 | Químicos, físicos e trabalhadores assemelhados não classificados sob outras epígrafes |
| 0-20 | Engenheiros agrônomos, florestais e de pesca |
| 0-21 | Engenheiros civis e arquitetos |
| 0-22 | Engenheiros de operações e desenhistas industriais |
| 0-23 | Engenheiros eletricistas e engenheiros eletrônicos |
| 0-24 | Engenheiros mecânicos |
| 0-25 | Engenheiros químicos |
| 0-26 | Engenheiros metalúrgicos |
| 0-27 | Engenheiros de minas e geólogos |
| 0-28 | Engenheiros de organização e métodos |
| 0-29 | Engenheiros, arquitetos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 0-30 | Técnicos de contabilidade, estatística, economia doméstica e administração |
| 0-31 | Técnicos de biologia, agronomia e trabalhadores assemelhados |
| 0-32 | Técnicos de mineração, metalurgia e geologia |
| 0-33 | Técnicos de obras civis, agrimensura, estradas, saneamento e trabalhadores assemelhados |
| 0-34 | Técnicos de eletricidade, eletrônica e telecomunicações |
| 0-35 | Técnicos de mecânica |
| 0-36 | Técnicos de química e trabalhadores assemelhados |
| 0-37 | Técnicos têxteis |
| 0-38 | Desenhistas técnicos |
| 0-39 | Técnicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 0-41 | Pilotos de aviação comercial, navegadores, mecânicos de vôo e trabalhadores assemelhados |
| 0-42 | Oficiais de bordo, pilotos e trabalhadores assemelhados (navegação marítima e interior) |
| 0-43 | Oficiais-maquinistas (navegação marítima e interior) |
| 0-51 | Biologistas e trabalhadores assemelhados |
| 0-52 | Bacteriologistas, farmacologistas e trabalhadores assemelhados |
| 0-61 | Médicos |
| 0-63 | Cirurgiões-dentistas |
| 0-65 | Médicos veterinários e trabalhadores assemelhados |
| 0-67 | Farmacêuticos |
| 0-68 | Nutricionistas e trabalhadores assemelhados |
| 0-71 | Enfermeiros |
| 0-72 | Técnicos de enfermagem e trabalhadores assemelhados (exceto enfermeiros) |
| 0-73 | Assistentes sociais |
| 0-74 | Psicólogos |
| 0-75 | Ortoptistas e óticos |
| 0-76 | Terapeutas |
| 0-77 | Operadores de equipamentos médicos e odontológicos |
| 0-79 | Médicos, cirurgiões-dentistas, médicos veterinários, enfermeiros e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 0-81 | Estatísticos |
| 0-82 | Matemáticos e atuários |
| 0-83 | Analistas de sistemas |
| 0-84 | Programadores de computador |
| 0-91 | Economistas |
| 0-92 | Administradores e trabalhadores assemelhados |
| 0-93 | Contadores |
| 0-99 | Economistas, administradores, contadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 1-21 | Advogados |
| 1-29 | Juristas não classificados sobre outras epígrafes |
| 1-31 | Professores de disciplinas pedagógicas de ensino superior |
| 1-32 | Professores de ciências físicas e químicas de ensino superior |
| 1-33 | Professores de engenharia e arquitetura |
| 1-34 | Professores de matemática, estatística e ciências afins de ensino superior |
| 1-35 | Professores de ciências econômicas, administrativas e contábeis de ensino superior |
| 1-36 | Professores de ciências humanas de ensino superior |
| 1-37 | Professores de ciências biológicas e médicas de ensino superior |
| 1-38 | Professores de línguas e literaturas de ensino superior |
| 1-39 | Professores de ensino superior não-classificados sob outras epígrafes |
| 1-41 | Professores de ensino de 2º grau |
| 1-42 | Professores de ensino de 1º grau |
| 1-43 | Professores de ensino pré-escolar |
| 1-44 | Professores e instrutores de formação profissional |
| 1-45 | Professores de ensino especial |
| 1-49 | Professores não-classificados sob outras epígrafes |
| 1-51 | Escritores e críticos |
| 1-52 | Jornalistas e redatores |
| 1-53 | Locutores e comentaristas de rádio e televisão |
| 1-59 | Escritores, jornalistas, redatores, locutores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 1-61 | Escultores, pintores e trabalhadores assemelhados |
| 1-63 | Fotógrafos, operadores de câmeras de cinema e televisão e trabalhadores assemelhados |
| 1-71 | Compositores, músicos e cantores |
| 1-72 | Coreógrafos e bailarinos |
| 1-73 | Atores e diretores de espetáculos |
| 1-74 | Empresários e produtores de espetáculos |
| 1-75 | Artistas de circo |
| 1-79 | Músicos, artistas, empresários e produtores de espetáculos não-classificados sob outras epígrafes |
| 1-81 | Técnicos desportivos e trabalhadores assemelhados |
| 1-82 | Atletas profissionais |
| 1-89 | Técnicos desportivos, atletas profissionais e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 1-91 | Bibliotecários, arquivologistas e museólogos |
| 1-92 | Sociólogos, antropólogos e trabalhadores assemelhados |
| 1-95 | Filólogos, tradutores e intérpretes |
| 1-96 | Membros de cultos religiosos e trabalhadores assemelhados |
| 1-97 | Analistas de ocupações e trabalhadores assemelhados |
| 1-98 | Técnicos, analistas de seguro, de importação e exportação e trabalhadores assemelhados |
| 1-99 | Trabalhadores das profissões científicas, técnicas, artísticas e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 2-11 | Membros superiores do Poder Legislativo |
| 2-12 | Membros superiores do Poder Executivo |
| 2-13 | Membros superiores do Poder Judiciário |
| 2-14 | Funcionários públicos superiores |
| 2-21 | Diplomatas |
| 2-31 | Diretores de empresas manufatureiras |
| 2-32 | Diretores de empresas agropecuárias, pesqueiras e extrativas |
| 2-33 | Diretores de empresas de produção e distribuição de energia elétrica e gás e de serviço de água e esgoto |
| 2-34 | Diretores de empresas de construção civil |
| 2-35 | Diretores de empresas do comércio atacadista e varejista, de empresas hoteleiras e estabelecimentos similares |
| 2-36 | Diretores de empresas de transportes e comunicações |
| 2-37 | Diretores de empresas financeiras, imobiliárias, companhias de seguros, empresas de prestação de serviços e outras similares |
| 2-38 | Diretores de empresas de serviços comunitários e sociais |
| 2-39 | Diretores de empresas não-classificados sob outras epígrafes |
| 2-41 | Gerentes administrativos e assemelhados |
| 2-42 | Gerentes de produção, de planejamento e de pesquisa e desenvolvimento |
| 2-43 | Gerentes financeiros, comerciais, de marketing e de publicidade |
| 2-49 | Gerentes de empresas não-classificados sob outras epígrafe |
| 3-01 | Chefes intermediários administrativos |
| 3-02 | Chefes intermediários de contabilidade e finanças |
| 3-09 | Chefes intermediários administrativos, de contabilidade e finanças não-classificados sob outras epígrafes |
| 3-11 | Agentes administrativos, assistentes administrativos e trabalhadores assemelhados |
| 3-12 | Técnicos e fiscais de tributação e arrecadação |
| 3-13 | Agentes superiores de polícia |
| 3-14 | Serventuários da justiça e trabalhadores assemelhados |
| 3-19 | Agentes de administração de empresas públicas e privadas não-classificados sob outras epígrafes |
| 3-21 | Secretários |
| 3-23 | Datilógrafos, estenógrafos e trabalhadores assemelhados |
| 3-31 | Auxiliares de contabilidade, caixas e trabalhadores assemelhados |
| 3-32 | Atendentes de guichê, bilheteiros e trabalhadores assemelhados |
| 3-39 | Trabalhadores de serviços de contabilidade, caixas e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 3-41 | Operadores de máquinas contábeis e de calcular |
| 3-42 | Operadores de máquinas de processamento automático de dados |
| 3-43 | Perfuradores e conferidores (cartões e fitas) |
| 3-44 | Técnicos de controle de produção e operação |
| 3-51 | Agentes de estação e de movimento (serviços ferroviários) |
| 3-52 | Chefes de serviços de correios e telecomunicações |
| 3-53 | Chefes de serviços aéreos, controladores de tráfego aéreo e trabalhadores assemelhados |
| 3-54 | Chefes e inspetores de serviços de transporte rodoviário |
| 3-55 | Chefes de serviços de transporte marítimo, fluvial e lacustre |
| 3-60 | Despachantes, fiscais e cobradores de transportes coletivos (exceto trem) |
| 3-70 | Classificadores de correspondência, carteiros e mensageiros |
| 3-80 | Telefonistas, telegrafistas e trabalhadores assemelhados |
| 3-91 | Trabalhadores de serviços de abastecimento e armazenagem |
| 3-93 | Auxiliares de escritório e trabalhadores assemelhados |
| 3-94 | Recepcionistas |
| 3-95 | Arquivistas e trabalhadores assemelhados |
| 3-99 | Trabalhadores de serviços administrativos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 4-10 | Comerciantes (comércio atacadista e varejista) |
| 4-21 | Supervisores de vendas e trabalhadores assemelhados |
| 4-22 | Supervisores de compras e compradores |
| 4-31 | Agentes e inspetores técnicos de vendas |
| 4-32 | Vendedores pracistas, representantes comerciais e trabalhadores assemelhados |
| 4-41 | Corretores de seguros, de imóveis e de títulos e valores |
| 4-42 | Agentes de venda de serviços às empresas |
| 4-43 | Leiloeiros, avaliadores e trabalhadores assemelhados |
| 4-51 | Vendedores de comércio atacadista, varejista e trabalhadores assemelhados |
| 4-52 | Vendedores ambulantes, vendedores a domicílio e jornaleiros |
| 4-53 | Demonstradores e trabalhadores assemelhados |
| 4-54 | Decoradores e trabalhadores assemelhados |
| 4-90 | Trabalhadores de comércio e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 5-00 | Gerentes de hotéis, restaurantes, bares, estabelecimentos similares e trabalhadores assemelhados |
| 5-20 | Mordomos, governantas e trabalhadores assemelhados |
| 5-31 | Cozinheiros e trabalhadores assemelhados |
| 5-32 | Garçons, barmen e trabalhadores assemelhados |
| 5-40 | Trabalhadores de serventia (domicílios e hotéis) e trabalhadores assemelhados |
| 5-41 | Comissários (serviço de transporte de passageiros) |
| 5-51 | Trabalhadores de serviços de administração de edifícios |
| 5-52 | Trabalhadores de serviços de conservação, manutenção, limpeza de edifícios, empresas comerciais, indústrias, áreas verdes e logradouros públicos |
| 5-60 | Lavadeiros, tintureiros e trabalhadores assemelhados |
| 5-70 | Cabeleireiros, especialistas em tratamentos de beleza e trabalhadores assemelhados |
| 5-72 | Pessoal de enfermagem, parteiras, laboratórios e trabalhadores assemelhados (exceto enfermeiros) |
| 5-81 | Bombeiros |
| 5-82 | Policiais e trabalhadores assemelhados |
| 5-83 | Guardas de segurança e trabalhadores assemelhados |
| 5-84 | Guardas de trânsito |
| 5-89 | Trabalhadores de serviços de proteção e segurança não-classificados sob outras epígrafes |
| 5-91 | Agentes de viagem e guias de turismo |
| 5-92 | Agentes de serviços funerários e embalsamadores |
| 5-99 | Trabalhadores de serviços de turismo, hospedagem, serventia, higiene, embelezamento, segurança e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 6-00 | Administradores de explorações agropecuárias e florestais |
| 6-01 | Capatazes de explorações agropecuárias e florestais |
| 6-11 | Produtores agropecuários polivalentes |
| 6-12 | Produtores agropecuários especializados |
| 6-21 | Trabalhadores agropecuários polivalentes e trabalhadores assemelhados |
| 6-31 | Trabalhadores da cultura de gramíneas |
| 6-32 | Trabalhadores da cultura de plantas fibrosas |
| 6-33 | Trabalhadores hortigranjeiros |
| 6-34 | Trabalhadores da floricultura |
| 6-35 | Trabalhadores da fruticultura |
| 6-36 | Trabalhadores da cultura de plantas produtoras de substâncias estimulantes e de especiarias (exceto as de extração florestal) |
| 6-37 | Trabalhadores da cultura de plantas oleaginosas |
| 6-38 | Trabalhadores da cultura de plantas produtoras de substâncias aromáticas, medicinais e tóxicas (exceto as de exploração florestal) |
| 6-39 | Trabalhadores agrícolas especializados não-classificados sob outras epígrafes |
| 6-41 | Trabalhadores da pecuária de grande porte |
| 6-42 | Trabalhadores da pecuária de médio porte |
| 6-43 | Trabalhadores da pecuária de pequeno porte |
| 6-44 | Trabalhadores da pecuária (insetos úteis) |
| 6-49 | Trabalhadores da pecuária não-classificados sob outras epígrafes |
| 6-51 | Trabalhadores florestais da exploração de espécies produtoras de madeiras |
| 6-52 | Trabalhadores florestais da exploração de espécies produtoras de gomas elásticas, não-elásticas e resinas |
| 6-53 | Trabalhadores florestais da exploração de espécies produtoras de fibras, ceras e óleos |
| 6-54 | Trabalhadores florestais da exploração de espécies produtoras de substâncias alimentícias |
| 6-55 | Trabalhadores florestais da exploração de espécies produtoras de substâncias aromáticas, medicinais e tóxicas |
| 6-59 | Trabalhadores florestais não-classificados sob outras epígrafes |
| 6-61 | Patrões de pesca |
| 6-62 | Pescadores industriais |
| 6-63 | Pescadores artesanais |
| 6-64 | Trabalhadores da aquicultura |
| 6-69 | Pescadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 6-71 | Operadores de máquinas e implementos agrícolas |
| 6-72 | Operadores de máquinas e implementos de pecuária |
| 6-73 | Operadores de máquinas e implementos de exploração florestal |
| 7-01 | Mestres, contramestres, supervisores de empresas manufatureiras e de construção civil e trabalhadores assemelhados |
| 7-02 | Mestres (empresas de extração mineral) |
| 7-03 | Mestres (empresas de energia elétrica, gás, água e esgoto) |
| 7-04 | Contramestres da indústria têxtil |
| 7-05 | Mestres, contramestres, supervisores e operadores de manutenção de sistemas operacionais e trabalha dores assemelhados |
| 7-11 | Mineiros e canteiros |
| 7-12 | Operadores de máquinas de extração de minérios (minas e pedreiras) |
| 7-13 | Trabalhadores de beneficiamento de minérios e pedras |
| 7-14 | Sondadores de poços de petróleo e gás e trabalhadores assemelhados |
| 7-15 | Sondadores de poços (exceto de petróleo e gás) |
| 7-16 | Salineiros (sal marinho) |
| 7-19 | Trabalhadores de minas e pedreiras, sondadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 7-20 | Operadores de aciaria |
| 7-21 | Forneiros e operadores metalúrgicos (primeira fusão) |
| 7-22 | Operadores de laminação |
| 7-23 | Forneiros metalúrgicos (segunda fusão e reaquecimento) |
| 7-24 | Fundidores de metais |
| 7-25 | Moldadores e macheiros |
| 7-26 | Trabalhadores de tratamento térmico e termoquímico de metais |
| 7-27 | Trefiladores e estiradores de metais |
| 7-28 | Galvanizadores e recobridores de metais |
| 7-29 | Trabalhadores metalúrgicos e siderúrgicos não-classificados sob outras epígrafes |
| 7-31 | Trabalhadores de tratamento da madeira |
| 7-32 | Operadores de máquinas de desdobrar madeira |
| 7-33 | Preparadores de pasta para papel |
| 7-34 | Operadores de máquinas de fabricação de papel e papelão |
| 7-35 | Preparadores de compensados e aglomerados |
| 7-39 | Trabalhadores de tratamento da madeira e de fabricação de papel e papelão não-classificados sob outras epígrafes |
| 7-41 | Operadores de britadeiras, trituradoras e misturadeiras (tratamentos químicos e afins) |
| 7-42 | Operadores de instalações térmicas para processamentos químicos |
| 7-43 | Operadores de aparelhos de filtragem e separação (tratamentos químicos e afins) |
| 7-44 | Operadores de aparelhos de destilação e reação |
| 7-45 | Operadores de refinação de petróleo |
| 7-46 | Operadores de coqueria |
| 7-47 | Trabalhadores da produção e manipulação de medicamentos |
| 7-49 | Operadores de instalações de processamentos químicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 7-51 | Trabalhadores de preparação de fibras |
| 7-52 | Fiandeiros e trabalhadores assemelhados |
| 7-53 | Trabalhadores de preparação de tecelagem |
| 7-54 | Tecelões |
| 7-55 | Tecelões de malhas |
| 7-56 | Trabalhadores de acabamento, tingimento e estamparia de produtos têxteis |
| 7-59 | Fiandeiros, tecelões, tingidores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 7-71 | Moleiros |
| 7-72 | Trabalhadores da fabricação e refinação de açúcar |
| 7-73 | Magarefes e trabalhadores assemelhados |
| 7-74 | Trabalhadores de industrialização e conservação de alimentos |
| 7-75 | Trabalhadores de tratamento do leite, fabricação de laticínios e de produtos similares |
| 7-76 | Padeiros, confeiteiros e trabalhadores assemelhados |
| 7-77 | Trabalhadores de preparação de café, cacau e produtos assemelhados |
| 7-78 | Trabalhadores de fabricação de cerveja, vinhos e outras bebidas |
| 7-79 | Trabalhadores de preparação de alimentos e bebidas não-classificados sob outras epígrafes |
| 7-81 | Preparadores de fumo |
| 7-82 | Charuteiros |
| 7-83 | Cigarreiros |
| 7-91 | Alfaiates, costureiros e modistas |
| 7-93 | Chapeleiros |
| 7-94 | Modelistas e cortadores (vestuário) |
| 7-95 | Costureiros (confecção em série) |
| 7-96 | Estofadores e trabalhadores assemelhados |
| 7-97 | Bordadores e cerzidores |
| 7-99 | Trabalhadores de costura, estofadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 8-01 | Sapateiros |
| 8-02 | Trabalhadores de calçados |
| 8-03 | Trabalhadores de artefatos de couro (exceto roupas e calçados) |
| 8-11 | Marceneiros e trabalhadores assemelhados |
| 8-12 | Operadores de máquinas de lavrar madeira |
| 8-19 | Marceneiros, operadores de máquinas de lavrar madeira e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 8-20 | Cortadores, polidores e gravadores de pedras |
| 8-31 | Forjadores |
| 8-32 | Ferramenteiros e modeladores de metais |
| 8-33 | Torneiros, fresadores, retificadores e trabalhadores assemelhados |
| 8-34 | Preparadores de máquinas-ferramentas (produção em série) |
| 8-35 | Operadores de máquinas-ferramentas (produção em série) |
| 8-36 | Polidores de metais e afiadores de ferramentas |
| 8-37 | Operadores de máquinas-ferramentas com comando numérico |
| 8-39 | Trabalhadores da usinagem de metais não-classificados sob outras epígrafes |
| 8-40 | Ajustadores mecânicos |
| 8-41 | Montadores de máquinas |
| 8-42 | Relojoeiros e montadores de instrumentos de precisão |
| 8-43 | Mecânicos de manutenção de veículos automotores |
| 8-44 | Mecânicos de manutenção de aeronaves |
| 8-45 | Mecânicos de manutenção de máquinas |
| 8-49 | Ajustadores mecânicos, montadores e mecânicos de máquinas, veículos e instrumentos de precisão não-classificados sob outras epígrafes |
| 8-51 | Montadores de equipamentos elétricos |
| 8-52 | Montadores de equipamentos eletrônicos |
| 8-54 | Reparadores de equipamentos elétricos e eletrônicos |
| 8-55 | Eletricistas de instalações |
| 8-56 | Instaladores e reparadores de equipamentos e aparelhos de telecomunicações |
| 8-57 | Instaladores e reparadores de linhas elétricas e de telecomunicações |
| 8-59 | Eletricistas, eletrônicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 8-61 | Operadores de estações de rádio e televisão |
| 8-62 | Operadores de equipamentos de sonorização, cenografia e projeção |
| 8-71 | Encanadores e instaladores de tubulações |
| 8-72 | Soldadores e oxicortadores |
| 8-73 | Chapeadores e caldeireiros |
| 8-74 | Montadores de estruturas metálicas e trabalhadores assemelhados |
| 8-80 | Joalheiros e ourives |
| 8-90 | Sopradores e moldadores de vidros e trabalhadores assemelhados |
| 8-91 | Cortadores e polidores de vidros |
| 8-92 | Ceramistas e trabalhadores assemelhados |
| 8-93 | Forneiros (vidraria e cerâmica) |
| 8-94 | Gravadores de vidro |
| 8-95 | Pintores e decoradores de vidro e cerâmica |
| 8-99 | Vidreiros, ceramistas e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-01 | Trabalhadores de fabricação de produtos de borracha (exceto pneumáticos) |
| 9-02 | Trabalhadores de fabricação, vulcanização e reparação de pneumáticos |
| 9-03 | Trabalhadores de fabricação de produtos de plástico |
| 9-10 | Confeccionadores de produtos de papel e papelão |
| 9-21 | Compositores tipográficos e trabalhadores assemelhados |
| 9-22 | Impressores |
| 9-23 | Estereotipistas e eletrotipistas |
| 9-24 | Gravadores e clicheristas (exceto fotogravadores) |
| 9-25 | Fotogravadores |
| 9-26 | Encadernadores e trabalhadores assemelhados |
| 9-27 | Trabalhadores de laboratórios fotográficos |
| 9-29 | Trabalhadores das artes gráficas não-classificados sob outras epígrafes |
| 9-31 | Pintores de obras e de estruturas metálicas |
| 9-39 | Pintores não-classificados sob outras epígrafes |
| 9-41 | Confeccionadores de instrumentos musicais e trabalhadores assemelhados |
| 9-42 | Cesteiros, confeccionadores de produtos de vime e similares e trabalhadores assemelhados |
| 9-43 | Trabalhadores da fabricação de produtos derivados de minerais não-metálicos |
| 9-49 | Trabalhadores da confecção de instrumentos musicais, de produtos de vime e similares, de derivados de minerais não-metálicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-51 | Pedreiros e estucadores |
| 9-52 | Trabalhadores de concreto armado |
| 9-53 | Telhadores |
| 9-54 | Carpinteiros |
| 9-55 | Ladrilheiros, taqueiros e trabalhadores assemelhados |
| 9-56 | Instaladores de material isolante |
| 9-57 | Vidraceiros |
| 9-59 | Trabalhadores da construção civil e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-61 | Operadores de instalações de produção de energia elétrica e nuclear |
| 9-69 | Operadores de máquinas fixas e de equipamentos similares não-classificados sob outras epígrafes |
| 9-71 | Trabalhadores da movimentação de cargas e descargas, estivagens e embalagens de mercadorias |
| 9-72 | Aparelhadores e emendadores de cabos (exceto cabos elétricos e de telecomunicações) |
| 9-73 | Operadores de guindastes e de equipamentos similares de elevação |
| 9-74 | Operadores de máquinas de construção civil, mineração e de equipamentos afins |
| 9-79 | Trabalhadores da movimentação e manipulação de mercadorias e materiais, operadores de máquinas de construção civil, mineração e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-81 | Contramestres de embarcações, marinheiros de convés e barqueiros |
| 9-82 | Maquinistas e foguistas de embarcações |
| 9-83 | Maquinistas e foguistas de locomotivas e máquinas similares |
| 9-84 | Agentes e auxiliares de manobras e conservação (transportes ferroviários) e trabalhadores assemelhados |
| 9-85 | Condutores de automóveis, ônibus, caminhões e veículos similares |
| 9-86 | Condutores de animais e de veículos de tração animal |
| 9-89 | Condutores de veículos de transporte e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-91 | Trabalhadores braçais não-classificados sob outras epígrafes |
| 9-99 | Trabalhadores que não podem ser classificados segundo a ocupação |
| 104 | Militares da Aeronáutica |
| 105 | Militares do Exército |
| 106 | Militares da Marinha |
| 107 | Policiais Militares |
| 108 | Bombeiros Militares |
ANEXO LI
CLASSIFICACÃO NACIONAL DE ATIVIDADES ECONÔMICAS RESUMIDA AGREGADA EM 3 DÍGITOS (Origem: PRT MS/GM 1969/2001, Anexo 3)
CLASSIFICAÇÃO NACIONAL DE ATIVIDADES ECONÔMICAS RESUMIDA AGREGADA EM 3 DÍGITOS
| INTERVALO | GRANDES GRUPOS |
|---|---|
| A 011 - 021 | AGRICULTURA, PECUÁRIA, SILVICULTURA, EXPLORAÇÃO FLORESTAL E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES |
| B 051 | PESCA, AQUICULTURA E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES |
| C 100 - 142 | INDÚSTRIAS EXTRATIVAS |
| D 151 - 372 | INDÚSTRIAS DE TRANSFORMAÇÃO |
| E 401 - 410 | PRODUÇÃO E DISTRIBUIÇÃO DE ELETRICIDADE, GÁS E ÁGUA ELETRICIDADE, GÁS E ÁGUA QUENTE |
| F 451 - 456 | CONSTRUÇÃO |
| G 501 - 527 | COMÉRCIO E REPARAÇÃO DE VEÍCULOS AUTOMOTORES, OBJETOS PESSOAIS E DOMÉSTICOS |
| H 551 - 552 | ALOJAMENTO E ALIMENTAÇÃO |
| I 601 - 642 | TRANSPORTE, ARMAZENAGEM E COMUNICAÇÕES |
| J 651 - 672 | INTERMEDIAÇÃO FINANCEIRA |
| K 701 - 749 | ATIVIDADES IMOBILIÁRIAS, ALUGUÉIS E SERVIÇOS PRESTADOS ÀS EMPRESAS |
| L 751 - 753 | ADMINISTRAÇÃO PÚBLICA, DEFESA E SEGURIDADE SOCIAL |
| M 801 - 809 | EDUCAÇÃO |
| N 851 - 853 | SAÚDE E SERVIÇOS SOCIAIS |
| O 900 - 930 | OUTROS SERVIÇOS COLETIVOS, SOCIAIS E PESSOAIS |
| P 950 | SERVIÇOS DOMÉSTICOS |
| Q 990 | ORGANISMOS INTERNACIONAIS E OUTRAS INSTITUIÇÕES EXTRATERRITORIAIS |
A - AGRICULTURA, PECUÁRIA, SILVICULTURA.
EXPLORAÇÃO FLORESTAL
E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES
011 - Produção de Lavouras Temporárias
Inclui cultivo de cereais; cultivo de algodão herbáceo; cultivo de cana-de-açúcar, cultivo de fumo; cultivo de soja; cultivo de outros produtos temporários.
012 - Horticultura e Produtos de Viveiro - Inclui cultivo de hortaliças; legumes e especiarias hortícolas; cultivo de flores e plantas ornamentais.
013 - Produção de Lavouras Permanentes
Inclui cultivo de frutas cítricas; cultivo de café; cultivo de cacau; cultivo de uva; cultivo de outras frutas, frutos secos; plantas para preparo de bebidas e para produção de condimentos
014 - Pecuária
Inclui criação de bovinos; criação de outros animais de grande porte; criação de ovinos; criação de suínos; criação de aves; criação de outros animais.
015 - Produção Mista: Lavoura e Pecuária
016 - Atividades de Serviços Relacionados com a Agricultura e Pecuária, Exceto Atividades Veterinárias
021 - Silvicultura, Exploração Florestal e Serviços Relacionados com estas Atividades
B - PESCA, AQUICULTURA E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES
051 - Pesca, Aquicultura e Atividades dos Serviços Relacionados com estas Atividades
C - INDÚSTRIAS EXTRATIVAS
100 - Extração de Carvão Mineral
111 - Extração de Petróleo e Gás Natural
112 - Serviços Relacionados com a Extração de Petróleo e Gás, exceto a Prospecção Realizada por Terceiros
131 - Extração de Minério de Ferro
132 - Extração de Minérios Metálicos Não Ferrosos
Inclui alumínio, estanho, manganês, metais preciosos, minerais radioativos, minerais metálicos não ferrosos
141 - Extração de Pedra, Areia e Argila
142 - Extração de Outros Minerais Não Metálicos
Incluir minerais para fabricação de adubos; fertilizantes e produtos químicos, extração e refino de sal marinho e sal-gema; outros minerais não metálicos
D - INDÚSTRIA DE TRANSFORMAÇÃO
151 - Abate e Preparação de Produtos de Carne e de Pescado
Inclui abate reses; preparação de produtos de carne; abate de aves e outros pequenos animais e preparação de produtos de carne; preparação de carne, banha e produtos de salsicharia não-associadas ao abate; preparação e preservação do pescado e fabricação de conservas de peixes, crustáceos e moluscos.
152 - Processamento, Preservação e Produção de Conservas de Frutas, Legumes e outros vegetais
Inclui processamento, preservação e produção de· conservas frutas; processamento, preservação e produção de conservas de legumes e outros vegetais; produção de sucos de frutas e de legumes.
153 - Produção de Óleos e Gorduras Vegetais e Animais
Inclui produção de óleos vegetais em bruto; refino de óleos vegetais; preparação de margarina e outras gorduras vegetais e de óleos de origem animal não-comestíveis.
154 - Laticínios
Inclui preparação do leite; fabricação de produtos do laticínio; fabricação de sorvetes.
155 - Moagem, Fabricação de Produtos Amiláceos e de Raçoes Balanceadas para Animais
Inclui beneficiamento de arroz e fabricação de produtos do arroz; moagem de trigo e fabricação de derivados; fabricação de farinha de mandioca e derivados; fabricação de fubá e farinha de milho; fabricação de amidos e féculas de vegetais e fabricação de óleos de milho; fabricação de rações balanceadas para animais; beneficiamento, moagem e preparação de outros alimentos de origem vegetal.
156 - Fabricação e Refino de Açúcar
Inclui usinas de açúcar; refino e moagem de açúcar.
157 - Torrefação e Moagem de Café
Inclui fabricação de café solúvel.
158 - Fabricação de Outros Produtos Alimentícios
Inclui fabricação de produtos de padaria, confeitaria e pastelaria; fabricação de biscoitos e bolachas; produção de derivados de cacau e elaboração de chocolates, balas, gomas de mascar; fabricação de massas alimentícias; preparação de especiarias, molhos, temperos e condimentos; preparação de produtos dietéticos, alimentos para crianças e outros alimentos conservados; fabricação de outros produtos alimentícios.
159 - Fabricação de Bebidas
Inclui Fabricação, retificação, homogeneização e mistura de aguardentes e outras e bebidas destiladas; Fabricação de vinho; Fabricação de malte, cervejas e chopes; Engarrafamento e gaseificação de águas minerais; Fabricação de refrigerantes e refrescos.
FABRICAÇÃO DE PRODUTOS DO FUMO
160 - Fabricação de produtos do fumo
FABRICAÇÃO DE PRODUTOS TÊXTEIS
171 - Beneficiamento de Fibras Têxteis Naturais
Inclui algodão; outras fibras têxteis naturais.
172 - Fiação
Inclui algodão; outras fibras têxteis naturais; fibras artificiais ou sintéticas; fabricação de linhas e fios para coser e bordar.
173 - Tecelagem - Inclusive Fiação e Tecelagem
Inclui algodão; fios de fibras têxteis naturais; fios e filamentos contínuos artificiais ou sintéticos.
174 - Fabricação de Artefatos Têxteis Incluindo Tecelagem
Inclui de artigos de tecido de uso doméstico, incluindo tecelagem; outros artefatos têxteis, incluindo tecelagem
175 - Serviços de Acabamento em Fios, Tecidos e Artigos Têxteis
Inclui os produzidos por terceiros.
176 - Fabricação de Artefatos Têxteis a Partir de Tecidos - Exclusive Vestuário e de Outros Artigos. Têxteis
Inclui artefatos de tapeçaria; artefatos de cordoaria; tecidos especiais; produzidos em malharias (tricotagens).
177 - Fabricação de Tecidos e Artigos de Malhas de Vestuário
CONFECÇÃO DE ARTIGOS DO VESTUÁRIO E ACESSÓRIOS
181 - Confecção de artigo do vestuário e acessórios
Inclui peças interiores do vestuário; outras peças do ves-tuário; roupas profissionais.
182 - Fabricação de Acessórios do Vestuário e de Segurança Profissional
Inclui acessórios para segurança e industrial e pessoal.
PREPARAÇÃO DE COUROS E FABRICAÇÃO DE ARTEFATOS DE COURO, ARTIGOS DE VIAGEM E CALÇADOS
191 - Curtimento e outras preparações de couro
192 - Fabricação de Artigos para Viagem e de Artefatos Diversos de Couro
Inclui fabricação de malas, bolsas, valises e outros artefatos para viagem de qualquer material; fabricação de outros artefatos de couro.
193 - Fabricação de Calçados
Inclui calçados de couro, tênis de qualquer material; calçados de plásticos; calçados de outros materiais.
FABRICAÇÃO DE PRODUTOS DE MADEIRA
201 - Desdobramento de madeira
202 - Fabricação de Produtos de Madeira, Cortiça e Material Trançado
Exclusive Móveis. Inclui madeira laminada e de chapas de madeira compensada, prensada ou aglomerada; esquadrias de madeira, de casas de madeira pré-fabricadas, de estruturas de madeira e artigos de carpintaria; artefatos de tanoaria e embalagens de madeira; artefatos diversos de madeira, palha, cortiça e material trançado - exceto móveis
FABRICAÇÃO DE CELULOSE, PAPEL E PRODUTOS DE PAPEL
211 - Fabricação de celulose e outras pastas para a fabricação de papel
212 - Fabricação de papel, papelão liso, cartolina e cartão
213 - Fabricação de embalagens de papel ou de papelão - inclusive a fabricação de papelão corrugado
214 - Fabricação de artefatos diversos de papel, papelão, cartolina e cartão para escritório, fitas e formulários contínuos - impressos ou não
EDIÇÃO, IMPRESSÃO E REPRODUÇÃO DE GRAVAÇÕES
221 - Edição, edição e impressão de jornais; revistas; livros; discos, fitas e outros materiais gravados; edição e impressão de outros produtos gráficos
222 - Impressão e Serviços Conexos para Terceiros;
Inclui impressão de jornais, revistas e livros; serviço de impressão de material escolar e de material para usos industrial e comercial; Execução de outros serviços gráficos
223 - Reprodução de Materiais Gravados: discos e fitas; fitas de vídeos; filmes; programas de informática em disquete e fitas.
231 - Coquerias
232 - Refino de Petróleo
233 - Elaboração de_Combustíveis Nucleares
234 - Produção de Álcool
FABRICAÇÃO DE PRODUTOS QUÍMICOS
241 - Fabricação de Produtos Químicos Inorgânicos
Inclui cloro e álcalis; intermediários para fertilizantes; fertilizantes fosfatados, nitrogenados e potássicos; gases industriais; outros produtos inorgânicos.
242 - Fabricação de Produtos Químicos Orgânicos
Inclui produtos petroquímicos básicos; Fabricação de intermediários para resinas e fibras; e outros produtos químicos orgânicos.
243 - Fabricação de Resinas Termoplásticas e Termofixas e Elastômetros
244 - Fabricação de fibras, fios, cabos e filamentos contínuos artificiais e Sintéticos
(exclui cabos metálicos para condução de eletricidade).
245 - Fabricação de Produtos Farmacêuticos
Inclui produtos farmoquímicos; medicamentos para uso humano; medicamentos para uso veterinário; materiais para usos médicos, hospitalares e odontológicos.
246 - Fabricação de Defensivos Agrícolas (Agrotóxicos)
Inclui inseticidas; fungicidas; herbicidas; outros defensivos agrícolas
247 - Fabricação de sabões, Detergentes, Produtos de Limpeza e Artigos de Perfumaria
248 -Fabricação de Tintas, Tintas de Impressão, Vernizes, Esmaltes, Lacas Impermeabilizante, Solventes e Produtos afins
249 - Fabricação de Produtos e Preparados Químicos Diversos
Inclui adesivos e selantes; explosivos; catalisadores; aditivos de uso industrial; chapas, filmes, papéis e outros materiais e produtos químicos para fotografia; discos e fitas virgens; e outros produtos químicos não especificados ou não classificados
FABRICAÇÃO DE ARTIGOS DE BORRACHA E PLÁSTICO
251 - Fabricação de artigos de borracha, pneumáticos e câmaras de ar, recondicionamento de pneumáticos e artefatos diversos de borracha
252 - Fabricação de Produtos de Plástico
Inclui laminados planos e tubulares de plástico; embalagem de plástico; artefatos diversos de plástico
FABRICAÇÃO DE PRODUTOS MINERAIS NÃO-METÁLICOS
261 - Fabricação de vidro e produtos de vidro
Inclui vidro plano de segurança; vasilhames de vidro e artigos de vidro
262 - Fabricação de cimento
263 - Fabricação de artefatos de concreto, cimento, fibrocimento, gesso e estuque
264 - Fabricação de produtos cerâmicos
Incluir e produtos cerâmicos não-refratários para uso estrutural na construção civil; produtos cerâmicos refratários; produtos cerâmicos não-refratários para usos diversos
269 - Aparelhamento de Pedras e Fabricação De Cal e de Outros Produtos De Minerais Não-metálicos
Inclui Britamento, aparelhamento e outros trabalhos em pedras (não associado a extração); Fabricação de cal virgem, cal hidratada, gesso e outros produtos de minerais não-metálicos
METALURGIA BÁSICA
271 - Siderúrgicas Integradas
Inclui Produção de laminados planos e não planos de aço
272 - Fabricação de Produtos Siderúrgicos - Exclusive em Siderúrgicas Integradas
Inclui produção de gusa; produção de ferro, aço e ferro-ligas em formas primárias e semi-acabados; relaminados, trefilados e retrefilados de aço, exclusive tubos.
273 - Fabricação de Tubos - Exclusive em Siderúrgicas Integradas
Inclui tubos de aço com costura; outros tubos de ferro e aço
274 - Metalurgia de Metais Não-Ferrosos: Alumínio e suas ligas, Metais Preciosos e outros metais não-ferrosos e suas ligas
275 Fundição
Inclui fabricação de peças fundidas de ferro e aço e de peças fundidas de metais não-ferrosos e suas ligas
FABRICAÇÃO DE PRODUTOS DE METAL - EXCETO MÁQUINAS E EQUIPAMENTOS
281 - Fabricação de estruturas metálicas e Obras de Caldeiraria Pesada
Inclui estruturas metálicas para edifícios, pontes, torres de transmissão, andaimes e outros fins; esquadrias de metal; obras de caldeiraria pesada
282 - Fabricação de tanques, Caldeiras e Reservatórios Metálicos
Inclui caldeiras para aquecimento central; caldeiras geradoras de vapor - exclusive para aquecimento central e para veículos
283 - Forjaria, Estamparia, Metalurgia do Pó e Serviços de Tratamento de Metais
Inclui produtos de forjados de aço e metais não-ferrosos e suas ligas; Fabricação de artefatos estampados de metal; Metalurgia do pó; Têmpera, cementação e tratamento térmico do aço, serviços de usinagem, galvanotécnica e solda.
284 - Fabricação de Artigos de Cutelaria, de Serralheria (exclusive esquadrias) e Ferramentas Manuais
Inclui embalagens metálicas; artefatos de trefilados; artigos de funilaria e de artigos de metal para usos doméstico e pessoal; outros produtos elaborados de metal.
FABRICAÇÃO DE MÁQUINAS E EQUIPAMENTOS
291 - Fabricação de Motores, Bombas, Compressores e Equipamentos de Transmissão
Inclui motores estacionários de combustão interna, turbinas e outras máquinas motrizes não elétricas - exclusive para aviões e veículos rodoviários; bombas e carneiros hidráulicos; válvulas, torneiras e registros; compressores; equipamentos de transmissão para fins industriais - inclusive rolamentos
292 - Fabricação de Máquinas e Equipamentos de Uso Geral
Inclui fornos industriais, aparelhos e equipamentos não elétricos para instalações térmicas; estufas e fornos elétricas para fins industriais; máquinas, equipamentos e aparelhos para transporte e elevação de cargas e pessoas; máquinas e aparelhos de refrigeração e ventilação de usos industrial e comercial; aparelhos de ar condicionado; outras máquinas e equipamentos de uso geral
293 - Fabricação de Tratores e de Máquinas e Equipamentos para Agricultura, Avicultura e Obtenção de Produtos Animais
294 - Fabricação de máquinas-ferramentas
295 - Fabricação de Máquinas e Equipamentos de Usos na Extração Mineral e Construção
Inclui máquinas e equipamentos para a indústria de prospecção e extração de petróleo; outras máquinas e equipamentos de uso na extração mineral e construção; tratores de esteira e tratores de uso na extração mineral e construção e mineração; máquinas e equipamentos de terraplanagem e pavimentação.
296 - Fabricação de Outras Máquinas e Equipamentos de Uso Específico
Inclui máquinas para a indústria metalúrgica - exclusive máquinas - ferramentas; máquinas e equipamentos para as industrias alimentar, de bebidas e fumo; máquinas e equipamentos para a indústria têxtil; máquinas e equipamentos para as indústrias do vestuário e de couro e calçados; máquinas e equipamentos para indústrias de celulose, papel e papelão e artefatos; outras máquinas e equipamentos de uso específico
297 - Fabricação de Armas, Munições e Equipamentos Militares e Equipamento Bélico Pesado
298 - Fabricação de Eletrodomésticos
Inclui fogões, refrigeradores e máquinas de lavar e secar para uso doméstico; outros aparelhos eletrodomésticos.
FABRICAÇÃO DE MÁQUINAS PARA ESCRITÓRIO E EQUIPAMENTOS DE INFORMÁTICA
301 - Fabricação de Máquinas Para Escritório
Inclui máquinas de escrever e calcular, copiadoras e outros equipamentos não-eletrônicos para escritório; máquinas de escrever e calcular, copiadoras e outros equipamentos eletrônicos destinados à automação gerencial e comercial
302 - Fabricação de Máquinas E Equipamentos de Sistemas Eletrônicos Para Processamento de Dados
Inclui computadores; equipamentos periféricos para máquinas eletrônicas para tratamento de informações.
FABRICAÇÃO DE MÁQUINAS, APARELHOS E MATERIAIS ELÉTRICOS
311 - Fabricação de geradores de corrente contínua ou alternada, transformadores, indutores, conversores, sincronizadores e semelhantes e motores elétricos
312 - Fabricação de Equipamentos para Distribuição e Controle de Energia Elétrica
Inclui subestações, quadros de comando, reguladores de voltagem e outros aparelhos e equipamentos para distribuição e controle de energia; material elétrico para instalações em circuito de consumo
313 - Fabricação de fios, cabos e condutores elétricos isolados
314 - Fabricação de pilhas, baterias e acumuladores elétricos
315 - Fabricação de luminárias e equipamentos de iluminação - exclusive para veículos
316 - Fabricação de material elétrico para veículos - exclusive baterias
319 - Fabricação de outros aparelhos ou equipamentos elétricos
Inclui eletrodos, contatos e outros artigos de carvão e grafita para uso elétrico, eletroimãs e isoladores; aparelho e utensílios para sinalização; outros aparelho ou equipamentos elétricos.
FABRICAÇÃO DE MATERIAL ELETRÔNICO E DE APARELHOS E EQUIPAMENTOS DE COMUNICAÇÕES
321 - Fabricação de material eletrônico básico
322 - Fabricação de Aparelhos e Equipamentos de Telefonia e Radiotelefonia e de Transmissores de Televisão e Rádio
Inclui equipamentos transmissores de rádio e televisão e de equipamentos para estações telefônicas, para radiotelefonia e radiotelegrafia - inclusive de microondas e repetidoras; aparelhos telefônicos, sistemas de intercomunicação e semelhantes
323 - Fabricação de aparelhos receptores de rádio e televisão e de reprodução, gravação ou amplificação de som e vídeo
FABRICAÇÃO DE EQUIPAMENTOS DE INSTRUMENTAÇÃO MÉDICOHOPITALARES, INSTRUMENTOS DE PRECISÃO E ÓPTICOS, EQUIPAMENTOS PARA AUTOMAÇÃO INSDUSTRIAL, CRONÔMETROS E RELÓGIOS
331 - Fabricação de aparelhos e instrumentos para usos médico-hospitalares, odontológicos e de laboratórios e aparelhos ortopédicos
332 - Fabricação de aparelhos e instrumentos de medida, teste e controle - exclusive equipamentos para controle de processos industriais
333 -
Fabricação de máquinas, aparelhos e equipamentos de sistemas eletrônicos dedicados a automação industrial e controle do processo produtivo
334 - Fabricação de aparelhos, instrumentos e materiais ópticos, fotográficos e cinematográficos
335 - Fabricação de cronômetros e relógios
FABRICAÇÃO E MONTAGEM DE VEÍCULOS AUTOMOTORES, REBOQUES E CARROCERIAS
341 - Fabricação de automóveis, camionetas e utilitários
342 - Fabricação de caminhões e ônibus
343 - Fabricação de cabines, carrocerias e reboques
344 - Fabricação de peças e acessórios para veículos automotores
Inclui peças e acessórios para o sistema motor; peças e acessórios para os sistemas de marcha e transmissão; peças e acessórios para o sistema de freios; peças e acessórios para o sistema de direção e suspensão; peças e acessórios de metal para veículos automotores não classificados em outra classe.
345 - Recondicionamento ou recuperação de motores para veículos automotores
346 - Construção e reparação de embarcações e estruturas flutuantes para esporte e lazer
352 - Construção, montagem e reparação de veículos ferroviários
Inclui construção e montagem de locomotivas, vagões e outros materiais rodantes; fabricação de peças e acessórios para veículos ferroviários; Reparação de veículos ferroviários
353 - Construção, montagem e reparação de aeronaves
359 - Fabricação de outros equipamentos de transporte
Inclui motocicletas; bicicletas e triciclos não-motorizados; outros equipamentos de transporte
FABRICAÇÃO DE MÓVEIS E INDÚSTRIAS DIVERSAS
361 - Fabricação de artigos do mobiliário
Inclui móveis com predominância de madeira; móveis com predominância de metal; móveis de outros materiais; colchões
369 Fabricação de Produtos Diversos
Inclui lapidação de pedras preciosas e semipreciosas, fabricação de artefatos de ourivesaria e joalheria; instrumentos musicais; artefatos para caça, pesca e esporte; brinquedos e de jogos recreativos; canetas, lápis, fitas impressoras para máquinas e outros artigos para escritório; aviamentos para costura; escovas, pincéis e vassouras; produtos diversos.
RECICLAGEM
371 - Reciclagem de sucatas metálicas
372 - Reciclagem de sucatas não-metálicas
E - PRODUÇÃO E DISTRIBUIÇÃO DE ELETRICIDADE, GÁS E ÁGUA
ELETRICIDADE, GÁS E ÁGUA QUENTE
401 - Produção e distribuição de energia elétrica
402 - Produção e distribuição de gás através de tubulações
403 - Produção e distribuição de vapor e água quente
CAPTAÇÃO, TRATAMENTO E DISTRIBUIÇÃO DE ÁGUA
410 - Captação, tratamento e distribuição de água
F - CONSTRUÇÃO
451 - Preparação do terreno
Inclui demolição e preparação do terreno; perfurações e execução de fundações destinadas à construção civil; grandes movimentações de terra
452 - Construção de edifícios e obras de engenharia civil
Inclui edificações (residenciais, industriais, comerciais e de serviços) - inclusive ampliação e reformas completas; obras viárias - inclusive manutenção; grandes estruturas e obras de arte; obras de urbanização e paisagismo; montagens industriais; obras de outros tipos.
453 - Obras de infraestrutura para Engenharia Elétrica, Eletrônica e Engenharia Ambiental
Inclui construção de barragens e represas para geração de energia elétrica; construção de estações e redes de distribuição de energia elétrica; construção de estações e redes de telefonia e comunicação; obras de prevenção e recuperação do meio ambiente.
454 - Obras de instalações
Inclui instalações elétricas; sistemas de ar condicionado, de ventilação e refrigeração; instalações hidráulicas, sanitárias, de gás e de sistema de prevenção contra incêndio; de para-raios; de segurança e alarme; outras obras de instalações.
455 - Obras de acabamentos e serviços auxiliares da construção
Inclui alvenaria e reboco; impermeabilização e serviços de pintura em geral; outros serviços auxiliares da construção.
456 - Aluguel de equipamentos de construção e demolição com operários
G - COMÉRCIO; REPARAÇÃO DE VEÍCULOS AUTOMOTORES
OBJETOS PESSOAIS E DOMÉSTICOS
COMÉRCIO E REPARAÇÃO DE VEÍCULOS AUTOMOTORES E MOTOCICLETAS; E COMÉRCIO A VAREJO DE COMBUSTÍVEIS
501 - Comércio a varejo e por atacado de veículos automotores
502 - Manutenção e reparação de veículos automotores
503 - Comércio a varejo e por atacado de peças e acessórios para veículos automotores
504 - Comércio a varejo e por atacado de motocicletas, partes, peças e acessórios
505 - Comércio a varejo de combustíveis
COMÉRCIO POR ATACADO E INTERMEDIÁRIOS DO COMÉRCIO
511 - Intermediários do comércio
Inclui matérias-primas agrícolas, animais vivos, matérias primas têxteis e produtos semi-acabados; combustíveis, minerais, metais e produtos químicos industriais; madeira, material de construção e ferragens; máquinas, equipamentos industriais, embarcações e aeronaves; móveis e artigos de uso doméstico; têxteis, vestuário, calçados e artigos de couro; produtos alimentícios, bebidas e fumo; comércio especializado em produtos não especificados anteriormente.
512 - Comércio atacadista de produtos agropecuários "in natura; produtos alimentícios para animais e comércio atacadista de animais vivos
513- Comércio atacadista de produtos alimentícios, bebidas e fumo
Inclui leite e produtos do leite; cereais beneficiados, farinhas, amidos e féculas; hortifrutigranjeiros; carnes e produtos de carne; pescados; bebidas; produtos do fumo; outros produtos alimentícios não especificados anteriormente.
514 - Comércio atacadista de artigos de usos pessoal e doméstico
Inclui fios têxteis, tecidos, artefatos de tecidos e de armarinho; artigos do vestuário e complementos; calçados; eletrodomésticos e outros equipamentos de usos pessoal e doméstico; produtos farmacêuticos, médicos, ortopédicos e odontológicos; cosméticos e produtos de perfumaria; artigos de escritório e de papelaria; papelão e seus artefatos, livros, jornais, e outras publicações; outros artigos de usos pessoal e doméstico, não especificados anteriormente.
515 - Comércio atacadista de produtos intermediários não-agropecuários, resíduos e sucatas
Inclui combustíveis; produtos extrativos de origem mineral; madeira, material de construção, ferragens e ferramentas; produtos químicos; resíduos e sucatas; outros produtos intermediários não agropecuários, não especificados anteriormente
516 - Comércio atacadista de máquinas, aparelhos e equipamentos para usos agropecuário, comercial, de escritório, industrial, técnico e profissional
519 - Comércio atacadista de mercadorias em geral ou não compreendidas nos grupos anteriores
COMÉRCIO VAREJISTA E REPARAÇÃO DE OBJETOS PESSOAIS E DOMÉSTICOS
521 - Comércio varejista não especializado
Inclui mercadorias em geral, com predominância de produtos alimentícios, com área de venda superior a 5000 metros quadrados - hipermercados; mercadorias em geral, com predominância de produtos alimentícios, com área de venda entre 300 e 5000 metros quadrados - supermercados; mercadorias em geral, com predominância de produtos alimentícios, com área de venda inferior a 300 metros quadrados; lojas de conveniência; comércio varejista não especializado, sem predominância de produtos alimentícios.
522 - comércio varejista de produtos alimentícios, bebidas e fumo em lojas especializadas
Inclui produtos de padaria, de laticínio, frios e conservas; doces, balas, bombons e semelhantes; carnes - açougues; bebidas; outros produtos alimentícios não especificados anteriormente e de produtos do fumo.
523 - Comércio varejista de tecidos e artigos de armarinho, vestuário e complementos, calçados, artigos de couro e viagem em lojas especializadas.
524 - Comércio varejista de outros produtos em lojas especializadas
Inclui produtos farmacêuticos, artigos médicos e ortopédicos, de perfumaria e cosméticos; máquinas e aparelhos de usos doméstico e pessoal, discos e instrumentos musicais; móveis, artigos de iluminação e outros artigos para residência; material de construção, ferragens e ferramentas manuais e produtos metalúrgicos; vidros, espelhos e vitrais; tintas e madeiras; equipamentos para escritório; informática e comunicação; livros, jornais, revistas e papelaria; gás liquefeito de petróleo (GLP); outros produtos não especificados anteriormente.
525 - Comércio varejista de artigos usados, em lojas
526 - Comércio varejista não realizado em lojas
Inclui comércio varejista de artigos em geral, por catálogo ou pedido pelo correio; realizado em vias públicas, postos móveis, através de máquinas automáticas e a domicílio
527 - Reparação de objetos pessoais e domésticos
Inclui reparação manutenção de máquinas e de aparelhos eletrodomésticos; reparação de calçados; reparação de outros objetos pessoais e domésticos.
H - ALOJAMENTO E ALIMENTAÇÃO
551 - Estabelecimentos hoteleiros com ou sem restaurante e outros tipos de alojamento temporário
552 - Restaurantes e outros estabelecimentos de serviços de alimentação
Inclui restaurante e estabelecimentos de bebidas, com serviço completo; lanchonetes e similares; cantinas (serviços de alimentação privativos); fornecimento de comida preparada; outros serviços de alimentação.
I - TRANSPORTE, ARMAZENAGEM E COMUNICAÇÕES
601 - Transporte ferroviário interurbano
602 - Outros transportes terrestres
Inclui transporte ferroviário de passageiros, urbano; transporte metroviário; transporte rodoviário de passageiros, regular, urbano; transporte rodoviário de passageiros, regular, não urbano; transporte rodoviário de passageiros, não regular; transporte rodoviário de cargas, em geral; transporte rodoviário de produtos perigosos; transporte rodoviário de mudanças; transporte regular em bondes, funiculares, teleféricos ou trens próprios para exploração de pontos turísticos
603 - Transporte dutoviário
611 - Transporte marítimo de cabotagem e longo curso
612 - Outros transportes aquaviários
Inclui navegação interior de passageiros; navegação interior de carga; transporte aquaviário urbano
621 - Transporte aéreo, regular
622 - Transporte aéreo, não regular
623 - Transporte espacial
ATIVIDADES ANEXAS E AUXILIARES DO TRANSPORTE E AGÊNCIAS DE VIAGEM
631 - Movimentação e armazenamento e depósitos de cargas e descarga
632 - Atividades auxiliares dos transportes terrestres, aquaviários e aéreos
633 - Atividades de agências de viagens e organizadores de viagem
634 - Atividades relacionadas a organização do transporte de cargas
CORREIO E TELECOMUNICAÇÕES
641 - Correio - atividades do Correio Nacional e outras atividades de correio
642 - Telecomunicações
J - INTERMEDIAÇÃO FINANCEIRA
INTERMEDIAÇÃO FINANCEIRA, EXCLUSIVE SEGUROS e PREVIDÊNCIA PRIVADA
651 - Banco Central
652 - Intermediação monetária - depósitos à vista
Inclui bancos comerciais; bancos múltiplos (com carteira comercial); caixas econômicas; cooperativas de crédito
653 - Intermediação monetária - outros tipos de depósitos
Inclui bancos múltiplos (sem carteira comercial); bancos de investimento; bancos de desenvolvimento; crédito imobiliário; sociedades de crédito, financiamento e investimento.
654 - Arredamento Mercantil
655 - Outras atividades de concessão de crédito
inclui agências de desenvolvimento; outras atividades de concessão de crédito.
659 - Outras atividade de intermediação financeira, não especificadas anteriormente
Inclui fundos mútuos, de investimento; sociedades de capitalização; outras atividades de intermediação financeira, não especificadas anteriormente.
SEGUROS E PREVIDÊNCIA PRIVADA
661 - Seguros de vida e não vida e resseguros
662 - Previdência privada fechada e aberta
663 - Planos de saúde
ATIVIDADES AUXILIARES DA INTERMEDIAÇÃO FINANCEIRA
671 - Atividades auxiliares da intermediação financeira, exclusive seguros e previdência privada
Inclui administração de mercados bursáteis; atividades de intermediários em transações de títulos e valores mobiliários; outras atividades auxiliares da intermediação financeira, não especificadas anteriormente.
672 - Atividades auxiliares dos seguros e da previdência privada
K - ATIVIDADES IMOBILIÁRIAS, ALUGUÉIS E SERVIÇOS PRESTADOS ÀS EMPRESAS
ATIVIDADES IMOBILIÁRIAS
701 - Incorporação de imóveis por conta própria
702 - Aluguel de imóveis
7-3 - Atividades imobiliárias - incorporação e administração de imóveis por conta de terceiros
704 - Condomínios prediais
ALUGUEL DE VEÍCULOS, MÁQUINAS E EQUIPAMENTOS SEM CONDUTORES OU OPERADORES E DE OBJETOS PESSOAIS E DOMÉSTICOS
711 - Aluguel de automóveis
712 - Aluguel de outros meios de transporte terrestre, embarcações e aeronaves
713 - Aluguel de máquinas e equipamentos
Inclui aluguel de máquinas e equipamentos agrícolas; máquinas e equipamentos para construção e engenharia civil; máquinas e equipamentos para escritórios; máquinas e equipamentos de outros tipos não especificados anteriormente
714 - Aluguel de objetos pessoais e domésticos
ATIVIDADES DE INFORMÁTICA E CONEXAS
721 - Consultoria em sistemas de informática
722 - Desenvolvimento de programas de informática
723 - Processamento de dados
724 - Atividades de Banco de Dados
725 - Manutenção e reparação de máquinas de escritório e de informática
729 - Outras atividades de informática, não especificadas anteriormente
PESQUISA E DESENVOLVIMENTO
731 - Pesquisa e desenvolvimento das ciências físicas e naturais
732 - Pesquisa e desenvolvimento das ciências sociais e humanas
SERVIÇOS PRESTADOS PRINCIPALMENTE ÀS EMPRESAS
741 - Atividades jurídicas, contábeis e de assessoria empresarial
Inclui atividades jurídicas; de contabilidade e auditoria; pesquisas de mercado e de opinião pública; gestão de participações societárias (holdings); sedes de empresas e unidades administrativas locais; atividades de assessoria em gestão empresarial.
742 - Serviços de arquitetura e engenharia e de assessoramento técnico especializado
743 - Ensaios de materiais e de produtos; análise de qualidade
744 - Publicidade
745 - Seleção, agenciamento e locação de mão-de-obra
746 - Atividades de investigação, vigilância e segurança
747 - Outras atividades de serviços prestados principalmente às empresas
Inclui atividades fotográficas; atividades de envasamento e empacotamento, por conta de terceiros; outras atividades de serviços prestados principalmente às empresas, não especificadas anteriormente.
L - ADMINISTRAÇÃO PÚBLICA, DEFESA E SEGURIDADE SOCIAL
751 - Administração do estado e da política econômica e social
Inclui administração pública em geral; regulação das atividades sociais e culturais; regulação das atividades econômicas; Atividades de apoio à administração pública
752 - Serviços coletivos prestados pela Administração Pública
Inclui relações exteriores; defesa, justiça, segurança e ordem pública; defesa civil
753 - Seguridade social
M- EDUCAÇÃO
801 - Educação pré-escola e fundamental
802 - Educação média de formação geral, profissionalizantes ou técnica
803 - Educação superior
809 - Formação permanente e outras atividades de ensino
Inclui ensino em autoescolas e cursos de pilotagem; educação supletiva; educação continuada ou permanente e aprendizagem profissional; ensino à distância; educação especial.
N - SAÚDE E SERVIÇOS SOCIAIS
851 - Atividades de atenção à saúde
Inclui atividades de atendimento hospitalar; de atendimento a urgências e emergências; de atenção ambulatorial; de serviços de complementação diagnóstica ou terapêutica; de outros profissionais da área de saúde; outras atividades relacionadas com a atenção à saúde
852 - Serviços veterinários
853 - Serviços sociais com ou sem alojamento
O - OUTROS SERVIÇOS COLETIVOS, SOCIAIS E PESSOAIS
900 - Limpeza urbana e esgoto; e atividades relacionadas
911 - Atividades de organizações empresariais, patronais e profissionais
912 - Atividades de organizações sindicais
919 - Outras Atividades Associativas
Inclui organizações religiosas; organizações políticas; outras atividades associativas, não-especificadas anteriormente
921 - Atividades Cinematográficas e de Vídeo
Inclui produção, distribuição e projeção de filmes cinematográficos e fitas de vídeo.
922 - Atividades de Rádio e de Televisão
923 - Outras Atividades Artísticas e de Espetáculos Inclui atividades de teatro, música e outras atividades artísticas e literárias; gestão de salas de espetáculos; outras atividades de espetáculos, não-especificadas anteriormente
924 - Atividades de Agências de Notícias
925 - Atividades de Bibliotecas, Arquivos, Museus e Outras Atividades Culturais
Inclui conservação do patrimônio histórico; atividades de jardins botânicos, zoológicos, parques nacionais e reservas ecológicas.
926 - Atividades Desportivas e Outras Relacionadas ao Lazer
SERVIÇOS PESSOAIS
930 - Serviços Pessoais
Inclui lavanderias e tinturarias; cabeleireiros e outros tratamentos de beleza; atividades funerárias e conexas; atividades de manutenção do físico corporal; outras atividades de serviços pessoais, não especificadas anteriormente.
P - SERVIÇOS DOMÉSTICOS
950 - Serviços Domésticos
Q - ORGANISMOS INTERNACIONAIS E OUTRAS INSTITUIÇÕES EXTRATERRITORIAIS
990 - Organismos Internacionais e Outras Instituições Extraterritoriais
ANEXO LII
LAUDO MÉDICO PARA EMISSÃO DA AIH - LAUDO MÉDICO PARA COMUNICAÇÃO DE AGRAVO RELACIONADO AO TRABALHO (Origem: PRT MS/GM 1969/2001, Anexo 4)
LAUDO MÉDICO PARA EMISSÃO DE AIH
LAUDO MÉDICO PARA COMUNICAÇÃO DE AGRAVO RELACIONADO AO TRABALHO
| UNIDADE DE ATENDIMENTO | ||||||||||||||||||||||||||||||||||
| NOME | CÓDIGO/CNPJ | |||||||||||||||||||||||||||||||||
| ÓRGÃO EMISSOR | ||||||||||||||||||||||||||||||||||
| NOME DO PACIENTE | ||||||||||||||||||||||||||||||||||
| Nº DO CARTÃO SUS | CPF | PIS/PASEP/Nº INDIVIDUAL | ||||||||||||||||||||||||||||||||
| ENDEREÇO | BAIRRO | MUNICÍPIO | UF | |||||||||||||||||||||||||||||||
| CEP | DATA DE NASCIMENTO | CBO/TRABALHADOR | SEXO | MASC. | FEM. | |||||||||||||||||||||||||||||
| PREENCHER EM CASO DE CAUSAS EXTERNAS | TIPO DE CAUSA EXTERNA | |||||||||||||||||||||||||||||||||
| PREENCHER EM CASO DE ACIDENTE DE TRÂNSITO | CGC DA SEGURADORA | Nº DO BILHETE | SÉRIE | |||||||||||||||||||||||||||||||
| PREENCHER EM CASO DE ACIDENTES E/OU DOENÇAS RELACIONADAS AO TRABALHO | ||||||||||||||||||||||||||||||||||
| PIS/PASEP/Nº INDIVIDUAL | VÍNCULO COM A PREVIDÊNCIA | |||||||||||||||||||||||||||||||||
| EMPREGADO | EMPREGADOR | AUTÔNOMO | DESEMPREG. | APOSENTADO | NÃO SEGURADO | |||||||||||||||||||||||||||||
| CNPJ/EMPRESA | CNAE/EMPRESA | ACIDENTE TRABAHO TIPICO | ACIDENTE TRABALHO TRAJETO | |||||||||||||||||||||||||||||||
| LAUDO TÉCNICO E JUSTIFICATIVA DA INTERNAÇÃO | ||||||||||||||||||||||||||||||||||
| PRINCIPAIS SINAIS E SINTOMAS CLÍNICOS | ||||||||||||||||||||||||||||||||||
| CONDIÇÕES QUE JUSTIFICAM A INTERNAÇÃO | ||||||||||||||||||||||||||||||||||
| PRINCIPAIS RESULTADOS E PROVAS DIAGNÓSTICO | ||||||||||||||||||||||||||||||||||
| DIAGNÓSTICO INICIAL | CID (1) | CID (2) | CLÍNICA CIRÚRGICA | CLÍNICA OBSTÉTRICA | CLÍNICA MÉDICA | |||||||||||||||||||||||||||||
| 1 | 2 | 3 | ||||||||||||||||||||||||||||||||
| PROCEDIMENTO SOLICITADO | FPT/CRON | PSIQUIÁTRICO | PEDIÁTRICA | OUTRAS | ||||||||||||||||||||||||||||||
| 4 | 5 | 7 | 9 | |||||||||||||||||||||||||||||||
| ASSINATURA DO MÉDICO SOLICITANTE (EXAMINADOR) | CRM | DATA | ||||||||||||||||||||||||||||||||
ANEXO LIII
ESPECIALIDADES E PRÉ-REQUISITOS PARA INSTITUIÇÕES PÚBLICAS ESTADUAIS, DISTRITAL E MUNICIPAIS DE SAÚDE E PARA OS HOSPITAIS PRIVADOS SEM FINS LUCRATIVOS, EXCETUANDO-SE ENTIDADES DE SAÚDE RECONHECIDAS COMO DE EXCELÊNCIA CONFORME LEI Nº 12.101/2009 E REGULAMENTOS. (Origem: PRT MS/GM 1248/2013, Anexo 1)
| ESPECIALIDADE | PRÉ-REQUISITOS | ||
|---|---|---|---|
| 1. Anestesiologia | Hospital com mínimo de 100 leitos gerais, 2 salas cirúrgicas, 10 a 20 leitos de UTI adulto, serviço de urgência hospitalar, habilitado para ortopedia ou neurocirurgia ou cardiologia. | ||
| 2. Clínica Médica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos UTI adulto e serviço de urgência hospitalar na rede. | ||
| 3. Cirurgia Geral | Hospital com mínimo de 100 leitos gerais; mínimo de 2 salas cirúrgicas; 5 a 10 leitos de UTI adulto; serviço de urgência hospitalar na rede. | ||
| 4. Cirurgia do Trauma | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede, possuir habilitação em Centro de Trauma. | ||
| 5. Cancerologia Clínica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; habilitação em UNACON ou CACON. | ||
| 6. Cancerologia Cirúrgica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de 2 salas cirúrgicas; habilitação em UNACON ou CACON. | ||
| 7. Cancerologia Pediátrica | Hospital com mínimo de 50 leitos, mínimo de 5 leitos de pediatria clínica por residente, mínimo de 5 leitos de UTI pediátrica; sala cirúrgica; habilitação em UNACON ou CACON. | ||
| 8. Cardiologia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade Cardiovascular. | ||
| 9. Ginecologia e Obstetrícia | Hospital com mínimo de 40 leitos gerais, mínimo de 5 leitos obstetrícia (clínica ou cirúrgica) por residente, 2 leitos ginecologia, 1 sala cirúrgica. | ||
| 10. Geriatria | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos UTI adulto. | ||
| 11. Medicina de Família e Comunidade | Atender aos parâmetros estabelecidos na Portaria nº 3.147/2012 | ||
| 12. Medicina Intensiva | Hospital com mínimo de 100 leitos gerais; mínimo de 10 a 20 leitos UTI adulto, serviço de urgência hospitalar na rede de atenção à saúde. | ||
| 13. Medicina de Urgência | Hospital com mínimo de 100 leitos gerais, 10 a 20 leitos UTI adulto, serviço de urgência hospitalar próprio. | ||
| 14. Neonatologia | Hospital com mínimo de 100 leitos gerais e/ou 20 leitos especializados em neonatologia no caso de maternidades; mínimo de 5 a 10 leitos de UTI neonatal. | ||
| 15. Nefrologia | Hospital com mínimo de mínimo 100 leitos gerais; mínimo 5 a 10 leitos de UTI adulto; serviço de urgência hospitalar na rede, possuir Serviço de Nefrologia ou Centro de Referência em Nefrologia habilitado. | ||
| 16. Neurocirurgia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade para Neurocirurgia. | ||
| 17. Neurologia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade para Neurologia. | ||
| 18. Ortopedia e Traumatologia | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede, possuir habilitação em Alta Complexidade para Ortopedia e Traumatologia | ||
| 19. Pediatria | Hospital com mínimo de 40 leitos, mínimo de 5 leitos de pediatria clínica por residente; mínimo de 5 leitos de UTI pediátrica e serviço de urgência pediátrica na rede. |
||
| 20. Psiquiatria | Hospital com mínimo de 100 leitos gerais com no mínimo 10 leitos especializados em saúde mental, além de CAPS II ou III e serviço de urgência hospitalar na rede de atenção à saúde. Rodízios em todos os equipamentos de atenção psicossocial do município. | ||
| 21.Radiologia e Diagnóstico por Imagem | Hospital que realize atendimento adulto, pediátrico e em ginecologia-obstetrícia; hospital com mínimo de 100 leitos gerais; sala cirúrgica, mínimo de 5 a 10 leitos de UTI adulto; serviço de urgência hospitalar na rede; possuir serviço de diagnóstico por imagem compatível com a formação do especialista em radiologia. | ||
| 22. Radioterapia | Hospital com mínimo de 100 leitos gerais; mínimo 5 a 10 leitos UTI adulto; habilitação em UNACON ou CACON com radioterapia no SUS. | ||
ANEXO LIV
ESPECIALIDADES E PRÉ-REQUISITOS PARA INSTITUIÇÕES FEDERAIS VINCULADAS AO MINISTÉRIO DA EDUCAÇÃO (MEC) (Origem: PRT MS/GM 1248/2013, Anexo 2)
ESPECIALIDADES E PRÉ-REQUISITOS PARA INSTITUIÇÕES FEDERAIS VINCULADAS AO MINISTÉRIO DA EDUCAÇÃO (MEC)
| ESPECIALIDADE | PRÉ-REQUISITOS |
|---|---|
| 1. Anestesiologia | Hospital com mínimo de 100 leitos gerais, 2 salas cirúrgicas, 10 a 20 leitos de UTI adulto, serviço de urgência hospitalar, habilitado para ortopedia ou neurocirurgia ou cardiologia |
| 2. Cancerologia Clínica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; habilitação em UNACON ou CACON |
| 3. Cancerologia Cirúrgica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de 2 salas cirúrgicas; habilitação em UNACON ou CACON. |
| 4. Cancerologia Pediátrica | Hospital com mínimo de 50 leitos, mínimo de 5 leitos de pediatria clínica por residente, mínimo de 5 leitos de UTI pediátrica; sala cirúrgica; habilitação em UNACON ou CACON. |
| 5. Cardiologia Pediátrica | Hospital com mínimo de 50 leitos, mínimo de 5 leitos de pediatria clínica por residente, mínimo de 5 leitos de UTI pediátrica; serviço de urgência hospitalar na rede; possuir serviço de diagnóstico por imagem compatível com a formação do especialista em cardiologia; possuir hospital habilitado como unidade de assistência de alta complexidade cardiovascular na rede. |
| 6. Cirurgia Cardiovascular | Hospital habilitado como unidade de assistência de alta complexidade cardiovascular |
| 7. Medicina de Família e Comunidade | Atender aos parâmetros estabelecidos na Portaria nº 3.147/2012 |
| 8. Medicina Nuclear | Hospital com mínimo de 100 leitos gerais; mínimo 5 a 10 leitos UTI adulto; habilitação em UNACON ou CACON com radioterapia no SUS. |
| 9. Neurocirurgia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade para Neurocirurgia |
| 10. Ortopedia e Traumatologia | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede, possuir habilitação em Alta Complexidade para Ortopedia e Traumatologia. |
| 11. Radioterapia | Hospital com mínimo de 100 leitos gerais; mínimo 5 a 10 leitos UTI adulto; habilitação em UNACON ou CACON com radioterapia no SUS |
| 12. Patologia/Patologia Clínica/Medicina Laboratorial | Hospital com no mínimo 100 leitos; serviço de verificação de óbitos; mínimo de duas salas cirúrgicas. |
| 13. Transplantes | Habilitação em Transplantes |
ANEXO LV
SERVIÇO DE ATENÇÃO ÀS PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL E SUAS CLASSIFICAÇÕES NO SISTEMA DE CADASTRO NACIONAL DE ESTABELECIMENTOS DE SAÚDE (Origem: PRT MS/GM 485/2014, Anexo 1)
| CÓD. SERV | DESCRIÇÃO DO SERVIÇO | CÓD. CLASS | DESCRIÇÃO DA CLASSIFICAÇÃO |
|---|---|---|---|
| 165 | SERVIÇO DE ATENÇÃO ÀS PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | 001 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL ÀS MULHERES EM SITUAÇÃO DE VIOLÊNCIA SEXUAL |
| 002 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL A ADOLESCENTES EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 003 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL ÀS CRIANÇAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 004 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL AOS HOMENS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 005 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL ÀS PESSOAS IDOSAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 006 | SERVIÇO DE REFERÊNCIA PARA INTERRUPÇÃO DE GRAVIDEZ NOS CASOS PREVISTOS EM LEI | ||
| 008 | SERVIÇOS AMBULATORIAIS COM ATENDIMENTO A PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL. |
ANEXO LVI
TERMO DE COMPROMISSO PARA GARANTIA DE ACESSO (Origem: PRT MS/GM 1097/2006, Anexo I)
TERMO DE COMPROMISSO PARA GARANTIA DE ACESSO
O município de ( nome do município de referência ) , representado pelo Secretário Municipal de Saúde ( nome do Secretário), assume a garantia de acesso aos usuários do Sistema Único de Saúde procedentes dos municípios XXXXX, WWWWW, YYYYY, ZZZZZZZ, conforme a Programação Pactuada e Integrada , aprovada na reunião da Comissão Intergestores Bipartite - CIB realizada em ___/___/___. (anexar relatório das referências recebidas)
_______________________________________
Local e data
______________________________ ____________________
(nome do gestor do município de referência) (assinatura)
______________________________ ____________________
(nome do coordenador municipal da CIB) (assinatura)
______________________________ ____________________
(nome do coordenador estadual da CIB) (assinatura)
_______________________________________________
(nome do coordenador estadual/municipal da CIB do estado encaminhador - no caso de PPI Interestadual)
ANEXO LVII
QUADROS MODELOS DA PROGRAMAÇÃO PACTUADA E INTEGRADA DA ASSISTÊNCIA EM SAÚDE (Origem: PRT MS/GM 1097/2006, Anexo II)
QUADRO 01
PPI ASSISTENCIAL - DETALHAMENTO DA PPI EM TODOS OS MUNICÍPIOS DA UF (valores anuais)
Competência: UF:
| IBGE | Município | ASSISTÊNCIA AMBULATORIAL | ASSISTÊNCIA HOSPITALAR | Incentivos permanentes de custeio * | Valores encaminhados a outras UFs | Valores recebidos de outras UFs | Ajustes | TOTAL PPI ASSISTENCIAL | ||
| Pop. Própria | Pop. Referência | Pop. Própria | Pop. Referência | |||||||
| Total quadro 01 | ||||||||||
* Os incentivos desta coluna referem-se ao SAMU, Centro de Referencia Saúde do Trabalhador, Integra - SUS, IAPI, FIDEPS e Incentivo de Adesão à Contratualização . Os valores referentes ao custeio dos Centros de Especialidades Odontológicas e dos Hospitais de Pequeno Porte estão contemplados nas colunas de população própria e referenciada, e deverão ser compatibilizados com o valor do incentivo de custeio previsto para cada estabelecimento.
QUADRO 02
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES PROGRAMADOS NA SES (valores anuais)
Competência: UF:
| Código da UF | ESPECIFICAÇÃO | TOTAL PPI ASSISTENCIAL |
Tratamento Fora do Domicílio Estadual |
||
Hemorrede |
||
Valores encaminhados a outras UFs |
||
Valores recebidos de outras UFs |
||
Outros...................................................(especificar ) |
||
Total quadro 02 |
||
OBS : total quadro 1 + total quadro 2 = total da UF Os valores recebidos pelos estabelecimentos da Rede Sarah não estão contemplados nestes quadros
QUADRO 03
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES ENCAMINHADOS A MUNICÍPIOS DE OUTRAS UFs DE REGIÕES INTERESTADUAIS (valores anuais)
Competência: UF:
| IBGE | Município de origem | IBGE município executor | Município executor | Recursos encaminhados | Total PPI assistencial | |
| Gestão Estadual | Gestão Municipal | |||||
| Subtotal estado Y | ||||||
| Subtotal estado X | ||||||
| Total quadro 03 | ||||||
QUADRO 04
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES A SEREM DESCONTADOS DA PPI DOS MUNICÍPIOS EM FUNÇÃO DE TCEP ENTRE OS GESTORES ESTADUAL e MUNICIPAL (valores anuais)
Competência: UF:
| IBGE | Município | Nome da Unidade | Código CNES | Número do Termo | Data de Publicação do Extrato do Termo | Fundo (FMS ou FES) para o qual serão realizadas as transferências | Valor ANUAL a ser destinado ao Fundo de Saúde |
| Total quadro 04 | |||||||
Os valores serão descontados da PPI dos municípios (quadro 1) quando as transferências forem realizadas ao FES.
Quando as transferências forem realizadas ao FMS os valores não serão descontados da PPI dos municípios
QUADRO 05
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES A SEREM DESCONTADOS DA PPI DOS MUNICÍPIOS EM FUNÇÃO DE ESTABELECIMENTOS SOB GESTÃO ESTADUAL (valores anuais)
Competência: UF:
| IBGE | Município | Valor ANUAL a ser destinado ao Fundo Estadual de Saúde |
www |
||
www |
||
subtotal do município WWW |
||
Total quadro 5 |
||
QUADRO 06
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES A SEREM DESCONTADOS DA PPI DOS MUNICÍPIOS PARA RETENÇÃO DOS RECURSOS PELO FNS E TRANSFERÊNCIA DIRETA ÀS UNIDADES PRESTADORAS UNIVERSITÁRIAS FEDERAIS (valores anuais)
Competência: UF:
| Gestão | IBGE | Municípios | Nome da Unidade | Código CNES | Nº do contrato | Data de Publicação do Extrato do Contrato | Valor ANUAL a ser retido no FNS e transferido diretamente a Unidade Prestadora |
| Gestão Municipal | |||||||
| subtotal 1ª parte do quadro 06 | |||||||
| Gestão Estadual | |||||||
| subtotal 2ª parte do quadro 06 |
QUADRO 07
(totalizador) - PPI ASSISTENCIAL - VALORES DE REPASSE AOS FUNDOS MUNICIPAIS DE SAÚDE (valores anuais)
Competência: UF:
| IBGE | Município | Assitência Ambulatorial e Hospitalar | Incentivos permanentes de custeio | Ajustes | Valores de TCEP com transferências realizadas ao FES (-) | Valores de estabelecimentos sob gestão estadual (-) | Valores retidos no Fundo Nacional da Saúde (-) | Valores encaminhados ou recebidos de outras UFs (+ ou-) | Total Fundo Municipal |
| Origem do dado | QUADRO 1 | QUADRO 4 | QUADRO 5 | QUADRO 6 1ªparte | Quadro 1 | ||||
| Valores transferidos aos FMS | |||||||||
QUADRO 08
(totalizador) - PPI ASSISTENCIAL - VALORES DE REPASSE AO FUNDO ESTADUAL DE SAÚDE (valores anuais)
Competência: UF:
| Código gestão estadual | ESPECIFICAÇÃO DOS RECURSOS | Origem do dado | Valor |
| 999999 | (+) Limites referentes aos recursos programados na SES | Quadro 2 | |
| 999999 | (+) Valores a receber referentes a estabelecimentos sob gestão estadual | Quadro 5 | |
| 999999 | (+) Valores a receber referentes à TCEP com transferências diretas ao FES | Quadro 4 | |
| 999999 | (-) Valores a serem retidos pelo Fundo Nacional de Saúde e transferidos diretamente às unidades prestadoras universitárias federais | Quadro 6 - 2ª parte | |
| 999999 | (+ ou -) Valores encaminhados ou recebidos de outras UFs | Quadro 2 | |
| (-) Outros descontos (campo excluisvo do Ministério da Saúde) | |||
| (+) Recursos de Origem da PPI INTERESTADUAL (Valores recebidos) | Detalhamento no quadro QRI | ||
| (+) Outros Acrescimos (campo exclusivo do Ministério da Saúde) | |||
| VALORES TRANSFERIDOS AO FUNDO ESTADUAL DE SAÚDE | |||
QUADRO 09
(totalizador) - PPI ASSISTENCIAL - CONSOLIDADO DA PROGRAMAÇÃO (valores anuais)
Competência: UF:
| Especificação | Origem do dado | Valor |
| Total dos valores transferidos aos Fundos Municipais de Saúde | Quadro 7 | |
| Total dos valores transferidos ao Fundo Estadual de Saúde | Quadro 8 | |
| Total dos valores retidos do Fundo Nacional de Saúde | Quadro 6 | |
| Total Geral da UF |
ANEXO LVIII
CALENDÁRIO NACIONAL DE VACINAÇÃO (Origem: PRT MS/GM 1533/2016, Anexo 1)
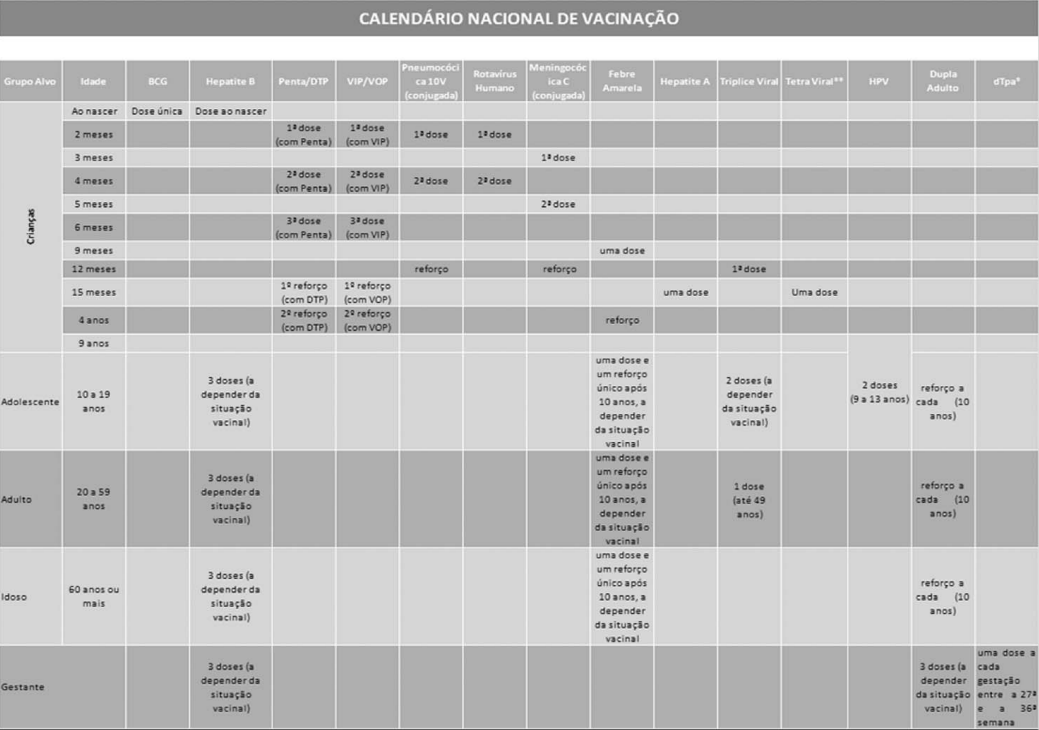
ANEXO LIX
CALENDÁRIO NACIONAL DE VACINAÇÃO DOS POVOS INDÍGENAS (Origem: PRT MS/GM 1533/2016, Anexo 2)
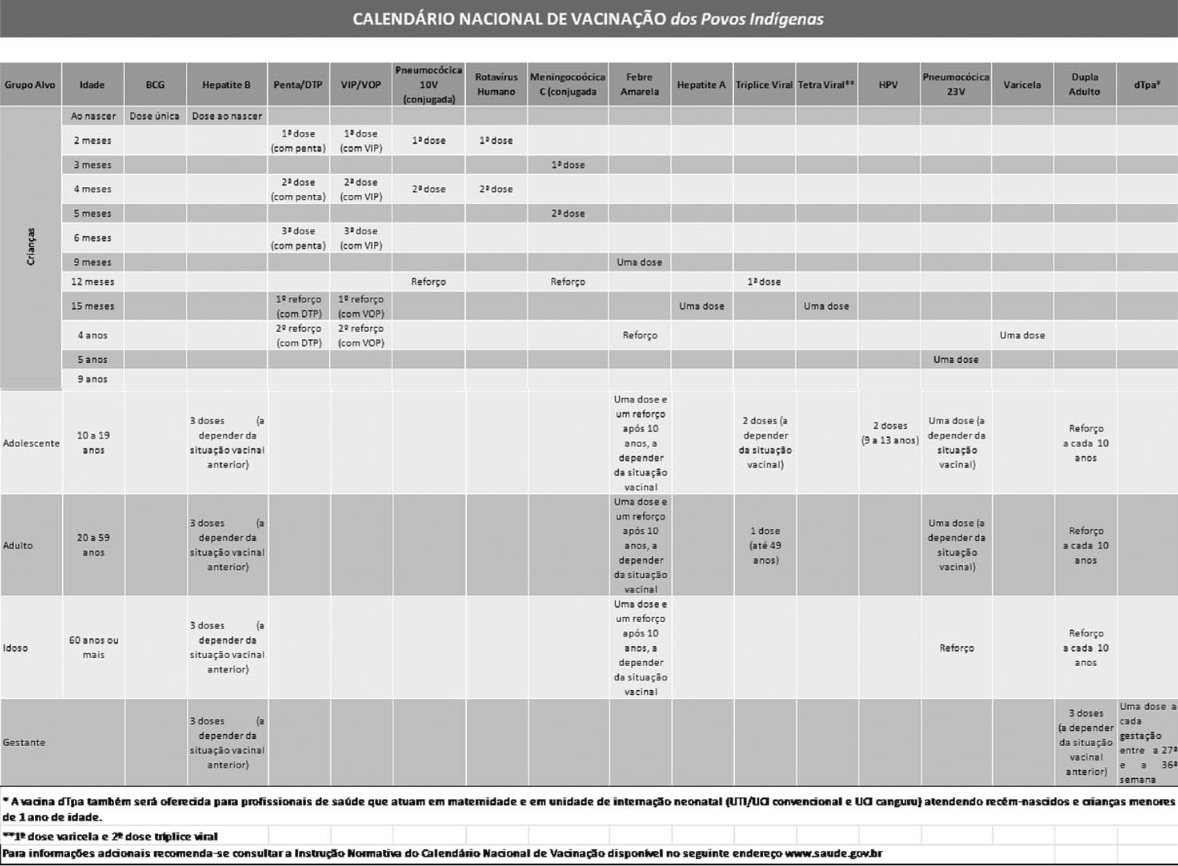
ANEXO LX
CAMPANHAS NACIONAIS DE VACINAÇÃO (Origem: PRT MS/GM 1533/2016, Anexo 3)
| Anexo III - Campanhas Nacionais de Vacinaçãos | |
| Influenza | Crianças de 6 meses a menores de 5 anos de idade, gestantes, puérperas, pessoas com 60 anos e mais, povos indígenas, trabalhadores de saúde, população privada de liberdade, funcionários do sistema prisional e indivíduos com comorbidades. |
| Poliomielite | Crianças de 1 ano a menores de 5 anos de idade |
| Multivacinação (todas as vacinas do Calendário Básico de Vacinação da Criança para atualização do esquema vacinal). | Crianças menores de 5 anos de idade |
| Seguimento contra o Sarampo (a cada 5 anos ou de acordo com a situação epidemiológica). | Crianças menores de 5 anos de idade |
ANEXO LXI
INSTRUÇÃO NORMATIVA REFERENTE AO CALENDÁRIO NACIONAL DE VACINAÇÃO (Origem: PRT MS/GM 1533/2016, Anexo 4)
O presente instrumento estabelece as normatizações técnicas do Programa Nacional de Imunizações referentes ao Calendário Nacional de Vacinação, de que trata a Portaria GM/MS nº xx, de julho de 2016.
Vacina BCG
Esquema:
Administrar dose única, o mais precocemente possível, de preferência na maternidade, logo após o nascimento.
Dose: 0,1mL via intradérmica.
Particularidades:
A comprovação da vacinação com BCG se dá por meio do registro da vacinação no cartão ou caderneta de vacinação, da identificação da cicatriz vacinal ou da palpação de nódulo, no deltoide direito, na ausência de cicatriz.
Crianças nascidas com peso inferior a 2 Kg, adiar a vacinação até que atinjam este peso.
Na rotina dos serviços, a vacina é disponibilizada para crianças até 4 (quatro) anos 11 meses e 29 dias, ainda não vacinadas.
Crianças vacinadas na faixa etária preconizada que não apresentam cicatriz vacinal após 6 (seis) meses da administração da vacina, revacinar apenas uma vez.
Esta vacina é contraindicada para gestantes e pessoas imunodeprimidas.
Pessoas hospitalizadas com comprometimento do estado geral, a vacinação deve ser adiada até a resolução do quadro clinico.
Contatos prolongados de portadores de hanseníase: vacinação seletiva, nas seguintes situações:
Menores de 1 (um) ano de idade:
Não vacinados: administrar 1 (uma) dose de BCG.
Comprovadamente vacinados que apresentem cicatriz vacinal: não administrar outra dose de BCG.
Comprovadamente vacinados que não apresentem cicatriz vacinal: administrar uma dose de BCG seis meses após a última dose.
A partir de 1 (um) ano de idade:
Sem cicatriz: administrar 1 (uma) dose.
Vacinados com 1 (uma) dose: administrar outra dose de BCG, com intervalo mínimo de 6 (seis) meses após a dose anterior.
Vacinados com 2 (duas) doses: não administrar outra dose de BCG.
Pessoas expostas ao HIV:
Administrar ao nascimento ou o mais precocemente possível.
Criança que chega ao serviço, ainda não vacinada, poderá receber BCG se assintomática e sem sinais de imunodepressão.
A revacinação não é indicada.
A partir dos 5 (cinco) anos de idade, pessoas portadoras de HIV não devem ser vacinadas, mesmo que assintomáticas e sem sinais de imunodeficiência.
Vacina Hepatite B (recombinante)
Esquema:
Administrar 1 (uma) dose ao nascer, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade. Esta dose pode ser administrada até 30 dias após o nascimento.
Completar o esquema de vacinação contra hepatite B com a vacina penta [vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada)], aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade.
Crianças que perderam a oportunidade de receber a vacina hepatite B (recombinante) até 1 (um) mês de idade, não administrar mais essa vacina. Iniciar esquema vacinal a partir de 2 (dois) meses de idade até 4 (quatro) anos 11 meses e 29 dias, com a vacina penta (vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada), com intervalo de 60 dias entre as doses, mínimo de 30 dias, conforme esquema detalhado notópico da vacina penta.
Pessoas a partir de 7 (sete) anos de idade:
Sem comprovação vacinal: administrar 3 (três) doses da vacina hepatite B com intervalo de 30 dias entre a primeira e a segunda dose e de 6 (seis) meses entre a primeira e a terceira dose (0, 1 e 6 meses).
Com esquema vacinal incompleto, não reiniciar o esquema, apenas completá-lo conforme situação encontrada.
Para gestantes em qualquer faixa etária e idade gestacional:
administrar 3 (três) doses da vacina hepatite B, considerando o histórico de vacinação anterior e os intervalos preconizados entre as doses. Caso não seja possível completar o esquema durante a gestação, deverá concluir após o parto.
Dose: 0,5 mL até os 19 anos de idade e 1 mL a partir de 20 anos de idade (Laboratório Butantan - nacional) e 0,5 mL até os 15 anos de idade e 1 mL a partir de 16 anos de idade (Laboratório Sanofi - internacional), via intramuscular.
Particularidades:
Em recém-nascidos de mães portadoras da hepatite B, administrar a vacina e a imunoglobulina humana anti-hepatite B, preferencialmente nas primeiras 12 horas, podendo a imunoglobulina ser administrada no máximo até 7 (sete) dias de vida.
Para pessoas com condições clínicas especiais recomenda-se consultar o Manual dos Centros de Referência para Imunobiológicos Especiais (CRIE) disponível em:
http://portalsaude.saude.gov.br/images/pdf/2014/dezembro/09/manual-cries-9dez14-web.pdf.
Vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada) - Vacina Penta
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias. A terceira dose não deverá ser dada antes dos 6 (seis) meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Na rotina dos serviços, a vacina penta está disponível para crianças até 6 (seis) anos 11 meses e 29 dias.
Crianças até 6 (seis) anos 11 meses e 29 dias, sem comprovação ou com esquema vacinal incompleto, iniciar ou complementar esquema com penta.
A vacina penta está contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina adsorvida difteria, tétano, pertussis (DTP)
Reforço:
Administrar 2 (dois) reforços, o primeiro aos 15 meses de idade e o segundo aos 4 (quatro) anos de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses de penta); intervalo mínimo de 6 (seis) meses entre os reforços.
Crianças com 4 anos de idade, sem nenhum reforço, administrar 2 reforços, considerando o intervalo de seis meses entre os reforços.
Crianças entre 5 (cinco) anos de idade e 6 (seis) anos 11 meses e 29 dias, que apresente um reforço, administrar um segundo reforço e crianças sem nenhum reforço, administrar apenas 1 (um) reforço.
Nos comunicantes domiciliares e escolares de casos de difteria ou coqueluche menores de 7 (sete) anos de idade, não vacinados ou com esquema incompleto ou com situação vacinal desconhecida, atualizar esquema, seguir orientações do esquema da vacina penta ou da DTP.
A vacina DTP é contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina Poliomielite 1, 2 e 3 (inativada) - VIP
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses. O intervalo mínimo é de 30 dias entre as doses.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças até 4 anos, 11 meses e 29 dias:
Sem comprovação vacinal: administrar 3 (três) doses da VIP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VIP mesmo tendo iniciado esquema com VOP.
Vacina Poliomielite 1 e 3 (atenuada) - VOP
Reforço:
Administrar o primeiro reforço aos 15 meses e o segundo aos 4 (quatro) anos de idade.
Dose: duas gotas, exclusivamente por via oral.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses).
Administrar o segundo reforço com intervalo mínimo de 6 (seis) meses após o primeiro reforço.
Indivíduos com 5 (cinco) anos de idade ou mais:
Sem comprovação vacinal: administrar 3 (três) doses da VOP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VOP;
Nesta faixa etária não há necessidade de reforço.
Repetir a dose imediatamente se a criança regurgitar, cuspir ou vomitar após a administração da vacina.
Esta vacina é contraindicada para pessoas imunodeprimidas, contatos de pessoa HIV positiva ou com imunodeficiência, bem como aqueles que tenham histórico de paralisia flácida associada à dose anterior da VOP.
Indicada para viajantes que se deslocam para países com recomendação da vacina.
Vacina pneumocócica 10-valente (conjugada) - Pneumo10v
Esquema:
Administrar 2 (duas) doses aos 2 (dois) e 4 (quatro) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar 1 (um) reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 4 (quatro) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias.
Crianças sem comprovação vacinal, entre 12 meses e 4 anos, de idade, administrar dose única.
Para as crianças de 2 meses a menores de 5 (cinco) anos de idade, com indicação clínica especial (ver manual do Crie), manter esquema de três doses e reforço.
Vacina rotavírus humano G1P1 [8] (atenuada) - VORH
Esquema:
Administrar 2 (duas) doses, aos 2 (dois) e 4 (quatro) meses de idade.
Dose: 1,5 mL - administrar todo o conteúdo da seringa exclusivamente por via oral.
Particularidades:
Para evitar a oportunidade perdida de vacinação, a primeira dose pode ser administrada a partir de 1 (um) mês e 15 dias até 3 (três) meses e 15 dias. A segunda dose pode ser administrada a partir de 3 (três) meses e 15 dias até 7 (sete) meses e 29 dias. Manter intervalo mínimo de 30 dias entre as doses.
Se a criança regurgitar, cuspir ou vomitar após a vacinação, não repetir a dose.
Esta vacina é contraindicada para crianças com histórico de invaginação intestinal ou com malformação congênita não corrigida do trato gastrointestinal.
Crianças com quadro agudo de gastroenterite (tais como: vômitos, diarreia, febre), adiar a vacinação até a resolução do quadro.
Crianças com imunodepressão deverão ser avaliadas e vacinadas mediante prescrição médica.
Vacina meningocócica C (conjugada) - Meningo C
Esquema:
Administrar 2 (duas) doses, aos 3 (três) e 5 (cinco) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar o reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 5 (cinco) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias.
Vacina febre amarela (atenuada) - Febre Amarela (FA)
Esquema: Administrar 1 (uma) dose aos 9 (nove) meses de idade.
Reforço: Administrar 1 (um) reforço aos 4 (quatro) anos de idade. O intervalo mínimo entre a dose do esquema e o reforço é de 30 dias.
Indicada para residentes ou viajantes para as Áreas com Recomendação da Vacina (ACRV).
Dose: 0,5 mL, via subcutânea.
Particularidades:
Pessoas a partir de 5 (cinco) anos de idade:
que receberam uma dose da vacina antes de completar 5 (cinco) anos de idade - administrar um reforço, com intervalo mínimo de 30 dias entre as doses.
que nunca foram vacinadas ou sem comprovante de vacinação - administrar a primeira dose da vacina e 1 (um) reforço após10 (dez) anos.
que receberam 2 (duas) doses da vacina - considerar vacinado. Não administrar nenhuma dose.
Para pessoas com 60 anos e mais, que nunca foram vacinadas ou sem comprovante de vacinação, o médico deverá avaliar o benefício/risco da vacinação, levando em conta os riscos da doença, comorbidades e eventos adversos nessa faixa etária.
Para gestantes, independente do estado vacinal, a vacinação não está indicada. Na impossibilidade de adiar a vacinação, em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Mulheres amamentando crianças com até 6 meses de idade, independentemente do estado vacinal: a vacinação não está indicada, devendo ser adiada até a criança completar 6 meses de idade. Na impossibilidade de adiar a vacinação, como em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Em caso de mulheres que estejam amamentando crianças menores de 6 (seis) meses de idade e receberam a vacina, o aleitamento materno deve ser suspenso preferencialmente por 28 dias após a vacinação (com um mínimo de 15 dias). Nessa situação a mãe e a criança deverão ser acompanhadas pelo serviço de saúde.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Em crianças menores de 2 (dois) anos de idade não vacinadas contra a febre amarela, não administrar as vacinas tríplice viral ou tetra viral simultaneamente com a vacina febre amarela. O intervalo entre as vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
A vacina febre amarela pode ser administrada simultaneamente ou com qualquer intervalo com todas as vacinas com exceção da primeira dose da vacina tríplice viral ou tetra viral em crianças menores de 2 (dois) anos de idade, como referido anteriormente.
Esta vacina é contraindicada para crianças abaixo dos 6 (seis) meses de idade.
Em situação de suspeita de surto de febre amarela, epizootia em primatas não humanos ou confirmação da circulação viral em vetores silvestres, uma dose deve ser administrada aos 6 (seis) meses de idade, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 9 (nove) meses e aos 4 (quatro) anos de idade.
Viajantes:
Deverão ser vacinados os viajantes que:
Se deslocarem para áreas com recomendação de vacinação no Brasil (estados das regiões Norte e Centro Oeste, Minas Gerais e Maranhão, e alguns municípios dos estados do Piauí, Bahia, São Paulo, Paraná, Santa Catarina e Rio Grande do Sul). Consultar a lista de municípios da ACRV no seguinte endereço: http://portalsaude.saude.gov.br/images/pdf/2015/novembro/19/Lista-de-Municipios-ACRV-Febre-Amarela-Set-2015.pdf
Se deslocarem para Países com risco para a febre amarela:
Conforme disposto no Regulamento Sanitário Internacional (RSI) a vacinação é recomendada de acordo com a situação epidemiológica de risco do país. Consultar a lista de países de risco para febre amarela e a necessidade de apresentação do Certificado Internacional de Vacinação ou Profilaxia (CIVP) para o ingresso em seu território, no seguinte endereço: www.anvisa.gov.br/viajante. Ressalta-se que para efeito de emissão do CIVP, a validade deste certificado terá início 10 dias a partir da aplicação da vacina em caso de primovacinação. Para mais informações sobre o CIVP, o consulado/ embaixada de cada país deverá ser consultado.
A vacina é indicada para viajantes pelo menos 10 (dez) dias antes da viagem. O prazo de 10 dias não se aplica no caso de revacinação.
Estrangeiros que irão visitar o Brasil:
Recomenda-se que os viajantes atualizem a sua situação vacinal conforme as orientações do calendário de vacinação do país de origem ou residência, previamente à chegada ao Brasil.
Vacina sarampo, caxumba e rubéola - Tríplice Viral
Esquema:
Administrar a primeira dose aos 12 meses de idade.
Completar o esquema de vacinação contra o sarampo, caxumba e rubéola com a vacina tetra viral aos 15 meses de idade (corresponde à segunda dose da vacina tríplice viral e uma dose da vacina varicela).
Dose: 0,5 mL, via subcutânea.
Particularidades:
A vacina tetra viral está disponível na rotina de vacinação para crianças com idade entre 15 meses e 1 ano 11 meses e 29 dias.
Detalhamento no tópico da vacina tetra viral.
Pessoas de 2 a 19 anos de idade não vacinadas ou com esquema incompleto devem ser vacinadas com a vacina tríplice viral conforme situação encontrada, considerando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 doses de vacina tríplice viral ou tetra viral;
Pessoas de 20 a 49 anos de idade não vacinadas devem receber uma dose de tríplice viral. Considerar vacinada a pessoa que comprovar 1 (uma) dose de vacina tríplice viral ou dupla viral;
Para profissionais de saúde independente da idade: administrar 2 (duas) doses, conforme situação vacinal encontrada, observando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 (0064uas) dose de vacina dupla viral ou tríplice viral.
Esta vacina é contraindicada para gestantes e crianças abaixo dos 6 (seis) meses de idade.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Mulheres em idade fértil devem evitar a gravidez até pelo menos 1 (um) mês após a vacinação.
Em crianças menores de 2 (dois) anos de idade não vacinadas com tríplice viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações de emergência epidemiológica para sarampo ou rubéola:
administrar 1 (uma) dose de tríplice viral em crianças na faixa etária entre 6 (seis) a 11 meses, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 12 meses e aos 15 meses de idade;
administrar 1 (uma) dose de dupla viral ou tríplice viral em pessoas acima de 50 anos de idade que não comprovarem nenhuma dose destas vacinas.
Vacina sarampo, caxumba, rubéola e varicela (atenuada) - Tetra viral
Esquema:
Administrar 1 (uma) dose aos 15 meses de idade em crianças que já tenham recebido a primeira dose da vacina tríplice viral.
Dose: 0,5 mL, subcutânea.
Particularidade:
Crianças que não foram vacinadas oportunamente aos 15 meses de idade, poderão ser vacinadas até 1 (um) ano 11 meses e 29 dias;
Em crianças menores de 2 (dois) anos de idade não vacinadas com tetra viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações emergenciais e na indisponibilidade da vacina tetra viral, as vacinas tríplice viral (sarampo, caxumba e rubéola) e varicela (atenuada) poderão ser utilizadas.
Vacina adsorvida hepatite A (inativada) - Hepatite A
Esquema:
Administrar uma dose aos 15 meses de idade. A idade máxima para administração é 1(um) ano, 11 meses, 29 dias.
Dose: 0,5mL, intramuscular.
Particularidades:
Crianças com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Vacina adsorvida difteria e tétano adulto - dT/ Dupla
Adulto
Reforço:
Indivíduos a partir de 7 (sete) anos de idade, com esquema vacinal completo (3 [três] doses) para difteria e tétano, administrar 1 (uma) dose a cada 10 anos após a última dose;
Em todos os casos, após completar o esquema básico (DTP, tetra ou penta) e reforços, administrar reforço com a dT a cada 10 anos, após a última dose;
Em casos de ferimentos graves, comunicantes de casos de difteria, antecipar a dose quando a última foi administrada há mais de 5 (cinco) anos.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Pessoas a partir de 7 (sete) anos de idade não vacinadas ou sem comprovação vacinal para difteria e tétano, administrar 3 (três) doses com intervalo de 60 dias entre as doses, mínimo de 30 dias. Indivíduos a partir de 7 (sete) anos de idade, com esquema incompleto para difteria e tétano, completar esquema de 3 (três) doses, considerando as doses anteriores, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
A vacina dupla adulto (dT) pode ser administrada a partir da comprovação da gravidez, em qualquer período gestacional, até 20 dias antes da data provável do parto.
Vacina adsorvida difteria, tétano e pertussis (acelular) tipo adulto - dTpa
Esquema:
Gestantes: 1 (uma) dose a cada gestação
A vacina é indicada para as gestantes a partir da vigésima sétima semana (27ª) a trigésima sexta (36ª) semana de gestação, preferencialmente, podendo ser administrada até 20 dias antes da data provável do parto, considerando o histórico vacinal de difteria, tétano (dT).
As gestantes que residem em áreas de difícil acesso poderão ser vacinadas a partir da vigésima (20ª) semana de gestação. Esta recomendação visa não perder a oportunidade de vacinar estas gestantes.
Particularidades:
Gestantes NÃO vacinadas previamente, administrar três doses de vacinas contendo toxoides tetânico e diftérico com intervalo de 60 dias entre as doses. Sendo 2 (duas) doses de dT e 1 (uma) dose de dTpa, preferencialmente entre 27ª e 36ª semanas de gestação.
Gestantes vacinadas com uma dose de dT, administrar uma dose de dT e uma dose de dTpa (entre 27ª e 36ª semanas de gestação) com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com duas doses de dT, administrar uma dose da dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há menos de cinco anos, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há mais de cinco anos, administrar uma dose de dTpa.
Gestantes em áreas de difícil acesso, administrar a vacina dTpa a partir da vigésima (20ª) semana de gestação adequando a administração das doses conforme quadro acima.
Gestantes que não foram vacinadas durante a gestação, aplicar uma dose de dTpa no puerpério o mais precoce possível.
Profissionais de Saúde e Parteiras tradicional:
Observação: Segundo o Ministério da Saúde parteira tradicional é aquela que presta assistência ao parto domiciliar baseada em saberes e práticas tradicionais e é reconhecida pela comunidade como parteira.
Administrar uma dose de dTpa para profissionais de saúde que atuam em maternidade e em unidade de internação neonatal (UTI/UCI convencional e UCI canguru) e parteiras que prestam atendimento a recém-nascidos, considerando o histórico vacinal de difteria, tétano.
Com esquema de vacinação primário completo:
Administração da dTpa como reforço a cada dez anos em substituição da dT.
Com esquema de vacinação primário incompleto:
Menos de três doses com a vacina dT: administrar uma dose de dTpa e completar o esquema com uma ou duas doses de dT (dupla adulto) de forma a totalizar três doses da vacina contendo o componente tetânico.
Dose: 0,5mL, intramuscular.
Vacina papilomavirus humano 6, 11, 16 e 18 (recombinante) - HPV
Esquema:
Administrar 2 (duas) doses, com intervalo de 6 (seis) meses entre as doses, nas meninas de 9 a 13 anos 11 meses e 29 dias.
Meninas e mulheres de 9 a 26 anos 11 meses e 29 dias, vivendo com HIV/Aids administrar 3 (três) doses com intervalo de 2 (dois) meses entre a primeira e a segunda dose e 6 (seis) meses entre a primeira e a terceira dose. Para a vacinação deste grupo, mantém-se a necessidade de prescrição médica.
Dose: 0,5 mL, intramuscular.
Particularidades:
Meninas com 14 anos de idade com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando o intervalo mínimo de seis meses entre as doses;
Mulheres com 27 anos, vivendo com HIV/Aids com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando os intervalos entre as doses.
Caso a primeira dose tenha sido administrada há mais de 6 meses, administrar a segunda dose e agendar a terceira dose, respeitando o intervalo mínimo de 90 dias entre a segunda e a terceira dose.
Esta vacina é contraindicada durante a gestação. Caso a mulher engravide após a primeira dose da vacina HPV ou receba a vacina inadvertidamente durante a gravidez, suspender a dose subsequente e completar o esquema vacinal, preferencialmente em até 45 dias após o parto. Nestes casos nenhuma intervenção adicional é necessária, somente o acompanhamento do pré-natal.
Mulheres que estão amamentando podem ser vacinadas com a vacina HPV.
Recomenda-se que a pessoa vacinada deverá permanecer sentada, sob observação por aproximadamente 15 minutos após a vacinação.
ANEXO LXII
INSTRUÇÃO NORMATIVA REFERENTE AO CALENDÁRIO NACIONAL DE VACINAÇÃO DOS POVOS INDÍGENAS (Origem: PRT MS/GM 1533/2016, Anexo 5)
O presente instrumento estabelece as normatizações técnicas do Programa Nacional de Imunizações referentes ao Calendário Nacional de Vacinação dos Povos Indígenas, de que trata a Portaria GM/MS nº xx de xx de xx de 2016.
Vacina BCG
Esquema:
Administrar dose única, o mais precoce possível, preferencialmente na maternidade, logo após nascimento.
Dose: 0,1mL, via intradérmica.
Particularidades:
A comprovação da vacinação com BCG se dá por meio do registro da vacinação no cartão ou caderneta de vacinação, por meio da identificação da cicatriz vacinal ou da palpação de nódulo na ausência de cicatriz.
Crianças nascidas com peso inferior a 2 Kg, adiar a vacinação até que atinjam este peso.
Na rotina dos serviços, a vacina é disponibilizada para crianças até 4(quatro) anos 11 meses e 29 dias, ainda não vacinadas.
Crianças vacinadas na faixa etária preconizada que não apresentam cicatriz vacinal após 6 (seis) meses da administração da vacina, revacinar apenas uma vez.
A realização do teste tuberculínico é dispensável antes ou depois da administração da vacina BCG, inclusive para os contatos de pacientes de hanseníase.
Contatos prolongados de portadores de hanseníase: vacinação seletiva, nas seguintes situações:
Menores de 1(um) ano de idade:
Não vacinados: administrar 1(uma) dose de BCG.
Comprovadamente vacinados que apresentem cicatriz vacinal: não administrar outra dose de BCG.
Comprovadamente vacinados que não apresentem cicatriz vacinal: administrar uma dose de BCG seis meses após a última dose.
A partir de 1 (um) ano de idade:
Sem cicatriz: administrar 1 (uma) dose.
Vacinados com 1 (uma) dose: administrar outra dose de BCG, com intervalo mínimo de 6 (seis) meses após a dose anterior.
Vacinados com 2 (duas) doses: não administrar outra dose de BCG.
Pessoas expostas ao HIV:
Administrar ao nascimento ou o mais precocemente possível.
Criança que chega ao serviço, ainda não vacinada, poderá receber BCG se assintomática e sem sinais de imunodepressão.
A revacinação não é indicada.
A partir dos 5 (cinco) anos de idade, pessoas portadoras de HIV não devem ser vacinadas, mesmo que assintomáticas e sem sinais de imunodeficiência.
Vacina Hepatite B (recombinante)
Esquema:
Administrar 1 (uma) dose ao nascer, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade. Esta dose pode ser administrada até 30 dias após o nascimento.
Completar o esquema de vacinação contra hepatite B com a vacina penta [vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada)], aos 2 (dois), 4 (quatro) e 6 (seis) meses deidade.
Crianças que perderam a oportunidade de receber a vacina hepatite B (recombinante) até 1 mês de idade, não administrar mais essa vacina. Iniciar esquema vacinal a partir de 2 (dois) meses de idade até 6 (seis) anos 11 meses e 29 dias, com a vacina penta (vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada), com intervalo de 60 dias entre as doses, mínimo de 30 dias, conforme esquema detalhado no tópico da vacina penta.
O presente instrumento estabelece as normatizações técnicas do Programa Nacional de Imunizações referentes ao Calendário Nacional de Vacinação dos Povos Indígenas, de que trata a Portaria GM/MS nº xx de xx de xx de 2016.
Vacina BCG
Esquema:
Administrar dose única, o mais precoce possível, preferencialmente na maternidade, logo após o nascimento.
Dose: 0,1mL, via intradérmica.
Particularidades:
A comprovação da vacinação com BCG se dá por meio do registro da vacinação no cartão ou caderneta de vacinação, por meio da identificação da cicatriz vacinal ou da palpação de nódulo na ausência de cicatriz.
Crianças nascidas com peso inferior a 2 Kg, adiar a vacinação até que atinjam este peso.
Na rotina dos serviços, a vacina é disponibilizada para crianças até 4 (quatro) anos 11 meses e 29 dias, ainda não vacinadas.
Crianças vacinadas na faixa etária preconizada que não apresentam cicatriz vacinal após 6 (seis) meses da administração da vacina, revacinar apenas uma vez.
A realização do teste tuberculínico é dispensável antes ou depois da administração da vacina BCG, inclusive para os contatos de pacientes de hanseníase.
Contatos prolongados de portadores de hanseníase: vacinação seletiva, nas seguintes situações:
Menores de 1 (um) ano de idade:
Não vacinados: administrar 1 (uma) dose de BCG.
Comprovadamente vacinados que apresentem cicatriz vacinal: não administrar outra dose de BCG.
Comprovadamente vacinados que não apresentem cicatriz vacinal: administrar uma dose de BCG seis meses após a última dose.
A partir de 1 (um) ano de idade:
Sem cicatriz: administrar 1 (uma) dose.
Vacinados com 1 (uma) dose: administrar outra dose de BCG, com intervalo mínimo de 6 (seis) meses após a dose anterior.
Vacinados com 2 (duas) doses: não administrar outra dose de BCG.
Pessoas expostas ao HIV:
Administrar ao nascimento ou o mais precocemente possível.
Criança que chega ao serviço, ainda não vacinada, poderá receber BCG se assintomática e sem sinais de imunodepressão.
A revacinação não é indicada.
A partir dos 5 (cinco) anos de idade, pessoas portadoras de HIV não devem ser vacinadas, mesmo que assintomáticas e sem sinais de imunodeficiência.
Vacina Hepatite B (recombinante)
Esquema:
Administrar 1 (uma) dose ao nascer, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade. Esta dose pode ser administrada até 30 dias após o nascimento.
Completar o esquema de vacinação contra hepatite B com a vacina penta [vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada)], aos 2 (dois), 4 (quatro) e 6 (seis) meses deidade.
Crianças que perderam a oportunidade de receber a vacina hepatite B (recombinante) até 1 mês de idade, não administrar mais essa vacina. Iniciar esquema vacinal a partir de 2 (dois) meses de idade até 6 (seis) anos 11 meses e 29 dias, com a vacina penta (vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada), com intervalo de 60 dias entre as doses, mínimo de 30 dias, conforme esquema detalhado no tópico da vacina penta.
Pessoas a partir de 7 (sete) anos de idade:
Sem comprovação vacinal: administrar 3 (três) doses da vacina hepatite B com intervalo de 30 dias entre a primeira e a segunda dose e de 6 (seis) meses entre a primeira e a terceira dose (0, 1 e 6 meses).
Com esquema vacinal incompleto, não reiniciar o esquema, apenas completá-lo conforme situação encontrada.
Para gestantes em qualquer faixa etária e idade gestacional:
administrar 3 (três) doses da vacina hepatite B, considerando o histórico de vacinação anterior e os intervalos preconizados entre as doses. Caso não seja possível completar o esquema durante a gestação, deverá concluir após o parto.
Dose: 0,5 mL até os 19 anos de idade e 1 mL a partir de 20 anos de idade (Laboratório Butantan - nacional) e 0,5 mL até os 15 anos de idade e 1 mL a partir de 16 anos de idade (Laboratório Sanofi - internacional), via intramuscular.
Particularidades:
Em recém-nascidos de mães portadoras da hepatite B, administrar a vacina e a imunoglobulina humana anti-hepatite B, preferencialmente nas primeiras 12 horas, podendo a imunoglobulina ser administrada no máximo até 7 (sete) dias de vida.
Para pessoas com condições clínicas especiais recomenda-se consultar o Manual dos Centros de Referência para Imunobiológicos Especiais (CRIE) disponível em:
http://portalsaude.saude.gov.br/images/pdf/2014/dezembro/09/manual-cries-9dez14-web.pdf.
Vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada) - Vacina Penta
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias. A terceira dose não deverá ser dada antes dos 6 (seis) meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Na rotina dos serviços, a vacina penta está disponível para crianças até 6 (seis) anos 11 meses e 29 dias;
Crianças até 6 (seis) anos 11 meses e 29 dias, sem comprovação ou com esquema vacinal incompleto, iniciar ou complementar esquema com penta;
A vacina penta está contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina adsorvida difteria, tétano, pertussis (DTP)
Reforço:
Administrar 2 (dois) reforços, o primeiro aos 15 meses de idade e o segundo aos 4 (quatro) anos de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses de penta); intervalo mínimo de 6 (seis) meses entre os reforços. Crianças com 4 anos de idade, sem nenhum reforço, administrar 2 reforços, considerando o intervalo de seis meses entre os reforços.
Nos comunicantes domiciliares e escolares de casos de difteria ou coqueluche menores de 7 (sete) anos de idade, não vacinados ou com esquema incompleto ou com situação vacinal desconhecida, atualizar esquema, seguir orientações do esquema da vacina penta ou da DTP.
A vacina DTP é contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina Poliomielite 1, 2 e 3 (inativada)- VIP
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses. O intervalo mínimo é de 30 dias entre as doses.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças até 4 anos, 11 meses e 29 dias:
Sem comprovação vacinal: administrar 3 (três) doses da VIP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VIP mesmo tendo iniciado esquema com VOP.
Vacina Poliomielite 1 e 3 (atenuada) - VOP
Reforço:
Administrar o primeiro reforço aos 15 meses e o segundo aos 4 (quatro) anos de idade.
Dose: duas gotas, exclusivamente por via oral.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses);
Administrar o segundo reforço com intervalo mínimo de 6 (seis) meses após o primeiro reforço;
Indivíduos com 5 (cinco) anos de idade ou mais:
Sem comprovação vacinal: administrar 3 (três) doses da VOP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VOP;
Nesta faixa etária não há necessidade de reforço.
Repetir a dose imediatamente se a criança regurgitar, cuspir ou vomitar após a administração da vacina.
Esta vacina é contraindicada para pessoas imunodeprimidas, contatos de pessoa HIV positiva ou com imunodeficiência, bem como aqueles que tenham histórico de paralisia flácida associada à dose anterior da VOP.
Indicada para viajantes que se deslocam para países com recomendação da vacina.
Vacina pneumocócica 10-valente (conjugada)- Pneumo10v
Esquema:
Administrar 2 (duas) doses aos 2 (dois) e 4 (quatro) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar 1 (um) reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 4 (quatro) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias
Crianças sem comprovação vacinal, entre 12 meses e 4 anos, de idade, administrar dose única.
Para as crianças de 2 meses a menores de 5 (cinco) anos de idade, com indicação clínica especial (ver manual do Crie), manter esquema de três doses e reforço.
Vacina rotavírus humano G1P1 [8] (atenuada)- VORH
Esquema:
Administrar 2 (duas) doses, aos 2 (dois) e 4 (quatro) meses de idade.
Dose: 1,5 mL - administrar todo o conteúdo da seringa exclusivamente por via oral.
Particularidades:
Para evitar a oportunidade perdida de vacinação, a primeira dose pode ser administrada a partir de 1 (um) mês e 15 dias até 3 (três) meses e 15 dias. A segunda dose pode ser administrada a partir de 3 (três) meses e 15 dias até 7 (sete) meses e 29 dias. Manter intervalo mínimo de 30 dias entre as doses.
Se a criança regurgitar, cuspir ou vomitar após a vacinação, não repetir a dose.
Esta vacina é contraindicada para crianças com histórico de invaginação intestinal ou com malformação congênita não corrigida do trato gastrointestinal.
Crianças com quadro agudo de gastroenterite (tais como: vômitos, diarreia, febre), adiar a vacinação até a resolução do quadro.
Crianças com imunodepressão deverão ser avaliadas e vacinadas mediante prescrição médica.
Vacina meningocócica C (conjugada) - Meningo C
Esquema:
Administrar 2 (duas) doses, aos 3 (três) e 5 (cinco) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar o reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 5 (cinco) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias.
Vacina febre amarela (atenuada) - Febre Amarela (FA)
Esquema: Administrar 1 (uma) dose aos 9 (nove) meses de idade.
Reforço: Administrar 1 (um) reforço aos 4 (quatro) anos de idade. O intervalo mínimo entre a dose do esquema e o reforço é de 30 dias.
Esta vacina é indicada para toda população indígena independente da Área com Recomendação para Vacinação (ACRV).
Dose: 0,5 mL, via subcutânea.
Particularidades:
Pessoas a partir de 5 (cinco) anos de idade:
que receberam uma dose da vacina antes de completar 5 (cinco) anos de idade - administrar um reforço, com intervalo mínimo de 30 dias entre as doses.
que nunca foram vacinadas ou sem comprovante de vacinação - administrar a primeira dose da vacina e 1 (um) reforço após 10 (dez) anos.
que receberam 2 (duas) doses da vacina - considerar vacinado. Não administrar nenhuma dose.
Para pessoas com 60 anos e mais, que nunca foram vacinadas ou sem comprovante de vacinação, o médico deverá avaliar o benefício/risco da vacinação, levando em conta os riscos da doença, comorbidades e eventos adversos nessa faixa etária.
Para gestantes, independente do estado vacinal, a vacinação não está indicada. Na impossibilidade de adiar a vacinação, em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Mulheres amamentando crianças com até 6 meses de idade, independentemente do estado vacinal: a vacinação não está indicada, devendo ser adiada até a criança completar 6 meses de idade. Na impossibilidade de adiar a vacinação, como em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Em caso de mulheres que estejam amamentando crianças menores de 6 (seis) meses de idade e receberam a vacina, o aleitamento materno deve ser suspenso preferencialmente por 28 dias após a vacinação (com um mínimo de 15 dias). Nessa situação a mãe e a criança deverão ser acompanhadas pelo serviço de saúde.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Em crianças menores de 2 (dois) anos de idade não vacinadas contra a febre amarela, não administrar as vacinas tríplice viral ou tetra viral simultaneamente com a vacina febre amarela. O intervalo mínimo entre as vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo devido à especificidade da população indígena, o intervalo mínimo poderá ser de 15 dias.
A vacina febre amarela pode ser administrada simultaneamente ou com qualquer intervalo com todas as vacinas com exceção da primeira dose da vacina tríplice viral ou tetra viral em crianças menores de 2 (dois) anos de idade, como referido anteriormente.
Esta vacina é contraindicada para crianças abaixo dos 6 (seis) meses de idade.
Em situação de suspeita de surto de febre amarela, epizootia em primatas não humanos ou confirmação da circulação viral em vetores silvestres, uma dose deve ser administrada aos 6 (seis) meses de idade, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 9 (nove) meses e aos 4 (quatro) anos de idade.
Vacina sarampo, caxumba e rubéola - Tríplice Viral
Esquema:
Administrar a primeira dose aos 12 meses de idade.
Completar o esquema de vacinação contra o sarampo, caxumba e rubéola com a vacina tetra viral aos 15 meses de idade (corresponde à segunda dose da vacina tríplice viral e uma dose da vacina varicela).
Dose: 0,5 mL, via subcutânea.
Particularidades:
A vacina tetra viral está disponível na rotina de vacinação para crianças com idade entre 15 meses e 1 ano 11 meses e 29 dias.
Detalhamento no tópico da vacina tetra viral.
Pessoas de 2 a 19 anos de idade não vacinadas ou com esquema incompleto devem ser vacinadas com a vacina tríplice viral conforme situação encontrada, considerando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 doses de vacina tríplice viral ou tetra viral;
Pessoas de 20 a 49 anos de idade não vacinadas devem receber uma dose de tríplice viral. Considerar vacinada a pessoa que comprovar 1 (uma) dose de vacina tríplice viral ou dupla viral;
Para profissionais de saúde independente da idade: administrar 2 (duas) doses, conforme situação vacinal encontrada, observando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 (duas) dose de vacina dupla viral ou tríplice viral.
Esta vacina é contraindicada para gestantes e crianças abaixo dos 6 (seis) meses de idade.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Mulheres em idade fértil devem evitar a gravidez até pelo menos 1 (um) mês após a vacinação.
Em crianças menores de 2 (dois) anos de idade não vacinadas com tríplice viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações de emergência epidemiológica para sarampo ou rubéola:
administrar 1 (uma) dose de tríplice viral em crianças na faixa etária entre 6 (seis) a 11 meses, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 12 meses e aos 15 meses de idade;
administrar 1 (uma) dose de dupla viral ou tríplice viral em pessoas acima de 50 anos de idade que não comprovarem nenhuma dose destas vacinas.
Vacina sarampo, caxumba, rubéola e varicela (atenuada) - Tetra viral
Esquema:
Administrar 1 (uma) dose aos 15 meses de idade em crianças que já tenham recebido a primeira dose da vacina tríplice viral.
Dose: 0,5 mL, subcutânea.
Particularidade:
Crianças que não foram vacinadas oportunamente aos 15 meses de idade, poderão ser vacinadas até 1 (um) ano 11 meses e 29 dias;
Em crianças menores de 2 (dois) anos de idade não vacinadas com tetra viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações emergenciais e na indisponibilidade da vacina tetra viral, as vacinas tríplice viral (sarampo, caxumba e rubéola) e varicela (atenuada) poderão ser utilizadas.
Vacina adsorvida hepatite A (inativada) - Hepatite A
Esquema:
Administrar uma dose aos 15 meses de idade. A idade máxima para administração é 1(um) ano, 11 meses, 29 dias.
Dose: 0,5mL, intramuscular.
Particularidades:
Crianças com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Vacina adsorvida difteria e tétano adulto - dT/ Dupla Adulto
Reforço:
Indivíduos a partir de 7 (sete) anos de idade, com esquema vacinal completo (3 [três] doses) para difteria e tétano, administrar 1 (uma) dose a cada 10 anos após a última dose;
Em todos os casos, após completar o esquema básico (DTP, tetra ou penta) e reforços, administrar reforço com a dT a cada 10 anos, após a última dose;
Em casos de ferimentos graves, comunicantes de casos de difteria, antecipar a dose quando a última foi administrada há mais de 5 (cinco) anos.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Indivíduos a partir de 7 (sete) anos de idade não vacinadas ou sem comprovação vacinal para difteria e tétano, administrar 3 (três) doses com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Indivíduos a partir de 7 (sete) anos de idade, com esquema incompleto para difteria e tétano, completar esquema de 3 (três) doses, considerando as doses anteriores, com intervalo de 60 diasentre as doses, mínimo de 30 dias.
A vacina dupla adulto (dT) pode ser administrada a partir da comprovação da gravidez, em qualquer período gestacional. Completar esquema até 20 dias antes do parto.
Vacina adsorvida difteria, tétano e pertussis (acelular) tipo adulto - dTpa
Esquema:
Gestantes: 1 (uma) dose a cada gestação
A vacina é indicada para as gestantes a partir da vigésima sétima semana (27ª) a trigésima sexta (36ª) semana de gestação, preferencialmente, podendo ser administrada até 20 dias antes da data provável do parto, considerando o histórico vacinal de difteria, tétano (dT).
As gestantes que residem em áreas de difícil acesso poderão ser vacinadas a partir da vigésima (20ª) semana de gestação. Esta recomendação visa não perder a oportunidade de vacinar estas gestantes.
Particularidades:
Gestantes NÃO vacinadas previamente, administrar três doses de vacinas contendo toxoides tetânico e diftérico com intervalo de 60 dias entre as doses. Sendo 2 (duas) doses de dT por uma dose de dTpa, preferencialmente entre 27ª e 36ª semanas de gestação.
Gestantes vacinadas com uma dose de dT, administrar uma dose de dT e uma dose de dTpa (entre 27ª e 36ª semanas de gestação) com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com duas doses de dT, administrar uma dose da dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há menos de cinco anos, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há mais de cinco anos, administrar uma dose de dTpa.
Gestantes em áreas de difícil acesso, administrar a vacina dTpa a partir da vigésima (20ª) semana de gestação adequando a administração das doses conforme quadro acima.
Gestantes que não foram vacinadas durante a gestação, aplicar uma dose de dTpa no puerpério o mais precoce possível.
Profissionais de Saúde e Parteiras tradicional:
Observação: Segundo o Ministério da Saúde parteira tradicional é aquela que presta assistência ao parto domiciliar baseada em saberes e práticas tradicionais e é reconhecida pela comunidade como parteira.
Administrar uma dose de dTpa para profissionais de saúde que atuam em maternidade e em unidade de internação neonatal (UTI/UCI convencional e UCI canguru) e parteiras que prestam atendimento a recém-nascidos, considerando o histórico vacinal de difteria, tétano.
Com esquema de vacinação primário completo:
Administração da dTpa como reforço a cada dez anos em substituição da dT.
Com esquema de vacinação primário incompleto:
Menos de três doses com a vacina dT: administrar uma dose de dTpa e completar o esquema com uma ou duas doses de dT (dupla adulto) de forma a totalizar três doses da vacina contendo o componente tetânico.
Dose: 0,5mL, intramuscular.
Vacina influenza (fracionada, inativada) - Gripe
Esquema:
Crianças entre 6 (seis) meses e 8 (oito) anos 11 meses 29 dias, primovacinadas (que tomarão a vacina pela primeira vez): administrar 2 (duas) doses, com intervalo de 30 dias entre as doses.
Para pessoas a partir de 9 (nove) anos: administrar 1 (uma) dose.
Dose:
Para crianças entre 6 (seis) meses e 2 (dois) anos 11 meses 29 dias: administrar 0,25 mL, via intramuscular ou subcutânea, a depender do país de origem do laboratório produtor (Verificar na bula que acompanha a vacina ou no informe da campanha anual).
Para pessoas a partir de 3 (três) anos de idade: 0,5 mL, via intramuscular ou subcutânea, a depender do país de origem do laboratório produtor.
Particularidades:
Em caso de mudança de faixa etária (de 2 para 3 anos de idade), manter a dose inicial do esquema, isto é, 0,25mL.
Gestantes: administrar esta vacina em qualquer idade gestacional.
Vacina pneumocócica 23-valente (polissacarídica) - Pneumo 23v
Esquema:
Administrar 1 (uma) dose em todos os indígenas a partir de 5 (cinco) anos de idade sem comprovação vacinal com as vacinas pneumocócicas conjugadas.
A partir dos 60 (sessenta) anos de idade, administrar 1 (uma) única dose adicional, respeitando o intervalo mínimo de 5 (cinco) anos da dose inicial.
Dose: 0,5 mL via intramuscular
Particularidades:
Contraindicada para as crianças menores de 2 (dois) anos de idade.
Não administrar em crianças menores de 5 (cinco) anos de idade.
Criança de 2 (dois) a 4 (quatro) anos, 11 meses e 29 dias que recebeu dose da vacina pneumocócica 23 valente e não tem histórico de vacinação com pneumocócica conjugada 10 valente, administrar uma dose desta vacina (pneumocócica conjugada 10 valente), não sendo necessárias doses adicionais.
Vacina papilomavirus humano 6, 11, 16 e 18 (recombinante) - HPV
Esquema:
Administrar 2 (duas) doses, com intervalo de 6 (seis) meses entre as doses, nas meninas de 9 a 13 anos 11 meses e 29 dias.
Meninas e mulheres de 9 a 26 anos 11 meses e 29 dias, vivendo com HIV/Aids administrar 3 (três) doses com intervalo de 2 (dois) meses entre a primeira e a segunda dose e 6 (seis) meses entre a primeira e a terceira dose. Para a vacinação deste grupo, mantém-se a necessidade de prescrição médica.
Dose: 0,5 mL, intramuscular.
Particularidades:
Meninas com 14 anos de idade com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando o intervalo mínimo de seis meses entre as doses;
Mulheres com 27 anos, vivendo com HIV/Aids com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando os intervalos entre as doses.
Caso a primeira dose tenha sido administrada há mais de 6 meses, administrar a segunda dose e agendar a terceira dose, respeitando o intervalo mínimo de 90 dias entre a segunda e a terceira dose.
Esta vacina é contraindicada durante a gestação. Caso a mulher engravide após a primeira dose da vacina HPV ou receba a vacina inadvertidamente durante a gravidez, suspender a dose subsequente e completar o esquema vacinal, preferencialmente em até 45 dias após o parto. Nestes casos nenhuma intervenção adicional é necessária, somente o acompanhamento do pré-natal.
Mulheres que estão amamentando podem ser vacinadas com a vacina HPV.
Recomenda-se que a pessoa vacinada deverá permanecer sentada, sob observação por aproximadamente 15 minutos após a vacinação.
Vacina varicela (atenuada)
Esquema:
Administrar uma dose aos 4 (quatro) anos de idade (até 4 anos 11 meses e 29 dias). Corresponde à segunda dose da vacina varicela, considerando a dose de tetra viral aos 15 meses de idade.
Dose: 0,5mL via subcutânea.
Particularidades:
Crianças entre 2 anos a 4 anos 11 meses e 29 dias não vacinadas com tetra viral, administrar duas doses da vacina varicela (atenuada), com intervalo mínimo de 30 dias entre as doses, sendo que a segunda dose deve ser administrada, preferencialmente, aos 4 (quatro) anos de idade.
Pessoas a partir dos 5 anos de idade não vacinadas ou sem comprovação vacinal, administrar 1 (uma) ou duas doses de vacina varicela (atenuada), a depender do laboratório produtor.
Mulheres em idade fértil devem evitar a gravidez até 1 (um) mês após a vacinação.
Esta vacina é contraindicada para gestantes, indivíduos imunodeprimidos ou que apresentaram anafilaxia à dose anterior.
A vacina varicela (atenuada) pode ser administrada simultaneamente com a vacina febre amarela. Na impossibilidade de realizar vacinação simultânea, adotar o intervalo mínimo de 30 dias entre as doses.
Em situações de emergência epidemiológica para varicela em área indígena:
Administrar a imunoglobulina anti-varicela zoster em crianças recém-nascidas até 8 (oito) meses de idade, gestantes e pessoas imunodeprimidas.
Administrar uma dose de vacina varicela (atenuada) em crianças entre 9 e 12 meses de idade (a depender do laboratório produtor). Não considerar esta dose como válida para a rotina e manter o esquema vacinal aos 15 meses com a tetra viral e aos 4 anos com a varicela.
Antecipar a dose de tetra viral em crianças entre 13 e 14 meses de idade e considerar como dose válida para a rotina de vacinação.
Vacinar com tetra viral as crianças entre 15 e 23 meses de idade, conforme as indicações da rotina de vacinação.
Antecipar a dose dos 4 anos em crianças entre 2 e 3 anos de idade e considerar como dose válida para a rotina.
Vacinar com varicela (atenuada) as crianças de 4 anos de idade, conforme as indicações do Calendário Nacional de Vacinação.
Vacinar as pessoas a partir dos 5 anos de idade, conforme histórico vacinal anterior.
ANEXO LXIII
TERMO DE RELATO CIRCUNSTANCIADO (Origem: PRT MS/GM 1508/2005, Anexo 1)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE RELATO CIRCUNSTANCIADO
Eu,____________________________________, brasileira, _______anos, portadora do documento de identificação tipo ___________, nº________,declaro que no dia _____, do mês _______________do ano de ________às ________, no endereço ________________________________ (ou proximidades - indicar ponto de referência) ______________________________, bairro ____________, cidade __________________________, fui vítima de crime de violência sexual, nas seguintes circunstâncias:_________________________________________
Em caso de agressor(s) desconhecido(os)
Declaro ainda, que fui agredida e violentada sexualmente por _______homem(s) de aproximadamente ____________anos, raça/cor ______________cabelos ___________________________, trajando (calça, camisa, camisetas, tênis e outros), outras informações (alcoolizado, drogado, condutor do veículo/tipo ________ etc.).
O crime foi presenciado por (se houver testemunha) ________________________________________
Em caso de agressor (a)(s) conhecido (a)(s)
Declaro ainda, que fui agredida e violentada sexualmente por (informação opcional) ____________________________________, sendo meu/minha_________________________ (indicar grau de parentesco ou de relacionamento social e afetivo), com ___________anos de idade e que no momento do crime encontrava-se/ ou não (alcoolizado, drogado)
O crime foi presenciado por (se houver testemunha) ________________________________________________
É o que tenho/ temos a relatar
Local e data:________________________________
______________________________
Nome, identificação e assinatura
_____________________________________
ANEXO LXIV
PARECER TÉCNICO (Origem: PRT MS/GM 1508/2005, Anexo 2)
(IDENTIFICAÇÃO DO SERVIÇO)
PARECER TÉCNICO
Em face da análise dos resultados dos exames físico geral, ginecológico, de ultra-sonografia obstétrica e demais documentos anexados ao prontuário hospitalar nº______________ da paciente ________________________________________________________, documento tipo______nº_______;manifesta-se pela compatibilidade entre a idade gestacional e a da data da violência sexual alegada.
Local e data:_________________________________
Médico (assinatura e carimbo)
ANEXO LXV
TERMO DE APROVAÇÃO DE PROCEDIMENTO DE INTERRUPÇÃO DA GRAVIDEZ RESULTANTE DE ESTUPRO (Origem: PRT MS/GM 1508/2005, Anexo 3)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE APROVAÇÃO DE PROCEDIMENTO DE INTERRUPÇÃO DA GRAVIDEZ RESULTANTE DE ESTUPRO
Nesta data, a Equipe de Saúde multidisciplinar do Serviço de__________________ do Hospital _________________________ , avaliou o pedido de interrupção de gestação, fundamentado na declaração de violência sexual apresentada, pela usuária _______________________________________________, portadora do documento de identificação tipo __________,nº ________, registro hospitalar nº__________com ________semanas de gestação. Atesta-se que o pedido se encontra em conformidade com o artigo 128 do inciso II do Código Penal, sem a presença de indicadores de falsa alegação de crime sexual. Portanto, APROVA-SE, de acordo com a conclusão do Parecer Técnico, a solicitação de interrupção de gestação formulada pela paciente e/ou por seu representante legal.
Local e data_________________________________
RESPONSÁVEIS PELA APROVAÇÃO
Equipe multiprofissional:
____________________________________________
Carimbo e assinatura
_____________________________________________
Carimbo e assinatura
______________________________________________
Carimbo e assinatura
ANEXO LXVI
TERMO DE RESPONSABILIDADE (Origem: PRT MS/GM 1508/2005, Anexo 4)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE RESPONSABILIDADE
Por meio deste instrumento, eu _______________________, portadora do documento de identificação tipo____________nº__________, ou legalmente representada por ___________________________________________, portador (a) do documento de identificação tipo_____________nº_________, assumo a responsabilidade penal decorrente da prática dos crimes de Falsidade Ideológica e de Aborto, previstos nos artigos 299 e 124 do Código Penal Brasileiro, caso as informações por mim prestadas ao serviço de atendimento às vítimas de violência sexual do Hospital________________________________ NÃO correspondam à legítima expressão da verdade.
Local e Data:______________________________________________________________________
Nome, identificação e assinatura.
ANEXO LXVII
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO INTERRUPÇÃO DE GRAVIDEZ RESULTANTE DE VIOLÊNCIA SEXUAL (Origem: PRT MS/GM 1508/2005, Anexo 5)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO INTERRUPÇÃO DE GRAVIDEZ RESULTANTE DE VIOLÊNCIA SEXUAL
Por meio deste instrumento eu,__________________________, documento de identificação tipo __________,nº_____________registro hospitalar nº____________ e/ou meu representante legal/responsável_______________________ documento de identificação tipo _________ nº ___________., em conformidade com o Artigo 128, inciso II do Código Penal Brasileiro, exerço o direito de escolha pela interrupção da gestação de forma livre, consciente e informada.
Declaro que estou informada da possibilidade de manter a gestação até o seu término, sendo-me garantido os cuidados de pré-natal e parto, apropriados para a situação; e das alternativas após o nascimento, que incluem a escolha de permanecer com a criança e inseri-la na família, ou de proceder com os mecanismos legais de doação.
Declaro, estar esclarecida (os) dos procedimentos médicos que serão adotados durante a realização da intervenção (abortamento previsto em Lei), bem como dos desconfortos e riscos possíveis à saúde, as formas de assistência e acompanhamentos posteriores e os profissionais responsáveis.
Declaro, que me é garantido o direito ao sigilo das informações prestadas, exceto em caso de requisição judicial.
Declaro, outrossim, que após convenientemente esclarecida pelos profissionais de saúde e ter entendido o que me foi explicado, solicito de forma livre e esclarecida a interrupção da gestação atual decorrente de violência sexual, e autorizo a equipe do Hospital ______________________________aos procedimentos necessários.
Local e data:__________________________________
________________________________
Nome, identificação e assinatura.
______________________________
Testemunha
Nome, identificação e assinatura
________________________________
Testemunha
Nome, identificação e assinatura
ANEXO LXVIII
NORMAS DE VIGILÂNCIA À SAÚDE DOS TRABALHADORES EXPOSTOS AO BENZENO (Origem: PRT MS/GM 776/2004, Anexo 1)
NORMAS DE VIGILÂNCIA À SAÚDE DOS TRABALHADORES EXPOSTOS AO BENZENO
1 - Objetivo
Regulamentar os procedimentos relativos à vigilância da saúde dos trabalhadores expostos ao benzeno.
2 - CAMPO DE APLICAÇÃO
As empresas e respectivas contratadas que produzem, utilizam, transportam, armazenam e manipulam benzeno ou suas misturas líquidas para os serviços de saúde públicos e privados, laboratórios e outras instâncias institucionais do campo da saúde do trabalhador.
3 - CONCEITOS
Vigilância Epidemiológica - Entende-se por vigilância epidemiológica um conjunto de ações que proporcionam o conhecimento, a detecção ou prevenção de qualquer mudança nos fatores determinantes e condicionantes da saúde individual e coletiva, com a finalidade de recomendar e adotar medidas de prevenção e controle das doenças ou agravos (Lei nº 8.080/90).
Vigilância Sanitária - Entende-se por vigilância sanitária um conjunto de ações capaz de eliminar, diminuir ou prevenir riscos à saúde e de intervir nos problemas sanitários decorrentes do meio ambiente, da produção e circulação de bens e da prestação de serviços de interesse da saúde (Lei nº 8.080/90).
Vigilância em Saúde do Trabalhador - Entende-se por vigilância em saúde do trabalhador uma atuação contínua e sistemática, ao longo do tempo, no sentido de detectar, conhecer, pesquisar e analisar os fatores determinantes e condicionantes dos agravos à saúde relacionados aos processos e ambientes de trabalho, em seus aspectos tecnológico, social e organizacional e epidemiológico, com a finalidade de planejar, executar e avaliar intervenções sobre esses aspectos, de forma a eliminá-los ou controlá-los (Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS - Portaria nº 3.120/GM, de 1º de julho de 1998).
Benzeno - É um hidrocarboneto aromático que se apresenta como um líquido incolor, lipossolúvel, volátil, inflamável, de odor característico, perceptível a concentrações da ordem de 12 ppm, cuja fórmula molecular é C6H6. Registro CAS n.71-43-2, registro ONU n.1114.
Benzenismo - Conjunto de sinais, sintomas e complicações decorrentes da exposição aguda ou crônica ao hidrocarboneto aromático, benzeno. As complicações podem ser agudas, quando houver exposição a altas concentrações com presença de sinais e sintomas neurológicos, ou crônicas, com sinais e sintomas clínicos diversos, podendo ocorrer complicações a médio ou a longo prazo, localizadas principalmente no sistema hematopoético.
4- DIRETRIZES
4.1- Diagnóstico da Intoxicação Ocupacional pelo Benzeno
4.1.1 - Introdução: O benzeno é um mielotóxico regular, leucemogênico e cancerígeno, mesmo em baixas concentrações. Outras alterações podem também ocorrer como descrito a seguir. Não existem sinais ou sintomas patognomônicos da intoxicação.
4.1.2- Síndrome Clínica da Intoxicação pelo Benzeno:
Quadro Clínico e Laboratorial da Toxicidade pelo Benzeno: Considera-se toxicidade do benzeno (ou benzenismo) quando a pessoa apresenta um conjunto de sinais e sintomas e que tenha sido exposta ao benzeno. O quadro clínico de toxicidade ao benzeno caracteriza-se por uma repercussão orgânica múltipla, em que o comprometimento da medula óssea é o componente mais freqüente e significativo, sendo a causa básica de diversas alterações hematológicas.
Os sinais e sintomas ocorrem em aproximadamente 60% dos casos. São eles: astenia, mialgia, sonolência, tontura e sinais infecciosos de repetição. Os dados laboratoriais hematológicos mais relevantes são representados pelo aparecimento de neutropenia, leucopenia, eosinofilia, linfocitopenia, monocitopenia, macrocitose, pontilhado basófilo, pseudo Pelger e plaquetopenia.
O diagnóstico de benzenismo, de natureza ocupacional, é eminentemente clínico e epidemiológico, fundamentando-se na história de exposição ocupacional e na observação de sintomas e sinais clínicos e laboratoriais descritos anteriormente.
Entende-se como exposição ocupacional a exposição acima de níveis populacionais, decorrente de atividades laborais.
Em pessoas potencialmente expostas ao benzeno, todas as alterações hematológicas devem ser valorizadas, investigadas e justificadas.
A toxicidade do benzeno pode ser aguda ou crônica. Em cada um desses casos há sinais e sintomas clínicos que descreveremos a seguir:
Efeitos Agudos: O benzeno é um irritante moderado das mucosas e sua aspiração em altas concentrações pode provocar edema pulmonar. Os vapores são, também, irritantes para as mucosas oculares e respiratórias.
A absorção do benzeno provoca efeitos tóxicos para o sistema nervoso central, causando, de acordo com a quantidade absorvida, narcose e excitação seguida de sonolência, tonturas, cefaléia, náuseas, taquicardia, dificuldade respiratória, tremores, convulsões, perda da consciência e morte.
Efeitos Crônicos: Principais Agravos À Saúde
Alterações Hematológicas: Vários tipos de alterações sangüíneas, isoladas ou associadas, estão relacionadas à exposição ao benzeno. Em virtude da lesão do tecido da medula óssea (local de produção de células sangüíneas), essas alterações correspondem, sobretudo, a hipoplasia, displasia e aplasia.
O aparecimento de macrocitose, pontilhado basófilo, hiposegmentação dos neutrófilos (pseudo Pelger), eosinofilia, linfocitopenia e macroplaquetas são alterações precocemente apreciadas na toxicidade benzênica.
A hipoplasia da medula óssea pode ocasionar, no sangue periférico, citopenia(s). A leucopenia com neutropenia corresponde à principal repercussão hematológica da hipoplasia secundária ao benzeno e, em menor freqüência, à plaquetopenia isolada ou associada à neutropenia. Estudos realizados em medula óssea de trabalhadores com benzenismo evidenciaram a relação entre a neutropenia periférica e a hipoplasia granulocítica, numa mediana de quatro anos de exposição. Estudo posterior, realizado com a mesma coorte de pacientes, após o afastamento da exposição, demonstrou um tempo médio de 5 anos para a recuperação hematológica periférica.
A aplasia da medula óssea, que corresponde à depressão de todas as linhagens hematológicas, expressa-se no sangue periférico através de pancitopenia (leucopenia, plaquetopenia e anemia).
O caráter leucemogênico do benzeno é amplamente reconhecido. As transformações leucêmicas, precedidas ou não por alterações mielodisplásicas, são objeto de diversas publicações, sendo a leucemia mielóide aguda, entre todas, a mais freqüente. Outras variantes são também descritas.
Além de leucemogênica, a toxicidade por benzeno está também relacionada ao surgimento de outras formas de doenças oncohematológicas, como linfoma não-Hodgkin, mieloma múltiplo e mielofibrose, embora em menor freqüência.
Alterações Neuro-Psicológicas e Neurológicas: São observadas alterações como: atenção, percepção, memória, habilidade motora, viso-espacial, viso-construtiva, função executiva, raciocínio lógico, linguagem, aprendizagem e humor.
Além dessas disfunções cognitivas, surgem outras alterações como: astenia, cefaléia, depressão, insônia, agitação e alterações de comportamento.
São também descritos quadros de polineuropatias periféricas e mielites transversas.
No sistema auditivo podem aparecer alterações periféricas como centrais, podendo ser observadas: perdas auditivas neurossensoriais, zumbidos, vertigens e dificuldades no processamento auditivo.
Outras Alterações: Foram observadas alterações cromossômicas numéricas e estruturais em linfócitos e células da medula óssea de trabalhadores expostos ao benzeno. É possível fazer avaliação de danos cromossomiais através de técnicas citogenéticas.
Podem ocorrer alterações dermatológicas tais como eritema e dermatite irritativa de contato por exposições ocupacionais repetidas e prolongadas ao benzeno.
Outras formas de câncer podem ser observadas devido a associação da exposição do benzeno com gás de coqueria e de vazamentos em indústrias que manipulam correntes de naftas ou produtos petroquímicos.
4.1.3 - Parâmetros Clínico-Laboratoriais
Parâmetros Clínicos: Durante a condução diagnóstica dos casos suspeitos de leucopenia secundária à toxicidade benzênica, alguns fatores devem ser considerados: as enfermidades ou as situações clínicas e fisiológicas que cursam com leucopenia, como, por exemplo, colagenoses, viroses, alcoolismo, exposição a medicamentos e a outros agentes mielotóxicos devem ser investigadas. As neutropenias constitucionais e as situações anteriormente descritas devem ser objeto de análise sistemática, sem, contudo, permitir que sua comprovação seja suficiente para afastar a hipótese de associação com a toxicidade benzênica, (veja principais causas de leucopenias no quadro 1).
QUADRO 1
PRINCIPAIS CAUSAS LEUCOPENIA:
| Infecciosas | Virais | Gripe, Mononucleose, Hepatite, CMV, Sarampo Rubéola, Dengue, HIV e Febre Amarela |
| Bacterianas | Tuberculose, Febre Tifóide, Septicemia e Brucelose. | |
| Outras | Histoplasmose, Sífilis, Ricketsioses, Psitacose, Malária e Calazar | |
| Esplenomegalias | Hepatopatia Crônica, Hepatopatia Alcoólica, Esquistosomose, Esplenomegalia Congestiva, Doença de Gaucher eSíndrome de Felty | |
| Imunológicas | LES, Artrite Reumatóide, Periarterite Nodosa, Outras Colagenoses, Doença Hemolítica Auto-Imune e ChoqueAnafilático | |
| Outras | Pseudoneutropenia, Desnutrição, Hipervitaminose A e Alcoolismo | |
| AgentesLeuco Penizantes | Regulares | Colchicina, Irradiação, Citostáticos e Benzeno |
| Ocasionais | Analgésicos, Antibióticos, Anticonvulsivantes, Sais de Ouro, Tranqüilizantes, Antitiroidianos, Diuréticos, Hipoglicemiantes, Antimaláricos, Anti-Histamínicos, Tuberculostáticos, Sulfonamidas e Barbitúricos. | |
| Alterações da Medula Óssea | Infiltração | Metástase, Linfoma e Necrose MO |
| Deficiências | Ferro, Vitamina B12, Vitamina B6 e Ácido Fólico | |
| Alteração do Parênquima | Leucemias, Síndrome Mielodisplásica, Síndrome de Fanconi, Hemoglobinúria Paroxística Noturna, Anemia Aplástica Idiopática, Neutropenia Cíclica Familiar, Hipoplasia Crônica e Agranulocitose Infantil | |
Por outro lado, uma série histórica evidenciando valores leucocitários baixos e constantes, na ausência de exames pré-admissionais, não deve ser suficiente para afastar neutropenia secundária ao benzenismo; o caso deve, portanto, permanecer em investigação.
Uma criteriosa análise do quadro clínico é insubstituível. Para se ter uma visão panorâmica, não se deve considerar apenas os resultados de exames, devendo ser valorizada também, a história ocupacional.
Hemograma: O hemograma é um dos principais instrumentos laboratoriais para detecção de alterações tardias da hematopoese em casos de toxicidade crônica por benzeno. Deve ser realizado pelo método automático com hemocitoscopia criteriosa. Deve-se salientar que a coleta deve ser realizada, na ausência de jejum.
Os valores referenciais para fins de análise devem ser os do próprio indivíduo em período prévio à exposição a qualquer agente mielotóxico. Do ponto de vista prático, caso seja desconhecido, admite-se como supostamente anormal toda leucopenia que, após ampla investigação, nenhuma causa reativa possa ser apontada que a justifique.
Os resultados de hemogramas devem ser organizados na forma de série histórica de forma a permitir a comparação sistemática e permanente dos dados e análise de alterações eventuais ou persistentes.
Deve-se salientar que todos os trabalhadores expostos ao benzeno, portadores de leucopenia isolada ou associada à outra alteração hematológica, são, a princípio, suspeitos de serem portadores de lesão da medula óssea mediada pelo benzeno. A partir desse ponto de vista, na ausência de outra causa, a leucopenia deve ser atribuída à toxicidade por essa substância.
Outros Exames: A análise clínica dos casos suspeitos deve nortear os passos seguintes até a conclusão destes. Pode ser necessária a realização de uma grande variedade de exames, como punção aspirativa e, ou biópsia de medula óssea, estudos citogenéticos, entre outros que ficam a critério de especialista.
4.1.4 - Protocolo de Investigação de Casos Suspeitos:
O protocolo de investigação de dano em expostos ao benzeno deve conter as seguintes informações e procedimentos:
a) História Clínica Atual e Pregressa, incluindo a investigação de exposição a agentes mielotóxicos (medicamentos, radiação ionizante, entre outros), interrogatório dos diversos aparelhos, antecedentes pessoais e familiares e exame físico completo;
b) História Ocupacional Atual (antecedentes profissionais) com informação sobre as empresas, setores, funções, tarefas e respectivos períodos de trabalho;
c) Levantamento dos Dados Hematológicos de que dispõe o trabalhador, inclusive os anteriores à admissão na empresa suspeita de causadora da toxicidade;
d) Exames Complementares:
- Hemograma com análise quantitativa e qualitativa das três séries sangüíneas e contagem de reticulócitos. Na ausência da série histórica, realizar três hemogramas com intervalo de 15 dias.
- Transaminases (AST e ALT), gama glutamil transferase, bilirrubinas totais e frações e LDH.
- Provas de atividades reumáticas ou inflamatórias: VHS, Proteína C reativa e FAN.
- Marcadores de Hepatite B e C (anti-HBS Ag, anti-HBc - IgM e anti-HCV).
- Anti-HIV.
e) Estudo da Medula Óssea (Biópsia de medula óssea e mielograma) - sempre que indicados clinicamente;
f) Outros Exames - poderão ser solicitados, de acordo com o exame clínico; e
g) Outras Investigações:
- Avaliação Sobre o Sistema Nervoso Central - Avaliação de queixas neuropsicológicas e neuropsiquiátricas, efeitos ototóxicos e alterações citogenéticas deverão ser realizados sempre que necessário.
- Avaliação Neuropsicológica / Neurocomportamental. É um instrumento para investigação dos efeitos que à exposição a substâncias neurotóxicas produz sobre os processos psíquicos no homem. Objetiva estabelecer a presença ou não de disfunção cognitiva e distúrbios afetivos e localizar alterações sutis, a fim de detectar as disfunções ainda em estágios iniciais.
- O benzeno, como os solventes, pode causar distúrbios de memória de curto prazo, raciocínio e resoluções de problemas, execução de tarefas viso-construtivas ou verbais e habilidade de planejar.
- A avaliação das alterações neuropsicológicas é feita por meio de bateria de testes específicos, padronizados e de entrevista clínica.
- Avaliação Neurológica - Para investigar os efeitos da exposição ao benzeno, bem como a solventes orgânicos no sistema auditivo, o uso de exames convencionais como a audiometria tonal por via aérea e óssea e a audiometria vocal podem não ser suficientes.
- O emprego de outros testes audiológicos como imitanciometria, exame vestibular, otoemissão acústica, audiometria de tronco cerebral e provas de processamento auditivo são importantes para complementar informações sobre o topodiagnóstico da lesão.
4.1.5 - Conclusão Diagnóstica:
O diagnóstico diferencial da intoxicação crônica pelo benzeno deverá ser conduzido pelo médico clínico responsável de acordo com o que lhe parecer adequado.
Do Caso Para Ser Investigado:
Critérios Para Iniciar a Investigação do Caso de Toxicidade Crônica do Benzeno - Alterações Hematológicas:
Para o reconhecimento de casos que serão investigados, deverão ser evidenciadas as seguintes situações em indivíduos expostos ocupacionalmente ao benzeno.
Embora estejam explícitos somente os critérios de alteração nos valores da contagem de leucócitos totais, todas as alterações hematológicas, consideradas relevantes, devem ser valorizadas e investigadas.
Constatação de alterações hematológicas - Instalação de leucopenia. Para análise da leucometria, recomenda-se:
4.1.5.1 - Para Trabalhadores sem História de Exposição:
A média de 3 hemogramas realizados com intervalo de 15 dias, sendo o primeiro realizado no processo de admissão no emprego. Esse será o parâmetro de comparação para verificação da instalação de leucopenia.
4.1.5.2 - Para Trabalhadores Antigos:
- O exame admissional anterior à exposição a agentes mielotóxicos servirá como referência.
- Caso não se localize o exame referido no item anterior, deve-se utilizar a média da contagem de leucócitos dos hemogramas anteriores à instalação da tendência decrescente.
- Quando, em juízo profissional, não for possível usar os dois critérios acima, adotar os valores de referência de Williams 2001, valores fixos populacionais contidos na Tabela 1 do anexo 1A destas Normas.
Devem ser alvo de investigação os trabalhadores que apresentarem:
(1) QUEDA RELEVANTE E PERSISTENTE DA LEUCOMETRIA, constatada através de 3 (três) exames com intervalo de 15 (quinze) dias, com ou sem outras alterações associadas.
Um índice arbitrário de 20% de redução da leucometria poderá ser usado para considerar queda significativa em relação aos critérios anteriores. Essa taxa poderá ser reavaliada, baseada em novos estudos. Variações menores e a presença de outras alterações hematológicas devem ser consideradas, quando suspeitada sua relevância.
Observação: na análise de séries históricas consolidadas com grandes períodos de acompanhamento, deve ser considerado o patamar pré-exposição ou o mais próximo possível desse período.
(2) PRESENÇA DE ALTERAÇÕES HEMATOLÓGICAS EM HEMOGRAMAS SERIADOS, sem outros achados clínicos que as justifiquem, como:
- AUMENTO DO VOLUME CORPUSCULAR MÉDIO (macrocitose), diminuição do número absoluto de linfócitos (linfopenia ou linfocitopenia);
- LEUCOCITOSE PERSISTENTE;
- ALTERAÇÕES NEUTROFÍLICAS: Pontilhado basófilo, hipossegmentação dos neutrófilos (pseudo Pelger) ;
- PRESENÇA DE MACROPLAQUETAS;
- LEUCOPENIA COM ASSOCIAÇÃO DE OUTRAS CITOPENIAS (plaquetopenia).
DO CASO CONSIDERADO SUSPEITO
Considera-se CASO SUSPEITO de toxidade crônica por benzeno a presença de alteração hematológica relevante e sustentada. A relevância foi definida nos critérios anteriores e a sustentabilidade considerada mínima é definida após a realização de 3 hemogramas com intervalos de 15 dias entre eles. Nas situações em que persistem as alterações nesse tempo mínimo de 45 dias, considera-se o CASO SUSPEITO.
Deve ser iniciada investigação segundo item protocolo de investigação de caso suspeito destas Normas.
DO CASO CONFIRMADO DE TOXICIDADE CRÔNICA DO BENZENO
Ao se realizar a avaliação clínico-laboratorial do caso suspeito e confirmada a ausência de enfermidades concomitantes que possam acarretar tais alterações além da exposição ao benzeno, fica estabelecido o diagnóstico de benzenismo.
4.2 - Tratamento de Intoxicação Ocupacional pelo Benzeno
Não existe tratamento medicamentoso específico para os casos de intoxicação pelo benzeno.
O acompanhamento médico para os casos confirmados de intoxicação deve ser regular e em longo prazo. As intercorrências clínicas devem ser tratadas com precocidade. As perturbações de ordem psíquica e social causadas aos indivíduos devem merecer atenção especializada em programas de saúde integrados sob o enfoque do trabalho.
4.3 - Prognóstico de Intoxicação Ocupacional pelo Benzeno
4.3.1 - Os trabalhadores que apresentaram alterações hematológicas devido à exposição ao benzeno devem ser considerados suscetíveis ou hipersensibilizados, sendo maior o risco de agravamento do quadro, em especial o desenvolvimento de neoplasias.
4.3.2 - É possível a reversão do quadro hematológico periférico que pode ocorrer após um período longo do afastamento do risco. Porém, a reversão para a “normalidade” do quadro hematimétrico, no sangue periférico, não deve ser considerada como estado de cura.
Todas as pessoas expostas e que manifestaram alterações hematológicas devem ter acompanhamento médico, devendo seu posto de trabalho e sua atividades serem analisados, no sentido de serem afastadas da exposição ocupacional ao benzeno, utilizando-se para tal o anexo 2 como critério. Tal procedimento deve ser assegurado pela empresa e aprovado pelo órgão competente da fiscalização do ambiente de trabalho (MTE/DRT e SUS).
4.3.3 - A reversão das alterações periféricas para níveis hematimétricos normais não exclui a possibilidade de evolução para o agravamento, como a manifestação de hemopatias malignas ou anemia aplástica tardia.
4.3.4 - Mesmo após a remissão das alterações hematológicas periféricas ou de outras manifestações clínicas, os casos deverão ser acompanhados clínica e laboratorialmente de forma permanente, com periodicidade pelo menos anual, através da realização de exames complementares propostos em um protocolo de acompanhamento pelo órgão de referência do SUS.
4.3.5 - A normalização ou estabilidade dos valores hematimétricos do sangue periférico, após afastamento do ambiente de trabalho, não descaracteriza a intoxicação e nem constitui critério para retorno a um ambiente ou função com risco de exposição.
4.4 - Consequências do Afastamento
4.4.1 - Alterações Psicossociais: A condição de incapaz, ainda que temporária ou circunstancial, para o trabalho, pode acarretar sérios transtornos psicossociais a esses indivíduos, entre os quais destacamos:
- Perda da Identidade Psicossocial: o indivíduo perde a sua referência social, ao deixar de ocupar o lugar que lhe era socialmente conferido, o que acarreta a conseqüente perda da identidade psíquica. O indivíduo não sabe mais quem é, nem que lugar ocupa.
- Estigmatização: o indivíduo se sente marcado - cabe lembrar que a palavra estigma é sinônimo de ferrete, instrumento que era usado para marcar os escravos - pela sua condição de não trabalhador.
Essas alterações psicossociais características dos trabalhadores, configuram um quadro psicopatológico peculiar do afastamento, onde uma alteração orgânica - por exemplo, uma leucopenia, propicia o desenvolvimento de outra, de ordem psíquica, ou seja, a necessidade de afastamento desses trabalhadores de áreas contaminadas pelo benzeno, somada à especificidade da qualificação da maioria desses trabalhadores, o que os impossibilita de trabalharem em outra atividade econômica, faz com que, mesmo afastados, ou mais precisamente em virtude desse afastamento, se produza um adoecimento de natureza psicossocial.
4.5 - Prevenção:
Considerando-se as características do produto como toxicidade e carcinogenicidade, as ações preventivas são as que se apresentam como sendo de maior relevância na proteção da saúde. Assim, o ambiente e o processo de trabalho devem assegurar sempre a menor exposição ocupacional possível.
Medidas de proteção coletiva adotadas no processo de trabalho, minimizando a exposição ou eliminando o agente, e medidas de proteção individual contribuem decididamente na prevenção da intoxicação.
A avaliação quantitativa do nível de benzeno no ar, associada à avaliação individual da exposição e à análise do Índice Biológico de Exposição (IBE) em grupos homogêneos de risco de exposição, constituí ferramenta importante quando se objetiva a avaliação da exposição e a implantação de medidas de controle para diminuição e eliminação do risco (vide Instrução Normativa - IN-01 Acordo do Benzeno).
5. Procedimentos Operacionais
5.1.Procedimentos Administrativos: (Conforme o Acordo Nacional do Benzeno e normatizado na IN-02).
As empresas devem garantir ao trabalhador sob investigação de alteração do seu estado de saúde com suspeita de ser de etiologia ocupacional, os seguintes procedimentos:
- afastamento da exposição, de acordo com o anexo 2;
- emissão da CAT;
- encaminhamento ao INSS para avaliação previdenciária;
- encaminhamento ao SUS para investigação clínica e registro;
- custeio pleno de consultas, exames e pareceres necessários à elucidação diagnóstica de suspeita de danos à saúde provocados por benzeno;
- custeio pleno de medicamentos, materiais médicos, internações hospitalares e procedimentos médicos de tratamento de dano à saúde provocado por benzeno ou suas seqüelas e conseqüências; e
- desencadear ações imediatas de correção, prevenção e controle no ambiente, condições e processos de trabalho.
5.2 - Procedimento Retorno:
Consideram-se como área de retorno os critérios apresentados no anexo 2 devem ser notificados imediatamente as comissões regionais do Benzeno e, em caso da não existência dessas comissões, aos órgãos de vigilância da Saúde do Trabalhador e ao DRT para verificação do local de retorno.
5.3 - Procedimentos de Informação:
O Ministério da Saúde, a partir dos dados de cadastro de empresas da CNP-Bz, deverá encaminhar aos respectivos Estados a relação dessas empresas para fins de acompanhamento regional.
5.3.1 - Informações Decorrentes das Empresas:
Cabe aos serviços das empresas cadastradas no MTE encaminhar aos serviços de saúde do trabalhador de sua área de abrangência, em meio magnético padronizado pelo SIMPEAQ, anualmente, no mês de março:
- Nome e registro de trabalhadores com data de nascimento, sexo, função, setor de atividade e empresa em que está prestando serviço no caso de terceiros, com ou sem sinais e sintomas de benzenismo, afastados ou não do trabalho, incluindo os demitidos a contar de um período de 20 anos passados.
- A série histórica de hemogramas realizados em exames admissional, periódicos e demissional, anualmente, no mês de março, em meio magnético padronizado pelo SIMPEAQ.
- Cópia dos resultados das alterações clínicas e dos exames de indicador biológico de exposição realizados em exames periódicos e demissional, bem como avaliações citoquímicas, imunológicas, citogenéticas, histológicas, neuropsicológicas e neuropsiquiátricas, realizadas em trabalhadores expostos ao benzeno, em meio magnético padronizado pelo SIMPEAQ.
- Dados de monitorização ambiental do benzeno (exposição individual e de área; média ponderada pelo tempo, curta duração, instantâneas de emergência ou não) realizada nos diversos setores da empresa, a cada semestre.
- As informações de acidentes com vazamentos, em 24 horas, e o registro permanente de modificações operacionais e estruturais das plantas.
Observações:
- É de responsabilidade solidária de contratantes e contratadas o envio e a padronização das informações contidas nos itens 1 a 7.
- Os prontuários médicos dos trabalhadores e dos intoxicados devem ser mantidos à disposição daqueles, dos seus representantes legalmente constituídos e dos órgãos públicos por, no mínimo, 20 (vinte) anos após o desligamento do trabalhador.
5.3.2 - Informações Decorrentes de Outras Instâncias:
As instâncias e serviços que atuam na área de saúde do trabalhador deverão realizar a vigilância epidemiológica de morbimortalidade de casos de aplasia de medula e câncer do sistema hematopoético, ocorridos em maiores de 18 anos de idade. Esse sistema deve ser gerenciado pelos serviços de saúde do trabalhador responsáveis por cada região, que terão as seguintes atribuições:
- analisar dos os dados das companhias de seguros das empresas cadastradas no MTE relativas a estes dados;
- identificar regionalmente os serviços de hematologia e oncologia que notificarão, conforme ficha de notificação anexa, os serviços de saúde do trabalhador da região. Por sua vez, esses serviços de saúde do trabalhador deverão investigar o nexo com a exposição ao benzeno em cada um desses casos;
- os dados confirmados de nexo com a exposição ao benzeno deverão ser comunicados pelos serviços de saúde via SINAN.
Os laboratórios de análises clínicas deverão notificar ao responsável pela vigilância em saúde do trabalhador de sua área todos os resultados de indicadores biológicos de exposição do benzeno, anualmente, em meio magnético, conforme padronização pelo SIMPEAQ.
Todos os dados constantes do Sistema de Informação deverão ser analisados e compilados nos diversos níveis do sistema (região/Município, Estado, Ministério da Saúde) e gerenciados pelas comissões regionais de acompanhamento do acordo do benzeno. O Ministério da Saúde deverá fazer a publicação anual dos dados analisados e compilados a esse nível.
5.4. Procedimentos de Intervenção:
Os serviços de saúde do trabalhador realizarão a vigilância dos ambientes e processos de trabalho, compreendendo a análise, a investigação, a orientação, a fiscalização e a aplicação de penalidades nas empresas, por meio de inspeções sanitárias.
A notificação, a intimação, a autuação, a multa, a suspensão de atividades e a interdição seguirão legislação da área de abrangência do serviço, de acordo com as legislações e portarias pertinentes, tais como Códigos Sanitários, Lei nº 8080/90 e Portaria nº 3120/GM, de 1º de julho de 1998.
Critérios para priorização da vigilância dos ambientes de trabalho:
- estatísticas geradas pelos Sistemas de Informação (SINAN, SIMPEAQ entre outros);
- o não-cumprimento de qualquer norma estabelecida para o benzeno;
- denúncia de trabalhadores, meios de comunicação ou sociedades civis;
- solicitação do sindicato de trabalhadores; e
- investigações sistemáticas.
Os serviços de saúde do trabalhador deverão privilegiar na intervenção nos ambientes de trabalho:
Análise das informações existentes (atas de CIPA, ROAS, PPEOB, PPRA, PCMSO, programas de saúde, ambiente e segurança, informações de outras instituições).
Análise e observação das situações potenciais de risco.
Estabelecimento de propostas de eliminação, controle e redução de risco.
Participação dos trabalhadores e seus representantes em todas as etapas da intervenção.
Processos de discussão, de negociação e de formalização de acordos envolvendo empregadores, governo, trabalhadores e sociedade civil para estabelecimento de medidas de eliminação, controle e redução da exposição ao benzeno além do previsto na legislação.
Ações de integração interinstitucionais com o Ministério do Trabalho e Emprego, Ministério da Previdência Social, os Ministérios Públicos, as Secretarias de Meio Ambiente, e as Instituições de ensino e pesquisa, entre outras.
Os serviços de saúde do trabalhador deverão manter atualizado o cadastro das empresas de produção, utilização, manipulação, armazenamento ou transporte de benzeno na sua área de abrangência.
As instâncias estaduais do SUS deverão assessorar os serviços municipais e regionais de saúde do trabalhador nas ações de vigilância dos ambientes de trabalho e realizá-las em caráter complementar.
Deverão ser incentivadas a criação e as ações de instâncias regionais de acompanhamento do acordo nacional do benzeno.
O Ministério da Saúde estabelecerá estratégias de integração entre os pólos de vigilância visando o reforço da municipalização e à comunicação entre os níveis do sistema.
Valores de referência em hematologia:
TABELA 1: TABELA DE LEUCÓCITOS, SEGUNDO WILLIAMS - 6ª EDIÇÃO - 2001
| Idade | Leucócitos(X 10³/µL) | Neutrófilos(X 103/µL) | Eosinófilos(X 10³/µL) | Basófilos(X 10³/µL) | Linfócitos(X 10³/µL) | Monócitos(X 10³/µL) | |
| Segmentados | Bastões | ||||||
| 1 | 6.0 - 17.5 | 1.0 - 8.5 | 0,35 | 0,05 - 0,7 | 0 - 0,2 | 4,0 - 10,5 | 0,05 - 1,1 |
| 4 | 5.5 - 15.5 | 1.5 - 7.5 | 0 - 1,0 | 0,02 - 0,65 | 0 - 0,2 | 2,0 - 8,0 | 0 - 0,8 |
| 6 | 5.0 - 14.5 | 1.5 - 7.0 | 0 - 1,0 | 0 - 0,65 | 0 - 0,2 | 1,5 - 7,0 | 0 - 0,8 |
| 10 | 4.5 - 13.5 | 1.8 - 7.0 | 0 - 1,0 | 0 - 0,60 | 0 - 0,2 | 1,5 - 6,5 | 0 - 0,8 |
| 21 | 4.5 - 11.0 | 1.8 - 7.0 | 0 - 0,7 | 0 - 0,45 | 0 - 0,2 | 1,0 - 4,8 | 0 - 0,8 |
VARIAÇÕES DOS VALORES DOS HEMOGRAMAS:
TABELA 2: DIFERENÇAS ÉTNICAS NO HEMOGRA, SEGUNDO WILLIAMS - 6ª EDIÇÃO - 2001
| Homens | Mulheres | |||||
| Caucasianos | Afrocaribenhos | Africanos | Caucasianos | Afrocaribenhos | Africanos | |
| Leucometria(X 10³/µL) | 5,7 (3,6 - 9,2) | 5,2 (2,8 - 9,5) | 4,5 (2,8 - 7,2) | 6,2 (3,5 - 10,8) | 5,7 (3,3 - 9,9) | 5,0 (3,2- 7,8) |
| Neutrófilos(X 10³/µL) | 3,2 (1,7 - 6,1) | 2,5 (1,0 - 5,8) | 2,0 (0,9 - 4,2) | 3,6 (1,7 - 7,5) | 3,0 (1,4 - 6,5) | 2,4 (1,3 - 4,2) |
| Linfócitos(X 10³/µL) | 1,7 (1,0 - 2,9) | 1,9 (1,0 - 3,6) | 1,8 (1,0 - 3,2) | 1,8 (1,0 - 3,5) | 2,0 (1,2 - 3,4) | 2,0 (1,1 - 3,6) |
| Monócitos(X 10³/µL) | 0,34 (0,18 - 0,62) | 0,33 (0,18 - 0,52) | 0,29 (0,15 - 0,58) | 0,30 (0,14 - 0,61) | 0,31 (0,16 - 0,59) | 0,28 (0,15 - 0,39) |
| Eosinófilos(X 10³/µL) | 0,12 (0,03 - 0,48) | 0,13 (0,03 - 0,58) | 0,12 (0,02 - 0,79) | 0,13 (0,04 - 0,44) | 0,10 (0,03 - 0,33) | 0,10 (0,02 - 0,41) |
| Plaquetas(X 10³/µL) | 218 (143 - 332) | 196 (122 - 313) | 183 (115 - 290) | 246 (169 - 358) | 236 (149 - 374) | 207 (125 - 342) |
TABELA 3: DIFERENÇAS ÉTNICAS E DE HORÁRIO DE COLETA NO HEMOGRA, SEGUNDO WINTROBE - 10ª EDIÇÃO - 1999.
HOMENS ADULTOS
| Horário de coleta | Europeus Caucasianos Idade média 25 9:30-11:30/ 14:30-16/30 |
Americanos Caucasianos 16-44 anos Antes do meio dia ou à tarde próximo ao meio dia |
Afroamericanos Antes do meio dia ou à tarde próximo ao meio dia |
Africanos 09:00-12:00 |
|
| Leucometria(X 10³/µL) | 3,487-9,206 | 3,722-9,828 | 4,550-10,100 | 3,600-10,200 | 2,587-9,075 |
| Neutrófilos(X 10³/µL) | 1,539-5,641 | 1,775-6,508 | 2,050-6,800 | 1,300-7,400 | 0,775-4,131 |
| Linfócitos(X 10³/µL) | 1,500-4,000 | 1,450-3,750 | 1,012-3,876 | ||
| Monócitos(X 10³/µL) | 0,220-0,950 | 0,210-1,050 | 0,062-0,688 | ||
| Eosinófilos(X 10³/µL) | 0,030-0,860 | 0,030-0,720 | 0,047-3,371 | ||
Nota: Os valores das tabelas 1, 2 e 3 demonstram que as variações são diferentes segundo a base populacional e as variabilidades decorrentes de métodos de coleta diversificados. Cabe destacar a necessidade de serem estabelecidos valores a partir da experiência brasileira e que estes deverão estar disponíveis assim que forem definidos.
ANEXO LXIX
CRITÉRIOS DE RETORNO DE TRABALHADORES AFASTADOS DO TRABALHO POR AGRAVOS À SAÚDE DECORRENTES DA EXPOSIÇÃO AO BENZENO (Origem: PRT MS/GM 776/2004, Anexo 2)
CRITÉRIOS DE RETORNO DE TRABALHADORES AFASTADOS DO TRABALHO POR AGRAVOS À SAÚDE DECORRENTES DA EXPOSIÇÃO AO BENZENO
1 - Objetivo: Definir parâmetros para o retorno seguro de trabalhadores afastados por agravos à saúde decorrentes da exposição ao benzeno.
2 - Critérios: O local de trabalho deve ser avaliado quanto aos seguintes critérios:
- avaliação da exposição - qualitativa e quantitativa; e
- avaliação epidemiológica de agravos à saúde dos trabalhadores.
3 - Critérios de Avaliação da Exposição:
Qualitativa: O trabalhador em situação de retorno, independentemente da área ou setor para onde for lotado, não deve participar de atividades que representam risco de exposição acima de 0.1 ppm, tais como (lista exemplificativa):
Paradas, emergências, vazamentos;
Leitura de nível de tanque com trena (e temperatura);
Transferências e carregamento de produtos;
Comando de evasões;
Coletas de amostras de produtos, insumos, matérias-primas, etc., para fins de controle de qualidade de processo;
Limpeza de equipamentos;
Acompanhamento de serviços de manutenção ou de liberação de equipamentos;
Atividade envolvendo outros mielotóxicos; e
A empresa deve possuir procedimento escrito que garanta o cumprimento deste critério e deve orientar seus trabalhadores quanto a esse procedimento.
Quantitativa: O trabalhador somente poderá ser lotado em área ou setor onde esteja ocorrendo controle rigoroso das concentrações de benzeno, de acordo com a IN-01.
Os resultados de avaliação da concentração de benzeno na área e na atividade não devem ultrapassar 0,1 ppmv MPT.
Para avaliação da conformidade com o valor de referência para retorno (0,1 ppm), serão considerados os resultados das concentrações obtidas no processo de avaliação realizado pela empresa, devendo ser submetidos à avaliação e validação das autoridades públicas competentes, TEM e/ou SUS, tanto o processo de coleta e análise quanto os valores obtidos.
4 - Critério de Avaliação Epidemiológica:
Realizar comparação das séries históricas de hemogramas de pelo menos 30 trabalhadores do setor/atividade escolhida para o retorno. Analisar a existência de casos de alterações hematológicas possivelmente relacionadas ao benzeno. Quando o setor tiver menos que 30 trabalhadores, considerar a população total dos trabalhadores do setor e a sua história epidemiológica para agravos à saúde decorrentes da exposição ao benzeno. É recomendado que o (s) grupos (s) homogêneos (s) de referência para avaliação seja (m) constituído (s) por empregados com cinco anos ou mais na atividade ou local de trabalho.
Na ocorrência de pelo menos um caso de diminuição persistente de, no mínimo, 20% da média dos parâmetros hematológicos considerados pela IN-02, sem justificativa clínica, deve ser caracterizada a existência de suspeitos de mielotoxidade ocupacional no grupo avaliado.
A presença de suspeitos de mielotoxicidade no setor ou atividade implica setor inadequado para o retorno do trabalhador.
Observações:
Caso o empregado tenha sido remanejado de área com exposição, o seu histórico deve ser avaliado à luz das atividades na nova área.
Na ausência de série histórica, recomenda-se a utilização dos seguintes parâmetros:
- realização do indicador biológico adotado pela empresa para avaliação de exposições a benzeno até 1 ppm (ácido trans, trans - mucônico urinário, por exemplo) no (s) grupo(s) homogêneo (s) de referência;
- comparação do hemograma atual com o exame admissional; e
- na ausência de exame admissional deve ser considerado como referência o critério de Williams (IN-02) para avaliação.
Validação: O GTB deverá participar do processo de seleção das áreas/atividades para o retorno dos trabalhadores, observando o item 9.7.1 nos casos de discordância.
A liberação da área/atividade para retorno deverá ser realizada pelas autoridades competentes na área de saúde e segurança.
ANEXO LXX
FICHA DE NOTIFICAÇÃO DE ELEVAÇÃO DO INDICADOR BIOLÓGICO DE EXPOSIÇÃO DO BENZENO ACIMA DA NORMALIDADE (Origem: PRT MS/GM 776/2004, Anexo 3)
Ficha de notificação de elevação do indicador biológico de exposição do benzeno acima da normalidade:
| Nome da empresa | |
| Endereço | |
| Município | Estado |
| CEP | Tel.: |
| Data da anormalidade verificada: | |
| Tipo de indicador biológico de exposição utilizado | |
| Valor encontrado | Valor de normalidade |
| Nome do trabalhador | |
| Função do trabalhador | |
| Setor de atividade | |
| Atividade realizada previamente o achado de anormalidade | |
| Investigações proferidas ao caso para sua avaliação pelo setor competente | |
| Nome dos demais trabalhadores envolvidos nesta mesma atividade | |
| Condutas estabelecidas para os trabalhadores envolvidos na atividade de risco | |
| Condutas estabelecidas ou a serem estabelecidas no ambiente de trabalho para melhoria das condições de exposição ao benzeno | |
| Observações | |
| Data - __/__/__ | Assinatura do profissional responsável carimbo legível |
ANEXO LXXI
SIGLAS (Origem: PRT MS/GM 776/2004, Anexo 4)
Siglas:
Anti-HBs Ag - marcador da Hepatite B
Anti-HBc -IgM - marcador da Hepatite B
BMO - Biópsia de Medula Óssea
CAS - Código Internacional de Substâncias Químicas
CAT - Comunicação de Acidente de Trabalho
CMV - Citomegalovirus
DRT - Delegacia Regional do Trabalho
FAN - Fator Anti-Nuclear
HIV - Virus da Síndrome de Imunodeficiência Adquirida
HCV - Vírus da Hepatite C
IBE - Indicador Biológico de Exposição
IgM - Imunoglobulina M
INSS - Instituto Nacional de Seguridade Social
MO - Medula Óssea
MS - Ministério da Saúde
MTE - Ministério do Trabalho e Emprego
LES - Lupus Eritematoso Sistêmico
ONU - Organização das Nações Unidas
PCMSO - Plano de Controle Médico de Saúde Ocupacional
PPEOB - Plano de Prevenção da Exposição Ocupacional ao Benzeno
PPRA - Plano de Prevenção de Riscos Ambientais
SIMPEAQ - Sistema de Informações de Populações Expostas a Agentes Químicos
SUS - Sistema Único de Saúde
VHS - Velocidade de Hemossedimentação
ANEXO LXXII
NORMAS PARA CADASTRAMENTO DE TRABALHADORES EXPOSTOS E EX-EXPOSTOS AO ASBESTO/AMIANTO (Origem: PRT MS/GM 1851/2006, Anexo 1)
ANEXO
NORMAS PARA CADASTRAMENTO DE TRABALHADORES EXPOSTOS E EX-EXPOSTOS AO ASBESTO/AMIANTO
Empresa:_________________________________________________
Endereço: ________________________________________________
CNPJ:_____________TEL.:__________FAX: _________________
Ramo de Atividade: ___________________________CNAE: ______
Nome do trabalhador:_______________________________________
Data de Nascimento:___/___/___ Sexo:___Nome da Mãe__________
Cartão SUS(opcional): ________________CPF:_________________
RG:_______________Órgão emisor:__________________________
Endereço:_____________________Cidade: _______ Estado: ______
Setor: _________________Cargo: ____________________________
Ocupação: ___________CBO:____________________________
Data de Admissão: ____/____/___
Em caso de trabalhador ex-exposto Data Demissão: ____/____/____
Exames:
1. Radiografia de tórax
| Data | Nº | Resultado |
2. Prova de Função Pulmonar (Espirometria)
| Data: __/__/__ | Predito | Medido | % | Limite Inferior da Normalidade |
| CVF | ||||
| VEF1/CVF | ||||
| FEF 25-75% |
Diagnóstico:________________________________________________________________________________________________
________________________________________________________________________________________________________________
Outras informações:__________________________________________________________________________________________
________________________________________________________________________________________________________________
Responsável pelo preenchimento: ______________________________________________________________________________
Nome completo e RG ou CRM: ________________________________________________________________________________
ANEXO LXXIII
PROGRAMA TELESSAÚDE BRASIL - TIPOS DE ESTABELECIMENTO E DESCRIÇÕES DE SERVIÇO (Origem: PRT MS/GM 2546/2011, Anexo 1)
TABELA 1
| CÓD. | TIPO DE ESTABELECIMENTO | CÓD. | SUBTIPOS |
| 75 | TELESSAÚDE | 75.1 | NÚCLEO TÉCNICO-CIENTÍFICO DO PROGRAMA NACIONAL TELES-SAÚDE BRASIL REDES |
| 75.2 | UNIDADE DE TELESSAÚDE |
TABELA 2
| CÓD SERV | DESCRIÇÃO DO SERVIÇO | CÓD CLASS | DESCRIÇÃO DA CLASSIFICAÇÃO | GRUPO | CBO | DESCRIÇÃO |
| 160 | TELECONSULORIA | 001 | TELECONSULTORIA ASSÍNCRONA | 1 | 2251* | MÉDICOS CLÍNICOS |
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 002 | TELECONSULTORIA SÍNCRONA | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253* | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234* | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIROS | ||||
| 8 | 2236* | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 003 | SEGUNDA OPINIÃO FORMATIVA | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253* | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234* | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIROS | ||||
| 8 | 2236* | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS |
* Qualquer CBO dentro desta família de CBO.
TABELA 3
| CÓD SERV | DESCRIÇÃO DO SERVIÇO | CÓD CLASS | DESCRIÇÃO DA CLASSIFICAÇÃO | GRUPO | CBO | DESCRIÇÃO |
| 107 | SERVIÇO DE ATENÇÃO À SAÚDE AUDITIVA | 007 | DIAGNÓSTICO EM AUDIOLOGIA/OTOLOGIA POR TELEMEDICINA | 1 | 2252-75 | MÉDICO OTORRINOLARINGOLOGISTA |
| 2 | 2238-10 | FONOAUDIOLÓGO | ||||
| 3 | 2251-24 | MÉDICO PEDIATRA | ||||
| 122 | SERVIÇO DE DIAGNÓSTICO POR MÉTODOS GRÁFICOS DINÂMICOS | 011 | POTENCIAIS EVOCADOS | 1 | 2251-12 | MÉDICO NEUROLOGISTA |
| 2 | 2238-10 | FONOAUDIÓLOGO | ||||
| 3 | 2252-75 | MÉDICO OTORRINOLARINGOLOGISTA | ||||
| 012 | POTENCIAIS EVOCADOS POR TELEMEDICINA | 1 | 2251-12 | MÉDICO NEUROLOGISTA | ||
| 2 | 2238-10 | FONOAUDIÓLOGO | ||||
| 3 | 2252-75 | MÉDICO OTORRINOLARINGOLOGISTA |
ANEXO LXXIV
NÚMERO DE HOSPITAIS PARA RECEBIMENTO DO INTEGRASUS (Origem: PRT MS/GM 878/2002, Anexo 1)
| UF | Nº de Hospitais previstos para recebimento do INTEGRASUS Níveis B e C | Nº de Hospitais Filantrópicos Estratégicos sem FIDEPS - Nível C | Nº de Hospitais elegíveis pelo Gestor Estadual - Nível B |
| ACRE | 2 | 0 | 2 |
| ALAGOAS | 4 | 1 | 3 |
| AMAPÁ | 2 | 0 | 2 |
| AMAZONAS | 4 | 0 | 4 |
| BAHIA | 11 | 2 | 9 |
| CEARÁ | 10 | 3 | 7 |
| DISTRITO FEDERAL | 0 | 0 | 0 |
| ESPÍRITO SANTO | 5 | 2 | 3 |
| GOIÁS | 7 | 1 | 6 |
| MARANHÃO | 4 | 0 | 4 |
| MATO GROSSO | 4 | 2 | 2 |
| MATO GROSSO DO SUL | 4 | 2 | 2 |
| MINAS GERAIS | 15 | 8 | 7 |
| PARÁ | 4 | 0 | 4 |
| PARAÍBA | 4 | 0 | 4 |
| PARANÁ | 13 | 3 | 10 |
| PERNAMBUCO | 7 | 0 | 7 |
| PIAUÍ | 4 | 0 | 4 |
| RIO DE JANEIRO | 10 | 3 | 7 |
| RIO GRANDE DO NORTE | 4 | 1 | 3 |
| RIO GRANDE DO SUL | 13 | 1 | 12 |
| RONDÔNIA | 3 | 0 | 3 |
| RORAIMA | 0 | 0 | 0 |
| SANTA CATARINA | 12 | 10 | 2 |
| SÃO PAULO | 47 | 20 | 27 |
| SERGIPE | 3 | 1 | 2 |
| TOCANTINS | 4 | 2 | 2 |
| TOTAL | 200 | 62 | 138 |
Obs: Os gestores deverão descontar do número de hospitais elegíveis os já habilitados pelo INTEGRASUS I, constantes do Anexo III.
ANEXO LXXV
HOSPITAIS ESTRATÉGICOS - INTEGRASUS NIVEL C (Origem: PRT MS/GM 878/2002, Anexo 2)
| UF | Município | CGC | Nome | Valor Mensal (R$) |
| AL | MACEIÓ | 12291290000159 | FUNDACAO HOSPITAL AGRO-INDUSTRIA DO ACUCAR DE ALAGOAS | 83.678,06 |
| BA | ITABUNA | 14349740000304 | SANTA CASA DE MISERICORDIA DE ITABUNA HOSPITAL MANOEL NOVAES | 56.539,30 |
| BA | SALVADOR | 13926639000144 | FUNDACAO MONTE TABOR / HOSPITAL SAO RAFAEL | 42.477,14 |
| CE | BARBALHA | 03284505000113 | HOSP. MAT. SÃO VICENTE DE PAULO | 37.049,99 |
| CE | QUIXADÁ | 07718372000105 | SOCIED Q E A A M INF H MATERNIDADE | 20.177,96 |
| CE | SOBRAL | 07818313000109 | SANTA CASA DE MISERICORDIA DE SOBRAL | 172.588,30 |
| ES | CACHOEIRO DE ITAPEMIRIM | 27187087000104 | SANTA CASA DE MISERICORDIA DE CACHOEIRO DE ITAPEMIRIM | 42.314,95 |
| ES | VITÓRIA | 28137925000106 | AFECC - HOSPITAL SANTA RITA DE CASSIA | 49.629,80 |
| GO | ITUMBIARA | 02198539000122 | HOSMAT SAO MARCOS | 19.124,47 |
| MG | CARANGOLA | 19274091000181 | CASA DE CARIDADE DE CARANGOLA | 57.717,05 |
| MG | DIVINÓPOLIS | 20146064000102 | FUNDACAO GERALDO CORREA HOSPITAL SAO JOAO DE DEUS | 128.510,33 |
| MG | IPATINGA | 19878404000100 | FUNDACAO SÃO FRANCISCO XAVIER HOSPITAL MARCIO CUNHA | 162.172,42 |
| MG | BELO HORIZONTE | 17214149000176 | FUNDACAO FELICE ROSSO HOSPITAL FELICIO ROCHO | 59.365,20 |
| MG | JUIZ DE FORA | 21575709000195 | SANTA CASA DE MISERICORDIA DE JUIZ DE FORA | 205.603,85 |
| MG | MONTES CLAROS | 22669931000110 | IRMANDADE N SRA MERCES SANTA CASA CARIDADE MONTES CLAROS | 210.450,72 |
| MG | PONTE NOVA | 26150979000178 | FUNDACAO FILANTROPICA E BENEF DE SAUDE ARNALDO GAVAZZA FILHO | 35.444,66 |
| MG | TEÓFILO OTÓN | 25104902000107 | ASSOC HOSSTA ROSALIA | 72.575,24 |
| MS | DOURADOS | 03604782000166 | ASSOCIACAO BENEFICENTE DOURADENSE/HOSEVAN DR E SRA G KING | 108.235,44 |
| MS | TRÊS LAGOAS | 03873593000199 | SOC BENEF DO HOSN SRA AUXILIADORA HOSN SRA AUXILIADORA | 44.769,93 |
| MT | CUIABÁ | 03468485000130 | SOCIEDADE DE PROTECAO A MATERNIDADE E A INFANCIA DE CUIABA | 87.557,25 |
| MT | RONDONÓPOLIS | 03099157000104 | SANTA CASA M E MATER DE RONDONOPOLIS | 70.136,80 |
| PR | APUCARANA | 76578137006392 | PROV B DA C I F C S VICENTE DE PAULO HOSS VICENTE DE PAULO | 56.906,35 |
| PR | LONDRINA | 78614971000119 | IRMANDADE DA SANTA CASA DE LONDRINA | 160.732,95 |
| PR | SÃO JOSÉ DOS PINHAIS | 81308868000155 | HOSPITAL E MATERNIDADE DE SAO JOSE DOS PINHAIS | 55.438,45 |
| RJ | ANGRA DOS REIS | 28503308000179 | HOSPITAL E MATERNIDADE CODRATO DE VILHENA | 40.555,29 |
| RJ | ITAPERUNA | 29640612000120 | CONFERENCIA SÃO JOSE DO AVAI HOSPITAL SAO JOSE DO AVAI | 112.380,48 |
| RJ | RESENDE | 31460108000190 | ASSOCIACAO DE PROTECAO A MATERNIDADE E A INFANCIA DE RESENDE | 15.831,87 |
| RN | MOSSORÓ | 08256240000163 | ASSOC A A MAT INFANCIA MOSSORO | 43.125,75 |
| RS | CAXIAS DO SUL | 88633227000115 | PIO SODAL DAMAS CARIDADE MANTENEDORA HOSN S DE POMPEIA | 99.793,20 |
| SC | CHAPECÓ | 02122913000106 | CONSORCIO REGIONAL DE SAUDE DO HOSPITAL LENOIR V. FERREIRA | 105.560,01 |
| SC | CRICIUMA | 92736040000890 | HOSPITAL SÃO JOSÉ - SOCIEDADE CARITATIVA | 130.535,61 |
| SC | FLORIANÓPOLIS | 83884999000106 | IRMANDADE DO SENHOR JESUS DOS PASSOS E HOSPITAL DE CARIDADE | 51.395,28 |
| SC | ITAJAÍ | 60194990002200 | IPMMI-HOSPITAL E MATERNIDADE MARIETA KONDER BORNHAUSEN | 91.481,93 |
| SC | SÃO JOSÉ | 82951245001130 | INSTITUTO DE CARDIOLOGIA SÃO JOSÉ | 72.710,11 |
| SC | JOAÇABA | 84588391000105 | HOSPITAL SANTA TEREZINHA | 30.047,03 |
| SC | LAGES | 84942887000127 | HOSCAR NOSSA SENHORA PRAZER | 73.770,35 |
| SC | LAGES | 84947167000154 | ASSOCIACAO BENEFICENTE SEARA DO BEM | 26.345,38 |
| SC | RIO DO SUL | 73433427000157 | FUNDACAO DE SAUDE DO ALTO VALE DO ITAJAI | 57.453,67 |
| SC | TUBARÃO | 83883306001213 | SOC DIV PROV HOSPITAL NOSSA SRA DA CONCEICAO | 131.749,33 |
| SE | ARACAJU | 13016332000106 | FUNDACAO DE BENEFICENCIA HOSPITAL DE CIRURGIA | 116.646,71 |
| SP | ARAÇATUBA | 43751502000167 | SANTA CASA DE MIS DE ARACATUBA-HOSSAGRADO CORACAO DE JESUS | 162.376,83 |
| SP | ARARAQUARA | 43964931000112 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE ARARAQUARA | 99.514,69 |
| SP | ARARAS | 44215341000150 | IRMANDADE STA CASA MIS. DE ARARAS | 74.153,29 |
| SP | BARRETOS | 44782779000110 | SANTA CASA DE MISERICORDIA DE BARRETOS | 92.489,33 |
| SP | BAURU | 48374680000130 | ASSOCIACAO HOSPITALAR DE BAURU | 266.540,77 |
| SP | CAMPINAS | 46043980000100 | MATERNIDADE DE CAMPINAS | 62.184,24 |
| SP | FERNANDÓPOLIS | 47844287000108 | SANTA CASA MISERICORDIA DE FERNANDOPOLIS | 59.772,88 |
| SP | FRANCA | 47969134000189 | FUNDACAO CIVIL CASA DE MISERICORDIA DE FRANCA | 189.122,34 |
| SP | ITAPEVA | 49797293000179 | SANTA CASA DE MISERICORDIA DE ITAPEVA | 63.841,33 |
| SP | LIMEIRA | 51473692000126 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE LIMEIRA | 177.776,06 |
| SP | MARÍLIA | 52049244000162 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE MARILIA | 81.817,79 |
| SP | MOJI DAS CRUZES | 52543766000116 | SANTA CASA DE MISERICORDIA DE MOGI DAS CRUZES | 118.392,97 |
| SP | MOJI-GUAÇU | 52739950000136 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE MOGI GUACU | 64.912,78 |
| SP | PIRACICABA | 54370630000187 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE PIRACICABA | 116.269,91 |
| SP | PIRACICABA | 54384631000261 | ASSOC FORN CANA PIRACICABA SECCAO HOSPITAL | 78.770,51 |
| SP | PRESIDENTE PRUDENTE | 44860740000254 | ASSOCIACAO PRUDENTINA DE EDUCACAO E CULTURA APEC - HOSPITAL | 53.385,26 |
| SP | PRESIDENTE PRUDENTE | 55344337000108 | SANTA CASA DE MISERICORDIA DE PRESIDENTE PRUDENTE | 101.885,62 |
| SP | SANTOS | 58198524000119 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE SANTOS | 220.926,60 |
| SP | SÃO CARLOS | 59610394000142 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE SAO CARLOS | 90.045,80 |
| SP | SÃO PAULO | 61904678000193 | AMPARO MATERNAL | 79.222,20 |
| TO | ARAGUAÍNA | 01368232000160 | CASA DE CARIDADE DOM ORIONE | 78.388,52 |
| TO | ARAGUAÍNA | 24232886003778 | PRO-SAUDE - ASSOC. BENEF. DE ASSIST. SOCIAL E HOSPITALAR | 117.103,62 |
| Total | 5.687.471,95 | |||
ANEXO LXXVI
HOSPITAIS HABILITADOS PELO INTEGRASUS I - RECLASSIFICADOS COMO NÍVEL B (Origem: PRT MS/GM 878/2002, Anexo 3)
| UF | Município | CGC | Nome | Valor Mensal (R$) |
| AL | São Miguel Dos Campos | 12737680000100 | SANTA CASA DE MISERICORDIA DE SAO MIGUEL DOS CAMPOS | 43.000,00 |
| PE | Recife | 10667814000138 | FUNDACAO ALTINO VENTURA | 3.783,34 |
| RS | Ijui | 90730508000138 | ASSOCIACAO HOSPITAL DE CARIDADE IJUI | 94.050,94 |
| RS | Lajeado | 91162511000165 | SOC BENEF E CARIDADE DE LAJEADO | 49.638,85 |
| RS | Porto Alegre | 92713825000171 | SANATORIO BELEM | 90.900,99 |
| RS | Porto Alegre | 92740539000103 | SOCIEDADE PORTUGUESA DE BENEFICENCIA | 55.998,42 |
| RS | Santo Angelo | 96210471000101 | ASSOCIACAO HOSPITAL DE CARIDADE DE SANTO ANGELO | 46.444,97 |
| RS | São Borja | 96488598000189 | FUNDACAO IVAN GOULART HOSPITAL INFANTIL | 29.245,56 |
| RS | Torres | 88625686003504 | SEBS HOSPITAL BENEF.NOSSA SRA.NAVEGANTES | 26.294,73 |
| SP | Avaré | 44584019000106 | SANTA CASA DE MISERICORDIA DE AVARÉ | 27.085,29 |
| SP | Barretos | 49150352000112 | FUNDACAO PIO XII | 30.098,29 |
| SP | Campinas | 50046887000127 | CENTRO INF DE INVESTIGACOES HEMAT DR DOMINGOS A BOLDRINI | 22.209,76 |
| SP | Capivari | 46925111000100 | SANTA CASA DE MISERICORDIA DE CAPIVARI | 18.180,47 |
| SP | Cruzeiro | 47431697000119 | SANTA CASA DE MISRICORDIA DE CRUZEIRO | 21.597,05 |
| SP | Dracena | 47617584000102 | IRMANDADE DA SANTA CASA DE MISERICORDIA E MATERNIDADE DE DRACENA | 14.587,72 |
| SP | Jacareí | 50460351000153 | ASSOCIACAO CASA FONTE DA VIDA | 15.019,93 |
| SP | Jaú | 50753631000150 | IRMANDADE DE MISERICORDIA DE JAU | 52.062,60 |
| SP | Jundiaí | 50944198000130 | HOSPITAL DE CARIDADE SAO VICENTE DE PAULO | 88.595,17 |
ANEXO LXXVII
DO PROGRAMA FARMÁCIA POPULAR DO BRASIL (PFPB) (Origem: PRT MS/GM 111/2016)
Art. 1º Fica instituído o Programa Farmácia Popular do Brasil (PFPB). (Origem: PRT MS/GM 111/2016, Art. 1º)
CAPÍTULO I
DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 111/2016, CAPÍTULO I)
Art. 2º O PFPB consiste na disponibilização de medicamentos e/ou correlatos à população, pelo Ministério da Saúde, através dos seguintes meios: (Origem: PRT MS/GM 111/2016, Art. 2º)
I - a "Rede Própria", constituída por Farmácias Populares, em parceria com os Estados, Distrito Federal e Municípios; e (Origem: PRT MS/GM 111/2016, Art. 2º, I)
II - o "Aqui Tem Farmácia Popular", constituído por meio de convênios com a rede privada de farmácias e drogarias. (Origem: PRT MS/GM 111/2016, Art. 2º, II)
Parágrafo Único. O PFPB Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias, os medicamentos e correlatos previamente definidos pelo Ministério da Saúde, nos termos Anexo 1 do Anexo LXXVII . (Origem: PRT MS/GM 111/2016, Art. 2º, Parágrafo Único)
Art. 3º Para os efeitos deste Anexo, consideram-se as seguintes definições: (Origem: PRT MS/GM 111/2016, Art. 3º)
I - medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, que contém um ou mais fármacos juntamente com outras substâncias, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico; (Origem: PRT MS/GM 111/2016, Art. 3º, I)
II - correlato: a substância, produto, aparelho ou acessório não enquadrado nos conceitos de droga, medicamento ou insumo farmacêutico, cujo uso ou aplicação esteja ligado à defesa e proteção da saúde individual ou coletiva, à higiene pessoal ou de ambientes, ou a fins diagnósticos e analíticos, os cosméticos e perfumes, e, ainda, os produtos dietéticos, óticos, de acústica médica, odontológicos e veterinários; (Origem: PRT MS/GM 111/2016, Art. 3º, II)
III - documento fiscal: documento de emissão obrigatória que comprova a venda de mercadoria ou a prestação de serviços de acordo com a legislação vigente; (Origem: PRT MS/GM 111/2016, Art. 3º, III)
IV - cupom vinculado: documento não-fiscal emitido em papel por equipamento eletrônico adequado, nas operações realizadas pelo Programa; (Origem: PRT MS/GM 111/2016, Art. 3º, IV)
V - Denominação Comum Brasileira (DCB): denominação do fármaco ou princípio farmacologicamente ativo aprovada pelo órgão federal responsável pela vigilância sanitária; (Origem: PRT MS/GM 111/2016, Art. 3º, V)
VI - princípio ativo: substância quimicamente caracterizada, cuja ação farmacológica é conhecida e responsável total ou parcialmente pelos efeitos terapêuticos do medicamento; (Origem: PRT MS/GM 111/2016, Art. 3º, VI)
VII - Unidade de Produto (UP): fração unitária corresponde a uma unidade farmacotécnica do medicamento ou a fração unitária de produtos correlatos; (Origem: PRT MS/GM 111/2016, Art. 3º, VII)
VIII - Valor de Referência (VR): preço referencial fixado pelo Ministério da Saúde para cada princípio ativo e correlato constante do Programa e definido para cada unidade de produto (UP); (Origem: PRT MS/GM 111/2016, Art. 3º, VIII)
IX - Preço de Dispensação - Rede Própria (PD-RP):valor do medicamento e correlato fixado para as farmácias da rede própria do PFPB; (Origem: PRT MS/GM 111/2016, Art. 3º, IX)
X - Preço de Venda - Aqui Tem (PV-AT): valor do medicamento e correlato praticado pelas farmácias e drogarias no ato da venda ao paciente, inclusive com eventuais descontos; e (Origem: PRT MS/GM 111/2016, Art. 3º, X)
XI - Código de barras: código constante na embalagem do produto que indicam informações relevantes, tais como o fabricante e apresentação. (Origem: PRT MS/GM 111/2016, Art. 3º, XI)
CAPÍTULO II
DA OPERACIONALIZAÇÃO E DO FUNCIONAMENTO DO PFPB
(Origem: PRT MS/GM 111/2016, CAPÍTULO II)
Art. 4º Na "Rede Própria", a Fundação Oswaldo Cruz (FIOCRUZ) será a executora das ações inerentes à aquisição, estocagem, e dispensação dos medicamentos, podendo para tanto firmar convênios com a União, Estados, Distrito Federal, Municípios e instituições, sob a supervisão direta e imediata do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 4º)
Art. 5º No "Aqui tem Farmácia Popular", a operacionalização do PFPB ocorrerá diretamente entre o Ministério da Saúde e a rede privada de farmácias e drogarias, mediante relação convenial regida pela Lei nº 8.666, de 21 de junho de 1993. (Origem: PRT MS/GM 111/2016, Art. 5º)
Art. 6º O elenco de medicamentos e/ou correlatos disponibilizados no âmbito do PFPB, bem como seus valores de referência e preços de dispensação, encontram-se previstos nos Anexos 1, 2, 3 e 4 do Anexo LXXVII . (Origem: PRT MS/GM 111/2016, Art. 6º)
§ 1º A garantia de disponibilidade de medicamentos pelo PFPB se dá sobre o princípio ativo e não sobre a marca do medicamento. (Origem: PRT MS/GM 111/2016, Art. 6º, § 1º)
§ 2º Os estabelecimentos credenciados têm autonomia no controle de estoque e critérios na comercialização dos medicamentos dentro do seu estabelecimento. (Origem: PRT MS/GM 111/2016, Art. 6º, § 2º)
Art. 7º No "Aqui Tem Farmácia Popular" e na "Rede Própria", os medicamentos definidos para o tratamento da hipertensão arterial, diabetes mellitus e/ou asma serão distribuídos gratuitamente aos beneficiários. (Origem: PRT MS/GM 111/2016, Art. 7º)
Parágrafo Único. Quando os medicamentos para hipertensão arterial, diabetes mellitus e/ou asma forem comercializados com preço de venda menor que o valor de referência definido no Anexo 1 do Anexo LXXVII , o Ministério da Saúde pagará 100% (cem por cento) do PV-AT. (Origem: PRT MS/GM 111/2016, Art. 7º, Parágrafo Único)
Art. 8º Na "Rede Própria", a dispensação dos medicamentos e/ou correlatos ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme preço de dispensação - rede própria estabelecidos. (Origem: PRT MS/GM 111/2016, Art. 8º)
Art. 9º No "Aqui Tem Farmácia Popular", o Ministério da Saúde pagará até 90% (noventa por cento) do valor de referência estabelecido, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo Ministério da Saúde e o PV-AT do medicamento e/ou correlato adquirido. (Origem: PRT MS/GM 111/2016, Art. 9º)
Parágrafo Único. Nos casos em que o medicamento e/ou correlato forem comercializados com o preço de venda menor do que o valor de referência definido no Anexo 2 do Anexo LXXVII , o Ministério da Saúde pagará 90% (noventa por cento) do preço de venda e o paciente a diferença. (Origem: PRT MS/GM 111/2016, Art. 9º, Parágrafo Único)
Seção I
Do "Aqui Tem Farmácia Popular"
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I)
Subseção I
Da Adesão ao PFPB Aqui Tem Farmácia Popular
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção I)
Art. 10. Poderão participar do PFPB Aqui Tem Farmácia Popular as farmácias e drogarias que atenderem aos seguintes critérios: (Origem: PRT MS/GM 111/2016, Art. 10)
I - Requerimento e Termo de Adesão (RTA) assinado pelas partes interessadas; (Origem: PRT MS/GM 111/2016, Art. 10, I)
II - Licença Sanitária Estadual ou Municipal, ativa e válida, nos termos da legislação vigente; (Origem: PRT MS/GM 111/2016, Art. 10, II)
III - inscrição no Cadastro Nacional de Pessoas Jurídicas (CNPJ), da Secretaria de Receita Federal do Brasil; (Origem: PRT MS/GM 111/2016, Art. 10, III)
IV - registro na Junta Comercial; (Origem: PRT MS/GM 111/2016, Art. 10, IV)
V - autorização de funcionamento emitida pela Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 111/2016, Art. 10, V)
VI - situação de regularidade com a Previdência Social; (Origem: PRT MS/GM 111/2016, Art. 10, VI)
VII - farmacêutico responsável técnico com Certificado de Regularidade Técnica (CRT) válido e emitido pelo Conselho Regional de Farmácia (CRF); (Origem: PRT MS/GM 111/2016, Art. 10, VII)
VIII - dispor de equipamento eletrônico adequado para emissão de documento fiscal e cupom vinculado para processamento das operações eletrônicas do PFPB, conforme detalhamento constante na Subseção II deste Capítulo; (Origem: PRT MS/GM 111/2016, Art. 10, VIII)
IX - dispor de sistema de gerenciamento eletrônico capaz de realizar requisições eletrônicas, por meio de interface web; e (Origem: PRT MS/GM 111/2016, Art. 10, IX)
X - dispor de pessoal treinado para atuar no PFPB, de acordo com as normas e procedimentos estabelecidos. (Origem: PRT MS/GM 111/2016, Art. 10, X)
§ 1º Para fins dos incisos II e VI do "caput", a Licença Sanitária Estadual ou Municipal e a regularidade junto à Previdência Social deverão estar válidas na data de emissão do Requerimento e Termo de Adesão. (Origem: PRT MS/GM 111/2016, Art. 10, § 1º)
§ 2º Ressalvados os critérios definidos neste artigo, é dispensável, para a habilitação, a satisfação das exigências previstas nos arts. 28 a 31 da Lei nº 8.666, de 21 de junho de 1993, por força do disposto no § 1º do art. 32 daquela Lei. (Origem: PRT MS/GM 111/2016, Art. 10, § 2º)
§ 3º Não poderão ser credenciadas ao PFPB Aqui Tem Farmácia Popular novas filiais cuja matriz e/ou filial esteja passando por processo de auditoria no Departamento Nacional de Auditoria do SUS (DENASUS). (Origem: PRT MS/GM 111/2016, Art. 10, § 3º)
§ 4º As farmácias e drogarias credenciadas no PFPB Aqui Tem Farmácia Popular autorizam, automaticamente, o Ministério da Saúde a acessar as informações de movimentações fiscais e tributárias junto à Receita Federal do Brasil, inclusive para fins de apuração e auditoria. (Origem: PRT MS/GM 111/2016, Art. 10, § 4º)
§ 5º Para a comprovação da regularidade do estabelecimento poderão ser solicitados, a qualquer tempo, outros documentos previstos na legislação vigente. (Origem: PRT MS/GM 111/2016, Art. 10, § 5º)
Art. 11. Após a análise dos documentos, a adesão das farmácias e drogarias ao PFPB Aqui Tem Farmácia Popular será autorizada pelo Departamento de Assistência Farmacêutica e Insumos Estratégicos da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (DAF/SCTIE/MS) e deferida por esta Secretaria com o seguinte fluxo: (Origem: PRT MS/GM 111/2016, Art. 11)
I - publicação no Diário Oficial da União (DOU); e (Origem: PRT MS/GM 111/2016, Art. 11, I)
II - disponibilização de "login" e senha para o representante legal das farmácias e drogarias para acesso ao Sistema Eletrônico de Autorização de Dispensação de Medicamentos e Correlatos (ADM). (Origem: PRT MS/GM 111/2016, Art. 11, II)
Art. 12. O "login" e senha provisórios e definitivos a serem utilizados nas autorizações do PFPB serão enviados para o correio eletrônico indicado pelo estabelecimento credenciado em seu cadastro. (Origem: PRT MS/GM 111/2016, Art. 12)
§ 1º Após a publicação da adesão e o cadastro no sistema, o estabelecimento receberá automaticamente um "login" e senha provisórios para realizar testes de homologação de conexão entre o seu sistema eletrônico adotado e o Sistema Autorizador do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 12, § 1º)
§ 2º Após a conclusão dos testes de homologação, o estabelecimento deverá solicitar ao Ministério da Saúde o envio do "login" e senha definitivos para acesso ao ambiente de produção do sistema autorizador. (Origem: PRT MS/GM 111/2016, Art. 12, § 2º)
§ 3º A senha definitiva permitirá, além da realização das autorizações de venda, o acesso à área restrita na página eletrônica do PFPB, no endereço www.saude.gov.br/aquitemfarmaciapopular (Origem: PRT MS/GM 111/2016, Art. 12, § 3º)
§ 4º O estabelecimento credenciado que não realizar os testes de homologação de conexão entre o seu sistema eletrônico adotado e o Sistema Autorizador do Ministério da Saúde, no prazo máximo de 6 (seis) meses a contar do envio do "login" e senha provisórios, terá seu descredenciamento do PFPB publicado no DOU e somente poderá solicitar nova adesão ao PFPB após 6 (seis) meses, contados da data da referida publicação. (Origem: PRT MS/GM 111/2016, Art. 12, § 4º)
Art. 13. A(s) senha(s) de acesso ao Sistema Autorizador é exclusiva do estabelecimento, sendo que o seu representante legal assume inteira responsabilidade pelo seu uso, de acordo com as normas do PFPB. (Origem: PRT MS/GM 111/2016, Art. 13)
Parágrafo Único. Qualquer alteração dos dados cadastrais do estabelecimento credenciado deverá ser imediatamente informada ao PFPB. (Origem: PRT MS/GM 111/2016, Art. 13, Parágrafo Único)
Art. 14. A publicação de que trata o art. 11, I configura a relação convenial estabelecida entre o Ministério da Saúde e a farmácia ou drogaria, a qual será regida na forma da Lei nº 8.666, de 1993. (Origem: PRT MS/GM 111/2016, Art. 14)
Art. 15. O Requerimento e Termo de Adesão (RTA) terá validade até o dia 30 (trinta) de abril de cada ano, podendo haver prorrogação do prazo por decisão do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 15)
§ 1º A renovação do credenciamento não será automática. (Origem: PRT MS/GM 111/2016, Art. 15, § 1º)
§ 2º As farmácias e drogarias deverão obrigatoriamente efetuar a renovação do credenciamento no prazo estipulado, sob pena de suspensão da conexão com o sistema de vendas DATASUS até sua regularização. (Origem: PRT MS/GM 111/2016, Art. 15, § 2º)
§ 3º As farmácias e drogarias que não realizarem a renovação do credenciamento por 2 (dois) anos consecutivos terão seu descredenciamento do PFPB publicado no DOU e somente poderão solicitar nova adesão ao PFPB após 6 (seis) meses, contados da data da referida publicação. (Origem: PRT MS/GM 111/2016, Art. 15, § 3º)
Subseção II
Da Autorização de Comercialização e da Dispensação dos Medicamentos e Correlatos
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção II)
Art. 16. A Autorização de Dispensação de Medicamentos e Correlatos (ADM) será processada por meio eletrônico, em tempo real, com base no código de barras da embalagem do medicamento e/ou do correlato. (Origem: PRT MS/GM 111/2016, Art. 16)
Parágrafo Único. O código de barras informado no sistema autorizador de vendas deverá ser igual ao código de barras da embalagem do medicamento e/ou correlato dispensado ao beneficiário. (Origem: PRT MS/GM 111/2016, Art. 16, Parágrafo Único)
Art. 17. As ADM serão validadas pelo Ministério da Saúde quando contiverem todas as informações indicadas na Subseção VI da Seção I do Capítulo II, desde que atendidos todos os critérios do PFPB. (Origem: PRT MS/GM 111/2016, Art. 17)
Art. 18. A cada operação, obrigatoriamente, o estabelecimento deve emitir duas vias do documento fiscal e do cupom vinculado. (Origem: PRT MS/GM 111/2016, Art. 18)
Art. 19. O cupom vinculado deverá conter as seguintes informações, de acordo com o Anexo 5 do Anexo LXXVII : (Origem: PRT MS/GM 111/2016, Art. 19)
I - nome completo por extenso do beneficiário ou de seu representante legal, em caso de menor de idade sem CPF; (Origem: PRT MS/GM 111/2016, Art. 19, I)
II - número do Cadastro de Pessoas Físicas (CPF) do beneficiário ou de seu representante legal, em caso de menor de idade sem CPF; (Origem: PRT MS/GM 111/2016, Art. 19, II)
III - assinatura do beneficiário ou de seu representante legal; (Origem: PRT MS/GM 111/2016, Art. 19, III)
IV - endereço do beneficiário ou espaço para preenchimento, devendo, obrigatoriamente, ser preenchido no ato da compra; (Origem: PRT MS/GM 111/2016, Art. 19, IV)
V - razão social e CNPJ da empresa; (Origem: PRT MS/GM 111/2016, Art. 19, V)
VI - nome do responsável legal da empresa; (Origem: PRT MS/GM 111/2016, Art. 19, VI)
VII - número de autorização do DATASUS; (Origem: PRT MS/GM 111/2016, Art. 19, VII)
VIII - número de inscrição do médico no Conselho Regional de Medicina (CRM) ou Registro do Ministério da Saúde (RMS) e respectiva unidade federativa; (Origem: PRT MS/GM 111/2016, Art. 19, VIII)
IX - valor total da venda, do subsídio do Ministério da Saúde, da parcela a ser paga pelo beneficiário e do custo-zero dos medicamentos para hipertensão arterial e diabetes melittus e asma; (Origem: PRT MS/GM 111/2016, Art. 19, IX)
X - data da compra; (Origem: PRT MS/GM 111/2016, Art. 19, X)
XI - nome e apresentação do medicamento e/ou correlato; (Origem: PRT MS/GM 111/2016, Art. 19, XI)
XII - código de barras do medicamento e/ou correlato; (Origem: PRT MS/GM 111/2016, Art. 19, XII)
XIII - posologia diária ou prescrição diária; (Origem: PRT MS/GM 111/2016, Art. 19, XIII)
XIV - quantidade autorizada; (Origem: PRT MS/GM 111/2016, Art. 19, XIV)
XV - saldo atual (conforme posologia ou prescrição diária); (Origem: PRT MS/GM 111/2016, Art. 19, XV)
XVI - data da próxima compra; (Origem: PRT MS/GM 111/2016, Art. 19, XVI)
XVII - identificação do operador da transação; e (Origem: PRT MS/GM 111/2016, Art. 19, XVII)
XVIII - número da Ouvidoria do Ministério da Saúde para consultas ou denúncias (136). (Origem: PRT MS/GM 111/2016, Art. 19, XVIII)
Art. 20. O beneficiário deverá assinar o cupom vinculado conforme documento oficial apresentado e preencher o endereço residencial completo, sendo que uma via deverá ser mantida pelo estabelecimento e a outra entregue a ele. (Origem: PRT MS/GM 111/2016, Art. 20)
Parágrafo Único. Aos beneficiários comprovadamente analfabetos será aceita a digital no cupom vinculado, desde que o próprio paciente compareça ao estabelecimento credenciado para a aquisição dos medicamentos e/ou correlatos do PFPB. (Origem: PRT MS/GM 111/2016, Art. 20, Parágrafo Único)
Art. 21. Para a comercialização e a dispensação dos medicamentos e/ou correlatos no âmbito do PFPB, as farmácias e drogarias devem observar as seguintes condições: (Origem: PRT MS/GM 111/2016, Art. 21)
I - apresentação, pelo beneficiário, de documento oficial com foto e número do CPF ou documento de identidade que conste o número do CPF; (Origem: PRT MS/GM 111/2016, Art. 21, I)
II - apresentação de prescrição médica, no caso de medicamentos, ou prescrição, laudo ou atestado médico, no caso de cor- relatos, conforme legislação vigente; e (Origem: PRT MS/GM 111/2016, Art. 21, II)
III - para a dispensação de fraldas geriátricas para incontinência, o paciente deverá ter idade igual ou superior a 60 (sessenta) anos ou ser pessoa com deficiência. (Origem: PRT MS/GM 111/2016, Art. 21, III) (com redação dada pela PRT MS/GM 937/2017)
§ 1º Com a ciência do beneficiário, o farmacêutico poderá complementar as informações referentes ao endereço do paciente que eventualmente não tenham sido disponibilizadas pelo profissional prescritor na prescrição, laudo ou atestado médico, conforme legislação vigente. (Origem: PRT MS/GM 111/2016, Art. 21, § 1º)
§ 2º As farmácias e drogarias deverão providenciar 2 (duas) cópias legíveis da prescrição, laudo ou atestado médico e do documento(s) de identidade oficial(s) apresentado no ato da compra. (Origem: PRT MS/GM 111/2016, Art. 21, § 2º)
§ 3º Para a dispensação de que trata o inciso III do caput, o paciente deverá apresentar prescrição, laudo ou atestado médico que indique a necessidade do uso de fralda geriátrica, no qual conste, na hipótese de paciente com deficiência, a respectiva Classificação Internacional de Doenças (CID). (Origem: PRT MS/GM 111/2016, Art. 21, § 3º) (dispositivo acrescentado pela PRT MS/GM 937/2017)
Art. 22. O estabelecimento deve manter por 5 (cinco) anos as vias assinadas dos cupons vinculados, do documento fiscal, da prescrição, laudo ou atestado médico e do documento(s) de identidade oficial(s) apresentado no ato da compra, em ordem cronológica de emissão, com arquivamento de 2 (duas) cópias, uma em meio físico e outra em arquivo digitalizado. (Origem: PRT MS/GM 111/2016, Art. 22)
§ 1º Caberá também às farmácias e drogarias manter os documentos fiscais de aquisição dos medicamentos e ou correlatos do PFPB junto aos fornecedores pelo mesmo prazo e forma previstos no "caput". (Origem: PRT MS/GM 111/2016, Art. 22, § 1º)
§ 2º No caso de não ser possível a guarda das cópias dos documentos em arquivo digitalizado, o estabelecimento deverá arquivá-las em meio físico, na forma estabelecida no "caput". (Origem: PRT MS/GM 111/2016, Art. 22, § 2º)
Art. 23. Para o PFPB, as prescrições, laudos ou atestados médicos terão validade de 180 (cento e oitenta) dias, a partir de sua emissão, exceto para os contraceptivos, cuja validade é de 365 (trezentos e sessenta e cinco) dias. (Origem: PRT MS/GM 111/2016, Art. 23)
Art. 24. O quantitativo do medicamento solicitado deve corresponder à posologia mensal compatível com os consensos de tratamento da doença para o qual é indicado e a dispensação deve obedecer à periodicidade de compra e os limites definidos, constantes no "Manual de Orientações às Farmácias e Drogarias Credenciadas no Aqui Tem Farmácia Popular", constante na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 24)
§ 1º Em casos excepcionais, nos quais as prescrições ultrapassem a quantidade mensal estabelecida, o interessado deverá enviar ao DAF/SCTIE/MS requerimento que contenha os dados pessoais do beneficiário (nome, endereço e CPF), informações para contato, cópia da receita médica e do relatório médico que justifique a prescrição com a Classificação Internacional de Doenças (CID10). (Origem: PRT MS/GM 111/2016, Art. 24, § 1º)
§ 2º A autorização para a dispensação de medicamentos que ultrapassar a quantidade mensal (extrateto) terá a mesma validade da receita que o acompanhe, podendo ser renovada por meio do envio da documentação atualizada ao DAF/SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 24, § 2º)
§ 3º O quantitativo excedente requerido somente será liberado após análise do DAF/SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 24, § 3º)
§ 4º As Fraldas Geriátricas do PFPB poderão ser retiradas a cada 10 (dez) dias. (Origem: PRT MS/GM 111/2016, Art. 24, § 4º)
Art. 25. Fica dispensada a obrigatoriedade da presença física do paciente, titular da prescrição, laudo ou atestado médico, mediante a apresentação dos seguintes documentos: (Origem: PRT MS/GM 111/2016, Art. 25)
I - do beneficiário titular da receita: documento oficial com foto e CPF ou documento de identidade que conste o número do CPF, salvo menor de idade, que permite a apresentação da certidão de nascimento ou registro geral (RG); e (Origem: PRT MS/GM 111/2016, Art. 25, I)
II - do representante legal, o qual assumirá, juntamente com o estabelecimento, a responsabilidade pela efetivação da transação: documento oficial com foto e CPF ou documento de identidade que conste o número do CPF; (Origem: PRT MS/GM 111/2016, Art. 25, II)
§ 1º Considera-se representante legal aquele que for: (Origem: PRT MS/GM 111/2016, Art. 25, § 1º)
I - declarado por sentença judicial; (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, I)
II - portador de instrumento público de procuração que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou correlatos junto ao PFPB; (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, II)
III - portador de instrumento particular de procuração com reconhecimento de firma, que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou correlatos junto ao PFPB; e (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, III)
IV - portador de identidade civil que comprove a responsabilidade pelo menor de idade, titular da receita médica. (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, IV)
§ 2º No ato da dispensação, as farmácias e drogarias deverão providenciar 2 (duas) cópias de toda a documentação prevista neste artigo, conforme determina o art. 22. (Origem: PRT MS/GM 111/2016, Art. 25, § 2º)
Subseção III
Do Pagamento pelo Ministério da Saúde
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção III)
Art. 26. O Ministério da Saúde efetuará os pagamentos, para as farmácias e drogarias credenciadas, no mês subsequente após o processamento das ADM validadas. (Origem: PRT MS/GM 111/2016, Art. 26)
§ 1º As ADM efetuadas no ambiente de homologação não serão computadas a título de pagamento. (Origem: PRT MS/GM 111/2016, Art. 26, § 1º)
§ 2º Quando o valor das autorizações validadas for menor que o das ADM estornadas ou em outras hipóteses em que haja óbice à compensação de créditos, será emitida à farmácia ou drogaria Guia de Recolhimento a União (GRU) para quitação do débito. (Origem: PRT MS/GM 111/2016, Art. 26, § 2º)
§ 3º Poderá ser emitida à farmácia ou drogaria uma GRU no valor total a ser estornado ao Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 26, § 3º)
§ 4º Nas hipóteses dos §§ 2º e 3º, o DAF/SCTIE/MS informará ao Fundo Nacional de Saúde (FNS/MS) que adotará as providências cabíveis. (Origem: PRT MS/GM 111/2016, Art. 26, § 4º)
Art. 27. Para estabelecimentos matriz e filiais, os valores devidos serão agrupados e os pagamentos serão efetuados exclusivamente para a matriz. (Origem: PRT MS/GM 111/2016, Art. 27)
Art. 28. Os pagamentos serão efetuados pelo FNS/MS em contas específicas previamente abertas pelas Farmácias participantes do PFPB e indicadas na fase de cadastramento, nos valores atestados pelo Diretor do DAF/SCTIE/MS, observadas as normas próprias da administração financeira pública. (Origem: PRT MS/GM 111/2016, Art. 28) (com redação dada pela PRT MS/GM 1182/2017)
Parágrafo Único. A apresentação da conta corrente, tornar-se-á requisito indispensável à habilitação dos agentes cadastrados no PFPB, devendo, tal medida, ser observada pelo DAF no ato da apresentação da documentação de habilitação ao Programa. (Origem: PRT MS/GM 111/2016, Art. 28, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 1182/2017)
Art. 29. O atesto dos pagamentos terá por base as informações geradas pelo Sistema Autorizador DATASUS. (Origem: PRT MS/GM 111/2016, Art. 29)
Parágrafo Único. Caso as farmácias e drogarias verifiquem possíveis divergências nos valores de repasse do Ministério da Saúde, deverão solicitar análise do pagamento ao DAF/SCTIE/MS, no prazo máximo de 90 (noventa) dias, a contar da data da ordem bancária de pagamento, indicando quais autorizações estão divergentes. (Origem: PRT MS/GM 111/2016, Art. 29, Parágrafo Único)
Art. 30. Os relatórios de processamento das ADM estarão disponíveis na página eletrônica do PFPB, para fins de verificação pela farmácia ou drogaria. (Origem: PRT MS/GM 111/2016, Art. 30)
Subseção IV
Da Identidade Visual e da Publicidade do PFPB
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção IV)
Art. 31. As farmácias e drogarias credenciadas deverão exibir, em seus estabelecimentos, peças publicitárias que identifiquem o credenciamento ao PFPB, indicadas a seguir: (Origem: PRT MS/GM 111/2016, Art. 31)
I - adesivo antifalsificação fornecido pelo Ministério da Saúde, sendo proibida sua reprodução e que deverá ser utilizado próximo ao caixa de pagamento; (Origem: PRT MS/GM 111/2016, Art. 31, I)
II - banner produzido pelo estabelecimento credenciado, de acordo com as normas de publicidade do PFPB, a ser afixado na frente do estabelecimento credenciado; e (Origem: PRT MS/GM 111/2016, Art. 31, II)
III - tabela contendo lista de medicamentos e seus valores de referência contidos nos Anexos 1 e 2 do Anexo LXXVII , disponível na página eletrônica do PFPB, em local visível de atendimento ao público. (Origem: PRT MS/GM 111/2016, Art. 31, III)
§ 1º A logomarca do "Aqui Tem Farmácia Popular" não pode ser alterada e é obrigatório o uso do slogan ou marca do Governo Federal, vinculada à logomarca, bem como a inscrição do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 31, § 1º)
§ 2º É proibida a publicidade ou o uso do nome do PFPB e das peças publicitárias fornecidas pelo Ministério da Saúde em qualquer tipo de manifestação diversa das previstas neste Anexo. (Origem: PRT MS/GM 111/2016, Art. 31, § 2º)
§ 3º Não é permitido vincular o PFPB a outras marcas, promoções, demais produtos e/ou convênios. (Origem: PRT MS/GM 111/2016, Art. 31, § 3º)
Art. 32. Os estabelecimentos credenciados somente poderão utilizar material publicitário e fazer campanha publicitária quando tiverem acesso ao ambiente de produção, seguindo as diretrizes definidas pelo Ministério da Saúde no Manual de Diretrizes para Aplicação em Peças Publicitárias específico do Programa, disponível na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 32)
Art. 33. Não é permitido às farmácias e drogarias não-credenciadas, descredenciadas ou apenas "em fase de credenciamento" exibirem publicidade referente ao PFPB, uma vez que somente o processo de credenciamento não garante que o mesmo será aprovado. (Origem: PRT MS/GM 111/2016, Art. 33)
Art. 34. O não cumprimento das normas de publicidade do PFPB sujeitará o estabelecimento às penalidades previstas na Subseção V da Seção I do Capítulo II. (Origem: PRT MS/GM 111/2016, Art. 34)
Subseção V
Do Controle, do Monitoramento e das Penalidades
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção V)
Art. 35. As Autorizações de Dispensação de Medicamentos e Correlatos (ADM) das farmácias e drogarias serão verificadas mensalmente ou quando houver necessidade, segundo os dados processados pelo Sistema Autorizador de Vendas, para controle e monitoramento do PFPB. (Origem: PRT MS/GM 111/2016, Art. 35)
Art. 36. Sempre que necessário, o Ministério da Saúde solicitará ao estabelecimento credenciado a prestação de informações detalhadas sobre as suas operações, bem como as cópias dos documentos previstos neste Anexo e nas legislações vigentes, as quais deverão ser encaminhadas no prazo máximo de 15 (quinze) dias, a contar do recebimento da solicitação. (Origem: PRT MS/GM 111/2016, Art. 36)
Art. 37. O descumprimento de qualquer das regras dispostas neste Anexo, pelas farmácias e drogarias, caracteriza prática de irregularidade no âmbito do PFPB, considerando-se irregulares as seguintes situações, entre outras: (Origem: PRT MS/GM 111/2016, Art. 37)
I - comercializar e dispensar medicamentos e/ou correlatos fora da estrita observância das regras de execução do PFPB; (Origem: PRT MS/GM 111/2016, Art. 37, I)
II - deixar de exigir a prescrição, laudo ou atestado médico, a apresentação do documento de identificação e CPF e a assinatura do titular do CPF no cupom vinculado, salvo exceções previstas neste Anexo; (Origem: PRT MS/GM 111/2016, Art. 37, II)
III - deixar de cobrar do paciente o pagamento da sua parcela referente à compra do(s) medicamento(s) e/ou correlato(s), salvo para as dispensações de medicamentos indicados para hipertensão arterial, diabetes mellitus e asma; (Origem: PRT MS/GM 111/2016, Art. 37, III)
IV - comercializar e dispensar medicamentos e/ou correlatos do PFPB em nome de terceiros, salvo exceções previstas neste Anexo; (Origem: PRT MS/GM 111/2016, Art. 37, IV)
V - estornar a venda cancelada ou irregular, com prazo superior a 7 (sete) dias da consolidação da transação; (Origem: PRT MS/GM 111/2016, Art. 37, V)
VI - comercializar medicamentos e correlatos com senha diversa daquela que foi conferida exclusivamente ao estabelecimento credenciado; (Origem: PRT MS/GM 111/2016, Art. 37, VI)
VII - firmar convênios e parcerias com empresas, cooperativas e instituições congêneres para operações coletivas no âmbito do PFPB; (Origem: PRT MS/GM 111/2016, Art. 37, VII)
VIII - fazer uso publicitário do PFPB fora das regras definidas neste Anexo; (Origem: PRT MS/GM 111/2016, Art. 37, VIII)
IX - deixar de expor as peças publicitárias que identifiquem o credenciamento ao PFPB, estabelecidas no art. 31; (Origem: PRT MS/GM 111/2016, Art. 37, IX)
X - cadastrar pacientes em nome do PFPB; (Origem: PRT MS/GM 111/2016, Art. 37, X)
XI - entregar medicamentos e/ou correlatos do PFPB fora do estabelecimento, especialmente em domicílio, uma vez que a venda exige a presença do paciente no estabelecimento, munido dos documentos necessários; (Origem: PRT MS/GM 111/2016, Art. 37, XI)
XII - deixar de observar as regras do órgão de vigilância sanitária para funcionamento do estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 37, XII)
XIII - permitir que terceiros, exceto nos casos previstos neste Anexo, assinem em nome do beneficiário.; (Origem: PRT MS/GM 111/2016, Art. 37, XIII)
XIV - rasurar quaisquer documentos necessários para a validação da venda dos itens constantes do elenco do programa; (Origem: PRT MS/GM 111/2016, Art. 37, XIV)
XV - receber a prescrição, laudo ou atestado médico com data posterior à autorização consolidada ou sem data de emissão; (Origem: PRT MS/GM 111/2016, Art. 37, XV)
XVI - lançar no sistema de vendas do programa informações divergentes das constantes na prescrição, laudo ou atestado médico e no documento do paciente; (Origem: PRT MS/GM 111/2016, Art. 37, XVI)
XVII - dispensar medicamentos e/ou correlatos que já tenham sido dispensados ou fornecidos, caso haja esta informação na prescrição, laudo ou atestado médico; (Origem: PRT MS/GM 111/2016, Art. 37, XVII)
XVIII - realizar a substituição do medicamento prescrito em desacordo com a legislação vigente; e (Origem: PRT MS/GM 111/2016, Art. 37, XVIII)
XIX - dispensar ao beneficiário medicamento e/ou correlato contendo o código de barras diverso daquele informado no sistema autorizador de vendas. (Origem: PRT MS/GM 111/2016, Art. 37, XIX)
Art. 38. O DAF/SCTIE/MS suspenderá preventivamente os pagamentos e/ou a conexão com os Sistemas DATASUS sempre que detectar indícios ou notícias de irregularidade(s) na execução do PFPB pelos estabelecimentos. (Origem: PRT MS/GM 111/2016, Art. 38)
§ 1º O estabelecimento com suspeita de prática irregular será notificado pelo DAF/SCTIE/MS a apresentar, no prazo de 15 (quinze) dias, documentos e esclarecimentos sobre os fatos averiguados. (Origem: PRT MS/GM 111/2016, Art. 38, § 1º)
§ 2º Apresentados ou não os esclarecimentos e documentos pelo estabelecimento no prazo indicado no § 1º e verificando-se que não foram sanados os indícios ou notícias de irregularidades, o DAF/SCTIE/MS solicitará ao DENASUS a instauração de procedimento para averiguação dos fatos. (Origem: PRT MS/GM 111/2016, Art. 38, § 2º)
§ 3º Em casos excepcionais, o DAF/SCTIE/MS poderá solicitar ao DENASUS a instauração de procedimento para averiguação, antes que seja oportunizado à empresa um prazo para apresentar esclarecimentos. (Origem: PRT MS/GM 111/2016, Art. 38, § 3º)
Art. 39. O DAF/SCTIE/MS emitirá relatório fundamentado sobre o descredenciamento do estabelecimento, que será deferido pela Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS), sem prejuízo da imposição das penalidades previstas no art. 87 da Lei nº 8.666, de 1993, nas seguintes hipóteses: (Origem: PRT MS/GM 111/2016, Art. 39)
I - após o recebimento do relatório conclusivo do procedimento instaurado pelo DENASUS; ou (Origem: PRT MS/GM 111/2016, Art. 39, I)
II - constatadas irregularidades e os documentos constantes nos autos demonstrem autoria e materialidade. (Origem: PRT MS/GM 111/2016, Art. 39, II)
Parágrafo Único. O DAF/SCTIE/MS poderá, ainda, quando julgar cabível, encaminhar cópia dos autos à Polícia Federal e ao Ministério Público Federal para a adoção das providências pertinentes, tendo em vista a atuação desses órgãos na apuração das infrações penais em detrimento de bens, serviços e interesses da União. (Origem: PRT MS/GM 111/2016, Art. 39, Parágrafo Único)
Art. 40. Após relatório conclusivo do DENASUS, o estabelecimento deverá recolher aos cofres públicos o débito correspondente ao valor repassado pelo Ministério da Saúde nas autorizações consideradas irregulares, sem prejuízo da multa prevista no art. 42. (Origem: PRT MS/GM 111/2016, Art. 40)
Art. 41. Ao estabelecimento com decisão de descredenciamento que pretender pleitear a liquidação de eventual competência pendente, caberá apresentar requerimentos por escrito assinado com firma reconhecida do representante legal ao DAF/SCTIE/MS, no prazo de 15 (quinze) dias, a contar da publicação de descredenciamento no DOU. (Origem: PRT MS/GM 111/2016, Art. 41)
Art. 42. O descumprimento de qualquer das regras estabelecidas no presente instrumento ensejará a aplicação de multa de até 10% (dez por cento), calculada sobre o montante das vendas efetuadas no âmbito do PFPB, referente aos últimos 3 (três) meses completos das autorizações consolidadas, e/ou bloqueio da conexão com os Sistemas DATASUS, por um prazo de 3 (três) a 6 (seis) meses. (Origem: PRT MS/GM 111/2016, Art. 42)
§ 1º Caso o estabelecimento tenha aderido ao PFPB há menos de 90 (noventa) dias, o cálculo será realizado levando-se em consideração todas as vendas efetuadas desde a data da publicação da sua adesão. (Origem: PRT MS/GM 111/2016, Art. 42, § 1º)
§ 2º Os estabelecimentos deverão encaminhar o comprovante de pagamento da multa no prazo de 30 (trinta) dias, a contar do recebimento da notificação. (Origem: PRT MS/GM 111/2016, Art. 42, § 2º)
§ 3º Quando houver multa, os estabelecimentos poderão solicitar a dedução do valor correspondente de eventual pagamento pendente. (Origem: PRT MS/GM 111/2016, Art. 42, § 3º)
Art. 43. O estabelecimento que for descredenciado por motivo de irregularidades somente poderá solicitar nova adesão ao PFPB Aqui Tem Farmácia Popular após o período de 2 (dois) anos, a contar da publicação do descredenciamento no DOU. (Origem: PRT MS/GM 111/2016, Art. 43)
§ 1º O descredenciamento de qualquer filial, por motivo de irregularidades, enseja a punição de toda a pessoa jurídica, matriz e filiais, nos termos do "caput". (Origem: PRT MS/GM 111/2016, Art. 43, § 1º)
§ 2º Excetua-se do disposto no "caput" os casos de incorporação ou fusão de empresas já credenciadas, mediante autorização prévia do DAF/SCTIE/MS, cujo CNPJ não tenha sido descredenciado em um período inferior a 2 (dois) anos e o responsável legal comprovar que não houve qualquer alteração quanto à localização do estabelecimento. (Origem: PRT MS/GM 111/2016, Art. 43, § 2º)
§ 3º A penalidade prevista no "caput" estende-se ao proprietário ou empresário individual, aos sócios empresários e, ainda, ao farmacêutico responsável à época em que foram praticadas as irregularidades que ocasionaram o descredenciamento. (Origem: PRT MS/GM 111/2016, Art. 43, § 3º)
§ 4º Após o prazo estabelecido no "caput" o representante legal poderá solicitar ao DAF/SCTIE/MS nova adesão por meio de requerimento assinado e com firma reconhecida, que deverá conter os dados da empresa, juntamente com os comprovantes de pagamento dos ressarcimentos e multas, quando houver, para análise e deliberação deste Departamento. (Origem: PRT MS/GM 111/2016, Art. 43, § 4º)
Subseção VI
Do Processamento Eletrônico das Autorizações das Dispensações de Medicamentos e Correlatos (ADM)
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção VI)
Art. 44. O processamento eletrônico das ADM é composto de três fases, nas quais o estabelecimento credenciado envia dados ao Sistema Autorizador referente à transação que, por sua vez, verifica as informações constantes em sua base de dados e retorna à verificação dos dados. (Origem: PRT MS/GM 111/2016, Art. 44)
Parágrafo Único. Após o envio de dados pelo estabelecimento credenciado em cada uma das fases do processamento eletrônico da ADM, o Sistema Autorizador verificará as informações constantes em sua base de dados e retornará à verificação dos dados. (Origem: PRT MS/GM 111/2016, Art. 44, Parágrafo Único)
Art. 45. A primeira fase do processo eletrônico só poderá ser realizada mediante a utilização de solução de segurança fornecida pelo Ministério da Saúde, nas seguintes condições: (Origem: PRT MS/GM 111/2016, Art. 45)
I - a solução de segurança será responsável pela identificação da estação de trabalho (computador) e da transação; (Origem: PRT MS/GM 111/2016, Art. 45, I)
II - a identificação da transação é obtida através da solução de segurança; e (Origem: PRT MS/GM 111/2016, Art. 45, II)
III - cada estação de trabalho (computador) deve ser identificada e cadastrada junto ao Ministério da Saúde para a realização da dispensação, conforme orientações a seguir: (Origem: PRT MS/GM 111/2016, Art. 45, III)
a) o cadastramento é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 111/2016, Art. 45, III, a)
b) as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 111/2016, Art. 45, III, b)
c) o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 111/2016, Art. 45, III, c)
Parágrafo Único. É de responsabilidade do estabelecimento a instalação, configuração e integração da solução de segurança. (Origem: PRT MS/GM 111/2016, Art. 45, Parágrafo Único)
Art. 46. Todas as fases do processo eletrônico só poderão ser realizadas mediante autenticação eletrônica do atendente com as seguintes determinações: (Origem: PRT MS/GM 111/2016, Art. 46)
I - o cadastramento de todos os atendentes é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 111/2016, Art. 46, I)
II - as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 111/2016, Art. 46, II)
III - o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 111/2016, Art. 46, III)
Art. 47. Na primeira fase do processo eletrônico, o estabelecimento informará os seguintes dados: (Origem: PRT MS/GM 111/2016, Art. 47)
I - código da solicitação; (Origem: PRT MS/GM 111/2016, Art. 47, I)
II - CNPJ do estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 47, II)
III - CPF do paciente; (Origem: PRT MS/GM 111/2016, Art. 47, III)
IV - CRM/RMS do médico que emitiu a prescrição; (Origem: PRT MS/GM 111/2016, Art. 47, IV)
V - Unidade Federativa que emitiu o CRM/RMS do médico prescritor; (Origem: PRT MS/GM 111/2016, Art. 47, V)
VI - data de emissão da prescrição; (Origem: PRT MS/GM 111/2016, Art. 47, VI)
VII - identificador da transação; (Origem: PRT MS/GM 111/2016, Art. 47, VII)
VIII - lista de medicamentos e correlatos, na qual para cada item deverá ser informado: (Origem: PRT MS/GM 111/2016, Art. 47, VIII)
a) código de barras da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 111/2016, Art. 47, VIII, a)
b) quantidade solicitada, em unidade conforme definida pelo Programa; (Origem: PRT MS/GM 111/2016, Art. 47, VIII, b)
c) valor unitário do medicamento e correlato; e (Origem: PRT MS/GM 111/2016, Art. 47, VIII, c)
d) quantidade diária prescrita. (Origem: PRT MS/GM 111/2016, Art. 47, VIII, d)
IX - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 47, IX)
X - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 47, X)
XI - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 47, XI)
XII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 47, XII)
Art. 48. Na segunda fase, após ter recebido a confirmação da primeira fase, o estabelecimento deve informar ao Sistema Autorizador os dados que fazem parte do processo de autorização, quais sejam: (Origem: PRT MS/GM 111/2016, Art. 48)
I - código da solicitação enviado na primeira fase; (Origem: PRT MS/GM 111/2016, Art. 48, I)
II - número da pré-autorização gerado pelo Sistema Autorizador e recebido pelo estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 48, II)
III - número do documento fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 48, III)
IV - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 48, IV)
V - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 48, V)
VI - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 48, VI)
VII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 48, VII)
§ 1º O Sistema Autorizador confirmará os medicamentos e correlatos autorizados ou uma mensagem e código de erro em casos de não autorização. (Origem: PRT MS/GM 111/2016, Art. 48, § 1º)
§ 2º Os códigos de retorno do sistema autorizador estão disponíveis na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 48, § 2º)
§ 3º As autorizações realizadas com mais de um medicamento e/ou correlato retornarão com a mesma autorização. (Origem: PRT MS/GM 111/2016, Art. 48, § 3º)
Art. 49. Na terceira e última fase, o estabelecimento confirmará o recebimento da pré-autorização e enviará os seguintes dados: (Origem: PRT MS/GM 111/2016, Art. 49)
I - número da pre-autorização; (Origem: PRT MS/GM 111/2016, Art. 49, I)
II - número do documento fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 49, II)
III - lista de medicamentos e correlatos autorizados com as seguintes informações: (Origem: PRT MS/GM 111/2016, Art. 49, III)
a) código de barras da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 111/2016, Art. 49, III, a)
b) quantidade autorizada em UP; (Origem: PRT MS/GM 111/2016, Art. 49, III, b)
c) valor da parcela do Ministério da Saúde informado pelo Sistema Autorizador; e (Origem: PRT MS/GM 111/2016, Art. 49, III, c)
d) valor da parcela do paciente informada pelo Sistema Autorizador. (Origem: PRT MS/GM 111/2016, Art. 49, III, d)
IV - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 49, IV)
V - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 49, V)
VI - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 49, VI)
VII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 49, VII)
Parágrafo Único. O estabelecimento receberá confirmação e finalização do processo de autorização da dispensação dos medicamentos e dos correlatos. (Origem: PRT MS/GM 111/2016, Art. 49, Parágrafo Único)
Art. 50. Para eventual estorno de autorizações já efetuadas, serão necessários os seguintes dados: (Origem: PRT MS/GM 111/2016, Art. 50)
I - número da autorização; (Origem: PRT MS/GM 111/2016, Art. 50, I)
II - número do documento fiscal; (Origem: PRT MS/GM 111/2016, Art. 50, II)
III - CNPJ do estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 50, III)
IV - lista de medicamentos e correlatos, na qual para cada item deverá ser informado: (Origem: PRT MS/GM 111/2016, Art. 50, IV)
a) código de barras da apresentação do medicamento e correlato; e (Origem: PRT MS/GM 111/2016, Art. 50, IV, a)
b) quantidade a ser estornada. (Origem: PRT MS/GM 111/2016, Art. 50, IV, b)
V - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 50, V)
VI - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 50, VI)
VII - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 50, VII)
VIII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 50, VIII)
Art. 51. As orientações para configuração da conexão do sistema eletrônico das farmácias e drogarias com o Sistema Autorizador se dará pelo envio de correio eletrônico juntamente com o usuário e senha provisórios para o endereço fornecido pelo estabelecimento no momento do cadastro no PFPB. (Origem: PRT MS/GM 111/2016, Art. 51)
Art. 52. Na página eletrônica do PFPB, estão disponíveis informações técnicas do Programa, bem como do processamento por meio do sistema eletrônico. (Origem: PRT MS/GM 111/2016, Art. 52)
Seção II
Da Dispensação dos Medicamentos e Correlatos nas Unidades da Rede Própria do PFPB
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção II)
Art. 53. A dispensação de medicamentos e correlatos na Rede Própria do PFPB ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação descritos nos Anexos 3 e 4 do Anexo LXXVII e de acordo com o Manual de Procedimentos Operacionais Padrão da FIOCRUZ e pelo Manual Básico. (Origem: PRT MS/GM 111/2016, Art. 53)
Parágrafo Único. A dispensação dos medicamentos para hipertensão, diabetes mellitus e asma ocorrerá por meio do sistema de vendas DATASUS, observados os procedimentos estabelecidos na Subseção II da Seção I do Capítulo II. (Origem: PRT MS/GM 111/2016, Art. 53, Parágrafo Único)
Seção III
Do Modelo de Gestão da Rede Própria
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção III)
Art. 54. O PFPB realizado em ação conjunta entre o Ministério da Saúde e a Fundação Oswaldo Cruz (FIOCRUZ), será coordenado por um Conselho Gestor, vinculado diretamente à SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 54)
Parágrafo Único. O Conselho Gestor do PFPB terá a seguinte composição: (Origem: PRT MS/GM 111/2016, Art. 54, Parágrafo Único)
I - três representantes da SCTIE/MS, sendo um deles o Diretor do DAF/SCTIE/MS, que o coordenará; e (Origem: PRT MS/GM 111/2016, Art. 54, Parágrafo Único, I)
II - três representantes indicados pela Presidência da FIOCRUZ. (Origem: PRT MS/GM 111/2016, Art. 54, Parágrafo Único, II)
Art. 55. As atividades do PFPB serão desenvolvidas de acordo com a Lei nº 10.858, de 13 de abril de 2004, pela FIOCRUZ, por meio da Gerência Técnica e da Gerência Administrativa do PFPB e pelo Ministério da Saúde, por meio da SCTIE/MS, sob a responsabilidade do DAF/SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 55)
Art. 56. Ao Conselho Gestor do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 111/2016, Art. 56)
I - aprovar anualmente o Plano de Metas e o Plano de Desenvolvimento; (Origem: PRT MS/GM 111/2016, Art. 56, I)
II - aprovar anualmente o Relatório de Gestão do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, II)
III - monitorar a execução orçamentária e a movimentação financeira; (Origem: PRT MS/GM 111/2016, Art. 56, III)
IV - acompanhar as propostas de convênios com instituições públicas ou privadas que visem apoiar o desenvolvimento do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, IV)
V - aprovar o Manual Básico do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, V)
VI - orientar e participar da formulação de indicadores de resultados e do impacto do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, VI)
VII - sugerir a habilitação de parceiros e a celebração de convênios que se façam necessárias, não previstas ou contempladas nas normas e requisitos estabelecidos; e (Origem: PRT MS/GM 111/2016, Art. 56, VII)
VIII - propor o elenco de medicamentos e/ou correlatos e a definição do preço de dispensação a ser disponibilizado pelo PFPB. (Origem: PRT MS/GM 111/2016, Art. 56, VIII)
Art. 57. À Gerência Técnica do PFPB compete: (Origem: PRT MS/GM 111/2016, Art. 57)
I - monitorar a qualidade dos serviços prestados pelas unidades vinculadas ao PFPB; (Origem: PRT MS/GM 111/2016, Art. 57, I)
II - coordenar as ações de formação e capacitação de recursos humanos para o desenvolvimento das atividades; (Origem: PRT MS/GM 111/2016, Art. 57, II)
III - coordenar as ações de atenção e de informação ao usuário, aos profissionais de saúde e aos parceiros; (Origem: PRT MS/GM 111/2016, Art. 57, III)
IV - promover a avaliação permanente da lista de produtos e serviços disponibilizados; e (Origem: PRT MS/GM 111/2016, Art. 57, IV)
V - coordenar a elaboração de manuais e procedimentos operacionais referentes a todas as atividades técnicas e às ações desenvolvidas nas farmácias. (Origem: PRT MS/GM 111/2016, Art. 57, V)
Art. 58. À Gerência Administrativa do PFPB compete: (Origem: PRT MS/GM 111/2016, Art. 58)
I - dar suporte à instalação e à manutenção de unidades mediante a celebração de convênios ou parcerias entre o Ministério da Saúde, a FIOCRUZ, os Estados, o Distrito Federal, os Municípios E Instituições; (Origem: PRT MS/GM 111/2016, Art. 58, I)
II - acompanhar e monitorar o gerenciamento das farmácias do PFPB; (Origem: PRT MS/GM 111/2016, Art. 58, II)
III - participar do planejamento de aquisição de produtos, de reposição de estoques de produtos, outros insumos materiais, equipamentos e contratação de serviços necessários para a implantação das unidades do PFPB; (Origem: PRT MS/GM 111/2016, Art. 58, III)
IV - acompanhar os processos de logística referentes à guarda, ao transporte e à distribuição de medicamentos e correlatos, insumos diversos, materiais e equipamentos das unidades do PFPB; e (Origem: PRT MS/GM 111/2016, Art. 58, IV)
V - aprovar os projetos das instalações e áreas físicas das farmácias a serem implantadas pelos Estados, Distrito Federal, Municípios e entidades conveniadas, visando adequação ao disposto no Manual Básico do PFPB. (Origem: PRT MS/GM 111/2016, Art. 58, V)
Art. 59. Ao DAF/SCTIE/MS compete: (Origem: PRT MS/GM 111/2016, Art. 59)
I - estabelecer mecanismos de controle e monitoramento da implementação, do desenvolvimento e dos resultados do PFPB; e (Origem: PRT MS/GM 111/2016, Art. 59, I)
II - supervisionar, por meio de suas coordenações, as seguintes ações: (Origem: PRT MS/GM 111/2016, Art. 59, II)
a) instrução dos processos administrativos de habilitação de Estados, Distrito Federal e Municípios e pela celebração de convênios com as instituições autorizadas; (Origem: PRT MS/GM 111/2016, Art. 59, II, a)
b) instrução dos processos administrativos de habilitação de empresas parceiras; (Origem: PRT MS/GM 111/2016, Art. 59, II, b)
c) emissão de pareceres sobre as solicitações de habilitações de Estados, Distrito Federal e Municípios, segundo procedimentos e critérios definidos no Manual Básico do PFPB; (Origem: PRT MS/GM 111/2016, Art. 59, II, c)
d) emissão de pareceres sobre as solicitações de celebração de convênios com instituições autorizadas, segundo procedimentos e critérios definidos no Manual Básico do PFPB; e (Origem: PRT MS/GM 111/2016, Art. 59, II, d)
e) emissão de pareceres sobre as solicitações de credenciamento de empresas parceiras. (Origem: PRT MS/GM 111/2016, Art. 59, II, e)
Art. 60. As despesas decorrentes do PFPB incidirão sobre as Ações Programáticas de Manutenção e Funcionamento das Farmácias Populares, a saber: 10.303.2015.20YR e 10.303.2015.20YS. (Origem: PRT MS/GM 111/2016, Art. 60)
CAPÍTULO III
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 111/2016, CAPÍTULO III)
Art. 61. A qualquer tempo, o representante legal do estabelecimento ou seu respectivo procurador poderá requerer seu descredenciamento junto ao PFPB, mediante o envio de documento assinado e com firma reconhecida, contendo os dados da empresa, sendo que o requerimento só será deferido caso não haja notícias ou indícios de irregularidades. (Origem: PRT MS/GM 111/2016, Art. 61)
Parágrafo Único. O estabelecimento descredenciado a pedido, na forma do "caput", somente poderá solicitar nova adesão ao PFPB após 6 (seis) meses, contados da data da publicação do descredenciamento no DOU. (Origem: PRT MS/GM 111/2016, Art. 61, Parágrafo Único)
Art. 62. O Ministério da Saúde manterá informações e orientações sistemáticas sobre a operação do PFPB na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 62)
§ 1º As definições estratégicas, bem como as normas para adesão e manutenção do PFPB, instalação e gestão das unidades, repasses de recursos fundo a fundo, celebração de convênios, monitoramento, avaliação e controle estão previstas no "Programa Farmácia Popular do Brasil - Manual Básico", na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 62, § 1º)
§ 2º As farmácias e drogarias credenciadas deverão seguir as normas de procedimento constantes no "Manual de Orientações às Farmácias e Drogarias Credenciadas no Aqui Tem Farmácia Popular" na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 62, § 2º)
Art. 63. As despesas decorrentes da execução do art. 21, III incidirão sobre a Ação Programática 10.303.2015.20YS.0001 - Manutenção e Funcionamento do Programa Farmácia Popular do Brasil pelo sistema copagamento. (Origem: PRT MS/GM 937/2017, Art. 2º)
ANEXO 1 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA (Origem: PRT MS/GM 111/2016, Anexo 1)
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA
(Redação dada pela PRT GM/MS n° 739 de 27.03.2018)
| Medicamento | Unidade Farmacotécnica | Valor de referência e Valor máximo para pagamento pelo MS por Unidade da Federação | ||||||||||||||||||||||||||
| Hipertensão arterial | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Atenolol 25 mg | 1 (um) comprimido | 0,10 | 0,11 | 0,09 | 0,11 | 0,10 | 0,11 | 0,10 | 0,10 | 0,11 | 0,11 | 0,10 | 0,10 | 0,09 | 0,11 | 0,11 | 0,11 | 0,11 | 0,12 | 0,11 | 0,10 | 0,10 | 0,10 | 0,10 | 0,09 | 0,11 | 0,08 | 0,10 |
| Captopril 25 mg | 1 (um) comprimido | 0,10 | 0,11 | 0,09 | 0,12 | 0,11 | 0,11 | 0,10 | 0,10 | 0,10 | 0,12 | 0,09 | 0,10 | 0,08 | 0,13 | 0,10 | 0,11 | 0,11 | 0,12 | 0,11 | 0,10 | 0,10 | 0,11 | 0,10 | 0,09 | 0,10 | 0,08 | 0,10 |
| Cloridrato de Propranolol 40 mg | 1 (um) comprimido | 0,07 | 0,08 | 0,07 | 0,08 | 0,07 | 0,08 | 0,07 | 0,07 | 0,08 | 0,08 | 0,07 | 0,07 | 0,07 | 0,08 | 0,08 | 0,07 | 0,08 | 0,08 | 0,08 | 0,08 | 0,07 | 0,07 | 0,08 | 0,07 | 0,08 | 0,06 | 0,07 |
| Hidroclorotiazida 25 mg | 1 (um) comprimido | 0,06 | 0,06 | 0,05 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,05 | 0,06 | 0,05 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,06 | 0,05 | 0,06 | 0,05 | 0,06 |
| Losartana Potássica 50 mg | 1 (um) comprimido | 0,17 | 0,18 | 0,17 | 0,17 | 0,16 | 0,18 | 0,20 | 0,16 | 0,19 | 0,19 | 0,16 | 0,16 | 0,14 | 0,19 | 0,16 | 0,18 | 0,19 | 0,20 | 0,21 | 0,17 | 0,16 | 0,15 | 0,18 | 0,16 | 0,18 | 0,15 | 0,16 |
| Maleato Enalapril 10 mg | 1 (um) comprimido | 0,16 | 0,18 | 0,17 | 0,18 | 0,17 | 0,19 | 0,18 | 0,17 | 0,17 | 0,19 | 0,15 | 0,17 | 0,14 | 0,20 | 0,16 | 0,19 | 0,19 | 0,20 | 0,18 | 0,17 | 0,18 | 0,17 | 0,17 | 0,14 | 0,19 | 0,13 | 0,17 |
| Diabetes mellitus | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Cloridrato de Metformina 500 mg | 1 (um) comprimido | 0,14 | 0,14 | 0,13 | 0,14 | 0,14 | 0,14 | 0,14 | 0,14 | 0,14 | 0,14 | 0,13 | 0,13 | 0,13 | 0,14 | 0,14 | 0,14 | 0,14 | 0,15 | 0,14 | 0,14 | 0,14 | 0,13 | 0,14 | 0,13 | 0,14 | 0,13 | 0,14 |
| Cloridrato de Metformina 500 mg - Ação Prolongada | 1 (um) comprimido | 0,23 | 0,24 | 0,22 | 0,23 | 0,23 | 0,24 | 0,23 | 0,23 | 0,23 | 0,25 | 0,23 | 0,23 | 0,24 | 0,24 | 0,24 | 0,24 | 0,24 | 0,25 | 0,25 | 0,23 | 0,24 | 0,23 | 0,23 | 0,22 | 0,23 | 0,22 | 0,23 |
| Cloridrato de Metformina 850 mg | 1 (um) comprimido | 0,15 | 0,16 | 0,14 | 0,17 | 0,15 | 0,16 | 0,15 | 0,16 | 0,16 | 0,16 | 0,15 | 0,15 | 0,14 | 0,16 | 0,16 | 0,15 | 0,16 | 0,17 | 0,16 | 0,16 | 0,15 | 0,14 | 0,15 | 0,15 | 0,16 | 0,14 | 0,15 |
| Glibenclamida 5mg | 1 (um) comprimido | 0,07 | 0,08 | 0,07 | 0,08 | 0,08 | 0,08 | 0,08 | 0,08 | 0,08 | 0,09 | 0,07 | 0,07 | 0,07 | 0,08 | 0,08 | 0,08 | 0,08 | 0,09 | 0,08 | 0,08 | 0,08 | 0,07 | 0,08 | 0,07 | 0,08 | 0,07 | 0,08 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, frasco-ampola 10 ml | 1 (um) frasco/ampola 10ml | 21,40 | 21,80 | 20,10 | 21,80 | 21,60 | 21,70 | 22,60 | 22,00 | 22,00 | 23,50 | 22,40 | 22,40 | 19,60 | 22,50 | 22,20 | 21,80 | 21,60 | 23,90 | 25,70 | 21,80 | 22,10 | 21,20 | 22,20 | 20,00 | 21,80 | 20,30 | 21,70 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, frasco-ampola 5 ml | 1 (um) frasco/ampola 5ml | 10,70 | 10,90 | 10,05 | 10,90 | 10,80 | 10,85 | 11,30 | 11,00 | 11,00 | 11,75 | 11,20 | 11,20 | 9,80 | 11,25 | 11,10 | 10,90 | 10,80 | 11,95 | 12,85 | 10,90 | 11,05 | 10,60 | 11,10 | 10,00 | 10,90 | 10,15 | 10,85 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, refil 1,5ml (carpule) | 1 (um) refil 1,5ml | 3,21 | 3,27 | 3,02 | 3,27 | 3,24 | 3,26 | 3,39 | 3,30 | 3,30 | 3,53 | 3,36 | 3,36 | 2,94 | 3,38 | 3,33 | 3,27 | 3,24 | 3,59 | 3,86 | 3,27 | 3,32 | 3,18 | 3,33 | 3,00 | 3,27 | 3,05 | 3,26 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, refil 3ml (carpule) | 1 (um) refil 3ml | 6,42 | 6,54 | 6,03 | 6,54 | 6,48 | 6,51 | 6,78 | 6,60 | 6,60 | 7,05 | 6,72 | 6,72 | 5,88 | 6,75 | 6,66 | 6,54 | 6,48 | 7,17 | 7,71 | 6,54 | 6,63 | 6,36 | 6,66 | 6,00 | 6,54 | 6,09 | 6,51 |
| Insulina humana NPH 100UI/mL | 1 (um) mililitro | 2,14 | 2,18 | 2,01 | 2,18 | 2,16 | 2,17 | 2,26 | 2,20 | 2,20 | 2,35 | 2,24 | 2,24 | 1,96 | 2,25 | 2,22 | 2,18 | 2,16 | 2,39 | 2,57 | 2,18 | 2,21 | 2,12 | 2,22 | 2,00 | 2,18 | 2,03 | 2,17 |
| Insulina Humana Regular 100 UI/ml, solução injetável, frasco-ampola 10 ml | 1 (um) frasco/ampola 10ml | 21,50 | 21,80 | 19,90 | 22,00 | 21,60 | 21,80 | 22,50 | 22,00 | 22,00 | 23,70 | 22,30 | 22,30 | 19,70 | 22,20 | 21,70 | 21,90 | 21,70 | 23,70 | 25,60 | 21,90 | 22,40 | 21,40 | 22,30 | 20,20 | 21,80 | 20,40 | 21,80 |
| Insulina Humana Regular 100 UI/ml, solução injetável, frasco-ampola 5 ml | 1 (um) frasco/ampola 5ml | 10,75 | 10,90 | 9,95 | 11,00 | 10,80 | 10,90 | 11,25 | 11,00 | 11,00 | 11,85 | 11,15 | 11,15 | 9,85 | 11,10 | 10,85 | 10,95 | 10,85 | 11,85 | 12,80 | 10,95 | 11,20 | 10,70 | 11,15 | 10,10 | 10,90 | 10,20 | 10,90 |
| Insulina humana regular 100UI/mL | 1 (um) mililitro | 2,15 | 2,18 | 1,99 | 2,20 | 2,16 | 2,18 | 2,25 | 2,20 | 2,20 | 2,37 | 2,23 | 2,23 | 1,97 | 2,22 | 2,17 | 2,19 | 2,17 | 2,37 | 2,56 | 2,19 | 2,24 | 2,14 | 2,23 | 2,02 | 2,18 | 2,04 | 2,18 |
| Insulina Humana Regular 100UI/ml, solução injetável, refil 1,5ml (carpules) | 1 (um) refil 1,5ml | 3,23 | 3,27 | 2,99 | 3,30 | 3,24 | 3,27 | 3,38 | 3,30 | 3,30 | 3,56 | 3,35 | 3,35 | 2,96 | 3,33 | 3,26 | 3,29 | 3,26 | 3,56 | 3,84 | 3,29 | 3,36 | 3,21 | 3,35 | 3,03 | 3,27 | 3,06 | 3,27 |
| Insulina Humana Regular 100UI/ml, solução injetável, refil 3ml (carpules) | 1 (um) refil 3ml | 6,45 | 6,54 | 5,97 | 6,60 | 6,48 | 6,54 | 6,75 | 6,60 | 6,60 | 7,11 | 6,69 | 6,69 | 5,91 | 6,66 | 6,51 | 6,57 | 6,51 | 7,11 | 7,68 | 6,57 | 6,72 | 6,42 | 6,69 | 6,06 | 6,54 | 6,12 | 6,54 |
| Asma | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Brometo de Ipratrópio 0,02 mg | 1 (uma) dose | 0,14 | 0,13 | 0,14 | 0,14 | 0,13 | 0,14 | 0,13 | 0,13 | 0,13 | 0,14 | 0,13 | 0,13 | 0,14 | 0,13 | 0,13 | 0,13 | 0,14 | 0,14 | 0,14 | 0,14 | 0,14 | 0,14 | 0,13 | 0,13 | 0,13 | 0,13 | 0,14 |
| Brometo de Ipratrópio 0,25 mg | 1 (um) mililitro | 0,42 | 0,46 | 0,42 | 0,42 | 0,44 | 0,47 | 0,45 | 0,45 | 0,46 | 0,48 | 0,43 | 0,47 | 0,42 | 0,49 | 0,45 | 0,45 | 0,49 | 0,48 | 0,47 | 0,44 | 0,45 | 0,45 | 0,45 | 0,44 | 0,45 | 0,43 | 0,44 |
| Dipropionato de Beclometasona 200 mcg/cápsula - Administração pulmonar, cápsulas inalantes | 1 (uma) cápsula | 0,35 | 0,35 | 0,34 | 0,35 | 0,35 | 0,35 | 0,35 | 0,35 | 0,35 | 0,36 | 0,35 | 0,35 | 0,37 | 0,35 | 0,36 | 0,35 | 0,35 | 0,37 | 0,38 | 0,35 | 0,36 | 0,35 | 0,36 | 0,35 | 0,35 | 0,36 | 0,35 |
| Dipropionato de Beclometasona 200 mcg/dose - Administração pulmonar, inalador doseado | 1 (uma) dose | 0,35 | 0,35 | 0,34 | 0,35 | 0,35 | 0,35 | 0,35 | 0,35 | 0,35 | 0,36 | 0,35 | 0,35 | 0,37 | 0,35 | 0,36 | 0,35 | 0,35 | 0,37 | 0,38 | 0,35 | 0,36 | 0,35 | 0,36 | 0,35 | 0,35 | 0,36 | 0,35 |
| Diproprionato de Beclometasona 250 mcg | 1 (uma) dose | 0,21 | 0,21 | 0,20 | 0,21 | 0,21 | 0,21 | 0,21 | 0,21 | 0,21 | 0,22 | 0,21 | 0,21 | 0,22 | 0,21 | 0,21 | 0,21 | 0,21 | 0,23 | 0,23 | 0,21 | 0,21 | 0,21 | 0,21 | 0,20 | 0,21 | 0,20 | 0,21 |
| Diproprionato de Beclometasona 50 mcg | 1 (uma) dose | 0,16 | 0,16 | 0,15 | 0,16 | 0,16 | 0,16 | 0,16 | 0,16 | 0,16 | 0,17 | 0,16 | 0,16 | 0,15 | 0,16 | 0,15 | 0,16 | 0,16 | 0,17 | 0,18 | 0,16 | 0,14 | 0,16 | 0,16 | 0,16 | 0,16 | 0,16 | 0,15 |
| Sulfato de Salbutamol 100 mcg | 1 (uma) dose | 0,09 | 0,09 | 0,08 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,10 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,10 | 0,10 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 | 0,09 |
| Sulfato de Salbutamol 5 mg | 1 (um) mililitro | 1,55 | 1,56 | 1,50 | 1,56 | 1,56 | 1,56 | 1,55 | 1,56 | 1,56 | 1,60 | 1,56 | 1,56 | 1,61 | 1,56 | 1,57 | 1,56 | 1,56 | 1,63 | 1,64 | 1,56 | 1,56 | 1,54 | 1,56 | 1,53 | 1,56 | 1,54 | 1,56 |
(Redação dada pela PRT GM/MS n° 739 de 27.03.2018)
ANEXO 2 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 111/2016, Anexo 2)
| ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR | ||||
|---|---|---|---|---|
| Indicação: Contracepção | ||||
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS | |
| Enantato de noretisterona 50 MG + valerato de estradiol 5 MG, ampola | 1 | (uma) ampola | R$ 11,31 | R$ 10,17 |
| Noretisterona 0,35 MG, comprimido - cartela com 35 comprimidos | 1 | (uma) cartela | R$ 4,96 | R$ 4,46 |
| Etinilestradiol 0,03 MG + levonorgestrel 0,15 MG, comprimido - cartela com 21 comprimidos | 1 | (uma) cartela | R$ 4,19 | R$ 3,77 |
| Acetato de medroxiprogesterona 150 MG, ampola | 1 | (uma) ampola | R$ 12,36 | R$ 11,12 |
| Indicação: Dislipidemia | ||||
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS | |
| Sinvastatina 10 MG comprimido | 1 | (um) comprimido | R$ 0,13 | R$ 0,12 |
| Sinvastatina 20 MG comprimido | 1 | (um) comprimido | R$ 0,26 | R$ 0,23 |
| Sinvastatina 40 MG comprimido | 1 | (um) comprimido | R$ 0,50 | R$ 0,45 |
| Indicação: Rinite | ||||
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS | |
| Budesonida 32 mcg/dose - Administração tópica nasal doseada | 1 (uma) dose | R$ 0,05 | R$ 0,04 | |
| Budesonida 50 mcg/dose - Administração tópica nasal doseada | 1 (uma) dose | R$ 0,07 | R$ 0,06 | |
| Dipropionato de Beclometasona 50 mcg/dose - Administração tópica nasal doseada | 1 (uma) dose | R$ 0,07 | R$ 0,06 | |
| Indicação: Doença de Parkinson | ||||
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS | |
| Carbidopa 25 MG + Levodopa 250 MG | 1 | (um) comprimido | R$ 0,64 | R$ 0,58 |
| Cloridrato de Benserazida 25 MG + Levodopa 100 MG | 1 | (um) comprimido | R$ 1,17 | R$ 1,05 |
| Indicação: Osteoporose | ||||
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento p elo MS | |
| Alendronato de Sódio 70 MG | 1 (um) comprimido | R$ 1,87 | R$ 1,68 | |
| Indicação: Glaucoma | ||||
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS | |
| Maleato de Timolol 0,25% - Solução Oftalmológica | 1 (um) mililitro | R$ 0,20 | R$ 0,18 | |
| Maleato de Timolol 0,50% - Solução Oftalmológica | 1 (um) mililitro | R$ 0,48 | R$ 0,43 | |
| Indicação: Incontinência | ||||
| Produto de higiene | Unidade | Valor de referência por tira | Valor máximo para pagamento pelo MS | |
| Fralda geriátrica | 1 | (uma) tira | R$ 0,71 | R$ 0,64 |
ANEXO 3 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA (Origem: PRT MS/GM 111/2016, Anexo 3)
| ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA | |||
|---|---|---|---|
| MEDICAMENTO / CORRELATO | APRESENTAÇÃO | UNIDADE DE CADASTRO | PREÇO DE DISPENSAÇÃO (R$) |
| Acetato de medroxiprogesterona | 150 mg/ml | Ampola | R$ 1,24 |
| Aciclovir | 200mg/comp. | Comprimido | R$ 0,28 |
| Ácido Acetilsalicílico | 500mg/comp. | Comprimido | R$ 0,04 |
| Ácido Acetilsalicílico | 100mg/comp. | Comprimido | R$ 0,03 |
| Ácido Fólico | 5mg/comp. | Comprimido | R$ 0,05 |
| Albendazol | 400mg/comp. mastigável | Comprimido | R$ 0,56 |
| Alendronato de Sódio | 70 mg/comp. | Comprimido | R$ 0,37 |
| Alopurinol | 100mg/comp. | Comprimido | R$ 0,08 |
| Amiodarona | 200mg/comp. | Comprimido | R$ 0,20 |
| Amitriptilina (Cloridrato) | 25mg/comp. | Comprimido | R$ 0,22 |
| Amoxicilina | 500mg/cáps. | Cápsula | R$ 0,19 |
| Amoxicilina | 250mg/5ml/pó p/susp. oral | Frasco 60 ml | R$ 1,96 |
| Amoxicilina | 250mg/5ml/pó p/susp. oral | Frasco 150 ml | R$ 4,90 |
| Azatioprina | 50mg/comp. | Comprimido | R$ 1,40 |
| Azitromicina | 500mg/comp. | Comprimido | R$ 2,64 |
| Benzilpenicilina Benzatina | 1.200.000ui/pó p/sus. inj. | Frasco-ampola | R$ 1,50 |
| Benzilpenicilina Procaína + Potássica | 300.000+100.000ui/pó/sus. inj. | Frasco-ampola | R$ 1,50 |
| Benzoato de Benzila | 200mg/ml/emulsão | Frasco 100 ml | R$ 1,40 |
| Benzoato de Benzila | 200mg/ml/emulsão | Frasco 60 ml | R$ 1,10 |
| Biperideno | 2mg/comp. | Comprimido | R$ 0,07 |
| Brometo de n-butilescopolamina | 10 mg/frasco | frasco de 20 ml | R$ 3,90 |
| Carbamazepina | 200mg/comp | Comprimido | R$ 0,13 |
| Carbidopa + Levodopa | 25mg + 250mg/comp. | Comprimido | R$ 0,48 |
| Cefalexina (Cloridrato ou Sal Sódico) | 500mg/cáps. | Cápsula | R$ 0,40 |
| Cefalexina (Cloridrato ou Sal Sódico) | 250mg/5ml/susp. oral | Frasco 60 ml | R$ 4,96 |
| Cefalexina (Cloridrato ou Sal Sódico) | 250mg/5ml/susp. oral | Frasco 125 ml | R$ 10,00 |
| Cetoconazol | 200mg/comp. | Comprimido | R$ 0,23 |
| Ciprofloxacino | 500mg/comp. | Comprimido | R$ 0,38 |
| Clonazepam | 2mg/comp | Comprimido | R$ 0,06 |
| Cloreto de Potássio | 60mg/ml/xpe. | Frasco 100 ml | R$ 1,88 |
| Cloreto de Sódio 0,9% | 9mg/ml/sol. nasal | Frasco | R$ 0,95 |
| Clorpromazina | 25mg/comp. | Comprimido | R$ 0,10 |
| Clorpromazina | 100mg/comp. | Comprimido | R$ 0,13 |
| Dexametazona | Crem.0,1% | Tubo | R$ 1,00 |
| Dexclorfeniramina (Maleato) | 2mg/comp. | Comprimido | R$ 0,06 |
| Dexclorfeniramina (Maleato) | 0,4mg/sol. Oral | Frasco 120 ml | R$ 2,07 |
| Diazepam | 5mg/comp.sulcado | Comprimido | R$ 0,04 |
| Diazepam | 10mg/comp.sulcado | Comprimido | R$ 0,08 |
| Digoxina | 0,25mg/comp. | Comprimido | R$ 0,06 |
| Dipirona | 500mg/ml gts | Frasco 10 ml | R$ 0,70 |
| Doxiciclina | 100mg/comp. | Comprimido | R$ 0,38 |
| Enantato de Noretisterona + Valerato de Estradiol | 50mg+5mg/injetável | Seringa 1 ml | R$ 1,13 |
| Eritromicina (Estearato ou Etilsuccinato) | 125mg/5ml/susp. oral | Frasco 60 ml | R$ 2,30 |
| Eritromicina (Estearato ou Etilsuccinato) | 500mg/comp./cáps. | Comprimido | R$ 0,54 |
| Etinilestradiol + Levonorgestrel | 0,03mg+0,15mg/comp | Cartela 21 cápsulas | R$ 0,42 |
| Fenitoína | 100mg/comp. | Comprimido | R$ 0,10 |
| Fenobarbital | 100mg/comp. | Comprimido | R$ 0,06 |
| Fluconazol | 100mg/rev. | Cápsula | R$ 0,95 |
| Fluconazol | 150mg/rev. | Cápsula | R$ 0,95 |
| Fluoxetina | 20mg/comp. | Comprimido | R$ 0,06 |
| Haloperidol | 1mg/comp. | Comprimido | R$ 0,08 |
| Haloperidol | 5mg/comp. | Comprimido | R$ 0,12 |
| Haloperidol | 2mg/ml/sol. oral | Frasco 20 ml | R$ 1,94 |
| Ibuprofeno | 300mg/comp. | Comprimido | R$ 0,16 |
| Levonorgestrel | 0,75mg/comp. | Comprimido | R$ 3,47 |
| Loratadina | 10mg/comp. | Comprimido | R$ 0,05 |
| Mebendazol | 100mg/comp. | Comprimido | R$ 0,05 |
| Mebendazol | 100mg/5ml/sup. Oral | Frasco 30 ml | R$ 1,10 |
| Metoclopramida (Cloridrato) | 10mg/comp. | Comprimido | R$ 0,04 |
| Metoclopramida (Cloridrato) | 4mg/ml/sol.oral | Frasco 10 ml | R$ 0,75 |
| Metronidazol | 250mg/comp. | Comprimido | R$ 0,10 |
| Metronidazol | 5% creme vaginal | Tubo 50 gramas | R$ 2,15 |
| Metronidazol (Benzoato) | 200mg/5ml/susp. oral | Frasco 100 ml | R$ 2,40 |
| Miconazol (Nitrato) | 2%/locão | Frasco 30 ml | R$ 1,86 |
| Miconazol (Nitrato) | 2%/pó | Frasco 30 ml | R$ 4,95 |
| Monitrato de Isossorbida | 20mg/comp. | Comprimido | R$ 0,10 |
| Neomicina (Sulfato) + Bacitracina (Zíncica) | 5mg + 250ui/g/pom. | Tubo 10 gramas | R$ 1,35 |
| Neomicina (Sulfato) + Bacitracina (Zíncica) | 5mg + 250ui/g/pom. | Tubo 15 gramas | R$ 2,02 |
| Nistatina | 25.000 UI/crem. Vaginal | Tubo 60 gramas | R$ 2,28 |
| Nistatina | 25.000 UI/crem. Vaginal | Tubo 50 gramas | R$ 1,90 |
| Nistatina | 100.000 UI/ml/ susp. Oral | Frasco 30 ml | R$ 3,62 |
| Noretisterona | 0,35mg/comp. | Cartela c/ 35 comprimidos | R$ 0,50 |
| Omeprazol | 20mg/cáps. | Cápsula | R$ 0,23 |
| Paracetamol | 500mg/comp. | Comprimido | R$ 0,09 |
| Paracetamol | 200mg/ml/sol. Oral gts | Frasco 10 ml | R$ 0,85 |
| Paracetamol | 200mg/ml/sol. Oral gts | Frasco 15 ml | R$ 1,27 |
| Paracetamol | 100mg/ml/sol. oral gts. | Frasco 10 ml | R$ 0,70 |
| Paracetamol | 100mg/ml/sol. oral gts. | Frasco 15 ml | R$ 1,00 |
| Prednisona | 20mg/comp. | Comprimido | R$ 0,18 |
| Prednisona | 5mg/comp. | Comprimido | R$ 0,08 |
| Prometazina (Cloridrato) | 25mg/comp. | Comprimido | R$ 0,12 |
| Ranitidina | 150mg/comp. | Comprimido | R$ 0,12 |
| Sais p/ Reidratação Oral | pó p/sol. Oral | Envelope 27,9 G | R$ 0,60 |
| Sinvastatina | 20mg/comp. | Comprimido | R$ 0,38 |
| Sulfametoxazol + Trimetoprima | 400mg + 80mg/comp. | Comprimido | R$ 0,08 |
| Sulfametoxazol + Trimetoprima | 200mg + 40mg/5ml/susp. Oral | Frasco 50 ml | R$ 1,45 |
| Sulfametoxazol + Trimetoprima | 200mg + 40mg/5ml/susp. Oral | Frasco 60 ml | R$ 1,74 |
| Sulfametoxazol + Trimetoprima | 200mg + 40mg/5ml/susp. Oral | Frasco 100 ml | R$ 2,90 |
| Sulfasalazina | 500mg/comp. | Comprimido | R$ 0,40 |
| Tiabendazol | 5%/pom. | Tubo 20 gramas | R$ 2,89 |
| Valproato de Sódio | 50mg/ml/xpe. | Frasco 100 ml | R$ 4,05 |
| Preservativo Masculino | Unidade | R$ 0,30 | |
ANEXO 4 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA (Origem: PRT MS/GM 111/2016, Anexo 4)
| ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA | |||
|---|---|---|---|
| MEDICAMENTO / CORRELATO | APRESENTAÇÃO | UNIDADE DE CADASTRO | PREÇO DE DISPENSAÇÃO (R$) |
| Atenolol | 25mg/comp. | Comprimido | 0 |
| Captopril | 25mg/comp. sulcado | Comprimido | 0 |
| Enalapril | 10mg/comp. | Comprimido | 0 |
| Enalapril | 20mg/comp. | Comprimido | 0 |
| Furosemida | 40mg/comp. | Comprimido | 0 |
| Glibenclamida | 5mg/comp. | Comprimido | 0 |
| Hidroclorotiazida | 25mg/comp. | Comprimido | 0 |
| Losartana | 50mg/comp. | Comprimido | 0 |
| Metformina | 500mg/comp. | Comprimido | 0 |
| Metformina | 850mg/comp. | Comprimido | 0 |
| Metildopa | 250mg/comp.rev. | Comprimido | 0 |
| Metildopa | 500mg/comp.rev. | Comprimido | 0 |
| Nifedipina | 20mg/comp.lib.cont. | Comprimido | 0 |
| Propranolol (Cloridrato) | 40mg/comp. | Comprimido | 0 |
| Verapamila (Cloridrato) | 80mg/comp. | Comprimido | 0 |
| Salbutamol (Sulfato) | 2mg/comp. Sulcado | Comprimido | 0 |
| Salbutamol (Sulfato) | 2mg/5ml/xpe. | Frasco 120 ml | 0 |
| Salbutamol (Sulfato) | 2mg/5ml/xpe. | Frasco 125 ml | 0 |
ANEXO 5 DO ANEXO LXXVII
MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 111/2016, Anexo 5)
MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR

ANEXO LXXVIII
NORMAS OPERACIONAIS DO PROGRAMA FARMÁCIA POPULAR DO BRASIL (PFPB) (Origem: PRT MS/GM 184/2011)
Art. 1º Aprovar as normas operacionais do Programa Farmácia Popular do Brasil (PFPB), na forma dos Capítulos, Seções e Anexos abaixo. (Origem: PRT MS/GM 184/2011, Art. 1º)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 184/2011, CAPÍTULO I)
Art. 2º O PFPB consiste na disponibilização de medicamentos e/ou correlatos à população, pelo Ministério da Saúde (MS), por meio dos meios descritos abaixo: (Origem: PRT MS/GM 184/2011, Art. 2º)
I - a "Rede Própria", constituída por Farmácias Populares, em parceria com os estados, Distrito Federal, municípios e hospitais filantrópicos; e (Origem: PRT MS/GM 184/2011, Art. 2º, I)
II - o "Aqui Tem Farmácia Popular", constituído por meio de convênios com a rede privada de farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 2º, II)
Art. 3º Na "Rede Própria", a Fundação Oswaldo Cruz (FIOCRUZ) será a executora das ações inerentes à aquisição, estocagem, comercialização e dispensação dos medicamentos, podendo para tanto firmar convênios com a União, estados, Distrito Federal, municípios e instituições, sob a supervisão direta e imediata do Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 3º)
Art. 4º No "Aqui tem Farmácia Popular" a operacionalização do PFPB ocorrerá diretamente entre o Ministério da Saúde e a rede privada de farmácias e drogarias, mediante relação contratual regida pela Lei nº 8.666, de 21 de junho de 1993. (Origem: PRT MS/GM 184/2011, Art. 4º)
Art. 5º O elenco de medicamentos e/ou correlatos disponibilizados no âmbito do PFPB, bem como seus valores de referência e preços de dispensação, encontram-se previstos nos Anexos 1, 2, 3, 4 e 5 do Anexo LXXVIII . (Origem: PRT MS/GM 184/2011, Art. 5º)
Art. 6º No "Aqui Tem Farmácia Popular" e na "Rede Própria" os medicamentos definidos para o tratamento da hipertensão arterial e/ou diabetes mellitus serão gratuitos aos usuários. (Origem: PRT MS/GM 184/2011, Art. 6º)
Parágrafo Único. Quando os medicamentos para hipertensão arterial e diabetes mellitus forem comercializados com preço de venda menor que o valor de referência definido, o Ministério da Saúde pagará aos estabelecimentos credenciados no "Aqui tem Farmácia Popular" 100% (cem por cento) do valor de venda. (Origem: PRT MS/GM 184/2011, Art. 6º, Parágrafo Único)
Art. 7º Na "Rede Própria" a dispensação dos medicamentos e/ou correlato ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação estabelecidos. (Origem: PRT MS/GM 184/2011, Art. 7º)
Art. 8º No "Aqui Tem Farmácia Popular" o MS pagará até 90% (noventa por cento) do valor de referência estabelecido aos demais medicamentos e/ou correlato, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo Ministério da Saúde e o Preço de Venda. (Origem: PRT MS/GM 184/2011, Art. 8º)
Art. 9º Para efeitos desta norma consideram-se as seguintes definições: (Origem: PRT MS/GM 184/2011, Art. 9º)
I - concentrador: empresa terceirizada que já possui a comunicação com o sistema de vendas do Programa e irá prover os serviços, a qual é contratada pelas farmácias e drogarias da rede privada; (Origem: PRT MS/GM 184/2011, Art. 9º, I)
II - medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, que contém um ou mais fármacos juntamente com outras substâncias, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico; (Origem: PRT MS/GM 184/2011, Art. 9º, II)
III - correlato: a substância, produto, aparelho ou acessório não enquadrado nos conceitos de droga, medicamento ou insumo farmacêutico, cujo uso ou aplicação esteja ligado à defesa e proteção da saúde individual ou coletiva, à higiene pessoal ou de ambientes, ou a fins diagnósticos e analíticos, os cosméticos e perfumes, e, ainda, os produtos dietéticos, óticos, de acústica médica, odontológicos e veterinários; (Origem: PRT MS/GM 184/2011, Art. 9º, III)
IV - cupom fiscal: documento fiscal emitido em bobina de papel nas operações realizadas pelo equipamento fiscal; (Origem: PRT MS/GM 184/2011, Art. 9º, IV)
V - cupom vinculado: documento não-fiscal emitido em bobina de papel nas operações realizadas pelo equipamento fiscal que contém as informações normatizadas referentes as vendas realizadas pelo Programa; (Origem: PRT MS/GM 184/2011, Art. 9º, V)
VI - Denominação Comum Brasileira (DCB): denominação do fármaco ou princípio farmacologicamente ativo aprovada pelo órgão federal responsável pela vigilância sanitária; (Origem: PRT MS/GM 184/2011, Art. 9º, VI)
VII - princípio ativo: substância quimicamente caracterizada, cuja ação farmacológica é conhecida e responsável total ou parcialmente pelos efeitos terapêuticos do medicamento; (Origem: PRT MS/GM 184/2011, Art. 9º, VII)
VIII - unidade de produto (up): fração unitária corresponde a uma unidade farmacotécnica do medicamento ou a fração unitária de produtos correlatos; (Origem: PRT MS/GM 184/2011, Art. 9º, VIII)
IX - valor de referência (vr): preço referencial fixado pelo Ministério da Saúde para cada princípio ativo e correlato constante do Programa e definido para cada unidade de produto (up); (Origem: PRT MS/GM 184/2011, Art. 9º, IX)
X - preço de dispensação - rede própria (pd-rp): valor do medicamento e correlato fixado para as farmácias da rede própria do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 9º, X)
XI - preço de venda - Aqui Tem (pv-at): valor do medicamento e correlato praticado pelas farmácias e drogarias no ato da venda ao paciente, inclusive com eventuais descontos. (Origem: PRT MS/GM 184/2011, Art. 9º, XI)
CAPÍTULO II
DAS NORMAS DE OPERAÇÃO E FUNCIONAMENTO DO AQUI TEM FARMÁCIA POPULAR
(Origem: PRT MS/GM 184/2011, CAPÍTULO II)
Seção I
DA FINALIDADE
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção I)
Art. 10. O Programa Farmácia Popular do Brasil - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população por meio da rede privada de farmácias e drogarias os medicamentos e correlatos previamente definidos pelo Ministério da Saúde, nos termos do Anexo 2 do Anexo LXXVIII . (Origem: PRT MS/GM 184/2011, Art. 10)
Art. 11. O MS pagará até 90% (noventa por cento) do valor de referência estabelecido, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo MS e o Preço de Venda do medicamento e/ou correlato adquirido. (Origem: PRT MS/GM 184/2011, Art. 11)
Art. 12. Nos casos em que o medicamento e/ou correlato forem comercializados com o preço de venda menor do que o valor de referência definido no Anexo 2 do Anexo LXXVIII , o Ministério da Saúde pagará 90% (noventa por cento) do preço de venda e o paciente a diferença. (Origem: PRT MS/GM 184/2011, Art. 12)
Art. 13. Para o tratamento de hipertensão arterial e/ou diabetes mellitus o Ministério da Saúde pagará 100% (cem por cento) do valor de referência, não cabendo ao usuário o pagamento de qualquer complementação. (Origem: PRT MS/GM 184/2011, Art. 13)
Parágrafo Único. Quando os medicamentos para hipertensão arterial e diabetes mellitus forem comercializados com preço de venda menor que o valor de referência definido no Anexo 1 do Anexo LXXVIII , o Ministério da Saúde pagará 100% do valor de venda. (Origem: PRT MS/GM 184/2011, Art. 13, Parágrafo Único)
Seção II
DA ADESÃO AO PROGRAMA
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção II)
Art. 14. Poderão participar do PFPB as farmácias e drogarias que atenderem aos seguintes critérios: (Origem: PRT MS/GM 184/2011, Art. 14)
I - requerimento e termo de adesão assinados pelo representante legal da empresa; (Origem: PRT MS/GM 184/2011, Art. 14, I)
II - ficha cadastral preenchida; (Origem: PRT MS/GM 184/2011, Art. 14, II)
III - inscrição no Cadastro Nacional de Pessoas Jurídicas (CNPJ), da Secretaria de Receita Federal do Brasil; (Origem: PRT MS/GM 184/2011, Art. 14, III)
IV - registro na junta comercial; (Origem: PRT MS/GM 184/2011, Art. 14, IV)
V - autorização de funcionamento emitida pela Agência Nacional de Vigilância Sanitária (ANVISA), ativa e válida, nos termos da Resolução da Diretoria Colegiada (RDC) nº 238, de 27 de dezembro de 2001, ou licença de funcionamento expedida pelo órgão de vigilância sanitária local, regional ou estadual; (Origem: PRT MS/GM 184/2011, Art. 14, V)
VI - farmacêutico responsável técnico com Certificado de Regularidade Técnica (CRT) válido e emitido pelo Conselho Regional de Farmácia (CRF); (Origem: PRT MS/GM 184/2011, Art. 14, VI)
VII - situação de regularidade com a Previdência Social; (Origem: PRT MS/GM 184/2011, Art. 14, VII)
VIII - dispor de equipamento eletrônico habilitado para emissão de cupom fiscal e vinculado para processamento das operações eletrônicas do Programa, conforme detalhamento constante na Seção VII do Capítulo II; (Origem: PRT MS/GM 184/2011, Art. 14, VIII)
IX - dispor de sistema de gerenciamento eletrônico capaz de realizar requisições eletrônicas, por meio de interface web; e (Origem: PRT MS/GM 184/2011, Art. 14, IX)
X - pessoal treinado para atuar no PFPB, de acordo com as normas e procedimentos estabelecidos. (Origem: PRT MS/GM 184/2011, Art. 14, X)
§ 1º Ressalvado o disposto no inciso VI deste artigo, é dispensável, para a habilitação, a satisfação das exigências previstas nos arts. 28 a 31 da Lei nº 8.666, de 21 de junho de 1993, por força do disposto em seu art. 32, § 1º. (Origem: PRT MS/GM 184/2011, Art. 14, § 1º)
§ 2º Não poderão ser credenciadas novas filiais no programa, cuja matriz esteja passando por processo de auditoria no Departamento Nacional de Auditoria do SUS (DENASUS). (Origem: PRT MS/GM 184/2011, Art. 14, § 2º)
Art. 15. Após a análise dos documentos, a adesão das farmácias e drogarias ao Programa será autorizada pelo MS, por meio do Departamento de Assistência Farmacêutica e Insumos Estratégicos, da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (DAF/SCTIE/MS), desde que atendidos os seguintes atos: (Origem: PRT MS/GM 184/2011, Art. 15)
I - publicação no Diário Oficial da União (DOU); e (Origem: PRT MS/GM 184/2011, Art. 15, I)
II - disponibilização de login e senha para o representante legal das farmácias e drogarias e login e senha para os atendentes para acesso ao Sistema Eletrônico de Autorização de Dispensação de Medicamentos e Correlatos (ADM). (Origem: PRT MS/GM 184/2011, Art. 15, II)
Art. 16. O login e senha provisórios e definitivos a serem utilizados nas transações do Programa serão enviados para o correio eletrônico indicado pelo estabelecimento credenciado em seu cadastro. (Origem: PRT MS/GM 184/2011, Art. 16)
§ 1º Após a publicação da adesão e o cadastro no sistema, o estabelecimento receberá automaticamente um login e senha provisórias que para realizar testes de homologação de conexão entre o seu sistema eletrônico adotado e o Sistema Autorizador do Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 16, § 1º)
§ 2º Após a conclusão dos testes de homologação, o estabelecimento deverá solicitar ao Ministério da Saúde o envio da senha e login definitivos para acesso ao ambiente de produção do Sistema Autorizador. (Origem: PRT MS/GM 184/2011, Art. 16, § 2º)
§ 3º A senha definitiva permitirá, além da realização das transações de venda, o acesso ao link disponível em http://www.saude.gov.br/aquitemfarmaciapopular. (Origem: PRT MS/GM 184/2011, Art. 16, § 3º)
Art. 17. A(s) senha(s) de acesso ao Sistema Autorizador é exclusiva do estabelecimento, sendo que o seu representante legal assume inteira responsabilidade pelo seu uso de acordo com as normas do Programa. (Origem: PRT MS/GM 184/2011, Art. 17)
Art. 18. O estabelecimento credenciado poderá optar por conexão direta ou conexão indireta por meio de terceiros, no caso, concentrador, permanecendo, ainda assim, de inteira responsabilidade do estabelecimento credenciado o cumprimento de todas as normas do Programa. (Origem: PRT MS/GM 184/2011, Art. 18)
§ 1º No caso de opção por conexão indireta, as farmácias e drogarias deverão informar, obrigatoriamente, no ato do cadastro, o CNPJ do concentrador. (Origem: PRT MS/GM 184/2011, Art. 18, § 1º)
§ 2º Os concentradores ficam igualmente sujeitos ao cumprimento das regras estabelecidas para o Programa, podendo ser penalizados com o bloqueio da conexão ao sistema de vendas DATASUS. (Origem: PRT MS/GM 184/2011, Art. 18, § 2º)
Art. 19. A publicação de que trata o art. 15, I configura a relação contratual estabelecida entre o Ministério da Saúde e a empresa, a qual será regida na forma da Lei nº 8.666, de 1993. (Origem: PRT MS/GM 184/2011, Art. 19)
Art. 20. O Requerimento do Termo de Adesão (RTA) terá validade até o dia 30 (trinta) de abril de cada ano. (Origem: PRT MS/GM 184/2011, Art. 20)
§ 1º A renovação do RTA não será automática. (Origem: PRT MS/GM 184/2011, Art. 20, § 1º)
§ 2º As farmácias e drogarias que não efetuarem a renovação no prazo estipulado terão a conexão com o sistema de vendas DATASUS bloqueado até sua regularização. (Origem: PRT MS/GM 184/2011, Art. 20, § 2º)
Seção III
DA AUTORIZAÇÃO DE COMERCIALIZAÇÃO E DA DISPENSAÇÃO DOS MEDICAMENTOS E CORRELATOS
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção III)
Art. 21. A Autorização de Dispensação de Medicamentos e Correlatos (ADM) será processada por meio eletrônico, em tempo real, com base no código de barras EAN da embalagem do medicamento e/ou do correlato. (Origem: PRT MS/GM 184/2011, Art. 21)
Art. 22. As ADMs serão validadas pelo Ministério da Saúde quando contiverem todas as informações indicadas na Seção VII do Capítulo II, desde que atendidos todos os critérios do PFPB. (Origem: PRT MS/GM 184/2011, Art. 22)
Art. 23. A cada operação, obrigatoriamente, o estabelecimento deve emitir duas vias do cupom fiscal e do cupom vinculado. (Origem: PRT MS/GM 184/2011, Art. 23)
Art. 24. O cupom vinculado, obrigatoriamente, deverá conter as seguintes informações, conforme modelo sugerido no Anexo 5 do Anexo LXXVIII : (Origem: PRT MS/GM 184/2011, Art. 24)
I - nome completo do beneficiário ou seu representante legal, por extenso; (Origem: PRT MS/GM 184/2011, Art. 24, I)
II - número do Cadastro de Pessoas Físicas (CPF) do beneficiário ou seu representante legal; (Origem: PRT MS/GM 184/2011, Art. 24, II)
III - assinatura do beneficiário ou seu representante legal; (Origem: PRT MS/GM 184/2011, Art. 24, III)
IV - endereço do beneficiário ou espaço para preenchimento; (Origem: PRT MS/GM 184/2011, Art. 24, IV)
V - razão social e CNPJ da empresa; (Origem: PRT MS/GM 184/2011, Art. 24, V)
VI - nome do responsável legal da empresa; (Origem: PRT MS/GM 184/2011, Art. 24, VI)
VII - número de autorização do DATASUS; (Origem: PRT MS/GM 184/2011, Art. 24, VII)
VIII - UF e Número de inscrição do médico no Conselho Regional de Medicina (CRM); (Origem: PRT MS/GM 184/2011, Art. 24, VIII)
IX - valor total da venda, do subsídio do MS, da parcela a ser paga pelo beneficiário e do custo-zero dos medicamentos para hipertensão arterial e diabetes melittus; (Origem: PRT MS/GM 184/2011, Art. 24, IX)
X - data da compra; (Origem: PRT MS/GM 184/2011, Art. 24, X)
XI - nome do medicamento, apresentação e/ou correlato; (Origem: PRT MS/GM 184/2011, Art. 24, XI)
XII - código de barras do medicamento e/ou correlato; (Origem: PRT MS/GM 184/2011, Art. 24, XII)
XIII - posologia diária ou prescrição diária; (Origem: PRT MS/GM 184/2011, Art. 24, XIII)
XIV - quantidade autorizada; (Origem: PRT MS/GM 184/2011, Art. 24, XIV)
XV - saldo atual (conforme posologia ou prescrição diária); (Origem: PRT MS/GM 184/2011, Art. 24, XV)
XVI - data da próxima compra; (Origem: PRT MS/GM 184/2011, Art. 24, XVI)
XVII - identificação do operador da transação; e (Origem: PRT MS/GM 184/2011, Art. 24, XVII)
XVIII - número da Ouvidoria do Ministério da Saúde para consultas ou denúncias (0800 61 136). (Origem: PRT MS/GM 184/2011, Art. 24, XVIII)
Art. 25. O paciente, obrigatoriamente, deve assinar o cupom vinculado, sendo que uma via deve ser mantida pelo estabelecimento e a outra entregue ao paciente. (Origem: PRT MS/GM 184/2011, Art. 25)
Art. 26. O estabelecimento deve manter por 5 (cinco) anos as vias assinadas dos cupons vinculados e cupons fiscais arquivadas em ordem cronológica de emissão, que deverão ser disponibilizados sempre que necessário. (Origem: PRT MS/GM 184/2011, Art. 26)
Art. 27. Para a comercialização e a dispensação dos medicamentos e/ou correlatos no âmbito do PFPB, as farmácias e drogarias devem obrigatoriamente observar as seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 27)
I - apresentação pelo paciente, de documento no qual conste o seu número de CPF, e sua fotografia; (Origem: PRT MS/GM 184/2011, Art. 27, I)
II - apresentação de prescrição médica, no caso de medicamentos, ou prescrição, laudo ou atestado médico, no caso de correlatos, com as seguintes informações: (Origem: PRT MS/GM 184/2011, Art. 27, II)
a) número de inscrição do médico no CRM, assinatura e carimbo médico e endereço do consultório; (Origem: PRT MS/GM 184/2011, Art. 27, II, a)
b) data da expedição da prescrição médica; e (Origem: PRT MS/GM 184/2011, Art. 27, II, b)
c) nome e endereço residencial do paciente. (Origem: PRT MS/GM 184/2011, Art. 27, II, c)
§ 1º As farmácias e drogarias deverão providenciar uma cópia da prescrição, laudo ou atestado médico apresentado pelo paciente no ato da compra e mantê-la por 5 (cinco) anos para apresentação sempre que for solicitado. (Origem: PRT MS/GM 184/2011, Art. 27, § 1º)
§ 2º Caberá as farmácias e drogarias manter por um prazo de 5 (cinco) anos para apresentação, sempre que necessário, as notas fiscais de aquisição dos medicamentos e/ou correlatos do PFPB junto aos fornecedores. (Origem: PRT MS/GM 184/2011, Art. 27, § 2º)
Art. 28. Para os medicamentos do Programa, as prescrições terão validade de 120 (cento e vinte) dias, a partir de sua emissão, exceto para os contraceptivos, cuja validade é de 12 (doze) meses. (Origem: PRT MS/GM 184/2011, Art. 28)
Parágrafo Único. As vendas posteriores aos períodos fixados no caput deste artigo devem necessariamente ser realizadas mediante a apresentação de nova prescrição. (Origem: PRT MS/GM 184/2011, Art. 28, Parágrafo Único)
Art. 29. O quantitativo do medicamento solicitado deve corresponder à posologia mensal compatível com os consensos de tratamento da doença para o qual é indicado e a dispensação deve obedecer os limites definidos pelo Programa. (Origem: PRT MS/GM 184/2011, Art. 29)
§ 1º Nos casos das prescrições que ultrapassam a quantidade mensal estabelecida, o interessado deverá enviar ao DAF/SCTIE/MS, a receita contendo os dados do usuário (nome, endereço e CPF) juntamente com um relatório feito pelo médico, classificando a patologia com o seu CID, justificando dessa forma a prescrição. (Origem: PRT MS/GM 184/2011, Art. 29, § 1º)
§ 2º A autorização para a dispensação de medicamentos que ultrapassar a quantidade mensal (extra-teto) terá validade de 120 (cento e vinte) dias, podendo ser renovada por meio do envio da documentação atualizada ao Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 29, § 2º)
Art. 30. Para a comercialização de Fralda Geriátrica no âmbito do PFPB, as farmácias e drogarias obrigatoriamente devem observar as seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 30)
I - disponibilizar fraldas geriátricas para incontinência de produtores que cumpram os requisitos técnicos estabelecidos pela Portaria nº 1480/GM/MS, de 31 de dezembro de 1990, e nº 10/RDC/ANVISA, de 21 de outubro de 1999; (Origem: PRT MS/GM 184/2011, Art. 30, I)
II - para a dispensação de fraldas geriátricas para incontinência, o paciente deverá ter idade igual ou superior a 60 (sessenta) anos; e (Origem: PRT MS/GM 184/2011, Art. 30, II)
III - apresentação, pelo paciente, de documento no qual conste seu número de CPF, e sua fotografia. (Origem: PRT MS/GM 184/2011, Art. 30, III)
Art. 31. Para as Fraldas Geriátricas do PFPB, as prescrições, laudos ou atestados médicos terão validade de 120 (cento e vinte) dias, a partir de sua emissão, podendo a retirada ocorrer a cada 10 (dez) dias, ficando limitado a 4 (quatro) unidades/dia de fralda. (Origem: PRT MS/GM 184/2011, Art. 31)
Parágrafo Único. As vendas posteriores ao período fixado no caput deste artigo devem necessariamente ser realizadas mediante a apresentação de nova prescrição/laudo/atestado médico. (Origem: PRT MS/GM 184/2011, Art. 31, Parágrafo Único)
Art. 32. Fica dispensada a obrigatoriedade da presença física do paciente, titular da prescrição, laudo ou atestado médico, quando se enquadrar nas seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 32)
I - incapacidade nos termos dos art. 3º e 4º do Código Civil, desde que comprovado; e (Origem: PRT MS/GM 184/2011, Art. 32, I)
II - pessoas idosas, com idade igual ou superior a 60 (sessenta) anos. (Origem: PRT MS/GM 184/2011, Art. 32, II)
§ 1º A dispensação dos medicamentos e/ou correlatos, nos casos previstos no art. 32, incisos I e II do Anexo LXXVIII , somente será realizada mediante apresentação dos seguintes documentos: (Origem: PRT MS/GM 184/2011, Art. 32, § 1º)
I - do paciente, titular da receita; CPF, RG ou certidão de nascimento; e (Origem: PRT MS/GM 184/2011, Art. 32, § 1º, I)
II - do representante legal, o qual assumirá, juntamente com o estabelecimento, as responsabilidades pela efetivação da transação: CPF e RG. (Origem: PRT MS/GM 184/2011, Art. 32, § 1º, II)
§ 2º Considera-se representante legal aquele que for: (Origem: PRT MS/GM 184/2011, Art. 32, § 2º)
I - declarado por sentença judicial; (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, I)
II - portador de instrumento público de procuração que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou correlatos junto ao programa; (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, II)
III - portador de instrumento particular de procuração com reconhecimento de firma, que autorize a compra de medicamentos e/ou correlatos junto ao programa; e (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, III)
IV - portador de identidade civil que comprove a dependência do menor de idade, titular da receita médica. (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, IV)
§ 3º As farmácias e drogarias deverão providenciar uma cópia da documentação prevista no § 1º e § 2º deste artigo no ato da compra e mantê-la por 5 (cinco) anos para apresentação sempre que for solicitada. (Origem: PRT MS/GM 184/2011, Art. 32, § 3º)
§ 4º Aos usuários comprovadamente analfabetos, será aceita a digital no Cupom Vinculado, desde que o próprio paciente compareça ao estabelecimento credenciado para a aquisição dos medicamentos e/ou correlatos do PFPB, devendo uma cópia do RG do paciente ser providenciada pelo estabelecimento e arquivada por 5 (cinco) anos. (Origem: PRT MS/GM 184/2011, Art. 32, § 4º)
Seção IV
DO PAGAMENTO PELO MINISTÉRIO DA SAÚDE
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção IV)
Art. 33. O Ministério da Saúde efetuará os pagamentos para as farmácias e drogarias credenciados no mês subsequente, após o processamento das Autorizações de Dispensação de Medicamentos e Correlatos (ADM), validadas no mês anterior. (Origem: PRT MS/GM 184/2011, Art. 33)
Art. 34. Para estabelecimentos matriz e filiais, os valores devidos serão agrupados e os pagamentos serão efetuados exclusivamente para a empresa matriz. (Origem: PRT MS/GM 184/2011, Art. 34)
Art. 35. Os pagamentos serão efetuados em contas específicas abertas pelo Fundo Nacional de Saúde nos valores atestados pelo Diretor do DAF/SCTIE/MS, e observadas as normas próprias da administração financeira pública. (Origem: PRT MS/GM 184/2011, Art. 35)
Art. 36. O atesto dos pagamentos terá por base as informações geradas pelo Sistema Autorizador DATASUS. (Origem: PRT MS/GM 184/2011, Art. 36)
Art. 37. Para fins de verificação pelo estabelecimento credenciado, estará disponível em http://www.saude.gov.br/aquitemfarmaciapopular, os relatórios das transações realizadas, bem como as transações rejeitadas no processamento. (Origem: PRT MS/GM 184/2011, Art. 37)
Seção V
DA IDENTIDADE VISUAL E DA PUBLICIDADE DO PROGRAMA
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção V)
Art. 38. As farmácias e drogarias credenciadas deverão obrigatoriamente exibir em seus estabelecimentos peças publicitárias que identifiquem o credenciamento ao PFPB, indicadas a seguir: (Origem: PRT MS/GM 184/2011, Art. 38)
I - adesivo anti-falsificação fornecido pelo MS, sendo proibido sua reprodução, e que deverá ser utilizado próximo ao caixa de pagamento; (Origem: PRT MS/GM 184/2011, Art. 38, I)
II - banner produzido pelo estabelecimento credenciado de acordo com as normas de publicidade do PFPB, a ser afixado na frente do estabelecimento credenciado; e (Origem: PRT MS/GM 184/2011, Art. 38, II)
III - tabela contendo os valores de referência contidos nos Anexos 1 e 2 do Anexo LXXVIII , disponível em http://www.saude.gov.br/aquitemfarmaciapopular. (Origem: PRT MS/GM 184/2011, Art. 38, III)
§ 1º A logomarca do "Aqui Tem Farmácia Popular" não pode ser alterada e é obrigatório o uso do slogan ou marca do Governo Federal, vinculada à logomarca, bem como a inscrição do "Ministério da Saúde". (Origem: PRT MS/GM 184/2011, Art. 38, § 1º)
§ 2º É proibida a publicidade em domicílio de paciente ou o uso do nome do PFPB e das peças publicitárias fornecidas pelo Ministério da Saúde em qualquer tipo de manifestação diversa das previstas neste Anexo. (Origem: PRT MS/GM 184/2011, Art. 38, § 2º)
§ 3º Não é permitido vincular o PFPB a outras marcas, promoções e/ou demais produtos do estabelecimento credenciado. (Origem: PRT MS/GM 184/2011, Art. 38, § 3º)
Art. 39. Os estabelecimentos habilitados somente poderão utilizar material publicitário e fazer campanha publicitária quando iniciar as vendas, seguindo as diretrizes definidas pelo Ministério da Saúde no Manual de Diretrizes para Aplicação em Peças Publicitárias específico do Programa, disponível em http://www.saude.gov.br/aquitemfarmaciapopular. (Origem: PRT MS/GM 184/2011, Art. 39)
Art. 40. Não é permitido às farmácias e drogarias não-credenciadas, descredenciadas ou apenas "em fase de credenciamento" exibirem publicidade referente ao PFPB, uma vez que somente o processo de credenciamento não garante que o mesmo será aprovado. (Origem: PRT MS/GM 184/2011, Art. 40)
Art. 41. O não-cumprimento das normas de publicidade do PFPB sujeitará o estabelecimento às penalidades previstas na Seção VI do Capítulo II. (Origem: PRT MS/GM 184/2011, Art. 41)
Seção VI
DO CONTROLE, DO MONITORAMENTO E DAS PENALIDADES
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção VI)
Art. 42. As transações das empresas serão verificadas mensalmente, ou quando houver necessidade, segundo os dados processados pelo Sistema Autorizador de Vendas, para controle e monitoramento do Programa. (Origem: PRT MS/GM 184/2011, Art. 42)
Art. 43. O Ministério da Saúde solicitará ao estabelecimento credenciado, sempre que necessário, a prestação de informações detalhadas sobre as suas operações, cópia das prescrições, laudos ou atestados médicos, das notas fiscais, dos cupons fiscais e vinculados, amostra de material publicitário e demais documentos comprobatórios das autorizações realizadas, as quais deverão ser encaminhadas no prazo máximo de 10 (dez) dias. (Origem: PRT MS/GM 184/2011, Art. 43)
Art. 44. O descumprimento de qualquer das regras dispostas neste Anexo e nos Anexos 1, 2, 3, 4 e 5 do Anexo LXXVIII pelas farmácias e drogarias caracteriza prática de irregularidade no âmbito do PFPB, sendo consideradas situações irregulares, dentre outras: (Origem: PRT MS/GM 184/2011, Art. 44)
I - comercializar e dispensar medicamentos e/ou correlatos fora da estrita observância das regras de execução do PFPB, dispostas neste Anexo; (Origem: PRT MS/GM 184/2011, Art. 44, I)
II - deixar de exigir a prescrição, laudo ou atestado médico, a apresentação do CPF e a assinatura do titular do CPF no cupom vinculado; (Origem: PRT MS/GM 184/2011, Art. 44, II)
III - deixar de cobrar do paciente o pagamento da sua parcela referente à compra do(s) medicamento(s) e/ou correlato(s), salvo para as dispensações de medicamentos indicados para hipertensão arterial e diabetes mellitus que poderá atingir até 100% (cem por cento) do vr; (Origem: PRT MS/GM 184/2011, Art. 44, III)
IV - comercializar e dispensar medicamentos e/ou correlatos do Programa em nome de terceiros, conforme disposto no art. 32; (Origem: PRT MS/GM 184/2011, Art. 44, IV)
V - estornar a venda cancelada ou irregular, com prazo superior a 7 (sete) dias da consolidação da transação; (Origem: PRT MS/GM 184/2011, Art. 44, V)
VI - comercializar medicamentos e correlatos com senha diversa daquela que foi conferida exclusivamente ao estabelecimento credenciado; (Origem: PRT MS/GM 184/2011, Art. 44, VI)
VII - firmar convênios e parcerias com empresas, cooperativas e instituições congêneres para operações coletivas no âmbito do PFPB; (Origem: PRT MS/GM 184/2011, Art. 44, VII)
VIII - fazer uso publicitário do PFPB fora das regras definidas neste Anexo; (Origem: PRT MS/GM 184/2011, Art. 44, VIII)
IX - deixar de expor as peças publicitárias que identifiquem o credenciamento ao PFPB, estabelecidas no art. 38; (Origem: PRT MS/GM 184/2011, Art. 44, IX)
X - cadastrar pacientes em nome do PFPB fora do estabelecimento, especialmente, em domicílio; (Origem: PRT MS/GM 184/2011, Art. 44, X)
XI - entregar medicamentos e/ou correlatos do PFPB fora do estabelecimento, especialmente em domicílio, uma vez que a venda exige a presença do paciente no estabelecimento, munido dos documentos necessários; (Origem: PRT MS/GM 184/2011, Art. 44, XI)
XII - deixar de observar as regras do órgão de vigilância sanitária para funcionamento do estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 44, XII)
XIII - permitir que pessoa distinta do titular da receita ou seu procurador legal assine em nome do paciente, o que poderá caracterizar falsidade ideológica; (Origem: PRT MS/GM 184/2011, Art. 44, XIII)
XIV - rasurar quaisquer documentos necessários para a validação da venda dos itens constantes do elenco do programa; (Origem: PRT MS/GM 184/2011, Art. 44, XIV)
XV - receber a prescrição, laudo ou atestado médico com data posterior a autorização consolidada; (Origem: PRT MS/GM 184/2011, Art. 44, XV)
XVI - lançar no sistema de vendas do programa, informações divergentes das constantes na prescrição, laudo ou atestado médico e no documento do paciente; (Origem: PRT MS/GM 184/2011, Art. 44, XVI)
XVII - dispensar medicamentos e/ou correlatos cuja prescrição, laudo ou atestado médico que já tiverem sido dispensados ou fornecidos, cuja comprovação se dê por meio da presença de carimbo com a inscrição fornecido; e (Origem: PRT MS/GM 184/2011, Art. 44, XVII)
XVIII - realizar a substituição do medicamento prescrito em desacordo com a legislação vigente. (Origem: PRT MS/GM 184/2011, Art. 44, XVIII)
Parágrafo Único. O DAF/SCTIE/MS poderá, a qualquer tempo, requisitar os documentos que comprovam a regularidade das farmácias e drogarias junto ao órgão de vigilância sanitária. (Origem: PRT MS/GM 184/2011, Art. 44, Parágrafo Único)
Art. 45. O DAF/SCTIE/MS suspenderá preventivamente os pagamentos e/ou a conexão com os Sistemas DATASUS sempre que detectar indícios ou notícias de irregularidade(s) na execução do PFPB pelos estabelecimentos. (Origem: PRT MS/GM 184/2011, Art. 45)
§ 1º A empresa com suspeita de prática irregular será notificada pelo DAF/SCTIE/MS a apresentar, no prazo de 15 (quinze) dias, esclarecimentos e documentos sobre os fatos averiguados. (Origem: PRT MS/GM 184/2011, Art. 45, § 1º)
§ 2º Com base na documentação apresentada pelo estabelecimento e não sanadas os indícios ou notícias de irregularidades, o DAF/SCTIE/MS solicitará ao DENASUS a instauração de procedimento para averiguação dos fatos. (Origem: PRT MS/GM 184/2011, Art. 45, § 2º)
§ 3º Em casos excepcionais, o DAF/SCTIE/MS poderá solicitar ao DENASUS a instauração de procedimento para averiguação dos fatos, antes que seja oportunizado à empresa um prazo para apresentar esclarecimentos. (Origem: PRT MS/GM 184/2011, Art. 45, § 3º)
Art. 46. Recebido o relatório conclusivo do procedimento instaurado pelo DENASUS, o DAF/SCTIE/MS, no prazo de 15 (quinze) dias, decidirá sobre o descredenciamento do estabelecimento, sem prejuízo da imposição das penalidades previstas no art. 87 da Lei nº 8.666, de 1993. (Origem: PRT MS/GM 184/2011, Art. 46)
Parágrafo Único. O DAF/SCTIE/MS poderá, ainda, caso julgar cabível, encaminhar o relatório conclusivo dos trabalhos do DENASUS à Policia Federal e ao Ministério Público para a adoção das providências pertinentes, tendo em vista a atuação desses órgãos na apuração das infrações penais em detrimento de bens, serviços e interesses da União. (Origem: PRT MS/GM 184/2011, Art. 46, Parágrafo Único)
Art. 47. Decidido pelo cancelamento, o estabelecimento será notificado para recolher aos cofres públicos o débito correspondente ao valor repassado pelo Ministério da Saúde nas transações consideradas irregulares, no prazo de 15 (quinze) dias, sem prejuízo da multa prevista no art. 49. (Origem: PRT MS/GM 184/2011, Art. 47)
§ 1º Caso o valor não seja recolhido no prazo fixado no caput, será instaurada Tomada de Contas Especial pelo Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 47, § 1º)
§ 2º Em conformidade com os ditames da Lei nº 10.522, de 19 de julho de 2002, será realizada a inscrição do nome da empresa no Cadastro Informativo de Créditos não Quitados do Setor Público Federal (CADIN), sem prejuízo do ajuizamento da pertinente ação de cobrança pela Procuradoria da Fazenda Nacional. (Origem: PRT MS/GM 184/2011, Art. 47, § 2º)
Art. 48. Ao estabelecimento com decisão de cancelamento definitivo que pretender pleitear a liquidação de eventual competência pendente caberá apresentar requerimentos por escrito ao DAF/SCTIE/MS, no prazo de 15 (quinze) dias, a contar da publicação de cancelamento. (Origem: PRT MS/GM 184/2011, Art. 48)
Parágrafo Único. Recebido o requerimento, o DAF/SCTIE/MS solicitará a realização de nova auditoria pelo DENASUS no estabelecimento, o qual apurará o montante a ser liquidado, nos termos da legislação vigente. (Origem: PRT MS/GM 184/2011, Art. 48, Parágrafo Único)
Art. 49. O descumprimento de qualquer das regras estabelecidas no presente instrumento ensejará à aplicação de multa de até 10% (dez por cento), calculada sobre o montante das vendas efetuadas no âmbito do PFPB referente ao último trimestre das transações consolidadas. (Origem: PRT MS/GM 184/2011, Art. 49)
Parágrafo Único. Caso o estabelecimento tenha aderido ao Programa em um prazo menor que 90 (noventa) dias, o cálculo será realizado levando-se em consideração as vendas efetuadas desde a data da publicação da sua adesão. (Origem: PRT MS/GM 184/2011, Art. 49, Parágrafo Único)
Art. 50. O estabelecimento e suas filiais, que forem descredenciado por motivo de irregularidades, se tiver interesse, somente poderá aderir ao Programa Farmácia Popular do Brasil/CoPagamento, novamente, após um período superior a 2 (dois) anos do cancelamento do contrato. (Origem: PRT MS/GM 184/2011, Art. 50)
Parágrafo Único. A penalidade prevista no caput se estende ao proprietário ou empresário individual, aos sócios empresários e, ainda, o farmacêutico responsável à época em que foram praticadas as irregularidades que ocasionaram o cancelamento da empresa detentora do Cadastro Nacional de Pessoa Jurídica (CNPJ) utilizado para a adesão ao Programa, que porventura pretenda abrir outro estabelecimento ou fazer novo cadastro para fins de adesão ao Programa. (Origem: PRT MS/GM 184/2011, Art. 50, Parágrafo Único)
Seção VII
DO PROCESSAMENTO ELETRÔNICO DAS AUTORIZAÇÕES DAS DISPENSAÇÕES DE MEDICAMENTOS E CORRELATOS
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção VII)
Art. 51. O processamento eletrônico da Autorização de Dispensação de Medicamentos e Correlatos (ADM) é composto de três fases, onde em cada uma das fases, o estabelecimento credenciado envia dados ao Sistema Autorizador referente à transação que, por sua vez, verificará as informações constantes em sua base de dados e retornará à verificação dos dados. (Origem: PRT MS/GM 184/2011, Art. 51)
Art. 52. A primeira fase do processo eletrônico só poderá ser realizada mediante a utilização de solução de segurança fornecida pelo Ministério da Saúde nas seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 52)
I - a solução de segurança será responsável pela identificação da estação de trabalho (computador) e da transação; (Origem: PRT MS/GM 184/2011, Art. 52, I)
II - a identificação da transação é obtida através da solução de segurança; (Origem: PRT MS/GM 184/2011, Art. 52, II)
III - cada estação de trabalho (computador) deve ser identificada e cadastrada junto ao Ministério da Saúde para realização da dispensação, conforme orientações a seguir: (Origem: PRT MS/GM 184/2011, Art. 52, III)
a) o cadastramento é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 52, III, a)
b) as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 184/2011, Art. 52, III, b)
c) o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 184/2011, Art. 52, III, c)
§ 1º É de responsabilidade do estabelecimento a instalação, configuração e integração da solução de segurança. (Origem: PRT MS/GM 184/2011, Art. 52, § 1º)
§ 2º O descumprimento dos requisitos previstos neste artigo invializará a venda. (Origem: PRT MS/GM 184/2011, Art. 52, § 2º) (com redação dada pela PRT MS/GM 726/2011)
Art. 53. Todas as fases do processo eletrônico só poderão ser realizadas mediante autenticação eletrônica do atendente com as seguintes determinações: (Origem: PRT MS/GM 184/2011, Art. 53)
I - o cadastramento de todos os atendentes é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 53, I)
II - as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 184/2011, Art. 53, II)
III - o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 184/2011, Art. 53, III)
Art. 54. Na primeira fase do processo eletrônico, o estabelecimento informará os seguintes dados: (Origem: PRT MS/GM 184/2011, Art. 54)
I - código da solicitação; (Origem: PRT MS/GM 184/2011, Art. 54, I)
II - CNPJ do estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 54, II)
III - CPF do paciente; (Origem: PRT MS/GM 184/2011, Art. 54, III)
IV - CRM do médico que emitiu a prescrição; (Origem: PRT MS/GM 184/2011, Art. 54, IV)
V - unidade federativa que emitiu o CRM do médico prescritor; (Origem: PRT MS/GM 184/2011, Art. 54, V)
VI - data de emissão da prescrição; (Origem: PRT MS/GM 184/2011, Art. 54, VI)
VII - identificador da transação; (Origem: PRT MS/GM 184/2011, Art. 54, VII)
VIII - lista de medicamentos e correlatos, na qual para cada item deverá ser informado: (Origem: PRT MS/GM 184/2011, Art. 54, VIII)
a) código de barras EAN da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, a)
b) quantidade solicitada, em unidade conforme definida pelo Programa; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, b)
c) valor unitário do medicamento e correlato; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, c)
d) quantidade diária prescrita; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, d)
IX - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 54, IX)
X - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 54, X)
XI - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 54, XI)
XII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 54, XII)
Art. 55. Na segunda fase, após ter recebido a confirmação da primeira fase, o estabelecimento deve informar ao Sistema Autorizador os dados que fazem parte do processo de autorização. Os dados são: (Origem: PRT MS/GM 184/2011, Art. 55)
I - código da solicitação, enviado na primeira fase; (Origem: PRT MS/GM 184/2011, Art. 55, I)
II - número da pré-autorização gerado pelo Sistema Autorizador e recebido pelo estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 55, II)
III - número do cupom fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 55, III)
IV - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 55, IV)
V - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 55, V)
VI - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 55, VI)
VII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 55, VII)
§ 1º O Sistema Autorizador confirmará os medicamentos e correlatos autorizados ou uma mensagem e código de erro em casos de não autorização. (Origem: PRT MS/GM 184/2011, Art. 55, § 1º)
§ 2º Os códigos de retorno do sistema autorizador estão disponíveis em www.saude.gov.br/aquitemfarmaciapopular e também no endereço eletrônico do PFPB. (Origem: PRT MS/GM 184/2011, Art. 55, § 2º)
§ 3º As transações realizadas com mais de um medicamento e/ou correlato retornarão com a mesma autorização. (Origem: PRT MS/GM 184/2011, Art. 55, § 3º)
Art. 56. Na terceira e última fase, o estabelecimento confirmará o recebimento da pré-autorização e enviará os seguintes dados: (Origem: PRT MS/GM 184/2011, Art. 56)
I - número da pré-autorização; (Origem: PRT MS/GM 184/2011, Art. 56, I)
II - número do cupom fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 56, II)
III - lista de medicamentos e correlatos autorizados com as seguintes informações: (Origem: PRT MS/GM 184/2011, Art. 56, III)
a) código de barras (EAN) da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 184/2011, Art. 56, III, a)
b) quantidade autorizada em unidades de produto (up); (Origem: PRT MS/GM 184/2011, Art. 56, III, b)
c) valor da parcela do MS informado pelo Sistema Autorizador; (Origem: PRT MS/GM 184/2011, Art. 56, III, c)
d) valor da parcela do paciente informada pelo Sistema Autorizador; (Origem: PRT MS/GM 184/2011, Art. 56, III, d)
IV - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 56, IV)
V - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 56, V)
VI - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 56, VI)
VII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 56, VII)
Parágrafo Único. O estabelecimento receberá confirmação e finalização do processo de autorização da dispensação dos
edicamentos e dos correlatos. (Origem: PRT MS/GM 184/2011, Art. 56, Parágrafo Único)
Art. 57. Para eventual estorno de transações já efetuadas serão necessários os seguintes dados: (Origem: PRT MS/GM 184/2011, Art. 57)
I - número da autorização; (Origem: PRT MS/GM 184/2011, Art. 57, I)
II - número do cupom fiscal; (Origem: PRT MS/GM 184/2011, Art. 57, II)
III - CNPJ do estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 57, III)
IV - lista de medicamentos e correlatos, na qual para cada item deverá ser informado:(Origem:PRT MS/GM 184/2011, Art. 57,V)
a) código de barras EAN da apresentação do medicamento e correlato; e (Origem: PRT MS/GM 184/2011, Art. 57, IV, a)
b) quantidade a ser estornada. (Origem: PRT MS/GM 184/2011, Art. 57, IV, b)
V - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 57, V)
VI - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 57, VI)
VII - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 57, VII)
VIII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 57, VIII)
Art. 58. A configuração da conexão do sistema eletrônico das farmácias e drogarias com o Sistema Autorizador se dará pelo envio automático de mensagem eletrônica com o usuário e senha para o endereço fornecido pelo estabelecimento no momento do cadastro no Programa. (Origem: PRT MS/GM 184/2011, Art. 58)
Art. 59. Em http://www.saude.gov.br/aquitemfarmaciapopular, estão disponíveis informações técnicas do Programa, bem como do processamento por meio do sistema eletrônico. (Origem: PRT MS/GM 184/2011, Art. 59)
CAPÍTULO III
DAS NORMAS DE OPERAÇÃO E FUNCIONAMENTO DA REDE PRÓPRIA
(Origem: PRT MS/GM 184/2011, CAPÍTULO III)
Seção I
DA DISPENSAÇÃO DOS MEDICAMENTOS E CORRELATOS NAS UNIDADES DA REDE PRÓPRIA DO PROGRAMA FARMÁCIA POPULAR
(Origem: PRT MS/GM 184/2011, CAPÍTULO III, Seção I)
Art. 60. A dispensação de medicamentos e correlatos na Rede Própria do PFPB ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação descritos no Anexo 2 do Anexo LXXVIII . (Origem: PRT MS/GM 184/2011, Art. 60)
Parágrafo Único. A dispensação de que trata o caput ocorrerá de acordo com o Manual de Procedimentos Operacionais Padrão e pelo Manual Básico. (Origem: PRT MS/GM 184/2011, Art. 60, Parágrafo Único)
Art. 61. Os medicamentos para o tratamento de hipertensão arterial e diabetes mellitus serão dispensados gratuitamente pelas unidades do Programa. (Origem: PRT MS/GM 184/2011, Art. 61)
Art. 62. Os procedimentos para dispensação dos medicamentos para o tratamento de hipertensão arterial e diabetes mellitus ocorrerão por meio do sistema de vendas DATASUS, de acordo com as regras definidas na Seção III do Capítulo II: (Origem: PRT MS/GM 184/2011, Art. 62)
I - apresentação pelo paciente, de documento no qual conste o número de CPF, e sua fotografia; (Origem: PRT MS/GM 184/2011, Art. 62, I)
II - apresentação de prescrição dentro do prazo de validade de 120 (cento e vinte) dias a partir de sua emissão; e (Origem: PRT MS/GM 184/2011, Art. 62, II)
III - o quantitativo de medicamento dispensado deve corresponder à posologia mensal compatível com os consensos de tratamento da doença para o qual é indicado e a dispensação deve obedecer os limites definidos pelo PFPB. (Origem: PRT MS/GM 184/2011, Art. 62, III)
Seção II
MODELO DE GESTÃO DA REDE PRÓPRIA
(Origem: PRT MS/GM 184/2011, CAPÍTULO III, Seção II)
Art. 63. O PFPB realizado em ação conjunta entre o Ministério da Saúde e a Fundação Oswaldo Cruz (FIOCRUZ), será coordenado por um Conselho Gestor, vinculado diretamente à SCTIE/MS. (Origem: PRT MS/GM 184/2011, Art. 63)
Parágrafo Único. O Conselho Gestor do PFPB terá a seguinte composição: (Origem: PRT MS/GM 184/2011, Art. 63, Parágrafo Único)
I - três representantes da SCTIE/MS, sendo um deles o Diretor do DAF/SCTIE/MS, que o coordenará; e (Origem: PRT MS/GM 184/2011, Art. 63, Parágrafo Único, I)
II - três representantes indicados pela Presidência da FIOCRUZ. (Origem: PRT MS/GM 184/2011, Art. 63, Parágrafo Único, II)
Art. 64. As atividades do PFPB serão desenvolvidas de acordo com a Lei nº 10.858, de 13 de abril de 2004, pela FIOCRUZ, por meio da Gerência Técnica e da Gerência Administrativa do Programa Farmácia Popular do Brasil e pelo Ministério da Saúde, por meio da SCTIE/MS, sob a responsabilidade do DAF/SCTIE/MS. (Origem: PRT MS/GM 184/2011, Art. 64)
Art. 65. Ao Conselho Gestor do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 184/2011, Art. 65)
I - aprovar anualmente o Plano de Metas e o Plano de Desenvolvimento; (Origem: PRT MS/GM 184/2011, Art. 65, I)
II - aprovar anualmente o Relatório de Gestão do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, II)
III - monitorar a execução orçamentária e a movimentação financeira; (Origem: PRT MS/GM 184/2011, Art. 65, III)
IV - acompanhar as propostas de convênios com instituições públicas ou privadas que visem apoiar o desenvolvimento do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, IV)
V - aprovar o Manual Básico do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, V)
VI - orientar e participar da formulação de indicadores de resultados e do impacto do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, VI)
VII - sugerir a habilitação de parceiros e a celebração de convênios que se façam necessárias, não-previstas ou contempladas nas normas e requisitos estabelecidos; e (Origem: PRT MS/GM 184/2011, Art. 65, VII)
VIII - propor o elenco de medicamentos e/ou correlatos, e definição do preço de dispensação a ser disponibilizado pelo PFPB. (Origem: PRT MS/GM 184/2011, Art. 65, VIII)
Art. 66. À Gerência Técnica do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 184/2011, Art. 66)
I - monitorar a qualidade dos serviços prestados pelas unidades vinculadas ao PFPB; (Origem: PRT MS/GM 184/2011, Art. 66, I)
II - coordenar as ações de formação e capacitação de recursos humanos para o desenvolvimento das atividades; (Origem: PRT MS/GM 184/2011, Art. 66, II)
III - coordenar as ações de atenção e de informação ao usuário, aos profissionais de saúde e aos parceiros; (Origem: PRT MS/GM 184/2011, Art. 66, III)
IV - promover a avaliação permanente da lista de produtos e serviços disponibilizados; e (Origem: PRT MS/GM 184/2011, Art. 66, IV)
V - coordenar a elaboração de manuais e procedimentos operacionais referentes a todas as atividades técnicas e às ações desenvolvidas nas farmácias. (Origem: PRT MS/GM 184/2011, Art. 66, V)
Art. 67. À Gerência Administrativa do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 184/2011, Art. 67)
I - dar suporte à instalação e à manutenção de unidades mediante a celebração de convênios ou parceria entre o Ministério da Saúde, a FIOCRUZ e os Municípios, os Estados, o Distrito Federal e Instituições; (Origem: PRT MS/GM 184/2011, Art. 67, I)
II - acompanhar e monitorar o gerenciamento das farmácias do PFPB; (Origem: PRT MS/GM 184/2011, Art. 67, II)
III - participar do planejamento de aquisição de produtos, de reposição de estoques de produtos, outros insumos materiais, equipamentos e contratação de serviços necessários para implantação das unidades do PFPB; (Origem: PRT MS/GM 184/2011, Art. 67, III)
IV - acompanhar os processos de logística referentes à guarda, ao transporte e à distribuição de medicamentos e correlatos, insumos diversos, materiais e equipamentos das unidades do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 67, IV)
V - aprovar os projetos das instalações e áreas físicas das farmácias a serem implantadas pelos municípios, estados, Distrito Federal e entidades conveniadas, visando adequação ao disposto no Manual Básico do Programa Farmácia Popular do Brasil. (Origem: PRT MS/GM 184/2011, Art. 67, V)
Art. 68. Ao DAF/SCTIE/MS compete: (Origem: PRT MS/GM 184/2011, Art. 68)
I - estabelecer mecanismos de controle e monitoramento da implementação, do desenvolvimento e dos resultados do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 68, I)
II - supervisionar por meio de suas coordenações, as seguintes ações: (Origem: PRT MS/GM 184/2011, Art. 68, II)
a) instrução dos processos administrativos de habilitação de municípios, estados e Distrito Federal e pela celebração de convênios com as instituições autorizadas; (Origem: PRT MS/GM 184/2011, Art. 68, II, a)
b) instrução dos processos administrativos de habilitação de empresas parceiras, nos termos deste Anexo; (Origem: PRT MS/GM 184/2011, Art. 68, II, b)
c) emissão dos pareceres sobre as solicitações de habilitações de Municípios, Estados e Distrito Federal segundo procedimentos e critérios definidos no Manual Básico do PFPB; (Origem: PRT MS/GM 184/2011, Art. 68, II, c)
d) emissão dos pareceres sobre as solicitações de celebração de convênios com instituições autorizadas, segundo procedimentos e critérios definidos no Manual Básico do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 68, II, d)
e) emissão dos pareceres sobre as solicitações de credenciamento de empresas parceiras nos termos deste Anexo. (Origem: PRT MS/GM 184/2011, Art. 68, II, e)
Art. 69. As definições estratégicas, bem como as normas para adesão e manutenção do PFPB, instalação e gestão das Unidades, repasses de recursos fundo a fundo, celebração de convênios, monitoramento, avaliação e controle estão previstas no "Programa Farmácia Popular do Brasil - Manual Básico", disponível em http://bvsms.saude.gov.br/bvs/publicacoes/PROGRAMA_FARMACIA_POPULAR.pdf. (Origem: PRT MS/GM 184/2011, Art. 70)
CAPÍTULO IV
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 184/2011, CAPÍTULO IV)
Art. 70. Eventuais conflitos decorrentes da relação contratual firmada no âmbito PFPB, não resolvidos pela via administrativa, serão dirimidos pela Justiça Federal da 1ª Região, Circunscrição Judiciária do Distrito Federal (Origem: PRT MS/GM 184/2011, Art. 71)
Art. 71. A qualquer tempo, o estabelecimento poderá requerer por intermédio de Ofício com os dados da empresa, assinado com firma reconhecida, a sua exclusão do PFPB, que se efetivará no prazo máximo de 30 (trinta) dias. (Origem: PRT MS/GM 184/2011, Art. 72)
Art. 72. O MS manterá informações e orientações sistemáticas sobre a operação do PFPB em http://www.saude.gov.br/aquitemfarmaciapopular, em que constará inclusive o Anexo LXXVIII. (Origem: PRT MS/GM 184/2011, Art. 73)
ANEXO 1 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL E DIABETES MELLITUS (Origem: PRT MS/GM 184/2011, Anexo 1)
Indicação: Hipertensão Arterial
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Captopril 25 mg, comprimido | 1 (um) comprimido | 0,28 | 0,28 |
| Maleato de enalapril 10 mg, comprimido | 1 (um) comprimido | 0,39 | 0,39 |
| Cloridrato de propranolol 40 mg, comprimido | 1 (um) comprimido | 0,08 | 0,08 |
| Atenolol 25 mg, comprimido | 1 (um) comprimido | 0,19 | 0,19 |
| Hidroclorotiazida 25 mg, comprimido | 1 (um) comprimido | 0,08 | 0,08 |
| Losartana Potássica 50 mg | 1 (um) comprimido | 0,32 | 0,32 |
Indicação: Diabetes Mellitus
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Glibenclamida 5 mg, comprimido | 1 (um) comprimido | 0,12 | 0,12 |
| Cloridrato de metformina 500 mg, comprimido | 1 (um) comprimido | 0,13 | 0,13 |
| Cloridrato de metformina 850 mg, comprimido | 1 (um) comprimido | 0,16 | 0,16 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, frasco-ampola 10 ml | 1 (um) frasco/ampola 10ml | 26,55 | 26,55 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, frasco-ampola 5 ml | 1 (um) frasco/ampola 5ml | 13,27 | 13,27 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, refil 3ml (carpule) | 1 (um) refil 3ml | 7,96 | 7,96 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, refil 1,5ml (carpule) | 1 (um) refil 1,5ml | 3,99 | 3,99 |
| Insulina Humana Regular 100 UI/ml, solução injetável, frasco-ampola 10 ml | 1 (um) frasco/ampola 10ml | 26,55 | 26,55 |
| Insulina Humana Regular 100 UI/ml, solução injetável, frasco-ampola 5 ml | 1 (um) frasco/ampola 5ml | 13,27 | 13,27 |
| Insulina Humana Regular 100UI/ml, solução injetável, refil 3ml (carpules) | 1 (um) refil 3ml | 7,96 | 7,96 |
| Insulina Humana Regular 100UI/ml, solução injetável, refil 1,5ml (carpules) | 1 (um) refil 1,5ml | 3,99 | 3,99 |
ANEXO 2 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 184/2011, Anexo 2)
Indicação: Contracepção
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Enantato de noretisterona 50 mg + valerato de estradiol 5 mg, ampola | 1 (uma) ampola | 11,31 | 10,17 |
| Norestisterona 0,35 mg, comprimido - cartela com 35 comprimidos | 1 (uma) cartela | 4,96 | 4,46 |
| Etinilestradiol 0,03 mg + levonorgestrel 0,15 mg, comprimido - cartela com 21 comprimi- dos | 1 (uma) cartela | 4,19 | 3,77 |
| Acetato de medroxiprogesterona 150 mg, ampola | 1 (uma) ampola | 12,36 | 11,12 |
Indicação: Dislipidemia
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Sinvastatina 10 mg comprimido | 1 (um) comprimido | 0,26 | 0,23 |
| Sinvastatina 20 mg comprimido | 1 (um) comprimido | 0,51 | 0,46 |
| Sinvastatina 40 mg comprimido | 1 (um) comprimido | 0,99 | 0,89 |
Indicação: Asma
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Sulfato de Salbutamol 5 mg/ml - Solução Inalação | 1 (um) mililitro | 0,88 | 0,79 |
| Sulfato de Salbutamol 100 mcg/dose - Administração pulmonar, inalador doseado | 1 (uma) dose | 0,10 | 0,09 |
| Brometo de Ipratrópio 0,25 mg/ml - Ad- ministração pulmonar, solução para inalação | 1 (um) mililitro | 0,27 | 0,24 |
| Brometo de Ipratrópio 0,02 mg/dose - Ad- ministração pulmonar, inalador doseado | 1 (uma) dose | 0,06 | 0,05 |
| Dipropionato de Beclometasona 50 mcg/dose - Administração pulmonar, inalador doseado | 1 (uma) dose | 0,13 | 0,12 |
| Dipropionato de Beclometasona 200 mcg/cápsula - Administração pulmonar, cápsulas inalantes | 1 (uma) cápsula | 0,25 | 0,23 |
| Dipropionato de Beclometasona 200 mcg/dose - Administração pulmonar, inalador doseado | 1 (uma) dose | 0,25 | 0,23 |
| Dipropionato de Beclometasona 250 mcg/dose - Administração pulmonar, inalador doseado | 1 (uma) dose | 0,15 | 0,14 |
Indicação: Rinite
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Budesonida 50 mcg/dose - Adminsitração tópica nasal doseada | 1 (uma) dose | 0,13 | 0,12 |
| Budesonida 32 mcg/dose - Adminsitração tópica nasal doseada | 1 (uma) dose | 0,09 | 0,08 |
Indicação: Doença de Parkinson
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Carbidopa 25 mg + Levodopa 250 mg | 1 (um) comprimido | 0,64 | 0,58 |
| Cloridrato de Benserazida 25 mg + Levo- dopa 100 mg | 1 (um) comprimido | 1,17 | 1,05 |
Indicação: Osteoporose
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Alendronato de Sódio 70 mg | 1 (um) comprimido | 3,74 | 3,37 |
Indicação: Glaucoma
| Princípio Ativo e concentração | Unidade Farmacotécnica | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS |
| Maleato de Timolol 0,25% - Solução Oftalmológica | 1 (um) mililitro | 0,40 | 0,36 |
| Maleato de Timolol 0,50% - Solução Oftalmológica | 1 (um) mililitro | 0,96 | 0,86 |
Indicação: Incontinência
| Produto de higiene | Unidade | Valor de referência por tira | Valor máximo para pagamento pelo MS |
| Fralda geriátrica | 1 (uma) tira | 0,71 | 0,64 |
ANEXO 3 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA (Origem: PRT MS/GM 184/2011, Anexo 3)
| It.. | MEDICAMENTO / CORRELATO | APRESENTAÇÃO | UNIDADE DE CADASTRO | PREÇO DE DISPENSAÇÃO (R$) | |
|---|---|---|---|---|---|
| 1 | Acetato de medroxiprogesterona |
150 mg/ml | Ampola | 1,24 | |
| 2 | Aciclovir |
200mg/comp. | Comprimido | 0,28 | |
| 3 | Ácido Acetilsalicílico |
500mg/comp. | Comprimido | 0,035 | |
| 4 | Ácido Acetilsalicílico |
100mg/comp. | Comprimido | 0,03 | |
| 5 | Ácido Fólico |
5mg/comp. | Comprimido | 0,054 | |
| 6 | Albendazol |
400mg/comp. mastigável | Comprimido | 0,56 | |
| 7 | Alendronato de Sódio* |
70 mg/comp. | Comprimido | 0,37 | |
| 8 | Alopurinol |
100mg/comp. | Comprimido | 0,08 | |
| 9 | Amiodarona |
200mg/comp. | Comprimido | 0,2 | |
| 10 | Amitriptilina(Cloridrato) |
25mg/comp. | Comprimido | 0,22 | |
| 11 | Amoxicilina |
500mg/cáps. | Cápsula | 0,19 | |
| 12 | Amoxicilina |
250mg/5ml/pó p/susp. oral | Frasco 60 ml | 1,96 | |
| 13 | Amoxicilina |
250mg/5ml/pó p/susp. oral | Frasco 150 ml | 4,9 | |
| 14 | Azatioprina |
50mg/comp. | Comprimido | 1,4 | |
| 15 | Azitromicina |
500mg/comp. | Comprimido | 2,64 | |
| 16 | Benzilpenicilina Benzatina |
1.200.000ui/pó p/sus. inj. | Frasco-ampola | 1,5 | |
| 17 | Benzilpenicilina Procaína+Potássica |
300.000+100.000ui/pó/sus. inj. | Frasco-ampola | 1,5 | |
| 18 | Benzoato de Benzila |
200mg/ml/emulsão | Frasco 100 ml | 1,4 | |
| 19 | Benzoato de Benzila |
200mg/ml/emulsão | Frasco 60 ml | 1,1 | |
| 20 | Biperideno |
2mg/comp. | Comprimido | 0,073 | |
| 21 | Brometo de n-butilescopolamina |
10 mg/frasco | frasco de 20 ml | 3,9 | |
| 22 | Carbamazepina |
200mg/comp. | Comprimido | 0,13 | |
| 23 | Carbidopa + Levodopa |
25mg + 250mg/comp. | Comprimido | 0,48 | |
| 24 | Cefalexina(Cloridrato ou Sal Sódico) |
500mg/cáps. | Cápsula | 0,4 | |
| 25 | Cefalexina(Cloridrato ou Sal Sódico) |
250mg/5ml/susp. oral | Frasco 60 ml | 4,96 | |
| 26 | Cefalexina(Cloridrato ou Sal Sódico) |
250mg/5ml/susp. oral | Frasco 125 ml | 10 | |
| 27 | Cetoconazol |
200mg/comp. | Comprimido | 0,23 | |
| 28 | Ciprofloxacino |
500mg/comp. | Comprimido | 0,38 | |
| 29 | Clonazepam* |
2mg/comp | Comprimido | 0,06 | |
| 30 | Cloreto de Potássio |
60mg/ml/xpe. | Frasco 100 ml | 1,88 | |
| 31 | Cloreto de Sódio 0,9% |
9mg/ml/sol. nasal | Frasco | 0,95 | |
| 32 | Clorpromazina |
25mg/comp. | Comprimido | 0,1 | |
| 33 | Clorpromazina |
100mg/comp. | Comprimido | 0,125 | |
| 34 | Dexametazona |
Crem.0,1% | Tubo | 1 | |
| 35 | Dexclorfeniramina(Maleato) |
2mg/comp. | Comprimido | 0,06 | |
| 36 | Dexclorfeniramina(Maleato) |
0,4mg/sol. Oral | Frasco 120 ml | 2,07 | |
| 37 | Diazepam |
5mg/comp.sulcado | Comprimido | 0,04 | |
| 38 | Diazepam |
10mg/comp.sulcado | Comprimido | 0,08 | |
| 39 | Digoxina |
0,25mg/comp. | Comprimido | 0,06 | |
| 40 | Dipirona |
500mg/ml gts | Frasco 10 ml | 0,7 | |
| 41 | Doxiciclina |
100mg/comp. | Comprimido | 0,38 | |
| 42 | Enantato de Noretisterona+Valerato de Estradiol |
50mg+5mg/injetável | Seringa 1 ml | 1,13 | |
| 43 | Eritromicina(Estearato ou Etilsuccinato) |
125mg/5ml/susp. oral | Frasco 60 ml | 2,3 | |
| 44 | Eritromicina(Estearato ou Etilsuccinato) |
500mg/comp./cáps. | Comprimido | 0,54 | |
| 45 | Etinilestradiol+Levonorgestrel |
0,03mg+0,15mg/comp | Cartela c/ 21 cápsulas | 0,42 | |
| 46 | Fenitoína |
100mg/comp. | compimido | 0,1 | |
| 47 | Fenobarbital |
100mg/comp. | Comprimido | 0,06 | |
| 48 | Fluconazol |
100mg/rev. | Cápsula | 0,95 | |
| 49 | Fluconazol |
150mg/rev. | Cápsula | 0,95 | |
| 50 | Fluoxetina* |
20mg/comp. | Comprimido | 0,06 | |
| 51 | Haloperidol |
1mg/comp. | Comprimido | 0,08 | |
| 52 | Haloperidol |
5mg/comp. | Comprimido | 0,12 | |
| 53 | Haloperidol |
2mg/ml/sol. oral | Frasco 20 ml | 1,94 | |
| 54 | Ibuprofeno |
300mg/comp. | Comprimido | 0,16 | |
| 55 | Levonorgestrel |
0,75mg/comp. | Comprimido | 3,47 | |
| 56 | Loratadina* |
10mg/comp. | Comprimido | 0,05 | |
| 57 | Mebendazol |
100mg/comp. | Comprimido | 0,05 | |
| 58 | Mebendazol |
100mg/5ml/sup. Oral | Frasco 30 ml | 1,1 | |
| 59 | Metoclopramida (Cloridrato) |
10mg/comp. | Comprimido | 0,04 | |
| 60 | Metoclopramida (Cloridrato) |
4mg/ml/sol.oral | Frasco 10 ml | 0,75 | |
| 61 | Metronidazol |
250mg/comp. | Comprimido | 0,1 | |
| 62 | Metronidazol |
5% creme vaginal | Tubo 50 gramas | 2,15 | |
| 63 | Metronidazol (Benzoato) |
200mg/5ml/susp. oral | Frasco 100 ml | 2,4 | |
| 64 | Miconazol (Nitrato) |
2%/locão | Frasco 30 ml | 1,86 | |
| 65 | Miconazol (Nitrato) |
2%/pó | Frasco 30 ml | 4,95 | |
| 66 | Monitrato de Isossorbida |
20mg/comp. | Comprimido | 0,1 | |
| 67 | Neomicina (Sulfato) + Bacitracina (Zín- cica) |
5mg + 250ui/g/pom. | Tubo 10 gramas | 1,35 | |
| 68 | Neomicina (Sulfato) + Bacitracina (Zín- cica) |
5mg + 250ui/g/pom. | Tubo 15 gramas | 2,02 | |
| 69 | Nistatina |
25.000 UI/crem. Vaginal | Tubo 60 gramas | 2,28 | |
| 70 | Nistatina |
25.000 UI/crem. Vaginal | Tubo 50 gramas | 1,9 | |
| 71 | Nistatina |
100.000 UI/ml/ susp. Oral | Frasco 30 ml | 3,62 | |
| 72 | Noretisterona |
0,35mg/comp. | Cartela c/ 35 comprimi- dos | 0,5 | |
| 73 | Omeprazol |
20mg/cáps. | Cápsula | 0,23 | |
| 74 | Paracetamol |
500mg/comp. | Comprimido | 0,09 | |
| 75 | Paracetamol |
200mg/ml/sol. Oral gts | Frasco 10 ml | 0,85 | |
| 76 | Paracetamol |
200mg/ml/sol. Oral gts | Frasco 15 ml | 1,27 | |
| 77 | Paracetamol |
100mg/ml/sol. oral gts. | Frasco 10 ml | 0,7 | |
| 78 | Paracetamol |
100mg/ml/sol. oral gts. | Frasco 15 ml | 1 | |
| 79 | Prednisona |
20mg/comp. | Comprimido | 0,18 | |
| 80 | Prednisona |
5mg/comp. | Comprimido | 0,08 | |
| 81 | Prometazina (Cloridrato) |
25mg/comp. | Comprimido | 0,12 | |
| 82 | Ranitidina |
150mg/comp. | Comprimido | 0,12 | |
| 83 | Sais p/ Reidratação Oral |
pó p/sol. Oral | Envelope 27,9 gramas | 0,6 | |
| 84 | Salbutamol (Sulfato) |
2mg/comp. Sulcado | Comprimido | 0,04 | |
| 85 | Salbutamol (Sulfato) |
2mg/5ml/xpe. | Frasco 120 ml | 1,15 | |
| 86 | Salbutamol (Sulfato) |
2mg/5ml/xpe. | Frasco 125 ml | 1,2 | |
| 87 | Sinvastatina |
20mg/comp. | Comprimido | 0,38 | |
| 88 | Sulfametoxazol + Trimetoprima |
400mg + 80mg/comp. | Comprimido | 0,08 | |
| 89 | Sulfametoxazol + Trimetoprima |
200mg + 40mg/5ml/susp. Oral | Frasco 50 ml | 1,45 | |
| 90 | Sulfametoxazol + Trimetoprima |
200mg + 40mg/5ml/susp. Oral | Frasco 60 ml | 1,74 | |
| 91 | Sulfametoxazol + Trimetoprima |
200mg + 40mg/5ml/susp. Oral | Frasco 100 ml | 2,9 | |
| 92 | Sulfasalazina |
500mg/comp. | Comprimido | 0,4 | |
| 93 | Sulfato Ferroso |
40mg Fe(II)/comp. rev. | Comprimido | 0,04 | |
| 94 | Sulfato Ferroso |
25mg/ml Fe(II)/sol. Oral | Frasco 30 ml | 0,75 | |
| 95 | Tiabendazol |
5%/pom. | Tubo 20 gramas | 2,89 | |
| 96 | Valproato de Sódio |
50mg/ml/xpe. | Frasco 100 ml | 4,05 | |
| 97 | Preservativo Masculino |
unidade | 0,3 | ||
* Disponíveis nas unidades do Programa a partir de 15 de março de 2011.
ANEXO 4 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL E DIABETES MELLITUS (Origem: PRT MS/GM 184/2011, Anexo 4)
| It. | MEDICAMENTO / CORRELATO | APRESENTAÇÃO | UNIDADE DE CADASTRO | PREÇO DE DISPENSAÇÃO (R$) |
| 1 | Atenolol | 25mg/comp. | Comprimido | 0,00 |
| 2 | Captopril | 25mg/comp. sulcado | Comprimido | 0,00 |
| 3 | Enalapril | 10mg/comp. | Comprimido | 0,00 |
| 4 | Enalapril | 20mg/comp. | Comprimido | 0,00 |
| 5 | Furosemida | 40mg/comp. | Comprimido | 0,00 |
| 6 | Glibenclamida | 5mg/comp. | Comprimido | 0,00 |
| 7 | Hidroclorotiazida | 25mg/comp. | Comprimido | 0,00 |
| 8 | Losartana* | 50mg/comp. | Comprimido | 0,00 |
| 9 | Metformina | 500mg/comp. | Comprimido | 0,00 |
| 10 | Metformina | 850mg/comp. | Comprimido | 0,00 |
| 11 | Metildopa | 250mg/comp.rev. | Comprimido | 0,00 |
| 12 | Metildopa | 500mg/comp.rev. | Comprimido | 0,00 |
| 13 | Nifedipina | 20mg/comp.lib.cont. | Comprimido | 0,00 |
| 14 | Propranolol (Cloridrato) | 40mg/comp. | Comprimido | 0,00 |
| 15 | Verapamila(Cloridrato) | 80mg/comp. | Comprimido | 0,00 |
* Disponível nas unidades do Programa a partir de 15 de março de 2011
ANEXO 5 DO ANEXO LXXVIII
MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 184/2011, Anexo 5)
----------------------------------------
MINISTÉRIO DA SAÚDE - FARMÁCIA POPULAR NÃO É DOCUMENTO FISCAL
----------------------------------------
RAZÃO SOCIAL
C.N.P.J. : 99.999.999/9999-99 Autorização M.S. : 999.999.999.999.999
Valor Total Venda : R$ xxxxxx Valor Total M.S. : R$ xxxxxx Valor Total Benef.: R$ xxxxxx Valor hipertensão/: R$ 0,00
diabetes
CRM/UF : XXX-UF
NOME Rep. Legal: DADOS DO VENDEDOR
Código: 167892 Nome do Vendedor:
DADOS DO BENEFICIÁRIO
NOME Nº C.P.F.
Endereço:
----------------------------------------
----------------------------------------
----------------------------------------
----------------------------------------
HISTÓRICO DE AUTORIZAÇÕES VIGENTES
----------------------------------------
CÓD. BARRAS MEDICAMENTO
COMPR POS AUT SAL V.MS V.BEN PROX.COM
----------------------------------------
NÚMERO DO EAN NOME DO MEDICAMENTO 12/08 3 60 30 9,00 1,00 12/09
NÚMERO DO EAN NOME DO MEDICAMENTO 12/08 3 60 30 9,00 1,00 12/09
NÚMERO DO EAN NOME DO MEDICAMENTO 12/08 3 60 30 9,00 1,00 12/09
ESPAÇO RESERVADO PARA MENSAGEM M.S. ESPAÇO RESERVADO PARA MENSAGEM M.S. ESPAÇO RESERVADO
PARA MENSAGEM M.S. ESPAÇO RESERVADO PARA MENSAGEM M.S.
Disque Denúncia: 0800 61 136
ANEXO LXXIX
INSTRUÇÃO NORMATIVA DE VIGILÂNCIA EM SAÚDE DO TRABALHADOR NO SUS (Origem: PRT MS/GM 3120/1998, Anexo 1)
1 - Apresentação
O avanço gradual, quantitativo e qualitativo da institucionalização das práticas de Saúde do Trabalhador, no setor saúde em todo o Brasil, reflete a consolidação da área como objeto indiscutível da saúde pública. E, por assim dizer, objeto, também, das políticas públicas direcionadas, em todos os níveis do Sistema Único de Saúde (SUS), para a prevenção dos agravos à saúde da população trabalhadora.
O conjunto de elementos deflagradores do avanço institucional, em relação à questão da Saúde do Trabalhador no SUS, compõe-se do aspecto legislativo, calcado na Lei nº 8.080, de 19 de setembro de 1990, e em diversas Constituições Estaduais e Municipais, na luta pela saúde desenvolvida pelos trabalhadores e suas organizações sindicais, passando pelo crescente comprometimento dos técnicos, ao nível dos serviços e universidades.
A presente Instrução Normativa pretende, de uma forma sucinta, fornecer subsídios básicos para o desenvolvimento de ações de Vigilância em Saúde do Trabalhador, no âmbito do Sistema Único de Saúde Parte do pressuposto que o sistema de saúde, embora deva ser preservado nas suas peculiaridades regionais que impliquem um respeito às diversas culturas e características populacionais, por ser único, também deve manter linhas mestras de atuação, especialmente pela necessidade de se compatibilizarem instrumentos, bancos de informações e intercâmbio de experiências.
As recomendações aqui apresentadas são fruto de alguns anos de discussão acumulada e extraída de diversas experiências de vigilância em saúde do trabalhador, em vários estados e municípios de todo o País. Trata-se de uma primeira aproximação normativa não só com os Programas Estaduais e Municipais de Saúde do Trabalhador, já instalados e em fase de instalação, mas, também com as estruturas de atenção à saúde das Secretarias Estaduais e Municipais, especialmente nas áreas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária.
A possibilidade de traduzir a capilaridade institucional do setor saúde em instâncias efetoras de mudança dos perfis de morbidade e mortalidade, resultantes da relação trabalho-ambiente-consumo e saúde, pressupõe um comprometimento das estruturas de atenção à saúde, em especial as de vigilância e fiscalização em saúde.
O objetivo da Instrução Normativa é, em suma, o de poder instrumentalizar minimamente os setores responsáveis pela vigilância e defesa da saúde, nas Secretarias de Estados e Municípios, de forma a incorporarem em suas práticas mecanismos de análise e intervenção sobre os processos e os ambientes de trabalho.
A abordagem de vigilância em saúde do trabalhador, considerada na Instrução Normativa, implica a superação dos limites conceituais e institucionais, tradicionalmente estruturados nos serviços de saúde, das ações dissociadas de vigilância epidemiológica e sanitária.
Além disso, nas ações de vigilância e fiscalização sanitária, propriamente ditas, implica-se transpor o objeto usual - o produto/consumidor - de forma a considerar, igualmente, como objeto, o processo/trabalhador/ambiente.
Dessa forma, a vigilância em saúde do trabalhador calca-se no modelo epidemiológico de pesquisa dos agravos, nos diversos níveis da relação entre o trabalho e a saúde, agregando ao universo da avaliação e análise a capacidade imediata da intervenção sobre os fatores determinantes dos danos à saúde.
Devido à sua concepção mais abrangente de saúde, relacionada ao processo de produção, capaz de lidar com a diversidade, a complexidade e o surgimento de novas formas de adoecer, a vigilância em saúde do trabalhador ultrapassa o aspecto normativo tratado pela fiscalização tradicional.
Em razão dessas implicações, a vigilância em saúde do trabalhador pressupõe uma rede de articulações que passa, fundamentalmente, pelos trabalhadores e suas organizações, pela área de pesquisa e formação de recursos humanos e pelas áreas de assistência e reabilitação.
Finalmente, levando-se em consideração o fato de ser uma área ainda em construção dentro do SUS, pretende-se que esta Instrução Normativa possa ser aprimorada, com a maior brevidade, uma vez utilizada pela rede de serviços, assim como se constitui na primeira de uma série de publicações normativas e orientadoras, relacionadas a temas específicos em saúde do trabalhador.
2 - Conceituação básica
A Vigilância em Saúde do Trabalhador compreende uma atuação contínua e sistemática, ao longo do tempo, no sentido de detectar, conhecer, pesquisar e analisar os fatores determinantes e Condicionantes dos agravos à saúde relacionados aos processos e ambientes de trabalho, em seus aspectos tecnológico, social, organizacional e epidemiológico, com a finalidade de planejar, executar e avaliar intervenções sobre esses aspectos, de forma a eliminá-los ou controlá-los.
A Vigilância em Saúde do Trabalhador compõe um conjunto de práticas sanitárias, articuladas supra-setorialmente, cuja especificidade está centrada na relação da saúde com o ambiente e os processos de trabalho e nesta com a assistência, calcado nos princípios da vigilância em saúde, para a melhoria das condições de vida e saúde da população.
A Vigilância em Saúde do Trabalhador não constitui uma área desvinculada e independente da vigilância em saúde como um todo mas, ao contrário, pretende acrescentar ao conjunto de ações da vigilância em saúde estratégias de produção de conhecimentos e mecanismos de intervenção sobre os processos de produção, aproximando os diversos objetos comuns das práticas sanitárias àqueles oriundos da relação entre o trabalho e a saúde.
3 - Princípios
A Vigilância em Saúde do Trabalhador pauta-se nos princípios do Sistema Único de Saúde, em consonância com os Sistemas Nacionais de Vigilância Sanitária e de Vigilância Epidemiológica, articulada com a área assistencial.
Além disso, tendo em vista a complexidade e a abrangência do objeto da vigilância, guarda peculiaridades que transpõem os limites setoriais da saúde, implicando a ampliação de sua abordagem.
Como princípios, esquematicamente, pode-se considerar:
3.1 - Universalidade: todos os trabalhadores, independentemente de sua localização, urbana ou rural, de sua forma de inserção no mercado de trabalho, formal ou informal, de seu vínculo empregatício, público ou privado, autônomo, doméstico, aposentado ou demitido são objeto e sujeitos da Vigilância em Saúde do Trabalhador.
3.2 - Integralidade das ações: o entendimento de atenção integral à saúde do trabalhador, compreendendo a assistência e recuperação dos agravos, os aspectos preventivos implicando intervenção sobre seus fatores determinantes em nível dos processos de trabalho e a promoção da saúde que implicam ações articuladas com os próprios trabalhadores e suas representações. A ênfase deve ser dirigida ao fato de que as ações individuais/curativas articulam-se com as ações coletivas, no âmbito da vigilância, considerando que os agravos à saúde do trabalhador são absolutamente preveníveis.
3 3 - Pluriinstitucionalidade: articulação, com formação de redes e sistemas, entre as instâncias de vigilância em saúde do trabalhador e os centros de assistência e reabilitação, as universidades e centros de pesquisa e as instituições públicas com responsabilidade na área de saúde do trabalhador consumo e ambiente.
3 4 - Controle social incorporação dos trabalhadores e das suas organizações, principalmente as sindicais, em todas as etapas da vigilância em saúde do trabalhador, compreendendo sua participação na identificação das demandas, no planejamento, no estabelecimento de prioridades e adoção de estratégias, na execução das ações, no seu acompanhamento e avaliação e no controle da aplicação de recursos.
3 5 - Hierarquização e descentralização: consolidação do papel do município e dos distritos sanitários como instância efetiva de desenvolvimento das ações de vigilância em saúde do trabalhador integrando os níveis estadual e nacional do Sistema Único de Saúde, no espectro da ação, em função de sua complexidade.
3.6 - Interdisciplinaridade: a abordagem multiprofissional sobre o objeto da vigilância em saúde do trabalhador deve contemplar os saberes técnicos, com a concorrência de diferentes áreas do conhecimento e, fundamentalmente, o saber operário, necessários para o desenvolvimento da ação.
3.7 - Pesquisa-intervenção: o entendimento de que a intervenção, no âmbito da- vigilância em saúde do trabalhador, é o deflagrador de um processo contínuo, ao longo do tempo, em que a pesquisa é sua parte indissolúvel, subsidiando e aprimorando a própria intervenção.
3.8 - O caráter transformador: a intervenção sobre os fatores determinantes e condicionantes dos problemas de saúde relacionados aos processos e ambientes de trabalho com o entendimento de que a vigilância em saúde do trabalhador, sob a lógica do controle social e da transparência das ações, pode ter na intervenção um caráter proponente de mudanças dos processos de trabalho, a partir das análises tecnológica, ergonômica, organizacional e ambiental efetuadas pelo coletivo de instituições, sindicatos, trabalhadores e empresas, inclusive, superando a própria legislação.
4 - Objetivos:
De forma esquemática pode-se dizer que a vigilância em saúde do trabalhador tem como objetivos:
a - conhecer a realidade de saúde da população trabalhadora, independentemente da forma de inserção no mercado de trabalho e do vínculo trabalhista estabelecido, considerando:
a1 - a caracterização de sua forma de adoecer e morrer em função da sua relação com o processo de trabalho;
a2 - o levantamento histórico dos perfis de morbidade e mortalidade em função da sua relação com o processo de trabalho;
a3 - a avaliação do processo, do ambiente e das condições em que o trabalho se realiza, identificando os riscos e cargas de trabalho a que está sujeita, nos seus aspectos tecnológicos ergonômicos e organizacionais já conhecidos;
a4 - a pesquisa e a análise de novas e ainda desconhecidas formas de adoecer e morrer em decorrência do trabalho;
b - intervir nos fatores determinantes de agravos à saúde da população trabalhadora, visando eliminá-los ou, na sua impossibilidade, atenuá-los e controlá-los, considerando:
b1 - a fiscalização do processo, do ambiente e das condições em que o trabalho se realiza, fazendo cumprir, com rigor, as normas e legislações existentes, nacionais ou mesmo internacionais quando relacionadas à promoção da saúde do trabalhador;
b2 - a negociação coletiva em saúde do trabalhador, além dos preceitos legais estabelecidos, quando se impuser a transformação do processo, do ambiente e das condições em que o trabalho se realiza, não prevista normativamente;
c - avaliar o impacto das medidas adotadas para a eliminação, atenuação e controle dos fatores determinantes de agravos à saúde, considerando:
c1 - a possibilidade de transformar os perfis de morbidade e mortalidade;
c2 - o aprimoramento contínuo da qualidade de vida no trabalho;
d - subsidiar a tomada de decisões dos órgãos competentes, nas três esferas de governo considerando:
d1 - o estabelecimento de políticas públicas, contemplando a relação entre o trabalho e a saúde no campo de abrangência da vigilância em saúde;
d2 - a interveniência, junto às instâncias do Estado e da sociedade, para o aprimoramento das normas legais existentes e para a criação de novas normas legais em defesa da saúde dos trabalhadores;
d3 - o planejamento das ações e o estabelecimento de suas estratégias;
d4 - a participação na estruturação de serviços de atenção à saúde dos trabalhadores; d5 - a participação na formação, capacitação e treinamento de recursos humanos com interesse na área;
e - estabelecer sistemas de informação em saúde do trabalhador, junto às estruturas existentes no setor saúde, considerando:
e1 - a criação de bases de dados comportando todas as informações oriundas do processo de vigilância e incorporando as informações tradicionais já existentes;
e2 - a divulgação sistemática das informações analisadas e consolidadas.
5 - Estratégias
A vigilância em saúde do trabalhador, como um conjunto de práticas sanitárias contínuas, calcada, entre outros princípios, na interdisciplinaridade, na pluriinstitucionalidade, no controle social, balizada na configuração do Sistema Único de Saúde, e tendo como imagem-objetivo a melhoria da qualidade de vida no trabalho, pressupõe o estabelecimento de estratégias operacionais para alcançá-Ia.
Embora cada Estado, Região ou Município, guardadas suas características, deva buscar a melhor forma de estabelecer suas próprias estratégias de vigilância, alguns pressupostos podem ser considerados como aplicáveis ao conjunto do SUS. Dentre os passos que podem ser estabelecidos na estratégia de operacionalização das ações, buscando manter uma lógica seqüencial de consolidação da vigilância, pode-se destacar:
5.1 - Onde já existam estruturas, estaduais e municipais, de saúde do trabalhador - Programas, Coordenações, Divisões, Gerências, Centros, Núcleos - promover e/ou aprofundar a relação institucional com as estruturas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária, buscando a superação da dicotomia existente em suas práticas, em que o objeto de ação da vigilância, em geral, não contempla o processo de produção e sua relação com a saúde dos trabalhadores. Com este intuito, recomenda-se a constituição de equipes multiprofissionais para a execução de ações interdisciplinares e pluriinstitucionais.
5.2 - Recomenda-se a criação de comissão, na forma colegiada, com a participação de trabalhadores, suas organizações sindicais e instituições públicas com responsabilidades em saúde do trabalhador, vinculada organicamente ao SUS e subordinada aos Conselhos Estaduais e Municipais de Saúde, com a finalidade de assessorá-lo na definição de políticas, no estabelecimento de diretrizes e prioridades, e no acompanhamento e avaliação da execução das ações de saúde do trabalhador.
5.3 - Dada a abrangência e as dificuldades operacionais de se implementarem, simultaneamente, ações de vigilância em todos os ambientes de trabalho, em um dado município ou região, faz-se necessário o planejamento dessas ações com o estabelecimento de prioridades, visando a intervenções de impacto, com efeitos educativos e disciplinadores sobre o setor. Para tanto, recomenda-se a adoção de alguns critérios como:
- Base Sindical: Uma vez que um determinado sindicato de trabalhadores, com alguma tradição de luta pela saúde identifique e encaminhe situações-problema, junto à estrutura de vigilância, desencadeia-se uma ação integrada que visa atuar não apenas na empresa denunciada, mas nas principais empresas abrangidas por aquela categoria de trabalhadores. O investimento da ação nesta base deve considerar a capacidade de reprodutibilidade, a partir do sindicato em questão e para o movimento sindical como um todo, numa dada região. - Ramo Produtivo: Consiste na atuação em todas as empresas com o mesmo perfil produtivo, capaz de se constituir em fonte de risco para a saúde, preponderantes numa dada região, independente da capacidade de mobilização dos sindicatos envolvidos. A utilização deste critério pode se dar por avaliação epidemiológica dos casos notificados, denúncias sucessivas ou análise dos processos produtivos. O investimento da ação, neste caso, visa à mudança dos processos de forma integrada, sem a punição de uma empresa em particular, mas intervindo em todas as empresas daquele setor e, em especial, nas que apresentam grande concentração de trabalhadores, sempre buscando a atuação conjunta com os sindicatos das categorias expostas.
- Território: Consiste na intervenção por varredura, em pequena área geográfica previamente delimitada (setor censitário, distrito de saúde, bairro, distrito industrial etc.), de todos os processos produtivos capazes de gerar dano à saúde. O investimento da ação, neste caso, visa abranger todos os trabalhadores, ao longo do tempo, a despeito de sua forma de inserção no mercado de trabalho e seu vínculo de emprego, a partir da elaboração de mapas dos processos produtivos, de modo a estabelecer um perfil de risco à saúde dos trabalhadores.
- Epidemiológico (evento-sentinela): Consiste na intervenção nas empresas, a partir de agravos à saúde dos trabalhadores que podem representar um problema coletivo, ainda não detectado, e mesmo um problema epidemiológico relevante. mas submerso A intervenção dirige-se à maior ou às maiores empresas considerando os aspectos potenciais de freqüência elou gravidade dos eventos-sentinela.
É importante salientar que os critérios acima não obedecem à ordem de hierarquia e tampouco são excludentes, podendo ser utilizados de forma combinada.
5.4 - Como estratégia de consolidação das ações de vigilância em saúde do trabalhador é fundamental que os Estados e os Municípios contemplem o tema na revisão de seus códigos de saúde.
6 - Metodologia
Considerando os objetivos da vigilância em saúde do trabalhador - conhecer a realidade para transformá-la, buscando um aprimoramento da qualidade de vida no trabalho, é necessário que se adotem metodologias capazes de estabelecer um diagnóstico situacional, dentro do princípio da pesquisa-intervenção, e capazes, ainda, de avaliar de modo permanente os seus resultados no sentido da; mudanças pretendidas.
Nesta linha, podem-se observar alguns pressupostos de caráter metodológico, compreendendo:
6.1 - Fase preparatória: Uma vez identificada a demanda, com base nas estratégias relacionadas, o planejamento da ação pressupõe uma fase preparatória, em que a equipe busca conhecer, com o maior aprofundamento possível, o(s) processo(s), o ambiente e as condições de trabalho do local onde será realizada a ação.
A preparação deve ser efetuada por meio de análise conjunta com os trabalhadores da(s) empresa(s) - objeto da vigilância e dos representantes sindicais daquela(s) categoria(s), tendo por objetivo não só aprofundar o conhecimento sobre o objeto da vigilância, através de seu saber operário mas, principalmente, traçar estratégias de desenvolvimento da ação. Deve-se lançar mão, ainda nesta fase, de consulta bibliográfica especializada e das informações locais disponíveis acerca do caso em questão.
6.2 - A intervenção (inspeção/fiscalização sanitária)
A intervenção, realizada em conjunto com os representantes dos trabalhadores, de outras instituições, e sob a responsabilidade administrativa da equipe da Secretaria Estadual e/ou Municipal de Saúde, deverá considerar, na inspeção sanitária em saúde do trabalhador, a observância das normas e legislações que regulamentam a relação entre o trabalho e a saúde, de qualquer origem, especialmente na esfera da saúde, do trabalho, da previdência, do meio ambiente e das internacionais ratificadas pelo Brasil.
Além disso, é.preciso considerar os aspectos passíveis de causar dano à saúde, mesmo que não estejam previstos nas legislações, considerando-se não só a observação direta por parte da equipe de situações de risco à saúde como, também, as questões subjetivas referidas pelos trabalhadores na relação de sua saúde com o trabalho realizado.
Os instrumentos administrativos de registro da ação, de exigências e outras medidas são os mesmos utilizados pelas áreas de Vigilância/Fiscalização Sanitária, tais como os Termos de Visita, Notificação, Intimação, Auto de Infração etc.
6.3 - Análise dos processos
Uma forma importante de considerar a capacidade potencial de adoecer no processo, no ambiente ou em decorrência das condições em que o trabalho se realiza é utilizar instrumentos que inventariem o processo produtivo e a sua forma de organização. Os instrumentos metodológicos, a serem estabelecidos no âmbito do SUS, devem ser entregues no ato da inspeção, para serem preenchidos pela empresa, e o Roteiro de Vigilância, construído e aplicado pela equipe, no momento da ação, é outra forma de conhecer os processos.
6.4 - Inquéritos
Como proposta metodológica de investigação, no mesmo tempo da intervenção, podem-se organizar inquéritos, por meio da equipe interdisciplinar e de representantes sindicais e/ou dos trabalhadores, aplicando questionários ao conjunto dos trabalhadores, contemplando a sua percepção da relação entre trabalho e saúde, a morbidade referida (sinais e sintomas objetivos e subjetivos), a vivência com o acidente e o quase acidente de trabalho (incidente crítico), consigo e com os companheiros, e suas sugestões para a transformação do processo, do ambiente e das condições em que o trabalho se realiza.
6.5 - Mapeamento de riscos
Podem-se utilizar algumas técnicas de mapeamento de riscos dos processos produtivos, de forma gradualmente mais complexa, à medida que a intervenção se consolide e as mudanças vão ocorrendo, sempre com a participação dos trabalhadores na sua elaboração.
Uma das técnicas que deve ser utilizada, especialmente em casos de acidentes graves e fatais, é a metodologia de árvore de causas para a investigação dos fatores determinantes do evento, que será objeto de publicação posterior.
Com a concorrência interdisciplinar, na equipe, de profissionais de áreas diversas e à medida que os trabalhadores se apropriem de novos conhecimentos acerca do tema, aprofunda-se a investigação, por intermédio da utilização de técnicas mais sofisticadas.
É importante mapear, além dos riscos tradicionalmente reconhecidos, as chamadas cargas de trabalho e as formas de desgaste do trabalhador.
6.6 - Estudos epidemiológicos
Os estudos epidemiológicos clássicos, tais como os seccionais, de coorte e caso controle, podem ser aplicados sempre que se identificar sua necessidade, igualmente com a concorrência, na equipe interdisciplinar de técnicos das universidades e centros de pesquisa; como assessores da equipe.
6.7 - Acompanhamento do processo
A intervenção implica a confecção de um relatório detalhado, incorporando o conjunto de informações coletadas, elaborado pela equipe, com a participação dos trabalhadores, servindo como parâmetro de avaliações futuras.
Em razão do ritmo de implementação das medidas, avalia-se a necessidade do envolvimento de outras instâncias como, por exemplo, o Ministério Público, com o objetivo de garantir as mudanças requeridas.
Cabe ressaltar que o entendimento da intervenção deve ser o de um processo de acompanhamento e avaliação, ao longo do tempo, em que se deve buscar a negociação com as diversas instâncias, objetivando o aprimoramento da qualidade de vida no trabalho.
7 - Informações básicas
As informações de interesse para as ações em saúde do trabalhador, atualmente disponíveis, limitam-se à avaliação do perfil de morbi-mortalidade da população em geral, sem lograr o conhecimento sistemático dos riscos e o dimensionamento da população trabalhadora a eles exposta, que permitam a análise e a intervenção sobre seus determinantes. É pensando na necessidade de se avançar nesse conhecimento para fins de intervenção e prevenção efetivas dos agravos relacionados ao trabalho, que foi definido o elenco de informações aqui apresentadas. sem perder a perspectiva de ser acrescidas outras de interesse local, regional ou mesmo nacional, à medida que o sistema de informações em saúde do trabalhador se estruture e se consolide.
7.1 - Informações acerca da mortalidade
As informações de mortalidade serão coletadas principalmente a partir da Declaração de Óbito, por intermédio do Sistema de Informações sobre Mortalidade (SIM). Cada Município deverá investir na melhoria da qualidade dos dados da Declaração de Óbito e, sempre que possível, cruzar com outras informações disponíveis, principalmente a Comunicação de Acidente de Trabalho (CAT), da Previdência Social.
7.2 - Informações acerca da morbidade
As informações de morbidade podem ser obtidas de diversas fontes, tais como a Ficha Individual de Notificação de Agravos referente às doenças incluídas no Sistema de .Notificação de Agravos Notificáveis (SINAN), a Comunicação de Acidente do Trabalho (CAT), normalmente utilizada para os trabalhadores do mercado formal de trabalho, regido pela Consolidação das Leis Trabalhistas (CLT); as fichas, prontuários e outros documentos oriundos dos atendimentos ambulatoriais (SIA/SUS) e de internações (SIH/SUS) na rede de serviços de saúde.
Os Estados e os Municípios poderão definir eventos-sentinela a ser notificados, incluindo-os no SINAN. Essa definição deverá ter por referência a análise do parque produtivo local ou a suspeita da existência de um agravo não diagnosticado como relacionado ao trabalho. A análise dos eventos-sentinela constituir-se-á em atividade complementar ao sistema de informações, particularmente neste momento em que o diagnóstico de doenças é muito reduzido. Observar, por exemplo, excessos de mortes ou morbidade por alguns tipos de cânceres ou de achados laboratoriais (leucopenias, anemias) que possam estar ocorrendo em grupos específicos de trabalhadores.
7.3 - Informações relativas às atividades e aos processos produtivos
Essas informações deverão ser obtidas à medida que os Estados e os Municípios executem e implantem as ações de vigilância.
Consideram-se, neste caso, Cadastros de Estabelecimentos, Relatórios de Inspeção, Termos de Notificação e Fichas de Vigilância.
Outras informações, utilizando os bancos de dados da RAIS e do IBGE, também poderão ser incorporadas, devendo ser desagregadas, por Município, para que possam ser adequadas aos níveis locais.
Outras fontes de informação que deverão ser utilizadas, à medida que o sistema se capacite para tal, são as dos serviços médicos e de segurança e higiene industrial de empresas, do Anexo I da CIPA (Norma Regulamentadora nº 5, Portaria nº 3.214/78, MTb), dos sindicatos, das associações patronais, dos serviços/institutos de medicina legal, de associações e entidades civis (associações de moradores, grupos ecológicos, culturais), de outros órgãos da administração pública (DETRAN, secretarias de proteção ambiental, de indústria e comércio, do trabalho etc). Devem ser considerados ainda estudos epidemiológicos e resultados de pesquisas de interesse da área de saúde do trabalhador, como fonte de informações.
Um maior detalhamento acerca da criação de bancos de dados e adequação das informações em saúde do trabalhador aos Sistemas de Informação existentes, considerando, entre outros, a coleta, o fluxo, o processamento, a análise e a divulgação das informações, será efetuado em publicação posterior.
Os Estados e os Municípios poderão acrescentar outras informações e metodologias que julgarem pertinentes, inclusive sugerindo sua incorporação em âmbito nacional nas publicações subseqüentes.
8 - Considerações finais
A construção do Sistema Único de Saúde pressupõe um esforço permanente na afirmação de seus princípios e na ampliação das redes solidárias institucionais com a sociedade organizada.
Dentro do SUS, a área de saúde do trabalhador emerge como um desafio a mais, no sentido de se proverem os meios necessários para atender com primazia o que, a partir de 1988, com a Constituição Federal, passou a ser atribuição precípua das Secretarias de Saúde de Estados e Municípios: a Vigilância em Saúde do Trabalhador.
É preciso considerar, contudo, as dificuldades inerentes ao sistema de saúde, cujas práticas tradicionais, de há muito enraizadas: não dispõem de mecanismos ágeis de adequação às novas necessidades, determinadas pela lei e, mesmo, ansiadas pela sociedade.
Com este intuito, a Instrução Normativa de Vigilância em Saúde do Trabalhador pretende ser um instrumento capaz de ser um móvel de sensibilização e de ampliação das redes solidárias de construção da área especificá e do próprio Sistema Único de Saúde.
Nesta perspectiva, pretende-se, ainda, com esta Instrução Normativa, iniciar uma série de publicações temáticas afins, entre as quais se destacam as questões dos Agrotóxicos, dos Sistemas de Informações, da Investigação de Acidentes de Trabalho, das Intoxicações por Metais Pesados, dos Agravos de Caráter Ergonômico, das Pneumopatias de Origem Ocupacional.
Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS
1 - Apresentação
O avanço gradual, quantitativo e qualitativo da institucionalização das práticas de Saúde do Trabalhador, no setor saúde em todo o Brasil, reflete a consolidação da área como objeto indiscutível da saúde pública. E, por assim dizer, objeto, também, das políticas públicas direcionadas, em todos os níveis do Sistema Único de Saúde (SUS), para a prevenção dos agravos à saúde da população trabalhadora.
O conjunto de elementos deflagradores do avanço institucional, em relação à questão da Saúde do Trabalhador no SUS, compõe-se do aspecto legislativo, calcado na Lei nº 8.080, de 19 de setembro de 1990, e em diversas Constituições Estaduais e Municipais, na luta pela saúde desenvolvida pelos trabalhadores e suas organizações sindicais, passando pelo crescente comprometimento dos técnicos, ao nível dos serviços e universidades.
A presente Instrução Normativa pretende, de uma forma sucinta, fornecer subsídios básicos para o desenvolvimento de ações de Vigilância em Saúde do Trabalhador, no âmbito do SUS parte do pressuposto que o sistema de saúde, embora deva ser preservado nas suas peculiaridades regionais que impliquem um respeito às diversas culturas e características populacionais, por ser único, também deve manter linhas mestras de atuação, especialmente pela necessidade de se compatibilizarem instrumentos, bancos de informações e intercâmbio de experiências.
As recomendações aqui apresentadas são fruto de alguns anos de discussão acumulada e extraída de diversas experiências de vigilância em saúde do trabalhador, em vários estados e municípios de todo o País. Trata-se de uma primeira aproximação normativa não só com os Programas Estaduais e Municipais de Saúde do Trabalhador, já instalados e em fase de instalação, mas, também com as estruturas de atenção à saúde das Secretarias Estaduais e Municipais, especialmente nas áreas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária.
A possibilidade de traduzir a capilaridade institucional do setor saúde em instâncias efetoras de mudança dos perfis de morbidade e mortalidade, resultantes da relação trabalho-ambiente-consumo e saúde, pressupõe um comprometimento das estruturas de atenção à saúde, em especial as de vigilância e fiscalização em saúde.
O objetivo da Instrução Normativa é, em suma, o de poder instrumentalizar minimamente os setores responsáveis pela vigilância e defesa da saúde, nas Secretarias de Estados e Municípios, de forma a incorporarem em suas práticas mecanismos de análise e intervenção sobre os processos e os ambientes de trabalho.
A abordagem de vigilância em saúde do trabalhador, considerada na Instrução Normativa, implica a superação dos limites conceituais e institucionais, tradicionalmente estruturados nos serviços de saúde, das ações dissociadas de vigilância epidemiológica e sanitária.
Além disso, nas ações de vigilância e fiscalização sanitária, propriamente ditas, implica-se transpor o objeto usual - o produto/consumidor - de forma a considerar, igualmente, como objeto, o processo/trabalhador/ambiente.
Dessa forma, a vigilância em saúde do trabalhador calca-se no modelo epidemiológico de pesquisa dos agravos, nos diversos níveis da relação entre o trabalho e a saúde, agregando ao universo da avaliação e análise a capacidade imediata da intervenção sobre os fatores determinantes dos danos à saúde.
Devido à sua concepção mais abrangente de saúde, relacionada ao processo de produção, capaz de lidar com a diversidade, a complexidade e o surgimento de novas formas de adoecer, a vigilância em saúde do trabalhador ultrapassa o aspecto normativo tratado pela fiscalização tradicional.
Em razão dessas implicações, a vigilância em saúde do trabalhador pressupõe uma rede de articulações que passa, fundamentalmente, pelos trabalhadores e suas organizações, pela área de pesquisa e formação de recursos humanos e pelas áreas de assistência e reabilitação.
Finalmente, levando-se em consideração o fato de ser uma área ainda em construção dentro do SUS, pretende-se que esta Instrução Normativa possa ser aprimorada, com a maior brevidade, uma vez utilizada pela rede de serviços, assim como se constitui na primeira de uma série de publicações normativas e orientadoras, relacionadas a temas específicos em saúde do trabalhador.
2 - Conceituação básica
A Vigilância em Saúde do Trabalhador compreende uma atuação contínua e sistemática, ao longo do tempo, no sentido de detectar, conhecer, pesquisar e analisar os fatores determinantes e condicionantes dos agravos à saúde relacionados aos processos e ambientes de trabalho, em seus aspectos tecnológico, social, organizacional e epidemiológico, com a finalidade de planejar, executar e avaliar intervenções sobre esses aspectos, de forma a eliminá-los ou controlá-los.
A Vigilância em Saúde do Trabalhador compõe um conjunto de práticas sanitárias, articuladas suprassetorialmente, cuja especificidade está centrada na relação da saúde com o ambiente e os processos de trabalho e nesta com a assistência, calcado nos princípios da vigilância em saúde, para a melhoria das condições de vida e saúde da população.
A Vigilância em Saúde do Trabalhador não constitui uma área desvinculada e independente da vigilância em saúde como um todo mas, ao contrário, pretende acrescentar ao conjunto de ações da vigilância em saúde estratégias de produção de conhecimentos e mecanismos de intervenção sobre os processos de produção, aproximando os diversos objetos comuns das práticas sanitárias àqueles oriundos da relação entre o trabalho e a saúde.
3 - Princípios
A Vigilância em Saúde do Trabalhador pauta-se nos princípios do SUS, em consonância com os Sistemas Nacionais de Vigilância Sanitária e de Vigilância Epidemiológica, articulada com a área assistencial.
Além disso, tendo em vista a complexidade e a abrangência do objeto da vigilância, guarda peculiaridades que transpõem os limites setoriais da saúde, implicando a ampliação de sua abordagem.
Como princípios, esquematicamente, pode-se considerar:
3.1 - Universalidade: todos os trabalhadores, independentemente de sua localização, urbana ou rural, de sua forma de inserção no mercado de trabalho, formal ou informal, de seu vínculo empregatício, público ou privado, autônomo, doméstico, aposentado ou demitido são objeto e sujeitos da Vigilância em Saúde do Trabalhador.
3.2 - Integralidade das ações: o entendimento de atenção integral à saúde do trabalhador, compreendendo a assistência e recuperação dos agravos, os aspectos preventivos implicando intervenção sobre seus fatores determinantes em nível dos processos de trabalho e a promoção da saúde que implicam ações articuladas com os próprios trabalhadores e suas representações. A ênfase deve ser dirigida ao fato de que as ações individuais/curativas articulam-se com as ações coletivas, no âmbito da vigilância, considerando que os agravos à saúde do trabalhador são absolutamente preveníveis.
3 3 - Pluriinstitucionalidade: articulação, com formação de redes e sistemas, entre as instâncias de vigilância em saúde do trabalhador e os centros de assistência e reabilitação, as universidades e centros de pesquisa e as instituições públicas com responsabilidade na área de saúde do trabalhador consumo e ambiente.
3 4 - Controle social incorporação dos trabalhadores e das suas organizações, principalmente as sindicais, em todas as etapas da vigilância em saúde do trabalhador, compreendendo sua participação na identificação das demandas, no planejamento, no estabelecimento de prioridades e adoção de estratégias, na execução das ações, no seu acompanhamento e avaliação e no controle da aplicação de recursos.
3 5 - Hierarquização e descentralização: consolidação do papel do município e dos distritos sanitários como instância efetiva de desenvolvimento das ações de vigilância em saúde do trabalhador integrando os níveis estadual e nacional do SUS, no espectro da ação, em função de sua complexidade.
3.6 - Interdisciplinaridade: a abordagem multiprofissional sobre o objeto da vigilância em saúde do trabalhador deve contemplar os saberes técnicos, com a concorrência de diferentes áreas do conhecimento e, fundamentalmente, o saber operário, necessários para o desenvolvimento da ação.
3.7 - Pesquisa-intervenção: o entendimento de que a intervenção, no âmbito da vigilância em saúde do trabalhador, é o deflagrador de um processo contínuo, ao longo do tempo, em que a pesquisa é sua parte indissolúvel, subsidiando e aprimorando a própria intervenção.
3.8 - O caráter transformador: a intervenção sobre os fatores determinantes e condicionantes dos problemas de saúde relacionados aos processos e ambientes de trabalho com o entendimento de que a vigilância em saúde do trabalhador, sob a lógica do controle social e da transparência das ações, pode ter na intervenção um caráter proponente de mudanças dos processos de trabalho, a partir das análises tecnológica, ergonômica, organizacional e ambiental efetuadas pelo coletivo de instituições, sindicatos, trabalhadores e empresas, inclusive, superando a própria legislação.
4 - Objetivos:
De forma esquemática pode-se dizer que a vigilância em saúde do trabalhador tem como objetivos:
a - conhecer a realidade de saúde da população trabalhadora, independentemente da forma de inserção no mercado de trabalho e do vínculo trabalhista estabelecido, considerando:
a1 - a caracterização de sua forma de adoecer e morrer em função da sua relação com o processo de trabalho;
a2 - o levantamento histórico dos perfis de morbidade e mortalidade em função da sua relação com o processo de trabalho;
a3 - a avaliação do processo, do ambiente e das condições em que o trabalho se realiza, identificando os riscos e cargas de trabalho a que está sujeita, nos seus aspectos tecnológicos ergonômicos e organizacionais já conhecidos;
a4 - a pesquisa e a análise de novas e ainda desconhecidas formas de adoecer e morrer em decorrência do trabalho;
b - intervir nos fatores determinantes de agravos à saúde da população trabalhadora, visando eliminá-los ou, na sua impossibilidade, atenuá-los e controlá-los, considerando:
b1 - a fiscalização do processo, do ambiente e das condições em que o trabalho se realiza, fazendo cumprir, com rigor, as normas e legislações existentes, nacionais ou mesmo internacionais quando relacionadas à promoção da saúde do trabalhador;
b2 - a negociação coletiva em saúde do trabalhador, além dos preceitos legais estabelecidos, quando se impuser a transformação do processo, do ambiente e das condições em que o trabalho se realiza, não prevista normativamente;
c - avaliar o impacto das medidas adotadas para a eliminação, atenuação e controle dos fatores determinantes de agravos à saúde, considerando:
c1 - a possibilidade de transformar os perfis de morbidade e mortalidade;
c2 - o aprimoramento contínuo da qualidade de vida no trabalho;
d - subsidiar a tomada de decisões dos órgãos competentes, nas três esferas de governo considerando:
d1 - o estabelecimento de políticas públicas, contemplando a relação entre o trabalho e a saúde no campo de abrangência da vigilância em saúde;
d2 - a interveniência, junto às instâncias do Estado e da sociedade, para o aprimoramento das normas legais existentes e para a criação de novas normas legais em defesa da saúde dos trabalhadores;
d3 - o planejamento das ações e o estabelecimento de suas estratégias;
d4 - a participação na estruturação de serviços de atenção à saúde dos trabalhadores;
d5 - a participação na formação, capacitação e treinamento de recursos humanos com interesse na área;
e - estabelecer sistemas de informação em saúde do trabalhador, junto às estruturas existentes no setor saúde, considerando:
e1 - a criação de bases de dados comportando todas as informações oriundas do processo de vigilância e incorporando as informações tradicionais já existentes;
e2 - a divulgação sistemática das informações analisadas e consolidadas.
5 - Estratégias
A vigilância em saúde do trabalhador, como um conjunto de práticas sanitárias contínuas, calcada, entre outros princípios, na interdisciplinaridade, na pluriinstitucionalidade, no controle social, balizada na configuração do SUS, e tendo como imagem-objetivo a melhoria da qualidade de vida no trabalho, pressupõe o estabelecimento de estratégias operacionais para alcançá-Ia.
Embora cada Estado, Região ou Município, guardadas suas características, deva buscar a melhor forma de estabelecer suas próprias estratégias de vigilância, alguns pressupostos podem ser considerados como aplicáveis ao conjunto do SUS. Dentre os passos que podem ser estabelecidos na estratégia de operacionalização das ações, buscando manter uma lógica sequencial de consolidação da vigilância, pode-se destacar:
5.1 - Onde já existam estruturas, estaduais e municipais, de saúde do trabalhador - Programas, Coordenações, Divisões, Gerências, Centros, Núcleos - promover e/ou aprofundar a relação institucional com as estruturas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária, buscando a superação da dicotomia existente em suas práticas, em que o objeto de ação da vigilância, em geral, não contempla o processo de produção e sua relação com a saúde dos trabalhadores. Com este intuito, recomenda-se a constituição de equipes multiprofissionais para a execução de ações interdisciplinares e pluriinstitucionais.
5.2 - Recomenda-se a criação de comissão, na forma colegiada, com a participação de trabalhadores, suas organizações sindicais e instituições públicas com responsabilidades em saúde do trabalhador, vinculada organicamente ao SUS e subordinada aos Conselhos Estaduais e Municipais de Saúde, com a finalidade de assessorá-lo na definição de políticas, no estabelecimento de diretrizes e prioridades, e no acompanhamento e avaliação da execução das ações de saúde do trabalhador.
5.3 - Dada a abrangência e as dificuldades operacionais de se implementarem, simultaneamente, ações de vigilância em todos os ambientes de trabalho, em um dado município ou região, faz-se necessário o planejamento dessas ações com o estabelecimento de prioridades, visando a intervenções de impacto, com efeitos educativos e disciplinadores sobre o setor. Para tanto, recomenda-se a adoção de alguns critérios como:
- Base Sindical: Uma vez que um determinado sindicato de trabalhadores, com alguma tradição de luta pela saúde identifique e encaminhe situações-problema, junto à estrutura de vigilância, desencadeia-se uma ação integrada que visa atuar não apenas na empresa denunciada, mas nas principais empresas abrangidas por aquela categoria de trabalhadores. O investimento da ação nesta base deve considerar a capacidade de reprodutibilidade, a partir do sindicato em questão e para o movimento sindical como um todo, numa dada região.
- Ramo Produtivo: Consiste na atuação em todas as empresas com o mesmo perfil produtivo, capaz de se constituir em fonte de risco para a saúde, preponderantes numa dada região, independente da capacidade de mobilização dos sindicatos envolvidos. A utilização deste critério pode se dar por avaliação epidemiológica dos casos notificados, denúncias sucessivas ou análise dos processos produtivos. O investimento da ação, neste caso, visa à mudança dos processos de forma integrada, sem a punição de uma empresa em particular, mas intervindo em todas as empresas daquele setor e, em especial, nas que apresentam grande concentração de trabalhadores, sempre buscando a atuação conjunta com os sindicatos das categorias expostas.
- Território: Consiste na intervenção por varredura, em pequena área geográfica previamente delimitada (setor censitário, distrito de saúde, bairro, distrito industrial etc.), de todos os processos produtivos capazes de gerar dano à saúde. O investimento da ação, neste caso, visa abranger todos os trabalhadores, ao longo do tempo, a despeito de sua forma de inserção no mercado de trabalho e seu vínculo de emprego, a partir da elaboração de mapas dos processos produtivos, de modo a estabelecer um perfil de risco à saúde dos trabalhadores.
- Epidemiológico (evento-sentinela): Consiste na intervenção nas empresas, a partir de agravos à saúde dos trabalhadores que podem representar um problema coletivo, ainda não detectado, e mesmo um problema epidemiológico relevante, mas submerso. A intervenção dirige-se à maior ou às maiores empresas considerando os aspectos potenciais de frequência elou gravidade dos eventos-sentinela.
É importante salientar que os critérios acima não obedecem à ordem de hierarquia e tampouco são excludentes, podendo ser utilizados de forma combinada.
5.4 - Como estratégia de consolidação das ações de vigilância em saúde do trabalhador é fundamental que os estados e os municípios contemplem o tema na revisão de seus códigos de saúde.
6 - Metodologia
Considerando os objetivos da vigilância em saúde do trabalhador - conhecer a realidade para transformá-la, buscando um aprimoramento da qualidade de vida no trabalho, é necessário que se adotem metodologias capazes de estabelecer um diagnóstico situacional, dentro do princípio da pesquisa-intervenção, e capazes, ainda, de avaliar de modo permanente os seus resultados no sentido das mudanças pretendidas.
Nesta linha, podem-se observar alguns pressupostos de caráter metodológico, compreendendo:
6.1 - Fase preparatória: Uma vez identificada a demanda, com base nas estratégias relacionadas, o planejamento da ação pressupõe uma fase preparatória, em que a equipe busca conhecer, com o maior aprofundamento possível, o(s) processo(s), o ambiente e as condições de trabalho do local onde será realizada a ação.
A preparação deve ser efetuada por meio de análise conjunta com os trabalhadores da(s) empresa(s) - objeto da vigilância e dos representantes sindicais daquela(s) categoria(s), tendo por objetivo não só aprofundar o conhecimento sobre o objeto da vigilância, através de seu saber operário mas, principalmente, traçar estratégias de desenvolvimento da ação. Deve-se lançar mão, ainda nesta fase, de consulta bibliográfica especializada e das informações locais disponíveis acerca do caso em questão.
6.2 - A intervenção (inspeção/fiscalização sanitária)
A intervenção, realizada em conjunto com os representantes dos trabalhadores, de outras instituições, e sob a responsabilidade administrativa da equipe da Secretaria Estadual e/ou Municipal de Saúde, deverá considerar, na inspeção sanitária em saúde do trabalhador, a observância das normas e legislações que regulamentam a relação entre o trabalho e a saúde, de qualquer origem, especialmente na esfera da saúde, do trabalho, da previdência, do meio ambiente e das internacionais ratificadas pelo Brasil.
Além disso, é.preciso considerar os aspectos passíveis de causar dano à saúde, mesmo que não estejam previstos nas legislações, considerando-se não só a observação direta por parte da equipe de situações de risco à saúde como, também, as questões subjetivas referidas pelos trabalhadores na relação de sua saúde com o trabalho realizado.
Os instrumentos administrativos de registro da ação, de exigências e outras medidas são os mesmos utilizados pelas áreas de Vigilância/Fiscalização Sanitária, tais como os Termos de Visita, Notificação, Intimação, Auto de Infração etc.
6.3 - Análise dos processos
Uma forma importante de considerar a capacidade potencial de adoecer no processo, no ambiente ou em decorrência das condições em que o trabalho se realiza é utilizar instrumentos que inventariem o processo produtivo e a sua forma de organização. Os instrumentos metodológicos, a serem estabelecidos no âmbito do SUS, devem ser entregues no ato da inspeção, para serem preenchidos pela empresa, e o Roteiro de Vigilância, construído e aplicado pela equipe, no momento da ação, é outra forma de conhecer os processos.
6.4 - Inquéritos
Como proposta metodológica de investigação, no mesmo tempo da intervenção, podem-se organizar inquéritos, por meio da equipe interdisciplinar e de representantes sindicais e/ou dos trabalhadores, aplicando questionários ao conjunto dos trabalhadores, contemplando a sua percepção da relação entre trabalho e saúde, a morbidade referida (sinais e sintomas objetivos e subjetivos), a vivência com o acidente e o quase acidente de trabalho (incidente crítico), consigo e com os companheiros, e suas sugestões para a transformação do processo, do ambiente e das condições em que o trabalho se realiza.
6.5 - Mapeamento de riscos
Podem-se utilizar algumas técnicas de mapeamento de riscos dos processos produtivos, de forma gradualmente mais complexa, à medida que a intervenção se consolide e as mudanças vão ocorrendo, sempre com a participação dos trabalhadores na sua elaboração.
Uma das técnicas que deve ser utilizada, especialmente em casos de acidentes graves e fatais, é a metodologia de árvore de causas para a investigação dos fatores determinantes do evento, que será objeto de publicação posterior.
Com a concorrência interdisciplinar, na equipe, de profissionais de áreas diversas e à medida que os trabalhadores se apropriem de novos conhecimentos acerca do tema, aprofunda-se a investigação, por intermédio da utilização de técnicas mais sofisticadas.
É importante mapear, além dos riscos tradicionalmente reconhecidos, as chamadas cargas de trabalho e as formas de desgaste do trabalhador.
6.6 - Estudos epidemiológicos
Os estudos epidemiológicos clássicos, tais como os seccionais, de coorte e caso controle, podem ser aplicados sempre que se identificar sua necessidade, igualmente com a concorrência, na equipe interdisciplinar de técnicos das universidades e centros de pesquisa; como assessores da equipe.
6.7 - Acompanhamento do processo
A intervenção implica a confecção de um relatório detalhado, incorporando o conjunto de informações coletadas, elaborado pela equipe, com a participação dos trabalhadores, servindo como parâmetro de avaliações futuras.
Em razão do ritmo de implementação das medidas, avalia-se a necessidade do envolvimento de outras instâncias como, por exemplo, o Ministério Público, com o objetivo de garantir as mudanças requeridas.
Cabe ressaltar que o entendimento da intervenção deve ser o de um processo de acompanhamento e avaliação, ao longo do tempo, em que se deve buscar a negociação com as diversas instâncias, objetivando o aprimoramento da qualidade de vida no trabalho.
7 - Informações básicas
As informações de interesse para as ações em saúde do trabalhador, atualmente disponíveis, limitam-se à avaliação do perfil de morbi-mortalidade da população em geral, sem lograr o conhecimento sistemático dos riscos e o dimensionamento da população trabalhadora a eles exposta, que permitam a análise e a intervenção sobre seus determinantes. É pensando na necessidade de se avançar nesse conhecimento para fins de intervenção e prevenção efetivas dos agravos relacionados ao trabalho, que foi definido o elenco de informações aqui apresentadas, sem perder a perspectiva de ser acrescidas outras de interesse local, regional ou mesmo nacional, à medida que o sistema de informações em saúde do trabalhador se estruture e se consolide.
7.1 - Informações acerca da mortalidade
As informações de mortalidade serão coletadas principalmente a partir da Declaração de Óbito, por intermédio do Sistema de Informações sobre Mortalidade (SIM). Cada Município deverá investir na melhoria da qualidade dos dados da Declaração de Óbito e, sempre que possível, cruzar com outras informações disponíveis, principalmente a Comunicação de Acidente de Trabalho (CAT), da Previdência Social.
7.2 - Informações acerca da morbidade
As informações de morbidade podem ser obtidas de diversas fontes, tais como a Ficha Individual de Notificação de Agravos referente às doenças incluídas no Sistema de .Notificação de Agravos Notificáveis (SINAN), a CAT, normalmente utilizada para os trabalhadores do mercado formal de trabalho, regido pela Consolidação das Leis Trabalhistas (CLT); as fichas, prontuários e outros documentos oriundos dos atendimentos ambulatoriais (SIA/SUS) e de internações (SIH/SUS) na rede de serviços de saúde.
Os estados e os municípios poderão definir eventos-sentinela a ser notificados, incluindo-os no SINAN. Essa definição deverá ter por referência a análise do parque produtivo local ou a suspeita da existência de um agravo não diagnosticado como relacionado ao trabalho. A análise dos eventos-sentinela constituir-se-á em atividade complementar ao sistema de informações, particularmente neste momento em que o diagnóstico de doenças é muito reduzido. Observar, por exemplo, excessos de mortes ou morbidade por alguns tipos de cânceres ou de achados laboratoriais (leucopenias, anemias) que possam estar ocorrendo em grupos específicos de trabalhadores.
7.3 - Informações relativas às atividades e aos processos produtivos
Essas informações deverão ser obtidas à medida que os estados e os municípios executem e implantem as ações de vigilância.
Consideram-se, neste caso, Cadastros de Estabelecimentos, Relatórios de Inspeção, Termos de Notificação e Fichas de Vigilância.
Outras informações, utilizando os bancos de dados da RAIS e do IBGE, também poderão ser incorporadas, devendo ser desagregadas, por Município, para que possam ser adequadas aos níveis locais.
Outras fontes de informação que deverão ser utilizadas, à medida que o sistema se capacite para tal, são as dos serviços médicos e de segurança e higiene industrial de empresas, do Anexo I da CIPA (Norma Regulamentadora nº 5, Portaria nº 3.214/78, MTb), dos sindicatos, das associações patronais, dos serviços/institutos de medicina legal, de associações e entidades civis (associações de moradores, grupos ecológicos, culturais), de outros órgãos da administração pública (Detran), secretarias de proteção ambiental, de indústria e comércio, do trabalho etc). Devem ser considerados ainda estudos epidemiológicos e resultados de pesquisas de interesse da área de saúde do trabalhador, como fonte de informações.
Um maior detalhamento acerca da criação de bancos de dados e adequação das informações em saúde do trabalhador aos Sistemas de Informação existentes, considerando, entre outros, a coleta, o fluxo, o processamento, a análise e a divulgação das informações, será efetuado em publicação posterior.
Os estados e os municípios poderão acrescentar outras informações e metodologias que julgarem pertinentes, inclusive sugerindo sua incorporação em âmbito nacional nas publicações subsequentes.
8 - Considerações finais
A construção do SUS pressupõe um esforço permanente na afirmação de seus princípios e na ampliação das redes solidárias institucionais com a sociedade organizada.
Dentro do SUS, a área de saúde do trabalhador emerge como um desafio a mais, no sentido de se proverem os meios necessários para atender com primazia o que, a partir de 1988, com a Constituição Federal, passou a ser atribuição precípua das Secretarias de Saúde de Estados e Municípios: a Vigilância em Saúde do Trabalhador.
É preciso considerar, contudo, as dificuldades inerentes ao sistema de saúde, cujas práticas tradicionais, de há muito enraizadas: não dispõem de mecanismos ágeis de adequação às novas necessidades, determinadas pela lei e, mesmo, ansiadas pela sociedade.
Com este intuito, a Instrução Normativa de Vigilância em Saúde do Trabalhador pretende ser um instrumento capaz de ser um móvel de sensibilização e de ampliação das redes solidárias de construção da área especificá e do próprio SUS.
Nesta perspectiva, pretende-se, ainda, com esta Instrução Normativa, iniciar uma série de publicações temáticas afins, entre as quais se destacam as questões dos Agrotóxicos, dos Sistemas de Informações, da Investigação de Acidentes de Trabalho, das Intoxicações por Metais Pesados, dos Agravos de Caráter Ergonômico, das Pneumopatias de Origem Ocupacional.
ANEXO LXXX
LISTA DE DOENÇAS RELACIONADAS AO TRABALHO (Origem: PRT MS/GM 1339/1999, Anexo 1)
AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL E DOENÇAS CAUSALMENTE RELACIONADAS COM OS RESPECTIVOS AGENTES OU FATORES DE RISCO (DENOMINADAS E CODIFICADAS SEGUNDO A CID-10)
AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
DOENÇAS CAUSALMENTE RELACIONADAS COM OS RESPECTIVOS AGENTES OU FATORES DE RISCO (DENOMINADAS E CODIFICADAS SEGUNDO A CID-10) |
1) Arsênio e seus compostos arsenicais |
- Angiossarcoma do fígado (C22.3) |
2) Asbesto ou Amianto |
- Neoplasia maligna do estômago (C16.-) |
3) Benzeno e seus homólogos tóxicos |
- Leucemias (C91-C95.-) |
4) Berílio e seus compostos tóxicos |
- Neoplasia maligna dos brônquios e do pulmão (C34.-) |
5) Bromo |
- Faringite Aguda ("Angina Aguda", "Dor de Garganta") (J02.9) |
6) Cádmio ou seus compostos |
- Neoplasia maligna dos brônquios e do pulmão (C34.-) |
7) Carbonetos metálicos de Tungstênio sinterizados |
- Outras Rinites Alérgicas (J30.3) |
8) Chumbo ou seus compostos tóxicos |
- Outras anemias devidas a transtornos enzimáticos (D55.8) |
9) Cloro |
- Rinite Crônica (J31.0) |
10) Cromo ou seus compostos tóxicos |
- Neoplasia maligna dos brônquios e do pulmão (C34.-) |
11) Flúor ou seus compostos tóxicos |
- Conjuntivite (H10) |
12) Fósforo ou seus compostos tóxicos |
- Polineuropatia devida a outros agentes tóxicos (G52.2) |
13) Hidrocarbonetos alifáticos ou aromáticos (seus derivados halogenados tóxicos) |
- Angiossarcoma do fígado (C22.3) |
14) Iodo |
- Conjuntivite (H10) |
15) Manganês e seus compostos tóxicos |
- Demência em outras doenças específicas classificadas em outros locais (F02.8) |
16) Mercúrio e seus compostos tóxicos |
- Outros transtornos mentais decorrentes de lesão e disfunção cerebrais e de doença física (F06.-) |
17) Substâncias asfixiantes: Monóxido de Carbono, Cianeto de Hidrogênio ou seus derivados tóxicos, Sulfeto de Hidrogênio (Ácido Sulfídrico) |
- Demência em outras doenças específicas classificadas em outros locais (F02.8) |
18) Sílica Livre |
- Neoplasia maligna dos brônquios e do pulmão (C34.-) |
19) Sulfeto de Carbono ou Dissulfeto de Carbono |
- Outros transtornos mentais decorrentes de lesão e disfunção cerebrais e de doença física (F06.-) |
20) Alcatrão, Breu, Betume, Hulha Mineral, Parafina e produtos ou resíduos dessas substâncias, causadores de epiteliomas primitivos da pele |
- Neoplasia maligna dos brônquios e do pulmão (C34.-) |
21) Ruído e afecção auditiva |
- Perda da Audição Provocada pelo Ruído (H83.3) |
22) Vibrações (afecções dos músculos, tendões, ossos, articulações, vasos sangüíneos periféricos ou dos nervos periféricos) |
- Síndrome de Raynaud (I73.0) |
23) Ar Comprimido |
- Otite Média não supurativa (H65.9) |
24) Radiações Ionizantes |
- Neoplasia maligna da cavidade nasal e dos seios paranasais (C30-C31.-) |
25) Microorganismos e parasitas infecciosos vivos e seus produtos tóxicos (Exposição ocupacional ao agente e/ou transmissor da doença, em profissões e/ou condições de trabalho especificadas) |
- Tuberculose (A15-A19.-) |
26) Algodão, Linho, Cânhamo, Sisal |
- Outras Rinites Alérgicas (J30.3) |
27) Agentes físicos, químicos ou biológicos, que afetam a pele, não considerados em outras rubricas |
- "Dermatoses Pápulo-Pustulosas e suas complicações infecciosas" (L08.9) |
DOENÇAS INFECCIOSAS E PARASITÁRIAS RELACIONADAS COM O TRABALHO (Grupo I da CID-10)
DOENÇAS |
AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
Tuberculose (A15-A19.-) |
Exposição ocupacional ao Mycobacterium tuberculosis (Bacilo de Koch) ou Mycobacterium bovis, em atividades em laboratórios de biologia, e atividades realizadas por pessoal de saúde, que propiciam contato direto com produtos contaminados ou com doentes cujos exames bacteriológicos são positivos (Z57.8) (Quadro 25) Hipersuscetibilidade do trabalhador exposto a poeiras de sílica (Sílico-tuberculose) (J65.-) |
Carbúnculo (A22.-) |
Zoonose causada pela exposição ocupacional ao Bacillus anthracis, em atividades suscetíveis de colocar os trabalhadores em contato direto com animais infectados ou com cadáveres desses animais; trabalhos artesanais ou industriais com pelos, pele, couro ou lã. (Z57.8) (Quadro 25) |
Brucelose (A23.-) |
Zoonose causada pela exposição ocupacional a Brucella melitensis, B. abortus, B. suis, B. canis, etc., em atividades em abatedouros, frigoríficos, manipulação de produtos de carne; ordenha e fabricação de laticínios e atividades assemelhadas. (Z57.8) (Quadro 25) |
Leptospirose (A27.-) |
Exposição ocupacional a Leptospira icterohaemorrhagiae (e outras espécies), pelo contato direto com águas sujas, ou efetuado em locais suscetíveis de serem sujos por dejetos de animais portadores da leptospira; trabalhos efetuados dentro de minas, túneis, galerias, esgotos em locais subterrâneos; trabalhos em cursos d¿água; trabalhos de drenagem; contato com roedores; trabalhos com animais domésticos, e com gado; preparação de alimentos de origem animal, de peixes, de laticínios, etc.. (Z57.8) (Quadro 25) |
Tétano (A35.-) |
Exposição ao Clostridium tetani, em circunstâncias de acidentes do trabalho na agricultura, na construção civil, na indústria, ou em acidentes de trajeto (Z57.8) (Quadro 25) |
Psitacose, Ornitose, Doença dos Tratadores de Aves (A70.-) |
Zoonoses causadas pela exposição ocupacional a Chlamydia psittaci ou Chlamydia pneumoniae, em trabalhos em criadouros de aves ou pássaros, atividades de Veterinária, em zoológicos, e em laboratórios biológicos, etc.(Z57.8) (Quadro 25) |
Dengue [Dengue Clássico] (A90.-) |
Exposição ocupacional ao mosquito (Aedes aegypti), transmissor do arbovírus da Dengue, principalmente em atividades em zonas endêmicas, em trabalhos de saúde pública, em trabalhos de laboratórios de pesquisa, entre outros. (Z57.8) (Quadro 25) |
Febre Amarela (A95.-) |
Exposição ocupacional ao mosquito (Aedes aegypti), transmissor do arbovírus da Febre Amarela, principalmente em atividades em zonas endêmicas, em trabalhos de saúde pública, em trabalhos de laboratórios de pesquisa, entre outros. (Z57.8) (Quadro 25) |
Hepatites Virais (B15-B19.-) |
Exposição ocupacional ao Vírus da Hepatite A (HAV); Vírus da Hepatite B (HBV); Vírus da Hepatite C (HCV); Vírus da Hepatite D (HDV); Vírus da Hepatite E (HEV), em trabalhos envolvendo manipulação, acondicionamento ou emprego de sangue humano ou de seus derivados; trabalho com "águas usadas" e esgotos; trabalhos em contato com materiais provenientes de doentes ou objetos contaminados por eles. (Z57.8) (Quadro 25) |
Doença pelo Vírus da Imunodeficiência Humana (HIV) (B20-B24.-) |
Exposição ocupacional ao Vírus da Imuno-deficiência Humana (HIV), principalmente em trabalhadores da saúde, em decorrência de acidentes pérfuro-cortantes com agulhas ou material cirúrgico contaminado, e na manipulação, acondicionamento ou emprego de sangue ou de seus derivados, e contato com materiais provenientes de pacientes infectados. (Z57.8) (Quadro 25) |
Dermatofitose (B35.-) e Outras Micoses Superficiais (B36.-) |
- Exposição ocupacional a fungos do gênero Epidermophyton, Microsporum e Trichophyton, em trabalhos em condições de temperatura elevada e umidade (cozinhas, ginásios, piscinas) e outras situações específicas de exposição ocupacional. (Z57.8) (Quadro 25) |
Candidíase (B37.-) |
Exposição ocupacional a Candida albicans, Candida glabrata, etc., em trabalhos que requerem longas imersões das mãos em água e irritação mecânica das mãos, tais como trabalhadores de limpeza, lavadeiras, cozinheiras, entre outros. (Z57.8) (Quadro 25) |
Paracoccidioidomicose (Blastomicose Sul Americana, Blastomicose Brasileira, Doença de Lutz) (B41.-) |
Exposição ocupacional ao Paracoccidioides brasiliensis, principalmente em trabalhos agrícolas ou florestais e em zonas endêmicas. (Z57.8) (Quadro 25) |
Malária (B50 ¿ B54.-) |
- Exposição ocupacional ao Plasmodium malariae; Plasmodium vivax; Plasmodium falciparum ou outros protozoários, principalmente em atividades de mineração, construção de barragens ou rodovias, em extração de petróleo e outras atividades que obrigam a entrada dos trabalhadores em zonas endêmicas (Z57.8) (Quadro 25) |
Leishmaniose Cutânea (B55.1) ou Leishmaniose Cutâneo-Mucosa (B55.2) |
Exposição ocupacional à Leishmania braziliensis, principalmente em trabalhos agrícolas ou florestais e em zonas endêmicas, e outras situações específicas de exposição ocupacional. (Z57.8) (Quadro 25) |
NEOPLASIAS (TUMORES) RELACIONADOS COM O TRABALHO (GRUPO II da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
Neoplasia maligna do estômago (C16.-) |
- Asbesto ou Amianto (X49.-; Z57.2)(Quadro 2) |
Angiossarcoma do fígado (C22.3) |
- Arsênio e seus compostos arsenicais (X48.-; X49.-; Z57.5) (Quadro 1) |
Neoplasia maligna do pâncreas (C25.-) |
- Cloreto de Vinila (X46.-; Z57.5) (Quadro 13) |
Neoplasia maligna da cavidade nasal e dos seios paranasais (C30-C31.-) |
- Radiações ionizantes (W88.-; Z57.1)(Quadro 24) |
Neoplasia maligna da laringe (C32.-) |
- Asbesto ou Amianto (Z57.2) (Quadro 2) |
Neoplasia maligna dos brônquios e do pulmão (C34.-) |
- Arsênio e seus compostos arsenicais (X48.-; X49.-; Z57.4 e Z57.5) (Quadro 1) |
Neoplasia maligna dos ossos e cartilagens articulares dos membros (Inclui "Sarcoma Ósseo") (C40.-) |
- Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
Outras neoplasias malignas da pele (C44.-) |
- Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) |
Mesotelioma (C45.-) |
- Asbesto ou Amianto (X49.-; Z57.2) (Quadro 2) |
Neoplasia maligna da bexiga (C67.-) |
- Alcatrão, breu, betume, hulha mineral, parafina e produtos de resíduos dessas substâncias (X49.-; Z57.5 (Quadro 20) |
Leucemias (C91-C95.-) |
- Benzeno (X46.-; Z57.5) (Quadro 3) |
DOENÇAS DO SANGUE E DOS ÓRGÃOS HEMATOPOÉTICOS RELACIONADAS COM O TRABALHO (Grupo III da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Síndromes Mielodisplásicas (D46.-) | - Benzeno (X46.-; Z57.5) (Quadro 3) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Outras anemias devidas a transtornos enzimáticos (D55.8) | - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) |
| Anemia Hemolítica adquirida (D59.2) | - Derivados nitrados e aminados do Benzeno (X46.-; Z57.5) |
| Anemia Aplástica devida a outros agentes externos (D61.2) | - Benzeno (X46.-; Z57.5) (Quadro 3) - Radiações ionizantes (W88.-) (Quadro 24) |
| Anemia Aplástica não especificada, Anemia hipoplástica SOE, Hipoplasia medular (D61.9) | - Benzeno (X46.-; Z57.5)(Quadro 3) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Anemia Sideroblástica secundária a toxinas (Inclui "Anemia Hipocrômica, Microcítica, com Reticulocitose") (D64.2) | - Chumbo ou seus compostos tóxicos (X46.-; Z57.5) (Quadro 8) |
| Púrpura e outras manifestações hemorrágicas (D69.-) | - Benzeno (X46.-; Z57.5) (Quadro 3) - Cloreto de Vinila (X46.-)(Quadro 13) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Agranulocitose (Neutropenia tóxica) (D70) | - Benzeno (X46.-; Z57.5) (Quadro 3) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Derivados do Fenol, Pentaclorofenol, Hidroxibenzonitrilo (X49.-; XZ57.5) |
| Outros transtornos especificados dos glóbulos brancos: leucocitose, reação leucemóide (D72.8) | - Benzeno (X46.-; Z57.5)(Quadro 3) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Metahemoglobinemia (D74.-) | - Aminas aromáticas e seus derivados (X49.-; Z57.5) |
DOENÇAS ENDÓCRINAS, NUTRICIONAIS E METABÓLICAS RELACIONADAS COM O TRABALHO (Grupo IV da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Hipotireoidismo devido a substâncias exógenas (E03.-) | - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Hidrocarbonetos halogenados (Clorobenzeno e seus derivados) (X46.-; Z57.5) (Quadro 13) - Tiuracil (X49.-; Z57.5) - Tiocinatos (X49.-; Z57.5) - Tiuréia (X49.-; Z57.5) |
| Outras Porfirias (E.80.2) | -Clorobenzeno e seus derivados (X46.-; Z57.4 e Z57.5) (Quadro 13) |
TRANSTORNOS MENTAIS E DO COMPORTAMENTO RELACIONADOS COM O TRABALHO (Grupo V da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Demência em outras doenças específicas classificadas em outros locais (F02.8) | -Manganês (X49.-; Z57.5) (Quadro 15) -Substâncias asfixiantes: CO, H2S, etc. (seqüela) (X47.-; Z57.5) (Quadro 17) -Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) |
| Delirium, não sobreposto a demência, como descrita (F05.0) | - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) |
| Outros transtornos mentais decorrentes de lesão e disfunção cerebrais e de doença física (F06.-) Transtorno Cognitivo Leve (F06.7) |
- Tolueno e outros solventes aromáticos neurotóxicos (X46.-; Z57.5) (Quadro 3) - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
| Transtornos de personalidade e de comportamento decorrentes de doença, lesão e de disfunção de personalidade (F07.-) Transtorno Orgânico de Personalidade (F07.0) Outros transtornos de personalidade e de comportamento decorrentes de doença, lesão ou disfunção cerebral (F07.8) |
- Tolueno e outros solventes aromáticos neurotóxicos (X46.-; Z57.5) (Quadro 3) - Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
| Transtorno Mental Orgânico ou Sintomático não especificado (F09.-) | - Tolueno e outros solventes aromáticos neurotóxicos (X46.-; Z57.5) (Quadro 3) - Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
| Transtornos mentais e comportamentais devidos ao uso do álcool: Alcoolismo Crônico (Relacionado com o Trabalho) (F10.2) | - Problemas relacionados com o emprego e com o desemprego: Condições difíceis de trabalho (Z56.5) -Circunstância relativa às condições de trabalho (Y96) |
| Episódios Depressivos (F32.-) | - Tolueno e outros solventes aromáticos neurotóxicos (X46.-; Z57.5) (Quadro 3) - Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
| Reações ao "Stress" Grave e Transtornos de Adaptação (F43.-) Estado de "Stress" Pós-Traumático (F43.1) |
-Outras dificuldades físicas e mentais relacionadas com o trabalho: reação após acidente do trabalho grave ou catastrófico, ou após assalto no trabalho (Z56.6) -Circunstância relativa às condições de trabalho (Y96) |
| Neurastenia (Inclui "Síndrome de Fadiga") (F48.0) | - Tolueno e outros solventes aromáticos neurotóxicos (X46.-; Z57.5) (Quadro 3) - Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
| Outros transtornos neuróticos especificados (Inclui "Neurose Profissional") (F48.8) | - Problemas relacionados com o emprego e com o desemprego (Z56.-): Desemprego (Z56.0); Mudança de emprego (Z56.1); Ameaça de perda de emprego (Z56.2); Ritmo de trabalho penoso (Z56.3); Desacordo com patrão e colegas de trabalho (Condições difíceis de trabalho) (Z56.5); Outras dificuldades físicas e mentais relacionadas com o trabalho (Z56.6) |
| Transtorno do Ciclo Vigília-Sono Devido a Fatores Não-Orgânicos (F51.2) | Problemas relacionados com o emprego e com o desemprego: Má adaptação à organização do horário de trabalho (Trabalho em Turnos ou Trabalho Noturno) (Z56.6) -Circunstância relativa às condições de trabalho (Y96) |
| - Ritmo de trabalho penoso (Z56.3) - Outras dificuldades físicase mentais relacionadas com o trabalho (Z56.6) |
- Ritmo de trabalho penoso (Z56.3) - Outras dificuldades físicas e mentais relacionadas com o trabalho (Z56.6) |
DOENÇAS DO SISTEMA NERVOSO RELACIONADAS COM O TRABALHO (Grupo VI da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Ataxia Cerebelosa (G11.1) | - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) |
| Parkisonismo Secundário devido a outros agentes externos (G21.2) | - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) |
| Outras formas especificadas de tremor (G25.2) | - Brometo de metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Tetracloroetano (X46.-; Z57.5) (Quadro 13) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) -Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
| Transtorno extrapiramidal do movimento não especificado (G25.9) | - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Cloreto de metileno (Diclorometano) e outros solventes halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) |
| Distúrbios do Ciclo Vigília-Sono (G47.2) | Problemas relacionados com o emprego e com o desemprego: Má adaptação à organização do horário de trabalho (Trabalho em Turnos ou Trabalho Noturno) (Z56.6) |
| Transtornos do nervo trigêmio (G50.-) | - Tricloroetileno e outros solventes halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) |
| Transtornos do nervo olfatório (G52.0) (Inclui "Anosmia") |
- Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Sulfeto de hidrogênio (X49.-; Z57.5) (Quadro 17) |
| Transtornos do plexo braquial (Síndrome da Saída do Tórax, Síndrome do Desfiladeiro Torácico) (G54.0) | - Posições forçadas e gestos repetitivos (Z57.8) |
| Mononeuropatias dos Membros Superiores (G56.-) Síndrome do Túnel do Carpo (G56.0) Outras Lesões do Nervo Mediano: Síndrome do Pronador Redondo (G56.1) Síndrome do Canal de Guyon (G56.2) Lesão do Nervo Cubital (ulnar): Sindrome do Túnel Cubital (G56.2) Lesão do Nervo Radial (G56.3) Outras Mononeuropatias dos Membros Superiores: Compressão do Nervo Supraescapular (G56.8) |
- Posições forçadas e gestos repetitivos (Z57.8) |
| Mononeuropatias do membro inferior (G57.) Lesão do Nervo Poplíteo Lateral (G57.3) |
- Posições forçadas e gestos repetitivos (Z57.8) |
| Polineuropatia devida a outros agentes tóxicos (G62.2) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Chumbo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Fósforo (X48.-; X49.-; Z57.4 e Z57.5) (Quadro 12) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) - n-Hexano (X46.-; Z57.5) (Quadro 13) - Metil-n-Butil Cetona (MBK) (X46.-; Z57.5) |
| Polineuropatia induzida pela radiação (G62.8) | - Radiações ionizantes (X88.-; Z57.1) (Quadro 24) |
| Encefalopatia Tóxica Aguda (G92.1) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Chumbo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Hidrocarbonetos alifáticos ou aromáticos (seus derivados halogenados neurotóxicos) (X46.-; Z57.5) (Quadro 13) - Mercúrio e seus derivados tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) |
| Encefalopatia Tóxica Crônica (G92.2) | - Tolueno e Xileno (X46.-; Z57.5) (Quadro 3) -Chumbo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) -Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) -Substâncias asfixiantes: CO, H2S, etc. (seqüela) (X47.-; Z57.5) (Quadro 17) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) |
DOENÇAS DO OLHO E ANEXOS RELACIONADAS COM O TRABALHO (Grupo VII da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Blefarite (H01.0) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Radiações Ionizantes (W88.-; Z57.1) (Quadro 24) - Cimento (X49.-; Z57.2) |
| Conjuntivite (H10) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Berílio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 4) - Flúor e seus compostos tóxicos (X49.-) (Quadro 11) - Iodo (X49.-; Z57.5) (Quadro 14) - Cloreto de etila (X46.-; Z57.5) (Quadro 13) - Tetracloreto de carbono (X46.-; Z57.5) (Quadro 13) - Outros solventes halogenados tóxicos (X46.-; Z57.4 e Z57.5) (Quadro 13) - Ácido sulfídrico (Sulfeto de hidrogênio) (X49.-; Z57.5) (Quadro 17) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Radiações Ultravioletas (W89; Z57.1 - Acrilatos (X49.-; Z57.5) - Cimento (X49.-; Z57.2) - Enzimas de origem animal, vegetal ou bacteriana (X44.-; Z57.2) - Furfural e Álcoól Furfurílico (X45.-; Z57.5) - Isocianatos orgânicos (X49.-; Z57.5) - Selênio e seus compostos (X49.-; Z57.5) |
| Queratite e Queratoconjuntivite (H16) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Ácido sulfídrico (Sulfeto de hidrogênio) (X49.-; Z57.5) (Quadro 17) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Radiações Infravermelhas (W90.-; Z57.1)} - Radiações Ultravioletas (W89.-; Z57.1) |
| Catarata (H28) | - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Radiações Infravermelhas (W90.-; Z57.1) |
| Inflamação Coriorretiniana (H30) | - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) |
| Neurite Óptica (H46) | - Brometo de metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Cloreto de metileno (Diclorometano) e outros solventes clorados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Tetracloreto de carbono (X46.-; Z57.5) (Quadro 13) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) -Metanol (X45.-; Z57.5) |
| Distúrbios visuais subjetivos (H53.-) | - Brometo de metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Cloreto de metileno e outros solventes clorados neurotóxicos (X46.-; Z57.5) (Quadro 13) |
DOENÇAS DO OUVIDO RELACIONADAS COM O TRABALHO (Grupo VIII da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Otite Média não-supurativa (H65.9) | - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) - Pressão atmosférica inferior à pressão padrão (W94.-; Z57.8) |
| Perfuração da Membrana do Tímpano (H72 ou S09.2) | - "Ar Comprimido" (W94.-; Z57.8) (Tabela 23) - Pressão atmosférica inferior à pressão padrão (W94.-; Z57.8) |
| Outras vertigens periféricas (H81.3) | - Cloreto de metileno e outros solventes halogenados tóxicos (X46.-; Z57.5) (Quadro 13) |
| Labirintite (H83.0) | - Brometo de metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) |
| Efeitos do ruído sobre o ouvido interno/ Perda da Audição Provocada pelo Ruído e Trauma Acústico (H83.3) | - Exposição ocupacional ao Ruído (Z57.0; W42.-) (Quadro 21) |
| Hipoacusia Ototóxica (H91.0) | 60-Homólogos do Benzeno otoneurotóxicos (Tolueno e Xileno) (X46.-; Z57.5) (Quadro 3) -Solventes orgânicos otoneurotóxicos (X46.-; Z57.8) (Quadro 13) |
| Otalgia e Secreção Auditiva (H92.-) Otalgia (H92.0), Otorréia (H92.1) ou Otorragia (H92.2) |
- "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) |
| Outras percepções auditivas anormais: Alteração Temporária do Limiar Auditivo, Comprometimento da Discriminação Auditiva e Hiperacusia (H93.2) | - Exposição ocupacional ao Ruído (Z57.0; X42.-) (Quadro 21) |
| Outros transtornos especificados do ouvido (H93.8) | - Brometo de metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) |
| Otite Barotraumática (T70.0) | - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) - Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-; Z57.8) |
| Sinusite Barotraumática (T70.1) | - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) - Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-) |
| "Mal dos Caixões" (Doença de Descompressão) (T70.4) | - "Ar Comprimido" (W94.-; Z57.8)(Quadro 23) - Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-; Z57.8) |
| Síndrome devida ao deslocamento de ar de uma explosão (T70.8) | - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) - Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-; Z57.8) |
DOENÇAS DO SISTEMA CIRCULATÓRIO RELACIONADAS COM O TRABALHO (Grupo IX da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Hipertensão Arterial (I10.-) | -Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) -Exposição ocupacional ao Ruído (Z57.0; X42.-) (Quadro 21) -Problemas relacionados com o emprego e com o desemprego (Z56.-) |
| Angina Pectoris (I20.-) | - Monóxido de Carbono (X47.-; Z57.5) (Quadro 17.1) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) - Nitroglicerina e outros ésteres do ácido nítrico (X49.-; Z57.5) - Problemas relacionados com o emprego e com o desemprego (Z56.-) |
| Infarto Agudo do Miocárdio (I21.-) | -Monóxido de Carbono (X47.-; Z57.5) (Quadro 17.1) -Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) -Nitroglicerina e outros ésteres do ácido nítrico (X49.-; Z57.5) -Problemas relacionados com o emprego e com o desemprego (Z56.-) |
| Cor Pulmonale SOE ou Doença Cardio-Pulmonar Crônica (I27.9) | - Complicação evolutiva das pneumoconioses graves, principalmente Silicose (Z57.2) (Quadro 18) |
| Placas epicárdicas ou pericárdicas (I34.8) | - Asbesto ou Amianto (W83.-; Z57.2) (Quadro 2) |
| Parada Cardíaca (I46.-) | -Derivados halogenados dos hidrocarbonetos alifáticos (X46.-) (Quadro 13) -Monóxido de Carbono (X47.-; Z57.5) (Quadro 17.1) -Outros agentes potencialmente causadores de arritmia cardíaca (Z57.5) |
| Arritmias cardíacas (I49.-) | -Arsênio e seus compostos arsenicais (X49.-; Z57.5) (Quadro 1) -Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) -Derivados halogenados dos hidrocarbonetos alifáticos (X46.-; Z57.5) (Quadro 13) -Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) -Monóxido de Carbono (X47.-; Z57.5) (Quadro 17.1) -Agrotóxicos organofosforados e carbamatos (X48; Z57.4) (Quadros 12 e 27) -Exposição ocupacional a Cobalto (X49.-; Z57.5) -Nitroglicerina e outros ésteres do ácido nítrico (X49.-; Z57.5) -Problemas relacionados com o emprego e com o desemprego (Z56.-) |
| Ateroesclerose (I70.-) Doença Ateroesclerótica do Coração (I25.1) |
- Sulfeto de carbono (X49.-; Z57.5)(Quadro 19) |
| Síndrome de Raynaud (I73.0) | - Cloreto de vinila (X46.-; Z57.5)(Quadro 13) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) - Trabalho em baixas temperaturas (frio) (W93.-; Z57.6) |
| Acrocianose e Acroparestesia (I73.8) | - Cloreto de vinila (X46.-; Z57.5) (Quadro 13) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) - Trabalho em baixas temperaturas (frio) (W93.-; Z57.6) |
DOENÇAS DO SISTEMA RESPIRATÓRIO RELACIONADAS COM O TRABALHO (Grupo X da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Faringite Aguda, não especificada ("Angina Aguda", "Dor de Garganta") (J02.9) | - Bromo (X49.-; Z57.5) (Quadro 5) - Iodo (X49.-; Z57.5)(Quadro 14) |
| Laringotraqueíte Aguda (J04.2) | - Bromo (X49.-; Z57.5) (Quadro 5) - Iodo (X49.-; Z57.5)(Quadro 14) |
| Outras Rinites Alérgicas (J30.3) | -Carbonetos metálicos de tungstênio sinterizados (X49.-; Z57.2 e Z57.5) (Quadro 7) -Cromo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 10) -Poeiras de algodão, linho, cânhamo ou sisal (Z57.2) (Quadro 26) -Acrilatos (X49.-; Z57.5) -Aldeído fórmico e seus polímeros (X49.-; Z57.5) -Aminas aromáticas e seus derivados (X49.-; Z57.5) -Anidrido ftálico (X49.-; Z57.5) -Azodicarbonamida (X49.-; Z57.5) -Carbetos de metais duros: cobalto e titânio (Z57.2) -Enzimas de origem animal, vegetal ou bacteriano (X44.-; Z57.3) -Furfural e Álcoól Furfurílico (X45.-; Z57.5) -Isocianatos orgânicos (X49.-; Z57.5) -Níquel e seus compostos (X49.-; Z57.5) -Pentóxido de vanádio (X49.-; Z57.5) -Produtos da pirólise de plásticos, cloreto de vinila, teflon (X49.-; Z57.5) -Sulfitos, bissulfitos e persulfatos (X49.-; Z57.5) -Medicamentos: macrólidos; ranetidina; penicilina e seus sais; cefalosporinas (X44.-; Z57.3) -Proteínas animais em aerossóis (Z57.3) -Outras substâncias de origem vegetal (cereais, farinhas, serragem, etc.) (Z57.2) -Outras susbtâncias químicas sensibilizantes da pele e das vias respiratórias (X49.-; Z57.2) (Quadro 27) |
| Rinite Crônica (J31.0) | - Arsênico e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Cloro gasoso (X47.-; Z57.5)(Quadro 9) - Cromo e seus compostos tóxicos (X49.-) (Quadro 10) - Gás de flúor e Fluoreto de Hidrogênio (X47.-; Z57.5) (Quadro 11) - Amônia (X47.-; Z57.5) - Anidrido sulfuroso (X49.-; Z57.5) - Cimento (Z57.2) - Fenol e homólogos (X46.-; Z57.5) - Névoas de ácidos minerais (X47.-; Z57.5) - Níquel e seus compostos (X49.-; Z57.5) - Selênio e seus compostos (X49.-; Z57.5) |
| Faringite Crônica (J31.2) | - Bromo (X49.-; Z57.5)(Quadro 5) |
| Sinusite Crônica (J32.-) | - Bromo (X49.-; Z57.5)(Quadro 5) - Iodo (X49.-; Z57.5)(Quadro 14) |
| Ulceração ou Necrose do Septo Nasal (J34.0) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Cromo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 10) - Soluções e aeoressóis de Ácido Cianídrico e seus derivados (X47.-; Z57.5) (Quadro17) |
| Perfuração do Septo Nasal (J34.8) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Cromo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 10) |
| Laringotraqueíte Crônica (J37.1) | - Bromo (X49.-; Z57.5) (Quadro 5) |
| Outras Doenças Pulmonares Obstrutivas Crônicas (Inclui: "Asma Obstrutiva", "Bronquite Crônica", "Bronquite Asmática", "Bronquite Obstrutiva Crônica") (J44.-) | - Cloro gasoso (X47.-; Z57.5)(Quadro 9)- Exposição ocupacional à poeira de sílica livre (Z57.2-) (Quadro 18) - Exposição ocupacional a poeiras de algodão, linho, cânhamo ou sisal (Z57.2-) (Quadro 26) - Amônia (X49.-; Z57.5) - Anidrido sulfuroso (X49.-; Z57.5) - Névoas e aerossóis de ácidos minerais (X47.-; Z57.5) - Exposição ocupacional a poeiras de carvão mineral (Z57.2) |
| Asma (J45.-) | -Mesma lista das substâncias sensibilizantes produtoras de Rinite Alérgica (X49.-; Z57.2, Z57.4 e Z57.5) |
| Pneumoconiose dos Trabalhadores do Carvão (J60.-) | - Exposição ocupacional a poeiras de carvão mineral (Z57.2) - Exposição ocupacional a poeiras de sílica-livre (Z57.2) (Quadro 18) |
| Pneumoconiose devida ao Asbesto (Asbestose) e a outras fibras minerais (J61.-) | - Exposição ocupacional a poeiras de asbesto ou amianto (Z57.2) (Quadro 2) |
| Pneumoconiose devida à poeira de Sílica (Silicose) (J62.8) | - Exposição ocupacional a poeiras de sílica-livre (Z57.2) (Quadro 18) |
| Beriliose (J63.2) | - Exposição ocupacional a poeiras de berílio e seus compostos tóxicos (Z57.2) (Quadro 4) |
| Siderose (J63.4) | - Exposição ocupacional a poeiras de ferro (Z57.2) |
| Estanhose (J63.5) | - Exposição ocupacional a poeiras de estanho (Z57.2) |
| Pneumoconiose devida a outras poeiras inorgânicas especificadas (J63.8) | - Exposição ocupacional a poeiras de carboneto de tungstênio (Z57.2)(Quadro 7) - Exposição ocupacional a poeiras de carbetos de metais duros (Cobalto, Titânio, etc.) (Z57.2) - Exposição ocupacional a rocha fosfática (Z57.2) - Exposição ocupacional a poeiras de alumina (Al2O3) ("Doença de Shaver") (Z57.2) |
| Pneumoconiose associada com Tuberculose ("Silico-Tuberculose") (J65.-) | - Exposição ocupacional a poeiras de sílica-livre (Z57.2) (Quadro 18) |
| Doenças das vias aéreas devidas a poeiras orgânicas (J66.-): Bissinose (J66.0), devidas a outras poeiras orgânicas especificadas (J66.8) |
- Exposição ocupacional a poeiras de algodão, linho, cânhamo, sisal (Z57.2) (Quadro 26) |
| Pneumonite por Hipersensibilidade a Poeira Orgânica (J67.-) Pulmão do Granjeiro (ou Pulmão do Fazendeiro) (J67.0) Bagaçose (J67.1); Pulmão dos Criadores de Pássaros (J67.2) Suberose (J67.3) Pulmão dos Trabalhadores de Malte (J67.4) Pulmão dos que Trabalham com Cogumelos (J67.5) Doença Pulmonar Devida a Sistemas de Ar Condicionado e de Umidificação do Ar (J67.7) Pneumonites de Hipersensibilidade Devidas a Outras Poeiras Orgânicas (J67.8) Pneumonite de Hipersensibilidade Devida a Poeira Orgânica não especificada (Alveolite Alérgica Extrínseca SOE; Pneumonite de Hipersensibilidade SOE (J67.0) |
- Exposição ocupacional a poeiras contendo microorganismos e parasitas infecciosos vivos e seus produtos tóxicos (Z57.2) (Quadro 25) - Exposição ocupacional a outras poeiras orgânicas (Z57.2) |
| Bronquite e Pneumonite devida a produtos químicos, gases, fumaças e vapores ("Bronquite Química Aguda") (J68.0) | - Berílio e seus compostos tóxicos (X49.-; ZX57.5) (Quadro 4) - Bromo (X49.-; Z57.5)(Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5)(Quadro 6) - Gás Cloro (X47.-; Z57.5) (Quadro 9) - Flúor ou seus compostos tóxicos (X47.-; Z57.5) (Quadro 11) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) -Iodo (X49.-; Z57.5) (Quadro 14) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Cianeto de hidrogênio (X47.-; Z57.5) (Quadro 17) |
| Edema Pulmonar Agudo devido a produtos químicos, gases, fumaças e vapores (Edema Pulmonar Químico) (J68.1) | - Berílio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 4) - Bromo (X49.-; Z57.5)(Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Gás Cloro (X47.-; Z57.5) (Quadro 9) - Flúor e seus compostos (X47.-; Z57.5) (Quadro 11) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) - Iodo (X49.-; Z57.5) (Quadro 14) - Cianeto de hidrogênio (X47.-; Z57.5) (Quadro 17) |
| Síndrome de Disfunção Reativa das Vias Aéreas (SDVA/RADS) (J68.3) | - Bromo (X49.-; Z57.5) (Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Gás Cloro (X47.-; Z57.5)(Quadro 9) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) - Iodo (X49.-; Z57.5)(Quadro 14) - Cianeto de hidrogênio (X47.-; Z57.5) (Quadro 17) - Amônia (X49.-; Z57.5) |
| Afeccções respiratórias crônicas devidas à inalação de gases, fumos, vapores e substâncias químicas: Bronquiolite Obliterante Crônica, Enfisema Crônico Difuso, Fibrose Pulmonar Crônica (J68.4) | - Arsênico e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Berílio e seus compostos (X49.-; Z57.5) (Quadro 4) - Bromo (X49.-; Z57.5)(Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Gás Cloro (X47.-; Z57.5) (Quadro 9) - Flúor e seus compostos (X47.-; Z57.5) (Quadro 11) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) - Iodo (X49.-; Z57.5)(Quadro 14) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Cianeto de hidrogênio (X47.-; Z57.5)(Quadro 17) - Ácido Sulfídrico (Sulfeto de hidrogênio) (X47.-; Z57.5) (Quadro 17) - Carbetos de metais duros (X49.-; Z57.5) - Amônia (X49.-; Z57.5) - Anidrido sulfuroso (X49.-; Z57.5) - Névoas e aerossóis de ácidos minerais (X47.-; Z57.5) - Acrilatos (X49.-; Z57.5) - Selênio e seus compostos (X49.-; Z57.5) |
| Pneumonite por Radiação (manifestação aguda) (J70.0) e Fibrose Pulmonar Conseqüente a Radiação (manifestação crônica) (J70.1) | - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Derrame pleural (J90.-) | - Exposição ocupacional a poeiras de Asbesto ou Amianto (Z57.2) (Quadro 2) |
| Placas pleurais (J92.-) | - Exposição ocupacional a poeiras de Asbesto ou Amianto (Z57.2)(Quadro 2) |
| Enfisema intersticial (J98.2) | - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) |
| Transtornos respiratórios em outras doenças sistêmicas do tecido conjuntivo classificadas em outra parte (M05.3): "Síndrome de Caplan" (J99.1) | - Exposição ocupacional a poeiras de Carvão Mineral (Z57.2) - Exposição ocupacional a poeiras de Sílica livre (Z57.2) (Quadro 18) |
DOENÇAS DO SISTEMA DIGESTIVO RELACIONADAS COM O TRABALHO (Grupo XI da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Erosão Dentária (K03.2) | -Névoas de fluoretos ou seus compostos tóxicos (X47.-; Z57.5) (Quadro 11) -Exposição ocupacional a outras névoas ácidas (X47.-; Z57.5) |
| Alterações pós-eruptivas da cor dos tecidos duros dos dentes (K03.7) | -Névoas de Cádmio ou seus compostos (X47.-; Z57.5) (Quadro 6) -Exposição ocupacional a metais: Cobre, Níquel, Prata (X47.-; Z57.5) |
| Gengivite Crônica (K05.1) | -Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) |
| Estomatite Ulcerativa Crônica (K12.1) | - Arsênio e seus compostos arsenicais (X49.-; Z57.5) (Quadro 1) - Bromo (X49.-; Z57.5) (Quadro 12. - Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) |
| Gastroenterite e Colite tóxicas (K52.-) | -Arsênio e seus compostos arsenicais (X49.-; Z57.5) (Quadro 1) -Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) -Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Outros transtornos funcionais do intestino ("Síndrome dolorosa abdominal paroxística apirética, com estado suboclusivo ("cólica do chumbo") (K59.8) | - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) |
| Doença Tóxica do Fígado (K71.-) Doença Tóxica do Fígado, com Necrose Hepática (K71.1) Doença Tóxica do Fígado, com Hepatite Aguda (K71.2) Doença Tóxica do Fígado com Hepatite Crônica Persistente (K71.3) Doença Tóxica do Fígado com Outros Transtornos Hepáticos (K71.8) |
-Cloreto de Vinila, Clorobenzeno Tetracloreto de Carbono, Clorofórmio, e outros solventes halogenados hepatotóxicos (X46.- e X48.-; Z57.4 e Z57.5) (Quadro 13) -Hexaclorobenzeno (HCB) (X48.-; Z57.4 e Z57.5) - Bifenilas policloradas (PCBs) (X49.-; Z57.4 e Z57.5) -Tetraclorodibenzodioxina (TCDD) (X49.-) |
| Hipertensão Portal (K76.6) | -Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) -Cloreto de Vinila (X46.-; Z57.5) (Quadro 13) -Tório (X49.-; Z57.5) |
DOENÇAS DA PELE E DO TECIDO SUBCUTÂNEO RELACIONADAS COM O TRABALHO (Grupo XII da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Outras Infecções Locais da Pele e do Tecido Subcutâneo: "Dermatoses Pápulo-Pustulosas e suas complicações infecciosas" (L08.9) | - Cromo e seus compostos tóxicos (Z57.5) (Quadro 10) - Hidrocarbonetos alifáticos ou aromáticos (seus derivados tóxicos) (Z57.5) (Quadro 13) - Microorganismos e parasitas infecciosos vivos e seus produtos tóxicos (Z57.5) (Quadro 25) - Outros agentes químicos ou biológicos que afetem a pele, não considerados em outras rubricas (Z57.5) (Quadro 27) |
| Dermatite Alérgica de Contato devida a Metais (L23.0) | - Cromo e seus compostos tóxicos (Z57.5) (Quadro 10) - Mercúrio e seus compostos tóxicos (Z57.5) (Quadro 16) |
| Dermatite Alérgica de Contato devida a Adesivos (L23.1) | - Adesivos, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite Alérgica de Contato devida a Cosméticos (fabricação/manipulação) (L23.2) | - Fabricação/manipulação de Cosméticos (Z57.5) (Quadro 27) |
| Dermatite Alérgica de Contato devida a Drogas em contato com a pele (L23.3) | - Drogas, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite Alérgica de Contato devida Corantes (L23.4) | - Corantes, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite Alérgica de Contato devida outros produtos químicos (L23.5) | - Cromo e seus compostos tóxicos (Z57.5) (Quadro 10) - Fósforo ou seus produtos tóxicos (Z57.5) (Quadro 12) - Iodo (Z57.5) (Quadro 14) - Alcatrão, Breu, Betume, Hulha Mineral, Parafina ou resíduos dessas substâncias (Z57.8) (Quadro 20) - Borracha (Z57.8) (Quadro 27) - Inseticidas (Z57.5) (Quadro 27) - Plásticos (Z57.8) (Quadro 27) |
| Dermatite Alérgica de Contato devida a Alimentos em contato com a pele (fabricação/ manipulação) (L23.6) | - Fabricação/manipulação de Alimentos (Z57.5) (Quadro 27) |
| Dermatite Alérgica de Contato devida a Plantas (Não inclui plantas usadas como alimentos) (L23.7) | - Manipulação de Plantas, em exposição ocupacional (Z57.8) (Quadro 27) |
| Dermatite Alérgica de Contato devida a outros agentes (Causa Externa especificada) (L23.8) | - Agentes químicos, não especificados anteriormente, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a Detergentes (L24.0) | - Detergentes, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a Óleos e Gorduras (L24.1) | - Óleos e Gorduras, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a Solventes: Cetonas, Ciclohexano, Compostos do Cloro, Ésteres, Glicol, Hidrocarbonetos (L24.2) | 60-Benzeno (X46.-; Z57.5) (Quadro 3) -Hidrocarbonetos aromáticos ou alifáticos ou seus derivados halogenados tóxicos (Z57.5) (Quadro 13) |
| Dermatite de Contato por Irritantes devida a Cosméticos (L24.3) | - Cosméticos, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a Drogas em contato com a pele (L24.4) | - Drogas, em exposição ocupacional (Z57.5) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a outros produtos químicos: Arsênio,Berílio, Bromo, Cromo, Cimento, Flúor, Fósforo, Inseticidas (L24.5) | - Arsênio e seus compostos arsenicais (Z57.5) (Quadro 1) - Berílio e seus compostos tóxicos (Z57.5) (Quadro 4) - Bromo (Z57.5) (Quadro 5) - Cromo e seus compostos tóxicos (Z57.5) (Quadro 10) - Flúor ou seus compostos tóxicos (Z57.5) (Quadro 11) - Fósforo (Z57.5) (Quadro 12) |
| Dermatite de Contato por Irritantes devida a Alimentos em contato com a pele (L24.6) | - Alimentos, em exposição ocupacional (Z57.8) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a Plantas, exceto alimentos (L24.7) | - Plantas, em exposição ocupacional (Z57.8) (Quadro 27) |
| Dermatite de Contato por Irritantes devida a outros agentes: Corantes (L24.8) | - Agentes químicos, não especificados anteriormente, em exposição ocupacional (Z57.5) (Quadro 27) |
| Urticária Alérgica (L50.0) | - Agrotóxicos e outros produtos químicos (X48.-; Z57.4 e Z57.5) (Quadro 27) |
| Urticária devida ao Calor e ao Frio (L50.2) | - Exposição ocupacional a calor e frio (W92,-; W93.-; Z57.6) (Quadro 27) |
| Urticária de Contato (L50.6) | - Exposição ocupacional a agentes químicos, físicos e biológicos que afetam a pele (X49.-; Z57.4 e Z57.5) (Quadro 27) |
| Queimadura Solar (L55) | - Exposição ocupacional a radiações actínicas (X32.-; Z57.1) (Quadro 27) |
| Outras Alterações Agudas da Pele devidas a Radiação Ultravioleta (L56.-) Dermatite por Fotocontato (Dermatite de Berloque) (L56.2) Urticária Solar (L56.3) Outras Alterações Agudas Especificadas da Pele devidas a Radiação Ultravioleta (L56.8) Outras Alterações Agudas da Pele devidas a Radiação Ultravioleta, sem outra especificação (L56.9) |
- Radiação Ultravioleta (W89.-; Z57.1) (Quadro 27) |
| Alterações da Pele devidas a Exposição Crônica a Radiação Não Ionizante (L57.-) Ceratose Actínica (L57.0) Outras Alterações: Dermatite Solar, "Pele de Fazendeiro", "Pele de Marinheiro" (L57.8) |
- Radiações não-ionizantes (W89.-; X32.-; Z57.1) (Quadro 27) |
| Radiodermatite (L58.-) Radiodermatite Aguda (L58.0) Radiodermatite Crônica (L58.1) Radiodermatite, não especificada (L58.9) Afecções da pele e do tecido conjuntivo relacionadas com a radiação, não especificadas (L59.9) |
- Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
| Outras formas de Acne: "Cloracne" (L70.8) | - Derivados halogenados dos hidrocarbonetos aromáticos, Monoclorobenzeno, Monobromobenzeno, - Hexaclorobenzeno (X46.; Z57.5) (Quadro 13) - Derivados do fenol, pentaclorofenol e do hidrobenzonitrilo (X49,-; Z57.4 e Z57.5) (Quadro 27) - Policloretos de Bifenila (PCBs) (X49.-; Z57.4 e Z57.5) (Quadro 27) |
| Outras formas de Cistos Foliculares da Pele e do Tecido Subcutâneo: "Elaioconiose" ou "Dermatite Folicular" (L72.8) | - Óleos e gorduras de origem mineral ou sintéticos (X49.-; Z57.5) (Quadro 27) |
| Outras formas de hiperpigmentação pela melanina: "Melanodermia" (L81.4) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) - Clorobenzeno e Diclorobenzeno (X46.-; Z57.4 e Z57.5)(Quadro 13) - Alcatrão, Breu, Betume, Hulha Mineral, Parafina, Creosoto, Piche, Coaltar ou resíduos dessas substâncias (Z57.8) (Quadro 20) - Antraceno e Dibenzoantraceno (Z57.5) (Quadro 20) - Bismuto (X44.-; Z57.5) (Quadro 27) - Citostáticos (X44.-; Z57.5) (Quadro 27) - Compostos nitrogenados: Ácido nítrico, Dinitrofenol (X49.-; Z57.5) (Quadro 27) - Naftóis adicionados a corantes (X49,-; Z57.5) (Quadro 27) - Óleos de corte (Z57.5) (Quadro 27) - Parafenilenodiamina e seus derivados (X49.-; Z47.5) (Quadro 27) - Poeira de determinadas madeiras (Z57.3) (Quadro 27) - Quinino e seus derivados (Z57.5) (Quadro 27) - Sais de ouro (X44.-; Z57.5) (Quadro 27) - Sais de prata (Seqüelas de Dermatite Crônica de Contato) (X44.-; Z57.5) (Quadro 27) |
| Leucodermia, não classificada em outra parte (Inclui "Vitiligo Ocupacional") (L81.5) | - Arsênio e seus compostos (X49.-; Z57.4 e Z57.5) (Quadro 1) - Hidroquinona e ésteres derivados (X49.-; Z57.5) (Quadro 27) - Monometil éter de hidroquinona (MBEH) (X49.-; Z57.5) (Quadro 27) - para-Aminofenol (X49.-; Z57.5) (Quadro 27) - para-Butilfenol (X49.-; Z57.5) (Quadro 27) - para-Cresol (X49.-; Z57.5) (Quadro 27) - Catecol e Pirocatecol (X49.-; Z57.5) (Quadro 27) - Clorofenol (X46.-; Z57.4 e Z57.5)(Quadro 27) |
| Outros transtornos especificados da pigmentação: "Porfiria Cutânea Tardia" (L81.8) | - Derivados halogenados dos hidrocarbonetos aromáticos: minocloro-benzeno, monobromo-benzeno, hexaclorobenzeno (X46.-; Z57.4 e Z57.5) (Quadro 13) |
| Ceratose Palmar e Plantar Adquirida (L85.1) | - Arsênio e seus compostos arsenicais (X49.-; Z57.4 e Z57.5) (Quadro 1) |
| Úlcera Crônica da Pele, não classificada em outra parte (L98.4) | - Cromo e seus compostos tóxicos (Z57.5) (Quadro 10)- Enzimas de origem animal, vegetal ou bacteriana (Z57.8) (Quadro 27) |
| Geladura (Frostbite) Superficial (T33): Eritema Pérnio |
-Cloreto de etila (anestésico local) (W93.-; Z57.6) (Quadro 13) -Frio (X31.-; W93.-; Z57.6) (Quadro 27) |
| Geladura (Frostbite) com Necrose de Tecidos (T34) | -Cloreto de etila (anestésico local) (W93.-; Z57.6) (Quadro 13) -Frio (X31.-; W93.-; Z57.6) (Quadro 27) |
DOENÇAS DO SISTEMA OSTEOMUSCULAR E DO TECIDO CONJUNTIVO, RELACIONADAS COM O TRABALHO (Grupo XIII da CID- 10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Artrite Reumatóide associada Pneumoconiose dos Trabalhadores do Carvão (J60.-): "Síndrome de Caplan" (M05.3) | - Exposição ocupacional a poeiras de carvão mineral (Z57.2)- Exposição ocupacional a poeiras de sílica livre (Z57.2)(Quadro 18)l |
| Gota induzida pelo chumbo (M10.1) | - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) |
| Outras Artroses (M19.-) | - Posições forçadas e gestos repetitivos (Z57.8) |
| Outros transtornos articulares não classificados em outra parte: Dor Articular (M25.5) | - Posições forçadas e gestos repetitivos (Z57.8)- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
| Síndrome Cervicobraquial (M53.1) | - Posições forçadas e gestos repetitivos (Z57.8) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
| Dorsalgia (M54.-) Cervicalgia (M54.2) Ciática (M54.3) Lumbago com Ciática (M54.4) |
- Posições forçadas e gestos repetitivos (Z57.8) -Ritmo de trabalho penoso (Z56.3) - Condições difíceis de trabalho (Z56.5) |
| Sinovites e Tenossinovites (M65.-) Dedo em Gatilho (M65.3) Tenossinovite do Estilóide Radial (De Quervain) (M65.4) Outras Sinovites e Tenossinovites (M65.8) Sinovites e Tenossinovites, não especificadas (M65.9) |
- Posições forçadas e gestos repetitivos (Z57.8) - Ritmo de trabalho penoso (Z56.3) - Condições difíceis de trabalho (Z56.5) |
| Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão, de origem ocupacional (M70.-) Sinovite Crepitante Crônica da mão e do punho (M70.0) Bursite da Mão (M70.1) Bursite do Olécrano (M70.2) Outras Bursites do Cotovelo (M70.3) Outras Bursites Pré-rotulianas (M70.4) Outras Bursites do Joelho (M70.5) Outros transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão (M70.8);Transtorno não especificado dos tecidos moles, relacionados com o uso, o uso excessivo e a pressão (M70.9). |
- Posições forçadas e gestos repetitivos (Z57.8) - Ritmo de trabalho penoso (Z56.3) - Condições difíceis de trabalho (Z56.5) |
| Fibromatose da Fascia Palmar: "Contratura ou Moléstia de Dupuytren" (M72.0) | - Posições forçadas e gestos repetitivos (Z57.8) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
| Lesões do Ombro (M75.-) Capsulite Adesiva do Ombro (Ombro Congelado, Periartrite do Ombro) (M75.0) Síndrome do Manguito Rotatório ou Síndrome do Supraespinhoso (M75.1) Tendinite Bicipital (M75.2) Tendinite Calcificante do Ombro (M75.3) Bursite do Ombro (M75.5) Outras Lesões do Ombro (M75.8) Lesões do Ombro, não especificadas (M75.9) |
- Posições forçadas e gestos repetitivos (Z57.8) - Ritmo de trabalho penoso (Z56) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
| Outras entesopatias (M77.-) Epicondilite Medial (M77.0) Epicondilite lateral ("Cotovelo de Tenista") Mialgia (M79.1) |
- Posições forçadas e gestos repetitivos (Z57.8) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
| Outros transtornos especificados dos tecidos moles (M79.8) | - Posições forçadas e gestos repetitivos (Z57.8) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
| Osteomalácia do Adulto induzida por drogas (M83.5) | -Cádmio ou seus compostos (X49.-)(Quadro 6) -Fósforo e seus compostos (Sesquissulfeto de Fósforo) (X49.-; Z57.5) (Quadro 12) |
| Fluorose do Esqueleto (M85.1) | - Flúor e seus compostos tóxicos (X49.-; Z57.5) (Quadro 11) |
| Osteonecrose (M87.-) Osteonecrose devida a drogas (M87.1) Outras Osteonecroses secundárias (M87.3) |
- Fósforo e seus compostos (Sesquissulfeto de Fósforo) (X49.-; Z57.5) (Quadro 12) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) - Radiações ionizantes (Z57.1) (Quadro 24) |
| Ostéolise (M89.5) (de falanges distais de quirodáctilos) | - Cloreto de Vinila (X49.-; Z57.5)(Quadro 13) |
| Osteonecrose no "Mal dos Caixões" (M90.3) | - "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) |
| Doença de Kienböck do Adulto (Osteo- condrose do Adulto do Semilunar do Carpo) (M93.1) e outras Osteocondro-patias especificadas (M93.8) |
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
DOENÇAS DO SISTEMA GÊNITO-URINÁRIO RELACIONADAS COM O TRABALHO (Grupo XIV da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Síndrome Nefrítica Aguda (N00.-) | - Hidrocarbonetos alifáticos halogenados nefrotóxicos (X46.-; Z57.5) (Quadro 13) |
| Doença Glomerular Crônica (N03.-) | - Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) |
| Nefropatia túbulo-intersticial induzida por metais pesados (N14.3) | - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) |
| Insuficiência Renal Aguda (N17) | - Hidrocarbonetos alifáticos halogenados nefrotóxicos (X46.-; Z57.5) (Quadro 13) |
| Insuficiência Renal Crônica (N18) | - Chumbo ou seus compostos (X49.-; Z57.5) (Quadro 8) |
| Cistite Aguda (N30.0) | - Aminas aromáticas e seus derivados (X49.-; Z57.5) |
| Infertilidade Masculina (N46) | - Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Radiações ionizantes (W88.-: Z57.1) (Quadro 24) - Chlordecone (X48.-; Z57.4) - Dibromocloropropano (DBCP) (X48.-; Z57.4 e Z57.5) - Calor (trabalho em temperaturas elevadas) (Z57.6) |
TRAUMATISMOS, ENVENENAMENTOS E ALGUMAS OUTRAS CONSEQÜÊNCIAS DE CAUSAS EXTERNAS, RELACIONADOS COM O TRABALHO - (Grupo XIX da CID-10)
| DOENÇAS | AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL |
| Efeitos tóxicos de Solventes Orgânicos (T52.-) Álcoóis (T51.8) e Cetonas (T52.4) Benzeno, Tolueno e Xileno (T52.1 e T52.2) Derivados halogenados dos Hidrocarbonetos Alifáticos e Aromáticos (T53) Tetracloreto de Carbono (T53.0) Clorofórmio (T53.1); Tricloroetileno (T53.2) Tetracloroetileno (T53.3) Dicloroetano (T53.4) Clorofluor-carbonos (T53.5) Outros derivados halogenados de hidrocarbonetos alifáticos (T53.6) Outros derivados halogenados de hidrocarbonetos aromáticos (T53.7) Derivados halogenados de hidrocarbonetos alifáticos e aromáticos, não especificados (T53.9) Sulfeto de Carbono (T65.4) | - Exposição ocupacional a agentes tóxicos em outras indústrias (Z57.5 |
| Efeito tóxico de Substâncias Corrosivas (T54) Fenol e homólogos do fenol (T54.0) Flúor e seus compostos (T65.8) Selênio e seus compostos (T56.8) Outros compostos orgânicos corrosivos (T54.1) Ácidos corrosivos e substâncias ácidas similares (T54.2) Álcalis cáusticos e substâncias alcalinas similares (T54.3) Efeito tóxico de substância corrosiva, não especificada (T54.9) | - Exposição ocupacional a agentes tóxicos em outras indústrias (Z57.5) |
| Efeito tóxico de Metais (T56) Arsênico e seus compostos (T57.0) Cádmio e seus compostos (T56.3) Chumbo e seus compostos (T56.0) Cromo e seus compostos (T56.2) Manganês e seus compostos (T57.2) Mercúrio e seus compostos (T56.1) Outros metais (T56.8) Metal, não especificado (T56.9) | - Exposição ocupacional a agentes tóxicos em outras indústrias (Z57.5) |
Asfixiantes Químicos (T57-59) |
- Exposição ocupacional a agentes tóxicos em outras indústrias (Z57.5) |
Praguicidas (Pesticidas, "Agrotóxicos") (T60) |
- Exposição ocupacional a agentes tóxicos na Agricultura (Z57.4) |
Efeitos da Pressão do Ar e da Pressão da Água (T70) |
- Exposição ocupacional a pressões atmosféricas anormais (W94.-; Z57.8) |
ANEXO LXXXI
PRINCÍPIOS GERAIS E CONDIÇÕES PARA O ADEQUADO ACOMPANHAMENTO PRÉ-NATAL (Origem: PRT MS/GM 569/2000, Anexo 1)
PRINCÍPIOS GERAIS E CONDIÇÕES PARA O ADEQUADO ACOMPANHAMENTO PRÉ-NATAL
Para a realização de um adequado acompanhamento pré-natal e assistência à gestante e à puérpera, o município deverá, por meio das unidades integrantes de seu sistema de saúde, desenvolver esta modalidade assistencial em conformidade com os princípios gerais e condições estabelecidas no presente documento, realizando as seguintes atividades:
I - Atividades
1-Realizar a primeira consulta de pré-natal até o 4° mês de gestação;
2-Garantir os seguintes procedimentos:
2.1-Realização de, no mínimo, 06 (seis) consultas de acompanhamento pré-natal, sendo, preferencialmente, uma no primeiro trimestre, duas no segundo e três no terceiro trimestre da gestação;
2.2-Realização de 01 (uma) consulta no puerpério, até 42 dias após o nascimento;
2.3-Realização dos seguintes exames laboratoriais:
a - ABO-Rh, na primeira consulta;
b - VDRL, um exame na primeira consulta e um na 30ª semana da gestação;
c - Urina rotina, um exame na primeira consulta e um na 30ª semana da gestação;
d - Glicemia de jejum, um exame na primeira consulta e um na 30ª semana da gestação;
e - HB/Ht, na primeira consulta.
2.4- Oferta de Testagem anti-HIV, com um exame na primeira consulta, naqueles municípios com população acima de 50 mil habitantes;
2.5-Aplicação de vacina antitetânica dose imunizante, segunda, do esquema recomendado ou dose de reforço em mulheres já imunizadas;
2.6-Realização de atividades educativas;
2.7-Classificação de risco gestacional a ser realizada na primeira consulta e nas subsequentes;
2.8-Garantir às gestantes classificadas como de risco, atendimento ou acesso à unidade de referência para atendimento ambulatorial e/ou hospitalar à gestação de alto risco.
II - Avaliação da Assistência Pré-natal .
Para avaliar a efetividade da assistência pré-natal oferecida, a partir dos dados disponíveis nos sistemas nacionais de informações em saúde o município e o estado devem utilizar, no mínimo, os seguintes indicadores:
1-Indicadores de Processo
1.1-Percentual de gestantes que se inscreveram no programa e realizaram a 1ª consulta até o quarto mês, em relação à população-alvo (número de gestantes existentes ou estimado pelo número de nascidos vivos do município);
1.2-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal;
1.3-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal e a consulta de puerpério;
1.4-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal e todos os exames básicos;
1.5-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal, a consulta de puerpério e todos os exames básicos;
1.6-Percentual de gestantes inscritas que receberam a dose imunizante da vacina antitetânica.
1.7-Percentual de gestantes inscritas que realizaram seis (06) consultas de pré-natal, a consulta de puerpério, todos os exames básicos; o teste anti-HIV, a dose imunizante da vacina antitetânica.
2. Indicadores de Resultado
2.1-Percentual de Recém-nascidos com diagnóstico de sífilis congênita em relação ao total dé recém-nascidos vivos do município.
2.2- Percentual de Recém-nascido com tétano neonatal, em relação ao total de recém-nascidos vivos do município
3-Indicadores de Impacto
3.1-Coeficiente de incidência de sífilis congênita no município comparando com o do ano anterior;
3.2-Coeficiente de incidência de tétano neonatal no município comparando com o do ano anterior;
3.3-Razão de mortalidade materna no município comparando com o do ano anterior;
3.4-Coeficiente de mortalidade neonatal precoce no município comparando com o do ano anterior:
3.5- Coeficiente de mortalidade neonatal tardia, no município comparando com o do ano anterior;
3.6- Coeficiente de mortalidade neonatal total no município comparando com o do ano anterior.
ANEXO LXXXII
PRINCÍPIOS GERAIS E CONDIÇÕES PARA A ADEQUADA ASSISTÊNCIA AO PARTO (Origem: PRT MS/GM 569/2000, Anexo 2)
PRINCÍPIOS GERAIS E CONDIÇÕES PARA A ADEQUADA ASSISTÊNCIA AO PARTO
A humanização da Assistência Obstétrica e Neonatal é condição para o adequado acompanhamento do parto e puerpério. Receber com dignidade a mulher e o recém-nascido é uma obrigação das unidades. A adoção de práticas humanizadas e seguras implica a organização das rotinas, dos procedimentos e da estrutura física, bem como a incorporação de condutas acolhedoras e não-intervencionistas.
Para a adequada assistência à mulher e ao recém-nascido no momento do parto, todas as Unidades Integrantes do SUS têm como responsabilidades:
1.atender a todas as gestantes que as procurem;
2. garantir a internação de todas as gestantes atendidas e que dela necessitem;
3. estar vinculada à Central de Regulação Obstétrica e Neonatal de modo a garantir a internação da parturiente nos casos de demanda excedente;
4. transferir a gestante e ou o neonato em transporte adequado, mediante vaga assegurada em outra unidade, quando necessário;
5. estar vinculada a uma ou mais unidades que prestam assistência pré-natal, conforme determinação do gestor local;
6. garantir a presença de pediatra na sala de parto;
7. realizar o exame de VDRL na mãe;
8. admitir a visita do pai sem restrição de horário;
9. garantir a realização das seguintes atividades:
-Realização de partos normais e cirúrgicos, e atendimento a intercorrências obstétricas:
-recepcionar e examinar as parturientes;
-assistir as parturientes em trabalho de parto;
-assegurar a execução dos procedimentos pré-anestésicos e anestésicos;
-proceder à lavagem e antissepsia cirúrgica das mãos;
-assistir a partos normais;
-realizar partos cirúrgicos;
-assegurar condições para que as parturientes tenham direito a acompanhante durante a internação, desde que a estrutura física assim permita;
-assistir ao abortamento incompleto, utilizando, preferencialmente, aspiração manual intra-uterina (AMIU);
-prestar assistência médica e de enfermagem ao recém-nascido;
-elaborar relatórios médico e enfermagem e fazer registro de parto;
-registrar a evolução do trabalho de parto em partograma;
-proporcionar cuidados no pós-anestésico e no pós-parto;
-garantir o apoio diagnóstico necessário
10. dispor dos recursos humanos, físicos, materiais e técnicos necessários à adequada assistência ao parto.
ANEXO LXXXIII
FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES DO SISPRENATAL E IDENTIFICAÇÃO DA GESTANTE (Origem: PRT MS/GM 570/2000, Anexo 1)

ANEXO LXXXIV
FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES DO SISPRENATAL(Origem: PRT MS/GM570/2000,Anexo 2)

ANEXO LXXXV
QUANTITATIVO DE CENTROS DE REFERÊNCIA EM TRATAMENTO DA DOR CRÔNICA - POR ESTADO (Origem: PRT MS/GM 1319/2002, Anexo 1)
| Estado | Quantitativo de Centros |
| ACRE | 01 |
| ALAGOAS | 03 |
| AMAPÁ | 01 |
| AMAZONAS | 03 |
| BAHIA | 13 |
| CEARÁ | 08 |
| DISTRITO FEDERAL | 02 |
| ESPÍRITO SANTO | 03 |
| GOIÁS | 05 |
| MARANHÃO | 06 |
| MATO GROSSO | 02 |
| MATO GROSSO DO SUL | 03 |
| MINAS GERAIS | 18 |
| PARÁ | 06 |
| PARAÍBA | 03 |
| PARANÁ | 10 |
| PERNAMBUCO | 08 |
| PIAUÍ | 03 |
| RIO DE JANEIRO | 15 |
| RIO GRANDE DO NORTE | 03 |
| RIO GRANDE DO SUL | 10 |
| RONDÔNIA | 01 |
| RORAIMA | 01 |
| SANTA CATARINA | 05 |
| SÃO PAULO | 38 |
| SERGIPE | 02 |
| TOCANTINS | 01 |
| BRASIL | 174 |
|---|
Observação: A estes quantitativos deverão ser agregados os 167 CACON atualmente cadastrados em todo o País.
ANEXO LXXXVI
DAS REGRAS E CRITÉRIOS PARA O CREDENCIAMENTO DE INSTITUIÇÕES E PARA APRESENTAÇÃO, RECEBIMENTO, ANÁLISE, APROVAÇÃO, EXECUÇÃO, ACOMPANHAMENTO, PRESTAÇÃO DE CONTAS E AVALIAÇÃO DE RESULTADOS DE PROJETOS NO ÂMBITO DO PROGRAMA NACIONAL DE APOIO À ATENÇÃO ONCOLÓGICA (PRONON) E DO PROGRAMA NACIONAL DE APOIO À ATENÇÃO DA SAÚDE DA PESSOA COM DEFICIÊNCIA (PRONAS/PCD) (Origem: PRT MS/GM 1550/2014)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I)
Art. 1º Ficam definidas as regras e os critérios para o credenciamento de instituições e para apresentação, recebimento, análise, aprovação, execução, acompanhamento, prestação de contas e avaliação de resultados de projetos no âmbito do Programa Nacional de Apoio à Atenção Oncológica (Pronon) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (Pronas/PCD). (Origem: PRT MS/GM 1550/2014, Art. 1º)
Art. 2º Para efeito deste Anexo, considera-se: (Origem: PRT MS/GM 1550/2014, Art. 2º)
I - acessibilidade e desenho universal: a acessibilidade é a possibilidade e condição de alcance, percepção e entendimento para a utilização com segurança e autonomia de edificações, espaço, mobiliário, equipamento urbano e elementos, observados os critérios técnicos da ABNT NBR 9050:2015, sendo que os princípios do desenho universal ampliam a compreensão das diferenças de habilidades e de interações com objetos e espaços, visando: (Origem: PRT MS/GM 1550/2014, Art. 2º, I)
a) eliminar barreiras arquitetônicas e comunicacionais; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, a)
b) promover o acesso, respeitando as capacidades individuais; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, b)
c) atender aos diferentes níveis de compreensão dos indivíduos; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, c)
d) promover legibilidade espacial e informativa; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, d)
e) prevenir riscos, ofertando ao usuário segurança física e psicológica para ocupar e atuar no espaço; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, e)
f) promover o menor desgaste físico, mental e emocional possível; e (Origem: PRT MS/GM 1550/2014, Art. 2º, I, f)
g) garantir adequada ergonomia, considerando a flexibilidade dos espaços, capacidades e funcionalidades dos usuários, instituindo espaços livres de barreiras físicas, comunicacionais e atitudinais e promovendo o acesso e a mobilidade para todo tipo de usuário, principalmente para pessoas com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, g)
II - capacidade técnico-operativa da instituição: aptidão do proponente de executar, de forma específica e eficiente, o projeto proposto, devendo ser comprovada por meio de informações anexas ao projeto, que esclareçam as características, propriedades e habilidades do proponente, dos membros ou de terceiros associados envolvidos diretamente na execução do projeto apresentado; (Origem: PRT MS/GM 1550/2014, Art. 2º, II)
III - captação de recursos: meio pelo qual a própria instituição buscará recursos com os doadores para financiamento de projetos; (Origem: PRT MS/GM 1550/2014, Art. 2º, III)
IV - conta captação: conta bloqueada para movimentação pela instituição, na qual os doadores e patrocinadores depositam os recursos para os projetos; (Origem: PRT MS/GM 1550/2014, Art. 2º, IV)
V - conta movimento: conta de livre movimentação pela instituição; (Origem: PRT MS/GM 1550/2014, Art. 2º, V)
VI - doador: pessoa física ou jurídica que financiará projetos e que obterá benefício de renúncia fiscal; (Origem: PRT MS/GM 1550/2014, Art. 2º, VI)
VII - educação permanente em saúde: proposta político-pedagógica que coloca o cotidiano do trabalho ou da formação em constante análise, construindo espaços coletivos para a reflexão e avaliação dos atos produzidos no cotidiano, de forma que o objeto de transformação é o sujeito no processo de trabalho, orientado para melhoria da qualidade da atenção à saúde, voltada a transformar e qualificar o trabalhador da saúde, e que engloba o aperfeiçoamento, a capacitação e o treinamento; (Origem: PRT MS/GM 1550/2014, Art. 2º, VII)
VIII - fase de apresentação de projeto: etapa em que a instituição credenciada apresenta projeto de modo detalhado para análise pelo Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 2º, VIII)
IX - fase de credenciamento: etapa inicial em que as instituições proponentes enviam ao Ministério da Saúde requerimento e documentos solicitando participação no Pronon ou no Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 2º, IX)
X - formação profissional: conjunto de atividades que visa à aquisição de conhecimentos, capacidades, atitudes e formas de comportamento exigidos para o exercício das funções próprias de uma profissão ou grupo de profissões em qualquer ramo de atividade econômica; (Origem: PRT MS/GM 1550/2014, Art. 2º, X)
XI - instituição: pessoa jurídica de direito privado, associativa ou fundacional, sem fins lucrativos, interessada em desenvolver ações e serviços no âmbito do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 2º, XI)
XII - manutenção ou conservação: conjunto de atividades que visa assegurar capacidade plena e condições de funcionamento contínuo, seguro e confiável dos sistemas e instalações da edificação, preservando-lhes as características, desempenho técnico e bom estado de conservação; (Origem: PRT MS/GM 1550/2014, Art. 2º, XII)
XIII - pesquisa clínica: sinônimo de ensaio clínico, ou seja, envolve pessoas que se oferecem para participar de investigações conduzidas cuidadosamente com o objetivo de descobrir melhores formas de tratar, prevenir, diagnosticar e compreender doenças humanas, e que inclui ensaios que testam novos tratamentos e terapias, bem como estudos de história natural de longo prazo, que fornecem informações valiosas sobre a progressão da doença; (Origem: PRT MS/GM 1550/2014, Art. 2º, XIII)
XIV - pesquisa epidemiológica: estudos epidemiológicos observacionais, como coorte, caso-controle e estudos transversais; (Origem: PRT MS/GM 1550/2014, Art. 2º, XIV)
XV - pesquisa experimental: pesquisa básica, pesquisas pré-clínicas, inclusive projetos que englobem pesquisa e desenvolvimento de produtos inovadores; (Origem: PRT MS/GM 1550/2014, Art. 2º, XV)
XVI - pesquisa socioantropológica: pesquisa que tem por objetivo principal conhecer o modo de vida de uma determinada comunidade, a fim de determinar quais problemas ou dificuldades enfrentam e o impacto desses problemas para a saúde e qualidade de vida; (Origem: PRT MS/GM 1550/2014, Art. 2º, XVI)
XVII - portaria de aprovação de projeto e autorização para captação de recursos: ato do Ministério da Saúde que torna pública a aprovação de projetos e autoriza o início da captação de recursos para o projeto; (Origem: PRT MS/GM 1550/2014, Art. 2º, XVII)
XVIII - portaria de credenciamento: ato do Ministério da Saúde que torna público o credenciamento das instituições, para que participem do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 2º, XVIII)
XIX - prestação de serviços médico-assistenciais: qualquer ação ou serviço que tenha como objetivo/objeto a prestação direta de assistência na área da saúde ou de apoio à saúde para a pessoa com câncer e/ou com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 2º, XIX)
XX - reforma: obras de conservação ou manutenção que não acarretem supressão ou acréscimo de área construída, tais como demolição e construção de paredes internas, pinturas, reparos em revestimentos, substituição de materiais de revestimento de piso, parede ou forro, substituição do tipo de telha ou manutenção da cobertura do bem, manutenção de instalações elétricas, instalações hidrossanitárias, rede de dados, substituição de esquadrias e obras de adequação para acessibilidade de acordo com critérios e parâmetros técnicos observados na ABNT NBR 9050:2015; (Origem: PRT MS/GM 1550/2014, Art. 2º, XX)
XXI - reparos: conjunto de operações para corrigir danos incipientes e de pequena repercussão, em bens móveis, imóveis ou equipamentos; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXI)
XXII - serviços de apoio à saúde: programas e ações de caráter intersetorial que atuam na fronteira do campo clínico e social, com o objetivo de ampliar, estimular e manter as capacidades funcionais, a integralidade do cuidado em reabilitação/habilitação, a autonomia, inclusão, inserção e participação social da pessoa com deficiência, por meio de práticas esportivas, terapias assistidas por animais, produção cultural e artística e de capacitação/habilitação para o trabalho; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXII)
XXIII - Sistema Nacional de Pesquisa de Custos e Índices da Construção Civil (SINAPI): cálculo realizado mensalmente pelo Instituto Brasileiro de Geografia e Estatística (IBGE), por meio de convênio com a Caixa Econômica Federal, que tem como objetivo a produção de informações de custos e índices de forma sistematizada e com abrangência nacional, visando à elaboração e avaliação de orçamentos, como também acompanhamento de custos; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIII)
XXIV - tecnologia assistiva: área do conhecimento, de característica interdisciplinar, que engloba produtos, recursos, metodologias, estratégias, práticas e serviços que objetivam promover a funcionalidade, relacionada à atividade e participação de pessoas com deficiência, incapacidades ou mobilidade reduzida, visando sua autonomia, independência, qualidade de vida e inclusão social, e que se dividem nas seguintes categorias: (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV)
a) auxílios para a vida diária e vida prática; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, a)
b) comunicação aumentativa e alternativa; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, b)
c) recursos de acessibilidade ao computador; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, c)
d) sistemas de controle de ambiente; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, d)
e) projetos arquitetônicos para acessibilidade; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, e)
f) órteses e próteses; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, f)
g) adequação postural; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, g)
h) auxílios de mobilidade; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, h)
i) auxílios para qualificação de habilidade visual e recursos que ampliam a informação a pessoas com baixa visão ou cegas; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, i)
j) auxílios para ampliação da habilidade auditiva e para autonomia na comunicação de pessoas com déficit auditivo e surdez; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, j)
k) adaptações em veículos; e (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, k)
l) esporte e lazer; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, l)
XXV - terapia assistida por animais (TAA): terapia focada nos benefícios da relação homem-animal, que tem como objetivos ampliar, estimular e manter as capacidades funcionais, a integralidade do cuidado em reabilitação/habilitação, a autonomia, a inclusão, a inserção e a participação social da pessoa com deficiência, por meio da inserção do animal em atividades terapêuticas; e (Origem: PRT MS/GM 1550/2014, Art. 2º, XXV)
XXVI - termo de compromisso: instrumento jurídico a ser celebrado entre o Ministério da Saúde e a instituição, o qual estabelecerá direitos e obrigações para a execução dos respectivos projetos no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 2º, XXVI)
Seção I
Do Programa Nacional de Apoio à Atenção Oncológica (Pronon)
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I, Seção I)
Art. 3º O Pronon tem a finalidade de captar e canalizar recursos para a prevenção e o combate ao câncer. (Origem: PRT MS/GM 1550/2014, Art. 3º)
Parágrafo Único. A prevenção e o combate ao câncer englobam a promoção da informação, a pesquisa, o rastreamento, o diagnóstico, o tratamento, os cuidados paliativos e a reabilitação referentes às neoplasias malignas e afecções correlatas. (Origem: PRT MS/GM 1550/2014, Art. 3º, Parágrafo Único)
Art. 4º O Pronon será implementado mediante incentivo fiscal a ações e serviços de atenção oncológica, desenvolvidos por instituições de prevenção e combate ao câncer. (Origem: PRT MS/GM 1550/2014, Art. 4º)
Parágrafo Único. Para efeito deste Anexo, consideram-se instituições de prevenção e combate ao câncer as pessoas jurídicas de direito privado, associativas ou fundacionais, sem fins lucrativos: (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único)
I - certificadas como Entidades Beneficentes de Assistência Social, na forma da Lei nº 12.101, de 27 de novembro de 2009; (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único, I)
II - qualificadas como Organizações Sociais (OS), na forma da Lei nº 9.637, de 15 de maio de 1998; ou (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único, II)
III - qualificadas como Organizações da Sociedade Civil de Interesse Público (OSCIP), na forma da Lei nº 9.790, de 23 de março de 1999. (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único, III)
Art. 5º As ações e os serviços de atenção oncológica a serem apoiados com recursos captados por meio do Pronon compreendem os seguintes campos de atuação: (Origem: PRT MS/GM 1550/2014, Art. 5º)
I - a prestação de serviços médico-assistenciais; (Origem: PRT MS/GM 1550/2014, Art. 5º, I)
II - a formação, o treinamento e o aperfeiçoamento de recursos humanos em todos os níveis; e (Origem: PRT MS/GM 1550/2014, Art. 5º, II)
III - a realização de pesquisas clínicas, epidemiológicas e experimentais. (Origem: PRT MS/GM 1550/2014, Art. 5º, III)
Art. 6º Para fins do disposto no art. 5º, são áreas prioritárias para execução das ações e serviços de atenção oncológica: (Origem: PRT MS/GM 1550/2014, Art. 6º)
I - prestação de serviços médico-assistenciais voltados à atenção/cuidado da pessoa com câncer, principalmente as ações voltadas ao diagnóstico e estadiamento da doença, ao tratamento cirúrgico, quimioterápico e radioterápico, e aos cuidados paliativos; (Origem: PRT MS/GM 1550/2014, Art. 6º, I)
II - prestação de serviços desenvolvidos em casas de apoio quando estes estabelecimentos tiverem como público-alvo as pessoas com câncer; (Origem: PRT MS/GM 1550/2014, Art. 6º, II)
III - apoio à prestação de serviços de saúde por meio da adequação da ambiência dos estabelecimentos; (Origem: PRT MS/GM 1550/2014, Art. 6º, III)
IV - desenvolvimento de projetos de educação permanente e formação de recursos humanos direcionados a profissionais que atuem na área de saúde em todos os níveis de atenção, especialmente: (Origem: PRT MS/GM 1550/2014, Art. 6º, IV)
a) formação técnica na área de radioterapia; (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, a)
b) formação de nível superior na área de radioterapia (físico-médico e radioterapeuta); (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, b)
c) educação permanente na área de cuidados paliativos; e (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, c)
d) educação permanente na área de oncologia pediátrica; (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, d)
V - realização de pesquisas para o desenvolvimento de novos métodos custo-efetivos para diagnóstico e terapêutica em câncer; (Origem: PRT MS/GM 1550/2014, Art. 6º, V)
VI - realização de pesquisas epidemiológicas, descritivas e analíticas, dos vários tipos de câncer existentes; (Origem: PRT MS/GM 1550/2014, Art. 6º, VI)
VII - realização de pesquisa e desenvolvimento de inovações, tecnologias e/ou produtos para prevenção, diagnóstico e/ou tratamento de câncer; (Origem: PRT MS/GM 1550/2014, Art. 6º, VII)
VIII - realização de pesquisas básicas e pré-clínicas que levem ao desenvolvimento de novos métodos diagnósticos ou terapêuticos em oncologia; (Origem: PRT MS/GM 1550/2014, Art. 6º, VIII)
IX - desenvolvimento de bancos de tumores; e (Origem: PRT MS/GM 1550/2014, Art. 6º, IX)
X - realização de pesquisas para avaliação de políticas, serviços, programas e ações de saúde em oncologia. (Origem: PRT MS/GM 1550/2014, Art. 6º, X)
Seção II
Do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (Pronas/PCD)
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I, Seção II)
Art. 7º O Pronas/PCD tem a finalidade de captar e canalizar recursos destinados a estimular e desenvolver ações de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência. (Origem: PRT MS/GM 1550/2014, Art. 7º)
Parágrafo Único. As ações de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência de que trata o "caput" se destinam à pesquisa, à promoção da informação e da saúde, identificação e diagnóstico precoce, tratamento, reabilitação/habilitação, uso terapêutico de tecnologias assistivas e projetos intersetoriais de apoio à saúde voltados às pessoas com deficiência física, auditiva, visual, intelectual, múltipla, pessoas com ostomia e com transtorno do espectro do autismo. (Origem: PRT MS/GM 1550/2014, Art. 7º, Parágrafo Único)
Art. 8º O Pronas/PCD será implementado mediante incentivo fiscal a ações e serviços de atenção à saúde da pessoa com deficiência, desenvolvidos por pessoas jurídicas de direito privado sem fins lucrativos, que se destinam ao tratamento de deficiências físicas, auditivas, visuais, intelectuais, múltiplas, pessoas com ostomia e com transtorno do espectro do autismo. (Origem: PRT MS/GM 1550/2014, Art. 8º)
Parágrafo Único. Consideram-se instituições de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência as pessoas jurídicas de direito privado, associativas ou fundacionais, sem fins lucrativos: (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único)
I - certificadas como Entidades Beneficentes de Assistência Social, na forma da Lei nº 12.101, de 2009; (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, I)
II - qualificadas como OS, na forma da Lei nº 9.637, de 1998; (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, II)
III - qualificadas como OSCIP, na forma da Lei nº 9.790, de 1999; ou (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, III)
IV - que prestem atendimento direto e gratuito às pessoas com deficiência e que sejam cadastradas no Sistema Nacional de Cadastro Nacional de Estabelecimentos de Saúde (SCNES) do Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, IV)
Art. 9º As ações e os serviços de atenção à saúde da pessoa com deficiência apoiados com as doações captadas por meio do Pronas/PCD compreendem os seguintes campos de atuação: (Origem: PRT MS/GM 1550/2014, Art. 9º)
I - serviços médico-assistenciais; (Origem: PRT MS/GM 1550/2014, Art. 9º, I)
II - formação, treinamento e aperfeiçoamento de recursos humanos em todos os níveis; e (Origem: PRT MS/GM 1550/2014, Art. 9º, II)
III - realização de pesquisas clínicas, epidemiológicas, experimentais e socioantropológicas. (Origem: PRT MS/GM 1550/2014, Art. 9º, III)
Art. 10. Para fins do disposto no art. 9º, consideram-se áreas prioritárias para execução das ações e serviços de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência: (Origem: PRT MS/GM 1550/2014, Art. 10)
I - prestação de serviços médico-assistenciais e de apoio à saúde da pessoa com deficiência, especialmente voltados a: (Origem: PRT MS/GM 1550/2014, Art. 10, I)
a) qualificação de serviços de saúde, por meio da adequação da ambiência de estabelecimentos, levando em consideração os princípios do desenho universal e os critérios técnicos da ABNT NBR 9050:2015, estabelecendo, assim, espaços de uso democrático onde todas as pessoas, inclusive aquelas com deficiência física, sensorial e/ou intelectual, tenham condições iguais de uso, compreensão e expressão; (Origem: PRT MS/GM 1550/2014, Art. 10, I, a)
b) reabilitação/habilitação da pessoa com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, I, b)
c) diagnóstico diferencial da pessoa com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, I, c)
d) identificação e estimulação precoce das deficiências; (Origem: PRT MS/GM 1550/2014, Art. 10, I, d)
e) adaptação, inserção e reinserção da pessoa com deficiência no trabalho; (Origem: PRT MS/GM 1550/2014, Art. 10, I, e)
f) ampliação, estimulação e manutenção das capacidades funcionais por meio de práticas esportivas; (Origem: PRT MS/GM 1550/2014, Art. 10, I, f)
g) ampliação, estimulação e manutenção das capacidades funcionais por meio de terapia assistida por animais (TAA); e (Origem: PRT MS/GM 1550/2014, Art. 10, I, g)
h) ampliação, estimulação e manutenção das capacidades funcionais por meio de produção artística e cultural; (Origem: PRT MS/GM 1550/2014, Art. 10, I, h)
II - desenvolvimento de projetos de educação permanente, formação e capacitação de recursos humanos da área de saúde, especialmente voltadas: (Origem: PRT MS/GM 1550/2014, Art. 10, II)
a) à formação técnica e capacitação em ortopedia técnica; (Origem: PRT MS/GM 1550/2014, Art. 10, II, a)
b) ao uso de tecnologia assistiva no campo da reabilitação/habilitação; (Origem: PRT MS/GM 1550/2014, Art. 10, II, b)
c) ao acolhimento, manejo e desenvolvimento de ações de cuidado à saúde da pessoa com deficiência, no âmbito da atenção básica, especializada, hospitalar e de urgência e emergência; (Origem: PRT MS/GM 1550/2014, Art. 10, II, c)
d) ao diagnóstico diferencial no campo da deficiência, especialmente em doenças raras, deficiência intelectual e transtornos do espectro do autismo; (Origem: PRT MS/GM 1550/2014, Art. 10, II, d)
e) ao uso da Classificação Internacional de Funcionalidade (CIF); e (Origem: PRT MS/GM 1550/2014, Art. 10, II, e)
f) ao uso de tecnologia de órtese robotizada de marcha (aparelho para tração ortopédica) e sua aplicação terapêutica em pacientes com lesão neurológica; (Origem: PRT MS/GM 1550/2014, Art. 10, II, f)
III - desenvolvimento de projetos de pesquisas clínicas, epidemiológicas, experimentais e socioantropológicas, especialmente voltadas: (Origem: PRT MS/GM 1550/2014, Art. 10, III)
a) aos novos métodos diagnósticos e de tratamento em reabilitação/habilitação às pessoas com deficiência e que sejam custo-efetivos; (Origem: PRT MS/GM 1550/2014, Art. 10, III, a)
b) ao uso da CIF e sua aplicabilidade no campo da saúde para as pessoas com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, III, b)
c) ao uso de tecnologias assistivas na reabilitação/habilitação das pessoas com deficiência, em especial que envolvam protocolos e diretrizes clínicas de órteses, próteses e meios auxiliares de locomoção; (Origem: PRT MS/GM 1550/2014, Art. 10, III, c)
d) aos métodos diagnósticos e terapêuticos da pessoa com deficiência, especialmente em doenças raras, deficiência intelectual e transtornos do espectro do autismo; (Origem: PRT MS/GM 1550/2014, Art. 10, III, d)
e) à avaliação de políticas, serviços, programas e ações de saúde especializados em reabilitação/habilitação; (Origem: PRT MS/GM 1550/2014, Art. 10, III, e)
f) às pesquisas básicas e pré-clínicas com potencial de translação para a saúde das pessoas com deficiências; (Origem: PRT MS/GM 1550/2014, Art. 10, III, f)
g) às pesquisas em neurociências com impacto na saúde das pessoas com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, III, g)
h) às pesquisas socioantropológicas sobre as deficiências; (Origem: PRT MS/GM 1550/2014, Art. 10, III, h)
i) às pesquisas epidemiológicas sobre os diversos tipos de deficiência; e (Origem: PRT MS/GM 1550/2014, Art. 10, III, i)
j) às pesquisas e desenvolvimento de inovações, tecnologias, dispositivos e/ou produtos de tecnologia assistiva, especialmente de órteses, próteses e meios auxiliares de locomoção (OPM). (Origem: PRT MS/GM 1550/2014, Art. 10, III, j)
Art. 11. O Ministério da Saúde poderá atualizar anualmente a relação de áreas prioritárias de que tratam os arts. 6º e 10 do Anexo LXXXVI para execução de ações e serviços de atenção oncológica e reabilitação no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 11)
Seção III
Do Comitê Gestor do Pronon e do Pronas/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I, Seção III)
Art. 12. Fica instituído, no âmbito do Ministério da Saúde, o Comitê Gestor do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 12)
Art. 13. O Comitê Gestor do Pronon e do Pronas/PCD será composto por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1550/2014, Art. 13)
I - 1 (um) representante da Secretaria-Executiva(SE/MS), que o coordenará; (Origem: PRT MS/GM 1550/2014, Art. 13, I)
II - 2 (dois) representantes da Secretaria de Atenção à Saúde (SAS/MS), representando a atenção oncológica e a atenção à pessoa com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 13, II)
III - 1 (um) representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, III)
IV - 1 (um) representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, IV)
V - 1 (um) representante da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, V)
VI - 1 (um) representante do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, VI)
VII - 1 (um) representante do Instituto Nacional de Traumatologia e Ortopedia (INTO/SAS/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, VII)
VIII - 1 (um) representante do Conselho Nacional de Saúde (CNS), oriundo da representação das entidades e dos movimentos sociais nacionais de usuários do SUS; (Origem: PRT MS/GM 1550/2014, Art. 13, VIII)
X - 1 (um) representante do Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 1550/2014, Art. 13, IX)
X - 1 (um) representante do Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 1550/2014, Art. 13, X)
§ 1º Os representantes, titulares e suplentes, serão indicados pelos dirigentes máximos dos respectivos órgãos e entidades à SE/MS, no prazo de 30 (trinta) dias, contado da data de publicação da Portaria nº 1550/GM/MS, de 29 de julho de 2014. (Origem: PRT MS/GM 1550/2014, Art. 13, § 1º)
§ 2º O Comitê Gestor do Pronon e do Pronas/PCD reunir-se-á em plenária ordinariamente uma vez por trimestre, extraordinariamente, mediante convocação da SE/MS e quando ocorrer a deliberação de que trata o art. 53, § 3º . (Origem: PRT MS/GM 1550/2014, Art. 13, § 2º)
§ 3º O membro do Comitê Gestor do Pronon e do Pronas/PCD declarará formalmente, em ata, eventual conflito de interesses entre suas atividades profissionais e o tema objeto de deliberação do colegiado, sendo que, presente o conflito de interesses, abster-se-á de participar da discussão e da deliberação. (Origem: PRT MS/GM 1550/2014, Art. 13, § 3º)
§ 4º O Comitê Gestor do Pronon e do Pronas/PCD poderá constituir Grupos de Trabalho (GT), por meio de ato da SE/MS, para o cumprimento de finalidades específicas. (Origem: PRT MS/GM 1550/2014, Art. 13, § 4º)
Art. 14. Compete ao Comitê Gestor do Pronon e do Pronas/PCD: (Origem: PRT MS/GM 1550/2014, Art. 14)
I - reavaliar, de ofício ou a requerimento, a definição das áreas prioritárias para execução das ações e serviços de atenção à pessoa com câncer e de atenção à pessoa com deficiência e, ser for o caso, propor alteração ao Ministro de Estado da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 14, I)
II - deliberar, de ofício ou a requerimento, sobre a priorização de projetos submetidos às áreas técnicas, considerando os recursos da renúncia fiscal disponíveis para o exercício; (Origem: PRT MS/GM 1550/2014, Art. 14, II)
III - definir parâmetros para aprovação, acompanhamento e prestação de contas dos projetos; (Origem: PRT MS/GM 1550/2014, Art. 14, III)
IV - definir a sistemática de monitoramento e avaliação do Pronon e do Pronas/PCD e formular proposições para os seus aprimoramentos; (Origem: PRT MS/GM 1550/2014, Art. 14, IV)
V - deliberar quanto ao descredenciamento de instituição com projeto em execução; e (Origem: PRT MS/GM 1550/2014, Art. 14, V)
VI - deliberar sobre os casos omissos. (Origem: PRT MS/GM 1550/2014, Art. 14, VI)
CAPÍTULO II
DAS COMPETÊNCIAS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO II)
Art. 15. Compete à SE/MS: (Origem: PRT MS/GM 1550/2014, Art. 15)
I - realizar a gestão administrativa do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 15, I)
II - receber e analisar a documentação de credenciamento enviada pelas instituições; (Origem: PRT MS/GM 1550/2014, Art. 15, II)
III - solicitar adequações ou complementações à documentação apresentada pelas instituições quando do credenciamento; (Origem: PRT MS/GM 1550/2014, Art. 15, III)
IV - analisar, de ofício ou a requerimento, o processo de descredenciamento da instituição; (Origem: PRT MS/GM 1550/2014, Art. 15, IV)
V - verificar, a qualquer tempo, a manutenção da qualificação da instituição e da regularidade fiscal, tributária e com a seguridade social; (Origem: PRT MS/GM 1550/2014, Art. 15, V)
VI - solicitar a abertura da Conta Captação e da Conta Movimento junto à instituição financeira oficial; (Origem: PRT MS/GM 1550/2014, Art. 15, VI)
VII - acompanhar a implementação e execução dos procedimentos acordados no Termo de Cooperação Técnica com a instituição financeira oficial; (Origem: PRT MS/GM 1550/2014, Art. 15, VII)
VIII - monitorar saldos e extratos da Conta Captação e da Conta Movimento; (Origem: PRT MS/GM 1550/2014, Art. 15, VIII)
IX - publicar, em meio oficial, os atos administrativos decorrentes das análises efetuadas no âmbito do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 15, IX)
X - elaborar e enviar a Declaração de Benefícios Fiscais (DBF) à Secretaria da Receita Federal do Brasil; (Origem: PRT MS/GM 1550/2014, Art. 15, X)
XI - apoiar, quanto à análise financeira, os demais órgãos do Ministério da Saúde na elaboração dos pareceres técnicos de projetos que preveem a realização de reformas; (Origem: PRT MS/GM 1550/2014, Art. 15, XI)
XII - analisar os aspectos contábeis e financeiros das prestações de contas dos projetos; e (Origem: PRT MS/GM 1550/2014, Art. 15, XII)
XIII - divulgar relatório de avaliação e acompanhamento das ações e serviços no âmbito do Pronon e do Pronas/PCD, nos termos do § 3º do art. 8º da Lei nº 12.715, de 2012. (Origem: PRT MS/GM 1550/2014, Art. 15, XIII)
XIV - autorizar o Fundo Nacional de Saúde (FNS) a realizar as operações financeiras envolvendo transferências de saldo entre Contas Captação e Contas Movimento, remanejamento de recursos entre projetos e estornos para regularização de depósitos equivocados. (Origem: PRT MS/GM 1550/2014, Art. 15, XIV) (dispositivo acrescentado pela PRT MS/GM 1575/2015)
Art. 16. Compete aos demais órgãos do Ministério da Saúde: (Origem: PRT MS/GM 1550/2014, Art. 16)
I - analisar, diligenciar e emitir parecer técnico conclusivo sobre os projetos encaminhados pela SE/MS, referente aos seus respectivos campos de atuação; (Origem: PRT MS/GM 1550/2014, Art. 16, I)
II - apresentar em reunião do Comitê Gestor do Pronon e do Pronas/PCD a análise preliminar dos projetos, para fins de priorização daqueles que terão aprovação final, considerando os recursos da renúncia fiscal disponíveis para o exercício; (Origem: PRT MS/GM 1550/2014, Art. 16, II)
III - avaliar pedidos de remanejamento de rubricas e adequação do projeto em função de captação inferior ou superior ao inicialmente planejado e aprovado, emitindo parecer conclusivo; (Origem: PRT MS/GM 1550/2014, Art. 16, III)
IV - acompanhar e avaliar a execução dos projetos; (Origem: PRT MS/GM 1550/2014, Art. 16, IV)
V - emitir parecer técnico conclusivo referente à avaliação física e financeira dos projetos; (Origem: PRT MS/GM 1550/2014, Art. 16, V)
VI - emitir parecer conclusivo das prestações de contas, para fins de encerramento dos projetos, abrangendo a análise contábil e financeira feita pela Secretaria-Executiva e a avaliação da execução física feita pela área; (Origem: PRT MS/GM 1550/2014, Art. 16, VI)
VII - elaborar relatório de avaliação e acompanhamento das ações e serviços no âmbito do Pronon e do Pronas/PCD, nos termos do § 3º do art. 8º da Lei nº 12.715, de 2012. (Origem: PRT MS/GM 1550/2014, Art. 16, VII)
CAPÍTULO III
DO CREDENCIAMENTO E DO DESCREDENCIAMENTO
(Origem: PRT MS/GM 1550/2014, CAPÍTULO III)
Seção I
Do Credenciamento das Instituições ao Pronon e ao Pronas/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO III, Seção I)
Art. 17. As instituições interessadas em participar do desenvolvimento de ações e serviços no âmbito do Pronon e do Pronas/PCD deverão obter prévio credenciamento perante o Ministério da Saúde, mediante requerimento específico para cada um dos programas, conforme modelos constantes dos Anexos 1 e 2 do Anexo LXXXVI , devidamente preenchido e assinado pelo dirigente da instituição e acompanhado da seguinte documentação: (Origem: PRT MS/GM 1550/2014, Art. 17)
I - comprovação da qualificação da instituição, através de: (Origem: PRT MS/GM 1550/2014, Art. 17, I)
a) cópia da portaria vigente que certifica a Entidade Beneficente de Assistência Social ou comprovação do protocolo de renovação tempestivo do Certificado de Entidade Beneficente de Assistência Social (CEBAS), nos termos da Lei nº 12.101, de 2009; (Origem: PRT MS/GM 1550/2014, Art. 17, I, a)
b) documento que comprove a qualificação como OS, nos termos da Lei nº 9.637, de 1998; (Origem: PRT MS/GM 1550/2014, Art. 17, I, b)
c) documento que comprove a qualificação como OSCIP, nos termos da Lei nº 9.790, de 1999; ou (Origem: PRT MS/GM 1550/2014, Art. 17, I, c)
d) comprovante de cadastro no SCNES e apresentação de declaração do gestor local atestando o atendimento direto e gratuito às pessoas com deficiência, quando o requerimento for de credenciamento junto ao Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 17, I, d)
II - cópia autenticada do estatuto ou contrato social vigente e respectivas alterações posteriores, ambos registrados em cartório; (Origem: PRT MS/GM 1550/2014, Art. 17, II)
III - cópia autenticada do comprovante de domicílio da sede da instituição; (Origem: PRT MS/GM 1550/2014, Art. 17, III)
IV - comprovante de inscrição e de situação cadastral no Cadastro Nacional da Pessoa Jurídica (CNPJ); (Origem: PRT MS/GM 1550/2014, Art. 17, IV)
V - cópia autenticada do RG e do CPF do dirigente da instituição; (Origem: PRT MS/GM 1550/2014, Art. 17, V)
VI - cópia autenticada da ata de eleição da atual diretoria ou do termo de posse de seus dirigentes, registrados em cartório; (Origem: PRT MS/GM 1550/2014, Art. 17, VI)
VII - comprovante de regularidade com o Fundo de Garantia por Tempo de Serviço (FGTS) e com o Instituto Nacional de Seguridade Social (INSS); (Origem: PRT MS/GM 1550/2014, Art. 17, VII)
VIII - Certidão Negativa Conjunta de Débitos Relativos a Tributos Federais e à Dívida Ativada da União: (Origem: PRT MS/GM 1550/2014, Art. 17, VIII)
a) da Procuradoria-Geral da Fazenda Nacional; (Origem: PRT MS/GM 1550/2014, Art. 17, VIII, a)
b) do Cadastro de Entidades Privadas Sem Fins Lucrativos Impedidas (CEPIM) da Controladoria-Geral da União; e (Origem: PRT MS/GM 1550/2014, Art. 17, VIII, b)
c) do Cadastro Informativo de Créditos não Quitados do Setor Público Federal (CADIN). (Origem: PRT MS/GM 1550/2014, Art. 17, VIII, c)
§ 1º Se o requerimento for apresentado por procurador, deverá constar, adicionalmente, cópia autenticada do RG e do CPF do outorgado e procuração com firma reconhecida, que contenha poderes que não configurem qualquer tipo de intermediação vedado pelo art. 11 da Lei nº 12.715, de 2012. (Origem: PRT MS/GM 1550/2014, Art. 17, § 1º)
§ 2º As informações de que trata o "caput" e suas atualizações são de inteira responsabilidade da instituição interessada, que deverá prestar todas as informações ao Ministério da Saúde, tempestivamente, quando solicitado. (Origem: PRT MS/GM 1550/2014, Art. 17, § 2º)
§ 3º A regularidade fiscal, tributária e com a seguridade social deverá ser mantida por todo o período de execução dos projetos, podendo a sua comprovação ser exigida a qualquer tempo pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 17, § 3º)
§ 4º Caso necessário, poderão ser requisitados outros documentos que comprovem ou complementem as informações prestadas na fase de credenciamento, devendo a instituição interessada responder à diligência de complementação e adequação em até 20 (vinte) dias, contados da data da notificação. (Origem: PRT MS/GM 1550/2014, Art. 17, § 4º)
Art. 18. O requerimento de que trata o "caput" do art. 17 será enviado ao Ministério da Saúde por meio de carta com Aviso de Recebimento (AR) ou SEDEX ou entregue diretamente no Protocolo Central do Ministério da Saúde, constando como destinatário "Ministério da Saúde - Pronon ou Pronas/PCD - Esplanada dos Ministérios, Bloco G, Protocolo Central, CEP 70058-900 Brasília - DF". (Origem: PRT MS/GM 1550/2014, Art. 18)
Parágrafo Único. Os requerimentos de credenciamento no Pronon e no Pronas/PCD deverão ser apresentados à Secretaria-Executiva do Ministério da Saúde no período de 1º de junho a 31 de julho de cada ano, para fins de submissão de projetos no exercício fiscal subsequente. (Origem: PRT MS/GM 1550/2014, Art. 18, § 1º) (com redação dada pela PRT MS/GM 275/2016)
Art. 19. São hipóteses de indeferimento do pedido de credenciamento: (Origem: PRT MS/GM 1550/2014, Art. 19)
I - apresentação incompleta da documentação ou fora dos prazos previstos neste Anexo; (Origem: PRT MS/GM 1550/2014, Art. 19, I)
II - requerimento perante órgão ou setor incompetente; (Origem: PRT MS/GM 1550/2014, Art. 19, II)
III - realizado por quem não seja legitimado; e (Origem: PRT MS/GM 1550/2014, Art. 19, III)
IV - se houver fundadas dúvidas quanto à veracidade das informações e dos documentos apresentados. (Origem: PRT MS/GM 1550/2014, Art. 19, IV)
Parágrafo Único. A decisão de indeferimento do pedido de credenciamento nas hipóteses de que trata o "caput" será devidamente justificada, nos termos do art. 50 da Lei nº 9.784, de 29 de janeiro de 1999. (Origem: PRT MS/GM 1550/2014, Art. 19, Parágrafo Único)
Art. 20. O credenciamento da instituição junto ao Pronon e ao Pronas/PCD servirá como prévia habilitação para os anos subsequentes, podendo ser apresentados projetos no prazo regulamentar previsto neste Anexo. (Origem: PRT MS/GM 1550/2014, Art. 20)
Art. 21. A SE/MS publicará no Diário Oficial da União (DOU) os resultados dos pedidos de credenciamento das instituições interessadas em participar do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 21)
§ 1º Caberá recurso à SE/MS da decisão de indeferimento, no prazo de 10 (dez) dias, contado da data da publicação de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 21, § 1º)
§ 2º Acolhidas as razões do recurso, será publicada portaria de credenciamento em favor da instituição recorrente, no prazo de 10 (dez) dias. (Origem: PRT MS/GM 1550/2014, Art. 21, § 2º)
§ 3º Não será conhecido recurso interposto fora do prazo de que trata o § 1º. (Origem: PRT MS/GM 1550/2014, Art. 21, § 3º)
Seção II
Do Descredenciamento das Instituições Junto ao Pronon e ao Pronas/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO III, Seção II)
Art. 22. As instituições serão descredenciadas junto ao Pronon e ao Pronas/PCD, por meio de portaria da SE/MS, nas seguintes hipóteses: (Origem: PRT MS/GM 1550/2014, Art. 22)
I - for declarada inabilitada, nos termos do art. 12 do Decreto nº 7.988, de 17 de abril de 2013; (Origem: PRT MS/GM 1550/2014, Art. 22, I)
II - perder a qualificação de Entidade Beneficente de Assistência Social, de OS ou de OSCIP; (Origem: PRT MS/GM 1550/2014, Art. 22, II)
III - perder a característica de prestação de atendimento direto e gratuito às pessoas com deficiência ou deixar de atualizar o cadastro no SCNES, no âmbito do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 22, III)
IV - perder a condição de regularidade fiscal, tributária ou com a seguridade social, previstas no art. 17, incisos VII e VIII II do Anexo LXXXVI ; (Origem: PRT MS/GM 1550/2014, Art. 22, IV)
V - omitir-se de atualizar o Ministério da Saúde sobre as informações de que trata o art. 17 e de enviar o documento de que trata o art. 64, parágrafo único; e (Origem: PRT MS/GM 1550/2014, Art. 22, V)
VI - informar em duplicidade o registro de procedimentos nos sistemas de informação do Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 22, VI)
§ 1º A instituição descredenciada perderá o direito de apresentar projetos no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 22, § 1º)
§ 2º Após o descredenciamento, a instituição poderá apresentar novo requerimento de credenciamento, nos termos do art. 17, para fazer jus à apresentação de novos projetos, desde que o descredenciamento não tenha sido proferido com base no inciso I. (Origem: PRT MS/GM 1550/2014, Art. 22, § 2º)
§ 3º Os projetos aprovados de instituições que foram descredenciadas, cuja execução não tenha sido iniciada, serão considerados reprovados, devendo a SE/MS tornar sem efeito a portaria de aprovação do projeto e de autorização para captação de recursos, em relação àquele projeto. (Origem: PRT MS/GM 1550/2014, Art. 22, § 3º)
§ 4º Serão submetidos à análise e deliberação do Comitê Gestor do Pronon e do Pronas/PCD os casos de descredenciamento de instituições que possuírem projeto em execução. (Origem: PRT MS/GM 1550/2014, Art. 22, § 4º)
§ 5º Caberá recurso à SE/MS da decisão de descredenciamento, no prazo de 10 (dez) dias, contado da data da publicação da portaria de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 22, § 5º)
§ 6º Acolhidas as razões do recurso, será publicada portaria de recredenciamento em favor da instituição recorrente, no prazo de 10 (dez) dias. (Origem: PRT MS/GM 1550/2014, Art. 22, § 6º)
§ 7º Não será conhecido recurso interposto fora do prazo de que trata o § 5º. (Origem: PRT MS/GM 1550/2014, Art. 22, § 7º)
CAPÍTULO IV
DOS PROJETOS NO ÂMBITO DO PRONON E DO PRONAS/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV)
Seção I
Da Apresentação de Projetos
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I)
Art. 23. Os projetos somente poderão ser apresentados para avaliação e aprovação pelo Ministério da Saúde por instituições previamente credenciadas a participar do desenvolvimento de ações e serviços no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 23)
Art. 24. A participação das instituições na realização de projetos referentes ao Pronon e ao Pronas/PCD não poderá ocorrer em prejuízo de suas atividades prestadas ao SUS, não podendo compreender o quantitativo executado ou em execução: (Origem: PRT MS/GM 1550/2014, Art. 24)
I - por meio de contratos, convênios e instrumentos congêneres firmados com órgãos e entidades integrantes do SUS; e (Origem: PRT MS/GM 1550/2014, Art. 24, I)
II - para obtenção do Certificado de Entidade Beneficente de Assistência Social, que trata a Lei nº 12.101, de 2009. (Origem: PRT MS/GM 1550/2014, Art. 24, II)
§ 1º Os projetos não poderão solicitar o custeio dos serviços já realizados na instituição, tampouco o pagamento de profissionais que já atuam no local, exceto nos casos em que houver a necessidade e possibilidade de se aumentar a carga horária desses profissionais com vistas a permitir a execução das atividades relativas ao objeto proposto no projeto. (Origem: PRT MS/GM 1550/2014, Art. 24, § 1º)
§ 2º Em nenhuma hipótese será admitida contratação de profissionais para execução de atividades que não apresentem relação com o objeto do projeto. (Origem: PRT MS/GM 1550/2014, Art. 24, § 2º)
§ 3º A instituição será responsável por garantir que as atividades descritas no plano de trabalho sejam novas ou adicionais às já realizada e que não serão cobradas ao SUS. (Origem: PRT MS/GM 1550/2014, Art. 24, § 3º)
§ 1º Na eventualidade de não atingimento do teto de recursos disponíveis para renúncia fiscal no exercício, considerando os projetos apresentados e aprovados no período a que se refere o "caput", o Ministério da Saúde poderá abrir nova etapa para recebimento de projetos no período de 15 a 31 de agosto de cada ano. (Origem: PRT MS/GM 1550/2014, Art. 25, § 1º)
§ 2º O valor de cada projeto apresentado no âmbito do Pronon e do Pronas/PCD está limitado a até 5% (cinco por cento) do valor global máximo destinado para dedução fiscal, estabelecido anualmente em ato conjunto do Ministério da Saúde e do Ministério da Fazenda. (Origem: PRT MS/GM 1550/2014, Art. 25, § 2º)
§ 3º Cada projeto deverá ser enquadrado exclusivamente em uma das ações e serviços de que tratam os arts. 5º e 9º do Anexo LXXXVI . (Origem: PRT MS/GM 1550/2014, Art. 25, § 3º)
Art. 25. A instituição credenciada poderá apresentar até 3 (três) projetos por ano, por programa, os quais deverão ser protocolados na Secretaria-Executiva do Ministério da Saúde no prazo de até 45 (quarenta e cinco) dias, a partir da publicação do ato conjunto do Ministério da Saúde e do Ministério da Fazenda, que estabelece anualmente o valor global máximo destinado para dedução fiscal. (Origem: PRT MS/GM 1550/2014, Art. 25) (com redação dada pela PRT MS/GM 275/2016)
Art. 26. Cada projeto apresentado no âmbito do Pronon e do Pronas/PCD conterá: (Origem: PRT MS/GM 1550/2014, Art. 26)
I - requerimento de apresentação de projeto devidamente preenchido, conforme modelo constante do Anexo 3 do Anexo LXXXVI , especificando: (Origem: PRT MS/GM 1550/2014, Art. 26, I)
a) uma das ações ou serviços a serem executados no âmbito do respectivo programa; (Origem: PRT MS/GM 1550/2014, Art. 26, I, a)
b) a descrição da estrutura física e de recursos materiais e humanos a serem utilizados para a execução do projeto; (Origem: PRT MS/GM 1550/2014, Art. 26, I, b)
c) a estimativa de recursos financeiros para início e término da execução do projeto; e (Origem: PRT MS/GM 1550/2014, Art. 26, I, c)
d) o cronograma de sua execução, observado o prazo máximo estabelecido no § 1º; (Origem: PRT MS/GM 1550/2014, Art. 26, I, d)
II - cópia do ato que deferiu o seu pedido de credenciamento nos termos do art. 21; (Origem: PRT MS/GM 1550/2014, Art. 26, II)
III - declaração de responsabilidade, conforme o modelo constante do Anexo 4 do Anexo LXXXVI , e de capacidade técnico-operativa, conforme o modelo constante do Anexo 5 do Anexo LXXXVI , para o cumprimento do objeto e dos objetivos contratados e execução físico-financeira das atividades necessárias; (Origem: PRT MS/GM 1550/2014, Art. 26, III)
IV - comprovação de anuência prévia favorável ao projeto pelos gestores estadual e/ou municipal de saúde do SUS, a depender de sua abrangência e do alcance das ações propostas nessas esferas de gestão, respeitada a legislação vigente; e (Origem: PRT MS/GM 1550/2014, Art. 26, IV)
V - declaração de comprometimento a submeter o projeto à apreciação dos comitês de ética, da Agência Nacional de Vigilância Sanitária (ANVISA) e da Comissão Técnica Nacional de Biossegurança (CTNBio), quando for o caso, e de somente iniciar a execução do projeto após enviar ao Ministério da Saúde comprovante(s) de ter obtido as necessárias autorizações éticas e sanitárias para realizar o estudo. (Origem: PRT MS/GM 1550/2014, Art. 26, V)
§ 1º O prazo para execução do projeto poderá ser de até 24 (vinte e quatro) meses, exceto quando se tratar de projetos de pesquisa, hipótese em que o prazo de execução poderá ser de até 36 (trinta e seis) meses. (Origem: PRT MS/GM 1550/2014, Art. 26, § 1º)
§ 2º O cronograma de execução do projeto deverá apresentar o tempo de sua execução em meses, considerando-se o seu início a partir da data de liberação dos recursos da Conta Captação para a Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 26, § 2º)
§ 3º A comprovação da capacidade técnico-operativa da instituição será aceita pelo Ministério da Saúde na condição de que o objeto a ser executado no projeto apresentado seja próprio das atividades regulares e habituais desenvolvidas pela instituição proponente. (Origem: PRT MS/GM 1550/2014, Art. 26, § 3º)
§ 4º Serão exigidos todos os documentos pertinentes ao enquadramento do projeto ao campo de atuação pretendido. (Origem: PRT MS/GM 1550/2014, Art. 26, § 4º)
Art. 27. O projeto deverá apresentar orçamento detalhado, contendo todos os custos envolvidos para alcance dos objetivos, informando a natureza das despesas e as categorias dos gastos. (Origem: PRT MS/GM 1550/2014, Art. 27)
§ 1º O orçamento poderá ser apresentado utilizando-se o modelo constante do Anexo 6 do Anexo LXXXVI , ou adaptado, conforme necessidade do objeto e das ações a serem executadas. (Origem: PRT MS/GM 1550/2014, Art. 27, § 1º)
§ 2º As despesas referentes aos serviços de elaboração do projeto e de captação de recursos deverão ser detalhadas na planilha de custos do projeto, sendo obrigatório o seu destaque em relação aos demais itens de despesas. (Origem: PRT MS/GM 1550/2014, Art. 27, § 2º)
§ 3º A elaboração do projeto e a captação de recursos poderão ser realizadas por profissionais contratados para este fim, desde que as despesas somadas não ultrapassem 5% (cinco por cento) do valor total previsto para o projeto, limitada ao teto de R$ 50.000,00 (cinquenta mil reais). (Origem: PRT MS/GM 1550/2014, Art. 27, § 3º)
Art. 28. Serão admitidas como despesas administrativas: (Origem: PRT MS/GM 1550/2014, Art. 28)
I - material de consumo para escritório; (Origem: PRT MS/GM 1550/2014, Art. 28, I)
II - locação de imóvel para atender os objetivos do projeto durante a sua execução; (Origem: PRT MS/GM 1550/2014, Art. 28, II)
III - serviços de postagens e correios; (Origem: PRT MS/GM 1550/2014, Art. 28, III)
IV - transporte e deslocamento de pessoal administrativo; (Origem: PRT MS/GM 1550/2014, Art. 28, IV)
V - conta de telefone, de água, de luz e de internet; (Origem: PRT MS/GM 1550/2014, Art. 28, V)
VI - honorários de pessoal administrativo, serviços contábeis e advocatícios contratados para execução do projeto e respectivos encargos sociais; e (Origem: PRT MS/GM 1550/2014, Art. 28, VI)
VII - outras despesas administrativas restritas, indispensáveis à execução dos projetos, assim consideradas pelo Ministério da Saúde, desde que especificadas no projeto e no seu respectivo orçamento. (Origem: PRT MS/GM 1550/2014, Art. 28, VII)
§ 1º As despesas de que trata o "caput" deverão ser apresentadas de forma detalhada, no demonstrativo orçamentário do projeto, não podendo ser apresentadas apenas de forma global. (Origem: PRT MS/GM 1550/2014, Art. 28, § 1º)
§ 2º São de responsabilidade da instituição as retenções e os recolhimentos relativos a impostos, tributos e contribuições que incidirem sobre os valores pagos pelos serviços contratados para a execução do projeto, observada a legislação específica vigente. (Origem: PRT MS/GM 1550/2014, Art. 28, § 2º)
Subseção I
Dos Projetos de Prestação de Serviços Médico-Assistenciais
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção I)
Art. 29. No caso de projetos de prestação de serviços médico-assistenciais, além do disposto nos arts. 23, 24, , 26, 27 e 28 do Anexo LXXXVI , a instituição deverá: (Origem: PRT MS/GM 1550/2014, Art. 29)
I - possuir estrutura física e capacidade técnico-operativa para o seu desenvolvimento; (Origem: PRT MS/GM 1550/2014, Art. 29, I)
II - apresentar manifestação de que o projeto está adequado à Política Nacional para a Prevenção e Controle do Câncer ou à Política Nacional de Saúde da Pessoa com Deficiência e a declaração favorável da respectiva direção do SUS à sua execução; (Origem: PRT MS/GM 1550/2014, Art. 29, II)
III - garantir que as ações que forem passíveis de regulação devem, obrigatoriamente, estar incluídas formalmente na regulação do gestor que deu a anuência ao projeto; (Origem: PRT MS/GM 1550/2014, Art. 29, III)
IV - apresentar documentos que comprovem o efetivo atendimento das normas de vigilância sanitária; (Origem: PRT MS/GM 1550/2014, Art. 29, IV)
V - comprovar cadastro prévio no SCNES; e (Origem: PRT MS/GM 1550/2014, Art. 29, V)
VI - estar habilitada em oncologia pelo Ministério da Saúde, quando os projetos tratarem de ações e serviços relacionados à alta complexidade em oncologia. (Origem: PRT MS/GM 1550/2014, Art. 29, VI)
Parágrafo Único. No caso de serviços de apoio à saúde, não será necessária a comprovação da inscrição no SCNES. (Origem: PRT MS/GM 1550/2014, Art. 29, Parágrafo Único)
Art. 30. A instituição que apresentar projetos prevendo a realização de ações e serviços constantes da relação dos procedimentos regulados pela Central Nacional de Regulação de Alta Complexidade (CNRAC) poderá, mediante habilitação específica para fins do Pronon ou do Pronas/PCD, ser autorizada a realizar tais procedimentos com regulação pela referida Central, observadas a vigência e as exigências referentes ao credenciamento ou habilitação, conforme as especificidades dos projetos. (Origem: PRT MS/GM 1550/2014, Art. 30)
Art. 31. A prestação de serviços médico-assistenciais no âmbito dos projetos referentes ao Pronon e ao Pronas/PCD deverá ser registrada no sistema de Comunicação de Informação Hospitalar e Ambulatorial (CIHA), conforme os procedimentos constantes em normas específicas. (Origem: PRT MS/GM 1550/2014, Art. 31)
§ 1º O CIHA será o sistema oficial para verificação, acompanhamento, avaliação e prestação de contas das ações e serviços que o proponente se comprometeu a realizar no projeto. (Origem: PRT MS/GM 1550/2014, Art. 31, § 1º)
§ 2º É vedado o registro das ações e serviços desenvolvidos no âmbito do Pronon e do Pronas/PCD em outros sistemas de informação do Ministério da Saúde, sendo, portanto, impedidos de serem cobrados de outras formas às instâncias gestoras do SUS. (Origem: PRT MS/GM 1550/2014, Art. 31, § 2º)
§ 3º Na hipótese de duplicidade de registro de procedimentos, a instituição poderá ser descredenciada e inabilitada para a apresentação de projetos no âmbito do Pronon e/ou do Pronas, durante os 3 (três) anos seguintes. (Origem: PRT MS/GM 1550/2014, Art. 31, § 3º)
Subseção II
Dos Projetos de Pesquisa
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção II)
Art. 32. Nos projetos de pesquisa, a instituição deverá possuir infraestrutura física e capacidade técnico-operativa para o seu desenvolvimento, sendo, porém, permitida parceria com instituições de ensino e pesquisa para complementá-las. (Origem: PRT MS/GM 1550/2014, Art. 32)
Parágrafo Único. Em nenhuma hipótese será permitida a transferência de recursos captados por meio do Pronon e do Pronas/PCD às instituições de ensino e pesquisa ou a profissionais vinculados a estas instituições em virtude da parceria de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 32, Parágrafo Único)
Subseção III
Dos Projetos de Formação, Capacitação e Aperfeiçoamento de Recursos Humanos
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção III)
Art. 33. Nos projetos de formação, capacitação e aperfeiçoamento de recursos humanos, além do disposto nos arts. 23, 24, , 26, 27 e 28 do Anexo LXXXVI , a instituição deverá: (Origem: PRT MS/GM 1550/2014, Art. 33)
I - enviar projeto pedagógico, justificando a atividade pretendida em acordo com o objeto final da instituição, devendo conter objetivos gerais e específicos que irão mensurar o atingimento dos resultados esperados; (Origem: PRT MS/GM 1550/2014, Art. 33, I)
II - encaminhar o currículo do responsável pela instituição e/ou do profissional que irá desenvolver a formação, a capacitação e o aperfeiçoamento; e (Origem: PRT MS/GM 1550/2014, Art. 33, II)
III - apresentar de forma detalhada o conteúdo, a carga-horária, o público-alvo, a metodologia a ser aplicada, a modalidade empregada e os recursos instrucionais e pedagógicos a serem utilizados. (Origem: PRT MS/GM 1550/2014, Art. 33, III)
Subseção IV
Dos Projetos que Preveem a Realização de Reformas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção IV)
Art. 34. Para execução dos projetos, somente será permitida a realização de despesas com obras em imóveis, no âmbito do Pronon e do Pronas/PCD, se referentes a reformas, incluindo-se ações de conservação, manutenção e reparos, ficando vedada a realização de investimentos com ampliação e construção de imóveis. (Origem: PRT MS/GM 1550/2014, Art. 34)
Art. 35. É necessária a apresentação de declaração firmada pelo responsável técnico da obra de que a planilha orçamentária apresenta quantitativos compatibilizados com o respectivo projeto de engenharia e de que os custos estão de acordo com as tabelas do SINAPI. (Origem: PRT MS/GM 1550/2014, Art. 35)
Parágrafo Único. Os custos também poderão ser apresentados, em caso de impossibilidade de uso da tabela SINAPI, a partir: (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único)
I - de pesquisa de preços com no mínimo 3 (três) propostas; (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, I)
II - de informações disponibilizadas por órgãos de classe e entidades profissionais, tais como o Sindicato da Indústria da Construção Civil (Sinduscon), o Instituto de Arquitetos do Brasil (IAB), o CREA e o CAU; (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, II)
III - de informações do Informativo Sistema Boletim de Custos (SBC); ou (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, III)
IV - do Sistema de Custos de Obra e Serviços de Engenharia (SCO) da Fundação Getúlio Vargas (FGV). (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, IV)
Subseção V
Dos Projetos que Preveem a Aquisição de Equipamentos e Materiais Permanentes
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção V)
Art. 36. As instituições deverão apresentar informações detalhadas sobre os equipamentos e materiais permanentes que serão adquiridos, de forma a permitir ao analista técnico avaliar a viabilidade técnica de instalação e operação dos equipamentos, bem como a sustentabilidade desses, conforme modelo constante do Anexo 7 do Anexo LXXXVI . (Origem: PRT MS/GM 1550/2014, Art. 36)
Parágrafo Único. Os equipamentos e materiais permanentes deverão constar nas relações de itens disponibilizadas pelo Fundo Nacional de Saúde, exceto quando vinculados a projetos de pesquisa clínica, experimental e de inovação tecnológica. (Origem: PRT MS/GM 1550/2014, Art. 36, Parágrafo Único)
Art. 37. Os equipamentos e materiais permanentes adquiridos para fins de projetos de pesquisa e que necessitem de importação deverão obedecer ao disposto em normas específicas da ANVISA. (Origem: PRT MS/GM 1550/2014, Art. 37)
Art. 38. Nos projetos que envolverem a aquisição ou produção de equipamentos e/ou materiais permanentes com recursos captados por meio do Pronon e do Pronas/PCD, o equipamento e/ou material permanente será revertido, ao final do projeto, mediante doação, ao patrimônio do ente federativo que anuiu com a realização do projeto, conforme o modelo de Termo de Doação constante do Anexo 8 do Anexo LXXXVI . (Origem: PRT MS/GM 1550/2014, Art. 38)
§ 1º O ente federativo beneficiário da doação de que trata o "caput" poderá utilizar os equipamentos e materiais permanentes em seus órgãos ou estabelecimentos públicos de assistência à saúde ou de ensino e pesquisa ou realizar a cessão de seu uso para entidades filantrópicas que atuam de forma complementar ao SUS, para atendimento de usuários do SUS. (Origem: PRT MS/GM 1550/2014, Art. 38, § 1º)
§ 2º A documentação comprobatória da formalização da doação de que trata "caput" deverá ser encaminhada ao Ministério da Saúde juntamente com o relatório final de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 38, § 2º)
§ 3º A instituição interessada em permanecer com os equipamentos e materiais permanentes após o término da execução do projeto deverá: (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º)
I - nos 30 (trinta) dias anteriores ao término do projeto, solicitar à Secretaria de Saúde do ente federativo que anuiu com a realização do projeto a manutenção do uso do equipamento e/ou material permanente; (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º, I)
II - firmar termo de compromisso a ser assinado com o gestor do SUS que anuiu com a realização do projeto, de modo a assumir a continuar utilizar o equipamento e/ou material permanente na prestação de ações e serviços de saúde aos usuários do SUS, sob pena de devolução dos bens à respectiva direção do SUS; e (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º, II)
III - no caso de manutenção do equipamento na instituição que executou o projeto, manter essa informação no SCNES. (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º, III)
§ 4º No caso de projeto de pesquisa que preveja a aquisição de equipamentos que não possuam registro ou cadastro junto à ANVISA, a destinação desses seguirá as normas sanitárias em vigor. (Origem: PRT MS/GM 1550/2014, Art. 38, § 4º)
Art. 39. Para definição dos custos de aquisição dos equipamentos e materiais permanentes, deverá ser consultado o Sistema de Informação e Gerenciamento de Equipamentos e Materiais (SIGEM) do Fundo Nacional de Saúde. (Origem: PRT MS/GM 1550/2014, Art. 39)
Parágrafo Único. No caso de equipamentos importados, para os quais não haja referência de preços no SIGEM, a instituição apresentará documentação comprobatória do preço praticado no mercado nacional e internacional, quando for o caso. (Origem: PRT MS/GM 1550/2014, Art. 39, Parágrafo Único)
Subseção VI
Dos Projetos que Preveem Aquisição de Medicamentos, Kits Diagnósticos, Materiais Médico-Hospitalares, Órteses, Próteses e Outros Produtos para a Saúde
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção VI)
Art. 40. Os projetos poderão prever a aquisição de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e de outros produtos para saúde, observando o seu objeto. (Origem: PRT MS/GM 1550/2014, Art. 40)
§ 1º Os medicamentos adquiridos no âmbito do projeto deverão estar listados na Relação Nacional de Medicamentos Essenciais (RENAME), exceto quando se tratar de medicamento utilizado no tratamento do câncer, especialmente aqueles utilizados para quimioterapia, que deverão ser registrados na ANVISA. (Origem: PRT MS/GM 1550/2014, Art. 40, § 1º)
§ 2º Para fins de pesquisa, será permitida a importação de produtos de que trata o "caput" e que não atendam às exigências do §1º, cuja importação sem necessidade de cadastro ou registro deve obedecer ao disposto na legislação específica. (Origem: PRT MS/GM 1550/2014, Art. 40, § 2º)
§ 3º Não será permitida a previsão de medicamentos cuja aquisição seja realizada de forma centralizada pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 40, § 3º)
§ 4º Os medicamentos utilizados em projetos de pesquisa também estarão sujeitos aos regulamentos dos programas de acesso expandido, uso compassivo e fornecimento de medicamentos pós-estudos, disposto em regulamento específico da ANVISA. (Origem: PRT MS/GM 1550/2014, Art. 40, § 4º)
Art. 41. Os medicamentos, materiais médico-hospitalares, kits diagnósticos, órteses e próteses adquiridos que não foram utilizados serão doados, ao término do projeto, ao ente federativo que anuiu com a realização do projeto, para a utilização em estabelecimentos públicos de assistência à saúde, de ensino e pesquisa ou para uso por entidades filantrópicas que atuam de forma complementar ao SUS, para atendimento dos usuários do sistema. (Origem: PRT MS/GM 1550/2014, Art. 41)
§ 1º A documentação comprobatória da formalização da doação de que trata o "caput" será encaminhada ao Ministério da Saúde juntamente com o relatório final de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 41, § 1º)
§ 2º A instituição executora que atue de forma complementar ao SUS interessada em permanecer com os produtos de que trata o "caput" após o término da execução do projeto deverá: (Origem: PRT MS/GM 1550/2014, Art. 41, § 2º)
I - nos 30 (trinta) dias anteriores ao término do projeto, solicitar à Secretaria de Saúde do ente federativo que anuiu com a realização do projeto a manutenção do uso dos produtos; e (Origem: PRT MS/GM 1550/2014, Art. 41, § 2º, I)
II - firmar termo de compromisso a ser firmado com o gestor do SUS que anuiu com a realização do projeto de que assume a obrigação de continuar a utilizar os produtos de que trata o "caput" na prestação de ações e serviços de saúde aos usuários do SUS, sob pena de devolução do bem à respectiva direção do sistema. (Origem: PRT MS/GM 1550/2014, Art. 41, § 2º, II)
Art. 42. Para apresentação dos preços de aquisição de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e outros produtos para a saúde, a instituição deverá utilizar o Banco de Preços em Saúde (BPS) e o Sistema Integrado de Administração de Serviços Gerais (SIASG). (Origem: PRT MS/GM 1550/2014, Art. 42)
Parágrafo Único. O acesso ao relatório de preços constantes no SIASG poderá ser realizado utilizando funcionalidade específica do BPS. (Origem: PRT MS/GM 1550/2014, Art. 42, Parágrafo Único)
Subseção VII
Dos Projetos que Preveem Comodato ou Cessão de Uso de Bens Imóveis ou Equipamentos
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção VII)
Art. 43. Os projetos que preveem comodato ou cessão de uso de bens imóveis ou equipamentos somente poderão incluir no orçamento as despesas de conservação dos bens imóveis ou dos equipamentos, por se tratarem de empréstimo de natureza gratuita. (Origem: PRT MS/GM 1550/2014, Art. 43)
Parágrafo Único. A comprovação do empréstimo dos bens imóveis ou dos equipamentos na modalidade de comodato ou cessão de uso deverá ser feita mediante a apresentação de cópia autenticada do respectivo contrato. (Origem: PRT MS/GM 1550/2014, Art. 43, Parágrafo Único)
Seção II
Das Vedações
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção II)
Art. 44. É vedada a previsão de despesas: (Origem: PRT MS/GM 1550/2014, Art. 44)
I - a título de taxa de administração ou similar; (Origem: PRT MS/GM 1550/2014, Art. 44, I)
II - em benefício de servidor ou empregado público, integrante do quadro de pessoal de órgão ou entidade pública da administração direta ou indireta de qualquer esfera governamental, por serviços de consultoria ou assistência técnica, salvo nas hipóteses previstas em leis específicas e na Lei de Diretrizes Orçamentárias (LDO); (Origem: PRT MS/GM 1550/2014, Art. 44, II)
III - em favor de clubes e associações de servidores públicos ou entidades congêneres; (Origem: PRT MS/GM 1550/2014, Art. 44, III)
IV - que resultarem em vantagem financeira ou material para o doador, nos termos da Lei nº 12.715, de 2012; (Origem: PRT MS/GM 1550/2014, Art. 44, IV)
V - com ações e serviços de captação que excedam o limite estabelecido no art. 27, § 3º ; (Origem: PRT MS/GM 1550/2014, Art. 44, V)
VI - com recepções, festas, coquetéis, serviços de bufê ou similares, excetuados os gastos com refeições dos profissionais ou com ações educativas, quando necessário à consecução dos objetivos do projeto; (Origem: PRT MS/GM 1550/2014, Art. 44, VI)
VII - referentes à compra de passagens em primeira classe ou classe executiva, salvo em caso de necessidade justificada, para pessoas com deficiência ou mobilidade reduzida; (Origem: PRT MS/GM 1550/2014, Art. 44, VII)
VIII - com taxas bancárias, multas, juros ou correção monetária, inclusive referentes a pagamentos ou recolhimentos fora dos prazos; e (Origem: PRT MS/GM 1550/2014, Art. 44, VIII)
IX - para custeio de ações e serviços médico-assistenciais, já executados pelo proponente para atenção às pessoas no âmbito do SUS. (Origem: PRT MS/GM 1550/2014, Art. 44, IX)
Art. 45. É vedada a apresentação de projeto por pessoa jurídica de direito privado que, respectivamente, seja ou tenha como dirigentes, administradores, controladores ou membros de seus conselhos: (Origem: PRT MS/GM 1550/2014, Art. 45)
I - agente político de Poder ou do Ministério Público, tanto quanto dirigente de órgão ou entidade da administração pública, de qualquer esfera governamental, ou respectivo cônjuge ou companheiro, bem como parente em linha reta, colateral ou por afinidade, até o terceiro grau; e (Origem: PRT MS/GM 1550/2014, Art. 45, I)
II - servidor público do Ministério da Saúde ou de suas entidades vinculadas, bem como seus respectivos cônjuges, companheiros e parentes em linha reta, colateral ou por afinidade, até o terceiro grau. (Origem: PRT MS/GM 1550/2014, Art. 45, II)
Art. 46. É vedada a contratação de pessoa física ou jurídica para apresentar-se como representante legal da instituição junto ao Pronon e ao Pronas, fato que configura intermediação, com exceção do disposto no art. 81, parágrafo único. (Origem: PRT MS/GM 1550/2014, Art. 46)
Seção III
Da Análise do Projeto
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção III)
Art. 47. A SE/MS encaminhará o projeto ao órgão do Ministério da Saúde competente para realizar a análise técnico-financeira no prazo de 10 (dez) dias, contado da data de autuação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 47)
Art. 48. O órgão do Ministério da Saúde competente realizará a análise técnico-financeira do projeto e emitirá parecer técnico conclusivo no prazo de 40 (quarenta) dias, contado da data de recebimento do projeto. (Origem: PRT MS/GM 1550/2014, Art. 48)
§ 1º O órgão do Ministério da Saúde competente poderá solicitar diretamente à instituição, por meio de correio eletrônico, a complementação ou adequação do projeto, com inclusão de informações não mencionada nos Anexos 1, 2, 3, 4, 5, 6, 7, 8, 9 e 10 do Anexo LXXXVI , que deverá ser apresentada pela instituição no prazo de 10 (dez) dias, contado da data do recebimento da notificação. (Origem: PRT MS/GM 1550/2014, Art. 48, § 1º)
§ 2º Na ocorrência da situação de que trata o § 1º, o prazo de que trata o "caput" ficará suspenso até a data de recebimento das informações adicionais. (Origem: PRT MS/GM 1550/2014, Art. 48, § 2º)
Art. 49. O parecer técnico conclusivo será redigido de forma clara, concisa e tecnicamente coerente, em conformidade com o modelo constante do Anexo 9 do Anexo LXXXVI , devendo manifestar-se quanto à adequação do projeto às políticas do Ministério da Saúde, e será conclusivo sobre a aprovação total, parcial ou reprovação, devidamente fundamentada, devendo conter: (Origem: PRT MS/GM 1550/2014, Art. 49)
I - descrição sobre a relevância do projeto, a sua adequação às ações prioritárias definidas pelo Ministério da Saúde e o seu potencial de contribuição para melhoria da execução, gestão e qualificação das ações e serviços de atenção à pessoa com câncer ou de reabilitação; (Origem: PRT MS/GM 1550/2014, Art. 49, I)
II - análise sobre o preenchimento completo e correto do requerimento de apresentação de projeto, conforme o modelo constante do Anexo 3 do Anexo LXXXVI ; (Origem: PRT MS/GM 1550/2014, Art. 49, II)
III - análise quanto ao enquadramento do projeto à Lei nº 12.715, de 2012, e às demais normas aplicáveis ao Pronon e ao Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 49, III)
IV - análise da adequação do projeto e da instituição aos mecanismos do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 49, IV)
V - análise das planilhas orçamentárias e dos documentos técnicos exigidos da instituição; (Origem: PRT MS/GM 1550/2014, Art. 49, V)
VI - avaliação da capacidade técnico-operacional para execução do projeto apresentado; (Origem: PRT MS/GM 1550/2014, Art. 49, VI)
VII - análise da adequação entre o objeto a ser executado e os produtos resultantes; (Origem: PRT MS/GM 1550/2014, Art. 49, VII)
VIII - análise da adequação das estratégias de ação aos objetivos, assinalando-se claramente no parecer se as etapas previstas são necessárias ou suficientes a sua realização e se são compatíveis com os prazos e custos previstos; (Origem: PRT MS/GM 1550/2014, Art. 49, VIII)
IX - verificação do enquadramento do projeto nos campos de atuação estabelecidos nos arts. 5º e 9º do Anexo LXXXVI ; e (Origem: PRT MS/GM 1550/2014, Art. 49, IX)
X - verificação da compatibilidade dos custos previstos com os preços praticados no mercado nacional e internacional, quando for o caso. (Origem: PRT MS/GM 1550/2014, Art. 49, X)
Parágrafo Único. O parecer técnico conclusivo será homologado pelo titular do órgão do Ministério da Saúde competente. (Origem: PRT MS/GM 1550/2014, Art. 49, Parágrafo Único)
Art. 50. São hipóteses para reprovação do projeto e consequente arquivamento do processo: (Origem: PRT MS/GM 1550/2014, Art. 50)
I - apresentação incompleta ou em desacordo com a documentação exigida por meio deste Anexo; (Origem: PRT MS/GM 1550/2014, Art. 50, I)
II - apresentação intempestiva de resposta à diligência prevista no art. 48, § 1º ; (Origem: PRT MS/GM 1550/2014, Art. 50, II)
III - existência de dúvidas fundamentadas quanto à veracidade dos documentos e das informações apresentadas; (Origem: PRT MS/GM 1550/2014, Art. 50, III)
IV - não observância das disposições da Lei nº 12.715, de 2012, do Decreto nº 7.988, de 2013, deste Anexo e demais normas que regem o Pronon e o Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 50, IV)
V - objeto e/ou cronograma idênticos ao de outro projeto já apresentado no mesmo ano fiscal; (Origem: PRT MS/GM 1550/2014, Art. 50, V)
VI - reapresentação de projeto similar arquivado ou já analisado e indeferido pelo Ministério da Saúde, no mesmo ano fiscal; e (Origem: PRT MS/GM 1550/2014, Art. 50, VI)
VII - fracionamento de outro projeto ativo, na medida em que seu objeto ou ação principal estejam nele contidas, podendo resultar em prejuízo para o alcance dos objetivos do projeto como um todo. (Origem: PRT MS/GM 1550/2014, Art. 50, VII)
Art. 51. A avaliação dos valores dos itens apresentados em cada uma das rubricas orçamentárias levará em conta os valores constantes do SIGEM, do BPS, do Sistema Integrado de Administração de Serviços Gerais (SIASG), do SINAPI, além de outros sistemas de informação que possam servir de referência para definição de preços e custos de ações e serviços de saúde. (Origem: PRT MS/GM 1550/2014, Art. 51)
§ 1º Quando os itens não estiverem relacionados nos sistemas descritos no "caput", os valores deverão representar a opção de maior economicidade, com base na cotação prévia realizada pela instituição de, no mínimo, 3 (três) orçamentos com preços praticados no mercado. (Origem: PRT MS/GM 1550/2014, Art. 51, § 1º)
§ 2º Caso não seja possível obter o número de cotações de que trata o § 1º, a instituição deverá apresentar justificativa circunstanciada, observados os princípios da impessoalidade e da moralidade. (Origem: PRT MS/GM 1550/2014, Art. 51, § 2º)
Art. 52. Após a manifestação do titular do órgão do Ministério da Saúde competente, o projeto e o parecer técnico conclusivo serão encaminhados à SE/MS. (Origem: PRT MS/GM 1550/2014, Art. 52)
Art. 53. O cumprimento de todos os requisitos dispostos neste Anexo não garante a aprovação do projeto, que dependerá, ainda, da consonância com as Redes de Atenção à Saúde, com as prioridades do Ministério da Saúde e com o limite financeiro destinado ao Pronon e ao Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 53)
§ 1º A aprovação final dos projetos será feita pelo Comitê Gestor do Pronon e do Pronas/PCD, a partir do parecer técnico conclusivo emitido para cada projeto e da consonância do projeto com as prioridades definidas por meio deste Anexo e com a Política Nacional para a Prevenção e Controle do Câncer e com a Política Nacional de Saúde da Pessoa com Deficiência. (Origem: PRT MS/GM 1550/2014, Art. 53, § 1º)
§ 2º A SE/MS enviará documento contendo o conjunto de resumos de projetos com parecer favorável dos órgãos do Ministério da Saúde competentes aos membros do Comitê Gestor do Pronon e do Pronas/PCD, para conhecimento prévio, em até 5 (cinco) dias, contados do prazo final de conclusão dos pareceres técnicos conclusivos. (Origem: PRT MS/GM 1550/2014, Art. 53, § 2º)
§ 3º O Comitê Gestor do Pronon e do Pronas/PCD deliberará sobre a aprovação dos projetos em reunião realizada em, no máximo, 10 (dez) dias após o envio do documento de que trata o §2º. (Origem: PRT MS/GM 1550/2014, Art. 53, § 3º)
Seção IV
Da Publicação do Resultado da Análise Técnica
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção IV)
Art. 54. Em caso de aprovação do projeto, caberá à SE/MS providenciar a publicação da portaria de aprovação do projeto e de autorização para captação de recursos em favor da instituição contemplada, no prazo de 5 (cinco) dias. (Origem: PRT MS/GM 1550/2014, Art. 54)
Art. 55. A portaria de aprovação de projetos e de autorização para captação de recursos conterá, no mínimo: (Origem: PRT MS/GM 1550/2014, Art. 55)
I - o número de registro do projeto no SIPAR; (Origem: PRT MS/GM 1550/2014, Art. 55, I)
II - o título do projeto; (Origem: PRT MS/GM 1550/2014, Art. 55, II)
III - a razão social da instituição e o respectivo CNPJ; (Origem: PRT MS/GM 1550/2014, Art. 55, III)
IV - o valor aprovado para captação de doações; (Origem: PRT MS/GM 1550/2014, Art. 55, IV)
V - os prazos de captação e de execução; e (Origem: PRT MS/GM 1550/2014, Art. 55, V)
VI - o extrato do projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 55, VI)
§ 1º A instituição ficará vinculada aos termos do projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 55, § 1º)
§ 2º Em caso de ocorrência de fato novo ou constatação de erro material que interfira na aprovação do projeto, o Ministério da Saúde poderá tornar sem efeito, no todo ou em parte, a portaria de aprovação de projeto e de autorização para captação de recursos, respeitados os direitos adquiridos em relação a metas ou etapas já executadas. (Origem: PRT MS/GM 1550/2014, Art. 55, § 2º)
Art. 56. Da publicação do resultado de que trata o art. 54, caberá recurso, no prazo de 5 (cinco) dias, contado da data de publicação da portaria, à autoridade que proferiu o parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 56)
§ 1º O recurso será encaminhado à SE/MS, que encaminhará à autoridade recorrida, no prazo de 5 (cinco) dias, contado da data de recebimento. (Origem: PRT MS/GM 1550/2014, Art. 56, § 1º)
§ 2º A área técnica fará análise do pedido e encaminhará à SE/MS, no prazo de 10 (dez) dias, contados da data de recebimento do recurso, e, na hipótese de reforma da decisão, será providenciada pela SE/MS a publicação de portaria de aprovação de projeto e de autorização para captação de recursos em favor da instituição contemplada ou de manutenção da decisão quanto à reprovação total ou parcial, no prazo de 5 (cinco) dias, contado do recebimento da decisão reformada. (Origem: PRT MS/GM 1550/2014, Art. 56, § 2º)
§ 3º Recursos intempestivos não serão conhecidos pela SE/MS. (Origem: PRT MS/GM 1550/2014, Art. 56, § 3º)
CAPÍTULO V
DAS DOAÇÕES
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V)
Art. 57. As doações no âmbito do Pronon e do Pronas/PCD poderão assumir as seguintes espécies de atos gratuitos: (Origem: PRT MS/GM 1550/2014, Art. 57)
I - transferência de quantias em dinheiro; (Origem: PRT MS/GM 1550/2014, Art. 57, I)
II - transferência de bens móveis ou imóveis; (Origem: PRT MS/GM 1550/2014, Art. 57, II)
III - comodato ou cessão de uso de bens imóveis ou equipamentos; (Origem: PRT MS/GM 1550/2014, Art. 57, III)
IV - realização de despesas com reformas; e (Origem: PRT MS/GM 1550/2014, Art. 57, IV)
V - fornecimento de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e outros produtos para a saúde. (Origem: PRT MS/GM 1550/2014, Art. 57, V)
Parágrafo Único. Os doadores deverão observar a regulamentação expedida pela Secretaria da Receita Federal do Brasil sobre os procedimentos a serem adotados para fruição dos benefícios fiscais relativos ao Imposto sobre a Renda das Pessoas Físicas e Jurídicas, nas doações efetuadas diretamente ao Pronon e ao Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 57, Parágrafo Único)
Art. 58. As informações relativas às doações a projetos do Pronon e do Pronas/PCD são de envio obrigatório pelo Ministério da Saúde à Secretaria da Receita Federal do Brasil, por meio do Programa Gerador da Declaração de Benefícios Fiscais (DBF), conforme instrução normativa da Receita Federal do Brasil. (Origem: PRT MS/GM 1550/2014, Art. 58)
Seção I
Da Transferência de Quantias em Dinheiro e da Abertura e Movimentação das Contas Correntes
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção I)
Art. 59. Os recursos financeiros captados no âmbito do Pronon e do Pronas/PCD serão depositados em conta bancária bloqueada, denominada Conta Captação, e geridas em conta de livre movimentação, denominada Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 59)
§ 1º As contas de que trata o "caput" serão vinculadas a cada projeto e serão abertas pelo Ministério da Saúde em instituição financeira oficial. (Origem: PRT MS/GM 1550/2014, Art. 59, § 1º)
§ 2º O Ministério da Saúde divulgará no Portal Saúde os dados das contas, em até 10 (dez) dias, contados da data de publicação da portaria de aprovação de projeto e de autorização para captação de recursos. (Origem: PRT MS/GM 1550/2014, Art. 59, § 2º)
§ 3º Somente poderão ser depositados na Conta Captação recursos de fontes relacionadas ao mecanismo de incentivo fiscal. (Origem: PRT MS/GM 1550/2014, Art. 59, § 3º)
§ 4º Competirá exclusivamente à instituição zelar para que não seja depositados na Conta Captação recursos oriundos de outras fontes não relacionadas ao mecanismo de renúncia fiscal. (Origem: PRT MS/GM 1550/2014, Art. 59, § 4º)
§ 5º Durante o acompanhamento da execução do projeto, o Ministério da Saúde poderá, motivadamente e a fim de garantir sua regularidade: (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º)
I - determinar o recolhimento parcial ou integral dos recursos constantes da Conta Captação; (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º, I)
II - bloquear a Conta Captação e a movimentação da Conta Movimento; e (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º, II)
III - providenciar a movimentação de recursos da Conta Captação e da Conta Movimento para a Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º, III)
§ 6º Após o prazo de captação ou quando for captada a integralidade dos recursos previstos no projeto, o Ministério da Saúde providenciará o bloqueio da Conta Captação. (Origem: PRT MS/GM 1550/2014, Art. 59, § 6º)
§ 7º Competirá ao Ministério da Saúde providenciar junto à instituição financeira oficial o encerramento de contas após o término da vigência do Termo de Compromisso ou no caso de equívoco de sua abertura. (Origem: PRT MS/GM 1550/2014, Art. 59, § 7º)
Art. 60. Os recursos financeiros oriundos de doação somente poderão ser captados após a publicação da portaria de aprovação de projeto e de autorização para captação de recursos de que trata o art. 54. (Origem: PRT MS/GM 1550/2014, Art. 60)
§ 1º Os recursos serão depositados na Conta Captação por meio de depósito identificado, com a informação obrigatória do CPF ou do CNPJ dos depositantes, ou, desde que tenha sido identificados os depositantes, por Transferência Eletrônica Disponível (TED) ou Documento de Operação de Crédito (DOC), com a informação da modalidade dos depósitos (doação). (Origem: PRT MS/GM 1550/2014, Art. 60, § 1º)
§ 2º Competirá à instituição esclarecer aos doadores quanto à forma de depósito na Conta Captação, informando as opções disponíveis, nos termos do § 1º. (Origem: PRT MS/GM 1550/2014, Art. 60, § 2º)
§ 3º Na hipótese do § 3º, o Ministério da Saúde comunicará o fato à Secretaria da Receita Federal do Brasil, para eventual fiscalização tributária. (Origem: PRT MS/GM 1550/2014, Art. 60, § 4º)
§ 4º Depósitos equivocados na Conta Captação, quando devidamente identificados e justificados, poderão ter o estorno autorizado pelo Ministério da Saúde, para o devido ajuste, desde que o pedido da instituição ocorra em data prévia à celebração do Termo de Compromisso e seja protocolado até o dia 28 de fevereiro do exercício fiscal seguinte à doação equivocadamente realizada. (Origem: PRT MS/GM 1550/2014, Art. 60, § 3º) (com redação dada pela PRT MS/GM 1575/2015)
Art. 61. Para a efetivação da abertura de contas correntes, além dos demais requisitos previstos neste Anexo, a instituição autorizará a instituição financeira oficial, em caráter irrevogável e irretratável, a cumprir as determinações do Ministério da Saúde relativas às movimentações financeiras. (Origem: PRT MS/GM 1550/2014, Art. 61)
Art. 62. O Ministério da Saúde e a instituição firmarão Termo de Compromisso, cujo prazo máximo de vigência será igual ao prazo de início da vigência do projeto até a última apresentação das demonstrações contábeis e do parecer conclusivo de que trata o art. 92, parágrafo único, e que regulará as obrigações entre as partes, especialmente quanto ao projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 62)
Parágrafo Único. O Ministério da Saúde convocará o representante legal da instituição para assinatura do Termo de Compromisso, depois de comprovada a captação de 100% (cem por cento) dos recursos previstos nos respectivos orçamentos. (Origem: PRT MS/GM 1550/2014, Art. 62, Parágrafo Único)
Art. 63. As Contas Movimento somente poderão ser operadas após a regularização cadastral, pelos respectivos titulares, na agência bancária da instituição financeira oficial onde tenham sido abertas, de acordo com as normas vigentes do Banco Central do Brasil, e depois da autorização do Ministério da Saúde para que a instituição financeira oficial repasse os recursos da Conta Captação para a Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 63)
Art. 64. Caberá à instituição emitir recibo em favor do doador, assinado por pessoa competente, em três vias, para cada depósito efetuado na Conta Captação, observados os requisitos estabelecidos pela Secretaria da Receita Federal do Brasil, e conforme os modelos constantes do Anexo 10 do Anexo LXXXVI sendo: (Origem: PRT MS/GM 1550/2014, Art. 64)
I - a primeira via para o doador; (Origem: PRT MS/GM 1550/2014, Art. 64, I)
II - a segunda via para o Ministério da Saúde; e (Origem: PRT MS/GM 1550/2014, Art. 64, II)
III - a terceira via para controle da própria instituição. (Origem: PRT MS/GM 1550/2014, Art. 64, III)
Parágrafo Único. A instituição encaminhará ao Ministério da Saúde, no prazo de até 20 (vinte) dias, ofício discriminando os números de ordem e os valores dos recibos emitidos, juntamente com os respectivos recibos. (Origem: PRT MS/GM 1550/2014, Art. 64, Parágrafo Único)
Art. 65. O desbloqueio dos recursos financeiros depositados na Conta Captação para fins de início da execução do projeto será condicionado à assinatura e publicação do Termo de Compromisso. (Origem: PRT MS/GM 1550/2014, Art. 65)
Art. 66. É vedada a captação de recursos de entidades vinculadas à instituição proponente. (Origem: PRT MS/GM 1550/2014, Art. 66)
Art. 67. Os recursos captados não poderão ser aplicados em atividades não integrantes do projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 67)
Art. 68. Somente poderão ser iniciadas as execuções dos projetos depois de captados 100% (cem por cento) dos recursos previstos nos respectivos orçamentos. (Origem: PRT MS/GM 1550/2014, Art. 68)
§ 1º A instituição não poderá ressarcir-se de despesas efetuadas em data anterior à celebração do Termo de Compromisso, exceto para captação de recursos e elaboração de projeto. (Origem: PRT MS/GM 1550/2014, Art. 68, § 1º)
§ 2º Para fins de verificação da captação de 100% (cem por cento) dos recursos previstos no orçamento, serão consideradas todas as doações recebidas a título das espécies previstas no art. 57. (Origem: PRT MS/GM 1550/2014, Art. 68, § 2º)
§ 3º As instituições terão o prazo de 90 (noventa) dias para captação dos recursos previstos no art. 59, podendo este prazo ser prorrogável, por mais 30 (trinta) dias, por meio de solicitação formal da instituição, devidamente justificada, antes de findar o prazo final de captação, observado o término do exercício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 68, § 3º)
§ 4º A liberação dos recursos para a Conta Movimento e, portanto, a autorização para início da execução do projeto, estará condicionada à apresentação dos recibos nos casos de doações previstas nos incisos II a V do art. 57, quando houver. (Origem: PRT MS/GM 1550/2014, Art. 68, § 5º)
§ 1º Somente após o prazo de captação previsto no art. 68, § 3º , a instituição executora poderá apresentar ao Ministério da Saúde a proposta de readequação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 69, § 1º)
§ 2º A proposta de readequação será enviada à SE/MS que, no prazo de 10 (dez) dias, remeterá ao órgão do Ministério da Saúde Competente. (Origem: PRT MS/GM 1550/2014, Art. 69, § 2º)
§ 3º O órgão do Ministério da Saúde que aprovou o projeto terá o prazo de 30 (trinta) dias do recebimento da proposta de readequação para emitir parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 69, § 3º)
§ 4º Após o recebimento do parecer técnico conclusivo, a SE/MS providenciará a publicação de Portaria com a divulgação do resultado da análise dos projetos de readequação, no prazo de 10 (dez) dias, contado do recebimento do parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 69, § 4º)
§ 5º Caso a instituição não apresente a readequação do projeto no prazo estabelecido no "caput" ou caso a readequação seja reprovada, os recursos captados deverão ser recolhidos à Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 69, § 5º)
Art. 69. Caso não haja a captação integral dos recursos financeiros no prazo previsto no art. 68, § 3º , desde que tenham sido captados pelo menos 60% dos recursos, a instituição enviará, no prazo de 30 (trinta) dias contados do término do período de captação de recursos, readequação das ações previstas no projeto aprovado ao valor total obtido na captação, mediante aprovação prévia do Ministério da Saúde, para fins de execução dos recursos financeiros. (Origem: PRT MS/GM 1550/2014, Art. 69) (com redação dada pela PRT MS/GM 1575/2015)
§ 1º A proposta de readequação de que trata o "caput" será enviada à SE/MS que, no prazo de 10 (dez) dias, remeterá ao órgão do Ministério da Saúde competente. (Origem: PRT MS/GM 1550/2014, Art. 70, § 1º)
§ 2º O órgão do Ministério da Saúde que aprovou o projeto terá o prazo de 30 (trinta) dias do recebimento da proposta de readequação para emitir parecer técnico conclusivo em relação à readequação de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 70, § 2º)
§ 3º Após receber o parecer técnico de que trata o § 2º, a SE/MS providenciará a publicação de portaria com a divulgação do resultado da análise das readequações do projeto, no prazo máximo de 10 (dez) dias, contado do recebimento do parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 70, § 3º)
§ 4º Os recursos captados remanescentes serão recolhidos na forma do art. 88. (Origem: PRT MS/GM 1550/2014, Art. 70, § 4º)
Art. 70. A instituição poderá enviar, no prazo de 30 (trinta) dias contados do término do período de captação de recursos, readequação para maior do orçamento do projeto aprovado, em até 20% (vinte por cento), a critério do Ministério da Saúde, na hipótese da captação de recursos realizada ser superior ao orçamento previsto no projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 70) (com redação dada pela PRT MS/GM 1575/2015)
Seção II
Da Transferência de Bens Móveis e Imóveis
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção II)
Art. 71. A transferência de bens móveis ou imóveis será feita diretamente aos órgãos e entidades públicas integrantes da administração pública direta e indireta da União, estados, Distrito Federal e municípios. (Origem: PRT MS/GM 1550/2014, Art. 71)
§ 1º A instituição participante do Pronon e do Pronas/PCD deverá obter aceitação do gestor local do SUS para as providências de transferência do bem para a administração pública. (Origem: PRT MS/GM 1550/2014, Art. 71, § 1º)
§ 2º A instituição poderá fazer uso do bem durante a vigência do projeto. (Origem: PRT MS/GM 1550/2014, Art. 71, § 2º)
§ 3º Somente será admitida a doação de bens móveis novos. (Origem: PRT MS/GM 1550/2014, Art. 71, § 3º)
§ 4º Na doação de bens móveis, o doador deverá apresentar a nota fiscal dos bens. (Origem: PRT MS/GM 1550/2014, Art. 71, § 4º)
Art. 72. Na hipótese de doação de bens imóveis, o doador deverá considerar como valor dos bens doados o constante da última Declaração de Bens e Direitos da Declaração de Ajuste Anual ou valor pago no caso de bens adquiridos no mesmo ano da doação, que não poderá ultrapassar o valor de mercado. (Origem: PRT MS/GM 1550/2014, Art. 72)
Seção III
Da Realização de Despesas com Reformas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção III)
Art. 73. No caso de despesas com reformas, executadas a título de doação, a comprovação será feita mediante a apresentação de notas fiscais, contrato de prestação de serviço ou de recibos devidamente assinados com a perfeita identificação da fonte pagadora, do beneficiário e discriminação a que se refere o pagamento. (Origem: PRT MS/GM 1550/2014, Art. 73)
Seção IV
Da Doação de Medicamentos, Kits Diagnósticos, Materiais Médico-Hospitalares, Órteses, Próteses e Outros Produtos para a Saúde
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção IV)
Art. 74. As doações de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e outros produtos para saúde somente poderão ser feitas por pessoas jurídicas e com apresentação de nota fiscal dos produtos doados. (Origem: PRT MS/GM 1550/2014, Art. 74)
§ 1º O prazo de validade dos produtos, quando for o caso, não poderá ser inferior a 12 (doze) meses. (Origem: PRT MS/GM 1550/2014, Art. 74, § 1º)
§ 2º O preço unitário dos produtos doados constante da nota fiscal não poderá exceder o preço incluído no orçamento aprovado, baseado nos sistemas de informação de que trata o art. 39. (Origem: PRT MS/GM 1550/2014, Art. 74, § 2º)
Seção V
Do remanejamento de recursos entre projetos no âmbito do Pronon e do Pronas/PCD
(Origem: PRT MS/GM 1550/2014, Seção I-A) (dispositivo acrescentado pela PRT MS/GM 1575/2015)
Art. 75. Será facultado à SE/MS remanejar recursos entre Contas Captação de diferentes projetos da mesma entidade credenciada no âmbito do Pronon e do Pronas/PCD, mediante solicitação formal da instituição credenciada e sem que acarrete prejuízos ao incentivador quanto ao benefício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 70-A)
§ 1º O remanejamento de que trata o "caput" somente poderá ser solicitado caso ambos os projetos sejam exclusivamente do Pronon ou exclusivamente do Pronas/PCD, após o encerramento do período de captação de recursos e previamente ao envio da readequação do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 1º)
§ 2º O projeto a ser beneficiado fará jus aos recursos remanejados até o limite de 20% (vinte por cento) a maior do valor aprovado por meio de portaria de aprovação do projeto e de autorização para captação de recursos de que trata o art. 54. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 3º)
§ 3º A instituição deverá apresentar readequação do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado em até 30 (trinta) dias contados do efetivo remanejamento de recursos. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 4º)
§ 4º É dispensada apresentação de readequação do projeto cedente do qual serão remanejados os recursos, quando a solicitação de remanejamento de recursos referir-se a valores que excedam o percentual máximo disposto no § 1º , podendo o remanejamento ocorrer em qualquer fase de execução do projeto cedente, excetuando-se saldo remanescente ao fim de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 5º)
§ 5º Quando os recursos captados não atingirem o percentual mínimo do § 1º , os recursos do projeto cedente também poderão ser remanejados, respeitando-se o limite disposto no § 3º e as vedações do art. 76, restando, no entanto, reprovado o projeto cedente e devendo-se recolher eventual saldo remanescente nos termos do art. 77. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 6º)
§ 6º Caso a instituição não observe os prazos do § 4º ou caso a readequação seja reprovada pelo órgão do Ministério da Saúde competente, os recursos remanejados deverão ser recolhidos à Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 7º)
§ 7º A SE/MS dará conhecimento ao Comitê Gestor do Pronon e do Pronas/PCD sobre os efetivos remanejamentos de recursos, em reunião ordinária subsequente, ou, se for o caso, em reunião extraordinária. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 8º)
§ 8º Excepcionalmente para os projetos apresentados em 2014 e 2015, o remanejamento de que trata o "caput" poderá ser solicitado após o encerramento do período de captação de recursos e previamente à celebração do termo de compromisso do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado, observados os termos dos §§ 3º e 4º. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 2º) (com redação dada pela PRT MS/GM 823/2016)
Art. 76. É vedado o remanejamento de recursos entre projetos quando: (Origem: PRT MS/GM 1550/2014, Art. 70-B)
I - não forem observados os critérios do art. 75; (Origem: PRT MS/GM 1550/2014, Art. 70-B, I)
II - o projeto cedente do qual serão remanejados os recursos e o projeto a ser beneficiado não pertencerem ambos ao Pronon ou ao Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 70-B, II)
III - o projeto cedente do qual serão remanejados os recursos e o projeto a ser beneficiado forem apresentados por instituições credenciadas com CNPJ distintos; (Origem: PRT MS/GM 1550/2014, Art. 70-B, III)
IV - o projeto cedente restar economicamente inviabilizado nos termos do § 1º ; (Origem: PRT MS/GM 1550/2014, Art. 70-B, IV)
V - o projeto cedente do qual serão remanejados os recursos e o projeto a ser beneficiado não forem apresentados no mesmo ano fiscal; e (Origem: PRT MS/GM 1550/2014, Art. 70-B, V)
VI - tratar-se de saldo remanescente ao fim de execução de projeto. (Origem: PRT MS/GM 1550/2014, Art. 70-B, VI)
Art. 77. Quando não houver possibilidade de remanejamento, os recursos serão devolvidos à Conta Única do Tesouro Nacional por meio de Guia de Recolhimento da União (GRU), sem prejuízo ao incentivador quanto ao benefício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 70-C)
Art. 78. A SE/MS publicará Portaria com o resultado da análise da solicitação de remanejamento de recursos no prazo de 20 (vinte) dias contados da data de protocolo da solicitação no Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 70-D)
Art. 79. Do indeferimento do remanejamento de recursos de que trata o art. 75, caberá recurso, no prazo de 5 (cinco) dias contados da notificação da instituição credenciada, à autoridade que proferiu a decisão, que, se não a reconsiderar no prazo de 5 (cinco) dias, o encaminhará à autoridade superior. (Origem: PRT MS/GM 1550/2014, Art. 70-E)
CAPÍTULO VI
DA EXECUÇÃO DOS PROJETOS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VI)
Art. 80. Os recursos da Conta Movimento serão destinados exclusivamente ao pagamento das despesas constantes do projeto aprovado, devendo sua movimentação se realizar por meio de qualquer operação bancária autorizada pelo Banco Central do Brasil, desde que fique identificada sua destinação e, no caso de pagamento, o credor. (Origem: PRT MS/GM 1550/2014, Art. 75)
Parágrafo Único. Fica vedado, em qualquer hipótese, o saque em espécie. (Origem: PRT MS/GM 1550/2014, Art. 75, Parágrafo Único)
Art. 81. Nenhuma aplicação dos recursos poderá ser efetuada mediante intermediação. (Origem: PRT MS/GM 1550/2014, Art. 76)
Parágrafo Único. Não configura intermediação a contratação de serviços de: (Origem: PRT MS/GM 1550/2014, Art. 76, Parágrafo Único)
I - elaboração de projetos de ações ou serviços para a obtenção de doação; e (Origem: PRT MS/GM 1550/2014, Art. 76, Parágrafo Único, I)
II - captação de recursos. (Origem: PRT MS/GM 1550/2014, Art. 76, Parágrafo Único, II)
Art. 82. Nas hipóteses previstas em Lei, Regulamento ou nesta Portaria, impõe-se a aplicação dos recursos no mercado financeiro, a qual deverá ser feita, obrigatoriamente, em fundo de aplicação financeira de curto prazo ou em operação de mercado aberto, lastreada em título da dívida pública federal. (Origem: PRT MS/GM 1550/2014, Art. 77)
Parágrafo Único. Os rendimentos obtidos em função das aplicações financeiras de que trata o "caput" deverão ser utilizados exclusivamente nas ações do projeto aprovado, estando sujeitos às mesmas condições de prestação de contas exigidas para os recursos incentivados, devendo o proponente justificar, quando da apresentação das prestações de contas, a ação escolhida, tendo como critério a obtenção do melhor resultado para a execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 77, Parágrafo Único)
Art. 83. Cada lançamento efetuado a débito na Conta Movimento deverá corresponder a um comprovante de sua regular aplicação no projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 78)
Art. 84. A instituição não poderá realizar pagamentos anteriores à celebração do Termo de Compromisso ou posteriores ao prazo de execução do projeto aprovado, sob pena de ressarcimento e demais penalidades previstas na legislação vigente. (Origem: PRT MS/GM 1550/2014, Art. 79)
Art. 85. Os documentos comprobatórios das despesas serão emitidos única e exclusivamente em nome da instituição beneficiária. (Origem: PRT MS/GM 1550/2014, Art. 80)
Parágrafo Único. A instituição registrará o número do processo administrativo referente ao projeto aprovado no âmbito do Pronon ou do Pronas/PCD em todos os documentos que comprovem as despesas. (Origem: PRT MS/GM 1550/2014, Art. 80, Parágrafo Único)
Art. 86. O Ministério da Saúde decidirá sobre eventual pedido de prorrogação de prazo para a execução do projeto, uma única vez, desde que fundamentado e apresentado pelo proponente em até 60 (sessenta) dias antes de encerrar o prazo inicialmente previsto para sua execução. (Origem: PRT MS/GM 1550/2014, Art. 81)
Art. 87. Quaisquer alterações no Plano de Trabalho do projeto autorizado serão submetidas à apreciação do órgão do Ministério da Saúde competente, com justificativas necessárias. (Origem: PRT MS/GM 1550/2014, Art. 82)
Parágrafo Único. O órgão do Ministério da Saúde competente terá o prazo de 10 (dez) dias para se manifestar formalmente acerca da alteração de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 82, Parágrafo Único)
Art. 88. Os recursos deverão ser recolhidos à Conta Única do Tesouro Nacional, por meio de Guia de Recolhimento da União (GRU), sem prejuízo ao doador quanto ao benefício fiscal, quando: (Origem: PRT MS/GM 1550/2014, Art. 83)
I - a instituição se negar a celebrar o Termo de Compromisso junto ao Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 83, I)
II - a instituição for considerada inabilitada, nos termos do art. 12 do Decreto nº 7.988, de 2013; (Origem: PRT MS/GM 1550/2014, Art. 83, II)
III - a instituição for descredenciada, nos termos do art. 22; (Origem: PRT MS/GM 1550/2014, Art. 83, III)
IV - houver impossibilidade de readequação do projeto; (Origem: PRT MS/GM 1550/2014, Art. 83, IV)
V - houver saldo remanescente em relação ao orçamento do projeto; (Origem: PRT MS/GM 1550/2014, Art. 83, V)
VI - houver saldo remanescente ao fim da execução do projeto; e (Origem: PRT MS/GM 1550/2014, Art. 83, VI)
VII - em caso de reprovação, parcial ou final, da execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 83, VII)
§ 1º Os recursos da Conta Captação e da Conta Movimento deverão ser recolhidos pela instituição beneficiária à Conta Única do Tesouro Nacional, no prazo de até 30 (trinta) dias, da notificação emitida pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 83, § 1º)
§ 2º O comprovante do recolhimento de saldo remanescente deverá ser apresentado juntamente com a prestação de contas do projeto, quando for o caso. (Origem: PRT MS/GM 1550/2014, Art. 83, § 2º)
CAPÍTULO VII
DO MONITORAMENTO, DA PRESTAÇÃO DE CONTAS E DA AVALIAÇÃO TÉCNICA
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII)
Seção I
Do Monitoramento
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII, Seção I)
Art. 89. As doações captadas pelas instituições no âmbito do Pronon e do Pronas/PCD são recursos públicos e estão sujeitas a acompanhamento, prestação de contas e avaliação técnica. (Origem: PRT MS/GM 1550/2014, Art. 84)
§ 1º A não aplicação sem justa causa ou aplicação incorreta dos recursos no âmbito do Pronon e do Pronas/PCD poderá ensejar instauração de Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 84, § 1º)
§ 2º As instituições deverão permitir e facilitar aos representantes do Ministério da Saúde o acesso a toda documentação, dependências e locais do projeto, a fiscalização por meio de auditorias, vistorias "in loco" e demais diligências de acompanhamento, que serão realizadas diretamente pelo Ministério da Saúde, por suas entidades vinculadas, ou mediante parceria com outros órgãos federais, estaduais e municipais. (Origem: PRT MS/GM 1550/2014, Art. 84, § 2º)
§ 3º A unidade executora do projeto será a própria instituição, que se responsabilizará integralmente por todos os atos, contratos e obrigações referentes à execução do projeto, não podendo atribuir a terceiros as atividades principais objeto do projeto, conforme previsto no plano de trabalho aprovado pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 84, § 3º)
§ 4º As diligências previstas no § 2º serão registradas em relatório de monitoramento do projeto, que integrará os autos do processo administrativo. (Origem: PRT MS/GM 1550/2014, Art. 84, § 4º)
§ 5º Caso necessário, o órgão do Ministério da Saúde responsável pelo acompanhamento e fiscalização do projeto poderá notificar a instituição a prestar esclarecimentos no prazo de 20 (vinte) dias. (Origem: PRT MS/GM 1550/2014, Art. 84, § 5º)
§ 6º O Ministério da Saúde determinará a suspensão do projeto, verificada a omissão da instituição no atendimento às diligências ou decorrido o prazo do § 5º sem o devido atendimento da notificação, e adotará as demais providências necessárias para a apuração de responsabilidade e o ressarcimento dos prejuízos ao erário. (Origem: PRT MS/GM 1550/2014, Art. 84, § 6º)
Seção II
Da Prestação de Contas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII, Seção II)
Art. 90. Será responsabilidade das instituições comprovar a correta aplicação dos recursos financeiros recebidos ao final do desenvolvimento das ações e serviços realizado no âmbito dos projetos, ou anualmente, se o projeto for executado em um período superior a 1 (um) ano. (Origem: PRT MS/GM 1550/2014, Art. 85)
Parágrafo Único. A apuração de eventuais ajustes contábeis no projeto observará a vigência do Termo de Compromisso em que está inserido, não sendo permitido remanejamento de saldo financeiro ou de qualquer outro recurso para eventual Termo de Compromisso subsequente. (Origem: PRT MS/GM 1550/2014, Art. 85, Parágrafo Único)
Art. 91. O relatório de execução do projeto, equivalente à prestação de contas, conterá informações sobre o conteúdo e o valor das atividades previstas e executadas e as demais informações acerca do desempenho físico-financeiro do projeto em relação ao respectivo projeto aprovado pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 86)
Parágrafo Único. O relatório de execução do projeto será enviado ao Ministério da Saúde por meio de carta com Aviso de Recebimento (AR) ou SEDEX ou entregue diretamente no Protocolo Central do Ministério da Saúde, contando como destinatário "Ministério da Saúde - Pronon ou Pronas/PCD - Esplanada dos Ministérios, Bloco G, Protocolo Central, CEP 70058-900 Brasília- DF". (Origem: PRT MS/GM 1550/2014, Art. 86, Parágrafo Único)
Art. 92. Os relatórios de execução dos projetos deverão estar acompanhados de demonstrações contábeis e financeiras, submetidas a parecer conclusivo de auditoria independente, realizada por instituição credenciada perante o respectivo Conselho Regional de Contabilidade (CRC). (Origem: PRT MS/GM 1550/2014, Art. 87)
Parágrafo Único. As demonstrações contábeis do projeto e o relatório de auditoria serão apresentados anualmente até o dia 30 de abril de cada ano de execução o projeto, juntamente com o relatório de execução, bem como no ano seguinte ao último exercício fiscal em que houve execução do projeto, devendo ser instruídos com os seguintes documentos: (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único)
I - relatório de cumprimento do objeto, no qual serão discriminados os resultados esperados e atingidos, os objetivos previstos e alcançados e os custos estimados e reais; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, I)
II - relatório final de execução físico-financeira; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, II)
III - relatório de execução de receitas e despesas; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, III)
IV - relação de pagamentos; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, IV)
V - cópia do extrato da conta bancária específica, desde o dia do recebimento dos recursos até a data do último pagamento; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, V)
VI - demonstrativo de rendimentos das aplicações; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, VI)
VII - comprovante de recolhimento dos recursos não aplicados, mediante Guia de Recolhimento da União (GRU), quando houver; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, VII)
VIII - comprovante de transferência dos recursos não utilizados da Conta Movimento para Conta Captação, quando houver; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, VIII)
IX - cópia dos documentos comprobatórios das despesas da prestação de contas; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, IX)
X - relação de bens adquiridos ou produzido com recursos do Pronon ou do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, X)
XI - fotografias e reportagens que comprovem a execução do projeto; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XI)
XII - relação de equipamentos e materiais permanentes adquiridos para as atividades do projeto, contendo o número e/ou identificação do projeto e controlados em inventário físico específico; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XII)
XIII - informações lançadas no CIHA; e (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XIII)
XIV - comprovante de encerramento da Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XIV)
Art. 93. Na ocasião da apresentação de relatório de auditoria e das demonstrações contábeis, a instituição poderá apresentar retificação ao relatório anual de execução do projeto referente ao mesmo exercício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 88)
Art. 94. É responsabilidade da instituição, efetuar a retenção e os recolhimentos de impostos e contribuições que incidirem sobre os recursos movimentados, serviços contratados e obrigações decorrentes de relações de trabalho. (Origem: PRT MS/GM 1550/2014, Art. 89)
Art. 95. Cabe à instituição emitir comprovantes em favor dos doadores, bem como manter o controle documental das receitas e despesas do projeto, pelo prazo de 5 (cinco) anos, contado da aprovação da prestação de contas, à disposição do Ministério da Saúde e dos órgãos de controle e fiscalização, caso seja instado a apresenta-las, respeitada a regulamentação da Secretaria da Receita Federal do Brasil. (Origem: PRT MS/GM 1550/2014, Art. 90)
§ 1º As faturas, recibos, notas fiscais, cheques emitidos e quaisquer outros documentos abrangidos por este artigo deverão conter a discriminação dos serviços contratados e dos produtos adquiridos, o número de registro no SIPAR e o nome do projeto. (Origem: PRT MS/GM 1550/2014, Art. 90, § 1º)
§ 2º Caso não haja possibilidade do prestador de serviços informar eletronicamente o número de registro no SIPAR e o nome do projeto, caberá ao representante legal da instituição declará-los expressamente no próprio documento. (Origem: PRT MS/GM 1550/2014, Art. 90, § 2º)
Seção III
Da Análise da Prestação de Contas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII, Seção III)
Art. 96. Caberá ao órgão do Ministério da Saúde que emitiu o parecer técnico conclusivo favorável à aprovação do projeto realizar a análise das atividades executadas, com emissão de parecer conclusivo do relatório em até 90 (noventa) dias, contados da data de recebimento. (Origem: PRT MS/GM 1550/2014, Art. 91)
§ 1º A análise dos aspectos contábeis e financeiros das prestações de contas dos projetos será feita pelo Fundo Nacional de Saúde e a emissão do parecer conclusivo, incluindo a avaliação da execução física, pelo órgão do Ministério que emitiu o parecer conclusivo de aprovação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 91, § 1º)
§ 2º Para fins de elaboração do parecer de que trata o "caput", o órgão do Ministério da Saúde competente poderá solicitar quaisquer informações necessárias à instituição participante, que deverá responder em até 15 (quinze) dias contados de sua notificação, por meio de correio eletrônico, caso em que o prazo previsto no "caput" ficará suspenso até a data de recebimento dessas informações. (Origem: PRT MS/GM 1550/2014, Art. 91, § 2º)
§ 3º A ausência de manifestação da instituição no prazo previsto no § 1º poderá implicar a reprovação do relatório. (Origem: PRT MS/GM 1550/2014, Art. 91, § 3º)
Art. 97. O parecer de prestação de contas abordará, no mínimo, os seguintes aspectos: (Origem: PRT MS/GM 1550/2014, Art. 92)
I - confirmação da apresentação dos documentos relacionados no art. 92, parágrafo único referente à análise da execução do objeto e dos objetivos do projeto; (Origem: PRT MS/GM 1550/2014, Art. 92, I)
II - comparação entre os resultados esperados e os atingidos pelo projeto; e (Origem: PRT MS/GM 1550/2014, Art. 92, II)
III - outros aspectos considerados relevantes pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 92, III)
§ 1º Caso o parecer conclua pelo descumprimento do objeto, a área técnica deverá indicar as metas ou as atividades descumpridas, recomendando a devolução dos recursos correspondentes. (Origem: PRT MS/GM 1550/2014, Art. 92, § 1º)
§ 2º Em caso de descumprimento integral do objeto, atestado no parecer de avaliação técnica, fica dispensada a análise financeira da prestação de contas. (Origem: PRT MS/GM 1550/2014, Art. 92, § 2º)
§ 3º Quando as contas e demais documentos comprobatórios do cumprimento do objeto do projeto não forem apresentados no prazo estipulado no art. 92, parágrafo único, o Ministério da Saúde registrará a inadimplência da instituição e a notificará, uma única vez, para que regularize a prestação de contas em 30 (trinta) dias, sob pena de reprovação. (Origem: PRT MS/GM 1550/2014, Art. 92, § 3º)
§ 4º Para elaboração do parecer a que se refere este artigo, o Ministério da Saúde poderá: (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º)
I - valer-se de informações, documentos ou outros elementos obtidos junto a autoridades públicas; (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º, I)
II - solicitar quaisquer informações, documentos ou outros elementos que julgar necessários; e (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º, II)
III - diligenciar a instituição para que apresente informações, documentos e outros esclarecimentos que julgar necessários para que possa avaliar a prestação de contas. (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º, III)
Art. 98. Os pareceres técnicos serão submetidos à autoridade máxima do órgão do Ministério da Saúde competente, para decisão de aprovação, aprovação com ressalvas ou reprovação. (Origem: PRT MS/GM 1550/2014, Art. 93)
§ 1º O projeto será considerado aprovado integralmente quando o parecer técnico atestar a aplicação regular dos recursos e indicar que o projeto teve avaliação técnica satisfatória. (Origem: PRT MS/GM 1550/2014, Art. 93, § 1º)
§ 2º O projeto será considerado aprovado com ressalvas quando, apesar de regulares as contas, tiver obtido avaliação técnica insatisfatória com fundamento nos aspectos do art. 97, desde que não resulte em prejuízo ao erário ou descumprimento do objeto. (Origem: PRT MS/GM 1550/2014, Art. 93, § 2º)
§ 3º O projeto será considerado reprovado quando: (Origem: PRT MS/GM 1550/2014, Art. 93, § 3º)
I - o objeto tenha sido descumprido, conforme atestado no parecer de avaliação técnica; ou (Origem: PRT MS/GM 1550/2014, Art. 93, § 3º, I)
II - a prestação de contas não seja considerada regular, ainda que o resultado do parecer de avaliação técnica tenha sido favorável quanto ao cumprimento do objeto. (Origem: PRT MS/GM 1550/2014, Art. 93, § 3º, II)
§ 4º A omissão na prestação de contas também é causa de reprovação, podendo ser sanada se apresentada até o julgamento da Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 93, § 4º)
Art. 99. O ato de aprovação, aprovação com ressalva ou reprovação poderá ser revisto de ofício pela autoridade máxima do órgão do Ministério da Saúde competente, a qualquer tempo, de forma justificada. (Origem: PRT MS/GM 1550/2014, Art. 94)
Art. 100. Caberá à SE/MS providenciar a publicação do resultado da análise da prestação de contas. (Origem: PRT MS/GM 1550/2014, Art. 95)
Art. 101. Quando a decisão for pela reprovação da prestação de contas, será assinalado o prazo de 30 (trinta) dias à instituição para recolhimento dos recursos que tenham sido irregularmente aplicados, atualizados desde a captação, pelo índice oficial da caderneta de poupança. (Origem: PRT MS/GM 1550/2014, Art. 96)
§ 1º As notificações para o recolhimento de que trata este artigo poderão ser expedidas com aviso de recebimento ou outra forma que assegure a ciência do interessado, sem prejuízo de notificação por correspondência eletrônica. (Origem: PRT MS/GM 1550/2014, Art. 96, § 1º)
§ 2º Esgotado o prazo sem o cumprimento das exigências ou solicitação de parcelamento de débito, caberá ao Ministério da Saúde providenciar a comunicação ao órgão de controle interno para instauração de Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 96, § 2º)
Art. 102. Quando a decisão for pela aprovação com ressalva em virtude de execução parcial do projeto, a decisão de que trata o art. 93 assinalará prazo de 30 (trinta) dias à instituição para recolhimento dos recursos remanescentes à Conta Única do Tesouro Nacional, incluídos os rendimentos da aplicação financeira, caso o proponente não os tenha recolhido espontaneamente na forma do art. 92, parágrafo único, VII. (Origem: PRT MS/GM 1550/2014, Art. 97)
Art. 103. A instituição poderá interpor recurso perante a SE/MS, que encaminhará à autoridade recorrida, no prazo máximo de 5 (cinco) dias, contados de seu recebimento. (Origem: PRT MS/GM 1550/2014, Art. 98)
§ 1º Se houver reformulação da decisão, será providenciada a publicação pela SE/MS de Portaria com o resultado da reanálise da prestação de contas, no prazo de 10 (dez) dias. (Origem: PRT MS/GM 1550/2014, Art. 98, § 1º)
§ 2º Se a autoridade recorrida mantiver a decisão, esta encaminhará o recurso à autoridade superior para apreciação, no prazo de 5 (cinco) dias. (Origem: PRT MS/GM 1550/2014, Art. 98, § 2º)
§ 3º Recursos intempestivos não serão conhecidos pela SE/MS. (Origem: PRT MS/GM 1550/2014, Art. 98, § 3º)
§ 4º A interposição de recurso não obsta as providências decorrentes de eventual Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 98, § 4º)
CAPÍTULO VIII
DO ATO DE INABILITAÇÃO DAS INSTITUIÇÕES PARTICIPANTES DO PRONON E DO PRONAS/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VIII)
Art. 104. Após avaliados os relatórios de execução dos projetos e em caso de execução de má qualidade ou de inexecução parcial ou completa das ações e serviços previstos no projeto, o Ministério da Saúde poderá inabilitar, por até 3 (três) anos, a instituição destinatária de recursos e participante do Pronon ou do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 99)
Parágrafo Único. O Ministério da Saúde divulgará em meio oficial as instituições consideradas inabilitadas, com o respectivo prazo de inabilitação para participar do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 99, Parágrafo Único)
Art. 105. Para fins do disposto no art. 104, são critérios para a inabilitação da instituição destinatária: (Origem: PRT MS/GM 1550/2014, Art. 100)
I - dolo ou má-fé; (Origem: PRT MS/GM 1550/2014, Art. 100, I)
II - violação da dignidade da pessoa humana; (Origem: PRT MS/GM 1550/2014, Art. 100, II)
III - prejuízo à saúde ou à vida do cidadão; (Origem: PRT MS/GM 1550/2014, Art. 100, III)
IV - descumprimento de normas éticas ou legais; (Origem: PRT MS/GM 1550/2014, Art. 100, IV)
V - descumprimento da política definida para o setor no Plano Nacional de Saúde e nas diretrizes do Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 100, V)
VI - prejuízo ao erário; (Origem: PRT MS/GM 1550/2014, Art. 100, VI)
VII - uso do projeto com intuito lucrativo; (Origem: PRT MS/GM 1550/2014, Art. 100, VII)
VIII - prejuízo das finalidades institucionais desenvolvidas pelo SUS; (Origem: PRT MS/GM 1550/2014, Art. 100, VIII)
IX - prestação de informações incompletas, distintas ou falsas em relação às solicitadas pelo Ministério da Saúde para análise e acompanhamento do projeto; e (Origem: PRT MS/GM 1550/2014, Art. 100, IX)
X - concessão a doador de vantagem de qualquer espécie ou bem em razão da doação. (Origem: PRT MS/GM 1550/2014, Art. 100, X)
Art. 106. Constatada a ocorrência de execução de má qualidade ou de inexecução parcial ou completa das ações e serviços previstos no projeto, o órgão do Ministério da Saúde responsável pelo acompanhamento do projeto notificará a instituição para que, no prazo de até 10 (dez) dias, se manifeste. (Origem: PRT MS/GM 1550/2014, Art. 101)
§ 1º Depois do recebimento das informações prestadas pela instituição: (Origem: PRT MS/GM 1550/2014, Art. 101, § 1º)
I - caso entenda que não tenha ocorrido quaisquer dos fatos suscitados, o órgão do Ministério da Saúde responsável analisará a possibilidade de concessão, mediante decisão motivada, de novo prazo, no máximo de 6 (seis) meses, para que o projeto seja devidamente executado; ou (Origem: PRT MS/GM 1550/2014, Art. 101, § 1º, I)
II - caso entenda que tenha ocorrido quaisquer dos fatos suscitados, o órgão do Ministério da Saúde responsável notificará novamente a instituição, com indicação do evento, para que, no prazo de 10 (dez) dias, apresente sua manifestação. (Origem: PRT MS/GM 1550/2014, Art. 101, § 1º, II)
§ 2º Na hipótese do inciso II do § 1º, prestadas as informações pela instituição, o órgão do Ministério da Saúde responsável decidirá, de forma motivada, pela ocorrência ou não do fato e: (Origem: PRT MS/GM 1550/2014, Art. 101, § 2º)
I - caso decida pela inocorrência do fato, aplicará o disposto no inciso I do § 1º; e (Origem: PRT MS/GM 1550/2014, Art. 101, § 2º, I)
II - caso decida pela ocorrência do fato, inabilitará a instituição destinatária, por até 3 (três) anos, observados critérios de razoabilidade e proporcionalidade e a gravidade do fato ocorrido. (Origem: PRT MS/GM 1550/2014, Art. 101, § 2º, II)
Art. 107. Caberá recurso para o Ministro de Estado da Saúde, da decisão de que trata o art. 106, § 2º , II, no prazo de 15 (quinze) dias, contado da notificação da instituição destinatária. (Origem: PRT MS/GM 1550/2014, Art. 102)
CAPÍTULO IX
DA TOMADA DE CONTAS ESPECIAL
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IX)
Art. 108. A instauração do processo de Tomada de Contas Especial se fará conforme as normas específicas em vigor, visando à apuração dos fatos, identificação dos responsáveis, quantificação do dano e obtenção do ressarcimento, sendo levada a efeito pelo órgão competente do Ministério da Saúde ou, na sua omissão, por determinação da Controladoria-Geral da União (CGU) ou do Tribunal de Contas da União (TCU). (Origem: PRT MS/GM 1550/2014, Art. 103)
Art. 109. Havendo instauração de Tomada de Contas Especial, o registro de seus atos será realizado no Sistema Integrado de Administração Financeira do Governo Federal (SIAFI), para consulta pública. (Origem: PRT MS/GM 1550/2014, Art. 104)
CAPÍTULO X
DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO X)
Art. 110. Constitui infração ao disposto na Lei nº 12.715, de 2012, no Decreto nº 7.988, de 2013, e neste Anexo o recebimento pelo doador de vantagem financeira ou bem, em razão da doação. (Origem: PRT MS/GM 1550/2014, Art. 105)
Art. 111. Em caso de má execução ou inexecução parcial ou total do projeto desenvolvido no âmbito do Pronon ou do Pronas/PCD, além do disposto no art. 106, a instituição ficará sujeita às demais responsabilizações cabíveis. (Origem: PRT MS/GM 1550/2014, Art. 106)
Art. 112. A dedução do imposto sobre a renda dos valores correspondentes às doações no âmbito do Pronon e do Pronas/PCD e a aplicação e movimentação dos recursos financeiros de que tratam os Capítulos IV e V do Decreto nº 7.988, de 2013, serão cumpridas pelas entidades observando-se, ainda, regras complementares do Ministério da Fazenda instituídas, conforme o caso, isoladamente ou em conjunto com o Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 107)
Art. 113. Aplicam-se aos procedimentos previstos neste Anexo as disposições da Lei nº 9.784, de 1999, em especial quanto aos prazos, recursos e comunicação de atos e decisões. (Origem: PRT MS/GM 1550/2014, Art. 108)
Art. 114. Ato do Ministro de Estado da Saúde disporá sobre o patrocínio com finalidade promocional no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 109)
ANEXO 1 DO ANEXO LXXXVI
REQUERIMENTO DE CREDENCIAMENTO AO PROGRAMA NACIONAL DE APOIO À ATENÇÃO ONCOLÓGICA (PRONON) (Origem: PRT MS/GM 1550/2014, Anexo 1)
| I - INFORMAÇÕES DA INSTITUIÇÃO | ||
|---|---|---|
| Razão Social: | ||
| CNPJ: | CNES: | Data de fundação da instituição: |
| Endereço: | ||
| Bairro: | Município: | UF: |
| CEP: | Fone: | FAX: |
| E-mail: | ||
| Nome do dirigente da instituição: | ||
| Procurador (se aplicável): | ||
| Qualificação da Instituição:( ) CEBAS-Saúde ( ) CEBAS-MDS ( ) CEBAS-MEC ( ) Organização Social ( ) OSCIP | ||
| II REQUERIMENTO | ||
| O representante legal da supracitada instituição vem requerer o credenciamento no Programa Nacional de Apoio à Atenção Oncológica (PRONON), como etapa prévia à apresentação de projetos, em conformidade com a Lei n° 12.715/2012 e demais legislação regulamentadora. Local e dataAssinatura do dirigente da instituição ____________________________________________ Nome do dirigente da instituição |
||
ANEXO 2 DO ANEXO LXXXVI
REQUERIMENTO DE CREDENCIAMENTO NO PROGRAMA NACIONAL DE APOIO À ATENÇÃO DA SAÚDE DA PESSOA COM DEFICIÊNCIA (PRONAS/PCD) (Origem: PRT MS/GM 1550/2014, Anexo 2)
| I - INFORMAÇÕES DA INSTITUIÇÃO | ||
|---|---|---|
| Razão Social: | ||
| Endereço: | ||
| Bairro: | Município: | UF: |
| CEP: | Fone: | FAX: |
| E-mail: | ||
| Nome do dirigente da instituição: | ||
| Procurador (se aplicável): | ||
| Qualificação da Instituição:[ ] CEBAS - Saúde [ ] CEBAS - MDS [ ] CEBAS - MEC [ ] Organização Social [ ] OSCIP[ ] Declaração de prestação de atendimento direto e gratuito e cadastro no SCNES | ||
| II - REQUERIMENTO | ||
| O representante legal da supracitada instituição vem requerer o credenciamento no Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), como etapa prévia à apresentação de projetos, em conformidade com a Lei n° 12.715/2012 e demais legislação regulamentadora. Local e dataAssinatura do dirigente da instituição ____________________________________________ Nome do dirigente da instituição |
||
ANEXO 3 DO ANEXO LXXXVI
APRESENTAÇÃO DE PROJETOS REFERENTES AO PROGRAMA NACIONAL DE APOIO À ATENÇÃO ONCOLÓGICA (PRONON) OU AO PROGRAMA NACIONAL DE APOIO À ATENÇÃO DA SAÚDE DA PESSOA COM DEFICIÊNCIA (PRONAS/PCD) (Origem: PRT MS/GM 1550/2014, Anexo 3)
A - INFORMAÇÕES DA INSTITUIÇÃO
| Programa: [ ] PRONON [ ] PRONAS/PCD | Portaria de credenciamento: n° e data | ||
| Razão Social: | |||
| CNPJ: | |||
| Endereço: | |||
| Bairro: | Município: | ||
| CEP: | Fone: | ||
| Procurador (se aplicável): | |||
B - DO PROJETO
O projeto congrega o conjunto mínimo de conceitos e instrumentos de gerenciamento, imprescindíveis para o monitoramento, avaliação e prestação de contas da execução físico-financeira.
| B.1 - INFORMAÇÕES GERAIS DO PROJETO | |
| 2.1 Título do Projeto: | |
| 2.2 Valor total do Projeto: | |
| 2.3 Prazo de execução (em meses): | |
| B.2 - DA(S) AÇÕES E SERVIÇOS DE ONCOLOGIA E REABILITAÇÃO | |
| De acordo com os artigos 5º e 9º desta Portaria, registrar o campo de atuação pretendida. Assinalar apenas uma única opção | |
| ( ) Prestação de serviços médico-assistenciais; | ( ) realização de pesquisas clínicas, epidemiológicas e experimentais. |
| ( ) Formação, treinamento e aperfeiçoamento de recursos humanos em todos os níveis; | |
| B.3 - ÁREA(S) PRIORITÁRIA(S) DO PRONON (De acordo com o artigo 6º) *Preenchimento exclusivo para projeto apresentados no âmbito do Programa Nacional de Apoio à Atenção Oncológica (PRONON). Neste item, descrever, de forma resumida, a área prioritária de que trata o projeto, considerando as opções citadas no Art. 6º. |
| B.4 - ÁREA(S) PRIORITÁRIA(S) DO PRONAS/PCD (De acordo com o artigo 10) *Preenchimento exclusivo para projeto apresentados no âmbito do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD). |
| Nesse item, descrever, de forma resumida, a área prioritária de que trata o projeto, considerando as opções citadas no Art. 10. |
| B.5 - INFORMAÇÕES ESPECÍFICAS DO PROJETO DE ASSISTÊNCIA E CAPACITAÇÃO |
| Descrição do projeto: |
a) Descrever o(s) objetivo(s) do projeto considerando as áreas prioritárias de sua aplicação; b) Apresentar a justificativa e aplicabilidade do projeto; c) Descrever os equipamentos, as ações e os serviços de saúde atualmente realizados em nível ambulatorial e hospitalar que apresentem relação com o objetivo do projeto, a fim de demonstrar as ações inovadoras a que o projeto se propõe; |
d) Descrever a estrutura física (ambientes e equipamentos) a ser utilizada e os recursos humanos a serem empregados na execução do projeto; e) Descrever a abrangência do projeto quanto a: - dimensão geográfica, com indicação de UF/município beneficiário; - população que será beneficiada com a execução do projeto; - instituições que serão beneficiadas com o projeto, quando houver, com indicação do número do CNES e/ou CNPJ. |
f) Descrever o número de vagas ofertadas, quando aplicável; g) Descrever os resultados esperados, decorrentes da execução do projeto, suas metas a serem atingidas e respectivos indicadores (conforme quadro abaixo); Resultado* Indicador** Meta*** |
* Os resultados devem apresentar coerência com o objetivo do projeto. ** Definir as variáveis que serão utilizadas para construção do indicador e apresentar método de cálculo. *** As metas devem ser quantitativas e devem considerar um prazo determinado. h) Apresentar o plano de atividades para execução do projeto (conforme quadro abaixo); |
ATIVIDADE DATA DE INÍCIO DATA DO FIM VALOR ESTIMADO (R$) - quando aplicável |
i) Descrever as atividades de monitoramento da execução do projeto; j) Quando aplicável, descrever formas de disseminação dos resultados do projeto, tais como: eventos científicos, oficinas, material de divulgação/publicação, entre outras formas; l) No caso do projeto envolver reforma, deverão ser atendidos os requisitos previstos nesta Portaria; m) Demais informações relevantes em conformidade com as especificidades da área de atuação e do projeto. |
| B.6 - INFORMAÇÕES ESPECÍFICAS DO PROJETO DE PESQUISA |
| Descrição do projeto: |
a) Informações gerais do projeto: a.1) Título do projeto; a.2) Pesquisador principal, com a identificação do nome, telefone e e-mail; a.3) Valor total do projeto; |
a.4) Período de execução. b)Informações específicas do projeto. b.1) Submeter protocolo de pesquisa com: i - Introdução: apresentar conceitos, antecedentes científicos que justifiquem a pesquisa. Relatar o estado atual do conhecimento sobre o assunto, por meio de uma revisão bibliográfica. Deve-se finalizar com a |
proposição do problema a ser estudado, evidenciado pela revisão apresentada. Recomenda-se a utilização de referências com forte poder de evidência científica; ii - Justificativa: explicar a relevância no desenvolvimento do estudo proposto, comentando repercussão científica, médica e/ou social dos resultados, além da sua viabilidade; iii - Hipótese: são possíveis respostas ao problema da pesquisa e orientam a busca de novas informações; iv - Objetivo Geral: define, esclarece e revela o foco de interesse da pesquisa; |
v - Objetivos Específicos: definem os diferentes pontos a serem abordados, visando verificar as hipóteses e concretizar o objetivo geral; vi - Procedimentos Metodológicos: conjunto de métodos e técnicas utilizadas para a realização de uma pesquisa. Deve incluir: - Desenho do estudo: tipo do estudo a ser realizado, como observacional, experimental, exploratório, descritivo, analítico, longitudinais, transversais, pesquisa básica, ensaios clínicos, epidemiológicos, revisão sistemática, estudo de campo e outros. |
- Participantes de pesquisa e tamanho amostral: critérios de inclusão e exclusão, informações necessárias ao cálculo do tamanho amostral, o valor obtido e as referências bibliográficas utilizadas. - Descrição do local do estudo. - Planejamento do estudo: descrever a sequência lógica de execução, técnicas utilizadas, testes e exames, quando couber. - Materiais e equipamentos: descrever a infraestrutura disponível e o aparato experimental necessário para a realização do estudo |
- Análise dos dados: descrever métodos, técnicas, testes estatísticos e/ou programas computacionais utilizados para trabalhar os dados obtidos. vii - Resultados esperados: descrever detalhadamente o que se almeja com o estudo, em consonância com as hipóteses previamente estabelecidas; viii - Aspectos éticos: descrever quais serão os procedimentos éticos adotados, em conformidade com as diretrizes e regulamentações vigentes; ix - Cronograma de atividades: planejar o estudo em meses, sendo recomendada a utilização do modelo de Gráfico Gantt; e |
x - Referências: indicar, segundo normas da ABNT, lista das publicações e documentos consultados e citados ao longo do texto. c) Descrever os resultados anuais esperados, decorrentes da execução do projeto, seus indicadores e respectivas metas a serem atingidas; d) Descrever os produtos gerados com a execução do projeto, seus indicadores e metas; e) Descrever as atividades de monitoramento e de avaliação e seus respectivos valores; |
f) Descrever a abrangência do projeto quanto a: i - população e/ou instituição beneficiada, seja diretamente - que receberá a intervenção do projeto - seja indiretamente - que poderá se beneficiar dos resultados do projeto, com indicação de n° CNES; ii - dimensão geográfica, com indicação de UF/município beneficiário; e iii - número de vagas ofertadas, quando aplicável. |
g) Quando aplicável, descrever formas de disseminação dos resultados do projeto, tais como: eventos científicos, oficinas, material de divulgação/publicação, dentre outras formas; h) Apresentar Organograma e Quadro de Atribuições, bem como currículo Lattes, para os principais atores envolvidos no projeto, incluindo a equipe executora e ressaltando a formação e experiências relevantes ao projeto; i) Apresentar o Plano de Atividades do Projeto com as seguintes especificações: i - descrição da atividade; ii - definição da data de início e fim de cada atividade; iii - descrição do indicador da atividade; iv - unidade de medida; v - metas quantitativas; e vi - valor estimado de cada atividade (anexar memória de cálculo) e total. j) Demais informações relevantes em conformidade com as especificidades da área de atuação e do projeto |
ANEXO 4 DO ANEXO LXXXVI
MODELO DE DECLARAÇÃO DE RESPONSABILIDADE (Origem: PRT MS/GM 1550/2014, Anexo 4)
| ATESTADO DE RESPONSABILIDADE TÉCNICA |
| Eu, NOME DO REPRESENTANTE LEGAL DA INSTITUIÇÃO CREDENCIADA, CPF Nº XXXX, sob Portaria nº xxxxx ATESTO, para fins de apresentação de projetos no âmbito do PRONON OU PRONAS/PCD do Ministério da Saúde, que o(a) INSTITUIÇÃO CREDENCIADA, inscrito(a) no CNPJ sob o nº XXXXX, situado(a) à ENDEREÇO COMPLETO com CEP, apresenta capacidade técnica e operacional para o desenvolvimento do Projeto "TÍTULO DO PROJETO", em atendimento ao disposto no Art. XX, da Portaria GM/MS nº XXX de XX de XXX de 2014, considerando as experiências na execução de projeto(s)/ação(es) na(s) área(s) XXXXXX, conforme DOCUMENTO ANEXO. |
ANEXO 5 DO ANEXO LXXXVI
MODELO DE DECLARAÇÃO DE CAPACIDADE TÉCNICO-OPERATIVA (Origem: PRT MS/GM 1550/2014, Anexo 5)
| DECLARAÇÃO DE CAPACIDADE OPERACIONAL |
| Declaramos, para os devidos fins que a instituição XXXXX, credenciada pela Portaria XXX de xx de xxxxx de 201x, inscrita no CNPJ sob o Nº XXXXXXXX estabelecida no [endereço da instituição XXXXXXX], possui capacidade técnica e operacional necessárias para a realização do projeto intitulado "XXXXXXXXXX" apresentado para execução no âmbito do PRONON ou PRONAS/PCD. |
| Local e Data. |
| [Nome do Representante Legal]Instituição XXXXX |
| * Enviar em papel timbrado da instituição |
ANEXO 6 DO ANEXO LXXXVI
MODELO DE ORÇAMENTO (Origem: PRT MS/GM 1550/2014, Anexo 6)
| DEMONSTRATIVO DA PROJEÇÃO DAS DESPESAS - PRONON OU PRONAS/PCD VALOR DO PROJETO: R$ XXX | |||
| CUSTOS DIRETOS DO PROJETO | |||
| NATUREZA | DESCRIÇÃO | PREVISÃO DE DESPESAS (R$) | % SOBRE O VALOR TOTAL DO PROJETO |
| CUSTEIO | Diárias | ||
| Passagens | |||
| Serviço de terceiros - Pessoa Física- serviço de captação de recursos- serviço de elaboração de projeto | |||
| Serviço de terceiros - Pessoa Jurídica- serviço de captação de recursos- serviço de elaboração de projeto | |||
| Material de Consumo | |||
| Consultoria | |||
| Coordenação | |||
| Outros (especificar) | |||
| CUSTOS INDIRETOS DO PROJETO | |||
| CAPITAL | Imobilizado Tangível | ||
| Obras (reformas) e Instalações | |||
| Equipamentos e Material Permanente | |||
| Equipamentos de Informática | |||
| Outros (especificar) | |||
| Imobilizado - Intangível (especificar) | |||
| TOTAL | |||
ANEXO 7 DO ANEXO LXXXVI
FORMULÁRIO DE INFORMAÇÕES COMPLEMENTARES PARA PROPOSTAS QUE PREVEEM A AQUISIÇÃO DE EQUIPAMENTOS E MATERIAIS PERMANENTES NO ÂMBITO DO PRONON E DO PRONAS/PCD (Origem: PRT MS/GM 1550/2014, Anexo 7)
FORMULÁRIO DE INFORMAÇÕES COMPLEMENTARES PARA PROPOSTAS QUE PREVEEM A AQUISIÇÃO DE EQUIPAMENTOS E MATERIAIS PERMANENTES NO ÂMBITO DO PRONON E DO PRONAS/PCD
| 1.Dados Institucionais | |
| Razão Social: | |
| Projeto:( ) PRONON( ) PRONAS/PCD | Nº DO SIPAR do Projeto: |
| 2.Responsável pela instituição | |
| Nome: | |
| Cargo: | Telefone: |
| E-mail para contato: | |
| 3.Infraestrutura | |
| 3.1 Os ambientes possuem áreas físicas adequadas em conformidade com a regulação do Ministério da Saúde, para a instalação e uso dos equipamentos e materiais permanentes solicitados? ( ) Sim ( ) Não, mas a reforma necessária está contemplada neste projeto ( ) Não possui área física |
|
| 3.2 Existem meios de acesso (pontos de desembarque, rampas, portas de acesso, corredores, etc.) para permitir a entrada e a instalação dos equipamentos de grande porte/volume? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.3 O estabelecimento possui Sistema de Aterramento de acordo com as normas vigentes (NBRs) aplicáveis? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.4 O estabelecimento possui Sistema de Proteção contra Descargas Atmosféricas (Pára-raios), de acordo com as normas vigentes (NBRs) aplicáveis? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.5 O estabelecimento possui Sistema de estabilização eletrônico de tensão? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.6 O estabelecimento possui gerador de energia elétrica? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.7 Os ambientes onde os equipamentos que possuem necessidade de climatização, possuem esse sistema? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.8 No caso de pleito de equipamentos que emitem radiações ionizantes, o estabelecimento possui estrutura de radioproteção de acordo com as normas vigentes aplicáveis? ( ) Sim ( ) Não ( ) Não se aplica a este projeto |
|
| 3.9 O estabelecimento dispõe de recursos humanos capacitados para a gerência e manutenção dos equipamentos e materiais permanentes dos equipamentos pleiteados? ( ) Sim, para gerência e manutenção ( ) Sim, para gerência, a manutenção é terceirizada ( ) Não, o serviço é terceirizado (gerência e manutenção) |
||||||
| ( ) Não se aplica | ||||||
| 3.10 Para os equipamentos de maior complexidade, estão sendo previstos contratos de manutenção externa? ( ) Sim ( ) Não ( ) Não se aplica |
||||||
| 3.11 Caso tenha respondido SIM a questão anterior, detalhe o tipo de contrato: ( ) Manutenção preventiva + Manutenção corretiva (somente mão-de-obra) ( ) Manutenção preventiva + Manutenção corretiva + Peças ( ) Manutenção preventiva + Manutenção corretiva + Peças + Acessórios |
||||||
| ( ) Não sei responder | ||||||
| 3.12 O estabelecimento dispõe de profissionais capacitados e habilitados para a operação do(s) equipamento(s) solicitado(s)? ( ) Sim ( ) Não, devendo capacitar profissionais disponíveis no estabelecimento, antes da aquisição ( ) Não, sem previsão de dispor de um programa de contratação |
||||||
| 4. Resíduos Sólidos de Serviços de Saúde (RSS) | ||||||
| 4.1 O estabelecimento possui um Plano de Gerenciamento de Resíduos Sólidos, conforme normas vigentes aplicáveis? ( ) Sim ( ) Em desenvolvimento ( ) Em fase de implantação |
||||||
| ( ) Não possui | ||||||
| 5. Resíduos Sólidos de Serviços de Saúde (RSS) | ||||||
| Item | Identificação do equipamento | Especificação técnica do equipamento | Quant. | Modalidade | Valorunitário (R$) | Valor total (R$) |
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
ANEXO 8 DO ANEXO LXXXVI
MODELO DE TERMO DE DOAÇÃO (Origem: PRT MS/GM 1550/2014, Anexo 8)
TERMO DE DOAÇÃO QUE ENTRE SI CELEBRAM A "INSTITUIÇÃO BENEFICIÁRIA XXXXX" E "INSTITUIÇÃO DONATÁRIA XXXXX"
Pelo presente instrumento, a Entidade de Saúde (sede e/ou filial) <NOME>, por intermédio da <Gerência/Superintendência/presidência> com sede xxxxxxxxxxxx, inscrita no CNPJ sob nº xx.xxx.xxx/xxx-xx, ora designado DOADOR, neste ato representado na forma do seu Estatuto por <nome.>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº <xxx.xxx.xxx-xx> e RG nº <xxxxxxx>, expedido pela xxx/xx, e de outro lado, a entidade beneficiada, <NOME>, inscrita no CNPJ/MF xxxxxxxxxx, com sede xxxxxxx, doravante denominado DONATÁRIO, neste ato representada por <nome>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº xxxxxxxxx e RG nº xxxxxxx, expedido pela xxx/xx, e de acordo com os autos do Processo nº <25000.xxxxxx/20xx-xx>,com fundamento na Lei nº 12.715, de 17 de setembro de 2012, no Decreto nº 7.988, de 17 de abril de 201, na nova Portaria GM/MS nº xxxxxx/2013, têm entre si celebrar o presente TERMO DE DOAÇÃO, sob a forma e condições constantes das seguintes CLÁUSULAS:
CLÁUSULA PRIMEIRA - DO OBJETO
O presente instrumento tem por objeto a Doação dos bens móveis e imóveis, relacionados no anexo deste Termo, tendo por finalidade a utilização pelo DONATÁRIO, na continuidade das ações e serviços de assistência à saúde da população, visando a melhoria da produção e qualidade dos procedimentos da atenção oncológica e/ou da atenção da saúde da pessoa com deficiência, assim como o aperfeiçoamento e expansão da capacidade operacional do Sistema Único de Saúde.
CLÁUSULA SEGUNDA - DAS OBRIGAÇÕES
O DONATÁRIO compromete-se a destinar os bens, objeto deste instrumento à execução de ações de saúde, conforme o disposto no art . Xxxx da nova Portaria nº xxxxxx/GM/MS de 2013.
PARÁGRAFO PRIMEIRO - O DONATÁRIO, em observância à cláusula Primeira e Segunda do presente termo, responsabiliza-se por:
a) manter em funcionamento e assumir custo operacional de acordo com parâmetros firmados pelo Ministério da Saúde;
b) adquirir equipamentos complementares, materiais permanentes e de consumo, necessários à implantação e operacionalização dos serviços objeto deste Termo;
c) efetuar manutenção preventiva e corretiva, após o término da garantia do equipamento doado;
d) manter atualizado os dados da Instituição prestadora de serviço ao SUS no Cadastro Nacional de Entidade de Saúde (CNES); e
e) é de responsabilidade do DONATÁRIO, prover treinamento aos seus colaboradores para utilização correta do(s) equipamento(s) doado(s), bem como a obtenção de todas as licenças necessárias para operação dos bens.
Parágrafo único. O anexo é parte integrante e indissociável deste Termo.
CLÁUSULA TERCEIRA - DAS DESPESAS
Os custos com remoção e instalação do equipamento e/ou material permanente serão arcados pela donatária.
CLÁUSULA QUARTA- DO RECEBIMENTO
O DONATÁRIO, por intermédio deste instrumento, atesta, plena e irrestritamente, o recebimento de todos os bens arrolados no anexo deste Termo.
CLÁUSULA QUINTA - DAS SANÇÕES ADMINISTRATIVAS
Em caso de constatação, pelo Ministério da Saúde ou pelos órgãos de controle externo, quanto a não utilização do bem doado para os fins e forma a que se propõe a presente DOAÇÃO, poderá ser promovida à revogação deste Termo, com comunicação prévia ao Ministério da Saúde, sem direito de indenização ao DONATÁRIO.
CLÁUSULA SEXTA - DA PUBLICAÇÃO
Incumbirá à entidade beneficiária providenciar a publicação do extrato deste Termo na Imprensa Oficial, até o quinto dia útil d o mês seguinte ao de sua assinatura, para ocorrer no prazo de 20 (vinte) dias daquela data.
CLÁUSULA SÉTIMA - DO FORO
Fica eleito o Foro da Seção Judiciária XXXX, com exclusão de qualquer outro, por mais privilegiado que seja para dirimir quaisquer dúvidas oriundas do presente Termo de Doação.
E, por estarem de pleno acordo, as partes assinam este Termo em três vias de igual teor e forma, que depois de lido e achado conforme para um só efeito, é assinado pelos partícipes na presença de 2 (duas) testemunhas, igualmente signatárias.
Local e data.
Pelo Doador Pelo Donatário
Nome: Nome:
Cargo : Cargo :
TESTEMUNHAS
Nome: Nome:
CPF: CPF:
ANEXO AO TERMO DE DOAÇÃO
| Programa Nacional de Apoio à Atenção Oncológica (PRONON) Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD) |
| Projeto: |
| Nº do Processo Ministério da Saúde: |
Dados do Doador:
| Entidade: | |||
| Nome do Representante: | |||
| Cargo: | |||
| RG: | CPF: | ||
| Endereço: | |||
| CEP: | Cidade/UF: | Telefone: | Fax: |
Dados do Donatário:
| Entidade: | |||
| Nome do Representante: | |||
| Cargo: | |||
| RG: | CPF: | ||
| Endereço: | |||
| CEP: | Cidade/UF: | Telefone: | Fax: |
| Descrição | Preço Unitário (R$) | Qtde | Preço Total (R$) |
ANEXO 9 DO ANEXO LXXXVI
MODELO DE PARECER TÉCNICO CONCLUSIVO (Origem: PRT MS/GM 1550/2014, Anexo 9)
MODELO DE PARECER TÉCNICO CONCLUSIVO
| PARECER TÉCNICO n° | Data: |
| SIPAR | [ ] PRONON [ ] PRONAS/PCD |
| Nome do projeto: | |
| Área de atuação: | |
| Razão social: | |
| CNPJ: | |
| Valor aprovado: R$ | |
| Prazo de execução aprovado: | |
| I - DO RESUMO DO PROJETO:a) descrever o objeto; eb) descrever o objetivo | |
| II - DA ANÁLISE TÉCNICA:a) descrever a relevância do projeto, a sua adequação às ações prioritárias definidas pelo Ministério da Saúde e o seu potencial de contribuição para melhoria da execução, gestão e qualificação das ações e serviços de atenção oncológica ou de reabilitação.b) verificar o completo e correto preenchimento do requerimento de apresentação de projeto do ANEXO III; | |
| c) analisar quanto ao enquadramento do projeto à Lei nº 12.715/2012, e às demais normativas do PRONON e do PRONAS/PCD;d) verificar a adequação do projeto e da instituição aos mecanismos dos programas;e) verificar as planilhas orçamentárias e os documentos técnicos exigidos da instituição; ef) verificar a duplicidade da proposta apresentada a qualquer modalidade de financiamento no âmbito do PRONON e do PRONAS/PCD | |
| g) aferir a capacidade técnica-operacional para execução do projeto apresentado;h) verificar a adequação entre o objeto a ser executado e os produtos resultantes, mediante indicadores para avaliação final do projeto;i) verificar a adequação das estratégias de ação aos objetivos, assinalando-se, claramente, no parecer, se as etapas previstas são necessárias ou suficientes à sua realização e se são compatíveis com os prazos e custos previstos; | |
| j) verificar o enquadramento do projeto nos campos de atuação estabelecidos no art. 6 e no 10;k) destacar a repercussão local, regional, nacional e internacional do projeto, conforme o caso;l) indicar os impactos e desdobramentos positivos ou negativos do projeto, no âmbito social ou outro considerado relevante;m) ressaltar a contribuição para o desenvolvimento da área ou segmento em que se insere o projeto analisado; | |
| n) verificar a compatibilidade dos custos previstos com os preços praticados no mercado regional da produção, destacando-os; eo) verificar o atendimento aos critérios e limites de custos estabelecidos pelo Ministério da Saúde. | |
| III - DA CONCLUSÃO: | |
| [ ] Aprovado [ ] Reprovado [ ] Em Diligência | |
| Assinaturas | |
ASPECTO PARA AVALIAÇÃO DO PROJETO
| Aspectos a serem observados para avaliação do mérito | Nota Máxima | Peso |
Tempo de experiência da instituição, em relação à área a que se refere a proposta |
10 | 1 |
Experiência em relação ao tema dos responsáveis pelo projeto |
10 | 2 |
Descrição dos objetivos clara e articulada com as ações previstas e as propostas do projeto |
10 | 2 |
Qualidade da metodologia para o alcance dos objetivos |
10 | 2 |
Metodologia e conteúdo com abordagem multiprofissional |
10 | 2 |
Viabilidade do projeto em relação ao cronograma de execução |
10 | 3 |
Metas e indicadores de monitoramento e avaliação das ações coerentes com as propostas no projeto |
10 | 2 |
Abrangência do projeto em regiões que apresentem vazios assistenciais |
10 | 4 |
ANEXO 10 DO ANEXO LXXXVI
MODELOS DE RECIBO (Origem: PRT MS/GM 1550/2014, Anexo 10)
MODELOS DE RECIBO
| MODELO DE RECIBO I Transferência de Quantias em Dinheiro |
|||||
|---|---|---|---|---|---|
| LOGO DA INSTITUIÇÃO |
|
||||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: |
NÚMERO DE ORDEM: |
|||
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||||
| DADOS DA PARTICIPAÇÃO | |||||
| 01. TIPO DA OPERAÇÃO: Transferência de Quantias em Dinheiro | |||||
| 02. VALOR DA DOAÇÃO: R$____________________Por extenso:____________________________________________________________ | |||||
| 03.BANCO: | 04. N° DA AGÊNCIA: | 05. N.º CONTA CORRENTE | 06. DATA DO RECEBIMENTO DA DOAÇÃO | ||
| DADOS DO DOADOR | |||||
| 7. NOME: | |||||
| 8. CNPJ/CPF: | 9. ENDEREÇO: |
||||
| 10. CIDADE: | 11. UF: |
12. CEP: |
13. TELEFONE: |
||
| 14. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica): | |||||
| DADOS DO PROJETO | |||||
| 15. [ ] PRONON 16. [ ] PRONAS/PCD | |||||
| 17. TÍTULO DO PROJETO: | |||||
| 18. Nº SIPAR DO PROJETO: | |||||
| 19. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||||
| 20. INSTITUIÇÃO PROPONENTE: | 21. CNPJ |
||||
| 22. ENDEREÇO: | 23. TELEFONE: |
||||
| 24. CIDADE: | 25. UF: |
26. CEP: |
|||
| DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO | |||||
| 27. NOME: | |||||
| 28. CPF: | 29. CARGO: |
30. TELEFONE: |
|||
| 31. LOCAL/DATA: | 32. ASSINATURA E CARIMBO |
||||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |||
| MODELO DE RECIBO II Transferência de Bens Movéis e Imóveis |
|||
|---|---|---|---|
| LOGO DA INSTITUIÇÃO | |||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: | NÚMERO DE ORDEM: | |
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||
| DADOS DA PARTICIPAÇÃO | |||
| 01. TIPO DA OPERAÇÃO: Transferência de Bens: (__) Movéis(__) Imóveis | |||
| 02. VALOR DA DOAÇÃO: Bens Móveis R$____________________ Por extenso:______________________ Bens Imóveis R$____________________ Por extenso:_______________________ |
|||
| 03. Documentação comprobatória - Bem Móveis (vide Anexo I) 04. Documentação comprobatória - Bens Imóveis (vide Anexo II) |
|||
| DADOS DO DOADOR | |||
|---|---|---|---|
| 5. NOME: | |||
| 6. CNPJ/CPF: | 7. ENDEREÇO: | ||
| 8. CIDADE: | 9. UF: | 10. CEP: | 11. TELEFONE: |
| 12. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica) | |||
| DADOS DO PROJETO | |||
|---|---|---|---|
| 13. [ ] PRONON 14. [ ] PRONAS/PCD | |||
| 15. TÍTULO DO PROJETO: | |||
| 16. Nº SIPAR DO PROJETO: | |||
| 17. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||
| 18. INSTITUIÇÃO PROPONENTE | 19. CNPJ: | ||
| 20. ENDEREÇO: | 21. TELEFONE: | ||
| 22. CIDADE: | 23. UF: | 24. CEP: | |
| DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO | |||||
|---|---|---|---|---|---|
| 25. NOME: | |||||
| 26. CPF: | 27. CARGO: | 28. TELEFONE: | |||
| 29. LOCAL/DATA | 30. ASSINATURA E CARIMBO | ||||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |||
(Anexo A) |
|||||
| Guia de Transferência de Bens Móveis | |||||
| Descrição do Bem | Especificação (nome e características) | Quantidade | Valor (R$) | Estado e Conservação Avaliação do bem | |
| (_)sim (anexar Laudo de Avaliação) (_)não |
|||||
| - Laudo de Avaliação deve conter: Nome do(s) avaliador(es) CPF: CNPJ: | |||||
| Endereço do(s) avaliador(es) - Última Declaração do IR | |||||
| (Anexo B) Documentação comprobatória - Bens Imóveis - Documentação de Transferência de Bem Imóveis, registrado em cartório - Certidão de feitos ajuizados, comprovando a existência ou não de ações contra o imóvel. - Registro e Escritura do Imóvel - Regularidade dos impostos/despesas do Imóvel |
|||||
| MODELO DE RECIBO III Comodato ou cessão de uso de bens imóveis ou equipamentos |
|||
|---|---|---|---|
| LOGO DA INSTITUIÇÃO | |||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: | NÚMERO DE ORDEM: | |
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||
| DADOS DA PARTICIPAÇÃO |
|---|
| 03. TIPO DA OPERAÇÃO: (__) Comodato de Equipamentos (__) Cessão de Uso de Bens Imóveis |
| 04. VALOR DA DOAÇÃO: R$____________________ Comodato de Equipamentos R$____________________ Por extenso:________________________________________________ Cessão de Uso de Bens Imóveis R$___________________ Por extenso:__________________________________ |
| 03. Documentação comprobatória - Comodato de Equipamentos (vide Anexo I) 04. Documentação comprobatória - Cessão de Uso de Bens Imóveis (vide Anexo II) |
| DADOS DO DOADOR | |||
|---|---|---|---|
| 5. NOME: | |||
| 6. CNPJ/CPF: | 7. ENDEREÇO: | ||
| 8. CIDADE: | 9. UF: | 10. CEP: | 11. TELEFONE: |
| 12. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica): | |||
| DADOS DO PROJETO | |||
|---|---|---|---|
| 13. [ ] PRONON 14. [ ] PRONAS/PCD | |||
| 15. TÍTULO DO PROJETO: | |||
| 16. Nº SIPAR DO PROJETO: | |||
| 17. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||
| 18. INSTITUIÇÃO PROPONENTE: | 19. CNPJ | ||
| 20. ENDEREÇO: | 21. TELEFONE: | ||
| 22. CIDADE: | 23. UF: | 24. CEP: | |
| DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO | |||
| 25. NOME: | |||
| 26. CPF: | 27. CARGO: | 28. TELEFONE: | |
| 29. LOCAL/DATA | 30. ASSINATURA E CARIMBO | ||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |
(Anexo A) Comodato de equipamentos (Anexo B) |
|||
| - Contrato de Cessão de Uso de Bens Imóveis - especificar a garantia dos equipamentos, observando a vigência do projeto. - Documentos que comprovam o atendimento às normas sanitárias. |
| MODELO DE RECIBO IV Fornecimento de material de consumo, hospitalar ou clínico, de medicamentos ou de produtos de alimentação |
|||
|---|---|---|---|
| LOGO DA INSTITUIÇÃO | |||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: | NÚMERO DE ORDEM: | |
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||
DADOS DA PARTICIPAÇÃO
| 05. TIPO DA OPERAÇÃO: (__) fornecimento de material de consumo hospitalar; (__) fornecimento de material de consumo cliníco; (__) fornecimento de medicamentos; e
|
| 06. VALOR DA DOAÇÃO:- fornecimento de material de consumo hospitalar R$____________________ Por extenso:_____________ - fornecimento de material de consumo clínico R$____________________ Por extenso:____________________________________________________ - fornecimento de medicamentos R$____________________ Por extenso:______________ - fornecimento de produtos de alimentação R$____________________ Por extenso: |
03. Documentação comprobatória para o tipo de operação vide Anexos |
DADOS DO DOADOR
| 4. NOME: | |||
| 5. CNPJ/CPF: | 6. ENDEREÇO: | ||
| 7. CIDADE: | 8. UF: | 9. CEP: | 10. TELEFONE: |
| 11. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica): | |||
DADOS DO PROJETO
| 12. [ ] PRONON 13. [ ] PRONAS/PCD | |||
| 14. TÍTULO DO PROJETO: | |||
| 15. Nº SIPAR DO PROJETO: | |||
| 16. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||
| 17. INSTITUIÇÃO PROPONENTE: | 18. CNPJ: | ||
| 19. ENDEREÇO: | 20. TELEFONE: | ||
| 21. CIDADE: | 22. UF: | 23. CEP: | |
DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO
| 24. NOME: | |||
| 25. CPF: | 26. CARGO: | 27. TELEFONE: | |
| 28. LOCAL/DATA | 29. ASSINATURA E CARIMBO | ||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |
| (Anexo A) Fornecimento de material de consumo hospitalar ou clínico/ Medicamentos/Produtos de alimentação |
|||
| - Contrato de Fornecimento - Ordem de Fornecimento – Nota Fiscal/Fatura |
|||
| Material de consumo hospitalar ou clínico | ||||
| Item | Especificação sucinta | Quantidade | Preço Unitário (em R$) | Preço Total (em R$) |
ANEXO LXXXVII
CRITÉRIOS E INDICAÇÕES PARA AUTOMONITORAMENTO DA GLICEMIA CAPILAR (Origem: PRT MS/GM 2583/2007, Anexo 1)
ANEXO
1. INTRODUÇÃO
O diabetes mellitus é uma doença crônica, caracterizada pelo comprometimento do metabolismo da glicose, cujo controle glicêmico inadequado resulta no aparecimento das graves complicações que reduzem a expectativa de vida e comprometem a qualidade de vida do portador desta doença.
As intervenções terapêuticas do diabetes visam ao rigoroso controle da glicemia e de outras condições clínicas no sentido de prevenir ou retardar a progressão da doença para as complicações crônicas micro e macrovasculares, assim como evitar complicações agudas, em especial a cetoacidose e o estado hiperglicêmico hiperosmolar. Essas intervenções objetivam minimizar os efeitos adversos do tratamento, garantir adesão do paciente às medidas terapêuticas e garantir o bem estar do paciente e de sua família.
Um programa de cuidado integral ao diabetes mellitus deve ter como prioridades estratégicas: a prevenção primária da doença com ações sobre os fatores de risco, a detecção precoce, o tratamento adequado que permita modificar a evolução da doença, previna as complicações e melhore a qualidade de vida dos portadores.
Essas estratégias devem ser coordenadas e integradas, levando em conta tanto ações de base populacional como aquelas sobre os grupos de risco e as de características individuais; devem ser custo-efetivas e fundamentadas em evidências científicas.
A organização do cuidado integral deve estar centrada na pessoa que vive com diabetes, em sua família e incluir a comunidade; deve ser planejada levando em conta os diversos aspectos do cuidado, as circunstâncias e os recursos locais.
A abordagem terapêutica deve ser multiprofissional, incluindo a assistência farmacêutica, o monitoramento da glicemia e outros parâmetros clínicos, planejamento da atividade física e orientação dietética. A participação do paciente e seu envolvimento constante e harmonioso com a equipe de saúde é fundamental para que as recomendações sejam seguidas e o tratamento, efetivo.
As duas abordagens fundamentais para avaliar o controle glicêmico são: a medida da Hemoglobina Glicada (A1c) e o automonitoramento da glicemia capilar (AMGC); ambas fornecem informações fundamentais e complementares para um tratamento adequado.
2. AUTOMONITORAMENTO DA GLICEMIA CAPILAR
O automonitoramento do nível de glicose do sangue por intermédio da medida da glicemia capilar é considerado uma ferramenta importante para seu controle, sendo parte integrante do autocuidado das pessoas com diabetes mellitus insulino-dependentes, aí compreendidos os portadores de diabetes mellitus tipo 1 (DM1), diabetes mellitus tipo 2 (DM2) que usam insulina e diabetes gestacional (DG).
2.1. Critérios para inclusão dos pacientes:
-o automonitoramento da glicemia capilar não deve ser considerado como uma intervenção isolada;
-sua necessidade e finalidade devem ser avaliadas pela equipe de saúde de acordo com o plano terapêutico global, que inclui intervenções de mudança de estilo de vida e medicamentos;
-deve estar integrado ao processo terapêutico e, sobretudo, ao desenvolvimento da autonomia do portador para o autocuidado por intermédio da Educação em Saúde;
-a indicação deve ser reavaliada e regulada a depender dos diversos estágios da evolução da doença, acordado com o paciente que deve ser capacitado a interpretar os resultados do AMGC e fazer as mudanças apropriadas nas dosagens da insulina;
-o AMGC deve ser oferecido de forma continuada para os pacientes selecionados de acordo com circunstâncias pessoais e quadro clínico e esses devem receber suporte continuado da equipe para garantir a eficácia do processo; a instrução inicial e a reinstrução periódica a respeito da monitorização da glicemia;
-o uso de medidores (glicosímetros) e de tiras reagentes deve ser individualizado e atender às necessidades do paciente; e
-a amostra do sangue deve ser colhida na ponta dos dedos da mão, acessado com picada de lancetas, daí ser também chamada de glicemia em "ponta do dedo".
2.2. Indicações do automonitoramento
O AMGC deve ser incentivado nos pacientes que usam insulina associado às estratégias de Educação em Saúde que visem aumentar a autonomia do portador para o autocuidado e essas ações devem ser incorporadas na rotina das unidades de saúde.
Não existem evidências científicas suficientes que o automonitoramento rotineiro da glicemia capilar nos pacientes diabéticos tipo 2 em terapia com hipoglicemiantes orais seja custo-efetivo para o melhor controle da glicemia. Nesses casos, a glicemia capilar pode ser realizada na própria unidade de saúde por ocasião das visitas regulares de avaliação definidas pela equipe conforme protocolo instituído.
A freqüência do AMGC deve ser determinada individualmente, dependente da situação clínica, do plano terapêutico, do esquema de utilização da insulina, do grau de informação e compromisso do paciente para o autocuidado e da sua capacidade de modificar sua medicação a partir das informações obtidas.
A freqüência diária recomendada em média deve ser três a quatro vezes ao dia.
Os portadores de diabetes tipo 1 e os que usam múltiplas injeções diárias de insulina podem fazer a glicemia de "ponta de dedo" 3 a 4 vezes ao dia e em horários de ocorrência de maior descontrole glicêmico permitindo ajustes individualizados da insulina; essas medidas incluem uma antes (pré-prandial) e 2 horas após as refeições (pós-prandial) e ao deitar. O teste à noite é importante para a prevenção de hipoglicemias noturnas.
Para os que usam insulina e agentes hipoglicemiantes orais e praticam exercício, o AMGC antes, durante e, especialmente, horas após o exercício pode contribuir para estabelecer o nível de resposta à atividade física. Essa informação pode ser usada para fazer ajustes nas doses e/ou na ingestão de carboidratos e evitar alterações glicêmicas significativas, sobretudo a hipoglicemia.
2.3. Avaliação e controle
A reavaliação das habilidades para o autocuidado, para o uso adequado das informações colhidas com o teste e da exatidão e precisão dos resultados oferecidos pelos glicosímetros devem ser feitas pelo menos anualmente ou quando houver discordância entre o controle glicêmico e/ou quadro clínico e as leituras obtidas. Para isso, os resultados do teste com o glicosímetro devem ser comparados com os da glicemia em jejum de laboratório medido simultaneamente.
O paciente deve fazer o registro dos resultados das glicemias capilares na freqüência estabelecida pela equipe e este deve estar disponível quando dos retornos agendados e registrados nos prontuários.
Outro fator a ser reavaliado é a freqüência e a constância da realização da glicemia capilar em "ponta do dedo"; essas são influenciadas pelo desconforto causado pelo alto número de terminações nervosas presentes neste local o que pode afetar a adesão do paciente. Alguns trabalhos recentes apresentam sítios alternativos para glicemia capilar, porém são pouco utilizados.
ANEXO LXXXVIII
TERMO DE COMPROMISSO ENTRE O MINISTÉRIO DA SAÚDE E O ESTADO PARA ADESÃO AO PROGRAMA DE VALORIZAÇÃO DO PROFISSIONAL DA ATENÇÃO BÁSICA (Origem: PRT MS/GM 568/2013, Anexo 2)
TERMO DE COMPROMISSO ENTRE O MINISTÉRIO DA SAÚDE E O ESTADO __________________, PARA ADESÃO AO PROGRAMA DE VALORIZAÇÃO DO PROFISSIONAL DA ATENÇÃO BÁSICA (PROVAB).
O Ministério da Saúde, CNPJ nº 00.394.544/0002-66, doravante denominado simplesmente MS, neste ato representado pelo Ministro de Estado da Saúde, ALEXANDRE ROCHA SANTOS PADILHA, e o ESTADO ____________, neste ato representado por ______________, (qualificação), considerando a Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações, que institui o PROGRAMA DE VALORIZAÇÃO DO PROFISSIONAL DA ATENÇÃO BÁSICA, doravante denominado PROVAB, resolvem CELEBRAR o presente Termo de Compromisso, mediante as cláusulas e condições seguintes:
CLÁUSULA PRIMEIRA - DO OBJETO
O presente Termo de Compromisso tem por objeto pleitear a habilitação ao recebimento dos recursos financeiros previstos na Portaria GM/MS nº XXX de 2013, de custeio para manutenção e execução das atividades das Coordenações Estaduais e do Distrito Federal ao PROVAB, que visa o estímulo e a valorização do profissional de saúde que atue em equipes no âmbito da Atenção Básica e na Estratégia de Saúde da Família, conforme previsto no art. 1º, da Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações.
CLÁUSULA SEGUNDA - DOS COMPROMISSOS COM A POLÍTICA NACIONAL DE ATENÇÃO BÁSICA
O gestor Estadual de saúde deverá orientar seus trabalhos em atendimento às exigências dispostas na Portaria nº 2.488/GM/MS, de 21 de outubro de 2011, da Política Nacional de Atenção Básica, notadamente no que se refere aos princípios e diretrizes gerais da atenção básica e a infraestrutura existente.
CLÁUSULA TERCEIRA - DAS OBRIGAÇÕES DO ESTADO
Para consecução do objeto estabelecido neste Termo de Compromisso, o ESTADO deverá atender os seguintes aspectos relativos à Gestão estadual do PROVAB e apoio aos municípios participantes do Programa:
a) Compor a Comissão de Coordenação Estadual do PROVAB e indicar o Coordenador Estadual;
b) Disponibilizar infraestrutura para o funcionamento da Comissão de Coordenação Estadual do PROVAB, bem como para as atividades do Coordenador Estadual do programa, prevendo deslocamentos eventuais aos municípios;
c) Auxiliar a Comissão de Coordenação Estadual do PROVAB no acompanhamento dos profissionais inseridos nos municípios e nas eventuais situações de remanejamento dos médicos;
d) Apoiar na fiscalização do cumprimento de carga horária dos médicos nas equipes de saúde da família;
e) Promover articulação da Comissão de Coordenação Estadual do PROVAB com a Comissão Permanente de Integração Ensino-Serviço (CIES) e o Conselho Estadual de Saúde (CES);
f) Incentivar a adesão das equipes de saúde da família com médicos participantes do PROVAB no Programa de Melhoria da Qualidade e do Acesso (PMAQ), no Programa de Requalificação de Unidades Básicas de Saúde (Requalifica UBS) e no e-SUS Atenção Básica;
g) Incentivar a implantação dos núcleos de telessaúde nos municípios;
h) Promover Fóruns de Educação Permanente em Saúde, com vistas à integração Ensino Serviço;
CLÁUSULA QUARTA - DAS OBRIGAÇÕES DO MINISTÉRIO DA SAÚDE
Constituem obrigações do Ministério da Saúde:
a) Coordenar em âmbito Nacional o programa e indicar representante para compor Comissão Coordenadora estadual do PROVAB ;
b) Selecionar, conforme edital público, os profissionais aptos a participar do PROVAB, nos termos do inciso I do art. 2º da Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações;
c) Garantir o pagamento da bolsa do trabalhador-estudante do PROVAB, obedecendo a legislação vigente e edital específico a ser publicado;
d) Garantir a inclusão dos profissionais do PROVAB em curso de especialização em Saúde da Família sob responsabilidade das universidades públicas participantes do Sistema Universidade Aberta do Sistema Único de Saúde (UNA-SUS);
e) Instalar e manter os Núcleos de Telessaúde, onde houver necessidade, nas instituições que forem responsáveis pela supervisão dos profissionais participantes do PROVAB e nas unidades básicas de saúde selecionadas pelo Programa;
f) Selecionar as instituições responsáveis pela supervisão e avaliação;
g) Expedir certificado de participação para os profissionais de saúde aprovados no PROVAB, conforme o disposto no art. 10 da Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações;
h) Promover a troca de experiência entre UNA-SUS, Instituições Supervisoras e estados, através de oficinas regionais de trabalho;
i) Garantir o monitoramento e avaliação do PROVAB;
j) Promover a integração com a Política Nacional de Educação Permanente em Saúde;
CLÁUSULA QUINTA - DA VIGÊNCIA
O presente Termo terá vigência por um ano a contar da data de sua assinatura, podendo ser prorrogado mediante celebração de aditivo.
CLÁUSULA SEXTA - DAS ALTERAÇÕES
As eventuais alterações ao presente compromisso serão realizadas por meio de Termo Aditivo acordado entre os partícipes.
CLÁUSULA SÉTIMA - DA PUBLICAÇÃO
O presente Termo deverá ser publicado em extrato no Diário Oficial da União, as expensas do MS.
CLÁUSULA OITAVA - DA RESOLUÇÃO DE CONFLITOS
Eventuais conflitos, dúvidas ou controvérsias decorrentes da interpretação e execução do presente Termo de Compromisso serão dirimidos administrativamente pelos partícipes.
E, por estarem de pleno acordo, as partes assumem os compromissos elencados acima, sem prejuízo de quaisquer outros que visem uma gestão democrática e que promovam a qualidade do trabalho, a promoção de saúde do trabalhador e a valorização dos profissionais de saúde, e firmam o presente Termo de Compromisso, na presença das testemunhas abaixo, para que produza seus jurídicos e legais efeitos.
Brasília, ______ de ____________ de 2013.
ALEXANDRE ROCHA SANTOS PADILHA ___________________Estado
Ministro de Estado da Saúde
TESTEMUNHAS: NOME:___________________________________________
RG:__________________________
NOME:___________________________________________
RG:__________________________
ANEXO LXXXIX
MUNICÍPIOS CONTEMPLADOS NA ETAPA II DO PROGRAMA DE QUALIFICAÇÃO E ESTRUTURAÇÃO DA GESTÃO DO TRABALHO E DA EDUCAÇÃO NO SUS (Origem: PRT MS/GM 2261/2006, Anexo 1)
| Municípios | População | Postos de Trabalho Públicos |
|---|---|---|
| Bahia | ||
| Feira de Santana | 511.153 | 2.666 |
| Vitória da Conquista | 277.659 | 1.915 |
| Ilhéus | 221.468 | 1.160 |
| Camaçarí | 181.223 | 1.542 |
| Ceará | ||
| Caucaia | 285.094 | 1.018 |
| Espírito Santo | ||
| Vila Velha | 378.553 | 1.236 |
| Serra | 361.328 | 2.039 |
| Cariacica | 344.457 | 1.156 |
| Colatina | 108.004 | 1.090 |
| Goiás | ||
| Anápolis | 302.822 | 1.162 |
| Maranhão | ||
| Imperatriz | 231.659 | 1.441 |
| Minas Gerais | ||
| Contagem | 573.870 | 2.726 |
| Uberlândia | 555.606 | 4.499 |
| Juiz de Fora | 485.500 | 4.025 |
| Betim | 361.710 | 4.031 |
| Montes Claros | 330.009 | 3.003 |
| Uberaba | 270.176 | 2.738 |
| Governador Valadares | 253.863 | 1.349 |
| Barbacena | 119.870 | 1.185 |
| Pará | ||
| Santarém | 269.961 | 1.017 |
| Paraíba | ||
| Campina Grande | 368.792 | 2.770 |
| Paraná | ||
| Londrina | 473.741 | 4.448 |
| Maringá | 308.260 | 2.207 |
| Cascavel | 266.604 | 1.507 |
| Pernambuco | ||
| Jaboatão dos Guararapes | 619.845 | 1.571 |
| Olinda | 378.649 | 1.833 |
| Paulista | 282.811 | 1.029 |
| Caruaru | 269.826 | 2.512 |
| Petrolina | 241.283 | 1.535 |
| Rio de Janeiro | ||
| São Gonçalo | 936.239 | 3.431 |
| Duque de Caxias | 819.096 | 4.088 |
| Nova Iguaçu | 804.044 | 3.265 |
| Niterói | 468.897 | 8.987 |
| São João de Meriti | 459.084 | 1.621 |
| Campos dos Goytacazes | 419.427 | 3.813 |
| Petrópolis | 299.131 | 2.401 |
| Volta Redonda | 250.884 | 2.367 |
| Itaboraí | 205.857 | 1.163 |
| Nova Friburgo | 175.987 | 1.331 |
| Nilópolis | 151.937 | 1.071 |
| Macaé | 147.940 | 1.046 |
| Itaguaí | 89.546 | 1.115 |
| Rio Grande do Norte | ||
| Mossoró | 222.587 | 1.989 |
| Rio Grande do Sul | ||
| Pelotas | 334.779 | 1.767 |
| Santa Maria | 258.128 | 3.128 |
| São Leopoldo | 203.942 | 1.031 |
| Rio Grande | 192.274 | 1.014 |
| Santa Catarina | ||
| Joinville | 469.362 | 3.215 |
| São José | 188.668 | 2.583 |
| São Paulo | ||
| Guarulhos | 1.188.206 | 5.302 |
| Campinas | 1.018.781 | 9.052 |
| São Bernardo do Campo | 758.430 | 2.758 |
| Osasco | 686.799 | 4.544 |
| Santo André | 662.444 | 1.650 |
| São José dos Campos | 578.617 | 3.028 |
| Sorocaba | 539.877 | 3.597 |
| Ribeirão Preto | 534.944 | 8.112 |
| Santos | 418.199 | 4.158 |
| Mauá | 391.119 | 1.673 |
| São José do Rio Preto | 389.781 | 1.169 |
| Diadema | 378.057 | 1.581 |
| Carapicuiba | 369.303 | 1.982 |
| Moji das Cruzes | 353.378 | 2.047 |
| Piracicaba | 349.610 | 2.025 |
| Bauru | 338.344 | 2.799 |
| São Vicente | 317.712 | 1.059 |
| Taubaté | 259.247 | 1.916 |
| Barueri | 239.697 | 1.171 |
| Sumaré | 219.311 | 1.469 |
| Marília | 212.017 | 1.712 |
| Presidente Prudente | 198.794 | 1.288 |
| Americana | 194.250 | 1.169 |
| Araçatuba | 176.025 | 1.041 |
| Ferraz de Vasconcelos | 161.113 | 1.469 |
| Itapecerica da Serra | 147.540 | 2.599 |
| Itu | 146.739 | 1.915 |
| Franco da Rocha | 117.282 | 1.277 |
| Botucatu | 115.418 | 3.338 |
| Cubatão | 115.272 | 1.047 |
| Assis | 91.886 | 1.333 |
| Caieiras | 84.254 | 1.310 |
| Lins | 68.929 | 1.031 |
| Fonte: Pesquisa IBGE/AMS, 2002. | ||
ANEXO XC
MUNICÍPIOS CONTEMPLADOS NA ETAPA III DO PROGRAMA DE QUALIFICAÇÃO E ESTRUTURAÇÃO DA GESTÃO DO TRABALHO E DA EDUCAÇÃO NO SUS (Origem: PRT MS/GM 2261/2006, Anexo 2)
| Municípios | População | Postos de Trabalho Públicos |
|---|---|---|
| Acre | ||
| Cruzeiro do Sul | 75.399 | 745 |
| Alagoas | ||
| Arapiraca | 195.200 | 770 |
| Amapá | ||
| Santana | 92.190 | 792 |
| Amazonas | ||
| Coari | 78.615 | 574 |
| Itacoatiara | 77.517 | 637 |
| Bahia | ||
| Itabuna | 201.296 | 898 |
| Juazeiro | 193.136 | 507 |
| Jequié | 148.186 | 905 |
| Alagoinhas | 135.448 | 761 |
| Lauro de Freitas | 131.494 | 662 |
| Barreiras | 126.885 | 658 |
| Porto Seguro | 120.479 | 543 |
| Paulo Afonso | 100.509 | 634 |
| Candeias | 80.368 | 771 |
| Serrinha | 73.511 | 538 |
| Itaberaba | 61.052 | 530 |
| Ceará | ||
| Juazeiro do Norte | 227.774 | 792 |
| Maracanau | 188.882 | 680 |
| Sobral | 166.543 | 673 |
| Crato | 110.378 | 736 |
| Maranguape | 94.796 | 518 |
| Iguatú | 89.654 | 741 |
| Quixadá | 72.979 | 552 |
| Crateús | 72.618 | 532 |
| Quixeramobim | 59.195 | 503 |
| Espírito Santo | ||
| Cachoeiro de Itapemirim | 187.643 | 599 |
| Linhares | 118.315 | 731 |
| São Mateus | 97.313 | 701 |
| Barra de São Francisco | 38.351 | 546 |
| Goiás | ||
| Aparecida de Goiânia | 400.412 | 817 |
| Luziânia | 166.413 | 626 |
| Rio Verde | 127.347 | 585 |
| Planaltina | 87.304 | 523 |
| Itumbiara | 84.210 | 685 |
| Jataí | 80.647 | 555 |
| Maranhão | ||
| Caxias | 142.296 | 924 |
| Timon | 138.715 | 761 |
| Codó | 113.314 | 500 |
| Barra do Corda | 77.992 | 574 |
| Mato Grosso | ||
| Várzea Grande | 236.932 | 723 |
| Rondonópolis | 160.971 | 745 |
| Cáceres | 86.430 | 596 |
| Mato Grosso do Sul | ||
| Dourados | 176.693 | 803 |
| Minas Gerais | ||
| Ribeirão das Neves | 288.605 | 679 |
| Ipatinga | 225.642 | 908 |
| Santa Luzia | 203.989 | 539 |
| Sete Lagoas | 201.436 | 961 |
| Divinópolis | 197.141 | 815 |
| Ibirité | 155.301 | 756 |
| Poços de Caldas | 145.968 | 665 |
| Patos de Minas | 132.369 | 906 |
| Teófilo Otoni | 128.386 | 508 |
| Varginha | 117.504 | 655 |
| Itabira | 103.478 | 631 |
| Passos | 102.315 | 550 |
| Ubá | 92.586 | 626 |
| Alfenas | 72.737 | 523 |
| Manhuaçú | 70.631 | 539 |
| Nova Lima | 69.247 | 617 |
| Pará | ||
| Ananindeua | 450.905 | 931 |
| Marabá | 186.003 | 954 |
| Castanhal | 147.643 | 645 |
| Cametá | 102.664 | 513 |
| Itaituba | 95.719 | 521 |
| Altamira | 81.942 | 599 |
| Tucuruí | 81.372 | 766 |
| Paraíba | ||
| Patos | 96.002 | 997 |
| Sousa | 62.839 | 594 |
| Paraná | ||
| Ponta Grossa | 290.818 | 926 |
| Foz do Iguaçu | 286.285 | 933 |
| São José dos Pinhais | 235.476 | 782 |
| Guarapuava | 162.754 | 607 |
| Paranaguá | 138.635 | 736 |
| Pinhais | 114.122 | 656 |
| Apucarana | 113.000 | 548 |
| Araucária | 107.450 | 660 |
| Pernambuco | ||
| Cabo de Santo Agostinho | 163.493 | 816 |
| Camaragibe | 140.577 | 812 |
| Garanhuns | 123.591 | 882 |
| Vitória de Santo Antão | 121.972 | 669 |
| Igarassu | 87.861 | 772 |
| Goiana | 74.027 | 674 |
| Arcoverde | 63.962 | 530 |
| Limoeiro | 56.916 | 788 |
| Palmares | 55.002 | 512 |
| Salgueiro | 53.338 | 564 |
| Piauí | ||
| Parnaíba | 138.530 | 735 |
| Picos | 71.975 | 843 |
| Floriano | 55.850 | 590 |
| Rio de Janeiro | ||
| Belford Roxo | 464.386 | 729 |
| Magé | 222.930 | 554 |
| Barra Mansa | 173.715 | 653 |
| Cabo Frio | 148.091 | 946 |
| Teresópolis | 145.123 | 571 |
| Angra dos Reis | 132.899 | 894 |
| Resende | 112.876 | 793 |
| Araruama | 92.445 | 595 |
| São Pedro da Aldeia | 71.453 | 552 |
| Saquarema | 58.369 | 563 |
| Arraial do Cabo | 25.504 | 543 |
| Casimiro de Abreu | 24.799 | 559 |
| Carmo | 15.603 | 580 |
| São Sebastião do Alto | 8.627 | 804 |
| Rio Grande do Norte | ||
| Parnamirim | 149.575 | 859 |
| São José de Mipibú | 37.652 | 510 |
| Santa Cruz | 32.363 | 541 |
| Rio Grande do Sul | ||
| Caxias do Sul | 388.740 | 760 |
| Canoas | 321.027 | 729 |
| Novo Hamburgo | 248.569 | 729 |
| Viamão | 246.377 | 540 |
| Alvorada | 200.967 | 501 |
| Passo Fundo | 179.346 | 843 |
| Sapucaia do Sul | 129.998 | 761 |
| Cachoeirinha | 115.415 | 814 |
| Erechim | 94.435 | 552 |
| Alegrete | 86.630 | 526 |
| Esteio | 83.900 | 510 |
| Rondônia | ||
| Jiparaná | 110.448 | 694 |
| Vilhena | 60.295 | 504 |
| Santa Catarina | ||
| Blumenau | 281.993 | 830 |
| Criciúma | 180.188 | 893 |
| Lages | 163.489 | 937 |
| Chapecó | 161.391 | 608 |
| Itajaí | 158.790 | 641 |
| São Paulo | ||
| Jundiaí | 337.233 | 644 |
| Itaquaquecetuba | 316.721 | 503 |
| Franca | 309.888 | 857 |
| Guarujá | 286.953 | 671 |
| Embu | 228.616 | 672 |
| Praia Grande | 222.000 | 632 |
| Taboão da Serra | 212.870 | 903 |
| São Carlos | 207.098 | 543 |
| Jacareí | 202.407 | 588 |
| Araraquara | 191.899 | 997 |
| Rio Claro | 180.373 | 588 |
| Cotia | 165.826 | 567 |
| São Caetano do Sul | 136.364 | 827 |
| Mojiguaçú | 133.737 | 650 |
| Ribeirão Pires | 112.382 | 505 |
| Catanduva | 111.955 | 620 |
| Salto | 101.601 | 505 |
| Itanhaém | 82.503 | 700 |
| Bebedouro | 77.674 | 608 |
| Pirassununga | 68.153 | 692 |
| Paulínia | 57.253 | 828 |
| São José do Rio Pardo | 52.306 | 555 |
| São Joaquim da Barra | 43.865 | 620 |
| Pariqueraaçu | 19.466 | 527 |
| Casa Branca | 27.403 | 958 |
| Santa Rita do Passa Quatro | 26.954 | 844 |
| Sergipe | ||
| Itabaiana | 81.666 | 579 |
| Tocantins | ||
| Araguaina | 122.450 | 799 |
| Fonte: Pesquisa IBGE/AMS, 2002. | ||
ANEXO XCI
MODELO DE OFÍCIO DE ENCAMINHAMENTO DE PROJETO (Origem: PRT MS/GM 2261/2006, Anexo 3)
Modelo de Ofício de Encaminhamento de Projeto
... [timbre da secretaria de saúde] ...
Ofício nº ...... [número do ofício] ...
... [município] ..., de ... [data] ...
Ao Senhor
... [nome completo] ...
Secretário de Gestão do Trabalho e da Educação na Saúde do Ministério da Saúde
Assunto: Encaminhamento de Projeto de Fortalecimento da Gestão do Trabalho e da Educação na Saúde
Senhor Secretário.
1. Encaminho, para análise e homologação, o Projeto de Fortalecimento da Gestão do Trabalho e da Educação na Saúde da
ecretaria de Saúde do Distrito Federal (ou Estado de .... [denominação] .... ou Município de ..... [denominação] ....).
2. Como anexo do individuado projeto, também segue a Declaração de Adesão, Alimentação e Atualização do INFORSUS. Atenciosamente,
... [nome completo] ...
Secretário de Saúde do Distrito Federal
(ou do Estado de ... [denominação] ... ou Município de ... [denominação] ...)
ANEXO XCII
MODELO DE DECLARAÇÃO DE ADESÃO, ALIMENTAÇÃO E ATUALIZAÇÃO DO INFORSUS (Origem: PRT MS/GM 2261/2006, Anexo 4)
Modelo de Declaração de Adesão, Alimentação e Atualização do INFORSUS
... [timbre da secretaria de saúde] ...
Declaração de Adesão, Alimentação e atualização do INFORSUS Declaro que, imediatamente após o início do funcionamento do Sistema Nacional de Informações de Recursos Humanos do Sistema Único de Saúde (INFORSUS), a Secretaria de Saúde do Distrito Federal (ou Estado de ... [denominação] ... ou Município de ... [deNominação] ...) promoverá os atos necessários para se integrar ao mencionado sistema. Declaro, ainda, que a Secretaria promoverá a alimentação e atualização dos dados requeridos, observando a periodicidade que vier a ser estabelecida.
[nome completo]
Secretário de Saúde do Distrito Federal
(ou do Estado de ... [denominação] ... ou Município de ... [denominação] ...)
ANEXO XCIII
DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SISTEMA ÚNICO DE SAÚDE (PROADI-SUS) (Origem: PRT MS/GM 2814/2014)
CAPÍTULO I
DAS DISPOSIÇÕES PRELIMINARES
(Origem: PRT MS/GM 2814/2014, CAPÍTULO I)
Art. 1º Ficam estabelecidos as regras e os critérios para a formalização, apresentação, análise, aprovação, monitoramento e avaliação dos projetos no âmbito do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (PROADI-SUS), bem como sua sistemática de gestão e fluxo processual. (Origem: PRT MS/GM 2814/2014, Art. 1º)
Parágrafo Único. O ciclo de gestão do PROADI-SUS obedecerá à periodicidade trienal, respeitado o exercício fiscal. (Origem: PRT MS/GM 2814/2014, Art. 1º, Parágrafo Único)
Art. 2º A entidade de saúde de reconhecida excelência estará apta a apresentar Projetos de Apoio no âmbito do PROADI-SUS dentre as seguintes áreas de atuação: (Origem: PRT MS/GM 2814/2014, Art. 2º)
I - estudos de avaliação e incorporação de tecnologia: projetos de realização de estudos de avaliação e incorporação de tecnologias; revisão sistemática de literatura; meta-análise de estudos clínicos; estudos clínicos; desenvolvimento de pesquisas e tecnologias úteis ao SUS para fins de diagnóstico, tratamento ou controle de doenças e promoção da qualidade de vida, buscando impacto nos determinantes de saúde com recorte étnico-racial e de gênero; (Origem: PRT MS/GM 2814/2014, Art. 2º, I)
II - capacitação de recursos humanos: projetos para realização de cursos; seminários; palestras; formação e capacitação em serviços destinados à qualificação de profissionais de saúde/gestão de serviços, de acordo com as necessidades identificadas pelos gestores do SUS e Política Nacional de Educação na Saúde, em consonância com as diretrizes traçadas pela Secretaria de Gestão do Trabalho e da Educação na Saúde - SGTES/MS; (Origem: PRT MS/GM 2814/2014, Art. 2º, II)
III - pesquisas de interesse público em saúde: projetos para realização de pesquisas relacionadas à promoção e à recuperação da saúde, prevenção de doenças e agravos; monitoramento; avaliação; mensuração de resultados de políticas/programas de saúde com recorte étnico-racial e de gênero; e (Origem: PRT MS/GM 2814/2014, Art. 2º, III)
IV - desenvolvimento de técnicas e operação de gestão em serviços de saúde: desenvolvimento e implantação de técnicas operacionais, sistemas e tecnologias da informação alinhadas com a gestão de serviços de saúde vinculados ao SUS; da racionalização de custos e ampliação da eficiência operacional dos serviços e sistemas regionais, com o desenvolvimento de controle de doenças no âmbito populacional, avançando nas metodologias estruturadas em torno de metas em qualidade de vida e saúde, incluindo, se necessário, a compra de materiais, desenvolvimento de softwares e equipamentos requeridos para a melhor operação das áreas acima referidas, bem como a efetivação de adequações físicas e de instalações necessárias a essas incorporações. (Origem: PRT MS/GM 2814/2014, Art. 2º, IV)
Art. 3º O Projeto de Apoio a ser apresentado deverá destacar a relevância, a adequação aos temas e objetivos prioritários a serem definidos por meio de ato específico do Ministério da Saúde e o seu potencial de contribuição para a governança do SUS. (Origem: PRT MS/GM 2814/2014, Art. 3º)
Art. 4º A entidade de saúde interessada em apresentar projetos no âmbito do PROADI-SUS deverá ser previamente certificada como entidade de reconhecida excelência pelo Ministério da Saúde, nos termos previstos no art. 11 "caput" da Lei nº 12.101/2009. (Origem: PRT MS/GM 2814/2014, Art. 4º)
Parágrafo Único. Os critérios e requisitos a serem estabelecidos para o reconhecimento de excelência de que trata o "caput" serão previstos em ato específico publicado pelo Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 4º, Parágrafo Único)
CAPÍTULO II
DAS COMPETÊNCIAS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II)
Seção I
Das Secretarias do Ministério da Saúde
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II, Seção I)
Art. 5º Compete à Secretaria-Executiva do Ministério da Saúde (SE/MS): (Origem: PRT MS/GM 2814/2014, Art. 5º)
I - realizar a gestão administrativa dos Projetos de Apoio, centralizando, coordenando e monitorando o fluxo dos seguintes documentos: (Origem: PRT MS/GM 2814/2014, Art. 5º, I)
a) carta consulta; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, a)
b) Projeto de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, b)
c) relatórios semestral, anual e final de atividades do Projeto de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, c)
d) pareceres técnicos das Secretarias e entidades competentes vinculadas ao Ministério da Saúde responsáveis pela análise, monitoramento e avaliação dos projetos; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, d)
e) Termos Aditivos ao Termo de Ajuste; e (Origem: PRT MS/GM 2814/2014, Art. 5º, I, e)
f) Termos Aditivos e apostilamentos aos Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 5º, I, f)
II - preparar relatório sobre as cartas-consulta apresentadas pelas entidades de saúde de reconhecida excelência e os projetos demandados pelas Secretarias e entidades vinculadas do Ministério da Saúde, para análise do Comitê de Avaliação e deliberação do Comitê Gestor do PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 5º, II)
III - elaborar e formalizar Termos de Ajuste, Aditivo e apostilamento aos Projetos de Apoio, conforme as necessidades, em interlocução com as Secretarias e entidades vinculadas responsáveis pelos projetos; (Origem: PRT MS/GM 2814/2014, Art. 5º, III)
IV - coordenar o Comitê de Avaliação do PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 5º, IV)
V - subsidiar o Comitê Gestor do PROADI-SUS na aprovação dos relatórios finais dos Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 5º, V)
VI - publicar portaria com os temas e objetivos prioritários definidos para o triênio; (Origem: PRT MS/GM 2814/2014, Art. 5º, VI)
VII - expedir a certidão prevista no art. 55; e (Origem: PRT MS/GM 2814/2014, Art. 5º, VII)
VIII - promover a articulação entre as Secretarias do Ministério da Saúde e entidades vinculadas envolvidas na execução dos Projetos de Apoio e as entidades de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 5º, VIII)
Art. 6º Compete às Secretarias do Ministério da Saúde e às entidades vinculadas: (Origem: PRT MS/GM 2814/2014, Art. 6º)
I - demandar Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 6º, I)
II - analisar e emitir parecer técnico sobre as cartas-consulta, devendo observar os seguintes critérios: (Origem: PRT MS/GM 2814/2014, Art. 6º, II)
a) o modelo constante do Anexo 2 do Anexo XCIII ; e (Origem: PRT MS/GM 2814/2014, Art. 6º, II, a)
b) os temas e objetivos prioritários definidos na Portaria publicada pela SE/MS, na forma do art. 3º. (Origem: PRT MS/GM 2814/2014, Art. 6º, II, b)
III - analisar, diligenciar e emitir parecer técnico conclusivo sobre os Projetos de Apoio encaminhados pela SE/MS, referente aos seus respectivos campos de atuação; (Origem: PRT MS/GM 2814/2014, Art. 6º, III)
IV - monitorar a execução e avaliar os resultados e a prestação de contas dos Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 6º, IV)
V - emitir parecer técnico conclusivo referente à execução física e financeira dos Projetos de apoio; e (Origem: PRT MS/GM 2814/2014, Art. 6º, V)
VI - emitir parecer técnico conclusivo relativo à suspensão ou ao cancelamento de Projetos de Apoio em execução, para submissão ao Comitê de Avaliação do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 6º, VI)
Seção II
Do Comitê de Avaliação do PROADI-SUS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II, Seção II)
Art. 7º O Comitê de Avaliação do PROADI-SUS será composto por representantes dos seguintes órgãos do Ministério da Saúde, entidades vinculadas, órgãos colegiados e entidades de saúde de reconhecida excelência: (Origem: PRT MS/GM 2814/2014, Art. 7º)
I - 1 (um) da Secretaria-Executiva (SE/MS), que o coordenará; (Origem: PRT MS/GM 2814/2014, Art. 7º, I)
II - 2 (dois) da Secretaria de Atenção à Saúde (SAS/MS), sendo 01 (um) do Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde (DCEBAS/SAS/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, II)
III - 01 (um) da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, III)
IV - 01 (um) da Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, IV)
V - 01 (um) da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, V)
VI - 01 (um) da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, VI)
VII - 01 (um) da Secretaria Especial de Saúde Indígena (SESAI/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, VII)
VIII - 01 (um) da Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 2814/2014, Art. 7º, VIII)
IX - 01(um) da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2814/2014, Art. 7º, IX)
X - 01 (um) do Conselho Nacional de Saúde (CNS); (Origem: PRT MS/GM 2814/2014, Art. 7º, X)
XI - 01 (um) do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2814/2014, Art. 7º, XI)
XII - 01 (um) do Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS) e; (Origem: PRT MS/GM 2814/2014, Art. 7º, XII)
XIII - 01 (um) representante das entidades de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 7º, XIII)
§ 1º Os representantes, titulares e suplentes, serão indicados ao Ministro de Estado da Saúde pela autoridade superior das respectivas Secretarias do Ministério da Saúde e entidades vinculadas, bem como pela presidência do CNS, CONASS, CONASEMS e pelo conjunto das entidades de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 7º, § 1º)
§ 2º O membro do Comitê de Avaliação do PROADI-SUS declarará formalmente, em ata, eventual conflito de interesses entre suas atividades profissionais e o tema objeto de deliberação do colegiado, sendo que, presente o conflito de interesses, abster-se-á de participar da discussão e da deliberação. (Origem: PRT MS/GM 2814/2014, Art. 7º, § 2º)
Art. 8º Compete ao Comitê de Avaliação do PROADI-SUS elaborar relatórios prévios que subsidiem as decisões a serem tomadas pelo Comitê Gestor do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 8º)
§ 1º Todos os processos que demandarem atuação do Comitê Gestor do PROADI-SUS serão previamente encaminhados ao Comitê de Avaliação do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 8º, § 1º)
§ 2º O Comitê de Avaliação do PROADI-SUS poderá constituir Grupos de Trabalho (GT) para o cumprimento de finalidades específicas. (Origem: PRT MS/GM 2814/2014, Art. 8º, § 2º)
§ 3º O Comitê de Avaliação do PROADI-SUS reunir-se-á em plenária ordinariamente uma vez por trimestre e, extraordinariamente, mediante convocação do Ministro de Estado da Saúde, a qualquer momento, sempre com antecedência de pelo menos 5 (cinco) dias úteis em relação às reuniões do Comitê Gestor. (Origem: PRT MS/GM 2814/2014, Art. 8º, § 3º)
Seção III
Do Comitê Gestor do PROADI-SUS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II, Seção III)
Art. 9º O Comitê Gestor do PROADI-SUS será composto pelas seguintes autoridades: (Origem: PRT MS/GM 2814/2014, Art. 9º)
I - Ministro de Estado da Saúde; (Origem: PRT MS/GM 2814/2014, Art. 9º, I)
II - Presidente do CONASS; e (Origem: PRT MS/GM 2814/2014, Art. 9º, II)
III - Presidente do CONASEMS. (Origem: PRT MS/GM 2814/2014, Art. 9º, III)
Parágrafo Único. As autoridades enumeradas no "caput" poderão fazer-se representar por delegação. (Origem: PRT MS/GM 2814/2014, Art. 9º, Parágrafo Único)
Art. 10. Compete ao Comitê Gestor do PROADI-SUS: (Origem: PRT MS/GM 2814/2014, Art. 10)
I - definir os temas e objetivos prioritários; (Origem: PRT MS/GM 2814/2014, Art. 10, I)
II - aprovar as cartas-consulta; (Origem: PRT MS/GM 2814/2014, Art. 10, II)
III - definir a Secretaria do Ministério da Saúde ou entidade vinculada competente para realizar a análise e acompanhamento de cada projeto constante de Cartas-consulta aprovadas; (Origem: PRT MS/GM 2814/2014, Art. 10, III)
IV - aprovar os Projetos de Apoio demandados; (Origem: PRT MS/GM 2814/2014, Art. 10, IV)
V - avaliar os resultados dos Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 10, V)
VI - formular proposições para aprimoramento do PROADI-SUS; e (Origem: PRT MS/GM 2814/2014, Art. 10, VI)
VII - analisar e deliberar acerca dos casos omissos. (Origem: PRT MS/GM 2814/2014, Art. 10, VII)
Parágrafo Único. O Comitê Gestor reunir-se-á em plenária ordinariamente uma vez por trimestre e, extraordinariamente, mediante convocação do Ministro de Estado da Saúde, a qualquer momento. (Origem: PRT MS/GM 2814/2014, Art. 10, Parágrafo Único)
CAPÍTULO III
DO TERMO DE AJUSTE
(Origem: PRT MS/GM 2814/2014, CAPÍTULO III)
Art. 11. A entidade de saúde de reconhecida excelência apta a apresentar projetos no âmbito do PROADI-SUS poderá firmar Termo de Ajuste com o Ministério da Saúde, o qual disciplinará os direitos e obrigações entre as partes, objetivando a elaboração, a execução, a prestação de contas e a avaliação dos projetos no âmbito do programa. (Origem: PRT MS/GM 2814/2014, Art. 11)
§ 1º O Termo de Ajuste deverá ser firmado em consonância com os temas e objetivos prioritários definidos em Portaria publicada pela SE/MS, observado o valor estimado da isenção tributária a ser obtida pela entidade de saúde de reconhecida excelência no triênio e observado o modelo do Anexo 1 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 11, § 1º)
§ 2º A Portaria SE/MS a que se refere o § 1º será publicada no ano anterior ao início do triênio, até 30 de junho. (Origem: PRT MS/GM 2814/2014, Art. 11, § 2º)
§ 3º Após firmado o Termo de Ajuste, a entidade de saúde de reconhecida excelência estará apta a apresentar Projetos de Apoio, que serão formalizados em processos administrativos independentes e vinculados ao Termo de Ajuste, respeitado o triênio de vigência e o limite das isenções tributárias. (Origem: PRT MS/GM 2814/2014, Art. 11, § 3º)
Art. 12. São cláusulas necessárias aos Termos de Ajustes firmados entre o Ministério da Saúde e a entidade de saúde de reconhecida excelência: (Origem: PRT MS/GM 2814/2014, Art. 12)
I - o objeto, em consonância com os temas e objetivos prioritários referentes ao respectivo triênio; (Origem: PRT MS/GM 2814/2014, Art. 12, I)
II - o prazo de vigência do Termo de Ajuste, o qual deverá ficar adstrito à vigência do respectivo triênio; (Origem: PRT MS/GM 2814/2014, Art. 12, II)
III - o valor estimado da isenção tributária a ser usufruída pela entidade de saúde de reconhecida excelência no triênio; (Origem: PRT MS/GM 2814/2014, Art. 12, III)
IV - os direitos, obrigações e responsabilidades das partes, especialmente a obrigatoriedade da entidade de saúde de apresentar, regularmente e sempre que requerida, ao Ministério da Saúde as informações e documentos exigidos, com a devida atualização, nos termos do regulamento vigente para o PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 12, IV)
V - a definição dos dados e informações confidenciais considerados como direito à intimidade das pessoas, sigilo profissional e intelectual, os quais deverão estar em estrita observância à legislação pertinente; (Origem: PRT MS/GM 2814/2014, Art. 12, V)
VI - a obrigação da prestação de contas nos termos deste Anexo; (Origem: PRT MS/GM 2814/2014, Art. 12, VI)
VII - o monitoramento e a avaliação dos Projetos de Apoio vinculados ao Termo de Ajuste; (Origem: PRT MS/GM 2814/2014, Art. 12, VII)
VIII - as vedações impostas às partes; (Origem: PRT MS/GM 2814/2014, Art. 12, VIII)
IX - as hipóteses de rescisão; (Origem: PRT MS/GM 2814/2014, Art. 12, IX)
X - o prazo de publicação; (Origem: PRT MS/GM 2814/2014, Art. 12, X)
XI - a indicação do foro para dirimir as dúvidas decorrentes da execução dos projetos vinculados ao Termo de Ajuste; e (Origem: PRT MS/GM 2814/2014, Art. 12, XI)
XII - a competência do Comitê Gestor do PROADI-SUS para decidir acerca de casos omissos. (Origem: PRT MS/GM 2814/2014, Art. 12, XII)
Parágrafo Único. O valor total da isenção tributária apurada no exercício fiscal anterior, comprovado por meio do Balanço Patrimonial, deverá ser informado, anualmente, ao Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 12, Parágrafo Único)
Art. 13. O Termo de Ajuste deverá dispor ainda sobre: (Origem: PRT MS/GM 2814/2014, Art. 13)
I - a observância dos requisitos previstos nas normas de ética em pesquisa vigentes; (Origem: PRT MS/GM 2814/2014, Art. 13, I)
II - a disponibilização dos recursos materiais instrucionais na rede mundial de computadores para entidades públicas e privadas, sem fins lucrativos e certificadas como beneficentes, mediante licença de uso de interesse do SUS, vedado o uso privado e comercial; (Origem: PRT MS/GM 2814/2014, Art. 13, II)
III - a divulgação e a publicidade dos produtos decorrentes da realização do projeto de apoio, previamente aprovadas pelo Ministério da Saúde, cujos textos deverão ser apresentados no idioma oficial do país, bem como deverão conter menção à parceria firmada com o Ministério da Saúde no âmbito do PROADI-SUS, de acordo com a Lei nº 12.101, de 2009; (Origem: PRT MS/GM 2814/2014, Art. 13, III)
IV - a obrigatoriedade do respeito às normas de editoração do Ministério da Saúde, quando resultar do projeto algum tipo de publicação; (Origem: PRT MS/GM 2814/2014, Art. 13, IV)
V - a previsão de publicação de artigos científicos em outros idiomas com fins de divulgação dos produtos decorrentes da realização do projeto de apoio, que não substituirá a entrega de relatório contendo metodologia detalhada e conjunto dos resultados obtidos em vernáculo; e (Origem: PRT MS/GM 2814/2014, Art. 13, V)
VI - a previsão de participação e apresentação de trabalhos (parciais ou completos) em eventos nacionais e internacionais, cujos textos deverão ser apresentados no idioma oficial do país para ciência da Secretaria competente ou entidade vinculada ao Ministério da Saúde, e deverão conter menção à parceria firmada no âmbito do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 13, VI)
Parágrafo Único. A titularidade dos direitos patrimoniais advindos das pesquisas científicas, dos programas desenvolvidos, bem como dos resultados tecnológicos decorrentes dos recursos do projeto de apoio referentes ao PROADI-SUS será do Ministério da Saúde, respeitados os direitos morais do autor quando da finalização do projeto, nos termos da Lei nº 9.610, de 19 de fevereiro de 1998. (Origem: PRT MS/GM 2814/2014, Art. 13, Parágrafo Único)
Art. 14. O Termo de Ajuste será assinado pelo Ministro de Estado da Saúde e pelo representante legal da entidade de saúde de reconhecida excelência até o dia 31 de agosto do exercício fiscal anterior ao início da sua vigência. (Origem: PRT MS/GM 2814/2014, Art. 14)
§ 1º O extrato do Termo de Ajuste publicado no Diário Oficial da União (DOU) conterá: (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único)
I - numeração sequencial e exclusiva para o PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, I)
II - o número de registro no Sistema Integrado de Protocolo e Arquivo (SIPAR) do Ministério da Saúde; (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, II)
III - a qualificação das partes; (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, III)
IV - o objeto e a finalidade do Termo de Ajuste; e (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, IV)
V - o valor de isenção previsto para o triênio. (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, V)
§ 2º O valor previsto da isenção das contribuições sociais deverá ser estimado com base no exercício fiscal anterior ao da celebração do Termo de Ajuste, ou através de projeção econômica com justificativa e memória de cálculo apresentadas pela entidade de excelência, devendo a variação anual do Termo de Ajuste ser ajustada mediante Termos Aditivos durante sua vigência. (Origem: PRT MS/GM 2814/2014, Art. 14, § 1º)
§ 3º O valor total dos projetos executados não poderá ser inferior ao valor da isenção das contribuições sociais usufruídas previstas no Termo de Ajuste, em observância ao disposto no § 2º do art. 11 da Lei nº 12.101, de 2009, considerando-se, nesse caso, o conjunto de Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 14, § 2º)
§ 4º As despesas executadas em desacordo ao estabelecido no art. 14, § 3º são de responsabilidade exclusiva da entidade de saúde, vedada a possibilidade de serem relacionadas ao valor das contribuições sociais usufruídas. (Origem: PRT MS/GM 2814/2014, Art. 14, § 3º)
Art. 15. O Termo de Ajuste poderá ser alterado, no decorrer de sua vigência, mediante celebração de Termo Aditivo, com as devidas justificativas e comprovações, nos seguintes casos: (Origem: PRT MS/GM 2814/2014, Art. 15)
I - alteração da qualificação da entidade de saúde e/ou do seu representante legal; (Origem: PRT MS/GM 2814/2014, Art. 15, I)
II - atualização ou alteração do valor estimado de isenção a ser usufruída pela entidade de saúde; (Origem: PRT MS/GM 2814/2014, Art. 15, II)
III - modificação dos direitos, das obrigações e das responsabilidades das partes; e (Origem: PRT MS/GM 2814/2014, Art. 15, III)
IV - retificação da redação das cláusulas inicialmente previstas no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 15, IV)
Art. 16. O Termo de Ajuste poderá ser rescindido nos seguintes casos: (Origem: PRT MS/GM 2814/2014, Art. 16)
I - a pedido da entidade de saúde de reconhecida excelência; (Origem: PRT MS/GM 2814/2014, Art. 16, I)
II - pela superveniência de norma legal com ele incompatível; e (Origem: PRT MS/GM 2814/2014, Art. 16, II)
III - pela inobservância de qualquer de suas cláusulas. (Origem: PRT MS/GM 2814/2014, Art. 16, III)
§ 1º No caso do inciso I, a entidade de saúde de reconhecida excelência permanecerá obrigada à execução dos Projetos de Apoio que estejam em andamento. (Origem: PRT MS/GM 2814/2014, Art. 16, § 1º)
§ 2º Nos casos dos incisos II e III do "caput", a rescisão do Termo de Ajuste será precedida de notificação formal e fundamentada, garantida a apresentação de defesa no prazo de 10 (dez) dias. (Origem: PRT MS/GM 2814/2014, Art. 16, § 2º)
CAPÍTULO IV
DO PROJETO DE APOIO
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV)
Art. 17. Uma vez firmado o Termo de Ajuste, a entidade de saúde de reconhecida excelência poderá apresentar Projetos de Apoio, considerando-se os temas e objetivos prioritários a que tenha aderido no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 17)
Parágrafo Único. O somatório dos valores dos Projetos de Apoio apresentados e aprovados deve corresponder ao montante de isenção tributária constante do Termo de Ajuste firmado entre a entidade de saúde de reconhecida excelência e o Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 17, Parágrafo Único)
Seção I
Dos Projetos Demandados
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção I)
Art. 18. As Secretarias do Ministério da Saúde e entidades vinculadas, sob aprovação do Comitê Gestor do PROADI-SUS, poderão demandar Projetos de Apoio, na forma do Anexo IV, de acordo com os temas e objetivos prioritários a que tenha aderido a entidade de saúde de reconhecida excelência no Termo de Ajuste firmado. (Origem: PRT MS/GM 2814/2014, Art. 18)
§ 1º A entidade de saúde deverá manifestar-se quanto à viabilidade técnico-financeira em apresentar Projeto de Apoio demandado pelo Ministério da Saúde, no prazo de até 15 (quinze) dias, a contar da data de recebimento da proposta de projeto demandado, nos termos do Anexo 4 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 18, § 1º)
§ 2º Caso haja viabilidade técnico-financeira para apresentação de Projeto de Apoio demandado pelo Ministério da Saúde, nos termos do §1º, a entidade de saúde deverá protocolar, na Secretaria- Executiva/MS, no prazo de até 45 (quarenta e cinco) dias, Projeto de Apoio conforme Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 18, § 2º)
§ 3º Em caso de inviabilidade técnico-financeira para apresentação de Projeto de Apoio demandado, a entidade de saúde de reconhecida excelência deverá justificar a inviabilidade declarada. (Origem: PRT MS/GM 2814/2014, Art. 18, § 3º)
Seção II
Da Carta Consulta
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção II)
Art. 19. A proposta de Projeto de Apoio será formalizada por intermédio de carta-consulta apresentada pela entidade de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 19)
Parágrafo Único. A carta-consulta será protocolada na Secretaria-Executiva do Ministério da Saúde (SE/MS) e será submetida, no prazo de até 5 (cinco) dias contados da data do protocolo, à Secretaria ou entidade vinculada competente para análise e emissão de parecer conclusivo. (Origem: PRT MS/GM 2814/2014, Art. 19, Parágrafo Único)
Art. 20. A Secretaria ou entidade vinculada competente emitirá parecer técnico no prazo de 15 (quinze) dias, nos moldes do Anexo 3 do Anexo XCIII , e o encaminhará à SE/MS para compor a análise do Comitê de Avaliação e posterior deliberação Comitê Gestor. (Origem: PRT MS/GM 2814/2014, Art. 20)
Parágrafo Único. Caso o parecer técnico não seja emitido no prazo previsto no "caput", o Comitê de Avaliação do PROADI-SUS poderá proceder à análise direta da carta-consulta. (Origem: PRT MS/GM 2814/2014, Art. 20, Parágrafo Único)
Art. 21. O Comitê Gestor deliberará acerca da aprovação ou reprovação das cartas-consulta na reunião ordinária subsequente ao seu recebimento, ou, em caso de urgência definida pelo Ministro de Estado da Saúde, em reunião extraordinária. (Origem: PRT MS/GM 2814/2014, Art. 21)
Art. 22. A SE/MS dará conhecimento à entidade de saúde acerca do resultado da deliberação da carta-consulta pelo Comitê Gestor no prazo de 05 (cinco) dias contados do seu recebimento. (Origem: PRT MS/GM 2814/2014, Art. 22)
Seção III
Da Apresentação de Projetos de Apoio
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção III)
Art. 23. Aprovada a carta-consulta, a entidade de saúde de reconhecida excelência apresentará o Projeto de Apoio proposto no prazo de até 45 (quarenta e cinco) dias, contados da data da notificação da aprovação da proposta. (Origem: PRT MS/GM 2814/2014, Art. 23)
§ 1º O Projeto de Apoio será apresentado nos moldes definidos no Anexo 5 do Anexo XCIII e será protocolado na SE/MS. (Origem: PRT MS/GM 2814/2014, Art. 23, § 1º)
§ 2º Nos casos de projetos referentes à realização de pesquisa, a entidade de saúde de reconhecida excelência enviará versão digital do Projeto de Apoio ao Comitê de Ética em Pesquisa (CEP) ou ao Comitê de Ética no Uso de Animais (CEUA). (Origem: PRT MS/GM 2814/2014, Art. 23, § 2º)
§ 3º A ausência de manifestação da entidade de saúde de reconhecida excelência previsto no "caput" implicará a necessidade de apresentação de nova carta-consulta. (Origem: PRT MS/GM 2814/2014, Art. 23, § 3º)
Art. 24. A SE/MS tramitará o Projeto de Apoio apresentado à Secretaria ou entidade vinculada competente, no prazo de 5 (cinco) dias contados da data do protocolo. (Origem: PRT MS/GM 2814/2014, Art. 24)
Art. 25. A análise técnica e financeira do Projeto de Apoio, recomendando ou não sua aprovação, será realizada por meio de parecer conclusivo da Secretaria ou entidade vinculada competente, no prazo de 45 (quarenta e cinco) dias, contados da data de recebimento e observado o modelo contido no Anexo 6 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 25)
Parágrafo Único. O prazo previsto no "caput" poderá ser prorrogado em até 15 (quinze) dias, a critério da unidade administrativa responsável pela análise. (Origem: PRT MS/GM 2814/2014, Art. 25, Parágrafo Único)
Art. 26. A Secretaria ou entidade vinculada competente poderá solicitar à entidade de saúde de reconhecida excelência complementação ao Projeto de Apoio apresentado, incluindo outras informações não mencionadas no Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 26)
§ 1º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de 15 (quinze) dias, contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 26, § 1º)
§ 2º A ausência de manifestação da entidade de saúde de reconhecida excelência previsto no § 1º implicará a não aprovação do Projeto de Apoio e o consequente arquivamento do processo. (Origem: PRT MS/GM 2814/2014, Art. 26, § 2º)
Art. 27. O parecer conclusivo da Secretaria ou entidade vinculada competente, devidamente aprovado pelo Secretário ou dirigente máximo da entidade, será tramitado à SE/MS no prazo de 5 (cinco) dias contados da aprovação final. (Origem: PRT MS/GM 2814/2014, Art. 27)
Art. 28. A SE/MS notificará a entidade de saúde de reconhecida excelência acerca da aprovação ou não do Projeto de Apoio, no prazo de 5 (cinco) dias contados da data de recebimento do processo. (Origem: PRT MS/GM 2814/2014, Art. 28)
Parágrafo Único. Será publicado extrato do Projeto de Apoio no DOU, contendo as seguintes informações: (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único)
I - numeração do Termo de Ajuste a que esteja vinculado; (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, I)
II - o número de registro no SIPAR; (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, II)
III - a qualificação das partes; (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, III)
IV - o objeto e a finalidade do Projeto de Apoio; e (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, IV)
V - e o valor de isenção previsto para a execução do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, V)
Art. 29. Os Projetos de Apoio a serem executados no âmbito do PROADI-SUS que envolverem o desenvolvimento e/ou aperfeiçoamento de Soluções de Tecnologia da Informação deverão observar os princípios e diretrizes estabelecidos na Política Nacional de Informação e Informática em Saúde (PNIIS) e no Plano Diretor de Tecnologia da Informação do Ministério da Saúde (PDTI-MS), e serão encaminhados ao do Comitê de Informação e Informática em Saúde do Ministério da Saúde (CIINFO/MS) para ciência. (Origem: PRT MS/GM 2814/2014, Art. 29)
§ 1º Para os fins previstos no "caput", os projetos que envolverem o desenvolvimento e/ou aperfeiçoamento de Soluções de Tecnologia da Informação serão objeto de análise técnica pelo Departamento de Informática do SUS (DATASUS). (Origem: PRT MS/GM 2814/2014, Art. 29, § 1º)
§ 2º A SE/MS encaminhará os projetos referidos no "caput" ao DATASUS após o recebimento do processo vindo da Secretaria ou entidade vinculada competente, observado o prazo previsto no art. 24. (Origem: PRT MS/GM 2814/2014, Art. 29, § 2º)
§ 3º O DATASUS emitirá parecer técnico no prazo de 15 (quinze) dias contados do recebimento do processo, que será então restituído à SE/MS. (Origem: PRT MS/GM 2814/2014, Art. 29, § 3º)
§ 4º Caberá ao DATASUS dar ciência do Projeto de Apoio de que trata este artigo ao Comitê de Informação e Informática em Saúde do Ministério da Saúde (CIINFO/MS). (Origem: PRT MS/GM 2814/2014, Art. 29, § 4º)
Art. 30. No Projeto de Apoio que envolver a aquisição de equipamento e/ou materiais permanentes deverá constar o órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa destinatário da doação dos bens adquiridos, os quais deverão ser registrados no patrimônio do órgão ou estabelecimento beneficiário quando da finalização do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 30)
§ 1º A documentação comprobatória da formalização da doação ao órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa deverá ser encaminhada em conjunto com o Relatório Anual referente ao último ano de vigência do projeto de apoio, conforme modelo constante do Anexo 7 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 30, § 1º)
§ 2º Quando finalizado o Projeto de Apoio, os equipamentos e/ou materiais permanentes utilizados em sua execução poderão ser destinados para uso em outro Projeto de Apoio que esteja sob a responsabilidade da mesma entidade de saúde de reconhecida excelência, desde que haja aprovação prévia da Secretaria ou entidade vinculada competente e do órgão ou estabelecimento beneficiário, indicado quando da elaboração do novo Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 30, § 2º)
§ 3º A aprovação prévia de que trata o § 2º deverá ser solicitada em até 90 (noventa) dias antes do término do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 30, § 3º)
§ 4º Os equipamentos e/ou materiais permanentes advindos de Projetos de Apoio findados deverão estar previstos no plano de trabalho do novo Projeto de Apoio sem previsão de custos relativos a sua aquisição e já indicada a propriedade do beneficiário. (Origem: PRT MS/GM 2814/2014, Art. 30, § 4º)
§ 5º No caso de projeto de pesquisa que preveja a aquisição de equipamentos que não possuam registro ou cadastro junto à ANVISA, a destinação desses seguirá as normas sanitárias em vigor. (Origem: PRT MS/GM 2814/2014, Art. 30, § 5º)
Seção IV
Das Alterações dos Projetos de Apoio
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção IV)
Art. 31. A entidade de saúde de reconhecida excelência poderá requerer à SE/MS alterações aos Projetos de Apoio durante a sua execução. (Origem: PRT MS/GM 2814/2014, Art. 31)
§ 1º O requerimento de alteração do Projeto de Apoio deverá conter informações suficientes para análise de mérito pela Secretaria ou entidade vinculada competente e responsável pelo monitoramento e avaliação, em especial: (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º)
I - justificativa para alteração de valor; (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º, I)
II - prorrogação ou redução de vigência do projeto; e (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º, II)
III - proposta de readequação da execução físico-financeira e os respectivos cronogramas de atividades e desembolsos, quando couber. (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º, III)
§ 2º A alteração do valor despendido no Projeto de Apoio deverá observar o disposto no § 2º do art. 11 da Lei nº 12.101, de 2009, considerando-se, nesse caso, o valor estimado da isenção tributária previsto no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 31, § 2º)
§ 3º É vedado à entidade de saúde de reconhecida excelência executar despesas em Projeto de Apoio sem a prévia autorização do Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 31, § 3º)
§ 4º As despesas executadas em desacordo ao estabelecido no §3º são de responsabilidade exclusiva da entidade de saúde, vedada a possibilidade de serem relacionadas ao montante da isenção tributária prevista no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 31, § 4º)
Art. 32. A SE/MS tramitará os requerimentos de alteração dos Projetos de Apoio, no prazo de 5 (cinco) dias contados da data de seu recebimento, para análise e emissão de parecer técnico conclusivo pela Secretaria ou entidade vinculada compete e responsável pelo monitoramento e avaliação do Projeto, para emissão de parecer técnico conclusivo no prazo de 45 (quarenta e cinco) dias, contados da data de tramitação. (Origem: PRT MS/GM 2814/2014, Art. 32)
§ 1º A Secretaria ou entidade vinculada competente poderá solicitar à entidade de saúde de reconhecida excelência complementação ao requerimento de alteração do Projeto de Apoio, incluindo outras informações não mencionadas no Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 32, § 1º)
§ 2º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de 10 (dez) dias, contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 32, § 2º)
Art. 33. A SE/MS dará conhecimento à entidade de saúde de reconhecida excelência acerca da aprovação ou não da alteração requerida, no prazo de 5 (cinco) dias contados a partir da data de seu recebimento do processo. (Origem: PRT MS/GM 2814/2014, Art. 33)
Art. 34. O requerimento de alteração do Projeto de Apoio deverá ser apresentado com prazo que viabilize a sua análise e aprovação ainda dentro da vigência do Projeto de Apoio, considerados os prazos de análise e encaminhamento previstos nesta Seção. (Origem: PRT MS/GM 2814/2014, Art. 34)
Art. 35. As alterações do Projeto de Apoio serão promovidas por Termo Aditivo aprovado pela Secretaria ou entidade vinculada competente e publicado no DOU, observado o modelo constante do Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 35)
§ 1º Fica dispensada a formalização de Termo Aditivo nas alterações aos Projetos de Apoio que digam respeito exclusivamente a: (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º)
I - alteração de cronograma físico-financeiro de execução do Projeto de Apoio, incluída redução de vigência; (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º, I)
II - inclusão ou exclusão de recursos financeiros no Projeto de Apoio, em decorrência de alterações de mercado, devidamente justificadas e confirmadas pela Secretaria ou entidade vinculada competente, que exijam o reequilíbrio econômico-financeiro, desde que mantido idêntico o objeto definido no Projeto; e (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º, II)
III - correção de erros materiais. (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º, III)
§ 2º Nos casos previstos no §1º, a alteração será promovida por simples apostilamento, definido como o registro da alteração no Projeto de Apoio formalizado. (Origem: PRT MS/GM 2814/2014, Art. 35, § 2º)
CAPÍTULO V
DO MONITORAMENTO E AVALIAÇÃO DOS PROJETOS DE APOIO
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V)
Seção I
Do Monitoramento
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção I)
Art. 36. O processo de monitoramento do Projeto de Apoio será realizado pela Secretaria ou entidade vinculada competente com o objetivo de resguardar a adequada execução do plano de trabalho aprovado, podendo contar com visitas ou inspeções "in loco" e podendo ensejar a determinação de reorientação de ações, caso se entenda pelo descumprimento do plano de trabalho. (Origem: PRT MS/GM 2814/2014, Art. 36)
§ 1º Em caso de determinação de reorientação de ações, as medidas tomadas pela entidade de saúde de reconhecida excelência serão informadas no próximo relatório de atividades a ser apresentado. (Origem: PRT MS/GM 2814/2014, Art. 36, § 1º)
§ 2º A Secretaria ou entidade vinculada competente poderá solicitar auxílio do Conselho Nacional de Secretários de Saúde (CONASS) ou do Conselho Nacional de Secretarias Municipais de Saúde para realização de diligências que julgue necessárias, observado o modelo constante do Anexo 5 do Anexo XCIII , no que couber. (Origem: PRT MS/GM 2814/2014, Art. 36, § 2º)
Seção II
Da Avaliação
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção II)
Art. 37. A prestação de contas e avaliação dos Projetos de Apoio ocorrerá mediante a apresentação, pela entidade de saúde de reconhecida excelência à SE/MS, de relatórios semestrais, anuais e final relativos a cada Projeto, conforme modelos dos Anexos 9, 10 e 11 do Anexo XCIII , sem prejuízo de outras informações que venham a ser solicitadas pelas Secretarias ou entidades vinculadas competentes. (Origem: PRT MS/GM 2814/2014, Art. 37)
Subseção I
Do Relatório Semestral de Atividades
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção II, Subeção I)
Art. 38. O relatório semestral de atividades compreenderá o período de 1º de janeiro a 30 de junho de cada ano e será apresentado pela entidade de saúde de reconhecida excelência até 31 de agosto do mesmo ano considerado, contendo, no mínimo, informações sobre: (Origem: PRT MS/GM 2814/2014, Art. 38)
I - o conteúdo das atividades previstas e executadas; e (Origem: PRT MS/GM 2814/2014, Art. 38, I)
II - o desempenho físico do Projeto de Apoio em relação ao previsto no plano de trabalho, observado o disposto no Anexo 9 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 38, II)
§ 1º O relatório semestral de atividades deverá ser protocolado pela entidade de saúde na SE/MS, que, no prazo de 5 (cinco) dias contados do protocolo, o remeterá à Secretaria ou à entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 38, § 1º)
§ 2º A Secretaria ou entidade vinculada competente emitirá, no prazo de 30 (trinta) dias contados do recebimento do processo, parecer de recomendação sobre o conteúdo do relatório semestral, com apontamentos e indicação de medidas corretivas reputadas necessárias à devida execução do Projeto de Apoio, quando couber. (Origem: PRT MS/GM 2814/2014, Art. 38, § 2º)
§ 3º Para fins de elaboração do parecer de que trata o § 2º, a Secretaria ou entidade vinculada competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão do parecer de recomendação ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 38, § 3º)
§ 4º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 3º, o parecer de recomendação será emitido com as informações que constem do processo, sabendo-se que o não atendimento de apontamentos e medidas corretivas indicadas pela Secretaria ou entidade vinculada competente poderá ensejar a reprovação do relatório anual de atividades do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 38, § 4º)
Art. 39. A SE/MS dará conhecimento à entidade de saúde acerca do parecer de recomendação em até 5 (cinco) dias contados do recebimento proveniente da Secretaria ou entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 39)
Subseção II
Do Relatório Anual de Atividades
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção II, Subeção II)
Art. 40. O relatório anual de atividades compreenderá o período de 1º de janeiro a 31 de dezembro de cada ano e será apresentado pela entidade de saúde de reconhecida excelência até 30 de abril do ano seguinte, contendo, no mínimo, informações sobre: (Origem: PRT MS/GM 2814/2014, Art. 40)
I - o conteúdo e o valor das atividades previstas e executadas; e (Origem: PRT MS/GM 2814/2014, Art. 40, I)
II - demais informações acerca dos desempenhos físico e financeiro do Projeto de Apoio em relação ao previsto no plano de trabalho, observado o disposto nos Anexos 9 e 10 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 40, II)
Parágrafo Único. O relatório anual de atividades será apresentado acompanhado de parecer de auditoria independente, contratada pela entidade de saúde de reconhecida excelência em contrato específico para cada Projeto ou para o conjunto de Projetos de Apoio vinculados ao Termo de Ajuste daquela entidade. (Origem: PRT MS/GM 2814/2014, Art. 40, Parágrafo Único)
Art. 41. O relatório anual de atividades será acompanhado, no mínimo, dos seguintes documentos: (Origem: PRT MS/GM 2814/2014, Art. 41)
I - relação de equipamentos, incluindo os de informática, e materiais permanentes adquiridos para as atividades do Projeto de Apoio, com o número e/ou identificação do Projeto para controle em inventário físico específico e com as respectivas notas fiscais comprobatórias da aquisição; (Origem: PRT MS/GM 2814/2014, Art. 41, I)
II - relação de serviços contratados para execução das atividades do Projeto de Apoio, arrolada em tabela separada, discriminando a personalidade jurídica do fornecedor, sua identificação, breve descrição dos serviços prestados e respectivos valores dispendidos, com as respectivas notas fiscais; (Origem: PRT MS/GM 2814/2014, Art. 41, II)
III - os demonstrativos de resultados por centro de custos, quando pertinente; e (Origem: PRT MS/GM 2814/2014, Art. 41, III)
IV - relatório técnico-científico do projeto de pesquisa, quando for o caso, conforme Anexo 12 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 41, IV)
Parágrafo Único. Quando se tratar da contratação de pessoa jurídica para atuação em mais de um Projeto de Apoio, com emissão de única nota fiscal, a entidade de saúde de reconhecida excelência deverá discriminar, nos respectivos relatórios anuais, os valores dispendidos por Projeto, juntando-se cópia da nota fiscal em todos os relatórios anuais de que fizer parte. (Origem: PRT MS/GM 2814/2014, Art. 41, Parágrafo Único)
Art. 42. A apuração de eventuais ajustes contábeis no Projeto de Apoio deverá observar a vigência do Termo de Ajuste, não sendo permitido remanejamento de saldo financeiro ou de qualquer outro recurso para o Termo de Ajuste subsequente. (Origem: PRT MS/GM 2814/2014, Art. 42)
Art. 43. O relatório anual de atividades será protocolado pela entidade de saúde de reconhecida excelência na SE/MS, que, no prazo de 5 (cinco) dias contados da data do protocolo, o remeterá à Secretaria ou à entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 43)
Art. 44. A Secretaria ou entidade vinculada competente realizará análise técnica e econômico-financeira das atividades executadas, com auxílio da SE/MS quando necessário, para, no prazo de até 45 (quarenta e cinco) dias a contar da data do recebimento do processo, emitir parecer técnico conclusivo, que analisará os aspectos técnicos das execuções física e financeira do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 44)
§ 1º Para fins de elaboração do parecer de que trata o "caput", a Secretaria ou entidade vinculada competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão dos pareceres ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 44, § 1º)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer conclusivo será emitido com as informações que constem do processo, sabendo-se que o não atendimento de apontamentos e medidas corretivas indicadas pela Secretaria ou entidade vinculada competente quando do parecer de recomendação do relatório semestral poderá ensejar a reprovação do relatório anual de atividades do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 44, § 2º)
Art. 45. Em caso de reprovação do relatório anual de atividades, o Projeto de Apoio correspondente será excluído do Termo de Ajuste, sem prejuízo de se considerar executados os recursos aplicados em resultados obtidos com a execução até o momento da primeira notificação que tenha indicado a necessidade de apontamentos e medidas corretivas. (Origem: PRT MS/GM 2814/2014, Art. 45)
Parágrafo Único. O valor anual que for considerado como não executado em razão da reprovação do relatório anual de atividades, bem como os valores remanescentes, quando houver, deverá ser objeto de novo Projeto de Apoio ou de inclusão em Projeto já em curso, com vistas à observância do emprego total do valor de isenção tributária constante do Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 45, Parágrafo Único)
Art. 46. A SE/MS dará conhecimento à entidade de saúde de reconhecida excelência acerca do parecer de análise do relatório anual de atividades em até 5 (cinco) dias contados do recebimento do processo. (Origem: PRT MS/GM 2814/2014, Art. 46)
Seção III
Do Relatório Final de Atividades
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção III)
Art. 47. Ao final do triênio de vigência do Termo de Ajuste, a entidade de saúde de reconhecida excelência apresentará relatório final de atividades de cada Projeto de Apoio executado, de forma a contemplar: (Origem: PRT MS/GM 2814/2014, Art. 47)
I - as informações relativas ao conteúdo e ao valor das atividades previstas e executadas de forma discriminada e por exercício fiscal; e (Origem: PRT MS/GM 2814/2014, Art. 47, I)
II - as informações acerca do desempenho físico e financeiro do Projeto em relação ao previsto no plano de trabalho, de acordo com o modelo constante do Anexo XI. (Origem: PRT MS/GM 2814/2014, Art. 47, II)
§ 1º O relatório final de atividades será apresentado no mesmo prazo do relatório anual de atividades referente ao último ano do triênio. (Origem: PRT MS/GM 2814/2014, Art. 47, § 1º)
§ 2º Nos Projetos referentes ao desenvolvimento de pesquisas, a entidade de saúde deverá encaminhar, ao término das atividades do Projeto de Apoio, relatório técnico-científico do projeto de pesquisa em versão impressa e digital conforme Anexo 11 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 47, § 2º)
Art. 48. O relatório final de atividades será protocolado pela entidade de saúde de reconhecida excelência na SE/MS, que, no prazo de 5 (cinco) dias contados da data do protocolo, o remeterá à Secretaria ou à entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 48)
Art. 49. A Secretaria ou entidade vinculada competente emitirá parecer técnico conclusivo do relatório final do Projeto, no prazo de 90 (noventa) dias a contar da data de sua tramitação, momento em que serão analisadas as execuções física e financeira do projeto, com apoio da SE/MS, quando necessário. (Origem: PRT MS/GM 2814/2014, Art. 49)
§ 1º Para fins de elaboração do parecer de que trata o "caput", a Secretaria ou entidade vinculada competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão dos pareceres ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 49, § 1º)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer conclusivo será emitido com as informações que constem do processo. (Origem: PRT MS/GM 2814/2014, Art. 49, § 2º)
§ 3º Admitir-se-á uma margem de execução de 10% (dez por cento) para mais ou para menos com relação ao valor total do Projeto de Apoio, sem que seja necessária autorização prévia do Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 49, § 3º)
§ 4º No caso de diferença a menor, a entidade de saúde de reconhecida excelência deverá viabilizar a inclusão do valor faltante em algum dos Projetos de Apoio vinculados ao Termo de Ajuste, de modo a garantir que o valor total empregado no conjunto dos Projetos não seja inferior ao valor da isenção das contribuições sociais usufruída, observados os fluxos e prazos previstos Anexo XCIII. (Origem: PRT MS/GM 2814/2014, Art. 49, § 4º)
CAPÍTULO VI
DOS PROJETOS ASSISTENCIAIS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO VI)
Art. 50. A entidade de saúde de reconhecida excelência poderá aplicar até 30% (trinta por cento) do valor da isenção usufruída em prestação de serviços públicos de saúde ambulatoriais e hospitalares ao SUS, mediante pacto com o gestor local do SUS. (Origem: PRT MS/GM 2814/2014, Art. 50)
§ 1º A prestação de serviços de saúde ambulatoriais e hospitalares no âmbito do PROADI-SUS constará do Termo de Ajuste firmado entre a entidade de saúde de reconhecida excelência e o Ministério da Saúde e não será remunerada pelo SUS. (Origem: PRT MS/GM 2814/2014, Art. 50, § 1º)
§ 2º A entidade de saúde deverá apresentar ao gestor local do SUS plano de trabalho com previsão de atendimento e detalhamento de custos, os quais não poderão exceder o valor por ela efetivamente despendido. (Origem: PRT MS/GM 2814/2014, Art. 50, § 2º)
Art. 51. A prestação de serviços de saúde ambulatoriais e hospitalares será apresentada por meio de carta-consulta a ser apresentada pela entidade de saúde de reconhecida excelência, conforme Anexo 1 do Anexo XCIII , a ser analisada pelo Comitê de Avaliação e aprovada pelo Comitê Gestor do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 51)
Art. 52. Aprovada a Carta-Consulta, o Projeto Assistencial deverá ser apresentado no prazo de 60 (sessenta) dias e será acompanhada de Declaração de Anuência do gestor local do SUS, dando ciência e concordando com os termos deste Anexo, na forma do Anexo 8 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 52)
§ 1º A responsabilidade pelo acompanhamento, monitoramento, avaliação e prestação de contas dos Projetos Assistenciais caberá ao gestor local do SUS que anuiu com o referido Projeto. (Origem: PRT MS/GM 2814/2014, Art. 52, § 1º)
§ 2º Aplicam-se aos Projetos Assistenciais, naquilo que couber, os dispositivos previstos neste Anexo para os Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 52, § 2º)
Art. 53. A prestação de serviços públicos de saúde de que trata este Capítulo deverá ser comprovada para fins de obtenção do CEBAS-saúde, observada a regulamentação respectiva. (Origem: PRT MS/GM 2814/2014, Art. 53)
Art. 54. Projetos Assistenciais que prevejam a realização de procedimentos de alta complexidade constantes da relação dos procedimentos regulados pela Central Nacional de Regulação de Alta Complexidade (CNRAC) conterão previsão expressa acerca da necessária regulação pela referida Central, observadas as vigências do respectivo Termo de Ajuste ou Termo Aditivo e as exigências referentes ao credenciamento ou habilitação conforme as especificidades dos Projetos. (Origem: PRT MS/GM 2814/2014, Art. 54)
CAPÍTULO VII
DA UTILIZAÇÃO DA ISENÇÃO FISCAL DECORRENTE DA EXECUÇÃO DOS PROJETOS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO VII)
Art. 55. Quando da análise dos relatórios anuais dos Projetos de Apoio, a SE/MS expedirá certidão que atesta o valor anual executado dos Projetos pelas entidades de saúde de reconhecida excelência, de acordo com os pareceres conclusivos elaborados pelas Secretarias ou entidades vinculadas competentes e pelos gestores locais de saúde. (Origem: PRT MS/GM 2814/2014, Art. 55)
§ 1º Nos dois primeiros anos do triênio, a SE/MS admitirá uma margem de execução de até 10% (dez por cento) para menos com relação ao valor total da isenção gozada pela entidade de saúde de reconhecida excelência no exercício fiscal a que se refere a certidão a ser expedida. (Origem: PRT MS/GM 2814/2014, Art. 55, § 1º)
§ 2º A certidão de que trata o "caput" será emitida até 31 de outubro do exercício fiscal subsequente e será enviada às respectivas entidades de saúde de reconhecida excelência e ao Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde (DCEBAS/SAS/MS), em até 5 (cinco) dias após sua emissão. (Origem: PRT MS/GM 2814/2014, Art. 55, § 2º)
Art. 56. A isenção fiscal apurada anualmente deverá ser comprovada por meio de relatório de auditoria, acompanhado dos seguintes demonstrativos contábeis: (Origem: PRT MS/GM 2814/2014, Art. 56)
I - Balanço Patrimonial; (Origem: PRT MS/GM 2814/2014, Art. 56, I)
II - Demonstração do Resultado do Exercício Fiscal; (Origem: PRT MS/GM 2814/2014, Art. 56, II)
III - Demonstração da Mutação de Patrimônio; (Origem: PRT MS/GM 2814/2014, Art. 56, III)
IV - Demonstração de Fluxo de Caixa; (Origem: PRT MS/GM 2814/2014, Art. 56, IV)
V - Notas Explicativas; e (Origem: PRT MS/GM 2814/2014, Art. 56, V)
VI - Demonstrativo de Execução Financeira do Projeto. (Origem: PRT MS/GM 2814/2014, Art. 56, VI)
Art. 57. No último exercício fiscal do Termo de Ajuste, caso o valor despendido no conjunto de Projetos de Apoio e Projetos Assistenciais de prestação de serviços públicos de saúde ambulatoriais e hospitalares ao SUS vinculados ao Termo de Ajuste seja inferior ao valor da isenção das contribuições sociais usufruída, as entidades deverão compensar a diferença até o término do prazo de validade de sua certificação, desde que tenham aplicado, no mínimo, 70% (setenta por cento) do valor usufruído anualmente com a isenção das contribuições sociais nos Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 57)
CAPÍTULO VIII
DO SISTEMA DE GESTÃO DE PROJETOS DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SUS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO VIII)
Art. 58. Fica instituído o Sistema de Gestão dos Projetos do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (SISPROADI-SUS), como o sistema oficial de gestão dos projetos de apoio apresentados ao PROADI-SUS, sob a supervisão da Secretaria-Executiva do Ministério da Saúde em parceria com o DATASUS. (Origem: PRT MS/GM 2814/2014, Art. 58)
§ 1º Os atos e procedimentos relativos aos processos no âmbito do PROADI-SUS deverão ser registrados pelo Ministério da Saúde, entidades vinculadas e pelas entidades de saúde de reconhecida excelência por meio do SISPROADI-SUS, nos termos deste Anexo. (Origem: PRT MS/GM 2814/2014, Art. 58, § 1º)
§ 2º Até que seja possível a utilização plena do SISPROADI-SUS para gestão dos processos no âmbito do PROADI-SUS, toda documentação deverá ser protocolada e tramitada fisicamente. (Origem: PRT MS/GM 2814/2014, Art. 58, § 2º)
Art. 59. Caberá à SE/MS: (Origem: PRT MS/GM 2814/2014, Art. 59)
I - fazer a gestão do SISPROADI-SUS, observado o disposto neste Anexo; (Origem: PRT MS/GM 2814/2014, Art. 59, I)
II - zelar pelas informações geradas no SISPROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 59, II)
III - articular internamente no Ministério da Saúde ou com órgãos dos Governos Federal, Estadual e Municipal, a integração do SISPROADI-SUS com outros sistemas de informações, quando necessário; (Origem: PRT MS/GM 2814/2014, Art. 59, III)
IV - acompanhar no SISPROADI-SUS o andamento dos projetos durante todo o fluxo processual; (Origem: PRT MS/GM 2814/2014, Art. 59, IV)
V - realizar o treinamento e divulgar informações de interesse dos usuários do Sistema; e (Origem: PRT MS/GM 2814/2014, Art. 59, V)
VI - auxiliar o DATASUS, as Secretarias e entidades vinculadas competentes e as entidades de saúde de reconhecida excelência na implantação do SISPROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 59, VI)
Art. 60. Ato específico do Ministro de Estado da Saúde definirá os procedimentos e fluxos do SISPROADI-SUS, especialmente para: (Origem: PRT MS/GM 2814/2014, Art. 60)
I - disponibilizar endereço eletrônico do SISPROADI-SUS na rede mundial de computadores; (Origem: PRT MS/GM 2814/2014, Art. 60, I)
II - zelar pela segurança e armazenamento das informações cadastradas e/ou geradas pelo SISPROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 60, II)
III - garantir a publicidade e a transparência das informações do SISPROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 60, III)
IV - realizar a integração do SISPROADI-SUS com outros sistemas de informações; e (Origem: PRT MS/GM 2814/2014, Art. 60, IV)
V - disponibilizar central de atendimento ao usuário do SISPROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 60, V)
Art. 61. Todos os atos referentes à submissão, análise, aprovação, celebração, execução, acompanhamento, alteração, prestação de contas e fiscalização dos Termos de Ajustes, Cartas-consulta, Projetos de Apoio e Projetos Assistenciais referentes ao triênio 2015-2017 e posteriores deverão ser registrados no SISPROADI-SUS, observado o art. 58, § 2º . (Origem: PRT MS/GM 2814/2014, Art. 61)
CAPÍTULO IX
DOS RECURSOS ADMINISTRATIVOS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IX)
Art. 62. Caberá recurso dirigido à autoridade que proferiu a decisão, com efeito suspensivo: (Origem: PRT MS/GM 2814/2014, Art. 62)
I - da decisão que não aprovar Projeto de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 62, I)
II - da decisão que não aprovar o pedido de alteração de Projeto de Apoio; e (Origem: PRT MS/GM 2814/2014, Art. 62, II)
III - da decisão que não aprovar o relatório anual de atividades do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 62, III)
Art. 63. O prazo para interposição de recurso será de 10 (dez) dias, contados da notificação da entidade de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 63)
Art. 64. Caso a autoridade que proferiu a decisão recorrida não a reconsiderar no prazo de 10 (dez) dias, de forma fundamentada, o recurso será encaminhado ao Comitê de Avaliação do PROADI-SUS, para análise e posterior encaminhamento ao Comitê Gestor do PROADI-SUS, para deliberação final. (Origem: PRT MS/GM 2814/2014, Art. 64)
Art. 65. Aplicam-se a este Capítulo, supletivamente, as regras constantes no Capítulo XV da Lei nº 9.784, de 29 de janeiro de 1999, que regula o processo administrativo no âmbito da Administração Pública Federal. (Origem: PRT MS/GM 2814/2014, Art. 65)
CAPÍTULO X
DA APROVAÇÃO DAS MINUTAS E DA PUBLICIDADE
(Origem: PRT MS/GM 2814/2014, CAPÍTULO X)
Art. 66. As minutas do Termo de Ajuste e dos Projetos de Apoio, bem como dos respectivos Termos Aditivos, serão submetidas previamente à Consultoria Jurídica junto ao Ministério da Saúde para emissão de parecer, que deverá ser emitido no prazo máximo de 20 (vinte) dias a contar da data do seu recebimento. (Origem: PRT MS/GM 2814/2014, Art. 66)
Parágrafo Único. Caso o prazo previsto no "caput" seja descumprido, o processo poderá retomar seu curso, a critério do DESID/SE/MS, sem prejuízo de manifestação posterior da Consultoria Jurídica junto ao Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 66, Parágrafo Único)
Art. 67. A eficácia dos Termos de Ajuste, Projetos de Apoio e respectivos Termos Aditivos ficará condicionada à publicação dos respectivos extratos no Diário Oficial da União, o que será providenciada pelo Ministério da Saúde, no prazo de até 20 (vinte) dias a contar da respectiva assinatura do documento. (Origem: PRT MS/GM 2814/2014, Art. 67)
CAPÍTULO XI
DISPOSIÇÕES GERAIS E TRANSITÓRIAS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO XI)
Art. 68. As entidades de saúde de reconhecida excelência poderão solicitar à SE/MS, com a devida exposição da finalidade e da aplicabilidade dos dados, a disponibilização dos bancos de dados provenientes de Projetos de Apoio desenvolvidos por outra entidade de saúde de reconhecida excelência, conforme política de segurança da informação e de acordo com as normas internas do Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 68)
Art. 69. Os prazos previstos neste Anexo começam a correr a partir da data da notificação oficial da entidade de saúde de reconhecida excelência, por documento ou por publicação na imprensa oficial, ou do recebimento do processo nas Secretarias e entidades vinculadas ao Ministério da Saúde, excluindo-se da contagem o dia do começo e incluindo-se o do vencimento. (Origem: PRT MS/GM 2814/2014, Art. 69)
Parágrafo Único. Considera-se prorrogado o prazo até o primeiro dia útil seguinte se o vencimento cair em dia em que não houver expediente ou este for encerrado antes da hora normal. (Origem: PRT MS/GM 2814/2014, Art. 69, Parágrafo Único)
Art. 70. No último ano do triênio, as cartas-consulta e os pedidos de alteração de Projetos de Apoio deverão ser apresentados até 15 de maio, com vistas a viabilizar o cumprimento dos prazos definidos neste Anexo. (Origem: PRT MS/GM 2814/2014, Art. 70)
§ 1º Excepcionalmente, a entidade de saúde de reconhecida excelência poderá apresentar carta-consulta e/ou pedido de alteração de Projeto de Apoio entre 16 de maio e 31 de agosto do último ano do triênio, caso em que a aprovação ficará a critério do Comitê Gestor do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 70, § 1º)
§ 2º Em caso de aprovação pelo Comitê Gestor na forma do §1º, os prazos de tramitação e análise pelas Secretarias e entidades vinculadas competentes ficam reduzidos pela metade, considerando-se a metade o próximo número inteiro. (Origem: PRT MS/GM 2814/2014, Art. 70, § 2º)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO XCIII
DO PROGRAMA DE APOIO AO DESENVOLVIMENTO
INSTITUCIONAL DO SISTEMA ÚNICO DE SAÚDE - PROADISUS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO I
DAS DISPOSIÇÕES PRELIMINARES
Art. 1º Ficam estabelecidas as regras e os critérios para apresentação, análise, aprovação, monitoramento e prestação de contas de projetos de apoio e para a prestação de serviços ambulatoriais e hospitalares no âmbito do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde - PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 2º A entidade de saúde que se proponha a realizar projetos de apoio e prestar serviços ambulatoriais e hospitalares referentes ao PROADI-SUS deverá ser previamente reconhecida como de excelência pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O reconhecimento de excelência de que trata o caput deverá estar em conformidade com o estabelecido: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - na Lei nº 12.101, de 27 de novembro de 2009; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - no Decreto nº 8.242, de 23 de maio de 2014; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - em ato específico do Ministério da Saúde que defina os critérios e os requisitos para comprovação de efetiva capacidade institucional da entidade de saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° O reconhecimento de excelência terá validade de três anos contados da publicação da portaria que defere o requerimento da entidade de saúde, permitidas renovações por igual período. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° O protocolo do requerimento de renovação servirá como prova da excelência da entidade de saúde até o julgamento do processo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO II
DAS COMPETÊNCIAS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção I
Do Comitê Gestor do PROADI-SUS
Art. 3º O Comitê Gestor do PROADI-SUS é instância colegiada decisória composta pelas seguintes autoridades: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - Ministro de Estado da Saúde, que o presidirá; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - Presidente do Conselho Nacional de Secretários de Saúde - CONASS; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - Presidente do Conselho Nacional de Secretarias Municipais de Saúde - CONASEMS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º As autoridades enumeradas no caput poderão fazer-se representar por delegação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A participação no Comitê Gestor do PROADI-SUS será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 4º Compete ao Comitê Gestor do PROADI-SUS: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - deliberar sobre as propostas apresentadas de projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - deliberar sobre a aprovação dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - deliberar sobre as propostas de prestação de serviços ambulatoriais e hospitalares ao SUS não remunerado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - deliberar, com base em parecer de recomendação da área técnica, sobre a interrupção dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - formular proposições para o aprimoramento do PROADI- SUS; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - deliberar acerca dos casos omissos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O Comitê Gestor reunir-se-á em plenária ordinariamente, pelo menos uma vez por trimestre, e, extraordinariamente, mediante convocação de seu presidente, a qualquer momento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Por meio de registro em ata de reunião, o Comitê Gestor do PROADI-SUS poderá determinar ao Comitê Técnico do PROADISUS o cumprimento de finalidade específica. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º A Secretaria-Executiva - SE/MS funcionará como secretaria administrativa do Comitê Gestor do PROADI-SUS, auxiliando nas atividades da instância colegiada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º As deliberações do Comitê Gestor do PROADI-SUS serão tomadas por maioria, presentes todos os membros, e serão formalizadas por meio de atas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção II
Do Comitê Técnico do PROADI-SUS
Art. 5º O Comitê Técnico do PROADI-SUS é instância colegiada de assessoramento técnico do Comitê Gestor do PROADISUS, constituído pelos seguintes representantes: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - um da Secretaria-Executiva - SE/MS, que o coordenará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - dois da Secretaria de Atenção à Saúde - SAS/MS, sendo, pelo menos, um do Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde - DCEBAS/SAS/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - um da Secretaria de Ciência, Tecnologia e Insumos Estratégicos - SCTIE/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - um da Secretaria de Gestão Estratégica e Participativa - SGEP/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - um da Secretaria de Gestão do Trabalho e da Educação na Saúde - SGTES/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - um da Secretaria de Vigilância em Saúde - SVS/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - um da Secretaria Especial de Saúde Indígena - SESAI/ MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - um da Agência Nacional de Saúde Suplementar - ANS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - um da Agência Nacional de Vigilância Sanitária - ANVISA; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - um do Conselho Nacional de Saúde - CNS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - um do Conselho Nacional de Secretários de Saúde - CONASS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - um do Conselho Nacional de Secretarias Municipais de Saúde - CONASEMS; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIII - um representante das entidades de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º Os representantes, titulares e suplentes, serão indicados pelos dirigentes máximos das respectivas áreas técnicas e entidades à SE/MS, no prazo de trinta dias contados da data de publicação desta Portaria. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A SE/MS publicará portaria de designação dos representantes do Comitê Técnico do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O membro do Comitê Técnico do PROADI-SUS declarará formalmente, em ata, eventual conflito de interesses entre suas atividades profissionais e o tema objeto de deliberação do colegiado, sendo que, presente o conflito de interesses, abster-se-á de participar da discussão e da deliberação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A participação no Comitê Técnico do PROADI-SUS será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 6º Compete ao Comitê Técnico do PROADI-SUS subsidiar as decisões a serem tomadas pelo Comitê Gestor do PROADISUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º Com exceção das propostas de projetos de apoio e de prestação de serviços ambulatoriais e hospitalares, todas as demandas e processos que exigirem a deliberação do Comitê Gestor do PROADI-SUS serão previamente encaminhados ao Comitê Técnico do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º O Comitê Técnico do PROADI-SUS poderá designar, por meio de registro em ata de reunião, representantes para compor Grupos de Trabalho - GT para o cumprimento de finalidades específicas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O Comitê Técnico do PROADI-SUS reunir-se-á em plenária ordinariamente, pelo menos uma vez por trimestre, e, extraordinariamente, mediante convocação de seu coordenador, a qualquer momento, sempre com antecedência de, pelo menos, cinco dias úteis em relação às reuniões do Comitê Gestor. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º As deliberações do Comitê Técnico do PROADI-SUS serão tomadas por maioria, presente a maioria absoluta dos membros, cabendo ao coordenador a decisão final em caso de empate, e serão formalizadas por meio de atas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção III
Das Secretarias do Ministério da Saúde e Entidades Vinculadas
Art. 7º Compete à SE/MS: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - realizar a gestão administrativa do PROADI-SUS, centralizando, coordenando e monitorando o fluxo referente a: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
a) requerimentos de concessão ou de renovação do reconhecimento de excelência das entidades de saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
b) Termos de Ajuste e respectivos Termos Aditivos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
c) propostas de projetos de apoio para encaminhamento à deliberação do Comitê Gestor; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
d) projetos de apoio e documentos correlatos; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
e) propostas de prestação de serviços ambulatoriais e hospitalares e documentos correlatos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - notificar as entidades de saúde quanto à emissão de pareceres técnicos e às deliberações do Comitê Gestor do PROADISUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - apoiar administrativamente o Comitê Gestor e o Comitê Técnico do PROADI-SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - atestar o valor anual executado com projetos de apoio pelas entidades de saúde de reconhecida excelência e expedir a certidão prevista no art. 39 desta Portaria; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - promover a articulação entre as Secretarias do Ministério da Saúde, as autarquias federais e fundações públicas vinculadas ao Ministério da Saúde e as entidades de saúde de reconhecida excelência; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - notificar as entidades de saúde a prestar esclarecimentos a qualquer tempo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 8º Compete às áreas técnicas, representadas pelas demais secretarias do Ministério da Saúde: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - analisar, diligenciar e emitir parecer técnico recomendativo aos projetos de apoio referentes aos seus respectivos campos de atuação, para subsidiar o Comitê Gestor do PROADI-SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - analisar, diligenciar e autorizar as solicitações de alteração dos planos de trabalho dos projetos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - monitorar a execução dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - emitir parecer técnico conclusivo ao Relatório de Prestação de Contas Anual referente à execução física e financeira dos projetos de apoio e, ao final do projeto, avaliar os resultados alcançados; V - apreciar a solicitação de destinação de equipamentos e/ou materiais permanentes; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - emitir parecer técnico recomendativo relativo à interrupção de projetos de apoio, para subsidiar a deliberação do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. Às autarquias federais e fundações públicas vinculadas ao Ministério da Saúde caberão atuar nos termos do caput, respeitadas suas respectivas áreas de competência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO III
DO TERMO DE AJUSTE
Art. 9º A entidade de saúde de reconhecida excelência firmará Termo de Ajuste com o Ministério da Saúde, o qual disciplinará os direitos e obrigações entre as partes referentes aos projetos de apoio e à prestação de serviços ambulatoriais e hospitalares ao SUS não remunerado no âmbito do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A celebração do Termo de Ajuste é condição necessária para a apresentação de projetos de apoio e para a prestação de serviços ambulatoriais e hospitalares ao SUS não remunerado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A entidade de saúde de reconhecida excelência que celebrar Termo de Ajuste com o Ministério da Saúde, nos termos do Capítulo III desta Portaria, deverá apresentar projetos de apoio ou planos de trabalho para prestação de serviços ambulatoriais e hospitalares em até cento e vinte dias da publicação do extrato do respectivo Termo de Ajuste no Diário Oficial da União. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° O Termo de Ajuste deve estar em consonância com o valor estimado da isenção tributária a ser obtida pela entidade de saúde de reconhecida excelência para o triênio de vigência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 10. São cláusulas necessárias ao Termo de Ajuste: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o objeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o prazo de vigência do Termo de Ajuste, que será de até três anos, o qual deverá ficar limitado ao período remanescente do triênio do PROADI-SUS, admitida uma única prorrogação por igual período; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - o valor estimado da isenção tributária a ser usufruída pela entidade de saúde de reconhecida excelência durante a vigência do Termo de Ajuste; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - os direitos, obrigações e responsabilidades das partes, especialmente a obrigatoriedade de a entidade de saúde de reconhecida excelência apresentar, regularmente e sempre que requerida, as informações e os documentos, com a devida atualização, exigidos pelo Ministério da Saúde, suas autarquias ou fundações públicas vinculadas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a definição dos dados e informações confidenciais considerados como direito à intimidade das pessoas, sigilo profissional e intelectual, os quais deverão estar em estrita observância à legislação pertinente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - o monitoramento e a avaliação dos projetos de apoio vinculados ao Termo de Ajuste, nos termos do art. 8º; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a obrigação da prestação de contas nos termos desta Portaria; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a prestação de serviços ambulatoriais e hospitalares, se for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - as vedações impostas às partes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - as hipóteses de rescisão; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - o prazo de publicação do extrato do termo de ajuste; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - a indicação do foro da sede do Ministério da Saúde para dirimir as dúvidas decorrentes da execução dos projetos vinculados ao Termo de Ajuste; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIII - a competência do Comitê Gestor do PROADI-SUS para decidir acerca de casos omissos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. O valor total da isenção tributária apurada no exercício fiscal anterior, comprovado por meio de demonstração contábil, deverá ser informado, anualmente, ao Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 11 O Termo de Ajuste deverá dispor ainda sobre: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - a observância aos requisitos previstos nas normas de ética em pesquisas vigentes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a disponibilização dos recursos materiais instrucionais na rede mundial de computadores para entidades públicas e privadas, sem fins lucrativos e certificadas como beneficentes, mediante licença de uso de interesse do SUS, vedado o uso privado e comercial; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a divulgação e a publicidade dos produtos decorrentes da realização do projeto de apoio, previamente aprovadas pelo Ministério da Saúde, bem como menção à parceria firmada com o Ministério da Saúde no âmbito do PROADI-SUS, de acordo com a Lei nº 12.101, de 2009; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a obrigatoriedade do respeito às normas de editoração do Ministério da Saúde, quando algum tipo de publicação resultar do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a previsão de publicação de artigos científicos em outros idiomas com fins de divulgação dos produtos decorrentes da realização do projeto de apoio, que não substituirá a entrega de relatório contendo metodologia detalhada e conjunto dos resultados obtidos em vernáculo; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a previsão de participação e apresentação de trabalhos (parciais ou completos) em eventos nacionais e internacionais e menção à parceria firmada no âmbito do PROADI-SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a previsão de doação dos bens permanentes adquiridos, nos termos do art. 32; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a previsão de que as despesas executadas que excedam o valor da isenção das contribuições sociais usufruída são de responsabilidade exclusiva da entidade de saúde de reconhecida excelência, vedada a possibilidade de serem computadas no valor da isenção das contribuições sociais usufruída; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a previsão de vedação de executar despesas em projeto de apoio que não tenham sido previstas no plano de trabalho ou no requerimento de alteração do projeto de apoio e previamente aprovadas pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A titularidade dos direitos patrimoniais advindos das pesquisas científicas, dos programas desenvolvidos, bem como dos resultados tecnológicos decorrentes dos recursos do projeto de apoio referentes ao PROADI-SUS será do Ministério da Saúde, respeitados os direitos morais do autor, nos termos da Lei nº 9.610, de 19 de fevereiro de 1998, e de outras normas aplicáveis. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Todos os produtos deverão ser apresentados previamente à divulgação para ciência e aprovação do Ministério da Saúde, na língua oficial do país. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 12 Os Termos de Ajuste serão submetidos previamente à Consultoria Jurídica junto ao Ministério da Saúde para emissão de parecer. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° As entidades de saúde de reconhecida excelência deverão apresentar solicitação para celebração ou prorrogação do Termo de Ajuste até 31 de agosto do exercício fiscal anterior ao início do triênio do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º O Ministério da Saúde terá o prazo de até cento e vinte dias para decidir sobre a solicitação de prorrogação prevista no parágrafo § 1º. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° No último ano de vigência dos Termos de Ajuste, os projetos de apoio e de prestação de serviços ambulatoriais e hospitalares para o triênio subsequente poderão ser autorizados e aprovados pelo Comitê Gestor do PROADI-SUS, condicionados à prévia celebração do Termo de Ajuste e desde que o início da execução dos projetos de apoio e dos serviços ocorra somente no exercício fiscal subsequente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A publicação do extrato de Termo de Ajuste no Diário Oficial da União, que é condição indispensável para sua eficácia, será providenciada pelo Ministério da Saúde até o quinto dia útil do mês seguinte ao de sua assinatura, para ocorrer no prazo de até vinte dias daquela data, e conterá: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - numeração sequencial e exclusiva para o PROADISUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o número de registro no Sistema Eletrônico de Informações (SEI) do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a qualificação das partes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - o objeto e a finalidade do Termo de Ajuste; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o valor de isenção estimado para o triênio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º O valor da isenção das contribuições sociais deverá ser estimado com base no exercício fiscal anterior ao da celebração do Termo de Ajuste ou mediante projeção econômica com justificativa e memória de cálculo apresentadas pela entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6º O valor total executado dos projetos de apoio e dos serviços ambulatoriais e hospitalares ao SUS não poderá ser inferior ao valor da isenção das contribuições sociais usufruída, em observância ao disposto no § 2º do art. 11 da Lei nº 12.101, de 2009. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º As despesas executadas que excedam o valor da isenção das contribuições sociais usufruída são de responsabilidade exclusiva da entidade de saúde de reconhecida excelência, vedada a possibilidade de serem computadas no valor da isenção das contribuições sociais usufruída. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 13 O Termo de Ajuste poderá ser alterado, no decorrer de sua vigência, mediante celebração de Termo Aditivo, com as devidas justificativas e comprovações. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A atualização do valor estimado da isenção a ser usufruída pela entidade de saúde de reconhecida excelência será formalizada anualmente por meio de apostilamento ao Termo de Ajuste, em consonância com os termos do parágrafo único do art. 10. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 14 O Termo de Ajuste poderá ser rescindido nos seguintes casos: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - a pedido da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - na hipótese de revogação ou de não renovação do reconhecimento de excelência da entidade de saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - quando houver superveniência de norma legal com ele incompatível; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - na hipótese de inobservância de qualquer de suas cláusulas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º No caso do inciso I do caput, a entidade de saúde de reconhecida excelência permanecerá obrigada à execução dos projetos de apoio que estejam em andamento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Nos casos dos incisos II, III e IV do caput, a rescisão do Termo de Ajuste será precedida de notificação formal e fundamentada, garantida a apresentação de defesa no prazo de dez dias. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO IV
DA APRESENTAÇÃO E APROVAÇÃO DOS PROJETOS
DE APOIO
Art. 15 A apresentação de propostas de projetos de apoio poderá ser realizada pelas entidades de reconhecida excelência, pelas áreas técnicas, pelo CONASS e pelo CONASEMS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A proposta deverá ser apresentada à SE/MS com antecedência de, pelo menos, cinco dias úteis em relação às reuniões do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A proposta de projeto de apoio deverá conter, no mínimo: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o nome do órgão ou entidade proponente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a entidade de saúde de reconhecida excelência executora do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a área técnica responsável pelo projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a área de atuação pretendida; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o título do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - os objetivos do projeto, inclusive aquele(s) do Plano Nacional de Saúde ao(s) qual(is) o projeto se vinculará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a abrangência territorial; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a justificativa e a relevância do projeto para o SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a proposta sumarizada do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - o período de execução estimado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - a estimativa orçamentária preliminar; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - as informações adicionais e os anexos, quando necessários. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° A recomendação ou a autorização para apresentação de projeto de apoio originário, respectivamente, do Comitê Técnico ou do Comitê Gestor do PROADI-SUS deverá fazer menção, no mínimo, aos itens dispostos nos incisos I a VIII do § 2° deste artigo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção I
Da Apresentação dos Projetos de Apoio
Art. 16 A entidade de saúde de reconhecida excelência somente poderá protocolar o projeto de apoio após a autorização do Comitê Gestor do PROADI-SUS de que trata o inciso I do art. 4°. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° Os projetos de apoio serão protocolados na SE/MS, que os formalizará em processos administrativos independentes, respeitando-se a vigência do Termo de Ajuste ao qual será vinculado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° Nos casos de projetos referentes à realização de pesquisa, a entidade de saúde de reconhecida excelência enviará versão digital do projeto de apoio ao Comitê de Ética em Pesquisa - CEP ou ao Comitê de Ética no Uso de Animais - CEUA. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 17 Os projetos de apoio deverão ser classificados em, pelo menos, um dos objetivos do Plano Nacional de Saúde e em uma das seguintes áreas de atuação, destacando-se a relevância e o potencial de contribuição do projeto para a governança do SUS: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - estudos de avaliação e incorporação de tecnologia: projetos de desenvolvimento de estudos de avaliação e incorporação de tecnologias; revisão sistemática de literatura; meta-análise de estudos clínicos; estudos clínicos; desenvolvimento de pesquisas e tecnologias úteis ao SUS para fins de diagnóstico, tratamento ou controle de doenças e promoção da qualidade de vida, buscando impacto nos determinantes de saúde com recorte étnico-racial e de gênero; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - capacitação de recursos humanos: projetos para realização de cursos; seminários; palestras; formação e capacitação em serviços destinados à qualificação de profissionais de saúde/gestão de serviços, de acordo com as necessidades identificadas pelos gestores do SUS e Política Nacional de Educação na Saúde, em consonância com as diretrizes traçadas pelo Ministério da Saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - pesquisas de interesse público em saúde: projetos para realização de pesquisas relacionadas à promoção e à recuperação da saúde, prevenção de doenças e agravos; monitoramento; avaliação; mensuração de resultados de políticas/programas de saúde com recorte étnico-racial e de gênero; ou (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - desenvolvimento de técnicas e operação de gestão em serviços de saúde: desenvolvimento e implantação de técnicas operacionais, sistemas e tecnologias da informação e avaliação de projetos alinhados com a gestão de serviços de saúde vinculados ao SUS; da racionalização de custos e ampliação da eficiência operacional dos serviços e sistemas regionais, com o desenvolvimento de controle de doenças no âmbito populacional, avançando nas metodologias estruturadas em torno de metas em qualidade de vida e saúde, incluindo, se necessário, a compra de materiais, desenvolvimento de softwares e equipamentos requeridos para a melhor operação das áreas acima referidas, bem como a efetivação de adequações físicas e de instalações necessárias a essas incorporações. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 18 Os projetos de apoio apresentados pelas entidades de saúde de reconhecida excelência deverão conter, no mínimo, a seguinte estrutura: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - as informações da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a área de atuação do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a justificativa; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - os objetivos, inclusive aquele(s) do Plano Nacional de Saúde ao(s) qual(is) o projeto se vinculará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a metodologia; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - o cronograma de entregas, atividades e marcos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a previsão, com orçamento destacado, dos eventos anuais de avaliação dos resultados parciais e/ou finais dos projetos de apoio, conforme disposto no caput do artigo 27; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - o orçamento por plano de contas e orçamento por entregas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - o plano de gestão de riscos do projeto de apoio; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - as informações adicionais e os anexos, quando necessário. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 19. A entidade de saúde de reconhecida excelência deverá observar critérios de economicidade e prever o uso racional dos recursos públicos na proposta orçamentária do projeto, cujos parâmetros de custos estarão previstos no Manual Técnico de Elaboração, Análise e Prestação de Contas dos Projetos PROADI-SUS, conforme caput do art. 46. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. É vedada a terceirização pelas entidades de saúde das atividades de gestão do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção II
Da Análise e Aprovação dos Projetos de Apoio
Art. 20 A análise técnica e financeira do projeto de apoio, recomendando a aprovação, aprovação parcial ou reprovação, será realizada pela área técnica, no prazo de trinta dias contados da data de recebimento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 21 O parecer recomendativo de análise técnica e financeira do projeto de apoio, a ser emitido pelas áreas técnicas deverá conter, no mínimo, a seguinte estrutura: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o nome da Secretaria do Ministério da Saúde, da Autarquia Federal ou da Fundação Pública vinculada ao Ministério da Saúse responsável pelo projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o departamento responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a coordenação-geral responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - os dados do projeto, referenciando o título, área de atuação, vigência, data da reunião do Comitê Gestor do PROADISUS que aprovou a proposta do projeto, valor estimado total e por ano; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a análise da justificativa; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a análise dos objetivos, inclusive aquele(s) do Plano Nacional de Saúde ao(s) qual(is) o projeto se vinculará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a análise da metodologia e do cronograma de entregas, atividades e marcos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a análise dos orçamentos por plano de contas e por entregas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - a análise do plano de gestão de riscos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - recomendação de aprovação, aprovação com ressalvas ou reprovação; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - o valor a ser executado, quando couber. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 22 A área técnica poderá solicitar à entidade de saúde de reconhecida excelência complementação ao projeto de apoio apresentado, incluindo outras informações não mencionadas no art. 18 desta Portaria. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de quinze dias contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer técnico será emitido com as informações que constem do processo, devendo ser consignado o não atendimento da solicitação de informações indicadas pela área técnica. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 23 Os projetos de apoio a serem executados no âmbito do PROADI-SUS que envolverem o desenvolvimento e/ou aperfeiçoamento de soluções de Tecnologia da Informação deverão observar os princípios e as diretrizes estabelecidos pelo Departamento de Informática do SUS - DATASUS/SE/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. Para os fins previstos no caput, os projetos de apoio que envolverem o desenvolvimento e/ou aperfeiçoamento de soluções de Tecnologia da Informação serão objeto de análise técnica pelo DATASUS/SE/MS, que emitirá parecer técnico no prazo de quinze dias contados do recebimento do processo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 24 O projeto de apoio e o parecer recomendativo, devidamente chancelado pelo Secretário ou autoridade equivalente das autarquias e fundações públicas vinculadas, serão submetidos ao Comitê Gestor do PROADI-SUS para deliberação sobre a aprovação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A autorização para início da execução do projeto de apoio ocorrerá com a publicação pela SE/MS, no Diário Oficial da União, de extrato de projeto de apoio, contendo as seguintes informações: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o número do Termo de Ajuste a que será vinculado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o número de registro no Sistema Eletrônico de Informações - SEI; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a razão social da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - o título do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o objetivo do projeto de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - o período de execução; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - o valor a ser despendido com o projeto de apoio, que corresponderá à parcela da isenção das contribuições sociais usufruída; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - o parecer técnico de aprovação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO V
DAS ALTERAÇÕES DOS PROJETOS DE APOIO, MONITORAMENTO,
AVALIAÇÃO DOS RESULTADOS E PRESTAÇÃO
DE CONTAS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção I
Das Alterações dos Projetos de Apoio
Art. 25 Durante a execução do projeto de apoio, a entidade de saúde de reconhecida excelência poderá requerer alterações do projeto de apoio, devendo protocolar, na SE/MS, requerimento em prazo que viabilize a análise e aprovação ainda na vigência do projeto, considerando-se os demais prazos previstos nesta Seção. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O requerimento de alteração do projeto de apoio deverá conter informações suficientes para análise da área técnica, que emitirá parecer técnico conclusivo no prazo de trinta dias contados do recebimento do processo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A área técnica poderá solicitar à entidade de saúde de reconhecida excelência complementação das informações apresentadas no requerimento de alteração do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de quinze dias contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º O acréscimo ou supressão de valor solicitado nas alterações do projeto de apoio que não ultrapassar vinte por cento do seu valor originário será objeto de decisão da área técnica competente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º O acréscimo ou supressão de valor solicitado nas alterações do projeto de apoio que ultrapassar o limite de vinte por cento do valor originário do projeto deverá ser submetido à deliberação do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6° Deverá ser republicado o extrato do projeto de apoio quando forem aprovadas alterações nos itens dispostos no art. 24. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º É vedado à entidade de saúde de reconhecida excelência executar despesas em projeto de apoio que não tenham sido previstas no plano de trabalho ou no requerimento de alteração do projeto de apoio e previamente aprovadas pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 8º As despesas executadas em desacordo com o estabelecido no § 7º são de responsabilidade exclusiva da entidade de saúde de reconhecida excelência, vedada a possibilidade de serem computadas no montante da isenção tributária prevista no Termo de Ajuste. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção II
Do Monitoramento dos Projetos de Apoio
Art. 26 O monitoramento do projeto de apoio será realizado pela área técnica competente, com o objetivo de resguardar a adequada execução do plano de trabalho aprovado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A entidade de saúde de reconhecida excelência deverá permitir e facilitar a fiscalização, vistoria in loco, acesso a documentação, dependências e locais do projeto e demais diligências de acompanhamento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso necessário, a área técnica responsável pelo acompanhamento e monitoramento do projeto de apoio poderá notificar a entidade de saúde de reconhecida excelência a prestar esclarecimentos no prazo de quinze dias. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º As ações de monitoramento e as diligências previstas no § 1º serão registradas em relatórios de monitoramento, pelo menos duas vezes ao ano, que integrarão os autos do processo administrativo e acompanharão o desempenho físico do projeto de apoio em relação ao previsto no plano de trabalho, podendo ensejar a proposição de medidas corretivas e de reorientação das ações para que se atinja o melhor resultado do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º Em caso de determinação de medidas corretivas e de reorientação de ações que exijam alteração do projeto de apoio, a entidade de saúde de reconhecida excelência deverá apresentar requerimento de alteração do projeto de apoio no prazo de quinze dias contados da notificação do Relatório de Monitoramento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5° Os ajustes e medidas decorrentes das medidas corretivas e das reorientações de ações serão registrados no Relatório de Monitoramento subsequente e informados detalhadamente, pela entidade de saúde de reconhecida excelência, no Relatório de Prestação de Contas Anual. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6° O descumprimento das medidas corretivas e das reorientações de ações poderá dar causa à reprovação da prestação decontas anual. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção III
Da Avaliação dos Resultados dos Projetos de Apoio
Art. 27 Os resultados parciais e/ou finais dos projetos de apoio serão objeto de avaliação anual, em evento específico, cujo orçamento deverá constar dos planos de trabalho dos respectivos projetos de apoio, nos termos do inciso VIII do art. 18. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A SE/MS consolidará em relatório as avaliações realizadas no evento referido no caput, que subsidiará a emissão do parecer técnico conclusivo de prestação de contas anual, conforme disposto no inciso IX do § 1º do art. 30. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção IV
Da Prestação de Contas Anual
Art. 28 A prestação de contas dos projetos de apoio ocorrerá mediante a apresentação à SE/MS, pela entidade de saúde de reconhecida excelência, de Relatório de Prestação de Contas Anual específico para cada projeto de apoio, sem prejuízo de outras informações que venham a ser solicitadas pelas áreas técnicas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° O Relatório de Prestação de Contas Anual compreenderá o período de 1º de janeiro a 31 de dezembro de cada ano e será apresentado pela entidade de saúde de reconhecida excelência à SE/MS, até 30 de abril do ano seguinte, contendo, no mínimo, as seguintes informações e documentos: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - as informações da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o sumário executivo do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a execução das entregas previstas e realizadas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a execução financeira prevista e realizada; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - as perspectivas sobre execução das entregas, execução financeira e os riscos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a aplicabilidade dos resultados do projeto, quando da apresentação do último Relatório de Prestação de Contas Anual do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - as informações adicionais, quando for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - os anexos, quando necessário; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a relação de equipamentos, incluindo os de informática, e materiais permanentes adquiridos para as atividades do projeto de apoio, com o número e/ou identificação do projeto para controle em inventário físico específico e com a relação das respectivas notas fiscais comprobatórias da aquisição; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - a relação de serviços contratados para execução das atividades do projeto de apoio, arrolada em tabela separada, discriminando a natureza jurídica do fornecedor, sua identificação, breve descrição dos serviços prestados e respectivos valores despendidos, com a relação das respectivas notas fiscais; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - o relatório técnico-científico do projeto de pesquisa, quando for o caso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° O Relatório de Prestação de Contas Anual será acompanhado de parecer de auditoria independente, contratada pela entidade de saúde de reconhecida excelência em contrato específico para cada projeto de apoio ou para o conjunto de projetos de apoio vinculados ao Termo de Ajuste daquela entidade. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° Quando se tratar da contratação de pessoa jurídica para atuação em mais de um projeto de apoio, com emissão de única nota fiscal, a entidade de saúde de reconhecida excelência deverá discriminar, nos respectivos Relatórios de Prestação de Contas Anuais, os valores despendidos por projeto. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A documentação comprobatória da formalização da doação ao órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa deverá ser encaminhada pela entidade de saúde de reconhecida excelência em conjunto com o Relatório de Prestação de Contas Anual referente ao último ano de vigência do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 29 A apuração de eventuais ajustes contábeis no projeto de apoio deverá observar a vigência do Termo de Ajuste, não sendo permitido remanejamento de saldo financeiro ou de qualquer outro recurso para o Termo de Ajuste subsequente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 30 A área técnica competente realizará análise técnica e econômico-financeira das atividades executadas no projeto de apoio, para, no prazo de até sessenta dias a contar da data do recebimento do processo, emitir parecer técnico conclusivo, com a aprovação do Secretário ou autoridade equivalente das autarquias e fundações públicas vinculadas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O parecer técnico conclusivo previsto no caput deverá conter, no mínimo, a seguinte estrutura: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o nome da Secretaria do Ministério da Saúde, da autarquia federal ou da fundação pública vinculada ao Ministério Saúde responsável pelo projeto de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o departamento responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a coordenação-geral responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a análise do sumário executivo do projeto de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a análise das entregas realizadas em relação às entregas previstas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a análise da execução financeira das entregas realizadas em relação às entregas previstas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a análise das perspectivas do projeto quanto à execução do cronograma e à gestão dos riscos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a análise do relatório de avaliação anual dos resultados parciais e/ou finais do projeto de apoio, conforme disposto no parágrafo único do artigo 27; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - a análise da aplicabilidade dos resultados do projeto de apoio, quando da apresentação do último Relatório de Prestação de Contas Anual do projeto de poio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - a análise do relatório técnico-científico do projeto de pesquisa, quando for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - a verificação da relação de equipamentos e materiais permanentes adquiridos para o projeto de apoio, conforme inciso IX do § 1º do art. 28; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIII - a verificação da relação de serviços contratados para o projeto de apoio, conforme inciso X do § 1º do art. 28; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIV - outras considerações adicionais, quando for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XV - a conclusão pela aprovação, aprovação com ressalvas ou reprovação; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XVI - o valor de execução aprovado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Para fins de elaboração do parecer de que trata o caput, a área técnica competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até quinze dias contados de sua notificação, caso em que o prazo para emissão dos pareceres ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 2º, o parecer conclusivo será emitido com as informações que constem do processo, sabendo-se que o não atendimento das medidas corretivas e de reorientação de ações indicadas pela área técnica competente em Relatório de Monitoramento poderá ensejar a aprovação parcial ou a reprovação do Relatório de Prestação de Contas Anual do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º Em caso de aprovação parcial ou reprovação do Relatório de Prestação de Contas Anual, poderão ser considerados executados os recursos aplicados em resultados obtidos com a execução até o momento da notificação que tenha indicado a necessidade de medidas corretivas ou de reorientação de ações, ou até outro marco posterior determinado pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º Com o objetivo de absorver eventuais intercorrências ou externalidades, poderá ser admitida, na prestação de contas do último exercício fiscal de vigência do projeto, desde que devidamente justificada, uma margem de execução de até quinze por cento para mais ou para menos, em relação ao valor total publicado do projeto de apoio, sem que seja necessária autorização prévia do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6º Não será admitida a margem de que trata o § 5º na hipótese de a alteração do valor decorrer de execução do projeto em desacordo com o plano de trabalho previamente aprovado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º O disposto no § 5º será objeto de análise e deverá constar do parecer técnico conclusivo emitido pela área técnica competente, nos termos do caput. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 8º Na hipótese de o projeto de apoio utilizar a margem de execução prevista no § 5º, o parecer técnico conclusivo de que trata o § 7º será submetido à deliberação do Comitê Gestor do PROADISUS, no prazo de sessenta dias contados da data de emissão do referido parecer. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 9º Os valores que forem considerados como não executados em razão da aprovação parcial ou da reprovação do Relatório de Prestação de Contas Anual, bem como os valores remanescentes, quando houver, deverão ser objeto de novo projeto de apoio ou de inclusão em projeto já em curso, com vistas à observância do emprego total do valor da isenção tributária usufruída. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 31 Caso o valor despendido no conjunto de projetos de apoio e de prestação de serviços de saúde ambulatoriais e hospitalares ao SUS vinculados ao Termo de Ajuste seja inferior ao valor da isenção das contribuições sociais usufruída, as entidades de saúde de reconhecida excelência deverão compensar a diferença até o término do prazo de validade de sua certificação, desde que tenham aplicado, no mínimo, setenta por cento do valor usufruído anualmente com a isenção das contribuições sociais. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º Para fins do caput, deve ser considerado o prazo de validade da certificação vigente na data da decisão que consignou que o valor despendido no conjunto de projetos vinculados ao Termo de Ajuste foi inferior ao da isenção das contribuições sociais usufruída, observado, ainda, o disposto no art. 24, § 2º, da Lei nº 12.101, de 2009. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º No caso de glosas ou não execução de valores que impliquem na necessidade de complementação prevista no caput, as entidades de saúde de reconhecida excelência poderão realizar a complementação mediante realização de novos projetos ou adição de valores a projetos já existentes, nos termos dos § § 4º e 5º do art. 25 do Decreto nº 8.242, de 23 de maio de 2014. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 32. No projeto de apoio que envolver a aquisição de equipamentos e/ou materiais permanentes, a entidade de saúde de reconhecida excelência deverá, em até sessenta dias antes do término do projeto de apoio, protocolar documento dirigido ao Ministério da Saúde indicando o órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa que propõe como destinatário da doação dos bens adquiridos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A celebração da doação de que trata o caput deverá ser precedida da análise da área técnica, nos termos do art. 25, após a qual os referidos bens deverão ser registrados no patrimônio do órgão ou estabelecimento beneficiário. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A documentação comprobatória da formalização da doação ao órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa deverá ser encaminhada em conjunto com o Relatório de Prestação de Contas Anual referente ao último ano de vigência do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º Quando finalizado o projeto de apoio, os equipamentos e/ou materiais permanentes utilizados em sua execução poderão ser destinados para uso em outro projeto de apoio que esteja sob a responsabilidade da mesma entidade de saúde de reconhecida excelência, desde que haja aprovação prévia da área técnica competente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A aprovação prévia de que trata o § 3º deverá ser solicitada em até sessenta dias antes do término do projeto de apoio em cuja execução os equipamentos e/ou materiais permanentes estão sendo utilizados. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º Os equipamentos e/ou materiais permanentes advindos de projetos de apoio findados deverão estar previstos no plano de trabalho do novo projeto de apoio, sem previsão de custos relativos à sua aquisição e, ao final do projeto, deverão observar as regras do caput deste artigo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6º Nas hipóteses em que houver impedimento técnico ou legal para a doação de equipamentos ou materiais permanentes, a entidade de saúde de reconhecida excelência deverá apresentar, em até sessenta dias antes do término do projeto de apoio, as devidas justificativas da inviabilidade de destinação, para análise e manifestação da área técnica competente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º No caso de projeto de pesquisa clínica que preveja a aquisição de equipamentos que sejam isentos de registro ou cadastro junto à Agência Nacional de Vigilância Sanitária - ANVISA nos termos da legislação aplicável, a destinação desses equipamentos seguirá as normas sanitárias em vigor. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO VI
DA PRESTAÇÃO DE SERVIÇOS AMBULATORIAIS E
HOSPITALARES
Art. 33 A entidade de saúde de reconhecida excelência poderá aplicar até trinta por cento do valor da isenção das contribuições sociais usufruídas na prestação de serviços de saúde ambulatoriais e hospitalares ao SUS não remunerados, compreendida como o conjunto de ações e serviços de assistência direta realizada em consultórios, ambulatórios, hospitais, prontos-socorros ou outros locais de promoção da saúde, incluindo atendimentos para fins de diagnóstico, prevenção, terapia, recuperação e internação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° É expressamente vedada, na prestação dos serviços de saúde ambulatoriais e hospitalares, a previsão de: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - realização de obras e reformas de infraestrutura física; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - aquisição de equipamentos e materiais permanentes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - terceirização da gestão na prestação de serviços ambulatoriais e hospitalares; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - execução de ações de estudos de avaliação e incorporação de tecnologia, capacitação de recursos humanos, pesquisas de interesse público em saúde e desenvolvimento de técnicas e operação de gestão em serviços de saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 34 As entidades de saúde de reconhecida excelência deverão protocolar na SE/MS propostas de prestação de serviços de saúde ambulatoriais e hospitalares ao SUS não remunerados, com memória de cálculo detalhada dos custos propostos, as quais serão submetidas à análise da Secretaria de Atenção à Saúde - SAS/MS, que, no prazo de trinta dias, emitirá parecer de recomendação para deliberação do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O parecer referido no caput deverá conter análise detalhada dos custos propostos para a prestação de serviços ambulatoriais e hospitalares, considerando as melhores práticas, a expertise e a otimização dos recursos pelas entidades de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º No caso de realização de prestação de serviços ambulatoriais e hospitalares em locais onde não exista prévia operação da entidade de saúde, o referencial a ser empregado são as práticas realizadas pelo gestor local da referida região. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 35 Após a autorização do Comitê Gestor do PROADISUS, nos termos do inciso III do art. 4°, a entidade de saúde de reconhecida excelência pactuará com o gestor local do SUS, mediante instrumento específico, plano de trabalho com a previsão de atendimentos e detalhamento de custos, publicando-se, em sequência, extrato dos serviços contratados no Diário Oficial respectivo, especificando, no mínimo: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o Termo de Ajuste do PROADI-SUS a que esteja vinculado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - as partes contratantes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - o objeto do contrato; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - o período de execução; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o valor previsto para a execução dos serviços a serem prestados, que corresponderá à parcela da isenção das contribuições sociais usufruída, observado o limite previsto no caput do art. 33. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O prazo da pactuação referido no caput é de sessenta dias após o recebimento de notificação da SE/MS pela entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A entidade de saúde deverá encaminhar à SE/MS extrato publicado do respectivo instrumento de pactuação, bem como o plano de trabalho aprovado e respectivo parecer conclusivo emitido pelo gestor local do SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O gestor local do SUS deverá dar ciência à respectiva Comissão Intergestores Bipartite - CIB do plano de trabalho pactuado com a entidade de saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 36 A análise técnica e financeira do plano de trabalho caberá ao gestor local do SUS, que poderá solicitar à entidade de saúde de reconhecida excelência complementação do plano de trabalho apresentado, incluindo outras informações que se fizerem necessárias. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de quinze dias contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer técnico será emitido com as informações que constem no processo, devendo-se dar destaque ao não atendimento da solicitação de informações. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° A comprovação dos custos dos serviços de saúde pactuados poderá ser exigida a qualquer tempo, mediante apresentação dos documentos necessários. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 37 A responsabilidade pelo monitoramento e análise da prestação de contas dos serviços de saúde ambulatoriais e hospitalares caberá ao gestor local do SUS, conforme a pactuação realizada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A entidade de saúde de reconhecida excelência deverá informar a produção na forma estabelecida nas demais normativas vigentes do Ministério da Saúde, com observação de não geração de créditos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A entidade de saúde deverá apresentar à SE/MS declaração fornecida pelo gestor local do SUS atestando os valores executados e os resultados obtidos com as atividades complementares normatizadas pelo § 4º do art. 11 da Lei nº 12.101, de 2009. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° Os relatórios previstos no caput deverão ser acompanhados de demonstrações contábeis e financeiras submetidas a parecer conclusivo de auditoria independente, realizada por instituição credenciada perante o Conselho Regional de Contabilidade. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4° A SE/MS encaminhará os documentos de que trata o § 2° para a SAS/MS, para fins de acompanhamento e fiscalização dos serviços prestados. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 38 A prestação de serviços de saúde ambulatoriais e hospitalares de que trata este Capítulo deverá ser comprovada para fins de obtenção do CEBAS-saúde, observada a regulamentação respectiva. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 39 A prestação de serviços de saúde ambulatoriais e hospitalares que preveja a realização de procedimentos de alta complexidade constantes da relação dos procedimentos regulados pela Central Nacional de Regulação de Alta Complexidade (CNRAC) conterá previsão expressa acerca da necessária regulação pela referida Central, observadas as vigências do respectivo Termo de Ajuste e as exigências referentes ao credenciamento ou habilitação conforme as especificidades dos projetos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO VII
DA CERTIFICAÇÃO DA EXECUÇÃO DOS RECURSOS
DE ISENÇÃO FISCAL
Art. 40 Quando da emissão dos pareceres conclusivos referentes aos Relatórios de Prestação de Contas Anual, a SE/MS atestará e expedirá certidão referente ao valor anual efetivamente executado pelas entidades de saúde de reconhecida excelência com os projetos de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A certidão de que trata o caput será enviada às respectivas entidades de saúde de reconhecida excelência e ao Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde - DCEBAS/SAS/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO VIII
DOS RECURSOS ADMINISTRATIVOS
Art. 41 Das decisões proferidas pelo Comitê Gestor do PROADI-SUS caberá pedido de reconsideração, sem efeito suspensivo, para análise e deliberação final, como última instância administrativa. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O prazo para interposição do pedido de reconsideração é de dez dias contados da notificação da entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Havendo justo receio de prejuízo de difícil ou incerta reparação decorrente da execução, o Comitê Gestor do PROADI-SUS poderá, de ofício ou a pedido, dar efeito suspensivo ao pedido de reconsideração. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O Comitê Técnico do PROADI-SUS deverá elaborar subsídios técnicos para subsidiar a deliberação final do Comitê Gestor do PROADI-SUS nos pedidos de reconsideração. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º O pedido de reconsideração deverá ser protocolado na SE/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art 42. Das decisões proferidas por outras autoridades ou órgãos no âmbito do PROADI-SUS caberá recurso, sem efeito suspensivo, dirigido à autoridade ou órgão que proferiu a decisão. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O prazo para interposição do recurso é de dez dias contados da notificação da entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a autoridade ou órgão que proferiu a decisão recorrida não a reconsidere no prazo de cinco dias, de forma fundamentada, o recurso será submetido ao Comitê Técnico do PROADI-SUS, para elaboração de subsídios técnicos e posterior encaminhamento ao Comitê Gestor do PROADI-SUS, para análise e deliberação final, como última instância administrativa. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º Havendo justo receio de prejuízo de difícil ou incerta reparação decorrente da execução, a autoridade ou órgão que proferiu a decisão recorrida ou o Comitê Gestor do PROADI-SUS poderá, de ofício ou a pedido, dar efeito suspensivo ao recurso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º O recurso deverá ser protocolados na SE/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 43 A autoridade ou órgão competente para julgar o recurso ou pedido de reconsideração não o conhecerá quando interposto: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - fora do prazo; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - perante órgão incompetente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - por quem não seja legitimado; ou (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - após exaurida a esfera administrativa. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 44. Aplicam-se a este Capítulo, subsidiariamente, as regras constantes no Capítulo XV da Lei nº 9.784, de 29 de janeiro de 1999. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO IX
DISPOSIÇÕES FINAIS E TRANSITÓRIAS
Art. 45 As entidades de saúde de reconhecida excelência poderão solicitar à SE/MS, com a devida exposição da finalidade e da aplicabilidade dos dados, a disponibilização dos bancos de dados provenientes de projetos de apoio desenvolvidos por outra entidade de saúde de reconhecida excelência, conforme política de segurança da informação e de acordo com as normas internas do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 46 A SE/MS disponibilizará em meio eletrônico, em até sessenta dias da publicação desta Portaria, Manual Técnico de Elaboração, Análise e Prestação de Contas dos Projetos PROADI-SUS, com diretrizes, orientações e informações complementares para: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - a proposição e a apresentação dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a elaboração dos pareceres recomendativos dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - as solicitações e análises das alterações dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a elaboração dos Relatórios de Monitoramento; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a apresentação do Relatório de Prestação de Contas Anual; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a elaboração do parecer de prestação de contas anual; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a sistemática de avaliação dos resultados dos projetos de apoio, nos termos do art. 27; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a elaboração de Termos de Doação, para atendimento ao disposto no art. 32; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - demais ações necessárias para cumprimento da presente Portaria. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 47 Os prazos previstos nesta Portaria começam a vigorar a partir da data da notificação da entidade de saúde de reconhecida excelência ou do recebimento do processo nas áreas técnicas, excluindo-se da contagem o dia do começo e incluindo-se o do vencimento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A notificação a que se refere o caput será feita: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - via postal, com Aviso de Recebimento - AR; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - diretamente ao destinatário, mediante termo de recebimento; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - por meio eletrônico que assegure a ciência do destinatário; ou (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - por publicação na imprensa oficial, apenas na hipótese de ter sido frustrada tentativa de notificação feita na forma dos incisos I ou III. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Considera-se prorrogado o prazo até o primeiro dia útil seguinte, se o vencimento cair em dia em que não houver expediente ou este for encerrado antes do horário normal. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 48 Todos os atos pendentes e os efeitos de projetos de apoio já aprovados passam a ser regidos pelas disposições desta Portaria, respeitado o ato jurídico perfeito. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 49 O disposto no § 1° do art. 12 desta Portaria referente à solicitação de prorrogação de Termo de Ajuste não se aplica ao triênio vigente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 1 DO ANEXO XCIII
MINUTA DE TERMO DE AJUSTE (Origem: PRT MS/GM 2814/2014, Anexo 1)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
MINUTA DE TERMO DE AJUSTE
TERMO DE AJUSTE QUE ENTRE SI CELEBRAM A UNIÃO, POR INTERMÉDIO DO MINISTÉRIO DA SAÚDE, E XXXXXXX, PARA IMPLANTAR E EXECUTAR PROJETOS NO ÂMBITO DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SISTEMA ÚNICO DE SAÚDE (PROADI-SUS).
A UNIÃO, por intermédio do MINISTÉRIO DA SAÚDE, inscrito sob o CNPJ nº 00.530.493/0001-71, situado na Esplanada dos Ministérios, Bloco G, edifício Sede, Brasília-DF, neste ato representado pelo Ministro de Estado da Saúde, ARTHUR CHIORO nomeado pelo Decreto de XX de XXXX de XXX, portador do CPF/MF nº XXXXXXX e RG nº XXXXXX, expedida pelo XXXXX, doravante denominado MINISTÉRIO e a <ENTIDADE DE SAÚDE> , inscrito no CNPJ sob o nº XXXXXXX, situado na XXXXXXX, habilitada pela Portaria nº <____>/GM/MS, de __ de _____ de_____, neste ato representada por seu Presidente XXXXXXX, portador do CPF/MF nº XXXXXXX e RG nº XXXXXX, expedido pela XXXXXX, doravante denominada ENTIDADE DE SAÚDE, celebram o presente Termo, com fulcro nas disposições da Lei nº 12.101, de 27 de novembro de 2009, do Decreto nº 8.242, de 23 de maio de 2014, da Portaria nº XXX/GM/MS, de xx de xxxxx de 2014, da Portaria n°XX/SE/MS, de XX de XXXX de 2014, e nas demais disposições normativas em vigor, legislação superveniente e em especial as que regem a matéria, mediante as cláusulas e condições a seguir:
CLÁUSULA PRIMEIRA - DO OBJETO
O presente termo tem por objeto a adesão da ENTIDADE DE SAÚDE ao Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (PROADI-SUS) no triênio XXXX/XXXX, a partir de Projetos de Apoio a serem apresentados nos seguintes temas de interesse:
ESPAÇO RESERVADO PARA LISTAGEM DOS TEMAS DE INTERESSE DA ENTIDADE, CONFORME A PORTARIA SE/MS A QUE SE REFIRA
SUBCLÁUSULA ÚNICA - Os Projetos de Apoio, na medida em que forem aprovados, serão vinculados ao presente Termo de Ajuste, respeitado o triênio de vigência e o limite das isenções tributárias.
CLÁUSULA SEGUNDA - DO PRAZO DE VIGÊNCIA
Este Termo de Ajuste vigerá a partir da data da sua assinatura até XXXX, prazo este improrrogável.
CLÁUSULA TERCEIRA - DA PREVISÃO DE RECURSOS
O valor estimado da isenção tributária relativa às contribuições sociais da ENTIDADE DE SAÚDE para o triênio XXXX/XXXX é de R$ XXXX (XXXXXX).
SUBCLÁUSULA PRIMEIRA - O somatório do valor dos Projetos de Apoio a serem aprovados e vinculados ao presente Termo de Ajuste não poderá ser superior ao valor estimado da isenção tributária indicada nesta Cláusula.
SUBCLÁUSULA SEGUNDA - A ENTIDADE DE SAÚDE informará ao Ministério da Saúde, anualmente, o valor total de isenção tributária apurado no exercício fiscal anterior, comprovado por meio do Balanço Patrimonial.
CLÁUSULA QUARTA - DOS DIREITOS, OBRIGAÇÕES E RESPONSABILIDADES DOS PARTÍCIPES
I - Compete ao MINISTÉRIO:
a) monitorar, acompanhar e avaliar os Projetos de Apoio que integrarão o presente Termo de Ajuste, no tocante a sua execução física e financeira, inclusive por meio de visitas técnicas;
b) analisar as respectivas prestações de contas dos Projetos de Apoio que integrarem o presente Termo de Ajuste, de acordo com as regras e critérios vigentes no Regulamento do PROADI-SUS;
c) adotar as medidas necessárias para o aperfeiçoamento e desenvolvimento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos projetos;
d) solicitar à ENTIDADE DE SAÚDE que adote as medidas necessárias para o aperfeiçoamento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos projetos; e
e) inserir todas as informações referentes a monitoramento, acompanhamento, avaliação e análise, bem como informações pertinentes à prestação de contas dos projetos, em sistema informatizado de gestão do PROADI-SUS, quando implantado e disponível.
II - Compete à ENTIDADE DE SAÚDE:
a) desenvolver e executar os Projetos de Apoio de acordo com os valores e conteúdos aprovados no plano de trabalho;
b) adotar as medidas necessárias para o aperfeiçoamento e desenvolvimento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos Projetos de Apoio;
c) solicitar ao MINISTÉRIO que adote as medidas necessárias ao aperfeiçoamento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos projetos;
d) protocolar/inserir os relatórios de prestação de contas a serem endereçados à Secretaria-Executiva/MS, conforme Cláusula Capítulo V da Portaria nº XXX/GM/MS, de XX de XXXX de 2014;
e) manter à disposição do MINISTÉRIO, pelo prazo mínimo de 10 anos, o conjunto de documentos relacionados aos Projetos de Apoio vinculados ao presente Termo de Ajuste;
f) apresentar, sempre que solicitado pelo MINISTÉRIO, informações ou detalhamento referente aos Projetos de Apoio, suas prestações de contas com documentação comprobatória, inclusive e especialmente os contratos relacionados ou ações a eles vinculados;
g) permitir e facilitar aos representantes do MINISTÉRIO o acesso aos locais de execução dos projetos, o exame da documentação produzida e a vistoria dos bens adquiridos no bojo de Projetos de Apoio vinculados ao presente Termo de Ajuste;
h) destinar dotação orçamentária específica da imunidade tributária usufruída para a aquisição de diárias e passagens para servidores/colaboradores do Ministério da Saúde realizarem visitas técnicas de monitoramento e avaliação, de acordo com instrumento de planejamento a ser pactuado, aplicando-se as normas do Decreto nº 5992/2006 e respectivas alterações, no que couber, e atentando-se às vedações da Lei 8.112/1990, quer se trate de servidores ou agente/colaborador no desempenho das atribuições em referência, devendo constar na prestação de contas dos projetos com a documentação comprobatória;
i) inserir o logotipo do MINISTÉRIO e do PROADI-SUS em material de divulgação e apresentação dos produtos vinculados aos Projetos de Apoio;
j) inserir todas as informações referentes ao Projeto de Apoio, inclusive relatórios de prestação de contas e atendimento de diligências, em sistema informatizado de gestão do PROADI-SUS, quando implantado e disponível; e
k) providenciar que textos de trabalhos, parciais e completos, a serem apresentados em eventos nacionais e internacionais contenham indicação expressa de execução no âmbito do PROADI-SUS e sejam apresentados em Língua Portuguesa à Secretaria ou entidade vinculada competente para acompanhamento do Projeto de Apoio respectivo.
SUBCLÁUSULA PRIMEIRA - Caso não seja possível a utilização plena do Sistema de Gestão de Projetos do Programa de Apoio ao Desenvolvimento Institucional do SUS (SISPROADI-SUS) para registro e tramitação dos atos e procedimentos relativos aos processos no âmbito do PROADI-SUS, o MINISTÉRIO e a ENTIDADE DE SAÚDE deverão valer-se da apresentação e tramitação física dos processos.
SUBCLÁUSULA SEGUNDA - Fica estabelecido que as obrigações legais decorrentes de eventuais contratações, celebração de convênios ou outras formas de ajuste, necessárias à consecução do objeto deste são de inteira responsabilidade da ENTIDADE DE SAÚDE, não possuindo assim qualquer vínculo com o MINISTÉRIO.
CLÁUSULA QUINTA - DOS DADOS E INFORMAÇÕES CONFIDENCIAIS
A execução dos Projetos de Apoio vinculados ao presente Termo de Ajuste que prevejam a transferência de dados dos sistemas nacionais de informação do MINISTÉRIO (partícipe divulgador) à ENTIDADE (partícipe receptor) será regida pelas regras e obrigações estabelecidas nesta cláusula, sobretudo no tocante a informações confidenciais e dados sensíveis.
SUBCLÁUSULA PRIMEIRA - DAS DEFINIÇÕES
a) Denominam-se dados ou informações confidenciais os dados considerados como direito à intimidade das pessoas e segredo profissional, incluindo-se os dados sensíveis e as informações proprietárias das subsidiárias de cada um dos partícipes, bem como de suas sociedades afiliadas, parceiros comerciais, provedores de dados e clientes. As Informações Confidenciais poderão ser escritas, orais, gravadas, ou contidas em fita, base de dados ou em qualquer outra mídia eletrônica ou mecânica. Toda informação confidencial é fornecida "no estado em que se encontra" e sem qualquer garantia, expressa, implícita ou não, em relação à precisão ou execução de tais Informações Confidenciais.
b) Informações Confidenciais não devem incluir informações que:
i. já eram de conhecimento do partícipe receptor antes da divulgação da informação;
ii. estejam ou tenham entrado em domínio público sem violação do presente Termo de Ajuste ou conduta ilícita do partícipe receptor;
iii. tenham sido legitimamente recebidas por um terceiro partícipe sem violação do presente Termo de Ajuste;
iv. tenham sido aprovadas para liberação por autorização por escrito da parte divulgadora; ou
v. cuja divulgação seja exigida mediante ordem final e definitiva de um órgão governamental ou tribunal competente, desde que o partícipe divulgador tenha sido devidamente informado da pendência e que tenha tido oportunidade para contestá-la.
c) Entende-se por dados sensíveis:
i. informação pessoalmente identificável relativa aos dados de indivíduos menores de idade;
ii. números de identificação pessoal com o nome associado;
iii. nome de solteiro da mãe com o nome associado;
iv. número da licença de motorista ou de qualquer outro documento de identificação governamental com o nome associado;
v. número de telefone identificado como não listado ou não publicado;
vi. cartão de crédito, de débito, ou número de contas bancárias com o nome associado e/ou com qualquer PIN ou código de acesso necessário;
vii. informações de saúde de identificação pessoal;
viii. informações financeiras ou de folha de pagamento incluindo número de identificação de funcionário;
ix. qualquer tipo de informação que figurar como direito à intimidade das pessoas e segredo profissional; e
x. qualquer outra informação assinalada como Dado Sensível ou cuja natureza claramente assim o indique.
SUBCLÁUSULA SEGUNDA - A responsabilidade assumida pela ENTIDADE, quanto à confidencialidade dos dados, é extensiva a terceiros que venham a ser contratados na execução dos Projetos de Apoio, exigindo-se da ENTIDADE que garanta esse compromisso de qualquer terceiro contratado, direta ou indiretamente.
SUBCLÁUSULA TERCEIRA - As obrigações contidas nesta Cláusula Quinta aplicam-se a todo dado confidencial e sensível divulgado pelos partícipes entre si, incluindo, sem limitação, todos os preços, listas de endereços, dados de propriedade industrial, modelo(s) de dados, integradores de dados, regras de negócio e quaisquer adaptadores relacionados, projetos de produtos, capacidades, especificações, código de programação, sistema de software e processos, informações sobre técnicas, negócios, planos de marketing e estratégias de produtos atuais e futuros, qualquer relatório de análise ou resultados de testes de qualquer produto, bem como a identidade dos atuais e potenciais clientes, provedores de dados e fornecedores.
SUBCLÁUSULA QUARTA - Cada um dos partícipes deve assegurar que qualquer Dado Sensível esteja criptografado em nível tal que a parte possa aceitar e transmitir ou dividir em dois ou mais arquivos físicos ou de dados, conforme o caso, com as chaves de identificação fornecidas ao partícipe receptor de tal forma que nenhum arquivo em si contenha Dados Sensíveis previamente à transmissão ou expedição de tais Dados Sensíveis ao outro partícipe, por meio de uma rede pública ou em meios físicos.
SUBCLÁUSULA QUINTA - DAS OBRIGAÇÕES COMUNS
a) Os partícipes concordam em manter as Informações Confidenciais em estrita confidencialidade e a não divulgar tais Informações Confidenciais a nenhum terceiro ou a usá-las para nenhum propósito que não aqueles autorizados pela outra parte;
b) Os partícipes concordam que irão empregar todas as medidas razoáveis para proteger as Informações Confidenciais da outra parte de divulgação desautorizada ou inadvertida, incluindo sem limitação todas as medidas que os partícipes adotariam para proteger suas próprias informações que consideram proprietárias;
c) Os partícipes devem divulgar as correspondentes Informações Confidenciais apenas para aqueles funcionários e contratados que tenham a necessidade de tomar conhecimento e somente na extensão necessária para possibilitar aos partícipes executarem adequadamente suas respectivas responsabilidades para com a outra e, no caso de qualquer teste de produto, somente para aqueles empregados que estejam diretamente envolvidos com o teste de tal produto;
d) Nenhum dos partícipes deve usar as Informações Confidenciais da outra parte para o "benchmark" de tais Informações Confidenciais contra produtos ou serviços oferecidos por terceiros (incluindo, sem limitação, produtos e/ou serviços oferecidos por subcontratados ou terceiros prestadores de serviço do partícipe receptor); e
e) Os partícipes comprometem-se a assegurar o compromisso individual de seus respectivos funcionários, prepostos e contratados com os termos do presente Termo de Ajuste.
SUBCLÁUSULA SEXTA - DAS OBRIGAÇÕES DA ENTIDADE
a) As Informações Confidenciais não devem ser traduzidas em outro formato ou idioma, decompiladas ou submetidas à engenharia reversa sem o consentimento prévio do partícipe divulgador;
b) Nenhuma cópia das Informações Confidenciais deverá ser feita pelo partícipe receptor, exceto quando necessária para a execução de serviços relativos às Informações Confidenciais de acordo com a solicitação do partícipe divulgador;
c) Mediante solicitação por escrito do partícipe divulgador, a qualquer momento, o partícipe requerido, por opção do partícipe divulgador, deve destruir ou devolver ao partícipe divulgador todas as fitas, disquetes ou outra mídia na qual as Informações Confidenciais do partícipe divulgador estejam armazenadas, e todas as respectivas cópias, se houver;
d) Caso seja solicitada pelo partícipe divulgador a destruição de qualquer Informação Confidencial, o partícipe receptor deve, dentro de 5 (cinco) dias úteis após a destruição, entregar ao partícipe divulgador um documento certificando que a destruição foi realizada; e
e) O partícipe receptor ou terceiros subcontratados devem manter obrigação de proteger a confidencialidade de todo dado e Informação Confidencial, mesmo após a rescisão do Termo de Ajuste, não podendo tais dados confidenciais ser revelados em nenhuma hipótese, em especial, aqueles considerados Dados Sensíveis.
SUBCLÁUSULA SÉTIMA - Cada partícipe deve ser considerado como depositário dos dados e Informações Confidenciais, incluindo todas as patentes, direitos autorais, desenhos, "mask work", marca, marca de serviço, segredos comerciais e quaisquer outros direitos de propriedade e interesses nela, e tanto a ENTIDADE quanto o MINISTÉRIO concordam que nada contido neste Termo de Ajuste deve ser interpretado como concessão de direitos, por licença ou outro, a qualquer Informação Confidencial divulgada nos termos do presente Termo.
SUBCLÁUSULA OITAVA - Fica estabelecido que caso haja qualquer divulgação de informação confidencial causada seja por ação ou por omissão da ENTIDADE, não poderá ser atribuída ao MINISTÉRIO nenhuma responsabilidade perante terceiros prejudicados, sendo de inteira responsabilidade da ENTIDADE a reparação.
SUBCLÁUSULA NONA - O MINISTÉRIO ao ter conhecimento da divulgação de qualquer informação confidencial ainda que seja parcial, a fim de atenuar eventual prejuízo e ou nova ocorrência, na razão das consequências que naquele ou nesse caso vierem a ocorrer, notificará a ENTIDADE para proceder:
a) no prazo máximo de 30 (trinta) dias, a correção dos motivos que resultaram na falta; e
b) a eventual reparação, quando for o caso, sob pena de ficar caracterizado como motivo para a suspensão ou encerramento da execução do respectivo Projeto de Apoio.
CLÁUSULA SEXTA - DA PRESTAÇÃO DE CONTAS
A prestação de contas dos Projetos de Apoio vinculados a este Termo de Ajuste deverá seguir o disposto na Portaria atualmente vigente, normas complementares e demais condições acordadas neste instrumento.
SUBCLÁUSULA PRIMEIRA - Admitir-se-á uma margem de execução de 10% (dez por cento) pra mais ou para menos com relação ao valor total do Projeto de Apoio, sem que seja necessária autorização prévia do MINISTÉRIO.
SUBCLÁUSULA SEGUNDA - No caso de diferença a menor, a ENTIDADE deverá viabilizar a inclusão do valor faltante em algum dos Projetos de Apoio vinculados ao presente Termo de Ajuste, de modo a garantir que o valor total empregado no conjunto dos Projetos não seja inferior ao valor da isenção das contribuições sociais usufruída, observado o disposto na Portaria vigente, sem prejuízo das devidas justificativas e respectiva anuência do MINISTÉRIO.
CLÁUSULA SÉTIMA - DO MONITORAMENTO E AVALIAÇÃO
A execução deste Termo de Ajuste e dos Projetos de Apoio que lhe sejam vinculados será acompanhada, avaliada e fiscalizada, em conformidade com o disposto nas regras e critérios previstos na Portaria do Ministério da Saúde vigente, normas complementares e demais condições acordadas neste instrumento.
CLAUSULA OITAVA - DAS VEDAÇÕES
I - Ao MINISTÉRIO é vedado:
a) alterar o objeto, total ou parcialmente, de Projetos de Apoio vinculados ao presente Termo de Ajuste sem a anuência expressa da ENTIDADE; e
b) deixar de se manifestar frente a solicitação de informações ou sobre informe produzido pela ENTIDADE em até 90 dias, se outro prazo não tiver sido expressamente fixado.
II - À ENTIDADE é vedado:
c) utilizar o recurso financeiro para fins distintos dos aprovados originalmente nos Projetos de Apoio;
d) transferir a terceiros a gestão dos Projetos de Apoio;
e) transferir a terceiros obrigações ora assumidas;
f) executar despesas em data anterior ou posterior à vigência de cada Projeto de Apoio ou de suas alterações, observadas as normas vigentes, sob pena de desaprovação parcial da prestação de contas respectiva; e
g) repassar a terceiros os produtos adquiridos e/ou desenvolvidos em razão do presente Termo de Ajuste, ou parte deles, sem prévia autorização do MINISTÉRIO.
CLÁUSULA NONA - DA RESERVA DE PROPRIEDADE INTELECTUAL E DAS REGRAS REFERENTES ÀS PUBLICAÇÕES DE MATERIAL PRODUZIDO NO ÂMBITO DO PRESENTE TERMO DE AJUSTE
Os bancos de dados provenientes de Projetos de Apoio vinculados ao presente Termo de Ajuste deverão garantir o sigilo e a confidencialidade dos sujeitos de pesquisa envolvidos, bem como obedecer aos demais requisitos previstos nas normas vigentes de ética em pesquisa.
SUBCLÁUSULA PRIMEIRA. A disponibilização dos recursos materiais instrucionais na rede mundial de computadores para entidades públicas e privadas sem fins lucrativos e certificadas como beneficentes de assistência social será feita mediante licença de uso de interesse do SUS, com vedação expressa do o uso privado e comercial.
SUBCLÁUSULA SEGUNDA. Os recursos materiais instrucionais decorrentes dos Projetos de Apoio vinculados ao presente Termo de Ajuste deverão ser disponibilizados na rede mundial de computadores para entidades públicas e privadas, sem fins lucrativos e certificadas como beneficentes, mediante licença de uso.
SUBCLÁUSULA TERCEIRA. A divulgação e a publicidade dos produtos decorrentes da execução de Projetos de Apoio vinculados ao presente Termo de Ajuste deverão ser previamente aprovadas pelo MINISTÉRIO, bem como deverão conter menção à parceria firmada no âmbito do PROADI-SUS, de acordo com a Lei nº 12.101, de 2009. (
SUBCLÁUSULA QUARTA. A publicação resultante de Projetos de Apoio vinculados ao presente Termo de Ajuste, bem como seus produtos de divulgação, deverá seguir a política editorial do MINISTÉRIO.
SUBCLÁUSULA QUINTA. Todos os produtos didáticos, editoriais e de divulgação desenvolvidos no âmbito dos Projetos de Apoio vinculados ao presente Termo de Ajuste deverão ser disponibilizados na Biblioteca Virtual em Saúde do MINISTÉRIO (BVS-MS), de forma gratuita e em texto integral, de acordo com os critérios da política editorial do MINISTÉRIO, no prazo de até 01 (um) ano após o encerramento do projeto em que tenham sido produzidos.
SUBCLÁUSULA SEXTA. A impossibilidade de cumprimento do prazo previsto na subcláusula quinta deverá ser formalmente justificada pela ENTIDADE, cabendo ao MINISTÉRIO acatar ou não a justificativa, no prazo máximo de sessenta dias.
SUBCLÁUSULA SÉTIMA. Vencido o prazo de 01 (um) ano fixado na subcláusula quinta e caso não seja acatada a justificativa apresentada conforme a subcláusula sexta, a ENTIDADE terá o prazo de trinta dias, a partir do recebimento da notificação, para o cumprimento da obrigação.
SUBCLÁUSULA OITAVA. O descumprimento pela ENTIDADE das obrigações previstas nas subcláusulas quinta, sexta e sétima ensejará a não-aprovação do Projeto de Apoio respectivo.
CLÁUSULA DÉCIMA - DA TITULARIDADE DOS BENS PATRIMONIAIS
SUBCLÁUSULA PRIMEIRA - No Projeto de Apoio que envolver a aquisição de equipamento e/ou material permanente, deverá constar o órgão e/ou entidade pública do SUS destinatário dos bens remanescentes na data da extinção do Projeto de Apoio.
SUBCLÁUSULA SEGUNDA - Para comprovação do dispositivo anterior, a ENTIDADE deverá apresentar ao final do Projeto de Apoio a formalização da doação do equipamento e/ou material permanente adquirido com os recursos do projeto ao seu destinatário, conforme Modelo disponível no anexo da Portaria vigente.
SUBCLÁSULA TERCEIRA - Caso constate o não cumprimento da obrigação prevista na subcláusula primeira, o MINISTÉRIO notificará a ENTIDADE, que terá o prazo máximo de 30 (trinta) dias para o saneamento, sem o que não será considerado encerrado o respectivo Projeto de Apoio.
CLÁUSULA DÉCIMA PRIMEIRA - DOS ADITAMENTOS
Termo de Ajuste poderá ser aditado na forma prevista na Portaria do Ministro de Estado da Saúde vigente como regulamento do PROADI-SUS.
CLÁUSULA DÉCIMA SEGUNDA - DA RESCISÃO
O presente Termo poderá ser rescindido nas hipóteses e na forma previstas na Portaria do Ministro de Estado da Saúde vigente como regulamento do PROADI-SUS
CLÁUSULA DÉCIMA TERCEIRA - DOS CASOS OMISSOS
Os casos omissos serão submetidos ao Comitê Gestor do PROADI-SUS, na forma previstas na Portaria do Ministro de Estado da Saúde vigente como regulamento do PROADI-SUS.
SUBCLÁUSULA ÚNICA. Caso a ENTIDADE não se conforme com a decisão do Comitê Gestor, o caso será submetido à Câmara de Conciliação e Arbitragem da Administração Federal - CCAF, órgão integrante da Advocacia-Geral da União, nos termos do Ato Regimental nº 5, de 27/09/2007 e alterações promovidas pelo Ato Regimental nº 2, de 9/4/2009.
CLÁUSULA DÉCIMA QUARTA - DA PUBLICAÇÃO
A Secretaria-Executiva do Ministério da Saúde providenciará a publicação do presente Termo de Ajuste no Diário Oficial da União, no prazo de 20 (vinte) dias contados da data de sua assinatura.
CLÁUSULA DECIMA QUINTA - DO FORO
Fica eleito o foro da Justiça Federal, Seção Judiciária do Distrito Federal, com exclusão de qualquer outro, por mais privilegiado que seja, para dirimir quaisquer questões oriundas do presente Termo de Ajuste.
E, para firmeza, validade e eficácia do que foi acordado, lavrou-se o presente instrumento em 2 (duas) vias de igual teor e forma, que após lido e achado conforme para um só efeito, é assinado pelos partícipes na presença de 2 (duas) testemunhas, igualmente signatárias.
Brasília, de de 2014.
ARTHUR CHIORO
XXXXX
Ministro de Estado da Saúde
Presidente XXXX
_____________________
_____________________
Nome:
CPF:
TESTEMUNHAS:
_____________________
_____________________
Nome:
CPF:
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 2 DO ANEXO do Anexo XCIII
MODELO PARA APRESENTAÇÃO DE CARTA CONSULTA AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 2)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 3 DO ANEXO XCIII
MODELO DE FORMULÁRIO DE ANÁLISE DA CARTA CONSULTA (Origem: PRT MS/GM 2814/2014, Anexo 3)
( ) Sim ( ) Não Se sim, qual? ( ) Estudos de Avaliação de Incorporação de Tecnologia ( ) Capacitação de Recursos Humanos ( ) Pesquisas de Interesse Público ( ) Técnicas e Operação de Gestão em Serviços de Saúde O modelo de apresentação da carta consulta (Anexo I) está obrigatória e devidamente preenchida com: * Descrição do tema ou objetivo prioritário relacionado à consulta; ( ) Sim ( ) Não Se sim, qual(is)? ( ) Promoção do acesso, qualidade, integralidade e cuidado em rede ( ) Financiamento e Gestão do SUS ( ) Inovação Científica e Tecnológica ( ) Desenvolvimento dos Profissionais e Trabalhadores do SUS * Descrição resumida da proposta do(s) possível(is) projeto(s) referente ao tema ou objetivo prioritário, contendo o objeto e resultados esperados; ( ) Sim ( ) Não * Apresentação da justificativa e aplicabilidade da proposição, ressaltando sua relevância para as políticas de saúde institucionalizadas no âmbito do Sistema Único de Saúde; ( ) Sim ( ) Não * Indicação do valor total estimado do(s) projeto(s) a ser(em) apresentados; ( ) Sim ( ) Não * Indicação da abrangência geográfica e/ou populacional do(s) projeto(s). ( ) Sim ( ) Não NECESSIDADE DE ENVOLVIMENTO DO GESTOR LOCAL DO SUS O desenvolvimento do(s) projeto(s) objeto(s) desta carta consulta depende do envolvimento do gestor local do SUS (Secretário Municipal e/ou Estadual de Saúde)? ( ) Sim ( ) Não |
A proposta da carta consulta fere algum princípio (universalidade, integralidade e equidade) do SUS ou está em desacordo com as políticas e diretrizes de saúde em âmbito federal (Plano Nacional de Saúde)? ( ) Sim ( ) Não Na referida proposta está compreendida a busca da redução das desigualdades regionais relativas ao acesso aos bens e serviços de saúde? ( ) Sim ( ) Não É observada na carta consulta o objetivo de fortalecimento da integração regional em rede de serviços da saúde e com outras políticas de inclusão social? ( ) Sim ( ) Não É possível associar o objeto da carta consulta à relação de complementaridade com investimentos realizados nas redes de atenção à saúde? ( ) Sim ( ) Não A indicação da abrangência do projeto está coerente com os princípios da universalidade e equidade do Sistema Único de Saúde? Caso negativo, existe alguma sugestão de melhoria para a abrangência do projeto? ( ) Sim ( ) Não |
( ) Sim ( ) Não Podem ocorrer conflitos de interesse na possível execução do objeto da carta consulta apresentada? Se sim, justifique. ( ) Sim ( ) Não _____________________________________ É necessário melhor direcionamento do objeto proposto? Se sim, descreva. ( ) Sim ( ) Não _______________________________________________________________________ Há indicação para que a formulação do projeto seja realizada em conjunto com as equipes técnicas do Ministério da Saúde, CONASS e/ou CONASEMS? ( ) Sim ( ) Não Quais benefícios o possível projeto, objeto desta carta consulta, poderá contribuir para o desenvolvimento institucional do SUS? Liste-os. ________________________________________________________________________ |
( ) Aprovação ( ) Não Aprovação Descreva as considerações quanto à sugestão acima selecionada. _____________________________________________________ Qual unidade deverá acompanhar a execução do projeto proposto pela referida carta-consulta? ______________________________________________________ Deverá ter o suporte de outra(s) unidade(s) para o acompanhamento do projeto? Qual(is)? ______________________________________________________ Brasília, de de |
|
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 4 DO AENXO XCIII
MODELO PARA APRESENTAÇÃO DE PROPOSTA DE PROJETO DEMANDADO (Origem: PRT MS/GM 2814/2014, Anexo 4)
( ) Estudos de Avaliação de Incorporação de Tecnologia ( ) Capacitação de Recursos Humanos ( ) Pesquisas de Interesse Público ( ) Técnicas e Operação de Gestão em Serviços de Saúde 2. A proposta está relacionada à: ( ) Promoção do acesso, qualidade, integralidade e cuidado em rede ( ) Financiamento e Gestão do SUS ( ) Inovação Científica e Tecnológica ( ) Desenvolvimento dos Profissionais e Trabalhadores do SUS 3. Descrição resumida do projeto, destacando sua relevância para as políticas de saúde do SUS. ___________________________________________________________________________ 4. Objetivo e resultados esperados. ___________________________________________________________________________ 5. Especificar a abrangência geográfica e/ou populacional do projeto. ___________________________________________________________________________ 6. Estimar o tempo necessário para execução do projeto. _________________________________________________ 7. Indicar se há necessidade de pactuação com Gestor Municipal e/ou Estadual para a realização do projeto. ___________________________________________________________________________ Nome e Qualificação do Técnico De Acordo: Nome e Qualificação do Coordenador e identificação da Coordenação De Acordo: Nome e Qualificação do Coordenador-Geral e identificação Coordenação-Geral De acordo. Encaminhe-se ao Departamento de Economia da Saúde, Investimentos e Desenvolvimento (DESID-SE) para conhecimento e providências. Nome e Qualificação do Diretor e identificação do Departamento |
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 5 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE PROJETOS REFERENTES AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 5)
MODELO PARA APRESENTAÇÃO DE PROJETOS REFERENTES AO PROADI-SUS
A - INFORMAÇÕES GERAIS
B - PLANO DE TRABALHO
O Plano de Trabalho congrega o conjunto mínimo de conceitos e instrumentos de gerenciamento, imprescindíveis para o monitoramento, avaliação e prestação de contas da execução físico-financeira do projeto de apoio ao PROADI-SUS
De acordo com o artigo 11 da Lei nº 12.101, de 27 de novembro de 2009, e do artigo 2º desta Portaria, registrar a área de atuação pretendida. ( ) Estudos de Avaliação e Incorporação de Tecnologia ( ) Capacitação de Recursos Humanos ( ) Pesquisas de Interesse Público em Saúde ( ) Desenvolvimento de Técnicas e Operação de Gestão em Serviços de Saúde B.2 - INFORMAÇÕES GERAIS DO PROJETO 2.1. Título do Projeto 2.2. Valor total do Projeto 2.3. Período de execução 2.4. Indicação de Secretaria competente ou entidade vinculada ao Ministério da Saúde responsável pelo monitoramento e avaliação. B.3. INFORMAÇÕES ESPECÍFICAS DO PROJETO 3.1. Descrição do projeto, mencionando sua aplicabilidade no desenvolvimento institucional do SUS: a) Descrever sucintamente o objeto do projeto; b) Apresentar justificativa e aplicabilidade da proposição, ressaltando sua relevância para as políticas de saúde institucionalizadas no âmbito do SUS; c) Apresentar análise da situação inicial, incluindo: análise de problemas, análise de objetivos e análise dos atores interessados; Especificar o planejamento do projeto descrevendo-o de acordo com a Matriz de Planejamento e seus respectivos conceitos, conforme Anexo III, bem como definindo e descrevendo os seguintes elementos: c.1) Descrever o objetivo proposto de desenvolvimento do SUS e seus indicadores; c.2) Descrever os objetivos específicos do projeto, seus indicadores e metas; c.3) Descrever as fases ou etapas do projeto, quando aplicável; c.4) Descrever os resultados semestrais e anuais esperados, decorrentes da execução do projeto, seus indicadores e respectivas metas a serem atingidas; c.5) Descrever os produtos gerados com a execução do projeto, seus indicadores e metas, quando aplicável; c.6) Descrever as principais atividades de intervenção vinculadas aos resultados esperados, seus prazos de execução e valores, conforme apresentado nos cronogramas de atividades e de desembolsos; c.7) Descrever as atividades de monitoramento e de avaliação e seus respectivos valores, atentando-se à c efinição do Item 1.5 do Anexo em referência; e c.8) Apresentar indicadores de avaliação de resultado e impacto que permitam avaliar as mudanças no SUS decorrentes da execução do projeto, bem como, quando pertinente, demais indicadores para o monitoramento e a avaliação do projeto. d) Descrever a abrangência do projeto quanto a: d.1) população e/ou instituição beneficiada, seja diretamente - que receberá a intervenção do projeto, seja indiretamente, que poderá se beneficiar dos resultados do projeto, com indicação de n° CNES; d.2) dimensão geográfica, com indicação de UF/município beneficiário; e d.3) número de vagas ofertadas, quando aplicável. e) Descrever detalhadamente o método a ser empregado para atingir os objetivos propostos, quando aplicável; f) Apresentar mecanismos e instrumentos para avaliação dos resultados, abrangendo a percepção do beneficiário, quando pertinente, com dados quantitativos e qualitativos; g) Descrever formas de disseminação dos resultados do projeto, tais como: eventos científicos, oficinas, material de divulgação/publicação, ferramentas de apoio ao desenvolvimento institucional do SUS, quando aplicáveis; h) Descrever cálculo de tamanho de amostra e número de instituições envolvidas no caso de projetos multicêntricos; j) Apresentar Organograma e Quadro de Atribuições para os principais atores envolvidos no projeto (funções, atribuições e principais tarefas), incluindo a equipe executora e ressaltando a formação e experiências relevantes ao projeto; k) Apresentar Plano de Comunicação, conforme as necessidades específicas do projeto, devendo ser formalizado com os seguintes elementos: k.1) os requisitos de comunicação das partes interessadas; k.2) as informações que serão comunicadas, inclusive formato, conteúdo e nível de detalhes; k.3) a pessoa responsável pela comunicação das informações; k.4) a pessoa ou os grupos que receberão as informações; k.5) os métodos ou tecnologias usados para transmitir as informações, como por exemplo: relatórios de monitoramento semestrais ou anuais, relatórios específicos, e-mails, sistemas informatizados, publicações, comunicados à imprensa etc.; k.6) a frequência da comunicação e os prazos; k.7) o método para atualizar e refinar o Plano de Comunicação conforme o projeto se desenvolve e avança; e k.8) glossário da terminologia comum. l) Apresentar o Plano de Atividades, conforme a Matriz de Planejamento do Projeto e as seguintes especificações: l.1) interdependências básicas entre as atividades; l.2) estimativa de duração de cada uma das atividades, levando em conta a quantidade e disponibilidade de recursos (humanos, materiais e financeiros) do projeto; l.3) definição da data de início e fim de cada atividade, levando em conta as estimativas realizadas e as dependências identificadas; e l.4) definição dos responsáveis pelas atividades. m) Demais informações relevantes em conformidade com as especificidades da área de atuação e do projeto. 3.2. Descrição do orçamento do projeto. a) Descrever detalhadamente o orçamento do projeto, ordenando os gastos em custeio e capital, discriminando por elemento de despesa; b) Especificamente aos gastos direcionados a recursos humanos, deve-se estabelecer o valor por hora trabalhada, bem como a quantidade de horas despendidas por cada integrante da equipe; e c) Ao final, deve-se consolidar o orçamento conforme modelo abaixo |
CRONOGRAMA SEMESTRAL DE ATIVIDADES |
|||||||
B.4.2 - Cronograma de Desembolso: previsão de desembolso de recursos financeiros, em conformidade com a proposta de execução das metas estabelecidas, de acordo com o Plano de Atividades apresentado.
CRONOGRAMA DE DESEMBOLSO FINANCEIRO DAS ATIVIDADES
Observação :
1) Para cada resultado e/ou produto deve ser apresentado um cronograma de desembolso por atividade de intervenção: Resultado 1, Resultado (...), Resultado "m", ou então, Produto 1, Produto (...), Produto "m".
2) Além dos cronogramas de desembolso por atividade de intervenção, deve ser apresentado um cronograma de desembolso por atividade de monitoramento e avaliação;
3) As atividades podem ser desagregadas em subatividades, para as quais não é obrigatória a apresentação de cronograma de desembolso.
(*) A expressão "Am.n", onde "m" significa índice do resultado ou produto e "n" o índice de atividade.
Data: ___/__/______
Assinatura do Responsável
Cargo : |
MATRIZ DE PLANEJAMENTO E MONITORAMENTO DO PROJETO
DA INTERVENÇÃO |
COMPROVAÇÃO |
IMPORTANTES |
||||||||||||||||||||||
Indicadores |
||||||||||||||||||||||||
(...): |
||||||||||||||||||||||||
(...): |
||||||||||||||||||||||||
OBSERVAÇÃO
A tabela acima é meramente ilustrativa e para fins didáticos. Assim sendo, as informações requeridas não precisam ser apresentadas no formato da tabela.
DEFINIÇÕES:
1. ESTRUTURA ANALÍTICA DO PROJETO (lógica da intervenção)
1.1. Objetivo do Projeto. Este é o objetivo ou o efeito esperado da intervenção, descrevendo-se a nova situação que se visa alcançar com a realização do projeto. Deve expressar as mudanças de estado que serão provocadas na situação do público-alvo pelos resultados do projeto, ao seu final. Pressupõe-se que, sem essa mudança, as melhorias que um projeto pode prover não teriam sustentabilidade, ou seja, não haveria desenvolvimento, entendido como um processo de transformação e melhoria ao longo do tempo.
O objetivo do projeto deve estar relacionado a um objetivo de desenvolvimento do SUS, que orienta a atuação do projeto dentro do contexto do PROADI-SUS, considerando as áreas de atuação e os temas e objetivos prioritários.
1.2 e 1.3. Resultados das Atividades e Produtos (entregas do projeto). Um projeto cria entregas ou resultados exclusivos. Um resultado pode estar relacionado a um ou mais produtos. Entende-se por produto um bem ou serviço produzido, ou seja, um resultado mensurável e verificável do trabalho.
Os resultados e produtos descrevem o escopo do projeto, ou seja, aquilo que é gerenciável pelo projeto e que é de responsabilidades da entidade executora. Enquanto o Objetivo do Projeto é um efeito desejado, mas que foge do controle e da responsabilidade direta da entidade, o alcance dos resultados e produtos tem que ser gerenciado de tal forma que pode ser atribuído aos esforços do projeto.
Quando o projeto apresentar resultados que possam ser subdivididos em produtos, cada resultado deve estar relacionado a um ou mais produtos, devendo o projeto trazer registrado na sua decomposição hierárquica todos os principais produtos relacionados a cada resultado.
Alguns projetos podem estar subdivididos em fases ou etapas de modo a oferecer melhor controle gerencial. A transição de uma fase para outra geralmente envolve e é definida por alguma forma de transferência técnica ou entrega, ou seja, produtos. O término e a aprovação de um ou mais produtos caracteriza uma fase do projeto. Assim sendo, é comum que um objetivo do projeto seja subdividido em fases ou etapas com produtos e atividades específicos. Nesse caso, a cada fase ou etapa deve corresponder um resultado, subdividido ou não em produtos.
Os principais resultados e produtos devem estar ligados às atividades de intervenção.
1.4. Atividades Principais de Intervenção e seus respectivos recursos e custos estimados. De acordo com os resultados e produtos que se deseja entregar, devem ser definidas quais são as atividades necessárias para sua consecução. Para cada resultado ou produto, conforme as especificidades da decomposição hierárquica apontadas no item acima, uma série de atividades principais deve ser elaborada. Têm que haver atividades suficientes e necessárias a fim de se alcançar um determinado resultado ou produto. Se as atividades previstas não forem suficientes, os resultados não poderão ser alcançados e se não forem necessárias, significa que o projeto desperdiça recursos.
Para cada atividade desenvolvida, seja de intervenção ou de monitoramento/avaliação, devem ser apresentados os recursos (pessoas, equipamentos e insumos) necessários à sua realização, quando solicitado pelo Ministério da Saúde por ocasião da prestação de contas, inclusive com detalhamento das quantidades e custos unitários dos recursos de cada atividade.
As atividades podem ser desagregadas em subatividades, para as quais não é obrigatória a apresentação dos recursos utilizados e dos custos incorridos.
Ressalta-se que apesar de não constar na Matriz de Planejamento do Projeto, é fundamental que, além das atividades de intervenção e seus respectivos recursos e custos, sejam definidas as Atividades de Monitoramento e Avaliação. Assim sendo, os projetos deverão apresentar as principais atividades de monitoramento e avaliação, seus respectivos prazos e recursos/custos.
Considera-se que o monitoramento é uma função contínua que deve buscar identificar o progresso do Projeto rumo aos resultados desejados ou eventuais obstáculos de execução que venham a dificultar o alcance dos resultados e/ou objetivos.
Considera-se que a avaliação deve buscar verificar não só o alcance dos resultados, mas também o alcance da mudança desejada, expondo as lições apreendidas e as recomendações para o futuro, além da identificação e disseminação de boas práticas.
2. INDICADORES OBJETIVAMENTE COMPROVÁVEIS
Um indicador é uma situação ou característica que serve como sinal comprobatório de outro fato. Os indicadores devem ser especificados baseados em fatos e evidências, considerando as seguintes questões:
O público-alvo: quem é beneficiado?
A quantidade: quanto?
A qualidade: quão bem?
O período: quando e quanto tempo?
A localização: onde?
As funções dos indicadores são: caracterizar mais detalhadamente os objetivos e resultados, estabelecendo o quê e quanto se pretende alcançar, e fornecer uma base para o monitoramento e a avaliação do projeto. Os indicadores se diferenciam de acordo com os níveis lógicos do projeto. Os resultados, que são os produtos pelos quais a gerência do projeto se responsabiliza, exigem indicadores de monitoramento:descrevem os produtos em termos do que será feito, o quanto, quando e quão bem. Esses indicadores têm que estar coerentes com as entradas, ou seja, as atividades e os recursos aplicados.
Por outro lado, o objetivo do projeto e o objetivo de desenvolvimento expressam efeitos esperados e, portanto, os seus indicadores são de efeitos, sejam efeitos diretos e indiretos, respectivamente. Eles indicam as mudanças esperadas. Dado a complexidade, quase sempre é necessário um conjunto de indicadores para medir cada um dos efeitos. A título de ilustração, podem-se considerar os seguintes tipos de indicadores:
Objetivo Imediato Resultados (saídas) Atividades Recursos (entradas) |
Efeito Produtos (benefícios) Processos Custos |
3. FONTES DE COMPROVAÇÃO
Onde se encontram as informações e os dados dos indicadores, ou seja, os locais e os documentos que poderão ser utilizados para verificar o conteúdo dos indicadores. Fontes podem ser estatísticas oficiais, pesquisas de opinião pública para os indicadores de efeito e são geralmente documentos produzidos pelo próprio sistema de informações gerenciais do projeto para os resultados. Considera-se fundamental que fontes adequadas existam e sejam confiáveis.
4. SUPOSIÇÕES IMPORTANTES
É uma espécie de análise de riscos do projeto. Suposições são fatores, externos ou internos ao projeto, considerados verdadeiros, reais ou certos, para fins de planejamento. Os fatores externos escapam à influência direta da gerência do projeto nos Hospitais de Excelência, estando mais ligados às condições ambientais sob o âmbito de atuação do Ministério da Saúde. Por isso, essas condições, além das internas ao projeto, devem estar claras desde o princípio, a fim de garantir-se que as ações necessárias serão implementadas pelo Ministério da Saúde, visando ao atingimento dos objetivos do projeto.
A inclusão de uma suposição importante depende de sua avaliação. Em primeiro lugar, ela tem que ser valiosa para o êxito do projeto. Segundo, tem que existir certo grau de risco de ela não ocorrer. E, terceiro, se for identificado que ela é relevante, mas pouco provável de ocorrer, significa que o êxito do projeto está em jogo e, consequentemente, a estratégia de intervenção deve ser mudada.
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 6 DO ANEXO XCIII
MODELO DE PARECER TÉCNICO PARA ANÁLISE DE PROJETO (Origem: PRT MS/GM 2814/2014, Anexo 6)
(Nome da SECRETARIA COMPETENTE OU ENTIDADE VINCULADA AO MS) |
|---|
Título do projeto: Data de início: Data de encerramento: Número do Protocolo: |
Ciclo: XXXX - XXXX Valor estimado ano 01: Valor estimado ano 02: |
Área(s) e subárea(s) de atuação: |
Tema(s) e objetivo(s) prioritário(s): ? |
Prazo de Atendimento: Número do Parecer: ____________/Ano. |
Análise da lógica de intervenção (Objetivos, Resultados, Produtos, Atividades de Intervenção, Atividades de Monitoramento e Avaliação): |
Análise dos Custos: |
( ) Aprovação ( ) Não Aprovação |
Unidade indicada para acompanhamento: (SC/EV indicada para acompanhamento conjunto) Anexos: |
Nome e Qualificação do Coordenador e identificação da Coordenação |
Nome e Qualificação do Coordenador-Geral e identificação Coordenação-Geral |
Nome e Qualificação do Diretor e identificação do Departamento |
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 7 DO ANEXO XCIII
MODELO DE TERMO DE DOAÇÃO (Origem: PRT MS/GM 2814/2014, Anexo 7)
MODELO DE TERMO DE DOAÇÃO
TERMO DE DOAÇÃO QUE ENTRE SI CELEBRAM A SOCIEDADE HOSPITAL "NOME" E "ENTIDADE DONATÁRIA"
Pelo presente instrumento, a Entidade de Saúde <NOME>, por intermédio da <Gerência/Superintendência> com sede xxxxxxxxxxxx, inscrita no CNPJ sob nº xx.xxx.xxx/xxx-xx, ora designado DOADOR, neste ato representado na forma do seu Estatuto por <nome.>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº <xxx.xxx.xxx-xx> e RG nº <xxxxxxx>, expedido pela xxx/xx, e de outro lado, a entidade beneficiada, <NOME>, inscrita no CNPJ/MF xxxxxxxxxx, com sede xxxxxxx, doravante denominado DONATÁRIO, neste ato representada por <nome>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº xxxxxxxxx e RG nº xxxxxxx, expedido pela xxx/xx, e de acordo com o Termo de Ajuste nº <xx/xxx>, constantes no autos do Processo nº <25000.xxxxxx/20xx-xx>, com fundamento na Portaria GM/MS nº xxxxx, de xxxx de abril de xxxxx, no Decreto nº 99.658, de 30 de outubro de 1990, alterado pelo Decreto nº 4.245, de 23 de maio de 2002, têm entre si acordado o presente TERMO DE DOAÇÃO, sob a forma e condições constantes das seguintes CLÁUSULAS:
CLÁUSULA PRIMEIRA - DO OBJETO - O presente instrumento tem por objeto a Doação dos bens, relacionados no anexo, parte integrante e indissociável deste Termo, tendo por finalidade a utilização pelo DONATÁRIO, na continuidade das ações e serviços de assistência à saúde da população, visando a melhoria da produção e qualidade dos procedimentos de atendimento, assim como o aperfeiçoamento e expansão da capacidade operacional do Sistema Único de Saúde.
SUBCLÁUSULA ÚNICA - O bem doado terá o seu valor residual considerado no momento da baixa do ativo.
CLÁUSULA SEGUNDA - Em se tratando de DOAÇÃO, o DONATÁRIO compromete-se a destinar os bens, objeto deste instrumento à execução de ações de saúde, sendo estes para sua utilização pelo órgão ou entidade beneficiária, conforme os dispostos no art. Xxxx da Portaria GM/MS nº xxxxxx nas subcláusulas 1º, 2º e 3º da Cláusula quinta do Termo de Ajuste nº <xx/xxx>
CLÁUSULA TERCEIRA - O DONATÁRIO, em observância à cláusula Primeira e Segunda do presente termo, responsabiliza-se por:
a) manter em funcionamento e assumir o custo operacional de acordo com parâmetros firmados pelo Ministério da Saúde;
b) adquirir equipamentos complementares, materiais permanentes e de consumo, necessários à implantação e operacionalização dos serviços objeto deste termo.;
c) efetuar manutenção preventiva e corretiva, após o término da garantia do equipamento doado;
d) manter atualizado os dados da Instituição prestadora de serviço ao SUS no Cadastro Nacional de Entidade de Saúde - CNES.
CLÁUSULA QUARTA - Os custos com remoção e instalação do equipamento e/ou material permanente no <donatária> serão arcados pelo DOADOR.
CLÁUSULA QUINTA - É de responsabilidade do DONATÁRIO, prover treinamento aos seus colaboradores para utilização correta do(s) equipamento(s) doado(s), bem como a obtenção de todas as licenças necessárias para operação dos bens.
CLÁUSULA SEXTA - O DONATÁRIO, por intermédio deste instrumento, atesta, plena e irrestritamente, o recebimento de todos os bens arrolados no Anexo deste Termo.
CLÁUSULA SÉTIMA - Em caso de constatação, pelo Ministério da Saúde ou pelos órgãos de controle externo, de não utilização do bem doado para os fins e forma a que se propõe a presente DOAÇÃO, poderá ser promovida à revogação parcial ou total deste termo, realocando-se o bem a outro estabelecimento público de saúde ou a outra instituição de ensino e pesquisa, conforme determinado pelo Ministério da Saúde, sem direito de indenização pelo DONATÁRIO.
CLÁUSULA OITAVA - Fica eleito o Foro da Seção Judiciária xxxx, com exclusão de qualquer outro, por mais privilegiado que seja, para dirimir quaisquer dúvidas oriundas do presente Termo de Doação.
E por estarem de pleno acordo, as partes assinam este Termo em três vias de igual teor e forma, que após lido e achado conforme para um só efeito, é assinado pelos partícipes na presença de 2 (duas) testemunhas, igualmente signatárias.
Local , .....de ...............de 20....
Pelo Hospital de Excelência
Nome:
Cargo:
TESTEMUNHAS:
Nome:
CPF:
Pelo Donatário
Nome:
Cargo :
TESTEMUNHAS:
Nome:
CPF:
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO AO TERMO DE DOAÇÃO
Dados do Doador:
Dados do Donatário:
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 8 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE DECLARAÇÃO DE ANUÊNCIA DO GESTOR LOCAL(Origem:PRT MS/GM2814/2014,Anexo8)
MODELO PARA APRESENTAÇÃO DE DECLARAÇÃO DE ANUÊNCIA DO GESTOR LOCAL
DECLARAÇÃO DE ANUÊNCIA
Eu, ____________________na qualidade de gestor local do SUS, portador do RG n.º ____________ e CPF n.º ____________com endereço funcional situado _________________cidade: ______uf:____telefone(xx) ________, e-mail: _________, declaro para os devidos fins, que a entidade de saúde de reconhecida excelência, _______________________apresentou o projeto assistencial "_________________________", vinculado a Carta Consulta n.º _________, aprovada pelo Comitê Gestor do PRAODI-SUS em ___/___/__, a ser desenvolvido pela a respectiva entidade em parceria com a Secretaria Municipal de Saúde de XXXXXX, cuja vigência estender-se-á de xxxx de xxxx de xxxx à xxxx de xxxxx de xxxxx.
Ressalta-se que o projeto apresentado encontra-se em consonância com as exigências previstas na Lei n.º 12.101 de 27 de novembro de 2009, bem como nos termos da Portaria que regulamenta o PROADISUS.
Sendo assim, APROVO o projeto assistencial apresentado, uma vez que, atende a necessidade de interesse local quanto à prestação de serviços ambulatoriais e hospitalares do Sistema Único de Saúde. __________________________________
Nome
Cargo
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 9 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE RELATÓRIO SEMESTRAL DE ATIVIDADES DO PROJETO REFERENTE AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 9)
- Indicar nominalmente as entidades beneficiárias, quando aplicável. (Referente item 3.1, "e.1" do Plano de Trabalho); e - Indicar o número de alunos que concluíram o curso ofertado, relacionando-os com a entidade beneficiaria e respectivo n° CNES, quando aplicável.(Referente ao Anexo VII, item 1.5 da Matriz de Planejamento, e item 3.1, "q", do Plano de Trabalho. - Indicar as atividades desenvolvidas quanto à disseminação da informação, de forma qualitativa e quantitativa (eventos, publicações técnico-científicas,boletins informativos, revistas, etc.), quando aplicável; - Apresentar a avaliação dos resultados obtidos junto aos beneficiários nas seguintes situações: - Avaliação pelos alunos (apresentação consolidada), em caso de projetos que envolvam capacitação de recursos humanos; - Avaliação do gestor local e /ou regional e diretor da instituição em caso de projetos que envolvam técnicas e operação de gestão em serviços de saúde; - Aceite do CEP/CONE na fase inicial, em caso de projetos que envolvam projetos de pesquisa de interesse público e estudos de avaliação e incorporação de tecnologia, quando aplicável. - Indicar a entrada de novos parceiros, se houver; - Indicar dificuldades relevantes encontradas durante a execução do projeto que impactaram direta e indiretamente no alcance das metas estabelecidas e se será necessária uma alteração no projeto em razão disso; - Mencionar outros resultados alcançados pelo projeto que não se enquadrem nas classificações anteriores; e - Descrever outras informações relevantes. |
||
Data: ___/__/______
Assinatura do Responsável
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 10 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE RELATÓRIO ANUAL DE ATIVIDADES DO PROJETO REFERENTE AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 10)
- Mencionar outros resultados alcançados pelo projeto que não se enquadrem nas classificações anteriores; e - Descrever outras informações relevantes. |
|||||||||
Data: ___/__/______
Assinatura do Responsável
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 11 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE RELATÓRIO FINAL DE ATIVIDADES DO PROJETO REFERENTE AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 11)
( ) Ano II ______ ( ) Ano III ______ |
|||||||||||
(Termo Aditivo ao Termo de Ajuste) (B) |
|||||||||||
- Indicar nominalmente as entidades beneficiárias, quando aplicável. (Referente item 3.1, "e.1" do Plano de Trabalho). - Indicar o número de alunos que concluíram o curso ofertado, relacionando-os com a entidade beneficiaria e respectivo n° CNES, quando aplicável.(Referente ao Anexo VII, item 1.5 da Matriz de Planejamento, e item 3.1, "q", do Plano de Trabalho. |
|||||||||||
- Apresentar a avaliação dos resultados obtidos junto aos beneficiários nas seguintes situações: - Avaliação pelos alunos (apresentação consolidada), em caso de projetos que envolvam capacitação de recursos humanos; |
|||||||||||
- Aceite do CEP/CONEna fase inicial, em caso de projetos que envolvam projetos de pesquisa de interesse público e estudos de avaliação e incorporação de tecnologia, quando aplicável. - Indicar a entrada de novos parceiros, caso haja. |
|||||||||||
- Apresentar relatório técnico-científico contendo: a) Resumo estruturado (até 5.000 caracteres); b) Problema de pesquisa; c) Fundamentação teórica; d) Objetivos; e) Procedimentos metodológicos; f) Conjunto dos resultados obtidos; g) Discussão (interpretação dos resultados a partir da fundamentação teórica apresentada); h) Conclusões/Recomendações |
|||||||||||
Data: ___/__/______
Assinatura do Responsável
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 12 DO ANEXO XCIII
MODELO PARA ELABORAÇÃO DE PARECER TÉCNICO DOS RELATÓRIOS DE ATIVIDADES DOS PROJETOS (Origem: PRT MS/GM 2814/2014, Anexo 12)
SECRETARIA ___________ DEPARTAMENTO _________________ COORDENAÇÃO-GERAL __________________________ |
INTERESSADO: inserir o hospital interessado |
|
Trata-se da análise do Relatório Anual de Atividades de "xxxx", registrado sob SIPAR 25000.000000/yyyy-00 e Relatório de Auditoria "xxxx", registrado sob SIPAR 25000.000000/yyyy-00, referente ao Projeto de Apoio ao PROADI-SUS "X"(inserir o nome do projeto) |
Apresentar descrição resumida dos objetivos gerais e específicos do projeto pactuado com o Ministério, ressaltando se houve ou há necessidade de alterações nos objetivos inicialmente pactuados. |
2.1 Execução Física |
a. As atividades foram executadas de acordo com o cronograma inicialmente e com a qualidade requerida/esperada? b. Descrever as dificuldades e obstáculos encontrados na execução física. c. Descrever as principais conquistas e avanços obtidos com a execução física obtida. d. O projeto atingiu seus objetivos? e. O projeto atingiu suas metas físicas (resultados e produtos)?f. Relatar se houve ou se haverá necessidade de reprogramação do cronograma de atividades, sem impactar nos objetivos e/ou resultados finais esperados. g. Informar se houve ou se haverá necessidade de alteração do plano de trabalho; h. Informar se houve ou se haverá necessidade de aditivo de prazo (observar nos projetos com prazo inferior a três anos) |
A execução financeira do projeto é apresentada por meio de dois relatórios inter-relacionados: o Relatório Anual de Atividades e o Relatório de Auditoria Independente da execução do projeto |
O Relatório de Auditoria Independente demonstra a opinião dos auditores quanto à prestação de contas do projeto, se ela apresenta adequadamente os gastos incorridos pelo hospital no respectivo exercício financeiro, de acordo com os registros contábeis do hospital, devendo estar claro que esses gastos foram auditados pela empresa de Auditoria Independente. |
a. Os gastos estão discriminados e comprovados no Relatório de Auditoria Independente? b. Há necessidade de maior especificação e/ou comprovação das despesas apresentadas no orçamento consolidado? É importante que as despesas estejam suficientemente especificadas e comprovadas, quer seja no orçamento consolidado, quer seja na forma de informações adicionais, devendo-se considerar como critério de relevância para a especificação/comprovação, a magnitude dos gastos de cada item de despesa |
Ao final, deve-se apresentar um breve resumo da situação da execução financeira com relação ao previsto no plano de trabalho, ressaltando a ocorrência de aditivos financeiros |
Valor anual aprovado (projeto inicial): R$ Valor anual aprovado (projeto aditado): R$ |
Valor executado apresentado (relatório de auditoria): R$ Valor executado aprovado: R$ |
Nesse item devem constar todas as diligências levantadas no item anterior e que devem ser atendidas pelo hospital com vistas à emissão de parecer conclusivo Caso trate-se de um parecer em prosseguimento a um primeiro parecer de diligência, deve-se informar se as diligências anteriormente apontadas foram respondidas pelo hospital. |
b. Aprovação do Sistema CEP/CONEP; c. Outros. |
Na conclusão, deve estar claro se o presente trata-se de parecer conclusivo (final) ou de parecer de diligência |
Caso se trate de parecer de diligência, sugere-se o texto abaixo: "Diante do exposto, sugere-se o atendimento das recomendações/pendências apresentadas no item 3, com vistas à emissão de parecer conclusivo." |
PARECER FAVORÁVEL (de aprovação sem restrições ou ressalvas) Caso se trate de parecer conclusivo, se este for favorável, sugerem-se os textos abaixo: |
PARECER DESFAVORÁVEL (de reprovação dos relatórios de prestação de contas) Caso a Coordenação-Geral seja desfavorável à aprovação do Relatório Anual, deve justificar e demostrar que foi respeitado o princípio do contraditório e da ampla defesa, tendo realizado todas as diligências possíveis junto ao hospital. |
De Acordo: Nome e Qualificação do Coordenador e identificação da Coordenação |
Nome e Qualificação do Coordenador-Geral e identificação Coordenação-Geral |
Nome e Qualificação do Diretor e identificação do Departamento |
ANEXO XCIV
ESTRATÉGIAS DE AÇÃO DO PROGRAMA NACIONAL PARA QUALIFICAÇÃO, PRODUÇÃO E INOVAÇÃO EM EQUIPAMENTOS E MATERIAIS DE USO EM SAÚDE NO COMPLEXO INDUSTRIAL DA SAÚDE (Origem: PRT MS/GM 375/2008, Anexo 1)
ESTRATÉGIAS DE AÇÃO DO PROGRAMA NACIONAL PARA QUALIFICAÇÃO, PRODUÇÃO E INOVAÇÃO EM EQUIPAMENTOS E MATERIAIS DE USO EM SAÚDE NO COMPLEXO INDUSTRIAL DA SAÚDE:
As estratégias do Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde, consistem no apoio, fomento e execução de ações e projetos voltados às áreas de:
I - Fomento ao Desenvolvimento Tecnológico, Produção e Inovação;
II - Regulação (em parceria com a Anvisa e o Inmetro);
III - Cooperação Técnica e Econômica;
IV - Compras Governamentais; e
V - Atração de Investimentos.
1 - Fomento ao Desenvolvimento Tecnológico, Produção e Inovação (em parceria com o BNDES e FINEP):
Apoio a programas e projetos de apoio tecnológico ao setor produtivo quanto a:
- obtenção de certificações internacionais e superação de barreiras técnicas, visando à exportação;
adequação de produtos a normas técnicas;
- adequação de processos produtivos; e
- ampliação da capacidade de diferenciação de produtos e inovação de processos.
Rede de Integração de tecnologias utilizadas em produtos médicos objetivando:
- monitorar as demandas tecnológicas do setor de produtos médicos e identificar em outros setores industriais quem pode suprir tais demandas; e
- apoiar projetos entre empresas fornecedoras e ICT's, para integração de tecnologias visando ao desenvolvimento de novos produtos e processo produtivos.
stimular a formação e a capacitação de recursos humanos na área de Engenharia Biomédica:
- Gestão da P, D & I;
- Segurança e Gerenciamento de Riscos em Tecnologia Médica;
- Boas Práticas de Fabricação de Produtos Médicos;
Avaliação Tecnológica de Produtos Médicos;
- Certificação, Ensaios e Qualificação Produtos Médicos;
- Treinamento em Operação e Segurança de Equipamentos Médico-Hospitalares; e
- Gerenciamento da Inovação de Tecnologias Médicas. Estabelecer mecanismos e programas para transferência de tecnologias estratégicas ao SUS:
- mapeamento das tecnologias estratégicas ao SUS;
- identificação e consolidação de parcerias estratégicas com institutos de tecnologia no Brasil e no exterior;
- estimular a implantação de centros de P,D&I no País; e
- fomentar programas e projetos que objetivem a transferência de tecnologias a empresas brasileiras.
2 - Regulação (em parceria com a Anvisa e o Inmetro): Ampliar a capacidade laboratorial para:
- equipamentos de radiodiagnóstico;
- compatibilidade eletromagnética de equipamentos médicos;
- segurança e desempenho de equipamentos médicos; e
- implantes ortopédicos.
Normalização de Produtos Médicos:
- internalização de normas técnicas internacionais aplicáveis a produtos médicos;
- acompanhamento do desenvolvimento de normas técnicas internacionais;
- uso da certificação Inmetro como instrumento para a garantia da qualidade de produtos de uso em saúde; e
- promover condições para que as empresas operem em conformidade com os regulamentos da Anvisa.
3 - Cooperação Técnica e Econômica:
- firmar termo de cooperação técnica com instituições internacionais visando à formação de recursos humanos e transferência de tecnologia; e
- articular com BNDES, FINEP e outros bancos oficiais, programas para o setor de equipamentos e materiais de uso em saúde.
4 - Compras Governamentais:
- avaliação do modelo de Tratamento Especial e Diferenciado para Países em Desenvolvimento - TED, em especial a compensação comercial, industrial ou tecnológica nas compras governamentais civis (OFFSET) em licitações internacionais; e
- estabelecer políticas e mecanismos para "Encomendas Tecnológicas" de produtos estratégicos.
5 - Atração de Investimentos:
- definir uma política para a atração de investimentos com base em modelos internacionais de sucesso;
- mapeamento dos países mais atrativos para investimento nos diversos segmentos do complexo produtivo;
- levantamento dos fundos internacionais (investimentos, subvenções, venture capital, seed money, joint venture, offset, etc.); e
- estimular o uso das Leis do Bem e da Inovação e identificar possibilidades de se desenvolver outros mecanismos de subvenção para o setor produtivo.
ANEXO XCV
DOS CRITÉRIOS PARA A DEFINIÇÃO DA LISTA DE PRODUTOS ESTRATÉGICOS PARA O SUS E DO ESTABELECIMENTO DAS PARCERIAS PARA O DESENVOLVIMENTO PRODUTIVO (PDP) E DOS RESPECTIVOS PROCESSOS DE SUBMISSÃO, INSTRUÇÃO, DECISÃO, TRANSFERÊNCIA E ABSORÇÃO DE TECNOLOGIA, AQUISIÇÃO DE PRODUTOS ESTRATÉGICOS PARA O SUS NO ÂMBITO DAS PDP E O RESPECTIVO MONITORAMENTO E AVALIAÇÃO (Origem: PRT MS/GM 2531/2014)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO I)
Art. 1º Ficam estabelecidos as diretrizes e os critérios para a definição da lista de produtos estratégicos para o Sistema Único de Saúde (SUS) e o estabelecimento das Parcerias para o Desenvolvimento Produtivo (PDP) e disciplina os respectivos processos de submissão, instrução, decisão, transferência e absorção de tecnologia, aquisição de produtos estratégicos para o SUS no âmbito das PDP e o respectivo monitoramento e avaliação. (Origem: PRT MS/GM 2531/2014, Art. 1º)
Art. 2º Para efeitos deste Anexo, são adotados os seguintes conceitos: (Origem: PRT MS/GM 2531/2014, Art. 2º)
I - Parceria para o Desenvolvimento Produtivo (PDP): parcerias que envolvem a cooperação mediante acordo entre instituições públicas e entre instituições públicas e entidades privadas para desenvolvimento, transferência e absorção de tecnologia, produção, capacitação produtiva e tecnológica do País em produtos estratégicos para atendimento às demandas do SUS; (Origem: PRT MS/GM 2531/2014, Art. 2º, I)
II - produtos estratégicos para o SUS: produtos necessários ao SUS para ações de promoção, prevenção e recuperação da saúde, com aquisições centralizadas ou passíveis de centralização pelo Ministério da Saúde e cuja produção nacional e de seus insumos farmacêuticos ativos ou componentes tecnológicos críticos são relevantes para o CEIS; (Origem: PRT MS/GM 2531/2014, Art. 2º, II)
III - lista de produtos estratégicos para o SUS: relação de produtos estratégicos para o SUS que define as prioridades anuais para a apresentação de propostas de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 2º, III)
IV - Complexo Econômico-Industrial da Saúde (CEIS): sistema produtivo da saúde que contempla as indústrias farmacêuticas, de base química e biotecnológica, os produtos para a saúde, tais como equipamentos e materiais, e os serviços de saúde; (Origem: PRT MS/GM 2531/2014, Art. 2º, IV)
V - instituição pública: órgão ou entidade da Administração Pública, Direta ou Indireta, de uma das três esferas do governo, que atue em pesquisa, desenvolvimento ou produção de medicamentos, soros, vacinas ou produtos para a saúde; (Origem: PRT MS/GM 2531/2014, Art. 2º, V)
VI - entidade privada: pessoa jurídica de direito privado, não integrante da Administração Pública, Direta ou Indireta, que seja detentora, desenvolvedora, possua licença da tecnologia a ser transferida ou que seja responsável pela produção de uma etapa da cadeia produtiva no País; (Origem: PRT MS/GM 2531/2014, Art. 2º, VI)
VII - núcleo tecnológico: conjunto de conhecimentos tecnológicos que capacita seu detentor a reproduzir, desenvolver, aprimorar e transferir a tecnologia dos produtos objetos de PDP; (Origem: PRT MS/GM 2531/2014, Art. 2º, VII)
VIII - inovação: introdução de novidade ou aperfeiçoamento no ambiente produtivo ou social que resulte em novos produtos, processos ou serviços; (Origem: PRT MS/GM 2531/2014, Art. 2º, VIII)
IX - verticalização: conjunto de etapas, unidades e sistemas produtivos que determinam o grau de internalização da cadeia produtiva do produto objeto de PDP no País; (Origem: PRT MS/GM 2531/2014, Art. 2º, IX)
X - Insumo Farmacêutico Ativo (IFA): substância química ou biológica ativa, fármaco, droga ou matéria-prima que tenha propriedades farmacológicas com finalidade medicamentosa, utilizada para diagnóstico, prevenção ou tratamento, empregada para modificar ou explorar sistemas fisiológicos ou estados patológicos, em benefício do paciente, cuja produção seja importante para o domínio do núcleo tecnológico pelo País no âmbito do CEIS; (Origem: PRT MS/GM 2531/2014, Art. 2º, X)
XI - componente tecnológico crítico: insumo, produto ou processo da cadeia produtiva das indústrias de produtos em saúde, de uso preventivo, terapêutico e diagnóstico, cuja produção seja importante para o domínio do núcleo tecnológico pelo País no âmbito do CEIS; (Origem: PRT MS/GM 2531/2014, Art. 2º, XI)
XII - portabilidade tecnológica: capacidade técnica e gerencial de transferência de determinada tecnologia pela entidade privada ou instituição pública que a detém para outra instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 2º, XII)
XIII - Processo Produtivo Básico (PPB): conjunto mínimo de operações no estabelecimento produtor que caracteriza a efetiva industrialização de determinado produto; (Origem: PRT MS/GM 2531/2014, Art. 2º, XIII)
XIV - termo de compromisso: documento firmado entre a instituição pública, que se responsabiliza pelo investimento, desenvolvimento, transferência e absorção de tecnologia de produtos estratégicos para o SUS, e o Ministério da Saúde, que se responsabiliza pela aquisição dos produtos objetos da PDP, contendo em anexo declaração de concordância com o referido documento subscrita pelos parceiros privados; e (Origem: PRT MS/GM 2531/2014, Art. 2º, XIV)
XV - internalização da tecnologia: finalização do processo de desenvolvimento, transferência e absorção de tecnologia objeto da PDP pela instituição pública, tornando-a detentora de todas as informações que garantam o domínio tecnológico e apta à portabilidade tecnológica para o atendimento das demandas do SUS. (Origem: PRT MS/GM 2531/2014, Art. 2º, XV)
Art. 3º São objetivos das PDP: (Origem: PRT MS/GM 2531/2014, Art. 3º)
I - ampliar o acesso da população a produtos estratégicos e diminuir a vulnerabilidade do SUS; (Origem: PRT MS/GM 2531/2014, Art. 3º, I)
II - reduzir as dependências produtiva e tecnológica para atender as necessidades de saúde da população brasileira a curto, médio e longo prazos, seguindo os princípios constitucionais do acesso universal e igualitário às ações e aos serviços de saúde; (Origem: PRT MS/GM 2531/2014, Art. 3º, II)
III - racionalizar o poder de compra do Estado, mediante a centralização seletiva dos gastos na área da saúde, com vistas à sustentabilidade do SUS e à ampliação da produção no País de produtos estratégicos; (Origem: PRT MS/GM 2531/2014, Art. 3º, III)
IV - proteger os interesses da Administração Pública e da sociedade ao buscar a economicidade e a vantajosidade, considerando-se preços, qualidade, tecnologia e benefícios sociais; (Origem: PRT MS/GM 2531/2014, Art. 3º, IV)
V - fomentar o desenvolvimento tecnológico e o intercâmbio de conhecimentos para a inovação no âmbito das instituições públicas e das entidades privadas, contribuindo para o desenvolvimento do CEIS e para torná-las competitivas e capacitadas; (Origem: PRT MS/GM 2531/2014, Art. 3º, V)
VI - promover o desenvolvimento e a fabricação em território nacional de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 3º, VI)
VII - buscar a sustentabilidade tecnológica e econômica do SUS a curto, médio e longo prazos, com promoção de condições estruturais para aumentar a capacidade produtiva e de inovação do País, contribuir para redução do déficit comercial do CEIS e garantir o acesso à saúde; e (Origem: PRT MS/GM 2531/2014, Art. 3º, VII)
VIII - estimular o desenvolvimento da rede de produção pública no País e do seu papel estratégico para o SUS. (Origem: PRT MS/GM 2531/2014, Art. 3º, VIII)
CAPÍTULO II
DA LISTA DE PRODUTOS ESTRATÉGICOS PARA O SUS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO II)
Art. 4º A lista de produtos estratégicos para o SUS é composta por produtos pertencentes aos seguintes grupos: (Origem: PRT MS/GM 2531/2014, Art. 4º)
I - Grupo 1: fármacos; (Origem: PRT MS/GM 2531/2014, Art. 4º, I)
II - Grupo 2: medicamentos; (Origem: PRT MS/GM 2531/2014, Art. 4º, II)
III - Grupo 3: adjuvantes; (Origem: PRT MS/GM 2531/2014, Art. 4º, III)
IV - Grupo 4: hemoderivados e hemocomponentes; (Origem: PRT MS/GM 2531/2014, Art. 4º, IV)
V - Grupo 5: vacinas; (Origem: PRT MS/GM 2531/2014, Art. 4º, V)
VI - Grupo 6: soros; (Origem: PRT MS/GM 2531/2014, Art. 4º, VI)
VII - Grupo 7: produtos biológicos ou biotecnológicos de origem humana, animal ou recombinante; (Origem: PRT MS/GM 2531/2014, Art. 4º, VII)
VIII - Grupo 8: produtos para a saúde, tais como equipamentos e materiais de uso em saúde; (Origem: PRT MS/GM 2531/2014, Art. 4º, VIII)
IX - Grupo 9: produtos para diagnóstico de uso "in vitro"; e (Origem: PRT MS/GM 2531/2014, Art. 4º, IX)
X - Grupo 10: "software" embarcado no dispositivo médico ou utilizado na transmissão de dados em saúde, na recuperação, reconstrução e processamento de sinais e imagens ou na comunicação entre dispositivos. (Origem: PRT MS/GM 2531/2014, Art. 4º, X)
Parágrafo Único. Poderão ser incluídos na lista de produtos estratégicos para o SUS os produtos e bens que compõem os programas estratégicos desenvolvidos no âmbito do Ministério da Saúde, ainda que não previstos nos grupos de que trata o "caput". (Origem: PRT MS/GM 2531/2014, Art. 4º, Parágrafo Único)
Art. 5º O Ministério da Saúde definirá, anualmente, a lista de produtos estratégicos para o SUS em conformidade com as recomendações expedidas pelo Grupo Executivo do Complexo Industrial da Saúde (GECIS). (Origem: PRT MS/GM 2531/2014, Art. 5º)
§ 1º A lista de que trata o "caput" será editada por ato do Ministro de Estado da Saúde e observará o disposto nos arts. 4º e 6º do Anexo XCV . (Origem: PRT MS/GM 2531/2014, Art. 5º, § 1º)
§ 2º O Ministério da Saúde poderá efetuar consultas específicas a órgãos e entidades, públicas e privadas, além de especialistas no tema, e consultas públicas antes de definir a lista de produtos estratégicos para o SUS, sem prejuízo das recomendações expedidas pelo GECIS, conforme disciplinado no Decreto nº 7.807, de 17 de setembro de 2012. (Origem: PRT MS/GM 2531/2014, Art. 5º, § 2º)
Art. 6º A lista de produtos estratégicos de que trata o art. 5º será definida considerando-se: (Origem: PRT MS/GM 2531/2014, Art. 6º)
I - necessariamente os seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 6º, I)
a) importância do produto para o SUS, conforme as políticas e os programas de promoção, prevenção e recuperação da saúde; (Origem: PRT MS/GM 2531/2014, Art. 6º, I, a)
b) aquisição centralizada do produto pelo Ministério da Saúde ou passível de centralização; e (Origem: PRT MS/GM 2531/2014, Art. 6º, I, b)
c) interesse de produção nacional do produto e de seus insumos farmacêuticos ativos ou componentes tecnológicos críticos relevantes para o CEIS; e (Origem: PRT MS/GM 2531/2014, Art. 6º, I, c)
II - adicionalmente pelo menos um dos seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 6º, II)
a) alto valor de aquisição para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 6º, II, a)
b) dependência expressiva de importação do produto para os programas e ações de promoção, prevenção e assistência à saúde no âmbito do SUS nos últimos 3 (três) anos; (Origem: PRT MS/GM 2531/2014, Art. 6º, II, b)
c) incorporação tecnológica recente no SUS; e (Origem: PRT MS/GM 2531/2014, Art. 6º, II, c)
d) produto negligenciado ou com potencial risco de desabastecimento. (Origem: PRT MS/GM 2531/2014, Art. 6º, II, d)
§ 1º Sem prejuízo do disposto no "caput", o Ministro de Estado da Saúde poderá alterar, a qualquer tempo, a lista de produtos estratégicos para o SUS, de forma justificada, após consulta ao GECIS. (Origem: PRT MS/GM 2531/2014, Art. 6º, § 1º)
§ 2º O potencial risco de desabastecimento, de que trata a alínea "d" do inciso II, estará configurado quando existir registro de desabastecimento no país justificado pela área finalística do Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 6º, § 2º)
§ 3º O produto estratégico para o SUS que seja objeto de processo de transferência de tecnologia no âmbito de PDP em curso constará no portal do Ministério da Saúde e somente será contemplado na definição anual da lista de produtos estratégicos para o SUS se for possível a execução de nova PDP relativa ao mesmo produto, considerando-se as propostas de projeto de PDP anteriormente aprovadas. (Origem: PRT MS/GM 2531/2014, Art. 6º, § 3º)
Art. 7º Os produtos estratégicos para o SUS poderão ser objeto de medidas e iniciativas voltadas para pesquisa, desenvolvimento, transferência de tecnologia, inovação e produção nacional, com a finalidade de contribuir para o fortalecimento do CEIS e para ampliação do seu acesso pela população. (Origem: PRT MS/GM 2531/2014, Art. 7º)
Art. 8º A lista de produtos estratégicos para o SUS encontra-se no portal do Ministério da Saúde, disponível por meio do endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 8º)
CAPÍTULO III
DOS SUJEITOS PARTICIPANTES DA PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO III)
Art. 9º Os sujeitos participantes da PDP poderão ser: (Origem: PRT MS/GM 2531/2014, Art. 9º)
I - instituição pública, individualmente ou conjuntamente a outras instituições públicas, com vistas a possibilitar segurança, portabilidade tecnológica, agilidade e dinamicidade no processo de pesquisa, desenvolvimento, absorção tecnológica e inovação; e (Origem: PRT MS/GM 2531/2014, Art. 9º, I)
II - entidade privada, individualmente ou conjuntamente a outras entidades privadas, com vistas a possibilitar segurança, portabilidade tecnológica, agilidade e dinamicidade no processo de transferência de tecnologia. (Origem: PRT MS/GM 2531/2014, Art. 9º, II)
CAPÍTULO IV
DO PROCESSO
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV)
Art. 10. O processo para o estabelecimento de PDP possui as seguintes fases: (Origem: PRT MS/GM 2531/2014, Art. 10)
I - proposta de projeto de PDP: fase de submissão e análise da viabilidade da proposta e, em caso de aprovação, celebração do termo de compromisso entre o Ministério da Saúde e a instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 10, I)
II - projeto de PDP: início da fase de implementação da proposta de projeto de PDP aprovada e do termo de compromisso; (Origem: PRT MS/GM 2531/2014, Art. 10, II)
III - PDP: início da fase de execução do desenvolvimento do produto, transferência e absorção de tecnologia de forma efetiva e celebração do contrato de aquisição do produto estratégico entre o Ministério da Saúde e a instituição pública; e (Origem: PRT MS/GM 2531/2014, Art. 10, III)
IV - internalização de tecnologia: fase de conclusão do desenvolvimento, transferência e absorção da tecnologia objeto da PDP em condições de produção do produto objeto de PDP no País e portabilidade tecnológica por parte da instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 10, IV)
Parágrafo Único. O fluxograma do processo de estabelecimento das PDP está previsto no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 10, Parágrafo Único)
Seção I
Da Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I)
Art. 11. A proposta de projeto de PDP será elaborada considerando-se a lista vigente de produtos estratégicos para o SUS. (Origem: PRT MS/GM 2531/2014, Art. 11)
Parágrafo Único. A proposta de projeto PDP seguirá o modelo de projeto executivo previsto no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 11, Parágrafo Único)
Art. 12. A proposta de projeto de PDP será apresentada por meio de expediente físico pela instituição pública ao Ministério da Saúde, especificamente à Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS). (Origem: PRT MS/GM 2531/2014, Art. 12)
Art. 13. A proposta de projeto de PDP deverá ser formalizada pela instituição pública junto à SCTIE/MS entre 1º de janeiro e 30 de abril. (Origem: PRT MS/GM 2531/2014, Art. 13)
§ 1º Esclarecimentos em relação à elaboração da proposta de projeto de PDP poderão ocorrer por meio de reuniões técnicas, e-mail ou expedientes físicos entre as instituições públicas e entidades privadas e o Ministério da Saúde a qualquer tempo, exceto durante o período de análise das propostas e de recursos administrativos. (Origem: PRT MS/GM 2531/2014, Art. 13, § 1º)
§ 2º Os resultados das avaliações das propostas de projeto de PDP serão divulgados nas reuniões do GECIS realizadas após o período de que trata o "caput". (Origem: PRT MS/GM 2531/2014, Art. 13, § 2º)
§ 3º O calendário anual de reuniões do GECIS será divulgado concomitantemente com a divulgação da lista de produtos estratégicos para o SUS, devendo a pauta das reuniões do GECIS ser divulgada com antecedência mínima de 7 (sete) dias da realização da reunião. (Origem: PRT MS/GM 2531/2014, Art. 13, § 3º)
§ 4º Em caso de propostas de projeto de PDP apresentadas no mesmo período e que versem sobre o mesmo produto estratégico para o SUS, a sua avaliação será feita de forma conjunta e respectivos resultados divulgados simultaneamente. (Origem: PRT MS/GM 2531/2014, Art. 13, § 4º)
§ 5º É facultada a abertura de novo período para apresentação de propostas de projeto de PDP, mediante divulgação no portal eletrônico do Ministério da Saúde, em caso excepcional de relevante interesse de saúde pública e de forma justificada pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 13, § 5º)
Subseção I
Das Diretrizes e dos Requisitos para a Elaboração de Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção I)
Art. 14. A elaboração de proposta de projeto de PDP observará as seguintes diretrizes: (Origem: PRT MS/GM 2531/2014, Art. 14)
I - quanto aos sujeitos participantes, serão indicadas de forma pormenorizada: (Origem: PRT MS/GM 2531/2014, Art. 14, I)
a) a instituição pública responsável pela absorção da tecnologia e fabricação do produto ao final da fase de internalização de tecnologia da PDP; (Origem: PRT MS/GM 2531/2014, Art. 14, I, a)
b) a entidade privada detentora ou desenvolvedora da tecnologia do produto, que será responsável pela transferência da tecnologia à instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 14, I, b)
c) a instituição pública ou entidade privada desenvolvedora nacional e produtora local do insumo farmacêutico ativo (IFA) ou componente tecnológico crítico; e (Origem: PRT MS/GM 2531/2014, Art. 14, I, c)
d) a motivação para a escolha das entidades privadas participantes da PDP pelas instituições públicas; (Origem: PRT MS/GM 2531/2014, Art. 14, I, d)
II - quanto ao objeto, será informado: (Origem: PRT MS/GM 2531/2014, Art. 14, II)
a) os produtos constantes da lista de produtos estratégicos para o SUS que serão objeto do desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP; (Origem: PRT MS/GM 2531/2014, Art. 14, II, a)
b) as especificações dos produtos que serão objeto do desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP, conforme definido em ato do Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 14, II, b)
c) o prazo de vigência da PDP e o cronograma de sua implementação, observadas as disposições deste Anexo; (Origem: PRT MS/GM 2531/2014, Art. 14, II, c)
III - quanto à propriedade intelectual: (Origem: PRT MS/GM 2531/2014, Art. 14, III)
a) a pesquisa, o desenvolvimento e a fabricação dos produtos a serem adquiridos no âmbito da PDP seguirão a legislação vigente; e (Origem: PRT MS/GM 2531/2014, Art. 14, III, a)
b) devem ser informados os números dos documentos das patentes concedidas ou em processamento no país, relacionados à produção e transferência de tecnologia do produto objeto de PDP, indicando seus respectivos titulares e a sua vigência; (Origem: PRT MS/GM 2531/2014, Art. 14, III, b)
IV - quanto aos cronogramas do projeto executivo: (Origem: PRT MS/GM 2531/2014, Art. 14, IV)
a) o prazo de vigência da PDP será proposto de acordo com a complexidade tecnológica para a internalização da tecnologia no País, respeitado o limite máximo de 10 (dez) anos; (Origem: PRT MS/GM 2531/2014, Art. 14, IV, a)
b) as atividades prévias ao registro do produto na Agência Nacional de Vigilância Sanitária (ANVISA), referentes à implementação do projeto de PDP, constarão do cronograma, detalhando-se os prazos previstos para a conclusão e os responsáveis pela execução de cada item do cronograma; (Origem: PRT MS/GM 2531/2014, Art. 14, IV, b)
c) o cronograma apresentado para as fases de estabelecimento de PDP deve ser detalhado, contendo cronogramas físico e financeiro compatíveis com a evolução das atividades e com a necessidade dos recursos, atendendo-se, no mínimo, aos itens apontados no modelo de projeto executivo; e (Origem: PRT MS/GM 2531/2014, Art. 14, IV, c)
d) identificação do início de cada uma das fases do processo de estabelecimento da PDP e respectivas atividades; (Origem: PRT MS/GM 2531/2014, Art. 14, IV, d)
V - quanto à documentação para registro e certificação: (Origem: PRT MS/GM 2531/2014, Art. 14, V)
a) os registros do produto objeto da PDP pela instituição pública e entidade privada na ANVISA e as alterações pós-registro constarão no cronograma da PDP para desenvolvimento, transferência e absorção de tecnologia, com indicação da Resolução da ANVISA a ser seguida a depender do produto; e (Origem: PRT MS/GM 2531/2014, Art. 14, V, a)
b) o cronograma de obtenção do registro ou renovação de licenças e certificados, quando aplicável, incluindo-se o Certificado de Boas Práticas de Fabricação (CBPF), junto à ANVISA será apresentado no projeto executivo para cada sujeito participante público e privado; (Origem: PRT MS/GM 2531/2014, Art. 14, V, b)
VI - quanto ao grau de integração produtiva: (Origem: PRT MS/GM 2531/2014, Art. 14, VI)
a) previsão da internalização da tecnologia pela instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 14, VI, a)
b) em caso de utilização, no início do projeto, de IFA ou de componente tecnológico crítico internacional, devem ser apontados os fabricantes e locais de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 14, VI, b)
c) demonstração de que a entidade privada praticará um grau de integração produtiva em território nacional pertinente com a produção nacional do produto objeto da PDP, sendo que: (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c)
1. para produtos de síntese química e síntese mista, o projeto deve contemplar a verticalização nacional de etapas produtivas significativas para o parque produtivo nacional farmoquímico e a garantia de acesso da instituição pública ao conhecimento tecnológico, incluindo-se o Arquivo Mestre da Droga (AMD); (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c, 1)
2. para produtos biológicos, obrigatoriedade de garantia da transferência do Banco de Células Mestre além dos conhecimentos tecnológicos requeridos para produção do produto no País; e (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c, 2)
3. para produtos em saúde, o projeto deve contemplar a produção do componente tecnológico crítico, aplicando-se, no que couber, as regras de origem ou o PPB, respeitando-se, quando for o caso, a dificuldade para a produção no País de componentes de uso não específico para a área da saúde como, por exemplo, os componentes microeletrônicos; e (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c, 3)
d) garantia de acesso ao conhecimento integral da tecnologia objeto de PDP a ser transferida por meio de processos de capacitação no País e, quando aplicável, no exterior; (Origem: PRT MS/GM 2531/2014, Art. 14, VI, d)
VII - quanto ao processo de produção: (Origem: PRT MS/GM 2531/2014, Art. 14, VII)
a) o projeto deve proporcionar o desenvolvimento do CEIS e apresentar as condições para tornar a instituição pública apta a produzir o produto objeto da PDP; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, a)
b) deverá ser apresentado o fluxo de produção planejado detalhadamente, envolvendo-se, no que se refere à infraestrutura: (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b)
1. a estrutura física necessária, com indicação se as plantas produtivas dos parceiros envolvidos possuem projetos de investimento; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b, 1)
2. as condições apropriadas para execução do projeto, englobando-se instalações, procedimentos, processos e recursos organizacionais; e (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b, 2)
3. quando necessárias adequações na infraestrutura, serão especificados pela instituição pública, no projeto executivo, os recursos necessários, os valores orçados e a previsão de conclusão dos investimentos críticos para a viabilização da PDP por parte de todos os parceiros; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b, 3)
c) os equipamentos necessários para o processo de produção e controle de qualidade do produto e dos insumos serão descritos no projeto executivo da PDP, informando-se a capacidade nominal, se os parceiros já possuem os referidos equipamentos ou previsão de sua aquisição e a previsão de gastos com o respectivo detalhamento sobre as fontes de recursos; e (Origem: PRT MS/GM 2531/2014, Art. 14, VII, c)
d) os recursos humanos necessários para execução do processo de gestão, de desenvolvimento e absorção tecnológica e garantia da qualidade do projeto serão relacionados, indicando-se o número, a formação e a qualificação necessária; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, d)
VIII - quanto à proposta de preço de venda e estimativa da capacidade de oferta: (Origem: PRT MS/GM 2531/2014, Art. 14, VIII)
a) serão apresentadas propostas com os valores unitários anuais em termos nominais e a capacidade de oferta anual do produto para o período do projeto; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, a)
b) os preços propostos serão compatíveis com os praticados pelo SUS e, quando necessário, aos preços de mercados internacionais dos países contemplados pela Câmara de Regulação do Mercado de Medicamentos (CMED), considerando os princípios da econonomicidade e da vantajosidade; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, b)
c) serão apresentados preços em escala decrescente dos valores, em bases reais, que serão consideradas em função da variação do Índice Nacional de Preços ao Consumidor Amplo (IPCA) ou índices setoriais de preços e, no que couber, a taxa de variação cambial, respeitando a regulação da CMED; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, c)
d) para a proposta de preços e estimativa da capacidade de oferta, serão utilizadas como fonte de dados: (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d)
1. os preços médios praticados pela Administração Pública e registrados nos bancos de dados oficiais, quais sejam o Banco de Preço em Saúde (BPS) e o Sistema Integrado de Administração de Serviços Gerais (SIASG); (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 1)
2. o preço praticado na última aquisição do produto pelo Ministério da Saúde, conforme extratos publicados no Diário Oficial da União (DOU), no caso de ser produto de aquisição centralizada; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 2)
3. o valor de repasse estabelecido em portaria específica do Ministério da Saúde ou os valores unitários definidos na Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais do SUS, utilizando-se, como referência, o período de 1 (um) ano anterior à apresentação da proposta de projeto de PDP no caso de produtos de aquisição não centralizada; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 3)
4. as atas de registros de preços do endereço eletrônico do Portal de Compras do Governo Federal e os sistemas nacionais de informações de saúde do SUS, para os demais produtos de aquisição não centralizada; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 4)
5. os preços médios praticados no mercado e registrados nos bancos de dados oficiais nacionais e internacionais e utilizados pela Administração Pública, tais como o Sistema de Acompanhamento de Mercado de Medicamentos (SAMMED) da CMED, o Sistema de Apoio à Elaboração de Projetos de Investimentos em Saúde (SOMASUS) do Ministério da Saúde, o Fundo Rotatório da Organização Pan-Americana da Saúde (OPAS) e o Fundo Global de Luta contra AIDS, Tuberculose e Malária; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 5)
6. os preços definidos pela CMED, de acordo com a legislação vigente; e (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 6)
7. os preços médios praticados no mercado internacional de países contemplados pela CMED para definição de preços de entrada de novos produtos, quando se tratar de produtos inovadores; e (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 7)
e) para produtos com prazo de expiração de patente a ocorrer durante as fases do projeto executivo, será apresentado estudo com as projeções de redução de preços compatíveis com o novo patamar de mercado; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, e)
IX - quanto ao balanço de divisas, será avaliado pela instituição pública proponente o impacto da importação do produto acabado, insumos farmacêuticos ativos, componentes tecnológicos críticos e intermediários, apresentando-se o balanço de divisas e a economia de divisas anual estimada durante as fases de estabelecimento da PDP, informando-se a metodologia de cálculo utilizada; (Origem: PRT MS/GM 2531/2014, Art. 14, IX)
X - quanto à análise de risco da PDP, a instituição pública proponente a apresentará conforme modelo de projeto executivo previsto no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br; e (Origem: PRT MS/GM 2531/2014, Art. 14, X)
XI - quanto aos investimentos necessários para concretização do projeto, estes serão factíveis à capacidade e fonte de financiamento informadas. (Origem: PRT MS/GM 2531/2014, Art. 14, XI)
§ 1º Em relação aos sujeitos participantes da PDP de que trata o inciso I do "caput", serão apresentadas cópias dos seguintes documentos comprobatórios: (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º)
I - do Cadastro Nacional da Pessoa Jurídica (CNPJ); (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, I)
II - do endereço da planta produtiva; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, II)
III - do alvará sanitário; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, III)
IV - da autorização de funcionamento e/ou autorização especial de funcionamento; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, IV)
V - do CBPF ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, V)
VI - termo de aprovação emitido pela vigilância sanitária local do projeto de construção, ampliação e/ou reforma da estrutura física; e (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, VI)
VII - registro sanitário do produto objeto da PDP concedido pela ANVISA em nome dos sujeitos participantes da PDP. (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, VII)
§ 2º Caso não seja possível a apresentação dos documentos elencados nos termos do § 1º com a proposta de projeto de PDP, deverão ser apresentados o cronograma para sua obtenção junto aos órgãos e entidades competentes e justificativas fundamentadas, de acordo com o processo de investimento, de desenvolvimento, absorção e transferência de tecnologia, para fins de análise das instâncias de avaliação da proposta. (Origem: PRT MS/GM 2531/2014, Art. 14, § 2º)
§ 3º Os sujeitos participantes de que trata o inciso I do "caput" firmarão declaração conjunta de concordância com todos os termos da proposta de projeto de PDP apresentada, inclusive em relação às informações contidas no projeto executivo, a qual também constará do rol de documentos que compõe a citada proposta. (Origem: PRT MS/GM 2531/2014, Art. 14, § 3º)
§ 4º As condições de usos adicionais do Banco de Células Mestre referentes ao produto objeto de PDP poderão ser definidas mediante acordo entre os sujeitos participantes da PDP. (Origem: PRT MS/GM 2531/2014, Art. 14, § 4º)
Subseção II
Das Instâncias de Avaliação da Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção II)
Art. 15. A análise e a avaliação da proposta de projeto de PDP serão realizadas pelas Comissões Técnicas de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 15)
Art. 16. Compete às Comissões Técnicas de Avaliação: (Origem: PRT MS/GM 2531/2014, Art. 16)
I - emitir relatório quanto à proposta de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 16, I)
II - sugerir prazos, critérios e condicionantes específicos para execução do projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 16, II)
III - avaliar o grau de integração produtiva em território nacional proposto para a produção nacional do produto; (Origem: PRT MS/GM 2531/2014, Art. 16, III)
IV - avaliar a economicidade e vantajosidade da proposta de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 16, IV)
V - verificar se os prazos do desenvolvimento e absorção tecnológica, incluindo-se as etapas regulatórias, são compatíveis com o cronograma proposto; (Origem: PRT MS/GM 2531/2014, Art. 16, V)
VI - avaliar a possibilidade e a viabilidade de execução de mais de uma PDP relativas ao mesmo produto, visando-se estimular a concorrência e diminuir a vulnerabilidade do SUS, indicando, quando for o caso, a factibilidade de mais de um projeto por produto, seja por questões sanitárias, de escala técnica, econômica ou pelos investimentos requeridos; e (Origem: PRT MS/GM 2531/2014, Art. 16, VI)
VII - outras competências que lhe foram atribuídas nos termos deste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 16, VII)
Art. 17. As Comissões Técnicas de Avaliação serão compostas por membros dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2531/2014, Art. 17)
I - do Ministério da Saúde: (Origem: PRT MS/GM 2531/2014, Art. 17, I)
a) 1 (um) da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); e (Origem: PRT MS/GM 2531/2014, Art. 17, I, a)
b) 1 (um) de cada Secretaria cujas competências estejam relacionadas ao objeto da proposta de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 17, I, b)
II - 1 (um) do Ministério da Indústria, Comércio Exterior e Serviços; (Origem: PRT MS/GM 2531/2014, Art. 17, II)
III - 1 (um) do Ministério da Ciência, Tecnologia, Inovações e Comunicações; (Origem: PRT MS/GM 2531/2014, Art. 17, III)
IV - 1 (um) do Banco Nacional de Desenvolvimento Econômico e Social (BNDES); (Origem: PRT MS/GM 2531/2014, Art. 17, IV)
V - 1 (um) da FINEP - Inovação e Pesquisa; e (Origem: PRT MS/GM 2531/2014, Art. 17, V)
VI - 1 (um) da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2531/2014, Art. 17, VI)
§ 1º Cada membro titular terá um suplente, que o substituirá em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 2531/2014, Art. 17, § 1º)
§ 2º A Coordenação de cada Comissão Técnica de Avaliação será exercida pelo representante da SCTIE/MS. (Origem: PRT MS/GM 2531/2014, Art. 17, § 2º)
§ 3º Os membros, titulares e suplentes, serão indicados pelos dirigentes máximos de seus respectivos órgãos e entidades ao Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 17, § 3º)
§ 4º A participação dos órgãos e entidades elencadas nos incisos II a VI do "caput" será formalizada após resposta a convite a eles encaminhado pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 17, § 4º)
§ 5º Ato do Secretário de Ciência, Tecnologia e Insumos Estratégicos constituirá a Comissão Técnica de Avaliação, com definição de seu objeto e prazo de duração. (Origem: PRT MS/GM 2531/2014, Art. 17, § 5º)
§ 6º Cada Comissão Técnica de Avaliação poderá avaliar uma ou mais propostas de projeto de PDP, a depender do objeto definido nos termos do ato de que trata o art. 17, § 5º . (Origem: PRT MS/GM 2531/2014, Art. 17, § 6º)
§ 7º A Coordenação da Comissão poderá convidar representantes de outros órgãos e entidades, públicas ou privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária para o cumprimento do disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 17, § 7º)
§ 8º Os representantes e especialistas de que trata o art. 17, § 7º assinarão termo de confidencialidade e declaração de inexistência de conflito de interesse para participarem das atividades para as quais foram convidados pela Coordenação da Comissão. (Origem: PRT MS/GM 2531/2014, Art. 17, § 8º)
Art. 18. Compete ao Comitê Deliberativo: (Origem: PRT MS/GM 2531/2014, Art. 18)
I - analisar e validar os relatórios das Comissões Técnicas de Avaliação; (Origem: PRT MS/GM 2531/2014, Art. 18, I)
II - aprovar ou reprovar as propostas de projeto de PDP, mediante parecer conclusivo; (Origem: PRT MS/GM 2531/2014, Art. 18, II)
III - definir os prazos, critérios e condicionantes específicos para execução das propostas de projetos de PDP, dos projetos de PDP e das PDP; (Origem: PRT MS/GM 2531/2014, Art. 18, III)
IV - analisar e validar o grau de integração produtiva em território nacional do produto objeto de PDP para aplicação das regras previstas neste Anexo; (Origem: PRT MS/GM 2531/2014, Art. 18, IV)
V - analisar e validar os prazos do desenvolvimento e absorção tecnológica, incluindo-se as etapas regulatórias, compatíveis com o cronograma proposto; (Origem: PRT MS/GM 2531/2014, Art. 18, V)
VI - estabelecer as condições de economicidade e vantajosidade da PDP; (Origem: PRT MS/GM 2531/2014, Art. 18, VI)
VII - indicar, motivadamente, a necessidade de submissão das propostas de projeto de PDP à nova avaliação por Comissão Técnica de Avaliação "ad hoc", cujos membros serão designados mediante ato do Secretário de Ciência, Tecnologia e Insumos Estratégicos, com definição de seu objeto e prazo de duração; e (Origem: PRT MS/GM 2531/2014, Art. 18, VII)
VIII - outras competências que lhe forem atribuídas nos termos deste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 18, VIII)
Parágrafo Único. Os membros da Comissão Técnica de Avaliação "ad hoc" de que trata o inciso VII assinarão termo de confidencialidade e declaração de inexistência de conflito de interesse para fins de análise das propostas de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 18, Parágrafo Único)
Art. 19. O Comitê Deliberativo será composto por membros dos seguintes órgãos: (Origem: PRT MS/GM 2531/2014, Art. 19) (com redação dada pela PRT MS/GM 1020/2015)
I - 1 (um) do Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 19, I) (com redação dada pela PRT MS/GM 1020/2015)
II - 1 (um) do Ministério da Indústria, Comércio Exterior e Serviços; (Origem: PRT MS/GM 2531/2014, Art. 19, II) (com redação dada pela PRT MS/GM 1020/2015)
III - 1 (um) do Ministério da Ciência, Tecnologia, Inovações e Comunicações; e (Origem: PRT MS/GM 2531/2014, Art. 19, III) (com redação dada pela PRT MS/GM 1020/2015)
IV - 1 (um) da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2531/2014, Art. 19, IV) (dispositivo acrescentado pela PRT MS/GM 1020/2015)
§ 1º Cada membro titular terá um suplente, que o substituirá em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 2531/2014, Art. 19, § 1º)
§ 2º A coordenação do Comitê Deliberativo será exercida pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 19, § 2º)
§ 3º Os membros, titulares e suplentes, serão indicados pelos dirigentes máximos de seus respectivos órgãos e entidade ao Ministério da Saúde e serão distintos daqueles que compõem as Comissões Técnicas de Avaliação. (Origem: PRT MS/GM 2531/2014, Art. 19, § 3º) (com redação dada pela PRT MS/GM 1020/2015)
§ 4º A participação dos órgãos elencados nos incisos II, III e IV do 'caput' será formalizada após resposta a convite a eles encaminhado pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 19, § 4º) (com redação dada pela PRT MS/GM 1020/2015)
§ 5º Ato do Ministro de Estado da Saúde constituirá o Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 19, § 5º)
§ 6º A Coordenação do Comitê poderá convidar representantes de outros órgãos e entidades, públicas ou privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária para o cumprimento do disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 19, § 6º)
§ 7º Os representantes e especialistas de que trata o art. 19, § 6º assinarão termo de confidencialidade e declaração de inexistência de conflito de interesse para participarem das atividades para as quais foram convidados pela Coordenação do Comitê. (Origem: PRT MS/GM 2531/2014, Art. 19, § 7º)
Art. 20. As funções dos membros das Comissões Técnicas de Avaliação, das Comissões Técnicas de Avaliação "ad hoc" e do Comitê Deliberativo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2531/2014, Art. 20)
Art. 21. O Comitê Deliberativo elaborará o seu regimento interno e o das Comissões Técnicas de Avaliação, a serem aprovados por ato do Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 21)
Parágrafo Único. A Comissão Técnica de Avaliação "ad hoc" terá suas atividades disciplinadas pelo regimento interno da Comissão Técnica de Avaliação. (Origem: PRT MS/GM 2531/2014, Art. 21, Parágrafo Único)
Subseção III
Dos Critérios de Análise de Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção III)
Art. 22. Serão considerados na análise de mérito da proposta de projeto de PDP os seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 22)
I - atendimento das diretrizes e dos requisitos previstos no art. 14; (Origem: PRT MS/GM 2531/2014, Art. 22, I)
II - objetivos da proposta consoantes com as políticas públicas desenvolvidas no SUS para promoção, prevenção e atenção à saúde; (Origem: PRT MS/GM 2531/2014, Art. 22, II)
III - importância da PDP para redução da vulnerabilidade econômica e tecnológica do SUS, bem como contribuição para o desenvolvimento científico, tecnológico e socioeconômico do País; (Origem: PRT MS/GM 2531/2014, Art. 22, III)
IV - ausência ou insuficiência de produção nacional ou risco de desabastecimento do produto acabado, IFA ou componente tecnológico crítico, contribuindo para a integração produtiva no âmbito do CEIS e para a redução do déficit comercial em saúde; (Origem: PRT MS/GM 2531/2014, Art. 22, IV)
V - clareza do objetivo geral a ser alcançado, dos objetivos específicos e das etapas ou produtos que, no conjunto, definam o que se quer alcançar com a PDP; (Origem: PRT MS/GM 2531/2014, Art. 22, V)
VI - adequação do cronograma à complexidade da tecnologia envolvida e aos requisitos regulatórios e sanitários; (Origem: PRT MS/GM 2531/2014, Art. 22, VI)
VII - racionalidade dos investimentos previstos, com indicação da fonte, cronogramas físico e financeiro compatíveis com a evolução das atividades e com a necessidade dos recursos; (Origem: PRT MS/GM 2531/2014, Art. 22, VII)
VIII - observância da legislação de propriedade intelectual em vigor; (Origem: PRT MS/GM 2531/2014, Art. 22, VIII)
IX - grau de integração produtiva compatível com o produto objeto de PDP e o desenvolvimento do parque produtivo nacional; (Origem: PRT MS/GM 2531/2014, Art. 22, IX)
X - potencial da instituição pública em relação a recursos humanos necessários para execução do projeto, área produtiva instalada ou projeto de adequação de área aprovado pela instância de financiamento, compatibilidade da natureza do projeto com as atividades executadas pela instituição pública e capacidade da instituição absorver a tecnologia do parceiro; (Origem: PRT MS/GM 2531/2014, Art. 22, X)
XI - correta delimitação das habilidades e competências das entidades privadas e das instituições públicas, linhas produtivas necessárias e existentes em cada planta fabril, análise de risco e prazo de vigência apresentados; (Origem: PRT MS/GM 2531/2014, Art. 22, XI)
XII - compatibilidade de execução e obtenção das previsões de registro e certificações perante os órgãos e entidades competentes; (Origem: PRT MS/GM 2531/2014, Art. 22, XII)
XIII - projeção de balanço de divisas e de economia anual gerada para o SUS nas aquisições do produto tendo em vista a última aquisição realizada pelo Sistema; (Origem: PRT MS/GM 2531/2014, Art. 22, XIII)
XIV - presença no projeto de planejamento de capacitação para a inovação, treinamentos da instituição pública pelos parceiros para absorção e transferência da tecnologia e desenvolvimento das plataformas produtiva e de conhecimento no País; e (Origem: PRT MS/GM 2531/2014, Art. 22, XIV)
XV - aceitação integral do processo e metodologias de monitoramento e avaliação definidos neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 22, XV)
Parágrafo Único. Serão priorizadas as propostas distintas de projetos de PDP, pelos mesmos parceiros, que envolvam produtos de alto valor e produtos para doenças e populações negligenciadas de interesse do Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 22, Parágrafo Único)
Art. 23. Os seguintes critérios de desempate serão utilizados quando o número de propostas de projetos de PDP aprovadas quanto ao mérito, nos termos do art. 22, para o mesmo produto for superior ao número de propostas cabíveis para aprovação, de acordo com as questões sanitárias e de viabilidades técnica e econômica: (Origem: PRT MS/GM 2531/2014, Art. 23)
I - adequação dos produtos e processos aos requerimentos dos programas e ações do Ministério da Saúde, visando atender às necessidades do SUS e da população; (Origem: PRT MS/GM 2531/2014, Art. 23, I)
II - instituição pública com linha de produção adequada para o produto objeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, II)
III - investimentos aplicados pelo parceiro privado para execução do projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, III)
IV - menor prazo para internalização da tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 23, IV)
V - proposta de preço que tenha potencial de maior economia para o Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 23, V)
VI - Autorização de Funcionamento e Autorização de Funcionamento Especial, quando aplicável, ativas para o parceiro privado produtor do produto acabado; (Origem: PRT MS/GM 2531/2014, Art. 23, VI)
VII - Autorização de Funcionamento e Autorização de Funcionamento Especial, quando aplicável, ativas para o parceiro privado produtor do insumo farmacêutico ativo (IFA) ou componente tecnológico crítico; (Origem: PRT MS/GM 2531/2014, Art. 23, VII)
VIII - CBPF válido para a linha de produção do produto objeto da proposta de PDP para a instituição pública ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 23, VIII)
IX - CBPF válido para a linha de produção do produto objeto de PDP para o parceiro privado produtor do produto acabado ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 23, IX)
X - CBPF válido para a linha de produção do produto objeto de PDP para o parceiro privado produtor do insumo farmacêutico ativo ou componente tecnológico crítico ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 23, X)
XI - apresentação adicional de inovação relacionada ao produto objeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, XI)
XII - contribuição relativa da tecnologia para o desenvolvimento do CEIS; (Origem: PRT MS/GM 2531/2014, Art. 23, XII)
XIII - entidade privada com linha de produção no País adequada para o produto objeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, XIII)
XIV - desenvolvimento tecnológico do produto objeto de PDP realizado no País; e (Origem: PRT MS/GM 2531/2014, Art. 23, XIV)
XV - contribuição para o equilíbrio competitivo e tecnológico do mercado. (Origem: PRT MS/GM 2531/2014, Art. 23, XV)
Art. 24. Serão considerados na análise da divisão de responsabilidades de instituições públicas, em casos de aprovação de mais de uma proposta de projeto de PDP para um mesmo produto, os seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 24)
I - estímulo à concorrência no mercado; (Origem: PRT MS/GM 2531/2014, Art. 24, I)
II - capacidade instalada para oferta do produto; (Origem: PRT MS/GM 2531/2014, Art. 24, II)
III - capacidade programada de acordo com o projeto de construção, ampliação e/ou reforma da estrutura física para oferta do produto conforme cronograma da proposta; (Origem: PRT MS/GM 2531/2014, Art. 24, III)
IV - demanda do SUS; e (Origem: PRT MS/GM 2531/2014, Art. 24, IV)
V - equilíbrio econômico-financeiro do projeto. (Origem: PRT MS/GM 2531/2014, Art. 24, V)
Subseção IV
Da Instrução do Processo Administrativo de Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção IV)
Art. 25. Caberá à SCTIE/MS a instrução do processo administrativo da proposta de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 25)
Art. 26. As propostas de projetos de PDP protocoladas na SCTIE/MS serão autuadas como processo e, em seguida, encaminhadas ao Departamento do Complexo Industrial e Inovação em Saúde (DECIIS/SCTIE/MS) por meio de despacho do Secretário de Ciência, Tecnologia e Insumos Estratégicos. (Origem: PRT MS/GM 2531/2014, Art. 26)
Parágrafo Único. Antes da remessa dos autos ao DECIIS/SCTIE/MS, o Secretário de Ciência, Tecnologia e Insumos Estratégicos classificará as informações constantes da proposta de projeto de PDP em grau de sigilo nos termos da Portaria nº 1.583/GM/MS, de 19 de julho de 2012. (Origem: PRT MS/GM 2531/2014, Art. 26, Parágrafo Único)
Art. 27. O DECIIS/SCTIE/MS encaminhará o processo para a Coordenação-Geral de Base Química e Biotecnológica (CGBQB/DECIIS/SCTIE/MS) ou a Coordenação-Geral de Equipamentos e Materiais para a Saúde (CGEMS/DECIIS/SCTIE/MS), a depender da área temática do produto, para fins de análise da proposta. (Origem: PRT MS/GM 2531/2014, Art. 27)
Art. 28. A Coordenação-Geral de que trata o art. 27, que seja responsável pela análise da proposta, elaborará nota técnica a fim de verificar se a proposta de projeto de PDP atendeu todos os requisitos e orientações constantes do modelo de projeto executivo de que trata o art. 11, parágrafo único. (Origem: PRT MS/GM 2531/2014, Art. 28)
Art. 29. A proposta de projeto de PDP será restituída pela Coordenação-Geral responsável ao DECIIS/SCTIE/MS e, em seguida, enviada ao Secretário de Ciência, Tecnologia e Insumos Estratégicos, incluindo-se a nota técnica de que trata o art. 28, para fins de avaliação e adoção das medidas necessárias para efetivação das competências do Ministério da Saúde previstas nos arts. 19 e 28 do Anexo XCV . (Origem: PRT MS/GM 2531/2014, Art. 29)
Art. 30. Após ser constituída a Comissão Técnica de Avaliação, a SCTIE/MS lhe encaminhará a proposta de projeto de PDP e a nota técnica de que trata o art. 28 para fins do disposto no art. 16. (Origem: PRT MS/GM 2531/2014, Art. 30)
Art. 31. Após trâmite pela Comissão Técnica de Avaliação, a proposta de projeto de PDP, incluindo-se os respectivos documentos produzidos no âmbito da SCTIE/MS e da própria Comissão, será encaminhada para o Comitê Deliberativo para fins do disposto no art. 18. (Origem: PRT MS/GM 2531/2014, Art. 31)
Subseção V
Do Processo de Avaliação e Decisório da Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção V)
Art. 32. A instituição pública será convocada pela SCTIE/MS para apresentação oral da proposta de projeto de PDP perante as Comissões Técnicas de Avaliação e, quando couber, perante o Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 32)
Parágrafo Único. Somente a instituição pública participará da apresentação oral da proposta, devendo responder aos questionamentos das Comissões Técnicas de Avaliação e do Comitê Deliberativo quanto à proposta de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 32, Parágrafo Único)
Art. 33. A Comissão Técnica de Avaliação analisará a proposta de projeto de PDP e poderá demandar à instituição pública ajustes no seu conteúdo para adequação ao disposto no art. 14. (Origem: PRT MS/GM 2531/2014, Art. 33)
§ 1º A proposta de projeto de PDP reajustada pela instituição pública nos termos do "caput" deverá ser enviada à SCTIE/MS no prazo máximo de 15 (quinze) dias após o recebimento da comunicação formal de que trata o "caput". (Origem: PRT MS/GM 2531/2014, Art. 33, § 1º)
§ 2º A proposta de projeto de PDP será analisada pela Comissão Técnica de Avaliação, que emitirá relatório com parecer final a ser encaminhado, com trâmite pela SCTIE/MS, ao Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 33, § 2º)
Art. 34. Após recebimento dos documentos de que trata o art. 33, o Comitê Deliberativo adotará as medidas previstas no art. 18. (Origem: PRT MS/GM 2531/2014, Art. 34)
Art. 35. As propostas de projetos de PDP aprovadas pelo Comitê Deliberativo serão formalizadas por meio de termos de compromisso subscritos pela instituição pública e pelo Ministério da Saúde, por meio da SCTIE/MS, e declaração de concordância pelos parceiros privados anexa ao termo de compromisso. (Origem: PRT MS/GM 2531/2014, Art. 35)
Parágrafo Único. Os termos de compromisso serão subscritos e anunciados em reuniões do GECIS até o final do ano em que foram apresentadas as respectivas propostas de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 35, Parágrafo Único)
Art. 36. O extrato do termo de compromisso da proposta de projeto de PDP aprovada será publicado no Diário Oficial da União (DOU). (Origem: PRT MS/GM 2531/2014, Art. 36)
Art. 37. Após assinatura do termo de compromisso, o DECIIS/SCTIE/MS enviará cópia do ato à instituição pública e à ANVISA, incluindo-se cópia dos documentos produzidos pela SCTIE/MS, Comissão Técnica de Avaliação e Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 37)
Art. 38. As propostas de projetos de PDP que não forem aprovadas pelo Comitê Deliberativo serão comunicadas pelo Ministério da Saúde, por meio da SCTIE/MS, à instituição pública proponente, com a respectiva motivação. (Origem: PRT MS/GM 2531/2014, Art. 38)
Art. 39. É facultado à instituição pública o direito de interposição de recurso administrativo em face da decisão de reprovação da proposta de projeto de PDP, com fundamento em razões de legalidade e de mérito, em única e última instância, dirigido ao Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 39)
§ 1º É de dez dias o prazo para interposição do recurso administrativo, sem efeito suspensivo, contado a partir da divulgação da decisão no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 39, § 1º)
§ 2º O recurso administrativo será encaminhado pelo Gabinete do Ministro (GM/MS) para a SCTIE/MS para elaboração de manifestação técnica que, em seguida, o remeterá para a Consultoria Jurídica (CONJUR/MS) para elaboração de manifestação jurídica a fim de subsidiar o julgamento pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 39, § 2º)
§ 3º Em caso de provimento do recurso administrativo, a proposta de projeto de PDP será encaminhada à SCTIE/MS para reavaliação por nova Comissão Técnica de Avaliação e pelo Comitê Deliberativo, observando-se o mesmo fluxo processual previsto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 39, § 3º)
Art. 40. A relação das propostas de projeto de PDP que não forem aprovadas, com a respectiva motivação, será divulgada no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 40)
Art. 41. A aprovação das propostas de projeto de PDP não vincula o Ministério da Saúde ao financiamento de investimentos e custeio de despesas nas instituições públicas. (Origem: PRT MS/GM 2531/2014, Art. 41)
Art. 42. Os regimentos internos das Comissões Técnicas de Avaliação e do Comitê Deliberativo definirão em caráter complementar os ritos, prazos, documentação, metodologia a ser utilizada para ponderação dos critérios de análise e competências para o processo de avaliação e decisório das propostas de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 42)
Seção II
Do Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção II)
Art. 43. Após a assinatura do termo de compromisso, inicia-se a fase do projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 43)
Art. 44. Na fase do projeto de PDP, o atendimento dos compromissos, responsabilidades e condicionantes do projeto ficará a cargo da instituição pública e da entidade privada. (Origem: PRT MS/GM 2531/2014, Art. 44)
Art. 45. Até o início da fase de PDP, a instituição pública e a entidade privada formalizarão acordo ou contrato de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP com observância dos critérios, diretrizes e orientações deste Anexo, sem interveniência do Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 45)
Parágrafo Único. A existência do acordo ou contrato de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP e a sua apresentação ao Ministério da Saúde pela instituição pública é requisito para a formalização do primeiro fornecimento do produto objeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 45, Parágrafo Único)
Art. 46. Qualquer necessidade de alteração do cronograma do projeto de PDP será apresentada oficialmente pela instituição pública, com justificativas fundamentadas, à SCTIE/MS para sua apreciação e, quando referente aos aspectos regulatórios sanitários, pelo Comitê Técnico Regulatório (CTR) da ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 46)
Parágrafo Único. A SCTIE/MS e, quando pertinente, o CTR da ANVISA decidirão sobre o pedido, "ad referendum" do Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 46, Parágrafo Único)
Art. 47. A instituição pública poderá apresentar proposta de alteração dos seus parceiros envolvidos no projeto de PDP, com as respectivas justificativas fundamentadas, à SCTIE/MS para sua apreciação, pela Comissão Técnica de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 47)
Parágrafo Único. A decisão sobre o pedido competirá ao Comitê Deliberativo, que decidirá pelo envio ou não de nova proposta de projeto de PDP para avaliação pela Comissão Técnica de Avaliação e pelo referido Comitê. (Origem: PRT MS/GM 2531/2014, Art. 47, Parágrafo Único)
Art. 48. A instituição pública poderá apresentar proposta de alteração das tecnologias do projeto de PDP, com as respectivas justificativas fundamentadas, à SCTIE/MS para sua apreciação, pela Comissão Técnica de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 48)
Parágrafo Único. Fica o Comitê Deliberativo autorizado a definir, em ato próprio, as hipóteses em que as propostas de alteração das tecnologias do projeto de PDP poderão ser avaliadas apenas pela SCTIE/MS ou pela SCTIE/MS e pela Comissão Técnica de Avaliação. (Origem: PRT MS/GM 2531/2014, Art. 48, Parágrafo Único)
Art. 49. Os pedidos de alterações de cronograma, parceiros ou tecnologia serão respondidos oficialmente pela SCTIE/MS ao requerente. (Origem: PRT MS/GM 2531/2014, Art. 49)
Art. 50. O fornecimento de informações quanto à execução do projeto de PDP para o Ministério da Saúde será realizado pela instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 50)
Parágrafo Único. A instituição pública encaminhará, em caráter ordinário, relatório de acompanhamento quadrimestral para o Ministério da Saúde, que ficará disponível para avaliação pelos Comitês Técnicos de Avaliação e pelo Comitê Deliberativo, observadas a Lei nº 12.527, de 18 de novembro de 2011, o Decreto nº 7.724, de 16 de maio de 2012, e a Portaria nº 1.583/GM/MS, de 19 de julho de 2012. (Origem: PRT MS/GM 2531/2014, Art. 50, Parágrafo Único)
Seção III
Da PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção III)
Art. 51. A PDP inicia-se com a demonstração ao Ministério da Saúde pela instituição pública do início da etapa de desenvolvimento, transferência e absorção de tecnologia, capacitação industrial e tecnológica, em conjunto com o primeiro fornecimento do produto objeto de PDP ao Ministério da Saúde pela instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 51)
§ 1º O ano 1 (um) da PDP se iniciará a partir da publicação do instrumento específico para o primeiro fornecimento do produto objeto da PDP pela instituição pública ao Ministério da Saúde no DOU. (Origem: PRT MS/GM 2531/2014, Art. 51, § 1º)
§ 2º A instituição pública encaminhará, em caráter ordinário, relatório de acompanhamento quadrimestral para o Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 51, § 2º)
Art. 52. A aquisição do produto objeto de PDP pelo Ministério da Saúde se dará apenas depois de cumpridas todas as etapas descritas nas Seções I e II do Capítulo IV do Anexo XCV e com a demonstração pela instituição pública do início da etapa de desenvolvimento, transferência e absorção de tecnologia, capacitação industrial e tecnológica. (Origem: PRT MS/GM 2531/2014, Art. 52)
§ 1º Para projetos de PDP relativos ao mesmo produto, a PDP que atender primeiramente ao estabelecido no "caput" e ter capacidade de suprimento poderá ser responsável pelo fornecimento da demanda total do Ministério da Saúde até que as outras PDP atendam ao estabelecido no "caput" e se inicie a divisão de responsabilidades aprovada para cada projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 52, § 1º)
§ 2º O produto objeto de PDP atenderá as apresentações, especificações, formas e quantitativos demandados pelo Ministério da Saúde, respeitando-se a regulação sanitária. (Origem: PRT MS/GM 2531/2014, Art. 52, § 2º)
§ 3º A definição de centralização da aquisição do produto deverá ocorrer mediante pactuação prévia na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 2531/2014, Art. 52, § 3º)
Art. 53. Para a primeira aquisição, o registro sanitário do produto objeto da PDP poderá ser da instituição pública ou da entidade privada, desde que esteja em processo comprovado de desenvolvimento, transferência e absorção de tecnologia, nos termos do inciso XXXII do artigo 24 da Lei nº 8.666, de 21 de junho de 1993. (Origem: PRT MS/GM 2531/2014, Art. 53)
§ 1º No caso do produto possuir registro sanitário em nome da entidade privada e estar em processo de transferência de tecnologia, a instituição pública deverá possuir todas as informações técnicas e cópia de inteiro teor do dossiê do referido registro aprovado pela ANVISA, assim como a documentação requerida para sua eventual atualização. (Origem: PRT MS/GM 2531/2014, Art. 53, § 1º)
§ 2º Da primeira aquisição do produto objeto da PDP, a instituição pública terá o prazo de 60 (sessenta) dias para apresentar à ANVISA o pedido de registro, em seu nome, do produto objeto da PDP, nos termos da Resolução da Diretoria Colegiada (RDC) nº 31/ANVISA, de 29 de maio de 2014, e da RDC nº 43/ANVISA, de 19 de setembro de 2014, quando aplicáveis, e demais regulamentações da ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 53, § 2º)
§ 3º A instituição pública terá o prazo de 30 (trinta) dias, contados do término do prazo de que trata o art. 53, § 2º , para encaminhar ao Ministério da Saúde a cópia do protocolo da referida documentação apresentada junto à ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 53, § 3º)
Art. 54. Após 1 (um) ano da primeira aquisição do produto objeto da PDP, o Ministério da Saúde apenas efetuará novas aquisições mediante comprovação pela instituição pública de que possui o registro sanitário do referido produto junto à ANVISA e da evolução das etapas de desenvolvimento, transferência e absorção de tecnologia, conforme cronograma aprovado no projeto executivo e eventuais alterações. (Origem: PRT MS/GM 2531/2014, Art. 54)
Art. 55. A aquisição do produto objeto da PDP se dará entre o Ministério da Saúde e a instituição pública, por meio de instrumento específico, e será realizada após observância e reanálise dos seguintes itens: (Origem: PRT MS/GM 2531/2014, Art. 55)
I - quanto à capacidade de atendimento: (Origem: PRT MS/GM 2531/2014, Art. 55, I)
a) serão verificadas as condições técnicas da instituição pública, junto à entidade privada, de entregar o produto nos quantitativos, termos e condições preconizados pelas áreas finalísticas do Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 55, I, a)
b) será verificada a capacidade da instituição pública de fornecer o produto nas apresentações e formas farmacêuticas e nas especificações técnicas solicitadas pelo Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 55, I, b)
II - será considerada a demanda do Ministério da Saúde à época de aquisição do produto objeto de PDP; e (Origem: PRT MS/GM 2531/2014, Art. 55, II)
III - quanto aos preços, economicidade e vantajosidade: (Origem: PRT MS/GM 2531/2014, Art. 55, III)
a) os preços estabelecidos para a aquisição de produto objeto da PDP considerarão o aporte tecnológico associado à internalização da produção e serão decrescentes em termos reais, podendo sofrer variação, nos períodos e na forma da legislação pertinente, de forma a levar em conta a flutuação nos preços médios de mercado nacionais e internacionais, a variação de preços medidas pelo IPCA ou por indicadores oficiais setoriais, a variação da taxa cambial quando envolver importações no período de transferência, considerando-se economias e sistemas de saúde similares aos do Brasil e, no que couber, as normas e critérios adotados pela CMED; (Origem: PRT MS/GM 2531/2014, Art. 55, III, a)
b) considerar-se-á na avaliação de preços, quando cabível, as estimativas de valores de mercado para produtos que estejam próximos ao período de expiração da patente e a redução relevante de preços de mercado decorrente de estratégias de competição das empresas; e (Origem: PRT MS/GM 2531/2014, Art. 55, III, b)
c) a economicidade e vantajosidade do processo deve ser analisada tendo como referência as orientações estabelecidas no art. 14, VIII. (Origem: PRT MS/GM 2531/2014, Art. 55, III, c)
§ 1º A análise de preços referenciada na proposta de projeto da PDP servirá como referencial para definição do preço de aquisição a ser praticado pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 55, § 1º)
§ 2º A Secretaria do Ministério da Saúde responsável pela execução do instrumento específico de aquisição do produto objeto da PDP junto à instituição pública deverá, em conjunto com a Secretaria-Executiva (SE/MS), realizar a análise de preços a serem praticados com o apoio técnico da SCTIE/MS, em procedimento administrativo distinto do processo de PDP. (Origem: PRT MS/GM 2531/2014, Art. 55, § 2º)
Art. 56. O processo administrativo de aquisição do produto objeto da PDP observará a legislação vigente e conterá toda a documentação necessária para comprovação da existência e regularidade da PDP, inclusive o extrato do termo de compromisso publicado no DOU e os documentos citados nesta Seção. (Origem: PRT MS/GM 2531/2014, Art. 56)
Parágrafo Único. A aquisição do produto objeto da PDP será efetuada mediante a celebração de contrato plurianual compatível com o cronograma da PDP, respeitando-se a legislação vigente. (Origem: PRT MS/GM 2531/2014, Art. 56, Parágrafo Único)
Art. 57. Verificada a capacidade de fornecimento, pela instituição pública, do produto objeto da PDP e para fins de sua aquisição, a SCTIE/MS encaminhará os seguintes documentos à Secretaria do Ministério da Saúde responsável pela sua aquisição: (Origem: PRT MS/GM 2531/2014, Art. 57)
I - cópia da página do DOU contendo a publicação da Resolução da ANVISA referente à concessão do registro sanitário do produto objeto da PDP; (Origem: PRT MS/GM 2531/2014, Art. 57, I)
II - cópia do CBPF do local de fabricação constante do registro sanitário; (Origem: PRT MS/GM 2531/2014, Art. 57, II)
III - cópia do extrato do termo de compromisso; e (Origem: PRT MS/GM 2531/2014, Art. 57, III)
IV - nota técnica elaborada pela SCTIE/MS contendo, no mínimo, os seguintes itens: (Origem: PRT MS/GM 2531/2014, Art. 57, IV)
a) instituição pública e entidade privada envolvida na PDP; (Origem: PRT MS/GM 2531/2014, Art. 57, IV, a)
b) objeto e objetivo da PDP, especificando-se o produto envolvido, as apresentações, a forma farmacêutica e o estágio da transferência de tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 57, IV, b)
c) prazo previsto pela instituição pública para a internalização da tecnologia; e (Origem: PRT MS/GM 2531/2014, Art. 57, IV, c)
d) declaração dos sujeitos participantes de concordância de atendimento dos objetivos do projeto para desenvolvimento, transferência e absorção de tecnologia nos termos deste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 57, IV, d)
Parágrafo Único. A Secretaria do Ministério da Saúde responsável pela aquisição do produto objeto da PDP poderá requerer da SCTIE/MS, caso seja de sua posse ou competência, outras informações e documentos que sejam necessários para a devida instrução do procedimento de aquisição. (Origem: PRT MS/GM 2531/2014, Art. 57, Parágrafo Único)
Art. 58. A proposta de alteração do cronograma da PDP, quando iniciado o processo de aquisição, será apresentada oficialmente pela instituição pública, com justificativas fundamentadas, à SCTIE/MS. (Origem: PRT MS/GM 2531/2014, Art. 58)
Parágrafo Único. Caso a proposta de alteração impactar na ampliação do período de aquisição de produto objeto da PDP conforme previsto no cronograma vigente, a SCTIE/MS encaminhará a proposta à Comissão Técnica de Avaliação e ao Comitê Deliberativo para avaliação e à Secretaria-Executiva do Ministério da Saúde (SE/MS) para decisão. (Origem: PRT MS/GM 2531/2014, Art. 58, Parágrafo Único)
Seção IV
Da Internalização da Tecnologia
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção IV)
Art. 59. Após finalização da PDP e concluído o processo de desenvolvimento, transferência e absorção de tecnologia pela instituição pública e entidade privada, as aquisições do produto que foi objeto de PDP não serão mais realizadas sob o rito disciplinado na Seção anterior. (Origem: PRT MS/GM 2531/2014, Art. 59)
Parágrafo Único. Nos casos previstos de impossibilidade das instituições públicas suprirem integralmente a demanda do Ministério da Saúde, proceder-se-á a processo licitatório para complementariedade do quantitativo necessário ao SUS. (Origem: PRT MS/GM 2531/2014, Art. 59, Parágrafo Único)
Art. 60. Comprovada a internalização de tecnologia, a instituição pública poderá, com a devida motivação analisada pelo Ministério da Saúde, transferir a tecnologia objeto de PDP a outra instituição pública para fins de atendimento às necessidades do SUS. (Origem: PRT MS/GM 2531/2014, Art. 60)
CAPÍTULO V
DO MONITORAMENTO E AVALIAÇÃO
(Origem: PRT MS/GM 2531/2014, CAPÍTULO V)
Art. 61. Cada PDP será monitorada de forma contínua desde o projeto de PDP até a internalização da tecnologia para fins de verificação dos avanços esperados no processo produtivo, desenvolvimento, transferência e absorção de tecnologia. (Origem: PRT MS/GM 2531/2014, Art. 61)
Art. 62. O monitoramento e a avaliação dos projetos de PDP e das PDP observará a ocorrência ou não do: (Origem: PRT MS/GM 2531/2014, Art. 62)
I - cumprimento do cronograma da PDP estabelecido no projeto executivo; e (Origem: PRT MS/GM 2531/2014, Art. 62, I)
II - cumprimento das obrigações e responsabilidades definidas durante as fases do processo para o estabelecimento de PDP. (Origem: PRT MS/GM 2531/2014, Art. 62, II)
Art. 63. O monitoramento técnico da capacitação, das atividades tecnológicas e produtivas, do projeto executivo e seu cronograma, do processo técnico de transferência de tecnologia e do desenvolvimento das capacidades da instituição pública para o novo patamar tecnológico, no âmbito da PDP, será realizado pela SCTIE/MS, com participação da ANVISA, mediante a atuação dos CTR, e com base em instrumentos e metodologias específicas, envolvendo-se as seguintes dimensões: (Origem: PRT MS/GM 2531/2014, Art. 63)
I - monitoramento técnico da capacitação e atividades tecnológicas e produtivas requeridas para a regulação sanitária, a cargo da ANVISA, mediante a atuação dos CTR, e com base em instrumentos e metodologias específicas; (Origem: PRT MS/GM 2531/2014, Art. 63, I)
II - monitoramento do projeto executivo, do processo técnico de transferência e de absorção de tecnologia e do desenvolvimento das capacidades da instituição pública para o novo patamar tecnológico, com base em instrumentos e metodologias específicas, sendo subsidiado pelas atividades previstas no inciso I do "caput", a cargo da SCTIE/MS; (Origem: PRT MS/GM 2531/2014, Art. 63, II)
III - análise de relatórios de acompanhamento enviados quadrimestralmente pela instituição pública ao Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 63, III)
IV - realização de visitas técnicas anuais conjuntas nas unidades fabris públicas e privadas pelo Ministério da Saúde e ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 63, IV)
Art. 64. Os projetos de PDP e as PDP que estejam em desacordo com requisitos, critérios, diretrizes e orientações estabelecidos e sejam identificados pelos mecanismos de monitoramento e avaliação instituídos neste Anexo serão suspensos pela SCTIE/MS para posterior análise das Comissões Técnicas de Avaliação e decisão do Comitê Deliberativo quanto à sua: (Origem: PRT MS/GM 2531/2014, Art. 64)
I - reestruturação: se for verificada a inobservância dos requisitos, critérios, diretrizes e orientações estabelecidos neste Anexo que comprometa os objetivos da PDP; ou (Origem: PRT MS/GM 2531/2014, Art. 64, I)
II - extinção: (Origem: PRT MS/GM 2531/2014, Art. 64, II)
a) se for efetuado dano à Administração Pública ou sua utilização em desacordo com os objetivos previstos neste Anexo; ou (Origem: PRT MS/GM 2531/2014, Art. 64, II, a)
b) se for descumprido de modo relevante e com risco de irreversibilidade o cronograma estabelecido na PDP, inclusive para efetivação do desenvolvimento, transferência e absorção de tecnologia em condições de portabilidade, sem justificativa de fatores alheios aos esforços dos participantes. (Origem: PRT MS/GM 2531/2014, Art. 64, II, b)
§ 1º A suspensão de que trata o "caput" será comunicada pela SCTIE/MS à Secretaria do Ministério da Saúde responsável pela execução do instrumento específico de aquisição do produto objeto da PDP junto à instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 64, § 1º)
§ 2º A adoção das medidas previstas neste artigo não exclui a aplicação de outras sanções e penalidades previstas na legislação vigente. (Origem: PRT MS/GM 2531/2014, Art. 64, § 2º)
Art. 65. A instituição pública e a entidade privada ficarão sujeitas a medidas administrativas e judiciais, além de sanções previstas em lei e nos contratos firmados, no caso de PDP que tenha iniciada a aquisição de produtos pelo Ministério da Saúde e a transferência de tecnologia para a instituição pública não seja efetivada, especialmente quando verificado eventual dano ao erário. (Origem: PRT MS/GM 2531/2014, Art. 65)
Parágrafo Único. Ficam ressalvadas do disposto no "caput" as situações de caso fortuito, força maior ou outras hipóteses devidamente fundamentadas de acordo com a legislação vigente, aprovadas pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 65, Parágrafo Único)
CAPÍTULO VI
DAS RESPONSABILIDADES INSTITUCIONAIS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO VI)
Art. 66. O Ministério da Saúde é responsável por: (Origem: PRT MS/GM 2531/2014, Art. 66)
I - elaborar e revisar a lista de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 66, I)
II - pactuar, junto à Comissão Intergestores Tripartite (CIT), a viabilidade de centralização de aquisição de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 66, II)
III - estimular as instituições públicas a apresentarem propostas de projetos de PDP que se enquadrem na lista de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 66, III)
IV - estimular as entidades privadas a participarem das iniciativas que favoreçam o investimento, o desenvolvimento tecnológico, a inovação e a geração de renda e emprego no Brasil de produtos estratégicos para o SUS, mediante sua participação em PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, IV)
V - receber e formalizar as propostas de projeto de PDP, com inclusão de sua manifestação técnica, quando couber, para fins de análise das Comissões Técnicas de Avaliação e discussão e decisão pelo Comitê Deliberativo; (Origem: PRT MS/GM 2531/2014, Art. 66, V)
VI - fornecer apoio técnico e administrativo para a realização das atividades das Comissões Técnicas de Avaliação e Comitê Deliberativo; (Origem: PRT MS/GM 2531/2014, Art. 66, VI)
VII - celebrar o termo de compromisso de cada projeto de PDP aprovado; (Origem: PRT MS/GM 2531/2014, Art. 66, VII)
VIII - monitorar e avaliar os projetos de PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, VIII)
IX - participar das reuniões do CTR e requerer informações e documentos, inclusive reuniões, da instituição pública e da entidade privada para acompanhamento da implementação do projeto de PDP e sugestão de estratégias para cumprimento; (Origem: PRT MS/GM 2531/2014, Art. 66, IX)
X - participar da fase de PDP e cumprir as responsabilidades e obrigações previstas na referida fase; e (Origem: PRT MS/GM 2531/2014, Art. 66, X)
XI - divulgar no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br, as informações públicas referentes às PDP, contendo, no mínimo, os seguintes dados: (Origem: PRT MS/GM 2531/2014, Art. 66, XI)
a) leis, decretos, portarias e resoluções relacionadas às PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, XI, a)
b) modelo de projeto executivo de PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, XI, b)
c) modelo de relatório de acompanhamento a ser apresentado pela instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 66, XI, c)
d) relação anual de propostas de projeto de PDP em análise, aprovadas ou não aprovadas; e (Origem: PRT MS/GM 2531/2014, Art. 66, XI, d)
e) relação anual de projetos de PDP e PDP e respectivos "status" de implementação e execução; e (Origem: PRT MS/GM 2531/2014, Art. 66, XI, e)
f) relação de produtos de PDP cuja aquisição foi iniciada pelo Ministério da Saúde via PDP, com cópia do extrato de publicação no DOU. (Origem: PRT MS/GM 2531/2014, Art. 66, XI, f)
Parágrafo Único. Para monitoramento e avaliação do projeto de PDP e da PDP, o Ministério da Saúde contará com o apoio dos órgãos e entidades da Administração Pública. (Origem: PRT MS/GM 2531/2014, Art. 66, Parágrafo Único)
Art. 67. A ANVISA é responsável por: (Origem: PRT MS/GM 2531/2014, Art. 67)
I - concluir as análises requeridas no âmbito dos projetos de PDP e de PDP para registro e alteração pós-registro em até 60 (sessenta) dias da data do requerimento; (Origem: PRT MS/GM 2531/2014, Art. 67, I)
II - priorizar, nos termos das normas sanitárias vigentes, as análises requeridas dos produtos objetos das PDP; (Origem: PRT MS/GM 2531/2014, Art. 67, II)
III - acompanhar, dentro das atividades do CTR, o atendimento ao cronograma para obtenção de registro sanitário do medicamento ou produto para a saúde, bem como as alterações pós-registro, para os produtores públicos e privados participantes de uma PDP, em consonância com o termo de compromisso aprovado, desde que atendam todas as normas e exigências sanitárias, acordado formalmente com a SCTIE/MS e demais Secretarias do Ministério da Saúde cujo produto faça parte de seus programas e ações; (Origem: PRT MS/GM 2531/2014, Art. 67, III)
IV - acompanhar o cronograma de obtenção ou renovação do CBPF, em consonância com o termo de compromisso aprovado, desde que atendam todas as normas e exigências sanitárias, acordado formalmente com a SCTIE/MS e demais Secretarias do Ministério da Saúde cujo produto faça parte de seus programas e ações; (Origem: PRT MS/GM 2531/2014, Art. 67, IV)
V - apoiar a SCTIE/MS com atividades de monitoramento e avaliação do desenvolvimento técnico dos projetos de PDP para atender os requisitos sanitários de qualidade e de internalização da produção no País, utilizando metodologias adequadas para este fim; (Origem: PRT MS/GM 2531/2014, Art. 67, V)
VI - realizar visitas técnicas anuais nas unidades fabris das instituições públicas e privadas, integrantes das PDP, junto ao Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 67, VI)
VII - monitorar tecnicamente a capacitação e as atividades tecnológicas e produtivas requeridas para a regulação sanitária dos produtores públicos e privados, de modo a subsidiar a internalização produtiva e tecnológica do produto objeto da PDP, mediante a atuação dos CTR e outras atividades proativas em que a ANVISA possa contribuir para seus resultados; e (Origem: PRT MS/GM 2531/2014, Art. 67, VII)
VIII - participar das Comissões Técnicas de Avaliação das propostas de projetos de PDP. (Origem: PRT MS/GM 2531/2014, Art. 67, VIII)
Art. 68. A instituição pública proponente e executora da PDP é responsável por: (Origem: PRT MS/GM 2531/2014, Art. 68)
I - elaborar e apresentar a proposta de projeto de PDP em observância aos critérios, requisitos, diretrizes e orientações deste Anexo, contendo, no mínimo, os dados solicitados conforme modelo de projeto executivo; (Origem: PRT MS/GM 2531/2014, Art. 68, I)
II - demonstrar a capacidade produtiva, os equipamentos e os recursos humanos necessários para execução do projeto de PDP na instituição pública, efetuando as adequações pertinentes para efetivação da transferência de tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 68, II)
III - realizar a análise de risco do projeto; (Origem: PRT MS/GM 2531/2014, Art. 68, III)
IV - enviar o projeto executivo de PDP à SCTIE/MS para análise, atendendo os prazos definidos neste Anexo; (Origem: PRT MS/GM 2531/2014, Art. 68, IV)
V - apresentar oralmente a proposta de projeto de PDP para as Comissões Técnicas de Avaliação e Comitê Deliberativo, após manifestação formal do Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 68, V)
VI - celebrar o termo de compromisso com o Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 68, VI)
VII - celebrar contratos ou outros instrumentos jurídicos com colaboradores e parceiros do projeto de PDP, seguindo os critérios e orientações deste Anexo e as premissas integrantes do termo de compromisso celebrado, sem prejuízos do acréscimo de outras condições necessárias ao bom atendimento do interesse público, em observância à legislação pertinente; (Origem: PRT MS/GM 2531/2014, Art. 68, VII)
VIII - peticionar o dossiê de registro do produto junto à ANVISA conforme normativos específicos da referida entidade e cronograma estabelecido; (Origem: PRT MS/GM 2531/2014, Art. 68, VIII)
IX - garantir, junto a seu parceiro privado, a internalização da produção nacional do IFA, componente tecnológico crítico e, quando aplicável, o atendimento à regra de origem e/ou PPB; (Origem: PRT MS/GM 2531/2014, Art. 68, IX)
X - acompanhar, monitorar e avaliar as ações desempenhadas pela entidade privada para a transferência de tecnologia e para o efetivo cumprimento do cronograma técnico-regulatório; (Origem: PRT MS/GM 2531/2014, Art. 68, X)
XI - participar ativamente do desenvolvimento dos produtos junto à entidade privada, acompanhando todo ciclo tecnológico; (Origem: PRT MS/GM 2531/2014, Art. 68, XI)
XII - realizar treinamentos para sua equipe, coordenada junto aos parceiros privados, a fim de absorver os conhecimentos necessários para a efetiva transferência de tecnologia do produto objeto da PDP, sendo a sua efetividade prática avaliada periodicamente, os registros dos treinamentos mantidos e os cronogramas oficializados ao Ministério da Saúde, estando disponíveis durante as visitas técnicas; (Origem: PRT MS/GM 2531/2014, Art. 68, XII)
XIII - participar das visitas técnicas na entidade privada em conjunto com o Ministério da Saúde e a ANVISA; (Origem: PRT MS/GM 2531/2014, Art. 68, XIII)
XIV - solicitar as priorizações de análise junto à ANVISA após petição de registro ou alteração pós-registro; (Origem: PRT MS/GM 2531/2014, Art. 68, XIV)
XV - cumprir o cronograma do projeto de PDP definido, comunicando e justificando ao Ministério da Saúde qualquer alteração necessária; (Origem: PRT MS/GM 2531/2014, Art. 68, XV)
XVI - enviar ao Ministério da Saúde, especificamente à SCTIE/MS, relatórios de acompanhamento quadrimestrais para os projetos de PDP aprovados, demostrando as atividades do projeto executadas, em andamento e previstas, apresentando justificativas fundamentadas em caso de alteração do cronograma apresentado no projeto executivo; (Origem: PRT MS/GM 2531/2014, Art. 68, XVI)
XVII - colaborar e fornecer a documentação necessária para a visita técnica do Ministério da Saúde e ANVISA na instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 68, XVII)
XVIII - participar das reuniões do CTR e do Ministério da Saúde, sempre que requerida; (Origem: PRT MS/GM 2531/2014, Art. 68, XVIII)
XIX - celebrar instrumento específico com o Ministério da Saúde para fornecimento de produtos no âmbito da PDP, respeitando as legislações pertinentes e os termos deste Anexo; e (Origem: PRT MS/GM 2531/2014, Art. 68, XIX)
XX - garantir o fornecimento e entrega dos produtos conforme quantitativo e cronograma definidos pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 68, XX)
Parágrafo Único. A escolha e as relações contratuais com a entidade privada são de inteira responsabilidade da instituição pública produtora celebrante da PDP, inclusive com relação à sua qualificação e à avaliação da regularidade de sua situação legal e idoneidade. (Origem: PRT MS/GM 2531/2014, Art. 68, Parágrafo Único)
Art. 69. Para participar da proposta de projeto de PDP, do projeto de PDP e da PDP, a entidade privada deverá: (Origem: PRT MS/GM 2531/2014, Art. 69)
I - participar da proposta de projeto de PDP em observância aos critérios, requisitos, diretrizes e orientações deste Anexo, contendo, no mínimo, os dados solicitados conforme modelo de projeto executivo; (Origem: PRT MS/GM 2531/2014, Art. 69, I)
II - demonstrar a capacidade produtiva, os equipamentos e os recursos humanos necessários para participação no projeto de PDP, efetuando as adequações pertinentes para efetivação da transferência de tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 69, II)
III - celebrar contratos ou outros instrumentos jurídicos com a instituição pública e parceiros privados do projeto de PDP, seguindo os critérios, requisitos, diretrizes e orientações deste Anexo e as premissas integrantes do termo de compromisso celebrado, sem prejuízos do acréscimo de outras condições necessárias ao bom atendimento do interesse público, em observância à legislação pertinente; (Origem: PRT MS/GM 2531/2014, Art. 69, III)
IV - garantir no projeto executivo, na esfera de sua responsabilidade, a internalização da produção nacional do IFA, componente tecnológico crítico e, quando aplicável, o atendimento à regra de origem e/ou PPB; (Origem: PRT MS/GM 2531/2014, Art. 69, IV)
V - garantir a transferência de tecnologia e o efetivo cumprimento do cronograma técnico-regulatório sob sua responsabilidade; (Origem: PRT MS/GM 2531/2014, Art. 69, V)
VI - participar ativamente do desenvolvimento dos produtos junto à instituição pública e aos parceiros privados; (Origem: PRT MS/GM 2531/2014, Art. 69, VI)
VII - realizar treinamentos a fim de transferir os conhecimentos necessários para o efetivo desenvolvimento e transferência de tecnologia do produto objeto da PDP, efetuando os registros dos treinamentos e os cronogramas oficializados ao Ministério da Saúde, estando disponíveis durante as visitas técnicas; (Origem: PRT MS/GM 2531/2014, Art. 69, VII)
VIII - receber visitas técnicas periódicas das equipes do Ministério da Saúde e da ANVISA, em consonância com as metodologias utilizadas, colaborando e fornecendo a documentação necessária; (Origem: PRT MS/GM 2531/2014, Art. 69, VIII)
IX - peticionar, quando couber, o dossiê de registro do produto e alterações pós-registro junto à ANVISA, conforme sua regulamentação específica; (Origem: PRT MS/GM 2531/2014, Art. 69, IX)
X - cumprir o cronograma do projeto de PDP aprovado, definindo junto ao parceiro público a possibilidade de qualquer alteração nele necessária; (Origem: PRT MS/GM 2531/2014, Art. 69, X)
XI - informar periodicamente à instituição pública, conforme cronograma definido, as atividades do projeto executadas, em andamento e previstas, auxiliando a instituição pública na elaboração dos relatórios de acompanhamento quadrimestrais e das justificativas fundamentadas em caso de alteração do cronograma e enviando à instituição pública documentos sobre o andamento do projeto e das atividades inerentes para sua efetivação, visando o atendimento do interesse público e das suas finalidades, entre as quais se incluem a transferência de tecnologia, a garantia de fornecimento e a produção local do insumo; (Origem: PRT MS/GM 2531/2014, Art. 69, XI)
XII - garantir o fornecimento e entrega dos produtos conforme quantitativo e cronograma definidos pela instituição pública para atender as demandas do Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 69, XII)
XIII - firmar a declaração conjunta de concordância aos termos da proposta de projeto de PDP, conforme disposto no art. 14, § 3º , e a declaração de concordância anexa ao termo de compromisso, nos termos do art. 35. (Origem: PRT MS/GM 2531/2014, Art. 69, XIII)
CAPÍTULO VII
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO VII)
Art. 70. As orientações, critérios, requisitos, diretrizes e formas de monitoramento e avaliação definidos neste Anexo são aplicáveis, no que couber, às PDP vigentes. (Origem: PRT MS/GM 2531/2014, Art. 70)
§ 1º Fica concedido o prazo de 180 (cento e oitenta) dias, a partir da data de publicação da Portaria nº 2531/GM/MS, de 12 de novembro de 2014, para adequação pelas instituições públicas e entidades privadas, no que couber, das PDP em vigor ao disposto no "caput". (Origem: PRT MS/GM 2531/2014, Art. 70, § 1º)
§ 2º A SCTIE/MS efetuará a classificação das PDP vigentes conforme as fases de estabelecimento de PDP previstas no art. 10. (Origem: PRT MS/GM 2531/2014, Art. 70, § 2º)
§ 3º Para as PDP vigentes de pesquisa e desenvolvimento que estejam em fase de desenvolvimento, transferência e absorção de tecnologia, a instituição pública poderá solicitar à SCTIE/MS a sua adequação para enquadramento como projeto de PDP ou PDP, nos termos deste Anexo, para fins de análise pela Comissão Técnica de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 70, § 3º)
§ 4º As propostas de projeto de PDP em tramitação no Ministério da Saúde nos termos da Portaria nº 837/GM/MS, de 18 de abril de 2012, e ainda não avaliadas pelas Comissões Gestoras serão restituídas pela SCTIE/MS às instituições proponentes para fins de adequação ao regramento disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 70, § 4º)
Art. 71. Na hipótese de existência de contratos vigentes entre o Ministério da Saúde e as instituições públicas para aquisição de produtos estratégicos até a data de publicação da Portaria nº 2531/GM/MS, de 12 de novembro de 2014, os referidos contratos serão adequados, no que couber, ao regramento disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 71)
Art. 72. Na hipótese de existência de acordo ou contrato de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP entre as instituições públicas e as entidades privadas até a data de publicação da Portaria nº 2531/GM/MS, de 12 de novembro de 2014, os referidos acordos contratos serão adequados, no que couber, ao regramento disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 72)
Art. 73. Até a edição da nova lista de produtos estratégicos para o SUS de que trata o art. 7º, permanecerá vigente a lista definida nos termos do art. 6º da Portaria nº 3.089/GM/MS, de 11 de dezembro de 2013. (Origem: PRT MS/GM 2531/2014, Art. 74)
ANEXO XCVI
PROGRAMA NACIONAL DE COMPETITIVIDADE EM VACINAS (INOVACINA) (Origem: PRT MS/GM 972/2006, Anexo 1)
PROGRAMA NACIONAL DE COMPETITIVIDADE EM VACINAS (INOVACINA)
Este Programa, gerado no âmbito do INOVAÇÂO EM SAÚDE/ FIOCRUZ, consta de quatro componentes:
A) Definição de políticas e organização da produção.
B) Modernização do parque produtivo.
C) Avaliação e regulação.
D) Desenvolvimento e inovação.
Esta versão do Programa “Inovacina” resume as conclusões de amplo processo de discussão em Oficinas de Trabalho, envolvendo os diversos setores, que se desenvolveu a partir da apresentação de textos produzidos por especialistas. Em cada componente são indicados “Propósitos”, “Objetivos” e “Instrumentos”. Expressam a síntese das discussões e as opiniões implícitas devem ser creditadas ao coletivo de gestores, produtores e acadêmicos que participaram do processo. Foram quase duzentos participantes providos de interesse (“stakeholders”), compondo o que se tem internacionalmente chamado a hélice tripla (“triple helix”). Em “Instrumentos” são detalhadas as propostas de ação concreta em cada componente.
COMPONENTE A:
Definição de políticas e organização da produção
PROPÓSITOS
1. Estabelecer o Programa Nacional de Competitividade em Vacinas (INOVACINA), coordenado pelo Ministério da Saúde (MS).
2. Estabelecer um espaço estratégico e permanente de discussão e definição de políticas, indicando nichos para cada instituição produtora, no âmbito do Programa.
3. Investir nos mecanismos de coordenação e de formação de rede inter-institucional, propiciando a formação de consórcio para integração dos produtores e incentivando-os a adotar estrutura jurídica que garanta uma maior flexibilidade e autonomia, facilitando a integração e a cooperação.
4. Fortalecer a capacidade produtiva nacional, para atender à demanda de vacinas essenciais para o Programa Nacional de Imunizações (PNI).
5. Promover mudanças na atual modalidade de financiamento da produção de imunobiológicos, empregando o poder de compra do Ministério da Saúde como instrumento de regulação de preços.
OBJETIVOS
1. Contribuir na definição das políticas científica, tecnológica, industrial e sanitária na área de vacinas e imunizações.
2. Dinamizar o crescimento do segmento, aumentando a sua capacidade tecnológica e o sinergismo entre os produtores públicos, garantindo competitividade e auto-sustentabilidade tecnológica e econômica do Programa.
3. Garantir a integração entre os atores do processo, coordenando as diversas etapas do desenvolvimento dos projetos específicos de vacinas e propiciando a utilização da plena capacidade instalada e de pessoal, visando à redução dos custos fixos de produção para suprir as necessidades nacionais e favorecer a exportação.
4. Garantir o aproveitamento das potencialidades de cada produtor, o aumento das possibilidades de negócio e a eliminação das restrições legais para exportação, propiciando ainda a internalização de vacinas que incorporem tecnologia avançada.
5. Fortalecer o entendimento das peculiaridades do setor de vacinas, propiciando a melhoria do fluxo de recursos financeiros, propor mudança no mecanismo de preços praticado pelo governo, pleiteando a obtenção de um excedente para investimentos que permitam atingir a auto-suficiência.
6. Estreitar o relacionamento dos produtores com o Ministério da Saúde, garantindo a prioridade da área e a regularidade nos desembolsos.
7. Melhorar a capacitação de pesquisadores e tecnologistas na pesquisa básica, desenvolvimento tecnológico, ensaios clínicos, propriedade intelectual, produção e gestão de projetos na perspectiva da inovação, incluindo a formação e a capacitação de pessoal estratégico (multidisciplinar) em vacinas, particularmente na engenharia de processos e nas funções de regulação.
8. Atuar no sentido de garantir a melhoria do regime de contratação de pessoal para continuidade e preservação dos grupos.
INSTRUMENTOS
1. Formalizar o Programa, contendo as estratégias e as proposições resultantes das Oficinas de Trabalho realizadas pelo “Projeto Inovação/FIOCRUZ”, e estabelecendo mecanismos regulares de consulta dos Ministérios entre si, com a Câmara Técnica e os produtores.
2. Propor o financiamento da FINEP e do BNDES para produtores públicos e modelos alternativos de financiamento que permitam a garantia de transferência de recursos financeiros.
3. Providenciar instrumentos legais (portarias) criando o INOVACINA e a Câmara Técnica de Imunobiológicos e nomeando os seus componentes.
4. Lançamento formal do Programa, pelo Presidente da República.
5. Levar o Programa ao conhecimento do Conselho Nacional de Saúde, da CIT e do Congresso Nacional, além de divulgá-lo amplamente à sociedade pela mídia.
6. Publicar livro com todas as contribuições e conclusões.
7. Incluir o Programa na agenda do Mercosul.
8. Definir o modelo jurídico institucional que formalize a integração em redes de cooperação e propiciar a utilização pelos participantes de Modelo Integrado de Gestão e de controle dos custos.
9. Solicitar a utilização de bolsas RHAE em instituições públicas produtoras e propor mecanismos especiais para fixação de doutores na área, além de incentivar a formação de programas de pós-graduação, incluindo a temática do desenvolvimento e a produção de imunobiológicos.
10. Propor uma série de medidas que garantam a consolidação do Programa, entre elas:
a) buscar orientação legal para utilizar o poder de compra do Ministério da Saúde em área de interesse público estratégico;
b) pleitear a alocação na área de vacinas de recursos dos Fundos Setoriais de Saúde, de Biotecnologia e de outras fontes como QUALISUS, fundações estaduais etc.,
c) propor a criação de Fundo de Capital de Giro, capitalizado pelo governo para o caso de falta de regularidade no fluxo de recursos;
d) buscar a utilização de Fundações pela maior flexibilidade nas compras;
e) integrar os esforços dos fóruns de competitividade do MDIC relacionados com a produção de fármacos e biotecnologia; e
f) acompanhar os trabalhos do Congresso Nacional na regulamentação das leis de “Inovação” e da “Parcerias Público Privado (PPP)”.
COMPONENTE B:
Modernização e Certificação do parque produtivo
PROPÓSITOS
1. Avaliar as necessidades de modernização em cada nicho.
2. Viabilizar a modernização das instalações de cada nicho.
3. Fortalecer o sistema nacional de controle de qualidade em vacinas e implantar sistema de garantia de qualidade.
OBJETIVOS
1. Garantir a qualidade da produção local para atender às necessidades internas (qualitativas e quantitativas), substituindo importações e propiciando ingresso no mercado mundial.
2. Aumentar a competitividade externa dos produtores nacionais, visando à superação das barreiras sanitárias para exportação.
3. Garantir a certificação das plantas industriais no âmbito do INOVACINA, com medidas que fortaleçam o sistema de controle e garantia de qualidade das vacinas produzidas.
INSTRUMENTOS
1. Implementar infra-estrutura para cumprimento das BPF (GMP) adequadas ao padrão internacional e propícias ao desenvolvimento de novas vacinas.
2. Garantir a aquisição para substituir equipamentos obsoletos e atingir porte tecnológico.
3. Definir fontes de financiamento e garantir o planejamento para a alocação dos recursos.
4. Viabilizar a articulação dos produtores com o BNDES, a FINEP e os programas de investimento do MS e dos Estados.
5. Pleitear a eliminação das restrições impostas ao financiamento das instituições públicas produtoras de bens e serviços pelos órgãos públicos de fomento.
6. Elaborar Plano de Certificação, pela ANVISA e a OMS, de cada produto e de cada planta no âmbito do Programa, detalhando etapas e custos.
7. Utilizar produtor âncora para capacitação dos profissionais de outras instituições no processo de certificação.
8. Garantir compras compartilhadas ou centralizadas, no âmbito do Programa, de produtos e serviços a um custo menor.
9. Integrar-se no esforço de constituição de um Sistema de Controle e Garantia de Qualidade para os produtos incluídos no Programa
COMPONENTE C: Avaliação e Regulação
PROPÓSITOS
1. Estabelecer infra-estrutura nacional para ensaios (clínicos e não-clínicos) de imunobiológicos (Rede Brasileira de Ensaios);
2. Buscar a incorporação da propriedade intelectual nas estratégias de desenvolvimento, gestão e produção;
3. Desencadear processo de discussão visando à adaptação da legislação regulatória de imunobiológicos à realidade brasileira.
OBJETIVOS
1. Fortalecer as atividades de ensaios (pré-clínicos, clínicos e epidemiológicos) em instituições públicas.
2. Difundir a discussão da importância da propriedade intelectual entre pesquisadores e produtores.
3. Desencadear ações visando à construção de conceitos que possam vir a mudar a legislação sobre ensaios clínicos e pré-clínicos e as exigências para registro de imunobiológicos.
INSTRUMENTOS
1. Promover seminários de âmbito nacional para discutir proposta de um programa para o desenvolvimento de ensaios (pré- clínicos, clínicos e epidemiológicos) dos imunobiológicos desenvolvidos no âmbito do Programa.
2. Retomar e formalizar os contatos já existentes entre instituições públicas que têm participado em Ensaios de Vacinas produzidas pelos produtores públicos nacionais.
3. Propor e desenvolver um projeto completo para a Rede Brasileira de Ensaios de Vacinas, no âmbito do Programa;
4. Estabelecer contato com centros do exterior envolvidos no esforço de realização de ensaios clínicos independentes, com financiamento exclusivamente público ou de instituições filantrópicas, à semelhança da “European Science Foundation” com seu “Pan-European Clinical Trials”.
5. Estabelecer relacionamento com as instâncias nacionais que se têm preocupado com a questão da propriedade intelectual para orientar os produtores a trabalhar com vacinas patenteadas a partir de acordo comercial ou licença, compatíveis com o TRIPS.
6. Estabelecer mecanismo permanente de consulta aos bancos de patentes de produtos que possam ser incluídos no Programa.
7. Desenvolver mecanismos para fortalecer as áreas de gestão de tecnologia das instituições participantes, incluindo a Propriedade Intelectual, com vistas a patentear os resultados do desenvolvimento de produtos e processos no âmbito do Programa.
8. Promover estudos visando a uma Consulta Pública para revisão da legislação de registro dos produtos gerados no âmbito do Programa.
COMPONENTE D: Desenvolvimento e Inovação
PROPÓSITOS
1. Incorporar a inovação na estratégia das organizações, visando ao desenvolvimento autônomo (e/ou à internalização) de tecnologias mais avançadas com alto valor agregado.
2. Definir um conjunto de vacinas prioritárias, incluindo adjuvantes e plataformas de aplicação de cada vacina.
3. Selecionar nichos tecnológicos prioritários, formação de redes e fortalecimento das instituições âncora.
OBJETIVOS
1. Articular as ações de saúde com ações de competitividade, elaborando uma agenda de pesquisa em vacinas com base nas prioridades públicas explícitas da política nacional de saúde.
2. Garantir a coordenação das atividades no âmbito do Programa, integrando pesquisa básica, desenvolvimento tecnológico, ensaios clínico-epidemiológicos, produção, regulamentação e mercado, levando em conta que as parcerias mudam em cada etapa.
3. Definir as rotas tecnológicas e a coordenação das atividades do ciclo de desenvolvimento dos produtos.
4. Estimular a criação de empresas autônomas de biotecnologia e o desenvolvimento desse setor nas organizações envolvidas no programa, especialmente, não apenas nas âncoras.
INSTRUMENTOS
1. Capacitar os produtores para o estabelecimento de estratégias competitivas de inovação e de penetração no mercado internacional.
2. Realizar estudos (custo-benefício, carga de doença, epidemiológicos pós-licenciamento) para orientar a definição das prioridades.
3. Identificar os principais gargalos para o desenvolvimento de cada vacina.
4. Contemplar sempre a transferência de tecnologia (internalização) como alternativa possível de desenvolvimento dos produtos.
5. Definir os cronogramas e as responsabilidades para cada produto proposto no âmbito do Programa.
6. Propor a adoção de incentivos financeiros para os produtores como garantia para o esforço de desenvolvimento de novas vacinas: incentivos fiscais; cartas-compromisso garantindo a aquisição do produto;financiamento para os grupos de gestão de projetos e das redes; criação de uma “alíquota de inovação” (o preço do produto vendido para o MS acrescido de um percentual de inovação); e inclusão nos orçamentos dos produtores de elemento capaz de assegurar o esforço de P&D etc.
ANEXO XCVII
TERMO DE ADESÃO (Origem: PRT MS/GM 1708/2013, Anexo 2)
Termo de Adesão
(MODELO EM PAPEL TIMBRADO)
UF:
Município (se for o caso):
Secretaria Municipal/Estadual de Saúde de
_________________
A Secretaria Municipal/ Estadual de Saúde de _______________, representada pelo seu Secretário Municipal/Estadual de Saúde, solicita adesão ao Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS), nos termos definidos pela Portaria nº , de de 2013, assumindo as responsabilidades expressas nos compromissos das metas definidas pelo Programa, visando induzir o aperfeiçoamento das ações de vigilância em saúde.
(local), ____, de ______________ de 2013.
__________________________________
GESTOR(A) MUNICIPAL/ ESTADUAL
(Nome e assinatura)
ANEXO XCVIII
METAS E INDICADORES PACTUADOS NO ÂMBITO DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (Origem: PRT MS/GM 2778/2014, Anexo 1)
I - Municípios e Distrito Federal
1. Meta: 90% (noventa por cento) de registros de óbitos alimentados no Sistema de Informações sobre Mortalidade (SIM) até 60 (sessenta) dias após o final do mês de ocorrência. Indicador: proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 (sessenta) dias após o final do mês de ocorrência.
2. Meta: 90% (noventa por cento) de registros de nascidos vivos alimentados no Sinasc até 60 (sessenta) dias após o final do mês de ocorrência.
Indicador: proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 (sessenta) dias após o final do mês de ocorrência.
3. Meta: 80% (oitenta por cento) ou mais de Salas de Vacina com alimentação mensal no SI-PNI, por Município.
Indicador: proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por Município.
4. Meta: 100% (cem por cento) das vacinas do calendário básico de vacinação da criança com a cobertura vacinal preconizada.
Indicador: proporção de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas.
5. Meta: 90% (noventa por cento) do número de análises obrigatórias para o parâmetro coliformes totais realizadas.
Indicador: Proporção de análises realizadas para o parâmetro Coliformes Totais em água para consumo humano.
6. Meta: 50 (cinquenta) semanas epidemiológicas com, pelo menos, uma notificação (positiva, negativa ou de surto), no período de um ano.
Indicador: número de semanas epidemiológicas com informações no Sinan.
7. Meta: 80% (oitenta por cento) de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 (sessenta) dias a partir da data de notificação. Indicador: proporção de casos de doenças de notificação compulsória imediata (DNCI) encerrados em até 60 (sessenta) dias após notificação.
8. Meta: 70% (setenta por cento) dos casos de malária com tratamento iniciado em até 48 (quarenta e oito) horas a partir do início dos sintomas.
Indicador: proporção de casos de malária que iniciaram tratamento em até 48 (quarenta e oito) horas a partir do início dos sintomas.
9. Meta: 4 (quatro) ciclos, dos 6 (seis) preconizados, com mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados para controle vetorial da dengue.
Indicador: número de ciclos que atingiram mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados para controle vetorial da dengue.
10. Meta: 80% (oitenta por cento) dos contatos intradomiciliares dos casos novos de hanseníase, nos anos das coortes, examinados.
Indicador: proporção de contatos intradomiciliares de casos novos de hanseníase examinados.
11. Meta: 80% (oitenta por cento) dos contatos dos casos novos de tuberculose pulmonar bacílífera examinados.
Indicador: proporção de contatos de casos novos de tuberculose pulmonar bacilífera examinados.
12. Meta: 2 (dois) testes de sífilis por gestante.
Indicador: número de testes de sífilis por gestante.
13. Meta: 15% (quinze por cento) de ampliação no número de testes de HIV realizados em relação ao ano anterior.
Indicador: número de testes de HIV realizado.
14. Meta: 90% (noventa por cento) das notificações de agravos e doenças relacionados ao trabalho com o campo "ocupação" preenchido.
Indicador: proporção de preenchimento do campo "ocupação" nas notificações de agravos e doenças relacionados ao trabalho.
II - Estados Ampliar o número de Municípios que alcançam as metas listadas acima.
Metas e Indicadores Pactuados no âmbito do Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS) a partir de 2018
Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Municípios e Distrito Federal Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
1. Meta: 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
2. Meta: 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
3. Meta: 80% de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
4. Meta: 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 1 ano de idade - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ªdose) - e para crianças de 1 ano de idade - Tríplice viral (1ª dose). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de vacinas selecionadas que compõem o Calendário Nacional de Vacinação para crianças menores de 1 ano de idade (Pentavalente - 3ª dose, Poliomielite - 3ª dose, Pneumocócica 10 valente - 2ª dose) e para crianças de 1 ano de idade (tríplice viral - 1ª dose) - com coberturas vacinais preconizadas. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
5. Meta: 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Percentual de amostras analisadas para o residual de agente desinfetante em água para consumo humano (parâmetro: cloro residual livre, cloro residual combinado ou dióxido de cloro). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
6. Meta: 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias, a partir da data de notificação. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
7. Meta: 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para os casos importados). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de casos de malária que iniciaram tratamento em tempo oportuno. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
8. Meta: 4 ciclos de visita domiciliar, dos 6 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
9. Meta: 82% dos contatos dos casos novos de hanseníase, nos anos das coortes, examinados. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de contatos examinados de casos novos de hanseníase diagnosticados nos anos das coortes. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
10. Meta: 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
11. Meta: 2 testes de sífilis por gestante. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Número de testes de sífilis por gestante. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
12. Meta 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Número de testes de HIV realizado. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
13. Meta: 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido de acordo com o código da Classificação Brasileira de Ocupações (CBO). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
14. Meta: 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
ANEXO XCIX
CADERNO DE INDICADORES DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (Origem: PRT MS/GM 2778/2014, Anexo 2)
Indicador 1 - Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 (sessenta) dias após o final do mês de ocorrência.
Indicador 2 - Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 (sessenta) dias após o final do mês de ocorrência.
|
|
- Os parâmetros adotados para estipular o volume esperado de registros de nascidos vivos para os municípios serão definidos com base no desempenho de cada Secretariamunicipal, no que se refere à captação desses eventos nos últimos 3 (três) anos estatísticos encerrados e publicados, conforme os seguintes estratos: I - Municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada adequada, terão o número de nascidos vivos esperados em cada mês calculado a partir do número de registros informados ao Sistema de Informação nos últimos 4 (quatro) anos, projetado por regressão linear simples para o ano em curso; II - Municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada inadequada, terão o número de nascidos vivos esperados em cada mês calculado a partir da aplicação da Taxa Bruta de Natalidade considerada minimamente adequada sobre a população estimada para o Município no ano corrente e, na sua ausência, para o ano anterior. O Ministério da Saúde emitirá anualmente Nota Técnica, apontando: a) em que estrato se enquadra cada Município para as finalidades que preconizam os incisos I e II acima; e b) toda a memória de cálculo do número de nascimentos esperados por ano e por mês, por Município. - A Secretaria de Vigilância em Saúde disponibiliza o número de nascidos vivos esperados por Município no seguinte endereço: http://svs.aids.gov.br/cgiae/sinasc/ no item documentação. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 3 - Proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por município.
Denominador: Número de salas de vacinas do município constante do cadastro do SI-PNI em junho de 2012. Fator de multiplicação: 100. |
|
- Em municípios até 10.000 habitantes, a alimentação do SI-PNI poderá ocorrer no nível central da Secretaria Municipal de Saúde, com a identificação das Salas de Vacinas correspondentes. - Os dados para a avaliação desse indicador levarão em conta o quantitativo de salas de vacinas existentes no Cadastro do Sistema de Informação de Avaliação do Programa Nacional de Imunizações (SIAPI) em junho de 2012, que subsidiou a elaboração da Portaria GM/MS nº 2.363/2012. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 4 - Proporção de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas.
CV BCG-ID = Numerador: nº de doses aplicadas de BCG < 1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Rotavírus Humano (VORH) = Numerador: nº de 2ª doses aplicadas de VORH <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Pentavalente (DTHib HeB) = Numerador: nº de 3ª doses aplicadas de Pentavalente (DTHib HeB) em <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Vacina contra Poliomielite= Numerador: nº de 3ª doses aplicadas de Vacina contra Poliomielite em <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Pneumocócica Conjugada 10v (PnC10v) = Numerador: nº de 3ª doses aplicadas de vacina Pneumocócica Conjugada 10v (PnC10v) em <1ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Meningocócica Conjugada C (MnC) = Numerador: nº de 2ª doses aplicadas de vacina Meningocócica Conjugada C (MnC) em <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Vacina Febre Amarela= Numerador: nº de doses da vacina febre amarela em menores de um ano de idade Denominador: população <1 ano de idade. Fator de multiplicação: 100. Aplica-se aos Municípios que fazem parte da Área com Recomendação de Vacinação da Febre Amarela. Tríplice viral = Numerador: nº de doses da vacina Tríplice viral em crianças de 1 ano de idade. Denominador: população 1 ano de idade. Fator de multiplicação: 100. Vacina Tetra viral - 95% Numerador: nº de doses da vacina Tetra viral em crianças de 1 ano de idade. Denominador: população 1 ano de idade. Fator de multiplicação: 100. Influenza = Numerador: nº de doses de vacina Influenza na população de 6 meses < 5 anos de idade. Denominador: população 6 meses < 5anos idade. Fator de multiplicação: 100. Passo 2: calcular a proporção de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas: Numerador: número de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas, de acordo com as normas do PNI. Denominador: total de vacinas do Calendário Básico de Vacinação da Criança. Fator de multiplicação: 100. |
|
- Em menores de um ano de idade: a) BCG-ID ³90%; b) Vacina Oral de Rotavírus Humano (VORH) ³90%; c) Pentavalente (DTHib HepB) ³95%; d) Vacina contra Poliomielite ³95% (no segundo semestre de 2012, o esquema vacinal passou a utilizar a vacina inativada poliomielite para a 1ª dose (2 meses) epara a 2ª dose (4 meses) e a vacina oral poliomielite para a 3ª dose (6 meses), com reforço aos 15 meses). e) Pneumocócica Conjugada (PnC10v) ³95%; f) Vacina Meningocócica Conjugada C (MnC) ³95%; e g) Vacina Febre Amarela =100%. - Em crianças de um ano de idade: a) Vacina tríplice viral ³95%; e b) Vacina tetra viral ³95%. - Em crianças de 6 meses a <5 anos de idade (CV em campanha anual): Influenza (INF) ³ 80%. Considerar o mês de agosto para avaliação da cobertura vacinal da influenza para o ano em curso. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 5 - Proporção de análises realizadas para o parâmetro Coliformes Totais em água para consumo humano
Denominador: total de amostras obrigatórias para o parâmetro coliformes totais. Fator de multiplicação: 100. |
|
Nesse sentido, orienta-se que o responsável pela vigilância da qualidade da água para consumo humano colete as amostras de água e envie para análise no laboratório de referência. Posteriormente, o responsável pela vigilância deverá inserir os resultados no Sistema de Informação de Vigilância da Qualidade da Água para Consumo Humano (Sisagua). O indicador permite avaliar a eficiência do processo de tratamento, bem como a integridade do sistema de distribuição e canalização. Vale salientar que para as fontes de água utilizadas para consumo humano e que não possuem tratamento, quando detectada a presença de coliformes totais e, tendo em vista a avaliação do atendimento ao padrão microbiológico da água para consumo humano, ressalta-se a necessidade de análise para verificação da presença de Escherichia coli (E. coli). Quando confirmada a positividade para E. coli, medidas corretivas devem ser adotadas, junto ao responsável pelo abastecimento de água ou à população, para garantir que a água atenda os valores de referências estabelecidos pela Portaria nº 2.914/GM/MS ,de 2011. - O número de análises obrigatórias para o parâmetro coliformes totais está previsto na Diretriz Nacional de Vigilância da Qualidade da Água para Consumo Humano, disponível no site da SVS, no seguinte endereço: http://u.saude.gov.br/images/pdf/2014/maio/30/Diretriz-Nacional-do-Plano-de-amostragem-da-Vigilancia-da-qualidade-da-agua-para- consumo-humano.pdf |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 6 - Número de semanas epidemiológicas com informações no Sinan.
- Permite que as três esferas de gestão do SUS possam responder oportunamente às mudanças na situação epidemiológica, com base em relatórios, recomendações einformações públicas para toda a rede de serviços de saúde, levando a medidas de intervenção adequadas. |
|
- A presença dessas informações indica que a vigilância em saúde local está ativa no monitoramento de doenças de notificação compulsória e, no caso de ausência de casos naquela semana, notifica negativamente às demais esferas. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 7 - Proporção de casos de doenças de notificação compulsória imediata (DNCI) encerrados em até 60 (sessenta) dias após notificação.
Denominador: total de registros de DNCI, por unidade de residência, notificados no período da avaliação. Fator de multiplicação: 100. |
|
Antraz pneumônico, Arenavírus, Botulismo, Cólera, Dengue (óbitos), Ebola, Eventos adversos graves ou óbitos pós-vacinação, Febre amarela, Febre de chikungunya, Febre do niloocidental e outras arboviroses de importância em saúde pública, Febre maculosa e outras riquetisioses, Febre purpúrica brasileira, Influenza humana produzida por novo subtipo viral, Lassa, Malária na região extra Amazônica, Marburg, Síndrome da Paralisia Flácida Aguda, Peste, Raiva humana, Rubéola, Sarampo, Síndrome da rubéola congênita, Síndrome respiratória aguda grave associada a coronavírus, Tularemia e Varíola. - Município que não possui registro no Sinan de, pelo menos, uma das doenças de notificação imediata citadas, no ano de análise, não pontua para o PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 8 - Proporção de casos de malária que iniciaram tratamento em até 48h a partir do início dos sintomas.
- Orienta o planejamento das ações para garantir acesso oportuno ao diagnóstico e tratamento de malária. |
|
Denominador: número total de casos de malária sintomáticos por local de notificação, excluídas Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado. Fator de multiplicação: 100. Para processamento dos dados no Sivep-Malária, utilizar os dados disponíveis na base NOTIPOXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: NOTIPO14.dbf); contar número de registros, agrupados por Município (MUN_NOT) ou por unidade da federação (UF_NOT), sendo ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, calcular o percentual de registros com intervalo menor ou igual a 2 dias (48h) em relação ao total de registros selecionados. Para processamento dos dados no Sinan, utilizar os dados disponíveis na base MALANXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: MALAN14.dbf). Contar número de registros, agrupados por Município (ID_MUNICIP) ou por unidade da federação (SG_UF_NOT), sendo AT_LAMINA ? 3 e AT_SINTOMA = 1. Para cada registro criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRATA menos DT_SIN_PRI). Em seguida calcular o percentual de registros com intervalo menor ou igual a 2 dias em relação ao total de registros selecionados. |
|
Sistema de Informação de Agravos de Notificação (Sinan), para os demais Estados. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEV E-mail: dagvs@saude.gov.br |
Indicador 9 - Número de ciclos que atingiram mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados para controle vetorial da dengue.
Numerador: número de imóveis visitados em cada um dos ciclos de visitas domiciliares de rotina para o controle da dengue. Denominador: número de imóveis da base do Reconhecimento Geográfico (RG) atualizado. Fator de multiplicação: 100. 2º passo - Soma do número de ciclos com mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados. |
|
Sistema de Informação do Programa Nacional de Controle da Dengue (SISPNCD). Sistema próprio do Estado ou Município. OBS.: Os Municípios possuem, em âmbito local, os dados referentes ao indicador aqui tratado, registrados no SISFAD, ou no SISPNCD, ou em planilhaseletrônicas próprias, formatadas para a identificação das visitas domiciliares realizadas, por ciclo. A consolidação nacional desses dados, sempre que necessária, será feita por meio de planilha do excel, preenchida pelas SES, com base nos dados levantados junto aos Municípios, e enviada ao Programa Nacional de Controle da Dengue via Formsus. |
|
- O método de cálculo deverá ser aplicado em cada ciclo para verificação da cobertura dos imóveis visitados. A cobertura mínima em cada ciclo deverá ser de 80% (oitenta por cento) dos imóveis. - Não deve ser considerada a média dos ciclos. - O Reconhecimento Geográfico (RG) deve ser atualizado de modo que o número de imóveis visitados não seja maior que o número de imóveis existentes, evitando coberturas acima de 100%. - Os imóveis visitados pelos Agentes Comunitários de Saúde (ACS) e, posteriormente, pelos Agentes de Controle de Endemias (ACE), a título de complementação, deverão ser registrados apenas como uma única vez. - O Município classificado como "Não infestado", em decorrência da pesquisa entomológica, não é obrigado a realizar visitas domiciliares para controle da dengue. Ele desenvolve outras ações de vigilância. Nesse caso, pontua no PQA-VS. Mas, se o Município nessa situação apresentar registro autóctone da doença no Sinan será considerado "Infestado" e deverá realizar as visitas domiciliares, conforme preconizado, para pontuar no PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 10 - Proporção de contatos intradomiciliares de casos novos de hanseníase examinados.
Denominador: total de contatos intradomiciliares dos casos novos de hanseníase registrados, por local de residência atual e diagnosticados nos anos das coortes - Paucibacilar e Multibacilar. Fator de multiplicação: 100. Processar os dados no TABWIN, de acordo com os seguintes passos: 1º passo - Tabulação Paucibacilar |
||
Modo Entrada: Caso Novo Tipo de Saída: Marcar todos exceto ERRO DE DIAGNÓSTICO e TRANSFERÊNCIAS 1 Class Oper Atual: PAUCIBACILAR (PB) |
||
Contato Examinado |
||
Suprimir Colunas Zeradas |
||
Modo Entrada: Caso Novo Tipo de Saída: Marcar todos exceto ERRO DEDIAGNÓSTICO e TRANSFERÊNCIAS Class Oper Atual: MULTIBACILAR (MB) Esq TeraAtual: PQT/MB/12 DOSES |
||
Altere o nome da coluna "Contato Registrado" clicando com o lado direito do mouse no título e adicione MB e ano diagnóstico selecionado (ex. Contato Registrado MB 2012). Repita a mesma ação para "Contato Examinado". Salvar como "Coorte contatos MB" para uso no 3º passo 3º Passo - Soma dos resultados obtidos nos passos anteriores: Numerador: número de contatos Paucibacilares Examinados Número de contatos Multibacilares Examinados. Denominador: número de contatos Paucibacilares Registrados Número de contatos Multibacilares registrados. Com a tabela de Coorte Contatos MB aberta no Tabwin, clique no Menu Arquivo INCLUIR TABELA, localizar a tabela "coorte contatos PB", salva anteriormente, e fazer a inclusão. No Menu OPERAÇÕES, clique em SOMAR e selecione com a tecla Ctrl e mouse os Contatos Registrados PB e Contatos Registrados MB e clique em OK, será criada uma nova coluna SOMA. Para renomear a coluna clique em cima do título com lado direito do mouse e altere o nome para Contatos Registrados PB MB, repita a mesma operação para Contatos Examinados PB MB. No Menu QUADRO, em ELIMINAR COLUNA, selecione todas exceto Contatos Registrados PB MB e Contatos Examinados PB MB. 4º passo - Cálculo do indicador: Proporção de contatos intradomiciliares de casos novos de hanseníase nos anos das coortes, examinados. Para realizar o cálculo, clique em CALCULAR INDICADOR no Menu OPERAÇÕES e selecione: Numerador: Contatos Examinados PB MB Denominador: Contatos Registrados PB MB Escala por: 100 Casas decimais: 1 Título da coluna: Altere para % de Contatos Examinados PB MB |
||
- Para fins operacionais, considera-se contato intradomiciliar toda e qualquer pessoa que resida ou tenha residido com o doente de hanseníase nos últimos cinco anos. - O exame dos contatos consiste no exame dermatoneurológico de todos os contatos intradomiciliares dos casos novos detectados, independentemente da classificação operacionale do repasse de orientações sobre período de incubação, transmissão e sinais e sintomas precoces da hanseníase. - A vacina BCG-ID (Bacilo de Calmette-Guërin) deverá ser aplicada nos contatos intradomiciliares sem presença de sinais e sintomas de hanseníase no momento da avaliação, independentemente de serem contatos de casos Paucibacilares (PB) ou Multibacilares (MB). - A aplicação da vacina BCG depende da história vacinal e segue as recomendações da normatização vigente. - A avaliação dos contatos intradomiciliares de casos novos de hanseníase diagnosticados nos anos das coortes foi adotada por considerar que o período de tratamento é também o tempo em que as equipes de saúde dispõem para examinar os contatos intradomiciliares dos casos novos de hanseníase. - As coortes são compostas de contatos intradomiciliares dos casos novos Paucibacilares, diagnosticados no ano anterior ao da avaliação e de contatos intradomiciliares dos casos novos Multibacilares diagnosticados dois anos antes à avaliação, semelhante às coortes para a avaliação da cura. Por exemplo: para a avaliação dos contatos examinados de 2014 será considerado os casos novos PB diagnosticados no ano de 2013 e os casos novos MB diagnosticados em 2012. - Ressalta-se que continua fundamental o empenho das equipes de saúde para que a vigilância dos contatos seja realizada oportunamente. - Para os Municípios que apresentaram casos novos de hanseníase no período da análise e que não registraram contatos, a meta deste indicador será considerada como não cumprida. - Município que não possui registro de casos novos de hanseníase nos anos das coortes no Sinan, entre residentes de seu território, não pontua para o PQA-VS. |
||
Departamento de Vigilância de Doenças Transmissíveis - DEVIT E-mail: dagvs@saude.gov.br |
||
Indicador 11 - Proporção de contatos de casos novos de tuberculose pulmonar bacilífera examinados.
Denominador: número de contatos registrados dos casos novos pulmonares bacilíferos, no período e local de residência avaliado. Fator de multiplicação: 100. |
|
Contatos menores de cinco anos, pessoas com HIV-aids e portadores de condições de alto risco devem ser considerados prioritários no processo de avaliação de contatos e tratamento 2. O controle de contato deve ser realizado, fundamentalmente, pela atenção primária. Para os Municípios que apresentaram caso novo de tuberculose pulmonar bacilífera no período da análise e que não registraram contatos, a meta deste indicador será considerada como não cumprida. Município que não possui registro, no Sinan, de casos novos pulmonares bacilíferos de residentes em seu território, não pontua para o PQA-VS. 1 WHO. Implementing the WHO StoTB strategy: a handbook for national tuberculosis control programmes. Geneva, 2008. 2 BRASIL. Manual de recomendações para o controle da tuberculose no Brasil. Ministério da Saúde, Secretaria de Vigilância em Saúde. - Brasília: Ministério da Saúde, 2011. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 12 - Número de testes de sífilis por gestante.
Denominador: número de partos hospitalares do SUS, por ano e Município de residência da gestante. Observações:1 . para o numerador considerar a quantidade aprovada, por município de residência, os seguintes procedimentos ambulatoriais: 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE;0214010082 TESTE RAPIDO PARA SIFILIS EM GESTANTE. 2. para o denominador considerar o total de AIH aprovadas de gestantes, por Município de residência, nos seguintes procedimentos: 0310010039 PARTO NORMAL; 0310010047 PARTO NORMAL EM GESTACAO DE ALTO RISCO; 0411010026 PARTO CESARIANO EM GESTACAO DE ALTO RISCO; 0411010034 PARTO CESARIANO; e, 0411010042 PARTO CESARIANO C/ LAQUEADURA TUBARIA. |
|
Denominador: Sistema de Informações Hospitalares do SUS (SIH/SUS). |
|
- Desde janeiro de 2014, foi adotado o Boletim de Procedimentos Ambulatoriais Individualizado (BPA-i), no SIA-SUS, para o procedimento 0202031179 VDRL P/ DETECCAO DE SÍFILIS EM GESTANTE, o que passou a permitir o registro do Município de residência da gestante. - Para o processamento "ano", considerar o período de janeiro a dezembro. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 13 - Número de testes de HIV realizado.
Observação: Considerar a "quantidade aprovada" dos seguintes procedimentos ambulatoriais: 0202030296 PESQUISA DE ANTICORPOS ANTI-HIV-1 (WESTERN BLOT); 0202030300 PESQUISA DE ANTICORPOS ANTI-HIV-1 HIV-2 (ELISA); 0202031020 PESQUISA DE HIV-1 POR IMUNOFLUORESCENCIA; 0214010040 TESTE RAPIDO PARA DETECCAO DE HIV EM GESTANTE; e, 0214010058 TESTE RÁPIDO PARA DETECÇÃO DE INFECÇÃO PELO HIV. |
|
- Os testes rápidos de HIV são comprados e disponibilizados pelo Ministério da saúde; os insumos para os demais exames são adquiridos por Estadose Municípios. - Todas as unidades de saúde do SUS estão aptas a solicitar o teste de HIV e sua realização pode ser feita em qualquer laboratório do sistema e da rede privada. - Para o processamento "ano", considerar o período de janeiro a dezembro. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 14 - Proporção de preenchimento do campo "ocupação" nas notificações de agravos e doenças relacionados ao trabalho.
Denominador: número total de casos de agravos e doenças relacionados ao trabalho notificados, em determinado ano e local de residência do caso. Fator de multiplicação: 100. |
|
a) acidente com exposição a material biológico relacionado ao trabalho; b) acidente de trabalho grave (graves, fatais e em crianças e adolescentes); c) câncer relacionado ao trabalho; d) dermatoses ocupacionais; e) lesão por esforço repetitivo/distúrbios osteomusculares relacionados ao trabalho (LER/DORT); f) perda auditiva induzida por ruído - PAIR relacionada ao trabalho; g) pneumoconioses relacionadas ao trabalho; h) transtornos mentais relacionados ao trabalho; e i) intoxicação exógena relacionada ao trabalho. Município que não possui registro de notificação de agravos e doenças relacionados ao trabalho em seu território, no Sinan, não pontua para o PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Caderno de Metas e Indicadores do Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS) a partir de 2018
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 1 - Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência.
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência. |
| Relevância do Indicador | - As informações de mortalidade do SIM são cada vez mais utilizadas para a formulação de políticas públicas e monitoramento de eventos estratégicos (mortalidade infantil, fetal, materna e mulheres em idade fértil), nas esferas federal, estadual e municipal. Por esse motivo, a oportunidade da notificação é fundamental. |
| Método de Cálculo | Numerador: Total de óbitos notificados até 60 dias após o final do mês de ocorrência, por local de residência.Denominador: Total de óbitos esperados (estimados).Fator de multiplicação: 100. |
| Fonte | Sistema de Informações sobre Mortalidade (SIM). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no SIM dos registros de óbito deve ser feita de forma regular e constante durante todo o ano.- Dentre todos os óbitos, a alimentação no SIM dos óbitos fetais, infantis e maternos deve ser priorizada, conforme preconizado na Portaria de Consolidação nº 1/GM/MS, de 28 de setembro de 2017, Capítulo VI, Seção I, Artigo nº 402 e Artigo nº 413. |
| - Quanto ao número de óbitos esperados, serão utilizados os mesmos parâmetros da Portaria nº 47/SVS/MS, de 03 de maio de 2016, adaptados para o contexto do PQA-VS. Assim, o método será aplicado a todos os municípios, inclusive para os menores de 30.000 habitantes.- Os municípios novos, bem como aqueles dos quais esses se desmembraram, deverão receber um tratamento provisório no monitoramento deste indicador, durante 4 | |
| (quatro) anos, a contar da data de instalação de fato (separação administrativa), para viabilizar a construção de série histórica, que permita estimar os volumes esperados de óbitos de seus residentes.- A Secretaria de Vigilância em Saúde disponibiliza o número de óbitos esperados por município no seguinte endereço: http://svs.aids.gov.br/cgiae/sim/ no item documentação. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 2 - Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência. |
| Relevância do Indicador | - As informações dos nascimentos do Sinasc são cada vez mais utilizadas para a formulação de políticas públicas e monitoramento de eventos estratégicos (como número de consultas de pré-natal, percentual de cesáreas desnecessárias), nas esferas federal, estadual e municipal. Por esse motivo, a oportunidade da notificação é fundamental. |
| Método de Cálculo | Numerador: Total de nascidos vivos notificados no Sinasc até 60 dias após o final do mês de ocorrência por local de residência.Denominador: Total de nascidos vivos esperados (estimados).Fator de multiplicação: 100. |
| Fonte | Sistema de Informações sobre Nascidos Vivos (Sinasc). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no Sinasc dos registros de nascimento deve ser feita de forma regular e constante durante todo o ano.- Quanto ao número de nascidos vivos esperados, serão utilizados os mesmos parâmetros da Portaria nº 47/SVS/MS, de 03 de maio de 2016, adaptados para o contexto do PQA-VS. Assim, o método será aplicado a todos os municípios, inclusive para os menores de 30.000 habitantes.- O Ministério da Saúde emitirá anualmente Nota Técnica, apontando: a) em que estrato se enquadra cada município para as finalidades que preconizam os incisos I e |
| II acima; e b) toda a memória de cálculo do número de nascimentos esperados por ano e por mês, por município.- Os municípios novos, bem como aqueles dos quais esses se desmembraram, deverão receber um tratamento provisório no monitoramento deste indicador, durante 4 (quatro) anos, a contar da data de instalação de fato (separação administrativa), para viabilizar a construção de série histórica, que permita estimar os volumes esperados de óbitos de seus residentes. | |
| - A Secretaria de Vigilância em Saúde irá disponibilizar o número de nascidos vivos esperados por município no seguinte endereço: http://svs.aids.gov.br/cgiae/sinasc/ no item documentação. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 3 - Proporção de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 80% de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. |
| Relevância do Indicador | - Permite monitorar a quantidade de salas de vacina do município que alimentam o sistema de informação de dados individualizados por residência regularmente (mensalmente), como fonte de informação dos dados de vacinação, para análise mais precisa dos dados de cobertura vacinal e controle da movimentação dos imunobiológicos. |
| Método de Cálculo | Numerador: Número de salas de vacina do município com alimentação mensal, no sistema de informação de dados individualizados por residência, das doses de vacinas aplicadas e da movimentação dos imunobiológicos (Registro do Vacinado / Movimentação de Imunobiológico).Denominador: Número de salas de vacina ativas no município, constantes do cadastro do sistema de informação do PNI, no período avaliado.Fator de multiplicação: 100. |
| Fonte | Sistema oficial de informação do Programa Nacional de Imunizações (Relatórios/Gestão da Informação, com dados individualizados por residência, e movimentação de imunobiológicos). |
| Periodicidade dos dados para monitoramento e avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Recomenda-se que a alimentação do sistema de informação seja feita na sala de vacina. Caso não seja possível, poderá ser realizada em outro setor da própria Unidade de Saúde, onde estiver localizada a sala de vacina, ou na sede da Secretaria Municipal de Saúde, caso não haja condições na Unidade de Saúde.- Os dados para a avaliação desse indicador levarão em conta o quantitativo de salas de vacinas existentes no Cadastro do Sistema de Informação do Programa Nacional de Imunizações (SIPNI). |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 4: Proporção de vacinas selecionadas que compõem o Calendário Nacional de Vacinação para crianças menores de 1 ano de idade (Pentavalente - 3ª dose, Poliomielite - 3ª dose, Pneumocócica 10 valente - 2ª dose) e para crianças de 1 ano de idade (tríplice viral - 1ª dose) - com coberturas vacinais preconizadas. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 1 ano de idade - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) - e para crianças de 1 ano de idade - Tríplice viral (1ª dose). |
| Relevância do Indicador | Estimular a vigilância das coberturas vacinais, com objetivo de manter altas coberturas e realização de ações que proporcione o alcance dessas metas, com intuito de manter a população protegida de doenças imunopreveníveis pelas seguintes vacinas:Pentavalente, que previne a difteria, tétano, coqueluche (DTP) e infecções por Haemophilus influenza tipo B e hepatite B, e é utilizada como indicador para comparação em âmbito internacional devido ao componente DTP; |
| Pneumocócica 10-valente, que previne as infecções causadas pelo pneumococo, responsável por doenças com elevadas cargas de morbidade e mortalidade;Poliomielite, para a prevenção da doença do mesmo nome, em fase de erradicação global; e,Tríplice viral, para a prevenção do sarampo e rubéola, doenças com compromisso de eliminação na região das Américas. | |
| Método de Cálculo | Numerador: Total das vacinas selecionadas que alcançaram a cobertura vacinal preconizada.Denominador: 4 vacinas selecionadas - Pentavalente, Pneumocócica 10-valente, Poliomielite e Tríplice viral.Fator de multiplicação: 100. |
| Fontes | Numerador: Sistema oficial de informação do Programa Nacional de Imunizações (Sipni).Denominador: Sistema de Informação de Nascidos Vivos (Sinasc). |
| Periodicidade dos dados para monitoramento e avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A idade adequada para aplicação de cada vacina selecionada obedecerá ao Calendário Nacional de Vacinação, publicado pelo Ministério da Saúde nos termos da Lei nº 6.259, de 30 de outubro de 1975, regulamentada pelo Decreto nº 78.231, de 12 de agosto de 1976, atualizado por notas informativas específicas. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 5 - Percentual de amostras analisadas para o residual de agente desinfetante em água para consumo humano (parâmetro: cloro residual livre, cloro residual combinado ou dióxido de cloro). (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante. |
| Relevância do Indicador | - Permite avaliar a implementação do monitoramento do teor de residual desinfetante na água utilizada para consumo humano, o que possibilita avaliar o atendimento do teor mínimo exigido para evitar a recontaminação da água tratada. |
| Método de Cálculo | Numerador: Número de amostras de água analisadas para o residual de agente desinfetante - RAD (parâmetros: cloro residual livre, cloro residual combinado ou dióxido de cloro).Denominador: Total de amostras obrigatórias para o RAD.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Vigilância da Qualidade da Água para Consumo Humano (Sisagua). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A verificação do quantitativo de amostras analisadas para RAD permite avaliar se o monitoramento dos parâmetros está sendo realizado conforme preconizado na Diretriz Nacional do Plano de Amostragem do Vigiagua.- A aplicação de agente desinfetante para inativação de organismos patogênicos é uma exigência da norma de potabilidade brasileira, que prevê, ainda, a necessidade |
| de manutenção de teor mínimo de residual de desinfetante em toda a extensão da rede de distribuição para prevenir uma possível recontaminação.- Os produtos químicos derivados de cloro são os mais empregados, em virtude do poder de manutenção de um residual desinfetante na água do sistema de distribuição. A Portaria de Consolidação nº 5/GM/MS, de 28 de setembro de 2017, Anexo XX, em seu Artigo 34, determina a manutenção de teor mínimo de cloro residual livre, cloro residual combinado ou de dióxido de cloro em toda a extensão do sistema de distribuição (reservatórios e rede).- Em função da fácil degradação das formas de cloro na água, a análise do residual do agente desinfetante deve ser realizada em campo, logo após a coleta, de forma a | |
| garantir um resultado mais fidedigno.- Quando verificado o não atendimento aos valores de referências preconizados na Portaria de Consolidação nº 5/GM/MS, de 28 de setembro de 2017, Anexo XX, na sua integralidade, medidas corretivas devem ser adotadas pelo responsável pelo abastecimento de água, para garantir o cumprimento dos valores de referências estabelecidos na portaria.- O número de análises obrigatórias para os parâmetros que medem os residuais de agentes desinfetantes está previsto na Diretriz Nacional de Vigilância da Qualidade | |
| da Água para Consumo Humano, disponível no site da SVS, no seguinte endereço:(http://portalarquivos.saude.gov.br/images/pdf/2016/junho/06/diretriz-nacional-plano-amostragem-agua.pdf)- O indicador refere-se ao quantitativo de análises de residual de agente desinfetante (RAD) para inferir sobre a qualidade da água consumida pela população. | |
| Todavia, para o planejamento adequado da amostragem, faz-se necessário que todas as formas de abastecimento existentes sejam identificadas e cadastradas no Sisagua, possibilitando avaliar as informações sobre o abastecimento de água de toda a população do município para o ano de referência. O percentual de cobertura de abastecimento é obtido a partir dos dados gerados pelo relatório de cobertura de abastecimento do Sisagua e calculado pela fórmula:% Pop.cadastrada= Pop.abast.SAA + Pop.abast.apenas SAC + Pop.abast.apenas SAI x 100 | |
| População município (IBGE)- A caracterização da forma de abastecimento de água para consumo humano, também auxilia: (i) a identificação de vulnerabilidades; (ii) a tomada de decisão dos gestores do SUS; e (iii) a elaboração de políticas públicas relacionadas ao tema. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 6 - Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias, a partir da data de notificação. |
| Relevância do Indicador | - Este indicador representa a capacidade de detecção de eventos de saúde pública e qualifica a informação, sendo relevante, pois envolve todos as doenças e agravos que são de notificação compulsória imediata nacional, cujas medidas de prevenção e controle estão previstas.- Permite avaliar e monitorar a capacidade de resolução das investigações de casos registrados e a atualização do Sinan. |
| Método de Cálculo | Numerador: Total de registros de DNCI, por unidade de residência, encerrados dentro de 60 dias a partir da data de notificação.Denominador: Total de registros de DNCI, por unidade de residência, notificados no período da avaliação.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Para este indicador, foram definidas, em virtude de sua magnitude e relevância, os seguintes eventos e doenças de notificação imediata nacional, listados na Portaria de Consolidação nº 4/GM/MS, de 28 de setembro de 2017, Anexo V, Capítulo I (págs. 341 e 342):Antraz pneumônico, Arenavírus, Botulismo, Cólera, Dengue (óbitos), Ebola, Febre amarela, Febre do Nilo ocidental e outras arboviroses de importância em saúde |
| pública, Febre maculosa e outras riquetisioses, Febre purpúrica brasileira, Hantavirose, Influenza humana produzida por novo subtipo viral, Lassa, Malária na região extra Amazônica, Marburg, Poliomielite por poliovírus selvagem, Peste, Óbito com suspeita de doença pelo vírus Zika, Óbito com suspeita de Febre de Chikungunya, Raiva humana, Rubéola, Sarampo, Síndrome de paralisia flácida aguda, Tularemia, Varíola e outras emergências de saúde pública.- É importante ressaltar que a Síndrome de Rubéola Congênita e a Síndrome Respiratória Aguda Grave por Coronavírus estão listadas na referida portaria, mas não | |
| terão seus dados processados na tabulação desse indicador, pelos motivos a seguir citados. No primeiro caso, o tempo de encerramento é de 180 dias, porque, para a confirmação ou descarte do caso suspeito pelo critério laboratorial, é necessário coletar a primeira amostra de espécimes clínicos para identificação viral no nascimento da criança e, depois, a segunda amostra, aos 6 meses de vida, com o objetivo de avaliar a excreção viral dessa criança. No segundo caso, essa síndrome é notificada ao CIEVS Nacional, através do Notifica, que utiliza e-mail ou formulário eletrônico Formsus e não por meio do Sinan. | |
| - As doenças listadas (DNCI) devem ser notificadas em 24 horas e registradas no Sinan no prazo de 7 dias.- No caso de epidemias de Dengue, Zika e Chinkungunya, a prioridade é investigar os óbitos, que são de notificação imediata.- Recomenda-se que os municípios alimentem regularmente a base de dados nacional, de acordo com as normativas vigentes, e que também utilizem seus dados locais, de forma a dar melhor visibilidade à dinâmica de seu quadro epidemiológico, em tempo oportuno, propiciando, quando necessária, a implementação de | |
| medidas de intervenção adequadas.Município que não possuir registro no Sinan de, pelo menos, uma das doenças de notificação imediata citadas, no ano de análise, não pontua para o PQA-VS. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 7 - Proporção de casos de malária que iniciaram tratamento em tempo oportuno. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para os casos importados). |
| Relevância do Indicador | - Permite avaliar a oportunidade da entrega de tratamento antimalárico, o que contribui para a redução da transmissão, morbidade e mortalidade pela doença.- Orienta o planejamento das ações para garantir acesso oportuno ao diagnóstico e tratamento de malária. |
| Método de Cálculo | Numerador: Número total de casos autóctones de malária, notificados em determinado município, sob tratamento em até 48 horas, após o início dos primeiros sintomas, somado ao número total de casos importados de malária, notificados em determinado município, sob tratamento em até 96 horas, após o início dos primeiros sintomas, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado.Denominador: Número total de casos de malária sintomáticos por local de notificação, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do |
| ano considerado.Fator de multiplicação: 100.Para processamento dos dados no Sivep-Malária, utilizar os dados disponíveis na base NOTIPOXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: NOTIPO14.dbf):Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE o mesmo município avaliado, ID_LVC = 2 e SINTOMAS = | |
| 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas).Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE diferente do município avaliado, sendo ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA | |
| menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados.Somar esses dois valores.Dividir pelo número total de registros, agrupados por município (MUN_NOT), sendo ID_LVC = 2 e SINTOMAS = 1.Para processamento dos dados no Sinan, utilizar os dados disponíveis na base MALANXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: MALAN14.dbf): | |
| Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF o mesmo município avaliado, AT_LAMINA ¹ 3 e AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRATA menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas).Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF diferente do município avaliado, AT_LAMINA¹3 e | |
| AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRATA menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados.Somar esses dois valores.Dividir pelo número total de registros, agrupados por município (ID_MUNICIP), sendo AT_LAMINA¹3 e AT_SINTOMA = 1. | |
| Fontes | Sistema de Informação de Vigilância Epidemiológica da Malária (Sivep-Malária), para Região Amazônica (estados da Região Norte, Maranhão e Mato Grosso).Sistema de Informação de Agravos de Notificação (Sinan), para os demais Estados. |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 30 de abril do ano posterior ao da avaliação. |
| Informações adicionais | Município que não possuir registro de notificação de casos de malária em seu território no Sivep-Malária ou no Sinan, de acordo com sua localização, não pontua para o PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 8 - Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 4 ciclos de visita domiciliar, dos 6 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. |
| Relevância do Indicador | Evidencia o conjunto de imóveis localizados em áreas infestadas pelo vetor e o quantitativo que realmente foi visitado pelos agentes de controle de endemias, preferencialmente em articulação com os agentes comunitários de saúde, em cada ciclo. |
| Método de Cálculo | 1º passo - Cobertura por cicloNumerador: número de imóveis visitados em cada um dos ciclos de visitas domiciliares de rotina para o controle das ArbovirosesDenominador: número de imóveis existentes na base do Reconhecimento Geográfico (RG) atualizado.Fator de multiplicação: 100.2º passo - Soma do número de ciclos com mínimo de 80% de cobertura de imóveis visitados. |
| Fontes | A consolidação nacional desses dados, será feita por meio de planilha de Excel, preenchida pelas SES, com base nos dados levantados junto aos municípios, e enviada ao Programa Nacional de Controle da Dengue via Formsus, ou por meio de formulário preenchido via Formsus.OBS.: Os municípios possuem, em âmbito local, os dados referentes ao indicador aqui tratado, registrados no SISPNCD, ou em planilhas eletrônicas próprias, formatadas para a identificação das visitas domiciliares realizadas, por ciclo. No entanto, a forma de envio para o nível central será conforme exposta acima. |
| Data para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Imóveis a serem trabalhados - As ações de controle vetorial da dengue devem ser realizadas, prioritariamente, em imóveis situados em áreas urbanas ou povoadas com características urbanas, de municípios que apresentem infestação domiciliar pelo Aedes aegypti, persistente, no mínimo, por 1 ano ou com histórico de transmissão. Opcionalmente, em grandes centros urbanos, as visitas de rotina a edifícios podem ser restritas à área comum e a apartamentos ao nível do solo.- O método de cálculo deverá ser aplicado em cada ciclo para verificação da cobertura dos imóveis visitados. A cobertura mínima em cada ciclo deverá ser de 80% |
| dos imóveis.- Não deve ser considerada a média dos ciclos.- O Reconhecimento Geográfico (RG) deve ser atualizado de modo que o número de imóveis visitados não seja maior que o número de imóveis existentes, evitando coberturas acima de 100%. | |
| - Os imóveis visitados pelos Agentes Comunitários de Saúde (ACS) e, posteriormente, pelos Agentes de Controle de Endemias (ACE), a título de complementação, deverão ser registrados apenas como uma única vez.- O município classificado como "Não infestado", em decorrência da pesquisa entomológica, não é obrigado a realizar visitas domiciliares para controle da dengue, pois desenvolve outras ações de vigilância. Nesse caso, pontua no PQA-VS. Mas, se o município nessa situação apresentar registro autóctone da doença no Sinan será considerado "Infestado" e deverá realizar as visitas domiciliares, conforme preconizado, para pontuar no PQA-VS. | |
| - Em decorrência do aumento dos casos de microcefalia foi decretado, ao final de 2015, estado de Emergência em Saúde Pública de Importância Nacional - ESPIN, o que ocasionou a intensificação das ações de controle de vetor, como consequência houve o aumento um ciclo de visitas, totalizando 7 ciclos preconizados para o ano de 2016. Com o fim da ESPIN, o número preconizado de ciclos segue o padrão comum recomendado de 6 ciclos. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 9 - Proporção de contatos examinados de casos novos de hanseníase diagnosticados nos anos das coortes. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 82% dos contatos dos casos novos de sanseníase, nos anos das coortes, examinados. | |
| Relevância do Indicador | - Mede a capacidade dos serviços em realizar a vigilância de contatos, de casos novos de hanseníase, para aumento da detecção precoce de casos novos e da interrupção da cadeia de transmissão. | |
| Método de Cálculo | Numerador: Número de contatos dos casos novos de hanseníase examinados, por local de residência atual e diagnosticados nos anos das coortes – Paucibacilar e Multibacilar. |
|
| Linha | UF Res Atual ou Mun Res AT | |
| Coluna | Não Ativa | |
| Incremento | Frequência | |
| Contato Registrado | ||
| Contato Examinado | ||
| Desmarcar: | Suprimir Linhas Zeradas | |
| Suprimir Colunas Zeradas | ||
| Seleções Disponíveis | Ano Diagnóstico: Subtrair 1 ao ano de avaliação | |
| Modo Entrada: Caso Novo | ||
| Tipo de Saída: Marcar todos exceto: Erro de DIAGÓSTICO e TRANSFERÊNCIAS 1 |
||
| Class Oper Atual: PAUCIBACILAR (PB) | ||
| Est Terap Atual: PQT/PB/6 DOSES | ||
| Não Classificados | Marcar: Ignorar | |
1 Para avaliação Municipal, desmarcar transferências para outros municípios, outros estados e outros países. Para avaliação regional, desmarcar transferências para outros municípios fora da regional correspondente, outros estados e outros países. |
||
| Linha | UF Res Atual ou Mun Res AT | |
| Coluna | Não Ativa | |
| Incremento | Frequência | |
| Contato Registrado | ||
| Contato Examinado | ||
| Desmarcar: | Suprimir Linhas Zeradas | |
| Suprimir Colunas Zeradas | ||
| Seleções Disponíveis | Ano Diagnóstico: subtrair 2 ao ano de avaliação (ex. se o ano da avaliação for 2018, selecionar o ano diagnóstico 2016) | |
| Modo Entrada: Caso Novo | ||
| Tipo de Saída: Marcar todos exceto: Erro de DIAGÓSTICO e TRANSFERÊNCIAS 1 |
||
| Class Oper Atual: MULTIBACILAR (MB) | ||
| Est Terap Atual: PQT/MB/12 DOSES | ||
| Não Classificados | Marcar: Ignorar | |
1 Para avaliação Municipal, desmarcar transferências para outros municípios, outros estados e outros países. Para avaliação regional, desmarcar transferências para outros municípios fora da regional correspondente, outros estados e outros países. |
||
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). | |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação. | |
| Informações adicionais | - A investigação epidemiológica dos contatos tem por finalidade a descoberta de casos novos entre aqueles que convivem ou conviveram com o doente e suas possíveis fontes de infecção.- Recomenda-se o exame dos contatos domiciliares e sociais (Portaria de Consolidação nº 2/GM/MS, de 28 de setembro de 2017, Anexo VI, Artigos 1º ao 3º). Entretanto, para o efeito de registro no Boletim de Acompanhamento e no Sinan, considerar os contatos domiciliares, que são todas as pessoas que residam ou | |
| tenham residido com o doente de hanseníase.- O exame dos contatos consiste no exame dermatoneurológico de todos os contatos dos casos novos detectados, independentemente da classificação operacional e na orientação quanto ao período de incubação, transmissão e sinais e sintomas precoces da hanseníase.- A vacina BCG-ID (Bacilo de Calmette-Guërin) deverá ser aplicada nos contatos sem presença de sinais e sintomas de hanseníase no momento da avaliação, independentemente de serem contatos de casos Paucibacilares (PB) ou Multibacilares (MB). | ||
| - A aplicação da vacina BCG depende da história vacinal e segue as recomendações da normatização vigente.- A avaliação dos contatos de casos novos de hanseníase diagnosticados nos anos das coortes foi adotada por considerar que o período de tratamento é também o tempo em que as equipes de saúde dispõem para examinar os contatos.- As coortes são compostas de contatos dos casos novos Paucibacilares, diagnosticados no ano anterior ao da avaliação, e de contatos dos casos novos Multibacilares, | ||
| diagnosticados dois anos antes à avaliação, semelhante às coortes para a avaliação da cura. Por exemplo: para a avaliação dos contatos examinados de 2018 será considerado os casos novos PB diagnosticados no ano de 2017 e os casos novos MB diagnosticados em 2016.- Ressalta-se a relevância do empenho das equipes de saúde para que a vigilância dos contatos seja realizada oportunamente.- Para os municípios que apresentaram casos novos de hanseníase no período da análise e que não registraram contatos, a meta deste indicador será considerada como | ||
| não cumprida.- Município que não possuir registro de casos novos de hanseníase nos anos das coortes no Sinan, entre residentes de seu território, não pontua para o PQA-VS. | ||
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Vigilância de Doenças Transmissíveis - DEVITE-mail: dagvs@saude.gov.br | |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 10 - Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados. |
| Relevância do Indicador | - Permite prevenir o adoecimento e diagnosticar precocemente caso de doença ativa nessa população1. |
| Método de Cálculo | Numerador: Número de contatos examinados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados.Denominador: Número de contatos registrados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação (dados parciais relativos ao ano da avaliação). |
| Informações adicionais | - Entende-se como contato toda pessoa que convive, no mesmo ambiente, com o caso índice, no momento do diagnóstico da TB. Esse convívio pode acontecer em casa ou em ambiente de trabalho, instituições de longa permanência, escola e outros.- Contatos menores de cinco anos, pessoas com HIV-aids e portadores de condições de alto risco devem ser considerados prioritários no processo de avaliação de contatos e tratamento1. |
| - O controle de contato deve ser realizado, fundamentalmente, pela atenção primária.- Para os municípios que não apresentaram casos novos de tuberculose pulmonar com confirmação laboratorial no período da análise, este indicador será considerado como não se aplica para efeito da avaliação de cumprimento de metas (ou seja, esse indicador não deverá ser considerado para o cálculo de cumprimento de metas).- Vale ressaltar a importância da identificação do caso suspeito, do diagnóstico da doença, da notificação do caso e do acompanhamento do paciente ao longo de todo | |
| tratamento, visando o desfecho cura e a obtenção da quebra de transmissão da doença.- Para os municípios que apresentaram caso de tuberculose pulmonar com confirmação laboratorial no período da análise e que não registraram contatos, a meta deste indicador deve ser considerada como não cumprida.1 BRASIL. Manual de recomendações para o controle da tuberculose no Brasil. Ministério da Saúde, Secretaria de Vigilância em Saúde. - Brasília: Ministério da Saúde, 2011. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 11 - Número de testes de sífilis por gestante. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 2 testes de sífilis por gestante. |
| Relevância do Indicador | - Como indicador de concentração, ajuda a expressar a qualidade do pré-natal, uma vez que a sífilis pode ser diagnosticada na gestante em dois momentos: durante a gestação e, também, durante o parto.- O tratamento da gestante reduz a probabilidade de transmissão vertical da sífilis e, consequentemente, a sífilis congênita. |
| Método de Cálculo | Numerador: Número de testes realizados para o diagnóstico da sífilis em gestantes, por ano e município de residência da gestante.Denominador: Número de partos hospitalares do SUS, por ano e município de residência da gestante.Observações:1. Para o numerador, considerar a quantidade aprovada, por município de residência, dos seguintes procedimentos ambulatoriais: |
| 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE;0214010082 TESTE RAPIDO PARA SIFILIS EM GESTANTE.2. Para o denominador, considerar o total de AIH aprovadas de gestantes, por município de residência, nos seguintes procedimentos:0310010039 PARTO NORMAL; | |
| 0310010047 PARTO NORMAL EM GESTACAO DE ALTO RISCO;0310010055 PARTO NORMAL EM CENTRO DE PARTO NORMAL (CPN);0411010026 PARTO CESARIANO EM GESTACAO DE ALTO RISCO;0411010034 PARTO CESARIANO; e, | |
| 0411010042 PARTO CESARIANO C/ LAQUEADURA TUBARIA. | |
| Fontes | Numerador: Sistema de Informações Ambulatoriais do SUS (SIA/SUS).Denominador: Sistema de Informações Hospitalares do SUS (SIH/SUS). |
| Dados para avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de maio do ano posterior ao da avaliação (dados parciais, no caso do denominador). |
| Informações adicionais | - Desde janeiro de 2014, foi adotado o Boletim de Procedimentos Ambulatoriais Individualizado (BPA-i), no SIA-SUS, para o procedimento 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE, o que passou a permitir o registro do município de residência da gestante.- Para o processamento "ano", considerar o período de janeiro a dezembro. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 12 - Número de testes de HIV realizado. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior. |
| Relevância do Indicador | - Permite avaliar a oportunidade do diagnóstico do HIV. |
| Método de Cálculo | Número de testes realizados para o diagnóstico de HIV, por ano e município de residência.Observação: Considerar a "quantidade aprovada" dos seguintes procedimentos ambulatoriais:0202030296 PESQUISA DE ANTICORPOS ANTI-HIV-1 (WESTERN BLOT);0202030300 PESQUISA DE ANTICORPOS ANTI-HIV-1 + HIV-2 (ELISA); |
| 0202031020 PESQUISA DE HIV-1 POR IMUNOFLUORESCENCIA;0214010040 TESTE RAPIDO PARA DETECCAO DE HIV EM GESTANTE; e,0214010058 TESTE RÁPIDO PARA DETECÇÃO DE INFECÇÃO PELO HIV. | |
| Fonte | Sistema de Informações Ambulatoriais (SIA/SUS). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação. |
| Informações adicionais | - O diagnóstico oportuno do HIV tem influência tanto na qualidade de vida das pessoas vivendo com HIV/aids, quanto na transmissão do vírus.- Os testes rápidos de HIV são comprados e disponibilizados pelo Ministério da saúde; os insumos para os demais exames são adquiridos por estados e municípios.- Todas as unidades de saúde do SUS estão aptas a solicitar o teste de HIV e sua realização pode ser feita em qualquer laboratório do sistema e da rede privada.- Para o processamento "ano", considerar o período de janeiro a dezembro |
| - Devem ser computados todos os testes realizados (testes rápidos e laboratoriais). | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 13 - Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido de acordo com o código da Classificação Brasileira de Ocupações (CBO). |
| Relevância do Indicador | - Identifica as ocupações que apresentam maiores incidências de agravos relacionados ao trabalho, possibilitando a definição de ações de promoção, prevenção, vigilância e assistência, de forma mais adequada. |
| Método de Cálculo para os Agravos | Numerador: Número de notificações de agravos com o campo "Ocupação" preenchido de acordo com o código da Classificação Brasileira de Ocupações (CBO) correspondente, na versão disponibilizada pelo Sinan, excluindo-se campo preenchido como ignorado, em determinado ano e local de notificação do caso.Denominador: Número total de casos de agravos relacionados ao trabalho notificados, em determinado ano e local de notificação.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para monitoramento e avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Relação de agravos:a. Acidente com exposição a material biológico relacionado ao trabalho;b. Acidente de trabalho grave (graves, fatais e em crianças e adolescentes);c. Intoxicação exógena relacionada ao Trabalho. |
| - Município que não possuir registro de notificação de agravos relacionados ao trabalho em seu território, no Sinan, não pontua para o PQA-VS.- A versão atualmente disponibilizada pelo Sinan corresponde à tabela oficial de Classificação Brasileira de Ocupações (CBO) 2002, adaptada pelo DATASUS. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 14 - Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. |
| Relevância do Indicador | - A violência é considerada uma questão de saúde pública mundial, o que torna necessária a ampliação de estratégias que interfiram nesse quadro. No Brasil, esse agravo representa a terceira causa de morte entre crianças de 0 a 9 anos de idade, passando a ocupar a primeira posição na população de 10 a 49 anos, decrescendo para a sexta posição entre os idosos (60 ou mais anos de idade). As vítimas, comumente, adquirem sequelas, permanentes ou não, que podem levar à incapacidade |
| para o trabalho ou para outras atividades rotineiras, ao absenteísmo, a custos com o pagamento de pensões e de tratamentos de saúde, configurando um importante problema de saúde pública. Nesse contexto, o Ministério da Saúde implementou o Sistema de Vigilância de Violências e Acidentes (VIVA/Sinan), como forma de sistematizar as informações sobre os casos de violências e permitir o cuidado intersetorial às vítimas. Dados gerados por esse sistema são demandados por vários setores do Ministério da Saúde e também por outros ministérios, bem como organizações não governamentais e imprensa. Desse modo, a qualidade dos dados é | |
| primordial para garantir uma análise fidedigna desse problema de saúde.- As características étnico-raciais de uma população constituem-se de variáveis de importância social e epidemiológica no estudo das análises de situação de saúde e, em especial, das desigualdades em saúde. Conhecê-las assume importância estratégica para a promoção da equidade no Sistema Único de Saúde (SUS), na qualidade dos serviços de saúde, na elaboração de políticas públicas e na identificação das doenças e agravos predominantes nos diferentes grupos que compõem a sociedade brasileira. Além disso, a informação "cor ou raça/etnia" possibilita ao SUS cumprir um de seus princípios fundamentais, a Equidade, ou seja, o compromisso de | |
| oferecer a todos os cidadãos e cidadãs um tratamento igualitário e, ao mesmo tempo, atender às necessidades que cada situação apresenta.- É um dado que pode orientar as intervenções nas populações específicas e o aprimoramento do campo raça/cor nos sistemas de informação de saúde, que é de responsabilidade dos trabalhadores e gestores dos serviços de saúde públicos e privados.- É fundamental a apropriação dos dados epidemiológicos pelos profissionais de saúde. Quer esses dados permaneçam nos serviços, quer sejam enviados aos diversos | |
| sistemas de informação, eles devem ser utilizados como instrumento capaz de indicar as ações necessárias para garantir a adequação da vigilância, da prevenção e da atenção dispensadas à saúde da população, respeitando-se as especificidades e fortalecendo a promoção da Cultura da Paz.- Sendo assim, é de suma importância melhorar a qualidade do preenchimento desses dados, em especial do campo raça/cor, que permite melhor caracterização da pessoa que sofreu violência. | |
| Método de Cálculo | Numerador: Total de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida, por município de notificação.Denominador: Total de casos notificados por município de notificação.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no VIVA/Sinan dos registros de notificações de violência interpessoal e autoprovocada deve ser feita de forma regular e constante durante todo o ano.- O objetivo desse indicador é melhorar a informação das notificações de violências e acidentes em sua totalidade, através do incentivo ao melhor preenchimento do |
| campo raça/cor e das demais variáveis.- Será considerada não válida a informação de raça/cor quando o campo estiver em branco ou com a opção "Ignorado".- Município que não possuir registro de notificação de violência interpessoal e autoprovocada em seu território, no VIVA/Sinan, não pontua para o PQA-VS. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
ANEXO C
METAS E INDICADORES PACTUADOS NO ÂMBITO DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (PQA-VS). (Origem: PRT MS/GM 2984/2016, Anexo 1)
Metas e Indicadores a partir do ano de 2017:
Municípios e Distrito Federal
1. Meta: 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência. Indicador: Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência.
2. Meta: 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência.
Indicador: Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência.
3. Meta: 80% de Salas de Vacina com alimentação mensal no SI-PNI, por município. Indicador: Proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por município.
4. Meta: 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose). Indicador: Proporção de vacinas selecionadas do Calendário Nacional de Vacinação para crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose) - com cobertura vacinal preconizada.
5. Meta: 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante. Indicador: Percentual de amostras analisadas para o Residual de Agente Desinfetante em água para consumo humano (cloro residual livre, cloro residual combinado ou dióxido de cloro).
6. Meta: 50 semanas epidemiológicas com, pelo menos, uma notificação (positiva, negativa ou de surto), no período de um ano.
Indicador: Número de semanas epidemiológicas com informações no Sinan.
7. Meta: 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias a partir da data de notificação. Indicador: Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação.
8. Meta: 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para os casos importados). Indicador: Proporção de casos de malária que iniciaram tratamento em tempo oportuno.
9. Meta: 4 ciclos, dos 7 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. Indicador: Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue.
10. Meta: 80% dos contatos dos casos novos de hanseníase, nos anos das coortes, examinados. Indicador: Proporção de contatos examinados de casos novos de hanseníase.
11. Meta: 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados. Indicador: Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial.
12. Meta: 2 testes de sífilis por gestante. Indicador: Número de testes de sífilis por gestante.
13. Meta: 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior. Indicador: Número de testes de HIV realizado.
14. Meta: 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido. Indicador: Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho.
15. Meta: 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. Indicador: Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida.
ANEXO CI
CADERNO DE METAS E INDICADORES DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (PQA-VS) (Origem: PRT MS/GM 2984/2016, Anexo 2)
Metas e Indicadores a partir do ano de 2017:
Indicador 1 - Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência.
| Meta | 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência |
| Relevância do Indicador | - As informações de mortalidade do SIM são cada vez mais utilizadas para a formulação de políticas públicas e monitoramento de eventos estratégicos (mortalidade infantil, fetal, materna e mulheres em idade fértil), nas esferas federal, estadual e municipal. Por esse motivo, a oportunidade da notificação é fundamental. |
| Método de Cálculo | Numerador: Total de óbitos notificados até 60 dias após o final do mês de ocorrência, por local de residência. Denominador: Total de óbitos esperados (estimados). Fator de Multiplicação: 100. |
| Fonte | Sistema de Informações sobre Mortalidade (SIM). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no SIM dos registros de óbito deve ser feita de forma regular e constante durante todo o ano. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 2 - Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência.
| Meta | 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência. |
| Relevância do Indicador | - As informações dos nascimentos do Sinasc são cada vez mais utilizadas para a formulação de políticas públicas e monitoramento de eventos estratégicos (como número de consultas de pré-natal, percentual de cesáreas desnecessárias), nas esferas federal, estadual e municipal. Por esse motivo, a oportunidade da notificação é fundamental. |
| Método de Cálculo | Numerador: Total de nascidos vivos notificados no Sinasc até 60 dias após o final do mês de ocorrência por local de residência. Denominador: Total de nascidos vivos esperados (estimados). Fator de Multiplicação: 100. |
| Fonte | Sistema de Informações sobre Nascidos Vivos (Sinasc). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação |
| Informações adicionais | - A alimentação no Sinasc dos registros de nascimento deve ser feita de forma regular e constante durante todo o ano. - Os parâmetros adotados para estipular o volume esperado de registros de nascidos vivos para os municípios serão definidos com base no desempenho de cada Secretaria Municipal, no que se refere à captação desses eventos nos últimos 3 (três) anos estatísticos encerrados e publicados, conforme os seguintes estratos: I - municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada adequada, terão o número de nascidos vivos esperados em cada mês calculado a partir do número de registros informados ao Sistema de Informação nos últimos 4 (quatro) anos, projetado por regressão linear simples para o ano em curso; II - municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada inadequada, terão o número de nascidos vivos esperados em cada mês calculado a partir da aplicação da Taxa Bruta de Natalidade considerada minimamente adequada (*) sobre a população estimada para o município no ano corrente e, na sua ausência, para o ano anterior, levando-se em conta também, para qualquer situação, os parâmetros adotados para corrigir (**), para fins de monitoramento, o volume de registros de nascidos vivos esperados por municípios no prazo de até 60 (sessenta) dias após o mês de ocorrência, calculados conforme definições a seguir: (*) Parâmetros mínimos de adequação da Taxas Brutas de Natalidade, segundo região e porte populacional: I - Para a Região Norte, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 14,2 em municípios menores de 50 mil habitantes, e 14,0 em municípios de 50 mil ou mais habitantes. II - Para a Região Nordeste, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 13,2 em municípios menores de 50 mil habitantes, e 12,8 em municípios de 50 mil ou mais habitantes. III - Para a Região Sudeste, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 10,5 em municípios menores de 50 mil habitantes, e 11,5 em municípios de 50 mil ou mais habitantes. IV - Para a Região Sul, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 10,0 em municípios menores de 50 mil habitantes, e 12,1 em municípios de 50 mil ou mais habitantes. V - Para a Região Centro-oeste, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 10,7 em municípios menores de 50 mil habitantes, e 13,8 em municípios de 50 mil ou mais habitantes. (**) Parâmetros adotados para corrigir, para fins de monitoramento, o volume de registros de nascidos vivos esperados por Municípios no prazo de até 60 (sessenta) dias após o mês de ocorrência, calculados conforme definições a seguir: I - Se a razão entre o número médio de nascidos vivos observados no triênio e o número de nascidos vivos esperados a partir da aplicação do parâmetro mínimo de adequação da Taxa Bruta de Natalidade sobre a população local for menor que 40%, o número de nascidos vivos esperados deve ser corrigido para 40% do que é projetado pela Taxa Bruta de Natalidade de adequação mínima. II - Se a razão entre o número médio de nascidos vivos observados no triênio e o número de nascidos vivos esperados a partir da aplicação do parâmetro mínimo de adequação da Taxa Bruta de Natalidade sobre a população local corresponder a um valor entre 40 e 89%, o número de nascidos vivos esperados deve ser acrescido de 10% do que é projetado pela Taxa Bruta de Natalidade de adequação mínima. III - Se razão entre o número médio de óbitos observados no triênio e o número de óbitos esperados a partir da aplicação do parâmetro mínimo de adequação da Taxa Bruta de Natalidade sobre a população local for maior ou igual a 90%, o número de nascidos vivos esperados deve ser aquele que é projetado pela Taxa Bruta de Natalidade de adequação mínima, sem correção. IV - Se o parâmetro para o cálculo do número esperado de nascidos vivos são os dados diretos do Sinasc, o número de nascidos vivos esperados deve ser aquele que é projetado pela regressão linear simples a partir da série histórica do sistema nos últimos 4 (quatro) anos, sem correção. V - Após a definição das metas anuais, feita pela aplicação dos critérios acima estabelecidos nos itens I a IV, deve-se compará-las com as metas do ano anterior, e todo município que apresente uma variação positiva entre um ano e outro de mais de 15% no número de nascidos vivos a serem coletados, a meta deve ser truncada em um aumento de 15%. - O Ministério da Saúde emitirá anualmente Nota Técnica, apontando: a) em que estrato se enquadra cada município para as finalidades que preconizam os incisos I e II acima; e b) toda a memória de cálculo do número de nascimentos esperados por ano e por mês, por município. - Os municípios novos, bem como aqueles dos quais esses se desmembraram, deverão receber um tratamento provisório no monitoramento deste indicador, durante 4 (quatro) anos, a contar da data de instalação de fato (separação administrativa), para viabilizar a construção de série histórica, que permita estimar os volumes esperados de óbitos de seus residentes. - A Secretaria de Vigilância em Saúde irá disponibilizar o número de nascidos vivos esperados por município no seguinte endereço: http://svs.aids.gov.br/cgiae/sinasc/ no item documentação |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 3 - Proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por município.
| Meta | 80% de Salas de Vacina com alimentação mensal no SI-PNI, por município |
| Relevância do Indicador | - Permite monitorar a quantidade de salas de vacinas do município utilizando o SI-PNI (Sistema de Informação nominal e por procedência do vacinado) regularmente como fonte de informação dos dados de vacinação, para análise mais precisa dos dados de cobertura vacinal. |
| Método de Cálculo | Numerador: Número de salas de vacina do município com alimentação mensal no SI-PNI. Denominador: Número de salas de vacinas do município constante do cadastro do SI-PNI em junho de 2012. Fator de multiplicação: 100. |
| Fonte | Sistema de Informação do Programa Nacional de Imunizações (SI-PNI). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação |
| Informações adicionais | - A alimentação do SI-PNI poderá ser realizada pela Unidade de Saúde onde estiver localizada a Sala de Vacina, não sendo necessária a instalação de e quipamento exclusivo para esse fim. - Em municípios até 10.000 habitantes, a alimentação do SI-PNI poderá ocorrer no nível central da Secretaria Municipal de Saúde, com a identificação das Salas de Vacinas correspondentes. - Os dados para a avaliação desse indicador levarão em conta o quantitativo de salas de vacinas existentes no Cadastro do Sistema de Informação de Avaliação do Programa Nacional de Imunizações (SIAPI) em junho de 2012, que subsidiou a elaboração da Portaria nº 2.363/GM/MS, de 2012. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 4 - Proporção de vacinas selecionadas do Calendário Nacional de Vacinação para crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose) - com cobertura vacinal preconizada.
| Meta | 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose). |
| Relevância do Indicador | As vacinas selecionadas estão voltadas para o controle de doenças de significativa importância, sendo fundamental a permanência de elevadas e homogêneas coberturas vacinais como estratégia para manter e ou avançar em relação à situação atual: - a vacina Pentavalente, que previne a difteria, tétano, coqueluche e infecções por Haemophilus influenzae tipo B e hepatite B; - a vacina Pneumocócica 10-valente, que previne as infecções causadas pelo pneumococo, responsável por doenças com elevadas cargas de morbidade e mortalidade; - a vacina poliomielite, para a prevenção da doença do mesmo nome, em fase de erradicação global; e, - a vacina tríplice viral, para a prevenção do sarampo e rubéola, doenças com compromisso de eliminação na região das Américas |
| Método de Cálculo | Numerador: Total das vacinas selecionadas que alcançaram a cobertura vacinal preconizada. Denominador: 4 vacinas selecionadas - Pentavalente, Pneumocócica 10-valente, Poliomielite e Tríplice viral. Fator de multiplicação: 100. |
| Fontes | Sistema de Informações do Programa Nacional de Imunizações (SIPNI) e Sistema de Informação de Nascidos Vivos (SINASC) |
| Dados para avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de abril do ano posterior ao da avaliação |
| Informações adicionais | A idade adequada para aplicação de cada vacina selecionada obedecerá ao Calendário Nacional de Vacinação atualizado e publicado pelo Ministério da Saúde nos termos da Lei nº 6.259, de 30 de outubro de 1975, regulamentada pelo Decreto nº 78.231, de 12 de agosto de 1976, bem como através de notas informativas |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 5 - Percentual de amostras analisadas para o Residual de Agente Desinfetante em água para consumo humano (cloro residual livre, cloro residual combinado ou dióxido de cloro).
| Meta | 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante |
| Relevância do Indicador | - Permite avaliar a eficácia do processo de desinfecção da água utilizada para consumo humano e da manutenção de teor mínimo para a inativação de organismos patogênicos |
| Método de Cálculo | Numerador: Número de amostras de água analisadas para o Residual de Agente Desinfetante (cloro residual livre, cloro residual combinado ou dióxido de cloro). Denominador: Total de amostras obrigatórias para o Residual de Agente Desinfetante (cloro residual livre, cloro residual combinado ou dióxido de cloro). Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Vigilância da Qualidade da Água pra Consumo Humano (Sisagua) |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A aplicação de agente desinfetante para inativação de organismos patogênicos é uma exigência da norma de potabilidade brasileira, que prevê, ainda, a necessidade de manutenção de teor mínimo de residual de desinfetante em toda a extensão da rede de distribuição para prevenir uma possível recontaminação. - O agente desinfetante tem a função de destruir ou inativar organismos patogênicos que possam estar presentes na água e, dessa forma, prevenir a propagação de doenças de veiculação hídrica. - Esse indicador possui importante papel para prevenção de agravos à saúde humana e seu monitoramento possibilita identificar situações nas quais a concentração encontra-se fora da faixa preconizada. - Os produtos químicos derivados de cloro são os mais empregados, em virtude do poder de manutenção de um residual desinfetante na água do sistema de distribuição. O Artigo 34 da Portaria n° 2.914/ GM/MS, de 2011, determina a manutenção de teor mínimo de cloro residual livre, cloro residual combinado ou de dióxido de cloro em toda a extensão do sistema de distribuição (reservatórios e rede). - Em função da fácil degradação das formas de cloro na água, a análise do residual do agente desinfetante deve ser realizada em campo logo após a coleta, de forma a garantir um resultado mais fidedigno. - Quando o não atendimento aos valores de referências preconizados na Portaria n° 2.914/ GM/MS, de 2011, for confirmado, medidas corretivas devem ser adotadas, junto ao responsável pelo abastecimento de água ou à população, para garantir que o cumprimento dos valores de referências estabelecidos na portaria. - O número de análises obrigatórias para os parâmetros que medem os residuais de agentes desinfetantes está previsto na Diretriz Nacional de Vigilância da Qualidade da Água para Consumo Humano, disponível no site da SVS, no seguinte endereço: (http://portalsaude.saude.gov.br/images/pdf/2016/junho/06/diretriz-nacional-plano-amostragem-agua.pdf) |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 6 - Número de semanas epidemiológicas com informações no Sinan.
| Meta | 50 semanas epidemiológicas com, pelo menos, uma notificação (positiva, negativa ou de surto), no período de um ano. |
| Relevância do Indicador | - Este indicador representa a atividade do sistema de vigilância de morbidades do país e complementa positivamente as obrigações previstas na Portaria nº 47/GM/MS, de 3 de maio de 2016 , que estabelece o bloqueio de recursos no caso de não ocorrer regularidade na alimentação. - Permite vigilância ativa de doenças e agravos de notificação compulsória, principalmente frente às situações de epidemias ou alteração do padrão epidemiológico. - Permite que as três esferas de gestão do SUS possam responder oportunamente às mudanças na situação epidemiológica, com base em relatórios, recomendações e informações públicas para toda a rede de serviços de saúde, levando a medidas de intervenção adequadas. |
| Método de Cálculo | Número de semanas epidemiológicas com, pelo menos, uma informação de notificação (positiva, negativa ou de surto) |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - O Sistema preconiza que deverá haver, pelo menos, uma informação de notificação (positiva, negativa ou surto) a cada semana epidemiológica, ao longo de todo o ano epidemiológico, totalizando 52 ou 53 semanas, de acordo com o ano. - A presença dessas informações indica que a vigilância em saúde local está ativa no monitoramento de doenças de notificação compulsória e, no caso de ausência de casos naquela semana, notifica negativamente às demais esferas |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 7 - Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação.
| Meta | 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias a partir da data de notificação |
| Relevância do Indicador | - Este indicador representa a capacidade de detecção de eventos de saúde pública e qualifica a informação, sendo relevante, pois envolve todos as doenças e agravos que são de notificação compulsória imediata nacional, cujas medidas de prevenção e controle estão previstas. - Permite avaliar e monitorar a capacidade de resolução das investigações de casos registrados e a atualização do Sinan. |
| Método de Cálculo | Numerador: Total de registros de DNCI, por unidade de residência, encerrados dentro de 60 dias a partir da data de notificação. Denominador: Total de registros de DNCI, por unidade de residência, notificados no período da avaliação. Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan) |
| Dados para avaliação | Sistema de Informação de Agravos de Notificação (Sinan) |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação |
| Informações adicionais | - Para este indicador, foram definidas, em virtude de sua magnitude e relevância, os seguintes eventos e doenças de notificação imediata nacional: Antraz pneumônico, Arenavírus, Botulismo, Cólera, Dengue (óbitos), Ebola, Febre amarela, Febre do Nilo ocidental e outras arboviroses deimportância em saúde pública, Febre maculosa e outras riquetisioses, Febre purpúrica brasileira, Hantavirose, Influenza humana produzida por novo subtipo viral, Lassa, Malária na região extra Amazônica, Marburg, Polimielite por poliovírus selvagem, Peste, Óbito com suspeita de doença pelo vírus Zika, Óbito com suspeita de Febre de Chikungunya, Raiva humana, Rubéola, Sarampo, Síndrome de Paralisia flácida aguda, Síndrome da rubéola congênita, Síndrome respiratória aguda grave associada a coronavírus, Tularemia, Varíola e outras emergências de saúde pública. - As doenças listadas (DNCI) devem ser notificadas em 24 horas e registradas no Sinan no prazo de 7 dias. - No caso de epidemias de Dengue, Zika e Chinkungunya, a prioridade é investigar os óbitos: apenas esses é que são de notificação imediata. - Município que não possuir registro no Sinan de, pelo menos, uma das doenças de notificação imediata citadas, no ano de análise, não pontua para o PQA-VS. |
Indicador 8 - Proporção de casos de malária que iniciaram tratamento em tempo oportuno.
| Meta | 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para os casos importados). |
| Relevância do Indicador | - Permite avaliar a oportunidade da entrega de tratamento antimalárico, o que contribui para a redução da transmissão, morbidade e mortalidade pela doença. - Orienta o planejamento das ações para garantir acesso oportuno ao diagnóstico e tratamento de malária. |
| Método de Cálculo | Numerador: Número total de casos autóctones de malária, notificados em determinado município, sob tratamento em até 48 horas, após o início dos primeiros sintomas, somado ao número total de casos importados de malária, notificados em determinado município, sob tratamento em até 96 horas, após o início dos primeiros sintomas, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado. Denominador: Número total de casos de malária sintomáticos por local de notificação, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado. Fator de multiplicação: 100. Para processamento dos dados no Sivep-Malária, utilizar os dados disponíveis na base NOTIPOXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: NOTIPO14.dbf): Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE o mesmo município avaliado, ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas). Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE diferente do município avaliado, sendo ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados. Somar esses dois valores. Dividir pelo número total de registros, agrupados por município (MUN_NOT), sendo ID_LVC = 2 e SINTOMAS = 1. Para processamento dos dados no Sinan, utilizar os dados disponíveis na base MALANXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: MALAN14.dbf): Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF o mesmo município avaliado, AT_LAMINA diferente 3 e AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRAT A menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas). Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF diferente do município avaliado, AT_LAMINA diferente 3 e AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRAT A menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados. Somar esses dois valores. Dividir pelo número total de registros, agrupados por município (ID_MUNICIP), sendo AT_LAMINA diferente 3 e AT_SINTOMA = 1 |
| Fontes | Sistema de Informação de Vigilância Epidemiológica da Malária (Sivep-Malária), para Região Amazônica (estados da Região Norte, Maranhão e Mato Grosso. Sistema de Informação de Agravos de Notificação (Sinan), para os demais Estados. |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 30 de abril do ano posterior ao da avaliação. |
| Informações adicionais | Município que não possuir registro de notificação de casos de malária em seu território no Sivep-Malária ou no Sinan, de acordo com sua localização, não pontua para o PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEV E-mail: dagvs@saude.gov.br |
Indicador 9 - Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue.
| Meta | 4 ciclos, dos 7 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. |
| Relevância do Indicador | - Evidencia o conjunto de imóveis localizados em áreas infestadas pelo vetor e o quantitativo que realmente foi visitado pelos agentes de controle de endemias, preferencialmente em articulação com os agentes comunitários de saúde, em cada ciclo. |
| Método de Cálculo | 1º passo - Cobertura por ciclo Numerador: Número de imóveis visitados em cada um dos ciclos de visitas domiciliares de rotina para o controle da dengue. Denominador: Número de imóveis da base do Reconhecimento Geográfico (RG) atualizado. Fator de multiplicação: 100. 2º passo - Soma do número de ciclos com mínimo de 80% de cobertura de imóveis visitados. |
| Fontes | Sistema Informatizado de Monitoramento da Presidência da República (SIM-PR). Sistema de Informação da Vigilância da Febre Amarela e Dengue (SISFAD). Sistema de Informação do Programa Nacional de Controle da Dengue (SISPNCD). Sistema próprio do estado ou município. OBS.: Os municípios possuem, em âmbito local, os dados referentes ao indicador aqui tratado, registrados no SISFAD, ou no SISPNCD, ou em planilhas eletrônicas próprias, formatadas para a identificação das visitas domiciliares realizadas, por ciclo. A consolidação nacional desses dados, sempre que necessária, será feita por meio de planilha do excel, preenchida pelas SES, com base nos dados levantados junto aos municípios, e enviada ao Programa Nacional de Controle da Dengue via Formsus. |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação. |
| Informações adicionais | - Imóveis a serem trabalhados - As ações de controle vetorial da dengue devem ser realizadas, prioritariamente, em imóveis situados em áreas urbanas ou povoadas com características urbanas, de municípios que apresentem infestação domiciliar pelo Aedes aegypti, persistente, no mínimo, por 1 ano ou com histórico de transmissão. Opcionalmente, em grandes centros urbanos, as visitas de rotina a edifícios podem ser restritas à área comum e a apartamentos ao nível do solo. - O método de cálculo deverá ser aplicado em cada ciclo para verificação da cobertura dos imóveis visitados. A cobertura mínima em cada ciclo deverá ser de 80% dos imóveis. - Não deve ser considerada a média dos ciclos. - O Reconhecimento Geográfico (RG) deve ser atualizado de modo que o número de imóveis visitados não seja maior que o número de imóveis existentes, evitando coberturas acima de 100%. - Os imóveis visitados pelos Agentes Comunitários de Saúde (ACS) e, posteriormente, pelos Agentes de Controle de Endemias (ACE), a título de complementação, deverão ser registrados apenas como uma única vez. - O município classificado como "Não infestado", em decorrência da pesquisa entomológica, não é obrigado a realizar visitas domiciliares para controle da dengue. Ele desenvolve outras ações de vigilância. Nesse caso, pontua no PQA-VS. Mas, se o município nessa situação apresentar registro autóctone da doença no Sinan será considerado "Infestado" e deverá realizar as visitas domiciliares, conforme preconizado, para pontuar no PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 10 - Proporção de contatos examinados de casos novos de hanseníase.
| Meta | 80% dos contatos dos casos novos de hanseníase, nos anos das coortes, examinados. |
| Relevância do Indicador | Mede a capacidade dos serviços em realizar a vigilância de contatos de casos novos de hanseníase para aumento da detecção oportuna de casos novos |
| Método de Cálculo | Numerador: Número de contatos dos casos novos de hanseníase examinados, por local de residência atual e diagnosticados nos anos das coortes - Paucibacilar e Multibacilar.
|
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação. |
| Informações adicionais | - A investigação epidemiológica tem por finalidade a descoberta de casos novos entre aqueles que convivem ou conviveram com o doente e suas possíveis fontes de infecção. - Recomenda-se o exame dos contatos domiciliares, de vizinhança e sociais. Entretanto, para o efeito de registro no Boletim de Acompanhamento e no Sinan, considerar os contatos domiciliares, que são todas as pessoas que residam ou tenham residido com o doente de hanseníase. - O exame dos contatos consiste no exame dermatoneurológico de todos os contatos dos casos novos detectados, independentemente da classificação operacional e do repasse de orientações sobre período de incubação, transmissão e sinais e sintomas precoces da hanseníase. - A vacina BCG-ID (Bacilo de Calmette-Guërin) deverá ser aplicada nos contatos sem presença de sinais e sintomas de hanseníase no momento da avaliação, independentemente de serem contatos de casos Paucibacilares (PB) ou Multibacilares (MB). - A aplicação da vacina BCG depende da história vacinal e segue as recomendações da normatização vigente. - A avaliação dos contatos de casos novos de hanseníase diagnosticados nos anos das coortes foi adotada por considerar que o período de tratamento é também o tempo em que as equipes de saúde dispõem para examinar os contatos dos casos novos de hanseníase. - As coortes são compostas de contatos dos casos novos Paucibacilares, diagnosticados no ano anterior ao da avaliação, e de contatos dos casos novos Multibacilares, diagnosticados dois anos antes à avaliação, semelhante às coortes para a avaliação da cura. Por exemplo: para a avaliação dos contatos examinados de 2017 será considerado os casos novos PB diagnosticados no ano de 2016 e os casos novos MB diagnosticados em 2015. - Ressalta-se a relevância do empenho das equipes de saúde para que a vigilância dos contatos seja realizada oportunamente. - Para os municípios que apresentaram casos novos de hanseníase no período da análise e que não registraram contatos, a meta deste indicador será considerada como não cumprida. - Município que não possuir registro de casos novos de hanseníase nos anos das coortes no Sinan, entre residentes de seu território, não pontua para o PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Vigilância de Doenças Transmissíveis - DEVIT E-mail: dagvs@saude.gov.br |
Indicador 11 - Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial.
| Meta | 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados. |
| Relevância do Indicador | - Permite prevenir o adoecimento e diagnosticar precocemente caso de doença ativa nessa população¹. |
| Método de Cálculo | Numerador: Número de contatos examinados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados. Denominador: Número de contatos registrados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados. Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação (dados parciais relativos ao ano da avaliação). |
| Informações adicionais | - Entende-se como contato toda pessoa que convive, no mesmo ambiente, com o caso índice, no momento do diagnóstico da TB. Esse convívio pode acontecer em casa ou em ambiente de trabalho, instituições de longa permanência, escola e outros. - Contatos menores de cinco anos, pessoas com HIV-aids e portadores de condições de alto risco devem ser considerados prioritários no processo de avaliaçãode contatos e tratamento1. - O controle de contato deve ser realizado, fundamentalmente, pela atenção primária. - Para os municípios que não apresentaram casos novos de tuberculose pulmonar com confirmação laboratorial no período da análise, este indicador será considerado como não se aplica para efeito da avaliação de cumprimento de metas (ou seja, esse indicador não deverá ser considerado para o cálculo de cumprimento de metas). - Vale ressaltar a importância da identificação do caso suspeito, do diagnóstico da doença, da notificação do caso e do acompanhamento do paciente ao longo de todo tratamento, visando o desfecho cura e a obtenção da quebra de transmissão da doença. - Para os municípios que apresentaram caso de tuberculose pulmonar com confirmação laboratorial no período da análise e que não registraram contatos, a meta deste indicador deve ser considerada como não cumprida. ¹BRASIL. Manual de recomendações para o controle da tuberculose no Brasil. Ministério da Saúde, Secretaria de Vigilância em Saúde. - Brasília: Ministério da Saúde, 2011. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 12 - Número de testes de sífilis por gestante.
| Meta | 2 testes de sífilis por gestante. |
| Relevância do Indicador | - Como indicador de concentração, ajuda a expressar a qualidade do pré-natal, uma vez que a sífilis pode ser diagnosticada na gestante em dois momentos: durante a gestação e, também, durante o parto. - O tratamento da gestante reduz a probabilidade de transmissão vertical da sífilis e, consequentemente, a sífilis congênita. |
| Método de Cálculo | Numerador: Número de testes realizados para o diagnóstico da sífilis em gestantes, por ano e município de residência da gestante. Denominador: Número de partos hospitalares do SUS, por ano e município de residência da gestante. Observações: 1. Para o numerador considerar a quantidade aprovada, por município de residência, dos seguintes procedimentos ambulatoriais: 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE; 0214010082 TESTE RAPIDO PARA SIFILIS EM GESTANTE. 2. Para o denominador considerar o total de AIH aprovadas de gestantes, por município de residência, nos seguintes procedimentos: 0310010039 PARTO NORMAL; 0310010047 PARTO NORMAL EM GESTACAO DE ALTO RISCO; 0310010055 PARTO NORMAL EM CENTRO DE PARTO NORMAL (CPN); 0411010026 PARTO CESARIANO EM GESTACAO DE ALTO RISCO; 0411010034 PARTO CESARIANO; e, 0411010042 PARTO CESARIANO C/ LAQUEADURA TUBARIA |
| Fontes | Numerador: Sistema de Informações Ambulatoriais do SUS (SIA/SUS). Denominador: Sistema de Informações Hospitalares do SUS (SIH/SUS). |
| Dados para avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de maio do ano posterior ao da avaliação (dados parciais, no caso do denominador). |
| Informações adicionais | - Desde janeiro de 2014, foi adotado o Boletim de Procedimentos Ambulatoriais Individualizado (BPA-i), no SIA-SUS, para o procedimento 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE, o que passou a permitir o registro do município de residência da gestante. - Para o processamento "ano", considerar o período de janeiro a dezembro. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 13 - Número de testes de HIV realizado
| Meta | 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior. |
| Relevância do Indicador | - Permite avaliar a oportunidade do diagnóstico do HIV. |
| Método de Cálculo | Número de testes realizados para o diagnóstico de HIV, por ano e município de residência. Observação: Considerar a "quantidade aprovada" dos seguintes procedimentos ambulatoriais: 0202030296 PESQUISA DE ANTICORPOS ANTI-HIV-1 (WESTERN BLOT); 0202030300 PESQUISA DE ANTICORPOS ANTI-HIV-1 + HIV-2 (ELISA); 0202031020 PESQUISA DE HIV-1 POR IMUNOFLUORESCENCIA; 0214010040 TESTE RAPIDO PARA DETECCAO DE HIV EM GESTANTE; e, 0214010058 TESTE RÁPIDO PARA DETECÇÃO DE INFECÇÃO PELO HIV. |
| Fonte | Sistema de Informações Ambulatoriais (SIA/SUS). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final 2014: 15 de maio de 2015. |
| Informações adicionais | - O diagnóstico oportuno do HIV tem influência tanto na qualidade de vida da pessoa vivendo com HIV/aids, quanto na transmissão do vírus. - Os testes rápidos de HIV são comprados e disponibilizados pelo Ministério da saúde; os insumos para os demais exames são adquiridos por estados e municípios. - Todas as unidades de saúde do SUS estão aptas a solicitar o teste de HIV e sua realização pode ser feita em qualquer laboratório do sistema e da rede privada. - Para o processamento "ano", considerar o período de janeiro a dezembro |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 14 - Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho.
| Meta | 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido. |
| Relevância do Indicador | - Identifica as ocupações que apresentam maiores incidências de agravos relacionados ao trabalho, possibilitando a definição de ações de promoção, prevenção, vigilância e assistência, de forma mais adequada. |
| Método de Cálculo para os Agravos | Numerador: Número de notificações de agravos com o campo "Ocupação" preenchido com o código da Classificação Brasileira de Ocupações (CBO) correspondente, na versão disponibilizada pelo Sinan, em determinado ano e local de ocorrência do caso. Denominador: Número total de casos de agravos relacionados ao trabalho notificados, em determinado ano e local de ocorrência. Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para monitoramento e avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Relação de agravos: a. Acidente com exposição a material biológico relacionado ao trabalho; b. Acidente de trabalho Grave (graves, fatais e em crianças e adolescentes); c. Intoxicação Exógena relacionada ao Trabalho. - Município que não possuir registro de notificação de agravos relacionados ao trabalho em seu território, no Sinan, não pontua para o PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 15 - Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida
| Meta | 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. |
| Relevância do Indicador | - A violência é considerada uma questão de saúde pública mundial, o que torna necessária a ampliação de estratégias que interfiram nesse quadro. No Brasil, esse agravo representa a terceira causa de morte entre crianças de 0 a 9 anos de idade, passando a ocupar a primeira posição na população de 10 a 49 anos, decrescendo para a sexta posição entre os idosos (60 ou mais anos de idade). As vítimas, comumente, adquirem sequelas, permanentes ou não, que podem levar à incapacidade para o trabalho ou para outras atividades rotineiras, ao absenteísmo, a custos com o pagamento de pensões e de tratamentos de saúde, configurando um importante problema de saúde pública. Nesse contexto, o Ministério da Saúde implementou o Sistema de Vigilância de Violências e Acidentes (VIVA/Sinan), como forma de sistematizar as informações sobre os casos de violências e permitir o cuidado intersetorial às vítimas. Dados gerados por esse sistema são demandados por vários setores do Ministério da Saúde e também por outros ministérios, bem como organizações não governamentais e imprensa. Desse modo, a qualidade dos dados é primordial para garantir uma análise fidedigna desse problema de saúde. |
| Método de Cálculo | Numerador: Total de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida, por município de notificação. Denominador: Total de casos notificados por município de notificação. Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no VIVA/Sinan dos registros de notificações de violência interpessoal e autoprovocada deve ser feita de forma regular e constante durante todo o ano. - O objetivo desse indicador é melhorar a informação das notificações de violências e acidentes em sua totalidade, através do incentivo ao melhor preenchimento do campo raça/cor e das demais variáveis. - Será considerada não válida a informação de raça/cor quando o campo estiver em branco ou com a opção "Ignorado". - Município que não possuir registro de notificação de violência interpessoal e autoprovocada em seu território, no VIVA/Sinan, não pontua para o PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em Saúde Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
ANEXO CII
DO PLANEJAMENTO, EXECUÇÃO E AVALIAÇÃO DAS AÇÕES DE VIGILÂNCIA E ASSISTÊNCIA À SAÚDE EM EVENTOS DE MASSA
Art. 1º Ficam definidas, no âmbito do Sistema Único de Saúde (SUS), as responsabilidades das esferas de gestão e estabelecidas as Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa. (Origem: PRT MS/GM 1139/2013, Art. 1º)
TÍTULO I
DAS DISPOSIÇÕES INICIAIS
(Origem: PRT MS/GM 1139/2013, TÍTULO I)
CAPÍTULO I
DA FINALIDADE E DA ABRANGÊNCIA
(Origem: PRT MS/GM 1139/2013, TÍTULO I, CAPÍTULO I)
Art. 2º As Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa têm por finalidade prevenir e mitigar os riscos à saúde a que está exposta a população envolvida em eventos de massa, a partir da definição de responsabilidades dos gestores do SUS, da saúde suplementar e do estabelecimento de mecanismos de controle e coordenação de ação durante todas as fases de desenvolvimento dos eventos com foco nas ações de atenção à saúde, incluindo promoção, proteção e vigilância e assistência à Saúde. (Origem: PRT MS/GM 1139/2013, Art. 2º)
Art. 3º As Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa se aplicam a todas as esferas de gestão do SUS e às respectivas autarquias a elas vinculadas. (Origem: PRT MS/GM 1139/2013, Art. 3º)
CAPÍTULO II
DAS DEFINIÇÕES
(Origem: PRT MS/GM 1139/2013, TÍTULO I, CAPÍTULO II)
Art. 4º Para efeito de planejamento, execução e avaliação das ações de vigilância e assistência à saúde em eventos de massa, são adotados os seguintes conceitos: (Origem: PRT MS/GM 1139/2013, Art. 4º)
I - Evento de Massa (EM): atividade coletiva de natureza cultural, esportiva, comercial, religiosa, social ou política, por tempo pré-determinado, com concentração ou fluxo excepcional de pessoas, de origem nacional ou internacional, e que, segundo a avaliação das ameaças, das vulnerabilidades e dos riscos à saúde pública exijam a atuação coordenada de órgãos de saúde pública da gestão municipal, estadual e federal e requeiram o fornecimento de serviços especiais de saúde, públicos ou privados (Sinonímia: grandes eventos, eventos especiais, eventos de grande porte); (Origem: PRT MS/GM 1139/2013, Art. 4º, I)
II - organizador de evento: pessoa física ou jurídica, de direito público ou privado, civil ou militar, responsável pelo planejamento e realização do evento de massa; (Origem: PRT MS/GM 1139/2013, Art. 4º, II)
III - autoridade sanitária: órgão ou agente público competente da área da saúde, com atribuição legal no âmbito da vigilância e da atenção à saúde; (Origem: PRT MS/GM 1139/2013, Art. 4º, III)
IV - autoridade fiscalizadora competente: agente público competente da vigilância sanitária e da saúde suplementar, com poder de polícia administrativo; (Origem: PRT MS/GM 1139/2013, Art. 4º, IV)
V - agente público regulador: autoridade pública sanitária, delegada pelo Gestor Local, que tem como função realizar a articulação entre os diversos níveis assistenciais do sistema de saúde, visando melhor resposta para as necessidades do paciente, ou seja, Médico Regulador da Central de Regulação das Urgências e/ou Central de Regulação de Leitos e/ou Complexo Regulatório; (Origem: PRT MS/GM 1139/2013, Art. 4º, V)
VI - Centro Integrado de Operações Conjuntas da Saúde (Ciocs): unidade operacional de trabalho de caráter extraordinário e temporário, com arquitetura integrada para a gestão das ações do setor saúde, nos âmbitos da vigilância e assistência, que visa o compartilhamento de informações em saúde; para apoiar as decisões durante os eventos de massa e monitorar os incidentes relacionados a saúde; (Origem: PRT MS/GM 1139/2013, Art. 4º, VI)
VII - Plano Operativo do Evento de Massa: documento voltado à preparação dos serviços e das equipes do SUS que contém o conjunto de atividades a serem desenvolvidas nas fases pré, durante e pós-evento, definidas de acordo com as necessidades de prevenção e mitigação de riscos e com base na avaliação do cenário de risco, alinhado aos planos de emergência e de contingência; (Origem: PRT MS/GM 1139/2013, Art. 4º, VII)
VIII - Plano de Emergência em Saúde: matriz operacional e institucional de resposta rápida, coordenada e efetiva a qualquer emergência em saúde pública, que tem a função de proteger a saúde da população, reduzir o impacto dos eventos e limitar a progressão de uma crise, reduzir a morbimortalidade e os impactos de emergências em saúde pública; e (Origem: PRT MS/GM 1139/2013, Art. 4º, VIII)
IX - Plano de Contingência: alinhado ao Plano de Emergência e específico por tipo de evento, como desastres naturais, surtos epidêmicos, acidentes com múltiplas vítimas e acidentes Químicos, Biológicos, Radiológicos e Nucleares (QBRN). (Origem: PRT MS/GM 1139/2013, Art. 4º, IX)
CAPÍTULO III
DAS RESPONSABILIDADES
(Origem: PRT MS/GM 1139/2013, TÍTULO I, CAPÍTULO III)
Art. 5º São responsabilidades das autoridades sanitárias avaliar e aprovar o planejamento e acompanhar a execução das atividades propostas pelos organizadores de eventos relativos à prevenção, mitigação de riscos e o projeto de provimento de serviços de saúde para os atendimentos à população envolvida no evento de massa. (Origem: PRT MS/GM 1139/2013, Art. 5º)
Art. 6º A Agência Nacional de Vigilância Sanitária (ANVISA) regulamentará sobre as responsabilidades do organizador do evento, dentro do escopo de suas competências. (Origem: PRT MS/GM 1139/2013, Art. 6º)
Art. 7º A Agência Nacional de Saúde Suplementar (ANS) editará regulamentos específicos de assistência à saúde suplementar relacionados a eventos de massa, em especial, referentes à garantia do acesso ao atendimento de urgência e emergência. (Origem: PRT MS/GM 1139/2013, Art. 7º)
Art. 8º A coordenação das ações relativas à vigilância e assistência à saúde em eventos de massa é responsabilidade do ente municipal, devendo ser compartilhada com os demais gestores do SUS, quando extrapolar os limites de competência e capacidade municipal, conforme as disposições das Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa e outros atos normativos complementares. (Origem: PRT MS/GM 1139/2013, Art. 8º)
§ 1º Nos eventos designados de interesse estadual a coordenação é compartilhada pelos gestores estaduais e municipais. (Origem: PRT MS/GM 1139/2013, Art. 8º, § 1º)
§ 2º Nos eventos designados de interesse nacional a coordenação é compartilhada entre os gestores municipais, estaduais e o Ministério da Saúde. (Origem: PRT MS/GM 1139/2013, Art. 8º, § 2º)
Art. 9º São previamente designados como eventos de massa de interesse nacional aqueles definidos pelo governo federal, por meio de ato específico. (Origem: PRT MS/GM 1139/2013, Art. 9º)
Art. 10. Adicionalmente, no âmbito da saúde, outros eventos podem ser definidos como de interesse nacional, podendo ser utilizados os critérios relacionados abaixo: (Origem: PRT MS/GM 1139/2013, Art. 10)
I - eventos internacionais com organização do governo brasileiro; (Origem: PRT MS/GM 1139/2013, Art. 10, I)
II - eventos onde se estima um grande fluxo de estrangeiros; (Origem: PRT MS/GM 1139/2013, Art. 10, II)
III - eventos internacionais com participação de mais de um chefe de Estado; (Origem: PRT MS/GM 1139/2013, Art. 10, III)
IV - eventos que ocorram concomitantemente mais de uma região geográfica; e (Origem: PRT MS/GM 1139/2013, Art. 10, IV)
V - eventos que excedam capacidade de resposta de determinada unidade federada.(Origem:PRT MS/GM 1139/2013,Art. 10, V)
Art. 11. Fica a cargo dos Estados declarar os eventos de interesse estadual, cabendo a Comissão Intergestores Bipartite definir os critérios a serem considerados para essa qualificação. (Origem: PRT MS/GM 1139/2013, Art. 11)
TÍTULO II
DAS DIRETRIZES NACIONAIS PARA PLANEJAMENTO, EXECUÇÃO E AVALIAÇÃO DAS AÇÕES DE SAÚDE EM EVENTOS DE MASSA
(Origem: PRT MS/GM 1139/2013, TÍTULO II)
CAPÍTULO I
DO PLANEJAMENTO
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO I)
Art. 12. O planejamento do setor saúde deve envolver as áreas de vigilância e assistência à saúde e estar articulados com os demais entes públicos e setor privado envolvidos com o evento de massa, particularmente com os organizadores dos eventos. (Origem: PRT MS/GM 1139/2013, Art. 12)
Art. 13. A atuação do SUS deve estar organizada em um Plano Operativo, específico para cada evento, alinhado aos Planos de Emergência em Saúde e de Contingência. (Origem: PRT MS/GM 1139/2013, Art. 13)
§ 1º Para elaboração do Plano Operativo tratado no caput deste artigo, as autoridades sanitárias devem considerar os documentos e as informações fornecidos pelo organizador do evento, com atenção aos seguintes pontos: (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º)
I - caracterização do evento; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, I)
II - avaliação dos riscos do evento de acordo com a população envolvida no evento de massa; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, II)
III - definição dos responsáveis nas áreas de interesse à saúde; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, III)
IV - fluxos de comunicação; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, IV)
V - oferta de produtos e serviços de interesse à saúde; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, V)
VI - projeto de provimento de serviços de saúde; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, VI)
VII - planejamento das ações em situações de urgência e emergência; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, VII)
VIII - monitoramento dos riscos durante o evento; e (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, VIII)
IX - demais ações exigidas em legislação específica. (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, IX)
§ 2º A caracterização dos eventos de massa e a avaliação dos riscos devem incluir os fatores e critérios descritos, respectivamente, no Anexos 1 e 2 do Anexo CII . (Origem: PRT MS/GM 1139/2013, Art. 13, § 2º)
§ 3º Quando o organizador do evento for um ente público ou a natureza e complexidade do evento exigir, os incisos V, VI e VII deverão ser objeto de pactuação regional. (Origem: PRT MS/GM 1139/2013, Art. 13, § 3º)
Art. 14. O planejamento do setor saúde, entre outras questões, deve contemplar: (Origem: PRT MS/GM 1139/2013, Art. 14)
I - avaliação dos riscos associados aos eventos e identificação das medidas de gerenciamento prioritárias; (Origem: PRT MS/GM 1139/2013, Art. 14, I)
II - explicitação das responsabilidades de cada esfera de gestão do SUS envolvida; (Origem: PRT MS/GM 1139/2013, Art. 14, II)
III - identificação dos entes públicos e setor privado que devem ser envolvidos no trabalho a ser desenvolvido pelo setor saúde; (Origem: PRT MS/GM 1139/2013, Art. 14, III)
IV - definição de fluxos de comunicação e pontos de contato estratégicos; (Origem: PRT MS/GM 1139/2013, Art. 14, IV)
V - articulação da RAS, inclusive laboratorial, para garantia do acesso da população envolvida no evento de massa nos planos de emergência e contingência; (Origem: PRT MS/GM 1139/2013, Art. 14, V)
VI - identificação da interface com outros planos de ação e ou de emergência; (Origem: PRT MS/GM 1139/2013, Art. 14, VI)
VII - ações de prevenção e promoção da saúde; (Origem: PRT MS/GM 1139/2013, Art. 14, VII)
VIII - ações de comunicação e educação em saúde; e (Origem: PRT MS/GM 1139/2013, Art. 14, VIII)
IX - monitoramento e avaliação das ações de vigilância e assistência à saúde. (Origem: PRT MS/GM 1139/2013, Art. 14, IX)
Parágrafo Único. Deve ser dada especial atenção aos riscos que alteram o padrão epidemiológico das doenças transmissíveis ou que impactam a rotina dos serviços de saúde. (Origem: PRT MS/GM 1139/2013, Art. 14, Parágrafo Único)
Art. 15. De acordo com a avaliação de risco e dimensão do evento, deve ser prevista no planejamento das ações do SUS a ativação do Ciocs. (Origem: PRT MS/GM 1139/2013, Art. 15)
Art. 16. Sempre que aplicável, as ações planejadas e os fluxos de comunicação definidos devem ser testados antes do início do evento de massa, com destaque nos seguintes pontos: (Origem: PRT MS/GM 1139/2013, Art. 16)
I - avaliação do funcionamento de novas atividades e estruturas; (Origem: PRT MS/GM 1139/2013, Art. 16, I)
II - teste do fluxo da informação avaliando se a mesma tem a destinação correta; (Origem: PRT MS/GM 1139/2013, Art. 16, II)
III - avaliação da capacidade de interlocução com os atores estratégicos; e (Origem: PRT MS/GM 1139/2013, Art. 16, III)
IV - teste da capacidade de resposta. (Origem: PRT MS/GM 1139/2013, Art. 16, IV)
Parágrafo Único. A realização de simulados a partir dos agravos mais prováveis é uma estratégia importante para o teste da capacidade de resposta do setor saúde. (Origem: PRT MS/GM 1139/2013, Art. 16, Parágrafo Único)
CAPÍTULO II
DA EXECUÇÃO
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO II)
Seção I
Da Vigilância em Saúde
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO II, Seção I)
Art. 17. As ações da vigilância em saúde devem ser executadas em observância ao Plano Operativo, sendo direcionadas às medidas de gerenciamento dos seguintes riscos: (Origem: PRT MS/GM 1139/2013, Art. 17)
I - ambientais; (Origem: PRT MS/GM 1139/2013, Art. 17, I)
II - epidemiológicos; e (Origem: PRT MS/GM 1139/2013, Art. 17, II)
III - relacionados ao uso ou consumo de produtos e serviços de interesse à saúde. (Origem: PRT MS/GM 1139/2013, Art. 17, III)
Art. 18. Em relação as medidas de gerenciamento dos riscos vinculados a agravos e doenças transmissíveis, deve-se dar atenção aos seguintes pontos: (Origem: PRT MS/GM 1139/2013, Art. 18)
I - vacinação dos trabalhadores de setores de linha de frente, de acordo com as orientações do Programa Nacional de Imunização; (Origem: PRT MS/GM 1139/2013, Art. 18, I)
II - intensificar as ações e os mecanismos de notificação em estabelecimentos de saúde públicos e privados, melhorando a oportunidade da notificação de eventos de importância em saúde pública por meio de canais institucionais; e (Origem: PRT MS/GM 1139/2013, Art. 18, II)
III - estabelecer mecanismos simplificados para notificação de casos e surtos pelos profissionais dos hotéis, com o objetivo de receber informações oportunas sobre eventos de saúde pública que ocorrerem na rede hoteleira durante o evento de massa. (Origem: PRT MS/GM 1139/2013, Art. 18, III)
Art. 19. Como medida de gerenciamento dos riscos associados ao uso e consumo de produtos e serviços, a autoridade fiscalizadora competente deve avaliar os estabelecimentos fornecedores dos serviços e produtos. (Origem: PRT MS/GM 1139/2013, Art. 19)
Art. 20. O organizador do evento deve ser informado sobre os resultados da fiscalização a fim de adotar medidas suplementares às sanções fiscais aplicadas pela vigilância sanitária. (Origem: PRT MS/GM 1139/2013, Art. 20)
Art. 21. A vigilância sanitária deve desenvolver estratégias específicas para controle do comércio ambulante de produto, em observância à legislação local específica e incluindo, quando aplicável, ações de orientação aos responsáveis pelas estruturas temporárias. (Origem: PRT MS/GM 1139/2013, Art. 21)
Art. 22. Caso o evento demande grande fluxo de turistas, as ações de fiscalização de infraestrutura e serviços nos pontos de entrada e meios de transporte, devem ser intensificadas. (Origem: PRT MS/GM 1139/2013, Art. 22)
Art. 23. Quando a organização do evento de massa exigir o envio de produtos procedentes do exterior, devem ser observados os requisitos específicos para o controle sanitários de bens e produtos, conforme disposto em legislação específica. (Origem: PRT MS/GM 1139/2013, Art. 23)
Art. 24. Deve ser reforçado o acompanhamento dos eventos de saúde pública de importância nacional e internacional; o monitoramento dos alertas e a captura de notícias, na mídia nacional e internacional, mantendo-se fluxo contínuo de informação com as demais áreas da saúde a fim de permitir respostas rápidas às eventuais doenças, agravos e riscos identificados. (Origem: PRT MS/GM 1139/2013, Art. 24)
Art. 25. O Ciocs deve observar os fluxos e procedimentos pré-estabelecidos, com envio de informações e resposta às emergências de saúde publica. (Origem: PRT MS/GM 1139/2013, Art. 25)
Seção II
Da Assistência à Saúde
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO II, Seção II)
Art. 26. Previamente ao evento, a autoridade sanitária da área de assistência à saúde, em articulação com a autoridade fiscalizadora competente, deve avaliar e acompanhar a execução do projeto de provimento dos serviços de saúde elaborado pelo organizador de evento, de acordo com o mapeamento de risco do evento, a fim de garantir a: (Origem: PRT MS/GM 1139/2013, Art. 26)
I - existência de posto médico avançado, fixo ou de campanha, com estrutura, insumos e medicamentos para: (Origem: PRT MS/GM 1139/2013, Art. 26, I)
a) acolhimento com classificação de risco; (Origem: PRT MS/GM 1139/2013, Art. 26, I, a)
b) observação; (Origem: PRT MS/GM 1139/2013, Art. 26, I, b)
c) pequenas cirurgias; (Origem: PRT MS/GM 1139/2013, Art. 26, I, c)
d) estabilização; e (Origem: PRT MS/GM 1139/2013, Art. 26, I, d)
e) suporte básico e avançado de vida. (Origem: PRT MS/GM 1139/2013, Art. 26, I, e)
II - retaguarda de ambulâncias na proporção adequada de unidades suporte básico (USB) e de unidades de suporte avançado (USA) por posto médico; e (Origem: PRT MS/GM 1139/2013, Art. 26, II)
III - distribuição espacial obedecendo aos critérios de acesso e segurança. (Origem: PRT MS/GM 1139/2013, Art. 26, III)
Art. 27. Deve ser definida a grade assistencial junto aos organizadores do evento, às operadoras de planos de saúde suplementar e aos gestores do SUS, a fim de estabelecer a responsabilidade na atenção à saúde e regulação do acesso da população envolvida aos pontos de atenção. (Origem: PRT MS/GM 1139/2013, Art. 27)
Art. 28. A Rede de Urgência, a retaguarda hospitalar dos municípios sede e da região, e a Hemorrede devem estar preparadas em conformidade com os Planos de Emergência e de Contingência do evento de massa. (Origem: PRT MS/GM 1139/2013, Art. 28)
Art. 29. Deve ser garantida a manutenção do tratamento do público com doenças renais e hematológicas crônicas. (Origem: PRT MS/GM 1139/2013, Art. 29)
Art. 30. As equipes de resposta da Força Nacional do SUS (FN-SUS) devem ser mantidas de prontidão para atuação, conforme disposto em regulamento específico. (Origem: PRT MS/GM 1139/2013, Art. 30)
Art. 31. Deve ser avaliada a efetividade e operacionalização das atividades de assistência à saúde de responsabilidade do organizador do evento, além de monitorada a situação das portas de entrada das urgências e retaguarda da Rede Hospitalar referenciada com informação em tempo real. (Origem: PRT MS/GM 1139/2013, Art. 31)
Parágrafo Único. Dentre as ações previstas no caput deste artigo, deve-se incluir o acompanhamento da informação dos registros dos atendimentos realizados. (Origem: PRT MS/GM 1139/2013, Art. 31, Parágrafo Único)
Art. 32. O responsável médico do evento e o agente público regulador devem trabalhar de forma articulada a fim de garantir a integração da regulação dos serviços contratados pela organização do evento com a regulação dos serviços públicos e da saúde suplementar para o acesso do público envolvido aos serviços de forma equânime, adequada e em tempo oportuno. (Origem: PRT MS/GM 1139/2013, Art. 32)
CAPÍTULO III
DA AVALIAÇÃO
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO III)
Art. 33. A avaliação da atuação da saúde na fase pós-evento deve ser desenvolvida com o propósito de identificar as oportunidades de melhoria e promover o aprimoramento da atuação governamental, direcionando os recursos para as capacidades que devem ser fortalecidas e subsidiando o planejamento de eventos futuros. (Origem: PRT MS/GM 1139/2013, Art. 33)
§ 1º Recomenda-se consultar a opinião de atores externos sobre os resultados do trabalho, particularmente os atores governamentais com interface e os organizadores do evento. (Origem: PRT MS/GM 1139/2013, Art. 33, § 1º)
§ 2º O relatório final da avaliação deve ser compartilhado com todas as áreas relacionadas com a vigilância e assistência à saúde em eventos de massa e disponibilizados nos endereços eletrônicos institucionais. (Origem: PRT MS/GM 1139/2013, Art. 33, § 2º)
TÍTULO III
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
(Origem: PRT MS/GM 1139/2013, TÍTULO III)
Art. 34. Fica instituído o Comitê de Eventos de Massa (CEM) do Ministério da Saúde com a seguinte composição: (Origem: PRT MS/GM 1139/2013, Art. 35)
I - 1 (um) representante da Secretaria-Executiva; (Origem: PRT MS/GM 1139/2013, Art. 35, I)
II - 1 (um) representante Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 1139/2013, Art. 35, II)
III - 1 (um) representante Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1139/2013, Art. 35, III)
IV - 1 (um) representante da Secretaria de Gestão Estratégica e Participativa; (Origem: PRT MS/GM 1139/2013, Art. 35, IV)
V - 1(um) da Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 1139/2013, Art. 35, V)
VI - 1 (um) do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 1139/2013, Art. 35, VI)
VII - 1 (um) do Conselho Nacional de Secretários Municipais de Saúde(CONASEMS);(Origem: PRT MS/GM 1139/2013,Art. 35,
VII)
VIII - 1 (um) representante Agência Nacional de Vigilância Sanitária; e (Origem: PRT MS/GM 1139/2013, Art. 35, VIII)
IX - 1 (um) representante Agência Nacional de Saúde Suplementar. (Origem: PRT MS/GM 1139/2013, Art. 35, IX)
§ 1º A coordenação executiva do CEM será realizada pela SE, que fornecerá em conjunto com a SVS, SAS e a ANVISA os apoios técnico e administrativo necessários para o seu funcionamento. (Origem: PRT MS/GM 1139/2013, Art. 35, § 1º)
§ 2º Os representantes titulares e os respectivos suplentes serão indicados pelos dirigentes dos respectivos órgãos e entidades à coordenação executiva do CEM. (Origem: PRT MS/GM 1139/2013, Art. 35, § 2º)
§ 3º O CEM poderá convocar representantes de órgãos e entidades, públicas e privadas, além de especialistas nos assuntos relacionados às suas atividades, quando entender necessário para o cumprimento dos objetivos previstos nas Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa. (Origem: PRT MS/GM 1139/2013, Art. 35, § 3º)
§ 4º O CEM poderá instituir grupos de trabalho para a execução de atividades específicas que entender necessárias para o cumprimento do disposto nas Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa. (Origem: PRT MS/GM 1139/2013, Art. 35, § 4º)
Art. 35. As funções dos membros do CEM não serão remuneradas e seu exercício será considerado de relevante interesse público. (Origem: PRT MS/GM 1139/2013, Art. 36)
Art. 36. É competência do CEM: (Origem: PRT MS/GM 1139/2013, Art. 37)
I - estabelecer diretrizes complementares àquelas definidas nas Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa, ações estratégicas e metas para a preparação das ações de saúde; (Origem: PRT MS/GM 1139/2013, Art. 37, I)
II - acompanhar a implementação das ações de preparação da saúde; e (Origem: PRT MS/GM 1139/2013, Art. 37, II)
III - subsidiar o Ministério da Saúde com informações para sua participação nas instâncias do governo federal relativas a eventos de massa. (Origem: PRT MS/GM 1139/2013, Art. 37, III)
ANEXO 1 DO ANEXO CII
FATORES FATORES PARA CARACTERIZAÇÃO DE UM EVENTO DE MASSA
Os eventos de massa apresentam características bastante distintas quando comparados, conforme finalidade, localização, idade e tipo de público, dentre outros fatores. O quadro abaixo separa os fatores em categorias e descreve situações específicas que exigem especial atenção. Esse quadro é genérico e foi criado com o objetivo de apoiar a caracterização dos eventos de massa. Em algumas situações, a avaliação do evento de massa pode apontar para a necessidade de aplicação de outros fatores e situações.
O processo de caracterização do evento deve ser realizado caso a caso.
I - Natureza do evento:
Religioso, esportivo, artístico, dentre outros.
II - Tempo de duração do evento;
III - Atores envolvidos:
a) Perfil estimado dos atores envolvidos: organizadores, trabalhadores contratados, trabalhadores voluntários, imprensa, população envolvida (número estimado, grupo etário, gênero, nacionalidade, características culturais e outras);
b) Número estimado de atores envolvidos de outras regiões do país ou exterior;
c) História pregressa relacionada aos atores envolvidos nos eventos anteriores, quando houver; e
d) Local e condição de acomodação;
IV - Local do evento:
a) Características do local e da estrutura onde o evento de massa será realizado; e
b) Características sanitárias e ambientais das áreas influenciadas pelo evento que podem ter relação com a ocorrência de doenças transmissíveis;
V - Época de realização do evento
a) Condições meteorológicas
b) Doenças sazonais, de natureza infecciosa ou não
c) Contexto epidemiológico do sistema local;
VI - Capacidade básica estabelecida dos serviços de vigilância e distância do evento;
a) Possibilidade de ocorrência de situações contidas na lista de eventos de notificação compulsória imediata de acordo com a legislação vigente.
PARA CARACTERIZAÇÃO DE UM EVENTO DE MASSA (Origem: PRT MS/GM 1139/2013, Anexo 1)
ANEXO 2 DO ANEXO CII
CRITÉRIOS PARA AVALIAÇÃO DO RISCO EM EVENTOS DE MASSA (Origem: PRT MS/GM 1139/2013, Anexo 2)
CRITÉRIOS PARA AVALIAÇÃO DO RISCO EM EVENTOS DE MASSA
Os riscos associados a um evento de massa podem variar de acordo com as características intrínsecas e extrínsecas ao próprio evento. Na Figura 1, são ilustradas como as características do evento podem impactar na saúde do público envolvido.
Figura 1 - Relação entre a característica do evento com o risco.
| Característica do evento | Consideração sobre o impacto à saúde |
| Condições ambientais | Temperatura ambiental (muito alta ou muito baixa) Umidade ambiental e precipitações (chuvas favorecem acidentes) |
| Tipo e quantidade de público | Alta concentração de pessoas, favorecendo a transmissão de doenças e ocorrência de acidentes. Tipo do público (concentração de grupo mais suscetível a doenças ou mesmo grupos com tendências a atos violentos). Relação entre a população do município e o público estimado que pode estressar a capacidade de resposta e atendimento instalada. |
| Duração do evento | Eventos longos aumentam a exposição a riscos. |
| Tipo de evento | Externo (Aumento do tempo exposição ao sol ou temperaturas baixas) Interno (concentração de pessoas e aumento de exposição) |
| Consumo de alimentos e bebidas alcoólicas | O consumo de alimentos inclui o risco de surtos de doenças transmitidas por alimentos e o uso de álcool pode favorecer comportamentos violentos, além de outros riscos inerentes |
| Condições de trabalho | Excesso de tempo de trabalho, sem descanso. Área de aguardo inadequada. Exposição por longos períodos de tempo a fatores ambientais desfavoráveis. (altas temperaturas ou temperaturas muito baixas). Estresse por cobrança no cumprimento de metas. |
No processo de avaliação devem ser listados todos os riscos associados aos eventos de massa, incluindo aqueles com baixa probabilidade de ocorrência. Exemplos de riscos associados a eventos de massa estão apresentados na Figura 2.
Figura 2 - Principais riscos associados a eventos de massa.
| Categoria do risco | Risco à saúde |
| Doenças Infecciosas | Doenças Transmitidas por Alimentos. Doenças endêmicas. Doenças respiratórias |
| Danos físicos | Fraturas, cortes e queimaduras |
| Danos associados a terrorismo | Danos decorrentes do uso de substâncias químicas, agentes biológicos e material radioativo |
| Danos relacionados ao comportamento ou condições do público | Danos associados ao consumo de álcool. Danos associados ao consumo de drogas. Ataques cardíacos. Crises de asma |
| Danos relacionados ao ambiente | Danos associados à exposição solar ou baixas temperaturas. Picadas ou ferimentos associados a animais. Reações alérgicas |
| Danos relacionados às atividades laborais | Desenvolvimento de atividades laborais sem o devido uso de EPC e EPI. Exposição do trabalhador a riscos de qualquer natureza para desempenho das atividades laborais. Danos associados a acidentes graves e fatais. Danos associados a acidentes envolvendo crianças e adolescentes. Danos associados ao uso de álcool e drogas. Danos associados a assédio moral e sexual. |
Depois de sua identificação, os riscos devem ser classificados segundo a sua probabilidade de ocorrência e severidade. Correlacionando-se a probabilidade e severidade, pode-se obter a relevância do risco para o evento de massa em análise.