Este texto não substitui o publicado no Diário Oficial da União

TÍTULO I - DA PROMOÇÃO, PROTEÇÃO E RECUPERAÇÃO DA SAÚDE (art. 2º ao art. 171)
CAPÍTULO I - DA PROMOÇÃO DA SAÚDE (art. 2º ao art. 42)
Seção I - Do Programa Academia da Saúde (art. 2º ao art. 42)
Subseção I - Das Disposições Gerais (art. 18 ao art. 23)
Subseção IV - Das Disposições Transitórias (art. 33 ao art. 35)
CAPÍTULO II - DO SANGUE, COMPONENTES E HEMODERIVADOS (art. 43 ao art. 47)
CAPÍTULO III - DA SAÚDE MENTAL (art. 48 ao art. 109)
Seção I - Do Programa De Volta Para Casa e Comissão de Acompanhamento (art. 48 ao art. 63)
CAPÍTULO IV - DA ALIMENTAÇÃO E NUTRIÇÃO (art. 110 ao art. 127)
Seção II - Do Programa Nacional de Suplementação de Vitamina A (art. 117 ao art. 127)
CAPÍTULO V - DA VIGILÂNCIA EM SAÚDE (art. 128 ao art. 141)
Seção I - Do Plano Diretor de Vigilância Sanitária (art. 128)
CAPÍTULO VI - DA TRIAGEM NEONATAL (art. 142 ao art. 150-I)
Seção I - Do Programa Nacional de Triagem Neonatal (PNTN) (art. 142 ao art. 148)
Seção III - Da Base de Dados do Programa Nacional de Triagem Neonatal (art. 150-A ao art. 150-B)
Seção III-A -Da Câmara Técnica de Assessoramento ao Programa Nacional de Triagem Neonatal (art. 150-C ao art. 150-I)
CAPÍTULO VII - DO ALEITAMENTO MATERNO (art. 151 ao art. 156-J)
Seção I - Do Comitê Nacional de Aleitamento Materno (CNAM) (art. 151 ao art. 156)
Seção II - Comitê Nacional de Amamentação (art. 156-A ao art. 156-I)
Seção III - Do Programa Nacional de Promoção, Proteção e Apoio à Amamentação (art. 156-J)
CAPÍTULO VIII - DA SEGURANÇA DO PACIENTE (art. 157 ao art. 166)
Seção I - Do Programa Nacional de Segurança do Paciente (PNSP) (art. 157 ao art. 166)
TÍTULO II - DO CONTROLE DE DOENÇAS E ENFRENTAMENTO DE AGRAVOS DE SAÚDE (art. 172 ao art. 363)
CAPÍTULO I - DA ELIMINAÇÃO DA HANSENÍASE (art. 172 ao art. 181)
CAPÍTULO II - DA REDUÇÃO DA MORBIMORTALIDADE POR ACIDENTES E VIOLÊNCIA (art. 182 ao art. 188)
Seção I - Do Projeto de Vida no Trânsito (art. 182 ao art. 185)
CAPÍTULO III - DA PREVENÇÃO E CONTROLE DO CÂNCER (art. 189 ao art. 228)
Seção I - Do Registro de Câncer de Base Populacional (RCBP) (art. 189 ao art. 192)
Seção II - Do Controle de Câncer de Mama (art. 193 ao art. 224)
Subseção I - Do Programa de Mamografia Móvel (art. 193 ao art. 205)
Subseção II - Do Programa Nacional de Qualidade em Mamografia (PNQM) (art. 206 ao art. 224)
Seção III - Do Programa Nacional de Combate ao Câncer de Colo Uterino (art. 225 ao art. 228)
CAPÍTULO IV - DO PROGRAMA DE CONTROLE DE PÊNFIGO FOLIÁCEO ENDÊMICO (art. 229)
Seção I - Disposições Gerais (art. 230 ao art. 237)
Seção II - Das Atribuições do Agente Comunitário de Saúde (ACS) (art. 238 ao art. 240)
CAPÍTULO VI - DO PLANO NACIONAL DE CONTENÇÃO DO POLIOVÍRUS (art. 241 ao art. 255)
Seção I - Do Comitê Nacional de Mobilização Contra a Dengue (art. 260 ao art. 268)
CAPÍTULO XI - DO PROGRAMA NACIONAL DE PREVENÇÃO E CONTROLE DA MALÁRIA (PNCM) (art. 292 ao art. 296)
CAPÍTULO XIII - DA VIGILÂNCIA EPIDEMIOLÓGICA (art. 320 ao art. 335)
Seção II - Da Vigilância Sentinela da Influenza (art. 325 ao art. 331)
Seção III - Do Serviço de Verificação de Óbito (SVO) (art. 332 ao art. 335)
CAPÍTULO XIV - DA MORTALIDADE MATERNA E NEONATAL (art. 336 ao art. 342)
Seção I - Da Comissão Nacional de Mortalidade Materna (art. 336 ao art. 338)
TÍTULO III - DA SAÚDE DE SEGMENTOS POPULACIONAIS (art. 364 ao art. 446)
CAPÍTULO I - DA SAÚDE DOS POVOS INDÍGENAS (art. 364 ao art. 392)
Subseção I - Das Disposições Preliminares (art. 364 ao art. 368)
Subseção II - Da Implementação da Estratégia AIDPI (art. 369 ao art. 370)
Subseção III - Dos Profissionais e sua Capacitação (art. 371 ao art. 372)
Subseção IV - Das Atribuições dos Órgãos e Agentes Envolvidos (art. 373 ao art. 375)
CAPÍTULO II - DA SAÚDE DA PESSOA COM DEFICIÊNCIA (art. 393 ao art. 406)
CAPÍTULO III - DA SAÚDE DO TRABALHADOR E DA TRABALHADORA (art. 407 ao art. 436)
Seção I - Do Comitê Nacional de Promoção da Saúde do Trabalhador do SUS (art. 407 ao art. 413)
Seção III - Da Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS (art. 422)
CAPÍTULO IV - DA ATENÇÃO INTEGRAL À SAÚDE DA CRIANÇA (art. 437 ao art. 446)
Seção II - Da Estratégia Brasileirinhas e Brasileirinhos Saudáveis (art. 444 ao art. 446)
TÍTULO IV - DA ORGANIZAÇÃO DA ATENÇÃO À SAÚDE (art. 447 ao art. 642)
CAPÍTULO I - DA ATENÇÃO BÁSICA (art. 447 ao art. 519-X)
Seção I - Da Ação Estratégica SUS Digital - Telessaúde (art. 447 ao art. 504)
Subseção I - Da Estrutura (art. 448 ao art. 451-A)
Subseção II - Da operacionalização (art. 452 ao art. 454-A)
Subseção III - Da coordenação e governança (art. 455 ao art. 459)
Subseção IV -
Da Comissão Permanente de Telessaúde (art. 462 ao art. 463)Seção III-A - Do Serviço de Especialidades em Saúde Bucal - Sesb (art. 514-A ao art. 514-P)
Seção IV -
Do Programa Saúde Na Hora (art. 519-A ao art. 519-J)Subseção I - Da Execução do Programa (art.519-N ao art. 519-S)
Subseção II - Do Incentivo Financeiro (art.519-T ao art. 519-U)
CAPÍTULO II - DA ATENÇÃO HOSPITALAR (art. 520 ao art. 530)
CAPÍTULO III - DO ATENDIMENTO E INTERNAÇÃO DOMICILIAR (art. 531 ao art. 564)
Seção I - Das Disposições Gerais (art. 531 ao art. 534)
Seção II - Da Indicação e Organização da Atenção Domiciliar (art. 535 ao art. 554)
Subseção I - Da indicação e das modalidades de Atenção Domiciliar (art. 535 ao art. 545)
Subseção II - Do Programa Melhor em Casa (PMeC) (art. 545A ao art. 545E)
Subseção II[A] - Do Serviço de Atenção Domiciliar (SAD) (art. 546 ao art. 548B)
Subseção I - Dos requisitos de habilitação e homologação de equipes do PMeC (art. 555 ao art. 559B)
Subseção II - Do Conteúdo e Fluxo do Projeto para Criação ou Ampliação do SAD (art. 560 ao art. 563)
Subseção III - Do monitoramento do PMeC (art. 563A ao art. 563B)
CAPÍTULO IV - DA ASSISTÊNCIA FARMACÊUTICA (art. 565 ao art. 578)
Seção II - Da Farmácia Viva (art. 570 ao art. 571)
Seção III - Do Programa Farmácia Popular do Brasil (PFPB) (art. 572 ao art. 573)
CAPÍTULO VI - DO PROGRAMA DE HUMANIZAÇÃO NO PRÉ-NATAL E NASCIMENTO (art. 596 ao art. 622)
CAPÍTULO VII - DO CONTROLE DA DOR E CUIDADOS PALIATIVOS (art. 623 ao art. 629)
Seção I - Da Câmara Técnica em Controle da Dor e Cuidados Paliativos (art. 623 ao art. 624)
Seção II - Dos Centros de Referência em Tratamento da Dor Crônica (art. 625 ao art. 629)
CAPÍTULO VIII - DA PROGRAMAÇÃO PACTUADA E INTEGRADA DA ASSISTÊNCIA EM SAÚDE (art. 630 ao art. 636)
TÍTULO V - DA ATENÇÃO A AGRAVOS ESPECÍFICOS (art. 643 ao art. 715)
Seção I - DOS OBJETIVOS E REQUISITOS PARA PARTICIPAÇÃO (art. 644 ao art. 648)
CAPÍTULO V - DA CÂMARA TÉCNICA EM REUMATOLOGIA (art. 664 ao art. 666)
CAPÍTULO VI - DA ATENÇÃO ONCOLÓGICA (art. 667 ao art. 678)
Seção II - Do Plano de Expansão da Radioterapia (art. 668 ao art. 678)
CAPÍTULO VIII - DO PROGRAMA DE ASSISTÊNCIA AOS PORTADORES DA DOENÇA ALZHEIMER (art. 701 ao art. 703)
CAPÍTULO IX - DA ASSISTÊNCIA DE ALTA COMPLEXIDADE EM TERAPIA NUTRICIONAL (art. 704 ao art. 711)
TÍTULO VI - DA ORGANIZAÇÃO DO SUS (art. 716 ao art. 863)
CAPÍTULO I - DA EDUCAÇÃO PERMANENTE EM SAÚDE (art. 716 ao art. 777)
Subseção I - Disposições Gerais (art. 742 ao art. 743)
Subseção II - Dos Critérios de Elegibilidade (art. 744 ao art. 745)
Subseção III - Do Monitoramento, Avaliação, Acompanhamento e Controle (art. 746 ao art. 749)
CAPÍTULO II - DA DESPRECARIZAÇÃO DO TRABALHO NO SUS (art. 778 ao art. 786)
Seção II - Da Rede de Apoio à Desprecarização do Trabalho no Âmbito do SUS (art. 783 ao art. 786)
CAPÍTULO III - DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SUS (PROADI-SUS) (art. 787)
CAPÍTULO IV - DAS TECNOLOGIAS EM SAÚDE (art. 788 ao art. 837)
Seção IV - Dos Produtos Estratégicos para o SUS (art. 810)
Seção V - Das Parcerias para o Desenvolvimento Produtivo (PDP) (art. 811 ao art. 819-D)
Seção V-A - Do Fórum de Articulação com a Sociedade Civil - FAS (art. 819-A)
Subseção I - Do Programa de Desenvolvimento e Inovação Local (PDIL) (art. 819-C)
Subseção II - Do Programa de Parcerias para o Desenvolvimento Produtivo (PDP) (art. 819-D)
Seção VI - Do Programa Nacional de Competitividade em Vacinas (INOVACINA) (art. 820 ao art. 823)
Seção VII - Do Comitê Gestor das Vacinas Pentavalente e Heptavalente (art. 824 ao art. 831)
Seção VIII - Da Câmara Técnica de Imunobiológicos (art. 832 ao art. 837)
CAPÍTULO VI - DO PROGRAMA NACIONAL DE DESENVOLVIMENTO GERENCIAL NO SUS (art. 848 ao art. 850)
Seção I - Da Apresentação, Seleção e Contratação de Projetos de Pesquisa (art. 863-C ao art. 863-H)
Seção II - Do Monitoramento e da Avaliação de Pesquisas (art. 863-I)
Seção III - Do Acesso e da Divulgação de Resultados de Pesquisas (art. 863-J ao art. 863-L)
CAPÍTULO XII - DO COMITÊ DE GOVERNANÇA DE PESQUISA EM SAÚDE (art. 863-M ao art. 863-S)
TÍTULO VII - DAS DISPOSIÇÕES FINAIS (art. 864 ao art. 865)
ANEXOS
Anexo I PROGRAMA DE NECESSIDADES DA ESTRUTURA FÍSICA MÍNIMA DOS POLOS DA ACADEMIA DA SAÚDE
Anexo II PROGRAMA DE NECESSIDADES DOS POLOS DA ACADEMIA DA SAÚDE EQUIPAMENTOS DA ÁREA DESCOBERTA
Anexo III LISTA DOS CBOS DOS PROFISSIONAIS DO PROGRAMA ACADEMIA DA SAÚDE
Anexo IV DO SANGUE, COMPONENTES E DERIVADOS
TÍTULO I DAS DISPOSIÇÕES GERAIS (art. 1º ao art. 5º)
TÍTULO II DO REGULAMENTO TÉCNICO DE PROCEDIMENTOS HEMOTERÁPICOS (art. 6º ao art. 367)
CAPÍTULO I DO SANGUE E SEUS COMPONENTES (art. 6º ao art. 236)
Seção I Dos Princípios Gerais (art. 6º ao art. 29)
Seção II Da Doação de Sangue (art. 30 ao art. 68)
Seção III Da Coleta de Sangue do Doador (art. 69 ao art. 81)
Seção IV Da Preparação de Componentes Sanguíneos (art. 82 ao art. 114)
Seção V Do Controle de Qualidade dos Componentes Sanguíneos (art. 115 ao art. 116)
Seção VI Dos Exames de Qualificação no Sangue do Doador (art. 117 ao art. 141)
Seção VII Da Rotulagem do Sangue do Doador (art. 142 ao art. 149)
Seção VIII Da Conservação do Sangue e Componentes (art. 150 ao art. 154)
Seção IX Da Doação de Componentes por Aférese (art. 155 ao art. 167)
Seção X Da Transfusão Sanguínea (art. 168 ao art. 183)
Seção XI Da Liberação de Sangue para Transfusão (art. 184 ao art. 188)
Seção XII Do Ato Transfusional (art. 189 ao art. 204)
Seção XIII Das Reações Transfusionais (art. 205 ao art. 210)
CAPÍTULO II DA GARANTIA DA QUALIDADE (art. 237 ao art. 273)
Seção I Dos Princípios Gerais do Sistema da Qualidade (art. 237 ao art. 253)
Seção II Da Infraestrutura (art. 254 ao art. 256)
Seção III Da Biossegurança (art. 257 ao art. 260)
Seção IV Do Descarte de Resíduos (art. 261 ao art. 264)
Seção V Do Transporte (art. 265 ao art. 271)
Seção VI Dos Contratos, Convênios e Termos de Compromisso (art. 272 ao art. 273)
CAPÍTULO IV DOS GRUPOS DE ASSESSORAMENTO TÉCNICO (GAT) (art. 283 ao art. 297)
CAPÍTULO V DAS COMISSÕES DE ASSESSORAMENTO TÉCNICO (art. 298 ao art. 367)
Anexo 1 do Anexo IV Tabela de Triagem Clínica de Doadores de Sangue - Doenças
Anexo 3 do Anexo IV Tabela de Triagem Clínica de Doadores de Sangue - Medicamentos
Anexo 4 do Anexo IV Tabela de Triagem Clínica de Doadores de Sangue - Vacinas
Anexo 5 do Anexo IV Do Algoritmo para a Testagem Obrigatória e Liberação de Bolsas de Sangue
Anexo 6 do Anexo IV Especificações dos Componentes Sanguíneos - Controle de Qualidade
Anexo 8 do Anexo IV Controle de Qualidade de Reagentes de Sorologia
Anexo 10 do Anexo IV Condições para Transporte de Sangue Total e Componentes Sanguíneos
Anexo 11 do Anexo IV Do Envio do Plasma para Indústria de Hemoderivados
Anexo 12 do Anexo IV PROGRAMA NACIONAL DE CONTROLE DE QUALIDADE EXTERNO EM SOROLOGIA (PNCQES)
Anexo 13 do Anexo IV DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Talassemias)
Anexo 14 do Anexo IV DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Talassemias)
Anexo 15 do Anexo IV DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Gestão de Equipamentos)
Anexo 16 do Anexo IV DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Gestão de Equipamentos)
Anexo 17 do Anexo IV DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Gestão Ambiental)
Anexo 18 do Anexo IV DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Gestão Ambiental)
Anexo 19 do Anexo IV DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Doença Falciforme)
Anexo 20 do Anexo IV TERMO DE CONFIDENCIALIDADE (CAT-Doença Falciforme)
Anexo 21 do Anexo IV DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-PDVS)
Anexo 22 do Anexo IV DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-PDVS)
Anexo 23 do Anexo IV DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Sangue Raro)
Anexo 24 do Anexo IV DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Sangue Raro)
Anexo VI INSTRUMENTO DE CONTROLE E AVALIAÇÃO DE SERVIÇOS PRESTADOS NÃO-SUS (INDICADORES)
Anexo VII ABATIMENTO DOS SERVIÇOS PRESTADOS A NÃO-SUS DOS SERVIÇOS PRESTADOS AO SUS
Anexo VIII TERMO DE ADESÃO MUNICIPAL AO PROGRAMA DE VOLTA PARA CASA
Anexo IX SOLICITAÇÃO DE AUXÍLIO-REABILITAÇÃO PSICOSSOCIAL
Anexo X SOLICITAÇÃO DE AUXÍLIO-REABILITAÇÃO PSICOSSOCIAL PELO REPRESENTANTE LEGAL
Anexo XII FORMULÁRIO DE INCLUSÃO DO SOLICITANTE
Anexo XIII TERMO DE COMPROMISSO
Anexo XIV MODALIDADES DE CENTROS DE ESPECIALIDADES ODONTOLÓGICAS (CEOS) TIPO 1, 2 E 3
Anexo XVI QUADRO - ÁREAS METROPOLITANAS PRIORIZADAS
Anexo XIX PLANO DIRETOR DE VIGILÂNCIA SANITÁRIA - PDVISA
CAPÍTULO I DAS DISPOSIÇÕES GERAIS (art. 2º ao art. 4º)
CAPÍTULO II DAS DEFINIÇÕES (art. 5º)
CAPÍTULO III DAS COMPETÊNCIAS E RESPONSABILIDADES (art. 6º ao art. 22)
Seção I Das Competências da União (art. 6º ao art. 10)
Seção II Das Competências dos Estados (art. 11)
Seção III Das Competências dos Municípios (art. 12)
Seção V Dos Laboratórios de Controle e Vigilância (art. 17 ao art. 22)
CAPÍTULO V DO PADRÃO DE POTABILIDADE (art. 27 ao art. 39)
CAPÍTULO VI DOS PLANOS DE AMOSTRAGEM (art. 40 ao art. 41)
CAPÍTULO VII DAS PENALIDADES (art. 42 ao art. 43)
CAPÍTULO VIII DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS (art. 44 ao art. 50)
Anexo 1 do Anexo XX TABELA DE PADRÃO MICROBIOLÓGICO DA ÁGUA PARA CONSUMO HUMANO
Anexo 2 do Anexo XX TABELA DE PADRÃO DE TURBIDEZ PARA ÁGUA PÓS-FILTRAÇÃO OU PRÉ-DESINFECÇÃO
Anexo 8 do Anexo XX TABELA DE PADRÃO DE CIANOTOXINAS DA ÁGUA PARA CONSUMO HUMANO
Anexo 9 do Anexo XX TABELA DE PADRÃO DE RADIOATIVIDADE DA ÁGUA PARA CONSUMO HUMANO
Anexo 10 do Anexo XX TABELA DE PADRÃO ORGANOLÉPTICO DE POTABILIDADE
Anexo 1 do Anexo XXI MÉTODOS DE ANÁLISES E PROCEDIMENTOS PARA A DETERMINAÇÃO DE ÍON FLUORETO NA ÁGUA
Anexo XXII IMPLANTAÇÃO DO PROGRAMA NACIONAL DE TRIAGEM NEONATAL
Anexo XXIII PROGRAMA NACIONAL DE TRIAGEM NEONATAL
Anexo XXV ASSISTÊNCIA HOSPITALAR EM PSIQUIATRIA NO SUS
Anexo XXVII TESTES DE CONTROLE DE QUALIDADE
Anexo XXIX INDICADORES PARA MONITORAMENTO DOS RESULTADOS REFERENTES À QUALIDADE DO EXAME MAMOGRÁFICO
Anexo XXXI MODELO DE PLANO DE TRABALHO PARA APOIO À IMPLANTAÇÃO DA ESTRATÉGIA E-SUS AB
Anexo XXXIII INFORMAÇÕES SOBRE A SÍNDROME DE IMUNODEFICIÊNCIA ADQUIRIDA E SUAS MEDIDAS DE CONTROLE
Anexo XXXIV PROGRAMA NACIONAL PARA A PREVENÇÃO E O CONTROLE DAS HEPATITES VIRAIS
Anexo XXXV CRITÉRIOS PARA PONTUAÇÃO, CLASSIFICAÇÃO E RELAÇÃO DOS HOSPITAIS
Anexo XXXVI MODALIDADES DE EQUIPES DE DESINSTITUCIONALIZAÇÃO
Anexo XXXVII "AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS"
Anexo XXXVIII OFICIO DE SOLICITAÇÃO DE INCENTIVO FINANCEIRO
Anexo XXXIX TERMO DE COMPROMISSO
Anexo XL OFÍCIO REFERENTE A REALOCAÇÃO DA EQUIPE DE DESINSTITUCIONALIZAÇÃO
Anexo XLI DESCRIÇÃO DA REALOCAÇÃO FINAL DA(S) EQUIPE(S) DE DESINSTITUCIONALIZAÇÃO
Anexo XLII OFICIO REFERENTE A REDUÇÃO DO NÚMERO DE LEITOS E RECLASSIFICAÇÃO DO HOSPITAL PSIQUIÁTRICO
Anexo XLIV VIGILÂNCIA EPIDEMIOLÓGICA HOSPITALAR - VEH
Anexo XLV REGISTRO DE CÂNCER DE BASE POLULACIONAL - RCBP
Anexo XLVI VIGILÂNCIA SENTINELA DA INFLUENZA
Anexo XLVII INSUMOS ESSENCIAIS PARA IMPLEMENTAÇÃO DA ESTRATÉGIA AIDPI
Anexo XLVIII MEDICAMENTOS ESSENCIAIS PARA A IMPLEMENTAÇÃO DA ESTRATÉGIA AIDPI
Anexo L CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕES - ESTRUTURA AGREGADA NA ORDEM DE 3 DIGITOS
Anexo LI CLASSIFICACÃO NACIONAL DE ATIVIDADES ECONÔMICAS RESUMIDA AGREGADA EM 3 DÍGITOS
Anexo LVI TERMO DE COMPROMISSO PARA GARANTIA DE ACESSO
Anexo LVII QUADROS MODELOS DA PROGRAMAÇÃO PACTUADA E INTEGRADA DA ASSISTÊNCIA EM SAÚDE
Anexo LVIII CALENDÁRIO NACIONAL DE VACINAÇÃO
Anexo LIX CALENDÁRIO NACIONAL DE VACINAÇÃO DOS POVOS INDÍGENAS
Anexo LX CAMPANHAS NACIONAIS DE VACINAÇÃO
Anexo LXI INSTRUÇÃO NORMATIVA REFERENTE AO CALENDÁRIO NACIONAL DE VACINAÇÃO
Anexo LXII INSTRUÇÃO NORMATIVA REFERENTE AO CALENDÁRIO NACIONAL DE VACINAÇÃO DOS POVOS INDÍGENAS
Anexo LXIII TERMO DE RELATO CIRCUNSTANCIADO
Anexo LXV TERMO DE APROVAÇÃO DE PROCEDIMENTO DE INTERRUPÇÃO DA GRAVIDEZ RESULTANTE DE ESTUPRO
Anexo LXVI TERMO DE RESPONSABILIDADE
Anexo LXVIII NORMAS DE VIGILÂNCIA À SAÚDE DOS TRABALHADORES EXPOSTOS AO BENZENO
Anexo LXXII NORMAS PARA CADASTRAMENTO DE TRABALHADORES EXPOSTOS E EX-EXPOSTOS AO ASBESTO/AMIANTO
Anexo LXXIV NÚMERO DE HOSPITAIS PARA RECEBIMENTO DO INTEGRASUS
Anexo LXXV HOSPITAIS ESTRATÉGICOS - INTEGRASUS NIVEL C
Anexo LXXVI HOSPITAIS HABILITADOS PELO INTEGRASUS I - RECLASSIFICADOS COMO NÍVEL B
Anexo LXXVII DO PROGRAMA FARMÁCIA POPULAR DO BRASIL (PFPB)
CAPÍTULO I DISPOSIÇÕES GERAIS (art. 2º ao art. 3º)
CAPÍTULO II DA OPERACIONALIZAÇÃO E DO FUNCIONAMENTO DO PFPB (art. 4º ao art. 60)
Seção I Do "Aqui Tem Farmácia Popular" (art. 10 ao art. 52)
Subseção I Da Adesão ao PFPB Aqui Tem Farmácia Popular (art. 10 ao art. 15)
Subseção III Do Pagamento pelo Ministério da Saúde (art. 26 ao art. 30)
Subseção IV Da Identidade Visual e da Publicidade do PFPB (art. 31 ao art. 34)
Subseção V Do Controle, do Monitoramento e das Penalidades (art. 35 ao art. 43)
Seção II Da Dispensação dos Medicamentos e Correlatos nas Unidades da Rede Própria do PFPB (art. 53)
Seção III Do Modelo de Gestão da Rede Própria (art. 54 ao art. 60)
CAPÍTULO III DAS DISPOSIÇÕES FINAIS (art. 61 ao art. 62)
Anexo 2 do Anexo LXXVII ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR
Anexo 3 do Anexo LXXVII ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA
Anexo 5 do Anexo LXXVII MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR
Anexo LXXVIII NORMAS OPERACIONAIS DO PROGRAMA FARMÁCIA POPULAR DO BRASIL (PFPB)
CAPÍTULO I DAS DISPOSIÇÕES GERAIS (art. 2º ao art. 9º)
CAPÍTULO II DAS NORMAS DE OPERAÇÃO E FUNCIONAMENTO DO AQUI TEM FARMÁCIA POPULAR (art. 10 ao art. 59)
Seção I DA FINALIDADE (art. 10 ao art. 13)
Seção II DA ADESÃO AO PROGRAMA (art. 14 ao art. 20)
Seção IV DO PAGAMENTO PELO MINISTÉRIO DA SAÚDE (art. 33 ao art. 37)
Seção V DA IDENTIDADE VISUAL E DA PUBLICIDADE DO PROGRAMA (art. 38 ao art. 41)
Seção VI DO CONTROLE, DO MONITORAMENTO E DAS PENALIDADES (art. 42 ao art. 50)
CAPÍTULO III DAS NORMAS DE OPERAÇÃO E FUNCIONAMENTO DA REDE PRÓPRIA (art. 60 ao art. 69)
Seção II MODELO DE GESTÃO DA REDE PRÓPRIA (art. 63 ao art. 69)
CAPÍTULO IV DAS DISPOSIÇÕES GERAIS (art. 70 ao art. 72)
Anexo 2 do Anexo LXXVIII ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR
Anexo 3 do Anexo LXXVIII ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA
Anexo 5 do Anexo LXXVIII MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR
Anexo 7 do Anexo LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - DIGNIDADE MENSTRUAL
Anexo LXXIX INSTRUÇÃO NORMATIVA DE VIGILÂNCIA EM SAÚDE DO TRABALHADOR NO SUS
Anexo LXXX LISTA DE DOENÇAS RELACIONADAS AO TRABALHO
Anexo LXXXI PRINCÍPIOS GERAIS E CONDIÇÕES PARA O ADEQUADO ACOMPANHAMENTO PRÉ-NATAL
Anexo LXXXII PRINCÍPIOS GERAIS E CONDIÇÕES PARA A ADEQUADA ASSISTÊNCIA AO PARTO
Anexo LXXXIV FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES DO SISPRENATAL
Anexo LXXXV QUANTITATIVO DE CENTROS DE REFERÊNCIA EM TRATAMENTO DA DOR CRÔNICA - POR ESTADO
CAPÍTULO I DAS DISPOSIÇÕES GERAIS (art. 1º ao art. 14)
Seção I Do Programa Nacional de Apoio à Atenção Oncológica (Pronon) (art. 3º ao art. 6º)
Seção III Do Comitê Gestor do Pronon e do Pronas/PCD (art. 12 ao art. 14)
CAPÍTULO II DAS COMPETÊNCIAS (art. 15 ao art. 16)
CAPÍTULO III DO CREDENCIAMENTO E DO DESCREDENCIAMENTO (art. 17 ao art. 22)
Seção I Do Credenciamento das Instituições ao Pronon e ao Pronas/PCD (art. 17 ao art. 21)
Seção II Do Descredenciamento das Instituições Junto ao Pronon e ao Pronas/PCD (art. 22)
CAPÍTULO IV DOS PROJETOS NO ÂMBITO DO PRONON E DO PRONAS/PCD (art. 23 ao art. 56)
Seção I Da Apresentação de Projetos (art. 23 ao art. 43)
Subseção I Dos Projetos de Prestação de Serviços Médico-Assistenciais (art. 29 ao art. 31)
Subseção II Dos Projetos de Pesquisa (art. 32)
Subseção III Dos Projetos de Formação, Capacitação e Aperfeiçoamento de Recursos Humanos (art. 33)
Subseção IV Dos Projetos que Preveem a Realização de Reformas (art. 34 ao art. 35)
Seção II Das Vedações (art. 44 ao art. 46)
Seção III Da Análise do Projeto (art. 47 ao art. 53)
Seção IV Da Publicação do Resultado da Análise Técnica (art. 54 ao art. 56)
CAPÍTULO V DAS DOAÇÕES (art. 57 ao art. 79)
Seção II Da Transferência de Bens Móveis e Imóveis (art. 71 ao art. 72)
CAPÍTULO VI DA EXECUÇÃO DOS PROJETOS (art. 80 ao art. 88)
CAPÍTULO VII DO MONITORAMENTO, DA PRESTAÇÃO DE CONTAS E DA AVALIAÇÃO TÉCNICA (art. 89 ao art. 103)
Seção I Do Monitoramento (art. 89)
Seção II Da Prestação de Contas (art. 90 ao art. 95)
Seção III Da Análise da Prestação de Contas (art. 96 ao art. 103)
CAPÍTULO IX DA TOMADA DE CONTAS ESPECIAL (art. 108 ao art. 109)
CAPÍTULO X DISPOSIÇÕES FINAIS (art. 110 ao art. 114)
Anexo 4 do Anexo LXXXVI MODELO DE DECLARAÇÃO DE RESPONSABILIDADE
Anexo 5 do Anexo LXXXVI MODELO DE DECLARAÇÃO DE CAPACIDADE TÉCNICO-OPERATIVA
Anexo 6 do Anexo LXXXVI MODELO DE ORÇAMENTO
Anexo 8 do Anexo LXXXVI MODELO DE TERMO DE DOAÇÃO
Anexo 9 do Anexo LXXXVI MODELO DE PARECER TÉCNICO CONCLUSIVO
Anexo LXXXVII CRITÉRIOS E INDICAÇÕES PARA AUTOMONITORAMENTO DA GLICEMIA CAPILAR
Anexo XCI MODELO DE OFÍCIO DE ENCAMINHAMENTO DE PROJETO
Anexo XCII MODELO DE DECLARAÇÃO DE ADESÃO, ALIMENTAÇÃO E ATUALIZAÇÃO DO INFORSUS
CAPÍTULO I DAS DISPOSIÇÕES PRELIMINARES (art. 1º ao art. 2º)
CAPÍTULO II DAS COMPETÊNCIAS (art. 3º ao art. 8º)
Seção I Do Comitê Gestor do PROADI-SUS (art. 3º ao art. 4º)
Seção II Do Comitê Técnico do PROADI-SUS (art. 5º ao art. 6º)
Seção III Das Secretarias do Ministério da Saúde e Entidades Vinculadas (art. 7º ao art. 8º)
CAPÍTULO III DO TERMO DE AJUSTE (art. 9º ao art. 14)
CAPÍTULO IV DA APRESENTAÇÃO E APROVAÇÃO DOS PROJETOS DE APOIO (art. 15 ao art. 24)
Seção I Da Apresentação dos Projetos de Apoio (art. 16 ao art. 19)
Seção II Da Análise e Aprovação dos Projetos de Apoio (art. 20 ao art. 24)
Seção I Das Alterações dos Projetos de Apoio (art. 25)
Seção II Do Monitoramento dos Projetos de Apoio o (art. 26)
Seção III Da Avaliação dos Resultados dos Projetos de Apoio (art. 27)
CAPÍTULO VI DA PRESTAÇÃO DE SERVIÇOS AMBULATORIAIS E HOSPITALARES (art. 33 ao art. 39)
CAPÍTULO VII DA CERTIFICAÇÃO DA EXECUÇÃO DOS RECURSOS DE ISENÇÃO FISCAL (art. 40)
CAPÍTULO VIII DOS RECURSOS ADMINISTRATIVOS (art. 41 ao art. 44)
CAPÍTULO VIII-A DO RECONHECIMENTO DE EXCELÊNCIA DAS ENTIDADES DE SAÚDE (art. 44-A ao art. 44-Q)
Seção I Da Comissão de Avaliação de Excelência das Entidades de Saúde (art. 44-C ao art. 44-E)
Seção II Do requerimento do reconhecimento de excelência (art. 44-F ao art. 44-G)
Seção III Da avaliação de excelência das entidades de saúde (art. 44-H ao art. 44-M)
CAPÍTULO IX DISPOSIÇÕES FINAIS E TRANSITÓRIAS (art. 45 ao art. 49)
Anexo 1 do Anexo XCIII MINUTA DE TERMO DE AJUSTE
Anexo 2 do Anexo XCIII MODELO PARA APRESENTAÇÃO DE CARTA CONSULTA AO PROADI-SUS
Anexo 3 do Anexo XCIII MODELO DE FORMULÁRIO DE ANÁLISE DA CARTA CONSULTA
Anexo 4 do Anexo XCIII MODELO PARA APRESENTAÇÃO DE PROPOSTA DE PROJETO DEMANDADO
Anexo 5 do Anexo XCIII MODELO PARA APRESENTAÇÃO DE PROJETOS REFERENTES AO PROADI-SUS
Anexo 6 do Anexo XCIII MODELO DE PARECER TÉCNICO PARA ANÁLISE DE PROJETO
Anexo 7 do Anexo XCIII MODELO DE TERMO DE DOAÇÃO
Anexo 8 do Anexo XCIII MODELO PARA APRESENTAÇÃO DE DECLARAÇÃO DE ANUÊNCIA DO GESTOR LOCAL
CAPÍTULO I DAS DISPOSIÇÕES GERAIS (art. 1º ao art. 3º)
CAPÍTULO II DA LISTA DE PRODUTOS ESTRATÉGICOS PARA O SUS (art. 4º ao art. 8º)
CAPÍTULO III DOS SUJEITOS PARTICIPANTES DA PDP (art. 9º)
CAPÍTULO IV DO PROCESSO (art. 10 ao art. 60)
Seção I Da Proposta de Projeto de PDP (art. 11 ao art. 42)
Subseção I Das Diretrizes e dos Requisitos para a Elaboração de Proposta de Projeto de PDP (art. 14)
Subseção II Das Instâncias de Avaliação da Proposta de Projeto de PDP (art. 15 ao art. 21)
Subseção III Dos Critérios de Análise de Proposta de Projeto de PDP (art. 22 ao art. 24)
Subseção V Do Processo de Avaliação e Decisório da Proposta de Projeto de PDP (art. 32 ao art. 42)
Seção II Do Projeto de PDP (art. 43 ao art. 50)
Seção III Da PDP (art. 51 ao art. 58)
Seção IV Da Internalização da Tecnologia (art. 59 ao art. 60)
CAPÍTULO V DO MONITORAMENTO E AVALIAÇÃO (art. 61 ao art. 65)
CAPÍTULO VI DAS RESPONSABILIDADES INSTITUCIONAIS (art. 66 ao art. 69)
Anexo XCVI PROGRAMA NACIONAL DE COMPETITIVIDADE EM VACINAS (INOVACINA)
Anexo XCIX CADERNO DE INDICADORES DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE
TÍTULO I DAS DISPOSIÇÕES INICIAIS (art. 2º ao art. 11)
CAPÍTULO I DA FINALIDADE E DA ABRANGÊNCIA (art. 2º ao art. 3º)
CAPÍTULO II DAS DEFINIÇÕES (art. 4º)
CAPÍTULO III DAS RESPONSABILIDADES (art. 5º ao art. 11)
CAPÍTULO I DO PLANEJAMENTO (art. 12 ao art. 16)
CAPÍTULO II DA EXECUÇÃO (art. 17 ao art. 32)
CAPÍTULO III DA AVALIAÇÃO (art. 33)
TÍTULO III DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS (art. 34 ao art. 36)
Anexo 1 do Anexo CII FATORES PARA CARACTERIZAÇÃO DE UM EVENTO DE MASSA
Anexo 2 do Anexo CII CRITÉRIOS PARA AVALIAÇÃO DO RISCO EM EVENTOS DE MASSA
Anexo [1] do Anexo CIII DO PROGRAMA DE PROTEÇÃO E PROMOÇÃO DA SAÚDE MENSTRUAL
Anexo 2 do Anexo CIII DO PROGRAMA MÉDICOS PELO BRASIL
Anexo 3 do Anexo CIII MODELO DE DECLARAÇÃO DE CONFLITO DE INTERESSES - CTA-QUALISUS CARDIO
Anexo CIV DO INCREMENTO FINANCEIRO PARA QUALIDADE DO SISTEMA NACIONAL DE TRANSPLANTES
Anexo CV DO PROGRAMA NACIONAL DE ACESSO À ÁGUA POTÁVEL EM TERRAS INDÍGENAS - PNATI
Anexo CVI DO FÓRUM DE ARTICULAÇÃO COM A SOCIEDADE CIVIL - FAS
Anexo CVIII DO PROGRAMA SUS DIGITAL
Anexo CIX DO PROGRAMA DE DESENVOLVIMENTO E INOVAÇÃO LOCAL - PDIL
Anexo CX DO PROGRAMA DE PARCERIAS PARA O DESENVOLVIMENTO PRODUTIVO - PDP
Anexo CXI PROGRAMA NACIONAL DE PROMOÇÃO, PROTEÇÃO E APOIO À AMAMENTAÇÃO
Voltar ao início do SumarioPortaria de ConsolidaÇÃo nº 5, de 28 de Setembro de 2017
Consolidação das normas sobre as ações e os serviços de saúde do Sistema Único de Saúde.
O MINISTRO DE ESTADO DA SAÚDE, no uso das atribuições que lhe confere o art. 87, parágrafo único, incisos I e II, da Constituição, resolve:
Art. 1º As ações e serviços de saúde do Sistema Único de Saúde (SUS) obedecerão ao disposto nesta Portaria.
TÍTULO I
DA PROMOÇÃO, PROTEÇÃO E RECUPERAÇÃO DA SAÚDE
CAPÍTULO I
DA PROMOÇÃO DA SAÚDE
Seção I
Do Programa Academia da Saúde
Art. 2º Fica instituído o Programa Academia da Saúde no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2681/2013, Art. 1º)
Art. 3º O Programa Academia da Saúde tem como objetivo principal contribuir para a promoção da saúde e produção do cuidado e de modos de vida saudáveis da população a partir da implantação de polos com infraestrutura e profissionais qualificados. (Origem: PRT MS/GM 2681/2013, Art. 2º)
Parágrafo Único. Os polos do Programa Academia da Saúde são espaços públicos construídos para o desenvolvimento das ações do programa, segundo os eixos descritos no art. 7º e em conformidade com os objetivos, princípios e diretrizes previstos nesta Seção. (Origem: PRT MS/GM 2681/2013, Art. 2º, Parágrafo Único)
Art. 4º São diretrizes do Programa Academia da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 3º)
I - configurar-se como ponto de atenção da Rede de Atenção à Saúde, complementar e potencializador das ações de cuidados individuais e coletivos na atenção básica; (Origem: PRT MS/GM 2681/2013, Art. 3º, I)
II - referenciar-se como um programa de promoção da saúde, prevenção e atenção das doenças crônicas não transmissíveis; e (Origem: PRT MS/GM 2681/2013, Art. 3º, II)
III - estabelecer-se como espaço de produção, ressignificação e vivência de conhecimentos favoráveis à construção coletiva de modos de vida saudáveis. (Origem: PRT MS/GM 2681/2013, Art. 3º, III)
Art. 5º São princípios do Programa Academia da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 4º)
I - participação popular e construção coletiva de saberes e práticas em promoção da saúde; (Origem: PRT MS/GM 2681/2013, Art. 4º, I)
II - intersetorialidade na construção e desenvolvimento das ações; (Origem: PRT MS/GM 2681/2013, Art. 4º, II)
III - interdisciplinaridade na produção do conhecimento e do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 4º, III)
IV - integralidade do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 4º, IV)
V - intergeracionalidade, promovendo o diálogo e troca entre gerações; e (Origem: PRT MS/GM 2681/2013, Art. 4º, V)
VI - territorialidade, reconhecendo o espaço como local de produção da saúde. (Origem: PRT MS/GM 2681/2013, Art. 4º, VI)
Parágrafo Único. O Programa Academia da Saúde também segue os princípios, diretrizes e objetivos da Política Nacional de Promoção da Saúde (PNPS) e da Política Nacional de Atenção Básica (PNAB). (Origem: PRT MS/GM 2681/2013, Art. 4º, Parágrafo Único)
Art. 6º São objetivos específicos do Programa Academia da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 5º)
I - ampliar o acesso da população às políticas públicas de promoção da saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, I)
II - fortalecer a promoção da saúde como estratégia de produção de saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, II)
III - desenvolver a atenção à saúde nas linhas de cuidado, a fim de promover o cuidado integral; (Origem: PRT MS/GM 2681/2013, Art. 5º, III)
IV - promover práticas de educação em saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, IV)
V - promover ações intersetoriais com outros pontos de atenção da Rede de Atenção à Saúde e outros equipamentos sociais do território; (Origem: PRT MS/GM 2681/2013, Art. 5º, V)
VI - potencializar as ações nos âmbitos da atenção básica, da vigilância em saúde e da promoção da saúde; (Origem: PRT MS/GM 2681/2013, Art. 5º, VI)
VII - promover a integração multiprofissional na construção e na execução das ações; (Origem: PRT MS/GM 2681/2013, Art. 5º, VII)
VIII - promover a convergência de projetos ou programas nos âmbitos da saúde, educação, cultura, assistência social, esporte e lazer; (Origem: PRT MS/GM 2681/2013, Art. 5º, VIII)
IX - ampliar a autonomia dos indivíduos sobre as escolhas de modos de vida mais saudáveis; (Origem: PRT MS/GM 2681/2013, Art. 5º, IX)
X - aumentar o nível de atividade física da população; (Origem: PRT MS/GM 2681/2013, Art. 5º, X)
XI - promover hábitos alimentares saudáveis; (Origem: PRT MS/GM 2681/2013, Art. 5º, XI)
XII - promover mobilização comunitária com a constituição de redes sociais de apoio e ambientes de convivência e solidariedade; (Origem: PRT MS/GM 2681/2013, Art. 5º, XII)
XIII - potencializar as manifestações culturais locais e o conhecimento popular na construção de alternativas individuais e coletivas que favoreçam a promoção da saúde; e (Origem: PRT MS/GM 2681/2013, Art. 5º, XIII)
XIV - contribuir para ampliação e valorização da utilização dos espaços públicos de lazer, como proposta de inclusão social, enfrentamento das violências e melhoria das condições de saúde e qualidade de vida da população. (Origem: PRT MS/GM 2681/2013, Art. 5º, XIV)
Art. 7º As atividades desenvolvidas no âmbito do Programa Academia da Saúde serão desenvolvidas conforme os seguintes eixos: (Origem: PRT MS/GM 2681/2013, Art. 6º)
I - práticas corporais e atividades físicas; (Origem: PRT MS/GM 2681/2013, Art. 6º, I)
II - produção do cuidado e de modos de vida saudáveis; (Origem: PRT MS/GM 2681/2013, Art. 6º, II)
III - promoção da alimentação saudável; (Origem: PRT MS/GM 2681/2013, Art. 6º, III)
IV - práticas integrativas e complementares; (Origem: PRT MS/GM 2681/2013, Art. 6º, IV)
V - práticas artísticas e culturais; (Origem: PRT MS/GM 2681/2013, Art. 6º, V)
VI - educação em saúde; (Origem: PRT MS/GM 2681/2013, Art. 6º, VI)
VII - planejamento e gestão; e (Origem: PRT MS/GM 2681/2013, Art. 6º, VII)
VIII - mobilização da comunidade. (Origem: PRT MS/GM 2681/2013, Art. 6º, VIII)
Art. 8º O Programa Academia da Saúde será implantado pelas Secretarias de Saúde do Distrito Federal e dos Municípios, com o apoio das Secretarias Estaduais de Saúde e do Ministério da Saúde. (Origem: PRT MS/GM 2681/2013, Art. 7º)
Art. 9º Compete ao Ministério da Saúde: (Origem: PRT MS/GM 2681/2013, Art. 8º)
I - elaborar diretrizes para implantação e funcionamento do Programa Academia da Saúde em âmbito nacional no SUS; (Origem: PRT MS/GM 2681/2013, Art. 8º, I)
II - elaborar normas técnicas do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, II)
III - definir recursos orçamentários e financeiros para a implantação do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, III)
IV - estimular pesquisas nas áreas de interesse para o Programa Academia da Saúde, em especial aquelas consideradas estratégicas para formação e desenvolvimento tecnológico para a promoção da saúde e produção do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 8º, IV)
V - estabelecer diretrizes para a educação permanente na área da promoção da saúde e da produção do cuidado, em consonância com as políticas de saúde vigentes; (Origem: PRT MS/GM 2681/2013, Art. 8º, V)
VI - manter articulação com os Estados para estimular a implantação de apoio aos Municípios para execução do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, VI)
VII - apoiar os Estados e o Distrito Federal no âmbito do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, VII)
VIII - promover articulação intersetorial para a efetivação do Programa Academia da Saúde com as outras políticas correlatas em âmbito nacional; (Origem: PRT MS/GM 2681/2013, Art. 8º, VIII)
IX - realizar monitoramento das propostas habilitadas para construção de polos do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 8º, IX)
X - propor instrumentos e indicadores para acompanhamento e avaliação do impacto da implantação do Programa Academia da Saúde no Distrito Federal e nos Municípios; (Origem: PRT MS/GM 2681/2013, Art. 8º, X)
XI - divulgar o Programa Academia da Saúde nos diferentes espaços colegiados do SUS e da sociedade; (Origem: PRT MS/GM 2681/2013, Art. 8º, XI)
XII - identificar experiências exitosas e promover o intercâmbio das tecnologias produzidas entre o Distrito Federal e os Municípios com o Programa Academia da Saúde; e (Origem: PRT MS/GM 2681/2013, Art. 8º, XII)
XIII - fortalecer a construção de Comunidade de Práticas no SUS. (Origem: PRT MS/GM 2681/2013, Art. 8º, XIII)
Art. 10. Compete às Secretarias de Saúde dos Estados e do Distrito Federal: (Origem: PRT MS/GM 2681/2013, Art. 9º)
I - apoiar os Municípios situados no respectivo Estado na implantação e no desenvolvimento do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 9º, I)
II - promover articulação intersetorial para a implantação do Programa Academia da Saúde no âmbito estadual; (Origem: PRT MS/GM 2681/2013, Art. 9º, II)
III - definir recursos orçamentários e financeiros para a construção de polos e para a manutenção do Programa Academia da Saúde, conforme pactuação e quando necessário; (Origem: PRT MS/GM 2681/2013, Art. 9º, III)
IV - pactuar, junto aos Municípios, os instrumentos e indicadores complementares para o acompanhamento e avaliação do impacto da implantação do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 9º, IV)
V - estimular pesquisas nas áreas de interesse para o Programa Academia da Saúde, em especial aquelas consideradas estratégicas para formação e desenvolvimento tecnológico para a promoção da saúde e produção do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 9º, V)
VI - identificar experiências exitosas e promover o intercâmbio das tecnologias produzidas entre os Municípios; (Origem: PRT MS/GM 2681/2013, Art. 9º, VI)
VII - monitorar e avaliar o Programa Academia da Saúde no âmbito distrital e estadual junto aos Municípios; e (Origem: PRT MS/GM 2681/2013, Art. 9º, VII)
VIII - divulgar o Programa Academia da Saúde nos diferentes espaços colegiados do SUS e da sociedade. (Origem: PRT MS/GM 2681/2013, Art. 9º, VIII)
Art. 11. Compete às Secretarias de Saúde do Distrito Federal e dos Municípios: (Origem: PRT MS/GM 2681/2013, Art. 10)
I - implantar o Programa Academia da Saúde no âmbito distrital e municipal; (Origem: PRT MS/GM 2681/2013, Art. 10, I)
II - executar os recursos financeiros de investimento repassados pelo Ministério da Saúde para a construção de polos do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, II)
III - inserir o Programa Academia da Saúde no Plano Municipal de Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, III)
IV - definir recursos orçamentários e financeiros para a construção de polos e manutenção do Programa Academia da Saúde, conforme pactuação e quando necessário; (Origem: PRT MS/GM 2681/2013, Art. 10, IV)
V - apresentar o Programa Academia da Saúde ao respectivo Conselho de Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, V)
VI - elaborar fluxos para o funcionamento do Programa Academia da Saúde na rede distrital ou municipal e propor fluxos regionais de saúde na Comissão Intergestores Regional; (Origem: PRT MS/GM 2681/2013, Art. 10, VI)
VII - promover articulação intersetorial para a efetivação do Programa Academia da Saúde no âmbito distrital e municipal; (Origem: PRT MS/GM 2681/2013, Art. 10, VII)
VIII - estimular alternativas inovadoras e socialmente contributivas ao desenvolvimento sustentável de comunidades; (Origem: PRT MS/GM 2681/2013, Art. 10, VIII)
IX - estabelecer mecanismos para a qualificação dos profissionais do sistema local de saúde na área da promoção da saúde e produção do cuidado; (Origem: PRT MS/GM 2681/2013, Art. 10, IX)
X - estabelecer instrumentos de gestão e indicadores complementares para o acompanhamento e avaliação do impacto da implantação do Programa Academia da Saúde; (Origem: PRT MS/GM 2681/2013, Art. 10, X)
XI - garantir o registro das atividades desenvolvidas no Programa; (Origem: PRT MS/GM 2681/2013, Art. 10, XI)
XII - utilizar o Sistema de Informação em Saúde para a Atenção Básica (SISAB) para envio de informações das atividades ao Ministério da Saúde ou outro sistema de informação vigente, observando-se os prazos determinados na Seção IV do Capítulo III do Título VII da Portaria de Consolidação nº 1; (Origem: PRT MS/GM 2681/2013, Art. 10, XII)
XIII - estimular pesquisas nas áreas de interesse para o Programa Academia da Saúde, em especial aquelas consideradas estratégicas para a formação e o desenvolvimento tecnológico para a promoção da saúde e produção do cuidado; e (Origem: PRT MS/GM 2681/2013, Art. 10, XIII)
XIV - divulgar o Programa Academia da Saúde nos diferentes espaços colegiados do SUS e da sociedade. (Origem: PRT MS/GM 2681/2013, Art. 10, XIV)
Art. 12. O Programa Academia da Saúde é um serviço da Atenção Básica e deve promover a articulação com toda a rede de atenção à saúde do SUS, bem como com outros serviços sociais realizados na respectiva região. (Origem: PRT MS/GM 2681/2013, Art. 11)
Art. 13. As atividades do Programa Academia da Saúde também serão desenvolvidas por profissionais da Atenção Básica, inclusive aqueles que atuam na Estratégia Saúde da Família e nos Núcleos de Apoio à Saúde da Família, quando houver. (Origem: PRT MS/GM 2681/2013, Art. 12)
Parágrafo Único. Além dos profissionais mínimos da equipe, o Distrito Federal e os Municípios poderão acrescentar profissional(ais) de outras áreas de conhecimento para o desenvolvimento de atividades afins aos objetivos, princípios e diretrizes do Programa Academia da Saúde. (Origem: PRT MS/GM 2681/2013, Art. 12, Parágrafo Único)
Art. 14. Fica recomendado ao Distrito Federal e aos Municípios a constituição de grupo de apoio à gestão para cada polo implantado, formado pelos profissionais que atuam no Programa Academia da Saúde e na Atenção Básica da área de abrangência do polo, por representantes do controle social e por profissionais de outras áreas envolvidas no Programa, a fim de garantir a gestão compartilhada do espaço e a organização das atividades. (Origem: PRT MS/GM 2681/2013, Art. 13)
Art. 15. O Programa Academia da Saúde será desenvolvido nos espaços dos polos, não havendo impedimento para extensão das atividades a outros equipamentos da saúde ou sociais. (Origem: PRT MS/GM 2681/2013, Art. 14)
Art. 16. Os recursos destinados à infraestrutura do polo do Programa Academia da Saúde poderão ser provenientes de recursos próprios da União, dos Estados, do Distrito Federal e dos Municípios, conforme pactuação. (Origem: PRT MS/GM 2681/2013, Art. 15)
Art. 17. É livre à iniciativa privada a reprodução total ou parcial de quaisquer das modalidades dos polos do Programa Academia da Saúde em espaços próprios, não havendo, porém, disponibilização de recursos financeiros de investimento e de custeio do Poder Público para tais fins. (Origem: PRT MS/GM 2681/2013, Art. 16)
Subseção I
Das Disposições Gerais
(Origem: PRT MS/GM 1707/2016, CAPÍTULO I)
Art. 18. Ficam definidos as regras e os critérios referentes aos incentivos financeiros de investimento para construção de polos; fica unificado o repasse do incentivo financeiro de custeio por meio do Piso Variável da Atenção Básica (PAB Variável); e ficam definidos os critérios de similaridade entre Programas em desenvolvimento no Distrito Federal e nos municípios e o Programa Academia da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 1º)
Art. 19. O Programa Academia da Saúde será desenvolvido nas seguintes modalidades de polos, a serem construídas pelo Distrito Federal e pelos municípios interessados, observadas as estruturas do Anexo I : (Origem: PRT MS/GM 1707/2016, Art. 2º)
I - Modalidade Básica; (Origem: PRT MS/GM 1707/2016, Art. 2º, I)
II - Modalidade Intermediária; e (Origem: PRT MS/GM 1707/2016, Art. 2º, II)
III - Modalidade Ampliada. (Origem: PRT MS/GM 1707/2016, Art. 2º, III)
§ 1º Os polos do Programa Academia da Saúde serão construídos pelo município ou Distrito Federal interessado, em conformidade com as estruturas físicas mínimas definidas no Anexo I . (Origem: PRT MS/GM 1707/2016, Art. 2º, § 1º)
§ 2º É facultada aos municípios e Distrito Federal a inclusão de equipamentos na área descoberta, dispostos no Anexo II , não podendo os mesmos serem substituídos por outros tipos. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 2º)
§ 3º É vedada a substituição dos equipamentos previstos no Anexo II por outros não previstos na regulamentação do Programa Academia da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 3º)
§ 4º Os polos do Programa Academia da Saúde deverão ser construídos na área de abrangência territorial do estabelecimento de saúde de referência no âmbito da Atenção Básica. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 4º)
§ 5º Para fins do disposto no § 4º, o polo da Modalidade Básica, tendo em vista sua estrutura reduzida, deverá ser construído em um raio de até 100 (cem) metros do estabelecimento de saúde de referência. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 5º)
§ 6º O polo do Programa Academia da Saúde deverá ser identificado utilizando padrões visuais do Programa Academia da Saúde, apresentados no Manual de Identidade Visual (MIV) do Programa Academia da Saúde, disponível no endereço eletrônico www.saude.gov.br/academiadasaude. (Origem: PRT MS/GM 1707/2016, Art. 2º, § 6º)
Art. 20. As ações desenvolvidas em cada polo do Programa Academia da Saúde deverão somar, no mínimo, 40 (quarenta) horas semanais, com garantia de funcionamento do polo em, pelo menos, 2 (dois) turnos diários, em horários definidos a partir da necessidade da população e do território. (Origem: PRT MS/GM 1707/2016, Art. 3º)
Art. 21. O gestor de saúde poderá ampliar, a qualquer momento, o número de profissionais vinculados ao Programa Academia da Saúde, respeitando a lista do Anexo III . (Origem: PRT MS/GM 1707/2016, Art. 4º)
Art. 22. O gestor de saúde deverá estimular que as equipes da Atenção Básica, especialmente as equipes do NASF, quando houver, desenvolvam ações no polo de forma compartilhada com o(s) profissional(is) do Programa Academia da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 5º)
Art. 23. Os municípios e Distrito Federal interessados em implantar o Programa Academia da Saúde, a partir da data de publicação da Portaria nº 1707/GM/MS, de 23 de setembro de 2016, farão jus aos seguintes incentivos financeiros: (Origem: PRT MS/GM 1707/2016, Art. 6º)
I - de investimento, para construção de polos do Programa Academia da Saúde, regido pela Subseção II da Seção I do Capítulo I do Título I; e (Origem: PRT MS/GM 1707/2016, Art. 6º, I)
II - de custeio, para a manutenção dos polos do Programa Academia da Saúde, regido pelo Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 6º, II)
Subseção II
Do Incentivo Financeiro de Investimento do Programa Academia da Saúde
(Origem: PRT MS/GM 1707/2016, CAPÍTULO II)
Art. 24. O ente federativo habilitado poderá solicitar ao DAB/SAS/MS a alteração do local ou endereço da construção do polo do Programa Academia da Saúde, desde que: (Origem: PRT MS/GM 1707/2016, Art. 13)
I - o pedido de alteração de endereço seja efetuado antes do recebimento da 2ª parcela do incentivo de investimento; (Origem: PRT MS/GM 1707/2016, Art. 13, I)
II - realize a inserção no SISMOB dos documentos e informações relativas aos novos endereços; e (Origem: PRT MS/GM 1707/2016, Art. 13, II)
III - realize a inserção no SISMOB, caso o novo endereço de construção do polo do Programa Academia da Saúde acarrete também a mudança do seu estabelecimento de referência no âmbito da Atenção Básica, dos seguintes documentos e informações: (Origem: PRT MS/GM 1707/2016, Art. 13, III)
a) novo número de habitantes a serem cobertos pelo polo do Programa Academia da Saúde; e (Origem: PRT MS/GM 1707/2016, Art. 13, III, a)
b) número registrado no SCNES do novo estabelecimento de referência no âmbito da Atenção Básica da área de abrangência do polo. (Origem: PRT MS/GM 1707/2016, Art. 13, III, b)
Parágrafo Único. O novo local ou endereço para o qual é solicitada a construção do polo do Programa Academia da Saúde deverá estar em conformidade com as estruturas e respectivas áreas definidas no Anexo I e com a modalidade contemplada na proposta. (Origem: PRT MS/GM 1707/2016, Art. 13, Parágrafo Único)
Art. 25. As informações de monitoramento sobre o início, a execução, o andamento e a conclusão da obra do polo do Programa Academia da Saúde serão inseridas no SISMOB pelo ente federativo habilitado, sendo de responsabilidade do gestor de saúde a permanente e contínua atualização desses dados no mínimo uma vez a cada 30 (trinta) dias, responsabilizando-se ainda pela veracidade e qualidade dos dados fornecidos. (Origem: PRT MS/GM 1707/2016, Art. 14)
§ 1º Na hipótese de inexistência de modificação das informações descritas neste artigo até 60 (sessenta) dias após a última inserção de dados, o ente federativo habilitado, ainda assim, fica obrigado a acessar o SISMOB para registro dessa atividade pelo próprio sistema informatizado. (Origem: PRT MS/GM 1707/2016, Art. 14, § 1º)
§ 2º O monitoramento de que trata o "caput" não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 1707/2016, Art. 14, § 2º)
Art. 26. Caso o gestor de saúde responsável não providenciar a regularização da alimentação ou atualização das informações no SISMOB por 60 (sessenta) dias consecutivos, o DAB/SAS/MS adotará as medidas necessárias à suspensão do repasse dos recursos financeiros do Ministério da Saúde ao respectivo ente federativo para a execução do respectivo programa ou estratégia, a qual perdurará até o saneamento da mencionada irregularidade. (Origem: PRT MS/GM 1707/2016, Art. 15)
Parágrafo Único. Regularizada a causa que ensejou a suspensão do repasse de recursos financeiros de que trata o "caput", o DAB/SAS/MS providenciará a regularização das transferências dos recursos. (Origem: PRT MS/GM 1707/2016, Art. 15, Parágrafo Único)
Art. 27. Com o término da obra objeto do incentivo financeiro de investimento de que trata esta Subseção, o ente federativo habilitado assumirá a manutenção preventiva do respectivo polo do Programa Academia da Saúde pelo prazo mínimo de 5 (cinco) anos, como condição para continuar no Programa e, depois desse prazo, para receber eventuais novos recursos financeiros. (Origem: PRT MS/GM 1707/2016, Art. 16)
Art. 28. As despesas para construção dos polos do Programa Academia da Saúde são de responsabilidade compartilhada, de forma tripartite, entre a União, os estados, o Distrito Federal e os municípios. (Origem: PRT MS/GM 1707/2016, Art. 17)
§ 1º A complementação dos recursos financeiros repassados pelo Ministério da Saúde é de responsabilidade conjunta dos estados e dos municípios, em conformidade com a pactuação estabelecida na respectiva CIB. (Origem: PRT MS/GM 1707/2016, Art. 17, § 1º)
§ 2º Caso o custo final da construção do polo do Programa Academia da Saúde seja superior ao incentivo financeiro de investimento repassado pelo Ministério da Saúde para cada modalidade, nos termos desta Subseção, a respectiva diferença de valores deverá ser custeada pelo próprio município, pelo Distrito Federal ou pelo estado, conforme pactuação. (Origem: PRT MS/GM 1707/2016, Art. 17, § 2º)
Subseção III
Dos Critérios de Similaridade entre Programa em Desenvolvimento no Distrito Federal e nos Municípios e o Programa Academia da Saúde
(Origem: PRT MS/GM 1707/2016, CAPÍTULO IV)
Art. 29. Poderão pleitear o credenciamento ao recebimento do incentivo financeiro de custeio de que trata a Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6, na condição de programa similar ao Programa Academia da Saúde, conforme disposto no art. 136, III da Portaria de Consolidação nº 6, as iniciativas locais que: (Origem: PRT MS/GM 1707/2016, Art. 25)
I - estejam em desenvolvimento sob a gestão da Secretaria Municipal de Saúde ou da Secretaria de Saúde do Distrito Federal; (Origem: PRT MS/GM 1707/2016, Art. 25, I)
II - possuam profissional(is) em atuação no programa similar conforme lista de códigos da CBO descrita no Anexo III, sendo pelo menos 1 (um) profissional com carga horária de 40 (quarenta) horas semanais ou 2 (dois) profissionais com carga horária mínima de 20 (vinte) horas semanais cada, o(s) qual(is) desenvolverá(ão) atividades no programa similar ao Programa Academia da Saúde; (Origem: PRT MS/GM 1707/2016, Art. 25, II)
III - desenvolvam as ações previstas no art. 7º; (Origem: PRT MS/GM 1707/2016, Art. 25, III)
IV - possuam estrutura física construída ou adaptada exclusivamente para o Programa, semelhante ou igual a uma das modalidades de polo do Programa Academia da Saúde prevista no art. 19 e localizada em território coberto pelas ações da Atenção Básica; e (Origem: PRT MS/GM 1707/2016, Art. 25, IV)
V - ofertem ações por, no mínimo, 40 (quarenta) horas semanais, com garantia de funcionamento do polo em, pelo menos, 2 (dois) turnos diários, em horários definidos a partir da necessidade da população e do território. (Origem: PRT MS/GM 1707/2016, Art. 25, V)
Parágrafo Único. Não serão consideradas estruturas físicas semelhantes às modalidades de polo do Programa Academia da Saúde: (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único)
I - estabelecimentos de ensino; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, I)
II - locais de práticas religiosas; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, II)
III - equipamentos esportivos, tais como ginásios, quadras esportivas e poliesportivas; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, III)
IV - clubes municipais ou comunitários de esporte, lazer e recreação; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, IV)
V - centro de treinamento desportivo; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, V)
VI - centro social urbano; (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, VI)
VII - conjunto de equipamentos para exercícios físicos resistidos dispostos em praças, parques e clubes; e (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, VII)
VIII - parques, praças e clubes em geral. (Origem: PRT MS/GM 1707/2016, Art. 25, Parágrafo Único, VIII)
Art. 30. Para pleitear o credenciamento ao recebimento do incentivo financeiro de custeio de que trata a Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6 destinado ao custeio de polos similares aos do Programa Academia da Saúde, serão observados os procedimentos dispostos no art. 137 da Portaria de Consolidação nº 6, no que couber. (Origem: PRT MS/GM 1707/2016, Art. 26)
Parágrafo Único. No momento da solicitação de recebimento do incentivo financeiro de custeio, na forma do "caput", o município ou Distrito Federal deverá informar o(s) SCNES do(s) polo(s) ou ao Estabelecimento de Atenção Básica onde a estrutura de apoio ao Programa esteja localizada. (Origem: PRT MS/GM 1707/2016, Art. 26, Parágrafo Único)
Art. 31. A habilitação ao credenciamento do incentivo financeiro de custeio de polos similares aos do Programa Academia da Saúde ocorrerá nos moldes do Anexo LXXV . (Origem: PRT MS/GM 1707/2016, Art. 27)
Art. 32. Para a manutenção do recebimento do incentivo financeiro de custeio, pelo Distrito Federal e municípios, destinado aos polos similares aos do Programa Academia da Saúde, será observado o disposto nos arts. 140 e 141 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 28)
Subseção IV
Das Disposições Transitórias
(Origem: PRT MS/GM 1707/2016, CAPÍTULO V)
Art. 33. Para as propostas de construção, ainda não concluídas, de polos do Programa Academia da Saúde habilitadas em 2013, 2014 e 2015, nos termos da Portaria nº 2.684/GM/MS, de 2013, serão observados os prazos dispostos no art. 805 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 29)
Art. 34. Para as propostas de construção de polos do Programa Academia da Saúde habilitadas em 2011 e 2012, nos termos da Portaria nº 2.684/GM/MS, de 8 de novembro de 2013, o repasse dos recursos financeiros será realizado mediante cumprimento § 4º do art. 19, das alíneas "c" e "d" do inciso II, alíneas "c" e "d" do inciso III e § 2º, todos do art. 804 da Portaria de Consolidação nº 6, bem como o art. 806 da Portaria de Consolidação nº 6 e os arts. 24, 25, 26, 27 e 28 , e, ainda, inserir no Sistema de Cadastro de Propostas Fundo a Fundo, disponível no endereço eletrônico www.fns.saude.gov.br, os seguintes documentos: (Origem: PRT MS/GM 1707/2016, Art. 30)
I - ordem de Serviço, assinada por profissional habilitado pelo CREA ou CAU, ratificada pelo gestor local e encaminhada à CIB ou CGSES/DF através de oficio, para solicitar a segunda parcela; e (Origem: PRT MS/GM 1707/2016, Art. 30, I)
II - atestado de Conclusão da Edificação, assinada por profissional habilitado pelo CREA ou CAU, ratificada pelo gestor local e encaminhada à CIB ou CGSES/DF através de Oficio, para solicitação da terceira parcela. (Origem: PRT MS/GM 1707/2016, Art. 30, II)
Parágrafo Único. O repasse da segunda e terceira parcelas de que tratam os incisos II e III do art. 804 da Portaria de Consolidação nº 6 apenas ocorrerá após análise e aprovação pelo DAB/SAS/MS das informações e dos documentos inseridos no Sistema do Fundo Nacional de Saúde e no SISMOB pelo ente federativo. (Origem: PRT MS/GM 1707/2016, Art. 30, Parágrafo Único)
Art. 35. Os polos do Programa da Academia da Saúde habilitados ao recebimento do incentivo de custeio nos termos da Portaria nº 2.684/GM/MS, de 8 de novembro de 2013 e da Portaria nº 183/GM/MS, de 30 de janeiro de 2014, serão regidos nos termos da regulamentação inaugurada com a publicação da Portaria nº 1.707/GM/MS, de 23 de setembro de 2016. (Origem: PRT MS/GM 1707/2016, Art. 31)
§ 1º Todos os polos custeados e habilitados nos termos da Portaria nº 2.684/GM/MS, de 2013, e da Portaria nº 183/GM/MS, de 30 de janeiro de 2014, passarão a receber, a partir da publicação da Portaria nº 1.707/GM/MS, de 23 de setembro de 2016, o incentivo financeiro de custeio de que trata a Seção VI do Capítulo II do Título II da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 31, § 1º)
§ 2º Os entes federativos com polos custeados fundo a fundo no Piso Varável da Vigilância em Saúde deverão proceder com o cadastro de proposta de custeio no sistema do Ministério da Saúde informado no endereço eletrônico www.saude.gov.br/academiadasaude, para fins de unificação do banco de informação. (Origem: PRT MS/GM 1707/2016, Art. 31, § 2º)
§ 3º O Distrito Federal e os municípios que se enquadrem na hipótese do § 2º e possuam mais de um polo custeados, nos termos da Portaria nº 2.684/GM/MS, de 2013, poderão cadastrar proposta de custeio para os demais polos, observado o disposto nos arts. 137, 138 e 139 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 31, § 3º)
Subseção V
Das Disposições Finais
(Origem: PRT MS/GM 1707/2016, CAPÍTULO VI)
Art. 36. O Distrito Federal e os municípios observarão o prazo que consta na Seção IV do Capítulo III do Título VII da Portaria de Consolidação nº 1, e suas alterações, para a operacionalização da estratégia e-SUSAB, por meio da utilização dos sistemas Coleta de Dados Simplificados (e-SUS CDS) e Prontuário Eletrônico do Cidadão (e-SUSAB PEC) e do Sistema de Informação em Saúde para a Atenção Básica (SISAB), para fins de financiamento e de adesão aos programas e estratégias da Política Nacional de Atenção Básica. (Origem: PRT MS/GM 1707/2016, Art. 32)
Art. 37. O monitoramento e a avaliação das atividades realizadas no âmbito do Programa Academia da Saúde ficarão a cargo do Ministério da Saúde, por meio da SAS/MS e da Secretaria de Vigilância em Saúde (SVS/MS), e das Secretarias de Saúde dos Estados, do Distrito Federal e dos municípios, podendo essas ações serem realizadas por meio de: (Origem: PRT MS/GM 1707/2016, Art. 33)
I - indicadores e instrumentos de gestão do SUS; (Origem: PRT MS/GM 1707/2016, Art. 33, I)
II - registro da produção dos profissionais de saúde no desenvolvimento de ações do Programa Academia da Saúde nos sistemas de informação do SUS; (Origem: PRT MS/GM 1707/2016, Art. 33, II)
III - instrumentos para identificar o grau de satisfação e adesão dos usuários; e (Origem: PRT MS/GM 1707/2016, Art. 33, III)
IV - inquéritos de base populacional. (Origem: PRT MS/GM 1707/2016, Art. 33, IV)
Art. 38. Na hipótese de execução integral do objeto originalmente pactuado e verificada sobra de recursos financeiros, o ente federativo poderá efetuar o remanejamento dos recursos e a sua aplicação nos termos da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1707/2016, Art. 34)
Art. 39. Nos casos em que for verificada a não execução integral do objeto originalmente pactuado e a existência de recursos financeiros repassados pelo Fundo Nacional de Saúde para os fundos de saúde estaduais, distrital e municipais não executados, seja parcial ou totalmente, o ente federativo estará sujeito à devolução dos recursos financeiros transferidos e não executados, acrescidos da correção monetária prevista em lei, observado o regular processo administrativo. (Origem: PRT MS/GM 1707/2016, Art. 35)
Art. 40. Nos casos em que se verificar que não houve a execução do objeto originalmente pactuado e que os recursos financeiros transferidos pelo Fundo Nacional de Saúde foram executados, total ou parcialmente, em objeto distinto ao originalmente pactuado, aplicar-se-á o regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Origem: PRT MS/GM 1707/2016, Art. 36)
Art. 41. Os recursos financeiros para a execução das atividades previstas no âmbito do Programa Academia da Saúde são oriundos do orçamento do Ministério da Saúde, podendo onerar uma ou mais das seguintes fontes orçamentárias abaixo: (Origem: PRT MS/GM 1707/2016, Art. 37)
I - em relação ao incentivo financeiro de investimento para construção de polos do Programa Academia da Saúde, o Programa de Trabalho 10.301.2015.20YL - Estruturação das Academias da Saúde; e (Origem: PRT MS/GM 1707/2016, Art. 37, I)
II - em relação ao incentivo financeiro de custeio dos polos do Programa Academia da Saúde e dos polos habilitados em programa em desenvolvimento no Distrito Federal e no município identificado como similar ao Programa Academia da Saúde, o Programa de Trabalho 10.301.2015.20AD - Piso de Atenção Básica Variável - Saúde da Família. (Origem: PRT MS/GM 1707/2016, Art. 37, II)
Art. 42. O repasse dos recursos financeiros referentes ao Programa Academia da Saúde ficará condicionado à existência de disponibilidade orçamentária anual do Ministério da Saúde. (Origem: PRT MS/GM 1707/2016, Art. 38)
CAPÍTULO II
DO SANGUE, COMPONENTES E HEMODERIVADOS
Art. 43. Os procedimentos operacionais pertinentes ao sangue, componentes e hemoderivados observarão o disposto no Anexo IV;
Art. 43-A. A destinação do plasma excedente do uso hemoterápico para indústria de hemoderivados deverá obedecer aos requisitos definidos no Anexo IV-A e demais determinações do Anexo IV. (Redação dada pela PRT GM?MS nº 1.710 de 08.07.2020)
Seção I
Do Ressarcimento de Custos Operacionais de Sangue e Hemocomponentes ao SUS, Quando Houver Fornecimento aos Não-Usuários do SUS e Instituições Privadas de Saúde
Art. 44. Fica aprovada, na forma do Anexo V , a tabela de referência para fins de ressarcimento aos serviços de hemoterapia públicos do Sistema Único de Saúde (SUS), de procedimentos para atendimento hemoterápico aos não-usuários do SUS e instituições privadas de saúde. (Origem: PRT MS/GM 1469/2006, Art. 1º)
Art. 45. Ficam aprovados, na forma do Anexo VI , os instrumentos/indicadores de controle e avaliação de serviços prestados aos não usuários do SUS e a instituições privadas de saúde. (Origem: PRT MS/GM 1469/2006, Art. 2º)
Art. 46. Fica estabelecido, em conformidade com o Anexo VII , o formato de abatimento da produção direcionada para atendimento hemoterápico aos não-usuários do SUS e a instituições privadas de saúde daquela apresentada mensalmente ao SUS. (Origem: PRT MS/GM 1469/2006, Art. 3º)
Art. 47. Os Serviços de Hemoterapia Públicos que prestam ou venham prestar atendimento não-SUS apresentarão, mensalmente, à Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Hospitalar e de Urgência (CGSH/DAHU/SAS/MS), o demonstrativo de que trata o Anexo VII . (Origem: PRT MS/GM 1469/2006, Art. 4º)
Parágrafo Único. Em conformidade com a Resolução RDC nº 151, de 21 de agosto de 2001, da Agência Nacional de Vigilância Sanitária, para efetivação do atendimento hemoterápico aos não-usuários do SUS e a instituições privadas de saúde pelos serviços de hemoterapia públicos, deverão ser firmados contratos interinstitucionais considerando os níveis de complexidade da unidade contratante. (Origem: PRT MS/GM 1469/2006, Art. 4º, Parágrafo Único)
Seção I
Do Programa De Volta Para Casa e Comissão de Acompanhamento
Art. 48. São considerados egressos e possíveis beneficiários para efeito da Lei nº 10.708, todas as pessoas portadoras de transtorno mental que estejam comprovadamente internadas em hospital psiquiátrico por período ininterrupto igual ou superior a dois anos, as quais deverão estar incluídas no Cadastro de Beneficiários Potenciais do Programa "De Volta Para Casa". (Origem: PRT MS/GM 2077/2003, Art. 1º)
Parágrafo Único. Este critério aplica-se também às situações previstas nos § 1º e § 3º, do artigo 3º, da Lei nº 10.708/2003. (Origem: PRT MS/GM 2077/2003, Art. 1º, Parágrafo Único)
Art. 49. São documentos e procedimentos necessários para inclusão no Cadastro de Beneficiários Potenciais do Programa "De Volta Para Casa": (Origem: PRT MS/GM 2077/2003, Art. 2º)
I - relação de beneficiários potenciais colhidas pelo gestor local nas unidades prestadoras, num prazo de 30 (trinta) dias, a contar da data da publicação da Portaria nº 2077/GM/MS, de 31 de outubro de 2003; (Origem: PRT MS/GM 2077/2003, Art. 2º, I)
II - relatório da área de controle e avaliação atestando a conferência dos dados constantes na relação do Inciso I; e (Origem: PRT MS/GM 2077/2003, Art. 2º, II)
III - relação de possíveis beneficiários encaminhados pelos Hospitais de Custódia e Tratamento Psiquiátrico, num prazo de 30 (trinta) dias, para Secretaria Estadual de Saúde a contar da data de publicação da Portaria nº 2077/GM/MS, de 31 de outubro de 2003. (Origem: PRT MS/GM 2077/2003, Art. 2º, III)
§ 1º As relações referidas nos incisos I e III deverão conter as seguintes informações: nome e CNPJ da instituição, nome do paciente, data de nascimento, RG ou certidão de nascimento (se houver), CPF (se houver), diagnóstico, data de início da internação. (Origem: PRT MS/GM 2077/2003, Art. 2º, § 1º)
§ 2º As relações acima referidas deverão ser encaminhadas à Secretaria de Estado da Saúde/Coordenação de Saúde Mental para conhecimento e registro, e à Secretaria de Atenção à Saúde, do Ministério da Saúde, para análise e validação pela Comissão de Acompanhamento do Programa "De Volta Para Casa" (CAP-MS), de que trata o art. 58. (Origem: PRT MS/GM 2077/2003, Art. 2º, § 2º)
Art. 50. Da habilitação dos Municípios, tendo em vista atender ao inciso IV do art. 3º, da Lei nº 10.708/2003, são pré-condições cumulativas: (Origem: PRT MS/GM 2077/2003, Art. 3º)
I - o Município ofertar ações de saúde que atendam às necessidades dos beneficiários, conforme certificação pela Comissão Estadual pela comissão de acompanhamento (CAP-SES), de que trata o art. 58; (Origem: PRT MS/GM 2077/2003, Art. 3º, I)
II - os Municípios terem aderido formalmente ao Programa, por meio de envio de Termo de Adesão Anexo VIII ; e (Origem: PRT MS/GM 2077/2003, Art. 3º, II)
III - formalização da habilitação pelo Ministério da Saúde por meio de portaria. (Origem: PRT MS/GM 2077/2003, Art. 3º, III)
Art. 51. Serão considerados Municípios prioritários para habilitação no Programa aqueles que possuem ações desenvolvidas, ou em desenvolvimento, de reintegração social para pessoas acometidas por transtorno mental, que tenham moradores em serviços residenciais terapêuticos, e equipe de saúde estruturada para apoiar esta ação e que cumpram as seguintes condições: (Origem: PRT MS/GM 2077/2003, Art. 4º)
I - apresentam alta concentração de pessoas internadas em hospitais psiquiátricos que atendem aos requisitos de temporalidade do tratamento; (Origem: PRT MS/GM 2077/2003, Art. 4º, I)
II - tenham hospitais em processo de descredenciamento do SUS; e (Origem: PRT MS/GM 2077/2003, Art. 4º, II)
III - que estejam destinados a acolher pacientes de programas de desinstitucionalização egressos de hospitais localizados em outros Municípios. (Origem: PRT MS/GM 2077/2003, Art. 4º, III)
Art. 52. A solicitação de inclusão no Programa "De Volta Para Casa", preenchida e assinada pelo paciente Anexo IX ou seu representante legal, quando necessário Anexo X é documento indispensável para iniciar o processo, e será dirigido à Secretaria Municipal de Saúde, de Município habilitado; (Origem: PRT MS/GM 2077/2003, Art. 5º)
Parágrafo Único. O fluxo da solicitação à Secretaria Municipal de Saúde obedecerá à seguinte sequência: (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único)
I - avaliação da solicitação por parte de uma equipe de saúde designada pelo gestor municipal conforme Instrução Normativa Anexo XI e utilizando como base roteiro específico para avaliação proposto em manual do Programa "De Volta Para Casa" a ser expedido pela Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único, I)
II - se o parecer for favorável, será preenchido Formulário de Inclusão do Solicitante Anexo XII , contendo informações necessárias e obrigatórias que deverá ser enviado ao Ministério da Saúde/Secretaria de Atenção à Saúde (CAP-MS); e (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único, II)
III - se a solicitação de inclusão não for aprovada, é facultado ao solicitante recurso junto à Secretaria Estadual de Saúde e, em última instância, ao Ministério da Saúde. (Origem: PRT MS/GM 2077/2003, Art. 5º, Parágrafo Único, III)
Art. 53. São requisitos necessários para a solicitação de inclusão do beneficiário no Programa "De Volta Para Casa": (Origem: PRT MS/GM 2077/2003, Art. 6º)
I - a habilitação do Município responsável pela atenção continuada; (Origem: PRT MS/GM 2077/2003, Art. 6º, I)
II - o beneficiário deverá possuir a documentação exigida: Documento de Identidade /Registro Geral ou Certidão de Nascimento; e (Origem: PRT MS/GM 2077/2003, Art. 6º, II)
III - Formulário de Inclusão no Programa preenchido pelo Município. (Origem: PRT MS/GM 2077/2003, Art. 6º, III)
Parágrafo Único. O Departamento de Ações Programáticas Estratégicas - Saúde Mental, da Secretaria de Atenção à Saúde, deste Ministério, poderá solicitar informações complementares, para validação da inclusão, de acordo com o caso. (Origem: PRT MS/GM 2077/2003, Art. 6º, Parágrafo Único)
Art. 54. Para efeito de pagamento, de acordo com artigo 2º da Lei nº 10.708/2003: (Origem: PRT MS/GM 2077/2003, Art. 7º)
§ 1º O recebimento do benefício pelo paciente se dará após a sua saída da instituição hospitalar e de sua inserção no Programa "De Volta Para Casa" no âmbito local; (Origem: PRT MS/GM 2077/2003, Art. 7º, § 1º)
§ 2º Quando for o caso, se o beneficiário do Programa necessitar de representante legal, este deverá firmar termo de compromisso de fielmente zelar pelos direitos e deveres do beneficiário no âmbito do referido Programa Anexo XIII ; (Origem: PRT MS/GM 2077/2003, Art. 7º, § 2º)
§ 3º Para os beneficiários contemplados nos § 1º e § 3º, do art 3º, da Lei nº 10.708/2003, os repasses serão efetuados quando aprovados os processos de inclusão; e (Origem: PRT MS/GM 2077/2003, Art. 7º, § 3º)
§ 4º A operacionalização do pagamento será descrita em manual do Programa "De Volta Para Casa" a ser expedido pela Secretaria de Atenção à Saúde - SAS/MS; (Origem: PRT MS/GM 2077/2003, Art. 7º, § 4º)
Art. 55. A saída do paciente da instituição hospitalar implicará a exclusão do leito do cadastro SIH/SUS e transferência dos recursos correspondentes para ações extra-hospitalares de Saúde Mental por meio de mecanismos a ser regulamentado pela Secretaria de Atenção à Saúde - SAS/MS. (Origem: PRT MS/GM 2077/2003, Art. 8º)
Art. 56. A suspensão do benefício, nos termos do artigo 4º, da Lei nº 10.708/2003, ocorrerá: (Origem: PRT MS/GM 2077/2003, Art. 9º)
§ 1º A qualquer momento, por solicitação do beneficiário ou seu representante legal; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 1º)
§ 2º Quando ocorrer reinternação do beneficiário em hospital psiquiátrico, por período igual ou superior a 30 (trinta) dias ao ano; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 2º)
§ 3º Quando o beneficiário, de acordo com relatório trimestral de avaliação individual, realizado pela coordenação local, não reunir condições de permanecer inserido no Programa, conforme inciso II, do artigo 4º, da supracitada Lei; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 3º)
§ 4º Quando a coordenação local do Programa identificar que o representante legal não cumpre com as exigências contidas no termo de compromisso, enquanto não seja definido um novo representante legal; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 4º)
§ 5º Quando o gestor local descumprir com os compromissos firmados no Termo de Adesão municipal ao Programa; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 5º)
§ 6º Quando o paradeiro do beneficiário for desconhecido por mais de 40 (quarenta dias). (Origem: PRT MS/GM 2077/2003, Art. 9º, § 6º)
§ 7º Nos casos previstos nos § 2º e § 3º, é facultado recurso, pelo beneficiário ou seu representante legal, à Secretaria Estadual de Saúde e, em última instância, ao Ministério da Saúde; (Origem: PRT MS/GM 2077/2003, Art. 9º, § 7º)
§ 8º Nos casos previstos no § 4º, é facultado recurso do Município ao Ministério da Saúde; e. (Origem: PRT MS/GM 2077/2003, Art. 9º, § 8º)
§ 9º Cabe à Secretaria Municipal de Saúde a notificação imediata à Secretaria de Estado da Saúde (CAP-SES), dos casos de reinternação dos beneficiários em hospital psiquiátrico ou Hospital de Custódia e Tratamento Psiquiátrico. (Origem: PRT MS/GM 2077/2003, Art. 9º, § 9º)
Art. 57. Para a renovação do benefício será necessário: (Origem: PRT MS/GM 2077/2003, Art. 10)
§ 1º Apresentação de relatório do gestor local ao Ministério da Saúde, contendo parecer da equipe de saúde que indicará necessidade de permanência do beneficiário no Programa, com antecedência de 60 dias do término de um ano do recebimento do auxílio; e (Origem: PRT MS/GM 2077/2003, Art. 10, § 1º)
§ 2º Parecer favorável da Comissão de Acompanhamento do Programa "De Volta Para Casa" (CAP-SES). (Origem: PRT MS/GM 2077/2003, Art. 10, § 2º)
Art. 58. Cabe ao Departamento de Ações Programáticas Estratégicas - Saúde Mental, da Secretaria de Atenção à Saúde, deste Ministério, ouvida a Comissão de Acompanhamento do Programa "De Volta Para Casa": (Origem: PRT MS/GM 2077/2003, Art. 11)
I - conceder o auxílio-reabilitação psicossocial; (Origem: PRT MS/GM 2077/2003, Art. 11, I)
II - decidir sobre inclusão e exclusão de beneficiário no Programa; (Origem: PRT MS/GM 2077/2003, Art. 11, II)
III - decidir sobre o pedido de renovação e homologá-lo ou não; (Origem: PRT MS/GM 2077/2003, Art. 11, III)
IV - gerar informação à instituição financeira quanto à renovação por mais 1 (um) ano; (Origem: PRT MS/GM 2077/2003, Art. 11, IV)
V - garantir recurso orçamentário para este fim; e (Origem: PRT MS/GM 2077/2003, Art. 11, V)
VI - decidir sobre habilitação de Município no Programa "De Volta Para Casa". (Origem: PRT MS/GM 2077/2003, Art. 11, VI)
Art. 59. O acompanhamento do auxílio-reabilitação psicossocial será efetuado através de Comissão de Acompanhamento do Programa "De Volta Para Casa" (CAP-MS), constituída pelo Ministério da Saúde, por meio de Portaria, que terá as seguintes atribuições: (Origem: PRT MS/GM 2077/2003, Art. 12)
I - emitir parecer sobre a habilitação de Municípios; (Origem: PRT MS/GM 2077/2003, Art. 12, I)
II - emitir parecer sobre inclusão e exclusão de beneficiário no Programa; (Origem: PRT MS/GM 2077/2003, Art. 12, II)
III - emitir parecer sobre renovação do auxílio-reabilitação psicossocial ao beneficiário; (Origem: PRT MS/GM 2077/2003, Art. 12, III)
IV - elaborar e pactuar as normas aplicáveis ao programa e submetê-las ao Ministério da Saúde; (Origem: PRT MS/GM 2077/2003, Art. 12, IV)
V - ratificar o levantamento nacional de clientela de beneficiários em potencial do Programa "De Volta Para Casa"; e (Origem: PRT MS/GM 2077/2003, Art. 12, V)
VI - acompanhar e assessorar a implantação e avaliação do Programa. (Origem: PRT MS/GM 2077/2003, Art. 12, VI)
Parágrafo Único. No âmbito Estadual deverá ser constituída Comissão Estadual de Acompanhamento do Programa "De Volta Para Casa" (CAP-SES) que terá as funções de emitir parecer sobre exclusão do Programa e renovação do benefício, bem como outras ações necessárias ao acompanhamento do Programa. (Origem: PRT MS/GM 2077/2003, Art. 12, Parágrafo Único)
Art. 60. Casos omissos serão decididos pela Secretaria de Atenção à Saúde - Departamento de Ações Programáticas Estratégicas - Saúde Mental, ouvida a Comissão de Acompanhamento do Programa "De Volta Para Casa". (Origem: PRT MS/GM 2077/2003, Art. 13)
Art. 61. Fica instituída a Comissão de Acompanhamento do "De Volta Para Casa" que será composta pelos representantes das seguintes instâncias/instituições, sob a coordenação do primeiro: (Origem: PRT MS/GM 2078/2003, Art. 1º)
I - Secretaria de Atenção à Saúde - Departamento de Ações Programáticas Estratégicas - Saúde Mental; (Origem: PRT MS/GM 2078/2003, Art. 1º, I)
II - Conselho Nacional dos Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2078/2003, Art. 1º, II)
III - Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); e (Origem: PRT MS/GM 2078/2003, Art. 1º, III)
IV - Comissão Intersetorial de Saúde Mental do Conselho Nacional de Saúde. (Origem: PRT MS/GM 2078/2003, Art. 1º, IV)
Art. 62. Ficam atribuídas à referida Comissão as seguintes responsabilidades: (Origem: PRT MS/GM 2078/2003, Art. 2º)
I - emitir parecer sobre a habilitação de Municípios; (Origem: PRT MS/GM 2078/2003, Art. 2º, I)
II - emitir parecer sobre inclusão e exclusão de beneficiário no Programa; (Origem: PRT MS/GM 2078/2003, Art. 2º, II)
III - emitir parecer sobre renovação do auxílio-reabilitação psicossocial ao beneficiário; (Origem: PRT MS/GM 2078/2003, Art. 2º, III)
IV - elaborar e pactuar as normas aplicáveis ao programa e submetê-las ao Ministério da Saúde; (Origem: PRT MS/GM 2078/2003, Art. 2º, IV)
V - pactuar a definição de Municípios prioritários para habilitação no programa; (Origem: PRT MS/GM 2078/2003, Art. 2º, V)
VI - ratificar o levantamento nacional de clientela de beneficiários em potencial do Programa "De Volta Para Casa"; e (Origem: PRT MS/GM 2078/2003, Art. 2º, VI)
VII - acompanhar e assessorar a implantação e avaliação do programa. (Origem: PRT MS/GM 2078/2003, Art. 2º, VII)
Art. 63. Fica atribuída à Secretaria de Atenção à Saúde (SAS/MS) a constituição de Grupo Técnico para assessorar a Comissão de Acompanhamento do Programa. (Origem: PRT MS/GM 2078/2003, Art. 3º)
Seção II
Do Programa de Desinstitucionalização Integrante do Componente Estratégias de Desinstitucionalização da Rede de Atenção Psicossocial (RAPS)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 64. Fica criado o Programa de Desinstitucionalização como integrante do componente Estratégias de Desinstitucionalização da Rede de Atenção Psicossocial (RAPS), no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2840/2014, Art. 1º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 65. O componente Estratégias de Desinstitucionalização da RAPS é constituído por iniciativas que visam garantir às pessoas com sofrimento ou transtorno mental, e com necessidades decorrentes do uso de crack, álcool e outras drogas, em situação de internação de longa permanência, o cuidado integral por meio de estratégias substitutivas, na perspectiva da garantia de direitos com a promoção de autonomia e o exercício de cidadania, buscando-se sua progressiva inclusão social. (Origem: PRT MS/GM 2840/2014, Art. 2º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 66. O Programa de Desinstitucionalização tem como objetivos: (Origem: PRT MS/GM 2840/2014, Art. 3º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
I - apoiar e desenvolver ações de desinstitucionalização de pessoas com sofrimento ou transtorno mental e com necessidades decorrentes do uso de crack, álcool e outras drogas em situação de internação de longa permanência em hospitais psiquiátricos no âmbito do SUS; e (Origem: PRT MS/GM 2840/2014, Art. 3º, I) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
II - apoiar e desenvolver ações e estratégias nos processos de reabilitação psicossocial no território das pessoas desinstitucionalizadas, favorecendo-se os percursos de produção de autonomia e da contratualidade social, de forma a garantir seus direitos e a efetiva participação e inclusão social, fortalecendo a RAPS. (Origem: PRT MS/GM 2840/2014, Art. 3º, II) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Parágrafo Único. Para fins desta Seção, considera-se a internação de longa permanência de que trata o inciso I do "caput" aquela superior a 1 (um) ano, de forma ininterrupta. (Origem: PRT MS/GM 2840/2014, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 67. Para a consecução dos objetivos estabelecidos pelo art. 66 fica criada, no âmbito do Programa de Desinstitucionalização, a Equipe de Desinstitucionalização. (Origem: PRT MS/GM 2840/2014, Art. 4º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 68. Compete à Equipe de Desinstitucionalização: (Origem: PRT MS/GM 2840/2014, Art. 5º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
I - apoiar as equipes profissionais de hospital psiquiátrico e realizar, quando necessária, a avaliação clínica, psiquiátrica e psicossocial das pessoas em situação de internação de longa permanência em hospitais psiquiátricos, objetivando a elaboração de Projeto Terapêutico Singular (PTS), orientado para a desinstitucionalização e reabilitação psicossocial no território; (Origem: PRT MS/GM 2840/2014, Art. 5º, I) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
II - apoiar as equipes de profissionais de hospital psiquiátrico na transformação da organização institucional, com vistas à reabilitação psicossocial, garantindo-se o respeito aos direitos humanos das pessoas internadas; (Origem: PRT MS/GM 2840/2014, Art. 5º, II) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
III - apoiar as equipes de profissionais de hospital psiquiátrico na reestruturação do funcionamento técnico operacional da instituição, com implementação e fortalecimento do trabalho em equipe multiprofissional, e a reorganização das enfermarias de acordo com a procedência das pessoas internadas e/ou municípios de residência atual dos familiares, respeitando-se, sempre que possível, os vínculos estabelecidos entre as pessoas internadas no ambiente hospitalar; (Origem: PRT MS/GM 2840/2014, Art. 5º, III) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
IV - apoiar as equipes de profissionais de hospital psiquiátrico no desenvolvimento de estratégias ou ações que favoreçam a construção de protagonismo das pessoas internadas, tais como assembleias, espaços coletivos de encontros e trocas, reapropriação do uso dos objetos pessoais; (Origem: PRT MS/GM 2840/2014, Art. 5º, IV) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
V - apoiar as equipes de profissionais de hospital psiquiátrico no desenvolvimento de estratégias que garantam o cuidado cotidiano na perspectiva da desinstitucionalização e da reabilitação psicossocial, incluídas as questões clínicas, com redimensionamento da atenção orientada para a construção de autonomia e o acesso aos direitos de cidadania; (Origem: PRT MS/GM 2840/2014, Art. 5º, V) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
VI - desenvolver ações nos contextos dos projetos terapêuticos singulares que viabilizem a obtenção de documentação e o acesso a benefícios previdenciários e assistenciais, assim como o auxílio-reabilitação psicossocial do Programa De Volta Para Casa; (Origem: PRT MS/GM 2840/2014, Art. 5º, VI) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
VII - identificar situação de curatela e procurações existentes com o devido acionamento dos órgãos competentes para as providências necessárias; (Origem: PRT MS/GM 2840/2014, Art. 5º, VII) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
VIII - desenvolver estratégias de rearticulação de vínculos familiares e/ou sociais e de promoção da participação dos familiares e/ou pessoas das redes sociais das pessoas internadas no processo de desinstitucionalização, tais como atenção familiar, visita domiciliar, reunião de familiares, assembleias, além de ações conjuntas com os familiares e as pessoas internadas; (Origem: PRT MS/GM 2840/2014, Art. 5º, VIII) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
IX - desenvolver ações que propiciem a interação das pessoas internadas com seus familiares e pessoas da cidade, com criação de espaços para promoção de encontros dentro do hospital e nos territórios da cidade; (Origem: PRT MS/GM 2840/2014, Art. 5º, IX) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
X - articular recursos, instituições e pontos de atenção da RAPS no território para acolhimento, cuidado e reabilitação psicossocial das pessoas com internação de longa permanência, visando à desinstitucionalização, respeitando-se, sempre que possível, os vínculos criados pelas pessoas durante o período em que estiveram internadas, de acordo com os seguintes critérios: (Origem: PRT MS/GM 2840/2014, Art. 5º, X) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
a) retorno à família, quando houver possibilidade de coabitação e convivência, de acordo com projetos terapêuticos singulares; (Origem: PRT MS/GM 2840/2014, Art. 5º, X, a) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
b) inserção nos Serviços Residenciais Terapêuticos (SRT); e (Origem: PRT MS/GM 2840/2014, Art. 5º, X, b) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
c) para as pessoas com deficiência, quando indicado, encaminhamento para as residências inclusivas, estabelecidas pela Portaria Interministerial nº 03/MDS/MS, de 21 de setembro de 2012; (Origem: PRT MS/GM 2840/2014, Art. 5º, X, c) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
XI - desenvolver estratégias para educação permanente dos atores institucionais e comunitários implicados no projeto; (Origem: PRT MS/GM 2840/2014, Art. 5º, XI) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
XII - avaliar os casos de internação psiquiátrica compulsória ou em cumprimento de medida de segurança e articular com os órgãos competentes para abordagem destas situações; e (Origem: PRT MS/GM 2840/2014, Art. 5º, XII) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
XIII - compor as equipes multiprofissionais dos pontos de atenção das RAPS, de acordo com os critérios definidos nos arts. 69 e 70 e no art. 1057 da Portaria de Consolidação nº 6, visando à qualificação das ações e estratégias desenvolvidas nestes pontos de atenção, em especial o apoio aos processos de reabilitação psicossocial no território das pessoas desinstitucionalizadas, favorecendo-se os percursos de produção de autonomia e de fortalecimento da contratualidade social, de forma a garantir seus direitos e efetiva participação e inclusão social. (Origem: PRT MS/GM 2840/2014, Art. 5º, XIII) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Parágrafo Único. As orientações e instrumentos para o desenvolvimento das ações indicadas no inciso I do "caput" serão disponibilizados na página da Coordenação-Geral de Saúde Mental, Álcool e Outras Drogas, do Ministério da Saúde (CGMAD/DAET/SAS/MS) por meio do endereço eletrônico www.saude.gov.br/mental, num prazo de 30 (trinta) dias a contar da data da publicação da Portaria nº 2840/GM/MS, de 29 de dezembro de 2014. (Origem: PRT MS/GM 2840/2014, Art. 5º, Parágrafo Único) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 69. A Equipe de Desinstitucionalização poderá ser de duas modalidades: (Origem: PRT MS/GM 2840/2014, Art. 6º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
I - modalidade A; e (Origem: PRT MS/GM 2840/2014, Art. 6º, I) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
II - modalidade B. (Origem: PRT MS/GM 2840/2014, Art. 6º, II) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 1º A modalidade A será composta pelos seguintes profissionais da área de saúde: (Origem: PRT MS/GM 2840/2014, Art. 6º, § 1º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
I - 1 (um) médico com formação e experiência em saúde mental ou psiquiatra; e (Origem: PRT MS/GM 2840/2014, Art. 6º, § 1º, I) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
II - 1 (um) profissional, dentre psicólogo, assistente social, terapeuta ocupacional e enfermeiro. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 1º, II) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 2º A modalidade B será composta pelos seguintes profissionais da área de saúde: (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
I - 1 (um) médico com formação e experiência em saúde mental ou psiquiatra; (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º, I) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
II - 1 (um) enfermeiro; e (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º, II) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
III - 3 (três) profissionais, dentre psicólogo, assistente social e terapeuta ocupacional, sendo preferencialmente 1 (um) profissional de cada categoria citada neste inciso. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 2º, III) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 3º No caso da equipe modalidade A, a carga horaria mínima será de 50 (cinquenta) horas semanais, devendo o médico apresentar carga horaria semanal mínima de 10 (dez) horas. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 3º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 4º O somatório da carga horária dos integrantes da Equipe de Desinstitucionalização modalidade B será de, no mínimo, 170 (cento e setenta) horas semanais. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 4º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 5º A Equipe de Desinstitucionalização das modalidades A e B terão sua carga horária de trabalho distribuída de segunda a sexta-feira, em regime diário de até 8 (oito) horas, podendo, se necessário, desenvolver atividades nos finais de semana e feriados. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 5º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 6º Os profissionais mencionados no § 2º do "caput" terão carga horária mínima de 20 (vinte) horas semanais de trabalho. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 6º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 7º A Equipe de Desinstitucionalização de modalidades A e B serão viabilizadas e geridas pelo gestor público municipal de saúde, respeitando-se a legislação vigente referente à contratação de recursos humanos. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 7º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 8º A Equipe de Desinstitucionalização deverá ser incluída no Sistema Cadastro Nacional de Estabelecimentos de Saúde (SCNES) pelo Município responsável. (Origem: PRT MS/GM 2840/2014, Art. 6º, § 8º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 70. A Equipe de Desinstitucionalização desenvolverá suas ações conforme previsto no art. 68, devendo cumprir as metas e os prazos estabelecidos nas "Ações de Desinstitucionalização e de Fortalecimento da RAPS" previstas no Anexo XXXVII . (Origem: PRT MS/GM 2840/2014, Art. 7º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 71. Caberá às Secretarias Estaduais de Saúde promover o desenvolvimento de ações de articulação dos Municípios e de cooperação técnica e financeira, quando couber, objetivando-se a desinstitucionalização das pessoas com internação de longa permanência em hospitais psiquiátricos e implantação e qualificação da RAPS. (Origem: PRT MS/GM 2840/2014, Art. 16) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 72. Uma vez cumpridas as recomendações previstas no art. 1058 da Portaria de Consolidação nº 6, o gestor encaminhará ofício, conforme modelo constante do Anexo XLII , informando a redução dos leitos psiquiátricos e, quando for o caso, a imediata reclassificação do hospital, de acordo com a Portaria nº 52/GM/MS, de 20 de janeiro de 2004, e a Seção V do Capítulo III do Título VIII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 2840/2014, Art. 19) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 73. A avaliação e o monitoramento do Programa de Desinstitucionalização serão realizados pode meio de: (Origem: PRT MS/GM 2840/2014, Art. 20) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
I - constituição de Comissão de Acompanhamento da execução das "Ações de Desinstitucionalização e de Fortalecimento da RAPS", com cooperação técnica federal, estadual e municipal, e com representações das respectivas áreas de saúde mental; e (Origem: PRT MS/GM 2840/2014, Art. 20, I) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
II - Grupo Condutor Regional da RAPS já constituído, que realizará o acompanhamento da execução das "Ações de Desinstitucionalização e de Fortalecimento da RAPS", com cooperação técnica federal, estadual e municipal e com representações das respectivas áreas de saúde mental. (Origem: PRT MS/GM 2840/2014, Art. 20, II) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 1º As estratégias de avaliação e de monitoramento da execução das "Ações de Desinstitucionalização e de Fortalecimento da RAPS" serão definidas e desenvolvidas pela Comissão de Acompanhamento ou Grupo Condutor Regional da RAPS. (Origem: PRT MS/GM 2840/2014, Art. 20, § 1º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
§ 2º A Comissão de Acompanhamento e Grupo Condutor Estadual da RAPS acompanharão o processo de avaliação e monitoramento das "Ações de Desinstitucionalização e de Fortalecimento da RAPS", bem como zelarão pelo seu cumprimento. (Origem: PRT MS/GM 2840/2014, Art. 20, § 2º) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Art. 74. O monitoramento de que trata esta Seção não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 2840/2014, Art. 21) (Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
Seção III
Do Programa de Atenção Integral a Usuários de Álcool e Outras Drogas
Art. 75. Fica instituído, no âmbito do SUS, o Programa de Atenção Integral a Usuários de Álcool e outras Drogas, a ser desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios. (Origem: PRT MS/GM 2197/2004, Art. 1º)
Art. 76. O Programa de Atenção Integral a Usuários de Álcool e outras Drogas terá como seus principais componentes: (Origem: PRT MS/GM 2197/2004, Art. 2º)
I - componente da atenção básica; (Origem: PRT MS/GM 2197/2004, Art. 2º, I)
II - componente da atenção nos CAPS-AD, ambulatórios e outras unidades extra-hospitalares especializadas; (Origem: PRT MS/GM 2197/2004, Art. 2º, II)
III - componente da atenção hospitalar de referência; e (Origem: PRT MS/GM 2197/2004, Art. 2º, III)
IV - componente da rede de suporte social (associações de ajuda mútua e entidades da sociedade civil), complementar à rede de serviços disponibilizados pelo SUS. (Origem: PRT MS/GM 2197/2004, Art. 2º, IV)
Art. 77. O componente da atenção básica, de que trata o art. 76, I refere-se à atenção integral aos usuários de álcool e outras drogas em unidades de atenção básica, ambulatórios não-especializados, Programa Saúde da Família e Programa de Agentes Comunitários de Saúde, entre outros dispositivos de cuidados possíveis, no âmbito da atenção básica, e deve ter como principais características: (Origem: PRT MS/GM 2197/2004, Art. 3º)
I - atuação articulada ao restante da rede de atenção integral aos usuários de álcool e outras drogas, bem como à rede de cuidados em saúde mental, devendo ainda ser implicada a rede de cuidados em DST/AIDS; (Origem: PRT MS/GM 2197/2004, Art. 3º, I)
II - atuação e inserção comunitárias, em maior nível de capilaridade para ações como detecção precoce de casos de uso nocivo e/ou dependência de álcool e outras drogas, de forma articulada a práticas terapêuticas/preventivas/educativas, tais como aconselhamento breve e intervenções breves voltadas para a redução ou o cessar do consumo, contemplando ainda o encaminhamento precoce para intervenções mais especializadas, ou para a abordagem de complicações clínicas e/ou psiquiátricas decorrentes de tal consumo; e (Origem: PRT MS/GM 2197/2004, Art. 3º, II)
III - adoção da lógica de redução de danos, que é estratégica para o êxito das ações desenvolvidas por essas unidades. (Origem: PRT MS/GM 2197/2004, Art. 3º, III)
Art. 78. O componente da atenção nos CAPSad, ambulatórios e outras unidades especializadas, objeto do art. 76, II, obedece a uma lógica de oferta de cuidados baseados na atenção integral, devendo ter como principais características: (Origem: PRT MS/GM 2197/2004, Art. 4º)
I - oferta aos usuários de álcool e outras drogas e seus familiares, de acolhimento, atenção integral (práticas terapêuticas/preventivas/de promoção de saúde/educativas/de reabilitação psicossocial) e estímulo à sua integração social e familiar; (Origem: PRT MS/GM 2197/2004, Art. 4º, I)
II - inserção comunitária de práticas e serviços, os quais devem atender a uma população referida a um território específico; (Origem: PRT MS/GM 2197/2004, Art. 4º, II)
III - funcionamento, especialmente para os CAPSad, segundo normas expressas na Portaria n° 189/SAS, de 20 de março de 2002, na Portaria n° 305/SAS, de 3 de maio de 2002, no Capítulo I do Título II do Anexo V da Portaria de Consolidação nº 3 e na Seção IV do Capítulo III do Título I; (Origem: PRT MS/GM 2197/2004, Art. 4º, III)
IV - articulação de todas estas unidades ao restante da rede de atenção integral aos usuários de álcool e outras drogas, bem como à rede de cuidados em saúde mental, devendo ainda ser considerada a rede de cuidados em DST/AIDS; e (Origem: PRT MS/GM 2197/2004, Art. 4º, IV)
V - adoção da lógica de redução de danos, como estratégica para o êxito das ações desenvolvidas por estas unidades. (Origem: PRT MS/GM 2197/2004, Art. 4º, V)
§ 1º As outras unidades ambulatoriais mencionadas devem trabalhar seguindo orientação específica, porém, dentro de sistemática similar à utilizada para os CAPSad, quanto à proposta de atenção integral a usuários e familiares, à inserção comunitária e à lógica territorial desses serviços. (Origem: PRT MS/GM 2197/2004, Art. 4º, § 1º)
§ 2º A criação do Serviço Hospitalar de Referência para a Atenção Integral aos Usuários de Álcool e outras Drogas (SHR-ad) não exclui a obrigatoriedade da existência de leitos para desintoxicação e repouso, conforme previsto pela Capítulo I do Título II do Anexo V da Portaria de Consolidação nº 3, mencionada anteriormente. (Origem: PRT MS/GM 2197/2004, Art. 4º, § 2º)
Art. 79. O componente de atenção hospitalar de referência, objeto do art. 76, III, define que os Serviços Hospitalares de Referência para a Atenção Integral aos Usuários de Álcool e outras Drogas (SHR-ad) serão instalados em Hospitais Gerais, e têm como objetivos: (Origem: PRT MS/GM 2197/2004, Art. 5º)
I - compor rede de atenção integral a usuários de álcool e outras drogas, participando do sistema de organização e regulação das demandas e fluxos assistenciais, em área geográfica definida, respeitando as atribuições e competências das instâncias do SUS para a sua implantação e gerenciamento; (Origem: PRT MS/GM 2197/2004, Art. 5º, I)
II - compor, na rede assistencial, e em sua estrutura de atendimento hospitalar de urgência e emergência, a rede hospitalar de retaguarda aos usuários de álcool e outras drogas; (Origem: PRT MS/GM 2197/2004, Art. 5º, II)
III - atuar respeitando as premissas do SUS e a lógica territorial, salvo em casos de ausência de recursos assistenciais similares, onde a clientela atendida poderá ultrapassar os limites territoriais previstos para a abrangência do serviço; (Origem: PRT MS/GM 2197/2004, Art. 5º, III)
IV - dar suporte à demanda assistencial caracterizada por situações de urgência/emergência que sejam decorrentes do consumo ou abstinência de álcool e/ou outras drogas, advindas da rede dos Centros de Atenção Psicossocial para a Atenção a Usuários de Álcool e outras Drogas (CAPSad), da rede básica de cuidados em saúde (Programa Saúde da Família, e Unidades Básicas de Saúde), e de serviços ambulatoriais especializados e não-especializados; (Origem: PRT MS/GM 2197/2004, Art. 5º, IV)
V - oferecer suporte hospitalar, por meio de internações de curta duração para usuários de álcool e/ou outras drogas, em situações assistenciais para as quais os recursos extra-hospitalares disponíveis não tenham obtido a devida resolutividade, ou ainda em casos de necessidade imediata de intervenção em ambiente hospitalar, sempre respeitadas as determinações da Lei nº 10.216, e sempre acolhendo os pacientes em regime de curtíssima e curta permanência; (Origem: PRT MS/GM 2197/2004, Art. 5º, V)
VI - oferecer, nas situações descritas no art. 76, incisos III e IV II , abordagem, suporte e encaminhamento adequado aos usuários que, mediante avaliação geral, evidenciarem indicativos de ocorrência de comorbidades de ordem clínica e/ou psíquica; e (Origem: PRT MS/GM 2197/2004, Art. 5º, VI)
VII - evitar a internação de usuários de álcool e outras drogas em hospitais psiquiátricos. (Origem: PRT MS/GM 2197/2004, Art. 5º, VII)
Art. 80. O componente da rede de suporte social, objeto do art. 76, II inclui dispositivos comunitários de acolhida e cuidados, que devem ter as seguintes características: (Origem: PRT MS/GM 2197/2004, Art. 6º)
I - estar articulados à rede de cuidados do SUS (não sendo, porém, componentes dessa rede, mas instância complementar), são exemplos os grupos de mútua ajuda, entidades congregadoras de usuários, associações comunitárias e demais entidades da sociedade civil organizada; (Origem: PRT MS/GM 2197/2004, Art. 6º, I)
II - configurar, assim, estrutura complementar à rede de serviços disponibilizados pelo SUS; e (Origem: PRT MS/GM 2197/2004, Art. 6º, II)
III - respeitar as determinações da Lei nº 10.216, para unidades, não componentes da rede do SUS, que trabalham com a permanência de pacientes em regime fechado. (Origem: PRT MS/GM 2197/2004, Art. 6º, III)
Art. 81. Os objetivos descritos no art. 79 serão direcionados prioritariamente a pessoas que fazem uso prejudicial de álcool, em face da magnitude epidemiológica do seu uso e de suas consequências, porém, contemplando igualmente o conjunto de usuários de álcool e outras drogas que apresente a maior demanda por cuidados, no território de abrangência de cada serviço. (Origem: PRT MS/GM 2197/2004, Art. 7º)
Parágrafo Único. O componente hospitalar do Programa de Atenção Integral a Usuários de Álcool e outras Drogas obedece às determinações da Lei nº 10.216/2001 que são relativas à internação hospitalar, considerando em sua lógica de funcionamento somente internações hospitalares que demandem por curta permanência dos usuários, em suas unidades de referência. (Origem: PRT MS/GM 2197/2004, Art. 7º, Parágrafo Único)
Art. 82. Em função da existência de diferentes níveis de organização para as redes assistenciais locais e da variação da incidência e da gravidade dos transtornos decorrentes do uso de álcool e outras drogas, e, como primeira etapa do programa, deverão ser habilitados Serviços Hospitalares de Atenção Integral aos Usuários de Álcool e outras Drogas (SRH-ad), de acordo com as prioridades abaixo estabelecidas: (Origem: PRT MS/GM 2197/2004, Art. 9º)
I - regiões metropolitanas; (Origem: PRT MS/GM 2197/2004, Art. 9º, I)
II - municípios acima de 200.000 habitantes; (Origem: PRT MS/GM 2197/2004, Art. 9º, II)
III - municípios que já possuam CAPSad em funcionamento; e (Origem: PRT MS/GM 2197/2004, Art. 9º, III)
IV - municípios onde já esteja implantado o Serviço de Atendimento Móvel de Urgência - SAMU/192. (Origem: PRT MS/GM 2197/2004, Art. 9º, IV)
Parágrafo Único. Deverão, também, ser levadas em consideração outras necessidades de ordem epidemiológica e estratégica para a consolidação da rede assistencial aos usuários de álcool e outras drogas. (Origem: PRT MS/GM 2197/2004, Art. 9º, Parágrafo Único)
Art. 83. A Secretaria de Atenção à Saúde adotará as providências necessárias ao cumprimento e à regulamentação do Programa de Atenção Integral a Usuários de Álcool e outras Drogas, no que se refere aos procedimentos a serem realizados pelos Serviços Hospitalares de Referência para a Atenção Integral aos Usuários de Álcool e outras Drogas (SHR-ad), critérios para habilitação e normas de funcionamento. (Origem: PRT MS/GM 2197/2004, Art. 11)
Seção IV
Do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas
Art. 84. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas, a ser desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, Distrito Federal e municípios, tendo por objetivos: (Origem: PRT MS/GM 816/2002, Art. 1º)
I - articular as ações desenvolvidas pelas três esferas de governo destinadas a promover a atenção aos pacientes com dependência e/ou uso prejudicial de álcool ou outras drogas; (Origem: PRT MS/GM 816/2002, Art. 1º, I)
II - organizar e implantar rede estratégica de serviços extra-hospitalares de atenção aos pacientes com esse tipo de transtorno, articulada à rede de atenção psicossocial; (Origem: PRT MS/GM 816/2002, Art. 1º, II)
III - aperfeiçoar as intervenções preventivas como forma de reduzir os danos sociais e à saúde representados pelo uso prejudicial de álcool e outras drogas; (Origem: PRT MS/GM 816/2002, Art. 1º, III)
IV - realizar ações de atenção/assistência aos pacientes e familiares, de forma integral e abrangente, com atendimento individual, em grupo, atividades comunitárias, orientação profissional, suporte medicamentoso, psicoterápico, de orientação e outros; (Origem: PRT MS/GM 816/2002, Art. 1º, IV)
V - organizar/regular as demandas e os fluxos assistenciais; (Origem: PRT MS/GM 816/2002, Art. 1º, V)
VI - promover, em articulação com instituições formadoras, a capacitação e supervisão das equipes de atenção básica, serviços e programas de saúde mental locais. (Origem: PRT MS/GM 816/2002, Art. 1º, VI)
Art. 85. Ficam definidas, na forma do Anexo XVIII , as competências e atribuições relativas à implantação/gestão do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas de cada nível de gestão do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 816/2002, Art. 2º)
Art. 86. Os procedimentos realizados pelos CAPS e NAPS existentes, após o seu recadastramento, assim como os novos serviços que vierem a ser criados e cadastrados em conformidade com o estabelecido na regulamentação do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas, serão remunerados através do Sistema APAC/SIA, conforme estabelecido Capítulo I do Título II do Anexo V da Portaria de Consolidação nº 3 e SAS/MS N° 189, de 20 de março de 2002. (Origem: PRT MS/GM 816/2002, Art. 5º)
Art. 87. Fica instituído o Programa Permanente de Capacitação de Recursos Humanos da rede SUS para os Serviços de Atenção aos Pacientes com Transtornos causados pelo Uso Prejudicial e/ou Dependência de Álcool e Outras Drogas, a ser regulamentado em ato específico da Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 816/2002, Art. 7º)
Art. 88. A Secretaria de Atenção à Saúde adotará as providências necessárias ao cumprimento do disposto nesta Seção, procedendo a sua respectiva regulamentação. (Origem: PRT MS/GM 816/2002, Art. 9º)
Seção V
Das Ações que Visam à Redução de Danos Sociais e à Saúde, Decorrentes do Uso de Produtos, Substâncias ou Drogas que Causem Dependência
Art. 89. As ações que visam à redução de danos sociais e à saúde, decorrentes do uso de produtos, substâncias ou drogas que causem dependência, são reguladas por esta Seção. (Origem: PRT MS/GM 1028/2005, Art. 1º)
Art. 90. A redução de danos sociais e à saúde, decorrentes do uso de produtos, substâncias ou drogas que causem dependência, desenvolver-se-á por meio de ações de saúde dirigidas a usuários ou a dependentes que não podem, não conseguem ou não querem interromper o referido uso, tendo como objetivo reduzir os riscos associados sem, necessariamente, intervir na oferta ou no consumo. (Origem: PRT MS/GM 1028/2005, Art. 2º)
Art. 91. As ações de redução de danos sociais e à saúde, decorrentes do uso de produtos, substâncias ou drogas que causem dependência, compreenderão uma ou mais das medidas de atenção integral à saúde, listadas a seguir, praticadas respeitando as necessidades do público alvo e da comunidade: (Origem: PRT MS/GM 1028/2005, Art. 3º)
I - informação, educação e aconselhamento; (Origem: PRT MS/GM 1028/2005, Art. 3º, I)
II - assistência social e à saúde; e (Origem: PRT MS/GM 1028/2005, Art. 3º, II)
III - disponibilização de insumos de proteção à saúde e de prevenção ao HIV/Aids e Hepatites. (Origem: PRT MS/GM 1028/2005, Art. 3º, III)
Art. 92. As ações de informação, educação e aconselhamento terão por objetivo o estímulo à adoção de comportamentos mais seguros no consumo de produtos, substâncias ou drogas que causem dependência, e nas práticas sexuais de seus consumidores e parceiros sexuais. (Origem: PRT MS/GM 1028/2005, Art. 4º)
§ 1º São conteúdos necessários das ações de informação, educação e aconselhamento: (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º)
I - informações sobre os possíveis riscos e danos relacionados ao consumo de produtos, substâncias ou drogas que causem dependência; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, I)
II - desestímulo ao compartilhamento de instrumentos utilizados para consumo de produtos, substâncias ou drogas que causem dependência; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, II)
III - orientação sobre prevenção e conduta em caso de intoxicação aguda ("overdose"); (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, III)
IV - prevenção das infecções pelo HIV, hepatites, endocardites e outras patologias de padrão de transmissão similar; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, IV)
V - orientação para prática do sexo seguro; (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, V)
VI - divulgação dos serviços públicos e de interesse público, nas áreas de assistência social e de saúde; e (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, VI)
VII - divulgação dos princípios e garantias fundamentais assegurados na Constituição Federal e nas declarações universais de direitos. (Origem: PRT MS/GM 1028/2005, Art. 4º, § 1º, VII)
§ 2º As ações de informação, educação e aconselhamento devem, necessariamente, ser acompanhadas da distribuição dos insumos destinados a minimizar os riscos decorrentes do consumo de produtos, substâncias e drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 4º, § 2º)
Art. 93. A oferta de assistência social e à saúde, na comunidade e em serviços, objetivará a garantia de assistência integral ao usuário ou ao dependente de produtos, substâncias ou drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 5º)
Parágrafo Único. São ações necessárias na oferta de assistência social e à saúde, quando requeridas pelo usuário ou pelo dependente: (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único)
I - o tratamento à dependência causada por produtos, substâncias ou drogas; (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, I)
II - o diagnóstico da infecção pelo HIV e o tratamento da infecção pelo HIV e da AIDS; (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, II)
III - a imunização, o diagnóstico e o tratamento das hepatites virais; (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, III)
IV - o diagnóstico e o tratamento das doenças sexualmente transmissíveis (DST); e (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, IV)
V - a orientação para o exercício dos direitos e garantias fundamentais previstos na Constituição Federal e quaisquer outros relativos à manutenção de qualidade digna da vida. (Origem: PRT MS/GM 1028/2005, Art. 5º, Parágrafo Único, V)
Art. 94. As estratégias de redução de danos incluirão a disponibilização de insumos de prevenção ao HIV/Aids e as estratégias da saúde pública dirigidas à proteção da vida e ao tratamento dos dependentes de produtos, substâncias e drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 6º)
Art. 95. As iniciativas relacionadas ao consumo de bebidas alcoólicas serão incluídas nas estratégias de redução de danos, dados os agravos relacionados a esta substância na população geral e que devam ser articuladas intersetorialmente de forma a potencializar os efeitos de promoção à saúde. (Origem: PRT MS/GM 1028/2005, Art. 7º)
Art. 96. As ações de redução de danos deverão ser desenvolvidas em todos os espaços de interesse público em que ocorra ou possa ocorrer o consumo de produtos, substâncias ou drogas que causem dependência, ou para onde se reportem os seus usuários. (Origem: PRT MS/GM 1028/2005, Art. 8º)
Parágrafo Único. As disposições desta Seção aplicam-se no âmbito do sistema penitenciário, das cadeias públicas, dos estabelecimentos educacionais destinados à internação de adolescentes, dos hospitais psiquiátricos, dos abrigos, dos estabelecimentos destinados ao tratamento de usuários ou dependentes ou de quaisquer outras instituições que mantenham pessoas submetidas à privação ou à restrição da liberdade. (Origem: PRT MS/GM 1028/2005, Art. 8º, Parágrafo Único)
Art. 97. As ações de redução de danos deverão ser desenvolvidas em consonância com a promoção dos direitos humanos, tendo especialmente em conta o respeito à diversidade dos usuários ou dependentes de produtos, substâncias ou drogas que causem dependência. (Origem: PRT MS/GM 1028/2005, Art. 9º)
§ 1º Em todas as ações de redução de danos, devem ser preservadas a identidade e a liberdade da decisão do usuário ou dependente ou pessoas tomadas como tais, sobre qualquer procedimento relacionado à prevenção, ao diagnóstico e ao tratamento. (Origem: PRT MS/GM 1028/2005, Art. 9º, § 1º)
§ 2º A contratação de pessoal para o trabalho com redução de danos, de que trata esta Seção deve dar prioridade aos membros da comunidade onde as ações serão desenvolvidas, observadas, no âmbito da Administração Pública, as normas de acesso a cargos ou empregos públicos, levando-se em conta principalmente o acesso à população alvo, independentemente do nível de instrução formal. (Origem: PRT MS/GM 1028/2005, Art. 9º, § 2º)
Seção VI
Do Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental
Art. 98. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental. (Origem: PRT MS/GM 799/2000, Art. 1º)
Parágrafo Único. O Programa de que trata este Artigo deverá contemplar as seguintes atividades: (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único)
I - avaliação da assistência à saúde mental no País, dentro do contexto de sistema global de atenção, promoção e recuperação da saúde mental; (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, a)
II - supervisão e avaliação, in loco, dos hospitais psiquiátricos que compõem a rede assistencial do Sistema Único de Saúde, tendo em vista a adoção de medidas que reforcem a continuidade do processo de reversão do modelo de atenção à saúde mental instituído no País; (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, b)
III - análise, avaliação e proposição de alternativas assistenciais na área de saúde mental; (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, c)
IV - elaboração e proposição de protocolos de regulação e de mecanismos de implementação de módulo de regulação da assistência à saúde mental que venha a compor as Centrais de Regulação, com o objetivo de regular, ordenar e orientar esta assistência e com o princípio fundamental de incrementar a capacidade do poder público de gerir o sistema de saúde e de responder, de forma qualificada e integrada, às demandas de saúde de toda a população. (Origem: PRT MS/GM 799/2000, Art. 1º, Parágrafo Único, d)
Art. 99. A Secretaria de Atenção à Saúde (SAS) estruturará Grupo Técnico de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental e designará os membros que dele farão parte. (Origem: PRT MS/GM 799/2000, Art. 2º)
§ 1º A convite deste Ministério da Saúde, a Comissão de Direitos Humanos da Câmara dos Deputados indicará um dos seus componentes para acompanhar os trabalhos do Grupo Técnico de que trata este Artigo. (Origem: PRT MS/GM 799/2000, Art. 2º, § 1º)
§ 2º O Grupo Técnico terá as seguintes atribuições e competências: (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º)
I - coordenar a implementação do Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental; (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, a)
II - coordenar e articular as ações que serão desenvolvidas pelos Grupos Técnicos designados, com a mesma finalidade, pelos estados, Distrito federal e municípios em Gestão Plena do Sistema Municipal; (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, b)
III - promover a capacitação dos profissionais que desenvolverão as atividades inerentes ao Programa instituído, especialmente daqueles integrantes dos Grupos Técnicos estaduais e municipais; (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, c)
IV - emitir relatórios técnicos contendo as análises, avaliações e acompanhamentos realizados e propondo medidas corretivas e de aperfeiçoamento do sistema de assistência em saúde mental. (Origem: PRT MS/GM 799/2000, Art. 2º, § 2º, d)
§ 3º As atividades dos Grupos Técnicos, tanto da Secretaria de Atenção à Saúde quanto dos estados e municípios, não substituem as ações e competências de supervisão, controle, avaliação e auditoria dos gestores do Sistema Único de Saúde - federal, estaduais e municipais. (Origem: PRT MS/GM 799/2000, Art. 2º, § 3º)
Art. 100. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema Municipal estruturarão, em seus respectivos âmbitos de atuação, Grupo Técnico de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental e designarão os membros que dele farão parte. (Origem: PRT MS/GM 799/2000, Art. 3º)
§ 1º Os Grupos Técnicos de que trata este Artigo deverão ser compostos, no mínimo, pelos seguintes técnicos: (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º)
I - Nos estados e no Distrito Federal: (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I)
a) 01 (um) representante da equipe da saúde mental; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I, a)
b) 01 (um) representante da equipe de vigilância sanitária; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I, b)
c) 01 (um) representante da equipe de controle e avaliação; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, I, c)
II - Nos municípios em Gestão Plena do Sistema Municipal: (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II)
a) 02 (dois) :representantes da equipe da saúde mental (01 do estado e 01 do município); (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II, a)
b) 02 (dois) representantes da equipe de vigilância sanitária (01 do estado e 01 do município); (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II, b)
c) 01 (um) representante da equipe de controle e avaliação; (Origem: PRT MS/GM 799/2000, Art. 3º, § 1º, II, c)
§ 2º Estes Grupos Técnicos terão as seguintes atribuições e competências: (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º)
I - realizar, nos seus respectivos âmbitos de atuação e sob a coordenação do Grupo Técnico estruturado pela Secretaria de Atenção à Saúde, as atividades inerentes ao Programa Permanente de Organização e Acompanhamento das Ações Assistenciais em Saúde Mental; (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º, a)
II - no caso dos Grupos Técnicos de estados, articular as ações que serão desenvolvidas pelos Grupos Técnicos designados, com a mesma finalidade, pelos municípios em Gestão Plena do Sistema Municipal; (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º, b)
III - emitir relatórios técnicos contendo as análises, avaliações e acompanhamentos realizados e propondo medidas corretivas e de aperfeiçoamento de seu respectivo sistema de assistência em saúde mental. (Origem: PRT MS/GM 799/2000, Art. 3º, § 2º, c)
Art. 101. A constatação de irregularidades ou o não cumprimento das normas vigentes implicará, de conformidade com o caso apresentado, em instauração de auditoria pelo Ministério da Saúde e oferecimento de denúncia ao Ministério Público. (Origem: PRT MS/GM 799/2000, Art. 4º)
Art. 102. A Secretaria de Atenção à Saúde adotará as medidas necessárias ao pleno cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 799/2000, Art. 5º)
Seção VII
Programa Nacional de Avaliação do Sistema Hospitalar/Psiquiatria (PNASH)
Art. 103. Ficam estabelecidas, na forma do Anexo XXV , as diretrizes e normas para a regulamentação da assistência hospitalar em psiquiatria no Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 251/2002, Art. 1º)
Art. 104. Fica estabelecida a seguinte classificação para os hospitais psiquiátricos integrantes da rede do SUS, apurada pelos indicadores de qualidade aferidos pelo Programa Nacional de Avaliação do Sistema Hospitalar/Psiquiatria (PNASH) e o número de leitos do hospital, constante no cadastro do Ministério da Saúde. (Origem: PRT MS/GM 251/2002, Art. 2º)
I - Classe I: Pontuação do PNASH: 81 - 100 %, Número de Leitos: 20-80; (Origem: PRT MS/GM 251/2002, Art. 2º, I)
II - Classe II: (Origem: PRT MS/GM 251/2002, Art. 2º, II)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 20-80; (Origem: PRT MS/GM 251/2002, Art. 2º, II, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 81-120; (Origem: PRT MS/GM 251/2002, Art. 2º, II, b)
III - Classe III: (Origem: PRT MS/GM 251/2002, Art. 2º, III)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 81-120; (Origem: PRT MS/GM 251/2002, Art. 2º, III, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 121-160; (Origem: PRT MS/GM 251/2002, Art. 2º, III, b)
IV - Classe IV: (Origem: PRT MS/GM 251/2002, Art. 2º, IV)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 121-160; (Origem: PRT MS/GM 251/2002, Art. 2º, IV, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 161-200; (Origem: PRT MS/GM 251/2002, Art. 2º, IV, b)
V - Classe V: (Origem: PRT MS/GM 251/2002, Art. 2º, V)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 161-200; (Origem: PRT MS/GM 251/2002, Art. 2º, V, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 201-240; (Origem: PRT MS/GM 251/2002, Art. 2º, V, b)
VI - Classe VI: (Origem: PRT MS/GM 251/2002, Art. 2º, VI)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 201-240; (Origem: PRT MS/GM 251/2002, Art. 2º, VI, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: 241-400; (Origem: PRT MS/GM 251/2002, Art. 2º, VI, b)
VII - Classe VII: (Origem: PRT MS/GM 251/2002, Art. 2º, VII)
a) Pontuação do PNASH: 61- 80%, Número de Leitos: 241-400; (Origem: PRT MS/GM 251/2002, Art. 2º, VII, a)
b) Pontuação do PNASH: 81-100%, Número de Leitos: Acima de 400; (Origem: PRT MS/GM 251/2002, Art. 2º, VII, b)
VIII - Classe VIII: Pontuação do PNASH: 61- 80%, Número de Leitos: Acima de 400. (Origem: PRT MS/GM 251/2002, Art. 2º, VIII)
Art. 105. Os hospitais que obtiverem índice inferior a 40% do PNASH, assim como os hospitais que não alcançarem o índice mínimo de 61% do PNASH, após o processo de reavaliação, não serão classificados conforme o estabelecido nesta Seção. (Origem: PRT MS/GM 251/2002, Art. 4º, Parágrafo Único)
Art. 106. O gestor local deverá adotar as providências necessárias para a suspensão de novas internações e a substituição planificada do atendimento aos pacientes dos hospitais que não obtiveram pontuação suficiente para a sua classificação. (Origem: PRT MS/GM 251/2002, Art. 5º)
Parágrafo Único. O gestor local, em conjunto com a Secretaria de Estado da Saúde, elaborará um projeto técnico para a substituição do atendimento aos pacientes dos hospitais não classificados, preferencialmente em serviços extra-hospitalares, determinando o seu descredenciamento do Sistema. (Origem: PRT MS/GM 251/2002, Art. 5º, Parágrafo Único)
Art. 107. A Secretaria de Atenção à Saúde promoverá a atualização dos procedimentos de atendimento em psiquiatria, de acordo com a classificação definida neste Anexo, em substituição ao estabelecido na Portaria GM/MS n° 469, de 03 de abril de 2001. (Origem: PRT MS/GM 251/2002, Art. 6º)
Art. 108. A Secretaria de Atenção à Saúde incluirá, na Tabela do Sistema de Informações Hospitalares do Sistema Único de Saúde (SIH-SUS), procedimento específico para o processamento das Autorizações de Internação Hospitalar (AIH) dos hospitais não classificados de acordo com os indicadores de qualidade aferidos pelo PNASH/Psiquiatria, até a transferência de todos os pacientes para outras unidades hospitalares ou serviços extra-hospitalares, definidas pelo gestor local do SUS. (Origem: PRT MS/GM 251/2002, Art. 7º)
Art. 109. É atribuição intransferível do gestor local do Sistema Único de Saúde estabelecer o limite das internações em psiquiatria e o controle da porta de entrada das internações hospitalares, estabelecendo instrumentos e mecanismos específicos e resolutivos de atendimento nas situações de urgência/emergência, preferencialmente em serviços extra-hospitalares ou na rede hospitalar não especializada. (Origem: PRT MS/GM 251/2002, Art. 8º)
§ 1º Para a organização da porta de entrada, devem ser seguidas as recomendações contidas no MANUAL DO GESTOR PARA ATENDIMENTO TERRITORIAL EM SAÚDE MENTAL. (Origem: PRT MS/GM 251/2002, Art. 8º, § 1º)
§ 2º O número mensal de internações e o limite de internações para cada município ou região, estimadas de acordo com as metas estabelecidas, deverão constar do Plano Diretor de Regionalização (PDR). (Origem: PRT MS/GM 251/2002, Art. 8º, § 2º)
CAPÍTULO IV
DA ALIMENTAÇÃO E NUTRIÇÃO
Seção I
Do Programa Nacional de Suplementação de Ferro (PNSF) da Política Nacional de Alimentação e Nutrição (PNAN)
Art. 110. Esta Seção atualiza as diretrizes nacionais do Programa Nacional de Suplementação de Ferro (PNSF) da Política Nacional de Alimentação e Nutrição (PNAN). (Origem: PRT MS/GM 1977/2014, Art. 1º)
Art. 111. O PNSF tem como objetivo prevenir e controlar a anemia por deficiência de ferro e deverá ser implantado nas Unidades Básicas de Saúde (UBS) de todos os Municípios brasileiros. (Origem: PRT MS/GM 1977/2014, Art. 2º)
Parágrafo Único. O público a ser atendido serão as crianças entre 6 (seis) e 24 (vinte e quatro) meses de idade, gestantes e mulheres até o 3º mês pós-parto e pós-aborto, que deverão ser suplementadas de forma profilática e universal, observando-se o Manual de Condutas Gerais do Programa Nacional de Suplementação de Ferro, definido pela Coordenação-Geral de Alimentação e Nutrição (CGAN/DAB/SAS/MS), disponível no endereço eletrônico
http://dab.saude.gov.br/portaldab/biblioteca.php?conteudo=publicacoes/manual_ferro2013. (Origem: PRT MS/GM 1977/2014, Art. 2º, Parágrafo Único)
Art. 112. São atribuições da União, por intermédio do Ministério da Saúde, no âmbito do Programa Nacional de Suplementação de Ferro: (Origem: PRT MS/GM 1977/2014, Art. 3º)
I - estimular e assessorar, tecnicamente, os Estados, o Distrito Federal e os Municípios para a implantação e a implementação do Programa, em nível nacional; (Origem: PRT MS/GM 1977/2014, Art. 3º, I)
II - elaborar materiais e divulgar as normas operacionais do Programa aos Estados, Distrito Federal e Municípios; (Origem: PRT MS/GM 1977/2014, Art. 3º, II)
III - monitorar, em nível nacional, a implantação, a operacionalização, o desempenho e o impacto do programa; (Origem: PRT MS/GM 1977/2014, Art. 3º, III)
IV - cooperar tecnicamente com os Estados, o Distrito Federal e os Municípios para o monitoramento da implantação, da operacionalização, do desempenho e do impacto no programa, em seus territórios; e (Origem: PRT MS/GM 1977/2014, Art. 3º, IV)
V - estabelecer parcerias com outras instâncias, órgãos e instituições, governamentais e não governamentais, para o fomento de atividades complementares, com o objetivo de promover a alimentação adequada e saudável. (Origem: PRT MS/GM 1977/2014, Art. 3º, V)
Art. 113. Para a implantação do Programa Nacional de Suplementação de Ferro, os Estados e o Distrito Federal deverão observar, nos seus respectivos territórios, as seguintes condições: (Origem: PRT MS/GM 1977/2014, Art. 4º)
I - definir a área técnica responsável pelo acompanhamento do Programa, sendo, de preferência, a que já seja responsável pelas ações de alimentação e nutrição em seu território; (Origem: PRT MS/GM 1977/2014, Art. 4º, I)
II - articular as áreas técnicas da respectiva Secretaria de Saúde, tais como alimentação e nutrição, atenção básica, saúde da criança, saúde da mulher, assistência farmacêutica, dentre outras, considerando as redes de atenção à saúde, para que o Programa seja implantado de forma integrada nos Municípios sediados em seus territórios; (Origem: PRT MS/GM 1977/2014, Art. 4º, II)
III - estimular e assessorar, tecnicamente, os Municípios localizados nas suas esferas de gestão, na implantação e na implementação do Programa; (Origem: PRT MS/GM 1977/2014, Art. 4º, III)
IV - monitorar, em nível estadual, a implantação, a operacionalização, o desempenho e o impacto do Programa, mediante a realização de visitas técnicas e auditorias; (Origem: PRT MS/GM 1977/2014, Art. 4º, IV)
V - auxiliar os Municípios sediados em seu território para o monitoramento referido no art. 113, IV; (Origem: PRT MS/GM 1977/2014, Art. 4º, V)
VI - divulgar os materiais e as normas operacionais do Programa aos Municípios; e (Origem: PRT MS/GM 1977/2014, Art. 4º, VI)
VII - capacitar os coordenadores municipais para a operacionalização do Programa de acordo com as orientações descritas no Manual de Condutas Gerais do Programa, definido pela CGAN/DAB/SAS/MS, nos termos do art. 111, parágrafo único. (Origem: PRT MS/GM 1977/2014, Art. 4º, VII)
Art. 114. Para a implantação do Programa Nacional de Suplementação de Ferro, o Distrito Federal e os Municípios deverão observar, em seus territórios, as seguintes condições: (Origem: PRT MS/GM 1977/2014, Art. 5º)
I - indicar um profissional técnico, devidamente capacitado, para coordenar o Programa, sendo, de preferência, o que já seja responsável pelas ações de alimentação e nutrição no Distrito Federal ou no respectivo Município; (Origem: PRT MS/GM 1977/2014, Art. 5º, I)
II - planejar, programar, adquirir, armazenar, controlar os estoques, os prazos de validade, distribuir e dispensar os suplementos de sulfato ferroso e ácido fólico, previstos no Componente Básico da Assistência Farmacêutica; (Origem: PRT MS/GM 1977/2014, Art. 5º, II)
III - estimular ações complementares de promoção do aleitamento materno e de alimentação adequada e saudável do público alvo; (Origem: PRT MS/GM 1977/2014, Art. 5º, III)
IV - identificar o público específico a ser atendido pelo programa de acordo com as recomendações do Manual de Condutas Gerais definido pela CGAN/DAB/SAS/MS, nos termos do art. 111, parágrafo único; (Origem: PRT MS/GM 1977/2014, Art. 5º, IV)
V - realizar o monitoramento do Programa por meio dos sistemas da Atenção Básica, da Assistência Farmacêutica ou de outro sistema municipal compatível; e (Origem: PRT MS/GM 1977/2014, Art. 5º, V)
VI - avaliar o desempenho do Programa em seu território. (Origem: PRT MS/GM 1977/2014, Art. 5º, VI)
Art. 115. O planejamento do Programa Nacional de Suplementação de Ferro deverá constar no Plano de Saúde e na respectiva Programação Anual de Saúde das Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios. (Origem: PRT MS/GM 1977/2014, Art. 6º)
Art. 116. O monitoramento de que trata esta Seção não dispensa o ente federativo beneficiário de comprovação da implementação do Programa Nacional de Suplementação de Ferro por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 1977/2014, Art. 7º)
Seção II
Do Programa Nacional de Suplementação de Vitamina A
Art. 117. Fica instituído o Programa Nacional de Suplementação de Vitamina A, destinado a prevenir e/ou controlar essa deficiência nutricional mediante a suplementação com megadoses de vitamina A, em crianças de seis a cinquenta e nove meses de idade e puérperas no pós-parto imediato, pertencentes à Região Nordeste, ao Vale do Jequitinhonha em Minas Gerais e ao Vale do Ribeira em São Paulo. (Origem: PRT MS/GM 729/2005, Art. 1º)
§ 1º Outras áreas ou regiões que detectem sinais da deficiência em crianças ou identifiquem, por meio de pesquisa científica, evidências da deficiência direta ou indireta poderão ser incorporados ao Programa a qualquer tempo. (Origem: PRT MS/GM 729/2005, Art. 1º, § 1º)
§ 2º O produto utilizado na suplementação de crianças e puérperas é a vitamina A na forma líquida, nas concentrações de 100.000 UI e 200.000 UI, diluída em óleo de soja e acrescida de vitamina E. (Origem: PRT MS/GM 729/2005, Art. 1º, § 2º)
§ 3º A suplementação da puérpera no pós-parto imediato é recomendada somente antes da alta hospitalar, conforme o Manual de Condutas Gerais do Programa definido pela Coordenação Geral da Política de Alimentação e Nutrição. (Origem: PRT MS/GM 729/2005, Art. 1º, § 3º)
Art. 118. O suplemento de vitamina A será enviado, conforme logística definida entre a Secretaria de Atenção à Saúde, por intermédio do Departamento de Atenção Básica da área técnica da política de alimentação e nutrição, e a Secretaria de Ciência, Tecnologia e Insumos Estratégicos por intermédio do Departamento de Assistência Farmacêutica e Insumos Estratégicos, do Ministério da Saúde, cujo quantitativo será calculado previamente com base no censo do Instituto Brasileiro de Geografia e Estatística (IBGE). (Origem: PRT MS/GM 729/2005, Art. 2º)
§ 1º O quantitativo de megadoses de vitamina A, necessário para o atendimento das puérperas no pós-parto imediato, será calculado com base no Sistema Nacional de Nascidos Vivos (SI-NASC). (Origem: PRT MS/GM 729/2005, Art. 2º, § 1º)
§ 2º Para o cálculo do quantitativo da megadose de vitamina A utilizada no exercício seguinte, o Ministério da Saúde deduzirá o saldo de produtos ainda disponíveis no município. (Origem: PRT MS/GM 729/2005, Art. 2º, § 2º)
§ 3º Caso seja necessário, o Ministério da Saúde avaliará a pertinência e a factibilidade de enviar quantitativo adicional da megadose de vitamina A ao município desde que haja solicitação formal do gestor municipal do SUS, devidamente fundamentada. (Origem: PRT MS/GM 729/2005, Art. 2º, § 3º)
Art. 119. As famílias que têm crianças de seis a cinquenta e nove meses deverão ser identificadas e assistidas por uma equipe de saúde da família ou por unidades básicas de saúde. (Origem: PRT MS/GM 729/2005, Art. 3º)
Parágrafo Único. As puérperas deverão ser suplementadas ainda nas maternidades e acompanhadas pelas unidades básicas de saúde. (Origem: PRT MS/GM 729/2005, Art. 3º, Parágrafo Único)
Art. 120. São atribuições do Ministério da Saúde: (Origem: PRT MS/GM 729/2005, Art. 4º)
I - a aquisição e o envio do suplemento de vitamina A, cuja responsabilidade fica a cargo da Assistência Farmacêutica, área técnica competente do Ministério da Saúde, conforme a logística definida e pactuada em conjunto com as Coordenações Estaduais de Alimentação e Nutrição; (Origem: PRT MS/GM 729/2005, Art. 4º, I)
II - o acompanhamento e o monitoramento da situação dos estados e dos municípios quanto ao nível de implantação e operacionalização do Programa e à cobertura populacional; (Origem: PRT MS/GM 729/2005, Art. 4º, II)
III - a avaliação do desempenho e o impacto do Programa em nível nacional e apoio das ações da mesma natureza nos estados e municípios; (Origem: PRT MS/GM 729/2005, Art. 4º, III)
IV - o delineamento e o apoio a estudos e pesquisas para avaliação de processos relativos ao Programa; (Origem: PRT MS/GM 729/2005, Art. 4º, IV)
V - a realização, por intermédio do Sistema Nacional de Auditoria (SNA), de auditorias em municípios alvo de denúncias e irregularidades na condução do Programa; (Origem: PRT MS/GM 729/2005, Art. 4º, V)
VI - o estabelecimento de parcerias com outras instâncias, órgãos e instituições, governamentais e não-governamentais para o fomento de atividades complementares, com o objetivo de promoção da alimentação saudável e prevenção de deficiência de vitamina A; e (Origem: PRT MS/GM 729/2005, Art. 4º, VI)
VII - a elaboração de materiais e a divulgação das normas operacionais do Programa aos estados. (Origem: PRT MS/GM 729/2005, Art. 4º, VII)
Art. 121. São condições necessárias, a serem observadas pelos estados, para implantação do Programa, citado no art. 117: (Origem: PRT MS/GM 729/2005, Art. 5º)
I - a indicação de área técnica responsável para coordenar, em âmbito estadual, a operacionalização do Programa, de preferência aquela já responsável pelas ações de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 5º, I)
II - a divulgação da norma operacional do Programa aos municípios, bem como o apoio na implantação dessas condições; (Origem: PRT MS/GM 729/2005, Art. 5º, II)
III - o acompanhamento e o monitoramento da situação dos municípios quanto ao nível de implantação e implementação do Programa; (Origem: PRT MS/GM 729/2005, Art. 5º, III)
IV - o remanejamento do quantitativo de suplemento entre municípios, se necessário; (Origem: PRT MS/GM 729/2005, Art. 5º, IV)
V - o estímulo, o auxílio e o monitoramento da implantação da Vigilância Alimentar e Nutricional nos municípios, de acordo com as normas estabelecidas em legislação própria; (Origem: PRT MS/GM 729/2005, Art. 5º, V)
VI - a implantação e a implementação do Programa Nacional de Suplementação de Vitamina A em todas as maternidades estaduais; (Origem: PRT MS/GM 729/2005, Art. 5º, VI)
VII - o apoio e o assessoramento aos municípios para a implantação e a manutenção da distribuição da megadose de vitamina A nas maternidades municipais; (Origem: PRT MS/GM 729/2005, Art. 5º, VII)
VIII - o assessoramento dos municípios na identificação da estratégia de ação para suplementação das crianças entre seis e cinquenta e nove meses de idade, de forma periódica e regular; (Origem: PRT MS/GM 729/2005, Art. 5º, VIII)
IX - o apoio à capacitação de recursos humanos nas ações de saúde inerentes ao controle e à prevenção das carências nutricionais, fortalecendo as atividades educativas de orientação alimentar e nutricional, com ênfase na promoção da alimentação saudável; (Origem: PRT MS/GM 729/2005, Art. 5º, IX)
X - a avaliação do desempenho e do impacto do Programa em nível estadual e do apoio ao município para o desenvolvimento dessas ações; e (Origem: PRT MS/GM 729/2005, Art. 5º, X)
XI - a apuração das denúncias de irregularidades na condução do Programa, mediante a realização de visitas técnicas e auditorias. (Origem: PRT MS/GM 729/2005, Art. 5º, XI)
Parágrafo Único. Além das atribuições descritas anteriormente, recomenda-se às Secretarias Estaduais de Saúde a criação de um grupo de trabalho com representantes das áreas técnicas afins para acompanhamento, monitoramento e avaliação do Programa e planejamento das ações necessárias a sua execução. (Origem: PRT MS/GM 729/2005, Art. 5º, Parágrafo Único)
Art. 122. São condições necessárias à implantação do Programa na respectiva localidade, a serem observadas pelos municípios dos estados citados no art. 117: (Origem: PRT MS/GM 729/2005, Art. 6º)
I - a indicação de um profissional técnico devidamente capacitado para coordenar o Programa, de preferência aquele já responsável pelas ações de alimentação e nutrição do município; (Origem: PRT MS/GM 729/2005, Art. 6º, I)
II - a identificação das famílias que tenham crianças de seis a cinquenta e nove meses e a administração da megadose de vitamina A, conforme o Manual de Condutas Gerais do Programa definido pela área técnica da política de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 6º, II)
III - a identificação, nas maternidades, das puérperas no pós-parto imediato para administração da megadose de vitamina A; (Origem: PRT MS/GM 729/2005, Art. 6º, III)
IV - o provimento das ações básicas de saúde e atividades educativas em alimentação e nutrição necessárias para que as famílias reconheçam a deficiência de vitamina A como problema de saúde e adotem hábitos alimentares saudáveis; (Origem: PRT MS/GM 729/2005, Art. 6º, IV)
V - o estímulo para que os responsáveis por crianças de seis a cinquenta e nove meses levem seus filhos aos serviços de saúde para dar seguimento às administrações das megadose de vitamina A; (Origem: PRT MS/GM 729/2005, Art. 6º, V)
VI - o recebimento e o armazenamento da megadose de vitamina A em local apropriado, bem como a utilização, em tempo hábil, de acordo com o prazo de validade; (Origem: PRT MS/GM 729/2005, Art. 6º, VI)
VII - o monitoramento das famílias assistidas pelo Programa por meio da Vigilância Alimentar e Nutricional, de acordo com as normas estabelecidas em legislação própria; (Origem: PRT MS/GM 729/2005, Art. 6º, VII)
VIII - a manutenção atualizada dos dados de controle do estoque e de distribuição da megadose de vitamina A, enviando mensalmente as informações para o nível federal e estadual, conforme a estratégia preconizada no Manual de Condutas Gerais do Programa definido pela área técnica da política de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 6º, VIII)
IX - o envio das informações à Coordenação Estadual do Programa quando os estoques de vitamina A estiverem excedendo as necessidades do município, possibilitando o remanejamento do suplemento para municípios vizinhos, ou quando os estoques estiverem aquém das necessidades, solicitando, nesse caso, quantitativo adicional, em tempo hábil, para não ocasionar descontinuidade do Programa, ou ainda quando o lote estiver com prazo de validade próximo da data a expirar; (Origem: PRT MS/GM 729/2005, Art. 6º, IX)
X - a capacitação de profissionais de saúde para operacionalização do Programa, de acordo com as orientações especificadas no Manual de Condutas Gerais do Programa definido pela área técnica da política de alimentação e nutrição; (Origem: PRT MS/GM 729/2005, Art. 6º, X)
XI - a implantação e a implementação do Programa Nacional de Suplementação de Vitamina A em todas as maternidades municipais; e (Origem: PRT MS/GM 729/2005, Art. 6º, XI)
XII - a avaliação do desempenho e, se possível, do impacto do Programa em nível municipal. (Origem: PRT MS/GM 729/2005, Art. 6º, XII)
Parágrafo Único. Além das atribuições descritas anteriormente, recomenda-se às Secretarias Municipais de Saúde: (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único)
I - o estabelecimento de parcerias com outras instituições que atuem na prevenção e no controle dos distúrbios nutricionais em nível local para a identificação e o acompanhamento das crianças em risco no município; (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único, I)
II - a promoção de ações voltadas à intensificação do aleitamento materno exclusivo até os seis meses e complementar até os dois anos ou mais de idade; e (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único, II)
III - a instituição de grupo de trabalho, com representantes das áreas técnicas afins para acompanhar, monitorar e avaliar o Programa e planejar ações necessárias a sua execução. (Origem: PRT MS/GM 729/2005, Art. 6º, Parágrafo Único, III)
Art. 123. A estratégia para o atendimento da população indígena aldeada no Programa Nacional de Suplementação de Vitamina A deve ser pactuada com a CGAPSI/DASI/SESAI, de forma a garantir o acesso e o adequado atendimento, observando-se a pertinência dessa ação frente às características culturais dessa população. (Origem: PRT MS/GM 729/2005, Art. 7º)
Art. 124. Os Centros Colaboradores em Alimentação e Nutrição prestam apoio técnico ao Ministério da Saúde e às Secretarias Estaduais de Saúde no desenvolvimento das ações da Política Nacional de Alimentação e Nutrição, inclusive na capacitação de recursos humanos, no acompanhamento e na avaliação do Programa Nacional de Suplementação de Vitamina A. (Origem: PRT MS/GM 729/2005, Art. 8º)
Parágrafo Único. Para fins do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios com os referidos Centros Colaboradores e de Referência em Alimentação e Nutrição, bem como com instituições de ensino e pesquisa com conhecimento técnico. (Origem: PRT MS/GM 729/2005, Art. 8º, Parágrafo Único)
Art. 125. A avaliação de impacto do Programa Nacional de Suplementação de Vitamina A deve contemplar a análise de sua eficácia, eficiência, efetividade e seus efeitos a curto, médio e longo prazo. (Origem: PRT MS/GM 729/2005, Art. 9º)
Parágrafo Único. Para fins do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios com Centros ou Universidade de referência para a avaliação do Programa. (Origem: PRT MS/GM 729/2005, Art. 9º, Parágrafo Único)
Art. 126. Cabe aos Conselhos Municipais, Estaduais e Nacional de Saúde, neste último por intermédio da Comissão Intersetorial de Alimentação e Nutrição, realizar o controle social, bem como acompanhar o processo de implantação e operacionalização do Programa Nacional de Suplementação de Vitamina A, nos respectivos níveis de atuação. (Origem: PRT MS/GM 729/2005, Art. 10)
Parágrafo Único. Para que esse controle seja efetuado, as informações sobre a operacionalização do Programa deverão ser disponibilizadas aos respectivos conselhos. (Origem: PRT MS/GM 729/2005, Art. 10, Parágrafo Único)
Art. 127. Poderá estar sujeito a penalidades o município que, por ação ou omissão de seus agentes, incorrer em fraudes conforme base legal da Agência Nacional de Vigilância Sanitária, segundo as Leis nº 6.360, de 23 de setembro de 1976 e nº 6.437, de 20 de agosto de 1977. (Origem: PRT MS/GM 729/2005, Art. 11)
CAPÍTULO V
DA VIGILÂNCIA EM SAÚDE
Seção I
Do Plano Diretor de Vigilância Sanitária
Art. 128. Fica aprovado o Plano Diretor de Vigilância Sanitária, na forma do Anexo XIX , e determinada sua divulgação. (Origem: PRT MS/GM 1052/2007, Art. 1º)
Seção II
Do Controle e da Vigilância da Qualidade da Água para Consumo Humano e seu Padrão de Potabilidade
Art. 129. O Anexo XX dispõe sobre o controle e vigilância da qualidade da água para consumo humano e seu padrão de potabilidade.
Art. 130. O Anexo XXI aprova as normas e padrões sobre fluoretação da água dos sistemas públicos de abastecimento, destinada ao consumo humano.
Seção III
Da Comissão Gestora e do Comitê Executivo do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas
Art. 131. Fica instituída a Comissão Gestora do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas, de caráter permanente e cunho deliberativo, com o objetivo de promover a articulação dos órgãos e entidades públicas para compatibilizar a Política Nacional sobre Mudança do Clima com as políticas públicas de saúde. (Origem: PRT MS/GM 3244/2011, Art. 1º)
Art. 132. Compete à Comissão Gestora de que trata o art. 131: (Origem: PRT MS/GM 3244/2011, Art. 2º)
I - assessorar o Ministro de Estado da Saúde nos temas relacionados à Política Nacional de Mudança do Clima (PNMC); (Origem: PRT MS/GM 3244/2011, Art. 2º, I)
II - assessorar o Ministro de Estado da Saúde nas ações relativas ao Comitê Interministerial sobre Mudança do Clima (CIM); (Origem: PRT MS/GM 3244/2011, Art. 2º, II)
III - elaborar e aprovar o Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas, em consonância com a PNMC e o Plano Nacional de Saúde; (Origem: PRT MS/GM 3244/2011, Art. 2º, III)
IV - articular, monitorar e avaliar a implementação do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas nas esferas federal, estadual, distrital e municipal do Sistema Único de Saúde (SUS); (Origem: PRT MS/GM 3244/2011, Art. 2º, IV)
V - identificar fontes de recursos para a elaboração, a implementação e o monitoramento do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas; (Origem: PRT MS/GM 3244/2011, Art. 2º, V)
VI - aprovar a constituição e o regimento interno da Comissão Gestora e de seus subcomitês temáticos; e (Origem: PRT MS/GM 3244/2011, Art. 2º, VI)
VII - instituir subcomitês temáticos. (Origem: PRT MS/GM 3244/2011, Art. 2º, VII)
Art. 133. A Comissão Gestora de que trata esta Seção será composta pelos dirigentes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 3244/2011, Art. 3º)
I - Secretaria-Executiva (SE/MS), que a coordenará; (Origem: PRT MS/GM 3244/2011, Art. 3º, I)
II - Gabinete do Ministro (GM/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, II)
III - Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, III)
IV - Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, IV)
V - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, V)
VI - Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, VI)
VII - Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, VII)
VIII - Secretaria Especial de Saúde Indígena (SESAI/MS); (Origem: PRT MS/GM 3244/2011, Art. 3º, VIII)
IX - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 3244/2011, Art. 3º, IX)
X - Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 3244/2011, Art. 3º, X)
XI - Fundação Oswaldo Cruz (FIOCRUZ); e (Origem: PRT MS/GM 3244/2011, Art. 3º, XI)
XII - Fundação Nacional de Saúde (FUNASA). (Origem: PRT MS/GM 3244/2011, Art. 3º, XII)
§ 1º Aos dirigentes de que trata este artigo compete indicar os seus respectivos representantes suplentes à Coordenação da Comissão Gestora no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº 3244/GM/MS, de 30 de dezembro de 2011. (Origem: PRT MS/GM 3244/2011, Art. 3º, § 1º)
§ 2º Fica assegurada a participação do Conselho Nacional de Secretários de Saúde (CONASS), Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS) e do Conselho Nacional de Saúde (CNS) na Comissão Gestora. (Origem: PRT MS/GM 3244/2011, Art. 3º, § 2º)
§ 3º Para os fins do disposto no art. 133, § 2º , ao CONASS, ao CONASEMS e ao CNS compete indicar os respectivos representantes, titular e suplente, à Coordenação da Comissão Gestora no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº 3244/GM/MS, de 30 de dezembro de 2011. (Origem: PRT MS/GM 3244/2011, Art. 3º, § 3º)
Art. 134. A Comissão Gestora poderá convidar representantes de órgãos e entidades públicas e privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 3244/2011, Art. 4º)
Art. 135. Fica instituído o Comitê Executivo do Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas, de caráter permanente e cunho técnico-consultivo, para realização das atividades de apoio à execução das atribuições da Comissão Gestora. (Origem: PRT MS/GM 3244/2011, Art. 5º)
Art. 136. O Comitê Executivo de que trata o art. 135 será composto pelos representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 3244/2011, Art. 6º)
I - SVS/MS, que o coordenará; (Origem: PRT MS/GM 3244/2011, Art. 6º, I)
II - SE/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, II)
III - SAS/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, III)
IV - SCTIE/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, IV)
V - SGEP/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, V)
VI - SGTES/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, VI)
VII - SESAI/MS; (Origem: PRT MS/GM 3244/2011, Art. 6º, VII)
VIII - ANVISA; (Origem: PRT MS/GM 3244/2011, Art. 6º, VIII)
IX - ANS; (Origem: PRT MS/GM 3244/2011, Art. 6º, IX)
X - FIOCRUZ; e (Origem: PRT MS/GM 3244/2011, Art. 6º, X)
XI - FUNASA. (Origem: PRT MS/GM 3244/2011, Art. 6º, XI)
§ 1º Aos dirigentes dos órgãos e entidades de que trata este artigo compete indicar os respectivos representantes, titular e suplente, à Coordenação do Comitê Executivo no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº 3244/GM/MS, de 30 de dezembro de 2011. (Origem: PRT MS/GM 3244/2011, Art. 6º, § 1º)
§ 2º A Coordenação do Comitê Executivo poderá convidar representantes de outros órgãos e entidades públicas, de entidades não-governamentais, bem como especialistas em assuntos ligados ao tema, cuja presença seja considerada necessária para o cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 3244/2011, Art. 6º, § 2º)
Art. 137. O Comitê Executivo poderá convidar entidades ou pessoas do setor público e privado, que atuem profissionalmente em atividades relacionadas ao tema, sempre que entender necessária a sua colaboração para o pleno alcance dos seus objetivos. (Origem: PRT MS/GM 3244/2011, Art. 7º)
Art. 138. O apoio administrativo e os meios necessários à execução dos trabalhos da Comissão Gestora e do Comitê Executivo de que tratam esta Seção serão fornecidos pela SE/MS. (Origem: PRT MS/GM 3244/2011, Art. 8º)
Parágrafo Único. As despesas de deslocamento para participação das reuniões da Comissão Gestora e do Comitê Executivo de que tratam esta Seção correrão por conta de cada órgão ou entidade partícipe. (Origem: PRT MS/GM 3244/2011, Art. 8º, Parágrafo Único)
Art. 139. A Comissão Gestora de que trata esta Seção aprovará o Plano Setorial da Saúde de Mitigação e de Adaptação às Mudanças Climáticas e a sua revisão em períodos regulares não superiores a 2 (dois) anos. (Origem: PRT MS/GM 3244/2011, Art. 9º)
Art. 140. A Comissão Gestora e o Comitê Executivo de que tratam esta Seção se reunirão em reuniões distintas, ordinariamente em periodicidade a ser estabelecida em regimento interno, e extraordinariamente a critério da respectiva coordenação, a pedido de qualquer de seus membros. (Origem: PRT MS/GM 3244/2011, Art. 10)
Art. 141. As funções dos membros da Comissão Gestora e do Comitê Executivo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 3244/2011, Art. 11)
Seção IV
Do Programa de Formação em Emergências em Saúde Pública (Profesp)
(Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-A. Fica instituído o Programa de Formação em Emergências em Saúde Pública (Profesp), no âmbito do Sistema Único de Saúde - SUS. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-B. Para os efeitos desta Seção, considera-se: (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
I - emergência em saúde pública: situação que demande o emprego urgente de medidas de prevenção, controle e contenção de riscos, danos e agravos à saúde pública, nos termos da Resolução nº 588, de 12 de julho de 2018, do Conselho Nacional de Saúde; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
II - cursos de capacitação: cursos básicos com até 79 (setenta e nove) horas; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
III - cursos de atualização: cursos com 80 (oitenta) a 179 (cento e setenta e nove) horas; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
IV - cursos de aperfeiçoamento: cursos com 180 (cento e oitenta) a 359 (trezentos e cinquenta e nove) horas; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
V - cursos presenciais: quando todas as atividades educacionais são realizadas presencialmente; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
VI - cursos semipresenciais: quando uma parte das atividades educacionais é realizada presencialmente, e a outra, a distância; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
VII - cursos à distância: quando todas as atividades educacionais são realizadas a distância, isto é, remotamente; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
VIII - cursos autoinstrucionais: cursos com aprendizado autônomo, ou seja, com uso de material autoexplicativo, sem tutoria e mediados por tecnologia; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
IX - tutor/tutoria: profissional que, de maneira síncrona ou assíncrona, presencial ou a distância, garante a qualidade na comunicação para o uso adequado do material do curso, acompanhando e avaliando a aprendizagem dos alunos durante todo o processo; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
X - formação continuada: capacitação de curta ou média duração voltada ao aperfeiçoamento do exercício de determinada profissão; e (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
XI - formação permanente: ações educativas embasadas na problematização do processo de trabalho, com o objetivo de transformar práticas profissionais, tendo como referência as necessidades de saúde pública. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-C. O Profesp tem por finalidade capacitar os profissionais que atuam na vigilância das emergências em saúde pública, nos três níveis de gestão do SUS, e tem por objetivos: (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
I - identificar as necessidades de formação no contexto da vigilância das emergências em saúde pública; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
II - estruturar, produzir e ofertar cursos de capacitação, atualização e aperfeiçoamento em vigilância das emergências em saúde pública; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
III - garantir a oferta de formação continuada e permanente no âmbito das emergências em saúde pública; e (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
IV - realizar articulação com atores nacionais e internacionais para aperfeiçoamento das estratégias de formação em vigilância das emergências em saúde pública. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-D. São diretrizes do Profesp: (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
I - disponibilizar e coordenar plataforma virtual de aprendizagem dos cursos ofertados; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
II - coordenar a oferta dos cursos, sejam eles autoinstrucionais ou com tutoria; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
III - coordenar e disponibilizar a inclusão e monitoramento de turmas, assim como relatórios finais dos profissionais inscritos nos cursos ofertados; e (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
IV - acompanhar o desempenho das ações de formação, com vistas a garantir a qualidade dos cursos, a frequência do cursista e a continuidade da oferta. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-E. Para os cursos que tiverem número de vagas limitadas serão realizados processos seletivos por meio de editais de chamada pública específicos, que estabelecerão, entre outras disposições, as condições e requisitos para a participação. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-F. As atividades práticas dos cursos presenciais e semipresenciais do Profesp poderão ser desempenhadas no âmbito da unidade de serviço em que o profissional cursista estiver atuando. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-G. Os cursos de aperfeiçoamento contarão com tutoria, na forma do regulamento próprio de cada curso. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Parágrafo único. O tutor deve ser profissional de nível superior que tenha experiência na área de vigilância em saúde e epidemiologia, e cumpra os requisitos previstos no regulamento de que trata o caput. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-H. Os certificados de conclusão dos cursos ofertados no âmbito do Profesp serão concedidos mediante o cumprimento dos requisitos estabelecidos em regulamento próprio de cada curso, devendo ser observadas a: (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
I - obtenção de notas mínimas nas avaliações por aula/módulo de cada curso; (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
II - entrega de tarefas e exercícios; e (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
III - frequência mínima de 75% (setenta e cinco por cento). (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-I. A gestão e a certificação dos cursos ofertados pelo Programa ficarão a cargo do Departamento de Emergências em Saúde Pública da Secretaria de Vigilância em Saúde do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-J. O monitoramento e a avaliação do Profesp serão conduzidos pelo Departamento de Emergências em Saúde Pública da Secretaria de Vigilância em Saúde do Ministério da Saúde, com vistas à adaptação de sua execução. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Art. 141-K. O Secretário de Vigilância em Saúde poderá editar normas complementares para a execução do disposto nesta Portaria. (Redação dada pela PRT GM/MS nº 4.111 de 28.11.2022)
Seção V
Do Programa Nacional de Vigilância em Saúde dos Riscos Associados aos Desastres - Vigidesastres
(Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-L. Fica instituído o Programa Nacional de Vigilância em Saúde dos Riscos Associados aos Desastres - Vigidesastres, no âmbito do Sistema Único de Saúde - SUS. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Parágrafo único. Nos estados e municípios interessados, será apoiada a criação de programas similares locais ou a instituição de pontos focais no âmbito do Vigidesastres. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-M. O Vigidesastres tem por finalidade o desenvolvimento de ações de vigilância em saúde relativas à gestão de riscos de emergências em saúde pública por desastres. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-N. Para os efeitos desta Seção, considera-se: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
I - desastre: resultado de eventos adversos, naturais ou tecnológicos, sobre um ecossistema vulnerável, causando danos humanos (mortes, lesões, enfermidades), materiais ou ambientais e consequentes prejuízos econômicos e sociais, além da interrupção do funcionamento normal de uma comunidade ou sociedade, excedendo a capacidade local de responder utilizando seus próprios recursos (humanos, materiais e financeiros); (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
II - desastres naturais: desastres causados por processos ou fenômenos naturais (hidrológicos, climatológicos, meteorológicos e geológicos), que podem implicar em perdas humanas ou outros impactos à saúde, danos ao meio ambiente e à propriedade, que provocam interrupção dos serviços e distúrbios sociais e econômicos; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
III - desastres tecnológicos: desastres originados de condições tecnológicas ou industriais (químicos, biológicos, radiológicos e nucleares), incluindo acidentes, incidentes ou atividades humanas específicas que podem implicar em perdas humanas ou outros impactos à saúde, além de danos ao meio ambiente e à propriedade, interrupção dos serviços e distúrbios sociais e econômicos, podendo ocorrer de forma intencional ou não; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
IV - gestão de riscos de emergência em saúde pública por desastres: conjunto de ações de vigilância em saúde voltadas à preparação, monitoramento, alerta, comunicação, resposta e reabilitação às emergências em saúde pública por desastres. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-O. Para fins dessa Seção, os desastres são reconhecidos como eventos de saúde pública, de origem natural ou tecnológica, sendo as suas tipologias classificadas conforme a Codificação Brasileira de Desastres e suas atualizações. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-P. A gestão do Vigidesastres ficará a cargo da Secretaria de Vigilância em Saúde do Ministério da Saúde, por meio da Coordenação-Geral de Emergências em Saúde Pública do Departamento de Emergências em Saúde Pública. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-Q. São diretrizes de ação do Vigidesastres, dentre outras: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
I - adoção de estratégias de cooperação entre a União, estados, e municípios, nas ações de preparação e resposta às emergências em saúde pública por desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
II - gestão de riscos por meio de estratégias para planejamento, alerta, intervenção, comunicação, monitoramento e resposta às emergências em saúde pública por desastres ou eventos com potencial de ocasionar desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
III - adoção da perspectiva multirrisco, considerando os potenciais impactos dos desastres para a saúde pública, diretos e indiretos, de curto, médio e longo prazo, tendo como premissa a preparação prévia para uma atuação coordenada; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
IV - promoção da articulação intersetorial, interfederativa e interinstitucional, considerando as especificidades das respectivas esferas de atuação do SUS na gestão de risco de desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
V - cooperação e intercâmbio técnico-científico no âmbito nacional e internacional com organizações governamentais e não governamentais, sobre gestão de riscos de emergências em saúde pública por desastres; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
VI - identificação de lacunas de conhecimento e proposição de mecanismos para aperfeiçoamento das estratégias nacionais de preparação e resposta às emergências em saúde pública por desastres. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art. 141-R. No âmbito do Vigidesastres, a gestão de riscos relativa às emergências em saúde pública por desastres compreenderá principalmente atuação nas seguintes fases: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
I - preparação contra desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
II - monitoramento, alerta e comunicação; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
III - resposta e reabilitação. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
§ 1º Poderão ser realizadas, no contexto do Programa, as seguintes ações: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
I - ações de preparação para desastres: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
a) proposição e implementação de ações e políticas de vigilância em saúde para preparação e resposta às emergências em saúde pública por desastres, a exemplo do estabelecimento de normativas, diretrizes, planos, manuais, protocolos e procedimentos; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
b) atualização de normas técnicas referentes às ações de vigilância em saúde desenvolvidas pelo Programa Vigidesastres em sua esfera de atuação; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
c) identificação das necessidades de formação para atuação em emergências em saúde pública por desastres para oferta de capacitação aos estados e municípios de profissionais dos estados e municípios que atuam em ESP por desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
d) apoio estados e municípios na instituição e no funcionamento do Vigidesastres em âmbito estadual e em municípios estratégicos, quando necessário; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
e) realização, em conjunto com os estados e municípios, de análise de situação em saúde, com identificação das vulnerabilidades do território e construção de planos, protocolos e procedimentos, conforme as especificidades locais; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
f) gestão dos estoques do kit de medicamentos e insumos para emergências em saúde pública por desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
g) estabelecimento de diretrizes e procedimentos para solicitação de kit de medicamentos e insumos estratégicos para localidades atingidas por desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
h) atualização, sempre que necessário, do elenco de medicamentos e insumos estratégicos que compõem o kit; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
i) promoção de cooperação e intercâmbio técnico-científico com organizações governamentais e não governamentais, de âmbito nacional e internacional na gestão de riscos em desastres em emergências em saúde pública. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
II - ações de monitoramento, alerta e comunicação: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
a) monitoramento, a partir dos sistemas de informações oficiais, de áreas de risco para desastres e populações vulneráveis, com vistas a proporcionar intervenções oportunas para fins de redução e eliminação de danos e impactos à saúde humana; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
b) identificação de fatores de riscos e populações vulneráveis, por meio da construção de mapa de ameaças, vulnerabilidades e riscos; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
c) emissão de alertas sobre potenciais emergências em saúde pública por desastres e seus impactos à saúde da população; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
d) realização de análise de situação em saúde de doenças transmissíveis e não transmissíveis, antes, durante e após uma emergência em saúde pública por desastres; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
e) estabelecimento e implementação de fluxos de comunicação entre as unidades estaduais e municipais do Vigidesastres e a gestão federal, antes, durante e após uma emergência em saúde pública por desastres; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
III - ações de resposta e reabilitação: (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
a) estabelecimento de estratégias de resposta coordenada em articulação com os estados, municípios e Distrito Federal; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
b) apoio, em nível nacional, estadual e municipal à mobilização, funcionamento e à desmobilização de Sala de Situação em Saúde ou do Centro de Operações de Emergências em Saúde Pública - COE, em situações de emergências em saúde pública por desastres; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
c) acionamento e mobilização de equipes de resposta às emergências em saúde pública por desastres, para as localidades atingidas por desastres, sempre que necessário; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
d) análise de solicitação de kit de medicamentos e insumos para emergências em saúde pública por desastres e adoção de providências para o seu envio, considerando a disponibilidade de estoque e o cumprimento dos requisitos exigidos para a solicitação; (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
e) apoio às ações de assistência humanitária internacional diante da ocorrência de desastres, incluindo o envio de equipes de resposta para desastres e/ou de kit de insumos e medicamentos, conforme normativas vigentes; e (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
f) proposição e indução de estudos e pesquisas para apoio nas etapas de resposta e reabilitação de localidades atingidas por desastres. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
§ 2º As ações do Programa dependerão da tipologia, magnitude e complexidade do desastre, podendo variar de acordo com as necessidades identificadas. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
§ 3º Outras ações além das mencionadas no § 1º poderão ser adotadas a depender das circunstâncias do caso concreto, conforme ato do Secretário de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Art.141-S. Compete à Secretaria de Vigilância em Saúde editar normas específicas para o funcionamento do Vigidesastres. (Redação dada pela PRT GM/MS nº 4.185 de 01.12.2022)
Seção VI
Do Programa de Treinamento em Epidemiologia Aplicada aos Serviços do Sistema Único de Saúde - Programa EpiSUS
(Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-T. Fica instituído o Programa de Treinamento em Epidemiologia Aplicada aos Serviços do Sistema Único de Saúde - Programa EpiSUS, em seus 3 (três) níveis de formação: fundamental, intermediário, avançado, além da formação de tutores em epidemiologia de campo. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 1º O Programa EpiSUS é uma estratégia de capacitação em serviço, com foco em epidemiologia de campo e investigação de surtos, epidemias e pandemias, cuja finalidade é fortalecer e ampliar a capacidade técnica de preparação e resposta a esses eventos, nas três esferas de gestão do SUS. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 2º O Ministério da Saúde é o responsável pela implementação, certificação e validação de todos os níveis da estratégia de capacitação do Programa EpiSUS, no território nacional. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 3º Compete à Secretaria de Vigilância em Saúde do Ministério da Saúde a edição e publicação de regras específicas no âmbito do Programa EpiSUS, de maneira a garantir a conformidade e qualidade da estratégia em todo o território nacional, em concordância com o preconizado pela Rede Global de Programas de Treinamento em Epidemiologia e Rede de Intervenções em Saúde Pública - TEPHINET, em todos os níveis de formação. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 4º As regras para a oferta descentralizada do Programa EpiSUS por município, estado e Distrito Federal, bem como os requisitos para certificação e validação do treinamento, em todos os níveis de formação, serão estabelecidas e divulgadas por ato próprio da Secretaria de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 5º O Programa EpiSUS é destinado a profissionais que atuam no SUS, pertencentes a qualquer uma das três esferas de gestão. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 6º A seleção de profissionais para participarem do Programa EpiSUS nos níveis Avançado e Intermediário será realizada por meio de chamada pública, que estabelecerá todas as condições e requisitos para a participação no processo seletivo, permanência e conclusão do treinamento. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-U. A gestão e coordenação do Programa EpiSUS ficará a cargo do Departamento de Emergências em Saúde Pública da Secretaria de Vigilância em Saúde, ao qual competirá: (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
I - gerir o Programa EpiSUS, em todos os seus níveis de formação; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
II - estabelecer e implementar, conforme pré-requisitos da TEPHINET, os indicadores, as estratégias de acompanhamento e a supervisão das ofertas do Programa EpiSUS em nível nacional; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
III - planejar, desenvolver e ofertar as atividades formativas do Programa EpiSUS, em todos os seus níveis; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
IV - incentivar a participação dos profissionais em treinamento, de acordo com o respectivo nível de formação, nas atividades que envolvem investigações epidemiológicas e outros eventos de saúde pública com relevância local, regional, nacional ou internacional, de modo complementar ou suplementar, em articulação com as demais unidades competentes e, quando necessário, em missões do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
V - ofertar vagas, organizar e conduzir o processo seletivo do Programa EpiSUS em todos os seus níveis de formação, quando ofertado pelo Ministério da Saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
VI - realizar certificação do Programa EpiSUS, em âmbito nacional, garantindo eficácia e eficiência do Programa, conforme indicadores a serem estabelecidos e divulgados por ato próprio da SVS/MS; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
VII - estabelecer as regras e os requisitos para certificação e validação do treinamento para ofertas descentralizadas do Programa EpiSUS, de acordo com § 4º do art. 141-T; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
VIII - realizar, nas estratégias descentralizadas, a validação da certificação de todos os níveis do Programa EpiSUS, de acordo com § 4º do art. 141-T; e (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
IX - receber e avaliar solicitações e designar equipe composta por profissionais participantes do Programa EpiSUS, para investigações de campo quando requisitado. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-U. A formação de tutores em epidemiologia de campo é parte da estratégia do Programa EpiSUS, sob responsabilidade da Secretaria de Vigilância em Saúde, e tem por finalidade a qualificação de profissionais do setor saúde para atuar como tutores do Programa EpiSUS nos níveis fundamental e intermediário em todas as unidades federativas e municípios interessados em formar equipes locais. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-V. Para atuação como tutor em epidemiologia de campo nos níveis EpiSUS-Fundamental e EpiSUS-Intermediário, o profissional deverá comprovar a realização do curso específico fornecido pela Secretaria de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Parágrafo único. Os critérios para seleção, qualificação e certificação dos tutores em epidemiologia de campo serão divulgados no manual do Programa EpiSUS, a ser disponibilizado através do website do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-W. O nível avançado do Programa EpiSUS, denominado EpiSUS-Avançado, tem como objetivo geral aprimorar a capacidade técnica de profissionais de nível superior, por meio de treinamento em serviço, para atuar frente às investigações epidemiológicas em situações de surtos, epidemias e pandemias em nível nacional e internacional, obedecendo as normativas vigentes de cooperações internacionais. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 1º O EpiSUS-Avançado tem duração de 2 (dois) anos, com regime de dedicação exclusiva e as atividades são desenvolvidas presencialmente no âmbito da Secretaria de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 2º As atividades desenvolvidas no âmbito do EpiSUS-Avançado poderão ocorrer em parceria com instituições nacionais e internacionais. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-X. São objetivos específicos do EpiSUS-Avançado: (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
I - realizar capacitação em serviço de profissionais de nível superior em epidemiologia de campo, com foco nas ações de vigilância; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
II - desenvolver a capacidade técnico-científica nos profissionais em treinamento, para colaborar na resolução de problemas de saúde pública, considerando as pesquisas direcionadas às necessidades de vigilância em saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
III - atuar na preparação e resposta às emergências em saúde pública, com foco em epidemiologia de campo; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
IV - fornecer capacitação técnica aos profissionais em treinamento para realizar avaliações de sistemas de vigilância em saúde ou programas específicos de saúde pública e análise de dados gerados pelos sistemas de informação oficiais do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
V - planejar e conduzir investigações e estudos epidemiológicos de surtos, epidemias e pandemias, de maneira a subsidiar a tomada de decisão dos gestores nas ações de prevenção e controle, nos níveis municipal, estadual e federal; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
VI - incentivar os profissionais em treinamento a participarem em eventos e congressos nacionais e internacionais, como parte de sua formação; e (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
VII - contribuir para a difusão do conhecimento técnico-científico por meio da divulgação de resultados de investigações epidemiológicas e de outros estudos desenvolvidos durante o treinamento por meio de notas técnicas, boletins, relatórios ou artigos publicados em periódicos. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-Y. O planejamento, acompanhamento e execução de todas as etapas do processo seletivo do EpiSUS-Avançado serão realizados pela coordenação do Programa EpiSUS. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 1º Será constituída equipe de equipe de seleção para o Programa EpiSUS, com a finalidade de implementar, executar e acompanhar todas as etapas do processo seletivo, por ato próprio da Secretaria de Vigilância em Saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 2º O profissional que se candidatar ao treinamento do Programa EpiSUS-Avançado terá suas atribuições no âmbito da Secretaria de Vigilância em Saúde informadas durante o período de treinamento, pela coordenação do Programa; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-Z. O nível intermediário do Programa EpiSUS, denominado EpiSUS-Intermediário, tem como objetivo geral ampliar e fortalecer as ações de vigilância em saúde, por meio de treinamento de profissionais de nível superior em serviços para atuar frente à avaliação de sistemas de vigilância em saúde e nas investigações de surtos e epidemias nos níveis estadual e municipal. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-AA. São objetivos específicos do EpiSUS-Intermediário: (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
I - ofertar qualificação aos profissionais do SUS para aprimorar a capacidade de identificar, investigar, responder e comunicar eventos epidemiológicos de interesse para a saúde pública; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
II - fornecer subsídios para aprimoramento dos fluxos de coleta, análise, interpretação e comunicação dos dados de vigilância em saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
III - avaliar sistemas de vigilância em saúde para subsidiar a qualificação das ações de vigilância em saúde; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
IV - fornecer treinamento na análise e interpretação de dados, de maneira que os profissionais em treinamento apliquem os conhecimentos adquiridos no planejamento das ações de prevenção e controle de doenças e agravos de interesse para a saúde pública em seu território de atuação; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
V - planejar e liderar investigações de campo, de acordo com as necessidades de estados, municípios e Distrito Federal; e (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
VI - apoiar as investigações de surtos, epidemias e pandemias, quando requerido pela coordenação do Programa EpiSUS, de acordo com as competências regimentais do Departamento de Emergências em Saúde Pública. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-AB. O EpiSUS-Intermediário será ofertado prioritariamente pela Secretaria de Vigilância em Saúde, em formato semipresencial, com conteúdo teórico ministrado em plataforma virtual estabelecida pela Secretaria de Vigilância em Saúde, com duração de 8 (oito) meses. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Parágrafo único. As atividades de campo delineadas na oferta do EpiSUS-Intermediário serão desempenhadas no território de atuação do profissional em treinamento. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-AC. O nível fundamental do Programa EpiSUS, denominado EpiSUS-Fundamental, tem como objetivo geral ampliar e fortalecer as ações de vigilância em saúde em nível local, voltado para a qualificação técnica a partir da descrição de dados epidemiológicos, da abordagem de conceitos básicos de vigilância e de monitoramento, investigação, coleta e análise de dados de agravos de interesse local. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-AD. São objetivos específicos do EpiSUS-Fundamental: (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
I - capacitar profissionais atuantes no SUS nos níveis básicos de vigilância e epidemiologia; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
II - fornecer bases para a melhoria da coleta e análise de dados e comunicação de problemas de saúde pública em nível local; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
III - fornecer apoio no planejamento e condução de investigações epidemiológicas, de acordo com a necessidade local; e (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
IV - contribuir para a formação em serviço de profissionais que atuam no SUS, fornecendo bases para o conhecimento epidemiológico, planejamento e execução das ações de vigilância em saúde no território. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-AE. Poderão participar do treinamento do EpiSUS-Fundamental os profissionais de níveis médio, técnico e superior, que estejam atuando nas áreas de vigilância em saúde, em quaisquer das esferas de gestão do SUS. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 1º O EpiSUS-Fundamental será ofertado prioritariamente pela Secretaria de Vigilância em Saúde, em formato semipresencial, com conteúdo teórico ministrado em plataforma virtual por ela definida e atividades de campo desempenhadas no território de atuação do profissional em treinamento, com duração de 3 (três) meses. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 2º A oferta do EpiSUS-Fundamental poderá ser realizada de maneira descentralizada, pelas Secretarias Estaduais de Saúde e Secretarias Municipais de Saúde, desde que os conteúdos e carga horária estejam alinhados com os indicadores definidos pela Secretaria de Vigilância em Saúde e preconizados pela TEPHINET; (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
§ 3º A certificação do EpiSUS-Fundamental é de responsabilidade do Ministério da Saúde. Nos casos em que a estratégia for ofertada por instituições parceiras, a certificação poderá ser fornecida de maneira conjunta com o Ministério da Saúde, observando o § 4º do art. 141-T. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Art. 141-AF. O Departamento de Emergências em Saúde Pública divulgará informações sobre o processo seletivo do EpiSUS-Fundamental, conforme agenda estabelecida pela coordenação do Programa. (Redação dada pela PRT GM/MS nº 4.339 de 16.12.2022)
Seção VII
Do Centro de Informações Estratégicas em Vigilância em Saúde (CIEVS)
(Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AG. Fica instituído o Centro de Informações Estratégicas em Vigilância em Saúde (CIEVS) como serviço de inteligência epidemiológica no âmbito do Sistema Nacional de Vigilância em Saúde - SNVS do Sistema Único de Saúde (SUS). (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AH. O CIEVS tem como finalidade realizar a detecção, a notificação, o monitoramento e o apoio à resposta a eventos de saúde que possam constituir emergência em saúde pública, no âmbito das três esferas de gestão do SUS. (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AI. Para os fins desta Seção, considera-se: (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
I - evento de saúde pública: situação que pode constituir potencial ameaça à saúde pública, como a ocorrência de surto ou epidemia, doença ou agravo de causa desconhecida, alteração no padrão clínico-epidemiológico das doenças conhecidas, considerando o potencial de disseminação, a magnitude, a gravidade, a severidade, a transcendência e a vulnerabilidade, bem como epizootias ou agravos decorrentes de desastres ou acidentes; e (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
II - emergência em saúde pública: situação que demanda o emprego urgente de medidas de prevenção, controle e contenção de riscos, danos e agravos à saúde pública. (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AJ. Compete ao CIEVS: (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
I - coletar, consolidar, avaliar, analisar e disseminar informações referentes a eventos de saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
II - detectar doenças inusitadas ou inesperadas e eventos de saúde que possam constituir emergência em saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
III - verificar eventos e rumores de saúde pública que possam constituir ameaça à saúde da população; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
IV - avaliar o risco das doenças, agravos e eventos de saúde pública que possam constituir uma emergência em saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
V - elaborar estratégias de comunicação de riscos para resposta a potenciais eventos de saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
VI - monitorar eventos de saúde pública para subsidiar ações de preparação, vigilância e resposta; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
VII - apoiar processos de formação continuada junto aos profissionais para o fortalecimento das ações de preparação, vigilância e resposta a eventos de saúde pública; e (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
VIII - apoiar o acionamento de equipes de pronta resposta a eventos de saúde pública. (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AK. Fica instituído o Centro Nacional de Informações Estratégicas em Vigilância em Saúde - CIEVS Nacional no âmbito do Ministério da Saúde, sob gestão do Departamento de Emergências em Saúde Pública da Secretaria de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AL. Além das competências estabelecidas no art. 141-AJ desta Seção, compete ao CIEVS Nacional: (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
I - estabelecer diretrizes de funcionamento e de atuação da Rede CIEVS; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
II - coordenar ações para detectar, notificar, monitora e apoiar a resposta a eventos de saúde pública que possam constituir emergência em saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
III - estabelecer estratégias para desenvolver, fortalecer e manter as capacidades de vigilância, alerta e resposta a eventos de saúde pública do SUS; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
IV - promover estratégias para a implementação da Política Nacional de Vigilância em Saúde - PNVS nas ações de vigilância, alerta e resposta a eventos de saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
V - definir, monitorar e avaliar indicadores de emergências em saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
VI - realizar avaliação de riscos de emergências em saúde pública; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
VII - coordenar o Comitê de Monitoramento de Eventos de Saúde Pública - CME do Ministério da Saúde;
VIII - atuar como o centro operacional do Ponto Focal Nacional do Regulamento Sanitário Internacional - PFRSI junto à Organização Mundial de Saúde - OMS; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
IX - manter comunicação de riscos sobre as mudanças dos cenários epidemiológicos nacional e internacional junto às demais esferas de gestão do SUS; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
X - cooperar com o aperfeiçoamento das capacidades básicas de vigilância, alerta e resposta nos âmbitos nacional e internacional, em conjunto com as demais esferas de gestão do SUS; (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
XI - apoiar os processos de formação continuada para o fortalecimento das ações de preparação, vigilância e resposta a eventos de saúde pública, nas três esferas de gestão do SUS; e (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
XII - apoiar a articulação do envio de equipes de resposta a eventos de saúde pública que superem a capacidade de resposta dos estados e municípios. (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Art. 141-AM. Compete à Secretaria de Vigilância em Saúde do Ministério da Saúde a edição de normas específicas para o funcionamento do CIEVS. (Redação dada pela PRT GM/MS nº 4.641 de 28.12.2022)
Seção VIII
Da Câmara Técnica de Assessoramento em Emergências em Saúde Pública (CTA-ESP)
(Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AN. Fica instituída a Câmara Técnica de Assessoramento em Emergências em Saúde Pública - CTA-ESP, de caráter consultivo, com o objetivo de avaliar os aspectos técnicos e científicos necessários para a condução de potenciais emergências em saúde pública e eventos que tenham sido declarados como emergências em saúde pública de importância nacional - ESPIN ou internacional - ESPII. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AO. A CTA-ESP será coordenada pelo Diretor do Departamento de Emergências em Saúde Pública da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AP. Compete à CTA-ESP: (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
I - monitorar a situação epidemiológica de eventos de saúde pública que possam se constituir como potenciais emergências em saúde pública e eventos que tenham sido declarados como ESPIN ou ESPII; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
II - propor diretrizes mínimas e ações de preparação, vigilância e resposta aos eventos de saúde pública que possam se constituir potenciais emergências em saúde pública e eventos que tenham sido declarados como ESPIN ou ESPII; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
III - definir ações de disseminação de informações de prevenção para a população durante eventos de saúde pública que possam se constituir como potenciais emergências em saúde pública e eventos que tenham sido declarados como ESPIN ou ESPII; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
IV - prestar apoio técnico-científico para a tomada de decisões das autoridades de saúde nos níveis federal, estadual e municipal. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AQ. A CTA-ESP será composta por: (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
I - 5 (cinco) representantes do Ministério da Saúde, sendo: (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
a) a Secretária de Vigilância em Saúde e Ambiente; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
b) o Diretor de Programa da Secretaria de Vigilância em Saúde e Ambiente; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
c) 1 (um) do Departamento de Emergências em Saúde Pública da Secretária de Vigilância em Saúde e Ambiente; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
d) 1 (um) da Secretaria de Atenção Primária à Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
e) 1 (um) da Secretaria de Atenção Especializada à Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
II - 1 (um) do Ministério da Agricultura e Pecuária; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
III - 1 (um) da Agência Nacional de Vigilância Sanitária; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
IV - 1 (um) da Fundação Oswaldo Cruz; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
V - 9 (nove) Entidades, sendo: (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
a) 1 (um) do Conselho Nacional de Secretários de Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
b) 1 (um) do Conselho Nacional de Secretários Municipais de Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
c) 1 (um) do Conselho Nacional de Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
d) 1 (um) Organização Pan-Americana da Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
e) 1 (um) do Centro Nacional de Gerenciamento de Riscos e Desastres; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
f) 1 (um) da Associação Brasileira de Saúde Coletiva; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
g) 1 (um) da Sociedade Brasileira de Medicina Tropical; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
h) 1 (um) Sociedade Brasileira de Infectologia; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
i) 1 (um) Sociedade Brasileira de Imunizações; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
VI - 6 (seis) Especialista de notório saber: (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
a) Betina Durovni, doutora em medicina; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
b) Carlos Machado de Freitas, pós-doutor em ciências ambientais; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
c) Cristiana Toscano Fonseca, doutora em imunologia; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
d) Gerson Penna, doutor em medicina tropical; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
e) José Cerbino Neto, doutor em epidemiologia; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
f) Oswaldo Gonçalves Cruz, doutor em engenharia biomédica. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
§ 1º Cada membro da CTA-ESP terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
§ 2º Os membros e seus suplentes serão indicados por ofício pelos titulares dos seus respectivos órgãos e entidades ao coordenador do CTA-ESP. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AR. A CTA-ESP se reunirá em caráter ordinário trimestralmente e em caráter extraordinário, sempre que necessário e por convocação oficial de seu Coordenador. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
§ 1º O quórum de reunião da CTA-ESP é de maioria simples. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
§ 2º As reuniões serão feitas presencialmente ou por meio de videoconferência. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
§ 3º Em cada reunião do CTA-ESP será elaborado relatório que será submetido à Secretária de Vigilância em Saúde e Ambiente do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
§ 4º A Secretaria-Executiva da CTA-ESP será exercida pelo Departamento de Emergências em Saúde Pública, da Secretaria de Vigilância em Saúde e Ambiente. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AS. A CTA-ESP poderá convidar representantes de outros órgãos e entidades, governamentais e não governamentais, bem como especialistas de notório conhecimento em assuntos relacionados ao tema, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Parágrafo único. Os especialistas de que trata o caput serão indicados pelo Coordenador da CTA-ESP observada a Portaria GM/MS nº 87, de 19 de janeiro de 2021. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Art. 141-AT. A participação na CTA-ESP será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 440 de 03.04.2023)
Seção IX
Da Câmara Técnica de Assessoramento em Leishmanioses - CTA-Leish
(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-AU. Fica instituída a Câmara Técnica de Assessoramento em Leishmanioses CTA-Leish, de caráter consultivo, com o objetivo de avaliar os aspectos técnicos e científicos necessários à vigilância e ao controle das leishmanioses. (Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-AV. Compete à CTA-Leish:(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
I - elaborar e revisar documentos técnicos relacionados à vigilância e ao controle das leishmanioses, bem como às ações da vigilância do óbito;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
II - emitir parecer técnico-científico sobre recomendações de tratamento e/ou esquemas terapêuticos individualizados não previstos em diretrizes editadas pelo Ministério da Saúde sobre leishmanioses, bem como parecer técnico-científico sobre recomendações de diagnóstico;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
III - emitir parecer técnico-científico sobre recomendações de diagnóstico das leishmanioses;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
IV - apoiar tecnicamente a análise e avaliação das investigações de óbitos por leishmanioses, em caráter complementar;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
V - apoiar tecnicamente a concepção e/ou realização de treinamentos de profissionais da rede pública de saúde sobre temas relacionados às leishmanioses;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
VI - auxiliar na elaboração e recomendação de ações de educação em saúde com foco na redução da incidência e letalidade das leishmanioses;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
VII - propor temas prioritários para o investimento em pesquisas científicas voltadas às leishmanioses, com base na identificação de lacunas do conhecimento; e(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
VIII - identificar, analisar e apresentar propostas para discussão e articulação institucional do processo de aperfeiçoamento da Política Nacional de Vigilância em Saúde e Ambiente - PNVSA.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 1º Os documentos técnicos de que trata o inciso I serão encaminhados à Coordenação-Geral de Vigilância de Zoonoses e Doenças de Transmissão Vetorial e, de acordo com o fluxo estabelecido, submetidos ao Departamento de Doenças Transmissíveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 2º As propostas de que trata o inciso VIII serão submetidas à Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-AW. A CTA-Leish será composta por representantes:(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
I - do Departamento de Doenças Transmissíveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde, que a coordenará;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
II - a Coordenação-Geral de Vigilância de Zoonoses e Doenças de Transmissão Vetorial do Departamento de Doenças Transmissíveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
III - da Secretaria de Atenção Primária à Saúde do Ministério da Saúde;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
IV - da Secretaria de Atenção Especializada à Saúde do Ministério da Saúde;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
V - da Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
VI - do Escritório de Representação da Organização Pan-Americana da Saúde/organização Mundial da Saúde - OPAS/OMS no Brasil;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
VII - da Sociedade Brasileira de Medicina Tropical - SBMT;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
VIII - do Fórum Social Brasileiro de Enfrentamento das Doenças Infecciosas e Negligenciadas;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
IX - da Fundação Oswaldo Cruz - Fiocruz:(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
a) Instituto Evandro Chagas (IEC);(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
b) Instituto Oswaldo Cruz (IOC) (Rio de Janeiro);(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
c) Instituto Nacional de Evandro Chagas (Rio de Janeiro);(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
d) Instituto Aggeu Magalhães (Pernambuco);(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
e) Instituto René Rachou (Minas Gerais)(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
f) Instituto Gonçalo Muniz (Bahia).(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
X - por especialistas ad hoc em assuntos relacionados às leishmanioses, nos termos do parágrafo único do art. 1º da Portaria GM/MS n° 87, de 19 de janeiro de 2021.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 1º Poderão participar da CTA-Leish, como convidados especiais, sem direito a voto, representantes das diferentes unidades do Ministério da Saúde, do Conselho Nacional de Secretários de Saúde -Conass e do Conselho Nacional de Secretarias Municipais de Saúde Conasems, além de governos estrangeiros, órgãos e entidades públicos e privados, organizações não governamentais e especialistas em assuntos afetos aos temas a serem discutidos em suas reuniões, cuja presença pontual seja considerada necessária ao cumprimento do disposto nesta Portaria.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 2º Os representantes de que tratam os incisos I a IX deverão ter um suplente cada, de modo a substituí-los em suas ausências e impedimentos.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 3º Os representantes de que tratam os incisos I a IX e seus suplentes serão indicados por ofício pelos titulares de seus respectivos órgãos e entidades à coordenação da CTA- Leish.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 4º A indicação dos especialistas de que trata o inciso X e o convite para os representantes dos órgãos ou entidades de que trata o § 1º será:(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
I - realizada pela Coordenação-Geral de Vigilância de Zoonoses e Doenças de Transmissão Vetorial do Departamento de Doenças Transmissíveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde, de acordo com os assuntos a serem tratados nas reuniões da CTA-Leish;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
II - submetida à aprovação da coordenação da CTA-Leish; e(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
III - formalizada por convite, mediante ofício, do Departamento de Doenças Transmissíveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 5º Os representantes de que tratam os incisos I e IX deverão atender aos requisitos dispostos no art. 3º da Portaria GM/MS n° 87, de 2021.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-AX. A CTA-Leish se reunirá, em caráter ordinário, anualmente e, em caráter extraordinário, por convocação de sua coordenação.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 1º O quórum de reunião é de maioria absoluta dos membros, e o quórum de aprovação é de maioria simples.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 2º Na ausência de consenso, a decisão deverá ser tomada pela coordenação da CTA-Leish.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 3º Os membros da CTA-Leish que se encontrarem no Distrito Federal se reunirão presencialmente ou por videoconferência, nos termos do Decreto n° 10.416, de 7 de julho de 2020, e os membros que se encontrarem em outros entes federativos participarão das reuniões por meio de videoconferência.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 4º As reuniões da CTA-Leish serão gravadas e formalizadas em ata, assinada por todos os participantes, que deverá ser acompanhada de relatório que evidencie os fundamentos técnicos e científicos das decisões.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
§ 5º A participação dos convidados de que trata o § 1º do art. 141-AW deverá ser previamente submetida à aprovação da coordenação da CTA-Leish, de acordo com os assuntos a serem tratados nas reuniões.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-AY. Compete à coordenação da CTA-Leish:(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
I - aprovar as pautas de reunião;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
II - aprovar a indicação dos representantes e convidados da CTA-Leish;(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
III - formalizar as atas de reunião; e(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
IV- submeter as manifestações da CTA-Leish à ciência da Secretária de Vigilância em Saúde e Ambiente do Ministério da Saúde.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-AZ. A secretaria-executiva da CTA-Leish será exercida por representante do Grupo Técnico das Leishmanioses da Coordenação-Geral de Vigilância de Zoonoses e Doenças de Transmissão Vetorial do Departamento de Doenças Transmissíveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-BA. As manifestações da CTA-Leish são consideradas atos preparatórios, nos termos do art. 20 do Decreto n° 7.724, de 16 de maio de 2012, e terão acesso restrito até a tomada de decisão final pela autoridade competente do Ministério da Saúde.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Parágrafo único. As manifestações da CTA-Leish não afastam a necessidade de observância do devido processo administrativo para incorporação, exclusão ou alteração pelo Sistema Único de Saúde - SUS de novos medicamentos, produtos e procedimentos, bem como para constituição ou alteração de protocolo clínico ou diretriz terapêutica, nos termos da Lei n° 12.401, de 28 de abril de 2011.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
Art. 141-BB. A participação na CTA-Leish será considerada prestação de serviço público relevante, não remunerada.(Redação dada pela PRT GM/MS n° 1.601 de 18.10.2023)
CAPÍTULO VI
DA TRIAGEM NEONATAL
Seção I
Do Programa Nacional de Triagem Neonatal (PNTN)
Art. 142. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa Nacional de Triagem Neonatal (PNTN). (Origem: PRT MS/GM 822/2001, Art. 1º)
§ 1º O Programa ora instituído deve ser executado de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, Distrito Federal e municípios e tem por objetivo o desenvolvimento de ações de triagem neonatal em fase pré-sintomática, acompanhamento e tratamento das doenças congênitas detectadas inseridas no Programa em todos os nascidos-vivos, promovendo o acesso, o incremento da qualidade e da capacidade instalada dos laboratórios especializados e serviços de atendimento, bem como organizar e regular o conjunto destas ações de saúde. (Origem: PRT MS/GM 822/2001, Art. 1º, § 1º)
§ 2º O Programa Nacional de Triagem Neonatal se ocupará da triagem com detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados nas seguintes doenças congênitas, de acordo com a respectiva Fase de Implantação do Programa: (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º)
I - fenilcetonúria; (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, a)
II - hipotireoidismo congênito; (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, b)
III - doenças falciformes e outras hemoglobinopatias; (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, c)
IV - fibrose cística. (Origem: PRT MS/GM 822/2001, Art. 1º, § 2º, d)
§ 3º Em virtude dos diferentes níveis de organização das redes assistenciais existentes nos estados e no Distrito Federal, da variação percentual de cobertura dos nascidos-vivos da atual triagem neonatal e da diversidade das características populacionais existentes no País, o Programa Nacional de Triagem Neonatal será implantado em fases, estabelecidas nesta Seção. (Origem: PRT MS/GM 822/2001, Art. 1º, § 3º)
Art. 143. Ficam configuradas as seguintes Fases de Implantação do Programa Nacional de Triagem Neonatal: (Origem: PRT MS/GM 822/2001, Art. 2º)
I - Fase I - Fenilcetonúria e Hipotireoidismo Congênito: Compreende a realização de triagem neonatal para fenilcetonúria e hipotireoidismo congênito, com a detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados. Os estados e o Distrito Federal deverão garantir a execução de todas as etapas do processo, devendo, para tanto, organizar uma Rede de Coleta de material para exame (envolvendo os municípios) e organizar/cadastrar o(s) Serviço(s) Tipo I de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas que garantam a realização da triagem, a confirmação diagnóstica e ainda o adequado acompanhamento e tratamento dos pacientes triados; (Origem: PRT MS/GM 822/2001, Art. 2º, I)
II - Fase II - Fenilcetonúria e Hipotireoidismo Congênito + Doenças Falciformes e outras Hemoglobinopatias: Compreende a realização de triagem neonatal para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias, com a detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamentos dos casos identificados. Os estados e o Distrito Federal deverão garantir a execução de todas as etapas do processo, devendo, para tanto, utilizar a rede de coleta organizada/definida na Fase I e organizar/cadastrar o(s) Serviço(s) Tipo II de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas que garantam a realização da triagem, a confirmação diagnóstica e ainda o adequado acompanhamento e tratamento dos pacientes triados; (Origem: PRT MS/GM 822/2001, Art. 2º, II)
III - Fase III - Fenilcetonúria, Hipotireoidismo Congênito, Doenças Falciformes e outras Hemoglobinopatias + Fibrose Cística: Compreende a realização de triagem neonatal para fenicetonúria, hipotireoidismo congênito, doenças falciformes, outras hemoglobinopatias e fibrose cística com a detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados. Os estados e o Distrito Federal deverão garantir a execução de todas as etapas do processo, devendo, para tanto, utilizar a rede de coleta organizada na Fase I e organizar/cadastrar o(s) Serviço(s) Tipo III de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas que garantam a realização da triagem, a confirmação diagnóstica e ainda o adequado acompanhamento e tratamento dos pacientes triados. (Origem: PRT MS/GM 822/2001, Art. 2º, III)
Art. 144. Ficam estabelecidas, na forma do Anexo XXII , as competências e atribuições relativas à implantação/gestão do Programa Nacional de Triagem Neonatal de cada nível de gestão do Sistema Único de Saúde. (Origem: PRT MS/GM 822/2001, Art. 3º)
Art. 145. Ficam estabelecidos, na forma do Anexo XXIII , os critérios/exigências a serem cumpridos pelos estados e pelo Distrito Federal para habilitação nas Fases de Implantação do Programa Nacional de Triagem Neonatal definidas no art. 143. (Origem: PRT MS/GM 822/2001, Art. 4º)
Art. 146. As Secretarias de Saúde dos estados, Distrito Federal e dos municípios, de acordo com seu nível de responsabilidade no Programa, organizarão Redes Estaduais de Triagem Neonatal que serão integradas por: (Origem: PRT MS/GM 822/2001, Art. 5º)
I - Postos de Coleta; (Origem: PRT MS/GM 822/2001, Art. 5º, a)
II - Serviços de Referência em Triagem Neonatal/ Acompanhamento e Tratamento de Doenças Congênitas Tipo I, II ou III. (Origem: PRT MS/GM 822/2001, Art. 5º, b)
§ 1º Compete aos municípios a organização/estruturação/ cadastramento de tantos postos de coleta quantos forem necessários para a adequada cobertura e acesso de suas respectivas populações, sendo obrigatória a implantação de pelo menos 01 (um) Posto de Coleta por município (municípios em que ocorram partos), em conformidade com o estabelecido no Anexo XXIV . (Origem: PRT MS/GM 822/2001, Art. 5º, § 1º)
§ 2º Compete aos estados e ao Distrito Federal a organização das Redes Estaduais de Triagem Neonatal, designando um Coordenador Estadual do Programa Nacional de Triagem Neonatal, articulando os Postos de Coleta Municipais com o(s) Serviço(s) de Referência, os fluxos de exames, a referência e contra-referência dos pacientes triados. (Origem: PRT MS/GM 822/2001, Art. 5º, § 2º)
§ 3º Compete, ainda, aos estados e ao Distrito Federal a organização/estruturação/cadastramento de Serviço(s) de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas, de acordo com a Fase de implantação do Programa, respectivamente de Tipo I, II ou III, que estejam aptos a realizar a triagem, a confirmação diagnóstica, o acompanhamento e tratamento das doenças triadas na Fase de Implantação do Programa em que o estado estiver, em conformidade com o estabelecido no Anexo XXIV , sendo obrigatória a implantação de pelo menos 01 (um) Serviço de Referência por estado no tipo adequado à sua Fase de Implantação do Programa. (Origem: PRT MS/GM 822/2001, Art. 5º, § 3º)
Art. 147. Ficam aprovadas, na forma do Anexo XXIV , as Normas de Funcionamento e Cadastramento de Postos de Coleta e de Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas. (Origem: PRT MS/GM 822/2001, Art. 6º)
Art. 148. A Secretaria de Atenção à Saúde elaborará e publicará o Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal e adotará as demais medidas necessárias ao fiel cumprimento do disposto nesta Seção, definindo, se for o caso, a inclusão/alteração de procedimentos/medicamentos nas Tabelas do SIA/SUS e SIH/SUS, pertinentes à adequada assistência aos pacientes, determinação extensiva às disposições constantes deste ato. (Origem: PRT MS/GM 822/2001, Art. 11)
Seção II
Dos Mecanismos que Possibilitem a Ampliação do Acesso dos Portadores Triados no Programa Nacional de Triagem Neonatal (PNTN) ao Tratamento e Acompanhamento das Doenças Diagnosticadas
Art. 149. Ficam definidos, no âmbito do Sistema Único de Saúde, mecanismos que possibilitem a ampliação do acesso dos portadores triados no Programa Nacional de Triagem Neonatal (PNTN) ao tratamento e acompanhamento das doenças diagnosticadas. (Origem: PRT MS/GM 1069/2002, Art. 1º)
Parágrafo Único. Estes mecanismos serão adotados de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em cooperação com as respectivas Redes Estaduais de Triagem Neonatal e seus Serviços de Referência em Triagem Neonatal. (Origem: PRT MS/GM 1069/2002, Art. 1º, Parágrafo Único)
Art. 150. A Secretaria de Atenção à Saúde estabelecerá os Protocolos Clínicos e Diretrizes Terapêuticas para o tratamento da Fenilcetonúria, Hipotireoidismo Congênito e Doença Falciforme e adotará as medidas necessárias à implementação das disposições deles constantes. (Origem: PRT MS/GM 1069/2002, Art. 2º)
Seção III
Da Base de Dados do Programa Nacional de Triagem Neonatal
(Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
Art. 150-A. O Programa Nacional de Triagem Neonatal - PNTN, previsto nos arts. 142 a 150 desta Portaria, contará com uma Base de Dados, com o objetivo de reunir informações para o acompanhamento e a avaliação, em âmbito nacional, das ações do Programa. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 1º O acompanhamento e a avaliação de que trata o caput serão realizados por meio do resultado de indicadores de saúde, conforme Anexo XXIV-A a esta Portaria, que serão obtidos a partir do conjunto de dados referentes aos componentes laboratorial e de acompanhamento da triagem neonatal biológica (teste do pezinho). (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 2º A Base de Dados do PNTN contemplará informações relativas: (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
I - ao registro de recém-nascidos que realizam a triagem neonatal biológica (teste do pezinho); e (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
II - às ações relacionadas ao Programa Nacional de Triagem Neonatal realizadas pelos estabelecimentos de saúde públicos e privados. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 3º O Ministério da Saúde dará ampla divulgação do resultado de indicadores de saúde obtidos pelos entes federativos. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
Art. 150-B. As informações que integrarão a Base de Dados do PNTN serão encaminhadas mensalmente, por meio eletrônico: (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
I - pelos estabelecimentos de saúde públicos e privados que realizam triagem neonatal às Secretarias de Saúde do Distrito Federal e dos Estados; e (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
II - pelas Secretarias de Saúde dos Estados e do Distrito Federal ao Ministério da Saúde, após a consolidação dos dados de que trata o inciso I do caput, observadas as configurações técnicas mínimas exigidas para transmissão dos dados pelos entes federativos. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 1º O envio de dados pelos estabelecimentos de saúde às Secretarias de Saúde do Distrito Federal e dos Estados, de que trata o inciso I do caput, poderá ser realizado por meio: (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
I - do "Sistema de Triagem Neonatal Biológica - SISNEO desktop"; ou (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
II - de outros softwares de Triagem Neonatal Biológica utilizados pelas Secretarias de Saúde dos Estados e do Distrito Federal, observado o disposto nos §§ 3º e 4º. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 2º O envio de dados pelas Secretarias de Saúde dos Estados e do Distrito Federal ao Ministério da Saúde, de que trata o inciso II do caput, deverá ser realizado até o 15º (décimo quinto) dia útil de cada mês, por meio do Sistema Centralizador Nacional de Dados da Triagem Neonatal - SISNEO, com informações consolidadas do conjunto de dados relativos a todo o mês anterior. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 3º Os dados a serem enviados pelos estabelecimentos de saúde públicos e privados e pelas Secretarias de Saúde dos Estados e do Distrito Federal deverão conter campos de informação padronizados, conforme instruções a serem disponibilizadas pelo Ministério da Saúde no sítio eletrônico http://ww.saude.gov.br/acoes-e-programas/programa-nacional-da-triagem-neonatal (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
§ 4º Compete à Secretaria de Atenção Especializada à Saúde - SAES/MS disponibilizar as instruções de que trata o § 3º, com os campos de informação padronizados e as configurações técnicas mínimas exigidas para transmissão dos dados pelos entes federativos, por meio do Sistema Centralizador Nacional de Dados da Triagem Neonatal - SISNEO. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
Seção III-A
Da Câmara Técnica de Assessoramento ao Programa Nacional de Triagem Neonatal
(Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-C. Fica instituída a Câmara Técnica de Assessoramento - CTA ao Programa Nacional de Triagem Neonatal - PNTN. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo único. Os encaminhamentos definidos pela CTA de que trata o caput serão submetidos à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção Especializada à Saúde, para apreciação e providências junto às instâncias deliberativas competentes. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-D. Compete à CTA em Triagem Neonatal: (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
I - assessorar na formulação, implementação, avaliação e monitoramento das ações relacionadas ao PNTN; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
II - contribuir na elaboração, revisão e monitoramento de normas técnicas, diretrizes e estratégias de atuação relacionadas ao PNTN; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
III - propor e elaborar estudos, análises e ações integradas de apoio à implementação do PNTN, bem como ações intersetoriais para a qualificação da implementação das atividades de gestão relativas ao PNTN; e (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - assessorar a Secretaria de Atenção Especializada à Saúde na organização de reuniões, eventos e treinamentos relacionados ao PNTN. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-E. A CTA em Triagem Neonatal será composta por representantes dos seguintes órgãos e entidades: (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
I - um da Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Especializada e Temática da Secretaria de Atenção Especializada à Saúde, que a coordenará; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
II - um da Coordenação-Geral de Doenças Raras do Departamento de Atenção Especializada e Temática da Secretaria de Atenção Especializada à Saúde; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
III - um da Coordenação de Atenção à Saúde da Criança e do Adolescente do Departamento de Gestão do Cuidado Integral da Secretaria de Atenção Primária à Saúde; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - um da Coordenação-Geral de Gestão de Sistemas de Informação em Saúde do Departamento de Regulação Assistencial e Controle da Secretaria de Atenção Especializada à Saúde; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
V - um dos Serviços de Referência em Triagem Neonatal; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
VI - um da Sociedade Brasileira de Triagem Neonatal e Erros Inatos do Metabolismo - SBTEIM; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
VII - um da Sociedade Brasileira de Genética Médica e Genômica - SBGM; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
VIII - um dos Serviços de Laboratório Especializado em Triagem Neonatal; (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
IX - um dos Serviços de Referência em Doenças Raras; e (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
X - um das Secretarias Estaduais de Saúde. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
XI - um do Conselho Nacional de Secretários de Saúde - Conass; e (Redação dada pela PRT GM/MS n° 5.276 de 12.09.2024)
XII - um do Conselho Nacional de Secretarias Municipais de Saúde - Conasems. (Redação dada pela PRT GM/MS n° 5.276 de 12.09.2024)
§ 1º Cada membro da CTA em Triagem Neonatal terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os membros da CTA em Triagem Neonatal e respectivos suplentes serão indicados pelos titulares dos órgãos ou entidades que representam e designados pelo Secretário de Atenção Especializada à Saúde do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Poderão participar das reuniões da CTA em Triagem Neonatal, como convidados especiais, sem direito a voto, representantes de outros órgãos e entidades, públicos ou privados, bem como especialistas em assuntos afetos ao tema em discussão, cuja presença pontual seja considerada necessária ao cumprimento do disposto nesta Seção. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-F. A CTA em Triagem Neonatal se reunirá, em caráter ordinário, pelo menos uma vez ao ano, preferencialmente de forma presencial, e, em caráter extraordinário, sempre que convocada pela sua coordenação, prioritariamente por meio eletrônico. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º O quórum de reunião da CTA em Triagem Neonatal é de maioria absoluta dos membros, e o quórum de aprovação é de maioria simples. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Além do voto ordinário, a coordenação da CTA em Triagem Neonatal terá o voto de qualidade em caso de empate. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º As reuniões da CTA em Triagem Neonatal deverão ter o seu registro formalizado em ata ou resumo executivo contendo os encaminhamentos e deliberações adotados, além da assinatura de todos os participantes. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º O Ministério da Saúde custeará as despesas com passagens e diárias para participação de membros ou convidados nas reuniões da CTA em Triagem Neonatal, observado o disposto nos regulamentos vigentes sobre o tema. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-G. A secretaria executiva da CTA em Triagem Neonatal será exercida pela Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Especializada e Temática da Secretaria de Atenção Especializada à Saúde, que prestará o apoio técnico-administrativo necessário ao funcionamento de suas atividades. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-H. A participação na CTA em Triagem Neonatal será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 150-I. Os relatórios das atividades da CTA em Triagem Neonatal serão encaminhados à Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Especializada e Temática da Secretaria de Atenção Especializada à Saúde para análise e ciência do Secretário de Atenção Especializada à Saúde do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.580 de 18.04.2024)
CAPÍTULO VII
DO ALEITAMENTO MATERNO
Seção I
Do Comitê Nacional de Aleitamento Materno (CNAM)
(Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 151. Fica instituído o Comitê Nacional de Aleitamento Materno (CNAM). (Origem: PRT MS/GM 111/2012, Art. 1º) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 152. O CNAM terá como objetivo assessorar a Área Técnica de Saúde da Criança e Aleitamento Materno, do Departamento de Ações Programáticas Estratégicas, da Secretaria de Atenção à Saúde (DAPES/SAS/MS), em assuntos relativos à promoção, proteção e apoio ao aleitamento materno. (Origem: PRT MS/GM 111/2012, Art. 2º) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 153. O CNAM apoiará o processo de articulação da Área Técnica de Saúde da Criança e Aleitamento Materno, mobilizando e sensibilizando setores do governo e da sociedade civil para o desenvolvimento de ações inerentes ao aleitamento materno. (Origem: PRT MS/GM 111/2012, Art. 3º) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 154. O CNAM será composto por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 111/2012, Art. 4º) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
I - Área Técnica de Saúde da Criança e Aleitamento Materno (DAPES/SAS/MS), que o coordenará; (Origem: PRT MS/GM 111/2012, Art. 4º, I) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
II - Área Técnica de Saúde da Mulher (DAPES/SAS/MS); (Origem: PRT MS/GM 111/2012, Art. 4º, II) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
III - Departamento de Atenção Básica (DAB/SAS/MS); (Origem: PRT MS/GM 111/2012, Art. 4º, III) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - Rede Brasileira de Bancos de Leite Humano; (Origem: PRT MS/GM 111/2012, Art. 4º, IV) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
V - Sociedade Brasileira de Pediatria (SBP); (Origem: PRT MS/GM 111/2012, Art. 4º, V) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO); (Origem: PRT MS/GM 111/2012, Art. 4º, VI) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
VII - Associação Brasileira de Obstetrizes e Enfermeiros Obstetras (ABENFO); (Origem: PRT MS/GM 111/2012, Art. 4º, VII) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - Rede Internacional em Defesa do Direito de Amamentar IBFAN-Brasil; (Origem: PRT MS/GM 111/2012, Art. 4º, VIII) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
IX - Conselho Federal de Nutricionistas; (Origem: PRT MS/GM 111/2012, Art. 4º, IX) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
X - Entidades Não Governamentais Ligadas à Defesa e Promoção do Aleitamento Materno; e (Origem: PRT MS/GM 111/2012, Art. 4º, X) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
XI - Universidades e/ou Institutos de Pesquisa. (Origem: PRT MS/GM 111/2012, Art. 4º, XI) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Parágrafo Único. Os representantes titulares e suplentes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Coordenação do Comitê, exceto os referentes aos incisos X e XI do "caput" deste artigo, que serão indicados pelo próprio CNAM. (Origem: PRT MS/GM 111/2012, Art. 4º, Parágrafo Único) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 155. O CNAM poderá convidar representantes de órgãos e entidades públicas e de entidades não governamentais, bem como especialistas em assuntos ligados ao tema, cuja presença seja considerada necessária ao cumprimento do dispositivo nesta Seção. (Origem: PRT MS/GM 111/2012, Art. 5º) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156. A participação do CNAM não será remunerada e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 111/2012, Art. 6º) (Revogado pela PRT GM/MS n° 5.427 de 02.10.2024)
Seção II
Comitê Nacional de Amamentação
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art.156-A. Fica instituído o Comitê Nacional de Amamentação - CNAM, de caráter permanente, no âmbito do Ministério da Saúde, com a finalidade de assessoramento à Coordenação-Geral de Atenção à Saúde das Crianças, Adolescentes e Jovens do Departamento de Gestão do Cuidado Integral da Secretaria de Atenção Primária à Saúde do Ministério da Saúde - CGCRIAJ/DGCI/SAPS/MS visando a implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-B. Compete ao CNAM: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - monitorar a integração e a coerência do Programa Nacional de Promoção, Proteção e Apoio à Amamentação em relação às demais políticas nacionais relacionadas ao tema; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - acompanhar o cumprimento dos compromissos internacionais assumidos pelo País no âmbito do Programa Nacional de Promoção, Proteção e Apoio à Amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - incentivar parcerias dos setores do Governo e da sociedade civil envolvidos na implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - emitir Nota Técnica acerca de novos estudos, protocolos e pesquisas científicas, apontando também seus pontos controversos, quando solicitado pela Coordenação-Geral de Atenção à Saúde das Crianças, Adolescentes e Jovens - CGCRIAJ; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - propor à Coordenação-Geral de Atenção à Saúde das Crianças, Adolescentes e Jovens - CGCRIAJ: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
a) a realização de estudos envolvendo a amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
b) a realização de reuniões de trabalho e científicas, visando à divulgação de conhecimento das áreas de sua competência; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
c) orientar na definição de ações e estratégias baseadas em evidências para a promoção, proteção e apoio à amamentação; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
d) elaborar relatórios e encaminhar propostas de conteúdo técnico e científico para apreciação e decisão da CGCRIAJ. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-C. O CNAM é composto por representantes dos seguintes órgãos e entidades: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - Ministério da Saúde: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
a) um da Coordenação-Geral de Atenção à Saúde das Crianças, Adolescentes e Jovens do Departamento de Gestão do Cuidado Integral da Secretaria de Atenção Primária à Saúde - CGCRIAJ/DGCI/SAPS/MS, que o coordenará; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
b) um da Coordenação-Geral de Atenção à Saúde das Mulheres do Departamento de Gestão do Cuidado Integral da Saúde da Secretaria de Atenção Primária à Saúde - CGESMU/DGCI/SAPS/MS; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
c) um da Coordenação-Geral de Alimentação e Nutrição do Departamento de Prevenção e Promoção da Saúde da Secretaria de Atenção Primária à Saúde - CGAN/DEPPROS/SAPS/MS; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
d) um do Departamento de Atenção Primária à Saúde Indígena da Secretaria de Saúde Indígena - DAPSI/SESAI/MS. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - um da Rede Brasileira de Bancos de Leite Humano - RBLH; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - um da Agência Nacional de Vigilância Sanitária - Anvisa; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - um da Agência Nacional de Saúde Suplementar - ANS; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - um da Organização Pan-americana de Saúde - OPAS; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - um do Fundo das Nações Unidas - UNICEF; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VII - um da Sociedade Brasileira de Pediatria - SBP; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - um da Sociedade Brasileira Enfermeiros Pediatras - SOBEP. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IX - um da Federação Brasileira de Ginecologia e Obstetrícia - Febrasgo; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
X - um da Associação Brasileira de Obstetrizes e Enfermeiros Obstetras - Abenfo; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
XI - um da Rede Internacional em Defesa do Direito de Amamentar IBFAN-Brasil; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
XII - um do Conselho Nacional de Segurança Alimentar e Nutricional -Consea; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
XIII - um representante do Conselho Nacional de Saúde - CNS. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
§ 1º Cada representante do CNAM terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
§ 2º Os membros do CNAM e respectivos suplentes serão indicados pelos titulares dos órgãos que representam e designados pelo Secretário de Atenção Primária à Saúde. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
§ 3º O Coordenador do CNAM poderá convidar especialistas e representantes da comunidade científica, dos setores público e privado e de entidades da sociedade civil, para participar de suas reuniões. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-D. O CNAM se reunirá, em caráter ordinário, quadrimestralmente e, em caráter extraordinário, mediante convocação de seu Coordenador. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
§ 1º O quórum de reunião do CNAM é de maioria absoluta dos membros, e o quórum de aprovação é de maioria simples. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
§ 2º Além do voto ordinário, o Coordenador terá o voto de qualidade em caso de empate. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-E. A Secretaria-Executiva do CNAM será exercida pela Coordenação-Geral de Atenção à Saúde das Crianças, Adolescentes e Jovens. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-F. O CNAM poderá instituir grupos de trabalho com o objetivo de realizar levantamentos de informações e elaborar estudos técnicos para subsidiar as suas discussões. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Parágrafo único. Os grupos de trabalho de que trata o caput: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - serão instituídos e compostos na forma de ato do CNAM; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - serão compostos por, no máximo, cinco membros; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - terão caráter temporário e duração não superior a 90 (noventa dias); e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - estarão limitados a, no máximo, 3 (três) em operação simultânea. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-G. Os membros do CNAM e dos grupos de trabalho que se encontrarem no Distrito Federal se reunirão presencialmente ou por videoconferência, e os membros que se encontrarem em outros entes federativos participarão das reuniões por meio de videoconferência. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-H. A participação no CNAM e nos grupos de trabalho será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-I. O CNAM elaborará e submeterá à aprovação da Ministra de Estado da Saúde o seu regimento interno. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Seção III
Do Programa Nacional de Promoção, Proteção e Apoio à Amamentação
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 156-J. Fica instituído o Programa Nacional de Promoção, Proteção e Apoio à Amamentação, na forma do Anexo CXI a esta Portaria. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO VIII
DA SEGURANÇA DO PACIENTE
Seção I
Do Programa Nacional de Segurança do Paciente (PNSP)
Art. 157. Fica instituído o Programa Nacional de Segurança do Paciente (PNSP). (Origem: PRT MS/GM 529/2013, Art. 1º)
Art. 158. O PNSP tem por objetivo geral contribuir para a qualificação do cuidado em saúde em todos os estabelecimentos de saúde do território nacional. (Origem: PRT MS/GM 529/2013, Art. 2º)
Art. 159. Constituem-se objetivos específicos do PNSP: (Origem: PRT MS/GM 529/2013, Art. 3º)
I - promover e apoiar a implementação de iniciativas voltadas à segurança do paciente em diferentes áreas da atenção, organização e gestão de serviços de saúde, por meio da implantação da gestão de risco e de Núcleos de Segurança do Paciente nos estabelecimentos de saúde; (Origem: PRT MS/GM 529/2013, Art. 3º, I)
II - envolver os pacientes e familiares nas ações de segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 3º, II)
III - ampliar o acesso da sociedade às informações relativas à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 3º, III)
IV - produzir, sistematizar e difundir conhecimentos sobre segurança do paciente; e (Origem: PRT MS/GM 529/2013, Art. 3º, IV)
V - fomentar a inclusão do tema segurança do paciente no ensino técnico e de graduação e pós-graduação na área da saúde. (Origem: PRT MS/GM 529/2013, Art. 3º, V)
Art. 160. Para fins desta Seção, são adotadas as seguintes definições: (Origem: PRT MS/GM 529/2013, Art. 4º)
I - Segurança do Paciente: redução, a um mínimo aceitável, do risco de dano desnecessário associado ao cuidado de saúde; (Origem: PRT MS/GM 529/2013, Art. 4º, I)
II - dano: comprometimento da estrutura ou função do corpo e/ou qualquer efeito dele oriundo, incluindo-se doenças, lesão, sofrimento, morte, incapacidade ou disfunção, podendo, assim, ser físico, social ou psicológico; (Origem: PRT MS/GM 529/2013, Art. 4º, II)
III - incidente: evento ou circunstância que poderia ter resultado, ou resultou, em dano desnecessário ao paciente; (Origem: PRT MS/GM 529/2013, Art. 4º, III)
IV - Evento adverso: incidente que resulta em dano ao paciente; (Origem: PRT MS/GM 529/2013, Art. 4º, IV)
V - Cultura de Segurança: configura-se a partir de cinco características operacionalizadas pela gestão de segurança da organização: (Origem: PRT MS/GM 529/2013, Art. 4º, V)
a) cultura na qual todos os trabalhadores, incluindo profissionais envolvidos no cuidado e gestores, assumem responsabilidade pela sua própria segurança, pela segurança de seus colegas, pacientes e familiares; (Origem: PRT MS/GM 529/2013, Art. 4º, V, a)
b) cultura que prioriza a segurança acima de metas financeiras e operacionais; (Origem: PRT MS/GM 529/2013, Art. 4º, V, b)
c) cultura que encoraja e recompensa a identificação, a notificação e a resolução dos problemas relacionados à segurança; (Origem: PRT MS/GM 529/2013, Art. 4º, V, c)
d) cultura que, a partir da ocorrência de incidentes, promove o aprendizado organizacional; e (Origem: PRT MS/GM 529/2013, Art. 4º, V, d)
e) cultura que proporciona recursos, estrutura e responsabilização para a manutenção efetiva da segurança. (Origem: PRT MS/GM 529/2013, Art. 4º, V, e)
VI - gestão de risco: aplicação sistêmica e contínua de iniciativas, procedimentos, condutas e recursos na avaliação e controle de riscos e eventos adversos que afetam a segurança, a saúde humana, a integridade profissional, o meio ambiente e a imagem institucional. (Origem: PRT MS/GM 529/2013, Art. 4º, VI)
Art. 161. Constituem-se estratégias de implementação do PNSP: (Origem: PRT MS/GM 529/2013, Art. 5º)
I - elaboração e apoio à implementação de protocolos, guias e manuais de segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 5º, I)
II - promoção de processos de capacitação de gerentes, profissionais e equipes de saúde em segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 5º, II)
III - inclusão, nos processos de contratualização e avaliação de serviços, de metas, indicadores e padrões de conformidade relativos à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 5º, III)
IV - implementação de campanha de comunicação social sobre segurança do paciente, voltada aos profissionais, gestores e usuários de saúde e sociedade; (Origem: PRT MS/GM 529/2013, Art. 5º, IV)
V - implementação de sistemática de vigilância e monitoramento de incidentes na assistência à saúde, com garantia de retorno às unidades notificantes; (Origem: PRT MS/GM 529/2013, Art. 5º, V)
VI - promoção da cultura de segurança com ênfase no aprendizado e aprimoramento organizacional, engajamento dos profissionais e dos pacientes na prevenção de incidentes, com ênfase em sistemas seguros, evitando-se os processos de responsabilização individual; e (Origem: PRT MS/GM 529/2013, Art. 5º, VI)
VII - articulação, com o Ministério da Educação e com o Conselho Nacional de Educação, para inclusão do tema segurança do paciente nos currículos dos cursos de formação em saúde de nível técnico, superior e de pós-graduação. (Origem: PRT MS/GM 529/2013, Art. 5º, VII)
Art. 162. Fica instituído, no âmbito do Ministério da Saúde, o Comitê de Implementação do Programa Nacional de Segurança do Paciente (CIPNSP), instância colegiada, de caráter consultivo, com a finalidade de promover ações que visem à melhoria da segurança do cuidado em saúde através de processo de construção consensual entre os diversos atores que dele participam. (Origem: PRT MS/GM 529/2013, Art. 6º)
Art. 163. Compete ao CIPNSP: (Origem: PRT MS/GM 529/2013, Art. 7º)
I - propor e validar protocolos, guias e manuais voltados à segurança do paciente em diferentes áreas, tais como: (Origem: PRT MS/GM 529/2013, Art. 7º, I)
a) infecções relacionadas à assistência à saúde; (Origem: PRT MS/GM 529/2013, Art. 7º, I, a)
b) procedimentos cirúrgicos e de anestesiologia; (Origem: PRT MS/GM 529/2013, Art. 7º, I, b)
c) prescrição, transcrição, dispensação e administração de medicamentos, sangue e hemoderivados; (Origem: PRT MS/GM 529/2013, Art. 7º, I, c)
d) processos de identificação de pacientes; (Origem: PRT MS/GM 529/2013, Art. 7º, I, d)
e) comunicação no ambiente dos serviços de saúde; (Origem: PRT MS/GM 529/2013, Art. 7º, I, e)
f) prevenção de quedas; (Origem: PRT MS/GM 529/2013, Art. 7º, I, f)
g) úlceras por pressão; (Origem: PRT MS/GM 529/2013, Art. 7º, I, g)
h) transferência de pacientes entre pontos de cuidado; e (Origem: PRT MS/GM 529/2013, Art. 7º, I, h)
i) uso seguro de equipamentos e materiais. (Origem: PRT MS/GM 529/2013, Art. 7º, I, i)
II - aprovar o Documento de Referência do PNSP; (Origem: PRT MS/GM 529/2013, Art. 7º, II)
III - incentivar e difundir inovações técnicas e operacionais que visem à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 7º, III)
IV - propor e validar projetos de capacitação em Segurança do Paciente; (Origem: PRT MS/GM 529/2013, Art. 7º, IV)
V - analisar quadrimestralmente os dados do Sistema de Monitoramento incidentes no cuidado de saúde e propor ações de melhoria; (Origem: PRT MS/GM 529/2013, Art. 7º, V)
VI - recomendar estudos e pesquisas relacionados à segurança do paciente; (Origem: PRT MS/GM 529/2013, Art. 7º, VI)
VII - avaliar periodicamente o desempenho do PNSP; e (Origem: PRT MS/GM 529/2013, Art. 7º, VII)
VIII - elaborar seu regimento interno e submetê-lo à aprovação do Ministro de Estado da Saúde. (Origem: PRT MS/GM 529/2013, Art. 7º, VIII)
Art. 164. O CIPNSP instituições é composto por representantes, titular e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 529/2013, Art. 8º)
I - do Ministério da Saúde: (Origem: PRT MS/GM 529/2013, Art. 8º, I)
a) um da Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, a)
b) um da Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, b)
c) um da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, c)
d) um da Secretaria de Vigilância em Saúde (SVS/MS); e (Origem: PRT MS/GM 529/2013, Art. 8º, I, d)
e) um da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 529/2013, Art. 8º, I, e)
II - um da Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 529/2013, Art. 8º, II)
III - um da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 529/2013, Art. 8º, III)
IV - um da Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 529/2013, Art. 8º, IV)
V - um do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 529/2013, Art. 8º, V)
VI - um do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 529/2013, Art. 8º, VI)
VII - um do Conselho Federal de Medicina (CFM); (Origem: PRT MS/GM 529/2013, Art. 8º, VII)
VIII - um do Conselho Federal de Enfermagem (COFEN); (Origem: PRT MS/GM 529/2013, Art. 8º, VIII)
IX - um do Conselho Federal de Odontologia (CFO); (Origem: PRT MS/GM 529/2013, Art. 8º, IX)
X - um do Conselho Federal de Farmácia (CFF); (Origem: PRT MS/GM 529/2013, Art. 8º, X)
XI - um da Organização Pan Americana de Saúde (OPAS); (Origem: PRT MS/GM 529/2013, Art. 8º, XI)
XII - quatro de Instituições Superiores de Ensino e Pesquisa com notório saber no tema Segurança do Paciente; (Origem: PRT MS/GM 529/2013, Art. 8º, XII)
XIII - um do Conselho Nacional de Saúde; e (Origem: PRT MS/GM 529/2013, Art. 8º, XIII)
XIV - um da Confederação Nacional de Saúde. (Origem: PRT MS/GM 529/2013, Art. 8º, XIV)
§ 1º A coordenação do CIPNSP será realizada pela ANVISA, que fornecerá em conjunto com a SAS/MS e a FIOCRUZ os apoios técnico e administrativo necessários para o seu funcionamento. (Origem: PRT MS/GM 529/2013, Art. 8º, § 1º)
§ 2º A participação das entidades de que tratam os incisos V a XIV do "caput" será formalizada após resposta a convite a eles encaminhado pela Coordenação do CIPNSP, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 529/2013, Art. 8º, § 2º)
§ 3º Os representantes titulares e os respectivos suplentes serão indicados pelos dirigentes dos respectivos órgãos e entidades à Coordenação do CIPNSP no prazo de 10 (dez) dias a contar da data da data de publicação da Portaria nº 529/GM/MS, de 01 de abril de 2013. (Origem: PRT MS/GM 529/2013, Art. 8º, § 3º)
§ 4º O CIPNSP poderá convocar representantes de órgãos e entidades, públicas e privadas, além de especialistas nos assuntos relacionados às suas atividades, quando entender necessário para o cumprimento dos objetivos previstos nesta Seção. (Origem: PRT MS/GM 529/2013, Art. 8º, § 4º)
§ 5º O CIPNSP poderá instituir grupos de trabalho para a execução de atividades específicas que entender necessárias para o cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 529/2013, Art. 8º, § 5º)
Art. 165. As funções dos membros do CIPNSP não serão remuneradas e seu exercício será considerado de relevante interesse público. (Origem: PRT MS/GM 529/2013, Art. 9º)
Art. 166. O Ministério da Saúde instituirá incentivos financeiros para a execução de ações e atividades no âmbito do PNSP, conforme normatização específica, mediante prévia pactuação na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 529/2013, Art. 10)
CAPÍTULO IX
DA SEMANA DE MOBILIZAÇÃO SAÚDE NA ESCOLA (SEMANA SAÚDE NA ESCOLA)
Art. 167. Fica definida a Semana de Mobilização Saúde na Escola (Semana Saúde na Escola), de periodicidade anual, como componente das ações do Programa Saúde na Escola. (Origem: PRT MS/GM 798/2015, Art. 1º)
Art. 168. A Semana Saúde na Escola é constituída por ações de promoção e de prevenção de agravos à saúde realizadas em estabelecimentos públicos de ensino em todo o território nacional com participação das equipes da Atenção Básica e das equipes das escolas. (Origem: PRT MS/GM 798/2015, Art. 2º)
Parágrafo Único. Os Ministros de Estado da Saúde e da Educação definirão, anualmente, os temas principais que nortearão a execução das ações de que trata o "caput". (Origem: PRT MS/GM 798/2015, Art. 2º, Parágrafo Único)
Art. 169. Poderão participar da Semana Saúde na Escola todos os estabelecimentos públicos de ensino do Distrito Federal, dos Estados e dos Municípios. (Origem: PRT MS/GM 798/2015, Art. 3º)
Parágrafo Único. É livre a iniciativa dos entes federados interessados em participar da mobilização, sem necessidade de prévia adesão. (Origem: PRT MS/GM 798/2015, Art. 3º, Parágrafo Único)
Art. 170. Para os Municípios aderidos ao PSE, as ações realizadas durante a Semana Saúde na Escola serão contabilizadas para o alcance das metas pactuadas no Termo de Compromisso do Programa, definido em ato conjunto dos Ministros de Estado da Saúde e da Educação. (Origem: PRT MS/GM 798/2015, Art. 4º)
Parágrafo Único. A contabilização das ações realizadas durante a Semana Saúde na Escola fica condicionada ao seu registro nos sistemas de monitoramento do PSE. (Origem: PRT MS/GM 798/2015, Art. 4º, Parágrafo Único)
Art. 171. O período de realização e o tema principal da Semana Saúde na Escola serão divulgados, anualmente, nos canais de comunicação do Ministério da Saúde e também por meios eletrônicos e/ou impressos de ampla circulação. (Origem: PRT MS/GM 798/2015, Art. 5º)
TÍTULO II
DO CONTROLE DE DOENÇAS E ENFRENTAMENTO DE AGRAVOS DE SAÚDE
CAPÍTULO I
DA ELIMINAÇÃO DA HANSENÍASE
Seção I
Do Conjunto de Ações e Medidas Coordenadas para a Eliminação da Hanseníase
Art. 172. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), um conjunto de ações e medidas coordenadas para a eliminação da hanseníase, a serem promovidas de forma compartilhada entre o Ministério da Saúde e as Secretarias de Saúde dos Estados, dos Municípios e do Distrito Federal, com a finalidade de fortalecer o desenvolvimento das ações de prevenção, diagnóstico, tratamento, reabilitação e controle da hanseníase, tendo por objetivos: (Origem: PRT MS/GM 586/2004, Art. 1º)
I - ampliar o acesso ao diagnóstico e ao tratamento nos municípios de maior endemicidade; (Origem: PRT MS/GM 586/2004, Art. 1º, I)
II - garantir atenção integral aos pacientes em todos os níveis de complexidade; (Origem: PRT MS/GM 586/2004, Art. 1º, II)
III - assegurar, nas unidades de saúde, tratamento completo para as formas paucibacilar e multibacilar; (Origem: PRT MS/GM 586/2004, Art. 1º, III)
IV - desenvolver ações de promoção à saúde e vigilância epidemiológica, bem como de diagnóstico e acompanhamento, tratamento e reabilitação das pessoas atingidas pela doença; (Origem: PRT MS/GM 586/2004, Art. 1º, IV)
V - promover a organização, a regulação, o acompanhamento e a avaliação do conjunto de ações de saúde para a efetiva eliminação da hanseníase; (Origem: PRT MS/GM 586/2004, Art. 1º, V)
VI - garantir informação acessível, atualizada e confiável, como ferramenta de avaliação, acompanhamento do estágio da eliminação para tomada de decisão; (Origem: PRT MS/GM 586/2004, Art. 1º, VI)
VII - responsabilizar os gestores e mobilizar a sociedade civil, na promoção do conhecimento sobre os sinais e sintomas da hanseníase; e (Origem: PRT MS/GM 586/2004, Art. 1º, VII)
VIII - ampliar a oferta de procedimentos de reabilitação física aos pacientes portadores de incapacidades/deformidades decorrentes da hanseníase. (Origem: PRT MS/GM 586/2004, Art. 1º, VIII)
Art. 173. Ficam integradas as ações de eliminação da hanseníase - diagnóstico e tratamento - na Atenção Básica, com o objetivo de promover o maior acesso das pessoas atingidas pela doença, em especial nos municípios endêmicos. (Origem: PRT MS/GM 586/2004, Art. 2º)
Art. 174. A Secretaria de Vigilância em Saúde e a Secretaria de Atenção à Saúde adotarão as medidas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 586/2004, Art. 3º)
Seção II
Dos Centros Colaboradores Nacionais, Macrorregionais e Estaduais para o Programa Nacional de Controle e Eliminação da Hanseníase e de Outras Dermatoses de Interesse Sanitário
Art. 175. Ficam aprovados os pré-requisitos, as atividades e demais orientações, constantes desta Seção, para o reconhecimento de instituições como Centros Colaboradores Nacionais, Macrorregionais e Estaduais para o Programa Nacional de Controle e Eliminação da Hanseníase e de outras dermatoses de interesse sanitário. (Origem: PRT MS/GM 814/2000, Art. 1º)
Parágrafo Único. Os Centros Colaboradores Nacionais e Macrorregionais serão reconhecidos por meio de portaria ministerial específica e os Centros Colaboradores Estaduais pela respectiva Secretaria de Estado da Saúde. (Origem: PRT MS/GM 814/2000, Art. 1º, Parágrafo Único)
Art. 176. São atividades dos Centros Colaboradores Nacionais: (Origem: PRT MS/GM 814/2000, Art. 2º)
I - o desenvolvimento de pesquisas de interesse do Programa Nacional de Controle e Eliminação da Hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 2º, I)
II - a capacitação de recursos humanos especializados na atenção básica e em outras de maior complexidade para o Programa Nacional mencionado; e (Origem: PRT MS/GM 814/2000, Art. 2º, II)
III - a realização de estudos de interesse do Programa Nacional de Controle e Eliminação da Hanseníase, com ênfase em epidemiologia, aspectos operacionais, resistência medicamentosa, efeitos colaterais e recidivas e monitoramento de eventos sentinelas. (Origem: PRT MS/GM 814/2000, Art. 2º, III)
Art. 177. Ficam definidos os pré-requisitos mínimos obrigatórios para o reconhecimento de Unidades de Saúde como Centros Colaboradores Estaduais, Macrorregionais ou Nacionais na área de dermatologia sanitária. (Origem: PRT MS/GM 814/2000, Art. 3º)
§ 1º São os seguintes os pré-requisitos para o reconhecimento de instituições como Centro Colaborador Estadual ou Macrorregional; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º)
I - dispor de equipe multidisciplinar capacitada para a assistência em dermatologia sanitária,com enfoque nas ações de controle da hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, I)
II - assessorar tecnicamente as demais Unidades de Saúde da rede do SUS na área de hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, II)
III - realizar e apoiar a capacitação técnica nas atividades de controle e eliminação da hanseníase e de outras dermatoses de interesse sanitário; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, III)
IV - esclarecer diagnósticos, inclusive de recidivas e de outras intercorrências; (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, IV)
V - desenvolver e apoiar o desenvolvimento de pesquisas de interesse do Programa de Controle e Eliminação da Hanseníase; e (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, V)
VI - estar vinculado formalmente a comitê de ética em pesquisa. (Origem: PRT MS/GM 814/2000, Art. 3º, § 1º, VI)
§ 2º São os seguintes os pré-requisitos para o reconhecimento de instituições como Centro Colaborador Nacional, além dos constantes no §1° precedente; (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º)
I - dispor de, pelo menos, um terço da equipe com titulação em nível de pós graduação; (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º, I)
II - possuir laboratório de pesquisa; e (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º, II)
III - apresentar produção científica regular. (Origem: PRT MS/GM 814/2000, Art. 3º, § 2º, III)
§ 3º Os Centros Colaboradores Nacionais deverão subsidiar o Ministério da Saúde nas decisões referentes à política de controle e eliminação da hanseníase e de outras dermatoses de direito sanitário. (Origem: PRT MS/GM 814/2000, Art. 3º, § 3º)
Art. 178. Os Centros Colaboradores Nacionais, Macrorregionais e Estaduais deverão trabalhar de forma integrada e assessorar as gerências de hanseníase, de acordo com a sua capacidade organizacional e em consonância com as normas técnicas nacionais. (Origem: PRT MS/GM 814/2000, Art. 4º)
Seção III
Dos Mecanismos para a Organização e a Implantação de Redes Estaduais/Municipais de Atenção à Hanseníase
Art. 179. Ficam estabelecidos os mecanismos para a organização e a implantação de Redes Estaduais/Municipais de Atenção à Hanseníase. (Origem: PRT MS/GM 587/2004, Art. 1º)
Art. 180. As Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios, de acordo com as respectivas condições de gestão e divisão de responsabilidades, adotarão as providências necessárias à organização e implantação das Redes Estaduais de Atenção à Hanseníase, que serão integradas por Serviços de Atenção à Hanseníase, a seguir discriminados: (Origem: PRT MS/GM 587/2004, Art. 2º)
I - Ações de Saúde na Atenção Básica; (Origem: PRT MS/GM 587/2004, Art. 2º, a)
II - Serviços de Atenção a Hanseníase na Média Complexidade; e (Origem: PRT MS/GM 587/2004, Art. 2º, b)
III - Serviços de Atenção a Hanseníase na alta Complexidade; (Origem: PRT MS/GM 587/2004, Art. 2º, c)
§ 1º As Ações de Saúde na Atenção Básica compreendem ações de caráter individual e coletivo de promoção e prevenção de incapacidade, resultantes da Hanseníase que possam ser realizadas neste nível de atenção, assim como ações informativas e educativas junto a comunidade de orientação familiar e encaminhamentos quando necessário para o Serviço de Atenção à Hanseníase na Média Complexidade. (Origem: PRT MS/GM 587/2004, Art. 2º, § 1º)
§ 2º Os Serviços de Atenção à Hanseníase na Média Complexidade compreendem ações de atenção diagnóstica e terapêutica especializadas, garantidas a partir do processo de referência e contrareferência do paciente afetado pela Hanseníase e que devem ser organizadas de acordo com o Plano Diretor de Regionalização (PDR) de cada Unidade Federada. (Origem: PRT MS/GM 587/2004, Art. 2º, § 2º)
§ 3º Os Serviços de Atenção à Hanseníase na Alta Complexidade caracterizam-se como serviços de maior nível de atenção e tem como finalidade prestar assistência multiprofissional e multidisciplinar especializada para o atendimento às pessoas portadoras de Hanseníase, incluindo as cirurgias reparadoras das sequelas de Hanseníase. (Origem: PRT MS/GM 587/2004, Art. 2º, § 3º)
Art. 181. A Secretaria de Atenção a Saúde, em conjunto com a Secretaria de Vigilância em Saúde, adotará as medidas necessárias à implementação do disposto nesta Seção. (Origem: PRT MS/GM 587/2004, Art. 3º)
CAPÍTULO II
DA REDUÇÃO DA MORBIMORTALIDADE POR ACIDENTES E VIOLÊNCIA
Seção I
Do Projeto de Vida no Trânsito
Art. 182. O Projeto Vida no Trânsito tem como objetivo subsidiar gestores no fortalecimento de políticas de prevenção de lesões e mortes no trânsito por meio do planejamento, monitoramento, acompanhamento e avaliação das ações. (Origem: PRT MS/GM 183/2014, Art. 35) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 183. Para a execução das ações do Projeto Vida no Trânsito, o ente federativo habilitado ao recebimento do incentivo financeiro assumirá as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 36) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - instituir Comitê Intersetorial Estadual, do Distrito Federal ou Municipal, de execução e acompanhamento do Projeto Vida no Trânsito ou tema similar; (Origem: PRT MS/GM 183/2014, Art. 36, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - instituir Comissão ou Subcomissão de Coleta de Dados, Análise e Gestão da Informação; (Origem: PRT MS/GM 183/2014, Art. 36, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
III - enviar anualmente à SVS/MS relatório com informações qualificadas sobre as lesões e mortes causadas no trânsito, utilizando banco de dados da segurança pública, trânsito e saúde sobre acidentes e vítimas; e (Origem: PRT MS/GM 183/2014, Art. 36, III) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
IV - promover o desenvolvimento de ações de intervenção baseadas nas evidências obtidas após análise de dados e informações, por meio de planejamento integrado e intersetorial, com projetos de intervenção focados a partir dos fatores de risco prioritários de ocorrência dos acidentes de trânsito, nos grupos de vítimas e nos pontos críticos de ocorrência de acidentes nos Municípios. (Origem: PRT MS/GM 183/2014, Art. 36, IV) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 184. O ente federativo será desabilitado do Projeto Vida no Trânsito nas seguintes hipóteses: (Origem: PRT MS/GM 183/2014, Art. 38) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - ausência de institucionalização do Comitê Intersetorial de execução e acompanhamento do Projeto Vida no Trânsito; ou (Origem: PRT MS/GM 183/2014, Art. 38, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - não envio do relatório anual da Comissão ou Subcomissão de Coleta de Dados, Análise e Gestão da Informação à SVS/MS. (Origem: PRT MS/GM 183/2014, Art. 38, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 185. A avaliação das ações do Projeto Vida no Trânsito será efetuada anualmente pela SVS/MS, a partir do ano subsequente ao da habilitação, por intermédio do relatório anual referido no art. 183, III. (Origem: PRT MS/GM 183/2014, Art. 39) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Seção II
Do Projeto de Redução de Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde, no âmbito do Sistema Único de Saúde
Art. 186. Fica aprovado, na forma dos Anexos XV, XVI e XVII , o "Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde", no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 344/2002, Art. 1º)
Parágrafo Único. O referido Projeto tem como objetivo reduzir a morbimortalidade por acidentes de trânsito no País, mediante o desenvolvimento de um conjunto de ações sistematizadas de prevenção de acidentes de trânsito. (Origem: PRT MS/GM 344/2002, Art. 1º, Parágrafo Único)
Art. 187. O Projeto Nacional ora aprovado será desenvolvido em parceria com os gestores dos três níveis de direção do SUS e com os órgãos e entidades de trânsito nacionais, estaduais e municipais. (Origem: PRT MS/GM 344/2002, Art. 2º)
Art. 188. Fica criada a Comissão Técnica de Acompanhamento, coordenada pela Secretaria de Políticas de Saúde, encarregada de assessorar, planejar, avaliar e supervisionar as ações levadas a efeito no âmbito dos estados e municípios. (Origem: PRT MS/GM 344/2002, Art. 3º)
CAPÍTULO III
DA PREVENÇÃO E CONTROLE DO CÂNCER
Seção I
Do Registro de Câncer de Base Populacional (RCBP)
Art. 189. O RCBP constitui-se de ferramenta de vigilância e monitoramento de neoplasias destinado a estimar incidências, taxas de mortalidade e de sobrevida, por meio da coleta, análise, interpretação e divulgação sistemática em uma população e períodos de tempo específicos. (Origem: PRT MS/GM 183/2014, Art. 20)
§ 1º O RCBP coletará informações de pessoas residentes nos Municípios onde estão localizados, as quais constituirão subsídio para o planejamento, a implementação de programas e de ações de prevenção e de atenção à população doente. (Origem: PRT MS/GM 183/2014, Art. 20, § 1º)
§ 2º O Ministério da Saúde disponibilizará no endereço eletrônico http://bvsms.saude. gov.br/bvs/ publicacoes/inca/manual_registros_cancer_base_populacional_2ed.pdf o Manual de Rotinas e Procedimentos para RCBP. (Origem: PRT MS/GM 183/2014, Art. 20, § 2º)
Art. 190. Para a execução de ações de RCBP, o estabelecimento assumirá as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 22)
I - encaminhamento anual ao Instituto Nacional de Câncer (INCA) e à SVS/MS da base de dados atualizada, consolidada e em meio digital, com defasagem máxima de 2 (dois) anos calendário, para avaliação de consistência e divulgação das informações; (Origem: PRT MS/GM 183/2014, Art. 22, I)
II - utilização, preferencialmente, do Sistema Informatizado para RCBP, desenvolvido pelo INCA para registros dos dados coletados; e (Origem: PRT MS/GM 183/2014, Art. 22, II)
III - fornecimento anual da base de dados, de informações e análise sobre perfil da incidência de câncer na localidade para as respectivas Secretarias Estaduais e Municipais de Saúde. (Origem: PRT MS/GM 183/2014, Art. 22, III)
Art. 191. O ente federativo será desabilitado das ações de RCBP nas seguintes hipóteses: (Origem: PRT MS/GM 183/2014, Art. 24)
I - deixar de encaminhar anualmente, até o mês de junho, a base de dados consolidada e atualizada em meio digital, de pelo menos um novo ano calendário para avaliação de consistência e divulgação das informações ao INCA, à SVS/MS e às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios; (Origem: PRT MS/GM 183/2014, Art. 24, I)
II - manter base de dados não atualizadas, com defasagem superior a 2 (dois) anos calendários; ou (Origem: PRT MS/GM 183/2014, Art. 24, II)
III - deixar de comprovar a formalização do contrato do serviço de RCBP, quando este for gerenciado por instituição pública ou filantrópica não vinculada às Secretarias de Saúde. (Origem: PRT MS/GM 183/2014, Art. 24, III)
Art. 192. A avaliação do RCBP será efetuada anualmente pela SVS/MS, a partir do ano seguinte ao da habilitação, por intermédio da base de dados a ela encaminhada. (Origem: PRT MS/GM 183/2014, Art. 25)
Seção II
Do Controle de Câncer de Mama
Subseção I
Do Programa de Mamografia Móvel
Art. 193. Fica instituído o Programa de Mamografia Móvel no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2304/2012, Art. 1º)
Art. 194. Para fins do disposto nesta Subseção, considera-se Mamografia Móvel o exame mamográfico realizado por unidade móvel de saúde com o objetivo de identificar e rastrear alterações relacionadas ao câncer de mama em todo território nacional. (Origem: PRT MS/GM 2304/2012, Art. 2º)
Art. 195. O Programa de Mamografia Móvel tem os seguintes objetivos: (Origem: PRT MS/GM 2304/2012, Art. 3º)
I - articular ações que visem ao aumento da cobertura mamográfica em todo território nacional, prioritariamente em favor das mulheres na faixa etária elegível, entre cinquenta e sessenta e nove anos de idade, para o rastreamento do câncer de mama; (Origem: PRT MS/GM 2304/2012, Art. 3º, I)
II - desenvolver ações coordenadas que visem à garantia do fornecimento regular do exame mamográfico às mulheres na faixa etária elegível para o rastreamento do câncer de mama, bienalmente; (Origem: PRT MS/GM 2304/2012, Art. 3º, II)
III - fortalecer ações de prevenção secundária para o câncer de mama, com favorecimento para o seu diagnóstico precoce e o encaminhamento em tempo adequado para a confirmação diagnóstica e o tratamento especializado; e (Origem: PRT MS/GM 2304/2012, Art. 3º, III)
IV - prestar ações de fortalecimento do desenvolvimento regional da rede de atendimento à população nos três níveis de atenção à saúde. (Origem: PRT MS/GM 2304/2012, Art. 3º, IV)
Art. 196. O Programa de Mamografia Móvel contemplará: (Origem: PRT MS/GM 2304/2012, Art. 4º)
I - prioritariamente, as mulheres na faixa etária elegível, entre cinquenta e sessenta e nove anos de idade, para o rastreamento do câncer de mama, conforme dados disponibilizados no Censo 2010 do Instituto Brasileiro de Geografia e Estatística (IBGE); e (Origem: PRT MS/GM 2304/2012, Art. 4º, I)
II - os entes federativos que se encontrarem com os menores percentuais de realização de exames de mamografia, segundo o Índice de Desempenho do SUS (IDSUS). (Origem: PRT MS/GM 2304/2012, Art. 4º, II)
Art. 197. O Programa de Mamografia Móvel será executado: (Origem: PRT MS/GM 2304/2012, Art. 5º)
I - por meio de parceria entre a União, por meio do Ministério da Saúde, os Estados, o Distrito Federal e os Municípios; e (Origem: PRT MS/GM 2304/2012, Art. 5º, I)
II - pela prestação de serviços de diagnóstico por imagem por estabelecimentos públicos ou privados de saúde, contratados ou conveniados, por meio de unidades móveis de saúde, interessados em realizar exames de mamografia. (Origem: PRT MS/GM 2304/2012, Art. 5º, II)
Art. 198. Para participação no Programa Mamografia Móvel, os entes federativos interessados devem cumprir os seguintes requisitos: (Origem: PRT MS/GM 2304/2012, Art. 6º)
I - cumprir com os objetivos do Programa de Mamografia Móvel de que trata o art. 195; (Origem: PRT MS/GM 2304/2012, Art. 6º, I)
II - identificar e convocar as mulheres elegíveis para o Programa; (Origem: PRT MS/GM 2304/2012, Art. 6º, II)
III - realizar agendamento regulado e organizado das mulheres elegíveis para o Programa; e (Origem: PRT MS/GM 2304/2012, Art. 6º, III)
IV - prover o atendimento nos serviços da atenção especializada de média e alta complexidade, para os casos que necessitarem de intervenções e cuidado por alterações no exame mamográfico. (Origem: PRT MS/GM 2304/2012, Art. 6º, IV)
Art. 199. Para fins de habilitação no Programa de Mamografia Móvel, os entes federativos interessados deverão encaminhar à Coordenação-Geral de Média e Alta Complexidade (CGMAC/DAET/SAS/MS) a seguinte documentação: (Origem: PRT MS/GM 2304/2012, Art. 7º)
I - estimativa do público-alvo total a ser coberto pelos serviços contratados, considerando-se a faixa etária prioritária definida no art. 196, I; (Origem: PRT MS/GM 2304/2012, Art. 7º, I)
II - relação dos estabelecimentos de saúde e respectivas unidades móveis que foram contratualizados para a realização de exames de mamografia no âmbito do Programa de Mamografia Móvel; (Origem: PRT MS/GM 2304/2012, Art. 7º, II)
III - proposta para a execução dos serviços, com os seguintes requisitos mínimos: (Origem: PRT MS/GM 2304/2012, Art. 7º, III)
a) área territorial de abrangência dos serviços previstos, conforme a capacidade de cada unidade móvel de saúde a ser autorizada; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, a)
b) fluxos micro e macrorregionais de encaminhamento; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, b)
c) indicação de estratégias que garantam o acesso da população triada residente em locais de difícil acesso; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, c)
d) metas físicas e financeiras a serem alcançadas, conforme a estimativa de público-alvo e a capacidade instalada de cada unidade móvel de saúde a ser autorizada; e (Origem: PRT MS/GM 2304/2012, Art. 7º, III, d)
e) declaração do gestor de saúde de que assume a responsabilidade, de acordo com a conformação da Região de Saúde, de: (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e)
1. encaminhamento das mulheres com alterações mamárias para serviços de confirmação diagnóstica e tratamento, quando indicados; (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e, 1)
2. encaminhamento das mulheres com confirmação diagnóstica de câncer de mama para tratamento nas unidades de tratamento especializado; e (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e, 2)
3. definição da unidade de atendimento especializado para a qual serão encaminhadas as mulheres identificadas com confirmação diagnóstica de câncer de mama; e (Origem: PRT MS/GM 2304/2012, Art. 7º, III, e, 3)
IV - expediente que comprove o envio à Comissão Intergestores Regional (CIR), à Comissão Intergestores Bipartite (CIB) ou, quando for o caso, ao Colegiado de Gestão da Secretaria de Saúde do Distrito Federal (CGSES/DF) sobre a participação no Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 7º, IV)
Parágrafo Único. A habilitação no Programa de Mamografia Móvel terá validade por 24 (vinte quatro) meses. (Origem: PRT MS/GM 2304/2012, Art. 7º, Parágrafo Único)
Art. 200. Para participação no Programa Mamografia Móvel, os estabelecimentos de saúde e respectivas unidades móveis devem cumprir os seguintes requisitos: (Origem: PRT MS/GM 2304/2012, Art. 8º)
I - dispor de alvará da vigilância sanitária local para a unidade móvel de saúde que realizará os exames de mamografia no território de atuação; (Origem: PRT MS/GM 2304/2012, Art. 8º, I)
II - ter registro no Sistema Cadastro Nacional de Estabelecimentos de Saúde (SCNES) para cada unidade móvel de saúde no seu respectivo território de atuação; (Origem: PRT MS/GM 2304/2012, Art. 8º, II)
III - dispor de áreas e instalações necessárias, suficientes e adequadas para a recepção dos pacientes e realização do exame de mamografia, com observância dos instrumentos normativos do Ministério da Saúde, especialmente a Portaria nº 453/SVS/MS, de 2 de junho de 1998; (Origem: PRT MS/GM 2304/2012, Art. 8º, III)
IV - dispor da presença de profissional médico radiologista, legalmente habilitado, no caso da emissão dos laudos na unidade móvel que realiza o exame, com respectivo registro ou inscrição no Conselho Regional de Medicina e cadastrado no respectivo estabelecimento de saúde móvel; (Origem: PRT MS/GM 2304/2012, Art. 8º, IV)
V - no caso de não possuir profissional médico radiologista na unidade móvel de saúde para emissão do laudo radiológico, garantir o respectivo laudo médico através de outra unidade de saúde disponível; (Origem: PRT MS/GM 2304/2012, Art. 8º, V)
VI - no caso de emissão de laudos por telerradiologia, dispor de: (Origem: PRT MS/GM 2304/2012, Art. 8º, VI)
a) profissional médico radiologista ou empresa especializada com central de laudos com capacidade instalada comprovada para emissão de laudos, observando-se os termos da Resolução nº 1.890, de 15 de janeiro de 2009, do Conselho Federal de Medicina (CFM); (Origem: PRT MS/GM 2304/2012, Art. 8º, VI, a)
b) canal de comunicação com capacidade de transmissão da informação necessária para o laudo radiológico; e (Origem: PRT MS/GM 2304/2012, Art. 8º, VI, b)
c) dispor de capacidade para envio dos laudos e imagens dos exames por meio digital ao órgão designado pelo gestor local de saúde; (Origem: PRT MS/GM 2304/2012, Art. 8º, VI, c)
VII - dispor de capacidade para envio de relatório sintético do atendimento realizado mensalmente ao(s) gestor(es) municipal(ais) do seu território de atuação; (Origem: PRT MS/GM 2304/2012, Art. 8º, VII)
VIII - dispor de equipe técnica para prévia vistoria dos locais por onde percorrerá a unidade móvel de saúde a fim de verificar condições de adequabilidade e logística necessárias; (Origem: PRT MS/GM 2304/2012, Art. 8º, VIII)
IX - garantir a integridade física dos pacientes e dos funcionários durante o procedimento, protegendo-os de situações de risco; (Origem: PRT MS/GM 2304/2012, Art. 8º, IX)
X - garantir igualdade de tratamento, sem quaisquer discriminações; (Origem: PRT MS/GM 2304/2012, Art. 8º, X)
XI - prestar atendimento de qualidade, observando-se as questões de sigilo profissional; (Origem: PRT MS/GM 2304/2012, Art. 8º, XI)
XII - utilizar os recursos tecnológicos e equipamentos necessários de acordo com a legislação e normas vigentes; e (Origem: PRT MS/GM 2304/2012, Art. 8º, XII)
XIII - observar os protocolos clínicos recomendados pelo Programa Nacional de Qualidade em Mamografia (PNQM) para a correta prestação dos serviços. (Origem: PRT MS/GM 2304/2012, Art. 8º, XIII)
§ 1º A participação de que trata este artigo não gera vínculo dos estabelecimentos de saúde, inclusive de seus funcionários ou prestadores de serviço, com o Ministério da Saúde ou direito à contratação pelos entes federativos que participarem do Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 8º, § 1º)
§ 2º A Secretaria de Atenção à Saúde (SAS/MS) publicará edital de cadastramento dos estabelecimentos de saúde interessados em participar do Programa Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 8º, § 2º)
Art. 201. Os entes federativos habilitados no Programa de Mamografia Móvel deverão: (Origem: PRT MS/GM 2304/2012, Art. 9º)
I - credenciar e cadastrar cada unidade móvel como estabelecimento de saúde; (Origem: PRT MS/GM 2304/2012, Art. 9º, I)
II - contratualizar e/ou monitorar em todas as suas etapas o projeto sob sua responsabilidade; e (Origem: PRT MS/GM 2304/2012, Art. 9º, II)
III - avaliar o alcance das metas definidas no âmbito do Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 9º, III)
Art. 202. Os procedimentos executados no âmbito do Programa de Mamografia Móvel serão informados pelos entes federativos participantes, conforme estabelecido em Portaria da SAS/MS. (Origem: PRT MS/GM 2304/2012, Art. 10)
Art. 203. Compete à Coordenação-Geral dos Sistemas de Informação (CGSI/DRAC/SAS/MS) providenciar junto ao Departamento de Informática do SUS (DATASUS) as adequações necessárias no Sistema de Informação Ambulatorial (SIA/SUS), ou em outro que vier a substituí-lo, para cumprimento do disposto nesta Subseção. (Origem: PRT MS/GM 2304/2012, Art. 12)
Art. 204. Caberá aos órgãos de controle interno, especialmente à área finalística, sem prejuízo das atribuições dos órgãos de controle externo previstas na legislação vigente, o monitoramento da correta aplicação dos recursos financeiros envolvidos no Programa de Mamografia Móvel. (Origem: PRT MS/GM 2304/2012, Art. 14)
Art. 205. A SAS/MS adotará as medidas necessárias para o cumprimento do disposto nesta Subseção. (Origem: PRT MS/GM 2304/2012, Art. 15)
Subseção II
Do Programa Nacional de Qualidade em Mamografia (PNQM)
Art. 206. Fica instituído o Programa Nacional de Qualidade em Mamografia (PNQM). (Origem: PRT MS/GM 2898/2013, Art. 1º)
Art. 207. O PNQM tem por objetivo avaliar o desempenho da prestação dos serviços de diagnóstico por imagem que realizam mamografia, com base em critérios e parâmetros referentes à qualidade da estrutura, do processo, dos resultados, da imagem clínica e do laudo. (Origem: PRT MS/GM 2898/2013, Art. 2º)
Art. 208. O PNQM tem abrangência nacional e se aplica a todos os estabelecimentos de saúde públicos e privados que realizam mamografia e que sejam vinculados ou não ao Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2898/2013, Art. 3º)
Art. 209. O PNQM será executado pelo Sistema Nacional de Vigilância Sanitária (SNVS), pela Secretaria de Atenção à Saúde (SAS/MS), pelo Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS/MS) e por todos os serviços de diagnósticos por imagem que realizam mamografia. (Origem: PRT MS/GM 2898/2013, Art. 4º)
Art. 210. Compete à SAS/MS: (Origem: PRT MS/GM 2898/2013, Art. 5º)
I - avaliar e monitorar a implantação e operacionalização do PNQM em todo o território nacional; (Origem: PRT MS/GM 2898/2013, Art. 5º, I)
II - analisar os resultados das avaliações do PNQM; (Origem: PRT MS/GM 2898/2013, Art. 5º, II)
III - divulgar os resultados do PNQM, anualmente, por meio do relatório final, no endereço eletrônico www.saude.gov.br/sas; e (Origem: PRT MS/GM 2898/2013, Art. 5º, III)
IV - monitorar, analisar e disponibilizar as informações referentes aos resultados dos exames mamográficos inseridos no Sistema de Informação do Câncer (SISCAN) pelos serviços de mamografia e dos indicadores de qualidade de que trata o Anexo XXIX . (Origem: PRT MS/GM 2898/2013, Art. 5º, IV)
Art. 211. Compete ao INCA/SAS/MS: (Origem: PRT MS/GM 2898/2013, Art. 6º)
I - coordenar e realizar a avaliação da qualidade das imagens clínicas das mamas e do laudo das mamografias de uma amostra encaminhada trienalmente pelos serviços aprovados pela Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2898/2013, Art. 6º, I)
II - solicitar aos serviços aprovados pela ANVISA o envio da amostra referida no inciso I, quando estes serviços ainda não tiverem enviado imagens clínicas das mamas e laudos para o INCA/SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 6º, II)
III - consolidar, monitorar e disponibilizar as informações referentes à avaliação das análises das imagens e laudos mamográficos; e (Origem: PRT MS/GM 2898/2013, Art. 6º, III)
IV - manter atualizados os dados de qualidade das imagens clínicas e dos laudos das mamografias, por meio do Sistema de Informação da Qualidade da Imagem e Interpretação Diagnóstica (QIID), disponibilizado no endereço eletrônico https://qiid.inca.gov.br, ou em outro sistema de informação definido pelo Ministério da Saúde. (Origem: PRT MS/GM 2898/2013, Art. 6º, IV)
§ 1º A amostra de que trata o inciso I deverá conter 5 (cinco) exames completos (imagem radiográfica e laudo) realizados em sistema digital ou 5 (cinco) incidências para os sistemas convencionais, sendo 2 (duas) incidências em crânio-caudal e 3 (três) incidências em médio-lateral oblíqua. (Origem: PRT MS/GM 2898/2013, Art. 6º, § 1º)
§ 2º É facultado ao INCA/SAS/MS receber o apoio de entidades profissionais e de especialistas que possuam comprovada qualificação técnica a respeito da matéria para realização da avaliação de que trata o inciso I. (Origem: PRT MS/GM 2898/2013, Art. 6º, § 2º)
§ 3º Os Requisitos de Qualidade dos Exames e dos Laudos em Mamografia, que deverão ser utilizados para a avaliação da qualidade da imagem clínica das mamas e dos laudos de mamografia, estão dispostos no Anexo XXVIII . (Origem: PRT MS/GM 2898/2013, Art. 6º, § 3º)
Art. 212. Compete à ANVISA: (Origem: PRT MS/GM 2898/2013, Art. 7º)
I - coordenar a avaliação dos Programas de Garantia da Qualidade (PGQ) dos serviços de diagnóstico por imagem que realizam mamografia; (Origem: PRT MS/GM 2898/2013, Art. 7º, I)
II - consolidar, monitorar e disponibilizar, anualmente, as informações referentes às avaliações dos PGQ realizadas pelo SNVS; (Origem: PRT MS/GM 2898/2013, Art. 7º, II)
III - manter atualizados os dados das análises dos PGQ, por meio do sistema de informação disponibilizado no endereço eletrônico www.mamografia.unifei.edu.br, ou em outro sistema de informação definido pela ANVISA; e (Origem: PRT MS/GM 2898/2013, Art. 7º, III)
IV - credenciar os Centros de Referência de que trata o art. 217. (Origem: PRT MS/GM 2898/2013, Art. 7º, IV)
Art. 213. Compete à Agência Nacional de Saúde Suplementar (ANS) dispor acerca da obrigatoriedade das operadoras de planos de saúde de somente contratar ou manter contratados serviços de diagnóstico por imagem que realizam mamografia que cumpram integralmente o PNQM. (Origem: PRT MS/GM 2898/2013, Art. 8º)
Art. 214. Compete aos gestores estaduais, distrital e municipais: (Origem: PRT MS/GM 2898/2013, Art. 9º)
I - apoiar a organização e a execução do PNQM no seu âmbito de atuação; (Origem: PRT MS/GM 2898/2013, Art. 9º, I)
II - monitorar a implementação do PNQM nos prestadores de serviço de diagnóstico por imagem que realizam mamografia; (Origem: PRT MS/GM 2898/2013, Art. 9º, II)
III - estimular e priorizar as visitas anuais das vigilâncias sanitárias estaduais, distrital e municipais nos serviços de diagnóstico por imagem que realizam mamografia visando o cumprimento do PGQ; e (Origem: PRT MS/GM 2898/2013, Art. 9º, III)
IV - monitorar os indicadores de que trata Anexo XXIX . (Origem: PRT MS/GM 2898/2013, Art. 9º, IV)
Parágrafo Único. Para fins do disposto no inciso III, as vigilâncias sanitárias estaduais, distrital e municipais poderão, eventualmente, contar com o apoio técnico dos Centros de Referência de que trata o art. 217. (Origem: PRT MS/GM 2898/2013, Art. 9º, Parágrafo Único)
Art. 215. Compete às vigilâncias sanitárias estaduais, distrital e municipais: (Origem: PRT MS/GM 2898/2013, Art. 10)
I - preencher os formulários constantes dos Anexos XXVI e XXVII ; e (Origem: PRT MS/GM 2898/2013, Art. 10, I)
II - avaliar os relatórios do PGQ, sendo-lhes facultado o apoio técnico pelos Centros de Referência de que trata o art. 217. (Origem: PRT MS/GM 2898/2013, Art. 10, II)
Parágrafo Único. O preenchimento de que trata o inciso I será realizado "in loco" e, pelo menos, uma vez ao ano. (Origem: PRT MS/GM 2898/2013, Art. 10, Parágrafo Único)
Art. 216. Compete aos serviços de diagnóstico por imagem que realizam mamografia, públicos e privados, participantes ou não do SUS: (Origem: PRT MS/GM 2898/2013, Art. 11)
I - participar do PNQM; (Origem: PRT MS/GM 2898/2013, Art. 11, I)
II - inserir no SISCAN ou no sistema de informação vigente definido pelo Ministério da Saúde as informações sobre os exames mamográficos realizados; (Origem: PRT MS/GM 2898/2013, Art. 11, II)
III - enviar anualmente ao órgão de vigilância sanitária competente o relatório do PGQ definido na legislação sanitária vigente, contemplando todos os testes de aceitação, constância e desempenho realizados no período; e (Origem: PRT MS/GM 2898/2013, Art. 11, III)
IV - enviar trienalmente para o INCA/SAS/MS uma amostra de exames para a análise de que trata o art. 211, I. (Origem: PRT MS/GM 2898/2013, Art. 11, IV)
Parágrafo Único. Os serviços de diagnóstico por imagem que realizam mamografia que não sejam participantes do SUS disporão de procedimento simplificado no SISCAN ou no sistema de informação vigente para a inserção das informações sobre os exames mamográficos realizados mensalmente. (Origem: PRT MS/GM 2898/2013, Art. 11, Parágrafo Único)
Art. 217. Poderão ser credenciadas como Centros de Referência as entidades que atendam aos seguintes critérios: (Origem: PRT MS/GM 2898/2013, Art. 12)
I - ser instituição pública de ensino e pesquisa ou entidade profissional ou de especialistas; (Origem: PRT MS/GM 2898/2013, Art. 12, I)
II - ter comprovada qualificação técnica reconhecida; e (Origem: PRT MS/GM 2898/2013, Art. 12, II)
III - ser indicado para habilitação pelo gestor estadual e pactuação na Comissão Intergestores Bipartite (CIB). (Origem: PRT MS/GM 2898/2013, Art. 12, III)
Art. 218. O PNQM contará com um Comitê de Avaliação constituído por 5 (cinco) membros, sendo: (Origem: PRT MS/GM 2898/2013, Art. 13)
I - 1 (um) da SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 13, I)
II - 1 (um) do INCA/SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 13, II)
III - 1 (um) da ANVISA; (Origem: PRT MS/GM 2898/2013, Art. 13, III)
IV - 1 (um) da ANS; e (Origem: PRT MS/GM 2898/2013, Art. 13, IV)
V - 1 (um) do Comitê de Especialistas para o fortalecimento das ações de prevenção e qualificação do diagnóstico e tratamento dos cânceres do colo do útero e de mama, instituído pela Portaria nº 1.472/GM/MS, de 24 de junho de 2011, cuja indicação deve ser feita consensualmente pelo Comitê de Especialistas. (Origem: PRT MS/GM 2898/2013, Art. 13, V)
§ 1º O Comitê de Avaliação do PNQM será coordenado pela SAS/MS, que fornecerá o apoio técnico-administrativo necessário ao funcionamento do Comitê. (Origem: PRT MS/GM 2898/2013, Art. 13, § 1º)
§ 2º Os membros do Comitê de Avaliação do PNQM serão indicados pelos respectivos órgãos ou entidades à SAS/MS e serão designados por meio de ato do Secretário da SAS/MS. (Origem: PRT MS/GM 2898/2013, Art. 13, § 2º)
§ 3º Para cada membro titular será indicado um membro suplente. (Origem: PRT MS/GM 2898/2013, Art. 13, § 3º)
§ 4º Compete ao Comitê de Avaliação do PNQM sugerir melhorias no processo de implantação e operacionalização do PNQM. (Origem: PRT MS/GM 2898/2013, Art. 13, § 4º)
§ 5º A regulamentação do funcionamento do Comitê de Avaliação se dará por meio da publicação de Regimento Interno. (Origem: PRT MS/GM 2898/2013, Art. 13, § 5º)
Art. 219. Para a realização da avaliação da qualidade dos serviços de diagnóstico por imagem que realizam mamografia será observado o seguinte fluxo: (Origem: PRT MS/GM 2898/2013, Art. 14)
I - as vigilâncias sanitárias estaduais, distrital ou municipais ou Centros de Referência preencherão os formulários de avaliação do PGQ, disponíveis nos Anexos XXVI e XXVII , e os enviarão para a ANVISA; (Origem: PRT MS/GM 2898/2013, Art. 14, I)
II - a ANVISA elaborará o relatório com a consolidação dos dados captados por meio dos formulários, indicando os serviços cujas imagens e laudos serão avaliados e enviará, mensalmente, à SAS/MS e ao INCA/SAS/MS; (Origem: PRT MS/GM 2898/2013, Art. 14, II)
III - o INCA/SAS/MS coordenará e realizará a avaliação das imagens clínicas e dos laudos dos serviços aprovados pela ANVISA; (Origem: PRT MS/GM 2898/2013, Art. 14, III)
IV - o INCA/SAS/MS enviará, mensalmente, à SAS/MS, relatório consolidado da avaliação das imagens clínicas e dos laudos; (Origem: PRT MS/GM 2898/2013, Art. 14, IV)
V - a SAS/MS analisará os resultados da avaliação do PGQ e da qualidade das imagens clínicas e laudos e elaborará o relatório final referente à avaliação dos serviços; (Origem: PRT MS/GM 2898/2013, Art. 14, V)
VI - a SAS/MS encaminhará o relatório final para a ANVISA e para o INCA/SAS/MS para ciência; e (Origem: PRT MS/GM 2898/2013, Art. 14, VI)
VII - a SAS/MS disponibilizará, anualmente, o relatório final no endereço eletrônicos www.saude.gov.br/sas. (Origem: PRT MS/GM 2898/2013, Art. 14, VII)
Art. 220. Os serviços de diagnóstico por imagem que realizam mamografia serão avaliados continuamente, e o resultado da avaliação será disponibilizado anualmente no endereço eletrônico www.saude.gov.br/sas. (Origem: PRT MS/GM 2898/2013, Art. 15)
Art. 221. Representantes das vigilâncias sanitárias estaduais, distrital e municipais, da ANVISA, do INCA/SAS/MS e da SAS/MS poderão realizar visitas "in loco" nos serviços de diagnóstico por imagem que realizam mamografia abrangidos pelo PNQM para: (Origem: PRT MS/GM 2898/2013, Art. 16)
I - realização de testes de desempenho do equipamento; e (Origem: PRT MS/GM 2898/2013, Art. 16, I)
II - orientação quanto à execução do PGQ dos serviços e dos procedimentos que garantam uma imagem clínica de qualidade. (Origem: PRT MS/GM 2898/2013, Art. 16, II)
Art. 222. A avaliação e o monitoramento do PNQM incluem a análise do processo de sua implantação em todo o território nacional e a análise dos resultados referentes à qualidade dos serviços de diagnóstico por imagem que realizam mamografia. (Origem: PRT MS/GM 2898/2013, Art. 17)
Parágrafo Único. O monitoramento dos resultados referentes à qualidade do exame mamográfico inclui a adoção dos indicadores de que trata o Anexo XXIX . (Origem: PRT MS/GM 2898/2013, Art. 17, Parágrafo Único)
Art. 223. A avaliação e o monitoramento do PNQM serão realizados pela SAS/MS, anualmente, a partir das informações fornecidas e pela ANVISA e pelo INCA/SAS/MS no exercício das atribuições de que trata esta Subseção, sendo que a validade da avaliação pela ANVISA é anual e a do INCA trienal. (Origem: PRT MS/GM 2898/2013, Art. 18)
Art. 224. O serviço de diagnóstico por imagem que realiza mamografia será considerado aprovado pelo PNQM se demonstrar o cumprimento dos critérios de aprovação relativos ao PGQ e à qualidade da imagem clínica e laudo, definidos nos Anexos XXVI e XXVII . (Origem: PRT MS/GM 2898/2013, Art. 19)
Seção III
Do Programa Nacional de Combate ao Câncer de Colo Uterino
Art. 225. Ficam aprovadas as Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero. (Origem: PRT MS/GM 2508/2011, Art. 1º)
Parágrafo Único. As Diretrizes de que trata o caput deste artigo estão consubstanciadas na obra "Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero", do Instituto Nacional de Câncer, ano 2011, ISBN 978-85-7318-184-5. (Origem: PRT MS/GM 2508/2011, Art. 1º, Parágrafo Único)
Art. 226. A obra de que trata esta Seção constitui-se o documento oficial adotado pelo Ministério da Saúde para o rastreamento do câncer do colo do útero no território nacional. (Origem: PRT MS/GM 2508/2011, Art. 2º)
Art. 227. A obra "Diretrizes Brasileiras para o Rastreamento do Câncer do Colo do Útero" ficará disponível no portal do Ministério da Saúde, no endereço eletrônico http://bvsms.saude.gov.br/bvs/publicacoes/inca/rastreamento_cancer_colo_utero.pdf. (Origem: PRT MS/GM 2508/2011, Art. 3º)
Art. 228. Findo o prazo definido pelo art. 149 do Anexo IV da Portaria de Consolidação nº 3, o financiamento do procedimento 02.03.01.008-6 - EXAME CITOPATOLÓGICO CERVICO VAGINAL/MICROFLORA-RASTREAMENTO continuará a ser via Fundo de Ações Estratégicas e Compensação (FAEC). (Origem: PRT MS/GM 613/2017, Art. 3º)
CAPÍTULO IV
DO PROGRAMA DE CONTROLE DE PÊNFIGO FOLIÁCEO ENDÊMICO
Art. 229. Ficam expedidas as instruções normativas para diagnóstico, tratamento e controle do Pênfigo Foliáceo Endêmico (fogo selvagem), na forma do Anexo XXX . (Origem: PRT MS/GM 1400/1991, Art. 1º)
CAPÍTULO V
DAS AÇÕES E SERVIÇOS DE SAÚDE VOLTADOS PARA VIGILÂNCIA, PREVENÇÃO E CONTROLE DE ZOONOSES E DE ACIDENTES CAUSADOS POR ANIMAIS PEÇONHENTOS E VENENOSOS, DE RELEVÂNCIA PARA A SAÚDE PÚBLICA
Art. 230. Esta Seção define as ações e os serviços de saúde voltados para vigilância, prevenção e controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública. (Origem: PRT MS/GM 1138/2014, Art. 1º)
Art. 231. Para fins desta Seção, considera-se animais de relevância para a saúde pública todo aquele que se apresenta como: (Origem: PRT MS/GM 1138/2014, Art. 2º)
I - vetor, hospedeiro, reservatório, portador, amplificador ou suspeito para alguma zoonose de relevância para a saúde pública, quanto à transmissão de agente etiológico para humanos; (Origem: PRT MS/GM 1138/2014, Art. 2º, I)
II - suscetível para alguma zoonose de relevância para a saúde pública, quando em situações de risco quanto à transmissão de agente etiológico para humanos; (Origem: PRT MS/GM 1138/2014, Art. 2º, II)
III - venenoso ou peçonhento de relevância para a saúde pública; ou (Origem: PRT MS/GM 1138/2014, Art. 2º, III)
IV - causador de agravo que represente risco de transmissão de doença para a população humana. (Origem: PRT MS/GM 1138/2014, Art. 2º, IV)
Art. 232. São consideradas ações e serviços públicos de saúde voltados para a vigilância, a prevenção e o controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública: (Origem: PRT MS/GM 1138/2014, Art. 3º)
I - desenvolvimento e execução de atividades, ações e estratégias relacionadas a animais de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, I)
II - desenvolvimento e execução de ações, atividades e estratégias de educação em saúde visando à guarda ou à posse responsável de animais para a prevenção das zoonoses; (Origem: PRT MS/GM 1138/2014, Art. 3º, II)
III - coordenação, execução e avaliação das ações de vacinação animal contra zoonoses de relevância para a saúde pública, normatizadas pelo Ministério da Saúde, bem como notificação e investigação de eventos adversos temporalmente associados a essas vacinações; (Origem: PRT MS/GM 1138/2014, Art. 3º, III)
IV - realização de diagnóstico laboratorial de zoonoses e identificação das espécies de animais, de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, IV)
V - recomendação e adoção de medidas de biossegurança que impeçam ou minimizem o risco de transmissão de zoonoses e da ocorrência de acidentes causados por animais peçonhentos e venenosos relacionados à execução das atividades de vigilância de zoonoses dispostas neste artigo; (Origem: PRT MS/GM 1138/2014, Art. 3º, V)
VI - desenvolvimento e execução de ações, atividades e estratégias de controle da população de animais, que devam ser executadas em situações excepcionais, em áreas determinadas, por tempo definido, para o controle da propagação de zoonoses de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, VI)
VII - coleta, recebimento, acondicionamento, conservação e transporte de espécimes ou amostras biológicas de animais para encaminhamento aos laboratórios, com vistas à identificação ou diagnóstico laboratorial de zoonoses de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, VII)
VIII - gerenciamento de resíduos de serviços de saúde gerados pelas ações de vigilância de zoonoses de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, VIII)
IX - eutanásia, quando indicado, de animais de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, IX)
X - recolhimento e transporte de animais, quando couber, de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, X)
XI - recepção de animais vivos e de cadáveres de animais quando forem de relevância para a saúde pública; (Origem: PRT MS/GM 1138/2014, Art. 3º, XI)
XII - manutenção e cuidados básicos de animais recolhidos em estabelecimento responsável por vigilância de zoonoses pertencente ao Sistema Único de Saúde (SUS), observando normatização vigente quanto aos prazos estipulados de permanência do animal, quando houver; (Origem: PRT MS/GM 1138/2014, Art. 3º, XII)
XIII - destinação adequada dos animais recolhidos; e (Origem: PRT MS/GM 1138/2014, Art. 3º, XIII)
XIV - investigação, por meio de necropsia, coleta e encaminhamento de amostras laboratoriais ou outros procedimentos pertinentes, de morte de animais suspeitos de zoonoses de relevância para saúde pública. (Origem: PRT MS/GM 1138/2014, Art. 3º, XIV)
Art. 233. Os estabelecimentos responsáveis por vigilância de zoonoses pertencentes ao SUS e os serviços voltados para a vigilância, a prevenção e o controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para saúde pública, deverão ser inscritos no Sistema de Cadastro Nacional de Estabelecimento de Saúde (SCNES), utilizando critérios de cadastramento que serão regulamentados em portaria específica do Secretário de Vigilância em Saúde do Ministério da Saúde. (Origem: PRT MS/GM 1138/2014, Art. 4º)
§ 1º Os estabelecimentos de que trata o "caput" têm por objetivos: (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
I - gerais: realizar ações, atividades e estratégias de vigilância, de prevenção, de controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública; e (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
II - específicos: realizar ações, atividades e estratégias de: (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
a) vigilância, de forma contínua e sistemática, de populações de animais potencialmente ou sabidamente de relevância para a saúde pública; (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
b) prevenção, de forma sistemática, de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para a saúde pública; e (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
c) controle, quando pertinente e necessário, de animais peçonhentos, venenosos, vetores, hospedeiros, reservatórios, amplificadores, portadores, suspeitos ou suscetíveis às zoonoses, quando estes forem de relevância para a saúde pública (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
§ 2º Os estabelecimentos responsáveis por vigilância de zoonoses pertencentes ao SUS deverão observar o Manual de Normas Técnicas para Estruturas Físicas de Unidades de Vigilância de Zoonoses, disponível no endereço eletrônico www.saude.gov.br/svs (Redação dada pela PRT GM/MS nº 2087 de 17.07.2018)
Art. 234. As ações e os serviços de saúde voltados para a vigilância, a prevenção e o controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para saúde pública, serão financiadas com os recursos do Piso Fixo de Vigilância em Saúde (PFVS), bem como com recursos próprios dos Estados, do Distrito Federal e dos Municípios, observando-se as disposições contidas na legislação vigente. (Origem: PRT MS/GM 1138/2014, Art. 5º)
Art. 235. As ações de vigilância, prevenção e controle de zoonoses e de acidentes causados por animais peçonhentos e venenosos, de relevância para saúde pública, deverão ser inseridas na Programação Anual de Saúde (PAS), observadas as diretrizes constantes nos Planos de Saúde. (Origem: PRT MS/GM 1138/2014, Art. 6º)
Art. 236. Os demonstrativos das ações e resultados alcançados comporão o Relatório Anual de Gestão (RAG), submetido ao respectivo Conselho de Saúde. (Origem: PRT MS/GM 1138/2014, Art. 7º)
Art. 237. A Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS) editará normatização técnica complementar esta Seção. (Origem: PRT MS/GM 1138/2014, Art. 8º)
Seção II
Das Atribuições do Agente Comunitário de Saúde (ACS)
Art. 238. Ficam definidas as atribuições do Agente Comunitário de Saúde (ACS) na prevenção e no controle da malária e da dengue. (Origem: PRT MS/GM 44/2002, Art. 1º)
Art. 239. São atribuições do ACS na prevenção e controle da malária: (Origem: PRT MS/GM 44/2002, Art. 2º)
I - em zona urbana: (Origem: PRT MS/GM 44/2002, Art. 2º, I)
a) realizar ações de educação em saúde e de mobilização social; (Origem: PRT MS/GM 44/2002, Art. 2º, I, a)
b) orientar o uso de medidas de proteção individual e coletiva; (Origem: PRT MS/GM 44/2002, Art. 2º, I, b)
c) mobilizar a comunidade para desenvolver medidas simples de manejo ambiental para o controle de vetores; (Origem: PRT MS/GM 44/2002, Art. 2º, I, c)
d) identificar sintomas da malária e encaminhar o paciente à unidade de saúde para diagnóstico e tratamento; (Origem: PRT MS/GM 44/2002, Art. 2º, I, d)
e) promover o acompanhamento dos pacientes em tratamento, ressaltando a importância de sua conclusão; (Origem: PRT MS/GM 44/2002, Art. 2º, I, e)
f) investigar a existência de casos na comunidade, a partir de sintomático; (Origem: PRT MS/GM 44/2002, Art. 2º, I, f)
g) preencher e encaminhar à Secretaria Municipal de Saúde a ficha de notificação dos casos ocorridos. (Origem: PRT MS/GM 44/2002, Art. 2º, I, g)
II - em área rural, além das atribuições relacionadas no item I deste artigo: (Origem: PRT MS/GM 44/2002, Art. 2º, II)
a) proceder à aplicação de imunotestes, conforme orientação da coordenação municipal do Pacs e PSF; (Origem: PRT MS/GM 44/2002, Art. 2º, II, a)
b) coletar lâminas de sintomáticos e enviá-las para leitura ao profissional responsável e, quando não for possível esta coleta de lâmina, encaminhar as pessoas para a unidade de referência; (Origem: PRT MS/GM 44/2002, Art. 2º, II, b)
c) receber o resultado dos exames e providenciar o acesso ao tratamento imediato e adequado, de acordo com as orientações da Secretaria Municipal de Saúde da Fundação Nacional de Saúde (FUNASA); (Origem: PRT MS/GM 44/2002, Art. 2º, II, c)
d) coletar lâmina para verificação de cura (LVC), após conclusão do tratamento, e encaminhá-la para leitura, de acordo com a estratégia local; (Origem: PRT MS/GM 44/2002, Art. 2º, II, d)
Art. 240. São atribuições do ACS na prevenção e no controle da dengue: (Origem: PRT MS/GM 44/2002, Art. 3º)
I - atuar junto aos domicílios informando os seus moradores sobre a doença - seus sintomas e riscos - e o agente transmissor; (Origem: PRT MS/GM 44/2002, Art. 3º, a)
II - informar o morador sobre a importância da verificação da existência de larvas ou mosquitos transmissores da dengue na casa ou redondezas; (Origem: PRT MS/GM 44/2002, Art. 3º, b)
III - vistoriar os cômodos da casa, acompanhado pelo morador, para identificar locais de existência de larvas ou mosquito transmissor da dengue; (Origem: PRT MS/GM 44/2002, Art. 3º, c)
IV - orientar a população sobre a forma de evitar e eliminar locais que possam oferecer risco para a formação de criadouros do Aedes aegypti; (Origem: PRT MS/GM 44/2002, Art. 3º, d)
V - promover reuniões com a comunidade para mobilizá-la para as ações de prevenção e controle da dengue; (Origem: PRT MS/GM 44/2002, Art. 3º, e)
VI - comunicar ao instrutor supervisor do Pacs/PSF a existência de criadouros de larvas e ou mosquitos transmissor da dengue, que dependam de tratamento químico, da interveniência da vigilância sanitária ou de outras intervenções do poder público; (Origem: PRT MS/GM 44/2002, Art. 3º, f)
VII - encaminhar os casos suspeitos de dengue à unidade de saúde mais próxima, de acordo com as orientações da Secretaria Municipal de Saúde; (Origem: PRT MS/GM 44/2002, Art. 3º, g)
CAPÍTULO VI
DO PLANO NACIONAL DE CONTENÇÃO DO POLIOVÍRUS
Seção I
Do Processo de Contenção Definitiva do Poliovírus Selvagem e Vacinal
Art. 241. Esta Seção dispõe sobre o preenchimento do Inquérito Nacional do poliovírus pelos laboratórios, públicos e privados, visando ao cumprimento do processo de contenção definitiva do poliovírus selvagem e vacinal. (Origem: PRT MS/GM 451/2017, Art. 1º)
Art. 242. Os laboratórios públicos e privados que atuam na área da saúde, educação, defesa, meio ambiente, agricultura, pesquisa e outras, bem como os laboratórios sediados em indústrias, deverão responder o Inquérito nacional do poliovírus contido no link: http://formsus.datasus.gov.br/site/formulario.php?id_aplicacao=23898. (Origem: PRT MS/GM 451/2017, Art. 2º)
Art. 243. Para os efeitos desta Portaria entende-se por: (Origem: PRT MS/GM 451/2017, Art. 3º)
I - materiais infectantes para poliovírus selvagem ou vacinal: materiais clínicos de casos confirmados de infecção por poliovírus selvagem e VDPV (Poliovirus Derivado da Vacina), amostras ambientais com água de esgoto ou in natura em que esses vírus estejam presentes, e produtos de replicação desses vírus, incluindo: (Origem: PRT MS/GM 451/2017, Art. 3º, I)
a) poliovírus isolados em cultivos celulares, cepas de referência, cepas para vacinas inativadas; (Origem: PRT MS/GM 451/2017, Art. 3º, I, a)
b) animais infectados com poliovírus ou materiais clínicos oriundos desses animais; (Origem: PRT MS/GM 451/2017, Art. 3º, I, b)
c) produtos de pesquisa em laboratório que possam conter as sequências do capsídeo do poliovírus selvagem; (Origem: PRT MS/GM 451/2017, Art. 3º, I, c)
d) estrutura total do RNA ou DNA que contêm sequências de capsídeos derivadas de poliovírus selvagem; e (Origem: PRT MS/GM 451/2017, Art. 3º, I, d)
e) células continuamente infectadas com cepas de poliovírus, cujas sequências do capsídeo derivam de poliovírus selvagem. (Origem: PRT MS/GM 451/2017, Art. 3º, I, e)
II - materiais potencialmente infectantes para poliovírus selvagem ou vacinal: (Origem: PRT MS/GM 451/2017, Art. 3º, II)
a) amostras de fezes ou secreções respiratórias coletadas para qualquer finalidade em uma área geográfica de circulação do poliovírus selvagem (incluindo VDPV) ou de uso da OPV (Vacina Oral da Polio); (Origem: PRT MS/GM 451/2017, Art. 3º, II, a)
b) produtos destes materiais em animais ou células permissivas para o poliovírus; (Origem: PRT MS/GM 451/2017, Art. 3º, II, b)
c) isolamentos de culturas de células semelhantes a enterovírus descaracterizados em países onde se sabe ou se suspeita da circulação do poliovírus selvagem ou VDPV no momento da coleta; (Origem: PRT MS/GM 451/2017, Art. 3º, II, c)
d) estoques de vírus entéricos e respiratórios manipulados em condições onde a replicação de poliovírus ou a contaminação é possível. (Origem: PRT MS/GM 451/2017, Art. 3º, II, d)
Art. 244. Caberá aos laboratórios que armazenam amostras de materiais infectantes e potencialmente infectantes para poliovírus selvagem e vacinal, a destruição, a contenção ou a transferência desses materiais para instalação essencial. (Origem: PRT MS/GM 451/2017, Art. 4º)
Parágrafo Único. Os laboratórios que optarem por conter as amostras infectantes e potencialmente infectantes para poliovirus selvagem e vacinal deverão cumprir com critérios de instalação essencial para poliovírus. (Origem: PRT MS/GM 451/2017, Art. 4º, Parágrafo Único)
Art. 245. Para fins desta Seção, instalação essencial para poliovírus são os laboratórios que cumprem com todos os critérios estabelecidos pelo Plano de Ação Global da Poliomielite - Documento GAP III, de acordo com a certificação dada pelas autoridades nacional ou internacional. (Origem: PRT MS/GM 451/2017, Art. 5º)
Art. 246. O descumprimento das disposições contidas nesta Seção constitui infração sanitária, nos termos da Lei nº 6.437, de 20 de agosto de 1977, sem prejuízo das responsabilidades civil, administrativa e penal cabíveis. (Origem: PRT MS/GM 451/2017, Art. 6º)
Seção II
Do Comitê Técnico para Contenção de Poliovírus em Laboratórios Brasileiros
Art. 247. Fica instituído o Comitê Técnico para contenção de Poliovírus em Laboratórios brasileiros com a finalidade de assessorar a Secretaria de Vigilância em Saúde na implementação do Plano Nacional de Contenção do Poliovírus. (Origem: PRT MS/GM 1398/2008, Art. 1º)
Art. 248. Compete ao Comitê Técnico: (Origem: PRT MS/GM 1398/2008, Art. 2º)
I - assessorar a Secretaria de Vigilância em Saúde na implementação do Plano Nacional de Contenção de Poliovírus Selvagem nos Laboratórios; (Origem: PRT MS/GM 1398/2008, Art. 2º, I)
II - verificar e avaliar a informação recebida das instituições e laboratórios; (Origem: PRT MS/GM 1398/2008, Art. 2º, II)
III - realizar o inventário de laboratório contendo poliovírus ou material potencialmente infectante: (Origem: PRT MS/GM 1398/2008, Art. 2º, III)
a) são considerados materiais potencialmente infectantes para o poliovírus: fezes, secreções de orofaringe e amostras de águas de esgoto ou in natura, de origens desconhecidas, ou coletadas para qualquer finalidade no Brasil, ou demais países da América Latina, até 1991, em regiões onde se suspeitava da presença dos poliovírus selvagens ou PVDV; e (Origem: PRT MS/GM 1398/2008, Art. 2º, III, a)
b) estão também incluídos nesta categoria os cultivos virais ainda não testados para poliovírus e/ou enterovírus isolados em cultivos celulares possuindo características de enterovírus; e cepas de poliovírus não diferenciadas; (Origem: PRT MS/GM 1398/2008, Art. 2º, III, b)
IV - identificar mecanismos e realizar atividades para captação de informações de instituições e laboratórios que não responderem ao inquérito no prazo estipulado pelo Plano Nacional; (Origem: PRT MS/GM 1398/2008, Art. 2º, IV)
V - elaborar informes periódicos do progresso das atividades de contenção do poliovírus em laboratórios à Comissão de Certificação Regional; (Origem: PRT MS/GM 1398/2008, Art. 2º, V)
VI - planejamento de atividades de destinação final de materiais identificados no inventário; e (Origem: PRT MS/GM 1398/2008, Art. 2º, VI)
VII - aprovar o relatório de progressos e relatórios finais do processo de contenção a ser apresentados para a Comissão Global de Avaliação do Processo de Erradicação da Poliomielite. (Origem: PRT MS/GM 1398/2008, Art. 2º, VII)
Art. 249. O Comitê Técnico será composto por um representante titular e um suplente, designados por ato especifico do Ministro da Saúde, de cada órgão e entidade do setor público e privado a seguir indicados: (Origem: PRT MS/GM 1398/2008, Art. 3º)
I - Secretaria de Vigilância em Saúde (SVS/MS): (Origem: PRT MS/GM 1398/2008, Art. 3º, I)
a) Departamento de Vigilância das Doenças Transmissíveis (DEVIT/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, a)
b) Coordenação-Geral de Laboratórios de Saúde Pública (CGLAB/DEGEVS/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, b)
c) Coordenação-Geral do Programa Nacional de Imunizações (CGPNI/DEVIT/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, c)
d) Coordenação-Geral de Doenças Transmissíveis (CGDT/DEVIT/SVS/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, I, d)
II - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS): (Origem: PRT MS/GM 1398/2008, Art. 3º, II)
a) Departamento de Ciência e Tecnologia (DECIT/SCTIE/MS); (Origem: PRT MS/GM 1398/2008, Art. 3º, II, a)
III - Fundação Oswaldo Cruz (FIOCRUZ): (Origem: PRT MS/GM 1398/2008, Art. 3º, III)
a) Departamento de Virologia; (Origem: PRT MS/GM 1398/2008, Art. 3º, III, a)
b) Instituto de Tecnologia em Imunobiológicos (Biomanguinhos); (Origem: PRT MS/GM 1398/2008, Art. 3º, III, b)
IV - Sociedade Brasileira de Infectologia; (Origem: PRT MS/GM 1398/2008, Art. 3º, IV)
V - Sociedade Brasileira de Virologia; (Origem: PRT MS/GM 1398/2008, Art. 3º, V)
VI - Sociedade Brasileira de Patologia Clínica; (Origem: PRT MS/GM 1398/2008, Art. 3º, VI)
VII - Sociedade Brasileira de Análises Clínicas; (Origem: PRT MS/GM 1398/2008, Art. 3º, VII)
VIII - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1398/2008, Art. 3º, VIII)
IX - Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 1398/2008, Art. 3º, IX)
X - Conselho Nacional de Secretários Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 1398/2008, Art. 3º, X)
Parágrafo Único. Sempre que necessário, o Comitê convidará, para participar das reuniões, representantes de órgãos e entidades com a finalidade de contribuir no desenvolvimento e aprimoramento dos trabalhos. (Origem: PRT MS/GM 1398/2008, Art. 3º, Parágrafo Único)
Art. 250. Os membros deverão declarar a inexistência de conflito de interesses com suas atividades no debate dos temas pertinentes ao Comitê, sendo que na eventualidade de existência de conflito de interesses, os mesmos deverão abster-se de participar da discussão e deliberação do tema. (Origem: PRT MS/GM 1398/2008, Art. 4º)
Art. 251. O Comitê Técnico será coordenado pelo Diretor do Departamento de Vigilância das Doenças Transmissíveis (DEVIT/SVS/MS) ou seu substituto, que terá as seguintes competências: (Origem: PRT MS/GM 1398/2008, Art. 5º)
I - coordenar as reuniões do Comitê; (Origem: PRT MS/GM 1398/2008, Art. 5º, I)
II - indicar um técnico da área para desenvolver atividades necessárias ao funcionamento do Comitê; (Origem: PRT MS/GM 1398/2008, Art. 5º, II)
III - encaminhar atas e relatórios para apreciação do Secretário de Vigilância em Saúde; (Origem: PRT MS/GM 1398/2008, Art. 5º, III)
IV - submeter à apreciação e aprovação do Secretário de Vigilância em Saúde as recomendações do comitê. (Origem: PRT MS/GM 1398/2008, Art. 5º, IV)
Art. 252. Aos membros do Comitê Técnico competirá: (Origem: PRT MS/GM 1398/2008, Art. 6º)
I - participar das reuniões ordinárias e extraordinárias do Comitê; (Origem: PRT MS/GM 1398/2008, Art. 6º, I)
II - identificar, analisar e apresentar materiais técnicos, bem como discutir e deliberar as matérias submetidas ao Comitê; (Origem: PRT MS/GM 1398/2008, Art. 6º, II)
III - propor ao Coordenador, com antecedência mínima de 10 (dez) dias, a convocação de reuniões extraordinárias, com objetivo de tratar de assuntos relevantes ou de urgência, que não possam aguardar a realização da reunião ordinária; e (Origem: PRT MS/GM 1398/2008, Art. 6º, III)
IV - indicar ao Coordenador, quando pertinente e relevante, pessoas ou representantes de entidades públicas ou privadas, a fim de compor grupos técnicos para temas específicos. (Origem: PRT MS/GM 1398/2008, Art. 6º, IV)
Art. 253. O Comitê Técnico reunir-se-á ordinariamente a cada seis meses ou extraordinariamente quando convocado pelo seu Coordenador, sendo que suas reuniões serão realizadas somente com a presença de, no mínimo, cinquenta por cento dos seus membros. (Origem: PRT MS/GM 1398/2008, Art. 7º)
§ 1º Os membros poderão deixar de integrá-lo a qualquer tempo a pedido do membro integrante, mediante formalização da solicitação de desligamento feita pelo Coordenador do Comitê ao Secretário de Vigilância em Saúde. (Origem: PRT MS/GM 1398/2008, Art. 7º, § 1º)
§ 2º Será desligado de suas funções o membro que, sem motivo justificado, deixar de comparecer a duas reuniões consecutivas. (Origem: PRT MS/GM 1398/2008, Art. 7º, § 2º)
Art. 254. As reuniões ordinárias e extraordinárias serão realizadas no Ministério da Saúde, situado em Brasília-DF, ou em local a ser definido por decisão do coordenador. (Origem: PRT MS/GM 1398/2008, Art. 8º)
Parágrafo Único. A decisão do coordenador que determinar a ocorrência de reuniões em local distinto do Ministério da Saúde, situado em Brasília-DF, deve ser devidamente motivada, incluindo entre seus argumentos os fatos e fundamentos que comprovam a impossibilidade de realização da reunião em Brasília-DF, com necessidade de aprovação dessa decisão pelo Secretário de Vigilância em Saúde (SVS/MS) ou por autoridade e ele hierarquicamente superior. (Origem: PRT MS/GM 1398/2008, Art. 8º, Parágrafo Único)
Art. 255. As funções dos membros do Comitê Técnico não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1398/2008, Art. 9º)
CAPÍTULO VII
DO DIAGNÓSTICO E TRATAMENTO E CONTROLE DA LEISHMANIOSE TEGUMENTAR AMERICANA
(Revogado pela PRT GM/MS n° 781 de 09.04.2020)
Art. 256. Ficam expedidas instruções normativas para diagnóstico e tratamento e controle da Leishmaniose Tegumentar Americana, na forma do Anexo XXXII . (Origem: PRT MS/GM 1402/1991, Art. 1º) (Revogado pela PRT GM/MS n° 781 de 09.04.2020)
CAPÍTULO VIII
DO PROGRAMA NACIONAL DE CONTROLE DA DENGUE (PNCD) E SEU COMITÊ TÉCNICO DE ACOMPANHAMENTO E ASSESSORAMENTO
Art. 257. Fica instituído o Programa Nacional de Controle da Dengue (PNCD), com as seguintes diretrizes: (Origem: PRT MS/GM 1933/2003, Art. 1º)
I - desenvolver campanhas de informação e de mobilização das pessoas, de maneira a criar-se uma maior responsabilização de cada família na manutenção de seu ambiente doméstico livre de potenciais criadouros do vetor; (Origem: PRT MS/GM 1933/2003, Art. 1º, I)
II - fortalecer a vigilância epidemiológica e entomológica para ampliar a capacidade de predição e de detecção precoce de surtos da doença; (Origem: PRT MS/GM 1933/2003, Art. 1º, II)
III - melhorar a qualidade do trabalho de campo de combate ao vetor; (Origem: PRT MS/GM 1933/2003, Art. 1º, III)
IV - integrar as ações de controle da dengue na atenção básica, com a mobilização do Programa de Agentes Comunitários de Saúde e Programa de Saúde da Família; (Origem: PRT MS/GM 1933/2003, Art. 1º, IV)
V - utilizar instrumentos legais que facilitem o trabalho do poder público na eliminação de criadouros em imóveis comerciais, casas abandonadas, dentre outros; (Origem: PRT MS/GM 1933/2003, Art. 1º, V)
VI - atuar multisetorialmente por meio do fomento à destinação adequada de resíduos sólidos e a utilização de recipientes seguros para armazenagem de água; (Origem: PRT MS/GM 1933/2003, Art. 1º, VI)
VII - desenvolver instrumentos mais eficazes de acompanhamento e supervisão das ações desenvolvidas pelo Ministério da Saúde, Estados e Municípios. (Origem: PRT MS/GM 1933/2003, Art. 1º, VI-A)
Art. 258. Fica criado o Comitê Técnico de Acompanhamento e Assessoramento do PNCD com a finalidade de coordenar a implementação, em nível nacional, das ações previstas no Programa Nacional de Controle da Dengue. (Origem: PRT MS/GM 1933/2003, Art. 2º)
Parágrafo Único. O Comitê Técnico de que trata o caput deste artigo será coordenado pela Secretaria de Vigilância em Saúde e contará com representantes da Secretaria de Atenção à Saúde/MS, da Secretaria de Gestão do Trabalho e da Educação na Saúde/MS, da Secretaria de Ciência, Tecnologia e Insumos Estratégicos/MS, da Agência Nacional de Vigilância Sanitária (ANVISA) e da Agência Nacional de Saúde Suplementar (ANS). (Origem: PRT MS/GM 1933/2003, Art. 2º, Parágrafo Único)
Art. 259. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, editar normas regulamentadoras deste Capítulo. (Origem: PRT MS/GM 1933/2003, Art. 3º)
Seção I
Do Comitê Nacional de Mobilização Contra a Dengue
Art. 260. Fica instituído o Comitê Nacional de Mobilização contra a Dengue. (Origem: PRT MS/GM 2001/2003, Art. 1º)
Art. 261. O Comitê será composto por representantes das instituições designadas abaixo, sob a Coordenação do primeiro: (Origem: PRT MS/GM 2001/2003, Art. 2º)
I - Secretaria de Vigilância em Saúde/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, I)
II - Gabinete do Ministro da Saúde; (Origem: PRT MS/GM 2001/2003, Art. 2º, II)
III - Secretaria-Executiva/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, III)
IV - Secretaria de Atenção à Saúde/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, IV)
V - Secretaria de Gestão do Trabalho e da Educação na Saúde/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, V)
VI - Secretaria de Ciência, Tecnologia e Insumos Estratégicos/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, VI)
VII - Secretaria de Gestão Participativa/MS; (Origem: PRT MS/GM 2001/2003, Art. 2º, VII)
VIII - Fundação Nacional de Saúde (FUNASA); (Origem: PRT MS/GM 2001/2003, Art. 2º, VIII)
IX - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2001/2003, Art. 2º, IX)
X - Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 2001/2003, Art. 2º, X)
XI - Conselho Nacional de Saúde (CNS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XI)
XII - Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XII)
XIII - Conselho Nacional dos Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XIII)
XIV - Conferência Nacional dos Bispos do Brasil (CNBB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XIV)
XV - Conselho das Igrejas Cristãs do Brasil; (Origem: PRT MS/GM 2001/2003, Art. 2º, XV)
XVI - Central Única dos Trabalhadores (CUT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XVI)
XVII - Associação Brasileira de Organizações Não Governamentais (ABONG); (Origem: PRT MS/GM 2001/2003, Art. 2º, XVII)
XVIII - Secretaria Nacional de Defesa Civil (SEDEC/MI); (Origem: PRT MS/GM 2001/2003, Art. 2º, XVIII)
XIX - Organização das Cooperativas Brasileiras (OCB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XIX)
XX - Confederação Nacional dos Transportes (CNT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XX)
XXI - Confederação Nacional das Indústrias (CNI); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXI)
XXII - Associação Brasileira de Imprensa (ABI); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXII)
XXIII - Confederação Brasileira de Futebol (CBF); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXIII)
XXIV - Confederação das Mulheres do Brasil (CMB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXIV)
XXV - Conselho de Reitores das Universidades Brasileiras (CRUB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXV)
XXVI - Associação Nacional de Jornais (ANJ); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXVI)
XXVII - União Nacional dos Dirigentes Municipais da Educação (UNDIME); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXVII)
XXVIII - Confederação Nacional dos Trabalhadores em Educação (CNTE); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXVIII)
XXIX - Associação Brasileira de Supermercados (ABRAS); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXIX)
XXX - Confederação Nacional do Comércio (CNC); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXX)
XXXI - Federação Nacional dos Jornalistas (FENAJ); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXI)
XXXII - Confederação Geral dos Trabalhadores (CGT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXII)
XXXIII - Força Sindical; (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXIII)
XXXIV - Instituto Brasileiro de Administração Municipal (IBAM); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXIV)
XXXV - Associação Brasileira das Emissoras de Rádio e TV (ABERT); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXV)
XXXVI - Comitê Olímpico Brasileiro (COB); (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXVI)
XXXVII - Ministério da Defesa; (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXVII)
XXXVIII - Fundação Cultural Palmares - Ministério da Cultura; (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXVIII)
XXXIX - Confederação Nacional das Donas de Casa e Consumidores; e (Origem: PRT MS/GM 2001/2003, Art. 2º, XXXIX)
XL - Conselho Nacional dos Comandantes Gerais da Policia Militar e Bombeiro Militar (CNCG). (Origem: PRT MS/GM 2001/2003, Art. 2º, XL)
Art. 262. Fica instituído o Comitê Nacional de Mobilização contra a Dengue com a finalidade de coordenar a implementação, em nível nacional, das ações de educação em saúde e mobilização social voltadas ao combate à doença, em especial as relativas ao Dia Nacional de Mobilização Contra a Dengue. (Origem: PRT MS/GM 1934/2003, Art. 2º)
Art. 263. O Comitê Nacional será composto por membros que representarão os segmentos do poder público e da sociedade civil, com mandato de 2 (dois) anos. (Origem: PRT MS/GM 1934/2003, Art. 3º)
§ 1º Os membros do Comitê Nacional de Mobilização contra a Dengue deverão declarar a inexistência de conflito de interesses com suas atividades públicas ou privadas no debate dos temas pertinentes. (Origem: PRT MS/GM 1934/2003, Art. 3º, § 1º)
§ 2º A participação no Comitê é considerada de relevante interesse nacional e não será remunerada. (Origem: PRT MS/GM 1934/2003, Art. 3º, § 2º)
Art. 264. Compete ao Comitê Nacional de Mobilização contra a Dengue: (Origem: PRT MS/GM 1934/2003, Art. 4º)
I - propor ações de educação em saúde e mobilização social para o combate à dengue; (Origem: PRT MS/GM 1934/2003, Art. 4º, I)
II - acompanhar e avaliar a implementação das ações previstas para o combate à doença. (Origem: PRT MS/GM 1934/2003, Art. 4º, II)
Art. 265. O Comitê Nacional será coordenado pelo representante da Secretaria de Vigilância em Saúde e/ou seu substituto, que terá as seguintes competências: (Origem: PRT MS/GM 1934/2003, Art. 5º)
I - coordenar as reuniões do Comitê; (Origem: PRT MS/GM 1934/2003, Art. 5º, I)
II - encaminhar atas e relatórios para apreciação do responsável pelas ações do Programa Nacional de Combate à Dengue, da Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1934/2003, Art. 5º, II)
III - submeter a apreciação e aprovação do Secretário de Vigilância em Saúde as deliberações oriundas das reuniões do Comitê Nacional. (Origem: PRT MS/GM 1934/2003, Art. 5º, III)
Art. 266. O Comitê Nacional reunir-se-á quando convocado pelo seu Coordenador. (Origem: PRT MS/GM 1934/2003, Art. 6º)
Art. 267. A Secretaria de Vigilância em Saúde orientará os estados e municípios para que instituam, por intermédio de suas secretarias de saúde, respectivamente, comitês estaduais e municipais de mobilização contra a dengue visando incentivar a articulação dos órgãos federais, estaduais e municipais, bem como das entidades civis, com o objetivo de implementar as ações de educação em saúde e mobilização social, em especial as relativas ao Dia Nacional de Mobilização Contra a Dengue. (Origem: PRT MS/GM 1934/2003, Art. 7º)
Art. 268. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, editar normas regulamentadoras do Comitê Nacional de Mobilização contra a Dengue. (Origem: PRT MS/GM 1934/2003, Art. 8º)
Seção II
Do Grupo Executivo com a Finalidade de Acompanhar e Propor as Medidas Necessárias para a Efetiva Implementação das Ações do Programa Nacional de Controle da Dengue (PNCD)
Art. 269. Fica instituído Grupo Executivo, no âmbito do Ministério da Saúde, com a finalidade de acompanhar e propor as medidas necessárias para a efetiva implementação das ações do Programa Nacional de Controle da Dengue (PNCD), visando a sua prevenção e controle em todo o território nacional. (Origem: PRT MS/GM 335/2007, Art. 1º)
Art. 270. O Grupo Executivo do PNCD é composto por representantes das secretarias subordinadas e órgãos vinculados: (Origem: PRT MS/GM 335/2007, Art. 2º)
I - Gabinete do Ministro; (Origem: PRT MS/GM 335/2007, Art. 2º, I) (com redação dada pela PRT MS/GM 767/2008)
a) Assessoria de Comunicação Social. (Origem: PRT MS/GM 335/2007, Art. 2º, I, a)
II - Secretaria Executiva; (Origem: PRT MS/GM 335/2007, Art. 2º, II) (com redação dada pela PRT MS/GM 767/2008)
III - Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 335/2007, Art. 2º, III) (com redação dada pela PRT MS/GM 767/2008)
IV - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 335/2007, Art. 2º, IV) (com redação dada pela PRT MS/GM 767/2008)
a) Departamento de Atenção Especializada; (Origem: PRT MS/GM 335/2007, Art. 2º, IV, a)
b) Departamento de Atenção Básica; e (Origem: PRT MS/GM 335/2007, Art. 2º, IV, b)
c) Departamento de Regulação, Avaliação e Controle. (Origem: PRT MS/GM 335/2007, Art. 2º, IV, c)
V - Secretaria de Gestão Estratégica e Participativa; (Origem: PRT MS/GM 335/2007, Art. 2º, V) (com redação dada pela PRT MS/GM 767/2008)
VI - Secretaria de Gestão do Trabalho e da Educação na Saúde; (Origem: PRT MS/GM 335/2007, Art. 2º, VI) (com redação dada pela PRT MS/GM 767/2008)
VII - Secretaria de Ciência, Tecnologia e Insumos Estratégicos; (Origem: PRT MS/GM 335/2007, Art. 2º, VII) (com redação dada pela PRT MS/GM 767/2008)
VIII - Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 335/2007, Art. 2º, VIII) (com redação dada pela PRT MS/GM 767/2008)
IX - Agência Nacional de Saúde Suplementar; (Origem: PRT MS/GM 335/2007, Art. 2º, IX) (com redação dada pela PRT MS/GM 767/2008)
X - Fundação Nacional de Saúde; e (Origem: PRT MS/GM 335/2007, Art. 2º, X) (com redação dada pela PRT MS/GM 767/2008)
XI - Fundação Oswaldo Cruz. (Origem: PRT MS/GM 335/2007, Art. 2º, XI) (dispositivo acrescentado pela PRT MS/GM 767/2008)
§ 1º O Grupo Executivo do PNCD será coordenado e designado pelo Secretário de Vigilância em Saúde e cada órgão indicará um representante e respectivo suplente, preferencialmente o titular ou seu substituto. (Origem: PRT MS/GM 335/2007, Art. 2º, § 1º)
§ 2º O Coordenador do Grupo Executivo poderá convidar representantes de outros órgãos e entidades, públicos ou privados, para participarem das reuniões por ele organizadas. (Origem: PRT MS/GM 335/2007, Art. 2º, § 2º)
Art. 271. Compete ao Grupo Executivo do PNCD: (Origem: PRT MS/GM 335/2007, Art. 3º)
I - acompanhar a execução das ações previstas pelo PNCD; (Origem: PRT MS/GM 335/2007, Art. 3º, I)
II - promover as articulações necessárias para a eficaz implementação das ações de prevenção e controle da dengue, assim como a assistência aos pacientes, inclusive com Estados e Municípios; (Origem: PRT MS/GM 335/2007, Art. 3º, II)
III - atuar nas restrições identificadas para adoção das medidas integrantes dos planos de combate à dengue; (Origem: PRT MS/GM 335/2007, Art. 3º, III)
IV - acompanhar a alocação dos recursos orçamentário- financeiros necessários para implementação das ações. (Origem: PRT MS/GM 335/2007, Art. 3º, IV)
Art. 272. Ficam os integrantes do Grupo Executivo responsáveis pelo desenvolvimento das ações previstas nos componentes do PNCD, dentre elas: (Origem: PRT MS/GM 335/2007, Art. 4º)
I - Vigilância epidemiológica; (Origem: PRT MS/GM 335/2007, Art. 4º, a)
II - Combate ao vetor; (Origem: PRT MS/GM 335/2007, Art. 4º, b)
III - Ações de saneamento ambiental; (Origem: PRT MS/GM 335/2007, Art. 4º, c)
IV - Ações integradas de educação em saúde, comunicação e mobilização social; (Origem: PRT MS/GM 335/2007, Art. 4º, d)
V - Capacitação de recursos humanos; (Origem: PRT MS/GM 335/2007, Art. 4º, e)
VI - Assistência básica, média e alta complexidade; (Origem: PRT MS/GM 335/2007, Art. 4º, f)
VII - Legislação; e (Origem: PRT MS/GM 335/2007, Art. 4º, g)
VIII - Sustentação político-social. (Origem: PRT MS/GM 335/2007, Art. 4º, h)
Art. 273. A participação no Grupo Executivo não ensejará remuneração e será considerada serviço público relevante. (Origem: PRT MS/GM 335/2007, Art. 5º)
§ 1º O Coordenador do Grupo Executivo será substituído, em suas ausências, pelo Coordenador do PNCD. (Origem: PRT MS/GM 335/2007, Art. 5º, § 1º)
§ 2º O Grupo Executivo reunir-se-á, mensalmente, por convocação de seu Coordenador, com registro em ata dos assuntos deliberados. (Origem: PRT MS/GM 335/2007, Art. 5º, § 2º)
CAPÍTULO IX
DO PROGRAMA NACIONAL DE VIGILÂNCIA, PREVENÇÃO E CONTROLE DAS IST E DO HIV/AIDS
Art. 274. Fica instituído o Programa Nacional de Vigilância, Prevenção e Controle das IST e do HIV/AIDS. (Origem: PRT MS/GM 236/1985, Art. 1º)
Art. 275. O Programa coordenará, a nível nacional, ações de vigilância epidemiológica das IST e do HIV/AIDS. (Origem: PRT MS/GM 236/1985, Art. 2º)
Art. 276. Compete ao Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS) a coordenação, a nível nacional, do Programa. (Origem: PRT MS/GM 236/1985, Art. 3º)
Art. 277. As medidas de prevenção das IST e do HIV/AIDS, no país, serão realizadas de forma articulado pelo Ministério da Saúde e pelas Secretaria de Saúdes dos Estados, Municípios e Distrito Federal. (Origem: PRT MS/GM 236/1985, Art. 4º)
Art. 278. As linhas básicas para operacionalização das ações de investigação e controle da síndrome de imunodeficiência adquirida constam do Anexo XXXIII . (Origem: PRT MS/GM 236/1985, Art. 5º)
CAPÍTULO X
DO PROGRAMA NACIONAL PARA PREVENÇÃO E CONTROLE DAS HEPATITES VIRAIS
Art. 279. Fica instituído, no âmbito do SUS, o Programa Nacional para a Prevenção e o Controle das Hepatites Virais, a ser desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos Estados, Municípios e Distrito Federal, tendo por objetivos: (Origem: PRT MS/GM 2080/2003, Art. 1º)
I - o desenvolvimento de ações de promoção da saúde, prevenção, diagnóstico, vigilância epidemiológica e sanitária das hepatites virais, acompanhamento e tratamento dos portadores de hepatites virais detectadas e inseridas no Programa; (Origem: PRT MS/GM 2080/2003, Art. 1º, I)
II - a ampliação do acesso, o incremento da qualidade e da capacidade instalada dos serviços de saúde em todos os seus níveis de complexidade, bem como de centros de referência para o tratamento das hepatites; e (Origem: PRT MS/GM 2080/2003, Art. 1º, II)
III - a organização, regulação, acompanhamento e avaliação do conjunto destas ações de saúde para o efetivo controle das hepatites virais. (Origem: PRT MS/GM 2080/2003, Art. 1º, III)
Parágrafo Único. O Programa Nacional para a Prevenção e o Controle das Hepatites Virais, criado através deste Capítulo ficará subordinado ao Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS). (Origem: PRT MS/GM 2080/2003, Art. 1º, Parágrafo Único)
Parágrafo Único. O Programa Nacional para a Prevenção e o Controle das Hepatites Virais será gerido pelo Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis (DCCI/SVS/MS). (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 280. O Programa Nacional para a Prevenção e o Controle das Hepatites Virais envolverá todos os aspectos relacionados à prevenção, vigilância e assistência aos pacientes portadores de hepatites virais, com ênfase nas Hepatites A, B, C, D e E. (Origem: PRT MS/GM 2080/2003, Art. 2º)
Art. 281. O do Anexo XXXIV define as competências e atribuições relativas à implantação/gestão do Programa Nacional para a Prevenção e o Controle das Hepatites Virais de cada nível de direção do SUS. (Origem: PRT MS/GM 2080/2003, Art. 3º)
Art. 282. Em virtude dos diferentes níveis de organização das redes assistenciais existentes nos Estados e no Distrito Federal, da diversidade das características populacionais existentes no País, da variação da incidência das hepatites nas diversas regiões e dos diferentes graus de necessidades assistenciais requeridos pelos portadores, o Programa Nacional para a Prevenção e o Controle das Hepatites Virais será constituído por três níveis assistenciais, a saber: (Origem: PRT MS/GM 2080/2003, Art. 4º)
I - Nível I - Atenção Básica; (Origem: PRT MS/GM 2080/2003, Art. 4º, I)
I - Nível I - Atenção Primária à Saúde; (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
II - Nível II - Assistência Ambulatorial e Hospitalar de Média Complexidade; e (Origem: PRT MS/GM 2080/2003, Art. 4º, II)
III - Nível III - Assistência Ambulatorial e Hospitalar de Alta Complexidade. (Origem: PRT MS/GM 2080/2003, Art. 4º, III)
Art. 283. O Nível I - Atenção Básica - compreende a realização de ações básicas de saúde voltadas para as hepatites virais, relativas a sua prevenção e à promoção da saúde para toda a população, bem como os processos de identificação de portadores de hepatites virais e de assistência básica dos casos identificados. (Origem: PRT MS/GM 2080/2003, Art. 5º)
Art. 283. O Nível I - Atenção Primária à Saúde - compreende a realização de ações voltadas à promoção da saúde, assim como as inerentes à prevenção, ao rastreio, diagnóstico e tratamento dos pacientes com hepatites virais. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
§ 1º O Nível I, de que trata o caput deste artigo, será prestado por meio de equipes da Estratégia Saúde da Família, postos ou centros de saúde e por centros de testagem e aconselhamento, os quais deverão articula-se com: (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
I - os serviços de saúde de Nível II para que seja garantida a referência e contra referência dos pacientes cuja situação clínica assim o requeira; e (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
II - os serviços de diagnóstico, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
§ 2º Os pacientes diagnosticados com hepatites virais poderão ter o tratamento prescrito no âmbito dos estabelecimentos de saúde de Nível I, de acordo com o nível de complexidade assistencial estabelecido nos Protocolos Clínicos e Diretrizes Terapêuticas elaborados e publicados pelas Secretarias de Vigilância em Saúde, de Atenção Primária à Saúde, de Atenção Especializada à Saúde e de Ciência, Tecnologia Inovação e Insumos Estratégicos em Saúde do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Parágrafo Único. A atenção básica de que trata o caput deste artigo será prestada por meio das equipes de saúde da família e postos/centros de saúde e centros de testagem e aconselhamento, na forma estabelecida no Plano Operacional do Programa Nacional de Hepatites Virais, os quais deverão articular-se com serviços de saúde de Nível II para que seja garantida a referência e contra-referência dos pacientes cuja situação clínica assim o requeira, bem como serviços de diagnóstico, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Origem: PRT MS/GM 2080/2003, Art. 5º, Parágrafo Único)
Art. 284. O Nível II - Assistência Ambulatorial e Hospitalar de Média Complexidade - compreende a execução de ações de diagnóstico e tratamento dos portadores de hepatites virais, de acordo com o previsto para seu nível de complexidade assistencial estabelecidas nos Protocolos Clínicos e Diretrizes Terapêuticas já elaborados/publicados ou a serem elaborados/publicados pela Secretaria de Vigilância em Saúde/Secretaria de Atenção à Saúde/Secretaria de Ciência, Tecnologia e Insumos Estratégicos/Ministério da Saúde. (Origem: PRT MS/GM 2080/2003, Art. 6º)
Parágrafo Único. As ações assistenciais definidas no caput deste artigo serão desenvolvidas por hospitais/ambulatórios de média complexidade, devidamente cadastrados para tal, em conformidade com o estabelecido no Plano Operacional do Programa Nacional, os quais deverão articular-se com serviços de saúde de Nível I e III para que seja garantida a referência e contra-referência dos pacientes cuja situação clínica assim o requeira, bem como serviços de diagnóstico de maior complexidade, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Origem: PRT MS/GM 2080/2003, Art. 6º, Parágrafo Único)
Parágrafo único. As ações assistenciais definidas no caput deste artigo serão desenvolvidas por hospitais ou ambulatórios de média complexidade, devidamente cadastrados para tal, os quais deverão articular-se com serviços de saúde de Nível I e III para que seja garantida a referência e contra referência dos pacientes cuja situação clínica assim o requeira, bem como serviços de diagnóstico de maior complexidade, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 285. O Nível III - Assistência Ambulatorial e Hospitalar de Alta Complexidade - compreende a execução de ações de diagnóstico e tratamento dos portadores de hepatites virais, de acordo com o previsto para seu nível de complexidade assistencial estabelecidas nos Protocolos Clínicos e Diretrizes Terapêuticas elaborados/publicados ou a serem elaborados/publicados pela Secretaria de Vigilância em Saúde/Secretaria de Atenção à Saúde/Secretaria de Ciência, Tecnologia e Insumos Estratégicos/Ministério da Saúde. (Origem: PRT MS/GM 2080/2003, Art. 7º)
Parágrafo Único. As ações assistenciais definidas no caput deste artigo serão desenvolvidas por Centros de Referência em Assistência aos Portadores de Hepatites Virais, devidamente cadastrados para tal, em conformidade com o estabelecido Plano Operacional do Programa Nacional, os quais constituirão a referência assistencial para a rede composta pelos diferentes níveis assistenciais integrantes do Programa, articulando-se com serviços de saúde de Nível II, garantindo assim a referência e contra-referência dos pacientes, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Origem: PRT MS/GM 2080/2003, Art. 7º, Parágrafo Único)
Parágrafo único. As ações assistenciais definidas no caput deste artigo serão desenvolvidas por Centros de Referência em Assistência aos Portadores de Hepatites Virais, devidamente cadastrados para tal, os quais constituirão a referência assistencial para a rede composta pelos diferentes níveis assistenciais integrantes do Programa, articulando-se com serviços de saúde de Nível II, garantindo assim a referência e contra-referência dos pacientes, de modo a estruturar uma rede assistencial hierarquizada e regionalizada. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 286. Caberá às Secretarias de Saúde dos Estados, Municípios e Distrito Federal, de acordo com o seu nível de responsabilidade no Programa, na forma do Anexo XXXIV , a organização das Redes Estaduais de Assistência aos Portadores de Hepatites Virais, que serão integradas por: (Origem: PRT MS/GM 2080/2003, Art. 8º)
I - Serviços de Nível I - Atenção Básica; (Origem: PRT MS/GM 2080/2003, Art. 8º, I)
I - Serviços de Nível I - Atenção Primária à Saúde; (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
II - Serviços de Nível II - Assistência Ambulatorial e Hospitalar de Média Complexidade; e (Origem: PRT MS/GM 2080/2003, Art. 8º, II)
III - Serviços de Nível III - (Centros de Referência em Assistência aos Portadores de Hepatites Virais) - Assistência Ambulatorial e Hospitalar de Alta Complexidade. (Origem: PRT MS/GM 2080/2003, Art. 8º, III)
Art. 287. A Secretaria de Vigilância em Saúde definirá a estrutura básica para o funcionamento do Programa Nacional para a Prevenção e o Controle das Hepatites Virais no nível central, organizará a estrutura operacional básica e adotará as providências necessárias à plena implementação deste Programa em todos os níveis de gestão do SUS. (Origem: PRT MS/GM 2080/2003, Art. 9º)
Art. 287 - A. Os medicamentos preconizados no tratamento das hepatites virais constantes na Relação Nacional de Medicamentos Essenciais (Rename) passam a compor o elenco do Componente Estratégico da Assistência Farmacêutica no âmbito do Sistema Único de Saúde (SUS). (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 287 - B. A dispensação dos medicamentos para hepatites virais deve seguir os critérios de elegibilidade estabelecidos por meio dos Protocolos Clínicos e Diretrizes Terapêuticas, publicados pelo Ministério da Saúde, e deverá ser realizada em farmácias designadas pelos gestores estaduais, municipais e do Distrito Federal, mediante pactuação no âmbito das Comissões Intergestores Bipartite (CIB), sendo facultado ao gestor municipal aderir ou não a dispensação dos medicamentos, também mediante pactuação no âmbito da CIB. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 287 - C. A definição e o detalhamento de fluxos de programação e distribuição de medicamentos, bem como o cronograma de implementação do modelo de acesso, serão pactuados no âmbito da CIT, por meio de ato normativo específico. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 287 - D. Os Estados, os Municípios e o Distrito Federal possuem autonomia para estruturar sua rede administrativa e assistencial, definindo a abrangência dos serviços voltados às hepatites virais em seu território. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
Art. 288. Fica instituído o Comitê Técnico de Acompanhamento e Assessoramento do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, com a finalidade de acompanhar e assessorar a implementação das ações previstas no Programa. (Origem: PRT MS/GM 2080/2003, Art. 10)
Art. 289. Fica instituído o Comitê Assessor do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, com as atribuições de assessorar o Programa na atualização dos assuntos técnicos e científicos envolvidos na apreciação das recomendações, auxiliar na elaboração das normas técnicas, do Plano Operacional, dos Protocolos de diagnóstico, tratamento e acompanhamento das hepatites virais e ainda na avaliação epidemiológica destas hepatites. (Origem: PRT MS/GM 2080/2003, Art. 12)
Art. 290. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, proceder às alterações que, eventualmente, se façam necessárias neste Capítulo, bem como editar normas regulamentadoras provenientes deste Capítulo. (Origem: PRT MS/GM 2080/2003, Art. 13)
Art. 291. A Secretaria de Atenção à Saúde, a Fundação Nacional de Saúde, a Agência Nacional de Vigilância Sanitária e a Secretaria de Ciência, Tecnologia e Insumos Estratégicos devem se articular com a Secretaria de Vigilância em Saúde para as providências necessárias, em suas respectivas áreas de atuação, para a plena implementação do Programa instituído por este Capítulo e pelo seu Plano Operacional, no que diz respeito à assistência de atenção básica, média/alta complexidade, vigilância epidemiológica e vigilância sanitária das hepatites virais. (Origem: PRT MS/GM 2080/2003, Art. 14)
Art. 291. A Secretaria de Atenção Primária à Saúde, a Secretaria de Atenção Especializada à Saúde, a Fundação Nacional de Saúde, a Agência Nacional de Vigilância Sanitária e a Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde devem se articular com a Secretaria de Vigilância em Saúde para as providências necessárias, em suas respectivas áreas de atuação, para a plena implementação do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, no que diz respeito à assistência de Atenção Primária à Saúde, média e alta complexidade, vigilância epidemiológica e vigilância sanitária das Hepatites Virais. (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
CAPÍTULO XI
DO PROGRAMA NACIONAL DE PREVENÇÃO E CONTROLE DA MALÁRIA (PNCM)
Art. 292. Fica instituído o Programa Nacional de Prevenção e Controle da Malária (PNCM), com as seguintes diretrizes: (Origem: PRT MS/GM 1932/2003, Art. 1º)
I - desenvolver atividades de informação e de mobilização político-social, com o objetivo de aumentar a participação da população nas ações de prevenção e controle da malária; (Origem: PRT MS/GM 1932/2003, Art. 1º, I)
II - fortalecer a vigilância em saúde para ampliar a capacidade de predição e de detecção precoce de surtos da doença; (Origem: PRT MS/GM 1932/2003, Art. 1º, II)
III - melhorar a qualidade do trabalho de campo no controle vetorial; (Origem: PRT MS/GM 1932/2003, Art. 1º, III)
IV - integrar as ações de controle da malária na atenção básica, com a efetiva participação dos Programas de Agentes Comunitários de Saúde e do Programa Saúde da Família; (Origem: PRT MS/GM 1932/2003, Art. 1º, IV)
V - utilizar os instrumentos legais que facilitem o trabalho do poder público no controle do meio ambiente para evitar surtos da doença; (Origem: PRT MS/GM 1932/2003, Art. 1º, V)
VI - atuar com o Instituto Nacional de Colonização e Reforma Agrária - INCRA e o Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis - IBAMA, nas regiões endêmicas de malária, visando à promoção de ações de prevenção e controle da doença para evitar surgimento de epidemias decorrentes de atividades antrópicas; (Origem: PRT MS/GM 1932/2003, Art. 1º, VI)
VII - desenvolver instrumentos de programação, acompanhamento e supervisão das ações desenvolvidas pelos gestores federal, estaduais e municipais. (Origem: PRT MS/GM 1932/2003, Art. 1º, VII)
Art. 293. Fica criado o Comitê Técnico de Acompanhamento e Assessoramento do PNCM, que será coordenado pela Secretaria de Vigilância em Saúde do Ministério da Saúde e contará com representantes do Ministério da Saúde; da Organização Pan-Americana da Saúde (OPAS); de Universidades, de Institutos de Pesquisas; da Sociedade Brasileira de Medicina Tropical (SBMT); da Associação Brasileira de Saúde Coletiva (ABRASCO); do Instituto Nacional de Colonização e Reforma Agrária (INCRA); e do Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis (IBAMA). (Origem: PRT MS/GM 1932/2003, Art. 2º)
Art. 294. Ficam criadas Câmaras Técnicas Específicas do PNCM com a finalidade de implementarem, em nível nacional, os componentes do programa que se fizerem necessários. (Origem: PRT MS/GM 1932/2003, Art. 3º)
Parágrafo Único. As Câmaras Técnicas de que trata o caput deste artigo serão coordenadas pela Secretaria de Vigilância em Saúde e contarão com técnicos de notório conhecimento nas áreas inerentes a cada Câmara. (Origem: PRT MS/GM 1932/2003, Art. 3º, Parágrafo Único)
Art. 295. O Secretário de Vigilância em Saúde definirá a composição do Comitê Técnico e das Câmaras Técnicas. (Origem: PRT MS/GM 1932/2003, Art. 4º)
Art. 296. Fica delegada competência ao Secretário de Vigilância em Saúde para, caso necessário, editar normas regulamentadoras deste Capítulo. (Origem: PRT MS/GM 1932/2003, Art. 5º)
CAPÍTULO XII
DO PROGRAMA NACIONAL DE PREVENÇÃO E CONTROLE DOS DISTÚRBIOS POR DEFICIÊNCIA DE IODO (PRÓ-IODO)
Art. 297. Fica instituído o Programa Nacional de Prevenção e Controle dos Distúrbios por Deficiência de Iodo (DDI), designado por Pró-Iodo, e ficam estabelecidas instruções para sua implementação. (Origem: PRT MS/GM 2362/2005, Art. 1º)
Art. 298. O Pró-Iodo destina-se a promover a eliminação virtual sustentável dos DDI mediante a obrigatoriedade de iodação do sal destinado ao consumo humano em todo o território nacional. (Origem: PRT MS/GM 2362/2005, Art. 2º)
Art. 299. O Pró-Iodo será executado de acordo com as seguintes linhas de ação: (Origem: PRT MS/GM 2362/2005, Art. 3º)
I - monitoramento do teor de iodo do sal para consumo humano; (Origem: PRT MS/GM 2362/2005, Art. 3º, I)
II - monitoramento do impacto da iodação do sal na saúde da população; (Origem: PRT MS/GM 2362/2005, Art. 3º, II)
III - atualização dos parâmetros legais dos teores de iodo do sal destinado ao consumo humano; e (Origem: PRT MS/GM 2362/2005, Art. 3º, III)
IV - implementação contínua de estratégias de informação, educação, comunicação e mobilização social. (Origem: PRT MS/GM 2362/2005, Art. 3º, IV)
§ 1º A Comissão Interinstitucional para a Prevenção e o Controle dos Distúrbios por Deficiência de Iodo - CIPCDDI, instituída no âmbito da Secretaria de Atenção à Saúde, terá a incumbência de acompanhar e avaliar o Programa. (Origem: PRT MS/GM 2362/2005, Art. 3º, § 1º)
§ 2º Os objetivos, indicadores de processo e de resultados, metas e atribuições dos entes governamentais e outros agentes envolvidos no Programa Nacional de Controle dos Distúrbios por Deficiência de Iodo serão detalhados na norma técnico-operacional específica, elaborada pela CIPCDDI. (Origem: PRT MS/GM 2362/2005, Art. 3º, § 2º)
Art. 300. São atribuições do Ministério da Saúde: (Origem: PRT MS/GM 2362/2005, Art. 4º)
I - estabelecer as diretrizes técnico-operacionais do Pró-Iodo e definir estratégia de divulgação aos estados e aos municípios; (Origem: PRT MS/GM 2362/2005, Art. 4º, I)
II - capacitar os responsáveis técnicos estaduais para prestar apoio aos municípios na operacionalização, na avaliação e no monitoramento do Pró-Iodo, bem como aos laboratórios de análises clínicas oficiais; (Origem: PRT MS/GM 2362/2005, Art. 4º, II)
III - elaborar manual técnico-operacional e materiais de apoio para execução e acompanhamento de ações específicas para a prevenção e o controle dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, III)
IV - promover a produção e a distribuição de materiais educativos e informativos, para profissionais de saúde e da educação, indústrias produtoras de sal e para população em geral, com apoio dos componentes da CIPCDDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, IV)
V - promover ações educativas e de comunicação, com vistas a esclarecer a população sobre a importância do consumo de iodo, bem como sobre o seu papel na prevenção dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, V)
VI - identificar as áreas caracterizadas como críticas e intensificar as linhas de ação do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 4º, VI)
VII - delinear, desenvolver e apoiar estudos e pesquisas que avaliem os processos e os resultados de impacto do Pró-Iodo em nível nacional, regional e local; (Origem: PRT MS/GM 2362/2005, Art. 4º, VII)
VIII - apoiar e fomentar a realização de inquéritos e levantamentos epidemiológicos referentes às patologias decorrentes dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 4º, VIII)
IX - estabelecer parcerias com outras instâncias do Ministério da Saúde, órgãos e instituições governamentais e não-governamentais, para o fomento de atividades complementares, com o objetivo de promover ações destinadas à prevenção e ao controle dos DDI; e (Origem: PRT MS/GM 2362/2005, Art. 4º, IX)
X - acompanhar a implantação e a implementação do Pró-Iodo, e monitorar seus resultados em âmbito nacional. (Origem: PRT MS/GM 2362/2005, Art. 4º, X)
Art. 301. São atribuições da Agência Nacional de Vigilância Sanitária (ANVISA): (Origem: PRT MS/GM 2362/2005, Art. 5º)
I - participar da coordenação, em âmbito nacional, do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 5º, I)
II - coordenar e regulamentar as ações de controle higiênico-sanitário dos estabelecimentos beneficiadores de sal e do produto exposto à comercialização; (Origem: PRT MS/GM 2362/2005, Art. 5º, II)
III - analisar e divulgar, sistematicamente, os resultados do controle e do monitoramento de iodação do sal para consumo humano; (Origem: PRT MS/GM 2362/2005, Art. 5º, III)
IV - definir estratégias de intervenção para promover, no comércio, a oferta de sal devidamente iodado; (Origem: PRT MS/GM 2362/2005, Art. 5º, IV)
V - promover a inserção dos laboratórios oficiais de bromatologia em programas de controle de qualidade analítica; e (Origem: PRT MS/GM 2362/2005, Art. 5º, V)
VI - promover a sensibilização do setor produtivo com vistas a atender à legislação sanitária vigente. (Origem: PRT MS/GM 2362/2005, Art. 5º, VI)
Art. 302. São atribuições comuns da Secretaria Estadual de Saúde e do órgão responsável pela vigilância sanitária estadual: (Origem: PRT MS/GM 2362/2005, Art. 6º)
I - designar uma área técnica responsável para coordenar, em âmbito estadual, as atividades relacionadas ao Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 6º, I)
II - divulgar as normas operacionais do Pró-Iodo aos municípios; (Origem: PRT MS/GM 2362/2005, Art. 6º, II)
III - acompanhar a implementação das ações do Pró-Iodo nos municípios; (Origem: PRT MS/GM 2362/2005, Art. 6º, III)
IV - integrar os laboratórios oficiais no programa de controle de qualidade analítica; (Origem: PRT MS/GM 2362/2005, Art. 6º, IV)
V - promover a sensibilização do setor produtivo com vistas a atender à legislação sanitária vigente; e (Origem: PRT MS/GM 2362/2005, Art. 6º, V)
VI - capacitar permanentemente os técnicos das Vigilâncias Sanitárias Estaduais na inspeção de indústrias beneficiadoras de sal e na aplicação sistematizada da legislação higiênico-sanitária. (Origem: PRT MS/GM 2362/2005, Art. 6º, VI)
Art. 303. São atribuições específicas da Secretaria Estadual de Saúde: (Origem: PRT MS/GM 2362/2005, Art. 7º)
I - capacitar os técnicos municipais no que se refere à operacionalização, à avaliação e ao monitoramento do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 7º, I)
II - elaborar materiais educativos e informativos sobre a prevenção e o controle dos DDI para profissionais de saúde e da educação e para a população em geral; (Origem: PRT MS/GM 2362/2005, Art. 7º, II)
III - participar do monitoramento do estado nutricional de iodo, que será promovido e coordenado pelo nível federal; e (Origem: PRT MS/GM 2362/2005, Art. 7º, III)
IV - avaliar o desempenho e o impacto do Pró-Iodo em nível estadual. (Origem: PRT MS/GM 2362/2005, Art. 7º, IV)
Parágrafo Único. Para o cumprimento do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios de cooperação com os estados. (Origem: PRT MS/GM 2362/2005, Art. 7º, Parágrafo Único)
Art. 304. São atribuições específicas do órgão responsável pela vigilância sanitária estadual: (Origem: PRT MS/GM 2362/2005, Art. 8º)
I - efetuar o controle higiênico-sanitário dos estabelecimentos beneficiadores de sal, com base nos critérios estabelecidos na legislação específica; (Origem: PRT MS/GM 2362/2005, Art. 8º, I)
II - realizar o monitoramento do sal para o consumo humano exposto à comercialização; e (Origem: PRT MS/GM 2362/2005, Art. 8º, II)
III - divulgar os resultados estaduais do Pró-Iodo e remetê-los à ANVISA. (Origem: PRT MS/GM 2362/2005, Art. 8º, III)
Art. 305. São atribuições comuns da Secretaria Municipal de Saúde e do órgão responsável pela vigilância sanitária municipal: (Origem: PRT MS/GM 2362/2005, Art. 9º)
I - designar uma área técnica responsável para coordenar, em âmbito municipal, o Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 9º, I)
II - implementar as normas técnico-operacionais do Pró-Iodo tanto na rotina dos serviços de saúde como nas visitas domiciliares da Equipe de Saúde da Família; e (Origem: PRT MS/GM 2362/2005, Art. 9º, II)
III - promover a sensibilização do setor produtivo e do comércio com vistas a atender à legislação sanitária vigente. (Origem: PRT MS/GM 2362/2005, Art. 9º, III)
Parágrafo Único. O órgão responsável pela vigilância sanitária municipal terá as suas atribuições definidas pelo órgão responsável pela vigilância sanitária estadual, em consonância com o tipo de gestão do Sistema Único de Saúde do município. (Origem: PRT MS/GM 2362/2005, Art. 9º, Parágrafo Único)
Art. 306. São atribuições específicas da Secretaria Municipal de Saúde: (Origem: PRT MS/GM 2362/2005, Art. 10)
I - garantir a capacitação de pessoal para a operacionalização, a avaliação e o monitoramento do Pró-Iodo; (Origem: PRT MS/GM 2362/2005, Art. 10, I)
II - desenvolver ações educativas e de comunicação, com vistas a esclarecer a população sobre a importância do consumo de sal iodado, bem como sobre o seu papel na prevenção dos DDI; (Origem: PRT MS/GM 2362/2005, Art. 10, II)
III - garantir a distribuição de materiais educativos e informativos para profissionais de saúde e da educação e para a população em geral; (Origem: PRT MS/GM 2362/2005, Art. 10, III)
IV - promover esforços intra e interinstitucionais para a confecção de materiais educativos e informativos, com vistas a fomentar a nutrição ótima de Iodo na população local; e (Origem: PRT MS/GM 2362/2005, Art. 10, IV)
V - participar das ações de monitoramento do impacto da iodação do sal na saúde da população. (Origem: PRT MS/GM 2362/2005, Art. 10, V)
Parágrafo Único. Fica facultado às Secretarias Municipais de Saúde o estabelecimento de parcerias com outras instituições. (Origem: PRT MS/GM 2362/2005, Art. 10, Parágrafo Único)
Art. 307. O órgão responsável pela vigilância sanitária municipal terá suas atribuições definidas pelo órgão responsável pela vigilância sanitária estadual, em consonância com o tipo de gestão do Sistema Único de Saúde do município. (Origem: PRT MS/GM 2362/2005, Art. 11)
Art. 308. Compete aos Conselhos Estaduais e Municipais de Saúde realizar o controle social do Programa, bem como acompanhar todo o processo operacional dele no seu âmbito de atuação. (Origem: PRT MS/GM 2362/2005, Art. 12)
Parágrafo Único. Para que esse controle seja efetuado, os estados e os municípios deverão tornar disponíveis as informações sobre a operacionalização do Programa. (Origem: PRT MS/GM 2362/2005, Art. 12, Parágrafo Único)
Art. 309. Compete ao Conselho Nacional de Saúde, por intermédio da Comissão Intersetorial de Alimentação e Nutrição, realizar o controle social do Programa em nível nacional. (Origem: PRT MS/GM 2362/2005, Art. 13)
Art. 310. Compete aos entes governamentais e não-governamentais empenharem-se na articulação necessária para o cumprimento dos objetivos e metas estabelecidos para o Pró- Iodo. (Origem: PRT MS/GM 2362/2005, Art. 14)
Art. 311. Fica definido que a cada três anos será realizado o monitoramento do impacto da iodação do sal na saúde da população, conforme o que for estabelecido em Protocolo Específico para Monitoramento do Impacto da Iodação do Sal na Saúde da População. (Origem: PRT MS/GM 2362/2005, Art. 15)
§ 1º A avaliação de impacto do Pró-Iodo deverá contemplar a análise de sua eficácia, efetividade e eficiência a curto, médio e longos prazos. (Origem: PRT MS/GM 2362/2005, Art. 15, § 1º)
§ 2º Para fins do disposto neste artigo, o Ministério da Saúde poderá celebrar convênios com os referidos Centros Colaboradores em Alimentação e Nutrição, bem como com instituições de ensino e pesquisa com conhecimento técnico-científico. (Origem: PRT MS/GM 2362/2005, Art. 15, § 2º)
Art. 312. A Secretaria de Atenção à Saúde, do Ministério da Saúde, adotará as providências necessárias ao cumprimento das disposições constantes neste Capítulo. (Origem: PRT MS/GM 2362/2005, Art. 16)
Seção I
Da Comissão Interinstitucional para a Prevenção e o Controle dos Distúrbios por Deficiência de Iodo
Art. 313. Fica instituída Comissão Interinstitucional para a Prevenção e o Controle dos Distúrbios por Deficiência de Iodo. (Origem: PRT MS/GM 520/2005, Art. 1º)
Art. 314. A Comissão Interinstitucional de que trata o art. 313 será composta por representantes dos órgãos/entidades abaixo relacionados e atuará sob a coordenação da Secretaria de Atenção à Saúde/MS: (Origem: PRT MS/GM 520/2005, Art. 2º)
I - Ministério da Saúde: (Origem: PRT MS/GM 520/2005, Art. 2º, I)
a) Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 520/2005, Art. 2º, I, a)
b) Secretaria de Vigilância em Saúde; e (Origem: PRT MS/GM 520/2005, Art. 2º, I, b)
c) Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 520/2005, Art. 2º, I, c)
II - Ministério da Agricultura, Pecuária e Abastecimento; (Origem: PRT MS/GM 520/2005, Art. 2º, II)
III - Ministério da Educação; (Origem: PRT MS/GM 520/2005, Art. 2º, III)
IV - Organização Pan-Americana da Saúde/Organização Mundial da Saúde; (Origem: PRT MS/GM 520/2005, Art. 2º, IV)
V - Fundo das Nações Unidas para a Infância; (Origem: PRT MS/GM 520/2005, Art. 2º, V)
VI - Vigilância Sanitária Estadual do Rio Grande do Norte; (Origem: PRT MS/GM 520/2005, Art. 2º, VI)
VII - Vigilância Sanitária Estadual do Rio de Janeiro; (Origem: PRT MS/GM 520/2005, Art. 2º, VII)
VIII - Associação Brasileira de Extratores e Refinadores de Sal; (Origem: PRT MS/GM 520/2005, Art. 2º, VIII)
IX - Sindicato dos Moageiros e Refinadores de Sal do Rio Grande do Norte; (Origem: PRT MS/GM 520/2005, Art. 2º, IX)
X - Sindicato da Indústria de Extração de Sal do Rio Grande do Norte; (Origem: PRT MS/GM 520/2005, Art. 2º, X)
XI - Sindicato da Indústria de Refino de Sal do Rio de Janeiro; (Origem: PRT MS/GM 520/2005, Art. 2º, XI)
XII - Associação Brasileira das Indústrias de Alimentação; e (Origem: PRT MS/GM 520/2005, Art. 2º, XII)
XIII - Instituto Brasileiro de Defesa do Consumidor. (Origem: PRT MS/GM 520/2005, Art. 2º, XIII)
Art. 315. A Comissão terá as seguintes atribuições: (Origem: PRT MS/GM 520/2005, Art. 3º)
I - acompanhar e avaliar o Programa Nacional de Prevenção e Controle dos Distúrbios por Deficiência de Iodo, designado por Pró-Iodo, bem como discutir a efetividade das ações adotadas; e (Origem: PRT MS/GM 520/2005, Art. 3º, I)
II - estabelecer estratégias de informação, de comunicação, de educação e de mobilização social com vistas à garantia da nutrição ótima de iodo. (Origem: PRT MS/GM 520/2005, Art. 3º, II)
Parágrafo Único. Cada um dos membros da Comissão Interinstitucional deverá compilar e fornecer toda informação necessária a ser analisada em conjunto para o acompanhamento e avaliação periódica dos resultados do Programa. (Origem: PRT MS/GM 520/2005, Art. 3º, Parágrafo Único)
Art. 316. A Comissão Interinstitucional ora instituída poderá convidar cientistas, especialistas ou pesquisadores de instituições acadêmicas ou científicas, de organismos internacionais, bem como representantes da sociedade civil para colaborarem na análise de assuntos específicos. (Origem: PRT MS/GM 520/2005, Art. 4º)
Art. 317. A Comissão Interinstitucional reunir-se-á, ordinariamente, duas vezes por ano, e, extraordinariamente, quando convocada por seu coordenador ou por solicitação de qualquer um de seus membros, cabendo neste último caso a apreciação do coordenador. (Origem: PRT MS/GM 520/2005, Art. 5º)
Art. 318. As competências e atribuições de cada componente da Comissão serão estabelecidas na norma técnico-operacional do Pró-Iodo. (Origem: PRT MS/GM 520/2005, Art. 6º)
Art. 319. As deliberações decorrentes da Comissão serão submetidas à aprovação do Secretário de Atenção à Saúde, do Ministério da Saúde. (Origem: PRT MS/GM 520/2005, Art. 7º)
CAPÍTULO XIII
DA VIGILÂNCIA EPIDEMIOLÓGICA
Seção I
Da Lista Nacional de Doenças e Agravos a Serem Monitorados por meio da Estratégia de Vigilância em Unidades Sentinelas e suas Diretrizes
Art. 320. Esta Seção define a lista nacional de doenças e agravos, na forma do Anexo XLIII , a serem monitorados por meio da estratégia de vigilância em unidades sentinelas e suas diretrizes. (Origem: PRT MS/GM 205/2016, Art. 1º)
Art. 321. Para efeito desta Seção considera-se vigilância sentinela o modelo de vigilância realizada a partir de estabelecimento de saúde estratégico para a vigilância de morbidade, mortalidade ou agentes etiológicos de interesse para a saúde pública, com participação facultativa, segundo norma técnica específica estabelecida pela Secretaria de Vigilância em Saúde (SVS/MS). (Origem: PRT MS/GM 205/2016, Art. 2º)
Art. 322. As autoridades de saúde garantirão o sigilo das informações pessoais integrantes da notificação compulsória, que estejam sob sua responsabilidade, conforme preconiza a Lei nº 12.527, de 18 de novembro de 2011. (Origem: PRT MS/GM 205/2016, Art. 3º)
Art. 323. As autoridades de saúde garantirão a divulgação atualizada dos dados públicos da notificação compulsória para profissionais de saúde, órgãos de controle social e população em geral. (Origem: PRT MS/GM 205/2016, Art. 4º)
Art. 324. A SVS/MS, as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios divulgarão, em endereço eletrônico oficial, o número de telefone, fax, endereço de e-mail institucional ou formulário para notificação compulsória. (Origem: PRT MS/GM 205/2016, Art. 5º)
Seção I -A
Da Rede Nacional de Serviços de Verificação de Óbito e Esclarecimento da Causa Mortis
(Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-A. Fica instituída a Rede Nacional de Serviços de Verificação de Óbito e Esclarecimento da Causa Mortis (RNSVO), integrante do Sistema Nacional de Vigilância Epidemiológica (SNVE). (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Parágrafo único. A RNSVO é composta pelos Serviços de Verificação de Óbito e Esclarecimento da Causa Mortis (SVO) instituídos nos municípios, estados e no Distrito Federal. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-B. A RNSVO tem como finalidade: (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
I - promover a qualificação e a melhoria dos dados e informações, no âmbito dos Estados, Distrito Federal e Municípios, sobre o esclarecimento da causa mortis de todos os óbitos sem elucidação diagnóstica, inclusive nos casos de morte natural com ou sem assistência médica; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
II - fortalecer a integração e qualificação dos dados e informações sobre mortalidade no âmbito da União, Estados, Distrito Federal e Municípios, por meio do Sistema de Informações sobre Mortalidade (SIM); (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
III - promover a integração dos SVOs que compõem a RNSVO, por meio do compartilhamento de informações e da capacitação dos médicos e técnicos que atuam nos referidos serviços; e (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
IV - subsidiar a definição e implementação de políticas de saúde. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Parágrafo único. O SVO deve priorizar o esclarecimento da causa mortis de casos de interesse da vigilância epidemiológica e óbitos suspeitos de causa de notificação compulsória ou de agravo inusitado à saúde. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-C. Os SVOs deverão executar as seguintes funções: (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
I - realizar autópsia para o esclarecimento da causa mortis natural com ou sem assistência médica, sem elucidação diagnóstica, incluindo os casos encaminhados pelo Instituto Médico Legal (IML); (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
II - transferir ao IML os casos: (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
a) confirmados ou suspeitos de morte por causas externas, verificados antes ou no decorrer da autópsia; e (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
b) em estado avançado de decomposição. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
III - comunicar ao órgão municipal competente os casos de corpos não identificados ou não-reclamados, após a realização da autópsia, para que seja emitida a Declaração de Óbito, realizado o registro civil e o sepultamento; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
IV - notificar os óbitos suspeitos de causa de notificação compulsória ou de agravo inusitado à saúde aos órgãos estaduais e municipais de vigilância epidemiológica; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
V - garantir a emissão das Declarações de Óbito dos cadáveres examinados no serviço, por profissionais médicos da instituição ou contratados para este fim; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
VI - encaminhar, mensalmente, ao gestor local do Sistema de Informações sobre Mortalidade (SIM): (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
a) lista de autópsias realizadas; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
b) cópias das Declarações de Óbito emitidas na instituição; e (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
c) atualização das informações constantes da Declaração de Óbito, quando for o caso. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-D. Para integrar a RNSVO, os SVOs deverão atender às seguintes obrigações, entre outras: (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
I - funcionar diariamente e de modo ininterrupto, para a recepção de corpos; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
II - cumprir a legislação sanitária vigente; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
III - adotar as medidas de biossegurança pertinentes para garantir a saúde dos trabalhadores e usuários do serviço; e (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
IV - contar com serviço próprio de remoção de cadáver ou com serviço de remoção contratado ou conveniado, para viabilizar o atendimento e o cumprimento das competências estabelecidas no art. 324-C. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-E. A responsabilidade técnica do SVO deve ser exercida por médico regularmente inscrito no Conselho Regional de Medicina do Estado onde o SVO for implantado. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 1º A responsabilidade de trata caput será exercida preferencialmente por médico patologista. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 2º Os exames necroscópicos só poderão ser realizados nas dependências dos SVO e por médico patologista. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 3º Os exames histopatológicos, hematológicos, bioquímicos, de microbiologia, toxicológicos, sorológicos e imuno-histoquímicos, poderão ser realizados fora das dependências dos SVOs, em laboratórios públicos ou privados, legalmente registrados no órgão de vigilância sanitária competente e nos conselhos regionais de profissionais do respectivo estado ou Distrito Federal. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 4º Nos casos previstos no § 3º, o laboratório estará submetido às normas técnicas e éticas vigentes, observado os sigilos legais. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 5º Caberá ao médico do SVO a emissão da Declaração de Óbito nas autópsias a que proceder. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-F. A criação de SVO dependerá de pactuação na Comissão Intergestores Bipartite (CIB), observadas as seguintes localidades prioritárias para implantação: (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
I - capitais ou Distrito Federal; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
II - regiões de fronteira; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
III - municípios com faculdade de medicina ou município circunvizinhos; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
IV - municípios com alta proporção de óbitos com a causa básica mal definida ou com alta ocorrência domiciliar; (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
V - municípios com alta taxa de mortalidade infantil; e (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
VI - municípios com elevada ocorrência de óbito materno ou de mulher em idade fértil. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-G. As secretarias de saúde dos estados, municípios e Distrito Federal poderão celebrar acordo ou convênio com instituição pública de ensino superior, instituições filantrópicas, Secretaria de Segurança Pública ou equivalente para a execução das funções do SVO. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-H. A área de abrangência do SVO deverá ser pactuada na CIB, podendo contemplar o território de um município ou mesmo de um grupo de municípios de uma ou mais regiões de saúde. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Parágrafo único. A gestão do SVO poderá ser municipal, estadual ou do Distrito Federal, gerenciado pela respectiva Secretaria de Saúde.
Art. 324-I. A integração à RNSVO está condicionada à solicitação formal à Secretaria de Vigilância em Saúde (SVS/MS) pelo Gestor Municipal, Estadual ou do Distrito Federal, a depender da gestão do SVO. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 1º Os critérios para integração à RNSVO serão definidos em ato específico do Secretário de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
§ 2º A solicitação de que dispõe o caput será avaliada pela Coordenação-Geral de Informações e Análises Epidemiológicas do Departamento de Análise em Saúde e Vigilância das Doenças Não Transmissíveis (CGIAE/DASNT/SVS). (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Art. 324-J. Compete à Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS) a adoção das medidas e procedimentos necessários para o pleno funcionamento e efetividade da RNSVO. (Redação dada pela PRT GM/MS nº 1.764 de 29.07.2021)
Seção II
Da Vigilância Sentinela da Influenza
Art. 325. A Vigilância Sentinela da Influenza tem como objetivo fortalecer a vigilância epidemiológica da influenza através da identificação da circulação dos vírus influenza e de outros vírus respiratórios, de acordo com a patogenicidade, a virulência em cada período sazonal, a existência de situações inusitadas ou o surgimento de novo subtipo viral. (Origem: PRT MS/GM 183/2014, Art. 26) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Parágrafo Único. A Vigilância Sentinela da Influenza também tem por finalidade o isolamento de espécimes virais e o respectivo envio oportuno ao Centro Colaborador de Influenza (CCI) de referência para as Américas e para a Organização Mundial da Saúde (OMS), visando à adequação da vacina da influenza sazonal. (Origem: PRT MS/GM 183/2014, Art. 26, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 326. A Vigilância Sentinela da Influenza possuirá 2 (dois) componentes, definidos de acordo com a população: (Origem: PRT MS/GM 183/2014, Art. 27) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - Vigilância Sentinela de Síndrome Gripal (SG), com monitoramento da vigilância agregada por Semana Epidemiológica (SE) dos atendimentos por SG; e (Origem: PRT MS/GM 183/2014, Art. 27, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - Vigilância Sentinela de Síndrome Respiratória Aguda Grave (SRAG) em UTI, com monitoramento da vigilância agregada por Semana Epidemiológica (SE) pelo CID 10: J09 a J18. (Origem: PRT MS/GM 183/2014, Art. 27, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 327. Para a execução das ações de Vigilância Sentinela de SG, o ente federativo habilitado ao recebimento do incentivo financeiro deverá assumir as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 29) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - coletar 5 (cinco) amostras clínicas dos casos de SG por semana, de modo a atingir o mínimo de 80% (oitenta por cento) de coleta de material da meta semanal, com oportuna digitação; e (Origem: PRT MS/GM 183/2014, Art. 29, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - digitar no Sistema de Informação da Vigilância Epidemiológica da Gripe (SIVEP-Gripe) agregado semanal por sexo e faixa etária dos atendimentos de SG e do total de atendimentos da Unidade Sentinela em, no mínimo, 90% (noventa por cento) das semanas epidemiológicas do ano. (Origem: PRT MS/GM 183/2014, Art. 29, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 328. Para a execução de ações de Vigilância Sentinela de SRAG, o ente federativo habilitado ao recebimento do incentivo financeiro deverá assumir as seguintes responsabilidades: (Origem: PRT MS/GM 183/2014, Art. 30) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - coletar amostras de no mínimo 80% (oitenta por cento) dos casos de SRAG notificados nas UTI incluídas na Vigilância da SRAG, com o devido envio de amostra aos LACEN e incluir os casos no sistema de informação SIVEP-Gripe; e (Origem: PRT MS/GM 183/2014, Art. 30, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - digitar semanalmente os dados do número de internações do CID 10: J09 a J18, de forma agregada, das UTI participantes, no SIVEP-Gripe, com uma regularidade de no mínimo 90% (noventa por cento) das semanas epidemiológicas do ano. (Origem: PRT MS/GM 183/2014, Art. 30, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 329. Para a implantação da Vigilância da SG e da SRAG, os entes federativos observarão o parâmetro populacional descrito no Anexo XLVI . (Origem: PRT MS/GM 183/2014, Art. 31) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 330. O ente federativo será desabilitado das ações de Vigilância Sentinela de SG e de SRAG na hipótese de descumprimento das metas estabelecidas nos arts. 327 e 328 , por 2 (dois) semestres consecutivos. (Origem: PRT MS/GM 183/2014, Art. 33) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 331. A avaliação das ações de Vigilância Sentinela de SG e de SRAG será efetuada semestralmente pela SVS/MS, a partir do ano da habilitação, por intermédio do SIVEP-Gripe. (Origem: PRT MS/GM 183/2014, Art. 34) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Seção III
Do Serviço de Verificação de Óbito (SVO)
Art. 332. O SVO tem por atribuição promover ações que proporcionem, via autópsia, o esclarecimento da causa mortis de todos os óbitos, com ou sem assistência médica, sem elucidação diagnóstica, e em especial aqueles sob investigação epidemiológica. (Origem: PRT MS/GM 183/2014, Art. 14) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 1º Os SVOs estaduais e municipais compõem a Rede Nacional de Serviços de Verificação de Óbito e Esclarecimento da Causa Mortis, que integra o Sistema Nacional de Vigilância em Saúde. (Origem: PRT MS/GM 183/2014, Art. 14, § 1º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 2º Os SVOs serão de abrangência regional, cuja classificação será indicada em resolução da CIB. (Origem: PRT MS/GM 183/2014, Art. 14, § 2º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 333. Para a execução de ações de SVO, o estabelecimento de saúde atenderá aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 16) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - ter equipe composta por médico especialista em patologia como responsável técnico e auxiliar em patologia; e (Origem: PRT MS/GM 183/2014, Art. 16, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - contar com suporte laboratorial para exames complementares. (Origem: PRT MS/GM 183/2014, Art. 16, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 334. O ente federativo será desabilitado das ações e serviços de SVO, total ou parcialmente, caso seus SVO habilitados deixem de notificar, no Sistema de Informações sobre Mortalidade (SIM), registro como atestante da Declaração de Óbito (DO), pelo prazo de 6 (seis) meses consecutivos. (Origem: PRT MS/GM 183/2014, Art. 18) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 1º A desabilitação será total quando todos os SVOs habilitados não cumprirem o estabelecido no "caput". (Origem: PRT MS/GM 183/2014, Art. 18, § 1º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 2º A desabilitação será parcial quando o descumprimento do estabelecido no "caput" não abranger todos os SVO habilitados. (Origem: PRT MS/GM 183/2014, Art. 18, § 2º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 3º A desabilitação parcial será realizada de forma proporcional ao número total de SVO do ente federativo habilitado. (Origem: PRT MS/GM 183/2014, Art. 18, § 3º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 335. A avaliação do SVO será efetuada semestralmente pela SVS/MS por meio do SIM, a partir do ano seguinte ao da habilitação. (Origem: PRT MS/GM 183/2014, Art. 19) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Seção IV
Programa de Treinamento em Epidemiologia Aplicada aos Serviços do Sistema Único de Saúde - Programa EpiSUS.
(Redação dada pela PRT GM/MS nº 1430 de 11.06.2018)
(Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-A. Fica instituído o Programa de Treinamento em Epidemiologia Aplicada aos Serviços do Sistema Único de Saúde - Programa EpiSUS. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-B. O Programa EpiSUS tem como objetivo geral aprimorar a capacidade técnica de profissionais de nível superior, por meio de treinamento em serviço para atuar frente às investigações epidemiológicas, tais como surtos e emergências em saúde pública no âmbito dos serviços do Sistema Único de Saúde. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-C. São objetivos específicos do Programa EpiSUS: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
I - capacitar profissionais de nível superior em epidemiologia de campo e vigilância em saúde; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
II - desenvolver capacidade técnica-científica para colaborar na resolução de problemas de saúde pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
III - colaborar na resposta às emergências em saúde pública, principalmente em investigações de surtos; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
IV - contribuir para a difusão do conhecimento técnico-científico, por meio da comunicação científica escrita e oral, da divulgação de resultados de investigações de surtos e de outros estudos desenvolvidos durante o treinamento; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
V - colaborar no planejamento e condução de investigações epidemiológicas de surtos/epidemias e outros eventos de saúde pública, incluindo a coleta, a análise, a descrição e a interpretação de dados para orientar a rápida tomada de decisão; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
VI - direcionar as ações de prevenção e controle de eventos de importância em saúde pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
VII - colaborar e conduzir avaliações de sistemas de vigilância em saúde ou programas específicos de saúde pública e análise de dados gerados pelos sistemas de informação; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
VIII - conduzir pesquisas direcionadas às necessidades das áreas de vigilância em saúde, desenvolvendo estudos de caráter técnico-científico; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
IX - colaborar no planejamento e execução de estudos epidemiológicos, incluindo a coleta, a análise, a descrição e a interpretação de dados para orientar a tomada de decisão, de forma rápida. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-D. Para o alcance dos objetivos do Programa EpiSUS, serão realizados processos seletivos para a escolha dos participantes de cada turma de treinamento. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Parágrafo único. Os processos seletivos de que trata o caput serão realizados por meio de editais de chamada pública específicos, que estabelecerão, entre outras disposições, as condições e requisitos para a participação, a manutenção e a conclusão dos interessados no treinamento ofertado. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-E. As atividades de gestão do Programa EpiSUS ficarão a cargo do Centro de Informações Estratégicas em Vigilância em Saúde - CIEVS, instituído pela Portaria nº 30/SVS/MS, de 7 de julho de 2005, ao qual competirá: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
I - coordenar o processo seletivo dos candidatos ao Programa EpiSUS; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
II - coordenar e desenvolver as atividades formativas de acordo com a grade curricular padronizada para os programas de treinamento em epidemiologia de campo, considerando os indicadores de qualidade definidos no âmbito da Rede de Programas de Treinamento em Epidemiologia e Intervenções em Saúde Pública - TEPHINET; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
III - assegurar a participação dos profissionais em treinamento em investigações de surtos e epidemias ou situações de risco para a saúde pública com relevância local, regional, nacional ou internacional, de modo complementar ou suplementar, em articulação com as demais unidades competentes e, quando necessário, em missões do Ministério da Saúde; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
IV - propiciar oportunidades para a capacitação em investigação de surtos ou outros eventos de saúde pública. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-F. O acompanhamento e a execução de todas as etapas de realização do processo seletivo serão realizados pela Equipe de Seleção do Programa EpiSUS. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Parágrafo único. A equipe de que trata o caput será instituída por ato da Secretaria de Vigilância em Saúde - SVS/MS. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-G. Poderão se candidatar ao processo seletivo para o treinamento no EpiSUS profissionais de nível superior das seguintes áreas: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
I - Biologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
II - Biomedicina; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
III - Educação Física; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
IV - Enfermagem; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
V - Farmácia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
VI - Fisioterapia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
VII - Fonoaudiologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
VIII - Medicina; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
IX - Medicina Veterinária; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
X - Nutrição; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
XI - Odontologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
XII - Psicologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
XIII - Saúde Coletiva/Saúde Pública; ou (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
XIV - Terapia Ocupacional. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-H. Os candidatos do processo seletivo para o treinamento do Programa EpiSUS deverão preencher, além de outras disposições constantes no edital, os seguintes requisitos: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
I - possuir, pelo menos, 1 (um) curso de pós-graduação, compreendendo cursos de especialização, com carga horária igual ou superior a 360 (trezentos e sessenta) horas, residência médica, residência multidisciplinar, mestrado ou doutorado em uma das seguintes áreas: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
a) epidemiologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
b) infecção hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
c) infectologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
d) medicina preventiva e social; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
e) saúde coletiva/pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
f) saúde da família, saúde do trabalhador; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
g) vigilância em saúde; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
h) vigilância epidemiológica; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
i) vigilância hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
j) vigilância sanitária; ou (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
k) vigilância em saúde ambiental; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
II - comprovar, pelo menos, 1 (um) ano de experiência profissional em cargos de nível superior, em uma das áreas listadas no art. 335-H; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
III - estar registrado no conselho da categoria profissional correspondente (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-I. Os profissionais de áreas não elencadas no art. 335-H poderão participar do processo seletivo para o treinamento do Programa EpiSUS, desde que preencham os seguintes requisitos: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
I - possuir formação de nível superior; e (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
II - possuir doutorado concluído e comprovar, pelo menos, 1 (um) ano de experiência profissional em cargos de nível superior, ambos nas seguintes áreas: (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
a) epidemiologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
b) infecção hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
c) infectologia; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
d) medicina preventiva e social; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
e) saúde coletiva/pública; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
f) saúde da família, saúde do trabalhador; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
g) vigilância em saúde; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
h) vigilância epidemiológica; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
i) vigilância hospitalar; (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
j) vigilância sanitária; ou (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
k) vigilância em saúde ambiental. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Art. 335-J. As atividades desenvolvidas no âmbito do Programa EpiSUS poderão ser compartilhadas e aprimoradas por meio da participação em eventos e cooperações internacionais relacionados à sua área de atuação. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Parágrafo único. A participação do Ministério da Saúde em cooperações internacionais deve observar o disposto no Art. 49, inciso I, da Constituição, quando acarretar encargos ou compromissos gravosos ao patrimônio nacional. (Redação dada pela PRT GM/MS nº 1430 de 11.06.2018) (Revogado pela PRT GM/MS Nº 4.339 de 16.12.2022)
Seção V
Da Vigilância Sentinela da Síndrome de Corrimento Uretral Masculino
(Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-K. Fica instituída a Vigilância Sentinela da Síndrome do Corrimento Uretral Masculino (VSCUM). (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Parágrafo Único. A Vigilância Sentinela da Síndrome do Corrimento Uretral Masculino é o método de monitoramento de dados em que unidades de saúde habilitadas realizam ações e enviam informações, conforme determinado pelo Ministério da Saúde, relacionadas ao combate da Síndrome do Corrimento Uretral Masculino. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-L. A VSCUM possui os seguintes objetivos: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
I - fortalecer ações de prevenção da Infecção Sexualmente Transmissível (IST) que causa corrimento uretral; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
II - subsidiar recomendação nacional para o tratamento da síndrome; e (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
III - monitorar a susceptibilidade de gonococos aos antimicrobianos. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-M. A unidade de saúde para solicitar a habilitação como unidade para a Vigilância Sentinela da Síndrome do Corrimento Uretral Masculino deverá: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
I - estar incluída no Cadastro Nacional de Estabelecimentos de Saúde (CNES); (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
II - enviar, por meio da Secretaria de Saúde Estadual, a SVS/MS as seguintes informações: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
a) fluxo de encaminhamento de amostras para laboratório de apoio local que deverá realizar o cultivo, isolamento e congelamento das cepas sugestivas de Neisseriagonorrhoeae para posterior análise da susceptibilidade aos antimicrobianos pelo Laboratório de Referência Nacional; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
b) fluxo de encaminhamento de amostras para laboratório de apoio local que fará parte da Rede Nacional de Laboratório para Diagnóstico Molecular de Clamídia e Gonococo (em implantação junto aos Estados); (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
c) número de atendimentos para infecções sexualmente transmissíveis sobre o total de atendimentos realizados pela unidade; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
d) indicação das atividades realizadas pelo serviço referentes ao diagnóstico e assistência a pacientes com sintomas de IST; e (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
e) demonstração de recursos humanos adequados para o cumprimento das funções estabelecidas no art. 335-O. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-N. Somente será habilitada uma unidade de saúde por Estado ou Distrito Federal como unidade sentinela, devendo ser priorizado os serviços localizados nas capitais da unidade da federação, devendo a escolha feita pela Secretaria de Vigilância em Saúde recair sobre as unidades que comprovaram por meio das informações de que trata o art. 335- M: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
I - caracterizar-se como um Serviço de Atenção à Saúde com expertise no manejo de pacientes com sintomas de IST; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
II - constituir-se um serviço de referência no diagnóstico e na assistência a pacientes com sintomas de IST; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
III - excelente fluxo de encaminhamento ao Laboratório de Referência Local (LRL) para cultivo, isolamento e congelamento das cepas sugestivas de Neisseriagonorrhoeae para posterior análise da susceptibilidade aos antimicrobianos pelo Laboratório de Referência Nacional (LRN); (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
IV - articulação com LRL para realização de Testes de Biologia Molecular para Clamídia e Gonorreia; e (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
V - possuir recursos humanos adequados para o cumprimento das funções estabelecidas no art. 335-O. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-O. Para execução das ações de Vigilância da Síndrome do Corrimento Uretral Masculino, a unidade sentinela habilitada deverá, mediante Termo de Declaração de Responsabilidade anexo, assumir as seguintes obrigações: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
I - notificar todos os corrimentos uretrais atendidos na unidade sentinela, nos termos desta Portaria; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
II - realizar coleta de dados epidemiológicos dos pacientes por meio de um formulário elaborado pelo Ministério da Saúde a ser disponibilizado por meio do Sistema de Informação de Agravos de Notificação - SINAN ou outro que venha a substituí-lo; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
III - realizar coleta e encaminhamento de amostras biológicas de, pelo menos, 80% das pessoas atendidas nas unidades sentinelas apresentando corrimento uretral, para realização de Testes de Biologia Molecular para Clamídia e Gonorreia pelo LRL; (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
IV - realizar, com a periodicidade a ser definida pelo Ministério da Saúde, o cultivo e isolamento de cepas sugestivas de Neisseriagonorrhoeae e encaminhar para o LRN, para posterior análise da susceptibilidade aos antimicrobianos, cabendo à unidade sentinela a articulação com demais instituições para o cumprimento deste item, quando necessário; e (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
V - realizar, conforme solicitação do Ministério da Saúde, a coleta e encaminhamento de amostras biológicas para investigação da etiologia do corrimento uretral por Biologia Molecular pelo LRN, visando à vigilância e monitoramento da susceptibilidade aos antimicrobianos dos demais patógenos que podem causar corrimento uretral, além da clamídia e do gonococo. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-P. O Ministério da Saúde disponibilizará: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
I - aos Laboratórios Centrais de Saúde Pública - LACEN ou àqueles indicados pelos Estados ou Distrito Federal, os insumos laboratoriais necessários para realização da Biologia Molecular para Detecção de Clamídia e Gonococo; e (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
II - às unidades sentinelas habilitadas: (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
a) os insumos necessários para realização da coleta de amostras, cultivo e isolamento das cepas sugestivas de Neisseriagonorrhoeae, bem como se responsabilizará pelo transporte dos isolados até o LRN; e (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
b) os insumos necessários para realização da coleta de amostras para investigação da etiologia do corrimento uretral por Biologia Molecular pelo LRN, bem como se responsabilizará pelo transporte dos isolados até o LRN. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-Q. A unidade sentinela será desabilitada das ações de "Vigilância sentinela do corrimento uretral e da resistência do gonococo aos antimicrobianos" na hipótese de descumprimento, injustificado, das obrigações previstas no art. 335 - O, por 4 (quatro) meses consecutivos. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Art. 335-R. A avaliação das ações de "Vigilância Sentinela da Síndrome do Corrimento Uretral Masculino" será efetuada anualmente pela SVS/MS, a partir do ano de habilitação. (Redação dada pela PRT GM/MS nº 1.553 de 17.06.2020)
Seção VI
Vigilância Epidemiológica Hospitalar
(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Art. 335-S. Fica instituída, no âmbito do Sistema Nacional de Vigilância Epidemiológica, a Vigilância Epidemiológica Hospitalar (VEH), com o objetivo de fortalecer e descentralizar a Vigilância Epidemiológica no âmbito hospitalar, proporcionando aos gestores elementos para apoiar a tomada de decisão frente aos eventos de interesse para saúde.(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Parágrafo único. A VEH consiste no conjunto de serviços, no âmbito hospitalar, que proporciona o conhecimento e a detecção de mudanças nos fatores determinantes e condicionantes da saúde individual e coletiva, com a finalidade de recomendar e adotar as medidas de prevenção e controle das doenças, transmissíveis e não-transmissíveis, e agravos à saúde.(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Art. 335-T. A VEH será executada pelos Núcleos Hospitalares de Epidemiologia (NHE), unidades intra-hospitalares que tem por objetivo oferecer informações estratégicas para a organização, preparação e resposta do serviço hospitalar no manejo de eventos de interesse à saúde, bem como subsidiar o planejamento e fortalecimento da vigilância em saúde local.(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Art. 335-U. Os NHE deverão desempenhar as seguintes atividades de VEH: (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
I - elaborar diagnóstico epidemiológico da unidade hospitalar; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
II - elaborar, implementar e revisar seu plano de trabalho anualmente; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
III - adotar o fluxo de notificação das doenças e agravos de notificação compulsória (DNC) e dos eventos de interesse para saúde pública estabelecidos pelo Ministério da Saúde; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
IV - notificar casos e óbitos ocorridos em âmbito hospitalar, alimentando oportunamente os sistemas de notificação oficiais do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
V - realizar a notificação negativa dos casos e óbitos, semanalmente, quando não houver casos de DNC no hospital;(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
VI - elaborar e manter um sistema de busca ativa para a detecção de infecções, eventos adversos, doenças e agravos de notificação compulsória e agravos relacionados ao trabalho nos pacientes internados e atendidos em pronto-socorro, unidades de internação e ambulatório; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
VII - elaborar e manter em operação sistema de busca ativa para detecção e notificação dos óbitos ocorridos no ambiente hospitalar, prioritariamente dos óbitos materno declarados de mulher em idade fértil, infantil e fetal e por doença infecciosa e mal definidos; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
VIII - monitorar, avaliar e divulgar o perfil de morbimortalidade hospitalar;(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
IX - notificar ao primeiro nível hierárquico superior da vigilância epidemiológica as DNC detectadas no âmbito hospitalar, de acordo com os instrumentos e fluxos de notificações definidos pelo Ministério da Saúde;(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
X - realizar a investigação epidemiológica das doenças, agravos, eventos constantes na lista nacional de doenças e agravos de notificação compulsória, detectados no ambiente hospitalar, em articulação com a secretaria municipal de saúde e com a secretaria estadual de saúde, incluindo as atividades de interrupção da cadeia de transmissão de casos e surtos, quando pertinentes, segundo as normas e procedimentos estabelecidos pelo Ministério da Saúde; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XI - cooperar com a investigação de surtos de Doenças de Notificação Compulsória e Infecções Relacionadas à Assistência à Saúde (Iras); (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XII - apoiar a investigação de óbitos maternos declarados e de mulheres em idade fértil ocorridos no ambiente hospitalar, em conjunto com a comissão de análise de óbitos e em articulação com a secretaria municipal de saúde e com a secretaria estadual de saúde;(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XIII - apoiar a investigação dos óbitos infantis e fetais ocorridos no ambiente hospitalar, em conjunto com a comissão de análise de óbitos e em articulação com a secretaria municipal de saúde e com a secretaria estadual de saúde; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XIV - apoiar investigação de óbitos potencialmente relacionados ao trabalho, ocorridos no ambiente hospitalar, em conjunto com a comissão de análise de óbitos e em articulação com a secretarias municipal de saúde e com a secretaria estadual de saúde; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XV - apoiar e desenvolver estudos epidemiológicos e operacionais, incluindo a avaliação de protocolos clínicos relacionados às DNC no ambiente hospitalar; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XVI - apoiar a Vigilância em Saúde do Trabalhador (Visat) na investigação epidemiológica das Doenças e Agravos relacionados ao Trabalho (Dart) de notificação compulsória, detectados em ambiente hospitalar, assim como no monitoramento, avaliação e divulgação do perfil de morbimortalidade por essas doenças e agravos; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XVII - manter comunicação ativa e sistemática com o Centro de Informações Estratégicas de Vigilância em Saúde (Cievs) sobre potenciais emergências em saúde pública; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XVIII - desenvolver processos de trabalho integrado aos demais setores da instituição, com o objetivo de responder às questões epidemiológicas da vigilância em saúde; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XIX - articular com outros serviços de vigilância em saúde para o desenvolvimento das ações de vigilância epidemiológica hospitalar, especialmente os Núcleos de Segurança do Paciente (NSP) e Comissões de Controle de Infecção Hospitalar (CCIH); (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XX - desenvolver processo de trabalho integrado aos setores estratégicos da unidade hospitalar, para fins de implementação das atividades de vigilância epidemiológica, com acesso às informações necessárias à detecção, monitoramento e encerramento de casos ou surtos sob investigação; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XXI - realizar vigilância dos processos e ambientes de trabalho, com vistas a orientar as mudanças das condições provocadoras de infecções, agravos, doenças e segurança do paciente; (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
XXII - implementar e monitorar a aplicação dos protocolos técnico-operacionais, visando a prevenção e controle das infecções, eventos adversos, doenças e agravos de notificação compulsória. (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Parágrafo único. As atividades dos NHE serão realizadas de forma articulada com:(Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
I - Núcleo de Segurança do Paciente (NSP); (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
II - Centro de Informações Estratégicas em Vigilância em Saúde (Cievs); e (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
III - demais estruturas ou setores de interesse para vigilância em saúde, que visem contribuir para a qualificação do cuidado em saúde ou manejo de potenciais emergências em saúde pública. (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Art. 335.V. A atuação da VEH deverá observar os protocolos e procedimentos padronizados pelo Ministério da Saúde, que permitam a identificação oportuna, a notificação imediata, a investigação inicial ou complementar e o registro ou a atualização de informações nos sistemas de informações oficiais. (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Art. 335-X. A VEH será avaliada por indicadores de qualidade definidos em normas específicas da Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS). (Redação dada pela PRT GM/MS nº 1.693 de 23.07.2021)
Seção VI-A
(Redação dada pela PRT GM/MS nº 470 de 13.04.2023)
Da Câmara Técnica de Assessoramento em Imunização (CTAI)
(Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
Art. 335-S. Fica instituída a Câmara Técnica de Assessoramento em Imunização - CTAI, nos termos do Anexo XLVI-A. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
CAPÍTULO XIV
DA MORTALIDADE MATERNA E NEONATAL
Seção I
Da Comissão Nacional de Mortalidade Materna
Art. 336. Fica instituída a Comissão Nacional de Mortalidade Materna, de caráter técnico-consultivo, com os seguintes objetivos: (Origem: PRT MS/GM 652/2003, Art. 1º)
I - realizar diagnóstico permanente da situação da Mortalidade Materna no Brasil, enfocando todos os seus múltiplos aspectos: sociais, econômicos, políticos, jurídicos e outros que facultem ações específicas para a sua solução; (Origem: PRT MS/GM 652/2003, Art. 1º, a)
II - propor diretrizes, instrumentos legais e princípios éticos que concretizem estratégias de redução da mortalidade materna; (Origem: PRT MS/GM 652/2003, Art. 1º, b)
III - acompanhar as ações do Ministério da Saúde no processo de articulação e integração das diferentes instituições e instâncias envolvidas na questão; (Origem: PRT MS/GM 652/2003, Art. 1º, c)
IV - oferecer subsídios para aperfeiçoamento da Política Nacional de Redução da Mortalidade Materna, estabelecendo correlações com os Comitês Estaduais, Regionais e Municipais; (Origem: PRT MS/GM 652/2003, Art. 1º, d)
V - mobilizar os diversos setores da sociedade afetos à questão, com finalidade de melhorar a saúde da mulher. (Origem: PRT MS/GM 652/2003, Art. 1º, e)
Art. 337. Serão membros da Comissão Nacional de Mortalidade Materna, sob a presidência do primeiro: (Origem: PRT MS/GM 652/2003, Art. 2º)
I - Coordenador da Área Técnica Saúde da Mulher, do Departamento de Ações Programáticas Estratégicas, do Ministério da Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, a)
II - um representante do Ministério da Saúde, como Secretário Executivo; (Origem: PRT MS/GM 652/2003, Art. 2º, b)
III - um representante do Centro Nacional de Epidemiologia, da Fundação Nacional de Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, c)
IV - um representante da Secretaria Especial de Políticas para as Mulheres; (Origem: PRT MS/GM 652/2003, Art. 2º, d)
V - um representante do Ministério Público da União; (Origem: PRT MS/GM 652/2003, Art. 2º, e)
VI - um representante do Conselho Nacional de Secretários Estaduais de Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, f)
VII - um representante do Conselho Nacional de Secretários Municipais de Saúde; (Origem: PRT MS/GM 652/2003, Art. 2º, g)
VIII - um representante do Conselho Federal de Medicina; (Origem: PRT MS/GM 652/2003, Art. 2º, h)
IX - um representante do Conselho Federal de Enfermagem; (Origem: PRT MS/GM 652/2003, Art. 2º, i)
X - um representante da Federação Brasileira das Sociedades de Ginecologia e Obstetrícia; (Origem: PRT MS/GM 652/2003, Art. 2º, j)
XI - um representante da Associação Brasileira de Enfermagem Obstétrica; (Origem: PRT MS/GM 652/2003, Art. 2º, k)
XII - um representante da Rede Nacional Feminista de Saúde e Direitos Reprodutivos; (Origem: PRT MS/GM 652/2003, Art. 2º, l)
XIII - um representante do Comitê de Perinatologia da Sociedade Brasileira de Pediatria; (Origem: PRT MS/GM 652/2003, Art. 2º, m)
XIV - um técnico do notório saber e reconhecida atuação no campo de estudo, vigilância e prevenção da Mortalidade Materna, a ser escolhido pelo Ministério da Saúde. (Origem: PRT MS/GM 652/2003, Art. 2º, n)
Art. 338. Serão membros convidados da Comissão Nacional de Mortalidade Materna técnicos de organizações nacionais e internacionais com atuação no campo de saúde da mulher. (Origem: PRT MS/GM 652/2003, Art. 3º)
Seção II
Da Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal
Art. 339. Instituir a Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal, de caráter técnico-consultivo, que atuará alinhada com o período proposto para se alcançar os Objetivos do Desenvolvimento do Milênio, com os seguintes objetivos: (Origem: PRT MS/GM 427/2005, Art. 1º) (com redação dada pela PRT MS/GM 2801/2008)
I - avaliar, sistematicamente, a implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal no Brasil; (Origem: PRT MS/GM 427/2005, Art. 1º, I)
II - propor estratégias de ação, diretrizes, instrumentos legais e princípios éticos que concretizem a implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal; (Origem: PRT MS/GM 427/2005, Art. 1º, II)
III - acompanhar as ações dos gestores em esfera federal, estadual e municipal no processo de implementação dos compromissos assumidos e na articulação e integração das diferentes instituições e instâncias envolvidas na implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal; e (Origem: PRT MS/GM 427/2005, Art. 1º, III)
IV - divulgar as ações desenvolvidas com o objetivo de efetivar o Pacto em questão. (Origem: PRT MS/GM 427/2005, Art. 1º, IV)
Art. 340. A Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal será coordenada pela Secretaria de Atenção à Saúde, e terá a seguinte composição: (Origem: PRT MS/GM 427/2005, Art. 2º)
I - Ministério da Saúde: (Origem: PRT MS/GM 427/2005, Art. 2º, I)
a) Departamento de Ações Programáticas Estratégicas da Secretaria de Atenção à Saúde (DAPES/SAS/MS) - 4 (quatro) representantes; (Origem: PRT MS/GM 427/2005, Art. 2º, I, a)
b) Secretaria de Vigilância em Saúde (SVS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, b)
c) Secretaria de Gestão Estratégica e Participativa (SGEP/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, c)
d) Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, d)
e) Secretaria Especial de Saúde Indígena (SESAI/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, f) (com redação dada pela PRT MS/GM 2801/2008)
f) Agência Nacional de Saúde Suplementar (ANS) - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, I, g)
g) Departamento de Atenção Básica da Secretaria de Atenção à Saúde (DAB/SAS/MS) - 1 (um) representante; e (Origem: PRT MS/GM 427/2005, Art. 2º, I, h) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
h) Departamento de Atenção Especializada e Temática da Secretaria de Atenção à Saúde (DAET/SAS/MS) - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, I, i) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
II - Secretaria Especial de Políticas para as Mulheres - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, II)
III - Secretaria Especial para Políticas de Promoção da Igualdade Racial - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, III)
IV - Secretaria Especial dos Direitos Humanos - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, IV)
V - Conselho Nacional de Secretários de Saúde - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, V)
VI - Conselho Nacional de Secretários Municipais de Saúde - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, VI)
VII - Conselho Nacional dos Direitos da Criança e do Adolescente - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, VII)
VIII - Conselho Federal de Medicina - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, VIII)
IX - Associação Médica Brasileira - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, IX)
X - Federação Brasileira das Associações de Ginecologia e Obstetrícia - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, X)
XI - Sociedade Brasileira de Pediatria - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XI)
XII - Rede Nacional de Bancos de Leite Humano - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XII)
XIII - Pastoral da Criança - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XIII)
XIV - Associação Brasileira de Enfermagem - 1 (um) representante (Origem: PRT MS/GM 427/2005, Art. 2º, XIV)
XV - Associação Brasileira de Enfermagem Obstétrica - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XV)
XVI - Rede Nacional Feminista de Saúde e Direitos Reprodutivos - um representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XVI)
XVII - Articulação de Mulheres do Brasil - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XVII)
XVIII - Confederação de Mulheres do Brasil - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XVIII)
XIX - Articulação de ONG de mulheres Negras - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XIX)
XX - Rede pela Humanização do Parto e Nascimento - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XX)
XXI - Rede Nacional de Parteiras Tradicionais - 1 (um) representante; e (Origem: PRT MS/GM 427/2005, Art. 2º, XXI)
XXII - Associação Brasileira de Pós-Graduação em Saúde Coletiva - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, XXII)
XXIII - Ministério da Defesa - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXIII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXIV - Ministério do Desenvolvimento Social e Agrário - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXIV) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXV - Ministério da Educação - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXV) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXVI - Secretaria Nacional de Juventude - um representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXVI) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXVII - Federação Nacional dos Médicos - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXVII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXVIII - Senado Federal - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXVIII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXIX - Câmara dos Deputados - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXIX) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXX - Conselho Federal de Psicologia - um representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXX) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXI - União Brasileira dos Estudantes Secundaristas - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXXI) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXII - União Nacional dos Estudantes - 1 (um) representante; (Origem: PRT MS/GM 427/2005, Art. 2º, XXXII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXIII - Rede de Saúde Perinatal Norte e Nordeste - um representante; e (Origem: PRT MS/GM 427/2005, Art. 2º, XXXIII) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXIV - Rede Amamenta Brasil - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, XXXIV) (dispositivo acrescentado pela PRT MS/GM 2801/2008)
XXXV - Coordenação da Política Nacional de Humanização (HumanizaSUS) - 1 (um) representante. (Origem: PRT MS/GM 427/2005, Art. 2º, XXXV) (dispositivo acrescentado pela )
Art. 341. Serão membros convidados da Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal os seguintes representantes: (Origem: PRT MS/GM 427/2005, Art. 3º)
I - do Fundo das Nações Unidas para a População (FNUAP), da Organização Pan Americana da Saúde (OPAS); (Origem: PRT MS/GM 427/2005, Art. 3º, I)
II - do Fundo das Nações Unidas para a Infância (UNICEF), do Centro Cochrane do Brasil/UNIFESP; e (Origem: PRT MS/GM 427/2005, Art. 3º, II)
III - da Rede Internacional em defesa do Direito de Amamentar e da Aliança Mundial para o Aleitamento Materno. (Origem: PRT MS/GM 427/2005, Art. 3º, III)
Art. 342. O Regimento Interno da Comissão Nacional de Monitoramento e Avaliação da Implementação do Pacto Nacional pela Redução da Mortalidade Materna e Neonatal será publicado em ato da Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 427/2005, Art. 4º)
CAPÍTULO XV
DOS COMITÊS PARA PREVENÇÃO E CONTROLE DA RESISTÊNCIA AOS ANTIMICROBIANOS E USO RACIONAL DE ANTIMICROBIANOS
CAPÍTULO XV
DO GRUPO DE TRABALHO DE ACOMPANHAMENTO DA IMPLEMENTAÇÃO DO PLANO DE AÇÃO NACIONAL DE PREVENÇÃO E CONTROLE DA RESISTÊNCIA AOS ANTIMICROBIANOS
Seção I
Do Comitê para Elaboração e Condução do Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos (CIPAN)
(Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 343. Fica instituído o Comitê encarregado da elaboração e condução do componente do setor saúde do Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos (CIPAN), no âmbito do Ministério da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 1º)
Art. 343. Fica instituído o Grupo Técnico de acompanhamento da implementação do Plano de Ação Nacional de Prevenção e Controle da Resistência aos Antimicrobianos -GT, no âmbito do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 344. O CIPAN é uma instância colegiada de caráter deliberativo e permanente, vinculado tecnicamente à Secretaria de Vigilância em Saúde, do Ministério da Saúde (SVS/MS), que contará com respaldo da Secretaria-Executiva na articulação e mobilização dos demais órgãos do Ministério da Saúde para o pleno desenvolvimento de suas funções. (Origem: PRT MS/GM 2775/2016, Art. 2º)
Art. 344. O GT é uma instância colegiada de caráter deliberativo e permanente, vinculado à Secretaria de Vigilância em Saúde do Ministério da Saúde - SVS/MS. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 345. Compete ao Comitê: (Origem: PRT MS/GM 2775/2016, Art. 3º)
I - coordenar as ações para a elaboração do componente do setor saúde do Plano de Ação Nacional (PAN), no âmbito do Ministério da Saúde, em conformidade com o Plano de Ação Global sobre Resistência Antimicrobiana (WHA 68.7) aprovado na 68ª Assembleia Mundial de Saúde; (Origem: PRT MS/GM 2775/2016, Art. 3º, I)
II - propor ações de vigilância, proteção, monitoramento, controle e prevenção da resistência microbiana, bem como acompanhar políticas, sugerir e elaborar propostas ao Ministro da Saúde, em assuntos relacionados a essa temática; e (Origem: PRT MS/GM 2775/2016, Art. 3º, II)
III - coordenar e avaliar as ações para a implementação e execução do PAN, no âmbito do Ministério da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 3º, III)
Art. 345. Compete ao Grupo Técnico: (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
I - coordenar as ações para a implementação do Plano de Ação Nacional de Resistência aos Antimicrobianos - PAN-BR, no âmbito do Ministério da Saúde, em conformidade com o Plano de Ação Global sobre Resistência Antimicrobiana (WHA 68.7) aprovado na 68ª Assembleia Mundial de Saúde; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
II - acompanhar e avaliar as ações de vigilância, proteção, monitoramento, controle e prevenção da resistência microbiana, no âmbito do Ministério da Saúde; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
III - propor ações de vigilância, no âmbito do Ministério da Saúde, para revisão do PAN-BR . (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 346. O Comitê será composto por representantes, titular e suplente, do Ministério da Saúde: (Origem: PRT MS/GM 2775/2016, Art. 4º)
I - Secretaria de Vigilância em Saúde (SVS/MS): (Origem: PRT MS/GM 2775/2016, Art. 4º, I)
a) Departamento de Vigilância das Doenças Transmissíveis (DEVIT), que o coordenará; (Origem: PRT MS/GM 2775/2016, Art. 4º, I, a)
b) Coordenação-Geral de Laboratórios de Saúde Pública (CGLAB/DEGEVS); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, b)
c) Coordenação-Geral de Doenças Transmissíveis (CGDT/DEVIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, c)
d) Coordenação-Geral do Programa Nacional de Controle da Tuberculose (CGPNCT/DEVIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, d)
e) Coordenação-Geral dos Programas Nacionais de Controle e Prevenção da Malária e das Doenças Transmitidas pelo Aedes (CGPNC/DEVIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, e)
f) Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DDAHV); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, f)
g) Departamento de Vigilância de Doenças e Agravos Não Transmissíveis e Promoção da Saúde (DANTPS); e (Origem: PRT MS/GM 2775/2016, Art. 4º, I, g)
h) Coordenação-Geral de Vigilância em Saúde Ambiental (CGVAM/DSAST); (Origem: PRT MS/GM 2775/2016, Art. 4º, I, h)
II - Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 2775/2016, Art. 4º, II)
III - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS): (Origem: PRT MS/GM 2775/2016, Art. 4º, III)
a) Departamento de Ciência e Tecnologia (DECIT); (Origem: PRT MS/GM 2775/2016, Art. 4º, III, a)
b) Departamento de Assistência Farmacêutica e Insumos Estratégicos(DAF); e (Origem: PRT MS/GM 2775/2016, Art. 4º, III, b)
c) Departamento de Gestão e Incorporação de Tecnologias em Saúde (DGITS); (Origem: PRT MS/GM 2775/2016, Art. 4º, III, c)
IV - Secretaria de Atenção à Saúde (SAS/MS): (Origem: PRT MS/GM 2775/2016, Art. 4º, IV)
a) Departamento de Atenção Especializada e Temática (DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, a)
b) Coordenação-Geral de Atenção Especializada (CGAE/DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, b)
c) Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, c)
d) Coordenação-Geral de Urgência e Emergência (CGUE/DAHU); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, d)
e) Coordenação-Geral do Sistema Nacional de Transplantes (CGSNT/DAET); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, e)
f) Departamento de Atenção Hospitalar e de Urgência (DAHU): (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, f)
g) Coordenação-Geral de Atenção Hospitalar (CGHOSP/DAHU); e (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, g)
h) Departamento de Atenção Básica (DAB); (Origem: PRT MS/GM 2775/2016, Art. 4º, IV, h)
V - Gabinete do Ministro; (Origem: PRT MS/GM 2775/2016, Art. 4º, V)
a) Assessoria de Assuntos Internacionais de Saúde (AISA); e (Origem: PRT MS/GM 2775/2016, Art. 4º, V, a)
b) Assessoria de Comunicação Social (ASCOM); (Origem: PRT MS/GM 2775/2016, Art. 4º, V, b)
VI - Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2775/2016, Art. 4º, VI)
§ 1º Nos afastamentos dos titulares que integram o Comitê estes serão substituídos pelos respectivos suplentes. (Origem: PRT MS/GM 2775/2016, Art. 4º, § 2º)
§ 2º Os integrantes da CIPAN serão designados em ato específico do Ministro da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 4º, § 3º)
Art. 346. O Grupo Técnico será composto por representante, titular e suplente, dos seguintes órgãos: (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
I - da Secretaria de Vigilância em Saúde - SVS/MS): (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
a) um da Coordenação-Geral de Laboratórios de Saúde Pública - CGLAB/DAEVS, que o coordenará; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
b) dois do Departamento de Imunização e Doenças Transmissíveis, sendo: (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
1. um da Coordenação-Geral de Vigilância de Zoonoses e Doenças de Transmissão Vetorial - CGZV/DEIDT; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
2. um da Coordenação-Geral de Vigilância de Arboviroses - CGARB/DEIDT; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
c) um da Coordenação-Geral de Vigilância das Doenças de Transmissão Respiratórias de Condições Crônicas do Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis - CGDR/DCCI; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
d) dois do Departamento de Análise em Saúde e Vigilância de Doenças Não Transmissíveis - DASNT, sendo um da Coordenação-Geral de Vigilância em Saúde Ambiental - CGVAM/DSAST; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
II - um da Secretaria-Executiva - SE/MS; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
III - dois da Secretaria de Ciência, Tecnologia e Insumos Estratégicos - SCTIE/MS, sendo: (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
a) um do Departamento de Ciência e Tecnologia - DECIT; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
b) um do Departamento de Assistência Farmacêutica e Insumos Estratégicos - DAF ou Departamento de Gestão e Incorporação de Tecnologias e Inovações em Saúde - DGITIS; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
IV - dois da Secretaria de Atenção Especializada à Saúde - SAES/MS, sendo: (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
a) um do Departamento de Atenção Especializada e Temática - DAET; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
b) um do Departamento de Atenção Hospitalar, Domiciliar e de Urgência - DAHU ; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
V - um do Departamento de Atenção Básica da Secretaria de Atenção Primária à Saúde - DAB/SAPS/MS; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
VI - um da Secretaria de Gestão do Trabalho e Educação em Saúde - SGTES/MS ; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
VII - um do Conselho Nacional de Secretários de Saúde - CONASS; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
VIII - um do Conselho Nacional de Secretarias Municipais de Saúde - CONASEMS ; (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
IX - dois do Gabinete do Ministro, sendo: (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
a) um da Assessoria de Assuntos Internacionais de Saúde - AISA/MS; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
b) um da Assessoria de Comunicação Social - ASCOM/MS; e (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
X - um da Agência Nacional de Vigilância Sanitária - ANVISA. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
§1º Cada membro do GT contará com um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 2º Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos à Coordenação-Geral de Laboratórios de Saúde Pública da Secretária de Vigilância em Saúde, no prazo de 15 (quinze) dias contados da data de publicação desta Portaria. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 3º Os integrantes do GT serão designados em ato específico do Secretário da Secretaria de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 347. Caberá ao Coordenador Executivo planejar e organizar as atividades do Comitê. (Origem: PRT MS/GM 2775/2016, Art. 5º)
Art. 347. A Coordenação-Geral de Laboratórios de Saúde Pública - CGLAB/DAEVS prestará o apoio técnico e administrativo necessários ao desenvolvimento dos trabalhos do GT. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 348. O Comitê poderá solicitar a contribuição de servidores dos órgãos do Ministério da Saúde e entidades a ele vinculadas, bem como servidores de outros órgãos e entidades da Administração Pública Federal, especialistas em assuntos ligados ao tema e representantes dos movimentos sociais, cuja presença seja considerada de relevância, nesta Seção. (Origem: PRT MS/GM 2775/2016, Art. 6º)
Art. 348. O Grupo Técnico poderá convidar para participar de suas reuniões servidores dos órgãos do Ministério da Saúde e entidades a ele vinculadas, bem como servidores de outros órgãos e entidades da Administração Pública Federal, especialistas em assuntos ligados ao tema e representantes dos movimentos sociais. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 349. O CIPAN, no desenvolvimento de suas atribuições, poderá constituir grupos técnicos para tratar de temas específicos. (Origem: PRT MS/GM 2775/2016, Art. 7º)
Art. 349. O GT se reunirá, em caráter ordinário, semestralmente, e, em caráter extraordinário, sempre que convocado por seu Coordenador. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 1º Os membros do GT que se encontrarem no Distrito Federal se reunirão presencialmente e os membros que se encontrarem em outros entes federativos participarão da reunião por meio de videoconferência. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 2º As reuniões serão instaladas com a presença mínima de maioria simples dos membros presentes. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 3º A aprovação das matérias ocorrerá prioritariamente por consenso ou, se não for alcançado, por maioria simples dos presentes, observado o disposto no § 2º. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 350. As despesas decorrentes da execução das atividades do CIPAN correrão à conta das dotações orçamentárias das Secretarias envolvidas que fornecerão o apoio técnico e administrativo necessário ao funcionamento do comitê. (Origem: PRT MS/GM 2775/2016, Art. 8º)
Art. 350. O GT elaborará seu regimento interno, no prazo máximo de 30 (trinta) dias, contados a partir da data de publicação da Portaria de designação de que trata o § 3º do art. 346. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 351. O Comitê fará proposta de regimento interno, no prazo máximo de 30 (trinta) dias, contados a partir da data de publicação da Portaria nº 2775/GM/MS, de 22 de dezembro de 2016. (Origem: PRT MS/GM 2775/2016, Art. 9º)
Parágrafo Único. O regimento interno de que trata o "caput" será homologado por ato específico do Ministro de Estado da Saúde. (Origem: PRT MS/GM 2775/2016, Art. 9º, Parágrafo Único)
Art. 351. As funções desempenhadas no âmbito do GT não serão remuneradas e seu exercício será considerado serviço público relevante. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 352. As funções desempenhadas no âmbito do Comitê de que trata esta Seção não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2775/2016, Art. 10)
Art. 352. As unidades organizacionais do Ministério da Saúde são responsáveis pela implementação, execução, avaliação e monitoramento das suas respectivas atividades definidas no PAN-BR. (Redação dada pela PRT GM/MS nº 1.929 de 11.08.2021)
Seção II
Do Comitê Técnico Assessor para Uso Racional de Antimicrobiano e Resistência Microbiana (Curarem)
(Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 353. Fica instituído o Comitê Técnico Assessor para Uso Racional de Antimicrobiano e Resistência Microbiana (Curarem), com caráter consultivo sobre aspectos técnicos e científicos necessários à definição de diretrizes nacionais para a vigilância, prevenção e controle da disseminação da resistência microbiana, comunitária e hospitalar, bem como no acompanhamento e avaliação das ações desenvolvidas pelo Ministério da Saúde. (Origem: PRT MS/GM 1133/2005, Art. 1º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 354. O Curarem será composto pelas seguintes instituições: (Origem: PRT MS/GM 1133/2005, Art. 2º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
I - Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, I) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
II - Agência Nacional de Vigilância Sanitária (ANVISA/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, II) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
III - Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, III) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
IV - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 1133/2005, Art. 2º, IV) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
V - Associação Brasileira de Pós-Graduação em Saúde Coletiva (Abrasco); (Origem: PRT MS/GM 1133/2005, Art. 2º, V) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VI - Associação Brasileira dos Profissionais em Controle de Infecção e Epidemiologia Hospitalar (ABIH); (Origem: PRT MS/GM 1133/2005, Art. 2º, VI) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VII - Sociedade Brasileira de Infectologia (SBI); (Origem: PRT MS/GM 1133/2005, Art. 2º, VII) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VIII - Sociedade Brasileira de Medicina Tropical (SBMT); (Origem: PRT MS/GM 1133/2005, Art. 2º, VIII) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
IX - Sociedade Brasileira de Patologia Clínica (SBPC); (Origem: PRT MS/GM 1133/2005, Art. 2º, IX) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
X - Sociedade Brasileira de Microbiologia (SBM); (Origem: PRT MS/GM 1133/2005, Art. 2º, X) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
XI - Sociedade Brasileira de Farmácia Hospitalar (SBRAFH); (Origem: PRT MS/GM 1133/2005, Art. 2º, XI) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
XII - Associação Brasileira de Odontologia (ABO); (Origem: PRT MS/GM 1133/2005, Art. 2º, XII) (com redação dada pela ) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 1º No desenvolvimento de suas atribuições, o Comitê poderá, a seu critério, solicitar apoio aos seguintes Ministérios e organizações de abrangência internacional: (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
I - Ministério da Agricultura, Pecuária e Abastecimento (MAPA); (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, I) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
II - Ministério da Educação (MEC); (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, II) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
III - Organização Pan-Americana da Saúde (OPAS); (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, III) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
IV - Sociedade Pan Americana de Infectologia; e (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, IV) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
V - Sociedade Pan Americana de Controle de Infecção Hospitalar. (Origem: PRT MS/GM 1133/2005, Art. 2º, § 1º, V) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 2º Os membros do Curarem deverão declarar a existência de conflito de interesses com suas atividades públicas ou privadas no debate dos temas pertinentes ao comitê, sendo que, na eventualidade da existência de conflito de interesses, os membros deverão abster-se de participar da discussão sobre o tema. (Origem: PRT MS/GM 1133/2005, Art. 2º, § 2º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 355. As instituições deverão indicar formalmente 1 (um) representante titular e 1 (um) representante suplente. (Origem: PRT MS/GM 1133/2005, Art. 3º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Parágrafo Único. Sempre que houver mudança de representante, do mandato ou do dirigente das instituições, as indicações devem ser refeitas conforme o disposto no caput deste artigo. (Origem: PRT MS/GM 1133/2005, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 356. Compete ao Curarem: (Origem: PRT MS/GM 1133/2005, Art. 4º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
I - assessorar o Ministério da Saúde no estabelecimento de diretrizes e definições de estratégias de atuação para a vigilância, a prevenção e o controle da emergência e disseminação da resistência microbiana comunitária e hospitalar; (Origem: PRT MS/GM 1133/2005, Art. 4º, I) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
II - avaliar o impacto das ações de vigilância, prevenção e controle da emergência e disseminação da resistência microbiana no País; (Origem: PRT MS/GM 1133/2005, Art. 4º, II) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
III - recomendar temas para pesquisas no campo da resistência microbiana comunitária e hospitalar; (Origem: PRT MS/GM 1133/2005, Art. 4º, III) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
IV - avaliar estratégias para vigilância, prevenção e controle da emergência e disseminação da resistência microbiana no País; (Origem: PRT MS/GM 1133/2005, Art. 4º, IV) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
V - subsidiar a implantação da Rede Nacional de Monitoramento de Resistência Microbiana; (Origem: PRT MS/GM 1133/2005, Art. 4º, V) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VI - analisar informações sobre a existência de produtos no mercado que favorecem a emergência e a disseminação da resistência microbiana no País com emissão de recomendação para a Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 1133/2005, Art. 4º, VI) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VII - sugerir a composição de comissões técnicas especiais para apreciações e pareceres que exigirem estudos específicos e mais aprofundados; e (Origem: PRT MS/GM 1133/2005, Art. 4º, VII) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VIII - contribuir na elaboração e/ou na revisão das normas técnicas relativas à resistência microbiana. (Origem: PRT MS/GM 1133/2005, Art. 4º, VIII) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 357. O Curarem será coordenado pelo representante do Ministério da Saúde e/ou por seu substituto, que terá as seguintes competências: (Origem: PRT MS/GM 1133/2005, Art. 5º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
I - coordenar as reuniões; (Origem: PRT MS/GM 1133/2005, Art. 5º, I) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
II - indicar um técnico para desenvolver atividades da secretaria-executiva; (Origem: PRT MS/GM 1133/2005, Art. 5º, II) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
III - encaminhar atas e relatórios para apreciação dos membros do Curarem; (Origem: PRT MS/GM 1133/2005, Art. 5º, III) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
IV - submeter à apreciação e aprovação das instituições do Ministério da Saúde as recomendações oriundas das reuniões ordinárias e extraordinárias; e (Origem: PRT MS/GM 1133/2005, Art. 5º, IV) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
V - convocar reuniões extraordinárias e de caráter emergencial. (Origem: PRT MS/GM 1133/2005, Art. 5º, V) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 358. Os membros do Curarem terão as seguintes competências: (Origem: PRT MS/GM 1133/2005, Art. 6º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
I - representar sua instituição nas reuniões ordinárias e extraordinárias do Curarem; (Origem: PRT MS/GM 1133/2005, Art. 6º, I) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
II - discutir, nas suas instituições, os temas pautados no comitê; (Origem: PRT MS/GM 1133/2005, Art. 6º, II) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
III - identificar, analisar a apresentar materiais técnicos científicos, bem como discutir as matérias submetidas ao Curarem; (Origem: PRT MS/GM 1133/2005, Art. 6º, III) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
IV - propor ao Coordenador, com antecedência mínima de 20 (vinte) dias, a convocação de reuniões extraordinárias, com o objetivo de tratar de assuntos relevantes ou de urgência que não possam aguardar a ordinária; (Origem: PRT MS/GM 1133/2005, Art. 6º, IV) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
V - indicar ao Coordenador, quando pertinente e relevante, pessoas ou representantes de entidades públicas ou privadas, a fim de compor grupos técnicos para temas específicos; (Origem: PRT MS/GM 1133/2005, Art. 6º, V) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VI - acompanhar a situação epidemiológica da disseminação da resistência microbiana no País; e (Origem: PRT MS/GM 1133/2005, Art. 6º, VI) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
VII - promover a discussão e a articulação institucional no processo de aperfeiçoamento das ações de vigilância, de prevenção e de controle da disseminação da resistência microbiana comunitária e hospitalar no País. (Origem: PRT MS/GM 1133/2005, Art. 6º, VII) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 359. O Curarem reunir-se-á ordinariamente três vezes por ano ou, extraordinariamente quando convocado pelo seu Coordenador, sendo que a reuniões serão realizadas somente com a presença de, no mínimo, cinquenta por cento mais um dos seus membros. (Origem: PRT MS/GM 1133/2005, Art. 7º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 1º Em situações de impossibilidade de comparecimento às reuniões ordinárias ou extraordinárias, os representantes titulares e suplentes do Curarem não poderão enviar substitutos. (Origem: PRT MS/GM 1133/2005, Art. 7º, § 1º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
§ 2º As instituições faltosas poderão ser destituídas do Curarem, a partir da segunda ausência sem justificativa formal. (Origem: PRT MS/GM 1133/2005, Art. 7º, § 2º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
Art. 360. As reuniões ordinárias e extraordinárias serão realizadas em Brasília ou em local a ser definido por decisão do coordenador. (Origem: PRT MS/GM 1133/2005, Art. 8º) (Revogado pela PRT GM/MS nº 1.929 de 11.08.2021)
CAPÍTULO XVI
DO PLANO NACIONAL DE ASSISTÊNCIA À CRIANÇA COM CARDIOPATIA CONGÊNITA
Art. 361. Fica aprovado o Plano Nacional de Assistência à Criança com Cardiopatia Congênita, com o objetivo de estabelecer diretrizes e integrar ações que favoreçam o acesso ao diagnóstico, ao tratamento e à reabilitação da criança e do adolescente com cardiopatia congênita, bem como a redução da morbimortalidade desse público. (Origem: PRT MS/GM 1727/2017, Art. 1º)
Parágrafo Único. O Plano será disponibilizado no endereço eletrônico www.saude.gov.br/sas. (Origem: PRT MS/GM 1727/2017, Art. 1º, Parágrafo Único)
Art. 362. O Plano visa orientar a organização da assistência à criança com cardiopatia congênita, de modo a proporcionar o cuidado integral da criança em todas as etapas: pré-natal, nascimento, assistência cardiovascular e seguimento. (Origem: PRT MS/GM 1727/2017, Art. 2º)
Parágrafo Único. O Plano está estruturado nos seguintes eixos: (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único)
I - diagnóstico pré-natal; (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, I)
II - diagnóstico no período neonatal; (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, II)
III - transporte seguro de recém-nascidos e crianças cardiopatas; (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, III)
IV - assistência cirúrgica; e (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, IV)
V - assistência multidisciplinar. (Origem: PRT MS/GM 1727/2017, Art. 2º, Parágrafo Único, V)
Art. 363. Para assegurar a sua implementação, o Plano: (Origem: PRT MS/GM 1727/2017, Art. 3º)
I - define as responsabilidades dos gestores do SUS envolvidos; (Origem: PRT MS/GM 1727/2017, Art. 3º, I)
II - determina diretrizes de financiamento; (Origem: PRT MS/GM 1727/2017, Art. 3º, II)
III - estabelece estratégias para o monitoramento, avaliação e controle; e (Origem: PRT MS/GM 1727/2017, Art. 3º, II-A)
IV - propõe recomendações para formação e capacitação. (Origem: PRT MS/GM 1727/2017, Art. 3º, III)
CAPÍTULO XVII
Da Estratégia de Saúde Cardiovascular
(Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Art. 363-A Fica instituída a Estratégia de Saúde Cardiovascular (ECV), no âmbito da Atenção Primária à Saúde - APS, para o fortalecimento da Rede de Atenção à Saúde das Pessoas com Doenças Crônicas, estabelecida no Anexo IV da Portaria de Consolidação GM/MS nº 3, de 28 de setembro de 2017. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Art. 363-B. A ECV possui os seguintes objetivos: (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
I - qualificar a atenção integral às pessoas com doenças cardiovasculares na APS; (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
II - dar suporte ao desenvolvimento de ações para prevenção e controle das doenças cardiovasculares no âmbito da APS, com ênfase às condições de Hipertensão Arterial Sistêmica (HAS) e Diabetes Mellitus (DM); e (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
III - promover o controle dos níveis pressóricos e glicêmicos, a adesão ao tratamento e a redução nas taxas de complicações, internações e morbimortalidade por doenças cardiovasculares. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Art. 363-C. São eixos de ações da ECV: (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
I - promoção da saúde e prevenção das doenças cardiovasculares no âmbito da APS; (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
II - educação em saúde e capacitação de profissionais e gestores, incluindo estratégias de autocuidado e outras ferramentas para promover a qualificação do cuidado e o aumento da adesão ao tratamento; (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
III - rastreamento, estratificação do risco cardiovascular, diagnóstico precoce e aperfeiçoamento dos processos de cuidado; (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
IV - fortalecimento dos processos de gestão, melhorias na estrutura física dos estabelecimentos de saúde da APS, organização dos processos de trabalho e disponibilidade de equipamentos para o cuidado; e (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
V - fomento à produção de pesquisa em doenças cardiovasculares para inovações assistenciais e de gestão nas temáticas relacionadas à prevenção e controle no âmbito da APS. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Parágrafo único. O detalhamento das ações será apresentado em manuais e instrutivos do Ministério da Saúde disponibilizados no endereço eletrônico "aps.saude.gov.br". (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Art. 363-D. A ECV poderá ser implementada pelos municípios e Distrito Federal, a qualquer tempo e sem necessidade de adesão, mediante a implementação de ações nos eixos de que trata o art. 363-C, com apoio do Ministério da Saúde e dos Estados. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Parágrafo único. O apoio à execução das ações nos eixos previstos no art. 363-C ocorrerá mediante conjunto integrado de incentivos financeiros e medidas voltadas à qualificação dos profissionais de saúde e gestores para a prevenção e controle das doenças cardiovasculares na APS, tendo ofertas de abrangência nacional e de ações direcionadas, de acordo com parâmetros técnicos definidos pela Secretaria de Atenção Primária à Saúde - SAPS. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Art. 363-E. Poderá ser instituído, a qualquer tempo, incentivo financeiro aos municípios e ao Distrito Federal, com vistas a apoiar a implementação da Estratégia. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
§ 1º As regras para o recebimento do incentivo financeiro constarão em ato normativo específico a ser editado pelo Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
§ 2º O incentivo financeiro de que trata o caput será transferido na modalidade fundo a fundo, pelo Fundo Nacional de Saúde aos respectivos fundos de saúde do Município ou do Distrito Federal, observada a legislação aplicável, em especial a Lei complementar nº 141, de 13 de janeiro de 2012 e o Decreto nº 7.827, de 16 de outubro de 2012. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Art. 363-F. A execução das ações da ECV será monitorada por meio do Sistema de Informação em Saúde para a Atenção Básica (SISAB) e considerará: (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
I - os indicadores de desempenho referentes ao cuidado de pessoas com HAS e DM previstos no modelo de financiamento da APS vigente; e (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
II - demais indicadores e metas complementares estabelecidos em documentos instrutivos, publicações e demais atos específicos a serem disponibilizados pelo Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
Parágrafo único. A Coordenação-Geral de Prevenção de Doenças Crônicas e Controle do Tabagismo da Secretaria de Atenção Primária à Saúde (CGCTAB/DEPROS/SAPS/MS) é a área responsável pela coordenação e monitoramento da Estratégia de Saúde Cardiovascular - ECV. (Redação dada pela PRT GM/MS nº 3.008 de 04.11.2021)
CAPÍTULO XVIII
Do Programa de Qualificação da Assistência Cardiovascular - QualiSUS Cardio
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Seção I
Das disposições preliminares
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-G. Fica instituído o Programa de Qualificação da Assistência Cardiovascular - QualiSUS Cardio. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-H. São objetivos do Programa QualiSUS Cardio: (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
I - avaliar o desempenho dos estabelecimentos de saúde no âmbito da alta complexidade cardiovascular a partir da análise de indicadores relativos ao volume, à qualidade e à complexidade da assistência ofertada; e (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
II - estabelecer incrementos sobre os valores de ações estratégicas da saúde cardiovascular em conformidade com o desempnho aferido. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-I. São eixos de ações do Programa QualiSUS Cardio: (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
I - o diagnóstico situacional, o monitoramento e a avaliação da rede nacional de alta complexidade cardiovascular no SUS; (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
II - a definição de modelos inovadores de aporte de recursos adicionais condicionado ao desempenho aferido por estabelecimento de saúde participante; (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
III - o fortalecimento dos processos de gestão, com ênfase na organização dos processo de trabalho e no aprimoramento da qualidade assistencial; e (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
IV - a educação em saúde e a capacitação de profissionais e gestores, com vistas à qualificação do cuidado ofertado. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Seção II
Dos requisitos para participação
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-J. A participação no QualiSUS Cardio será efetivada após a habilitação dos estabelecimentos de saúde por meio do Sistema de Apoio à Implementação de Políticas em Saúde - SAIPS ou qualquer outro que venha a substituí-lo. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 1º Os critérios utilizados para julgar a participação de determinado estabelecimento de saúde no Programa bem como o cronograma de habilitação serão estabelecidos em ato normativo específico a ser editado pelo Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 2º A habilitação de que trata o caput será publicada em Portaria de homologação da habilitação no Diário Oficial da União (DOU), a qual contará com a relação dos estabelecimentos habilitados. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Seção III
Da classificação dos estabelecimentos de saúde
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-K. O Programa QualiSUS Cardio estabelece a classificação dos estabelecimentos de saúde em níveis de desempenho. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Parágrafo único. A classificação de que trata o caput deverá considerar simultaneamente: (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
I - o volume assistencial do estabelecimento de saúde frente aos parâmetros mínimos de produção estabelecidos na norma aplicável; e (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
II - a análise comparativa entre o desempenho individual de cada estabelecimento de saúde e o desempenho agregado dos estabelecimentos de saúde que compõem seu respectivo território, conforme indicadores, análise multicritérios e regramento complementar dispostos em ato normativo específico a ser editado pelo Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-L. A classificação dos estabelecimentos de saúde no âmbito do Programa terá a validade de um ciclo correspondente a dois anos de duração. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Parágrafo único. Os critérios relativos à desclassificação e à reclassificação de estabelecimentos de saúde por ocasião de início de novo ciclo ou à pedido serão estabelecidos em ato normativo específico a ser editado pelo Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Seção IV
Do aporte adicional de recursos
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-M. Fica estabelecido que serão concedidos incrementos financeiros sobre ações estratégicas para os estabelecimentos de saúde no âmbito do Programa QualiSUS Cardio de acordo com seus níveis de desempenho. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Seção V
Do monitoramento
Art. 363-N. O monitoramento do QualiSUS Cardio será realizado pela Secretaria de Atenção Especializada à Saúde (SAES/MS), por meio, entre outras, das seguintes ações: (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
I - análise periódica da realização das ações estratégicas relacionadas ao Programa com base nos dados e informações constantes dos sistemas do SUS; (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
II - realização de visitas técnicas por meio de base amostral para fins de verificação da adequação da coleta e registro dos dados que compõem os indicadores objeto da classificação; e (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
III - análise de documentos e informações que poderão ser solicitados, a qualquer momento, aos estabelecimentos de saúde participantes do Programa. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Parágrafo único. Sem prejuízo do monitoramento de que trata o caput, os entes estaduais, distrital e municipais realizarão, no âmbito de suas competências, o controle do cumprimento dos critérios, parâmetros e indicadores estabelecidos pelo Programa. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Seção VI
Da Câmara Técnica Assessora do QualiSUS Cardio
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-O. Fica instituída a Câmara Técnica Assessora (CTA) do Programa QualiSUS Cardio. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Parágrafo único. A CTA-QualiSUS Cardio tem caráter consultivo, técnico-científico, interinstitucional e multidisciplinar e tem como objetivo contribuir com o desenvolvimento, a implementação e o aprimoramento do Programa, bem como colaborar em matérias estratégicas à temática de acordo com o interesse da Secretaria de Atenção Especializada à Saúde (SAES). (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-P. A CTA-QualiSUS Cardio será composta por representantes, titular e suplente, dos seguintes órgãos e entidades: (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
I - Secretaria de Atenção Especializada à Saúde (SAES/MS): (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
a) Coordenação-Geral de Atenção Especializada do Departamento de Atenção Especializada e Temática - CGAE/DAET/SAES/MS; (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
b) Departamento de Regulação, Avaliação e Controle de Sistemas - DRAC/SAES/MS; (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
II - Sociedade Brasileira de Cardiologia (SBC); (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
III - Sociedade Brasileira de Cirurgia Cardiovascular (SBCCV); (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
IV - Sociedade Brasileira de Arritmias Cardíacas (Sobrac); (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
V - Sociedade Brasileira de Hemodinâmica e Cardiologia Intervencionista (SBHCI); (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
VI - Sociedade Brasileira de Angiologia e Cirurgia Vascular (SBACV); e (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
VII - Departamento de Estimulação Cardíaca (DECA/SBCCV). (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 1º A coordenação da CTA-QualiSUS Cardio será exercida pela Coordenação-Geral de Atenção Especializada do Departamento de Atenção Especializada e Temática - CGAE/DAET/SAES/MS, a quem competirá convocar as reuniões ordinárias e extraordinárias da Comissão. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 2º A convocação das reuniões ordinárias e extraordinárias da CTA-QualiSUS Cardio dar-se-á mediante a expedição de convite com a indicação da pauta, do local, da data e do horário da reunião. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 3º Os membros da CTA deverão ser indicados nominalmente pelos órgãos e entidades que a compõem e devem declarar quaisquer conflitos de interesse, conforme modelo Anexo. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 4º A substituição de representantes da CTA-QualiSUS Cardio deverá ser realizada por meio de ofício dirigido à coordenação da CTA-QualiSUS Cardio. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-Q. À coordenação da CTA-QualiSUS Cardio fica reservada a prerrogativa de convidar especialistas e outras instituições para a prestação de apoio, em caráter consultivo, às atividades desenvolvidas. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 1º O convite da CTA-QualiSUS Cardio também deverá indicar a pauta, o local, a data e o horário da reunião. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
§ 2º Os convidados a apoiar às atividades da CTA-QualiSUS Cardio devem atender aos seguintes requisitos: (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
I - declarar quaisquer conflitos de interesse, conforme modelo Anexo, os quais serão julgados pela coordenação da Comissão para fins de convalidação da sua participação; (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
II - possuir qualificação técnica ou acadêmica compatíveis com as atividades desenvolvidas; e (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
III - manter confidencialidade em relação à documentação e informação técnica obtida, nos termos da legislação aplicável. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-R. As reuniões da CTA-QualiSUS Cardio devem ser relatadas em Ata, contendo o resumo dos encaminhamentos e a assinatura dos participantes. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-S. As reuniões da CTA-QualiSUS Cardio ocorrerão, de forma ordinária, quadrimestralmente. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Parágrafo único. Caso necessário, poderão ser convocadas pela coordenação da CTA-QualiSUS Cardio reuniões extraordinárias. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-T. A abertura dos trabalhos da CTA-QualiSUS Cardio ocorrerá quando presentes à reunião a maioria de seus membros, incluindo representante da coordenação da Câmara. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-U. A participação na CTA-QualiSUS Cardio será considerada prestação de serviço público relevante e não remunerada. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
Art. 363-V. As despesas referentes à participação dos membros da CTA-QualiSUS Cardio às reuniões não serão custeadas pelo Ministério da Saúde. (Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
TÍTULO III
DA SAÚDE DE SEGMENTOS POPULACIONAIS
CAPÍTULO I
DA SAÚDE DOS POVOS INDÍGENAS
Seção I
Da Estratégia Atenção Integrada às Doenças Prevalentes na Infância (Estratégia AIDPI) e sua Implementação e Execução no Âmbito do Subsistema de Atenção à Saúde Indígena (SasiSUS)
Subseção I
Das Disposições Preliminares
(Origem: PRT MS/GM 1397/2017, CAPÍTULO I)
Art. 364. Esta Seção dispõe sobre a Estratégia Atenção Integrada às Doenças Prevalentes na Infância (Estratégia AIDPI), sua implementação e execução no âmbito do Subsistema de Atenção à Saúde Indígena SasiSUS. (Origem: PRT MS/GM 1397/2017, Art. 1º)
Art. 365. A Estratégia AIDPI, desenvolvida originalmente pela Organização Mundial da Saúde (OMS) e pelo Fundo das Nações Unidas para a Infância e a Adolescência (UNICEF), caracteriza-se pela consideração da atenção à saúde na infância, simultânea e integrada do conjunto de doenças de maior prevalência na infância. (Origem: PRT MS/GM 1397/2017, Art. 2º)
Art. 366. A Estratégia AIDPI tem por objetivo: (Origem: PRT MS/GM 1397/2017, Art. 3º)
I - identificar sinais clínicos que permitam fazer uma triagem rápida quanto à natureza da atenção requerida pela criança, como encaminhamento urgente a um hospital, tratamento ambulatorial ou orientação para cuidados e vigilância no domicílio; (Origem: PRT MS/GM 1397/2017, Art. 3º, I)
II - ampliar e qualificar as ações de atenção integral à saúde das crianças; e (Origem: PRT MS/GM 1397/2017, Art. 3º, II)
III - diminuir a morbimortalidade de crianças de 0 (zero) a 4 (quatro) anos 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 1397/2017, Art. 3º, III)
Art. 367. São pilares básicos da Estratégia AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 4º)
I - educação permanente dos profissionais de saúde indígena no nível da Atenção Básica; (Origem: PRT MS/GM 1397/2017, Art. 4º, I)
II - reorganização e adaptação dos serviços de saúde e processos de trabalhos em áreas indígenas; e (Origem: PRT MS/GM 1397/2017, Art. 4º, II)
III - educação em saúde na família e nas comunidades. (Origem: PRT MS/GM 1397/2017, Art. 4º, III)
Art. 368. As condutas preconizadas pela Estratégia AIDPI incorporam as normas do Ministério da Saúde relativas à promoção, à prevenção e ao tratamento dos problemas infantis mais frequentes, a saber: (Origem: PRT MS/GM 1397/2017, Art. 5º)
I - aleitamento materno; (Origem: PRT MS/GM 1397/2017, Art. 5º, I)
II - promoção de alimentação saudável; (Origem: PRT MS/GM 1397/2017, Art. 5º, II)
III - crescimento e desenvolvimento infantil; (Origem: PRT MS/GM 1397/2017, Art. 5º, III)
IV - imunização; e (Origem: PRT MS/GM 1397/2017, Art. 5º, IV)
V - desnutrição, anemia, doenças diarreicas, infecções respiratórias agudas, malária, problemas de ouvido, dor de garganta, prevenção da violência, dentre outros. (Origem: PRT MS/GM 1397/2017, Art. 5º, V)
§ 1º O acompanhamento do crescimento e desenvolvimento infantil deve ser priorizado pelas Equipes Multidisciplinares de Saúde Indígena, pois compreende todas as atividades relacionadas à promoção do desenvolvimento saudável da criança e à detecção de problemas no atraso do desenvolvimento neuropsicomotor. (Origem: PRT MS/GM 1397/2017, Art. 5º, § 1º)
§ 2º Para dar seguimento aos tratamentos dos problemas infantis, cabe as Equipes Multidisciplinares de Saúde Indígena fazer os arranjos necessários para que as consultas de retorno ou visitas domiciliares de acompanhamento da criança doente sejam realizadas. (Origem: PRT MS/GM 1397/2017, Art. 5º, § 2º)
Subseção II
Da Implementação da Estratégia AIDPI
(Origem: PRT MS/GM 1397/2017, CAPÍTULO II)
Art. 369. A implementação da Estratégia AIDPI no âmbito do Distritos Sanitários Especiais Indígenas DSEI/SESAI/MS, será realizada por meio das seguintes etapas: (Origem: PRT MS/GM 1397/2017, Art. 6º)
I - ações de capacitação de profissionais de saúde; (Origem: PRT MS/GM 1397/2017, Art. 6º, I)
II - reorganização dos serviços de saúde e processos de trabalho das Equipes Multidisciplinares de Saúde Indígena - EMSI; e (Origem: PRT MS/GM 1397/2017, Art. 6º, II)
III - realização das visitas de seguimento e avaliação da implementação da estratégia. (Origem: PRT MS/GM 1397/2017, Art. 6º, III)
Parágrafo Único. A visita de seguimento permite a análise e os encaminhamentos para a resolução dos problemas encontrados pelos profissionais de saúde na aplicação da estratégia. (Origem: PRT MS/GM 1397/2017, Art. 6º, Parágrafo Único)
Art. 370. A implementação da Estratégia AIDPI será: (Origem: PRT MS/GM 1397/2017, Art. 7º)
I - coordenada pela Coordenação-Geral de Atenção Primária à Saúde Indígena (CGAPSI/DASI/SESAI/MS); (Origem: PRT MS/GM 1397/2017, Art. 7º, I)
II - apoiada pela Coordenação-Geral de Saúde da Criança e Aleitamento Materno (CGSCAM/DAPES/SAS); e (Origem: PRT MS/GM 1397/2017, Art. 7º, II)
III - executada pelos DSEI/SESAI/MS. (Origem: PRT MS/GM 1397/2017, Art. 7º, III)
Subseção III
Dos Profissionais e sua Capacitação
(Origem: PRT MS/GM 1397/2017, CAPÍTULO III)
Art. 371. São profissionais envolvidos na AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 8º)
I - profissional do nível operacional: médico ou enfermeiro que atua nos serviços de saúde, priorizando os integrantes da Equipe Multidisciplinar de Saúde Indígena - EMSI; (Origem: PRT MS/GM 1397/2017, Art. 8º, I)
II - docente: profissional que é professor de escolas de Medicina ou de Enfermagem, que participa de cursos de AIDPI; (Origem: PRT MS/GM 1397/2017, Art. 8º, II)
III - multiplicador/facilitador: profissional que atua como professor nos diversos cursos da Estratégia ADIPI Criança, AIDPI Neonatal e AIDPI Comunitário Materno Infantil, devidamente capacitado por meio de curso específico; e (Origem: PRT MS/GM 1397/2017, Art. 8º, III)
IV - cofacilitador: profissional capacitado em curso de multiplicador, mas que não atuou em nenhum curso. (Origem: PRT MS/GM 1397/2017, Art. 8º, IV)
Parágrafo Único. Além dos multiplicadores/facilitadores, os demais profissionais de saúde, devidamente capacitados, a exemplo dos nutricionistas e farmacêuticos, poderão atuar de forma complementar para atenção integral às crianças. (Origem: PRT MS/GM 1397/2017, Art. 8º, Parágrafo Único)
Art. 372. Os profissionais envolvidos na AIDPI deverão realizar curso de capacitação, pelos multiplicadores/facilitadores, recebendo os materiais pedagógicos e as devidas orientações referentes à metodologia a ser utilizada durante a capacitação. (Origem: PRT MS/GM 1397/2017, Art. 9º)
Subseção IV
Das Atribuições dos Órgãos e Agentes Envolvidos
(Origem: PRT MS/GM 1397/2017, CAPÍTULO IV)
Art. 373. São atribuições da CGAPSI/SESAI/MS em parceria com a CGSCAM/DAPES/SAS/MS: (Origem: PRT MS/GM 1397/2017, Art. 10)
I - estimular e assessorar os DSEI/SESAI/MS na implantação e implementação da Estratégia AIDPI; (Origem: PRT MS/GM 1397/2017, Art. 10, I)
II - promover oficinas de revisão técnica, atualização e adaptações do material didático utilizado nos cursos de capacitação, pela equipe AIDPI nacional de referência; (Origem: PRT MS/GM 1397/2017, Art. 10, II)
III - monitorar a implantação da estratégia e acompanhar os indicadores de atenção à saúde da criança estabelecidos pactuados no Plano Nacional de Saúde Indígena; e (Origem: PRT MS/GM 1397/2017, Art. 10, III)
IV - formar e atualizar multiplicadores da AIDPI. (Origem: PRT MS/GM 1397/2017, Art. 10, IV)
Art. 374. São atribuições dos DSEI/SESAI/MS: (Origem: PRT MS/GM 1397/2017, Art. 11)
I - executar a AIDPI em conformidade com o perfil epidemiológico, priorizando-se áreas de maior vulnerabilidade para implementação da estratégia; (Origem: PRT MS/GM 1397/2017, Art. 11, I)
II - priorizar a Estratégia AIDPI como ferramenta para reorganização do serviço e a redução da morbimortalidade infantil; (Origem: PRT MS/GM 1397/2017, Art. 11, II)
III - garantir insumos e medicamentos essenciais recomendados para a implementação da Estratégia AIDPI; (Origem: PRT MS/GM 1397/2017, Art. 11, III)
IV - garantir recursos financeiros e logísticos para a capacitação de profissionais; (Origem: PRT MS/GM 1397/2017, Art. 11, IV)
V - apoiar os multiplicadores da estratégia ou profissionais capacitados para realização de visitas periódicas de monitoramento; (Origem: PRT MS/GM 1397/2017, Art. 11, V)
VI - apoiar os profissionais da EMSI na resolução dos problemas identificados durante a utilização da estratégia; (Origem: PRT MS/GM 1397/2017, Art. 11, VI)
VII - inserir e manter atualizados os dados necessários para o cálculo dos indicadores de atenção à saúde da criança indígena estabelecidos nos instrumentos de gestão; e (Origem: PRT MS/GM 1397/2017, Art. 11, VII)
VIII - manter articulação com a rede de serviços de saúde com o objetivo de garantir a atenção de média e alta complexidade. (Origem: PRT MS/GM 1397/2017, Art. 11, VIII)
Parágrafo Único. O DSEI/SESAI/MS deverá se articular, para a garantia da atenção integral à saúde das crianças indígenas, com a rede de saúde levando-se em consideração a organização regional e a hierarquização da rede assistencial, com a participação complementar dos Estados, Distrito Federal e Municípios e das demais instâncias de gestão e controle social do SUS. (Origem: PRT MS/GM 1397/2017, Art. 11, Parágrafo Único)
Art. 375. São atribuições dos profissionais multiplicadores/facilitadores na Estratégia AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 12)
I - apoiar o planejamento para implantação e implementação da estratégia; (Origem: PRT MS/GM 1397/2017, Art. 12, I)
II - promover, com apoio da DASI/SESAI/MS, a capacitação das equipes multidisciplinares de saúde indígena; e (Origem: PRT MS/GM 1397/2017, Art. 12, II)
III - realizar visitas de seguimento para avaliação da estratégia. (Origem: PRT MS/GM 1397/2017, Art. 12, III)
Subseção V
Da Composição da AIDIPI
(Origem: PRT MS/GM 1397/2017, CAPÍTULO V)
Art. 376. Para fins da implementação, a Estratégia AIDPI é composta por três componentes: (Origem: PRT MS/GM 1397/2017, Art. 13)
I - AIDPI Neonatal; (Origem: PRT MS/GM 1397/2017, Art. 13, I)
II - AIDPI Criança; e (Origem: PRT MS/GM 1397/2017, Art. 13, II)
III - AIDPI Comunitário Materno Infantil (Origem: PRT MS/GM 1397/2017, Art. 13, III)
Art. 377. A AIDPI Neonatal compreende a atenção à mulher antes da gestação até a criança menor que 2 (dois) meses. (Origem: PRT MS/GM 1397/2017, Art. 14)
Parágrafo Único. A estratégia AIDPI Neonatal pode ser utilizada por médicos e enfermeiros, devidamente capacitados, que trabalham com gestantes, lactentes e crianças, desde o nascimento até 5 (cinco) anos (59 meses e 29 dias) de idade, na Atenção Básica. (Origem: PRT MS/GM 1397/2017, Art. 14, Parágrafo Único)
Art. 378. A AIDPI Criança compreende a atenção a criança de 2 (dois) meses a menores de 4 (quatro) anos 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 1397/2017, Art. 15)
Parágrafo Único. A estratégia AIDPI Criança pode ser utilizada por médicos e enfermeiros, devidamente capacitados, que trabalham com gestantes, lactentes e crianças, desde o nascimento até 5 (cinco) anos (59 meses e 29 dias) de idade, na Atenção Básica. (Origem: PRT MS/GM 1397/2017, Art. 15, Parágrafo Único)
Art. 379. A AIDPI Comunitário Materno Infantil compreende a atenção à mulher antes da gestação até as crianças menores de 4 (quatro) anos 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 1397/2017, Art. 16)
Parágrafo Único. A estratégia AIDPI Comunitário Materno Infantil pode ser utilizada por agentes indígenas de saúde e técnicos de enfermagem devidamente capacitados. (Origem: PRT MS/GM 1397/2017, Art. 16, Parágrafo Único)
Subseção VI
Das Disposições Finais
(Origem: PRT MS/GM 1397/2017, CAPÍTULO VI)
Art. 380. São indicadores estratégicos para acompanhamento dos resultados da implementação da AIDPI: (Origem: PRT MS/GM 1397/2017, Art. 17)
I - taxa de mortalidade infantil; (Origem: PRT MS/GM 1397/2017, Art. 17, I)
II - taxa de mortalidade neonatal; (Origem: PRT MS/GM 1397/2017, Art. 17, II)
III - taxa de mortalidade materna; (Origem: PRT MS/GM 1397/2017, Art. 17, III)
IV - incidência de déficit nutricional em menores de 5 (cinco) anos; (Origem: PRT MS/GM 1397/2017, Art. 17, IV)
V - incidência de baixo peso em gestantes; (Origem: PRT MS/GM 1397/2017, Art. 17, V)
VI - proporção de crianças indígenas de 1 (um) a 4 (quatro) anos com esquema vacinal completo; (Origem: PRT MS/GM 1397/2017, Art. 17, VI)
VII - proporção de crianças indígenas menores de 1 (um) ano com esquema vacinal completo; (Origem: PRT MS/GM 1397/2017, Art. 17, VII)
VIII - proporção de atendimentos de pré-natal; (Origem: PRT MS/GM 1397/2017, Art. 17, VIII)
IX - proporção de óbitos infantis investigados; e (Origem: PRT MS/GM 1397/2017, Art. 17, IX)
X - proporção de óbitos maternos investigados. (Origem: PRT MS/GM 1397/2017, Art. 17, X)
Art. 381. A Estratégia AIDPI será detalhada em manual específico disponibilizado pelo Ministério da Saúde. (Origem: PRT MS/GM 1397/2017, Art. 18)
Art. 382. Os insumos e medicamentos essenciais para a implementação da Estratégia AIDPI serão os listados nos Anexos XLVII e XLVIII . (Origem: PRT MS/GM 1397/2017, Art. 19)
Seção II
Do Calendário Nacional de Vacinação, o Calendário Nacional de Vacinação dos Povos Indígenas e as Campanhas Nacionais de Vacinação
Art. 383. Esta Seção define o Calendário Nacional de Vacinação, o Calendário Nacional de Vacinação dos Povos Indígenas e as Campanhas Nacionais de Vacinação, no âmbito do Programa Nacional de Imunizações (PNI), em todo o território nacional. (Origem: PRT MS/GM 1533/2016, Art. 1º)
Art. 384. Os Calendários e as Campanhas Nacionais de Vacinação têm por objetivo o controle, a eliminação e a erradicação de doenças imunopreveníveis. (Origem: PRT MS/GM 1533/2016, Art. 2º)
§ 1º O Calendário Nacional de Vacinação será adotado de acordo com o disposto no Anexo LVIII , observada a Instrução Normativa do Calendário Nacional de Vacinação de que trata o Anexo LXI . (Origem: PRT MS/GM 1533/2016, Art. 2º, § 1º)
§ 2º O Calendário Nacional de Vacinação dos Povos Indígenas será adotado de acordo com o disposto no Anexo LIX , observada a Instrução Normativa do Calendário Nacional de Vacinação dos Povos Indígenas de que trata o Anexo LXII . (Origem: PRT MS/GM 1533/2016, Art. 2º, § 2º)
§ 3º As Campanhas Nacionais de Vacinação serão adotadas de acordo com o disposto no Anexo LX . (Origem: PRT MS/GM 1533/2016, Art. 2º, § 3º)
Art. 385. As Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios adotarão os Calendários Nacionais de Vacinação para execução das ações de vacinação. (Origem: PRT MS/GM 1533/2016, Art. 3º)
Art. 386. Compete à Secretaria Especial de Saúde Indígena (SESAI/MS) a execução das ações de vacinação nas áreas indígenas. (Origem: PRT MS/GM 1533/2016, Art. 4º)
Art. 387. O Ministério da Saúde será responsável pela aquisição e pelo fornecimento às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios das vacinas preconizadas nos Calendários e nas Campanhas Nacionais de Vacinação de que trata esta Seção. (Origem: PRT MS/GM 1533/2016, Art. 5º)
Parágrafo Único. Os insumos necessários ao atendimento dos Calendários e das Campanhas Nacionais de Vacinação, quais sejam seringas, agulhas e impressos para registro das atividades de vacinação, serão fornecidos às unidades de saúde do Sistema Único de Saúde (SUS) de acordo com as competências de cada esfera dedireção do SUS. (Origem: PRT MS/GM 1533/2016, Art. 5º, Parágrafo Único)
Art. 388. Compete às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios a gestão da Rede de Frio, observado o disposto no Capítulo III do Título VII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 1533/2016, Art. 6º)
Parágrafo Único. Para fins do disposto nesta Seção, consideram-se: (Origem: PRT MS/GM 1533/2016, Art. 6º, Parágrafo Único)
I - Rede de Frio: sistema dotado de estrutura física e técnicoadministrativa, orientado pelo Programa Nacional de Imunizações (PNI), por meio de normatização (coordenação), planejamento, avaliação e financiamento, visando à manutenção adequada da Cadeia de Frio; e (Origem: PRT MS/GM 1533/2016, Art. 6º, Parágrafo Único, I)
II - Cadeia de Frio: processo logístico da Rede de Frio para conservação dos imunobiológicos, incluindo-se as etapas de recebimento, armazenamento, distribuição e transporte, de forma oportuna e eficiente, para assegurar a preservação de suas características originais. (Origem: PRT MS/GM 1533/2016, Art. 6º, Parágrafo Único, II)
Art. 389. O registro das informações quanto às vacinas administradas será feito nos instrumentos padronizados no âmbito do PNI, obedecendo-se ao fluxo e à periodicidade ali definidos, sendo responsabilidade: (Origem: PRT MS/GM 1533/2016, Art. 7º)
I - das Secretarias de Saúde do Distrito Federal e dos Municípios, no que se refere ao registro no Sistema de Informação do Programa Nacional de Imunizações (SIPNI); e (Origem: PRT MS/GM 1533/2016, Art. 7º, I)
II - da SESAI/MS, no que se refere ao registro no Sistema de Informação de Atenção à Saúde Indígena (SIASI). (Origem: PRT MS/GM 1533/2016, Art. 7º, II)
Art. 390. A comprovação da vacinação será feita por meio do cartão ou caderneta de vacinação, emitido pelas unidades de saúde públicas e privadas, devidamente credenciadas no âmbito do SUS, contendo as seguintes informações: (Origem: PRT MS/GM 1533/2016, Art. 8º)
I - dados pessoais: nome completo, data de nascimento e endereço; (Origem: PRT MS/GM 1533/2016, Art. 8º, I)
II - nome da vacina; (Origem: PRT MS/GM 1533/2016, Art. 8º, II)
III - data; (Origem: PRT MS/GM 1533/2016, Art. 8º, III)
IV - número do lote; (Origem: PRT MS/GM 1533/2016, Art. 8º, IV)
V - laboratório produtor; (Origem: PRT MS/GM 1533/2016, Art. 8º, V)
VI - unidade vacinadora; e (Origem: PRT MS/GM 1533/2016, Art. 8º, VI)
VII - nome do vacinador. (Origem: PRT MS/GM 1533/2016, Art. 8º, VII)
Parágrafo Único. O cartão ou caderneta de vacinação é um documento de caráter pessoal e intransferível, válido em todo o território nacional, sendo que sua atualização deve ser feita em conformidade com as indicações do Calendário Nacional de Vacinação. (Origem: PRT MS/GM 1533/2016, Art. 8º, Parágrafo Único)
Art. 391. Fica a Secretaria de Vigilância em Saúde (SVS/MS) autorizada a editar normas complementares esta Seção e adotar as medidas necessárias para a implantação e o cumprimento do Calendário Nacional de Vacinação, do Calendário Nacional de Vacinação dos Povos Indígenas e das Campanhas Nacionais de Vacinação. (Origem: PRT MS/GM 1533/2016, Art. 9º)
Art. 392. O Ministério da Saúde disponibilizará manual instrutivo com normatizações técnicas sobre o Calendário Nacional de Vacinação, o Calendário Nacional de Vacinação dos Povos Indígenas e as Campanhas Nacionais de Vacinação, cujo conteúdo estará disponível no endereço eletrônico www.saude.gov.br/svs. (Origem: PRT MS/GM 1533/2016, Art. 10)
CAPÍTULO I-A
DO PROGRAMA NACIONAL DE ACESSO À ÁGUA POTÁVEL EM TERRAS INDÍGENAS - PNATI
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 392-A. Este Capítulo dispõe sobre o Programa Nacional de Acesso à Água Potável em Terras Indígenas - PNATI, nos termos do Anexo CV. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
CAPÍTULO II
DA SAÚDE DA PESSOA COM DEFICIÊNCIA
Seção I
Do Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência
Art. 393. Fica instituído o Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência, de caráter técnico-consultivo, com a finalidade de subsidiar o Ministério da Saúde na implementação do Plano Nacional para Pessoas com Deficiência. (Origem: PRT MS/GM 2672/2011, Art. 1º)
Art. 394. Compete ao Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência: (Origem: PRT MS/GM 2672/2011, Art. 2º)
I - estabelecer os padrões de qualidade dos serviços de reabilitação; (Origem: PRT MS/GM 2672/2011, Art. 2º, I)
II - definir os critérios de organização e de funcionamento dos serviços da rede de reabilitação, do modelo de cuidado e de gestão, por meio de transferência de tecnologia; (Origem: PRT MS/GM 2672/2011, Art. 2º, II)
III - propor e apoiar tecnicamente o Processo de Qualificação dos serviços de reabilitação; (Origem: PRT MS/GM 2672/2011, Art. 2º, III)
IV - estabelecer parâmetros para a Certificação de Qualidade dos novos serviços de reabilitação visual, auditiva, física e intelectual, bem como aos serviços já existentes, que aderirem ao Processo de Qualificação; e (Origem: PRT MS/GM 2672/2011, Art. 2º, IV)
V - propor e apoiar processos de formação e qualificação dos profissionais da rede de reabilitação, em parceria com serviços de referência definidos por critérios técnicos. (Origem: PRT MS/GM 2672/2011, Art. 2º, V)
Art. 395. Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência será composto por membros, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2672/2011, Art. 3º)
I - Gabinete do Ministro da Saúde (GM/MS); (Origem: PRT MS/GM 2672/2011, Art. 3º, I)
II - Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 2672/2011, Art. 3º, II)
III - Secretaria de Atenção à Saúde (SAS/MS): (Origem: PRT MS/GM 2672/2011, Art. 3º, III)
a) Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS); (Origem: PRT MS/GM 2672/2011, Art. 3º, III, a)
b) Departamento de Atenção Básica (DAB/SAS/MS); e (Origem: PRT MS/GM 2672/2011, Art. 3º, III, b)
c) Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 2672/2011, Art. 3º, III, c)
IV - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2672/2011, Art. 3º, IV)
V - Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2672/2011, Art. 3º, V)
VI - Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2672/2011, Art. 3º, VI)
VII - Secretaria Especial de Direitos Humanos da Presidência da República (SEDH-PR), por meio da Secretaria Nacional de Promoção dos Direitos da Pessoa com Deficiência; (Origem: PRT MS/GM 2672/2011, Art. 3º, VII)
VIII - entidades prestadoras de serviços de reabilitação auditiva: (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII)
a) Fundação de São Paulo/Centro Auditivo da Criança (DERDIC/PUC/SP); (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, a)
b) Hospital de Reabilitação de Anomalias Crânio-faciais/Centro de Pesquisas Audiológicas (Centrinho de Bauru/SP); (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, b)
c) Fundação Faculdade de Medicina (MEC/MPAS/HC); (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, c)
d) Hospital de Clinicas da Universidade de Campinas (CEPRE/Unicamp de Campinas); e (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, d)
e) Hospital de Clinicas de Porto Alegre (HC/RS). (Origem: PRT MS/GM 2672/2011, Art. 3º, VIII, e)
IX - entidades prestadoras de serviços de reabilitação física: (Origem: PRT MS/GM 2672/2011, Art. 3º, IX)
a) Associação das Pioneiras Sociais (SARAH/DF); (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, a)
b) Instituto Nacional de Traumatologia e Ortopedia (INTO/MS/ RJ); (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, b)
c) Associação de Assistência à Criança Deficiente (AACD); (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, c)
d) Associação Pestalozzi de Niterói/RJ; e (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, d)
e) Instituto de Ortopedia e Traumatologia do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (IOT/HC/FM/USP). (Origem: PRT MS/GM 2672/2011, Art. 3º, IX, e)
X - entidades prestadoras de serviços de reabilitação visual: (Origem: PRT MS/GM 2672/2011, Art. 3º, X)
a) Serviço de Oftalmologia da Universidade Federal de São Paulo (UNIFESP); (Origem: PRT MS/GM 2672/2011, Art. 3º, X, a)
b) Fundação Catarinense de Educação Especial/SC; (Origem: PRT MS/GM 2672/2011, Art. 3º, X, b)
c) Fundação Dorina Nowill para Cegos/SP; e (Origem: PRT MS/GM 2672/2011, Art. 3º, X, c)
d) Associação Brasileira de Assistência ao Deficiente Visual (LARAMARA/SP). (Origem: PRT MS/GM 2672/2011, Art. 3º, X, d)
XI - entidades prestadoras de serviços de reabilitação intelectual: (Origem: PRT MS/GM 2672/2011, Art. 3º, XI)
a) Fundação Síndrome de Down de Campinas/SP; (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, a)
b) Núcleo de Assistência Integral ao Paciente Especial de Santa Catarina (NAIPE/SC); (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, b)
c) Associação de Pais e Amigos dos Excepcionais de São Paulo (APAE/SP); e (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, c)
d) Núcleo de Neurodesenvolvimento Professor Mário Coutinho, da Universidade Federal de Pelotas (UFPel/RS). (Origem: PRT MS/GM 2672/2011, Art. 3º, XI, d)
§ 1º Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência será coordenado pelo DAPES/SAS/MS. (Origem: PRT MS/GM 2672/2011, Art. 3º, § 1º)
§ 2º A adesão dos órgãos e entidades ao Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência será realizada mediante a celebração de termo de compromisso específico. (Origem: PRT MS/GM 2672/2011, Art. 3º, § 2º)
§ 3º Desde que haja consenso entre os membros, o Comitê poderá convidar servidores de outros órgãos e entidades públicas, de entidades não-governamentais, bem como especialistas em assuntos ligados ao tema, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 2672/2011, Art. 3º, § 3º)
Art. 396. Ao DAPES/SAS/MS, na qualidade de coordenador do Comitê de que trata esta Seção, compete: (Origem: PRT MS/GM 2672/2011, Art. 4º)
I - convocar e coordenar as reuniões e organizar suas pautas; (Origem: PRT MS/GM 2672/2011, Art. 4º, I)
II - disponibilizar os recursos necessários para a viabilização dos trabalhos do Comitê e seus Grupos de Trabalho; (Origem: PRT MS/GM 2672/2011, Art. 4º, II)
III - dar conhecimento à população, por meio de pronunciamentos e/ou documentos oficiais, das decisões e ações do Comitê; e (Origem: PRT MS/GM 2672/2011, Art. 4º, III)
IV - indicar e realizar as formulações técnicas do Comitê para as subsequentes deliberações junto às instâncias internas e Comissões Intergestores do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2672/2011, Art. 4º, IV)
Art. 397. O Comitê se reunirá ordinariamente duas vezes ao ano e extraordinariamente por convocação da Coordenação. (Origem: PRT MS/GM 2672/2011, Art. 5º)
Art. 398. O Comitê será constituído por 4 (quatro) Grupos de Trabalho (GTs). (Origem: PRT MS/GM 2672/2011, Art. 6º)
Parágrafo Único. Os GTs terão o objetivo de aprofundar as discussões sobre temas específicos e apresentar proposições atinentes a cada uma das áreas de reabilitação - visual, auditiva, física e intelectual -, incluindo as deficiências múltiplas, que serão consideradas em cada um dos GTs específicos. (Origem: PRT MS/GM 2672/2011, Art. 6º, Parágrafo Único)
Art. 399. Os GTs serão denominados da seguinte forma: (Origem: PRT MS/GM 2672/2011, Art. 7º)
I - Grupo de Trabalho da Deficiência Física; (Origem: PRT MS/GM 2672/2011, Art. 7º, I)
II - Grupo de Trabalho da Deficiência Auditiva; (Origem: PRT MS/GM 2672/2011, Art. 7º, II)
III - Grupo de Trabalho da Deficiência Visual; e (Origem: PRT MS/GM 2672/2011, Art. 7º, III)
IV - Grupo de Trabalho da Deficiência Intelectual. (Origem: PRT MS/GM 2672/2011, Art. 7º, IV)
Art. 400. Compete aos GTs: (Origem: PRT MS/GM 2672/2011, Art. 8º)
I - realizar estudos e elaborar documentos técnicos para subsidiar os trabalhos da Comissão; (Origem: PRT MS/GM 2672/2011, Art. 8º, I)
II - desenvolver as ações deliberadas pelo Comitê concernentes à área específica de sua atuação; e (Origem: PRT MS/GM 2672/2011, Art. 8º, II)
III - contribuir com o processo de apoio in loco aos serviços da rede de reabilitação para a observância dos critérios e parâmetros de qualidade, de organização e de funcionamentos dos serviços, atuando ativamente nos processos da Qualificação e de Certificação. (Origem: PRT MS/GM 2672/2011, Art. 8º, III)
Parágrafo Único. A participação dos GTs nos processos da Qualificação e de Certificação dos serviços poderá contar com a contribuição de instituições e centros de excelência escolhidos por critérios técnicos e observará a estratégia de apoio desenvolvida pelo Ministério da Saúde. (Origem: PRT MS/GM 2672/2011, Art. 8º, Parágrafo Único)
Art. 401. Cada GT será composto por: (Origem: PRT MS/GM 2672/2011, Art. 9º)
I - representantes das respectivas entidades de reabilitação que compõem o Comitê; (Origem: PRT MS/GM 2672/2011, Art. 9º, I)
II - 1 (um) integrante designado entre os membros do Comitê; e (Origem: PRT MS/GM 2672/2011, Art. 9º, II)
III - 2 (dois) representantes do DAPES/SAS/MS. (Origem: PRT MS/GM 2672/2011, Art. 9º, III)
Parágrafo Único. A participação de outros especialistas e/ou profissionais de referência para subsidiar as discussões e produção técnica do GT poderá ocorrer tanto na forma presencial, em reuniões, como por meio de consultoria à distância. (Origem: PRT MS/GM 2672/2011, Art. 9º, Parágrafo Único)
Art. 402. Os GTs serão coordenados pelo DAPES/SAS/MS, que indicará entre seus membros um especialista para cada GT. (Origem: PRT MS/GM 2672/2011, Art. 10)
Art. 403. Os GTs se reunirão trimestralmente ou em caráter extraordinário sempre que a Coordenação entender necessário. (Origem: PRT MS/GM 2672/2011, Art. 11)
Art. 404. Poderão ser instituídos, em caráter transitório, outros GTs para a discussão de temas específicos, de acordo com as demandas e mediante indicação do Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência, a fim de se alcançar a execução plena das atribuições do Comitê. (Origem: PRT MS/GM 2672/2011, Art. 12)
Art. 405. As funções exercidas pelos membros e convidados no âmbito do Comitê Nacional de Assessoramento e Apoio às Ações de Saúde do Plano Nacional para Pessoas com Deficiência e seus respectivos GTs não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2672/2011, Art. 13)
Art. 406. O Comitê definirá, em sua primeira reunião, o cronograma de trabalho e sua agenda de atividades. (Origem: PRT MS/GM 2672/2011, Art. 14)
CAPÍTULO III
DA SAÚDE DO TRABALHADOR E DA TRABALHADORA
Seção I
Do Comitê Nacional de Promoção da Saúde do Trabalhador do SUS
Art. 407. Fica instituído o Comitê Nacional de Promoção da Saúde do Trabalhador do Sistema Único de Saúde, objetivando: (Origem: PRT MS/GM 2871/2009, Art. 1º)
I - formular as Diretrizes da Política Nacional de Promoção da Saúde do Trabalhador do SUS, contendo programas e ações que tenham como objetivo aperfeiçoar, garantir e (ou) recuperar as condições e ambientes de trabalho no SUS; (Origem: PRT MS/GM 2871/2009, Art. 1º, I)
II - harmonizar a Política Nacional de Promoção da Saúde do Trabalhador do SUS com as políticas de gestão do trabalho, gestão da educação e saúde do trabalhador implementadas pelo Ministério da Saúde; (Origem: PRT MS/GM 2871/2009, Art. 1º, II)
III - propor estratégias de vigilância e monitoramento dos riscos e da morbidade ligados aos ambientes de trabalho; (Origem: PRT MS/GM 2871/2009, Art. 1º, III)
IV - indicar estratégias de comunicação e participação dos trabalhadores do SUS para garantir o acompanhamento e a adoção das ações e programas constantes da Política; (Origem: PRT MS/GM 2871/2009, Art. 1º, IV)
V - articular instituições de pesquisa e universidades para a execução de estudos e pesquisas em saúde do trabalhador, integrando uma rede de colaboradores para o desenvolvimento técnico-científico na área; (Origem: PRT MS/GM 2871/2009, Art. 1º, V)
VI - propor linhas de financiamento para ações e produção de conhecimento na área; (Origem: PRT MS/GM 2871/2009, Art. 1º, VI)
VII - elaborar instrumentos informativos e desenvolver processos de formação sobre saúde do trabalhador e políticas de saúde para entidades e lideranças sindicais, profissionais, gestores e conselheiros de saúde; e (Origem: PRT MS/GM 2871/2009, Art. 1º, VII)
VIII - manter articulação com a Rede Nacional de Atenção Integral à Saúde do Trabalhador (RENAST). (Origem: PRT MS/GM 2871/2009, Art. 1º, VIII)
Art. 408. O Comitê terá a seguinte composição: (Origem: PRT MS/GM 2871/2009, Art. 2º)
I - seis representantes do Ministério da Saúde, quais sejam: (Origem: PRT MS/GM 2871/2009, Art. 2º, I)
a) um representante do Departamento de Gestão e da Regulação do Trabalho em Saúde, da Secretaria de Gestão do Trabalho e da Educação na Saúde (DEGERTS/SGTES); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, a)
b) um representante da Coordenação-Geral da Regulação e Negociação do Trabalho em Saúde, do DEGERTS/SGTES; (Origem: PRT MS/GM 2871/2009, Art. 2º, I, b)
c) um representante do Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador, da Secretaria de Vigilância em Saúde (DSAST/SVS); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, c)
d) um representante da Coordenação-Geral de Saúde do Trabalhador, da SVS; (Origem: PRT MS/GM 2871/2009, Art. 2º, I, d)
e) um representante da Coordenação de Recursos Humanos, da Subsecretaria de Assuntos Administrativos, da Secretaria-Executiva (CGRH/SAA/SE); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, e)
f) um representante da área da Política Nacional de Humanização, da Secretaria de Atenção à Saúde (SAS); (Origem: PRT MS/GM 2871/2009, Art. 2º, I, f)
II - um representante do Ministério do Planejamento, Desenvolvimento e Gestão; (Origem: PRT MS/GM 2871/2009, Art. 2º, II)
III - um representante do Ministério do Trabalho; (Origem: PRT MS/GM 2871/2009, Art. 2º, III)
IV - um representante do Conselho Nacional dos Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2871/2009, Art. 2º, IV)
V - um representante do Conselho Nacional dos Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2871/2009, Art. 2º, V)
VI - onze representantes da bancada dos trabalhadores da Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS); e (Origem: PRT MS/GM 2871/2009, Art. 2º, VI) (com redação dada pela PRT MS/GM 238/2010)
VII - um representante de entidade patronal do setor privado da saúde. (Origem: PRT MS/GM 2871/2009, Art. 2º, VII) (dispositivo acrescentado pela PRT MS/GM 238/2010)
§ 1º À exceção dos representantes do Ministério da Saúde, os demais integrantes do Comitê serão livremente designados por meio de expediente subscrito pelos representantes legais dos órgãos e instituições representadas. (Origem: PRT MS/GM 2871/2009, Art. 2º, § 1º)
§ 2º Serão designados suplentes que, na ausência do titular, deverão participar das reuniões. (Origem: PRT MS/GM 2871/2009, Art. 2º, § 2º)
§ 3º A Organização Pan-Americana da Saúde (OPAS), a Agência Nacional de Vigilância Sanitária (ANVISA), a Fundação Oswaldo Cruz (FIOCRUZ) e a Rede de Observatório em Recursos Humanos em Saúde (ROREHS) terão assento no Comitê como convidados permanentes. (Origem: PRT MS/GM 2871/2009, Art. 2º, § 3º)
Art. 409. O Comitê Nacional de Promoção da Saúde do Trabalhador do SUS deverá, no prazo de 120 dias, a contar da data de designação de seus integrantes, formular proposta das Diretrizes para a Política Nacional de Promoção da Saúde do Trabalhador do SUS. (Origem: PRT MS/GM 2871/2009, Art. 3º)
§ 1º Após o prazo acima referido, a proposta elaborada será apresentada e pactuada na Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS) e, em seguida, levada para aprovação do Conselho Nacional de Saúde (CNS) e na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 2871/2009, Art. 3º, § 1º)
§ 2º Para a elaboração das Diretrizes, o Comitê reunir-se-á, ordinariamente, de acordo com cronograma elaborado na reunião de instalação do Comitê e, extraordinariamente, sempre que convocado pela Coordenação-Geral. (Origem: PRT MS/GM 2871/2009, Art. 3º, § 2º) (com redação dada pela PRT MS/GM 238/2010)
§ 3º Após a publicação das Diretrizes, o Comitê reunir-se-á, ordinariamente, uma vez a cada 2 (dois) meses e, extraordinariamente, sempre que convocada pela Coordenação Geral, atendendo convocação enviada por ofício, via correio eletrônico, com antecedência mínima de 20 (dias) dias. (Origem: PRT MS/GM 2871/2009, Art. 3º, § 3º)
Art. 410. O Comitê será constituído pelas seguintes instâncias: (Origem: PRT MS/GM 2871/2009, Art. 4º)
I - Plenário; (Origem: PRT MS/GM 2871/2009, Art. 4º, I)
II - Coordenação-Geral; (Origem: PRT MS/GM 2871/2009, Art. 4º, II)
III - Coordenação-Adjunta; e (Origem: PRT MS/GM 2871/2009, Art. 4º, III)
IV - Secretaria-Executiva. (Origem: PRT MS/GM 2871/2009, Art. 4º, IV)
§ 1º A Coordenação-Geral e a Secretaria-Executiva serão compartilhadas pelo Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS) e o Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador (DSAST/SVS/MS). (Origem: PRT MS/GM 2871/2009, Art. 4º, § 1º)
§ 2º A Coordenação Adjunta será indicada pela bancada de trabalhadores da MNNP-SUS. (Origem: PRT MS/GM 2871/2009, Art. 4º, § 2º)
§ 3º Os técnicos responsáveis pela Secretaria Executiva serão livremente designados pelos Diretores referidos no § 1º. (Origem: PRT MS/GM 2871/2009, Art. 4º, § 3º)
§ 4º O Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS) e o Departamento de Vigilância em Saúde Ambiental e Saúde do Trabalhador (DSAST/SVS/MS) fornecerão o necessário suporte administrativo para o regular funcionamento do Comitê. (Origem: PRT MS/GM 2871/2009, Art. 4º, § 4º)
Art. 411. O Comitê poderá constituir grupos de trabalho e convidar profissionais de notório saber na matéria, ou especialistas de outros órgãos ou entidades, para prestar assessoria as suas atividades. (Origem: PRT MS/GM 2871/2009, Art. 5º)
Art. 412. As decisões do Plenário do Comitê serão tomadas por consenso. (Origem: PRT MS/GM 2871/2009, Art. 6º)
Art. 413. A participação no Comitê Nacional de Promoção da Saúde do Trabalhador do SUS é considerada prestação de serviço público relevante, não sendo remunerada. (Origem: PRT MS/GM 2871/2009, Art. 7º)
Seção II
Do Preenchimento de Autorização de Internação Hospitalar (AIH), em Casos de Quadro Compatível com Causas Externas e com Doenças e Acidentes Relacionados ao Trabalho
Art. 414. É obrigatório para todas as instituições de assistência à saúde do Sistema Único de Saúde (SUS), para fins de vigilância epidemiológica e sanitária, o preenchimento dos campos CID principal e CID secundário para os registros de causas externas e de agravos à saúde do trabalhador na Autorização de Internação Hospitalar (AIH) de acordo com a Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde (CID), em vigor. (Origem: PRT MS/GM 1969/2001, Art. 1º)
Parágrafo Único. O registro de causas externas e de agravos à saúde relacionados ao trabalho deverão ser detalhados no Laudo Médico para Emissão de AIH de acordo com o roteiro disposto no Anexo XLIX . (Origem: PRT MS/GM 1969/2001, Art. 1º, Parágrafo Único)
Art. 415. Fica criado e tornado obrigatório o preenchimento na Autorização de Internação Hospitalar (AIH), do campo Ocupação, segundo a Classificação Brasileira de Ocupações Resumida (CBO-R), na identificação do paciente, nos casos de acidentes e doenças relacionados ao trabalho em conformidade com os Anexos L e LI . (Origem: PRT MS/GM 1969/2001, Art. 2º)
Art. 416. Fica criado e tornado obrigatório o preenchimento, na Autorização de Internação Hospitalar (AIH), do campo Classificação Nacional de Atividades Econômicas Resumida (CNAE-R) no item referente aos dados do empregador. (Origem: PRT MS/GM 1969/2001, Art. 3º)
Art. 417. É obrigatório o preenchimento, na Autorização de Internação Hospitalar (AIH), do campo Vínculo com a Previdência em relação à atividade formal e CGC/CNPJ da Empresa, atividade autônoma, desempregado, aposentado ou não segurado. (Origem: PRT MS/GM 1969/2001, Art. 4º)
Art. 418. Fica definido como de responsabilidade do Responsável Técnico da Unidade de Atendimento Hospitalar que prestou assistência ao paciente, a notificação, por escrito, à Vigilância Epidemiológica e Sanitária do estado, município ou do Distrito Federal e Delegacia Regional do Trabalho, nos casos comprovados ou suspeitos, de agravos à saúde relacionados ao trabalho, cuja fonte de exposição represente riscos a outros trabalhadores e/ou ao meio ambiente. (Origem: PRT MS/GM 1969/2001, Art. 5º)
Art. 419. Deverão constar do Laudo Médico para Emissão de Autorização de Internação Hospitalar (AIH) as informações a serem prestadas em conformidade com Anexo LII . (Origem: PRT MS/GM 1969/2001, Art. 6º)
Art. 420. A Secretaria de Atenção à Saúde adotará as medidas complementares para a operacionalização e cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1969/2001, Art. 7º)
Art. 421. O Departamento de Informática do SUS (DATASUS) implementará, na Autorização de Internação Hospitalar (AIH), as alterações pertinentes, visando assegurar o cumprimento das disposições constantes nesta Seção. (Origem: PRT MS/GM 1969/2001, Art. 8º)
Seção III
Da Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS
Art. 422. Fica aprovada a Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS, na forma do Anexo LXXIX , com a finalidade de definir procedimentos básicos para o desenvolvimento das ações correspondentes. (Origem: PRT MS/GM 3120/1998, Art. 1º)
Seção IV
Da Lista de Doenças Relacionadas ao Trabalho, a Ser Adotada como Referência dos Agravos Originados no Processo de Trabalho no SUS
Art. 423. Fica instituída a Lista de Doenças relacionadas ao Trabalho, a ser adotada como referência dos agravos originados no processo de trabalho no Sistema Único de Saúde, para uso clínico e epidemiológico, constante no Anexo LXXX . (Origem: PRT MS/GM 1339/1999, Art. 1º) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
Art. 423. Fica instituída a Lista de Doenças Relacionadas ao Trabalho (LDRT), a ser adotada como referência das doenças e agravos oriundos do processo de trabalho. (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020)
Art. 423. Fica instituída a Lista de Doenças Relacionadas ao Trabalho (LDRT), a ser adotada como referência das doenças e agravos oriundos do processo de trabalho. (Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
§ 1º A LDRT destina-se, no âmbito da saúde, às seguintes finalidades, entre outras: (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
I - orientar o uso clínico-epidemiológico, de forma a permitir a qualificação da atenção integral à Saúde do Trabalhador; (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
II - facilitar o estudo da relação entre o adoecimento e o trabalho; (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
III - adotar procedimentos de diagnóstico; (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
IV - elaborar projetos terapêuticos mais acurados; e (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
V - orientar as ações de vigilância e promoção da saúde em nível individual e coletivo. (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
§2º A LDRT será atualizada por portaria do Ministro de Estado da Saúde, organizada nas seguintes estruturas: (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
I - Lista A: Agentes e/ou fatores de risco com respectivas doenças relacionadas ao trabalho; e (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
II - Lista B: Doenças relacionadas ao trabalho com respectivos agentes e/ou fatores de risco. (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020) (Revogado pela PRT GM/MS n° 1.999 de 27.11.2023)
§ 3º A LDRT destina-se, no âmbito da saúde, às seguintes finalidades, entre outras:(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
§ 3º A LDRT não substitui as instâncias científicas no estabelecimento de relações causais entre substâncias e doenças, e orienta-se, no âmbito da saúde, às seguintes finalidades, entre outras: (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
I - orientar o uso clínico-epidemiológico, de forma a permitir a qualificação da atenção integral à Saúde do Trabalhador;(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
II - facilitar o estudo da relação entre o adoecimento e o trabalho;(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
III - adotar procedimentos de diagnóstico;(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
IV - elaborar projetos terapêuticos mais acurados; e(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
V - orientar as ações de vigilância e promoção da saúde em nível individual e coletivo.(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
V - orientar as ações de vigilância em saúde e promoção da saúde em nível individual e coletivo. (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
§ 4º A LDRT consta no Anexo LXXX desta Portaria, sendo organizada nas seguintes estruturas:(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
I - Lista A: agentes e/ou fatores de risco com respectivas doenças relacionadas ao trabalho; e(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
II - Lista B: doenças relacionadas ao trabalho com respectivos agentes e/ou fatores de risco. (Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
Art. 424. Esta lista poderá ser revisada anualmente. (Origem: PRT MS/GM 1339/1999, Art. 2º) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
Art. 424. A LDRT será revisada no prazo máximo de 5 (cinco) anos, observado o contexto epidemiológico nacional e internacional. (Redação dada pela PRT GM/MS n° 2.309 de 28.08.2020)
Seção V
Da Regulamentação dos Procedimentos Relativos à Vigilância da Saúde dos Trabalhadores Expostos ao Benzeno
Art. 425. Ficam instituídas, na forma dos Anexos LXVIII, LXIX, LXX e LXXI , as Normas de Vigilância à Saúde dos Trabalhadores expostos ao Benzeno nos processos de trabalho que produzem, utilizam, transportam, armazenam ou manipulam benzeno e, ou suas misturas líquidas. (Origem: PRT MS/GM 776/2004, Art. 1º)
Seção VI
Dos Procedimentos e Critérios para Envio de Listagem de Trabalhadores Expostos e Ex-expostos ao Asbesto/Amianto nas Atividades de Extração, Industrialização, Utilização, Manipulação, Comercialização, Transporte e Destinação Final de Resíduos, bem como aos Produtos e Equipamentos que o Contenham
Art. 426. Ficam aprovados, na forma do Anexo LXXII , os procedimentos para envio ao Sistema Único de Saúde (SUS) da listagem de trabalhadores expostos e ex-expostos ao asbesto/amianto e/ou a produtos/equipamentos que o contenham e às atividades discriminadas na ementa desta Seção. (Origem: PRT MS/GM 1851/2006, Art. 1º)
Art. 427. Todas as empresas, que desenvolvem ou desenvolveram atividades descritas na Seção VI do Capítulo III do Título III, encaminharão anualmente ao órgão responsável pela gestão do SUS, em nível municipal ou, na sua ausência, ao órgão regional, listagem de trabalhadores expostos e ex-expostos ao asbesto/amianto. (Origem: PRT MS/GM 1851/2006, Art. 2º)
§ 1º A listagem e as informações referentes aos trabalhadores expostos e ex-expostos ao asbesto/amianto em atividade, independentemente de notificação por parte do SUS, deverão ser encaminhadas, preferencialmente, por meio eletrônico, impreterivelmente, até o primeiro dia útil do mês de julho, devidamente protocoladas na Secretaria Municipal de Saúde (SMS) ou no Centro de Referência em Saúde do Trabalhador ou no Serviço de Vigilância à Saúde do Trabalhador, da Secretaria Estadual de Saúde, ou, na inexistência dos órgãos citados, no Serviço de Vigilância à Saúde do SUS, onde a empresa está situada. (Origem: PRT MS/GM 1851/2006, Art. 2º, § 1º)
§ 2º A listagem referente ao exercício de anos anteriores, a contar do dia 1º de junho de 1995, poderá ser requisitada por meio de notificação pelo órgão competente, tendo a empresa até 30 (trinta) dias úteis para sua entrega. (Origem: PRT MS/GM 1851/2006, Art. 2º, § 2º)
§ 3º No que se refere às empresas que substituíram o asbesto/amianto, as obrigações previstas neste artigo e parágrafos anteriores limitam-se aos trabalhadores expostos no período em que elas utilizaram ou manipularam o asbesto/amianto ou produtos/equipamentos que o continham. (Origem: PRT MS/GM 1851/2006, Art. 2º, § 3º)
Art. 428. A listagem dos trabalhadores expostos e ex-expostos ao asbesto/amianto, conforme o Anexo LXXII , deverá conter, entre outras, as seguintes informações: (Origem: PRT MS/GM 1851/2006, Art. 3º)
I - identificação; (Origem: PRT MS/GM 1851/2006, Art. 3º, I)
II - diagnósticos de radiografias de tórax - raio X-, de acordo com padrão da Organização Internacional do Trabalho (OIT) para diagnóstico de pneumoconioses, OIT/2000; (Origem: PRT MS/GM 1851/2006, Art. 3º, II)
III - resultados de provas de função pulmonar, com valores em percentual teórico para: (Origem: PRT MS/GM 1851/2006, Art. 3º, III)
a) Capacidade Vital Forçada - CVF; (Origem: PRT MS/GM 1851/2006, Art. 3º, III, a)
b) Volume Expiratório no 1º segundo - VEF1; (Origem: PRT MS/GM 1851/2006, Art. 3º, III, b)
c) Índice de Tiffenau - VEF1/CVF; e (Origem: PRT MS/GM 1851/2006, Art. 3º, III, c)
d) fluxo expiratório forçado em 25% e 75%. (Origem: PRT MS/GM 1851/2006, Art. 3º, III, d)
Art. 429. A cada diagnóstico ou suspeita de doença relacionada ao asbesto/amianto, os trabalhadores expostos e ex-expostos serão encaminhados ao SUS, acompanhados de uma via da respectiva Comunicação de Acidente de Trabalho (CAT), para notificação do caso à vigilância epidemiológica do SUS/SINAN. (Origem: PRT MS/GM 1851/2006, Art. 4º)
Art. 430. O não-cumprimento do disposto nesta Seção sujeitará as empresas às penalidades previstas na legislação pertinente. (Origem: PRT MS/GM 1851/2006, Art. 5º)
Seção VII
Da Vacinação Obrigatória dos Trabalhadores das Áreas Portuárias, Aeroportuárias, de Terminais e Passagens de Fronteira
Art. 431. É obrigatória a vacinação dos trabalhadores das áreas portuárias, aeroportuárias, de terminais e passagens de fronteira. (Origem: PRT MS/GM 1986/2001, Art. 1º)
Art. 432. É obrigatória a vacinação dos tripulantes ou pessoal dos meios de transporte que procedam de áreas endêmicas e de países com transmissão de febre amarela, segundo a situação epidemiológica e avaliação de risco. (Origem: PRT MS/GM 1986/2001, Art. 2º)
Art. 433. Fica recomendada a vacinação para viajantes que se dirigem às áreas endêmicas e aos países com transmissão de febre amarela, segundo a situação epidemiológica e avaliação de risco. A vacinação deve ter antecedência mínima de 10 dias antes da viagem. (Origem: PRT MS/GM 1986/2001, Art. 3º)
Art. 434. Fica adotada a exigência do certificado internacional de vacinação válido para os viajantes que chegam de países com transmissão de febre amarela, segundo a situação epidemiológica e avaliação de risco. A vacinação deve ter antecedência mínima de 10 dias antes da viagem, exceto se o viajante for revacinado antes do fim do período de validade do certificado. Nesta situação, a validade do certificado será imediata. (Origem: PRT MS/GM 1986/2001, Art. 4º)
Art. 435. Nas áreas endêmicas do território nacional, as autoridades sanitárias estaduais e municipais deverão prover certificado de vacinação para os indivíduos vacinados, devendo manter registros ativos para eventuais verificações. (Origem: PRT MS/GM 1986/2001, Art. 5º)
Art. 436. O Ministério da Saúde, através de seus órgãos competentes, FUNASA e ANVISA, editará normas regulamentadoras desta Seção. (Origem: PRT MS/GM 1986/2001, Art. 6º)
CAPÍTULO IV
DA ATENÇÃO INTEGRAL À SAÚDE DA CRIANÇA
Seção I
Do Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância no âmbito do SUS
Art. 437. Fica instituído Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2362/2012, Art. 1º)
Art. 438. Ao Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância compete: (Origem: PRT MS/GM 2362/2012, Art. 2º)
I - subsidiar a formulação de conteúdos programáticos, normas técnico-gerenciais, métodos e instrumentos para o aprimoramento das políticas de saúde voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, I)
II - apresentar proposições de aprimoramento das ações e estratégias para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, II)
III - ampliar a discussão sobre o desenvolvimento integral da primeira infância, com participação da sociedade civil, com o objetivo de favorecer o acesso, a equidade e a integralidade das ações e serviços prestados no âmbito do SUS; (Origem: PRT MS/GM 2362/2012, Art. 2º, III)
IV - desenvolver estratégias de articulação intersetorial das políticas públicas sociais básicas, que permitam a qualificação dos serviços de atenção integral à primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, IV)
V - contribuir na sensibilização e na mobilização social com o objetivo de facilitar e promover a implementação das diretrizes das políticas públicas de saúde voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 2º, V)
VI - realizar o balanço semestral do andamento da implementação e dos resultados das políticas públicas de saúde voltadas para o desenvolvimento da primeira infância; e (Origem: PRT MS/GM 2362/2012, Art. 2º, VI)
VII - funcionar como um espaço de articulação intersetorial e discussão permanente sobre as políticas públicas de saúde em construção e execução para o desenvolvimento integral da primeira infância. (Origem: PRT MS/GM 2362/2012, Art. 2º, VII)
Art. 439. O Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância será composto por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2362/2012, Art. 3º)
I - 5 (cinco) do Ministério da Saúde (MS); (Origem: PRT MS/GM 2362/2012, Art. 3º, I)
II - 1 (um) do Ministério da Educação (MEC); (Origem: PRT MS/GM 2362/2012, Art. 3º, II)
III - 1 (um) do Ministério do Desenvolvimento Social e Agrário; (Origem: PRT MS/GM 2362/2012, Art. 3º, III)
IV - 1 (um) da Secretaria de Direitos Humanos da Presidência da República (SDH-PR); (Origem: PRT MS/GM 2362/2012, Art. 3º, IV)
V - 1 (um) do Conselho Nacional de Saúde (CNS); (Origem: PRT MS/GM 2362/2012, Art. 3º, V)
VI - 1 (um) do Conselho Nacional de Educação (CNE); e (Origem: PRT MS/GM 2362/2012, Art. 3º, VI)
VII - 1 (um) do Conselho Nacional de Assistência Social (CNAS). (Origem: PRT MS/GM 2362/2012, Art. 3º, VII)
§ 1º O Comitê será coordenado pelo Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS). (Origem: PRT MS/GM 2362/2012, Art. 3º, § 1º)
§ 2º A participação dos órgãos e entidades de que tratam os incisos II, III, IV, VI e VII do "caput", será formalizada após resposta a convite a eles encaminhado pela Coordenação do Comitê, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 2362/2012, Art. 3º, § 2º)
§ 3º Para fins do disposto no inciso I do caput, a Coordenação do Comitê efetuará a indicação dos representantes do Ministério da Saúde. (Origem: PRT MS/GM 2362/2012, Art. 3º, § 3º)
§ 4º O Comitê se reunirá semestralmente ou, quando solicitado, em caráter extraordinário. (Origem: PRT MS/GM 2362/2012, Art. 3º, § 4º)
Art. 440. Serão convidados para participar do Comitê de Especialistas e de Mobilização Social para o Desenvolvimento Integral da Primeira Infância: (Origem: PRT MS/GM 2362/2012, Art. 4º)
I - 2 (dois) representantes dos Poderes Legislativo e Judiciário; (Origem: PRT MS/GM 2362/2012, Art. 4º, I)
II - 10 (dez) representantes de movimentos sociais, fóruns e redes constituídos pela sociedade civil que atuem na área da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 4º, II)
III - 10 (dez) representantes de universidades e instituições de ensino e pesquisa que atuem na área da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 4º, III)
IV - 5 (cinco) profissionais de notório saber no tema da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 4º, IV)
V - 2 (dois) representantes de organismos internacionais, sendo: (Origem: PRT MS/GM 2362/2012, Art. 4º, V)
a) 1 (um) do Fundo das Nações Unidas para Infância e Adolescência (UNICEF); e (Origem: PRT MS/GM 2362/2012, Art. 4º, V, a)
b) 1 (um) da Organização Pan-americana de Saúde (OPAS); e (Origem: PRT MS/GM 2362/2012, Art. 4º, V, b)
VI - convidados especiais, profissionais da área de comunicação, artistas e intelectuais, entre outros que o Comitê entenda relevantes para o cumprimento de suas finalidades. (Origem: PRT MS/GM 2362/2012, Art. 4º, VI)
Parágrafo Único. Os representantes de que trata o caput do artigo serão convidados pela Coordenação do Comitê. (Origem: PRT MS/GM 2362/2012, Art. 4º, Parágrafo Único)
Art. 441. Na qualidade de Coordenador do Comitê, além de fornecer os apoios técnico e administrativo necessários para o seu funcionamento, compete ao Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS): (Origem: PRT MS/GM 2362/2012, Art. 5º)
I - organizar a pauta das reuniões; (Origem: PRT MS/GM 2362/2012, Art. 5º, I)
II - promover a articulação entre os membros do Comitê e subsidiá-los com as informações por ele demandadas; (Origem: PRT MS/GM 2362/2012, Art. 5º, II)
III - promover a divulgação dos relatórios de acompanhamento dos trabalhos e resultados alcançados; (Origem: PRT MS/GM 2362/2012, Art. 5º, III)
IV - articular os órgãos do Ministério da Saúde envolvidos com as demandas nas ações e estratégias voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 5º, IV)
V - elaborar a memória e sistematizar os produtos e documentos produzidos pelo Comitê; e (Origem: PRT MS/GM 2362/2012, Art. 5º, V)
VI - manter o Comitê informado sobre os processos de implantação das políticas públicas de saúde da criança. (Origem: PRT MS/GM 2362/2012, Art. 5º, VI)
Art. 442. Para o desenvolvimento integral da primeira infância, compete ao DAPES/SAS/MS: (Origem: PRT MS/GM 2362/2012, Art. 6º)
I - identificar necessidades e buscar alternativas para a educação, capacitação e qualificação dos profissionais de saúde responsáveis pela implementação das ações e estratégias voltadas para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 6º, I)
II - propor ações voltadas para a educação e formação para o desenvolvimento integral da primeira infância; (Origem: PRT MS/GM 2362/2012, Art. 6º, II)
III - identificar necessidades, buscar alternativas e propor ações para o financiamento da política para a primeira infância e propor meios de sua regulação; e (Origem: PRT MS/GM 2362/2012, Art. 6º, III)
IV - identificar as necessidades e propor instrumentos para viabilizar a articulação e pactuação entre os entes federados e pontos de atenção das redes temáticas prioritárias. (Origem: PRT MS/GM 2362/2012, Art. 6º, IV)
Art. 443. A participação no Comitê não será remunerada e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2362/2012, Art. 7º)
Seção II
Da Estratégia Brasileirinhas e Brasileirinhos Saudáveis
Art. 444. Fica instituída a Estratégia Brasileirinhas e Brasileirinhos Saudáveis com o objetivo de construir novas ofertas de cuidado humanizado à saúde e fortalecer aquelas tradicionalmente dirigidas a mulheres e crianças, na perspectiva do vínculo, crescimento e desenvolvimento integral da criança de zero a cinco anos. (Origem: PRT MS/GM 2395/2009, Art. 1º)
Parágrafo Único. A estratégia será implantada a partir de projeto piloto contemplando uma cidade com mais de cem mil habitantes de cada macrorregião, a saber: região Norte, Rio Branco; região Nordeste, Recife; região Centro-Oeste, Campo Grande; região Sudeste, Rio de Janeiro; e região Sul, Florianópolis. (Origem: PRT MS/GM 2395/2009, Art. 1º, Parágrafo Único)
Art. 445. Fica instituído o Comitê Técnico-Consultivo para assessorar, monitorar e avaliar a implantação/implementação da estratégia. (Origem: PRT MS/GM 2395/2009, Art. 2º)
§ 1º O Comitê Técnico-Consultivo terá a seguinte composição: (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º)
I - três representantes da Secretaria de Atenção à Saúde (SAS/MS); a saber: (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I)
a) Área Técnica de Saúde da Criança e Aleitamento Materno; (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I, a)
b) Área Técnica de Saúde da Mulher; e (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I, b)
c) Política Nacional de Humanização; (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, I, c)
II - um representante da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, II)
III - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, III)
IV - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, IV)
V - um representante da Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, V)
VI - um representante da Secretaria-Executiva (SE/MS) (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, VI)
VII - um representante da Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, VII)
VIII - um representante do Instituto Fernandes Figueira (IFF/FIOCRUZ); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, VIII)
IX - um representante da Rede Brasileira de Bancos de Leite Humano (REDEBLH/FIOCRUZ); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, IX)
X - um representante da Rede Norte-Nordeste de Saúde Perinatal (RENOSP); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, X)
XI - um representante da Fundação Nacional de Saúde (FUNASA); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XI)
XII - um representante da Sociedade Brasileira de Pediatria (SBP); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XII)
XIII - um representante da Federação Brasileira de Ginecologia e Obstetrícia (FEBRASGO); (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XIII)
XIV - um representante da Associação Brasileira de Enfermagem (ABEn); e (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XIV)
XV - um representante da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2395/2009, Art. 2º, § 1º, XV)
§ 2º A Coordenação do Comitê Técnico-Consultivo ficará a cargo da Fundação Oswaldo Cruz (FIOCRUZ). (Origem: PRT MS/GM 2395/2009, Art. 2º, § 2º)
Art. 446. Os recursos para o funcionamento do Comitê Técnico-Consultivo e a implementação da Estratégia serão de responsabilidade da Área Técnica de Saúde da Criança e Aleitamento Materno/DAPES/SAS, correrão por conta da funcional programática 10.301.2015.20YI.0001 - Implementação de Políticas de Atenção à Saúde. (Origem: PRT MS/GM 2395/2009, Art. 3º)
TÍTULO IV
DA ORGANIZAÇÃO DA ATENÇÃO À SAÚDE
Seção I
Do Programa Nacional Telessaúde Brasil Redes (Telessaúde Brasil Redes)
Seção I
Da Ação Estratégica SUS Digital - Telessaúde
(Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 447. Fica instituído o Programa Nacional Telessaúde Brasil Redes (Telessaúde Brasil Redes). (Origem: PRT MS/GM 2546/2011, Art. 1º)
Art. 447. Fica instituída a Ação Estratégica SUS Digital - Telessaúde, no âmbito do Programa SUS Digital, de que trata o Anexo CVIII a esta Portaria, com o objetivo de apoiar a consolidação das redes de atenção à saúde e do Subsistema de Saúde Indígena, por meio do estabelecimento de diretrizes e da oferta de serviços que promovam a integralidade e a continuidade do cuidado entre todos os níveis de atenção no Sistema Único de Saúde - SUS. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo Único. O Telessaúde tem por objetivo apoiar a consolidação das Redes de Atenção à Saúde ordenadas pela Atenção Básica no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 2546/2011, Art. 1º, Parágrafo Único)
Parágrafo único. A Ação Estratégica SUS Digital - Telessaúde deverá estar integrada com os Planos de Ação de Transformação para a Saúde Digital - PA Saúde Digital, de que trata o art. 7º, § 1º, do Anexo CVIII a esta Portaria. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Subseção I
Da Estrutura
(Origem: PRT MS/GM 2546/2011, CAPÍTULO I)
Subseção I
Da Estrutura
(Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 448. O Telessaúde Brasil Redes fornecerá aos profissionais e trabalhadores das Redes de Atenção à Saúde no SUS os seguintes serviços: (Origem: PRT MS/GM 2546/2011, Art. 2º)
Art. 448. A Ação Estratégica SUS Digital - Telessaúde fornecerá aos gestores, profissionais e usuários das redes de atenção à saúde no SUS as seguintes modalidades de serviços assistenciais: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - Teleconsultoria: consulta registrada e realizada entre trabalhadores, profissionais e gestores da área de saúde, por meio de instrumentos de telecomunicação bidirecional, com o fim de esclarecer dúvidas sobre procedimentos clínicos, ações de saúde e questões relativas ao processo de trabalho, podendo ser de dois tipos: (Origem: PRT MS/GM 2546/2011, Art. 2º, I)
I - teleconsultoria: consultoria mediada por tecnologias digitais de informação e comunicação - TDIC, realizada entre profissionais de saúde, com a finalidade de esclarecer dúvidas sobre procedimentos clínicos, ações de saúde e questões relativas ao processo de trabalho, podendo ser de dois tipos: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
a) síncrona - teleconsultoria realizada em tempo real, geralmente por chat, web ou videoconferência; ou (Origem: PRT MS/GM 2546/2011, Art. 2º, I, a)
a) síncrona: realizada com interação simultânea dos participantes, seja por telefone, videoconferência, ferramenta de conversa instantânea ou outras aplicações; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
b) assíncrona - teleconsultoria realizada por meio de mensagens offline. (Origem: PRT MS/GM 2546/2011, Art. 2º, I, b)
b) assíncrona: realizada por meio de comunicações não simultâneas, como correio eletrônico ou troca de mensagens por aplicativos; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - Telediagnóstico: serviço autônomo que utiliza as tecnologias da informação e comunicação para realizar serviços de apoio ao diagnóstico através de distâncias geográfica e temporal; (Origem: PRT MS/GM 2546/2011, Art. 2º, II)
II - teletriagem: interação remota entre profissional de saúde e paciente para determinar a prioridade e o tipo de atendimento necessário, com base na gravidade do estado de saúde do paciente; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - Segunda Opinião Formativa: resposta sistematizada, construída com base em revisão bibliográfica, nas melhores evidências científicas e clínicas e no papel ordenador da atenção básica à saúde, a perguntas originadas das teleconsultorias, e selecionadas a partir de critérios de relevância e pertinência em relação às diretrizes do SUS; e (Origem: PRT MS/GM 2546/2011, Art. 2º, III)
III - teleconsulta: consulta remota, mediada por TDIC, para a troca de informações clínicas, laboratoriais e de imagens entre profissional de saúde e paciente, com possibilidade de prescrição e emissão de atestados, devendo ser observadas as resoluções vigentes de cada conselho de classe profissional em exercício; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - Tele-educação: conferências, aulas e cursos, ministrados por meio da utilização das tecnologias de informação e comunicação. (Origem: PRT MS/GM 2546/2011, Art. 2º, IV)
IV - telediagnóstico: serviço prestado à distância, geográfica ou temporal, mediado por TDIC, com transmissão de gráficos, imagens e dados para emissão de laudo ou parecer por profissional de saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
V - telemonitoramento: interação remota realizada sob orientação e supervisão de profissional de saúde envolvido no cuidado ao paciente para monitoramento ou vigilância de parâmetros de saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - teleinterconsulta: interação remota para a troca de opiniões e informações clínicas, laboratoriais e de imagens entre profissionais de saúde, com a presença do paciente, para auxílio diagnóstico ou terapêutico, facilitando a atuação interprofissional; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - teleducação: aulas, cursos, fóruns de discussão, palestras, reuniões de matriciamento e seminários realizados por meio de TDIC; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VIII - telerregulação: atividades de controle, gerenciamento, organização e priorização do acesso e dos fluxos assistenciais no SUS, com atuação articulada com os demais serviços de telessaúde, por meio de TDIC, contribuindo tanto para o aumento da resolubilidade quanto para a redução dos tempos e filas de espera, em consonância com as diretrizes da Política Nacional de Regulação do SUS, de que trata o Anexo XXVI à Portaria de Consolidação GM/MS nº 2, de 28 de setembro de 2017; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IX - teleorientação: ação de conscientização sobre bem-estar, cuidados em saúde e prevenção de doenças, por meio da disseminação de informações e orientações em saúde direcionadas ao cidadão. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º Os serviços de telessaúde serão realizados pelos profissionais de saúde nos Núcleos ou Pontos de Telessaúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º A prestação de serviços de telessaúde deverá ser baseada na melhor e mais atualizada evidência científica, observados o custo e a efetividade das ações. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 3º O prazo regular para envio da resposta à teleconsultoria assíncrona, de que trata o inciso I, alínea "b", será fixado em protocolos estabelecidos por cada Núcleo de Telessaúde, não devendo exceder o prazo máximo de 72 (setenta e duas) horas, a contar do recebimento do pedido da consulta. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 4º A Ação Estratégica SUS Digital - Telessaúde fornecerá aos gestores, profissionais e usuários das redes de atenção à saúde no SUS a Segunda Opinião Formativa - SOF, serviço não assistencial que consiste em resposta sistematizada e elaborada a partir de perguntas originadas de demanda específica, com base em revisão bibliográfica e nas melhores evidências científicas e clínicas, selecionadas por meio de critérios de relevância e pertinência em relação às diretrizes do SUS. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 449. O Telessaúde Brasil Redes é integrado por gestores da saúde, instituições formadoras de profissionais de saúde e serviços de saúde do SUS, sendo constituído por: (Origem: PRT MS/GM 2546/2011, Art. 3º)
Art. 449. As ações e os serviços de telessaúde deverão: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - Núcleo de Telessaúde Técnico-Científico: instituições formadoras e de gestão e/ou serviços de saúde responsáveis pela formulação e gestão de Teleconsultorias, Telediagnósticos e Segunda Opinião Formativa; e (Origem: PRT MS/GM 2546/2011, Art. 3º, I)
I - ser praticados por profissionais de saúde devidamente inscritos e regulares nos respectivos conselhos de fiscalização de exercício profissional; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - Ponto de Telessaúde: serviços de saúde a partir dos quais os trabalhadores e profissionais do SUS demandam Teleconsultorias e/ou Telediagnósticos. (Origem: PRT MS/GM 2546/2011, Art. 3º, II)
II - ser disponibilizados por plataformas digitais cujo responsável técnico seja inscrito no respectivo conselho profissional; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - atender aos preceitos éticos de autonomia, beneficência, não maleficência, sigilo das informações e demais normas deontológicas vigentes; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - observar a livre decisão e o consentimento informado do paciente; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
V - observar as normas e orientações do Ministério da Saúde sobre notificação compulsória de doenças e outros agravos à saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - garantir a privacidade, a confidencialidade, a proteção de dados e a segurança da informação, observado o disposto nas Leis nºs 12.965, de 23 de abril de 2014, 12.842, de 10 de julho de 2013, e 13.709, de 14 de agosto de 2018, bem como, nas hipóteses cabíveis, os ditames da Lei nº 13.787, de 27 de dezembro de 2018, e os códigos de ética profissionais; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - seguir os preceitos éticos de cada profissão no exercício das atividades de saúde realizadas a distância, observado o mesmo padrão de qualidade assistencial adotado no atendimento presencial; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VIII - fornecer seus dados atualizados aos bancos de dados oficiais do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo Único. As Teleconsultorias, os Telediagnósticos, as Segundas Opiniões Formativas e as ações de Tele-educação demandadas pelos profissionais de saúde do SUS poderão ser elaborados e respondidos por Teleconsultores a partir de qualquer Núcleo de Telessaúde Técnico-Científico ou Ponto de Telessaúde. (Origem: PRT MS/GM 2546/2011, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 450. As Teleconsultorias, os Telediagnósticos e a Segunda Opinião Formativa serão respondidos pelos Núcleos Técnico-Científicos com base na melhor e na mais atualizada evidência clínica e científica disponível, adequada e pertinente ao contexto de origem da solicitação. (Origem: PRT MS/GM 2546/2011, Art. 4º)
Art. 450. O atendimento ao paciente por meio da utilização de TDIC, no âmbito da Ação Estratégica SUS Digital - Telessaúde, deverá ser registrado em prontuário clínico, conforme as regras e os padrões de interoperabilidade e informação em saúde estabelecidos pelo Ministério da Saúde, e deverá conter: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - os dados clínicos necessários à boa condução do caso, preenchidos em cada contato com o paciente; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - a data, a hora, a tecnologia da informação e a comunicação utilizada no atendimento; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - o número de inscrição no respectivo conselho profissional. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º É direito do paciente, ou seu representante legal, solicitar e receber cópia em mídia digital ou impressa dos dados de seu registro. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º Compete ao profissional de saúde registrar o consentimento livre e informado do paciente em relação às ações e aos serviços de telessaúde, de que trata o art. 449, inciso IV. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo Único. A resposta deverá ressaltar o conhecimento inerente à resolução do problema e que venha a contribuir com a educação permanente dos profissionais envolvidos, com vistas à ampliação de sua capacidade e autonomia na resolução de casos semelhantes. (Origem: PRT MS/GM 2546/2011, Art. 4º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 451. O prazo regular para envio da resposta à Teleconsultoria Assíncrona será fixado em protocolos estabelecidos por cada Núcleo Técnico-Científico, em comum acordo com o Comitê Gestor Estadual, não devendo exceder o prazo máximo de 72 (setenta e duas) horas a contar do recebimento da consulta. (Origem: PRT MS/GM 2546/2011, Art. 5º)
Art. 451. Os registros e documentos emitidos em meio eletrônico pelos profissionais de saúde durante os atendimentos realizados por telessaúde deverão observar o disposto no art. 14 da Lei nº 14.063, de 23 de setembro de 2020, bem como os limites estabelecidos em legislação e atos normativos específicos das respectivas categorias profissionais. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º O atestado emitido pelo profissional de saúde deverá conter, no mínimo, as seguintes informações: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - identificação do profissional, incluindo nome e número de inscrição no respectivo conselho profissional; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - identificação e dados pessoais do paciente; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - registro de data e hora; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - duração do atestado; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
V - assinatura eletrônica qualificada. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º A prescrição de receitas observará os requisitos previstos na Lei nº 5.991, de 17 de dezembro de 1973, e nos atos da Agência Nacional de Vigilância Sanitária - Anvisa, inclusive quanto aos receituários de medicamentos sujeitos a controle especial. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 451-A. As incorporações, exclusões ou alterações de tecnologias de telessaúde no âmbito do SUS, incluindo protocolos clínicos e diretrizes terapêuticas, deverão ser avaliadas pela Comissão Nacional de Incorporação de Tecnologias no Sistema Único de Saúde - Conitec, observado o disposto no Decreto nº 7.646, de 21 de dezembro de 2011. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Subseção II
Da Gestão e do Funcionamento
(Origem: PRT MS/GM 2546/2011, CAPÍTULO II)
Subseção II
Da operacionalização
(Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 452. A gestão do Telessaúde Brasil Redes é estruturada da seguinte forma: (Origem: PRT MS/GM 2546/2011, Art. 6º)
Art. 452. A Ação Estratégica SUS Digital - Telessaúde será executada pela União, estados, Distrito Federal e municípios, podendo incluir a participação de instituições de ensino superior, instituições de pesquisa e institutos tecnológicos. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - Coordenação Nacional, exercida pelo Ministério da Saúde por meio da Secretaria de Gestão do Trabalho e Educação na Saúde (SGTES/MS) e da Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 2546/2011, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - Coordenação Estadual, exercida pela Secretaria de Saúde do Estado ou do Distrito Federal ou por outra instância integrante do comitê gestor estadual, conforme aprovação da Comissão Intergestores Bipartite (CIB); (Origem: PRT MS/GM 2546/2011, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - Comitê Gestor Estadual; (Origem: PRT MS/GM 2546/2011, Art. 6º, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - Núcleo Técnico-Científico de Telessaúde; e (Origem: PRT MS/GM 2546/2011, Art. 6º, IV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
V - gestor municipal de saúde. (Origem: PRT MS/GM 2546/2011, Art. 6º, V) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 453. Compete à Coordenação Nacional do Telessaúde Brasil Redes: (Origem: PRT MS/GM 2546/2011, Art. 7º)
Art. 453. Para a operacionalização da Ação Estratégica SUS Digital - Telessaúde, deverão ser adotadas, de forma integrada, as seguintes ações estruturantes: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - monitorar a implementação e o funcionamento do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, I)
I - formação de profissionais de saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - avaliar e zelar pelo alcance dos objetivos e metas do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, II)
II - implantação de infraestrutura de conectividade; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - manter a Biblioteca Virtual Telessaúde Brasil, disponível em www.telessaudebrasil.org.br, como referência e identidade do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, III)
III - interoperabilidade das plataformas de telessaúde com a Rede Nacional de Dados em Saúde - RNDS, os prontuários eletrônicos e a plataforma Meu SUS Digital; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - disponibilizar as diretrizes para a operacionalização e os referenciais nacionais de avaliação do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 7º, IV)
IV - serviços de comunicação e de inovação aplicados à telessaúde, alinhados à gestão e oferta dos serviços de saúde do SUS. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
V - definir os padrões tecnológicos de interoperabilidade, conteúdo e segurança que permitirão a troca de informações entre os sistemas que viabilizam a operação do Telessaúde Brasil Redes e os diferentes sistemas de informação do SUS, incluídos o Cartão Nacional de Saúde e o Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SCNES); (Origem: PRT MS/GM 2546/2011, Art. 7º, V) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - definir o conjunto de dados que fará parte do Registro Eletrônico de Saúde (RES) a partir das Teleconsultorias realizadas, visando à implementação de um registro nacional e longitudinal, conforme Capítulo I do Título VII da Portaria de Consolidação nº 1; e (Origem: PRT MS/GM 2546/2011, Art. 7º, VI) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - aprovar o Projeto para implementação do Telessaúde Brasil Redes no respectivo Estado, conforme descrito no art. 457. (Origem: PRT MS/GM 2546/2011, Art. 7º, VII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo Único. A Coordenação Nacional constituirá Comissão de Monitoramento e Avaliação, com representação das Secretarias do Ministério da Saúde, do Conselho Nacional de Secretários de Saúde (CONASS), do Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS) e de outros Ministérios e entidades que desenvolvam ações e iniciativas relacionadas ao Telessaúde Brasil Redes. (Origem: PRT MS/GM 2546/2011, Art. 7º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º A formação de que trata o inciso I se dará no âmbito das ações de implementação da telessaúde nas redes de atenção à saúde no SUS, devendo ser coordenada pelos entes proponentes listados no art. 452. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º O Ministério da Saúde, por meio da Secretaria de Informação e Saúde Digital, apoiará os estados, Distrito Federal e municípios na implantação das ações de que tratam os incisos II, III e IV. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 454. Compete à Coordenação Estadual do Telessaúde Brasil Redes: (Origem: PRT MS/GM 2546/2011, Art. 8º)
Art. 454. A Ação Estratégica SUS Digital - Telessaúde é constituída de: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - coordenar em âmbito estadual as ações do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 8º, I)
I - Núcleo de Telessaúde: instituição que ofereça as seguintes modalidades de ações e serviços de telessaúde visando qualificar, ampliar e fortalecer o SUS: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
a) serviços de telessaúde: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
1. oferta de serviços de telessaúde de acordo com as demandas estadual, distrital ou municipal; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
2. composição e manutenção da equipe de teleconsultores e do corpo clínico de especialistas de referência, compatíveis com a demanda pelos serviços de telessaúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
b) ações de educação permanente para a realização e o uso dos serviços de saúde digital e telessaúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
c) serviços de suporte de tecnologia da informação às ações de telessaúde; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
d) monitoramento e avaliação do uso e da qualidade dos serviços de saúde digital e telessaúde; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - promover a articulação entre as instâncias de gestão do SUS e os demais integrantes do Telessaúde Brasil Redes; e (Origem: PRT MS/GM 2546/2011, Art. 8º, II)
II - Ponto de Telessaúde: estabelecimento de saúde inserido nas redes de atenção à saúde no SUS - RAS que demandam os serviços de telessaúde, a partir dos quais os usuários e os profissionais de saúde do SUS serão beneficiados pelas ações dos Núcleo de Telessaúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - criar condições necessárias de infraestrutura e gestão, visando garantir o funcionamento do Telessaúde Brasil Redes; e (Origem: PRT MS/GM 2546/2011, Art. 8º, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - promover a articulação do Telessaúde Brasil Redes à regulação da oferta de serviços e à Central de Regulação Médica das Urgências, em parceria com a gestão municipal e federal de saúde, de forma compartilhada e articulada com os pontos de atenção da rede. (Origem: PRT MS/GM 2546/2011, Art. 8º, IV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º O Núcleo de Telessaúde poderá contar com o apoio das equipes de atenção primária e dos outros níveis de atenção na oferta dos serviços de saúde digital e telessaúde, devendo integrar as redes de atenção à saúde e as linhas de cuidado no âmbito do SUS. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º O Ponto de Telessaúde poderá ofertar os serviços de telessaúde conforme sua área de expertise e composição das equipes de saúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 3º O Ponto de Telessaúde poderá ser implantado em todos os níveis de atenção presentes nas redes de atenção à saúde no SUS, devendo ser equipado com a infraestrutura necessária no caso de ofertar ações e serviços de telessaúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 4º A gestão estadual, distrital ou municipal de saúde deverá: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - cadastrar no Cadastro Nacional de Estabelecimentos de Saúde - CNES os Núcleos e os Pontos de Telessaúde, conforme normativa vigente. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - providenciar a vinculação de um Núcleo de Telessaúde a um ou mais Pontos de Telessaúde no "Módulo Conjunto - Serviços Especializados", constante da versão local do CNES, indicando o serviço especializado "160 - Telessaúde" para ambos os cadastros. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 5º Os seguintes estabelecimentos de saúde, que ofertem ações e serviços de telessaúde como Ponto de Telessaúde, ficam dispensados da utilização do código "75", para o cadastro no CNES: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - 01 - Posto de Saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - 02 - Centro de Saúde/Unidade Básica de Saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - 04 - Policlínica; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - 05 - Hospital Geral; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
V - 07 - Hospital Especializado; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - 32 - Unidade Móvel Fluvial; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - 36 - Clínica Especializada/Ambulatório Especializado; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
VIII - 39 - Unidade de Serviço de Apoio de Diagnose e Terapia; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
IX - 62 - Hospital/Dia - Isolado; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
X - 64 - Central de Regulação de Serviços de Saúde;
XI - 68 - Secretaria de Saúde; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
XII - 70 - Centro de Atenção Psicossocial; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
XIII - 71 - Centro de Apoio à Saúde da Família; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
XIV - 72 - Unidade de Atenção à Saúde Indígena; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
XV - 73 - Pronto Atendimento; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
XVI - 76 - Central de Regulação Médica de Urgências. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 6º Para fins de cadastro dos estabelecimentos de saúde de que trata o § 5º, deve ser utilizado o serviço especializado "160 - Telessaúde", conforme normativa vigente. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 7º Os Pontos de Telessaúde deverão dispor de instalações físicas e equipamentos compatíveis com o desenvolvimento das atividades ofertadas. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 454-A. Os Núcleos de Telessaúde serão classificados da seguinte forma: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - estadual e distrital: quando a sede do Núcleo de Telessaúde está vinculada à gestão estadual ou distrital, sendo composta pelo conjunto de municípios ou regiões administrativas integrantes; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - municipal: quando a sede do Núcleo de Telessaúde está vinculada à gestão municipal, com abrangência no próprio município; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
III - intermunicipal: quando a sede do Núcleo de Telessaúde está vinculada à gestão municipal, com mais de um município integrante, ainda que em estados diferentes;
IV - interestadual: quando a sede do Núcleo de Telessaúde está vinculada à gestão estadual, com mais de um estado integrante; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
V - técnico-científico: quando a sede do Núcleo de Telessaúde está vinculada a uma universidade ou instituição de ensino superior pública, instituição de pesquisa, ciência e tecnologia ou a um conjunto de universidades integradas em um estado ou macrorregião de saúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo único. O Núcleo de Telessaúde deverá: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - apresentar relatório anual de atividades que comprove o alcance dos serviços e das metas previstas no Plano de Trabalho; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - dispor de instalações físicas e equipamentos compatíveis com o desenvolvimento das atividades ofertadas. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Subseção III
Da coordenação e governança
(Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 455. O Comitê Gestor Estadual será vinculado à CIB e composto por: (Origem: PRT MS/GM 2546/2011, Art. 9º)
Art. 455. O Comitê Gestor de Saúde Digital - CGSD, de que trata o art. 244-H da Portaria de Consolidação GM/MS nº 1, de 28 de setembro de 2017, é a instância deliberativa da Ação Estratégica SUS Digital - Telessaúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo único. A coordenação executiva da Ação Estratégica SUS Digital - Telessaúde compete ao Ministério da Saúde, por meio da Secretaria de Informação e Saúde Digital. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - um representante da Secretaria de Saúde do Estado ou do Distrito Federal; (Origem: PRT MS/GM 2546/2011, Art. 9º, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - um representante da Comissão de Integração Ensino Serviço (CIES); (Origem: PRT MS/GM 2546/2011, Art. 9º, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - dois representantes do Conselho de Secretários Municipais de Saúde (COSEMS); (Origem: PRT MS/GM 2546/2011, Art. 9º, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - um representante dos Coordenadores de Núcleos Técnico-Científicos no Estado; e (Origem: PRT MS/GM 2546/2011, Art. 9º, IV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
V - um representante das Escolas Técnicas do SUS no Estado ou Distrito Federal. (Origem: PRT MS/GM 2546/2011, Art. 9º, V) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º Compete ao Comitê Gestor Estadual: (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
I - promover a articulação entre as instâncias de gestão estadual, municipal e de instituições de ensino, tendo em vista a gestão do programa no âmbito estadual; (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - integrar a rede colaborativa entre os Pontos e Núcleos Estaduais de Telessaúde Técnico-Científicos, em âmbito regional e nacional; e (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - elaborar e implementar projetos contemplando as necessidades loco-regionais. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 1º, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º A constituição e a composição do Comitê Gestor Estadual será pactuada na CIB, que poderá incluir outras representações além daquelas previstas no § 1º deste artigo. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 2º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 3º O Comitê Gestor Estadual elaborará o Projeto para implementação do Telessaúde Brasil Redes no respectivo Estado, enviando-o à Coordenação Nacional do Programa. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 3º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 4º O Projeto referido no art. 455, § 3º conterá Plano de Trabalho pactuado na CIB e Plano Operativo Anual, este último contendo as seguintes informações: (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
I - definição das metas físicas das unidades, dos atendimentos e dos serviços de apoio diagnóstico e terapêutico, com os respectivos quantitativos e fluxos; (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - definição das metas de qualidade e dos parâmetros e indicadores de avaliação; e (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - descrição das atividades de aprimoramento e aperfeiçoamento da gestão. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 4º, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 5º A Coordenação Nacional fará a análise e as readequações técnicas necessárias do Projeto, de acordo com as diretrizes nacionais do Telessaúde Brasil Redes e com a disponibilidade orçamentária. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 5º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 6º O relatório anual das atividades deverá demonstrar o alcance das metas estabelecidas no Plano Operativo ou, em caso de não alcance, a justificativa e as medidas de saneamento que foram adotadas. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 6º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 7º Para aprovação do Projeto de implantação do Telessaúde Brasil Redes, a Coordenação Nacional contará com a cooperação técnica do Comitê Consultivo, constituído por docentes, pesquisadores, profissionais de saúde e gestores, com reconhecida experiência, nomeados pelo Secretário de Gestão do Trabalho e da Educação na Saúde do Ministério da Saúde. (Origem: PRT MS/GM 2546/2011, Art. 9º, § 7º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 8º As funções dos membros do Comitê Consultivo previsto no art. 455, § 7º não serão remuneradas e seu exercício será considerado serviço público relevante (Origem: PRT MS/GM 2546/2011, Art. 9º, § 8º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 456. Compete ao Núcleo Técnico-Científico de Telessaúde: (Origem: PRT MS/GM 2546/2011, Art. 10)
Art. 456. Compete aos gestores municipais e estaduais, bem como aos gestores das instituições de ensino superior, das instituições de pesquisa e dos institutos tecnológicos que integram a Ação Estratégica SUS Digital - Telessaúde, criar as condições necessárias para implementação, monitoramento e avaliação das atividades de telessaúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo único. Aplicam-se aos gestores do Distrito Federal as competências dos gestores municipais e estaduais. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - responsabilizar-se pela oferta de Teleconsultoria, Telediagnóstico e Segunda Opinião Formativa. (Origem: PRT MS/GM 2546/2011, Art. 10, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - compor e manter equipe de Teleconsultores e corpo clínico de especialistas de referência, compatível com a demanda pelos serviços descritos no art. 456, I; (Origem: PRT MS/GM 2546/2011, Art. 10, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - promover e apoiar a formação de Teleconsultores no âmbito do Telessaúde Brasil Redes; (Origem: PRT MS/GM 2546/2011, Art. 10, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - atualizar as informações e inserir dados no sistema nacional de informações do Telessaúde Brasil Redes, junto ao Ministério da Saúde, devendo apresentar relatório anual de atividades que comprove o alcance das metas previstas no Plano de Trabalho; (Origem: PRT MS/GM 2546/2011, Art. 10, IV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
V - garantir a adequação aos padrões de interoperabilidade propostos pelo Telessaúde Brasil Rede; (Origem: PRT MS/GM 2546/2011, Art. 10, V) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - apoiar o desenvolvimento de protocolos que incluam a solicitação prévia de Teleconsultorias sobre procedimentos, para avaliação da necessidade de encaminhamento ou de solicitação para a Central de Regulação Médica das Urgências; (Origem: PRT MS/GM 2546/2011, Art. 10, VI) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - monitorar e avaliar o Telessaúde Brasil Redes no seu âmbito de atuação, incluindo a análise do número de solicitações de Teleconsultorias, do tempo de resposta para os usuários do serviço, do número e da pertinência dos encaminhamentos e solicitações de exames complementares, com vistas à ampliação do acesso aos serviços e à melhoria da resolubilidade da atenção à saúde dos usuários do SUS; e (Origem: PRT MS/GM 2546/2011, Art. 10, VII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VIII - desenvolver ações de tele-educação, com base nas necessidades loco-regionais identificadas e em consonância com as prioridades da política nacional de saúde. (Origem: PRT MS/GM 2546/2011, Art. 10, VIII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 457. Compete ao gestor municipal de saúde dos Municípios que integram o Telessaúde Brasil Rede: (Origem: PRT MS/GM 2546/2011, Art. 11)
Art. 457. O Ministério da Saúde, por meio da Secretaria de Informação e Saúde Digital, será o responsável por monitorar o funcionamento dos Núcleos e Pontos de Telessaúde, considerando as seguintes bases de dados: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
I - comprometer-se com a implementação, monitoramento e avaliação do Telessaúde Brasil Redes no seu respectivo Município, em articulação com o Comitê Gestor Estadual e com a respectiva instância intermunicipal; e (Origem: PRT MS/GM 2546/2011, Art. 11, I)
I - para implantação dos Núcleos e Pontos de Telessaúde: CNES; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
II - promover a integração dos profissionais de saúde com as ações do Telessaúde Brasil Redes, de acordo com a carga-horária e conforme a legislação vigente. (Origem: PRT MS/GM 2546/2011, Art. 11, II)
II - para produção dos Núcleos e Pontos de Telessaúde: (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
a) Sistema de Informação em Saúde para a Atenção Básica - SISAB; (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
b) Sistema de Informações Ambulatoriais do SUS - SIA; e (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
c) Sistema de Informação Hospitalar Descentralizado - SIHD. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º O monitoramento de que trata o caput será regulado por atos normativos específicos do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º O envio regular de dados, conforme o cronograma dos sistemas de informação vigentes, compete à gestão estadual, distrital ou municipal de saúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Subseção III
Das Disposições Finais
(Origem: PRT MS/GM 2546/2011, CAPÍTULO III)
Art. 458. Fica criado o código 75 - Telessaúde na Tabela de Estabelecimentos do Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SNCES) e o tipo tipo de estabelecimento 75 - Telessaúde, com os subtipos Núcleo Técnico-Científico e Unidade de Telessaúde, conforme Tabela 1 do Anexo LXXIII . (Origem: PRT MS/GM 2546/2011, Art. 12)
Art. 458. Caberá ao Ministério da Saúde financiar a implantação e o custeio dos Núcleos e Pontos de Telessaúde, bem como oferecer cooperação técnica, reservado o direito de suspender os repasses de recursos e a cooperação diante do não cumprimento do disposto nesta Seção e do não alcance das metas estabelecidas no Plano de Trabalho. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo único. O financiamento previsto no caput será regulado por atos normativos específicos do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º Entende-se por Telessaúde o estabelecimento autônomo que utiliza as tecnologias de informação e comunicação para realizar assistência e educação em saúde através de distâncias geográficas e temporais. (Origem: PRT MS/GM 2546/2011, Art. 12, § 1º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º Entende-se por Núcleo Científico-Tecnológico a instituição integrante do Telessaúde Brasil Redes que ofereça Teleconsultoria e Segunda Opinião Formativa, com o objetivo de qualificar, ampliar e fortalecer o SUS. (Origem: PRT MS/GM 2546/2011, Art. 12, § 2º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 3º Entende-se por Unidade de Telessaúde o estabelecimento autônomo e não vinculado ao Telessaúde Brasil Redes que utiliza as tecnologias de informação e comunicação para realizar serviços de Teleconsultoria e de Apoio ao Diagnóstico através de distâncias geográficas e temporais. (Origem: PRT MS/GM 2546/2011, Art. 12, § 3º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 459. Fica criado o campo "Vinculação dos Núcleos Técnico-Científicos Telessaúde Brasil Redes aos Pontos de Telessaúde" no Módulo Básico do SCNES. (Origem: PRT MS/GM 2546/2011, Art. 14)
Art. 459. Compete à Coordenação-Geral de Gestão de Sistemas de Informações em Saúde do Departamento de Regulação Assistencial e Controle da Secretaria de Atenção Especializada à Saúde do Ministério da Saúde adotar as providências necessárias para as adequações do CNES ao disposto nesta Seção. (Redação dada pela PRT GM/MS n° 3.691 de 23.05.2024)
Parágrafo Único. Os Núcleos de Telessaúde Técnico-Científicos do Telessaúde Brasil Redes deverão informar os respectivos códigos do SCNES dos estabelecimentos de saúde onde estiverem implantados Pontos de Telessaúde. (Origem: PRT MS/GM 2546/2011, Art. 14, § 1º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 460. Caberá à Coordenação-Geral dos Sistemas de Informação do Departamento de Regulação, Avaliação e Controle de Sistemas (CGSI/DRAC/SAS/MS) adotar as providências necessárias junto ao Departamento de Informática do SUS (DATASUS) para o cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 2546/2011, Art. 15) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 461. Caberá ao Ministério da Saúde financiar a fase inicial da implementação da etapa de expansão dos novos Núcleos de Telessaúde Técnico-Científicos e oferecer cooperação técnica, reservado o direito de suspender os repasses de recursos e a cooperação diante do não cumprimento do disposto nesta Seção e do não alcance das metas estabelecidas no Plano de Trabalho. (Origem: PRT MS/GM 2546/2011, Art. 16) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 1º O financiamento previsto no caput deste artigo será regulado por atos específicos do Ministério da Saúde. (Origem: PRT MS/GM 2546/2011, Art. 16, § 1º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
§ 2º Uma vez implementado no Estado, as três esferas de governo serão responsáveis por garantir a sustentabilidade técnico-financeira do Programa Nacional Telessaúde Brasil Redes. (Origem: PRT MS/GM 2546/2011, Art. 16, § 2º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Subseção IV
Da Comissão Permanente de Telessaúde
(Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 462. Fica instituída, no âmbito do Ministério da Saúde, a Comissão Permanente de Telessaúde, com as seguintes atribuições: (Origem: PRT MS/GM 452/2010, Art. 1º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
I - assessoramento de projetos em Telessaúde em andamento no Ministério da Saúde; (Origem: PRT MS/GM 452/2010, Art. 1º, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - elaboração de proposta para estabelecer padrões de intercâmbio de informações, avaliação de qualidade de projetos de Telemedicina e Telessaúde; (Origem: PRT MS/GM 452/2010, Art. 1º, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - estudo e avaliação de propostas para reembolso de serviços desenvolvidos por instituições universitárias e hospitalares, na área de saúde, por meio do uso de recursos de Telemedicina e Telessaúde; (Origem: PRT MS/GM 452/2010, Art. 1º, III) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - acompanhamento de sistemática para atualização profissional continuada por Telessaúde; (Origem: PRT MS/GM 452/2010, Art. 1º, IV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
V - formação de base de informação estratégica sobre implementação de Telemedicina e Telessaúde: (Origem: PRT MS/GM 452/2010, Art. 1º, V) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - desenvolvimento de trabalhos cooperados com diversos órgãos governamentais e privados para facilitar a estruturação de Telemedicina e Telessaúde no País; (Origem: PRT MS/GM 452/2010, Art. 1º, VI) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - constituição de Conselho Assessor de Telemedicina e Telessaúde; e (Origem: PRT MS/GM 452/2010, Art. 1º, VII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VIII - identificação e formação de grupo de Centros Colaboradores. (Origem: PRT MS/GM 452/2010, Art. 1º, VIII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Art. 463. A Comissão terá a seguinte composição: (Origem: PRT MS/GM 452/2010, Art. 2º) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
I - 3 (três) representantes do Ministério da Saúde; (Origem: PRT MS/GM 452/2010, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
II - 2 (dois) representantes do Ministério da Ciência, Tecnologia, Inovações e Comunicações; (Origem: PRT MS/GM 452/2010, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
III - 2 (dois) representantes do Ministério da Educação; (Origem: PRT MS/GM 452/2010, Art. 2º, IV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IV - 1 (um) representante do Ministério da Defesa; (Origem: PRT MS/GM 452/2010, Art. 2º, V) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
V - 1 (um) representante da Organização Pan-Americana da Saúde; (Origem: PRT MS/GM 452/2010, Art. 2º, VI) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VI - 1 (um) representante do Conselho Federal de Medicina; (Origem: PRT MS/GM 452/2010, Art. 2º, VII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VII - 1 (um) representante da Universidade de São Paulo; (Origem: PRT MS/GM 452/2010, Art. 2º, VIII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
VIII - 1 (um) representante da Universidade Estadual do Amazonas; (Origem: PRT MS/GM 452/2010, Art. 2º, IX) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
IX - 1 (um) representante da Universidade Estadual do Rio de Janeiro; (Origem: PRT MS/GM 452/2010, Art. 2º, X) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
X - 1 (um) representante da Universidade Federal de Minas Gerais; (Origem: PRT MS/GM 452/2010, Art. 2º, XI) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XI - 1 (um) representante da Universidade Federal de Pernambuco; (Origem: PRT MS/GM 452/2010, Art. 2º, XII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XII - 1 (um) representante da Universidade Federal de Santa Catarina; (Origem: PRT MS/GM 452/2010, Art. 2º, XIII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XIII - 1 (um) representante da Universidade Federal de São Paulo; (Origem: PRT MS/GM 452/2010, Art. 2º, XIV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XIV - 1 (um) representante da Universidade Federal do Ceará; (Origem: PRT MS/GM 452/2010, Art. 2º, XV) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XV - 1 (um) representante do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 452/2010, Art. 2º, XVI) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XVI - 1 (um) representante do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 452/2010, Art. 2º, XVII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XVII - 1 (um) representante do Centro Gestor e Operacional do Sistema de Proteção da Amazônia (CENSIPAM), da Casa Civil, da Presidência da República; (Origem: PRT MS/GM 452/2010, Art. 2º, XVIII) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XVIII - 1 (um) representante do Conselho Brasileiro de Telemedicina e Telessaúde (CBTms); e (Origem: PRT MS/GM 452/2010, Art. 2º, XIX) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
XIX - 1 (um) representante da Universidade Federal do Rio Grande do Sul. (Origem: PRT MS/GM 452/2010, Art. 2º, XX) (Revogado pela PRT GM/MS n° 3.691 de 23.05.2024)
Subseção V
Da Requalificação das Unidades Básicas de Saúde (UBS), o Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, integrado ao Programa Nacional Telessaúde Brasil Redes
Art. 464. Fica instituído, no âmbito do Programa de Requalificação das Unidades Básicas de Saúde (UBS), o Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, integrado ao Programa Nacional Telessaúde Brasil Redes. (Origem: PRT MS/GM 2554/2011, Art. 1º)
Parágrafo Único. O Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica tem como objetivos ampliar a resolutividade da Atenção Básica e promover sua integração com o conjunto da Rede de Atenção à Saúde. (Origem: PRT MS/GM 2554/2011, Art. 1º, Parágrafo Único)
Art. 465. Para os fins desta Subseção, informatizar a Unidade Básica de Saúde (UBS) significa dotá-la de equipamentos de informática e garantir a conectividade e o uso de tecnologias de informação dirigidas: (Origem: PRT MS/GM 2554/2011, Art. 2º)
I - à qualificação das ações e serviços ofertados por este ponto de atenção; (Origem: PRT MS/GM 2554/2011, Art. 2º, I)
II - à integração deste ponto de atenção com os demais pontos de atenção integrantes da Rede de Atenção à Saúde; e (Origem: PRT MS/GM 2554/2011, Art. 2º, II)
III - ao desenvolvimento de ações de telessaúde, apoio matricial, formação e educação permanente. (Origem: PRT MS/GM 2554/2011, Art. 2º, III)
Parágrafo Único. A informatização prevista no caput deverá assegurar a participação das UBS no Telessaúde Brasil Redes. (Origem: PRT MS/GM 2554/2011, Art. 2º, Parágrafo Único)
Art. 466. O Telessaúde Brasil Redes na Atenção Básica tem como objetivo desenvolver ações de apoio à atenção à saúde e de educação permanente das equipes de atenção básica, visando à educação para o trabalho, na perspectiva da melhoria da qualidade do atendimento, da ampliação do escopo de ações ofertadas por essas equipes, da mudança das práticas de atenção e da organização do processo de trabalho, por meio da oferta de Teleconsultoria, Segunda Opinião Formativa e Telediagnóstico. (Origem: PRT MS/GM 2554/2011, Art. 3º)
Art. 467. O Telessaúde Brasil Redes na Atenção Básica será estruturado na forma de uma rede de serviços que prevê a criação de projetos intermunicipais ou de regiões de saúde, geridos de maneira compartilhada, com a possibilidade de participação das Secretarias Estaduais de Saúde, instituições de ensino e serviços de saúde, que garantam o uso da tecnologia como ferramenta de ampliação das ações da atenção básica e de melhoria do acesso e da qualidade da atenção à saúde ao cidadão. (Origem: PRT MS/GM 2554/2011, Art. 4º)
Parágrafo Único. No caso do Distrito Federal, os projetos apresentados poderão contemplar a Região Integrada de Desenvolvimento do Distrito Federal e Entorno (RIDE DF e Entorno). (Origem: PRT MS/GM 2554/2011, Art. 4º, Parágrafo Único)
Art. 468. Será priorizada a articulação com os 12 (doze) Núcleos do Telessaúde Brasil já implantados e os demais em processo de expansão quando da publicação da Portaria nº 2554/GM/MS, de 28 de outubro de 2011, ou que venham a ser implantados depois disso, apoiados nas gestões municipais, estaduais e universidades públicas, para que estes garantam apoio matricial e preparação das equipes dos novos Núcleos, além de outras formas de cooperação que venham a ser pactuadas no âmbito de cada projeto intermunicipal ou de região de saúde. (Origem: PRT MS/GM 2554/2011, Art. 5º)
Art. 469. O Telessaúde Brasil Redes na Atenção Básica será composto por: (Origem: PRT MS/GM 2554/2011, Art. 6º)
I - Núcleo(s) de Telessaúde Técnico-Científico na Atenção Básica; (Origem: PRT MS/GM 2554/2011, Art. 6º, I)
II - Pontos do Telessaúde Brasil Redes na Atenção Básica; (Origem: PRT MS/GM 2554/2011, Art. 6º, II)
III - unidade de gestão intermunicipal ou de região de saúde do projeto; e (Origem: PRT MS/GM 2554/2011, Art. 6º, III)
IV - coordenação municipal do projeto. (Origem: PRT MS/GM 2554/2011, Art. 6º, IV)
Art. 470. O Núcleo de Telessaúde Técnico-Científico na Atenção Básica deve possuir sede física e ser composto por equipe e equipamentos que garantam a coordenação e execução das ações cotidianas de: (Origem: PRT MS/GM 2554/2011, Art. 7º)
I - Teleconsultoria; (Origem: PRT MS/GM 2554/2011, Art. 7º, I)
II - educação permanente; (Origem: PRT MS/GM 2554/2011, Art. 7º, II)
III - apoio matricial; (Origem: PRT MS/GM 2554/2011, Art. 7º, III)
IV - preparação de pessoal e das equipes para o uso do serviço; (Origem: PRT MS/GM 2554/2011, Art. 7º, IV)
V - resolução de problemas relacionados ao uso do serviço; (Origem: PRT MS/GM 2554/2011, Art. 7º, V)
VI - monitoramento e avaliação do uso e da qualidade do serviço; e (Origem: PRT MS/GM 2554/2011, Art. 7º, VI)
VII - monitoramento e avaliação do impacto do Telessaúde Brasil Redes na Atenção Básica e seus resultados na atenção à saúde da população. (Origem: PRT MS/GM 2554/2011, Art. 7º, VII)
Art. 471. Compete aos Núcleos de Telessaúde Técnico-Científicos na Atenção Básica: (Origem: PRT MS/GM 2554/2011, Art. 8º)
I - organizar, ofertar e regular a Segunda Opinião Formativa, Teleconsultoria e Telediagnóstico, além de outras ações e serviços ofertados; (Origem: PRT MS/GM 2554/2011, Art. 8º, I)
II - estabelecer fluxos, prazos e protocolos, com base na melhor evidência científica disponível, e adscrição de equipes de atenção básica de modo que facilite o uso dos serviços e as solicitações das equipes; (Origem: PRT MS/GM 2554/2011, Art. 8º, II)
III - possuir equipe de teleconsultores que garanta, minimamente, a oferta de Teleconsultoria e Segunda Opinião Formativa; (Origem: PRT MS/GM 2554/2011, Art. 8º, III)
IV - articular o Telessaúde à regulação da oferta de serviços; (Origem: PRT MS/GM 2554/2011, Art. 8º, IV)
V - propiciar a elaboração, de forma compartilhada e pactuada com os pontos de atenção da rede, de fluxograma e protocolos clínicos que incluam a solicitação prévia de Segunda Opinião Formativa e/ou Teleconsultoria antes do encaminhamento ou da solicitação para a central de regulação; e (Origem: PRT MS/GM 2554/2011, Art. 8º, V)
VI - monitorar e avaliar o projeto, incluindo-se a avaliação do número de solicitações de Segunda Opinião Formativa e Teleconsultorias, do tempo de resposta para os usuários, do número e da qualidade dos encaminhamentos e solicitações de exames realizados e da ampliação da resolutividade da atenção básica. (Origem: PRT MS/GM 2554/2011, Art. 8º, VI)
Parágrafo Único. Os Núcleos de Telessaúde Técnico-Científicos na Atenção Básica são classificados como: (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 2859/2014)
I - Estadual: quando a sede do Núcleo está vinculada à gestão Estadual, tendo um conjunto de Municípios integrantes; (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único, I)
II - Municipal: quando a sede do Núcleo está vinculada à gestão Municipal, tendo abrangência apenas no próprio Município; ou (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único, II)
III - Intermunicipal: quando a sede do Núcleo está vinculada à gestão Municipal, tendo um conjunto de Municípios integrantes. (Origem: PRT MS/GM 2554/2011, Art. 8º, Parágrafo Único, III)
Art. 472. Os Pontos do Telessaúde Brasil Redes na Atenção Básica serão implementados em UBS equipadas e com pontos conectados e deverão ter seu processo de trabalho definido junto à equipe de atenção básica usuária. (Origem: PRT MS/GM 2554/2011, Art. 9º)
Art. 473. A unidade de gestão intermunicipal ou de região de saúde do projeto deverá responder pelo conjunto do projeto e tomar as decisões necessárias à sua operacionalização (Origem: PRT MS/GM 2554/2011, Art. 10)
Art. 474. Compete à unidade de gestão intermunicipal ou de região de saúde do projeto: (Origem: PRT MS/GM 2554/2011, Art. 11)
I - informar sobre o andamento do projeto; (Origem: PRT MS/GM 2554/2011, Art. 11, I)
II - gerenciar ações para a formação dos profissionais dos Núcleos de Telessaúde Técnico-Científicos vinculados aos serviços de saúde dos Municípios integrantes do Telessaúde Brasil Redes na Atenção Básica; (Origem: PRT MS/GM 2554/2011, Art. 11, II)
III - apoiar todos os Municípios que fazem parte do projeto; e (Origem: PRT MS/GM 2554/2011, Art. 11, III)
IV - garantir condições para a participação de todos os profissionais das equipes de atenção básica nas ações oferecidas pelo Programa Telessaúde Brasil Redes na Atenção Básica. (Origem: PRT MS/GM 2554/2011, Art. 11, IV)
Art. 475. A coordenação municipal do projeto será responsável pela gestão do projeto no âmbito de cada Município. (Origem: PRT MS/GM 2554/2011, Art. 12)
Art. 476. A Teleconsultoria é ação primordial do Telessaúde Brasil Redes na Atenção Básica e será instituída nos projetos a serem apresentados a partir das disposições do Programa Nacional Telessaúde Brasil Redes. (Origem: PRT MS/GM 2554/2011, Art. 13)
Art. 477. Para a execução das ações de que trata esta Subseção, serão priorizadas as Equipes de Saúde da Família (ESF) que já participem de programas de formação, educação permanente e de estímulo ao provimento e fixação de profissionais de saúde desenvolvidos ou financiados pelo Ministério da Saúde. (Origem: PRT MS/GM 2554/2011, Art. 14)
Art. 478. Os profissionais ligados ao Núcleo de Telessaúde Técnico-Científico que realizam Teleconsultoria e Segunda Opinião Formativa a partir dos Pontos do Telessaúde Brasil Redes na Atenção Básica serão, preferencialmente, trabalhadores da própria rede de serviços dos Municípios participantes. (Origem: PRT MS/GM 2554/2011, Art. 15)
Parágrafo Único. A preferência por profissionais trabalhadores da rede de serviços do Município participante visa à capacitação progressiva desses profissionais, que já atuam na área, para as funções do Telessaúde Brasil Redes, com vistas à acumulação de inteligência e expertise para sustentabilidade do Programa. (Origem: PRT MS/GM 2554/2011, Art. 15, Parágrafo Único)
Art. 479. Para implementação do Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, os Estados, o Distrito Federal e os Municípios deverão apresentar ao Ministério da Saúde o Projeto de Informatização e Telessaúde Brasil Redes na Atenção Básica, respeitada a data-limite definida pelo Ministério da Saúde. (Origem: PRT MS/GM 2554/2011, Art. 16)
Parágrafo Único. O projeto de que trata o caput será homologado pela Comissão Intergestores Bipartite (CIB) ou pelo Colegiado de Gestão da Secretaria de Saúde do Distrito Federal e, posteriormente, enviado para o Ministério da Saúde. (Origem: PRT MS/GM 2554/2011, Art. 16, § 1º)
Art. 480. O Ministério da Saúde, por intermédio do Departamento de Atenção Básica da Secretaria de Atenção à Saúde (DAB/SAS/MS), publicará no endereço eletrônico www.saude.gov.br/dab o manual instrutivo que detalhará os requisitos a serem cumpridos no projeto, tais como conteúdo, cronograma, informações, e definições, incluindo aquelas que versam sobre a distribuição dos recursos financeiros para os Fundos Municipais e/ou Distrital e Estaduais de Saúde. (Origem: PRT MS/GM 2554/2011, Art. 17)
Art. 481. Serão publicados periodicamente, em portaria específica da Secretaria de Atenção à Saúde (SAS/MS), os valores relativos ao repasse de recursos financeiros aos Municípios, por Estado, para os Projetos do Componente de Informatização e Telessaúde Brasil Redes na Atenção Básica, no âmbito do Programa de Requalificação das Unidades Básicas de Saúde. (Origem: PRT MS/GM 2554/2011, Art. 18)
Art. 482. Compete ao Ministério da Saúde fazer a análise técnica dos Projetos de Informatização e Telessaúde Brasil Redes na Atenção Básica, segundo diretrizes e critérios de adequação ao programa, tais como: (Origem: PRT MS/GM 2554/2011, Art. 19)
I - impacto; (Origem: PRT MS/GM 2554/2011, Art. 19, I)
II - exequibilidade; (Origem: PRT MS/GM 2554/2011, Art. 19, II)
III - conectividade; (Origem: PRT MS/GM 2554/2011, Art. 19, III)
IV - sustentabilidade; (Origem: PRT MS/GM 2554/2011, Art. 19, IV)
V - custo-efetividade; (Origem: PRT MS/GM 2554/2011, Art. 19, V)
VI - abrangência; (Origem: PRT MS/GM 2554/2011, Art. 19, VI)
VII - cobertura do projeto; e (Origem: PRT MS/GM 2554/2011, Art. 19, VII)
VIII - disponibilidade financeira. (Origem: PRT MS/GM 2554/2011, Art. 19, VIII)
Art. 483. O Ministério da Saúde editará, posteriormente, ato específico que disponha sobre o repasse de recursos para o custeio das atividades para o período posterior ao de que trata o "caput" deste artigo. (Origem: PRT MS/GM 2525/2013, Art. 2º)
Subseção VI
Dos Núcleos Intermunicipais e Estaduais de Telessaúde do Programa Nacional de Telessaúde Brasil Redes na Atenção Básica
Art. 484. As equipes da Atenção Básica de que trata esta Subseção incluem: (Origem: PRT MS/GM 2859/2014, Art. 9º)
I - as Equipes de Saúde da Família; (Origem: PRT MS/GM 2859/2014, Art. 9º, I)
II - as Equipes de Atenção Básica; (Origem: PRT MS/GM 2859/2014, Art. 9º, II)
III - as Equipes de Atenção Domiciliar; (Origem: PRT MS/GM 2859/2014, Art. 9º, III)
IV - os Núcleos de Apoio à Saúde da Família (NASF); (Origem: PRT MS/GM 2859/2014, Art. 9º, IV)
V - as Equipes de Saúde da Família Ribeirinhas (ESFR); (Origem: PRT MS/GM 2859/2014, Art. 9º, V)
VI - as Equipes de Saúde da Família Fluviais (ESFF); (Origem: PRT MS/GM 2859/2014, Art. 9º, VI)
VII - as equipes dos Consultórios na Rua; e (Origem: PRT MS/GM 2859/2014, Art. 9º, VII)
VIII - todas as demais equipes previstas ou que venham a ser previstas na Política Nacional de Atenção Básica (PNAB). (Origem: PRT MS/GM 2859/2014, Art. 9º, VIII)
Art. 485. O porte dos Núcleos de Telessaúde está relacionado à quantidade de equipes da Atenção Básica participantes, observada a seguinte gradação: (Origem: PRT MS/GM 2859/2014, Art. 10)
I - porte I: 80 (oitenta) a 199 (cento e noventa e nove) equipes da Atenção Básica participantes; (Origem: PRT MS/GM 2859/2014, Art. 10, I)
II - porte II: 200 (duzentas) a 399 (trezentas e noventa e nove) equipes da Atenção Básica participantes; (Origem: PRT MS/GM 2859/2014, Art. 10, II)
III - porte III: 400 (quatrocentas) a 599 (quinhentas e noventa e nove) equipes da Atenção Básica participantes; e (Origem: PRT MS/GM 2859/2014, Art. 10, III)
IV - porte IV: a partir de 600 (seiscentas) equipes da Atenção Básica participantes. (Origem: PRT MS/GM 2859/2014, Art. 10, IV)
Art. 486. O monitoramento dos Núcleos de Telessaúde por parte do Ministério da Saúde será mensal e a avaliação das informações que embasarão os valores do incentivo financeiro de custeio mensal a serem repassados será trimestral. (Origem: PRT MS/GM 2859/2014, Art. 11)
§ 1º Os indicadores dispostos nesta Subseção poderão ser revistos, a qualquer tempo, quando necessária repactuação, com objetivo de atualização e incremento. (Origem: PRT MS/GM 2859/2014, Art. 11, § 1º)
§ 2º A constatação, a qualquer tempo, do descumprimento das exigências e condições para o recebimento do incentivo financeiro de custeio mensal de que trata esta Subseção implicará na suspensão do repasse correspondente, até a regularização da situação do Núcleo de Telessaúde. (Origem: PRT MS/GM 2859/2014, Art. 11, § 2º)
§ 3º No caso da ocorrência da hipótese descrita no art. 486, § 2º , não serão devidos os valores do incentivo financeiro de custeio mensal desde a sua suspensão até a regularização da situação. (Origem: PRT MS/GM 2859/2014, Art. 11, § 3º)
Art. 487. Será disponibilizado manual instrutivo, no endereço eletrônico do Departamento de Atenção Básica (DAB/SAS/MS), disponível no Portal da Saúde em http://dab.saude.gov.br/portaldab/, contendo as orientações sobre os componentes do custeio e a forma de monitoramento dos indicadores previstos nesta Subseção. (Origem: PRT MS/GM 2859/2014, Art. 12)
Art. 488. Ato específico do Ministro de Estado da Saúde, após pactuação na Comissão Intergestores Tripartite (CIT), definirá os valores do incentivo financeiro de custeio mensal de que trata esta Subseção. (Origem: PRT MS/GM 2859/2014, Art. 13)
Art. 489. Ato específico do Ministro de Estado da Saúde habilitará os respectivos entes federativos beneficiários ao recebimento do incentivo financeiro de custeio mensal de que trata esta Subseção. (Origem: PRT MS/GM 2859/2014, Art. 14)
Parágrafo Único. Após a publicação do ato específico de que trata o "caput", o incentivo financeiro de custeio mensal será repassado pelo Fundo Nacional de Saúde ao fundo de saúde do ente beneficiário. (Origem: PRT MS/GM 2859/2014, Art. 14, Parágrafo Único)
Art. 490. Será permitido mudar o perfil do núcleo de Estadual para Intermunicipal ou vice-versa, desde que encaminhado documento com resolução da CIB solicitando tal alteração ao DAB/SAS/MS. (Origem: PRT MS/GM 2859/2014, Art. 15)
Parágrafo Único. Após análise e aprovação pelo DAB/SAS/MS do documento de que trata o "caput", será editado ato específico do Ministro de Estado da Saúde para adequar o perfil do Núcleo de Telessaúde do ente federativo previamente habilitado ao pactuado na CIB. (Origem: PRT MS/GM 2859/2014, Art. 15, Parágrafo Único)
Art. 491. A comprovação da aplicação dos recursos financeiros transferidos por força desta Subseção será apresentada no Relatório Anual de Gestão (RAG), previsto na Lei nº 8.142, de 28 de dezembro de 1990, e no Decreto nº 1.651, de 28 de setembro de 1995, e assinado pelo respectivo Conselho de Saúde. (Origem: PRT MS/GM 2859/2014, Art. 16)
Art. 492. O Sistema Nacional de Auditoria (SNA), com fundamento nos relatórios de gestão, acompanhará a conformidade da aplicação dos recursos transferidos, nos termos do disposto no art. 5º do Decreto nº 1.232, de 30 de agosto de 1994. (Origem: PRT MS/GM 2859/2014, Art. 17)
Subseção VII
Do Programa Nacional Telessaúde Brasil Redes para Apoiar a Implantação da Estratégia e-SUS AB
Art. 493. Fica instituído o incentivo financeiro de custeio destinado aos Municípios, Estados e Distrito Federal com núcleos de Telessaúde do Programa Nacional Telessaúde Brasil Redes para apoio à implantação da estratégia e-SUS AB. (Origem: PRT MS/GM 58/2015, Art. 1º)
Art. 494. O cálculo do valor do incentivo a ser repassado para cada Município, Estado e Distrito Federal com núcleo de telessaúde considerará a abrangência de implantação (número de equipes de Atenção Básica apoiadas) e o sistema de "software" (Coleta de Dados Simplificado - CDS e o Prontuário Eletrônico do Cidadão - PEC) que será implantado nas Unidades Básicas de Saúde as quais as equipes apoiadas estão vinculadas e que deverão constar no projeto enviado ao DAB/SAS/MS). (Origem: PRT MS/GM 58/2015, Art. 3º)
Parágrafo Único. Caberá ao Ministério da Saúde estipular os valores mínimos e máximos do incentivo financeiro previsto nesta Subseção aos quais cada Estado, Distrito Federal e Município, sedes de Núcleo de Telessaúde estarão habilitados ao recebimento, após pactuação na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 58/2015, Art. 3º, Parágrafo Único)
Art. 495. Para fins de acompanhamento das atividades dos Núcleos de Telessaúde serão consideradas as atividades desenvolvidas pelos Núcleos de Telessaúde na implantação do CDS e/ou PEC, quais sejam: (Origem: PRT MS/GM 58/2015, Art. 4º)
I - realizar web conferências sobre a estratégia e-SUS AB no período de vigência do plano de trabalho; (Origem: PRT MS/GM 58/2015, Art. 4º, I)
II - realizar oficinas de trabalho sobre a estratégia e-SUS AB no período de vigência do plano de trabalho; (Origem: PRT MS/GM 58/2015, Art. 4º, II)
III - realizar visitas em Unidades Básicas de Saúde para implantação do PEC, no período de vigência do plano de trabalho; e (Origem: PRT MS/GM 58/2015, Art. 4º, III)
IV - monitorar a evolução do estágio de implantação do e-SUS AB e envio dos dados nos Municípios vinculados ao plano de trabalho. (Origem: PRT MS/GM 58/2015, Art. 4º, IV)
Parágrafo Único. O monitoramento das informações descritas no art. 4º, ocorrerá periodicamente, através de envio de relatório das atividades pelos Núcleos de Telessaúde ao Ministério da Saúde. (Origem: PRT MS/GM 58/2015, Art. 4º, Parágrafo Único)
Art. 496. O incentivo financeiro de custeio de que trata esta Subseção será repassado em (duas) parcelas ao Município sede do Núcleo de Telessaúde para os projetos intermunicipais e ao Estado sede do Núcleo de Telessaúde para os Projetos Estaduais. (Origem: PRT MS/GM 58/2015, Art. 5º)
§ 1º A primeira parcela corresponderá a 50% (cinquenta por cento) do valor total a ser repassado, após aprovação de Plano de Trabalho encaminhado ao Departamento de Atenção Básica. (Origem: PRT MS/GM 58/2015, Art. 5º, § 1º)
§ 2º A segunda parcela corresponderá a 50% (cinquenta por cento) do valor total a ser repassado e será liberada quando, no mínimo, 60% dos Municípios identificados nos planos de trabalhos encaminhados pelos núcleos de Telessaúde estiverem com status de implantação intermediário e/ou implantado. (Origem: PRT MS/GM 58/2015, Art. 5º, § 2º)
§ 3º Os recursos federais referentes ao incentivo financeiro de custeio de que trata esta Subseção poderão ser transferidos pelo Fundo Nacional de Saúde diretamente aos Fundos de Saúde Estaduais, conforme pactuação na Comissão Intergestores Bipartite (CIB). (Origem: PRT MS/GM 58/2015, Art. 5º, § 3º)
Art. 497. Para acompanhamento do andamento da implantação nas Unidades Básicas de Saúde serão considerados, a partir do relatório de envio de dados ao SISAB, os seguintes estágios de implantação: (Origem: PRT MS/GM 58/2015, Art. 6º)
I - somente envio de informações de Atividade Coletiva; (Origem: PRT MS/GM 58/2015, Art. 6º, I)
II - envio de Informações de outras ações; e (Origem: PRT MS/GM 58/2015, Art. 6º, II)
III - envio de informações de, pelo menos, Cadastro Individual, Atendimento Individual e visita domiciliar. (Origem: PRT MS/GM 58/2015, Art. 6º, III)
Parágrafo Único. O estágio da implantação nas Unidades Básicas de Saúde será considerado como: (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único)
I - não Iniciado - Nenhuma UBS iniciou a implantação; (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, I)
II - incipiente - Ao menos uma UBS iniciou implantação; (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, II)
III - intermediário - 30% e < 60% das UBS em Estágio II ou III; e (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, III)
IV - implantado - 60% das UBS em Estágio II ou III. (Origem: PRT MS/GM 58/2015, Art. 6º, Parágrafo Único, IV)
Art. 498. Na hipótese de execução integral do objeto originalmente pactuado e verificada sobra de recursos financeiros, o ente federativo poderá efetuar o remanejamento dos recursos e a sua aplicação nos termos da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 58/2015, Art. 7º)
Art. 499. A comprovação da aplicação dos recursos financeiros transferidos por força desta Subseção será apresentada no Relatório Anual de Gestão (RAG), previsto na Lei nº 8.142, de 28 de dezembro de 1990, e no Decreto nº 1.651, de 28 de setembro de 1995, e assinado pelo respectivo Conselho de Saúde. (Origem: PRT MS/GM 58/2015, Art. 8º)
Art. 500. O Sistema Nacional de Auditoria (SNA), com fundamento nos relatórios de gestão, acompanhará a conformidade da aplicação dos recursos transferidos, nos termos do disposto no art. 5º do Decreto nº 1.232, de 30 de agosto de 1994. (Origem: PRT MS/GM 58/2015, Art. 9º)
Art. 501. Nos casos em que for verificada a não execução integral do objeto originalmente pactuado e a existência de recursos financeiros repassados pelo Fundo Nacional de Saúde para os Fundos de Saúde Estaduais, Distrital e Municipais não executados, seja parcial ou totalmente, o ente federativo estará sujeito à devolução dos recursos financeiros transferidos e não executados, acrescidos da correção monetária prevista em lei, observado o regular processo administrativo. (Origem: PRT MS/GM 58/2015, Art. 10)
Art. 502. Nos casos em que for verificado que os recursos financeiros transferidos pelo Fundo Nacional de Saúde foram executados, total ou parcialmente, em objeto distinto ao originalmente pactuado, aplicar-se-á o regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Origem: PRT MS/GM 58/2015, Art. 11)
Art. 503. Os recursos financeiros para execução do objeto, de que trata esta Subseção, para os Núcleos Municipais e Intermunicipais, são oriundos do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.301.2015.8577 - Piso de Atenção Básica Fixo. (Origem: PRT MS/GM 58/2015, Art. 12)
Art. 504. Os recursos financeiros para execução do objeto, de que trata esta Subseção, para os Núcleos Estaduais, são oriundos do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.302.2015.8585 - Atenção à Saúde da População para Procedimentos em Média e Alta Complexidade. (Origem: PRT MS/GM 58/2015, Art. 13)
Seção I-A
Do Programa de Informatização das Unidades Básicas de
Saúde
(Incluído pela PRT GM/MS n° 2.920 de 31.10.2017)
Seção I-A
Do Programa de Apoio à Informatização e Qualificação dos Dados da Atenção Primária à Saúde - Informatiza APS
(Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019)
Art. 504-A. Fica instituído o Programa de Informatização
das Unidades Básicas de Saúde - PIUBS, no âmbito da Política
Nacional de Atenção Básica - PNAB e da Política Nacional de
Informação e Informática em Saúde - PNIIS. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 1º O PIUBS consiste no fornecimento de infraestrutura
tecnológica, além de serviços de Tecnologia da Informação, que
possibilite a implantação e a manutenção de prontuário eletrônico
nas Unidades Básicas de Saúde - UBS dos Municípios e do
Distrito Federal. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 2º As regras sobre o custeio do PIUBS estão definidas
nos arts. 172-A a 172-D da Portaria de Consolidação nº 6/GM/MS,
de 28 de setembro de 2017. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
Art. 504-A. Fica instituído o Programa de Apoio à Informatização e Qualificação dos Dados da Atenção Primária à Saúde - Informatiza APS, com o objetivo de informatizar todas as equipes de Saúde da Família - eSF e equipes de Atenção Primária à Saúde - eAP do País e de qualificar os dados em saúde dos municípios e Distrito Federal. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Parágrafo único. Os municípios e Distrito Federal que aderirem ao Programa Informatiza APS farão jus ao recebimento de incentivos financeiros de custeio mensal nos termos dos arts. 172-A a 172-D da Portaria de Consolidação nº 6/GM/MS, de 28 de setembro de 2017. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 504-B. A participação dos Municípios e do Distrito
Federal no PIUBS, que ocorrerá mediante a assinatura de termo de
adesão, permitirá ao ente escolher: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
I - a contratação de empresas pelo Ministério da Saúde,
após processo de credenciamento, para a implantação e manutenção
de prontuário eletrônico de paciente em suas UBS; ou (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
II - nos casos em que contar com prontuários eletrônicos
em funcionamento, a solicitação de transferência de recursos financeiros
para o custeio desses serviços já implantados, desde que
atendam aos requisitos técnicos definidos por ato do Departamento
de Atenção Básica. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 1º O Ministério da Saúde disponibilizará portal eletrônico
para acesso pelos Municípios e Distrito Federal ao
PIUBS. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 2° O termo de adesão de que trata o caput será
disponibilizado no portal eletrônico referido no § 1º e deverá
prever detalhadamente as responsabilidades do município ou do
Distrito Federal aderente, inclusive no que concerne: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
I - à escolha de uma das alternativas previstas nos incisos
do caput; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
II - às informações a serem prestadas regularmente ao
Ministério da Saúde na execução do PIUBS; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
III - à necessidade de motivação da opção por uma das
soluções das empresas credenciadas disponíveis no portal eletrônico
referido no § 1º, na hipótese de ter sido escolhida a
alternativa prevista no inciso I do caput; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
IV - ao provimento dos meios necessários para que a
empresa contratada possa desempenhar os seus serviços, na hipótese
de ter sido escolhida a alternativa prevista no inciso I do
caput; e (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
V - ao acompanhamento dos serviços desempenhados pela
empresa contratada, na hipótese de ter sido escolhida a alternativa
prevista no inciso I do caput. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 3º A escolha da contratação prevista no inciso I do
caput poderá ocorrer mesmo nos casos em que os municípios e o
Distrito Federal possuam prontuário eletrônico em funcionamento
em suas UBS, desde que devidamente justificada. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 4º A adesão de município ou do Distrito federal ao
PIUBS não isentará o ente e suas equipes de Atenção Básica de
transmitir os dados de produção mensal para a base nacional do
Sistema de Informação em Saúde para a Atenção Básica - SISAB
em qualquer fase do programa (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 5º O processo de credenciamento e contratação de que
trata o inciso I do caput será regido por regras previstas em edital
a ser publicado pelo Ministério da Saúde. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 6º Para fins da opção de que trata o inciso III do § 2º,
as soluções das empresas credenciadas serão apresentadas aos
municípios e Distrito Federal por meio do portal eletrônico referido
no § 1º, com a descrição das características de cada solução
e sem a identificação das empresas credenciadas. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
Art. 504-B. Para fins desta Portaria, considera-se: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - informatização: uso de sistema de prontuário eletrônico nos ambientes de atendimento direto ao cidadão, devidamente preenchido a cada atendimento e com envio adequado de dados ao Ministério da Saúde, de acordo com os requisitos definidos nas normas vigentes; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - sistema de prontuário eletrônico: sistema a ser utilizado em toda a rede de Atenção Primária à Saúde, preferencialmente o Prontuário Eletrônico do Cidadão - PEC da estratégia e-SUS APS, disponibilizado pelo Ministério da Saúde, ou outro sistema compatível com o modelo de dados adotado pelo Ministério da Saúde, devendo ser observado, para fins de integração com a base de dados do sistema de informação da Atenção Primária à Saúde, o modelo mais recente do padrão Layout e-SUS APS de Dados de Interface (LEDI) de comunicação entre os sistemas, conforme especificação técnica do sistema e-SUS APS; e (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - prontuário eletrônico: repositório de informações mantidas de forma eletrônica, compreendendo as informações de saúde, clínicas e administrativas, originadas das ações das diversas categorias profissionais que compõem a APS, ao longo da vida de um indivíduo. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Parágrafo único. O sistema de prontuário eletrônico deve atender aos requisitos definidos pelo Ministério da Saúde, inclusive para fins de interoperabilidade, e possuir as seguintes características principais: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - registro de anamnese, exame objetivo e variáveis clínicas; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - prescrição de medicamentos ou outros métodos terapêuticos; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - emissão de atestados e outros documentos clínicos; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
IV - solicitação de exames e outros métodos diagnósticos complementares; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
V - encaminhamentos a outros pontos da rede de atenção à saúde; e (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
VI - acesso rápido aos problemas de saúde e intervenções atuais. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 504-C. Fica instituído o Comitê Gestor do PIUBS -
CGPIUBS, com a seguinte composição: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
I - um representante, titular e suplente, do Departamento
de Monitoramento e Avaliação do SUS da Secretaria-Executiva -
DEMAS/SE, que o coordenará; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
II - um representante, titular e suplente, do Departamento
de Atenção Básica da Secretaria de Atenção à Saúde -
DAB/SAS; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
III - um representante, titular e suplente, do Departamento
de Informática do SUS da Secretaria-Executiva - DATASUS/SE;
e (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
IV - um representante, titular e suplente, da Subsecretaria
de Assuntos Administrativos da Secretaria-Executiva - SAA/SE. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 1º Os representantes deverão ser escolhidos entre servidores
dos órgãos mencionados nos incisos do caput e serão
indicados pelo Secretário de Atenção à Saúde, no caso do incisoII do caput, e pelo Secretário-Executivo, no caso dos incisos I, III
e IV do caput. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 2º Os órgãos participantes do CGPIUBS fornecerão o
apoio técnico e administrativo necessário às atividades desse comitê. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
Art. 504-C. Poderão aderir ao Programa Informatiza APS, por meio de sistema a ser disponibilizado pelo Ministério da Saúde, os municípios e o Distrito Federal que possuírem eSF ou eAP informatizadas e cadastradas no Sistema Nacional de Cadastro de Estabelecimentos de Saúde - SCNES de acordo com as normas vigentes. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 1º Serão consideradas eSF ou eAP informatizadas aquelas que, em pelo menos uma das três competências anteriores à solicitação de adesão ao Programa Informatiza APS, tiverem enviado informações ao Ministério da Saúde provenientes de sistema de prontuário eletrônico. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 2º A solicitação de adesão será submetida à análise da Secretaria de Atenção Primária à Saúde do Ministério da Saúde, que avaliará o cumprimento dos requisitos do Programa Informatiza APS e a existência de disponibilidade orçamentária e financeira. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 3º Caso deferida a solicitação de adesão, será publicada portaria de homologação da adesão no Diário Oficial da União. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 504-D. Compete ao CGPIUBS: (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
I - planejar, articular e gerir o PIUBS, com base em
diretrizes definidas pelo Comitê Gestor da Estratégia de e-Saúde; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
II - definir, monitorar e avaliar a execução das ações a
serem desenvolvidas no âmbito do PIUBS; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
III - deliberar sobre a suspensão dos repasses dos valores
do programa em face do descumprimento das obrigações assumidas
pelos municípios e Distrito Federal no PIUBS, observada
a necessidade de notificação prévia e prazo para resposta do ente
aderente, nos termos do art. 172-D da Portaria de Consolidação nº
6/GM/MS, de 2017; (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
V - dispor sobre os casos omissos nesta Portaria e nos
instrumentos de adesão, credenciamento e contratação e sobre as
demais medidas necessárias para garantir a plena execução do
programa; e (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
VI - fornecer o apoio técnico e administrativo necessário
para a plena execução do programa. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 1º As reuniões ordinárias do CGPIUBS serão quinzenais,
podendo ser convocadas reuniões extraordinárias pelo coordenador. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 2º As deliberações do CGPIUBS serão tomadas por
maioria simples, cabendo ao coordenadora decisão final em caso
de empate, e serão formalizadas por meio de atas. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
§ 3º A participação no CGPIUBS será considerada prestação
de serviço público relevante, não remunerada. (Incluído pela PRT GM/MS n° 2.920 de 31.10.2017) (Revogado pela PRT GM/MS nº 2.983 de 11.11.2019)
Art. 504-D. No âmbito do Programa Informatiza APS, compete: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - ao Ministério da Saúde: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
a) definir os parâmetros mínimos a serem observados no Programa, inclusive quanto ao envio de dados pelos entes federativos ao Ministério da Saúde; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
b) realizar a transferência do incentivo financeiro federal previsto nos arts. 172-A a 172-D da Portaria de Consolidação nº 6/GM/MS, de 2017, a partir do recebimento dos dados da Atenção Primária à Saúde provenientes de sistema de prontuário eletrônico; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
c) monitorar e avaliar a qualidade dos dados enviados pelos municípios e Distrito Federal ao Ministério da Saúde, consoante previsto no art. 504-E; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
d) cooperar tecnicamente com os estados e municípios para qualificação, controle, avaliação e auditoria do Programa Informatiza APS; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
e) suspender a transferência dos incentivos nas hipóteses previstas no art. 172-C da Portaria de Consolidação nº 6/GM/MS, de 2017; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
f) cancelar a adesão dos municípios e Distrito Federal nas hipóteses do art. 504-F; e (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
g) fornecer modelos de editais, contratos e outros documentos para licitação e contratação relativas à informatização; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - às Secretarias Estaduais de Saúde: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
a) apoiar os municípios na melhoria do serviço de informatização no âmbito da Atenção Primária à Saúde; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
b) apoiar os municípios no monitoramento do envio e na qualidade dos dados da Atenção Primária à Saúde encaminhados ao Ministério da Saúde; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
c) cooperar tecnicamente com o Ministério da Saúde e os municípios para qualificação, controle, avaliação e auditoria do Programa Informatiza APS; e (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
d) mapear os municípios com dificuldade na condução de processo licitatório relativo à informatização, preferencialmente por região de saúde, e apoiá-los nesse processo; e (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - às Secretarias de Saúde dos Municípios e do Distrito Federal aderentes ao Programa Informatiza APS: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
a) implantar e aperfeiçoar sistema de prontuário eletrônico em toda sua rede de Atenção Primária à Saúde, observado o disposto no art. 504-B; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
b) enviar regularmente os dados e as informações do sistema de prontuário eletrônico ao Ministério da Saúde, consoante requisitos e parâmetros mínimos do Programa Informatiza APS; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
c) quando for utilizado o sistema PEC da estratégia e-SUS APS, enviar ao Ministério da Saúde, pela plataforma de pesquisa de opinião do e-SUS APS, contribuições sobre a utilização do sistema, com o objetivo de auxiliar na sua constante melhoria e desenvolvimento; (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
d) monitorar a regularidade do envio e a qualidade dos dados da Atenção Primária à Saúde encaminhados ao Ministério da Saúde, com observância dos parâmetros mínimos do Programa Informatiza APS; e (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
e) realizar os processos licitatórios e as contratações relativas à informatização necessárias para o adequado envio dos dados da Atenção Primária à Saúde ao Ministério da Saúde, bem como fiscalizar as aquisições e os serviços de informatização eventualmente contratados. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 504-E. O monitoramento e a avaliação da qualidade dos dados da Atenção Primária à Saúde enviados pelos municípios e Distrito Federal ao Ministério da Saúde serão realizados de acordo com plano de monitoramento do Programa Informatiza APS, que deverá ser informado às Secretarias de Saúde dos municípios e Distrito Federal aderentes e divulgado na internet pela Secretaria de Atenção Primária à Saúde. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 1º O plano de monitoramento deverá estabelecer anualmente parâmetros mínimos de quantidade e qualidade em relação aos dados da Atenção Primária à Saúde, tendo como referência a eSF ou a eAP, a serem enviados ao Ministério da Saúde pelos municípios e Distrito Federal aderentes. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 2º O plano de monitoramento deverá prever prazo para os municípios e Distrito Federal aderentes se adequarem aos novos parâmetros mínimos fixados a cada ano. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 3º A não observância dos parâmetros mínimos de que trata este artigo poderá acarretar a suspensão da transferência mensal do incentivo financeiro, nos termos do art. 172-C da Portaria de Consolidação nº 6/GM/MS, de 2017, ou até o cancelamento automático da adesão ao Programa Informatiza APS, nos termos do art. 504-F. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 504-F. A adesão dos municípios e Distrito Federal ao Programa Informatiza APS será cancelada automaticamente: (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - na hipótese de não serem enviados os dados da Atenção Primária à Saúde ao Ministério da Saúde, por meio de sistema de prontuário eletrônico, nas seis competências consecutivas a contar da data de publicação da portaria de homologação da adesão; ou (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - após seis competências consecutivas de ocorrência das hipóteses de suspensão da transferência do incentivo mensal previstas no art. 172-C da Portaria de Consolidação nº 6/GM/MS, de 2017. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 504-G. Compete ao Secretário de Atenção Primária à Saúde do Ministério da Saúde, caso entenda necessário, dispor sobre normas complementares para a execução do Programa Informatiza APS. (Redação dada pela PRT GM/MS nº 2.983 de 11.11.2019) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Seção II
Do Programa Nacional de Melhoria do Acesso e da Qualidade da Atenção Básica (PMAQ-AB)
Art. 505. Fica instituído o Programa Nacional de Melhoria do Acesso e da Qualidade da Atenção Básica (PMAQ-AB). (Origem: PRT MS/GM 1645/2015, Art. 1º)
Art. 506. O PMAQ-AB tem como objetivo induzir a ampliação do acesso e a melhoria da qualidade da atenção básica, com garantia de um padrão de qualidade comparável nacional, regional e localmente,de maneira a permitir maior transparência e efetividade das ações governamentais direcionadas à Atenção Básica em Saúde. (Origem: PRT MS/GM 1645/2015, Art. 2º)
Art. 507. São diretrizes do PMAQ-AB: (Origem: PRT MS/GM 1645/2015, Art. 3º)
I - definir parâmetro de qualidade, considerando-se as diferentes realidades de saúde, de maneira a promover uma maior resolutividade das equipes de saúde da atenção básica; (Origem: PRT MS/GM 1645/2015, Art. 3º, I)
II - estimular processo contínuo e progressivo de melhoramento dos padrões e indicadores de acesso e de qualidade que envolva a gestão, o processo de trabalho e os resultados alcançados pelas equipes de saúde da atenção básica; (Origem: PRT MS/GM 1645/2015, Art. 3º, II)
III - transparência em todas as suas etapas, permitindo-se o contínuo acompanhamento de suas ações e resultados pela sociedade; (Origem: PRT MS/GM 1645/2015, Art. 3º, III)
IV - envolver e mobilizar os gestores federal, estaduais, do Distrito Federal e municipais, as equipes de saúde de atenção básica e os usuários em um processo de mudança de cultura de gestão e qualificação da atenção básica; (Origem: PRT MS/GM 1645/2015, Art. 3º, IV)
V - desenvolver cultura de planejamento, negociação e contratualização, que implique na gestão dos recursos em função dos compromissos e resultados pactuados e alcançados; (Origem: PRT MS/GM 1645/2015, Art. 3º, V)
VI - estimular o fortalecimento do modelo de atenção previsto na Política Nacional de Atenção Básica, o desenvolvimento dos trabalhadores e a orientação dos serviços em função das necessidades e da satisfação dos usuários; e (Origem: PRT MS/GM 1645/2015, Art. 3º, VI)
VII - caráter voluntário para a adesão tanto pelas equipes de saúde da atenção básica quanto pelos gestores municipais, a partir do pressuposto de que o seu êxito depende da motivação e proatividade dos atores envolvidos. (Origem: PRT MS/GM 1645/2015, Art. 3º, VII)
Art. 508. O PMAQ-AB é composto por 3 (três) Fases e um Eixo Estratégico Transversal de Desenvolvimento que compõem um ciclo. (Origem: PRT MS/GM 1645/2015, Art. 4º)
§ 1º O PMAQ-AB se refere a processos e fases que se sucedem para o desenvolvimento e a melhoria contínua da qualidade da atenção básica. (Origem: PRT MS/GM 1645/2015, Art. 4º, § 1º)
§ 2º Cada ciclo do PMAQ-AB ocorrerá a cada 24 (vinte e quatro) meses. (Origem: PRT MS/GM 1645/2015, Art. 4º, § 2º)
Art. 509. A Fase 1 do PMAQ-AB é denominada Adesão e Contratualização. (Origem: PRT MS/GM 1645/2015, Art. 5º)
§ 1º Na Fase 1, todas as equipes de saúde da atenção básica, incluindo as equipes de saúde bucal e Núcleos de Apoio ao Saúde da Família, independente do modelo pelo qual se organizam, poderão aderir ao PMAQ-AB, desde que se encontrem em conformidade com os princípios da atenção básica e com os critérios a serem definidos no Manual Instrutivo do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 1º)
§ 2º O Distrito Federal ou o Município poderá incluir todas ou apenas parte das suas equipes de saúde da atenção básica na adesão ao PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 2º)
§ 3º Na Fase 1 serão observadas as seguintes etapas: (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º)
I - formalização da adesão pelo Distrito Federal ou Município,que será feita por intermédio do preenchimento de formulário eletrônico específico a ser indicado pelo Ministério da Saúde; (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º, I)
II - contratualização da equipe de saúde da atenção básica e do gestor do Distrito Federal ou municipal, de acordo com as diretrizes e critérios definidos do Manual Instrutivo do PMAQ-AB; e (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º, II)
III - informação sobre a adesão do Município ao Conselho Municipal de Saúde e à Comissão Intergestores Regional. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 3º, III)
§ 4º Para os fins do disposto no inciso III do § 3º, o Distrito Federal informará a adesão ao respectivo Conselho de Saúde. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 4º)
§ 5º A Fase 1 será realizada pelas equipes que ingressarem no PMAQ-AB pela primeira vez a cada ciclo. (Origem: PRT MS/GM 1645/2015, Art. 5º, § 5º)
Art. 510. A Fase 2 do PMAQ-AB é denominada Certificação e será composta por: (Origem: PRT MS/GM 1645/2015, Art. 6º)
I - avaliação externa de desempenho das equipes de saúde e gestão da atenção básica, que será coordenada de forma tripartite e realizada por instituições de ensino e/ou pesquisa, por meio da verificação de evidências para um conjunto de padrões previamente determinados; (Origem: PRT MS/GM 1645/2015, Art. 6º, I)
II - avaliação de desempenho dos indicadores contratualizados na etapa de adesão e contratualização, conforme disposto no art. 509; e (Origem: PRT MS/GM 1645/2015, Art. 6º, II)
III - verificação da realização de momento autoavaliativo pelos profissionais das equipes de atenção básica. (Origem: PRT MS/GM 1645/2015, Art. 6º, III)
§ 1º As equipes contratualizadas avaliadas nos termos deste artigo receberão as seguintes classificações de desempenho: (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º)
I - Ótimo; (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, I)
II - Muito Bom; (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, II)
III - Bom; (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, III)
IV - Regular; e (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, IV)
V - Ruim. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 1º, V)
§ 2º Caso a equipe contratualizada não alcance um conjunto de padrões mínimos de qualidade considerados essenciais, nos termos do Manual Instrutivo do PMAQ-AB, ela será automaticamente certificada com desempenho ruim. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 2º)
§ 3º Para que a equipe seja classificada com o desempenho ótimo, além de obter uma nota mínima, deverá alcançar um conjunto de padrões considerados estratégicos, nos termos do Manual Instrutivo do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 3º)
§ 4º O conjunto das classificações de desempenho das equipes contratualizadas comporá o Fator de Desempenho do Distrito Federal e de cada Município. (Origem: PRT MS/GM 1645/2015, Art. 6º, § 4º)
Art. 511. A Fase 3 do PMAQ-AB é denominada Recontratualização, que se caracteriza pela pactuação singular do Distrito Federal e dos Municípios com incremento de novos padrões e indicadores de qualidade, estimulando a institucionalização de um processo cíclico e sistemático a partir dos resultados verificados na fase 2 do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 7º)
Parágrafo Único. A Fase 3 será realizada pelas equipes que participaram do PMAQ-AB em ciclo anterior. (Origem: PRT MS/GM 1645/2015, Art. 7º, Parágrafo Único)
Art. 512. O Eixo Estratégico Transversal de Desenvolvimento do PMAQ-AB é composto pelos seguintes elementos: (Origem: PRT MS/GM 1645/2015, Art. 8º)
I - autoavaliação, a ser feita pela equipe de saúde da atenção básica a partir de instrumentos ofertados pelo PMAQ-AB ou outros definidos e pactuados pelo Estado, Distrito Federal, Município ou Região de Saúde; (Origem: PRT MS/GM 1645/2015, Art. 8º, I)
II - monitoramento, a ser realizado pelas equipes de saúde da atenção básica, pela Secretaria Municipal de Saúde e pela Secretaria de Estado da Saúde do Distrito Federal, pela Secretaria de Estado da Saúde e pelo Ministério da Saúde em parceria com as Comissões Intergestores Regionais (CIR), a partir dos indicadores de saúde contratualizados na Fase 1 do PMAQ-AB; (Origem: PRT MS/GM 1645/2015, Art. 8º, II)
III - educação permanente, por meio de ações dos gestores municipais, do Distrito Federal, estaduais e federal, considerando-se as necessidades de educação permanente das equipes; (Origem: PRT MS/GM 1645/2015, Art. 8º, III)
IV - apoio institucional, a partir de estratégia de suporte às equipes de saúde da atenção básica pelos Municípios e à gestão municipal pelas Secretarias de Estado da Saúde e Conselho de Secretarias Municipais de Saúde (COSEMS); e (Origem: PRT MS/GM 1645/2015, Art. 8º, IV)
V - cooperação horizontal presencial e/ou virtual, que deverá ocorrer entre equipes de atenção básica e entre gestores, com o intuito de permitir a troca de experiências e práticas promotoras de melhoria da qualidade da atenção básica. (Origem: PRT MS/GM 1645/2015, Art. 8º, V)
Parágrafo Único. O Eixo Estratégico Transversal de Desenvolvimento deve ser entendido como transversal a todas as Fases, de maneira a assegurar que as ações de promoção da melhoria da qualidade possam ser desenvolvidas em todas as etapas do ciclo do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 8º, Parágrafo Único)
Art. 513. O Grupo de Trabalho de Atenção à Saúde da Comissão Intergestores Tripartite (CIT) acompanhará o desenvolvimento do PMAQ-AB, com avaliação e definição, inclusive, dos instrumentos utilizados no Programa. (Origem: PRT MS/GM 1645/2015, Art. 11)
Parágrafo Único. O Grupo de Trabalho de que trata o "caput" poderá convidar especialistas para discussão e manifestação acerca de elementos do PMAQ-AB. (Origem: PRT MS/GM 1645/2015, Art. 11, Parágrafo Único)
Art. 514. O Ministério da Saúde, por meio do Departamento de Atenção Básica da Secretaria de Atenção à Saúde (DAB/SAS/MS), publicará o Manual Instrutivo do PMAQ-AB, com a metodologia pactuada e outros detalhamentos do Programa. (Origem: PRT MS/GM 1645/2015, Art. 12)
Seção III-A
Do Serviço de Especialidades em Saúde Bucal - Sesb
(Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-A. Fica instituído o componente Serviço de Especialidades em Saúde Bucal - Sesb, no âmbito das ações estratégicas da Atenção Primária à Saúde - APS. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Parágrafo único. O Sesb é uma estratégia de ampliação da oferta de especialidades em saúde bucal, servindo de referência para as equipes de Saúde Bucal - eSB da APS. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-B. São objetivos do serviço de que trata esta Seção: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - oferecer à população os serviços de especialidades odontológicas tendo em vista o atendimento integral, segundo os princípios do Sistema Único de Saúde; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - ampliar e qualificar a oferta de serviços de especialidades odontológicas em municípios com até 20.000 habitantes; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
III - atender os parâmetros para Saúde Bucal relativos a ações especializadas da Portaria GM/MS nº 1.631 de 1º de outubro de 2015, alcançando o índice de 0,05 a 0,08 procedimentos utilizados para monitoramento dos Centros de Especialidades Odontológicas por habitante a cada ano. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-C. O Sesb deverá funcionar com os seguintes parâmetros mínimos: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - horário de funcionamento de 30 (trinta) horas semanais; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - nenhum profissional com carga horária individual menor que dez horas semanais; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
III - um auxiliar ou técnico de saúde bucal, com carga horária semanal mínima de 30 (trinta) horas; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
IV - duas especialidades odontológicas ofertadas; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
V - dispor de cadeira odontológica completa, canetas de baixa e alta rotação, compressor odontológico, aparelho fotopolimerizador, aparelho de raio-x odontológico, autoclave compatível com o tipo de serviço e instrumentais e materiais odontológicos permanentes suficientes para oferta adequada da atenção especializada em saúde bucal à população brasileira." (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-D. Os entes federativos interessados deverão solicitar o credenciamento do Sesb por meio de sistema de informação específico a ser disponibilizado no endereço eletrônico do Ministério da Saúde referente à APS, nos termos do Anexo 1 do Anexo XXII da Portaria de Consolidação GM/MS nº 2, de 28 de setembro de 2017. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 1º A solicitação de que trata o caput deverá estar acompanhada dos seguintes documentos: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - ofício ao Conselho Municipal de Saúde - CMS, à Secretaria Estadual de Saúde - SES e à Comissão Intergestores Bipartite - CIB para conhecimento da solicitação de credenciamento pleiteada ao Ministério da Saúde; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - termo de compromisso atestando que o serviço atende aos requisitos estabelecidos nesta Portaria, com prazo de 90 (noventa) dias, a contar do credenciamento do Sesb, para providenciar a atualização dos sistemas de informação relacionados e iniciar o funcionamento do serviço; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
III - ofício ao Ministério da Saúde, apresentado no serviço de protocolo digital respectivo, com solicitação de credenciamento do serviço, dando ciência de que essa solicitação foi comunicada ao Conselho Municipal de Saúde, à SES e à CIB. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 2º O gestor local deverá sinalizar em sistema de informação específico as especialidades odontológicas a serem ofertadas conforme necessidade epidemiológica do seu território. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 3º Após credenciado, o gestor local poderá alterar, no sistema, as especialidades odontológicas inicialmente apresentadas. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-E. A Secretaria de Atenção Primária à Saúde do Ministério da Saúde analisará as solicitações de habilitação, utilizando como critério de deferimento o atendimento aos seguintes requisitos pelos municípios: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - possuir até 20.000 (vinte mil) habitantes, conforme estimativa populacional calculada pelo Instituto Brasileiro de Geografia e Estatística - IBGE referente ao último ano disponível; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - possuir cobertura populacional estimada de saúde bucal na APS no município de, no mínimo, 75% (setenta e cinco por cento), conforme disposto na Política Nacional de Atenção Básica - PNAB vigente; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
III - não dispor de Centro de Especialidades Odontológicas - CEO credenciado no município. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 1º As solicitações de habilitação serão atendidas de acordo com a disponibilidade orçamentária e financeira do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 2º Após o deferimento das solicitações, o Ministério da Saúde publicará portaria de homologação da habilitação no Diário Oficial da União - DOU. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-F. Os entes federativos que tiverem o Sesb habilitado farão jus aos seguintes incentivos financeiros: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - incentivo financeiro de implantação; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - incentivo financeiro de custeio; e III - incentivo financeiro de pagamento por desempenho. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-G. O incentivo financeiro de implantação terá o valor de R$ 24.000,00 (vinte e quatro mil reais), a ser repassado em parcela única. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Parágrafo único. O incentivo financeiro de que trata o caput poderá ser utilizado em despesas de capital ou de custeio, sob definição do gestor local no ato da solicitação a ser indicado no sistema de informação específico. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-H. O incentivo financeiro de custeio terá o valor de R$ 7.200,00 (sete mil e duzentos reais), a ser repassado mensalmente. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-I. O incentivo financeiro de pagamento por desempenho terá o valor de R$ 1.800,00 (mil e oitocentos reais), a ser repassado mensalmente, para os municípios que alcançarem os indicadores estratégicos em avaliação quadrimestral. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 1º O conjunto de indicadores estratégicos do pagamento por desempenho será distribuído em: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - proporção de agendamentos realizados pelo Sesb em até 72 (setenta e duas) horas; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - satisfação da pessoa atendida pelo Sesb. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 2º Após pactuação tripartite, as metas referentes aos indicadores de que trata este artigo serão definidas em ato normativo específico da Secretaria de Atenção Primária à Saúde do Ministério da Saúde, com a especificação técnica dos indicadores definida em ficha de qualificação. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 3º Os indicadores do pagamento por desempenho previstos no § 1º e as regras de apuração poderão ser alterados após o monitoramento, avaliação e repactuação tripartite. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 4º A apuração dos indicadores será realizada quadrimestralmente (janeiro a abril; maio a agosto; e setembro a dezembro), e os resultados serão disponibilizados no quadrimestre subsequente. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 5º O pagamento mensal por desempenho de cada quadrimestre estará vinculado ao resultado obtido pelo município e pelo Distrito Federal no quadrimestre anterior. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 6º O monitoramento das regras estabelecidas neste artigo ocorrerá conforme disponibilização de painel para monitoramento e avaliação dos indicadores, em endereço eletrônico do Ministério da Saúde referente à APS. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 7º Enquanto houver indisponibilidade do painel de monitoramento de que trata o parágrafo anterior, será considerado como integralmente cumprido o(s) indicador(es) cuja aferição restar impossibilitada. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-J. Os entes federativos que tiverem o Sesb habilitado deverão: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - manter cadastro regular do serviço no Sistema de Cadastro Nacional de Estabelecimentos de Saúde - SCNES; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - fazer uso da estratégia e-SUS APS por meio do Prontuário Eletrônico do Cidadão - PEC para registro das informações dos atendimentos ou de sistema terceiro que contemple as funcionalidades da respectiva estratégia; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
III - enviar produção no Sistema de Informação da Atenção Básica - Sisab; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
IV - apresentar, preferencialmente, padronização de identificação visual a ser disponibilizada conforme modelo a ser publicado em endereço eletrônico do Ministério da Saúde referente à APS; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
V - manter os parâmetros do serviço, conforme o art. 514-C. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-K. O monitoramento dos serviços habilitados será realizado pela Secretaria de Atenção Primária à Saúde do Ministério da Saúde, por meio, dentre outras, das seguintes atividades: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - análise periódica de execução dos procedimentos relacionados ao serviço, por meio de dados constantes nos sistemas do Sistema Único de Saúde - SUS; (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - realização de visitas técnicas por meio de base amostral para fins de verificação da adequação da coleta e do registro dos dados que compõem os indicadores objeto do incentivo financeiro de pagamento por desempenho; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
III - análise de documentos e informações, que poderão ser solicitados aos gestores a qualquer tempo. Parágrafo único. Sem prejuízo do monitoramento e da avaliação realizados pela Secretaria de Atenção Primária à Saúde do Ministério da Saúde de que trata o caput, os entes estaduais, municipais e distrital realizarão, no âmbito de suas competências, o controle do cumprimento dos critérios, parâmetros e indicadores estabelecidos nesta Seção. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-L. O repasse do incentivo financeiro de custeio mensal de que trata o art. 514-H será suspenso na hipótese de descumprimento das regras estabelecidas nos arts. 514-C e 514-J. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 1º Para fins do disposto no caput, será considerado descumprimento dos registros no Sisab a ausência de informações por três competências consecutivas. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
§ 2º A suspensão dos incentivos financeiros se dará a partir da ocorrência do fato, permanecerá até a adequação das irregularidades identificadas e não acarretará transferência retroativa. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-M. Poderão gerar o descredenciamento do serviço: (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
I - a permanência do serviço, por mais de 12 (doze) competências consecutivas, com ocorrência de suspensão total dos incentivos financeiros federais de custeio; e (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
II - o descumprimento das obrigações previstas nos arts. 514-C e 514-J nos casos em que, motivadamente, as circunstâncias demandem o descredenciamento sem prévia suspensão. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-N. A Secretaria de Atenção Primária à Saúde do Ministério da Saúde fará a avaliação dos resultados alcançados relacionados aos indicadores constantes nesta Seção, a serem disponibilizados em endereço eletrônico do Ministério da Saúde referente à APS. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-O. A Secretaria de Atenção Especializada à Saúde do Ministério da Saúde expedirá ato específico e realizará as adequações necessárias nos sistemas de informação do SUS pertinentes para fins de viabilizar a identificação no Cadastro Nacional de Estabelecimentos de Saúde - CNES dos estabelecimentos de saúde habilitados na modalidade de Sesb. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Art. 514-P. Os recursos orçamentários para execução dos repasses de que trata esta Seção correrão por conta do orçamento do Ministério da Saúde, perfazendo o valor total de R$ 88.140.000,00 (oitenta e oito milhões, cento e quarenta mil reais) para o ano de 2023, devendo onerar as Funcionais Programáticas: 10.301.5019.219A - Piso de Atenção Primária à Saúde, no seguinte plano orçamentário PO - 000A - Incentivo para Ações Estratégicas e 10.301.5019.8581 - Estruturação da Rede de serviços de Atenção Básica de Saúde -PO-0001 Estruturação da Atenção à Saúde Bucal. (Redação dada pela PRT GM/MS n° 751 de 20.06.2023)
Seção III
Do Grupo de Trabalho para Mapeamento, Avaliação e Monitoramento dos Dados Judiciários e Propositura de Atuações Estratégicas em Face da Judicialização no Âmbito do Projeto Mais Médicos para o Brasil
Art. 515. Fica instituído Grupo de Trabalho para mapeamento, avaliação e monitoramento dos dados judiciários e propositura de atuações estratégicas em face da judicialização no âmbito do Projeto Mais Médicos para o Brasil, com os seguintes objetivos: (Origem: PRT MS/GM 1560/2017, Art. 1º)
I - diagnóstico para reforço das estratégias judiciais que viabilizem a reversão das decisões favoráveis aos médicos cooperados, e mitigação dos efeitos da judicialização inclusive no âmbito das instâncias especiais do Poder Judiciário no Brasil; (Origem: PRT MS/GM 1560/2017, Art. 1º, I)
II - buscar diálogo e interação com o sistema judiciário brasileiro para apresentação dos impactos negativos das citadas demandas aos propósitos do Projeto Mais Médicos para o Brasil, notadamente a desassistência aos usuários do serviço de Atenção Básica em regiões de extrema vulnerabilidade no Brasil; (Origem: PRT MS/GM 1560/2017, Art. 1º, II)
III - interação com os órgãos de assessoramento jurídico da União e com o Ministério das Relações Exteriores para tratamento conjuntural das demandas; (Origem: PRT MS/GM 1560/2017, Art. 1º, III)
IV - monitoramento e avaliação dos pleitos e do tratamento judiciário das demandas, inclusive para atuação preventiva; (Origem: PRT MS/GM 1560/2017, Art. 1º, IV)
V - apresentar propostas de interlocuções com a Organização Panamericana de Saúde (OPAS), para estratégias de cumprimento das decisões judiciais até que sejam revertidas; e (Origem: PRT MS/GM 1560/2017, Art. 1º, V)
VI - outras medidas que entendam cabíveis. (Origem: PRT MS/GM 1560/2017, Art. 1º, VI)
Art. 516. O Grupo de Trabalho será composto por 6 (seis) membros representantes do Ministério da Saúde, contemplando as seguintes representações, com respectivas suplências em igual quantitativo: (Origem: PRT MS/GM 1560/2017, Art. 2º)
I - Gabinete da Secretaria de Gestão do Trabalho e da Educação na Saúde (GAB/SGTES/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, I)
II - Departamento de Planejamento e Regulação da Provisão de Profissionais de Saúde da Secretaria de Gestão do Trabalho e da Educação na Saúde (DEPREPS/SGTES/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, II)
III - Coordenação-Geral de Planejamento e Orçamento da Secretaria de Gestão do Trabalho e da Educação na Saúde (CGPLAN/SGTES/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, III)
IV - Secretaria-Executiva do Ministério da Saúde (SE/MS); (Origem: PRT MS/GM 1560/2017, Art. 2º, IV)
V - Consultoria Jurídica do Ministério da Saúde (CONJUR/MS); e (Origem: PRT MS/GM 1560/2017, Art. 2º, V)
VI - Assessoria para Assuntos Internacionais em Saúde, do Gabinete do Ministro (AISA/GM/MS). (Origem: PRT MS/GM 1560/2017, Art. 2º, VI)
§ 1º A coordenação dos trabalhos será exercida pela Secretaria-Executiva do Ministério da Saúde, cabendo ao seu representante a função de secretariar as atividades e manter registro de todas as convocações, pautas e atas. (Origem: PRT MS/GM 1560/2017, Art. 2º, § 1º)
§ 2º Serão convidados a integrar o grupo de trabalho, como membros colaborativos: (Origem: PRT MS/GM 1560/2017, Art. 2º, § 2º)
I - o Ministério das Relações Exteriores; e (Origem: PRT MS/GM 1560/2017, Art. 2º, § 2º, I)
II - a Advocacia-Geral da União, nas representações da Secretaria-Geral de Contencioso e da Procuradoria-Geral da União. (Origem: PRT MS/GM 1560/2017, Art. 2º, § 2º, II)
Art. 517. As atividades desempenhadas no Grupo de Trabalho não serão remuneradas na medida em que são afins às funções ordinárias dos membros, reconhecida a relevância dessa atuação para a Administração Pública Federal. (Origem: PRT MS/GM 1560/2017, Art. 3º)
Art. 518. Pela imprevisibilidade de esgotamento do objeto, o Grupo de Trabalho exercerá suas atividades por prazo indeterminado. (Origem: PRT MS/GM 1560/2017, Art. 4º)
Art. 519. O Grupo de Trabalho poderá expedir relatórios, recomendações, manuais, cartilhas e quaisquer outros produtos, assim como pleitear reuniões para discussão dos temas e encaminhamentos que entenda como essenciais e colaborativos ao cumprimento dos seus objetivos, reportando-se à Secretaria-Executiva. (Origem: PRT MS/GM 1560/2017, Art. 5º)
Seção IV
DO PROGRAMA SAÚDE NA HORA
(Incluído pela PRT GM/MS nº 397 de 16.03.2020)
Art. 519-A Fica instituído o Programa Saúde na Hora no âmbito da Política Nacional de Atenção Básica, com objetivo de implementar o horário estendido de funcionamento das Unidades de Saúde da Família (USF) e Unidades Básicas de Saúde (UBS), no Sistema Único de Saúde (SUS). (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 1º Os municípios e Distrito Federal poderão aderir ao Programa, nos termos desta Seção. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 2º Os municípios e o Distrito Federal que aderirem ao Programa farão jus ao recebimento de incentivos financeiros de custeio nos termos da Seção XII do Capítulo II do Título II da Portaria de Consolidação nº 6/GM/MS, de 28 de setembro de 2017. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-B São objetivos do Programa Saúde na Hora: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - ampliar o horário de funcionamento das USF e UBS, possibilitando maior acesso dos usuários aos serviços; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - ampliar a cobertura da Estratégia Saúde da Família; e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - ampliar o acesso às ações e serviços considerados essenciais na Atenção Primária à Saúde (APS); (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
IV - ampliar o número de usuários nas ações e nos serviços promovidos nas USF e UBS; e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
V - reduzir o volume de atendimentos de usuários com condições de saúde de baixo risco em unidades de pronto atendimento e emergências hospitalares. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-C Os estabelecimentos participantes do Saúde na Hora poderão ter as seguintes equipes cadastradas no SCNES: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - equipes de Saúde da Família (eSF); (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - equipes de Atenção Primária (eAP); e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - equipes de Saúde Bucal (eSB). (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-D As USF ou UBS participantes do Programa Saúde na Hora deverão possuir: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - quanto ao horário de funcionamento: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
a) USF 60h: com funcionamento mínimo de 60 (sessenta) horas semanais, sendo: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
1. 12 (doze) horas diárias ininterruptas, de segunda-feira a sexta-feira, durante os 5 (cinco) dias úteis na semana; ou (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
2. 11 (onze) horas diárias ininterruptas, de segunda a sexta-feira, durante os 5 (cinco) dias úteis da semana, e 5 (cinco) horas aos sábados ou domingos; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
b) USF 60h com saúde bucal: com funcionamento mínimo de 60 (sessenta) horas semanais, sendo: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
1. 12 (doze) horas diárias ininterruptas, de segunda-feira a sexta-feira, durante os 5 (cinco) dias úteis na semana; ou (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
2. 11 (onze) horas diárias ininterruptas, de segunda a sexta-feira, durante os 5 (cinco) dias úteis da semana, e 5 (cinco) horas aos sábados ou domingos; e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
c) USF 75h com saúde bucal: com funcionamento mínimo de 75 (setenta e cinco) horas semanais, sendo: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
1. 15 (quinze) horas diárias ininterruptas de segunda-feira a sexta-feira, durante 5 (cinco) dias úteis na semana; ou (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
2. 14 (quatorze) horas diárias ininterruptas, de segunda a sexta-feira, durante os 5 (cinco) dias úteis da semana, e 5 (cinco) horas aos sábados ou domingos; ou (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
d) USF ou UBS 60h simplificado: com funcionamento mínimo de 60 (sessenta) horas semanais, sendo: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
1. 12 (doze) horas diárias ininterruptas, de segunda-feira a sexta-feira, durante os 5 (cinco) dias úteis na semana; ou (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
2. 11 (onze) horas diárias ininterruptas, de segunda a sexta-feira, durante os 5 (cinco) dias úteis da semana, e 5 (cinco) horas aos sábados ou domingos. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - quanto ao quantitativo mínimo de equipes de saúde: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
a) USF 60h: 3 (três) equipes de Saúde da Família; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
b) USF 60h com saúde bucal: 3 (três) equipes de Saúde da Família e 2 (duas) equipes de Saúde Bucal; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
c) USF 75h com saúde bucal: 6 (seis) equipes de Saúde da Família e 3 (três) equipes de Saúde Bucal; ou (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
d) USF ou UBS 60h simplificado: mínimo de 60 (sessenta) horas somada a carga horária de todas as equipes de saúde da unidade, podendo ser uma combinação de eSF (40 h) e eAP (20h ou 30h). (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-E As USF e UBS participantes do Programa Saúde na Hora deverão ofertar os mesmos serviços de saúde em todos os turnos de funcionamento. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-F Para cada formato de funcionamento das USF ou UBS de que trata o inciso I do art. 519-D, poderão ser acrescentadas eSF ou eAP além do quantitativo previsto no inciso II do art. 519-D. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-G Para a realização do horário de funcionamento previsto no inciso I do art. 519-D, deverão ser somadas as cargas horárias semanais de cada categoria profissional que integra as eSF ou eAP e eSB, considerando o quantitativo mínimo de equipes estabelecido no inciso II do art. 519-D. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 1º Os médicos, enfermeiros e cirurgiões-dentistas que integram as eSF ou eAP e as eSB deverão cumprir carga horária individual mínima de 20 (vinte) horas semanais. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 2º O somatório das cargas horárias individuais mínimas de que trata o § 1º deste artigo deverá corresponder a uma carga horária por categoria profissional de, pelo menos, 40 (quarenta) horas semanais por eSF e eSB, exceto para as eAP e eSB modalidade I com profissionais de 20 horas ou 30 horas semanais. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 3º Os médicos, enfermeiros e cirurgiões-dentistas das equipes de que trata esta Portaria poderão participar de mais de uma eSF, eAP ou eSB. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 4º O disposto neste artigo não se aplica aos demais profissionais de saúde da eSF e eSB, para os quais há obrigatoriedade de carga horária de 40 (quarenta) horas semanais e vínculo a apenas 1 (uma) eSF ou 1 (uma) eSB no SCNES vigente, consoante ao disposto na Política Nacional de Atenção Básica - PNAB, exceto para as eAP e eSB modalidade I com profissionais de 20 horas ou 30 horas semanais. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-H A adesão ao Programa Saúde na Hora se dará mediante Termo de Compromisso firmado entre o Ministério da Saúde e o Distrito Federal ou município, observado o seguinte fluxo: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - o gestor distrital ou municipal de saúde deverá solicitar a adesão da USF ou UBS ao Programa, com anuência ao Termo de Compromisso e indicação das equipes selecionadas na forma do art. 519-D desta Portaria, por meio de sistema eletrônico disponibilizado pelo Ministério da Saúde; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - a solicitação será submetida à análise do Ministério da Saúde, que avaliará se está de acordo com os critérios previstos nesta Portaria e se existe prévia disponibilidade orçamentária e financeira; e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - caso deferida a solicitação, será publicada Portaria de homologação da adesão no Diário Oficial da União. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Parágrafo único. No momento da solicitação de adesão de que trata o inciso I do caput deste artigo, o Distrito Federal ou município deverá possuir: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - USF ou UBS cadastrada no SCNES para o trabalho das equipes de Saúde; e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - o quantitativo de equipes de Saúde exigido para o formato de funcionamento almejado, conforme o disposto no art. 519-D, cadastrado no SCNES. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-I O Distrito Federal ou município aderente ao Programa Saúde na Hora deverá: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - possuir USF ou UBS cadastrada no SCNES para o trabalho das equipes de Saúde; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - cumprir os requisitos de horário de funcionamento, quantidade de equipes de Saúde e carga horária previstos no art. 519-D; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
III - possuir Gerente de Atenção Primária, com nível superior, que não seja integrante das equipes vinculadas à USF em que exerce a função de Gerente, cumprindo carga horária semanal mínima de 30 (trinta) horas e executando as atribuições estabelecidas na PNAB; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
IV - utilizar Prontuário Eletrônico que atenda ao modelo de informação definido pelo Ministério da Saúde, preferencialmente o e-SUS-APS/PEC; e (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
V - identificar a USF e UBS com a identidade visual do Programa Saúde na Hora, disponibilizada pelo Ministério da Saúde. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 1º Para o formato de funcionamento previsto na alínea "d" do inciso I do art. 519- D, o Distrito Federal ou município deverá: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - atender os requisitos previstos nos incisos I, II e V do caput; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - utilizar Prontuário Eletrônico de que dispõe o inciso IV do caput, ou implantar o Prontuário em até 12 (doze) competências consecutivas do SCNES a contar da data de publicação da portaria de homologação da adesão ao Programa. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 2º A partir da data de publicação da portaria de homologação da adesão, a gestão municipal terá o prazo de até 6 (seis) competências consecutivas do SCNES para atender a todos os requisitos previstos no caput, sob pena de cancelamento de sua adesão, com exceção do disposto no inciso II do §1º deste artigo. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Art. 519-J As USF e UBS participantes do Programa Saúde na Hora serão avaliadas e monitoradas por meio dos seguintes indicadores obtidos a partir de informações extraídas dos sistemas de informação em saúde vigentes: (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
I - indicadores essenciais: vinculados ao processo de avaliação de desempenho das eSF, eAP ou eSB participantes do Programa; (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
II - indicadores de monitoramento: acompanhados de forma regular para complementação de informações sobre a oferta de ações e serviços e sobre os resultados alcançados pelas eSF, eAP ou eSB participantes do Programa. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 1º A avaliação e o monitoramento das USF e UBS e das equipes participantes do Programa visa à melhoria do acesso, da abrangência, da oferta de serviços, da produtividade e da resolutividade da Atenção Primária à Saúde. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 2º Constará no manual instrutivo do Programa, disponibilizado pelo Ministério da Saúde em plataforma online, a ficha de qualificação dos indicadores essenciais e de monitoramento do Programa. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
§ 3º O Distrito Federal ou município que aderir ao Programa deverá cumprir os indicadores essenciais de que trata o inciso I do caput, sob pena de suspensão da transferência dos incentivos financeiros de custeio previstos no art. 172-J da Seção XII do Capítulo II do Título II da Portaria de Consolidação nº 6/GM/MS, de 28 de setembro de 2017. (Incluído pela PRT GM/MS nº 397 de 16.03.2020) (Revogado pela PRT GM/MS n° 3.493 de 10.04.2024)
Seção V
DO PROGRAMA DE REVITALIZAÇÃO DE UNIDADES BÁSICAS DE SAÚDE POR MEIO DO TRABALHO DE PESSOAS PRIVADAS DE LIBERDADE
(Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-K. Fica instituído o Programa de revitalização de Unidades Básicas de Saúde por meio do trabalho de pessoas privadas de liberdade. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Parágrafo único. O Programa de revitalização será executado pelos entes federativos, conforme legislação e normativas vigentes a respeito do trabalho de privados de liberdade, e contará com repasse de recursos financeiros da União para os municípios e Distrito Federal, observados os requisitos estabelecidos nesta Seção. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-L. São objetivos do Programa de que trata esta Seção: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - promover, de forma eficiente, a melhoria estrutural e a revitalização dos espaços físicos das Unidades Básicas de Saúde; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - promover o acesso ao trabalho de pessoas privadas de liberdade, entendendo-o como um determinante social das condições de saúde e de reintegração social; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
III - fortalecer a articulação intersetorial no âmbito do Sistema Único de Saúde, em especial entre as áreas da saúde e da administração penitenciária. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-M. Para fins desta Seção, considera-se: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - revitalização: atividade de manutenção realizada para conservar ou recuperar a capacidade funcional da edificação e de suas partes constituintes de atender as necessidades e segurança dos seus usuários, visando melhorar suas condições de habitabilidade, incluindo: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
a) serviços realizados para prevenir ou corrigir a perda de desempenho decorrente da deterioração dos seus componentes, ou de atualizações nas necessidades dos seus usuários; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
b) atividades de pintura, reparos em reboco, assentamento de revestimentos cerâmicos, recuperação de áreas degradadas, consertos, marcenaria, serralheria, serviços elétricos e hidráulicos, tratamentos contra infiltração e umidade, entre outras atividades; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - pessoas privadas de liberdade aptas ao trabalho: aquelas em cumprimento de pena no regime semiaberto e aberto, com idade superior a 18 (dezoito) anos, observada a legislação aplicável. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Parágrafo único. Para fins do inciso I do caput, excluem-se as atividades de ampliação, construção, alteração do uso da edificação ou aquisição de material permanente. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Subseção I
Da Execução do Programa
(Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-N. O Programa será executado pela União, por intermédio do Ministério da Saúde, e pelos Municípios e Distrito Federal. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Parágrafo único. Os entes federativos poderão aderir ao Programa a qualquer momento, mediante a solicitação a ser formalizada pelos gestores locais do SUS, na forma prevista em modelos a serem disponibilizados pelo Ministério da Saúde." (NR)
Art. 519-O. Caberá ao Ministério da Saúde, por meio da Secretaria de Atenção Primária à Saúde - SAPS/MS, realizar, entre outras, as seguintes atividades no âmbito do Programa: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - coordenar, acompanhar e monitorar a execução nacional do Programa; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - estabelecer os procedimentos de adesão dos entes federativos; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
III - repassar incentivo financeiro para os entes federativos aderentes; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
IV - definir os indicadores de desempenho e as metas do Programa, visando ao aperfeiçoamento da Atenção Primária à Saúde; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
V - acompanhar e monitorar os resultados obtidos no Programa. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-P. Os entes federativos aderentes deverão cumprir as regras previstas nesta Seção e nas cláusulas constantes no Termo de Adesão, especialmente as seguintes obrigações: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - coordenar, acompanhar e monitorar a execução local do projeto de revitalização; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - disponibilizar e manter infraestrutura e materiais necessários para a implementação do projeto, como equipamentos de proteção individual, insumos para atividades de revitalização, aluguel de veículos, entre outros; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
III - garantir a adequada prestação dos serviços profissionais necessários à execução do projeto, como aqueles desenvolvidos por arquitetos e engenheiros, entre outros; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
IV - observar as regras aplicáveis aos pagamentos relativos à força de trabalho prisional, como o salário-mínimo, alimentação e vale-transporte, nos termos da Lei nº 7.210, de 11 de julho 1984 (Lei de Execução Penal); (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
V - assegurar a adequada articulação com as Secretarias Estadual ou do Distrito Federal responsável pela administração penitenciária, para o desenvolvimento adequado do projeto de revitalização; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
VI - apresentar informações sobre o andamento do projeto, sempre que solicitado, e apresentar, no prazo definido, relatório final da execução do projeto. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-Q. Os entes federativos interessados deverão solicitar a adesão, por meio de ofício, à Coordenação de Saúde no Sistema Prisional do Ministério da Saúde (COPRIS/CGGAP/DESF/SAPS/MS), acompanhado das seguintes informações e documentos: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - Termo de compromisso do Programa, assinado pelo gestor local de saúde do município ou do Distrito Federal; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - Projeto de revitalização por Unidade Básica de Saúde, acompanhado de orçamento detalhado, a ser executado, no máximo, em 12 (doze) meses, que conterá: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
a) a identificação da Unidade Básica de Saúde a ser contemplada; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
b) as necessidades de revitalização da Unidade Básica de Saúde; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
c) a indicação dos estabelecimentos prisionais em que as pessoas privadas de liberdade aptas ao trabalho estejam cumprindo pena, preferencialmente no território do município ou do Distrito Federal; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
III - Termo de Cooperação, subscrito pelo gestor local de saúde do município ou do Distrito Federal e pela Secretaria Estadual ou do Distrito Federal de Administração Penitenciária ou órgão congênere, que conterá a previsão de que: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
a) o estabelecimento prisional indicado conta com pessoas privadas de liberdade aptas ao trabalho do projeto de revitalização; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
b) há viabilidade de utilização da referida força de trabalho no cronograma indicado. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 1º Serão disponibilizados pelo Ministério da Saúde, no endereço eletrônico "https://aps.saude.gov.br", modelos dos documentos de que trata este artigo, que poderão ser adaptados de acordo com as necessidades locais. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 2º É vedada a inclusão no projeto de revitalização de Unidades Básicas de Saúde já contempladas em outros programas e estratégias destinados à execução de obras de construção, ampliação e reforma, mediante repasse de recursos financeiros, no âmbito da Atenção Primária à Saúde, cujas obras estejam em execução ou tenham sido finalizadas em período inferior a 3 (três) anos da data de solicitação de adesão ao Programa de que trata esta Seção. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 3º Caso o município não possua estabelecimento prisional em seu território, poderá indicar estabelecimentos em municípios próximos. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-R. O Ministério da Saúde analisará as solicitações de adesão ao Programa considerando a adequação às regras desta Seção e de acordo com os seguintes critérios: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - as necessidades de revitalização de cada Unidade Básica de Saúde e a abrangência das atividades previstas no projeto; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - o Índice de Desenvolvimento Humano Municipal - IDHM; e (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
III - a disponibilidade financeiro-orçamentária. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Parágrafo único. Após o deferimento das solicitações, o Ministério da Saúde publicará Portaria de homologação da adesão e de financiamento no Diário Oficial de União (DOU). (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-S. Os entes federativos aderentes terão o prazo de 12 (doze) meses para a execução do projeto de revitalização, a contar da data do repasse do incentivo financeiro pelo Ministério da Saúde. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Subseção II
Do Incentivo Financeiro
(Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-T. Os entes federativos aderentes ao Programa farão jus ao incentivo financeiro de custeio, no valor de R$ 30.000,00 (trinta mil reais) por unidade básica de saúde a ser revitalizada.
§ 1º O incentivo financeiro de que trata o caput será transferido na modalidade fundo a fundo, em parcela única, pelo Fundo Nacional de Saúde aos respectivos fundos municipais de saúde ou fundo de saúde do Distrito Federal, por meio do Bloco de Manutenção das Ações e Serviços Públicos de Saúde, conforme art. 3º do Título I da Portaria de Consolidação GM/MS nº 6, de 28 de setembro de 2017. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 2º O repasse do incentivo financeiro está condicionado à publicação da portaria de homologação da adesão ao Programa, nos termos do parágrafo único do art. 519-R. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 3º O incentivo financeiro de que trata o caput deverá ser utilizado na finalidade do Programa, em despesas de custeio relacionadas às atividades de que trata o inciso I do art. 519-M. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 4º O incentivo financeiro de que trata o caput não deverá ser utilizado em despesas que não se enquadrem no Bloco de Manutenção das Ações e Serviços Públicos de Saúde, como construção ou ampliação de edificações e aquisição de material permanente, entre outras. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-U. O ente federativo aderente que se desligar do Programa ou não cumprir as regras do Programa, estará sujeito à devolução integral dos valores repassados, observado o regular processo administrativo, nos termos da Portaria GM/MS nº 885, de 4 de maio de 2021. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Parágrafo único. O descumprimento das regras do Programa, para fins de desligamento do ente federativo, será avaliado pela SAPS/MS, considerando a proporcionalidade e razoabilidade. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Subseção III
Do Monitoramento
(Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-V. O monitoramento do Programa será realizado pela SAPS/MS, por meio, entre outras, das seguintes atividades: (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
I - análise de relatórios de execução do projeto, com informações físicas e financeiras, que poderão ser solicitados aos entes a qualquer momento; (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
II - análise do relatório final a ser apresentado pelos entes aderentes. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 1º O Ministério da Saúde disponibilizará o modelo de relatório final a ser apresentado pelos entes aderentes, a fim de avaliar a execução do projeto de revitalização. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
§ 2º A verificação de parâmetros de que tratam as normas de execução do Programa de revitalização não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros recebidos por meio do Relatório Anual de Gestão (RAG). (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Subseção IV
Disposições Finais
(Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-W. Os recursos orçamentários para execução das ações da União de que trata esta Seção serão oriundos do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.301.5019.219A - Piso de Atenção Primária à Saúde - PO 000A - Incentivo para Ações Estratégicas. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
Art. 519-X. A Secretaria de Atenção Primária à Saúde - SAPS/MS resolverá eventuais casos omissos e poderá dispor sobre normas complementares para a execução do Programa. (Redação dada pela PRT GM/MS nº 1.698 de 23.07.2021)
CAPÍTULO II
DA ATENÇÃO HOSPITALAR
Art. 520. As ações de Vigilância Epidemiológica Hospitalar (VEH) terão por objetivo detectar, de modo oportuno, as doenças transmissíveis e os agravos de importância nacional ou internacional, bem como a alteração do padrão epidemiológico em regiões estratégicas do país, desenvolvida em estabelecimentos de saúde hospitalares, que atuarão como unidades sentinelas para a Rede de Vigilância Epidemiológica Hospitalar de Interesse Nacional (REVEH). (Origem: PRT MS/GM 183/2014, Art. 5º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 1º A atuação da VEH tomará por base protocolos e procedimentos padronizados, que permitam a identificação oportuna, a notificação imediata, a investigação inicial ou complementar e o registro ou a atualização de informações no SINAN e em outros sistemas oficiais, quando disponíveis. (Origem: PRT MS/GM 183/2014, Art. 5º, § 1º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 2º A VEH será realizada de modo articulado com o Núcleo de Segurança do Paciente (NSP), instituído pela Portaria nº 529/GM/MS, de 1º de abril de 2013, e demais estruturas ou setores integrantes do sistema hospitalar que visem contribuir para a qualificação do cuidado em saúde ou vigilância das doenças e agravos. (Origem: PRT MS/GM 183/2014, Art. 5º, § 2º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 3º Os valores destinados aos hospitais federais integrantes do sistema VEH não serão incorporados ao incentivo financeiro de custeio para implantação e manutenção de ações e serviços públicos estratégicos de vigilância em saúde, sendo financiados de forma direta pelo Ministério da Saúde, conforme procedimento que será regulamentado em ato específico do Ministro de Estado da Saúde. (Origem: PRT MS/GM 183/2014, Art. 5º, § 3º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 521. Para desenvolver as ações de VEH, os entes federativos devem possuir hospitais que tenham sido habilitados como estratégicos para a composição da REVEH. (Origem: PRT MS/GM 183/2014, Art. 6º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Parágrafo Único. Para compor a REVEH, o estabelecimento de saúde deverá ser credenciado para a instalação, registro e atualização das informações no SINAN junto à Secretaria de Saúde do Distrito Federal ou do Município, devendo-se atender ao SUS na proporção de 1 (um) hospital com 50 (cinquenta) ou mais leitos para cada 1.000.000 (um milhão) de habitantes, ou, no mínimo, 1 (um) hospital por Estado, independentemente do número de habitantes, e que seja: (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - hospital geral de referência nacional, regional, estadual, distrital ou municipal; (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - hospital especializado em doenças transmissíveis de referência nacional, regional, estadual, distrital ou municipal; (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
III - hospital participante de estratégia de vigilância sentinela de doenças e agravos de interesse da SVS/MS; ou (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, III) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
IV - hospital participante de estratégias gerenciadas por outras Secretarias do Ministério da Saúde ou pela Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 183/2014, Art. 6º, Parágrafo Único, IV) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 522. Para a execução de ações de VEH, o estabelecimento de saúde deverá atender aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 7º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - designar profissional de saúde de nível superior, preferencialmente com experiência em vigilância epidemiológica, como responsável pelas atividades de vigilância epidemiológica hospitalar; (Origem: PRT MS/GM 183/2014, Art. 7º, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - promover, em até 24 (vinte e quatro) horas, a notificação compulsória imediata de todos os casos e óbitos por doenças ou agravos identificados, segundo legislação vigente; (Origem: PRT MS/GM 183/2014, Art. 7º, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
III - realizar investigação complementar dos casos e óbitos hospitalizados já notificados por outros estabelecimentos de saúde, registrando-se a informação no instrumento ou sistema de informação correspondente, quando disponível; e (Origem: PRT MS/GM 183/2014, Art. 7º, III) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
IV - elaborar relatório trimestral com o perfil de morbidade e mortalidade hospitalar das doenças de notificação compulsória, a ser encaminhado à Secretaria Municipal de Saúde em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 7º, IV) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 523. Para a execução de ações de VEH, as Secretarias de Saúde dos Estados deverão atender aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 8º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - designar profissional ou setor de referência para implementar e gerir a estratégia de vigilância epidemiológica hospitalar em seu âmbito de gestão; (Origem: PRT MS/GM 183/2014, Art. 8º, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - consolidar os relatórios encaminhados pelas Secretarias Municipais de Saúde participantes da REVEH de sua área de abrangência, independente da gestão hospitalar, federal, estadual ou municipal, para conhecimento e análise do perfil de morbidade e mortalidade hospitalar, das doenças de notificação compulsória do seu território; e (Origem: PRT MS/GM 183/2014, Art. 8º, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
III - encaminhar relatório semestral consolidado à SVS/MS, em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 8º, III) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 524. Para a execução de ações de VEH, as Secretarias de Saúde dos Municípios deverão atender aos seguintes requisitos: (Origem: PRT MS/GM 183/2014, Art. 9º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - designar profissional ou setor de referência para implementar e gerir a estratégia de vigilância epidemiológica hospitalar em seu âmbito de gestão; (Origem: PRT MS/GM 183/2014, Art. 9º, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - consolidar os relatórios encaminhados pelos estabelecimentos de saúde participantes da REVEH de sua área de abrangência, independentemente da gestão hospitalar federal, estadual ou municipal, para conhecimento e análise do perfil de morbidade e mortalidade hospitalar das doenças de notificação compulsória de seu território; e (Origem: PRT MS/GM 183/2014, Art. 9º, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
III - encaminhar relatório trimestral consolidado à Secretaria de Saúde Estadual, em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 9º, III) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 525. Compete à Secretaria de Saúde do Distrito Federal as mesmas atribuições das Secretarias de Saúde Municipais descritas no art. 524, ressalvando-se o disposto no art. 524, III. (Origem: PRT MS/GM 183/2014, Art. 10) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Parágrafo Único. A Secretaria de Saúde do Distrito Federal deverá encaminhar semestralmente relatório consolidado à SVS/MS em instrumento padronizado, por meio eletrônico ou impresso. (Origem: PRT MS/GM 183/2014, Art. 10, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 526. O ente federativo será desabilitado das ações de VEH, total ou parcialmente, tendo em vista o número de seus estabelecimentos de saúde habilitados como estratégicos para a composição da REVEH, cadastrados no SCNES, quando: (Origem: PRT MS/GM 183/2014, Art. 12) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
I - o tempo entre a notificação e a digitação dos registros de notificação compulsória imediata seja superior a 7 (sete) dias em mais de 50% (cinquenta por cento) dos casos ou óbitos identificados pelo componente da REVEH, por três meses consecutivos; ou (Origem: PRT MS/GM 183/2014, Art. 12, I) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
II - deixar de promover a notificação negativa registrada no SINAN por mais de 4 (quatro) semanas epidemiológicas consecutivas, quando da ausência de notificação compulsória. (Origem: PRT MS/GM 183/2014, Art. 12, II) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 1º A desabilitação será total quando todos os estabelecimentos de saúde do ente federativo, habilitados como estratégicos para a composição da REVEH e cadastrados no SCNES, enquadrarem-se no disposto no inciso I ou II do "caput". (Origem: PRT MS/GM 183/2014, Art. 12, § 1º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 2º A desabilitação será parcial quando o enquadramento no disposto no inciso I ou II do "caput" não abranger todos os estabelecimentos de saúde do ente federativo habilitados como estratégicos para a composição da REVEH. (Origem: PRT MS/GM 183/2014, Art. 12, § 2º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
§ 3º A desabilitação parcial será realizada de forma proporcional ao número total de estabelecimentos de saúde do ente federativo habilitados como estratégicos para a composição da REVEH, cadastrados no SCNES e aqueles, dentre estes, que se enquadrarem no disposto no inciso I ou II do "caput". (Origem: PRT MS/GM 183/2014, Art. 12, § 3º) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 527. A avaliação das ações de VEH será efetuada semestralmente pela SVS/MS por meio do SINAN, a partir do ano seguinte ao da habilitação. (Origem: PRT MS/GM 183/2014, Art. 13) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Seção I
Do Programa Nacional de Incentivo à Parceria entre os Hospitais Filantrópicos Sem Fins Lucrativos
Art. 528. Fica instituído o Programa Nacional de Incentivo à Parceria entre os Hospitais Filantrópicos sem fins lucrativos e o Sistema Único de Saúde. (Origem: PRT MS/GM 878/2002, Art. 1º)
Art. 529. Ficam estabelecidos os seguintes requisitos mínimos para habilitação de hospitais filantrópicos e sem fins lucrativos à adesão ao Programa Nacional de Incentivo à Parceria entre os Hospitais Filantrópicos sem fins lucrativos com o Sistema Único de Saúde: (Origem: PRT MS/GM 878/2002, Art. 2º)
I - possuir registro nos órgãos competentes federais, estaduais ou municipais incumbidos do cadastro de instituições de assistência social beneficente, educacional ou de saúde; (Origem: PRT MS/GM 878/2002, Art. 2º, a)
II - possuir Certificado de Filantropia emitido pelo Conselho Nacional de Assistência Social (CNAS); (Origem: PRT MS/GM 878/2002, Art. 2º, b)
III - ter sido submetido à avaliação do Programa Nacional de Avaliação dos Serviços Hospitalares (PNASH) e obtido, no mínimo, 60% de aproveitamento; (Origem: PRT MS/GM 878/2002, Art. 2º, c)
IV - informar, por meio da Comunicação de Internação Hospitalar e Ambulatorial (CIHA), na sua totalidade, as internações de pacientes não usuários do SUS; (Origem: PRT MS/GM 878/2002, Art. 2º, d)
V - apresentar percentual de devolução das cartas enviadas pelo Ministério da Saúde (por erro no preenchimento na identificação do paciente), de no máximo 10%, a partir da competência março 2002; (Origem: PRT MS/GM 878/2002, Art. 2º, e)
VI - não ter denúncias comprovadas de cobranças indevidas ou de mau atendimento a usuários do SUS. (Origem: PRT MS/GM 878/2002, Art. 2º, f)
Art. 530. Os hospitais habilitados ao INTEGRASUS que, a qualquer tempo, deixarem de cumprir com quaisquer dos requisitos listados no art. 529 sofrerão penalidades de advertência ou de desabilitação mediante avaliação da Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 878/2002, Art. 3º)
CAPÍTULO III
DO ATENDIMENTO E INTERNAÇÃO DOMICILIAR
Seção I
Das Disposições Gerais
(Origem: PRT MS/GM 825/2016, CAPÍTULO I)
Art. 531. Este Capítulo define a Atenção Domiciliar (AD) no âmbito do SUS e atualiza as equipes habilitadas. (Origem: PRT MS/GM 825/2016, Art. 1º)
Art. 531. Este Capítulo define a Atenção Domiciliar (AD), o Serviço de Atenção Domiciliar (SAD), o Programa Melhor em Casa (PMeC) e o cuidador no âmbito do SUS. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 532. Para efeitos deste Capítulo considera-se: (Origem: PRT MS/GM 825/2016, Art. 2º)
I - Atenção Domiciliar (AD): modalidade de atenção à saúde integrada às Rede de Atenção à Saúde (RAS), caracterizada por um conjunto de ações de prevenção e tratamento de doenças, reabilitação, paliação e promoção à saúde, prestadas em domicílio, garantindo continuidade de cuidados; (Origem: PRT MS/GM 825/2016, Art. 2º, I)
II - Serviço de Atenção Domiciliar (SAD): serviço complementar aos cuidados realizados na atenção básica e em serviços de urgência, substitutivo ou complementar à internação hospitalar, responsável pelo gerenciamento e operacionalização das Equipes Multiprofissionais de Atenção Domiciliar (EMAD) e Equipes Multiprofissionais de Apoio (EMAP); e (Origem: PRT MS/GM 825/2016, Art. 2º, II)
III - cuidador: pessoa(s), com ou sem vínculo familiar com o usuário, apta(s) para auxiliá-lo em suas necessidades e atividades da vida cotidiana e que, dependendo da condição funcional e clínica do usuário, deverá(ão) estar presente(s) no atendimento domiciliar. (Origem: PRT MS/GM 825/2016, Art. 2º, III)
Art. 532-A. A AD, no âmbito do SUS, deve ser parte da rotina das equipes de Atenção Primária à Saúde (eAP), conforme as diretrizes da: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Política Nacional de Atenção Básica (PNAB), nos termos do Anexo XXII à Portaria de Consolidação GM/MS nº 2, de 28 de setembro de 2017; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Política Nacional de Atenção Especializada em Saúde (PNAES), nos termos da Portaria GM/MS nº 1.604, de 18 de outubro de 2023. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 533. O SAD tem como objetivos: (Origem: PRT MS/GM 825/2016, Art. 3º)
I - redução da demanda por atendimento hospitalar; (Origem: PRT MS/GM 825/2016, Art. 3º, I)
II - redução do período de permanência de usuários internados; (Origem: PRT MS/GM 825/2016, Art. 3º, II)
III - humanização da atenção à saúde, com a ampliação da autonomia dos usuários; e (Origem: PRT MS/GM 825/2016, Art. 3º, III)
IV - a desinstitucionalização e a otimização dos recursos financeiros e estruturais da RAS. (Origem: PRT MS/GM 825/2016, Art. 3º, IV)
IV - Otimização dos recursos financeiros e estruturais da RAS. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 534. A AD seguirá as seguintes diretrizes: (Origem: PRT MS/GM 825/2016, Art. 4º)
I - ser estruturada de acordo com os princípios de ampliação e equidade do acesso, acolhimento, humanização e integralidade da assistência, na perspectiva da RAS; (Origem: PRT MS/GM 825/2016, Art. 4º, I)
II - estar incorporada ao sistema de regulação, articulando-se com os outros pontos de atenção à saúde; (Origem: PRT MS/GM 825/2016, Art. 4º, II)
II - Estar articulada com os outros pontos de atenção à saúde, garantindo a continuidade do cuidado; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - adotar linhas de cuidado por meio de práticas clínicas cuidadoras baseadas nas necessidades do usuário, reduzindo a fragmentação da assistência e valorizando o trabalho em equipes multiprofissionais e interdisciplinares; e (Origem: PRT MS/GM 825/2016, Art. 4º, III)
IV - estimular a participação ativa dos profissionais de saúde envolvidos, do usuário, da família e do(s) cuidador(es). (Origem: PRT MS/GM 825/2016, Art. 4º, IV)
IV - Estimular a participação ativa dos profissionais de saúde envolvidos, tendo em vista a ampliação da autonomia do(s) usuário(s), da família e do(s) cuidador(es). (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Seção II
Da Indicação e Organização da Atenção Domiciliar
(Origem: PRT MS/GM 825/2016, CAPÍTULO II)
Subseção I
Da indicação e das modalidades de Atenção Domiciliar
(Origem: PRT MS/GM 825/2016, CAPÍTULO II, Seção I)
Art. 535. A AD é indicada para pessoas que, estando em estabilidade clínica, necessitam de atenção à saúde em situação de restrição ao leito ou ao lar de maneira temporária ou definitiva ou em grau de vulnerabilidade na qual a atenção domiciliar é considerada a oferta mais oportuna para tratamento, paliação, reabilitação e prevenção de agravos, tendo em vista a ampliação de autonomia do usuário, família e cuidador. (Origem: PRT MS/GM 825/2016, Art. 5º)
Art. 535. A AD é indicada para pessoas que necessitam de atenção à saúde e que estejam em situação de restrição ao leito ou lar ou em condição clínica ou de vulnerabilidade, de forma temporária ou permanente, na qual a atenção domiciliar é considerada a oferta mais oportuna para tratamento, paliação, reabilitação e prevenção de agravos. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 536. A AD será organizada em três modalidades: (Origem: PRT MS/GM 825/2016, Art. 6º)
I - Atenção Domiciliar 1 (AD 1); (Origem: PRT MS/GM 825/2016, Art. 6º, I)
II - Atenção Domiciliar 2 (AD 2); e (Origem: PRT MS/GM 825/2016, Art. 6º, II)
III - Atenção Domiciliar 3 (AD 3). (Origem: PRT MS/GM 825/2016, Art. 6º, III)
§ 1º A determinação da modalidade está atrelada às necessidades de cuidado peculiares a cada caso, em relação à periodicidade indicada das visitas, à intensidade do cuidado multiprofissional e ao uso de equipamentos. (Origem: PRT MS/GM 825/2016, Art. 6º, § 1º)
§ 2º A divisão em modalidades é importante para a compreensão do perfil de atendimento prevalente, e, consequentemente, para adequado planejamento e gestão dos recursos humanos, materiais necessários, e fluxos intra e intersetoriais. (Origem: PRT MS/GM 825/2016, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 537. Nas três modalidades de AD, as equipes responsáveis pela assistência têm como atribuição: (Origem: PRT MS/GM 825/2016, Art. 7º)
Art. 537. As equipes que realizam AD têm como atribuições: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - trabalhar em equipe multiprofissional integrada à RAS; (Origem: PRT MS/GM 825/2016, Art. 7º, I)
I - Realizar assistência à saúde dos usuários, de acordo com suas necessidades de integração com a RAS; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - identificar, orientar e capacitar o(s) cuidador(es) do usuário em atendimento, envolvendo-o(s) na realização de cuidados, respeitando seus limites e potencialidades, considerando-o(s) como sujeito(s) do processo; (Origem: PRT MS/GM 825/2016, Art. 7º, II)
III - acolher demanda de dúvidas e queixas dos usuários, familiares ou cuidadores; (Origem: PRT MS/GM 825/2016, Art. 7º, III)
IV - promover espaços de cuidado e de trocas de experiências para cuidadores e familiares; (Origem: PRT MS/GM 825/2016, Art. 7º, IV)
V - utilizar linguagem acessível, considerando o contexto; (Origem: PRT MS/GM 825/2016, Art. 7º, V)
VI - pactuar fluxos para atestado de óbito, devendo ser preferencialmente emitido por médico da EMAD ou da Equipe de Atenção Básica do respectivo território; (Origem: PRT MS/GM 825/2016, Art. 7º, VI)
VII - articular, com os demais estabelecimentos da RAS, fluxos para admissão e alta dos usuários em AD, por meio de ações como busca ativa e reuniões periódicas; e (Origem: PRT MS/GM 825/2016, Art. 7º, VII)
VII - Articular, com os demais estabelecimentos da RAS, fluxos para admissão e alta dos usuários em AD, a partir dos critérios de elegibilidade em cada ponto da rede, tendo em vista a transição do cuidado segura, a otimização da assistência às demandas de reabilitação intensiva e a redução do tempo de espera para cirurgias eletivas; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VIII - participar dos processos de educação permanente e capacitações pertinentes. (Origem: PRT MS/GM 825/2016, Art. 7º, VIII)
Art. 538. Considera-se elegível, na modalidade AD 1, o usuário que, tendo indicação de AD, requeira cuidados com menor frequência e com menor necessidade de intervenções multiprofissionais, uma vez que se pressupõe estabilidade e cuidados satisfatórios pelos cuidadores. (Origem: PRT MS/GM 825/2016, Art. 8º)
Art. 538. Considera-se elegível, na modalidade AD 1, o usuário que, tendo indicação de AD devido a adoecimento por condição crônica estável e a restrição ao leito ou lar, requeira cuidados da equipe de saúde com frequência espaçada e programada, a ser definida conforme seu Plano Terapêutico Singular (PTS). (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A prestação da assistência à saúde na modalidade AD 1 é de responsabilidade das equipes de atenção básica, por meio de acompanhamento regular em domicílio, de acordo com as especificidades de cada caso. (Origem: PRT MS/GM 825/2016, Art. 8º, § 1º)
§ 2º As equipes de atenção básica que executarem as ações na modalidade AD 1 devem ser apoiadas pelos Núcleos de Apoio à Saúde da Família, ambulatórios de especialidades e centros de reabilitação. (Origem: PRT MS/GM 825/2016, Art. 8º, § 2º)
Parágrafo único. A prestação da assistência à saúde na modalidade AD 1 é de responsabilidade da Atenção Primária à Saúde (APS), por meio de acompanhamento regular em domicílio, de acordo com as especificidades de cada caso e conforme o preconizado na PNAB e demais normas aplicáveis. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 539. Considera-se elegível na modalidade AD 2 o usuário que, tendo indicação de AD, e com o fim de abreviar ou evitar hospitalização, apresente: (Origem: PRT MS/GM 825/2016, Art. 9º)
Art. 539. Considera-se elegível, na modalidade AD 2, o usuário que, tendo indicação de AD, necessite de cuidados multiprofissionais, transitórios e intensificados, minimamente semanais, com atendimentos regulares fora do horário de funcionamento dos serviços de APS, e que apresente as seguintes condições clínicas: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - afecções agudas ou crônicas agudizadas, com necessidade de cuidados intensificados e sequenciais, como tratamentos parenterais ou reabilitação; (Origem: PRT MS/GM 825/2016, Art. 9º, I)
I - Afecções agudas, com necessidade de tratamentos parenterais ou outros procedimentos frequentes; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - afecções crônico-degenerativas, considerando o grau de comprometimento causado pela doença, que demande atendimento no mínimo semanal; (Origem: PRT MS/GM 825/2016, Art. 9º, II)
II - Afecções crônicas agudizadas, com necessidade de cuidados sequenciais, tratamentos parenterais ou reabilitação com possibilidade de ganho de funcionalidade; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - necessidade de cuidados paliativos com acompanhamento clínico no mínimo semanal, com o fim de controlar a dor e o sofrimento do usuário; ou (Origem: PRT MS/GM 825/2016, Art. 9º, III)
III - Afecções que demandem cuidados paliativos, com necessidade de visitas sequenciais para manejo de sintomas não controlados; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - prematuridade e baixo peso em bebês com necessidade de ganho ponderal. (Origem: PRT MS/GM 825/2016, Art. 9º, IV)
IV - Prematuridade com necessidade de ganho ponderal ou de procedimentos sequenciais. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 540. Considera-se elegível, na modalidade AD 3, usuário com qualquer das situações listadas na modalidade AD 2, quando necessitar de cuidado multiprofissional mais frequente, uso de equipamento(s) ou agregação de procedimento(s) de maior complexidade (por exemplo, ventilação mecânica, paracentese de repetição, nutrição parenteral e transfusão sanguínea), usualmente demandando períodos maiores de acompanhamento domiciliar. (Origem: PRT MS/GM 825/2016, Art. 10)
Art. 540. Considera-se elegível, na modalidade AD 3, o usuário: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Que se enquadre em qualquer das situações listadas no art. 539 e que necessite de: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) Cuidados predominantemente multiprofissionais; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
b) Uso de equipamentos ou agregação de procedimentos de maior complexidade, tais como: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
1. Ventilação mecânica invasiva e não invasiva domiciliar; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
2. Nutrição parenteral; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
3. Transfusão sanguínea; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
4. Diálise peritoneal; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
5. Hemodiálise; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
6. Drenagens repetidas (toracocentese, paracentese e outras); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
7. Cuidados paliativos em fase final de vida; ou (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
8. Condições crônico-degenerativas progressivas; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Com necessidade de procedimentos sistemáticos em domicílio, como reabilitação intensiva, antibioticoterapia e outros. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º Os usuários com necessidade de diálise peritoneal ou hemodiálise continuarão vinculados à equipe assistencial de sua referência nas clínicas ou centros de terapia renal substitutiva particulares ou conveniadas ao SUS e, a qualquer momento de necessidade clínica, serão referenciados para tais serviços, em conformidade com a integralidade de seu cuidado. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º A responsabilidade e o protagonismo do SAD/PMeC com os usuários da modalidade AD 3 não excluem a responsabilidade dos serviços da APS com relação à sua população adscrita nem a necessidade de um plano de cuidado compartilhado. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 541. O atendimento aos usuários elegíveis nas modalidades AD 2 e AD 3 é de responsabilidade do SAD. (Origem: PRT MS/GM 825/2016, Art. 11)
Parágrafo Único. Fica facultado à EMAD Tipo 2 prestar assistência apenas na modalidade AD 2, caso não possua condições técnicas e operacionais para a execução da modalidade AD 3. (Origem: PRT MS/GM 825/2016, Art. 11, Parágrafo Único)
Art. 542. Ao usuário em AD acometido de intercorrências agudas será garantido atendimento, transporte e retaguarda para as unidades assistenciais de funcionamento 24 (vinte e quatro) horas/dia, previamente definidas como referência para o usuário. (Origem: PRT MS/GM 825/2016, Art. 12)
Art. 542. Ao usuário em AD acometido por intercorrências agudas que não sejam possíveis de serem resolvidas pela equipe do SAD, deverá ser garantido pelo conjunto de pontos de atenção da RAS o transporte para as unidades assistenciais de funcionamento 24 (vinte e quatro) horas por dia, previamente definidas como referência para pacientes do SAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Parágrafo único. O transporte eletivo dos pacientes do SAD/PMeC deverá ser realizado na lógica da rede integrada, pelos equipamentos da RAS implantados para esse fim, como transporte sanitário. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 543. A admissão de usuários dependentes funcionalmente, segundo a Classificação Internacional de Funcionalidade, Incapacidade e Saúde (CIF), será condicionada à presença de cuidador(es) identificado(s). (Origem: PRT MS/GM 825/2016, Art. 13)
Art. 543. A permanência e a alta do paciente em reabilitação no SAD/PMeC observarão o seguinte: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - A transição do cuidado segura, conforme as diretrizes da PNAES; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Poderão ser avaliadas com os instrumentos de desempenho e capacidade funcional, por meio de escalas e classificações diagnósticas respectivas às atribuições profissionais envolvidas no processo de reabilitação, com base na Classificação Internacional de Funcionalidade, Incapacidade e Saúde (CIF), na Classificação Brasileira de Diagnósticos Fisioterapêuticos (CBDF), na Medida de Independência Funcional (MIF) e demais escalas destinadas à avaliação da capacidade funcional disponíveis na literatura científica. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 544. Será inelegível para a AD o usuário que apresentar pelo menos uma das seguintes situações: (Origem: PRT MS/GM 825/2016, Art. 14)
I - necessidade de monitorização contínua; (Origem: PRT MS/GM 825/2016, Art. 14, I)
I - Necessidade clínica que demande assistência de qualquer profissional de saúde presencial permanente e/ou monitorização contínua; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - necessidade de assistência contínua de enfermagem; (Origem: PRT MS/GM 825/2016, Art. 14, II) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
II-A - Residência em município não habilitado para SAD/PMeC; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - necessidade de propedêutica complementar, com demanda potencial para a realização de vários procedimentos diagnósticos, em sequência, com urgência; (Origem: PRT MS/GM 825/2016, Art. 14, III)
IV - necessidade de tratamento cirúrgico em caráter de urgência; ou (Origem: PRT MS/GM 825/2016, Art. 14, IV)
V - necessidade de uso de ventilação mecânica invasiva, nos casos em que a equipe não estiver apta a realizar tal procedimento. (Origem: PRT MS/GM 825/2016, Art. 14, V) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
V-A - Instabilidade hemodinâmica ou respiratória ou outras condições que configurem risco de piora abrupta e ameaça imediata à vida, salvo nos casos de cuidados paliativos em fase final de vida em que o usuário já tenha Diretivas Antecipadas de Vontade (DAV) manifestando vontade de falecer em domicílio e equipe (s) do SAD com condições de prestar assistência adequada para alívio do sofrimento. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 545. O descumprimento dos acordos assistenciais entre a equipe multiprofissional e o usuário, familiar(es) ou cuidador(es) poderá acarretar a exclusão do usuário do SAD, ocasião na qual o atendimento do usuário se dará em outro serviço adequado ao seu caso, conforme regulação local. (Origem: PRT MS/GM 825/2016, Art. 15)
Art. 545. Em qualquer forma de atendimento pelas equipes do SAD, será necessário um responsável de referência, podendo ser o próprio usuário, caso aprovado pela equipe. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A presença de cuidador será obrigatória nos casos de usuários em situações de vulnerabilidade ou dependentes funcionalmente para realização de atividades cotidianas básicas. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º O descumprimento dos acordos assistenciais pactuados entre equipe multiprofissional e usuário, familiar (es) ou cuidador (es) poderá implicar a exclusão do usuário do PMeC, ocasião em que o atendimento ao usuário poderá ocorrer em outro serviço adequado ao seu caso, conforme organização da RAS local. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Subseção II
Do Programa Melhor em Casa (PMeC)
(Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 545-A. Fica instituído o Programa Melhor em Casa (PMeC) com o objetivo de fomentar a utilização do SAD no âmbito do SUS. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Parágrafo único. O PMeC complementa os cuidados realizados na APS e nos serviços de urgência, substitutivos ou complementares à internação hospitalar, estabelecendo regras para o gerenciamento e a operacionalização das Equipes Multiprofissionais de Atenção Domiciliar (EMAD) e das Equipes Multiprofissionais de Apoio (EMAP). (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 545-B. O PMeC será executado, de modo tripartite, pela União, por intermédio do Ministério da Saúde, pelos estados, pelo Distrito Federal e pelos municípios. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A adesão ao PMeC será realizada pelos municípios, estados ou Distrito Federal interessados mediante solicitação de habilitação e homologação de equipes do SAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Para fins do disposto no § 1º, não caberá solicitação para um único município por proponente duplo (município e estado concomitantes). (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 545-C. Cabe às Secretarias Municipais de Saúde e do Distrito Federal: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Planejar, implantar, organizar, gerenciar e executar o SAD no seu território de abrangência; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Garantir a composição da equipe assistencial do SAD/PMeC, bem como o fornecimento de insumos, medicamentos e equipamentos necessários ao atendimento; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Garantir ao usuário, por meio de fluxos locais pactuados na RAS, os serviços de retaguarda, especialmente os de urgência e emergência, internação hospitalar e referência para especialidades e exames complementares disponíveis na RAS; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Construir com os demais pontos da RAS a regulação do acesso ao SAD/PMeC e os fluxos para os encaminhamentos do SAD aos serviços de referência; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Fiscalizar, controlar, monitorar periodicamente, avaliar e incentivar a atuação das equipes para garantir a assistência prestada ao paciente, família e cuidadores, conforme disposto neste Capítulo; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VI - Manter capacitações periódicas contínuas internas das equipes EMAD, EMAP e EMAP-R e externas junto à RAS, com disponibilização no SAD de planilha anual de temas que serão abordados; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VII - Complementar os recursos financeiros repassados pelo Ministério da Saúde para o custeio mensal do SAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 545-D. Cabe às Secretarias Estaduais de Saúde: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Prestar assessoria técnica aos municípios nos processos de construção de projetos no âmbito do SAD/PMeC, solicitação de habilitação e implementação nos processos assistenciais e de gestão; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Habilitar novas equipes do SAD/PMeC; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Realizar monitoramento periódico em conjunto com o Ministério da Saúde e avaliação dos SAD/PMeC, por meio de visitas remotas ou in loco, pelo menos uma vez ao ano; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Promover e participar dos processos que envolvam educação permanente e continuada, bem como elaboração de fluxos interestaduais e municipais; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Participar da complementação do financiamento do SAD/PMeC, podendo contemplar recursos destinados à capacitação/formação dos profissionais, aquisição de equipamentos pertinentes a ações assistenciais e de gestão, conforme a Relação Nacional de Equipamentos e Materiais Permanentes Financiáveis para o SUS (RENEM), além de recursos atrelados a indicadores que evidenciem a otimização do uso dos leitos hospitalares simples e de UTI; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VI - Criar fluxo com disponibilização de canal de comunicação oficial para recebimento de demandas técnicas e de solicitações de intervenção nos SAD caso necessário. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 545-E. Cabe ao Ministério da Saúde: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Homologar a habilitação SAD/PMeC feita pelos estados, conforme as regras deste Capítulo; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Fazer a gestão do PMeC em âmbito nacional, incluindo monitoramento e avaliação; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Prestar assessoria técnica aos demais entes; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Transferir incentivo financeiro aos municípios que tiverem equipes homologadas, para auxílio do custeio do SAD/PMeC; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Produzir materiais de apoio técnico, promover educação permanente e realizar e fomentar pesquisas para aprimoramento contínuo da AD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Subseção II[A]
Do Serviço de Atenção Domiciliar (SAD)
(Origem: PRT MS/GM 825/2016, CAPÍTULO II, Seção II)
Art. 546. As equipes que compõem o SAD são: (Origem: PRT MS/GM 825/2016, Art. 16)
Art. 546. As equipes que compõem o PMeC são: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Equipes Multiprofissionais de Atenção Domiciliar (EMAD), que pode ser constituída como: (Origem: PRT MS/GM 825/2016, Art. 16, I)
a) EMAD Tipo 1; ou (Origem: PRT MS/GM 825/2016, Art. 16, I, a)
b) EMAD Tipo 2; e (Origem: PRT MS/GM 825/2016, Art. 16, I, b)
II - Equipe Multiprofissional de Apoio (EMAP). (Origem: PRT MS/GM 825/2016, Art. 16, II)
III - Equipe Multiprofissional de Apoio para Reabilitação (EMAP-R). (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A EMAD e a EMAP devem ser cadastradas no Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SCNES), conforme as normativas de cadastramento vigentes. (Origem: PRT MS/GM 825/2016, Art. 16, § 1º)
§ 1º O cadastramento no CNES das equipes do PMeC observará o seguinte: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - As EMAD e EMAP deverão ser cadastradas, preferencialmente, em unidades de funcionamento 24 (vinte e quatro) horas; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - As EMAP-R deverão ser cadastradas, preferencialmente, na APS; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - A EMAD é pré-requisito para constituição de um SAD, não sendo possível a implantação de uma EMAP sem a existência prévia de uma EMAD, exceto para municípios com menos de 20.000 (vinte mil) habitantes, que poderão constituir uma EMAP-R sem a necessidade de constituição prévia de um SAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º A EMAD é pré-requisito para constituição de um SAD, não sendo possível a implantação de uma EMAP sem a existência prévia de uma EMAD. (Origem: PRT MS/GM 825/2016, Art. 16, § 2º) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 547. A EMAD terá a seguinte composição mínima: (Origem: PRT MS/GM 825/2016, Art. 17)
Art. 547. As EMAD terão as seguintes composições mínimas e somas de carga horária semanal mínimas, conforme a Classificação Brasileira de Ocupações (CBO): (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - EMAD Tipo 1: (Origem: PRT MS/GM 825/2016, Art. 17, I)
a) profissional(is) médico(s) com somatório de carga horária semanal (CHS) de, no mínimo, 40 (quarenta) horas de trabalho por equipe; (Origem: PRT MS/GM 825/2016, Art. 17, I, a)
b) profissional(is) enfermeiro(s) com somatório de CHS de, no mínimo, 40 (quarenta) horas de trabalho por equipe; (Origem: PRT MS/GM 825/2016, Art. 17, I, b)
b) profissional (is) enfermeiro (s): 60 (sessenta) horas; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
c) profissional(is) fisioterapeuta(s) ou assistente(s) social(is) com somatório de CHS de, no mínimo, 30 (trinta) horas de trabalho por equipe; e (Origem: PRT MS/GM 825/2016, Art. 17, I, c)
d) profissionais auxiliares ou técnicos de enfermagem, com somatório de CHS de, no mínimo, 120 (cento e vinte) horas de trabalho por equipe; (Origem: PRT MS/GM 825/2016, Art. 17, I, d)
d) profissionais técnicos de enfermagem: 120 (cento e vinte) horas; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - EMAD Tipo 2: (Origem: PRT MS/GM 825/2016, Art. 17, II)
a) profissional médico com CHS de, no mínimo, 20 (vinte) horas de trabalho; (Origem: PRT MS/GM 825/2016, Art. 17, II, a)
b) profissional enfermeiro com CHS de, no mínimo, 30 (trinta) horas de trabalho; (Origem: PRT MS/GM 825/2016, Art. 17, II, b)
c) profissional fisioterapeuta ou assistente social com somatório de CHS de, no mínimo, 30 (trinta) horas de trabalho; e (Origem: PRT MS/GM 825/2016, Art. 17, II, c)
d) profissionais auxiliares ou técnicos de enfermagem, com somatório de CHS de, no mínimo, 120 (cento e vinte) horas de trabalho. (Origem: PRT MS/GM 825/2016, Art. 17, II, d)
d) profissionais técnicos de enfermagem: 120 (cento e vinte) horas. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Parágrafo Único. Nenhum profissional componente de EMAD poderá ter CHS inferior a 20 (vinte) horas de trabalho. (Origem: PRT MS/GM 825/2016, Art. 17, Parágrafo Único)
§ 1º Nenhum profissional componente de EMAD poderá ter carga horária inferior a 20 (vinte) horas de trabalho. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Para SAD composto por duas ou mais EMAD, recomenda-se ter um profissional de nível superior da área de saúde ou gestão para exercer a função de coordenação, bem como um auxiliar administrativo. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 548. A EMAP terá composição mínima de 3 (três) profissionais de nível superior, escolhidos entre as ocupações listadas a seguir, cuja soma das CHS de seus componentes será de, no mínimo, 90 (noventa) horas de trabalho: (Origem: PRT MS/GM 825/2016, Art. 18)
I - assistente social; (Origem: PRT MS/GM 825/2016, Art. 18, I)
II - fisioterapeuta; (Origem: PRT MS/GM 825/2016, Art. 18, II)
III - fonoaudiólogo; (Origem: PRT MS/GM 825/2016, Art. 18, III)
IV - nutricionista; (Origem: PRT MS/GM 825/2016, Art. 18, IV)
V - odontólogo; (Origem: PRT MS/GM 825/2016, Art. 18, V)
VI - psicólogo; (Origem: PRT MS/GM 825/2016, Art. 18, VI)
VII - farmacêutico; ou (Origem: PRT MS/GM 825/2016, Art. 18, VII)
VIII - terapeuta ocupacional. (Origem: PRT MS/GM 825/2016, Art. 18, VIII)
Parágrafo Único. Nenhum profissional componente da EMAP poderá ter CHS inferior a 20 (vinte) horas de trabalho. (Origem: PRT MS/GM 825/2016, Art. 18, Parágrafo Único)
§ 1º Nenhum profissional componente da EMAP poderá ter CHS inferior a 20 (vinte) horas de trabalho. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º A soma das cargas horárias semanais dos componentes da EMAP será de, no mínimo, 90 (noventa) horas. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º A soma das cargas horárias semanais dos componentes da EMAP-R será de, no mínimo, 60 (sessenta) horas. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 548-A. A EMAP-R será composta por, no mínimo, três profissionais de nível superior, dentre as ocupações a seguir: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Fisioterapeuta; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Fonoaudiólogo; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Nutricionista; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Terapeuta ocupacional; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Psicólogo; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VI - Enfermeiro. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 548-B. Cabe às equipes do SAD/PMeC, com apoio do gestor local e demais atores envolvidos, em consonância com as diretrizes da PNAB e PNAES: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Definir protocolos e alinhar fluxos de acesso ao SAD/PMeC com os núcleos internos de regulação dos hospitais e escritórios de gestão de alta hospitalar, de forma a: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) priorizar a redução do tempo médio de permanência hospitalar e de permanência em Unidade de Pronto Atendimento (UPA); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
b) evitar novas internações; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
c) colaborar na redução das listas de espera para procedimentos cirúrgicos e na alta precoce no pós-operatório; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Definir protocolos e indicadores assistenciais, bem como alinhar fluxos de alta e de transferência do SAD com as equipes de APS e os serviços de urgência e emergência hospitalar, para seguimento do cuidado; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Promover a continuidade segura do cuidado, com possibilidade de utilizar recursos de tecnologias de informação e comunicação (TIC) e de telessaúde, de acordo com as normas do Ministério da Saúde e dos conselhos profissionais; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Definir fluxos de transporte e acesso a especialidades, apoio diagnóstico complementar e atendimento ou internação eletiva ou de urgência; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Realizar apoio matricial para as equipes da APS. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Subseção III
Do Funcionamento do SAD
(Origem: PRT MS/GM 825/2016, CAPÍTULO II, Seção III)
Subseção III
Do funcionamento do SAD/PMeC
(Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 549. O SAD será organizado a partir de uma base territorial, sendo referência em atenção domiciliar para uma população definida e se relacionará com os demais serviços de saúde que compõem a RAS, em especial com a atenção básica, atuando como matriciadores dessas equipes, quando necessário. (Origem: PRT MS/GM 825/2016, Art. 19)
Art. 549. O SAD será organizado a partir de uma base territorial dentro do município no qual foi habilitado ou nos municípios agrupados, sendo referência em atenção domiciliar para uma população definida e se relacionando com os demais serviços de saúde, de modo que o cuidado ao paciente seja de responsabilidade de todos os pontos da RAS para garantir a integralidade do cuidado e a continuidade da assistência. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A EMAD realizará atendimento, no mínimo, 1 (uma) vez por semana a cada usuário. (Origem: PRT MS/GM 825/2016, Art. 19, § 1º)
§ 2º A EMAP será acionada somente a partir da indicação clínica da EMAD, para dar suporte e complementar suas ações. (Origem: PRT MS/GM 825/2016, Art. 19, § 2º)
§ 2º A EMAP será acionada somente por meio da indicação clínica da EMAD, para dar suporte e complementação às ações da EMAD, devendo atuar a partir do planejamento conjunto entre as equipes. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º Durante o período em que o usuário estiver sob os cuidados do SAD, a equipe de atenção básica de sua referência deverá compartilhar o cuidado, participando na elaboração do Projeto Terapêutico Singular (PTS) daquele usuário. (Origem: PRT MS/GM 825/2016, Art. 19, § 3º)
§ 3º Durante o período em que o usuário estiver sob os cuidados do SAD/PMeC, o PTS para o usuário deverá ser compartilhado com a equipe de atenção primária de referência. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 4º O SAD deverá articular-se com os outros serviços da RAS, principalmente hospitais, serviços de urgência e Atenção Básica, buscando evitar demanda direta dos usuários. (Origem: PRT MS/GM 825/2016, Art. 19, § 4º)
§ 4º A admissão no SAD/PMeC se dará por meio de encaminhamento ou busca ativa com a utilização de protocolos de elegibilidade, como instrumento de avaliação e complexidade de atenção domiciliar (IAEC-AD), conforme os fluxos pactuados com outros serviços da RAS, de modo a evitar a demanda espontânea do usuário. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 5º O encaminhamento do paciente ao SAD/PMeC para a primeira avaliação deverá: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Ser realizado, prioritariamente, por meios digitais, como e-mail ou sistema informatizado; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Utilizar instrumentos específicos contendo os critérios para admissão; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Ser preenchido por profissional devidamente identificado e assinado com registro profissional e telefone de contato. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 6º Não será admitido paciente diretamente pela EMAP para reabilitação, sendo necessária sempre a avaliação inicial pela EMAD para decisão de elegibilidade ao SAD/PMeC. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 7º As EMAD e EMAP deverão estar vinculadas a estabelecimentos que garantam seu funcionamento mínimo de 12 (doze) horas por dia, prioritariamente em hospitais ou serviços de urgência e emergência, com o intuito de: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Potencializar busca ativa para desospitalização pré-hospitalar e hospitalar; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Propiciar retaguarda para intercorrências de pacientes domiciliados fora do horário de funcionamento do SAD/PMeC; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Facilitar fluxo para apoio diagnóstico, utilização de medicações especiais e outros insumos eventualmente necessários e disponíveis em hospitais e urgências. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 8º Excepcionalmente, a EMAD e a EMAP poderão estar localizadas em outros estabelecimentos que não os citados no § 7º, devendo constar justificativa no projeto enviado para habilitação. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 9º As EMAP-R deverão estar vinculadas, preferencialmente, a estabelecimentos da APS, sendo dispensada a exigência de funcionamento de 24 (vinte e quatro) horas. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 550. A admissão do usuário ao SAD exigirá a sua prévia concordância e de seu familiar ou, na inexistência de familiar, de seu cuidador, com assinatura de termo de esclarecimento e responsabilidade. (Origem: PRT MS/GM 825/2016, Art. 20)
Art. 550. A admissão do usuário ao SAD/PMeC exigirá sua prévia concordância ou de seu responsável legal e, se for caso, com assinatura de termo de esclarecimento e responsabilidade. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Parágrafo único. Também haverá a necessidade de concordância do paciente, de seu responsável legal, se for o caso, ou de familiar ou cuidador para fins de desligamento por alta administrativa do SAD/PMeC, devendo ser preenchido e assinado o termo de recusa de atendimento respectivo. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 551. Em municípios com porte populacional que permita a implantação de mais de 1 (uma) EMAD, fica facultada a organização do SAD a partir de arranjos diferenciados compostos por EMAD responsável pelo cuidado de pacientes com características específicas, tais como equipes voltadas para o atendimento infantil e neonatal. (Origem: PRT MS/GM 825/2016, Art. 21)
Art. 551. Em municípios com porte populacional que permita a implantação de mais de uma EMAD, fica facultada, a partir da segunda equipe, a organização do SAD/PMeC por meio de arranjos diferenciados compostos por EMAD responsável pelo cuidado de pacientes com características específicas, nos termos do § 3º do art. 559, sempre mantendo, ao menos, uma EMAD para atendimento clínico generalista. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 552. Estima-se, em média, o atendimento de 60 (sessenta) usuários para cada EMAD Tipo 1 e 30 (trinta) usuários para cada EMAD Tipo 2, mensalmente. (Origem: PRT MS/GM 825/2016, Art. 22)
Art. 552. São parâmetros de produção estimados para as equipes: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Para cada EMAD tipo I é esperado, em média, o atendimento de 50 (cinquenta) usuários por mês; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Para cada EMAD tipo II é esperado o atendimento de 25 (vinte e cinco) usuários por mês, com uma proporção de 70% (setenta por cento) destes em modalidade AD 2 e 30% (trinta por cento) em modalidade AD 3. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º O quantitativo de produção de que trata o caput poderá variar de acordo com o nível de complexidade dos cuidados, o perfil da maioria dos usuários admitidos e as características geográficas, de mobilidade e outras peculiaridades do município. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Caso não haja atingimento dos quantitativos de produção estimados, o Ministério da Saúde e as Secretarias Estaduais de Saúde farão ações educativas, presencial ou a distância, para melhoramento desses parâmetros. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 553. O SAD ofertará, no mínimo, 12 (doze) horas/dia de funcionamento, de modo que o trabalho da EMAD seja no formato de cuidado horizontal (diarista) em dias úteis e nos finais de semana e feriados, de forma a assegurar a continuidade da atenção em saúde, podendo utilizar, nestas ocasiões, o regime de plantão. (Origem: PRT MS/GM 825/2016, Art. 23)
Art. 553. O SAD deverá garantir continuidade e regularidade, inclusive aos finais de semana e feriados, da assistência aos usuários, de acordo com seus PTS. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Parágrafo Único. A EMAP deverá apoiar a EMAD nos dias úteis e, quando necessário, ter escala especial para finais de semana e feriados. (Origem: PRT MS/GM 825/2016, Art. 23, Parágrafo Único)
§ 1º A EMAD deverá funcionar por, no mínimo, 12 (doze) horas diurnas nos sete dias da semana, podendo ser o trabalho dos profissionais organizado no formato de cuidado horizontal ou diarista ou em regime de plantão, conforme a necessidade. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º A EMAP deverá apoiar a EMAD nos dias úteis e, quando necessário, ter escala especial para finais de semana e feriados de acordo com o PTS dos pacientes a serem assistidos. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º A assistência deverá ser garantida pelos profissionais do SAD à noite, em finais de semana e feriados, por meio de escalas especiais remotas, plantões presenciais ou com retaguarda de profissionais de outros serviços da rede, conforme pactuações locais. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 4º Nas situações em que as condições clínicas dos pacientes exigirem, o acesso às medicações necessárias, às especialidades, ao apoio diagnóstico complementar e ao atendimento/internação eletivo ou de urgência deverá ser realizado por outros pontos da rede. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 5º A EMAP-R deverá funcionar nos dias úteis por, no mínimo, quatro horas diurnas e, quando necessário, ter escala especial para finais de semana e feriados, de acordo com o PTS dos pacientes a serem assistidos. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 553-A. Há possibilidade de acompanhamento por meio de atendimento remoto, que deverá: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Ser realizado após avaliação presencial para orientações e auxílio ao usuário; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Ser intercalado com visita presencial; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Constar do PTS de cada usuário; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Ser lançado na produtividade da equipe com código específico. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º Para a execução do atendimento remoto, o SAD/PMeC necessitará minimamente de: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Sala para atividade de atendimento remoto; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Profissional da área da saúde, preferencialmente de nível técnico ou superior, para intermediar a utilização das TIC e telessaúde e os processos gerenciais da consulta; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Equipamentos de TIC e telessaúde suficientes para a realização de consultas de forma virtual, em qualidade adequada, incluindo, além do computador, webcam e microfone, ou equipamentos equivalentes, e conexão de internet. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Os materiais de que trata o inciso III do § 1º poderão ser obtidos conforme lista da RENEM, devendo seguir as normas que regulamentam a estruturação de estabelecimentos de saúde. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º A oferta do atendimento remoto deverá estar disponível em todo o horário de funcionamento do SAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 554. As equipes contarão com infraestrutura especificamente destinada para o seu funcionamento que contemple: (Origem: PRT MS/GM 825/2016, Art. 24)
Art. 554. O gestor municipal ou estadual deverá garantir ao SAD/PMeC infraestrutura adequada e que contemple: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - equipamentos; (Origem: PRT MS/GM 825/2016, Art. 24, I)
I - Equipamentos médico-hospitalares; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - material permanente e de consumo; (Origem: PRT MS/GM 825/2016, Art. 24, II)
II - Material permanente e de consumo, equipamento de informática e mobiliário; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - aparelho telefônico; e (Origem: PRT MS/GM 825/2016, Art. 24, III)
III - Aparelhos telefônicos, no mínimo um aparelho fixo e um aparelho móvel; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - veículo(s) para locomoção das equipes. (Origem: PRT MS/GM 825/2016, Art. 24, IV)
IV - Veículo (s) exclusivo (s) identificado (s) com a logomarca do PMeC, 12 (doze) horas por dia, sete dias na semana, no mínimo um para cada EMAP, um para cada EMAP-R e, para as EMAD, respeitar a seguinte proporção: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) 1 EMAD: dois carros; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
b) 2 EMAD: três carros; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
c) 3 EMAD: cinco carros; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
d) 4 EMAD: seis carros; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
e) 5 EMAD: oito carros; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
f) 6 EMAD: nove carros; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
g) a partir de 6 EMAD: acréscimo de um veículo a cada nova EMAD; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Transporte eletivo e de urgência e emergência para os usuários, conforme pactuação na RAS; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VI - Uniformes para as equipes contendo a identificação do PMeC. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º Os equipamentos e os materiais citados no "caput", bem como os prontuários dos usuários atendidos pelo SAD serão instalados na estrutura física de unidade de saúde municipal, estadual ou do Distrito Federal, a critério do gestor de saúde local. (Origem: PRT MS/GM 825/2016, Art. 24, § 1º)
§ 2º Não é obrigatório que o SAD possua sede própria, podendo estar sediado em estabelecimento de saúde, conforme regras definidas em normativa específica. (Origem: PRT MS/GM 825/2016, Art. 24, § 2º)
§ 3º As EMAP-R devem estar localizadas na estrutura física do estabelecimento de saúde a que estiverem vinculadas, tendo apoio da gestão. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 4º Nos finais de semana e feriados, a quantidade de veículos circulantes poderá ser ajustada à demanda programada. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Seção III
Dos Requisitos e Fluxos para Habilitação do SAD
(Origem: PRT MS/GM 825/2016, CAPÍTULO III)
Seção III
Dos requisitos e procedimentos de habilitação e homologação de equipes do PMeC
(Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Subseção I
Dos Requisitos para Habilitação
(Origem: PRT MS/GM 825/2016, CAPÍTULO III, Seção I)
Subseção I
Dos requisitos de habilitação e homologação de equipes do PMeC
(Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 555. São requisitos para habilitação do SAD: (Origem: PRT MS/GM 825/2016, Art. 25)
Art. 555. São requisitos para habilitação de EMAD e EMAP: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - população municipal igual ou superior a 20.000 (vinte mil) habitantes, com base na população mais recente estimada pela Fundação Instituto Brasileiro de Geografia e Estatística (IBGE); (Origem: PRT MS/GM 825/2016, Art. 25, I)
I - População municipal igual ou superior a 20.000 (vinte mil) habitantes, com base na população mais recente estimada pelo Instituto Brasileiro de Geografia e Estatística (IBGE); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - hospital de referência no município ou região a qual integra; e (Origem: PRT MS/GM 825/2016, Art. 25, II)
III - cobertura de Serviço de Atendimento Móvel de Urgência (SAMU 192) habilitado e em funcionamento. (Origem: PRT MS/GM 825/2016, Art. 25, III)
IV - Possuir cobertura mínima de 60% (sessenta por cento) da APS, considerando a cobertura de saúde suplementar. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A população mínima referida no inciso I do "caput" pode ser atingida por um município, isoladamente, ou por meio de agrupamento de Municípios cuja população seja inferior a 20.000 (vinte mil) habitantes, devendo ocorrer, nesse caso, prévia pactuação na Comissão Intergestores Bipartite (CIB) e, se houver, na Comissão Intergestores Regional (CIR); (Origem: PRT MS/GM 825/2016, Art. 25, § 1º)
§ 1º A população mínima referida no inciso I do caput pode ser originada de um município, isoladamente, ou por meio de agrupamento de municípios cuja população seja inferior a 20.000 (vinte mil) habitantes. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Em municípios com população igual ou superior a 40.000 (quarenta mil) habitantes será aceito serviço de atendimento móvel de urgência equivalente ao SAMU. (Origem: PRT MS/GM 825/2016, Art. 25, § 2º)
§ 3º Os municípios com proposta de SAD por meio de agrupamento deverão celebrar convênio, pactuar Contrato Organizativo de Ação Pública de Saúde (COAP) ou estabelecer outro formato jurídico interfederativo responsável por registrar as atribuições e responsabilidades entre os entes federativos. (Origem: PRT MS/GM 825/2016, Art. 25, § 3º)
§ 3º Os municípios com proposta de habilitação de SAD por meio de agrupamento deverão celebrar instrumento jurídico interfederativo específico para definir as atribuições e responsabilidades entre os entes federativos. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 4º Os municípios referidos no § 3º deverão aprovar os acordos celebrados entre si na respectiva CIB ou na CIR, se houver, e enviá-los ao Departamento de Atenção Hospitalar e de Urgência da Secretaria de Atenção à Saúde do Ministério da Saúde (DAHU/SAS/MS), juntamente com o projeto referido na Subseção II da Seção II do Capítulo III do Título IV. (Origem: PRT MS/GM 825/2016, Art. 25, § 4º)
§ 4º Para fins do disposto no § 3º, os municípios deverão aprovar os acordos celebrados na respectiva Comissão Intergestores Bipartite (CIB) ou Regional (CIR) e apresentar deliberação ocorrida há, no máximo, seis meses. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 5º No caso de o proponente do SAD ser a Secretaria Estadual de Saúde, o projeto deverá ser pactuado com o gestor municipal de saúde do(s) município(s) em que o SAD atuará, aprovado na CIB, não sendo permitida a duplicidade de proponentes para um mesmo município. (Origem: PRT MS/GM 825/2016, Art. 25, § 5º)
§ 6º No caso do § 5º, o documento com o registro da pactuação deverá ser enviado ao DAHU/SAS/MS juntamente com o projeto referido na Subseção II da Seção III do Capítulo III do Título IV. (Origem: PRT MS/GM 825/2016, Art. 25, § 6º)
§ 6º Na hipótese do agrupamento de que trata o § 3º, deverá haver cobertura mínima de 80% (oitenta por cento) de APS da população adscrita, considerando a cobertura de saúde suplementar. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 7º A habilitação das EMAP será aprovada juntamente ou após a habilitação da EMAD respectiva. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 556. Os municípios com população igual ou superior a 40.000 (quarenta mil) habitantes poderão solicitar habilitação de EMAD Tipo 1. (Origem: PRT MS/GM 825/2016, Art. 26)
Art. 556. Municípios com população igual ou superior a 40.000 (quarenta mil) e inferior a 100.000 (cem mil) habitantes poderão solicitar habilitação de uma EMAD tipo I. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 557. Municípios com população inferior a 40.000 (quarenta mil) habitantes poderão solicitar habilitação de EMAD Tipo 2, individualmente, se tiverem população entre 20.000 (vinte mil) e 39.999 (trinta e nove mil e novecentos e noventa e nove) habitantes ou por meio de agrupamento, no caso daqueles com menos de 20.000 (vinte mil) habitantes. (Origem: PRT MS/GM 825/2016, Art. 27)
Art. 557. Municípios ou agrupamentos com população superior a 20.000 (vinte mil) e inferior a 40.000 (quarenta mil) habitantes poderão solicitar habilitação de uma EMAD tipo II. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 558. Municípios com população igual ou maior que 150.000 (cento e cinquenta mil) habitantes, poderão solicitar a segunda EMAD e, sucessivamente, 1 (uma) nova EMAD a cada 100.000 (cem mil) novos habitantes. (Origem: PRT MS/GM 825/2016, Art. 28)
Art. 558. Municípios com população igual ou superior a 100.000 (cem mil) habitantes poderão solicitar a segunda EMAD e, sucessivamente, uma EMAD a cada 100.000 (cem mil) novos habitantes. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 559. Todos os municípios com uma EMAD, tipo 1 ou tipo 2, poderão solicitar 1 (uma) EMAP, sendo possível a implantação de mais 1 (uma) EMAP a cada 3 (três) EMAD a mais implantadas. (Origem: PRT MS/GM 825/2016, Art. 29)
Art. 559. Todos os municípios com uma EMAD tipo I ou tipo II poderão solicitar uma EMAP, na proporção de uma EMAP para as três primeiras EMAD e, após a quarta EMAD implantada, uma EMAP a cada duas EMAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º Municípios com população superior a 200.000 (duzentos mil) habitantes poderão solicitar aumento do número de equipes EMAD adicionais, modificando a proporção de uma a cada 100.000 (cem mil) habitantes para uma a cada 80.000 (oitenta mil) habitantes, desde que todas as equipes já atuantes tenham atingido, nos 12 (doze) meses anteriores ao momento da solicitação, os seguintes indicadores: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Média de número de pacientes por EMAD tipo I maior ou igual a 50 (cinquenta); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Percentual de alta mensal do SAD maior ou igual a 25% (vinte e cinco por cento); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Procedência hospitalar maior ou igual a 70% (setenta por cento); e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Cadastro das equipes no CNES e alimentação do SISAB, sem nenhuma suspensão nos 12 (doze) meses anteriores. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º A proporção de que trata o § 1º poderá ser reduzida novamente, mediante solicitação, para uma a cada 64.000 (sessenta e quatro mil) habilitantes, caso haja o atingimento anterior dos indicadores listados nos incisos do § 1º por todas as equipes atuantes após um ano do deferimento do primeiro aumento de equipes. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º Em municípios com porte populacional que permita a implantação de mais de uma EMAD, fica facultada a organização do SAD/PMeC a partir de arranjos diferenciados compostos por EMAD especializada, responsável pelo cuidado de pacientes com características específicas, tais como atendimento pediátrico, ortopédico, cuidados paliativos, ventilação mecânica, dentre outros, conforme a necessidade assistencial do território. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 559-A. Os municípios com até 20.000 (vinte mil) habitantes poderão solicitar a habilitação de uma EMAP-R para reabilitação domiciliar de média e alta complexidade, essencialmente nas modalidades AD 2 e AD 3, que deverá trabalhar de forma integrada com a RAS. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Parágrafo único. A EMAP-R deverá ser composta pelos profissionais de nível superior descritos no art. 548-A e a soma da carga horária semanal de seus componentes será de, no mínimo, 60 (sessenta) horas. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 559-B. Para fins deste Capítulo, consideram-se: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Habilitação no CNES: ato do gestor estadual ou distrital que atesta o cumprimento dos requisitos de funcionamento de EMAD, EMAP ou EMAP-R, nos termos deste Capítulo, permitindo seu cadastramento e o registro de sua produção no CNES; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Homologação: ato do gestor federal que ratifica a habilitação no CNES realizada pelo gestor estadual ou distrital, vinculando recursos financeiros. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Subseção II
Do Conteúdo e Fluxo do Projeto para Criação ou Ampliação do SAD
(Origem: PRT MS/GM 825/2016, CAPÍTULO III, Seção II)
Art. 560. O gestor de saúde do Município, Estado ou Distrito Federal deverá elaborar projeto para criação ou ampliação do SAD, contemplando os seguintes requisitos: (Origem: PRT MS/GM 825/2016, Art. 30)
Art. 560. A proposta de habilitação de EMAD, EMAP ou EMAP-R deverá contemplar os seguintes requisitos: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - quadro resumo que contenha os seguintes dados: Município, Unidade Federativa, população, nome e contatos (telefone e e-mail) do Coordenador ou Referência Técnica da Atenção Domiciliar, proponente (Município, Estado ou Distrito Federal), número de equipes por tipo, confirmação de SAMU ou serviço equivalente e confirmação de hospital de referência no Município ou região; (Origem: PRT MS/GM 825/2016, Art. 30, I)
II - objetivos do projeto; (Origem: PRT MS/GM 825/2016, Art. 30, II)
III - caracterização do(s) ente(s) federativo(s) proponentes, a partir de dados sócio-demográficos, da descrição dos serviços de saúde existentes e perfil epidemiológico, com problematização e justificativas para a implantação da política; (Origem: PRT MS/GM 825/2016, Art. 30, III)
III-A - Pactuação em CIB ou CIR, discutida dentro da concepção de Planejamento Regional Integrado, seguida de solicitação por parte do gestor de saúde estadual ou distrital, por meio do Sistema de Apoio à Implementação de Políticas em Saúde (SAIPS) ou qualquer outro sistema que esteja vigente à época, e de homologação da (s) equipe (s) por parte do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - especificação do número de equipes (EMAD e EMAP) previstas, observados os critérios e os prazos descritos neste Capítulo, incluindo os territórios de abrangência; (Origem: PRT MS/GM 825/2016, Art. 30, IV)
IV - Especificação do número de equipes previstas, observados os critérios e prazos descritos neste Capítulo, incluindo os territórios de abrangência; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - quadro de profissionais, mencionando as CHS; (Origem: PRT MS/GM 825/2016, Art. 30, V)
VI - descrição da inserção do SAD na RAS, incluindo serviços de referência, de forma a assegurar fluxos para: (Origem: PRT MS/GM 825/2016, Art. 30, VI)
VI - Descrição da inserção do SAD/PMeC na RAS, incluindo os serviços de referência, de forma a assegurar fluxos para: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) admissão, alta e intercorrências com a rede básica, de urgências e hospitalar; (Origem: PRT MS/GM 825/2016, Art. 30, VI, a)
b) encaminhamentos para especialidades e para métodos complementares de diagnóstico tanto para situações eletivas quanto de urgência; (Origem: PRT MS/GM 825/2016, Art. 30, VI, b)
c) confirmação e expedição de atestado de óbito domiciliar; e (Origem: PRT MS/GM 825/2016, Art. 30, VI, c)
d) transporte e remoção do usuário, dentro das especificidades locais, tanto em situações eletivas indicadas pelo SAD, quanto de urgência; (Origem: PRT MS/GM 825/2016, Art. 30, VI, d)
d) transporte e remoção do usuário, dentro das especificidades locais, tanto em situações eletivas indicadas pelo SAD/PMeC quanto em situações de urgência; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VII - descrição da infraestrutura para o SAD, incluindo-se área física, mobiliário, telefone, equipamentos, veículo(s) para locomoção da(s) EMAD e EMAP; (Origem: PRT MS/GM 825/2016, Art. 30, VII)
VII - Descrição da infraestrutura para o SAD, incluindo-se área física, mobiliário, telefone, equipamentos e veículo (s) para locomoção da (s) EMAD, EMAP, EMAP-R, além do CNES do estabelecimento de saúde em que será alocado; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
VIII - descrição do funcionamento do SAD, com garantia de cobertura de 12 (doze) horas diárias, inclusive nos finais de semana e feriados; (Origem: PRT MS/GM 825/2016, Art. 30, VIII)
VIII - Descrição do funcionamento do SAD/PMeC, com garantia de cobertura de 12 (doze) horas diárias, inclusive nos finais de semana e feriados; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IX - proposta de educação permanente e capacitação para profissionais do SAD e cuidadores, indicando periodicidade e temáticas; e (Origem: PRT MS/GM 825/2016, Art. 30, IX)
IX - Proposta de educação permanente e capacitação para profissionais do SAD/PMe e cuidadores, indicando periodicidade e temáticas; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
X - descrição de estratégias de monitoramento e avaliação do SAD, tomando como referência os indicadores propostos no Manual de Monitoramento e Avaliação: Programa Melhor em Casa, disponível no endereço eletrônico do Ministério da Saúde. (Origem: PRT MS/GM 825/2016, Art. 30, X)
X - Descrição de estratégias de monitoramento e avaliação do SAD/PMeC, tomando como referência os indicadores propostos no "Manual de Monitoramento e Avaliação: Programa Melhor em Casa", disponível no sítio eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º Para Municípios com menos de 20.000 habitantes agrupados para proposta de SAD, o projeto deve observar requisitos adicionais descritos no Manual Instrutivo do SAD, bem como o documento previsto no art. 555, § 2º . (Origem: PRT MS/GM 825/2016, Art. 30, § 1º)
Parágrafo único. Para municípios com menos de 20.000 (vinte mil) habitantes agrupados para proposta de SAD, o projeto deverá observar os requisitos adicionais descritos em documento específico emitido pela Secretaria de Atenção Especializada à Saúde, bem como no documento previsto no § 3º do art. 555 desta Portaria. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º O gestor de saúde local enviará o projeto para criação ou ampliação do SAD ao DAHU/SAS/MS, , por meio do Sistema de Apoio à Implementação de Políticas em Saúde. (SAIPS). (Origem: PRT MS/GM 825/2016, Art. 30, § 2º) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 561. O DAHU/SAS/MS fará a análise do projeto de criação ou ampliação do SAD, considerando-se as diretrizes e critérios previstos neste Capítulo e a disponibilidade orçamentária, bem como providenciará o devido encaminhamento interno com vistas à publicação de ato normativo de habilitação dos entes federativos beneficiários. (Origem: PRT MS/GM 825/2016, Art. 31)
Art. 561. O processo de habilitação de equipes do PMeC ficará sob responsabilidade do gestor de saúde estadual ou distrital e obedecerá ao seguinte rito: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Solicitação do gestor de saúde proponente municipal, estadual ou distrital, acompanhada dos documentos que comprovem o cumprimento tanto dos requisitos de que trata o art. 560 quanto das diretrizes deste Capítulo; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Verificação do gestor de saúde estadual ou distrital do cumprimento dos requisitos de que trata o art. 560 e das diretrizes deste Capítulo; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Publicação de portaria de habilitação pelo gestor estadual ou distrital; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Cadastramento das equipes no CNES pelo gestor de saúde estadual ou distrital. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º Publicada a portaria de habilitação, o gestor local deverá implantar a(s) equipe(s) solicitada(s), promovendo o cadastramento destas no SCNES em até 3 (três) meses, a contar da data de publicação da sua portaria de habilitação, sob pena de perder sua respectiva habilitação. (Origem: PRT MS/GM 825/2016, Art. 31, § 1º)
§ 1º O gestor local deverá implantar a (s) equipe (s) solicitada (s) e já habilitada (s), promovendo o cadastramento destas no CNES em até seis meses, contados da data de publicação da portaria de habilitação, sob pena de perder sua respectiva habilitação. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Equipes descadastradas do SCNES por 6 (seis) competências seguidas ou com suspensão de repasse de recursos de custeio por mais de 6 (seis) competências seguidas em função das irregularidades previstas no art. 307 da Portaria de Consolidação nº 6, terão suas habilitações automaticamente revogadas. (Origem: PRT MS/GM 825/2016, Art. 31, § 2º)
§ 2º O gestor local será responsável pelo cumprimento do adequado preenchimento dos sistemas de informação e monitoramento dos indicadores, bem como pela conferência da validação dos dados na base federal. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 562. O cadastramento das EMAD e EMAP, no SCNES, deverá ser feito em unidades cujas mantenedoras sejam as secretarias de saúde estaduais, do Distrito Federal ou municipais ou, ainda, unidades que façam parte da rede conveniada ao SUS, conforme as regras de cadastramento publicadas em ato específico. (Origem: PRT MS/GM 825/2016, Art. 32)
Art. 562. O cadastramento das EMAD, EMAP e EMAP-R no CNES deverá ser feito em unidades cujas mantenedoras sejam as Secretarias Estaduais, Distrital ou Municipais de Saúde ou, ainda, unidades que façam parte da rede conveniada ao SUS, conforme as regras de cadastramento publicadas em ato específico. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 562-A. O processo de homologação de equipes do PMeC ficará sob responsabilidade do gestor federal e obedecerá ao seguinte rito: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Solicitação do gestor de saúde estadual ou distrital, por meio do SAIPS, acompanhada dos documentos que comprovem o cumprimento dos requisitos de que tratam os arts. 560 e 561 desta Portaria; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Verificação pelo Departamento de Atenção Hospitalar, Domiciliar e de Urgência da Secretaria de Atenção Especializada à Saúde do cumprimento dos requisitos de que tratam os arts. 560 e 561 desta Portaria; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Publicação de portaria de homologação pela Secretaria de Atenção Especializada à Saúde. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º A homologação está condicionada: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - À disponibilidade de recursos financeiros do Ministério da Saúde; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - À existência de produção no sistema de informação pertinente. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º O recebimento regular e automático do incentivo de custeio mensal diretamente do Fundo Nacional de Saúde (FNS) para auxílio na manutenção dos serviços efetivamente implantados ocorrerá somente após a publicação da homologação por meio do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 563. Os estabelecimentos de saúde credenciados no código 13.01 (Internação Domiciliar) até a data de publicação da Portaria nº 825/GM/MS, de 25 de abril de 2016 permanecerão habilitados e continuarão recebendo os recursos financeiros devidos por meio de Autorização de Internação Hospitalar (AIH), informadas no SIH-SUS. (Origem: PRT MS/GM 825/2016, Art. 33)
§ 1º Após a publicação da Portaria nº 825/GM/MS, de 25 de abril de 2016, não poderão ser habilitados novos estabelecimentos de saúde no código 13.01. (Origem: PRT MS/GM 825/2016, Art. 33, § 1º)
§ 2º Não será permitido o registro concomitante de usuário em serviço com habilitação 13.01 e em SAD, sendo considerado faturamento duplicado. (Origem: PRT MS/GM 825/2016, Art. 33, § 2º)
Subseção III
Do monitoramento do PMeC
(Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 563-A. A partir da homologação das equipes, o PMeC será monitorado e avaliado pelo Ministério da Saúde com base nas seguintes diretrizes: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Durante os seis primeiros meses após a homologação das equipes, o monitoramento realizado considerará apenas o envio de dados dos indicadores e a presença no CNES para fins de repasse do custeio federal; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Após os seis primeiros meses, será considerado o alcance das metas dos indicadores; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - O monitoramento dos indicadores será realizado semestralmente, a partir dos dados enviados mensalmente por meio do sistema de informação vigente; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - O Ministério da Saúde visitará anualmente, no mínimo, 3% (três por cento) dos municípios com SAD/PMeC habilitados, definidos por sorteio, a partir de situações identificadas por meio do sistema de informação, casos de denúncias ou solicitação do SAD. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º São indicadores a serem monitorados semestralmente pelos entes federados, de acordo com o perfil de seu município: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Percentual de usuários oriundos de hospital e/ou serviço de urgência: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) municípios com população até 100.000 (cem mil) habitantes: percentual maior que 40% (quarenta por cento); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
b) municípios com população acima de 100.000 (cem mil) até 500.000 (quinhentos mil) habitantes: percentual maior que 60% (sessenta por cento); e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
c) municípios com população acima de 500.000 (quinhentos mil) habitantes: percentual maior que 70% (setenta por cento); (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Total de usuários atendidos pelo SAD por mês: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) meta de 50 (cinquenta) para EMAD tipo I; ou (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
b) meta de 25 (vinte e cinco) para EMAD tipo II; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Percentual de usuários admitidos como AD2 e AD3 em relação ao total de usuários admitidos no SAD/PMeC: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
a) em torno de 70% (setenta por cento) de AD2; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
b) até 30% (trinta por cento) de AD3; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Média de permanência estimada: 30 (trinta) a 60 (sessenta) dias para equipes clínicas generalistas; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
V - Percentual de desfecho alta: maior que 30% (trinta por cento) por mês. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º O número de atendimentos por mês será monitorado mensalmente no caso de EMAP-R, sendo o mínimo de 50 (cinquenta) por profissional todo mês. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º Não será exigido o indicador do inciso IV do § 1º quando houver equipes especializadas, como de cuidados paliativos, de ventilação mecânica domiciliar, dentre outras. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 4º Terão suas habilitações automaticamente revogadas, em função das irregularidades previstas no art. 307 da Portaria de Consolidação GM/MS nº 6, de 2017, sendo necessário novo processo de habilitação e homologação, as equipes: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - Descadastradas do CNES por seis competências ou mais, seguidas ou não; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - Sem produção no SISAB por seis competências ou mais, seguidas ou não; ou (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Com suspensão de repasse de recursos de custeio por seis competências ou mais, seguidas ou não. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 5º Após a suspensão do repasse, o gestor terá até três meses para regularizar a situação da equipe. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 6º O Ministério da Saúde poderá, a qualquer tempo, solicitar documentos e informações, bem como realizar vistorias remotas ou in loco, para fins de monitoramento dos requisitos de homologação. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 7º Em caso de não atingimento dos indicadores estimados, o Ministério da Saúde e as Secretarias Estaduais de Saúde farão ações educativas, presencial ou a distância, para melhoramento desses parâmetros. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 563-B. O gestor de saúde estadual ou distrital poderá, a qualquer tempo, solicitar documentos e informações, bem como realizar vistorias, para fins de monitoramento dos requisitos de habilitação. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º São diretrizes para as visitas de monitoramento remotas ou in loco a serem realizadas pelas Secretarias Estaduais ou Distrital de Saúde: (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
I - As visitas terão por objetivo a verificação do funcionamento adequado do SAD, considerando as normativas vigentes, o apoio no seu desenvolvimento e a qualificação a partir de orientações e norteamento de ações; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
II - As solicitações de visitas poderão ocorrer por demanda da própria Secretaria de Saúde, pelo SAD ou mesmo por denúncia, sendo a visita realizada de forma presencial ou virtual e, no mínimo, uma visita anual para cada SAD, conforme pactuação de agenda entre Secretaria Estadual e Secretaria Municipal de Saúde; (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
III - Deverá ser usado roteiro específico para as visitas; e (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
IV - Deverão ser enviados relatórios aos gestores locais com os apontamentos pertinentes, as inconsistências eventualmente detectadas e a indicação do prazo para os devidos ajustes. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º O relatório de que trata o inciso IV do § 1º também deverá ser encaminhado ao Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º A descrição dos indicadores, do método de cálculo e das metas, o detalhamento do roteiro para as visitas, as implicações da ausência de cumprimento de metas e a presença de irregularidades identificadas in loco ou remotamente serão divulgados pela Secretaria de Atenção Especializada à Saúde em documento específico. (Redação dada pela PRT GM/MS n° 3.005 de 02.01.2024)
Seção IV
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 825/2016, CAPÍTULO V)
(Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
Art. 564. Fica atualizado o quantitativo de habilitações de equipes de EMAD e EMAP, com base nas equipes cadastradas no SCNES na competência definitiva de dezembro de 2015, considerando-se as proporções e os prazos previstos nos arts. 559 e 561 . (Origem: PRT MS/GM 825/2016, Art. 42) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 1º As equipes cadastradas no SCNES até a publicação da Portaria nº 825/GM/MS, de 25 de abril de 2016, previamente habilitadas, serão consideradas vigentes e automaticamente inclusas na relação constante do Anexo XXVIII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 825/2016, Art. 42, § 1º) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 2º Desde a competência financeira de janeiro/2016, fica autorizada a transferência do custeio mensal de 1/12 (um doze avos) do valor anual aos entes beneficiários, conforme detalhado no Anexo XXVIII da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 825/2016, Art. 42, § 2º) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
§ 3º Novas habilitações ocorrerão por meio de portarias com esta finalidade, observando-se o disposto neste Capítulo e as disponibilidades orçamentárias e financeiras de cada exercício. (Origem: PRT MS/GM 825/2016, Art. 42, § 3º) (Revogado pela PRT GM/MS n° 3.005 de 02.01.2024)
CAPÍTULO IV
DA ASSISTÊNCIA FARMACÊUTICA
Seção I
Do Grupo Executivo para o Programa Nacional de Plantas Medicinais e Fitoterápicos
Art. 565. Fica instituído, no âmbito do Ministério da Saúde, Grupo Executivo para o Programa Nacional de Plantas Medicinais e Fitoterápicos. (Origem: PRT MS/GM 1274/2008, Art. 1º)
Art. 566. O Grupo Executivo terá a seguinte composição: (Origem: PRT MS/GM 1274/2008, Art. 2º)
I - dois representantes da Secretaria de Ciência, Tecnologia e Insumos Estratégicos: (Origem: PRT MS/GM 1274/2008, Art. 2º, I)
a) Departamento de Assistência Farmacêutica e Insumos Estratégicos (DAF/SCTIE/MS); (Origem: PRT MS/GM 1274/2008, Art. 2º, I, a)
b) Departamento de Economia em Saúde (DES/SCTIE/MS); (Origem: PRT MS/GM 1274/2008, Art. 2º, I, b)
II - um representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1274/2008, Art. 2º, II)
III - um representante da Fundação Oswaldo Cruz (FIOCRUZ), do Núcleo de Gestão em Biodiversidade e Saúde/Centro de Produtos Naturais/Instituto de Tecnologia em Fármacos (Farmanguinhos); e (Origem: PRT MS/GM 1274/2008, Art. 2º, III)
IV - um representante do Grupo Hospitalar Conceição (GHC/MS), do Núcleo de Estudos e Pesquisas de Plantas Medicinais e Fitoterapia. (Origem: PRT MS/GM 1274/2008, Art. 2º, IV)
Art. 567. O Grupo Executivo deverá apoiar o Ministério da Saúde na coordenação do Programa Nacional de Plantas Medicinais e Fitoterápicos (PNPMF). (Origem: PRT MS/GM 1274/2008, Art. 3º)
Art. 568. O Grupo Executivo será assessorado por uma Secretaria-Executiva, que ficará encarregada de organizar, acompanhar e encaminhar as deliberações do Grupo Executivo. (Origem: PRT MS/GM 1274/2008, Art. 4º)
Art. 569. O Grupo Executivo poderá convidar outros representantes do Ministério da Saúde, e de entidades vinculadas ao setor público e privado que atuem profissionalmente em atividades relacionadas ao tema desta Seção, sempre que entenda necessária a sua colaboração para o pleno alcance dos seus objetivos. (Origem: PRT MS/GM 1274/2008, Art. 5º)
Art. 570. Fica instituída, no âmbito do Sistema Único de Saúde (SUS), sob gestão estadual, municipal ou do Distrito Federal, a Farmácia Viva. (Origem: PRT MS/GM 886/2010, Art. 1º)
§ 1º A Farmácia viva, no contexto da Política Nacional de Assistência Farmacêutica, deverá realizar todas as etapas, desde o cultivo, a coleta, o processamento, o armazenamento de plantas medicinais, a manipulação e a dispensação de preparações magistrais e oficinais de plantas medicinais e fitoterápicos. (Origem: PRT MS/GM 886/2010, Art. 1º, § 1º)
§ 2º Fica vedada a comercialização de plantas medicinais e fitoterápicos elaborados a partir das etapas mencionadas no parágrafo primeiro. (Origem: PRT MS/GM 886/2010, Art. 1º, § 2º)
Art. 571. A Farmácia Viva fica sujeita ao disposto em regulamentação sanitária e ambiental específicas, a serem emanadas pelos órgãos regulamentadores afins. (Origem: PRT MS/GM 886/2010, Art. 2º)
Seção III
Do Programa Farmácia Popular do Brasil (PFPB)
Art. 572. O Anexo LXXVII dispõe sobre o Programa Farmácia Popular do Brasil (PFPB).
Art. 573. O Anexo LXXVIII dispõe sobre as Normas Operacionais do Programa Farmácia Popular do Brasil (PFPB). (Revogado pela PRT GM/MS nº 2.898 de 26.10.2021)
Seção IV
Do Programa Nacional de Qualificação da Assistência Farmacêutica (QUALIFAR-SUS)
Art. 574. Esta Seção institui o Programa Nacional de Qualificação da Assistência Farmacêutica no âmbito do Sistema Único de Saúde (QUALIFAR-SUS). (Origem: PRT MS/GM 1214/2012, Art. 1º)
Art. 575. O QUALIFAR-SUS tem por finalidade contribuir para o processo de aprimoramento, implementação e integração sistêmica das atividades da Assistência Farmacêutica nas ações e serviços de saúde, visando a uma atenção contínua, integral, segura responsável e humanizada. (Origem: PRT MS/GM 1214/2012, Art. 2º)
Art. 576. São diretrizes do QUALIFAR-SUS: (Origem: PRT MS/GM 1214/2012, Art. 3º)
I - promover condições favoráveis para a estruturação dos serviços farmacêuticos no Sistema Único de Saúde (SUS) como estratégia de qualificação do acesso aos medicamentos e da gestão do cuidado; (Origem: PRT MS/GM 1214/2012, Art. 3º, I)
II - contribuir para garantia e ampliação do acesso da população a medicamentos eficazes, seguros, de qualidade e o seu uso racional, visando à integralidade do cuidado, resolutividade e o monitoramento dos resultados terapêuticos desejados; (Origem: PRT MS/GM 1214/2012, Art. 3º, II)
III - estimular a elaboração de normas, procedimentos, recomendações e outros documentos que possam orientar e sistematizar as ações e os serviços farmacêuticos, com foco na integralidade, na promoção, proteção e recuperação da saúde; (Origem: PRT MS/GM 1214/2012, Art. 3º, III)
IV - promover a educação permanente e fortalecer a capacitação para os profissionais de saúde em todos os âmbitos da atenção, visando ao desenvolvimento das ações da Assistência Farmacêutica no SUS; e (Origem: PRT MS/GM 1214/2012, Art. 3º, IV)
V - favorecer o processo contínuo e progressivo de obtenção de dados, que possibilitem acompanhar, avaliar e monitorar a gestão da Assistência farmacêutica, o planejamento, programação, controle, a disseminação das informações e a construção e acompanhamento de indicadores da Assistência Farmacêutica. (Origem: PRT MS/GM 1214/2012, Art. 3º, V)
Art. 577. O QUALIFAR-SUS está organizado em 4 (quatro) eixos, com os seguintes objetivos: (Origem: PRT MS/GM 1214/2012, Art. 4º)
I - Eixo Estrutura: contribuir para a estruturação dos serviços farmacêuticos no SUS, de modo que estes sejam compatíveis com as atividades desenvolvidas na Assistência Farmacêutica, considerando a área física, os equipamentos, mobiliários e recursos humanos; (Origem: PRT MS/GM 1214/2012, Art. 4º, I)
II - Eixo Educação: promover a educação permanente e capacitação dos profissionais de saúde para qualificação das ações da Assistência Farmacêutica voltadas ao aprimoramento das práticas profissionais no contexto das Redes de Atenção à Saúde; (Origem: PRT MS/GM 1214/2012, Art. 4º, II)
III - Eixo Informação: produzir documentos técnicos e disponibilizar informações que possibilitem o acompanhamento, monitoramento e avaliação das ações e serviços da Assistência Farmacêutica; e (Origem: PRT MS/GM 1214/2012, Art. 4º, III)
IV - Eixo Cuidado: inserir a Assistência Farmacêutica nas práticas clínicas visando a resolutividade das ações em saúde, otimizando os benefícios e minimizando os riscos relacionados à farmacoterapia. (Origem: PRT MS/GM 1214/2012, Art. 4º, IV)
Art. 578. A operacionalização dos eixos do QUALIFAR-SUS de que trata esta Seção será regulada em atos específicos, mediante pactuação prévia no âmbito da Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 1214/2012, Art. 5º)
CAPÍTULO V
CENTRO DE ESPECIALIDADES ODONTOLÓGICAS (CEOS) E LABORATÓRIOS REGIONAIS DE PRÓTESES DENTÁRIAS (LRPDS)
Art. 579. Ficam instituídos os Centros de Especialidades Odontológicas (CEOs) e de Laboratórios Regionais de Próteses Dentárias (LRPDs), e estabelecidos os critérios, normas e requisitos para seu credenciamento. (Origem: PRT MS/GM 599/2006, Art. 1º)
§ 1º Os CEOs são estabelecimentos de saúde registrados no Cadastro Nacional de Estabelecimentos de Saúde (CNES), classificados como Tipo Clínica Especializada/Ambulatório de Especialidade, com serviço especializado de Odontologia para realizar, no mínimo, as seguintes atividades: (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º)
I - diagnóstico bucal, com ênfase no diagnóstico e detecção do câncer bucal; (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, I)
II - periodontia especializada; (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, II)
III - cirurgia oral menor dos tecidos moles e duros; (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, III)
IV - endodontia; e (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, IV)
V - atendimento a portadores de necessidades especiais. (Origem: PRT MS/GM 599/2006, Art. 1º, § 1º, V)
§ 2º O LRPD é o estabelecimento cadastrado no CNES como Unidade de Saúde de Serviço de Apoio Diagnóstico Terapêutico (SADT) para realizar, no mínimo, o serviço de prótese dentária total e/ou prótese parcial removível. (Origem: PRT MS/GM 599/2006, Art. 1º, § 2º)
§ 3º O cadastramento nas modalidades estabelecidas nesta Seção, CEO Tipo 1, CEO Tipo 2, CEO Tipo 3 e LRPD e a verificação das informações das Unidades de Saúde serão efetuados pelo Sistema de Informação Ambulatorial (SIA) e o Cadastro Nacional de Estabelecimentos de Saúde (CNES), por meio de serviço e classificação específicos, sem o prejuízo de outras formas. (Origem: PRT MS/GM 599/2006, Art. 1º, § 3º)
§ 4º Unidades de Saúde que disponham das condições estabelecidas nesta Seção poderão credenciar-se conforme o estabelecido no § 3º e de acordo com o fluxo definido no art. 585. (Origem: PRT MS/GM 599/2006, Art. 1º, § 4º)
Art. 580. A Unidade de Saúde a ser habilitada nas modalidades de CEO e/ou de LRPD atenderá às seguintes condições: (Origem: PRT MS/GM 599/2006, Art. 2º)
I - ser referência para o próprio município, região ou microrregião de saúde, de acordo com o Plano Diretor de Regionalização (PDR); (Origem: PRT MS/GM 599/2006, Art. 2º, I)
II - ser Unidade de Saúde cadastrada no CNES; e (Origem: PRT MS/GM 599/2006, Art. 2º, II)
III - dispor dos equipamentos e dos recursos mínimos exigidos nesta Seção que estejam exclusivamente a serviço do SUS e dos serviços mínimos exigidos nesta Seção. (Origem: PRT MS/GM 599/2006, Art. 2º, III)
Art. 581. Ficam definidas, na forma do Anexo XIV , as características das modalidades de CEO estabelecidas no art. 579. (Origem: PRT MS/GM 599/2006, Art. 3º)
Art. 582. O não atendimento às condições e características definidas nesta Seção pelos municípios pleiteantes, bem como pelas Unidades de Saúde, a qualquer tempo, implicará o descredenciamento da Unidade de Saúde. (Origem: PRT MS/GM 599/2006, Art. 5º)
Parágrafo Único. Caberá às CIBs e/ou ao Ministério da Saúde encaminhar a solicitação ao DAB/SAS/MS, para posterior publicação. (Origem: PRT MS/GM 599/2006, Art. 5º, Parágrafo Único)
Art. 583. Em relação aos tipos de prestadores fica estabelecido que: (Origem: PRT MS/GM 599/2006, Art. 6º)
I - somente as Unidades de Saúde de natureza jurídica pública, universidades de qualquer natureza jurídica, consórcios públicos de saúde de qualquer natureza jurídica e serviços sociais autônomos poderão credenciar-se como CEO; e (Origem: PRT MS/GM 599/2006, Art. 6º, I)
II - não haverá restrição quanto à natureza jurídica para as Unidades de Saúde credenciarem-se como LRPD. (Origem: PRT MS/GM 599/2006, Art. 6º, II)
Art. 584. Os gestores deverão providenciar a adequação visual da Unidade de Saúde à qual está sendo pleiteado o credenciamento, para os itens considerados obrigatórios, do Manual de Inserção de Logotipo disponibilizado pelo Ministério da Saúde em seu endereço eletrônico. (Origem: PRT MS/GM 599/2006, Art. 7º)
Art. 585. Ficam definidas as condições gerais e o fluxo de credenciamento para os Centros de Especialidades Odontológicas (CEOs) e os Laboratórios Regionais de Próteses Dentárias (LRPDs). (Origem: PRT MS/GM 599/2006, Art. 4º)
§ 1º O gestor poderá credenciar como CEO e LRPD quantos estabelecimentos forem necessários para atendimento à demanda da população da região/microrregião de saúde, limitado à disponibilidade financeira do Ministério da Saúde. (Origem: PRT MS/GM 599/2006, Art. 4º, § 1º)
§ 2º O gestor também poderá credenciar CEO e LRPD com recursos próprios. (Origem: PRT MS/GM 599/2006, Art. 4º, § 2º)
§ 3º O gestor municipal e o estadual interessados em implantar CEO ou em credenciar algum estabelecimento de saúde deverá apresentar sua proposta à Comissão Intergestores Bipartite (CIB) do respectivo Estado, indicando se o pleito é para CEO Tipo 1, CEO Tipo 2 ou CEO Tipo 3. (Origem: PRT MS/GM 599/2006, Art. 4º, § 3º)
§ 4º A partir da proposta do pleiteante, a Comissão Intergestores Bipartite (CIB) informará o Ministério da Saúde - Secretaria de Atenção à Saúde, Departamento de Atenção Básica, Área de Saúde Bucal (DAB/SAS/MS) - sobre o(s) Município(s) e o(s) estabelecimento(s) de saúde aprovado(s). (Origem: PRT MS/GM 599/2006, Art. 4º, § 4º)
§ 5º A proposta de que trata o § 4º deste artigo deverá contemplar minimamente os seguintes elementos: (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º)
I - identificação do Município ou do Estado pleiteante e do estabelecimento de saúde, com cópia do registro no Cadastro Nacional de Estabelecimentos de Saúde (CNES); (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, a)
II - descrição dos serviços que serão ofertados; (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, b)
III - demonstração da coerência com o Plano Diretor de Regionalização; (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, c)
IV - identificação da área de abrangência do CEO, indicando para qual município, região ou microrregião é referência, mencionando, inclusive, a população coberta; e (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, d)
V - emissão de documento, pelos gestores, atestando que atendem aos requisitos estabelecidos na Seção I do Capítulo V do Título IV, com prazo de 30 (trinta) dias, a contar do credenciamento do CEO, para providenciar a atualização, caso necessário, dos sistemas de informação relacionados. (Origem: PRT MS/GM 599/2006, Art. 4º, § 5º, e)
§ 6º Deverá ser adotado como critério de seleção o maior percentual de cobertura das Equipes de Saúde Bucal do Programa Saúde da Família. (Origem: PRT MS/GM 599/2006, Art. 4º, § 6º)
§ 7º Caberá às respectivas CIB encaminhar solicitação de habilitação dos CEO, conforme o fluxo estabelecido no parágrafo 4º deste artigo e à Secretaria de Atenção à Saúde a formalização em portaria específica. (Origem: PRT MS/GM 599/2006, Art. 4º, § 7º)
§ 8º O LRPD é o estabelecimento cadastrado no CNES com o tipo de estabelecimento 39 - Unidade de Saúde de Serviço de Apoio Diagnóstico Terapêutico (SADT) e subtipo de estabelecimento 39.03 para realizar, no mínimo, um dos procedimentos definidos na Seção V do Capítulo I do Título III da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 599/2006, Art. 4º, § 8º)
I - os Municípios com qualquer base populacional poderão cadastrar o(s) LRPD; e (Origem: PRT MS/GM 599/2006, Art. 4º, § 8º, a)
II - não há restrição quanto à natureza jurídica para os estabelecimentos a serem cadastrados por esses Municípios como LRPD. (Origem: PRT MS/GM 599/2006, Art. 4º, § 8º, b)
§ 9º O gestor municipal ou estadual, interessado em credenciar/contratar um ou mais LRPD, encaminhará a proposta por intermédio de ofício à Área Técnica de Saúde Bucal - Departamento de Atenção Básica - Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 599/2006, Art. 4º, § 9º)
§ 10. A proposta que trata da implantação dos LRPD deverá contemplar, minimamente, os seguintes elementos: (Origem: PRT MS/GM 599/2006, Art. 4º, § 10)
I - identificação do Município ou do Estado pleiteante e do Estabelecimento de Saúde, com cópia do CNES; (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, a)
II - identificação da área de abrangência do serviço que irá ser ofertado, indicando qual Município, região ou microrregião é referência, mencionando, inclusive, a população coberta; (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, b)
III - descrição dos procedimentos que serão ofertados; e (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, c)
IV - emissão de documento, pelo gestor, informando a capacidade de produção, por mês, do estabelecimento a ser credenciado/contratado. (Origem: PRT MS/GM 599/2006, Art. 4º, § 10, d)
§ 11. O Departamento de Atenção Básica, da Secretaria de Atenção à Saúde (DAB/SAS) realizará avaliação trimestral da produção total realizada pelo Município, com base nos dados extraídos dos sistemas de informação e de disseminação de dados, referentes aos procedimentos definidos no art. 196 da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 599/2006, Art. 4º, § 11)
§ 12. A verificação e a análise das informações dos procedimentos realizados nos LRPD será por meio do Sistema de Informação Ambulatorial do SUS (SIA/SUS). (Origem: PRT MS/GM 599/2006, Art. 4º, § 12)
Seção II
Do Programa de Melhoria do Acesso e Qualidade dos Centros de Especialidades Odontológicas (PMAQ-CEO)
Art. 586. Esta Seção dispõe sobre o Programa de Melhoria do Acesso e Qualidade dos Centros de Especialidades Odontológicas (PMAQ-CEO). (Origem: PRT MS/GM 1599/2015, Art. 1º)
Art. 587. O PMAQ-CEO tem como objetivo induzir a ampliação do acesso e a melhoria da qualidade nos CEO, com garantia de um padrão de qualidade comparável nacional, regional e localmente, de maneira a permitir maior transparência e efetividade das ações governamentais direcionadas à atenção especializada em saúde bucal. (Origem: PRT MS/GM 1599/2015, Art. 2º)
Art. 588. Constituem-se diretrizes do PMAQ-CEO: (Origem: PRT MS/GM 1599/2015, Art. 3º)
I - definir parâmetros de qualidade dos CEO, considerando as diferentes realidades de saúde, de maneira a promover uma maior resolutividade dos serviços especializados em saúde bucal; (Origem: PRT MS/GM 1599/2015, Art. 3º, I)
II - fortalecer o processo de referência e contra referência de saúde bucal; (Origem: PRT MS/GM 1599/2015, Art. 3º, II)
III - estimular processo contínuo e progressivo de melhoramento dos padrões e indicadores de acesso e de qualidade que envolva a gestão, o processo de trabalho e os resultados alcançados pelos CEO; (Origem: PRT MS/GM 1599/2015, Art. 3º, III)
IV - transparência em todas as suas etapas, permitindo-se o contínuo acompanhamento de suas ações e resultados pela sociedade; (Origem: PRT MS/GM 1599/2015, Art. 3º, IV)
V - envolver e mobilizar os gestores federal, estaduais, do Distrito Federal e municipais, as equipes dos CEO e os usuários num processo de mudança de cultura de gestão e qualificação da atenção especializada em saúde bucal; (Origem: PRT MS/GM 1599/2015, Art. 3º, V)
VI - desenvolver cultura de planejamento, negociação e contratualização, que implique na gestão dos recursos em função dos compromissos e resultados pactuados e alcançados; (Origem: PRT MS/GM 1599/2015, Art. 3º, VI)
VII - estimular a efetiva mudança do modelo de atenção em saúde bucal, o desenvolvimento dos trabalhadores e a orientação dos serviços em função das necessidades e da satisfação dos usuários; e (Origem: PRT MS/GM 1599/2015, Art. 3º, VII)
VIII - caráter voluntário para a adesão tanto pelos profissionais do CEO quanto pelos gestores municipais, a partir do pressuposto de que o seu êxito depende da motivação e proatividade dos atores envolvidos. (Origem: PRT MS/GM 1599/2015, Art. 3º, VIII)
Art. 589. O PMAQ-CEO será composto por 3 (três) fases e um Eixo Estratégico Transversal de Desenvolvimento que compõem um ciclo. (Origem: PRT MS/GM 1599/2015, Art. 4º)
§ 1º O PMAQ-CEO se refere a processos e fases que se sucedem para o desenvolvimento e a melhoria contínua da qualidade da atenção especializada em saúde bucal. (Origem: PRT MS/GM 1599/2015, Art. 4º, § 1º)
§ 2º Cada ciclo do PMAQ-CEO ocorrerá a cada 24 (vinte e quatro) meses. (Origem: PRT MS/GM 1599/2015, Art. 4º, § 2º)
Art. 590. A Fase 1 do PMAQ-CEO é denominada Adesão e Contratualização. (Origem: PRT MS/GM 1599/2015, Art. 5º)
§ 1º Na Fase 1, todos os CEO habilitados pelo Ministério da Saúde através de portaria específica, independente do Tipo, I, II ou III, poderão aderir ao PMAQ-CEO desde que se encontrem em conformidade com os critérios a serem definidos no Manual Instrutivo do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 5º, § 1º)
§ 2º O estado, o município ou o Distrito Federal poderá incluir no Programa um ou mais CEO sob sua gestão. (Origem: PRT MS/GM 1599/2015, Art. 5º, § 2º)
§ 3º Nesta Fase 1 serão observadas as seguintes etapas: (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º)
I - formalização da adesão pelo estado, município ou Distrito Federal, por intermédio do preenchimento de formulário eletrônico específico a ser indicado pelo Ministério da Saúde; (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º, I)
II - contratualização da equipe do CEO e do gestor Estadual, Municipal ou do Distrito Federal, de acordo com as diretrizes e critérios definidos do Manual Instrutivo do PMAQ-CEO; e (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º, II)
III - informação sobre a adesão do município deve ser encaminhada ao Conselho Municipal de Saúde, à CIR e à CIB. No caso do estado, a Comissão Intergestores Bipartite e o Distrito Federal deve encaminhar informação sobre a adesão ao respectivo Conselho de Saúde. (Origem: PRT MS/GM 1599/2015, Art. 5º, § 3º, III)
§ 4º A Fase 1 será realizada pelos CEO que ingressarem no PMAQ-CEO pela primeira vez a cada ciclo. (Origem: PRT MS/GM 1599/2015, Art. 5º, Parágrafo Único)
Art. 591. A Fase 2 do PMAQ-CEO é denominada Certificação e será composta por: (Origem: PRT MS/GM 1599/2015, Art. 6º)
I - avaliação externa de desempenho dos CEO e da gestão da atenção especializada em saúde bucal, que será coordenada de forma tripartite e realizada por instituições de ensino e/ou pesquisa, por meio da verificação de evidências para um conjunto de padrões previamente determinados e pesquisa de satisfação do usuário; (Origem: PRT MS/GM 1599/2015, Art. 6º, I)
II - avaliação de desempenho dos indicadores contratualizados na etapa de adesão e contratualização, conforme disposto no art. 590; e (Origem: PRT MS/GM 1599/2015, Art. 6º, II)
III - verificação da realização de momento autoavaliativo pelos profissionais dos CEO. (Origem: PRT MS/GM 1599/2015, Art. 6º, III)
§ 1º Os CEOs contratualizados avaliados nos termos deste artigo receberão as seguintes classificações de desempenho: (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º)
I - ótimo; (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, I)
II - muito bom; (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, II)
III - bom; (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, III)
IV - regular; e (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, IV)
V - ruim. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 1º, V)
§ 2º Caso o CEO contratualizado não alcance um conjunto de padrões mínimos de qualidade considerados essenciais, nos termos do Manual Instrutivo do PMAQ-CEO, ele será automaticamente certificado com desempenho ruim. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 2º)
§ 3º Para que o CEO seja classificada com o desempenho ótimo, além de obter uma nota mínima, deverá alcançar um conjunto de padrões considerados estratégicos, nos termos do Manual Instrutivo do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 3º)
§ 4º O conjunto das classificações de desempenho dos CEOs contratualizados comporá o Fator de Desempenho do Distrito Federal, do estado e de cada município. (Origem: PRT MS/GM 1599/2015, Art. 6º, § 4º)
Art. 592. A Fase 3 do PMAQ-CEO é denominada Recontratualização, que se caracteriza pela pactuação singular dos estados, municípios e do Distrito Federal com incremento de novos padrões e indicadores de qualidade, estimulando a institucionalização de um processo cíclico e sistemático a partir dos resultados verificados nas Fases 2 do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 7º)
Parágrafo Único. A Fase 3 será realizada pelos CEO que participaram do PMAQ-CEO em ciclo anterior. (Origem: PRT MS/GM 1599/2015, Art. 7º, Parágrafo Único)
Art. 593. O Eixo Estratégico Transversal de Desenvolvimento do PMAQ-CEO é composto pelos seguintes elementos: (Origem: PRT MS/GM 1599/2015, Art. 8º)
I - autoavaliação, a ser feita pela equipe do CEO a partir de instrumentos ofertados pelo PMAQ-CEO ou outros definidos e pactuados pelo município, Distrito Federal, estado ou Região de Saúde; (Origem: PRT MS/GM 1599/2015, Art. 8º, I)
II - monitoramento, a ser realizado pela equipe do CEO, pela Secretaria Municipal de Saúde e pela Secretaria de Estado da Saúde do Distrito Federal, pela Secretaria de Estado da Saúde e pelo Ministério da Saúde em parceria com as CIR, a partir dos indicadores de saúde contratualizados na Fase 1 do PMAQ-CEO; (Origem: PRT MS/GM 1599/2015, Art. 8º, II)
III - educação permanente, por meio de ações dos gestores municipais, do Distrito Federal, estaduais e federal, considerando-se as necessidades de educação permanente das equipes dos CEO; (Origem: PRT MS/GM 1599/2015, Art. 8º, III)
IV - apoio institucional, a partir de estratégia de suporte aos CEO pelos gestores municipais e à gestão municipal pelas Secretarias de Estado da Saúde (SES), Conselhos de Secretarias Municipais de Saúde (COSEMS), CIR, CIB e Ministério da Saúde (MS); e (Origem: PRT MS/GM 1599/2015, Art. 8º, IV)
V - cooperação horizontal (presencial e/ou virtual), que deverá ocorrer entre equipes do CEO e entre gestores, com o intuito de permitir a troca de experiências e práticas promotoras de melhoria da qualidade da atenção especializada em saúde bucal. (Origem: PRT MS/GM 1599/2015, Art. 8º, V)
Parágrafo Único. O Eixo Estratégico Transversal de Desenvolvimento deve ser entendido como transversal em todas as Fases, de maneira a assegurar que as ações de promoção da melhoria da qualidade possam ser desenvolvidas em todas as etapas do ciclo do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 8º, Parágrafo Único)
Art. 594. O Grupo de Trabalho de Atenção à Saúde da CIT acompanhará o desenvolvimento do PMAQ-CEO, com avaliação e definição, inclusive, dos instrumentos utilizados no Programa. (Origem: PRT MS/GM 1599/2015, Art. 11)
Parágrafo Único. O Grupo de Trabalho de que trata o "caput" poderá convidar especialistas para discussão e manifestação acerca de elementos do PMAQ-CEO. (Origem: PRT MS/GM 1599/2015, Art. 11, Parágrafo Único)
Art. 595. O Ministério da Saúde, por meio do DAB/SAS/MS, publicará o Manual Instrutivo do PMAQ-CEO, com a metodologia pactuada e outros detalhamentos do Programa. (Origem: PRT MS/GM 1599/2015, Art. 12)
CAPÍTULO VI
DO PROGRAMA DE HUMANIZAÇÃO NO PRÉ-NATAL E NASCIMENTO
Art. 596. Fica instituído o Programa de Humanização no Pré-natal e Nascimento, no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 569/2000, Art. 1º)
Parágrafo Único. O Programa objeto deste Artigo será executado de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, municípios e do Distrito Federal e tem por objetivo o desenvolvimento de ações de promoção, prevenção e assistência à saúde de gestantes e recém-nascidos, promovendo a ampliação do acesso a estas ações, o incremento da qualidade e da capacidade instalada da assistência obstétrica e neonatal bem como sua organização e regulação no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 569/2000, Art. 1º, Parágrafo Único)
Art. 597. São princípios e diretrizes para a estruturação do Programa de Humanização no Pré-natal e Nascimento: (Origem: PRT MS/GM 569/2000, Art. 2º)
I - toda gestante tem direito ao acesso a atendimento digno e de qualidade no decorrer da gestação, parto e puerpério; (Origem: PRT MS/GM 569/2000, Art. 2º, a)
II - toda gestante tem direito ao acompanhamento pré-natal adequado de acordo com os princípios gerais e condições estabelecida no Anexo LXXXI ; (Origem: PRT MS/GM 569/2000, Art. 2º, b)
III - toda gestante tem direito de saber e ter assegurado o acesso à maternidade em que será atendida no momento do parto; (Origem: PRT MS/GM 569/2000, Art. 2º, c)
IV - toda gestante tem direito à assistência ao parto e ao puerpério e que esta seja realizada de forma humanizada e segura, de acordo com os princípios gerais e condições estabelecidas no Anexo LXXXII ; . (Origem: PRT MS/GM 569/2000, Art. 2º, d)
V - todo recém-nascido tem direito à assistência neonatal de forma humanizada e segura; (Origem: PRT MS/GM 569/2000, Art. 2º, e)
VI - as autoridades sanitárias dos âmbitos federal, estadual e municipal são responsáveis pela garantia dos direitos enunciados nas alíneas acima. (Origem: PRT MS/GM 569/2000, Art. 2º, f)
Art. 598. O Programa de Humanização no Pré-natal e Nascimento será constituído pelos seguintes componentes, regulamentados em ato próprio do Ministério da Saúde: (Origem: PRT MS/GM 569/2000, Art. 3º)
I - Componente I - Incentivo à Assistência Pré-natal; (Origem: PRT MS/GM 569/2000, Art. 3º, a)
II - Componente II - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal; (Origem: PRT MS/GM 569/2000, Art. 3º, b)
III - Componente III - Nova Sistemática de Pagamento da Assistência ao Parto. (Origem: PRT MS/GM 569/2000, Art. 3º, c)
§ 1º O Componente I - Incentivo à Assistência Pré-natal, tem o objetivo de estimular os estados e municípios, de acordo com os princípios e critérios estabelecidos, a realizarem o acompanhamento pré-natal completo e o cadastramento das gestantes; (Origem: PRT MS/GM 569/2000, Art. 3º, § 1º)
§ 2º O Componente II - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal terá dois componentes; (Origem: PRT MS/GM 569/2000, Art. 3º, § 2º)
I - criação de condições técnicas, financeiras e operacionais que permitam o desenvolvimento de mecanismos destinados à organização e regulação da assistência obstétrica e neonatal por meio do estabelecimento de protocolos de regulação, da estruturação de Centrais de Regulação e estruturação de sistemas móveis de atendimento pré e inter-hospitalares, e (Origem: PRT MS/GM 569/2000, Art. 3º, § 2º, a)
II - financiamento do incremento da qualidade assistencial e da capacidade instalada obstétrica e neonatal de hospitais públicos e filantrópicos integrantes do Sistema Único de Saúde que prestem este tipo de assistência e que cumpram os requisitos e critérios de elegibilidade estabelecidos. (Origem: PRT MS/GM 569/2000, Art. 3º, § 2º, b)
§ 3º O Componente III-A nova sistemática de pagamento da assistência ao parto, tem a finalidade de melhorar as condições do custeio desta assistência nos hospitais cadastrados no Sistema de Informações Hospitalares do Sistema Único de Saúde SIH/SUS e terá dois componentes: (Origem: PRT MS/GM 569/2000, Art. 3º, § 3º)
I - alteração do valor e forma de remuneração da assistência ao parto, e (Origem: PRT MS/GM 569/2000, Art. 3º, § 3º, a)
II - pagamento de um adicional sobre o valor de que trata a alínea "a" para aqueles hospitais que prestarem assistência ao parto a gestantes cadastradas no Programa de Incentivo à Assistência Pré-natal e que tenham o acompanhamento pré-natal completo. (Origem: PRT MS/GM 569/2000, Art. 3º, § 3º, b)
Art. 599. Ficam estabelecidas, para cada nível de gestão do Sistema Único de Saúde, as seguintes competências/atribuições na implementação do Programa de Humanização no Pré-natal e Nascimento: (Origem: PRT MS/GM 569/2000, Art. 5º)
§ 1º São competências/atribuições do Ministério da Saúde: (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º)
I - articular com estados, municípios e Distrito Federal a implantação do Programa e estabelecer mecanismos de controle, avaliação e acompanhamento do processo; (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, a)
II - assessorar os estados, municípios e o Distrito Federal na elaboração de seus respectivos Programas Estaduais de Humanização no Pré-natal e Nascimento, na estruturação das Centrais de Regulação Obstétrica e Neonatal e na implantação dos sistemas móveis de atendimento; (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, b)
III - estabelecer normas técnicas e critérios de elegibilidade para inclusão no Programa; (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, c)
IV - alocar recursos destinados ao co-financiamento dos componentes integrantes do Programa. (Origem: PRT MS/GM 569/2000, Art. 5º, § 1º, d)
§ 2º São competências/atribuições das Secretarias de Saúde dos Estados e do Distrito Federal: (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º)
I - elaborar, em articulação com as respectivas Secretarias Municipais de Saúde e como condição indispensável à implantação do Programa Nacional,os Programas Estaduais de Humanização no Pré-natal e Nascimento, organizando seus sistemas estaduais/regionais de assistência obstétrica e neonatal que contemplem ações voltadas para a atenção básica, o apoio laboratorial, a atenção ambulatorial especializada e a assistência hospitalar obstétrica e neonatal, explicitando as unidades de referência para o diagnóstico, a atenção ambulatorial à gestação de alto risco e a assistência ao parto de baixo e alto risco; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, a)
II - coordenar e executar, em articulação com as Secretarias Municipais de Saúde, a programação física e financeira da assistência obstétrica e neonatal; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, b)
III - estruturar e garantir o funcionamento das Centrais Estaduais de Regulação Obstétrica e Neonatal; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, c)
IV - assessorar os municípios na estruturação de suas respectivas Centrais Municipais de Regulação Obstétrica e Neonatal e na implantação dos sistemas móveis de atendimento; . (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, d)
V - assessorar os municípios no processo de implementação do Programa e seus respectivos componentes e no desenvolvimento de mecanismos destinados a seu controle, avaliação e acompanhamento; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, e)
VI - alocar, complementarmente, recursos financeiros próprios para o desenvolvimento do Programa; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, f)
VII - monitorar o desempenho do respectivo programa e os resultados alcançados, mediante o acompanhamento de indicadores de morbimortalidade materna e neonatal, no âmbito estadual; (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, g)
VIII - manter atualizados os bancos de dados que estejam sob sua responsabilidade SIM, SINASC, SIPAC. (Origem: PRT MS/GM 569/2000, Art. 5º, § 2º, h)
§ 3º São competências/atribuições das Secretarias Municipais de Saúde: (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º)
I - participar da elaboração do Programa Estadual de Humanização no Pré-natal e Nascimento; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, a)
II - estruturar e garantir o funcionamento da Central Municipal de Regulação Obstétrica e Neonatal, naqueles municípios que cumpram os critérios de elegibilidade estabelecidos; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, b)
III - estruturar e garantir o funcionamento do sistema móvel de atendimento pré e inter-hospitalar, naqueles municípios que cumpram os critérios de elegibilidade estabelecidos; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, c)
IV - garantir o atendimento pré-natal e do puerpério em seu próprio território e realizar o cadastro de suas gestantes; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, d)
V - identificar laboratórios e garantir a realização dos exames básicos e o acesso aos exames de seguimento do pré-natal, em seu próprio território ou em outro município, mediante programação regional; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, e)
VI - estabelecer a referência para a assistência ambulatorial e hospitalar à gestante de alto risco, em seu próprio território ou em outro município, mediante programação regional; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, f)
VII - alocar, complementarmente, recursos financeiros próprios para o desenvolvimento do Programa; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, g)
VIII - monitorar o desempenho do respectivo programa e os resultados alcançados mediante o acompanhamento de indicadores de morbimortalidade materna e neonatal, no âmbito municipal; (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, h)
IX - manter atualizados os bancos de dados que estejam sob sua responsabilidade SIM, SINASC, SIPAC. (Origem: PRT MS/GM 569/2000, Art. 5º, § 3º, i)
Seção IDo Componente I do Programa de Humanização no Pré-natal e Nascimento - Incentivo à Assistência Pré-natal no âmbito do SUS
Art. 600. Fica instituído o Componente I do Programa de Humanização no Pré-natal e Nascimento - Incentivo à Assistência Pré-natal no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 570/2000, Art. 1º)
Parágrafo Único. O Componente objeto deste artigo tem o objetivo de estimular os estados e municípios a incrementar a qualidade do acompanhamento pré-natal, promovendo o cadastramento de suas gestantes, organizando seus sistemas assistenciais, municipais e estaduais, garantindo a realização do acompanhamento pré-natal completo e a articulação deste com a assistência ao parto e puerpério. (Origem: PRT MS/GM 570/2000, Art. 1º, Parágrafo Único)
Art. 601. A adesão ao Componente I - Incentivo à Assistência Pré-natal será condicionada ao cumprimento, pelos municípios pleiteantes, dos seguintes requisitos: (Origem: PRT MS/GM 570/2000, Art. 4º)
I - dispor de sistema de assistência pré-natal, ao parto; puerpério e neonatal devidamente organizado, com definição de unidades de referência para o diagnóstico, assistência ambulatorial e hospitalar; (Origem: PRT MS/GM 570/2000, Art. 4º, I)
II - dispor de rede ambulatorial para realização do pré-natal e consulta no puerpério; (Origem: PRT MS/GM 570/2000, Art. 4º, II)
III - dispor de laboratórios vinculados à sua rede para realização dos exames básicos ou garantir acesso; (Origem: PRT MS/GM 570/2000, Art. 4º, III)
IV - dispor de Unidade(s) de Referência para o Atendimento Ambulatorial e Hospitalar à Gestante de Alto Risco ou garantir acesso; (Origem: PRT MS/GM 570/2000, Art. 4º, IV)
V - estabelecer mecanismos de vinculação pré-natal/parto; (Origem: PRT MS/GM 570/2000, Art. 4º, V)
VI - estabelecer mecanismos de cadastramento no pré-natal das gestantes até o 4° mês da gestação e garantir, de acordo com os princípios gerais e condições para o acompanhamento pré-natal estabelecidos no Anexo LXXXI , a realização dos seguintes procedimentos: (Origem: PRT MS/GM 570/2000, Art. 4º, VI)
a) realizar a primeira consulta de pré-natal até o 4° mês da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VI, a)
b) Realizar, no mínimo, 06 (seis) consultas de acompanhamento pré-natal, sendo, preferencialmente, uma no primeiro trimestre, duas no segundo e três no terceiro trimestre da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VI, b)
c) Realizar 01 (uma) consulta no puerpério, até 42 dias após o nascimento; (Origem: PRT MS/GM 570/2000, Art. 4º, VI, c)
VII - realizar os seguintes exames laboratoriais: (Origem: PRT MS/GM 570/2000, Art. 4º, VII)
a) ABO-Rh, na primeira consulta; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, a)
b) VDRL, um exame na primeira consulta e um na 30ª semana da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, b)
c) urina - rotina, (elementos anormais e sedimentos) - um exame na primeira consulta e um na 30ª semana da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, c)
d) glicemia de jejum, um exame na primeira consulta e um na 30ª semana da gestação; (Origem: PRT MS/GM 570/2000, Art. 4º, VII, d)
e) HB/Ht, na primeira consulta. (Origem: PRT MS/GM 570/2000, Art. 4º, VII, e)
VIII - oferta de testagem anti-HIV, com um exame na primeira consulta, naqueles municípios com população acima de 50 mil habitantes; (Origem: PRT MS/GM 570/2000, Art. 4º, VIII)
IX - aplicação de vacina antitetânica dose imunizante (segunda do esquema recomendado) ou dose de reforço em mulheres já imunizadas; (Origem: PRT MS/GM 570/2000, Art. 4º, IX)
X - realização de atividades educativas; (Origem: PRT MS/GM 570/2000, Art. 4º, X)
XI - classificação de risco gestacional a ser realizada na primeira consulta e nas subsequentes; (Origem: PRT MS/GM 570/2000, Art. 4º, XI)
XII - garantir às gestantes classificadas como de risco, atendimento ou acesso à unidade de referência para atendimento ambulatorial e/ou hospitalar à gestação de alto risco. (Origem: PRT MS/GM 570/2000, Art. 4º, XII)
Art. 602. Para ser incluído no Componente I - Incentivo à Assistência Pré-natal, o município pleiteante deverá apresentar o TERMO DE ADESÃO, e integraremos Planos Regionais para a Assistência à Gestação, ao Parto e ao Recém-Nascido, a serem articulados pela respectiva Secretaria Estadual de Saúde/SES, a seguir encaminhando-os à Secretaria de Políticas de Saúde, para fins de publicação. (Origem: PRT MS/GM 570/2000, Art. 5º)
Art. 603. O Incentivo à Assistência Pré-natal a ser pago pelo Ministério da Saúde aos municípios que aderirem ao Componente será operacionalizado da seguinte forma: (Origem: PRT MS/GM 570/2000, Art. 8º)
§ 1º O município cadastrará as gestantes na 1ª consulta de pré-natal (até o 4° mês de gravidez), através da Ficha de Cadastramento da Gestante-do Componente I Incentivo à Assistência Pré-natal, constante do Anexo LXXXIII ; (Origem: PRT MS/GM 570/2000, Art. 8º, § 1º)
§ 2º A Ficha de Cadastramento da Gestante deverá alimentar o SISPRENATAL, programa a ser disponibilizado pelo DATASUS; (Origem: PRT MS/GM 570/2000, Art. 8º, § 2º)
§ 3º A Ficha de Cadastramento da Gestante conterá os seguintes dados de alimentação obrigatória: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º)
I - dados de cadastramento: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I)
a) nome da unidade de saúde; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, a)
b) código da unidade no SIA; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, b)
c) nome do município; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, c)
d) código do município no IBGE; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, d)
e) sigla da UF; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, e)
f) código da UF no IBGE. (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, I, f)
II - identificação da gestante: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II)
a) número da gestante no SISPRENATAL; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, a)
b) gestante acompanhada pelo PSF e código da área e da microárea; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, b)
c) nome da Gestante; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, c)
d) data do nascimento da gestante - dia/mês/ano; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, d)
e) nome da mãe da gestante; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, e)
f) endereço residencial; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, f)
g) número do cartão SUS; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, g)
h) Número do CPF; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, h)
i) Certidão de Nascimento ou Casamento; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, i)
j) Identidade; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, j)
k) carteira de trabalho. (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, II, k)
III - dados assistenciais: (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III)
a) data da 1ª consulta pré-natal; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III, a)
b) data da última menstruação; (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III, b)
c) responsável pela primeira consulta pré-natal. (Origem: PRT MS/GM 570/2000, Art. 8º, § 3º, III, c)
§ 4º A Ficha de Cadastramento da Gestante referente ao Componente I - Incentivo à Assistência Pré-Natal, será emitida em 02 (duas) vias, devendo 01 (uma) via ser arquivada no prontuário da gestante na unidade onde a mesma realizou a primeira consulta pré-natal ou consulta de cadastramento, e a segunda deve ser encaminhada para digitação das informações no SISPRENATAL, para possibilitar o recebimento do valor do incentivo. (Origem: PRT MS/GM 570/2000, Art. 8º, § 4º)
§ 5º Após a alimentação do SISPRENATAL com a Ficha de Cadastramento da Gestante, o próprio sistema gerará automaticamente um BPA magnético específico, para importação no SIA/SUS, com o código de procedimento 07.071.02.7 - ADESÃO AO COMPONENTE I - INCENTIVO A ASSISTÊNCIA PRÉ NATAL, que passa a integrar a Tabela do SIA-SUS no Subgrupo 07.070.00.4 - Procedimento de Assistência Pré-Natal. É considerado executado quando realizado o preenchimento e a alimentação do SISPRENATAL com todos os campos da Ficha de Cadastramento da Gestante - Componente I - Incentivo à Assistência Pré-Natal: Nível de Hierarquia: 01, 02 ,03, 04; 05, 06,07. 08; Serviço/classificação: 32/122, 32/123; Atividade profissional: 01, 22, 29, 59, 60, 73, 74, 76, 79, 84; Tipo de Prestador: 05, 15, 04,14; Tipo de Atendimento: 00; Grupo de Atendimento: 00; Faixa Etária: 00; Valor: 10,00. (Origem: PRT MS/GM 570/2000, Art. 8º, § 5º)
I - o procedimento Adesão ao Componente I - Incentivo à Assistência Pré-natal só será efetuado pelo SIA/SUS a unidades públicas municipais ou estaduais; (Origem: PRT MS/GM 570/2000, Art. 8º, § 5º, I)
§ 6º O SISPRENATAL terá duas saídas, sendo uma delas para alimentação do SIA/SUS e outra para formação da Base de Dados Nacional do próprio sistema. (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º)
I - Para alimentação do SIA/SUS, as Secretarias Municipais de Saúde deverão observar o cronograma definido pelo DATASUS para aquele sistema; (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, I)
II - A saída do SISPRENATAL com os dados exclusivos do programa deverá ser apresentada pelas Secretarias Municipais de Saúde, por meio magnético, com a evolução aos atendimentos à Secretaria Estadual de Saúde/SES para transmissão ao DATASUS, na área de conferência 38, até o dia 15 de cada mês; (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, II)
III - O DATASUS remeterá à SES o recibo de entrada dos dados na Base Nacional SISPRENATAL; (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, III)
IV - O DATASUS atualizará a Base Nacional do SISPRENATAL, até o 5° dia útil, a contar da data de transferência dos dados pela SES. (Origem: PRT MS/GM 570/2000, Art. 8º, § 6º, IV)
§ 7º No término do pré-natal, após a realização do parto e da consulta do puerpério, e quando devidamente alimentado, o SISPRENATAL gerará BPA magnético específico, lançando o código de procedimento abaixo discriminado, que passa a integrar a tabela do SIA/SUS: 07.071.03.5 - CONCLUSÃO DA ASSISTÊNCIA PRENATAL. É considerado executado o procedimento quando realizadas as 6 (seis) consultas de pré-natal, todos os exames obrigatórios, a imunização anti-tetânica, a realização do parto e da consulta do puerpério nas gestantes cadastradas no SISPRENATAL: Nível de Hierarquia: 01, 02, 03, 04, 05, 06, 07, 08; Serviço/classificação: 32/122; 32/123; Tipo de Prestador: 05, 15, 04, 14; Atividade profissional: 01 22 29 59 60 73 74 76 79 84; Tipo de Atendimento: 00; Grupo de Atendimento: 00; Faixa Etária: 00;Valor: 40,00. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º)
I - A cada consulta pré-natal realizada pela gestante acompanhada pelo Programa de Humanização no Pré-natal e Nascimento, o profissional responsável pela consulta, deverá preencher a FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES NO SISPRENATAL, que alimentará o sistema. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º, II)
II - Os dados referentes a cada gestante, constantes da FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES NO SISPRENATAL, constante do Anexo LXXXIV , serão consolidados pelo próprio sistema que emitirá BPA magnético específico, para importação no SIA/SUS, possibilitando o pagamento do incentivo 07.071.035 - Conclusão da Assistência Pré-natal. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º, III)
III - O SISPRENATAL, será integrado ao SGAIH permitindo cruzamento de informações e disponibilizando um relatório constando o número de cadastramento da gestante no SISPRENATAL e o número da AIH utilizada no parto da mesma gestante. (Origem: PRT MS/GM 570/2000, Art. 8º, § 7º, IV)
Art. 604. As Secretarias Estaduais de Saúde, em articulação com as Secretarias Municipais de Saúde, deverão elaborar os Planos Regionais para a Assistência à Gestação, Parto e ao Recém-nascido. (Origem: PRT MS/GM 570/2000, Art. 9º)
Art. 605. A Secretaria de Atenção à Saúde adotará as medidas necessárias ao fiel cumprimento do disposto nesta Seção, ficando autorizada a realizar as alterações de códigos de procedimento bem como sua descrição e valor, quando pertinente. (Origem: PRT MS/GM 570/2000, Art. 12)
Seção II
Do Componente II do Programa de Humanização no Pré-natal e Nascimento - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal, no âmbito do SUS
Art. 606. Fica instituído o Componente II do Programa de Humanização no Pré-natal e Nascimento - Organização, Regulação e Investimentos na Assistência Obstétrica e Neonatal, no âmbito do Sistema Único de Saúde. (Origem: PRT MS/GM 571/2000, Art. 1º)
Art. 607. A Secretaria de Atenção à Saúde estabelecerá os requisitos para a participação de estados, municípios e Distrito Federal no componente de que trata esta Seção, os critérios de elegibilidade de municípios e hospitais a serem contemplados, os quantitativos de recursos do montante global a serem destinados a cada atividade, os componentes de despesa que serão autorizados para cada tipo de atividade, bem como adote as demais medidas necessárias ao fiel cumprimento desta Seção. (Origem: PRT MS/GM 571/2000, Art. 3º)
Parágrafo Único. As Secretarias de Saúde dos estados, municípios e do Distrito Federal e os hospitais que cumprirem com os requisitos e critérios estabelecidos, deverão elaborar projeto de investimentos específico, plano de trabalho e cronograma de desembolso a serem submetidos à apreciação da Secretaria de Atenção à Saúde, que após aprovação, os enviará à Secretaria-Executiva para a celebração dos respectivos convênios. (Origem: PRT MS/GM 571/2000, Art. 3º, Parágrafo Único)
Seção III
Do Componente III do Programa de Humanização no Pré-natal e Nascimento - Nova Sistemática de Pagamento à Assistência ao Parto
Art. 608. Fica instituído o Componente III do Programa de Humanização no Pré-natal e Nascimento Nova Sistemática de Pagamento à Assistência ao Parto. (Origem: PRT MS/GM 572/2000, Art. 1º)
Parágrafo Único. O Componente objeto deste artigo estabelecerá alterações na sistemática de pagamento da assistência ao parto, possibilitando a melhoria da Qualidade assistencial. (Origem: PRT MS/GM 572/2000, Art. 1º, Parágrafo Único)
Art. 609. A assistência pré-natal deverá ser realizada de acordo com os princípios gerais e condições para o acompanhamento pré-natal estabelecidas no Capítulo VI do Título IV e ser efetuada, preferencialmente, nos termos da Seção I do Capítulo VI do Título IV da mesma data, que institui o Componente I do Programa de Humanização no Pré-natal e Nascimento - Incentivo à Assistência Pré-natal no âmbito do Sistema Único de Saúde; (Origem: PRT MS/GM 572/2000, Art. 2º, § 2º)
§ 1º A assistência ao parto e puerpério deverá ser realizada de acordo com os princípios gerais e condições estabelecidas no Anexo LXXXII ; (Origem: PRT MS/GM 572/2000, Art. 2º, § 3º)
§ 2º As unidades prestadoras de serviços do Sistema Único de Saúde deverão integrar-se ao sistema de saúde local, no sentido de possibilitar a adequada organização e regulação assistencial, a ampliação do acesso e da qualidade do atendimento e viabilizando a atenção ao pré-natal, parto, puerpério e assistência ao recém-nascido de forma mais humanizada; (Origem: PRT MS/GM 572/2000, Art. 2º, § 4º)
§ 3º Os Centros de Parto Normal, Casas de Parto, Hospitais e Maternidades integrantes do Sistema único de Saúde deverão estar vinculadas às Unidades Básicas e de Saúde da Família de sua área de abrangência. (Origem: PRT MS/GM 572/2000, Art. 2º, § 5º)
Art. 610. Determina que a Secretaria de Atenção à Saúde priorize o envio de cartas, às pacientes submetidas aos procedimentos de parto nas Unidades prestadoras de serviços do SUS, com questionário de avaliação das condições e da qualidade do atendimento prestado. (Origem: PRT MS/GM 572/2000, Art. 5º)
Art. 611. É de responsabilidade dos gestores estaduais e municipais, dependendo das prerrogativas e competências compatíveis com o nível de gestão, efetuar o acompanhamento, controle, avaliação e auditoria que garantam o cumprimento das regras do Componente III do Programa de Humanização no Pré-natal e Nascimento. (Origem: PRT MS/GM 572/2000, Art. 8º)
Art. 612. A Secretaria de Atenção à Saúde adotará as medidas necessárias ao fiel cumprimento das regras do Componente III do Programa de Humanização no Pré-natal e Nascimento, ficando autorizada a realizar as alterações de códigos de procedimento bem como sua descrição e valor quando pertinente. (Origem: PRT MS/GM 572/2000, Art. 10)
Seção IV
Da Atenção Integral e Humanizada à Mulher e ao Recém-nascido no Alojamento Conjunto
Art. 613. Ficam instituídas as diretrizes para atenção integral e humanizada à mulher e ao recém-nascido no Alojamento Conjunto. (Origem: PRT MS/GM 2068/2016, Art. 1º)
Parágrafo Único. As diretrizes dispostas nesta Seção aplicam-se ao Alojamento Conjunto de serviços de saúde, públicos e privados, inclusive das Forças Armadas, de hospitais universitários e de ensino. (Origem: PRT MS/GM 2068/2016, Art. 1º, Parágrafo Único)
Art. 614. O Alojamento Conjunto é o local em que a mulher e o recém-nascido sadio, logo após o nascimento, permanecem juntos, em tempo integral, até a alta. (Origem: PRT MS/GM 2068/2016, Art. 2º)
Parágrafo Único. O Alojamento Conjunto possibilita a atenção integral à saúde da mulher e do recém-nascido, por parte do serviço de saúde. (Origem: PRT MS/GM 2068/2016, Art. 2º, Parágrafo Único)
Art. 615. A manutenção da mulher e do recém-nascido em Alojamento Conjunto apresenta as seguintes vantagens: (Origem: PRT MS/GM 2068/2016, Art. 3º)
I - favorece e fortalece o estabelecimento do vínculo afetivo entre pai, mãe e filho; (Origem: PRT MS/GM 2068/2016, Art. 3º, I)
II - propicia a interação de outros membros da família com o recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 3º, II)
III - favorece o estabelecimento efetivo do aleitamento materno com o apoio, promoção e proteção, de acordo com as necessidades da mulher e do recém-nascido, respeitando as características individuais; (Origem: PRT MS/GM 2068/2016, Art. 3º, III)
IV - propicia aos pais e acompanhantes a observação e cuidados constantes ao recém-nascido, possibilitando a comunicação imediata de qualquer anormalidade; (Origem: PRT MS/GM 2068/2016, Art. 3º, IV)
V - fortalece o autocuidado e os cuidados com o recém nascido, a partir de atividades de educação em saúde desenvolvidas pela equipe multiprofissional; (Origem: PRT MS/GM 2068/2016, Art. 3º, V)
VI - diminui o risco de infecção relacionada à assistência em serviços de saúde; e (Origem: PRT MS/GM 2068/2016, Art. 3º, VI)
VII - propicia o contato dos pais e familiares com a equipe multiprofissional por ocasião da avaliação da mulher e do recém nascido, e durante a realização de outros cuidados. (Origem: PRT MS/GM 2068/2016, Art. 3º, VII)
Art. 616. O Alojamento Conjunto destina-se a: (Origem: PRT MS/GM 2068/2016, Art. 4º)
I - mulheres clinicamente estáveis e sem contraindicações para a permanência junto ao seu bebê; (Origem: PRT MS/GM 2068/2016, Art. 4º, I)
II - recém-nascidos clinicamente estáveis, com boa vitalidade, capacidade de sucção e controle térmico; peso maior ou igual a 1800 gramas e idade gestacional maior ou igual a 34 semanas; (Origem: PRT MS/GM 2068/2016, Art. 4º, II)
III - recém-nascidos com acometimentos sem gravidade, como por exemplo: icterícia, necessitando de fototerapia, malformações menores, investigação de infecções congênitas sem acometimento clínico, com ou sem microcefalia; e (Origem: PRT MS/GM 2068/2016, Art. 4º, III)
IV - recém-nascidos em complementação de antibioticoterapia para tratamento de sífilis ou sepse neonatal após estabilização clínica na UTI ou UCI neonatal. (Origem: PRT MS/GM 2068/2016, Art. 4º, IV)
§ 1º Cabe ao serviço de saúde realizar a gestão eficiente de leitos de forma que mulheres em outras situações ginecológicas e obstétricas, especialmente em situação de perda gestacional, não permaneçam no mesmo quarto ou enfermaria com puérperas e recémnascidos. (Origem: PRT MS/GM 2068/2016, Art. 4º, § 1º)
§ 2º Incumbe ao serviço de saúde evitar que puérperas que não podem amamentar por doença de base ou uso de medicamentos, permaneçam junto com mulheres que amamentam. (Origem: PRT MS/GM 2068/2016, Art. 4º, § 2º)
Art. 617. O Alojamento Conjunto contará com os seguintes recursos humanos mínimos: (Origem: PRT MS/GM 2068/2016, Art. 5º)
I - Enfermagem: (Origem: PRT MS/GM 2068/2016, Art. 5º, I)
a) profissional de nível superior para função de coordenação, preferencialmente com habilitação em neonatologia/obstetrícia ou 2 (dois) anos de experiência profissional comprovada na área, com jornada horizontal diária mínima de quatro horas; (Origem: PRT MS/GM 2068/2016, Art. 5º, I, a)
b) profissional de nível superior para assistência, preferencialmente com habilitação em neonatologia/obstetrícia ou 2 (dois) anos de experiência profissional comprovada na área para cada 20 binômios mãe-RN ou fração em cada turno; e (Origem: PRT MS/GM 2068/2016, Art. 5º, I, b)
c) profissional de nível técnico para cada oito binômios mãe RN ou fração em cada turno. (Origem: PRT MS/GM 2068/2016, Art. 5º, I, c)
II - Pediatria: (Origem: PRT MS/GM 2068/2016, Art. 5º, II)
a) profissional médico para função de responsabilidade técnica com jornada horizontal diária mínima de 4 (quatro) horas, preferencialmente com habilitação em neonatologia ou título de especialista em pediatria fornecido pela Sociedade Brasileira de Pediatria ou residência médica em pediatria ou em neonatologia, reconhecida pelo Ministério da Educação; (Origem: PRT MS/GM 2068/2016, Art. 5º, II, a)
b) profissional médico para assistência com jornada horizontal diária mínima de quatro horas, preferencialmente com habilitação em neonatologia ou título de especialista em pediatria fornecido pela Sociedade Brasileira de Pediatria ou residência médica em pediatria ou em neonatologia, reconhecida pelo Ministério da Educação para cada 20 recém-nascidos ou fração; e (Origem: PRT MS/GM 2068/2016, Art. 5º, II, b)
c) profissional médico plantonista preferencialmente com habilitação em neonatologia ou título de especialista em pediatria fornecido pela Sociedade Brasileira de Pediatria ou residência médica em neonatologia ou residência médica em pediatria, reconhecida pelo Ministério da Educação para cada 20 recém-nascidos ou fração. Plantonista do alojamento conjunto poderá ser profissional da equipe da Unidade de Cuidados Intermediários Convencional ou Canguru (UCINCo ou UCINCa), prevista no Título IV do Anexo II da Portaria de Consolidação nº 3, ou, ainda, da equipe de assistência ao recém-nascido no nascimento quando o estabelecimento não disponibilizar de leitos UCINCo/UCINCa; (Origem: PRT MS/GM 2068/2016, Art. 5º, II, c)
III - Obstetrícia: (Origem: PRT MS/GM 2068/2016, Art. 5º, III)
a) profissional médico para função de responsabilidade técnica com jornada horizontal diária mínima de quatro horas, preferencialmente com habilitação em Ginecologia e Obstetrícia, ou título de especialista ou residência médica em Ginecologia e Obstetrícia; (Origem: PRT MS/GM 2068/2016, Art. 5º, III, a)
b) profissional médico para assistência, com jornada horizontal diária mínima de quatro horas, preferencialmente com habilitação em Ginecologia e Obstetrícia, ou título de especialista ou residência médica em Ginecologia e Obstetrícia para cada 20 puérperas ou fração; e (Origem: PRT MS/GM 2068/2016, Art. 5º, III, b)
c) profissional médico plantonista, preferencialmente com habilitação em Ginecologia e Obstetrícia, ou título de especialista ou residência médica em Ginecologia e Obstetrícia. Plantonista do Alojamento Conjunto poderá ser profissional da equipe de obstetras de plantão. (Origem: PRT MS/GM 2068/2016, Art. 5º, III, c)
§ 1º O profissional de Enfermagem de nível superior e o médico poderão acumular as funções de responsabilidade técnica e assistência. (Origem: PRT MS/GM 2068/2016, Art. 5º, § 1º)
§ 2º Os serviços de saúde que realizam 500 partos por ano ou menos poderão estabelecer outros arranjos de jornadas de trabalho, desde que seja garantida assistência integral e presencial à mulher e ao recém-nascido pelas equipes multiprofissionais. (Origem: PRT MS/GM 2068/2016, Art. 5º, § 2º)
§ 3º Outras categorias profissionais poderão ser necessárias na assistência à mulher e ao recém-nascido no Alojamento Conjunto, conforme necessidades específicas, tais como profissionais de ortopedia, neurologia, oftalmologia, cirurgia geral e infantil, assistente social, psicologia, nutrição, fisioterapia e fonoaudiologia. (Origem: PRT MS/GM 2068/2016, Art. 5º, § 3º)
Art. 618. Cabe à equipe multiprofissional no Alojamento Conjunto: (Origem: PRT MS/GM 2068/2016, Art. 6º)
I - avaliar as puérperas diariamente, com atenção aos sinais de alerta para complicações no período pós-parto, tais como sangramento vaginal aumentado, febre, dor exacerbada, edema assimétrico de extremidades, sinais inflamatórios de ferida cirúrgica, sinais de sofrimento psíquico e depressão pós-parto; (Origem: PRT MS/GM 2068/2016, Art. 6º, I)
II - promover e proteger o aleitamento materno sob livre demanda, apoiando a puérpera na superação de possíveis dificuldades de acordo com suas necessidades específicas e respeitando suas características individuais; (Origem: PRT MS/GM 2068/2016, Art. 6º, II)
III - garantir à mulher o direito a acompanhante, de sua livre escolha, durante toda a internação e a receber visitas diárias, inclusive de filhos menores; (Origem: PRT MS/GM 2068/2016, Art. 6º, III)
IV - estimular e facilitar a presença do pai sem restrição de horário, inclusive de genitor sócio-afetivo; (Origem: PRT MS/GM 2068/2016, Art. 6º, IV)
V - oferecer à mulher orientações relativas à importância de não ofertar ao recém-nascido nenhum outro alimento ou bebida, além do leite materno, exceto em situações especiais com prescrição médica ou de nutricionista, destacando que, nesses casos, deverá ser oferecido, preferencialmente, leite humano pasteurizado de Banco de Leite Humano; (Origem: PRT MS/GM 2068/2016, Art. 6º, V)
VI - oferecer à mulher orientações relativas à importância de não usar protetores de mamilo e não oferecer bicos artificiais ou chupetas ao recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 6º, VI)
VII - oferecer à mulher orientações sobre os riscos da amamentação cruzada amamentar outro recém-nascido que não seja o próprio filho, e da proibição desta prática no Alojamento Conjunto; (Origem: PRT MS/GM 2068/2016, Art. 6º, VII)
VIII - apoiar, incentivar e orientar a participação da mãe e do pai nos cuidados ao recém-nascido, bem como de outros familiares, de acordo com o desejo dos pais da criança; (Origem: PRT MS/GM 2068/2016, Art. 6º, VIII)
IX - orientar e estimular o contato pele a pele, posição canguru, pelo tempo que a mãe e o pai considerarem oportuno e prazeroso, especialmente quando se tratar de recém-nascido com peso inferior a 2500g; (Origem: PRT MS/GM 2068/2016, Art. 6º, IX)
X - realizar o exame clínico do recém-nascido em seu próprio berço ou no leito materno, preferencialmente na presença da mãe e do pai; (Origem: PRT MS/GM 2068/2016, Art. 6º, X)
XI - realizar o banho do recém-nascido na cuba de seu próprio berço ou banheira e assegurar a limpeza e a desinfecção entre o uso de acordo com padronização da Comissão de Controle de Infecção Hospitalar das respectivas maternidades. Durante o banho, orientar os cuidados necessários para a prevenção de hipotermia, incentivando a participação materna e paterna ou de outro acompanhante; (Origem: PRT MS/GM 2068/2016, Art. 6º, XI)
XII - avaliar o peso do recém-nascido de acordo com necessidades individuais; (Origem: PRT MS/GM 2068/2016, Art. 6º, XII)
XIII - adotar técnicas não farmacológicas de prevenção/redução da dor para a coleta de sangue e outros procedimentos dolorosos. Recomenda-se a sucção ao seio materno previamente, durante a realização de procedimentos; (Origem: PRT MS/GM 2068/2016, Art. 6º, XIII)
XIV - identificar e enfatizar os recursos disponíveis na comunidade e na rede de saúde local para atendimento continuado das mulheres e das crianças, referindo-as ou agendando-as para acompanhamento no serviço de saúde na primeira semana após o parto; (Origem: PRT MS/GM 2068/2016, Art. 6º, XIV)
XV - realizar atividades de educação em saúde, preferencialmente em grupo, com o objetivo de: (Origem: PRT MS/GM 2068/2016, Art. 6º, XV)
a) ampliar o autocuidado das mulheres e de cuidados com os recém-nascidos; (Origem: PRT MS/GM 2068/2016, Art. 6º, XV, a)
b) desfazer mitos relacionados à maternidade, à paternidade, ao aleitamento materno, ao puerpério, ao retorno à vida sexual, entre outros; e (Origem: PRT MS/GM 2068/2016, Art. 6º, XV, b)
c) oferecer orientações quanto aos cuidados de saúde, nutrição, higiene, saúde sexual e reprodutiva, destacando o direito a uma vida sexual livre, prazerosa e segura e o direito à escolha sobre a reprodução se, quando e quantas vezes engravidar, com esclarecimento sobre métodos contraceptivos disponíveis e importância do uso do preservativo masculino ou feminino. (Origem: PRT MS/GM 2068/2016, Art. 6º, XV, c)
XVI - ofertar a inserção de método contraceptivo de longa duração e alta eficácia antes da alta, caso seja escolha da mulher. (Origem: PRT MS/GM 2068/2016, Art. 6º, XVI)
Parágrafo Único. A equipe de saúde deverá conferir atenção ao estabelecimento de vínculo entre a mãe e o recém-nascido, a riscos e a vulnerabilidades particulares, bem como manter observação e escuta qualificada para esclarecer dúvidas e apoiar a mulher nesse período. (Origem: PRT MS/GM 2068/2016, Art. 6º, Parágrafo Único)
Art. 619. O Alojamento Conjunto contará com os seguintes recursos físicos: (Origem: PRT MS/GM 2068/2016, Art. 7º)
I - os quartos devem ser ambientes destinados à assistência à puérpera e ao recém-nascido com capacidade para um ou dois leitos, com banheiro anexo; (Origem: PRT MS/GM 2068/2016, Art. 7º, I)
II - as enfermarias devem ser ambientes destinados à assistência à puérpera e ao recém-nascido com capacidade para três a seis leitos, com banheiro anexo, conforme normativas vigentes da ANVISA; (Origem: PRT MS/GM 2068/2016, Art. 7º, II)
III - para cada leito materno, deve ser disponibilizado um berço para o recém-nascido e uma poltrona para acompanhante. O berço do recém-nascido deve ficar ao lado do leito da mãe e deve ser respeitada a distância mínima de um metro entre leitos ocupados; e (Origem: PRT MS/GM 2068/2016, Art. 7º, III)
IV - os quartos devem ter tamanho adequado para acomodar mulher e recém-nascido, de acordo com as normas vigentes da ANVISA. (Origem: PRT MS/GM 2068/2016, Art. 7º, IV)
Parágrafo Único. Medidas que assegurem a privacidade da mulher devem ser adotadas, assim como a observação do conforto luminoso para as puérperas os recém-nascidos e acompanhantes, quando instalados em quartos ou enfermarias com mais de um leito. (Origem: PRT MS/GM 2068/2016, Art. 7º, Parágrafo Único)
Art. 620. O serviço de saúde responsável pelo Alojamento Conjunto deverá dispor dos seguintes equipamentos, materiais e medicamentos para atendimento à mulher e ao recém-nascido: (Origem: PRT MS/GM 2068/2016, Art. 8º)
I - berço de material de fácil limpeza, desinfecção e que permita a visualização lateral; (Origem: PRT MS/GM 2068/2016, Art. 8º, I)
II - bandeja individualizada com termômetro, material de higiene e curativo umbilical; (Origem: PRT MS/GM 2068/2016, Art. 8º, II)
III - estetoscópio clínico e esfigmomanômetro; (Origem: PRT MS/GM 2068/2016, Art. 8º, III)
IV - balança; (Origem: PRT MS/GM 2068/2016, Art. 8º, IV)
V - balança para recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 8º, V)
VI - régua antropométrica e fita métrica inelástica de plástico; (Origem: PRT MS/GM 2068/2016, Art. 8º, VI)
VII - aparelho de fototerapia, um para cada 10 berços; (Origem: PRT MS/GM 2068/2016, Art. 8º, VII)
VIII - oftalmoscópio; (Origem: PRT MS/GM 2068/2016, Art. 8º, VIII)
IX - otoscópio; (Origem: PRT MS/GM 2068/2016, Art. 8º, IX)
X - aspirador com manômetro e oxigênio; (Origem: PRT MS/GM 2068/2016, Art. 8º, X)
XI - glicosímetro; (Origem: PRT MS/GM 2068/2016, Art. 8º, XI)
XII - analgésicos, anti-inflamatórios, antibióticos, anti-hipertensivos e outras medicações de uso comum no puerpério e no período neonatal; e de enfermagem, composto por desfibrilador, carro ou maleta contendo medicamentos, ressuscitador manual com reservatório, máscaras, laringoscópio completo, tubos endotraqueais, conectores, cânulas de Guedel e fio guia estéril, apropriados para adultos e recém nascidos. O carro ou maleta de emergência pode ser único para atendimento materno e ao recém-nascido. (Origem: PRT MS/GM 2068/2016, Art. 8º, XII)
Art. 621. A alta da mulher e do recém-nascido deverá ser realizada mediante elaboração de projeto terapêutico singular, considerando-se, para o tempo de alta, as necessidades individuais. (Origem: PRT MS/GM 2068/2016, Art. 9º)
Parágrafo Único. Recomenda-se a permanência mínima de 24 horas em Alojamento Conjunto, momento a partir do qual a alta pode ser considerada, desde que preenchidos os critérios abaixo listados: (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único)
I - puérpera: (i) em bom estado geral, com exame físico normal, sem sinais de infecção puerperal/sítio cirúrgico, com loquiação fisiológica; (ii) sem intercorrências mamárias como fissura, escoriação, ingurgitamento ou sinais de mastite, e orientada nas práticas de massagem circular e ordenha do leite materno; (iii) com recuperação adequada, comorbidades compensadas ou com encaminhamento assegurado para seguimento ambulatorial de acordo com as necessidades; (iv) bem orientada para continuidade dos cuidados em ambiente domiciliar e referenciada para Unidade Básica de Saúde (retorno assegurado até o 7º dia após o parto); (v) estabelecimento de vínculo entre mãe e bebê; (vi) com encaminhamento para unidade de referência para acesso a ações de saúde sexual e reprodutiva e escolha de método anticoncepcional, caso a mulher não receba alta já em uso de algum método contraceptivo, ou para seguimento pela atenção básica da prescrição ou inserção de método pela equipe da maternidade; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, I)
II - recém-nascido: (i) a termo e com peso adequado para a idade gestacional, sem comorbidades e com exame físico normal. (ii) com ausência de icterícia nas primeiras 24 horas de vida; (iii) com avaliação de icterícia, preferencialmente transcutânea, e utilização do normograma de Bhutani para avaliar a necessidade de acompanhamento dos níveis de bilirrubina quando necessário; (iv) apresentando diurese e eliminação de mecônio espontâneo e controle térmico adequado; (v) com sucção ao seio com pega e posicionamento adequados, com boa coordenação sucção/deglutição, salvo em situações em que há restrições ao aleitamento materno; (vi) em uso de substituto do leite humano/formula láctea para situações em que a amamentação é contra-indicada de acordo com atualização OMS/2009 "Razões médicas aceitáveis para uso de substitutos do leite". (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, II)
III - revisão das sorologias da mulher realizadas durante a gestação ou no momento da internação para o parto, assim como investigação de infecções congênitas no recém-nascido, conforme necessidade. Entre as sorologias, merecem destaque: sífilis, HIV, toxoplasmose e hepatite B. Outras doenças infectocontagiosas, como citomegalovírus, herpes simplex e infecções por arbovírus deverão ser investigadas se houver história sugestiva durante a gestação e/ou sinais clínicos sugestivos no recém-nascido; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, III)
IV - realização de tipagem sanguínea, Coombs da mãe e do recém-nascido, quando indicado; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, IV)
V - oximetria de pulso (teste do coraçãozinho) e Triagem Ocular (Teste do Reflexo Vermelho ou teste do olhinho) realizados; Triagem Auditiva (teste da orelhinha) assegurada no primeiro mês de vida e Triagem Biológica (teste do pezinho) assegurada preferencialmente entre o 3º e 5º dia de vida; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, V)
VI - avaliação e vigilância adequadas dos recém-nascidos para sepse neonatal precoce com base nos fatores de risco da mãe e de acordo com as diretrizes atuais do Ministério da Saúde para a prevenção de infecção pelo estreptococo do grupo B; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, VI)
VII - a mãe, o pai e outros cuidadores devem ter conhecimento e habilidade para dispensar cuidados adequados ao recém nascido, e reconhecer situações de risco como a ingestão inadequada de alimento, o agravamento da icterícia e eventual desidratação nos primeiros sete dias de vida; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, VII)
VIII - avaliação do serviço social para os fatores de risco psíquicos, sociais e ambientais, como o uso de drogas ilícitas, alcoolismo, tabagismo, antecedentes de negligência, violência doméstica, doença mental, doenças transmissíveis e situações de vulnerabilidade social; (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, VIII)
IX - agenda com a Atenção Básica, o retorno da mulher e do recém-nascido entre o terceiro e o quinto dia de vida (5º Dia de Saúde Integral); e (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, IX)
X - preenchimento de todos os dados na Caderneta da Gestante e na Caderneta de Saúde da Criança. (Origem: PRT MS/GM 2068/2016, Art. 9º, Parágrafo Único, X)
Art. 622. No momento da alta, a equipe multiprofissional fornecerá à mulher as seguintes orientações: (Origem: PRT MS/GM 2068/2016, Art. 10)
I - procurar a Unidade Básica de Saúde ou o pronto-atendimento caso a mulher apresente sinais de infecção (febre, secreção purulenta vaginal, por ferida operatória ou nas mamas), sangramento com odor fétido ou com volume aumentado, edema assimétrico de extremidades, dor refratária a analgésicos, sofrimento emocional, astenia exacerbada ou outros desconfortos; (Origem: PRT MS/GM 2068/2016, Art. 10, I)
II - procurar a Unidade Básica de Saúde se o recém-nascido apresentar problemas com aleitamento materno, icterícia ou qualquer outra alteração; (Origem: PRT MS/GM 2068/2016, Art. 10, II)
III - em caso de intercorrências com as mamas, os Bancos de Leite Humano poderão oferecer a assistência referente às boas práticas da amamentação, e orientações sobre a doação de leite humano; (Origem: PRT MS/GM 2068/2016, Art. 10, III)
IV - realizar vacinação conforme calendário vacinal; (Origem: PRT MS/GM 2068/2016, Art. 10, IV)
V - higienizar as mãos antes e após o cuidado com o recém nascido; (Origem: PRT MS/GM 2068/2016, Art. 10, V)
VI - evitar ambientes aglomerados ou com pessoas apresentando sinais e sintomas de doenças infectocontagiosas, como gripe e resfriado; (Origem: PRT MS/GM 2068/2016, Art. 10, VI)
VII - prevenir a morte súbita do recém-nascido por meio dos seguintes cuidados: deixar a criança em posição supina, manter a amamentação ao seio e evitar o tabagismo materno ou outra forma de exposição da criança ao fumo; (Origem: PRT MS/GM 2068/2016, Art. 10, VII)
VIII - transportar o recém-nascido de forma segura e prevenir acidentes domésticos; e (Origem: PRT MS/GM 2068/2016, Art. 10, VIII)
IX - para crianças filhos de mães cuja amamentação é contraindicada de acordo com razões médicas aceitáveis/OMS/2009, orientar o preparo correto da formula láctea e higienização dos utensílios utilizados para preparo e oferta desse alimento. (Origem: PRT MS/GM 2068/2016, Art. 10, IX)
CAPÍTULO VII
DO CONTROLE DA DOR E CUIDADOS PALIATIVOS
Seção I
Da Câmara Técnica em Controle da Dor e Cuidados Paliativos
Art. 623. Fica instituída a Câmara Técnica em Controle da Dor e Cuidados Paliativos, com a seguinte composição: (Origem: PRT MS/GM 3150/2006, Art. 1º)
I - três representantes da Secretaria de Atenção à Saúde - SAS/MS; (Origem: PRT MS/GM 3150/2006, Art. 1º, I)
II - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde - SGTES/MS; (Origem: PRT MS/GM 3150/2006, Art. 1º, II)
III - um representante do Instituto Nacional de Câncer - INCA/MS; (Origem: PRT MS/GM 3150/2006, Art. 1º, III)
IV - um representante da Sociedade Brasileira para o Estudo da Dor - SBED; (Origem: PRT MS/GM 3150/2006, Art. 1º, IV)
V - um representante da Academia Nacional de Cuidados Paliativos - ANCP; (Origem: PRT MS/GM 3150/2006, Art. 1º, V)
VI - um representante da Sociedade Brasileira de Anestesiologia - SBA; (Origem: PRT MS/GM 3150/2006, Art. 1º, VI)
VII - um representante da Sociedade Brasileira de Neurocirurgia - SBN; (Origem: PRT MS/GM 3150/2006, Art. 1º, VII)
VIII - um representante do Conselho Nacional de Secretários de Saúde - CONASS; e (Origem: PRT MS/GM 3150/2006, Art. 1º, VIII)
IX - um representante do Conselho Nacional de Secretários Municipais de Saúde - CONASEMS. (Origem: PRT MS/GM 3150/2006, Art. 1º, IX)
§ 1º Os representantes acima mencionados deverão ser formalmente indicados pelas respectivas instituições, devendo a indicação ser renovada anualmente. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 1º)
§ 2º A Câmara Técnica em Controle da Dor e Cuidados Paliativos será coordenada pela Secretaria de Atenção à Saúde - SAS/MS. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 2º)
§ 3º A Câmara Técnica em Controle da Dor e Cuidados Paliativos, quando julgar necessário, poderá convidar participantes ad hoc, sempre de caráter institucional, interno ou externo ao Ministério da Saúde, nas áreas correlacionadas. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 3º)
§ 4º À Câmara Técnica em Controle da Dor e Cuidados Paliativos cabe pronunciar-se sobre: (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º)
I - as diretrizes nacionais sobre controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, a)
II - as ações de controle da dor e cuidados paliativos, levadas a cabo no âmbito coletivo ou individual na assistência pública; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, b)
III - as recomendações para o desenvolvimento dessas ações nas entidades públicas e privadas que integram o SUS e, quando solicitado, o sistema de saúde suplementar; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, c)
IV - a atualização das normas e procedimentos do SUS referentes ao controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, d)
V - a incorporação tecnológica para ações de controle da dor e cuidados paliativos, encaminhando parecer para a Comissão para Incorporação de Tecnologias do Ministério da Saúde - CITEC; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, e)
VI - projetos de incentivo para ações de controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, f)
VII - a estruturação de redes de atenção na área de controle da dor e cuidados paliativos; (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, g)
VIII - a formação e qualificação de profissionais para atuação em controle da dor e cuidados paliativos; e (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, h)
IX - a avaliação de estudos e pesquisas na área de controle da dor e cuidados paliativos. (Origem: PRT MS/GM 3150/2006, Art. 1º, § 4º, i)
Art. 624. A Secretaria de Atenção à Saúde tomará as providências cabíveis para a operacionalização dos trabalhos da referida Câmara. (Origem: PRT MS/GM 3150/2006, Art. 2º)
Seção II
Dos Centros de Referência em Tratamento da Dor Crônica
Art. 625. Ficam criados, no âmbito do Sistema Único de Saúde, os Centros de Referência em Tratamento da Dor Crônica. (Origem: PRT MS/GM 1319/2002, Art. 1º)
Parágrafo Único. Entende-se por Centros de Referência em Tratamento da Dor Crônica aqueles hospitais cadastrados pela Secretaria de Atenção à Saúde como Centro de Alta Complexidade em Oncologia de Tipo I, II ou III e ainda aqueles hospitais gerais que, devidamente cadastrados como tal, disponham de ambulatório para tratamento da dor crônica e de condições técnicas, instalações físicas, equipamentos e recursos humanos específicos e adequados para a prestação de assistência aos portadores de dor crônica de forma integral e integrada e tenham capacidade de se constituir em referência para a rede assistencial do estado na área de tratamento da dor crônica. (Origem: PRT MS/GM 1319/2002, Art. 1º, Parágrafo Único)
Art. 626. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema Municipal de Saúde, de acordo com as respectivas condições de gestão e a divisão de responsabilidades definida na regulamentação, adotarão as providências necessárias à implantação/organização/habilitação e cadastramento dos Centros de Referência em Tratamento da Dor Crônica. (Origem: PRT MS/GM 1319/2002, Art. 2º)
Art. 627. Na definição dos quantitativos e distribuição geográfica dos Centros de Referência de que trata o art. 625, as Secretarias de Saúde dos estados e do Distrito Federal utilizarão os seguintes critérios: (Origem: PRT MS/GM 1319/2002, Art. 3º)
I - população; (Origem: PRT MS/GM 1319/2002, Art. 3º, a)
II - necessidades de cobertura assistencial; (Origem: PRT MS/GM 1319/2002, Art. 3º, b)
III - mecanismos de acesso e fluxos de referência e contra-referência; (Origem: PRT MS/GM 1319/2002, Art. 3º, c)
IV - nível de complexidade dos serviços; (Origem: PRT MS/GM 1319/2002, Art. 3º, d)
V - distribuição geográfica dos serviços; e (Origem: PRT MS/GM 1319/2002, Art. 3º, e)
VI - integração com a rede de atenção básica e programa de saúde da família. (Origem: PRT MS/GM 1319/2002, Art. 3º, f)
§ 1º O quantitativo máximo de Centros de Referência em Tratamento da Dor Crônica, por estado, encontra-se definido no Anexo LXXXV ; (Origem: PRT MS/GM 1319/2002, Art. 3º, § 1º)
§ 2º A este quantitativo agregam-se os Centros de Alta Complexidade em Oncologia já cadastrados ou a serem cadastrados pela Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1319/2002, Art. 3º, § 2º)
Art. 628. A Secretaria de Atenção à Saúde definirá as Normas de Cadastramento de Centros de Referência em Tratamento da Dor Crônica, bem como adotará as providências necessárias ao fiel cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1319/2002, Art. 4º)
Art. 629. Serão automaticamente cadastrados como Centros de Referência em Tratamento da Dor Crônica aqueles hospitais que venham a ser cadastrados como Centro de Alta Complexidade em Oncologia (CACON) pela Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1319/2002, Art. 5º, Parágrafo Único)
CAPÍTULO VIII
DA PROGRAMAÇÃO PACTUADA E INTEGRADA DA ASSISTÊNCIA EM SAÚDE
Art. 630. A Programação Pactuada e Integrada da Assistência em Saúde seja um processo instituído no âmbito do Sistema Único de Saúde (SUS) onde, em consonância com o processo de planejamento, são definidas e quantificadas as ações de saúde para a população residente em cada território, bem como efetuados os pactos intergestores para garantia de acesso da população aos serviços de saúde. (Origem: PRT MS/GM 1097/2006, Art. 1º)
Parágrafo Único. A Programação Pactuada e Integrada da Assistência em Saúde tem por objetivo organizar a rede de serviços, dando transparência aos fluxos estabelecidos, e definir, a partir de critérios e parâmetros pactuados, os limites financeiros destinados à assistência da população própria e das referências recebidas de outros municípios. (Origem: PRT MS/GM 1097/2006, Art. 1º, Parágrafo Único)
Art. 631. A Programação Pactuada e Integrada da Assistência em Saúde orientar-se-á pelo Manual de "Diretrizes para a Programação Pactuada e Integrada da Assistência em Saúde", a ser disponibilizado pelo Ministério da Saúde. (Origem: PRT MS/GM 1097/2006, Art. 2º)
Art. 632. Os objetivos gerais do processo de Programação Pactuada e Integrada da Assistência em Saúde são: (Origem: PRT MS/GM 1097/2006, Art. 3º)
I - buscar a equidade de acesso da população brasileira às ações e aos serviços de saúde em todos os níveis de complexidade; (Origem: PRT MS/GM 1097/2006, Art. 3º, I)
II - orientar a alocação dos recursos financeiros de custeio da assistência à saúde pela lógica de atendimento às necessidades de saúde da população; (Origem: PRT MS/GM 1097/2006, Art. 3º, II)
III - definir os limites financeiros federais para a assistência de média e alta complexidade de todos os municípios, compostos por parcela destinada ao atendimento da população do próprio município em seu território e pela parcela correspondente à programação das referências recebidas de outros municípios; (Origem: PRT MS/GM 1097/2006, Art. 3º, III)
IV - possibilitar a visualização da parcela dos recursos federais, estaduais e municipais, destinados ao custeio de ações de assistência à saúde; (Origem: PRT MS/GM 1097/2006, Art. 3º, IV)
V - fornecer subsídios para os processos de regulação do acesso aos serviços de saúde; (Origem: PRT MS/GM 1097/2006, Art. 3º, V)
VI - contribuir na organização das redes de serviços de saúde; e (Origem: PRT MS/GM 1097/2006, Art. 3º, VI)
VII - possibilitar a transparência dos pactos intergestores resultantes do processo de Programação Pactuada e Integrada da Assistência e assegurar que estejam explicitados no "Termo Compromisso para Garantia de Acesso", conforme Anexo LVI . (Origem: PRT MS/GM 1097/2006, Art. 3º, VII)
§ 1º O Termo de Compromisso para Garantia de Acesso, de que trata o art. 632, VII, é o documento que, com base no processo de Programação Pactuada e Integrada, deve conter as metas físicas e orçamentárias das ações a serem ofertadas nos municípios de referência, que assumem o compromisso de atender aos encaminhamentos acordados entre os gestores para atendimento da população residente em outros municípios. (Origem: PRT MS/GM 1097/2006, Art. 3º, § 1º)
§ 2º O Termo de Compromisso para Garantia de Acesso entre municípios de uma mesma Unidade Federada deve ser aprovado na respectiva Comissão Intergestores Bipartite - CIB. (Origem: PRT MS/GM 1097/2006, Art. 3º, § 2º)
§ 3º O Termo de Compromisso para Garantia de Acesso interestadual deve ser aprovado nas Comissões Intergestores Bipartite dos Estados envolvidos. (Origem: PRT MS/GM 1097/2006, Art. 3º, § 3º)
Art. 633. Os pressupostos gerais que deverão nortear a Programação Pactuada e Integrada (PPI) da Assistência são os seguintes: (Origem: PRT MS/GM 1097/2006, Art. 4º)
I - integrar o processo geral de planejamento em saúde de cada Estado e município, de forma ascendente, coerente com os Planos de Saúde em cada esfera de gestão; (Origem: PRT MS/GM 1097/2006, Art. 4º, I)
II - orientar-se pelo diagnóstico dos principais problemas de saúde, como base para a definição das prioridades; (Origem: PRT MS/GM 1097/2006, Art. 4º, II)
III - ser coordenado pelo gestor estadual com seus métodos, processos e resultados aprovados pela Comissão Intergestores Bipartite. (CIB), em cada unidade federada; e (Origem: PRT MS/GM 1097/2006, Art. 4º, III)
IV - estar em consonância com o processo de construção da regionalização. (Origem: PRT MS/GM 1097/2006, Art. 4º, IV)
Art. 634. Os eixos orientadores do processo de Programação Pactuada e Integrada (PPI) da assistência são os seguintes: (Origem: PRT MS/GM 1097/2006, Art. 5º)
I - Centralidade da Atenção Básica - a programação da assistência deve partir das ações básicas em saúde, para compor o rol de ações de maior complexidade tecnológica, estabelecendo os patamares mínimos de demanda orientada pelos problemas e estratégias da atenção básica, não apenas na sua dimensão assistencial, como também na de promoção e prevenção; (Origem: PRT MS/GM 1097/2006, Art. 5º, I)
II - Conformação das Aberturas Programáticas: (Origem: PRT MS/GM 1097/2006, Art. 5º, II)
a) a programação da atenção básica e da média complexidade ambulatorial deve partir de áreas estratégicas; (Origem: PRT MS/GM 1097/2006, Art. 5º, II, a)
b) a programação das ações ambulatoriais que não estão organizadas por áreas estratégicas deve ser orientada pela estrutura da Tabela de Procedimentos, com flexibilidade no seu nível de agregação, permitindo, inclusive, a programação de procedimentos que não estão previstos na tabela; (Origem: PRT MS/GM 1097/2006, Art. 5º, II, b)
c) a programação hospitalar deve ser orientada pelas clínicas de acordo com a distribuição de leitos do Cadastro Nacional de Estabelecimentos de Saúde (CNES); e (Origem: PRT MS/GM 1097/2006, Art. 5º, II, c)
d) os procedimentos financiados pelo Fundo de Ações Estratégicas e Compensação (FAEC) devem ser programados de acordo com as aberturas programáticas definidas, bem como as ações executadas pelos serviços financiados por valores globais; (Origem: PRT MS/GM 1097/2006, Art. 5º, II, d)
III - Parâmetros para Programação de Ações de Saúde: (Origem: PRT MS/GM 1097/2006, Art. 5º, III)
a) a programação das ações de atenção básica e média complexidade ambulatorial serão orientadas a partir de parâmetros de concentração e cobertura populacional, sugeridos pelo Ministério da Saúde, conforme portaria específica a ser publicada; (Origem: PRT MS/GM 1097/2006, Art. 5º, III, a)
b) a programação das ações de alta complexidade dar-se-á, conforme parâmetros já definidos para a estruturação das redes de serviços de alta complexidade; (Origem: PRT MS/GM 1097/2006, Art. 5º, III, b)
IV - Integração das Programações - os agravos de relevância para a Vigilância em Saúde serão incorporados nas áreas estratégicas previstas na PPI da Assistência, considerando as metas traçadas anualmente na PPI da Vigilância em Saúde; (Origem: PRT MS/GM 1097/2006, Art. 5º, IV)
V - Composição das Fontes de Recursos Financeiros a serem Programados - visualização da parcela dos recursos federais, estaduais e municipais, destinados ao custeio de ações de assistência à saúde; e (Origem: PRT MS/GM 1097/2006, Art. 5º, V)
VI - Processo de Programação e Relação Intergestores - definição das seguintes etapas no processo de programação: (Origem: PRT MS/GM 1097/2006, Art. 5º, VI)
a) Etapa Preliminar de Programação; (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, a)
b) Programação Municipal; (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, b)
c) Pactuação Regional; e (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, c)
d) Consolidação da PPI Estadual. (Origem: PRT MS/GM 1097/2006, Art. 5º, VI, d)
§ 1º Quando necessário, será realizada a programação interestadual, com a participação dos Estados e dos municípios envolvidos, com mediação do gestor federal e aprovação nas respectivas Comissões Intergestores Bipartite, mantendo consonância com o processo de construção da regionalização. (Origem: PRT MS/GM 1097/2006, Art. 5º, § 1º)
§ 2º A programação de estados, de municípios e do Distrito Federal deve ser refletida na programação dos estabelecimentos de saúde sob sua gestão. (Origem: PRT MS/GM 1097/2006, Art. 5º, § 2º)
§ 3º Dar flexibilidade aos gestores estaduais e municipais na definição de parâmetros e prioridades que irão orientar a programação, respeitando as pactuações nas Comissões Intergestores Bipartite (CIB) e na Comissão Intergestores Tripartite (CIT); (Origem: PRT MS/GM 1097/2006, Art. 5º, § 3º)
Art. 635. A programação nas regiões de fronteiras internacionais deve respeitar o Sistema Integrado de Saúde nas Fronteiras (SIS Fronteiras), instituído pela Portaria nº 1.120/GM, de 6 de julho de 2005. (Origem: PRT MS/GM 1097/2006, Art. 6º)
Art. 636. A Programação Pactuada e Integrada deve ser realizada no mínimo a cada gestão estadual, respeitando as pactuações nas Comissões Intergestores Bipartite, e revisada periodicamente, sempre que necessário, em decorrência de alterações de fluxo no atendimento ao usuário, de oferta de serviços, na tabela de procedimentos, nos limites financeiros, entre outras. (Origem: PRT MS/GM 1097/2006, Art. 7º)
Parágrafo Único. Estabelecer que no início da gestão municipal seja efetuada uma revisão da PPI estadual para face dos novos Planos Municipais de Saúde. (Origem: PRT MS/GM 1097/2006, Art. 7º, Parágrafo Único)
CAPÍTULO X
DO REMANEJAMENTO INTRAESTADUAL DE RECURSOS DO LIMITE FINANCEIRO DA MÉDIA E ALTA COMPLEXIDADE
(Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
Art. 637. Ao final do processo de Programação Pactuada e Integrada da Assistência, a Secretaria de Estado da Saúde e do Distrito Federal encaminhará à Secretaria de Atenção à Saúde, do Ministério da Saúde, a seguinte documentação acompanhada de ofício devidamente assinado pelos Coordenadores Estadual e Municipal da CIB: (Origem: PRT MS/GM 1097/2006, Art. 8º)
I - cópia da resolução CIB que aprova a nova programação; (Origem: PRT MS/GM 1097/2006, Art. 8º, I)
II - quadros com os Limites Financeiros da Assistência de Média e Alta Complexidade, conforme Anexo LVII , devidamente assinados pelos Coordenadores Estadual e Municipal da CIB; (Origem: PRT MS/GM 1097/2006, Art. 8º, II)
III - quadro síntese dos critérios e parâmetros adotados; e (Origem: PRT MS/GM 1097/2006, Art. 8º, III)
IV - memória dos pactos municipais realizados com explicitação das metas físicas e financeiras. (Origem: PRT MS/GM 1097/2006, Art. 8º, IV)
§ 1º As Secretarias de Saúde dos Estados e do Distrito Federal podem dispor de instrumentos próprios de programação, respeitando os padrões estabelecidos por este Capítulo. (Origem: PRT MS/GM 1097/2006, Art. 8º, § 1º)
§ 2º Os incisos III e IV deste artigo podem ser substituídos pelo envio da base do sistema informatizado do Ministério da Saúde, para os Estados que optarem pela sua utilização. (Origem: PRT MS/GM 1097/2006, Art. 8º, § 2º)
Art. 637. O remanejamento intraestadual de recursos do Limite Financeiro da Média e Alta Complexidade (Teto MAC) será operacionalizado por meio do Módulo de Remanejamento, que integra o Sistema de Controle do Teto MAC (SISMAC). (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
Art. 638. Alterações periódicas físicas e/ou financeiras que repercutam em modificações nos Limites Financeiros da Assistência de Média e Alta Complexidade Ambulatorial e Hospitalar dos estados, dos municípios e do Distrito Federal, serão aprovadas pelas respectivas Comissões Intergestores Bipartite (CIB) e encaminhadas à Secretaria de Atenção à Saúde, pela Secretaria de Estado da Saúde e do Distrito Federal, mediante ofício devidamente assinado pelos Coordenadores Estadual e Municipal da CIB, acompanhado da seguinte documentação: (Origem: PRT MS/GM 1097/2006, Art. 9º) (com redação dada pela PRT MS/GM 1699/2011)
I - cópia da Resolução da CIB que altera o(s) limite(s) financeiro(s), justificando e explicitando os valores anuais do Estado e dos Municípios envolvidos; e (Origem: PRT MS/GM 1097/2006, Art. 9º, I)
II - quadros com os Limites Financeiros da Assistência de Média e Alta Complexidade conforme o Anexo LVII , devidamente assinados pelos Coordenadores Estadual e Municipal da CIB. (Origem: PRT MS/GM 1097/2006, Art. 9º, II)
Parágrafo Único. Deve ser anexada à resolução da CIB, memória das alterações realizadas explicitando quantitativos físicos e financeiros. (Origem: PRT MS/GM 1097/2006, Art. 9º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 1699/2011)
Art. 638. A alteração do Teto MAC sob gestão dos municípios e da Secretaria Estadual de Saúde deverá ser aprovada pela respectiva Comissão Intergestores Bipartite (CIB), não impactando o valor total do Teto MAC da unidade federada. (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
Art. 639. Os documentos discriminados nos incisos dos arts. 637 e 638 deverão ser postados à Secretaria de Atenção à Saúde, até o dia 25 do mês anterior à competência em que vigorará o novo limite financeiro de Média e Alta Complexidade (MAC). (Origem: PRT MS/GM 1097/2006, Art. 10)
Parágrafo Único. Os quadros referentes Anexo LVII também deverão ser encaminhados em meio magnético à Secretaria de Atenção à Saúde, Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS), por meio do endereço eletrônico ppiassistencial@saude.gov.br, até o dia 25 do mês anterior à competência em que vigorará o novo limite financeiro MAC. (Origem: PRT MS/GM 1097/2006, Art. 10, Parágrafo Único)
Art. 639. A Secretaria Estadual de Saúde é responsável por inserir no SISMAC: (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
I - informações sobre dados financeiros; (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
II - documentos referentes às alterações físicas correspondentes aos valores remanejados; e (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
III - resolução da CIB assinada conjuntamente pelo Secretário de Estado e pelo presidente do Conselho de Secretarias Municipais de Saúde (COSEMS). (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
§ 1º A resolução da CIB deverá conter o número do protocolo gerado pelo SISMAC, com preenchimento dos dados financeiros. (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
§ 2º Os valores remanejados serão disponibilizados para acesso público no SISMAC. (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
Art. 640. Compete à Secretaria de Atenção à Saúde, por intermédio do Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS), a conferência e a validação da documentação encaminhada pelos Estados e o Distrito Federal, bem como a devida orientação às Secretarias Estaduais quanto ao seu correto preenchimento. (Origem: PRT MS/GM 1097/2006, Art. 11)
Art. 640. Os processos devidamente instruídos no SISMAC até dois dias úteis antes do dia 19 de cada mês surtirão efeito financeiro na parcela que estiver sendo processada naquele mês. (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
Art. 641. As alterações de limites financeiros, cumpridos os trâmites e prazos estabelecidos neste Capítulo, entrerão em vigor a partir da competência subsequente ao envio da documentação pela CIB, por intermédio de portaria da Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1097/2006, Art. 12)
§ 1º Quando ocorrerem erros no preenchimento da documentação, o Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS) deverá comunicar à CIB, viabilizando um prazo para regularização pela SES, não superior a cinco dias úteis, objetivando que a vigência da publicação não seja prejudicada. (Origem: PRT MS/GM 1097/2006, Art. 12, § 1º)
§ 2º Não serão realizadas alterações de limites financeiros, com efeitos retroativos em relação ao prazo estabelecido no art. 639, excetuando os casos excepcionais, devidamente justificados. (Origem: PRT MS/GM 1097/2006, Art. 12, § 2º)
§ 3º Os casos excepcionais deverão ser enviados à Secretaria de Atenção à Saúde (SAS/MS), com as devidas justificativas pela CIB Estadual e estarão condicionados à aprovação do Secretário de Atenção à Saúde, para posterior processamento pelo Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS). (Origem: PRT MS/GM 1097/2006, Art. 12, § 3º)
§ 4º As mudanças operacionais/gerenciais, em relação aos limites financeiros, adotadas por Secretarias Estaduais e/ou Municipais de Saúde ou ainda por Comissões Intergestores Bipartite, antes da vigência da publicação de portaria da SAS/MS, serão de exclusiva responsabilidade do gestor do SUS que as adotar. (Origem: PRT MS/GM 1097/2006, Art. 12, § 4º)
§ 5º Nas situações em que não houver acordo na Comissão Intergestores Bipartite, vale o disposto no regulamento do Pacto de Gestão, publicado pela Portaria nº 699/GM, de 30 de março de 2006. (Origem: PRT MS/GM 1097/2006, Art. 12, § 5º)
Art. 641. O Departamento de Regulação, Avaliação e Controle da Secretaria de Atenção Especializada à Saúde (DRAC/SAES/MS) é responsável por: (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
I - efetivar os remanejamentos; (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
II - prestar auxílio técnico aos estados e municípios sobre o remanejamento de recursos do Teto MAC; e (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
III - aprimorar e manter atualizado o Módulo de Remanejamento, que integra o SISMAC. (Redação dada pela PRT GM/MS nº 3.257 de 12.12.2019)
Art. 642. A Secretaria de Atenção à Saúde/MS adotará as medidas necessárias à publicação de portaria com Parâmetros para Programação de Ações de Assistência à Saúde. (Origem: PRT MS/GM 1097/2006, Art. 13)
CAPITULO IX
DO PROGRAMA MÉDICOS PELO BRASIL
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 642-A Este Capítulo dispõe sobre as diretrizes para a execução do Programa Médicos pelo Brasil, instituído pela Lei nº 13.958, de 18 de dezembro de 2019, nos termos do Anexo CIII. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
CAPÍTULO X
DO PROGRAMA DE QUALIDADE NO PROCESSO DE DOAÇÃO E TRANSPLANTES (QUALIDOT)
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO XI
DO INCREMENTO FINANCEIRO PARA QUALIDADE DO SISTEMA NACIONAL DE TRANSPLANTES
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 642-B. Este Capítulo dispõe sobre o Programa de Qualidade no Processo de Doação e Transplantes (QUALIDOT), nos termos do Anexo CIV. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 642-B Este Capítulo dispõe sobre o incremento Financeiro para Qualidade do Sistema Nacional de Transplantes, no âmbito do Sistema Único de Saúde - SUS, nos termos do Anexo CIV. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
TÍTULO V
DA ATENÇÃO A AGRAVOS ESPECÍFICOS
CAPÍTULO I
DO PROGRAMA SOS EMERGÊNCIAS NO ÂMBITO DA REDE DE ATENÇÃO ÀS URGÊNCIAS E EMERGÊNCIAS (RUE)
Art. 643. Este Capítulo dispõe sobre o Programa SOS Emergência, no âmbito da Rede de Atenção às Urgências e Emergências (RUE). (Origem: PRT MS/GM 1663/2012, Art. 1º)
Parágrafo Único. O Programa SOS Emergências é uma ação estratégia prioritária para a implementação do Componente Hospitalar da RUE, realizada em conjunto com os Estados, Distrito Federal e Municípios para a qualificação da gestão e do atendimento de usuários do Sistema Único de Saúde (SUS) nas maiores e mais complexas Portas de Entrada Hospitalares de Urgência do SUS. (Origem: PRT MS/GM 1663/2012, Art. 1º, Parágrafo Único)
Seção I
DOS OBJETIVOS E REQUISITOS PARA PARTICIPAÇÃO
(Origem: PRT MS/GM 1663/2012, CAPÍTULO I)
Art. 644. São objetivos do Programa SOS Emergências: (Origem: PRT MS/GM 1663/2012, Art. 2º)
I - estimular a organização e a implantação da RUE, buscando um pacto cooperativo entre as instâncias de gestão do SUS para garantir os investimentos e recursos necessários a esta mudança de modelo de atenção nos grandes prontos-socorros dos estabelecimentos hospitalares integrados ao SUS; (Origem: PRT MS/GM 1663/2012, Art. 2º, I)
II - intervir de forma mais organizada, ágil e efetiva sobre a oferta do cuidado nas grandes emergências hospitalares do SUS; (Origem: PRT MS/GM 1663/2012, Art. 2º, II)
III - assessorar tecnicamente a equipe do hospital participante do Programa e oferecer capacitação para aprimoramento da gestão do cuidado ao paciente em situação de urgência e emergência; (Origem: PRT MS/GM 1663/2012, Art. 2º, III)
IV - apoiar as unidades hospitalares para a melhoria da gestão e da qualidade assistencial, por meio da implantação de dispositivos como a classificação de risco, gestão de leitos, implantação de protocolos clínico-assistenciais e administrativos, adequação da estrutura e ambiência hospitalar, regulação e articulação com o sistema de saúde; e (Origem: PRT MS/GM 1663/2012, Art. 2º, IV)
V - possibilitar a readequação física e tecnológica dos serviços de urgência e emergência da unidade hospitalar. (Origem: PRT MS/GM 1663/2012, Art. 2º, V)
Art. 645. O Programa SOS Emergências será integrado por Portas de Entradas Hospitalares de Urgência selecionadas pelo Ministério da Saúde, em conjunto com as Secretarias de Saúde estaduais, distrital e municipais. (Origem: PRT MS/GM 1663/2012, Art. 3º)
Parágrafo Único. Serão consideradas Portas de Entradas Hospitalares de Urgência prioritárias para o Programa SOS Emergências aquelas que cumprirem os seguintes requisitos: (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único)
I - ser referência regional, realizando no mínimo dez por cento dos atendimentos aos usuários do SUS em situação de urgência e emergência oriundos de outros Municípios, conforme registro no Sistema de Informação Hospitalar (SIH/SUS); (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, I)
II - ter, no mínimo, cem leitos cadastrados no Sistema de Cadastro Nacional de Estabelecimentos (SCNES); (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, II)
III - estar habilitada em pelo menos uma das seguintes linhas de cuidado: (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III)
a) cardiovascular; (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, a)
b) neurologia/neurocirurgia; (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, b)
c) traumato-ortopedia; ou (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, c)
d) ser referência em pediatria; (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, III, d)
IV - ter maior volume de produção de procedimentos ambulatoriais e de internação, conforme registro no SIH/SUS e no Sistema de Informação Ambulatorial (SIA/SUS), ou outro(s) que vierem a substituí-lo(s); e (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, IV)
V - ter a aprovação do(s) gestor(es) estadual(is), municipal(is), distrital de saúde e do Ministério da Saúde, de acordo com o território abrangido pelo referenciamento dos usuários do SUS em situação de urgência e emergência para ingresso do estabelecimento hospitalar no Programa. (Origem: PRT MS/GM 1663/2012, Art. 3º, Parágrafo Único, V)
Art. 646. O estabelecimento hospitalar selecionado para o Programa SOS Emergências deverá se adequar aos critérios de qualificação dispostos no art. 861 da Portaria de Consolidação nº 6, e cumprir as seguintes exigências: (Origem: PRT MS/GM 1663/2012, Art. 4º)
I - construir processo seguro e qualificado de gestão das emergências por meio da criação do Núcleo de Acesso e Qualidade Hospitalar (NAQH), observado o disposto nos arts. 35 e 36 do Anexo III da Portaria de Consolidação nº 3; (Origem: PRT MS/GM 1663/2012, Art. 4º, I)
II - elaborar o diagnóstico situacional acerca do papel do estabelecimento hospitalar na Região de Saúde, com análise dos processos internos de trabalho e da gestão interna; (Origem: PRT MS/GM 1663/2012, Art. 4º, II)
III - elaborar o plano de ação para melhoria do acesso e qualidade assistencial; (Origem: PRT MS/GM 1663/2012, Art. 4º, III)
IV - monitorar e avaliar os produtos e resultados das ações previstas no plano de ação; (Origem: PRT MS/GM 1663/2012, Art. 4º, IV)
V - criar mecanismos seguros de gestão do acesso pelo risco por meio da implantação do Acolhimento e Classificação de Risco (ACCR); (Origem: PRT MS/GM 1663/2012, Art. 4º, V)
VI - implantar programa de qualificação dos profissionais para atendimento ao paciente em situação de urgência e emergência; (Origem: PRT MS/GM 1663/2012, Art. 4º, VI)
VII - instituir espaços de discussão coletiva com os trabalhadores; (Origem: PRT MS/GM 1663/2012, Art. 4º, VII)
VIII - induzir melhorias no gerenciamento da Unidade de Emergência por meio da readequação e/ou implantação de sistemas de gestão hospitalar para o monitoramento contínuo da qualidade assistencial; (Origem: PRT MS/GM 1663/2012, Art. 4º, VIII)
IX - participar, por meio de representantes do NAQH, da construção do Plano Regional da Rede de Atenção às Urgências do seu território; e (Origem: PRT MS/GM 1663/2012, Art. 4º, IX)
X - atuar de forma conjunta desenvolvendo estratégias que envolvam a articulação e integração do estabelecimento hospitalar ao SUS e suas redes de atenção. (Origem: PRT MS/GM 1663/2012, Art. 4º, X)
Art. 647. Para o cumprimento das exigências dispostas no art. 646, o estabelecimento hospitalar selecionado para o Programa SOS Emergências contará com o apoio técnico do Ministério da Saúde, por meio do Departamento de Atenção Especializada e Temática (DAET/SAS/MS), com o objetivo de fornecer apoio local à equipe do NAQH e de direção do hospital, com vistas: (Origem: PRT MS/GM 1663/2012, Art. 5º)
I - ao desenvolvimento de atividades cotidianas relativas à atenção às urgências no ambiente hospitalar; (Origem: PRT MS/GM 1663/2012, Art. 5º, I)
II - à qualificação da gestão hospitalar; e (Origem: PRT MS/GM 1663/2012, Art. 5º, II)
III - à sua integração à Rede de Atenção à Saúde. (Origem: PRT MS/GM 1663/2012, Art. 5º, III)
Art. 648. O Ministério da Saúde, por meio do Programa de Apoio ao Desenvolvimento Institucional do SUS (PROADI-SUS), promoverá a capacitação e formação dos profissionais das instituições hospitalares selecionadas para o Programa SOS Emergências na área de Urgência e Emergência, além de participar na oferta de tecnologias oferecendo a estrutura necessária para o seu desenvolvimento e para a qualificação do cuidado e da gestão. (Origem: PRT MS/GM 1663/2012, Art. 6º)
Seção II
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 1663/2012, CAPÍTULO III)
Art. 649. O Programa SOS Emergências será monitorado e acompanhado pelo DAET/SAS/MS, com o apoio do Comitê Nacional de Apoio e Acompanhamento do Programa SOS Emergências, instituído por meio do Termo de Cooperação Técnica nº 12/2011, de 8 de novembro de 2011, publicado no Diário Oficial da União do dia 10 de novembro de 2011, Seção 3, p. 132. (Origem: PRT MS/GM 1663/2012, Art. 13)
CAPÍTULO II
DO PROGRAMA DE ASSISTÊNCIA VENTILATÓRIA NÃO INVASIVA AOS PORTADORES DE DOENÇAS NEUROMUSCULARES
Art. 650. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa de Assistência Ventilatória Não Invasiva aos Portadores de Doenças Neuromusculares. (Origem: PRT MS/GM 1370/2008, Art. 1º)
§ 1º O Programa ora instituído tem por objetivo melhorar a atenção à saúde dos portadores de doenças neuromusculares, adotar medidas que permitam retardar a perda da função vital destes pacientes ou mesmo evitá-la, promover a melhoria da sua qualidade e expectativa de vida e, ainda, ampliar o acesso à ventilação nasal intermitente de pressão positiva quando a mesma estiver indicada. (Origem: PRT MS/GM 1370/2008, Art. 1º, § 1º)
§ 2º O rol das doenças neuromusculares a ser contemplado pelo Programa será definido, em ato próprio, pela Secretaria de Atenção à Saúde. (Origem: PRT MS/GM 1370/2008, Art. 1º, § 2º)
§ 3º Pelo seu escopo restrito à distrofia muscular progressiva, fica extinto o Programa de Assistência Ventilatória Não Invasiva aos Pacientes Portadores de Distrofia Muscular Progressiva instituído pela Portaria nº 1.531/GM, de 4 de setembro de 2001. (Origem: PRT MS/GM 1370/2008, Art. 1º, § 3º)
Art. 651. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema adotarão as medidas necessárias à organização e implantação do Programa de Assistência Ventilatória Não Invasiva aos Portadores de Doenças Neuromusculares ora instituído. (Origem: PRT MS/GM 1370/2008, Art. 2º)
Art. 652. A Secretaria de Atenção à Saúde (SAS/MS) estabelecerá os critérios técnicos para a implantação do Programa, o rol de doenças a serem contempladas, bem como adotará as medidas necessárias ao fiel cumprimento do disposto neste Capítulo. (Origem: PRT MS/GM 1370/2008, Art. 3º)
CAPÍTULO III
DO PROJETO DE ESTRUTURAÇÃO E QUALIFICAÇÃO DOS SERVIÇOS EXISTENTES DE ORTOPEDIA, TRAUMATOLOGIA E REABILITAÇÃO PÓS-OPERATÓRIA (PROJETO SUPORTE)
Art. 653. Fica criado o Projeto de Estruturação e Qualificação dos Serviços Existentes de Ortopedia, Traumatologia e Reabilitação Pós-Operatória no Sistema Único de Saúde (PROJETO SUPORTE). (Origem: PRT MS/GM 401/2005, Art. 1º)
Parágrafo Único. O objetivo do Projeto é promover a estruturação de serviços de tráumato-ortopedia e de reabilitação pós-operatória, por meio do apoio técnico e financeiro às Secretarias Estaduais e às Municipais de Saúde na implantação e implementação de serviços de ortopedia, traumatologia e reabilitação pós-operatória de média e alta complexidade, prioritariamente nas regiões com baixa capacidade de oferta e de produção nas referidas especialidades. (Origem: PRT MS/GM 401/2005, Art. 1º, Parágrafo Único)
Art. 654. As ações serão desenvolvidas de forma integrada e pactuada entre os gestores do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 401/2005, Art. 2º)
Art. 655. As parcerias entre o Ministério da Saúde e as Secretarias Estaduais e as Municipais serão firmadas por instrumento legal específico. (Origem: PRT MS/GM 401/2005, Art. 3º)
Art. 656. Caberá ao Ministério da Saúde, representado pelo Instituto Nacional de Tráumato-Ortopedia (INTO), na medida das disponibilidades materiais e financeiro-orçamentária, a assessoria e execução do Projeto SUPORTE para: (Origem: PRT MS/GM 401/2005, Art. 4º)
I - apoiar a organização da rede de atenção em tráumato-ortopedia e reabilitação de forma hierarquizada, contemplando os três níveis de atenção, e fomentar a sua estruturação, de acordo com os princípios do SUS; (Origem: PRT MS/GM 401/2005, Art. 4º, I)
II - elaborar protocolos operacionais de referência e contrareferência e protocolos técnicos de procedimentos; (Origem: PRT MS/GM 401/2005, Art. 4º, II)
III - realizar diagnóstico da oferta de serviços, que inclui instalações físicas, equipamentos e profissionais de saúde; (Origem: PRT MS/GM 401/2005, Art. 4º, III)
IV - realizar diagnóstico da demanda e dos serviços prestados, a partir da avaliação da fila de Tratamento Fora de Domicílio (TFD), dos dados disponíveis na Central Nacional de Regulação de Alta Complexidade (CNRAC) e de outros instrumentos congêneres, bem como da produção ambulatorial e hospitalar registrada no SIA/SUS e no SIH/SUS; (Origem: PRT MS/GM 401/2005, Art. 4º, IV)
V - apoiar financeiramente a estruturação dos serviços de tráumato-ortopedia e de reabilitação pós-operatória, na aquisição de equipamentos hospitalares e insumos especializados para realização de cirurgias ortopédicas, que serão disponibilizados aos Estados e aos Municípios por meio de instrumento legal próprio; (Origem: PRT MS/GM 401/2005, Art. 4º, V) (com redação dada pela PRT MS/GM 490/2010)
VI - apoiar a realização de procedimentos cirúrgicos em tráumato-ortopedia preferencialmente em alta complexidade - disponibilizando equipe multiprofissional, e insumos especializados. (Origem: PRT MS/GM 401/2005, Art. 4º, VI) (com redação dada pela PRT MS/GM 490/2010)
VII - deslocar a equipe e viabilizar o transporte dos materiais para realização dos procedimentos cirúrgicos do inciso V; (Origem: PRT MS/GM 401/2005, Art. 4º, VII)
VIII - promover a educação permanente durante a realização dos procedimentos cirúrgicos em tráumato-ortopedia por meio de cursos teórico-práticos; (Origem: PRT MS/GM 401/2005, Art. 4º, VIII)
IX - realizar assessoria a distância, via internet, para avaliação de casos clínicos; (Origem: PRT MS/GM 401/2005, Art. 4º, IX)
X - promover educação permanente a distância, por meio de vídeoconferência; (Origem: PRT MS/GM 401/2005, Art. 4º, X)
XI - assessorar a implantação de programas de residência médica em tráumato-ortopedia e residência em enfermagem ortopédica das unidades da região; (Origem: PRT MS/GM 401/2005, Art. 4º, XI)
XII - assessorar os programas de residência médica em tráumato-ortopedia e de especialização em enfermagem ortopédica das unidades da região; (Origem: PRT MS/GM 401/2005, Art. 4º, XII)
XIII - disponibilizar bolsas para programas em conjunto de residência médica em tráumato-ortopedia e de especialização em enfermagem ortopédica; e (Origem: PRT MS/GM 401/2005, Art. 4º, XIII)
XIV - assessorar a padronização e aquisição de implantes ortopédicos. (Origem: PRT MS/GM 401/2005, Art. 4º, XIV)
Art. 657. A Secretaria de Atenção à Saúde avaliará a execução da implementação dos serviços de que trata o art. 653, parágrafo único por meio de termos de compromisso e/ou convênios. (Origem: PRT MS/GM 401/2005, Art. 5º)
Art. 658. Deverão constar dos termos de compromissos e/ou convênios, quando da adesão, que caberá às Secretarias Estaduais e Municipais de Saúde: (Origem: PRT MS/GM 401/2005, Art. 6º)
I - garantir o acesso às informações para realização dos diagnósticos de oferta e de demanda; (Origem: PRT MS/GM 401/2005, Art. 6º, I)
II - implementar, quando necessário, instrumentos de registro e de sistematização de informações; (Origem: PRT MS/GM 401/2005, Art. 6º, II)
III - garantir a adequação da área física para implantação dos serviços de média e alta complexidade em tráumato-ortopedia, de acordo com a normalização vigente; (Origem: PRT MS/GM 401/2005, Art. 6º, III)
IV - garantir a manutenção e o funcionamento dos equipamentos hospitalares de que trata o art. 656, V; (Origem: PRT MS/GM 401/2005, Art. 6º, IV)
V - garantir quantitativo suficiente de profissionais de saúde para o desenvolvimento das atividades dos serviços de média e alta complexidade em tráumato-ortopedia e reabilitação pós-operatória; (Origem: PRT MS/GM 401/2005, Art. 6º, V)
VI - garantir os recursos logísticos na unidade para a realização de procedimentos cirúrgicos em tráumato-ortopedia pela equipe do INTO, disponibilizando equipe multiprofissional, salas de cirurgia, leitos hospitalares e de terapia intensiva, central de material e esterilização, Serviço de Apoio Diagnóstico Terapêuticos - SADT, insumos e demais recursos necessários à adequada consecução dos procedimentos supramencionados; (Origem: PRT MS/GM 401/2005, Art. 6º, VI)
VII - garantir a hospedagem individual, alimentação no local de trabalho para a equipe do INTO; (Origem: PRT MS/GM 401/2005, Art. 6º, VII)
VIII - garantir o pagamento integral da ajuda de custo para os profissionais do INTO, no prazo máximo de 15 (quinze) dias, após a realização dos procedimentos cirúrgicos; (Origem: PRT MS/GM 401/2005, Art. 6º, VIII)
IX - selecionar, indicar e garantir a participação dos profissionais de saúde que atuam nas áreas de tráumato-ortopedia, anestesiologia, terapia intensiva, reabilitação pós-operatória e enfermagem ortopédica nos programas de educação permanente tanto na região como no INTO, conforme cronograma estabelecido; (Origem: PRT MS/GM 401/2005, Art. 6º, IX)
X - garantir o deslocamento e a hospedagem dos profissionais da região para os eventos de educação permanente, conforme cronograma estabelecido; e (Origem: PRT MS/GM 401/2005, Art. 6º, X)
XI - garantir os recursos logísticos na região para a realização dos eventos teóricos, tais como auditório, recursos áudiovisuais e outros. (Origem: PRT MS/GM 401/2005, Art. 6º, XI)
Art. 659. As Secretarias Estaduais de Saúde e às Secretarias Municipais de Saúde deverão apresentar à Secretaria de Atenção à Saúde as necessidades quanto à estruturação de serviços de tráumato-ortopedia e reabilitação pós-operatória, de acordo com o art. 653 acompanhadas de parecer favorável da Comissão Intergestores Bipartite. (Origem: PRT MS/GM 401/2005, Art. 7º)
§ 1º Serão priorizadas pela Secretaria de Atenção à Saúde as demandas para a realização das ações de caráter estrutural, organizativo e operacional provenientes dos Estados que compõem a Amazônia Legal. (Origem: PRT MS/GM 401/2005, Art. 7º, § 1º)
§ 2º As solicitações das demais regiões serão analisadas pela Secretaria de Atenção à Saúde de acordo com prioridades e disponibilidade orçamentária e financeira. (Origem: PRT MS/GM 401/2005, Art. 7º, § 2º)
Art. 660. Os recursos orçamentários para a estruturação desses serviços correrão por conta do Programa de Trabalho 10.302.2015.8535 - Estruturação de Unidades de Atenção Especializada em Saúde. (Origem: PRT MS/GM 401/2005, Art. 8º)
CAPÍTULO IV
DA COMISSÃO NACIONAL COM A FINALIDADE DE AVALIAR E DEFINIR DIRETRIZES POLÍTICAS PARA A PROMOÇÃO DA SAÚDE, PREVENÇÃO E CONTROLE DAS DOENÇAS E AGRAVOS NÃO TRANSMISSÍVEIS
Art. 661. Constituir Comissão Nacional com a finalidade de avaliar e definir diretrizes políticas para a promoção da saúde, prevenção e controle das doenças e agravos não-transmissíveis, integrada por representante de cada uma das unidades do Ministério da Saúde e entidade vinculada e das instituições, a seguir indicadas: (Origem: PRT MS/GM 1359/2003, Art. 1º)
I - Secretaria-Executiva; (Origem: PRT MS/GM 1359/2003, Art. 1º, I)
II - Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, II)
III - Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, III)
IV - Instituto Nacional de Câncer; (Origem: PRT MS/GM 1359/2003, Art. 1º, IV)
V - Agência Nacional de Vigilância Sanitária; (Origem: PRT MS/GM 1359/2003, Art. 1º, V)
VI - Conselho Nacional de Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, VI)
VII - Conselho Nacional de Secretários Estaduais de Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, VII)
VIII - Conselho Nacional de Secretários Municipais de Saúde; (Origem: PRT MS/GM 1359/2003, Art. 1º, VIII)
IX - Organização Pan-Americana da Saúde. (Origem: PRT MS/GM 1359/2003, Art. 1º, IX)
Parágrafo Único. A coordenação da Comissão será exercida pela Secretaria de Vigilância em Saúde do Ministério da Saúde. (Origem: PRT MS/GM 1359/2003, Art. 1º, Parágrafo Único)
Art. 662. A política de redução das doenças e agravos não-transmissíveis deverá objetivar: (Origem: PRT MS/GM 1359/2003, Art. 2º)
I - a articulação de todas as ações em desenvolvimento no País para seu controle, visando reorientá-las sob o enfoque da promoção da saúde; (Origem: PRT MS/GM 1359/2003, Art. 2º, I)
II - o desenvolvimento da cultura institucional baseada na prevenção, para diminuir a morbidade, mortalidade e incapacidade que causam; (Origem: PRT MS/GM 1359/2003, Art. 2º, II)
III - a associação das ações individuais, especialmente a detecção precoce e o tratamento oportuno de casos, com as de caráter coletivo; (Origem: PRT MS/GM 1359/2003, Art. 2º, III)
IV - o apoio ao ordenamento dos serviços de saúde, segundo as estratégias de atenção à saúde da família, da participação da população e do controle social. (Origem: PRT MS/GM 1359/2003, Art. 2º, IV)
Art. 663. Consideram-se objetivos específicos das ações dirigidas à prevenção e ao controle das doenças e agravos não-transmissíveis: (Origem: PRT MS/GM 1359/2003, Art. 3º)
I - a melhoria da situação de saúde da população brasileira, no que diz respeito à implementação de intervenções que busquem diminuir a presença de fatores de risco, incluindo hábitos alimentares inadequados, sedentarismo, obesidade, tabagismo, alcoolismo e outros; (Origem: PRT MS/GM 1359/2003, Art. 3º, I)
II - o estabelecimento de intervenções integrais precoces e adequadas para controle da hipertensão, diabetes e arterioesclerose, a fim de diminuir as deficiências físicas resultantes de enfermidades cerebrovasculares, assim como reduzir as patologias do comportamento; (Origem: PRT MS/GM 1359/2003, Art. 3º, II)
III - a incorporação, nos serviços de saúde, de práticas preventivas dos fatores de riscos e promocionais de estilos de vida saudáveis para a família, dentro de uma percepção integrada, que compreenda os ciclos biológicos, com ênfase nas relações psíquicas, sociais e culturais; (Origem: PRT MS/GM 1359/2003, Art. 3º, III)
IV - o estímulo à participação comunitária, por meio da comunicação social, com o sentido de gerar opinião favorável à adoção de comportamentos, atitudes e hábitos protetores da saúde, mediante alianças para a ação da população diante de determinados fatores de risco e para o desenvolvimento social, descentralizado e intersetorial; (Origem: PRT MS/GM 1359/2003, Art. 3º, IV)
V - a realização de estudos e análises da situação dessas doenças e de avaliação de impacto das ações, programas e políticas para acompanhamento das ações destinadas à sua prevenção e ao seu controle; (Origem: PRT MS/GM 1359/2003, Art. 3º, V)
VI - a implantação de projetos e atividades com a finalidade de prevenir acidentes, especialmente de trânsito, e violências, com repercussão na demanda dos serviços de saúde. (Origem: PRT MS/GM 1359/2003, Art. 3º, VI)
CAPÍTULO V
DA CÂMARA TÉCNICA EM REUMATOLOGIA
Art. 664. Fica instituída a Câmara Técnica em Reumatologia com a finalidade elaborar as diretrizes para à atenção à saúde da pessoa com doenças reumatológicas, bem como acompanhar, avaliar e atualizar as normas, parâmetros e procedimentos da Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materias Especiais do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 3443/2010, Art. 1º)
Parágrafo Único. A Câmara Técnica de que trata o caput será composta pelos membros a seguir relacionados e atuará sob a coordenação do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde (DAET/SAS/MS): (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único) (com redação dada pela PRT MS/GM 1256/2014)
I - um representante do Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, I)
II - um representante do Departamento de Atenção Especializada e Temática (DAET/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, II)
III - um representante do Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, III)
IV - um representante do Departamento de Atenção Básica (DAB/SAS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, IV)
V - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, V)
VI - um representante da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, VI)
VII - um representante da Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, VII)
VIII - um representante do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, VIII)
IX - um representante do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, IX)
X - um representante do Hospital Universitário indicado pela Associação Brasileira dos Hospitais Universitários e de Ensino (ABRAHUE); (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, X)
XI - um representante da Sociedade Brasileira de Reumatologia; e (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, XI)
XII - um representante da Associação Nacional de Pacientes com Reumatismo (ANAPAR). (Origem: PRT MS/GM 3443/2010, Art. 1º, Parágrafo Único, XII)
Art. 665. São atribuições da Câmara Técnica em Reumatologia: (Origem: PRT MS/GM 3443/2010, Art. 2º)
I - a elaboração de Diretrizes para a atenção à saúde da pessoa com doença reumatológica; (Origem: PRT MS/GM 3443/2010, Art. 2º, I)
II - as ações de promoção da saúde, da prevenção, de diagnóstico e do tratamento de doenças e agravos levadas a cabo no âmbito coletivo ou individual na assistência pública e privada; (Origem: PRT MS/GM 3443/2010, Art. 2º, II)
III - as recomendações para o desenvolvimento das ações das entidades públicas e privadas que integram o SUS e, quando solicitado, o sistema de saúde suplementar; (Origem: PRT MS/GM 3443/2010, Art. 2º, III)
IV - acompanhar , monitorar e sugerir revisão, quando indicado, da tabela de procedimentos relativos à Atenção Á Saúde da pessoa com doença reumatológica; (Origem: PRT MS/GM 3443/2010, Art. 2º, IV)
V - a estruturação de redes de atenção na área de reumatologia; e (Origem: PRT MS/GM 3443/2010, Art. 2º, V)
VI - a avaliação de estudos e pesquisas na área de reumatologia. (Origem: PRT MS/GM 3443/2010, Art. 2º, VI)
Art. 666. A Câmara Técnica se reunirá, periodicamente, conforme cronograma a ser estabelecido pelo Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde (DAET/SAS/MS). (Origem: PRT MS/GM 3443/2010, Art. 3º) (com redação dada pela PRT MS/GM 1256/2014)
Parágrafo Único. A Câmara Técnica em Reumatologia, quando julgar necessário, poderá convidar participantes ad hoc, sempre de caráter institucional, internos ou externos ao Ministério da Saúde, nas áreas correlacionadas com a reumatologia. (Origem: PRT MS/GM 3443/2010, Art. 3º, Parágrafo Único)
CAPÍTULO VI
DA ATENÇÃO ONCOLÓGICA
Seção I
Das Regras e Critérios para o Credenciamento de Instituições e para Apresentação, Recebimento, Análise, Aprovação, Execução, Acompanhamento, Prestação de Contas e Avaliação de Resultados de Projetos no âmbito do Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD)
Art. 667. O Anexo LXXXVI dispõe sobre as regras e critérios para o credenciamento de instituições e para apresentação, recebimento, análise, aprovação, execução, acompanhamento, prestação de contas e avaliação de resultados de projetos no âmbito do Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD).
Seção II
Do Plano de Expansão da Radioterapia
Art. 668. Fica instituído o Plano de Expansão da Radioterapia no Sistema Único de Saúde (SUS), com o objetivo de articular projetos de ampliação e qualificação de hospitais habilitados em oncologia, em consonância com os vazios assistenciais, as demandas regionais de assistência oncológica e as demandas tecnológicas do SUS. (Origem: PRT MS/GM 931/2012, Art. 1º)
Art. 669. São objetivos do Plano de Expansão da Radioterapia no SUS: (Origem: PRT MS/GM 931/2012, Art. 2º)
I - definir, coordenar e aplicar método de criação de novos serviços de radioterapia em hospitais habilitados no SUS como Unidade de Assistência de Alta Complexidade em Oncologia (UNACON); (Origem: PRT MS/GM 931/2012, Art. 2º, I)
II - definir, coordenar e aplicar método de ampliação de serviços existentes de radioterapia em hospitais habilitados no SUS como UNACON com Serviço de Radioterapia ou como Centro de Assistência de Alta Complexidade em Oncologia (CACON); (Origem: PRT MS/GM 931/2012, Art. 2º, II)
III - desenvolver o Plano de Ações para Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 2º, III)
IV - definir, em parceria com as Secretarias Municipais e Estaduais de Saúde, a expansão adequada à Rede de Atenção à Saúde, especificamente quanto à atenção oncológica; (Origem: PRT MS/GM 931/2012, Art. 2º, IV)
V - coordenar e monitorar visitas técnicas de diagnóstico necessárias durante a implantação do projeto e coordenação do processo de obras e de aquisição de equipamentos de diagnóstico e tratamento; (Origem: PRT MS/GM 931/2012, Art. 2º, V)
VI - coordenar a elaboração de pareceres técnicos relacionados ao Plano, em resposta a solicitações do Ministério da Saúde, dos Poderes Legislativo e Judiciário, organizações da sociedade civil, órgãos de controle estatais, Secretarias de Saúde, Hospitais e outros; (Origem: PRT MS/GM 931/2012, Art. 2º, VI)
VII - subsidiar programas de capacitação de profissionais; (Origem: PRT MS/GM 931/2012, Art. 2º, VII)
VIII - gerenciar todos os projetos de criação ou ampliação nos hospitais habilitados na alta complexidade em oncologia com recursos do Ministério da Saúde; e (Origem: PRT MS/GM 931/2012, Art. 2º, VIII)
IX - articular as demandas tecnológicas do SUS com as iniciativas do Plano Brasil Maior para o estímulo à produção e desenvolvimento tecnológico nacional, por intermédio da internalização da produção dos equipamentos. (Origem: PRT MS/GM 931/2012, Art. 2º, IX)
Art. 670. O Plano de Expansão da Radioterapia no SUS será executado por criação ou ampliação de serviços de radioterapia ofertados ao SUS, mediante a formalização de convênio para doação de equipamentos de radioterapia devidamente instalados, com a apresentação de todos os documentos exigidos no instrumento referido. (Origem: PRT MS/GM 931/2012, Art. 3º)
Art. 670 - O Plano de Expansão da Radioterapia no SUS - PER/SUS tem por escopo expandir, atualizar e melhorar a prestação do serviço de radioterapia no SUS, ao promover as seguintes ações nas unidades hospitalares habilitadas no SUS, para a assistência de alta complexidade em oncologia, que a ele aderirem: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - criar serviços de radioterapia, incluindo a entrega de projetos básico e executivo, a execução de obras, o apoio técnico ao processo de avaliação, monitoramento e fiscalização dos projetos e obras e a entrega de um conjunto de equipamentos de radioterapia, incluindo ou não de braquiterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - ampliar os serviços de radioterapia existentes, incluindo a entrega de projetos básico e executivos, a execução de obras, o apoio técnico ao processo de avaliação, monitoramento e fiscalização dos projetos e obras e a entrega de equipamentos para radioterapia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - disponibilizar equipamentos de radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - realizar a atualização tecnológica de equipamentos de radioterapia existentes; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - promover a compensação tecnológica ao País. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1º A adesão de hospital ao PER/SUS dar-se-á por meio da celebração de Termo de Compromisso a ser firmado com o Ministério da Saúde, que conterá, entre outras, cláusulas com as seguintes obrigações ao hospital convenente: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - disponibilizar área física desimpedida, compatível com a modalidade de sua inserção no Plano; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - acompanhar a instalação do(s) equipamento(s) e seu comissionamento, emitindo parecer de responsável técnico para o Ministério da Saúde quanto à sua execução; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - assegurar boas condições das instalações do serviço de radioterapia e o correto funcionamento do(s) equipamentos; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - prestar serviços de radioterapia à população, nos termos da Portaria n° 140/SAS/MS, de 27 de fevereiro de 2014, ou de norma congênere que a complemente ou substitua. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - colaborar com o gestor público nas atividades necessárias à regulação do acesso ao serviço de radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VI - garantir recursos humanos necessários para o atendimento radioterápico, em observância às normativas da CNEN e da Resolução RDC/Anvisa nº 20, de 2 de fevereiro de 2006, ou de normas congêneres que as complementem ou substituam; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VII - colaborar no treinamento de recursos humanos especializados para prestação de serviços em radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VIII - assegurar, por meio de contratos de manutenção preventiva e corretiva, boas condições de funcionamento para o(s) equipamento(s) cedido(s) após o término do período de garantia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IX - ofertar ao gestor público vagas para atendimentos em radioterapia compatíveis com a capacidade de atendimento do novo equipamento, de, no mínimo, 50 (cinquenta) pacientes tratados em radioterapia em base mensal ou 600 pacientes em base anual; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
X - aceitar a doação do(s) equipamento(s) contemplado(s) após o prazo de 3 (três) anos contados a partir da concessão de licença de operação pela CNEN; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
X - aceitar o termo de doação do equipamento contemplado, após a emissão da licença de operação pela CNEN; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
XI - manter atualizada a Certificação de Entidades Beneficentes de Assistência Social - CEBAS e a regularização fiscal; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
XII - devolver os recursos financeiros atualizados ao Tesouro Nacional, referentes às despesas incorridas pelo Ministério da Saúde com as atividades do Plano de Expansão relativas ao estabelecimento, em caso de desligamento do hospital do PER-SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2° A doação do(s) equipamento(s) aos hospitais contemplados pelas soluções de radioterapia no âmbito do PER-SUS de que trata o inciso X do § 1º, ocorrerá somente após o cumprimento integral das demais cláusulas pactuadas. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 671. O convênio a que se refere o art. 670 somente será assinado mediante a apresentação de declaração emitida pela respectiva Secretaria de Saúde Estadual, constando os seguintes compromissos mínimos: (Origem: PRT MS/GM 931/2012, Art. 4º)
I - priorização dos processos para aprovação de projetos, licenciamento e credenciamento de serviços de radioterapia no âmbito da Secretaria de Saúde Estadual; (Origem: PRT MS/GM 931/2012, Art. 4º, I)
II - regulação do acesso de pacientes para os serviços de radioterapia criados ou ampliados no âmbito deste Plano; e (Origem: PRT MS/GM 931/2012, Art. 4º, II)
III - garantia de apoio técnico e financeiro ao hospital, quando a Secretaria Estadual de Saúde julgar pertinente e necessário. (Origem: PRT MS/GM 931/2012, Art. 4º, III)
Parágrafo Único. Para os fins do estabelecido no "caput" deste artigo, o hospital e a respectiva Secretaria Estadual de Saúde terão responsabilidade solidária. (Origem: PRT MS/GM 931/2012, Art. 4º, Parágrafo Único)
Art. 671 - O desligamento de hospital do PER/SUS deverá ser apreciado pelo Comitê Gestor do Plano de Expansão de Radioterapia do SUS - CGPER/SUS, após formalização do pleito: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - pelo hospital que pleiteia a sua exclusão; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - pela Secretaria Estadual ou Municipal de Saúde gestora do serviço; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - pela área técnica do Ministério da Saúde que tenha interface com a temática, em virtude do descumprimento do convênio firmado ou das normas aplicáveis à alta-complexidade em oncologia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1° A decisão sobre o desligamento de hospital do PER/SUS deverá considerar os termos da pactuação realizada e as normas aplicáveis à alta-complexidade em oncologia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º Da decisão sobre o desligamento caberá recurso, no prazo de 30 (trinta) dias contados da ciência do interessado, ao qual se atribuirá efeito suspensivo, ao Ministro de Estado da Saúde, que decidirá em última instância. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 3° Esgotadas as vias administrativas, o CGPER/SUS oficiará a entidade hospitalar beneficiada para proceder à devolução dos recursos financeiros, atualizados, devidos ao Tesouro Nacional e referentes às despesas incorridas pelo Ministério da Saúde com as atividades do PER/SUS relativas ao estabelecimento, consoante os termos da pactuação realizada. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 4° Findo o processo de desligamento de hospital do Plano de Expansão de Radioterapia do SUS, deverá o CGPER/SUS indicar outro hospital, em observância aos arts. 672 e 673 desta Portaria, para integrar o PER/SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 672. A assinatura de convênios no âmbito do Plano de Expansão da Radioterapia no SUS será feita com a observância de ordem de classificação e de prioridade para os hospitais interessados, observada a pontuação fixada no Anexo XXXV . (Origem: PRT MS/GM 931/2012, Art. 5º)
§ 1º As Secretarias de Saúde Estaduais poderão, mediante justificativa técnica, propor nova ordem de classificação e de prioridade para os hospitais pontuados e classificados em seu Estado, bem como propor a inclusão de outros estabelecimentos de saúde na listagem. (Origem: PRT MS/GM 931/2012, Art. 5º, § 1º)
§ 2º O pedido de nova ordem de classificação ou de inclusão de novos estabelecimentos de saúde, conforme § 1º, somente poderá ser formulado se as Secretarias de Saúde Estaduais promoverem, previamente, chamamento público para seleção de potenciais interessados. (Origem: PRT MS/GM 931/2012, Art. 5º, § 2º)
Art. 672 - A inclusão de hospital no PER/SUS observará o déficit regional de oferta de radioterapia e os equipamentos e instalações de radioterapia existentes no estabelecimento hospitalar elegível. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1º A inclusão ou substituição de hospital observará priorização baseada em: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - oferta regional de radioterapia nos estados e Distrito Federal, estimada pelo número de equipamentos de teleterapia (acelerador linear e unidade de cobalto) que prestam serviços ao SUS, segundo o SCNES em 31 de dezembro de 2016 e os parâmetros estabelecidos na Portaria n° 140/SAS/MS, de 2014, habilitados na atenção especializada em oncologia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - número de equipamentos de teleterapia (unidade de cobalto ou acelerador linear) instalados conforme informado no SCNES em 31 de dezembro de 2016; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - necessidade assistencial no hospital, caracterizada pela relação entre a produção de cirurgia oncológica, quimioterapia e radioterapia aprovada nos últimos 12 meses e o esperado segundo a Portaria n° 140/SAS/MS, de 2014. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º A inclusão de hospital para fins apenas de disponibilização de equipamento de radioterapia será condicionada: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - à informação ao Ministério da Saúde, nos termos do Anexo I, sobre a disponibilidade de casamata compatível com acelerador linear especificado no PER/SUS, não utilizada ou ocupada por unidade de Cobalto ou acelerador linear obsoleto, assim considerado aquele que está fora do período de suporte pelo fabricante do equipamento original; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - à declaração de capacidade financeira para execução de obra física de adequação da casamata ao equipamento disponibilizado pelo Plano de Expansão da Radioterapia, quando essa obra for necessária; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - ao compromisso em realizar a obra física de adequação e disponibilizar casamata desimpedida para receber o equipamento de radioterapia em prazo não superior a 6 (seis) meses, quando essa obra for necessária; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - à priorização baseada nos critérios definidos no § 1º deste artigo (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 3º A inclusão de hospital para fins apenas de atualização de equipamento de radioterapia será condicionada: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - a estudo de viabilidade técnica e econômica demonstrando vantagem em termos de eficiência e economicidade para a atualização tecnológica frente à alternativa de substituição do equipamento; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - à declaração de capacidade financeira do hospital para execução de obra física de adequação da casamata para atualização do equipamento pelo Plano de Expansão da Radioterapia, quando essa obra for necessária; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - ao compromisso do hospital em realizar a obra física em prazo não superior a 6 (seis) meses, quando essa obra for necessária; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - à priorização baseada nos critérios definidos no § 1º deste artigo. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 4º Em casos justificados e aprovados pelas instâncias técnicas e deliberativas do PER/SUS, os prazos previstos no inciso III do § 2º e no inciso III do § 3º poderão, excepcionalmente, ser prorrogados uma vez por igual período. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 5º Para fins do disposto no § 4º: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - o estabelecimento interessado deverá submeter pleito fundamentado de prorrogação do prazo para apreciação das instâncias técnicas e deliberativas do PER/SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - a Secretaria-Executiva do Ministério da Saúde, na qualidade de Coordenadora do Comitê Gestor do PER/SUS, publicará portaria nos casos de deferimento do pleito; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - o prazo de prorrogação terá início a partir da sua publicação de trata o inciso II, respeitado o limite previsto no § 4º. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
Art. 673. Para fins de criação ou ampliação de serviços de radioterapia, são elegíveis para adesão ao Plano de Expansão da Radioterapia no SUS os estabelecimentos hospitalares públicos ou privados sem fins lucrativos que sejam habilitados como: (Origem: PRT MS/GM 931/2012, Art. 6º)
I - UNACON; (Origem: PRT MS/GM 931/2012, Art. 6º, I)
II - UNACON com Serviço de Radioterapia; (Origem: PRT MS/GM 931/2012, Art. 6º, II)
III - UNACON com Serviço de Hematologia; (Origem: PRT MS/GM 931/2012, Art. 6º, III)
IV - UNACON com Serviço de Oncologia Pediátrica; (Origem: PRT MS/GM 931/2012, Art. 6º, IV)
V - CACON; e (Origem: PRT MS/GM 931/2012, Art. 6º, V)
VI - CACON com Serviço de Oncologia Pediátrica. (Origem: PRT MS/GM 931/2012, Art. 6º, VI)
Art. 673 - São elegíveis, para inclusão no PER/SUS, os hospitais públicos ou privados sem fins lucrativos que estejam habilitados como: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - UNACON; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - UNACON com Serviço de Radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - UNACON com Serviço de Hematologia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - UNACON com Serviço de Oncologia Pediátrica; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - CACON; ou (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VI - CACON com Serviço de Oncologia Pediátrica. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1° O CGPER/SUS poderá apreciar a solicitação de inclusão no PER/SUS de hospitais credenciados ao SUS em processo de habilitação para atendimento em alta complexidade em oncologia, mas apenas deliberará após deferimento da habilitação de que trata o caput deste artigo. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2° A inclusão de hospitais no PER/SUS requer aprovação pela Comissão Intergestores Bipartite (CIB). (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 3° A contar da publicação desta Portaria, o hospital terá o prazo de 30 (trinta) dias para informar ao Ministério da Saúde, mediante ofício, o interesse em aderir ao PER/SUS e apresentar a documentação pertinente, conforme anexo I; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 4° Na hipótese de não ter recebido pedidos suficientes de adesão no prazo estipulado no parágrafo anterior, poderá o Ministério da Saúde conceder igual prazo para novas candidaturas. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§5° Os hospitais que solicitarem adesão ao PER/SUS no prazo previsto no § 4° concorrerão às vagas que não tiverem sido preenchidas pelos hospitais que solicitaram adesão no prazo previsto no § 3º. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 674. Para fins de criação de serviços de radioterapia, são elegíveis para adesão ao Plano de Expansão da Radioterapia no SUS os hospitais públicos ou privados sem fins lucrativos associados a serviço isolado de radioterapia com fins lucrativos. (Origem: PRT MS/GM 931/2012, Art. 7º) (Revogado pela pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 675. Fica instituído o Comitê Gestor do Plano de Expansão da Radioterapia no SUS, que será composto pelos seguintes membros: (Origem: PRT MS/GM 931/2012, Art. 8º)
I - Secretário(a) Executivo(a) do Ministério da Saúde (SE), que o coordenará; (Origem: PRT MS/GM 931/2012, Art. 8º, I)
II - Secretário(a) de Atenção à Saúde do Ministério da Saúde (SAS); (Origem: PRT MS/GM 931/2012, Art. 8º, II)
III - Secretário(a) de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE); e (Origem: PRT MS/GM 931/2012, Art. 8º, III)
IV - Diretor-Geral do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS). (Origem: PRT MS/GM 931/2012, Art. 8º, IV)
Art. 675. Fica instituído o Comitê Gestor do Plano de Expansão da Radioterapia no SUS - CGPER/SUS, que será composto pelos titulares dos seguintes órgãos: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - Secretaria-Executiva do Ministério da Saúde (SE/MS), que o coordenará; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - Secretaria de Atenção Especializada à Saúde do Ministério da Saúde ( S A ES / M S ) ; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - Secretaria de Ciência, Tecnologia e Insumos Estratégicos para à Saúde (SCTIE/MS); e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
IV - Diretoria-Geral do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAES/MS). (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 1º Os substitutos dos titulares dos órgãos elencados no caput serão seus suplentes no CGPER/SUS, que atuarão nas ausências e impedimentos do titular. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 2º O quórum de reunião e de aprovação do CGPER/SUS é de maioria dos membros. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 3º As reuniões serão preferencialmente realizadas de modo presencial, de modo que os membros do Comitê Gestor que se encontrarem em outros entes federativos deverão participar da reunião por meio de videoconferência. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 4º A SE/MS prestará o apoio administrativo necessário ao desenvolvimento dos trabalhos do CGPER/SUS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 5º A participação no CGPER/SUS será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
Art. 676. Compete ao Comitê Gestor: (Origem: PRT MS/GM 931/2012, Art. 9º)
I - aprovar as diretrizes estratégicas do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 9º, I)
II - aprovar o Plano de Ações elaborado pelo Comitê Executivo; (Origem: PRT MS/GM 931/2012, Art. 9º, II)
III - aprovar outras ações propostas pelo Comitê Executivo; (Origem: PRT MS/GM 931/2012, Art. 9º, III)
IV - propor os locais e hospitais, em consonância com as respectivas Secretarias Estaduais de Saúde, onde serão implementados os projetos de criação ou ampliação de serviços de radioterapia; e (Origem: PRT MS/GM 931/2012, Art. 9º, IV)
V - avaliar as propostas das Secretarias Estaduais de Saúde para nova ordem de classificação e de prioridade para os hospitais pontuados e classificados em seu Estado. (Origem: PRT MS/GM 931/2012, Art. 9º, V)
Parágrafo Único. O Comitê Gestor reunir-se-á semestralmente com o objetivo de acompanhar a execução do Plano de Ações aprovado. (Origem: PRT MS/GM 931/2012, Art. 9º, Parágrafo Único)
Art. 676 - Compete ao CGPER/SUS: (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
I - deliberar sobre diretrizes estratégicas para o PER/SUS; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - deliberar sobre ações recomendadas pelo Comitê Executivo
para consecução do PER/SUS; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - deliberar sobre a inclusão e o desligamento de hospitais
no PER/SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 1º O CGPER/SUS reunir-se-á, ordinariamente, em periodicidade
semestral, com o objetivo de acompanhar a execução das
ações aprovadas. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º O coordenador do CGPER/SUS poderá, quando entender
necessário, convocar reuniões extraordinárias. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
Art. 676. Compete ao CGPER/SUS: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - deliberar sobre diretrizes estratégicas para o PER/SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - deliberar sobre ações recomendadas pelo CEPER/SUS para consecução do PER/SUS; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - deliberar sobre a inclusão e o desligamento de hospitais no PER/SUS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 1º O CGPER/SUS reunir-se-á, ordinariamente, a cada 90 (noventa) dias, com o objetivo de acompanhar a execução da implementação das soluções do PER/SUS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 2º O coordenador do CGPER/SUS poderá, quando entender necessário, convocar reuniões extraordinárias. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
Art. 677. Fica instituído o Comitê Executivo do Plano de Expansão da Radioterapia no SUS, que será composto por representantes dos seguintes órgãos do Ministério da Saúde: (Origem: PRT MS/GM 931/2012, Art. 10)
I - Departamento do Complexo Industrial e Inovação em Saúde (DECIIS/SCTIE/MS), que o coordenará; (Origem: PRT MS/GM 931/2012, Art. 10, I)
II - Departamento de Atenção Especializada e Temática (DAET/SAS/MS); (Origem: PRT MS/GM 931/2012, Art. 10, II)
III - Departamento de Logística em Saúde (DLOG/SE/MS); (Origem: PRT MS/GM 931/2012, Art. 10, III)
IV - Subsecretaria de Assuntos Administrativos (SAA/SE/MS); e (Origem: PRT MS/GM 931/2012, Art. 10, IV)
V - Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS/MS). (Origem: PRT MS/GM 931/2012, Art. 10, V)
Art. 677. Fica instituído o Comitê Executivo do Plano de Expansão da Radioterapia no SUS - CEPER/SUS, que será composto pelos titulares dos seguintes órgãos: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - Coordenação-Geral de Planejamento e Orçamento (CGPO/SCTIE/MS), que o coordenará; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - Departamento de Atenção Especializada e Temática (DAET/SAES/MS); (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - Departamento de Logística em Saúde (DLOG/SE/MS); (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
IV - Subsecretaria de Assuntos Administrativos (SAA/SE/MS); e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
V - Instituto Nacional de Câncer José Alencar Gomes da Silva ( I N C A / S A ES / M S ) . (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 1º Os substitutos dos titulares dos órgãos elencados no caput serão seus suplentes no CEPER/SUS, que atuarão nas ausências e impedimentos do titular. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 2º O quórum de reunião e de aprovação do CEPER/SUS é de maioria dos membros. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 3º As reuniões serão preferencialmente realizadas de modo presencial, de modo que os membros do Comitê Gestor que se encontrarem em outros entes federativos deverão participar da reunião por meio de videoconferência. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 4º A SCTIE/MS prestará o apoio administrativo necessário ao desenvolvimento dos trabalhos do CEPER/SUS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
Art. 678. Compete ao Comitê Executivo: (Origem: PRT MS/GM 931/2012, Art. 11)
I - propor ao Comitê Gestor as diretrizes estratégicas do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, I)
II - elaborar o Plano de Ações, que conterá, entre outras, as linhas estratégicas que orientarão o emprego de esforços e recursos, materiais e financeiros, necessários à execução do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, II)
III - propor outras ações ao Comitê Gestor; (Origem: PRT MS/GM 931/2012, Art. 11, III)
I - propor ao CGPER/SUS as diretrizes estratégicas para o
PER/SUS; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
II - gerenciar e monitorar as ações necessárias à execução do
PER/SUS; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
III - propor ao ao CGPER/SUS a inclusão ou o desligamento
de hospitais no PER/SUS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - gerenciar e monitorar a implantação das ações estabelecidas no Plano de Ações; e (Origem: PRT MS/GM 931/2012, Art. 11, IV)
V - propor ao Comitê Gestor a listagem dos locais e hospitais onde serão implementados os projetos de criação ou ampliação de serviços de radioterapia. (Origem: PRT MS/GM 931/2012, Art. 11, V)
§ 1º O Comitê Executivo contará com: (Origem: PRT MS/GM 931/2012, Art. 11, § 1º)
I - Gerência de Projeto, exercida pela Coordenação-Geral de Equipamentos e Materiais de Uso em Saúde (CGEMS/DECIIS/SCTIE/MS), com apoio do DAET/SAS/MS e do INCA/SAS/MS; (Origem: PRT MS/GM 931/2012, Art. 11, § 1º, I)
II - Apoio Logístico, exercido em conjunto pela SAA/SE/MS, pelo DLOG/SE/MS e pela Secretaria de Planejamento e Orçamento (SPO/SE/MS), no âmbito de suas competências; e (Origem: PRT MS/GM 931/2012, Art. 11, § 1º, II)
III - Coordenação Técnica, exercida pelo INCA/SAS/MS. (Origem: PRT MS/GM 931/2012, Art. 11, § 1º, III)
III - Coordenação Técnica, exercida pela Coordenação-Geral
de Atenção Especializada CGAE/DAET/SAS/MS, com apoio do INCA/SAS/MS. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 2º O Comitê Executivo reunir-se-á mensalmente com o objetivo de acompanhar a execução o Plano de Expansão de Radioterapia no SUS. (Origem: PRT MS/GM 931/2012, Art. 11, § 2º)
§ 3º Compete à Gerência de Projeto do Comitê Executivo: (Origem: PRT MS/GM 931/2012, Art. 11, § 3º)
I - acompanhar as ações que integram o Plano de Expansão de Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, I)
II - subsidiar tecnicamente o Comitê Executivo; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, II)
III - analisar a adesão ao Plano de Expansão de Radioterapia no SUS, bem como futuras alterações; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, III)
IV - avaliar e acompanhar os projetos de criação e ampliação de serviços de radioterapia, considerando aspectos de estrutura e assistenciais; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, IV)
V - acompanhar a execução do cronograma de obras para criação ou ampliação dos serviços de radioterapia; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, V)
IV - avaliar e acompanhar os projetos de criação e ampliação
ou disponibilização de equipamento, considerando os aspectos de estrutura. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - acompanhar a execução do cronograma de obras para
criação, ampliação ou de adequação da casamata, bem como a instalação
dos equipamentos de radioterapia; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
VI - acompanhar a execução do cronograma de compensação tecnológica previsto na aquisição das tecnologias previstas no Plano de Expansão de Radioterapia no SUS, em consonância com o objetivo previsto no art. 669, IX; (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, VI)
VII - participar de visitas técnicas; e (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, VII)
VIII - acompanhar, por meio de indicadores específicos, a implantação e produção assistencial dos serviços criados e ampliados. (Origem: PRT MS/GM 931/2012, Art. 11, § 3º, VIII)
§ 4º A Gerência de Projeto poderá convocar reuniões e solicitar técnicos e relatórios de qualquer área do Ministério da Saúde, para acompanhar e monitorar a implantação das ações que integram o Plano de Ações. (Origem: PRT MS/GM 931/2012, Art. 11, Parágrafo Único)
§ 5º Compete ao Apoio Logístico: (Origem: PRT MS/GM 931/2012, Art. 11, § 4º)
I - colaborar na elaboração e execução do Plano de Ações para a Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, § 4º, I)
II - orientar, implementar e avaliar os processos e as ações de compra de bens e de contratação de serviços relativos ao Plano de Ações; e (Origem: PRT MS/GM 931/2012, Art. 11, § 4º, II)
III - orientar e avaliar os processos de orçamento, finanças e contabilidade das compras de bens e contratações de serviços relativos ao Plano de Ações. (Origem: PRT MS/GM 931/2012, Art. 11, § 4º, III)
III - apoiar tecnicamente o Comitê Gestor do Plano de Expansão; (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
IV - elaborar e consolidar relatórios semestrais que subsidiarão
as reuniões do Comitê Gestor do Plano de Expansão; e (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
V - acompanhar por meio de indicadores específicos a implantação
e produção assistencial dos serviços contemplados neste Plano
após início de operação dos equipamentos de radioterapia. (Redação dada pela PRT MS/GM n° 3.283 de 04.12.2017)
§ 6º Compete à Coordenação Técnica: (Origem: PRT MS/GM 931/2012, Art. 11, § 5º)
I - atuar como facilitadora da implantação do Plano de Expansão da Radioterapia no SUS; (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, I)
II - contribuir para a implementação das diretrizes do Plano de Ações; (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, II)
III - apoiar tecnicamente o Comitê Gestor do Plano de Expansão; e (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, III)
IV - elaborar e consolidar relatórios semestrais que subsidiarão as reuniões do Comitê Gestor do Plano de Expansão. (Origem: PRT MS/GM 931/2012, Art. 11, § 5º, IV)
§ 7º As funções dos membros do Comitê Gestor e do Comitê Executivo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 931/2012, Art. 11, § 6º)
Art. 678. Compete ao CEPER/SUS: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - propor ao CGPER/SUS as diretrizes estratégicas para o PER/SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - gerenciar e monitorar as ações necessárias à execução do PER/SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - propor ao CGPER/SUS a inclusão ou o desligamento de hospitais no PER/SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
IV - gerenciar e monitorar a implantação das ações estabelecidas no Plano de Ações; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
V - propor ao Comitê Gestor a listagem dos locais e hospitais onde serão implementados os projetos de criação ou ampliação de serviços de radioterapia. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 1º O Comitê Executivo contará com: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - Gerência de Projeto, exercida pela CGPO/SCTIE/MS, com apoio do DAET/SAES/MS e do INCA/SAES/MS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - Apoio Logístico, exercido em conjunto pela SAA/SE/MS, pelo DLOG/SE/MS e pela Secretaria de Planejamento e Orçamento (SPO/SE/MS), no âmbito de suas competências; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - Coordenação Técnica, exercida pela Coordenação-Geral de Atenção Especializada CGAE/DAET/SAS/MS, com apoio do INCA/SAES/MS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 2º O Comitê Executivo reunir-se-á mensalmente com o objetivo de acompanhar a execução o Plano de Expansão de Radioterapia no SUS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 3º Compete à Gerência de Projeto do Comitê Executivo: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - acompanhar as ações que integram o Plano de Expansão de Radioterapia no SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - subsidiar tecnicamente o Comitê Executivo; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - analisar a adesão ao Plano de Expansão de Radioterapia no SUS, bem como futuras alterações; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
IV - avaliar e acompanhar os projetos de criação e ampliação ou disponibilização de equipamento, considerando os aspectos de estrutura; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
V - acompanhar a execução do cronograma de obras para criação, ampliação ou de adequação da casamata, bem como a instalação dos equipamentos de radioterapia; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
VI - acompanhar a execução do cronograma de compensação tecnológica previsto na aquisição das tecnologias previstas no Plano de Expansão de Radioterapia no SUS, em consonância com o objetivo previsto no art. 669, inciso IX; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
VII - participar de visitas técnicas; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
VIII - elaborar e consolidar relatórios trimestrais que subsidiarão as reuniões do Comitê Gestor do Plano de Expansão. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 4º A Gerência de Projeto poderá convocar reuniões e solicitar técnicos e relatórios de qualquer área do Ministério da Saúde, para acompanhar e monitorar a implantação das ações que integram o Plano de Ações. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 5º Compete ao Apoio Logístico: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - colaborar na elaboração e execução do Plano de Ações para a Expansão da Radioterapia no SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - orientar, implementar e avaliar os processos e as ações de compra de bens e de contratação de serviços relativos ao Plano de Ações; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - apoiar tecnicamente o Comitê Gestor do Plano de Expansão; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
IV - elaborar e consolidar relatórios trimestrais que subsidiarão as reuniões do Comitê Gestor do Plano de Expansão. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 6º Compete à Coordenação Técnica: (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
I - atuar como facilitadora da implantação do Plano de Expansão da Radioterapia no SUS; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
II - contribuir para a implementação das diretrizes do Plano de Ações; (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
III - apoiar tecnicamente o Comitê Gestor do Plano de Expansão; e (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
IV - acompanhar, por meio de indicadores específicos, a implantação e produção assistencial dos serviços criados e ampliados pelo PER/SUS. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
§ 7º A participação no CEPER/SUS será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT MS/GM n° 659 de 28.03.2022)
CAPÍTULO VII
DO SERVIÇO DE ATENÇÃO ÀS PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL
Seção I
Da Organização do Serviço de Atenção às Pessoas em Situação de Violência Sexual
Art. 679. Esta Seção define o funcionamento do Serviço de Atenção às Pessoas em Situação de Violência Sexual no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 485/2014, Art. 1º)
Art. 680. O Serviço de Atenção às Pessoas em Situação de Violência Sexual no âmbito do SUS integra as redes intersetoriais de enfrentamento da violência contra mulheres, homens, crianças, adolescentes e pessoas idosas e tem como funções precípuas preservar a vida, ofertar atenção integral em saúde e fomentar o cuidado em rede. (Origem: PRT MS/GM 485/2014, Art. 2º)
Art. 681. O Serviço de Atenção às Pessoas em Situação de Violência Sexual poderá ser organizado em todos os estabelecimentos de saúde integrantes do SUS, conforme as especificidades e atribuições de cada estabelecimento. (Origem: PRT MS/GM 485/2014, Art. 3º)
Art. 682. O Serviço de Atenção às Pessoas em Situação de Violência Sexual poderá abranger as seguintes classificações: (Origem: PRT MS/GM 485/2014, Art. 4º)
I - Serviço de Referência para Atenção Integral às Mulheres em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, I)
II - Serviço de Referência para Atenção Integral a Adolescentes em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, II)
III - Serviço de Referência para Atenção Integral às Crianças em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, III)
IV - Serviço de Referência para Atenção Integral aos Homens em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, IV)
V - Serviço de Referência para Atenção Integral às Pessoas Idosas em Situação de Violência Sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, V)
VI - Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei; e (Origem: PRT MS/GM 485/2014, Art. 4º, VI)
VII - Serviços ambulatoriais com atendimento a pessoas em situação de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 4º, VII)
§ 1º Os Serviços de Referência para Atenção Integral às Mulheres, Adolescentes, Crianças, Homens e Pessoas Idosas em situação de violência sexual e o Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei poderão ser organizados em hospitais gerais e maternidades, prontos-socorros, Unidades de Pronto-Atendimento (UPA) e no conjunto de serviços de urgência não hospitalares. (Origem: PRT MS/GM 485/2014, Art. 4º, § 1º)
§ 2º Os serviços ambulatoriais, como Unidades Básicas de Saúde (UBS), Centros de Atenção Psicossocial (CAPS), ambulatórios de especialidades e outros, compõem a rede de cuidado a pessoas em situação de violência sexual, devendo realizar o atendimento conforme suas especificidades e atribuições. (Origem: PRT MS/GM 485/2014, Art. 4º, § 2º)
Art. 683. Os Serviços de Referência para Atenção Integral às Mulheres, Adolescentes, Crianças, Homens e Pessoas Idosas em Situação de Violência Sexual terão suas ações desenvolvidas em conformidade com a Norma Técnica de Prevenção e Tratamento dos Agravos resultantes da Violência Sexual contra Mulheres e Adolescentes do Ministério da Saúde, realizando: (Origem: PRT MS/GM 485/2014, Art. 5º)
I - acolhimento; (Origem: PRT MS/GM 485/2014, Art. 5º, I)
II - atendimento humanizado, observados os princípios do respeito da dignidade da pessoa humana, da não discriminação, do sigilo e da privacidade; (Origem: PRT MS/GM 485/2014, Art. 5º, II)
III - escuta qualificada, propiciando ambiente de confiança e respeito; (Origem: PRT MS/GM 485/2014, Art. 5º, III)
IV - informação prévia ao paciente, assegurada sua compreensão sobre o que será realizado em cada etapa do atendimento e a importância das condutas médicas, multiprofissionais e policiais, respeitada sua decisão sobre a realização de qualquer procedimento; (Origem: PRT MS/GM 485/2014, Art. 5º, IV)
V - atendimento clínico; (Origem: PRT MS/GM 485/2014, Art. 5º, V)
VI - atendimento psicológico; (Origem: PRT MS/GM 485/2014, Art. 5º, VI)
VII - realização de anamnese e preenchimento de prontuário onde conste, entre outras, as seguintes informações: (Origem: PRT MS/GM 485/2014, Art. 5º, VII)
a) data e hora do atendimento; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, a)
b) história clínica detalhada, com dados sobre a violência sofrida; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, b)
c) exame físico completo, inclusive exame ginecológico, se for necessário; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, c)
d) descrição minuciosa das lesões, com indicação da temporalidade e localização específica;e (Origem: PRT MS/GM 485/2014, Art. 5º, VII, d)
e) identificação dos profissionais que atenderam a pessoa em situação de violência; (Origem: PRT MS/GM 485/2014, Art. 5º, VII, e)
VIII - dispensação e administração de medicamentos para profilaxias indicadas conforme as normas, regras e diretrizes técnicas do Ministério da Saúde; (Origem: PRT MS/GM 485/2014, Art. 5º, VIII)
IX - exames laboratoriais necessários; (Origem: PRT MS/GM 485/2014, Art. 5º, IX)
X - preenchimento da ficha de notificação compulsória de violência doméstica, sexual e outras violências; (Origem: PRT MS/GM 485/2014, Art. 5º, X)
XI - orientação e agendamento ou encaminhamento para acompanhamento clínico e psicossocial; e (Origem: PRT MS/GM 485/2014, Art. 5º, XI)
XII - orientação às pessoas em situação de violência ou aos seus responsáveis a respeito de seus direitos e sobre a existência de outros serviços para atendimento a pessoas em situação de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 5º, XII)
§ 1º Sem prejuízo da atuação do Instituto Médico Legal (IML), os estabelecimentos de saúde poderão realizar, no âmbito dos serviços de referência dispostos no "caput", a coleta, guarda provisória, preservação e entrega de material com vestígios de violência sexual, conforme o disposto no Decreto nº 7.958, de 13 de março de 2013. (Origem: PRT MS/GM 485/2014, Art. 5º, § 1º)
§ 2º Os estabelecimentos de saúde que organizarem a oferta dos serviços de referência dispostos no "caput" funcionarão em regime integral, 24 (vinte e quatro) horas por dia, nos 7 (sete) dias da semana e sem interrupção da continuidade entre os turnos, sendo de competência do gestor local de saúde a regulação do acesso aos leitos em casos de internação. (Origem: PRT MS/GM 485/2014, Art. 5º, § 2º)
Art. 684. O Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei terá suas ações desenvolvidas em conformidade com a Norma Técnica de Atenção Humanizada ao Abortamento do Ministério da Saúde, realizando: (Origem: PRT MS/GM 485/2014, Art. 6º)
I - atendimento clínico, ginecológico, cirúrgico e psicossocial, contando com serviço de apoio laboratorial; (Origem: PRT MS/GM 485/2014, Art. 6º, I)
II - apoio diagnóstico e assistência farmacêutica; e (Origem: PRT MS/GM 485/2014, Art. 6º, II)
III - coleta e guarda de material genético. (Origem: PRT MS/GM 485/2014, Art. 6º, III)
Parágrafo Único. Os estabelecimentos de saúde que organizarem a oferta do serviço de referência disposto no "caput" funcionarão em regime integral, 24 (vinte e quatro) horas por dia, nos 7 (sete) dias da semana e sem interrupção da continuidade entre os turnos, sendo de competência do gestor local de saúde a regulação do acesso aos leitos em casos de internação. (Origem: PRT MS/GM 485/2014, Art. 6º, Parágrafo Único)
Art. 685. A equipe dos Serviços de Referência para Atenção Integral às Mulheres, Adolescentes, Crianças, Homens e Pessoas Idosas em Situação de Violência Sexual e do Serviço de Referência para Interrupção de Gravidez nos Casos Previstos em Lei possuirá a seguinte composição de referência: (Origem: PRT MS/GM 485/2014, Art. 7º)
I - 1 (um) médico clínico ou 1 (um) médico em especialidades cirúrgicas; (Origem: PRT MS/GM 485/2014, Art. 7º, I)
II - 1 (um) enfermeiro; (Origem: PRT MS/GM 485/2014, Art. 7º, II)
III - 1 (um) técnico em enfermagem; (Origem: PRT MS/GM 485/2014, Art. 7º, III)
IV - 1 (um) psicólogo; (Origem: PRT MS/GM 485/2014, Art. 7º, IV)
V - 1 (um) assistente social; e (Origem: PRT MS/GM 485/2014, Art. 7º, V)
VI - 1 (um) farmacêutico. (Origem: PRT MS/GM 485/2014, Art. 7º, VI)
§ 1º Equipamentos e outros materiais necessários para o funcionamento adequado dos serviços de referência deverão estar organizados e disponíveis para os profissionais em escala de atendimento, de acordo com as normas, regras e diretrizes técnicas estabelecidas pelo Ministério da Saúde. (Origem: PRT MS/GM 485/2014, Art. 7º, § 1º)
§ 2º Os serviços de referência assegurarão a continuidade do cuidado e do acompanhamento, incluindo-se a realização dos exames regulares, de acordo com os protocolos clínicos e diretrizes técnicas em vigor. (Origem: PRT MS/GM 485/2014, Art. 7º, § 2º)
Art. 686. Os Serviços de Referência para Atenção Integral a Adolescentes e às Crianças em Situação de Violência Sexual comunicarão imediatamente ao Conselho Tutelar da respectiva localidade a suspeita ou confirmação de maus tratos contra criança ou adolescente, de acordo com o art. 13 da Lei nº 8.069, de 13 de julho de 1990 (Estatuto da Criança e do Adolescente). (Origem: PRT MS/GM 485/2014, Art. 8º)
Art. 687. O Serviço de Referência para Atenção Integral às Pessoas Idosas em Situação de Violência Sexual subsidiará com informações à rede intersetorial de serviços de saúde e assistência social de que trata a Lei nº 10.741, de 1º de outubro de 2003 (Estatuto do Idoso). (Origem: PRT MS/GM 485/2014, Art. 9º)
Art. 688. Os serviços ambulatoriais com atendimento a pessoas em situação de violência sexual deverão oferecer acolhimento, atendimento humanizado e multidisciplinar e encaminhamento, sempre que necessário, aos serviços referência na Saúde, serviços de assistência social ou de outras políticas públicas voltadas ao enfrentamento da violência e órgãos e entidades de defesa de direitos. (Origem: PRT MS/GM 485/2014, Art. 10)
Parágrafo Único. Os medicamentos para profilaxias indicadas, inclusive anticoncepção de emergência, deverão ser dispensados e administrados nos serviços ambulatoriais às vítimas de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 10, Parágrafo Único)
Art. 689. O Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações realizará a notificação compulsória das situações atendidas através da Ficha de Notificação/Investigação Individual de Violências Doméstica, Sexual e/ou outras Violências, disponível no Sistema de Informação de Agravos de Notificação (SINAN). (Origem: PRT MS/GM 485/2014, Art. 11)
Art. 690. O monitoramento e a avaliação do Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações constituem responsabilidade do Ministério da Saúde e das respectivas Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios. (Origem: PRT MS/GM 485/2014, Art. 12)
§ 1º O Ministério da Saúde, por meio do Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS), em parceria com demais áreas do Ministério da Saúde, estabelecerá em conjunto com as Secretarias de Saúde dos estados, do Distrito Federal e dos municípios, o apoio técnico para a implementação, o monitoramento e a avaliação do Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações. (Origem: PRT MS/GM 485/2014, Art. 12, § 1º)
§ 2º O Ministério da Saúde e as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios desenvolverão mecanismos de informação e comunicação à população sobre os endereços em que estejam situados os Serviços de Referência para Atenção Integral às Pessoas em Situação de Violência Sexual, de acordo com os dados registrados no Sistema do Cadastro Nacional de Estabelecimentos de Saúde (SCNES). (Origem: PRT MS/GM 485/2014, Art. 12, § 2º)
Art. 691. Compete ao Ministério da Saúde: (Origem: PRT MS/GM 485/2014, Art. 13)
I - financiar, de acordo com a sua disponibilidade orçamentária e financeira, a adequação dos espaços físicos, equipamentos e insumos para atendimento às pessoas em situação de violência sexual com coleta de informações e vestígios; (Origem: PRT MS/GM 485/2014, Art. 13, I)
II - criar procedimento específico na Tabela de Procedimentos, Medicamentos e OPM do SUS para atendimento multiprofissional e interdisciplinar às vítimas de violência sexual em serviços de referência; e (Origem: PRT MS/GM 485/2014, Art. 13, II)
III - cofinanciar as ações de atenção integral às pessoas em situação de violência sexual. (Origem: PRT MS/GM 485/2014, Art. 13, III)
Art. 692. Compete às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios: (Origem: PRT MS/GM 485/2014, Art. 14)
I - adotar as providências necessárias para a organização do Serviço de Atenção às Pessoas em Situação de Violência Sexual em suas diversas classificações; (Origem: PRT MS/GM 485/2014, Art. 14, I)
II - orientar o cadastramento dos estabelecimentos de saúde no SCNES, de acordo com as classificações descritas no Anexo LV ; (Origem: PRT MS/GM 485/2014, Art. 14, II)
III - estabelecer fluxos e mecanismos de referência e contrarreferência entre os serviços, de forma que o acesso seja ampliado e o atendimento adequado e humanizado, observada a organização das redes regionalizadas de atenção; (Origem: PRT MS/GM 485/2014, Art. 14, III)
IV - realizar o acompanhamento, o controle e a avaliação das ações e serviços para o fortalecimento das políticas de atenção às pessoas em situação de violência sexual no âmbito dos Estados, do Distrito Federal e dos Municípios em parceria com o Ministério da Saúde; e (Origem: PRT MS/GM 485/2014, Art. 14, IV)
V - implementar ações e estratégias de apoio intersetorial ao enfrentamento da violência sexual previstas nas normas, regras e diretrizes técnicas para prevenção e tratamento dos agravos resultantes da violência sexual em vigor, incluindo-se: (Origem: PRT MS/GM 485/2014, Art. 14, V)
a) a qualificação periódica de equipes multiprofissionais; (Origem: PRT MS/GM 485/2014, Art. 14, V, a)
b) o desenvolvimento de mecanismos de supervisão, apoio técnico e incorporação de tecnologias que favoreçam a qualificação e expansão do número de Serviços de Atenção às Pessoas em Situação de Violência Sexual, de acordo com as potencialidades regionais e locais; e (Origem: PRT MS/GM 485/2014, Art. 14, V, b)
c) a articulação dos diversos serviços de saúde a outros recursos públicos no sentido de garantir o acesso, o cuidado e os encaminhamentos necessários para a proteção, defesa de direitos e responsabilização das pessoas que cometem violências. (Origem: PRT MS/GM 485/2014, Art. 14, V, c)
Art. 693. Caberá ao Ministério da Saúde, em conjunto com as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios, tornar pública, inclusive no endereço eletrônico do Ministério da Saúde, a relação de estabelecimentos de saúde que atenderão pessoas em situação de violência sexual no âmbito do SUS, de acordo com suas especificidades. (Origem: PRT MS/GM 485/2014, Art. 15)
Seção II
Do Procedimento de Justificação e Autorização da Interrupção da Gravidez nos Casos Previstos em Lei
Art. 694. O Procedimento de Justificação e Autorização da Interrupção da Gravidez nos casos previstos em lei é condição necessária para adoção de qualquer medida de interrupção da gravidez no âmbito do Sistema Único de Saúde, excetuados os casos que envolvem riscos de morte à mulher. (Origem: PRT MS/GM 1508/2005, Art. 1º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 695. O Procedimento de Justificação e Autorização da Interrupção da Gravidez nos casos previstos em lei compõe-se de quatro fases que deverão ser registradas no formato de Termos, arquivados anexos ao prontuário médico, garantida a confidencialidade desses termos. (Origem: PRT MS/GM 1508/2005, Art. 2º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 696. A primeira fase é constituída pelo relato circunstanciado do evento, realizado pela própria gestante, perante dois profissionais de saúde do serviço. (Origem: PRT MS/GM 1508/2005, Art. 3º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Parágrafo Único. O Termo de Relato Circunstanciado deverá ser assinado pela gestante ou, quando incapaz, também por seu representante legal, bem como por dois profissionais de saúde do serviço, e conterá: (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
I - local, dia e hora aproximada do fato; (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, I) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
II - tipo e forma de violência; (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, II) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
III - descrição dos agentes da conduta, se possível; e (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, III) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
IV - identificação de testemunhas, se houver. (Origem: PRT MS/GM 1508/2005, Art. 3º, Parágrafo Único, IV) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 697. A segunda fase dá-se com a intervenção do médico que emitirá parecer técnico após detalhada anamnese, exame físico geral, exame ginecológico, avaliação do laudo ultrassonográfico e dos demais exames complementares que porventura houver. (Origem: PRT MS/GM 1508/2005, Art. 4º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 1º Paralelamente, a mulher receberá atenção e avaliação especializada por parte da equipe de saúde multiprofissional, que anotará suas avaliações em documentos específicos. (Origem: PRT MS/GM 1508/2005, Art. 4º, § 1º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 2º Três integrantes, no mínimo, da equipe de saúde multiprofissional subscreverão o Termo de Aprovação de Procedimento de Interrupção da Gravidez, não podendo haver desconformidade com a conclusão do parecer técnico. (Origem: PRT MS/GM 1508/2005, Art. 4º, § 2º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 3º A equipe de saúde multiprofissional deve ser composta, no mínimo, por obstetra, anestesista, enfermeiro, assistente social e/ou psicólogo. (Origem: PRT MS/GM 1508/2005, Art. 4º, § 3º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 698. A terceira fase verifica-se com a assinatura da gestante no Termo de Responsabilidade ou, se for incapaz, também de seu representante legal, e esse Termo conterá advertência expressa sobre a previsão dos crimes de falsidade ideológica (art. 299 do Código Penal) e de aborto (art. 124 do Código Penal), caso não tenha sido vítima de violência sexual. (Origem: PRT MS/GM 1508/2005, Art. 5º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 699. A quarta fase se encerra com o Termo de Consentimento Livre e Esclarecido, que obedecerá aos seguintes requisitos: (Origem: PRT MS/GM 1508/2005, Art. 6º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
I - o esclarecimento à mulher deve ser realizado em linguagem acessível, especialmente sobre: (Origem: PRT MS/GM 1508/2005, Art. 6º, I) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
a) os desconfortos e riscos possíveis à sua saúde; (Origem: PRT MS/GM 1508/2005, Art. 6º, I, a) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
b) os procedimentos que serão adotados quando da realização da intervenção médica; (Origem: PRT MS/GM 1508/2005, Art. 6º, I, b) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
c) a forma de acompanhamento e assistência, assim como os profissionais responsáveis; e (Origem: PRT MS/GM 1508/2005, Art. 6º, I, c) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
d) a garantia do sigilo que assegure sua privacidade quanto aos dados confidenciais envolvidos, exceto quanto aos documentos subscritos por ela em caso de requisição judicial; (Origem: PRT MS/GM 1508/2005, Art. 6º, I, d) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
II - deverá ser assinado ou identificado por impressão datiloscópica, pela gestante ou, se for incapaz, também por seu representante legal; e (Origem: PRT MS/GM 1508/2005, Art. 6º, II) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
III - deverá conter declaração expressa sobre a decisão voluntária e consciente de interromper a gravidez. (Origem: PRT MS/GM 1508/2005, Art. 6º, III) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 700. Todos os documentos que integram o Procedimento de Justificação e Autorização da Interrupção da Gravidez nos casos previstos em lei, conforme Modelos dos Anexos LXIII, LXIV, LXV, LXVI e LXVII desta Seção, deverão ser assinados pela gestante, ou, se for incapaz, também por seu representante legal, elaborados em duas vias, sendo uma fornecida para a gestante. (Origem: PRT MS/GM 1508/2005, Art. 7º) (Revogado pela PRT GM/MS nº 2.282 de 27.08.2020) (Repristinado pela PRT GM/MS nº 13 de 13.01.2023)
CAPÍTULO VIII
DO PROGRAMA DE ASSISTÊNCIA AOS PORTADORES DA DOENÇA ALZHEIMER
Art. 701. Fica instituído, no âmbito do Sistema Único de Saúde, o Programa de Assistência aos Portadores da Doença de Alzheimer. (Origem: PRT MS/GM 703/2002, Art. 1º)
Art. 702. O Programa ora instituído será desenvolvido de forma articulada pelo Ministério da Saúde e pelas Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em cooperação com as respectivas Redes Estaduais de Assistência à Saúde do Idoso e seus Centros de Referência em Assistência à Saúde do Idoso. (Origem: PRT MS/GM 703/2002, Art. 2º)
Parágrafo Único. Os Centros de Referência integrantes da Rede mencionada no caput deste Artigo são os responsáveis pelo diagnóstico, tratamento e acompanhamento dos pacientes, orientação a familiares e cuidadores e o que mais for necessário à adequada atenção aos pacientes portadores da Doença de Alzheimer. (Origem: PRT MS/GM 703/2002, Art. 2º, Parágrafo Único)
Art. 703. A Secretaria de Atenção à Saúde deverá estabelecer o Protocolo Clínico e Diretrizes Terapêuticas para o tratamento da demência por Doença de Alzheimer, incluir os medicamentos utilizados neste tratamento no rol dos Medicamentos Excepcionais e adotar as demais medidas que forem necessárias ao fiel cumprimento do disposto neste Capítulo. (Origem: PRT MS/GM 703/2002, Art. 3º)
CAPÍTULO IX
DA ASSISTÊNCIA DE ALTA COMPLEXIDADE EM TERAPIA NUTRICIONAL
Art. 704. Ficam instituídos, no âmbito do Sistema Único de Saúde, mecanismos para a organização e implantação da assistência de Alta Complexidade em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 1º)
Parágrafo Único. A assistência de Alta Complexidade em Terapia Nutricional será composta por: (Origem: PRT MS/GM 343/2005, Art. 1º, Parágrafo Único)
I - Unidades de Assistência de Alta Complexidade em Terapia Nutricional; e (Origem: PRT MS/GM 343/2005, Art. 1º, Parágrafo Único, I)
II - Centros de Referência de Alta Complexidade em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 1º, Parágrafo Único, II)
Art. 705. As Unidades de Assistência de Alta Complexidade em Terapia Nutricional e os Centros de Referência de Alta Complexidade em Terapia Nutricional proporcionarão condições técnicas, instalações físicas, equipamentos e recursos humanos adequados à prestação de assistência hospitalar e especializada a pacientes em risco nutricional ou desnutridos, incluindo, na sua solicitação de credenciamento, os critérios da Política Nacional de Humanização. (Origem: PRT MS/GM 343/2005, Art. 2º)
Parágrafo Único. As aptidões e atribuições das Unidades e dos Centros de Referência de Alta Complexidade em Terapia Nutricional serão regulamentadas pela Secretaria de Atenção à Saúde - SAS em ato próprio. (Origem: PRT MS/GM 343/2005, Art. 2º, Parágrafo Único)
Art. 706. As Secretarias de Saúde dos estados, do Distrito Federal e dos municípios em Gestão Plena do Sistema Municipal de Saúde, de acordo com as respectivas condições de gestão e a divisão de responsabilidades definida na regulamentação, adotarão as providências necessárias ao credenciamento das Unidades de Assistência de Alta Complexidade em Terapia Nutricional e dos Centros de Referência de Alta Complexidade em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 3º)
Art. 707. Fica instituída a "Câmara Técnica em Terapia Nutricional", subordinada à Secretaria de Atenção à Saúde, com o objetivo de acompanhar a implantação e implementação do disposto neste Capítulo. (Origem: PRT MS/GM 343/2005, Art. 4º)
Art. 708. Os seguintes instrumentos de gestão devem ser regulamentados: (Origem: PRT MS/GM 343/2005, Art. 5º)
I - Banco de Dados dos Usuários de Terapia Nutricional; e (Origem: PRT MS/GM 343/2005, Art. 5º, I)
II - Protocolos de Triagem e Avaliação Nutricional, Protocolos de Indicação de Terapia Nutricional e de Protocolos para o Acompanhamento dos Pacientes em Terapia Nutricional. (Origem: PRT MS/GM 343/2005, Art. 5º, II)
Art. 709. A Secretaria de Atenção à Saúde adotará as medidas necessárias à implantação do disposto neste Capítulo. (Origem: PRT MS/GM 343/2005, Art. 6º)
Art. 710. Os processos de solicitação de habilitação dos estabelecimentos de saúde para realização dos procedimentos em Terapia Nutricional deverão ser aprovados pela Comissão Intergestores Bipartite (CIB) e encaminhados para apreciação da Coordenação-Geral de Alta Complexidade, do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 343/2005, Art. 7º)
Art. 711. Os recursos orçamentários de que trata este Capítulo correrão por conta do orçamento do Ministério da Saúde, devendo onerar os Programas de Trabalho: (Origem: PRT MS/GM 343/2005, Art. 8º)
I - 10.302.1220.8585 - Atenção à Saúde da População nos Municípios habilitados em Gestão Plena do Sistema e nos Estados habilitados em Gestão Plena/Avançada; e (Origem: PRT MS/GM 343/2005, Art. 8º, I)
II - 10.302.1220.8587 - Atenção à Saúde da População nos Municípios não-habilitados em Gestão Plena do Sistema e nos estados não-habilitados em Gestão Plena/Avançada. (Origem: PRT MS/GM 343/2005, Art. 8º, II)
CAPÍTULO X
DA ATENÇÃO AOS PORTADORES DE HIPERTENSÃO ARTERIAL E DE DIABETES MELLITUS
Seção I
Do Elenco de Medicamentos e Insumos Disponibilizados pelo SUS, nos Termos da Lei nº. 11.347, de 2006, aos Usuários Portadores de Diabetes Mellitus
Art. 712. Fica definido o elenco de medicamentos e insumos que devem ser disponibilizados na rede do Sistema Único de Saúde, destinados ao monitoramento da glicemia capilar dos portadores de diabetes mellitus, nos termos da Lei Federal nº 11.347, de 2006. (Origem: PRT MS/GM 2583/2007, Art. 1º)
I - MEDICAMENTOS: (Origem: PRT MS/GM 2583/2007, Art. 1º, I)
a) glibenclamida 5 mg comprimido; (Origem: PRT MS/GM 2583/2007, Art. 1º, I, a)
b) cloridrato de metformina 500 mg e 850 mg comprimido; (Origem: PRT MS/GM 2583/2007, Art. 1º, I, b)
c) glicazida 80 mg comprimido; (Origem: PRT MS/GM 2583/2007, Art. 1º, I, c)
d) insulina humana NPH - suspensão injetável 100 UI/mL; e (Origem: PRT MS/GM 2583/2007, Art. 1º, I, d)
e) insulina humana regular - suspensão injetável 100 UI/mL. (Origem: PRT MS/GM 2583/2007, Art. 1º, I, e)
II - INSUMOS: (Origem: PRT MS/GM 2583/2007, Art. 1º, II)
a) seringas com agulha acoplada para aplicação de insulina; (Origem: PRT MS/GM 2583/2007, Art. 1º, II, a)
b) tiras reagentes de medida de glicemia capilar; e (Origem: PRT MS/GM 2583/2007, Art. 1º, II, b)
c) lancetas para punção digital. (Origem: PRT MS/GM 2583/2007, Art. 1º, II, c)
Art. 713. Os insumos do art. 712, II devem ser disponibilizados aos usuários do SUS, portadores de diabetes mellitus insulino-dependentes e que estejam cadastrados no cartão SUS e/ou no Programa de Hipertensão e Diabetes (Hiperdia). (Origem: PRT MS/GM 2583/2007, Art. 2º)
§ 1º As tiras reagentes de medida de glicemia capilar serão fornecidas mediante a disponibilidade de aparelhos medidores (glicosímetros). (Origem: PRT MS/GM 2583/2007, Art. 2º, § 1º)
§ 2º A prescrição para o automonitoramento será feita a critério da Equipe de Saúde responsável pelo acompanhamento do usuário portador de diabetes mellitus, observadas as normas estabelecidas no Anexo LXXXVII . (Origem: PRT MS/GM 2583/2007, Art. 2º, § 2º)
§ 3º O fornecimento de seringas e agulhas para administração de insulina deve seguir o protocolo estabelecido para o manejo e tratamento do diabetes mellitus contido no nº 16 da série "Cadernos da Atenção Básica - Ministério da Saúde, disponível em versões impressa e eletrônica no endereço http://dab.saude.gov.br/portaldab/biblioteca.php. (Origem: PRT MS/GM 2583/2007, Art. 2º, § 3º)
Art. 714. Os usuários portadores de diabetes mellitus insulino-dependentes devem estar inscritos nos Programas de Educação para Diabéticos, promovidos pelas unidades de saúde do SUS, executados conforme descrito: (Origem: PRT MS/GM 2583/2007, Art. 3º)
I - a participação de portadores de diabetes mellitus pressupõe vínculo com a unidade de saúde do SUS responsável pela oferta do Programa de Educação, que deve estar inserido no processo terapêutico individual e coletivo, incluindo acompanhamento clínico e seguimento terapêutico, formalizados por meio dos devidos registros em prontuário; (Origem: PRT MS/GM 2583/2007, Art. 3º, I)
II - as ações programáticas abordarão componentes do cuidado clínico, incluindo a promoção da saúde, o gerenciamento do cuidado e as atualizações técnicas relativas a diabetes mellitus; (Origem: PRT MS/GM 2583/2007, Art. 3º, II)
III - as ações devem ter como objetivos o desenvolvimento da autonomia para o autocuidado, a construção de habilidades e o desenvolvimento de atitudes que conduzam à contínua melhoria do controle sobre a doença, objetivando o progressivo aumento da qualidade de vida e a redução das complicações do diabetes mellitus. (Origem: PRT MS/GM 2583/2007, Art. 3º, III)
Art. 715. A aquisição, a distribuição, a dispensação e o financiamento dos medicamentos e insumos de que trata esta Seção são de responsabilidade da União, dos Estados, do Distrito Federal e dos Municípios, conforme pactuação Tripartite e as normas do Componente Básico da Assistência Farmacêutica. (Origem: PRT MS/GM 2583/2007, Art. 4º)
TÍTULO VI
DA ORGANIZAÇÃO DO SUS
CAPÍTULO I
DA EDUCAÇÃO PERMANENTE EM SAÚDE
Seção I
Programa de Formação de Profissional de Nível Médio para a Saúde (PROFAPS)
Art. 716. Ficam definidas as diretrizes e estratégias para a implementação do Programa de Formação de Profissional de Nível Médio para a Saúde (PROFAPS). (Origem: PRT MS/GM 3189/2009, Art. 1º)
§ 1º A educação profissional a que se refere esta Seção será desenvolvida por meio de cursos e programas de formação inicial e continuada de trabalhadores, incluídos a capacitação, o aperfeiçoamento, a especialização e a atualização em todos os níveis de escolaridade, e a educação profissional técnica de nível médio desenvolvida, de forma articulada, com o ensino médio. (Origem: PRT MS/GM 3189/2009, Art. 1º, § 1º)
§ 2º O programa de formação profissional técnica de nível médio em áreas estratégicas para a saúde deve considerar as especificidades regionais, as necessidades de formação e a capacidade de oferta institucional de ações técnicas de educação de nível médio na saúde. (Origem: PRT MS/GM 3189/2009, Art. 1º, § 2º)
Art. 717. A proposição das ações de formação profissional técnica de nível médio em áreas estratégicas para a saúde será conduzida pelos Colegiados de Gestão Regional, com a participação das Comissões de Integração Ensino-Serviço (CIES). (Origem: PRT MS/GM 3189/2009, Art. 2º)
§ 1º Os Colegiados de Gestão Regional, considerando as especificidades locais, as necessidades de formação técnica de nível médio identificadas na região de saúde observadas no Plano Estadual de Educação Permanente em Saúde definirão os cursos de formação profissional técnica de nível médio, contemplando as prioridades constantes na medida 4.5 do Programa MAIS SAÚDE: Direito de Todos, instituído pelo Governo Federal por meio do Ministério da Saúde. (Origem: PRT MS/GM 3189/2009, Art. 2º, § 1º)
§ 2º As CIES deverão participar da formulação e do desenvolvimento dos programas de formação profissional técnica de nível médio com vistas a atender às demandas de áreas estratégicas para a saúde. (Origem: PRT MS/GM 3189/2009, Art. 2º, § 2º)
Art. 718. As áreas técnicas estratégicas prioritárias para a educação profissional técnica de nível médio na saúde são: Radiologia, Patologia Clínica e Citotécnico, Hemoterapia, Manutenção de Equipamentos, Saúde Bucal, Prótese Dentária, Vigilância em Saúde e Enfermagem. (Origem: PRT MS/GM 3189/2009, Art. 3º)
Art. 719. As áreas estratégicas para o nível de aperfeiçoamento/capacitação são: Saúde do Idoso para as equipes da Estratégia Saúde da Família e equipes de enfermagem das instituições de longa permanência, e a formação dos Agentes Comunitários de Saúde. (Origem: PRT MS/GM 3189/2009, Art. 4º)
Parágrafo Único. A formação dos Agentes Comunitários de Saúde obedecerá as disposições da Seção V do Capítulo I do Título VI da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 3189/2009, Art. 4º, Parágrafo Único)
Art. 720. Terão prioridade na formulação e execução técnicapedagógica dos cursos do PROFAPS as Escolas Técnicas de Saúde do SUS, as Escolas de Saúde Pública e os Centros Formadores vinculados aos gestores estaduais e municipais de saúde, como um componente para seu fortalecimento institucional e pedagógico. (Origem: PRT MS/GM 3189/2009, Art. 5º)
Parágrafo Único. A pactuação dos projetos na CIB poderá contemplar outras instituições formadoras, desde que legalmente reconhecidas e habilitadas para este fim, quando, no seu âmbito regional, não houver instituições formadoras citadas no caput do artigo ou quando a capacidade da mesma apresentar-se insuficiente para a demanda de formação. (Origem: PRT MS/GM 3189/2009, Art. 5º, Parágrafo Único)
Art. 721. O Ministério da Saúde e as Secretarias de Saúde Estaduais, Municipais e do Distrito Federal serão responsáveis por: (Origem: PRT MS/GM 3189/2009, Art. 6º)
I - planejar o PROFAPS, no seu âmbito de gestão, contando com a colaboração das CIES; e (Origem: PRT MS/GM 3189/2009, Art. 6º, I)
II - estimular, acompanhar e regular a utilização dos serviços de saúde, em seu âmbito de gestão, para atividades curriculares e extracurriculares dos cursos de formação técnica de nível médio. (Origem: PRT MS/GM 3189/2009, Art. 6º, II)
Art. 722. Os projetos a serem encaminhados à Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS), para liberação dos recursos do PROFAPS, deverão seguir as diretrizes da Política Nacional de Educação Permanente em Saúde e as orientações para a elaboração dos projetos constantes dos Anexos XCIII e XCIV da Portaria de Consolidação nº 6. (Origem: PRT MS/GM 3189/2009, Art. 7º)
Art. 723. A SGTES/MS deverá monitorar, acompanhar e supervisionar as ações previstas no PROFAPS estabelecendo cooperação técnica com as instituições formadoras na formulação e execução dos cursos. (Origem: PRT MS/GM 3189/2009, Art. 8º)
Art. 724. As secretarias de saúde dos estados, dos municípios e do Distrito Federal manterão, à disposição da SGTES/MS e dos órgãos de fiscalização e controle, todas as informações relativas à execução das atividades de implementação do PROFAPS. (Origem: PRT MS/GM 3189/2009, Art. 9º)
Seção II
Da Implementação e Execução do Programa de Bolsas para a Educação pelo Trabalho, de Responsabilidade Técnico-administrativa do Ministério da Saúde
Art. 725. Ficam aprovadas as normas para a implementação e a execução do Programa de Bolsas para a Educação pelo Trabalho, de responsabilidade técnico-administrativa do Ministério da Saúde. (Origem: PRT MS/GM 1111/2005, Art. 1º)
Art. 726. O Programa de Bolsas para a Educação pelo Trabalho é uma estratégia para provimento e fixação de profissionais em programas, projetos, ações e atividades em regiões prioritárias para o Sistema Único de Saúde (SUS), destinado aos estudantes de graduação dos cursos da área da saúde, profissionais de nível superior e trabalhadores da área da saúde e tem como objetivo promover a vivência, estágios, aperfeiçoamentos, formação e especialização de nível superior e médio em áreas prioritárias. (Origem: PRT MS/GM 1111/2005, Art. 2º) (com redação dada pela PRT MS/GM 754/2012)
I - possibilitar que o Ministério da Saúde cumpra seu papel constitucional de ordenador da formação de profissionais de saúde por meio da indução e do apoio ao desenvolvimento dos processos formativos necessários em todo o País, de acordo com características sociais e regionais; (Origem: PRT MS/GM 1111/2005, Art. 2º, I)
II - contribuir para a formação de profissionais de saúde com perfil adequado às necessidades e políticas de saúde do País; (Origem: PRT MS/GM 1111/2005, Art. 2º, II)
III - sensibilizar e preparar estudantes e profissionais de saúde para o adequado enfrentamento das diferentes realidades de vida e de saúde da população brasileira em todo o território nacional; (Origem: PRT MS/GM 1111/2005, Art. 2º, III)
IV - induzir o provimento e favorecer a fixação de profissionais de saúde no âmbito da atenção em saúde com qualidade em todo o território nacional; e (Origem: PRT MS/GM 1111/2005, Art. 2º, IV)
V - contribuir para a universalidade e a equidade no acesso à atenção em saúde. (Origem: PRT MS/GM 1111/2005, Art. 2º, V)
Art. 727. Para a mais adequada execução e implementação do presente Programa, o Ministério da Saúde poderá estabelecer cooperação técnica, financeira ou operacional com instituições de ensino, de pesquisa e de desenvolvimento científico e tecnológico e com as secretarias estaduais e as secretarias municipais de saúde. (Origem: PRT MS/GM 1111/2005, Art. 3º)
Art. 728. O Programa de Bolsas para a Educação pelo Trabalho terá as seguintes abrangências: (Origem: PRT MS/GM 1111/2005, Art. 4º)
I - bolsas para acadêmicos, modalidade iniciação ao trabalho; (Origem: PRT MS/GM 1111/2005, Art. 4º, I)
II - bolsas para profissionais em educação em serviço, sob supervisão docente-assistencial, orientadas ao aperfeiçoamento e à especialização ou modalidade residente; e (Origem: PRT MS/GM 1111/2005, Art. 4º, II)
III - bolsas para corpo docente da educação em serviço, sob supervisão docente-assistencial, orientadas ao aperfeiçoamento e à especialização, modalidade preceptor, tutor e/ou orientador de serviço. (Origem: PRT MS/GM 1111/2005, Art. 4º, III)
IV - bolsa destinada ao trabalhador-estudante. (Origem: PRT MS/GM 1111/2005, Art. 4º, IV) (dispositivo acrescentado pela PRT MS/GM 754/2012)
Parágrafo Único. Para a instituição do Programa estabelecido no art. 725, é obrigatória a figura do preceptor, ficando facultada a inserção do tutor ou do orientador de serviço, caso não haja possibilidade de garantir ambos, conforme as peculiaridades de cada realidade local. (Origem: PRT MS/GM 1111/2005, Art. 4º, Parágrafo Único)
Art. 729. A Bolsa para a Iniciação ao Trabalho é dirigida aos estudantes de graduação da área da saúde que estejam participando regularmente de atividades curriculares ou de extensão que proporcionem vivência ou estágio no SUS, realizados em áreas temáticas, em regiões geográficas ou em serviços assistenciais prioritários ao sistema de saúde. (Origem: PRT MS/GM 1111/2005, Art. 5º)
Art. 730. A Bolsa para o Aperfeiçoamento e Especialização é dirigida aos profissionais de saúde que estejam cursando programas de aperfeiçoamento e especialização em serviço, sob supervisão docente assistencial ou de residência em área profissional da saúde, credenciados junto à Comissão Nacional de Residência Multiprofissional em Saúde (CNRMS), e a médicos que estejam cursando programas de residência médica, credenciados junto à CNRM, dando-se preferência, em qualquer caso, às áreas temáticas de regiões geográficas ou aos serviços assistenciais prioritários ao sistema de saúde. (Origem: PRT MS/GM 1111/2005, Art. 6º)
Art. 731. A Bolsa para o Corpo Docente é dirigida àqueles que exercem funções de preceptoria, de tutoria e de orientação em serviço, conforme as seguintes determinações: (Origem: PRT MS/GM 1111/2005, Art. 7º)
I - preceptoria: função de supervisão docente-assistencial por área específica de atuação ou de especialidade profissional, dirigida aos profissionais de saúde com curso de graduação e mínimo de três anos de experiência em área de aperfeiçoamento ou especialidade ou titulação acadêmica de especialização ou de residência, que exerçam atividade de organização do processo de aprendizagem especializado e de orientação técnica aos profissionais ou estudantes, respectivamente em aperfeiçoamento ou especialização ou em estágio ou vivência de graduação ou de extensão; (Origem: PRT MS/GM 1111/2005, Art. 7º, I)
II - tutoria: função de supervisão docente-assistencial no campo de aprendizagens profissionais da área da saúde, exercida em campo, dirigida aos profissionais de saúde com curso de graduação e mínimo de três anos de atuação profissional, que exerçam papel de orientadores de referência para os profissionais ou estudantes, respectivamente, em aperfeiçoamento ou especialização ou em estágio ou vivência de graduação ou de extensão, devendo pertencer à equipe local de assistência e estar diariamente presente nos ambientes onde se desenvolvem as aprendizagens em serviço; e (Origem: PRT MS/GM 1111/2005, Art. 7º, II)
III - orientação de serviço: função de supervisão docente-assistencial de caráter ampliado, exercida em campo, dirigida aos trabalhadores de saúde de quaisquer níveis de formação, atuantes nos ambientes em que se desenvolvem programas de aperfeiçoamento e especialização em serviço, bem como de iniciação ao trabalho, estágios e vivências, respectivamente, para profissionais e estudantes da área da saúde, e que exerçam atuação específica de instrutoria, devendo reportar-se ao tutor, sempre que necessário, respeitando a legislação em vigor. (Origem: PRT MS/GM 1111/2005, Art. 7º, III)
Art. 732. A bolsa para o trabalhador-estudante será dirigida a profissionais que estejam realizando curso de pós-graduação lato ou stricto sensu e que integrem programas, projetos, ações e atividades em regiões prioritárias para o Sistema Único de Saúde, observadas as estratégias do Ministério da Saúde para o provimento e a fixação de profissionais de saúde. (Origem: PRT MS/GM 1111/2005, Art. 7º-A)
Art. 733. As Bolsas para a Educação pelo Trabalho que constituem o Programa terão como valores mínimos os seguintes padrões de referência: (Origem: PRT MS/GM 1111/2005, Art. 8º)
I - para as Bolsas de Iniciação ao Trabalho, a Bolsa para a Iniciação Tecnológica, nível A (ITI-A), do Quadro de Níveis de Bolsas de Fomento Tecnológico e Extensão Inovadora de Longa Duração, do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq); (Origem: PRT MS/GM 1111/2005, Art. 8º, I)
II - para as Bolsas de Aperfeiçoamento e Especialização, a Bolsa de Residência Médica, regulamentada por lei específica, com a qual essa modalidade guarda simetria e isonomia; e (Origem: PRT MS/GM 1111/2005, Art. 8º, II)
III - para as Bolsas do Corpo Docente, as Bolsas para o Desenvolvimento Tecnológico, nível DTI-ID, para Preceptores e Tutores, Apoio Técnico, níveis ATP-A ou ATP-B, para Orientadores de Serviço, respectivamente para trabalhadores detentores ou não de formação superior, conforme o Quadro de Níveis de Bolsas de Fomento Tecnológico e Extensão Inovadora de Longa Duração, do Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq). (Origem: PRT MS/GM 1111/2005, Art. 8º, III)
Parágrafo Único. O valor da bolsa para trabalhador-estudante será fixado pelo Ministério da Saúde a cada programa, projeto, ação ou atividade a que estiver vinculada. (Origem: PRT MS/GM 1111/2005, Art. 8º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 754/2012)
Art. 734. O Ministério da Saúde poderá majorar os valores estabelecidos para as bolsas, considerando as necessidades de provimento e fixação de profissionais de saúde nas diferentes temáticas e serviços assistenciais ou relativos à dificuldade de acesso e locomoção nos diferentes locais e regiões do País. (Origem: PRT MS/GM 1111/2005, Art. 9º)
Art. 735. A seleção dos participantes do Programa de Bolsas para a Educação pelo Trabalho será realizada mediante seleção pública com ampla divulgação, de acordo com as normas que regulamentam os processos de formação de nível superior e médio, estágios e vivências de graduação e extensão universitária, o aperfeiçoamento e a especialização em área profissional, os programas de residência e programas, projetos, ações e atividades que visem ao provimento e à fixação de profissionais de saúde em regiões prioritárias para o SUS, devendo explicitar, sempre que possível: (Origem: PRT MS/GM 1111/2005, Art. 10) (com redação dada pela PRT MS/GM 754/2012)
I - o número de vagas disponibilizadas para cada modalidade de bolsas; (Origem: PRT MS/GM 1111/2005, Art. 10, I) (dispositivo acrescentado pela PRT MS/GM 754/2012)
II - a área temática; e (Origem: PRT MS/GM 1111/2005, Art. 10, II) (dispositivo acrescentado pela PRT MS/GM 754/2012)
III - a região geográfica e o ambiente onde se desenvolverão as atividades de aprendizagem em serviço. (Origem: PRT MS/GM 1111/2005, Art. 10, III) (dispositivo acrescentado pela PRT MS/GM 754/2012)
Parágrafo Único. As atividades de educação pelo trabalho serão desenvolvidas exclusivamente no âmbito do SUS. (Origem: PRT MS/GM 1111/2005, Art. 10, Parágrafo Único) (com redação dada pela PRT MS/GM 754/2012)
Art. 736. O Ministério da Saúde tem a responsabilidade técnico-administrativa do Programa, resguardado o papel da Comissão Intersetorial de Recursos Humanos, do Conselho Nacional de Saúde, atendendo ao disposto no art. 12 da Lei nº 8.080, de 19 de setembro de 1990 (Lei Orgânica da Saúde), e do Ministério da Educação nas áreas de competências. (Origem: PRT MS/GM 1111/2005, Art. 11)
Art. 737. Os recursos orçamentários de que trata esta Seção correrão por conta do orçamento do Ministério da Saúde, devendo onerar o seguinte Programa de Trabalho: (Origem: PRT MS/GM 1111/2005, Art. 12)
I - 10.128.2015.20YD - Educação e Formação em Saúde; e (Origem: PRT MS/GM 1111/2005, Art. 12, I)
Seção III
Do Programas de Residência Médica em Medicina de Família e Comunidade (PRM-MFC), por meio do Programa de Bolsas para a Educação pelo Trabalho
Art. 738. Os programas de residência médica em medicina de família e comunidade (PRM-MFC) serão apoiados por meio do Programa de Bolsas para a Educação pelo Trabalho, do Ministério da Saúde. (Origem: PRT MS/GM 1143/2005, Art. 1º)
Parágrafo Único. Os programas deverão ter como campo central de práticas da especialidade os ambientes e os territórios de atuação das equipes de saúde da família que atuam nas áreas mais carentes dos municípios, complementado pelas demais unidades assistenciais da cidade e região, tendo em vista o conjunto das aprendizagens necessárias à especialidade. (Origem: PRT MS/GM 1143/2005, Art. 1º, Parágrafo Único)
Art. 739. Os programas de residência médica em medicina de família e comunidade devem ser construídos mediante cooperação entre Instituições Formadoras, Secretarias Municipais e Estaduais de Saúde. (Origem: PRT MS/GM 1143/2005, Art. 2º)
Parágrafo Único. A cooperação deve incluir a definição do itinerário de formação, considerando a situação de saúde e a realidade de trabalho existente na região, bem como a oferta das condições necessárias para a realização do processo de formação. (Origem: PRT MS/GM 1143/2005, Art. 2º, Parágrafo Único)
Art. 740. À Instituição Formadora participante dos PRM-MCF, apoiada pelo Ministério da Saúde, compete: (Origem: PRT MS/GM 1143/2005, Art. 6º)
I - credenciamento do programa de residência médica em medicina de família e comunidade junto à Comissão Nacional de Residência Médica; (Origem: PRT MS/GM 1143/2005, Art. 6º, I)
II - promover oferta de programa de preparação e educação permanente em saúde para os preceptores e tutores que tomarem parte da residência; e (Origem: PRT MS/GM 1143/2005, Art. 6º, II)
III - cooperar com o município participante no desenvolvimento das capacidades pedagógicas, assistenciais e tecnológicas locais e regionais. (Origem: PRT MS/GM 1143/2005, Art. 6º, III)
Art. 741. À Secretaria Municipal ou Estadual de Saúde participante dos PRM-MCF apoiada pelo Ministério da Saúde, compete: (Origem: PRT MS/GM 1143/2005, Art. 7º)
I - cumprir as metas estabelecidas no Programa de Expansão da Estratégia de Saúde da Família - PROESF/ atenção básica; (Origem: PRT MS/GM 1143/2005, Art. 7º, I)
II - cooperar com a Instituição Formadora na montagem da residência médica e na identificação e liberação de médicos da rede para o cumprimento dos papéis de preceptor e de tutor; (Origem: PRT MS/GM 1143/2005, Art. 7º, II)
III - complementar a bolsa para o residente, conforme o art. 614 da Portaria de Consolidação nº 6; (Origem: PRT MS/GM 1143/2005, Art. 7º, III)
IV - eleger as áreas comprovadamente mais carentes do município para a inserção dos médicos em formação, junto às equipes de saúde da família; e (Origem: PRT MS/GM 1143/2005, Art. 7º, IV)
V - assegurar as condições para a participação do médico residente em todas as atividades pertinentes à sua formação, bem como para o desenvolvimento da educação permanente em saúde de todos os profissionais envolvidos no processo. (Origem: PRT MS/GM 1143/2005, Art. 7º, V)
Seção IV
Da Estratégia de Qualificação das Redes de Atenção à Saúde (RAS) por meio do Incentivo à Formação de Especialistas na Modalidade Residência Médica em Áreas Estratégicas do SUS
Subseção I
Disposições Gerais
(Origem: PRT MS/GM 1248/2013, CAPÍTULO I)
Art. 742. Fica instituída a Estratégia de Qualificação das Redes de Atenção à Saúde (RAS) por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 1248/2013, Art. 1º)
Art. 743. A Estratégia de Qualificação da RAS por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do SUS tem por objetivos: (Origem: PRT MS/GM 1248/2013, Art. 2º)
I - reforçar financeiramente o custeio das RAS e dos estabelecimentos hospitalares beneficiários, considerando-se as despesas adicionais necessárias à qualificação da assistência para o ensino; (Origem: PRT MS/GM 1248/2013, Art. 2º, I)
II - garantir a melhoria da estrutura hospitalar e da organização e funcionamento das RAS, de forma a aprimorar o funcionamento dos Programas de Residência Médica; (Origem: PRT MS/GM 1248/2013, Art. 2º, II)
III - garantir aos residentes ambientes de formação adequadas, como sala com computadores com acesso à internet e sala de estudo com materiais didáticos disponíveis e atualizados, como livros e revistas científicas; (Origem: PRT MS/GM 1248/2013, Art. 2º, III)
IV - garantir o aprimoramento técnico-científico necessário para qualificar a atuação dos profissionais envolvidos na assistência que tenham função de preceptoria, estimulando sua formação em cursos de pós-graduação, cursos de formação de preceptores e disseminando o acesso a bibliotecas virtuais e a outras fontes de publicações de artigos científicos; (Origem: PRT MS/GM 1248/2013, Art. 2º, IV)
V - estimular a inserção articulada e integrada dos estabelecimentos hospitalares participantes da RAS no âmbito do SUS por meio de Programa de Residência Médica em rede; (Origem: PRT MS/GM 1248/2013, Art. 2º, V)
VI - estimular a participação dos hospitais e demais estabelecimentos que compõem as RAS em atividades de pesquisa, desenvolvimento e gestão de tecnologias em saúde, de acordo com as necessidades do SUS; (Origem: PRT MS/GM 1248/2013, Art. 2º, VI)
VII - incentivar a qualificação do processo de gestão para favorecer que as instituições responsáveis pela formação de especialistas atuem com maior eficiência e efetividade; (Origem: PRT MS/GM 1248/2013, Art. 2º, VII)
VIII - estimular o papel dos estabelecimentos de saúde na formação de novos profissionais de saúde e na capacitação dos profissionais que atuem nos diversos segmentos que compõem o SUS, privilegiando as funções e especialidades requeridas para suprir as necessidades das RAS; (Origem: PRT MS/GM 1248/2013, Art. 2º, VIII)
IX - ampliar e qualificar Programa de Residência Médica em áreas estratégicas e regiões prioritárias do SUS por meio da abertura de novas vagas e qualificação das vagas existentes para formação de especialistas no país; (Origem: PRT MS/GM 1248/2013, Art. 2º, IX)
X - aprimorar o processo de gestão dos Programas de Residência Médica por meio das Comissões Estaduais de Residência Médica (CEREM) e das Comissões de Residência Médica (COREME), fortalecendo o seu papel previsto na legislação vigente; e (Origem: PRT MS/GM 1248/2013, Art. 2º, X)
XI - assegurar a participação das CEREM e das COREME na gestão dos recursos financeiros e no monitoramento e avaliação dos objetivos dispostos nesta Seção. (Origem: PRT MS/GM 1248/2013, Art. 2º, XI)
Parágrafo Único. Para fins do disposto no inciso V do "caput", considera-se Programa de Residência Médica em rede o programa que contemplar as demandas das redes temáticas prioritárias do SUS, tais como Rede Cegonha, Rede de Urgência e Emergência, Rede de Atenção Psicossocial, por meio de linhas de cuidado estabelecidas nas portarias específicas e entre os serviços que compõem as respectivas redes. (Origem: PRT MS/GM 1248/2013, Art. 2º, Parágrafo Único)
Subseção II
Dos Critérios de Elegibilidade
(Origem: PRT MS/GM 1248/2013, CAPÍTULO II)
Art. 744. Poderão aderir à Estratégia de Qualificação da RAS por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do SUS: (Origem: PRT MS/GM 1248/2013, Art. 3º)
I - entidades públicas estaduais, distrital ou municipais de saúde; (Origem: PRT MS/GM 1248/2013, Art. 3º, I)
II - entidades públicas federais vinculadas ao Ministério da Educação (MEC); e (Origem: PRT MS/GM 1248/2013, Art. 3º, II)
III - estabelecimentos hospitalares privados sem fins lucrativos que atuem de forma complementar ao SUS, excetuando-se entidades certificadas nos termos do art. 11 da Lei nº 12.101, de 27 de novembro de 2009, e seus regulamentos. (Origem: PRT MS/GM 1248/2013, Art. 3º, III)
Art. 745. Para admissão na Estratégia de Qualificação da RAS por meio do incentivo à formação de especialistas na modalidade Residência Médica em áreas estratégicas do SUS, as entidades e estabelecimentos de que trata o art. 744 deverão conter Programa de Residência Médica que cumpra os seguintes critérios: (Origem: PRT MS/GM 1248/2013, Art. 4º)
I - estar vinculado a um estabelecimento hospitalar integrante do SUS ou a uma Secretaria de Saúde do Estado, Distrito Federal ou do Município, com oferecimento de, no mínimo, 5 (cinco) novas vagas nas especialidades listadas nos termos dos Anexos em Programa de Residência Médica com início no ano em curso da apresentação da proposta; (Origem: PRT MS/GM 1248/2013, Art. 4º, I)
II - cumprir pré-requisitos descritos nos termos dos Anexos LIII e LIV ; (Origem: PRT MS/GM 1248/2013, Art. 4º, II)
III - estar localizado em instituição contratualizada pelo gestor estadual, distrital ou municipal do SUS quando se tratar de estabelecimento hospitalar, nos termos da legislação vigente; (Origem: PRT MS/GM 1248/2013, Art. 4º, III)
IV - estar localizado em instituição que realiza atividades de ensino, podendo ou não ser certificada como hospital de ensino; (Origem: PRT MS/GM 1248/2013, Art. 4º, IV)
V - estar localizado em Município com mais de 50.000 (cinquenta mil) habitantes ou constituir-se como referência em região de saúde com mais de 50.000 (cinquenta mil) habitantes; (Origem: PRT MS/GM 1248/2013, Art. 4º, V)
VI - atender ao parâmetro de, no mínimo, 5 (cinco) leitos para cada residente, quando em ambiente hospitalar; (Origem: PRT MS/GM 1248/2013, Art. 4º, VI)
VII - dispor de instalações físicas adequadas para as atividades do Programa de Residência Médica; (Origem: PRT MS/GM 1248/2013, Art. 4º, VII)
VIII - dispor de Programa de Educação Permanente para os preceptores; e (Origem: PRT MS/GM 1248/2013, Art. 4º, VIII)
IX - ter autorizada a solicitação de credenciamento provisório ou aumento de vagas para o seu respectivo Programa de Residência Médica pela Comissão Nacional de Residência Médica (CNRM) para inicio das atividades do programa de residência no ano em curso da apresentação da proposta. (Origem: PRT MS/GM 1248/2013, Art. 4º, IX)
Subseção III
Do Monitoramento, Avaliação, Acompanhamento e Controle
(Origem: PRT MS/GM 1248/2013, CAPÍTULO IV)
Art. 746. Para fins de monitoramento, avaliação, acompanhamento e controle da aplicação dos recursos repassados por meio do Fundo Nacional de Saúde, ficam estabelecidos os seguintes prazos máximos a serem cumpridos pelos entes federativos e pelos estabelecimentos hospitalares privados beneficiários: (Origem: PRT MS/GM 1248/2013, Art. 22)
I - 6 (seis) meses, a contar da data da liberação do incentivo financeiro, para conclusão da reforma e/ou ampliação dos ambientes; e (Origem: PRT MS/GM 1248/2013, Art. 22, I)
II - 90 (noventa) dias após a conclusão da reforma e/ou ampliação para início do efetivo funcionamento dos ambientes reformados e/ou ampliados. (Origem: PRT MS/GM 1248/2013, Art. 22, II)
§ 1º Caso sejam descumpridos quaisquer prazos definidos neste artigo, os entes federativos e os estabelecimentos hospitalares privados beneficiários deverão encaminhar, no prazo de 30 (trinta) dias do término dos citados prazos, as justificativas ao Ministério da Saúde especialmente ao DRAC/SAS/MS e ao DEGES/SGTES/MS, para análise. (Origem: PRT MS/GM 1248/2013, Art. 22, § 1º)
§ 2º Caso aceitas as justificativas, o Ministério da Saúde poderá prorrogar o prazo de que trata o inciso I do "caput" por até 6 (seis) meses e o prazo de que trata o inciso II do "caput" por até 90 (noventa) dias. (Origem: PRT MS/GM 1248/2013, Art. 22, § 2º)
§ 3º Caso não haja apresentação de justificativas pelos estabelecimentos hospitalares privados beneficiários ou o Ministério da Saúde não aceite as que forem apresentadas, o estabelecimento estará sujeito à devolução imediata dos recursos financeiros repassados, acrescidos da correção monetária prevista em lei. (Origem: PRT MS/GM 1248/2013, Art. 22, § 3º)
§ 4º Caso não haja apresentação de justificativas pelos entes federativos beneficiários ou o Ministério da Saúde não aceite as que forem apresentadas, o ente federativo beneficiário estará sujeito, no que for pertinente, à devolução imediata dos recursos financeiros repassados, acrescidos da correção monetária prevista em lei, ou ao regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Origem: PRT MS/GM 1248/2013, Art. 22, § 4º)
§ 5º O monitoramento de que trata este artigo não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 1248/2013, Art. 22, § 5º)
Art. 747. Além do disposto no art. 746, caberá aos órgãos de controle interno, especialmente à área finalística, o monitoramento da correta aplicação dos recursos oriundos dos incentivos financeiros previstos nesta Seção. (Origem: PRT MS/GM 1248/2013, Art. 23)
Art. 748. Compete às Secretarias de Saúde dos estados, do Distrito Federal e dos municípios o monitoramento e a avaliação direta e continuada dos Programas de Residência Médica, em articulação com as instituições formadoras e as COREME, por meio dos contratos, convênios ou instrumentos congêneres firmados e de visitas técnicas para avaliação do seu funcionamento. (Origem: PRT MS/GM 1248/2013, Art. 24)
Parágrafo Único. Caberá às Secretarias de Saúde dos estados, do Distrito Federal e dos municípios, em articulação com as instituições formadoras e as COREME, informar, periodicamente, ao DEGES/SGTES/MS sobre o monitoramento e avaliação dos Programas beneficiados pelos recursos definidos nesta Seção, por meio de relatório anual. (Origem: PRT MS/GM 1248/2013, Art. 24, Parágrafo Único)
Art. 749. Os entes federativos e estabelecimentos hospitalares privados beneficiários enviarão relatórios semestrais ao DRAC/SAS/MS e ao DEGES/SGTES/MS com a descrição analítica da aplicação dos recursos dos incentivos financeiros percebidos, assinado pelo gestor do estabelecimento hospitalar e pelo coordenador da COREME local. (Origem: PRT MS/GM 1248/2013, Art. 25)
Seção V
Do Programa de Valorização do Profissional da Atenção Básica (PROVAB)
Art. 750. Esta Seção dispõe sobre a criação das Comissões de Coordenação Estadual e do Distrito Federal do Programa de Valorização do Profissional da Atenção Básica (PROVAB) e cria incentivo financeiro para manutenção e execução de suas atividades no ano de 2013. (Origem: PRT MS/GM 568/2013, Art. 1º)
Art. 751. As Comissões de Coordenação Estadual e do Distrito Federal do PROVAB constituem-se instâncias de coordenação, orientação e execução das atividades necessárias à execução do PROVAB no âmbito do respectivo ente federativo. (Origem: PRT MS/GM 568/2013, Art. 2º)
§ 1º As Secretarias de Saúde dos Estados e do Distrito Federal são responsáveis pela implantação da respectiva Comissão de Coordenação Estadual ou do Distrito Federal do PROVAB e pela indicação do Coordenador Estadual. (Origem: PRT MS/GM 568/2013, Art. 2º, § 1º)
§ 2º As Comissões de Coordenação Estadual e do Distrito Federal do PROVAB atenderão às regras e diretrizes técnicas fixadas pela Comissão Coordenadora do PROVAB de que trata a Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011. (Origem: PRT MS/GM 568/2013, Art. 2º, § 2º)
Art. 752. As Comissões de Coordenação Estadual e do Distrito Federal do PROVAB terão a seguinte composição mínima: (Origem: PRT MS/GM 568/2013, Art. 3º)
I - Representação do Ministério da Saúde; (Origem: PRT MS/GM 568/2013, Art. 3º, I)
II - Representação da Secretaria Estadual de Saúde; (Origem: PRT MS/GM 568/2013, Art. 3º, II)
III - Conselho de Secretários Municipais de Saúde - COSEMS; e (Origem: PRT MS/GM 568/2013, Art. 3º, III)
IV - Representação das Instituições Supervisoras. (Origem: PRT MS/GM 568/2013, Art. 3º, IV)
Parágrafo Único. O Coordenador Estadual será indicado pelas Secretarias de Saúde dos Estados e do Distrito Federal entre os membros da Comissão de Coordenação Estadual e do Distrito Federal. (Origem: PRT MS/GM 568/2013, Art. 3º, Parágrafo Único)
Seção VI
Do Comitê Estratégico para o Aperfeiçoamento da Qualidade da Formação de Profissionais de Saúde e de Estudos de Necessidade de Profissionais de Saúde e de Especialistas para o SUS
Art. 753. Fica constituído o Comitê Estratégico, no âmbito do Ministério da Saúde, que deverá subsidiar o planejamento de iniciativas com o objetivo de aperfeiçoar a qualidade da formação dos profissionais de saúde e de especialistas de acordo com as necessidades do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 266/2012, Art. 1º)
Art. 754. O Comitê de que trata o art. 753 será composto por: (Origem: PRT MS/GM 266/2012, Art. 2º)
I - Ministro de Estado da Saúde, que o presidirá; (Origem: PRT MS/GM 266/2012, Art. 2º, I)
II - Coordenador-Executivo do Conselho Técnico-Consultivo, designado pelo Ministro de Estado da Saúde; (Origem: PRT MS/GM 266/2012, Art. 2º, II)
III - Secretária-Executiva do Ministério da Saúde; (Origem: PRT MS/GM 266/2012, Art. 2º, III)
IV - Secretário de Atenção à Saúde do Ministério da Saúde; e (Origem: PRT MS/GM 266/2012, Art. 2º, IV)
V - Secretário de Gestão do Trabalho e da Educação na Saúde do Ministério da Saúde. (Origem: PRT MS/GM 266/2012, Art. 2º, V)
Art. 755. O Comitê Estratégico será assessorado por um Conselho Técnico-Consultivo, composto por quinze membros, sendo especialistas de notório saber nas áreas de que trata o art. 753, representantes de entidades profissionais ou de ensino ou gestores da área da saúde. (Origem: PRT MS/GM 266/2012, Art. 3º)
§ 1º Os representantes do Conselho Técnico-Consultivo serão indicados pelo Coordenador-Executivo do Conselho Técnico-Consultivo e designados pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 266/2012, Art. 3º, § 1º)
§ 2º O Coordenador-Executivo encaminhará ao Comitê Estratégico os resultados dos trabalhos e as propostas técnicas do Conselho. (Origem: PRT MS/GM 266/2012, Art. 3º, § 2º)
Art. 756. Compete ao Comitê Estratégico: (Origem: PRT MS/GM 266/2012, Art. 4º)
I - elaborar projetos de apoio ao aperfeiçoamento da qualidade da formação dos profissionais de saúde e identificação da necessidade de oferta de formação de profissionais de saúde e de especialistas; (Origem: PRT MS/GM 266/2012, Art. 4º, I)
II - sugerir estudos de avaliação do impacto das medidas adotadas; e (Origem: PRT MS/GM 266/2012, Art. 4º, II)
III - apresentar propostas de ações dirigidas ao provimento e fixação de profissionais de saúde em localidades e populações desassistidas de atenção à saúde. (Origem: PRT MS/GM 266/2012, Art. 4º, III)
§ 1º O Comitê Estratégico terá, no mínimo, 4 (quatro) reuniões ordinárias anualmente e reuniões extraordinárias, convocadas pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 266/2012, Art. 4º, § 1º)
§ 2º O Conselho Técnico-Consultivo se reunirá, a qualquer tempo, mediante provocação do seu Coordenador-Executivo. (Origem: PRT MS/GM 266/2012, Art. 4º, § 2º)
§ 3º O membro impossibilitado de participar em reunião do Comitê Estratégico ou do Conselho Técnico-Consultivo deverá comunicar a sua ausência ao Gabinete do Ministro com antecedência mínima de 2 (dois) dias úteis. (Origem: PRT MS/GM 266/2012, Art. 4º, § 3º)
§ 4º As reuniões do Conselho Técnico-Consultivo acontecerão preferencialmente em Brasília-DF. (Origem: PRT MS/GM 266/2012, Art. 4º, § 4º)
Art. 757. O Comitê Estratégico e o Conselho Técnico-Consultivo terão o apoio administrativo do Gabinete do Ministro para o desempenho de suas atividades. (Origem: PRT MS/GM 266/2012, Art. 5º)
Art. 758. As funções dos membros do Comitê Estratégico e dos representantes do Conselho Técnico-Consultivo não serão remuneradas e seu exercício será considerado de relevância para o serviço público. (Origem: PRT MS/GM 266/2012, Art. 6º)
Art. 759. O Gabinete do Ministro adotará as providências necessárias para a operacionalização das atividades de que tratam esta Seção. (Origem: PRT MS/GM 266/2012, Art. 7º)
Seção VII
Do Programa de Qualificação e Estruturação da Gestão do Trabalho e da Educação no SUS (PROGESUS)
Art. 760. Fica instituído o Programa de Qualificação e Estruturação da Gestão do Trabalho e da Educação no SUS (ProgeSUS), para colaborar técnica e financeiramente com a execução de projetos voltados ao fortalecimento dos Setores de Gestão do Trabalho e da Educação na Saúde de Secretarias de Saúde de estados, do Distrito Federal e de municípios. (Origem: PRT MS/GM 2261/2006, Art. 1º)
Art. 761. O ProgeSUS tem os seguintes componentes: (Origem: PRT MS/GM 2261/2006, Art. 2º)
I - componente I: financiamento para a modernização dos Setores de Gestão do Trabalho e da Educação na Saúde de Secretarias de Saúde de Estados, do Distrito Federal e de Municípios por meio da aquisição de mobiliário e de equipamentos de informática; (Origem: PRT MS/GM 2261/2006, Art. 2º, I)
II - componente II: disponibilização, pelo Ministério da Saúde, de Sistema de Informação Gerencial para o Setor de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde que desejarem adotá-lo; (Origem: PRT MS/GM 2261/2006, Art. 2º, II)
III - componente III: capacitação de equipes dos Setores de Gestão do Trabalho e da Educação na Saúde de Secretarias de Saúde de Estados, do Distrito Federal e de Municípios; e (Origem: PRT MS/GM 2261/2006, Art. 2º, III)
IV - componente IV: participação no Sistema Nacional de Informações em Gestão do Trabalho do SUS (InforSUS). (Origem: PRT MS/GM 2261/2006, Art. 2º, IV)
§ 1º O financiamento de que trata o art. 761, I não se destina à aquisição de computadores portáteis. (Origem: PRT MS/GM 2261/2006, Art. 2º, § 1º)
§ 2º O InforSUS, instituído e gerenciado pelo Ministério da Saúde, e alimentado periodicamente pelos seus participantes, será integrado por um conjunto de dados sobre a gestão do trabalho, definidos pela Comissão Intergestores do ProgeSUS(CIP). (Origem: PRT MS/GM 2261/2006, Art. 2º, § 2º)
Art. 762. O componente I do ProgeSUS será disponibilizado nas seguintes etapas: (Origem: PRT MS/GM 2261/2006, Art. 3º)
I - 1ª etapa: para estados, Distrito Federal e capitais; (Origem: PRT MS/GM 2261/2006, Art. 3º, I)
II - 2ª etapa: para municípios que tenham mais de 1.000 postos de trabalho público em saúde, conforme o Anexo LXXXIX ; (Origem: PRT MS/GM 2261/2006, Art. 3º, II)
III - 3ª etapa: para municípios que tenham entre 500 e 1.000 postos de trabalho público em saúde, conforme o Anexo XC ; e (Origem: PRT MS/GM 2261/2006, Art. 3º, III)
IV - 4ª etapa: para municípios que tenham menos de 500 postos de trabalho público em saúde. (Origem: PRT MS/GM 2261/2006, Art. 3º, IV)
§ 1º O número de postos de trabalho público em saúde dos municípios citados nos incisos II a IV do caput deste artigo tem por base a pesquisa IBGE/AMS, realizada em 2002. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 1º)
§ 2º Em cada etapa, o Secretário de Gestão do Trabalho e da Educação na Saúde publicará edital convocando as Secretarias de Saúde a apresentar projetos voltados ao fortalecimento de seus Setores de Gestão do Trabalho e da Educação na Saúde, fixando os necessários prazos, o valor máximo do financiamento e os critérios de seleção e classificação, os desta, exclusivamente, para a 4ª etapa. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 2º)
§ 3º O edital de convocação será disponibilizado no endereço eletrônico www.saude.gov.br/degerts, a partir da data da publicação do seu extrato no Diário Oficial da União. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 3º)
§ 4º As etapas de que tratam os incisos I a IV do caput deste artigo poderão ser executadas concomitantemente. (Origem: PRT MS/GM 2261/2006, Art. 3º, § 4º)
Art. 763. Para participar do componente I do ProgeSUS, os estados, o Distrito Federal e os municípios deverão observar os seguintes requisitos: (Origem: PRT MS/GM 2261/2006, Art. 4º)
I - possuir setor de gestão do trabalho e da educação na saúde na própria estrutura organizacional da Secretaria de Saúde ou comprometer-se a inseri-lo em prazo certo, especificado no próprio Projeto; (Origem: PRT MS/GM 2261/2006, Art. 4º, I)
II - possuir área física adequada para o setor nas dependências da própria Secretaria de Saúde, funcionando com equipe específica, ou comprometer-se a instalá-lo em prazo certo, especificado no próprio Projeto; (Origem: PRT MS/GM 2261/2006, Art. 4º, II)
III - aderir aos componentes III e IV do ProgeSUS; e (Origem: PRT MS/GM 2261/2006, Art. 4º, III)
IV - atender às demais exigências previstas em normas que regulem o repasse de recursos para o financiamento do Sistema Único de Saúde. (Origem: PRT MS/GM 2261/2006, Art. 4º, IV)
Art. 764. Para participar exclusivamente dos componentes II e/ou III do ProgeSUS, os estados, o Distrito Federal ou os municípios deverão encaminhar sua solicitação diretamente à Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES), do Ministério da Saúde. (Origem: PRT MS/GM 2261/2006, Art. 5º)
§ 1º O deferimento da solicitação dependerá da observância dos seguintes requisitos: (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º)
I - para o componente II: (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, I)
a) existência de equipamentos de informática com configuração adequada às exigências do Sistema de Informação Gerencial; e (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, I, a)
b) disponibilização de profissional do Setor de Gestão do Trabalho e da Educação na Saúde para ser capacitado a operar o Sistema de Informação Gerencial; (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, I, b)
II - para o componente III: (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, II)
a) disponibilização de profissional do Setor para participar de processo de capacitação; e (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, II, a)
b) atendimento das exigências metodológicas do processo de capacitação oferecido. (Origem: PRT MS/GM 2261/2006, Art. 5º, § 1º, II, b)
§ 2º Em relação art. 764, § 1º , II, o atendimento da solicitação observará o previsto em portaria específica, expedida pelo Secretário de Gestão do Trabalho e da Educação na Saúde. (Origem: PRT MS/GM 2261/2006, Art. 5º, § 2º)
Art. 765. Os projetos deverão ser encaminhados à SGTES, contendo: (Origem: PRT MS/GM 2261/2006, Art. 6º)
I - o Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde da Secretaria de Saúde; e (Origem: PRT MS/GM 2261/2006, Art. 6º, I)
II - o Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde da Secretaria de Saúde. (Origem: PRT MS/GM 2261/2006, Art. 6º, II)
Art. 766. O Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde deverá conter: (Origem: PRT MS/GM 2261/2006, Art. 7º)
I - justificativa; (Origem: PRT MS/GM 2261/2006, Art. 7º, I)
II - objetivos (geral e específico); (Origem: PRT MS/GM 2261/2006, Art. 7º, II)
III - planejamento das ações estruturantes; e (Origem: PRT MS/GM 2261/2006, Art. 7º, III)
IV - Planilha de Custo. (Origem: PRT MS/GM 2261/2006, Art. 7º, IV)
Parágrafo Único. A Planilha de Custo deverá apresentar o valor total do projeto, no que se refere ao Componente I do ProgeSUS, detalhando os itens de mobiliário e de equipamentos de informática que serão adquiridos. (Origem: PRT MS/GM 2261/2006, Art. 7º, Parágrafo Único)
Art. 767. O Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde deverá conter: (Origem: PRT MS/GM 2261/2006, Art. 8º)
I - justificativa; (Origem: PRT MS/GM 2261/2006, Art. 8º, I)
II - objetivos (geral e específico); e (Origem: PRT MS/GM 2261/2006, Art. 8º, II)
III - planejamento das ações de qualificação. (Origem: PRT MS/GM 2261/2006, Art. 8º, III)
Parágrafo Único. O Plano deverá apresentar as ações necessárias ao enfrentamento das principais dificuldades encontradas no campo da gestão, da negociação e da educação na saúde, e os seus respectivos prazos de execução. (Origem: PRT MS/GM 2261/2006, Art. 8º, Parágrafo Único)
Art. 768. Os projetos deverão ser encaminhados juntamente com os seguintes documentos, após sua aprovação na Comissão Intergestores Bipartite (CIB): (Origem: PRT MS/GM 2261/2006, Art. 9º)
I - ofício assinado pelo gestor de saúde ( Anexo XCI ); (Origem: PRT MS/GM 2261/2006, Art. 9º, I)
II - declaração de adesão, alimentação e atualização do InforSUS ( Anexo XCII ); (Origem: PRT MS/GM 2261/2006, Art. 9º, II)
III - ato formal da instituição do Setor de Gestão do Trabalho e da Educação na Saúde vinculado à estrutura da Secretaria de Saúde, quando existente; e (Origem: PRT MS/GM 2261/2006, Art. 9º, III)
IV - cópia da ata ou da resolução de sua aprovação na CIB. (Origem: PRT MS/GM 2261/2006, Art. 9º, IV)
§ 1º Em 30 (trinta) dias, contados do término do prazo indicado para a conclusão do componente I do ProgeSUS, o gestor de saúde deverá apresentar à SGTES o relatório de sua execução. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 1º)
§ 2º A homologação de projetos, em cada etapa do componente I, compete ao Secretário de Gestão do Trabalho e da Educação na Saúde e será formalizada por meio de portaria publicada imediatamente após o encerramento da fase de análise e verificação de atendimento de exigências para o repasse de recursos para o financiamento do SUS. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 2º)
§ 3º A portaria de que trata o art. 768, § 2º deverá conter: (Origem: PRT MS/GM 2261/2006, Art. 9º, § 3º)
I - a relação das Secretarias de Saúde cujos projetos foram homologados; e (Origem: PRT MS/GM 2261/2006, Art. 9º, § 3º, I)
II - a relação das Secretarias de Saúde cuja homologação dos projetos encontra-se pendente de alguma adequação, indicando-se esta e o prazo para sua apresentação. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 3º, II)
§ 4º Após o transcurso do prazo de que trata o art. 768, § 3º , II, o Secretário de Gestão do Trabalho e da Educação na Saúde publicará nova portaria, contendo: (Origem: PRT MS/GM 2261/2006, Art. 9º, § 4º)
I - a relação das Secretarias de Saúde cujos projetos foram homologados; e (Origem: PRT MS/GM 2261/2006, Art. 9º, § 4º, I)
II - a relação das Secretarias de Saúde cujos projetos deixaram de ser homologados porque não sofreram as necessárias adequações. (Origem: PRT MS/GM 2261/2006, Art. 9º, § 4º, II)
Art. 769. A gestão do ProgeSUS e a verificação da adequação dos projetos competem ao Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS). (Origem: PRT MS/GM 2261/2006, Art. 10)
Parágrafo Único. A gestão do ProgeSUS será exercida pelo Diretor do Departamento de Gestão e da Regulação do Trabalho em Saúde e, em seu impedimento, pelo Coordenador-Geral da Gestão do Trabalho em Saúde. (Origem: PRT MS/GM 2261/2006, Art. 10, Parágrafo Único)
Art. 770. Fica constituída a Comissão Intergestores do ProgeSUS (CIP), com a seguinte composição: (Origem: PRT MS/GM 2261/2006, Art. 11)
I - três representantes do Departamento de Gestão e da Regulação do Trabalho em Saúde (DEGERTS/SGTES/MS); (Origem: PRT MS/GM 2261/2006, Art. 11, I)
II - dois representantes do Departamento de Gestão da Educação na Saúde (DEGES/SGTES/MS); (Origem: PRT MS/GM 2261/2006, Art. 11, II)
III - um representante da Coordenação-Geral de Recursos Humanos (CGRH), da Secretaria-Executiva do Ministério da Saúde; (Origem: PRT MS/GM 2261/2006, Art. 11, III)
IV - um representante do Departamento de Informação e Informática do SUS (DATASUS), da Secretaria-Executiva do Ministério da Saúde; (Origem: PRT MS/GM 2261/2006, Art. 11, IV)
V - dois representantes do Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 2261/2006, Art. 11, V)
VI - dois representantes do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 2261/2006, Art. 11, VI)
§ 1º Incumbe aos órgãos e às entidades relacionadas neste artigo a indicação de seus respectivos representantes. (Origem: PRT MS/GM 2261/2006, Art. 11, § 1º)
§ 2º A indicação de que trata o art. 770, § 1º deverá ser feita por escrito e dirigida ao Diretor do Departamento de Gestão e da Regulação do Trabalho em Saúde. (Origem: PRT MS/GM 2261/2006, Art. 11, § 2º)
Art. 771. Compete à CIP: (Origem: PRT MS/GM 2261/2006, Art. 12)
I - apresentar proposições sobre o conteúdo e a metodologia das ações de cronograma de desenvolvimento de cada ação; (Origem: PRT MS/GM 2261/2006, Art. 12, I)
II - apresentar proposições de melhoria para o funcionamento dos Setores de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde de estados, do Distrito Federal e de municípios; (Origem: PRT MS/GM 2261/2006, Art. 12, II)
III - apresentar proposição referente aos indicadores que serão usados na avaliação do impacto do ProgeSUS no que tange ao fortalecimento dos Setores de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde de estados, do Distrito Federal e de municípios; (Origem: PRT MS/GM 2261/2006, Art. 12, III)
IV - acompanhar e apresentar proposições que contribuam para a eficaz execução do ProgeSUS; (Origem: PRT MS/GM 2261/2006, Art. 12, IV)
V - avaliar e classificar os projetos apresentados pelas Secretarias Municipais de Saúde na 4ª etapa do componente I do ProgeSUS; e (Origem: PRT MS/GM 2261/2006, Art. 12, V)
VI - definir o conjunto de dados que conformarão o Sistema Nacional de Informações em Gestão do Trabalho do SUS e a forma como os Setores de Gestão do Trabalho e da Educação na Saúde das Secretarias de Saúde irão alimentá-lo. (Origem: PRT MS/GM 2261/2006, Art. 12, VI)
Art. 772. A CIP será coordenada pelo Diretor do DEGERTS, ou, por sua delegação, por qualquer outro membro. (Origem: PRT MS/GM 2261/2006, Art. 13)
Art. 773. A CIP contará com assessores técnicos, indicados pelo seu Coordenador, e poderá convidar especialista ou instituições para contribuir com a execução dos seus trabalhos. (Origem: PRT MS/GM 2261/2006, Art. 14)
Art. 774. Ao DEGERTS incumbe garantir os meios necessários à consecução das atribuições da CIP. (Origem: PRT MS/GM 2261/2006, Art. 15)
Art. 775. A CIP reunir-se-á periodicamente ou sempre que convocada pelo seu Coordenador. (Origem: PRT MS/GM 2261/2006, Art. 16)
Art. 776. Os Municípios compreendidos nas etapas 3ª e 4ª previstas no art. 762 deverão observar os seguintes requisitos para participar do componente I do ProgeSUS: (Origem: PRT MS/GM 2261/2006, Art. 4º-A)
I - designação, de ofício, pelo gestor municipal de saúde, de técnico responsável pela área da Gestão do Trabalho e da Educação na Saúde (RH); (Origem: PRT MS/GM 2261/2006, Art. 4º-A, I)
II - estabelecimento de espaço físico na Secretaria de Saúde, para desenvolvimento das atividades da área; (Origem: PRT MS/GM 2261/2006, Art. 4º-A, II)
III - compromisso de liberar o técnico responsável pelas atividades da área para participar dos processos de capacitação desenvolvidos no âmbito do ProgeSUS; (Origem: PRT MS/GM 2261/2006, Art. 4º-A, III)
IV - declaração de adesão ao Sistema Nacional de Informações em Gestão do Trabalho no SUS (art. 761, IV) e compromisso com sua alimentação e atualização; e (Origem: PRT MS/GM 2261/2006, Art. 4º-A, IV)
V - apresentar cópia das atribuições e responsabilidades sanitárias referentes aos eixos 5 e 6 (Gestão do Trabalho e Educação na Saúde, respectivamente) do Termo de Compromisso de Gestão Municipal, publicado em Portaria do Ministério da Saúde após sua homologação na CIT. (Origem: PRT MS/GM 2261/2006, Art. 4º-A, V)
Parágrafo Único. Os incisos I, II, III e IV devem estar contemplados no Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde e o inciso V no Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde. (Origem: PRT MS/GM 2261/2006, Art. 4º-A, Parágrafo Único)
Art. 777. O projeto contendo o Plano de Estruturação do Setor de Gestão do Trabalho e da Educação na Saúde e o Plano de Qualificação da Gestão do Trabalho e da Educação na Saúde deve ser encaminhado à Secretaria de Gestão do Trabalho e da Educação na Saúde juntamente com os seguintes documentos: (Origem: PRT MS/GM 2261/2006, Art. 4º-B)
I - ofício assinado pelo gestor de saúde; (Origem: PRT MS/GM 2261/2006, Art. 4º-B, I)
II - declaração de adesão, alimentação e atualização do InforSUS; (Origem: PRT MS/GM 2261/2006, Art. 4º-B, II)
III - ofício do gestor municipal de saúde designando técnico responsável pelas atividades da área da Gestão do Trabalho e da Educação na Saúde (RH), bem como informando a instalação de espaço físico, dentro da Secretaria de Saúde, para desenvolvimento das atividades da área; (Origem: PRT MS/GM 2261/2006, Art. 4º-B, III)
IV - cópia da ata ou da resolução de sua aprovação na CIB; e (Origem: PRT MS/GM 2261/2006, Art. 4º-B, IV)
V - cópia das atribuições e responsabilidades sanitárias referentes aos eixos 5 e 6 (Gestão do Trabalho e Educação na Saúde, respectivamente) do Termo de Compromisso de Gestão Municipal, publicado em Portaria do Ministério da Saúde após sua homologação na CIT. (Origem: PRT MS/GM 2261/2006, Art. 4º-B, V)
Parágrafo Único. Os projetos aprovados serão priorizados nas ações de qualificação do ProgeSUS, bem como será oferecido à Secretaria de Saúde o Sistema de Informação Gerencial específico para a Gestão do Trabalho e capacitação em sua instalação e operação. (Origem: PRT MS/GM 2261/2006, Art. 4º-B, Parágrafo Único)
Seção VIII
Do Plano Nacional de Fortalecimento das Residências em Saúde
(Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-A. Fica instituído o Plano Nacional de Fortalecimento das Residências em Saúde, que visa valorizar e qualificar residentes, corpo docente-assistencial e gestores de programas de residência em saúde e apoiar institucionalmente programas de residência em saúde, no âmbito do Sistema Único de Saúde (SUS). (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 1º A oferta das ações relativas ao plano ocorrerá em ciclos trienais, sendo o primeiro ciclo correspondente ao triênio 2021-2023. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 2º Ao término de cada ciclo, o plano será submetido à avaliação das ações e do orçamento executado, para fins de planejamento de novo triênio. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-B. Para fins desta portaria, consideram-se: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
I - corpo docente-assistencial: profissionais vinculados às instituições formadoras, que participam do desenvolvimento das estratégias pedagógicas, das atividades teóricas e teórico-práticas, composto por docentes, tutores e preceptores; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
II - criação de programas de residência em saúde: desenvolvimento de propostas para criação de novos programas de residência em saúde a serem submetidas aos processos de credenciamento da Comissão Nacional de Residência Médica (CNRM) ou Comissão Nacional de Residência Multiprofissional em Saúde (CNRMS); (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
III - gestores de programas de residência em saúde: coordenadores de Comissão de Residência Médica (COREME) ou Comissão de Residência Multiprofissional em Saúde (COREMU), ou coordenadores e supervisores de programas de residência em saúde; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
IV - instituições elegíveis: instituições federais vinculadas ao Ministério da Saúde (MS), instituições federais vinculadas ao Ministério da Educação (MEC), instituições privadas sem fins lucrativos, órgãos e instituições públicas municipais, estaduais e distritais; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
V - preceptores: profissionais de saúde, declarados por instituições elegíveis, como responsáveis por conduzir e supervisionar, por meio de orientação e acompanhamento, os residentes em seu respectivo programa de residência em saúde; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
VI - reativação de programas de residência em saúde: recredenciamento de programas de residência em saúde que já foram contemplados com bolsas de residência financiadas pelo Ministério da Saúde e que estão impossibilitados de funcionar regularmente; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
VII - reestruturação de programas de residência em saúde: programas de residência em saúde, com ato autorizativo vigente, que já foram contemplados com bolsas de residência financiadas pelo Ministério da Saúde e que demandem suporte técnico a respeito de aspectos que afetem seu funcionamento; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
VIII - residências em saúde: residências médicas definidas na Lei nº 6.932, de 7 de julho de 1981, e residências em área profissional da saúde definidas na Lei nº 11.129, de 30 de junho de 2005; e (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
IX - residentes: profissionais de saúde inscritos em programas de residência em saúde aprovados pela CNRM ou CNRMS. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-C. São objetivos do Plano Nacional de Fortalecimento das Residências em Saúde: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
I - valorizar e qualificar residentes, corpo docente-assistencial e gestores de programas de residência em saúde; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
II - fortalecer a atuação do preceptor na formação do residente; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
III - contribuir, de forma complementar, para a formação qualificada de profissionais de saúde, em especialidades, áreas de atuação e áreas de concentração prioritárias para o SUS; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
IV - apoiar institucionalmente programas de residência em saúde; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
V - ampliar o número de programas de residência em saúde com bolsas financiadas pelo Ministério da Saúde (MS), em regiões prioritárias para o SUS; e (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
VI - contribuir para a oferta de profissionais especializados, egressos de programas de residência em saúde, nas regiões prioritárias para o SUS. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-D. O plano se desenvolverá por meio de três eixos: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
I - Ofertas Educacionais: consiste em um conjunto de ações de capacitação e qualificação profissional de residentes, corpo docente-assistencial e gestores de programas de residência em saúde, na modalidade de cursos, apoio à produção científica e outros processos formativos; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
II - Valorização Ensino-Assistencial: consiste em cursos para qualificação do corpo docente-assistencial com intuito de aprimorar o conhecimento científico e, consequentemente, contribuir de maneira qualitativa e quantitativa no ensino e na formação de novos especialistas, e com a produção científica no país; e (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
III - Apoio Institucional: consiste em um conjunto de ações de apoio técnico, pedagógico e institucional às instituições proponentes de programas de residência em saúde na elaboração de projetos pedagógicos e na condução de processos administrativos para a criação, reativação ou reestruturação de programas de residência, em conformidade com as necessidades e capacidades loco-regionais do SUS. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Subseção I
Das Ações de Ofertas Educacionais
(Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-E. O Ministério da Saúde, por meio da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES), disponibilizará ofertas educacionais para capacitar e qualificar os residentes, o corpo docente-assistencial e os gestores de programas de residência em saúde. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 1º As ofertas serão disponibilizadas por meio de contratos, convênios ou instrumentos congêneres, firmados entre o MS e as instituições parceiras. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 2º As ações de ofertas educacionais poderão ser disponibilizadas a todos os residentes, corpo docente-assistencial e gestores de programas de residência em saúde, exceto as ofertas com critérios de seleção definidos em regulamentação específica. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-F. Os residentes, corpo docente-assistencial e gestores de programas de residência em saúde poderão aderir ao plano, por meio da inscrição em ações de capacitação ou qualificação, segundo o regulamento de cada oferta educacional. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Parágrafo único. As ofertas educacionais e as condições para adesão serão disponibilizadas nos portais https://sigresidencias.saude.gov.br e https://registra-rh.saude.gov.br. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-G. O monitoramento será realizado pela SGTES, por meio da análise de relatórios periódicos de execução dos cursos, com informações administrativas e financeiras, incluindo listas de inscritos, desistentes e concluintes dos cursos realizados. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Subseção II
Das Ações de Valorização Ensino-Assistencial
(Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-H. O Ministério da Saúde, por meio da SGTES, apoiará e desenvolverá ações de aprimoramento do conhecimento científico e contribuirá de maneira qualitativa e quantitativa no ensino e na formação de novos especialistas, bem como na produção científica no país. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 1º As ações do eixo de valorização ensino-assistencial são destinadas ao corpo docente-assistencial de programas de residência em saúde credenciados pela CNRM e CNRMS, exceto das instituições privadas com fins lucrativos. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 2º É vedado ao corpo docente-assistencial a adesão em mais de um edital simultaneamente, ainda que atuem em mais de um programa de residência em saúde, sendo limitada a concessão de um incentivo financeiro por profissional. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-I. Serão ofertados editais de seleção para o corpo docente-assistencial previamente declarados por seus coordenadores no Cadastro Nacional Docente-Assistencial, disponível no Portal Registra-RH Saúde https://registra-rh.saude.gov.br. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 1º Poderão ser declarados no Cadastro Nacional Docente-Assistencial todos os docentes, tutores e preceptores de programas de residência autorizados no âmbito das respectivas comissões nacionais. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 2º Cada edital poderá ser destinado a um público-alvo específico do corpo docente-assistencial. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 3º O edital de seleção deverá prever, dentre outros: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
I - os compromissos do corpo docente-assistencial de programas de residências em saúde selecionados, como a comprovação de apresentação: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
a) de projetos de intervenção; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
b) de produção de artigos científicos; e (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
c) de participação em inquéritos elaborados pelo Ministério da Saúde; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
II - as hipóteses de devolução do incentivo financeiro. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-J. Haverá concessão de incentivo financeiro ao corpo docente-assistencial de programas de residências em saúde selecionados via edital, mediante a participação em capacitações profissionais. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 1º O valor referente ao incentivo financeiro previsto nesta subseção corresponde ao estabelecido para a bolsa de mestrado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES). (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 2º A atualização do valor atribuído ao incentivo de valorização ensino-assistencial ocorrerá após revisão pela CAPES para a bolsa de mestrado e dependerá da inclusão e aprovação no Projeto de Lei do Orçamento Anual (PLOA) para o exercício seguinte, sendo vedado o pagamento retroativo. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-K. O monitoramento será realizado pela SGTES, por meio do acompanhamento da entrega dos compromissos estabelecidos em editais. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Subseção III
Das Ações de Apoio Institucional
(Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-L. O Ministério da Saúde, por meio da SGTES, ofertará ações de apoio técnico, pedagógico e institucional às instituições proponentes de programas de residência em saúde na elaboração de projetos pedagógicos e na condução de processos administrativos para criação, reativação ou reestruturação de programas de residência em saúde, em conformidade com as necessidades e capacidades loco-regionais do SUS. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Parágrafo único. As ações de apoio institucional serão executadas em parceria com instituições federais, mediante a celebração de termo de execução descentralizada. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-M. As regiões prioritárias serão definidas pela SGTES a cada ciclo trienal, em conjunto com o Conselho Nacional de Secretários de Saúde (CONASS), Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS), Comissão Nacional de Residência Médica (CNRM) e Comissão Nacional de Residência Multiprofissional em Saúde (CNRMS), por meio da análise de indicadores sanitários e de recursos humanos. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-N. A adesão ocorrerá mediante chamada pública, na qual poderão participar os entes da federação integrantes das regiões prioritárias. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-O. As ações do eixo Apoio Institucional serão desenvolvidas e acompanhadas por Apoiadores Técnicos Loco-Regionais. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 1º Poderão ser Apoiadores Técnicos Loco-Regionais: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
I - membros representantes das Comissões Estaduais de Residência Médica (CEREMs); (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
II - membros representantes das comissões descentralizadas da residência multiprofissional em saúde; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
III - membros representantes das Secretarias Estaduais de Saúde; e (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
IV - membros representantes dos Conselhos de Secretarias Municipais de Saúde (COSEMS). (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
§ 2º Os Apoiadores Técnicos Loco-Regionais deverão ter conhecimento e experiência em saúde pública, residências em saúde ou em relação ao Sistema Único de Saúde (SUS). (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-P. Aos Apoiadores Técnicos Loco-Regionais poderão ser concedidos incentivos de natureza técnico-pedagógica ou a título de bolsa, conforme critérios estabelecidos pelas instituições federais, mediante a articulação local das atividades necessárias para o desenvolvimento das ações de criação, reestruturação e reativação dos programas de residência em saúde no território. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Parágrafo único. Os incentivos de que tratam o caput deverão ter como referência os valores pagos aos bolsistas pesquisadores das universidades federais. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-Q. O monitoramento será realizado pela SGTES, por meio da análise de relatórios e indicadores referentes ao processo de criação, reativação e reestruturação de programas de residência em saúde. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Subseção IV
Da Competência para Execução do Plano
(Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-R. O Plano Nacional de Fortalecimento das Residências em Saúde será coordenado pelo Ministério da Saúde, por meio da SGTES, à qual compete: (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
I - coordenar, acompanhar e monitorar a execução das ações descritas no Plano e os resultados obtidos; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
II - estabelecer e implementar os procedimentos e critérios de adesão ao Plano; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
III - propor ofertas educacionais complementares, em conjunto com o CONASS, CONASEMS, CNRM, CNRMS, observadas as diretrizes gerais estabelecidas pelas respectivas comissões; (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
IV - desenvolver mecanismos técnico-pedagógico e institucional, em conjunto com o CONASS, CONASEMS, CNRM, CNRMS, que possibilitem o apoio institucional na criação, reativação e reestruturação de programas de residência em saúde; e (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
V - definir as metas e os indicadores de cada eixo do Plano. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Parágrafo único. Para a execução das atividades do Plano, a SGTES poderá celebrar contratos, convênios ou instrumentos congêneres, observada a legislação aplicável e os princípios regentes da Administração Pública. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Subseção V
Disposições Finais
(Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-S. Os recursos orçamentários para a execução das ações da União de que trata esta Portaria recairão sobre o orçamento do MS, onerando a Categoria Funcional Programática 10.128.5021.20YD.0001 - Educação e Formação em Saúde. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Parágrafo único. Para a execução deste Plano, deverão ser respeitados os limites orçamentários da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES). (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
Art. 777-T. A SGTES resolverá eventuais casos omissos e poderá dispor sobre normas regulamentares para a execução do Plano. (Redação dada pela PRT GM/MS nº 1.598 de 15.07.2021)
CAPÍTULO II
DA DESPRECARIZAÇÃO DO TRABALHO NO SUS
Seção I
Do Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS
Art. 778. Fica criado o Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS, vinculado à Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS), objetivando: (Origem: PRT MS/GM 2430/2003, Art. 1º) (com redação dada pela PRT MS/GM 2729/2013)
I - fixar as diretrizes para o recadastramento nacional dos trabalhadores com vínculo de trabalho precário, e estabelecer, para este, o cronograma de sua realização; (Origem: PRT MS/GM 2430/2003, Art. 1º, I)
II - definir um modelo de cadastro mínimo para ser aplicado em todo o País, o qual poderá ser adaptado para atender as necessidades e interesses locais; (Origem: PRT MS/GM 2430/2003, Art. 1º, II)
III - monitorar as formas de substituição do trabalho precário nas três esferas de governo (federal, estadual e municipal); (Origem: PRT MS/GM 2430/2003, Art. 1º, III)
IV - dimensionar e estimular a realização de concurso público nas três esferas de governo, em cumprimento de princípio constitucional e de recomendações de resoluções das últimas Conferências Nacionais de Saúde e de Recursos Humanos; (Origem: PRT MS/GM 2430/2003, Art. 1º, IV)
V - realizar o levantamento das formas de precarização do trabalho no SUS; (Origem: PRT MS/GM 2430/2003, Art. 1º, V)
VI - indicar as formas legais de contratação, quando for o caso, e apresentar as iniciativas requeridas para sua implementação, tendo em conta a política de preservação do emprego e da renda dos ocupados no setor; (Origem: PRT MS/GM 2430/2003, Art. 1º, VI)
VII - avaliar os impactos financeiros das medidas propostas e suas repercussões em face da Lei Complementar nº 101, de 4 de maio de 2000 (D.O.U. de 05/05/2000), que estabelece normas de finanças públicas voltadas para a responsabilidade na gestão fiscal e dá outras providências; (Origem: PRT MS/GM 2430/2003, Art. 1º, VII)
VIII - monitorar as decisões judiciais e os acordos extrajudiciais sobre finanças públicas e gestão fiscal que versem sobre o disposto no inciso VII deste artigo, buscando formular alternativas para superar possíveis entraves legais e fiscais com gestores do SUS; (Origem: PRT MS/GM 2430/2003, Art. 1º, VIII)
IX - induzir, por meio de cooperação com os demais entes federados, a adoção de uma nova concepção de relações estáveis de trabalho no SUS - que erradique os vínculos precários e valorize o trabalhador -, em benefício de melhorias na qualidade do acesso e do atendimento dispensado aos usuários do SUS; (Origem: PRT MS/GM 2430/2003, Art. 1º, IX)
X - propor mecanismos de financiamento pelo Governo Federal que estimulem as formas legais de relações de trabalho no SUS, com especial ênfase para a organização das equipes de saúde da família; (Origem: PRT MS/GM 2430/2003, Art. 1º, X)
XI - divulgar iniciativas adotadas na gestão do trabalho no SUS, de enfoque multiprofissional, que dignifiquem o trabalho humano e a consequente melhoria dos serviços de saúde no País; (Origem: PRT MS/GM 2430/2003, Art. 1º, XI)
XII - apoiar e estimular a criação de Comitês Estaduais e Municipais de Desprecarização do Trabalho no SUS; e (Origem: PRT MS/GM 2430/2003, Art. 1º, XII)
XIII - elaborar políticas e formular diretrizes para a desprecarização do trabalho no SUS. (Origem: PRT MS/GM 2430/2003, Art. 1º, XIII)
Art. 779. O Comitê terá a seguinte composição: (Origem: PRT MS/GM 2430/2003, Art. 2º)
I - 7 (sete) representantes do Ministério da Saúde, quais sejam: (Origem: PRT MS/GM 2430/2003, Art. 2º, I)
a) a Secretária de Gestão do Trabalho e da Educação na Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, a)
b) a Diretora do Departamento de Gestão e da Regulação do Trabalho em Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, b)
c) o Coordenador-Geral de Gestão do Trabalho em Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, c)
d) o Coordenador-Geral da Regulação e Negociação do Trabalho em Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, d)
e) a Diretora do Departamento de Atenção Básica da Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, e)
f) o Diretor do Departamento de Regulação, Avaliação e Controle de Sistemas da Secretaria de Atenção à Saúde; e (Origem: PRT MS/GM 2430/2003, Art. 2º, I, f)
g) o Coordenador-Geral de Recursos Humanos do Ministério da Saúde; (Origem: PRT MS/GM 2430/2003, Art. 2º, I, g)
II - 1 (um) representante do Ministério do Planejamento, Desenvolvimento e Gestão; (Origem: PRT MS/GM 2430/2003, Art. 2º, II)
III - 1 (um) representante do Ministério do Trabalho; (Origem: PRT MS/GM 2430/2003, Art. 2º, III)
IV - 1 (um) representante do Conselho Nacional dos Secretários Estaduais de Saúde (CONASS); (Origem: PRT MS/GM 2430/2003, Art. 2º, IV)
V - 1 (um) representante do Conselho Nacional dos Secretários Municipais de Saúde (CONASEMS); (Origem: PRT MS/GM 2430/2003, Art. 2º, V)
VI - 1 (um) representante de empregador privado que integre a Mesa Nacional de Negociação Permanente do SUS; e (Origem: PRT MS/GM 2430/2003, Art. 2º, VI)
VII - 6 (seis) representantes de trabalhadores indicados pela Mesa Nacional de Negociação Permanente do SUS (MNNP-SUS). (Origem: PRT MS/GM 2430/2003, Art. 2º, VII) (com redação dada pela PRT MS/GM 2729/2013)
Parágrafo Único. A exceção dos representantes do Ministério da Saúde, os demais integrantes do Comitê serão livremente designados por meio de expediente subscrito pelos representantes legais dos órgãos e instituições representadas. (Origem: PRT MS/GM 2430/2003, Art. 2º, Parágrafo Único)
Art. 780. Os trabalhos do Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS serão coordenados por um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS), que garantirá apoio técnico e de pessoal necessários para o seu regular funcionamento. (Origem: PRT MS/GM 2430/2003, Art. 3º) (com redação dada pela PRT MS/GM 2729/2013)
§ 1º Um representante dos trabalhadores de que trata o art. 779, VII será escolhido por sua bancada para exercer a subcoordenação do Comitê. (Origem: PRT MS/GM 2430/2003, Art. 3º, § 1º) (dispositivo acrescentado pela PRT MS/GM 2729/2013)
§ 2º Caberá ao coordenador de que trata o "caput" encaminhar à MNNP-SUS as atas de reunião e demais atos exarados pelo Comitê, no prazo de 20 (vinte) dias úteis. (Origem: PRT MS/GM 2430/2003, Art. 3º, § 2º) (dispositivo acrescentado pela PRT MS/GM 2729/2013)
Art. 781. Os acordos realizados no âmbito do Comitê Nacional Interinstitucional de Desprecarização deverão ser homologados pela MNP-SUS, cuja Secretaria-Executiva efetuará os encaminhamentos necessários. (Origem: PRT MS/GM 2430/2003, Art. 3º-A)
Art. 782. Respeitado os limites impostos por seu objeto, o Comitê atuará da forma mais ampla possível, gozando de autonomia para constituir grupos de trabalho, se isso entender seja necessário. (Origem: PRT MS/GM 2430/2003, Art. 4º)
Seção II
Da Rede de Apoio à Desprecarização do Trabalho no Âmbito do SUS
Art. 783. Fica instituída a Rede de Apoio a Desprecarização do Trabalho no âmbito do Sistema Único de Saúde, para propiciar o intercâmbio de informações entre o Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS e os comitês estaduais e municipais que dela participarem. (Origem: PRT MS/GM 928/2006, Art. 1º)
Parágrafo Único. Poderão se integrar à Rede de Apoio as instituições ou entidades que desenvolvam ações na área de gestão do trabalho. (Origem: PRT MS/GM 928/2006, Art. 1º, Parágrafo Único)
Art. 784. A solicitação de adesão à Rede de Apoio a Desprecarização do Trabalho, dirigida à Coordenação dos Trabalhos do Comitê Nacional Interinstitucional de Desprecarização do Trabalho no SUS, e subscrita pelo representante legal do requerente, deverá trazer, anexo, o ato formal de constituição deste. (Origem: PRT MS/GM 928/2006, Art. 2º)
Parágrafo Único. O não encaminhamento do meio de prova especificado pelo caput deste artigo acarretará o indeferimento da solicitação caso a ausência não seja remediada no prazo de dez dias. (Origem: PRT MS/GM 928/2006, Art. 2º, Parágrafo Único)
Art. 785. A coordenação e subcoordenação dos trabalhos da Rede serão exercidas, respectivamente, pelo Secretário de Gestão do Trabalho e da Educação na Saúde e pelo Diretor do Departamento de Gestão e da Regulação do Trabalho em Saúde. (Origem: PRT MS/GM 928/2006, Art. 3º)
Art. 786. A Secretaria de Gestão do Trabalho e da Educação na Saúde assegurará os recursos necessários para o funcionamento da Rede, incluindo a comunicação permanente entre os seus componentes, através de fóruns presenciais e/ou meio eletrônico. (Origem: PRT MS/GM 928/2006, Art. 4º)
CAPÍTULO III
DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SUS (PROADI-SUS)
Art. 787. O Anexo XCIII dispõe sobre o Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (PROADI-SUS).
CAPÍTULO IV
DAS TECNOLOGIAS EM SAÚDE
Seção I
Do Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde
(Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 788. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde, que passa a integrar um conjunto de políticas adotadas para estimular a eficiência produtiva no Complexo Industrial da Saúde, constituindo uma prioridade tanto do Sistema Único de Saúde quanto da Política Industrial, Tecnológica e de Comércio Exterior (PITCE). (Origem: PRT MS/GM 374/2008, Art. 1º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 789. O Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde tem como objetivo promover o fortalecimento e a modernização do conjunto de laboratórios públicos encarregados da produção de medicamentos e imunobiológicos de relevância estratégica para o Sistema Único de Saúde, por intermédio da ampliação da participação no Complexo Produtivo da Saúde, do aumento da capacidade inovadora e da mudança de patamar competitivo, contribuindo para a redução da defasagem tecnológica existente e o desenvolvimento econômico, científico e tecnológico do País. (Origem: PRT MS/GM 374/2008, Art. 2º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 790. São objetivos específicos do Programa, segundo os segmentos que compõem a produção do conjunto de laboratórios públicos: (Origem: PRT MS/GM 374/2008, Art. 3º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - Segmento Farmacêutico: (Origem: PRT MS/GM 374/2008, Art. 3º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
a) estimular a internalização da produção de farmoquímicos e medicamentos de maior impacto para o Sistema Único de Saúde; (Origem: PRT MS/GM 374/2008, Art. 3º, I, a) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
b) modernizar os Laboratórios Farmacêuticos Oficiais em termos tecnológicos e organizacionais e capacitá-los para estabelecer parcerias com o setor produtivo privado; (Origem: PRT MS/GM 374/2008, Art. 3º, I, b) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
c) estimular a produção de medicamentos para doenças negligenciadas e de suas matérias-primas, superando o hiato entre o esforço de produção e inovação dos países desenvolvidos e as necessidades nacionais; e (Origem: PRT MS/GM 374/2008, Art. 3º, I, c) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
d) apoiar a implementação da Política Nacional de Plantas Medicinais e Fitoterápicos. (Origem: PRT MS/GM 374/2008, Art. 3º, I, d) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - Segmento Biotecnológico (imunobiológicos, biofármacos, hemoderivados e reagentes para diagnóstico): (Origem: PRT MS/GM 374/2008, Art. 3º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
a) capacitar os produtores públicos do País para a produção da matéria-prima ativa com recursos às novas biotecnologias; (Origem: PRT MS/GM 374/2008, Art. 3º, II, a) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
b) modernizar os produtores públicos em termos tecnológicos e organizacionais e capacitá-los para estabelecer parcerias com o setor produtivo privado; (Origem: PRT MS/GM 374/2008, Art. 3º, II, b) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
c) estruturar o País para exportar produtos que atendam às demandas articuladas pela Organização Mundial da Saúde para as regiões menos desenvolvidas; (Origem: PRT MS/GM 374/2008, Art. 3º, II, c) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
d) implementar a Política de Desenvolvimento da Biotecnologia na área de Saúde Humana; (Origem: PRT MS/GM 374/2008, Art. 3º, II, d) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
e) priorizar a produção, no País, de reagentes para o diagnóstico de doenças transmissíveis utilizados pelo SUS com recursos às novas biotecnologias; (Origem: PRT MS/GM 374/2008, Art. 3º, II, e) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
f) consolidar a produção pública de reagentes biológicos para diagnóstico e estabelecer parcerias com o setor privado e instituições científicas para o desenvolvimento e a comercialização de novos produtos e insumos para diagnóstico; (Origem: PRT MS/GM 374/2008, Art. 3º, II, f) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
g) internalizar, no País, a produção de hemoderivados, atendendo aos preceitos constitucionais, associada com a capacitação tecnológica; (Origem: PRT MS/GM 374/2008, Art. 3º, II, g) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
h) favorecer a consolidação do produtor estatal nacional (Hemobras) como uma empresa pública eficiente, comprometida com resultados e tecnologicamente qualificada; e (Origem: PRT MS/GM 374/2008, Art. 3º, II, h) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
i) fomentar o desenvolvimento de hemoderivados produzidos por tecnologia recombinante e outras rotas tecnológicas. (Origem: PRT MS/GM 374/2008, Art. 3º, II, i) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 791. São diretrizes estabelecidas para o Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde: (Origem: PRT MS/GM 374/2008, Art. 4º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - fortalecer, ampliar e qualificar a participação dos produtores públicos no Complexo Industrial da Saúde, de modo a contribuir no processo de transformação da estrutura produtiva do País, tornando-a compatível com um novo padrão de consumo em saúde e com novos padrões tecnológicos; (Origem: PRT MS/GM 374/2008, Art. 4º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - fomentar as atividades de PD&I no âmbito dos produtores públicos, tornando-os competitivos e capacitados a enfrentar a concorrência global em bases permanentes num contexto de incessante mudança tecnológica; (Origem: PRT MS/GM 374/2008, Art. 4º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
III - promover melhorias na gestão dos produtores públicos, estimulando o planejamento estratégico e a adoção de estruturas organizacionais e modelos de gestão capazes de dotá-los de maior agilidade, flexibilidade e eficiência; (Origem: PRT MS/GM 374/2008, Art. 4º, III) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IV - promover a articulação entre os produtores públicos buscando atuação coordenada e cooperada em todas as áreas, mediante a estratégia de organização em rede; (Origem: PRT MS/GM 374/2008, Art. 4º, IV) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
V - promover a substituição de importações de produtos e insumos de uso em saúde, priorizando os que possuem maior densidade de conhecimento e de inovação e que sejam considerados estratégicos para o SUS; (Origem: PRT MS/GM 374/2008, Art. 4º, V) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VI - utilizar estrategicamente o poder de compra do Estado na área da saúde em articulação com políticas de fomento ao desenvolvimento industrial; (Origem: PRT MS/GM 374/2008, Art. 4º, VI) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VII - promover a articulação entre os produtores públicos e a indústria privada com vistas à realização de ações complementares e sinérgicas em benefício do mercado público de saúde; (Origem: PRT MS/GM 374/2008, Art. 4º, VII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VIII - propor, no âmbito do SUS, alterações na legislação de compras de forma a permitir o uso estratégico do poder de compra do Estado para produtos inovadores de alta essencialidade para a saúde; e (Origem: PRT MS/GM 374/2008, Art. 4º, VIII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IX - promover a articulação dos produtores públicos com a infra-estrutura científica e tecnológica no País para atender aos requerimentos da inovação, viabilizando o desenvolvimento de produtos e processos e a adequação da produção pública aos requerimentos de saúde e de competitividade. (Origem: PRT MS/GM 374/2008, Art. 4º, IX) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 792. O presente Programa será executado, no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, de forma integrada e coordenada com as ações de Assistência Farmacêutica. (Origem: PRT MS/GM 374/2008, Art. 5º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 793. O Programa Nacional de Fomento à Produção Pública e Inovação no Complexo Industrial da Saúde contará com um Comitê Gestor e uma Secretaria-Executiva, a serem instituídos no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde. (Origem: PRT MS/GM 374/2008, Art. 6º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
§ 1º Compete ao Comitê Gestor deliberar sobre a estrutura organizacional e o funcionamento do Programa, com vistas a permitir uma discussão permanente dos problemas e a reavaliação constante das prioridades, instrumentos e ações do Programa. O Comitê Gestor será presidido pelo Diretor do Departamento de Economia da Saúde, Investimentos e Desenvolvimento e será integrado por representantes do Departamento de Economia da Saúde, Investimentos e Desenvolvimento e do Departamento de Assistência Farmacêutica e Insumos Estratégicos, da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (DAF/SCTIE/MS). (Origem: PRT MS/GM 374/2008, Art. 6º, § 1º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
§ 2º A Secretaria-Executiva será operada pela Coordenação-Geral de Estudos e Projetos, do Departamento de Economia da Saúde, Investimentos e Desenvolvimento e terá a atribuição de prestar apoio técnico e administrativo para execução do Programa. (Origem: PRT MS/GM 374/2008, Art. 6º, § 2º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Seção II
Do Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde
(Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 794. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde, que passa a integrar um conjunto de políticas adotadas para estimular a eficiência produtiva no Complexo Industrial da Saúde, constituindo uma prioridade tanto do Sistema Único de Saúde quanto da Política Industrial, Tecnológica e de Comércio Exterior (PITCE). (Origem: PRT MS/GM 375/2008, Art. 1º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 795. O Programa ora instituído tem como objetivo fortalecer e modernizar o setor de equipamentos e materiais de uso em saúde visando à ampliação da capacidade inovadora das empresas e a mudança de seu patamar competitivo, contribuindo para a redução da defasagem tecnológica existente e o desenvolvimento econômico, científico e tecnológico do País. (Origem: PRT MS/GM 375/2008, Art. 2º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 796. São objetivos específicos estabelecidos para o Programa: (Origem: PRT MS/GM 375/2008, Art. 3º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - definir prioridades considerando as demandas tecnológicas do SUS, os mercados alvo do setor produtivo e a competência técnica instalada no País; (Origem: PRT MS/GM 375/2008, Art. 3º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - estimular a interação entre empresas universidades e ICT's com o setor produtivo e incentivar o intercâmbio tecnológico entre os setores industriais; (Origem: PRT MS/GM 375/2008, Art. 3º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
III - articular para garantir estabilidade regulatória em parceria com a ANVISA e o INMETRO; (Origem: PRT MS/GM 375/2008, Art. 3º, III) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IV - estimular a certificação de produtos como instrumento promotor da inovação e desenvolvimento do setor; (Origem: PRT MS/GM 375/2008, Art. 3º, IV) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
V - estimular a ampliação dos investimentos públicos e privados em P,D&I.; (Origem: PRT MS/GM 375/2008, Art. 3º, V) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VI - estimular o setor privado a utilizar os instrumentos de apoio existentes para ampliar o desenvolvimento tecnológico no setor público e privado; (Origem: PRT MS/GM 375/2008, Art. 3º, VI) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VII - estimular a formação e capacitação de recursos humanos nas áreas biomédicas; (Origem: PRT MS/GM 375/2008, Art. 3º, VII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VIII - expandir e modernizar a infraestrutura de Tecnologia Indústria Básica (TIB) para o setor; e (Origem: PRT MS/GM 375/2008, Art. 3º, VIII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IX - propor a adoção de políticas de compra governamentais baseadas na qualidade dos insumos e na transferência de tecnologia. (Origem: PRT MS/GM 375/2008, Art. 3º, IX) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 797. São diretrizes estabelecidas para o Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde: (Origem: PRT MS/GM 375/2008, Art. 4º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - promover a articulação da cadeia produtiva com a infra-estrutura científica e tecnológica no País para atender aos requerimentos da inovação, viabilizando o desenvolvimento de produtos e processos e a adequação do setor produtivo em consonância com os programas do Ministério da Saúde, em especial os da Secretaria de Atenção a Saúde - SAS; (Origem: PRT MS/GM 375/2008, Art. 4º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - participar da formulação, implementação e avaliação de políticas, diretrizes e metas para as áreas e temas estratégicos necessários ao desenvolvimento do Complexo Industrial da Saúde no âmbito do SUS; (Origem: PRT MS/GM 375/2008, Art. 4º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
III - estabelecer métodos e mecanismos para a análise da viabilidade econômico-sanitária de empreendimentos em saúde; (Origem: PRT MS/GM 375/2008, Art. 4º, III) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IV - formular, avaliar, elaborar normas e participar na execução da política nacional e na produção de insumos estratégicos e equipamentos para a saúde, em articulação com os demais órgãos governamentais; (Origem: PRT MS/GM 375/2008, Art. 4º, IV) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
V - consolidar programas e ações, no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos, que permitam a definição de uma estratégia nacional de fomento, desenvolvimento, transferência de tecnologia e inovação para os produtos estratégicos na área da saúde; (Origem: PRT MS/GM 375/2008, Art. 4º, V) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VI - coordenar a organização e o desenvolvimento de programas, projetos e ações que visem induzir o desenvolvimento, a difusão e a incorporação de novas tecnologias no Sistema Único de Saúde; (Origem: PRT MS/GM 375/2008, Art. 4º, VI) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VII - articular a substituição de importações de produtos e insumos de uso em saúde, priorizando os que possuem maior densidade de conhecimento e de inovação e que sejam considerados estratégicos para o SUS; (Origem: PRT MS/GM 375/2008, Art. 4º, VII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VIII - formular, propor diretrizes e coordenar o desenvolvimento de ações intersetoriais e regulatórias voltadas à produção de equipamentos e materiais para a saúde de interesse nacional; e (Origem: PRT MS/GM 375/2008, Art. 4º, VIII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IX - propor, no âmbito do SUS, alterações na legislação de compras de forma a permitir o uso estratégico do poder de compra do Estado para produtos inovadores de alta essencialidade para a saúde. (Origem: PRT MS/GM 375/2008, Art. 4º, IX) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 798. O presente Programa será executado no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde, de forma integrada e coordenada com as ações da Secretaria de Atenção a Saúde (SAS) e outras instâncias do Ministério da Saúde envolvidas com o tema. (Origem: PRT MS/GM 375/2008, Art. 5º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 799. O Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde contará com um Comitê Gestor e uma Secretaria-Executiva, a serem instituídos no âmbito da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde. (Origem: PRT MS/GM 375/2008, Art. 6º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
§ 1º Compete ao Comitê Gestor deliberar sobre a estrutura organizacional e o funcionamento do Programa, com vistas a permitir uma discussão permanente dos problemas e a reavaliação constante das prioridades, instrumentos e ações do Programa. O Comitê Gestor será presidido pelo Diretor do Departamento de Economia da Saúde e será integrado por representantes da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE) e da Secretaria de Atenção a Saúde (SAS). (Origem: PRT MS/GM 375/2008, Art. 6º, § 1º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
§ 2º A Secretaria-Executiva será operada pela Coordenação-Geral de Economia da Saúde do Departamento de Economia da Saúde e terá a atribuição de prestar apoio técnico e administrativo para execução do Programa. (Origem: PRT MS/GM 375/2008, Art. 6º, § 2º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 800. Ficam estabelecidas, na forma do Anexo XCIV , as estratégias de ação do Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde. (Origem: PRT MS/GM 375/2008, Art. 7º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Seção III
Do Programa para o Desenvolvimento do Complexo Industrial da Saúde (PROCIS)
Subseção I
Disposições Gerais
(Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 801. Fica instituído o Programa para o Desenvolvimento do Complexo Industrial da Saúde (PROCIS), com o objetivo de fortalecer os produtores públicos e a infraestrutura de produção e inovação em saúde do setor público. (Origem: PRT MS/GM 506/2012, Art. 1º)
Parágrafo Único. Para efeitos desta Seção são considerados produtores públicos os órgãos ou entidades que integrem a administração pública e sejam responsáveis pela produção de fármacos, biofármacos, medicamentos, imunobiológicos, produtos médicos, equipamentos e materiais de uso em saúde e "kits" para diagnóstico de uso "in vitro", primordialmente destinados aos programas estratégicos de saúde pública. (Origem: PRT MS/GM 506/2012, Art. 1º, Parágrafo Único)
Art. 801. Fica instituído o Programa para o Desenvolvimento do Complexo Industrial da Saúde (PROCIS), que tem como objetivo geral apoiar e fomentar o desenvolvimento tecnológico, a transferência de tecnologia e a inovação e produção nacionais, visando ampliar o acesso a tecnologias no âmbito do Sistema Único de Saúde (SUS) e promover a eficiência produtiva do Complexo Industrial da Saúde (CIS). (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Parágrafo único. Para efeitos desta Subseção, são consideradas componentes do CIS as instituições públicas e privadas sem fins lucrativos de fármacos, biofármacos, medicamentos, imunobiológicos, produtos médicos, equipamentos, produtos para saúde e testes diagnósticos. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 801-A. São diretrizes do PROCIS: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - estimular a articulação da geração de conhecimento científico e tecnológico com as oportunidades estratégicas de mercado referentes a tecnologias inovadoras e sustentáveis para o SUS; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - atender às políticas estratégicas e às ações prioritárias do Ministério da Saúde em consonância com os princípios do SUS, quais sejam, integralidade, universalidade e equidade da atenção à saúde; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
III - manter o aproveitamento das complementariedades entre os laboratórios e respeitar as vocações e o perfil produtivo. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 802. O PROCIS tem os seguintes objetivos: (Origem: PRT MS/GM 506/2012, Art. 2º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - apoiar a modernização e estruturação produtiva e gerencial; (Origem: PRT MS/GM 506/2012, Art. 2º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - apoiar a qualificação da produção e manter vigente o Certificado de Boas Práticas de Fabricação (CBPF) emitido pela Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 506/2012, Art. 2º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
III - fortalecer as parcerias para o desenvolvimento produtivo visando desenvolver e absorver produtos estratégicos para o Sistema Único de Saúde; (Origem: PRT MS/GM 506/2012, Art. 2º, III) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IV - apoiar a qualificação da gestão com vistas a promover maior eficiência e efetividade; (Origem: PRT MS/GM 506/2012, Art. 2º, IV) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
V - apoiar o desenvolvimento tecnológico e a transferência de tecnologias, estratégicos para o Sistema Único de Saúde (SUS); (Origem: PRT MS/GM 506/2012, Art. 2º, V) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VI - manter o aproveitamento das complementariedades entre os laboratórios e respeitar as vocações e o perfil produtivo; e (Origem: PRT MS/GM 506/2012, Art. 2º, VI) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VII - apoiar a infraestrutura pública de tecnologia e inovação para suporte à produção no país de produtos estratégicos para o SUS. (Origem: PRT MS/GM 506/2012, Art. 2º, VII) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 803. O PROCIS será operacionalizado mediante a assinatura de instrumentos específicos a serem firmados entre o Ministério da Saúde e os produtores públicos. (Origem: PRT MS/GM 506/2012, Art. 3º)
§ 1º Os instrumentos de que trata o caput observarão as disposições do Decreto nº 6.170, de 25 de julho de 2007, e da Portaria Interministerial nº 127/MP/MF/MCT, de 29 de maio de 2008, e serão acompanhados de Plano de Trabalho que contenha os seguintes detalhamentos mínimos: (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º)
I - objetivos e meios de execução do projeto; (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º, I)
II - contrapartidas econômica, financeira e/ou de recursos humanos; e (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º, II)
III - orçamento envolvido e respectivo cronograma de desembolso e de execução. (Origem: PRT MS/GM 506/2012, Art. 3º, § 1º, III)
§ 2º Caberá à Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS) a aprovação dos Planos de Trabalho encaminhados pelos produtores públicos para adesão ao PROCIS. (Origem: PRT MS/GM 506/2012, Art. 3º, § 2º)
Art. 803. São estratégias de atuação do PROCIS: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - consolidar projetos e ações realizados pelas instituições públicas e privadas sem fins lucrativos para o desenvolvimento, transferência de tecnologia e inovação de produtos estratégicos para o SUS; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - fortalecer a internalização da produção de insumos de uso em saúde, priorizando os que têm maior densidade de conhecimento e de inovação; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
III - apoiar a modernização da infraestrutura produtiva das instituições públicas e privadas sem fins lucrativos no âmbito do CIS; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
IV - apoiar e fomentar políticas, programas e projetos do Ministério da Saúde, com vistas ao desenvolvimento, à transferência de tecnologia e à inovação; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
V - estimular a produção de medicamentos para doenças negligenciadas e de suas matérias-primas, de modo a superar o hiato entre o esforço de produção e inovação dos países desenvolvidos e as necessidades nacionais. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 804. O produtor público elegível ao PROCIS deverá se comprometer a implementar ações para atender às seguintes exigências mínimas: (Origem: PRT MS/GM 506/2012, Art. 4º)
I - implantação de sistema eficiente de gestão que assegure o efetivo cumprimento dos objetivos estabelecidos no PROCIS; (Origem: PRT MS/GM 506/2012, Art. 4º, I)
II - manutenção de estrutura de gestão compatível com o projeto a ser desenvolvido, que contemple as seguintes áreas: (Origem: PRT MS/GM 506/2012, Art. 4º, II)
a) planejamento; (Origem: PRT MS/GM 506/2012, Art. 4º, II, a)
b) regulatória; (Origem: PRT MS/GM 506/2012, Art. 4º, II, b)
c) controle e garantia de qualidade; (Origem: PRT MS/GM 506/2012, Art. 4º, II, c)
d) produtiva; (Origem: PRT MS/GM 506/2012, Art. 4º, II, d)
e) suprimentos; e (Origem: PRT MS/GM 506/2012, Art. 4º, II, e)
f) jurídica; (Origem: PRT MS/GM 506/2012, Art. 4º, II, f)
III - designação de responsável técnico em cada uma das áreas descritas no inciso II, para interlocução regular com o Comitê Gestor do PROCIS; (Origem: PRT MS/GM 506/2012, Art. 4º, III)
IV - observância estrita dos seguintes itens: (Origem: PRT MS/GM 506/2012, Art. 4º, IV)
a) cronograma físico e financeiro dos termos de cooperação ou convênios celebrados no âmbito do PROCIS; (Origem: PRT MS/GM 506/2012, Art. 4º, IV, a)
b) cronograma de entrega dos produtos fixado nos instrumentos de compras firmados com o Ministério da Saúde; (Origem: PRT MS/GM 506/2012, Art. 4º, IV, b)
c) cronograma de atendimento aos requisitos regulatórios da ANVISA; e (Origem: PRT MS/GM 506/2012, Art. 4º, IV, c)
d) atendimento às normativas da Câmara de Regulação do Mercado de Medicamentos (CMED). (Origem: PRT MS/GM 506/2012, Art. 4º, IV, d)
§ 1º O cumprimento das exigências listadas neste artigo é requisito condicionante para efetivação dos repasses financeiros afetos ao PROCIS. (Origem: PRT MS/GM 506/2012, Art. 4º, § 1º)
§ 2º Os produtores públicos elegíveis ou beneficiados pelo PROCIS deverão garantir livre acesso às suas instalações ao Ministério da Saúde. (Origem: PRT MS/GM 506/2012, Art. 4º, § 2º)
Art. 804. O PROCIS será executado mediante parcerias com instituições públicas e privadas sem fins lucrativos, por meio do repasse de recursos federais para o desenvolvimento de projetos vinculados ao objetivo, às diretrizes e às estratégias do Programa que tenham: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - relevância para a missão institucional do SUS; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - aderência aos planos e às políticas do Governo Federal. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Parágrafo único. Caberá à Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde (SCTIE/MS) a gestão do PROCIS no âmbito do Ministério da Saúde, devendo, entre outras atribuições: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - providenciar o recebimento e a seleção de propostas; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - encaminhar os instrumentos pertinentes para assinatura pela autoridade competente, conforme o caso, visando à operacionalização do Programa; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
III - monitorar e fiscalizar a execução do Programa. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 804-A. A participação no PROCIS se dará mediante seleção por editais de chamamento público, bem como por apoio direto a projetos de interesse do Ministério da Saúde, quando admitido pela legislação aplicável, como instrumento destinado às ações específicas de execução de políticas públicas. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Parágrafo único. O chamamento público para celebração dos instrumentos de repasse deverá ser precedido da publicação, em sítio eletrônico oficial, por prazo não inferior a 15 (quinze) dias, de extrato do projeto de pesquisa, desenvolvimento e inovação, que deverá conter, no mínimo, o valor do apoio financeiro, o prazo e a forma de apresentação da proposta pelos interessados, bem como o objeto, os objetivos, os critérios de elegibilidade e o perfil das instituições. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 804-B. As instituições públicas e privadas sem fins lucrativos deverão apresentar propostas que atendam, entre outros requisitos constantes em edital, ao seguinte: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - vinculação às diretrizes e estratégias adotadas pelo PROCIS; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - demonstração da relevância do projeto para a missão institucional do SUS e da sua aderência aos planos e às políticas do Governo Federal; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
III - projeto claro e coeso, contendo: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
a) objetivos da proposta e metas a serem atingidas; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
b) descrição das atividades a serem executadas com vistas a alcançar os resultados pretendidos; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
c) parâmetros a serem utilizados para a aferição do cumprimento das metas; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
d) etapas e cronograma de execução; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
e) metodologia de gestão de projetos a ser utilizada, contemplando a metodologia de gestão de riscos. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Parágrafo único. Além do disposto no caput, as instituições deverão comprovar capacidade técnica e científica para execução da proposta apresentada. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 804-C. A seleção das propostas será realizada pela SCTIE/MS, que procederá à sua avaliação em observância aos princípios e regras constitucionais que regem a atividade da administração pública, considerando, entre outros critérios qualitativos de avaliação dos interessados, a competência técnica, a capacidade de gestão e as experiências anteriores. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 1º A decisão de que trata o caput deverá ser fundamentada, no mínimo, quanto à: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - especificidade do tema; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - necessidade de desenvolvimento de soluções tecnológicas de programas prioritários e estratégicos; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
III - criticidade; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
IV - singularidade da instituição ou existência de competência restrita; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
V - vinculação às prioridades de programas de governo e programas estratégicos da área da saúde ou urgência no seu desenvolvimento. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 2º Após a avaliação, o Secretário de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde publicará, no sítio eletrônico do Ministério da Saúde, portaria com a relação das propostas selecionadas. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 3º As instituições selecionadas deverão adotar os procedimentos cabíveis para a celebração dos instrumentos pertinentes à execução do programa, nos termos da Subseção III deste Capítulo. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Subseção II
Da Celebração dos Instrumentos para Operacionalização do PROCIS
(Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 805. Caberá ao Ministério da Saúde a assinatura de instrumentos de cooperação com outros Ministérios e entes federados, com vistas à integração das ações de todas as esferas de governo direcionadas à temática do PROCIS. (Origem: PRT MS/GM 506/2012, Art. 5º) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 805. A operacionalização do PROCIS ocorrerá por meio da celebração de instrumentos com as instituições públicas ou privadas sem fins lucrativos contempladas, para o repasse de recursos. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 1º A natureza do projeto e da instituição definirá o tipo de instrumento a ser celebrado, tais como Termo de Execução Descentralizada (TED), Convênio, Contrato de Repasse, entre outros instrumentos possíveis de serem firmados entre o Ministério da Saúde e as instituições públicas ou privadas sem fins lucrativos. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 2º Os instrumentos a serem celebrados observarão a legislação aplicável e serão acompanhados de plano de trabalho, que seguirá o modelo de projeto a ser disponibilizado no sítio eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 805-A. Os instrumentos a serem celebrados no âmbito do PROCIS, sem prejuízo dos requisitos decorrentes de seu enquadramento jurídico, na forma do art. 805, conterão previsão acerca do compromisso das instituições públicas e privadas sem fins lucrativos de implementar ações para atender às seguintes exigências mínimas: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - implantação de sistema eficiente de gestão que assegure o efetivo cumprimento dos objetivos estabelecidos no projeto; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - manutenção de estrutura de gestão compatível com o projeto a ser desenvolvido e com a metodologia de gestão de projeto implantada, contemplando as seguintes áreas: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
a) planejamento; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
b) regulatória; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
c) suprimentos; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
d) jurídica; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
III - designação de responsável técnico em cada uma das áreas descritas no inciso II para interlocução regular com os responsáveis técnicos e gestores do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
IV - observância estrita dos seguintes itens: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
a) elaboração de cronograma físico e financeiro dos instrumentos celebrados no âmbito do PROCIS, contendo, no mínimo, metas, etapas ou fases, indicadores de resultados, ferramentas de medição claramente estabelecidas e plano de mitigação de riscos; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
b) elaboração de relatórios situacionais quadrimestrais; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
c) gestão de atendimento aos requisitos regulatórios da ANVISA; (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
V - observância à legislação vigente que regula a propriedade intelectual no país, quando da obtenção de resultados passíveis de proteção gerados no âmbito do PROCIS; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
VI - comunicação à SCTIE/MS de resultados gerados no âmbito do PROCIS passíveis de proteção, quanto à existência de pedido de proteção de ativos e eventual infração cometida por terceiros. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 1º O cumprimento das exigências listadas neste artigo será requisito condicionante para efetivação dos repasses financeiros afetos ao PROCIS. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
§ 2º As instituições públicas e privadas sem fins lucrativos participantes do PROCIS deverão garantir livre acesso às suas instalações ao Ministério da Saúde, sempre que solicitado. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 806. Fica instituído o Comitê Gestor do PROCIS, composto pelos seguintes órgãos e entidade: (Origem: PRT MS/GM 506/2012, Art. 6º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS), que o coordenará; (Origem: PRT MS/GM 506/2012, Art. 6º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - Secretaria de Atenção à Saúde (SAS/MS); (Origem: PRT MS/GM 506/2012, Art. 6º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
III - Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 506/2012, Art. 6º, III) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
IV - Secretaria-Executiva (SE/MS); (Origem: PRT MS/GM 506/2012, Art. 6º, IV) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
V - Fundo Nacional de Saúde (FNS/SE/MS); e (Origem: PRT MS/GM 506/2012, Art. 6º, V) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
VI - Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 506/2012, Art. 6º, VI) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
§ 1º Cada órgão ou entidade indicará um membro titular e um suplente à Coordenação do Comitê. (Origem: PRT MS/GM 506/2012, Art. 6º, § 1º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
§ 2º A coordenação do Comitê Gestor será exercida pelo Secretário da SCTIE/MS, que será substituído, em suas ausências, pelo Diretor do Departamento do Complexo Industrial e Inovação em Saúde (DECIIS/SCTIE/MS). (Origem: PRT MS/GM 506/2012, Art. 6º, § 2º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 807. Compete ao Comitê Gestor: (Origem: PRT MS/GM 506/2012, Art. 7º) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
I - gerenciar e monitorar a implantação das ações do PROCIS; (Origem: PRT MS/GM 506/2012, Art. 7º, I) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
II - assegurar o cumprimento dos Planos de Trabalho aprovados; e (Origem: PRT MS/GM 506/2012, Art. 7º, II) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
III - avaliar o cumprimento das exigências contidas no art. 804. (Origem: PRT MS/GM 506/2012, Art. 7º, III) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Parágrafo Único. Para fins do disposto no "caput", caberá ao DECIIS/SCTIE/MS verificar o adequado cumprimento de cada Plano de Trabalho aprovado, com a elaboração de relatórios trimestrais, a partir da realização de reuniões e visitas técnicas. (Origem: PRT MS/GM 506/2012, Art. 7º, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.915 de 11.07.2022)
Subseção III
Disposições Finais
(Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022)
Art. 808. Caberá à SE/MS, à SAS/MS, à SVS/MS e à ANVISA oferecer à SCTIE/MS os subsídios necessários ao desenvolvimento e ao acompanhamento do PROCIS, observadas as respectivas competências regimentais. (Origem: PRT MS/GM 506/2012, Art. 8º)
Art. 808. Caberá às áreas finalísticas do Ministério da Saúde, quando necessário, oferecer à SCTIE/MS os subsídios para o desenvolvimento e o acompanhamento do PROCIS, observadas as respectivas competências regimentais. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 809. Caberá ao FNS/SE/MS o apoio institucional e técnico necessário para o efetivo cumprimento dos instrumentos específicos firmados com os produtores públicos beneficiados pelo PROCIS. (Origem: PRT MS/GM 506/2012, Art. 9º)
Parágrafo Único. O FNS/SE/MS, com o apoio da SE/MS e da SCTIE/MS, publicará orientação, na forma de Manual Técnico, específica para os Termos de Cooperação ou Convênios firmados no âmbito do PROCIS. (Origem: PRT MS/GM 506/2012, Art. 9º, Parágrafo Único)
Art. 809. Caberá ao Fundo Nacional de Saúde (FNS) o apoio institucional e técnico necessário ao efetivo cumprimento dos instrumentos a serem firmados com as instituições públicas ou privadas sem fins lucrativos beneficiadas pelo PROCIS. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Parágrafo único. O FNS, com o apoio da Secretaria Executiva (SE/MS) e da SCTIE/MS, publicará orientação para os instrumentos a serem firmados no âmbito do PROCIS. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 809-A. Os recursos financeiros para o financiamento dos projetos e das ações de que trata esta Portaria são oriundos do orçamento do Ministério da Saúde, onerando os seguintes Programas de Trabalho 2015 - Fortalecimento do Sistema Único de Saúde (SUS), nas seguintes ações: (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
I - 20K7 - apoio ao desenvolvimento e modernização de plataformas tecnológicas para fortalecimento do Complexo Industrial da Saúde; e (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
II - 8636 - fortalecimento da inovação tecnológica de insumos estratégicos para o SUS. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Parágrafo único. Poderão ser utilizadas outras fontes orçamentárias para o financiamento dos projetos e ações do PROCIS e o cumprimento de seu objetivo. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Art. 809-B. Os processos de monitoramento, avaliação e acompanhamento do PROCIS a serem realizados pela SCTIE/MS deverão atender às orientações previstas nos normativos vigentes. (Redação dada pela PRT GM/MS nº 2.915 de 11.07.2022) (Revogado pela PRT GM/MS n° 2.262 de 08.12.2023)
Seção III-A
Da Comissão Consultiva Permanente para o Complexo Econômico-Industrial da Saúde - CPCEIS
(Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Art. 809-C. Fica instituída a Comissão Consultiva Permanente para o Complexo Econômico-Industrial da Saúde - CPCEIS, no âmbito do Ministério da Saúde, com objetivo de colaborar na identificação de demandas prioritárias do Sistema Único de Saúde - SUS e subsidiar a atuação do representante do Ministério da Saúde no Grupo Executivo do Complexo Econômico-Industrial da Saúde - Geceis. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 1º A CPCEIS tem caráter permanente, consultivo e não deliberativo. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 2º Cada membro da CPCEIS apresentará as suas respectivas demandas à Comissão, que serão consolidadas e encaminhadas ao representante do Ministério da Saúde no Geceis para definição das prioridades tecnológicas e de produção nacional. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 3º Para fins do disposto no § 2º, o representante do Ministério da Saúde no Geceis definirá as demandas prioritárias que serão apresentadas a este Grupo Executivo. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Art. 809-D. A CPCEIS será composta por um representante de cada uma das Secretarias do Ministério da Saúde listadas a seguir: (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
I - Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde, que a coordenará; (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
II - Secretaria de Atenção Especializada à Saúde; (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
III - Secretaria de Atenção Primária à Saúde; (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
IV - Secretaria de Vigilância em Saúde e Ambiente; (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
V - Secretaria de Saúde Indígena; (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
VI - Secretaria de Gestão do Trabalho e da Educação na Saúde; e (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
VII - Secretaria de Informação e Saúde Digital. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 1º Cada membro titular da CPCEIS terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 2º Os membros da CPCEIS e respectivos suplentes serão indicados pelos titulares das Secretarias que representam e designados em ato do Secretário de Ciência, Tecnologia, Inovação e Complexo da Saúde. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 3º Os membros designados poderão, a qualquer tempo, propor a substituição dos seus respectivos representantes. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Art. 809-E. A secretaria-executiva da CPCEIS será exercida pela Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde, que coordenará as atividades da Comissão. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Parágrafo único. Cabe ao Departamento do Complexo Econômico-Industrial da Saúde da Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde prestar o apoio técnico-administrativo necessário às atividades da Comissão. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Art. 809-F. A CPCEIS se reunirá, em caráter ordinário, a cada três meses e, em caráter extraordinário, sempre que convocada pela sua coordenação. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 1º Os membros da Comissão que se encontrarem no Distrito Federal se reunirão presencialmente, sendo assegurada a possibilidade, se assim desejarem, de participação por meio de videoconferência, independentemente da forma de convocação, nos termos do disposto no Decreto nº 10.416, de 7 de julho de 2020. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 2º Os membros da CPCEIS que se encontrarem em outros entes federativos participarão das reuniões por meio de videoconferência. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
§ 3º O quórum de instalação das reuniões da CPCEIS é de cinco membros. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Art. 809-G. A participação na CPCEIS será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Art. 809-H. A secretaria-executiva da CPCEIS deverá elaborar relatório anual circunstanciado de suas atividades, destacando as demandas prioritárias do SUS, e o encaminhará à Secretaria Executiva e ao Gabinete do Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 1.178 de 28.08.2023)
Seção IV
Dos Produtos Estratégicos para o SUS
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 810. O Anexo XCV, Capítulo II, dispõe sobre os critérios para a definição da lista de produtos estratégicos para o SUS, em consonância com o Decreto 7.807/2012. (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Seção V
Das Parcerias para o Desenvolvimento Produtivo (PDP)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 811. O Anexo XCV, Capítulos I e III a VII, estabelece as Parcerias para o Desenvolvimento Produtivo (PDP) e disciplina os respectivos processos de submissão, instrução, decisão, transferência e absorção de tecnologia, aquisição de produtos estratégicos para o SUS no âmbito das PDP e o respectivo monitoramento e avaliação. (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Subseção I
Do Comitê Deliberativo para Análise e Avaliação de Parcerias para o Desenvolvimento Produtivo (PDP)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 812. Fica constituído o Comitê Deliberativo para análise e avaliação de Parcerias para o Desenvolvimento Produtivo (PDP). (Origem: PRT MS/GM 918/2015, Art. 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 813. O Comitê Deliberativo será composto pelos seguintes membros: (Origem: PRT MS/GM 918/2015, Art. 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - Ministério da Saúde (MS); (Origem: PRT MS/GM 918/2015, Art. 2º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - Ministério da Ciência, Tecnologia, Inovações e Comunicações; (Origem: PRT MS/GM 918/2015, Art. 2º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - Ministério da Indústria, Comércio Exterior e Serviços; (Origem: PRT MS/GM 918/2015, Art. 2º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 918/2015, Art. 2º, IV) (dispositivo acrescentado pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º O membro suplente substituirá o membro titular em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 918/2015, Art. 2º, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º As funções dos membros do Comitê Deliberativo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 918/2015, Art. 2º, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 814. A coordenação do Comitê Deliberativo será exercida pelo membro titular do Ministério da Saúde e quando do seu impedimento, será assumida pelo seu membro suplente. (Origem: PRT MS/GM 918/2015, Art. 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 815. Os objetos de trabalho do Comitê Deliberativo (CD) são: (Origem: PRT MS/GM 918/2015, Art. 4º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - Propostas de projeto de PDP; (Origem: PRT MS/GM 918/2015, Art. 4º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - Projetos de PDP; e (Origem: PRT MS/GM 918/2015, Art. 4º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - PDP. (Origem: PRT MS/GM 918/2015, Art. 4º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 816. Compete ao Comitê Deliberativo (CD): (Origem: PRT MS/GM 918/2015, Art. 5º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - analisar e validar os relatórios das Comissões Técnicas de Avaliação; (Origem: PRT MS/GM 918/2015, Art. 5º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - aprovar ou reprovar as propostas de projeto de PDP, mediante parecer conclusivo; (Origem: PRT MS/GM 918/2015, Art. 5º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - definir os prazos, critérios e condicionantes específicos para execução das propostas de projetos de PDP, dos projetos de PDP e das PDP; (Origem: PRT MS/GM 918/2015, Art. 5º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - analisar e validar o grau de integração produtiva em território nacional do produto objeto de PDP para aplicação das regras previstas no Anexo XCV ; (Origem: PRT MS/GM 918/2015, Art. 5º, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - analisar e validar os prazos do desenvolvimento e absorção tecnológica, incluindo-se as etapas regulatórias, compatíveis com o cronograma proposto; (Origem: PRT MS/GM 918/2015, Art. 5º, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - estabelecer as condições de economicidade e vantajosidade da PDP; (Origem: PRT MS/GM 918/2015, Art. 5º, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - indicar, motivadamente, a necessidade de submissão das propostas de projeto de PDP à nova avaliação por Comissão Técnica de Avaliação "ad hoc", cujos membros serão designados mediante ato do Secretário de Ciência, Tecnologia e Insumos Estratégicos, com definição de seu objeto e prazo de duração; (Origem: PRT MS/GM 918/2015, Art. 5º, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - avaliar as propostas de alterações das tecnologias do projeto de PDP ou dos parceiros envolvidos no projeto de PDP; (Origem: PRT MS/GM 918/2015, Art. 5º, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - avaliar as propostas de alteração do cronograma da PDP apresentadas pela instituição publica, quando iniciado o processo de aquisição, nos casos da proposta de alteração impactar na ampliação do período de aquisição do produto objeto da PDP conforme previsto no cronograma vigente; e (Origem: PRT MS/GM 918/2015, Art. 5º, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - outras competências que lhe forem atribuídas. (Origem: PRT MS/GM 918/2015, Art. 5º, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 817. A coordenação do Comitê Deliberativo poderá convidar representantes de outros órgãos e entidades, públicas ou privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária. (Origem: PRT MS/GM 918/2015, Art. 6º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 818. Todos os participantes e convidados deverão assinar termo de confidencialidade e declaração de inexistência de conflito de interesses para participação nas atividades do Comitê Deliberativo. (Origem: PRT MS/GM 918/2015, Art. 7º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 819. O Comitê Deliberativo elaborará seu regimento interno e o das Comissões Técnicas de Avaliação, a serem aprovados por ato do Ministro do Estado da Saúde. (Origem: PRT MS/GM 918/2015, Art. 8º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Seção V-A
Do Fórum de Articulação com a Sociedade Civil - FAS
(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 819-A. Fica instituído o Fórum de Articulação com a Sociedade Civil - FAS, com objetivo de assessorar o Grupo Executivo do Complexo Econômico-Industrial da Saúde - Geceis - nas propostas de iniciativas e de ações voltadas ao fortalecimento das políticas públicas no âmbito do Complexo Econômico-Industrial da Saúde - Ceis - e de estabelecer a atuação articulada e colaborativa de que trata o § 3º do art. 5º do Decreto nº 11.464, de 3 de abril de 2023, nos termos do Anexo CVI. (Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Seção V-B
Da Implementação da Estratégia Nacional de Desenvolvimento do Complexo Econômico-Industrial da Saúde
(Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 819-B. As regras atinentes à implementação da Estratégia Nacional de Desenvolvimento do Complexo Econômico-Industrial da Saúde, no âmbito do Ministério da Saúde, são as que constam no Anexo CVII desta Portaria de Consolidação. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Subseção I
Do Programa de Desenvolvimento e Inovação Local (PDIL)
(Redação dada pela PRT GM/MS n° 4.473
de 20.06.2024)
Art. 819-C. As regras referentes ao Programa de Desenvolvimento e Inovação Local - PDIL constam no Anexo CIX desta Portaria de Consolidação. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Subseção II
Do Programa de Parcerias para o Desenvolvimento Produtivo (PDP)
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 819-D. As regras referentes ao Programa de Parcerias para o Desenvolvimento Produtivo (PDP) são as que constam no Anexo CX desta Portaria de Consolidação. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Subseção III
Diretrizes para apoiar programas, instrumentos e ações de qualificação no ambiente regulatório para o estímulo à produção e à inovação no âmbito do Complexo Econômico-Industrial da Saúde - Ceis
(Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
Art. 819-E Ficam estabelecidas diretrizes para apoiar programas, instrumentos e ações de qualificação no ambiente regulatório sanitário, com a finalidade de estimular a produção e a inovação no âmbito do Complexo Econômico-Industrial da Saúde - Ceis: (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
I - fortalecimento do Ceis; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
II - estímulo à inovação, ao desenvolvimento tecnológico e à produção local; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
III - ampliação da eficiência e da celeridade na análise dos processos regulatórios; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
IV - articulação de políticas públicas prioritárias do SUS e do Ceis com a regulação sanitária; e (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
V - promoção de ações para melhorar o ambiente regulatório, a fim de estimular a inovação e a pesquisa clínica. (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
Art. 819-F São objetivos para o fortalecimento de ambiente regulatório no âmbito do Ceis: (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
I - promover ações de fortalecimento institucional para o suporte do Ceis; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
II - redução da vulnerabilidade produtiva e tecnológica do SUS; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
III - apoiar o aprimoramento do aparato regulatório sanitário do país para o enfrentamento dos desafios referentes ao desenvolvimento tecnológico, de inovação, de produção local e de bens e serviços; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
IV - contribuir com o desenvolvimento e a implementação de mecanismos que garantam a integração do Ministério da Saúde com a Anvisa; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
V- alinhar as atividades regulatórias às prioridades e aos desafios produtivos e tecnológicos do Ceis e do SUS; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
VI - desenvolver e implementar sistemas e plataformas digitais integradas para auxiliar no processo regulatório sanitário, contribuindo para a transformação digital alinhada com a Política Nacional de Saúde Digital e Inovação no SUS; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
VII - proporcionar iniciativas para estimular a adequação da força de trabalho, visando apoiar o desenvolvimento do Ceis, incluindo a qualificação e a capacitação de profissionais em processos regulatórios; (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
VIII - colaborar com iniciativas para a modernização do marco legal do Sistema Nacional de Vigilância Sanitária e suas atividades; e (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
IX - cooperar com o acesso universal à saúde. (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
Art. 819-G As ações para o fortalecimento do ambiente regulatório serão operacionalizadas por meio de instrumentos específicos. (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
Parágrafo único. Cabe a Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde coordenar as ações de operacionalização, de que trata o caput, com a colaboração do Grupo Executivo do Complexo Econômico-Industrial da Saúde - Geceis. (Redação dada pela PRT GM/MS n° 5.271 de 22.08.2024)
Seção VI
Do Programa Nacional de Competitividade em Vacinas (INOVACINA)
Art. 820. Fica instituído o Programa Nacional de Competitividade em Vacinas (INOVACINA), que integra o conjunto de políticas adotada para estimular a eficiência produtiva considerada como vetor dinâmico da atividade industrial pelas "Diretrizes de Política Industrial, Tecnológica e de Comércio Exterior". (Origem: PRT MS/GM 972/2006, Art. 1º)
Art. 821. O Programa INOVACINA tem por finalidade criar condições para alcançar a auto-suficiência nacional na produção das vacinas incluídas no Programa Nacional de Imunização (PNI), por meio das seguintes ações: (Origem: PRT MS/GM 972/2006, Art. 2º)
I - investir na infra-estrutura e no custeio da pesquisa e desenvolvimento em vacinas, incluindo bolsas de pesquisa; (Origem: PRT MS/GM 972/2006, Art. 2º, I)
II - investir no estabelecimento de condições de Boas Práticas de Produção (BPP) nos laboratórios públicos e privados sem fins lucrativos, produtores de vacinas no País; (Origem: PRT MS/GM 972/2006, Art. 2º, II)
III - aperfeiçoar o sistema de regulação de vacinas, com especial atenção aos mecanismos desenvolvidos pela Agência Nacional de Vigilância Sanitária (ANVISA); e (Origem: PRT MS/GM 972/2006, Art. 2º, III)
IV - investir no estabelecimento de uma Rede Pública de Ensaios pré-clínicos e clínicos de vacinas, destinada a avaliar a segurança, a eficácia e efetividade das vacinas produzidas. (Origem: PRT MS/GM 972/2006, Art. 2º, IV)
Art. 822. O Programa INOVACINA deverá seguir as diretrizes de uma Câmara Técnica de Imunobiológicos que orientará, em última instância, sua estrutura organizacional, composição e funcionamento. (Origem: PRT MS/GM 972/2006, Art. 3º)
Art. 823. Fica aprovada a Estrutura Organizacional do Programa INOVACINA, na forma Anexo XCVI . (Origem: PRT MS/GM 972/2006, Art. 4º)
Seção VII
Do Comitê Gestor das Vacinas Pentavalente e Heptavalente
Art. 824. Fica instituído, no âmbito do Ministério da Saúde, o Comitê Gestor das vacinas pentavalente e heptavalente, com a missão de promover, coordenar e acompanhar a execução das atividades de desenvolvimento tecnológico e de produção das vacinas pentavalente e heptavalente junto aos laboratórios públicos produtores de imunobiológicos e seus parceiros, para atender prioritariamente ao Programa Nacional de Imunizações (PNI). (Origem: PRT MS/GM 2691/2011, Art. 1º)
Art. 825. O Comitê Gestor atuará sob a coordenação da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS) e será composto por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2691/2011, Art. 2º)
I - Departamento do Complexo Industrial e Inovação em Saúde da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (DECIIS/SCTIE/MS); (Origem: PRT MS/GM 2691/2011, Art. 2º, I)
II - Departamento de Vigilância das Doenças Transmissíveis da Secretaria de Vigilância em Saúde do Ministério da Saúde (DEVIT/SVS/MS); (Origem: PRT MS/GM 2691/2011, Art. 2º, II)
III - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2691/2011, Art. 2º, III)
IV - Instituto de Tecnologia em Imunobiológicos (Bio-Manguinhos); (Origem: PRT MS/GM 2691/2011, Art. 2º, IV)
V - Instituto Butantan; e (Origem: PRT MS/GM 2691/2011, Art. 2º, V)
VI - Fundação Ezequiel Dias (Funed). (Origem: PRT MS/GM 2691/2011, Art. 2º, VI)
§ 1º Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos e entidades à coordenação do Comitê Gestor. (Origem: PRT MS/GM 2691/2011, Art. 2º, § 1º)
§ 2º As funções dos membros do Comitê Gestor não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2691/2011, Art. 2º, § 2º)
Art. 826. Compete ao Comitê Gestor: (Origem: PRT MS/GM 2691/2011, Art. 3º)
I - analisar e validar a adoção das rotas tecnológicas e das parcerias propostas para o desenvolvimento das vacinas pentavalente e heptavalente; (Origem: PRT MS/GM 2691/2011, Art. 3º, I)
II - pactuar compromissos mútuos e o plano de ação, contendo metas, responsabilidades, cronograma de atividades e prazos para o desenvolvimento, a produção e a implementação das vacinas pentavalente e heptavalente no País; e (Origem: PRT MS/GM 2691/2011, Art. 3º, II)
III - realizar a gestão e acompanhamento da execução do plano de ação pactuado. (Origem: PRT MS/GM 2691/2011, Art. 3º, III)
Art. 827. Compete à Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS): (Origem: PRT MS/GM 2691/2011, Art. 4º)
I - coordenar as ações de fomento ao fortalecimento da infraestrutura e à qualificação da produção dos laboratórios públicos produtres de imunobiológicos; (Origem: PRT MS/GM 2691/2011, Art. 4º, I)
II - estimular parcerias público-privadas de transferência de tecnologia visando desenvolvimento tecnológico e inovação na produção de insumos estratégicos na área da saúde; (Origem: PRT MS/GM 2691/2011, Art. 4º, II)
III - orientar os requisitos mínimos que regerá a transferência de tecnologia entre os laboratórios públicos produtores de imunobiológicos e seus parceiros privados; e (Origem: PRT MS/GM 2691/2011, Art. 4º, III)
IV - coordenar o processo de avaliação e incorporação de tecnologias em saúde. (Origem: PRT MS/GM 2691/2011, Art. 4º, IV)
Art. 828. Compete à Secretaria de Vigilância em Saúde do Ministério da Saúde (SVS/MS): (Origem: PRT MS/GM 2691/2011, Art. 5º)
I - fornecer as especificações técnicas das rotas tecnológicas, as definições de parâmetros de programação e padrões de qualidade relativos às vacinas pentavalente e heptavalente destinadas ao PNI; e (Origem: PRT MS/GM 2691/2011, Art. 5º, I)
II - coordenar os processos relativos à aquisição e à distribuição das vacinas pentavalente e heptavalente em âmbito nacional. (Origem: PRT MS/GM 2691/2011, Art. 5º, II)
Art. 829. Compete à Agência Nacional de Vigilância Sanitária (ANVISA) acompanhar as atividades relativas ao desenvolvimento, produção, registro e pós-registro das vacinas pentavalente e heptavalente junto aos laboratórios públicos produtores de imunobiológicos por meio de Comitês Técnico-Regulatórios específicos, conforme disposto na Resolução RDC Nº 2, de 2 de fevereiro de 2011. (Origem: PRT MS/GM 2691/2011, Art. 6º)
Art. 830. Compete aos laboratórios públicos produtores de imunobiológicos celebrar contratos, convênios e/ou acordos de cooperação entre si ou com seus parceiros privados para o desenvolvimento tecnológico e a produção das vacinas pentavalente e heptavalente. (Origem: PRT MS/GM 2691/2011, Art. 7º)
Art. 831. O Comitê Gestor poderá convocar entidades, bem como especialistas, a compor o Comitê quando necessário ao pleno alcance dos objetivos propostos. (Origem: PRT MS/GM 2691/2011, Art. 8º)
Seção VIII
Da Câmara Técnica de Imunobiológicos
Art. 832. Fica instituída a Câmara Técnica de Imunobiológicos, para discussão permanente dos problemas e da reavaliação constante das prioridades e das políticas na área de vacinas com vistas à dinamização do crescimento e à competitividade do segmento e ao aumento da capacidade tecnológica e do sinergismo entre os produtores. (Origem: PRT MS/GM 973/2006, Art. 1º)
Art. 833. A Câmara Técnica de Imunobiológicos tem por finalidade atuar nos espaços que constituem as vertentes centrais para a ampliação da competitividade no setor, em: (Origem: PRT MS/GM 973/2006, Art. 2º)
I - pesquisa, desenvolvimento e inovação em saúde; (Origem: PRT MS/GM 973/2006, Art. 2º, I)
II - produção, comercialização e preços de imunobiológicos; e (Origem: PRT MS/GM 973/2006, Art. 2º, II)
III - qualidade e sustentabilidade econômica. (Origem: PRT MS/GM 973/2006, Art. 2º, III)
Art. 834. A Câmara Técnica de Imunobiológicos terá as seguintes atribuições: (Origem: PRT MS/GM 973/2006, Art. 3º)
I - definir as diretrizes estratégicas do Programa Brasileiro de Competitividade em Vacinas (INOVACINA); (Origem: PRT MS/GM 973/2006, Art. 3º, I)
II - definir estratégias para inovação, incluindo acordos de transferência de tecnologia e desenvolvimento interno; (Origem: PRT MS/GM 973/2006, Art. 3º, II)
III - definir políticas de pesquisa e desenvolvimento, com planejamento a longo prazo, envolvendo propriedade intelectual, recursos humanos e ensaios clínicos; (Origem: PRT MS/GM 973/2006, Art. 3º, III)
IV - propor a definição de produtos prioritários atuais e futuros; (Origem: PRT MS/GM 973/2006, Art. 3º, IV)
V - definir mecanismos para ampliar a articulação entre os produtores; (Origem: PRT MS/GM 973/2006, Art. 3º, V)
VI - definir critérios para seleção e definição de nichos de mercado entre os produtores; (Origem: PRT MS/GM 973/2006, Art. 3º, VI)
VII - desenvolver estudos para acompanhamento da dinâmica do mercado internacional e nacional; (Origem: PRT MS/GM 973/2006, Art. 3º, VII)
VIII - desenvolver propostas de transformação de formas de gestão dos laboratórios oficiais, considerando a auto-sustentabilidade como um pré-requisito; (Origem: PRT MS/GM 973/2006, Art. 3º, VIII)
IX - propor políticas de financiamento abrangentes, multiinstitucionais (FINEP, BNDES, CNPq, CAPES), para capital de giro, modernização da produção, certificação das plantas de produção para cumprimento das normas de Boas Práticas de Fabricação, investimento em desenvolvimento e inovação tecnológica e na formação de especialistas; (Origem: PRT MS/GM 973/2006, Art. 3º, IX)
X - propor uma política de preços e financiamento da produção que permita a auto-sustentabilidade dos produtores; (Origem: PRT MS/GM 973/2006, Art. 3º, X)
XI - revisar os aspectos regulatórios incluindo uma visão de desenvolvimento econômico e tecnológico; e (Origem: PRT MS/GM 973/2006, Art. 3º, XI)
XII - outras atividades correlacionadas como sistemas de controle de qualidade e a produção de animais de laboratório. (Origem: PRT MS/GM 973/2006, Art. 3º, XII)
Parágrafo Único. Caberá à Câmara elaborar proposta de cronograma de trabalho e de regimento interno. (Origem: PRT MS/GM 973/2006, Art. 3º, Parágrafo Único)
Art. 835. A Câmara Técnica de Imunobiológicos será um corpo colegiado constituído por membros e respectivos suplentes designados pelo Ministro da Saúde, formado por titulares ou por representantes das seguintes unidades integrantes da estrutura organizacional do Ministério da Saúde e entidades vinculadas: (Origem: PRT MS/GM 973/2006, Art. 4º)
I - Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE); (Origem: PRT MS/GM 973/2006, Art. 4º, I)
II - Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 973/2006, Art. 4º, II)
III - Secretaria de Vigilância em Saúde (SVS); (Origem: PRT MS/GM 973/2006, Art. 4º, III)
IV - Secretaria de Atenção à Saúde (SAS); (Origem: PRT MS/GM 973/2006, Art. 4º, IV)
V - Agência Nacional de Vigilância Sanitária (ANVISA); e (Origem: PRT MS/GM 973/2006, Art. 4º, V)
VI - 3 Três representantes dos Laboratórios Produtores Oficiais. (Origem: PRT MS/GM 973/2006, Art. 4º, VI)
Parágrafo Único. A Presidência da Câmara caberá ao representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE); (Origem: PRT MS/GM 973/2006, Art. 4º, Parágrafo Único)
Art. 836. Caberá ao colegiado solicitar o apoio de servidores dos órgãos e entidades do Ministério da Saúde, bem como convidar representantes de outros órgãos da administração pública e de outros Ministérios, cuja presença seja considerada necessária ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 973/2006, Art. 5º)
Parágrafo Único. A participação de pessoas externas ao Ministério da Saúde é considerada atividade de relevante interesse nacional e não será remunerada. (Origem: PRT MS/GM 973/2006, Art. 5º, Parágrafo Único)
Art. 837. A Câmara Técnica de Imunobiológicos terá o apoio de Grupos Técnicos de Trabalho formados por especialistas em cada área para subsidiar e orientar suas decisões. (Origem: PRT MS/GM 973/2006, Art. 6º)
§ 1º Deverão ter caráter permanente: (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º)
I - Grupo Técnico de Trabalho para a área de Recursos Humanos; (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º, I)
II - Grupo Técnico de Trabalho para a área de Produção; (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º, II)
III - Grupo Técnico de Trabalho para Pesquisa & Desenvolvimento. (Origem: PRT MS/GM 973/2006, Art. 6º, § 1º, III)
§ 2º A Câmara reunir-se-á ordinariamente a cada dois meses e extraordinariamente, sempre que necessário, por convocação do Presidente. (Origem: PRT MS/GM 973/2006, Art. 6º, § 2º)
Seção IX
Do Plano de Ação de Pesquisa Clínica no Brasil
Art. 837-A. Fica instituído o Plano de Ação de Pesquisa Clínica no Brasil, com a finalidade de aumentar a capacidade do País em desenvolver e atrair ensaios clínicos. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Parágrafo único. O Plano será disponibilizado no sítio eletrônico http://portalms.saude.gov.br/ciencia-e-tecnologia-e-complexo-industrial. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Art. 837-B. São objetivos do Plano de Ação de Pesquisa Clínica no Brasil: (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
I - aperfeiçoar o sistema de análise ética em pesquisas envolvendo seres humanos; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
II - apoiar a Agência Nacional de Vigilância Sanitária - Anvisa no aprimoramento do sistema regulatório para pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
III - aprimorar a capacidade científica instalada em pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
IV - promover a formação continuada de recursos humanos em pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
V - aprimorar a governança da Rede Nacional de Pesquisa Clínica - RNCP; e (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
VI - apoiar a translação e a difusão do conhecimento em pesquisa clínica. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Art. 837-C. O Plano de Ação de Pesquisa Clínica no Brasil está estruturado em seis eixos estratégicos: (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
I - regulação ética; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
II - regulação sanitária; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
III - fomento científico e tecnológico; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
IV - formação em pesquisa clínica; (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
V - Rede Nacional de Pesquisa Clínica - RNPC; e (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
VI - gestão do conhecimento. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Art. 837-D. Caberá ao Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde - DECIT/SCTIE/MS coordenar, implementar, monitorar e avaliar as ações que compõem o Plano de Ação de Pesquisa Clínica no Brasil. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
§ 1º O DECIT/SCTIE/MS será responsável pela articulação com as demais Secretarias do Ministério da Saúde, a Anvisa, a Comissão Nacional de Ética em Pesquisa do Conselho Nacional de Saúde - CONEP/CNS, o Ministério da Ciência, Tecnologia, Inovações e Comunicações, o Ministério da Educação, o Ministério da Indústria, Comércio Exterior e Serviços e outros órgãos e entidades da administração pública direta e indireta e da sociedade civil organizada atuantes no campo da ciência, tecnologia e inovação, para participarem das atividades do Plano, sempre que essa participação for pertinente em razão de sua área de atuação. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
§ 2º Para o alcance dos objetivos do Plano, o DECIT/SCTIE/MS poderá ainda: (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
I - articular para promover a aproximação do setor regulado com órgãos e entidades da administração pública direta e indireta; e (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
II - constituir grupos de trabalho para o cumprimento de finalidades específicas relacionadas ao Plano e convidar, para fazerem parte de sua composição, representantes de outros órgãos e entidades da administração pública direta e indireta, da sociedade civil organizada e do setor regulado. (Redação dada Pela PRT GM/MS nº 559 de 14.03.2018)
Seção X
Do Programa Pesquisa para o SUS: gestão compartilhada em saúde - PPSUS
(Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-E. Fica instituído o Programa Pesquisa para o SUS: gestão compartilhada em saúde - PPSUS. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-F. São objetivos do PPSUS: (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
I - apoiar financeiramente o desenvolvimento de pesquisas científicas, tecnológicas e/ou de inovação que objetivem contribuir para a resolução de problemas de saúde da população dos Estados e do Distrito Federal e para o fortalecimento da gestão do SUS; (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
II - promover a aproximação dos sistemas de saúde com os de ciência e tecnologia locais; e (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
III - reduzir as desigualdades regionais no campo da ciência, tecnologia e inovação em saúde no País. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-G. Na execução do PPSUS, o Ministério da Saúde articulará para promover a participação de diversos órgãos e entidades, como o Conselho Nacional de Desenvolvimento Científico e Tecnológico - CNPq, as Secretarias Estaduais de Saúde e os órgãos ou entidades estaduais de amparo à pesquisa. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Parágrafo único. Caberá ao Ministério da Saúde coordenar nacionalmente e monitorar a execução do PPSUS, observado o disposto no documento "Diretrizes Técnicas do PPSUS". (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-H. As pesquisas realizadas no âmbito do PPSUS serão apoiadas financeiramente pelo Ministério da Saúde e, mediante pactuação, pelos Estados e Distrito Federal, além de outras entidades de saúde ou pesquisa interessadas. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-I. As linhas de pesquisa a serem financiadas pelo PPSUS serão estabelecidas com a participação das Secretarias Estaduais de Saúde, dos órgãos ou entidades estaduais de amparo à pesquisa e de representantes da área acadêmica, e deverão estar relacionadas com os problemas na área de saúde pública enfrentados pelos Estados e Distrito Federal. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
§ 1º Serão incentivadas pesquisas multicêntricas para o fortalecimento de parcerias interinstitucionais e interestaduais, visando o compartilhamento de expertise e de infraestrutura. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
§ 2º A seleção das pesquisas a serem financiadas pelo PPSUS será feita por meio de chamada pública, observados os princípios da impessoalidade e transparência. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-J. Para a operacionalização do PPSUS o Ministério da Saúde poderá firmar contratos, convênios, acordos e outros instrumentos congêneres com órgãos e entidades públicas e privadas. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
Art. 837-K. A execução do PPSUS está condicionada à disponibilidade orçamentária e financeira do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.020 de 19.11.2019)
CAPÍTULO IV-A
DO PROGRAMA NACIONAL DE GENÔMICA E SAÚDE DE PRECISÃO - GENOMAS BRASIL
(Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Seção I
Disposições Gerais
(Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-L. Fica instituído, no âmbito do Sistema Único de Saúde (SUS), o Programa Nacional de Genômica e Saúde de Precisão (Genomas Brasil). (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Parágrafo único. O Genomas Brasil é um programa de ciência, tecnologia e inovação que tem como finalidade: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - incentivar o desenvolvimento científico e tecnológico nacional nas áreas de genômica e saúde de precisão; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - promover o desenvolvimento da indústria genômica nacional; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - estabelecer prova de conceito para uma linha de cuidado em genômica e saúde de precisão no âmbito do SUS. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-M. Para fins deste Capítulo, considera-se: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - genômica: campo da biologia molecular que estuda a estrutura, a função, a evolução, o mapeamento completo e a edição do genoma; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - medicina genômica: campo interdisciplinar da saúde que objetiva compreender como a interação entre genes e fatores ambientais influenciam na susceptibilidade de doenças e que utiliza informações genômicas para diagnóstico, prognóstico, monitoramento de fatores de risco e tratamento; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - saúde de precisão: conjunto de técnicas que utilizam informações clínicas e biológicas do indivíduo ou de subgrupos da população para personalizar o cuidado em saúde; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
IV - produtos de medicina genômica e saúde de precisão: produtos, processos, serviços ou sistemas de diagnóstico, prognóstico, preventivos e terapêuticos oriundos da medicina genômica e da saúde de precisão, incluindo os produtos de terapias avançadas, conforme definição dada pela Resolução da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária nº 214, de 7 de fevereiro de 2018; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
V - prova de conceito: modelo prático que possa provar um conceito teórico estabelecido por uma pesquisa, de forma a testar e verificar que o conceito em questão é suscetível e viável de implementação. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837- N. São objetivos do Programa Genomas Brasil: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - estabelecer o genoma de referência da população brasileira; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - instituir um banco nacional de dados genômicos e clínicos; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - promover o aumento da capacidade científica instalada e do capital intelectual nacional em medicina genômica e saúde de precisão; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
IV - promover o fortalecimento e a competitividade da indústria nacional de insumos e de produtos de medicina genômica e saúde de precisão; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
V - capacitar a força de trabalho do SUS em medicina genômica e saúde de precisão. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837- O. O Programa Genomas Brasil rege-se pelos seguintes princípios: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - prática clínica em genômica e saúde de precisão baseada em evidência científica; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - autonomia do consentimento informado e da vontade dos participantes de pesquisa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - direito dos participantes de pesquisa às informações sobre as condições de saúde pessoais avaliadas na pesquisa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
IV - dignidade e respeito aos participantes de pesquisa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
V - respeito à dignidade humana, valores sociais, morais, éticos, culturais e religiosos; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
VI - não-discriminação e não-estigmatização do participante de pesquisa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
VII - confidencialidade e sigilo das informações pessoais dos participantes de pesquisa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
VIII - integridade, confidencialidade e autenticidade das informações; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
IX - responsabilidade ética, legal e social em relação aos conhecimentos gerados pelo Programa. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Seção II
Da Governança
(Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837- P. Fica instituído o Conselho Deliberativo do Programa Genomas Brasil, órgão responsável por: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - definir as ações prioritárias do Programa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - deliberar sobre as estratégias, planejamento, execução e monitoramento das ações do Programa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - definir normas, regulamentos técnicos, protocolos e outros instrumentos relacionados às ações do Programa; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
IV - instituir Comissões Temáticas; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
V - deliberar sobre casos omissos; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
VI - instituir seu regimento interno. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Parágrafo único. As deliberações do Conselho serão publicizadas pelo Secretário de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-Q. O Conselho Deliberativo do Programa Genomas Brasil será composto pelo: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - Ministro de Estado da Saúde, que o presidirá; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - Secretário-Executivo do Ministério da Saúde; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - Secretário de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
§ 1º Os Secretários do Ministério da Saúde não previstos nos incisos II e III do caput, ou seus representantes indicados, poderão ser convidados a participar das reuniões do Conselho Deliberativo. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
§ 2º Poderão participar das reuniões do Conselho, como convidados especiais representantes e especialistas de outros órgãos e entidades, públicos ou privados. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-R. O Conselho Deliberativo do Programa Genomas Brasil se reunirá em caráter ordinário, no mínimo, duas vezes ao ano e, em caráter extraordinário, sempre que convocado pelo seu Presidente. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Parágrafo único. As deliberações do Conselho serão tomadas por consenso, presentes todos os membros, e serão formalizadas por meio de atas. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-S. As funções de Secretaria-Executiva do Conselho Deliberativo do Programa Genomas Brasil serão exercidas pelo Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Parágrafo único. A Secretaria-Executiva prestará apoio logístico e administrativo ao Conselho. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-T. As participações no Conselho Deliberativo serão consideradas prestações de serviço público relevante, não remunerado. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-U. O Conselho Deliberativo do Programas Genomas Brasil poderá instituir comissões temáticas com o objetivo de assessorar as situações específicas de competência do Conselho. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Parágrafo único. As comissões temáticas serão compostas na forma definida pelo Conselho e instituídas em ato do Secretário de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Seção III
Do Financiamento
(Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-V. As fontes de financiamento para execução do Programa Genomas Brasil poderão incluir: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
I - dotações orçamentárias consignadas ao Ministério da Saúde na Lei Orçamentária Anual da União e em seus créditos adicionais; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
II - recursos oriundos de emenda parlamentar a projetos de lei orçamentária destinados a ações e serviços públicos de saúde; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
III - recursos advindos de programas de renúncia fiscal do Ministério da Saúde, incluindo: (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
a) o Programa Nacional de Apoio à Atenção Oncológica (PRONON), instituído pela Lei nº 12.715, de 17 de setembro de 2012; (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
b) o Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), instituído pela Lei nº 12.715, de 17 de setembro de 2012; e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
c) o Programa de Apoio ao Desenvolvimento Institucional do SUS (PROADI-SUS); e (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
IV - recursos oriundos de outros órgãos ou entidade participantes das ações do Programa. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Seção IV
Das Disposições Finais
(Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
Art. 837-X. O Ministério da Saúde poderá firmar acordos e parcerias com órgãos e entidades nacionais ou internacionais, públicos ou privados, para cooperação técnica ou apoio financeiro. (Redação dada pela PRT GM/MS nº 1.949 de 04.08.2020)
CAPÍTULO V
DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (PQA-VS)
Art. 838. Este Capítulo regulamenta o Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS), com a definição de suas diretrizes, financiamento, metodologia de adesão e critérios de avaliação dos estados, Distrito Federal e municípios. (Origem: PRT MS/GM 1708/2013, Art. 1º)
Art. 839. O PQA-VS tem como objetivo induzir o aperfeiçoamento das ações de vigilância em saúde nos âmbitos estadual, distrital e municipal e é composto por Fase de Adesão e Fase de Avaliação. (Origem: PRT MS/GM 1708/2013, Art. 2º)
Art. 840. São diretrizes do PQA-VS: (Origem: PRT MS/GM 1708/2013, Art. 3º)
I - o processo contínuo e progressivo de melhoria das ações de vigilância em saúde que envolva a gestão, o processo de trabalho e os resultados alcançados pelos Estados, Distrito Federal e Municípios; (Origem: PRT MS/GM 1708/2013, Art. 3º, I)
II - a gestão baseada em compromissos e resultados, expressos em metas de indicadores pactuados, constantes do Anexos XCVIII e XCIX ; e (Origem: PRT MS/GM 1708/2013, Art. 3º, II)
II - a gestão baseada em compromissos e resultados, expressos em metas de indicadores pactuados, constantes em portaria específica; e (Redação dada pela PRT GM/MS n° 232 de 09.01.2023)
III - adesão voluntária de Estados, Distrito Federal e Municípios. (Origem: PRT MS/GM 1708/2013, Art. 3º, III)
Art. 841. A Fase de Adesão ao PQA-VS é composta pelas seguintes etapas: (Origem: PRT MS/GM 1708/2013, Art. 5º)
I - assinatura do Termo de Adesão ao PQA-VS pelos Municípios, com o preenchimento do modelo apresentado no Anexo XCVII ; (Origem: PRT MS/GM 1708/2013, Art. 5º, I)
II - encaminhamento pelo Município do Termo de Adesão à Comissão Intergestores Regional (CIR), para conhecimento, e envio à Comissão Intergestores Bipartite (CIB) para homologação; e (Origem: PRT MS/GM 1708/2013, Art. 5º, II)
III - encaminhamento pela CIB à Secretaria de Vigilância em Saúde (SVS/MS) de Resolução com a relação dos Municípios que aderiram ao PQA-VS. (Origem: PRT MS/GM 1708/2013, Art. 5º, III)
§ 1º A Secretaria de Saúde do Distrito Federal, após a assinatura do Termo de Adesão, o encaminhará a seu Colegiado de Gestão para conhecimento e posterior envio à SVS/MS. (Origem: PRT MS/GM 1708/2013, Art. 5º, § 1º)
§ 2º A adesão das Secretarias Estaduais de Saúde somente ocorrerá quando, pelo menos, 60% (sessenta por cento) dos Municípios de seu território tiverem formalizado o Termo de Adesão de que trata o inciso I do "caput", exigindo, para a formalização de sua adesão, a assinatura do Modelo constante do Anexo XCVII e posterior envio à SVS/MS. (Origem: PRT MS/GM 1708/2013, Art. 5º, § 2º)
Art. 842. A adesão de novos entes federativos ao PQA-VS ocorrerá até o final do primeiro trimestre de cada ano. (Origem: PRT MS/GM 1708/2013, Art. 7º)
Parágrafo Único. O Ministério da Saúde divulgará a relação dos Estados, Distrito Federal e Municípios que aderirem ao PQA-VS por meio de ato publicado no Diário Oficial da União. (Origem: PRT MS/GM 1708/2013, Art. 7º, § 2º)
Art. 843. A Fase de Avaliação do PQA-VS é composta pelas seguintes etapas: (Origem: PRT MS/GM 1708/2013, Art. 8º)
I - extração dos dados existentes no banco nacional do sistema de informação correspondente referentes a cada indicador pactuado; (Origem: PRT MS/GM 1708/2013, Art. 8º, I)
II - comparação entre os resultados obtido s e a metas estabelecidas; e (Origem: PRT MS/GM 1708/2013, Art. 8º, II)
III - quantificação do número de metas alcançadas de acordo com a estratificação estabelecida pelo PQA-VS com base na população residente em cada Município, de acordo com os dados da Fundação Instituto Brasileiro de Geografia e Estatística (IBGE). (Origem: PRT MS/GM 1708/2013, Art. 8º, III)
§ 1º A quantificação de que trata o inciso III do "caput" será a base para a definição do recurso financeiro a ser repassado para os Municípios aderidos ao PQA-VS. (Origem: PRT MS/GM 1708/2013, Art. 8º, § 1º)
§ 2º A Fase de Avaliação ocorrerá anualmente no segundo trimestre do ano subsequente ao da adesão do ente federativo. (Origem: PRT MS/GM 1708/2013, Art. 8º, § 2º)
Art. 844. O Ministério da Saúde divulgará o resultado da Fase de Avaliação do PQA-VS e os valores a serem transferidos aos Estados, Distrito Federal e Municípios que aderirem ao Programa por meio de ato publicado no Diário Oficial da União. (Origem: PRT MS/GM 1708/2013, Art. 12)
Art. 845. A relação de metas, com seus respectivos indicadores, e a metodologia para a Fase de Avaliação, estabelecidas por este Capítulo, poderão ser revisadas anualmente pela SVS/MS. (Origem: PRT MS/GM 1708/2013, Art. 14)
Parágrafo Único. Na hipótese de ocorrer a revisão de que trata o "caput", o Ministério da Saúde a submeterá à CIT para aprovação. (Origem: PRT MS/GM 1708/2013, Art. 14, Parágrafo Único)
Art. 846. Ficam definidos a relação de metas e seus respectivos indicadores do Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS). (Origem: PRT MS/GM 2984/2016, Art. 1º)
Art. 847. A relação das metas, com seus respectivos indicadores, que expressam os compromissos e responsabilidades de estados, Distrito Federal e municípios, no âmbito do PQA-VS, consta do Anexo C . (Origem: PRT MS/GM 2984/2016, Art. 2º)
Art. 847. As metas, com seus respectivos indicadores, que expressam os compromissos e responsabilidades dos estados, municípios e Distrito Federal no âmbito do PQA-VS, constarão em portaria específica. (Redação dada pela PRT GM/MS n° 232 de 09.01.2023)
§ 1º O valor das metas definidas não poderá ser alterado pelo ente federado aderido ao Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS). (Origem: PRT MS/GM 2984/2016, Art. 2º, § 1º)
Parágrafo único. O valor das metas definidas não poderá ser alterado pelo ente federado aderido ao PQA-VS. (Redação dada pela PRT GM/MS n° 232 de 09.01.2023)
§ 2º Anexo CI apresenta o Caderno de Indicadores do PQA-VS, referente às metas de que trata o "caput" deste artigo. (Origem: PRT MS/GM 2984/2016, Art. 2º, § 2º) (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
CAPÍTULO VI
DO PROGRAMA NACIONAL DE DESENVOLVIMENTO GERENCIAL NO SUS
Art. 848. Fica instituído o Programa Nacional de Desenvolvimento Gerencial no Sistema Único de Saúde (PNDG), com o objetivo de incentivar os processos de qualificação para a gestão e gerência do Sistema Único de Saúde. (Origem: PRT MS/GM 1311/2010, Art. 1º)
§ 1º São diretrizes do PNDG: (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º)
I - orientar-se pelos princípios e práticas da gestão democrática e participativa; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, I)
II - fortalecer a capacidade de desenvolver novos conhecimentos, habilidades e atitudes gerenciais centrados nas necessidades e demandas dos usuários; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, II)
III - desenvolver o programa em estreita articulação com a Política de Educação Permanente em Saúde (EPS); (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, III)
IV - estabelecer parcerias com os gestores do SUS quanto aos processos de formação adequados às diversas realidades locais, regionais e estaduais, bem como em relação ao nível instrucional do profissional de saúde a ser atingido pelo PNDG; e (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, IV)
V - consolidar o eixo da gestão do trabalho e educação na saúde do Pacto de Gestão. (Origem: PRT MS/GM 1311/2010, Art. 1º, § 1º, V)
§ 2º São objetivos do PNDG: (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º)
I - garantir a integralidade e a qualidade das práticas de saúde, no âmbito do SUS; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, I)
II - qualificar os profissionais de saúde para o exercício da função gerencial em todos os pontos do SUS; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, II)
III - estabelecer instrumentos de cooperação entre os gestores do SUS e as instituições de educação superior da área da saúde, visando à melhoria da qualidade e resolutividade da atenção à saúde prestada ao usuário e à integração da rede na educação permanente; (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, III)
IV - promover articulação entre as diversas iniciativas de formação e de capacitação dos gestores nos diversos níveis de governo; e (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, IV)
V - buscar integração com as instituições de ensino, principalmente em relação às universidades, escolas de saúde pública, institutos de saúde coletiva. (Origem: PRT MS/GM 1311/2010, Art. 1º, § 2º, V)
Art. 849. O PNDG será composto pela Comissão Consultiva, responsável por definir as linhas e áreas prioritárias para a execução do presente programa, e será constituída por: (Origem: PRT MS/GM 1311/2010, Art. 2º)
I - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde; (Origem: PRT MS/GM 1311/2010, Art. 2º, I)
II - um representante da Secretaria-Executiva; (Origem: PRT MS/GM 1311/2010, Art. 2º, II)
III - um representante da Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1311/2010, Art. 2º, III)
IV - um representante da Secretaria de Gestão Estratégica e Participativa; (Origem: PRT MS/GM 1311/2010, Art. 2º, IV)
V - um representante da Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 1311/2010, Art. 2º, V)
VI - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos; (Origem: PRT MS/GM 1311/2010, Art. 2º, VI)
VII - um membro titular e um suplente do Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 1311/2010, Art. 2º, VII)
VIII - um membro titular e um suplente do Conselho Nacional de Secretários Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 1311/2010, Art. 2º, VIII)
Parágrafo Único. Compete à Secretaria de Gestão do Trabalho e da Educação na Saúde, do Ministério da Saúde, a coordenação da Comissão prevista no caput deste artigo. (Origem: PRT MS/GM 1311/2010, Art. 2º, Parágrafo Único)
Art. 850. O Ministério da Saúde destinará recursos orçamentários da Funcional Programática nº 10.128.1436.8630.0001 para atender ao Programa Nacional de Desenvolvimento Gerencial no SUS (PNDG). (Origem: PRT MS/GM 1311/2010, Art. 3º)
CAPÍTULO VII
DO MONITORAMENTO DAS AÇÕES E SERVIÇOS PÚBLICOS ESTRATÉGICOS DE VIGILÂNCIA EM SAÚDE
Art. 851. O Ministério da Saúde, por meio da SVS/MS, efetuará o monitoramento sistemático e regular das ações e serviços públicos estratégicos de vigilância em saúde, para fins de manutenção do recebimento do incentivo financeiro de custeio mensal correspondente. (Origem: PRT MS/GM 183/2014, Art. 45) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Parágrafo Único. A manutenção do repasse dos recursos do incentivo financeiro está condicionada à alimentação regular dos sistemas de informação de base nacional, previstos no art. 454 da Portaria de Consolidação nº 6, mediante monitoramento regular e sistemático pela SVS/MS. (Origem: PRT MS/GM 183/2014, Art. 45, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 852. O cancelamento do repasse do recurso se dará de forma parcial ou total, a depender do número de ações ou serviços desabilitados e dos recursos destinados ao ente. (Origem: PRT MS/GM 183/2014, Art. 46) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Parágrafo Único. O ente poderá pleitear nova habilitação à ação ou ao serviço para qual tenha sido desabilitado, desde que apresente novo termo de compromisso previsto no art. 505, § 1º , I da Portaria de Consolidação nº 6, e se comprometa com as responsabilidades relacionadas à respectiva ação ou serviço público estratégicos de vigilância em saúde, o que será avaliado e aprovado ou não pela SVS/MS. (Origem: PRT MS/GM 183/2014, Art. 46, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 853. O monitoramento do incentivo financeiro de custeio para implantação e manutenção de ações e serviços públicos estratégicos de vigilância em saúde não dispensa o ente federativo beneficiário de comprovação da aplicação dos recursos financeiros percebidos por meio do Relatório Anual de Gestão (RAG). (Origem: PRT MS/GM 183/2014, Art. 48) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
Art. 854. O detalhamento das ações específicas e serviços públicos estratégicos de vigilância em saúde será inserido na Programação Anual de Saúde (PAS), observadas as diretrizes constantes nos Planos de Saúde dos entes federativos. (Origem: PRT MS/GM 183/2014, Art. 51) (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
CAPÍTULO VIII
DO PROGRAMA NACIONAL DE AVALIAÇÃO DE SERVIÇOS DE SAÚDE (PNASS)
Art. 855. Fica instituído o Programa Nacional de Avaliação de Serviços de Saúde (PNASS). (Origem: PRT MS/GM 28/2015, Art. 1º)
Art. 856. O PNASS tem como objetivo geral avaliar a eficiência, eficácia e efetividade das estruturas, processos e resultados relacionados ao risco, acesso e satisfação dos cidadãos frente aos serviços de saúde do Sistema Único de Saúde (SUS), buscando a apreensão mais completa e abrangente possível da suas realidades, em suas diferentes dimensões, na busca da resolubilidade e qualidade. (Origem: PRT MS/GM 28/2015, Art. 2º)
Art. 857. O PNASS tem como objetivos específicos: (Origem: PRT MS/GM 28/2015, Art. 3º)
I - incentivar a cultura avaliativa dos gestores para os serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, I)
II - fomentar a cultura avaliativa nos estabelecimentos de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, II)
III - ser instrumento de apoio à gestão do SUS; (Origem: PRT MS/GM 28/2015, Art. 3º, III)
IV - produzir conhecimento qualitativo da rede de serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, IV)
V - implementar padrões de conformidade dos serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, V)
VI - incorporar indicadores de produção para avaliação de serviços de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, VI)
VII - aferir a satisfação dos usuários do SUS; (Origem: PRT MS/GM 28/2015, Art. 3º, VII)
VIII - conhecer as condições e relações de trabalho dos profissionais nos estabelecimentos de saúde; (Origem: PRT MS/GM 28/2015, Art. 3º, VIII)
IX - identificar oportunidades e possibilidades de melhoria; (Origem: PRT MS/GM 28/2015, Art. 3º, IX)
X - possibilitar a observação de experiências exitosas para melhoria da qualidade local; e (Origem: PRT MS/GM 28/2015, Art. 3º, X)
XI - disponibilizar os resultados para conhecimento público. (Origem: PRT MS/GM 28/2015, Art. 3º, XI)
Art. 858. O PNASS será executado por meio de instrumentos avaliativos, como roteiros de verificação e questionários de pesquisa, estabelecidos pelo Departamento de Regulação, Avaliação e Controle de Sistemas (DRAC/SAS/MS), que avaliarão os estabelecimentos de atenção especializada em saúde, ambulatorial e hospitalar, quanto as seguintes dimensões: (Origem: PRT MS/GM 28/2015, Art. 4º)
I - estrutura; (Origem: PRT MS/GM 28/2015, Art. 4º, I)
II - processos de trabalho; (Origem: PRT MS/GM 28/2015, Art. 4º, II)
III - resultados relacionados ao risco; e (Origem: PRT MS/GM 28/2015, Art. 4º, III)
IV - satisfação dos usuários em relação ao atendimento recebido. (Origem: PRT MS/GM 28/2015, Art. 4º, IV)
Art. 859. O PNASS será aplicado periodicamente nos estabelecimentos de atenção especializada em saúde, ambulatorial e hospitalar, contemplados com recursos financeiros provenientes de programas, políticas e incentivos do Ministério da Saúde. (Origem: PRT MS/GM 28/2015, Art. 5º)
§ 1º Os estabelecimentos de atenção especializada em saúde a serem avaliados pelo PNASS serão indicados a partir de critérios estabelecidos pelo Ministério da Saúde. (Origem: PRT MS/GM 28/2015, Art. 5º, § 1º)
§ 2º O Ministério da Saúde poderá firmar termo de cooperação com Instituições de Ensino Superior Federais para a aplicação dos instrumentos avaliativos do PNASS. (Origem: PRT MS/GM 28/2015, Art. 5º, § 2º)
Art. 860. Fica instituído o Sistema de Informação do PNASS (SIPNASS), sistema informatizado com a finalidade de armazenar os dados coletados, gerenciar o fluxo a partir da aplicação dos instrumentos avaliativos e subsidiar a análise e a produção dos resultados do PNASS, para divulgação. (Origem: PRT MS/GM 28/2015, Art. 6º)
Art. 861. O DRAC/SAS/MS será responsável pela coordenação e monitoramento do PNASS. (Origem: PRT MS/GM 28/2015, Art. 7º)
Art. 862. Os recursos orçamentários, objeto deste Capítulo, correrão por conta do Programa de Trabalho 10.302.2015.8721 - Implementação da Regulação, Controle e Avaliação da Atenção à Saúde. (Origem: PRT MS/GM 28/2015, Art. 8º)
CAPÍTULO IX
DO PLANEJAMENTO, EXECUÇÃO E AVALIAÇÃO DAS AÇÕES DE VIGILÂNCIA E ASSISTÊNCIA À SAÚDE EM EVENTOS DE MASSA
Art. 863. O Anexo CII dispõe sobre o planejamento, execução e avaliação das ações de vigilância e assistência à saúde em eventos de massa.
CAPÍTULO X
DO COMITÊ INTERINSTITUCIONAL DE FARMACOVIGILÂNCIA DE VACINAS E OUTROS IMUNOBIOLÓGICOS - CIFAVI
(Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 863-A. O Anexo CIII dispõe sobre o Comitê Interinstitucional de Farmacovigilância de Vacinas e outros Imunobiológicos - CIFAVI. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
CAPÍTULO XI
DAS DIRETRIZES PARA O FINANCIAMENTO DE PROJETOS DE PESQUISA CIENTÍFICA, TECNOLÓGICA OU DE DESENVOLVIMENTO OU INOVAÇÃO EM SAÚDE PELO MINISTÉRIO DA SAÚDE
(Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-B. O Ministério da Saúde poderá financiar projetos de pesquisa científica, tecnológica ou de desenvolvimento ou inovação em saúde, conforme diretrizes estabelecidas neste Capítulo. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Seção I
Da Apresentação, Seleção e Contratação de Projetos de Pesquisa
(Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-C. Os projetos de pesquisa de que trata o art. 863-B poderão ser apresentados por pesquisadores vinculados a instituições científicas e tecnológicas (ICT) de natureza pública ou privada, sem fins lucrativos. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Parágrafo único. A contratação de projetos de pesquisa de que trata esta Seção é feita com a ICT a que está vinculado o proponente e está sujeita à prévia disponibilidade orçamentária de recursos do orçamento da União destinados ao Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-D. A seleção de projetos de pesquisa científica, tecnológica ou de desenvolvimento ou inovação em saúde ocorrerá por meio de chamada pública ou de celebração direta. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Parágrafo único. Salvo casos justificados, a seleção deverá observar a agenda de prioridades de pesquisa do Ministério da Saúde aprovada pelo Comitê de Governança de Pesquisa em Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-E. As chamadas públicas poderão ser lançadas pelo Ministério da Saúde com vistas à realização de atividades de pesquisa, desenvolvimento e inovação em saúde, bem como à implantação e recuperação de infraestruturas institucionais de ciência, tecnologia e inovação, observadas as determinações do manual instrutivo a ser disponibilizado pelo Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde no sítio eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 1º Poderão ser lançadas chamadas públicas em colaboração com outros órgãos da administração pública, agências de fomento, fundações de apoio à pesquisa e demais entidades nacionais ou internacionais, de direito público ou privado. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 2º A pesquisa contratada na modalidade mencionada no caput estará sujeita às regras previstas no edital da chamada pública, que disporá sobre a apresentação, a admissibilidade, o julgamento, a análise, a aprovação, a contratação, a execução, o monitoramento, a avaliação e a disseminação de resultados, bem como sobre a prestação de contas do projeto de pesquisa. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-F. A contratação direta será aplicada a projetos que atendam a demandas em caráter de emergência em saúde pública ou que apresentem justificada singularidade, ou, ainda, que sejam considerados prioritários para o Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 1º Os projetos de pesquisa a serem contemplados com a contratação direta deverão ser justificados pelas áreas técnicas do Ministério da Saúde, observadas as determinações do manual instrutivo de que trata o art. 863-E. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 2º Os projetos de pesquisa contemplados com a contratação direta poderão partir de iniciativa de pesquisador interessado, após verificada a relevância da proposta para o aprimoramento do Sistema Único de Saúde -SUS. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 3º Quando instrumentalizada por termo de execução descentralizada ou convênio, a pesquisa contratada na forma do caput estará sujeita a rito específico estabelecido pelo Ministério da Saúde em regulamento. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-G. Na contratação direta e na chamada pública, caberá pedido de reconsideração das decisões proferidas nas etapas de: (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
I - admissibilidade do projeto de pesquisa; (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
II - contratação do projeto de pesquisa; e (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
III - prestação de contas do projeto de pesquisa. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 1º O pedido de reconsideração será apresentado no prazo de 5 (cinco) dias úteis, a contar da notificação do interessado, à autoridade que proferiu a decisão, que deverá se manifestar no prazo de 10 (dez) dias úteis, contados do recebimento do pedido. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 2º Desprovido o pedido de reconsideração de que trata o caput, poderá o requerente apresentar recurso no prazo de 10 (dez) dias úteis, a contar da ciência da decisão, à autoridade hierarquicamente superior, que deverá se manifestar no prazo de 10 (dez) dias úteis, contados do recebimento do recurso. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 3º A decisão de admissibilidade do projeto de pesquisa é preliminar à análise de mérito do projeto e incumbe à Secretaria responsável pelo fomento à pesquisa no âmbito do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 4º As decisões de contratação e de prestação de contas do projeto de pesquisa cabem à Secretaria responsável pelo fomento à pesquisa no âmbito do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 5º Os recursos de decisões proferidas pelos Secretários do Ministério da Saúde serão dirigidos ao Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 6º Os pedidos de reconsideração e os recursos não serão conhecidos pelo Ministério da Saúde quando interpostos fora do prazo e para unidade não competente. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 7º Aplica-se aos pedidos de reconsideração e aos recursos de que trata esta Seção, no que couber, o disposto na Lei nº 9.784, de 29 de janeiro de 1999. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-H. As pesquisas financiadas nos termos da presente Seção deverão ser inseridas em plataforma própria do Ministério da Saúde que contenha informações unificadas quanto ao financiamento de pesquisas pela Pasta, nos termos de regulamento. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Parágrafo único. A área técnica responsável pelo financiamento da pesquisa no âmbito do Ministério da Saúde zelará pela garantia de inserção, completude e consistência das informações da pesquisa em saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Seção II
Do Monitoramento e da Avaliação de Pesquisas
(Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-I. A área técnica responsável pelo financiamento da pesquisa no Ministério da Saúde deverá realizar o monitoramento e a avaliação dos resultados do projeto, visando resguardar sua adequada execução, observados os objetivos, o cronograma, o orçamento, as metas e os indicadores previstos no plano de trabalho. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 1º O monitoramento de que trata o caput será feito por meio dos seguintes instrumentos e ações, entre outros: (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
I - análise dos relatórios parciais de execução físico-financeira; (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
II - análise do relatório de prestação de contas final; (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
III - visitas técnicas in loco, quando pertinentes, para acompanhamento do desenvolvimento do projeto; e (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
IV - análise de quaisquer outros produtos ou entregas relativos à condução da pesquisa em saúde visando à incorporação do conhecimento científico no processo de tomada de decisão em saúde, a interesse da administração pública. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 2º Incumbe à área técnica do Ministério da Saúde responsável por cada financiamento definir, no instrumento respectivo, a periodicidade do monitoramento da pesquisa contratada de acordo com a sua complexidade, sendo necessária a emissão do relatório de monitoramento, bem como definir a pertinência e a frequência da realização de visitas técnicas, observadas, de modo facultativo, as recomendações do Comitê de Governança de Pesquisa em Saúde.
§ 3º Os pesquisadores e as instituições responsáveis contratados para a execução da pesquisa deverão, sempre que solicitado pelo Ministério da Saúde, apresentar esclarecimentos complementares sobre o andamento do estudo. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 4º Achados decorrentes da condução do estudo ou pesquisa que impliquem risco ou benefício comprovado aos participantes e/ou à comunidade deverão ser comunicados ao Ministério da Saúde imediatamente quando identificados, independentemente do envio de relatórios parciais ou finais. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 5º Durante a análise dos relatórios de prestação de contas parcial ou final, ou a qualquer tempo, poderão ser feitas reuniões ou diligências com o objetivo de obter mais informações, documentos e outros elementos julgados pertinentes pela área técnica responsável pelo financiamento da pesquisa no âmbito do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 6º Para fins do disposto neste artigo, a área técnica responsável pelo financiamento da pesquisa no âmbito do Ministério da Saúde avaliará a possibilidade de monitoramento remoto, por meio de videoconferência. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Seção III
Do Acesso e da Divulgação de Resultados de Pesquisas
(Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-J. A qualquer tempo, a interesse da administração pública, os coordenadores das pesquisas contratadas deverão conceder acesso aos resultados parciais e final do estudo ao Ministério da Saúde, especificando a aplicabilidade para o aprimoramento do SUS, independentemente da publicação em revista científica indexada, resguardados o direito de propriedade intelectual e o ineditismo científico. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 1º Os resultados das pesquisas financiadas pelo Ministério da Saúde deverão ser apresentados em seminários de avaliação, resumos executivos e relatórios de execução de pesquisa. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 2º A apresentação dos resultados do estudo ao Ministério da Saúde será realizada em formato e vocabulário compreensíveis aos gestores, visando à institucionalização da promoção do uso de evidências científicas como subsídio para a tomada de decisão em saúde, por meio da incorporação de práticas de tradução do conhecimento. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-K. Os pesquisadores financiados pelo Ministério da Saúde deverão observar as seguintes diretrizes gerais, relacionadas ao compartilhamento de dados e à publicação dos resultados da pesquisa apoiada: (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
I - compartilhamento de dados da pesquisa (open data): (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
a) os protocolos e instrumentos das pesquisas financiadas deverão ser publicados em plataformas específicas para tal finalidade, possibilitando sua apropriação e discussão por outros grupos de pesquisa; (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
b) os bancos de dados pertinentes aos projetos deverão ser disponibilizados ao Ministério da Saúde, sempre que solicitado, a interesse da administração pública; e (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
c) a coleta, o armazenamento e a cessão de amostras biológicas deverão seguir as diretrizes estabelecidas na Resolução CNS nº 441, de 12 de maio de 2011, na Resolução CNS nº 446, de 12 de dezembro de 2012, na Portaria GM/MS nº 2.201, de 14 de setembro de 2011, e na Lei nº 11.105, de 24 de março de 2005; e (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
II - publicação dos resultados da pesquisa (open access): (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
a) a publicação dos resultados dos estudos financiados deverá ser feita em periódicos nacionais e/ou internacionais, em acesso aberto; (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
b) os artigos publicados em língua estrangeira deverão ser traduzidos para a língua portuguesa e entregues ao Ministério da Saúde, a fim de serem disponibilizados a potenciais usuários da informação no Brasil e demais países lusófonos; e (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
c) a divulgação dos resultados das pesquisas em qualquer meio de comunicação ou publicação deverá citar, obrigatoriamente, o apoio e o financiamento do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 1º Eventuais restrições de acesso serão submetidas a consulta no Comitê de Governança de Pesquisa em Saúde e decididas pela área técnica responsável pelo financiamento da pesquisa no âmbito do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
§ 2º O pesquisador responsável pelo projeto da instituição contratada deverá executar plano de disseminação de resultados científicos, cujas orientações constarão no manual instrutivo a ser disponibilizado pelo Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde no sítio eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
Art. 863-L. Os resultados das pesquisas, sujeitos à propriedade intelectual, serão regidos de acordo com legislação específica. (Redação dada pela PRT GM/MS nº 4.282 de 12.12.2022)
CAPÍTULO XII
DO COMITÊ DE GOVERNANÇA DE PESQUISA EM SAÚDE
(Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Art. 863-M. Fica instituído o Comitê de Governança de Pesquisa em Saúde, no âmbito do Ministério da Saúde, com a finalidade de estabelecer a governança das ações relacionadas ao fomento à pesquisa em saúde no órgão. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Art. 863-N. O Comitê de Governança de Pesquisa em Saúde será composto por: (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
I - um representante do Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde (DECIT/SCTIE/MS), que o coordenará; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
I - um representante do Departamento de Ciência e Tecnologia da Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde (DECIT/SECTICS/MS), que o coordenará; (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
II - um representante da Secretaria-Executiva (SE/MS); (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
III - um representante da Secretaria de Atenção Primária à Saúde (SAPS/MS); (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
IV - um representante da Secretaria de Atenção Especializada à Saúde (SAES/M S) ; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
V - um representante da Secretaria de Vigilância em Saúde (SVS/MS); (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
V - um representante da Secretaria de Vigilância em Saúde e Ambiente (SVSA/MS); (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
VI - um representante da Secretaria Especial de Saúde Indígena (SESAI/MS); e (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
VI - um representante da Secretaria de Saúde Indígena (SESAI/MS); (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
VII - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS). (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
VII - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); e (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
VIII - um representante da Secretaria de Informação e Saúde Digital (SEIDIGI/MS). (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
§ 1º Cada membro do Comitê terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 2º Os representantes indicados para compor o Comitê de Governança de Pesquisa em Saúde, tanto os titulares quanto os suplentes, deverão ser ocupantes de Cargos Comissionados Executivos ou Funções Comissionadas Executivas, de nível 13 ou equivalente, ou de cargo de hierarquia superior. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 3º Poderão participar das reuniões do Comitê, como convidados, sem direito a voto, representantes e especialistas de outros órgãos e entidades, públicos ou privados, mediante anuência do coordenador. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 4º Os membros do Comitê de Governança de Pesquisa em Saúde serão designados por ato do Ministro de Estado da Saúde.
Art. 863-O. Compete ao Comitê: (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
I - aprovar a agenda de prioridades de pesquisa do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
II - opinar quanto à aplicação dos recursos públicos destinados à pesquisa em saúde; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
III - acompanhar as ações relacionadas à pesquisa em saúde em situações excepcionais e emergenciais; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
IV - propor políticas, programas e ações relacionadas ao fomento à pesquisa em saúde; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
V - propor diretrizes e boas práticas de fomento à pesquisa em saúde e de uso das evidências científicas; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
VI - fomentar a disseminação do conhecimento científico e a promoção do uso de evidências científicas para a tomada de decisão; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
VII - promover a transparência ativa por meio de plataforma oficial contendo dados e informações referentes à pesquisa em saúde no Ministério da Saúde; e (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
VIII - estimular a ciência aberta no âmbito do Ministério da Saúde; e (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
IX - elaborar o seu regimento interno. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Art. 863-P. O Comitê de Governança de Pesquisa em Saúde se reunirá, em caráter ordinário, semestralmente, e em caráter extraordinário, sempre que necessário, mediante convocação do seu coordenador. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 1º O quórum de reunião é de maioria absoluta, e o quórum de aprovação é de maioria simples. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 2º Na hipótese de empate, além do voto ordinário, o coordenador do Comitê exercerá o voto de qualidade. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 3º Os membros do Comitê que se encontrarem no Distrito Federal se reunirão presencialmente ou por videoconferência, e os membros que se encontrarem em outros entes federativos participarão da reunião remotamente. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Art. 863-Q. Poderão ser instituídos grupos de trabalho para subsidiar tecnicamente as atividades e deliberações do Comitê. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 1º Os grupos de trabalho de que trata o caput deste artigo: (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
I - serão instituídos por ato do Comitê de Governança de Pesquisa em Saúde, que definirá os objetivos específicos de cada grupo; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
II - não poderão ter mais de sete membros; (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
III - terão caráter temporário, com duração não superior a um ano; e (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
IV - estarão limitados ao número de três grupos operando simultaneamente. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
§ 2º Os membros dos grupos de trabalho serão designados pelo coordenador do Comitê. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Art. 863-R. A Secretaria-Executiva do Comitê será exercida pelo DECIT/SC TIE/MS. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Art. 863-R. A Secretaria-Executiva do Comitê será exercida pelo DECIT/SECTICS/MS. (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
Parágrafo único. Compete ao DECIT/SCTIE/MS apoiar as atividades técnicas e administrativas do Comitê e de seus grupos de trabalho. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
Parágrafo único. Compete ao DECIT/SECTICS/MS apoiar as atividades técnicas e administrativas do Comitê e de seus grupos de trabalho. (Redação dada pela PRT GM/MS n° 124 de 10.02.2023)
Art. 863-S. A participação no Comitê de Governança de Pesquisa em Saúde será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS nº 4.021 de 16.11.2022)
CAPÍTULO XIII
DO PROGRAMA SUS DIGITAL
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 863-T. Fica instituído o Programa SUS Digital, na forma do Anexo CVIII a esta Portaria. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
TÍTULO VII
DAS DISPOSIÇÕES FINAIS
Art. 864. Ficam revogadas, por consolidação, as seguintes normas:
I - Portaria nº 2681/GM/MS, de 7 de novembro de 2013, publicada no Diário Oficial da União, Seção 1, de 8 de novembro de 2013, p. 37;
II - arts. 1º a 6º, 13 a 17, 25 a 38 da Portaria nº 1707/GM/MS, de 23 de setembro de 2016, publicada no Diário Oficial da União, Seção 1, de 26 de setembro de 2016, p. 36;
III - arts. 1º a 4º da Portaria nº 1469/GM/MS, de 10 de julho de 2006, publicada no Diário Oficial da União, Seção 1, de 11 de julho de 2006, p. 41;
IV - Portaria nº 2077/GM/MS, de 31 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 4 de novembro de 2003, p. 43;
V - Portaria nº 2078/GM/MS, de 31 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 4 de novembro de 2003, p. 45;
VI - arts. 1º a 7º, 16, 19 a 21 da Portaria nº 2840/GM/MS, de 29 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 30 de dezembro de 2014, p. 54;
VII - arts. 1º a 7º, 9º e 11 da Portaria nº 2197/GM/MS, de 14 de outubro de 2004, publicada no Diário Oficial da União, Seção 1, de 15 de outubro de 2004, p. 49;
VIII - arts. 1º, 2º, 5º, 7º e 9º da Portaria nº 816/GM/MS, de 30 de abril de 2002, publicada no Diário Oficial da União, Seção 1, de 3 de maio de 2002, p. 29;
IX - Portaria nº 1028/GM/MS, de 1 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 4 de julho de 2005, p. 55;
X - Portaria nº 799/GM/MS, de 19 de julho de 2000, publicada no Diário Oficial da União, Seção 1, de 20 de julho de 2000, p. 13;
XI - Portaria nº 251/GM/MS, de 31 de janeiro de 2002, publicada no Diário Oficial da União, Seção 1, de 4 de fevereiro de 2002, p. 52;
XII - Portaria nº 1977/GM/MS, de 12 de setembro de 2014, publicada no Diário Oficial da União, Seção 1, de 15 de setembro de 2014, p. 53;
XIII - Portaria nº 729/GM/MS, de 13 de maio de 2005, publicada no Diário Oficial da União, Seção 1, de 16 de maio de 2005, p. 60;
XIV - Portaria nº 1052/GM/MS, de 8 de maio de 2007, publicada no Diário Oficial da União, Seção 1, de 9 de maio de 2007, p. 33;
XV - Portaria nº 3244/GM/MS, de 30 de dezembro de 2011, publicada no Diário Oficial da União, Seção 1, de 2 de janeiro de 2012, p. 52;
XVI - arts. 1º a 6º e 11 da Portaria nº 822/GM/MS, de 6 de junho de 2001, publicada no Diário Oficial da União, Seção 1, de 7 de junho de 2001, p. 33;
XVII - Portaria nº 1069/GM/MS, de 5 de junho de 2002, publicada no Diário Oficial da União, Seção 1, de 10 de junho de 2002, p. 28;
XVIII - Portaria nº 111/GM/MS, de 19 de janeiro de 2012, publicada no Diário Oficial da União, Seção 1, de 20 de janeiro de 2012, p. 40;
XIX - Portaria nº 529/GM/MS, de 1 de abril de 2013, publicada no Diário Oficial da União, Seção 1, de 2 de abril de 2013, p. 43;
XX - Portaria nº 798/GM/MS, de 17 de junho de 2015, publicada no Diário Oficial da União, Seção 1, de 19 de junho de 2015, p. 32;
XXI - Portaria nº 586/GM/MS, de 6 de abril de 2004, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2004, p. 87;
XXII - Portaria nº 814/GM/MS, de 26 de julho de 2000, publicada no Diário Oficial da União, Seção 1, de 27 de julho de 2000, p. 26;
XXIII - Portaria nº 587/GM/MS, de 6 de abril de 2004, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2004, p. 87;
XXIV - Portaria nº 183/GM/MS, de 30 de janeiro de 2014, publicada no Diário Oficial da União, Seção 1, de 31 de janeiro de 2014, p. 59;
XXV - Portaria nº 344/GM/MS, de 19 de fevereiro de 2002, publicada no Diário Oficial da União, Seção 1, de 20 de fevereiro de 2002, p. 29;
XXVI - arts. 1º a 10, 12, 14 e 15 da Portaria nº 2304/GM/MS, de 4 de outubro de 2012, publicada no Diário Oficial da União, Seção 1, de 5 de outubro de 2012, p. 86;
XXVII - Portaria nº 2898/GM/MS, de 28 de novembro de 2013, publicada no Diário Oficial da União, Seção 1, de 29 de novembro de 2013, p. 119;
XXVIII - Portaria nº 2508/GM/MS, de 27 de outubro de 2011, publicada no Diário Oficial da União, Seção 1, de 28 de outubro de 2011, p. 40;
XXIX - Portaria nº 613/GM/MS, de 3 de março de 2017, publicada no Diário Oficial da União, Seção 1, de 6 de março de 2017, p. 73;
XXX - Portaria nº 1400/GM/MS, de 14 de agosto de 1991, publicada no Diário Oficial da União, Seção 1, de 16 de agosto de 1991, p. 14;
XXXI - Portaria nº 1138/GM/MS, de 23 de maio de 2014, publicada no Diário Oficial da União, Seção 1, de 26 de maio de 2014, p. 83;
XXXII - Portaria nº 44/GM/MS, de 3 de janeiro de 2002, publicada no Diário Oficial da União, Seção 1, de 8 de janeiro de 2002, p. 77;
XXXIII - Portaria nº 451/GM/MS, de 13 de fevereiro de 2017, publicada no Diário Oficial da União, Seção 1, de 14 de fevereiro de 2017, p. 31;
XXXIV - Portaria nº 1398/GM/MS, de 8 de julho de 2008, publicada no Diário Oficial da União, Seção 1, de 9 de julho de 2008, p. 42;
XXXV - Portaria nº 1402/GM/MS, de 14 de agosto de 1991, publicada no Diário Oficial da União, Seção 1, de 16 de agosto de 1991, p. 19;
XXXVI - Portaria nº 1933/GM/MS, de 9 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 10 de outubro de 2003, p. 58;
XXXVII - Portaria nº 2001/GM/MS, de 17 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 20 de outubro de 2003, p. 81;
XXXVIII - arts. 2º a 8º da Portaria nº 1934/GM/MS, de 9 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 10 de outubro de 2003, p. 58;
XXXIX - Portaria nº 335/GM/MS, de 12 de fevereiro de 2007, publicada no Diário Oficial da União, Seção 1, de 13 de fevereiro de 2007, p. 56;
XL - Portaria nº 236/GM/MS, de 2 de maio de 1985, publicada no Diário Oficial da União, Seção 1, de 6 de maio de 1985, p. 6856;
XLI - Portaria nº 2080/GM/MS, de 31 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 4 de novembro de 2003, p. 45;
XLII - Portaria nº 1932/GM/MS, de 9 de outubro de 2003, publicada no Diário Oficial da União, Seção 1, de 10 de outubro de 2003, p. 58;
XLIII - Portaria nº 2362/GM/MS, de 1 de dezembro de 2005, publicada no Diário Oficial da União, Seção 1, de 2 de dezembro de 2005, p. 59;
XLIV - Portaria nº 520/GM/MS, de 6 de abril de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2005, p. 39;
XLV - Portaria nº 205/GM/MS, de 17 de fevereiro de 2016, publicada no Diário Oficial da União, Seção 1, de 18 de fevereiro de 2016, p. 24;
XLVI - Portaria nº 652/GM/MS, de 28 de maio de 2003, publicada no Diário Oficial da União, Seção 1, de 30 de maio de 2003, p. 78;
XLVII - Portaria nº 427/GM/MS, de 22 de março de 2005, publicada no Diário Oficial da União, Seção 1, de 23 de março de 2005, p. 23;
XLVIII - Portaria nº 2775/GM/MS, de 22 de dezembro de 2016, publicada no Diário Oficial da União, Seção 1, de 23 de dezembro de 2016, p. 164;
XLIX - Portaria nº 1133/GM/MS, de 6 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2005, p. 23;
L - Portaria nº 1727/GM/MS, de 11 de julho de 2017, publicada no Diário Oficial da União, Seção 1, de 12 de julho de 2017, p. 47;
LI - Portaria nº 1397/GM/MS, de 7 de junho de 2017, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2017, p. 87;
LII - Portaria nº 1533/GM/MS, de 18 de agosto de 2016, publicada no Diário Oficial da União, Seção 1, de 19 de agosto de 2016, p. 55;
LIII - Portaria nº 2672/GM/MS, de 16 de novembro de 2011, publicada no Diário Oficial da União, Seção 1, de 17 de novembro de 2011, p. 84;
LIV - Portaria nº 2871/GM/MS, de 19 de novembro de 2009, publicada no Diário Oficial da União, Seção 1, de 20 de novembro de 2009, p. 119;
LV - Portaria nº 1969/GM/MS, de 25 de outubro de 2001, publicada no Diário Oficial da União, Seção 1, de 26 de outubro de 2001, p. 87;
LVI - Portaria nº 3120/GM/MS, de 1 de julho de 1998, publicada no Diário Oficial da União, Seção 1, de 2 de julho de 1998, p. 36;
LVII - Portaria nº 1339/GM/MS, de 18 de novembro de 1999, publicada no Diário Oficial da União, Seção 1, de 19 de novembro de 1999, p. 21;
LVIII - Portaria nº 776/GM/MS, de 28 de abril de 2004, publicada no Diário Oficial da União, Seção 1, de 29 de abril de 2004, p. 34;
LIX - Portaria nº 1851/GM/MS, de 9 de agosto de 2006, publicada no Diário Oficial da União, Seção 1, de 10 de agosto de 2006, p. 34;
LX - Portaria nº 1986/GM/MS, de 25 de outubro de 2001, publicada no Diário Oficial da União, Seção 1, de 26 de outubro de 2001, p. 93;
LXI - Portaria nº 2362/GM/MS, de 17 de outubro de 2012, publicada no Diário Oficial da União, Seção 1, de 18 de outubro de 2012, p. 45;
LXII - Portaria nº 2395/GM/MS, de 7 de outubro de 2009, publicada no Diário Oficial da União, Seção 1, de 9 de outubro de 2009, p. 115;
LXIII - Portaria nº 2546/GM/MS, de 27 de outubro de 2011, publicada no Diário Oficial da União, Seção 1, de 28 de outubro de 2011, p. 50;
LXIV - Portaria nº 452/GM/MS, de 4 de março de 2010, publicada no Diário Oficial da União, Seção 1, de 5 de março de 2010, p. 53;
LXV - arts. 1º a 19 da Portaria nº 2554/GM/MS, de 28 de outubro de 2011, publicada no Diário Oficial da União, Seção 1, de 31 de outubro de 2011, p. 28;
LXVI - Portaria nº 2525/GM/MS, de 29 de outubro de 2013, publicada no Diário Oficial da União, Seção 1, de 30 de outubro de 2013, p. 45;
LXVII - arts. 9º a 17 da Portaria nº 2859/GM/MS, de 29 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 30 de dezembro de 2014, p. 61;
LXVIII - Portaria nº 58/GM/MS, de 29 de janeiro de 2015, publicada no Diário Oficial da União, Seção 1, de 30 de janeiro de 2015, p. 100;
LXIX - arts. 1º a 8º, 11 e 12 da Portaria nº 1645/GM/MS, de 2 de outubro de 2015, publicada no Diário Oficial da União, Seção 1, de 5 de outubro de 2015, p. 668;
LXX - Portaria nº 1560/GM/MS, de 21 de junho de 2017, publicada no Diário Oficial da União, Seção 1, de 22 de junho de 2017, p. 31;
LXXI - arts. 1º a 3º da Portaria nº 878/GM/MS, de 8 de maio de 2002, publicada no Diário Oficial da União, Seção 1, de 10 de maio de 2002, p. 72;
LXXII - arts. 1º a 33 e 42 da Portaria nº 825/GM/MS, de 25 de abril de 2016, publicada no Diário Oficial da União, Seção 1, de 26 de abril de 2016, p. 33;
LXXIII - Portaria nº 1274/GM/MS, de 25 de junho de 2008, publicada no Diário Oficial da União, Seção 1, de 26 de junho de 2008, p. 41;
LXXIV - Portaria nº 886/GM/MS, de 20 de abril de 2010, publicada no Diário Oficial da União, Seção 1, de 22 de abril de 2010, p. 75;
LXXV - Portaria nº 1214/GM/MS, de 13 de junho de 2012, publicada no Diário Oficial da União, Seção 1, de 14 de junho de 2012, p. 29;
LXXVI - Portaria nº 599/GM/MS, de 23 de março de 2006, publicada no Diário Oficial da União, Seção 1, de 24 de março de 2006, p. 51;
LXXVII - arts. 1º a 8º, 11 e 12 da Portaria nº 1599/GM/MS, de 30 de setembro de 2015, publicada no Diário Oficial da União, Seção 1, de 2 de outubro de 2015, p. 31;
LXXVIII - arts. 1º a 3º e 5º da Portaria nº 569/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 4;
LXXIX - arts. 1º, 4º, 5º, 8º, 9º e 12 da Portaria nº 570/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 6;
LXXX - arts. 1º e 3º da Portaria nº 571/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 8;
LXXXI - arts. 1º, 2º, 5º, 8º e 10 da Portaria nº 572/GM/MS, de 1 de junho de 2000, publicada no Diário Oficial da União, Seção 1, de 8 de junho de 2000, p. 8;
LXXXII - Portaria nº 2068/GM/MS, de 21 de outubro de 2016, publicada no Diário Oficial da União, Seção 1, de 24 de outubro de 2016, p. 120;
LXXXIII - Portaria nº 3150/GM/MS, de 12 de dezembro de 2006, publicada no Diário Oficial da União, Seção 1, de 13 de dezembro de 2006, p. 111;
LXXXIV - Portaria nº 1319/GM/MS, de 23 de julho de 2002, publicada no Diário Oficial da União, Seção 1, de 24 de julho de 2002, p. 81;
LXXXV - Portaria nº 1097/GM/MS, de 22 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 23 de maio de 2006, p. 40;
LXXXVI - arts. 1º a 6º e 13 da Portaria nº 1663/GM/MS, de 6 de agosto de 2012, publicada no Diário Oficial da União, Seção 1, de 7 de agosto de 2012, p. 32;
LXXXVII - Portaria nº 1370/GM/MS, de 3 de julho de 2008, publicada no Diário Oficial da União, Seção 1, de 4 de julho de 2008, p. 192;
LXXXVIII - Portaria nº 401/GM/MS, de 16 de março de 2005, publicada no Diário Oficial da União, Seção 1, de 17 de março de 2005, p. 28;
LXXXIX - Portaria nº 1359/GM/MS, de 21 de julho de 2003, publicada no Diário Oficial da União, Seção 1, de 23 de julho de 2003, p. 45;
XC - Portaria nº 3443/GM/MS, de 11 de novembro de 2010, publicada no Diário Oficial da União, Seção 1, de 12 de novembro de 2010, p. 38;
XCI - Portaria nº 931/GM/MS, de 10 de maio de 2012, publicada no Diário Oficial da União, Seção 1, de 11 de maio de 2012, p. 140;
XCII - Portaria nº 485/GM/MS, de 1 de abril de 2014, publicada no Diário Oficial da União, Seção 1, de 2 de abril de 2014, p. 53;
XCIII - Portaria nº 1508/GM/MS, de 1 de setembro de 2005, publicada no Diário Oficial da União, Seção 1, de 2 de setembro de 2005, p. 125;
XCIV - Portaria nº 703/GM/MS, de 12 de abril de 2002, publicada no Diário Oficial da União, Seção 1, de 16 de abril de 2002, p. 28;
XCV - Portaria nº 343/GM/MS, de 7 de março de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de março de 2005, p. 39;
XCVI - Portaria nº 2583/GM/MS, de 10 de outubro de 2007, publicada no Diário Oficial da União, Seção 1, de 15 de outubro de 2007, p. 49;
XCVII - arts. 1º a 9º da Portaria nº 3189/GM/MS, de 18 de dezembro de 2009, publicada no Diário Oficial da União, Seção 1, de 23 de dezembro de 2009, p. 59;
XCVIII - Portaria nº 1111/GM/MS, de 5 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 7 de julho de 2005, p. 47;
XCIX - arts. 1º, 2º, 6º e 7º da Portaria nº 1143/GM/MS, de 7 de julho de 2005, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2005, p. 30;
C - arts. 1º a 4º, 22 a 25 da Portaria nº 1248/GM/MS, de 24 de junho de 2013, publicada no Diário Oficial da União, Seção 1, de 25 de junho de 2013, p. 31;
CI - Portaria nº 568/GM/MS, de 5 de abril de 2013, publicada no Diário Oficial da União, Seção 1, de 8 de abril de 2013, p. 55;
CII - Portaria nº 266/GM/MS, de 15 de fevereiro de 2012, publicada no Diário Oficial da União, Seção 1, de 16 de fevereiro de 2012, p. 26;
CIII - Portaria nº 2261/GM/MS, de 22 de setembro de 2006, publicada no Diário Oficial da União, Seção 1, de 26 de setembro de 2006, p. 34;
CIV - Portaria nº 2430/GM/MS, de 23 de dezembro de 2003, publicada no Diário Oficial da União, Seção 1, de 26 de dezembro de 2003, p. 26;
CV - Portaria nº 928/GM/MS, de 2 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 3 de maio de 2006, p. 44;
CVI - Portaria nº 374/GM/MS, de 28 de fevereiro de 2008, publicada no Diário Oficial da União, Seção 1, de 29 de fevereiro de 2008, p. 118;
CVII - Portaria nº 375/GM/MS, de 28 de fevereiro de 2008, publicada no Diário Oficial da União, Seção 1, de 29 de fevereiro de 2008, p. 119;
CVIII - arts. 1º a 9º da Portaria nº 506/GM/MS, de 21 de março de 2012, publicada no Diário Oficial da União, Seção 1, de 22 de março de 2012, p. 38;
CIX - Portaria nº 918/GM/MS, de 6 de julho de 2015, publicada no Diário Oficial da União, Seção 2, de 7 de julho de 2015, p. 41;
CX - Portaria nº 972/GM/MS, de 3 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 4 de maio de 2006, p. 25;
CXI - Portaria nº 2691/GM/MS, de 16 de novembro de 2011, publicada no Diário Oficial da União, Seção 1, de 17 de novembro de 2011, p. 88;
CXII - Portaria nº 973/GM/MS, de 3 de maio de 2006, publicada no Diário Oficial da União, Seção 1, de 4 de maio de 2006, p. 26;
CXIII - arts. 1º a 3º, 5º, 7º, 8º, 12 e 14 da Portaria nº 1708/GM/MS, de 16 de agosto de 2013, publicada no Diário Oficial da União, Seção 1, de 19 de agosto de 2013, p. 44;
CXIV - arts. 1º e 2º da Portaria nº 2984/GM/MS, de 27 de dezembro de 2016, publicada no Diário Oficial da União, Seção 1, de 28 de dezembro de 2016, p. 109;
CXV - Portaria nº 1311/GM/MS, de 27 de maio de 2010, publicada no Diário Oficial da União, Seção 1, de 2 de junho de 2010, p. 65;
CXVI - Portaria nº 28/GM/MS, de 8 de janeiro de 2015, publicada no Diário Oficial da União, Seção 1, de 9 de janeiro de 2015, p. 739;
CXVII - Portaria nº 158/GM/MS, de 4 de fevereiro de 2016, publicada no Diário Oficial da União, Seção 1, de 5 de fevereiro de 2016, p. 37;
CXVIII - Portaria nº 1840/GM/MS, de 13 de setembro de 1996, publicada no Diário Oficial da União, Seção 1, de 16 de setembro de 1996, p. 43;
CXIX - Portaria nº 1544/GM/MS, de 15 de outubro de 1997, publicada no Diário Oficial da União, Seção 1, de 16 de outubro de 1997, p. 92;
CXX - Portaria nº 1589/GM/MS, de 7 de julho de 2011, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2011, p. 68;
CXXI - Portaria nº 1588/GM/MS, de 7 de julho de 2011, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2011, p. 68;
CXXII - Portaria nº 1587/GM/MS, de 7 de julho de 2011, publicada no Diário Oficial da União, Seção 1, de 8 de julho de 2011, p. 67;
CXXIII - Portaria nº 1880/GM/MS, de 3 de setembro de 2012, publicada no Diário Oficial da União, Seção 1, de 4 de setembro de 2012, p. 130;
CXXIV - Portaria nº 2543/GM/MS, de 12 de novembro de 2014, publicada no Diário Oficial da União, Seção 1, de 14 de novembro de 2014, p. 145;
CXXV - Portaria nº 2545/GM/MS, de 12 de novembro de 2014, publicada no Diário Oficial da União, Seção 1, de 14 de novembro de 2014, p. 147;
CXXVI - Portaria nº 158/GM/MS, de 12 de fevereiro de 2015, publicada no Diário Oficial da União, Seção 1, de 13 de fevereiro de 2015, p. 29;
CXXVII - Portaria nº 475/GM/MS, de 17 de abril de 2015, publicada no Diário Oficial da União, Seção 1, de 20 de abril de 2015, p. 62;
CXXVIII - Portaria nº 795/GM/MS, de 17 de junho de 2015, publicada no Diário Oficial da União, Seção 1, de 19 de junho de 2015, p. 31;
CXXIX - Portaria nº 1440/GM/MS, de 18 de setembro de 2015, publicada no Diário Oficial da União, Seção 1, de 21 de setembro de 2015, p. 32;
CXXX - Portaria nº 2612/GM/MS, de 19 de novembro de 2012, publicada no Diário Oficial da União, Seção 1, de 20 de novembro de 2012, p. 24;
CXXXI - Portaria nº 1737/GM/MS, de 19 de agosto de 2004, publicada no Diário Oficial da União, Seção 1, de 23 de agosto de 2004, p. 40;
CXXXII - Portaria nº 2264/GM/MS, de 16 de outubro de 2014, publicada no Diário Oficial da União, Seção 1, de 17 de outubro de 2014, p. 52;
CXXXIII - Portaria nº 2914/GM/MS, de 12 de dezembro de 2011, publicada no Diário Oficial da União, Seção 1, de 14 de dezembro de 2011, p. 39;
CXXXIV - Portaria nº 635/GM/MS, de 26 de dezembro de 1975, publicada no Diário Oficial da União, Seção 1, de 30 de janeiro de 1976, p. 1455;
CXXXV - Portaria nº 111/GM/MS, de 28 de janeiro de 2016, publicada no Diário Oficial da União, Seção 1, de 29 de janeiro de 2016, p. 104;
CXXXVI - Portaria nº 937/GM/MS, de 7 de abril de 2017, publicada no Diário Oficial da União, Seção 1, de 10 de abril de 2017, p. 27;
CXXXVII - arts. 1º a 68, 70 a 73 da Portaria nº 184/GM/MS, de 3 de fevereiro de 2011, publicada no Diário Oficial da União, Seção 1, de 4 de fevereiro de 2011, p. 35;
CXXXVIII - Portaria nº 1550/GM/MS, de 29 de julho de 2014, publicada no Diário Oficial da União, Seção 1, de 30 de julho de 2014, p. 37;
CXXXIX - Portaria nº 2814/GM/MS, de 22 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 24 de dezembro de 2014, p. 58;
CXL - Portaria nº 2531/GM/MS, de 12 de novembro de 2014, publicada no Diário Oficial da União, Seção 1, de 13 de novembro de 2014, p. 102;
CXLI - Portaria nº 2778/GM/MS, de 18 de dezembro de 2014, publicada no Diário Oficial da União, Seção 1, de 19 de dezembro de 2014, p. 200;
CXLII - Portaria nº 1139/GM/MS, de 10 de junho de 2013, publicada no Diário Oficial da União, Seção 1, de 11 de junho de 2013, p. 22.
Art. 865. Esta Portaria entra em vigor na data de sua publicação.
RICARDO BARROS
ANEXO I
PROGRAMA DE NECESSIDADES DA ESTRUTURA FÍSICA MÍNIMA DOS POLOS DA ACADEMIA DA SAÚDE (Origem: PRT MS/GM 1707/2016, Anexo 1)
Programa de Necessidades da Estrutura Física Mínima dos Polos da Academia da Saúde
MODALIDADE BÁSICA
Constituída por área coberta de apoio, área descoberta e área de acessos, circulação e paisagismo.
| Ambientes | Quantidade mínima (unid.) | Área unitária (m²) | Área total (m²) | |
| 1 | Área coberta de apoio | 1 | 50,00 | 50,00 |
| 2 | Área descoberta | 1 | 150,00 | 150,00 |
| 3 | Área de acessos, circulação e paisagismo | 1 | 50,00 | 50,00 |
| Total | 250,00 | |||
MODALIDADE INTERMEDIÁRIA
Constituída por edificação de apoio, área descoberta e área de acessos, circulação e paisagismo.
| Ambientes | Quantidade mínima (unid.) | Área Unitária (m²) | Área Total (m²) | |
| 1 | Edificação de apoio | 1 | 63,20 | 63,20 |
| 1.1 | Sala de vivência | 1 | 45,00 | 45,00 |
| 1.2 | Depósito | 1 | 5,60 | 5,60 |
| 1.3 | Sanitário masculino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.4 | Sanitário feminino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.5 | Paredes e circulação interna | - | - | 6,20 |
| 2 | Área descoberta | 1 | 150,00 | 150,00 |
| 3 | Área de acessos, circulação e paisagismo | 1 | 50,00 | 50,00 |
| Área total | 263,20 | |||
MODALIDADE AMPLIADA
Constituída por edificação de apoio, área descoberta e área de acessos, circulação e paisagismo.
| Ambientes | Quantidade mínima (unid.) | Área Unitária (m²) | Área Total (m² | |
| 1 | Edificação de apoio | 1 | 101,20 | 101,20 |
| 1.1 | Sala de vivência | 1 | 50,00 | 50,00 |
| 1.2 | Sala de orientação | 1 | 9,00 | 9,00 |
| 1.2 | Depósito | 1 | 10,80 | 10,80 |
| 1.3 | Sanitário masculino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.4 | Sanitário feminino adaptado para pessoas com deficiência | 1 | 3,20 | 3,20 |
| 1.5 | Depósito de material de limpeza | 1 | 2,00 | 2,00 |
| 1.6 | Copa | 1 | 3,00 | 3,00 |
| 1.5 | Paredes e circulação interna | - | - | 20,00 |
| 2 | Área descoberta | 1 | 250,00 | 250,00 |
| 3 | Área de acessos, circulação e paisagismo | 1 | 100,00 | 100,00 |
| Área Total | 451,20 | |||
ANEXO II
PROGRAMA DE NECESSIDADES DOS POLOS DA ACADEMIA DA SAÚDE EQUIPAMENTOS DA ÁREA DESCOBERTA (Origem: PRT MS/GM 1707/2016, Anexo 2)
Programa de Necessidades dos Polos da Academia da Saúde Equipamentos da Área Descoberta
| Equipamentos de alvenaria* | Quantidade mínima (unid.) | |
| 1 | Barras paralelas | 1** |
| 2 | Espaldar simples | 1 |
| 3 | Banco | 3 |
| 4 | Prancha para abdominal | 2 |
| 5 | Barra horizontal tripla | 1 |
| 6 | Barras marinheiro | 2*** |
| 7 | Barra fixa de apoio | 2 |
* Os croquis dos equipamentos listados podem ser visualizados no Manual de Infraestrutura do Programa Academia da Saúde.
**Cada unidade equivale a um par de barras paralelas.
***Cada unidade equivale a um par de barras marinheiro
ANEXO III
LISTA DOS CBOS DOS PROFISSIONAIS DO PROGRAMA ACADEMIA DA SAÚDE (Origem: PRT MS/GM 1707/2016, Anexo 3)
Lista dos CBOS dos Profissionais do Programa Academia da Saúde
De acordo com a legislação vigente do Código Brasileiro de Ocupação o(s) profissional (is) do Programa Academia da Saúde deverá(ão) ser dos seguintes CBOs:
| CÓD. CBO | DESCRIÇÃO DA OCUPAÇÃO |
| 2241-E1 | PROFISSIONAL DE EDUCAÇÃO FISICA NA SAÚDE |
| 2516-05 | ASSISTENTE SOCIAL |
| 2239-05 | TERAPEUTA OCUPACIONAL |
| 2236-05 | FISIOTERAPEUTA GERAL |
| 2238-10 | FONOAUDIOLOGO GERAL |
| 2237-10 | NUTRICIONISTA |
| 2515-10 | PSICOLOGO |
| 1312-C1 | SANITARISTA |
| 5153-05 | EDUCADOR SOCIAL |
| 2263-05 | MUSICOTERAPEUTA |
| 2263-10 | ARTETERAPEUTA |
| 2628* | ARTISTAS DA DANÇA (EXCETO DANÇA TRADICIONAL E POPULAR) |
| 3761* | DANÇARINOS TRADICIONAIS E POPULARES |
Obs.: *Possibilidade de inclusão de qualquer CBO da respectiva família.
ANEXO IV
DO SANGUE, COMPONENTES E DERIVADOS (Origem: PRT MS/GM 158/2016)
TÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 158/2016, TÍTULO I)
Art. 1º Fica instituído o regulamento técnico de procedimentos hemoterápicos, nos termos do Título II. (Origem: PRT MS/GM 158/2016, Art. 1º)
Art. 2º O regulamento técnico de que trata este Anexo tem o objetivo de regulamentar a atividade hemoterápica no País, de acordo com os princípios e diretrizes da Política Nacional de Sangue, Componentes e Derivados, no que se refere à captação, proteção ao doador e ao receptor, coleta, processamento, estocagem, distribuição e transfusão do sangue, de seus componentes e derivados, originados do sangue humano venoso e arterial, para diagnóstico, prevenção e tratamento de doenças. (Origem: PRT MS/GM 158/2016, Art. 2º)
§ 1º É de observância obrigatória o presente regulamento técnico e respectivos Anexos 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 e 11 do Anexo IV por todos os órgãos e entidades, públicas e privadas, que executam atividades hemoterápicas em todo o território nacional no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN). (Origem: PRT MS/GM 158/2016, Art. 2º, § 1º)
§ 2º A manutenção de toda a cadeia produtiva do sangue depende dos valores voluntários e altruístas da sociedade para o ato da doação, devendo o candidato à doação de sangue ser atendido sob os princípios da universalidade, integralidade e equidade no âmbito do Sistema Único de Saúde (SUS). (Origem: PRT MS/GM 158/2016, Art. 2º, § 2º)
§ 3º Os serviços de hemoterapia promoverão a melhoria da atenção e acolhimento aos candidatos à doação, realizando a triagem clínica com vistas à segurança do receptor, porém com isenção de manifestações de juízo de valor, preconceito e discriminação por orientação sexual, identidade de gênero, hábitos de vida, atividade profissional, condição socioeconômica, cor ou etnia, dentre outras, sem prejuízo à segurança do receptor. (Origem: PRT MS/GM 158/2016, Art. 2º, § 3º)
Art. 3º A execução das ações de vigilância sanitária, controle de qualidade e vigilância epidemiológica no território nacional fica a cargo dos órgãos de apoio do SINASAN de que trata o art. 9º da Lei nº 10.205, de 21 de março de 2001, aos quais cabe a definição e estabelecimento da forma de realização dessas ações por meio de regulamentos próprios. (Origem: PRT MS/GM 158/2016, Art. 3º)
Art. 4º Além do cumprimento do regulamento técnico constante deste Anexo, os órgãos e entidades que executem atividades hemoterápicas observarão ainda, os requisitos sanitários para funcionamento de serviços de hemoterapia definidos pela Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 158/2016, Art. 4º)
Art. 5º Para fins deste Anexo, considera-se: (Origem: PRT MS/GM 158/2016, Art. 5º)
I - ação corretiva: atividade realizada para eliminar a causa de uma não conformidade existente ou outra situação indesejável a fim de prevenir recorrência; (Origem: PRT MS/GM 158/2016, Art. 5º, I)
II - ação preventiva: ação tomada para reduzir o potencial de não conformidades ou outras situações indesejáveis; (Origem: PRT MS/GM 158/2016, Art. 5º, II)
III - calibração: comparação das medidas realizadas por um instrumento com aquelas feitas por outro instrumento mais exato ou padrão, com o propósito de detectar, relatar e eliminar erros em medições, sendo que o instrumento padrão deve ser rastreável; (Origem: PRT MS/GM 158/2016, Art. 5º, III)
IV - camada leucoplaquetária: denominação dada à camada de células localizada na parte superior de uma amostra ou bolsa de sangue total submetida à centrifugação; (Origem: PRT MS/GM 158/2016, Art. 5º, IV)
V - cirurgia de grande porte: cirurgia com grande probabilidade de perda de fluido e sangue; (Origem: PRT MS/GM 158/2016, Art. 5º, V)
VI - contato sexual, fazer sexo ou ter relação sexual: termos que se aplicam a qualquer das seguintes atividades: (Origem: PRT MS/GM 158/2016, Art. 5º, VI)
a) sexo anal: contato entre pênis e ânus; (Origem: PRT MS/GM 158/2016, Art. 5º, VI, a)
b) sexo oral: contato entre boca ou língua com vagina, pênis ou ânus de outro/outra; e (Origem: PRT MS/GM 158/2016, Art. 5º, VI, b)
c) sexo vaginal: contato entre pênis e vagina; (Origem: PRT MS/GM 158/2016, Art. 5º, VI, c)
VII - doação autóloga: doação do próprio paciente para seu uso exclusivo; (Origem: PRT MS/GM 158/2016, Art. 5º, VIII)
VIII - doação de reposição: doação advinda do indivíduo que doa para atender à necessidade de um paciente, feitas por pessoas motivadas pelo próprio serviço, família ou amigos dos receptores de sangue para repor o estoque de componentes sanguíneos do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, IX)
IX - doação espontânea: doação feita por pessoas motivadas para manter o estoque de sangue do serviço de hemoterapia, decorrente de um ato de altruísmo, sem identificação do nome do possível receptor; (Origem: PRT MS/GM 158/2016, Art. 5º, X)
X - doador apto: doador cujos dados pessoais, condições clínicas, laboratoriais e epidemiológicas se encontram em conformidade com os critérios de aceitação vigentes para doação de sangue; (Origem: PRT MS/GM 158/2016, Art. 5º, XI)
XI - doador associado com TRALI: o doador cujo componente sanguíneo foi transfundido durante as 6 (seis) horas precedentes à primeira manifestação clínica de TRALI; (Origem: PRT MS/GM 158/2016, Art. 5º, XII)
XII - doador de primeira vez: é aquele indivíduo que doa pela primeira vez naquele serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, XIII)
XIII - doador de repetição: doador que realiza 2 (duas) ou mais doações no período de 12 (doze) meses; (Origem: PRT MS/GM 158/2016, Art. 5º, XIV)
XIV - doador esporádico: doador que repete a doação após intervalo superior a 12 (doze) meses da última doação; (Origem: PRT MS/GM 158/2016, Art. 5º, XV)
XV - doador implicado em TRALI: doador no qual são encontrados anticorpos anti-HLA classe I ou II ou anti-HNA ou ambos, sendo que este anticorpo deve ter especificidade para um antígeno presente nos leucócitos do receptor ou deve haver uma reação positiva entre o soro do doador e os leucócitos do receptor (prova cruzada positiva); (Origem: PRT MS/GM 158/2016, Art. 5º, XVI)
XVI - doador inapto definitivo: doador que nunca poderá doar sangue para outra pessoa, podendo, em alguns casos, realizar doação autóloga; (Origem: PRT MS/GM 158/2016, Art. 5º, XVII)
XVII - doador inapto por tempo indeterminado: doador que se encontra impedido de doar sangue para outra pessoa por um período indefinido de tempo segundo as normas regulatórias vigentes, mas apto a realizar doação autóloga; (Origem: PRT MS/GM 158/2016, Art. 5º, XVIII)
XVIII - doador inapto temporário: doador que se encontra impedido de doar sangue para outra pessoa por determinado período de tempo, podendo realizar doação autóloga quando possível e necessário; (Origem: PRT MS/GM 158/2016, Art. 5º, XIX)
XIX - documento oficial com fotografia: diz respeito à Carteira de Identidade, Carteira Nacional de Habilitação, Carteira de Trabalho, Passaporte, Registro Nacional de Estrangeiro, Certificado de Reservista e Carteira Profissional emitida por classe, sendo aceitas fotocópias autenticadas desde que as fotos e inscrições estejam legíveis e as imagens permitam a identificação do portador; (Origem: PRT MS/GM 158/2016, Art. 5º, XX)
XX - equipamento crítico: equipamento que pode afetar a qualidade dos produtos ou serviços críticos do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, XXI)
XXI - fornecedor: pessoa física ou jurídica que fornece um produto ou serviço à organização; (Origem: PRT MS/GM 158/2016, Art. 5º, XXII)
XXII - manutenção corretiva: são reparos de defeitos funcionais ocorridos durante a utilização do equipamento; (Origem: PRT MS/GM 158/2016, Art. 5º, XXIII)
XXIII - manutenção preventiva: é a manutenção que visa manter o equipamento dentro de condições normais de utilização com o objetivo de serem reduzidas as possibilidades de ocorrência de defeitos por desgaste ou envelhecimento de seus componentes; (Origem: PRT MS/GM 158/2016, Art. 5º, XXIV)
XXIV - material ou insumo crítico: item de material ou insumo que pode afetar a qualidade dos produtos ou serviços críticos da instituição; (Origem: PRT MS/GM 158/2016, Art. 5º, XXV)
XXV - não conformidade: falha em atingir requisitos previamente especificados; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVI)
XXVI - procedimentos operacionais (PO): documentos detalhados baseados em processos e procedimentos que refletem a prática atual da instituição e visam sua padronização, apresentados, geralmente, em módulos, além de incluírem as atividades de "Boas Práticas de Fabricação (BPF)" e as especificações necessárias; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVII)
XXVII - qualificação: etapa do processo de validação que corresponde à ação de verificação que uma pessoa, equipamento ou material trabalha corretamente e produz os resultados esperados; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVIII)
XXVIII - qualificação de pessoas: aspectos da educação, treinamento e experiência de um indivíduo, necessários para preencher com sucesso os requisitos de determinada função; (Origem: PRT MS/GM 158/2016, Art. 5º, XXIX)
XXIX - qualificação de fornecedores: método de avaliação utilizado para assegurar que os materiais, equipamentos, insumos ou serviços obtidos de determinado fornecedor atendem a requisitos especificados pela instituição; (Origem: PRT MS/GM 158/2016, Art. 5º, XXX)
XXX - rastreabilidade: habilidade de seguir a história, aplicação ou localização de um produto ou serviço por meio da identificação de registros; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXI)
XXXI - registros obrigatórios: registros relacionados diretamente com o cadastro e triagem de doadores de sangue, procedimentos de coleta, preparo e modificação dos componentes sanguíneos, exames de qualificação do sangue do doador e dos procedimentos pré-transfusionais, da transfusão e das complicações relacionadas a transfusões, permitindo, desta forma, a completa rastreabilidade do processo; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXII)
XXXII - remessa de insumo ou reagente: cada entrega do insumo ou reagente recebida pelo serviço de hemoterapia, podendo ser composta por 1 (um) ou mais lotes de um mesmo produto; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXIII)
XXXIII - retrovigilância: parte da hemovigilância que trata da investigação retrospectiva relacionada à rastreabilidade das bolsas de doações anteriores de um doador que apresentou viragem de um marcador (soroconversão) ou relacionada a um receptor de sangue que veio a apresentar marcador positivo para uma doença transmissível, termo também aplicável em casos de detecção de positividade em análises microbiológicas de componentes sanguíneos e investigação de quadros infecciosos bacterianos em receptores, sem manifestação imediata, mas potencialmente imputados à transfusão; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXIV)
XXXIV - serviço crítico: serviço que pode afetar a qualidade dos produtos ou serviços críticos da instituição; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXV)
XXXV - serviço de hemoterapia: estabelecimento de saúde que desenvolve atividades de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXVI)
XXXVI - serviços de saúde ou instituição de assistência à saúde: todos os serviços relacionados ao atendimento à saúde; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXVII)
XXXVII - sistema ou circuito aberto: sistema que não permite a preparação e separação de componentes sanguíneos sem a exposição de seu conteúdo ao ar ou a elementos externos; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXVIII)
XXXVIII - sistema ou circuito fechado: sistema que permite a preparação e separação de componentes sanguíneos sem a exposição de seu conteúdo ao ar ou a elementos externos; (Origem: PRT MS/GM 158/2016, Art. 5º, XXXIX)
XXXIX - sistema de qualidade: estrutura organizacional, responsabilidades, políticas, processos, procedimentos e recursos estabelecidos pela diretoria-executiva da instituição para atingir a política de qualidade; (Origem: PRT MS/GM 158/2016, Art. 5º, XL)
XL - solução aditiva: solução adicionada a componentes celulares para manutenção de suas propriedades durante o armazenamento; (Origem: PRT MS/GM 158/2016, Art. 5º, XLI)
XLI - temperatura ambiente: é a temperatura situada entre 15°C e 30°C; (Origem: PRT MS/GM 158/2016, Art. 5º, XLII)
XLII - teste de proficiência: avaliação externa estruturada a partir dos métodos de laboratório que verifica a "adequabilidade" de processos, procedimentos, equipamentos, fornecedores e reagentes; (Origem: PRT MS/GM 158/2016, Art. 5º, XLIII)
XLIII - TRALI: sigla em inglês para "transfusional related acute lung injury", que significa lesão pulmonar aguda associada à transfusão; e (Origem: PRT MS/GM 158/2016, Art. 5º, XLIV)
XLIV - validação: demonstração por meio de documentação e evidências objetivas em que requisitos pré-definidos para procedimentos ou processos específicos são consistentemente atendidos. (Origem: PRT MS/GM 158/2016, Art. 5º, XLV)
TÍTULO II
DO REGULAMENTO TÉCNICO DE PROCEDIMENTOS HEMOTERÁPICOS
(Origem: PRT MS/GM 158/2016, TÍTULO II)
CAPÍTULO I
DO SANGUE E SEUS COMPONENTES
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I)
Seção I
Dos Princípios Gerais
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção I)
Art. 6º A transfusão de sangue e seus componentes deve ser utilizada criteriosamente na medicina, uma vez que toda transfusão traz em si um risco ao receptor, seja imediato ou tardio, devendo ser indicada de forma criteriosa. (Origem: PRT MS/GM 158/2016, Art. 6º)
Parágrafo Único. A indicação de transfusão de sangue poderá ser objeto de análise e aprovação pela equipe médica do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 6º, Parágrafo Único)
Art. 7º Nas cirurgias eletivas deverão ser consideradas ações que reduzam o consumo de componentes sanguíneos alogênicos, como métodos que diminuam o sangramento no intraoperatório ou a realização de transfusão autóloga. (Origem: PRT MS/GM 158/2016, Art. 7º)
Art. 8º A responsabilidade técnica pelo serviço de hemoterapia ficará a cargo de um médico especialista em hemoterapia e/ou hematologia ou qualificado por órgão competente devidamente reconhecido para este fim pelo Coordenador do Sistema Estadual de Sangue, Componentes e Derivados. (Origem: PRT MS/GM 158/2016, Art. 8º)
Parágrafo Único. Cabe ao médico responsável técnico a responsabilidade final por todas as atividades médicas e técnicas que incluam o cumprimento das normas técnicas e a determinação da adequação das indicações da transfusão de sangue e de componentes. (Origem: PRT MS/GM 158/2016, Art. 8º, Parágrafo Único)
Art. 9º As atividades técnicas realizadas no serviço de hemoterapia que não estejam especificamente consideradas por este Anexo serão aprovadas pelo responsável técnico da instituição de assistência à saúde. (Origem: PRT MS/GM 158/2016, Art. 9º)
Art. 10. Nos serviços de hemoterapia de maior complexidade, como o Hemocentro Coordenador, a responsabilidade administrativa será de profissional qualificado. (Origem: PRT MS/GM 158/2016, Art. 10)
Parágrafo Único. O profissional qualificado de que trata o "caput" possuirá, preferencialmente, formação de nível superior em qualquer área de conhecimento e com experiência em administração ou gestão de serviços de saúde. (Origem: PRT MS/GM 158/2016, Art. 10, Parágrafo Único)
Art. 11. As instituições de assistência à saúde que realizem intervenções cirúrgicas de grande porte, atendimentos de urgência e emergência ou que efetuem mais de 60 (sessenta) transfusões por mês devem contar com, pelo menos, uma Agência Transfusional (AT). (Origem: PRT MS/GM 158/2016, Art. 11)
§ 1º As instituições de assistência à saúde que não se enquadrem nos critérios estabelecidos no "caput", mas cujo tempo de viabilização do procedimento transfusional, a exemplo do tempo entre coleta de amostra, preparo e instalação do componente sanguíneo, comprometer a assistência ao paciente, deverão buscar alternativas para minimizar esse risco e garantir o suporte hemoterápico necessário. (Origem: PRT MS/GM 158/2016, Art. 11, § 1º)
§ 2º A mesma conduta de que trata o § 1º deverá ser tomada em unidades de assistência à saúde que realizam procedimentos obstétricos. (Origem: PRT MS/GM 158/2016, Art. 11, § 2º)
§ 3º Toda instituição de assistência à saúde que possa, potencialmente, utilizar sangue e componentes sanguíneos terá convênio, contrato ou termo de compromisso formalizado com um serviço de hemoterapia de referência para assistência hemoterápica, conforme descrito no art. 272, sem prejuízo de outras normas aplicáveis. (Origem: PRT MS/GM 158/2016, Art. 11, § 3º)
Art. 12. Toda instituição de assistência à saúde que realiza transfusão de sangue e componentes sanguíneos comporá ou fará parte de um Comitê Transfusional. (Origem: PRT MS/GM 158/2016, Art. 12)
§ 1º É competência do Comitê Transfusional o monitoramento da prática hemoterápica na instituição de assistência à saúde visando o uso racional do sangue, a atividade educacional continuada em hemoterapia, a hemovigilância e a elaboração de protocolos de atendimento da rotina hemoterápica. (Origem: PRT MS/GM 158/2016, Art. 12, § 1º)
§ 2º Os serviços de hemoterapia e as instituições de assistência à saúde que possuam Agências Transfusionais constituirão seus próprios Comitês Transfusionais. (Origem: PRT MS/GM 158/2016, Art. 12, § 2º)
§ 3º A constituição do Comitê Transfusional será compatível e adequar-se-á às necessidades e complexidades de cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 12, § 3º)
§ 4º As instituições de assistência à saúde que não possuam Agência Transfusional participarão das atividades do Comitê Transfusional do serviço de hemoterapia que as assiste ou constituirão Comitê Transfusional próprio. (Origem: PRT MS/GM 158/2016, Art. 12, § 4º)
Art. 13. O serviço de hemoterapia colaborará com as atividades dos Comitês Transfusionais das instituições de assistência à saúde para as quais forneça componentes sanguíneos para atividade transfusional, de elaboração e implementação de protocolos para controlar as indicações, o uso e o descarte dos componentes sanguíneos, quando solicitado. (Origem: PRT MS/GM 158/2016, Art. 13)
Art. 14. O serviço de hemoterapia possuirá equipe profissional, constituída por pessoal técnico e administrativo, suficiente e competente, sob a supervisão do responsável técnico e administrativo. (Origem: PRT MS/GM 158/2016, Art. 14)
Parágrafo Único. A equipe profissional de que trata o "caput" adequar-se-á às necessidades e complexidades de cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 14, Parágrafo Único)
Art. 15. Os supervisores técnicos das áreas do serviço de hemoterapia possuirão registro profissional no respectivo conselho de classe, requisito para o exercício da profissão. (Origem: PRT MS/GM 158/2016, Art. 15)
Art. 16. O serviço de hemoterapia possuirá ambiente e equipamentos adequados para que as diferentes atividades possam ser realizadas segundo as boas práticas de produção e/ou manipulação. (Origem: PRT MS/GM 158/2016, Art. 16)
Art. 17. O serviço de hemoterapia implementará programas destinados a minimizar os riscos para a saúde e garantir a segurança dos receptores, dos doadores e dos seus funcionários. (Origem: PRT MS/GM 158/2016, Art. 17)
Art. 18. Cada serviço de hemoterapia manterá um conjunto de procedimentos operacionais, técnicos e administrativos para cada área técnica e administrativa. (Origem: PRT MS/GM 158/2016, Art. 18)
§ 1º Os procedimentos operacionais serão elaborados pelas áreas técnicas e administrativas pertinentes, incluindo as medidas de biossegurança. (Origem: PRT MS/GM 158/2016, Art. 18, § 1º)
§ 2º Os procedimentos operacionais deverão ser aprovados pelos responsáveis técnicos dos setores relacionados e pelo responsável técnico do serviço de hemoterapia ou conforme determinado pelo programa de garantia de qualidade de cada instituição de saúde, em conformidade com o manual da qualidade válido da própria instituição. (Origem: PRT MS/GM 158/2016, Art. 18, § 2º)
§ 3º Os procedimentos operacionais de que trata o "caput" serão disponibilizados a todos os funcionários do respectivo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 18, § 3º)
§ 4º O cumprimento das disposições contidas nos procedimentos operacionais de que trata o "caput" é obrigatório a todo o pessoal atuante no serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 18, § 4º)
§ 5º Os procedimentos operacionais de que trata o "caput" serão avaliados anualmente quanto à adequação e à atualização, quando apropriado. (Origem: PRT MS/GM 158/2016, Art. 18, § 5º)
§ 6º A introdução de novas técnicas no serviço de hemoterapia será precedida de avaliação e validação dos procedimentos para assegurar os critérios de qualidade. (Origem: PRT MS/GM 158/2016, Art. 18, § 6º)
Art. 19. Os responsáveis, técnicos e administrativos, com apoio da direção do serviço de hemoterapia, assegurarão que todas as normas e procedimentos sejam apropriadamente divulgados e executados. (Origem: PRT MS/GM 158/2016, Art. 19)
Parágrafo Único. Deverá ser garantido o aprovisionamento no serviço de hemoterapia de todos os insumos necessários para a realização das suas atividades. (Origem: PRT MS/GM 158/2016, Art. 19, Parágrafo Único)
Art. 20. Os materiais e substâncias que entrarem diretamente em contato com o sangue ou componentes a serem transfundidos em humanos serão estéreis, apirogênicos e descartáveis. (Origem: PRT MS/GM 158/2016, Art. 20)
Parágrafo Único. Os materiais, equipamentos, substâncias e insumos industrializados, como bolsas, equipos de transfusão, seringas, filtros, conjuntos de aférese, agulhas, anticoagulantes, dentre outros, utilizados para a coleta, preservação, processamento, armazenamento e transfusão do sangue e seus componentes, assim como os reagentes usados para a triagem de infecções transmissíveis pelo sangue e para os testes imuno-hematológicos, devem satisfazer as normas vigentes e estarem registrados ou autorizados para uso pela autoridade sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 20, Parágrafo Único)
Art. 21. É permitida ao serviço de hemoterapia a produção e utilização de reagentes para testes imuno-hematológicos, desde que exista autorização da ANVISA, conforme dispõe o art. 6º da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Art. 21)
Parágrafo Único. A autorização da ANVISA a que se refere o "caput" não se aplica aos reagentes de controles laboratoriais internos e soros raros. (Origem: PRT MS/GM 158/2016, Art. 21, Parágrafo Único)
Art. 22. O serviço de hemoterapia estabelecerá um programa laboratorial de controle de qualidade interno e participará de programa laboratorial de controle de qualidade externo (proficiência), para assegurar que as normas e os procedimentos sejam apropriadamente executados e que os equipamentos, materiais e reagentes funcionem corretamente. (Origem: PRT MS/GM 158/2016, Art. 22)
Art. 23. Os registros obrigatórios definidos por este Anexo serão guardados pela instituição de saúde por um período mínimo de 20 (vinte) anos. (Origem: PRT MS/GM 158/2016, Art. 23)
Art. 24. Os registros e documentos referentes às atividades desenvolvidas pelo serviço de hemoterapia deverão possibilitar a identificação do técnico responsável pela execução da atividade. (Origem: PRT MS/GM 158/2016, Art. 24)
Art. 25. O serviço de hemoterapia informará à autoridade sanitária competente, obrigatoriamente, qualquer ocorrência de investigação decorrente de casos de soroconversão. (Origem: PRT MS/GM 158/2016, Art. 25)
Art. 26. Os dados de produção dos serviços de hemoterapia referentes às atividades hemoterápicas serão disponibilizados nos respectivos serviços de hemoterapia e ao Ministério da Saúde, aos órgãos de controle e aos órgãos e entidades públicas de vigilância sanitária, na forma definida por esses órgãos e entidades. (Origem: PRT MS/GM 158/2016, Art. 26)
Art. 27. Compete ao coordenador do SINASAN definir a forma de utilização do plasma congelado excedente do uso terapêutico dos serviços de hemoterapia públicos e privados, com vistas ao atendimento de interesse nacional, conforme previsto no § 2º do art. 14 da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Art. 27)
§ 1º Não é permitida ao serviço de hemoterapia, público ou privado, a disponibilização de plasma para indústria de hemoderivados ou de componentes sanguíneos especiais, nacional ou internacional, sem a autorização expressa, por escrito, do Ministério da Saúde. (Origem: PRT MS/GM 158/2016, Art. 27, § 1º)
§ 2º Para o envio de plasma excedente do uso terapêutico e obtido por plasmaférese para indústria de hemoderivados, deve existir autorização do Ministério da Saúde, conforme o disposto no Anexo 11 do Anexo IV e outras determinações deste Anexo. (Origem: PRT MS/GM 158/2016, Art. 27, § 2º)
§ 3º Serão estabelecidos, nas formas definidas no Anexo 11 do Anexo IV , por meio de critérios técnicos, os serviços de hemoterapia que serão fornecedores de plasma para a indústria de hemoderivados, conforme a viabilidade e a capacidade operacional, além da competência técnica do serviço de hemoterapia para fornecer matéria-prima. (Origem: PRT MS/GM 158/2016, Art. 27, § 3º)
§ 4º Caso não haja solicitação do serviço de hemoterapia ou autorização do Ministério da Saúde nos termos deste artigo para disponibilização dos estoques excedentes de plasma para a produção industrial por um período de 1 (um) ano, a partir da sua produção, o serviço de hemoterapia definirá medidas quanto à manutenção ou eliminação dos componentes sanguíneos em seus estoques. (Origem: PRT MS/GM 158/2016, Art. 27, § 4º)
Art. 28. Em caso de envio do plasma para beneficiamento no exterior, conforme estabelecido no inciso VIII do art. 16 da Lei nº 10.205, de 2001, a indústria produtora deverá obter, junto à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS), autorização para exportação do plasma, observando, ainda, o disposto no § 1º do art. 14 e no parágrafo único do art. 22 do referido diploma legal. (Origem: PRT MS/GM 158/2016, Art. 28)
Art. 29. Não é permitido o envio de sangue, componentes e derivados como matéria-prima para a utilização na produção de reagentes de diagnóstico ou painéis de controle de qualidade, para indústria nacional ou internacional, de natureza pública ou privada, ou laboratório sem autorização formal prévia da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 158/2016, Art. 29)
§ 1º A autorização de que trata o "caput" observará às seguintes medidas: (Origem: PRT MS/GM 158/2016, Art. 29, § 1º)
I - o serviço de hemoterapia componente do SINASAN, público ou privado, que pretende enviar sangue, componentes e derivados para a produção de reagentes de diagnóstico ou painéis para indústria ou laboratórios, deve solicitar à CGSH/DAET/SAS/MS autorização para o fornecimento, informando previsão da quantidade a ser enviada no ano e destino, para fins de cadastro e credenciamento; (Origem: PRT MS/GM 158/2016, Art. 29, § 1º, I)
II - a CGSH/DAET/SAS/MS avaliará a solicitação e, se pertinente, credenciará o serviço de hemoterapia e emitirá autorização anual de fornecimento de matéria-prima para a produção de reagentes de diagnóstico e painéis de controle de qualidade à indústria ou laboratório informado, por ofício; e (Origem: PRT MS/GM 158/2016, Art. 29, § 1º, II)
III - anualmente, o serviço de hemoterapia apresentará à CGSH/DAET/SAS/MS relatório dos fornecimentos, que será requisito para a renovação da autorização para o ano seguinte. (Origem: PRT MS/GM 158/2016, Art. 29, § 1º, III)
§ 2º O envio de sangue, componentes e derivados pelo serviço de hemoterapia, como insumo para a utilização em pesquisa, será notificado à CGSH/DAET/SAS/MS, informando o número das bolsas, instituição a que foram enviadas e a finalidade a que se destinam. (Origem: PRT MS/GM 158/2016, Art. 29, § 2º)
§ 3º Os fornecimentos citados nos §§ 1º e 2º poderão ser encaminhados à ANVISA a fim de realizar os procedimentos de vigilância sanitária cabíveis. (Origem: PRT MS/GM 158/2016, Art. 29, § 3º)
Seção II
Da Doação de Sangue
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção II)
Art. 30. A doação de sangue deve ser voluntária, anônima e altruísta, não devendo o doador, de forma direta ou indireta, receber qualquer remuneração ou benefício em virtude da sua realização. (Origem: PRT MS/GM 158/2016, Art. 30)
Art. 31. O sigilo das informações prestadas pelo doador antes, durante e depois do processo de doação de sangue deve ser absolutamente preservado, respeitadas outras determinações previstas na legislação vigente. (Origem: PRT MS/GM 158/2016, Art. 31)
§ 1º Os resultados dos testes de triagem laboratorial serão fornecidos mediante solicitação do doador. (Origem: PRT MS/GM 158/2016, Art. 31, § 1º)
§ 2º Os resultados dos testes de triagem laboratorial somente poderão ser entregues ao próprio doador ou, mediante apresentação de procuração, a terceiros. (Origem: PRT MS/GM 158/2016, Art. 31, § 2º)
Art. 32. O candidato à doação de sangue deve assinar termo de consentimento livre e esclarecido, no qual declara expressamente consentir: (Origem: PRT MS/GM 158/2016, Art. 32)
I - em doar o seu sangue para utilização em qualquer paciente que dele necessite; (Origem: PRT MS/GM 158/2016, Art. 32, I)
II - a realização de todos os testes de laboratório exigidos pelas leis e normas técnicas vigentes; (Origem: PRT MS/GM 158/2016, Art. 32, II)
III - que o seu nome seja incorporado a arquivo de doadores, local e nacional; (Origem: PRT MS/GM 158/2016, Art. 32, III)
IV - que em caso de resultados reagentes ou inconclusivos nas triagens laboratoriais, ou em situações de retrovigilância, seja permitida a "busca ativa" pelo serviço de hemoterapia ou por órgão de vigilância em saúde para repetição de testes ou testes confirmatórios e de diagnóstico; e (Origem: PRT MS/GM 158/2016, Art. 32, IV)
V - que os componentes sanguíneos produzidos a partir da sua doação, quando não utilizado em transfusão, possam ser utilizados em produção de reagentes e hemoderivados ou como insumos para outros procedimentos, autorizados legalmente. (Origem: PRT MS/GM 158/2016, Art. 32, V)
§ 1º A utilização de qualquer material proveniente da doação de sangue para pesquisas somente será permitida segundo as normas que regulamentam a ética em pesquisa no Brasil. (Origem: PRT MS/GM 158/2016, Art. 32, § 1º)
§ 2º Previamente à assinatura do termo de consentimento, devem ser prestadas informações ao candidato à doação, com linguagem compreensível, sobre as características do processo de doação, o destino do sangue doado, os riscos associados à doação, os testes que serão realizados em seu sangue para detectar infecções e a possibilidade da ocorrência de resultados falsos-reagentes nesses testes de triagem. (Origem: PRT MS/GM 158/2016, Art. 32, § 2º)
§ 3º Ao candidato à doação deve ser oferecida a oportunidade de fazer todas as perguntas que julgar necessárias para esclarecer suas dúvidas a respeito do procedimento e negar seu consentimento, se assim lhe aprouver. (Origem: PRT MS/GM 158/2016, Art. 32, § 3º)
Art. 33. É obrigatória a disponibilização ao candidato à doação de material informativo sobre as condições básicas para a doação e sobre as infecções transmissíveis pelo sangue. (Origem: PRT MS/GM 158/2016, Art. 33)
Parágrafo Único. O material de que trata o "caput" explicitará a importância de suas respostas na triagem clínica e os riscos de transmissão de enfermidades infecciosas pela transfusão de sangue. (Origem: PRT MS/GM 158/2016, Art. 33, Parágrafo Único)
Art. 34. O serviço de hemoterapia deve garantir o acesso à doação de sangue aos portadores de necessidades especiais segundo as normas gerais para doadores de sangue estabelecidas neste Anexo, inclusive com a disponibilização de materiais informativos e questionários adaptados a essas necessidades, proporcionando condições de entendimento na triagem clínica e outras medidas que se fizerem necessárias. (Origem: PRT MS/GM 158/2016, Art. 34)
Art. 35. Como critério para a seleção dos doadores, no dia da doação o profissional de saúde de nível superior, qualificado, capacitado, conhecedor das regras previstas neste Anexo e sob supervisão médica, avaliará os antecedentes e o estado atual do candidato a doador para determinar se a coleta pode ser realizada sem causar prejuízo ao doador e se a transfusão dos componentes sanguíneos preparados a partir dessa doação pode vir a causar risco para os receptores. (Origem: PRT MS/GM 158/2016, Art. 35)
Parágrafo Único. A avaliação de que trata o "caput" será realizada por meio de entrevista individual, em ambiente que garanta a privacidade e o sigilo das informações prestadas, sendo mantido o registro em meio eletrônico ou físico da entrevista. (Origem: PRT MS/GM 158/2016, Art. 35, Parágrafo Único)
Art. 36. Com a finalidade de proteger os doadores, serão adotadas, tanto no momento da seleção de candidatos quanto no momento da doação, as seguintes medidas e critérios estabelecidos neste regulamento: (Origem: PRT MS/GM 158/2016, Art. 36)
I - a frequência anual máxima de doações e o intervalo mínimo entre as doações; (Origem: PRT MS/GM 158/2016, Art. 36, I)
II - as idades mínima e máxima para doação; (Origem: PRT MS/GM 158/2016, Art. 36, II)
III - a massa corpórea mínima; (Origem: PRT MS/GM 158/2016, Art. 36, III)
IV - a aferição do pulso; (Origem: PRT MS/GM 158/2016, Art. 36, IV)
V - a aferição da pressão arterial; (Origem: PRT MS/GM 158/2016, Art. 36, V)
VI - os níveis de hematócrito/hemoglobina; (Origem: PRT MS/GM 158/2016, Art. 36, VI)
VII - a história médica e os antecedentes patológicos do doador; (Origem: PRT MS/GM 158/2016, Art. 36, VII)
VIII - a utilização de medicamentos; (Origem: PRT MS/GM 158/2016, Art. 36, VIII)
IX - as hipóteses de gestação, lactação, abortamento e menstruação; (Origem: PRT MS/GM 158/2016, Art. 36, IX)
X - o jejum e a alimentação adequada; (Origem: PRT MS/GM 158/2016, Art. 36, X)
XI - o consumo de bebidas alcoólicas; (Origem: PRT MS/GM 158/2016, Art. 36, XI)
XII - os episódios alérgicos; (Origem: PRT MS/GM 158/2016, Art. 36, XII)
XIII - as ocupações habituais; e (Origem: PRT MS/GM 158/2016, Art. 36, XIII)
XIV - o volume a ser coletado. (Origem: PRT MS/GM 158/2016, Art. 36, XIV)
Art. 37. A frequência máxima admitida é de 4 (quatro) doações anuais para o homem e de 3 (três) doações anuais para a mulher, exceto em circunstâncias especiais, que devem ser avaliadas e aprovadas pelo responsável técnico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 37)
§ 1º O intervalo mínimo entre doações deve ser de 2 (dois) meses para os homens e de 3 (três) meses para as mulheres. (Origem: PRT MS/GM 158/2016, Art. 37, § 1º)
§ 2º Em caso de doador autólogo, a frequência e o intervalo entre as doações devem ser programados de acordo com o protocolo aprovado pelo responsável técnico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 37, § 2º)
Art. 38. O doador de sangue ou componentes deverá ter idade entre 16 (dezesseis) anos completos e 69 (sessenta e nove) anos, 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 158/2016, Art. 38)
§ 1º Os candidatos à doação de sangue com idade entre 16 (dezesseis) e 17 (dezessete) anos devem possuir consentimento formal, por escrito, do seu responsável legal para cada doação que realizar. (Origem: PRT MS/GM 158/2016, Art. 38, § 1º)
§ 2º O consentimento do responsável legal de que trata o § 1º deve incluir a autorização para o cumprimento de todas as exigências e responsabilidades estabelecidas aos demais doadores na Seção II do Capítulo I do Título II, bem como para submeter-se a triagem clínica e realizar e receber os resultados da triagem laboratorial na forma prevista nos arts. 67 e 68 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 38, § 2º)
§ 3º Os resultados dos testes de triagem laboratorial do doador somente serão entregues ao próprio doador, na forma prevista neste Anexo, não sendo permitida a entrega a terceiros, mesmo aos responsáveis legais, exceto quando houver procuração, nos termos do art. 31, § 2º . (Origem: PRT MS/GM 158/2016, Art. 38, § 3º)
§ 4º Em casos de necessidades tecnicamente justificáveis, o candidato cuja idade seja inferior a 16 (dezesseis) anos ou igual ou superior a 70 (setenta) anos será aceito para fins de doação após análise pelo médico do serviço de hemoterapia, com avaliação dos riscos e benefícios e apresentação de relatório que justifique a necessidade da doação, registrando-a na ficha do doador. (Origem: PRT MS/GM 158/2016, Art. 38, § 4º)
§ 5º O limite para a primeira doação será de 60 (sessenta) anos, 11 (onze) meses e 29 (vinte e nove) dias. (Origem: PRT MS/GM 158/2016, Art. 38, § 5º)
Art. 39. Para ser selecionado para doação, o candidato deve ter, no mínimo, peso de 50 kg (cinquenta quilogramas). (Origem: PRT MS/GM 158/2016, Art. 39)
§ 1º Candidatos com peso abaixo de 50 kg (cinquenta quilogramas) poderão ser aceitos para fins de doação, após avaliação médica, desde que o volume do anticoagulante na bolsa de coleta seja proporcional ao volume a ser coletado, respeitadas as demais determinações da Seção III do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 39, § 1º)
§ 2º Não serão selecionados os candidatos à doação que apresentarem perda de peso inexplicável superior a 10% (dez por cento) da massa corporal nos 3 (três) meses que antecederem à doação. (Origem: PRT MS/GM 158/2016, Art. 39, § 2º)
Art. 40. Na aferição do pulso do candidato, a pulsação deverá apresentar características normais, ser regular e sua frequência não deve ser menor que 50 (cinquenta) nem maior que 100 (cem) batimentos por minuto. (Origem: PRT MS/GM 158/2016, Art. 40)
Parágrafo Único. A aceitação de doadores com pulso irregular ou com frequência fora dos limites estabelecidos no "caput" dependerá de avaliação médica. (Origem: PRT MS/GM 158/2016, Art. 40, Parágrafo Único)
Art. 41. Na aferição da pressão arterial do candidato, a pressão sistólica não deve ser maior que 180 mmHg (cento e oitenta milímetros de mercúrio) e a pressão diastólica não deve ser maior que 100 mmHg (cem milímetros de mercúrio). (Origem: PRT MS/GM 158/2016, Art. 41)
Parágrafo Único. Doadores com limite de pressão arterial fora dos parâmetros estabelecidos no "caput" somente serão considerados aptos para doação após avaliação médica qualificada. (Origem: PRT MS/GM 158/2016, Art. 41, Parágrafo Único)
Art. 42. No momento da seleção, será determinada a concentração de hemoglobina (Hb) ou de hematócrito (Ht) em amostra de sangue do candidato à doação obtida por punção digital ou por venopunção ou por método validado que possa vir a substituí-los. (Origem: PRT MS/GM 158/2016, Art. 42)
§ 1º Os valores mínimos aceitáveis do nível de hemoglobina/hematócrito são: (Origem: PRT MS/GM 158/2016, Art. 42, § 1º)
I - mulheres: Hb =12,5g/dL ou Ht =38%; e (Origem: PRT MS/GM 158/2016, Art. 42, § 1º, I)
II - homens: Hb =13,0g/dL ou Ht =39%. (Origem: PRT MS/GM 158/2016, Art. 42, § 1º, II)
§ 2º O candidato que apresente níveis de Hb igual ou maior que 18,0g/dL ou Ht igual ou maior que 54% será impedido de doar e encaminhado para investigação clínica. (Origem: PRT MS/GM 158/2016, Art. 42, § 2º)
Art. 43. Serão avaliados a história médica e os antecedentes patológicos do doador segundo as doenças e antecedentes que contraindicam definitiva ou temporariamente a doação de sangue constantes dos Anexos 1 e 2 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 43)
Art. 44. A história terapêutica recente, em relação ao uso de medicamentos pelo candidato, receberá avaliação especial por parte do médico, uma vez que a indicação quanto ao próprio tratamento pode motivar a inaptidão do candidato à doação. (Origem: PRT MS/GM 158/2016, Art. 44)
§ 1º Cada medicamento será avaliado individualmente e em conjunto e, sempre que possa apresentar alguma correlação com a doação de sangue, registrado na ficha de triagem. (Origem: PRT MS/GM 158/2016, Art. 44, § 1º)
§ 2º Será observada a lista detalhada de medicamentos que contraindicam a doação ou exijam cuidados especiais, nos termos do Anexo 3 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 44, § 2º)
§ 3º A ingestão do ácido acetilsalicílico (aspirina) e/ou outros anti-inflamatórios não esteroides (AINE) que interfiram na função plaquetária, nos 3 (três) dias anteriores à doação, exclui a preparação de plaquetas para esta doação, mas não implica a inaptidão do candidato. (Origem: PRT MS/GM 158/2016, Art. 44, § 3º)
Art. 45. A gestação é motivo de inaptidão temporária para doação de sangue até 12 (doze) semanas após o parto ou abortamento. (Origem: PRT MS/GM 158/2016, Art. 45)
§ 1º Não serão aceitas como doadoras as mulheres em período de lactação, a menos que o parto tenha ocorrido há mais de 12 (doze) meses. (Origem: PRT MS/GM 158/2016, Art. 45, § 1º)
§ 2º Em caso de necessidade técnica, a doação da mãe para o recém-nascido poderá ser realizada, desde que haja consentimento por escrito do hemoterapeuta e do médico obstetra, com apresentação de relatório médico que a justifique. (Origem: PRT MS/GM 158/2016, Art. 45, § 2º)
§ 3º A doação autóloga de gestantes será aceita se contar com a aprovação formal do obstetra responsável e do médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 45, § 3º)
§ 4º A aprovação de que trata o § 3º será registrada em prontuário médico com assinatura dos profissionais envolvidos. (Origem: PRT MS/GM 158/2016, Art. 45, § 4º)
Art. 46. A menstruação não é contraindicação para a doação. (Origem: PRT MS/GM 158/2016, Art. 46)
Parágrafo Único. A hipermenorreia ou outras alterações menstruais serão avaliadas pelo médico. (Origem: PRT MS/GM 158/2016, Art. 46, Parágrafo Único)
Art. 47. Será oferecida ao doador a possibilidade de hidratação oral antes da doação e os doadores que se apresentarem em jejum prolongado receberão um lanche antes da doação. (Origem: PRT MS/GM 158/2016, Art. 47)
§ 1º Não será coletado sangue de candidatos que tenham feito refeição copiosa e rica em substâncias gordurosas há menos de 3 (três) horas da coleta. (Origem: PRT MS/GM 158/2016, Art. 47, § 1º)
§ 2º Após a doação, é obrigatória a oferta de hidratação oral adequada ao doador, objetivando a reposição de líquidos. (Origem: PRT MS/GM 158/2016, Art. 47, § 2º)
§ 3º É recomendável que o doador permaneça por 15 (quinze) minutos no serviço de hemoterapia após a doação. (Origem: PRT MS/GM 158/2016, Art. 47, § 3º)
Art. 48. Qualquer evidência de alcoolismo crônico é motivo para caracterizar o candidato como doador inapto definitivo. (Origem: PRT MS/GM 158/2016, Art. 48)
Parágrafo Único. A ingestão de bebidas alcoólicas contraindica a doação por 12 (doze) horas após o consumo. (Origem: PRT MS/GM 158/2016, Art. 48, Parágrafo Único)
Art. 49. O doador alérgico somente será aceito se estiver assintomático no momento da doação. (Origem: PRT MS/GM 158/2016, Art. 49)
§ 1º São doadores inaptos definitivos aqueles que referem enfermidades atópicas graves, como asma brônquica grave e antecedente de choque anafilático. (Origem: PRT MS/GM 158/2016, Art. 49, § 1º)
§ 2º Os tratamentos dessensibilizantes contraindicam a doação até 72 (setenta e duas) horas depois da última aplicação. (Origem: PRT MS/GM 158/2016, Art. 49, § 2º)
Art. 50. Os candidatos à doação de sangue que exerçam ocupações, "hobbies" ou esportes que ofereçam riscos para si ou para outrem somente serão selecionados caso possam interromper tais atividades pelo período mínimo de 12 (doze) horas após a doação. (Origem: PRT MS/GM 158/2016, Art. 50)
§ 1º Consideram-se ocupações, "hobbies" ou esportes de risco, dentre outros: (Origem: PRT MS/GM 158/2016, Art. 50, § 1º)
I - pilotagem de avião ou helicóptero; (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, I)
II - condução de veículos de grande porte, como ônibus, caminhões e trens; (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, II)
III - operação de maquinário de alto risco, como na indústria e construção civil; (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, III)
IV - trabalho em andaimes; e (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, IV)
V - prática de paraquedismo ou mergulho. (Origem: PRT MS/GM 158/2016, Art. 50, § 1º, V)
§ 2º Atividades não contempladas no § 1º serão avaliadas pelo médico do serviço de hemoterapia para fins de seleção de candidatos à doação. (Origem: PRT MS/GM 158/2016, Art. 50, § 2º)
Art. 51. O volume de sangue total a ser coletado deve ser, no máximo, de 8 (oito) mL/kg de peso para as mulheres e de 9 (nove) mL/kg de peso para os homens. (Origem: PRT MS/GM 158/2016, Art. 51)
Parágrafo Único. O volume admitido por doação é de 450 mL ± 45 mL, aos quais podem ser acrescidos até 30 mL para a realização dos exames laboratoriais exigidos pelas leis e normas técnicas. (Origem: PRT MS/GM 158/2016, Art. 51, Parágrafo Único)
Art. 52. Com a finalidade de proteger os receptores, serão adotadas, tanto no momento da seleção de candidatos quanto no momento da doação, a avaliação das seguintes medidas e critérios, de acordo com os parâmetros estabelecidos por este regulamento: (Origem: PRT MS/GM 158/2016, Art. 52)
I - aspectos gerais do candidato, que deve ter aspecto saudável à ectoscopia e declarar bem-estar geral; (Origem: PRT MS/GM 158/2016, Art. 52, I)
II - temperatura corpórea do candidato, que não deve ser superior a 37ºC (trinta e sete graus Celsius); (Origem: PRT MS/GM 158/2016, Art. 52, II)
III - condição de imunizações e vacinações do candidato, nos termos do Anexo 4 do Anexo IV ; (Origem: PRT MS/GM 158/2016, Art. 52, III)
IV - local da punção venosa em relação à presença de lesões de pele e características que permitam a punção adequada; (Origem: PRT MS/GM 158/2016, Art. 52, IV)
V - histórico de transfusões recebidas pelo doador, uma vez que os candidatos que tenham recebido transfusões de sangue, componentes sanguíneos ou hemoderivados nos últimos 12 (doze) meses devem ser excluídos da doação; (Origem: PRT MS/GM 158/2016, Art. 52, V)
VI - histórico de doenças infecciosas; (Origem: PRT MS/GM 158/2016, Art. 52, VI)
VII - histórico de enfermidades virais; (Origem: PRT MS/GM 158/2016, Art. 52, VII)
VIII - histórico de doenças parasitárias; (Origem: PRT MS/GM 158/2016, Art. 52, VIII)
IX - histórico de enfermidades bacterianas; (Origem: PRT MS/GM 158/2016, Art. 52, IX)
X - estilo de vida do candidato a doação; (Origem: PRT MS/GM 158/2016, Art. 52, X)
XI - situações de risco vivenciadas pelo candidato; e (Origem: PRT MS/GM 158/2016, Art. 52, XI)
XII - histórico de cirurgias e procedimentos invasivos. (Origem: PRT MS/GM 158/2016, Art. 52, XII)
Art. 53. Em relação ao histórico de doenças infecciosas, o candidato à doação não deve apresentar enfermidade infecciosa aguda nem deve ter antecedentes de infecções transmissíveis pelo sangue. (Origem: PRT MS/GM 158/2016, Art. 53)
§ 1º No caso de infecções e uso de antibióticos, o candidato estará apto à doação 2 (duas) semanas após o fim do tratamento e desaparecimento dos sintomas. (Origem: PRT MS/GM 158/2016, Art. 53, § 1º)
§ 2º Candidatos à doação que tenham se deslocado ou que sejam procedentes de regiões, nacionais ou internacionais, endêmicas ou com epidemias confirmadas de doenças infecciosas que não sejam prevalentes na região da doação (não endêmicas) serão considerados aptos somente após 30 dias da saída dessas regiões, excetuando-se os casos contemplados no art. 57. (Origem: PRT MS/GM 158/2016, Art. 53, § 2º)
§ 3º Em situações especiais, como emergências em saúde pública, surtos epidêmicos, entre outros, os serviços de hemoterapia, em cooperação com as autoridades sanitárias, podem adequar critérios técnicos para seleção de doadores. (Origem: PRT MS/GM 158/2016, Art. 53, § 3º)
Art. 54. Quanto ao histórico de enfermidades virais, é considerado definitivamente inapto para a doação de sangue o indivíduo que: (Origem: PRT MS/GM 158/2016, Art. 54)
I - tenha antecedente de hepatite viral após os 11 (onze) anos de idade, exceto para caso de comprovação de infecção aguda de hepatite A (IgM reagente) à época do diagnóstico clínico, hipótese em que o doador poderá ser considerado apto após avaliação do resultado pelo médico do serviço de hemoterapia; ou (Origem: PRT MS/GM 158/2016, Art. 54, I)
II - tenha antecedente clínico, laboratorial ou história atual de infecção pelos agentes HBV, HCV, HIV ou HTLV. (Origem: PRT MS/GM 158/2016, Art. 54, II)
§ 1º O candidato com sintoma de gripe ou resfriado associado à temperatura corporal maior ou igual 38°C (trinta e oito graus Celsius) é inapto por 2 (duas) semanas após o desaparecimento dos sintomas. (Origem: PRT MS/GM 158/2016, Art. 54, § 1º)
§ 2º Aquele que relatar resfriado comum, mas não se enquadrar nas condições descritas no § 1º, poderá ser aceito desde que assintomático no momento da doação. (Origem: PRT MS/GM 158/2016, Art. 54, § 2º)
Art. 55. Todos os doadores serão questionados sobre situações ou comportamentos que levem a risco acrescido para infecções sexualmente transmissíveis, devendo ser excluídos da seleção quem os apresentar. (Origem: PRT MS/GM 158/2016, Art. 55)
Parágrafo Único. A entrevista do doador deve incluir, ainda, perguntas vinculadas aos sintomas e sinais sugestivos de Síndrome de Imunodeficiência Adquirida (SIDA) como: (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único)
I - perda de peso inexplicada; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, I)
II - suores noturnos; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, II)
III - manchas azuladas ou purpúricas mucocutâneas (sarcoma de Kaposi); (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, III)
IV - aumento de linfonodos com duração superior a 30 (trinta) dias; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, IV)
V - manchas brancas ou lesões ulceradas não usuais na boca; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, V)
VI - febre inexplicada por mais de 10 (dez) dias; (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, VI)
VII - tosse persistente ou dispneia; e (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, VII)
VIII - diarreia persistente. (Origem: PRT MS/GM 158/2016, Art. 55, Parágrafo Único, VIII)
Art. 56. Serão observadas as hipóteses de inaptidão para doação em virtude do histórico das seguintes doenças parasitárias: (Origem: PRT MS/GM 158/2016, Art. 56)
I - malária; (Origem: PRT MS/GM 158/2016, Art. 56, I)
II - doença de Chagas; e (Origem: PRT MS/GM 158/2016, Art. 56, II)
III - Encefalopatia Espongiforme Humana ou Doença de Creutzfeldt-Jakob (DCJ) e suas variantes. (Origem: PRT MS/GM 158/2016, Art. 56, III)
Art. 57. Para malária, a inaptidão de candidato à doação de sangue deve ocorrer usando-se, como critério de referência, a Incidência Parasitária Anual (IPA) do Município. (Origem: PRT MS/GM 158/2016, Art. 57)
§ 1º Em áreas endêmicas com antecedentes epidemiológicos de malária, considerar-se-á inapto o candidato: (Origem: PRT MS/GM 158/2016, Art. 57, § 1º)
I - que tenha tido malária nos 12 (doze) meses que antecedem a doação; (Origem: PRT MS/GM 158/2016, Art. 57, § 1º, I)
II - com febre ou suspeita de malária nos últimos 30 (trinta) dias; e (Origem: PRT MS/GM 158/2016, Art. 57, § 1º, II)
III - que tenha se deslocado ou procedente de área de alto risco (IPA maior que 49,9) há menos de 30 (trinta) dias. (Origem: PRT MS/GM 158/2016, Art. 57, § 1º, III)
§ 2º Em áreas não endêmicas de malária, considerar-se-á inapto o candidato que tenha se deslocado ou que seja procedente de Municípios localizados em áreas endêmicas há menos de 30 (trinta) dias. (Origem: PRT MS/GM 158/2016, Art. 57, § 2º)
§ 3º Em áreas não endêmicas de malária, considerar-se-á apto o candidato: (Origem: PRT MS/GM 158/2016, Art. 57, § 3º)
I - procedente de Municípios localizados em áreas endêmicas, após 30 (trinta) dias e até 12 (doze) meses do deslocamento, sendo que, nesse período, é necessária a realização de testes de detecção do plasmódio ou de antígenos plasmodiais, conforme art. 131; (Origem: PRT MS/GM 158/2016, Art. 57, § 3º, I)
II - procedente de Municípios localizados em áreas endêmicas, após 12 (doze) meses do deslocamento, sem necessidade de realização de testes de detecção; e (Origem: PRT MS/GM 158/2016, Art. 57, § 3º, II)
III - que tenha manifestado malária após 12 (doze) meses do tratamento e comprovação de cura. (Origem: PRT MS/GM 158/2016, Art. 57, § 3º, III)
§ 4º Independentemente da endemicidade da área, será considerado inapto definitivo o candidato que teve infecção por "Plasmodium malariae" (Febre Quartã). (Origem: PRT MS/GM 158/2016, Art. 57, § 4º)
§ 5º Em casos de surtos de malária, a decisão quanto aos critérios de inaptidão deve ser tomada após avaliação conjunta com a autoridade epidemiológica competente. (Origem: PRT MS/GM 158/2016, Art. 57, § 5º)
Art. 58. Para Doença de Chagas, o candidato com antecedente epidemiológico de contato domiciliar com Triatomíneo em área endêmica ou com diagnóstico clínico ou laboratorial de Doença de Chagas deve ser excluído de forma permanente, sendo considerado doador inapto definitivo. (Origem: PRT MS/GM 158/2016, Art. 58)
Parágrafo Único. Os casos de contato em área não endêmica deverão ser submetidos a teste sorológico pré-doação, utilizando-se métodos de alta sensibilidade. (Origem: PRT MS/GM 158/2016, Art. 58, Parágrafo Único)
Art. 59. Para casos de Encefalopatia Espongiforme Humana e suas variantes, causadores da Doença de Creutzfeldt-Jakob (DCJ), será definitivamente excluído como doador o candidato que se enquadre em uma das seguintes situações: (Origem: PRT MS/GM 158/2016, Art. 59)
I - tenha tido diagnóstico de Encefalopatia Espongiforme Humana ou qualquer outra forma da doença; (Origem: PRT MS/GM 158/2016, Art. 59, I)
II - tenha história familiar de Encefalopatia Espongiforme Humana; (Origem: PRT MS/GM 158/2016, Art. 59, II)
III - tenha permanecido no Reino Unido e/ou na República da Irlanda por mais de 3 (três) meses, de forma cumulativa, após o ano de 1980 até 31 de dezembro de 1996; (Origem: PRT MS/GM 158/2016, Art. 59, III)
IV - tenha permanecido 5 (cinco) anos ou mais, consecutivos ou intermitentes, na Europa após 1980 até os dias atuais; (Origem: PRT MS/GM 158/2016, Art. 59, IV)
V - tenha recebido hormônio de crescimento ou outros medicamentos de origem hipofisária não recombinante; (Origem: PRT MS/GM 158/2016, Art. 59, V)
VI - tenha feito uso de insulina bovina; (Origem: PRT MS/GM 158/2016, Art. 59, VI)
VII - tenha recebido transplante de córnea ou implante de material biológico à base de dura-máter; e (Origem: PRT MS/GM 158/2016, Art. 59, VII)
VIII - tenha recebido transfusão de sangue ou componentes no Reino Unido após 1980. (Origem: PRT MS/GM 158/2016, Art. 59, VIII)
Art. 60. Quanto ao histórico de enfermidades bacterianas, os doadores portadores de enfermidades agudas serão excluídos temporariamente, até a cura definitiva, observado o disposto no Anexo 1 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 60)
Art. 61. Quanto ao estilo de vida do candidato a doação, a história atual ou pregressa de uso de drogas injetáveis ilícitas é contraindicação definitiva para a doação de sangue. (Origem: PRT MS/GM 158/2016, Art. 61)
§ 1º Serão inspecionados ambos os braços dos candidatos para detectar evidências de uso repetido de drogas parenterais ilícitas, sendo que a presença desses sinais determina a inaptidão definitiva do doador. (Origem: PRT MS/GM 158/2016, Art. 61, § 1º)
§ 2º O uso de anabolizantes injetáveis sem prescrição médica, crack ou cocaína por via nasal (inalação) é causa de exclusão da doação por um período de 12 (doze) meses, contados a partir da data da última utilização. (Origem: PRT MS/GM 158/2016, Art. 61, § 2º)
§ 3º O uso de maconha impede a doação por 12 (doze) horas. (Origem: PRT MS/GM 158/2016, Art. 61, § 3º)
§ 4º A evidência de uso de qualquer outro tipo de droga deve ser avaliada. (Origem: PRT MS/GM 158/2016, Art. 61, § 4º)
§ 5º No caso do uso de drogas ilícitas, deve ser realizada também a avaliação criteriosa do comportamento individual do candidato e do grau de dependência, dando foco à exposição a situações de risco acrescido de transmissão de infecções por transfusão, e especial atenção à utilização compartilhada de seringas e agulhas no uso de substâncias injetáveis. (Origem: PRT MS/GM 158/2016, Art. 61, § 5º)
Art. 62. Em situações de risco acrescido vivenciadas pelos candidatos, considerar-se-á inapto definitivo o candidato que apresente qualquer uma das situações abaixo: (Origem: PRT MS/GM 158/2016, Art. 62)
I - ter evidência clínica ou laboratorial de infecções transmissíveis por transfusão de sangue; (Origem: PRT MS/GM 158/2016, Art. 62, I)
II - ter sido o único doador de sangue de um paciente que tenha apresentado soroconversão para hepatite B ou C, HIV ou HTLV na ausência de qualquer outra causa provável para a infecção; (Origem: PRT MS/GM 158/2016, Art. 62, II)
III - possuir "piercing" na cavidade oral e/ou na região genital, devido ao risco permanente de infecção, podendo candidatar-se a nova doação 12 (doze) meses após a retirada; e (Origem: PRT MS/GM 158/2016, Art. 62, III)
IV - ter antecedente de compartilhamento de seringas ou agulhas. (Origem: PRT MS/GM 158/2016, Art. 62, IV)
Art. 63. Considerar-se-á inapto temporário, por 12 (doze) meses após a cura, o candidato a doador que teve alguma Doença Sexualmente Transmissível (DST). (Origem: PRT MS/GM 158/2016, Art. 63)
Parágrafo Único. Nos casos em que se evidenciem infecções repetidas por DST e consequente maior risco de reinfecção, o candidato deve ser considerado inapto definitivamente. (Origem: PRT MS/GM 158/2016, Art. 63, Parágrafo Único)
Art. 64. Considerar-se-á inapto temporário por 12 (doze) meses o candidato que tenha sido exposto a qualquer uma das situações abaixo: (Origem: PRT MS/GM 158/2016, Art. 64)
I - que tenha feito sexo em troca de dinheiro ou de drogas ou seus respectivos parceiros sexuais; (Origem: PRT MS/GM 158/2016, Art. 64, I)
II - que tenha feito sexo com um ou mais parceiros ocasionais ou desconhecidos ou seus respectivos parceiros sexuais; (Origem: PRT MS/GM 158/2016, Art. 64, II)
III - que tenha sido vítima de violência sexual ou seus respectivos parceiros sexuais; (Origem: PRT MS/GM 158/2016, Art. 64, III)
IV - homens que tiveram relações sexuais com outros homens e/ou as parceiras sexuais destes; (Origem: PRT MS/GM 158/2016, Art. 64, IV) (Revogado pela PRT GM/MS n° 1.682 de 02.07.2020)
V - que tenha tido relação sexual com pessoa portadora de infecção pelo HIV, hepatite B, hepatite C ou outra infecção de transmissão sexual e sanguínea; (Origem: PRT MS/GM 158/2016, Art. 64, V)
VI - que tenha vivido situação de encarceramento ou de confinamento obrigatório não domiciliar superior a 72 (setenta e duas) horas, durante os últimos 12 (doze) meses, ou os parceiros sexuais dessas pessoas; (Origem: PRT MS/GM 158/2016, Art. 64, VI)
VII - que tenha feito "piercing", tatuagem ou maquiagem definitiva, sem condições de avaliação quanto à segurança do procedimento realizado; (Origem: PRT MS/GM 158/2016, Art. 64, VII)
VIII - que seja parceiro sexual de pacientes em programa de terapia renal substitutiva e de pacientes com história de transfusão de componentes sanguíneos ou derivados; e (Origem: PRT MS/GM 158/2016, Art. 64, VIII)
IX - que teve acidente com material biológico e em consequência apresentou contato de mucosa e/ou pele não íntegra com o referido material biológico. (Origem: PRT MS/GM 158/2016, Art. 64, IX)
Art. 65. Quanto ao histórico de cirurgias e procedimentos invasivos, deve ser observado o disposto no Anexo 2 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 65)
§ 1º O candidato submetido a cirurgia deve ser considerado inapto por tempo variável de acordo com o porte do procedimento e a evolução clínica. (Origem: PRT MS/GM 158/2016, Art. 65, § 1º)
§ 2º O candidato submetido a procedimento odontológico deve ser considerado inapto por tempo variável de acordo com o procedimento e a evolução clínica. (Origem: PRT MS/GM 158/2016, Art. 65, § 2º)
§ 3º Qualquer procedimento endoscópico leva a uma inaptidão à doação de sangue por 6 (seis) meses. (Origem: PRT MS/GM 158/2016, Art. 65, § 3º)
Art. 66. Os registros dos doadores serão mantidos com a finalidade de garantir a segurança do processo da doação de sangue e a sua rastreabilidade. (Origem: PRT MS/GM 158/2016, Art. 66)
§ 1º Para doação de sangue, é obrigatório apresentar documento de identificação com fotografia, emitido por órgão oficial, sendo aceita fotocópia autenticada do documento, desde que as fotos e inscrições estejam legíveis e as imagens permitam a identificação do portador. (Origem: PRT MS/GM 158/2016, Art. 66, § 1º)
§ 2º Todo candidato a doação deve ter um registro no serviço de hemoterapia, que será, preferencialmente, em arquivo eletrônico. (Origem: PRT MS/GM 158/2016, Art. 66, § 2º)
§ 3º Serão adotadas ações que garantam a confiabilidade, o sigilo e a segurança das informações constantes do registro dos doadores. (Origem: PRT MS/GM 158/2016, Art. 66, § 3º)
§ 4º Constarão do registro dos doadores as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 66, § 4º)
I - nome completo do candidato; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, I)
II - sexo; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, II)
III - data de nascimento; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, III)
IV - número e órgão expedidor do documento de identificação; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, IV)
V - nacionalidade e naturalidade; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, V)
VI - filiação; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, VI)
VII - ocupação habitual; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, VII)
VIII - endereço e telefone para contato; (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, VIII)
IX - número do registro do candidato no serviço de hemoterapia ou no programa de doação de sangue; e (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, IX)
X - registro da data de comparecimento. (Origem: PRT MS/GM 158/2016, Art. 66, § 4º, X)
§ 5º O serviço de hemoterapia, a seu critério, poderá oferecer ao doador a oportunidade de se auto excluir por motivos de risco acrescidos não informados ou deliberadamente omitidos durante a triagem, de forma confidencial. (Origem: PRT MS/GM 158/2016, Art. 66, § 5º)
§ 6º Antes de assinar o termo de consentimento, o doador será informado sobre os cuidados a serem observados durante e após a coleta e orientado sobre as possíveis reações adversas. (Origem: PRT MS/GM 158/2016, Art. 66, § 6º)
Art. 67. O doador deverá ser informado sobre os motivos de inaptidão temporária ou definitiva para doação de sangue, identificados na triagem clínica. (Origem: PRT MS/GM 158/2016, Art. 67)
§ 1º O motivo da inaptidão identificada na triagem clínica será registrado na ficha de triagem. (Origem: PRT MS/GM 158/2016, Art. 67, § 1º)
§ 2º O serviço de hemoterapia disporá de um sistema de comunicação ao doador. (Origem: PRT MS/GM 158/2016, Art. 67, § 2º)
§ 3º A inaptidão identificada na triagem laboratorial será comunicada ao doador com objetivo de esclarecimento e encaminhamento do caso. (Origem: PRT MS/GM 158/2016, Art. 67, § 3º)
§ 4º Antes da comunicação ao doador, o serviço de hemoterapia realizará repetição em duplicata dos testes com resultados inicialmente reagentes, conforme algoritmo de que trata o Anexo 5 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 67, § 4º)
Art. 68. O serviço de hemoterapia informará, mensalmente, à autoridade sanitária competente, os dados dos doadores com resultados dos testes laboratoriais para doenças transmissíveis pelo sangue, reagentes nas repetições em duplicata, e as ausências dos doadores convocados para a coleta de novas amostras ou recebimento de orientações, conforme padronização definida pelas instâncias competentes e pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 68)
Seção III
Da Coleta de Sangue do Doador
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção III)
Art. 69. A coleta de sangue será realizada em condições assépticas, sob a supervisão de médico ou enfermeiro, através de uma única punção venosa, em bolsas plásticas com sistema fechado e estéril destinado especificamente para este fim. (Origem: PRT MS/GM 158/2016, Art. 69)
Art. 70. A sala da coleta de sangue será limpa, iluminada, confortável e agradável. (Origem: PRT MS/GM 158/2016, Art. 70)
Art. 71. Será garantida a identificação correta e segura do doador durante todo o processo de coleta de sangue. (Origem: PRT MS/GM 158/2016, Art. 71)
§ 1º A ficha do doador, a bolsa de sangue e os tubos-pilotos contendo as amostras de sangue serão adequadamente identificados, de modo que as bolsas e os tubos correspondam efetivamente ao respectivo doador. (Origem: PRT MS/GM 158/2016, Art. 71, § 1º)
§ 2º O nome do doador não constará na etiqueta das bolsas de sangue, com exceção daquelas destinadas à transfusão autóloga. (Origem: PRT MS/GM 158/2016, Art. 71, § 2º)
§ 3º A identificação dos tubos para exames laboratoriais e das bolsas, principal e satélites, será feita por código de barras ou etiqueta impressa que permita a vinculação dos tubos e bolsas com a doação. (Origem: PRT MS/GM 158/2016, Art. 71, § 3º)
Art. 72. As bolsas utilizadas na coleta de sangue conterão anticoagulantes, nas quantidades prescritas e recomendadas pelos fabricantes das bolsas e em função do volume de sangue a ser coletado. (Origem: PRT MS/GM 158/2016, Art. 72)
§ 1º A quantidade habitual de anticoagulante em uma bolsa de coleta é de 60-65 mL. (Origem: PRT MS/GM 158/2016, Art. 72, § 1º)
§ 2º Para a quantidade de anticoagulante de que trata o § 1º, o volume ideal de coletas de bolsas é de 450 ± 45 mL de sangue total. (Origem: PRT MS/GM 158/2016, Art. 72, § 2º)
§ 3º Para a quantidade de anticoagulante de que trata o § 1º, o concentrado de hemácias produzido em bolsas com 300 a 404 mL de sangue total pode ser usado para transfusão, desde que seja aplicado um rótulo que indique "unidade de baixo volume de concentrado de hemácias". (Origem: PRT MS/GM 158/2016, Art. 72, § 3º)
§ 4º Não serão preparados outros componentes a partir de unidades de baixo volume que não estejam abrangidos pelo § 3º. (Origem: PRT MS/GM 158/2016, Art. 72, § 4º)
§ 5º As coletas especiais de bolsas de sangue de doadores com volume total inferior a 300 mL para fins transfusionais somente podem ser obtidas com a utilização de bolsas específicas produzidas para este fim ou manipuladas em sistema estéril, não sendo permitida a abertura do sistema de conexões para correção do volume de anticoagulante, sem prejuízo das orientações contidas no "caput" e respectivos parágrafos. (Origem: PRT MS/GM 158/2016, Art. 72, § 5º)
§ 6º Coletas de bolsas com volume total inferior a 300 mL serão desprezadas, com exceção do disposto no § 5º. (Origem: PRT MS/GM 158/2016, Art. 72, § 6º)
Art. 73. Para a realização da coleta de sangue, deve-se inspecionar e palpar a fossa antecubital do braço do doador para a escolha da veia a ser puncionada, dando-se preferência à veia cubital mediana. (Origem: PRT MS/GM 158/2016, Art. 73)
Parágrafo Único. Deve-se evitar punção em locais com lesões dermatológicas ou cicatriciais, inclusive as relacionadas com punções anteriores. (Origem: PRT MS/GM 158/2016, Art. 73, Parágrafo Único)
Art. 74. A área da pele para punção venosa para coleta deve ser cuidadosamente preparada. (Origem: PRT MS/GM 158/2016, Art. 74)
§ 1º A área escolhida para a punção venosa deve ser submetida a uma cuidadosa higienização que deve contemplar duas etapas de antissepsia. (Origem: PRT MS/GM 158/2016, Art. 74, § 1º)
§ 2º A veia a puncionar não deverá ser palpada após a preparação da pele. (Origem: PRT MS/GM 158/2016, Art. 74, § 2º)
§ 3º Caso não seja possível observar o disposto no § 2º, todo o procedimento de higienização deverá ser repetido. (Origem: PRT MS/GM 158/2016, Art. 74, § 3º)
Art. 75. O procedimento da coleta de sangue garantirá a segurança do doador e do processo de doação. (Origem: PRT MS/GM 158/2016, Art. 75)
§ 1º O procedimento de coleta de sangue será realizado por profissionais de saúde treinados e capacitados, trabalhando sob a supervisão de enfermeiro ou médico. (Origem: PRT MS/GM 158/2016, Art. 75, § 1º)
§ 2º Todo o material utilizado no procedimento será descartável, estéril e apirogênico. (Origem: PRT MS/GM 158/2016, Art. 75, § 2º)
§ 3º O tempo de coleta não será superior a 15 (quinze) minutos, sendo o tempo ideal de até 12 (doze) minutos. (Origem: PRT MS/GM 158/2016, Art. 75, § 3º)
§ 4º O tubo coletor ("segmento de coleta", "macarrão" ou "rabicho") da bolsa deve estar fechado por pinça, logo abaixo da agulha. (Origem: PRT MS/GM 158/2016, Art. 75, § 4º)
§ 5º Observado o disposto no § 4º, somente depois que a agulha transfixar a pele do doador é que a pinça deve ser retirada ou aberta. (Origem: PRT MS/GM 158/2016, Art. 75, § 5º)
§ 6º Caso seja necessária a realização de mais de uma punção, será utilizada nova bolsa de coleta. (Origem: PRT MS/GM 158/2016, Art. 75, § 6º)
§ 7º Ao término da coleta da bolsa, o tubo coletor será lacrado utilizando-se dois nós apertados, previamente preparados até o processamento da bolsa de sangue total, sendo preferível a utilização de seladoras dielétricas apropriadas. (Origem: PRT MS/GM 158/2016, Art. 75, § 7º)
Art. 76. Serão adotados cuidados com o doador após a doação, a fim de garantir sua integridade. (Origem: PRT MS/GM 158/2016, Art. 76)
§ 1º Será ofertada hidratação oral ao doador depois da doação, antes que o mesmo se retire da instituição. (Origem: PRT MS/GM 158/2016, Art. 76, § 1º)
§ 2º É aconselhável a oferta de lanche ao doador. (Origem: PRT MS/GM 158/2016, Art. 76, § 2º)
§ 3º É recomendável que o doador permaneça, no mínimo, 15 (quinze) minutos no serviço de hemoterapia antes de ser liberado. (Origem: PRT MS/GM 158/2016, Art. 76, § 3º)
§ 4º Os doadores serão instruídos para que: (Origem: PRT MS/GM 158/2016, Art. 76, § 4º)
I - façam o veículo parar imediatamente no caso de, após deixarem o serviço de hemoterapia, ocorrer mal estar ao serem transportados por motocicletas ou conduzirem veículos automotores; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, I)
II - aguardem, pelo menos, 60 (sessenta) minutos antes de consumir cigarros, cigarrilhas, charutos, cachimbos ou quaisquer outros produtos fumígenos, derivados ou não do tabaco; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, II)
III - aguardem aproximadamente 12 (doze) horas antes de realizar qualquer esforço físico, especialmente com o membro relacionado à doação; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, III)
IV - mantenham a compressão no local da punção em caso de sangramento ou hematomas; (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, IV)
V - comuniquem ao serviço de hemoterapia caso apresentem qualquer sinal ou sintoma de processo infeccioso, como febre ou diarreia, ou que tenham tido o diagnóstico de alguma doença infectocontagiosa até 7 (sete) dias após a doação; e (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, V)
VI - comuniquem ao serviço de hemoterapia caso tenham obtido o diagnóstico de malária até 30 dias após a doação. (Origem: PRT MS/GM 158/2016, Art. 76, § 4º, VI)
Art. 77. Durante o processo de coleta de sangue, serão recolhidas amostras para realização dos exames laboratoriais necessários. (Origem: PRT MS/GM 158/2016, Art. 77)
§ 1º As amostras de que trata o "caput" serão coletadas a cada doação, devendo os rótulos da bolsa e dos tubos serem idênticos. (Origem: PRT MS/GM 158/2016, Art. 77, § 1º)
§ 2º As amostras serão coletadas por meio de dispositivos próprios integrados ao sistema de bolsa que permitam a coleta das amostras no início da doação, sem a abertura do sistema. (Origem: PRT MS/GM 158/2016, Art. 77, § 2º)
§ 3º É recomendado que o sistema de bolsa utilizado para coleta de amostras possibilite o desvio do primeiro fluxo de sangue da doação, reduzindo o risco de contaminação bacteriana dos componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 77, § 3º)
Art. 78. O serviço de hemoterapia que realiza coleta de sangue deve estar preparado para o atendimento a reações adversas à doação. (Origem: PRT MS/GM 158/2016, Art. 78)
§ 1º Para cumprimento do disposto no "caput", serão observados, no mínimo, os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 78, § 1º)
I - a existência de procedimentos operacionais com instruções específicas para a prevenção, identificação e tratamento das reações adversas nos doadores; (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, I)
II - a disponibilidade de medicamentos e equipamentos necessários para oferecer assistência médica ao doador que apresente reações adversas; (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, II)
III - a garantia de privacidade para o atendimento do doador em caso de necessidade; e (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, III)
IV - a manutenção de registro das reações adversas à doação. (Origem: PRT MS/GM 158/2016, Art. 78, § 1º, IV)
§ 2º O doador permanecerá nas dependências do serviço de hemoterapia durante o tempo necessário para sua completa recuperação, caso apresente alguma reação adversa. (Origem: PRT MS/GM 158/2016, Art. 78, § 2º)
§ 3º O serviço de hemoterapia terá uma referência para atendimento de urgências ou emergências que porventura venham a ocorrer com o doador. (Origem: PRT MS/GM 158/2016, Art. 78, § 3º)
§ 4º Serão oferecidas informações e esclarecimentos ao doador sobre os possíveis efeitos adversos da doação e orientações de como proceder na hipótese de ocorrência dos mesmos. (Origem: PRT MS/GM 158/2016, Art. 78, § 4º)
§ 5º Para o atendimento de emergências relacionadas ao doador, a equipe profissional possuirá treinamento adequado e terá equipamento específico disponível no local da coleta, inclusive na coleta externa. (Origem: PRT MS/GM 158/2016, Art. 78, § 5º)
§ 6º Os equipamentos, medicamentos e demais especificações técnicas para estruturação do serviço de hemoterapia para atenção de emergência seguirão as normas do Sistema Nacional de Urgência e Emergência do Ministério da Saúde e demais regulamentos técnicos. (Origem: PRT MS/GM 158/2016, Art. 78, § 6º)
§ 7º O treinamento e padronização dos procedimentos para atendimento de situações de emergência seguirão as diretrizes de apoio ao suporte avançado de vida, da Sociedade Brasileira de Cardiologia, inclusive para montagem de carro de emergência, considerando a característica da atividade. (Origem: PRT MS/GM 158/2016, Art. 78, § 7º)
Art. 79. As bolsas de sangue total resultantes do processo de coleta serão adequadamente acondicionadas. (Origem: PRT MS/GM 158/2016, Art. 79)
§ 1º Para a produção apenas de Concentrado de Hemácias (CH) e plasma fresco congelado (PFC), as bolsas de sangue total serão acondicionadas o mais brevemente possível, após a coleta, a 4 ±2 °C. (Origem: PRT MS/GM 158/2016, Art. 79, § 1º)
§ 2º Se a produção de Concentrado de Plaquetas (CP) também for programada, as bolsas de sangue serão acondicionadas a temperaturas entre 20 a 24ºC (vinte a vinte e quatro graus Celsius), nunca devendo ser inferior a 20°C (vinte), preferencialmente dentro das primeiras 8 (oito) horas e não excedendo o máximo de 24 (vinte quatro) horas, até que as plaquetas sejam separadas. (Origem: PRT MS/GM 158/2016, Art. 79, § 2º)
Art. 80. Para a realização de coletas externas, serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 80)
I - o procedimento para avaliar a adequação do local e da estrutura; (Origem: PRT MS/GM 158/2016, Art. 80, I)
II - a compatibilidade entre a equipe e o número de doadores esperado; e (Origem: PRT MS/GM 158/2016, Art. 80, II)
III - a presença de, pelo menos, um médico e um enfermeiro para a constituição da equipe de coleta externa. (Origem: PRT MS/GM 158/2016, Art. 80, III)
§ 1º No procedimento para avaliar a adequação do local e da estrutura para a realização das coletas externas, verificar-se-á: (Origem: PRT MS/GM 158/2016, Art. 80, § 1º)
I - a compatibilidade da infraestrutura com o processo de coleta, a fim de permitir o fluxo adequado; (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, I)
II - a iluminação e ventilação da área física para coleta de sangue; (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, II)
III - a privacidade para a triagem clínica; (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, III)
IV - as condições adequadas para o atendimento de intercorrências clínicas dos doadores; e (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, IV)
V - as condições para oferta de hidratação oral e descanso após a doação. (Origem: PRT MS/GM 158/2016, Art. 80, § 1º, V)
§ 2º O serviço de hemoterapia informará regularmente a programação de coletas externas à Vigilância Sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 80, § 2º)
§ 3º É obrigatória a informação à Vigilância Sanitária competente dos locais para coleta externa, para eventual avaliação da adequação e operacionalidade. (Origem: PRT MS/GM 158/2016, Art. 80, § 3º)
§ 4º Para as coletas externas, o serviço de hemoterapia terá referência para atendimento de urgência ou emergência que porventura ocorra ao doador, observadas as determinações do art. 78. (Origem: PRT MS/GM 158/2016, Art. 80, § 4º)
Art. 81. O manuseio de resíduos do serviço de hemoterapia e a higienização da área de coleta externa obedecerão às normas específicas e à legislação vigente. (Origem: PRT MS/GM 158/2016, Art. 81)
Seção IV
Da Preparação de Componentes Sanguíneos
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção IV)
Art. 82. A bolsa de sangue total coletada, tecnicamente satisfatória, poderá ser processada para a obtenção de um ou mais dos seguintes componentes: (Origem: PRT MS/GM 158/2016, Art. 82)
I - eritrocitários; (Origem: PRT MS/GM 158/2016, Art. 82, I)
II - plasmáticos; e (Origem: PRT MS/GM 158/2016, Art. 82, II)
III - plaquetários. (Origem: PRT MS/GM 158/2016, Art. 82, III)
§ 1º Os componentes sanguíneos também poderão ser coletados por aférese. (Origem: PRT MS/GM 158/2016, Art. 82, § 1º)
§ 2º O sangue total coletado em solução CPDA-1 terá validade de 35 (trinta e cinco) dias contados a partir da coleta e de 21 (vinte e um) dias quando coletado em ACD, CPD e CP2D, sempre devendo ser armazenado a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 82, § 2º)
§ 3º As especificações técnicas dos componentes de que trata o "caput" e que deverão ser observados pelo serviço de hemoterapia estão descritas no Anexo 6 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 82, § 3º)
Art. 83. Para o processo de produção e liberação de componentes sanguíneos, o serviço de hemoterapia terá uma política de avaliação dos doadores para prevenção de TRALI, que levará em consideração o sexo do doador e o número de gestações das doadoras. (Origem: PRT MS/GM 158/2016, Art. 83)
Art. 84. A esterilidade do componente será mantida durante o processamento, mediante o emprego de métodos assépticos, equipos e soluções estéreis e livres de pirogênios. (Origem: PRT MS/GM 158/2016, Art. 84)
Art. 85. A transferência de componente da bolsa-matriz para a bolsa-satélite, ou de uma bolsa-satélite para a outra, será realizada em circuito fechado. (Origem: PRT MS/GM 158/2016, Art. 85)
Art. 86. A manipulação do componente sanguíneo que exija a abertura do circuito será realizada em cabine de segurança biológica. (Origem: PRT MS/GM 158/2016, Art. 86)
Parágrafo Único. Se o circuito for aberto durante o processamento, os componentes serão descartados se não forem utilizados em até 24 (vinte quatro) horas após a produção, para componentes cuja temperatura de armazenamento seja 4 ± 2 °C, e em até 4 (quatro) horas, para concentrado de plaquetas (CP). (Origem: PRT MS/GM 158/2016, Art. 86, Parágrafo Único)
Art. 87. Os componentes eritrocitários serão produzidos de acordo com os critérios técnicos definidos neste Anexo, e são definidos como: (Origem: PRT MS/GM 158/2016, Art. 87)
I - concentrado de hemácias (CH); (Origem: PRT MS/GM 158/2016, Art. 87, I)
II - concentrado de hemácias lavadas; (Origem: PRT MS/GM 158/2016, Art. 87, II)
III - concentrado de hemácias com camada leucoplaquetária removida; (Origem: PRT MS/GM 158/2016, Art. 87, III)
IV - concentrado de hemácias desleucocitado; (Origem: PRT MS/GM 158/2016, Art. 87, IV)
V - concentrado de hemácias congeladas; e (Origem: PRT MS/GM 158/2016, Art. 87, V)
VI - hemácias rejuvenescidas. (Origem: PRT MS/GM 158/2016, Art. 87, VI)
Art. 88. Os concentrados de hemácias são os eritrócitos que permanecem na bolsa depois que esta é centrifugada e o plasma extraído para uma bolsa-satélite. (Origem: PRT MS/GM 158/2016, Art. 88)
§ 1º Os concentrados de hemácias sem solução aditiva devem ter hematócrito entre 65% e 80%. (Origem: PRT MS/GM 158/2016, Art. 88, § 1º)
§ 2º No caso de bolsas com solução aditiva, o hematócrito pode variar de 50 a 70%. (Origem: PRT MS/GM 158/2016, Art. 88, § 2º)
§ 3º Todos os componentes eritrocitários devem ser armazenados à temperatura de 4 ± 2 °C, exceto hemácias congeladas. (Origem: PRT MS/GM 158/2016, Art. 88, § 3º)
§ 4º Os glóbulos vermelhos separados em sistema fechado devem ser armazenados a 4 ± 2 °C e têm validade de: (Origem: PRT MS/GM 158/2016, Art. 88, § 4º)
I - em ACD/CPD/CP2D: 21 dias; (Origem: PRT MS/GM 158/2016, Art. 88, § 4º, I)
II - em CPDA-1: 35 (trinta e cinco) dias; e (Origem: PRT MS/GM 158/2016, Art. 88, § 4º, II)
III - em solução aditiva: 42 (quarenta e dois) dias. (Origem: PRT MS/GM 158/2016, Art. 88, § 4º, III)
Art. 89. Os concentrados de hemácias lavados são obtidos após lavagens com solução compatível estéril em quantidade suficiente (1 a 3 litros), de modo que sua quantidade final de proteínas totais seja inferior a 500 mg/unidade, devendo a temperatura de armazenamento ser de 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 89)
§ 1º A indicação dos componentes de que trata o "caput" está relacionada com a profilaxia de reações alérgicas ou com a utilização em pacientes deficientes de proteínas específicas, a exemplo de deficientes de IgA. (Origem: PRT MS/GM 158/2016, Art. 89, § 1º)
§ 2º Em função do método utilizado, o produto de que trata o "caput" pode conter quantidades variáveis dos leucócitos e plaquetas originalmente presentes na unidade, porém não é indicado para evitar aloimunização contra antígenos leucoplaquetários. (Origem: PRT MS/GM 158/2016, Art. 89, § 2º)
§ 3º A validade dos componentes de que trata o "caput" é de 24 (vinte quatro) horas depois de sua obtenção. (Origem: PRT MS/GM 158/2016, Art. 89, § 3º)
Art. 90. Os concentrados de hemácias com camada leucoplaquetária removida são concentrados de hemácias que devem ser preparados por um método que, por meio da remoção da camada leucoplaquetária, reduza o número de leucócitos no componente final a menos de 1,2 x 10e9 por unidade. (Origem: PRT MS/GM 158/2016, Art. 90)
§ 1º Os componentes de que trata o "caput" podem ser destinados à prevenção de reações transfusionais febris não hemolíticas e não são adequados para profilaxia de aloimunização leucoplaquetária, programas de transfusão crônica e prevenção de infecção por citomegalovírus (CMV). (Origem: PRT MS/GM 158/2016, Art. 90, § 1º)
§ 2º Os concentrados de hemácias com camada leucoplaquetária removida devem ser armazenados a 4 ± 2 °C e sua validade é de 24 (vinte quatro) horas depois de aberto o sistema. (Origem: PRT MS/GM 158/2016, Art. 90, § 2º)
§ 3º A validade dos concentrados de que trata o § 2º é definida pela solução de conservação/aditiva utilizada, conforme disposto no art. 88, § 4º . (Origem: PRT MS/GM 158/2016, Art. 90, § 3º)
Art. 91. Os concentrados de hemácias desleucocitados são concentrados de hemácias contendo menos que 5,0 x 10e6 leucócitos por unidade. (Origem: PRT MS/GM 158/2016, Art. 91)
§ 1º Quando for realizada antes do armazenamento, a desleucocitação deve ser feita em até 48 horas após a coleta. (Origem: PRT MS/GM 158/2016, Art. 91, § 1º)
§ 2º Na desleucocitação, pode ser utilizado sistema de conexão estéril ou conjuntos de coleta com filtro, sendo que, nesse caso, o tempo de validade corresponde ao original do componente. (Origem: PRT MS/GM 158/2016, Art. 91, § 2º)
§ 3º Não é recomendada a utilização de filtros de desleucocitação em beira de leito. (Origem: PRT MS/GM 158/2016, Art. 91, § 3º)
§ 4º Caso o concentrado de que trata o "caput" seja preparado em sistema aberto, a validade será de 24 (vinte e quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 91, § 4º)
§ 5º Os concentrados de que trata o "caput" são indicados para prevenção de reação transfusional febril não hemolítica e profilaxia de aloimunização leucocitária, aplicando-se, principalmente, a pacientes em programa de transfusão crônica, como pessoas com talassemia e com doença falciforme. (Origem: PRT MS/GM 158/2016, Art. 91, § 5º)
§ 6º Os concentrados de que trata o "caput" podem ser utilizados como alternativa para a redução da transmissão de citomegalovírus (CMV) em substituição a componentes soronegativos para CMV. (Origem: PRT MS/GM 158/2016, Art. 91, § 6º)
Art. 92. Os concentrados de hemácias congeladas são concentrados de hemácias conservadas em temperaturas iguais ou inferiores a -65°C (65°C negativos), na presença de um agente crioprotetor. (Origem: PRT MS/GM 158/2016, Art. 92)
§ 1º São agentes crioprotetores: (Origem: PRT MS/GM 158/2016, Art. 92, § 1º)
I - glicerol; e (Origem: PRT MS/GM 158/2016, Art. 92, § 1º, I)
II - amido hidroxilado. (Origem: PRT MS/GM 158/2016, Art. 92, § 1º, II)
§ 2º O glicerol será removido por meio de lavagem, depois que as hemácias forem descongeladas, caso seja o agente crioprotetor utilizado. (Origem: PRT MS/GM 158/2016, Art. 92, § 2º)
§ 3º As hemácias conservadas sem solução aditiva serão congeladas dentro do período de até 6 (seis) dias depois da coleta do sangue, exceto quando forem rejuvenescidas. (Origem: PRT MS/GM 158/2016, Art. 92, § 3º)
§ 4º As unidades raras de concentrado de hemácias poderão ser congeladas sem rejuvenescimento até a data do vencimento. (Origem: PRT MS/GM 158/2016, Art. 92, § 4º)
§ 5º As hemácias processadas com solução aditiva serão congeladas antes da data de vencimento do concentrado de hemácias. (Origem: PRT MS/GM 158/2016, Art. 92, § 5º)
§ 6º A bolsa de concentrado de hemácias deverá ser aberta sob fluxo laminar e armazenada no congelador até o período máximo de 4 (quatro) horas após a abertura do circuito para a inclusão do glicerol. (Origem: PRT MS/GM 158/2016, Art. 92, § 6º)
§ 7º O método de deglicerolização assegurará: (Origem: PRT MS/GM 158/2016, Art. 92, § 7º)
I - a remoção adequada do glicerol; (Origem: PRT MS/GM 158/2016, Art. 92, § 7º, I)
II - o nível de hemoglobina livre na solução sobrenadante inferior a 0,2 g por unidade; e (Origem: PRT MS/GM 158/2016, Art. 92, § 7º, II)
III - a recuperação de, pelo menos, 80% dos glóbulos vermelhos originalmente presentes na unidade. (Origem: PRT MS/GM 158/2016, Art. 92, § 7º, III)
§ 8º Na preparação do componente final destinado à transfusão, o tubo conectado à bolsa será preenchido com uma alíquota do componente, de forma que haja hemácias disponíveis para subsequentes provas de compatibilidade. (Origem: PRT MS/GM 158/2016, Art. 92, § 8º)
§ 9º A validade dos concentrados de hemácias congeladas é de 10 (dez) anos, contados da data da doação do sangue. (Origem: PRT MS/GM 158/2016, Art. 92, § 9º)
§ 10. Após o descongelamento, as hemácias devem ser usadas em até 24 (vinte quatro) horas se a deglicerolização for realizada em sistema aberto ou 14 (quatorze) dias se em sistema fechado, devendo sempre ser conservadas a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 92, § 10)
Art. 93. As hemácias rejuvenescidas são as hemácias tratadas por um método que restabeleça os níveis normais de 2,3 DPG e ATP. (Origem: PRT MS/GM 158/2016, Art. 93)
§ 1º Depois de rejuvenescidos, os concentrados de hemácias serão lavados e transfundidos dentro de 24 (vinte e quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 93, § 1º)
§ 2º Os rótulos indicarão a utilização de soluções de rejuvenescimento. (Origem: PRT MS/GM 158/2016, Art. 93, § 2º)
Art. 94. Os componentes plasmáticos serão produzidos utilizando-se os critérios técnicos definidos neste Anexo e são definidos como: (Origem: PRT MS/GM 158/2016, Art. 94)
I - plasma fresco congelado (PFC); (Origem: PRT MS/GM 158/2016, Art. 94, I)
II - plasma fresco congelado dentro de 24 (vinte quatro) horas (PFC24); (Origem: PRT MS/GM 158/2016, Art. 94, II)
III - plasma isento do crioprecipitado (PIC); (Origem: PRT MS/GM 158/2016, Art. 94, III)
IV - plasma comum, não fresco, normal ou simples (PC); e (Origem: PRT MS/GM 158/2016, Art. 94, IV)
V - crioprecipitado (CRIO). (Origem: PRT MS/GM 158/2016, Art. 94, V)
Art. 95. O PFC é o plasma separado de uma unidade de sangue total por centrifugação ou por aférese e congelado completamente em até 8 (oito) horas depois da coleta, atingindo temperaturas iguais ou inferiores a -30ºC (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 95)
§ 1º O tempo máximo para a separação do plasma de que trata o "caput" é de 6 (seis) horas depois da coleta. (Origem: PRT MS/GM 158/2016, Art. 95, § 1º)
§ 2º O PFC será armazenado à temperatura de, no mínimo, - 20°C (vinte graus Celsius negativos), sendo, porém, recomendada a temperatura igual ou inferior a -30°C (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 95, § 2º)
§ 3º Quando for utilizada a técnica de congelamento em banho de imersão em álcool, a bolsa plástica de plasma será protegida de alteração química, derrames e contaminação. (Origem: PRT MS/GM 158/2016, Art. 95, § 3º)
§ 4º O PFC tem, a partir da data da doação, a validade de: (Origem: PRT MS/GM 158/2016, Art. 95, § 4º)
I - 12 (doze) meses, se armazenado em temperatura entre -20°C (vinte graus Celsius negativos) e -30°C (trinta graus Celsius negativos); e (Origem: PRT MS/GM 158/2016, Art. 95, § 4º, I)
II - 24 (vinte quatro) meses, se armazenado à temperatura de -30°C (trinta graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 95, § 4º, II)
Art. 96. PFC24 é o plasma separado de uma unidade de sangue total por centrifugação e congelado completamente entre 8 (oito) e 24 (vinte quatro) horas após a coleta, atingindo temperaturas iguais ou inferiores a -30°C (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 96)
§ 1º O tempo máximo para a separação de que trata o "caput" é de 18 (dezoito) horas depois da coleta se a unidade de sangue total for mantida refrigerada (4 ± 2 °C). (Origem: PRT MS/GM 158/2016, Art. 96, § 1º)
§ 2º No caso do sangue total ser rapidamente resfriado logo após a coleta até a temperatura de 22 ± 2 °C, utilizando-se sistemas especiais validados de refrigeração, o tempo máximo para o congelamento é de 24 (vinte quatro) horas depois da coleta. (Origem: PRT MS/GM 158/2016, Art. 96, § 2º)
§ 3º O PFC24 deve ser armazenado à temperatura de, no mínimo, -20°C (vinte graus Celsius negativos), sendo, porém, recomendada a temperatura igual ou inferior a -30°C (trinta graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 96, § 3º)
§ 4º O PFC24 tem, a partir da data da doação, a validade de: (Origem: PRT MS/GM 158/2016, Art. 96, § 4º)
I - 12 (doze) meses, se armazenado em temperatura entre - 20°C (vinte graus Celsius negativos) e -30°C (trinta graus Celsius negativos); e (Origem: PRT MS/GM 158/2016, Art. 96, § 4º, I)
II - 24 (vinte e quatro) meses, se armazenado à temperatura de -30°C (trinta graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 96, § 4º, II)
Art. 97. Os PFC e PFC24 podem ser utilizados em pacientes para fins terapêuticos com o objetivo de reposição de fatores de coagulação deficientes (deficiências múltiplas ou específicas na ausência do fator purificado). (Origem: PRT MS/GM 158/2016, Art. 97)
Art. 98. O PIC é o plasma do qual foi retirado, em sistema fechado, o crioprecipitado. (Origem: PRT MS/GM 158/2016, Art. 98)
§ 1º O PIC tem, a partir da data da doação, a validade de 12 (doze) meses a partir da coleta, devendo ser armazenado à temperatura de -20°C (vinte graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 98, § 1º)
§ 2º A Púrpura Trombocitopênica Trombótica (PTT) é a única indicação clínica possível para o PIC. (Origem: PRT MS/GM 158/2016, Art. 98, § 2º)
Art. 99. O PC é o plasma cujo congelamento não se deu dentro das especificações técnicas assinaladas nos arts. 95 e 96 do Anexo IV , ou, ainda, resultado da transformação de um PFC, de um PFC24 ou de um PIC cujo período de validade expirou. (Origem: PRT MS/GM 158/2016, Art. 99)
§ 1º O PC será armazenado em temperatura igual ou inferior a -20°C (vinte graus Celsius negativos), e tem a validade de 5 (cinco) anos a partir da data de coleta. (Origem: PRT MS/GM 158/2016, Art. 99, § 1º)
§ 2º O PC não pode ser utilizado para transfusão, devendo ser exclusivamente destinado à produção de hemoderivados. (Origem: PRT MS/GM 158/2016, Art. 99, § 2º)
Art. 100. Os PFC, PFC24 e PIC a serem utilizados exclusivamente com finalidade terapêutica poderão ser mantidos em temperatura igual ou inferior a -18°C (dezoito graus Celsius negativos), por até 12 (doze) meses, sendo este o prazo de validade. (Origem: PRT MS/GM 158/2016, Art. 100)
Art. 101. O plasma excedente do uso terapêutico, considerado a ser destinado para fracionamento industrial, deve ser armazenado em temperatura igual ou inferior a -20°C (vinte graus Celsius negativos), observando, ainda, demais determinações deste Anexo. (Origem: PRT MS/GM 158/2016, Art. 101)
Art. 102. O CRIO é a fração de plasma insolúvel em frio, obtida a partir do plasma fresco congelado, contendo glicoproteínas de alto peso molecular, principalmente fator VIII, fator de von Willebrand, fator XIII e fibrinogênio. (Origem: PRT MS/GM 158/2016, Art. 102)
§ 1º Para a obtenção do CRIO, o PFC deve ser descongelado a 4 ± 2 °C e imediatamente centrifugado nessa mesma temperatura. (Origem: PRT MS/GM 158/2016, Art. 102, § 1º)
§ 2º O sobrenadante pobre em crioprecipitado (plasma isento de crioprecipitado) deve ser extraído, em circuito fechado, permanecendo um volume de até 40 mL junto ao material insolúvel em frio. (Origem: PRT MS/GM 158/2016, Art. 102, § 2º)
§ 3º O crioprecipitado resultante deve ser recongelado em até 1(uma) hora após a sua obtenção. (Origem: PRT MS/GM 158/2016, Art. 102, § 3º)
§ 4º O produto final deve conter, no mínimo, 150mg de fibrinogênio por unidade em, pelo menos, 75% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 102, § 4º)
§ 5º O CRIO tem, a partir da data da doação, a validade de: (Origem: PRT MS/GM 158/2016, Art. 102, § 5º)
I - 12 (doze) meses, se armazenado em temperatura entre - 20°C (vinte graus Celsius negativos) e -30°C (trinta graus Celsius negativos); e (Origem: PRT MS/GM 158/2016, Art. 102, § 5º, I)
II - 24 (vinte e quatro) meses, se armazenado à temperatura de -30°C (trinta graus Celsius negativos) ou inferior. (Origem: PRT MS/GM 158/2016, Art. 102, § 5º, II)
§ 6º O CRIO pode ser indicado a portadores de deficiência de fibrinogênio (quantitativa ou qualitativa) e na deficiência de fator XIII, quando o fator purificado não estiver disponível. (Origem: PRT MS/GM 158/2016, Art. 102, § 6º)
§ 7º O crioprecipitado também pode ser utilizado na produção de cola de fibrina. (Origem: PRT MS/GM 158/2016, Art. 102, § 7º)
Art. 103. O tubo coletor da bolsa do plasma deve estar totalmente preenchido e ter uma extensão mínima de 15 cm (quinze centímetros) e máxima de 20 cm (vinte centímetros) entre as duas soldaduras, uma proximal e uma distal. (Origem: PRT MS/GM 158/2016, Art. 103)
Art. 104. A ocorrência de uso excepcional de crioprecipitado em pacientes hemofílicos e portadores de doença de Von Willebrand deve ser imediatamente relatada à CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 158/2016, Art. 104)
Art. 105. A realização de procedimento de plasmaférese para obtenção de insumos para indústria de hemoderivados é atividade exclusiva dos serviços de hemoterapia públicos. (Origem: PRT MS/GM 158/2016, Art. 105)
§ 1º Os serviços de hemoterapia que forem fornecedores na modalidade de que trata o "caput" solicitarão autorização à CGSH/DAET/SAS/MS para realização do procedimento e envio do plasma para a indústria. (Origem: PRT MS/GM 158/2016, Art. 105, § 1º)
§ 2º Serão observados, ainda, os critérios estabelecidos na Seção IX do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 105, § 2º)
§ 3º O envio do plasma para indústria deve obedecer aos requisitos definidos no Anexo 11 do Anexo IV e demais determinações deste Anexo. (Origem: PRT MS/GM 158/2016, Art. 105, § 3º)
§ 4º Somente plantas de produção de hemoderivados nacional de natureza pública receberão o plasma dos serviços de hemoterapia brasileiros obtido por plasmaférese, obedecendo, ainda, o estabelecido na Seção VI do Capítulo II do Título II. (Origem: PRT MS/GM 158/2016, Art. 105, § 4º)
§ 5º A plasmaférese para uso terapêutico obedecerá ao disposto na Seção IX do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 105, § 5º)
Art. 106. Quando o serviço de hemoterapia for fornecedor de PFC, PFC24 ou PC como matéria prima para a indústria de hemoderivados serão observadas as normas técnico-sanitárias específicas para a produção e armazenamento do plasma, sem prejuízo das normas estabelecidas neste Anexo. (Origem: PRT MS/GM 158/2016, Art. 106)
Art. 107. Os Concentrados de Plaquetas (CP) serão produzidos utilizando critérios técnicos definidos neste Anexo e são definidos como: (Origem: PRT MS/GM 158/2016, Art. 108)
I - CP obtido de sangue total; (Origem: PRT MS/GM 158/2016, Art. 108, I)
II - CP obtido por aférese; (Origem: PRT MS/GM 158/2016, Art. 108, II)
III - CP desleucocitados; e (Origem: PRT MS/GM 158/2016, Art. 108, III)
IV - Pool de plaquetas. (Origem: PRT MS/GM 158/2016, Art. 108, IV)
§ 1º O CP obtido a partir do sangue total é uma suspensão de plaquetas em plasma, preparado mediante dupla centrifugação de uma unidade de sangue total, coletada em tempo não maior que 15 (quinze) minutos e preferencialmente em até 12 (doze) minutos. (Origem: PRT MS/GM 158/2016, Art. 108, § 1º)
§ 2º O CP também pode ser obtido por aférese. (Origem: PRT MS/GM 158/2016, Art. 108, § 2º)
§ 3º As unidades com agregados plaquetários grosseiramente visíveis não serão empregadas na transfusão. (Origem: PRT MS/GM 158/2016, Art. 108, § 3º)
§ 4º Os CP devem ser conservados a 22 ± 2 oC, sob agitação constante em agitador próprio para este fim. (Origem: PRT MS/GM 158/2016, Art. 108, § 4º)
§ 5º A validade dos CP é de 3 (três) a 5 (cinco) dias, dependendo do plastificante da bolsa de conservação. (Origem: PRT MS/GM 158/2016, Art. 108, § 5º)
§ 6º As indicações de transfusão de CP levarão em consideração não somente a contagem, mas também: (Origem: PRT MS/GM 158/2016, Art. 108, § 6º)
I - a existência de fatores de risco; (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, I)
II - a realização de procedimentos invasivos; (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, II)
III - a presença de sangramentos clinicamente significativos; e (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, III)
IV - alterações da função plaquetária. (Origem: PRT MS/GM 158/2016, Art. 108, § 6º, IV)
Art. 108. Os CPs obtidos de sangue total conterão, no mínimo, 5,5 x 10e10 plaquetas por bolsa em, pelo menos, 75% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 109)
§ 1º As plaquetas devem estar suspensas em volume suficiente de plasma (40 a 70 mL), de tal maneira que o pH seja maior ou igual a 6,4 no último dia de validade do produto. (Origem: PRT MS/GM 158/2016, Art. 109, § 1º)
§ 2º Os CP obtidos de sangue total podem ser produzidos a partir: (Origem: PRT MS/GM 158/2016, Art. 109, § 2º)
I - de plasma rico em plaquetas; ou (Origem: PRT MS/GM 158/2016, Art. 109, § 2º, I)
II - da camada leucoplaquetária de sangue total, que apresenta contaminação leucocitária menor. (Origem: PRT MS/GM 158/2016, Art. 109, § 2º, II)
§ 3º A produção do plasma rico em plaquetas ou da camada leucoplaquetária e dos respectivos CP poderá ser realizada até 24 (vinte e quatro) horas após a coleta se o sangue total for mantido em condições validadas para manter a temperatura de 22 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 109, § 3º)
§ 4º A quantidade de plaquetas em uma dose padrão para indivíduos adultos é equivalente a quantidade obtida a partir de 4 (quatro) a 6 (seis) unidades de sangue total. (Origem: PRT MS/GM 158/2016, Art. 109, § 4º)
Art. 109. O CP obtido por aférese, de um único doador, deve conter, no mínimo, 3,0 x 10e11 plaquetas em, pelo menos, 90% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 110)
§ 1º No caso de obtenção de componentes duplos, a contagem deve ser superior ou igual a 6,0 x 10e11 plaquetas em, pelo menos, 90% das unidades avaliadas. (Origem: PRT MS/GM 158/2016, Art. 110, § 1º)
§ 2º As plaquetas obtidas mediante procedimentos de aférese em circuito fechado têm validade de até 5 (cinco) dias e exigem as mesmas condições de conservação que as plaquetas de sangue total. (Origem: PRT MS/GM 158/2016, Art. 110, § 2º)
§ 3º O componente de que trata o "caput" caracteriza-se por uma baixa contaminação leucocitária. (Origem: PRT MS/GM 158/2016, Art. 110, § 3º)
Art. 110. Os CP desleucocitados são obtidos pela remoção de leucócitos por meio de filtros para este fim ou por meio de equipamento de aférese. (Origem: PRT MS/GM 158/2016, Art. 111)
§ 1º O pool de CP desleucocitado, obtido de sangue total, deve conter menos que 5,0 x 10e6 leucócitos ou cada unidade deve conter abaixo de 0,83 x 10e6 leucócitos. (Origem: PRT MS/GM 158/2016, Art. 111, § 1º)
§ 2º O CP obtido por aférese deve preencher o mesmo requisito definido para o pool de concentrado de plaquetas. (Origem: PRT MS/GM 158/2016, Art. 111, § 2º)
§ 3º A validade do CP obtido por aférese é de 4 (quatro) horas, quando preparado em sistema aberto. (Origem: PRT MS/GM 158/2016, Art. 111, § 3º)
§ 4º Se a preparação do CP obtido por aférese ocorrer em sistema fechado, a unidade conserva a validade original do concentrado de plaquetas, desde que a bolsa utilizada para armazenamento seja compatível com o volume. (Origem: PRT MS/GM 158/2016, Art. 111, § 4º)
§ 5º O CP obtido por aférese será utilizado em pacientes que possuam antecedentes de reação febril não hemolítica ou quando estiver indicada a profilaxia da aloimunização a antígenos leucocitários. (Origem: PRT MS/GM 158/2016, Art. 111, § 5º)
§ 6º O CP obtido por aférese pode ser utilizado como alternativa para evitar a transmissão de Citomegalovirus (CMV) em substituição a componentes soronegativos para CMV. (Origem: PRT MS/GM 158/2016, Art. 111, § 6º)
Art. 111. O pool de concentrados de plaquetas obtidos de sangue total é um produto que pode ser separado a partir de concentrados de plaquetas randômicos preparados pelo plasma rico em plaquetas ou a partir de pool de camada leucoplaquetária (buffy coat). (Origem: PRT MS/GM 158/2016, Art. 112)
Art. 112. Os Concentrados de Granulócitos (CG) são suspensões de granulócitos em plasma, obtidas por aférese de doador único. (Origem: PRT MS/GM 158/2016, Art. 113)
§ 1º O CG deve conter, no mínimo, 1,0 x 10e10 granulócitos em todas as unidades coletadas, a menos que seja preparado para recém-nascidos. (Origem: PRT MS/GM 158/2016, Art. 113, § 1º)
§ 2º A validade do CG é de 24 (vinte quatro) horas, devendo ser administrado o mais rapidamente possível depois que a sua coleta for concluída, obrigatoriamente em ambiente hospitalar. (Origem: PRT MS/GM 158/2016, Art. 113, § 2º)
§ 3º A temperatura de conservação do CG é de 22 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 113, § 3º)
§ 4º A indicação terapêutica do CG restringe-se a pacientes gravemente neutropênicos com infecção comprovada, refratários à terapêutica antimicrobiana adequada. (Origem: PRT MS/GM 158/2016, Art. 113, § 4º)
Art. 113. Os componentes sanguíneos irradiados são componentes celulares que devem ser produzidos utilizando-se procedimentos que garantam que a irradiação tenha ocorrido e que a dose mínima tenha sido de 25 Gy (2.500 cGy) sobre o plano médio da unidade irradiada. (Origem: PRT MS/GM 158/2016, Art. 114)
§ 1º A dose em qualquer ponto do componente de que trata o "caput" não deve ser inferior a 15 Gy (1.500 cGy) e nem superior a 50 Gy (5.000 cGy). (Origem: PRT MS/GM 158/2016, Art. 114, § 1º)
§ 2º O procedimento de que trata o § 1º tem como objetivo inativar funcionalmente linfócitos viáveis dos produtos sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 114, § 2º)
§ 3º As unidades irradiadas devem ser adequadamente rotuladas e identificadas e o processo de irradiação deve ser validado periodicamente. (Origem: PRT MS/GM 158/2016, Art. 114, § 3º)
§ 4º A irradiação será feita em irradiador de células próprio para irradiação de sangue e componentes. (Origem: PRT MS/GM 158/2016, Art. 114, § 4º)
§ 5º Quando o aparelho de que trata o § 4º não estiver disponível, a irradiação poderá ser feita em acelerador linear usado para tratamento de radioterapia, sob supervisão de profissional qualificado. (Origem: PRT MS/GM 158/2016, Art. 114, § 5º)
§ 6º O controle de qualidade da fonte radioativa do equipamento de que trata o § 4º deve ser realizado e documentado, no mínimo anualmente. (Origem: PRT MS/GM 158/2016, Art. 114, § 6º)
§ 7º A irradiação pode ser realizada no próprio serviço de hemoterapia ou em centros contratados. (Origem: PRT MS/GM 158/2016, Art. 114, § 7º)
§ 8º A validade dos componentes celulares irradiados difere pela lesão de membrana, portanto, o concentrado de hemácias irradiado deve, preferencialmente, ser produzido até 14 (quatorze) dias após a coleta e obrigatoriamente armazenado até no máximo 28 (vinte oito) dias após a irradiação observando a data de validade original do componente. (Origem: PRT MS/GM 158/2016, Art. 114, § 8º)
§ 9º Nos casos em que exista justificativa para a irradiação de componentes com mais de 14 (quatorze) dias de coleta, a transfusão deve ocorrer em 48 (quarenta e oito) horas. (Origem: PRT MS/GM 158/2016, Art. 114, § 9º)
§ 10. O concentrado de hemácias irradiado para uso em transfusão intrauterina ou transfusão neonatal maciça deve ser utilizado até no máximo 24 (vinte e quatro) horas da irradiação e 5 (cinco) dias após a data da coleta. (Origem: PRT MS/GM 158/2016, Art. 114, § 10)
§ 11. A indicação de componentes celulares irradiados tem como objetivo reduzir o risco de Doença do Enxerto Contra Hospedeiro associada à Transfusão (DECH-AT), em situações como: (Origem: PRT MS/GM 158/2016, Art. 114, § 11)
I - transfusão intrauterina; (Origem: PRT MS/GM 158/2016, Art. 114, § 11, I)
II - recém-nascidos de baixo peso (inferior a 1.200 g) e/ou prematuros (inferior a 28 (vinte e oito) semanas); (Origem: PRT MS/GM 158/2016, Art. 114, § 11, II)
III - portadores de imunodeficiências congênitas graves; (Origem: PRT MS/GM 158/2016, Art. 114, § 11, III)
IV - pacientes recebendo terapia imunossupressora como pós transplante de medula óssea; (Origem: PRT MS/GM 158/2016, Art. 114, § 11, IV)
V - transfusão de componentes HLA compatíveis; e (Origem: PRT MS/GM 158/2016, Art. 114, § 11, V)
VI - quando o receptor for parente em primeiro grau do doador. (Origem: PRT MS/GM 158/2016, Art. 114, § 11, VI)
§ 12. Nas demais situações clínicas não abrangidas no § 11, a decisão de irradiar os componentes ficará sujeita à avaliação e protocolos de cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 114, § 12)
Art. 114. Os CP e os concentrados de granulócitos irradiados mantêm as suas datas de validade original. (Origem: PRT MS/GM 158/2016, Art. 115)
Seção V
Do Controle de Qualidade dos Componentes Sanguíneos
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção V)
Art. 115. Os serviços de hemoterapia realizarão o controle de qualidade sistemático de todos os tipos de componentes sanguíneos que produzirem. (Origem: PRT MS/GM 158/2016, Art. 116)
§ 1º O controle de qualidade dos concentrados de hemácias e dos concentrados de plaquetas deve ser realizado em, pelo menos, 1% da produção ou 10 (dez) unidades por mês, o que for maior. (Origem: PRT MS/GM 158/2016, Art. 116, § 1º)
§ 2º O controle de qualidade dos plasmas e dos crioprecipitados deve ser feito em amostragem definida no Anexo 6 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 116, § 2º)
§ 3º O serviço de hemoterapia deve ter protocolos escritos, definindo: (Origem: PRT MS/GM 158/2016, Art. 116, § 3º)
I - o tipo de controle a ser feito em cada componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 116, § 3º, I)
II - a amostragem; e (Origem: PRT MS/GM 158/2016, Art. 116, § 3º, II)
III - os parâmetros mínimos esperados para cada item controlado. (Origem: PRT MS/GM 158/2016, Art. 116, § 3º, III)
§ 4º Cada item verificado pelo controle de qualidade deve apresentar um percentual de conformidade igual ou superior a 75%. (Origem: PRT MS/GM 158/2016, Art. 116, § 4º)
§ 5º Com relação à produção de concentrado de plaquetas por aférese e contagem de leucócitos em componentes celulares desleucocitados a conformidade considerada deve ser igual ou superior a 90%. (Origem: PRT MS/GM 158/2016, Art. 116, § 5º)
§ 6º A avaliação da contaminação microbiológica dos componentes sanguíneos celulares será realizada utilizando-se amostragem igual ou superior a 1% da produção ou 10 (dez) unidades por mês, o que for maior. (Origem: PRT MS/GM 158/2016, Art. 116, § 6º)
§ 7º Na hipótese do § 6º, todos os casos positivos devem ser devidamente investigados na busca de uma causa corrigível. (Origem: PRT MS/GM 158/2016, Art. 116, § 7º)
§ 8º Pelo alto risco de contaminação microbiológica dos concentrados de plaquetas pela sua condição de armazenamento, recomenda-se realização de avaliação de contaminação microbiológica em 100% desta produção. (Origem: PRT MS/GM 158/2016, Art. 116, § 8º)
§ 9º Serão observados os parâmetros mínimos a serem verificados em cada componente sanguíneo, nos termos do Anexo 6 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 116, § 9º)
Art. 116. Os serviços de hemoterapia realizarão avaliações periódicas dos resultados do controle de qualidade, de forma que tais resultados sejam revisados e analisados, e ações corretivas sejam propostas para as não conformidades observadas. (Origem: PRT MS/GM 158/2016, Art. 117)
Seção VI
Dos Exames de Qualificação no Sangue do Doador
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção VI)
Art. 117. O serviço de hemoterapia realizará os seguintes exames imuno-hematológicos para qualificação do sangue do doador, a fim de garantir a eficácia terapêutica e a segurança da futura doação: (Origem: PRT MS/GM 158/2016, Art. 118)
I - tipagem ABO; (Origem: PRT MS/GM 158/2016, Art. 118, I)
II - tipagem RhD; e (Origem: PRT MS/GM 158/2016, Art. 118, II)
III - pesquisa de anticorpos antieritrocitários irregulares. (Origem: PRT MS/GM 158/2016, Art. 118, III)
Art. 118. A tipagem ABO será realizada testando-se as hemácias com reagentes anti-A, anti-B e anti-AB, sendo que, no caso de serem usados antissoros monoclonais, a utilização do soro anti-AB não é obrigatória. (Origem: PRT MS/GM 158/2016, Art. 119)
§ 1º A tipagem reversa deve ser sempre realizada, testando-se o soro ou plasma de amostra da doação com suspensões de hemácias conhecidas A1 e B e, opcionalmente, A2 e O. (Origem: PRT MS/GM 158/2016, Art. 119, § 1º)
§ 2º Nenhum componente sanguíneo será rotulado e liberado para utilização até que qualquer discrepância entre a tipagem direta e reversa tenha sido resolvida. (Origem: PRT MS/GM 158/2016, Art. 119, § 2º)
Art. 119. O antígeno RhD será determinado colocando-se as hemácias com antissoro anti-RhD (Anti-D). (Origem: PRT MS/GM 158/2016, Art. 120)
§ 1º Paralelamente ao procedimento previsto no "caput" deve ser sempre efetuado um controle da tipagem RhD, utilizando-se soro-controle compatível com o antissoro utilizado e do mesmo fabricante do anti-D. (Origem: PRT MS/GM 158/2016, Art. 120, § 1º)
§ 2º No caso de utilização de antissoros anti-D produzido em meio salino, o uso do soro-controle na reação é dispensável. (Origem: PRT MS/GM 158/2016, Art. 120, § 2º)
§ 3º Se a reação for negativa para a presença do antígeno RhD, será efetuada a pesquisa do antígeno D-fraco. (Origem: PRT MS/GM 158/2016, Art. 120, § 3º)
§ 4º Para a realização da pesquisa de antígeno D-fraco, recomenda-se a utilização de, no mínimo, dois antissoros anti-RhD (anti-D), sendo que, pelo menos um desses antissoros contenha anticorpos da classe IgG. (Origem: PRT MS/GM 158/2016, Art. 120, § 4º)
§ 5º Os antissoros de que trata o § 4º devem ser obtidos de linhagens celulares distintas incluindo a fase da antiglobulina humana. (Origem: PRT MS/GM 158/2016, Art. 120, § 5º)
§ 6º Quando a tipagem RhD ou a pesquisa do antígeno D-fraco resultar positiva, o sangue deve ser rotulado como "RhD positivo". (Origem: PRT MS/GM 158/2016, Art. 120, § 6º)
§ 7º Quando ambas as provas de que trata o § 4º resultarem negativas, o sangue deve ser rotulado como "RhD negativo". (Origem: PRT MS/GM 158/2016, Art. 120, § 7º)
§ 8º Em doadores de sangue tipados como RhD negativo, recomenda-se a pesquisa dos antígenos C (maiúsculo) e E (maiúsculo) e os componentes sanguíneos devem ser devidamente identificados. (Origem: PRT MS/GM 158/2016, Art. 120, § 8º)
§ 9º A utilização dos concentrados de hemácias RhD negativo C ou E positivos deve obedecer a protocolos escritos específicos da instituição ou seguir critérios do responsável técnico de cada local. (Origem: PRT MS/GM 158/2016, Art. 120, § 9º)
§ 10. Se a reação com o soro-controle de RhD for positiva, a tipagem RhD é considerada inválida e o componente sanguíneo só deve ser rotulado e liberado para uso após a resolução do problema. (Origem: PRT MS/GM 158/2016, Art. 120, § 10)
Art. 120. O registro de uma tipagem ABO e RhD prévia de um doador não serve para a identificação das unidades de sangue subsequentemente doadas pelo mesmo doador. (Origem: PRT MS/GM 158/2016, Art. 121)
§ 1º Novas determinações devem ser realizadas a cada doação. (Origem: PRT MS/GM 158/2016, Art. 121, § 1º)
§ 2º Em caso de doações prévias, deve ser comparada a tipagem ABO e RhD com o último registro disponível. (Origem: PRT MS/GM 158/2016, Art. 121, § 2º)
§ 3º Qualquer discrepância nos resultados das tipagens sanguíneas de que trata o "caput" será resolvida antes de se rotular e liberar para uso os componentes sanguíneos produzidos. (Origem: PRT MS/GM 158/2016, Art. 121, § 3º)
Art. 121. Deve ser realizada no sangue dos doadores a pesquisa de anticorpos antieritrocitários irregulares, empregando-se métodos que evidenciem a presença de anticorpos clinicamente significativos. (Origem: PRT MS/GM 158/2016, Art. 122)
§ 1º Os componentes sanguíneos que contenham anticorpos antieritrocitários irregulares devem ser rotulados como tais. (Origem: PRT MS/GM 158/2016, Art. 122, § 1º)
§ 2º As condições e situações nas quais os componentes de que trata o § 1º podem ser utilizados ficarão a critério do responsável técnico de cada local, sendo, porém, recomendável que os componentes plasmáticos e os concentrados de plaquetas não sejam utilizados para transfusão. (Origem: PRT MS/GM 158/2016, Art. 122, § 2º)
Art. 122. É recomendada a realização do teste de hemolisina para transfusões de plaquetas não isogrupo utilizando-se um método qualitativo com incubação a 37ºC (trinta e sete graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 123)
Parágrafo Único. Componentes sanguíneos com resultados de hemólise total ou parcial devem ser evitados em transfusões não isogrupo. (Origem: PRT MS/GM 158/2016, Art. 123, Parágrafo Único)
Art. 123. É recomendada a realização da fenotipagem de antígenos eritrocitários dos sistemas Rh (D, C, c, E, e) e Kell (K1) nas amostras de sangue de doadores, conforme as demandas do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 124)
Art. 124. É recomendada a realização da investigação de subgrupo de A em doadores de sangue, quando houver resultados discrepantes entre as provas ABO direta e reversa ou na busca de concentrado de hemácias de subgrupo A2 para pacientes que apresentam anticorpo anti-A1 clinicamente significante. (Origem: PRT MS/GM 158/2016, Art. 125)
Art. 125. Os testes de que tratam os arts. 118, 119, 120, 121, 122 e 123 do Anexo IV devem ser realizados em laboratórios cuja rotina seja adequada para triagem imuno-hematológica de doadores de sangue, com reagentes registrados ou autorizados pela ANVISA. (Origem: PRT MS/GM 158/2016, Art. 126)
Art. 126. Será realizado o controle de qualidade de reagentes em imuno-hematologia. (Origem: PRT MS/GM 158/2016, Art. 127)
§ 1º Os reagentes devem ser armazenados de acordo com as instruções do fabricante, devendo ser evitada, ao máximo, a permanência do reagente fora das temperaturas indicadas para seu armazenamento. (Origem: PRT MS/GM 158/2016, Art. 127, § 1º)
§ 2º O serviço de hemoterapia realizará controles de qualidade em cada lote e remessa recebidos para comprovar que os reagentes estão dentro dos padrões estabelecidos e que não foram alterados durante o transporte. (Origem: PRT MS/GM 158/2016, Art. 127, § 2º)
§ 3º Para as análises do controle de qualidade, recomenda-se seguir os padrões presentes no Anexo 7 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 127, § 3º)
§ 4º No caso de antissoros de origem monoclonal, é indispensável a identificação na bula, do clone celular utilizado para produção pelo fabricante. (Origem: PRT MS/GM 158/2016, Art. 127, § 4º)
§ 5º Serão verificadas, periodicamente, possíveis alterações durante a manipulação ou armazenamento dos reagentes no serviço de hemoterapia, utilizando protocolos definidos pelo serviço. (Origem: PRT MS/GM 158/2016, Art. 127, § 5º)
§ 6º Os resultados dos controles devem ser registrados para acompanhamento do desempenho dos produtos. (Origem: PRT MS/GM 158/2016, Art. 127, § 6º)
§ 7º Serão estabelecidas medidas corretivas quando forem detectadas anormalidades no processo do controle de qualidade em imuno-hematologia. (Origem: PRT MS/GM 158/2016, Art. 127, § 7º)
Art. 127. Será realizado, ainda, o controle de qualidade das técnicas empregadas, utilizando-se sistematicamente e durante o procedimento técnico, controles negativos e positivos para confirmar os resultados obtidos. (Origem: PRT MS/GM 158/2016, Art. 128)
Art. 128. O serviço de hemoterapia realizará testes para infecções transmissíveis pelo sangue, a fim de reduzir riscos de transmissão de doenças e em prol da qualidade do sangue doado. (Origem: PRT MS/GM 158/2016, Art. 129)
Art. 129. É obrigatória a realização de exames laboratoriais de alta sensibilidade a cada doação, para detecção de marcadores para as seguintes infecções transmissíveis pelo sangue, cumprindo-se ainda, os algoritmos descritos no Anexo 5 do Anexo IV para cada marcador: (Origem: PRT MS/GM 158/2016, Art. 130)
I - sífilis; (Origem: PRT MS/GM 158/2016, Art. 130, I)
II - doença de Chagas; (Origem: PRT MS/GM 158/2016, Art. 130, II)
III - hepatite B; (Origem: PRT MS/GM 158/2016, Art. 130, III)
IV - hepatite C; (Origem: PRT MS/GM 158/2016, Art. 130, IV)
V - AIDS; e (Origem: PRT MS/GM 158/2016, Art. 130, V)
VI - HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 130, VI)
§ 1º Os exames de que trata o "caput" devem ser feitos em amostra colhida no ato da doação. (Origem: PRT MS/GM 158/2016, Art. 130, § 1º)
§ 2º Os exames serão realizados em laboratórios específicos para triagem laboratorial de doadores de sangue, com conjuntos diagnósticos (kits) próprios para esta finalidade, registrados na ANVISA. (Origem: PRT MS/GM 158/2016, Art. 130, § 2º)
§ 3º Fica vedada a realização de exames sorológicos em pool de amostras de sangue. (Origem: PRT MS/GM 158/2016, Art. 130, § 3º)
§ 4º É permitido o emprego de pool de amostras para testes de pesquisa de ácido nucléicos (NAT) para detecção de infecções transmissíveis pelo sangue. (Origem: PRT MS/GM 158/2016, Art. 130, § 4º)
§ 5º O sangue total e seus componentes não serão transfundidos antes da obtenção de resultados finais não reagentes/negativos, nos testes de detecção para: (Origem: PRT MS/GM 158/2016, Art. 130, § 5º)
I - hepatite B; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, I)
II - hepatite C; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, II)
III - AIDS; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, III)
IV - doença de Chagas; (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, IV)
V - sífilis; e (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, V)
VI - infecção por HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 130, § 5º, VI)
§ 6º São os testes para detecção de hepatite B: (Origem: PRT MS/GM 158/2016, Art. 130, § 6º)
I - detecção do antígeno de superfície do vírus da hepatite B (HBV) - HBsAg; (Origem: PRT MS/GM 158/2016, Art. 130, § 6º, I)
II - detecção de anticorpos contra o capsídeo do HBV - anti- HBc (IgG ou IgG + IgM); e (Origem: PRT MS/GM 158/2016, Art. 130, § 6º, II)
III - detecção de ácido nucleico (NAT) do HBV. (Origem: PRT MS/GM 158/2016, Art. 130, § 6º, III)
§ 7º São os testes para detecção de hepatite C: (Origem: PRT MS/GM 158/2016, Art. 130, § 7º)
I - detecção do anticorpo contra o vírus da hepatite C (HCV) ou detecção combinada de anticorpo + antígeno do HCV; e (Origem: PRT MS/GM 158/2016, Art. 130, § 7º, I)
II - detecção de ácido nucleico (NAT) do HCV. (Origem: PRT MS/GM 158/2016, Art. 130, § 7º, II)
§ 8º São os testes para detecção de AIDS: (Origem: PRT MS/GM 158/2016, Art. 130, § 8º)
I - detecção de anticorpo contra o HIV ou detecção combinada do anticorpo contra o HIV + antígeno p24 do HIV; e (Origem: PRT MS/GM 158/2016, Art. 130, § 8º, I)
II - detecção de ácido nucleico (NAT) do HIV. (Origem: PRT MS/GM 158/2016, Art. 130, § 8º, II)
§ 9º O teste de que trata o inciso I do § 8º incluirá, obrigatoriamente, a pesquisa de anticorpos contra os subtipos 1, 2 e O. (Origem: PRT MS/GM 158/2016, Art. 130, § 9º)
§ 10. O teste para doença de Chagas será por meio da detecção de anticorpo anti-T cruzi por método de ensaio imunoenzimático (EIE) ou quimioiluminescência (QLM). (Origem: PRT MS/GM 158/2016, Art. 130, § 10)
§ 11. O teste para sífilis será por intermédio da detecção de anticorpo anti-treponêmico ou não-treponêmico. (Origem: PRT MS/GM 158/2016, Art. 130, § 11)
§ 12. O teste para infecção por HTLV I/II será mediante a detecção de anticorpo contra o HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 130, § 12)
§ 13. Somente podem ser liberadas as bolsas com resultados não reagentes/negativos tanto para os testes sorológicos quanto para os testes de detecção de ácido nucleico. (Origem: PRT MS/GM 158/2016, Art. 130, § 13)
§ 14. Deverão ser excluídos como doadores, temporária ou definitivamente, e, se necessário, encaminhados a um serviço de referência, os que apresentarem resultados reagentes. (Origem: PRT MS/GM 158/2016, Art. 130, § 14)
§ 15. No caso da realização dos testes NAT em pool, o grupo de amostras que apresentar resultado positivo deve ser desmembrado e suas amostras testadas individualmente para identificação do(s) agente(s) infeccioso(s) em questão, considerando a possibilidade de desmembramento cruzado. (Origem: PRT MS/GM 158/2016, Art. 130, § 15)
§ 16. As bolsas cujas amostras individuais forem positivas ou inconclusivas nos testes NAT ou que tenham resultados discrepantes com os testes sorológicos serão descartadas, e o doador será convocado para repetição dos testes em nova amostra e/ou orientação. (Origem: PRT MS/GM 158/2016, Art. 130, § 16)
§ 17. As amostras de doadores com resultado NAT HIV e/ou HCV negativo em pool e teste sorológico positivo ou inconclusivo serão testadas individualmente pelo teste NAT. (Origem: PRT MS/GM 158/2016, Art. 130, § 17)
§ 18. As amostras de doadores com resultado NAT HBV negativo em pool e teste sorológico HBsAg positivo ou inconclusivo serão testadas individualmente pelo teste NAT. (Origem: PRT MS/GM 158/2016, Art. 130, § 18)
Art. 130. O serviço de hemoterapia realizará exames laboratoriais de alta sensibilidade a cada doação, para detecção de citomegalovírus (CMV) em todas as unidades de sangue ou componentes destinados aos pacientes nas seguintes situações: (Origem: PRT MS/GM 158/2016, Art. 131)
I - submetidos a transplantes de célula progenitora e de órgãos, com sorologia não reagente para CMV; (Origem: PRT MS/GM 158/2016, Art. 131, I)
II - recém-nascidos de mães CMV negativo ou com resultados sorológicos desconhecidos que tenham peso ao nascimento inferior a 1.200g; e (Origem: PRT MS/GM 158/2016, Art. 131, II)
III - transfusão intrauterina. (Origem: PRT MS/GM 158/2016, Art. 131, III)
§ 1º Componentes celulares desleucocitados, segundo definição constante do Anexo 6 do Anexo IV , podem substituir a utilização de componentes soronegativos para CMV. (Origem: PRT MS/GM 158/2016, Art. 131, § 1º)
§ 2º Sempre que a sorologia para CMV for realizada, o resultado constará do rótulo das bolsas de componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 131, § 2º)
Art. 131. Nas regiões endêmicas de malária, com transmissão ativa, independente da incidência parasitária da doença, será realizado teste para detecção do plasmódio ou de antígenos plasmodiais. (Origem: PRT MS/GM 158/2016, Art. 132)
Art. 132. O serviço de hemoterapia que realiza exames para detecção de infecções transmissíveis pelo sangue para qualificação no sangue do doador, participará regularmente de, pelo menos, um programa de controle de qualidade externo (proficiência), realizará controle de qualidade interno e disporá de sistema de garantia da qualidade na realização dos testes. (Origem: PRT MS/GM 158/2016, Art. 133)
Parágrafo Único. O controle de qualidade interno e o sistema de garantia da qualidade compreendem os seguintes itens: (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único)
I - validação de cada lote/remessa de conjunto diagnóstico antes da sua colocação na rotina de trabalho; (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, I)
II - validação das baterias de testes utilizando controles positivos diferentes dos fornecidos pelo fabricante; (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, II)
III - análise periódica dos coeficientes de variação (CV) dos testes de detecção de infecções transmissíveis por transfusão de sangue; (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, III)
IV - qualificação de novos produtos e/ou metodologias por meio da testagem e validação destes em seu serviço de hemoterapia antes da implantação na rotina; e (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, IV)
V - rastreabilidade dos dados. (Origem: PRT MS/GM 158/2016, Art. 133, Parágrafo Único, V)
Art. 133. Os laboratórios de triagem de doadores de sangue para infecções passíveis de transmissão sanguínea trabalharão com os tubos primários, colhidos diretamente do doador, até a fase de pipetagem das amostras nas placas ou nos tubos das estantes para a reação. (Origem: PRT MS/GM 158/2016, Art. 134)
Art. 134. Quando os testes de triagem forem reagentes (positivo ou inconclusivo) em um doador de sangue que em doações prévias apresentava testes não reagentes/negativos, o que configura soroconversão ou viragem, o serviço de hemoterapia adotará procedimentos de retrovigilância. (Origem: PRT MS/GM 158/2016, Art. 135)
§ 1º Quando a soroconversão/viragem for detectada pelo teste de detecção de ácido nucleico (NAT) do HIV, HCV e/ou HBV, isoladamente ou em associação com o teste sorológico, não é necessária a realização de testes para confirmação do resultado inicial. (Origem: PRT MS/GM 158/2016, Art. 135, § 1º)
§ 2º Quando a soroconversão/viragem for detectada somente pelo teste sorológico, é necessária a realização de testes com a mesma amostra, para confirmação do resultado inicial, conforme o caso: (Origem: PRT MS/GM 158/2016, Art. 135, § 2º)
I - HBsAg: realizar teste de neutralização, ou 1 (um) segundo teste com reagente de outra origem ou de outro fabricante ou com outra metodologia; (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, I)
II - Anti-HBc: realizar 1 (um) segundo teste com reagente de outra origem ou de outro fabricante ou com outra metodologia; (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, II)
III - Anti-HCV: realizar 1 (um) segundo teste de detecção de anticorpo com reagente de outra origem ou de outro fabricante ou com outra metodologia, ou teste com reagente que detecte de maneira combinada antígeno e anticorpo do HCV; (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, III)
IV - Anti-HIV: realizar 1 (um) segundo teste de detecção de anticorpo ou detecção combinada do anticorpo contra o HIV + antígeno p24 do HIV, com reagente de outra origem ou de outro fabricante ou com outra metodologia; e (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, IV)
V - Anti-HTLV I/II: realizar 1 (um) segundo teste de detecção de anticorpo com reagente de outra origem ou de outro fabricante ou com outra metodologia, ou teste de detecção de ácido nucléico (NAT) do HTLV I/II. (Origem: PRT MS/GM 158/2016, Art. 135, § 2º, V)
§ 3º Caso o laboratório que realizou os testes de triagem não faça o teste de confirmação de resultado inicial, a mesma amostra será encaminhada a outro laboratório no prazo de 10 (dez) dias úteis para a sua realização ou o processo de retrovigilância será desencadeado mesmo sem a confirmação do resultado inicial. (Origem: PRT MS/GM 158/2016, Art. 135, § 3º)
§ 4º Na hipótese do § 3º, o laboratório que realizar o teste de confirmação de resultado inicial remeterá o resultado do exame ao serviço de hemoterapia no prazo máximo de 30 (trinta) dias. (Origem: PRT MS/GM 158/2016, Art. 135, § 4º)
Art. 135. No caso do teste de confirmação do resultado inicial apontar resultado reagente (positivo ou inconclusivo), o serviço de hemoterapia verificará o destino de todos os componentes sanguíneos da(s) doação(ões) anterior(es), adotando os seguintes procedimentos: (Origem: PRT MS/GM 158/2016, Art. 136)
I - nos casos de soroconversão com confirmação dos resultados iniciais reagentes (positivo ou inconclusivo) para Anti-HIV, Anti-HCV, HBsAg ou Anti-HTLV I/II, realizar-se-á a investigação de retrovigilância da última doação com triagem sorológica não reagente e todas as doações realizadas até 6 (seis) meses antes desta; (Origem: PRT MS/GM 158/2016, Art. 136, I)
II - nos casos de soroconversão com confirmação do resultado inicial reagente (positivo ou inconclusivo) para Anti-HBc, realizar-se-á a investigação de retrovigilância para a última doação (mais recente) com triagem sorológica não reagente, caso esta tenha ocorrido menos de 12 (doze) meses antes da soroconversão; e (Origem: PRT MS/GM 158/2016, Art. 136, II)
III - nos casos de soroconversão para teste de detecção de ácido nucleico (NAT) para HIV, HCV e/ou HBV, com teste de triagem sorológica não reagente realizar-se-á a investigação de retrovigilância da última doação com triagem laboratorial negativa e todas as doações realizadas até 3 (três) meses antes desta. (Origem: PRT MS/GM 158/2016, Art. 136, III)
§ 1º O teste de detecção de ácido nucléico (NAT) do agente infeccioso que estiver sendo investigado pode ser realizado na amostra da doação anterior à soroconversão, utilizando amostra da plasmateca/soroteca ou da unidade de plasma armazenado. (Origem: PRT MS/GM 158/2016, Art. 136, § 1º)
§ 2º Na hipótese do § 1º, o procedimento de retrovigilância deve ser realizado, independentemente do resultado obtido. (Origem: PRT MS/GM 158/2016, Art. 136, § 2º)
§ 3º Caso ainda haja algum componente sanguíneo envolvido no procedimento de retrovigilância armazenado em qualquer serviço de hemoterapia, realizar-se-á a devolução para o serviço produtor para as providências cabíveis. (Origem: PRT MS/GM 158/2016, Art. 136, § 3º)
§ 4º O serviço de hemoterapia comunicará, simultaneamente e por escrito, à indústria que recebeu o plasma, à ANVISA e à CGSH/DAHU/SAS/MS quando as unidades de plasma das doações envolvidas no procedimento de retrovigilância já tiverem sido enviadas para o fracionamento industrial. (Origem: PRT MS/GM 158/2016, Art. 136, § 4º)
Art. 136. Compete ao serviço de hemoterapia: (Origem: PRT MS/GM 158/2016, Art. 137)
I - cumprir o algoritmo para cada marcador, conforme Anexo 5 do Anexo IV ; (Origem: PRT MS/GM 158/2016, Art. 137, I)
II - descartar as bolsas de componentes sanguíneos que tenham resultado reagente em qualquer um dos testes obrigatórios para infecções transmissíveis pelo sangue realizados na triagem laboratorial, segundo os preceitos estabelecidos na legislação pertinente; (Origem: PRT MS/GM 158/2016, Art. 137, II)
III - bloquear os doadores considerados inaptos nos testes para infecções transmissíveis pelo sangue; e (Origem: PRT MS/GM 158/2016, Art. 137, III)
IV - convocar e orientar o doador com resultados de testes reagentes (positivo ou inconclusivo), encaminhando-o a serviços assistenciais para confirmação do diagnóstico e/ou acompanhamento e tratamento. (Origem: PRT MS/GM 158/2016, Art. 137, IV)
Parágrafo Único. Caso o doador com resultados de testes reagentes (positivo ou inconclusivo) não compareça para a coleta de segunda amostra e/ou orientações, o serviço de hemoterapia comunicará ao órgão de vigilância em saúde competente, conforme as legislações sanitárias vigentes. (Origem: PRT MS/GM 158/2016, Art. 137, Parágrafo Único)
Art. 137. Os resultados dos exames de triagem dos doadores são absolutamente sigilosos. (Origem: PRT MS/GM 158/2016, Art. 138)
§ 1º Quando os exames forem feitos em serviço de hemoterapia diferente daquela em que ocorreu a doação, o envio dos resultados será feito de modo a assegurar a não identificação do doador, sendo vedada a transmissão verbal ou por via telefônica dos resultados. (Origem: PRT MS/GM 158/2016, Art. 138, § 1º)
§ 2º O envio dos resultados por fax ou por meio eletrônico é permitido, sem a identificação do nome por extenso do doador. (Origem: PRT MS/GM 158/2016, Art. 138, § 2º)
Art. 138. Não é obrigatório que o serviço de hemoterapia firme o diagnóstico da doença ou testes confirmatórios de infecções biológicas. (Origem: PRT MS/GM 158/2016, Art. 139)
Art. 139. Pelo menos durante os 6 (seis) próximos meses após a doação, será conservada (plasmateca ou soroteca) uma alíquota da amostra de plasma ou soro de cada doação de sangue em temperatura igual ou inferior a -20° C (vinte graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Art. 140)
Art. 140. O descarte ou a liberação do sangue, em função dos resultados da testagem das amostras para os vários marcadores que deverão ser observados, seguirá o disposto no algoritmo de que trata o Anexo 5 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 141)
Art. 141. É obrigatória a pesquisa de hemoglobina S nos doadores de sangue, pelo menos, na primeira doação. (Origem: PRT MS/GM 158/2016, Art. 142)
§ 1º Os componentes eritrocitários de doadores com pesquisa de hemoglobina S positiva conterão esta informação no seu rótulo, sem necessidade de descarte dos mesmos. (Origem: PRT MS/GM 158/2016, Art. 142, § 1º)
§ 2º Os componentes de que trata o § 1º não serão desleucocitados e nem utilizados em pacientes: (Origem: PRT MS/GM 158/2016, Art. 142, § 2º)
I - com hemoglobinopatias; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, I)
II - com acidose grave; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, II)
III - recém-nascidos; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, III)
IV - de transfusão intrauterina; (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, IV)
V - de procedimentos cirúrgicos com circulação extracorpórea; ou (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, V)
VI - com hipotermia. (Origem: PRT MS/GM 158/2016, Art. 142, § 2º, VI)
§ 3º O doador que apresentar pesquisa de hemoglobina S positiva será orientado e encaminhado a serviço assistencial para avaliação clínica, se for o caso. (Origem: PRT MS/GM 158/2016, Art. 142, § 3º)
Seção VII
Da Rotulagem do Sangue do Doador
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção VII)
Art. 142. É obrigatória a fixação de rótulos e etiquetas em cada unidade de sangue, que ficarão firmemente aderidos à bolsa plástica. (Origem: PRT MS/GM 158/2016, Art. 143)
§ 1º Os rótulos de que trata o "caput" não serão adulterados. (Origem: PRT MS/GM 158/2016, Art. 143, § 1º)
§ 2º As informações contidas nos rótulos e etiquetas finais das bolsas serão impressas de forma legível. (Origem: PRT MS/GM 158/2016, Art. 143, § 2º)
Art. 143. É obrigatório o controle de rotulagem de cada unidade por duas pessoas diferentes, a menos que seja utilizada a tecnologia de código de barras ou alguma outra forma eletrônica de verificação devidamente validada. (Origem: PRT MS/GM 158/2016, Art. 144)
Art. 144. A identificação das bolsas na coleta permitirá a rastreabilidade da bolsa desde a sua obtenção até o término do ato transfusional, permitindo, inclusive, a investigação de eventos adversos que eventualmente possam ocorrer durante ou após o ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 145)
Art. 145. A identificação das bolsas de coleta será realizada por sistema numérico ou alfanumérico, sendo acompanhada de código de barras. (Origem: PRT MS/GM 158/2016, Art. 146)
Parágrafo Único. No momento da coleta, a identificação a que se refere o "caput" será feita nas bolsas principais e satélites, não devendo ser raspada, removida ou coberta posteriormente. (Origem: PRT MS/GM 158/2016, Art. 146, Parágrafo Único)
Art. 146. Todos os rótulos que identificam as bolsas de sangue e os tubos das amostras para testes laboratoriais terão identificação adicional por código de barras. (Origem: PRT MS/GM 158/2016, Art. 147)
Art. 147. Serão incluídos no rótulo do tubo com amostra para os testes de triagem os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 148)
I - nome ou sigla do serviço de hemoterapia coletor; (Origem: PRT MS/GM 158/2016, Art. 148, I)
II - data da coleta; e (Origem: PRT MS/GM 158/2016, Art. 148, II)
III - identificação numérica ou alfanumérica da amostra. (Origem: PRT MS/GM 158/2016, Art. 148, III)
Parágrafo Único. Outros sistemas de identificação não abrangidos pelos incisos I a III do "caput" poderão ser utilizados, desde que estas informações possam ser recuperadas. (Origem: PRT MS/GM 158/2016, Art. 148, Parágrafo Único)
Art. 148. Os rótulos dos componentes sanguíneos liberados para uso conterão as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 149)
I - nome e endereço do serviço de hemoterapia coletor; (Origem: PRT MS/GM 158/2016, Art. 149, I)
II - data da coleta; (Origem: PRT MS/GM 158/2016, Art. 149, II)
III - nome do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 149, III)
IV - volume aproximado do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 149, IV)
V - identificação numérica ou alfanumérica que permita a rastreabilidade do doador e da doação; (Origem: PRT MS/GM 158/2016, Art. 149, V)
VI - nome do anticoagulante ou outra solução preservativa (exceto nos componentes obtidos por aférese); (Origem: PRT MS/GM 158/2016, Art. 149, VI)
VII - temperatura adequada para a conservação; (Origem: PRT MS/GM 158/2016, Art. 149, VII)
VIII - data de vencimento do produto; (Origem: PRT MS/GM 158/2016, Art. 149, VIII)
IX - o grupo ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 149, IX)
X - o resultado da pesquisa de anticorpos antieritrocitários irregulares, quando esta for positiva, de preferência com o nome do anticorpo identificado; (Origem: PRT MS/GM 158/2016, Art. 149, X)
XI - o resultado dos testes não reagentes para triagem de infecções transmissíveis pelo sangue; e (Origem: PRT MS/GM 158/2016, Art. 149, XI)
XII - a inscrição "doação autóloga", quando for o caso. (Origem: PRT MS/GM 158/2016, Art. 149, XII)
Parágrafo Único. Nos componentes nos quais o tempo de armazenamento é fator crítico para a qualidade destes, será considerada a hora de coleta na determinação do prazo de vencimento. (Origem: PRT MS/GM 158/2016, Art. 149, Parágrafo Único)
Art. 149. Os rótulos de componentes liberados, submetidos a procedimentos de modificação para formação de pool (concentrados de plaquetas e crioprecipitados), conterão as informações: (Origem: PRT MS/GM 158/2016, Art. 150)
I - a indicação de que se trata de um pool e o número do pool; (Origem: PRT MS/GM 158/2016, Art. 150, I)
II - nome do serviço de hemoterapia responsável pela preparação do pool; (Origem: PRT MS/GM 158/2016, Art. 150, II)
III - grupo ABO e RhD das unidades do pool; (Origem: PRT MS/GM 158/2016, Art. 150, III)
IV - volume aproximado do pool; e (Origem: PRT MS/GM 158/2016, Art. 150, IV)
V - data e horário de vencimento do pool. (Origem: PRT MS/GM 158/2016, Art. 150, V)
§ 1º Será informado nos rótulos dos componentes de que trata o "caput", ainda, quando o mesmo for irradiado ou CMV negativo. (Origem: PRT MS/GM 158/2016, Art. 150, § 1º)
§ 2º O serviço de hemoterapia que preparou o pool terá um sistema que permita a rastreabilidade de todas as unidades que o compõe. (Origem: PRT MS/GM 158/2016, Art. 150, § 2º)
Seção VIII
Da Conservação do Sangue e Componentes
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção VIII)
Art. 150. As câmaras de conservação em que se armazenam o sangue, os componentes sanguíneos e os hemoderivados serão apropriadas para esta finalidade e de uso exclusivo. (Origem: PRT MS/GM 158/2016, Art. 151)
Art. 151. É permitida a utilização da mesma câmara de conservação para armazenamento de reagentes e amostras envolvidos nos testes pré-transfusionais. (Origem: PRT MS/GM 158/2016, Art. 152)
§ 1º A localização e identificação dos compartimentos serão evidentes e distintas dentro da câmara. (Origem: PRT MS/GM 158/2016, Art. 152, § 1º)
§ 2º Em serviço de hemoterapia de pequeno porte, é permitida a utilização de uma mesma câmara de conservação para armazenamento dos componentes sanguíneos, reagentes e amostras, sem prejuízo do descrito no "caput". (Origem: PRT MS/GM 158/2016, Art. 152, § 2º)
Art. 152. Os componentes sanguíneos serão armazenados à temperatura que resulte ótima para sua função e para a segurança do produto, de acordo com o disposto na Seção IV do Capítulo I do Título II. (Origem: PRT MS/GM 158/2016, Art. 153)
§ 1º As câmaras de conservação que são utilizadas para conservar o sangue e seus componentes terão um sistema de ventilação para circulação de ar e temperatura uniformemente distribuída em todos os compartimentos. (Origem: PRT MS/GM 158/2016, Art. 153, § 1º)
§ 2º É recomendável que as câmaras de conservação para concentrado de hemácias, plaquetas e plasma possuam registrador gráfico contínuo de temperatura. (Origem: PRT MS/GM 158/2016, Art. 153, § 2º)
§ 3º Em situações em que não esteja disponível o recurso citado no § 2º, a verificação e o registro da temperatura serão realizados a cada 4 (quatro) horas, se os equipamentos estiverem em uso rotineiro, isto é, com abertura constante das portas. (Origem: PRT MS/GM 158/2016, Art. 153, § 3º)
§ 4º Em situações em que as portas estiverem permanentemente fechadas, o monitoramento pode ser feito, no máximo, a cada 12 (doze) horas, sendo obrigatória a instalação de um termômetro de registro de temperatura máxima e mínima. (Origem: PRT MS/GM 158/2016, Art. 153, § 4º)
§ 5º Os registros de temperatura serão periodicamente revisados por uma pessoa qualificada. (Origem: PRT MS/GM 158/2016, Art. 153, § 5º)
Art. 153. As câmaras de conservação de componentes sanguíneos terão sistema de alarme sonoro e visual que serão ativados a uma temperatura que permita a execução das condutas apropriadas para evitar que o sangue e os componentes sofram danos devido a temperaturas incorretas. (Origem: PRT MS/GM 158/2016, Art. 154)
§ 1º As câmaras de conservação de concentrados de hemácias e plaquetas serão dotadas de alarmes de alta e de baixa temperatura. (Origem: PRT MS/GM 158/2016, Art. 154, § 1º)
§ 2º As câmaras de conservação de plasma não precisam de alarmes de baixa temperatura. (Origem: PRT MS/GM 158/2016, Art. 154, § 2º)
Art. 154. No serviço de hemoterapia haverá planos de contingência com procedimentos escritos, facilmente disponíveis, que contenham instruções sobre como proceder em casos de cortes de energia elétrica ou em casos de defeitos na cadeia do frio. (Origem: PRT MS/GM 158/2016, Art. 155)
Seção IX
Da Doação de Componentes por Aférese
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção IX)
Art. 155. Aplicam-se à seleção e ao cuidado dos doadores por aférese as normas estabelecidas para a doação de sangue total. (Origem: PRT MS/GM 158/2016, Art. 156)
Parágrafo Único. A coleta de granulócitos, linfócitos e células progenitoras hematopoiéticas por aférese será precedida de avaliação médica. (Origem: PRT MS/GM 158/2016, Art. 156, Parágrafo Único)
Art. 156. A coleta por aférese em doadores que não cumpram os requisitos habituais só será realizada se o componente a ser coletado tiver uma aplicação especial para um determinado receptor, e se um hemoterapeuta autorizar formalmente o procedimento. (Origem: PRT MS/GM 158/2016, Art. 157)
Parágrafo Único. Os procedimentos de aférese serão realizados com uso de equipamentos próprios para este fim. (Origem: PRT MS/GM 158/2016, Art. 157, Parágrafo Único)
Art. 157. Para realizar a doação por aférese, o doador deve concordar com o procedimento por meio da assinatura de um termo de consentimento livre e esclarecido. (Origem: PRT MS/GM 158/2016, Art. 158)
§ 1º Para o cumprimento do disposto no "caput", serão aplicadas as regras estabelecidas no art. 32. (Origem: PRT MS/GM 158/2016, Art. 158, § 1º)
§ 2º O termo de consentimento para a doação por aférese explicará, de maneira clara: (Origem: PRT MS/GM 158/2016, Art. 158, § 2º)
I - o procedimento de coleta; (Origem: PRT MS/GM 158/2016, Art. 158, § 2º, I)
II - as possíveis complicações; e (Origem: PRT MS/GM 158/2016, Art. 158, § 2º, II)
III - os riscos para o doador. (Origem: PRT MS/GM 158/2016, Art. 158, § 2º, III)
Art. 158. O médico hemoterapeuta será o responsável pelo procedimento de aférese. (Origem: PRT MS/GM 158/2016, Art. 159)
Parágrafo Único. Durante o procedimento de aférese, o doador será acompanhado pela equipe do serviço de hemoterapia, que disporá de cuidados médicos de emergência para o caso de reações adversas. (Origem: PRT MS/GM 158/2016, Art. 159, Parágrafo Único)
Art. 159. O volume sanguíneo extracorpóreo não deve superar 15% da volemia do doador. (Origem: PRT MS/GM 158/2016, Art. 160)
Art. 160. A doação de plasma por aférese poderá ser feita em situações especiais, com o objetivo de suprir a necessidade transfusional de determinados pacientes. (Origem: PRT MS/GM 158/2016, Art. 161)
§ 1º O intervalo mínimo entre duas plasmaféreses em um doador é de 48 (quarenta e oito) horas, podendo um mesmo doador realizar doações, no máximo, 2 (duas) vezes em um período de 7 (sete) dias e 4 (quatro) vezes em um período de 2 (dois) meses. (Origem: PRT MS/GM 158/2016, Art. 161, § 1º)
§ 2º Depois da quarta doação efetuada em menos de 60 (sessenta) dias, haverá um intervalo de, no mínimo, 2 (dois) meses até a doação subsequente. (Origem: PRT MS/GM 158/2016, Art. 161, § 2º)
§ 3º O número máximo anual de doações de plasma por aférese, por doador, não será maior que 12 (doze). (Origem: PRT MS/GM 158/2016, Art. 161, § 3º)
§ 4º A dosagem de proteína total sérica e de IgG e IgM serão monitoradas em intervalos de 4 (quatro) meses para doadores em que o intervalo entre as doações seja inferior a 4 (quatro) semanas. (Origem: PRT MS/GM 158/2016, Art. 161, § 4º)
§ 5º O volume de plasma por coleta não excederá 10 mL por Kg de peso até o máximo de 600 mL. (Origem: PRT MS/GM 158/2016, Art. 161, § 5º)
§ 6º Se um doador de plasma por aférese doar uma unidade de sangue total, ou se a perda de hemácias durante o procedimento for superior a 200 mL, devem transcorrer, pelo menos, 8 (oito) semanas antes que um novo procedimento de plasmaférese seja realizado. (Origem: PRT MS/GM 158/2016, Art. 161, § 6º)
Art. 161. O serviço de hemoterapia que possui programa de doação de plasma por aférese para obtenção de matéria-prima para produção de componentes sanguíneos especiais e hemoderivados obedecerá a todos os requisitos definidos neste Anexo para seleção do doador e coleta de sangue. (Origem: PRT MS/GM 158/2016, Art. 162)
§ 1º O serviço de hemoterapia manterá cadastro especial de doadores que se encontrem na condição descrita no "caput". (Origem: PRT MS/GM 158/2016, Art. 162, § 1º)
§ 2º O doador de plasma por aférese para fins industriais receberá todas as informações referentes ao procedimento a que será submetido. (Origem: PRT MS/GM 158/2016, Art. 162, § 2º)
§ 3º A ciência e consentimento especial do doador serão registrados para o fim proposto no "caput". (Origem: PRT MS/GM 158/2016, Art. 162, § 3º)
Art. 162. Será realizada a contagem de plaquetas em todos os candidatos à doação por plaquetaférese. (Origem: PRT MS/GM 158/2016, Art. 163)
§ 1º A contagem de plaquetas a que se refere o "caput" será realizada no dia da doação ou nos 3 (três) dias que a antecedem, desde que não tenha havido outra doação de plaquetas no período. (Origem: PRT MS/GM 158/2016, Art. 163, § 1º)
§ 2º O candidato a doador não deve ser submetido a uma plaquetaférese se a sua contagem de plaquetas for inferior a 150 x 10e3 plaquetas/µL. (Origem: PRT MS/GM 158/2016, Art. 163, § 2º)
§ 3º A estimativa de contagem de plaquetas do doador no final do procedimento de coleta não pode ser inferior a 100 x 10e3 plaquetas/µL. (Origem: PRT MS/GM 158/2016, Art. 163, § 3º)
§ 4º O intervalo mínimo entre duas plaquetaféreses em um doador é de 48 (quarenta e oito) horas, podendo um mesmo doador realizar doações, no máximo, 4 (quatro) vezes por mês e 24 (vinte quatro) vezes por ano. (Origem: PRT MS/GM 158/2016, Art. 163, § 4º)
§ 5º Se um doador de plaquetas por aférese doar uma unidade de sangue total, ou se a perda de hemácias durante o procedimento for superior a 200 mL, deverão transcorrer, pelo menos, 4 (quatro) semanas antes que um novo procedimento de plaquetaférese seja realizado. (Origem: PRT MS/GM 158/2016, Art. 163, § 5º)
Art. 163. A coleta de leucócitos por leucocitaférese será objeto de protocolo especialmente elaborado pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 164)
§ 1º É permitida a utilização de agentes mobilizadores de granulócitos, tais como G-CSF e/ou corticosteroides, quando não contraindicados, e de agentes hemossedimentantes nos doadores que deverão estar especificados no protocolo. (Origem: PRT MS/GM 158/2016, Art. 164, § 1º)
§ 2º A coleta de que trata o "caput" só poderá ser feita se a contagem de leucócitos no doador for superior a 5,0 x 10e3/µL. (Origem: PRT MS/GM 158/2016, Art. 164, § 2º)
§ 3º É obrigatória a realização de contagem de granulócitos em todos os concentrados de granulócitos coletados. (Origem: PRT MS/GM 158/2016, Art. 164, § 3º)
§ 4º Serão incluídos no termo de consentimento livre e esclarecido para coleta de granulócitos as complicações e riscos relacionados ao uso das medicações mobilizadoras e do agente hemossedimentante. (Origem: PRT MS/GM 158/2016, Art. 164, § 4º)
§ 5º A seleção de doadores de linfócitos seguirá critérios específicos e pré-definidos em protocolo terapêutico de transplante de células progenitoras alogênicas. (Origem: PRT MS/GM 158/2016, Art. 164, § 5º)
Art. 164. A coleta de múltiplos componentes por aférese será objeto de protocolo especial a ser elaborado pelo serviço de hemoterapia, e poderá ser realizada através das seguintes opções: (Origem: PRT MS/GM 158/2016, Art. 165)
I - 1 (um) concentrado de plaquetas com, no mínimo, 3,0 x 10e11 plaquetas e um concentrado de hemácias, com no mínimo 45g de hemoglobina; e (Origem: PRT MS/GM 158/2016, Art. 165, I)
II - 2 (duas) unidades de concentrados de hemácias, cada uma com, no mínimo, 45g de hemoglobina. (Origem: PRT MS/GM 158/2016, Art. 165, II)
§ 1º Para a coleta de que trata o inciso I do "caput", serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 165, § 1º)
I - o intervalo mínimo entre cada doação e o número máximo de coletas por ano são os mesmos estabelecidos para a doação de sangue total; (Origem: PRT MS/GM 158/2016, Art. 165, § 1º, I)
II - o doador deve ter contagem de plaquetas igual ou superior a 150 x 10e3/µL, dosagem de hemoglobina superior a 13g/dL e peso superior a 60 kg; e (Origem: PRT MS/GM 158/2016, Art. 165, § 1º, II)
III - o volume total dos componentes coletados deve ser inferior a 8 mL/kg de peso do doador do sexo feminino e 9 mL/kg do sexo masculino. (Origem: PRT MS/GM 158/2016, Art. 165, § 1º, III)
§ 2º Para a coleta de que trata o inciso II do "caput", serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 165, § 2º)
I - o doador deve pesar, no mínimo, 70 kg, e ter uma dosagem de hemoglobina superior a 14g/dL; (Origem: PRT MS/GM 158/2016, Art. 165, § 2º, I)
II - o intervalo mínimo entre as doações será de 4 (quatro) meses para os homens e de 6 (seis) meses para as mulheres; e (Origem: PRT MS/GM 158/2016, Art. 165, § 2º, II)
III - o volume total dos componentes coletados deve ser inferior a 8 mL/kg de peso do doador do sexo feminino e 9 mL/kg do sexo masculino. (Origem: PRT MS/GM 158/2016, Art. 165, § 2º, III)
Art. 165. Os doadores de componentes sanguíneos por aférese serão submetidos aos mesmos exames de qualificação do doador de sangue total, além dos exames específicos para cada tipo de doação. (Origem: PRT MS/GM 158/2016, Art. 166)
§ 1º Os exames de triagem laboratorial para infecções transmissíveis pelo sangue serão realizados em amostra colhida no mesmo dia do procedimento. (Origem: PRT MS/GM 158/2016, Art. 166, § 1º)
§ 2º Para coleta de granulócitos, linfócitos e células pro-genitoras hematopoiéticas, os exames de que trata o "caput" poderão ser realizados em amostras colhidas até 72 (setenta e duas) horas antes da doação. (Origem: PRT MS/GM 158/2016, Art. 166, § 2º)
Art. 166. Será mantido registro de cada procedimento de aférese, no qual constará as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 167)
I - a identidade do doador; (Origem: PRT MS/GM 158/2016, Art. 167, I)
II - o tipo de componente sanguíneo(s) produzido(s); (Origem: PRT MS/GM 158/2016, Art. 167, II)
III - o volume de componente(s) produzido(s); (Origem: PRT MS/GM 158/2016, Art. 167, III)
IV - o anticoagulante empregado; (Origem: PRT MS/GM 158/2016, Art. 167, IV)
V - a duração da coleta; (Origem: PRT MS/GM 158/2016, Art. 167, V)
VI - as drogas administradas e respectivas doses; e (Origem: PRT MS/GM 158/2016, Art. 167, VI)
VII - as reações adversas ocorridas durante a coleta e o tratamento aplicado. (Origem: PRT MS/GM 158/2016, Art. 167, VII)
Art. 167. A aférese terapêutica será efetuada apenas mediante a solicitação escrita do médico do paciente e com a concordância do médico hemoterapeuta. (Origem: PRT MS/GM 158/2016, Art. 168)
§ 1º O médico hemoterapeuta responsável pelo procedimento determinará o volume de sangue a ser processado, a frequência do procedimento e a necessidade de cuidados especiais. (Origem: PRT MS/GM 158/2016, Art. 168, § 1º)
§ 2º O serviço de hemoterapia terá protocolo escrito para a execução dos procedimentos de aférese terapêutica, descrevendo a metodologia empregada. (Origem: PRT MS/GM 158/2016, Art. 168, § 2º)
§ 3º Os registros do procedimento serão mantidos e conterão as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 168, § 3º)
I - a identificação do paciente; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, I)
II - o diagnóstico; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, II)
III - o tipo de procedimento terapêutico; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, III)
IV - o método empregado; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, IV)
V - o volume sanguíneo extracorpóreo processado; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, V)
VI - o tipo e quantidade do componente removido ou tratado; (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, VI)
VII - o tipo e quantidade dos líquidos utilizados; e (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, VII)
VIII - qualquer reação adversa ocorrida e medicação administrada. (Origem: PRT MS/GM 158/2016, Art. 168, § 3º, VIII)
§ 4º Aplicam-se à aférese terapêutica os cuidados de emergência estabelecidos no art. 158, os quais poderão ser acrescidos por outros em função do quadro clínico de cada paciente. (Origem: PRT MS/GM 158/2016, Art. 168, § 4º)
Seção X
Da Transfusão Sanguínea
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção X)
Art. 168. As solicitações para transfusão de sangue ou componentes serão feitas exclusivamente por médicos, em formulário de requisição específico que contenha informações suficientes para a correta identificação do receptor. (Origem: PRT MS/GM 158/2016, Art. 169)
§ 1º Devem constar no formulário de que trata o "caput", no mínimo, os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 169, § 1º)
I - nome completo do paciente sem abreviaturas; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, I)
II - data de nascimento; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, II)
III - sexo; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, III)
IV - idade; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, IV)
V - número do prontuário ou registro do paciente; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, V)
VI - número do leito (no caso de paciente internado); (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, VI)
VII - diagnóstico; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, VII)
VIII - componente sanguíneo solicitado (com o respectivo volume ou quantidade); (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, VIII)
IX - modalidade da transfusão; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, IX)
X - resultados laboratoriais que justifiquem a indicação do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, X)
XI - data; (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XI)
XII - dados do médico solicitante (nome completo, assinatura e número do CRM); (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XII)
XIII - peso do paciente (quando indicado); e (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XIII)
XIV - antecedentes transfusionais, gestacionais e de reações à transfusão quando relatados pelo paciente. (Origem: PRT MS/GM 158/2016, Art. 169, § 1º, XIV)
§ 2º Não serão aceitas pelo serviço de hemoterapia requisições de transfusão fora dos padrões descritos no § 1º, incompletas, ilegíveis ou rasuradas. (Origem: PRT MS/GM 158/2016, Art. 169, § 2º)
§ 3º Em situação clinicamente justificável, a requisição de transfusão poderá ser aceita conforme protocolo estabelecido pelo serviço de hemoterapia, não eximida a necessidade de coletar as informações previstas no § 1º na sequência do evento transfusional. (Origem: PRT MS/GM 158/2016, Art. 169, § 3º)
§ 4º As instituições de assistência à saúde e os serviços de hemoterapia que disponham de tecnologia para emissão de prontuário eletrônico poderão estabelecer rotinas para prescrição eletrônica de componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 169, § 4º)
Art. 169. São as modalidades de transfusão: (Origem: PRT MS/GM 158/2016, Art. 170)
I - programada para determinado dia e hora; (Origem: PRT MS/GM 158/2016, Art. 170, I)
II - de rotina a se realizar dentro das 24 (vinte e quatro) horas; (Origem: PRT MS/GM 158/2016, Art. 170, II)
III - de urgência a se realizar dentro das 3 (três) horas; ou (Origem: PRT MS/GM 158/2016, Art. 170, III)
IV - de emergência quando o retardo da transfusão puder acarretar risco para a vida do paciente. (Origem: PRT MS/GM 158/2016, Art. 170, IV)
Parágrafo Único. As transfusões serão realizadas, preferencialmente, no período diurno. (Origem: PRT MS/GM 158/2016, Art. 170, Parágrafo Único)
Art. 170. Na hipótese de transfusão de urgência ou emergência, a liberação de sangue total ou concentrado de hemácias antes do término dos testes pré-transfusionais poderá ser feita, desde que obedecidas às seguintes condições: (Origem: PRT MS/GM 158/2016, Art. 171)
I - o quadro clínico do paciente justifique a emergência, isto é, quando o retardo no início da transfusão coloque em risco a vida do paciente; (Origem: PRT MS/GM 158/2016, Art. 171, I)
II - existência de procedimento escrito no serviço de hemoterapia, estipulando o modo como esta liberação será realizada; (Origem: PRT MS/GM 158/2016, Art. 171, II)
III - termo de responsabilidade assinado pelo médico responsável pelo paciente no qual afirme expressamente o conhecimento do risco e concorde com o procedimento; e (Origem: PRT MS/GM 158/2016, Art. 171, III)
IV - as provas pré-transfusionais devem ser finalizadas, mesmo que a transfusão já tenha sido completada. (Origem: PRT MS/GM 158/2016, Art. 171, IV)
§ 1º A indicação de transfusões de emergência deve ser previamente definida em protocolo elaborado pelo Comitê Transfusional da instituição de assistência à saúde em que esta ocorrerá, sem prejuízo do disposto no inciso II do "caput". (Origem: PRT MS/GM 158/2016, Art. 171, § 1º)
§ 2º O médico solicitante deve estar ciente dos riscos das transfusões de urgência ou emergência e será responsável pelas consequências do ato transfusional, se esta situação houver sido criada por seu esquecimento, omissão ou pela indicação da transfusão sem aprovação prévia nos protocolos definidos pelo Comitê Transfusional. (Origem: PRT MS/GM 158/2016, Art. 171, § 2º)
§ 3º Se não houver amostra do paciente no serviço de hemoterapia, esta será colhida assim que possível. (Origem: PRT MS/GM 158/2016, Art. 171, § 3º)
§ 4º Nos casos de transfusão na modalidade de emergência, em que não houver tempo para tipagem do sangue do receptor, é recomendável o uso de hemácias O RhD negativo. (Origem: PRT MS/GM 158/2016, Art. 171, § 4º)
§ 5º Na hipótese de ocorrência do disposto no § 4º, caso não haja o tipo de sangue em estoque suficiente no serviço de hemoterapia, poderá ser usado O RhD positivo, sobretudo em pacientes do sexo masculino ou em pacientes de qualquer sexo com mais de 45 (quarenta e cinco) anos de idade. (Origem: PRT MS/GM 158/2016, Art. 171, § 5º)
§ 6º As amostras de pacientes submetidos a transfusão de emergência devem ser colhidas antes da transfusão ou pelo menos antes da administração de grande quantidade de componentes sanguíneos, pois isto pode comprometer o resultado dos testes pré-transfusionais. (Origem: PRT MS/GM 158/2016, Art. 171, § 6º)
§ 7º A equipe médica deve observar que na maioria das emergências é possível realizar a tipagem ABO do receptor, possibilitando o uso de sangue isogrupo. (Origem: PRT MS/GM 158/2016, Art. 171, § 7º)
§ 8º Em situações de emergências concomitantes, recomendam-se cuidados adicionais na identificação dos pacientes e preconiza-se a utilização de hemácias O, reduzindo, assim, o risco de incompatibilidade ABO por erro de identificação. (Origem: PRT MS/GM 158/2016, Art. 171, § 8º)
§ 9º Constará dos rótulos dos componentes sanguíneos, de forma clara, a informação de que foram liberados sem a finalização dos testes pré-transfusiosnais, quando for o caso. (Origem: PRT MS/GM 158/2016, Art. 171, § 9º)
§ 10. A opção pelo tipo sanguíneo a ser transfundido nas situações de emergência fará parte de protocolo específico mencionado no inciso II do "caput", a ser mantido por cada serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 171, § 10)
Art. 171. O envio do componente sanguíneo não implica a interrupção dos testes pré-transfusionais, que continuarão sendo realizados. (Origem: PRT MS/GM 158/2016, Art. 172)
Parágrafo Único. Em caso de anormalidade nos testes de que trata o "caput", o médico assistente será imediatamente notificado, e a decisão sobre a suspensão ou continuação da transfusão será tomada em conjunto com o médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 172, Parágrafo Único)
Art. 172. A liberação de uma unidade de sangue ou componente sanguíneo para estoque em outro serviço de hemoterapia será feita: (Origem: PRT MS/GM 158/2016, Art. 173)
I - para serviço de hemoterapia que tenha contrato, convênio ou termo de compromisso com o serviço de hemoterapia distribuidor, definindo as responsabilidades entre as partes, para o fornecimento de unidades de sangue ou componentes sanguíneos; (Origem: PRT MS/GM 158/2016, Art. 173, I)
II - mediante solicitação por escrito do médico do serviço de hemoterapia ao qual se destina, com aposição de sua assinatura, nome legível e CRM do solicitante; (Origem: PRT MS/GM 158/2016, Art. 173, II)
III - após verificação das condições de segurança necessárias para o correto acondicionamento e transporte do produto; e (Origem: PRT MS/GM 158/2016, Art. 173, III)
IV - respeitados os demais critérios para a liberação de sangue e componentes sanguíneos citados neste Anexo. (Origem: PRT MS/GM 158/2016, Art. 173, IV)
Parágrafo Único. O serviço de hemoterapia que receber uma unidade de sangue ou componente sanguíneo de outro serviço de hemoterapia registrará o recebimento, obedecendo aos mesmos critérios estabelecidos para a sua liberação. (Origem: PRT MS/GM 158/2016, Art. 173, Parágrafo Único)
Art. 173. Em relação às amostras de sangue para testes pré-transfusionais, todos os tubos devem ser rotulados no momento da coleta, com o nome completo do receptor sem abreviaturas, seu número de identificação, identificação do coletador e data da coleta, sendo recomendável a identificação por código de barras ou etiqueta impressa. (Origem: PRT MS/GM 158/2016, Art. 174)
Parágrafo Único. Tubos que não estejam corretamente identificados não serão aceitos pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 174, Parágrafo Único)
Art. 174. As amostras usadas para os testes pré-transfusionais serão coletadas para este fim específico, tendo uma validade de até 72 (setenta e duas) horas. (Origem: PRT MS/GM 158/2016, Art. 175)
Art. 175. Antes que uma amostra de sangue seja utilizada para realizar os testes pré-transfusionais, será confirmado se os dados contidos na solicitação transfusional estão de acordo com os dados que constam do tubo da amostra. (Origem: PRT MS/GM 158/2016, Art. 176)
Parágrafo Único. Em casos de dúvidas ou discrepâncias, será obtida uma nova amostra. (Origem: PRT MS/GM 158/2016, Art. 176, Parágrafo Único)
Art. 176. Os testes pré-transfusionais incluirão: (Origem: PRT MS/GM 158/2016, Art. 177)
I - para sangue total e concentrado de hemácias: (Origem: PRT MS/GM 158/2016, Art. 177, I)
a) a tipagem ABO (direta e reversa) e RhD e a pesquisa de anticorpos antieritrocitários irregulares no sangue do receptor; (Origem: PRT MS/GM 158/2016, Art. 177, I, a)
b) a retipagem ABO (direta) e RhD do componente sanguíneo; e (Origem: PRT MS/GM 158/2016, Art. 177, I, b)
c) a realização de uma prova de compatibilidade entre as hemácias do doador e o soro ou plasma do receptor (prova de compatibilidade maior), nos casos especificados no art. 178; (Origem: PRT MS/GM 158/2016, Art. 177, I, c)
II - para concentrado de granulócitos: (Origem: PRT MS/GM 158/2016, Art. 177, II)
a) a tipagem ABO (direta e reversa) e RhD e a pesquisa de anticorpos antieritrocitários irregulares no sangue do receptor; (Origem: PRT MS/GM 158/2016, Art. 177, II, a)
b) a retipagem ABO (direta) e RhD do sangue do doador (amostra coletada no dia de coleta do concentrado de granulócitos); e (Origem: PRT MS/GM 158/2016, Art. 177, II, b)
c) a realização de prova de compatibilidade entre as hemácias do doador (amostra coletada no dia da coleta do concentrado de granulócitos ) e o soro ou plasma do receptor (prova de compatibilidade maior), nos casos especificados no art. 178; (Origem: PRT MS/GM 158/2016, Art. 177, II, c)
III - para concentrado de plaquetas: (Origem: PRT MS/GM 158/2016, Art. 177, III)
a) a tipagem ABO (direta e reversa) e RhD no sangue do receptor; e (Origem: PRT MS/GM 158/2016, Art. 177, III, a)
b) a pesquisa de anticorpos antieritrocitários irregulares no sangue do receptor; (Origem: PRT MS/GM 158/2016, Art. 177, III, b)
IV - para plasma e crioprecipitado: tipagem ABO (direta e reversa) e RhD no sangue do receptor. (Origem: PRT MS/GM 158/2016, Art. 177, IV)
Parágrafo Único. Na repetição dos testes no sangue do doador, serão observados os seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único)
I - a tipagem ABO será repetida em todos os componentes eritrocitários a serem compatibilizados usando uma amostra obtida de um segmento do tubo-coletor da bolsa; (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único, I)
II - a repetição da tipagem RhD será realizada em bolsas rotuladas como "RhD negativo"; e (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único, II)
III - não é necessário repetir o teste para pesquisa do antígeno D fraco da bolsa de componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 177, Parágrafo Único, III)
Art. 177. Nos exames de sangue do receptor, a tipagem ABO e RhD e a pesquisa de anticorpos antieritrocitários irregulares serão realizadas nas amostras de sangue do receptor de componentes eritrocitários. (Origem: PRT MS/GM 158/2016, Art. 178)
§ 1º Se nos 3 (três) meses que antecedem a transfusão, o paciente tiver sido transfundido com sangue ou componentes contendo hemácias (concentrados de hemácias, concentrados de plaquetas e concentrados de granulócitos) ou tiver história de gestação, as amostras para os testes pré-transfusionais serão obtidas dentro das 72 (setenta e duas) horas que antecedem o ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 178, § 1º)
§ 2º A conduta estabelecida no § 1º será aplicada mesmo na falta de informações fidedignas acerca dos antecedentes. (Origem: PRT MS/GM 158/2016, Art. 178, § 2º)
§ 3º A tipagem ABO será realizada testando-se as hemácias com reagentes anti-A, anti-B e anti-AB. (Origem: PRT MS/GM 158/2016, Art. 178, § 3º)
§ 4º Na hipótese do § 3º, caso sejam usados antissoros monoclonais, a utilização do soro anti-AB não é obrigatória. (Origem: PRT MS/GM 158/2016, Art. 178, § 4º)
§ 5º A tipagem reversa sempre será realizada, testando-se o soro ou plasma com suspensão de hemácias conhecidas A1 e B e, opcionalmente, A2 e O. (Origem: PRT MS/GM 158/2016, Art. 178, § 5º)
§ 6º Nenhum resultado de tipagem ABO será concluído até a resolução das discrepâncias entre a tipagem direta e reversa. (Origem: PRT MS/GM 158/2016, Art. 178, § 6º)
§ 7º O antígeno RhD será determinado colocando-se as hemácias com antissoro anti-RhD (anti-D). (Origem: PRT MS/GM 158/2016, Art. 178, § 7º)
§ 8º Paralelamente ao estabelecido no § 7º, sempre será efetuado um controle da tipagem RhD, utilizando-se soro-controle compatível com o antissoro utilizado e do mesmo fabricante do anti-D. (Origem: PRT MS/GM 158/2016, Art. 178, § 8º)
§ 9º No caso de utilização de antissoros anti-D produzidos em meio salino o uso do soro-controle na reação é dispensável. (Origem: PRT MS/GM 158/2016, Art. 178, § 9º)
§ 10. Se a reação com o soro-controle RhD for positiva, decorrente da presença eventual de anticorpos aderidos às hemácias ou proteínas séricas anormais, a tipagem RhD é considerada inválida e pode ser definida empregando-se antissoro anti-D produzido em meio salino. (Origem: PRT MS/GM 158/2016, Art. 178, § 10)
§ 11. Se a reação for negativa para a presença do antígeno RhD, recomenda-se a realização da pesquisa do antígeno D-fraco. (Origem: PRT MS/GM 158/2016, Art. 178, § 11)
§ 12. Se a pesquisa de que trata o § 11 não for realizada, o paciente será considerado RhD negativo para fins transfusionais. (Origem: PRT MS/GM 158/2016, Art. 178, § 12)
§ 13. Quando a tipagem RhD ou a pesquisa do antígeno D-fraco resultar positiva, o paciente pode ser considerado "RhD-positivo". (Origem: PRT MS/GM 158/2016, Art. 178, § 13)
§ 14. Quando ambas as provas resultarem negativas, o paciente será considerado "RhD-negativo". (Origem: PRT MS/GM 158/2016, Art. 178, § 14)
§ 15. Recomenda-se a utilização de um antissoro monoclonal que detecta o antígeno D parcial categoria VI (DVI+ / positivo) e um antissoro que não detecta o antígeno D parcial categoria VI (DVI- / negativo). (Origem: PRT MS/GM 158/2016, Art. 178, § 15)
§ 16. Na hipótese do § 15, quando houver discrepância nos resultados entre os dois antissoros utilizados, deve-se investigar a presença dos antígenos D-fraco e D parcial na amostra. (Origem: PRT MS/GM 158/2016, Art. 178, § 16)
§ 17. Em pacientes "RhD-negativo" recomenda-se ser realizada a pesquisa dos antígenos C (maiúsculo) e E (maiúsculo). (Origem: PRT MS/GM 158/2016, Art. 178, § 17)
§ 18. Recomenda-se a realização da fenotipagem para os antígenos eritrocitários no sangue do receptor, dos sistemas Rh (E, e, C, c), Kell (K), Duffy (Fya, Fyb), Kidd (Jka, Jkb) e MNS (S, s), para pacientes aloimunizados contra antígenos eritrocitários ou que estão ou poderão entrar em esquema de transfusão crônica, com o objetivo de auxiliar a identificação de possíveis anticorpos antieritrocitários irregulares. (Origem: PRT MS/GM 158/2016, Art. 178, § 18)
§ 19. Nos casos abrangidos pelo § 18, recomenda-se a realização de transfusões fenótipo compatível, quando possível. (Origem: PRT MS/GM 158/2016, Art. 178, § 19)
§ 20. A pesquisa de anticorpos antieritrocitários irregulares será realizada obedecendo aos seguintes critérios: (Origem: PRT MS/GM 158/2016, Art. 178, § 20)
I - os métodos usados para pesquisa de anticorpos antieritrocitários irregulares no soro ou plasma devem ser capazes de detectar anticorpos clinicamente significativos e devem incluir incubação a 37 °C e o uso do soro antiglobulina humana (anti-IgG ou poliespecífico); e (Origem: PRT MS/GM 158/2016, Art. 178, § 20, I)
II - para evitar resultados falsos negativos nas técnicas em tubo na fase da antiglobulina, será utilizado um reagente controle contendo hemácias sensibilizadas com anticorpos IgG. (Origem: PRT MS/GM 158/2016, Art. 178, § 20, II)
Art. 178. Será realizado teste de compatibilidade entre o sangue do receptor e amostras das bolsas a serem utilizadas no ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 179)
§ 1º A prova de compatibilidade maior será realizada antes da administração de sangue total ou concentrado de hemácias utilizando-se hemácias obtidas do tubo coletor da bolsa a ser transfundida e o soro ou plasma do receptor. (Origem: PRT MS/GM 158/2016, Art. 179, § 1º)
§ 2º Se a pesquisa de anticorpos antieritrocitários irregulares for negativa e não existirem antecedentes transfusionais ou gestacionais, a fase da antiglobulina do teste de compatibilidade poderá ser omitida. (Origem: PRT MS/GM 158/2016, Art. 179, § 2º)
§ 3º Quando a pesquisa de anticorpos antieritrocitários irregulares mostrar resultados positivos, recomenda-se a identificação da especificidade do(s) anticorpo(s) detectado(s) para seleção segura de concentrados de hemácias fenotipados a serem transfundidos. (Origem: PRT MS/GM 158/2016, Art. 179, § 3º)
§ 4º Se o serviço não realizar a identificação de que trata o §3º, recomenda-se que amostras do paciente sejam encaminhadas a um serviço de imuno-hematologia eritrocitário de referência para completar a investigação laboratorial. (Origem: PRT MS/GM 158/2016, Art. 179, § 4º)
§ 5º Quando os resultados dos testes pré-transfusionais demonstrarem que não há concentrado de hemácias compatível para o receptor, o serviço de hemoterapia comunicará este fato ao médico solicitante e, em conjunto com este, realizará a avaliação clínica do paciente. (Origem: PRT MS/GM 158/2016, Art. 179, § 5º)
§ 6º A decisão de transfundir concentrado de hemácias incompatível será justificada por escrito, em termo assinado pelo hemoterapeuta e/ou pelo médico assistente do paciente e, quando possível, pelo paciente ou seu responsável legal. (Origem: PRT MS/GM 158/2016, Art. 179, § 6º)
Art. 179. O serviço de hemoterapia que realiza atendimento de emergência terá protocolo escrito que defina a sua conduta nas transfusões maciças. (Origem: PRT MS/GM 158/2016, Art. 180)
§ 1º Para efeito deste Anexo, entende-se por transfusão maciça: (Origem: PRT MS/GM 158/2016, Art. 180, § 1º)
I - paciente que tiver recebido uma quantidade de sangue total ou concentrado de hemácias aproximadamente igual à sua volemia em período inferior a 24 (vinte e quatro) horas; e (Origem: PRT MS/GM 158/2016, Art. 180, § 1º, I)
II - paciente que tiver recebido uma quantidade de sangue total ou concentrado de hemácias superior a 10 unidades em período inferior a 24 (vinte e quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 180, § 1º, II)
§ 2º A reposição de componentes sanguíneos deve ser indicada à medida que se identificam alterações específicas por meio de avaliação clínica e laboratorial ou baseada em protocolos pré-estabelecidos pela instituição. (Origem: PRT MS/GM 158/2016, Art. 180, § 2º)
§ 3º Os testes pré-transfusionais poderão ser abreviados após a troca de uma volemia sanguínea. (Origem: PRT MS/GM 158/2016, Art. 180, § 3º)
Art. 180. O serviço de hemoterapia abrirá registro para cada receptor de transfusão, o qual conterá todas as informações relativas aos exames pré-transfusionais, antecedentes de reações adversas à transfusão, data das transfusões e relação dos componentes sanguíneos transfundidos, com os respectivos tipos e identificação. (Origem: PRT MS/GM 158/2016, Art. 181)
Parágrafo Único. O registro de que trata o "caput" será consultado e atualizado a cada transfusão e a cada exame imuno-hematológico realizado. (Origem: PRT MS/GM 158/2016, Art. 181, Parágrafo Único)
Art. 181. O sangue total e os concentrados de hemácias serão ABO compatíveis. (Origem: PRT MS/GM 158/2016, Art. 182)
§ 1º Os receptores "RhD-positivo" poderão receber sangue total ou concentrado de hemácias "RhD-positivo" ou "RhD-negativo". (Origem: PRT MS/GM 158/2016, Art. 182, § 1º)
§ 2º Os receptores "RhD-negativo" receberão sangue total ou hemácias "RhD-negativo", exceto em circunstâncias justificadas e desde que não apresentem sensibilização prévia. (Origem: PRT MS/GM 158/2016, Art. 182, § 2º)
§ 3º Quando um receptor apresentar anticorpos antieritrocitários irregulares clinicamente significativos nos testes dispostos no art. 177, § 20, ou tiver antecedentes de presença de tais anticorpos, o sangue total ou concentrado de hemácias a serem transfundidos serão compatíveis e não possuirão os antígenos correspondentes. (Origem: PRT MS/GM 158/2016, Art. 182, § 3º)
§ 4º Na hipótese do § 3º, recomenda-se a profilaxia para aloimunização contra outros antígenos utilizando-se concentrados de hemácias fenotipadas. (Origem: PRT MS/GM 158/2016, Art. 182, § 4º)
§ 5º Para pacientes que não apresentam anticorpos antieritrocitários que estão ou poderão entrar em esquema de transfusão crônica, recomenda-se a utilização de concentrado de hemácias fenotipadas compatíveis, principalmente para os sistemas mais imunogênicos (Rh, Kell, Duffy, Kidd e MNS), sob avaliação médica. (Origem: PRT MS/GM 158/2016, Art. 182, § 5º)
§ 6º As transfusões de plasma devem ser ABO compatíveis com as hemácias do receptor e não necessitam de provas de compatibilidade. (Origem: PRT MS/GM 158/2016, Art. 182, § 6º)
§ 7º As transfusões de crioprecipitado não necessitam de provas de compatibilidade e, em crianças de até 10 (dez) anos ou 35 kg, serão isogrupo ou ABO compatíveis. (Origem: PRT MS/GM 158/2016, Art. 182, § 7º)
§ 8º O plasma contido nos concentrados de plaquetas será ABO compatível com as hemácias do receptor. (Origem: PRT MS/GM 158/2016, Art. 182, § 8º)
§ 9º Caso não seja possível o cumprimento do determinado no § 8º, recomenda-se avaliar o volume de plasma do componente sanguíneo e a presença de anti-A e anti-B de relevância clínica (hemolisina) na decisão de transfundir concentrado de plaquetas não isogrupo. (Origem: PRT MS/GM 158/2016, Art. 182, § 9º)
§ 10. As hemácias presentes nos concentrados de granulócitos serão ABO compatíveis com o plasma do receptor. (Origem: PRT MS/GM 158/2016, Art. 182, § 10)
§ 11. Para as transfusões de concentrados de granulócitos colhidos em doadores estimulados pelo G-CSF, será feita uma prova de compatibilidade maior com o soro do receptor e as hemácias do doador antes de se iniciar a administração do G-CSF ao doador. (Origem: PRT MS/GM 158/2016, Art. 182, § 11)
§ 12. Na hipótese do § 11, caso a prova de compatibilidade resulte incompatível, a doação não deve ser efetuada. (Origem: PRT MS/GM 158/2016, Art. 182, § 12)
§ 13. O médico do serviço de hemoterapia pode suspender ou modificar uma transfusão quando considerá-la desnecessária, registrando de maneira clara a alteração e os motivos desta decisão. (Origem: PRT MS/GM 158/2016, Art. 182, § 13)
Art. 182. Na amostra pré-transfusional inicial para transfusão em neonatos e crianças de até 4 (quatro) meses de vida será realizada a tipagem ABO direta. (Origem: PRT MS/GM 158/2016, Art. 183)
§ 1º Não será realizada a tipagem reversa. (Origem: PRT MS/GM 158/2016, Art. 183, § 1º)
§ 2º O antígeno RhD será determinado colocando-se as hemácias com antissoro anti-RhD (Anti-D). (Origem: PRT MS/GM 158/2016, Art. 183, § 2º)
§ 3º Paralelamente ao procedimento disposto no § 2º, será efetuado o controle da tipagem RhD através de soro controle compatível com o antissoro utilizado e do mesmo fabricante do anti-D. (Origem: PRT MS/GM 158/2016, Art. 183, § 3º)
§ 4º No caso de utilização de antissoros anti-D produzido em meio salino, o uso do soro controle na reação será dispensável. (Origem: PRT MS/GM 158/2016, Art. 183, § 4º)
§ 5º Se a reação com o soro-controle RhD for positiva, decorrente da presença de alo-anticorpos maternos aderidos às hemácias do recém-nascido, a tipagem RhD será considerada inválida e poderá ser definida empregando-se antissoro anti-D produzido em meio salino. (Origem: PRT MS/GM 158/2016, Art. 183, § 5º)
§ 6º Se as hemácias selecionadas para transfusão não forem do grupo O, será investigada, no soro ou plasma do neonato e das crianças até 4 (quatro) meses de vida, a presença de anti-A ou anti-B, com métodos que incluam uma fase de antiglobulina. (Origem: PRT MS/GM 158/2016, Art. 183, § 6º)
§ 7º O teste a que se refere o § 6º não precisa ser realizado se houver disponibilidade de uma amostra do sangue da mãe para tipagem ABO e se a tipagem ABO da mãe for a mesma do recém-nascido. (Origem: PRT MS/GM 158/2016, Art. 183, § 7º)
§ 8º Se ocorrer detecção da presença de anti-A ou anti-B, será transfundido concentrado de hemácias "O" até que o anticorpo deixe de ser demonstrável no soro do neonato ou das crianças com até 4 (quatro) meses de vida. (Origem: PRT MS/GM 158/2016, Art. 183, § 8º)
§ 9º Na amostra pré-transfusional inicial, será realizada a pesquisa de anticorpos antieritrocitários irregulares utilizando-se, preferencialmente, o soro da mãe ou eluato do recém-nascido. (Origem: PRT MS/GM 158/2016, Art. 183, § 9º)
§ 10. Se a pesquisa de anticorpos irregulares for negativa, não será necessário compatibilizar as hemácias para a primeira transfusão nem para as transfusões subsequentes dentro do período neonatal, desde que as hemácias sejam do grupo "O". (Origem: PRT MS/GM 158/2016, Art. 183, § 10)
§ 11. Se a pesquisa de anticorpos irregulares demonstrar a presença de anticorpos clinicamente significativos, a transfusão será feita com unidades que não contenham os antígenos correspondentes. (Origem: PRT MS/GM 158/2016, Art. 183, § 11)
§ 12. As unidades a que se refere o § 11 devem ser compatibilizadas com soro do neonato ou com soro da sua mãe. (Origem: PRT MS/GM 158/2016, Art. 183, § 12)
§ 13. Os neonatos não serão transfundidos com sangue total, plasma ou outros componentes sanguíneos que contenham anticorpos irregulares clinicamente significativos. (Origem: PRT MS/GM 158/2016, Art. 183, § 13)
§ 14. A transfusão de componentes celulares em recém-nascidos com menos de 1.200 g de peso será feita com produtos desleucocitados ou não reagentes para CMV. (Origem: PRT MS/GM 158/2016, Art. 183, § 14)
Art. 183. Em caso de exsanguíneo transfusão, para a seleção do componente sanguíneo, será utilizado em recém-nascidos sangue total colhido há menos de 5 (cinco) dias. (Origem: PRT MS/GM 158/2016, Art. 184)
§ 1º Caso não haja disponibilidade de sangue recente, será utilizado sangue colhido há mais de 5 (cinco) dias, sendo, para isto, necessária uma autorização escrita do médico assistente e do médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 184, § 1º)
§ 2º É recomendado o uso de plasma compatível com as hemácias do paciente. (Origem: PRT MS/GM 158/2016, Art. 184, § 2º)
§ 3º Os casos de incompatibilidade pelo sistema Rh ou por outros sistemas, as hemácias serão compatíveis com o soro da mãe e desprovidas do(s) antígeno(s) contra o(s) qual (is) a mãe está imunizada. (Origem: PRT MS/GM 158/2016, Art. 184, § 3º)
§ 4º Nos exames imuno-hematológicos, serão realizados, rotineiramente, a tipagem ABO e RhD, a pesquisa de D fraco e o teste direto da antiglobulina humana nos recém-nascidos de mães RhD negativo. (Origem: PRT MS/GM 158/2016, Art. 184, § 4º)
§ 5º Na transfusão intrauterina serão utilizados concentrados de hemácias do grupo "O" compatíveis com os anticorpos maternos e componentes desleucocitados ou não reagentes para CMV irradiados. (Origem: PRT MS/GM 158/2016, Art. 184, § 5º)
Seção XI
Da Liberação de Sangue para Transfusão
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XI)
Art. 184. Será afixado, em toda bolsa de componente sanguíneo a ser transfundida, um cartão de transfusão (rótulo ou etiqueta) que indique: (Origem: PRT MS/GM 158/2016, Art. 185)
I - o nome completo do receptor; (Origem: PRT MS/GM 158/2016, Art. 185, I)
II - a instituição de assistência à saúde, enfermaria ou leito em que se encontra o receptor; (Origem: PRT MS/GM 158/2016, Art. 185, II)
III - o registro e a tipagem ABO e RhD do receptor; (Origem: PRT MS/GM 158/2016, Art. 185, III)
IV - o número de identificação da bolsa de componente sanguíneo e sua tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 185, IV)
V - a conclusão do teste de compatibilidade maior; (Origem: PRT MS/GM 158/2016, Art. 185, V)
VI - a data do envio do componente sanguíneo para a transfusão; e (Origem: PRT MS/GM 158/2016, Art. 185, VI)
VII - o nome do responsável pela realização dos testes pré-transfusionais e pela liberação do componente sanguíneo. (Origem: PRT MS/GM 158/2016, Art. 185, VII)
Art. 185. Serão conservadas a 4 ± 2 °C, durante pelo menos 3 (três) dias após a transfusão, uma amostra do concentrado de hemácias (segmento do tubo coletor) e uma amostra de soro ou plasma do receptor (retenção de amostras de sangue e componentes sanguíneos). (Origem: PRT MS/GM 158/2016, Art. 186)
Art. 186. Serão avaliados, antes da liberação para a transfusão, o aspecto do componente sanguíneo e o respectivo cartão de transfusão. (Origem: PRT MS/GM 158/2016, Art. 187)
§ 1º Na avaliação de que trata o "caput", serão verificados: (Origem: PRT MS/GM 158/2016, Art. 187, § 1º)
I - a coloração; (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, I)
II - a integridade do sistema; (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, II)
III - a presença de hemólise ou de coágulos; e (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, III)
IV - a data de validade. (Origem: PRT MS/GM 158/2016, Art. 187, § 1º, IV)
§ 2º O componente sanguíneo não será liberado na constatação, através da avaliação de que trata o "caput", de anormalidades ou se não contiver no cartão de transfusão as informações necessárias. (Origem: PRT MS/GM 158/2016, Art. 187, § 2º)
Art. 187. O cartão de transfusão do componente sanguíneo conterá, ainda, as seguintes instruções de procedimento ao transfusionista: (Origem: PRT MS/GM 158/2016, Art. 188)
I - identificar adequadamente o receptor; (Origem: PRT MS/GM 158/2016, Art. 188, I)
II - transfundir somente mediante prescrição médica; (Origem: PRT MS/GM 158/2016, Art. 188, II)
III - conferir os resultados dos exames que aparecem no rótulo da bolsa; (Origem: PRT MS/GM 158/2016, Art. 188, III)
IV - utilizar equipo de infusão específico para transfusão; (Origem: PRT MS/GM 158/2016, Art. 188, IV)
V - não adicionar e nem infundir conjuntamente com medicamentos ou soluções não isotônicas; e (Origem: PRT MS/GM 158/2016, Art. 188, V)
VI - verificar e informar o serviço de hemoterapia sobre qualquer efeito adverso imediato. (Origem: PRT MS/GM 158/2016, Art. 188, VI)
Art. 188. Os componentes liberados para transfusão, mas não utilizados, podem ser reintegrados ao estoque se as condições de transporte e armazenamento forem conhecidas e adequadas, sendo que tais componentes devem ser submetidos à inspeção visual antes da reintegração. (Origem: PRT MS/GM 158/2016, Art. 189)
§ 1º Não serão reintegradas ao estoque unidades violadas. (Origem: PRT MS/GM 158/2016, Art. 189, § 1º)
§ 2º O profissional do serviço de hemoterapia que receber a devolução de uma bolsa de componente sanguíneo não utilizada deverá inspecioná-la, retirar a identificação do receptor e registrar a devolução. (Origem: PRT MS/GM 158/2016, Art. 189, § 2º)
§ 3º São condições indispensáveis para que o componente sanguíneo possa ser reintegrado ao estoque: (Origem: PRT MS/GM 158/2016, Art. 189, § 3º)
I - o sistema de acondicionamento não estar aberto; (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, I)
II - o componente ter sido mantido em temperatura apropriada durante todo o tempo de permanência fora do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, II)
III - a trajetória da bolsa estar devidamente documentada; (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, III)
IV - existir um segmento ou tubo conectado à bolsa de concentrado de hemácias de tamanho suficiente para permitir a realização de outros testes de compatibilidade; e (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, IV)
V - novo cumprimento dos requisitos que regem a liberação de toda unidade de sangue. (Origem: PRT MS/GM 158/2016, Art. 189, § 3º, V)
Seção XII
Do Ato Transfusional
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XII)
Art. 189. A transfusão será prescrita por médico e registrada no prontuário do paciente. (Origem: PRT MS/GM 158/2016, Art. 190)
Parágrafo Único. É obrigatório que fiquem registrados, no prontuário do paciente, a data da transfusão, os números e a origem dos componentes sanguíneos transfundidos. (Origem: PRT MS/GM 158/2016, Art. 190, Parágrafo Único)
Art. 190. As transfusões serão realizadas por médico ou profissional de saúde habilitado, qualificado e conhecedor das normas constantes deste Anexo, e serão realizadas apenas sob supervisão médica, isto é, em local em que haja, pelo menos, um médico presente que possa intervir em casos de reações transfusionais. (Origem: PRT MS/GM 158/2016, Art. 191)
§ 1º O paciente deve ter os seus sinais vitais (temperatura, pressão arterial e pulso) verificados e registrados, pelo menos, imediatamente antes do início e após o término da transfusão. (Origem: PRT MS/GM 158/2016, Art. 191, § 1º)
§ 2º Os primeiros 10 (dez) minutos de transfusão serão acompanhados pelo médico ou profissional de saúde qualificado para tal atividade, que permanecerá ao lado do paciente durante este intervalo de tempo. (Origem: PRT MS/GM 158/2016, Art. 191, § 2º)
§ 3º Durante o transcurso do ato transfusional o paciente será periodicamente monitorado para possibilitar a detecção precoce de eventuais reações adversas. (Origem: PRT MS/GM 158/2016, Art. 191, § 3º)
§ 4º Se houver alguma reação adversa o médico será comunicado imediatamente. (Origem: PRT MS/GM 158/2016, Art. 191, § 4º)
Art. 191. O receptor será identificado imediatamente antes da transfusão por meio da informação de seu nome completo, prestada pelo próprio receptor ou por profissional da equipe médica e/ou de enfermagem responsável pela assistência direta ao paciente. (Origem: PRT MS/GM 158/2016, Art. 192)
§ 1º Havendo qualquer discrepância entre a identificação do receptor e a constante da bolsa, a transfusão será suspensa até o esclarecimento do fato. (Origem: PRT MS/GM 158/2016, Art. 192, § 1º)
§ 2º Haverá mecanismos, tais como pulseiras ou braceletes, que reduzam a possibilidade de erro na identificação do receptor na hipótese de receptores inconscientes ou desorientados. (Origem: PRT MS/GM 158/2016, Art. 192, § 2º)
Art. 192. Antes do início da transfusão, os componentes eritrocitários não permanecerão à temperatura ambiente por mais de 30 (trinta) minutos. (Origem: PRT MS/GM 158/2016, Art. 193)
§ 1º Caso o tempo de que trata o "caput" seja atingindo, o componente será recolocado, imediatamente, em temperatura adequada de armazenamento. (Origem: PRT MS/GM 158/2016, Art. 193, § 1º)
§ 2º O componente será descartado na hipótese de não cumprimento do procedimento de que trata o § 1º. (Origem: PRT MS/GM 158/2016, Art. 193, § 2º)
Art. 193. As unidades de plasma serão transfundidas o mais brevemente possível após seu descongelamento, não devendo exceder 24 (vinte e quatro) horas se armazenadas a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 194)
Art. 194. Os componentes plaquetários serão mantidos em agitação contínua e transfundidos em até 24 (vinte e quatro) horas depois de saírem do agitador contínuo de plaquetas, desde que agitados antes do uso. (Origem: PRT MS/GM 158/2016, Art. 195)
Art. 195. Todas as transfusões de componentes sanguíneos serão administradas por meio de equipos livres de pirógenos e descartáveis, que incluam filtro que retenha coágulos e agregados alternativamente. (Origem: PRT MS/GM 158/2016, Art. 196)
§ 1º Poderá ser utilizado filtro de leucócitos. (Origem: PRT MS/GM 158/2016, Art. 196, § 1º)
§ 2º A utilização de filtros para desleucocitação à beira do leito dispensa o uso de filtros padrão. (Origem: PRT MS/GM 158/2016, Art. 196, § 2º)
Art. 196. Os componentes sanguíneos serão infundidos em, no máximo, 4 (quatro) horas. (Origem: PRT MS/GM 158/2016, Art. 197)
Parágrafo Único. Quando o período estabelecido no "caput" for atingindo, a transfusão será interrompida e as bolsas descartadas. (Origem: PRT MS/GM 158/2016, Art. 197, Parágrafo Único)
Art. 197. O aquecimento do sangue antes da transfusão, quando indicado, será realizado de forma controlada, em aquecedores próprios para este fim. (Origem: PRT MS/GM 158/2016, Art. 198)
§ 1º Os aquecedores de que trata o "caput" serão dotados de termômetro visível e alarme sonoro e visual. (Origem: PRT MS/GM 158/2016, Art. 198, § 1º)
§ 2º Haverá protocolo escrito, elaborado pelo serviço de hemoterapia, que defina as indicações e os procedimentos para o aquecimento de sangue. (Origem: PRT MS/GM 158/2016, Art. 198, § 2º)
Art. 198. Nenhum medicamento será adicionado à bolsa do componente sanguíneo ou infundido na mesma linha venosa, exceto a solução de cloreto de sódio a 0,9%, em casos excepcionais. (Origem: PRT MS/GM 158/2016, Art. 199)
Art. 199. O plasma fresco congelado e o plasma isento de crioprecipitado serão descongelados à temperatura de 37ºC (trinta e sete graus Celsius) em dispositivo devidamente qualificado. (Origem: PRT MS/GM 158/2016, Art. 200)
§ 1º Para evitar contaminação, a bolsa será protegida por invólucro plástico durante o descongelamento em banho-maria. (Origem: PRT MS/GM 158/2016, Art. 200, § 1º)
§ 2º As unidades de plasma serão transfundidas o mais brevemente possível após seu descongelamento, não excedendo 24 (vinte e quatro) horas, quando armazenadas a 4 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 200, § 2º)
§ 3º É proibido o recongelamento das unidades de plasma não transfundidas. (Origem: PRT MS/GM 158/2016, Art. 200, § 3º)
Art. 200. O crioprecipitado será descongelado à temperatura de 37°C (trinta e sete graus Celsius) devendo-se observar os mesmos procedimentos constantes do "caput" e §§ 1º e 3º do art. 199. (Origem: PRT MS/GM 158/2016, Art. 201)
Parágrafo Único. O crioprecipitado será transfundido o mais brevemente possível após o seu descongelamento, não excedendo 6 (seis) horas, quando mantido à temperatura de 22 ± 2 °C. (Origem: PRT MS/GM 158/2016, Art. 201, Parágrafo Único)
Art. 201. Nas transfusões de concentrados de plaquetas obtidos de sangue total em receptores RhD negativo, do sexo feminino, com menos de 45 (quarenta e cinco) anos de idade, serão transfundidos, preferencialmente, concentrados de plaquetas RhD negativo. (Origem: PRT MS/GM 158/2016, Art. 202)
§ 1º Caso as plaquetas a serem transfundidas sejam RhD positivo, será realizada uma pesquisa de anticorpos antieritrocitários irregulares pré-transfusional na receptora. (Origem: PRT MS/GM 158/2016, Art. 202, § 1º)
§ 2º Caso a receptora de que trata o "caput" não possua anti-RhD, recomenda-se a administração de imunoglobulina anti-RhD por via parenteral, até 72 (setenta e duas) horas após a transfusão. (Origem: PRT MS/GM 158/2016, Art. 202, § 2º)
§ 3º Nas transfusões subsequentes será repetida a pesquisa de anticorpos antieritrocitários irregulares e se não for detectado o anticorpo anti-RhD, recomenda-se repetir a dose de imunoglobulina anti-RhD. (Origem: PRT MS/GM 158/2016, Art. 202, § 3º)
Art. 202. Os concentrados de granulócitos serão transfundidos utilizando equipos livres de pirógenos e descartáveis, que incluam um filtro capaz de reter coágulos e agregados. (Origem: PRT MS/GM 158/2016, Art. 203)
Parágrafo Único. A transfusão de concentrados de granulócitos será objeto de protocolo elaborado pelo serviço de hemoterapia que contemple tanto as unidades como o procedimento de mobilização e coleta. (Origem: PRT MS/GM 158/2016, Art. 203, Parágrafo Único)
Art. 203. As transfusões em pacientes ambulatoriais serão realizadas em local apropriado destinado a tal fim. (Origem: PRT MS/GM 158/2016, Art. 204)
Parágrafo Único. Nas transfusões em pacientes ambulatoriais serão observadas as mesmas normas que regem as transfusões em pacientes internados. (Origem: PRT MS/GM 158/2016, Art. 204, Parágrafo Único)
Art. 204. Em casos especiais, a transfusão será realizada no domicílio do receptor, desde que todo ato transfusional seja realizado sob supervisão médica. (Origem: PRT MS/GM 158/2016, Art. 205)
Parágrafo Único. O médico que acompanha o ato transfusional em domicílio será o responsável pela garantia do cumprimento de todas as normas de medicina transfusional e disporá de medicamentos, materiais e equipamentos para atendimento de eventuais situações de emergência derivadas do ato transfusional. (Origem: PRT MS/GM 158/2016, Art. 205, Parágrafo Único)
Seção XIII
Das Reações Transfusionais
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XIII)
Art. 205. A instituição de assistência à saúde que realiza transfusões terá um sistema para detecção, notificação e avaliação das reações transfusionais. (Origem: PRT MS/GM 158/2016, Art. 206)
§ 1º Na suspeita de reação transfusional o paciente receberá atendimento imediato e tanto o médico assistente quanto o serviço de hemoterapia que preparou a transfusão deverão ser comunicados. (Origem: PRT MS/GM 158/2016, Art. 206, § 1º)
§ 2º A instituição de assistência à saúde manterá os registros no prontuário do paciente referentes à investigação e à conduta adotadas nas reações transfusionais. (Origem: PRT MS/GM 158/2016, Art. 206, § 2º)
§ 3º O comitê transfusional do serviço de hemoterapia ou da instituição de assistência à saúde será informado e monitorará as reações transfusionais ocorridas zelando pelo atendimento e notificação dessas reações. (Origem: PRT MS/GM 158/2016, Art. 206, § 3º)
Art. 206. As reações transfusionais imediatas serão avaliadas e acompanhadas pelo serviço que realizou a transfusão. (Origem: PRT MS/GM 158/2016, Art. 207)
§ 1º Consideram-se reações transfusionais imediatas aquelas que ocorrem até 24 (vinte e quatro) horas depois de iniciada a transfusão. (Origem: PRT MS/GM 158/2016, Art. 207, § 1º)
§ 2º Em caso de reações transfusionais imediatas, serão adotadas, entre outras, as seguintes medidas: (Origem: PRT MS/GM 158/2016, Art. 207, § 2º)
I - interromper a transfusão, exceto em caso de reações alérgicas leves (urticária) nas quais a transfusão do componente sanguíneo não precisa ser suspensa; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, I)
II - manter acesso venoso; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, II)
III - examinar rótulos das bolsas e de todos os registros relacionados à transfusão para verificar se houve erro na identificação do paciente ou das bolsas transfundidas; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, III)
IV - não desprezar as bolsas de componentes sanguíneos transfundidas e encaminhá-las ao serviço de hemoterapia, quando pertinente; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, IV)
V - comunicar ao médico assistente e/ou médico do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, V)
VI - informar ao comitê transfusional; e (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, VI)
VII - notificar a ocorrência à autoridade sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 207, § 2º, VII)
Art. 207. No caso de suspeita de reação hemolítica serão coletadas novas amostras de sangue do receptor. (Origem: PRT MS/GM 158/2016, Art. 208)
§ 1º As amostras de que trata o "caput" serão rotuladas apropriadamente e, juntamente com a bolsa do componente sanguíneo em questão, mesmo vazia, serão imediatamente remetidas ao serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 208, § 1º)
§ 2º Os testes pré-transfusionais serão repetidos com as amostras pré e pós-reação tranfusional. (Origem: PRT MS/GM 158/2016, Art. 208, § 2º)
§ 3º Na amostra pós-reação transfusional serão realizados, no mínimo, os seguintes testes: (Origem: PRT MS/GM 158/2016, Art. 208, § 3º)
I - inspeção visual do soro ou plasma para detecção de hemólise; (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, I)
II - tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, II)
III - Teste Direto da Antiglobulina (TDA); (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, III)
IV - prova de compatibilidade maior com o resíduo de hemácias da bolsa; e (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, IV)
V - pesquisa de anticorpos antieritrocitários irregulares, utilizando técnicas que aumentem a sensibilidade do método. (Origem: PRT MS/GM 158/2016, Art. 208, § 3º, V)
§ 4º Os resultados dos testes realizados com amostra pós-reação transfusional serão confrontados com os obtidos com a amostra pré-transfusão. (Origem: PRT MS/GM 158/2016, Art. 208, § 4º)
Art. 208. Os casos de suspeita de reação por contaminação microbiana ou lesão pulmonar aguda relacionada à transfusão (TRALI) serão comunicados ao serviço de hemoterapia produtor do componente sanguíneo para rastreamento do(s) provável(veis) doador(es) envolvido(s) e dos demais componentes sanguíneos dele(s) porventura coletado(s), de acordo com o procedimento operacional do serviço. (Origem: PRT MS/GM 158/2016, Art. 209)
§ 1º Nos casos de suspeita de contaminação microbiana é necessária cultura microbiológica da bolsa e do paciente. (Origem: PRT MS/GM 158/2016, Art. 209, § 1º)
§ 2º Os doadores associados ou implicados com caso de TRALI serão liberados para doação de sangue total, mas não para doação de plaquetas por aférese. (Origem: PRT MS/GM 158/2016, Art. 209, § 2º)
§ 3º O concentrado de hemácias obtido da doação de que trata o § 2º será liberado para transfusão após o procedimento de lavagem e o plasma será utilizado apenas para fracionamento industrial. (Origem: PRT MS/GM 158/2016, Art. 209, § 3º)
Art. 209. Em caso de febre relacionada à transfusão com elevação da temperatura corporal acima de 1ºC (grau Celsius) após o início da transfusão e atingindo temperatura superior 38°C (graus Celsius), a transfusão será interrompida imediatamente e o componente sanguíneo não será mais infundido no paciente. (Origem: PRT MS/GM 158/2016, Art. 210)
Art. 210. As complicações ou reações transfusionais tardias serão avaliadas e acompanhadas. (Origem: PRT MS/GM 158/2016, Art. 211)
§ 1º Todos os casos em que haja suspeita de transmissão de infecção por transfusão serão avaliados. (Origem: PRT MS/GM 158/2016, Art. 211, § 1º)
§ 2º Novo estudo dos doadores dos componentes sanguíneos suspeitos será realizado, incluindo a convocação e a repetição dos testes para infecções transmissíveis de todos os doadores envolvidos. (Origem: PRT MS/GM 158/2016, Art. 211, § 2º)
§ 3º Depois da investigação do caso, os seguintes procedimentos devem ser realizados: (Origem: PRT MS/GM 158/2016, Art. 211, § 3º)
I - comunicar ao médico do paciente a eventual soroconversão de um ou mais doadores envolvidos no caso; (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, I)
II - após identificar o doador, encaminhá-lo para tratamento especializado e excluí-lo do arquivo de doadores do serviço de hemoterapia; (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, II)
III - registrar as medidas efetuadas para o diagnóstico, notificação e encaminhamento; e (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, III)
IV - notificar a ocorrência à autoridade sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 211, § 3º, IV)
Seção XIV
Do Sangue Autólogo
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XIV)
Art. 211. O procedimento de doação autóloga pré-operatória dependerá da solicitação do médico assistente e requer a aprovação do médico hemoterapeuta. (Origem: PRT MS/GM 158/2016, Art. 212)
Art. 212. A unidade de componente sanguíneo a ser utilizada será rotulada com os dizeres "Doação Autóloga" e será segregada e utilizada apenas para transfusão autóloga. (Origem: PRT MS/GM 158/2016, Art. 213)
Art. 213. Não é permitida a migração de bolsas de componentes sanguíneos autólogos para uso alogênico. (Origem: PRT MS/GM 158/2016, Art. 214)
Art. 214. As doações autólogas serão submetidas aos mesmos testes imuno-hematológicos e testes para detecção de infecções transmissíveis pelo sangue realizados nas doações alogênicas. (Origem: PRT MS/GM 158/2016, Art. 215)
Art. 215. Os pacientes que possuam testes para infecções transmissíveis pelo sangue reagentes para qualquer das infecções testadas poderão ser aceitos nos programas de autotransfusão. (Origem: PRT MS/GM 158/2016, Art. 216)
Parágrafo Único. No caso tratado no "caput" será necessária a identificação com etiqueta especial, indicando a situação de risco de contaminação da bolsa e haverá concordância explícita do procedimento, por escrito, do médico assistente do paciente e do médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 216, Parágrafo Único)
Art. 216. O serviço de hemoterapia deve definir os critérios para aceitação e rejeição de doadores autólogos, sendo contraindicações absolutas: (Origem: PRT MS/GM 158/2016, Art. 217)
I - insuficiência cardíaca descompensada; (Origem: PRT MS/GM 158/2016, Art. 217, I)
II - estenose aórtica grave; (Origem: PRT MS/GM 158/2016, Art. 217, II)
III - angina pectoris instável; (Origem: PRT MS/GM 158/2016, Art. 217, III)
IV - infarto do miocárdio nos últimos 6 (seis) meses; (Origem: PRT MS/GM 158/2016, Art. 217, IV)
V - acidente vascular cerebral isquêmico nos últimos 6 (seis) meses; (Origem: PRT MS/GM 158/2016, Art. 217, V)
VI - alto grau de obstrução da artéria coronária esquerda; (Origem: PRT MS/GM 158/2016, Art. 217, VI)
VII - cardiopatia cianótica; e (Origem: PRT MS/GM 158/2016, Art. 217, VII)
VIII - presença de infecção ativa ou tratamento antimicrobiano. (Origem: PRT MS/GM 158/2016, Art. 217, VIII)
§ 1º As demais contraindicações serão avaliadas caso a caso, de acordo com o protocolo do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 217, § 1º)
§ 2º O volume de sangue a ser coletado respeitará o estabelecido no art. 51. (Origem: PRT MS/GM 158/2016, Art. 217, § 2º)
§ 3º Não há limites de idade para as doações autólogas. (Origem: PRT MS/GM 158/2016, Art. 217, § 3º)
§ 4º A concentração de hemoglobina ou hematócrito do doador-paciente não deve ser inferior a 11g/dL e 33%, respectivamente. (Origem: PRT MS/GM 158/2016, Art. 217, § 4º)
§ 5º A frequência das doações autólogas será determinada pelo médico hemoterapeuta. (Origem: PRT MS/GM 158/2016, Art. 217, § 5º)
§ 6º Não será colhido sangue do doador-paciente dentro das 72 (setenta e duas) horas anteriores à cirurgia, sendo que o intervalo entre cada doação autóloga não será inferior a 7 (sete) dias, a não ser em situações excepcionais, devidamente justificadas por um médico do serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 217, § 6º)
Art. 217. Serão realizados exames nas unidades coletadas, a fim de determinar o grupo ABO e RhD conforme especificado nos arts. 119 do Anexo IV , respectivamente. (Origem: PRT MS/GM 158/2016, Art. 218)
§ 1º No sangue autólogo, obtido de um doador-paciente, será realizado teste para detecção de anticorpos antieritrocitários irregulares, conforme especificado no art. 121, bem como os testes para infecções transmissíveis, de acordo com o disposto nos arts. 129 e 130 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 218, § 1º)
§ 2º O doador-paciente e o seu médico serão notificados sobre qualquer anormalidade nos exames realizados. (Origem: PRT MS/GM 158/2016, Art. 218, § 2º)
Art. 218. Além do estabelecido na Seção VII do Capítulo I do Título II, o rótulo da unidade autóloga conterá, pelo menos, as seguintes informações: (Origem: PRT MS/GM 158/2016, Art. 219)
I - nome completo do doador-paciente; (Origem: PRT MS/GM 158/2016, Art. 219, I)
II - nome da unidade de assistência à saúde de origem e número de registro do doador-paciente no serviço de hemoterapia; e (Origem: PRT MS/GM 158/2016, Art. 219, II)
III - legenda "Doação Autóloga", conforme mencionado no art. 212. (Origem: PRT MS/GM 158/2016, Art. 219, III)
Art. 219. Antes da transfusão dos componentes autólogos no doador-paciente, serão realizadas as determinações estabelecidas no art. 177. (Origem: PRT MS/GM 158/2016, Art. 220)
Parágrafo Único. Na doação autóloga, é opcional a realização do teste de compatibilidade de que trata o art. 178, § 1º . (Origem: PRT MS/GM 158/2016, Art. 220, Parágrafo Único)
Art. 220. O sangue autólogo, em situações excepcionais, poderá ser coletado do paciente imediatamente antes da cirurgia (hemodiluição normovolêmica) ou recuperado do campo cirúrgico ou de um circuito extracorpóreo (recuperação intraoperatória). (Origem: PRT MS/GM 158/2016, Art. 221)
Art. 221. As unidades de sangue obtidas no pré-operatório imediato, por hemodiluição normovolêmica, permanecerão na sala de cirurgia em que o paciente está sendo operado durante todo o ato cirúrgico. (Origem: PRT MS/GM 158/2016, Art. 222)
§ 1º As unidades de sangue de que trata o "caput" poderão ser utilizadas no doador-paciente em até 24 (vinte e quatro) horas depois da coleta, desde que mantidas à temperatura de 4 ± 2 °C, ou em até 8 (oito) horas, se as bolsas forem mantidas à temperatura entre 20°C e 24°C. (Origem: PRT MS/GM 158/2016, Art. 222, § 1º)
§ 2º A transfusão das bolsas autólogas depois que o doador-paciente deixou a sala de cirurgia poderá ser realizada, desde que haja protocolo escrito que defina como serão feitos a identificação e o armazenamento destas bolsas. (Origem: PRT MS/GM 158/2016, Art. 222, § 2º)
§ 3º O procedimento de hemodiluição pré-operatória poderá ser realizado mesmo em unidades de assistência à saúde que não disponham de serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 222, § 3º)
Art. 222. A recuperação intraoperatória de sangue será feita por meio de máquinas especialmente destinadas a este fim. (Origem: PRT MS/GM 158/2016, Art. 223)
§ 1º Não é permitida a recuperação intraoperatória quando existirem riscos de veiculação ou disseminação de agentes infecciosos e/ou células neoplásicas. (Origem: PRT MS/GM 158/2016, Art. 223, § 1º)
§ 2º O sangue recuperado no intraoperatório não será transfundido em outros pacientes. (Origem: PRT MS/GM 158/2016, Art. 223, § 2º)
§ 3º O sangue recuperado no intraoperatório será transfundido em até 4 (quatro) horas após a coleta. (Origem: PRT MS/GM 158/2016, Art. 223, § 3º)
Art. 223. O serviço de hemoterapia manterá protocolo escrito acerca dos procedimentos relativos à doação autóloga, incluindo a seleção de anticoagulantes e soluções usadas no processamento; os aspectos ligados à identificação das bolsas e a sua preservação; bem como os aspectos concernentes às reações adversas. (Origem: PRT MS/GM 158/2016, Art. 224)
Art. 224. No serviço de hemoterapia haverá um médico responsável pelo programa de transfusão autóloga pré-operatória e de recuperação intraoperatória. (Origem: PRT MS/GM 158/2016, Art. 225)
Art. 225. O doador-paciente ou seu responsável assinará termo de consentimento previamente à realização dos procedimentos de coleta autóloga. (Origem: PRT MS/GM 158/2016, Art. 226)
Art. 226. O serviço de hemoterapia estabelecerá protocolos para atendimento: (Origem: PRT MS/GM 158/2016, Art. 227)
I - de pacientes aloimunizados (anticorpos específicos para antígenos eritrocitários ou do sistema HLA/HPA); (Origem: PRT MS/GM 158/2016, Art. 227, I)
II - para sangria terapêutica; e (Origem: PRT MS/GM 158/2016, Art. 227, II)
III - para transfusão de substituição em adultos (exsanguineotransfusão). (Origem: PRT MS/GM 158/2016, Art. 227, III)
Parágrafo Único. Os procedimentos constantes dos protocolos de que trata o "caput" serão aprovados pelo responsável técnico da unidade e serão mantidos registros relativos a estes procedimentos realizados. (Origem: PRT MS/GM 158/2016, Art. 227, Parágrafo Único)
Seção XV
Dos Registros
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO I, Seção XV)
Art. 227. O serviço de hemoterapia terá um sistema de registro apropriado que permita a rastreabilidade da unidade de sangue ou componente, desde a sua obtenção até o seu destino final, incluindo-se os resultados dos exames de laboratório referentes a este produto. (Origem: PRT MS/GM 158/2016, Art. 228)
Art. 228. Os registros referentes à doação e à transfusão serão armazenados por, pelo menos, 20 (vinte) anos. (Origem: PRT MS/GM 158/2016, Art. 229)
§ 1º Será garantida a inviolabilidade dos registros. (Origem: PRT MS/GM 158/2016, Art. 229, § 1º)
§ 2º Quando os registros constarem de arquivos informatizados serão feitas cópias de segurança a serem arquivadas em locais distintos do arquivo original. (Origem: PRT MS/GM 158/2016, Art. 229, § 2º)
Art. 229. Os registros referentes à doação e à transfusão serão, preferencialmente, informatizados. (Origem: PRT MS/GM 158/2016, Art. 230)
Art. 230. Todos os registros do serviço de hemoterapia são absolutamente confidenciais. (Origem: PRT MS/GM 158/2016, Art. 231)
Art. 231. O serviço de hemoterapia, quando solicitado, informará os dados de seus registros às autoridades sanitárias e estas garantirão a confidencialidade destas informações, conforme a legislação vigente. (Origem: PRT MS/GM 158/2016, Art. 232)
Art. 232. Os registros relativos à doação conterão: (Origem: PRT MS/GM 158/2016, Art. 233)
I - a identificação da doação, numérica ou alfanumérica, que permita a rastreabilidade do doador e da doação; (Origem: PRT MS/GM 158/2016, Art. 233, I)
II - os dados pessoais (documento de identidade) do doador que permita sua correta identificação; (Origem: PRT MS/GM 158/2016, Art. 233, II)
III - a reação adversa durante a coleta, se houver ocorrido; (Origem: PRT MS/GM 158/2016, Art. 233, III)
IV - o peso, o pulso, a pressão arterial, a temperatura e o valor de hemoglobina ou hematócrito; (Origem: PRT MS/GM 158/2016, Art. 233, IV)
V - o documento assinado pelo doador a cada doação, declarando a veracidade das informações prestadas na triagem clínica e autorizando a utilização do sangue de acordo com o art. 32; e (Origem: PRT MS/GM 158/2016, Art. 233, V)
VI - as razões pelas quais a doação foi recusada. (Origem: PRT MS/GM 158/2016, Art. 233, VI)
Art. 233. Os registros de produção dos componentes sanguíneos conterão os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 234)
I - a data da coleta; (Origem: PRT MS/GM 158/2016, Art. 234, I)
II - o número ou alfanúmero de identificação da unidade coletada; (Origem: PRT MS/GM 158/2016, Art. 234, II)
III - o volume de sangue coletado; (Origem: PRT MS/GM 158/2016, Art. 234, III)
IV - a tipagem ABO e RhD do doador; (Origem: PRT MS/GM 158/2016, Art. 234, IV)
V - o resultado de fenotipagem eritrocitária, se realizada; (Origem: PRT MS/GM 158/2016, Art. 234, V)
VI - o resultado dos testes para infecções transmissíveis pelo sangue, de acordo com os arts. 129 e 130 do Anexo IV , e outros porventura realizados; (Origem: PRT MS/GM 158/2016, Art. 234, VI)
VII - a pesquisa de hemoglobina S; e (Origem: PRT MS/GM 158/2016, Art. 234, VII)
VIII - o destino do sangue coletado e dos componentes produzidos. (Origem: PRT MS/GM 158/2016, Art. 234, VIII)
Art. 234. Os registros de distribuição dos componentes sanguíneos liberados conterão os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 235)
I - data; (Origem: PRT MS/GM 158/2016, Art. 235, I)
II - número ou alfanúmero de identificação da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 235, II)
III - especificação da unidade de componente sanguíneo distribuída; (Origem: PRT MS/GM 158/2016, Art. 235, III)
IV - volume da unidade de componente sanguíneo distribuída; (Origem: PRT MS/GM 158/2016, Art. 235, IV)
V - tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 235, V)
VI - conclusão dos testes para infecções transmissíveis pelo sangue; e (Origem: PRT MS/GM 158/2016, Art. 235, VI)
VII - identificação do local de destino. (Origem: PRT MS/GM 158/2016, Art. 235, VII)
Art. 235. Os registros dos componentes sanguíneos liberados para transfusão conterão os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 236)
I - data de entrada dos componentes sanguíneos no serviço de hemoterapia que realizou a liberação para transfusão; (Origem: PRT MS/GM 158/2016, Art. 236, I)
II - número ou alfanúmero de identificação do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, II)
III - especificação da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, III)
IV - volume da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, IV)
V - tipagem ABO e RhD; (Origem: PRT MS/GM 158/2016, Art. 236, V)
VI - data de validade da unidade de componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 236, VI)
VII - data da transfusão; (Origem: PRT MS/GM 158/2016, Art. 236, VII)
VIII - nome completo do receptor; (Origem: PRT MS/GM 158/2016, Art. 236, VIII)
IX - número de registro e localização do receptor; (Origem: PRT MS/GM 158/2016, Art. 236, IX)
X - tipagem ABO e RhD do receptor; (Origem: PRT MS/GM 158/2016, Art. 236, X)
XI - resultado da pesquisa de anticorpos antieritrocitários; e (Origem: PRT MS/GM 158/2016, Art. 236, XI)
XII - resultado das provas de compatibilidade. (Origem: PRT MS/GM 158/2016, Art. 236, XII)
§ 1º As unidades de componentes sanguíneos que não forem utilizadas para transfusões terão registro do seu destino final e do motivo da não utilização. (Origem: PRT MS/GM 158/2016, Art. 236, § 1º)
§ 2º Outros testes laboratoriais que forem necessários serão devidamente registrados. (Origem: PRT MS/GM 158/2016, Art. 236, § 2º)
Art. 236. Serão registrados os números das unidades transfundidas e as reações imediatas associadas a transfusões no prontuário médico do paciente. (Origem: PRT MS/GM 158/2016, Art. 237)
CAPÍTULO II
DA GARANTIA DA QUALIDADE
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II)
Seção I
Dos Princípios Gerais do Sistema da Qualidade
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção I)
Art. 237. O serviço de hemoterapia possuirá manuais de procedimentos operacionais acerca das seguintes atividades do ciclo do sangue: (Origem: PRT MS/GM 158/2016, Art. 238)
I - captação; (Origem: PRT MS/GM 158/2016, Art. 238, I)
II - registro; (Origem: PRT MS/GM 158/2016, Art. 238, II)
III - triagem clínica; (Origem: PRT MS/GM 158/2016, Art. 238, III)
IV - coleta; (Origem: PRT MS/GM 158/2016, Art. 238, IV)
V - triagem laboratorial; (Origem: PRT MS/GM 158/2016, Art. 238, V)
VI - processamento; (Origem: PRT MS/GM 158/2016, Art. 238, VI)
VII - armazenamento; (Origem: PRT MS/GM 158/2016, Art. 238, VII)
VIII - distribuição; (Origem: PRT MS/GM 158/2016, Art. 238, VIII)
IX - transporte; (Origem: PRT MS/GM 158/2016, Art. 238, IX)
X - transfusão; (Origem: PRT MS/GM 158/2016, Art. 238, X)
XI - controle de qualidade dos componentes sanguíneos, insumos críticos e processos; e (Origem: PRT MS/GM 158/2016, Art. 238, XI)
XII - descarte de resíduos. (Origem: PRT MS/GM 158/2016, Art. 238, XII)
§ 1º Os procedimentos operacionais de cada atividade citada serão disponibilizados a todo o pessoal envolvido na atividade. (Origem: PRT MS/GM 158/2016, Art. 238, § 1º)
§ 2º O serviço de hemoterapia avaliará anualmente os procedimentos operacionais tratados no "caput" quanto à necessidade de revisão ou descrição dos processos a serem atualizados, sendo que todas as revisões/atualizações deverão ser registradas. (Origem: PRT MS/GM 158/2016, Art. 238, § 2º)
Art. 238. O serviço de hemoterapia determinará formalmente as atribuições e responsabilidades técnicas e administrativas por processos e/ou áreas. (Origem: PRT MS/GM 158/2016, Art. 239)
Parágrafo Único. O serviço de hemoterapia definirá e divulgará sua missão e sua política da qualidade, considerando os requisitos dos usuários. (Origem: PRT MS/GM 158/2016, Art. 239, Parágrafo Único)
Art. 239. O serviço de hemoterapia disporá de políticas e ações que assegurem a qualidade dos produtos e serviços garantindo que os procedimentos e processos ocorram sob condições controladas. (Origem: PRT MS/GM 158/2016, Art. 240)
§ 1º São, entre outras, as ações de que trata o "caput": (Origem: PRT MS/GM 158/2016, Art. 240, § 1º)
I - métodos e ferramentas de melhoria contínua; (Origem: PRT MS/GM 158/2016, Art. 240, § 1º, I)
II - processos de proposição de ações preventivas e corretivas; e (Origem: PRT MS/GM 158/2016, Art. 240, § 1º, II)
III - tratamento das reclamações e sugestões dos usuários. (Origem: PRT MS/GM 158/2016, Art. 240, § 1º, III)
§ 2º O desempenho dos processos será acompanhado por meio de indicadores e definição de metas. (Origem: PRT MS/GM 158/2016, Art. 240, § 2º)
Art. 240. O serviço de hemoterapia criará processo para identificação, investigação e análise dos desvios, com proposição de ações corretivas e verificação da eficácia das ações. (Origem: PRT MS/GM 158/2016, Art. 241)
Art. 241. O serviço de hemoterapia possuirá o número adequado de profissionais qualificados para a realização das atividades e os pré-requisitos para a realização das funções e tarefas serão formalmente documentados. (Origem: PRT MS/GM 158/2016, Art. 242)
§ 1º O serviço de hemoterapia possuirá programa de treinamento e capacitação de pessoal, constituído de treinamento inicial e continuado relacionado com as tarefas específicas que são realizadas pelo profissional, além de noções sobre medicina transfusional, boas práticas de laboratório e biossegurança. (Origem: PRT MS/GM 158/2016, Art. 242, § 1º)
§ 2º Os treinamentos serão documentados e será realizado procedimento de avaliação de eficácia deles, quando considerado relevante pelo serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 242, § 2º)
§ 3º O serviço de hemoterapia implantará indicadores relacionados com as atividades de treinamento, que serão acompanhados continuamente por sua direção. (Origem: PRT MS/GM 158/2016, Art. 242, § 3º)
Art. 242. O serviço de hemoterapia identificará os equipamentos que são críticos para suas atividades e criará programa baseado em políticas, definição de processos e procedimentos que garanta a adequação destes às atividades relacionadas. (Origem: PRT MS/GM 158/2016, Art. 243)
§ 1º O serviço de hemoterapia possuirá processo de qualificação dos equipamentos baseado em: (Origem: PRT MS/GM 158/2016, Art. 243, § 1º)
I - definição de requisitos exigidos; (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, I)
II - adequação às atividades a que se destinam; (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, II)
III - compatibilização com a infraestrutura disponível; e (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, III)
IV - suporte técnico do fornecedor. (Origem: PRT MS/GM 158/2016, Art. 243, § 1º, IV)
§ 2º Os equipamentos utilizados para coleta, processamento, testes laboratoriais, armazenamento e transfusão do sangue serão objeto de programas de controle, que incluirão a qualificação inicial, a calibração periódica e as manutenções preventiva e corretiva. (Origem: PRT MS/GM 158/2016, Art. 243, § 2º)
§ 3º O serviço de hemoterapia observará os seguintes itens para eleição e qualificação de equipamentos para suas atividades: (Origem: PRT MS/GM 158/2016, Art. 243, § 3º)
I - seleção do equipamento: (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I)
a) especificação do equipamento; (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I, a)
b) compatibilização com infraestrutura do serviço de hemoterapia; e (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I, b)
c) instalação; (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, I, c)
II - qualificação dos equipamentos: os equipamentos devem ser qualificados para o uso pretendido, incluindo verificação dos registros pertinentes e do risco para doadores, operadores ou comunidade; e (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, II)
III - uso do equipamento: qualificação dos equipamentos nas condições de utilização na rotina de trabalho. (Origem: PRT MS/GM 158/2016, Art. 243, § 3º, III)
Art. 243. Todos os equipamentos críticos possuirão uma identificação única que permita sua completa rastreabilidade nos processos e procedimentos envolvidos. (Origem: PRT MS/GM 158/2016, Art. 244)
Art. 244. Os equipamentos serão qualificados anteriormente à utilização ou implementação na rotina do serviço de hemoterapia e operados de acordo com as normas especificadas pelo fabricante. (Origem: PRT MS/GM 158/2016, Art. 245)
Art. 245. A calibração e a manutenção preventiva dos equipamentos serão efetuadas em intervalos pré-determinados, utilizando-se métodos definidos e adequados e critérios de aceitação. (Origem: PRT MS/GM 158/2016, Art. 246)
§ 1º Os parâmetros de calibração e de manutenção variam com as características de cada equipamento, conforme especificação técnica do fabricante. (Origem: PRT MS/GM 158/2016, Art. 246, § 1º)
§ 2º Todas as operações de que trata este artigo serão registradas no momento em que serão feitas. (Origem: PRT MS/GM 158/2016, Art. 246, § 2º)
§ 3º Quando forem verificadas irregularidades, serão aplicadas medidas corretivas envolvendo o próprio equipamento e/ou os produtos relacionados a ele. (Origem: PRT MS/GM 158/2016, Art. 246, § 3º)
Art. 246. As não conformidades observadas durante a qualificação, a calibração e a manutenção preventiva dos equipamentos serão adequadamente documentadas, assim como as correções efetuadas, registrando-se os defeitos apresentados pelo equipamento, com a respectiva data do reparo. (Origem: PRT MS/GM 158/2016, Art. 247)
Art. 247. A investigação e o seguimento das falhas dos equipamentos incluirão: (Origem: PRT MS/GM 158/2016, Art. 248)
I - avaliação dos produtos ou serviços fornecidos envolvidos com o equipamento em questão; (Origem: PRT MS/GM 158/2016, Art. 248, I)
II - garantia da segregação do equipamento; (Origem: PRT MS/GM 158/2016, Art. 248, II)
III - investigação do evento; (Origem: PRT MS/GM 158/2016, Art. 248, III)
IV - ações para requalificação do equipamento; e (Origem: PRT MS/GM 158/2016, Art. 248, IV)
V - notificação do evento ao fabricante e às autoridades sanitárias, quando indicado. (Origem: PRT MS/GM 158/2016, Art. 248, V)
Art. 248. O serviço de hemoterapia possuirá programa de manutenção preventiva e calibração de equipamentos, que contemple, entre outros, os requisitos mínimos de manutenção preventiva e calibração periódica, conforme a frequência de ocorrências, do tempo de uso do equipamento ou do padrão de desempenho em avaliações anteriores. (Origem: PRT MS/GM 158/2016, Art. 249)
§ 1º Equipamentos não contemplados em orientações técnicas propostas pelo Ministério da Saúde terão seu programa definido pelo responsável técnico do serviço de hemoterapia utilizando informações do fabricante. (Origem: PRT MS/GM 158/2016, Art. 249, § 1º)
§ 2º Será realizada nova calibração após cada manutenção corretiva que impacte nos parâmetros críticos do equipamento. (Origem: PRT MS/GM 158/2016, Art. 249, § 2º)
Art. 249. O serviço de hemoterapia possuirá câmaras de conservação (cadeia do frio) específicas para componentes sanguíneos, exceto nas situações previstas no art. 151. (Origem: PRT MS/GM 158/2016, Art. 250)
§ 1º As câmaras de conservação serão equipadas com sistema de alarme sonoro e visual. (Origem: PRT MS/GM 158/2016, Art. 250, § 1º)
§ 2º Os alarmes de que trata o § 1º serão testados, pelo menos, a cada 3 (três) meses. (Origem: PRT MS/GM 158/2016, Art. 250, § 2º)
§ 3º Haverá, por escrito, a conduta a ser tomada em relação ao armazenamento dos componentes na hipótese de ocorrência de falta de energia ou defeito nos equipamentos de estocagem. (Origem: PRT MS/GM 158/2016, Art. 250, § 3º)
§ 4º As câmaras de conservação em que se armazenam os componentes sanguíneos serão qualificadas para esta finalidade. (Origem: PRT MS/GM 158/2016, Art. 250, § 4º)
§ 5º As câmaras de conservação para concentrado de hemácias terão um sistema de ventilação para circulação de ar e temperatura uniformemente distribuída em todos os compartimentos. (Origem: PRT MS/GM 158/2016, Art. 250, § 5º)
§ 6º Será disponibilizado um plano de contingência formal para as situações de não conformidades na temperatura de armazenamento que descreva as medidas a serem tomadas em tais situações, para garantir a adequada preservação dos componentes armazenados. (Origem: PRT MS/GM 158/2016, Art. 250, § 6º)
Art. 250. A faixa de temperatura de armazenamento das amostras e reagentes é de 2ºC (dois graus Celsius) a 8ºC (oito graus Celsius), ressalvadas as orientações específicas de fabricantes ou ensaios laboratoriais. (Origem: PRT MS/GM 158/2016, Art. 251)
§ 1º É recomendável que as câmaras de conservação utilizadas para armazenamento de reagentes e amostras de sangue de doadores e pacientes tenham registrador contínuo de temperatura. (Origem: PRT MS/GM 158/2016, Art. 251, § 1º)
§ 2º Caso o serviço de hemoterapia não possua o registrador de que trata o § 1º, as câmaras de conservação deverão possuir termômetro de registro de temperatura máxima e mínima, e a temperatura será verificada e registrada a cada 12 (doze) horas. (Origem: PRT MS/GM 158/2016, Art. 251, § 2º)
Art. 251. Os banhos termostatizados (banhos-maria) ou incubadoras possuirão termômetro de uso exclusivo. (Origem: PRT MS/GM 158/2016, Art. 252)
Parágrafo Único. A temperatura será registrada a cada 24 (vinte e quatro) horas e conferida imediatamente antes do uso do equipamento. (Origem: PRT MS/GM 158/2016, Art. 252, Parágrafo Único)
Art. 252. A direção do serviço de hemoterapia implantará processos de controle interno com o objetivo de verificar o cumprimento dos requisitos pré-definidos. (Origem: PRT MS/GM 158/2016, Art. 253)
Parágrafo Único. Os resultados serão registrados e revisados pela direção do serviço de hemoterapia e pela área auditada com proposição de ações corretivas e preventivas. (Origem: PRT MS/GM 158/2016, Art. 253, Parágrafo Único)
Art. 253. O serviço de hemoterapia manterá um sistema de controle e qualificação de produtos e serviços críticos, o que inclui a inspeção dos produtos quando do recebimento e da sua utilização e o monitoramento dos resultados obtidos com o insumo (gestão de fornecedores e insumos). (Origem: PRT MS/GM 158/2016, Art. 254)
§ 1º A lista de materiais e serviços críticos será definida pelo responsável técnico do serviço de hemoterapia, que conterá entre outros: (Origem: PRT MS/GM 158/2016, Art. 254, § 1º)
I - os conjuntos diagnósticos de sorologia e de imuno-hematologia; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, I)
II - filtros de desleucocitação; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, II)
III - conjuntos para aférese; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, III)
IV - bolsas para coleta e conservação de componentes; (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, IV)
V - equipo de transfusão; e (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, V)
VI - bolsas. (Origem: PRT MS/GM 158/2016, Art. 254, § 1º, VI)
§ 2º O serviço de hemoterapia criará um sistema que permita a rastreabilidade de lote e validade de todos os insumos considerados críticos. (Origem: PRT MS/GM 158/2016, Art. 254, § 2º)
§ 3º O serviço de hemoterapia implantará programa de qualificação de fornecedores e de produtos e serviços críticos e acompanhará o desempenho destes durante a utilização. (Origem: PRT MS/GM 158/2016, Art. 254, § 3º)
§ 4º O serviço de hemoterapia possuirá condições adequadas para armazenamentos dos insumos respeitando orientações dos fabricantes. (Origem: PRT MS/GM 158/2016, Art. 254, § 4º)
§ 5º O manuseio dos produtos de que trata o § 4º deverá evitar inversões (trocas), danos, deterioração ou outros efeitos adversos. (Origem: PRT MS/GM 158/2016, Art. 254, § 5º)
§ 6º Antes da inspeção inicial, os insumos críticos recém-recebidos permanecerão identificados até a sua liberação para uso. (Origem: PRT MS/GM 158/2016, Art. 254, § 6º)
§ 7º O armazenamento será realizado de maneira a facilitar a rotatividade dos estoques. (Origem: PRT MS/GM 158/2016, Art. 254, § 7º)
§ 8º As condições de armazenamento serão avaliadas periodicamente. (Origem: PRT MS/GM 158/2016, Art. 254, § 8º)
§ 9º Para evitar perdas serão considerados os prazos de validade dos produtos no momento de liberação para uso. (Origem: PRT MS/GM 158/2016, Art. 254, § 9º)
Seção II
Da Infraestrutura
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção II)
Art. 254. Áreas e equipamentos serão distribuídos, construídos ou adaptados para facilitar as atividades realizadas no serviço de hemoterapia. (Origem: PRT MS/GM 158/2016, Art. 255)
§ 1º A disposição dos equipamentos e o fluxo de trabalho terão como objetivo a minimização de erros. (Origem: PRT MS/GM 158/2016, Art. 255, § 1º)
§ 2º No processo de gestão de infraestrutura será considerada a legislação específica vigente. (Origem: PRT MS/GM 158/2016, Art. 255, § 2º)
Art. 255. O serviço de hemoterapia possuirá programa de manutenção preventiva para equipamentos e instalações relacionados com infraestrutura como, entre outros: (Origem: PRT MS/GM 158/2016, Art. 256)
I - grupo gerador de emergência; (Origem: PRT MS/GM 158/2016, Art. 256, I)
II - quadro de distribuição de energia; (Origem: PRT MS/GM 158/2016, Art. 256, II)
III - Sistema de Proteção Contra Descarga Atmosférica (SPDA) e aterramento; (Origem: PRT MS/GM 158/2016, Art. 256, III)
IV - sistema de ar condicionado; e (Origem: PRT MS/GM 158/2016, Art. 256, IV)
V - caixas d'água. (Origem: PRT MS/GM 158/2016, Art. 256, V)
Art. 256. O serviço de hemoterapia possuirá programa de manutenção preventiva para sistemas de proteção e combate a incêndios e Equipamentos de Proteção Coletiva (EPC). (Origem: PRT MS/GM 158/2016, Art. 257)
Seção III
Da Biossegurança
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção III)
Art. 257. O serviço de hemoterapia manterá procedimentos escritos a respeito das normas de biossegurança a serem seguidas por todos os funcionários. (Origem: PRT MS/GM 158/2016, Art. 258)
Parágrafo Único. Haverá capacitação e educação continuada de toda a equipe acerca dos procedimentos de biossegurança. (Origem: PRT MS/GM 158/2016, Art. 258, Parágrafo Único)
Art. 258. O serviço de hemoterapia disponibilizará os Equipamentos de Proteção Individual (EPI) e Coletiva (EPC) necessários para a segurança dos seus funcionários. (Origem: PRT MS/GM 158/2016, Art. 259)
Parágrafo Único. As áreas e procedimentos desenvolvidos serão mapeados para identificação dos riscos presentes e os EPI e EPC necessários. (Origem: PRT MS/GM 158/2016, Art. 259, Parágrafo Único)
Art. 259. Áreas, equipamentos e superfícies de trabalho com risco de contaminação por sangue ou outros elementos receberão limpeza diária e desinfecção. (Origem: PRT MS/GM 158/2016, Art. 260)
§ 1º Respingos visíveis serão limpos imediatamente. (Origem: PRT MS/GM 158/2016, Art. 260, § 1º)
§ 2º Os procedimentos de que trata o "caput" serão descritos em procedimentos operacionais específicos. (Origem: PRT MS/GM 158/2016, Art. 260, § 2º)
Art. 260. Os profissionais envolvidos com processos de risco trajarão roupas e sapatos que assegurem a sua proteção. (Origem: PRT MS/GM 158/2016, Art. 261)
Seção IV
Do Descarte de Resíduos
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção IV)
Art. 261. No descarte de sangue total, componentes e resíduos de laboratório será observado o disposto no Plano de Gerenciamento de Resíduos de Serviços de Saúde (PGRSS) e serão respeitadas as demais normas técnico-sanitárias pertinentes editadas pela ANVISA e outros órgãos reguladores. (Origem: PRT MS/GM 158/2016, Art. 262)
Art. 262. O serviço de hemoterapia indicará o profissional de nível superior de seu quadro que será responsável pela elaboração e implantação do PGRSS da instituição. (Origem: PRT MS/GM 158/2016, Art. 263)
Art. 263. O serviço de hemoterapia possuirá programa decapacitação e educação continuada envolvendo todos os profissionais, inclusive os funcionários de empresas contratadas (terceirizadas) no manuseio de resíduos de serviços de saúde (RSS). (Origem: PRT MS/GM 158/2016, Art. 264)
Art. 264. Se o serviço de hemoterapia optar pelo tratamento interno de seus resíduos, este será realizado em equipamento qualificado e procedimento validado. (Origem: PRT MS/GM 158/2016, Art. 265)
Parágrafo Único. Será assegurado que a empresa contratada para transporte, tratamento e destinação final seja licenciada pelos órgãos ambientais. (Origem: PRT MS/GM 158/2016, Art. 265, Parágrafo Único)
Seção V
Do Transporte
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção V)
Art. 265. O envio de sangue e componentes para uso terapêutico e amostras para realização de exames laboratoriais em outra instituição de assistência à saúde obedecerá à legislação relacionada vigente, às normas de biossegurança e às exigências técnicas relacionadas à sua conservação. (Origem: PRT MS/GM 158/2016, Art. 266)
Parágrafo Único. A orientação técnica quanto às condições de transporte ficará a cargo do serviço de hemoterapia fornecedor e será formalizada no contrato, convênio ou termo de compromisso. (Origem: PRT MS/GM 158/2016, Art. 266, Parágrafo Único)
Art. 266. O envio de bolsas de componentes sanguíneos para finalidades não terapêuticas, como matéria-prima para a utilização em pesquisa, produção de reagentes ou painéis de controle de qualidade pelo serviço de hemoterapia, será informado à autoridade de vigilância sanitária competente. (Origem: PRT MS/GM 158/2016, Art. 267)
Art. 267. O envio de plasma fresco congelado e plasma não fresco para indústria de hemoderivados será definido e autorizado pelo Ministério da Saúde, quando houver destino viável para uso em interesse nacional para produção de medicamentos hemoderivados e ou medicamentos estratégicos. (Origem: PRT MS/GM 158/2016, Art. 268)
Parágrafo Único. As especificações técnicas do plasma, armazenamento e transporte serão normatizadas pela ANVISA, sem prejuízo do disposto neste Anexo. (Origem: PRT MS/GM 158/2016, Art. 268, Parágrafo Único)
Art. 268. O envio de componentes sanguíneos será acompanhado por documento que contenha os seguintes dados: (Origem: PRT MS/GM 158/2016, Art. 269)
I - nome, endereço e telefone de contato do serviço de hemoterapia remetente do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 269, I)
II - nome, endereço e telefone de contato do serviço de hemoterapia de destino do componente sanguíneo; (Origem: PRT MS/GM 158/2016, Art. 269, II)
III - relação dos componentes sanguíneos enviados, com os seus respectivos números de identificação; (Origem: PRT MS/GM 158/2016, Art. 269, III)
IV - condições de conservação; (Origem: PRT MS/GM 158/2016, Art. 269, IV)
V - data e hora da retirada; e (Origem: PRT MS/GM 158/2016, Art. 269, V)
VI - identificação do responsável pelo transporte dos componentes sanguíneos. (Origem: PRT MS/GM 158/2016, Art. 269, VI)
Art. 269. O componente sanguíneo será transportado em temperaturas adequadas para a manutenção das suas propriedades biológicas. (Origem: PRT MS/GM 158/2016, Art. 270)
§ 1º Os recipientes de transporte serão resistentes, impedirão vazamentos e possibilitarão a lavagem e desinfecção regular. (Origem: PRT MS/GM 158/2016, Art. 270, § 1º)
§ 2º O sangue total coletado em locais diferentes daqueles em que será processado será transportado à temperatura de 22 ± 2°C (vinte a vinte e quatro graus Celsius), sendo que para produção de concentrado de plaquetas a temperatura de transporte não poderá ser inferior a 20°C (vinte graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 2º)
§ 3º Se o sangue total não for destinado à produção de concentrado de plaquetas, ele poderá ser transportado à temperatura de 1°C (um grau Celsius) a 10°C (dez graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 3º)
§ 4º Os concentrados de hemácias serão transportados de forma a assegurar a manutenção da temperatura entre 1 °C (um grau Celsius) e 10°C (dez graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 4º)
§ 5º Os concentrados de plaquetas e de granulócitos serão conservados e transportados à temperatura de 22±2 °C (vinte a vinte e quatro graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 5º)
§ 6º É recomendado que os concentrados de plaquetas sejam agitados antes do uso se a agitação não for mantida durante o transporte. (Origem: PRT MS/GM 158/2016, Art. 270, § 6º)
§ 7º Os componentes serão mantidos congelados durante o transporte, quando for o caso. (Origem: PRT MS/GM 158/2016, Art. 270, § 7º)
§ 8º Os componentes descongelados serão transportados em temperaturas entre 1°C (um grau Celsius) e 10°C (dez graus Celsius). (Origem: PRT MS/GM 158/2016, Art. 270, § 8º)
§ 9º O aspecto de cada unidade será inspecionado no momento do envio e no momento da recepção, sendo descartadas todas as unidades que apresentem alterações à inspeção visual. (Origem: PRT MS/GM 158/2016, Art. 270, § 9º)
Art. 270. Os componentes sanguíneos serão transportados por profissionais orientados quanto às condições de transporte e os procedimentos a serem realizados em eventuais intercorrências. (Origem: PRT MS/GM 158/2016, Art. 271)
Art. 271. As condições de transporte e acondicionamento de sangue total e componente sanguíneos, relativo à capacidade máxima de bolsas por embalagem, quantitativo de material refrigerante, capacidade de empilhamento e sistema de monitoramento da temperatura, serão validadas a fim de garantir a integridade do produto durante todo o percurso previsto. (Origem: PRT MS/GM 158/2016, Art. 272)
Parágrafo Único. Recomenda-se, no mínimo, a execução das atividades de transporte conforme descrito no Anexo 10 do Anexo IV . (Origem: PRT MS/GM 158/2016, Art. 272, Parágrafo Único)
Seção VI
Dos Contratos, Convênios e Termos de Compromisso
(Origem: PRT MS/GM 158/2016, TÍTULO II, CAPÍTULO II, Seção VI)
Art. 272. O serviço de hemoterapia que distribui componentes sanguíneos para estoque formalizará por escrito com o serviço de hemoterapia receptor, um contrato, convênio ou termo de compromisso no qual constará: (Origem: PRT MS/GM 158/2016, Art. 273)
I - nomes e dados jurídicos das instituições envolvidas; (Origem: PRT MS/GM 158/2016, Art. 273, I)
II - responsabilidades técnicas e financeiras de cada uma das partes, respeitando-se todas as normas técnicas constantes deste Anexo; (Origem: PRT MS/GM 158/2016, Art. 273, II)
III - responsabilidade pelo transporte adequado do sangue e seus componentes; (Origem: PRT MS/GM 158/2016, Art. 273, III)
IV - penalidades para o não cumprimento das obrigações; e (Origem: PRT MS/GM 158/2016, Art. 273, IV)
V - vigência. (Origem: PRT MS/GM 158/2016, Art. 273, V)
Art. 273. Outras situações não contempladas neste Anexo quanto aos Contratos, Convênios e Termo de Compromisso ficarão a critério das partes envolvidas. (Origem: PRT MS/GM 158/2016, Art. 274)
CAPÍTULO III
DO PROGRAMA NACIONAL DE CONTROLE DE QUALIDADE EXTERNO EM SOROLOGIA E IMUNO-HEMATOLOGIA
Art. 274. Fica instituído o Programa Nacional de Controle de Qualidade Externo em Sorologia e lmunohematologia para Unidades Hemoterápicas (PNCQES), ao qual estão sujeitos todos os serviços de hemoterapia, públicos e privados, em todo Território Nacional. (Origem: PRT MS/GM 1840/1996, Art. 1º)
Parágrafo Único. Caberá ao Sistema único de Saúde, por meio de seus órgãos competentes, fiscalizar e coordenar o cumprimento das normas estabelecidas neste Capítulo e Anexo 12 do Anexo IV . (Origem: PRT MS/GM 1840/1996, Art. 1º, Parágrafo Único)
Art. 275. Todas as Unidades Hemoterápicas públicas e privadas, existentes no País, que executam testes acrológicos para triagem de doadores de sangue, por si ou por meio de terceiros, então sujeitas ao PNCQES. (Origem: PRT MS/GM 1840/1996, Art. 4º)
§ 1º Entende-se por Unidades Hemoterápicas aquelas enquadradas ou definidas na Portaria-SVS nº 121. de 24 de novembro de 1995 (anexo I), excetuando-se, para enquadramento neste Capítulo, as agências transfusionais. (Origem: PRT MS/GM 1840/1996, Art. 4º, § 1º)
§ 2º Em especifico, os Postos de Coleta, Unidades de Coleta e Transfusão, ou qualquer serviço de hemoterapia que colete o sangue destinado à transfusão, deverá obrigatoriamente certificar-se, acompanhar e possuir cópias dos laudos técnicos e das medidas corretivas, se houverem, provando que o laboratório ou Unidade Hemoterápica aonde os testes sorológicos são executados, estão regulares no PNCQES, conforme exigências deste Capítulo. (Origem: PRT MS/GM 1840/1996, Art. 4º, § 2º)
Art. 276. O cumprimento deste Capítulo será condição precípua para a obtenção e revalidação do licenciamento junto às Secretarias de Saúde dos Estados e do Distrito Federal. (Origem: PRT MS/GM 1840/1996, Art. 5º)
Art. 277. O não cumprimento das normas estabelecidas por este Capítulo será considerado falta grave e resultará no descredenciamento do serviço junto ao SUS e aplicação das sanções previstas na Lei nº 6.437. de 20 de agosto de 1977. (Origem: PRT MS/GM 1840/1996, Art. 6º)
Art. 278. O PNCQES será coordenado pela Secretaria de Vigilância Sanitária do Ministério da Saúde em consonância com as diretrizes e procedimentos estabelecidos pela Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1544/1997, Art. 2º)
Art. 279. Os serviços de hemoterapia, públicos e privados, autônomos ou integrantes da estrutura de estabelecimentos de saúde, ficam sujeitos às normas fixadas na Lei n.º 7649, de 25 de janeiro de 1988, no seu Regulamento, aprovado pelo Decreto n.º 95721, de 11 de janeiro de 1988, à regulamentação do Programa Nacional de Controle de Qualidade Externo em Sorologia para Unidades Hemoterápicas (PNCQES), bem como às demais constantes na legislação de vigilância sanitária. (Origem: PRT MS/GM 1544/1997, Art. 3º)
§ 1º O disposto no caput aplica-se, inclusive, aos estabelecimentos de saúde que realizem procedimentos médico-cirúrgicos para os quais seja necessária a utilização de sangue para transfusão. (Origem: PRT MS/GM 1544/1997, Art. 3º, § 1º)
§ 2º Os estabelecimentos referidos no art. 279, § 1º , quando não dispuserem de serviços hemoterápicos próprios, deverão comprovar, para esse fim, a contratação de serviços hemoterápicos com instituição licenciada pelo órgão de vigilância sanitária competente. (Origem: PRT MS/GM 1544/1997, Art. 3º, § 2º)
Art. 280. Os painéis de soros e hemácias para controle, certificação e garantia de qualidade, utilizados no país, serão registrados na Secretaria de Vigilância Sanitária do Ministério da Saúde. (Origem: PRT MS/GM 1544/1997, Art. 4º)
Art. 281. Caberá à Secretaria de Vigilância Sanitária do Ministério da Saúde estabelecer, em conjunto com os órgãos de Vigilância Sanitária Estaduais, a programação anual das inspeções, bem como a demanda e o suprimento de painéis de soros e hemácias, os procedimentos de avaliação dos sistemas de controle dos serviços hemoterápicos e as medidas corretivas pertinentes. (Origem: PRT MS/GM 1544/1997, Art. 5º)
Parágrafo Único. Caberá ao Ministério da Saúde a aquisição dos painéis de soros e hemácias para distribuição às Vigilâncias Sanitárias Estaduais. (Origem: PRT MS/GM 1544/1997, Art. 5º, Parágrafo Único)
Art. 282. A análise de referência dos conjuntos e reagentes diagnósticos registrados e comercializados no país, utilizados nos serviços hemoterápicos, será executada pelos laboratórios oficiais de controle de qualidade, Integrantes da Rede Nacional de Laboratórios Oficiais de Saúde Pública. (Origem: PRT MS/GM 1544/1997, Art. 6º)
CAPÍTULO IV
DOS GRUPOS DE ASSESSORAMENTO TÉCNICO (GAT)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção I
Do Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Sorologia (AEQ - Sorologia)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 283. Fica instituído o Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Sorologia (AEQ - Sorologia), com a finalidade de assessorar a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1589/2011, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 284. Competirá ao GAT: (Origem: PRT MS/GM 1589/2011, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - assessorar tecnicamente a CGSH/DAET/SAS/MS em assuntos relacionados ao AEQ - Sorologia, visando analisar resultados; (Origem: PRT MS/GM 1589/2011, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - determinar ações a serem tomadas; e (Origem: PRT MS/GM 1589/2011, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - participar da produção científica/educativa do Programa e de consultorias. (Origem: PRT MS/GM 1589/2011, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 285. O GAT será constituído por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1589/2011, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 1589/2011, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
a) CGSH/DAET/SAS/MS, que o coordenará; (Origem: PRT MS/GM 1589/2011, Art. 3º, I, a) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1589/2011, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - Hemocentro da Universidade Estadual de Campinas (UNICAMP); (Origem: PRT MS/GM 1589/2011, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - Hemocentro Coordenador do Rio de Janeiro (HEMORIO); (Origem: PRT MS/GM 1589/2011, Art. 3º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - Hemocentro Coordenador de Santa Catarina (HEMOSC); (Origem: PRT MS/GM 1589/2011, Art. 3º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VI - Fundação Pró-Sangue - Hemocentro de São Paulo; (Origem: PRT MS/GM 1589/2011, Art. 3º, VI) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VII - Instituto de Tecnologia em Imunobiológicos da Fundação Oswaldo Cruz (Biomanguinhos/FIOCRUZ); (Origem: PRT MS/GM 1589/2011, Art. 3º, VII) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VIII - Universidade Federal de Goiás (UFG); e (Origem: PRT MS/GM 1589/2011, Art. 3º, VIII) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IX - Instituto Nacional de Controle de Qualidade em Saúde da Fundação Oswaldo Cruz (INCQS/FIOCRUZ). (Origem: PRT MS/GM 1589/2011, Art. 3º, IX) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. Os representantes, titulares e suplentes, serão indicados, pelos dirigentes de seus respectivos órgãos e entidades à Coordenação do GAT. (Origem: PRT MS/GM 1589/2011, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 286. O GAT poderá convidar servidores dos órgãos e entidades do Ministério da Saúde, de outros órgãos da Administração Pública Federal, de entidades não-governamentais, bem como especialistas em assuntos ligados ao tema, cujas presenças sejam consideradas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1589/2011, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 287. As funções dos membros do GAT não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1589/2011, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção II
Do Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Imuno-hematologia (AEQ Imuno-hematologia)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 288. Fica instituído o Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Imunohematologia (AEQ Imunohematologia), com a finalidade de assessorar a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1588/2011, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 289. Competirá ao GAT: (Origem: PRT MS/GM 1588/2011, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - assessorar tecnicamente a CGSH/DAET/SAS/MS em assuntos relacionados ao AEQ Imunohematologia, visando analisar resultados; (Origem: PRT MS/GM 1588/2011, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - determinar ações a serem tomadas; e (Origem: PRT MS/GM 1588/2011, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - participar da produção científica/educativa do Programa e de consultorias. (Origem: PRT MS/GM 1588/2011, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 290. O GAT será constituído por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1588/2011, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 1588/2011, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
a) CGSH/DAET/SAS/MS, que o coordenará; (Origem: PRT MS/GM 1588/2011, Art. 3º, I, a) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1588/2011, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - Hemocentro Coordenador do Rio de Janeiro (HEMORIO); (Origem: PRT MS/GM 1588/2011, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - Hemocentro Coordenador de Santa Catarina (HEMOSC); (Origem: PRT MS/GM 1588/2011, Art. 3º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - Hemocentro da Universidade Estadual de Campinas (UNICAMP); (Origem: PRT MS/GM 1588/2011, Art. 3º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VI - Hemocentro de Botucatu (UNESP); (Origem: PRT MS/GM 1588/2011, Art. 3º, VI) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VII - Fundação de Hematologia e Hemoterapia do Amazonas (HEMOAM); (Origem: PRT MS/GM 1588/2011, Art. 3º, VII) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VIII - Fundação Centro de Hemoterapia e Hematologia do Pará (HEMOPA); (Origem: PRT MS/GM 1588/2011, Art. 3º, VIII) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IX - Hemocentro Coordenador de Pernambuco (Fundação HEMOPE); e (Origem: PRT MS/GM 1588/2011, Art. 3º, IX) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
X - Fundação Centro de Hematologia e Hemoterapia de Minas Gerais (HEMOMINAS). (Origem: PRT MS/GM 1588/2011, Art. 3º, X) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos e entidades, à Coordenação do GAT. (Origem: PRT MS/GM 1588/2011, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 291. O GAT poderá convidar servidores dos órgãos e entidades do Ministério da Saúde, de outros órgãos da Administração Pública Federal, de entidades não governamentais, bem como especialistas em assuntos ligados ao tema, cujas presenças sejam consideradas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1588/2011, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 292. As funções dos membros do GAT não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1588/2011, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção III
Do Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Hemocomponentes (AEQ - Hemocomponentes)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 293. Fica instituído o Grupo de Assessoramento Técnico (GAT) do Programa de Avaliação Externa da Qualidade em Hemocomponentes (AEQ - Hemocomponentes), com a finalidade de assessorar a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS). (Origem: PRT MS/GM 1587/2011, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 294. Competirá ao GAT: (Origem: PRT MS/GM 1587/2011, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - assessorar tecnicamente a CGSH/DAET/SAS/MS em assuntos relacionados ao AEQ - Hemocomponentes, visando analisar resultados; (Origem: PRT MS/GM 1587/2011, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - determinar ações a serem tomadas; e (Origem: PRT MS/GM 1587/2011, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - participar da produção cientifica/educativa do Programa e de consultorias. (Origem: PRT MS/GM 1587/2011, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 295. O GAT será constituído por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1587/2011, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - Secretaria de Atenção à Saúde: (Origem: PRT MS/GM 1587/2011, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
a) CGSH/DAET/SAS/MS, que o coordenará; (Origem: PRT MS/GM 1587/2011, Art. 3º, I, a) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - Hemocentro Coordenador do Rio de Janeiro (HEMORIO); (Origem: PRT MS/GM 1587/2011, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - Hemocentro Coordenador de Santa Catarina (HEMOSC); (Origem: PRT MS/GM 1587/2011, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - Fundação Pró-Sangue - Hemocentro de São Paulo; (Origem: PRT MS/GM 1587/2011, Art. 3º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - Fundação Hemocentro de Brasília; (Origem: PRT MS/GM 1587/2011, Art. 3º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VI - Hemocentro Coordenador de Pernambuco (Fundação HEMOPE); e (Origem: PRT MS/GM 1587/2011, Art. 3º, VI) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
VII - Fundação de Hematologia e Hemoterapia de Minas Gerais (HEMOMINAS). (Origem: PRT MS/GM 1587/2011, Art. 3º, VII) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. Os representantes, titulares e suplentes, serão indicados pelos dirigentes de seus respectivos órgãos e entidades, à Coordenação do GAT. (Origem: PRT MS/GM 1587/2011, Art. 3º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 296. O GAT poderá convidar servidores dos órgãos e entidades do Ministério da Saúde, de outros órgãos da Administração Pública Federal, de entidades nãogovernamentais, bem como especialistas em assuntos ligados ao tema, cujas presenças sejam consideradas necessárias ao cumprimento do disposto nesta Seção. (Origem: PRT MS/GM 1587/2011, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 297. As funções dos membros do GAT não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1587/2011, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
CAPÍTULO V
DAS COMISSÕES DE ASSESSORAMENTO TÉCNICO
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção I
Das Comissões de Assessoramento Técnico às Coagulopatias, outras Doenças Hemorrágicas Hereditárias e Plaquetopatias (CAT - Coagulopatias) e ao Diagnóstico Laboratorial em Hemostasia (CAT-Hemostasia)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 298. Ficam instituídas, no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN), a Comissão de Assessoramento Técnico às Coagulopatias, outras Doenças Hemorrágicas Hereditárias e Plaquetopatias (CAT-Coagulopatias) e a Comissão de Assessoramento Técnico ao Diagnóstico Laboratorial em Hemostasia (CAT-Hemostasia). (Origem: PRT MS/GM 1880/2012, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 299. A CAT-Coagulopatias tem por finalidades: (Origem: PRT MS/GM 1880/2012, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - contribuir com a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS) na formulação da política nacional para a atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - acompanhar as ações e atividades do Programa Nacional de Coagulopatias Hereditárias, no âmbito do Sistema Único de Saúde (SUS), a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de tratamento e atenção à saúde dos pacientes, sob responsabilidade do SINASAN; (Origem: PRT MS/GM 1880/2012, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - propor à CGSH/DAET/SAS/MS políticas, ações e atividades para o referido Programa Nacional de Coagulopatias Hereditárias e para o desenvolvimento das ações de atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - sugerir à CGSH/DAET/SAS/MS publicações referentes ao Programa Nacional de Coagulopatias Hereditárias; e (Origem: PRT MS/GM 1880/2012, Art. 2º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - instituir Grupos de Trabalho para o desenvolvimento de atividades específicas relacionadas ao cumprimento de suas finalidades. (Origem: PRT MS/GM 1880/2012, Art. 2º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 300. A CAT-Coagulopatias é composta por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1880/2012, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - um representante da CGSH/DAET/SAS/MS, que a coordenará; (Origem: PRT MS/GM 1880/2012, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - cinco representantes da área de hematologia clínica com ênfase em hemostasia e trombose e que desenvolvam atividades no âmbito do SUS; e (Origem: PRT MS/GM 1880/2012, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - um representante dos usuários do Programa Nacional de Coagulopatias Hereditárias. (Origem: PRT MS/GM 1880/2012, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes de que tratam os incisos I e II do caput serão indicados pela Secretaria de Atenção à Saúde (SAS/MS) à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º O representante de que trata o inciso III do caput será indicado pela Federação Brasileira de Hemofilia à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Os órgãos e entidades integrantes do CAT-Coagulopatias deverão revisar e indicar, a cada dois anos, os seus representantes no âmbito da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Para os fins do art. 300, § 3º , a substituição dos membros de que trata o inciso II do "caput" não poderá ser superior a um terço dos citados representantes. (Origem: PRT MS/GM 1880/2012, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 301. A CAT-Hemostasia tem por finalidades: (Origem: PRT MS/GM 1880/2012, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - contribuir com a CGSH/DAET/SAS/MS na formulação da política nacional para a atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 4º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - acompanhar as ações e atividades do Programa Nacional de Coagulopatias Hereditárias no âmbito do SUS, a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de diagnóstico clínico e laboratorial para a atenção à saúde dos pacientes, sob responsabilidade do SINASAN; (Origem: PRT MS/GM 1880/2012, Art. 4º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - propor à CGSH/DAET/SAS/MS políticas, ações e atividades para o referido Programa Nacional de Coagulopatias Hereditárias e para o desenvolvimento das ações de atenção às pessoas com coagulopatias, outras doenças hemorrágicas hereditárias e plaquetopatias; (Origem: PRT MS/GM 1880/2012, Art. 4º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - sugerir à CGSH/DAET/SAS/MS publicações referentes ao Programa Nacional de Coagulopatias Hereditárias; e (Origem: PRT MS/GM 1880/2012, Art. 4º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - instituir Grupos de Trabalho específicos para o desenvolvimento de atividades específicas relacionadas ao cumprimento de suas finalidades. (Origem: PRT MS/GM 1880/2012, Art. 4º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 302. A CAT-Hemostasia é composta por representantes, titular e suplente, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1880/2012, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - um representante da CGSH/DAET/SAS/MS, que a coordenará; e (Origem: PRT MS/GM 1880/2012, Art. 5º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - seis representantes da área de diagnóstico laboratorial em hemostasia e trombose e que desenvolvam atividades no âmbito do SUS; e (Origem: PRT MS/GM 1880/2012, Art. 5º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - um representante dos usuários do Programa Nacional de Coagulopatias Hereditárias. (Origem: PRT MS/GM 1880/2012, Art. 5º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes de que tratam os incisos I e II do caput serão indicados pela Secretaria de Atenção à Saúde (SAS/MS) à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º O representante de que trata o inciso III do caput será indicado pela Federação Brasileira de Hemofilia à Coordenação da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Os órgãos e entidades integrantes do CAT-Hemostasia deverão revisar e indicar, a cada dois anos, os seus representantes no âmbito da Comissão. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Para os fins do art. 302, § 3º , a substituição dos membros de que trata o inciso II do "caput" não poderá ser superior a um terço dos citados representantes. (Origem: PRT MS/GM 1880/2012, Art. 5º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 303. A participação na CAT-Coagulopatias e na CAT- Hemostasia é considerada como de relevante interesse público e não será remunerada. (Origem: PRT MS/GM 1880/2012, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. As Comissões poderão convidar entidades ou pessoas do setor público e privado, que atuem profissionalmente em atividades relacionadas ao tema, sempre que entender necessária a sua colaboração para o pleno alcance das suas finalidades. (Origem: PRT MS/GM 1880/2012, Art. 6º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 304. Os membros da CAT-Coagulopatias e da CAT-Hemostasia devem subscrever as seguintes declarações por ocasião do início de suas atividades nas Comissões: (Origem: PRT MS/GM 1880/2012, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse; e (Origem: PRT MS/GM 1880/2012, Art. 7º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade. (Origem: PRT MS/GM 1880/2012, Art. 7º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse por qualquer dos membros das Comissões, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) avaliar a conveniência ou não da manutenção do representante na Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 1880/2012, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros das Comissões, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) efetuar a imediata retirada do representante da Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 1880/2012, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 305. A CAT-Coagulopatias e a CAT-Hemostasia reunir-se-ão por convocação da Coordenação ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 1880/2012, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à CGSH/DAET/SAS/MS a convocação dos membros, a organização das reuniões, a elaboração e divulgação da pauta e atas de reunião e o arquivo dos documentos elaborados. (Origem: PRT MS/GM 1880/2012, Art. 8º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem incluídos na pauta de reunião serão propostos pela CGSH/DAET/SAS/MS ou pelos membros das comissões. (Origem: PRT MS/GM 1880/2012, Art. 8º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º O Ministério da Saúde custeará despesas de passagens e diárias para participação de membros ou convidados nas reuniões da CAT-Coagulopatias e da CAT-Hemostasia. (Origem: PRT MS/GM 1880/2012, Art. 8º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 306. A ausência do titular ou suplente, sem justificativa, a duas reuniões consecutivas da Comissão acarretará a sua exclusão. (Origem: PRT MS/GM 1880/2012, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. Compete à CGSH/DAET/SAS/MS adotar as providências necessárias para o cumprimento do disposto neste artigo, inclusive requerer ao órgão ou à entidade interessada que efetive a indicação de novo representante para recompor a Comissão. (Origem: PRT MS/GM 1880/2012, Art. 9º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção II
Da Comissão de Assessoramento Técnico em Gestão de Equipamentos (CAT-Gestão de Equipamentos), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 307. Fica instituída a Comissão de Assessoramento Técnico em Gestão de Equipamentos (CAT-Gestão de Equipamentos), no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN). (Origem: PRT MS/GM 2543/2014, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 308. A CAT-Gestão de Equipamentos tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 2543/2014, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - elaborar propostas na área de Gestão de Equipamentos, visando minimizar as desigualdades regionais, otimizando a aplicação de recursos, adequação e incorporação de novas tecnologias em saúde, na segurança dos trabalhadores e na qualificação de produtos e serviços na área de sangue e derivados; (Origem: PRT MS/GM 2543/2014, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - contribuir com a CGSH/DAHU/SAS/MS no acompanhamento e monitoramento das ações e atividades da área de Gestão de Equipamentos, no âmbito dos serviços de hematologia e hemoterapia do Sistema Único de Saúde (SUS), a fim de atender a legislação vigente e qualificar a Hemorrede Pública Nacional, sob responsabilidade do SINASAN; e (Origem: PRT MS/GM 2543/2014, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de Gestão de Equipamentos. (Origem: PRT MS/GM 2543/2014, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 309. A CAT-Gestão de Equipamentos é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2543/2014, Art. 3º) (com redação dada pela PRT MS/GM 325/2015) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - 4 (quatro) representantes da CGSH/DAHU/SAS/MS; (Origem: PRT MS/GM 2543/2014, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - 1 (um) representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2543/2014, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - 5 (cinco) representantes dos serviços de saúde públicos, preferencialmente vinculados a serviços de hematologia e hemoterapia; e (Origem: PRT MS/GM 2543/2014, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - 3 (três) representantes de instituições de ensino superior público. (Origem: PRT MS/GM 2543/2014, Art. 3º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 2543/2014, Art. 3º, § 1º) (com redação dada pela PRT MS/GM 325/2015) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º A participação das entidades ou órgãos de que tratam os incisos III e IV do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Um dos representantes da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-Gestão de Equipamentos. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas do CAT-Gestão de Equipamentos determina a exclusão do membro, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 5º) (com redação dada pela PRT MS/GM 325/2015) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º A indicação nominal de representantes na CAT-Gestão de Equipamentos será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 2543/2014, Art. 3º, § 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 310. Os membros da CAT-Gestão de Equipamentos promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 2543/2014, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 311. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-Gestão de Equipamentos, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 2543/2014, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 312. Os membros do CAT-Gestão de Equipamentos e os convidados de que trata o art. 311 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 2543/2014, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 15 do Anexo IV ; e (Origem: PRT MS/GM 2543/2014, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo constante do Anexo 16 do Anexo IV . (Origem: PRT MS/GM 2543/2014, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Gestão de Equipamentos, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2543/2014, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Gestão de Equipamentos, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 2543/2014, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 313. A CAT-Gestão de Equipamentos reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 2543/2014, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à coordenação do CAT-Gestão de Equipamentos organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e pelos membros das Comissão. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º A convocação e a organização das reuniões do CAT-Gestão de Equipamentos são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Cabe à coordenação da CAT-Gestão de Equipamentos organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2543/2014, Art. 7º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 314. As despesas de passagens e diárias dos membros e convidados da CAT-Gestão de Equipamentos serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 2543/2014, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 315. As atividades desenvolvidas no âmbito da CAT-Gestão de Equipamentos não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2543/2014, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção III
Da Comissão de Assessoramento Técnico em Gestão Ambiental (CAT-Gestão Ambiental), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 316. Fica instituída a Comissão de Assessoramento Técnico em Gestão Ambiental (CAT-Gestão Ambiental), no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN). (Origem: PRT MS/GM 2545/2014, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 317. A CAT-Gestão Ambiental tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 2545/2014, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - elaborar propostas e propor ações na área de gestão ambiental, visando minimizar as desigualdades regionais, otimizando a aplicação de recursos, preservando o meio ambiente, a saúde da população e a segurança dos trabalhadores; (Origem: PRT MS/GM 2545/2014, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - contribuir com a CGSH/DAHU/SAS/MS no acompanhamento e monitoramento das ações e atividades da área de gestão ambiental, no âmbito dos serviços de hematologia e hemoterapia do Sistema Único de Saúde (SUS), a fim de atender a legislação vigente e qualificar a Hemorrede Pública Nacional, sob responsabilidade do SINASAN; e (Origem: PRT MS/GM 2545/2014, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de gestão ambiental. (Origem: PRT MS/GM 2545/2014, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. As ações de assessoramento para a qualificação técnica e gerencial da Hemorrede a serem desenvolvidas pelo CAT-Gestão Ambiental ocorrerão no âmbito da CGSH/DAHU/SAS/MS e dos serviços de hematologia e hemoterapia públicos. (Origem: PRT MS/GM 2545/2014, Art. 2º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 318. A CAT-Gestão Ambiental é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2545/2014, Art. 3º) (com redação dada pela PRT MS/GM 326/2015) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - 2 (dois) representantes da CGSH/DAHU/SAS/MS; (Origem: PRT MS/GM 2545/2014, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - 1 (um) representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2545/2014, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - 4 (quatro) representantes dos serviços de hematologia e hemoterapia públicos; e (Origem: PRT MS/GM 2545/2014, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - 2 (dois) representantes de instituições de ensino superior público. (Origem: PRT MS/GM 2545/2014, Art. 3º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 2545/2014, Art. 3º, § 1º) (com redação dada pela PRT MS/GM 326/2015) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º A participação das entidades ou órgãos de que tratam os incisos III e IV do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Um dos representantes da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-Gestão Ambiental. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas do CAT-Gestão Ambiental determina a exclusão do membro, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 5º) (com redação dada pela PRT MS/GM 326/2015) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º A indicação nominal de representantes da CAT-Gestão Ambiental será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 2545/2014, Art. 3º, § 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 319. Os membros da CAT-Gestão Ambiental promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultantes de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 2545/2014, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 320. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-Gestão Ambiental, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 2545/2014, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 321. Os membros do CAT-Gestão Ambiental e os convidados de que trata o art. 320 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 2545/2014, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 17 do Anexo IV ; e (Origem: PRT MS/GM 2545/2014, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo constante do Anexo 18 do Anexo IV . (Origem: PRT MS/GM 2545/2014, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Gestão Ambiental, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2545/2014, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Gestão Ambiental, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 2545/2014, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 322. A CAT-Gestão Ambiental reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 2545/2014, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à coordenação do CAT-Gestão Ambiental organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e/ou pelos membros da Comissão. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º A convocação e a organização das reuniões do CAT-Gestão Ambiental são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Cabe à coordenação da CAT-Gestão Ambiental organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 2545/2014, Art. 7º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 323. As despesas de passagens e diárias dos membros e convidados da CAT-Gestão Ambiental serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 2545/2014, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 324. As atividades desenvolvidas no âmbito da CAT-Gestão Ambiental não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2545/2014, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção IV
Da Comissão de Assessoramento Técnico à Política Nacional de Atenção Integral às Pessoas com Doença Falciforme (CAT-Doença Falciforme), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 325. Fica instituída a Comissão de Assessoramento Técnico à Política Nacional de Atenção Integral às Pessoas com Doença Falciforme (CAT-Doença Falciforme), no âmbito do Sistema Nacional de Sangue, Componentes e Hemoderivados (SINASAN). (Origem: PRT MS/GM 158/2015, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 326. A CAT-Doença Falciforme tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 158/2015, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - contribuir e assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS) na implementação da Política Nacional de Atenção Integral às Pessoas com Doença Falciforme; (Origem: PRT MS/GM 158/2015, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - acompanhar as ações e atividades da Política Nacional de Atenção Integral às Pessoas com Doença Falciforme no âmbito do Sistema Único de Saúde (SUS), a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de tratamento e atenção à saúde dos pacientes sob responsabilidade do SINASAN; (Origem: PRT MS/GM 158/2015, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - propor à CGSH/DAHU/SAS/MS a realização de ações e atividades para a Política Nacional de Atenção Integral às Pessoas com Doença Falciforme; (Origem: PRT MS/GM 158/2015, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que dêem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de atenção às pessoas com doença falciforme; e (Origem: PRT MS/GM 158/2015, Art. 2º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - recomendar à CGSH/DAHU/SAS/MS publicações referentes à Política Nacional de Atenção Integral às Pessoas com Doença Falciforme. (Origem: PRT MS/GM 158/2015, Art. 2º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 327. A CAT-Doença Falciforme será composta por representantes, titulares e respectivos suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 158/2015, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - 1 (um) da CGSH/DAHU/SAS/MS; (Origem: PRT MS/GM 158/2015, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - 6 (seis) da área de saúde multiprofissional, com atividades desenvolvidas em serviços do SUS; e (Origem: PRT MS/GM 158/2015, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - 1 (um) de usuários da atenção a essa doença. (Origem: PRT MS/GM 158/2015, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes, titulares e respectivos suplente, serão indicados pelo Secretário de Atenção à Saúde em ato específico (SAS/MS). (Origem: PRT MS/GM 158/2015, Art. 3º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os representantes suplentes substituirão os titulares em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 158/2015, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º O representante da CGSH/DAHU/SAS/MS exercerá a coordenação da CAT-Doença Falciforme. (Origem: PRT MS/GM 158/2015, Art. 3º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º A composição da CAT-Doença Falciforme, titulares e respectivos suplentes, será revista a cada 2 (dois) anos. (Origem: PRT MS/GM 158/2015, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º A CGSH/DAHU/SAS/MS pode sugerir à SAS/MS nomes para composição da CAT-Doença Falciforme, respeitada a composição definida no "caput". (Origem: PRT MS/GM 158/2015, Art. 3º, § 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 6º Aos representantes da CAT-Doença Falciforme referidos no inciso II do "caput" será garantida a renovação de pelo menos um terço dos membros, a cada dois anos. (Origem: PRT MS/GM 158/2015, Art. 3º, § 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 7º A ausência, sem justificativa, a 2 (duas) reuniões consecutivas da CAT-Doença Falciforme determina a exclusão do membro e seu substituto, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 158/2015, Art. 3º, § 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 328. Os membros da CAT-Doença Falciforme promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 158/2015, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 329. Poderão ser convidados, a critérios da CGSH/DAHU/SAS/MS ou da CAT-Doença Falciforme, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 158/2015, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 330. Os membros da CAT-Doença Falciforme e os convidados de que trata o art. 329 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 158/2015, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo do Anexo 19 do Anexo IV ; e (Origem: PRT MS/GM 158/2015, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo do Anexo 20 do Anexo IV . (Origem: PRT MS/GM 158/2015, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Doença Falciforme, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 158/2015, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Doença Falciforme, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 158/2015, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 331. A CAT-Doença Falciforme reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 158/2015, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à coordenação da CAT-Doença Falciforme organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 158/2015, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS ou pelos representantes da CAT-Doença Falciforme. (Origem: PRT MS/GM 158/2015, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º A convocação e a organização das reuniões da CAT-Doença Falciforme são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 158/2015, Art. 7º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Cabe à coordenação da CAT-Doença Falciforme organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 158/2015, Art. 7º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 332. As despesas de passagens e diárias dos membros e convidados da CAT-Doença Falciforme serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 158/2015, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 333. As atividades desenvolvidas no âmbito da CAT-Doença Falciforme não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 158/2015, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção V
Da Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública (CAT-QNHP), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 334. Fica instituída a Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública (CATQNHP), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN). (Origem: PRT MS/GM 475/2015, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 335. A CAT-QNHP tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados do Departamento de Atenção Hospitalar e de Urgência (CGSH/DAHU/SAS/MS), tendo as seguintes atribuições: (Origem: PRT MS/GM 475/2015, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - elaborar proposta à CGSH/DAHU/SAS/MS de estratégias para qualificação técnica e gerencial, visando minimizar as desigualdades regionais, fortalecer o desenvolvimento institucional e o funcionamento da hemorrede pública nacional; (Origem: PRT MS/GM 475/2015, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - contribuir com a CGSH/DAHU/SAS/MS no monitoramento das ações e atividades para o desenvolvimento da Qualificação Técnica e Gerencial da Hemorrede Nacional, incluindo a análise de resultados de avaliações e a proposição de ações para melhoria dos serviços de hematologia e hemoterapia; e (Origem: PRT MS/GM 475/2015, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, manuais, protocolos e diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de qualificação técnica e gerencial da hemorrede. (Origem: PRT MS/GM 475/2015, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 336. A CAT-QNHP é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 475/2015, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - 6 (seis) representantes da CGSH/DAHU/SAS/MS; e (Origem: PRT MS/GM 475/2015, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - 6 (seis) representantes dos serviços de saúde públicos, preferencialmente vinculados aos serviços de hematologia e hemoterapia. (Origem: PRT MS/GM 475/2015, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes serão indicados pela CGSH/DAHU/SAS/MS à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 475/2015, Art. 3º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º A participação das entidades ou órgãos de que trata o inciso II do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 475/2015, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Um dos representantes da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-QNHP. (Origem: PRT MS/GM 475/2015, Art. 3º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas da CAT-QNHP determina a exclusão do membro, cabendo à CGSH/DAHU/SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 475/2015, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º A indicação nominal de representantes na CAT-QNHP será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 475/2015, Art. 3º, § 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 337. Os membros da CAT-QNHP promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria n° 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 475/2015, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 338. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-QNHP, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 475/2015, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 339. Os membros da CAT-QNHP e os convidados de que trata o art. 338 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 475/2015, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 25 do Anexo IV ; e (Origem: PRT MS/GM 475/2015, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo constante do Anexo 26 do Anexo IV . (Origem: PRT MS/GM 475/2015, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe a CAT-QNHP, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 475/2015, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-QNHP, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 475/2015, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 340. A CAT-QNHP reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou por requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 475/2015, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à coordenação da CAT-QNHP organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 475/2015, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e pelos membros da Comissão. (Origem: PRT MS/GM 475/2015, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º A convocação e a organização das reuniões da CATQNHP são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 475/2015, Art. 7º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Cabe à coordenação da CAT-QNHP organizar e divulgar aos seus membros as atas e outros documentos pertinentes às suas atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 475/2015, Art. 7º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 341. As despesas de passagens e diárias dos membros e convidados da CAT-QNHP serão custeadas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 475/2015, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 342. As atividades desenvolvidas no âmbito da CATQNHP não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 475/2015, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção VI
Da Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue (CAT-PDVS), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 343. Fica instituída a Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue (CAT-PDVS), no âmbito do Sistema Nacional de Sangue, Componentes e derivados (SINASAN). (Origem: PRT MS/GM 795/2015, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 344. A CAT-PDVS tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAHU/SAS/MS), tendo ainda as seguintes atribuições: (Origem: PRT MS/GM 795/2015, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - elaborar propostas à CGSH/DAHU/SAS/MS de estratégias voltadas para a promoção da doação voluntária de sangue, como de ações e atividades que visem à captação de doadores; (Origem: PRT MS/GM 795/2015, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - contribuir com a CGSH/DAHU/SAS/MS no acompanhamento e monitoramento das ações, atividades e estratégias para a promoção da doação de sangue no âmbito nacional; e (Origem: PRT MS/GM 795/2015, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - sugerir à CGSH/DAHU/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas, além de capacitações junto à Hemorrede Nacional voltadas para a promoção da doação voluntária de sangue. (Origem: PRT MS/GM 795/2015, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 345. A CAT-PDVS é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 795/2015, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - 1 (um) representante da CGSH/DAHU/SAS/MS; e (Origem: PRT MS/GM 795/2015, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - 6 (seis) representantes dos serviços de saúde públicos, preferencialmente vinculados a serviços de hematologia e hemoterapia, atuantes nas áreas relacionadas à promoção da doação voluntária de sangue nos hemocentros, considerando os setores de captação e comunicação social, dentre outros. (Origem: PRT MS/GM 795/2015, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 795/2015, Art. 3º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º A participação das entidades ou órgãos de que trata o inciso II do "caput" será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 795/2015, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º O representante da CGSH/DAHU/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-PDVS. (Origem: PRT MS/GM 795/2015, Art. 3º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas do CAT-PDVS determina a exclusão do membro, cabendo à SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 795/2015, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º A indicação nominal de representantes na CAT-PDVS será revista a cada 2 (dois) anos, devendo a CGSH/DAHU/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 795/2015, Art. 3º, § 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 346. Os membros da CAT-PDVS promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 795/2015, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 347. Poderão ser convidados, a critério da CGSH/DAHU/SAS/MS ou da CAT-PDVS, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos, mediante ato do Secretário da SAS/MS, após proposta da Comissão. (Origem: PRT MS/GM 795/2015, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 348. Os membros do CAT-PDVS e os convidados de que trata o art. 347 encaminharão as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 795/2015, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 21 do Anexo IV ; e (Origem: PRT MS/GM 795/2015, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo constante do Anexo 22 do Anexo IV . (Origem: PRT MS/GM 795/2015, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-PDVS, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 795/2015, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-PDVS, cabe à CGSH/DAHU/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Hospitalar e de Urgência (DAHU/SAS/MS). (Origem: PRT MS/GM 795/2015, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 349. A CAT-PDVS reunir-se-á por convocação da CGSH/DAHU/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 795/2015, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à coordenação da CAT-PDVS organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 795/2015, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem abordados na pauta serão propostos pela CGSH/DAHU/SAS/MS e pelos membros da Comissão. (Origem: PRT MS/GM 795/2015, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º A convocação e a organização das reuniões da CAT-PDVS são de responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 795/2015, Art. 7º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Cabe à coordenação da CAT-PDVS organizar e divulgar aos seus membros as atas e outros documentos pertinentes às sua atividades, os quais, após assinados pelos participantes, devem ser arquivados sob a responsabilidade da CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 795/2015, Art. 7º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 350. As despesas de passagens e diárias dos membros e convidados da CAT-PDVS serão garantidas pela CGHS/DAHU/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 795/2015, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 351. As atividades desenvolvidas no âmbito da CAT- PDVS não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 795/2015, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção VII
Da Comissão de Assessoramento Técnico em Sangue Raro (CAT-Sangue Raro), no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 352. Fica instituída a Comissão de Assessoramento Técnico em Sangue Raro (CAT-Sangue Raro), no âmbito do Sistema Nacional de Sangue, Componentes e derivados (SINASAN). (Origem: PRT MS/GM 1440/2015, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 353. A CAT-Sangue Raro tem por finalidade assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS), tendo ainda as seguintes atribuições: (Origem: PRT MS/GM 1440/2015, Art. 2º)(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - elaborar e apresentar propostas na área de Hemoterapia à CGSH/DAET/SAS/MS, visando estabelecer ações e mecanismos que garantam a captação e reserva de sangue e componentes com fenótipos raros, bem como sua mobilização para a atenção hemoterápica; (Origem: PRT MS/GM 1440/2015, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - contribuir com a CGSH/DAET/SAS/MS na formulação, avaliação e normatização das atividades relacionadas aos bancos de sangue de hemácias e plaquetas raras, com vistas à estruturação de uma Rede de Bancos de Sangue Raro, no âmbito da Hemorrede Nacional; (Origem: PRT MS/GM 1440/2015, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - contribuir com a CGSH/DAET/SAS/MS no acompanhamento e monitoramento das ações e atividades relacionadas à temática, junto aos serviços de hematologia e hemoterapia do Sistema Único de Saúde (SUS), a fim de atender a legislação vigente e qualificar a Hemorrede Pública Nacional para a oferta dos serviços; e (Origem: PRT MS/GM 1440/2015, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - sugerir à CGSH/DAET/SAS/MS documentos, notas técnicas, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que deem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações voltadas para a assistência hemoterápica qualificada a pacientes que necessitem de sangue raro. (Origem: PRT MS/GM 1440/2015, Art. 2º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 354. A CAT-Sangue Raro é composta por representantes dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1440/2015, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - 2 (dois) representantes da CGSH/DAET/SAS/MS; (Origem: PRT MS/GM 1440/2015, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - 1 (um) representante da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 1440/2015, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - 4 (quatro) representantes dos serviços de hematologia e hemoterapia públicos; (Origem: PRT MS/GM 1440/2015, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - 1 (um) representante da Associação Brasileira de Hematologia, Hemoterapia e Terapia Celular; e (Origem: PRT MS/GM 1440/2015, Art. 3º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - 2 (dois) representantes dos serviços de saúde, pesquisa e/ou ensino, que desenvolvam atividades na área de imuno-hematologia eritrocitária e plaquetária. (Origem: PRT MS/GM 1440/2015, Art. 3º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes serão indicados pelos dirigentes de seus respectivos órgãos e entidades à Secretaria de Atenção à Saúde (SAS/MS). (Origem: PRT MS/GM 1440/2015, Art. 3º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º A participação das entidades ou órgãos de que trata o inciso II a V será formalizada após resposta a convite a elas encaminhado pelo Secretário da SAS/MS, com indicação dos seus respectivos representantes. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Um dos representantes da CGSH/DAET/SAS/MS, designado por ato específico do Secretário de Atenção à Saúde, exercerá a coordenação da CAT-Sangue Raro. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º A ausência, sem justificativa, a duas reuniões consecutivas da CAT-Sangue Raro, determina a exclusão do membro, cabendo à CGSH/DAET/SAS/MS providenciar nova representação do órgão ou entidade. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º A indicação nominal de representantes na CAT-Sangue Raro será revista a cada 2 (dois) anos, devendo a CGSH/DAET/SAS/MS sugerir à SAS/MS a indicação nominal de novos representantes. (Origem: PRT MS/GM 1440/2015, Art. 3º, § 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 355. Os membros da CAT-Sangue Raro promoverão a cessão de direitos autorais para publicações e divulgação de todo material técnico resultante de trabalhos desenvolvidos pela Comissão, oriundos de interesse do Ministério da Saúde ou de demanda espontânea, na forma definida pela Portaria nº 612/GM/MS, de 26 de março de 2009. (Origem: PRT MS/GM 1440/2015, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 356. Poderão ser convidados, a critério da CGSH/DAET/SAS/MS ou da CAT-Sangue Raro, especialistas "ad hoc" para participarem de discussões técnicas, elaboração de documentos e orientações sobre temas afins, podendo ser criados Grupos de Trabalho específicos. (Origem: PRT MS/GM 1440/2015, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 357. Os membros da CAT-Sangue Raro e os convidados devem encaminhar as seguintes declarações, quando de seu ingresso na Comissão: (Origem: PRT MS/GM 1440/2015, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo constante do Anexo 23 do Anexo IV ; e (Origem: PRT MS/GM 1440/2015, Art. 6º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo constante do Anexo 24 do Anexo IV . (Origem: PRT MS/GM 1440/2015, Art. 6º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse de qualquer dos representantes, cabe à CAT-Sangue Raro, por maioria simples, avaliar a conveniência ou não da manutenção do representante na Comissão, temporária ou permanentemente, com posterior comunicação do ato ao interessado e à CGSH/DAHU/SAS/MS. (Origem: PRT MS/GM 1440/2015, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da CAT-Sangue Raro, cabe à CGSH/DAET/SAS/MS efetuar a imediata retirada do representante da Comissão, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 1440/2015, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 358. A CAT-Sangue Raro reunir-se-á por convocação da CGSH/DAET/SAS/MS ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 1440/2015, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à coordenação da CAT-Sangue Raro organizar a pauta e coordenar as reuniões. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem abordados na pauta devem ser propostos pela CGSH/DAET/SAS/MS e pelos membros das Comissão. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º A convocação e a organização das reuniões da CAT- Sangue Raro são de responsabilidade da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º Cabe à coordenação da CAT-Sangue Raro organizar e divulgar aos seus membros as atas e outros documentos pertinentes às suas atividades, os quais, após assinados pelos participantes, devem ser arquivadas sob a responsabilidade da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 1440/2015, Art. 7º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 359. As despesas de passagens e diárias dos membros e convidados da CAT-Sangue Raro serão custeadas pela CGSH/DAET/SAS/MS, quando relacionadas com as atividades da Comissão. (Origem: PRT MS/GM 1440/2015, Art. 8º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 360. As atividades desenvolvidas no âmbito da CAT-Sangue Raro não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 1440/2015, Art. 9º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Seção VIII
Da Comisssão de Assessoramento Técnico às Talassemias (CAT-Talassemias)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 361. Fica instituída, no âmbito do Sistema Nacional de Sangue, Componentes e Derivados (SINASAN), a Comissão de Assessoramento Técnico às Talassemias. (Origem: PRT MS/GM 2612/2012, Art. 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. Para fins desta Seção, a Comissão de Assessoramento Técnico às Talassemias doravante será denominada CAT-Talassemias. (Origem: PRT MS/GM 2612/2012, Art. 1º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 362. A CAT-Talassemias tem por finalidades: (Origem: PRT MS/GM 2612/2012, Art. 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - contribuir e assessorar tecnicamente a Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada e Temática, da Secretaria de Atenção à Saúde, do Ministério da Saúde (CGSH/DAET/SAS/MS) na formulação da política nacional para atenção às pessoas com Talassemias; (Origem: PRT MS/GM 2612/2012, Art. 2º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - acompanhar as ações e atividades do Programa Nacional de Talassemias, no âmbito do Sistema Único de Saúde (SUS), a fim de contribuir com o aperfeiçoamento do gerenciamento de ações de tratamento e atenção à saúde dos pacientes, sob responsabilidade do SINASAN; (Origem: PRT MS/GM 2612/2012, Art. 2º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - propor à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) políticas, ações e atividades para o referido Programa Nacional de Talassemias, elaborar documentos, pareceres, recomendações, manuais, protocolos, diretrizes, condutas e rotinas que dêem sustentabilidade, segurança e resolutividade ao desenvolvimento das ações de atenção às pessoas com Talassemias; (Origem: PRT MS/GM 2612/2012, Art. 2º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
IV - recomendar à CGSH/DAET/SAS/MS publicações referentes ao Programa Nacional de Talassemias; e (Origem: PRT MS/GM 2612/2012, Art. 2º, IV) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
V - instituir Grupos de Trabalho para o desenvolvimento de atividades específicas relacionadas ao cumprimento de suas finalidades. (Origem: PRT MS/GM 2612/2012, Art. 2º, V) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 363. A CAT-Talassemias é composta por representantes, titular e suplente: (Origem: PRT MS/GM 2612/2012, Art. 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - um representante da CGSH/DAET/SAS/MS, que a coordenará; (Origem: PRT MS/GM 2612/2012, Art. 3º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - sete representantes da área de hematologia clínica com ênfase em Talassemias, com atividades desenvolvidas em serviços do Sistema Único de Saúde; (Origem: PRT MS/GM 2612/2012, Art. 3º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
III - um representante dos usuários da atenção às Talassemias, sendo substituído, em sua ausência, por seu suplente. (Origem: PRT MS/GM 2612/2012, Art. 3º, III) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Os representantes de que tratam os incisos I, II e III do caput serão indicados pela Secretaria de Atenção à Saúde (SAS/MS) à Coordenação da Comissão. (Origem: PRT MS/GM 2612/2012, Art. 3º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º A indicação nominal de representantes na CAT-Talassemias citados no caput deve ser revista a cada dois anos, devendo a CGSH/DAET/SAS/MS sugerir à SAS a indicação nominal desses representantes. (Origem: PRT MS/GM 2612/2012, Art. 3º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Para os fins do art. 363, § 2º , a substituição dos membros de que trata o inciso II do caput não poderá ser superior a um terço dos citados representantes. (Origem: PRT MS/GM 2612/2012, Art. 3º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 364. A participação na CAT-Talassemias é considerada como de relevante interesse público, não será remunerada e não terá ressarcimento pecuniário ou de qualquer outra natureza pelos trabalhos desenvolvidos, inclusive publicações técnicas, manuais, protocolos, entre outras publicações técnicas. (Origem: PRT MS/GM 2612/2012, Art. 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. A CAT-Talassemias poderá convidar entidades ou pessoas do setor público e privado que atuem profissionalmente em atividades relacionadas ao tema sempre que entender necessária a sua colaboração para o pleno alcance das suas finalidades. (Origem: PRT MS/GM 2612/2012, Art. 4º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 365. Os membros da CAT-Talassemias devem subscrever as seguintes declarações por ocasião do início de suas atividades na Comissão: (Origem: PRT MS/GM 2612/2012, Art. 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
I - declaração de conflito de interesse, conforme modelo do Anexo 13 do Anexo IV ; e (Origem: PRT MS/GM 2612/2012, Art. 5º, I) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
II - declaração de confidencialidade, conforme modelo do Anexo 14 do Anexo IV . (Origem: PRT MS/GM 2612/2012, Art. 5º, II) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Em caso de conflito de interesse por qualquer dos membros das Comissões, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) avaliar a conveniência ou não da manutenção do representante na Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 2612/2012, Art. 5º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Em caso de quebra de confidencialidade por qualquer dos membros da Comissão, sejam titulares ou suplentes, cabe à Coordenação-Geral de Sangue e Hemoderivados (CGSH/DAET/SAS/MS) efetuar a imediata retirada do representante da Comissão, de forma motivada, com posterior comunicação do ato ao interessado e ao Diretor do Departamento de Atenção Especializada e Temática (DAET/SAS/MS). (Origem: PRT MS/GM 2612/2012, Art. 5º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 366. A CAT-Talassemias reunir-se-á por convocação da Coordenação ou a requerimento da maioria simples de seus membros. (Origem: PRT MS/GM 2612/2012, Art. 6º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 1º Compete à CGSH/DAET/SAS/MS a convocação dos membros, a organização das reuniões, a elaboração e a divulgação da pauta e atas de reunião e o arquivo dos documentos elaborados. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 2º Os temas a serem incluídos na pauta de reunião serão propostos pela CGSH/DAET/SAS/MS ou pelos membros da comissão. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 3º Os suplentes devem substituir os titulares na ausência destes nas reuniões. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 3º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 4º O Ministério da Saúde custeará despesas de passagens e diárias para participação de membros ou convidados nas reuniões da CAT-Talassemias ou a participação de seus membros em eventos, ações e atividades de interesse da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 4º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
§ 5º Cabe ao representante da CGSH/DAET/SAS/MS organizar e divulgar aos membros da comissão as atas e outros documentos pertinentes às atividades da CAT-Talassemias, os quais, após assinados pelos participantes, devem ser arquivados, sob a responsabilidade da CGSH/DAET/SAS/MS. (Origem: PRT MS/GM 2612/2012, Art. 6º, § 5º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Art. 367. A ausência do titular ou suplente, sem justificativa, a duas reuniões consecutivas da CAT-Talassemias acarretará a sua exclusão. (Origem: PRT MS/GM 2612/2012, Art. 7º) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Parágrafo Único. Compete à CGSH/DAET/SAS/MS adotar as providências necessárias para o cumprimento do disposto neste artigo, efetivando a indicação de novo representante para recompor a Comissão. (Origem: PRT MS/GM 2612/2012, Art. 7º, Parágrafo Único) (Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
TÍTULO III
DO FORNECIMENTO DE SANGUE E HEMOCOMPONENTES NO SISTEMA ÚNICO DE SAÚDE (SUS)
Art. 368. O sangue e os hemocomponentes obtidos pelo SUS, diretamente nos serviços públicos ou em serviços privados contratados, serão destinados prioritariamente ao atendimento de usuários do próprio SUS. (Origem: PRT MS/GM 1737/2004, Art. 1º)
§ 1º Os serviços públicos de hemoterapia do SUS deverão ser capacitados e estruturados para atender integralmente à demanda de fornecimento de hemocomponentes para o próprio SUS. (Origem: PRT MS/GM 1737/2004, Art. 1º, § 1º)
§ 2º A contratação pelo SUS de serviços privados de hemoterapia para complementação da rede pública somente será admitida quando comprovada pelo gestor local a insuficiência dos serviços públicos, devendo ser autorizada pelos respectivos Conselhos Estaduais/Municipais de Saúde, ouvido o coordenador estadual da hemorrede. (Origem: PRT MS/GM 1737/2004, Art. 1º, § 2º)
§ 3º Os gestores estaduais e municipais deverão reavaliar a necessidade de manutenção dos contratos com serviços privados, bem como a respectiva programação físico-orçamentária dos serviços privados contratados, limitando-a ao estritamente necessário ao atendimento da demanda do SUS não absorvida pelos serviços de hemoterapia da rede pública, submetendo-a à aprovação do respectivo Conselho de Saúde, conforme Sistema Estadual de Sangue, Componentes e Derivados. (Origem: PRT MS/GM 1737/2004, Art. 1º, § 3º)
Art. 369. Os serviços de hemoterapia públicos ou privados contratados pelo SUS poderão fornecer sangue e hemocomponentes destinados a pacientes e serviços assistenciais privados nas seguintes hipóteses: (Origem: PRT MS/GM 1737/2004, Art. 2º)
I - quando a rede assistencial do SUS não possuir demanda para a utilização de todos os hemocomponentes produzidos e tiver sido garantida a manutenção no serviço de hemoterapia de um estoque mínimo de segurança; (Origem: PRT MS/GM 1737/2004, Art. 2º, I)
II - em situação de emergência, calamidade pública ou outra necessidade imprevisível, devidamente atestada pelo gestor público responsável; ou (Origem: PRT MS/GM 1737/2004, Art. 2º, II)
III - quando houver a necessidade de sangue ou hemocomponente raro. (Origem: PRT MS/GM 1737/2004, Art. 2º, III)
§ 1º O estoque mínimo referido no inciso I deste artigo será definido pelo gestor estadual ou municipal do SUS em conjunto com as direções de cada um dos serviços de hemoterapia e aprovação do Conselho Estadual ou Municipal de Saúde. (Origem: PRT MS/GM 1737/2004, Art. 2º, § 1º)
§ 2º Em qualquer caso, deverá existir um estoque mínimo de segurança para cada espécie de hemocomponente a ser definido pelo responsável técnico do serviço de hemoterapia baseado na média mensal de utilização desse hemocomponente na rede do SUS nos últimos 6 (seis) meses. (Origem: PRT MS/GM 1737/2004, Art. 2º, § 2º)
Art. 370. O fornecimento de hemocomponentes por serviços públicos de hemoterapia a outros serviços, de hemoterapia ou assistenciais, deverá ocorrer mediante a celebração de contrato/convênio estabelecido entre o Gestor Estadual do SUS e o Serviço de Hemoterapia Público Estadual e deste com o interessado, e que: (Origem: PRT MS/GM 1737/2004, Art. 3º)
I - seja reproduzido o disposto no art. 369; (Origem: PRT MS/GM 1737/2004, Art. 3º, I)
II - sejam introduzidos controles para a rastreabilidade das bolsas de hemocomponentes fornecidas, especialmente, para a identificação do paciente em que foi transfundida e a natureza de seu vínculo com a instituição (SUS, saúde suplementar ou assistência particular); e (Origem: PRT MS/GM 1737/2004, Art. 3º, II)
III - sejam estipuladas sanções, inclusive pecuniárias, para o não fornecimento de informações sobre o destino das bolsas de hemocomponentes, ou informações incorretas e/ou incompletas conforme o previsto no art. 371, § 3º . (Origem: PRT MS/GM 1737/2004, Art. 3º, III)
Parágrafo Único. A Secretaria de Atenção à Saúde (SAS/MS), por meio do Departamento de Atenção Especializada e Temática (DAET/SAS/MS), definirá regras específicas a serem observadas nos contratos ou convênios de fornecimento de hemocomponentes. (Origem: PRT MS/GM 1737/2004, Art. 3º, Parágrafo Único)
Art. 371. Os custos referentes à coleta, ao processamento, à realização de exames de triagem incorridos pelo SUS na obtenção dos hemocomponentes fornecidos a serviços de hemoterapia ou assistenciais para aplicação em pacientes privados, inclusive da saúde suplementar, serão ressarcidos ao Fundo Estadual ou Municipal de Saúde, da seguinte forma: (Origem: PRT MS/GM 1737/2004, Art. 4º)
I - em serviço de hemoterapia da administração pública, onde existam mecanismos de ressarcimento direto, esse deve ser feito ao serviço fornecedor; e (Origem: PRT MS/GM 1737/2004, Art. 4º, I)
II - os procedimentos referentes à produção dos hemocomponentes em questão não serão faturados ao SUS. (Origem: PRT MS/GM 1737/2004, Art. 4º, II)
§ 1º Caberá à Agência Nacional de Saúde Suplementar (ANS), à Agência Nacional de Vigilância Sanitária (ANVISA) e à Secretaria de Atenção à Saúde (SAS), do Ministério da Saúde, definir os valores e a forma de identificação dos procedimentos a serem ressarcidos. (Origem: PRT MS/GM 1737/2004, Art. 4º, § 1º)
§ 2º Os serviços de saúde que atendam a pacientes do SUS e a pacientes privados, inclusive da saúde suplementar, deverão manter estrito controle do destino das bolsas de hemocomponentes recebidas de serviços de hemoterapia do SUS, sejam públicos ou privados contratados, devendo, para tanto: (Origem: PRT MS/GM 1737/2004, Art. 4º, § 2º)
I - mensalmente, em data a ser fixada pelo gestor estadual ou municipal, apresentar à Secretaria de Saúde, ao órgão local da vigilância sanitária e ao serviço de hemoterapia fornecedor demonstrativo que indique, para cada hemocomponente, o saldo inicial do seu estoque no mês, as bolsas recebidas, as bolsas transfundidas por categoria de paciente (SUS, saúde suplementar e particular), as bolsas descartadas e o saldo final; e (Origem: PRT MS/GM 1737/2004, Art. 4º, § 2º, I)
II - fornecer aos mesmos órgãos ou instituições mencionados no inciso I deste parágrafo relação nominal dos pacientes que receberam as bolsas de hemocomponentes. (Origem: PRT MS/GM 1737/2004, Art. 4º, § 2º, II)
§ 3º Na hipótese de não fornecimento dos demonstrativos e relatórios mencionados no § 2º, o gestor estadual ou municipal deverá adotar providências para imediata auditoria e fiscalização no serviço de saúde inadimplente, adotando as medidas para o ressarcimento e aplicação das sanções mencionadas no art. 370, III. (Origem: PRT MS/GM 1737/2004, Art. 4º, § 3º)
Art. 372. Os serviços de hemoterapia privados contratados pelo SUS deverão transferir ao serviço de hemoterapia público designado pelo gestor estadual ou municipal do SUS os concentrados de hemácias e sangue total produzidos e não utilizados na assistência a pacientes do SUS, com o prazo de 7 (sete) dias antes do seu vencimento. (Origem: PRT MS/GM 1737/2004, Art. 5º) (com redação dada pela PRT MS/GM 373/2005)
Parágrafo Único. Com relação ao plasma, os serviços de hemoterapia privados contratados pelo SUS deverão observar o disposto na Resolução da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária nº 73, de 3 de agosto de 2000. (Origem: PRT MS/GM 1737/2004, Art. 5º, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 373/2005)
Art. 373. O serviço de hemoterapia ou de assistência à saúde que cobre de seus pacientes ou das instituições de saúde suplementar qualquer custo pelo fornecimento ou transfusão de bolsas de sangue e hemocomponentes deverá informar ao paciente o custo específico dos insumos, materiais, exames laboratoriais, sorológicos, de ácidos nucléicos e imunoematológicos incorridos, bem como dos honorários por serviços médicos, conforme o previsto no artigo 2º, parágrafo único, da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 1737/2004, Art. 6º)
Parágrafo Único. No caso da bolsa de sangue ou hemocomponente ser originária de serviço de hemoterapia do SUS, inclusive contratado, o paciente deverá ser informado do custo assumido perante o poder público, além dos demais itens mencionados no caput deste artigo, acrescidos na própria instituição, se for o caso. (Origem: PRT MS/GM 1737/2004, Art. 6º, Parágrafo Único)
TÍTULO IV
DOS CRITÉRIOS PARA A HABILITAÇÃO DOS ESTABELECIMENTOS DE HEMOTERAPIA PARA REALIZAÇÃO DO PROCEDIMENTO TESTES DE ÁCIDOS NUCLEICOS EM AMOSTRAS DE SANGUE NA TRIAGEM DE DOADOR
Art. 374. Ficam definidos os seguintes critérios para que os estabelecimentos de hemoterapia sejam habilitados como Sítios Testadores NAT: (Origem: PRT MS/GM 2264/2014, Art. 1º)
I - centralização de maior quantitativo de amostras processadas; (Origem: PRT MS/GM 2264/2014, Art. 1º, I)
II - maior número de doações; (Origem: PRT MS/GM 2264/2014, Art. 1º, II)
III - melhor acesso logístico regional; (Origem: PRT MS/GM 2264/2014, Art. 1º, III)
IV - critérios epidemiológicos e sanitários regionais; (Origem: PRT MS/GM 2264/2014, Art. 1º, IV)
V - área física disponível para os equipamentos da plataforma NAT; (Origem: PRT MS/GM 2264/2014, Art. 1º, V)
VI - sistema informatizado que permita transcrição automática dos resultados; e (Origem: PRT MS/GM 2264/2014, Art. 1º, VI)
VII - profissionais capacitados para realização do NAT. (Origem: PRT MS/GM 2264/2014, Art. 1º, VII)
ANEXO 1 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Doenças (Origem: PRT MS/GM 158/2016, Anexo 1)
ANEXO I
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - DOENÇAS
| A - PRINCIPAIS CAUSAS DE INAPTIDÃO DEFINITIVA PARA DOAÇÃO DE SANGUE | ||
| Alcoolismo crônico | ||
| Anafilaxia (choque anafilático) | ||
| Antecedentes de acidente vascular cerebral (AVC) | ||
| Bronquite e asma (crises com intervalos de 3 meses ou menos, sem controle com medicamentos por via inalatória) | ||
| Babesiose | ||
| Blastomicose sistêmica | ||
| Câncer (inclusive leucemia). Antecedentes de carcinoma in situ de cérvix uterina e de carcinoma basocelular de pele não impedem a doação de sangue | ||
| Doença cardiovascular grave. Especial atenção para doença coronariana, angina, arritmia cardíaca grave, insuficiência cardíaca, doença valvular, aneurismas, má formações arteriovenosas, endocardite com sequela, miocardite com sequela, trombose arterial, trombose venosa recorrente e trombofilia. | ||
| Diabetes tipo I, diabetes tipo II, insulino-dependente. | ||
| Doença de Chagas | ||
| Doenças autoimunes que comprometam mais de um órgão. Por exemplo: lúpus eritematoso sistêmico, tireoidites imunes, artrite reumatoide, etc. | ||
| Doença pulmonar grave: especial atenção à enfisema, doença pulmonar obstrutiva crônica (DPOC), história de embolia pulmonar | ||
| Doenças endócrinas: hiperaldosteronismo, hiperfunção hipofisária, hiperlipoproteinemias essenciais, hipertireoidismo, hipopituitarismo, insuficiência suprarrenal, síndrome de Cushing | ||
| Doenças gastrointestinais: cirrose hepática, retocolite ulcerativa crônica, doença de Crohn, hepatopatia crônica de origem desc onhecida, hipertensão porta, pancreatite crônica | ||
| Doenças neurológicas: esclerose em placa, esclerose lateral amiotrófica, esclerose múltipla, hematoma extra ou subdural com sequela, leucoencefalopatia multifocal progressiva, neurofibromatose forma maior, miastenia gravis | ||
| Doença renal crônica | ||
| Doenças hemorrágicas congênitas ou adquiridas | ||
| Doença de Creustzfeldt Jakob (vaca louca) ou histórico familiar de encefalopatia espongiforme humana e suas variantes, transplante de córnea e implante a base de dura-matér | ||
| Elefantíase (filariose) | ||
| Esquistossomose hepatoesplênica | ||
| Feocromocitoma | ||
| Hanseníase | ||
| Hepatite viral após 11 anos de idade (exceto para caso de comprovação de hepatite A aguda com IgM reagente, a época do diagnóstico clínico) | ||
| Infecção por HBV, HCV, HIV, HTLV I/II | ||
| Intoxicações por metais pesados | ||
| Leishmaniose visceral (Calazar) | ||
| Malária (Febre quartã - Plasmodium malarie) | ||
| Doença psiquiátrica que gere inimputabilidade jurídica (incapacidade) | ||
| Pênfigo foliáceo | ||
| Psoríase extensa ou com outras manifestações associadas | ||
| Reação adversa grave em doação anterior | ||
| Tuberculose extrapulmonar |
| B. PRINCIPAIS CAUSAS DE INAPTIDÃO TEMPORÁRIA PARA A DOAÇÃO DE SANGUE | ||
| Causas de inaptidão temporária | Tempo de inaptidão | |
| Atraso menstrual em mulheres em idade fértil | Até que se afaste a possibilidade de gravidez ou de outro problema que impeça a doação | |
| Adenomegalia a esclarecer | Avaliação caso a caso | |
| Alergias (tratamento de dessensibilização) | 3 dias após o fim do tratamento | |
| Alergias (urticária, rinite, dermatite e outras) | Na fase aguda e durante o tratamento | |
| Blastomicose pulmonar | 5 | anos depois da cura |
| Brucelose | 1 | ano após o tratamento ou 8 semanas após a potencial exposição |
| Caxumba | 3 | semanas após a cura |
| Citomegalovírus | 3 | meses após desaparecimento dos sintomas |
| Cólera | 3 | meses após a cura |
| Conjuntivite | 1 | semana após a cura |
| Dengue | 4 | semanas após a cura |
| Dengue hemorrágico | 6 | meses após a cura |
| Diarreia | 1 | semana após a cura |
| Epilepsia | 3 anos após suspensão do tratamento e sem relato de crise convulsiva | |
| Erisipela | 2 | semanas após a cura |
| Gripes ou resfriados | 1 | semana após cessarem os sintomas |
| Herpes simplex genital, Herpes simplex oral, etc. | Após o desaparecimento das lesões | |
| Herpes Zoster | 6 | meses após desaparecimento de sintomas |
| Infecções bacterianas comuns não complicadas (por exemplo: sinusite, amigdalite, otite, infecção urinária baixa) | 2 semanas após o fim do tratamento | |
| Leptospirose | 3 | meses após a cura |
| Lesões de pele no local da punção venosa | Até a cura | |
| Lesões dermatológicas: eritema polimorfo, eritrodermias, líquen plano | 6 meses após a cura | |
| Meningite infecciosa | 6 | meses após a cura |
| Mononucleose infecciosa | 6 | meses após a cura |
| Osteomielite aguda | 2 | meses após a cura |
| Osteomielite crônica | Definitivo | |
| Pericardite infecciosa (exceto tuberculosa) | 12 meses após a cura | |
| Pielonefrite | 1 | mês após a cura |
| Piercing, tatuagem ou maquiagem definitiva | 6 meses após realização; 12 meses se não houver condição de avaliação da segurança do procedimento realizado; se na cavidade oral e/ou na região genital, devido ao risco permanente de infecção, a inaptidão é de 12 meses da retirada. | |
| Rubéola | 2 | semanas após a cura |
| Retirada de verrugas, unhas, manchas e outros pequenos procedimentos dermatológicos | Após a cicatrização | |
| Síndrome vestibular periférica (labirintite) | 30 dias após a crise e sem uso de medicamento | |
| Sífilis | 12 meses o tratamento | |
| Tromboflebite isolada | 6 | meses após a cura |
| Toxoplasmose comprovada laboratorialmente | 1 | ano após a cura |
| Tuberculose pulmonar | 5 | anos depois da cura |
| Ulcera péptica | 12 meses após a cura | |
| Varicela | 3 | semanas após a cura |
ANEXO 2 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Cirurgias e Procedimentos Invasivos (Origem: PRT MS/GM 158/2016, Anexo 2)
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - CIRURGIAS E PROCEDIMENTOS INVASIVOS
| A - PRINCIPAIS CIRURGIAS E SUA CORRELAÇÃO COM A DOAÇÃO DE SANGUE | |
| Cirurgias | Tempo de inaptidão |
| Cirurgia cardíaca | Definitivo |
| Gastrectomia total | Definitivo |
| Pneumectomia ou lobectomia | Definitivo |
| Esplenectomia | Definitivo, exceto se for pós-trauma |
| Cirurgias de miopia ou catarata | Após alta oftalmológica |
| Nefrolitotomia extracorpórea | 1 mês |
| Apendicectomia | 3 meses |
| Hemorroidectomia | |
| Hernioplastia | |
| Ressecção de varizes | |
| Cirurgia plástica sob anestesia local | |
| Amigdalectomia | |
| Colecistectomia | 6 meses |
| Vagotomia super-seletiva | |
| Histerectomia | |
| Laminectomia | |
| Artrodese de coluna | |
| Tireoidectomia | |
| Nódulo de mama | |
| Cirurgia plástica sob anestesia com bloqueio peridural ou raquimedular ou geral | |
| Ortopédicas em geral | |
| Cirurgia de politrauma | 12 meses |
| Colectomia | |
| Esplenectomia pós-trauma | |
| Nefrectomia | |
| Ressecção de aneurisma | |
| Procedimentos endoscópicos inclusive cirurgias laparoscópicas | 6 meses |
| B - CIRURGIAS E PROCEDIMENTOS ODONTOLÓGICOS | |
| Tratamento de canal, drenagem de abscesso, gengivites e cirurgias com anestesia local | 1 semana após o procedimento ou uma semana após o término do anti-inflamatório e/ou do antibiótico |
| Extração dentária | 7 dias após o procedimento |
| Procedimentos sem anestesia e sangramento (por exemplo: pequenas cáries e ajuste de aparelhos) | 1 dia após o procedimento |
| Remoção de tártaro e outros procedimentos com anestesia local (por exemplo: obturações) | 3 dias após o procedimento |
| Cirurgias odontológicas com anestesia geral | 1 mês após o término do tratamento |
ANEXO 3 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Medicamentos (Origem: PRT MS/GM 158/2016, Anexo 3)
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - MEDICAMENTOS
| PRINCIPAIS MEDICAMENTOS E SUA CORRELAÇÃO COM A DOAÇÃO DE SANGUE | |
| Medicamento | Tempo de inaptidão |
| Antibióticos e quimioterápicos antibacterianos ou antifúngicos | Temporário de acordo com a vida média da droga |
| Corticosteroides sistêmicos | Depende da doença para a qual foi utilizado. Inaptidão mínima de 48 horas após a suspensão |
| Corticosteroides tópicos | Só contraindicam a doação se a doença de base o fizer |
| Anticoagulantes | 10 dias após a interrupção do medicamento |
| Anticonvulsivantes | Enquanto estiver usando o medicamento |
| Analgésicos: paracetamol, dipirona sódica ou similares | Não contraindicam a doação, mesmo que tenham sido utilizados no dia da doação |
| Anorexígenos | 7 dias após a interrupção do medicamento |
| Anti-inflamatórios: ácido acetilsalicílico, diclo-fenacos, meloxicam, piroxicam, fenilbutazona, etc. (com efeito na função plaquetária) | Não contraindicam a doação, porém não deve ser preparado concentrado de plaquetas a partir daquela doação, se o remédio foi usado nos últimos 3 dias |
| ANTI-HIPERTENSIVOS E OUTROS MEDICAMENTOS CARDIOLÓGICOS | |
| Medicamento | Tempo de inaptidão |
| Ação Central: metildopa, clonidina, reserpina | 48 horas após a suspensão do medicamento pelo médico assistente e avaliado caso a caso |
| Beta-bloqueadores: propranolol, atenolol, oxprenolol ou similares | |
| Bloqueadores alfa-adrenérgicos: prazosina, etc. | |
| Diuréticos | Não há contraindicação. Orientar o doador a fazer uma hidratação oral prévia mais rigorosa |
| Inibidores de enzima conversora de angiotensina: captopril, enalapril, etc. | Não há contraindicação |
| Antagonistas de angiotensina II: losartana, etc. | |
| Bloqueadores de canais de cálcio: nifedipina, etc. | |
| Vasodilatadores: hidralazina, minoxidil,etc. | 5 dias após a suspensão do remédio |
| Antiarrítmicos: amiodarona, etc. | Enquanto estiver usando o medicamento |
| MEDICAMENTOS PSIQUIÁTRICOS | |
| Medicamento | Tempo de inaptidão |
| Antidepressivos | Não contraindicam a doação, porém o doador deve ser avaliado pelo médico. |
| Antipsicóticos: haloperidol, clorpromazina, etc | 7 dias após a suspensão do medicamento pelo médico assistente e avaliado caso a caso |
| Ansiolíticos e soníferos | Só contraindicam a doação se a dose for elevada |
| HORMÔNIOS E ANTIMETABÓLICOS | |
| Medicamento | Tempo de inaptidão |
| Hormônio do crescimento hipofisário humano | Definitivo |
| Hormônio gonadotrófico hipofisário humano | |
| Hormônio do crescimento recombinante | Não há contraindicação |
| Anticoncepcionais | |
| Testosterona | 6 meses após a suspensão da medicação |
| Danazol | 6 meses após a suspensão da medicação |
| Hormônios femininos | Não há contraindicação, a menos que estejam sendo usados para tratamento do câncer |
| Outros hormônios hipofisários recombinantes | Depende do motivo pelo qual o medicamento foi usado |
| Antitireoidianos de síntese: propiltiouracila, tiamazol, etc. | Avaliação caso a caso |
| Anticolesterolinemicos: clofibrato, estatinas, etc | Não contraindicam a doação a menos que estejam sendo usados para tratamento de hiperlipidemia familiar |
| MEDICAMENTOS TERATOGÊNICOS | |
| Medicamento | Tempo de inaptidão |
| Isotretinoína | 1 mês de inaptidão após a última dose |
| Finasterida | 1 mês após a interrupção do medicamento |
| Dutasterida | 6 meses após a interrupção do medicamento |
| Acitretina | 3 anos após a interrupção do medicamento |
| Etretionato | Inaptidão definitiva |
ANEXO 4 DO ANEXO IV
Tabela de Triagem Clínica de Doadores de Sangue - Vacinas (Origem: PRT MS/GM 158/2016, Anexo 4)
TABELA DE TRIAGEM CLÍNICA DE DOADORES DE SANGUE - VACINAS
| PRINCIPAIS VACINAS E SUA CORRELAÇÃO COM A DOAÇÃO DE SANGUE | |
| Vacinas de vírus ou bactérias vivos e atenuados | |
| Vacina | Tempo de inaptidão |
| Pólio oral (Sabin) | 4 semanas |
| Febre tifóide oral | |
| Caxumba (Parotidite) | |
| Tríplice viral [Caxumba (Parotidite), Sarampo e Rubéola] | |
| Dupla viral (Sarampo e Rubéola) | |
| Febre amarela | |
| Sarampo | |
| BCG | |
| Rubéola | |
| Varicela (Catapora)/Herpes zoster | |
| Varíola* | |
| Rotavírus | |
| Influenza | |
| Outras vacinas produzidas a partir de micro-organismos vivos ou atenuados contra infecções não relacionadas acima deverão obedecer ao tempo de inaptidão de 4 semanas, ou outras recomendações dos fabricantes. | |
| * Doença erradicada. No entanto, manter esta restrição por situações excepcionais. | |
| Vacinas de vírus ou bactérias inativados, toxoides ou recombinantes | |
| Vacina | Tempo de inaptidão |
| Cólera | 48 horas |
| Pólio (Salk) | |
| Dupla do tipo adulto - dT(Difteria e Tétano) | |
| DTPa (Difteria,Tétano e Coqueluche acelular) | |
| Tetra (Difteria,Tétano, Coqueluche e Hemophillus influenzae do tipo b) | |
| Tétano | |
| Febre tifoide (injetável) | |
| Meningite | |
| Coqueluche | |
| Peste | |
| Pneumococo | |
| Leptospirose | |
| Brucelose | |
| Hemophillus influenzae do tipo b, hepatite A | |
| Hepatite B recombinante | |
| HPV (Human Papiloma Vírus) | |
| Influenza | |
| Vacina Antirrábica (vacina inativada proveniente de cultivos celulares) | 48 horas 12 (doze) meses se após exposição animal |
| Outras vacinas produzidas a partir de micro-organismos inativados, toxoides ou recombinantes contra infecções não relacionadas acima, deverão obedecer ao tempo de inaptidão de 48 horas, ou outras recomendações dos fabricantes. | |
| Imunoterapia passiva | |
| Soro | Tempo de inaptidão |
| Imunoterapia passiva heteróloga (soro) | 4 semanas |
| Imunoterapia passiva homóloga (soro humano) | 1 ano |
| Observações: | |
| Vacinação para hepatite A (inativada) e B (recombinante) considerar inapto por 48 horas, se não relacionado com exposição ao vírus. No caso de utilização de vacinas em situação de bloqueio de surto, o período de inaptidão estará relacionado com o período de incubação da doença. Em caso de indivíduos que estejam participando de estudos clínicos para vacinas considerar inapto por 1 (um) ano após o término do protocolo de vacinação. | |
| No caso de uso de vacinas que ainda estejam em processo de registro, considerar inapto por 1 (um) ano após o término do protocolo de vacinação. | |
ANEXO 5 DO ANEXO IV
Do Algoritmo para a Testagem Obrigatória e Liberação de Bolsas de Sangue (Origem: PRT MS/GM 158/2016, Anexo 5)
DO ALGORITMO PARA A TESTAGEM OBRIGATÓRIA E LIBERAÇÃO DE BOLSAS DE SANGUE
Serão disponibilizados no endereço www.saude.gov.br/sangue os algoritmos:
I - para testagem e liberação de bolsas de sangue (HBsAg, anti HBc, anti-HTLVI/II, sífilis e doença de chagas; e
II - para testagem e liberação de bolsas de sangue (HIV, HCV e HBV, testes sorológicos e NAT ).
Parágrafo único. Entende-se por NAT positivo a positividade em amostra já testada individualmente.
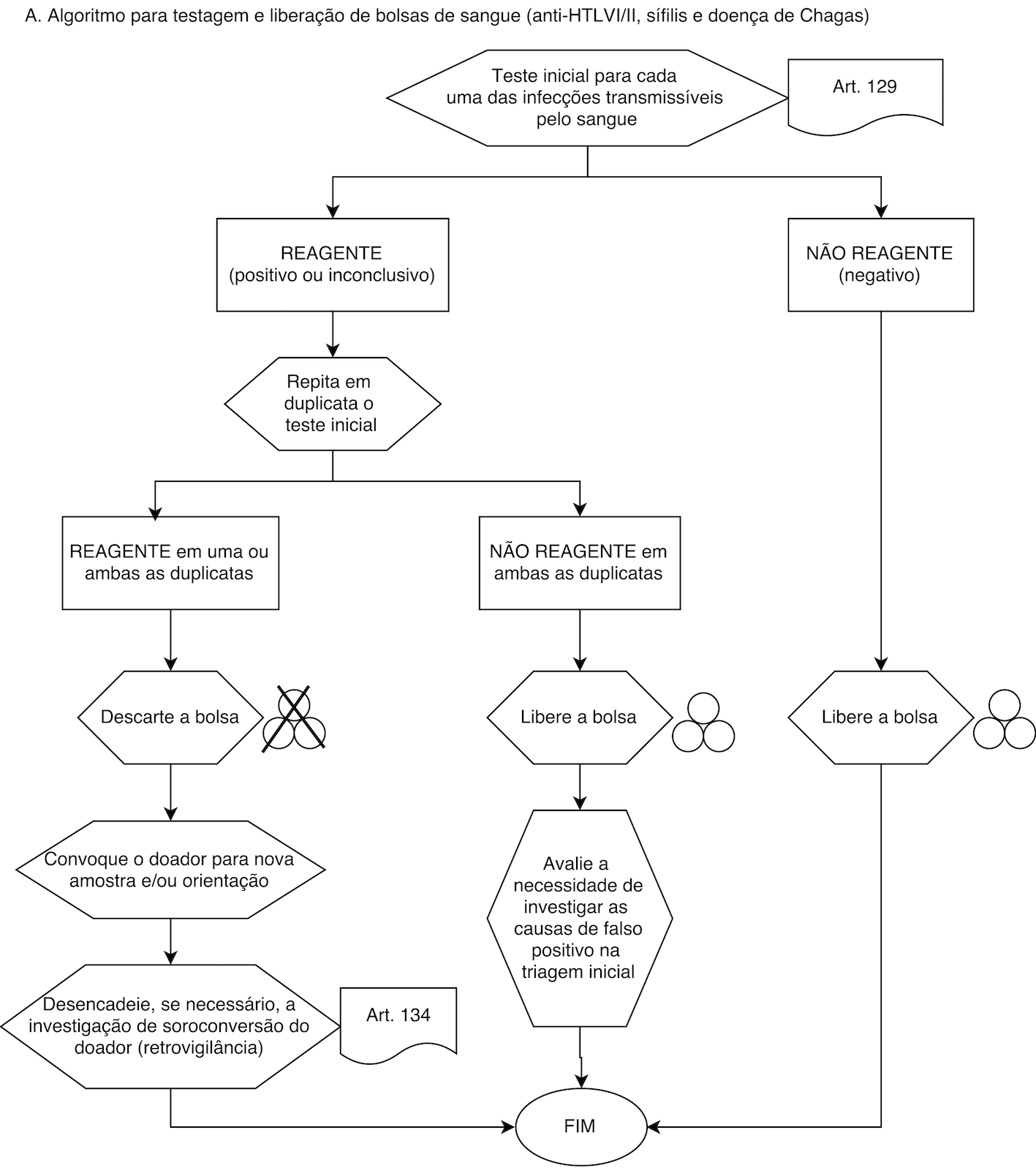
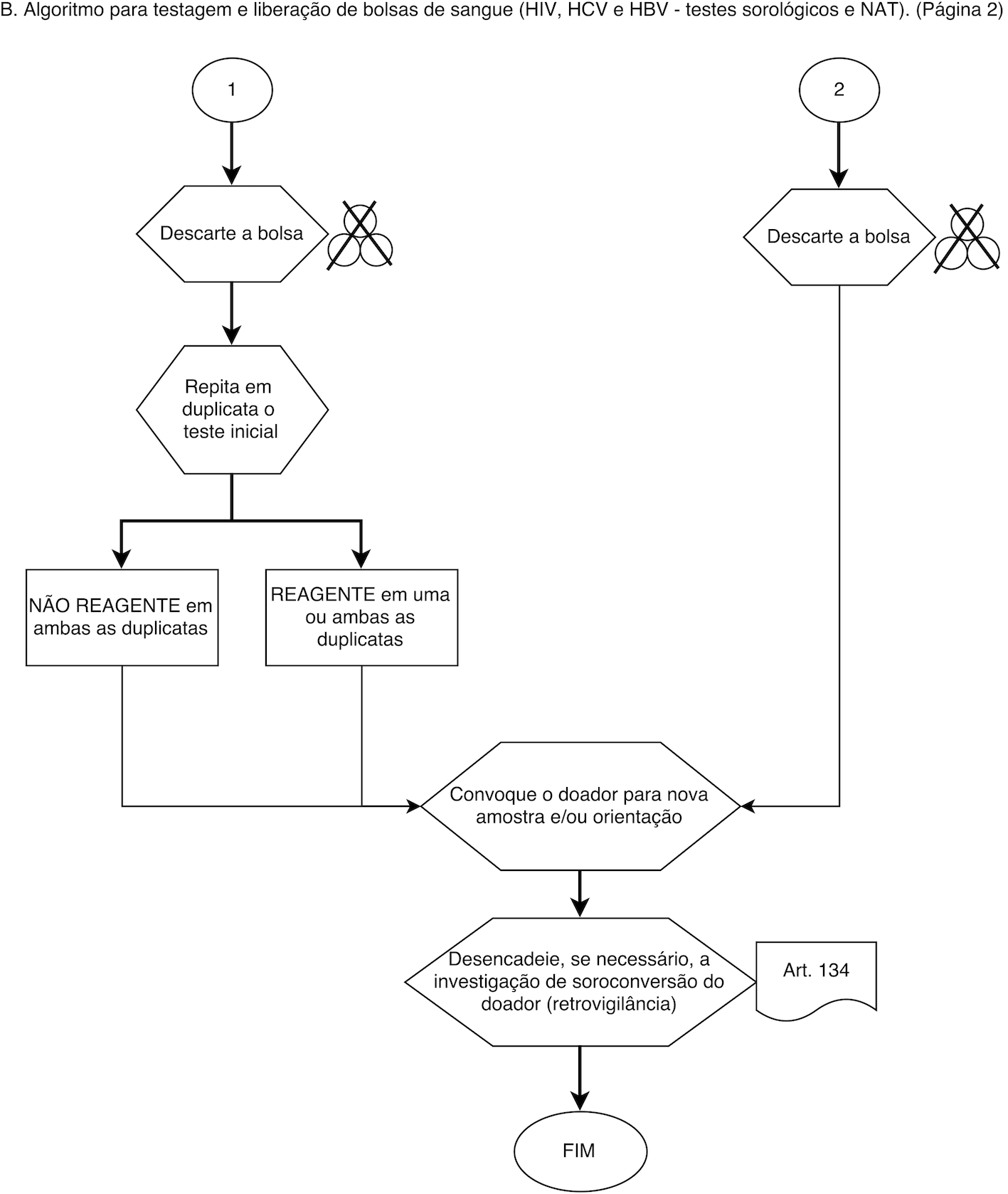
ANEXO 6 DO ANEXO IV
Especificações dos Componentes Sanguíneos - Controle de Qualidade (Origem: PRT MS/GM 158/2016, Anexo 6)
ESPECIFICAÇÕES DOS COMPONENTES SANGUÍNEOS - CONTROLE DE QUALIDADE
| Concentrado de hemácias | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 45g/unidade |
| Hematócrito | 50 a 80% * |
| Grau de hemólise | menor que 0,8% da massa eritrocitária (no último dia de armazenamento) |
| Microbiológica | Negativa |
| * O hematócrito esperado depende do tipo de solução preservativa utilizada na bolsa, sendo de 50 a 70% para os concentrados de hemácias com soluções aditivas e de 65 a 80% para com CPDA-1. | |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias lavadas | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 40g/unidade |
| Hematócrito | 50 a 75% |
| Grau de hemólise | menor que 0,8% da massa eritrocitária |
| Recuperação | maior que 80% da massa eritrocitária |
| Proteína residual | menor que 0,5g/unidade |
| Microbiológica | Negativa |
| OBS.: em todas as unidades produzidas deve ser testado o teor residual de proteína, os demais parâmetros devem ser testados em 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias desleucocitadas | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 40g/unidade |
| Grau de hemólise | menor que 0,8% da massa eritrocitária |
| Leucócitos residuais | menor que 5,0 x 10e6/unidade |
| Microbiológica | Negativa |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias com camada leucoplaquetária removida | |
| Análises | Valores esperados |
| Teor de hemoglobina | maior que 43g/unidade |
| Hematócrito | 50 a 80%* |
| Grau de hemólise | menor que 0,8% da massa eritrocitária (no último dia de armazenamento) |
| Leucócitos | menor que 1,2 x 10e9/unidade |
| Microbiológica | Negativa |
| * O hematócrito esperado depende do tipo de solução preservativa utilizada na bolsa, sendo de 50 a 70% para os concentrados de hemácias com soluções aditivas e de 65 a 80% para com CPDA-1. | |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de hemácias congeladas | |
| Análises | Valores esperados |
| Volume | maior que 185mL* |
| Hemoglobina no sobrenadante | menor que 0,2g/unidade* |
| Teor de hemoglobina | maior que 36g/unidade* |
| Hematócrito | 50 a 75%* e ** |
| Recuperação | maior que 80% da massa eritrocitária |
| Osmolaridade | menor que 340 mOsm/L |
| Contagem de leucócitos | menor que 0,1 x 10e9/unidade |
| Microbiológica | Negativa |
* Os parâmetros de volume, hemoglobina sobrenadante, teor de hemoglobina e hematócrito devem ser avaliados em todas as unidades produzidas, os demais em 1% da produção ou 10 unidades por mês (o que for maior). |
|
| Concentrado de plaquetas obtido de sangue total | |
| Análises | Valores esperados |
| Volume | 40 – 70ml |
| Contagem de plaquetas | maior igual que 5,5 x 10e10/unidade |
| Contagem de leucócitos | |
| Preparado de plasma rico em plaquetas | menor que 2,0 x 10e8/unidade |
| Preparado de camada leucocitária | menor que 0,5 x 10e8/unidade |
| pH | maior que 6,4 (no último dia de armazenamento) |
| Microbiológica | Negativa |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
Concentrado de plaquetas por aférese |
|
Análises |
Valores esperados |
Volume |
maior igual que 200mL* |
Contagem de plaquetas |
maior que= 3,0 x 10e11/unidade (plaquetaférese simples) |
maior que= 6,0 x 10e11/unidade (plaquetaférese dupla) |
|
Contagem de leucócitos |
menor que 5,0 x 10e6/unidade |
pH |
maior que 6,4 (no último dia de armazenamento) |
Microbiológica |
Negativa |
* Deve ser garantido um volume mínimo de plasma ou solução aditiva de 40 mL por 5,5 x 10 e 10 plaquetas. |
|
| Concentrado de plaquetas desleucocitadas | |
| Análises | Valores esperados |
| Contagem de plaquetas | maior que= 5,5 x 10e10/unidade |
| Contagem de leucócitos: | |
| no pool | menor que 5,0 x 10e6/pool |
| por unidade | menor que 0,83 x 10e6/unidade |
| pH | maior que 6,4* (no último dia de armazenamento) |
| Microbiológica | Negativa |
| * A medida do pH só deve ser feita se a desleucocitação for realizada pré-armazenamento. | |
| OBS.: deve ser realizado controle de qualidade em, pelo menos, 1% da produção ou 10 unidades por mês (o que for maior). | |
| Concentrado de granulócitos por aférese* | |
| Análises | Valores esperados |
| Volume | menor que 500mL |
| Contagem de granulócitos | maior que= 1,0 x 10e10/unidade |
| * Estes parâmetros devem ser testados em todas as unidades produzidas. | |
| Plasma comum (plasma não fresco, plasma normal ou plasma simples)* | |
| Análises | Valores esperados |
| Volume | maior que= 150mL |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas. | |
| Plasma isento de crioprecipitado (PIC)* | |
| Análises | Valores esperados |
| Volume | maior que= 140 mL |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas. | |
| Plasma fresco congelado (PFC) e Plasma fresco congelado dentro de 24 horas (PFC24)* | |
| Análises | Valores esperados |
| Volume | maior que= 150mL |
| TTPA 1; 2 | Até valor do pool controle + 20% |
| Fator VIII:C 1; 2; 3 | maior que= a 0,7UI/mL |
| Fator V 1; 2; 3 | maior que= a 0,7UI/mL |
| Leucócitos residuais 4 | menor que 0,1 x 10e6/mL |
| Hemácias residuais 4 | menor que 6,0 x 10e6/mL |
| Plaquetas residuais 4 | menor que 50 x 10e6/mL |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas, os demais em 1% da produção ou 4 (quatro) unidades (o que for maior) mensalmente. 1 - O serviço de hemoterapia pode optar por apenas um destes parâmetros utilizando unidades com até 30 (trinta) dias de armazenamento. O serviço de hemoterapia deve realizar dosagem de Fator VIII | |
| quando fornecer plasma excedente para fracionamento. 2 - A análise deve ser feita utilizando amostras de PFC e PFC24 conjuntamente e em proporção definida pelo serviço baseado na produção. 3 - As dosagens de Fator VIII:C e Fator V podem ser realizados em pools de até 10 (dez) amostras de | |
| bolsas de plasma, com um mínimo de 4 (quatro) pools mensais. 4 - As células residuais devem ser contadas antes do congelamento. | |
| Crioprecipitado* | |
| Análises | Valores esperados |
| Volume | 10 a 40mL (em todas a unidade produzidas) |
| Fibrinogênio | maior que150mg/unidade |
| * O parâmetro de volume deve ser avaliado em todas as unidades produzidas, os demais em 1% da produção ou 4 unidades (o que for maior), em unidades com até 30 (trinta) dias de armazenamento, nos meses em que houver produção. | |
ANEXO 7 DO ANEXO IV
Controle de Qualidade dos Reagentes de Imuno-Hematologia - Parâmetros Recomendados (Origem: PRT MS/GM 158/2016, Anexo 7)
CONTROLE DE QUALIDADE DOS REAGENTES DE IMUNO-HEMATOLOGIA - PARÂMETROS RECOMENDADOS
A.Inspeção dos reagentes:
| Parâmetros | Especificações | Frequência |
| Avaliação do rótulo | Nome do fabricante, nome e origem do produto, data de validade, | A cada lote/remessa |
| número do lote, volume, temperatura de estocagem, número de registro na ANVISA, firmemente afixado ao frasco e que permita a inspeção visual do conteúdo. | ||
| Avaliação das instruções de uso | Nome e composição do reagente, descrição dos procedimentos técnicos, informações claras e legíveis e em português. | A cada lote/remessa |
| Avaliação da embalagem / frasco | Embalagem íntegra e bem vedada e frascos conta-gotas transparentes. | A cada lote/remessa |
B. Inspeção visual dos reagentes
| Reagentes | Especificações | Frequência |
| Antissoros, potencializadores, soluções e enzimas proteolíticas | Ausência de precipitados, gelatina, partículas, fungos, turvação e hemólise. | Diária |
| Reagentes de hemácias | Ausência de hemólise, turvação do líquido sobrenadante ou escurecimento da hemácia. | Diária |
C - Inspeção laboratorial dos reagentes: Hemácias "A" e "B"
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Pode ser avaliada pela intensidade de aglutinação obtida com plas- mas ou soros que possuam os anticorpos complementares aos an- tígenos presentes nas hemácias | A cada lote/remessa |
| testadas. Testar hemácias "A" (suspensão a 3-5%) com plasma "B" e hemácias "B" (suspensão a 3-5%) com plasma "A". A intensidade mínima de aglutinação obtida | ||
| para qualificar o reagente de hemácias é de 2+. Não deve ocorrer a formação de empilhamento ("rouleaux"). | ||
| Especificidade | Pode ser avaliada pela capacidade do anticorpo reconhecer apenas seus antígenos eritrocitários complementares. Testar hemácias "A" e "B" (suspensão a 3-5%) | A cada lote/remessa |
| com plasmas "AB". Não deve haver aglutinação, visto que não há anticorpo específico para promovê-la no teste | ||
| realizado. Não deve ocorrer a formação de empilhamento ("rou- leaux"). |
D - Inspeção laboratorial dos reagentes: Antissoros anti-A, -B e -AB
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Deve ser avaliada por meio da intensidade da aglutinação do soro não diluído com hemácia contendo o antígeno | A cada lote/remessa |
| correspondente. Testar os soros anti-A, -B, -AB com hemácias (suspensão a 3-5%) que contenham os antígenos correspondentes. Ver padrão de avaliação dos resultados no | ||
| quadro D.1. | ||
| Potência: título | É determinado utilizando diluições em série dos antissoros (1/1 até 1/2048) colocando-os em contato com hemácias que contenham os antígenos correspondentes | A cada lote/remessa |
| Testar os soros anti-A, -B, -AB com hemácias (suspensão a 3-5%) que contenham os antígenos correspondentes. Ver padrão de avaliação dos resultados no | ||
| quadro D.1. | ||
| Potência: avidez | É avaliada pela medida do tempo entre a adição do soro e hemácias testes e a identificação macroscópica inicial da aglutinação. Testar os soros anti-A, -B, -AB | A cada lote/remessa |
| com hemácias (suspensão a 10-20%) que contenham os antígenos correspondentes. Ver padrão de avaliação dos resultados no quadro D.1. | ||
| Especificidade | Pode ser avaliada pela capacidade do anticorpo reconhecer apenas seus antígenos eritrocitários complementares. Testar os soros anti-A, - B e -AB com hemácias "O" | A cada lote/remessa |
| (suspensão a 3-5%). Não deve haver aglutinação, visto que não há antígeno específico para promovê-la nos testes realizados. |
D.1. Parâmetros de Intensidade de aglutinação e título esperados para os antissoros anti-A, -B e -AB
| Antissoro | Reagentes de hemácias utilizados* | Intensidade mínima de aglutinação sem diluição do antissoro | Avidez (suspensão de hemácias a 20%) | Título |
| Anti-A | A1 | 3+ | até 15'' | 256 |
| Cor: Azul | ||||
| A2 | 2+ | até 30'' | 128 | |
| A1B | 3+ | até 30'' | 128 | |
| A2B | 2+ | até 45'' | 64 | |
| Anti-B | B | 3+ | até 15'' | 256 |
| Cor: Amarela | ||||
| A1B | 3+ | até 15'' | 256 | |
| Anti-AB | A1 | 3+ | até 15'' | 256 |
| Cor: Incolor | ||||
| A1B | 3+ | até 15'' | 256 | |
| B | 3+ | até 15'' | 256 | |
| A2 | 3+ | até 30'' | 128 |
* no mínimo 3 hemácias de cada fenótipo.
E. Inspeção laboratorial dos reagentes: Antissoros anti-RhD
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Pode ser avaliada por meio da intensidade de aglutinação do soro não di- luído com hemácias contendo os antígenos correspondentes. Testar o | A cada lote/remessa |
| soro anti-RhD com hemácias "O" positivo (suspensão 3-5%). Ver padrão de avaliação dos resultados no quadro E. 1 | ||
| Potência: título | É determinado por meio de diluições em série dos antissoros(1/1 até 1/2048) colocando-os em contato com hemácias que contenham os antí- genos correspondentes. Testar os soros anti | A cada lote/remessa |
| RhD com hemácias "O" positivo (suspensão a 3-5%). Ver padrão de avaliação dos resultados no quadro E. 1 | ||
| Potência: avidez | É avaliada pela medida do tempo entre a adição do soro e hemácias testes e a identificação macroscópica inicial da aglutinação. Testar os soros antiRhD com hemácias "O" positivo | A cada lote/remessa |
| (suspensão a 40-50%). Ver padrão de avaliação dos resultados no quadro E. 1. | ||
| Especificidade | Pode ser avaliada pela capacidade do anticorpo reconhecer apenas seus an- tígenos eritrocitários complementares. Testar os soros anti-RhD com hemá- cias "O" RhD negativo (suspensão a 3- | A cada lote/remessa |
| 5%). Não deve haver aglutinação, visto que não há antígeno específico para promovê-la nos testes realizados. |
E.1. Parâmetros de intensidade de aglutinação e título esperados para os antissoros anti-RhD
| Antissoro | Fenótipos das hemácias utilizados | Intensidade mínima de aglutinação sem diluição | Avidez (suspensão de hemácias a 40- 50%) | Título |
| Anti-RhD | "O" R0r (Dccee) | 3+ | até 30'' | 32 |
| Cor: incolor | ||||
| "O" R1r (DCcee) | 3+ | até 30'' | 32 | |
| "O" R2r (DccEe) | 3+ | até 30'' | 32 |
*Deve-se utilizar no mínimo 3 hemácias de cada fenótipo
F. Inspeção laboratorial dos reagentes: Antiglobulina Humana (AGH)
| Parâmetros | Especificações | Frequência |
| Potência: intensidade de aglutinação | Pode ser avaliada pela intensidade da aglutinação da AGH com hemácias RhD positivas (preferencialmente R0r Dccee) sensibilizadas com anticorpos da classe IgG após adsorção (plasma | a cada lote/remessa |
| humano com anti-RhD ou soro comercial anti-RhD policlonal).Testar a AGH realizando o teste de antiglobulina direto (Coombs direto) com as | ||
| hemácias sensibilizadas "O" RhD positivo (suspensão a 3-5%). A intensidade mínima de aglutinação esperada é de 3+ | ||
| Especificidade | O antissoro não deve reagir com hemácias que não estejam sensibilizadas com anticorpos IgG e/ou complemento. Testar a AGH realizando o teste de antiglobulina direto (Coombs direto) com 3 | a cada lote/remessa |
| hemácias distintas (suspensão a 3-5%) não sensibilizadas. Não deve haver aglutinação ou hemólise. |
G. Inspeção laboratorial dos reagentes: Salina, LISS, albumina bovina e enzimas proteolíticas
| Reagentes | Especificações | Frequência |
| Salina | Não pode promover hemólise e aglutinação de hemácias não sensibilizadas nos testes imuno-hematológicos. Estas características deverão ser observadas quando este reagente estiver em uso. | diária |
| Verificar pH cujos valores permitidos são de 6,0 a 8,0 | a cada lote/remessa diária | |
| LISS | Não pode promover hemólise e aglutinação de hemácias não sensibilizadas nos testes imuno-hematológicos. Estas características deve- rão ser observadas quando este reagente estiver em uso. | |
| Verificar pH cujos valores permitidos são de 6,5 a 7,0 | a cada lote/remessa |
H. Inspeção visual das colunas de aglutinação:
| Indicadores | Especificações | Frequência |
| Microtubos com gel ou pérolas | Totalmente sedimentados, aspecto homogêneo e solução tampão acima da coluna. Não devem apresentar sinais de ressecamento, partículas em suspensão e bolhas de ar. O nível do gel ou das | diária |
| pérolas em todos os microtubos deve ser de 2/3. O nível do tampão deve estar entre 1 a 2 mm acima do gel ou pérola de vidro. | ||
| Lacres de alumínio | Sem perfurações ou irregularidades. Na retirada do lacre é preciso observar, na parte inferior da folha de alumínio, as marcas impressas das bordas dos | diária |
| orifícios dos microtubos que indicam o fechamento correto. |
Observações:
1) todos os testes de controle de qualidade de reagentes devem ser registrados em formulários específicos. Estes devem informar o nome do reagente, fabricante, lote, validade, resultados dos testes e responsável pela execução do teste;
2) os reagentes que estiverem fora das especificações técnicas descritas acima não devem ser utilizados na rotina. Registrar as não conformidades e investigar as causas das inadequações; e
3) recomenda-se que serviços de hemoterapia que utilizarem outros reagentes elaborem procedimentos de controle de qualidade, porém sem caráter obrigatório.
ANEXO 8 DO ANEXO IV
Controle de Qualidade de Reagentes de Sorologia (Origem: PRT MS/GM 158/2016, Anexo 8)
Art. 1º O serviço de hemoterapia adotará ferramentas de boas práticas para a avaliação, manipulação e monitoração que garantam a qualidade dos serviços prestados. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º)
Parágrafo Único. O controle do processo da triagem sorológica compreenderá: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único)
I - a qualificação inicial; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, I)
II - a qualificação dos lotes/remessa de reagentes; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, II)
III - o monitoramento diário; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, III)
IV - a calibração periódica de equipamentos; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, IV)
V - a manutenção preventiva e corretiva. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 1º, Parágrafo Único, V)
Art. 2º Os kits de conjuntos diagnósticos serão aprovados antes da aquisição ou do início de utilização. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º)
§ 1º Durante a avaliação será utilizado, no mínimo, um lote do reagente em teste. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 1º)
§ 2º Serão testados os equipamentos e "software", verificando se apresentam segurança em todo o processo. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 2º)
§ 3º Serão utilizadas amostras de sangue com resultados conhecidos e caracterizadas laboratorialmente ou painéis comerciais. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 3º)
§ 4º Para a aprovação dos conjuntos diagnósticos serão avaliados: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 4º)
I - a sensibilidade, que deverá ter valor mínimo de 100%, não sendo aceito nenhum falso negativo; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 4º, I)
II - a especificidade, que deverá ser acima de 99%. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 4º, II)
§ 5º No momento da aquisição ou início de utilização dos kits, equipamentos ou "softwares", os fornecedores apresentarão: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º)
I - certificado de registro de produto e equipamento, quando aplicável; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º, I)
II - plano continuado de capacitação teórico-prática de recursos humanos; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º, II)
III - plano de manutenção corretiva, preventiva e de calibração para cada equipamento em comodato. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 5º, III)
§ 6º No momento do recebimento dos kits, equipamentos e "softwares", será realizada, em cada lote e em cada remessa, inspeção com o objetivo de verificar a conformidade com o solicitado antes da aquisição ou início da utilização. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 6º)
§ 7º Na inspeção de que trata o § 6º serão avaliados: (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º)
I - os reagentes; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, I)
II - a integridade da embalagem; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, II)
III - a bula; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, III)
IV - o nome dos reagentes; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, IV)
V - as condições de acondicionamento e transporte; (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, V)
VI - o lote; e (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, VI)
VII - a validade. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 7º, VII)
§ 8º No controle de lotes e remessas serão utilizadas amostras com resultados conhecidos e caracterizados laboratorialmente ou painéis comerciais. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 8º)
§ 9º Os equipamentos e "softwares" deverão estar em conformidade com a avaliação realizada antes da aquisição. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 2º, § 9º)
Art. 3º O Controle de Qualidade Interno (CQI) será realizado com a finalidade de evidenciar a perda da sensibilidade dos ensaios, identificar variações lote a lote e remessa a remessa e detectar erros aleatórios ou sistemáticos. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º)
§ 1º O Controle de Qualidade Interno Positivo (CQIP) será adquirido ou produzido obedecendo-se os critérios de boas práticas. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 1º)
§ 2º O CQIP será caracterizado e validado previamente quando for de produção interna. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 2º)
§ 3º Em cada corrida será usado, no mínimo, 1 (um) CQIP e os resultados não conformes dessa análise invalidarão os ensaios. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 3º)
§ 4º A produção de CQIP para métodos imunoenzimáticos (EIE) de quimioluminescência (QLM) e métodos de floculação (VDRL/RPR) par a os ensaios de anti-HIV1/2, HBsAg, anti-HBc, anti-HCV, anti-HTLV I/II, Chagas e Sífilis será específica para cada metodologia. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 4º)
§ 5º Nas ações para caracterização das bolsas de plasma positivo para produção do CQIP, a validação deste compreenderá a testagem por, no mínimo, duas metodologias diferentes em que pelo menos uma seja diferente da utilizada na rotina. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 5º)
§ 6º É recomendável a utilização de uma metodologia confirmatória na validação do CQIP se disponível. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 6º)
§ 7º É recomendado que a determinação do coeficiente de variação (CV) específico para cada sistema analítico seja aferido intra e interensaios. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 7º)
§ 8º O valor de leitura (DO ou RLU) do CQIP deve estar na faixa de 1,5 a 4,5 vezes o valor do ponto de corte do ensaio (cut off) testado na metodologia específica. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 8º)
§ 9º No caso de CQIP para métodos de floculação (VDRL/RPR), será utilizado plasma com resultado reagente na triagem sorológica para sífilis, com título mínimo de 1/16 e teste treponêmico positivo. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 9º)
§ 10. Os CQIP serão armazenados em temperatura igual ou inferior a -20ºC (vinte graus Celsius negativos). (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 10)
§ 11. As alíquotas do CQIP a serem utilizadas serão descongeladas uma única vez, em virtude da possibilidade de ocorrência de precipitação de imunoglobulinas e consequente alteração do padrão de reatividade. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 3º, § 11)
Art. 4º A participação em programas de proficiência (Controle de Qualidade Externo) tem como finalidade a verificação da proficiência da triagem sorológica do laboratório. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º)
§ 1º É esperado nos programas de proficiência a completa conformidade dos resultados (100% de acerto). (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º, § 1º)
§ 2º Resultados discrepantes dos esperados terão as causas analisadas (erros técnicos, equipamentos, reagentes, dentre outros) e medidas corretivas serão implementadas, quando cabíveis. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º, § 2º)
§ 3º As testagens das amostras dos painéis de controle externo serão realizadas nas mesmas condições e com os mesmos procedimentos adotados na rotina, atendidas as orientações do fornecedor. (Origem: PRT MS/GM 158/2016, Anexo 8, Art. 4º, § 3º)
ANEXO 9 DO ANEXO IV
Controle de Qualidade de Reagentes de Teste de Detecção de Ácido Nucleico (NAT) para HIV, HCV e HBV (Origem: PRT MS/GM 158/2016, Anexo 9)
CONTROLE DE QUALIDADE DE REAGENTES DE TESTE DE DETECÇÃO DE ÁCIDO NUCLEICO (NAT) PARA HIV, HCV E HBV
Art. 1º O serviço de hemoterapia adotará ferramentas de boas práticas para a avaliação, manipulação e monitoração dos testes de detecção de ácido nucleico, que garantam a qualidade dos serviços prestados.
Art. 2º O controle do processo da triagem NAT compreenderá:
I - a qualificação inicial;
II - a qualificação dos lotes/remessas de reagentes;
III - o monitoramento diário;
IV - a calibração periódica; e
V - a manutenção preventiva e corretiva de equipamentos.
Art. 3º O NAT para HIV, HCV e HBV, a ser utilizado pelo serviço de hemoterapia, deve ser capaz de detectar em 95% das vezes 600 UI/mL para HCV, 600 cópias/mL para HIV e 300 UI/mL para HBV na amostra do doador.
Parágrafo único. A sensibilidade do teste e o número de amostras do pool serão definidos em conjunto para atender à sensibilidade da amostra do doador.
A. Disposições Gerais.
Os kits (conjuntos diagnósticos) deverão ser aprovados antes da aquisição ou início de utilização:
-durante a avaliação deve ser utilizado, no mínimo, um lote do reagente em teste;
-devem-se testar os equipamentos e "software", verificando se apresentam segurança em todo o processo; e
-devem ser utilizadas amostras de sangue com resultados conhecidos e caracterizadas laboratorialmente ou painéis comerciais.
A.1. Critérios para a aprovação:
-devem ser avaliadas: sensibilidade e especificidade; e
-valores mínimos de aceitação:
a)sensibilidade de 100% (não é aceitável nenhum falso negativo); e
b)especificidade: acima de 99%.
A.2. No momento da aquisição ou início de utilização dos kits/equipamentos/"software"os fornecedores deverão apresentar:
-certificado de registro de produto e equipamento (quando aplicável);
-plano continuado de capacitação teórico-prática de recursos humanos; e
-plano de manutenção corretiva, preventiva e de calibração para cada equipamento em comodato.
A.3. Inspeção no recebimento dos "kits"/equipamentos/"software":
-objetivos: verificar se estão em conformidade com o solicitado antes da aquisição ou início de utilização. Deve ser realizada para cada lote e em cada remessa;
- avaliar: reagentes, integridade da embalagem, bula, nome dos reagentes, condições de acondicionamento e transporte, lote e validade;
-controle de lote/remessa: utilizar amostras com resultados conhecidos e caracterizadas laboratorialmente ou painéis comerciais; e
-equipamentos e "software": deverão estar em conformidade com a avaliação que foi realizada antes da aquisição.
B. Controle de Qualidade Interno (CQI).
O CQI tem a finalidade de: evidenciar a perda da sensibilidade dos ensaios, identificar variações lote a lote/remessa a remessa e detectar erros aleatórios ou sistemáticos.
O controle de qualidade interno positivo (CQIP) poderá ser produzido, obedecendo aos critérios das boas práticas, ou adquirido. Quando a produção for interna este controle deve ser caracterizado e validado previamente.
- o controle de qualidade interno positivo (CQIP) pode ser obtido através de diluições seriadas de plasma com resultados sorológicos e de NAT positivos (pool e single) para os marcadores empregados na detecção. Deverá ser estabelecido um valor de corte para o CQIP, considerando a diluição utilizada. A produção de CQIP deve ser específica para cada metodologia;
- as amostras do CQIP devem ser armazenadas em condições que garantam a sua estabilidade; e
- o CQIP deve ser testado em todas as rotinas, nas mesmas condições das amostras e com os mesmos procedimentos adotados na rotina. Os resultados do CQIP deverão ser monitorados em todas as rotinas e atender aos critérios de aceitação pré-definidos.
C. Participação em programas de proficiência (Controle de Qualidade Externo).
Têm como finalidade verificar a proficiência da triagem NAT do laboratório. Espera-se completa conformidade dos resultados (100 % de acerto). Resultados discrepantes dos esperados deverão ter suas causas analisadas (erros técnicos, equipamentos, reagentes, entre outros) e medidas corretivas deverão ser implementadas, se pertinentes.
As testagens das amostras dos painéis de controle externo devem ser realizadas nas mesmas condições e com os mesmos procedimentos adotados na rotina, atendendo orientações do fornecedor.
ANEXO 10 DO ANEXO IV
Condições para Transporte de Sangue Total e Componentes Sanguíneos (Origem: PRT MS/GM 158/2016, Anexo 10)
CONDIÇÕES PARA TRANSPORTE DE SANGUE TOTAL E COMPONENTES SANGUÍNEOS
| Condições de transporte | Sangue total para processamento | Concentrado de hemácias | Plasma fresco congelado | Crioprecipitado | Concentrado de plaquetas |
| Temperatura de transporte | 20o a 24oC (para produção de CP) ou 1° a 10°C (não for destinado à produção de CP). | 1 a 10ºC | Manter estado congelado | Manter estado congelado | A temperaturas próximas das de armazenamento |
| Substância resfriadora recomenda- da | Placas de 1,4-butanediol Gelo reciclável | Gelo reciclável | Gelo seco ou gelo reciclável | Gelo seco ou gelo reciclável | Somente em condições de alta temperatura: gelo reciclável |
| Tempo máximo de transporte | 18 horas | 24 horas | 24 horas | 24 horas | 24 horas |
ANEXO 11 DO ANEXO IV
Do Envio do Plasma para Indústria de Hemoderivados (Origem: PRT MS/GM 158/2016, Anexo 11)
Art. 1º O coordenador do SINASAN definirá quanto à utilização de todo plasma congelado excedente do uso terapêutico existente em qualquer serviço de hemoterapia público ou privado com vistas ao atendimento de interesse nacional, conforme previsto no § 1º do art. 14 da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 1º)
Art. 2º Não é permitida aos serviços de hemoterapia, públicos ou privados, a disponibilização de plasma para indústria de hemoderivados, nacional ou internacional, sem a autorização escrita do Ministério da Saúde. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 2º)
Art. 3º A realização de procedimento de plasmaférese obedecerá ao disposto no art. 101 do Anexo IV . (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 3º)
Parágrafo Único. A obtenção de insumos para indústria de hemoderivados é atividade exclusiva dos serviços de hemoterapia públicos, sendo que os serviços de hemoterapia que forem fornecedores nesta modalidade deverão solicitar autorização escrita da CGSH/DAHU/SAS/MS para coleta e envio do plasma com este fim. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 3º, Parágrafo Único)
Art. 4º Somente plantas industriais nacionais de natureza pública receberão o plasma dos serviços de hemoterapia brasileiros obtido por plasmaférese. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 4º)
Parágrafo Único. A CGSH/DAHU/SAS/MS acompanhará os resultados das atividades de certificação dos serviços de hemoterapia e beneficiamento do plasma pelas plantas industriais de hemoderivados, a fim de garantir o estabelecido nos inciso VIII, XII e XIV do art. 16 da Lei nº 10.205, de 2001. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 4º, Parágrafo Único)
Art. 5º A CGSH/DAHU/SAS/MS verificará, oportunamente, por meio de critérios técnicos, os serviços de hemoterapia que serão fornecedores de plasma para a indústria de hemoderivados, conforme a viabilidade e capacidade operacional, além de competência técnica do serviço de hemoterapia para fornecer matéria-prima. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 5º)
Art. 6º A CGSH/DAHU/SAS/MS emitirá documento ao serviço de hemoterapia certificado e aprovado pela indústria de hemoderivados para fornecimento de plasma autorizando o serviço de hemoterapia a fornecer plasma como matéria-prima para a indústria certificadora pelo período de um ano ou até a expiração da validade da certificação anterior (conforme normativas sanitárias vigentes) que se baseará nas informações prestadas pela indústria produtora. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º)
§ 1º A autorização de que trata o "caput" será dada ao serviço de hemoterapia anualmente para fornecimento do plasma excedente do uso terapêutico à indústria que o certificou, devendo, ainda, acordar com esta os demais procedimentos necessários à execução do beneficiamento do plasma. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 1º)
§ 2º Para cumprimento do disposto no § 1º, a indústria produtora de hemoderivados que atua no âmbito do SINASAN deverá: (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 2º)
I - certificar os fornecedores de matéria-prima, quanto aos procedimentos operacionais adotados pelos serviços de hemoterapia, conforme critérios estabelecidos pela legislação vigente, obedecendo à periodicidade prevista na legislação sanitária vigente; e (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 2º, I)
II - apresentar relatório circunstanciado da avaliação dos serviços de hemoterapia à CGSH/DAHU/SAS/MS para ciência e autorização de fornecimento em até 30 (trinta) dias após a visita. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 2º, II)
§ 3º O relatório de aprovação servirá para concessão da autorização de fornecimento do plasma. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 3º)
§ 4º O relatório da não aprovação servirá para adoção de medidas para melhoria pelos serviços de hemoterapia para qualificação do plasma. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 4º)
§ 5º Para recolhimento do plasma dos serviços de hemoterapia autorizados, a indústria produtora definirá junto ao fornecedor o cronograma de recolhimento do plasma excedente do uso terapêutico. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 5º)
§ 6º A indústria apresentará à CGSH/DAHU/SAS/MS, ao décimo quinto dia de cada mês, relatório de suas atividades de auditorias de certificação de fornecedores, recolhimento do plasma, informando: (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º)
I - quais serviços de hemoterapia foram auditados no mês e resultados; (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º, I)
II - em quais serviços de hemoterapia ocorreu o recolhimento de plasma, data e quantidades recolhidas; e (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º, III)
III - intercorrências que demandem intervenção dessa Coordenação. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 6º, IV)
§ 7º A indústria produtora apresentará semestralmente o relatório de produção de hemoderivados, para ciência e acompanhamento das atividades desenvolvidas no âmbito do SINASAN, e no qual constará: (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º)
I - a quantidade de plasma recolhido, enviado para fábrica, beneficiado, descartado e principais motivos de descarte; (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º, I)
II - os rendimentos dos fracionamentos; e (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º, II)
III - a quantidade de hemoderivados produzidos. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 6º, § 7º, III)
Art. 7º O SINASAN fomentará que os serviços de hemoterapia busquem qualificação de sua produção de plasma para atender ao interesse nacional na produção de hemoderivados, sem prejuízo à terapêutica. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 7º)
Art. 8º Quando houver a necessidade de exportação temporária do plasma para fins de beneficiamento no exterior, a indústria que executará a operação deve solicitar autorização de exportação temporária do plasma à CGSH/DAHU/SAS/MS, anteriormente à solicitação de licenças sanitárias e demais providências necessárias. (Origem: PRT MS/GM 158/2016, Anexo 11, Art. 8º)
ANEXO 12 DO ANEXO IV
PROGRAMA NACIONAL DE CONTROLE DE QUALIDADE EXTERNO EM SOROLOGIA (PNCQES) (Origem: PRT MS/GM 1840/1996, Anexo 1)
1. Definições
1.1 Programa Nacional de Controle de Qualidade Externo em Sorologia - PNCQES - É um Programa de amplitude nacional, implantado pelo Ministério da Saúde, com o objetivo de avaliar a qualidade e o desempenho dos resultados doa testes sorológicos realizados nas Unidades Hemoterápicas. Esta avaliação será realizada no mínimo semestralmente, utilizando painéis de soros conhecidos (multipaineis), produzidos pela instituição credenciada.
1 2. Testes de Proficiência em Laboratórios de Sorologia - É uma avaliação do desempenho do laboratório, envolvendo a utilização de painéis, para determinar a qualidade dos resultados, por intermédio da comparação dos resultados obtidos pelo avaliado com os resultados conhecidos.
1.3. Painel de soros - É um conjunto de amostras de soros estáveis e bem caracterizadas quanto à sua negatividade ou positividade para sífilis, doença de Chagas, HBV, HCV, HTLV I e II, e HIV. A caracterização é feita por meio de ensaios de diferentes procedências e características e também pela utilização de métodos complementares/confirmatórios. O resultado dos testes somente será conhecido pelo laboratório produtor (instituição de referência).
1.4 Laboratório de referência e produtor - É o laboratório credenciado pelo Ministério da Saúde, em função de competência especifica, para produzir painéis de soros conhecidos e avaliar os resultados obtidos pelas Unidades Hemoterápicas por intermédio de laudos técnicos.
ITEM 2 (Suprimido pela Portaria GM/MS1544, de 1997).
3. Critérios de Avaliação
3.1 A Portaria MS nº 1376 de 19 de novembro de 1993 identifica a obrigatoriedade da utilização de técnicas de alta sensibilidade para triagem sorológica de doadores de sangue, em função dos riscos da liberação de resultados falsos negativos. Portanto, o PNCQES considerará como falta grave a não detecção da positividade nos soros contidos nos multipaineis, exigindo-se 100% de sensibilidade em relação ao número total de amostras. Quando assim detectado e por sua inteira responsabilidade, a unidade avaliada deverá corrigir, de imediato, os fatores responsáveis pelo(s) resultado(s) inadequado(s), comunicando obrigatoriamente o fato ao órgão de vigilância sanitária do Sistema Único de Saúde da unidade federada. Neste caso, a unidade avaliada deverá repetir o teste de proficiência, no prazo máximo de 30 dias.
3.2. A especificidade dos resultados, deverá também ser avaliada, em função de que os resultados falsos positivos indicam a qualidade dos testes realizados. Os critérios utilizados serão:
- de 75% a 100% de acertos por tipo de teste (os doença) e no total do número de determinações será considerado como desempenho ótimo.
- abaixo de 75% de acertos será considerado como desempenho insatisfatório, devendo a unidade avaliada identificar e corrigir o(s) fator(es) responsável(eis) de imediato. Deverá também, neste caso, comunicar ao órgão de vigilância sanitária do Sistema Único de Saúde da unidade federada, assim como, quais foram as medidas corretivas. Deverá tombem repetir o teste de proficiência no prazo máximo de 30 dias.
4. Laudos Técnicos
4.1 Os laudos serão emitidos pelo Laboratório Credenciado conforme formulários abaixo.
| Instituição |
| Data:___/___/___ |
Assinalar com "X" a positividade encontrada em cada amostra.
| Amostra | Resultados obtidos | AMS093596 |
1- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
2- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
3- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
4- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
5- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
6- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
7- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
8- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
9- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
10- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
11- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
12- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
13- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
14- |
Sífilis HIV HTLV HCV AgHBs anti-HBc Chapas |
|
Responsável (Nome): |
||
Data: ___/___/___ |
Assinatura: |
|
AVALIAÇÃO
|
|
| Responsável (Nome): | |
| Data: ___/___/___ | Assinatura: |
| Instituição: | |
| Data: ___/___/___ | |||||
| Método | Marca | Geração | Lote | Vencimento | |
| SÍFILIS | V.D.R.L | / / | |||
| Hemaglutinação | / / | ||||
| ELISA | / / | ||||
| FTAabs | / / | ||||
| Outros | / / | ||||
| anti-HIV | ELISA (Lisado Viral) | / / | |||
| ELISA 1+2 | / / | ||||
| IFI | / / | ||||
| Western Blot | / / | ||||
| Outros | / / | ||||
| anti HTL VVII | ELISA | / / | |||
| Western Blot | / / | ||||
| Outros | / / | ||||
| anti-HCV | ELISA | / / | |||
| ImunoBlot | / / | ||||
| Outros | / / | ||||
| AgHBs | ELISA | / / | |||
| Outros | / / | ||||
| anti-HBc | ELISA | / / | |||
| Outros | / / | ||||
Doença de Chagas |
ELISA | / / | |||
| Hemaglutinação | / / | ||||
| IFI | / / | ||||
| Outros | / / | ||||
| Responsável (Nome): | |||||
| Data: ___/___/__ | Assinatura: | ||||
ANEXO 13 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Talassemias) (Origem: PRT MS/GM 2612/2012, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFLITO DE INTERESSE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº <nº do CPF>, declaro junto à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAE/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico às Talassemias (CAT-Talassemias), que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar)_____________________________________________.
( ) Consultoria técnica em andamento: (citar)______________________________________________.
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar)_________________________________________________.
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na CAT-Talassemias: (citar) _________________________________________________.
( ) Outro: (especificar)_____________________________________________.
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/DAE/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 14 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Talassemias) (Origem: PRT MS/GM 2612/2012, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº <nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas ao Programa de Talassemias, coordenado pela Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAE/SAS/MS) e à Comissão de Assessoramento Técnico às Talassemias (CAT-Talassemias), do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1.Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2.Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH/DAE/SAS/MS ou direção dos serviços de saúde sob os quais há a atuação da CAT-Talassemias;
3.Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4.Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_________________________________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 15 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Gestão de Equipamentos) (Origem: PRT MS/GM 2543/2014, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº < nº do CPF?, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão de Equipamento, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Gestão de Equipamento, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão de Equipamento;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 16 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Gestão de Equipamentos) (Origem: PRT MS/GM 2543/2014, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº < nº do CPF?, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão de Equipamento, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Gestão de Equipamento, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão de Equipamento;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 17 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Gestão Ambiental) (Origem: PRT MS/GM 2545/2014, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFLITO DE INTERESSE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº ? nº do CPF?, declaro junto á Coordenação Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico em Gestão Ambiental, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar) ________ .
( ) Consultoria técnica em andamento: (citar)__________________________ .
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ____________________ .
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na Gestão Ambiental: (citar)_________________________ .
( ) Outro: (especificar)____________________________________________ .
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 18 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Gestão Ambiental) (Origem: PRT MS/GM 2545/2014, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, ?nome completo?, ?nacionalidade?, ?estado civil?, ?profissão?, inscrito (a) no CPF/MF sob o nº ? nº do CPF?, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão Ambiental, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Gestão Ambiental, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão Ambiental;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 19 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Doença Falciforme) (Origem: PRT MS/GM 158/2015, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Eu, nome completo, nacionalidade, estado civil, profissão, inscrito (a) no CPF/MF sob o nº nº do CPF, declaro, junto à Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAHU/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico à Doença Falciforme (CAT-Doença Falciforme), que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar)
______________________________________________.
( ) Consultoria técnica em andamento: (citar)
______________________________________________.
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar)
__________________________________________________
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na CAT-Talassemias: (citar)
__________________________________________________
( ) Outro: (especificar)
_____________________________________________
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/DAHU/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 20 DO ANEXO IV
TERMO DE CONFIDENCIALIDADE (CAT-Doença Falciforme) (Origem: PRT MS/GM 158/2015, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Eu, nome completo, nacionalidade, estado civil, profissão, inscrito (a) no CPF/MF sob o nº nº do CPF, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas à Política Nacional de Atenção às Pessoas com Doença Falciforme, coordenada pela Coordenação-Geral de Sangue e Hemoderivados, do Departamento de Atenção Especializada, da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAHU/SAS/MS) e à Comissão de Assessoramento Técnico às Doença Falciforme (CAT-Doença Falciforme), do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionado ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH/DAHU/SAS/MS ou direção dos serviços de saúde sob os quais há a atuação da CAT-Doença Falciforme;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4.Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_________________________________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 21 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-PDVS) (Origem: PRT MS/GM 795/2015, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, declaro junto á Coordenação Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar) .
_______________________________________________________
( ) Consultoria técnica em andamento: (citar)
___________________ .
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ______________.
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na Gestão de Equipamento: (citar).
______________________________________________________
( ) Outro: (especificar)
___________________________________
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 22 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-PDVS) (Origem: PRT MS/GM 795/2015, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Gestão de Equipamento, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico para a Promoção da Doação Voluntária de Sangue, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1.Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2.Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação do CAT- Gestão de Equipamento;
3.Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4.Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 23 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (CAT-Sangue Raro) (Origem: PRT MS/GM 1440/2015, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFLITO DE INTERESSE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, declaro junto à Coordenação-Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico em Sangue Raro, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) Vínculo empregatício com instituição de natureza privada: (citar) ________ .
( ) Consultoria técnica em andamento: (citar)__________________________ .
( ) Membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ____________________ .
( ) Vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na CAT-Sangue Raro : (citar) _________________________ .
( ) Outro: (especificar)____________________________________________ .
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 24 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (CAT-Sangue Raro) (Origem: PRT MS/GM 1440/2015, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
DECLARAÇÃO DE CONFIDENCIALIDADE
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Sangue Raro, no âmbito da Coordenação Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico em Sangue Raro, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1 Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2 Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas ao programa mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação da CAT-Sangue Raro;
3 Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível através do programa mencionado;
4 Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 25 DO ANEXO IV
DECLARAÇÃO DE CONFLITO DE INTERESSE (Origem: PRT MS/GM 475/2015, Anexo 1)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Eu, <nome completo>, <nacionalidade>, <estado civil>,<profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, declaro junto à Coordenação-Geral de Sangue e Hemoderivados da Secretaria de Atenção à Saúde do Ministério da Saúde (CGSH/DAHU/SAS/MS), para fins de atuação como membro colaborador na Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública, que possuo os potenciais conflitos de interesse, entre outras condições relevantes, as seguintes:
( ) vínculo empregatício com instituição de natureza privada:(citar) _______________
( ) consultoria técnica em andamento: (citar) ________
( ) membro de comitê técnico assessor de empresas produtoras de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam vir a integrar protocolos utilizados nas atividades da área de sangue e hemoderivados: (citar) ________________________________
( ) vínculo de emprego, contrato de consultoria ou ações de organização(ões) civis que, de alguma forma, possam ter benefícios ou prejuízos com a sua participação na Qualificação Técnica e Gerencial da Hemorrede Pública Nacional: (citar)_________________________
( ) outro: (especificar) _________________________
( ) não possuo conflitos de interesses relevantes para a atuação nas atividades da área de sangue e hemoderivados desenvolvidas pelo Ministério da Saúde.
Por fim, comprometo-me a informar à CGSH/SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesse, para conhecimento e avaliação.
Em ___/ ___/ ____
_____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
ANEXO 26 DO ANEXO IV
DECLARAÇÃO DE CONFIDENCIALIDADE (Origem: PRT MS/GM 475/2015, Anexo 2)
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Eu, <nome completo>, <nacionalidade>, <estado civil>, <profissão>, inscrito (a) no CPF/MF sob o nº < nº do CPF>, assumo o compromisso de manter confidencialidade e sigilo sobre todas as informações técnicas e outras a que tiver acesso, relacionadas às ações de Qualificação Técnica e Gerencial da Hemorrede Pública Nacional, no âmbito da Coordenação-Geral de Sangue e Hemoderivados do Ministério da Saúde e à Comissão de Assessoramento Técnico à Qualificação Nacional da Hemorrede Pública, do qual sou membro colaborador.
Por este Termo de Confidencialidade comprometo-me a:
1. Não utilizar as informações confidenciais a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para uso de terceiros;
2. Não efetuar nenhuma gravação ou cópia da documentação confidencial a que tiver acesso relacionadas a Qualificação Técnica e Gerencial da Hemorrede Pública Nacional mencionado, a não ser aquelas necessárias a atividade e com autorização da CGSH ou direção dos serviços de saúde sob os quais há a atuação da CAT a Qualificação Nacional da Hemorrede Pública;
3. Apropriar-me ou para outrem de material confidencial e/ou sigiloso que venha a ser disponível por meio da Qualificação Técnica e Gerencial da Hemorrede Pública Nacional mencionado;
4. Não repassar o conhecimento das informações confidenciais e/ou estratégicas do Ministério da Saúde, responsabilizando-me por todas as pessoas que vierem a ter acesso às informações por meu intermédio.
A vigência da obrigação de confidencialidade, assumida pela minha pessoa por meio deste termo, será por tempo indeterminado, ou enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou ainda, mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade, fico ciente de todas as sanções judiciais que poderão advir.
Em ___/ ___/ ____
____________________________
Assinatura
(Revogado pela PRT GM/MS n° 3.580 de 18.04.2024)
Anexo IV-A
Do Fornecimento do Plasma Excedente do Uso Hemoterápico
(Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
Art. 1º O plasma excedente do uso hemoterápico, produzido pelos serviços que compõe a Rede Nacional de Serviço de Hemoterapia no âmbito do SINASAN, será destinado à Empresa Brasileira de Hemoderivados e Biotecnologia - Hemobrás, para fins do uso industrial na produção de medicamentos hemoderivados. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
Art. 2º Os Serviços de Hemoterapia certificados como fornecedores de plasma para a Hemobrás deverão: (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
I - obter autorização anual do Ministério da Saúde para efetivar o fornecimento regular de plasma à Hemobrás; e (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
II - atender às demais orientações constantes no Anexo IV desta Portaria. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
Parágrafo único. Após o cumprimento do disposto no caput, os Serviços de Hemoterapia deverão, periodicamente, transferir para a Hemobrás a quantidade excedente de plasma, nos termos do § 2º do art. 14 da Lei nº 10.205, de 21 de março de 2001. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
§ 1º Para obtenção da autorização anual prevista no inciso I do caput, os Serviços de Hemoterapia deverão enviar solicitação, por meio de ofício, à Coordenação-Geral de Sangue e Hemoderivados - CGSH/DAET/SAES/MS, acompanhada de: (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
I - informações sobre: (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
a) a quantidade total de plasma produzido no último ano; e (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
b) a quantidade estimada de plasma excedente do uso hemoterápico a ser disponibilizada; (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
II - comprovação de certificação do Serviço de Hemoterapia pela Hemobrás como fornecedor de matéria prima da empresa para fins industriais, conforme exigências da RDC ANVISA nº 301, de 21 de agosto de 2019, e demais normas sanitárias aplicáveis. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 2º A CGSH/DAET/SAES/MS avaliará a conformidade da solicitação de que trata o §1º com os critérios previstos nesta Portaria e, em caso de aprovação, emitirá a respectiva autorização ao Serviço de Hemoterapia. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 3º Após a emissão da autorização, os Serviços de Hemoterapia deverão transferir para a Hemobrás, periodicamente, a quantidade excedente de plasma, nos termos do § 2º do art. 14 da Lei nº 10.205, de 21 de março de 2001. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 4º Os aspectos operacionais acerca da transferência de que trata o §3º devem ser estabelecidos em instrumento específico a ser firmado entre os Serviços de Hemoterapia e a Hemobrás. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 5º Para a renovação da autorização, o Serviço de Hemoterapia deverá encaminhar nova solicitação à CGSH/DAET/SAES/MS, acompanhada de relatório acerca do quantitativo de plasma transferido à Hemobrás durante a vigência da autorização previamente concedida. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
Art. 3º Na hipótese de existência de excedente de plasma que supere a capacidade de absorção da Hemobrás, os Serviços de Hemoterapia, mediante autorização do Ministério da Saúde, poderão encaminhar a matéria prima a outros centros de produção de hemoderivados, resguardado o caráter da não-comercialização, nos termos do § 3º do art. 14 da Lei nº 10.205, de 2001. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
§ 1º No caso previsto no caput, toda a produção dos outros centros de produção de hemoderivados deverá ser disponibilizada ao Ministério da Saúde. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
§ 2º Havendo solicitação concomitante dos Serviços de Hemoterapia para o fornecimento do plasma excedente do uso hemoterápico, para servir de matéria prima para indústrias e laboratórios de produção de reagentes de diagnóstico, painéis e outros insumos hemoterápicos, ou para instituições de ensino e pesquisa, o Ministério da Saúde poderá autorizar o envio na forma prevista neste Anexo IV, desde que esse fornecimento não incorra em prejuízo à produção dos medicamentos apoiada por esta Portaria. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
Art. 4º Cabe à Hemobrás, no cumprimento de suas atribuições previstas no art. 3º da Lei nº 10.972, de 2004, o gerenciamento do plasma excedente do uso hemoterápico para uso industrial e de pesquisa, no que concerne à produção de medicamentos hemoderivados e outros produtos hemoterápicos, devendo ainda: (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
I - planejar e operacionalizar, junto aos serviços de hemoterapia fornecedores de plasma, o recolhimento do plasma excedente do uso hemoterápico, conforme a sua capacidade de absorção de matéria prima e de produção de medicamentos; (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
II - informar ao Ministério da Saúde, no primeiro semestre do ano imediatamente anterior, a previsão de disponibilidade de medicamentos hemoderivados a serem produzidos; (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
III - informar aos órgãos de vigilância sanitária, a cada partida de produção: (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
a) a origem e quantidade de matéria-prima, a qual deverá ser obrigatoriamente testada; e (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
b) a expedição de produtos acabados ou semiacabados, conforme nos termos do art. 21 da Lei nº 10.205, de 2001; e (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
IV - apresentar ao Ministério da Saúde, até o dia 10 de janeiro de cada ano, relatório detalhado, no qual deve constar, discriminado por serviço de hemoterapia de origem do plasma: (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
a) o quantitativo de plasma recolhido no ano anterior; e (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
b) os prazos de validade do plasma estocado. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
Art. 5º Em caso de envio do plasma excedente do uso terapêutico para uso industrial no exterior na produção de medicamento, nos termos do inciso VIII do art. 16 da Lei nº 10.205, de 2001, a Hemobrás deverá obter autorização junto ao Ministério da Saúde antes do início dos trâmites de exportação da matéria-prima. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
Parágrafo único. É vedada a doação ou exportação de sangue, componentes e hemoderivados, salvo nas hipóteses excepcionais previstas no § 1º do art. 14 da Lei nº 10.205, de 2001. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
§ 1º A concessão de autorização para exportação excepcional do plasma recolhido para uso na produção de hemoderivados no exterior de que trata o caput é específica para cada envio de matéria prima para o exterior. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 2º O pedido de autorização deverá ser encaminhado à CGSH/DAET/SAES/MS, acompanhado das seguintes informações: (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
I - manifestação técnica, contendo, dentre outros: (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
a) a finalidade da exportação; (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
b) os dados gerais do acordo, contrato ou outro instrumento congênere ao qual está vinculado o envio, incluindo as partes envolvidas e o prazo de vigência; (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
c) a finalidade do uso do plasma; e (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
d) o total de plasma e relação do total de bolsas a serem enviadas, por origem, tipo de plasma e quantidades por serviço fornecedor; (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
II - extrato no DOU de acordo, contrato ou outro instrumento congênere; (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
III - dados e documentos da exportação; e (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
IV - relatório de saldos de bolsas enviadas, utilizadas e descartadas no exterior. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 3º A solicitação de autorização será analisada pela CGSH/DAET/SAES/MS, que avaliará a conformidade com os critérios previstos nesta Portaria e, em caso de aprovação, emitirá documento de autorização de exportação do plasma à Hemobrás. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 4º Após a emissão da autorização de exportação, a Hemobrás garantirá ao Ministério da Saúde: (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
I - o acesso às informações relativas ao plasma humano brasileiro em seus estoques no Brasil e no exterior para verificação do material destinado ao uso industrial na produção de hemoderivados; e (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
II - o acesso in loco, a qualquer tempo, aos referidos estoques, seja em instalações próprias ou de parceiros comerciais e de transferência de tecnologia. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
§ 5º É vedada a doação ou exportação de sangue, componentes e hemoderivados, salvo nas hipóteses excepcionais previstas no § 1º do art. 14 da Lei nº 10.205, de 2001. (Redação dada pela PRT GM/MS nº 569 de 18.03.2022)
Art. 6º Os medicamentos hemoderivados produzidos pela Hemobrás a partir do uso industrial do plasma excedente do uso hemoterápico, conforme art. 1º deste Anexo, serão destinados ao Ministério da Saúde, até o limite de sua necessidade, de forma que a produção dos referidos medicamentos será ressarcida na forma legalmente prevista. (Redação dada pela PRT GM/MS nº 1.710 de 08.07.2020)
ANEXO V
TABELA DE REFERÊNCIA PARA O RESSARCIMENTO ENTRE SERVIÇOS DE HEMOTERAPIA SUS/INSTITUIÇÕES PRIVADAS DE SAÚDE PARA O CUMPRIMENTO DA PORTARIA Nº 1.737/GM, DE 19 DE AGOSTO DE 2004 (Origem: PRT MS/GM 1469/2006, Anexo 1)
| Hemocomponentes ou procedimentos | Valor referência em reais |
|---|---|
| Custos operacionais do Sangue Total* | 285 |
| Custos operacionais do Concentrado de Hemácias* | 150 |
| Custos operacionais do Concentrado de Plaquetas Randômico* | 135 |
| Custos operacionais do Concentrado de plaquetas de Aférese (8 unid)* | 900 |
| Custos operacionais do Plasma Fresco Congelado* | 125 |
| Custos operacionais do Crioprecipitado* | 100 |
| Custos operacionais do Concentrado de Leucócitos de Aférese* | 1750 |
| Deleucotização de concentrado de Hemácias | 80 |
| Deleucotização de concentrado de plaquetas | 85 |
| Irradiação (por bolsa) | 20 |
| Lavagem de componentes celulares (Sistema aberto) | 10 |
| Lavagem de componentes celulares (Sistema fechado) | 110 |
| Fenotipagem para dois sistemas (Rh e Kell) | 45 |
| Fenotipagem de três ou mais sistemas | 65 |
| Aliquotagem de componente | 25 |
| Programa Auto-transfusão pré-depósito (por bolsa) | 350 |
| Seleção Pré-Transfusional I (ABO/Rh/PAI) | 30 |
| Seleção Pré-Transfusional II (Prova de compatibilidade) | 15 |
| Seleção Pré-Transfusional III (Recém-nascido) | 30 |
| Painel de Hemácias para identificação de anticorpos irregulares | 43 |
Obsevação:
*Entende-se por custos operacionais: valores referentes a insumos, materiais, exames sorológicos, imuno-hematológicos e demais exames laboratoriais, realizados para a seleção dos referidos materiais biológicos, bem como honorários por serviços médicos.
ANEXO VI
INSTRUMENTO DE CONTROLE E AVALIAÇÃO DE SERVIÇOS PRESTADOS NÃO-SUS (INDICADORES) (Origem: PRT MS/GM 1469/2006, Anexo 2)
Instrumento de controle e avaliação de serviços prestados não-SUS (indicadores)
Indicadores de acompanhamento do fornecimento de sangue por unidades públicas a pacientes não-SUS.
1 - Taxa de estoque de segurança.
[Nº de CH liberados] - [Nº de CH trans- X 100 fundidos]
________________________________________
Nº de CH transfundidos
Avaliação de período de 180 dias.
O serviço público pode absorver demandas de atendimento não-SUS se apresentar taxa 10% de acordo com o número de coletas no último ano,
Valor inferior a 10% deverá ser plenamente justificado no relatório de avaliação e controle (Anexo III).
2 - Percentual de coletas na população da região de abrangência
Nº de Coletas de ST realizadas na região de abran- X 100 gência em 12 meses
_________________________________________________________________
População estimada na região de abrangência no último mês do mesmo período
O serviço público para absorver novas demandas deverá ter a porcentagem < 3%.
3 - Percentual de Transfusões realizadas em pacientes não- SUS
Total de hemocomponentes transfundidos não- X 100 SUS
_______________________________________________
Total de hemocomponentes transfundidos no período
Indicador de acompanhamento do atendimento não-SUS pela hemorrede pública brasileira (regional e geral).
ANEXO VII
ABATIMENTO DOS SERVIÇOS PRESTADOS A NÃO-SUS DOS SERVIÇOS PRESTADOS AO SUS (Origem: PRT MS/GM 1469/2006, Anexo 3)
Abatimento dos serviços prestados a não-SUS dos serviços prestados ao SUS.
1. Proposta
Componentes obtidos a partir de unidade de Sangue Total (± 450 mL)
| Componente | Fração de abatimento de cada módulo da tabela SUS |
| Concentrado de Hemácias | 0,5 |
| Concentrado de Plaquetas Randômico | 0,2 |
| Plasma | 0,3 |
| Crioprecipitado | 0,2 |
| Coleta por aférese | 1 |
| Alíquotas de concentrados de Hemácias | 0,5 |
2. Procedimentos que devem ser abatidos:
| Módulo a serem descontados | |
| 37.011.01-4 | Triagem |
| 37.011.02-2 | Coleta de Sangue |
| 37.011.03-0 | Coleta por Processadora de Sangue |
| 37.021.01-0 | Exames de Imuno-hematologia |
| 37.031.01-5 | Sorologia I |
| 37.041.01-0 | Processamento de Sangue |
OBS. Os Códigos de referencia são da atual tabela SAI/SUS e deverão ser atualizados sempre que necessário
3. Modelo de demonstrativo de abatimento do Faturamento SUS
Demonstrativo de Prestação de Serviços não-SUS
I - Identificação
HEMOCENTRO
Endereço:
CNPJ nº:
Inscrição Estadual nº:
Dirigente:
| II. Produção (1) | |
| Módulos | Quantitativo |
| 37.011.01-4 - Triagem Clinica | |
| 37.011.02-2 - Coleta de Sangue | |
| 37.011.03-0 - Coleta processadora automática | |
| 37.021.01-0 - Exames Imuno-hematológicos | |
| 37.031.01-5 - Sorologia I | |
| 37.041.01-0 - Processamento | |
| III. Atendimento (não-SUS) | |||
| Hemocomponentes | Quantitativo | Índice de Abatimento | Quantitativo abatido |
| Sangue Total | X 1,0 | 0 | |
| Concentrado de Hemácias | X 0,5 | 0 | |
| Concentrado de Plaquetas | X 0,2 | 0 | |
| Plasma | X 0,3 | 0 | |
| Crioprecipitado | X 0,3 | 0 | |
| TOTAL (2) | 0 | ||
| Plaquetaférese (3) | 0 | X 1,0 | 0 |
| IV. FATURAMENTO SUS apresentado (1) - (2 e 3) | |
| Módulos | Quantitativo |
| 37.011.01-4 - Triagem Clinica | 0 |
| 37.011.02-2 - Coleta de Sangue | 0 |
| 37.011.03-0 - Coleta Plaquetaférese | 0 |
| 37.021.01-0 - Exames Imuno-hematológicos | 0 |
| 37.031.01-5 - Sorologia I | 0 |
| 37.041.01-0 - Processamento | 0 |
4. Caso Exemplo
Exemplo:
No mês de abril de 2005 o hemocentro forneceu à rede não- SUS 250 CH, 50 Plasmas e 30 concentrados plaquetários. O que se deve abater da fatura apresentada ao SUS?
| Componente | Fração de abatimento de cada módulo da tabela SUS | Exemplo |
| Concentrado de Hemácias | 0,5 | 250 x 0,5 = 125 |
| Concentrado de Plaquetas Randômico | 0,2 | 30 x 0,2 = 6 |
| Plasma | 0,3 | 50 x 0,3 = 15 |
| Crioprecipitado | 0,2 | 0 |
| TOTAL | 146 coletas | |
No exemplo deverão ser abatidos da fatura apresentada ao SUS 146 cobranças nos módulos de Triagem Clínica, Coleta ST, Exames Imuno-hematológicos, Exames Sorológicos e Processamento.
ANEXO VIII
TERMO DE ADESÃO MUNICIPAL AO PROGRAMA DE VOLTA PARA CASA (Origem: PRT MS/GM 2077/2003, Anexo 1)
MUNICÍPIO: _________________________________ UF:______
ENDEREÇO: ______________________________ CEP:_______
NOME DO PREFEITO:___________________________________
NOME DO SECRETÁRIO MUNICIPAL DE SAÚDE: _________________ RG:_______
A Prefeitura Municipal de_________________________________solicita adesão ao Programa “De Volta Para Casa”, que se destina à assistência, acompanhamento e integração social, fora de unidade hospitalar, de pacientes acometidos de transtornos mentais, egressos de longa internação em hospitais ou unidades psiquiátricas, sendo o auxílio parte integrante de um programa de ressocialização de pessoas com transtorno mental e excluídas do convívio social, conforme definido em Lei nº 10.708 de 31 de julho de 2003 e em Portaria GM/Nº 2077/GM, de 31 de outubro de 2003.
Ao aderir ao Programa, esta Prefeitura Municipal, por intermédio de sua Secretaria de Saúde, assume os seguintes compromissos:
-ser responsável pela atenção integral em saúde e assegurar a continuidade de cuidados em saúde mental, em programas extra- hospitalares, para os beneficiários do Programa:
-seleção, avaliação, preenchimento e encaminhamento de ficha cadastral e demais documentações exigidas dos beneficiários a
serem incluídos no Programa;
-realizar o acompanhamento dos beneficiários inseridos no programa;
-avaliar o desempenho e implantação do programa em nível municipal; e
- submeter ao Conselho Municipal de Saúde informações sobre o desenvolvimento contínuo das ações realizadas pelo Município quanto à implementação e resultados do programa, aos beneficiários atendidos.
O(A) Coordenador(a) Responsável pelo Programa “De Volta para Casa” neste Município será:
NOME COMPLETO:___________________________________________
REG: ___________________________
Assinatura do(a) Coordenador(a) do Programa:
Local e Data: __________________, _______ de _______ de _____
________________________________________________________
Assinatura do Secretário Municipal de Saúde
________________________________________________________
Assinatura do Prefeito Municipal
ANEXO IX
SOLICITAÇÃO DE AUXÍLIO-REABILITAÇÃO PSICOSSOCIAL (Origem: PRT MS/GM 2077/2003, Anexo 2)
Eu _____________________________________________, solicito, enquanto um direito a mim facultado no inciso 1º, do artigo 3º, da Portaria GM Nº 2077/GM de 31 de outubro de 2003, a inclusão para recebimento do auxílio-reabilitação psicossocial criado pela Lei Nº 10.708, de 31 de julho de 2003.
Local e Data:_________________, ____de _____________ de_____
________________________________________________________
Assinatura/Impressão digital do Beneficiário Solicitante
HOSPITAL (com CNPJ) OU SERVIÇO RESIDENCIAL TERAPÊUTICO DE ORIGEM DO SOLICITANTE:
________________________________________________________
ANEXO X
SOLICITAÇÃO DE AUXÍLIO-REABILITAÇÃO PSICOSSOCIAL PELO REPRESENTANTE LEGAL (Origem: PRT MS/GM 2077/2003, Anexo 3)
Eu___________________________________, representante legal de_________________________________________________, enquanto direito facultado no inciso 1º do artigo 3º, da Portaria GM Nº 2077/GM de 31 de outubro de 2003, e atendendo às condições legais para tanto, solicito a inclusão da pessoa, à qual represento, para ser beneficiária do recebimento do auxílio-reabilitação psicossocial, criado pela Lei nº 10.708, de 31 de julho de 2003.
ANEXO XI
INSTRUÇÃO NORMATIVA (Origem: PRT MS/GM 2077/2003, Anexo 4)
Esta Instrução Normativa da portaria do Programa “De Volta Para Casa”, criado pelo Ministério da Saúde, visa oferecer orientações importantes que complementam assuntos referidos em artigos desta portaria para auxiliar na implantação deste programa.
1 - RESPONSABILIDADE DOS GESTORES DO SUS COM O PROGRAMA
I - Ao nível municipal compete:
-ser responsável pela atenção integral em saúde e assegurar a continuidade de cuidados em saúde mental, em programas extra-hospitalares para os beneficiários do programa;
-seleção, avaliação, preenchimento e encaminhamento ao Ministério da Saúde de informações cadastrais necessárias dos beneficiários a serem incluídos no Programa; e
-acompanhamento dos beneficiários inseridos no programa.
II - Ao nível estadual compete:
-acompanhar as ações dos Municípios vinculados ao programa;
-confirmar o Município como apto a se inserir no programa;
-analisar os recursos provenientes das solicitações indeferidas pelos Municípios; e
-ter papel articulador entre os Hospitais de Custódia e Tratamento Psiquiátrico e Município, quanto da indicação de pessoas em condições de serem beneficiadas pelo programa.
III - Ao nível federal compete:
-cadastrar os beneficiários dos Municípios habilitados no programa, que não estão em Gestão Plena do Sistema;
-organizar e consolidar os cadastros dos beneficiários e dos Municípios inseridos no programa;
-zelar pelo monitoramento e avaliação do programa;
-definir critérios de prioridade de inclusão de beneficiários por Municípios;
-julgar os recursos provenientes do âmbito municipal ou estadual;
-o processamento mensal da folha de pagamento aos beneficiários do programa; e
-constituir Comissão Gestora do Programa “De Volta Para Casa”.
2 - BENEFICIÁRIOS
Para fins de cálculo de tempo de internação, períodos de alta por transferência para outros serviços, em razão de intercorrências clínicas ou cirúrgicas, não serão considerados interrupções de internação para fins de contabilizar a temporalidade de internação exigida.
3 - QUANTO A INCLUSÃO DE BENEFICIÁRIOS NO PROGRAMA
O Município deverá preencher cadastro de inclusão de beneficiário para o programa e enviá-lo ao Ministério da Saúde, quando:
-da solicitação de inclusão no programa por parte do beneficiário, ou seu representante legal;
-a avaliação de equipe de saúde local confirmar os requisitos exigidas na Lei nº 10.708/2003, para inclusão no programa; e da habilitação do Município pelo Ministério da Saúde no Programa.
Será necessário que a pessoa incluída no programa esteja de alta hospitalar ou morando em residência terapêutica; com suas famílias de origem ou famílias substitutas, ou formas alternativas de moradia e de convívio social.
4 - ATENÇÃO CONTINUADA EM SAÚDE MENTAL NO MUNICÍPIO
O Município habilitado designará equipe de saúde específica de apoio direto aos beneficiários, para garantir ao beneficiado a atenção continuada em saúde mental, na rede de saúde local ou regional. Esta equipe deverá ter suas ações baseadas em proposta de reabilitação psicossocial assistida, a serem explicitadas em programa de saúde mental municipal, o qual deverá conter estratégia de acompanhamento dos beneficiários e de avaliação regular do processo de reintegração social destes.
5 - RESPONSABILIDADES DO REPRESENTANTE LEGAL
O representante legal do beneficiário do programa terá sua indicação e desempenho supervisionados pela equipe de saúde do Município. Se for identificado caso de inadequado e ilícito uso, por parte do representante legal, do benefício recebido, deverão ser tomadas medidas cabíveis no âmbito municipal, em primeira instância, para intervenção e responsabilização quanto aos atos infligidos, podendo vir a ser necessário o recurso a outras instâncias.
6 - CONTROLE E AVALIAÇÃO DO PROGRAMA
6.1 - MINISTÉRIO DA SAÚDE
Compete à Comissão de Acompanhamento do Programa “De Volta Para Casa” definir estratégias de acompanhamento e avaliação da implantação do programa junto aos Municípios. Caberá auditoria interna para apuração de irregularidade quanto ao pagamento indevido, inclusão e exclusão de beneficiários.
6.2 - ESTADO
Acompanhar e apoiar a implementação do programa junto aos Municípios habilitados de seu Estado;
Constituir Comissão de acompanhamento do Programa em âmbito estadual, quando houver Municípios do Estados habilitados no programa.
6.3 - MUNICÍPIO
O Município habilitado assegurará atenção continuada de saúde mental na rede de saúde e promoverá avaliações do processo de implantação do programa, cabendo ao mesmo enviá-las para o Ministério da Saúde, através instrumento específico, a ser determinado pela Comissão de Acompanhamento do Programa e divulgado pelo Ministério da Saúde.
7 - COMISSÃO DE ACOMPANHAMENTO DO PROGRAMA
A Comissão de Acompanhamento do Programa deverá ser constituída em portaria e terá dentre seus membros: representante do Conass, representante do Conasems, representante da Comissão Intersetorial de Saúde Mental do Conselho Nacional de Saúde e Departamento de Ações Programáticas Estratégicas - Saúde Mental - Secretaria de Atenção à Saúde do Ministério da Saúde.
8 - RESPONSABILIDADE DA INSTITUIÇÃO FINANCEIRA OFICIAL
A instituição financeira oficial deverá, mediante remuneração e condições a serem pactuadas com o Ministério da Saúde, obedecidas as formulações legais: organizar e operar a logística de pagamento dos benefícios; elaborar os relatórios financeiros necessários ao acompanhamento, à avaliação e à auditoria da execução do programa por parte do Ministério da Saúde.
ANEXO XII
FORMULÁRIO DE INCLUSÃO DO SOLICITANTE (Origem: PRT MS/GM 2077/2003, Anexo 5)
FORMULÁRIO DE INCLUSÃO DO SOLICITANTE
1. DADOS DO ESTABELECIMENTO:
-Inclusão ou Alteração (DADO OBRIGATÓRIO)
-Nº CNES Estabelecimento (DADO OBRIGATÓRIO)
-Nome do Estabelecimento (DADO OBRIGATÓRIO)
-Código IBGE (DADO OBRIGATÓRIO)
-Data de Preenchimento (DADO OBRIGATÓRIO)
2. DADOS RESIDENCIAIS:
-UF (DADO OBRIGATÓRIO)
-Número do IBGE (DADO OBRIGATÓRIO)
-Nome do Município (DADO NÃO OBRIGATÓRIO)
-Tipo do Logradouro (DADO OBRIGATÓRIO)
-Nome do Logradouro (DADO OBRIGATÓRIO); Número (DADO OBRIGATÓRIO); Complemento (DADO NÃO OBRIGA- TÓRIO); Bairro/Distrito (DADO OBRIGATÓRIO); CEP (DADO OBRIGATÓRIO); DDD-Telefone (DADO NÃO OBRIGATÓRIO)
3. DADOS PESSOAIS:
- Nome Completo - sem abreviaturas (DADO OBRIGATÓRIO)
- Nome da Mãe - sem abreviaturas (DADO OBRIGATÓRIO)
-Nome do Pai (DADO NÃO OBRIGATÓRIO)
-Sexo (DADO OBRIGATÓRIO)
-Raça/Cor (DADO NÃO OBRIGATÓRIO)
-Situação Familiar (DADO NÃO OBRIGATÓRIO)
-Nacionalidade (DADO OBRIGATÓRIO)
-Data de Nascimento dd/mm/aaaa (DADO OBRIGATÓRIO)
-UF de Nascimento (DADO OBRIGATÓRIO)
-Município de Nascimento (DADO OBRIGATÓRIO)
-Nome do Município (DADO NÃO OBRIGATÓRIO)
-Escolaridade (DADO NÃO OBRIGATÓRIO)
-Freqüenta Escola? Sim ou Não (DADO OBRIGATÓRIO)
-CBOR - Código Brasileiro de Ocupação-reduzido (DADO NÃO OBRIGATÓRIO)
-Ocupação (DADO NÃO OBRIGATÓRIO)
-PIS/PASEP (DADO NÃO OBRIGATÓRIO)
-CPF (DADO NÃO OBRIGATÓRIO)
-CERTIDÃO/TIPO (DADO OBRIGATÓRIO) - ou RG (Identidade)
-Identidade ((DADO OBRIGATÓRIO) - ou Certidão/Tipo
-Data de Emissão da Identidade (DADO NÃO OBRIGATÓRIO)
-UF da Identidade (DADO NÃO OBRIGATÓRIO)
-Órgão Expedidor (DADO NÃO OBRIGATÓRIO)
4. DADOS ESPECÍFICOS QUANTO AO PROGRAMA DE VOLTA PARA CASA (DADOS NÃO OBRIGATÓRIOS)
-Tipo de Moradia: Serviço Residencial Terapêutico; Moradia com Familiares; Mora Sozinho ou Outro.
-Procedência (instituição de origem do beneficiário): Serviço Residencial Terapêutico; Hospital Psiquiátrico; Hospital de Custódia e Tratamento Psiquiátrico.
-Tempo de internação: 2 anos; entre 2 e 5 anos; entre 5 e 10 anos; acima de 10 anos.
INFORMAÇÃO IMPORTANTE: Se o beneficiário possuir representante legal também serão necessárias as mesmas informações, acima descritas, deste representante, exceto tipo de moradia e tempo de internação e procedência. O nº do CNES deverá ser o mesmo do beneficiário.
ANEXO XIII
TERMO DE COMPROMISSO (Origem: PRT MS/GM 2077/2003, Anexo 6)
Eu,____________________________________________, na qualidade de representante legal de ___________________________, beneficiário do “De Volta Para Casa”, comprometo-me a receber o benefício criado pela Lei Nº 10.708, de 31 de julho de 2003, e a:
-zelar fielmente pelos direitos e deveres do beneficiário no âmbito do referido Programa;
-incumbir-me do dever de representar os interesses de um paciente em qualquer matéria especificada, ou de direitos específicos em seu nome, nos termos dos princípios para a Proteção de Pessoas Acometidas de Transtornos Mentais (ONU, 1991); e
-Prestar todas as informações que me forem solicitadas pela equipe de Saúde Mental responsável pelo acompanhamento do beneficiário.
Local e Data: ______________, ____ de ________ de _____
________________________________________________
Assinatura/Impressão digital do Solicitante
ANEXO XIV
MODALIDADES DE CENTROS DE ESPECIALIDADES ODONTOLÓGICAS (CEOS) TIPO 1, 2 E 3 (Origem: PRT MS/GM 599/2006, Anexo 1)
Modalidades de Centros de Especialidades Odontológicas (CEOs) Tipo 1, 2 e 3
| CEO I | CEO II | CEO III | |
| Atividades | Diagnóstico bucal, com ênfase ao câncer; periodontia especializada; cirurgia oral menor dos tecidos moles e duros; endodontia; atendimento a portadores de necessidades especiais. | Idem | Idem |
| Equipamentos e materiais | Aparelho de raios-X dentário; equipo odontológico; canetas de alta e baixa rotação; amalgamador; fotopolimerizador; compressor compatível com os serviços; instrumentais compatíveis com os serviços; e 3 consultórios odontológicos completos (cadeira, unidade auxiliar, equipo e refletor) | Aparelho de raios-X dentário; equipo odontológico; canetas de alta e baixa rotação;amalgamador; fotopolimerizador; compressor compatível com os serviços; instrumentais compatíveis com os serviços; e 4 a 6 consultórios odontológicos completos (cadeira, unidade auxiliar, equipo e refletor). | Aparelho de raios-X dentário; equipo odontológico; canetas de alta e baixa rotação; amalgamador; fotopolimerizador; compressor compatível com os serviços; instrumentais compatíveis com os serviços; e 7 ou mais consultórios odontológicos completos (cadeira, unidade auxiliar, equipo e refletor) |
| Outros recursos | Mobiliário e espaço físico compatível com os serviços ofertados. | Mobiliário e espaço físico compatível com os serviços ofertados. | Mobiliário e espaço físico compatível com os serviços ofertados |
| Recursos humanos | 3 ou mais cirurgiões dentistas e 1 auxiliar de consultório dentário por consultório odontológico. Obs: cada um dos consultórios odontológicos deve ser utilizado para a realização de procedimentos clínicos por, no mínimo, 40 horas semanais, independente do número de cirurgiões dentistas que nele atuem. No mínimo de pessoal de apoio administrativo - recepcionista, auxiliar de serviços gerais e auxiliar administrativo. |
4 ou mais cirurgiões dentistas e 1 auxiliar de consultório dentário por consultório odontológico. Obs: cada um dos consultórios odontológicos deve ser utilizado para a realização de procedimentos clínicos por, no mínimo, 40 horas semanais, independente do número de cirurgiões dentistas que nele atuem. No mínimo de pessoal de apoio administrativo - recepcionista, auxiliar de serviços gerais e auxiliar administrativo. |
7 ou mais cirurgiões dentistas e 1 auxiliar de consultório dentário por consultório odontológico. Obs: cada um dos consultórios odontológicos deve ser utilizado para a realização de procedimentos clínicos por, no mínimo, 40 horas semanais, independente do número de cirurgiões dentistas que nele atuem. No mínimo de pessoal de apoio administrativo - recepcionista, auxiliar de serviços gerais e auxiliar administrativo. |
ANEXO XV
PROJETO DE REDUÇÃO DA MORBIMORTALIDADE POR ACIDENTES DE TRÂNSITO - MOBILIZANDO A SOCIEDADE E PROMOVENDO A SAÚDE (Origem: PRT MS/GM 344/2002, Anexo 1)
Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde
APRESENTAÇÃO
O Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde, a seguir apresentado, tem como fundamentação:
a) a Lei N.° 9503, de 23 de setembro de 1997, que institui o Código de Trânsito Brasileiro o qual, em seu Art. 78 e parágrafo único, estabelece o desenvolvimento e a implementação de programas destinados à prevenção de acidentes por parte dos Ministérios da Saúde, Educação e do Desporto, do Trabalho, dos Transportes e da Justiça, por intermédio do Conselho Nacional de Trânsito (Contran);
b) o disposto na Portaria N.º 737 MS/GM, de 16 de maio de 2001, que determina aos órgãos e entidades do Ministério da Saúde a promoção, a elaboração ou a readequação de seus planos, programas, projetos e atividades em conformidade com as diretrizes e responsabilidades estabelecidas na Política Nacional de Redução da Morbimortalidade por Acidentes e Violência; e
c) a diretriz da referida Política Nacional relativa à promoção da adoção de comportamentos e de ambientes seguros e saudáveis.
1. JUSTIFICATIVA
Os acidentes de trânsito são um importante problema de saúde pública no País. Visando articular ações de prevenção da morbimortalidade por tais agravos, no âmbito do sistema de saúde, o Ministério da Saúde apresenta o Projeto de Redução da Morbimortalidade por Acidentes de Trânsito - Mobilizando a Sociedade e Promovendo a Saúde, com destaque para as medidas a serem implementadas nos aglomerados urbanos onde se concentra a maior parte da malha viária e as ocorrências de casos e óbitos.
Atualmente, os acidentes de trânsito constituem, entre as causas externas, a maior causa de internação, além gerar altos custos hospitalares, perdas materiais, despesas previdenciárias e grande sofrimento para as vítimas e os seus familiares. Em 1998, ocorreram 30.994 óbitos por acidentes de transporte, coeficiente de 19,16 por 100 mil habitantes, o que, por si só, expressa a relevância epidemiológica e social do tema e a necessidade de uma articulação intersetorial entre as áreas de saúde e trânsito. Tais conseqüências demonstram o significativo peso econômico e social dos acidentes de trânsito, reforçando sobremaneira a importância desta proposta de intervenção.
O novo Código de Trânsito Brasileiro, vigente desde 21 de janeiro de 1998 - Lei N.º 9.503 -, confere atribuições do Ministério da Saúde em relação aos acidentes de trânsito, estabelecendo, por intermédio do Conselho Nacional de Trânsito, financiamento para a implementação de programas, no âmbito do SUS, destinados à prevenção de acidentes. Como eixos operacionais, o presente Projeto visa sensibilizar prioritariamente os gestores estaduais e municipais da área da saúde, da educação e de trânsito; capacitar equipes de profissionais de saúde dos serviços de emergência para a melhoria das informações; e mobilizar a sociedade para atitudes positivas em relação às medidas preventivas no trânsito, mediante a capacitação de representantes de sindicatos de empregadores e condutores de veículos de grande e pequeno porte, profissionais da mídia e representantes de organizações da sociedade civil comprometidas com as questões de cidadania, os quais atuarão como multiplicadores de informações e de medidas sobre prevenção de acidentes.
Adicionalmente, outro grande eixo é a melhoria da qualidade das informações sobre os eventos relacionados aos acidentes de trânsito, no âmbito dos vários órgãos e instituições que atuam na área. Essas informações não apenas auxiliarão o planejamento e a execução de políticas públicas no setor, como também permitirão acompanhar resultados e avaliar projetos de prevenção de acidentes de trânsito.
O projeto será coordenado pelo Ministério da Saúde e executado pelos governos estaduais e municipais, o que viabiliza sua execução com capilaridade. Prevê um trabalho intersetorial e com participação social, garantindo que a questão seja tratada de forma abrangente e compartilhada, facilitando assim o alcance de seu objetivo: reduzir a morbimortalidade por acidentes de trânsito.
2. ÁREAS PRIORITÁRIAS PARA O DESENVOLVIMENTO DO PROJETO
A distribuição territorial da população brasileira apresenta marcante concentração em aglomerados urbanos situados, em sua maioria, na região Sudeste e no litoral. Existem no País, atualmente, 49 aglomerados urbanos nos quais concentram-se 48% da população brasileira. Além disso, segundo dados do Denatran, a maior parte da malha viária faz a ligação entre esses grandes aglomerados, que são, ainda, os pólos de atividade econômica. A população flutuante que circula por essas estradas, vinda de outras localidades, é também elevada, ainda que dados mais precisos não estejam disponíveis.
A definição das áreas prioritárias de atuação do projeto, obedeceu a dois critérios: óbito - por acidente de trânsito - como marcador (SIM/MS-98) e o conceito de aglomerados urbanos*. Foram enumerados todos os aglomerados urbanos brasileiros, metropolitanos e não - metropolitanos, e capitais. Estudou-se a freqüência dos óbitos, o coeficiente de mortalidade específico e a mortalidade proporcional por acidentes de transporte. A partir da ponderação desses três indicadores, foi construído um índice que leva em conta a magnitude, o risco e a importância dos acidentes de transporte na mortalidade geral e sua distribuição nesses aglomerados.
*Caracterização e tendências da rede urbana no Brasil. Campinas, SP: Unicamp.IE, (Coleção Pesquisas, 3 ) v.2.IPEA/Unicamp.IE.Nessur/IBGE,1999.
O Gráfico Índice para Acidentes de Trânsito (Anexo II) mostra o índice construído e aplicado às cidades e aglomerados urbanos priorizados no Projeto, que abrangerá 84 municípios em 26 áreas metropolitanas de 14 unidades da federação, atingindo uma população total de 46.365.905 habitantes, conforme mostra o Quadro Áreas Metropolitanas priorizadas (Anexo I).
A exceção ao critério aglomerado urbano foi a inclusão de três capitais (Boa Vista, Porto Velho e Macapá) as quais, apesar de não constituírem aglomerados, apresentam isoladamente risco elevado para óbitos por acidentes de trânsito.
3. OBJETIVOS
3.1 OBJETIVO GERAL
Implementar, em aglomerados urbanos selecionados, ações de promoção da saúde e de prevenção de acidentes de trânsito, mediante a mobilização do setor saúde, prefeituras e sociedade civil organizada, no sentido de promover mudança de hábitos, atitudes, valores culturais e situações ambientais que interferem na ocorrência dos acidentes de trânsito, melhorando a qualidade da informação e reduzindo as taxas de morbimortalidade por estes eventos.
3.2 OBJETIVOS ESPECÍFICOS
- Sensibilizar e capacitar gestores estaduais e municipais para a realização de ações de promoção da saúde e de prevenção de acidentes de trânsito.
- Formular, em parceria com órgãos e entidades do Ministério da Saúde e com o Denatran, proposta para a elaboração de um sistema de notificação compulsória de agravos por causas externas em geral, e de acidentes de trânsito em particular, nas regiões escolhidas, bem como estabelecer e definir fluxo de informações entre os parceiros.
- Mobilizar e capacitar as equipes de profissionais de saúde dos serviços de emergência para a melhoria das informações.
- Construir banco de dados epidemiológicos para identificar grupos de risco e subsidiar as ações de intervenção, o qual possibilitar tanto a identificação de áreas críticas para acidentes de trânsito, quanto a integração de ações com os órgãos locais de trânsito, transporte e saúde.
- Capacitar profissionais da mídia local e representantes de organizações da sociedade civil, comprometidas com as questões de cidadania, para atuarem como agentes multiplicadores de informações sobre prevenção de acidentes.
- Mobilizar e capacitar representantes de empregadores e condutores de veículos de grande e pequeno porte.
- Tornar disponível e direcionar ao Contran/Denatran as bases de dados, indicadores, parâmetros de intervenção, relatórios de experiências e resultados.
- Produzir e apoiar a produção de materiais educativos e de suporte para o desenvolvimento das ações do Projeto.
4. ESTRATÉGIAS OPERACIONAIS
4.1 Constituir Comissão Técnica de Acompanhamento do Projeto, sob a coordenação da Secretaria de Políticas de Saúde/MS, composta por representantes do Ministério da Saúde, que ficará responsável pela assessoria, planejamento, avaliação e supervisão das ações levadas a efeito pelos estados e municípios.
4.2 Sensibilizar os gestores municipais para que incorporem os conteúdos deste Projeto às realidades, interesses e valores culturais locais, e estimular a formulação de estratégias intersetoriais para a redução da morbimortalidade por acidentes de trânsito e a melhoria do sistema de informação.
4.3 Capacitar, segundo os pressupostos deste Projeto, os condutores de veículos de grande e pequeno porte, com sede nos municípios selecionados, sensibilizando-os para as questões de violência no trânsito, suas causas, agravos e seqüelas. Tal ação objetiva qualificá-los como agentes multiplicadores das informações junto aos demais associados.
4.4 Sensibilizar os profissionais de comunicação, mediante a realização de oficinas, para utilizarem os espaços da mídia como fonte de disseminação de informações sobre a questão da violência no trânsito e suas estratégias de redução, mobilizando a sociedade e promovendo a saúde.
4.5 Sensibilizar os membros de ONGs e sociedade civil organizada para atuarem como mobilizadores que possam advogar em favor da prevenção de acidentes.
4.6 Capacitar, mediante a realização de oficinas nos aglomerados urbanos e capitais selecionadas, os profissionais de saúde, gerentes de serviços de urgência e emergência para:
- participarem da construção de sistema de notificação compulsória de agravos por causas externas;
- trabalharem para qualificar a informação;
- construirem, a partir da ficha de notificação elaborada, bancos de dados padronizados nos municípios, que possam servir de instrumento de avaliação e acompanhamento das ações de intervenção;
- tornar disponíveis para o Contran/Denatran e demais parceiros os dados consolidados a partir dos bancos municipais.
4.7 Produzir 100% dos materiais de apoio às oficinas e apoiar a produção dos materiais promocionais contendo as logomarcas do Ministério da Saúde, do Ministério da Justiça e dos municípios conveniados:
- produzir materiais de apoio à campanha: cartazes, bottons, chaveiros, adesivos, banners, outdoors etc.
- identificar espaços de veiculação alternativos e oficiais, como pontos de encontro de caminhoneiros e de táxis, estações rodoferroviárias, postos de gasolina, lojas de conveniência, oficinas mecânicas, bares, restaurantes, cafés virtuais etc.
- elaborar material específico sobre a temática para veiculação na homepage do Ministério da Saúde, estimulando a população a buscar informações também por meio do Disque Saúde e de correio eletrônico.
4.8 Adequar e aprovar os projetos municipais para repasse de recursos aos aglomerados urbanos e capitais selecionadas, levando em conta a proporcionalidade populacional e o índice encontrado.
5. METODOLOGIA
Todo o processo de desenvolvimento deste Projeto está pautado nas seguintes diretrizes:
- o planejamento participativo, em que os diversos atores sociais, incluindo a própria população, possam construir seus planos locais e regionais, atendendo às suas especificidades e particularidades;
- a descentralização administrativa, diretriz constitucional do SUS, que permeia a implementação de todas as políticas de saúde;
- a intersetorialidade, concebida como estratégia de envolvimento de múltiplos atores, organizados em torno de um objetivo comum, o que implica o estabelecimento de parcerias, com responsabilidades compartilhadas nas ações de prevenção e de promoção da redução da morbimortalidade por acidentes de trânsito.
Deve-se ainda ressaltar que, após o segundo ano de execução deste Projeto, a expectativa é de que os municípios e as regiões priorizadas possam garantir a sustentabilidade das ações iniciadas, com recursos próprios, possibilitando assim que o Ministério da Saúde invista em ações semelhantes nas demais áreas de risco no País.
6. MONITORAMENTO E AVALIAÇÃO
O monitoramento e a avaliação ficarão a cargo da Secretaria de Políticas de Saúde/MS e do Denatran/MJ e compreenderão indicadores de processo e de resultados. Os indicadores de processo serão desenvolvidos mediante a participação de uma equipe técnica multiprofissional, sob a coordenação da Secretaria de Políticas de Saúde/MS. Os indicadores de resultados estarão voltados para avaliar o impacto das ações, por intermédio de uma série de instrumentos já existentes ou gerados por essa intervenção.
O indicador escolhido para acompanhamento dos resultados é o coeficiente de mortalidade por acidentes de trânsito.
ANEXO XVI
QUADRO - ÁREAS METROPOLITANAS PRIORIZADAS (Origem: PRT MS/GM 344/2002, Anexo 2)
Quadro - Áreas metropolitanas priorizadas
| Região | UF | Área metropolitana | Total População |
| Norte | Roraima | Boa Vista | 163.024 |
| Rondônia | Porto Velho | 304.585 | |
| Amapá | Macapá | 244.972 | |
| Nordeste | Alagoas | Maceió | 766.498 |
| Pernambuco | Recife | 2.890.829 | |
| Caruaru | 259.725 | ||
| Sudeste | Rio de Janeiro | Rio de Janeiro | 10.247.097 |
| Cabo Frio | 113.813 | ||
| São Paulo | São Paulo | 16.393.741 | |
| Limeira | 401.067 | ||
| Ribeirão Preto | 467.908 | ||
| S. J. dos Campos | 1.021.975 | ||
| Minas Gerais | Belo Horizonte | 3.529.886 | |
| Espírito Santo | Vitória | 1.187.144 | |
| Sul | Paraná | Curitiba | 1.908.659 |
| Londrina | 530.455 | ||
| Cascavel | 231.901 | ||
| Maringá | 280.644 | ||
| Santa Catarina | Florianópolis | 431.310 | |
| Joinville | 418.569 | ||
| Blumenau | 240.302 | ||
| Itajaí | 141.976 | ||
| Criciúma | 164.973 | ||
| Centro Oeste | Goiás | Goiânia | 1.345.942 |
| Distrito Federal | Brasília | 2.043.007 | |
| Mato Grosso | Cuiabá | 655.236 | |
| Total geral | 14 | 26 | 46.365.905 |
ANEXO XVII
GRÁFICO: ÍNDICE* PARA ACIDENTES DE TRÂNSITO - CIDADES E AGLOMERADOS URBANOS PRIORIZADOS - BRASIL, 1998. (Origem: PRT MS/GM 344/2002, Anexo 3)
*Índice – composto pelos indicadores; freqüência de óbitos, coeficiente de mortalidade proporcional para acidentes de transporte.
** Capital exclusiva.
*** Cidade pólo e respectivo aglomerado.
ANEXO XVIII
COMPETÊNCIAS E ATRIBUIÇÕES RELATIVAS À IMPLANTAÇÃO/GESTÃO DO PROGRAMA NACIONAL DE ATENÇÃO COMUNITÁRIA INTEGRADA A USUÁRIOS DE ÁLCOOL E OUTRAS DROGAS (Origem: PRT MS/GM 816/2002, Anexo 1)
COMPETÊNCIAS
1. Compete ao Ministério da Saúde:
a - Instituir o Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e outras Drogas, seus princípios e diretrizes de implantação e funcionamento, estabelecendo critérios/exigências de habilitação de serviços, critérios de implantação das redes de assistência aos portadores de transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas e critérios técnicos de desenvolvimento do trabalho;
b - Atribuir à Assessoria Técnica da Secretaria de Assistência à Saúde (ASTEC/SAS/MS) a coordenação do Programa em âmbito nacional;
c - Definir e implementar ações de vigilância epidemiológica e sanitária no que se refere aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e drogas;
d - Definir e implementar planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos pacientes com dependência e/ou uso prejudicial de álcool e outras drogas, estabelecendo convênios de cooperação técnica com as instituições formadoras ou serviços;
e - Estabelecer as normas de funcionamento e cadastramento de serviços que integrarão as redes assistenciais;
f - Articular com os estados, municípios e o Distrito Federal a implantação do Programa e o estabelecimento de mecanismos de controle, avaliação e acompanhamento do processo;
g - Assessorar os estados e o Distrito Federal na implantação, em seus respectivos âmbitos de atuação, do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e outras Drogas e na organização de suas respectivas Redes Estaduais;
h - Utilizar os sistemas de informação epidemiológica e assistencial para constituir um banco de dados que permita acompanhar e avaliar o desenvolvimento do Programa, definindo seus indicadores;
i - Apoiar a realização de estudos de prevalência de base populacional para o conhecimento da distribuição dos pacientes portadores de transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas e outras pesquisas relevantes;
j - Alocar recursos financeiros destinados ao co-financiamento das atividades do Programa;
l - Divulgar o Programa de maneira a conscientizar e informar a população e os profissionais de saúde sobre a importância da realização das ações preventivas e assistenciais previstas no Programa.
2. Compete às Secretarias de Saúde dos Estados e do Distrito Federal:
a - Elaborar, em parceria com as Secretarias Municipais de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas;
b - Designar um Coordenador Estadual do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e Outras Drogas, em articulação com o Programa de Saúde Mental do Estado;
c - Organizar e implantar rede estadual estratégica de serviços extra-hospitalares de atenção aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas, identificando os serviços delas integrantes, os Centros de Atenção Psicossocial, estabelecendo os fluxos de referência e contra-referência entre estes serviços e garantindo a execução de todas as fases do processo assistencial previsto no Programa;
d - Criar as condições para a estruturação/criação/implantação/cadastramento dos Centros de Atenção Psicossocial para Atendimento de Pacientes com dependência e/ou uso prejudicial de Álcool e outras Drogas;
e - Definir e implementar ações de vigilância epidemiológica e sanitária no que se refere aos transtornos causados pelo uso prejudicial ou dependência de álcool e drogas;
f - Definir e implementar planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos portadores de transtornos causados pelo uso abusivo de álcool e drogas;
g - Assessorar os municípios no processo de implementação do Programa, no desenvolvimento das atividades e na adoção de mecanismos destinados ao controle, avaliação e acompanhamento do processo;
h - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento/incremento do Programa;
i - Monitorar o desempenho do Programa em seu estado e os resultados alcançados;
j - Manter atualizados os bancos de dados que estejam sob sua responsabilidade.
3. Compete às Secretarias Municipais de Saúde:
a - Elaborar, em parceria com a respectiva Secretaria estadual de Saúde, por intermédio da Comissão Intergestores Bipartite, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Atenção Comunitária Integrada a Usuários de Álcool e outras Drogas;
b - Criar as condições para a estruturação/criação/implantação/cadastramento de Centros de Atenção Psicossocial e adotar as providências necessárias para integrá-lo(s) na rede estadual estratégica de serviços extra-hospitalares de atenção aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e outras drogas;
c - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento/incremento do Programa;
d - Monitorar o desempenho do Programa em seu município e os resultados alcançados;
e - Executar ações de vigilância epidemiológica e sanitária no que se refere aos transtornos causados pelo uso prejudicial e/ou dependência de álcool e drogas;
f - Executar programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos pacientes com dependência e/ou uso prejudicial de álcool e outras drogas;
g - Manter atualizados os bancos de dados que estejam sob sua responsabilidade, que deverão ser notificados ao gestor estadual do SUS;
ANEXO XIX
PLANO DIRETOR DE VIGILÂNCIA SANITÁRIA - PDVISA (Origem: PRT MS/GM 1052/2007, Anexo 1)
ANEXO
PLANO DIRETOR DE VIGILÂNCIA SANITÁRIA - PDVISA
EIXO I -
ORGANIZAÇÃO E GESTÃO DO SISTEMA NACIONAL DE VIGILÂNCIA SANITÁRIA NO ÂMBITO DO SUS
O reconhecimento da Vigilância Sanitária - Visa como responsabilidade indelegável do Estado e como um componente indissociável do SUS é a base estratégica do Sistema Nacional de Vigilância Sanitária - SNVS. Nesse sentido, tem-se o entendimento de que esse campo da saúde pública é, também, uma arena de conflitos e um espaço privilegiado de intervenção para a defesa dos interesses sanitários e coletivos. Portanto, cabe à Vigilância Sanitária, em articulação com as demais práticas de saúde, atuar no âmbito da proteção contra danos, riscos e determinantes dos problemas de saúde que afetam a população.
Assim, a intersetorialidade é adotada, prioritariamente, como prática de gestão, permitindo o estabelecimento de espaços compartilhados para o desenvolvimento das ações e serviços de saúde, tanto no âmbito da saúde como na relação com outros setores governamentais e não-governamentais.
No processo de fortalecimento do SNVS, os princípios e diretrizes do SUS estão permanentemente presentes. A busca, na atenção à saúde, pelos princípios da universalidade, integralidade, eqüidade, descentralização da gestão e das ações, regionalização e hierarquização dos serviços de saúde e participação social orientarão sempre o estabelecimento de políticas e a pauta de negociação entre os gestores das três esferas de governo.
Nesse sentido, a descentralização das ações de Vigilância Sanitária é, além de um princípio norteador, uma estratégia de fortalecimento desse setor nas três esferas de governo. Por isso, a revisão das responsabilidades dos gestores do Sistema ultrapassa o campo das intenções normativas e incorpora o estabelecimento de metas de cobertura e definição de indicadores de desempenho, acompanhados por processos que viabilizem o controle social. O redirecionamento pretendido ajusta-se à capacidade de gestão de cada esfera de governo e à adoção do princípio da autoridade territorial, equilibrado pelo compromisso com a avaliação e o gerenciamento do risco sanitário.
A heterogeneidade decorrente das especificidades locais implicará a construção de pactos que expressem tal diversidade, abolindo-se a utilização exclusiva da classificação das ações por níveis de complexidade. Nesse sentido, estabelece-se como ação essencial a revisão do processo de planejamento e execução das ações de Vigilância Sanitária sob uma nova ótica, a da responsabilidade sanitária, por meio da definição de um elenco norteador de ações que permita assimilar as diversidades locais, os problemas de saúde e as necessidades de intervenção diante da estrutura existente. Dessa forma, o elenco de ações deverá ser pactuado locorregionalmente como parte integrante de um processo de desenvolvimento dos serviços de Vigilância Sanitária capaz de subsidiar a descentralização e de gerar ações mais efetivas para a promoção e a proteção da saúde da população.
Há de se considerar também, no delineamento do processo de descentralização, o princípio da complementaridade das ações, sempre que o nível de execução preferencial não contar com as condições necessárias para seu desempenho.
Na lógica da descentralização, as pactuações e as programações das ações de Vigilância Sanitária devem levar em consideração o aporte de recursos financeiros dos entes federados e as novas perspectivas do financiamento setorial.
Assim, o financiamento das ações de Vigilância Sanitária acompanha as diretrizes do Pacto de Gestão para o financiamento do SUS. Nessa perspectiva compõe junto com o componente "Vigilância Epidemiológica e Ambiental" o Bloco da Vigilância em Saúde. O objetivo é que os recursos sejam alocados com vistas à superação das desigualdades de acesso e à garantia da integralidade da atenção à saúde.
Na área de organização do SNVS, as diretrizes preconizadas visam incrementar a capacidade de gestão dos órgãos que o integram nas esferas municipal, estadual e federal, por meio do delineamento das relações entre seus componentes, do estabelecimento das responsabilidades sanitárias respectivas e da adoção de instrumentos e mecanismos que garantam maior eficácia, eficiência e efetividade.
Nesse contexto, determinadas diretrizes visam à superação das deficiências de estrutura ainda observadas, como aquelas relativas à organização dos serviços e dos processos de trabalho em Vigilância Sanitária, ao estabelecimento de suporte jurídico e à gestão do trabalho, em termos qualitativos e quantitativos, assim como à implantação do Sistema Nacional de Informação em Vigilância Sanitária - Visa, que se articule com os sistemas de informações de base nacional do SUS.
Além disso, deve-se destacar a necessária articulação efetiva das políticas e práticas de Vigilância Sanitária, Vigilância Epidemiológica, Vigilância Ambiental e Saúde do Trabalhador, enfatizando-se o princípio da integralidade.
Ainda a discussão sobre o papel da rede laboratorial integrante do SNVS deve ser aprofundada na perspectiva da estruturação e manutenção de uma rede regionalizada e hierarquizada, com tecnologias adequadas aos diversos objetos de regulação da Vigilância Sanitária e com a perspectiva da retroalimentação dos conhecimentos e informações nela produzida aos demais componentes do Sistema. Para isso, é urgente a implementação de uma linha de financiamento específica para custear a estruturação e a execução das ações laboratoriais em Vigilância Sanitária, como também a definição de uma rede complementar que garanta a execução de ações laboratoriais de interesse da Vigilância Sanitária não existentes nos laboratórios de Saúde Pública.
A concretização dessas diretrizes parte dos Planos de Ação realizados em cada esfera de governo como um componente do processo de planejamento e formulação de seus Planos de Saúde, com o propósito precípuo de consolidar o Sistema Nacional de Vigilância Sanitária no âmbito do Sistema Único de Saúde.
Diretrizes do Eixo I
1. Reafirmação do caráter indissociável da Vigilância Sanitária, como componente do SUS, respeitando seus princípios e diretrizes:
a) adequação dos processos de trabalho de Vigilância Sanitária visando à integração com as demais políticas e práticas de saúde;
b) estímulo à construção de práticas de gestão que incentivem a intersetorialidade, institucionalizadas formalmente, compartilhando espaços de ações e serviços com outros setores governamentais e não governamentais que possuam interface com o campo de atuação da Vigilância Sanitária e respeitando as especificidades locais; e
c) desenvolvimento, na esfera federal, de mecanismos que garantam a integração da ANVISA com as demais áreas responsáveis por ações de promoção e proteção à saúde.
2. Revisão do processo de planejamento e execução das ações de Vigilância Sanitária, sob a ótica da responsabilidade sanitária, com a definição do elenco norteador para subsidiar a descentralização da gestão e das ações, mediante:
a) a análise dos riscos sanitários, da situação de saúde e das necessidades sociais;
b) o levantamento e análise dos recursos físicos, financeiros e humanos existentes e os necessários ao desenvolvimento das ações de Vigilância Sanitária; e
c) a definição de agendas de prioridades locorregionais, com vistas a intervenções.
3. Definição das relações e responsabilidades sanitárias das três esferas de governo, estabelecendo formas de articulação e execução de ações de Vigilância Sanitária de maneira integrada e consoante com os princípios do SUS:
a) articulação, cooperação e apoio efetivo entre Ministério da Saúde, ANVISA, Estados, Distrito Federal e Municípios, visando à consolidação do processo de estruturação do SNVS, por meio da pactuação entre as três esferas de governo;
b) definição e implementação de instrumentos de pactuação e gestão que favoreçam maior eficiência, eficácia e efetividade à ação de Vigilância Sanitária, reconhecendo e respeitando a diversidade e especificidade locorregional; e
c) aprofundamento da estruturação do SNVS para o gerenciamento dos riscos e controle sanitário de portos, aeroportos e fronteiras, por meio da pactuação e do fortalecimento da articulação entre as esferas de governo.
4. Fortalecimento da Vigilância Sanitária em todas as esferas de governo:
a) indução política da estruturação da Vigilância Sanitária a fim de que cada esfera de governo tenha estrutura e estratégias para o gerenciamento do risco sanitário local;
b) promoção da qualificação dos profissionais que atuam em Vigilância Sanitária;
c) estímulo à introdução da temática de Vigilância Sanitária na pauta dos espaços colegiados de gestão, discussão técnica e pactuação do SUS; e
d) apoio jurídico à Vigilância Sanitária, fortalecendo suas ações locais.
5. Desenvolvimento de processos de planejamento, monitoramento, avaliação e auditoria compartilhados e contínuos, nas três esferas de governo, para melhor apoiá-las no processo de assunção de suas responsabilidades:
a) desenvolvimento de processos e instrumentos de avaliação dos serviços e das ações de Vigilância Sanitária - expressos nos Relatórios de Gestão das três esferas de governo - visando à redução dos riscos e agravos à saúde; e
b) definição de metas de cobertura e de indicadores de desempenho e incorporação dos resultados das avaliações ao processo decisório nas três esferas de governo.
6. Constituição de uma política de financiamento para investimento e custeio, em consonância com as diretrizes do Pacto pela Saúde, por parte das três esferas de governo, com vistas à estruturação dos serviços e à operacionalização das ações de Vigilância Sanitária - Visa, adotando a eqüidade e a transparência na aplicação dos recursos como princípios norteadores.
7. Estruturação e implantação de um Sistema Nacional de Informação, que promova transparência e subsidie o processo de gestão do SNVS, integrado aos sistemas de base nacional do Ministério da Saúde.
8. Harmonização da Gestão do Trabalho e Educação em Vigilância Sanitária com as diretrizes da Política Nacional de Gestão do Trabalho e Educação na Saúde.
9. Articulação do Sistema Nacional de Laboratórios de Saúde Publica como suporte das ações de Vigilância Sanitária:
a) desenvolvimento de tecnologias de comunicação, para permitir a troca ágil de informações referentes à comunicação do risco sanitário;
b) definição de uma linha de financiamento para custeio e investimento; e
c) reestruturação da rede complementar de laboratórios.
10. Articulação efetiva das políticas e práticas de Vigilância Sanitária, Vigilância Epidemiológica, Vigilância Ambiental e Vigilância da Saúde do Trabalhador.
11. Consolidação da responsabilidade dos componentes do Sistema Nacional de Vigilância Sanitária de exercer seu poder de polícia em relação às condições e ambientes de trabalho.
EIXO II
AÇÃO REGULATÓRIA: VIGILÂNCIA DE PRODUTOS, DE SERVIÇOS E DE AMBIENTES
A reconfiguração da ordem econômica mundial recente e, principalmente, as expectativas de contínuas mudanças decorrentes da globalização e da rapidez da circulação de informações tornam as práticas de Vigilância Sanitária crescentemente relevantes. Os novos padrões de produção e circulação de mercadorias e seus possíveis efeitos sobre a saúde das populações têm levado à necessidade de adoção de medidas de proteção da saúde ao mesmo tempo ágeis, firmes e criativas por parte dos órgãos públicos, privados e da sociedade em geral.
No que tange à Vigilância Sanitária, a reorientação das ações de regulação constituirá medida fundamental para responder às novas exigências sociais e políticas geradas com a expansão do mercado de consumo e a diversificação dos produtos e dos serviços ofertados pelos setores produtivos.
A Vigilância Sanitária pode ser vista como espaço de intervenção do Estado, cujo objetivo é adequar o sistema produtivo de bens e de serviços de interesse sanitário, bem como os ambientes, às demandas sociais e às necessidades do sistema de saúde. Sua principal função é atuar no sentido de prevenir, eliminar ou minimizar o risco sanitário envolvido em suas áreas de atuação, promovendo e protegendo a saúde da população.
Desse modo, suas ações têm o propósito de implementar concepções e atitudes éticas a respeito da qualidade das relações, dos processos produtivos, do ambiente e dos serviços. Em virtude de seu papel regulador, essas ações representam uma importante possibilidade de articular os poderes governamentais, impulsionar a participação social e aperfeiçoar as relações sociais.
O processo de estruturação da Vigilância Sanitária acompanhou as mudanças e as reformas do Estado. A partir do início da década de 1990, a reforma do Estado visava, sobretudo, à redução do tamanho do Estado e à mudança de regras macroeconômicas. O foco estava na agilização administrativa e no atendimento das demandas do setor produtivo. Com a criação do Mercosul, em 1991, a Secretaria Nacional de Vigilância Sanitária passou a se responsabilizar também pelos processos de harmonização da regulamentação sanitária. Na segunda metade dessa mesma década, ocorreu nova onda de reformas e foi criada a Agência Nacional de Vigilância Sanitária.
Pode-se afirmar que em cada época foi adotado um conceito e um modelo de regulação, embora esse termo seja relativamente recente. Classicamente, o termo regulação tem uma carga conceitual pautada nos processos econômicos e de reestruturação do papel do Estado, capitaneada pela reforma neoliberal produzida nas últimas décadas. A partir desse conceito, limita-se o papel do Estado no processo de produção e consumo de bens, produtos e serviços, a "regulador" do mercado. Utilizado sem muitos problemas nos campos abarcados pelas agências criadas para regular as atividades econômicas privatizadas (energia elétrica, telefonia etc.), mostra-se limitado quando aplicado aos objetos de trabalho da saúde e, mais especificamente, da Vigilância Sanitária. Diante dessa constatação, tornase necessário que seja traduzido para essa área que, idealmente, deve estar voltada à gestão do risco sanitário.
Para grande parte dos autores, o processo de regulação abrange: aprovação de regras pertinentes (regulamentos, normas, resoluções etc.); implementação concreta desses regulamentos (autorizações, licenças, registros etc.); fiscalização de seu cumprimento e imposição de sanções ou penalidades perante as infrações. Portanto, regulação conjuga os três tipos de poder: normativo, executivo e parajudicial. Ela cumpre vários objetivos: restringir práticas empresariais, regular mercados, controlar qualidade e preço, afastar a concorrência desleal e, ainda, corrigir informações aos consumidores. Esse processo também merece uma reflexão profunda para sua transposição para a área da Vigilância Sanitária.
Assim, a regulação nessa área ganha um complemento ao conceito. Trata-se aqui não apenas de regulação, mas regulação sanitária. Esta não se limita apenas a uma função de árbitro entre produtores e consumidores, diferencia-se por vários aspectos:
a) as características particulares dos produtos, bens e serviços que, ao ser utilizados, podem ter efeitos danosos à saúde;
b) são, muitas vezes, objetos de difícil materialização (o meio ambiente, o ar que respiramos, a fonte de água que bebemos), ou que são consumidos à medida que são produzidos (serviços de saúde);
c) necessidade de se conhecer ampla e previamente a realidade social e sanitária na qual esses produtos e serviços se inserem ou serão consumidos; e
d) não se trata de processo de consumo como os demais, mas de processo que envolve sujeitos e cidadãos ou coletividades que consomem bens ou serviços essenciais à sua vida.
Um segundo conceito deve ser considerado para a correta compreensão da regulação e sua aplicação na área da Vigilância Sanitária. Ele está explícito na própria definição da função dessa área, que é a de atuar no sentido de prevenir, eliminar ou minimizar risco sanitário. O conceito de risco tem sido objeto de muitas reflexões, pois, mais uma vez, sua transposição para a Vigilância Sanitária não pode se dar de forma direta e linear. O termo risco não deve ser tomado apenas na sua concepção estatística no sentido de probabilidade de ocorrência de eventos danosos. Muitas vezes o risco coloca-se como possibilidade, sem que haja, de fato, dados quantitativos, mas sim indícios, baseados na racionalidade e nos conhecimentos científicos disponíveis. Essa concepção, aliada ao contexto de incertezas produzido pelas rápidas mudanças no sistema produtivo, é base, até mesmo, para que a Vigilância Sanitária adote em seu processo de regulação o princípio da precaução. Assim, além dos objetivos acima descritos no conceito mais clássico de regulação, na Vigilância Sanitária ele ganha outro objetivo fundamental - o de preservar e promover a saúde dos indivíduos, do meio ambiente e dos locais de trabalho.
A partir desses conceitos, pode-se pensar no modelo de regulação sanitária do País, que deve estar orientado pela identificação e avaliação dos riscos e busca de mecanismos que garantam a segurança sanitária e a proteção da saúde. A escolha entre alternativas para a regulação, diante das análises produzidas e das situações de incerteza científica, significa gerenciar os riscos, e estas escolhas não podem estar reduzidas a atos administrativos de natureza cartorial ou fiscalizatória. Também é preciso reconhecer que o processo de regulação se dá num contexto de conflitos de interesses, que podem gerar embates. Para minimizar suas fragilidades, é fundamental que as decisões estejam baseadas em conhecimentos científicos sólidos e ampla divulgação de informações, para que a sociedade organizada possa interferir no processo.
Com esse sentido ampliado de regulação, estratégias como o aprimoramento dos processos produtivos e do controle da qualidade dos produtos e serviços oferecidos, bem como a comunicação do risco e o estímulo ao consumo consciente são algumas das possibilidades de implementação da regulação com o objetivo de proteger a saúde da população. Nesse sentido, essas práticas deverão ser continuamente promovidas e aprimoradas para tornar as ações de vigilância mais efetivas, o que implica repensar os instrumentos e a incorporação adequada dos conhecimentos e tecnologias constantemente produzidos.
Dessa forma, a atribuição legal da Vigilância Sanitária diz respeito aos processos de regulação do risco sanitário, mas não deve se restringir apenas a uma perspectiva fiscalizatória e sim ampliar, a partir de uma visão que permita incorporar às práticas de proteção, aquelas de promoção da saúde. Importantes ações, hoje ainda incipientes na Vigilância Sanitária, tais como o monitoramento da propaganda, as notificações pós-comercialização, a comunicação do risco (alertas sanitários para a sociedade em geral), o monitoramento e a avaliação dos produtos e medicamentos registrados, em especial os novos ou com novas indicações, ao longo de sua comercialização e a educação em saúde visando ao consumo seguro de produtos e medicamentos poderiam ser exemplificadas como ações de promoção da saúde.
Outro aspecto considerado essencial para o adequado desenvolvimento da função de regulação é o reconhecimento do caráter intersetorial dos objetos das ações de Vigilância Sanitária, o que torna necessária a articulação com os diversos órgãos e instituições responsáveis pela normatização e acompanhamento de produtos, serviços e ações. Portanto, a criação de estratégias de integração e discussão com os diferentes atores envolvidos com a temática da Vigilância Sanitária constituem estratégias fundamentais de trabalho.
Entretanto, tendo em vista que a Vigilância Sanitária está organizada como um sistema em todo o território nacional, a regulação deve ser concebida considerando o papel dos três componentes do sistema - federal, estadual e municipal - potencializando seu caráter universal e de integralidade.
Ainda sobre o princípio constitucional da integralidade no SUS, é importante que ele seja aplicado, nas atribuições de regulação em Vigilância Sanitária, para compreender todo o ciclo produtivo de bens e serviços de interesse à saúde, desde a garantia da qualidade dos insumos importados, passando pela garantia dos procedimentos de produção ou de processamentos internos até o monitoramento da propaganda para seu consumo, sejam eles produtos ou serviços.
Uma outra importante diretriz para a Vigilância Sanitária diz respeito à sua articulação com a política de saúde do País. As ações de regulação devem se pautar por prioridades definidas nessa política, considerando programas e projetos desenvolvidos pelo Sistema Único de Saúde.
De forma geral, a circulação de informações e dos novos conhecimentos tem sido enormemente amplificada com a revolução tecnológica produzida pela informática. A incorporação desses conhecimentos e de evidências científicas bem embasadas é fundamental para dar consistência à regulação de áreas importantes como a de medicamentos e de produtos para a saúde. Portanto, são fundamentais investimentos vigorosos e ininterruptos em pesquisas e na capacitação de profissionais para acessar e analisar criticamente seus resultados.
O desenvolvimento e a implantação de um sistema de informação é hoje uma necessidade que deve ser vista como prioridade para o fortalecimento do SNVS. Seu papel seria o de consolidar as informações produzidas no próprio sistema, produzir alertas e auxiliar na tomada de decisões e definição de prioridades para a Vigilância Sanitária, além disso, deverá ter a capacidade de interoperabilidade com os sistemas e bancos de dados nacionais do Ministério da Saúde.
No aspecto do trabalho respaldado por evidências científicas, a discussão sobre o papel dos laboratórios deve ser aprofundada na perspectiva da estruturação e manutenção de uma rede com tecnologias recentes e adequadas aos diversos objetos de regulação e da retroalimentação dos conhecimentos e informações neles produzidas aos demais componentes do Sistema Nacional de Vigilância Sanitária - Visa.
Por fim, deve-se ressaltar que a Vigilância Sanitária, em sua função reguladora, é muitas vezes vista, equivocadamente, como um entrave à produção local. No entanto, é importante destacar que o papel regulador, adequadamente conduzido, constitui-se em um instrumento de promoção da qualidade dos produtos e serviços, recebendo, até mesmo, o reconhecimento internacional e contribuindo para o desenvolvimento nacional.
Diretrizes do Eixo II:
1. Institucionalização de ações de caráter intersetorial com os diversos órgãos que tenham interface com ações de Vigilância Sanitária - VISA
a) articulação com outros órgãos responsáveis por ações regulatórias, reconhecendo seus limites de competência;
b) articulação das ações de Vigilância Sanitária com as prioridades das demais políticas públicas, nas três esferas de governo;
c) articulação com os diversos órgãos e entidades de proteção do consumidor, defesa da cidadania, regulação econômica e monitoramento de mercado, bem como com os órgãos responsáveis pelo controle de qualidade e avaliação de conformidade; e
d) articulação com as empresas empregadoras, sindicatos, estabelecimentos privados de prestação de servicos de saúde, operadoras de planos de saúde e Agência Nacional de Saúde Suplementar (ANS) para a redução de riscos sanitários e melhoria das condições de vida e saúde.
2. Aprimoramento da aplicação do princípio da precaução como um valor fundamental para as ações de Vigilância Sanitária, para a avaliação de novas tecnologias e para a tomada de decisões, de forma que proteja e promova a saúde da população.
3. Sistematização e incorporação dos conhecimentos produzidos no próprio SNVS às práticas de Vigilância Sanitária, a partir das ações de registro, fiscalização e monitoramento, dentre outras.
4. Promoção do acesso aos conhecimentos científicos pertinentes às ações de regulação para os profissionais do Sistema Nacional de Vigilância Sanitária.
5. Promoção de mecanismos de disseminação efetiva das comunicações de risco sanitário à população.
6. Articulação entre as diversas esferas de governo para a definição de prioridades da regulação sanitária e execução das ações de Vigilância Sanitária.
7. Articulação com a rede de Laboratórios de Saúde Pública nas diversas esferas de governo, como componente essencial ao exercício da ação regulatória.
8. Elaboração e revisão da legislação, do marco regulatório, dos regulamentos técnicos e dos processos de trabalho em Vigilância Sanitária, de forma participativa e tripartite, à luz dos conhecimentos recentes e das referências internacionais:
a) harmonização das ações e instrumentos de controle sanitário e adoção de procedimentos operacionais padronizados em Vigilância Sanitária; e
b) aprimoramento dos instrumentos inerentes ao processo regulatório, visando à racionalização das atividades da Vigilância Sanitária.
9. Consolidação e ampliação, em âmbito nacional, da estratégia de vigilância e monitoramento de eventos adversos e queixas técnicas relacionadas ao uso de produtos e serviços de saúde.
10. Articulação da ação regulatória da Visa com as diretrizes e estratégias da política de desenvolvimento nacional, levando em consideração os riscos sanitários, contribuindo para o aprimoramento da qualidade de produtos, processos e serviços.
EIXO III
A VIGILÂNCIA SANITÁRIA NO CONTEXTO DA ATENÇÃO INTEGRAL À SAÚDE
A Vigilância Sanitária, concebida como campo de saúde coletiva, é indissociável do conjunto de ações que integram as políticas de saúde. Nessa dimensão, há a necessidade de articulação permanente das ações de Vigilância Sanitária nas distintas esferas de governo e destas com as ações de saúde desenvolvidas no âmbito do SUS. A adoção de práticas de saúde resolutivas, seguras, éticas e humanizadas, acompanhadas de iniciativas para a qualificação dos trabalhadores de saúde e a consolidação do controle social, constituirão dimensões essenciais para a qualidade e a integralidade da atenção à saúde prestada à população.
A integralidade pode refletir três grandes sentidos diferentes: o primeiro, refere-se às práticas dos profissionais de saúde; o segundo, refere-se à organização dos serviços e o terceiro, aplica-se às respostas governamentais aos problemas de saúde.
O avanço para a integralidade na atenção deverá estar expresso prioritariamente na estrutura e na organização dos serviços, nos instrumentos de planejamento e gestão adotados nos três níveis de governo, nos processos de trabalho e qualificação dos trabalhadores de saúde e no estímulo ao desenvolvimento de políticas intersetoriais. Essas diretrizes devem gerar as condições necessárias para a inserção da Vigilância Sanitária nos distintos níveis de complexidade da atenção à saúde do SUS.
Na atenção básica, a busca pela reestruturação da prática focada no atendimento integral e por serviços de qualidade, eficientes e resolutivos, deve ser objetivo norteador da Vigilância Sanitária em sua inserção nesse nível de atenção. Espera-se que além das ações assistenciais, sejam realizadas ações de promoção de saúde e de prevenção de agravos - incluindo aqueles relativos ao consumo de bens e serviços e as interações com o ambiente de trabalho e de vida, ações típicas do campo da Vigilância Sanitária - pelas equipes de saúde da família e das unidades básicas de saúde, com destaque para o agente de saúde.
Contudo, não se propõe que os profissionais de atenção básica devam incorporar a atribuição de polícia administrativa inerente aos profissionais de Vigilância Sanitária. A atenção básica em sua responsabilidade local deve incorporar o olhar que configura as ações de Vigilância Sanitária na história natural dos agravos e determinantes de saúde, desenvolvendo tecnologias de cuidado no contexto da integralidade.
Os profissionais de saúde, de forma geral, devem estar preparados para realizar ações próprias de assistência à saúde, para atuar na identificação de riscos sanitários potenciais e danos à saúde da população de seu território, bem como saber agir de forma multidisciplinar e intersetorial na proteção e promoção da saúde.
A Vigilância Sanitária deverá, também, articular-se às ações e aos programas desenvolvidos pelo SUS, destinados aos grupos vulneráveis de nossa sociedade, em virtude da necessidade de ações de promoção e proteção à saúde.
Trabalhar a integralidade no SUS não é apenas favorecer o trabalho conjunto de setores nos diferentes níveis de complexidade da assistência, mas descompartimentalizar as diversas ações locais, desenvolvendo um processo de trabalho condizente com a realidade local que ao mesmo tempo preserve as especificidades dos setores e compartilhe suas tecnologias, na constituição da qualidade de vida e da cidadania.
Diretrizes do Eixo III
1. Articulação permanente entre as ações de Vigilância Sanitária e os demais serviços e ações de saúde desenvolvidos no âmbito do SUS, garantindo a transversalidade nos diversos níveis de atenção à saúde.
2. Articulação das ações de Vigilância Sanitária, Epidemiológica, Ambiental e de Saúde do Trabalhador, no sentido de consolidar a vigilância dos determinantes do processo saúde-doença, com vistas à atenção integral à saúde.
3. Promoção e fortalecimento do trabalho conjunto da Vigilância Sanitária com a atenção básica, contribuindo para a reflexão de saberes e práticas multidisciplinares e intersetoriais, favorecendo a integralidade das ações de saúde, nas três esferas de governo:
a) desenvolvimento de novos processos de trabalho que incorporem as tecnologias de Vigilância Sanitária às ações básicas de saúde, com enfoque no risco sanitário; e
b) descompartimentalização dos processos de trabalho nas ações locais, preservando especificidades e compartilhando tecnologias, conhecimentos e experiências.
4. Revisão do processo de planejamento e execução das ações de Vigilância Sanitária, considerando a responsabilidade sanitária, o território, o risco sanitário, a transcendência de eventos de interesse da saúde e as prioridades nacionais e locorregionais de saúde, visando à integralidade das ações de atenção à saúde.
5. Articulação na definição de políticas de formação de trabalhadores do SUS para promover a integração da Vigilância Sanitária com as demais áreas da saúde no cumprimento do princípio da integralidade.
EIXO IV
PRODUÇÃO DO CONHECIMENTO, PESQUISA E DESENVOLVIMENTO TECNOLÓGICO
A pesquisa e o desenvolvimento tecnológico em Vigilância Sanitária assumem caráter importante na construção de uma agenda de atuação, devidamente articulada com a Política Nacional de Ciência, Tecnologia e Inovação em Saúde (PNCTIS) do Ministério da Saúde.
No entanto, verifica-se uma lacuna no campo da produção do conhecimento em Vigilância Sanitária que precisa ser preenchida, quer seja por estratégias como o desenvolvimento de estudos sobre a função regulatória e seus impactos nos problemas de saúde, quer seja no controle de inúmeros riscos à saúde relacionados a processos produtivos e a bens de consumo e dos potenciais efeitos adversos de numerosas e complexas exposições relacionadas às diversas tecnologias utilizadas nos serviços de saúde.
É consenso que a pesquisa é ferramenta importante para a tomada de decisões na definição de políticas e no planejamento em saúde, contribuindo para a melhoria das ações de promoção, proteção e recuperação da saúde e a diminuição das desigualdades sociais.Nesse sentido, e em consonância com a PNCTIS, a Vigilância Sanitária incorpora como princípios básicos: o respeito à vida e à dignidade humana das pessoas, a melhoria da saúde da população brasileira, a busca da eqüidade em saúde, a inclusão e o controle social e o respeito à pluralidade filosófica e metodológica. A Vigilância Sanitária incorpora também as estratégias de ação da PNCTIS para a produção de conhecimento, pesquisas e desenvolvimento tecnológico no setor, como: a sustentação e o fortalecimento do esforço nacional em ciência, tecnologia e inovação em saúde, a criação do sistema nacional de inovação em saúde, a superação das desigualdades regionais, o aprimoramento da capacidade regulatória, a difusão dos avanços científicos e tecnológicos, bem como a formação e a capacitação de recursos humanos.
Observa-se também que as rotinas dos profissionais de Vigilância Sanitária são baseadas não só no aparato legal da legislação vigente, mas num somatório entre este e o conhecimento implícito das questões que perpassam as atividades relacionadas a produtos, serviços e ambientes.
A sistematização dessa prática profissional, realizada por meio de diversas abordagens metodológicas, possibilita avanços importantes para a melhoria dos processos de trabalho.
A busca de mecanismos de disseminação e intercâmbio da produção de conhecimento em Visa também tem sido bastante discutida pelo SNVS. Destacam-se, nesse sentido, os Simpósios Brasileiros de Vigilância Sanitária (Simbravisa), realizados pela Associação Brasileira de Pós-Graduação em Saúde Coletiva (Abrasco), que demonstram claramente as contribuições dos profissionais de Vigilância Sanitária para o acúmulo de conhecimentos relativos às ações desenvolvidas nesse campo.
O acelerado avanço tecnológico na área da saúde, paralelo à alta velocidade de incorporação dessas novas tecnologias no mercado, tende a provocar um déficit de conhecimento por parte dos gestores e dos profissionais que, muitas vezes, desconhecem a eficácia, a efetividade e a segurança na escolha da tecnologia apropriada para determinada situação. Para tanto, há necessidade de articulação com a Política Nacional de Gestão de Tecnologias em Saúde (PNGTS), a qual contempla os aspectos referentes à avaliação de tecnologia em saúde, desencadeando um amplo processo de produção, atualização, revisão e disseminação desses conhecimentos e sua aplicabilidade no setor, proporcionando informações úteis e adequadas para a tomada de decisão.
Outra questão de relevância é o desenvolvimento de padrões de ética nos estudos e pesquisas realizados. O crescimento acentuado das pesquisas no Brasil, se por um lado representa um avanço no desenvolvimento científico e tecnológico, por outro, aumenta as possibilidades de risco, engendrando novas formas de ameaças à saúde humana. Portanto, requer um cuidadoso acompanhamento dos centros de pesquisa, dos protocolos de pesquisa e o estabelecimento de critérios rigorosos de credenciamento e acompanhamento pelas comissões de ética.
A disseminação e difusão dos avanços científicos e tecnológicos por meio do estabelecimento de mecanismos de comunicação social apresentam-se como um meio para a apropriação dos conhecimentos produzidos e dos benefícios decorrentes dos estudos desenvolvidos por parte dos pesquisadores, setor regulado, gestores e trabalhadores do SUS e sociedade civil. Para tanto, faz-se necessária a constituição de canais de divulgação que permitam a introdução de formas de comunicação acessíveis e compreensíveis para o público em geral.
Além disso, entende-se como questão de importância fundamental para consolidação do Sistema Nacional de Vigilância Sanitária, o desenvolvimento de estratégias para a formação, a qualificação e a capacitação de profissionais que atuam no âmbito do Sistema de Saúde. Essas estratégias deverão contemplar o desenvolvimento de competências dos profissionais para uma atuação crítica e autônoma, minimizando-se, assim, a importação acrítica de padrões, modelos, protocolos de avaliação, critérios científicos e normas.
Desse modo, considera-se essencial a necessidade do desenvolvimento de estudos e pesquisas, de forma contínua e sistemática, acerca das tecnologias, produtos, serviços e ambientes de interesse à saúde, considerando a relação risco-custo-benefício, acompanhando seus efeitos adversos e promovendo estratégias continuadas para seu uso racional.
Diretrizes do Eixo IV
1. Estímulo à Produção de Conhecimento em Vigilância Sanitária, buscando integrá-la à Política Nacional de Ciência, Tecnologia e Inovação em Saúde do SUS:
a) produção e disseminação do conhecimento em Vigilância Sanitária, com a participação de outros atores sociais, tais como: segmentos da sociedade civil organizada, setor regulado, instituições de ensino e pesquisa, profissionais de saúde etc.;
b) consolidação e ampliação dos Centros Colaboradores em Vigilância Sanitária, de acordo com as potencialidades regionais, articulando-os com os demais órgãos do SNVS, para o apoio ao desenvolvimento da Vigilância Sanitária; e
c) aprimoramento dos instrumentos de disseminação do conhecimento, para tornar mais efetiva a comunicação entre o SNVS e a população.
2. Consolidação do campo da Vigilância Sanitária nos espaços acadêmicos de formação e de produção científica, ensino e pesquisa e reconhecimento dela como campo de pesquisa, inerente ao campo da Saúde Coletiva, ressaltando a necessidade de interlocução com outras áreas, tendo em vista seu caráter interdisciplinar, multiprofissional e intersetorial.
3. Fomento à produção de conhecimento e ao desenvolvimento tecnológico voltados para o aprimoramento do SNVS, na perspectiva da diversidade de abordagens metodológicas:
a) participação com outros setores governamentais envolvidos na Política Nacional de Ciência, Tecnologia e Inovação em Saúde para a elaboração de um plano de incorporação tecnológica a partir da identificação das necessidades de aquisição de equipamentos e tecnologias, com vistas à avaliação do impacto social, econômico, ambiental e sanitário decorrente de sua utilização;
b) aporte de recursos de forma contínua e sistemática ao desenvolvimento de pesquisas e tecnologia nos serviços de Vigilância Sanitária;
c) fomento à efetivação de estudos sobre os determinantes dos riscos sanitários decorrentes dos novos arranjos demográficos e epidemiológicos e dos modos de produção e consumo, objetivando a ampliar a efetividade na proteção da saúde;
d) estímulo à realização de estudos sobre a função regulatória e seus impactos nos problemas de saúde e no controle de inúmeros riscos à saúde relacionados a processos produtivos, bens de consumo, serviços e ambientes;
e) fomento à efetivação de parcerias entre o SNVS e instituições de ensino e pesquisa - nacionais e internacionais - para o desenvolvimento de projetos em Vigilância Sanitária, de forma que aprimore suas práticas e bases de ação; e
f) incentivo à produção de pesquisa pelos serviços de Vigilância Sanitária.
4. Contribuição da Vigilância Sanitária no processo de identificação das necessidades de aquisição de equipamentos e tecnologias e na definição de mecanismos de incorporação tecnológica e de pesquisas, que contemplem as singularidades regionais, para avaliação do impacto social, econômico, ambiental e sanitário decorrente de seu uso.
5. Utilização das diretrizes e definições estabelecidas na Política Nacional de Gestão de Tecnologias em Saúde (PNGTS) como base para a avaliação de tecnologia em saúde, envolvendo as três esferas de governo, com vistas a subsidiar a tomada de decisão acerca da incorporação crítica e independente de produtos e processos.
6. Incorporação e utilização do conhecimento acerca dos avanços tecnológicos e biotecnológicos em saúde, com ênfase na biossegurança, considerando as implicações e repercussões no campo da bioética e da ética em pesquisa:
a) utilização de mecanismos e critérios para avaliação do uso de produtos e serviços sujeitos à Vigilância Sanitária e outras inovações tecnológicas, visando ao desenvolvimento de pesquisas, considerando a avaliação de impactos e suas conseqüências para a saúde.
7. Promoção sistemática de eventos para a ampla difusão de conhecimentos sobre os determinantes do processo saúde-doença, fatores de risco e situação de saúde da população.
EIXO V
CONSTRUÇÃO DA CONSCIÊNCIA SANITÁRIA: MOBILIZAÇÃO, PARTICIPAÇÃO E CONTROLE SOCIAL
A Constituição Federal de 1988 possibilitou novas experiências de exercício da cidadania na medida em que criou espaços de participação representativos e democráticos para elaboração de políticas públicas e instrumentos de controle em sua implementação.
A Lei n° 8.142/90 dispõe sobre as instâncias de participação e controle social no Sistema Único de Saúde, regulamentando preceitos constitucionais no bojo da reforma democrática do Estado brasileiro. O Ministério Público, o Poder Legislativo e o Judiciário têm também atribuições relacionadas à defesa da cidadania em seus diversos aspectos, incluindo o que se refere ao direito à saúde.
No que diz respeito ao entendimento entre o que é participação e controle social não se tem como preocupação um aprofundamento conceitual desses objetos neste texto. Entretanto, é válido apontar que alguns autores definem controle social como a forma e os mecanismos com os quais a sociedade organizada fiscaliza e controla o poder público em relação às suas ações e gastos financeiros, exercendo assim seu direito de cidadãos em requererem do Estado a definição de prioridades. Por sua vez, outros autores consideram que a participação social deve também ser considerada como um exercício pleno de cidadania e de direito, descrita na Constituição, na qual a lógica não se restringe apenas à fiscalização, mas amplia sua contribuição à política pública que o Governo vem estabelecendo em suas ações de Estado. considerando as prerrogativas legais da Vigilância Sanitária - de interferir no espaço em que atuam forças de mercado e no jogo de interesses econômicos, cujos resultados influenciam diretamente as condições de vida e de saúde das pessoas -, os mecanismos de participação e controle social são essenciais para que todos os agentes que atuam na saúde e na produção de produtos e bens de consumo não comprometam as ações de Vigilância Sanitária fundamentais para o cumprimento da missão legal do Sistema Nacional de Vigilancia Sanitaria. Torna-se fundamental o debate público das decisões que possam afetar a segurança das pessoas e da coletividade, até mesmo na feitura das normas administrativas.
Observa-se que a Vigilância Sanitária esteve, em alguns momentos, na pauta das discussões dos mecanismos de participação e controle social, como: a I Conferência Nacional de Saúde do Consumidor, em 1986; a 11ª Conferência Nacional de Saúde, em 2000, na qual se apontou a necessidade de realização da conferência temática de Vigilância Sanitária; e a I Conferência Nacional de Vigilância Sanitária, realizada em 2001, cujo tema central tratou da efetivação do Sistema Nacional de Vigilância Sanitária, com vistas à proteção e à promoção da saúde, assim como à construção da cidadania.
Outro espaço de participação e controle social que hoje se encontra em funcionamento no Conselho Nacional de Saúde é a Comissão Intersetorial de Vigilância Sanitária e Farmacoepidemiologia, descrita no artigo 13, inciso III, da Lei nº 8.080/90, que tem por finalidade a articulação das políticas e programas de interface da Vigilância Sanitária com as demais áreas da saúde.
A exemplo das demais áreas da Saúde Coletiva, já existem, hoje, instâncias formais de participação e controle social direcionadas à Vigilância Sanitária. Entretanto, igualmente às demais áreas da saúde, tal participação e controle só podem ser exercidos mediante o conhecimento pela sociedade do que é Vigilância Sanitária e mediante o reconhecimento de sua importância como campo de promoção e proteção da saúde. Assim, entendendo que essa discussão atualmente é frágil, é importante enfatizar a necessidade de se promover ações que elevem a consciência sanitária da população de forma que tal participação e controle se efetivem.
Por sua natureza, a Vigilância Sanitária pode ser concebida igualmente como espaço de exercício da cidadania e do controle social, que, por sua capacidade transformadora da qualidade dos produtos, dos processos e das relações sociais, exige ação interdisciplinar e interinstitucional.
É importante, ainda, ressaltar a necessidade de mediação entre diferentes instâncias, para envolver o Executivo, o Legislativo, o Judiciário e outros setores do Estado e da sociedade, ampliando o compromisso desses com a concretização do SUS.
A Vigilância Sanitária entende que a parceria com a sociedade é fundamental para a concretização de suas ações visto que esta tem seu campo de atuação relacionado à defesa do consumidor real ou potencial de produtos e serviços, garantindo o direito do cidadão a uma vida saudável. Assim sendo, faz-se necessário desenvolver atividades de educação para a saúde, de democratização da informação, de transparência das suas ações e o estabelecimento de mecanismos de escuta da sociedade, possibilitando assim o incremento da consciência sanitária
ANEXO XX
DO CONTROLE E DA VIGILÂNCIA DA QUALIDADE DA ÁGUA PARA CONSUMO HUMANO E SEU PADRÃO DE POTABILIDADE (Origem: PRT MS/GM 2914/2011)
Art. 1º Ficam definidos os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. (Origem: PRT MS/GM 2914/2011, Art. 1º)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 2914/2011, CAPÍTULO I)
Art. 2º Este Anexo se aplica à água destinada ao consumo humano proveniente de sistema e solução alternativa de abastecimento de água. (Origem: PRT MS/GM 2914/2011, Art. 2º)
Parágrafo Único. As disposições deste Anexo não se aplicam à água mineral natural, à água natural e às águas adicionadas de sais destinadas ao consumo humano após o envasamento, e a outras águas utilizadas como matéria-prima para elaboração de produtos, conforme Resolução (RDC) nº 274, de 22 de setembro de 2005, da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2914/2011, Art. 2º, Parágrafo Único)
Art. 3º Toda água destinada ao consumo humano, distribuída coletivamente por meio de sistema ou solução alternativa coletiva de abastecimento de água, deve ser objeto de controle e vigilância da qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 3º)
Art. 4º Toda água destinada ao consumo humano proveniente de solução alternativa individual de abastecimento de água, independentemente da forma de acesso da população, está sujeita à vigilância da qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 4º)
CAPÍTULO II
DAS DEFINIÇÕES
(Origem: PRT MS/GM 2914/2011, CAPÍTULO II)
Art. 5º Para os fins deste Anexo, são adotadas as seguintes definições: (Origem: PRT MS/GM 2914/2011, Art. 5º)
I - água para consumo humano: água potável destinada à ingestão, preparação e produção de alimentos e à higiene pessoal, independentemente da sua origem; (Origem: PRT MS/GM 2914/2011, Art. 5º, I)
II - água potável: água que atenda ao padrão de potabilidade estabelecido neste Anexo e que não ofereça riscos à saúde; (Origem: PRT MS/GM 2914/2011, Art. 5º, II)
III - padrão de potabilidade: conjunto de valores permitidos como parâmetro da qualidade da água para consumo humano, conforme definido neste Anexo; (Origem: PRT MS/GM 2914/2011, Art. 5º, III)
IV - padrão organoléptico: conjunto de parâmetros caracterizados por provocar estímulos sensoriais que afetam a aceitação para consumo humano, mas que não necessariamente implicam risco à saúde; (Origem: PRT MS/GM 2914/2011, Art. 5º, IV)
V - água tratada: água submetida a processos físicos, químicos ou combinação destes, visando atender ao padrão de potabilidade; (Origem: PRT MS/GM 2914/2011, Art. 5º, V)
VI - sistema de abastecimento de água para consumo humano: instalação composta por um conjunto de obras civis, materiais e equipamentos, desde a zona de captação até as ligações prediais, destinada à produção e ao fornecimento coletivo de água potável, por meio de rede de distribuição; (Origem: PRT MS/GM 2914/2011, Art. 5º, VI)
VII - solução alternativa coletiva de abastecimento de água para consumo humano: modalidade de abastecimento coletivo destinada a fornecer água potável, com captação subterrânea ou superficial, com ou sem canalização e sem rede de distribuição; (Origem: PRT MS/GM 2914/2011, Art. 5º, VII)
VIII - solução alternativa individual de abastecimento de água para consumo humano: modalidade de abastecimento de água para consumo humano que atenda a domicílios residenciais com uma única família, incluindo seus agregados familiares; (Origem: PRT MS/GM 2914/2011, Art. 5º, VIII)
IX - rede de distribuição: parte do sistema de abastecimento formada por tubulações e seus acessórios, destinados a distribuir água potável até as ligações prediais; (Origem: PRT MS/GM 2914/2011, Art. 5º, IX)
X - ligações prediais: conjunto de tubulações e peças especiais, situado entre a rede de distribuição de água e o cavalete, este incluído; (Origem: PRT MS/GM 2914/2011, Art. 5º, X)
XI - cavalete: kit formado por tubos e conexões destinados à instalação do hidrômetro para realização da ligação de água; (Origem: PRT MS/GM 2914/2011, Art. 5º, XI)
XII - interrupção: situação na qual o serviço de abastecimento de água é interrompido temporariamente, de forma programada ou emergencial, em razão da necessidade de se efetuar reparos, modificações ou melhorias no respectivo sistema; (Origem: PRT MS/GM 2914/2011, Art. 5º, XII)
XIII - intermitência: é a interrupção do serviço de abastecimento de água, sistemática ou não, que se repete ao longo de determinado período, com duração igual ou superior a seis horas em cada ocorrência; (Origem: PRT MS/GM 2914/2011, Art. 5º, XIII)
XIV - integridade do sistema de distribuição: condição de operação e manutenção do sistema de distribuição (reservatório e rede) de água potável em que a qualidade da água produzida pelos processos de tratamento seja preservada até as ligações prediais; (Origem: PRT MS/GM 2914/2011, Art. 5º, XIV)
XV - controle da qualidade da água para consumo humano: conjunto de atividades exercidas regularmente pelo responsável pelo sistema ou por solução alternativa coletiva de abastecimento de água, destinado a verificar se a água fornecida à população é potável, de forma a assegurar a manutenção desta condição; (Origem: PRT MS/GM 2914/2011, Art. 5º, XV)
XVI - vigilância da qualidade da água para consumo humano: conjunto de ações adotadas regularmente pela autoridade de saúde pública para verificar o atendimento a este Anexo, considerados os aspectos socioambientais e a realidade local, para avaliar se a água consumida pela população apresenta risco à saúde humana; (Origem: PRT MS/GM 2914/2011, Art. 5º, XVI)
XVII - garantia da qualidade: procedimento de controle da qualidade para monitorar a validade dos ensaios realizados; (Origem: PRT MS/GM 2914/2011, Art. 5º, XVII)
XVIII - recoleta: ação de coletar nova amostra de água para consumo humano no ponto de coleta que apresentou alteração em algum parâmetro analítico; e (Origem: PRT MS/GM 2914/2011, Art. 5º, XVIII)
XIX - passagem de fronteira terrestre: local para entrada ou saída internacional de viajantes, bagagens, cargas, contêineres, veículos rodoviários e encomendas postais. (Origem: PRT MS/GM 2914/2011, Art. 5º, XIX)
CAPÍTULO III
DAS COMPETÊNCIAS E RESPONSABILIDADES
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III)
Seção I
Das Competências da União
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção I)
Art. 6º Para os fins deste Anexo, as competências atribuídas à União serão exercidas pelo Ministério da Saúde (MS) e entidades a ele vinculadas, conforme estabelecido nesta Seção. (Origem: PRT MS/GM 2914/2011, Art. 6º)
Art. 7º Compete à Secretaria de Vigilância em Saúde (SVS/MS): (Origem: PRT MS/GM 2914/2011, Art. 7º)
I - promover e acompanhar a vigilância da qualidade da água para consumo humano, em articulação com as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios e respectivos responsáveis pelo controle da qualidade da água; (Origem: PRT MS/GM 2914/2011, Art. 7º, I)
II - estabelecer ações especificadas no Programa Nacional de Vigilância da Qualidade da Água para Consumo Humano (VIGIAGUA); (Origem: PRT MS/GM 2914/2011, Art. 7º, II)
III - estabelecer as ações próprias dos laboratórios de saúde pública, especificadas na Seção V do Capítulo III; (Origem: PRT MS/GM 2914/2011, Art. 7º, III)
IV - estabelecer diretrizes da vigilância da qualidade da água para consumo humano a serem implementadas pelos Estados, Distrito Federal e Municípios, respeitados os princípios do SUS; (Origem: PRT MS/GM 2914/2011, Art. 7º, IV)
V - estabelecer prioridades, objetivos, metas e indicadores de vigilância da qualidade da água para consumo humano a serem pactuados na Comissão Intergestores Tripartite; e (Origem: PRT MS/GM 2914/2011, Art. 7º, V)
VI - executar ações de vigilância da qualidade da água para consumo humano, de forma complementar à atuação dos Estados, do Distrito Federal e dos Municípios. (Origem: PRT MS/GM 2914/2011, Art. 7º, VI)
Art. 8º Compete à Secretaria Especial de Saúde Indígena (SESAI/MS) executar, diretamente ou mediante parcerias, incluída a contratação de prestadores de serviços, as ações de vigilância e controle da qualidade da água para consumo humano nos sistemas e soluções alternativas de abastecimento de água das aldeias indígenas. (Origem: PRT MS/GM 2914/2011, Art. 8º)
Art. 9º Compete à Fundação Nacional de Saúde (FUNASA) apoiar as ações de controle da qualidade da água para consumo humano proveniente de sistema ou solução alternativa de abastecimento de água para consumo humano, em seu âmbito de atuação, conforme os critérios e parâmetros estabelecidos neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 9º)
Art. 10. Compete à ANVISA exercer a vigilância da qualidade da água nas áreas de portos, aeroportos e passagens de fronteiras terrestres, conforme os critérios e parâmetros estabelecidos neste Anexo, bem como diretrizes específicas pertinentes. (Origem: PRT MS/GM 2914/2011, Art. 10)
Seção II
Das Competências dos Estados
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção II)
Art. 11. Compete às Secretarias de Saúde dos Estados: (Origem: PRT MS/GM 2914/2011, Art. 11)
I - promover e acompanhar a vigilância da qualidade da água, em articulação com os Municípios e com os responsáveis pelo controle da qualidade da água; (Origem: PRT MS/GM 2914/2011, Art. 11, I)
II - desenvolver as ações especificadas no VIGIAGUA, consideradas as peculiaridades regionais e locais; (Origem: PRT MS/GM 2914/2011, Art. 11, II)
III - desenvolver as ações inerentes aos laboratórios de saúde pública, especificadas na Seção V do Capítulo III; (Origem: PRT MS/GM 2914/2011, Art. 11, III)
IV - implementar as diretrizes de vigilância da qualidade da água para consumo humano definidas no âmbito nacional; (Origem: PRT MS/GM 2914/2011, Art. 11, IV)
V - estabelecer as prioridades, objetivos, metas e indicadores de vigilância da qualidade da água para consumo humano a serem pactuados na Comissão Intergestores Bipartite; (Origem: PRT MS/GM 2914/2011, Art. 11, V)
VI - encaminhar aos responsáveis pelo abastecimento de água quaisquer informações referentes a investigações de surto relacionado à qualidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 11, VI)
VII - realizar, em parceria com os Municípios, nas situações de surto de doença diarréica aguda ou outro agravo de transmissão fecal-oral, os seguintes procedimentos: (Origem: PRT MS/GM 2914/2011, Art. 11, VII)
a) análise microbiológica completa, de modo a apoiar a investigação epidemiológica e a identificação, sempre que possível, do gênero ou espécie de micro-organismos; (Origem: PRT MS/GM 2914/2011, Art. 11, VII, a)
b) análise para pesquisa de vírus e protozoários, no que couber, ou encaminhamento das amostras para laboratórios de referência nacional, quando as amostras clínicas forem confirmadas para esses agentes e os dados epidemiológicos apontarem a água como via de transmissão; e (Origem: PRT MS/GM 2914/2011, Art. 11, VII, b)
c) envio das cepas de Escherichia coli aos laboratórios de referência nacional para identificação sorológica. (Origem: PRT MS/GM 2914/2011, Art. 11, VII, c)
VIII - executar as ações de vigilância da qualidade da água para consumo humano, de forma complementar à atuação dos Municípios, nos termos da regulamentação do SUS. (Origem: PRT MS/GM 2914/2011, Art. 11, VIII)
Seção III
Das Competências dos Municípios
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção III)
Art. 12. Compete às Secretarias de Saúde dos Municípios: (Origem: PRT MS/GM 2914/2011, Art. 12)
I - exercer a vigilância da qualidade da água em sua área de competência, em articulação com os responsáveis pelo controle da qualidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 12, I)
II - executar ações estabelecidas no VIGIAGUA, consideradas as peculiaridades regionais e locais, nos termos da legislação do SUS; (Origem: PRT MS/GM 2914/2011, Art. 12, II)
III - inspecionar o controle da qualidade da água produzida e distribuída e as práticas operacionais adotadas no sistema ou solução alternativa coletiva de abastecimento de água, notificando seus respectivos responsáveis para sanar a(s) irregularidade(s) identificada(s); (Origem: PRT MS/GM 2914/2011, Art. 12, III)
IV - manter articulação com as entidades de regulação quando detectadas falhas relativas à qualidade dos serviços de abastecimento de água, a fim de que sejam adotadas as providências concernentes a sua área de competência; (Origem: PRT MS/GM 2914/2011, Art. 12, IV)
V - garantir informações à população sobre a qualidade da água para consumo humano e os riscos à saúde associados, de acordo com mecanismos e os instrumentos disciplinados no Decreto nº 5.440, de 4 de maio de 2005; (Origem: PRT MS/GM 2914/2011, Art. 12, V)
VI - encaminhar ao responsável pelo sistema ou solução alternativa coletiva de abastecimento de água para consumo humano informações sobre surtos e agravos à saúde relacionados à qualidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 12, VI)
VII - estabelecer mecanismos de comunicação e informação com os responsáveis pelo sistema ou solução alternativa coletiva de abastecimento de água sobre os resultados das ações de controle realizadas; (Origem: PRT MS/GM 2914/2011, Art. 12, VII)
VIII - executar as diretrizes de vigilância da qualidade da água para consumo humano definidas no âmbito nacional e estadual; (Origem: PRT MS/GM 2914/2011, Art. 12, VIII)
IX - realizar, em parceria com os Estados, nas situações de surto de doença diarréica aguda ou outro agravo de transmissão fecal-oral, os seguintes procedimentos: (Origem: PRT MS/GM 2914/2011, Art. 12, IX)
a) análise microbiológica completa, de modo a apoiar a investigação epidemiológica e a identificação, sempre que possível, do gênero ou espécie de micro-organismos; (Origem: PRT MS/GM 2914/2011, Art. 12, IX, a)
b) análise para pesquisa de vírus e protozoários, quando for o caso, ou encaminhamento das amostras para laboratórios de referência nacional quando as amostras clínicas forem confirmadas para esses agentes e os dados epidemiológicos apontarem a água como via de transmissão; e (Origem: PRT MS/GM 2914/2011, Art. 12, IX, b)
c) envio das cepas de Escherichia coli aos laboratórios de referência nacional para identificação sorológica. (Origem: PRT MS/GM 2914/2011, Art. 12, IX, c)
X - cadastrar e autorizar o fornecimento de água tratada, por meio de solução alternativa coletiva, mediante avaliação e aprovação dos documentos exigidos no art. 14. (Origem: PRT MS/GM 2914/2011, Art. 12, X)
Parágrafo Único. A autoridade municipal de saúde pública não autorizará o fornecimento de água para consumo humano, por meio de solução alternativa coletiva, quando houver rede de distribuição de água, exceto em situação de emergência e intermitência. (Origem: PRT MS/GM 2914/2011, Art. 12, Parágrafo Único)
Seção IV
Do Responsável pelo Sistema ou Solução Alternativa Coletiva de Abastecimento de Água para Consumo Humano
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção IV)
Art. 13. Compete ao responsável pelo sistema ou solução alternativa coletiva de abastecimento de água para consumo humano: (Origem: PRT MS/GM 2914/2011, Art. 13)
I - exercer o controle da qualidade da água; (Origem: PRT MS/GM 2914/2011, Art. 13, I)
II - garantir a operação e a manutenção das instalações destinadas ao abastecimento de água potável em conformidade com as normas técnicas da Associação Brasileira de Normas Técnicas (ABNT) e das demais normas pertinentes; (Origem: PRT MS/GM 2914/2011, Art. 13, II)
III - manter e controlar a qualidade da água produzida e distribuída, nos termos deste Anexo, por meio de: (Origem: PRT MS/GM 2914/2011, Art. 13, III)
a) controle operacional do(s) ponto(s) de captação, adução, tratamento, reservação e distribuição, quando aplicável; (Origem: PRT MS/GM 2914/2011, Art. 13, III, a)
b) exigência, junto aos fornecedores, do laudo de atendimento dos requisitos de saúde estabelecidos em norma técnica da ABNT para o controle de qualidade dos produtos químicos utilizados no tratamento de água; (Origem: PRT MS/GM 2914/2011, Art. 13, III, b)
c) exigência, junto aos fornecedores, do laudo de inocuidade dos materiais utilizados na produção e distribuição que tenham contato com a água; (Origem: PRT MS/GM 2914/2011, Art. 13, III, c)
d) capacitação e atualização técnica de todos os profissionais que atuam de forma direta no fornecimento e controle da qualidade da água para consumo humano; e (Origem: PRT MS/GM 2914/2011, Art. 13, III, d)
e) análises laboratoriais da água, em amostras provenientes das diversas partes dos sistemas e das soluções alternativas coletivas, conforme plano de amostragem estabelecido neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 13, III, e)
IV - manter avaliação sistemática do sistema ou solução alternativa coletiva de abastecimento de água, sob a perspectiva dos riscos à saúde, com base nos seguintes critérios: (Origem: PRT MS/GM 2914/2011, Art. 13, IV)
a) ocupação da bacia contribuinte ao manancial; (Origem: PRT MS/GM 2914/2011, Art. 13, IV, a)
b) histórico das características das águas; (Origem: PRT MS/GM 2914/2011, Art. 13, IV, b)
c) características físicas do sistema; (Origem: PRT MS/GM 2914/2011, Art. 13, IV, c)
d) práticas operacionais; e (Origem: PRT MS/GM 2914/2011, Art. 13, IV, d)
e) na qualidade da água distribuída, conforme os princípios dos Planos de Segurança da Água (PSA) recomendados pela Organização Mundial de Saúde (OMS) ou definidos em diretrizes vigentes no País. (Origem: PRT MS/GM 2914/2011, Art. 13, IV, e)
V - encaminhar à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios relatórios das análises dos parâmetros mensais, trimestrais e semestrais com informações sobre o controle da qualidade da água, conforme o modelo estabelecido pela referida autoridade; (Origem: PRT MS/GM 2914/2011, Art. 13, V)
VI - fornecer à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios os dados de controle da qualidade da água para consumo humano, quando solicitado; (Origem: PRT MS/GM 2914/2011, Art. 13, VI)
VII - monitorar a qualidade da água no ponto de captação, conforme estabelece o art. 40; (Origem: PRT MS/GM 2914/2011, Art. 13, VII)
VIII - comunicar aos órgãos ambientais, aos gestores de recursos hídricos e ao órgão de saúde pública dos Estados, do Distrito Federal e dos Municípios qualquer alteração da qualidade da água no ponto de captação que comprometa a tratabilidade da água para consumo humano; (Origem: PRT MS/GM 2914/2011, Art. 13, VIII)
IX - contribuir com os órgãos ambientais e gestores de recursos hídricos, por meio de ações cabíveis para proteção do(s) manancial(ais) de abastecimento(s) e das bacia(s) hidrográfica(s); (Origem: PRT MS/GM 2914/2011, Art. 13, IX)
X - proporcionar mecanismos para recebimento de reclamações e manter registros atualizados sobre a qualidade da água distribuída, sistematizando-os de forma compreensível aos consumidores e disponibilizando-os para pronto acesso e consulta pública, em atendimento às legislações específicas de defesa do consumidor; (Origem: PRT MS/GM 2914/2011, Art. 13, X)
XI - comunicar imediatamente à autoridade de saúde pública municipal e informar adequadamente à população a detecção de qualquer risco à saúde, ocasionado por anomalia operacional no sistema e solução alternativa coletiva de abastecimento de água para consumo humano ou por não-conformidade na qualidade da água tratada, adotando-se as medidas previstas no art. 44; e (Origem: PRT MS/GM 2914/2011, Art. 13, XI)
XII - assegurar pontos de coleta de água na saída de tratamento e na rede de distribuição, para o controle e a vigilância da qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 13, XII)
Art. 14. O responsável pela solução alternativa coletiva de abastecimento de água deve requerer, junto à autoridade municipal de saúde pública, autorização para o fornecimento de água tratada, mediante a apresentação dos seguintes documentos: (Origem: PRT MS/GM 2914/2011, Art. 14)
I - nomeação do responsável técnico habilitado pela operação da solução alternativa coletiva; (Origem: PRT MS/GM 2914/2011, Art. 14, I)
II - outorga de uso, emitida por órgão competente, quando aplicável; e (Origem: PRT MS/GM 2914/2011, Art. 14, II)
III - laudo de análise dos parâmetros de qualidade da água previstos neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 14, III)
Art. 15. Compete ao responsável pelo fornecimento de água para consumo humano por meio de veículo transportador: (Origem: PRT MS/GM 2914/2011, Art. 15)
I - garantir que tanques, válvulas e equipamentos dos veículos transportadores sejam apropriados e de uso exclusivo para o armazenamento e transporte de água potável; (Origem: PRT MS/GM 2914/2011, Art. 15, I)
II - manter registro com dados atualizados sobre o fornecedor e a fonte de água; (Origem: PRT MS/GM 2914/2011, Art. 15, II)
III - manter registro atualizado das análises de controle da qualidade da água, previstos neste Anexo; (Origem: PRT MS/GM 2914/2011, Art. 15, III)
IV - assegurar que a água fornecida contenha um teor mínimo de cloro residual livre de 0,5 mg/L; e (Origem: PRT MS/GM 2914/2011, Art. 15, IV)
V - garantir que o veículo utilizado para fornecimento de água contenha, de forma visível, a inscrição "ÁGUA POTÁVEL" e os dados de endereço e telefone para contato. (Origem: PRT MS/GM 2914/2011, Art. 15, V)
Art. 16. A água proveniente de solução alternativa coletiva ou individual, para fins de consumo humano, não poderá ser misturada com a água da rede de distribuição. (Origem: PRT MS/GM 2914/2011, Art. 16)
Seção V
Dos Laboratórios de Controle e Vigilância
(Origem: PRT MS/GM 2914/2011, CAPÍTULO III, Seção V)
Art. 17. Compete ao Ministério da Saúde: (Origem: PRT MS/GM 2914/2011, Art. 17)
I - habilitar os laboratórios de referência regional e nacional para operacionalização das análises de maior complexidade na vigilância da qualidade da água para consumo humano, de acordo com os critérios estabelecidos na Portaria nº 70/SVS/MS, de 23 de dezembro de 2004; (Origem: PRT MS/GM 2914/2011, Art. 17, I)
II - estabelecer as diretrizes para operacionalização das atividades analíticas de vigilância da qualidade da água para consumo humano; e (Origem: PRT MS/GM 2914/2011, Art. 17, II)
III - definir os critérios e os procedimentos para adotar metodologias analíticas modificadas e não contempladas nas referências citadas no art. 22. (Origem: PRT MS/GM 2914/2011, Art. 17, III)
Art. 18. Compete às Secretarias de Saúde dos Estados habilitar os laboratórios de referência regional e municipal para operacionalização das análises de vigilância da qualidade da água para consumo humano. (Origem: PRT MS/GM 2914/2011, Art. 18)
Art. 19. Compete às Secretarias de Saúde dos Municípios indicar, para as Secretarias de Saúde dos Estados, outros laboratórios de referência municipal para operacionalização das análises de vigilância da qualidade da água para consumo humano, quando for o caso. (Origem: PRT MS/GM 2914/2011, Art. 19)
Art. 20. Compete aos responsáveis pelo fornecimento de água para consumo humano estruturar laboratórios próprios e, quando necessário, identificar outros para realização das análises dos parâmetros estabelecidos neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 20)
Art. 21. As análises laboratoriais para controle e vigilância da qualidade da água para consumo humano podem ser realizadas em laboratório próprio, conveniado ou subcontratado, desde que se comprove a existência de sistema de gestão da qualidade, conforme os requisitos especificados na NBR ISO/IEC 17025:2005. (Origem: PRT MS/GM 2914/2011, Art. 21)
Art. 22. As metodologias analíticas para determinação dos parâmetros previstos neste Anexo devem atender às normas nacionais ou internacionais mais recentes, tais como: (Origem: PRT MS/GM 2914/2011, Art. 22)
I - Standard Methods for the Examination of Water and Wastewater, de autoria das instituições American Public Health Association (APHA), American Water Works Association (AWWA) e Water Environment Federation (WEF); (Origem: PRT MS/GM 2914/2011, Art. 22, I)
II - United States Environmental Protection Agency (USEPA); (Origem: PRT MS/GM 2914/2011, Art. 22, II)
III - Normas publicadas pela International Standartization Organization (ISO); e (Origem: PRT MS/GM 2914/2011, Art. 22, III)
IV - Metodologias propostas pela Organização Mundial à Saúde (OMS). (Origem: PRT MS/GM 2914/2011, Art. 22, IV)
CAPÍTULO IV
DAS EXIGÊNCIAS APLICÁVEIS AOS SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA PARA CONSUMO HUMANO
(Origem: PRT MS/GM 2914/2011, CAPÍTULO IV)
Art. 23. Os sistemas e as soluções alternativas coletivas de abastecimento de água para consumo humano devem contar com responsável técnico habilitado. (Origem: PRT MS/GM 2914/2011, Art. 23)
Art. 24. Toda água para consumo humano, fornecida coletivamente, deverá passar por processo de desinfecção ou cloração. (Origem: PRT MS/GM 2914/2011, Art. 24)
Parágrafo Único. As águas provenientes de manancial superficial devem ser submetidas a processo de filtração. (Origem: PRT MS/GM 2914/2011, Art. 24, Parágrafo Único)
Art. 25. A rede de distribuição de água para consumo humano deve ser operada sempre com pressão positiva em toda sua extensão. (Origem: PRT MS/GM 2914/2011, Art. 25)
Art. 26. Compete ao responsável pela operação do sistema de abastecimento de água para consumo humano notificar à autoridade de saúde pública e informar à respectiva entidade reguladora e à população, identificando períodos e locais, sempre que houver: (Origem: PRT MS/GM 2914/2011, Art. 26)
I - situações de emergência com potencial para atingir a segurança de pessoas e bens; (Origem: PRT MS/GM 2914/2011, Art. 26, I)
II - interrupção, pressão negativa ou intermitência no sistema de abastecimento; (Origem: PRT MS/GM 2914/2011, Art. 26, II)
III - necessidade de realizar operação programada na rede de distribuição, que possa submeter trechos a pressão negativa; (Origem: PRT MS/GM 2914/2011, Art. 26, III)
IV - modificações ou melhorias de qualquer natureza nos sistemas de abastecimento; e (Origem: PRT MS/GM 2914/2011, Art. 26, IV)
V - situações que possam oferecer risco à saúde. (Origem: PRT MS/GM 2914/2011, Art. 26, V)
CAPÍTULO V
DO PADRÃO DE POTABILIDADE
(Origem: PRT MS/GM 2914/2011, CAPÍTULO V)
Art. 27. A água potável deve estar em conformidade com padrão microbiológico, conforme disposto no Anexo 1 do Anexo XX e demais disposições deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 27)
§ 1º No controle da qualidade da água, quando forem detectadas amostras com resultado positivo para coliformes totais, mesmo em ensaios presuntivos, ações corretivas devem ser adotadas e novas amostras devem ser coletadas em dias imediatamente sucessivos até que revelem resultados satisfatórios. (Origem: PRT MS/GM 2914/2011, Art. 27, § 1º)
§ 2º Nos sistemas de distribuição, as novas amostras devem incluir no mínimo uma recoleta no ponto onde foi constatado o resultado positivo para coliformes totais e duas amostras extras, sendo uma à montante e outra à jusante do local da recoleta. (Origem: PRT MS/GM 2914/2011, Art. 27, § 2º)
§ 3º Para verificação do percentual mensal das amostras com resultados positivos de coliformes totais, as recoletas não devem ser consideradas no cálculo. (Origem: PRT MS/GM 2914/2011, Art. 27, § 3º)
§ 4º O resultado negativo para coliformes totais das recoletas não anula o resultado originalmente positivo no cálculo dos percentuais de amostras com resultado positivo. (Origem: PRT MS/GM 2914/2011, Art. 27, § 4º)
§ 5º Na proporção de amostras com resultado positivo admitidas mensalmente para coliformes totais no sistema de distribuição, expressa no Anexo 1 do Anexo XX , não são tolerados resultados positivos que ocorram em recoleta, nos termos do art. 27, § 1º . (Origem: PRT MS/GM 2914/2011, Art. 27, § 5º)
§ 6º Quando o padrão microbiológico estabelecido no Anexo 1 do Anexo XX for violado, os responsáveis pelos sistemas e soluções alternativas coletivas de abastecimento de água para consumo humano devem informar à autoridade de saúde pública as medidas corretivas tomadas. (Origem: PRT MS/GM 2914/2011, Art. 27, § 6º)
§ 7º Quando houver interpretação duvidosa nas reações típicas dos ensaios analíticos na determinação de coliformes totais e Escherichia coli, deve-se fazer a recoleta. (Origem: PRT MS/GM 2914/2011, Art. 27, § 7º)
Art. 28. A determinação de bactérias heterotróficas deve ser realizada como um dos parâmetros para avaliar a integridade do sistema de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 28)
§ 1º A contagem de bactérias heterotróficas deve ser realizada em 20% (vinte por cento) das amostras mensais para análise de coliformes totais nos sistemas de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 28, § 1º)
§ 2º Na seleção dos locais para coleta de amostras devem ser priorizadas pontas de rede e locais que alberguem grupos populacionais de risco. (Origem: PRT MS/GM 2914/2011, Art. 28, § 2º)
§ 3º Alterações bruscas ou acima do usual na contagem de bactérias heterotróficas devem ser investigadas para identificação de irregularidade e providências devem ser adotadas para o restabelecimento da integridade do sistema de distribuição (reservatório e rede), recomendando-se que não se ultrapasse o limite de 500 UFC/mL. (Origem: PRT MS/GM 2914/2011, Art. 28, § 3º)
Art. 29. Recomenda-se a inclusão de monitoramento de vírus entéricos no(s) ponto(s) de captação de água proveniente(s) de manancial(is) superficial(is) de abastecimento, com o objetivo de subsidiar estudos de avaliação de risco microbiológico. (Origem: PRT MS/GM 2914/2011, Art. 29)
Art. 30. Para a garantia da qualidade microbiológica da água, em complementação às exigências relativas aos indicadores microbiológicos, deve ser atendido o padrão de turbidez expresso no Anexo 2 do Anexo XX e devem ser observadas as demais exigências contidas neste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 30)
§ 1º Entre os 5% (cinco por cento) dos valores permitidos de turbidez superiores ao VMP estabelecido no Anexo 2 do Anexo XX , para água subterrânea com desinfecção, o limite máximo para qualquer amostra pontual deve ser de 5,0 uT, assegurado, simultaneamente, o atendimento ao VMP de 5,0 uT em toda a extensão do sistema de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 30, § 1º)
§ 2º O valor máximo permitido de 0,5 uT para água filtrada por filtração rápida (tratamento completo ou filtração direta), assim como o valor máximo permitido de 1,0 uT para água filtrada por filtração lenta, estabelecidos no Anexo 2 do Anexo XX , deverão ser atingidos conforme as metas progressivas definidas no Anexo 3 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 30, § 2º)
§ 3º O atendimento do percentual de aceitação do limite de turbidez, expresso no Anexo 2 do Anexo XX , deve ser verificado mensalmente com base em amostras, preferencialmente no efluente individual de cada unidade de filtração, no mínimo diariamente para desinfecção ou filtração lenta e no mínimo a cada duas horas para filtração rápida. (Origem: PRT MS/GM 2914/2011, Art. 30, § 3º)
Art. 31. Os sistemas de abastecimento e soluções alternativas coletivas de abastecimento de água que utilizam mananciais superficiais devem realizar monitoramento mensal de Escherichia coli no(s) ponto(s) de captação de água. (Origem: PRT MS/GM 2914/2011, Art. 31)
§ 1º Quando for identificada média geométrica anual maior ou igual a 1.000 Escherichia coli/100mL deve-se realizar monitoramento de cistos de Giardia spp. e oocistos de Cryptosporidium spp. no(s) ponto(s) de captação de água. (Origem: PRT MS/GM 2914/2011, Art. 31, § 1º)
§ 2º Quando a média aritmética da concentração de oocistos de Cryptosporidium spp. for maior ou igual a 3,0 oocistos/L no(s) pontos(s) de captação de água, recomenda-se a obtenção de efluente em filtração rápida com valor de turbidez menor ou igual a 0,3 uT em 95% (noventa e cinco por cento) das amostras mensais ou uso de processo de desinfecção que comprovadamente alcance a mesma eficiência de remoção de oocistos de Cryptosporidium spp. (Origem: PRT MS/GM 2914/2011, Art. 31, § 2º)
§ 3º Entre os 5% (cinco por cento) das amostras que podem apresentar valores de turbidez superiores ao VMP estabelecido no art. 30, § 2º , o limite máximo para qualquer amostra pontual deve ser menor ou igual a 1,0 uT, para filtração rápida e menor ou igual a 2,0 uT para filtração lenta. (Origem: PRT MS/GM 2914/2011, Art. 31, § 3º)
§ 4º A concentração média de oocistos de Cryptosporidium spp. referida no art. 31, § 2º deve ser calculada considerando um número mínino de 24 (vinte e quatro) amostras uniformemente coletadas ao longo de um período mínimo de um ano e máximo de dois anos. (Origem: PRT MS/GM 2914/2011, Art. 31, § 4º)
Art. 32. No controle do processo de desinfecção da água por meio da cloração, cloraminação ou da aplicação de dióxido de cloro devem ser observados os tempos de contato e os valores de concentrações residuais de desinfetante na saída do tanque de contato expressos nos Anexos 4, 5 e 6 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 32)
§ 1º Para aplicação dos Anexos 4, 5 e 6 do Anexo XX deve-se considerar a temperatura média mensal da água. (Origem: PRT MS/GM 2914/2011, Art. 32, § 1º)
§ 2º No caso da desinfecção com o uso de ozônio, deve ser observado o produto, concentração e tempo de contato (CT) de 0,16 mg.min/L para temperatura média da água igual a 15º C. (Origem: PRT MS/GM 2914/2011, Art. 32, § 2º)
§ 3º Para valores de temperatura média da água diferentes de 15º C, deve-se proceder aos seguintes cálculos: (Origem: PRT MS/GM 2914/2011, Art. 32, § 3º)
I - para valores de temperatura média abaixo de 15ºC: duplicar o valor de CT a cada decréscimo de 10ºC; e (Origem: PRT MS/GM 2914/2011, Art. 32, § 3º, I)
II - para valores de temperatura média acima de 15ºC: dividir por dois o valor de CT a cada acréscimo de 10ºC. (Origem: PRT MS/GM 2914/2011, Art. 32, § 3º, II)
§ 4º No caso da desinfecção por radiação ultravioleta, deve ser observada a dose mínima de 1,5 mJ/cm2 para 0,5 log de inativação de cisto de Giardia spp. (Origem: PRT MS/GM 2914/2011, Art. 32, § 4º)
Art. 33. Os sistemas ou soluções alternativas coletivas de abastecimento de água supridas por manancial subterrâneo com ausência de contaminação por Escherichia coli devem realizar cloração da água mantendo o residual mínimo do sistema de distribuição (reservatório e rede), conforme as disposições contidas no art. 34. (Origem: PRT MS/GM 2914/2011, Art. 33)
§ 1º Quando o manancial subterrâneo apresentar contaminação por Escherichia coli, no controle do processo de desinfecção da água, devem ser observados os valores do produto de concentração residual de desinfetante na saída do tanque de contato e o tempo de contato expressos nos Anexos 4, 5 e 6 do Anexo XX ou a dose mínima de radiação ultravioleta expressa no art. 32, § 4º . (Origem: PRT MS/GM 2914/2011, Art. 33, § 1º)
§ 2º A avaliação da contaminação por Escherichia coli no manancial subterrâneo deve ser feita mediante coleta mensal de uma amostra de água em ponto anterior ao local de desinfecção. (Origem: PRT MS/GM 2914/2011, Art. 33, § 2º)
§ 3º Na ausência de tanque de contato, a coleta de amostras de água para a verificação da presença/ausência de coliformes totais em sistemas de abastecimento e soluções alternativas coletivas de abastecimento de águas, supridas por manancial subterrâneo, deverá ser realizada em local à montante ao primeiro ponto de consumo. (Origem: PRT MS/GM 2914/2011, Art. 33, § 3º)
Art. 34. É obrigatória a manutenção de, no mínimo, 0,2 mg/L de cloro residual livre ou 2 mg/L de cloro residual combinado ou de 0,2 mg/L de dióxido de cloro em toda a extensão do sistema de distribuição (reservatório e rede). (Origem: PRT MS/GM 2914/2011, Art. 34)
Art. 35. No caso do uso de ozônio ou radiação ultravioleta como desinfetante, deverá ser adicionado cloro ou dióxido de cloro, de forma a manter residual mínimo no sistema de distribuição (reservatório e rede), de acordo com as disposições do art. 34. (Origem: PRT MS/GM 2914/2011, Art. 35)
Art. 36. Para a utilização de outro agente desinfetante, além dos citados neste Anexo, deve-se consultar o Ministério da Saúde, por intermédio da SVS/MS. (Origem: PRT MS/GM 2914/2011, Art. 36)
Art. 37. A água potável deve estar em conformidade com o padrão de substâncias químicas que representam risco à saúde e cianotoxinas, expressos nos Anexos 7 e 8 do Anexo XX e demais disposições deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 37)
§ 1º No caso de adição de flúor (fluoretação), os valores recomendados para concentração de íon fluoreto devem observar a Portaria nº 635/GM/MS de 26 de dezembro de 1975, não podendo ultrapassar o VMP expresso na Tabela do Anexo 7 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 37, § 1º)
§ 2º As concentrações de cianotoxinas referidas no Anexo 8 do Anexo XX devem representar as contribuições da fração intracelular e da fração extracelular na amostra analisada. (Origem: PRT MS/GM 2914/2011, Art. 37, § 2º)
§ 3º Em complementação ao previsto no Anexo 8 do Anexo XX , quando for detectada a presença de gêneros potencialmente produtores de cilindrospermopsinas no monitoramento de cianobactérias previsto no art. 40, § 1º , recomenda-se a análise dessas cianotoxinas, observando o valor máximo aceitável de 1,0 µg/L. (Origem: PRT MS/GM 2914/2011, Art. 37, § 3º)
§ 4º Em complementação ao previsto no Anexo 8 do Anexo XX , quando for detectada a presença de gêneros de cianobactérias potencialmente produtores de anatoxina-a(s) no monitoramento de cianobactérias previsto no art. 40, § 1º , recomenda-se a análise da presença desta cianotoxina. (Origem: PRT MS/GM 2914/2011, Art. 37, § 4º)
Art. 38. Os níveis de triagem que conferem potabilidade da água do ponto de vista radiológico são valores de concentração de atividade que não excedem 0,5 Bq/L para atividade alfa total e 1Bq/L para beta total. (Origem: PRT MS/GM 2914/2011, Art. 38)
Parágrafo Único. Caso os níveis de triagem citados neste artigo sejam superados, deve ser realizada análise específica para os radionuclídeos presentes e o resultado deve ser comparado com os níveis de referência do Anexo 9 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 38, Parágrafo Único)
Art. 39. A água potável deve estar em conformidade com o padrão organoléptico de potabilidade expresso no Anexo 10 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 39)
§ 1º Recomenda-se que, no sistema de distribuição, o pH da água seja mantido na faixa de 6,0 a 9,5. (Origem: PRT MS/GM 2914/2011, Art. 39, § 1º)
§ 2º Recomenda-se que o teor máximo de cloro residual livre em qualquer ponto do sistema de abastecimento seja de 2 mg/L. (Origem: PRT MS/GM 2914/2011, Art. 39, § 2º)
§ 3º Na verificação do atendimento ao padrão de potabilidade expresso nos Anexos 7, 8, 9 e 10 do Anexo XX , eventuais ocorrências de resultados acima do VMP devem ser analisadas em conjunto com o histórico do controle de qualidade da água e não de forma pontual. (Origem: PRT MS/GM 2914/2011, Art. 39, § 3º)
§ 4º Para os parâmetros ferro e manganês são permitidos valores superiores ao VMPs estabelecidos no Anexo 10 do Anexo XX , desde que sejam observados os seguintes critérios: (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º)
I - os elementos ferro e manganês estejam complexados com produtos químicos comprovadamente de baixo risco à saúde, conforme preconizado no art. 13 e nas normas da ABNT; (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º, I)
II - os VMPs dos demais parâmetros do padrão de potabilidade não sejam violados; e (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º, II)
III - as concentrações de ferro e manganês não ultrapassem 2,4 e 0,4 mg/L, respectivamente. (Origem: PRT MS/GM 2914/2011, Art. 39, § 4º, III)
§ 5º O responsável pelo sistema ou solução alternativa coletiva de abastecimento de água deve encaminhar à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios informações sobre os produtos químicos utilizados e a comprovação de baixo risco à saúde, conforme preconizado no art. 13 e nas normas da ABNT. (Origem: PRT MS/GM 2914/2011, Art. 39, § 5º)
CAPÍTULO VI
DOS PLANOS DE AMOSTRAGEM
(Origem: PRT MS/GM 2914/2011, CAPÍTULO VI)
Art. 40. Os responsáveis pelo controle da qualidade da água de sistemas ou soluções alternativas coletivas de abastecimento de água para consumo humano, supridos por manancial superficial e subterrâneo, devem coletar amostras semestrais da água bruta, no ponto de captação, para análise de acordo com os parâmetros exigidos nas legislações específicas, com a finalidade de avaliação de risco à saúde humana. (Origem: PRT MS/GM 2914/2011, Art. 40)
§ 1º Para minimizar os riscos de contaminação da água para consumo humano com cianotoxinas, deve ser realizado o monitoramento de cianobactérias, buscando-se identificar os diferentes gêneros, no ponto de captação do manancial superficial, de acordo com a Tabela do Anexo 11 do Anexo XX , considerando, para efeito de alteração da frequência de monitoramento, o resultado da última amostragem. (Origem: PRT MS/GM 2914/2011, Art. 40, § 1º)
§ 2º Em complementação ao monitoramento do Anexo 11 do Anexo XX , recomenda-se a análise de clorofila-a no manancial, com frequência semanal, como indicador de potencial aumento da densidade de cianobactérias. (Origem: PRT MS/GM 2914/2011, Art. 40, § 2º)
§ 3º Quando os resultados da análise prevista no § 2° deste artigo revelarem que a concentração de clorofila-a em duas semanas consecutivas tiver seu valor duplicado ou mais, deve-se proceder nova coleta de amostra para quantificação de cianobactérias no ponto de captação do manancial, para reavaliação da frequência de amostragem de cianobactérias. (Origem: PRT MS/GM 2914/2011, Art. 40, § 3º)
§ 4º Quando a densidade de cianobactérias exceder 20.000 células/ml, deve-se realizar análise de cianotoxinas na água do manancial, no ponto de captação, com frequência semanal. (Origem: PRT MS/GM 2914/2011, Art. 40, § 4º)
§ 5º Quando as concentrações de cianotoxinas no manancial forem menores que seus respectivos VMPs para água tratada, será dispensada análise de cianotoxinas na saída do tratamento de que trata o Anexo 12 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 40, § 5º)
§ 6º Em função dos riscos à saúde associados às cianotoxinas, é vedado o uso de algicidas para o controle do crescimento de microalgas e cianobactérias no manancial de abastecimento ou qualquer intervenção que provoque a lise das células. (Origem: PRT MS/GM 2914/2011, Art. 40, § 6º)
§ 7º As autoridades ambientais e de recursos hídricos definirão a regulamentação das excepcionalidades sobre o uso de algicidas nos cursos d'água superficiais. (Origem: PRT MS/GM 2914/2011, Art. 40, § 7º)
Art. 41. Os responsáveis pelo controle da qualidade da água de sistema e solução alternativa coletiva de abastecimento de água para consumo humano devem elaborar e submeter para análise da autoridade municipal de saúde pública, o plano de amostragem de cada sistema e solução, respeitando os planos mínimos de amostragem expressos nos Anexos 11, 12, 13 e 14 do Anexo XX . (Origem: PRT MS/GM 2914/2011, Art. 41)
§ 1º A amostragem deve obedecer aos seguintes requisitos: (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º)
I - distribuição uniforme das coletas ao longo do período; (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, I)
II - representatividade dos pontos de coleta no sistema de distribuição (reservatórios e rede), combinando critérios de abrangência espacial e pontos estratégicos, entendidos como: (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II)
a) aqueles próximos a grande circulação de pessoas: terminais rodoviários, terminais ferroviários, entre outros; (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, a)
b) edifícios que alberguem grupos populacionais de risco, tais como hospitais, creches e asilos; (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, b)
c) aqueles localizados em trechos vulneráveis do sistema de distribuição como pontas de rede, pontos de queda de pressão, locais afetados por manobras, sujeitos à intermitência de abastecimento, reservatórios, entre outros; e (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, c)
d) locais com sistemáticas notificações de agravos à saúde tendo como possíveis causas os agentes de veiculação hídrica. (Origem: PRT MS/GM 2914/2011, Art. 41, § 1º, II, d)
§ 2º No número mínimo de amostras coletadas na rede de distribuição, previsto no Anexo 12 do Anexo XX , não se incluem as amostras extras (recoletas). (Origem: PRT MS/GM 2914/2011, Art. 41, § 2º)
§ 3º Em todas as amostras coletadas para análises microbiológicas, deve ser efetuada medição de turbidez e de cloro residual livre ou de outro composto residual ativo, caso o agente desinfetante utilizado não seja o cloro. (Origem: PRT MS/GM 2914/2011, Art. 41, § 3º)
§ 4º Quando detectada a presença de cianotoxinas na água tratada, na saída do tratamento, será obrigatória a comunicação imediata às clínicas de hemodiálise e às indústrias de injetáveis. (Origem: PRT MS/GM 2914/2011, Art. 41, § 4º)
§ 5º O plano de amostragem para os parâmetros de agrotóxicos deverá considerar a avaliação dos seus usos na bacia hidrográfica do manancial de contribuição, bem como a sazonalidade das culturas. (Origem: PRT MS/GM 2914/2011, Art. 41, § 5º)
§ 6º Na verificação do atendimento ao padrão de potabilidade expressos nos Anexos 7, 8, 9 e 10 do Anexo XX , a detecção de eventuais ocorrências de resultados acima do VMP devem ser analisadas em conjunto com o histórico do controle de qualidade da água. (Origem: PRT MS/GM 2914/2011, Art. 41, § 6º)
§ 7º Para populações residentes em áreas indígenas, populações tradicionais, dentre outras, o plano de amostragem para o controle da qualidade da água deverá ser elaborado de acordo com as diretrizes específicas aplicáveis a cada situação. (Origem: PRT MS/GM 2914/2011, Art. 41, § 7º)
CAPÍTULO VII
DAS PENALIDADES
(Origem: PRT MS/GM 2914/2011, CAPÍTULO VII)
Art. 42. Serão aplicadas as sanções administrativas previstas na Lei nº 6.437, de 20 de agosto de 1977, aos responsáveis pela operação dos sistemas ou soluções alternativas de abastecimento de água que não observarem as determinações constantes deste Anexo, sem prejuízo das sanções de natureza civil ou penal cabíveis. (Origem: PRT MS/GM 2914/2011, Art. 42)
Art. 43. Cabe ao Ministério da Saúde, por intermédio da SVS/MS, e às Secretarias de Saúde dos Estados, do Distrito Federal dos Municípios, ou órgãos equivalentes, assegurar o cumprimento deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 43)
CAPÍTULO VIII
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
(Origem: PRT MS/GM 2914/2011, CAPÍTULO VIII)
Art. 44. Sempre que forem identificadas situações de risco à saúde, o responsável pelo sistema ou solução alternativa coletiva de abastecimento de água e as autoridades de saúde pública devem, em conjunto, elaborar um plano de ação e tomar as medidas cabíveis, incluindo a eficaz comunicação à população, sem prejuízo das providências imediatas para a correção da anormalidade. (Origem: PRT MS/GM 2914/2011, Art. 44)
Art. 45. É facultado ao responsável pelo sistema ou solução alternativa coletiva de abastecimento de água solicitar à autoridade de saúde pública a alteração na frequência mínima de amostragem de parâmetros estabelecidos neste Anexo, mediante justificativa fundamentada. (Origem: PRT MS/GM 2914/2011, Art. 45)
Parágrafo Único. Uma vez formulada a solicitação prevista no caput deste artigo, a autoridade de saúde pública decidirá no prazo máximo de 60 (sessenta) dias, com base em análise fundamentada no histórico mínimo de dois anos do controle da qualidade da água considerando os respectivos planos de amostragens e de avaliação de riscos à saúde, da zona de captação e do sistema de distribuição. (Origem: PRT MS/GM 2914/2011, Art. 45, Parágrafo Único)
Art. 46. Verificadas características desconformes com o padrão de potabilidade da água ou de outros fatores de risco à saúde, conforme relatório técnico, a autoridade de saúde pública competente determinará ao responsável pela operação do sistema ou solução alternativa coletiva de abastecimento de água para consumo humano que: (Origem: PRT MS/GM 2914/2011, Art. 46)
I - amplie o número mínimo de amostras; (Origem: PRT MS/GM 2914/2011, Art. 46, I)
II - aumente a frequência de amostragem; e (Origem: PRT MS/GM 2914/2011, Art. 46, II)
III - realize análises laboratoriais de parâmetros adicionais. (Origem: PRT MS/GM 2914/2011, Art. 46, III)
Art. 47. Constatada a inexistência de setor responsável pela qualidade da água na Secretaria de Saúde dos Estados, do Distrito Federal e dos Municípios, os deveres e responsabilidades previstos, respectivamente, nos arts. 11 e 12 do Anexo XX serão cumpridos pelo órgão equivalente. (Origem: PRT MS/GM 2914/2011, Art. 47)
Art. 48. O Ministério da Saúde promoverá, por intermédio da SVS/MS, a revisão deste Anexo no prazo de 5 (cinco) anos ou a qualquer tempo. (Origem: PRT MS/GM 2914/2011, Art. 48)
Parágrafo Único. Os órgãos governamentais e não-governamentais, de reconhecida capacidade técnica nos setores objeto desta regulamentação, poderão requerer a revisão deste Anexo, mediante solicitação justificada, sujeita a análise técnica da SVS/MS. (Origem: PRT MS/GM 2914/2011, Art. 48, Parágrafo Único)
Art. 49. A União, os Estados, o Distrito Federal e os Municípios deverão adotar as medidas necessárias ao fiel cumprimento deste Anexo. (Origem: PRT MS/GM 2914/2011, Art. 50)
Art. 50. Ao Distrito Federal competem as atribuições reservadas aos Estados e aos Municípios. (Origem: PRT MS/GM 2914/2011, Art. 51)
ANEXO 1 DO ANEXO XX
TABELA DE PADRÃO MICROBIOLÓGICO DA ÁGUA PARA CONSUMO HUMANO (Origem: PRT MS/GM 2914/2011, Anexo 1)
NOTAS: (1) Valor Máximo Permitido.
(2) Indicador de contaminação fecal.
(3) Indicador de eficiência de tratamento.
(4) Indicador de integridade do sistema de distribuição (reservatório e rede).
ANEXO 2 DO ANEXO XX
TABELA DE PADRÃO DE TURBIDEZ PARA ÁGUA PÓS-FILTRAÇÃO OU PRÉ-DESINFECÇÃO (Origem: PRT MS/GM 2914/2011, Anexo 2)
NOTAS: (1) Valor Máximo Permitido.
(2) Unidade de Turbidez.
(3) Este valor deve atender ao padrão de turbidez de acordo com o especificado no § 2º do art. 30.
ANEXO 3 DO ANEXO XX
TABELA DE METAS PROGRESSIVAS PARA ATENDIMENTO AO VALOR MÁXIMO PERMITIDO DE 0,5 UT PARA FILTRAÇÃO RÁPIDA E DE 1,0 UT PARA FILTRAÇÃO LENTA (Origem: PRT MS/GM 2914/2011, Anexo 3)
ANEXO 4 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO POR MEIO DA CLORAÇÃO, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL LIVRE, COM A TEMPERATURA E O PH DA ÁGUA(¹) (Origem: PRT MS/GM 2914/2011, Anexo 4)
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de cloro livre na saída do tanque de contato (mg/L).
Tabela de tempo de contato mínimo (minutos) a ser observado para a desinfecção por meio da cloração, de acordo com concentração de cloro residual livre, com a temperatura e o pH da água(¹)
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de cloro livre na saída do tanque de contato (mg/L).
ANEXO 5 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO POR MEIO DE CLORAMINAÇÃO, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL COMBINADO (CLORAMINAS) E COM A TEMPERATURA DA ÁGUA, PARA VALORES DE PH DA ÁGUA ENTRE 6 E 9(¹) (Origem: PRT MS/GM 2914/2011, Anexo 5)
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de cloro combinado na saída do tanque de contato (mg/L).
ANEXO 6 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO COM DIÓXIDO DE CLORO, DE ACORDO COM CONCENTRAÇÃO DE DIÓXIDO DE CLORO E COM A TEMPERATURA DA ÁGUA, PARA VALORES DE PH DA ÁGUA ENTRE 6 E 9(¹) (Origem: PRT MS/GM 2914/2011, Anexo 6)
NOTAS:
(1) Valores intermediários aos constantes na tabela podem ser obtidos por interpolação.
(2) C: residual de dióxido de cloro na saída do tanque de contato (mg/L).
ANEXO 7 DO ANEXO XX
TABELA DE PADRÃO DE POTABILIDADE PARA SUBSTÂNCIAS QUÍMICAS QUE REPRESENTAM RISCO À SAÚDE (Origem: PRT MS/GM 2914/2011, Anexo 7)
NOTAS:
(1) CAS é o número de referência de compostos e substâncias químicas adotado pelo Chemical Abstract Service.
(2) Valor Máximo Permitido.
(3) Somatório dos isômeros alfa, beta e os sais de endossulfan, como exemplo o sulfato de endossulfan,
(4) Esse parâmetro é usualmente e equivocadamente, conhecido como BHC.
(5) Análise exigida de acordo com o desinfetante utilizado.
(6) Ácidos haloacéticos: Ácido monocloroacético (MCAA) - CAS = 79-11-8, Ácido monobromoacético (MBAA) - CAS = 79-08-3, Ácido dicloroacético (DCAA) - CAS = 79-43-6, Ácido 2,2 - dicloropropiônico (DALAPON) - CAS = 75-99-0, Ácido tricloroacético (TCAA) - CAS = 76-03-9, Ácido bromocloroacético (BCAA) CAS = 5589-96-3, 1,2,3, tricloropropano (PI) - CAS = 96-18-4, Ácido dibromoacético (DBAA) - CAS = 631-64-1, e Ácido bromodicloroacético (BDCAA) - CAS = 7113-314-7.
(7) Trihalometanos: Triclorometano ou Clorofórmio (TCM) - CAS = 67-66-3, Bromodiclorometano (BDCM) - CAS = 75-27-4, Dibromoclorometano (DBCM) - CAS = 124-48-1, Tribromometano ou Bromofórmio (TBM) - CAS = 75-25-2.
ANEXO 8 DO ANEXO XX
TABELA DE PADRÃO DE CIANOTOXINAS DA ÁGUA PARA CONSUMO HUMANO (Origem: PRT MS/GM 2914/2011, Anexo 8)
NOTAS:
(1) A frequência para o controle de cianotoxinas está prevista na tabela do Anexo XII.
(2) Valor Máximo Permitido.
(3) O valor representa o somatório das concentrações de todas as variantes de microcistinas.
ANEXO 9 DO ANEXO XX
TABELA DE PADRÃO DE RADIOATIVIDADE DA ÁGUA PARA CONSUMO HUMANO (Origem: PRT MS/GM 2914/2011, Anexo 9)
NOTAS: (1) Sob solicitação da Comissão Nacional de Energia Nuclear, outros radionuclídeos devem ser investigados.
ANEXO 10 DO ANEXO XX
TABELA DE PADRÃO ORGANOLÉPTICO DE POTABILIDADE (Origem: PRT MS/GM 2914/2011, Anexo 10)
NOTAS:
(1) Valor máximo permitido.
(2) Unidade Hazen (mgPt-Co/L).
(3) Intensidade máxima de percepção para qualquer característica de gosto e odor com exceção do cloro livre, nesse caso por ser uma característica desejável em água tratada.
(4) Unidade de turbidez.
ANEXO 11 DO ANEXO XX
TABELA DE FREQUÊNCIA DE MONITORAMENTO DE CIANOBACTÉRIAS NO MANANCIAL DE ABASTECIMENTO DE ÁGUA (Origem: PRT MS/GM 2914/2011, Anexo 11)
ANEXO 12 DO ANEXO XX
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES FÍSICAS, QUÍMICAS E DE RADIOATIVIDADE, EM FUNÇÃO DO PONTO DE AMOSTRAGEM, DA POPULAÇÃO ABASTECIDA E DO TIPO DE MANANCIAL. (Origem: PRT MS/GM 2914/2011, Anexo 12)
NOTAS:
(1) Análise exigida de acordo com o desinfetante utilizado.
(2) As amostras devem ser coletadas, preferencialmente, em pontos de maior tempo de detenção da água no sistema de distribuição.
(3) A definição da periodicidade de amostragem para o quesito de radioatividade será definido após o inventário inicial, realizado semestralmente no período de 2 anos, respeitando a sazonalidade pluviométrica.
(4) Para agrotóxicos, observar o disposto no parágrafo 5º do artigo 41.
(5) Dispensada análise na rede de distribuição quando o parâmetro não for detectado na saída do tratamento e, ou, no manancial, à exceção de substâncias que potencialmente possam ser introduzidas no sistema ao longo da distribuição.
ANEXO 13 DO ANEXO XX
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS MENSAIS PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES MICROBIOLÓGICAS, EM FUNÇÃO DA POPULAÇÃO ABASTECIDA (Origem: PRT MS/GM 2914/2011, Anexo 13)
NOTA:
(1) Recomenda-se a coleta de, no mínimo, quatro amostras semanais.
ANEXO 14 DO ANEXO XX
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA MÍNIMA DE AMOSTRAGEM PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SOLUÇÃO ALTERNATIVA COLETIVA, PARA FINS DE ANÁLISES FÍSICAS, QUÍMICAS E MICROBIOLÓGICAS, EM FUNÇÃO DO TIPO DE MANANCIAL E DO PONTO DE AMOSTRAGEM (Origem: PRT MS/GM 2914/2011, Anexo 14)
NOTAS:
(1) Para veículos transportadores de água para consumo humano, deve ser realizada uma análise de cloro residual livre em cada carga e uma análise, na fonte de fornecimento, de cor, turbidez, pH e coliformes totais com freqüência mensal, ou outra amostragem determinada pela autoridade de saúde pública.
(2) O número e a frequência de amostras coletadas no sistema de distribuição para pesquisa de Escherichia coli devem seguir o determinado para coliformes totais.
ANEXO XX
PROCEDIMENTOS DE CONTROLE E DE VIGILÂNCIA DA QUALIDADE DA ÁGUA PARA CONSUMO HUMANO E SEU PADRÃO DE POTABILIDADE
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 1º Este Anexo estabelece os procedimentos de controle e de vigilância da qualidade da água para consumo humano e seu padrão de potabilidade. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 2º Este Anexo se aplica à água destinada ao consumo humano proveniente de sistema de abastecimento de água, solução alternativa de abastecimento de água, coletiva e individual, e carro-pipa. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 3º Toda água destinada ao consumo humano, distribuída coletivamente por meio de sistema, solução alternativa coletiva de abastecimento de água ou carro-pipa, deve ser objeto de controle e vigilância da qualidade da água. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 4º Toda água destinada ao consumo humano proveniente de solução alternativa individual de abastecimento de água está sujeita à vigilância da qualidade da água. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO II
DAS DEFINIÇÕES
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 5º Para os fins deste Anexo são adotadas as seguintes definições: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - água para consumo humano: água potável destinada à ingestão, preparação de alimentos e à higiene pessoal, independentemente da sua origem; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - água potável: água que atenda ao padrão de potabilidade estabelecido neste Anexo e que não ofereça riscos à saúde; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - padrão de potabilidade: conjunto de valores permitidos para os parâmetros da qualidade da água para consumo humano, conforme definido neste Anexo; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - padrão organoléptico: conjunto de valores permitidos para os parâmetros caracterizados por provocar estímulos sensoriais que afetam a aceitação para consumo humano, mas que não necessariamente implicam risco à saúde; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - sistema de abastecimento de água para consumo humano (SAA): instalação composta por um conjunto de obras civis, materiais e equipamentos, desde a zona de captação até as ligações prediais, destinada à produção e ao fornecimento coletivo de água potável, por meio de rede de distribuição; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VI - solução alternativa coletiva de abastecimento de água para consumo humano (SAC): modalidade de abastecimento coletivo destinada a fornecer água potável, sem rede de distribuição; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VII - solução alternativa individual de abastecimento de água para consumo humano (SAI): modalidade de abastecimento de água para consumo humano que atenda a domicílios residenciais com uma única família, incluindo seus agregados familiares; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VIII - rede de distribuição: parte do sistema de abastecimento formada por tubulações e seus acessórios, destinados a distribuir água potável até as ligações prediais; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IX - ligações prediais: conjunto de tubos, peças, conexões e equipamentos que interliga a rede de distribuição à instalação hidráulica predial do usuário; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
X - instalação hidráulica predial: rede ou tubulação de água que vai da ligação de água do sistema de abastecimento até o reservatório de água do usuário; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XI - intermitência: paralização do fornecimento de água com duração igual ou superior a seis horas em cada ocorrência; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XII - controle da qualidade da água para consumo humano: conjunto de atividades exercidas regularmente pelo responsável pelo sistema ou por solução alternativa coletiva de abastecimento de água, destinado a verificar se a água fornecida à população é potável, de forma a assegurar a manutenção desta condição; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIII - vigilância da qualidade da água para consumo humano: conjunto de ações adotadas regularmente pela autoridade de saúde pública para verificar o atendimento a este Anexo e avaliar se a água consumida pela população apresenta risco à saúde; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIV - plano de amostragem: documento que inclui definição dos pontos de coleta, número e frequência de coletas de amostras para análise da qualidade da água e de parâmetros a serem monitorados; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XV - evento de saúde pública (ESP): situação que pode constituir potencial ameaça à saúde pública, como a ocorrência de surto ou epidemia, doença ou agravo de causa desconhecida, alteração no padrão clínico epidemiológico das doenças conhecidas, considerando o potencial de disseminação, a magnitude, a gravidade, a severidade, a transcendência e a vulnerabilidade, bem como epizootias ou agravos decorrentes de desastres ou acidentes; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVI - evento de massa: atividade coletiva de natureza cultural, esportiva, comercial, religiosa, social ou política, por tempo pré-determinado, com concentração ou fluxo excepcional de pessoas, de origem nacional ou internacional, e que, segundo a avaliação das ameaças, das vulnerabilidades e dos riscos à saúde pública exijam a atuação coordenada de órgãos de saúde pública da gestão municipal, estadual e federal e requeiram o fornecimento de serviços especiais de saúde, públicos ou privados; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVII - carro-pipa: veículo equipado com reservatório utilizado exclusivamente para distribuição e transporte de água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVIII - análise de situação de saúde: ações de monitoramento contínuo da situação de saúde da população do País, Estado, Região, Município ou áreas de abrangência de equipes de atenção à saúde, por estudos e análises que identifiquem e expliquem problemas de saúde e o comportamento dos principais indicadores de saúde, contribuindo para um planejamento de saúde abrangente; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIX - plano de ação: conjunto de ações, procedimentos e protocolos que visam corrigir, no menor tempo possível, situações de risco a saúde identificadas em SAA ou SAC; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XX - situação de risco à saúde: situação que apresenta risco ou ameaça à saúde pública decorrente de desastres, acidentes ou mudanças ambientais, ou ainda por alterações das condições normais de operação e manutenção de sistemas e soluções alternativas de abastecimento de água para consumo, que alterem a qualidade ou quantidade da água de consumo oferecida à população; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XXI - povos e comunidades tradicionais: grupos culturalmente diferenciados e que se reconhecem como tais, que possuem formas próprias de organização social, que ocupam e usam territórios e recursos naturais como condição para sua reprodução cultural, social, religiosa, ancestral e econômica, utilizando conhecimentos, inovações e práticas gerados e transmitidos pela tradição. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO III
DAS COMPETÊNCIAS E RESPONSABILIDADES
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção I
Das Competências Gerais dos Entes Federados
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 6º São competências da União, dos Estados, do Distrito Federal e dos Municípios, em seu âmbito administrativo: Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - promover a formação em vigilância da qualidade da água para consumo humano para os profissionais de saúde do SUS; Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - estabelecer mecanismos de acompanhamento da inserção dos dados no Sistema de Informação da Vigilância da Qualidade da Água para Consumo Humano (Sisagua); Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - analisar as informações do Sisagua na perspectiva de gestão de riscos e da segurança da água para consumo humano; Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - monitorar os indicadores pactuados para avaliação das ações e serviços de vigilância da qualidade da água para consumo humano; Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - informar à população, de forma clara e acessível, sobre a qualidade da água para consumo humano e os riscos à saúde associados, de acordo com o disposto no Decreto nº 5.440, de 4 de maio de 2005, ou em instrumento legal que venha substituí-lo; Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VI - realizar análise de situação de saúde relacionada ao abastecimento de água para consumo humano; e Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VII - promover ações em articulação com órgãos públicos que tenham relação com o abastecimento de água para consumo humano, tais como órgãos ambientais, gestores de recursos hídricos e entidades de regulação de serviços de saneamento básico. Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção II
Das Competências da União
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 7º Para os fins deste Anexo, as competências atribuídas à União serão exercidas pelo Ministério da Saúde e entidades a ele vinculadas, conforme estabelecido nesta Seção. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 8º Compete à Secretaria de Vigilância em Saúde (SVS/MS): (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - promover e acompanhar a vigilância da qualidade da água para consumo humano em articulação com as Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios e respectivos responsáveis pelo controle da qualidade da água; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - implementar o Programa Nacional de Vigilância da Qualidade da Água para Consumo Humano (Vigiagua); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - estabelecer diretrizes nacionais da vigilância da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - estabelecer prioridades, objetivos, metas e indicadores de vigilância da qualidade da água para consumo humano a serem pactuados na Comissão Intergestores Tripartite (CIT); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - gerenciar o Sisagua; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VI - disponibilizar publicamente os dados e informações do Sisagua; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VII - executar ações de vigilância da qualidade da água para consumo humano de forma complementar à atuação dos Estados, do Distrito Federal e dos Municípios. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 9º Compete à Secretaria Especial de Saúde Indígena (SESAI/MS): (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - planejar, coordenar, supervisionar, orientar, monitorar e avaliar as ações desenvolvidas nas aldeias indígenas; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - estabelecer diretrizes para as ações da qualidade da água para consumo humano em aldeias indígenas, a serem implementadas pelos respectivos Distritos Sanitários Especiais Indígenas (DSEI), considerando a realidade local, os aspectos epidemiológicos, socioambientais e etnoculturais; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - planejar e implementar, por meio dos Distritos Sanitários Especiais Indígenas (DSEI), ou mediante parcerias, as ações de qualidade da água para consumo humano nas aldeias indígenas, incluindo a operação, a manutenção, o monitoramento e a adoção de boas práticas; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - avaliar e implementar ações para minimização ou eliminação de potenciais riscos à saúde relacionados ao abastecimento de água para consumo humano em aldeias indígenas; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - inserir no Sisagua, os dados sobre o abastecimento de água para consumo humano das aldeias indígenas, por meio dos Distritos Sanitários Especiais Indígenas. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 10. Compete à Fundação Nacional de Saúde (FUNASA) apoiar as ações de controle e vigilância da qualidade da água para consumo humano, de forma articulada com seus respectivos responsáveis, conforme os critérios e parâmetros estabelecidos neste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 11. Compete à Agência Nacional de Vigilância Sanitária (Anvisa): (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - exercer a vigilância da qualidade da água para consumo humano nas áreas de portos, aeroportos e passagens de fronteiras terrestres, conforme os critérios e parâmetros estabelecidos neste Anexo, bem como diretrizes específicas pertinentes; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - regulamentar, controlar e fiscalizar águas envasadas, nos termos do inciso II do § 1º do art. 8º da Lei nº 9.782, de 26 de janeiro de 1999. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção III
Das Competências dos Estados
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 12. Compete às Secretarias de Saúde dos Estados e do Distrito Federal: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - promover, coordenar, implementar e supervisionar as ações de vigilância da qualidade da água em sua área de competência, em articulação com os responsáveis por SAA ou SAC e com as secretarias de saúde dos municípios, conforme estabelecido neste Anexo e: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) no Programa Vigiagua; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) na Diretriz Nacional do Plano de Amostragem da Vigilância da Qualidade da Água para Consumo Humano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) na Diretriz para Atuação em Situações de Surtos de Doenças e Agravos de Veiculação Hídrica; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - elaborar diretrizes e normas pertinentes à vigilância da qualidade da água complementares à disciplina nacional; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - estabelecer as prioridades, objetivos, metas, prazos para inserção de dados no Sisagua e indicadores de vigilância da qualidade da água para consumo humano a serem pactuados na Comissão Intergestores Bipartite (CIB); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - encaminhar, imediatamente, aos responsáveis por SAA e SAC e as respectivas agências reguladoras informações referentes aos eventos de saúde pública relacionados à qualidade da água para consumo humano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - executar as ações de vigilância da qualidade da água para consumo humano de forma complementar à atuação dos Municípios, em especial a realização de inspeção sanitária em formas de abastecimento de água para consumo humano. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção IV
Das Competências dos Municípios
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 13. Compete às Secretarias de Saúde dos Municípios e do Distrito Federal: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - exercer a vigilância da qualidade da água em sua área de competência, em articulação com o responsável por SAA ou SAC, conforme estabelecido neste Anexo e: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) no Programa Vigiagua; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) na Diretriz nacional do plano de amostragem da vigilância da qualidade da água para consumo humano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) na Diretriz para Atuação em Situações de Surtos de Doenças e Agravos de Veiculação Hídrica; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - elaborar, quando necessário, normas pertinentes à vigilância da qualidade da água complementares às disciplinas estadual e nacional; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - manter atualizados no Sisagua os dados de cadastro, controle e vigilância das formas de abastecimento de água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - autorizar o fornecimento de água para consumo humano, por meio de sistema ou solução alternativa coletiva de abastecimento de água, considerando os documentos exigidos no art. 15 deste Anexo; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - autorizar o fornecimento de água para consumo humano por meio de carro-pipa; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VI - realizar inspeções sanitárias periódicas em sistemas e soluções alternativas de abastecimento de água e carro-pipa; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VII - solicitar anualmente ou sempre que necessário, o plano de amostragem ao responsável por SAA ou SAC; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VIII - emitir parecer sobre o plano de amostragem elaborado pelo responsável por SAA ou SAC em até 30 (trinta) dias após o recebimento; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IX - inserir, no Sisagua, os dados do monitoramento de vigilância da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
X - analisar as informações disponíveis sobre as formas de abastecimento de água para consumo humano, com o objetivo de avaliar o cumprimento dos dispositivos deste Anexo e, quando identificadas não conformidades, proceder com as ações cabíveis, dentre outras ações: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) comunicar imediatamente ao responsável por SAA ou SAC as não conformidades identificadas; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) informar imediatamente às entidades de regulação dos serviços de saneamento básico sobre as não conformidades identificadas, no que couber; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) comunicar imediatamente à população, de forma clara e acessível, sobre os riscos associados ao abastecimento de água e medidas a serem adotadas; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XI - determinar ao responsável por SAA ou SAC, quando verificadas não conformidades que apontem para situações de risco à saúde, que: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) elabore plano de ação; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) adote e informe as medidas corretivas; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) amplie o número mínimo de amostras; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
d) aumente a frequência de amostragem; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
e) inclua o monitoramento de parâmetros adicionais; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XII - intensificar as ações do Programa Vigiagua quando ocorrerem eventos de massa, situações de risco a saúde ou eventos de saúde pública relacionados ao abastecimento de água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIII - realizar as ações de vigilância da qualidade da água para consumo humano nas áreas urbanas e rurais, incluindo comunidades tradicionais, aglomerados subnormais, grupos vulneráveis e comunidades indígenas localizadas na sede do município e em terras indígenas não homologadas, neste caso de forma articulada com o respectivo Distrito Sanitário Especial Indígena; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIV - avaliar o atendimento dos dispositivos deste Anexo, por parte do responsável por SAA ou SAC, notificando-os e estabelecendo prazo para sanar a(s) irregularidade(s) identificada(s); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XV - encaminhar, imediatamente, aos responsáveis pelo controle da qualidade da água para consumo humano e as respectivas agências reguladoras, informações referentes aos eventos de saúde pública relacionados à qualidade da água para consumo humano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVI - solicitar aos responsáveis por SAA ou SAC as informações sobre os produtos químicos utilizados no tratamento de água para consumo humano e sobre os materiais que tenham contato com a água para consumo humano durante sua produção, armazenamento e distribuição. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. Caso a autoridade de saúde não se manifeste no prazo determinado no inciso VIII, importará a aprovação tácita do plano de amostragem até manifestação em contrário, sem prejuízo de eventual responsabilização do responsável por SAA ou SAC por danos decorrentes de falha no plano de amostragem. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção V
Do responsável pelo sistema ou por solução alternativa coletiva de abastecimento de água para consumo humano
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 14. Compete ao responsável por SAA ou SAC: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - exercer o controle da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - operar e manter as instalações destinadas ao abastecimento de água potável em conformidade com as normas técnicas da Associação Brasileira de Normas Técnicas (ABNT) e demais normas pertinentes; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - fornecer água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - encaminhar à autoridade de saúde pública, anualmente e sempre que solicitado, o plano de amostragem de cada SAA e SAC, elaborado conforme art. 44 deste Anexo, para avaliação da vigilância; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - realizar o monitoramento da qualidade da água, conforme plano de amostragem definido para cada sistema e solução alternativa coletiva de abastecimento de água; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VI - promover capacitação e atualização técnica dos profissionais que atuam na produção, distribuição, armazenamento, transporte e controle da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VII - exigir dos fornecedores na aquisição, comprovação de que os materiais utilizados na produção, armazenamento e distribuição não alteram a qualidade da água e não ofereçam risco à saúde, segundo critérios da ANSI/NSF 61 ou certificação do material por um Organismo de Certificação de Produto (OCP) reconhecido pelo INMETRO; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VIII - exigir dos fornecedores, laudo de atendimento dos requisitos de saúde (LARS) e da comprovação de baixo risco a saúde (CBRS), para o controle de qualidade dos produtos químicos utilizados no tratamento da água, considerando a norma técnica da ABNT NBR 15.784; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IX - manter à disposição da autoridade de saúde dos Estados, do Distrito Federal e dos Municípios as informações sobre os produtos químicos utilizados no tratamento de água para consumo humano e sobre os materiais que tenham contato com a água para consumo humano durante sua produção, armazenamento e distribuição; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
X - manter avaliação sistemática do SAA ou SAC, sob a perspectiva dos riscos à saúde, com base nos seguintes critérios: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) ocupação da bacia contribuinte ao manancial; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) histórico das características das águas; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) características físicas do sistema; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
d) condições de operação e manutenção; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
e) qualidade da água distribuída; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XI - encaminhar à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios os dados de cadastro das formas de abastecimento e os relatórios de controle da qualidade da água, conforme o modelo estabelecido pela referida autoridade; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XII - registrar no Sisagua os dados de cadastro das formas de abastecimento e de controle da qualidade da água, quando acordado com a Secretaria de Saúde; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIII - fornecer à autoridade de saúde pública dos Estados, do Distrito Federal e dos Municípios os dados de controle da qualidade da água para consumo humano, quando solicitados; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIV - comunicar aos órgãos ambientais e aos gestores de recursos hídricos as características da qualidade da água do(s) manancial(ais) de abastecimento em desacordo com os limites ou condições da respectiva classe de enquadramento, conforme definido na legislação específica vigente; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XV - comunicar à autoridade de saúde pública alterações na qualidade da água do(s) manancial(ais) de abastecimento que revelem risco à saúde; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVI - contribuir com os órgãos ambientais e gestores de recursos hídricos, por meio de ações cabíveis para proteção do(s) manancial(ais) de abastecimento(s) e da(s) bacia(s) hidrográfica(s); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVII - proporcionar mecanismos para recebimento de reclamações, e manter registros atualizados sobre a qualidade da água distribuída e sobre as limpezas de reservatórios, sistematizando-os de forma compreensível aos consumidores e disponibilizando-os para pronto acesso e consulta pública, em atendimento às legislações específicas de defesa do consumidor e acesso à informação; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XVIII - implementar as ações de sua competência descritas no Decreto nº 5.440, de 4 de maio de 2005, ou em instrumento legal que venha substituí-lo; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XIX - exigir do responsável pelo carro-pipa, a autorização para transporte e fornecimento de água para consumo humano emitida pela autoridade de saúde pública, quando o carro-pipa não pertencer ao próprio responsável pelo SAA ou SAC, nos termos do inciso V do art. 13 deste Anexo; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XX - fornecer ao responsável pelo carro-pipa, no momento do abastecimento de água, documento com identificação do SAA ou SAC onde o carro-pipa foi abastecido, contendo a data e o horário do abastecimento; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XXI - notificar previamente à autoridade de saúde pública e informar à respectiva entidade reguladora e à população abastecida, quando houver operações programadas, que possam submeter trechos do sistema de distribuição à pressão negativa ou intermitência; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XXII - comunicar imediatamente à autoridade de saúde pública municipal e informar à população abastecida, em linguagem clara e acessível, a detecção de situações de risco à saúde ocasionadas por anomalia operacional ou por não conformidade na qualidade da água, bem como as medidas adotadas; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
XXIII - assegurar pontos de amostragem: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) na saída de cada filtro ou após a mistura da água filtrada, caso seja comprovado o impedimento da realização do monitoramento individual de cada unidade filtrante; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) na saída do tratamento; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) no(s) reservatório(s); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
d) na rede de distribuição; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
e) nos pontos de captação. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 15. O responsável por SAA ou SAC deve requerer, junto à Autoridade de Saúde Pública Municipal, autorização para início da operação e fornecimento de água para consumo humano, mediante a apresentação dos seguintes documentos: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - anotação de Responsabilidade Técnica do responsável pela operação do sistema ou solução alternativa coletiva; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - comprovação de regularidade junto ao órgão ambiental e de recursos hídricos; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - laudo de análise dos parâmetros de qualidade da água previstos neste Anexo; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - plano de amostragem. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção VI
Do responsável pela distribuição e transporte de água potável por meio de carro-pipa
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 16. Compete ao responsável pela distribuição e transporte de água potável por meio de carro-pipa: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - solicitar à autoridade de saúde pública autorização para transporte de água para consumo humano e cadastramento do carro-pipa; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - abastecer o carro-pipa exclusivamente com água potável, proveniente de sistema ou solução alternativa coletiva de abastecimento de água; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - manter as condições higiênico-sanitárias do carro-pipa exigidas pela autoridade de saúde pública; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - utilizar tanques, válvulas e equipamentos de carga e descarga da água exclusivamente para armazenamento e transporte de água potável, fabricados em materiais que não alteram a qualidade da água; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - portar o documento exigido no inciso XX, art. 14 deste Anexo e a autorização para transporte de água potável emitida pela autoridade de saúde pública, durante o deslocamento do carro-pipa; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VI - manter o teor mínimo de cloro residual livre de 0,5 mg/L; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
VII - garantir que o tanque utilizado para o transporte de água potável contenha, de forma visível, a inscrição "ÁGUA POTÁVEL" e os dados de endereço e telefone para contato. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. É vedado o transporte de água potável em carro-pipa com tanque compartimentado utilizado para transporte de outras cargas. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Seção VII
Dos Laboratórios de Controle e Vigilância
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 17. Compete ao Ministério da Saúde, no que concerne aos Laboratórios de Controle e Vigilância: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - coordenar, em âmbito nacional, as ações de laboratório necessárias para a vigilância da qualidade da água; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - habilitar os laboratórios de referência regional e nacional para operacionalização das análises da vigilância da qualidade da água para consumo humano, de acordo com os critérios estabelecidos na Portaria SVS/MS nº 33, de 22 de junho de 2017; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - indicar os laboratórios de referência nacional para realização das análises de vigilância da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - estabelecer as diretrizes para operacionalização das atividades analíticas de vigilância da qualidade da água para consumo humano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
V - definir os critérios e os procedimentos para adotar metodologias analíticas modificadas e não contempladas nas referências citadas no art. 22. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 18. Compete às Secretarias de Saúde dos Estados, no que concerne aos Laboratórios de Controle e Vigilância: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - coordenar, em âmbito estadual, as ações laboratoriais, sob sua competência, necessárias para a vigilância da qualidade da água, de forma articulada com a Rede Nacional de Laboratórios de Saúde Pública; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - habilitar os laboratórios de referência regional e municipal para operacionalização das análises de vigilância da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - indicar os laboratórios de referência regional e municipal para realização das análises de vigilância da qualidade da água para consumo humano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - encaminhar amostras para laboratórios da Rede Nacional de Laboratórios de Saúde Pública e Centros Colaboradores quando não houver capacidade local de análise. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 19. Compete às Secretarias de Saúde dos Municípios, no que concerne aos Laboratórios de Controle e Vigilância: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - coordenar e executar, em âmbito municipal, as ações de laboratório sob sua competência, necessárias para a vigilância da qualidade da água, de forma articulada com a Rede Nacional de Laboratórios de Saúde Pública; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - indicar, para as Secretarias de Saúde dos Estados, outros laboratórios de referência municipal para operacionalização das análises de vigilância da qualidade da água para consumo humano, quando for o caso. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 20. As análises laboratoriais para controle da qualidade da água para consumo humano podem ser realizadas em laboratório próprio, conveniado ou contratado, desde que estes comprovem a existência de boas práticas de laboratório e biossegurança, conforme normas da Agência Nacional de Vigilância Sanitária e demais normas relacionadas, e comprovem a existência de sistema de gestão da qualidade, conforme os requisitos especificados na NBR ISO/IEC 17025. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 21. As análises laboratoriais para vigilância da qualidade da água para consumo humano devem ser realizadas nos laboratórios de saúde pública. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. De forma complementar, as análises laboratoriais de vigilância da qualidade da água para consumo humano poderão ser realizadas em laboratórios conveniados ou contratados, desde que estes comprovem a existência de boas práticas de laboratório e biossegurança, conforme normas da Agência Nacional de Vigilância Sanitária e demais normas relacionadas, e comprovem a existência de sistema de gestão da qualidade, conforme os requisitos especificados na NBR ISO/IEC 17025. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 22. As metodologias analíticas para determinação dos parâmetros previstos neste Anexo devem atender às normas nacionais ou internacionais mais recentes, tais como: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - Standard Methods for the Examination of Water and Wastewater, de autoria das instituições American Public Health Association (APHA), American Water Works Association (AWWA) e Water Environment Federation (WEF); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - United States Environmental Protection Agency (USEPA); (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - Normas publicadas pela International Standartization Organization (ISO); e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
IV - Metodologias propostas pela Organização Mundial à Saúde (OMS). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º O Limite de quantificação (LQ) das metodologias utilizadas deve ser menor ou igual ao valor máximo permitido para cada parâmetro analisado. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º Os Limites de detecção (LD) e quantificação (LQ) devem ser inseridos no Sisagua. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Outras metodologias que não estejam relacionadas nas normas citadas no caput deste artigo podem ser utilizadas desde que sejam devidamente validadas e registradas conforme os requisitos especificados na NBR ISO/IEC 17025. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO IV
DAS EXIGÊNCIAS APLICÁVEIS AOS SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA PARA CONSUMO HUMANO
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 23. Os sistemas e as soluções alternativas coletivas de abastecimento de água para consumo humano devem contar com técnico habilitado responsável pela operação, com a respectiva anotação de responsabilidade técnica (ART) expedida pelo Conselho de Classe. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 24. Toda água para consumo humano fornecida coletivamente deverá passar por processo de desinfecção ou adição de desinfetante para manutenção dos residuais mínimos, conforme as disposições contidas no art. 32. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. As águas provenientes de manancial superficial devem ser submetidas a processo de filtração. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 25. A rede de distribuição de água para consumo humano deve ser operada sempre com: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - pressão positiva em toda sua extensão; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - regularidade de fornecimento evitando situações de paralisação e intermitências; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - práticas de desinfecção das tubulações em eventos de trocas de suas seções. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 26. A instalação hidráulica predial ligada ao sistema de abastecimento de água não poderá ser também alimentada por outras fontes. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO V
DO PADRÃO DE POTABILIDADE
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 27. A água potável deve estar em conformidade com padrão microbiológico, conforme disposto nos Anexos 1 a 8 e demais disposições deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º No controle da qualidade da água, quando forem detectadas amostras com resultado positivo para coliformes totais, mesmo em ensaios presuntivos, ações corretivas devem ser adotadas pelo responsável pelo SAA ou SAC e novas amostras devem ser coletadas em dias imediatamente sucessivos até que revelem resultados satisfatórios. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º Nos sistemas de distribuição, as novas amostras devem incluir no mínimo uma recoleta no ponto onde foi constatado o resultado positivo para coliformes totais e duas amostras extras, sendo uma à montante e outra à jusante do local da recoleta. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º As recoletas não devem ser consideradas no cálculo do percentual mensal de amostras com resultados positivos de coliformes totais. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º O resultado negativo para coliformes totais das recoletas não anula o resultado originalmente positivo no cálculo dos percentuais de amostras com resultado positivo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º Não são tolerados resultados positivos que ocorram em recoleta, nos termos do § 1º do art. 27. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 6º Quando o padrão bacteriológico estabelecido no Anexo 1 for violado, o responsável pelo SAA ou SAC deve informar à autoridade de saúde pública as medidas corretivas adotadas. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 7º Quando houver interpretação duvidosa nas reações típicas dos ensaios analíticos na determinação de coliformes totais e Escherichia coli, deve-se fazer a recoleta. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 28. Para a garantia da qualidade microbiológica da água, em complementação às exigências relativas aos indicadores microbiológicos, deve ser atendido o padrão de turbidez expresso no Anexo 2 e devem ser observadas as demais exigências contidas neste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Entre os 5% (cinco por cento) dos valores permitidos de turbidez superiores ao VMP estabelecido no Anexo 2 para água subterrânea, pós-desinfecção, o limite máximo para qualquer amostra pontual deve ser de 5,0 uT. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º Em toda a extensão do sistema de distribuição (reservatório e rede) ou pontos de consumo deverá atender ao VMP de 5,0 uT para turbidez. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º O atendimento do percentual de aceitação do limite de turbidez, expresso no Anexo 2, deve ser verificado mensalmente com base em amostras coletadas no efluente individual de cada unidade de filtração, no mínimo semanalmente para pós-desinfecção de água subterrânea, no mínimo diariamente para filtração lenta e a cada duas horas para filtração rápida ou filtração em membranas. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º Caso seja comprovado o impedimento da realização do monitoramento individual de cada unidade filtrante, poderá ser realizado o monitoramento na mistura do efluente dos diferentes filtros. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 29. Os sistemas e soluções alternativas coletivas de abastecimento de água que utilizam mananciais superficiais devem realizar monitoramento mensal de Escherichia coli no(s) ponto(s) de captação de água. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Quando for identificada média geométrica móvel dos últimos 12 meses de monitoramento maior ou igual a 1.000 Escherichia coli/100mL, deve-se avaliar a eficiência de remoção da Estação de Tratamento de Água (ETA) por meio do monitoramento semanal de esporos de bactérias aeróbias. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º A amostragem para o monitoramento semanal de esporos de bactérias aeróbias citada no § 1º deste artigo deve ser realizada na água bruta na entrada da ETA e na água filtrada, no efluente individual de cada unidade de filtração. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º O monitoramento para avaliação da eficiência de remoção de esporos de bactérias aeróbias na ETA deve ser mantido semanalmente, enquanto permanecerem as condições estabelecidas no § 1º deste artigo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º Quando a média aritmética da avaliação da eficiência de remoção da ETA, com base no mínimo em 4 amostragens no mês, for inferior a 2,5 log (99,7%), deve ser realizado monitoramento de cistos de Giardia spp. e oocistos de Cryptosporidium spp. em cada ponto de captação de água com frequência mensal ao longo dos 12 (doze) meses seguintes. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º Sistemas e soluções alternativas coletivas de abastecimento de água que realizam pré-oxidação devem proceder ao monitoramento de (oo)cistos de Cryprosporidium e Giardia quando identificada média geométrica móvel maior ou igual a 1.000 Escherichia coli/100mL. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 6º Uma vez iniciado o monitoramento de (oo)cistos, pode ser interrompido o monitoramento de esporos de bactérias aeróbias. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 7º Quando a média aritmética da concentração de oocistos de Cryptosporidium spp. for maior ou igual a 1,0 oocisto/L no(s) pontos(s) de captação de água, deve-se obter efluente em filtração rápida com valor de turbidez menor ou igual a 0,3 uT em 95% (noventa e cinco por cento) das amostras mensais ou uso de processo de desinfecção que comprovadamente alcance a mesma eficiência de remoção de oocistos. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 8º Entre os 5% (cinco por cento) das amostras que podem apresentar valores de turbidez superiores a 0,3 uT o limite máximo para qualquer amostra pontual deve ser menor ou igual a 1,0 uT para filtração rápida. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 9º Caso a concentração de oocistos seja inferior a 1 oocisto/L e a média geométrica móvel se mantenha superior ou igual a 1.000 Escherichia coli/100mL deve-se realizar o monitoramento de esporos de bactérias aeróbias pelo período de um ano. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 10. A concentração média de oocistos de Cryptosporidium spp., referida no § 7º deste artigo, deve ser calculada considerando um número mínimo de 12 (doze) amostras uniformemente coletadas ao longo dos 12 (doze) meses de monitoramento. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 11. Havendo comprovação de que todos os filtros rápidos do sistema de tratamento produzam água com turbidez inferior a 0,3 uT, de maneira sistemática, dispensa-se a realização dos ensaios exigidos neste artigo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 12. Para SAA e SAC com tratamento por filtração em membrana, deve-se obter um efluente filtrado com turbidez menor ou igual a 0,1 uT em pelo menos 99% das medições realizadas no mês. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 30. Para sistemas e soluções alternativas coletivas de abastecimento de água com captação em mananciais superficiais, no controle do processo de desinfecção da água por meio da cloração, cloraminação, da aplicação de dióxido de cloro ou de isocianuratos clorados devem ser observados os tempos de contato e as concentrações residuais de desinfetante na saída do tanque de contato, em função, quando cabível, dos valores de pH e temperatura, expressos nos Anexos 3, 4 e 5. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Para aplicação dos Anexos 3, 4 e 5 deve-se considerar a temperatura média mensal da água. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º No caso da desinfecção com o uso de ozônio, deve ser observado o produto concentração e tempo de contato (CT) de 0,34 mg.min/L para temperatura média mensal da água igual a 15º C. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Para valores de temperatura média da água diferentes de 15ºC, deve-se proceder aos seguintes cálculos para desinfecção com ozônio: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - para valores de temperatura média abaixo de 15ºC: duplicar o valor de CT a cada decréscimo de 10ºC; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - para valores de temperatura média acima de 15ºC: dividir por dois o valor de CT a cada acréscimo de 10ºC. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º No caso da desinfecção por radiação ultravioleta, deve ser observada a dose mínima de 2,1 mJ/cm2para 1,0 log (90%) de inativação de cistos de Giardia spp. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 31. Os sistemas ou soluções alternativas coletivas de abastecimento de água supridas por manancial subterrâneo com ausência de contaminação por Escherichia coli devem adicionar agente desinfetante, conforme as disposições contidas no art. 32. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Quando o manancial subterrâneo apresentar contaminação por Escherichia coli, no controle do processo de desinfecção da água por meio da cloração, cloraminação, da aplicação de dióxido de cloro ou de isocianuratos clorados, devem ser observados os tempos de contato e as concentrações residuais de desinfetante na saída do tanque de contato, em função, quando cabível, dos valores de pH e temperatura, expressos nos Anexos 6, 7 e 8 deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º No caso da desinfecção por radiação ultravioleta, deve ser observada a dose mínima de 1,5 mJ/cm2. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º No caso da desinfecção com o uso de ozônio, deve ser observado o produto, concentração e tempo de contato (CT) de 0,16 mg.min/L para temperatura média da água igual a 15ºC. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º Para valores de temperatura média da água diferentes de 15ºC, deve-se proceder aos seguintes cálculos para desinfecção com ozônio: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - para valores de temperatura média abaixo de 15ºC: duplicar o valor de CT a cada decréscimo de 10ºC; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - para valores de temperatura média acima de 15ºC: dividir por dois o valor de CT a cada acréscimo de 10ºC. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º A avaliação da contaminação por Escherichia coli no manancial subterrâneo deve ser feita mediante coleta mensal de uma amostra de água em ponto anterior ao local de desinfecção. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 6º Na ausência de tanque de contato, a coleta de amostras de água para a verificação da presença/ausência de coliformes totais em SAA e SAC, supridos por manancial subterrâneo, deverá ser realizada em local a montante ao primeiro ponto de consumo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 7º Caso o SAA ou SAC seja suprido também por manancial superficial, deverá seguir as exigências para desinfecção deste tipo de manancial. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 32. É obrigatória a manutenção de, no mínimo, 0,2 mg/L de cloro residual livre ou 2 mg/L de cloro residual combinado ou de 0,2 mg/L de dióxido de cloro em toda a extensão do sistema de distribuição (reservatório e rede) e nos pontos de consumo.
Art. 33. No caso do uso de ozônio ou radiação ultravioleta como desinfetante, deverá ser adicionado cloro ou dióxido de cloro, de forma a manter residual mínimo no sistema de distribuição (reservatório e rede) e no ponto de consumo, de acordo com as disposições do art. 32. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 34. A aplicação de compostos isocianuratos clorados deve seguir as diretrizes para utilização de cloro residual livre. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 35. Para a utilização de outro agente desinfetante, além dos citados neste Anexo, deve-se consultar o Ministério da Saúde, por intermédio da SVS/MS. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 36. A água potável deve estar em conformidade com o padrão de substâncias químicas que representam risco à saúde e cianotoxinas, expressos nos Anexos 9 e 10 e demais disposições deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º No caso de adição de flúor (fluoretação), os valores recomendados para concentração de íon fluoreto devem observar o Anexo XXI da Portaria de Consolidação nº 5/2017, não podendo ultrapassar o VMP expresso no Anexo 9 deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º O VMP de cada cianotoxina referida no Anexo 10 é referente à concentração total, considerando as frações intracelular e extracelular. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 37. Os níveis de triagem usados na avaliação da potabilidade da água, do ponto de vista radiológico, são os valores de concentração de atividade que não excedam 0,5 Bq/L para atividade alfa total e 1,0 Bq/L para beta total. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Caso os níveis de triagem de beta total sejam superados, deverá ser subtraída a contribuição do emissor beta K-40 (isótopo de Potássio com massa atômica 40 u). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º Caso as concentrações de atividades de alfa ou de beta total, após a subtração do K-40, permaneçam acima dos níveis de triagem citados neste artigo, outra amostra deverá ser coletada e analisada para alfa e beta total. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Se os novos valores obtidos continuarem acima dos níveis de triagem, consultar regulamento específico (POSIÇÃO REGULATÓRIA 3.01/012:2020) da Comissão Nacional de Energia Nuclear (CNEN) para saber como proceder nessa situação. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º A CNEN poderá solicitar à análise específica de radionuclídeos naturais e/ou artificiais potencialmente presentes na água, assim como outras informações relevantes, conforme especificado em sua POSIÇÃO REGULATÓRIA 3.01/012:2020. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º A CNEN avaliará sobre a potabilidade do ponto de vista radiológico, com base na dose total estimada devido à ingestão de água contendo todos os radionuclídeos presentes. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 6º Até que a CNEN avalie a potabilidade da água do ponto de vista radiológico, nenhuma medida de restrição ao abastecimento com base no aspecto radiológico deve ser adotada, considerando as elevadas incertezas que podem estar associadas às técnicas para determinação de alfa e beta total. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 7º A amostra para avaliação radiológica deve ser coletada semestralmente na rede de distribuição de SAA ou no ponto de consumo de SAC. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 38. A água potável deve estar em conformidade com o padrão organoléptico de potabilidade expresso no Anexo 11 e demais disposições deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Para os parâmetros ferro e manganês são permitidos valores superiores ao VMPs estabelecidos no Anexo 11, desde que sejam observados os seguintes critérios: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - os elementos ferro e manganês estejam complexados com produtos químicos comprovadamente de baixo risco à saúde, conforme preconizado no inciso VIII do art. 14 e nas normas da ABNT; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - as concentrações de ferro e manganês não ultrapassem 2,4 e 0,4 mg/L, respectivamente. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 39. A soma das razões das concentrações de nitrito e nitrato e seus respectivos VMPs, estabelecidos no Anexo 9, não deve exceder 1. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º O critério definido no caput deste artigo é expresso pela seguinte inequação: (Concentração nitrato/VMP nitrato)+(Concentração nitrito/VMP nitrito) £1. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º O critério definido no caput deste artigo é expresso pela seguinte inequação: (Concentração nitrato/VMP nitrato)+(Concentração nitrito/VMP nitrito)£1. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
§ 2º O critério definido no caput deste artigo não exime o cumprimento dos VMP estabelecidos individualmente para nitrito e nitrato. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 40. O cumprimento do padrão de potabilidade de subprodutos da desinfecção deve ser verificado com base na média móvel dos resultados das amostras analisadas nos últimos doze meses, de acordo com o plano de amostragem definido neste Anexo.
Parágrafo único. A média móvel de que trata o caput deste artigo deve ser computada individualmente para cada ponto de amostragem. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 41. Na verificação do atendimento ao padrão de potabilidade expresso nos Anexos 9 a 11, a comparação dos resultados analíticos com o VMP de parâmetros expressos pelo somatório de analitos individuais deve obedecer aos seguintes requisitos: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - caso pelo menos um analito seja quantificado, considerar, para a soma dos componentes com resultados menores que o LD ou o LQ, os valores de LD/2 e LQ/2, respectivamente; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - caso nenhum analito apresente resultado quantificado e pelo menos um analito seja menor que o LQ considerar o maior valor de LQ; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - caso os resultados de todos os analitos sejam menores que o LD, considerar o maior valor de LD. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. O somatório dos LQ de todos os analitos individuais deve ser no máximo igual ao VMP estabelecido para o somatório. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO VI
DOS PLANOS DE AMOSTRAGEM DE CONTROLE DA QUALIDADE DA ÁGUA PARA CONSUMO HUMANO
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 42. Os responsáveis por SAA e SAC devem analisar pelo menos uma amostra semestral da água bruta em cada ponto de captação com vistas a uma gestão preventiva de risco. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Nos Sistemas e soluções alternativas coletivas de abastecimento de água para consumo humano, supridos por manancial superficial devem realizar análise dos parâmetros Demanda Química de Oxigênio (DQO), Demanda Bioquímica de Oxigênio (DBO), Oxigênio Dissolvido (OD), Turbidez, Cor Verdadeira, pH, Fósforo Total, Nitrogênio Amoniacal Total e dos parâmetros inorgânicos, orgânicos e agrotóxicos, exigidos neste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º Sistemas e soluções alternativas coletivas de abastecimento de água para consumo humano, supridos por manancial subterrâneo devem realizar análise dos parâmetros Turbidez, Cor Verdadeira, pH, Fósforo Total, Nitrogênio Amoniacal Total, condutividade elétrica e dos parâmetros inorgânicos, orgânicos e agrotóxicos, exigidos neste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 43. Para minimizar os riscos de contaminação da água para consumo humano com cianotoxinas, os responsáveis por SAA ou SAC com captação em mananciais superficiais devem realizar monitoramento para identificação e contagem de células de cianobactérias, de acordo com a Tabela do Anexo 12, considerando, para efeito de alteração da frequência de monitoramento, o resultado da última amostragem. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º Em complementação ao monitoramento do Anexo 12, deve ser realizada análise de clorofila-a no manancial, com frequência mensal, como indicador de potencial aumento da contagem de cianobactérias, de modo que: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - quando os resultados da análise prevista no § 1º deste artigo revelarem que a concentração de clorofila-a é igual ou superior a 10 μg/L, deve-se proceder a nova coleta de amostra para análise do fitoplâncton; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - se a contagem de células de cianobactérias representar 10% ou mais do fitoplâncton, deve ser realizado monitoramento semanal de cianobactérias no manancial, no ponto de captação; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
III - o monitoramento de clorofila-a descrito no § 1º deste artigo pode ser substituído pelo monitoramento mensal de cianobactérias no ponto de captação, atendendo o limite de contagem de células de cianobactérias menor ou igual a 10.000 células/mL. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º Quando a contagem de células de cianobactérias exceder 20.000 células/mL, deve-se realizar análise das cianotoxinas microcistinas, saxitoxinas e cilindrospermopsinas no ponto de captação com frequência no mínimo semanal, de modo que as análises de cianotoxinas no ponto de captação devem permanecer enquanto se mantiver contagem de células de cianobactérias superior a 20.000 células/mL. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Alternativamente ao monitoramento de cianobactérias pode ser realizado o monitoramento semanal de cianotoxinas na água bruta (entrada da ETA), de modo que, quando o monitoramento de cianotoxinas for realizado semanalmente na água bruta, fica dispensada a realização do monitoramento de cianobactérias e clorofila-a no ponto de captação. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º Quando a análise de cianotoxinas realizada na água bruta (entrada da ETA) ou em pelo menos um ponto de captação for superior ao VMP expresso no Anexo 10, será obrigatória a realização da análise de cianotoxinas na saída do tratamento com frequência semanal. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º Quando a análise de cianotoxinas na água bruta (entrada da ETA) ou em todos os pontos de captação for inferior ao VMP expresso no Anexo 10, será dispensada a realização desta análise na saída do tratamento. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 6º O monitoramento de cianobactérias, quando exigido, deve ser realizado em cada ponto de captação e deve identificar os gêneros presentes. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 7º Em função dos riscos à saúde associados às cianotoxinas, é vedado o uso de algicidas para o controle do crescimento de microalgas e cianobactérias no manancial de abastecimento ou qualquer intervenção que provoque a lise das células. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 8º As autoridades ambientais e de recursos hídricos definirão a regulamentação das excepcionalidades sobre o uso de algicidas nos cursos d'água superficiais. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 9º Quando detectada a presença de cianotoxinas na água tratada, na saída do tratamento, será obrigatória a comunicação imediata a autoridade de saúde pública, às clínicas de hemodiálise e às indústrias de injetáveis. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 44. Os responsáveis por SAA e SAC devem elaborar anualmente e submeter para análise da autoridade municipal de saúde pública, o plano de amostragem de cada sistema e solução, respeitando os planos mínimos de amostragem expressos neste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º A amostragem deve obedecer aos seguintes requisitos: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - distribuição uniforme das coletas ao longo do período de um ano; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - representatividade dos pontos de coleta no sistema de distribuição (reservatórios e rede), combinando critérios de abrangência espacial e pontos estratégicos, entendidos como: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
a) aqueles próximos a grande circulação de pessoas: terminais rodoviários, terminais ferroviários, entre outros; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
b) edifícios que alberguem grupos populacionais de risco, tais como hospitais, creches, asilos e presídios; (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
c) aqueles localizados em trechos vulneráveis do sistema de distribuição como pontas de rede, pontos de queda de pressão, locais afetados por manobras, sujeitos à intermitência de abastecimento, reservatórios, entre outros; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
d) locais com sistemáticas notificações de agravos à saúde tendo como possíveis causas os agentes de veiculação hídrica. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º No número mínimo de amostras coletadas na rede de distribuição e no ponto de consumo, previsto no Anexo 14 e no Anexo 15, não se incluem as amostras extras (recoletas). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Em todas as amostras coletadas para análises bacteriológicas, deve ser efetuada medição de cor aparente, turbidez, pH e residual de desinfetante. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Em todas as amostras coletadas para análises bacteriológicas, deve ser efetuada medição de cor aparente, turbidez e residual de desinfetante. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
§ 4º As coletas de amostras para análise dos parâmetros de agrotóxicos deverão considerar a avaliação dos seus usos na bacia hidrográfica do manancial de contribuição, bem como a sazonalidade das culturas. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º Na verificação do atendimento ao padrão de potabilidade expressos nos Anexos 9 a 11, a detecção de eventuais ocorrências de resultados acima do VMP deve ser analisada em conjunto com o histórico do controle de qualidade da água. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 6º O plano de amostragem deve abranger aglomerados subnormais e grupos sociais vulneráveis abastecidos. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 45. Para populações residentes em áreas indígenas e povos e comunidades tradicionais, o plano de amostragem para o controle da qualidade da água deverá ser elaborado de acordo com as diretrizes específicas aplicáveis a cada situação. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. O plano de amostragem para o monitoramento da qualidade da água em áreas indígenas deverá ser implementado de acordo com o Plano de Monitoramento da Qualidade da Água para Consumo Humano elaborado pelos Distritos Sanitários Especiais Indígenas (DSEI), considerando as diretrizes estabelecidas pela SESAI/MS. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO VII
DAS PENALIDADES
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 46. Serão aplicadas as sanções previstas na Lei nº 6.437, de 20 de agosto de 1977, e na Lei nº 8.078, de 11 de setembro de 1990, além de normativas estaduais e municipais aplicáveis, aos responsáveis por SAA ou SAC que não observarem as determinações constantes neste Anexo, sem prejuízo das sanções de natureza civil ou penal cabíveis. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 47. Cabe ao Ministério da Saúde, por intermédio da SVS/MS, e às Secretarias de Saúde dos Estados, do Distrito Federal e dos Municípios, assegurar o cumprimento deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
CAPÍTULO VIII
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 48. Sempre que forem identificadas situações de risco à saúde, os responsáveis pelo SAA ou SAC e as autoridades de saúde pública devem, em conjunto, elaborar um plano de ação e tomar as medidas cabíveis, incluindo a eficaz comunicação à população, sem prejuízo das providências imediatas para a correção das não conformidades. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 49. A Autoridade de Saúde Pública poderá exigir dos responsáveis por SAA e SAC a elaboração e implementação de Plano de Segurança da Água (PSA), conforme a metodologia e o conteúdo preconizados pela Organização Mundial da Saúde ou definidos em diretrizes do Ministério da Saúde, para fins de gestão preventiva de risco à saúde (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 50. É facultado ao responsável por SAA ou SAC solicitar à autoridade de saúde pública alteração dos parâmetros monitorados e da frequência mínima de amostragem, mediante apresentação de: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
I - histórico mínimo de dois anos de monitoramento da qualidade da água bruta, tratada e distribuída, considerando o plano de amostragem estabelecido neste Anexo; e (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
II - PSA, conforme art. 49. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 1º A autoridade de saúde pública deve emitir parecer sobre a solicitação prevista no caput deste artigo, no prazo máximo de 120 (cento e vinte) dias, com base em análise fundamentada nos documentos referidos nos incisos I e II deste artigo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 2º As alterações do plano de amostragem autorizadas pela autoridade de saúde pública terão validade máxima de dois anos, podendo ser suspensa caso ocorram alterações na bacia hidrográfica ou nos sistemas e soluções alternativas coletivas de abastecimento de água que justifiquem. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 3º Para renovação da autorização prevista no caput deste artigo, o responsável por SAA ou SAC deverá encaminhar à autoridade de saúde pública a solicitação de renovação acompanhada da revisão do PSA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 4º A autoridade de saúde pública deve emitir parecer sobre a solicitação de renovação, no prazo máximo de 60 (sessenta) dias, com base na análise da revisão do PSA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
§ 5º Quando observada a não implementação do PSA por parte do responsável por SAA ou SAC, será exigido o cumprimento integral do plano de amostragem estabelecido neste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 51. O Ministério da Saúde promoverá, por intermédio da SVS/MS, a revisão deste Anexo no prazo de 5 (cinco) anos ou a qualquer tempo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parágrafo único. Os órgãos governamentais e não-governamentais, de reconhecida capacidade técnica nos setores objeto desta regulamentação, poderão requerer a revisão deste Anexo, mediante solicitação justificada, sujeita a análise técnica da SVS/MS. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 52. A União, os Estados, o Distrito Federal e os Municípios deverão adotar as medidas necessárias ao fiel cumprimento deste Anexo. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 53. Ao Distrito Federal competem as atribuições reservadas aos Estados e aos Municípios. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 54. Fica estabelecido o prazo máximo de 12 (doze) meses, contados a partir da data de publicação deste Anexo, para que os órgãos e entidades sujeitos à aplicação deste Anexo promovam as adequações necessárias à implementação do monitoramento de esporos de bactérias aeróbias, conforme art. 29. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 55. Fica estabelecido o prazo máximo de 24 (vinte e quatro) meses, contados a partir da data de publicação deste Anexo, para que os órgãos e entidades sujeitos à aplicação deste Anexo promovam as adequações necessárias para o alcance do novo VMP para o parâmetro dureza, conforme Anexo 11. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Art. 56. Enquanto o monitoramento de esporos de bactérias aeróbias não estiver implantado, deve-se realizar o monitoramento de cistos de Giardia e oocistos de Cryptosporidium ao ser identificada média geométrica móvel dos últimos 12 (doze)meses de monitoramento maior ou igual a 1.000 Escherichia coli/100mL. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 1 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE PADRÃO BACTERIOLÓGICO DA ÁGUA PARA CONSUMO HUMANO. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Formas de abastecimento |
Parâmetro |
VMP(1) |
||
SAI |
Escherichia coli(2) |
Ausência em 100 mL |
||
SAA e SAC |
Na saída do tratamento |
Coliformes totais(3) |
Ausência em 100 mL |
|
Sistema de distribuição e pontos de consumo |
Escherichia coli(2) |
Ausência em 100 mL |
||
Coliformes totais(4) |
Sistemas ou soluções alternativas coletivas que abastecem menos de 20.000 habitantes |
Apenas uma amostra, entre as amostras examinadas no mês pelo responsável pelo sistema ou por solução alternativa coletiva de abastecimento de água, poderá apresentar resultado positivo |
||
Sistemas ou soluções alternativas coletivas que abastecem a partir de 20.000 habitantes |
Ausência em 100 mL em 95% das amostras examinadas no mês pelo responsável pelo sistema ou por solução alternativa coletiva de abastecimento de água. |
|||
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. Valor Máximo Permitido (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
2. Indicador de contaminação fecal. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
3. Indicador de eficiência de tratamento. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
4. Indicador da condição de operação e manutenção do sistema de distribuição de SAA e pontos de consumo e reservatório de SAC em que a qualidade da água produzida pelos processos de tratamento seja preservada (indicador de integridade). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 2 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE PADRÃO DE TURBIDEZ PARA ÁGUA PÓS-DESINFECÇÃO (PARA ÁGUAS SUBTERRÂNEAS) OU PÓS-FILTRAÇÃO (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Tratamento da água |
VMP(1) |
Número de amostras |
Frequência |
Filtração rápida (tratamento completo ou filtração direta) |
0,5 uT(2) em 95% das amostras. 1,0 uT no restante das amostras mensais coletadas. |
1 |
A cada 2horas |
Filtração em Membrana |
0,1 uT(2) em 99% das amostras. |
1 |
A cada 2horas |
Filtração lenta |
1,0 uT(2) em 95% das amostras. 2,0 uT no restante das amostras mensais coletadas. |
1 |
Diária |
Pós-desinfecção (para águas subterrâneas) |
1,0 uT(2) em 95% das amostras. 5,0 uT no restante das amostras mensais coletadas. |
1 |
Semanal |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. Valor Máximo Permitido (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
2. Unidade de Turbidez (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 3 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO EM SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA COM CAPTAÇÃO EM MANANCIAIS SUPERFICIAIS, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL LIVRE, COM A TEMPERATURA E O pH DA ÁGUA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
C (1) |
Temperatura (5ºC ) |
Temperatura (10ºC ) |
Temperatura (15ºC ) |
||||||||||||||||||
Valores de pH |
Valores de pH |
Valores de pH |
|||||||||||||||||||
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
|
0,1 |
248 |
308 |
376 |
452 |
538 |
633 |
739 |
175 |
218 |
266 |
320 |
380 |
448 |
522 |
124 |
154 |
188 |
226 |
269 |
317 |
369 |
0,2 |
138 |
171 |
208 |
251 |
298 |
351 |
410 |
97 |
121 |
147 |
177 |
211 |
248 |
290 |
69 |
85 |
104 |
125 |
149 |
176 |
205 |
0,3 |
98 |
121 |
148 |
178 |
211 |
249 |
290 |
69 |
86 |
104 |
126 |
150 |
176 |
205 |
49 |
60 |
74 |
89 |
106 |
124 |
145 |
0,4 |
76 |
95 |
116 |
139 |
166 |
195 |
227 |
54 |
67 |
82 |
98 |
117 |
138 |
161 |
38 |
47 |
58 |
70 |
83 |
97 |
114 |
0,5 |
63 |
78 |
96 |
115 |
137 |
161 |
188 |
45 |
55 |
68 |
81 |
97 |
114 |
133 |
32 |
39 |
48 |
58 |
68 |
81 |
94 |
0,6 |
54 |
67 |
82 |
99 |
117 |
138 |
161 |
38 |
47 |
58 |
70 |
83 |
98 |
114 |
27 |
34 |
41 |
49 |
59 |
69 |
80 |
0,7 |
47 |
59 |
72 |
87 |
103 |
121 |
141 |
34 |
42 |
51 |
61 |
73 |
86 |
100 |
24 |
29 |
36 |
43 |
51 |
61 |
71 |
0,8 |
42 |
53 |
64 |
77 |
92 |
108 |
126 |
30 |
37 |
45 |
55 |
65 |
76 |
89 |
21 |
26 |
32 |
39 |
46 |
54 |
63 |
0,9 |
38 |
48 |
58 |
70 |
83 |
98 |
114 |
27 |
34 |
41 |
49 |
59 |
69 |
81 |
19 |
24 |
29 |
35 |
42 |
49 |
57 |
1,0 |
35 |
43 |
53 |
64 |
76 |
89 |
104 |
25 |
31 |
38 |
45 |
54 |
63 |
74 |
18 |
22 |
27 |
32 |
38 |
45 |
52 |
1,1 |
32 |
40 |
49 |
59 |
70 |
82 |
96 |
23 |
28 |
35 |
42 |
50 |
58 |
68 |
16 |
20 |
24 |
29 |
35 |
41 |
48 |
1,2 |
30 |
37 |
45 |
55 |
65 |
77 |
89 |
21 |
26 |
32 |
39 |
46 |
54 |
63 |
15 |
19 |
23 |
27 |
33 |
38 |
45 |
1,3 |
28 |
35 |
42 |
51 |
61 |
72 |
83 |
20 |
25 |
30 |
36 |
43 |
51 |
59 |
14 |
17 |
21 |
26 |
30 |
36 |
42 |
1,4 |
26 |
33 |
40 |
48 |
57 |
67 |
78 |
19 |
23 |
28 |
34 |
40 |
48 |
55 |
13 |
16 |
20 |
24 |
29 |
34 |
39 |
1,5 |
25 |
31 |
38 |
45 |
54 |
63 |
74 |
18 |
22 |
27 |
32 |
38 |
45 |
52 |
12 |
15 |
19 |
23 |
27 |
32 |
37 |
1,6 |
24 |
29 |
36 |
43 |
51 |
60 |
70 |
17 |
21 |
25 |
30 |
36 |
42 |
49 |
12 |
15 |
18 |
21 |
25 |
30 |
35 |
1,7 |
22 |
28 |
34 |
41 |
48 |
57 |
66 |
16 |
20 |
24 |
29 |
34 |
40 |
47 |
11 |
14 |
17 |
20 |
24 |
28 |
33 |
1,8 |
21 |
26 |
32 |
39 |
46 |
54 |
63 |
15 |
19 |
23 |
27 |
33 |
38 |
45 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
1,9 |
20 |
25 |
31 |
37 |
44 |
52 |
60 |
14 |
18 |
22 |
26 |
31 |
37 |
43 |
10 |
13 |
15 |
19 |
22 |
26 |
30 |
2,0 |
19 |
24 |
29 |
35 |
42 |
50 |
58 |
14 |
17 |
21 |
25 |
30 |
35 |
41 |
10 |
12 |
15 |
18 |
21 |
25 |
29 |
2,1 |
19 |
23 |
28 |
34 |
40 |
48 |
56 |
13 |
16 |
20 |
24 |
29 |
34 |
39 |
9 |
12 |
14 |
17 |
20 |
24 |
28 |
2,2 |
18 |
22 |
27 |
33 |
39 |
46 |
53 |
13 |
16 |
19 |
23 |
27 |
32 |
38 |
9 |
11 |
14 |
16 |
19 |
23 |
27 |
2,3 |
17 |
21 |
26 |
31 |
37 |
44 |
51 |
12 |
15 |
18 |
22 |
26 |
31 |
36 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
2,4 |
17 |
21 |
25 |
30 |
36 |
43 |
50 |
12 |
15 |
18 |
21 |
26 |
30 |
35 |
8 |
10 |
13 |
15 |
18 |
21 |
25 |
2,5 |
16 |
20 |
24 |
29 |
35 |
41 |
48 |
11 |
14 |
17 |
21 |
25 |
29 |
34 |
8 |
10 |
12 |
15 |
17 |
21 |
24 |
2,6 |
16 |
19 |
24 |
28 |
34 |
40 |
46 |
11 |
14 |
17 |
20 |
24 |
28 |
33 |
8 |
10 |
12 |
14 |
17 |
20 |
23 |
2,7 |
15 |
19 |
23 |
27 |
33 |
38 |
45 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
8 |
9 |
11 |
14 |
16 |
19 |
22 |
2,8 |
15 |
18 |
22 |
27 |
32 |
37 |
43 |
10 |
13 |
16 |
19 |
22 |
26 |
31 |
7 |
9 |
11 |
13 |
16 |
19 |
22 |
2,9 |
14 |
18 |
21 |
26 |
31 |
36 |
42 |
10 |
12 |
15 |
18 |
22 |
26 |
30 |
7 |
9 |
11 |
13 |
15 |
18 |
21 |
3,0 |
14 |
17 |
21 |
25 |
30 |
35 |
41 |
10 |
12 |
15 |
18 |
21 |
25 |
29 |
7 |
9 |
10 |
13 |
15 |
18 |
20 |
C(1) |
Temperatura (20ºC ) |
Temperatura (25ºC ) |
Temperatura (30ºC ) |
||||||||||||||||||
Valores de pH |
Valores de pH |
Valores de pH |
|||||||||||||||||||
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
|
0,1 |
88 |
109 |
133 |
160 |
190 |
224 |
261 |
62 |
77 |
94 |
113 |
134 |
158 |
185 |
44 |
54 |
66 |
80 |
95 |
112 |
130 |
0,2 |
49 |
60 |
74 |
89 |
105 |
124 |
145 |
34 |
43 |
52 |
63 |
75 |
88 |
102 |
24 |
30 |
37 |
44 |
53 |
62 |
72 |
0,3 |
34 |
43 |
52 |
63 |
75 |
88 |
103 |
24 |
30 |
37 |
44 |
53 |
62 |
73 |
17 |
21 |
26 |
31 |
37 |
44 |
51 |
0,4 |
27 |
33 |
41 |
49 |
59 |
69 |
80 |
19 |
24 |
29 |
35 |
41 |
49 |
57 |
13 |
17 |
20 |
25 |
29 |
34 |
40 |
0,5 |
22 |
28 |
34 |
41 |
48 |
57 |
66 |
16 |
20 |
24 |
29 |
34 |
40 |
47 |
11 |
14 |
17 |
20 |
24 |
28 |
33 |
0,6 |
19 |
24 |
29 |
35 |
41 |
49 |
57 |
14 |
17 |
20 |
25 |
29 |
35 |
40 |
10 |
12 |
14 |
17 |
21 |
24 |
28 |
0,7 |
17 |
21 |
25 |
31 |
36 |
43 |
50 |
12 |
15 |
18 |
22 |
26 |
30 |
35 |
8 |
10 |
13 |
15 |
18 |
21 |
25 |
0,8 |
15 |
19 |
23 |
27 |
32 |
38 |
45 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
7 |
9 |
11 |
14 |
16 |
19 |
22 |
0,9 |
14 |
17 |
21 |
25 |
29 |
35 |
40 |
10 |
12 |
14 |
17 |
21 |
24 |
29 |
7 |
8 |
10 |
12 |
15 |
17 |
20 |
1,0 |
12 |
15 |
19 |
23 |
27 |
32 |
37 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
6 |
8 |
9 |
11 |
13 |
16 |
18 |
1,1 |
11 |
14 |
17 |
21 |
25 |
29 |
34 |
8 |
10 |
12 |
15 |
18 |
21 |
24 |
6 |
7 |
9 |
10 |
12 |
15 |
17 |
1,2 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
7 |
9 |
11 |
14 |
16 |
19 |
22 |
5 |
7 |
8 |
10 |
11 |
14 |
16 |
1,3 |
10 |
12 |
15 |
18 |
21 |
25 |
29 |
7 |
9 |
11 |
13 |
15 |
18 |
21 |
5 |
6 |
7 |
9 |
11 |
13 |
15 |
1,4 |
9 |
12 |
14 |
17 |
20 |
24 |
28 |
7 |
8 |
10 |
12 |
14 |
17 |
20 |
5 |
6 |
7 |
8 |
10 |
12 |
14 |
1,5 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
6 |
8 |
9 |
11 |
13 |
16 |
18 |
4 |
5 |
7 |
8 |
10 |
11 |
13 |
1,6 |
8 |
10 |
13 |
15 |
18 |
21 |
25 |
6 |
7 |
9 |
11 |
13 |
15 |
17 |
4 |
5 |
6 |
8 |
9 |
11 |
12 |
1,7 |
8 |
10 |
12 |
14 |
17 |
20 |
23 |
6 |
7 |
8 |
10 |
12 |
14 |
17 |
4 |
5 |
6 |
7 |
9 |
10 |
12 |
1,8 |
8 |
9 |
11 |
14 |
16 |
19 |
22 |
5 |
7 |
8 |
10 |
12 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
11 |
1,9 |
7 |
9 |
11 |
13 |
16 |
18 |
21 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
4 |
4 |
5 |
7 |
8 |
9 |
11 |
2,0 |
7 |
9 |
10 |
13 |
15 |
18 |
20 |
5 |
6 |
7 |
9 |
11 |
12 |
14 |
3 |
4 |
5 |
6 |
7 |
9 |
10 |
2,1 |
7 |
8 |
10 |
12 |
14 |
17 |
20 |
5 |
6 |
7 |
8 |
10 |
12 |
14 |
3 |
4 |
5 |
6 |
7 |
8 |
10 |
2,2 |
6 |
8 |
10 |
12 |
14 |
16 |
19 |
4 |
6 |
7 |
8 |
10 |
11 |
13 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
2,3 |
6 |
8 |
9 |
11 |
13 |
16 |
18 |
4 |
5 |
7 |
8 |
9 |
11 |
13 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
2,4 |
6 |
7 |
9 |
11 |
13 |
15 |
18 |
4 |
5 |
6 |
8 |
9 |
11 |
12 |
3 |
4 |
4 |
5 |
6 |
8 |
9 |
2,5 |
6 |
7 |
9 |
10 |
12 |
15 |
17 |
4 |
5 |
6 |
7 |
9 |
10 |
12 |
3 |
4 |
4 |
5 |
6 |
7 |
8 |
2,6 |
5 |
7 |
8 |
10 |
12 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
12 |
3 |
3 |
4 |
5 |
6 |
7 |
8 |
2,7 |
5 |
7 |
8 |
10 |
12 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
11 |
3 |
3 |
4 |
5 |
6 |
7 |
8 |
2,8 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
4 |
5 |
6 |
7 |
8 |
9 |
11 |
3 |
3 |
4 |
5 |
6 |
7 |
8 |
2,9 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
4 |
4 |
5 |
6 |
8 |
9 |
11 |
3 |
3 |
4 |
5 |
5 |
6 |
7 |
3,0 |
5 |
6 |
7 |
9 |
11 |
12 |
14 |
3 |
4 |
5 |
6 |
7 |
9 |
10 |
2 |
3 |
4 |
4 |
5 |
6 |
7 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. C: residual de cloro livre na saída do tanque de contato (mg/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 4 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO EM SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA COM CAPTAÇÃO EM MANANCIAIS SUPERFICIAIS, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL COMBINADO (CLORAMINAS) E COM A TEMPERATURA DA ÁGUA, PARA VALORES DE pH DA ÁGUA ENTRE 6,0 E 9,0. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
C (1) |
Temperatura (5ºC ) |
Temperatura (10ºC ) |
Temperatura (15ºC ) |
Temperatura (20ºC ) |
Temperatura (25ºC ) |
Temperatura (30ºC ) |
0,1 |
7385 |
6185 |
4985 |
3785 |
2585 |
1385 |
0,2 |
3693 |
3093 |
2493 |
1893 |
1293 |
693 |
0,3 |
2462 |
2062 |
1662 |
1262 |
862 |
462 |
0,4 |
1846 |
1546 |
1246 |
946 |
646 |
346 |
0,5 |
1477 |
1237 |
997 |
757 |
517 |
277 |
0,6 |
1231 |
1031 |
831 |
631 |
431 |
231 |
0,7 |
1055 |
884 |
712 |
541 |
369 |
198 |
0,8 |
923 |
773 |
623 |
473 |
323 |
173 |
0,9 |
821 |
687 |
554 |
421 |
287 |
154 |
1,0 |
739 |
619 |
499 |
379 |
259 |
139 |
1,1 |
671 |
562 |
453 |
344 |
235 |
126 |
1,2 |
615 |
515 |
415 |
315 |
215 |
115 |
1,3 |
568 |
476 |
383 |
291 |
199 |
107 |
1,4 |
528 |
442 |
356 |
270 |
185 |
99 |
1,5 |
492 |
412 |
332 |
252 |
172 |
92 |
1,6 |
462 |
387 |
312 |
237 |
162 |
87 |
1,7 |
434 |
364 |
293 |
223 |
152 |
81 |
1,8 |
410 |
344 |
277 |
210 |
144 |
77 |
1,9 |
389 |
326 |
262 |
199 |
136 |
73 |
2,0 |
369 |
309 |
249 |
189 |
129 |
69 |
2,1 |
352 |
295 |
237 |
180 |
123 |
66 |
2,2 |
336 |
281 |
227 |
172 |
118 |
63 |
2,3 |
321 |
269 |
217 |
165 |
112 |
60 |
2,4 |
308 |
258 |
208 |
158 |
108 |
58 |
2,5 |
295 |
247 |
199 |
151 |
103 |
55 |
2,6 |
284 |
238 |
192 |
146 |
99 |
53 |
2,7 |
274 |
229 |
185 |
140 |
96 |
51 |
2,8 |
264 |
221 |
178 |
135 |
92 |
49 |
2,9 |
255 |
213 |
172 |
131 |
89 |
48 |
3,0 |
246 |
206 |
166 |
126 |
86 |
46 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. C: residual de cloro combinado na saída do tanque de contato (mg/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 5 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO EM SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA COM CAPTAÇÃO EM MANANCIAIS SUPERFICIAIS, DE ACORDO COM CONCENTRAÇÃO DE DIÓXIDO DE CLORO E COM A TEMPERATURA DA ÁGUA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
C (1) |
Temperatura (5ºC ) |
Temperatura (10ºC ) |
Temperatura (15ºC ) |
Temperatura (20ºC ) |
Temperatura (25ºC ) |
Temperatura (30ºC ) |
Temperatura (35ºC ) |
0,1 |
108 |
77 |
63 |
55 |
49 |
45 |
41 |
0,2 |
54 |
38 |
31 |
27 |
24 |
22 |
21 |
0,3 |
36 |
26 |
21 |
18 |
16 |
15 |
14 |
0,4 |
27 |
19 |
16 |
14 |
12 |
11 |
10 |
0,5 |
22 |
15 |
13 |
11 |
10 |
9 |
8 |
0,6 |
18 |
13 |
10 |
9 |
8 |
7 |
7 |
0,7 |
15 |
11 |
9 |
8 |
7 |
6 |
6 |
0,8 |
13 |
10 |
8 |
7 |
6 |
6 |
5 |
0,9 |
12 |
9 |
7 |
6 |
5 |
5 |
5 |
1,0 |
11 |
8 |
6 |
5 |
5 |
4 |
4 |
1,1 |
10 |
7 |
6 |
5 |
4 |
4 |
4 |
1,2 |
9 |
6 |
5 |
5 |
4 |
4 |
3 |
1,3 |
8 |
6 |
5 |
4 |
4 |
3 |
3 |
1,4 |
8 |
5 |
4 |
4 |
3 |
3 |
3 |
1,5 |
7 |
5 |
4 |
4 |
3 |
3 |
3 |
1,6 |
7 |
5 |
4 |
3 |
3 |
3 |
3 |
1,7 |
6 |
5 |
4 |
3 |
3 |
3 |
2 |
1,8 |
6 |
4 |
3 |
3 |
3 |
2 |
2 |
1,9 |
6 |
4 |
3 |
3 |
3 |
2 |
2 |
2,0 |
5 |
4 |
3 |
3 |
2 |
2 |
2 |
2,1 |
5 |
4 |
3 |
3 |
2 |
2 |
2 |
2,2 |
5 |
3 |
3 |
2 |
2 |
2 |
2 |
2,3 |
5 |
3 |
3 |
2 |
2 |
2 |
2 |
2,4 |
4 |
3 |
3 |
2 |
2 |
2 |
2 |
2,5 |
4 |
3 |
3 |
2 |
2 |
2 |
2 |
2,6 |
4 |
3 |
2 |
2 |
2 |
2 |
2 |
2,7 |
4 |
3 |
2 |
2 |
2 |
2 |
2 |
2,8 |
4 |
3 |
2 |
2 |
2 |
2 |
1 |
2,9 |
4 |
3 |
2 |
2 |
2 |
2 |
1 |
3,0 |
4 |
3 |
2 |
2 |
2 |
1 |
1 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. C: residual de dióxido de cloro na saída do tanque de contato (mg/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 6 DO ANEXO XX
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO EM SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA COM CAPTAÇÃO EM MANANCIAIS SUBTERRÂNEOS, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL LIVRE, COM A TEMPERATURA E O pH DA ÁGUA.
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
C(1) |
Temperatura (5ºC ) |
Temperatura (10ºC ) |
Temperatura (15ºC ) |
||||||||||||||||||
Valores de pH |
Valores de pH |
Valores de pH |
|||||||||||||||||||
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
|
0,1 |
124 |
154 |
188 |
226 |
269 |
317 |
369 |
88 |
109 |
133 |
160 |
190 |
224 |
261 |
62 |
77 |
94 |
113 |
134 |
158 |
185 |
0,2 |
69 |
85 |
104 |
125 |
149 |
176 |
205 |
49 |
60 |
74 |
89 |
106 |
124 |
145 |
34 |
43 |
52 |
63 |
75 |
88 |
102 |
0,3 |
49 |
60 |
74 |
89 |
106 |
124 |
145 |
34 |
43 |
52 |
63 |
75 |
88 |
103 |
24 |
30 |
37 |
44 |
53 |
62 |
73 |
0,4 |
38 |
47 |
58 |
70 |
83 |
97 |
114 |
27 |
33 |
41 |
49 |
59 |
69 |
80 |
19 |
24 |
29 |
35 |
41 |
49 |
57 |
0,5 |
32 |
39 |
48 |
58 |
68 |
81 |
94 |
22 |
28 |
34 |
41 |
48 |
57 |
66 |
16 |
20 |
24 |
29 |
34 |
40 |
47 |
0,6 |
27 |
34 |
41 |
49 |
59 |
69 |
81 |
19 |
24 |
29 |
35 |
41 |
49 |
57 |
14 |
17 |
20 |
25 |
29 |
35 |
40 |
0,7 |
24 |
29 |
36 |
43 |
51 |
61 |
71 |
17 |
21 |
25 |
31 |
36 |
43 |
50 |
12 |
15 |
18 |
22 |
26 |
30 |
35 |
0,8 |
21 |
26 |
32 |
39 |
46 |
54 |
63 |
15 |
19 |
23 |
27 |
32 |
38 |
45 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
0,9 |
19 |
24 |
29 |
35 |
42 |
49 |
57 |
14 |
17 |
21 |
25 |
29 |
35 |
40 |
10 |
12 |
15 |
17 |
21 |
24 |
29 |
1,0 |
18 |
22 |
27 |
32 |
38 |
45 |
52 |
12 |
15 |
19 |
23 |
27 |
32 |
37 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
1,1 |
16 |
20 |
24 |
29 |
35 |
41 |
48 |
11 |
14 |
17 |
21 |
25 |
29 |
34 |
8 |
10 |
12 |
15 |
18 |
21 |
24 |
1,2 |
15 |
19 |
23 |
27 |
33 |
38 |
45 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
8 |
9 |
11 |
14 |
16 |
19 |
22 |
1,3 |
14 |
17 |
21 |
26 |
30 |
36 |
42 |
10 |
12 |
15 |
18 |
21 |
25 |
30 |
7 |
9 |
11 |
13 |
15 |
18 |
21 |
1,4 |
13 |
16 |
20 |
24 |
29 |
34 |
39 |
9 |
12 |
14 |
17 |
20 |
24 |
28 |
7 |
8 |
10 |
12 |
14 |
17 |
20 |
1,5 |
12 |
15 |
19 |
23 |
27 |
32 |
37 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
6 |
8 |
9 |
11 |
13 |
16 |
18 |
1,6 |
12 |
15 |
18 |
21 |
25 |
30 |
35 |
8 |
10 |
13 |
15 |
18 |
21 |
25 |
6 |
7 |
9 |
11 |
13 |
15 |
17 |
1,7 |
11 |
14 |
17 |
20 |
24 |
28 |
33 |
8 |
10 |
12 |
14 |
17 |
20 |
23 |
6 |
7 |
8 |
10 |
12 |
14 |
17 |
1,8 |
11 |
13 |
16 |
19 |
23 |
27 |
32 |
8 |
9 |
11 |
14 |
16 |
19 |
22 |
5 |
7 |
8 |
10 |
12 |
14 |
16 |
1,9 |
10 |
13 |
15 |
19 |
22 |
26 |
30 |
7 |
9 |
11 |
13 |
16 |
18 |
21 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
2,0 |
10 |
12 |
15 |
18 |
21 |
25 |
29 |
7 |
9 |
10 |
13 |
15 |
18 |
20 |
5 |
6 |
7 |
9 |
11 |
12 |
14 |
2,1 |
9 |
12 |
14 |
17 |
20 |
24 |
28 |
7 |
8 |
10 |
12 |
14 |
17 |
20 |
5 |
6 |
7 |
8 |
10 |
12 |
14 |
2,2 |
9 |
11 |
14 |
16 |
19 |
23 |
27 |
6 |
8 |
10 |
12 |
14 |
16 |
19 |
4 |
6 |
7 |
8 |
10 |
11 |
13 |
2,3 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
6 |
8 |
9 |
11 |
13 |
16 |
18 |
4 |
5 |
7 |
8 |
9 |
11 |
13 |
2,4 |
8 |
10 |
13 |
15 |
18 |
21 |
25 |
6 |
7 |
9 |
11 |
13 |
15 |
18 |
4 |
5 |
6 |
8 |
9 |
11 |
12 |
2,5 |
8 |
10 |
12 |
15 |
17 |
21 |
24 |
6 |
7 |
9 |
10 |
12 |
15 |
17 |
4 |
5 |
6 |
7 |
9 |
10 |
12 |
2,6 |
8 |
10 |
12 |
14 |
17 |
20 |
23 |
5 |
7 |
8 |
10 |
12 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
12 |
2,7 |
8 |
9 |
11 |
14 |
16 |
19 |
22 |
5 |
7 |
8 |
10 |
12 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
11 |
2,8 |
7 |
9 |
11 |
13 |
16 |
19 |
22 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
4 |
5 |
6 |
7 |
8 |
9 |
11 |
2,9 |
7 |
9 |
11 |
13 |
15 |
18 |
21 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
4 |
4 |
5 |
6 |
8 |
9 |
11 |
3,0 |
7 |
9 |
10 |
13 |
15 |
18 |
21 |
5 |
6 |
7 |
9 |
11 |
12 |
14 |
3 |
4 |
5 |
6 |
7 |
9 |
10 |
C (1) |
Temperatura (20ºC ) |
Temperatura (25ºC ) |
Temperatura (30ºC ) |
||||||||||||||||||
Valores de pH |
Valores de pH |
Valores de pH |
|||||||||||||||||||
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
6,0 |
6,5 |
7,0 |
7,5 |
8,0 |
8,5 |
9,0 |
|
0,1 |
44 |
54 |
66 |
80 |
95 |
112 |
130 |
31 |
38 |
47 |
56 |
67 |
79 |
92 |
22 |
27 |
33 |
40 |
48 |
56 |
65 |
0,2 |
24 |
30 |
37 |
44 |
53 |
62 |
72 |
17 |
21 |
26 |
31 |
37 |
44 |
51 |
12 |
15 |
18 |
22 |
26 |
31 |
36 |
0,3 |
17 |
21 |
26 |
31 |
37 |
44 |
51 |
12 |
15 |
18 |
22 |
26 |
31 |
36 |
9 |
11 |
13 |
16 |
19 |
22 |
26 |
0,4 |
13 |
17 |
20 |
25 |
29 |
34 |
40 |
10 |
12 |
14 |
17 |
21 |
24 |
28 |
7 |
8 |
10 |
12 |
15 |
17 |
20 |
0,5 |
11 |
14 |
17 |
20 |
24 |
28 |
33 |
8 |
10 |
12 |
14 |
17 |
20 |
23 |
6 |
7 |
8 |
10 |
12 |
14 |
17 |
0,6 |
10 |
12 |
14 |
17 |
21 |
24 |
28 |
7 |
8 |
10 |
12 |
15 |
17 |
20 |
5 |
6 |
7 |
9 |
10 |
12 |
14 |
0,7 |
8 |
10 |
13 |
15 |
18 |
21 |
25 |
6 |
7 |
9 |
11 |
13 |
15 |
18 |
4 |
5 |
6 |
8 |
9 |
11 |
12 |
0,8 |
7 |
9 |
11 |
14 |
16 |
19 |
22 |
5 |
7 |
8 |
10 |
11 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
11 |
0,9 |
7 |
8 |
10 |
12 |
15 |
17 |
20 |
5 |
6 |
7 |
9 |
10 |
12 |
14 |
3 |
4 |
5 |
6 |
7 |
9 |
10 |
1,0 |
6 |
8 |
9 |
11 |
13 |
16 |
18 |
4 |
5 |
7 |
8 |
9 |
11 |
13 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
1,1 |
6 |
7 |
9 |
10 |
12 |
15 |
17 |
4 |
5 |
6 |
7 |
9 |
10 |
12 |
3 |
4 |
4 |
5 |
6 |
7 |
8 |
1,2 |
5 |
7 |
8 |
10 |
11 |
14 |
16 |
4 |
5 |
6 |
7 |
8 |
10 |
11 |
3 |
3 |
4 |
5 |
6 |
7 |
8 |
1,3 |
5 |
6 |
8 |
9 |
11 |
13 |
15 |
4 |
4 |
5 |
6 |
8 |
9 |
10 |
2 |
3 |
4 |
5 |
5 |
6 |
7 |
1,4 |
5 |
6 |
7 |
8 |
10 |
12 |
14 |
3 |
4 |
5 |
6 |
7 |
8 |
10 |
2 |
3 |
4 |
4 |
5 |
6 |
7 |
1,5 |
4 |
5 |
7 |
8 |
10 |
11 |
13 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
2 |
3 |
3 |
4 |
5 |
6 |
7 |
1,6 |
4 |
5 |
6 |
8 |
9 |
11 |
12 |
3 |
4 |
4 |
5 |
6 |
7 |
9 |
2 |
3 |
3 |
4 |
5 |
5 |
6 |
1,7 |
4 |
5 |
6 |
7 |
9 |
10 |
12 |
3 |
3 |
4 |
5 |
6 |
7 |
8 |
2 |
2 |
3 |
4 |
4 |
5 |
6 |
1,8 |
4 |
5 |
6 |
7 |
8 |
10 |
11 |
3 |
3 |
4 |
5 |
6 |
7 |
8 |
2 |
2 |
3 |
3 |
4 |
5 |
6 |
1,9 |
4 |
4 |
5 |
7 |
8 |
9 |
11 |
3 |
3 |
4 |
5 |
6 |
6 |
8 |
2 |
2 |
3 |
3 |
4 |
5 |
5 |
2,0 |
3 |
4 |
5 |
6 |
7 |
9 |
10 |
2 |
3 |
4 |
4 |
5 |
6 |
7 |
2 |
2 |
3 |
3 |
4 |
4 |
5 |
| 2,1 | 3 | 4 | 5 | 6 | 7 | 8 | 10 | 2 | 3 | 4 | 4 | 5 | 6 | 7 | 2 | 2 | 2 | 3 | 4 | 4 | 5 |
| 2,2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 2 | 3 | 3 | 4 | 5 | 6 | 7 | 2 | 2 | 2 | 3 | 3 | 4 | 5 |
| 2,3 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 2 | 3 | 3 | 4 | 5 | 6 | 6 | 2 | 2 | 2 | 3 | 3 | 4 | 5 |
| 2,4 | 3 | 4 | 4 | 5 | 6 | 8 | 9 | 2 | 3 | 3 | 4 | 5 | 5 | 6 | 1 | 2 | 2 | 3 | 3 | 4 | 4 |
| 2,5 | 3 | 4 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 4 | 4 | 5 | 6 | 1 | 2 | 2 | 3 | 3 | 4 | 4 |
| 2,6 | 3 | 3 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 4 | 4 | 5 | 6 | 1 | 2 | 2 | 3 | 3 | 4 | 4 |
| 2,7 | 3 | 3 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 3 | 4 | 5 | 6 | 1 | 2 | 2 | 2 | 3 | 3 | 4 |
| 2,8 | 3 | 3 | 4 | 5 | 6 | 7 | 8 | 2 | 2 | 3 | 3 | 4 | 5 | 5 | 1 | 2 | 2 | 2 | 3 | 3 | 4 |
| 2,9 | 3 | 3 | 4 | 5 | 5 | 6 | 7 | 2 | 2 | 3 | 3 | 4 | 5 | 5 | 1 | 2 | 2 | 2 | 3 | 3 | 4 |
| 3,0 | 2 | 3 | 4 | 4 | 5 | 6 | 7 | 2 | 2 | 3 | 3 | 4 | 4 | 5 | 1 | 2 | 2 | 2 | 3 | 3 | 4 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. C: residual de cloro livre na saída do tanque de contato (mg/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 7 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO EM SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA COM CAPTAÇÃO EM MANANCIAIS SUBTERRÂNEOS, DE ACORDO COM CONCENTRAÇÃO DE CLORO RESIDUAL COMBINADO (CLORAMINAS) E COM A TEMPERATURA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
C (1) |
Temperatura (5ºC ) |
Temperatura (10ºC ) |
Temperatura (15ºC ) |
Temperatura (20ºC ) |
Temperatura (25ºC ) |
Temperatura (30ºC ) |
Temperatura (35ºC ) |
0,1 |
3693 |
3093 |
2493 |
1893 |
1293 |
693 |
93 |
0,2 |
1846 |
1546 |
1246 |
946 |
646 |
346 |
46 |
0,3 |
1231 |
1031 |
831 |
631 |
431 |
231 |
31 |
0,4 |
923 |
773 |
623 |
473 |
323 |
173 |
23 |
0,5 |
739 |
619 |
499 |
379 |
259 |
139 |
19 |
0,6 |
615 |
515 |
415 |
315 |
215 |
115 |
15 |
0,7 |
528 |
442 |
356 |
270 |
185 |
99 |
13 |
0,8 |
462 |
387 |
312 |
237 |
162 |
87 |
12 |
0,9 |
410 |
344 |
277 |
210 |
144 |
77 |
10 |
1,0 |
369 |
309 |
249 |
189 |
129 |
69 |
9 |
1,1 |
336 |
281 |
227 |
172 |
118 |
63 |
8 |
1,2 |
308 |
258 |
208 |
158 |
108 |
58 |
8 |
1,3 |
284 |
238 |
192 |
146 |
99 |
53 |
7 |
1,4 |
264 |
221 |
178 |
135 |
92 |
49 |
7 |
1,5 |
246 |
206 |
166 |
126 |
86 |
46 |
6 |
1,6 |
231 |
193 |
156 |
118 |
81 |
43 |
6 |
1,7 |
217 |
182 |
147 |
111 |
76 |
41 |
5 |
1,8 |
205 |
172 |
138 |
105 |
72 |
38 |
5 |
1,9 |
194 |
163 |
131 |
100 |
68 |
36 |
5 |
2,0 |
185 |
155 |
125 |
95 |
65 |
35 |
5 |
2,1 |
176 |
147 |
119 |
90 |
62 |
33 |
4 |
2,2 |
168 |
141 |
113 |
86 |
59 |
31 |
4 |
2,3 |
161 |
134 |
108 |
82 |
56 |
30 |
4 |
2,4 |
154 |
129 |
104 |
79 |
54 |
29 |
4 |
2,5 |
148 |
124 |
100 |
76 |
52 |
28 |
4 |
2,6 |
142 |
119 |
96 |
73 |
50 |
27 |
4 |
2,7 |
137 |
115 |
92 |
70 |
48 |
26 |
3 |
2,8 |
132 |
110 |
89 |
68 |
46 |
25 |
3 |
2,9 |
127 |
107 |
86 |
65 |
45 |
24 |
3 |
3,0 |
123 |
103 |
83 |
63 |
43 |
23 |
3 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. C: residual de cloro combinado na saída do tanque de contato (mg/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 8 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE TEMPO DE CONTATO MÍNIMO (MINUTOS) A SER OBSERVADO PARA A DESINFECÇÃO EM SISTEMAS E SOLUÇÕES ALTERNATIVAS COLETIVAS DE ABASTECIMENTO DE ÁGUA COM CAPTAÇÃO EM MANANCIAIS SUBTERRÂNEOS, DE ACORDO COM CONCENTRAÇÃO DE DIÓXIDO DE CLORO E COM A TEMPERATURA DA ÁGUA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
C(1) |
Temperatura (5ºC) |
Temperatura (10ºC) |
Temperatura (15ºC) |
Temperatura (20ºC) |
Temperatura (25ºC) |
Temperatura (30ºC) |
Temperatura (35ºC) |
0,1 |
53 |
38 |
31 |
27 |
24 |
22 |
21 |
0,2 |
27 |
19 |
16 |
14 |
12 |
11 |
10 |
0,3 |
18 |
13 |
10 |
9 |
8 |
7 |
7 |
0,4 |
13 |
10 |
8 |
7 |
6 |
6 |
5 |
0,5 |
11 |
8 |
6 |
5 |
5 |
4 |
4 |
0,6 |
9 |
6 |
5 |
5 |
4 |
4 |
3 |
0,7 |
8 |
5 |
4 |
4 |
3 |
3 |
3 |
0,8 |
7 |
5 |
4 |
3 |
3 |
3 |
3 |
0,9 |
6 |
4 |
3 |
3 |
3 |
2 |
2 |
1,0 |
5 |
4 |
3 |
3 |
2 |
2 |
2 |
1,1 |
5 |
3 |
3 |
2 |
2 |
2 |
2 |
1,2 |
4 |
3 |
3 |
2 |
2 |
2 |
2 |
1,3 |
4 |
3 |
2 |
2 |
2 |
2 |
2 |
1,4 |
4 |
3 |
2 |
2 |
2 |
2 |
1 |
1,5 |
4 |
3 |
2 |
2 |
2 |
1 |
1 |
1,6 |
3 |
2 |
2 |
2 |
2 |
1 |
1 |
1,7 |
3 |
2 |
2 |
2 |
1 |
1 |
1 |
1,8 |
3 |
2 |
2 |
2 |
1 |
1 |
1 |
1,9 |
3 |
2 |
2 |
1 |
1 |
1 |
1 |
2,0 |
3 |
2 |
2 |
1 |
1 |
1 |
1 |
2,1 |
3 |
2 |
1 |
1 |
1 |
1 |
1 |
2,2 |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
2,3 |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
2,4 |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
2,5 |
2 |
2 |
1 |
1 |
1 |
1 |
1 |
2,6 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
2,7 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
2,8 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
2,9 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
3,0 |
2 |
1 |
1 |
1 |
1 |
1 |
1 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. C: residual de dióxido de cloro na saída do tanque de contato (mg/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 9 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE PADRÃO DE POTABILIDADE PARA SUBSTÂNCIAS QUÍMICAS QUE REPRESENTAM RISCO À SAÚDE. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE PADRÃO DE POTABILIDADE PARA SUBSTÂNCIAS QUÍMICAS INORGÂNICAS QUE REPRESENTAM RISCO À SAÚDE |
|||
Parâmetro |
CAS(1) |
Unidade |
VMP(2) |
Antimônio |
7440-36-0 |
mg/L |
0,006 |
Arsênio |
7440-38-2 |
mg/L |
0,01 |
Bário |
7440-39-3 |
mg/L |
0,7 |
Cádmio |
7440-43-9 |
mg/L |
0,003 |
Chumbo |
7439-92-1 |
mg/L |
0,01 |
Cobre |
7440-50-8 |
mg/L |
2 |
Cromo |
7440-47-3 |
mg/L |
0,05 |
Fluoreto |
7782-41-4 |
mg/L |
1,5 |
Mercúrio Total |
7439-97-6 |
mg/L |
0,001 |
Níquel |
7440-02-0 |
mg/L |
0,07 |
Nitrato (como N)(3) |
14797-55-8 |
mg/L |
10 |
Nitrito (como N)(3) |
14797-65-0 |
mg/L |
1 |
Selênio |
7782-49-2 |
mg/L |
0,04 |
Urânio |
7440-61-1 |
mg/L |
0,03 |
TABELA DE PADRÃO DE POTABILIDADE PARA SUBSTÂNCIAS ORGÂNICAS QUE REPRESENTAM RISCO À SAÚDE |
|||
Parâmetro |
CAS(1) |
Unidade |
VMP(2) |
1,2 Dicloroetano |
107-06-2 |
μg/L |
5 |
Acrilamida |
79-06-1 |
μg/L |
0,5 |
Benzeno |
71-43-2 |
μg/L |
5 |
Benzo[a]pireno |
50-32-8 |
μg/L |
0,4 |
Cloreto de Vinila |
75-01-4 |
μg/L |
0,5 |
Di(2-etilhexil) ftalato |
117-81-7 |
μg/L |
8 |
Diclorometano |
75-09-2 |
μg/L |
20 |
Dioxano |
123-91-1 |
μg/L |
48 |
Epicloridrina |
106-89-8 |
μg/L |
0,4 |
Etilbenzeno |
100-41-4 |
μg/L |
300 |
Pentaclorofenol |
87-86-5 |
μg/L |
9 |
Tetracloreto de Carbono |
56-23-5 |
μg/L |
4 |
Tetracloroeteno |
127-18-4 |
μg/L |
40 |
Tolueno |
108-88-3 |
μg/L |
30 |
Tricloroeteno |
79-01-6 |
μg/L |
4 |
Xilenos |
1330-20-7 |
μg/L |
500 |
TABELA DE PADRÃO DE POTABILIDADE PARA AGROTÓXICOS E METABÓLITOS QUE REPRESENTAM RISCO À SAÚDE |
|||
Parâmetro |
CAS(1) |
Unidade |
VMP(2) |
2,4 D |
94-75-7 |
μg/L |
30 |
Alacloro |
15972-60-8 |
μg/L |
20 |
Aldicarbe + Aldicarbesulfona +Aldicarbesulfóxido |
116-06-3 (aldicarbe) 1646-88-4(aldicarbesulfona) 1646-87-3 (aldicarbe sulfóxido) |
μg/L |
10 |
Aldrin + Dieldrin |
309-00-2 (aldrin) 60-57-1 (dieldrin) |
μg/L |
0,03 |
Ametrina |
834-12-8 |
μg/L |
60 |
Atrazina + S-Clorotriazinas (Deetil-Atrazina - Dea, Deisopropil-Atrazina - Dia e Diaminoclorotriazina -Dact) |
1912-24-9 (Atrazina) 6190-65-4 (Deetil-Atrazina - Dea) 1007-28-9 (Deisopropil-Atrazina - Dia) 3397-62-4 (Diaminoclorotriazina -Dact) |
μg/L |
2,0 |
Carbendazim |
10605-21-7 |
μg/L |
120 |
Carbofurano |
1563-66-2 |
μg/L |
7 |
Ciproconazol |
94361-06-5 |
μg/L |
30 |
Clordano |
5103-74-2 |
μg/L |
0,2 |
Clorotalonil |
1897-45-6 |
μg/L |
45 |
Clorpirifós + clorpirifós-oxon |
2921-88-2 (clorpirifós) 5598-15-2 (clorpirifósoxon) |
μg/L |
30,0 |
DDT+DDD+DDE |
50-29-3 (p,p'-DDT) 72-54-8 (p,p'-DDD) 72-55-9 (p,p'-DDE) |
μg/L |
1 |
Difenoconazol |
119446-68-3 |
μg/L |
30 |
Dimetoato + ometoato |
60-51-5 (Dimetoato) 1113-02-6 (Ometoato) |
μg/L |
1,2 |
Diuron |
330-54-1 |
μg/L |
20 |
Epoxiconazol |
135319-73-2 |
μg/L |
60 |
Fipronil |
120068-37-3 |
μg/L |
1,2 |
Flutriafol |
76674-21-0 |
μg/L |
30 |
Glifosato + AMPA |
1071-83-6 (glifosato) 1066-51-9 (AMPA) |
μg/L |
500 |
Hidroxi-Atrazina |
2163-68-0 |
μg/L |
120,0 |
Lindano (gama HCH) |
58-89-9 |
μg/L |
2 |
Malationa |
121-75-5 |
μg/L |
60 |
Mancozebe + ETU |
8018-01-7 (Mancozebe) 96-45-7 (Ampa) |
μg/L |
8 |
Metamidofós + Acefato |
10265-92-6 (Metamidofós) 30560-19-1 (Acefato) |
μg/L |
7 |
Metolacloro |
51218-45-2 |
μg/L |
10 |
Metribuzim |
21087-64-9 |
μg/L |
25 |
Molinato |
2212-67-1 |
μg/L |
6 |
Paraquate |
4685-14-7 |
μg/L |
13 |
Picloram |
1918-02-1 |
μg/L |
60 |
Profenofós |
41198-08-7 |
μg/L |
0,3 |
Propargito |
2312-35-8 |
μg/L |
30 |
Protioconazol + ProticonazolDestio |
178928-70-6 (Protioconazol) 120983-64-4 (ProticonazolDestio) |
μg/L |
3 |
Simazina |
122-34-9 |
μg/L |
2 |
Tebuconazol |
107534-96-3 |
μg/L |
180 |
Terbufós |
13071-79-9 |
μg/L |
1,2 |
Tiametoxam |
153719-23-4 |
μg/L |
36 |
Tiodicarbe |
59669-26-0 |
μg/L |
90 |
Tiram |
137-26-8 |
μg/L |
6 |
Trifluralina |
1582-09-8 |
μg/L |
20 |
TABELA DE PADRÃO DE POTABILIDADE PARA SUBPRODUTOS DA DESINFECÇÃO QUE REPRESENTAM RISCO À SAÚDE(4) |
|||
Parâmetro |
CAS(1) |
Unidade |
VMP(2) |
2,4,6 Triclorofenol |
88-06-2 |
mg/L |
0,2 |
2,4-diclorofenol |
120-83-2 |
mg/L |
0,2 |
Ácidos haloacéticos total(5) |
- |
mg/L |
0,08 |
Bromato |
15541-45-4 |
mg/L |
0,01 |
Cloraminas Total |
- |
mg/L |
4 |
Clorato |
7775-09-9 |
mg/L |
0,7 |
Clorito |
7758-19-2 |
mg/L |
0,7 |
Cloro residual livre |
7782-50-5 |
mg/L |
5 |
N-nitrosodimetilamina(6) |
62-75-9 |
mg/L |
0,0001 |
TrihalometanosTotal(7) |
- |
mg/L |
0,1 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. CAS é o número de referência de compostos e substâncias químicas adotado pelo Chemical Abstract Service. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
2. Valor Máximo Permitido. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
3. A soma das razões das concentrações de nitrito e nitrato e seus respectivos VMPs, deve atender ao disposto no art. 39. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
4. Análise exigida de acordo com o desinfetante utilizado e oxidante utilizado para pré-oxidação. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
5. Ácidos haloacéticos: ácido monocloroacético - CAS = 79-11-8, ácido dicloroacético - CAS = 79-43-6, ácido tricloroacético - CAS = 76-03-9, ácido monobromoacético - CAS = 79-08-3, ácido dibromoacético - CAS = 631-64-1, ácido bromocloroacético - CAS = 5589-96-8, ácido bromodicloroacético - CAS = 71133-14-7, ácido dibromocloroacético - CAS = 5278-95-5, ácido tribromoacético - CAS = 75-96-7. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
6. O monitoramento será obrigatório apenas onde se pratique a desinfecção por cloraminação. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
7. Trihalometanos: Triclorometano ou Clorofórmio (TCM) - CAS = 67-66-3, Bromodiclorometano (BDCM) - CAS = 75-27-4, Dibromoclorometano (DBCM) - CAS = 124-48-1, Tribromometano ou Bromofórmio (TBM) - CAS = 75-25-2. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 10 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE PADRÃO DE CIANOTOXINAS DA ÁGUA PARA CONSUMO HUMANO. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parâmetro(1) |
Unidade |
VMP(²) |
Cilindrospermopsinas |
μg/L |
1,0 |
Microcistinas |
μg/L (equivalente de MCYST-LR)(3) |
1,0 |
Saxitoxinas |
μg/L (equivalente STX) |
3,0 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. A frequência para o controle de cianotoxinas está prevista na tabela do Anexo 13. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
2. Valor Máximo Permitido. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
3. O valor representa o somatório das concentrações de todas as variantes de microcistinas. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 11 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE PADRÃO ORGANOLÉPTICO DE POTABILIDADE. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Parâmetro |
CAS |
Unidade |
VMP(¹) |
Alumínio |
7429-90-5 |
mg/L |
0,2 |
Amônia (como N) |
7664-41-7 |
mg/L |
1,2 |
Cloreto |
16887-00-6 |
mg/L |
250 |
Cor Aparente (2) |
uH |
15 |
|
1,2 diclorobenzeno |
95-50-1 |
mg/L |
0,001 |
1,4 diclorobenzeno |
106-46-7 |
mg/L |
0,0003 |
Dureza total |
mg/L |
300 |
|
Ferro |
7439-89-6 |
mg/L |
0,3 |
Gosto e odor |
Intensidade |
6 |
|
Manganês |
7439-96-5 |
mg/L |
0,1 |
Monoclorobenzeno |
108-90-7 |
mg/L |
0,02 |
Sódio |
7440-23-5 |
mg/L |
200 |
Sólidos dissolvidos totais |
mg/L |
500 |
|
Sulfato |
14808-79-8 |
mg/L |
250 |
Sulfeto de hidrogênio |
7783-06-4 |
mg/L |
0,05 |
Turbidez (3) |
uT |
5 |
|
Zinco |
7440-66-6 |
mg/L |
5 |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. Valor máximo permitido. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
2. Unidade Hazen (mgPt-Co/L). (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
3. Unidade de turbidez. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 12 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE FREQUÊNCIA DE MONITORAMENTO DE CIANOBACTÉRIAS EM MANANCIAIS SUPERFICIAIS DE ABASTECIMENTO DE ÁGUA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Quando a contagem de células de cianobactérias (células/mL) for: |
Frequência |
£ 10.000 |
Trimestral |
> 10.000 |
Semanal |
ANEXO 13 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES FÍSICAS E QUÍMICAS, EM FUNÇÃO DO PONTO DE AMOSTRAGEM, DA POPULAÇÃO ABASTECIDA E DO TIPO DE MANANCIAL. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
|
|
|
|
||||||
|
|
|
|||||||
|
|
|
|
|
|
||||
|
|
||||||||
|
|
|
|
|
|||||
|
|
|
|||||||
|
|
|
|
|
|||||
|
|
|
|
|
|||||
|
|
|
|
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. Análise exigida de acordo com o desinfetante utilizado. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
2. Para sistemas que realizam a fluoretação ou desfluoretação da água. Os demais sistemas devem realizar o monitoramento de fluoreto conforme a frequência definida para demais parâmetros. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
3. Quando houver pré-oxidação com agente diferente do desinfetante incluir o monitoramento de subproduto em função do oxidante utilizado. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
4. As amostras devem ser coletadas, preferencialmente, em pontos de maior tempo de detenção da água no sistema de distribuição. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
5. Deve ser monitorado apenas pelos SAA e SAC que fazem o uso de polímero que apresenta essa substância em sua constituição. A coleta de amostra deve ser realizada durante o período em que esse polímero for utilizado no tratamento de água. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
6. Quando o parâmetro não for detectado na saída do tratamento (resultado da análise menor que o limite de detecção) fica dispensado o monitoramento na água distribuída, à exceção de substâncias que potencialmente possam ser introduzidas no sistema. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
7. Cloreto de Vinila deve ser monitorado na rede de distribuição, mesmo que não seja encontrado na saída do tratamento, tendo em vista a possibilidade de serem liberados de materiais a base de plástico PVC. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
8. Para agrotóxicos, observar o disposto no parágrafo 4º do artigo 44. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
9. Quando o parâmetro for detectado na saída do tratamento, deve-se monitorar com frequência trimestral na saída do tratamento e no sistema de distribuição. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO 13 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
(Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES FÍSICAS E QUÍMICAS, EM FUNÇÃO DO PONTO DE AMOSTRAGEM, DA POPULAÇÃO ABASTECIDA E DO TIPO DE MANANCIAL. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021) (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
|
|
|
|
||||||
|
|
|
|||||||
|
|
|
|
|
|
||||
|
|
||||||||
|
|
|
|
|
|||||
|
|
|
|
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|||||
|
|
|
|
||||||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
||
NOTAS: (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
1. Análise exigida de acordo com o desinfetante utilizado. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
2. Para sistemas que realizam a fluoretação ou desfluoretação da água. Os demais sistemas devem realizar o monitoramento de fluoreto conforme a frequência definida para demais parâmetros. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
3. Quando houver pré-oxidação com agente diferente do desinfetante incluir o monitoramento de subproduto em função do oxidante utilizado. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
4. As amostras devem ser coletadas, preferencialmente, em pontos de maior tempo de detenção da água no sistema de distribuição. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
5. Deve ser monitorado apenas pelos SAA e SAC que fazem o uso de polímero que apresenta essa substância em sua constituição. A coleta de amostra deve ser realizada durante o período em que esse polímero for utilizado no tratamento de água. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
6. Quando o parâmetro não for detectado na saída do tratamento (resultado da análise menor que o limite de detecção) fica dispensado o monitoramento na água distribuída, à exceção de substâncias que potencialmente possam ser introduzidas no sistema. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
7. Cloreto de Vinila deve ser monitorado na rede de distribuição, mesmo que não seja encontrado na saída do tratamento, tendo em vista a possibilidade de serem liberados de materiais a base de plástico PVC. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
8. Para agrotóxicos, observar o disposto no parágrafo 4º do artigo 44. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
9. Quando o parâmetro for detectado na saída do tratamento, deve-se monitorar com frequência trimestral na saída do tratamento e no sistema de distribuição. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
ANEXO 13 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS E FREQUÊNCIA PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES FÍSICAS E QUÍMICAS, EM FUNÇÃO DO PONTO DE AMOSTRAGEM, DA POPULAÇÃO ABASTECIDA E DO TIPO DE MANANCIAL. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
Parâmetro |
Tipo de Manancial | Saída do Tratamento |
Sistema de distribuição (reservatórios e redes) |
||||||
Nº Amostras |
Frequência |
População abastecida |
|||||||
<50.000 hab. |
50.000 a 250.000 hab. |
>250.000 hab. |
<50.000 hab. |
50.000 a 250.000 hab. |
>250.000 hab. |
||||
Número de amostras |
Frequência |
||||||||
Turbidez, Residual de desinfetante(1), Cor aparente |
Superficial |
1 |
A cada 2 horas |
Conforme § 3º do art. 44 |
|||||
Subterrâneo |
1 |
Semanal |
|||||||
pH e Fluoreto(2) |
Superficial |
1 |
A cada 2 horas |
Dispensada a análise |
|||||
Subterrâneo |
1 |
Semanal |
Dispensada a análise |
||||||
Gosto e odor |
Superficial |
1 |
Trimestral |
Dispensada a análise |
|||||
Subterrâneo |
1 |
Semestral |
Dispensada a análise |
||||||
Cianotoxinas |
Superficial |
1 |
Semanal quando contagem de cianobactérias³ 20.000 células/mL |
Dispensada a análise |
|||||
Produtos secundários da desinfecção(3) |
Superficial |
Dispensada a análise |
1(4) |
4(4) |
8(4) |
Bimestral |
|||
Subterrâneo |
1(4) |
2(4) |
3(4) |
Anual |
Semestral |
Semestral |
|||
Acrilamida(5) |
Superficial ou Subterrâneo |
1 |
Mensal |
1(6) |
1(6) |
1(6) |
Mensal |
||
Epicloridrina(5) |
Superficial ou Subterrâneo |
1 |
Mensal |
1(6) |
1(6) |
1(6) |
Mensal |
||
Cloreto de Vinila(7) |
Superficial ou Subterrâneo |
1 |
Semestral |
1 |
1 |
1 |
Semestral |
||
Demais parâmetros (8)(9) |
Superficial ou Subterrâneo |
1 |
Semestral |
1(6) |
1(6) |
1(6) |
Trimestral |
||
(Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
NOTAS: (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(1) Análise exigida de acordo com o desinfetante utilizado. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(2) Para sistemas que realizam a fluoretação ou desfluoretação da água. Os demais sistemas devem realizar o monitoramento de fluoreto conforme a frequência definida para demais parâmetros. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(3) Quando houver pré-oxidação com agente diferente do desinfetante incluir o monitoramento de subproduto em função do oxidante utilizado. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(4) As amostras devem ser coletadas, preferencialmente, em pontos de maior tempo de detenção da água no sistema de distribuição. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(5) Deve ser monitorado apenas pelos SAA e SAC que fazem o uso de polímero que apresenta essa substância em sua constituição. A coleta de amostra deve ser realizada durante o período em que esse polímero for utilizado no tratamento de água. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(6) Quando o parâmetro não for detectado na saída do tratamento (resultado da análise menor que o limite de detecção) fica dispensado o monitoramento na água distribuída, à exceção de substâncias que potencialmente possam ser introduzidas no sistema. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(7) Cloreto de Vinila deve ser monitorado na rede de distribuição, mesmo que não seja encontrado na saída do tratamento, tendo em vista a possibilidade de serem liberados de materiais a base de plástico PVC. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(8) Para agrotóxicos, observar o disposto no parágrafo 4º do artigo 44. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
(9) Quando o parâmetro for detectado na saída do tratamento, deve-se monitorar com frequência trimestral na saída do tratamento e no sistema de distribuição. (Redação dada pela PRT GM/MS nº 2.472 de 28.09.2021)
ANEXO 14 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS MENSAIS PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES BACTERIOLÓGICAS, EM FUNÇÃO DA POPULAÇÃO ABASTECIDA. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
|
|
|
|
||||||||||
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
||||||||||||
ANEXO 14 DO ANEXO XX
(Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
(Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
TABELA DE NÚMERO MÍNIMO DE AMOSTRAS MENSAIS PARA O CONTROLE DA QUALIDADE DA ÁGUA DE SISTEMA DE ABASTECIMENTO, PARA FINS DE ANÁLISES BACTERIOLÓGICAS, EM FUNÇÃO DA POPULAÇÃO ABASTECIDA. (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
Saída do Tratamento |
Sistema de distribuição (reservatórios e rede) (Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021) | ||||||||||||
Parâmetro |
|||||||||||||
Tipo de Manancial |
(Número de amostras por unidade de tratamento) |
População abastecida |
|||||||||||
<5.000 |
5.000 a 10.000 |
10.000 a 50.000 |
50.000 a 80.000 |
80.000 a 130.000 |
130.000 a 250.000 |
250.000 a 340.000 |
340.000 a 400.000 |
400.000 a 600.000 |
600.000 a 1.140.000 |
>1.140.000 |
|||
Coliformes totais |
Superficial |
Duas amostras semanais |
5 |
10 |
1 para cada 1.000 habitantes |
25 + 1 para cada 2.000 habitantes |
1 + 1 para cada 1.250 habitantes |
40 + 1 para cada 2.000 habitantes |
115 + 1 para cada 5.000 habitantes |
47 + 1 para cada 2.500 habitantes |
127 + 1 para cada 5.000 habitantes |
187 + 1 para cada 10.000 habitantes |
244 + 1 para cada 20.000 habitantes (Máximo de 400) |
Subterrâneo |
Semanal |
||||||||||||
Escherichia coli |
- |
||||||||||||
(Retificado pelo D.O.U seção 1 pág. 60 do dia 14.06.2021)
Parâmetro |
Tipo de manancial |
Saída do tratamento |
Número de amostras retiradas no ponto de consumo (para cada 1000 hab.) |
Frequência de amostragem |
Cor aparente, pH, coliformes totais eEscherichia coli |
Superficial |
1 |
1 |
Semanal |
Subterrâneo |
1 |
1 |
Mensal |
|
Turbidez |
Superficial |
1 |
1 |
Semanal |
Subterrâneo |
1 |
1 |
Semanal na saída do tratamento Mensal no ponto de consumo |
|
Residual de desinfetante(1) |
Superficial ou Subterrâneo |
1 |
1 |
Diário |
Demais parâmetros |
Superficial ou Subterrâneo |
1 |
- |
Semestral |
NOTAS: (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
1. Análise exigida de acordo com o desinfetante utilizado. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
Republicada por ter saído no DOU nº 85, de 7-5-2021, Seção 1, páginas 126 a 136, com incorreção no original. (Redação dada pela PRT GM/MS nº 888 de 04.05.2021)
ANEXO XXI
Normas e Padrões sobre Fluoretação da Água dos Sistemas Públicos de Abastecimento, Destinada ao Consumo Humano (Origem: PRT MS/GM 635/1975)
Art. 1º Aprovar as Normas e Padrões, a seguir, sobre a fluoretação da água dos sistemas públicos de abastecimento, destinada ao consumo humano. (Origem: PRT MS/GM 635/1975, Art. 1º)
Art. 2º Para efeito de fluoretação da água dos sistemas públicos de abastecimento, destinada ao consumo humano, são adotadas as seguintes definições: (Origem: PRT MS/GM 635/1975, Art. 2º)
I - Fluoretação: Teor de concentração do íon fluoreto presente na água destinada ao consumo humano, apto a produzir os efeitos desejados à prevenção da cárie dental. (Origem: PRT MS/GM 635/1975, Art. 2º, I)
II - Íon: Átomos ou grupos de átomos dotados de carga elétrica. (Origem: PRT MS/GM 635/1975, Art. 2º, II)
III - Concentração de íon Fluoreto: Relação entre a massa do íon fluoreto dissolvida na água e a massa da solução, geralmente expressa em partes por milhão (ppm) que representa miligramas de íon flúor por quilograma de solução. Para efeito desta norma admite-se que 1 litro de água, pesa 1 quilograma; portanto 1 ppm é 1 mg/litro. (Origem: PRT MS/GM 635/1975, Art. 2º, III)
IV - Composto Fluoretado: Qualquer composto químico que contenha em sua composição o íon fluoreto (F). (Origem: PRT MS/GM 635/1975, Art. 2º, IV)
V - Dosador de Produtos Químicos: Equipamento que lança na água quantidades pré-determinadas de produtos químicos. (Origem: PRT MS/GM 635/1975, Art. 2º, V)
VI - Dosagem por Solução: Aquela na qual o produto químico é medido como volume de solução. (Origem: PRT MS/GM 635/1975, Art. 2º, VI)
VII - Dosagem a seco: Aquela na qual uma quantidade medida de um composto químico seco é descarregada por um dosador durante um determinado intervalo de tempo. (Origem: PRT MS/GM 635/1975, Art. 2º, VII)
VIII - Dosador a Seco Volumétrico: Equipamento que descarrega volume específico (cm3, dm3, etc.) e de produto químico, durante um determinado intervalo de tempo. (Origem: PRT MS/GM 635/1975, Art. 2º, VIII)
IX - Dosador a Seco Gravimétrico: Equipamento que descarrega um certo peso (g, kg, etc.) de produto químico durante um determinado intervalo de tempo. (Origem: PRT MS/GM 635/1975, Art. 2º, IX)
X - Prevalência de Cárie Dental: Quantidade desta afecção existente numa comunidade ou num indivíduo em dado momento. (Origem: PRT MS/GM 635/1975, Art. 2º, X)
Art. 3º Os sistemas públicos de abastecimento de água fluoretada deverão obedecer aos seguintes requisitos mínimos: (Origem: PRT MS/GM 635/1975, Art. 3º)
I - Abastecimento contínuo da água distribuída à população, em caráter regular e sem interrupção. (Origem: PRT MS/GM 635/1975, Art. 3º, I)
II - A água distribuída deve atender os padrões de potabilidade. (Origem: PRT MS/GM 635/1975, Art. 3º, II)
III - Sistemas de operação e manutenção adequados. (Origem: PRT MS/GM 635/1975, Art. 3º, III)
IV - Sistema de controle rotineiro da qualidade da água distribuída. (Origem: PRT MS/GM 635/1975, Art. 3º, IV)
Art. 4º A concentração recomendada de íon fluoreto nas águas de abastecimento público é obtida pela fórmula constante no Anexo 2 do Anexo XXI . (Origem: PRT MS/GM 635/1975, Art. 4º)
Art. 5º Os limites recomendados para a concentração do íon fluoreto em função da média das Temperaturas máximas diárias são os indicados no Quadro I constante no Anexo 1 do Anexo XXI . (Origem: PRT MS/GM 635/1975, Art. 5º)
Art. 6º Os compostos químicos de flúor que podem ser empregados nos sistemas públicos de abastecimento de água são os indicados no Quadro II constante no Anexo 1 do Anexo XXI (Origem: PRT MS/GM 635/1975, Art. 6º)
Art. 7º Os métodos de análise e procedimentos para determinação da concentração do íon fluoreto na água são os indicados nos subítens seguintes, e a descrição dos mesmos as constantes do Anexo 1 do Anexo XXI , sua Tabela e Figura. (Origem: PRT MS/GM 635/1975, Art. 7º)
I - Métodos analíticos: (Origem: PRT MS/GM 635/1975, Art. 7º, I)
a) Eletrométrico. (Origem: PRT MS/GM 635/1975, Art. 7º, I, a)
b) SPADNS (fotométrico). (Origem: PRT MS/GM 635/1975, Art. 7º, I, b)
c) Visual da Alizarina. (Origem: PRT MS/GM 635/1975, Art. 7º, I, c)
II - Procedimentos: (Origem: PRT MS/GM 635/1975, Art. 7º, II)
a) Para a determinação do teor de íon fluoreto, as águas brutas e fluoretadas deverão ser analisadas por um dos métodos discriminados no Anexo 1 do Anexo XXI . (Origem: PRT MS/GM 635/1975, Art. 7º, II, a)
b) A frequência diária das análises a serem efetuadas dependerá da complexidade e porte do sistema de água. (Origem: PRT MS/GM 635/1975, Art. 7º, II, b)
c) O controle (diário e mensal) a ser exercido sobre a água, conterá obrigatoriamente, os seguintes elementos: (Origem: PRT MS/GM 635/1975, Art. 7º, II, c)
1. Cidade. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 1)
2. Estado. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 2)
3. Dia, mês e ano. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 3)
4. Responsável pela análise. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 4)
5. Dose ótima de flúor. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 5)
6. Método de análise (com ou sem destilação). (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 6)
7. Composto de flúor empregado. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 7)
8. Vazão do sistema. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 8)
9. Teor do íon fluoreto natural. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 9)
10. Quantidade de composto de flúor agregado (diário); (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 10)
11. Teor diário de íon fluoreto na água fluoretada. (Origem: PRT MS/GM 635/1975, Art. 7º, II, c, 11)
Parágrafo Único. Para os métodos analíticos de SPADNS (fotométrico) e Visual da Alizarina, deverão ser realizadas a destilação prévia das amostras (Anexo 3 do Anexo XXI) com o objetivo de eliminar os interferentes, caso seja necessário. (Origem: PRT MS/GM 635/1975, Art. 7º, Parágrafo Único)
Art. 8º Os tipos e precisão dos equipamentos tolerados para dosagem dos compostos de flúor são os seguintes: (Origem: PRT MS/GM 635/1975, Art. 8º)
I - Tipos: (Origem: PRT MS/GM 635/1975, Art. 8º, I)
a) De Solução. (Origem: PRT MS/GM 635/1975, Art. 8º, I, a)
b) A seco (volumétrico e gravimétrico). (Origem: PRT MS/GM 635/1975, Art. 8º, I, b)
II - Precisão: (Origem: PRT MS/GM 635/1975, Art. 8º, II)
a) O equipamento para dosagem dos compostos fluoretados por via úmida deverão permitir no máximo um erro de 0,1 mg/l a um nível de 1 mg/l, ou seja 10% para mais ou menos. (Origem: PRT MS/GM 635/1975, Art. 8º, II, a)
b) Nos equipamentos para dosagem dos compostos fluoretados por via seca será tolerada uma oscilação para mais ou menos de no máximo 3 a 5% no tipo volumétrico e de 1 a 2% no tipo gravimétrico. (Origem: PRT MS/GM 635/1975, Art. 8º, II, b)
Art. 9º As técnicas de fluoretação de acordo com o composto químico a utilizar, em função da vazão do sistema com a dosagem a seco ou por via úmida, são as descritas no Quadro III, do Anexo 1 do Anexo XXI , indicativos dos compostos químicos, vazão 1 l/s, equipamentos requeridos, espécies de produtos químicos, manuseio, pontos de aplicação e cuidados especiais. (Origem: PRT MS/GM 635/1975, Art. 9º)
ANEXO 1 DO ANEXO XXI
MÉTODOS DE ANÁLISES E PROCEDIMENTOS PARA A DETERMINAÇÃO DE ÍON FLUORETO NA ÁGUA (Origem: PRT MS/GM 635/1975, Anexo 1)
1. Considerações Gerais.
Entre os diversos métodos para determinação do íon fluoreto na água, os eletrométricos e os colorimétricos são atualmente considerados os mais satisfatórios. Os métodos colorimétricos são baseados na reação entre o fluoreto e a laca de zircônio com um corante orgânico. O fluoreto forma um complexo Zr F - que é incolor. A proporção que a quantidade de íons fluoreto cresce, a coloração da Laca decresce ou modifica seu matiz.
Como todos os métodos colorimétricos estão sujeitos a erros provocados por íons interferentes existentes na amostra é necessário destilá-la antes de se fazer a determinação do fluoreto. Se os interferentes presentes na amostra estão em concentrações baixas, não será necessário destilá-la podendo-se passar diretamente aos métodos colorimétricos.
2. Seleção do Método.
A adição de um tampão de citrato, livra o método eletrométrico de interferentes tais como íons de alumínio, hexametafosfato, ferro e ortofosfato, que nos métodos colorimétricos são eliminados por destilação preliminar.
Ambos os métodos colorimétricos são aplicáveis a amostras contendo teores de fluoreto na faixa de 0,05 a 1,4 mg/l, enquanto que o método eletrométrico é aplicável para teores de 0,1 a 5 mg/l.
Com a aplicação dos métodos SPADNS e eletrométrico os resultados são lidos imediatamente, enquanto que, com o de alizarina, é necessário esperar 1 hora após a adição do corante para o desenvolvimento da cor.
Os métodos SPADNS . e eletrométrico necessitam equipamentos, enquanto o visual de alizarina necessita apenas vidraria de laboratório. Padrões permanentes para o método visual poderão ser usados, mas precauções especiais deverão ser tomadas pelo analista.
3. Interferentes nos métodos colorimétricos.
Em geral os métodos colorimétricos estão sujeitos aos mesmos interferentes, variando apenas os graus. A tabela indica as substâncias que comumente interferem nos dois métodos. Estas interferências não são aditivas. A amostra deverá ser previamente destilada quando qualquer substância presente cause interferência, cujo erro seja de 0,1 mg/l, ou quando houver dúvida no efeito. A destilação também é recomendada para as amostras coloridas ou turvas. Algumas vezes pode-se diluir a amostra ou neutralizá-la, quando for o caso, para diminuir os efeitos interferentes.
O cloro interfere em todos os métodos colorimétricos e deverá ser removido.
Nos métodos colorimétricos volumes e temperaturas são críticos e devem ser medidos com precisão, pois deles dependem os resultados.
4. Amostragem
Frascos de polietileno são preferíveis na coleta de amostras de água para análise de fluoretos. Frascos de vidro são satisfatórios desde que se evite usar frascos que contiveram soluções concentradas de fluoretos. Em todos os casos, deverá ser adotada a prática de lavar inicialmente os frascos com a água que vai ser analisada.
Caso se aproveitem na determinação de fluoretos amostras colhidas para exames bacteriológicos, deve-se tomar precauções quanto às substâncias usadas para eliminar o cloro, pois o tiosulfato, em concentrações de 100 mg/l, interfere produzindo precipitado.
5. Tabela
Substâncias interferentes nos métodos colorimétricos
Substância Interferente |
MétodoSpands |
Método Visual de Alizarina |
||
Conc. mg/L |
Tipo de Erro |
Conc. mg/L |
Tipo de Erro |
|
Alcalinidade (CaCO3) |
5.000 |
- |
400 |
- |
Alumínio (AI+++) |
0,1 |
- |
0,25 |
- |
Cloreto (Cl--) |
7.000 |
+ |
2.000 |
- |
Ferro (Fe+++) |
10 |
- |
2 |
+ |
Hexametafosfato (NaPO3)6 |
1,0 |
+ |
1,0 |
+ |
Fosfato (PO4 -) |
16 |
+ |
5 |
+ |
Sulfato (SO4-) |
200 |
+ |
300 |
+ |
6. Destilação preliminar
6.1. Discussão - Por meio de destilação, o íon fluoreto pode ser separado dos outros elementos existentes nas águas, na forma de ácido fluossilíco ou fluorídrico. A recuperação quantitativa do fluoreto se obtém usando amostras relativamente grandes e sob altas temperaturas.
6.2. Equipamento - O aparelho de destilação (figura) consiste: de um balão de vidro pirex, com capacidade de um litro, fundo redondo e pescoço longo, de um tubo de conexão; de um condensador eficiente; e de um termômetro com escala de 0º a 200ºC. Qualquer outro destilador semelhante ao da figura poderá ser usado. Os pontos críticos a serem observados são aqueles que afetam a completa recuperação dos fluoretos, tais como obstruções na passagem do vapor etc., e condições que podem aumentar o arraste do sulfato. Deste modo, pode-se usar anteparos de asbesto para proteger da chama a parte superior do balão de destilação. Pode-se modificar este aparelho de modo a desligar automaticamente quando a destilação acabar.
6.3. Reagentes:
a) ácido sulfúrico concentrado. b) sulfato de prata cristalizado.
6.4. Procedimento:
a) Coloque 400 ml de água no frasco de destilação e cuidadosamente acione 200 ml de ácido sulfúrico concentrado.
Agite até homogeneizar o conteúdo do frasco. Adicione 25 a 35 pérolas de vidro e ligue o aparelho como mostra a figura, certificando-se que todas as juntas estão ajustadas. Comece a aquecer lentamente, passando aos poucos a um aquecimento tão rápido quando permitir o condensador (o destilado deverá sair frio) até que a temperatura do líquido contido no frasco atinja exatamente 180º C. Neste instante pare a destilação e elimine o destilado. Este processo serve para remover qualquer contaminação de fluoreto e ajustar a relação ácido-água para destilações subsequentes.
b) Após esfriar a mistura de ácido remanescente do item anterior ou de destilações prévias, até 120º C ou abaixo, adiciona 300 ml da amostra, misture cuidadosamente, e destile corno descrito anteriormente até a temperatura atingir 180º C. Para prevenir o arraste de sulfato, não permita que a temperatura ultrapasse l8Oº C.
c) Adicione sulfato de prata ao frasco de destilação, na proporção de 5 mg por miligrama de cloreto, quando amostras de alto conteúdo em cloretos são analisadas.
d) Use a solução de ácido sulfúrico repetidamente até que os contaminantes das amostras de água, acumuladas no frasco de destilação, comecem a interferir no destilado. Verifique a possibilidade de uso do ácido periodicamente, destilando amostras conhecidas de fluoretos. Após a destilação de amostras com altos teores de fluoretos, adicione 300 ml de água e continue a destilação combinando os destilados. Se necessário repita a operação até que o conteúdo de fluoretos no destilado seja mínimo. Adicione ao primeiro destilado, os destilados subseqüentes. Após períodos de inatividade, destile água e elimine o destilado, antes de destilar a amostra.
6.5. Interpretação dos Resultados - O fluoreto recuperado na destilação está quantitativamente dentro da precisão dos métodos usados para a determinação.
7. Método Eletrométrico:
7.1. Interferentes - Cátions polivalentes tais como AI(+++), Fe(+++) e Si(+++) formam complexos o íon fluoreto. A formação dos complexos depende do pH da solução e dos níveis de relação entre o fluoreto e os tipos de complexos. Em presença de concentrações de alumínio acima de 2 mg/l, o íon citrato numa solução tampão, preferentemente formará complexos com o alumínio, libertando o íon fluoreto.
Em soluções ácidas, o íon hidrogênio forma complexos com o íon fluoreto, mas o complexo é desprezível se o pH for ajustado acima de 5. Em soluções alcalinas o íon hidroxila interfere com a resposta do eletrodo em função de íon fluoreto, sempre que o nível de hidroxila for maior do que um décimo do nível do íon fluoreto presente. Entretanto, a um pH igual ou menor que 8, a concentração de hidroxila é igual ou menor que 10-6 molar e neste caso não haverá interferência para qualquer concentração de fluoretos detectáveis.
7.2. Equipamento:
a) Potenciômetro com escala de pH ampliada ou um medidor específico de íons que possuam um milivoltímetro ou outra escala apropriada além da de pH.
b) Eletrodo tipo Beckman n.º 40.463 ou Corning n.º 476.012 ou Orion n.º 900.100 ou outro semelhante.
c) Eletrodo especial para fluoretos.
d) Agitador magnético com barra agitadora revestida de teflon. e) Cronômetro.
7.3. Reagentes:
a) Solução de Fluoreto de 100 ug/ml - Dissolva 221,0 mg de fluoreto de sódio anidro (N-F), em água destilada e leva o volume para 1.000 ml. Cada ml da solução contém 100 ug de F.
b) Solução Padrão de Fluoreto - Dilua 100 ml da solução de fluoreto de 100 ug/ml para 1.000 ml com água destilada. Cada ml conterá 10 ug de F.
c) Solução Tampão (TISAB) - Coloque aproximadamente 500 ml de água destilada em um becker de 1.000 ml. Adicione 57 ml de ácido acético glacial, 58 g de cloreto de sadio (NaCI) e 12 g de citrato de sódio bi-hidratado. (Na3C6H5O72H2O). Agite até dissolver. Coloque o becker em um banho de água para esfriar, coloque o eletrodo de pH e o de referência e leve o pH 5,0 a 5,5 com hidróxido de sódio 6N (125 ml aproximadamente). Esfrie para a temperatura ambiente. Coloque num balão volumétrico de 1.000 ml e leve o volume até a marca com água destilada.
7.4. Procedimento:
a) Calibração do instrumento - Não é necessário fazer calibrações nos potenciômetros quando a faixa de fluoreto é de 0,2 a 2,0 mg/l;
b) Preparação de Padrões de Fluoreto - Pipete 2,00; 4,00; 6,00; 8,00; 10,00; 16,00; 20,00 ml da solução padrão do fluoreto em urna série de balões volumétricos de 100 ml. A cada balão adicione 50 ml de solução tampão e leve os volumes a 100 ml com água destilada. Misture bem. Cada balão conterá respectivamente 0,20; 0,40; 0,60; 0,80; 1,00; 1,20; 1,60 e 2,00 mg/litro.
c) Tratamento da amostra - Coloque 50 ml da amostra em um balão volumétrico de 100 ml e complete o volume com a solução tampão. Misture bem. Mantenha os padrões e amostra na mesma temperatura, preferentemente na de calibração dos balões.
d) Medida com o eletrodo - Transfira os padrões e a amostra para uma série de beckers de 150 ml. Mergulhe os eletrodos em cada becker e meça o potencial desenvolvido enquanto a agitação é mantida por meio de um agitador magnético. Evite agitar a solução antes da imersão dos eletrodos porque se bolhas de ar aderirem ao eletrodo poderão produzir leituras errôneas ou fluoração dos ponteiros. Espere 3 minutos antes de ler no milivoltímetro. Lave os eletrodos com água destilada e enxágue entre cada leitura.
Quando usar um potenciômetro de escala ampliada ou um medidor específico, recalibre freqüentemente o eletrodo verificando a leitura de 1,00 mg/l (50 ug F) da solução padrão e ajustando o controle de calibração.
Faça um gráfico em papel de 3 ciclos a leitura em milivolts contra ug F da solução padrão.
7.5. Cálculos: mg/l F = ug F/ ml da amostra
8. Método SPADNS
8.1. Equipamento:
a) Espectrofotômetro que possa usar o comprimento de onda de 510 mu e tenha uma passagem de luz de pelos menos 1 cm.
b) Fotômetro de filtro com passagem de luz de pelo menos 1 cm equipado com filtro amarelo esverdeado tendo transmitância máxima em 550 a 580 mu.
8.2. Reagentes:
a) Solução padrão de fluoreto - deverá ser preparada na forma indicada em 7.4.5. do método eletrométrico.
b) Solução SPADNS - dissolva 958 mg SPADNS, 2 - parasulfofenilazo -1,8 dihidroxi - 3,6-naftaleno disulfonato de sódio, também chamado 4,5 dihidroxi - 3- parasulfofenilazo - 2,7 naftaleno disulfonato trissódico, em água destilada e dilua para 500 ml. Esta solução é estável indefinidamente se protegida da luz solar direta.
c) Reagente ácido de zirconila - dissolva 133 mg de cloreto de zirconio octahidratado, ZrOCI2. 8H20 em cerca de 25 ml de água destilada. Adicione 350 ml de HCI concentrado e dilua para 500 ml com água destilada.
d) Reagente ácido de zirconila - SPADNS - misture volumes iguais de soluções SPADNS e ácida de zirconila. Esta solução é estável por 2 anos.
e) Solução de Referência - adicione 10 ml da solução de SPADNS a 100 ml de água destilada. Dilua 7 ml de HCI concentrado para 10 ml com água destilada e adicione à solução SPADNS diluída. Esta solução é estável indefinidamente e será usada como ponto de referência para o espectrofotômetro ou o fotômetro. Esta solução poderá ser substituída por um dos padrões de fluoreto.
f) Solução de arsenito de sódio - dissolva 5,0 g. de NaAsO2 e dilua para 1.000 ml com água destilada.
8.3. Procedimento:
a) Preparação da curva padrão - prepare padrões de fluoretos na faixa de 0 a 1,40 mg/l diluindo quantidades apropriadas da solução padrão de fluoreto para 50 ml com água destilada. Pipete 5 ml do reagente ácido de zirconila e 5 ml do reagente. SPADNS ou 10 ml do reagente misto de zirconila ácida SPADNS em cada padrão e misture bem Ajuste o fotômetro ou o espectrofotômetro ao zero de absorção com a solução de referência e imediatamente faça a leitura da absorção em cada um dos padrões. Faça um gráfico da curva da concentração em fluoretos versus absorção. Prepare nova curva padrão sempre que novos reagentes tenham que ser preparados. Se não for usada solução de referência, calibre o espectrofotômetro ou fotômetro para algum ponto da curva com um padrão de fluoreto.
b) Pré-tratamento da amostra - se a amostra contém cloro residual, remova-o pela adição de 1 gota (0,05 ml) da solução de arsenito de sódio para cada 0,1 mg de Cl e misture. Concentrações de arsenito de sódio de 1.300 mg/l produzem erros de 0,1 mg/l de F.
c) Desenvolvimento da cor - use amostra de 50 ml ou uma alíquota diluída para 50 ml. Ajuste a temperatura para a mesma da curva padrão. Adicione 5 ml da solução SPADNS e 5 ml da solução ácida de zirconila ou 10 ml da solução mista de zirconila ácida - SPADNS. Misture bem e leia imediatamente a absorção, ajustando primeiro o fotômetro ou espectrofotômetro ao ponto de referência. Se a absorção estiver fora da curva padrão, repita a operação diluindo a amostra.
8.4. Cálculos:
mg/l F = A/(ml amostra) x B/C
onde
A = mg de fluoreto determinado fotometricamente.
B/C = é aplicado somente quando a amostra for diluída para um volume B e uma alíquota C for tomada para o desenvolvimento da cor.
9. Método Visual da Alizarina.
9.1. Equipamento:
a) Série de tubos Nessler de 100 ml, ou b) Comparador visual de cor.
9.2. Reagentes:
a) Solução de Fluoretos - deverá ser preparada como indicada para o método eletrométrico.
b) Reagente Zircônio-Alizarina - dissolva 300 mg de cloreto de zircônio octahidratado, ZrOCl2. 8 H20, em 50 ml de água destilada e coloque em balão volumétrico de 1.000 ml. Dissolva 70 mg de 3-alizarinassulfonato de sódio, também conhecida por vermelho de alizarina S, em 50 ml de água destilada e adicione ao frasco de 1.000 ml que já contém a solução de cloreto de zircônio. Deixe em repouso para clarear.
c) Solução ácida - dilua 101 ml de HCI concentrado para, aproximadamente, 400 ml com água destilada. Dilua, cuidadosamente, 33,3 ml de H2S04 concentrado para 400 ml com água destilada. Após esfriar, misture as duas soluções.
d) Reagente ácido de Zircônio-Alizarina - adicione à solução ácida do item C a de Zircônio-Alizarina contida no balão de 1.000 ml. Complete o volume com água destilada e misture. O reagente muda de cor do vermelho ao amarelo em aproximadamente uma hora. Guardado e protegido da luz solar direta, é estável por 6 meses.
e) Solução de arsenito de sódio - deverá ser preparada do mesmo modo como indicado para método - SPADNS
9.3. Procedimento:
a) Pré-tratamento da amostra - se a amostra contém cloro residual, remova-o adicionando 1 gota (0,05 ml) da solução de arsenito de sódio para cada 0,1 mg de Cl.
b) Preparação dos Padrões - Prepare uma série de padrões diluindo volumes conhecidos da solução padrão de fluoreto de 10 ug para 100 ml nos tubos Nessler. Escolha a faixa de padrões de modo a atingir a concentração da amostra. Quanto menor o intervalo entre as concentrações dos padrões, maior a precisão na análise. Geralmente usa-se intervalos de 50 ug/l.
d) Desenvolvimento da cor - encha um tubo Nessler de 100 ml com a amostra ou uma diluição desta quando for necessário e iguale as temperaturas desta com a dos padrões. Adicione, a cada tubo 5,00 ml do reagente ácido de zircônio-alizarina. Misture e compare as amostras com os padrões após 1 hora de repouso.
9.4. Cálculos:
Mg/l F = A/(ml amostra) x B/C
onde
A = mg de F determinada visualmente. A razão B/C é aplicada quando houver necessidade de diluir o volume C da amostra para o volume B final.
QUADRO I
Limites recomendados para a concentração do íon fluoreto em função da média das temperaturas máximas diárias.
Média das temperaturas máximas diárias do ar (ºC) |
Limites recomendados para a concentração do íon fluoreto (mg/l) |
||
mínimo |
máximo |
ótimo |
|
10,0 - 12,1 |
0,9 |
1,7 |
1,2 |
12,2 - 14,6 |
0,8 |
1,5 |
1,1 |
14,7 - 17,7 |
0,8 |
1,3 |
1,0 |
17,8 - 21,4 |
0,7 |
1,2 |
0,9 |
21,5 - 26,3 |
0,7 |
1,0 |
0,8 |
26,4 - 32,5 |
0,6 |
0,8 |
0,7 |
QUADRO II
Compostos de Flúor
Podem ser empregados:
| Características | Fluoreto de Cálcio (Fluorita) CaF2 | Fluossilicato deSódio Na2 SiF6 | Fluoreto do sódio NaF | Ácido FluossilícicoH2SiF6 |
| Forma | Pó | Pó ou cristais finos | Pó ou cristal | Líquido |
| Peso Molecular | 78,08 | 188,05 | 42,0 | 144,08 |
| Pureza Comercial % | 85 a 98 | 98 a 99 | 90 a 98 | 22 a 30 |
| Solubilidade gr/100gr(25ºC) | 0,0016 | 0,762 | 4,05 | |
| pH da solução saturada | 6,7 | 3,5 | 7,6 | 1,2 (solução l%) |
| Íon Fluoreto em % (100% puro) | 48,8 | 60,7 | 42,25 | 79,2 |
Os compostos de flúor especificados são os de uso corrente no Brasil, entretanto outros compostos poderão ser utilizados desde que existentes no mercado.
QUADRO III
Técnicas de Fluoretação
De acordo com o composto químico a utilizar e em função da vazão do sistema, podem ser:
| Composto Químico | Vazão l/s | Equipamento Requerido | Especificação do Produto Químico | Manuseio | Ponto de Aplicação | Cuidados |
| Com dosagem à seco | ||||||
| Fluossilicato de Sódio ou Fluoreto de Sódio | 6 a 90 | Dosador volumétrico Balança Tremonha (tegão) Câmara de dissolução | Pó, em sacos, tambores ou a granel | Alimentação direta do saco Equipamento de manejo a granel | Canal aberto Afluente do filtro Reservatório de água filtrada | Poeira Respingos Efeito de arco na tremonha |
| > 90 | Dosador gravimétrico Tremonha Câmara de dissolução | |||||
| Com dosagem por via úmida | ||||||
| Fluoreto de Cálcio(Fluorita) | < 1.000 | Tanque de solução de sulfato de alumínio misturador | Fluorita 100% passando na peneira 350 mesh pureza > 98% | Pesagem Mistura Constante Medição deVazão | Na entrada da ETA juntamente com Al2 (SO4)3 | |
| Fluoreto de Sódio | < 30 | Dosador de Solução Tanque de Mistura Balança Agitador | Cristalino e isento de poeira em sacos ou tambores | Pesagem Mistura Medição | Efluente do Filtro | Poeira Respingos Preparo daSolução |
| 30 a 130 | Dosador de Solução Saturador Medidor de Vazão | a) Saturador descendente:Cristal grosso, em tambores ou sacos. b) Saturadorascendente: Cristal fino | Esvaziamento completo da embalagem | Reservatório de água filtrada | Poeira Respingo | |
| Ácido | < 30 | Dosador de Solução Balança Tanque Calibrado Tanque de Mistura Misturador | Ácido fortificado (pouca Sílica) em tambores ou bombonas | Despejo ouSifonamento Medição Mistura Pesagem | Efluente do Filtro Reservatório de água filtrada | Corrosão Vapores Respingos Preparo deSolução |
| Fluossilícico | > 30 | Dosador de Solução Tanque Diário Balança Bomba para Transferência | S. Granel em vagões ou caminhões | bombeamento | Corrosão Vapores Vazamentos | |
ANEXO 2 DO ANEXO XXI
FÓRMULA DA CONCENTRAÇÃO RECOMENDADA DE ÍON FLUORETO NAS ÁGUAS DE ABASTECIMENTO PÚBLICO (Origem: PRT MS/GM 635/1975, Anexo 2)

onde
E = 10,3 + 0,725 T
T = média de Temperaturas máximas diárias observadas durante um período mínimo de 1 ano (recomendado 5 anos) em graus centígrados.
ANEXO 3 DO ANEXO XXI
FIGURA (Origem: PRT MS/GM 635/1975, Anexo 3)
ANEXO XXII
IMPLANTAÇÃO DO PROGRAMA NACIONAL DE TRIAGEM NEONATAL (Origem: PRT MS/GM 822/2001, Anexo 1)
ANEXO I
IMPLANTAÇÃO DO PROGRAMA NACIONAL DE TRIAGEM NEONATAL
COMPETÊNCIAS E ATRIBUIÇÕES:
1 - MINISTÉRIO DA SAÚDE
a - Instituir o Programa Nacional de Triagem Neonatal, o rol das doenças a serem triadas, os princípios e diretrizes da implantação do Programa, o estabelecimento de critérios/exigências de habilitação nas fases de implantação, critérios de implantação das redes de triagem neonatal e os critérios técnicos de desenvolvimento do trabalho;
b - Elaborar e publicar Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal e Protocolos Clínicos e Diretrizes Terapêuticas a serem adotados pelo Programa Nacional de Triagem Neonatal;
c - Estabelecer as normas de funcionamento e cadastramento de Postos de Coleta e de Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas;
d - Articular com os estados, municípios e o Distrito Federal a implantação do Programa e o estabelecimento de mecanismos de controle, avaliação e acompanhamento do processo;
e - Assessorar os estados e o Distrito Federal na implantação, em seus respectivos âmbitos de atuação, do Programa Nacional de Triagem Neonatal e na organização de suas respectivas Redes Estaduais de Triagem Neonatal;
f - Avaliar as condições de habilitação dos estados e do Distrito Federal nas Fases de Implantação do Programa;
g - Criar um banco de dados que permita acompanhar e avaliar o desenvolvimento do Programa, definindo seus indicadores;
h - Alocar recursos financeiros destinados ao co-financiamento das atividades do Programa;
i - Divulgar o Programa de maneira a conscientizar e informar a população e os profissionais de saúde sobre a importância da realização da Triagem Neonatal.
2 - SECRETARIAS DE SAÚDE DOS ESTADOS E DO DISTRITO FEDERAL
a - Elaborar, em parceria com as Secretarias Municipais de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Triagem Neonatal;
b - Designar um Coordenador Estadual do Programa Nacional de Triagem Neonatal;
c - Organizar a Rede Estadual de Triagem Neonatal, identificando os Postos de Coleta, estabelecendo os fluxos de referência e contra-referência entre os Postos e os Serviços de Referência e garantindo a execução de todas as fases do processo de sua respectiva fase de implantação do Programa – triagem, confirmação diagnóstica, acompanhamento e tratamento dos pacientes identificados como portadores das patologias triadas;
d - Criar as condições para a estruturação/criação/implantação/cadastramento dos Serviços de Referência em Triagem Neonatal/ Acompanhamento e Tratamento de Doenças Congênitas de Tipo I, II ou III, conforme sua respectiva fase de implantação do Programa;
e - Articular com os demais gestores estaduais as eventuais referências laboratoriais dos Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas, conforme previsto no Anexo III desta Portaria;
f - Organizar a rede assistencial complementar – ambulatorial e hospitalar, destinada a garantir a retaguarda dos Serviços de Referência de Triagem Neonatal no atendimento dos pacientes triados, em conformidade com o estabelecido no Anexo III desta Portaria;
g - Assessorar os municípios no processo de implementação do Programa, na estruturação/criação/implantação/cadastramento dos Postos de Coleta, no desenvolvimento das atividades e na adoção de mecanismos destinados ao controle, avaliação e acompanhamento do processo;
h - Avaliar as condições epidemiológicas de seu estado para eventual implantação da Fase III do Programa;
i - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento / incremento do Programa;
j - Monitorar o desempenho do Programa em seu estado e os resultados alcançados, mediante o acompanhamento de indicadores de cobertura da Triagem em termos de porcentual de cobertura dos recém-nascidos no estado;
k - Manter atualizados os bancos de dados que estejam sob sua responsabilidade, integrando, inclusive, os dados de Triagem Neonatal provenientes da rede privada de laboratórios, que deverão ser notificados ao gestor estadual do SUS.
3 - SECRETARIAS MUNICIPAIS DE SAÚDE
a - Elaborar, em parceria com a respectiva Secretaria estadual de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional de Triagem Neonatal;
b- Criar as condições para a estruturação/criação/implantação/cadastramento do(s) Posto(s) de Coleta e adotar as providencias necessárias para integrá-lo(s) na Rede Estadual de Triagem Neonatal;
c - Apoiar a estruturação/manutenção/funcionamento dos Serviços de Referência em Triagem Neonatal que estejam instalados em seu município;
d - Organizar a rede assistencial complementar – ambulatorial e hospitalar, destinada a garantir a retaguarda dos Serviços de Referência de Triagem Neonatal no atendimento dos pacientes triados, em conformidade com o estabelecido no Anexo III desta Portaria;
e - Alocar, complementarmente, recursos financeiros próprios para o desenvolvimento/incremento do Programa;
f - Monitorar o desempenho do Programa em seu município e os resultados alcançados, mediante o acompanhamento de indicadores de cobertura da Triagem em termos de percentual de cobertura dos recém -nascidos no município;
g - Manter atualizados os bancos de dados que estejam sob sua responsabilidade, integrando, inclusive, os dados de Triagem Neonatal provenientes da rede privada de laboratórios, que deverão ser notificados ao gestor estadual do SUS.
ANEXO XXIII
PROGRAMA NACIONAL DE TRIAGEM NEONATAL (Origem: PRT MS/GM 822/2001, Anexo 2)
ANEXO II
PROGRAMA NACIONAL DE TRIAGEM NEONATAL
PRINCÍPIOS E DIRETRIZES, CRITÉRIOS/EXIGÊNCIAS PARA HABILITAÇÃO NAS FASES DE IMPLANTAÇÃO
O Programa Nacional de Triagem Neonatal tem por objetivo o desenvolvimento de ações de triagem neonatal, diagnóstico, acompanhamento e tratamento das seguintes doenças congênitas:
- Fenilcetonúria;
- Hipotireodismo Congênito;
- Doenças Falciformes e outras Hemoglobinopatias;
- Fibrose Cística.
A - PRINCÍPIOS E DIRETRIZES
A implantação do Programa deverá seguir os seguintes Princípios e Diretrizes:
1 - Todo recém-nascido tem direito ao acesso à realização de testes de Triagem Neonatal, em conformidade com o disposto nesta Portaria. Os testes deverão ser realizados até o 30º dia de vida (preferencialmente entre o 2º e o 7º dia de vida), com coleta do material efetuada de acordo com os critérios técnicos estabelecidos no Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal a ser elaborado e publicado pela Secretaria de Assistência à Saúde/SAS/MS;
2 - O Programa Nacional de Triagem Neonatal deverá ser organizado de maneira a garantir plenamente o acesso aos recém-nascidos não só à realização dos exames preconizados e à confirmação diagnóstica, mas também ao acompanhamento e tratamento das doenças detectadas. Devem ser estruturados os fluxos de referência e contra-referência, os Postos de Coleta adequados e os respectivos Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de acordo com a Fase de Implantação do Programa, em conformidade com o estabelecido no Anexo III desta Portaria.
3 - Todo recém-nascido suspeito de ser portador de uma das patologias triadas deverá ser reconvocado para a realização dos exames complementares confirmatórios, de acordo com o estabelecido no Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal a ser elaborado e publicado pela Secretaria de Assistência à Saúde/SAS/MS;
4 - Todo recém-nascido vivo identificado/confirmado como portador de uma das patologias triadas tem direito ao acompanhamento, orientação e tratamento adequado, conforme descrito no Manual de Normas Técnicas e Rotinas Operacionais do Programa Nacional de Triagem Neonatal e nos respectivos Protocolos Clínicos e Diretrizes Terapêuticas a serem elaborados e publicados pela Secretaria de Assistência à Saúde;
5 - As autoridades sanitárias nos níveis federal, estadual e municipal, de acordo as respectivas competências e atribuições estabelecidas no Artigo 5º desta Portaria, serão responsáveis pela adoção das medidas pertinentes e adequadas à garantia dos direitos enunciados nas alíneas acima.
B – CRITÉRIOS/EXIGÊNCIAS PARA HABILITAÇÃO
Os estados e o Distrito Federal deverão cumprir, de acordo com a Fase de Implantação, os seguintes critérios/exigências de habilitação:
1 – FASE I – Triagem, confirmação diagnóstica, acompanhamento e tratamento da fenilcetonúria e hipotireoidismo congênito:
Para se habilitar na Fase I de Implantação do Programa Nacional de Triagem Neonatal, os estados e o Distrito Federal deverão enviar à Secretaria de Assistência à Saúde uma solicitação de habilitação na Fase I que deverá ser instruída com:
1.1 - Rede Estadual de Coleta – informar nominalmente e por município a relação dos Postos de Coleta (pelo menos 1 por município em que sejam realizados partos) que foram organizados/cadastrados no estado, em conformidade com as Normas de Funcionamento e Cadastramento estabelecidas no Anexo III desta Portaria.
1.2 - Serviço(s) Tipo I de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas – identificar/organizar e enviar a SAS a documentação necessária para cadastramento do(s) Serviço(s) de Referência (pelo menos 1 por estado), de acordo com as Normas de Funcionamento e Cadastramento de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo I, estabelecidas no Anexo III desta Portaria;
1.3 - Nome do Coordenador Estadual do Programa Nacional de Triagem Neonatal;
1.4 - Compromisso formal, firmado pelo Secretário da Saúde, de que o estado buscará a cobertura de 100% de seus nascidos-vivos no que diz respeito à triagem neonatal da fenilcetonúria e hipotireoidismo congênito bem como a garantia da confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados com estas doenças congênitas.
Obs.: Aqueles estados/Distrito Federal que já estejam realizando os exames de triagem neonatal para Fenilcetonúria e Hipotireoidismo Congênito previstos nas Fase I, deverão adotar as providências necessárias para consolidar seu processo de triagem neonatal, organizando a rede de coleta e definindo o(s) Serviço(s) de Referência, garantido, desta forma, além da realização dos exames preconizados, o adequado acompanhamento e tratamento dos pacientes triados e identificados como portadores destas doenças, devendo cumprir os mesmos passos de habilitação descritos acima.
2 - Fase II - Triagem, confirmação diagnóstica, acompanhamento e tratamento da fenilcetonúria, hipotireoidismo congênito + doenças falciformes e outras hemoglobinopatias:
Para se habilitar na Fase II de Implantação do Programa Nacional de Triagem Neonatal, os estados e o Distrito Federal deverão enviar à Secretaria de Assistência à Saúde uma solicitação de habilitação na Fase II que deverá ser instruída com:
2.1 - Habilitação na Fase I – informar a habilitação
2.2 - Rede Estadual de Coleta – informar nominalmente e por município a relação dos Postos de Coleta (pelo menos 1 por município em que sejam realizados partos) que foram organizados/cadastrados no estado, em conformidade com as Normas de Funcionamento e Cadastramento estabelecidas no Anexo III desta Portaria – mesma Rede informada na habilitação na Fase I;
2.3 - Serviço(s) Tipo II de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas– identificar/organizar e enviar à SAS a documentação necessária para cadastramento do(s) Serviço(s) de Referência (pelo menos 1 por estado), de acordo com as Normas de Funcionamento e Cadastramento de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo II, estabelecidas no Anexo III desta Portaria;
2.4 - Nome do Coordenador Estadual do Programa Nacional de Triagem Neonatal – o mesmo da Fase I;
2.5 - Compromisso formal, firmado pelo Secretário da Saúde, de que o estado buscará a cobertura de 100% de seus nascidos-vivos no que diz respeito à triagem neonatal da fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias bem como a garantia da confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados com estas doenças congênitas.
Obs.: Aqueles estados/Distrito Federal que já cumpram integralmente os critérios/exigências estabelecidos nas Fases I e II poderão solicitar, diretamente, habilitação na Fase II.
3 - Fase III - Triagem, confirmação diagnóstica, acompanhamento e tratamento da fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias + fibrose cística:
Para se habilitar na Fase III de Implantação do Programa Nacional de Triagem Neonatal, os estados e o Distrito Federal deverão enviar à Secretaria de Assistência à Saúde uma solicitação de habilitação na Fase III que deverá ser instruída com:
3.1 - Habilitação na Fase II – informar a habilitação;
3.2 - Comprovação de que o estado já tenha garantido uma cobertura igual ou superior a 70% dos nascidos vivos nas doenças definidas nas Fases I e II;
3.3 – Informações a respeito das características populacionais e incidência fibrose cística no estado que indiquem a necessidade e que apresentem adequada relação custo-benefício para a realização deste tipo de triagem;
3.4 - Rede Estadual de Coleta – informar nominalmente e por município a relação dos Postos de Coleta (pelo menos 1 por município em que sejam realizados partos) que foram organizados/cadastrados no estado, em conformidade com as Normas de Funcionamento e Cadastramento estabelecidas no Anexo III desta Portaria – a mesma Rede informada na habilitação das Fases I e II;
3.5 - Serviço(s) Tipo III de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas – identificar/organizar e enviar à SAS a documentação necessária para cadastramento do(s) Serviço(s) de Referência (pelo menos 1 por estado), de acordo com as Normas de Funcionamento e Cadastramento de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo III, estabelecidas no Anexo III desta Portaria;
3.6 - Nome do Coordenador Estadual do Programa Nacional de Triagem Neonatal – o mesmo das Fases I e II;
3.7 - Compromisso formal, firmado pelo Secretário da Saúde, de que o estado buscará a cobertura de 100% de seus nascidos-vivos no que diz respeito à triagem neonatal da fenilcetonúria, hipotireoidismo congênito, doenças falciforme, outras hemoglobinopatias e fibrose cística bem como a garantia da confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados com estas doenças congênitas.
Obs.: Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverão ser, preferencialmente, os mesmos serviços em todas as fases. Assim o de Tipo I (na Fase I) deve ser adequadamente adaptado e incrementada sua capacidade operacional para transformá-lo em Tipo II quando o estado pretender a habilitação na Fase II. Da mesma forma, o de Tipo II deverá ser adequado para o Tipo III quando o estado pretender a habilitação na Fase III de Implantação do Programa.
ANEXO XXIV
NORMAS PARA FUNCIONAMENTO E CADASTRAMENTO DE POSTOS DE COLETA E DE SERVIÇOS DE REFERÊNCIA EM TRIAGEM NEONATAL/ACOMPANHAMENTO E TRATAMENTO DE DOENÇAS CONGÊNITAS(Origem:PRT MS/GM 822/2001,Anexo3)
ANEXO III
NORMAS PARA FUNCIONAMENTO E CADASTRAMENTO DE POSTOS DE COLETA E DE SERVIÇOS DE REFERÊNCIA EM TRIAGEM NEONATAL/ACOMPANHAMENTO E TRATAMENTO DE DOENÇAS CONGÊNITAS
A - POSTOS DE COLETA
Os municípios devem organizar/estruturar/implantar e cadastrar tantos Postos de Coleta quantos forem necessários para a cobertura/acesso de sua população à realização da coleta de material para a realização dos exames relativos à Triagem Neonatal. É obrigatória a instalação de pelo menos um (01) Posto de Coleta por Município (naqueles em que são realizados partos).
1 - Processo de Cadastramento
1.1 - Município em Gestão Plena do Sistema Municipal:
A Secretaria Municipal de Saúde deverá criar as condições para a organização / estruturação / implantação / cadastramento do(s) Posto(s) de Coleta de seu município e adotar as providências necessárias para integrá-lo(s) à Rede Estadual de Coleta e referenciá-lo(s) ao Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas ao qual estiver vinculado (providência a ser adotada junto à Secretaria Estadual de Saúde).
Uma vez definido(s) o(s) Posto(s) de Coleta e se cumpridas as exigências abaixo mencionadas, a Secretaria Municipal de Saúde deverá adotar as providências necessárias ao seu cadastramento junto ao Departamento de Informática do SUS/DATASUS. Feito o cadastramento, a SMS deverá informar à Secretaria Estadual de Saúde, em documento próprio, a relação de seu(s) Posto(s) na qual constem: nome do município, nome do(s) estabelecimento(s) cadastrados e nome da pessoa responsável pela atividade.
1.2 - Município que não esteja em Gestão Plena do Sistema Municipal
A Secretaria Municipal de Saúde deverá criar as condições para a organização/estruturação/ implantação do(s) Posto(s) de Coleta de seu município e adotar as providências necessárias para integrá-lo(s) à Rede Estadual de Coleta e referenciá-lo(s) ao Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas ao qual estiver vinculado (providência a ser adotada junto à Secretaria Estadual de Saúde).
Uma vez definido(s) o(s) Posto(s) de Coleta e se cumpridas as exigências abaixo mencionadas, a Secretaria Municipal de Saúde deverá formalizar junto à Secretaria Estadual de Saúde o pedido de cadastramento de seu(s) Posto(s), que após a devida análise, adotará as providências necessárias ao seu cadastramento junto ao DATASUS.
1.3 – Secretaria Estadual de Saúde
A Secretaria Estadual de Saúde é a responsável pela organização de Rede Estadual de Coleta e sua vinculação ao(s) Serviço(s) de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas. Para isso, deverá cadastrar o(s) Postos(s) de Coleta dos municípios que não estejam em Gestão Plena do Sistema Municipal e consolidar a relação total de Postos de Coleta cadastrados (de todos os municípios em que sejam realizados partos, em gestão plena ou não) organizando-os por município e identificando, para cada um deles, a referência para o seu respectivo Serviço de Referência em Triagem Neonatal. Esta relação consolidada deverá ser enviada para a Secretaria de Assistência à Saúde por ocasião da solicitação de habilitação do estado em uma das Fases de Implantação do Programa, conforme estabelecido no Anexo II desta Portaria. A Secretaria Estadual de Saúde deverá informar às Secretarias Municipais de Saúde e a seus respectivos Postos de Coleta o nome do Serviço de Referência em Triagem Neonatal ao qual deverão ser enviadas as amostras coletadas.
2 - Exigência para Cadastramento de Postos de Coleta
2.1 - Características Gerais
A escolha do local para instalação do Posto de Coleta, a critério da Secretaria Estadual/Municipal de Saúde, poderá recair sobre uma unidade de saúde já existente, um local específico para o desenvolvimento desta atividade ou ainda sobre o(s) hospital(is)/maternidade(s) em que tenha ocorrido o parto. Nesta última hipótese, deverá ficar bastante claro que a coleta do material será realizada somente após o 2º dia de vida recém-nascido (freqüentemente na alta hospitalar). Nas situações onde a coleta não é realizada nas maternidades, as mesmas deverão dispor de um formulário contendo orientação de local e data para a coleta (modelo existente no Manual de Normas Técnicas e Rotinas Operacionais do PNTN, a ser publicado pela SAS/MS). Neste caso, a unidade coletora deverá, também, assumir, formalmente, o compromisso de que a coleta ocorrerá nos primeiros 30 (trinta) dias de vida do bebê, preferencialmente na 1ª semana.
O material coletado, dentro das normas estabelecidas no Manual de Normas Técnicas e Rotinas Operacionais do PNTN, será enviado ao Laboratório do Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas indicado pelo gestor do SUS, num prazo nunca superior a 05 (cinco) dias úteis.
2.2 - Instalações Físicas
Os Postos de Coleta deverão dispor, no mínimo, do seguinte:
- Recepção e sala de espera para acompanhantes e entrega de resultados;
- Sala de coleta;
- Área adequada para guarda de material e armazenamento de amostras (conforme descrito no Manual do PNTN) e arquivamento de resultados
2.3 - Recursos Humanos
Os Postos de Coleta deverão dispor, no mínimo, dos seguintes recursos humanos:
- Recepcionista ou auxiliar administrativo;
- Profissional da área de saúde com, no mínimo, formação de nível médio comprovada.
2.4 - Materiais e Equipamentos
Os Postos de Coleta deverão dispor, no mínimo, do seguinte:
- Papel filtro, lancetas e formulários (comprovantes de coleta), fornecidas pelo Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas (que foi identificado e informado pela Secretaria Estadual de Saúde);
- Algodão e álcool para assepsia (não pode ser usado álcool iodado);
- Luvas descartáveis;
- Material para curativo;
- Bancada de trabalho;
- Cadeiras;
- Armário;
- Arquivo;
- Geladeira
2.5 - Rotinas de Funcionamento e Atendimento
Os Postos deverão possuir manual técnico em que todos os procedimentos estejam descritos pormenorizadamente, contemplando o estabelecido no Manual de Normas Técnicas e Rotinas Operacionais do PNTN, com no mínimo, os seguintes itens:
- Horário de funcionamento;
- Fluxo de atendimento do paciente;
- Registro da(s) data(s) de treinamento(s) de todos os seus funcionários técnicos e administrativos;
- Fluxo de recebimento de material e envio de amostras ao laboratório do Serviço de Referência, especificando claramente os procedimentos utilizados para evitar a troca de amostras;
- Descrição de cada uma das atividades;
Técnica de Coleta utilizada, indicando claramente o modo de coleta para cada exame, especificando as normas de biossegurança utilizadas tanto para o paciente como para o coletor;
- Registro do intervalo médio de tempo entre a coleta e envio de amostras ao laboratório;
- Registro da realização da coleta e arquivamento do comprovante assinado pelo responsável pelo RN;
- Registro da entrega de resultados e arquivamento do comprovante ao responsável pelo RN;
- Registro do intervalo médio de tempo entre a coleta e entrega/retirada dos resultados às famílias;
- Fluxo de busca ativa de reconvocados;
- Registro das ações de busca ativa dos casos reconvocados, assim como do intervalo de tempo entre a data da reconvocação e comparecimento para nova coleta;
- Registro das rotinas de armazenamento, manipulação e dejeto de materiais orgânicos, que devem seguir às normas vigentes.
B - SERVIÇOS DE REFERÊNCIA EM TRIAGEM NEONATAL / ACOMPANHAMENTO E TRATAMENTO DE DOENÇAS CONGÊNITAS
As Secretarias de Saúde dos Estados e do Distrito Federal devem cadastrar (pelo menos um) Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas para a cobertura e acesso de sua população à realização da triagem neonatal, confirmação diagnóstica, acompanhamento e tratamento dos pacientes triados.
1 – Cadastramento
1.1 - Planejamento/Distribuição de Serviços
As Secretarias de Saúde dos estados e do Distrito Federal deverão, em conformidade com o quantitativo de nascidos vivos do estado e respeitados os critérios técnicos, as garantias de adequado fluxo operacional do Serviço e adequada relação custo-benefício, estabelecer um planejamento de distribuição regional dos Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de maneira a facilitar o acesso dos usuários e a cobertura assistencial.
1.2 - Processo de Cadastramento
1.2.1 - A abertura de qualquer Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverá ser precedida de consulta ao Gestor do SUS – Secretaria de Saúde do estado, do Distrito Federal ou do município em Gestão Plena do Sistema Municipal, sobre as normas vigentes, a necessidade de sua criação, o planejamento/distribuição regional e a possibilidade de cadastramento, sem a qual o SUS não se obriga ao cadastramento. Cabe à Secretaria Estadual de Saúde, conforme já enunciado, o planejamento da rede e a definição do quantitativo de Serviços necessários de acordo com os critérios estabelecidos por esta Portaria;
1.2.2 – Uma vez confirmada a necessidade do cadastramento e conduzido o processo de seleção de prestadores de serviços pelo Gestor do SUS, o processo de cadastramento deverá ser formalizado pela Secretaria de Saúde do estado, do Distrito Federal ou do município em Gestão Plena do Sistema Municipal, de acordo com as respectivas condições de gestão e a divisão de responsabilidades estabelecida na Norma Operacional de Assistência à Saúde – NOAS/SUS 01/2001;
1.2.3 - O Processo de Cadastramento deverá ser instruído com:
a - Documentação comprobatória do cumprimento das exigências estabelecidas por esta Portaria;
b - Relatório de Vistoria – a vistoria deverá ser realizada “in loco” pela Secretaria de Saúde responsável pela formalização do Processo de Cadastramento que avaliará as condições de funcionamento do Serviço para fins de cadastramento: área física, recursos humanos, responsabilidade técnica e demais exigências estabelecidas nesta Portaria;
c - Parecer Conclusivo do Gestor – manifestação expressa, firmada pelo Secretário da Saúde, em relação ao cadastramento. No caso de Processo formalizado por Secretaria Municipal de município em Gestão Plena do Sistema Municipal de Saúde, deverá constar, além do parecer do gestor local, o parecer do gestor estadual do SUS, que será responsável pela integração do novo Serviço à rede de referência estadual e a definição da relação do Serviço cadastrado com a rede de coleta.
1.2.4 - Uma vez emitido o parecer a respeito do cadastramento, pelo(s) Gestor(es) do SUS, e se o mesmo for favorável, o Processo deverá ser encaminhado ao Ministério da Saúde / SAS, para análise;
1.2.5 - O Ministério da Saúde / SAS avaliará o Processo de Cadastramento e determinará a realização de vistoria “in loco” do Serviço pelo Grupo Técnico de Assessoramento em Triagem Neonatal. Uma vez aprovado o cadastramento, a Secretaria de Assistência à Saúde tomará as providências necessárias à sua publicação.
2 - Exigências para Cadastramento de Serviços de Referência em Triagem Neonatal / Acompanhamento e Tratamento de Doenças Congênitas
2.1 - Exigências Gerais
2.1.1 – Características Gerais
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas são destinados à operacionalização, execução e controle do Programa Nacional de Triagem Neonatal, na sua área de abrangência. Estes serviços são responsáveis pelo cumprimento de todo o processo referente à triagem neonatal, desde a coleta, realização dos exames, busca ativa, confirmação diagnóstica, acompanhamento e tratamento dos casos positivos detectados, conforme definido no PNTN e portanto devem englobar:
- Rede de Coleta – composta pelos Postos de Coleta dos municípios/estado. A rede deve ser organizada pela Secretaria Estadual de Saúde, que vinculará, conforme estabelecido nesta Portaria, os Postos ao respectivo Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas. O Serviço de Referência e seu laboratório deverão ter, formalmente estabelecida, a relação nominal (por município) dos Postos de Coleta a eles vinculados e ter rotinas estabelecidas de envio de material para coleta para estes Postos (lancetas, papel filtro), recepção das amostras e reconvocação de pacientes.
- Laboratório Especializado em Triagem Neonatal – Laboratório/Biologia Molecular (conforme estabelecido no Subitem 2.2.1 e 2.2.2 deste Anexo);
- Ambulatório Multidisciplinar Especializado (conforme estabelecido no Subitem 2.2.3 deste Anexo);
- Sistema de Registro de Informações Automatizado (conforme estabelecido no Subitem 2.2.4 deste Anexo)
- Rede Assistencial Complementar (conforme estabelecido no subitem 2.2.5 deste Anexo);
Os Serviços de Referência deverão ser organizados a fim de atender a totalidade dos recém-nascidos vivos de sua respectiva área de abrangência.
2.1.2 – Tipos de Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas
Os Serviços de Referência em Triagem Neonatal serão classificados de acordo com sua capacidade operacional no que diz respeito ao acompanhamento e tratamento das doenças congênitas estabelecidas nas Fases de Implantação do Programa e com os exames que são capazes de realizar - capacidade técnica do laboratório especializado – próprio ou terceirizado, em:
- Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo I - Unidade que disponha de equipe multiprofissional especializada nos atendimentos ao recém-nascido triado para fenilcetonúria e hipotireoidismo congênito. A realização dos exames de triagem e confirmação diagnóstica deverão ser realizados em laboratório especializado, próprio ou terceirizado, apto à realização destes exames e em conformidade com estabelecido neste Anexo.
- Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo II - Unidade que disponha de equipe multiprofissional especializada nos atendimentos ao recém-nascido triado para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias. A realização dos exames de triagem e confirmação diagnóstica deverão ser realizados em laboratório especializado, próprio ou terceirizado, apto à realização destes exames e em conformidade com estabelecido neste Anexo. Deve-se atentar para o fato que o laboratório deve ser apto a realizar exames confirmatórios para as doenças falciformes e outras hemoglobinopatias, por biologia molecular.
- Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas Tipo III - Unidade que disponha de equipe multiprofissional especializada nos atendimentos ao recém-nascido triado para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias e fibrose cística. A realização dos exames de triagem e confirmação diagnóstica deverão ser realizados em laboratório especializado, próprio ou terceirizado, apto à realização destes exames e em conformidade com estabelecido neste Anexo. Deve-se atentar para o fato que o laboratório deve ser apto a realizar exames confirmatórios para as doenças falciformes, outras hemoglobinopatias e fibrose cística, por biologia molecular.
Obs.: Somente poderão cadastrar Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de tipo I, II ou III aqueles estados que estiverem habilitados, respectivamente, nas Fases I, II ou III de Implantação do Programa.
2.1.3 - Manutenção do Cadastro e Descadastramento
Para manutenção do cadastramento, os Serviços de Referência deverão, além de cumprir as normas estabelecidas pela presente Portaria, enviar à Secretaria de Assistência à Saúde/MS, até o dia 15 do mês subseqüente a cada mês de competência, os relatórios de acompanhamento do Programa, especificados no Manual de Normas Técnicas e Rotinas Operacionais do PNTN . Se o Serviço não enviar, no prazo estipulado e por 03 (três) meses consecutivos, estes relatórios, a Secretaria de Assistência à Saúde descadastrará o Serviço faltoso.
O descadastramento também poderá ocorrer se, após avaliação de funcionamento do Serviço por meio de auditorias periódicas (MS/SMS/SES) o Serviço de Referência deixar de cumprir qualquer um dos critérios estabelecidos nesta Portaria.
2.2 – Exigências Específicas
Além das exigência gerais, o Serviço de Referência deverá cumprir com as seguintes exigências específicas:
2.2.1 - Laboratório Especializado em Triagem Neonatal
O Serviço de Referência deverá dispor, próprio ou terceirizado, de um Laboratório Especializado em Triagem Neonatal.
No caso de laboratório terceirizado, o Serviço de Referência deverá apresentar cópia de contrato/convênio celebrado com o laboratório em que fiquem claramente estabelecidas as garantias de realização de todos os exames preconizados na Fase de Implantação em que o estado esteja habilitado e o fiel cumprimento de todas as normas e critérios estabelecidos pela presente Portaria.
Serviço de Referência Tipo I - o laboratório deverá cumprir as exigências de funcionamento e cadastramento estabelecidas nesta Portaria, inserir-se no Programa Nacional de Triagem Neonatal cumprindo suas atribuições/obrigações e ser capaz de realizar exames de triagem e confirmação diagnóstica para fenilcetonúria e hipotireoidismo congênito.
Serviço de Referência Tipo II - o laboratório deverá cumprir as exigências de funcionamento e cadastramento estabelecidas nesta Portaria, inserir-se no Programa Nacional de Triagem Neonatal cumprindo suas atribuições/obrigações e ser capaz de realizar exames de triagem e confirmação diagnóstica para fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias. Deverá ser apto a realizar, por biologia molecular, os exames confirmatórios das doenças falciformes e outras hemoglobinopatias.
Serviço de Referência Tipo III - o laboratório deverá cumprir as exigências de funcionamento e cadastramento estabelecidas nesta Portaria, inserir-se no Programa Nacional de Triagem Neonatal cumprindo suas atribuições/obrigações e ser capaz de realizar exames de triagem e confirmação diagnóstica para fenilcetonúria, hipotireoidismo congênito, doenças falciformes, outras hemoglobinopatias e fibrose cística. Deverá ser apto a realizar, por biologia molecular, os exames confirmatórios das doenças falciformes, outras hemoglobinopatias e fibrose cística.
Obs.:
1 – Se o Serviço de Referência não dispuser de Laboratório próprio, poderá contratar/conveniar a realização dos exames necessários de um laboratório terceirizado. A escolha deste laboratório, dentro ou fora do estado, deverá recair sobre aquele laboratório que se enquadre e cumpra com as exigências estabelecidas nesta Portaria.
2 - Na hipótese de laboratório próprio do Serviço de Referência ou de laboratório terceirizado não serem capazes de realizar exames por biologia molecular, poderá ser contratado/conveniado outro laboratório para realizar estes exames.
Em qualquer hipótese, o laboratório deverá apresentar Licença de Funcionamento emitida pela Coordenadoria de Fiscalização Sanitária da Secretaria de Saúde do estado ou DF, que poderá ser revogada, a qualquer momento, em caso de descumprimento das normas estabelecidas por esta Portaria. Igualmente, o Laboratório deverá ter/apresentar certificação de Controle de Qualidade Internacional em Triagem Neonatal, devidamente atualizado.
2.2.1.1 – Características do Laboratório Especializado
O laboratório especializado em Triagem Neonatal tem características próprias que o distinguem de um laboratório de Análises Clínicas tradicional:
GERAIS:
- nele se analisam grandes quantidades de amostras para um mesmo parâmetro, enquanto num laboratório de análises clínicas, se analisam menor quantidade de amostras para uma variedade de parâmetros;
- além disso, tendo em vista a característica populacional da triagem e as variações normalmente encontradas em ensaios consecutivos realizados em dias diferentes, é importante que a rotina do laboratório de triagem, manuseie um número mínimo diário de amostras em cada técnica utilizada, para haver coerência e uniformidade dos resultados individuais e populacionais;
- laboratórios de triagem neonatal utilizam amostras de sangue obtidas por meio de punção no calcanhar, impregnadas em papel filtro padronizado, especialmente desenvolvidos para este fim. Estas amostras são de fácil transporte através do correio, de fácil armazenagem e podem ser analisadas por uma grande variedade de técnicas.
ESPECÍFICAS:
- deve possuir manual técnico em que todos os procedimentos estejam descritos pormenorizadamente;
- todos os procedimentos devem ser objeto de Controle periódico de Qualidade Interno;
- realizar análise laboratorial para todos os ensaios ao menos 05 (cinco) vezes por semana, visando o devido domínio técnico;
- ter equipe técnica treinada com capacitação específica para análise de amostras em sangue seco;
- utilizar técnicas adequadas e de recomendação internacional em Triagem Neonatal;
- ser responsável pela distribuição de lancetas e papel filtro padronizado (PNTN), de maneira a não haver solução de continuidade na rede de coleta. Se for próprio do Serviço de Referência, o laboratório enviará o material citado diretamente aos Postos de Coleta.
No caso de laboratório terceirizado, deverá fornecer o material ao Serviço de Referência contratante, que se responsabilizará pela distribuição aos Postos.
2.2.1.2 - Instalações Físicas
A área física do laboratório deverá se enquadrar nos critérios e normas estabelecidos pela legislação em vigor ou outros ditames legais que venham a substituí-los ou complementar, a saber:
- Portaria GM/MS nº 1884, de 11 de novembro de 1994 – Normas para Projetos Físicos de Estabelecimentos Assistenciais de Saúde;
- Resolução nº 05, de 05 de agosto de 1993, do CONAMA – Conselho Nacional de Meio Ambiente.
A área física deve ser adequada, permitindo que os exames sejam desenvolvidos com organização e segurança e ser convenientemente, iluminada e ventilada.
A temperatura ambiente deve ser adequada para a realização dos testes que exigem uma temperatura específica. Deve ainda ser permanentemente monitorada para assegurar que está dentro da faixa aceitável.
A energia elétrica deve ser adequada e suficiente para os equipamentos em uso.
Para o preparo de reagentes é necessário a utilização de água purificada por método de reconhecida eficiência.
O laboratório deve estar de acordo com os códigos de biossegurança, incluindo provisões para o manuseio seguro de amostras de sangue, reagentes e despejo correto do lixo.
Área de Apoio – esta área deverá ser composta por, no mínimo, as seguintes instalações:
- Sala de espera e recepção para recebimento e entrega de resultados;
- Área de apoio administrativo;
- Área de seleção e encaminhamento de amostras;
- Área refrigerada adequada para guarda de material e armazenamento de amostras.
Área técnica isolada da área de apoio
- Sala para o desenvolvimento de atividades laboratoriais, compatível com o número de exames em rotina.
2.2.1.3 - Recursos Humanos
A equipe enumerada a seguir se constitui na equipe mínima capaz para realização de testes em 100.000 amostras/ano. Esta equipe deve ser modificada para ser compatível com o número de exames realizados pelo laboratório.
- 01 (um) responsável técnico: médico/biomédico/bioquímico, devidamente habilitado, com experiência mínima de dois anos em triagem neonatal, declarada e comprovada por ele. É o responsável, em última instância, pelos resultados de todos os exames realizados em seu laboratório;
- 02 (dois) técnicos de nível superior: biomédico/bioquímico/biólogo, com treinamento específico e orientação na área de triagem, tanto em relação à execução das técnicas laboratoriais, como em relação à interpretação dos resultados, controles de qualidade e finalidades dos diferentes exames;
- 01 (um) supervisor técnico, quando houver três ou mais técnicos de nível superior, que será responsável pela supervisão direta dos demais técnicos e que, juntamente com o responsável técnico, participará das demais tarefas de organização do laboratório;
- 02 (dois) técnicos de nível médio com habilitação comprovada, com treinamento específico na área de triagem neonatal;
- 02 (dois) profissionais de nível médio para área administrativa, devendo um deles estar capacitado a realizar as funções descritas em Recursos Humanos do Sistema de Registro e Informações Automatizado;
- 01 (um) profissional de apoio em serviços gerais, com primeiro grau completo, treinado.
2.2.1.4 - Materiais e Equipamentos
Os materiais e equipamentos técnicos deverão ser selecionados de acordo com as metodologias escolhidas entre as reconhecidas e disponíveis no mercado nacional/internacional e referendadas nos programas de Controle de Qualidade Internacionais para Triagem Neonatal. Os fornecedores escolhidos deverão se responsabilizar, por meio de contratos, por manter estoques de segurança correspondentes, no mínimo, a 01 (um) mês de atividade, para suprir eventuais problemas com importação.
Os equipamentos técnicos deverão ser automatizados ou semi-automatizados.
O laboratório deve possuir:
- todos os equipamentos necessários em perfeito estado de conservação para assegurar a qualidade dos exames que realiza;
- programa de controle de qualidade de desempenho dos equipamentos, assim como de manutenção dos mesmos.
- todos os kits e reagentes necessários para as metodologias em uso, devendo ser armazenados em quantidade suficiente para a sua rotina e utilizados de acordo com as instruções do fabricante.
As informações sobre todos os reagentes e Kits utilizados devem ser convenientemente protocoladas. Estas informações compreendem:
- produtos adquiridos comercialmente: o nome do fabricante, do lote, data de validade, data de aquisição, condições de armazenamento e outras informações consideradas pertinentes para o produto em questão;
- reagentes preparados no laboratório: data do preparo, nome do técnico que preparou, condições de armazenamento e outras informações consideradas pertinentes para o reagente em questão.
2.2.1.5 - Laudos
Os laudos dos exames devem ser claros e conter informações sobre o método empregado para cada exame, com a assinatura ou chancela eletrônica do Responsável Técnico e acompanhado de observações, quando necessário, que os tornem mais compreensíveis.
Os resultados das dosagens de Fenilalanina e T4neo/TSHneo devem ser quantitativos.
Se HPLC for a metodologia escolhida para triagem de doenças falciformes e hemoglobinopatias, os casos alterados nesta metodologia, deverão ser confirmados por Focalização Isoelétrica e ser igualmente reportados.
2.2.1.6 - Rotinas de Funcionamento e Atendimento
O laboratório deve possuir Rotinas de Funcionamento escritas, atualizadas a cada 04 (quatro) anos e assinadas pelo Responsável técnico pelo Laboratório de Referência em Triagem Neonatal, contemplando, no mínimo, os seguintes itens:
- Horário de funcionamento;
- Identificação do responsável técnico (ou substituto) presente durante todo o intervalo de funcionamento do laboratório;
- Registro da(s) data(s) de treinamento(s) de todos os seus funcionários;
- Fluxo de atividades no laboratório: do recebimento da amostra até o envio de resultados;
-Descrição de cada uma das atividades;
- Registro do intervalo médio de tempo entre o recebimento da amostra e liberação de resultados.
2.2.1.7 - Relatórios de Acompanhamento
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverão enviar à Secretaria de Assistência à Saúde, até o dia 15 do mês subseqüente a cada mês de referência, relatório de acompanhamento do laboratório (próprio ou terceirizado), contendo no mínimo:
- Número de amostras analisadas para cada uma das patologias triadas;
- Número de casos suspeitos detectados para cada uma das patologias triadas;
- Número de casos positivos confirmados para cada uma das patologias triadas;
- Dados de identificação e resultados dos casos positivos detectados, para inclusão no Banco de Dados - PNTN/MS.
2.2.2 – Laboratório – Biologia Molecular
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de Tipo II e III deverão contar com Laboratório apto a realizar os testes de detecção de mutações de doenças falciformes, outras hemoglobinopatias e fibrose cística. Este Laboratório poderá ser próprio do Serviço de Referência, do Laboratório Especializado em Triagem Neonatal terceirizado ou ainda um outro laboratório contratado/conveniado especificamente para realizar os testes de biologia molecular. Em qualquer destas hipóteses, o laboratório de biologia molecular deverá cumprir todas as especificações já descritas para Laboratório Especializado em Triagem Neonatal e as seguintes especificações adicionais:
- Responsável Técnico:
O responsável técnico pelo laboratório de biologia molecular deverá estar devidamente habilitado nesta área.
- Área Física:
Para os procedimentos de biologia molecular, deve haver três áreas bem definidas, aqui designadas como áreas 1, 2 e 3, distribuídas em pelo menos duas salas. As áreas 1 e 2 podem ser combinadas em uma única sala. Cada área deve ter seu equipamento adequado e exclusivo. A utilização de luvas é sempre necessária.
Fluxo reagentes/amostras deve ser: área 1 » área 2 » área 3.
Área 1: é destinada aos procedimentos que envolvam preparo de reagentes ("pré-mix"). Nesta área deve haver os materiais e equipamentos necessários para a atividade. Recomenda-se que nesta área haja fluxo laminar com luz ultra-violeta e que as soluções sejam mantidas em congelador próprio. Recomenda-se restrição ao tráfego de pessoas e utilização de aventais exclusivos.
Área 2: é destinada à extração de DNA e adição do DNA à reação de PCR. Deve ser mantida limpa, com o uso de reagentes químicos (p.ex., HCl 1N) e/ou de luz ultravioleta (UV). Nesta área também deve haver os materiais e equipamentos necessários para a atividade. Recomenda-se restrição ao tráfego de pessoas e utilização de aventais exclusivos.
Área 3: é destinada aos procedimentos de amplificação e pós-amplificação. É a única sala em que se deve manipular o produto amplificado. Procedimentos químicos (p.ex., HCl 1N) e/ou utilização de luz ultra-violeta (UV), podem ser utilizados para inativar produtos amplificados. O termociclador pode ser mantido nesta área, ou numa outra área diferente das áreas 1 e 2.
- Reagentes:
O laboratório de biologia molecular deve possuir todos os reagentes necessários para as metodologias em uso, devendo ser armazenados e utilizados de acordo com as instruções do fabricante.
As informações sobre todos os reagentes utilizados devem ser convenientemente protocoladas. Estas informações compreendem: em caso de produtos adquiridos comercialmente, o nome do fabricante, do lote, a data de validade, a data de aquisição, condições de armazenamento e outras informações consideradas pertinentes para o produto em questão; em caso de reagentes preparados no laboratório: data do preparo, nome do técnico que preparou o reagente, condições de armazenamento e outras informações consideradas pertinentes para o reagente em questão.
- Amostras:
No caso do material ser colhido no Serviço de Referência, a amostra deve ser encaminhada ao laboratório de biologia molecular com a indicação do anti-coagulante utilizado (se for o caso), do nome da pessoa responsável pela coleta e identificação da amostra, assim como data e hora da coleta.
2.2.3 - Ambulatório Multidisciplinar Especializado:
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas deverão contar, em suas próprias instalações, com Ambulatório Multidisciplinar Especializado.
Serviço de Referência Tipo I – Ambulatório Multidisciplinar Especializado capaz de realizar a orientação familiar, o acompanhamento e tratamento dos pacientes triados em fenilcetonúria e hipotireoidismo congênito. Deverá contar, adicionalmente, com uma rede de serviços complementares.
Serviço de Referência Tipo II – Ambulatório Multidisciplinar Especializado capaz de realizar a orientação familiar, o acompanhamento e tratamento dos pacientes triados em fenilcetonúria, hipotireoidismo congênito, doenças falciformes e outras hemoglobinopatias. Deverá contar, adicionalmente, com uma rede de serviços complementares. No caso das doenças falciformes e outras hemoglobinopatias poderá manter um acordo operacional com outros serviços (como Hemocentros, por exemplo) para o acompanhamento/tratamento destas doenças.
Serviço de Referência Tipo III– Ambulatório Multidisciplinar Especializado capaz de realizar a orientação familiar, o acompanhamento e tratamento dos pacientes triados em fenilcetonúria, hipotireodismo congênito, doenças falciformes, outras hemoglobinopatias e fibrose cística. Deverá contar, adicionalmente, com uma rede de serviços complementares. No caso das doenças falciformes e outras hemoglobinopataias poderá manter um acordo operacional com outros serviços (como Hemocentros, por exemplo) para o acompanhamento/tratamento destas doenças. Esta mesma situação é válida para a fibrose cística.
Após confirmação diagnóstica, conforme descrito nos protocolos e diretrizes terapêuticas para tratamento das doenças, todos os pacientes triados no PNTN deverão ser prontamente atendidos por equipe multidisciplinar do Serviço de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas.
2.2.3.1 – Instalações Físicas:
O Ambulatório Multidisciplinar deve contar, no mínimo, com o seguinte:
- Sala de espera e recepção;
- Sala de consultas;
- Sala de reuniões para integração da equipe multidisciplinar com a equipe do laboratório.
2.2.3.2 - Recursos Humanos
Deverá ser composto por uma equipe multidisciplinar mínima que contenha:
- 01 (um) médico pediatra;
- 01 (um) médico endocrinologista ou endocrinologista pediátrico;
- 01 (um) nutricionista;
- 01 (um) psicólogo;
- 01 (um) assistente social.
Observação: Um dos profissionais da equipe, preferencialmente um profissional médico, deverá ter recebido uma capacitação técnica em “Aconselhamento Genético específico para Triagem Neonatal” em um serviço reconhecido de Genética Médica.
2.2.3.3 – Materiais e Equipamentos
- Balcão para recepção;
- Cadeiras para a espera;
- Escrivaninha e cadeiras para o(s) consultório(s);
- Mesa de exames;
- Duas balanças: uma para bebê (capacidade até 15 Kg), e outra para pacientes maiores (com medida de estatura acoplada);
- Uma régua para medir estatura de bebês;
- Fita métrica;
- Estetoscópio;
- Material necessário para realização de testes psicométricos.
2.2.3.4 - Rotinas de funcionamento e atendimento:
O Ambulatório deve ter Rotinas de Funcionamento e Atendimento escritas. Sugere-se como horário para os profissionais, inicialmente, um turno dos dias úteis para cada profissional da equipe, com facilidades para sobreaviso caso haja urgência de atendimento para algum caso suspeito. Além disso, um turno específico por semana para reuniões da equipe multidisciplinar. Conforme aumento dos casos detectados, extensão do período de atendimento para novos turnos.
Quando algum caso suspeito é detectado no laboratório, o mesmo deverá imediatamente acionar a Busca Ativa do Serviço de Referência.
- Fenilcetonúria
Os pacientes com fenilcetonúria terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico pediatra, nutricionista, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica, orientação nutricional e aconselhamento genético específico para a patologia quanto ao risco de recorrência. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento da fenilcetonúria.
- Hipotireoidismo Congênito
Os pacientes com hipotireoidismo congênito terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico endocrinologista, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica e aconselhamento genético específico para a patologia quanto ao risco de recorrência, quando necessário. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento do hipotireoidismo congênito.
- Doenças Falciformes e outras Hemoglobinopatias
Os pacientes com doenças falciformes e outras hemoglobinopatias terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico pediatra, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica e aconselhamento genético específico para a patologia quanto ao risco de recorrência. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento das doenças falciformes e outras hemoglobinopatias, no Serviço de Referência em Triagem Neonatal ou em outro serviço (Hemocentro, por exemplo), conforme acordo operacional.
- Fibrose Cística
Os pacientes com fibrose cística terão o primeiro Acompanhamento Multidisciplinar em Triagem Neonatal (AMTN) com: médico pediatra, psicólogo e assistente social. Receberão orientação sobre o diagnóstico, terapêutica e aconselhamento genético específico para a patologia quanto ao risco de recorrência. A continuidade do atendimento seguirá o protocolo e diretrizes terapêuticas para tratamento da fibrose cística, no Serviço de Referência em Triagem Neonatal ou em outro serviço, conforme acordo operacional.
2.2.4 - Sistema de Registro e Informações Automatizado
2.2.4.1 - Descrição Geral
O Serviço de Referência – Tipo I, II ou III, deverá manter registro e controle dos trabalhos e dos resultados, incluindo as amostras, folhas de leitura/documentação originais, por um período de no mínimo 05 (cinco) anos. Para isto deverá dispor de um sistema informatizado de controle de todas as atividades do Serviço, dando agilidade aos procedimentos, rastreabilidade das informações, e segurança na transcrição e emissão de laudos automáticos. Além disso deverá dispor de facilidades de comunicação de dados para troca de informações.
Registro de Pacientes - O Serviço deve possuir um prontuário para cada paciente com as informações completas do quadro clínico e sua evolução, todas devidamente escritas, de forma clara e precisa, datadas e assinadas pelo profissional responsável pelo atendimento. Os prontuários deverão estar devidamente ordenados no Serviço de Arquivo Médico.
2.2.4.2- Funcionamento
Funcionalmente o Sistema de Registro e Informações deverá:
- Identificar univocamente cada amostra recebida (PNTN/MS), com a data de recebimento, origem, e os resultados finais, permitindo sua rastreabilidade;
- Fazer o encaminhamento ordenado das amostras ao laboratório, de forma a manter relação com a identificação original;
- Registrar de forma segura e unívoca os resultados dos testes de cada amostra, registrando através de senhas, o responsável técnico pela liberação dos mesmos;
- Identificar automaticamente os casos que deverão ser reconvocados;
- Receber do laboratório e disponibilizar automaticamente os resultados dos exames realizados, de forma a evitar erros de transcrição;
- Exigir do laboratório que disponibilize rapidamente os resultados, no máximo em 5 dias úteis após o recebimento da amostra, remetendo-os à rede de coleta de forma segura e auditável;
- Receber do laboratório e emitir os resultados por computador em formulários impressos e/ou Internet, devendo constar no mínimo de:
§Resultados individuais para serem entregues aos responsáveis pelo Recém - Nascido;
§Relação de exames processados, para cada remessa feita pelo Posto de Coleta, com os resultados obtidos;
§Relação de amostras que devem ser colhidas novamente, para cada remessa feita pelo Posto de Coleta;
- Manter mecanismos de controle quantitativo e qualitativo do retorno dos casos reconvocados e devolvidos como inadequados da rede de coleta, até o diagnóstico final;
- Manter atualizado os Cadastros de Casos Positivos de cada uma das patologias detectadas, montando um prontuário para cada paciente;
- Fazer a interface com os demais serviços complementares em termos de solicitação de exames, consultas, procedimentos e resultados de exames específicos para os pacientes positivos, fornecendo e recebendo as informações necessárias ao atendimento;
- Manter os arquivos de dados dos exames realizados, para efeito de rastreamento e estatísticas, pelo período mínimo de 05 (cinco) anos;
- Facilitar a comunicação de dados, sugerindo-se a conexão das estações de trabalho em rede local, para compartilhamento de programas e dados; e conexão à Internet por transmissão de banda larga (modem de alta velocidade, cable, DSL, etc.);
- Manter procedimentos especiais de segurança, devendo para tanto, manter no local, cópias diárias de segurança dos arquivos e programas instalados, e em armazenamento externo, cópias semanais dos mesmos arquivos e programas;
- Enviar, periodicamente, quaisquer dados solicitados pela SAS/MS, para composição do Banco de Dados de Triagem Neonatal;
2.2.4.3 – Equipamentos Básicos
Os equipamentos de informática deverão ser em número suficiente para prover agilidade à rotina, permitindo a liberação rápida de resultados. Tipicamente deverão ser microcomputadores conectados em rede a um servidor central. Assim sugere-se a seguinte composição:
- Um servidor central que armazenará os dados;
- Um servidor de reserva, de capacidade similar a do servidor principal, com imagem do disco do servidor central, de forma a poder assumir o processamento em 15 minutos após a falha do servidor principal;
-Estações de trabalho individuais, em número adequado, instaladas nos postos de trabalho do Serviço de Referência, como: Seleção de Amostras, Secretaria, Laboratório, Impressão e Remessa de Resultados, Atendimento de Reconvocados, Ambulatório e outros.
2.2.4.4 – Instalações Físicas
Os servidores de dados, principal e reserva, deverão ser instalados em local isolado, de acesso restrito, em ambiente com temperatura constante em torno de 25 graus centígrados e livre de poeira.
Todos os equipamentos deverão receber alimentação elétrica com tensão e freqüência constantes, sendo todos conectados a um circuito terra, comum e específico a todos eles.
Os servidores deverão ser alimentados por uma fonte de energia sem interrupção, com bateria de capacidade de 15 minutos após a falha de energia.
Todos os equipamentos de rede e servidores deverão ser adquiridos de boas fontes de fornecimento.
2.2.4.5 – Recursos Humanos
Para a operação dos sistemas e primeiro suporte em emergências, o Serviço de Referência deve contar com, no mínimo, um operador técnico de nível médio, capaz de:
- operar todas as rotinas do sistema;
- permitir e controlar o acesso dos usuários às rotinas e dados do sistema;
- diagnosticar falhas na rede, equipamentos e sistemas operativos, dando o primeiro atendimento em situações anormais;
- executar os procedimentos rotineiros de segurança.
2.2.5 – Rede Assistencial Complementar
Os Serviços de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas de Tipo I, II e III devem contar, segundo suas necessidades e de acordo com as doenças triadas/acompanhadas/tratadas relativas a seu Tipo e à Fase de Implantação do Programa em que o estado esteja habilitado, com uma rede assistencial complementar. Esta rede tem o objetivo de garantir o atendimento integral e integrado aos pacientes triados no Serviço de Referência e de garantir o acesso dos pacientes a procedimentos não disponíveis no Serviço de Referência.
2.2.5.1 – Estruturação da Rede
Cabe à Secretaria de Saúde dos estados e do Distrito Federal articular, em conjunto com seu(s) respectivo(s) Serviço(s) de Referência em Triagem Neonatal/Acompanhamento e Tratamento de Doenças Congênitas a rede assistencial complementar. A unidades hospitalares, ambulatoriais e laboratoriais, pertencentes à rede estadual e/ou municipal, deverão ser disponibilizadas pelos gestores locais do SUS.
Na estruturação da rede complementar, deverão ser considerados os seguintes aspectos:
- Qualidade, resolutividade dos serviços com capacidade instalada para atendimento da demanda esperada;
- Regionalização dos serviços, permitindo a facilidade de deslocamento dos pacientes ou envio das amostras.
Na eventual necessidade de constituir a rede complementar com serviços/hospitais de outro estado que não o daquele do Serviço de Referência, os gestores estaduais do SUS dos estados envolvidos deverão articular a relação entre o Serviço de Referência e o(s) serviço(s)/hospital(is) complementares.
- Formalização da Rede Assistencial Complementar – a relação entre o Serviço de Referência em Triagem Neonatal e as unidades integrantes da rede assistencial complementar deverá ser devidamente formalizada, em documento escrito e assinado pelas partes, com a interveniência do(s) respectivo(s) gestor(es) estadual(is) do SUS, onde fique mínima e claramente expresso o seguinte:
- tipo de assistência complementar a ser prestada;
- a concordância do serviço complementar em receber os pacientes referenciados pelo Serviço de Referência em Triagem Neonatal;
- declaração do serviço complementar de que prestará os serviços pelo SUS e que os mesmos não acarretarão ônus de qualquer espécie, ao paciente e/ou a seus familiares;
2.2.5.2 - Composição da Rede
A rede deverá prover acesso, conforme a necessidade do Serviço de Referência em Triagem Neonatal, em uma unidade ou mais aos seguintes serviços:
- Serviço Ambulatorial Especializado em Doenças Falciformes (DF) e Hemoglobinopatias (Hbpatias):
O Serviço deverá dispor de uma equipe mínima composta de um hematologista pediátrico e um hematologista de adulto, ambos com título de especialista.
- Serviço Ambulatorial Especializado em Fibrose Cística (FC):
O Serviço deverá dispor de uma equipe mínima composta de um pneumologista pediátrico e um pneumologista de adulto, ambos com título de especialista além de um fisioterapeuta e serviço de radiologia.
- Rede Hospitalar de retaguarda credenciada para o atendimento emergencial, internamento e UTI para pacientes portadores de Doenças Falciformes, Hemoglobinopatias e Fibrose Cística - O Hospital de referência deverá ser um Hospital Geral/Especializado, com UTI infantil e de adulto, serviço de emergência e internação.
ANEXO XXIV-A
INDICADORES PARA ACOMPANHAMENTO E AVALIAÇÃO DAS AÇÕES DO PROGRAMA NACIONAL DE TRIAGEM NEONATAL - PNTN
(Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
1. Quantidade de recém-nascidos triados por Estado; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
2. Quantidade de recém-nascidos por idade na data da coleta; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
3. Média em dias entre a data da coleta da amostra e a chegada da 1ª amostra no laboratório; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
4. Média em dias entre a data de recebimento da 1ª amostra pelo laboratório e a data de emissão de resultados; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
5. Quantidade de recém-nascidos com resultado alterado na 1ª amostra por doença triada; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
6. Quantidade de recém-nascidos reconvocados por motivo de reconvocação; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
7. Quantidade de Unidades Básicas de Saúde (UBS) e de Unidades de Saúde da Família (USF) cadastradas no Município; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
8. Quantidade de recém-nascidos reconvocados com nova amostra pendente; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
9. Média em dias entre a data de liberação do primeiro resultado alterado e a data de chegada da nova amostra ao laboratório; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
10. Média em dias entre a data de liberação do resultado da 1ª amostra e data do agendamento da 1º consulta; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
11. Média em dias entre a data de liberação do resultado laboratorial da 2ª amostra e data do agendamento da consulta; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
12. Idade média do recém-nascido na data da 1ª consulta; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
13. Quantidade de casos diagnosticados por doença triada; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
14. Quantidade de recém-nascido em acompanhamento ambulatorial por doença triada; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
15. Quantidade de pacientes cadastrados no serviço de referência do Programa de Triagem Neonatal Biológica; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
16. Quantidade de óbitos dos pacientes em acompanhamento ambulatorial; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
17. Quantidade de medicação de alto custo prescrita; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
18. Quantidade de medicação de alto custo dispensada; (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
19. Quantidade de consultas agendadas; e (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
20. Quantidade de consultas atendidas. (Redação dada pela PRT GM/MS n° 187 de 03.02.2020)
ANEXO XXV
ASSISTÊNCIA HOSPITALAR EM PSIQUIATRIA NO SUS (Origem: PRT MS/GM 251/2002, Anexo 1)
1. DIRETRIZES:
2. NORMAS PARA O ATENDIMENTO HOSPITALAR
2.1 Entende-se como hospital psiquiátrico aquele cuja maioria de leitos se destine ao tratamento especializado de clientela psiquiátrica em regime de internação.
2.2 - Determinações gerais:
2.2.1. o hospital deve articular-se com a rede comunitária de saúde mental, estando a porta-de-entrada do sistema de internação situada no serviço territorial de referência para o hospital;
2.2.2.está proibida a existência de espaços restritivos (celas fortes);
2.2.3.deve ser resguardada a inviolabilidade da correspondência dos pacientes internados;
2.2.4.deve haver registro adequado, em prontuário único, dos procedimentos diagnósticos e terapêuticos nos pacientes, ficando garantida, no mínimo, a seguinte periodicidade:
2.3 - Estes serviços devem oferecer, de acordo com a necessidade de cada paciente, as seguintes atividades:
a) avaliação médico-psicológica e social;
b) garantia do atendimento diário ao paciente por, no mínimo, um membro da equipe multiprofissional, de acordo com o projeto terapêutico individual;
c) atendimento individual (medicamentoso, psicoterapia breve, terapia ocupacional, dentre outros);
d) atendimento grupal (grupo operativo, psicoterapia em grupo, atividades socioterápicas);
e) preparação do paciente para a alta hospitalar, garantindo sua referência para a continuidade do tratamento em serviço territorial com programa de atenção compatível com sua necessidade (ambulatório, hospital-dia, núcleo/centro de atenção psicossocial), e para residência terapêutica quando indicado, sempre com o objetivo de promover a reintegração social e familiar do paciente e visando prevenir a ocorrência de outras internações;
f) essas atividades deverão constituir o projeto terapêutico da instituição, definido como o conjunto de objetivos e ações, estabelecidos e executados pela equipe multiprofissional, voltados para a recuperação do paciente, desde a admissão até a alta. Inclui o desenvolvimento de programas específicos e interdisciplinares, adequados à característica da clientela, e compatibiliza a proposta de tratamento com a necessidade de cada usuário e de sua família. Envolve, ainda, a existência de um sistema de referência e contra-referência que permite o encaminhamento do paciente após a alta, para a continuidade do tratamento. Representa, enfim, a existência de uma filosofia que norteia e permeia todo o trabalho institucional, imprimindo qualidade à assistência prestada. O referido projeto deverá ser apresentado por escrito;
g) desenvolvimento de projeto terapêutico específico para pacientes de longa permanência - aqueles com mais de 01 (um) ano ininterrupto de internação. O projeto deve conter a preparação para o retorno à própria moradia ou a serviços residenciais terapêuticos, ou a outra forma de inserção domiciliar;
h) desenvolvimento de projetos terapêuticos específicos para pacientes com deficiência física e mental grave e grande dependência;
i) abordagem à família: orientação sobre o diagnóstico, o programa de tratamento, a alta hospitalar e a continuidade do tratamento.
2.4 Com vistas a garantir condições físicas adequadas ao atendimento da clientela psiquiátrica internada, deverão ser observados os parâmetros das Normas Específicas referentes à área de engenharia e arquitetura e vigilância sanitária em vigor, Portaria GM/MS N° 1884, de 11 de novembro de 1994, ou a que vier substituí-la, expedidas pelo Ministério da Saúde.
2.5 O hospital psiquiátrico especializado deverá destinar 1 enfermaria para intercorrências clínicas, com um mínimo de 6m2/leito e número de leitos igual a 1/50 do total do hospital, com camas "Fowler", oxigênio, aspirador de secreção, vaporizador, nebulizador e bandeja ou carro de parada, e ainda:
2.6 O hospital psiquiátrico especializado deverá ter sala(s) de estar, jogos, etc., com um mínimo de 40 m2, mais 20m2 para cada 100 leitos a mais ou fração, com televisão e música ambiente nas salas de estar.
2.7 .Recursos Humanos
Os hospitais psiquiátricos especializados deverão contar com, no mínimo:
E ainda:
O psiquiatra plantonista poderá, também, compor uma das equipes básicas como psiquiatra assistente, desde que, além de seu horário de plantonista cumpra 15 horas semanais em, pelo menos três outros dias da semana.
A composição dos recursos humanos deve garantir a continuidade do quantitativo necessário em situações de férias, licenças e outros eventos.
ANEXO XXVI
PROGRAMA NACIONAL DE QUALIDADE EM MAMOGRAFIA (PNQM) E PROGRAMA DE GARANTIA DE QUALIDADE (PGQ) - FORMULÁRIO DE AVALIAÇÃO (Origem: PRT MS/GM 2898/2013, Anexo 1)
| PROGRAMA NACIONAL DE QUALIDADE EM MAMOGRAFIA - PNQM PROGRAMA DE GARANTIA DE QUALIDADE- PGQ | |||
| Formulário de Avaliação | |||
| Número do CNES do estabelecimento: | |||
| ITEM | QUESTÃO | SIM | NÃO |
| 1 | O serviço possui um Programa de Garantia da Qualidade (PGQ). | ||
| 2 | O PGQ contempla ações que envolvam a gestão da estrutura, do processo e dos resultados. | ||
| 3 | Os objetivos e as atividades do PGQ são divulgados aos profissionais do serviço. | ||
| 4 | Há um representante da administração formalmente designado com autoridade e responsabilidade para assegurar que as ações relativas ao PGQ sejam estabelecidas e mantidas. | ||
| 5 | O PGQ está descrito em um manual ou em documento equivalente. | ||
| 6 | O desempenho do PGQ é avaliado periodicamente pelos responsáveis. | ||
| 7 | A avaliação do desempenho do PGQ é documentada. | ||
| 8 | O serviço tem procedimentos de auditorias internas para verificar se o PGQ está conforme os requisitos estabelecidos. | ||
| 9 | Existem relatórios de auditoria interna da qualidade indicando as não conformidades encontradas. | ||
| 10 | Existem registros da implementação das ações corretivas recomendadas nos relatórios de auditoria interna. | ||
| 11 | Os profissionais do serviço são capacitados para executar adequadamente as tarefas a eles designadas. | ||
| 12 | São mantidos registros dessas capacitações. | ||
| 13 | O serviço toma as medidas necessárias para assegurar que nenhum paciente seja submetido a uma exposição médica sem que seja solicitada por um médico. | ||
| 14 | Existem mecanismos para garantir que as doses administradas nos pacientes em decorrência dos exames sejam as menores possíveis, conforme os níveis de referência estabelecidos na normatização vigente. | ||
| 15 | Existe registro das medidas preventivas adotadas pelo serviço para evitar falhas no processo de trabalho. | ||
| 16 | Existe registro das medidas corretivas adotadas pelo serviço quando identificadas falhas nos processos de trabalho. | ||
| 17 | Os profissionais são informados quando da ocorrência de erros relacionados ao desempenho incorreto de suas funções. | ||
| 18 | O serviço possui Plano de Gerenciamento de Tecnologias implantado. | ||
| 19 | Existe um programa documentado de manutenção preventiva dos equipamentos. | ||
| 20 | Existe um programa documentado de manutenção corretiva dos equipamentos. | ||
| 21 | Existe um programa documentado de limpeza dos equipamentos. | ||
| 22 | Existem mecanismos para garantir a adequação da calibração e das condições de operação dos instrumentos de monitoração e de dosimetria do feixe. | ||
| 23 | O responsável pelo serviço participa do processo de compra dos produtos e insumos utilizados. | ||
| 24 | Existem especificações de compras de produtos e insumos definindo claramente os requisitos a serem atendidos pelo fornecedor. | ||
| 25 | O serviço notifica os eventos adversos relacionados ao uso dos equipamentos aos órgãos competentes. | ||
| 26 | O serviço executa os testes de desempenho dos equipamentos periodicamente (Controle de Qualidade - CQ). | ||
ANEXO XXVII
TESTES DE CONTROLE DE QUALIDADE (Origem: PRT MS/GM 2898/2013, Anexo 2)
Seção 1 - Dados Pessoais
1. Nome completo (insira aqui o seu nome completo)
2. Endereço eletrônico (insira aqui o seu e-mail. Ex: ciclano@provedor.com)
3. Telefones (insira aqui o(s) seu(s) telefones)
4. Instituição (nome da instituição em que você trabalha)
Seção 2 - Dados Profissionais
5. Vínculo com a vigilância sanitária
Seção 3 - Informações Gerais
6. Razão social do estabelecimento
7. Nome fantasia do estabelecimento
8. CNPJ (digite o número do CNPJ com os caracteres)
9. Endereço
10. Número de inscrição no Cadastro Nacional de Estabelecimentos de Saúde (CNES)
11. Atividade
12. Telefone
13. Responsável técnico
14. Quantos mamógrafos existem no serviço? (informe apenas números)
15. Data (data do preenchimento)
Seção 4 - Outros Dados
16. Qual é o número de série do mamógrafo?
17. O mamógrafo possui registro atualizado na Anvisa? Deve-se verificar se o equipamento estava com registro válido na Anvisa na data da sua compra. Não se aplica aos mamógrafos comprados antes de 2001.
18. O serviço apresentou os testes de aceitação do mamógrafo? Na aceitação do equipamento, devem ser realizados todos os testes pertinentes descritos na Portaria SVS/MS nº. 453/98. As medidas de atenuação da bandeja de compressão e do receptor de imagem são realizadas apenas na aceitação e, portanto, não devem ser exigidas periodicamente.
19. Como estão os resultados do levantamento radiométrico? O levantamento radiométrico deve ser realizado a cada quatro anos OU após a realização de modificações autorizadas OU quando houver mudança na carga de trabalho semanal ou nas características ou ocupação das áreas circunvizinhas.
20. O serviço enviou o relatório do Programa de Garantia de Qualidade?
21. Como estão os valores representativos de dose? Estas medidas devem ser realizadas a cada 2 (dois) anos.
22. Como está a exatidão do indicador de tensão do tubo (KVp)? Este teste deve ser realizado anualmente.
23. Como está a reprodutibilidade da tensão do tubo (KVp)? Recomenda-se a realização anual deste teste.
24. Como está a exatidão do tempo de exposição? Este teste deve ser realizado anualmente.
25. Como está a reprodutibilidade do tempo de exposição? Recomenda-se a realização anual deste teste.
26. Como está a reprodutibilidade da exposição (taxa de kerma no ar)? Este teste deve ser realizado anualmente.
27. Como está a medida da camada semi-redutora (CSR ou HVL, em inglês)? A medida da CSR deve ser realizada anualmente.
28. Como está a linearidade da taxa de kerma no ar com o mAs? Este teste deve ser realizado anualmente.
29. O mamógrafo possui sistema automático de exposição?
30. Como está a reprodutibilidade do sistema automático de exposição? Este teste deve ser realizado anualmente.
31. Como está o tamanho do ponto focal? Esta medida deve ser realizada anualmente.
32. Como está a integridade dos EPI? Essa avaliação deve ser realizada anualmente.
33. Como está a vedação da câmara escura? Este teste deve ser realizado anualmente.
34. Como está a exatidão do sistema de colimação? Este teste deve ser realizado semestralmente.
35. Como estão o contato tela-filme e a integridade das telas e chassis? Estes testes devem ser realizados semestralmente.
36. O mamógrafo possui grade antidifusora?
37. A luminância do(s) negatoscópio(s) está entre 3.000 e 3.500 nit? Essas medidas devem ser realizadas semestralmente.
38. O serviço apresentou o índice de rejeição de mamografias? Este índice deve ser apresentado semestralmente.
39. Qual é o percentual de mamografias rejeitadas? Ex: Se o percentual de mamografias rejeitadas for de 10%, digite 10.
40. A qualidade da imagem, avaliada no simulador, está adequada? Em cada equipamento de mamografia, deve ser realizada, mensalmente, uma avaliação da qualidade de imagem com um simulador mamográfico equivalente ao adotado pelo Colégio Americano de Radiologia (ACR), e com registro válido junto à Anvisa.
41. O mamógrafo possui sistema automático de compressão? O sistema de compressão possibilita compressão apenas entre 11 e 18 kgf?
42. Como está a sensitometria do sistema de processamento? Este teste deve ser realizado diariamente.
Tabela auxiliar
| Testes de Controle de Qualidade | |||
| Testes | Periodicidade | Tolerância | |
| 1 | Dose de entrada na pele | Bienal | < 10 mGy (Grade) |
| 2 | Exatidão do indicador de tensão do tubo | Anual | 2kV |
| 3 | Reprodutibilidade da tensão do tubo | Anual (recomendado) | 10% |
| 4 | Exatidão do tempo de exposição | Anual | 10% |
| 5 | Reprodutibilidade do tempo de exposição | Anual (recomendado) | 10% |
| 6 | Reprodutibilidade da exposição (taxa de kerma no ar) | Anual | 10% |
| 7 | Camada semirredutora | Anual | (kVp/100)<CSR<(kVp/100 + 0,1) |
| 8 | Linearidade da taxa de kerma com mAs | Anual | 20% |
| 9 | Reprodutibilidade do sistema automático de exposição | Anual | 10% |
| 10 | Tamanho do ponto focal | Anual | < 0,4 mm |
| 11 | Integridade dos acessórios e vestimentas (EPI) | Anual | Visual |
| 12 | Vedação da câmara escura | Anual | Visual |
| 13 | Exatidão do sistema de colimação | Semestral | 2% DFF |
| 14 | Contato tela filme/integridade dos chassis | Semestral | Visual |
| 15 | Condições dos negatoscópios | Semestral | Entre 3.000 e 3.500 nit |
| 16 | Índice de rejeição de mamografias | Semestral | - |
| 17 | Imagem do simulador tipo ACR | Mensal | Fibra de 0,75 mm; massas de 0,75 mm e microcalcificações de 0,32mm |
| 18 | Força de compressão | Anual | entre 11 e 18 Kgf |
| 19 | Alinhamento da placa de compressão | Anual (recomendado) | Visual |
| 20 | Sensitometria | Diária | - |
| 21 | Transmissão do suporte receptor | Aceitação/Manutenção | < 1µGya 5 cm |
| 22 | Gerador trifásico ou alta frequência | Aceitação/Manutenção | - |
| 23 | Distância foco-pele | Aceitação/Manutenção | > 30 cm |
Observação:
No caso dos equipamentos de mamografia digital (CR ou DR), aplicam-se todos os testes previstos na Portaria nº 453/SVS/MS, 1º de junho de 1998, exceto aqueles relacionados ao processamento da imagem. Lembramos que o serviço deve realizar todos os testes recomendados pelos fabricantes dos equipamentos, inclusive avaliação dos monitores utilizados nos laudos, quando houver.
ANEXO XXVIII
DOS CRITÉRIOS DE QUALIDADE PARA A AVALIAÇÃO DA QUALIDADE DAS IMAGENS CLÍNICAS DAS MAMAS E DO LAUDO D (Origem: PRT MS/GM 2898/2013, Anexo 3)
DOS CRITÉRIOS DE QUALIDADE PARA A AVALIAÇÃO DA QUALIDADE DAS IMAGENS CLÍNICAS DAS MAMAS E DO LAUDO DAS MAMOGRAFIAS DO PNQM
Das Imagens Radiográficas
Os serviços de diagnóstico por imagem que realizam mamografia deverão atender aos seguintes requisitos de qualidade das imagens radiográficas:
I - nas imagens, devem constar:
a) a identificação do exame;
b) a identificação do serviço de diagnóstico por imagem;
c) o registro do paciente;
d) a data do exame;
e) a abreviatura da incidência radiográfica;
f) a lateralidade da mama;
II - cada uma das imagens que compõem o exame deve conter uma identificação legível, que não se sobreponha às estruturas anatômicas;
III - a identificação do exame deve ser feita por uma legenda posicionada nos quadrantes laterais da imagem, quando se tratar de uma incidência axial, e nos quadrantes superiores da imagem, quando se tratar de uma incidência lateral;
IV - a abreviatura da incidência radiográfica deve sempre estar acompanhada da indicação da lateralidade da mama representada pela letra E para a mama esquerda e pela letra D ou R E ou L para a mama direita, observadas as seguintes abreviaturas:
a) crânio-caudal: CC-D e CC-E;
b) médio-lateral oblíqua: MLO-D e MLO-E;
c) crânio-caudal exagerada: XCC-D e XCC-E
d) cleavage: CV-D e CV-E;
e) perfil ou médio-lateral: ML-D e ML-E;
f) perfil medial ou látero-medial: LM-D e LM-E;
g) caudo-cranial: RCC-D e RCC-E;
h) ampliação: AMP;
i) axila: AXI-D e AXI-E;
j) incidência com utilização da manobra de Eklund: EKL;
V - o exame deve ser composto por, no mínimo, duas incidências básicas de cada mama: a crânio-caudal e a médio-lateraloblíqua, observado o seguinte:
a) se as imagens forem analógicas, devem ser feitas em filmes separados;
b) se as imagens forem digitais, devem ser impressas em filme específico, sem redução, ou gravadas em meio magnético;
VI - a critério do médico interpretador do exame, devem ser realizadas incidências radiográficas complementares ou manobras, sempre que forem detectadas alterações nas incidências básicas que mereçam melhor avaliação;
VII - sempre que possível, nas mulheres com implantes mamários devem ser realizadas, para cada mama, as duas incidências básicas e duas incidências com a manobra de deslocamento posterior da prótese (manobra de Eklund), salvo quando impossível a manobra, caso em que fica recomendada a realização de incidências em perfil complementares bilaterais;
VIII - para a realização do exame, a mama deve ser comprimida com o objetivo de reduzir os efeitos de imagem causados pela sobreposição dos tecidos mamários, e não deve ser introduzido nenhum artefato de imagem originado durante a compressão da mama, inclusive dobra de tecido cutâneo;
IX - o nível de exposição da mama aos raios-X deve ser estabelecido, na rotina dos exames, pelo dispositivo de controle automático do mamógrafo, de modo que as imagens para interpretação apresentem uma escala de contraste que permita uma boa diferenciação das diversas densidades dos tecidos mamários;
X - os contornos das estruturas normais e patológicas da mama devem se apresentar na imagem radiográfica com perda mínima de definição, sem borramento;
XI - o ruído presente na imagem deve ser imperceptível, de modo a não dificultar a visualização das estruturas normais da mama, evitando a simulação de achados radiológicos inexistentes que simulem lesões;
XII - a imagem radiográfica deve estar livre de artefatos de qualquer origem; e
XIII - nas imagens digitais, deve haver:
a) visualização da linha da pele, dos ligamentos de Cooper e das estruturas vasculares nas áreas claras e escuras;
b) ausência de ruído perceptível nas áreas claras e escuras;
c) contraste suficiente nas áreas claras e escuras, com tecido glandular claro e área de fundo escura e sem saturação dos tons de cinza, tanto nas áreas claras como nas áreas escuras das imagens;
d) na incidência crânio-caudal, também devem-se observar os seguintes critérios:
1. as mamas devem estar simétricas, havendo boa visibilidade dos quadrantes mediais e laterais, sem favorecer um quadrante em detrimento do outro;
2. o músculo peitoral deve ser visto em cerca de 30% (trinta por cento) dos exames;
3. a gordura retromamária deve ser vista em todos os exames, demonstrando que a parte glandular da mama foi radiografada, as estruturas vasculares devem ser vistas em regiões de parênquima denso; e
4. a papila deve estar paralela ao filme e posicionada no raio de 12 (doze) horas; e
e) na incidência médio-lateral oblíqua, também devem-se observar os seguintes requisitos:
1. as mamas devem estar simétricas;
2. o músculo grande peitoral deve ser visto, no mínimo, até a altura da papila, com borda anterior convexa;
3. o sulco inframamário deve ser visto na borda inferior da imagem;
4. a gordura retromamária deve ser vista em todos os exames, demonstrando que a parte glandular da mama foi radiografada; e
5. a papila deve estar paralela ao filme, as estruturas vasculares devem ser vistas em regiões de parênquima denso e a mama não deve estar pêndula.
Do Laudo Radiográfico
Os serviços de diagnóstico por imagem que realizam mamografia devem atender aos critérios de qualidade para a leitura dos exames e a expedição dos laudos radiográficos, nos seguintes termos:
I a leitura dos exames em filmes fica reservada aos exames que não utilizam tecnologia digital e a leitura dos exames realizados em equipamentos com tecnologia digital deve ser feita, preferencialmente, em monitores específicos para interpretação das imagens das mamas; e
II o laudo radiográfico deve conter as seguintes informações:
a) identificação do serviço, da idade do examinado e data do exame;
b) se exame de rastreamento ou de diagnóstico;
c) número de filmes ou imagens;
d) padrão mamário;
e) achados radiográficos;
f) classificação BI-RADS®;
g) recomendação de conduta; e
h) nome e assinatura do médico interpretador do exame.
ANEXO XXIX
INDICADORES PARA MONITORAMENTO DOS RESULTADOS REFERENTES À QUALIDADE DO EXAME MAMOGRÁFICO (Origem: PRT MS/GM 2898/2013, Anexo 4)
INDICADORES PARA MONITORAMENTO DOS RESULTADOS REFERENTES À QUALIDADE DO EXAME MAMOGRÁFICO
a) Percentual de mamografias de rastreamento positivas na população entre 50-69 anos.
Fórmula de cálculo:
Nº de mamografias de rastreamento (50-69 anos) BI-RADS® 0, 4, 5 / Nº total de mamografias de rastreamento (50-69 anos) X 100.
b) Percentual de mamografias diagnósticas positivas com achados no exame clínico.
Fórmulas de cálculo:
Nº de mamografias diagnósticas positivas BI-RADS® 4 ou 5/Nº total de mamografias diagnósticas com informação de "achados no exame clínico" X 100.
c) Taxa de detecção de câncer em mamografias de rastreamento
Fórmula de cálculo:
Nº de mulheres na faixa etária de 50-69 anos com exame histopatológico positivo com data posterior à realização da mamografia de rastreamento no período de 12 meses/ Nº de mulheres na faixa etária de 50-69 anos com mamografia de rastreamento no período de 12 meses p/ 1.000 mulheres.
d) Valor preditivo positivo em mamografias de rastreamento com recomendação de biópsia
Fórmula de cálculo:
Nº de mulheres com BI-RADS® 4 e 5 em mamografia de rastreamento na faixa etária de 50-69 anos com recomendação de biópsia e histopatológico positivo /Total de mulheres com mamografia de rastreamento com BI-RADS® 4 e 5 na faixa etária de 50-69 anos com recomendação de biópsia X 100.
e) Valor preditivo positivo em mamografias diagnósticas por "achados no exame clínico" com recomendação de biópsia.
Fórmula de cálculo:
Nº de mulheres com BI-RADS® 4 e 5 em mamografia diagnóstica por "achados no exame clínico" e histopatológico positivo / Total de mulheres com mamografia diagnóstica por "achados no exame clínico" e BI-RADS® 4 e 5 com recomendação de biópsia X 100.
ANEXO XXX
INSTRUÇÕES NORMATIVAS PARA DIAGNÓSTICO, TRATAMENTO E CONTROLE DO PÊNFIGO FOLIÁCEO ENDÊMICO (FOGO SELVAGEM) (Origem: PRT MS/GM 1400/1991, Anexo 1)
O Controle de Pênfigo Foliáceo Endêmico, devido a sua endemicidade em algumas regiões do Brasil, baseia-se no:
1- DIAGNÓSTICO - O diagnóstico do Pênfigo Foliáceo Endêmico baseia-se em suas características clínicas e em exames laboratoriais.
1.1- Exame clínico - Deve-se valorizar as lesões bolhosas e erosivas e suas localizações preferenciais, o sinal de Nikolsky e a procedência do doente.
As lesões características estão representadas por bolhas de teto frouxo que rapidamente se rompem para deixar áreas erosadas, inicialmente eritematosas e que se tornam escamo-crostosas. É frequente o doente não perceber a existência de bolhas íntegras, mas, apenas o aparecimento das áreas erosadas, que determinam a sensação de prurido e ardência. As lesões podem permanecer localizadas por longo tempo, ou podem evoluir e invadir parte, ou mesmo, todo o tegumento (eritrodermia).
É frequente a ocorrência de infecção secundária sobre estas lesões, exalando odor característico.
As lesões iniciais distribuem-se preferencialmente pelas áreas ditas seborréicas, como couro cabeludo, face, região pré-esternal e interescapular.
O sinal de Nikolsky é precoce e de grande utilidade, e deve ser pesquisado em pele aparentemente sã, fazendo-se pressão digital e movimento de deslizamento - é positivo quando há erosão da área pesquisada.
Epidemiologicamente, a procedência do paciente de áreas reconhecidamente endêmicas é um dado muito importante para o diagnóstico.
1.2- Exames Laboratoriais - A confirmação diagnóstica deve ser feita através de exame histopatológico de material obtido de biópsia de pele, o qual deve ser colhido preferencialmente, em lesão bolhosa recente ou em sua ausência, na borda de uma lesão erosada.
Histopatologicamente a bolha está situada nas camadas mais superficiais da epiderme, logo abaixo da camada córnea, e, em seu interior, são encontradas células acantolíticas.
O citodiagnóstico e a imunofluorescência são úteis, porém representam recursos complementares somente utilizáveis em centros especializados.
2- TRATAMENTO - Baseia-se na corticoterapia por via oral, que representa, até o momento o principal recurso efetivo para a remissão clínica da doença, sendo de primeira escolha a prednisona e, de segunda escolha, a triancinolona na dose equivalente.
2.1- Prednisona
a) Dose de ataque - Se faz com 1 a 1,5mg/Kg/dia, em dose única, no café da manhã, até o desaparecimento do quadro erosivo bolhoso, o que ocorre na maioria das vezes, após 30 a 40 dias de tratamento.
b) Redução progressiva - Deve ser feita com a diminuição de 10mg de 10 em 10 dias, até conseguir a dose mínima que mantenha o doente sem lesão.
c) Dose de manutenção - Geralmente deve ser feita com dose em torno de 10 a 20mg ao dia, por um período de 3 meses. Mantendo-se a remissão dos sintomas, esta dose poderá ser dada em dias alternados. Após 6 a 12 meses, sem lesões, pode-se tentar administrar a dose de manutenção de 3 em 3 dias.
d) Retirada do corticosteróide - Somente quando o doente se mantém, pelo menos, de 1 a 3 anos livre de sintomas.
e) Em casos frustos (formas benignas ou localizadas da doença), a dose de ataque pode ser de 20 a 40mg de prednisona ao dia.
f) Tratamento local- deve ser feito com banhos de permanganato de potássio (KMnO4) na diluição de 1:30.000 para as exsudativas; a medida que as lesões vão se tornando menos úmidas, faz-se o uso de cremes de corticosteróides associados a antibióticos. Para as fases secas, usa-se pomadas de corticosteróides.
É de fundamental importância evitar complicações secundárias, que podem ser responsáveis pela evolução desfavorável do quadro clínico.
A antibioticoterapia deve ser instituída, em caso de ocorrência de infecção secundária.
2.2- Recomendações
a) na fase de diagnóstico e início da terapêutica, o doente deve permanecer internado, sob assistência de serviços especializados e rigorosa vigilância médica, exceto na forma frusta, quando o mesmo pode ser mantido em regime ambulatorial sob acompanhamento médico.
b) em zonas endêmicas dever-se-á capacitar hospitais gerais regionais para diagnóstico e tratamento.
c) os doentes em fase de remissão da moléstia, recebendo dose de manutenção do corticosteróide, deverão ser encaminhados para acompanhamento ambulatorial na unidade de saúde mais próxima ao seu domicílio.
3- PROFILAXIA
3.1- Ainda não se pode padronizar medidas de caráter preventivo, porque a etiopatogenia do Pênfigo Foliáceo Endêmico ainda está em fase de elucidação.
3.2- A doença não se transmite de homem para homem.
3.3- Sabe-se que a moléstia envolve a formação de autoanticorpos, dirigidos para os espaços intercelulares da epiderme (anticorpos antiepiteliais), o que parece filiar o Pênfigo Foliáceo Endêmico (fogo-selvagem) ao grupo das moléstias autoimunes.
3.4- Contudo, pouco se sabe e nada se pode afirmar seguintes aspectos:
a) a existência de algum agente infeccioso;
b) a participação de vetores alados borrachudo
c) o mecanismo pelo qual se deflagra o processo de auto-anticorpos.
3.5- Nos estados endêmicos, a notificação de casos diagnósticados à unidade sanitária mais próxima representa elemento fundamental para a avaliação da gravidade do problema, e, deverá ser feita no formulário próprio, já existente, para as doenças de notificação compulsória.
Estas instruções normativas estão detalhadas no guia para controle do Pênfigo Foliáceo.
ANEXO XXXI
MODELO DE PLANO DE TRABALHO PARA APOIO À IMPLANTAÇÃO DA ESTRATÉGIA E-SUS AB (Origem: PRT MS/GM 58/2015, Anexo 1)
I.Abrangência da Oferta
| MUNICÍPIOS CONTEMPLADOS | Nº DE UNIDADES DE SAÚDE DE ACORDO COM OS POSSÍVEIS CENÁRIOS DE IMPLANTAÇÃO | Nº TOTAL DE EQUIPES CONTEMPLADAS | ||||||
| Nº | % EM RELAÇÃO AO TOTAL | CDS-UBS | CDS-SMS | PEC CDS | PEC | TOTAL | Nº | % EM RELAÇÃO AO TOTAL |
II.Planejamento detalhado das ações
| EIXOS | RESULTADOS ESPERADOS | AÇÕES | DESCRIÇÃO/DETALHAMENTO | PRAZO DA ATIVIDADE | RESPONSÁVEIS | CRONOGRAMA |
| Materiais didáticos e de apoio à implantação | ||||||
| Formação de Multiplicadores | ||||||
| Apoio presencial | ||||||
| Monitoramento de implantação | ||||||
| Contratação de recursos humanos | ||||||
| Outros |
III.Planejamento orçamentário
| ITEM | QUANTIDADE | VALOR | CRITÉRIO | PRAZO | VALOR TOTAL |
| ... | |||||
| ... | |||||
| TOTAL | R$ 00000,00 |
ANEXO XXXII
NORMAS TÉCNICAS PARA DIAGNÓSTICO, TRATAMENTO E CONTROLE DA LEISHMANIOSE TEGUMENTAR AMERICANA (Origem: PRT MS/GM 1402/1991, Anexo 1)
(Revogado pela PRT GM/MS n° 781 de 09.04.2020)
NORMAS TÉCNICAS PARA DIAGNÓSTICO, TRATAMENTO E CONTROLE DA LEISHMANIOSE TEGUMENTAR AMERICANA
O controle da Leishmaniose Tegumentar será orientado para os seguintes objetivos: (Revogado pela PRT GM/MS n° 781 de 09.04.2020)
- O diagnóstico do doente, através do atendimento de demanda, fornecimento de insumos para diagnóstico complementar, investigação de focos e recebimento de notificações;
- orientação terapêutica padronizada, com o fornecimento da medicação e acompanhamento do doente;
- a investigação epidemiológica dos focos e adoção de medidas profiláticas pertinentes;
- a educação em saúde, através da ação participativa envolvendo os usuários dos serviços de saúde, equipes técnicas e a população em geral, de modo a fomentar a percepção do problema e a necessidade dos recursos a serem aplicados em cada realidade.
1. DIAGNÓSTICO - Para qualquer das formas deve ser clínico, epidemiológico e laboratorial, exceto nas áreas onde não se dispõe de recursos laboratoriais.
1.1- Diagnóstico clínico - A forma ulcerada franca é a mais comum, caracteriza-se por úlcera, com bordas elevadas em moldura, fundo granuloso com ou sem exsudação e indolor. Outras formas encontradas são a úlcero-crostosa, impetigoide, úlcero-vegetante, verrucosa, tuberosa, liquenóide ou framboesiforme. Na fase inicial é frequente a linfangite e/ou a adenopatia satélite às lesões. Quando existem lesões mucosas as queixas são de obstrução e eliminação de crostas nasais, epistaxes, e ao exame, ulceração de septo nasal.
1.2- Diagnóstico epidemiológico - Baseia-se em informações sobre residência e procedência do paciente, residências anteriores, e atividades profissionais relacionadas com desmatamento. Em presença de lesões suspeitas de mucosas deve-se investigar a preexistência de lesão cutânea, e a procedência e atividade profissional do paciente, naquela ocasião.
1.3- Diagnóstico laboratorial - Baseia-se na evidenciação do parasita e em provas imunológicas.
1.3.1- Diagnóstico parasitológico
A evidenciação do parasita é feita através de exames direto e indireto. Para a pesquisa direta são utilizados os seguintes procedimentos: escarificação, punção aspirativa, impressão por aposição e biopsia. O material deve ser colhido na superfície ou na borda interna de lesões novas; é raro o encontro de parasitas em lesões com mais do um ano. A identificação e tipagem do parasita através dos métodos abaixo é de grande utilidade na indicação terapêutica adequada. Entretanto, a tipagem só é possível em alguns centros de referência.
Para o cultivo o meio de escolha é o NNN, enriquecido com uma fase líquida de LIT-BHI, e o material pode ser obtido por punção-aspirativa ou por biopsia.
A inoculação em animais de laboratório é feita em hamster, principalmente nas patas posteriores.
Na histopatologia o diagnóstico de certeza só é dado quando se identifica o parasita nos tecidos.
1.3.2- O diagnóstico imunológico pode ser feito através de:
a) Intradermoreação de Montenegro, que traduz a resposta alérgica de hipersensibilidade celular retardada. É da grande valor presuntivo, dada a sua sensibilidade e especificidade, sendo positiva em mais de 90% dos casos de LTA. Nas lesões mucosas a reação é quase sempre positiva. Geralmente permanece positiva após o tratamento ou cicatrização espontânea da lesão, negativando nos indivíduos pouco reatores e nos precocemente tratados. Em áreas endêmicas deve ser valorizado, levando em consideração uma leishmaniose anterior ou, apenas exposição ao parasita sem doença.
Essa reação pode estar negativa de 1 a 4 meses após o inicia de lesão. É negativa na Leishmaniose anérgica.
b) Imunofluorescência indireta (IFI).
c) Testes imunoenzimáticos (ELISA).
As reações sorológicas de imunofluorescência indireta e os testes imunoenzimáticos (ELISA) são muitos úteis, principalmente nos casos com lesões extensas e múltiplas e no diagnóstico precoce das lesões mucosas secundárias ou primárias. A IFI apresenta reação cruzada com a leishmaniose visceral e a doença de Chagas.
Após o tratamento e cura clínica da forma cutânea, os títulos caem ou desaparecem com alguns meses, podendo ser de utilidade no critério de cura.
Estes testes, são exigíveis em alguns centros de referência.
2. TRATAMENTO - A droga de primeira escolha é o antimonial pentavalente - antimoniato de N. Metil-glucamina (Glucantime). Atualmente não se recomenda a interrupção do Glucantime. (Revogado pela PRT GM/MS n° 781 de 09.04.2020)
A Organização Mundial da Saúde (OMS) recomenda que a dose deste antimonial seja calculada em mg/SbV/Kg/dia,(SbV significa antimônio puro).
As apresentações comerciais são em ampolas de 5ml, que contém 425mg do antimônio puro. Portanto, cada ml contém 85mg do antimônio puro.
É indicado para tratamento de todas as formas de leishmanioese tegumentar, embora as formas mucosas e cutâneo-mucosa exijam maior cuidado, por apresentarem respostas mais lentas e maior possibilidade de recidivas.
Não havendo resposta satisfatória com o tratamento pelo antimonial pentavalente, as drogas de segunda escolha são as Anfotericina B e a Pentamidina, esta última em fase de introdução no Brasil.
2.1- Antimoniato de N-Metil-Glucamina (Glucantime)
a) Forma cutânea - a dose recomendada pela OMS varia entre 10mg a 20mg/SbV/Kg/dia - sugere-se 15mg SbV/Kg/dia (Ex.: 2amp. para um paciente de 60Kg) durante 20 dias seguidos, por via intramuscular ou endovenosa, no final do dia, para possibilitar o repouso após a aplicação. Se não houver cicatrização completa após duas semanas do término do tratamento, o esquema deverá ser repetido. Persistindo o insucesso, o diagnóstico deverá ser reavaliado em serviço especializado.
Não deve ser administrada em gestantes.
A administração do Glucantime em pacientes com mais de 50 anos, ou ainda em portadores de cardiopatias, nefropatias, hepatopatias e doença de Chagas, pode desencadear toxicidade, exigindo vigilância permanente quanto ao eletrocardiograma, provas de função renal e provas de função hepática. O tratamento deverá ser suspenso uma vez constatados alterações eletrocardiográficas persistentes ou progressivas, ou ainda alterações importantes nas provas de funções renal e hepática.
A medicação pode produzir alguns efeitos colaterais, as vezes exigindo a suspensão do tratamento. Entre eles temas: artralgia, mialgia, inapetência, náuseas, vômitos, plenitude gástrica, epigastralgia, pirose, dor abdominal, prurido, febre, fraqueza, cefaléia, tontura, palpitação, insônia, nervosismo, choque pirogênico, edema, herpes zoster e insuficiência renal aguda.
b) Forma mucosa deve ser tratada com 20mg SbV/Kg/dia durante 30 dias, ou pode prolongar-se até a cura clínica, com rigorosa vigilância do paciente, e sempre que possível deve ser feito em âmbito hospitalar.
- Não se obtendo resposta satisfatória, adotar uma das medicações alternativas - Anfotericina B ou Pentamidina.
2.2- Anfotericina B (Fungizon)
É a droga de segunda escolha, empregada quando não se obtém resposta ao tratamento com antimonial. É a mais eficaz nas manifestações mucosas da leishmaniose, sendo as recidivas menos freqüentes.
Apresentação: 1 frasco = 50mg
Dose/Modo de Aplicação
Inicia-se com 0,5mg/Kg/dia em dias alternados, aumentando gradualmente até a dose total de 1mg/Kg, sem ultrapassar 50mg. Administração é feita por via endovenosa, gota a gota, lentamente (4 horas de infusão) diluída em soro glicosado a 5%, utilizando equipo em Y, sendo um frasco com anfotericina e outro com 50 a 100mg de hidrocortizona, para evitar a flebite. Deve ser administrada em dias alternados até a cura clínica, o que deve ocorrer quando atingir as seguintes doses totais: na forma cutânea, 1 a 1,5gr; nas formas mucosas e cutâneo-mucosa, 2,5 a 3gr.
Se necessário, esta dose total poderá ser elevada desde que o paciente esteja sob vigilância clínica rigorosa, acompanhada das provas laboratoriais que permitam avaliar, principalmente, a função renal.
Recomenda-se realizar avaliação clínica e laboratorial antes do início do tratamento, fazendo-se avaliação cardiológica, exames bioquímicos para avaliação das funções renal (dosagem de uréia, creatinina e k). Avaliação da função hepática (dosagem de bilirrubinas, transaminases e fosfatase alcalina) e hemograma. Essas avaliações deverão ser feitas semanalmente.
Em idosos a reavaliação da função renal e cardíaca deve ser feita 2 vezes por semana, desde que haja alterações.
É importante enfatizar que a medicação deve ser feita sob vigilância em serviços especializados, com o paciente hospitalizado.
Os efeitos colaterais de ocorrência mais frequente (febre,anorexia, náuseas, vômitos e flebite) podem ser atenuados ou evitados com o uso de antipiréticos, antieméticos ou de 50 a 100mg de hidrocortisona, acrescentados ao soro.
É contra indicada para administração em gestantes, cardiopatas, nefropatas e hepatopatas.
2.3- Isotionato de Pentamidina (Pentacarinat)
Apresentação: cada frasco contém 200mg
A OMS recomenda, para todas as formas, administrar 4mg/Kg/dia, via intramuscular, durante 5 ou mais semanas, dependendo da resposta clínica.
Experiência brasileira tem mostrado que, para a forma cutânea, ocasionada por Leishmania guyanensis obtem-se bons resultados terapêuticos, com poucos efeitos colaterais, utilizando-se a mesma dose e via de administração, porém, com apenas 3 aplicações e intervalo de dois dias entre cada aplicação.
A Pentamidina, face o seu efeito hipoglicemiante, deverá ser administrada após uma refeição.
As reações adversas mais frequentes são dor, induração e abcessos estéreis no local da aplicação, além de náuseas, vômitos, tonturas, adinamias, mialgias, cefaléia, hipotensão, lipotímias, síncope, hiperglicemia e hipoglicemia. Diabetes mellitus pode ocorrer a partir da administração da dose total de 1 grama.
Nas doses recomendas pela OMS, sugere-se a realização do exame bioquímico para avaliação das funções renal (dosagem da uréia e da creatinina) hepática (dosagem das transaminases, bilirrubinas e fosfatase alcalina) e glicemia periodicamente, no curso do tratamento. O acompanhamento eletrocardiográfico, antes, durante e no final do tratamento é também recomendado.
É contra-indicada para gestantes, e para portadores de diabetes, insuficiência renal, insuficiência hepática, doenças cardíacas e crianças com menos de 8Kg de peso.
3- CONTROLE DO TRATAMENTO - é feito principalmente pelo aspecto clínico das lesões, reepitelização das lesões ulceradas e regressão, nas formas mucosas a regressão de todos os sinais deve se comprovada pelo exame otorrinolaringológico.
No tratamento com 3 doses de Pentamidina verifica-se a cicatrização das lesões, em média, 25 dias após a última injeção.
Laboratorialmente devemos considerar que a imunofluorescência indireta e útil para o diagnóstico, principalmente, na forma mucosa.
Títulos positivos persistentes são encontrados em pacientes com freqüentes recidivas, com potencialidade de desenvolver a forma secundária mucosa, ou em indivíduos que permanecem em áreas endêmicas.
Ainda não está suficientemente estabelecido um critério de cura parasitológica para a LTA.
4- MEDIDAS GERAIS DE CONTROLE DA LTA
4.1- Medidas de atuação na cadeia de transmissão
Para a elaboração de um programa de controle torna-se necessária a integração das diversas instituições que atuam na área, evitando-se duplicidade de ações e gastos desnecessários.
As características peculiares da LTA - a diversidade de agentes, reservatórios, vetores e situações epidemiológicas, indicam que as estratégias de controle devem ser flexíveis e distintas, de aplicação restrita, adequadas a cada região ou foco particular. A complexidade do controle se evidencia quando se consideram as inúmeras lacunas ainda existentes no conhecimento destes aspectos.
Para a seleção de estratégias adequadas a cada região geográfica deverá ser considerada a análise epidemiológica dos dados referentes a:
1) Notificação dos casos humanos quanto à forma clínica, sexo, idade, profissão e procedência;
2) Estudos entomológicos para definir as espécies vetoras, sua dispersão, graus de antropofilia e exofilia, infecção natural;
3) Estudos parasitológicos para definir a espécie do agente etiológico circulante no foco;
4) Estudos ecológicos para determinação dos reservatórios animais envolvidos.
Como resultados dessa análise, poderão ser desenvolvidas as seguintes ações:
a) Diagnóstico precoce e tratamento adequado dos casos humanos, cuja competência é da rede básica de saúde, através do atendimento à demanda passiva, notificações e busca ativa em áreas de maior morbidade ou onde o acesso da população à rede é dificultada por diversos fatores.
b) Diagnóstico animal precoce e seguro para controle e/ou eliminação dos infectados.
c) Medidas de redução do contato homem-vetor, através de:
- medidas educativas - educação da comunidade;
- ampliação de inseticidas;
- medidas de proteção individual; e
- controle de reservatórios.
4.2- Vacina
Com relação a utilização da vacina para Leishmaniose Tegumentar Americana quer para imunoprofilaxia quer para imunoterapia, em virtude dos resultadas apresentados até o momento não serem conclusivos, sua utilização no território nacional, fica condicionada à autorização prévia do Ministério da Saúde.
5- DEFINIÇÃO DE RESPONSABILIDADES DAS INSTITUIÇÕES DE SAÚDE NOS DIFERENTES NÍVEIS
As ações de controle serão desenvolvidas a partir dos trabalhos conjunto entre a Fundação Nacional de Saúde (controle de vetores, reservatórios e busca ativa) e a Rede Básica de Saúde (controle de doentes e busca ativa).
Tradicionalmente a SUCAM se responsabilizou por todas as atividades de vigilância epidemiológica, não só da Leishmaniose Visceral como também da Leishmaniose Tegumentar, em todos os níveis; trabalho que hoje está incorporado à Fundação Nacional de Saúde (FNS).
Entretanto, o processo de descentralização em andamento no Sistema único de Saúde (SUS), impõe a revisão das atribuições de cada instituição, com vistas à atuação conjunta e hierarquizada de todas as instituições de saúde.
Considerando as interfaces das instâncias técnicas da Fundação Nacional de Saúde, no que tange à normalização para o controle da Leishmaniose Tegumentar, faz-se necessário o planejamento e acompanhamento conjunto a nível nacional, desempenhando as seguintes atribuições:
- Normalização da vigilância epidemiológica, investigação e controle dos focos, através de inquérito e intervenções na cadeia epidemiológica.
- Distribuição de insumos críticos.
- Normalização em diagnóstico, tratamento e acompanhamento dos doentes de LTA, para a rede básica dos serviços de saúde.
Sendo assim, faz-se necessário que as Secretarias de Saúde Estaduais e Municipais assumam gradualmente as suas funções de vigilância epidemiológica, aos agravos prevalentes nas respectivas regiões e de assistência aos portadores de Leishmaniose Tegumentar.
Do mesmo modo, a atuação do Estado requer que as estratégias de controle sejam estabelecidas de acordo com realidade de cada Unidade Federada.
Implementar as atividades de referência da Leishmaniose Tegumentar Americana nos Centros de Zoonoses e Serviços de Referência de Dermatologia Sanitária com vistas a obtenção do impacto epidemiológico necessário.
(Revogado pela PRT GM/MS n° 781 de 09.04.2020)
ANEXO XXXIII
INFORMAÇÕES SOBRE A SÍNDROME DE IMUNODEFICIÊNCIA ADQUIRIDA E SUAS MEDIDAS DE CONTROLE (Origem: PRT MS/GM 236/1985, Anexo 1)
I) CONCEITOS BÁSICOS:
a) Síndrome de Imunodeficiência Adquirida: Atualmente, para efeitos epidemiológicos, identifica-se a síndrome como o conjunto de alterações provocadas pela perda de imunidade medida por células, a partir da ação de um agente viral, provavelmente o HTLV-III ou LAV e que se manifestam pelo aparecimento de infecções oportunistas e/ou neoplasias, particularmente o Sarcoma de Kaposi.
b) Grupos em risco: São considerados grupos em risco para a doença:
. homossexuais e bissexuais masculinos;
. usuários de drogas injetáveis;
. hemofílicos ou politransfundidos.
c) Caso Suspeito: É aquele que, pertencendo a um grupo de risco, apresenta um ou mais dos sintomas prodrômicos de SIDA ou AIDS: poliadenopatia, diarréia , febre, cansaço e perda de peso.
d) Caso Confirmado: É o indívíduo que, pertencendo a algum grupo de risco, apresente uma ou mais das seguintes entidades mórbidas:
1- Sarcoma de Kaposi, em indivíduos com menos de sessenta anos de idade;
2- Linfoma limitado ao cérebro;
3- Pneumonia por Pneumocystis carinii;
4- Toxoplasmose, causando pneumonia, ou infecção do sistema nervoso central;
5- Strongiloidíase, causando pneumonia , infecção do sistema nervoso central, ou infecção generalizada;
6- Candidíase, causando esofagite;
7- Criptococose, causando infecção pulmonar, do sistema nervoso central, ou disseminada;
8- Micobacterioses atípicas, comprovadas através da cultura;
9- Infecções causadas por citomegalovirus no pulmão, no trato gastrointestinal, sistema nervoso central, suprarenal e pâncreas;
10- Infecções por virus herpes, tipo um ou dois, muco-cutâneas (com úlceras que persistem por mais de um mês), pulmonares, do aparelho digestivo, ou disseminadas;
11- Leucoencefalopatia multifocal progressiva.
Devem-se usar como critérios de exclusão:
a)- História recente de terapia imunossupressora anterior ao aparecimento da doença.
b)- Presença de alguma outra enfermidade pré-existente associada com imunossuspenssão, como imunodeficiência congênita, processo de malignidade linfo-reticular ou subnutrição grave.
e) Comunicantes: Deverão ser considerados como tais os parceiros sexuais de casos confirmados de SIDA ou AIDS.
II- MEDIDAS DE CONTROLE
As medidas de controle e prevenção do AIDS consistem na execução de um conjunto de ações sobre os Casos confirmados, Casos suspeitos, Comunicantes, e Grupos em risco, quais sejam:
1) Os casos suspeitos ou confirmados devem ser submetidos a investigação epidemiológica, clínica, laboratorial e educação sanitária.
1.1 A investigação epidemiológica consta da identificação do grupo em risco, meio de transmissão e identificação de comunicantes.
1.2 A investigação clínica consta da identificação de sinais e sintomas de suspeita, tais como fadiga, febre persistente, sudorese noturna, calafrios, perda de peso acentuada, diarréia persistente, linfadenopatia generalizada, depressão e apatia, ou de confirmação, como infecção por germes oportunistas (pneumonia por Pneumocystis carinii, criptococose, candidíase, strongiloidíase, etc.), e/ou sarcoma de kaposi, e alguns tipos de linfomas de formas clínicas atípicas, quando à idade de incidência, ou gravidade e peculiaridade do quadro clínico.
1.3 A investigação laboratorial consiste na identificação, dos germes causadores das infecções oportunistas, realização de hemograma e de perfil imunológico, que consiste de testes intra-dérmicos (PPD, estreptoquinase, estreptodornase, candidina, tricofitina e DNCB), dosagem de linfócitos T e B, quantificação e relação dos linfócitos T-auxiliadores (OCT4) e T-surpressores (OKT8) e cultura de linfócitos.
A utilização de testes sorológicos, como dosagem da beta-dois-microglobulina anti-HTLV não tem indicação de utilização extensiva no País.
1.4 A educação sanitária constará de informação, aos pacientes, dos meios simples de diminuir a transmissibilidade da doença, tendentes a evitar a promiscuidade sexual e à doação de sangue.
2) Os comunicantes devem ser submetidos à investigação epidemiológica, clinica e educação sanitária conforme o descrito no parágrafo anterior.
3) Para os indivíduos pertencentes aos grupos em risco realizar-se-ão apenas programas de educação sanitária.
3.1 O AIDS, como doença sexualmente transmissível, deve ser prevenida através da informação aos indivíduos dos grupos em risco (homossexuais ou bissexuais do sexo masculino) sobre a maior incidência da doença com a multiplicidade de parceiros sexuais, esclarecendo-se que o risco aumenta proporcionalmente ao número de parceiros. Há indícios, de que o uso de preservativos, no ato sexual, diminue a transmissibilidade da síndrome.
3.2 Os viciados em drogas injetadas intravenosamente devem ser orientados para a interrupção desta prática ou, no mínimo, para a utilização de material descartável de uso exclusivo e individual.
3.3 A Prevenção do AIDS transfusional deve ser enfocada sob diversos aspectos:
- Orientação ao doador de sangue, submetendo-se previamente à leitura de material explicativo sobre ítens que impedem a doação de sangue, incluindo dados sobre AIDS.
- O item anterior deve ser seguido de todos os procedimentos habituais, prévios à doação de sangue (anamnese, exame clínico e hematimétrico).
- Após a realização de exames sorológicos para detecção de lues, doença de Chagas e hepatite, as unidades positivas devem ser desprezadas.
- No tratamento do hemofílico devem ser utilizados os crioprecipitados preparados a partir de unidades individuais de sangue coletado. Os concentrados de fator VIII ou IX, industrializados ou oficinais só devem ser utilizados, após tratamento pelo calor ou por método químicos que inviabilizem a sua infectividade, proibindo-se gradual e rapidamente a utilização daqueles não tratados (pelo seu maior risco potencial de transmitir AIDS).
- Visando a autosuficiência do país em homo-derivados, há que se incentivar as indústrias nacionais e produzirem produtos tratados, visando à eliminação do risco de transmissão do AIDS.
- Considerando que o AIDS é um problema recente , sobretudo no âmbito da Hemoterapia , inexistindo portanto normas sanitárias federais a respeito, devem-se estabelecer, no Ministério da Saúde, mecanismos para que se procedam a tais medidas.
- Deve-se incluir na tabela de procedimentos do INAMPS os concentrados de fator VIII e IX tratados.
3.4 A prevenção junto ao pessoal da área de saúde deve ser realizada através de normas de precaução no manejo de sangue, fluídos, secreções e excreções .
O pessoal da área de saúde deve estar ciente de que não há nenhuma evidência de contágio através de contatos puramente sociais e ocupacionais, bem como através do ar, da comida ou objetos. Estudos realizados em países com maior experiência com o gravo revelam que sua ocorrência entre profissionais de saúde é praticamente nula.
. A necessidade de se observar precauções apropriadas para prevenir a disseminação da doença deve ser contrabalançada pela necessidade de se assegurar ao paciente discrição sobre seu estado.
. As medidas a serem tomadas devem ser semelhantes às recomendadas para prevenção de hepatite B, ou seja:
. As pessoas que têm contato com sangue, tecido, secreções, excreções ou objetos e superfícies potencialmente por eles contaminados devem usar luvas e, em seguida, lavar bem as mãos com água e sabão.
. Antes de entrar e sair do quarto de um paciente com AIDS, ou suspeita de AIDS, a lavagem das mãos é indispensável. As amostras destes pacientes devem ter rótulo especiais de identificação, sem mencionar especificamente a doença, e devem ser transportados em sacos plásticos ou em outro tipo de recipiente fechado. As superfícies contaminadas com sangue ou secreções devem ser desinfetadas imediatamente com diluição 1:10 de solução de hipoclorito de sódio a 5% ou álcool a 25%.
. As pessoas que têm contato direto com o sangue, secreções ou excreções desses pacientes, devem usar aventais.
. Não é necessário o uso rotineiro de máscaras para os pacientes com AIDS, a não ser aqueles que têm tosse, e só quando deixam o quarto. Os funcionários e visitas, que têm contato direto com pacientes com tosse, devem também usar máscaras.
. Seringas e agulhas devem ser colocadas em recipiente rígidos, não passíveis de perfuração. Sempre que possível deve ser usado material descartável.
A descontaminação de equipamento clínico-cirúrgico deve ser feita com as mesmas técnicas de esterilização recomendadas para pacientes com hepatite B.
III - MEDIDAS OPERACIONAIS
O controle da Síndrome de Imunodeficiência Adquirida no Brasil se fará através da execução das seguintes medidas operacionais:
1 . COORDENAÇÃO E EXECUÇÃO
A Divisão Nacional de Dermatologia Sanitária da Secretaria Nacional de Programas Especiais de Saúde, coordenará as ações de controle do SIDA ou AIDS, com as seguintes atribuições:
a - Consolidação do mecanismo de obtenção, análise e difusão das informações técnicas, particularmente, as epidemiológicas;
b - Fomento ao desenvolvimento de ciência e tecnologia e de recursos humanos para a área;
c - Produção de materiais educativos e normativos;
d - Apoio de recursos técnicos humanos e logísticos ao nível executor;
e - Definição, conjuntamente com as Secretarias de Estado de Saúde, das instituições de saúde que darão suporte regional ao programa;
f - Definição das instituições públicas que atuarão como centros de referência para o programa.
De igual forma, o nível executor será assumido pelas Secretarias do Estado de Saúde, através de uma estratégia gradual que contemple, prioritariamente, as áreas metropolitanas das Unidades Federadas que já contam com casos notificados da moléstia.
2. ACOMPANHAMENTO DO PROBLEMA
2.1 – A notificação dos casos será realizada diretamente das Secretarias Estaduais de Saúde ao órgão coordenador nacional (DNDS/MS). Cabe-lhes, nas diversas UFS, coletar os dados em todas as fontes sob a sua jurisdição. A informação deverá ser remetida até quinto dia útil do mês seguinte ao que corresponde a informação. Em termos de notificação, deverão incluir-se os seguintes ítens: iniciais do nome, idade, sexo, município de residência e enquadramento do caso (suspeito ou confirmado). Ademais, se recomenda a elaboração de uma ficha de investigação epidemiológica, da qual deverá ser anexada uma cópia à informação mensal de cada caso confirmado. Recomenda-se também que, a nível de Secretarias Estaduais, estabeleçam-se os mecanismo adequados para a obtenção de dados necessários. Podem-se concluir:
a – Caracterização de um órgão coordenador responsável, a nível da Secretaria de Saúde;
b – Solicitação da notificação telefônica imediata de todo caso suspeito ou confirmado;
c – Procura de notificações de casos novos nos centros geradores de dados.
O Ministério da Saúde remeterá, com periodicidade trimestral, um relatório acerca da evolução e da situação epidemiológica da doença no país.
Esta informação será difundida para as instituições oficiais de saúde do país e seletivamente, à instituições privadas e para os órgãos internacionais de saúde.
2.2 – Todo óbito em cujo atestado médico constar (parte IV da Declaração de Óbito) um dos diagnósticos a seguir relacionados deverá ser informado, pelo setor da Secretaria que manipule inicialmente dados de mortalidade, ao setor que coordena as ações referentes a SIDA ou AIDS, para as seguintes medidas:
a – Verificar se o caso já era conhecido, investigando-o se for o caso;
b – Confirmação (ou alteração) do (s) diagnóstico (s) definitivo (s).
Da mesma forma, o setor que coordena as ações referentes a SIDA ou AIDS deverá informar ao setor de mortalidade todo o óbito por este síndrome que for conhecido, para que seja identificada a respectiva declaração de óbito (D.O.), para as seguintes medidas:
a – Verificar o procedimento da D.O., complementando-o se for o caso;
b – Verificar o (s) diagnóstico (s), corrigindo-o (s), se for o caso.
Relação de diagnósticos ou termos que devem ser considerados:
a. Pneumonia por Pneumocystis carini ;
b. Toxoplasmose provocado pneumonia ou infecção do sistema nervoso central;
c. Esofagite por cândida;
d. Pneumonia por cândida;
e. Criptococose pulmonar, do sistema nervoso central ou disseminada;
f. Aspergilose pulmonar;
g. Micobacterioses atípicas;
h. Turberculose disseminada;
i. Infecções por citomegalovirus;
j. Infecções prolongadas ou disseminadas por herpes simples;
l . Varicela em adultos;
m. Sarcoma de Kaposi;
n. Linfoma limitado ao cérebro;
o. Linfoma de Burkit;
p. SIDA;
q. AIDS;
r. Imonodeficiência;
s. Deficiência imunitária;
t. Deficiência de imunidade celular;
u. Infecção oportunista.
3. DIFUSÃO DA INFORMAÇÃO
3.1. Educação técnica continuada
Os Serviços de saúde implementarão medidas de educação continuada destinadas aos profissionais que atendem diretamente à população, nos diversos níveis de atuação. Nesse sentido o Ministério da Saúde acionará, para o seu enfrentamento, o envolvimento de todas as estruturas governamentais, e no aspecto educativo, a articulação interinstitucional MS/MEC é imperiosa.
3.2. EDUCAÇÃO SANITÁRIA
Os Serviços de Saúde aplicação, de modo amplo e permanente, medidas de Educação Sanitária aos grupos de riscos do SIDA ou AIDS (Síndrome de Imunodeficiência Adquirida), de acordo com os seguintes princípios técnicos, respectivamente, para com:
a) Aspectos:
1 – Restringir a atividade sexual a um único parceiro;
2 – Evitar a doação de sangue;
3 – Procurar os serviços de saúde em caso de suspeita da doença.
b) Os comunicantes:
1 – Restringir a atividade sexual a um único parceiro;
2 – Evitar a doação de sangue;
3 – Procurar os serviços de saúde em caso de suspeita da doença.
c) Os homossexuais:
1 – Restringir a atividade sexual a um único parceiro;
2 – Evitar a doação de sangue;
3 – Procurar os serviços de saúde em caso de suspeita da doença.
d) Os tóxico-dependentes:
1 – Abandonar o uso de drogas;
2 – Utilizar, ao menos, seringas exclusivas ou descartáveis;
3 – Evitar a doação de sangue;
4 – Procurar os serviços de saúde em caso de suspeita da doença.
e) Os hemofílicos ou politransfundidos;
1 – Utilizar crioprecipitados artesanais ou concentrados industriais ou oficinais tratados;
2 – Procurar os serviços de saúde em caso de suspeita da doença.
§ 1. Os casos suspeitos ou confirmados serão submetidos a investigação epidemiológica, clínica, laboratorial e educação sanitária.
§ 2. Os comunicantes serão submetidos à investigação epidemiológica, clínica e educação sanitária.
§ 3. Os indivíduos pertencentes aos grupos em risco serão submetidos apenas à educação sanitária.
§ 4. Segundo o grupo em risco da síndrome, deve-se considerar a SIDA ou AIDS, sob os seguintes aspectos epidemiológicos.
a) doença sexualmente transmissível;
b) doença transmitida através de agulhas e seringas contaminadas, utilizadas em injeção intravenosa de drogas por tóxico-dependentes;
c) doença transmitida através de transfusão de sangue, componentes e derivados;
d) risco limitado para o pessoal da área de saúde.
ANEXO XXXIV
PROGRAMA NACIONAL PARA A PREVENÇÃO E O CONTROLE DAS HEPATITES VIRAIS(Origem:PRT MS/GM 2080/2003,Anexo1)
COMPETÊNCIAS E ATRIBUIÇÕES
I - Compete ao Ministério da Saúde:
a) instituir o Programa Nacional para a Prevenção e o Controle das Hepatites Virais, os princípios e diretrizes da implantação do Programa, bem como estabelecer critérios/exigências de habilitação de serviços, critérios de implantação das redes de assistência aos portadores de hepatites virais e os critérios técnicos de desenvolvimento do trabalho;
b) designar um Coordenador Nacional do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, subordinado ao Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS);
b) designar um Coordenador Nacional do Programa Nacional para a Prevenção e o Controle das Hepatites Virais, subordinado ao Departamento de Doenças de Condições Crônicas e Infecções Sexualmente Transmissíveis (DCCI/SVS/MS); (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
c) definir e implementar, por meio da Secretaria de Vigilância em Saúde as ações de vigilância epidemiológica e sanitária no âmbito das hepatites virais;
d) elaborar e publicar sob coordenação do Departamento de Vigilância, Prevenção e Controle de Infecções Sexualmente Transmissíveis, do HIV/AIDS e das Hepatites Virais (DIAHV/SVS/MS) em parceria com a Secretaria de Atenção à Saúde e a Secretaria de Ciência, Tecnologia e Insumos Estratégicos os Protocolos Clínicos e Diretrizes Terapêuticas a serem adotados pelo Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
d) elaborar e publicar sob coordenação do Departamento de Doenças e Condições Crônicas e Infecções Sexualmente Transmissíveis (DCCI/SVS/MS) em parceria com a Secretaria de Atenção Primária à Saúde, Secretaria de Atenção Especializada à Saúde e a Secretaria de Ciência, Tecnologia, Inovação e Insumos Estratégicos em Saúde os Protocolos Clínicos e Diretrizes Terapêuticas a serem adotados pelo Programa Nacional para a Prevenção e o Controle das Hepatites Virais; (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
e) definir e implementar planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos portadores de hepatites virais;
f) estabelecer as normas de funcionamento e cadastramento de serviços que integrarão as redes assistenciais, em seus respectivos níveis de complexidade;
g) articular com os estados, municípios e o Distrito Federal a implantação do Programa e o estabelecimento de mecanismos de controle, avaliação e acompanhamento do processo;
h) assessorar os estados e o Distrito Federal na implantação, em seus respectivos âmbitos de atuação, do Programa Nacional para a Prevenção e o Controle das Hepatites Virais e na organização de suas respectivas Redes Estaduais de Assistência aos Portadores de Hepatites Virais;
i) utilizar os sistemas de informação epidemiológica e assistencial para constituir um banco de dados que permita acompanhar e avaliar o desenvolvimento do Programa, definindo seus indicadores;
j) apoiar a realização de estudos de prevalência de base populacional para o conhecimento da distribuição das hepatites virais no País e outras pesquisas sobre a relevância de cada um dos fatores de risco;
k) alocar recursos financeiros destinados ao co-financiamento das atividades do Programa; e
l) divulgar o Programa de maneira a conscientizar e informar a população e os profissionais de saúde sobre a importância da realização das ações assistenciais previstas no Programa.
m) realizar a aquisição centralizada e distribuir aos Estados e Distrito Federal os medicamentos destinados ao tratamento das hepatites virais no SUS (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
II - Compete às Secretarias de Saúde dos Estados e do Distrito Federal:
a) elaborar, em parceria com as Secretarias Municipais de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
b) designar um Coordenador Estadual do Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
c) instituir Comitê de Coordenação integrado pelos órgãos estaduais que possuem as atribuições, relativas às hepatites virais, de acompanhamento epidemiológico, prevenção, controle e assistência;
d) organizar a Rede Estadual de Assistência aos Portadores de Hepatites Virais, identificando os serviços dela integrantes, em seus respectivos níveis de complexidade, estabelecendo os fluxos de referência e contra-referência entre estes serviços e garantindo a execução de todas as fases do processo assistencial previsto no Programa;
e) criar as condições para a estruturação/criação/implantação/cadastramento dos Centros de Referência em Assistência aos Portadores de Hepatites Virais;
f) implementar ações de vigilância epidemiológica e sanitária no âmbito das hepatites virais;
g) desenvolver planos e programas de treinamento e capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência aos portadores de hepatites virais;
h) articular com os demais gestores estaduais as eventuais referências interestaduais de pacientes cujas necessidades assistenciais não encontrem capacidade técnica instalada para o seu atendimento no Estado de origem;
i) assessorar os municípios no processo de implementação do Programa, no desenvolvimento das atividades e na adoção de mecanismos destinados ao controle, avaliação e acompanhamento do processo;
j) alocar, complementarmente, recursos financeiros próprios para o desenvolvimento /incremento do Programa;
k) monitorar o desempenho do Programa em seu Estado e os resultados alcançados; e
l) manter atualizados os bancos de dados que estejam sob a sua responsabilidade.
m) realizar a distribuição interna e a dispensação dos medicamentos destinados ao tratamento das hepatites virais disponibilizados pelo Ministério da Saúde, conforme pactuação em CIB; (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
III - Compete às Secretarias Municipais de Saúde:
a) elaborar, em parceria com a respectiva Secretaria Estadual de Saúde, as estratégias de implantação, em seu âmbito de atuação, do Programa Nacional para a Prevenção e o Controle das Hepatites Virais;
b) criar as condições para a estruturação/criação/implantação/cadastramento de serviço(s) de Nível I e adotar as providencias necessárias para integrá-lo(s) à Rede Estadual Assistência aos Portadores de Hepatites Virais;
c) apoiar a estruturação/manutenção/funcionamento dos Serviços de Nível II e dos Centros de Referência em Assistência aos Portadores de Hepatites Virais que estejam instalados em seu Município;
d) alocar, complementarmente, recursos financeiros próprios para o desenvolvimento /incremento do Programa;
e) monitorar o desempenho do Programa em seu Município e os resultados alcançados;
f) executar ações de vigilância epidemiológica das hepatites virais;
g) realizar capacitação de recursos humanos nas áreas de prevenção, vigilância e assistência dos portadores de hepatites virais;
h) manter atualizados os bancos de dados que estejam sob sua responsabilidade, que deverão ser notificados ao gestor estadual do SUS; e
i) promover a mobilização da comunidade, dos grupos de risco e profissionais de saúde visando a efetiva participação nas ações de prevenção e controle das hepatites.
j) realizar, em parceria com a respectiva Secretaria Estadual de Saúde, a dispensação dos medicamentos destinados ao tratamento das hepatites virais disponibilizados pelo Ministério da Saúde, conforme pactuação em CIB; (Redação dada pela PRT GM/MS nº 1.537 de 12.06.2020)
ANEXO XXXV
CRITÉRIOS PARA PONTUAÇÃO, CLASSIFICAÇÃO E RELAÇÃO DOS HOSPITAIS (Origem: PRT MS/GM 931/2012, Anexo 1)
| Critérios para pontuação dos Hospitais | |
|---|---|
| 1) Hospitais inseridos em UFs com capacidade instalada, em radioterapia, inferior a demanda estimada de casos novos de câncer (suboferta), sendo adotada a relação de um equipamento (acelerador linear ou unidade de telecobaltoterapia) para cada mil casos .novos de câncer, conforme parâmetro estabelecido pela Portaria SAS/MS nº 741/2005. | |
| Critério | Pontuação |
| Apresentar déficit em serviço de radioterapia, igual a 1 (um), na UF onde se encontra o hospital | 1 (um) ponto |
| Apresentar déficit de radioterapia, igual a 2 (dois), na UF onde se encontra o hospital | 2 (dois) pontos |
| Apresentar déficit de radioterapia, igual a 3 (três), na UF onde se encontra o hospital | 3 (três) pontos |
| Apresentar déficit de radioterapia, maior que 3 (três), na UF onde se encontra o hospital | 4 (quatro) pontos |
| 2)As UFs que não apresentaram déficit em RT, porém em suas macrorregiões existe capacidade instalada, em radioterapia, inferior a demanda estimada de casos novos de câncer (suboferta), foi adotada a mesma relação de um equipamento (acelerador linear ou unidade de telecobaltoterapia) para cada mil casos novos de câncer, conforme parâmetro estabelecido pela Portaria SAS/MS nº 741/2005: | |
| Critério | Pontuação |
| Apresentar déficit em serviço de radioterapia, igual a 1 (um), na macrorregião onde se encontra o hospital | 1 (um) ponto |
| Apresentar déficit de radioterapia, igual a 2 (dois), na macrorregião onde se encontra o hospital | 2 (dois) pontos |
| Apresentar déficit de radioterapia, igual a 3 (três), na macrorregião onde se encontra o hospital | 3 (três) pontos |
| Apresentar déficit de radioterapia, maior que 3 (três), na macrorregião onde se encontra o hospital | 4 (quatro) pontos |
| 3)Natureza jurídica da instituição: | |
| Critério | Pontuação |
| Ser hospital filantrópico | 0 (zero) ponto |
| Ser hospital público | 1 (um) ponto |
| 4) Possuir número total de leitos, exceto os obstétricos, conforme intervalos | |
| Critério | Pontuação |
| 0 a 50 | 0 (zero) ponto |
| 51 a 100 | 3 (três) pontos |
| 101 a 150 | 6 (seis) pontos |
| Maior que 151 | 10 (dez) pontos |
| 5) Hospitais que atendam aos parâmetros mínimos de produção, estabelecidos pela Portaria SAS/MS nº 741/2005 para cada uma das principais modalidades terapêuticas, respeitada sua habilitação* | |
| 5.1) Cirurgia oncológica (CO) | |
| Critério | Pontuação |
| Proporcional à capacidade instalada (0 a 25%) | 0 (zero) ponto |
| Proporcional à capacidade instalada (26 a 50%) | 3 (três) pontos |
| Proporcional à capacidade instalada (51 a 75%) | 6 (seis) pontos |
| Proporcional à capacidade instalada (maior que 75%) | 10 (dez) pontos |
| 5.2) Quimioterapia (QT) | |
| Critério | Pontuação |
| Proporcional à capacidade instalada (0 a 25%) | 0 (zero) ponto |
| Proporcional à capacidade instalada (26 a 50%) | 3 (três) pontos |
| Proporcional à capacidade instalada (51 a 75%) | 6 (seis) pontos |
| Proporcional à capacidade instalada (maior que 75%) | 10 (dez) pontos |
| 5.3) Radioterapia (RT) | |
| Proporcional à capacidade instalada (0 a 25%) | 0 (zero) ponto |
| Proporcional à capacidade instalada (26 a 50%) | 3 (três) pontos |
| Proporcional à capacidade instalada (51 a 75%) | 6 (seis) pontos |
| Proporcional à capacidade instalada (maior que 75%) | 10 (dez) pontos |
| 6) Participação no Sistema de Registro Hospitalar de Câncer - SisRHC | |
| Critério | Pontuação |
| Não participar do sistema de informação SisRHC | 0 (zero) ponto |
| Instituição participante do Sistema de Registro Hospitalar de Câncer e não enviando informações regulares ao SisRHC | 5 (cinco) pontos |
| Instituição participante do Sistema de Registro Hospitalar de Câncer e enviando informações regulares ao SisRHC | 10 (dez) pontos |
| Critérios para classificação dos Hospitais |
| Déficit macrorregional. |
| Pontuação hospitalar |
| Critérios para relacionar os Hospitais |
| Ampliação |
| Hospital com serviço de radioterapia com um só equipamento de megavoltagem |
| Obsolescência dos equipamentos existentes. |
| Produção radioterápica. |
| Estruturação em redes de atenção e produção dos serviços existentes, buscando o acesso assistencial. |
| Necessidade macrorregional - já computados os projetos em andamento. |
| Criação |
| Estruturação em redes de atenção, buscando o acesso assistencial. |
| Necessidade macrorregional - já computados os projetos em andamento |
| Critérios de desempate |
| Natureza Jurídica - Público |
| Estar em UF com déficit em serviço de radioterapia. |
| Uso racional de RH (ampliação > criação)**. |
*Computada toda a produção para o hospital quando habilitado como complexo hospitalar ou terceiriza o serviço de radioterapia, quimioterapia ou cirurgia com outro estabelecimento.
**Utilização máxima dos recursos humanos especializados de nível técnico e superior disponíveis em um determinado município ou estado.
ANEXO XXXVI
MODALIDADES DE EQUIPES DE DESINSTITUCIONALIZAÇÃO (Origem: PRT MS/GM 2840/2014, Anexo 1)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
ANEXO XXXVII
"AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS" (Origem: PRT MS/GM 2840/2014, Anexo 2)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
EQUIPE DE DESINSTITUCIONALIZAÇÃO -
MODALIDADE: ________________________
VALOR DO PROJETO: _____________
1. DADOS GERAIS:
1.1 ESTADO: _________________________
1.2 MUNICÍPIO: ____CNES Secretaria Municipal de Saúde: ___
1.3 HOSPITAL: ___________CNES: __________________
N. DE LEITOS SUS: ______PÚBLICO ( ) PRIVADO ( )
GESTÃO MUNICIPAL ( ) ESTADUAL ( )
1.4 NÚMERO DE PESSOAS COM INTERNAÇÃO DE LONGA PERMANÊNCIA: ________________________
2. DIAGNÓSTICO SITUACIONAL
2.1 RAPS EXISTENTE NO MUNICÍPIO
2.2 SITUAÇÃO E CONDIÇÕES GERAIS DO HOSPITAL PSIQUIÁTRICO
2.3 SITUAÇÃO E CONDIÇÕES GERAIS DAS PESSOAS COM INTERNAÇÃO DE LONGA PERMANÊNCIA
2.4 LEVANTAMENTO INICIAL DA PROCEDÊNCIA E DOS MUNICÍPIOS DE RESIDÊNCIA ATUAL DAS FAMÍLIAS DAS PESSOAS, COM INTERNAÇÃO DE LONGA PERMANÊNCIA, A SER ATUALIZADO DURANTE O PROCESSO. (COM OBSERVAÇÃO DAS RECOMENDAÇÕES DO PARAGRAFO ÚNICO DO ART 5º)
3. "AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS" (COM OBSERVAÇÃO DAS RECOMENDAÇÕES DOS ART. 5º, 6º, 7º. 9º e 17º):
3.1 ATUAÇÃO DA EQUIPE DE DESINSTITUCIONALIZAÇÃO: AÇÕES - META - CRONOGRAMA
3.2 ESTRATÉGIAS E PONTOS DE ATENÇÃO A SEREM DESENVOLVIDOS NA RAPS (DE ACORDO COM A MATRIZ DIAGNÓSTICA DA PORTARIA Nº 3.088/GM/MS DE 23 DE DEZEMBRO DE 2011, REPUBLICADA NO DOU DE 21 DE MAIO DE 2013)
AÇÕES - META - CRONOGRAMA
3.3. PARCERIAS PROPOSTAS:
- OUTROS MUNICÍPIOS? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
_____________________________________________________________________________
- UNIVERSIDADES? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
- ENTIDADES DE DEFESA DOS DIREITOS HUMANOS?
( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
- MOVIMENTOS SOCIAIS? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
- INSTITUIÇÕES DO CAMPO DO DIREITO E NÚCLEOS DE ASSESSORIA JURÍDICA VINCULADOS ÀS FACULDADES DE
DIREITO? ( ) SIM ( ) NÃO
DESCRIÇÃO RESUMIDA DA PROPOSTA:
______________________________________________________________________________
4. ESTRATÉGIAS DE MONITORAMENTO E AVALIAÇÃO DAS "AÇÕES DE DESINSTITUCIONALIZAÇÃO E DE FORTALECIMENTO DA RAPS" (COM OBSERVAÇÃO DAS RECOMENDAÇÕES DO ART 20º e 21º)
______________________________________________________________________________
5. PLANEJAMENTO DA REALOCAÇÃO DOS PROFISSIONAIS DA(S) EQUIPE(S) DE DESINSTITUCIONALIZAÇÃO PARA A QUALIFICAÇÃO DOS PONTOS DE ATENÇÃO E COMPONENTES DA RAPS
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
______________________________________________________________________________
ANEXO XXXVIII
OFICIO DE SOLICITAÇÃO DE INCENTIVO FINANCEIRO (Origem: PRT MS/GM 2840/2014, Anexo 3)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretario(a) Municipal de Saúde, ____________________, vem por meio deste solicitar o recurso financeiro a ser incorporado no teto de média e alta complexidade para a implantação da modalidade ___________________ do Programa de Desinstitucionalização.
_____________________________________________
Secretário(a) Municipal de Saúde
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
ANEXO XXXIX
TERMO DE COMPROMISSO (Origem: PRT MS/GM 2840/2014, Anexo 4)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretario(a) Municipal de Saúde, ____________________, vem por meio deste, assegurar a criação do Programa de Desinstitucionalização integrante do componente "Estratégias de Desinstitucionalização" da RAPS, e a realização de todas as etapas previstas nas "Ações de Desinstitucionalização e de Fortalecimento da RAPS" conforme o cronograma apresentado, assim como o desenvolvimento dos investimentos necessários para a efetividade do trabalho proposto.
_____________________________________________
Secretário(a) Municipal de Saúde
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
ANEXO XL
OFÍCIO REFERENTE A REALOCAÇÃO DA EQUIPE DE DESINSTITUCIONALIZAÇÃO (Origem: PRT MS/GM 2840/2014, Anexo 5)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretário(a) Municipal de Saúde, ____________________, vem por meio deste informar a realocação da Equipe de Desinstitucionalização para qualificação dos pontos de atenção da RAPS, de acordo com os Art. 7º e 17°, desta Portaria. A descrição da realocação da equipe será apresentada no Anexo VI.
_____________________________________________
Secretário(a) Municipal de Saúde
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
ANEXO XLI
DESCRIÇÃO DA REALOCAÇÃO FINAL DA(S) EQUIPE(S) DE DESINSTITUCIONALIZAÇÃO(Origem:PRT MS/GM 2840/2014,Anexo 6)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
ANEXO XLII
OFICIO REFERENTE A REDUÇÃO DO NÚMERO DE LEITOS E RECLASSIFICAÇÃO DO HOSPITAL PSIQUIÁTRICO (Origem: PRT MS/GM 2840/2014, Anexo 7)
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
O MUNICÍPIO DE _____________, através da SECRETARIA MUNICIPAL DE SAÚDE, representada pelo(a) Secretário(a) Municipal de Saúde, ____________________, vem por meio deste informar que foram fechados _____ leito(s) do Hospital Psiquiátrico __________________________________________ com CNES __________. Informo, ainda, que os referidos leitos foram excluídos do CNES do Hospital _______________________________________________________________.
(Se necessário) Dessa forma, solicito a reclassificação do hospital psiquiátrico _______________________________________ de acordo com o Programa Anual de Reestruturação da Assistência Psiquiátrica Hospitalar no SUS (PRH), instituído pela Portaria Nº 52/GM/MS de 20 de janeiro de 2004 e alterada pela Portaria N°2644 GM/MS de 28 de outubro de 2009 tendo em vista que o referido hospital apresenta, na atualidade _________ leitos.
_____________________________________________
Secretário(a) Municipal de Saúde
(Revogado pela PRT GM/MS Nº 596 de 22.03.2022)
ANEXO XLIII
LISTA NACIONAL DE DOENÇAS E AGRAVOS A SEREM MONITORADOS PELA ESTRATÉGIA DE VIGILÂNCIA SENTINELA (Origem: PRT MS/GM 205/2016, Anexo 1)
ANEXO
Lista Nacional de Doenças e Agravos a serem monitorados pela Estratégia de Vigilância Sentinela
ANEXO XLIII
LISTA NACIONAL DE DOENÇAS E AGRAVOS A SEREM MONITORADOS PELA ESTRATÉGIA DE VIGILÂNCIA SENTINELA
(Redação dada pela PRT GM/MS n° 5.201 de 15.08.2024)
| I. | Vigilância de doenças de transmissão respiratória |
| 1 | Doença pneumocócica invasiva |
| 2 | Síndrome Respiratória Aguda Grave (SRAG) |
| 3 | Síndrome Gripal (SG) |
| II. | Vigilância de doenças de transmissão hídrica e/ou alimentar |
| 1 | Rotavírus |
| 2 | Doença Diarreica Aguda |
| 3 | Síndrome Hemolítica Urêmica |
| III. | Vigilância de doenças sexualmente transmissíveis |
| 1 | Síndrome de Corrimento Uteral Masculino |
| IV. | Síndrome neurológica pós infecção febril exantemática |
(Redação dada pela PRT GM/MS n° 5.201 de 15.08.2024)
ANEXO XLIV (Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
VIGILÂNCIA EPIDEMIOLÓGICA HOSPITALAR - VEH (Origem: PRT MS/GM 183/2014, Anexo 3)
VIGILÂNCIA EPIDEMIOLÓGICA HOSPITALAR - VEH
O montante do recurso a ser repassado para os entes federativos habilitados à Rede de Vigilância Epidemiológica Hospitalar de interesse nacional, do qual será deduzido o montante de recursos dos hospitais de gestão federal que vierem a ser definidos pelo ente federado para compor a rede em seu território, será de:
ANEXO XLV
REGISTRO DE CÂNCER DE BASE POLULACIONAL - RCBP (Origem: PRT MS/GM 183/2014, Anexo 4)
(Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
REGISTRO DE CÂNCER DE BASE POLULACIONAL - RCBP
A habilitação ao recebimento do recurso referente ao Registro de Câncer de Base Populacional será destinado aos seguintes entes federativos:
ANEXO XLVI
VIGILÂNCIA SENTINELA DA INFLUENZA (Origem: PRT MS/GM 183/2014, Anexo 5)
(Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
VIGILÂNCIA SENTINELA DA INFLUENZA
O financiamento da Vigilância Sentinela da Influenza obedecerá ao seguinte parâmetro populacional:
*A cada intervalo populacional de 500.000 habitantes deve-se implantar 01 Vigilância da SG
(Revogado pela PRT GM/MS n° 3.311 de 12.12.2019)
ANEXO XLVI-A
Da Câmara Técnica de Assessoramento em Imunização (CTAI)
(Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
Art. 1º A Câmara Técnica de Assessoramento em Imunização - CTAI, de caráter consultivo, tem como objetivo prestar assessoria técnica e científica em matéria de interesse do Programa Nacional de Imunizações do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 470 de 13.04.2023).
Art. 1º A Câmara Técnica de Assessoramento em Imunização - CTAI, de caráter consultivo, tem como objetivo de avaliar os aspectos técnicos e científicos necessários à implementação do Programa Nacional de Imunizações. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 1º A Câmara Técnica de Assessoramento em Imunização - CTAI, de caráter consultivo, tem como objetivo prestar assessoria técnica e científica em matéria de interesse do Programa Nacional de Imunizações do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
Art. 2º Compete à CTAI: (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 2º Nos termos solicitados por seu coordenador, compete à CTAI: (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
I - analisar a situação epidemiológica das doenças imunopreveníveis; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
I - desenvolver estudos técnicos e científicos sobre imunização; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
II - propor ações para implementação do Programa Nacional de Imunizações; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
II - avaliar a necessidade de atualização do Calendário Nacional de Vacinação; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
III - propor a atualização do Calendário Nacional de Vacinação; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
III - analisar a situação da cobertura vacinal em âmbito nacional; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
IV - analisar a situação da cobertura vacinal em âmbito nacional; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
IV - analisar a situação das doenças imunopreveníveis em âmbito nacional; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
V - realizar análise técnica e científica para propor a definição do público alvo e estimativa de doses necessárias para a imunização; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
V - subsidiar técnica e cientificamente a definição do público alvo para a imunização; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
VI - propor ações de disseminação das informações e do conhecimento que possam esclarecer a população acerca da imunização; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
VI - propor ações de disseminação das informações e do conhecimento, que possam esclarecer a população acerca da imunização; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
VII - propor ações para a operacionalização da vacinação; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
VII - auxiliar técnica e cientificamente as decisões do Ministério da Saúde no tocante à segurança do cumprimento do esquema vacinal; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
VIII - auxiliar técnica e cientificamente as decisões no tocante à segurança do cumprimento do esquema vacinal; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
VIII - propor diretrizes nas áreas de pesquisa, produção, aquisição, distribuição e utilização de imunobiológicos, fundamentadas em avaliações sistemáticas e em dados técnicos e científicos; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
IX - propor diretrizes nas áreas de pesquisa, produção, aquisição, distribuição e utilização de imunobiológicos, fundamentado em avaliações sistemáticas e em dados técnicos científicos; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
IX - elaborar manifestação técnica e científica sobre temas de interesse do Programa Nacional de Imunizações; e (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
X - elaborar manifestação técnica e científica sobre temas relacionados ao Programa Nacional de Imunizações; e (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Revogado pela PRT GM/MS nº 3.473 de 12.09.2022) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
X - contribuir na revisão e elaboração de normas técnicas e científicas de interesse do Programa Nacional de Imunizações. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Revogado pela PRT GM/MS nº 3.473 de 12.09.2022)
XI - elaborar seu regimento interno. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Revogado pela PRT GM/MS nº 3.473 de 12.09.2022) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 3º A CTAI será composta por um representante: (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 3º A CTAI será composta: (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
I - do Departamento de Imunização e Doenças Imunopreveníveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde, que o coordenará; (Redação dada pela PRT GM/MS nº 470 de 13.04.2023).
I - do Departamento de Imunização e Doenças Transmissíveis - DEIDT/SVS/MS, que o coordenará; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
I - pelo Diretor do Departamento de Imunização e Doenças Transmissíveis da Secretaria de Vigilância em Saúde do Ministério da Saúde - DEIDT/SVS/MS, que a coordenará; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
II - da Coordenação-Geral de Incorporação Científica e Imunização do Departamento de Imunização e Doenças Imunopreveníveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da saúde; (Redação dada pela PRT GM/MS nº 470 de 13.04.2023).
II - da Coordenação-Geral do Programa Nacional de Imunizações da Secretaria de Vigilância em Saúde - CGPNI/DEIDT/SVS/MS; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
II - pelo Coordenador-Geral do Programa Nacional de Imunizações do Departamento de Imunização e Doenças Transmissíveis da Secretaria de Vigilância em Saúde do Ministério da Saúde - CGPNI/DEIDT/SVS/MS; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
III - do Conselho Nacional de Secretários de Saúde - CONASS; (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
III - por um representante do Conselho Nacional de Secretários de Saúde - CONASS; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
IV - do Conselho Nacional de Secretários Municipais de Saúde - CONASESMS; e (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
IV - por um representante do Conselho Nacional de Secretários Municipais de Saúde - CONASEMS; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
V - de órgãos e entidades governamentais e não governamentais, que estejam envolvidos técnica e cientificamente com a temática, e especilistas de notório conhecimento em assuntos relacionados à imunização. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
V - por representantes de órgãos ou entidades, públicos ou privados, que estejam envolvidos técnica e cientificamente com a temática; e (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
VI - por especialistas de notório conhecimento em assuntos relacionados à imunização. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
§ 1º Os membros da CTAI de que tratam os incisos I a II serão os titulares dos órgãos e os suplentes os seus respectivos substitutos legais. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 1º Os suplentes dos representantes da CTAI de que tratam os incisos I e II do caput serão os seus substitutos legais. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
§ 2º Os membros, titulares e suplentes, de que tratam os incisos III e IV serão indicados ao coordenador da Câmara pelos titulares das entidades. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 2º Os representantes, titulares e suplentes, de que tratam os incisos III e IV do caput serão indicados ao coordenador da CTAI pelos titulares das entidades. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
§ 3º Os membros de que trata o inciso V serão indicados pelo coordenador da Câmara de acordo com os assuntos tratados na CTAI, observado o disposto na Portaria GM/MS nº 87, de 19 de janeiro de 2021. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 3º A indicação dos órgãos ou entidades de que trata o inciso V do caput e dos especialistas de que trata o inciso VI do caput será: (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
I - feita pela Coordenação-Geral do Programa Nacional de Imunização, de acordo com os assuntos a serem tratados nas reuniões; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
II - submetida à aprovação do coordenador da CTAI; e (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
III - formalizada por convite mediante ofício do Secretário de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
§ 4º Os representantes de que tratam os incisos V e VI do caput devem atender aos seguintes requisitos: (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
I - não possuir qualquer vínculo ou circunstância que possa suscitar potencial conflito de interesse em relação ao tema submetido a sua análise, de forma a permitir a atuação com independência e idoneidade; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
II - possuir qualificação técnica e acadêmica necessária à atividade solicitada; e (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
III - manter confidencialidade em relação à documentação e informação técnica obtida, nos termos da legislação aplicável. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
§ 5º Os representantes de que tratam os incisos III e IV do caput devem atender ao disposto nos incisos I e III do § 4º. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
§ 6º Para fins do disposto nos incisos I e III do § 4º e no § 5º, deverão ser firmados os termos constantes dos Anexos 1 e 2, sem prejuízo da prestação de informações adicionais, a critério do coordenador da CTAI. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
Art. 4º A CTAI se reunirá em caráter ordinário semestralmente e em caráter extraordinário, sempre que necessário e por convocação de seu Coordenador. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
§ 1º O quórum de reunião da Câmara é de 7 (sete) membros e as decisões serão tomadas por consenso. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
§ 2º Caso não exista consenso, a decisão deverá ser tomada pelo Coordenador da reunião. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
§ 3º As reuniões da Câmara serão feitas presencialmente ou por meio de videoconferência. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
§ 4º As reuniões da Câmara serão formalizadas em ata, e as deliberações serão submetidas ao dirigente da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 470 de 13.04.2023).
§ 4º As reuniões da Câmara serão formalizadas em ata e as deliberações serão submetidas ao Secretário de Vigilância em Saúde. (Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021) (Represtinado pela PRT GM/MS nº 13 de 13.01.2023)
§ 5º O convite para a reunião da CTAI indicará os assuntos a serem tratados, o local, a data e o horário da reunião.(Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
§ 6º Em cada reunião, os representantes de que tratam os incisos III a VI do caput do art. 3º deverão firmar as declarações a que se refere o § 6º do art. 3º. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
§ 7º As manifestações da CTAI são consideradas atos preparatórios, nos termos do art. 20 do Decreto nº 7.724, de 16 de maio de 2012, e serão de acesso restrito até a tomada de decisão final pela autoridade competente do Ministério da Saúde.(Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
§ 8º Compete ao coordenador da CTAI: (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
I - aprovar a pauta de reunião; (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
II - aprovar a indicação dos representantes da CTAI, nos termos do § 3º do art. 3º;(Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
III - formalizar a ata de reunião; e (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
IV - submeter as manifestações da CTAI à ciência do Secretário de Vigilância em Saúde.(Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
Art. 5º A Secretaria-Executiva da CTAI será exercida pela Coordenação-Geral de Incorporação Científica e Imunização do Departamento de Imunização e Doenças Imunopreveníveis da Secretaria de Vigilância em Saúde e Ambiente do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 470 de 13.04.2023).
Art. 5º A Secretaria-Executiva da CTAI será exercida pela CGPNI/DEIDT/SVS/MS.(Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
Art. 6º A participação na CTAI será considerada prestação de serviço público relevante, não remunerada(Redação dada pela PRT GM/MS nº 1.841 de 05.08.2021)
Art. 7º A manifestação da CTAI não afasta a necessidade de observância do devido processo administrativo para a incorporação, a exclusão ou a alteração pelo Sistema Único de Saúde - SUS de novos medicamentos, produtos e procedimentos, bem como para a constituição ou a alteração de protocolo clínico ou de diretriz terapêutica, nos termos dos arts. 19-Q e 19-R da Lei nº 8.080, de 19 de setembro de 1990. (Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022) (Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
ANEXO 1 DO ANEXO XLVI-A
DECLARAÇÃO DE AUSÊNCIA DE CONFLITO INTERESSES
(Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
Eu,______________________________________________________________, portador do CPF nº________________________e da cédula de identidade nº _____________________, para participar da Câmara Técnica de Assessoramento em Imunizações (CTAI), prestando um serviço consultivo de interesse para o Ministério da Saúde, e tendo fornecidas todas as informações pertinentes para a participação na CTAI, declaro, para os devidos fins, que não possuo nenhum tipo de conflito de interesse relacionado ao tema submetido à minha análise, viabilizando, desta forma, a minha atuação técnico-científica.
Declaro ter ciência de que a prestação de declaração falsa me sujeitará às penalidades previstas na legislação.
Data: ____________
Assinatura:
(Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
ANEXO 2 DO ANEXO XLVI-A
TERMO DE CONFIDENCIALIDADE
(Redação dada pela PRT GM/MS nº 3.473 de 12.09.2022)
Eu ____________________________________________, inscrito(a) no CPF/MF sob o nº _______________, abaixo firmado, assumo o compromisso de manter confidencialidade e sigilo das informações técnicas e outras relacionadas à reunião da Câmara Técnica de Assessoramento em Imunização do Ministério da Saúde. Por este termo de confidencialidade e sigilo comprometo-me:
1. A não utilizar QUAISQUER informações (Técnicas Administrativas ou Gerenciais), confidenciais ou não, a que tiver acesso, para gerar benefício próprio exclusivo e/ou unilateral, presente ou futuro, ou para o uso de terceiros;
2. A não efetuar nenhuma gravação ou cópia da documentação a que tiver acesso;
3. A não apropriar para mim ou para outrem de QUALQUER material técnico, gerencial ou administrativo que venha a ser disponível;
4. A não repassar o conhecimento das informações, responsabilizando-se por todas as pessoas que vierem a ter acesso às informações, por meu intermédio, sob pena de ressarcir a ocorrência de qualquer dano e/ou prejuízo oriundo de uma eventual quebra de sigilo ou confidencialidade de todas as informações fornecidas.
5. Em cuidar para que as informações confidenciais fiquem restritas ao conhecimento tão somente das pessoas que estejam diretamente envolvidos nas discussões, análises, reuniões e negócios, devendo cientificá-los da existência deste Termo e da natureza confidencial destas informações.
Neste Termo, as seguintes expressões serão a ssim definidas:
Informação Confidencial: toda informação revelada e decisões adotadas no âmbito da Reunião CTAI/MS. A informação inclui, mas não se limita, aos documentos técnicos formalizados, documentações produzidas, relatórios técnicos, metodologias de estudo apresentadas em reunião, fonte de informação, dentre outras.
Não constituirá "Informação" ou "Informação Confidencial" para os propósitos deste Termo aquela que:
a. Seja de domínio público no momento da revelação ou após a revelação, exceto se isso ocorrer em decorrência de ato ou omissão da Parte Receptora;
b. Já esteja em poder da Parte Receptora, como resultado de sua própria pesquisa, contanto que a Parte Receptora possa comprovar esse fato;
c. Tenha sido legitimamente recebida de terceiros;
d. Seja revelada em razão de uma ordem válida ou de uma ordem judicial, somente até a extensão de tais ordens, contanto que a Parte Receptora tenha notificado a existência de tal ordem, previamente e por escrito, à Parte Reveladora, dando a esta, na medida do possível, tempo hábil para pleitear medidas de proteção que julgar cabíveis;
A vigência da obrigação de confidencialidade e sigilo, assumida pela minha pessoa por meio deste termo, terá a validade enquanto a informação não for tornada de conhecimento público por qualquer outra pessoa, ou mediante autorização escrita, concedida à minha pessoa pelas partes interessadas neste termo.
Pelo não cumprimento do presente Termo de Confidencialidade e Sigilo, fica o abaixo assinado ciente de todas as sanções judiciais que poderão advir.
Brasília, ___ de ______________ de _______. ____________________________________________
Nome/Assinatura/Carimbo
(Redação suprimida pela PRT GM/MS nº 13 de 13.01.2023)
ANEXO XLVII
INSUMOS ESSENCIAIS PARA IMPLEMENTAÇÃO DA ESTRATÉGIA AIDPI (Origem: PRT MS/GM 1397/2017, Anexo 1)
1. Aparelho de pressão infantil
2. Espaçador infantil para inalação
3. Estetoscópio infantil
4. Hemoglobinômetro
5. Jarra e copos descartáveis para terapia de reidratação oral
6. Máscara infantil para inalação
7. Oxímetro de pulso
8. Abaixador de língua
9. Aparelho de nebulização
10. Balança infantil
11. Caderneta de Saúde da Criança
12. Fita métrica
13. Formulários de atendimento da criança
14. Otoscópio
15. Régua antropométrica
16. Termômetro clínico
ANEXO XLVIII
MEDICAMENTOS ESSENCIAIS PARA A IMPLEMENTAÇÃO DA ESTRATÉGIA AIDPI (Origem: PRT MS/GM 1397/2017, Anexo 2)
1. Acetato de betametasona injetável 3mg/ml
2. Ácido fólico comprimido 5mg ou suspensão 0.2 mg/ml
3. Albendazol suspensão 40mg/ml
4. Amoxicílina comprimido de 250 mg ou suspensão 250mg/5m
5. Amoxixilina + clavulanato de potássio suspensão 250mg/5ml
6. Antimalárico oral, em áreas endémicas
7. Azitromicina suspensão 40mg/ml
8. Cefalexina suspensão 250mg/5ml
9. Dipirona comprimido de 500mg ou gotas
10. Eritromicina suspensão 250mg/5ml
11. Ibuprofeno suspensão 50mg/ml
12. Mebendazol comprimido de 100mg ou suspensão
13. Nistatina suspensão 100.000 UI
14. Ondansentrona comprimido de 4mg
15. Paracetamol comprimido de 500mg ou gotas
16. Penicilina benzatina 1.200.000 ou 600.000 UI
17. Penicilina G procaína frasco de 400 000 UI
18. Predinisolona suspensão 3mg/ml
19. Prednisona comprimidos 5mg e 20mg
20. Sais de reidratação oral (SRO)
21. Salbutamol ou Fenoterol 100 mcg/dose, aerossol (bombinha)
22. Solução de ringer + lactato
23. Solução Fisiológica 0,9%
24. Soro Glicosado 5%
25. Sulfametoxazol + Trimetoprima suspensão 40 mg/ml + 8mg/ml
26. Sulfato de zinco xarope 4mg/ml
27. Sulfato ferroso gotas 25mg/ml ou xarope 5mg/ml
28. Vitamina A cápsulas com 100.000UI e 200.000UI
ANEXO XLIX
ROTEIRO (Origem: PRT MS/GM 1969/2001, Anexo 1)
ROTEIRO
A) PARA O REGISTRO DE CAUSAS EXTERNAS
Descrever o tipo de causa externa segundo a Classificação Estatística Internacional de Doencas e Problemas Relacionados à Saúde em vigor.
I - COMPREENDE-SE COMO CAUSAS EXTERNAS
Um conjunto de agravos à saúde decorrentes de acidentes de trânsito, quedas, envenenamentos, afogamentos e outras ocorrências provocadas por circunstâncias ambientais e causas acidentais ou intencionais tais como homicídios, agressões e lesões autoprovocadas e/ou acidentes e doenças relacionadas ao trabalho.
II - PREENCHIMENTO DO LAUDO MÉDICO PARA EMISSÃO DE AIH
O preenchimento de todas as informações solicitadas no Laudo Médico para emissão de AIH facilita a compreensão do agrave sofrido pela pessoa, dos dados a: partir do atendimento, da conduta, orientação; acompanhamento e destino dado ao paciente, apoiando o correto preenchimento da Autorização de Internação Hospitalar - AIH, que será utilizada posteriormente para fins epidemiológicos, sanitários, administrativos e previdenciários.
O preenchimento completo e preciso do CID principal e do CID secundário representa uma síntese desse conjunto de informação de forma codificada.
III- RESPONSABILIDADES
1 - Quem registra a entrada do paciente: serviço de registro da unidade que prestou atendimento, que colhe o máximo possível de informações pessoais e sobre a ocorrência.
2 - Quem registra o atendimento: médico (a) que atende o paciente.
3 - Onde registrar: no Laudo Médico para Emissão de AIH conforme modelo disposto Anexo IV desta Portaria.
4 - Registrar no Laudo Médico para Emissão de AIH:
- o tipo de causa externa, a natureza da lesão,
- a parte do corpo atingida,
- o agente causador do agravo,
- o local de ocorrência,
- a atividade da vítima (no momento do ocorrido).
5 - O Laudo Médico para Emissão de AIH deverá ser preenchido em 03 (três) vias, sendo a primeira via anexada ao prontuário do paciente, a segunda via encaminhada ao gestor local de saúde e a terceira via, entregue ao paciente ou responsável, para fins previdenciários junto ao empregador, em casos de Acidentes ou Doenças relacionadas ao Trabalho.
INFORMAÇÕES IMPORTANTES:
A notificação dos casos é responsabilidade da unidade como um todo, e não apenas dos profissionais que fizeram o atendimento, portanto todos devem estar atentos à identificação das causas e comprometidos com o acompanhamento do paciente.
E importante que a gerência local de saúde conheça o número e a natureza dos casos atendidos, de forma a definir as estratégias de intervenção adequadas.
E fundamental que todos os setores e profissionais da unidade recebam este roteiro instrutivo e compreendam a importância do adequado preenchimento das informações solicitadas.
B) PARA O REGISTRO DE AGRAVOS RELACIONADOS AO TRABALHO
O conjunto das informações sobre os agravos à saúde relacionados ao trabalho visa atender a especificidades e necessidades da área de saúde do trabalhador no que diz respeito ao SIH/SUS. A atenção integral à saúde do trabalhador requer articulação do SUS em todos os níveis de complexidade e nas três esferas de governo: União, Estados e Municípios, no sentido de aperfeiçoar o atendimento que já vem sendo realizado, e ao mesmo tempo comprovar as ações realizadas, disponibilizar informações necessárias à vigilância da saúde, à fiscalização do trabalho e à área previdenciária.
Informações Básicas que deverão constar da AIH - Autorização de Internação Hospitalar e do respectivo Laudo Médico para Emissão de AIH (ANEXO I )
- Acidente de Trabalho de trajeto - (ocorrido no trajeto de ida ou volta do trabalho)
- Acidente de Trabalho típico (ocorrido no próprio local de trabalho)
- Doença Relacionada ao trabalho
- CID Principal
- CID Secundário
- Descrição da Natureza da Lesão
- Classificação Brasileira de Ocupações - CBO-R
- Classificação Nacional de Atividades Econômicas - CNAE-R
O referido Laudo Médico para Emissão de AIH - uma vez preenchido deverá ter uma cópia disponibilizada ao paciente e/ou familiares; possibilitando ao trabalhador acidentado ou portador de doença relacionada ao trabalho, comprovar o atendimento realizado no SUS e obter junto ao empregador, a emissão da CAT - Comunicação de Acidente do Trabalho - a qual dará acesso ao benefício previdenciário a que tem, de acordo com a legislação vigente.
Preencher o campo - CID - com o(s) diagnóstico(s) correspondentes ao tipo de acidente ou doença relacionada ao trabalho, de acordo com a CID - Classificação Estatística Internacional de Doenças e Problemas Relacionados à Saúde em vigor.
Descrever no espaço destinado ao Laudo Técnico: o agente causador do agravo, a situação geradora do acidente ou doença, a natureza lesão; parte do corpo atingida (em caso e acidente) ou o sistema/aparelho atingido (em caso de doença relacionada ao trabalho) e o(s) respectivo(s) diagnóstico(s).
OBS. Caso não seja possível obter no momento da emissão do Laudo Médico para Emissão de AIH as informações sobre a CNAE do empregador e a CBO do trabalhador, tais informações deverão ser registradas posteriormente na própria AIH.
I - IDENTIFICAÇÃO DO TRABALHADOR
a. Registro do nome completo do paciente, sem abreviaturas
b. Cadastro de Pessoa Física/CPF
c. Endereço completo, Município, UF, CEP, Telefone
d. Número do Cartão Nacional do SUS
e. Ocupação/CBO - Código Brasileiro de Atividades Econômicas
f. Número do Cartão Nacional do SUS do trabalhador
II - IDENTIFICAÇÃO DO EMPREGADOR
a. Registro do Ramo de Atividade Econômica da Empresa segundo a CNAE - Classificação Nacional de Atividade Econômica
b. Registro do CGC/CNPJ da empresa
CNAE - informar o código relativo à atividade principal do estabelecimento em conformidade com aquela que determina o Grau de Risco para fins de contribuição para os benefícios concedidos em razão do grau de incidência da incapacidade laborativa decorrente dos riscos ambientais do trabalho. O código CNAE (Classificação Nacional de Atividade Econômica) encontra-se no documento de CGC ou CNPJ da empresa ou no Anexo I desta portaria.
CGC/CNPJ - informar o número da matrícula no Cadastro Geral de Contribuintes - CGC ou da mat. Área - informar a natureza da prestação de serviço, se urbana ou rural.
III - CARACTERIZAÇAO DO AGRAVO A SAÚDE RELACIONADO AO TRABALHO
Acidente do trabalho é o que ocorre pelo exercício do trabalho a serviço da empresa, com o segurado empregado, trabalhador avulso, médico residente, bem como com o segurado especial no exercício de suas atividades, provocando lesão corporal ou perturbação funcional que cause a morte, a perda ou redução, temporária ou permanente, da capacidade para o trabalho.
Consideram-se como acidente do trabalho:
- doença profissional, assim entendida a produzida ou desencadeada pelo exercício do trabalho peculiar a determinada atividade e constante da relação elaborada pelo Ministério do Trabalho e da Previdência Social.
- doença do trabalho, assim entendida a adquirida ou desencadeada em função de condições especiais em que o trabalho é realizado e com ele se relacione diretamente.
Equiparam-se também ao acidente do trabalho:
- o acidente ligado ao trabalho que, embora não tenha sido a causa única, haja contribuído diretamente para a morte do segurado, para redução ou perda da sua capacidade para o trabalho, ou produzido lesão que exija atenção médica para a sua recuperação;
- o acidente sofrido no local e no horário do trabalho em consequência de:
a. ato de agressão, sabotagem ou terrorismo praticado por terceiros ou companheiros de trabalho;
b. ofensa física intencional, inclusive de terceiro, por motivo de disputa relacionada ao trabalho;
c. ato de imprudência, de negligência ou de imperícia de terceiros ou de companheiro de trabalho;
d. ato de pessoa privada do uso da razão;
e. desabamento, inundações, incêndio e outros casos fortuitos ou decorrentes de força maior;
- a doença proveniente de contaminação acidental do empregado no exercício de sua atividade;
- o acidente sofrido pelo segurado, ainda que fora do local e horário de trabalho:
a. na execução de ordem ou na realização de serviço sob a autoridade da empresa;
b. na prestação espontânea de qualquer serviço à empresa para lhe evitar prejuízo ou proporcionar proveito;
c. em viagem a serviço da empresa, inclusive para estudo quando financiada por estar dentro de seus planos para melhor capacitação da mão-de-obra, independentemente do meio de locomoção utilizado, inclusive veículo de propriedade do segurado;
d. no percurso da residência para o local de trabalho ou deste para aquela, qualquer que seja o meio de locomoção, inclusive veículo de propriedade do segurado.
- A comunicação de acidente do trabalho deverá ser feita pela empresa, ou na falta desta o próprio acidentado, seus dependentes, a entidade sindical competente, o médico assistente ou qualquer autoridade pública.
- O prazo para a comunicação do acidente de trabalho é o primeiro dia útil seguinte ao da ocorrência e, em caso de morte, de imediato.
INFORMAÇÕES IMPORTANTES
Relativas ao ACIDENTE OU DOENÇA
Agente causador - informar o agente diretamente relacionado ao acidente, podendo ser máquina, equipamento ou ferramenta, como uma prensa ou uma injetora de plásticos; ou produtos químicos, agentes físicos ou biológicos como benzeno, sílica, ruído ou sal- monela. Pode ainda ser consignada uma situação específica como queda, choque elétrico, atropelamento (Tratando-se de acidente do trabalho, de doenças profissionais ou do trabalho).
Descrição da situação geradora do acidente ou doença - descrever a situação ou a atividade de trabalho desenvolvida pelo acidentado e por outros diretamente relacionados ao acidente. Tratando- se de acidente de trajeto, especificar o deslocamento e informar se o percurso foi ou não alterado ou interrompido por motivos alheios ao trabalho. No caso de doença, descrever a atividade de trabalho, o ambiente ou as condições em que o trabalho era realizado.
Obs.: Evitar consignar neste campo diagnóstico da doença ou lesão (Exemplo: indicar a exposição continuada a níveis acentuados de benzeno em função da atividade de pintar motores com tintas contendo solventes orgânicos, e não benzenismo).
LAUDO MÉDICO
Descrição e natureza da lesão - fazer relato claro e sucinto informando a natureza, tipo da lesão e/ou quadro clínico da doença citando a parte do corpo atingida, sistemas ou aparelhos.
Exemplos:
a) edema, equimose e limitação dos movimentos na articulação tíbio társica direita;
b) sinais flogísticos, edema no antebraço esquerdo e dor à movimentação da flexão do punho esquerdo.
Diagnóstico provável - informar, objetivamente, o diagnóstico.
Exemplos:
a) entorse tornozelo. direito;
b) tendinite dos flexores do carpo.
CID - 10 - Classificar conforme a Classificação Internacional de Doenças - CID - 10.
Exemplos:
a) S93.4- entorse e distensão do tornozelo;
b) M65.9 - sinovite ou tendinite não especificada.
Observações - citar qualquer tipo de informação médica adicional, como condições patológicas pré-existentes, com causas, se há compatibilidade entre o estágio evolutivo das lesões e a data do acidentes declarada, se há recomendação especial para permanência no trabalho, etc.
ANEXO L
CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕES - ESTRUTURA AGREGADA NA ORDEM DE 3 DIGITOS (Origem: PRT MS/GM 1969/2001, Anexo 2)
| CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕESESTRUTURA AGREGADA NA ORDEM DE 3 DÍGITOSDESCRIÇÃO DOS GRANDES GRUPOS DE OCUPAÇÕES | |
| CÓDIGO MATRIZ | GRANDE GRUPO |
| 1 | TRABALHADORES DAS PROFISSÕES CIENTÍFICAS, TÉCNICAS, ARTÍSTICAS E TRABALHADORES ASSEMELHADOS Os trabalhadores deste grande grupo realizam pesquisas e aplicam conhecimentos científicos na solução de problemas de ordem técnica, econômica, artística, social e empresarial e desenvolvem outras atividades de caráter profissional nos campos da química e física; da engenharia e arquitetura; da aviação e marinha; da biologia e agronomia; da medicina, odontologia e veterinária; da estatística, das matemáticas e análises de sistemas; da economia, administração e ciências contábeis; do direito; do ensino; da literatura, artes e comunicação social e do esporte. |
| 2 | MEMBROS DOS PODERES LEGISLATIVO, EXECUTIVO E JUDICIÁRIO, FUNCIONÁRIOS PÚBLICOS SUPERIORES, DIRETORES DE EMPRESAS E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo desempenham funções de caráter legislativo, desenvolvem atividades de direção e assessoramento do Poder Executivo e processam e julgam assuntos legais e jurídicos como membros do Poder Judiciário; exercem funções de caráter diplomático, desempenham, em empresas governamentais ou privadas, atividades diretivas de alto nível; planejam, organizam e controlam os trabalhos dessas empresas; dirigem e coordenam órgãos específicos da administração superior. |
| 3 | TRABALHADORES DE SERVIÇOS ADMINISTRATIVOS E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo aplicam leis, decretos e regulamentos promulgados pelos governos federal, estaduais, municipais ou por autoridades locais; controlam o trabalho dos empregados de escritório e atividades afins e os serviços de transportes e comunicações; mantêm os registros das operações financeiras e outras transações comerciais realizadas pelas empresas; manejam fundos em nome da organização ou de sua clientela; reproduzem, em estenografia, datilografia ou por outros meios, textos orais ou escritos; operam máquina de escritório ou instalações telefônicas e telegráficas; chefiam os sistemas de transportes e comunicações e controlam as operações relativas aos mesmos; exercem funções nas empresas de serviços postais e telegráficos; realizam outras tarefas similares. |
| 4 | TRABALHADORES DE COMÉRCIO E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo exercem o comércio atacadista e varejista, por conta própria, em empresas de pequeno porte; dedicam-se à compra e venda de toda a classe de bens e serviços ou cumprem funções diretamente relacionadas com essas atividades. Os trabalhadores que dirigem, como representantes dos proprietários ou acionistas, as atividades de empresas que se dedicam ao comércio atacadista e varejista e ao ramo hoteleiro estão classificados no grupo de base 2-43, gerentes financeiros, comerciais e de publicidade. |
| 5 | TRABALHADORES DE SERVIÇOS DE TURISMO, HOSPEDAGEM, SERVENTIA, HIGIENE E EMBELEZAMENTO, SEGURANÇA AUXILIARES DE SAÚDE E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo administram, organizam, supervisionam ou desempenham serviços de turismo, hospedagem, doméstico, pessoais, de proteção e outros similares. |
| 6 | TRABALHADORES AGROPECUÁRIOS, FLORESTAIS, DA PESCA E TRABALHADORES ASSEMELHADOS Os trabalhadores compreendidos neste grande grupo chefiam unidades de explorações agropecuárias e florestais e grupos de trabalhadores encarregados da execução de atividades pertinentes a essas explorações; exploram, por conta própria, estabelecimentos agropecuários de tipo familiar; executam os trabalhos próprios dos cultivos agrícolas, da criação de animais e da exploração de florestas; pescam e realizam tarefas análogas; operam máquinas e implementos utilizados na agricultura, pecuária e explorações florestais. |
| 7,8,9 | TRABALHADORES DA PRODUÇÃO INDUSTRIAL, OPERADORES DE MÁQUINAS, CONDUTORES DE VEÍCULOS E TRABALHADORES ASSEMELHADOS Os trabalhadores deste grande grupo desempenham tarefas diretamente ligadas aos trabalhos de extração de minerais, petróleo e gás; beneficiamento e transformação de matérias-primas e fabricação e reparação de produtos industriais; construção, manutenção e reparação de edifícios, estradas e outras obras civis; operação de máquinas; condução de veículos de transporte e de equipamento de terraplanagem; manipulação de mercadorias e materiais, e outras tarefas relacionadas com produção industrial que requeiram, fundamentalmente, esforço físico. |
| 10 | MEMBROS DAS FORÇAS ARMADAS, POLICIAIS E BOMBEIROS MILITARES Estão compreendidas neste grande grupo as pessoas que servem voluntária ou obrigatoriamente às milícias e que, dedicando-se exclusivamente a esse serviço, não podem aceitar um emprego civil, só o fazendo no interesse público. Abrange os membros permanentes das Forças Armadas de terra, mar e ar, assim como o pessoal que se acha temporariamente em serviço ativo por período estabelecido nas leis ou regulamentos específicos, para seguir cursos e programas de treinamento ou prestar serviços auxiliares, bem como exercer outra atividade de conveniência nacional. Incluem-se ainda policiais e bombeiros militares que se dedicam à garantia de segurança municipal, estadual e nacional. Excluem-se deste grupo os empregados civis que trabalham nos departamentos administrativos do governo relacionados com questões de defesa; os membros das polícias civil e federal; os empregados de alfândegas e outros serviços civis das Forças Armadas; os membros da reserva militar que não estão integralmente dedicados ao serviço ativo e as pessoas que foram chamadas às Forças Armadas, provisoriamente, para efetuar um curto período de treinamento. |
| CLASSIFICAÇÃO BRASILEIRA DE OCUPAÇÕESESTRUTURA AGREGADA NA ORDEM DE 3 DÍGITOS | |
| CÓDIGO | GRUPO DE OCUPAÇÕES |
| 0-11 | Químicos |
| 0-12 | Físicos |
| 0-19 | Químicos, físicos e trabalhadores assemelhados não classificados sob outras epígrafes |
| 0-20 | Engenheiros agrônomos, florestais e de pesca |
| 0-21 | Engenheiros civis e arquitetos |
| 0-22 | Engenheiros de operações e desenhistas industriais |
| 0-23 | Engenheiros eletricistas e engenheiros eletrônicos |
| 0-24 | Engenheiros mecânicos |
| 0-25 | Engenheiros químicos |
| 0-26 | Engenheiros metalúrgicos |
| 0-27 | Engenheiros de minas e geólogos |
| 0-28 | Engenheiros de organização e métodos |
| 0-29 | Engenheiros, arquitetos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 0-30 | Técnicos de contabilidade, estatística, economia doméstica e administração |
| 0-31 | Técnicos de biologia, agronomia e trabalhadores assemelhados |
| 0-32 | Técnicos de mineração, metalurgia e geologia |
| 0-33 | Técnicos de obras civis, agrimensura, estradas, saneamento e trabalhadores assemelhados |
| 0-34 | Técnicos de eletricidade, eletrônica e telecomunicações |
| 0-35 | Técnicos de mecânica |
| 0-36 | Técnicos de química e trabalhadores assemelhados |
| 0-37 | Técnicos têxteis |
| 0-38 | Desenhistas técnicos |
| 0-39 | Técnicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 0-41 | Pilotos de aviação comercial, navegadores, mecânicos de vôo e trabalhadores assemelhados |
| 0-42 | Oficiais de bordo, pilotos e trabalhadores assemelhados (navegação marítima e interior) |
| 0-43 | Oficiais-maquinistas (navegação marítima e interior) |
| 0-51 | Biologistas e trabalhadores assemelhados |
| 0-52 | Bacteriologistas, farmacologistas e trabalhadores assemelhados |
| 0-61 | Médicos |
| 0-63 | Cirurgiões-dentistas |
| 0-65 | Médicos veterinários e trabalhadores assemelhados |
| 0-67 | Farmacêuticos |
| 0-68 | Nutricionistas e trabalhadores assemelhados |
| 0-71 | Enfermeiros |
| 0-72 | Técnicos de enfermagem e trabalhadores assemelhados (exceto enfermeiros) |
| 0-73 | Assistentes sociais |
| 0-74 | Psicólogos |
| 0-75 | Ortoptistas e óticos |
| 0-76 | Terapeutas |
| 0-77 | Operadores de equipamentos médicos e odontológicos |
| 0-79 | Médicos, cirurgiões-dentistas, médicos veterinários, enfermeiros e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 0-81 | Estatísticos |
| 0-82 | Matemáticos e atuários |
| 0-83 | Analistas de sistemas |
| 0-84 | Programadores de computador |
| 0-91 | Economistas |
| 0-92 | Administradores e trabalhadores assemelhados |
| 0-93 | Contadores |
| 0-99 | Economistas, administradores, contadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 1-21 | Advogados |
| 1-29 | Juristas não classificados sobre outras epígrafes |
| 1-31 | Professores de disciplinas pedagógicas de ensino superior |
| 1-32 | Professores de ciências físicas e químicas de ensino superior |
| 1-33 | Professores de engenharia e arquitetura |
| 1-34 | Professores de matemática, estatística e ciências afins de ensino superior |
| 1-35 | Professores de ciências econômicas, administrativas e contábeis de ensino superior |
| 1-36 | Professores de ciências humanas de ensino superior |
| 1-37 | Professores de ciências biológicas e médicas de ensino superior |
| 1-38 | Professores de línguas e literaturas de ensino superior |
| 1-39 | Professores de ensino superior não-classificados sob outras epígrafes |
| 1-41 | Professores de ensino de 2º grau |
| 1-42 | Professores de ensino de 1º grau |
| 1-43 | Professores de ensino pré-escolar |
| 1-44 | Professores e instrutores de formação profissional |
| 1-45 | Professores de ensino especial |
| 1-49 | Professores não-classificados sob outras epígrafes |
| 1-51 | Escritores e críticos |
| 1-52 | Jornalistas e redatores |
| 1-53 | Locutores e comentaristas de rádio e televisão |
| 1-59 | Escritores, jornalistas, redatores, locutores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 1-61 | Escultores, pintores e trabalhadores assemelhados |
| 1-63 | Fotógrafos, operadores de câmeras de cinema e televisão e trabalhadores assemelhados |
| 1-71 | Compositores, músicos e cantores |
| 1-72 | Coreógrafos e bailarinos |
| 1-73 | Atores e diretores de espetáculos |
| 1-74 | Empresários e produtores de espetáculos |
| 1-75 | Artistas de circo |
| 1-79 | Músicos, artistas, empresários e produtores de espetáculos não-classificados sob outras epígrafes |
| 1-81 | Técnicos desportivos e trabalhadores assemelhados |
| 1-82 | Atletas profissionais |
| 1-89 | Técnicos desportivos, atletas profissionais e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 1-91 | Bibliotecários, arquivologistas e museólogos |
| 1-92 | Sociólogos, antropólogos e trabalhadores assemelhados |
| 1-95 | Filólogos, tradutores e intérpretes |
| 1-96 | Membros de cultos religiosos e trabalhadores assemelhados |
| 1-97 | Analistas de ocupações e trabalhadores assemelhados |
| 1-98 | Técnicos, analistas de seguro, de importação e exportação e trabalhadores assemelhados |
| 1-99 | Trabalhadores das profissões científicas, técnicas, artísticas e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 2-11 | Membros superiores do Poder Legislativo |
| 2-12 | Membros superiores do Poder Executivo |
| 2-13 | Membros superiores do Poder Judiciário |
| 2-14 | Funcionários públicos superiores |
| 2-21 | Diplomatas |
| 2-31 | Diretores de empresas manufatureiras |
| 2-32 | Diretores de empresas agropecuárias, pesqueiras e extrativas |
| 2-33 | Diretores de empresas de produção e distribuição de energia elétrica e gás e de serviço de água e esgoto |
| 2-34 | Diretores de empresas de construção civil |
| 2-35 | Diretores de empresas do comércio atacadista e varejista, de empresas hoteleiras e estabelecimentos similares |
| 2-36 | Diretores de empresas de transportes e comunicações |
| 2-37 | Diretores de empresas financeiras, imobiliárias, companhias de seguros, empresas de prestação de serviços e outras similares |
| 2-38 | Diretores de empresas de serviços comunitários e sociais |
| 2-39 | Diretores de empresas não-classificados sob outras epígrafes |
| 2-41 | Gerentes administrativos e assemelhados |
| 2-42 | Gerentes de produção, de planejamento e de pesquisa e desenvolvimento |
| 2-43 | Gerentes financeiros, comerciais, de marketing e de publicidade |
| 2-49 | Gerentes de empresas não-classificados sob outras epígrafe |
| 3-01 | Chefes intermediários administrativos |
| 3-02 | Chefes intermediários de contabilidade e finanças |
| 3-09 | Chefes intermediários administrativos, de contabilidade e finanças não-classificados sob outras epígrafes |
| 3-11 | Agentes administrativos, assistentes administrativos e trabalhadores assemelhados |
| 3-12 | Técnicos e fiscais de tributação e arrecadação |
| 3-13 | Agentes superiores de polícia |
| 3-14 | Serventuários da justiça e trabalhadores assemelhados |
| 3-19 | Agentes de administração de empresas públicas e privadas não-classificados sob outras epígrafes |
| 3-21 | Secretários |
| 3-23 | Datilógrafos, estenógrafos e trabalhadores assemelhados |
| 3-31 | Auxiliares de contabilidade, caixas e trabalhadores assemelhados |
| 3-32 | Atendentes de guichê, bilheteiros e trabalhadores assemelhados |
| 3-39 | Trabalhadores de serviços de contabilidade, caixas e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 3-41 | Operadores de máquinas contábeis e de calcular |
| 3-42 | Operadores de máquinas de processamento automático de dados |
| 3-43 | Perfuradores e conferidores (cartões e fitas) |
| 3-44 | Técnicos de controle de produção e operação |
| 3-51 | Agentes de estação e de movimento (serviços ferroviários) |
| 3-52 | Chefes de serviços de correios e telecomunicações |
| 3-53 | Chefes de serviços aéreos, controladores de tráfego aéreo e trabalhadores assemelhados |
| 3-54 | Chefes e inspetores de serviços de transporte rodoviário |
| 3-55 | Chefes de serviços de transporte marítimo, fluvial e lacustre |
| 3-60 | Despachantes, fiscais e cobradores de transportes coletivos (exceto trem) |
| 3-70 | Classificadores de correspondência, carteiros e mensageiros |
| 3-80 | Telefonistas, telegrafistas e trabalhadores assemelhados |
| 3-91 | Trabalhadores de serviços de abastecimento e armazenagem |
| 3-93 | Auxiliares de escritório e trabalhadores assemelhados |
| 3-94 | Recepcionistas |
| 3-95 | Arquivistas e trabalhadores assemelhados |
| 3-99 | Trabalhadores de serviços administrativos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 4-10 | Comerciantes (comércio atacadista e varejista) |
| 4-21 | Supervisores de vendas e trabalhadores assemelhados |
| 4-22 | Supervisores de compras e compradores |
| 4-31 | Agentes e inspetores técnicos de vendas |
| 4-32 | Vendedores pracistas, representantes comerciais e trabalhadores assemelhados |
| 4-41 | Corretores de seguros, de imóveis e de títulos e valores |
| 4-42 | Agentes de venda de serviços às empresas |
| 4-43 | Leiloeiros, avaliadores e trabalhadores assemelhados |
| 4-51 | Vendedores de comércio atacadista, varejista e trabalhadores assemelhados |
| 4-52 | Vendedores ambulantes, vendedores a domicílio e jornaleiros |
| 4-53 | Demonstradores e trabalhadores assemelhados |
| 4-54 | Decoradores e trabalhadores assemelhados |
| 4-90 | Trabalhadores de comércio e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 5-00 | Gerentes de hotéis, restaurantes, bares, estabelecimentos similares e trabalhadores assemelhados |
| 5-20 | Mordomos, governantas e trabalhadores assemelhados |
| 5-31 | Cozinheiros e trabalhadores assemelhados |
| 5-32 | Garçons, barmen e trabalhadores assemelhados |
| 5-40 | Trabalhadores de serventia (domicílios e hotéis) e trabalhadores assemelhados |
| 5-41 | Comissários (serviço de transporte de passageiros) |
| 5-51 | Trabalhadores de serviços de administração de edifícios |
| 5-52 | Trabalhadores de serviços de conservação, manutenção, limpeza de edifícios, empresas comerciais, indústrias, áreas verdes e logradouros públicos |
| 5-60 | Lavadeiros, tintureiros e trabalhadores assemelhados |
| 5-70 | Cabeleireiros, especialistas em tratamentos de beleza e trabalhadores assemelhados |
| 5-72 | Pessoal de enfermagem, parteiras, laboratórios e trabalhadores assemelhados (exceto enfermeiros) |
| 5-81 | Bombeiros |
| 5-82 | Policiais e trabalhadores assemelhados |
| 5-83 | Guardas de segurança e trabalhadores assemelhados |
| 5-84 | Guardas de trânsito |
| 5-89 | Trabalhadores de serviços de proteção e segurança não-classificados sob outras epígrafes |
| 5-91 | Agentes de viagem e guias de turismo |
| 5-92 | Agentes de serviços funerários e embalsamadores |
| 5-99 | Trabalhadores de serviços de turismo, hospedagem, serventia, higiene, embelezamento, segurança e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 6-00 | Administradores de explorações agropecuárias e florestais |
| 6-01 | Capatazes de explorações agropecuárias e florestais |
| 6-11 | Produtores agropecuários polivalentes |
| 6-12 | Produtores agropecuários especializados |
| 6-21 | Trabalhadores agropecuários polivalentes e trabalhadores assemelhados |
| 6-31 | Trabalhadores da cultura de gramíneas |
| 6-32 | Trabalhadores da cultura de plantas fibrosas |
| 6-33 | Trabalhadores hortigranjeiros |
| 6-34 | Trabalhadores da floricultura |
| 6-35 | Trabalhadores da fruticultura |
| 6-36 | Trabalhadores da cultura de plantas produtoras de substâncias estimulantes e de especiarias (exceto as de extração florestal) |
| 6-37 | Trabalhadores da cultura de plantas oleaginosas |
| 6-38 | Trabalhadores da cultura de plantas produtoras de substâncias aromáticas, medicinais e tóxicas (exceto as de exploração florestal) |
| 6-39 | Trabalhadores agrícolas especializados não-classificados sob outras epígrafes |
| 6-41 | Trabalhadores da pecuária de grande porte |
| 6-42 | Trabalhadores da pecuária de médio porte |
| 6-43 | Trabalhadores da pecuária de pequeno porte |
| 6-44 | Trabalhadores da pecuária (insetos úteis) |
| 6-49 | Trabalhadores da pecuária não-classificados sob outras epígrafes |
| 6-51 | Trabalhadores florestais da exploração de espécies produtoras de madeiras |
| 6-52 | Trabalhadores florestais da exploração de espécies produtoras de gomas elásticas, não-elásticas e resinas |
| 6-53 | Trabalhadores florestais da exploração de espécies produtoras de fibras, ceras e óleos |
| 6-54 | Trabalhadores florestais da exploração de espécies produtoras de substâncias alimentícias |
| 6-55 | Trabalhadores florestais da exploração de espécies produtoras de substâncias aromáticas, medicinais e tóxicas |
| 6-59 | Trabalhadores florestais não-classificados sob outras epígrafes |
| 6-61 | Patrões de pesca |
| 6-62 | Pescadores industriais |
| 6-63 | Pescadores artesanais |
| 6-64 | Trabalhadores da aquicultura |
| 6-69 | Pescadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 6-71 | Operadores de máquinas e implementos agrícolas |
| 6-72 | Operadores de máquinas e implementos de pecuária |
| 6-73 | Operadores de máquinas e implementos de exploração florestal |
| 7-01 | Mestres, contramestres, supervisores de empresas manufatureiras e de construção civil e trabalhadores assemelhados |
| 7-02 | Mestres (empresas de extração mineral) |
| 7-03 | Mestres (empresas de energia elétrica, gás, água e esgoto) |
| 7-04 | Contramestres da indústria têxtil |
| 7-05 | Mestres, contramestres, supervisores e operadores de manutenção de sistemas operacionais e trabalha dores assemelhados |
| 7-11 | Mineiros e canteiros |
| 7-12 | Operadores de máquinas de extração de minérios (minas e pedreiras) |
| 7-13 | Trabalhadores de beneficiamento de minérios e pedras |
| 7-14 | Sondadores de poços de petróleo e gás e trabalhadores assemelhados |
| 7-15 | Sondadores de poços (exceto de petróleo e gás) |
| 7-16 | Salineiros (sal marinho) |
| 7-19 | Trabalhadores de minas e pedreiras, sondadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 7-20 | Operadores de aciaria |
| 7-21 | Forneiros e operadores metalúrgicos (primeira fusão) |
| 7-22 | Operadores de laminação |
| 7-23 | Forneiros metalúrgicos (segunda fusão e reaquecimento) |
| 7-24 | Fundidores de metais |
| 7-25 | Moldadores e macheiros |
| 7-26 | Trabalhadores de tratamento térmico e termoquímico de metais |
| 7-27 | Trefiladores e estiradores de metais |
| 7-28 | Galvanizadores e recobridores de metais |
| 7-29 | Trabalhadores metalúrgicos e siderúrgicos não-classificados sob outras epígrafes |
| 7-31 | Trabalhadores de tratamento da madeira |
| 7-32 | Operadores de máquinas de desdobrar madeira |
| 7-33 | Preparadores de pasta para papel |
| 7-34 | Operadores de máquinas de fabricação de papel e papelão |
| 7-35 | Preparadores de compensados e aglomerados |
| 7-39 | Trabalhadores de tratamento da madeira e de fabricação de papel e papelão não-classificados sob outras epígrafes |
| 7-41 | Operadores de britadeiras, trituradoras e misturadeiras (tratamentos químicos e afins) |
| 7-42 | Operadores de instalações térmicas para processamentos químicos |
| 7-43 | Operadores de aparelhos de filtragem e separação (tratamentos químicos e afins) |
| 7-44 | Operadores de aparelhos de destilação e reação |
| 7-45 | Operadores de refinação de petróleo |
| 7-46 | Operadores de coqueria |
| 7-47 | Trabalhadores da produção e manipulação de medicamentos |
| 7-49 | Operadores de instalações de processamentos químicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 7-51 | Trabalhadores de preparação de fibras |
| 7-52 | Fiandeiros e trabalhadores assemelhados |
| 7-53 | Trabalhadores de preparação de tecelagem |
| 7-54 | Tecelões |
| 7-55 | Tecelões de malhas |
| 7-56 | Trabalhadores de acabamento, tingimento e estamparia de produtos têxteis |
| 7-59 | Fiandeiros, tecelões, tingidores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 7-71 | Moleiros |
| 7-72 | Trabalhadores da fabricação e refinação de açúcar |
| 7-73 | Magarefes e trabalhadores assemelhados |
| 7-74 | Trabalhadores de industrialização e conservação de alimentos |
| 7-75 | Trabalhadores de tratamento do leite, fabricação de laticínios e de produtos similares |
| 7-76 | Padeiros, confeiteiros e trabalhadores assemelhados |
| 7-77 | Trabalhadores de preparação de café, cacau e produtos assemelhados |
| 7-78 | Trabalhadores de fabricação de cerveja, vinhos e outras bebidas |
| 7-79 | Trabalhadores de preparação de alimentos e bebidas não-classificados sob outras epígrafes |
| 7-81 | Preparadores de fumo |
| 7-82 | Charuteiros |
| 7-83 | Cigarreiros |
| 7-91 | Alfaiates, costureiros e modistas |
| 7-93 | Chapeleiros |
| 7-94 | Modelistas e cortadores (vestuário) |
| 7-95 | Costureiros (confecção em série) |
| 7-96 | Estofadores e trabalhadores assemelhados |
| 7-97 | Bordadores e cerzidores |
| 7-99 | Trabalhadores de costura, estofadores e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 8-01 | Sapateiros |
| 8-02 | Trabalhadores de calçados |
| 8-03 | Trabalhadores de artefatos de couro (exceto roupas e calçados) |
| 8-11 | Marceneiros e trabalhadores assemelhados |
| 8-12 | Operadores de máquinas de lavrar madeira |
| 8-19 | Marceneiros, operadores de máquinas de lavrar madeira e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 8-20 | Cortadores, polidores e gravadores de pedras |
| 8-31 | Forjadores |
| 8-32 | Ferramenteiros e modeladores de metais |
| 8-33 | Torneiros, fresadores, retificadores e trabalhadores assemelhados |
| 8-34 | Preparadores de máquinas-ferramentas (produção em série) |
| 8-35 | Operadores de máquinas-ferramentas (produção em série) |
| 8-36 | Polidores de metais e afiadores de ferramentas |
| 8-37 | Operadores de máquinas-ferramentas com comando numérico |
| 8-39 | Trabalhadores da usinagem de metais não-classificados sob outras epígrafes |
| 8-40 | Ajustadores mecânicos |
| 8-41 | Montadores de máquinas |
| 8-42 | Relojoeiros e montadores de instrumentos de precisão |
| 8-43 | Mecânicos de manutenção de veículos automotores |
| 8-44 | Mecânicos de manutenção de aeronaves |
| 8-45 | Mecânicos de manutenção de máquinas |
| 8-49 | Ajustadores mecânicos, montadores e mecânicos de máquinas, veículos e instrumentos de precisão não-classificados sob outras epígrafes |
| 8-51 | Montadores de equipamentos elétricos |
| 8-52 | Montadores de equipamentos eletrônicos |
| 8-54 | Reparadores de equipamentos elétricos e eletrônicos |
| 8-55 | Eletricistas de instalações |
| 8-56 | Instaladores e reparadores de equipamentos e aparelhos de telecomunicações |
| 8-57 | Instaladores e reparadores de linhas elétricas e de telecomunicações |
| 8-59 | Eletricistas, eletrônicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 8-61 | Operadores de estações de rádio e televisão |
| 8-62 | Operadores de equipamentos de sonorização, cenografia e projeção |
| 8-71 | Encanadores e instaladores de tubulações |
| 8-72 | Soldadores e oxicortadores |
| 8-73 | Chapeadores e caldeireiros |
| 8-74 | Montadores de estruturas metálicas e trabalhadores assemelhados |
| 8-80 | Joalheiros e ourives |
| 8-90 | Sopradores e moldadores de vidros e trabalhadores assemelhados |
| 8-91 | Cortadores e polidores de vidros |
| 8-92 | Ceramistas e trabalhadores assemelhados |
| 8-93 | Forneiros (vidraria e cerâmica) |
| 8-94 | Gravadores de vidro |
| 8-95 | Pintores e decoradores de vidro e cerâmica |
| 8-99 | Vidreiros, ceramistas e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-01 | Trabalhadores de fabricação de produtos de borracha (exceto pneumáticos) |
| 9-02 | Trabalhadores de fabricação, vulcanização e reparação de pneumáticos |
| 9-03 | Trabalhadores de fabricação de produtos de plástico |
| 9-10 | Confeccionadores de produtos de papel e papelão |
| 9-21 | Compositores tipográficos e trabalhadores assemelhados |
| 9-22 | Impressores |
| 9-23 | Estereotipistas e eletrotipistas |
| 9-24 | Gravadores e clicheristas (exceto fotogravadores) |
| 9-25 | Fotogravadores |
| 9-26 | Encadernadores e trabalhadores assemelhados |
| 9-27 | Trabalhadores de laboratórios fotográficos |
| 9-29 | Trabalhadores das artes gráficas não-classificados sob outras epígrafes |
| 9-31 | Pintores de obras e de estruturas metálicas |
| 9-39 | Pintores não-classificados sob outras epígrafes |
| 9-41 | Confeccionadores de instrumentos musicais e trabalhadores assemelhados |
| 9-42 | Cesteiros, confeccionadores de produtos de vime e similares e trabalhadores assemelhados |
| 9-43 | Trabalhadores da fabricação de produtos derivados de minerais não-metálicos |
| 9-49 | Trabalhadores da confecção de instrumentos musicais, de produtos de vime e similares, de derivados de minerais não-metálicos e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-51 | Pedreiros e estucadores |
| 9-52 | Trabalhadores de concreto armado |
| 9-53 | Telhadores |
| 9-54 | Carpinteiros |
| 9-55 | Ladrilheiros, taqueiros e trabalhadores assemelhados |
| 9-56 | Instaladores de material isolante |
| 9-57 | Vidraceiros |
| 9-59 | Trabalhadores da construção civil e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-61 | Operadores de instalações de produção de energia elétrica e nuclear |
| 9-69 | Operadores de máquinas fixas e de equipamentos similares não-classificados sob outras epígrafes |
| 9-71 | Trabalhadores da movimentação de cargas e descargas, estivagens e embalagens de mercadorias |
| 9-72 | Aparelhadores e emendadores de cabos (exceto cabos elétricos e de telecomunicações) |
| 9-73 | Operadores de guindastes e de equipamentos similares de elevação |
| 9-74 | Operadores de máquinas de construção civil, mineração e de equipamentos afins |
| 9-79 | Trabalhadores da movimentação e manipulação de mercadorias e materiais, operadores de máquinas de construção civil, mineração e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-81 | Contramestres de embarcações, marinheiros de convés e barqueiros |
| 9-82 | Maquinistas e foguistas de embarcações |
| 9-83 | Maquinistas e foguistas de locomotivas e máquinas similares |
| 9-84 | Agentes e auxiliares de manobras e conservação (transportes ferroviários) e trabalhadores assemelhados |
| 9-85 | Condutores de automóveis, ônibus, caminhões e veículos similares |
| 9-86 | Condutores de animais e de veículos de tração animal |
| 9-89 | Condutores de veículos de transporte e trabalhadores assemelhados não-classificados sob outras epígrafes |
| 9-91 | Trabalhadores braçais não-classificados sob outras epígrafes |
| 9-99 | Trabalhadores que não podem ser classificados segundo a ocupação |
| 104 | Militares da Aeronáutica |
| 105 | Militares do Exército |
| 106 | Militares da Marinha |
| 107 | Policiais Militares |
| 108 | Bombeiros Militares |
ANEXO LI
CLASSIFICACÃO NACIONAL DE ATIVIDADES ECONÔMICAS RESUMIDA AGREGADA EM 3 DÍGITOS (Origem: PRT MS/GM 1969/2001, Anexo 3)
CLASSIFICAÇÃO NACIONAL DE ATIVIDADES ECONÔMICAS RESUMIDA AGREGADA EM 3 DÍGITOS
| INTERVALO | GRANDES GRUPOS |
|---|---|
| A 011 - 021 | AGRICULTURA, PECUÁRIA, SILVICULTURA, EXPLORAÇÃO FLORESTAL E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES |
| B 051 | PESCA, AQUICULTURA E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES |
| C 100 - 142 | INDÚSTRIAS EXTRATIVAS |
| D 151 - 372 | INDÚSTRIAS DE TRANSFORMAÇÃO |
| E 401 - 410 | PRODUÇÃO E DISTRIBUIÇÃO DE ELETRICIDADE, GÁS E ÁGUA ELETRICIDADE, GÁS E ÁGUA QUENTE |
| F 451 - 456 | CONSTRUÇÃO |
| G 501 - 527 | COMÉRCIO E REPARAÇÃO DE VEÍCULOS AUTOMOTORES, OBJETOS PESSOAIS E DOMÉSTICOS |
| H 551 - 552 | ALOJAMENTO E ALIMENTAÇÃO |
| I 601 - 642 | TRANSPORTE, ARMAZENAGEM E COMUNICAÇÕES |
| J 651 - 672 | INTERMEDIAÇÃO FINANCEIRA |
| K 701 - 749 | ATIVIDADES IMOBILIÁRIAS, ALUGUÉIS E SERVIÇOS PRESTADOS ÀS EMPRESAS |
| L 751 - 753 | ADMINISTRAÇÃO PÚBLICA, DEFESA E SEGURIDADE SOCIAL |
| M 801 - 809 | EDUCAÇÃO |
| N 851 - 853 | SAÚDE E SERVIÇOS SOCIAIS |
| O 900 - 930 | OUTROS SERVIÇOS COLETIVOS, SOCIAIS E PESSOAIS |
| P 950 | SERVIÇOS DOMÉSTICOS |
| Q 990 | ORGANISMOS INTERNACIONAIS E OUTRAS INSTITUIÇÕES EXTRATERRITORIAIS |
A - AGRICULTURA, PECUÁRIA, SILVICULTURA.
EXPLORAÇÃO FLORESTAL
E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES
011 - Produção de Lavouras Temporárias
Inclui cultivo de cereais; cultivo de algodão herbáceo; cultivo de cana-de-açúcar, cultivo de fumo; cultivo de soja; cultivo de outros produtos temporários.
012 - Horticultura e Produtos de Viveiro - Inclui cultivo de hortaliças; legumes e especiarias hortícolas; cultivo de flores e plantas ornamentais.
013 - Produção de Lavouras Permanentes
Inclui cultivo de frutas cítricas; cultivo de café; cultivo de cacau; cultivo de uva; cultivo de outras frutas, frutos secos; plantas para preparo de bebidas e para produção de condimentos
014 - Pecuária
Inclui criação de bovinos; criação de outros animais de grande porte; criação de ovinos; criação de suínos; criação de aves; criação de outros animais.
015 - Produção Mista: Lavoura e Pecuária
016 - Atividades de Serviços Relacionados com a Agricultura e Pecuária, Exceto Atividades Veterinárias
021 - Silvicultura, Exploração Florestal e Serviços Relacionados com estas Atividades
B - PESCA, AQUICULTURA E SERVIÇOS RELACIONADOS COM ESTAS ATIVIDADES
051 - Pesca, Aquicultura e Atividades dos Serviços Relacionados com estas Atividades
C - INDÚSTRIAS EXTRATIVAS
100 - Extração de Carvão Mineral
111 - Extração de Petróleo e Gás Natural
112 - Serviços Relacionados com a Extração de Petróleo e Gás, exceto a Prospecção Realizada por Terceiros
131 - Extração de Minério de Ferro
132 - Extração de Minérios Metálicos Não Ferrosos
Inclui alumínio, estanho, manganês, metais preciosos, minerais radioativos, minerais metálicos não ferrosos
141 - Extração de Pedra, Areia e Argila
142 - Extração de Outros Minerais Não Metálicos
Incluir minerais para fabricação de adubos; fertilizantes e produtos químicos, extração e refino de sal marinho e sal-gema; outros minerais não metálicos
D - INDÚSTRIA DE TRANSFORMAÇÃO
151 - Abate e Preparação de Produtos de Carne e de Pescado
Inclui abate reses; preparação de produtos de carne; abate de aves e outros pequenos animais e preparação de produtos de carne; preparação de carne, banha e produtos de salsicharia não-associadas ao abate; preparação e preservação do pescado e fabricação de conservas de peixes, crustáceos e moluscos.
152 - Processamento, Preservação e Produção de Conservas de Frutas, Legumes e outros vegetais
Inclui processamento, preservação e produção de· conservas frutas; processamento, preservação e produção de conservas de legumes e outros vegetais; produção de sucos de frutas e de legumes.
153 - Produção de Óleos e Gorduras Vegetais e Animais
Inclui produção de óleos vegetais em bruto; refino de óleos vegetais; preparação de margarina e outras gorduras vegetais e de óleos de origem animal não-comestíveis.
154 - Laticínios
Inclui preparação do leite; fabricação de produtos do laticínio; fabricação de sorvetes.
155 - Moagem, Fabricação de Produtos Amiláceos e de Raçoes Balanceadas para Animais
Inclui beneficiamento de arroz e fabricação de produtos do arroz; moagem de trigo e fabricação de derivados; fabricação de farinha de mandioca e derivados; fabricação de fubá e farinha de milho; fabricação de amidos e féculas de vegetais e fabricação de óleos de milho; fabricação de rações balanceadas para animais; beneficiamento, moagem e preparação de outros alimentos de origem vegetal.
156 - Fabricação e Refino de Açúcar
Inclui usinas de açúcar; refino e moagem de açúcar.
157 - Torrefação e Moagem de Café
Inclui fabricação de café solúvel.
158 - Fabricação de Outros Produtos Alimentícios
Inclui fabricação de produtos de padaria, confeitaria e pastelaria; fabricação de biscoitos e bolachas; produção de derivados de cacau e elaboração de chocolates, balas, gomas de mascar; fabricação de massas alimentícias; preparação de especiarias, molhos, temperos e condimentos; preparação de produtos dietéticos, alimentos para crianças e outros alimentos conservados; fabricação de outros produtos alimentícios.
159 - Fabricação de Bebidas
Inclui Fabricação, retificação, homogeneização e mistura de aguardentes e outras e bebidas destiladas; Fabricação de vinho; Fabricação de malte, cervejas e chopes; Engarrafamento e gaseificação de águas minerais; Fabricação de refrigerantes e refrescos.
FABRICAÇÃO DE PRODUTOS DO FUMO
160 - Fabricação de produtos do fumo
FABRICAÇÃO DE PRODUTOS TÊXTEIS
171 - Beneficiamento de Fibras Têxteis Naturais
Inclui algodão; outras fibras têxteis naturais.
172 - Fiação
Inclui algodão; outras fibras têxteis naturais; fibras artificiais ou sintéticas; fabricação de linhas e fios para coser e bordar.
173 - Tecelagem - Inclusive Fiação e Tecelagem
Inclui algodão; fios de fibras têxteis naturais; fios e filamentos contínuos artificiais ou sintéticos.
174 - Fabricação de Artefatos Têxteis Incluindo Tecelagem
Inclui de artigos de tecido de uso doméstico, incluindo tecelagem; outros artefatos têxteis, incluindo tecelagem
175 - Serviços de Acabamento em Fios, Tecidos e Artigos Têxteis
Inclui os produzidos por terceiros.
176 - Fabricação de Artefatos Têxteis a Partir de Tecidos - Exclusive Vestuário e de Outros Artigos. Têxteis
Inclui artefatos de tapeçaria; artefatos de cordoaria; tecidos especiais; produzidos em malharias (tricotagens).
177 - Fabricação de Tecidos e Artigos de Malhas de Vestuário
CONFECÇÃO DE ARTIGOS DO VESTUÁRIO E ACESSÓRIOS
181 - Confecção de artigo do vestuário e acessórios
Inclui peças interiores do vestuário; outras peças do ves-tuário; roupas profissionais.
182 - Fabricação de Acessórios do Vestuário e de Segurança Profissional
Inclui acessórios para segurança e industrial e pessoal.
PREPARAÇÃO DE COUROS E FABRICAÇÃO DE ARTEFATOS DE COURO, ARTIGOS DE VIAGEM E CALÇADOS
191 - Curtimento e outras preparações de couro
192 - Fabricação de Artigos para Viagem e de Artefatos Diversos de Couro
Inclui fabricação de malas, bolsas, valises e outros artefatos para viagem de qualquer material; fabricação de outros artefatos de couro.
193 - Fabricação de Calçados
Inclui calçados de couro, tênis de qualquer material; calçados de plásticos; calçados de outros materiais.
FABRICAÇÃO DE PRODUTOS DE MADEIRA
201 - Desdobramento de madeira
202 - Fabricação de Produtos de Madeira, Cortiça e Material Trançado
Exclusive Móveis. Inclui madeira laminada e de chapas de madeira compensada, prensada ou aglomerada; esquadrias de madeira, de casas de madeira pré-fabricadas, de estruturas de madeira e artigos de carpintaria; artefatos de tanoaria e embalagens de madeira; artefatos diversos de madeira, palha, cortiça e material trançado - exceto móveis
FABRICAÇÃO DE CELULOSE, PAPEL E PRODUTOS DE PAPEL
211 - Fabricação de celulose e outras pastas para a fabricação de papel
212 - Fabricação de papel, papelão liso, cartolina e cartão
213 - Fabricação de embalagens de papel ou de papelão - inclusive a fabricação de papelão corrugado
214 - Fabricação de artefatos diversos de papel, papelão, cartolina e cartão para escritório, fitas e formulários contínuos - impressos ou não
EDIÇÃO, IMPRESSÃO E REPRODUÇÃO DE GRAVAÇÕES
221 - Edição, edição e impressão de jornais; revistas; livros; discos, fitas e outros materiais gravados; edição e impressão de outros produtos gráficos
222 - Impressão e Serviços Conexos para Terceiros;
Inclui impressão de jornais, revistas e livros; serviço de impressão de material escolar e de material para usos industrial e comercial; Execução de outros serviços gráficos
223 - Reprodução de Materiais Gravados: discos e fitas; fitas de vídeos; filmes; programas de informática em disquete e fitas.
231 - Coquerias
232 - Refino de Petróleo
233 - Elaboração de_Combustíveis Nucleares
234 - Produção de Álcool
FABRICAÇÃO DE PRODUTOS QUÍMICOS
241 - Fabricação de Produtos Químicos Inorgânicos
Inclui cloro e álcalis; intermediários para fertilizantes; fertilizantes fosfatados, nitrogenados e potássicos; gases industriais; outros produtos inorgânicos.
242 - Fabricação de Produtos Químicos Orgânicos
Inclui produtos petroquímicos básicos; Fabricação de intermediários para resinas e fibras; e outros produtos químicos orgânicos.
243 - Fabricação de Resinas Termoplásticas e Termofixas e Elastômetros
244 - Fabricação de fibras, fios, cabos e filamentos contínuos artificiais e Sintéticos
(exclui cabos metálicos para condução de eletricidade).
245 - Fabricação de Produtos Farmacêuticos
Inclui produtos farmoquímicos; medicamentos para uso humano; medicamentos para uso veterinário; materiais para usos médicos, hospitalares e odontológicos.
246 - Fabricação de Defensivos Agrícolas (Agrotóxicos)
Inclui inseticidas; fungicidas; herbicidas; outros defensivos agrícolas
247 - Fabricação de sabões, Detergentes, Produtos de Limpeza e Artigos de Perfumaria
248 -Fabricação de Tintas, Tintas de Impressão, Vernizes, Esmaltes, Lacas Impermeabilizante, Solventes e Produtos afins
249 - Fabricação de Produtos e Preparados Químicos Diversos
Inclui adesivos e selantes; explosivos; catalisadores; aditivos de uso industrial; chapas, filmes, papéis e outros materiais e produtos químicos para fotografia; discos e fitas virgens; e outros produtos químicos não especificados ou não classificados
FABRICAÇÃO DE ARTIGOS DE BORRACHA E PLÁSTICO
251 - Fabricação de artigos de borracha, pneumáticos e câmaras de ar, recondicionamento de pneumáticos e artefatos diversos de borracha
252 - Fabricação de Produtos de Plástico
Inclui laminados planos e tubulares de plástico; embalagem de plástico; artefatos diversos de plástico
FABRICAÇÃO DE PRODUTOS MINERAIS NÃO-METÁLICOS
261 - Fabricação de vidro e produtos de vidro
Inclui vidro plano de segurança; vasilhames de vidro e artigos de vidro
262 - Fabricação de cimento
263 - Fabricação de artefatos de concreto, cimento, fibrocimento, gesso e estuque
264 - Fabricação de produtos cerâmicos
Incluir e produtos cerâmicos não-refratários para uso estrutural na construção civil; produtos cerâmicos refratários; produtos cerâmicos não-refratários para usos diversos
269 - Aparelhamento de Pedras e Fabricação De Cal e de Outros Produtos De Minerais Não-metálicos
Inclui Britamento, aparelhamento e outros trabalhos em pedras (não associado a extração); Fabricação de cal virgem, cal hidratada, gesso e outros produtos de minerais não-metálicos
METALURGIA BÁSICA
271 - Siderúrgicas Integradas
Inclui Produção de laminados planos e não planos de aço
272 - Fabricação de Produtos Siderúrgicos - Exclusive em Siderúrgicas Integradas
Inclui produção de gusa; produção de ferro, aço e ferro-ligas em formas primárias e semi-acabados; relaminados, trefilados e retrefilados de aço, exclusive tubos.
273 - Fabricação de Tubos - Exclusive em Siderúrgicas Integradas
Inclui tubos de aço com costura; outros tubos de ferro e aço
274 - Metalurgia de Metais Não-Ferrosos: Alumínio e suas ligas, Metais Preciosos e outros metais não-ferrosos e suas ligas
275 Fundição
Inclui fabricação de peças fundidas de ferro e aço e de peças fundidas de metais não-ferrosos e suas ligas
FABRICAÇÃO DE PRODUTOS DE METAL - EXCETO MÁQUINAS E EQUIPAMENTOS
281 - Fabricação de estruturas metálicas e Obras de Caldeiraria Pesada
Inclui estruturas metálicas para edifícios, pontes, torres de transmissão, andaimes e outros fins; esquadrias de metal; obras de caldeiraria pesada
282 - Fabricação de tanques, Caldeiras e Reservatórios Metálicos
Inclui caldeiras para aquecimento central; caldeiras geradoras de vapor - exclusive para aquecimento central e para veículos
283 - Forjaria, Estamparia, Metalurgia do Pó e Serviços de Tratamento de Metais
Inclui produtos de forjados de aço e metais não-ferrosos e suas ligas; Fabricação de artefatos estampados de metal; Metalurgia do pó; Têmpera, cementação e tratamento térmico do aço, serviços de usinagem, galvanotécnica e solda.
284 - Fabricação de Artigos de Cutelaria, de Serralheria (exclusive esquadrias) e Ferramentas Manuais
Inclui embalagens metálicas; artefatos de trefilados; artigos de funilaria e de artigos de metal para usos doméstico e pessoal; outros produtos elaborados de metal.
FABRICAÇÃO DE MÁQUINAS E EQUIPAMENTOS
291 - Fabricação de Motores, Bombas, Compressores e Equipamentos de Transmissão
Inclui motores estacionários de combustão interna, turbinas e outras máquinas motrizes não elétricas - exclusive para aviões e veículos rodoviários; bombas e carneiros hidráulicos; válvulas, torneiras e registros; compressores; equipamentos de transmissão para fins industriais - inclusive rolamentos
292 - Fabricação de Máquinas e Equipamentos de Uso Geral
Inclui fornos industriais, aparelhos e equipamentos não elétricos para instalações térmicas; estufas e fornos elétricas para fins industriais; máquinas, equipamentos e aparelhos para transporte e elevação de cargas e pessoas; máquinas e aparelhos de refrigeração e ventilação de usos industrial e comercial; aparelhos de ar condicionado; outras máquinas e equipamentos de uso geral
293 - Fabricação de Tratores e de Máquinas e Equipamentos para Agricultura, Avicultura e Obtenção de Produtos Animais
294 - Fabricação de máquinas-ferramentas
295 - Fabricação de Máquinas e Equipamentos de Usos na Extração Mineral e Construção
Inclui máquinas e equipamentos para a indústria de prospecção e extração de petróleo; outras máquinas e equipamentos de uso na extração mineral e construção; tratores de esteira e tratores de uso na extração mineral e construção e mineração; máquinas e equipamentos de terraplanagem e pavimentação.
296 - Fabricação de Outras Máquinas e Equipamentos de Uso Específico
Inclui máquinas para a indústria metalúrgica - exclusive máquinas - ferramentas; máquinas e equipamentos para as industrias alimentar, de bebidas e fumo; máquinas e equipamentos para a indústria têxtil; máquinas e equipamentos para as indústrias do vestuário e de couro e calçados; máquinas e equipamentos para indústrias de celulose, papel e papelão e artefatos; outras máquinas e equipamentos de uso específico
297 - Fabricação de Armas, Munições e Equipamentos Militares e Equipamento Bélico Pesado
298 - Fabricação de Eletrodomésticos
Inclui fogões, refrigeradores e máquinas de lavar e secar para uso doméstico; outros aparelhos eletrodomésticos.
FABRICAÇÃO DE MÁQUINAS PARA ESCRITÓRIO E EQUIPAMENTOS DE INFORMÁTICA
301 - Fabricação de Máquinas Para Escritório
Inclui máquinas de escrever e calcular, copiadoras e outros equipamentos não-eletrônicos para escritório; máquinas de escrever e calcular, copiadoras e outros equipamentos eletrônicos destinados à automação gerencial e comercial
302 - Fabricação de Máquinas E Equipamentos de Sistemas Eletrônicos Para Processamento de Dados
Inclui computadores; equipamentos periféricos para máquinas eletrônicas para tratamento de informações.
FABRICAÇÃO DE MÁQUINAS, APARELHOS E MATERIAIS ELÉTRICOS
311 - Fabricação de geradores de corrente contínua ou alternada, transformadores, indutores, conversores, sincronizadores e semelhantes e motores elétricos
312 - Fabricação de Equipamentos para Distribuição e Controle de Energia Elétrica
Inclui subestações, quadros de comando, reguladores de voltagem e outros aparelhos e equipamentos para distribuição e controle de energia; material elétrico para instalações em circuito de consumo
313 - Fabricação de fios, cabos e condutores elétricos isolados
314 - Fabricação de pilhas, baterias e acumuladores elétricos
315 - Fabricação de luminárias e equipamentos de iluminação - exclusive para veículos
316 - Fabricação de material elétrico para veículos - exclusive baterias
319 - Fabricação de outros aparelhos ou equipamentos elétricos
Inclui eletrodos, contatos e outros artigos de carvão e grafita para uso elétrico, eletroimãs e isoladores; aparelho e utensílios para sinalização; outros aparelho ou equipamentos elétricos.
FABRICAÇÃO DE MATERIAL ELETRÔNICO E DE APARELHOS E EQUIPAMENTOS DE COMUNICAÇÕES
321 - Fabricação de material eletrônico básico
322 - Fabricação de Aparelhos e Equipamentos de Telefonia e Radiotelefonia e de Transmissores de Televisão e Rádio
Inclui equipamentos transmissores de rádio e televisão e de equipamentos para estações telefônicas, para radiotelefonia e radiotelegrafia - inclusive de microondas e repetidoras; aparelhos telefônicos, sistemas de intercomunicação e semelhantes
323 - Fabricação de aparelhos receptores de rádio e televisão e de reprodução, gravação ou amplificação de som e vídeo
FABRICAÇÃO DE EQUIPAMENTOS DE INSTRUMENTAÇÃO MÉDICOHOPITALARES, INSTRUMENTOS DE PRECISÃO E ÓPTICOS, EQUIPAMENTOS PARA AUTOMAÇÃO INSDUSTRIAL, CRONÔMETROS E RELÓGIOS
331 - Fabricação de aparelhos e instrumentos para usos médico-hospitalares, odontológicos e de laboratórios e aparelhos ortopédicos
332 - Fabricação de aparelhos e instrumentos de medida, teste e controle - exclusive equipamentos para controle de processos industriais
333 -
Fabricação de máquinas, aparelhos e equipamentos de sistemas eletrônicos dedicados a automação industrial e controle do processo produtivo
334 - Fabricação de aparelhos, instrumentos e materiais ópticos, fotográficos e cinematográficos
335 - Fabricação de cronômetros e relógios
FABRICAÇÃO E MONTAGEM DE VEÍCULOS AUTOMOTORES, REBOQUES E CARROCERIAS
341 - Fabricação de automóveis, camionetas e utilitários
342 - Fabricação de caminhões e ônibus
343 - Fabricação de cabines, carrocerias e reboques
344 - Fabricação de peças e acessórios para veículos automotores
Inclui peças e acessórios para o sistema motor; peças e acessórios para os sistemas de marcha e transmissão; peças e acessórios para o sistema de freios; peças e acessórios para o sistema de direção e suspensão; peças e acessórios de metal para veículos automotores não classificados em outra classe.
345 - Recondicionamento ou recuperação de motores para veículos automotores
346 - Construção e reparação de embarcações e estruturas flutuantes para esporte e lazer
352 - Construção, montagem e reparação de veículos ferroviários
Inclui construção e montagem de locomotivas, vagões e outros materiais rodantes; fabricação de peças e acessórios para veículos ferroviários; Reparação de veículos ferroviários
353 - Construção, montagem e reparação de aeronaves
359 - Fabricação de outros equipamentos de transporte
Inclui motocicletas; bicicletas e triciclos não-motorizados; outros equipamentos de transporte
FABRICAÇÃO DE MÓVEIS E INDÚSTRIAS DIVERSAS
361 - Fabricação de artigos do mobiliário
Inclui móveis com predominância de madeira; móveis com predominância de metal; móveis de outros materiais; colchões
369 Fabricação de Produtos Diversos
Inclui lapidação de pedras preciosas e semipreciosas, fabricação de artefatos de ourivesaria e joalheria; instrumentos musicais; artefatos para caça, pesca e esporte; brinquedos e de jogos recreativos; canetas, lápis, fitas impressoras para máquinas e outros artigos para escritório; aviamentos para costura; escovas, pincéis e vassouras; produtos diversos.
RECICLAGEM
371 - Reciclagem de sucatas metálicas
372 - Reciclagem de sucatas não-metálicas
E - PRODUÇÃO E DISTRIBUIÇÃO DE ELETRICIDADE, GÁS E ÁGUA
ELETRICIDADE, GÁS E ÁGUA QUENTE
401 - Produção e distribuição de energia elétrica
402 - Produção e distribuição de gás através de tubulações
403 - Produção e distribuição de vapor e água quente
CAPTAÇÃO, TRATAMENTO E DISTRIBUIÇÃO DE ÁGUA
410 - Captação, tratamento e distribuição de água
F - CONSTRUÇÃO
451 - Preparação do terreno
Inclui demolição e preparação do terreno; perfurações e execução de fundações destinadas à construção civil; grandes movimentações de terra
452 - Construção de edifícios e obras de engenharia civil
Inclui edificações (residenciais, industriais, comerciais e de serviços) - inclusive ampliação e reformas completas; obras viárias - inclusive manutenção; grandes estruturas e obras de arte; obras de urbanização e paisagismo; montagens industriais; obras de outros tipos.
453 - Obras de infraestrutura para Engenharia Elétrica, Eletrônica e Engenharia Ambiental
Inclui construção de barragens e represas para geração de energia elétrica; construção de estações e redes de distribuição de energia elétrica; construção de estações e redes de telefonia e comunicação; obras de prevenção e recuperação do meio ambiente.
454 - Obras de instalações
Inclui instalações elétricas; sistemas de ar condicionado, de ventilação e refrigeração; instalações hidráulicas, sanitárias, de gás e de sistema de prevenção contra incêndio; de para-raios; de segurança e alarme; outras obras de instalações.
455 - Obras de acabamentos e serviços auxiliares da construção
Inclui alvenaria e reboco; impermeabilização e serviços de pintura em geral; outros serviços auxiliares da construção.
456 - Aluguel de equipamentos de construção e demolição com operários
G - COMÉRCIO; REPARAÇÃO DE VEÍCULOS AUTOMOTORES
OBJETOS PESSOAIS E DOMÉSTICOS
COMÉRCIO E REPARAÇÃO DE VEÍCULOS AUTOMOTORES E MOTOCICLETAS; E COMÉRCIO A VAREJO DE COMBUSTÍVEIS
501 - Comércio a varejo e por atacado de veículos automotores
502 - Manutenção e reparação de veículos automotores
503 - Comércio a varejo e por atacado de peças e acessórios para veículos automotores
504 - Comércio a varejo e por atacado de motocicletas, partes, peças e acessórios
505 - Comércio a varejo de combustíveis
COMÉRCIO POR ATACADO E INTERMEDIÁRIOS DO COMÉRCIO
511 - Intermediários do comércio
Inclui matérias-primas agrícolas, animais vivos, matérias primas têxteis e produtos semi-acabados; combustíveis, minerais, metais e produtos químicos industriais; madeira, material de construção e ferragens; máquinas, equipamentos industriais, embarcações e aeronaves; móveis e artigos de uso doméstico; têxteis, vestuário, calçados e artigos de couro; produtos alimentícios, bebidas e fumo; comércio especializado em produtos não especificados anteriormente.
512 - Comércio atacadista de produtos agropecuários "in natura; produtos alimentícios para animais e comércio atacadista de animais vivos
513- Comércio atacadista de produtos alimentícios, bebidas e fumo
Inclui leite e produtos do leite; cereais beneficiados, farinhas, amidos e féculas; hortifrutigranjeiros; carnes e produtos de carne; pescados; bebidas; produtos do fumo; outros produtos alimentícios não especificados anteriormente.
514 - Comércio atacadista de artigos de usos pessoal e doméstico
Inclui fios têxteis, tecidos, artefatos de tecidos e de armarinho; artigos do vestuário e complementos; calçados; eletrodomésticos e outros equipamentos de usos pessoal e doméstico; produtos farmacêuticos, médicos, ortopédicos e odontológicos; cosméticos e produtos de perfumaria; artigos de escritório e de papelaria; papelão e seus artefatos, livros, jornais, e outras publicações; outros artigos de usos pessoal e doméstico, não especificados anteriormente.
515 - Comércio atacadista de produtos intermediários não-agropecuários, resíduos e sucatas
Inclui combustíveis; produtos extrativos de origem mineral; madeira, material de construção, ferragens e ferramentas; produtos químicos; resíduos e sucatas; outros produtos intermediários não agropecuários, não especificados anteriormente
516 - Comércio atacadista de máquinas, aparelhos e equipamentos para usos agropecuário, comercial, de escritório, industrial, técnico e profissional
519 - Comércio atacadista de mercadorias em geral ou não compreendidas nos grupos anteriores
COMÉRCIO VAREJISTA E REPARAÇÃO DE OBJETOS PESSOAIS E DOMÉSTICOS
521 - Comércio varejista não especializado
Inclui mercadorias em geral, com predominância de produtos alimentícios, com área de venda superior a 5000 metros quadrados - hipermercados; mercadorias em geral, com predominância de produtos alimentícios, com área de venda entre 300 e 5000 metros quadrados - supermercados; mercadorias em geral, com predominância de produtos alimentícios, com área de venda inferior a 300 metros quadrados; lojas de conveniência; comércio varejista não especializado, sem predominância de produtos alimentícios.
522 - comércio varejista de produtos alimentícios, bebidas e fumo em lojas especializadas
Inclui produtos de padaria, de laticínio, frios e conservas; doces, balas, bombons e semelhantes; carnes - açougues; bebidas; outros produtos alimentícios não especificados anteriormente e de produtos do fumo.
523 - Comércio varejista de tecidos e artigos de armarinho, vestuário e complementos, calçados, artigos de couro e viagem em lojas especializadas.
524 - Comércio varejista de outros produtos em lojas especializadas
Inclui produtos farmacêuticos, artigos médicos e ortopédicos, de perfumaria e cosméticos; máquinas e aparelhos de usos doméstico e pessoal, discos e instrumentos musicais; móveis, artigos de iluminação e outros artigos para residência; material de construção, ferragens e ferramentas manuais e produtos metalúrgicos; vidros, espelhos e vitrais; tintas e madeiras; equipamentos para escritório; informática e comunicação; livros, jornais, revistas e papelaria; gás liquefeito de petróleo (GLP); outros produtos não especificados anteriormente.
525 - Comércio varejista de artigos usados, em lojas
526 - Comércio varejista não realizado em lojas
Inclui comércio varejista de artigos em geral, por catálogo ou pedido pelo correio; realizado em vias públicas, postos móveis, através de máquinas automáticas e a domicílio
527 - Reparação de objetos pessoais e domésticos
Inclui reparação manutenção de máquinas e de aparelhos eletrodomésticos; reparação de calçados; reparação de outros objetos pessoais e domésticos.
H - ALOJAMENTO E ALIMENTAÇÃO
551 - Estabelecimentos hoteleiros com ou sem restaurante e outros tipos de alojamento temporário
552 - Restaurantes e outros estabelecimentos de serviços de alimentação
Inclui restaurante e estabelecimentos de bebidas, com serviço completo; lanchonetes e similares; cantinas (serviços de alimentação privativos); fornecimento de comida preparada; outros serviços de alimentação.
I - TRANSPORTE, ARMAZENAGEM E COMUNICAÇÕES
601 - Transporte ferroviário interurbano
602 - Outros transportes terrestres
Inclui transporte ferroviário de passageiros, urbano; transporte metroviário; transporte rodoviário de passageiros, regular, urbano; transporte rodoviário de passageiros, regular, não urbano; transporte rodoviário de passageiros, não regular; transporte rodoviário de cargas, em geral; transporte rodoviário de produtos perigosos; transporte rodoviário de mudanças; transporte regular em bondes, funiculares, teleféricos ou trens próprios para exploração de pontos turísticos
603 - Transporte dutoviário
611 - Transporte marítimo de cabotagem e longo curso
612 - Outros transportes aquaviários
Inclui navegação interior de passageiros; navegação interior de carga; transporte aquaviário urbano
621 - Transporte aéreo, regular
622 - Transporte aéreo, não regular
623 - Transporte espacial
ATIVIDADES ANEXAS E AUXILIARES DO TRANSPORTE E AGÊNCIAS DE VIAGEM
631 - Movimentação e armazenamento e depósitos de cargas e descarga
632 - Atividades auxiliares dos transportes terrestres, aquaviários e aéreos
633 - Atividades de agências de viagens e organizadores de viagem
634 - Atividades relacionadas a organização do transporte de cargas
CORREIO E TELECOMUNICAÇÕES
641 - Correio - atividades do Correio Nacional e outras atividades de correio
642 - Telecomunicações
J - INTERMEDIAÇÃO FINANCEIRA
INTERMEDIAÇÃO FINANCEIRA, EXCLUSIVE SEGUROS e PREVIDÊNCIA PRIVADA
651 - Banco Central
652 - Intermediação monetária - depósitos à vista
Inclui bancos comerciais; bancos múltiplos (com carteira comercial); caixas econômicas; cooperativas de crédito
653 - Intermediação monetária - outros tipos de depósitos
Inclui bancos múltiplos (sem carteira comercial); bancos de investimento; bancos de desenvolvimento; crédito imobiliário; sociedades de crédito, financiamento e investimento.
654 - Arredamento Mercantil
655 - Outras atividades de concessão de crédito
inclui agências de desenvolvimento; outras atividades de concessão de crédito.
659 - Outras atividade de intermediação financeira, não especificadas anteriormente
Inclui fundos mútuos, de investimento; sociedades de capitalização; outras atividades de intermediação financeira, não especificadas anteriormente.
SEGUROS E PREVIDÊNCIA PRIVADA
661 - Seguros de vida e não vida e resseguros
662 - Previdência privada fechada e aberta
663 - Planos de saúde
ATIVIDADES AUXILIARES DA INTERMEDIAÇÃO FINANCEIRA
671 - Atividades auxiliares da intermediação financeira, exclusive seguros e previdência privada
Inclui administração de mercados bursáteis; atividades de intermediários em transações de títulos e valores mobiliários; outras atividades auxiliares da intermediação financeira, não especificadas anteriormente.
672 - Atividades auxiliares dos seguros e da previdência privada
K - ATIVIDADES IMOBILIÁRIAS, ALUGUÉIS E SERVIÇOS PRESTADOS ÀS EMPRESAS
ATIVIDADES IMOBILIÁRIAS
701 - Incorporação de imóveis por conta própria
702 - Aluguel de imóveis
7-3 - Atividades imobiliárias - incorporação e administração de imóveis por conta de terceiros
704 - Condomínios prediais
ALUGUEL DE VEÍCULOS, MÁQUINAS E EQUIPAMENTOS SEM CONDUTORES OU OPERADORES E DE OBJETOS PESSOAIS E DOMÉSTICOS
711 - Aluguel de automóveis
712 - Aluguel de outros meios de transporte terrestre, embarcações e aeronaves
713 - Aluguel de máquinas e equipamentos
Inclui aluguel de máquinas e equipamentos agrícolas; máquinas e equipamentos para construção e engenharia civil; máquinas e equipamentos para escritórios; máquinas e equipamentos de outros tipos não especificados anteriormente
714 - Aluguel de objetos pessoais e domésticos
ATIVIDADES DE INFORMÁTICA E CONEXAS
721 - Consultoria em sistemas de informática
722 - Desenvolvimento de programas de informática
723 - Processamento de dados
724 - Atividades de Banco de Dados
725 - Manutenção e reparação de máquinas de escritório e de informática
729 - Outras atividades de informática, não especificadas anteriormente
PESQUISA E DESENVOLVIMENTO
731 - Pesquisa e desenvolvimento das ciências físicas e naturais
732 - Pesquisa e desenvolvimento das ciências sociais e humanas
SERVIÇOS PRESTADOS PRINCIPALMENTE ÀS EMPRESAS
741 - Atividades jurídicas, contábeis e de assessoria empresarial
Inclui atividades jurídicas; de contabilidade e auditoria; pesquisas de mercado e de opinião pública; gestão de participações societárias (holdings); sedes de empresas e unidades administrativas locais; atividades de assessoria em gestão empresarial.
742 - Serviços de arquitetura e engenharia e de assessoramento técnico especializado
743 - Ensaios de materiais e de produtos; análise de qualidade
744 - Publicidade
745 - Seleção, agenciamento e locação de mão-de-obra
746 - Atividades de investigação, vigilância e segurança
747 - Outras atividades de serviços prestados principalmente às empresas
Inclui atividades fotográficas; atividades de envasamento e empacotamento, por conta de terceiros; outras atividades de serviços prestados principalmente às empresas, não especificadas anteriormente.
L - ADMINISTRAÇÃO PÚBLICA, DEFESA E SEGURIDADE SOCIAL
751 - Administração do estado e da política econômica e social
Inclui administração pública em geral; regulação das atividades sociais e culturais; regulação das atividades econômicas; Atividades de apoio à administração pública
752 - Serviços coletivos prestados pela Administração Pública
Inclui relações exteriores; defesa, justiça, segurança e ordem pública; defesa civil
753 - Seguridade social
M- EDUCAÇÃO
801 - Educação pré-escola e fundamental
802 - Educação média de formação geral, profissionalizantes ou técnica
803 - Educação superior
809 - Formação permanente e outras atividades de ensino
Inclui ensino em autoescolas e cursos de pilotagem; educação supletiva; educação continuada ou permanente e aprendizagem profissional; ensino à distância; educação especial.
N - SAÚDE E SERVIÇOS SOCIAIS
851 - Atividades de atenção à saúde
Inclui atividades de atendimento hospitalar; de atendimento a urgências e emergências; de atenção ambulatorial; de serviços de complementação diagnóstica ou terapêutica; de outros profissionais da área de saúde; outras atividades relacionadas com a atenção à saúde
852 - Serviços veterinários
853 - Serviços sociais com ou sem alojamento
O - OUTROS SERVIÇOS COLETIVOS, SOCIAIS E PESSOAIS
900 - Limpeza urbana e esgoto; e atividades relacionadas
911 - Atividades de organizações empresariais, patronais e profissionais
912 - Atividades de organizações sindicais
919 - Outras Atividades Associativas
Inclui organizações religiosas; organizações políticas; outras atividades associativas, não-especificadas anteriormente
921 - Atividades Cinematográficas e de Vídeo
Inclui produção, distribuição e projeção de filmes cinematográficos e fitas de vídeo.
922 - Atividades de Rádio e de Televisão
923 - Outras Atividades Artísticas e de Espetáculos Inclui atividades de teatro, música e outras atividades artísticas e literárias; gestão de salas de espetáculos; outras atividades de espetáculos, não-especificadas anteriormente
924 - Atividades de Agências de Notícias
925 - Atividades de Bibliotecas, Arquivos, Museus e Outras Atividades Culturais
Inclui conservação do patrimônio histórico; atividades de jardins botânicos, zoológicos, parques nacionais e reservas ecológicas.
926 - Atividades Desportivas e Outras Relacionadas ao Lazer
SERVIÇOS PESSOAIS
930 - Serviços Pessoais
Inclui lavanderias e tinturarias; cabeleireiros e outros tratamentos de beleza; atividades funerárias e conexas; atividades de manutenção do físico corporal; outras atividades de serviços pessoais, não especificadas anteriormente.
P - SERVIÇOS DOMÉSTICOS
950 - Serviços Domésticos
Q - ORGANISMOS INTERNACIONAIS E OUTRAS INSTITUIÇÕES EXTRATERRITORIAIS
990 - Organismos Internacionais e Outras Instituições Extraterritoriais
ANEXO LII
LAUDO MÉDICO PARA EMISSÃO DA AIH - LAUDO MÉDICO PARA COMUNICAÇÃO DE AGRAVO RELACIONADO AO TRABALHO (Origem: PRT MS/GM 1969/2001, Anexo 4)
LAUDO MÉDICO PARA EMISSÃO DE AIH
LAUDO MÉDICO PARA COMUNICAÇÃO DE AGRAVO RELACIONADO AO TRABALHO
| UNIDADE DE ATENDIMENTO | ||||||||||||||||||||||||||||||||||
| NOME | CÓDIGO/CNPJ | |||||||||||||||||||||||||||||||||
| ÓRGÃO EMISSOR | ||||||||||||||||||||||||||||||||||
| NOME DO PACIENTE | ||||||||||||||||||||||||||||||||||
| Nº DO CARTÃO SUS | CPF | PIS/PASEP/Nº INDIVIDUAL | ||||||||||||||||||||||||||||||||
| ENDEREÇO | BAIRRO | MUNICÍPIO | UF | |||||||||||||||||||||||||||||||
| CEP | DATA DE NASCIMENTO | CBO/TRABALHADOR | SEXO | MASC. | FEM. | |||||||||||||||||||||||||||||
| PREENCHER EM CASO DE CAUSAS EXTERNAS | TIPO DE CAUSA EXTERNA | |||||||||||||||||||||||||||||||||
| PREENCHER EM CASO DE ACIDENTE DE TRÂNSITO | CGC DA SEGURADORA | Nº DO BILHETE | SÉRIE | |||||||||||||||||||||||||||||||
| PREENCHER EM CASO DE ACIDENTES E/OU DOENÇAS RELACIONADAS AO TRABALHO | ||||||||||||||||||||||||||||||||||
| PIS/PASEP/Nº INDIVIDUAL | VÍNCULO COM A PREVIDÊNCIA | |||||||||||||||||||||||||||||||||
| EMPREGADO | EMPREGADOR | AUTÔNOMO | DESEMPREG. | APOSENTADO | NÃO SEGURADO | |||||||||||||||||||||||||||||
| CNPJ/EMPRESA | CNAE/EMPRESA | ACIDENTE TRABAHO TIPICO | ACIDENTE TRABALHO TRAJETO | |||||||||||||||||||||||||||||||
| LAUDO TÉCNICO E JUSTIFICATIVA DA INTERNAÇÃO | ||||||||||||||||||||||||||||||||||
| PRINCIPAIS SINAIS E SINTOMAS CLÍNICOS | ||||||||||||||||||||||||||||||||||
| CONDIÇÕES QUE JUSTIFICAM A INTERNAÇÃO | ||||||||||||||||||||||||||||||||||
| PRINCIPAIS RESULTADOS E PROVAS DIAGNÓSTICO | ||||||||||||||||||||||||||||||||||
| DIAGNÓSTICO INICIAL | CID (1) | CID (2) | CLÍNICA CIRÚRGICA | CLÍNICA OBSTÉTRICA | CLÍNICA MÉDICA | |||||||||||||||||||||||||||||
| 1 | 2 | 3 | ||||||||||||||||||||||||||||||||
| PROCEDIMENTO SOLICITADO | FPT/CRON | PSIQUIÁTRICO | PEDIÁTRICA | OUTRAS | ||||||||||||||||||||||||||||||
| 4 | 5 | 7 | 9 | |||||||||||||||||||||||||||||||
| ASSINATURA DO MÉDICO SOLICITANTE (EXAMINADOR) | CRM | DATA | ||||||||||||||||||||||||||||||||
ANEXO LIII
ESPECIALIDADES E PRÉ-REQUISITOS PARA INSTITUIÇÕES PÚBLICAS ESTADUAIS, DISTRITAL E MUNICIPAIS DE SAÚDE E PARA OS HOSPITAIS PRIVADOS SEM FINS LUCRATIVOS, EXCETUANDO-SE ENTIDADES DE SAÚDE RECONHECIDAS COMO DE EXCELÊNCIA CONFORME LEI Nº 12.101/2009 E REGULAMENTOS. (Origem: PRT MS/GM 1248/2013, Anexo 1)
| ESPECIALIDADE | PRÉ-REQUISITOS | ||
|---|---|---|---|
| 1. Anestesiologia | Hospital com mínimo de 100 leitos gerais, 2 salas cirúrgicas, 10 a 20 leitos de UTI adulto, serviço de urgência hospitalar, habilitado para ortopedia ou neurocirurgia ou cardiologia. | ||
| 2. Clínica Médica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos UTI adulto e serviço de urgência hospitalar na rede. | ||
| 3. Cirurgia Geral | Hospital com mínimo de 100 leitos gerais; mínimo de 2 salas cirúrgicas; 5 a 10 leitos de UTI adulto; serviço de urgência hospitalar na rede. | ||
| 4. Cirurgia do Trauma | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede, possuir habilitação em Centro de Trauma. | ||
| 5. Cancerologia Clínica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; habilitação em UNACON ou CACON. | ||
| 6. Cancerologia Cirúrgica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de 2 salas cirúrgicas; habilitação em UNACON ou CACON. | ||
| 7. Cancerologia Pediátrica | Hospital com mínimo de 50 leitos, mínimo de 5 leitos de pediatria clínica por residente, mínimo de 5 leitos de UTI pediátrica; sala cirúrgica; habilitação em UNACON ou CACON. | ||
| 8. Cardiologia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade Cardiovascular. | ||
| 9. Ginecologia e Obstetrícia | Hospital com mínimo de 40 leitos gerais, mínimo de 5 leitos obstetrícia (clínica ou cirúrgica) por residente, 2 leitos ginecologia, 1 sala cirúrgica. | ||
| 10. Geriatria | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos UTI adulto. | ||
| 11. Medicina de Família e Comunidade | Atender aos parâmetros estabelecidos na Portaria nº 3.147/2012 | ||
| 12. Medicina Intensiva | Hospital com mínimo de 100 leitos gerais; mínimo de 10 a 20 leitos UTI adulto, serviço de urgência hospitalar na rede de atenção à saúde. | ||
| 13. Medicina de Urgência | Hospital com mínimo de 100 leitos gerais, 10 a 20 leitos UTI adulto, serviço de urgência hospitalar próprio. | ||
| 14. Neonatologia | Hospital com mínimo de 100 leitos gerais e/ou 20 leitos especializados em neonatologia no caso de maternidades; mínimo de 5 a 10 leitos de UTI neonatal. | ||
| 15. Nefrologia | Hospital com mínimo de mínimo 100 leitos gerais; mínimo 5 a 10 leitos de UTI adulto; serviço de urgência hospitalar na rede, possuir Serviço de Nefrologia ou Centro de Referência em Nefrologia habilitado. | ||
| 16. Neurocirurgia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade para Neurocirurgia. | ||
| 17. Neurologia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade para Neurologia. | ||
| 18. Ortopedia e Traumatologia | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede, possuir habilitação em Alta Complexidade para Ortopedia e Traumatologia | ||
| 19. Pediatria | Hospital com mínimo de 40 leitos, mínimo de 5 leitos de pediatria clínica por residente; mínimo de 5 leitos de UTI pediátrica e serviço de urgência pediátrica na rede. |
||
| 20. Psiquiatria | Hospital com mínimo de 100 leitos gerais com no mínimo 10 leitos especializados em saúde mental, além de CAPS II ou III e serviço de urgência hospitalar na rede de atenção à saúde. Rodízios em todos os equipamentos de atenção psicossocial do município. | ||
| 21.Radiologia e Diagnóstico por Imagem | Hospital que realize atendimento adulto, pediátrico e em ginecologia-obstetrícia; hospital com mínimo de 100 leitos gerais; sala cirúrgica, mínimo de 5 a 10 leitos de UTI adulto; serviço de urgência hospitalar na rede; possuir serviço de diagnóstico por imagem compatível com a formação do especialista em radiologia. | ||
| 22. Radioterapia | Hospital com mínimo de 100 leitos gerais; mínimo 5 a 10 leitos UTI adulto; habilitação em UNACON ou CACON com radioterapia no SUS. | ||
ANEXO LIV
ESPECIALIDADES E PRÉ-REQUISITOS PARA INSTITUIÇÕES FEDERAIS VINCULADAS AO MINISTÉRIO DA EDUCAÇÃO (MEC) (Origem: PRT MS/GM 1248/2013, Anexo 2)
ESPECIALIDADES E PRÉ-REQUISITOS PARA INSTITUIÇÕES FEDERAIS VINCULADAS AO MINISTÉRIO DA EDUCAÇÃO (MEC)
| ESPECIALIDADE | PRÉ-REQUISITOS |
|---|---|
| 1. Anestesiologia | Hospital com mínimo de 100 leitos gerais, 2 salas cirúrgicas, 10 a 20 leitos de UTI adulto, serviço de urgência hospitalar, habilitado para ortopedia ou neurocirurgia ou cardiologia |
| 2. Cancerologia Clínica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; habilitação em UNACON ou CACON |
| 3. Cancerologia Cirúrgica | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de 2 salas cirúrgicas; habilitação em UNACON ou CACON. |
| 4. Cancerologia Pediátrica | Hospital com mínimo de 50 leitos, mínimo de 5 leitos de pediatria clínica por residente, mínimo de 5 leitos de UTI pediátrica; sala cirúrgica; habilitação em UNACON ou CACON. |
| 5. Cardiologia Pediátrica | Hospital com mínimo de 50 leitos, mínimo de 5 leitos de pediatria clínica por residente, mínimo de 5 leitos de UTI pediátrica; serviço de urgência hospitalar na rede; possuir serviço de diagnóstico por imagem compatível com a formação do especialista em cardiologia; possuir hospital habilitado como unidade de assistência de alta complexidade cardiovascular na rede. |
| 6. Cirurgia Cardiovascular | Hospital habilitado como unidade de assistência de alta complexidade cardiovascular |
| 7. Medicina de Família e Comunidade | Atender aos parâmetros estabelecidos na Portaria nº 3.147/2012 |
| 8. Medicina Nuclear | Hospital com mínimo de 100 leitos gerais; mínimo 5 a 10 leitos UTI adulto; habilitação em UNACON ou CACON com radioterapia no SUS. |
| 9. Neurocirurgia | Hospital com mínimo de 100 leitos gerais; mínimo de 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede e possuir habilitação em Alta Complexidade para Neurocirurgia |
| 10. Ortopedia e Traumatologia | Hospital com mínimo de 100 leitos gerais; mínimo de 5 a 10 leitos de UTI adulto; mínimo de duas salas cirúrgicas; serviço de urgência hospitalar na rede, possuir habilitação em Alta Complexidade para Ortopedia e Traumatologia. |
| 11. Radioterapia | Hospital com mínimo de 100 leitos gerais; mínimo 5 a 10 leitos UTI adulto; habilitação em UNACON ou CACON com radioterapia no SUS |
| 12. Patologia/Patologia Clínica/Medicina Laboratorial | Hospital com no mínimo 100 leitos; serviço de verificação de óbitos; mínimo de duas salas cirúrgicas. |
| 13. Transplantes | Habilitação em Transplantes |
ANEXO LV
SERVIÇO DE ATENÇÃO ÀS PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL E SUAS CLASSIFICAÇÕES NO SISTEMA DE CADASTRO NACIONAL DE ESTABELECIMENTOS DE SAÚDE (Origem: PRT MS/GM 485/2014, Anexo 1)
| CÓD. SERV | DESCRIÇÃO DO SERVIÇO | CÓD. CLASS | DESCRIÇÃO DA CLASSIFICAÇÃO |
|---|---|---|---|
| 165 | SERVIÇO DE ATENÇÃO ÀS PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | 001 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL ÀS MULHERES EM SITUAÇÃO DE VIOLÊNCIA SEXUAL |
| 002 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL A ADOLESCENTES EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 003 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL ÀS CRIANÇAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 004 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL AOS HOMENS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 005 | SERVIÇO DE REFERÊNCIA PARA ATENÇÃO INTEGRAL ÀS PESSOAS IDOSAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL | ||
| 006 | SERVIÇO DE REFERÊNCIA PARA INTERRUPÇÃO DE GRAVIDEZ NOS CASOS PREVISTOS EM LEI | ||
| 008 | SERVIÇOS AMBULATORIAIS COM ATENDIMENTO A PESSOAS EM SITUAÇÃO DE VIOLÊNCIA SEXUAL. |
ANEXO LVI
TERMO DE COMPROMISSO PARA GARANTIA DE ACESSO (Origem: PRT MS/GM 1097/2006, Anexo I)
TERMO DE COMPROMISSO PARA GARANTIA DE ACESSO
O município de ( nome do município de referência ) , representado pelo Secretário Municipal de Saúde ( nome do Secretário), assume a garantia de acesso aos usuários do Sistema Único de Saúde procedentes dos municípios XXXXX, WWWWW, YYYYY, ZZZZZZZ, conforme a Programação Pactuada e Integrada , aprovada na reunião da Comissão Intergestores Bipartite - CIB realizada em ___/___/___. (anexar relatório das referências recebidas)
_______________________________________
Local e data
______________________________ ____________________
(nome do gestor do município de referência) (assinatura)
______________________________ ____________________
(nome do coordenador municipal da CIB) (assinatura)
______________________________ ____________________
(nome do coordenador estadual da CIB) (assinatura)
_______________________________________________
(nome do coordenador estadual/municipal da CIB do estado encaminhador - no caso de PPI Interestadual)
ANEXO LVII
QUADROS MODELOS DA PROGRAMAÇÃO PACTUADA E INTEGRADA DA ASSISTÊNCIA EM SAÚDE (Origem: PRT MS/GM 1097/2006, Anexo II)
QUADRO 01
PPI ASSISTENCIAL - DETALHAMENTO DA PPI EM TODOS OS MUNICÍPIOS DA UF (valores anuais)
Competência: UF:
| IBGE | Município | ASSISTÊNCIA AMBULATORIAL | ASSISTÊNCIA HOSPITALAR | Incentivos permanentes de custeio * | Valores encaminhados a outras UFs | Valores recebidos de outras UFs | Ajustes | TOTAL PPI ASSISTENCIAL | ||
| Pop. Própria | Pop. Referência | Pop. Própria | Pop. Referência | |||||||
| Total quadro 01 | ||||||||||
* Os incentivos desta coluna referem-se ao SAMU, Centro de Referencia Saúde do Trabalhador, Integra - SUS, IAPI, FIDEPS e Incentivo de Adesão à Contratualização . Os valores referentes ao custeio dos Centros de Especialidades Odontológicas e dos Hospitais de Pequeno Porte estão contemplados nas colunas de população própria e referenciada, e deverão ser compatibilizados com o valor do incentivo de custeio previsto para cada estabelecimento.
QUADRO 02
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES PROGRAMADOS NA SES (valores anuais)
Competência: UF:
| Código da UF | ESPECIFICAÇÃO | TOTAL PPI ASSISTENCIAL |
Tratamento Fora do Domicílio Estadual |
||
Hemorrede |
||
Valores encaminhados a outras UFs |
||
Valores recebidos de outras UFs |
||
Outros...................................................(especificar ) |
||
Total quadro 02 |
||
OBS : total quadro 1 + total quadro 2 = total da UF Os valores recebidos pelos estabelecimentos da Rede Sarah não estão contemplados nestes quadros
QUADRO 03
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES ENCAMINHADOS A MUNICÍPIOS DE OUTRAS UFs DE REGIÕES INTERESTADUAIS (valores anuais)
Competência: UF:
| IBGE | Município de origem | IBGE município executor | Município executor | Recursos encaminhados | Total PPI assistencial | |
| Gestão Estadual | Gestão Municipal | |||||
| Subtotal estado Y | ||||||
| Subtotal estado X | ||||||
| Total quadro 03 | ||||||
QUADRO 04
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES A SEREM DESCONTADOS DA PPI DOS MUNICÍPIOS EM FUNÇÃO DE TCEP ENTRE OS GESTORES ESTADUAL e MUNICIPAL (valores anuais)
Competência: UF:
| IBGE | Município | Nome da Unidade | Código CNES | Número do Termo | Data de Publicação do Extrato do Termo | Fundo (FMS ou FES) para o qual serão realizadas as transferências | Valor ANUAL a ser destinado ao Fundo de Saúde |
| Total quadro 04 | |||||||
Os valores serão descontados da PPI dos municípios (quadro 1) quando as transferências forem realizadas ao FES.
Quando as transferências forem realizadas ao FMS os valores não serão descontados da PPI dos municípios
QUADRO 05
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES A SEREM DESCONTADOS DA PPI DOS MUNICÍPIOS EM FUNÇÃO DE ESTABELECIMENTOS SOB GESTÃO ESTADUAL (valores anuais)
Competência: UF:
| IBGE | Município | Valor ANUAL a ser destinado ao Fundo Estadual de Saúde |
www |
||
www |
||
subtotal do município WWW |
||
Total quadro 5 |
||
QUADRO 06
PPI ASSISTENCIAL - DETALHAMENTO DOS VALORES A SEREM DESCONTADOS DA PPI DOS MUNICÍPIOS PARA RETENÇÃO DOS RECURSOS PELO FNS E TRANSFERÊNCIA DIRETA ÀS UNIDADES PRESTADORAS UNIVERSITÁRIAS FEDERAIS (valores anuais)
Competência: UF:
| Gestão | IBGE | Municípios | Nome da Unidade | Código CNES | Nº do contrato | Data de Publicação do Extrato do Contrato | Valor ANUAL a ser retido no FNS e transferido diretamente a Unidade Prestadora |
| Gestão Municipal | |||||||
| subtotal 1ª parte do quadro 06 | |||||||
| Gestão Estadual | |||||||
| subtotal 2ª parte do quadro 06 |
QUADRO 07
(totalizador) - PPI ASSISTENCIAL - VALORES DE REPASSE AOS FUNDOS MUNICIPAIS DE SAÚDE (valores anuais)
Competência: UF:
| IBGE | Município | Assitência Ambulatorial e Hospitalar | Incentivos permanentes de custeio | Ajustes | Valores de TCEP com transferências realizadas ao FES (-) | Valores de estabelecimentos sob gestão estadual (-) | Valores retidos no Fundo Nacional da Saúde (-) | Valores encaminhados ou recebidos de outras UFs (+ ou-) | Total Fundo Municipal |
| Origem do dado | QUADRO 1 | QUADRO 4 | QUADRO 5 | QUADRO 6 1ªparte | Quadro 1 | ||||
| Valores transferidos aos FMS | |||||||||
QUADRO 08
(totalizador) - PPI ASSISTENCIAL - VALORES DE REPASSE AO FUNDO ESTADUAL DE SAÚDE (valores anuais)
Competência: UF:
| Código gestão estadual | ESPECIFICAÇÃO DOS RECURSOS | Origem do dado | Valor |
| 999999 | (+) Limites referentes aos recursos programados na SES | Quadro 2 | |
| 999999 | (+) Valores a receber referentes a estabelecimentos sob gestão estadual | Quadro 5 | |
| 999999 | (+) Valores a receber referentes à TCEP com transferências diretas ao FES | Quadro 4 | |
| 999999 | (-) Valores a serem retidos pelo Fundo Nacional de Saúde e transferidos diretamente às unidades prestadoras universitárias federais | Quadro 6 - 2ª parte | |
| 999999 | (+ ou -) Valores encaminhados ou recebidos de outras UFs | Quadro 2 | |
| (-) Outros descontos (campo excluisvo do Ministério da Saúde) | |||
| (+) Recursos de Origem da PPI INTERESTADUAL (Valores recebidos) | Detalhamento no quadro QRI | ||
| (+) Outros Acrescimos (campo exclusivo do Ministério da Saúde) | |||
| VALORES TRANSFERIDOS AO FUNDO ESTADUAL DE SAÚDE | |||
QUADRO 09
(totalizador) - PPI ASSISTENCIAL - CONSOLIDADO DA PROGRAMAÇÃO (valores anuais)
Competência: UF:
| Especificação | Origem do dado | Valor |
| Total dos valores transferidos aos Fundos Municipais de Saúde | Quadro 7 | |
| Total dos valores transferidos ao Fundo Estadual de Saúde | Quadro 8 | |
| Total dos valores retidos do Fundo Nacional de Saúde | Quadro 6 | |
| Total Geral da UF |
ANEXO LVIII
CALENDÁRIO NACIONAL DE VACINAÇÃO (Origem: PRT MS/GM 1533/2016, Anexo 1)
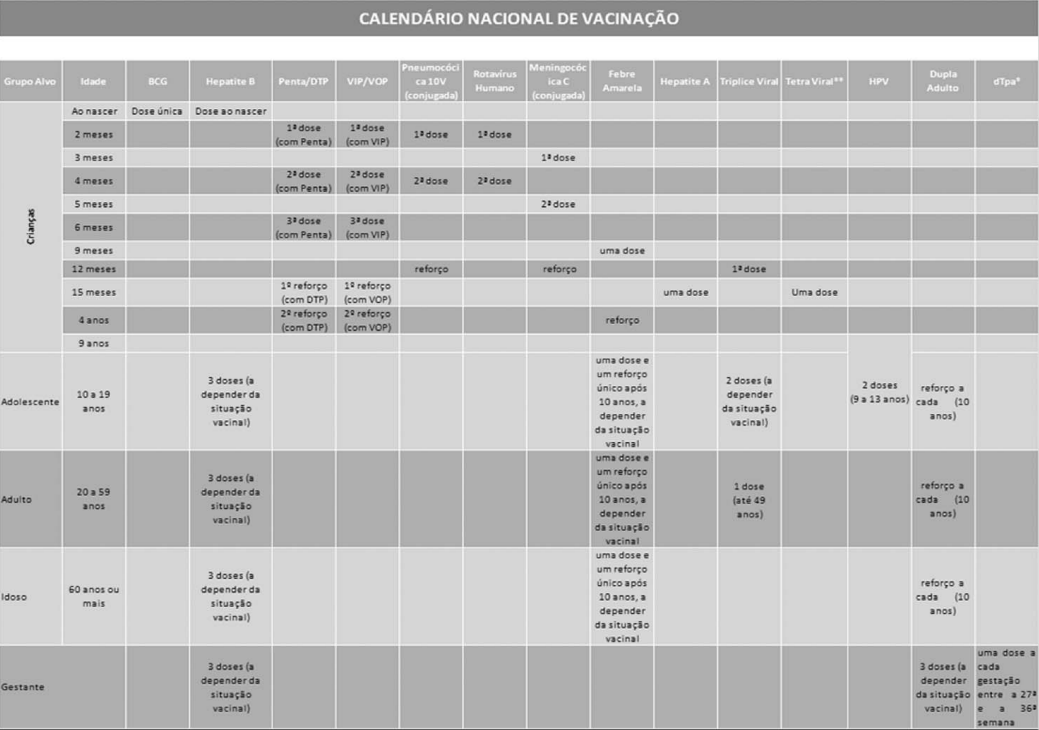
ANEXO LIX
CALENDÁRIO NACIONAL DE VACINAÇÃO DOS POVOS INDÍGENAS (Origem: PRT MS/GM 1533/2016, Anexo 2)
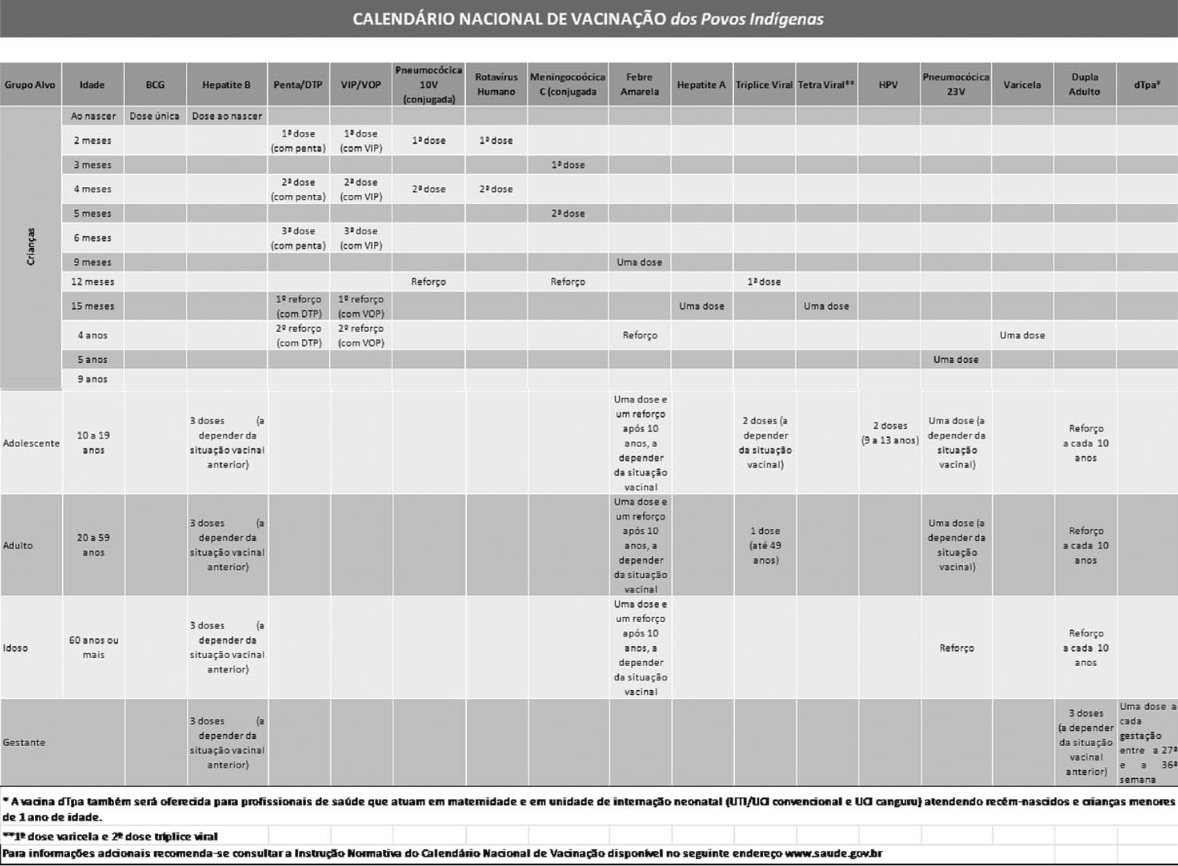
ANEXO LX
CAMPANHAS NACIONAIS DE VACINAÇÃO (Origem: PRT MS/GM 1533/2016, Anexo 3)
| Anexo III - Campanhas Nacionais de Vacinaçãos | |
| Influenza | Crianças de 6 meses a menores de 5 anos de idade, gestantes, puérperas, pessoas com 60 anos e mais, povos indígenas, trabalhadores de saúde, população privada de liberdade, funcionários do sistema prisional e indivíduos com comorbidades. |
| Poliomielite | Crianças de 1 ano a menores de 5 anos de idade |
| Multivacinação (todas as vacinas do Calendário Básico de Vacinação da Criança para atualização do esquema vacinal). | Crianças menores de 5 anos de idade |
| Seguimento contra o Sarampo (a cada 5 anos ou de acordo com a situação epidemiológica). | Crianças menores de 5 anos de idade |
ANEXO LXI
INSTRUÇÃO NORMATIVA REFERENTE AO CALENDÁRIO NACIONAL DE VACINAÇÃO (Origem: PRT MS/GM 1533/2016, Anexo 4)
O presente instrumento estabelece as normatizações técnicas do Programa Nacional de Imunizações referentes ao Calendário Nacional de Vacinação, de que trata a Portaria GM/MS nº xx, de julho de 2016.
Vacina BCG
Esquema:
Administrar dose única, o mais precocemente possível, de preferência na maternidade, logo após o nascimento.
Dose: 0,1mL via intradérmica.
Particularidades:
A comprovação da vacinação com BCG se dá por meio do registro da vacinação no cartão ou caderneta de vacinação, da identificação da cicatriz vacinal ou da palpação de nódulo, no deltoide direito, na ausência de cicatriz.
Crianças nascidas com peso inferior a 2 Kg, adiar a vacinação até que atinjam este peso.
Na rotina dos serviços, a vacina é disponibilizada para crianças até 4 (quatro) anos 11 meses e 29 dias, ainda não vacinadas.
Crianças vacinadas na faixa etária preconizada que não apresentam cicatriz vacinal após 6 (seis) meses da administração da vacina, revacinar apenas uma vez.
Esta vacina é contraindicada para gestantes e pessoas imunodeprimidas.
Pessoas hospitalizadas com comprometimento do estado geral, a vacinação deve ser adiada até a resolução do quadro clinico.
Contatos prolongados de portadores de hanseníase: vacinação seletiva, nas seguintes situações:
Menores de 1 (um) ano de idade:
Não vacinados: administrar 1 (uma) dose de BCG.
Comprovadamente vacinados que apresentem cicatriz vacinal: não administrar outra dose de BCG.
Comprovadamente vacinados que não apresentem cicatriz vacinal: administrar uma dose de BCG seis meses após a última dose.
A partir de 1 (um) ano de idade:
Sem cicatriz: administrar 1 (uma) dose.
Vacinados com 1 (uma) dose: administrar outra dose de BCG, com intervalo mínimo de 6 (seis) meses após a dose anterior.
Vacinados com 2 (duas) doses: não administrar outra dose de BCG.
Pessoas expostas ao HIV:
Administrar ao nascimento ou o mais precocemente possível.
Criança que chega ao serviço, ainda não vacinada, poderá receber BCG se assintomática e sem sinais de imunodepressão.
A revacinação não é indicada.
A partir dos 5 (cinco) anos de idade, pessoas portadoras de HIV não devem ser vacinadas, mesmo que assintomáticas e sem sinais de imunodeficiência.
Vacina Hepatite B (recombinante)
Esquema:
Administrar 1 (uma) dose ao nascer, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade. Esta dose pode ser administrada até 30 dias após o nascimento.
Completar o esquema de vacinação contra hepatite B com a vacina penta [vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada)], aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade.
Crianças que perderam a oportunidade de receber a vacina hepatite B (recombinante) até 1 (um) mês de idade, não administrar mais essa vacina. Iniciar esquema vacinal a partir de 2 (dois) meses de idade até 4 (quatro) anos 11 meses e 29 dias, com a vacina penta (vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada), com intervalo de 60 dias entre as doses, mínimo de 30 dias, conforme esquema detalhado notópico da vacina penta.
Pessoas a partir de 7 (sete) anos de idade:
Sem comprovação vacinal: administrar 3 (três) doses da vacina hepatite B com intervalo de 30 dias entre a primeira e a segunda dose e de 6 (seis) meses entre a primeira e a terceira dose (0, 1 e 6 meses).
Com esquema vacinal incompleto, não reiniciar o esquema, apenas completá-lo conforme situação encontrada.
Para gestantes em qualquer faixa etária e idade gestacional:
administrar 3 (três) doses da vacina hepatite B, considerando o histórico de vacinação anterior e os intervalos preconizados entre as doses. Caso não seja possível completar o esquema durante a gestação, deverá concluir após o parto.
Dose: 0,5 mL até os 19 anos de idade e 1 mL a partir de 20 anos de idade (Laboratório Butantan - nacional) e 0,5 mL até os 15 anos de idade e 1 mL a partir de 16 anos de idade (Laboratório Sanofi - internacional), via intramuscular.
Particularidades:
Em recém-nascidos de mães portadoras da hepatite B, administrar a vacina e a imunoglobulina humana anti-hepatite B, preferencialmente nas primeiras 12 horas, podendo a imunoglobulina ser administrada no máximo até 7 (sete) dias de vida.
Para pessoas com condições clínicas especiais recomenda-se consultar o Manual dos Centros de Referência para Imunobiológicos Especiais (CRIE) disponível em:
http://portalsaude.saude.gov.br/images/pdf/2014/dezembro/09/manual-cries-9dez14-web.pdf.
Vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada) - Vacina Penta
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias. A terceira dose não deverá ser dada antes dos 6 (seis) meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Na rotina dos serviços, a vacina penta está disponível para crianças até 6 (seis) anos 11 meses e 29 dias.
Crianças até 6 (seis) anos 11 meses e 29 dias, sem comprovação ou com esquema vacinal incompleto, iniciar ou complementar esquema com penta.
A vacina penta está contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina adsorvida difteria, tétano, pertussis (DTP)
Reforço:
Administrar 2 (dois) reforços, o primeiro aos 15 meses de idade e o segundo aos 4 (quatro) anos de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses de penta); intervalo mínimo de 6 (seis) meses entre os reforços.
Crianças com 4 anos de idade, sem nenhum reforço, administrar 2 reforços, considerando o intervalo de seis meses entre os reforços.
Crianças entre 5 (cinco) anos de idade e 6 (seis) anos 11 meses e 29 dias, que apresente um reforço, administrar um segundo reforço e crianças sem nenhum reforço, administrar apenas 1 (um) reforço.
Nos comunicantes domiciliares e escolares de casos de difteria ou coqueluche menores de 7 (sete) anos de idade, não vacinados ou com esquema incompleto ou com situação vacinal desconhecida, atualizar esquema, seguir orientações do esquema da vacina penta ou da DTP.
A vacina DTP é contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina Poliomielite 1, 2 e 3 (inativada) - VIP
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses. O intervalo mínimo é de 30 dias entre as doses.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças até 4 anos, 11 meses e 29 dias:
Sem comprovação vacinal: administrar 3 (três) doses da VIP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VIP mesmo tendo iniciado esquema com VOP.
Vacina Poliomielite 1 e 3 (atenuada) - VOP
Reforço:
Administrar o primeiro reforço aos 15 meses e o segundo aos 4 (quatro) anos de idade.
Dose: duas gotas, exclusivamente por via oral.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses).
Administrar o segundo reforço com intervalo mínimo de 6 (seis) meses após o primeiro reforço.
Indivíduos com 5 (cinco) anos de idade ou mais:
Sem comprovação vacinal: administrar 3 (três) doses da VOP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VOP;
Nesta faixa etária não há necessidade de reforço.
Repetir a dose imediatamente se a criança regurgitar, cuspir ou vomitar após a administração da vacina.
Esta vacina é contraindicada para pessoas imunodeprimidas, contatos de pessoa HIV positiva ou com imunodeficiência, bem como aqueles que tenham histórico de paralisia flácida associada à dose anterior da VOP.
Indicada para viajantes que se deslocam para países com recomendação da vacina.
Vacina pneumocócica 10-valente (conjugada) - Pneumo10v
Esquema:
Administrar 2 (duas) doses aos 2 (dois) e 4 (quatro) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar 1 (um) reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 4 (quatro) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias.
Crianças sem comprovação vacinal, entre 12 meses e 4 anos, de idade, administrar dose única.
Para as crianças de 2 meses a menores de 5 (cinco) anos de idade, com indicação clínica especial (ver manual do Crie), manter esquema de três doses e reforço.
Vacina rotavírus humano G1P1 [8] (atenuada) - VORH
Esquema:
Administrar 2 (duas) doses, aos 2 (dois) e 4 (quatro) meses de idade.
Dose: 1,5 mL - administrar todo o conteúdo da seringa exclusivamente por via oral.
Particularidades:
Para evitar a oportunidade perdida de vacinação, a primeira dose pode ser administrada a partir de 1 (um) mês e 15 dias até 3 (três) meses e 15 dias. A segunda dose pode ser administrada a partir de 3 (três) meses e 15 dias até 7 (sete) meses e 29 dias. Manter intervalo mínimo de 30 dias entre as doses.
Se a criança regurgitar, cuspir ou vomitar após a vacinação, não repetir a dose.
Esta vacina é contraindicada para crianças com histórico de invaginação intestinal ou com malformação congênita não corrigida do trato gastrointestinal.
Crianças com quadro agudo de gastroenterite (tais como: vômitos, diarreia, febre), adiar a vacinação até a resolução do quadro.
Crianças com imunodepressão deverão ser avaliadas e vacinadas mediante prescrição médica.
Vacina meningocócica C (conjugada) - Meningo C
Esquema:
Administrar 2 (duas) doses, aos 3 (três) e 5 (cinco) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar o reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 5 (cinco) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias.
Vacina febre amarela (atenuada) - Febre Amarela (FA)
Esquema: Administrar 1 (uma) dose aos 9 (nove) meses de idade.
Reforço: Administrar 1 (um) reforço aos 4 (quatro) anos de idade. O intervalo mínimo entre a dose do esquema e o reforço é de 30 dias.
Indicada para residentes ou viajantes para as Áreas com Recomendação da Vacina (ACRV).
Dose: 0,5 mL, via subcutânea.
Particularidades:
Pessoas a partir de 5 (cinco) anos de idade:
que receberam uma dose da vacina antes de completar 5 (cinco) anos de idade - administrar um reforço, com intervalo mínimo de 30 dias entre as doses.
que nunca foram vacinadas ou sem comprovante de vacinação - administrar a primeira dose da vacina e 1 (um) reforço após10 (dez) anos.
que receberam 2 (duas) doses da vacina - considerar vacinado. Não administrar nenhuma dose.
Para pessoas com 60 anos e mais, que nunca foram vacinadas ou sem comprovante de vacinação, o médico deverá avaliar o benefício/risco da vacinação, levando em conta os riscos da doença, comorbidades e eventos adversos nessa faixa etária.
Para gestantes, independente do estado vacinal, a vacinação não está indicada. Na impossibilidade de adiar a vacinação, em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Mulheres amamentando crianças com até 6 meses de idade, independentemente do estado vacinal: a vacinação não está indicada, devendo ser adiada até a criança completar 6 meses de idade. Na impossibilidade de adiar a vacinação, como em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Em caso de mulheres que estejam amamentando crianças menores de 6 (seis) meses de idade e receberam a vacina, o aleitamento materno deve ser suspenso preferencialmente por 28 dias após a vacinação (com um mínimo de 15 dias). Nessa situação a mãe e a criança deverão ser acompanhadas pelo serviço de saúde.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Em crianças menores de 2 (dois) anos de idade não vacinadas contra a febre amarela, não administrar as vacinas tríplice viral ou tetra viral simultaneamente com a vacina febre amarela. O intervalo entre as vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
A vacina febre amarela pode ser administrada simultaneamente ou com qualquer intervalo com todas as vacinas com exceção da primeira dose da vacina tríplice viral ou tetra viral em crianças menores de 2 (dois) anos de idade, como referido anteriormente.
Esta vacina é contraindicada para crianças abaixo dos 6 (seis) meses de idade.
Em situação de suspeita de surto de febre amarela, epizootia em primatas não humanos ou confirmação da circulação viral em vetores silvestres, uma dose deve ser administrada aos 6 (seis) meses de idade, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 9 (nove) meses e aos 4 (quatro) anos de idade.
Viajantes:
Deverão ser vacinados os viajantes que:
Se deslocarem para áreas com recomendação de vacinação no Brasil (estados das regiões Norte e Centro Oeste, Minas Gerais e Maranhão, e alguns municípios dos estados do Piauí, Bahia, São Paulo, Paraná, Santa Catarina e Rio Grande do Sul). Consultar a lista de municípios da ACRV no seguinte endereço: http://portalsaude.saude.gov.br/images/pdf/2015/novembro/19/Lista-de-Municipios-ACRV-Febre-Amarela-Set-2015.pdf
Se deslocarem para Países com risco para a febre amarela:
Conforme disposto no Regulamento Sanitário Internacional (RSI) a vacinação é recomendada de acordo com a situação epidemiológica de risco do país. Consultar a lista de países de risco para febre amarela e a necessidade de apresentação do Certificado Internacional de Vacinação ou Profilaxia (CIVP) para o ingresso em seu território, no seguinte endereço: www.anvisa.gov.br/viajante. Ressalta-se que para efeito de emissão do CIVP, a validade deste certificado terá início 10 dias a partir da aplicação da vacina em caso de primovacinação. Para mais informações sobre o CIVP, o consulado/ embaixada de cada país deverá ser consultado.
A vacina é indicada para viajantes pelo menos 10 (dez) dias antes da viagem. O prazo de 10 dias não se aplica no caso de revacinação.
Estrangeiros que irão visitar o Brasil:
Recomenda-se que os viajantes atualizem a sua situação vacinal conforme as orientações do calendário de vacinação do país de origem ou residência, previamente à chegada ao Brasil.
Vacina sarampo, caxumba e rubéola - Tríplice Viral
Esquema:
Administrar a primeira dose aos 12 meses de idade.
Completar o esquema de vacinação contra o sarampo, caxumba e rubéola com a vacina tetra viral aos 15 meses de idade (corresponde à segunda dose da vacina tríplice viral e uma dose da vacina varicela).
Dose: 0,5 mL, via subcutânea.
Particularidades:
A vacina tetra viral está disponível na rotina de vacinação para crianças com idade entre 15 meses e 1 ano 11 meses e 29 dias.
Detalhamento no tópico da vacina tetra viral.
Pessoas de 2 a 19 anos de idade não vacinadas ou com esquema incompleto devem ser vacinadas com a vacina tríplice viral conforme situação encontrada, considerando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 doses de vacina tríplice viral ou tetra viral;
Pessoas de 20 a 49 anos de idade não vacinadas devem receber uma dose de tríplice viral. Considerar vacinada a pessoa que comprovar 1 (uma) dose de vacina tríplice viral ou dupla viral;
Para profissionais de saúde independente da idade: administrar 2 (duas) doses, conforme situação vacinal encontrada, observando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 (0064uas) dose de vacina dupla viral ou tríplice viral.
Esta vacina é contraindicada para gestantes e crianças abaixo dos 6 (seis) meses de idade.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Mulheres em idade fértil devem evitar a gravidez até pelo menos 1 (um) mês após a vacinação.
Em crianças menores de 2 (dois) anos de idade não vacinadas com tríplice viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações de emergência epidemiológica para sarampo ou rubéola:
administrar 1 (uma) dose de tríplice viral em crianças na faixa etária entre 6 (seis) a 11 meses, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 12 meses e aos 15 meses de idade;
administrar 1 (uma) dose de dupla viral ou tríplice viral em pessoas acima de 50 anos de idade que não comprovarem nenhuma dose destas vacinas.
Vacina sarampo, caxumba, rubéola e varicela (atenuada) - Tetra viral
Esquema:
Administrar 1 (uma) dose aos 15 meses de idade em crianças que já tenham recebido a primeira dose da vacina tríplice viral.
Dose: 0,5 mL, subcutânea.
Particularidade:
Crianças que não foram vacinadas oportunamente aos 15 meses de idade, poderão ser vacinadas até 1 (um) ano 11 meses e 29 dias;
Em crianças menores de 2 (dois) anos de idade não vacinadas com tetra viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações emergenciais e na indisponibilidade da vacina tetra viral, as vacinas tríplice viral (sarampo, caxumba e rubéola) e varicela (atenuada) poderão ser utilizadas.
Vacina adsorvida hepatite A (inativada) - Hepatite A
Esquema:
Administrar uma dose aos 15 meses de idade. A idade máxima para administração é 1(um) ano, 11 meses, 29 dias.
Dose: 0,5mL, intramuscular.
Particularidades:
Crianças com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Vacina adsorvida difteria e tétano adulto - dT/ Dupla
Adulto
Reforço:
Indivíduos a partir de 7 (sete) anos de idade, com esquema vacinal completo (3 [três] doses) para difteria e tétano, administrar 1 (uma) dose a cada 10 anos após a última dose;
Em todos os casos, após completar o esquema básico (DTP, tetra ou penta) e reforços, administrar reforço com a dT a cada 10 anos, após a última dose;
Em casos de ferimentos graves, comunicantes de casos de difteria, antecipar a dose quando a última foi administrada há mais de 5 (cinco) anos.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Pessoas a partir de 7 (sete) anos de idade não vacinadas ou sem comprovação vacinal para difteria e tétano, administrar 3 (três) doses com intervalo de 60 dias entre as doses, mínimo de 30 dias. Indivíduos a partir de 7 (sete) anos de idade, com esquema incompleto para difteria e tétano, completar esquema de 3 (três) doses, considerando as doses anteriores, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
A vacina dupla adulto (dT) pode ser administrada a partir da comprovação da gravidez, em qualquer período gestacional, até 20 dias antes da data provável do parto.
Vacina adsorvida difteria, tétano e pertussis (acelular) tipo adulto - dTpa
Esquema:
Gestantes: 1 (uma) dose a cada gestação
A vacina é indicada para as gestantes a partir da vigésima sétima semana (27ª) a trigésima sexta (36ª) semana de gestação, preferencialmente, podendo ser administrada até 20 dias antes da data provável do parto, considerando o histórico vacinal de difteria, tétano (dT).
As gestantes que residem em áreas de difícil acesso poderão ser vacinadas a partir da vigésima (20ª) semana de gestação. Esta recomendação visa não perder a oportunidade de vacinar estas gestantes.
Particularidades:
Gestantes NÃO vacinadas previamente, administrar três doses de vacinas contendo toxoides tetânico e diftérico com intervalo de 60 dias entre as doses. Sendo 2 (duas) doses de dT e 1 (uma) dose de dTpa, preferencialmente entre 27ª e 36ª semanas de gestação.
Gestantes vacinadas com uma dose de dT, administrar uma dose de dT e uma dose de dTpa (entre 27ª e 36ª semanas de gestação) com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com duas doses de dT, administrar uma dose da dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há menos de cinco anos, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há mais de cinco anos, administrar uma dose de dTpa.
Gestantes em áreas de difícil acesso, administrar a vacina dTpa a partir da vigésima (20ª) semana de gestação adequando a administração das doses conforme quadro acima.
Gestantes que não foram vacinadas durante a gestação, aplicar uma dose de dTpa no puerpério o mais precoce possível.
Profissionais de Saúde e Parteiras tradicional:
Observação: Segundo o Ministério da Saúde parteira tradicional é aquela que presta assistência ao parto domiciliar baseada em saberes e práticas tradicionais e é reconhecida pela comunidade como parteira.
Administrar uma dose de dTpa para profissionais de saúde que atuam em maternidade e em unidade de internação neonatal (UTI/UCI convencional e UCI canguru) e parteiras que prestam atendimento a recém-nascidos, considerando o histórico vacinal de difteria, tétano.
Com esquema de vacinação primário completo:
Administração da dTpa como reforço a cada dez anos em substituição da dT.
Com esquema de vacinação primário incompleto:
Menos de três doses com a vacina dT: administrar uma dose de dTpa e completar o esquema com uma ou duas doses de dT (dupla adulto) de forma a totalizar três doses da vacina contendo o componente tetânico.
Dose: 0,5mL, intramuscular.
Vacina papilomavirus humano 6, 11, 16 e 18 (recombinante) - HPV
Esquema:
Administrar 2 (duas) doses, com intervalo de 6 (seis) meses entre as doses, nas meninas de 9 a 13 anos 11 meses e 29 dias.
Meninas e mulheres de 9 a 26 anos 11 meses e 29 dias, vivendo com HIV/Aids administrar 3 (três) doses com intervalo de 2 (dois) meses entre a primeira e a segunda dose e 6 (seis) meses entre a primeira e a terceira dose. Para a vacinação deste grupo, mantém-se a necessidade de prescrição médica.
Dose: 0,5 mL, intramuscular.
Particularidades:
Meninas com 14 anos de idade com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando o intervalo mínimo de seis meses entre as doses;
Mulheres com 27 anos, vivendo com HIV/Aids com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando os intervalos entre as doses.
Caso a primeira dose tenha sido administrada há mais de 6 meses, administrar a segunda dose e agendar a terceira dose, respeitando o intervalo mínimo de 90 dias entre a segunda e a terceira dose.
Esta vacina é contraindicada durante a gestação. Caso a mulher engravide após a primeira dose da vacina HPV ou receba a vacina inadvertidamente durante a gravidez, suspender a dose subsequente e completar o esquema vacinal, preferencialmente em até 45 dias após o parto. Nestes casos nenhuma intervenção adicional é necessária, somente o acompanhamento do pré-natal.
Mulheres que estão amamentando podem ser vacinadas com a vacina HPV.
Recomenda-se que a pessoa vacinada deverá permanecer sentada, sob observação por aproximadamente 15 minutos após a vacinação.
ANEXO LXII
INSTRUÇÃO NORMATIVA REFERENTE AO CALENDÁRIO NACIONAL DE VACINAÇÃO DOS POVOS INDÍGENAS (Origem: PRT MS/GM 1533/2016, Anexo 5)
O presente instrumento estabelece as normatizações técnicas do Programa Nacional de Imunizações referentes ao Calendário Nacional de Vacinação dos Povos Indígenas, de que trata a Portaria GM/MS nº xx de xx de xx de 2016.
Vacina BCG
Esquema:
Administrar dose única, o mais precoce possível, preferencialmente na maternidade, logo após nascimento.
Dose: 0,1mL, via intradérmica.
Particularidades:
A comprovação da vacinação com BCG se dá por meio do registro da vacinação no cartão ou caderneta de vacinação, por meio da identificação da cicatriz vacinal ou da palpação de nódulo na ausência de cicatriz.
Crianças nascidas com peso inferior a 2 Kg, adiar a vacinação até que atinjam este peso.
Na rotina dos serviços, a vacina é disponibilizada para crianças até 4(quatro) anos 11 meses e 29 dias, ainda não vacinadas.
Crianças vacinadas na faixa etária preconizada que não apresentam cicatriz vacinal após 6 (seis) meses da administração da vacina, revacinar apenas uma vez.
A realização do teste tuberculínico é dispensável antes ou depois da administração da vacina BCG, inclusive para os contatos de pacientes de hanseníase.
Contatos prolongados de portadores de hanseníase: vacinação seletiva, nas seguintes situações:
Menores de 1(um) ano de idade:
Não vacinados: administrar 1(uma) dose de BCG.
Comprovadamente vacinados que apresentem cicatriz vacinal: não administrar outra dose de BCG.
Comprovadamente vacinados que não apresentem cicatriz vacinal: administrar uma dose de BCG seis meses após a última dose.
A partir de 1 (um) ano de idade:
Sem cicatriz: administrar 1 (uma) dose.
Vacinados com 1 (uma) dose: administrar outra dose de BCG, com intervalo mínimo de 6 (seis) meses após a dose anterior.
Vacinados com 2 (duas) doses: não administrar outra dose de BCG.
Pessoas expostas ao HIV:
Administrar ao nascimento ou o mais precocemente possível.
Criança que chega ao serviço, ainda não vacinada, poderá receber BCG se assintomática e sem sinais de imunodepressão.
A revacinação não é indicada.
A partir dos 5 (cinco) anos de idade, pessoas portadoras de HIV não devem ser vacinadas, mesmo que assintomáticas e sem sinais de imunodeficiência.
Vacina Hepatite B (recombinante)
Esquema:
Administrar 1 (uma) dose ao nascer, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade. Esta dose pode ser administrada até 30 dias após o nascimento.
Completar o esquema de vacinação contra hepatite B com a vacina penta [vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada)], aos 2 (dois), 4 (quatro) e 6 (seis) meses deidade.
Crianças que perderam a oportunidade de receber a vacina hepatite B (recombinante) até 1 mês de idade, não administrar mais essa vacina. Iniciar esquema vacinal a partir de 2 (dois) meses de idade até 6 (seis) anos 11 meses e 29 dias, com a vacina penta (vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada), com intervalo de 60 dias entre as doses, mínimo de 30 dias, conforme esquema detalhado no tópico da vacina penta.
O presente instrumento estabelece as normatizações técnicas do Programa Nacional de Imunizações referentes ao Calendário Nacional de Vacinação dos Povos Indígenas, de que trata a Portaria GM/MS nº xx de xx de xx de 2016.
Vacina BCG
Esquema:
Administrar dose única, o mais precoce possível, preferencialmente na maternidade, logo após o nascimento.
Dose: 0,1mL, via intradérmica.
Particularidades:
A comprovação da vacinação com BCG se dá por meio do registro da vacinação no cartão ou caderneta de vacinação, por meio da identificação da cicatriz vacinal ou da palpação de nódulo na ausência de cicatriz.
Crianças nascidas com peso inferior a 2 Kg, adiar a vacinação até que atinjam este peso.
Na rotina dos serviços, a vacina é disponibilizada para crianças até 4 (quatro) anos 11 meses e 29 dias, ainda não vacinadas.
Crianças vacinadas na faixa etária preconizada que não apresentam cicatriz vacinal após 6 (seis) meses da administração da vacina, revacinar apenas uma vez.
A realização do teste tuberculínico é dispensável antes ou depois da administração da vacina BCG, inclusive para os contatos de pacientes de hanseníase.
Contatos prolongados de portadores de hanseníase: vacinação seletiva, nas seguintes situações:
Menores de 1 (um) ano de idade:
Não vacinados: administrar 1 (uma) dose de BCG.
Comprovadamente vacinados que apresentem cicatriz vacinal: não administrar outra dose de BCG.
Comprovadamente vacinados que não apresentem cicatriz vacinal: administrar uma dose de BCG seis meses após a última dose.
A partir de 1 (um) ano de idade:
Sem cicatriz: administrar 1 (uma) dose.
Vacinados com 1 (uma) dose: administrar outra dose de BCG, com intervalo mínimo de 6 (seis) meses após a dose anterior.
Vacinados com 2 (duas) doses: não administrar outra dose de BCG.
Pessoas expostas ao HIV:
Administrar ao nascimento ou o mais precocemente possível.
Criança que chega ao serviço, ainda não vacinada, poderá receber BCG se assintomática e sem sinais de imunodepressão.
A revacinação não é indicada.
A partir dos 5 (cinco) anos de idade, pessoas portadoras de HIV não devem ser vacinadas, mesmo que assintomáticas e sem sinais de imunodeficiência.
Vacina Hepatite B (recombinante)
Esquema:
Administrar 1 (uma) dose ao nascer, o mais precocemente possível, nas primeiras 24 horas, preferencialmente nas primeiras 12 horas após o nascimento, ainda na maternidade. Esta dose pode ser administrada até 30 dias após o nascimento.
Completar o esquema de vacinação contra hepatite B com a vacina penta [vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada)], aos 2 (dois), 4 (quatro) e 6 (seis) meses deidade.
Crianças que perderam a oportunidade de receber a vacina hepatite B (recombinante) até 1 mês de idade, não administrar mais essa vacina. Iniciar esquema vacinal a partir de 2 (dois) meses de idade até 6 (seis) anos 11 meses e 29 dias, com a vacina penta (vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada), com intervalo de 60 dias entre as doses, mínimo de 30 dias, conforme esquema detalhado no tópico da vacina penta.
Pessoas a partir de 7 (sete) anos de idade:
Sem comprovação vacinal: administrar 3 (três) doses da vacina hepatite B com intervalo de 30 dias entre a primeira e a segunda dose e de 6 (seis) meses entre a primeira e a terceira dose (0, 1 e 6 meses).
Com esquema vacinal incompleto, não reiniciar o esquema, apenas completá-lo conforme situação encontrada.
Para gestantes em qualquer faixa etária e idade gestacional:
administrar 3 (três) doses da vacina hepatite B, considerando o histórico de vacinação anterior e os intervalos preconizados entre as doses. Caso não seja possível completar o esquema durante a gestação, deverá concluir após o parto.
Dose: 0,5 mL até os 19 anos de idade e 1 mL a partir de 20 anos de idade (Laboratório Butantan - nacional) e 0,5 mL até os 15 anos de idade e 1 mL a partir de 16 anos de idade (Laboratório Sanofi - internacional), via intramuscular.
Particularidades:
Em recém-nascidos de mães portadoras da hepatite B, administrar a vacina e a imunoglobulina humana anti-hepatite B, preferencialmente nas primeiras 12 horas, podendo a imunoglobulina ser administrada no máximo até 7 (sete) dias de vida.
Para pessoas com condições clínicas especiais recomenda-se consultar o Manual dos Centros de Referência para Imunobiológicos Especiais (CRIE) disponível em:
http://portalsaude.saude.gov.br/images/pdf/2014/dezembro/09/manual-cries-9dez14-web.pdf.
Vacina adsorvida difteria, tétano, pertussis, hepatite B (recombinante) e Haemophilus influenzae B (conjugada) - Vacina Penta
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias. A terceira dose não deverá ser dada antes dos 6 (seis) meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Na rotina dos serviços, a vacina penta está disponível para crianças até 6 (seis) anos 11 meses e 29 dias;
Crianças até 6 (seis) anos 11 meses e 29 dias, sem comprovação ou com esquema vacinal incompleto, iniciar ou complementar esquema com penta;
A vacina penta está contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina adsorvida difteria, tétano, pertussis (DTP)
Reforço:
Administrar 2 (dois) reforços, o primeiro aos 15 meses de idade e o segundo aos 4 (quatro) anos de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses de penta); intervalo mínimo de 6 (seis) meses entre os reforços. Crianças com 4 anos de idade, sem nenhum reforço, administrar 2 reforços, considerando o intervalo de seis meses entre os reforços.
Nos comunicantes domiciliares e escolares de casos de difteria ou coqueluche menores de 7 (sete) anos de idade, não vacinados ou com esquema incompleto ou com situação vacinal desconhecida, atualizar esquema, seguir orientações do esquema da vacina penta ou da DTP.
A vacina DTP é contraindicada para crianças a partir de 7 (sete) anos de idade.
Vacina Poliomielite 1, 2 e 3 (inativada)- VIP
Esquema:
Administrar 3 (três) doses, aos 2 (dois), 4 (quatro) e 6 (seis) meses de idade, com intervalo de 60 dias entre as doses. O intervalo mínimo é de 30 dias entre as doses.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças até 4 anos, 11 meses e 29 dias:
Sem comprovação vacinal: administrar 3 (três) doses da VIP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VIP mesmo tendo iniciado esquema com VOP.
Vacina Poliomielite 1 e 3 (atenuada) - VOP
Reforço:
Administrar o primeiro reforço aos 15 meses e o segundo aos 4 (quatro) anos de idade.
Dose: duas gotas, exclusivamente por via oral.
Particularidades:
Administrar o primeiro reforço com intervalo mínimo de 6 (seis) meses após a última dose do esquema primário (três doses);
Administrar o segundo reforço com intervalo mínimo de 6 (seis) meses após o primeiro reforço;
Indivíduos com 5 (cinco) anos de idade ou mais:
Sem comprovação vacinal: administrar 3 (três) doses da VOP, com intervalo de 60 dias entre as doses, mínimo de 30 dias;
Com esquema incompleto: completar esquema com a VOP;
Nesta faixa etária não há necessidade de reforço.
Repetir a dose imediatamente se a criança regurgitar, cuspir ou vomitar após a administração da vacina.
Esta vacina é contraindicada para pessoas imunodeprimidas, contatos de pessoa HIV positiva ou com imunodeficiência, bem como aqueles que tenham histórico de paralisia flácida associada à dose anterior da VOP.
Indicada para viajantes que se deslocam para países com recomendação da vacina.
Vacina pneumocócica 10-valente (conjugada)- Pneumo10v
Esquema:
Administrar 2 (duas) doses aos 2 (dois) e 4 (quatro) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar 1 (um) reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 4 (quatro) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias
Crianças sem comprovação vacinal, entre 12 meses e 4 anos, de idade, administrar dose única.
Para as crianças de 2 meses a menores de 5 (cinco) anos de idade, com indicação clínica especial (ver manual do Crie), manter esquema de três doses e reforço.
Vacina rotavírus humano G1P1 [8] (atenuada)- VORH
Esquema:
Administrar 2 (duas) doses, aos 2 (dois) e 4 (quatro) meses de idade.
Dose: 1,5 mL - administrar todo o conteúdo da seringa exclusivamente por via oral.
Particularidades:
Para evitar a oportunidade perdida de vacinação, a primeira dose pode ser administrada a partir de 1 (um) mês e 15 dias até 3 (três) meses e 15 dias. A segunda dose pode ser administrada a partir de 3 (três) meses e 15 dias até 7 (sete) meses e 29 dias. Manter intervalo mínimo de 30 dias entre as doses.
Se a criança regurgitar, cuspir ou vomitar após a vacinação, não repetir a dose.
Esta vacina é contraindicada para crianças com histórico de invaginação intestinal ou com malformação congênita não corrigida do trato gastrointestinal.
Crianças com quadro agudo de gastroenterite (tais como: vômitos, diarreia, febre), adiar a vacinação até a resolução do quadro.
Crianças com imunodepressão deverão ser avaliadas e vacinadas mediante prescrição médica.
Vacina meningocócica C (conjugada) - Meningo C
Esquema:
Administrar 2 (duas) doses, aos 3 (três) e 5 (cinco) meses de idade, com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Reforço:
Administrar o reforço aos 12 meses de idade.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Crianças que iniciaram o esquema primário após 5 (cinco) meses de idade, devem completa-lo até 12 meses, com intervalo mínimo de 30 dias entre as doses; administrar o reforço com intervalo mínimo de 60 dias após a última dose.
O reforço deve ser administrado entre 12 meses a 4 (quatro) anos, 11 meses e 29 dias.
Vacina febre amarela (atenuada) - Febre Amarela (FA)
Esquema: Administrar 1 (uma) dose aos 9 (nove) meses de idade.
Reforço: Administrar 1 (um) reforço aos 4 (quatro) anos de idade. O intervalo mínimo entre a dose do esquema e o reforço é de 30 dias.
Esta vacina é indicada para toda população indígena independente da Área com Recomendação para Vacinação (ACRV).
Dose: 0,5 mL, via subcutânea.
Particularidades:
Pessoas a partir de 5 (cinco) anos de idade:
que receberam uma dose da vacina antes de completar 5 (cinco) anos de idade - administrar um reforço, com intervalo mínimo de 30 dias entre as doses.
que nunca foram vacinadas ou sem comprovante de vacinação - administrar a primeira dose da vacina e 1 (um) reforço após 10 (dez) anos.
que receberam 2 (duas) doses da vacina - considerar vacinado. Não administrar nenhuma dose.
Para pessoas com 60 anos e mais, que nunca foram vacinadas ou sem comprovante de vacinação, o médico deverá avaliar o benefício/risco da vacinação, levando em conta os riscos da doença, comorbidades e eventos adversos nessa faixa etária.
Para gestantes, independente do estado vacinal, a vacinação não está indicada. Na impossibilidade de adiar a vacinação, em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Mulheres amamentando crianças com até 6 meses de idade, independentemente do estado vacinal: a vacinação não está indicada, devendo ser adiada até a criança completar 6 meses de idade. Na impossibilidade de adiar a vacinação, como em situações de emergência epidemiológica, vigência de surtos, epidemias ou viagem para área de risco de contrair a doença, o médico deverá avaliar o benefício/risco da vacinação.
Em caso de mulheres que estejam amamentando crianças menores de 6 (seis) meses de idade e receberam a vacina, o aleitamento materno deve ser suspenso preferencialmente por 28 dias após a vacinação (com um mínimo de 15 dias). Nessa situação a mãe e a criança deverão ser acompanhadas pelo serviço de saúde.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Em crianças menores de 2 (dois) anos de idade não vacinadas contra a febre amarela, não administrar as vacinas tríplice viral ou tetra viral simultaneamente com a vacina febre amarela. O intervalo mínimo entre as vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo devido à especificidade da população indígena, o intervalo mínimo poderá ser de 15 dias.
A vacina febre amarela pode ser administrada simultaneamente ou com qualquer intervalo com todas as vacinas com exceção da primeira dose da vacina tríplice viral ou tetra viral em crianças menores de 2 (dois) anos de idade, como referido anteriormente.
Esta vacina é contraindicada para crianças abaixo dos 6 (seis) meses de idade.
Em situação de suspeita de surto de febre amarela, epizootia em primatas não humanos ou confirmação da circulação viral em vetores silvestres, uma dose deve ser administrada aos 6 (seis) meses de idade, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 9 (nove) meses e aos 4 (quatro) anos de idade.
Vacina sarampo, caxumba e rubéola - Tríplice Viral
Esquema:
Administrar a primeira dose aos 12 meses de idade.
Completar o esquema de vacinação contra o sarampo, caxumba e rubéola com a vacina tetra viral aos 15 meses de idade (corresponde à segunda dose da vacina tríplice viral e uma dose da vacina varicela).
Dose: 0,5 mL, via subcutânea.
Particularidades:
A vacina tetra viral está disponível na rotina de vacinação para crianças com idade entre 15 meses e 1 ano 11 meses e 29 dias.
Detalhamento no tópico da vacina tetra viral.
Pessoas de 2 a 19 anos de idade não vacinadas ou com esquema incompleto devem ser vacinadas com a vacina tríplice viral conforme situação encontrada, considerando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 doses de vacina tríplice viral ou tetra viral;
Pessoas de 20 a 49 anos de idade não vacinadas devem receber uma dose de tríplice viral. Considerar vacinada a pessoa que comprovar 1 (uma) dose de vacina tríplice viral ou dupla viral;
Para profissionais de saúde independente da idade: administrar 2 (duas) doses, conforme situação vacinal encontrada, observando o intervalo mínimo de 30 dias entre as doses. Considerar vacinada a pessoa que comprovar 2 (duas) dose de vacina dupla viral ou tríplice viral.
Esta vacina é contraindicada para gestantes e crianças abaixo dos 6 (seis) meses de idade.
Pessoas com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Mulheres em idade fértil devem evitar a gravidez até pelo menos 1 (um) mês após a vacinação.
Em crianças menores de 2 (dois) anos de idade não vacinadas com tríplice viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações de emergência epidemiológica para sarampo ou rubéola:
administrar 1 (uma) dose de tríplice viral em crianças na faixa etária entre 6 (seis) a 11 meses, não sendo considerada válida para rotina, devendo ser mantido o esquema vacinal aos 12 meses e aos 15 meses de idade;
administrar 1 (uma) dose de dupla viral ou tríplice viral em pessoas acima de 50 anos de idade que não comprovarem nenhuma dose destas vacinas.
Vacina sarampo, caxumba, rubéola e varicela (atenuada) - Tetra viral
Esquema:
Administrar 1 (uma) dose aos 15 meses de idade em crianças que já tenham recebido a primeira dose da vacina tríplice viral.
Dose: 0,5 mL, subcutânea.
Particularidade:
Crianças que não foram vacinadas oportunamente aos 15 meses de idade, poderão ser vacinadas até 1 (um) ano 11 meses e 29 dias;
Em crianças menores de 2 (dois) anos de idade não vacinadas com tetra viral, não administrar esta vacina simultaneamente com a vacina febre amarela. O intervalo entre estas vacinas é de 30 dias, salvo em situações especiais que impossibilitem manter este intervalo (com um mínimo de 15 dias).
Em situações emergenciais e na indisponibilidade da vacina tetra viral, as vacinas tríplice viral (sarampo, caxumba e rubéola) e varicela (atenuada) poderão ser utilizadas.
Vacina adsorvida hepatite A (inativada) - Hepatite A
Esquema:
Administrar uma dose aos 15 meses de idade. A idade máxima para administração é 1(um) ano, 11 meses, 29 dias.
Dose: 0,5mL, intramuscular.
Particularidades:
Crianças com imunodepressão deverão ser avaliadas e vacinadas segundo orientações do manual do Crie.
Vacina adsorvida difteria e tétano adulto - dT/ Dupla Adulto
Reforço:
Indivíduos a partir de 7 (sete) anos de idade, com esquema vacinal completo (3 [três] doses) para difteria e tétano, administrar 1 (uma) dose a cada 10 anos após a última dose;
Em todos os casos, após completar o esquema básico (DTP, tetra ou penta) e reforços, administrar reforço com a dT a cada 10 anos, após a última dose;
Em casos de ferimentos graves, comunicantes de casos de difteria, antecipar a dose quando a última foi administrada há mais de 5 (cinco) anos.
Dose: 0,5 mL, via intramuscular.
Particularidades:
Indivíduos a partir de 7 (sete) anos de idade não vacinadas ou sem comprovação vacinal para difteria e tétano, administrar 3 (três) doses com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Indivíduos a partir de 7 (sete) anos de idade, com esquema incompleto para difteria e tétano, completar esquema de 3 (três) doses, considerando as doses anteriores, com intervalo de 60 diasentre as doses, mínimo de 30 dias.
A vacina dupla adulto (dT) pode ser administrada a partir da comprovação da gravidez, em qualquer período gestacional. Completar esquema até 20 dias antes do parto.
Vacina adsorvida difteria, tétano e pertussis (acelular) tipo adulto - dTpa
Esquema:
Gestantes: 1 (uma) dose a cada gestação
A vacina é indicada para as gestantes a partir da vigésima sétima semana (27ª) a trigésima sexta (36ª) semana de gestação, preferencialmente, podendo ser administrada até 20 dias antes da data provável do parto, considerando o histórico vacinal de difteria, tétano (dT).
As gestantes que residem em áreas de difícil acesso poderão ser vacinadas a partir da vigésima (20ª) semana de gestação. Esta recomendação visa não perder a oportunidade de vacinar estas gestantes.
Particularidades:
Gestantes NÃO vacinadas previamente, administrar três doses de vacinas contendo toxoides tetânico e diftérico com intervalo de 60 dias entre as doses. Sendo 2 (duas) doses de dT por uma dose de dTpa, preferencialmente entre 27ª e 36ª semanas de gestação.
Gestantes vacinadas com uma dose de dT, administrar uma dose de dT e uma dose de dTpa (entre 27ª e 36ª semanas de gestação) com intervalo de 60 dias entre as doses, mínimo de 30 dias.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com duas doses de dT, administrar uma dose da dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há menos de cinco anos, administrar uma dose de dTpa.
Gestantes na 27ª a 36ª semanas de gestação, vacinada com três doses de dT e com dose de reforço há mais de cinco anos, administrar uma dose de dTpa.
Gestantes em áreas de difícil acesso, administrar a vacina dTpa a partir da vigésima (20ª) semana de gestação adequando a administração das doses conforme quadro acima.
Gestantes que não foram vacinadas durante a gestação, aplicar uma dose de dTpa no puerpério o mais precoce possível.
Profissionais de Saúde e Parteiras tradicional:
Observação: Segundo o Ministério da Saúde parteira tradicional é aquela que presta assistência ao parto domiciliar baseada em saberes e práticas tradicionais e é reconhecida pela comunidade como parteira.
Administrar uma dose de dTpa para profissionais de saúde que atuam em maternidade e em unidade de internação neonatal (UTI/UCI convencional e UCI canguru) e parteiras que prestam atendimento a recém-nascidos, considerando o histórico vacinal de difteria, tétano.
Com esquema de vacinação primário completo:
Administração da dTpa como reforço a cada dez anos em substituição da dT.
Com esquema de vacinação primário incompleto:
Menos de três doses com a vacina dT: administrar uma dose de dTpa e completar o esquema com uma ou duas doses de dT (dupla adulto) de forma a totalizar três doses da vacina contendo o componente tetânico.
Dose: 0,5mL, intramuscular.
Vacina influenza (fracionada, inativada) - Gripe
Esquema:
Crianças entre 6 (seis) meses e 8 (oito) anos 11 meses 29 dias, primovacinadas (que tomarão a vacina pela primeira vez): administrar 2 (duas) doses, com intervalo de 30 dias entre as doses.
Para pessoas a partir de 9 (nove) anos: administrar 1 (uma) dose.
Dose:
Para crianças entre 6 (seis) meses e 2 (dois) anos 11 meses 29 dias: administrar 0,25 mL, via intramuscular ou subcutânea, a depender do país de origem do laboratório produtor (Verificar na bula que acompanha a vacina ou no informe da campanha anual).
Para pessoas a partir de 3 (três) anos de idade: 0,5 mL, via intramuscular ou subcutânea, a depender do país de origem do laboratório produtor.
Particularidades:
Em caso de mudança de faixa etária (de 2 para 3 anos de idade), manter a dose inicial do esquema, isto é, 0,25mL.
Gestantes: administrar esta vacina em qualquer idade gestacional.
Vacina pneumocócica 23-valente (polissacarídica) - Pneumo 23v
Esquema:
Administrar 1 (uma) dose em todos os indígenas a partir de 5 (cinco) anos de idade sem comprovação vacinal com as vacinas pneumocócicas conjugadas.
A partir dos 60 (sessenta) anos de idade, administrar 1 (uma) única dose adicional, respeitando o intervalo mínimo de 5 (cinco) anos da dose inicial.
Dose: 0,5 mL via intramuscular
Particularidades:
Contraindicada para as crianças menores de 2 (dois) anos de idade.
Não administrar em crianças menores de 5 (cinco) anos de idade.
Criança de 2 (dois) a 4 (quatro) anos, 11 meses e 29 dias que recebeu dose da vacina pneumocócica 23 valente e não tem histórico de vacinação com pneumocócica conjugada 10 valente, administrar uma dose desta vacina (pneumocócica conjugada 10 valente), não sendo necessárias doses adicionais.
Vacina papilomavirus humano 6, 11, 16 e 18 (recombinante) - HPV
Esquema:
Administrar 2 (duas) doses, com intervalo de 6 (seis) meses entre as doses, nas meninas de 9 a 13 anos 11 meses e 29 dias.
Meninas e mulheres de 9 a 26 anos 11 meses e 29 dias, vivendo com HIV/Aids administrar 3 (três) doses com intervalo de 2 (dois) meses entre a primeira e a segunda dose e 6 (seis) meses entre a primeira e a terceira dose. Para a vacinação deste grupo, mantém-se a necessidade de prescrição médica.
Dose: 0,5 mL, intramuscular.
Particularidades:
Meninas com 14 anos de idade com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando o intervalo mínimo de seis meses entre as doses;
Mulheres com 27 anos, vivendo com HIV/Aids com esquema vacinal incompleto, completar esquema conforme situação encontrada, considerando os intervalos entre as doses.
Caso a primeira dose tenha sido administrada há mais de 6 meses, administrar a segunda dose e agendar a terceira dose, respeitando o intervalo mínimo de 90 dias entre a segunda e a terceira dose.
Esta vacina é contraindicada durante a gestação. Caso a mulher engravide após a primeira dose da vacina HPV ou receba a vacina inadvertidamente durante a gravidez, suspender a dose subsequente e completar o esquema vacinal, preferencialmente em até 45 dias após o parto. Nestes casos nenhuma intervenção adicional é necessária, somente o acompanhamento do pré-natal.
Mulheres que estão amamentando podem ser vacinadas com a vacina HPV.
Recomenda-se que a pessoa vacinada deverá permanecer sentada, sob observação por aproximadamente 15 minutos após a vacinação.
Vacina varicela (atenuada)
Esquema:
Administrar uma dose aos 4 (quatro) anos de idade (até 4 anos 11 meses e 29 dias). Corresponde à segunda dose da vacina varicela, considerando a dose de tetra viral aos 15 meses de idade.
Dose: 0,5mL via subcutânea.
Particularidades:
Crianças entre 2 anos a 4 anos 11 meses e 29 dias não vacinadas com tetra viral, administrar duas doses da vacina varicela (atenuada), com intervalo mínimo de 30 dias entre as doses, sendo que a segunda dose deve ser administrada, preferencialmente, aos 4 (quatro) anos de idade.
Pessoas a partir dos 5 anos de idade não vacinadas ou sem comprovação vacinal, administrar 1 (uma) ou duas doses de vacina varicela (atenuada), a depender do laboratório produtor.
Mulheres em idade fértil devem evitar a gravidez até 1 (um) mês após a vacinação.
Esta vacina é contraindicada para gestantes, indivíduos imunodeprimidos ou que apresentaram anafilaxia à dose anterior.
A vacina varicela (atenuada) pode ser administrada simultaneamente com a vacina febre amarela. Na impossibilidade de realizar vacinação simultânea, adotar o intervalo mínimo de 30 dias entre as doses.
Em situações de emergência epidemiológica para varicela em área indígena:
Administrar a imunoglobulina anti-varicela zoster em crianças recém-nascidas até 8 (oito) meses de idade, gestantes e pessoas imunodeprimidas.
Administrar uma dose de vacina varicela (atenuada) em crianças entre 9 e 12 meses de idade (a depender do laboratório produtor). Não considerar esta dose como válida para a rotina e manter o esquema vacinal aos 15 meses com a tetra viral e aos 4 anos com a varicela.
Antecipar a dose de tetra viral em crianças entre 13 e 14 meses de idade e considerar como dose válida para a rotina de vacinação.
Vacinar com tetra viral as crianças entre 15 e 23 meses de idade, conforme as indicações da rotina de vacinação.
Antecipar a dose dos 4 anos em crianças entre 2 e 3 anos de idade e considerar como dose válida para a rotina.
Vacinar com varicela (atenuada) as crianças de 4 anos de idade, conforme as indicações do Calendário Nacional de Vacinação.
Vacinar as pessoas a partir dos 5 anos de idade, conforme histórico vacinal anterior.
ANEXO LXIII
TERMO DE RELATO CIRCUNSTANCIADO (Origem: PRT MS/GM 1508/2005, Anexo 1)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE RELATO CIRCUNSTANCIADO
Eu,____________________________________, brasileira, _______anos, portadora do documento de identificação tipo ___________, nº________,declaro que no dia _____, do mês _______________do ano de ________às ________, no endereço ________________________________ (ou proximidades - indicar ponto de referência) ______________________________, bairro ____________, cidade __________________________, fui vítima de crime de violência sexual, nas seguintes circunstâncias:_________________________________________
Em caso de agressor(s) desconhecido(os)
Declaro ainda, que fui agredida e violentada sexualmente por _______homem(s) de aproximadamente ____________anos, raça/cor ______________cabelos ___________________________, trajando (calça, camisa, camisetas, tênis e outros), outras informações (alcoolizado, drogado, condutor do veículo/tipo ________ etc.).
O crime foi presenciado por (se houver testemunha) ________________________________________
Em caso de agressor (a)(s) conhecido (a)(s)
Declaro ainda, que fui agredida e violentada sexualmente por (informação opcional) ____________________________________, sendo meu/minha_________________________ (indicar grau de parentesco ou de relacionamento social e afetivo), com ___________anos de idade e que no momento do crime encontrava-se/ ou não (alcoolizado, drogado)
O crime foi presenciado por (se houver testemunha) ________________________________________________
É o que tenho/ temos a relatar
Local e data:________________________________
______________________________
Nome, identificação e assinatura
_____________________________________
ANEXO LXIV
PARECER TÉCNICO (Origem: PRT MS/GM 1508/2005, Anexo 2)
(IDENTIFICAÇÃO DO SERVIÇO)
PARECER TÉCNICO
Em face da análise dos resultados dos exames físico geral, ginecológico, de ultra-sonografia obstétrica e demais documentos anexados ao prontuário hospitalar nº______________ da paciente ________________________________________________________, documento tipo______nº_______;manifesta-se pela compatibilidade entre a idade gestacional e a da data da violência sexual alegada.
Local e data:_________________________________
Médico (assinatura e carimbo)
ANEXO LXV
TERMO DE APROVAÇÃO DE PROCEDIMENTO DE INTERRUPÇÃO DA GRAVIDEZ RESULTANTE DE ESTUPRO (Origem: PRT MS/GM 1508/2005, Anexo 3)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE APROVAÇÃO DE PROCEDIMENTO DE INTERRUPÇÃO DA GRAVIDEZ RESULTANTE DE ESTUPRO
Nesta data, a Equipe de Saúde multidisciplinar do Serviço de__________________ do Hospital _________________________ , avaliou o pedido de interrupção de gestação, fundamentado na declaração de violência sexual apresentada, pela usuária _______________________________________________, portadora do documento de identificação tipo __________,nº ________, registro hospitalar nº__________com ________semanas de gestação. Atesta-se que o pedido se encontra em conformidade com o artigo 128 do inciso II do Código Penal, sem a presença de indicadores de falsa alegação de crime sexual. Portanto, APROVA-SE, de acordo com a conclusão do Parecer Técnico, a solicitação de interrupção de gestação formulada pela paciente e/ou por seu representante legal.
Local e data_________________________________
RESPONSÁVEIS PELA APROVAÇÃO
Equipe multiprofissional:
____________________________________________
Carimbo e assinatura
_____________________________________________
Carimbo e assinatura
______________________________________________
Carimbo e assinatura
ANEXO LXVI
TERMO DE RESPONSABILIDADE (Origem: PRT MS/GM 1508/2005, Anexo 4)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE RESPONSABILIDADE
Por meio deste instrumento, eu _______________________, portadora do documento de identificação tipo____________nº__________, ou legalmente representada por ___________________________________________, portador (a) do documento de identificação tipo_____________nº_________, assumo a responsabilidade penal decorrente da prática dos crimes de Falsidade Ideológica e de Aborto, previstos nos artigos 299 e 124 do Código Penal Brasileiro, caso as informações por mim prestadas ao serviço de atendimento às vítimas de violência sexual do Hospital________________________________ NÃO correspondam à legítima expressão da verdade.
Local e Data:______________________________________________________________________
Nome, identificação e assinatura.
ANEXO LXVII
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO INTERRUPÇÃO DE GRAVIDEZ RESULTANTE DE VIOLÊNCIA SEXUAL (Origem: PRT MS/GM 1508/2005, Anexo 5)
(IDENTIFICAÇÃO DO SERVIÇO)
TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO INTERRUPÇÃO DE GRAVIDEZ RESULTANTE DE VIOLÊNCIA SEXUAL
Por meio deste instrumento eu,__________________________, documento de identificação tipo __________,nº_____________registro hospitalar nº____________ e/ou meu representante legal/responsável_______________________ documento de identificação tipo _________ nº ___________., em conformidade com o Artigo 128, inciso II do Código Penal Brasileiro, exerço o direito de escolha pela interrupção da gestação de forma livre, consciente e informada.
Declaro que estou informada da possibilidade de manter a gestação até o seu término, sendo-me garantido os cuidados de pré-natal e parto, apropriados para a situação; e das alternativas após o nascimento, que incluem a escolha de permanecer com a criança e inseri-la na família, ou de proceder com os mecanismos legais de doação.
Declaro, estar esclarecida (os) dos procedimentos médicos que serão adotados durante a realização da intervenção (abortamento previsto em Lei), bem como dos desconfortos e riscos possíveis à saúde, as formas de assistência e acompanhamentos posteriores e os profissionais responsáveis.
Declaro, que me é garantido o direito ao sigilo das informações prestadas, exceto em caso de requisição judicial.
Declaro, outrossim, que após convenientemente esclarecida pelos profissionais de saúde e ter entendido o que me foi explicado, solicito de forma livre e esclarecida a interrupção da gestação atual decorrente de violência sexual, e autorizo a equipe do Hospital ______________________________aos procedimentos necessários.
Local e data:__________________________________
________________________________
Nome, identificação e assinatura.
______________________________
Testemunha
Nome, identificação e assinatura
________________________________
Testemunha
Nome, identificação e assinatura
ANEXO LXVIII
NORMAS DE VIGILÂNCIA À SAÚDE DOS TRABALHADORES EXPOSTOS AO BENZENO (Origem: PRT MS/GM 776/2004, Anexo 1)
NORMAS DE VIGILÂNCIA À SAÚDE DOS TRABALHADORES EXPOSTOS AO BENZENO
1 - Objetivo
Regulamentar os procedimentos relativos à vigilância da saúde dos trabalhadores expostos ao benzeno.
2 - CAMPO DE APLICAÇÃO
As empresas e respectivas contratadas que produzem, utilizam, transportam, armazenam e manipulam benzeno ou suas misturas líquidas para os serviços de saúde públicos e privados, laboratórios e outras instâncias institucionais do campo da saúde do trabalhador.
3 - CONCEITOS
Vigilância Epidemiológica - Entende-se por vigilância epidemiológica um conjunto de ações que proporcionam o conhecimento, a detecção ou prevenção de qualquer mudança nos fatores determinantes e condicionantes da saúde individual e coletiva, com a finalidade de recomendar e adotar medidas de prevenção e controle das doenças ou agravos (Lei nº 8.080/90).
Vigilância Sanitária - Entende-se por vigilância sanitária um conjunto de ações capaz de eliminar, diminuir ou prevenir riscos à saúde e de intervir nos problemas sanitários decorrentes do meio ambiente, da produção e circulação de bens e da prestação de serviços de interesse da saúde (Lei nº 8.080/90).
Vigilância em Saúde do Trabalhador - Entende-se por vigilância em saúde do trabalhador uma atuação contínua e sistemática, ao longo do tempo, no sentido de detectar, conhecer, pesquisar e analisar os fatores determinantes e condicionantes dos agravos à saúde relacionados aos processos e ambientes de trabalho, em seus aspectos tecnológico, social e organizacional e epidemiológico, com a finalidade de planejar, executar e avaliar intervenções sobre esses aspectos, de forma a eliminá-los ou controlá-los (Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS - Portaria nº 3.120/GM, de 1º de julho de 1998).
Benzeno - É um hidrocarboneto aromático que se apresenta como um líquido incolor, lipossolúvel, volátil, inflamável, de odor característico, perceptível a concentrações da ordem de 12 ppm, cuja fórmula molecular é C6H6. Registro CAS n.71-43-2, registro ONU n.1114.
Benzenismo - Conjunto de sinais, sintomas e complicações decorrentes da exposição aguda ou crônica ao hidrocarboneto aromático, benzeno. As complicações podem ser agudas, quando houver exposição a altas concentrações com presença de sinais e sintomas neurológicos, ou crônicas, com sinais e sintomas clínicos diversos, podendo ocorrer complicações a médio ou a longo prazo, localizadas principalmente no sistema hematopoético.
4- DIRETRIZES
4.1- Diagnóstico da Intoxicação Ocupacional pelo Benzeno
4.1.1 - Introdução: O benzeno é um mielotóxico regular, leucemogênico e cancerígeno, mesmo em baixas concentrações. Outras alterações podem também ocorrer como descrito a seguir. Não existem sinais ou sintomas patognomônicos da intoxicação.
4.1.2- Síndrome Clínica da Intoxicação pelo Benzeno:
Quadro Clínico e Laboratorial da Toxicidade pelo Benzeno: Considera-se toxicidade do benzeno (ou benzenismo) quando a pessoa apresenta um conjunto de sinais e sintomas e que tenha sido exposta ao benzeno. O quadro clínico de toxicidade ao benzeno caracteriza-se por uma repercussão orgânica múltipla, em que o comprometimento da medula óssea é o componente mais freqüente e significativo, sendo a causa básica de diversas alterações hematológicas.
Os sinais e sintomas ocorrem em aproximadamente 60% dos casos. São eles: astenia, mialgia, sonolência, tontura e sinais infecciosos de repetição. Os dados laboratoriais hematológicos mais relevantes são representados pelo aparecimento de neutropenia, leucopenia, eosinofilia, linfocitopenia, monocitopenia, macrocitose, pontilhado basófilo, pseudo Pelger e plaquetopenia.
O diagnóstico de benzenismo, de natureza ocupacional, é eminentemente clínico e epidemiológico, fundamentando-se na história de exposição ocupacional e na observação de sintomas e sinais clínicos e laboratoriais descritos anteriormente.
Entende-se como exposição ocupacional a exposição acima de níveis populacionais, decorrente de atividades laborais.
Em pessoas potencialmente expostas ao benzeno, todas as alterações hematológicas devem ser valorizadas, investigadas e justificadas.
A toxicidade do benzeno pode ser aguda ou crônica. Em cada um desses casos há sinais e sintomas clínicos que descreveremos a seguir:
Efeitos Agudos: O benzeno é um irritante moderado das mucosas e sua aspiração em altas concentrações pode provocar edema pulmonar. Os vapores são, também, irritantes para as mucosas oculares e respiratórias.
A absorção do benzeno provoca efeitos tóxicos para o sistema nervoso central, causando, de acordo com a quantidade absorvida, narcose e excitação seguida de sonolência, tonturas, cefaléia, náuseas, taquicardia, dificuldade respiratória, tremores, convulsões, perda da consciência e morte.
Efeitos Crônicos: Principais Agravos À Saúde
Alterações Hematológicas: Vários tipos de alterações sangüíneas, isoladas ou associadas, estão relacionadas à exposição ao benzeno. Em virtude da lesão do tecido da medula óssea (local de produção de células sangüíneas), essas alterações correspondem, sobretudo, a hipoplasia, displasia e aplasia.
O aparecimento de macrocitose, pontilhado basófilo, hiposegmentação dos neutrófilos (pseudo Pelger), eosinofilia, linfocitopenia e macroplaquetas são alterações precocemente apreciadas na toxicidade benzênica.
A hipoplasia da medula óssea pode ocasionar, no sangue periférico, citopenia(s). A leucopenia com neutropenia corresponde à principal repercussão hematológica da hipoplasia secundária ao benzeno e, em menor freqüência, à plaquetopenia isolada ou associada à neutropenia. Estudos realizados em medula óssea de trabalhadores com benzenismo evidenciaram a relação entre a neutropenia periférica e a hipoplasia granulocítica, numa mediana de quatro anos de exposição. Estudo posterior, realizado com a mesma coorte de pacientes, após o afastamento da exposição, demonstrou um tempo médio de 5 anos para a recuperação hematológica periférica.
A aplasia da medula óssea, que corresponde à depressão de todas as linhagens hematológicas, expressa-se no sangue periférico através de pancitopenia (leucopenia, plaquetopenia e anemia).
O caráter leucemogênico do benzeno é amplamente reconhecido. As transformações leucêmicas, precedidas ou não por alterações mielodisplásicas, são objeto de diversas publicações, sendo a leucemia mielóide aguda, entre todas, a mais freqüente. Outras variantes são também descritas.
Além de leucemogênica, a toxicidade por benzeno está também relacionada ao surgimento de outras formas de doenças oncohematológicas, como linfoma não-Hodgkin, mieloma múltiplo e mielofibrose, embora em menor freqüência.
Alterações Neuro-Psicológicas e Neurológicas: São observadas alterações como: atenção, percepção, memória, habilidade motora, viso-espacial, viso-construtiva, função executiva, raciocínio lógico, linguagem, aprendizagem e humor.
Além dessas disfunções cognitivas, surgem outras alterações como: astenia, cefaléia, depressão, insônia, agitação e alterações de comportamento.
São também descritos quadros de polineuropatias periféricas e mielites transversas.
No sistema auditivo podem aparecer alterações periféricas como centrais, podendo ser observadas: perdas auditivas neurossensoriais, zumbidos, vertigens e dificuldades no processamento auditivo.
Outras Alterações: Foram observadas alterações cromossômicas numéricas e estruturais em linfócitos e células da medula óssea de trabalhadores expostos ao benzeno. É possível fazer avaliação de danos cromossomiais através de técnicas citogenéticas.
Podem ocorrer alterações dermatológicas tais como eritema e dermatite irritativa de contato por exposições ocupacionais repetidas e prolongadas ao benzeno.
Outras formas de câncer podem ser observadas devido a associação da exposição do benzeno com gás de coqueria e de vazamentos em indústrias que manipulam correntes de naftas ou produtos petroquímicos.
4.1.3 - Parâmetros Clínico-Laboratoriais
Parâmetros Clínicos: Durante a condução diagnóstica dos casos suspeitos de leucopenia secundária à toxicidade benzênica, alguns fatores devem ser considerados: as enfermidades ou as situações clínicas e fisiológicas que cursam com leucopenia, como, por exemplo, colagenoses, viroses, alcoolismo, exposição a medicamentos e a outros agentes mielotóxicos devem ser investigadas. As neutropenias constitucionais e as situações anteriormente descritas devem ser objeto de análise sistemática, sem, contudo, permitir que sua comprovação seja suficiente para afastar a hipótese de associação com a toxicidade benzênica, (veja principais causas de leucopenias no quadro 1).
QUADRO 1
PRINCIPAIS CAUSAS LEUCOPENIA:
| Infecciosas | Virais | Gripe, Mononucleose, Hepatite, CMV, Sarampo Rubéola, Dengue, HIV e Febre Amarela |
| Bacterianas | Tuberculose, Febre Tifóide, Septicemia e Brucelose. | |
| Outras | Histoplasmose, Sífilis, Ricketsioses, Psitacose, Malária e Calazar | |
| Esplenomegalias | Hepatopatia Crônica, Hepatopatia Alcoólica, Esquistosomose, Esplenomegalia Congestiva, Doença de Gaucher eSíndrome de Felty | |
| Imunológicas | LES, Artrite Reumatóide, Periarterite Nodosa, Outras Colagenoses, Doença Hemolítica Auto-Imune e ChoqueAnafilático | |
| Outras | Pseudoneutropenia, Desnutrição, Hipervitaminose A e Alcoolismo | |
| AgentesLeuco Penizantes | Regulares | Colchicina, Irradiação, Citostáticos e Benzeno |
| Ocasionais | Analgésicos, Antibióticos, Anticonvulsivantes, Sais de Ouro, Tranqüilizantes, Antitiroidianos, Diuréticos, Hipoglicemiantes, Antimaláricos, Anti-Histamínicos, Tuberculostáticos, Sulfonamidas e Barbitúricos. | |
| Alterações da Medula Óssea | Infiltração | Metástase, Linfoma e Necrose MO |
| Deficiências | Ferro, Vitamina B12, Vitamina B6 e Ácido Fólico | |
| Alteração do Parênquima | Leucemias, Síndrome Mielodisplásica, Síndrome de Fanconi, Hemoglobinúria Paroxística Noturna, Anemia Aplástica Idiopática, Neutropenia Cíclica Familiar, Hipoplasia Crônica e Agranulocitose Infantil | |
Por outro lado, uma série histórica evidenciando valores leucocitários baixos e constantes, na ausência de exames pré-admissionais, não deve ser suficiente para afastar neutropenia secundária ao benzenismo; o caso deve, portanto, permanecer em investigação.
Uma criteriosa análise do quadro clínico é insubstituível. Para se ter uma visão panorâmica, não se deve considerar apenas os resultados de exames, devendo ser valorizada também, a história ocupacional.
Hemograma: O hemograma é um dos principais instrumentos laboratoriais para detecção de alterações tardias da hematopoese em casos de toxicidade crônica por benzeno. Deve ser realizado pelo método automático com hemocitoscopia criteriosa. Deve-se salientar que a coleta deve ser realizada, na ausência de jejum.
Os valores referenciais para fins de análise devem ser os do próprio indivíduo em período prévio à exposição a qualquer agente mielotóxico. Do ponto de vista prático, caso seja desconhecido, admite-se como supostamente anormal toda leucopenia que, após ampla investigação, nenhuma causa reativa possa ser apontada que a justifique.
Os resultados de hemogramas devem ser organizados na forma de série histórica de forma a permitir a comparação sistemática e permanente dos dados e análise de alterações eventuais ou persistentes.
Deve-se salientar que todos os trabalhadores expostos ao benzeno, portadores de leucopenia isolada ou associada à outra alteração hematológica, são, a princípio, suspeitos de serem portadores de lesão da medula óssea mediada pelo benzeno. A partir desse ponto de vista, na ausência de outra causa, a leucopenia deve ser atribuída à toxicidade por essa substância.
Outros Exames: A análise clínica dos casos suspeitos deve nortear os passos seguintes até a conclusão destes. Pode ser necessária a realização de uma grande variedade de exames, como punção aspirativa e, ou biópsia de medula óssea, estudos citogenéticos, entre outros que ficam a critério de especialista.
4.1.4 - Protocolo de Investigação de Casos Suspeitos:
O protocolo de investigação de dano em expostos ao benzeno deve conter as seguintes informações e procedimentos:
a) História Clínica Atual e Pregressa, incluindo a investigação de exposição a agentes mielotóxicos (medicamentos, radiação ionizante, entre outros), interrogatório dos diversos aparelhos, antecedentes pessoais e familiares e exame físico completo;
b) História Ocupacional Atual (antecedentes profissionais) com informação sobre as empresas, setores, funções, tarefas e respectivos períodos de trabalho;
c) Levantamento dos Dados Hematológicos de que dispõe o trabalhador, inclusive os anteriores à admissão na empresa suspeita de causadora da toxicidade;
d) Exames Complementares:
- Hemograma com análise quantitativa e qualitativa das três séries sangüíneas e contagem de reticulócitos. Na ausência da série histórica, realizar três hemogramas com intervalo de 15 dias.
- Transaminases (AST e ALT), gama glutamil transferase, bilirrubinas totais e frações e LDH.
- Provas de atividades reumáticas ou inflamatórias: VHS, Proteína C reativa e FAN.
- Marcadores de Hepatite B e C (anti-HBS Ag, anti-HBc - IgM e anti-HCV).
- Anti-HIV.
e) Estudo da Medula Óssea (Biópsia de medula óssea e mielograma) - sempre que indicados clinicamente;
f) Outros Exames - poderão ser solicitados, de acordo com o exame clínico; e
g) Outras Investigações:
- Avaliação Sobre o Sistema Nervoso Central - Avaliação de queixas neuropsicológicas e neuropsiquiátricas, efeitos ototóxicos e alterações citogenéticas deverão ser realizados sempre que necessário.
- Avaliação Neuropsicológica / Neurocomportamental. É um instrumento para investigação dos efeitos que à exposição a substâncias neurotóxicas produz sobre os processos psíquicos no homem. Objetiva estabelecer a presença ou não de disfunção cognitiva e distúrbios afetivos e localizar alterações sutis, a fim de detectar as disfunções ainda em estágios iniciais.
- O benzeno, como os solventes, pode causar distúrbios de memória de curto prazo, raciocínio e resoluções de problemas, execução de tarefas viso-construtivas ou verbais e habilidade de planejar.
- A avaliação das alterações neuropsicológicas é feita por meio de bateria de testes específicos, padronizados e de entrevista clínica.
- Avaliação Neurológica - Para investigar os efeitos da exposição ao benzeno, bem como a solventes orgânicos no sistema auditivo, o uso de exames convencionais como a audiometria tonal por via aérea e óssea e a audiometria vocal podem não ser suficientes.
- O emprego de outros testes audiológicos como imitanciometria, exame vestibular, otoemissão acústica, audiometria de tronco cerebral e provas de processamento auditivo são importantes para complementar informações sobre o topodiagnóstico da lesão.
4.1.5 - Conclusão Diagnóstica:
O diagnóstico diferencial da intoxicação crônica pelo benzeno deverá ser conduzido pelo médico clínico responsável de acordo com o que lhe parecer adequado.
Do Caso Para Ser Investigado:
Critérios Para Iniciar a Investigação do Caso de Toxicidade Crônica do Benzeno - Alterações Hematológicas:
Para o reconhecimento de casos que serão investigados, deverão ser evidenciadas as seguintes situações em indivíduos expostos ocupacionalmente ao benzeno.
Embora estejam explícitos somente os critérios de alteração nos valores da contagem de leucócitos totais, todas as alterações hematológicas, consideradas relevantes, devem ser valorizadas e investigadas.
Constatação de alterações hematológicas - Instalação de leucopenia. Para análise da leucometria, recomenda-se:
4.1.5.1 - Para Trabalhadores sem História de Exposição:
A média de 3 hemogramas realizados com intervalo de 15 dias, sendo o primeiro realizado no processo de admissão no emprego. Esse será o parâmetro de comparação para verificação da instalação de leucopenia.
4.1.5.2 - Para Trabalhadores Antigos:
- O exame admissional anterior à exposição a agentes mielotóxicos servirá como referência.
- Caso não se localize o exame referido no item anterior, deve-se utilizar a média da contagem de leucócitos dos hemogramas anteriores à instalação da tendência decrescente.
- Quando, em juízo profissional, não for possível usar os dois critérios acima, adotar os valores de referência de Williams 2001, valores fixos populacionais contidos na Tabela 1 do anexo 1A destas Normas.
Devem ser alvo de investigação os trabalhadores que apresentarem:
(1) QUEDA RELEVANTE E PERSISTENTE DA LEUCOMETRIA, constatada através de 3 (três) exames com intervalo de 15 (quinze) dias, com ou sem outras alterações associadas.
Um índice arbitrário de 20% de redução da leucometria poderá ser usado para considerar queda significativa em relação aos critérios anteriores. Essa taxa poderá ser reavaliada, baseada em novos estudos. Variações menores e a presença de outras alterações hematológicas devem ser consideradas, quando suspeitada sua relevância.
Observação: na análise de séries históricas consolidadas com grandes períodos de acompanhamento, deve ser considerado o patamar pré-exposição ou o mais próximo possível desse período.
(2) PRESENÇA DE ALTERAÇÕES HEMATOLÓGICAS EM HEMOGRAMAS SERIADOS, sem outros achados clínicos que as justifiquem, como:
- AUMENTO DO VOLUME CORPUSCULAR MÉDIO (macrocitose), diminuição do número absoluto de linfócitos (linfopenia ou linfocitopenia);
- LEUCOCITOSE PERSISTENTE;
- ALTERAÇÕES NEUTROFÍLICAS: Pontilhado basófilo, hipossegmentação dos neutrófilos (pseudo Pelger) ;
- PRESENÇA DE MACROPLAQUETAS;
- LEUCOPENIA COM ASSOCIAÇÃO DE OUTRAS CITOPENIAS (plaquetopenia).
DO CASO CONSIDERADO SUSPEITO
Considera-se CASO SUSPEITO de toxidade crônica por benzeno a presença de alteração hematológica relevante e sustentada. A relevância foi definida nos critérios anteriores e a sustentabilidade considerada mínima é definida após a realização de 3 hemogramas com intervalos de 15 dias entre eles. Nas situações em que persistem as alterações nesse tempo mínimo de 45 dias, considera-se o CASO SUSPEITO.
Deve ser iniciada investigação segundo item protocolo de investigação de caso suspeito destas Normas.
DO CASO CONFIRMADO DE TOXICIDADE CRÔNICA DO BENZENO
Ao se realizar a avaliação clínico-laboratorial do caso suspeito e confirmada a ausência de enfermidades concomitantes que possam acarretar tais alterações além da exposição ao benzeno, fica estabelecido o diagnóstico de benzenismo.
4.2 - Tratamento de Intoxicação Ocupacional pelo Benzeno
Não existe tratamento medicamentoso específico para os casos de intoxicação pelo benzeno.
O acompanhamento médico para os casos confirmados de intoxicação deve ser regular e em longo prazo. As intercorrências clínicas devem ser tratadas com precocidade. As perturbações de ordem psíquica e social causadas aos indivíduos devem merecer atenção especializada em programas de saúde integrados sob o enfoque do trabalho.
4.3 - Prognóstico de Intoxicação Ocupacional pelo Benzeno
4.3.1 - Os trabalhadores que apresentaram alterações hematológicas devido à exposição ao benzeno devem ser considerados suscetíveis ou hipersensibilizados, sendo maior o risco de agravamento do quadro, em especial o desenvolvimento de neoplasias.
4.3.2 - É possível a reversão do quadro hematológico periférico que pode ocorrer após um período longo do afastamento do risco. Porém, a reversão para a “normalidade” do quadro hematimétrico, no sangue periférico, não deve ser considerada como estado de cura.
Todas as pessoas expostas e que manifestaram alterações hematológicas devem ter acompanhamento médico, devendo seu posto de trabalho e sua atividades serem analisados, no sentido de serem afastadas da exposição ocupacional ao benzeno, utilizando-se para tal o anexo 2 como critério. Tal procedimento deve ser assegurado pela empresa e aprovado pelo órgão competente da fiscalização do ambiente de trabalho (MTE/DRT e SUS).
4.3.3 - A reversão das alterações periféricas para níveis hematimétricos normais não exclui a possibilidade de evolução para o agravamento, como a manifestação de hemopatias malignas ou anemia aplástica tardia.
4.3.4 - Mesmo após a remissão das alterações hematológicas periféricas ou de outras manifestações clínicas, os casos deverão ser acompanhados clínica e laboratorialmente de forma permanente, com periodicidade pelo menos anual, através da realização de exames complementares propostos em um protocolo de acompanhamento pelo órgão de referência do SUS.
4.3.5 - A normalização ou estabilidade dos valores hematimétricos do sangue periférico, após afastamento do ambiente de trabalho, não descaracteriza a intoxicação e nem constitui critério para retorno a um ambiente ou função com risco de exposição.
4.4 - Consequências do Afastamento
4.4.1 - Alterações Psicossociais: A condição de incapaz, ainda que temporária ou circunstancial, para o trabalho, pode acarretar sérios transtornos psicossociais a esses indivíduos, entre os quais destacamos:
- Perda da Identidade Psicossocial: o indivíduo perde a sua referência social, ao deixar de ocupar o lugar que lhe era socialmente conferido, o que acarreta a conseqüente perda da identidade psíquica. O indivíduo não sabe mais quem é, nem que lugar ocupa.
- Estigmatização: o indivíduo se sente marcado - cabe lembrar que a palavra estigma é sinônimo de ferrete, instrumento que era usado para marcar os escravos - pela sua condição de não trabalhador.
Essas alterações psicossociais características dos trabalhadores, configuram um quadro psicopatológico peculiar do afastamento, onde uma alteração orgânica - por exemplo, uma leucopenia, propicia o desenvolvimento de outra, de ordem psíquica, ou seja, a necessidade de afastamento desses trabalhadores de áreas contaminadas pelo benzeno, somada à especificidade da qualificação da maioria desses trabalhadores, o que os impossibilita de trabalharem em outra atividade econômica, faz com que, mesmo afastados, ou mais precisamente em virtude desse afastamento, se produza um adoecimento de natureza psicossocial.
4.5 - Prevenção:
Considerando-se as características do produto como toxicidade e carcinogenicidade, as ações preventivas são as que se apresentam como sendo de maior relevância na proteção da saúde. Assim, o ambiente e o processo de trabalho devem assegurar sempre a menor exposição ocupacional possível.
Medidas de proteção coletiva adotadas no processo de trabalho, minimizando a exposição ou eliminando o agente, e medidas de proteção individual contribuem decididamente na prevenção da intoxicação.
A avaliação quantitativa do nível de benzeno no ar, associada à avaliação individual da exposição e à análise do Índice Biológico de Exposição (IBE) em grupos homogêneos de risco de exposição, constituí ferramenta importante quando se objetiva a avaliação da exposição e a implantação de medidas de controle para diminuição e eliminação do risco (vide Instrução Normativa - IN-01 Acordo do Benzeno).
5. Procedimentos Operacionais
5.1.Procedimentos Administrativos: (Conforme o Acordo Nacional do Benzeno e normatizado na IN-02).
As empresas devem garantir ao trabalhador sob investigação de alteração do seu estado de saúde com suspeita de ser de etiologia ocupacional, os seguintes procedimentos:
- afastamento da exposição, de acordo com o anexo 2;
- emissão da CAT;
- encaminhamento ao INSS para avaliação previdenciária;
- encaminhamento ao SUS para investigação clínica e registro;
- custeio pleno de consultas, exames e pareceres necessários à elucidação diagnóstica de suspeita de danos à saúde provocados por benzeno;
- custeio pleno de medicamentos, materiais médicos, internações hospitalares e procedimentos médicos de tratamento de dano à saúde provocado por benzeno ou suas seqüelas e conseqüências; e
- desencadear ações imediatas de correção, prevenção e controle no ambiente, condições e processos de trabalho.
5.2 - Procedimento Retorno:
Consideram-se como área de retorno os critérios apresentados no anexo 2 devem ser notificados imediatamente as comissões regionais do Benzeno e, em caso da não existência dessas comissões, aos órgãos de vigilância da Saúde do Trabalhador e ao DRT para verificação do local de retorno.
5.3 - Procedimentos de Informação:
O Ministério da Saúde, a partir dos dados de cadastro de empresas da CNP-Bz, deverá encaminhar aos respectivos Estados a relação dessas empresas para fins de acompanhamento regional.
5.3.1 - Informações Decorrentes das Empresas:
Cabe aos serviços das empresas cadastradas no MTE encaminhar aos serviços de saúde do trabalhador de sua área de abrangência, em meio magnético padronizado pelo SIMPEAQ, anualmente, no mês de março:
- Nome e registro de trabalhadores com data de nascimento, sexo, função, setor de atividade e empresa em que está prestando serviço no caso de terceiros, com ou sem sinais e sintomas de benzenismo, afastados ou não do trabalho, incluindo os demitidos a contar de um período de 20 anos passados.
- A série histórica de hemogramas realizados em exames admissional, periódicos e demissional, anualmente, no mês de março, em meio magnético padronizado pelo SIMPEAQ.
- Cópia dos resultados das alterações clínicas e dos exames de indicador biológico de exposição realizados em exames periódicos e demissional, bem como avaliações citoquímicas, imunológicas, citogenéticas, histológicas, neuropsicológicas e neuropsiquiátricas, realizadas em trabalhadores expostos ao benzeno, em meio magnético padronizado pelo SIMPEAQ.
- Dados de monitorização ambiental do benzeno (exposição individual e de área; média ponderada pelo tempo, curta duração, instantâneas de emergência ou não) realizada nos diversos setores da empresa, a cada semestre.
- As informações de acidentes com vazamentos, em 24 horas, e o registro permanente de modificações operacionais e estruturais das plantas.
Observações:
- É de responsabilidade solidária de contratantes e contratadas o envio e a padronização das informações contidas nos itens 1 a 7.
- Os prontuários médicos dos trabalhadores e dos intoxicados devem ser mantidos à disposição daqueles, dos seus representantes legalmente constituídos e dos órgãos públicos por, no mínimo, 20 (vinte) anos após o desligamento do trabalhador.
5.3.2 - Informações Decorrentes de Outras Instâncias:
As instâncias e serviços que atuam na área de saúde do trabalhador deverão realizar a vigilância epidemiológica de morbimortalidade de casos de aplasia de medula e câncer do sistema hematopoético, ocorridos em maiores de 18 anos de idade. Esse sistema deve ser gerenciado pelos serviços de saúde do trabalhador responsáveis por cada região, que terão as seguintes atribuições:
- analisar dos os dados das companhias de seguros das empresas cadastradas no MTE relativas a estes dados;
- identificar regionalmente os serviços de hematologia e oncologia que notificarão, conforme ficha de notificação anexa, os serviços de saúde do trabalhador da região. Por sua vez, esses serviços de saúde do trabalhador deverão investigar o nexo com a exposição ao benzeno em cada um desses casos;
- os dados confirmados de nexo com a exposição ao benzeno deverão ser comunicados pelos serviços de saúde via SINAN.
Os laboratórios de análises clínicas deverão notificar ao responsável pela vigilância em saúde do trabalhador de sua área todos os resultados de indicadores biológicos de exposição do benzeno, anualmente, em meio magnético, conforme padronização pelo SIMPEAQ.
Todos os dados constantes do Sistema de Informação deverão ser analisados e compilados nos diversos níveis do sistema (região/Município, Estado, Ministério da Saúde) e gerenciados pelas comissões regionais de acompanhamento do acordo do benzeno. O Ministério da Saúde deverá fazer a publicação anual dos dados analisados e compilados a esse nível.
5.4. Procedimentos de Intervenção:
Os serviços de saúde do trabalhador realizarão a vigilância dos ambientes e processos de trabalho, compreendendo a análise, a investigação, a orientação, a fiscalização e a aplicação de penalidades nas empresas, por meio de inspeções sanitárias.
A notificação, a intimação, a autuação, a multa, a suspensão de atividades e a interdição seguirão legislação da área de abrangência do serviço, de acordo com as legislações e portarias pertinentes, tais como Códigos Sanitários, Lei nº 8080/90 e Portaria nº 3120/GM, de 1º de julho de 1998.
Critérios para priorização da vigilância dos ambientes de trabalho:
- estatísticas geradas pelos Sistemas de Informação (SINAN, SIMPEAQ entre outros);
- o não-cumprimento de qualquer norma estabelecida para o benzeno;
- denúncia de trabalhadores, meios de comunicação ou sociedades civis;
- solicitação do sindicato de trabalhadores; e
- investigações sistemáticas.
Os serviços de saúde do trabalhador deverão privilegiar na intervenção nos ambientes de trabalho:
Análise das informações existentes (atas de CIPA, ROAS, PPEOB, PPRA, PCMSO, programas de saúde, ambiente e segurança, informações de outras instituições).
Análise e observação das situações potenciais de risco.
Estabelecimento de propostas de eliminação, controle e redução de risco.
Participação dos trabalhadores e seus representantes em todas as etapas da intervenção.
Processos de discussão, de negociação e de formalização de acordos envolvendo empregadores, governo, trabalhadores e sociedade civil para estabelecimento de medidas de eliminação, controle e redução da exposição ao benzeno além do previsto na legislação.
Ações de integração interinstitucionais com o Ministério do Trabalho e Emprego, Ministério da Previdência Social, os Ministérios Públicos, as Secretarias de Meio Ambiente, e as Instituições de ensino e pesquisa, entre outras.
Os serviços de saúde do trabalhador deverão manter atualizado o cadastro das empresas de produção, utilização, manipulação, armazenamento ou transporte de benzeno na sua área de abrangência.
As instâncias estaduais do SUS deverão assessorar os serviços municipais e regionais de saúde do trabalhador nas ações de vigilância dos ambientes de trabalho e realizá-las em caráter complementar.
Deverão ser incentivadas a criação e as ações de instâncias regionais de acompanhamento do acordo nacional do benzeno.
O Ministério da Saúde estabelecerá estratégias de integração entre os pólos de vigilância visando o reforço da municipalização e à comunicação entre os níveis do sistema.
Valores de referência em hematologia:
TABELA 1: TABELA DE LEUCÓCITOS, SEGUNDO WILLIAMS - 6ª EDIÇÃO - 2001
| Idade | Leucócitos(X 10³/µL) | Neutrófilos(X 103/µL) | Eosinófilos(X 10³/µL) | Basófilos(X 10³/µL) | Linfócitos(X 10³/µL) | Monócitos(X 10³/µL) | |
| Segmentados | Bastões | ||||||
| 1 | 6.0 - 17.5 | 1.0 - 8.5 | 0,35 | 0,05 - 0,7 | 0 - 0,2 | 4,0 - 10,5 | 0,05 - 1,1 |
| 4 | 5.5 - 15.5 | 1.5 - 7.5 | 0 - 1,0 | 0,02 - 0,65 | 0 - 0,2 | 2,0 - 8,0 | 0 - 0,8 |
| 6 | 5.0 - 14.5 | 1.5 - 7.0 | 0 - 1,0 | 0 - 0,65 | 0 - 0,2 | 1,5 - 7,0 | 0 - 0,8 |
| 10 | 4.5 - 13.5 | 1.8 - 7.0 | 0 - 1,0 | 0 - 0,60 | 0 - 0,2 | 1,5 - 6,5 | 0 - 0,8 |
| 21 | 4.5 - 11.0 | 1.8 - 7.0 | 0 - 0,7 | 0 - 0,45 | 0 - 0,2 | 1,0 - 4,8 | 0 - 0,8 |
VARIAÇÕES DOS VALORES DOS HEMOGRAMAS:
TABELA 2: DIFERENÇAS ÉTNICAS NO HEMOGRA, SEGUNDO WILLIAMS - 6ª EDIÇÃO - 2001
| Homens | Mulheres | |||||
| Caucasianos | Afrocaribenhos | Africanos | Caucasianos | Afrocaribenhos | Africanos | |
| Leucometria(X 10³/µL) | 5,7 (3,6 - 9,2) | 5,2 (2,8 - 9,5) | 4,5 (2,8 - 7,2) | 6,2 (3,5 - 10,8) | 5,7 (3,3 - 9,9) | 5,0 (3,2- 7,8) |
| Neutrófilos(X 10³/µL) | 3,2 (1,7 - 6,1) | 2,5 (1,0 - 5,8) | 2,0 (0,9 - 4,2) | 3,6 (1,7 - 7,5) | 3,0 (1,4 - 6,5) | 2,4 (1,3 - 4,2) |
| Linfócitos(X 10³/µL) | 1,7 (1,0 - 2,9) | 1,9 (1,0 - 3,6) | 1,8 (1,0 - 3,2) | 1,8 (1,0 - 3,5) | 2,0 (1,2 - 3,4) | 2,0 (1,1 - 3,6) |
| Monócitos(X 10³/µL) | 0,34 (0,18 - 0,62) | 0,33 (0,18 - 0,52) | 0,29 (0,15 - 0,58) | 0,30 (0,14 - 0,61) | 0,31 (0,16 - 0,59) | 0,28 (0,15 - 0,39) |
| Eosinófilos(X 10³/µL) | 0,12 (0,03 - 0,48) | 0,13 (0,03 - 0,58) | 0,12 (0,02 - 0,79) | 0,13 (0,04 - 0,44) | 0,10 (0,03 - 0,33) | 0,10 (0,02 - 0,41) |
| Plaquetas(X 10³/µL) | 218 (143 - 332) | 196 (122 - 313) | 183 (115 - 290) | 246 (169 - 358) | 236 (149 - 374) | 207 (125 - 342) |
TABELA 3: DIFERENÇAS ÉTNICAS E DE HORÁRIO DE COLETA NO HEMOGRA, SEGUNDO WINTROBE - 10ª EDIÇÃO - 1999.
HOMENS ADULTOS
| Horário de coleta | Europeus Caucasianos Idade média 25 9:30-11:30/ 14:30-16/30 |
Americanos Caucasianos 16-44 anos Antes do meio dia ou à tarde próximo ao meio dia |
Afroamericanos Antes do meio dia ou à tarde próximo ao meio dia |
Africanos 09:00-12:00 |
|
| Leucometria(X 10³/µL) | 3,487-9,206 | 3,722-9,828 | 4,550-10,100 | 3,600-10,200 | 2,587-9,075 |
| Neutrófilos(X 10³/µL) | 1,539-5,641 | 1,775-6,508 | 2,050-6,800 | 1,300-7,400 | 0,775-4,131 |
| Linfócitos(X 10³/µL) | 1,500-4,000 | 1,450-3,750 | 1,012-3,876 | ||
| Monócitos(X 10³/µL) | 0,220-0,950 | 0,210-1,050 | 0,062-0,688 | ||
| Eosinófilos(X 10³/µL) | 0,030-0,860 | 0,030-0,720 | 0,047-3,371 | ||
Nota: Os valores das tabelas 1, 2 e 3 demonstram que as variações são diferentes segundo a base populacional e as variabilidades decorrentes de métodos de coleta diversificados. Cabe destacar a necessidade de serem estabelecidos valores a partir da experiência brasileira e que estes deverão estar disponíveis assim que forem definidos.
ANEXO LXIX
CRITÉRIOS DE RETORNO DE TRABALHADORES AFASTADOS DO TRABALHO POR AGRAVOS À SAÚDE DECORRENTES DA EXPOSIÇÃO AO BENZENO (Origem: PRT MS/GM 776/2004, Anexo 2)
CRITÉRIOS DE RETORNO DE TRABALHADORES AFASTADOS DO TRABALHO POR AGRAVOS À SAÚDE DECORRENTES DA EXPOSIÇÃO AO BENZENO
1 - Objetivo: Definir parâmetros para o retorno seguro de trabalhadores afastados por agravos à saúde decorrentes da exposição ao benzeno.
2 - Critérios: O local de trabalho deve ser avaliado quanto aos seguintes critérios:
- avaliação da exposição - qualitativa e quantitativa; e
- avaliação epidemiológica de agravos à saúde dos trabalhadores.
3 - Critérios de Avaliação da Exposição:
Qualitativa: O trabalhador em situação de retorno, independentemente da área ou setor para onde for lotado, não deve participar de atividades que representam risco de exposição acima de 0.1 ppm, tais como (lista exemplificativa):
Paradas, emergências, vazamentos;
Leitura de nível de tanque com trena (e temperatura);
Transferências e carregamento de produtos;
Comando de evasões;
Coletas de amostras de produtos, insumos, matérias-primas, etc., para fins de controle de qualidade de processo;
Limpeza de equipamentos;
Acompanhamento de serviços de manutenção ou de liberação de equipamentos;
Atividade envolvendo outros mielotóxicos; e
A empresa deve possuir procedimento escrito que garanta o cumprimento deste critério e deve orientar seus trabalhadores quanto a esse procedimento.
Quantitativa: O trabalhador somente poderá ser lotado em área ou setor onde esteja ocorrendo controle rigoroso das concentrações de benzeno, de acordo com a IN-01.
Os resultados de avaliação da concentração de benzeno na área e na atividade não devem ultrapassar 0,1 ppmv MPT.
Para avaliação da conformidade com o valor de referência para retorno (0,1 ppm), serão considerados os resultados das concentrações obtidas no processo de avaliação realizado pela empresa, devendo ser submetidos à avaliação e validação das autoridades públicas competentes, TEM e/ou SUS, tanto o processo de coleta e análise quanto os valores obtidos.
4 - Critério de Avaliação Epidemiológica:
Realizar comparação das séries históricas de hemogramas de pelo menos 30 trabalhadores do setor/atividade escolhida para o retorno. Analisar a existência de casos de alterações hematológicas possivelmente relacionadas ao benzeno. Quando o setor tiver menos que 30 trabalhadores, considerar a população total dos trabalhadores do setor e a sua história epidemiológica para agravos à saúde decorrentes da exposição ao benzeno. É recomendado que o (s) grupos (s) homogêneos (s) de referência para avaliação seja (m) constituído (s) por empregados com cinco anos ou mais na atividade ou local de trabalho.
Na ocorrência de pelo menos um caso de diminuição persistente de, no mínimo, 20% da média dos parâmetros hematológicos considerados pela IN-02, sem justificativa clínica, deve ser caracterizada a existência de suspeitos de mielotoxidade ocupacional no grupo avaliado.
A presença de suspeitos de mielotoxicidade no setor ou atividade implica setor inadequado para o retorno do trabalhador.
Observações:
Caso o empregado tenha sido remanejado de área com exposição, o seu histórico deve ser avaliado à luz das atividades na nova área.
Na ausência de série histórica, recomenda-se a utilização dos seguintes parâmetros:
- realização do indicador biológico adotado pela empresa para avaliação de exposições a benzeno até 1 ppm (ácido trans, trans - mucônico urinário, por exemplo) no (s) grupo(s) homogêneo (s) de referência;
- comparação do hemograma atual com o exame admissional; e
- na ausência de exame admissional deve ser considerado como referência o critério de Williams (IN-02) para avaliação.
Validação: O GTB deverá participar do processo de seleção das áreas/atividades para o retorno dos trabalhadores, observando o item 9.7.1 nos casos de discordância.
A liberação da área/atividade para retorno deverá ser realizada pelas autoridades competentes na área de saúde e segurança.
ANEXO LXX
FICHA DE NOTIFICAÇÃO DE ELEVAÇÃO DO INDICADOR BIOLÓGICO DE EXPOSIÇÃO DO BENZENO ACIMA DA NORMALIDADE (Origem: PRT MS/GM 776/2004, Anexo 3)
Ficha de notificação de elevação do indicador biológico de exposição do benzeno acima da normalidade:
| Nome da empresa | |
| Endereço | |
| Município | Estado |
| CEP | Tel.: |
| Data da anormalidade verificada: | |
| Tipo de indicador biológico de exposição utilizado | |
| Valor encontrado | Valor de normalidade |
| Nome do trabalhador | |
| Função do trabalhador | |
| Setor de atividade | |
| Atividade realizada previamente o achado de anormalidade | |
| Investigações proferidas ao caso para sua avaliação pelo setor competente | |
| Nome dos demais trabalhadores envolvidos nesta mesma atividade | |
| Condutas estabelecidas para os trabalhadores envolvidos na atividade de risco | |
| Condutas estabelecidas ou a serem estabelecidas no ambiente de trabalho para melhoria das condições de exposição ao benzeno | |
| Observações | |
| Data - __/__/__ | Assinatura do profissional responsável carimbo legível |
ANEXO LXXI
SIGLAS (Origem: PRT MS/GM 776/2004, Anexo 4)
Siglas:
Anti-HBs Ag - marcador da Hepatite B
Anti-HBc -IgM - marcador da Hepatite B
BMO - Biópsia de Medula Óssea
CAS - Código Internacional de Substâncias Químicas
CAT - Comunicação de Acidente de Trabalho
CMV - Citomegalovirus
DRT - Delegacia Regional do Trabalho
FAN - Fator Anti-Nuclear
HIV - Virus da Síndrome de Imunodeficiência Adquirida
HCV - Vírus da Hepatite C
IBE - Indicador Biológico de Exposição
IgM - Imunoglobulina M
INSS - Instituto Nacional de Seguridade Social
MO - Medula Óssea
MS - Ministério da Saúde
MTE - Ministério do Trabalho e Emprego
LES - Lupus Eritematoso Sistêmico
ONU - Organização das Nações Unidas
PCMSO - Plano de Controle Médico de Saúde Ocupacional
PPEOB - Plano de Prevenção da Exposição Ocupacional ao Benzeno
PPRA - Plano de Prevenção de Riscos Ambientais
SIMPEAQ - Sistema de Informações de Populações Expostas a Agentes Químicos
SUS - Sistema Único de Saúde
VHS - Velocidade de Hemossedimentação
ANEXO LXXII
NORMAS PARA CADASTRAMENTO DE TRABALHADORES EXPOSTOS E EX-EXPOSTOS AO ASBESTO/AMIANTO (Origem: PRT MS/GM 1851/2006, Anexo 1)
ANEXO
NORMAS PARA CADASTRAMENTO DE TRABALHADORES EXPOSTOS E EX-EXPOSTOS AO ASBESTO/AMIANTO
Empresa:_________________________________________________
Endereço: ________________________________________________
CNPJ:_____________TEL.:__________FAX: _________________
Ramo de Atividade: ___________________________CNAE: ______
Nome do trabalhador:_______________________________________
Data de Nascimento:___/___/___ Sexo:___Nome da Mãe__________
Cartão SUS(opcional): ________________CPF:_________________
RG:_______________Órgão emisor:__________________________
Endereço:_____________________Cidade: _______ Estado: ______
Setor: _________________Cargo: ____________________________
Ocupação: ___________CBO:____________________________
Data de Admissão: ____/____/___
Em caso de trabalhador ex-exposto Data Demissão: ____/____/____
Exames:
1. Radiografia de tórax
| Data | Nº | Resultado |
2. Prova de Função Pulmonar (Espirometria)
| Data: __/__/__ | Predito | Medido | % | Limite Inferior da Normalidade |
| CVF | ||||
| VEF1/CVF | ||||
| FEF 25-75% |
Diagnóstico:________________________________________________________________________________________________
________________________________________________________________________________________________________________
Outras informações:__________________________________________________________________________________________
________________________________________________________________________________________________________________
Responsável pelo preenchimento: ______________________________________________________________________________
Nome completo e RG ou CRM: ________________________________________________________________________________
ANEXO LXXIII
PROGRAMA TELESSAÚDE BRASIL - TIPOS DE ESTABELECIMENTO E DESCRIÇÕES DE SERVIÇO (Origem: PRT MS/GM 2546/2011, Anexo 1)
TABELA 1
TABELA 2
* Qualquer CBO dentro desta família de CBO.
TABELA 3
ANEXO LXXIII
PROGRAMA TELESSAÚDE BRASIL - TIPOS DE ESTABELECIMENTO E DESCRIÇÕES DE SERVIÇO (Origem: PRT MS/GM 2546/2011, Anexo 1)
TABELA 1
TABELA 2
* Qualquer CBO dentro desta família de CBO.
TABELA 3
ANEXO LXXIII
AÇÃO ESTRATÉGICA SUS DIGITAL - TELESSAÚDE - TIPOS DE ESTABELECIMENTO E DESCRIÇÕES DE SERVIÇO
(Redação dada pela PRT GM/MS n° 3.526 de 12.04.2024)
TABELA 1
| CÓD. | TIPO DE ESTABELECIMENTO | CÓD | SUBTIPOS |
| 75 | TELESSAÚDE | 75.1 | NÚCLEO DE TELESSAÚDE |
| 75.2 | PONTO DE TELESSAÚDE |
(Redação dada pela PRT GM/MS n° 3.526 de 12.04.2024)
TABELA 2
| CÓD. SERV. | DESCRIÇÃO DO SERVIÇO | CÓD. CLASS. | DESCRIÇÃO DA CLASSIFICAÇÃO | GRUPO | CBO | DESCRIÇÃO |
| 160 | TELESSAÚDE | 001 | TELECONSULTORIA ASSÍNCRONA | 1 | 2251* | MÉDICOS CLÍNICOS |
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 002 | TELECONSULTORIA SÍNCRONA | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 003 | TELERREGULAÇÃO | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 004 | TELEDIAGNÓSTICO | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 005 | TELE-EDUCAÇÃO | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 006 | TELECONSULTA | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 007 | TELEMONITORAMENTO | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 008 | TELEORIENTAÇÃO | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 009 | TELEINTERCONSULTA | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 010 | TELETRIAGEM | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL | ||||
| 011 | SEGUNDA OPINIÃO FORMATIVA** | 1 | 2251* | MÉDICOS CLÍNICOS | ||
| 2 | 2252* | MÉDICOS EM ESPECIALIDADES CIRÚRGICAS | ||||
| 3 | 2253 | MÉDICOS EM MEDICINA DIAGNÓSTICA E TERAPÊUTICA | ||||
| 4 | 2232* | CIRURGIÃO DENTISTA | ||||
| 5 | 2234 | FARMACÊUTICO | ||||
| 6 | 2516* | ASSISTENTE SOCIAL | ||||
| 7 | 2235* | ENFERMEIRO | ||||
| 8 | 2236 | PROF. FISIOTERAPIA E AFINS | ||||
| 9 | 2237* | NUTRICIONISTA | ||||
| 10 | 2238* | FONOAUDIÓLOGO | ||||
| 11 | 2515* | PSICÓLOGOS E PSICANALISTAS | ||||
| 12 | 2239-05* | TERAPEUTA OCUPACIONAL |
(Redação dada pela PRT GM/MS n° 3.526 de 12.04.2024)
* Qualquer CBO dentro desta família de CBO.
** Serviço não é uma ação de assistência à saúde, diferente das modalidades de telessaúde.
ANEXO LXXIV
NÚMERO DE HOSPITAIS PARA RECEBIMENTO DO INTEGRASUS (Origem: PRT MS/GM 878/2002, Anexo 1)
| UF | Nº de Hospitais previstos para recebimento do INTEGRASUS Níveis B e C | Nº de Hospitais Filantrópicos Estratégicos sem FIDEPS - Nível C | Nº de Hospitais elegíveis pelo Gestor Estadual - Nível B |
| ACRE | 2 | 0 | 2 |
| ALAGOAS | 4 | 1 | 3 |
| AMAPÁ | 2 | 0 | 2 |
| AMAZONAS | 4 | 0 | 4 |
| BAHIA | 11 | 2 | 9 |
| CEARÁ | 10 | 3 | 7 |
| DISTRITO FEDERAL | 0 | 0 | 0 |
| ESPÍRITO SANTO | 5 | 2 | 3 |
| GOIÁS | 7 | 1 | 6 |
| MARANHÃO | 4 | 0 | 4 |
| MATO GROSSO | 4 | 2 | 2 |
| MATO GROSSO DO SUL | 4 | 2 | 2 |
| MINAS GERAIS | 15 | 8 | 7 |
| PARÁ | 4 | 0 | 4 |
| PARAÍBA | 4 | 0 | 4 |
| PARANÁ | 13 | 3 | 10 |
| PERNAMBUCO | 7 | 0 | 7 |
| PIAUÍ | 4 | 0 | 4 |
| RIO DE JANEIRO | 10 | 3 | 7 |
| RIO GRANDE DO NORTE | 4 | 1 | 3 |
| RIO GRANDE DO SUL | 13 | 1 | 12 |
| RONDÔNIA | 3 | 0 | 3 |
| RORAIMA | 0 | 0 | 0 |
| SANTA CATARINA | 12 | 10 | 2 |
| SÃO PAULO | 47 | 20 | 27 |
| SERGIPE | 3 | 1 | 2 |
| TOCANTINS | 4 | 2 | 2 |
| TOTAL | 200 | 62 | 138 |
Obs: Os gestores deverão descontar do número de hospitais elegíveis os já habilitados pelo INTEGRASUS I, constantes do Anexo III.
ANEXO LXXV
HOSPITAIS ESTRATÉGICOS - INTEGRASUS NIVEL C (Origem: PRT MS/GM 878/2002, Anexo 2)
| UF | Município | CGC | Nome | Valor Mensal (R$) |
| AL | MACEIÓ | 12291290000159 | FUNDACAO HOSPITAL AGRO-INDUSTRIA DO ACUCAR DE ALAGOAS | 83.678,06 |
| BA | ITABUNA | 14349740000304 | SANTA CASA DE MISERICORDIA DE ITABUNA HOSPITAL MANOEL NOVAES | 56.539,30 |
| BA | SALVADOR | 13926639000144 | FUNDACAO MONTE TABOR / HOSPITAL SAO RAFAEL | 42.477,14 |
| CE | BARBALHA | 03284505000113 | HOSP. MAT. SÃO VICENTE DE PAULO | 37.049,99 |
| CE | QUIXADÁ | 07718372000105 | SOCIED Q E A A M INF H MATERNIDADE | 20.177,96 |
| CE | SOBRAL | 07818313000109 | SANTA CASA DE MISERICORDIA DE SOBRAL | 172.588,30 |
| ES | CACHOEIRO DE ITAPEMIRIM | 27187087000104 | SANTA CASA DE MISERICORDIA DE CACHOEIRO DE ITAPEMIRIM | 42.314,95 |
| ES | VITÓRIA | 28137925000106 | AFECC - HOSPITAL SANTA RITA DE CASSIA | 49.629,80 |
| GO | ITUMBIARA | 02198539000122 | HOSMAT SAO MARCOS | 19.124,47 |
| MG | CARANGOLA | 19274091000181 | CASA DE CARIDADE DE CARANGOLA | 57.717,05 |
| MG | DIVINÓPOLIS | 20146064000102 | FUNDACAO GERALDO CORREA HOSPITAL SAO JOAO DE DEUS | 128.510,33 |
| MG | IPATINGA | 19878404000100 | FUNDACAO SÃO FRANCISCO XAVIER HOSPITAL MARCIO CUNHA | 162.172,42 |
| MG | BELO HORIZONTE | 17214149000176 | FUNDACAO FELICE ROSSO HOSPITAL FELICIO ROCHO | 59.365,20 |
| MG | JUIZ DE FORA | 21575709000195 | SANTA CASA DE MISERICORDIA DE JUIZ DE FORA | 205.603,85 |
| MG | MONTES CLAROS | 22669931000110 | IRMANDADE N SRA MERCES SANTA CASA CARIDADE MONTES CLAROS | 210.450,72 |
| MG | PONTE NOVA | 26150979000178 | FUNDACAO FILANTROPICA E BENEF DE SAUDE ARNALDO GAVAZZA FILHO | 35.444,66 |
| MG | TEÓFILO OTÓN | 25104902000107 | ASSOC HOSSTA ROSALIA | 72.575,24 |
| MS | DOURADOS | 03604782000166 | ASSOCIACAO BENEFICENTE DOURADENSE/HOSEVAN DR E SRA G KING | 108.235,44 |
| MS | TRÊS LAGOAS | 03873593000199 | SOC BENEF DO HOSN SRA AUXILIADORA HOSN SRA AUXILIADORA | 44.769,93 |
| MT | CUIABÁ | 03468485000130 | SOCIEDADE DE PROTECAO A MATERNIDADE E A INFANCIA DE CUIABA | 87.557,25 |
| MT | RONDONÓPOLIS | 03099157000104 | SANTA CASA M E MATER DE RONDONOPOLIS | 70.136,80 |
| PR | APUCARANA | 76578137006392 | PROV B DA C I F C S VICENTE DE PAULO HOSS VICENTE DE PAULO | 56.906,35 |
| PR | LONDRINA | 78614971000119 | IRMANDADE DA SANTA CASA DE LONDRINA | 160.732,95 |
| PR | SÃO JOSÉ DOS PINHAIS | 81308868000155 | HOSPITAL E MATERNIDADE DE SAO JOSE DOS PINHAIS | 55.438,45 |
| RJ | ANGRA DOS REIS | 28503308000179 | HOSPITAL E MATERNIDADE CODRATO DE VILHENA | 40.555,29 |
| RJ | ITAPERUNA | 29640612000120 | CONFERENCIA SÃO JOSE DO AVAI HOSPITAL SAO JOSE DO AVAI | 112.380,48 |
| RJ | RESENDE | 31460108000190 | ASSOCIACAO DE PROTECAO A MATERNIDADE E A INFANCIA DE RESENDE | 15.831,87 |
| RN | MOSSORÓ | 08256240000163 | ASSOC A A MAT INFANCIA MOSSORO | 43.125,75 |
| RS | CAXIAS DO SUL | 88633227000115 | PIO SODAL DAMAS CARIDADE MANTENEDORA HOSN S DE POMPEIA | 99.793,20 |
| SC | CHAPECÓ | 02122913000106 | CONSORCIO REGIONAL DE SAUDE DO HOSPITAL LENOIR V. FERREIRA | 105.560,01 |
| SC | CRICIUMA | 92736040000890 | HOSPITAL SÃO JOSÉ - SOCIEDADE CARITATIVA | 130.535,61 |
| SC | FLORIANÓPOLIS | 83884999000106 | IRMANDADE DO SENHOR JESUS DOS PASSOS E HOSPITAL DE CARIDADE | 51.395,28 |
| SC | ITAJAÍ | 60194990002200 | IPMMI-HOSPITAL E MATERNIDADE MARIETA KONDER BORNHAUSEN | 91.481,93 |
| SC | SÃO JOSÉ | 82951245001130 | INSTITUTO DE CARDIOLOGIA SÃO JOSÉ | 72.710,11 |
| SC | JOAÇABA | 84588391000105 | HOSPITAL SANTA TEREZINHA | 30.047,03 |
| SC | LAGES | 84942887000127 | HOSCAR NOSSA SENHORA PRAZER | 73.770,35 |
| SC | LAGES | 84947167000154 | ASSOCIACAO BENEFICENTE SEARA DO BEM | 26.345,38 |
| SC | RIO DO SUL | 73433427000157 | FUNDACAO DE SAUDE DO ALTO VALE DO ITAJAI | 57.453,67 |
| SC | TUBARÃO | 83883306001213 | SOC DIV PROV HOSPITAL NOSSA SRA DA CONCEICAO | 131.749,33 |
| SE | ARACAJU | 13016332000106 | FUNDACAO DE BENEFICENCIA HOSPITAL DE CIRURGIA | 116.646,71 |
| SP | ARAÇATUBA | 43751502000167 | SANTA CASA DE MIS DE ARACATUBA-HOSSAGRADO CORACAO DE JESUS | 162.376,83 |
| SP | ARARAQUARA | 43964931000112 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE ARARAQUARA | 99.514,69 |
| SP | ARARAS | 44215341000150 | IRMANDADE STA CASA MIS. DE ARARAS | 74.153,29 |
| SP | BARRETOS | 44782779000110 | SANTA CASA DE MISERICORDIA DE BARRETOS | 92.489,33 |
| SP | BAURU | 48374680000130 | ASSOCIACAO HOSPITALAR DE BAURU | 266.540,77 |
| SP | CAMPINAS | 46043980000100 | MATERNIDADE DE CAMPINAS | 62.184,24 |
| SP | FERNANDÓPOLIS | 47844287000108 | SANTA CASA MISERICORDIA DE FERNANDOPOLIS | 59.772,88 |
| SP | FRANCA | 47969134000189 | FUNDACAO CIVIL CASA DE MISERICORDIA DE FRANCA | 189.122,34 |
| SP | ITAPEVA | 49797293000179 | SANTA CASA DE MISERICORDIA DE ITAPEVA | 63.841,33 |
| SP | LIMEIRA | 51473692000126 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE LIMEIRA | 177.776,06 |
| SP | MARÍLIA | 52049244000162 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE MARILIA | 81.817,79 |
| SP | MOJI DAS CRUZES | 52543766000116 | SANTA CASA DE MISERICORDIA DE MOGI DAS CRUZES | 118.392,97 |
| SP | MOJI-GUAÇU | 52739950000136 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE MOGI GUACU | 64.912,78 |
| SP | PIRACICABA | 54370630000187 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE PIRACICABA | 116.269,91 |
| SP | PIRACICABA | 54384631000261 | ASSOC FORN CANA PIRACICABA SECCAO HOSPITAL | 78.770,51 |
| SP | PRESIDENTE PRUDENTE | 44860740000254 | ASSOCIACAO PRUDENTINA DE EDUCACAO E CULTURA APEC - HOSPITAL | 53.385,26 |
| SP | PRESIDENTE PRUDENTE | 55344337000108 | SANTA CASA DE MISERICORDIA DE PRESIDENTE PRUDENTE | 101.885,62 |
| SP | SANTOS | 58198524000119 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE SANTOS | 220.926,60 |
| SP | SÃO CARLOS | 59610394000142 | IRMANDADE DA SANTA CASA DE MISERICORDIA DE SAO CARLOS | 90.045,80 |
| SP | SÃO PAULO | 61904678000193 | AMPARO MATERNAL | 79.222,20 |
| TO | ARAGUAÍNA | 01368232000160 | CASA DE CARIDADE DOM ORIONE | 78.388,52 |
| TO | ARAGUAÍNA | 24232886003778 | PRO-SAUDE - ASSOC. BENEF. DE ASSIST. SOCIAL E HOSPITALAR | 117.103,62 |
| Total | 5.687.471,95 | |||
ANEXO LXXVI
HOSPITAIS HABILITADOS PELO INTEGRASUS I - RECLASSIFICADOS COMO NÍVEL B (Origem: PRT MS/GM 878/2002, Anexo 3)
| UF | Município | CGC | Nome | Valor Mensal (R$) |
| AL | São Miguel Dos Campos | 12737680000100 | SANTA CASA DE MISERICORDIA DE SAO MIGUEL DOS CAMPOS | 43.000,00 |
| PE | Recife | 10667814000138 | FUNDACAO ALTINO VENTURA | 3.783,34 |
| RS | Ijui | 90730508000138 | ASSOCIACAO HOSPITAL DE CARIDADE IJUI | 94.050,94 |
| RS | Lajeado | 91162511000165 | SOC BENEF E CARIDADE DE LAJEADO | 49.638,85 |
| RS | Porto Alegre | 92713825000171 | SANATORIO BELEM | 90.900,99 |
| RS | Porto Alegre | 92740539000103 | SOCIEDADE PORTUGUESA DE BENEFICENCIA | 55.998,42 |
| RS | Santo Angelo | 96210471000101 | ASSOCIACAO HOSPITAL DE CARIDADE DE SANTO ANGELO | 46.444,97 |
| RS | São Borja | 96488598000189 | FUNDACAO IVAN GOULART HOSPITAL INFANTIL | 29.245,56 |
| RS | Torres | 88625686003504 | SEBS HOSPITAL BENEF.NOSSA SRA.NAVEGANTES | 26.294,73 |
| SP | Avaré | 44584019000106 | SANTA CASA DE MISERICORDIA DE AVARÉ | 27.085,29 |
| SP | Barretos | 49150352000112 | FUNDACAO PIO XII | 30.098,29 |
| SP | Campinas | 50046887000127 | CENTRO INF DE INVESTIGACOES HEMAT DR DOMINGOS A BOLDRINI | 22.209,76 |
| SP | Capivari | 46925111000100 | SANTA CASA DE MISERICORDIA DE CAPIVARI | 18.180,47 |
| SP | Cruzeiro | 47431697000119 | SANTA CASA DE MISRICORDIA DE CRUZEIRO | 21.597,05 |
| SP | Dracena | 47617584000102 | IRMANDADE DA SANTA CASA DE MISERICORDIA E MATERNIDADE DE DRACENA | 14.587,72 |
| SP | Jacareí | 50460351000153 | ASSOCIACAO CASA FONTE DA VIDA | 15.019,93 |
| SP | Jaú | 50753631000150 | IRMANDADE DE MISERICORDIA DE JAU | 52.062,60 |
| SP | Jundiaí | 50944198000130 | HOSPITAL DE CARIDADE SAO VICENTE DE PAULO | 88.595,17 |
ANEXO LXXVII
DO PROGRAMA FARMÁCIA POPULAR DO BRASIL (PFPB) (Origem: PRT MS/GM 111/2016)
Art. 1º Fica instituído o Programa Farmácia Popular do Brasil (PFPB). (Origem: PRT MS/GM 111/2016, Art. 1º)
CAPÍTULO I
DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 111/2016, CAPÍTULO I)
Art. 2º O PFPB consiste na disponibilização de medicamentos e/ou correlatos à população, pelo Ministério da Saúde, através dos seguintes meios: (Origem: PRT MS/GM 111/2016, Art. 2º)
Art. 2º O PFPB visa à disponibilização complementar de medicamentos do Componente Básico da Assistência Farmacêutica (CBAF) à população, e fraldas geriátricas, sendo estas exclusivamente ao idoso e à pessoa com deficiência, pelo Ministério da Saúde, através dos seguintes meios: (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 2º O PFPB consiste na disponibilização de medicamentos à população e fraldas geriátricas, sendo estas exclusivamente ao idoso e à pessoa com deficiência, pelo Ministério da Saúde, através dos seguintes meios: (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 2º O PFPB consiste na disponibilização, pelo Ministério da Saúde, de medicamentos à população, de fraldas geriátricas ao idoso e à pessoa com deficiência, exclusivamente, e de absorventes higiênicos às pessoas beneficiárias do Programa de Proteção e Promoção da Saúde e Dignidade Menstrual, através dos seguintes meios: (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
I - a "Rede Própria", constituída por Farmácias Populares, em parceria com os Estados, Distrito Federal e Municípios; e (Origem: PRT MS/GM 111/2016, Art. 2º, I)
II - o "Aqui Tem Farmácia Popular", constituído por meio de convênios com a rede privada de farmácias e drogarias. (Origem: PRT MS/GM 111/2016, Art. 2º, II)
Parágrafo Único. O PFPB Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias, os medicamentos e correlatos previamente definidos pelo Ministério da Saúde, nos termos Anexo 1 do Anexo LXXVII . (Origem: PRT MS/GM 111/2016, Art. 2º, Parágrafo Único)
Parágrafo Único. O PFPB - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias, os medicamentos do CBAF previamente definidos pelo Ministério da Saúde e fraldas geriátricas, nos termos do Anexo 1 do Anexo LXXVII. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo único. O PFPB - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias os medicamentos e correlatos previamente definidos pelo Ministério da Saúde, nos termos do Anexo 1 e 2 do Anexo LXXVII. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
Parágrafo único. O PFPB - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias, os medicamentos e correlatos previamente definidos pelo Ministério da Saúde, nos termos dos Anexos 1, 2 e 6 do Anexo LXXVII." (Redação dada pela PRT GM/MS nº 675 de 07.06.2023). (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Parágrafo único. O PFPB - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias, os medicamentos, fraldas geriátricas e absorventes higiênicos, previamente definidos pelo Ministério da Saúde, nos termos dos Anexos 1, 2, 6 e 7 do Anexo LXXVII. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Parágrafo único. O PFPB - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população, por meio da rede privada de farmácias e drogarias, os medicamentos, fraldas geriátricas e absorventes higiênicos, previamente definidos pelo Ministério da Saúde, nos termos dos Anexos 1, 2 e 6 do Anexo LXXVII. (Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
Art. 3º Para os efeitos deste Anexo, consideram-se as seguintes definições: (Origem: PRT MS/GM 111/2016, Art. 3º)
I - medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, que contém um ou mais fármacos juntamente com outras substâncias, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico; (Origem: PRT MS/GM 111/2016, Art. 3º, I)
I - Medicamentos do Componente Básico da Assistência Farmacêutica: Itens constantes nos Anexos I da Relação Nacional de Medicamentos Essenciais (RENAME). (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
I - medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, que contém um ou mais fármacos juntamente com outras substâncias, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
II - correlato: a substância, produto, aparelho ou acessório não enquadrado nos conceitos de droga, medicamento ou insumo farmacêutico, cujo uso ou aplicação esteja ligado à defesa e proteção da saúde individual ou coletiva, à higiene pessoal ou de ambientes, ou a fins diagnósticos e analíticos, os cosméticos e perfumes, e, ainda, os produtos dietéticos, óticos, de acústica médica, odontológicos e veterinários; (Origem: PRT MS/GM 111/2016, Art. 3º, II) (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
III - documento fiscal: documento de emissão obrigatória que comprova a venda de mercadoria ou a prestação de serviços de acordo com a legislação vigente; (Origem: PRT MS/GM 111/2016, Art. 3º, III)
IV - cupom vinculado: documento não-fiscal emitido em papel por equipamento eletrônico adequado, nas operações realizadas pelo Programa; (Origem: PRT MS/GM 111/2016, Art. 3º, IV)
V - Denominação Comum Brasileira (DCB): denominação do fármaco ou princípio farmacologicamente ativo aprovada pelo órgão federal responsável pela vigilância sanitária; (Origem: PRT MS/GM 111/2016, Art. 3º, V)
VI - princípio ativo: substância quimicamente caracterizada, cuja ação farmacológica é conhecida e responsável total ou parcialmente pelos efeitos terapêuticos do medicamento; (Origem: PRT MS/GM 111/2016, Art. 3º, VI)
VII - Unidade de Produto (UP): fração unitária corresponde a uma unidade farmacotécnica do medicamento ou a fração unitária de produtos correlatos; (Origem: PRT MS/GM 111/2016, Art. 3º, VII)
VIII - Valor de Referência (VR): preço referencial fixado pelo Ministério da Saúde para cada princípio ativo e correlato constante do Programa e definido para cada unidade de produto (UP); (Origem: PRT MS/GM 111/2016, Art. 3º, VIII)
VIII - Valor de Referência (VR): preço referencial fixado pelo Ministério da Saúde para cada princípio ativo constante do Programa e para fralda geriátrica, definido para cada unidade de produto (UP); (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
VIII - Valor de Referência (VR): preço referencial fixado pelo Ministério da Saúde para cada princípio ativo constante do Programa e para fralda geriátrica e absorvente higiênico, definido para cada unidade de produto (UP); (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
IX - Preço de Dispensação - Rede Própria (PD-RP):valor do medicamento e correlato fixado para as farmácias da rede própria do PFPB; (Origem: PRT MS/GM 111/2016, Art. 3º, IX)
IX - Preço de Dispensação - Rede Própria (PD-RP): valor do medicamento fixado para as farmácias da rede própria do PFPB; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
X - Preço de Venda - Aqui Tem (PV-AT): valor do medicamento e correlato praticado pelas farmácias e drogarias no ato da venda ao paciente, inclusive com eventuais descontos; e (Origem: PRT MS/GM 111/2016, Art. 3º, X)
X - Preço de Venda - Aqui Tem (PV-AT): valor do medicamento e da fralda geriátrica praticado pelas farmácias e drogarias no ato da venda ao paciente, inclusive com eventuais descontos; e (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
X - Preço de Venda - Aqui Tem (PV-AT): valor do medicamento, da fralda geriátrica e do absorvente higiênico praticado pelas farmácias e drogarias no ato da venda ao paciente, inclusive com eventuais descontos; e (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XI - Código de barras: código constante na embalagem do produto que indicam informações relevantes, tais como o fabricante e apresentação. (Origem: PRT MS/GM 111/2016, Art. 3º, XI)
CAPÍTULO II
DA OPERACIONALIZAÇÃO E DO FUNCIONAMENTO DO PFPB
(Origem: PRT MS/GM 111/2016, CAPÍTULO II)
Art. 4º Na "Rede Própria", a Fundação Oswaldo Cruz (FIOCRUZ) será a executora das ações inerentes à aquisição, estocagem, e dispensação dos medicamentos, podendo para tanto firmar convênios com a União, Estados, Distrito Federal, Municípios e instituições, sob a supervisão direta e imediata do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 4º)
Art. 5º No "Aqui tem Farmácia Popular", a operacionalização do PFPB ocorrerá diretamente entre o Ministério da Saúde e a rede privada de farmácias e drogarias, mediante relação convenial regida pela Lei nº 8.666, de 21 de junho de 1993. (Origem: PRT MS/GM 111/2016, Art. 5º)
§ 1º A abertura de novos processos de credenciamento de farmácias e drogarias ao PFPB estará condicionada à discricionariedade da Administração Pública, mediante a publicação de instrumento convocatório.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º O instrumento convocatório poderá prever, entre outros: (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
I - o número de vagas disponíveis; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
II - regras para seleção dos estabelecimentos; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
III - critérios de priorização para seleção dos interessados ao credenciamento;(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - critérios de eliminação e exclusão do processo de credenciamento;(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
V - condicionantes para manutenção do vínculo junto ao PFPB; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - vedações adicionais para participação do PFPB; e (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - solicitação de documentos adicionais e certidões que comprovem a regularidade e idoneidade da empresa, dos responsáveis legais e sócios. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 6º O elenco de medicamentos e/ou correlatos disponibilizados no âmbito do PFPB, bem como seus valores de referência e preços de dispensação, encontram-se previstos nos Anexos 1, 2, 3 e 4 do Anexo LXXVII . (Origem: PRT MS/GM 111/2016, Art. 6º)
Art. 6º O elenco de medicamentos disponibilizados no âmbito do PFPB, seus valores de referência e preços de dispensação, bem como o valor de referência da fralda geriátrica, encontram-se previstos nos Anexos 1, 2, 3 e 4 do Anexo LXXVII.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 6º Os itens disponibilizados no âmbito do PFPB e seus valores de referência encontram-se previstos nos Anexos 1, 2, 3, 4 e 6 do Anexo LXXVII. (Redação dada pela PRT GM/MS nº 675 de 07.06.2023).
§ 1º A garantia de disponibilidade de medicamentos pelo PFPB se dá sobre o princípio ativo e não sobre a marca do medicamento. (Origem: PRT MS/GM 111/2016, Art. 6º, § 1º)
§ 2º Os estabelecimentos credenciados têm autonomia no controle de estoque e critérios na comercialização dos medicamentos dentro do seu estabelecimento. (Origem: PRT MS/GM 111/2016, Art. 6º, § 2º)
Art. 7º No "Aqui Tem Farmácia Popular" e na "Rede Própria", os medicamentos definidos para o tratamento da hipertensão arterial, diabetes mellitus e/ou asma serão distribuídos gratuitamente aos beneficiários. (Origem: PRT MS/GM 111/2016, Art. 7º)
Parágrafo Único. Quando os medicamentos para hipertensão arterial, diabetes mellitus e/ou asma forem comercializados com preço de venda menor que o valor de referência definido no Anexo 1 do Anexo LXXVII , o Ministério da Saúde pagará 100% (cem por cento) do PV-AT. (Origem: PRT MS/GM 111/2016, Art. 7º, Parágrafo Único)
Art. 7º No "Aqui Tem Farmácia Popular", serão disponibilizados gratuitamente aos usuários, nos termos definidos no Anexo 1 do Anexo LXXVII, os medicamentos:(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
Art. 7º No "Aqui Tem Farmácia Popular", os contraceptivos, absorventes higiênicos e os medicamentos para tratamento de hipertensão arterial, diabetes mellitus, asma osteoporose, dislipidemia, rinite, doença de Parkinson e glaucoma, definidos nos Anexo 1 e 6 do Anexo LXXVII, serão disponibilizados gratuitamente aos usuários. (Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
I - contraceptivos;(Redação dada pela PRT GM/MS nº 675 de 07.06.2023) (Revogado pela PRT GM/MS n° 4.811 de 04.07.2024)
II - para hipertensão arterial; (Redação dada pela PRT GM/MS nº 675 de 07.06.2023) (Revogado pela PRT GM/MS n° 4.811 de 04.07.2024)
III - para diabetes mellitus; (Redação dada pela PRT GM/MS nº 675 de 07.06.2023) (Revogado pela PRT GM/MS n° 4.811 de 04.07.2024)
IV - para asma; e(Redação dada pela PRT GM/MS nº 675 de 07.06.2023) (Revogado pela PRT GM/MS n° 4.811 de 04.07.2024)
V - para osteoporose.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023) (Revogado pela PRT GM/MS n° 4.811 de 04.07.2024)
Parágrafo único. Quando os medicamentos elencados no caput forem comercializados com preço de venda menor que o valor de referência definido no Anexo 1 do Anexo LXXVII, o Ministério da Saúde pagará 100% (cem por cento) do PV-AT."(Redação dada pela PRT GM/MS nº 675 de 07.06.2023) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 1º No “Aqui Tem Farmácia Popular”, serão disponibilizados absorventes higiênicos, de forma gratuita, exclusivamente às pessoas beneficiárias do Programa de Proteção e Promoção da Saúde e Dignidade Menstrual, nos termos previstos na regulamentação desse Programa. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 2º Quando os medicamentos de que trata o caput e os absorventes higiênicos, de que trata § 1º, forem comercializados com preço de venda menor que o valor de referência definido nos Anexos 1 e 7 do Anexo LXXVII, o Ministério da Saúde pagará 100% (cem por cento) do PV-AT. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 2º Quando os medicamentos de que trata o caput e os absorventes higiênicos, de que trata § 1º, forem comercializados com preço de venda menor que o valor de referência definido no Anexo 1 do Anexo LXXVII, o Ministério da Saúde pagará 100% (cem por cento) do PV-AT. (Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
Art. 8º Na "Rede Própria", a dispensação dos medicamentos e/ou correlatos ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme preço de dispensação - rede própria estabelecidos. (Origem: PRT MS/GM 111/2016, Art. 8º)
Art. 8º Na "Rede Própria", a dispensação dos medicamentos ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação estabelecidos.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 9º No "Aqui Tem Farmácia Popular", o Ministério da Saúde pagará até 90% (noventa por cento) do valor de referência estabelecido, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo Ministério da Saúde e o PV-AT do medicamento e/ou correlato adquirido. (Origem: PRT MS/GM 111/2016, Art. 9º)
Art. 9º No "Aqui Tem Farmácia Popular", o Ministério da Saúde pagará até 90% (noventa por cento) do valor de referência estabelecido, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo Ministério da Saúde e o PV-AT do medicamento e das fraldas geriátricas adquiridos. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 9º No "Aqui Tem Farmácia Popular", o Ministério da Saúde pagará até 90% (noventa por cento) do valor de referência dos itens definidos no Anexo 2 do Anexo LXXVII para tratamento de: (Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
I - incontinência urinária; (Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
II - diabetes mellitus associada a doença cardiovascular; (Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
III - dislipidemia;(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
IV - rinite;(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
V - doença de Parkinson; e (Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
VI - glaucoma.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
Art. 9º No "Aqui Tem Farmácia Popular", o Ministério da Saúde pagará até 90% (noventa por cento) do valor de referência dos itens definidos no Anexo 2 do Anexo LXXVII para tratamento de incontinência urinária e diabetes mellitus associada a doença cardiovascular. (Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
§ 1º Nos casos em que o medicamento e as fraldas geriátricas forem comercializados com o preço de venda menor do que o valor de referência definido no Anexo 2 do Anexo LXXVII, o Ministério da Saúde pagará 90% (noventa por cento) do preço de venda e o paciente a diferença. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
§ 1º Nos casos em que os itens elencados no caput forem comercializados com preço de venda menor que o valor de referência definido no Anexo 2 do Anexo LXXVII, o Ministério da Saúde pagará 90% (noventa por cento) do PV-AT.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
§ 2º Os medicamentos para a patologia de diabetes mellitus associada a doença cardiovascular somente serão dispensados para pacientes a partir de 65 anos, aplicando-se o disposto no caput e no § 1º. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022). (Revogação dada pela PRT GM/MS nº 675 de 07.06.2023).
§ 3º Para os beneficiários do Programa Bolsa Família, os itens de que trata o caput serão disponibilizados gratuitamente. ((Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
§ 4º Na hipótese prevista no § 3º, o Ministério da Saúde pagará 100% (cem por cento) do valor de referência dos itens definidos no Anexo 6 do Anexo LXXVII.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
§ 5º Nos casos em que os itens de que trata o § 3º forem comercializados com preço de venda menor que o valor de referência definido no Anexo 6 do Anexo LXXVII, o Ministério da Saúde pagará 100% (cem por cento) do PV-AT."(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
Parágrafo Único. Nos casos em que o medicamento e/ou correlato forem comercializados com o preço de venda menor do que o valor de referência definido no Anexo 2 do Anexo LXXVII , o Ministério da Saúde pagará 90% (noventa por cento) do preço de venda e o paciente a diferença. (Origem: PRT MS/GM 111/2016, Art. 9º, Parágrafo Único)
Parágrafo Único. Nos casos em que o medicamento e as fraldas geriátricas forem comercializados com o preço de venda menor do que o valor de referência definido no Anexo 2 do Anexo LXXVII, o Ministério da Saúde pagará 90% (noventa por cento) do preço de venda e o paciente a diferença. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção I
Do "Aqui Tem Farmácia Popular"
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I)
Subseção I
Da Adesão ao PFPB Aqui Tem Farmácia Popular
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção I)
Art. 10. Poderão participar do PFPB Aqui Tem Farmácia Popular as farmácias e drogarias que atenderem aos seguintes critérios: (Origem: PRT MS/GM 111/2016, Art. 10)
Art. 10. Poderão participar do PFPB - Aqui Tem Farmácia Popular as farmácias e drogarias selecionadas nos termos do instrumento convocatório que atenderem aos seguintes critérios: (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
I - Requerimento e Termo de Adesão (RTA) assinado pelas partes interessadas; (Origem: PRT MS/GM 111/2016, Art. 10, I)
II - Licença Sanitária Estadual ou Municipal, ativa e válida, nos termos da legislação vigente; (Origem: PRT MS/GM 111/2016, Art. 10, II)
III - inscrição no Cadastro Nacional de Pessoas Jurídicas (CNPJ), da Secretaria de Receita Federal do Brasil; (Origem: PRT MS/GM 111/2016, Art. 10, III)
IV - registro na Junta Comercial; (Origem: PRT MS/GM 111/2016, Art. 10, IV)
V - autorização de funcionamento emitida pela Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 111/2016, Art. 10, V)
VI - situação de regularidade com a Previdência Social; (Origem: PRT MS/GM 111/2016, Art. 10, VI)
VII - farmacêutico responsável técnico com Certificado de Regularidade Técnica (CRT) válido e emitido pelo Conselho Regional de Farmácia (CRF); (Origem: PRT MS/GM 111/2016, Art. 10, VII)
VIII - dispor de equipamento eletrônico adequado para emissão de documento fiscal e cupom vinculado para processamento das operações eletrônicas do PFPB, conforme detalhamento constante na Subseção II deste Capítulo; (Origem: PRT MS/GM 111/2016, Art. 10, VIII)
IX - dispor de sistema de gerenciamento eletrônico capaz de realizar requisições eletrônicas, por meio de interface web; e (Origem: PRT MS/GM 111/2016, Art. 10, IX)
X - dispor de pessoal treinado para atuar no PFPB, de acordo com as normas e procedimentos estabelecidos. (Origem: PRT MS/GM 111/2016, Art. 10, X)
§ 1º Para fins dos incisos II e VI do "caput", a Licença Sanitária Estadual ou Municipal e a regularidade junto à Previdência Social deverão estar válidas na data de emissão do Requerimento e Termo de Adesão. (Origem: PRT MS/GM 111/2016, Art. 10, § 1º)
§ 2º Ressalvados os critérios definidos neste artigo, é dispensável, para a habilitação, a satisfação das exigências previstas nos arts. 28 a 31 da Lei nº 8.666, de 21 de junho de 1993, por força do disposto no § 1º do art. 32 daquela Lei. (Origem: PRT MS/GM 111/2016, Art. 10, § 2º)
§ 3º Não poderão ser credenciadas ao PFPB Aqui Tem Farmácia Popular novas filiais cuja matriz e/ou filial esteja passando por processo de auditoria no Departamento Nacional de Auditoria do SUS (DENASUS). (Origem: PRT MS/GM 111/2016, Art. 10, § 3º)
§ 3º Não poderão ser credenciados ao PFPB Aqui Tem Farmácia Popular estabelecimentos cuja matriz, filial e/ou qualquer outro estabelecimento da mesma sociedade empresarial tenha apresentado indícios de irregularidade na operacionalização do PFPB ou esteja em processo de auditoria pelo Departamento Nacional de Auditoria do SUS (DENASUS).(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º Não poderão ser credenciados ao PFPB - Aqui Tem Farmácia Popular estabelecimentos cuja matriz ou filial tenha, em curso, procedimento de apuração de indícios ou notícias de irregularidades na operacionalização do PFPB. (Redação dada pela PR GM/MS n° 1.469 de 05.10.2023)
§ 4º As farmácias e drogarias credenciadas no PFPB Aqui Tem Farmácia Popular autorizam, automaticamente, o Ministério da Saúde a acessar as informações de movimentações fiscais e tributárias junto à Receita Federal do Brasil, inclusive para fins de apuração e auditoria. (Origem: PRT MS/GM 111/2016, Art. 10, § 4º)
§ 5º Para a comprovação da regularidade do estabelecimento poderão ser solicitados, a qualquer tempo, outros documentos previstos na legislação vigente. (Origem: PRT MS/GM 111/2016, Art. 10, § 5º)
Art. 11. Após a análise dos documentos, a adesão das farmácias e drogarias ao PFPB Aqui Tem Farmácia Popular será autorizada pelo Departamento de Assistência Farmacêutica e Insumos Estratégicos da Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (DAF/SCTIE/MS) e deferida por esta Secretaria com o seguinte fluxo: (Origem: PRT MS/GM 111/2016, Art. 11)
I - publicação no Diário Oficial da União (DOU); e (Origem: PRT MS/GM 111/2016, Art. 11, I)
II - disponibilização de "login" e senha para o representante legal das farmácias e drogarias para acesso ao Sistema Eletrônico de Autorização de Dispensação de Medicamentos e Correlatos (ADM). (Origem: PRT MS/GM 111/2016, Art. 11, II)
II - disponibilização de "login" e senha para o representante legal das farmácias e drogarias para acesso ao Sistema Eletrônico de Autorização de Dispensação de Medicamentos e das Fraldas Geriátricas (ADM).(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - disponibilização de login e senha para o representante legal das farmácias e drogarias para acesso ao Sistema Eletrônico de Autorização da Dispensação de Medicamentos e da Disponibilização de Fraldas Geriátricas e Absorventes Higiênicos (ADM). (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 12. O "login" e senha provisórios e definitivos a serem utilizados nas autorizações do PFPB serão enviados para o correio eletrônico indicado pelo estabelecimento credenciado em seu cadastro. (Origem: PRT MS/GM 111/2016, Art. 12)
§ 1º Após a publicação da adesão e o cadastro no sistema, o estabelecimento receberá automaticamente um "login" e senha provisórios para realizar testes de homologação de conexão entre o seu sistema eletrônico adotado e o Sistema Autorizador do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 12, § 1º)
§ 2º Após a conclusão dos testes de homologação, o estabelecimento deverá solicitar ao Ministério da Saúde o envio do "login" e senha definitivos para acesso ao ambiente de produção do sistema autorizador. (Origem: PRT MS/GM 111/2016, Art. 12, § 2º)
§ 3º A senha definitiva permitirá, além da realização das autorizações de venda, o acesso à área restrita na página eletrônica do PFPB, no endereço www.saude.gov.br/aquitemfarmaciapopular (Origem: PRT MS/GM 111/2016, Art. 12, § 3º)
§ 4º O estabelecimento credenciado que não realizar os testes de homologação de conexão entre o seu sistema eletrônico adotado e o Sistema Autorizador do Ministério da Saúde, no prazo máximo de 6 (seis) meses a contar do envio do "login" e senha provisórios, terá seu descredenciamento do PFPB publicado no DOU e somente poderá solicitar nova adesão ao PFPB após 6 (seis) meses, contados da data da referida publicação. (Origem: PRT MS/GM 111/2016, Art. 12, § 4º)
Art. 13. A(s) senha(s) de acesso ao Sistema Autorizador é exclusiva do estabelecimento, sendo que o seu representante legal assume inteira responsabilidade pelo seu uso, de acordo com as normas do PFPB. (Origem: PRT MS/GM 111/2016, Art. 13)
Parágrafo Único. Qualquer alteração dos dados cadastrais do estabelecimento credenciado deverá ser imediatamente informada ao PFPB. (Origem: PRT MS/GM 111/2016, Art. 13, Parágrafo Único)
Art. 14. A publicação de que trata o art. 11, I configura a relação convenial estabelecida entre o Ministério da Saúde e a farmácia ou drogaria, a qual será regida na forma da Lei nº 8.666, de 1993. (Origem: PRT MS/GM 111/2016, Art. 14)
Art. 15. O Requerimento e Termo de Adesão (RTA) terá validade até o dia 30 (trinta) de abril de cada ano, podendo haver prorrogação do prazo por decisão do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 15)
§ 1º A renovação do credenciamento não será automática. (Origem: PRT MS/GM 111/2016, Art. 15, § 1º)
§ 2º As farmácias e drogarias deverão obrigatoriamente efetuar a renovação do credenciamento no prazo estipulado, sob pena de suspensão da conexão com o sistema de vendas DATASUS até sua regularização. (Origem: PRT MS/GM 111/2016, Art. 15, § 2º)
§ 3º As farmácias e drogarias que não realizarem a renovação do credenciamento por 2 (dois) anos consecutivos terão seu descredenciamento do PFPB publicado no DOU e somente poderão solicitar nova adesão ao PFPB após 6 (seis) meses, contados da data da referida publicação. (Origem: PRT MS/GM 111/2016, Art. 15, § 3º)
Subseção II
Da Autorização de Comercialização e da Dispensação dos Medicamentos e Correlatos
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção II)
Subseção II
Da Autorização de Comercialização e da Dispensação dos Medicamentos e das Fraldas Geriátricas
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Subseção II
Da Autorização da Comercialização e Dispensação de Medicamentos e da Disponibilização de Fraldas Geriátricas e Absorventes Higiênicos (ADM).
(Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 16. A Autorização de Dispensação de Medicamentos e Correlatos (ADM) será processada por meio eletrônico, em tempo real, com base no código de barras da embalagem do medicamento e/ou do correlato. (Origem: PRT MS/GM 111/2016, Art. 16)
Art. 16. A Autorização de Dispensação de Medicamentos e das Fraldas Geriátricas (ADM) será processada por meio eletrônico, em tempo real, com base no código de barras da embalagem do medicamento e das fraldas geriátricas.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 16. A Autorização da Dispensação de Medicamentos e da Disponibilização de Fraldas Geriátricas e Absorventes Higiênicos (ADM) será processada por meio eletrônico, em tempo real, com base no código de barras da embalagem do medicamento e das fraldas geriátricas e absorventes higiênicos. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Parágrafo Único. O código de barras informado no sistema autorizador de vendas deverá ser igual ao código de barras da embalagem do medicamento e/ou correlato dispensado ao beneficiário. (Origem: PRT MS/GM 111/2016, Art. 16, Parágrafo Único)
Parágrafo Único. O código de barras informado no sistema autorizador de vendas deverá ser igual ao código de barras da embalagem do(s) medicamento(s) e/ou da(s) fralda(s) geriátrica(s) dispensado(s) ao beneficiário.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo único. O código de barras informado no sistema autorizador de vendas deverá ser igual ao código de barras da embalagem do medicamento, da fralda geriátrica ou do absorvente higiênico disponibilizado ao beneficiário. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 17. As ADM serão validadas pelo Ministério da Saúde quando contiverem todas as informações indicadas na Subseção VI da Seção I do Capítulo II, desde que atendidos todos os critérios do PFPB. (Origem: PRT MS/GM 111/2016, Art. 17)
Art. 18. A cada operação, obrigatoriamente, o estabelecimento deve emitir duas vias do documento fiscal e do cupom vinculado. (Origem: PRT MS/GM 111/2016, Art. 18)
Art. 19. O cupom vinculado deverá conter as seguintes informações, de acordo com o Anexo 5 do Anexo LXXVII : (Origem: PRT MS/GM 111/2016, Art. 19)
Art. 19. O cupom vinculado deverá conter as seguintes informações, de acordo com o Anexo 5 do Anexo LXXVII:(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
I - nome completo por extenso do beneficiário ou de seu representante legal, em caso de menor de idade sem CPF; (Origem: PRT MS/GM 111/2016, Art. 19, I)
II - número do Cadastro de Pessoas Físicas (CPF) do beneficiário ou de seu representante legal, em caso de menor de idade sem CPF; (Origem: PRT MS/GM 111/2016, Art. 19, II)
III - assinatura do beneficiário ou de seu representante legal; (Origem: PRT MS/GM 111/2016, Art. 19, III)
IV - endereço do beneficiário ou espaço para preenchimento, devendo, obrigatoriamente, ser preenchido no ato da compra; (Origem: PRT MS/GM 111/2016, Art. 19, IV)
V - razão social e CNPJ da empresa; (Origem: PRT MS/GM 111/2016, Art. 19, V)
VI - nome do responsável legal da empresa; (Origem: PRT MS/GM 111/2016, Art. 19, VI)
VII - número de autorização do DATASUS; (Origem: PRT MS/GM 111/2016, Art. 19, VII)
VIII - número de inscrição do médico no Conselho Regional de Medicina (CRM) ou Registro do Ministério da Saúde (RMS) e respectiva unidade federativa; (Origem: PRT MS/GM 111/2016, Art. 19, VIII)
IX - valor total da venda, do subsídio do Ministério da Saúde, da parcela a ser paga pelo beneficiário e do custo-zero dos medicamentos para hipertensão arterial e diabetes melittus e asma; (Origem: PRT MS/GM 111/2016, Art. 19, IX)
IX - valor total da venda, do subsídio do Ministério da Saúde, da parcela a ser paga pelo beneficiário e do custo zero dos medicamentos disponibilizados gratuitamente.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
X - data da compra; (Origem: PRT MS/GM 111/2016, Art. 19, X)
XI - nome e apresentação do medicamento e/ou correlato; (Origem: PRT MS/GM 111/2016, Art. 19, XI)
XI - nome e apresentação do medicamento e/ou da fralda geriátrica (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XI - nome e apresentação do medicamento, da fralda geriátrica ou do absorvente higiênico; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XII - código de barras do medicamento e/ou correlato; (Origem: PRT MS/GM 111/2016, Art. 19, XII)
XII - código de barras do medicamento e/ou da fralda geriátrica; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XII - código de barras do medicamento, da fralda geriátrica ou do absorvente higiênico; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XIII - posologia diária ou prescrição diária; (Origem: PRT MS/GM 111/2016, Art. 19, XIII)
XIV - quantidade autorizada; (Origem: PRT MS/GM 111/2016, Art. 19, XIV)
XV - saldo atual (conforme posologia ou prescrição diária); (Origem: PRT MS/GM 111/2016, Art. 19, XV)
XVI - data da próxima compra; (Origem: PRT MS/GM 111/2016, Art. 19, XVI)
XVII - identificação do operador da transação; e (Origem: PRT MS/GM 111/2016, Art. 19, XVII)
XVIII - número da Ouvidoria do Ministério da Saúde para consultas ou denúncias (136). (Origem: PRT MS/GM 111/2016, Art. 19, XVIII)
Art. 20. O beneficiário deverá assinar o cupom vinculado conforme documento oficial apresentado e preencher o endereço residencial completo, sendo que uma via deverá ser mantida pelo estabelecimento e a outra entregue a ele. (Origem: PRT MS/GM 111/2016, Art. 20)
Parágrafo Único. Aos beneficiários comprovadamente analfabetos será aceita a digital no cupom vinculado, desde que o próprio paciente compareça ao estabelecimento credenciado para a aquisição dos medicamentos e/ou correlatos do PFPB. (Origem: PRT MS/GM 111/2016, Art. 20, Parágrafo Único)
Parágrafo Único. Aos beneficiários comprovadamente analfabetos será aceita a digital no cupom vinculado, desde que o próprio paciente compareça ao estabelecimento credenciado para a aquisição dos medicamentos e/ou fraldas geriátricas do PFPB.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Parágrafo único. No caso de pessoa beneficiária comprovadamente analfabeta, será aceita a digital no cupom vinculado, desde que a pessoa beneficiária compareça ao estabelecimento credenciado ao PFPB para a aquisição do medicamento, da fralda geriátrica ou do absorvente higiênico. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 21. Para a comercialização e a dispensação dos medicamentos e/ou correlatos no âmbito do PFPB, as farmácias e drogarias devem observar as seguintes condições: (Origem: PRT MS/GM 111/2016, Art. 21)
Art. 21. Para a comercialização e a dispensação dos medicamentos e/ou das fraldas geriátricas no âmbito do PFPB, as farmácias e drogarias devem observar as seguintes condições: (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 21. Para a comercialização e dispensação dos medicamentos ou para a disponibilização das fraldas geriátricas e dos absorventes higiênicos no âmbito do PFPB, as farmácias e drogarias devem observar as seguintes condições: (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
I - apresentação, pelo beneficiário, de documento oficial com foto e número do CPF ou documento de identidade que conste o número do CPF; (Origem: PRT MS/GM 111/2016, Art. 21, I)
II - apresentação de prescrição médica, no caso de medicamentos, ou prescrição, laudo ou atestado médico, no caso de cor- relatos, conforme legislação vigente; e (Origem: PRT MS/GM 111/2016, Art. 21, II) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - apresentação de prescrição médica, no caso dos medicamentos, prescrição, laudo ou atestado médico, conforme legislação vigente, no caso das fraldas geriátricas, ou autorização emitida pelo Ministério da Saúde, no caso dos absorventes higiênicos; e (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
III - para a dispensação de fraldas geriátricas para incontinência, o paciente deverá ter idade igual ou superior a 60 (sessenta) anos ou ser pessoa com deficiência. (Origem: PRT MS/GM 111/2016, Art. 21, III) (com redação dada pela PRT MS/GM 937/2017)
§ 1º Com a ciência do beneficiário, o farmacêutico poderá complementar as informações referentes ao endereço do paciente que eventualmente não tenham sido disponibilizadas pelo profissional prescritor na prescrição, laudo ou atestado médico, conforme legislação vigente. (Origem: PRT MS/GM 111/2016, Art. 21, § 1º)
§ 2º As farmácias e drogarias deverão providenciar 2 (duas) cópias legíveis da prescrição, laudo ou atestado médico e do documento(s) de identidade oficial(s) apresentado no ato da compra. (Origem: PRT MS/GM 111/2016, Art. 21, § 2º) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 2º As farmácias e drogarias deverão providenciar 2 (duas) cópias legíveis da prescrição, laudo ou atestado médico, da autorização emitida pelo Ministério da Saúde, no caso dos absorventes higiênicos, e do(s) documento(s) de identidade oficial(is) apresentado(s) no ato da compra. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 3º Para a dispensação de que trata o inciso III do caput, o paciente deverá apresentar prescrição, laudo ou atestado médico que indique a necessidade do uso de fralda geriátrica, no qual conste, na hipótese de paciente com deficiência, a respectiva Classificação Internacional de Doenças (CID). (Origem: PRT MS/GM 111/2016, Art. 21, § 3º) (dispositivo acrescentado pela PRT MS/GM 937/2017)
Art. 21-A No prazo de cento e oitenta dias a partir da publicação desta Portaria, somente as prescrições eletrônicas passarão a ser aceitas para a autorização de comercialização e dispensação dos medicamentos e das fraldas geriátricas, no âmbito do PFPB. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022) (Revogado pela PRT GM/MS nº 13 de 13.01.2023)
Parágrafo único. O Ministério da Saúde providenciará as alterações normativas e adaptações dos sistemas necessários para a aplicação do disposto no caput. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022) (Revogado pela PRT GM/MS nº 13 de 13.01.2023)
Art. 22. O estabelecimento deve manter por 5 (cinco) anos as vias assinadas dos cupons vinculados, do documento fiscal, da prescrição, laudo ou atestado médico e do documento(s) de identidade oficial(s) apresentado no ato da compra, em ordem cronológica de emissão, com arquivamento de 2 (duas) cópias, uma em meio físico e outra em arquivo digitalizado. (Origem: PRT MS/GM 111/2016, Art. 22)
§ 1º Caberá também às farmácias e drogarias manter os documentos fiscais de aquisição dos medicamentos e ou correlatos do PFPB junto aos fornecedores pelo mesmo prazo e forma previstos no "caput". (Origem: PRT MS/GM 111/2016, Art. 22, § 1º)
§ 2º No caso de não ser possível a guarda das cópias dos documentos em arquivo digitalizado, o estabelecimento deverá arquivá-las em meio físico, na forma estabelecida no "caput". (Origem: PRT MS/GM 111/2016, Art. 22, § 2º)
Art. 22. O estabelecimento deve manter por 10 (dez) anos, em ordem cronológica de emissão, com arquivamento de 2 (duas) cópias mantidas em locais distintos, uma em meio físico e outra em arquivo digitalizado:(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
I - os cupons vinculados assinados, os documento fiscais, as prescrições, laudos ou atestados médicos e os documento(s) de identidade oficial(is) apresentado(s) no ato da compra; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
I - os cupons vinculados assinados, os documentos fiscais, as prescrições, laudos ou atestados médicos, a autorização emitida pelo Ministério da Saúde, no caso dos absorventes higiênicos, e o(s) documento(s) de identidade oficial(is) apresentado(s) no ato da compra; e (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - os documentos fiscais de aquisição dos respectivos medicamentos e/ou fraldas geriátricas dispensados no âmbito do PFPB. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - os documentos fiscais de aquisição dos respectivos medicamentos, fraldas geriátricas ou absorventes higiênicos dispensados no âmbito do PFPB. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 1º No caso de não ser possível a guarda das cópias dos documentos em arquivo digitalizado, o estabelecimento deverá arquivá-las em meio físico, em locais distintos, na forma estabelecida no caput.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Quando da instauração de procedimento administrativo para apuração de notícias ou indícios de irregularidades no âmbito do PFPB, as farmácias e drogarias deverão manter a guarda da documentação prevista no caput, referente às vendas realizadas no período de 10 (dez) anos até a data da comunicação pelo Ministério da Saúde.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º A contagem do prazo previsto no caput deste artigo se interrompe no momento da comunicação, pelo Ministério da Saúde, quanto à necessidade de instauração do procedimento administrativo para apuração de notícias ou indícios de irregularidades no âmbito do PFPB, até a sua conclusão. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 23. Para o PFPB, as prescrições, laudos ou atestados médicos terão validade de 180 (cento e oitenta) dias, a partir de sua emissão, exceto para os contraceptivos, cuja validade é de 365 (trezentos e sessenta e cinco) dias. (Origem: PRT MS/GM 111/2016, Art. 23)
Art. 23 Para o PFPB, a prescrição, laudo, atestado médico e autorização terão validade de 180 (cento e oitenta) dias, a partir de sua emissão, exceto para os contraceptivos, cuja validade é de 365 (trezentos e sessenta e cinco) dias. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 24. O quantitativo do medicamento solicitado deve corresponder à posologia mensal compatível com os consensos de tratamento da doença para o qual é indicado e a dispensação deve obedecer à periodicidade de compra e os limites definidos, constantes no "Manual de Orientações às Farmácias e Drogarias Credenciadas no Aqui Tem Farmácia Popular", constante na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 24)
§ 1º Em casos excepcionais, nos quais as prescrições ultrapassem a quantidade mensal estabelecida, o interessado deverá enviar ao DAF/SCTIE/MS requerimento que contenha os dados pessoais do beneficiário (nome, endereço e CPF), informações para contato, cópia da receita médica e do relatório médico que justifique a prescrição com a Classificação Internacional de Doenças (CID10). (Origem: PRT MS/GM 111/2016, Art. 24, § 1º)
§ 2º A autorização para a dispensação de medicamentos que ultrapassar a quantidade mensal (extrateto) terá a mesma validade da receita que o acompanhe, podendo ser renovada por meio do envio da documentação atualizada ao DAF/SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 24, § 2º)
§ 3º O quantitativo excedente requerido somente será liberado após análise do DAF/SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 24, § 3º)
§ 4º As Fraldas Geriátricas do PFPB poderão ser retiradas a cada 10 (dez) dias. (Origem: PRT MS/GM 111/2016, Art. 24, § 4º)
Art. 25. Fica dispensada a obrigatoriedade da presença física do paciente, titular da prescrição, laudo ou atestado médico, mediante a apresentação dos seguintes documentos: (Origem: PRT MS/GM 111/2016, Art. 25) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 25 Fica dispensada a obrigatoriedade da presença física do paciente, titular da prescrição, laudo, atestado médico ou autorização, mediante apresentação dos seguintes documentos: (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
I - do beneficiário titular da receita: documento oficial com foto e CPF ou documento de identidade que conste o número do CPF, salvo menor de idade, que permite a apresentação da certidão de nascimento ou registro geral (RG); e (Origem: PRT MS/GM 111/2016, Art. 25, I)
II - do representante legal, o qual assumirá, juntamente com o estabelecimento, a responsabilidade pela efetivação da transação: documento oficial com foto e CPF ou documento de identidade que conste o número do CPF; (Origem: PRT MS/GM 111/2016, Art. 25, II)
§ 1º Considera-se representante legal aquele que for: (Origem: PRT MS/GM 111/2016, Art. 25, § 1º)
I - declarado por sentença judicial; (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, I)
II - portador de instrumento público de procuração que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou correlatos junto ao PFPB; (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, II)
II - portador de instrumento público de procuração que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou fraldas geriátricas junto ao PFPB; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - portador de instrumento público de procuração que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos, fraldas geriátricas ou absorventes higiênicos no âmbito do PFPB; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
III - portador de instrumento particular de procuração com reconhecimento de firma, que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou correlatos junto ao PFPB; e (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, III)
III - portador de instrumento particular de procuração com reconhecimento de firma, que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou fraldas geriátricas junto ao PFPB; e(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
III - portador de instrumento particular de procuração com reconhecimento de firma que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos, fraldas geriátricas ou absorventes higiênicos no âmbito do PFPB; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
IV - portador de identidade civil que comprove a responsabilidade pelo menor de idade, titular da receita médica. (Origem: PRT MS/GM 111/2016, Art. 25, § 1º, IV)
§ 2º No ato da dispensação, as farmácias e drogarias deverão providenciar 2 (duas) cópias de toda a documentação prevista neste artigo, conforme determina o art. 22. (Origem: PRT MS/GM 111/2016, Art. 25, § 2º)
Subseção III
Do Pagamento pelo Ministério da Saúde
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção III)
Art. 26. O Ministério da Saúde efetuará os pagamentos, para as farmácias e drogarias credenciadas, no mês subsequente após o processamento das ADM validadas. (Origem: PRT MS/GM 111/2016, Art. 26)
§ 1º As ADM efetuadas no ambiente de homologação não serão computadas a título de pagamento. (Origem: PRT MS/GM 111/2016, Art. 26, § 1º)
§ 2º Quando o valor das autorizações validadas for menor que o das ADM estornadas ou em outras hipóteses em que haja óbice à compensação de créditos, será emitida à farmácia ou drogaria Guia de Recolhimento a União (GRU) para quitação do débito. (Origem: PRT MS/GM 111/2016, Art. 26, § 2º)
§ 3º Poderá ser emitida à farmácia ou drogaria uma GRU no valor total a ser estornado ao Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 26, § 3º)
§ 4º Nas hipóteses dos §§ 2º e 3º, o DAF/SCTIE/MS informará ao Fundo Nacional de Saúde (FNS/MS) que adotará as providências cabíveis. (Origem: PRT MS/GM 111/2016, Art. 26, § 4º)
Art. 27. Para estabelecimentos matriz e filiais, os valores devidos serão agrupados e os pagamentos serão efetuados exclusivamente para a matriz. (Origem: PRT MS/GM 111/2016, Art. 27)
Art. 28. Os pagamentos serão efetuados pelo FNS/MS em contas específicas previamente abertas pelas Farmácias participantes do PFPB e indicadas na fase de cadastramento, nos valores atestados pelo Diretor do DAF/SCTIE/MS, observadas as normas próprias da administração financeira pública. (Origem: PRT MS/GM 111/2016, Art. 28) (com redação dada pela PRT MS/GM 1182/2017)
Parágrafo Único. A apresentação da conta corrente, tornar-se-á requisito indispensável à habilitação dos agentes cadastrados no PFPB, devendo, tal medida, ser observada pelo DAF no ato da apresentação da documentação de habilitação ao Programa. (Origem: PRT MS/GM 111/2016, Art. 28, Parágrafo Único) (dispositivo acrescentado pela PRT MS/GM 1182/2017)
Art. 29. O atesto dos pagamentos terá por base as informações geradas pelo Sistema Autorizador DATASUS. (Origem: PRT MS/GM 111/2016, Art. 29)
Parágrafo Único. Caso as farmácias e drogarias verifiquem possíveis divergências nos valores de repasse do Ministério da Saúde, deverão solicitar análise do pagamento ao DAF/SCTIE/MS, no prazo máximo de 90 (noventa) dias, a contar da data da ordem bancária de pagamento, indicando quais autorizações estão divergentes. (Origem: PRT MS/GM 111/2016, Art. 29, Parágrafo Único)
Art. 30. Os relatórios de processamento das ADM estarão disponíveis na página eletrônica do PFPB, para fins de verificação pela farmácia ou drogaria. (Origem: PRT MS/GM 111/2016, Art. 30)
Subseção IV
Da Identidade Visual e da Publicidade do PFPB
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção IV)
Art. 31. As farmácias e drogarias credenciadas deverão exibir, em seus estabelecimentos, peças publicitárias que identifiquem o credenciamento ao PFPB, indicadas a seguir: (Origem: PRT MS/GM 111/2016, Art. 31)
I - adesivo antifalsificação fornecido pelo Ministério da Saúde, sendo proibida sua reprodução e que deverá ser utilizado próximo ao caixa de pagamento; (Origem: PRT MS/GM 111/2016, Art. 31, I)
II - banner produzido pelo estabelecimento credenciado, de acordo com as normas de publicidade do PFPB, a ser afixado na frente do estabelecimento credenciado; e (Origem: PRT MS/GM 111/2016, Art. 31, II)
III - tabela contendo lista de medicamentos e seus valores de referência contidos nos Anexos 1 e 2 do Anexo LXXVII , disponível na página eletrônica do PFPB, em local visível de atendimento ao público. (Origem: PRT MS/GM 111/2016, Art. 31, III)
III - tabela contendo lista de medicamentos e seus valores de referência contidos nos Anexos 1, 2 e 6 do Anexo LXXVII, disponível na página eletrônica do PFPB, em local visível de atendimento ao público.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
III - tabela contendo lista de medicamentos e seus valores de referência contidos nos Anexos 1, 2 e 6 do Anexo LXXVII, disponível na página eletrônica do PFPB, em local visível de atendimento ao público. (Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
§ 1º A logomarca do "Aqui Tem Farmácia Popular" não pode ser alterada e é obrigatório o uso do slogan ou marca do Governo Federal, vinculada à logomarca, bem como a inscrição do Ministério da Saúde. (Origem: PRT MS/GM 111/2016, Art. 31, § 1º)
§ 2º É proibida a publicidade ou o uso do nome do PFPB e das peças publicitárias fornecidas pelo Ministério da Saúde em qualquer tipo de manifestação diversa das previstas neste Anexo. (Origem: PRT MS/GM 111/2016, Art. 31, § 2º)
§ 3º Não é permitido vincular o PFPB a outras marcas, promoções, demais produtos e/ou convênios. (Origem: PRT MS/GM 111/2016, Art. 31, § 3º)
Art. 32. Os estabelecimentos credenciados somente poderão utilizar material publicitário e fazer campanha publicitária quando tiverem acesso ao ambiente de produção, seguindo as diretrizes definidas pelo Ministério da Saúde no Manual de Diretrizes para Aplicação em Peças Publicitárias específico do Programa, disponível na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 32)
Art. 33. Não é permitido às farmácias e drogarias não-credenciadas, descredenciadas ou apenas "em fase de credenciamento" exibirem publicidade referente ao PFPB, uma vez que somente o processo de credenciamento não garante que o mesmo será aprovado. (Origem: PRT MS/GM 111/2016, Art. 33)
Art. 34. O não cumprimento das normas de publicidade do PFPB sujeitará o estabelecimento às penalidades previstas na Subseção V da Seção I do Capítulo II. (Origem: PRT MS/GM 111/2016, Art. 34)
Subseção V
Do Controle, do Monitoramento e das Penalidades
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção V)
Art. 35. As Autorizações de Dispensação de Medicamentos e Correlatos (ADM) das farmácias e drogarias serão verificadas mensalmente ou quando houver necessidade, segundo os dados processados pelo Sistema Autorizador de Vendas, para controle e monitoramento do PFPB. (Origem: PRT MS/GM 111/2016, Art. 35)
Art. 35. As Autorizações de Dispensação de Medicamentos e das Fraldas Geriátricas (ADM) das farmácias e drogarias serão verificadas mensalmente ou quando houver necessidade, segundo os dados processados pelo Sistema Autorizador de Vendas, para controle e monitoramento do PFPB. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 35 As ADMs das farmácias e drogarias serão verificadas mensalmente ou quando houver necessidade, segundo os dados processados pelo sistema autorizador de vendas, para controle e monitoramento do PFPB. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 36. Sempre que necessário, o Ministério da Saúde solicitará ao estabelecimento credenciado a prestação de informações detalhadas sobre as suas operações, bem como as cópias dos documentos previstos neste Anexo e nas legislações vigentes, as quais deverão ser encaminhadas no prazo máximo de 15 (quinze) dias, a contar do recebimento da solicitação. (Origem: PRT MS/GM 111/2016, Art. 36)
Art. 37. O descumprimento de qualquer das regras dispostas neste Anexo, pelas farmácias e drogarias, caracteriza prática de irregularidade no âmbito do PFPB, considerando-se irregulares as seguintes situações, entre outras: (Origem: PRT MS/GM 111/2016, Art. 37)
I - comercializar e dispensar medicamentos e/ou correlatos fora da estrita observância das regras de execução do PFPB; (Origem: PRT MS/GM 111/2016, Art. 37, I)
I - comercializar e dispensar medicamentos e/ou fraldas geriátricas fora da estrita observância das regras de execução do PFPB; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
I - comercializar e dispensar medicamentos, fraldas geriátricas ou absorventes higiênicos fora da estrita observância às regras de execução do PFPB; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - deixar de exigir a prescrição, laudo ou atestado médico, a apresentação do documento de identificação e CPF e a assinatura do titular do CPF no cupom vinculado, salvo exceções previstas neste Anexo; (Origem: PRT MS/GM 111/2016, Art. 37, II) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
II - deixar de exigir a prescrição, laudo ou atestado médico, a autorização, a apresentação do documento de identificação e CPF e a assinatura do titular do CPF no cupom vinculado, salvo exceções previstas neste Anexo; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
III - deixar de cobrar do paciente o pagamento da sua parcela referente à compra do(s) medicamento(s) e/ou correlato(s), salvo para as dispensações de medicamentos indicados para hipertensão arterial, diabetes mellitus e asma; (Origem: PRT MS/GM 111/2016, Art. 37, III)
III - deixar de cobrar do paciente o pagamento da sua parcela referente à compra do(s) medicamento(s) e/ou fralda(s) geriátrica(s), salvo para as dispensações de medicamentos indicados para hipertensão arterial, diabetes mellitus e asma; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
III - deixar de cobrar do paciente o pagamento da sua parcela referente à compra dos medicamentos e/ou fraldas geriátricas, salvo para as dispensações de medicamentos gratuitos.(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
IV - comercializar e dispensar medicamentos e/ou correlatos do PFPB em nome de terceiros, salvo exceções previstas neste Anexo; (Origem: PRT MS/GM 111/2016, Art. 37, IV)
IV - comercializar e dispensar medicamentos e/ou fraldas geriátricas do PFPB em nome de terceiros, salvo exceções previstas neste Anexo; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)(Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
IV - comercializar e dispensar medicamentos e/ou disponibilizar fraldas geriátricas e absorventes higiênicos, no âmbito do PFPB, em nome de terceiros, salvo exceções previstas neste Anexo; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
V - estornar a venda cancelada ou irregular, com prazo superior a 7 (sete) dias da consolidação da transação; (Origem: PRT MS/GM 111/2016, Art. 37, V)
VI - comercializar medicamentos e correlatos com senha diversa daquela que foi conferida exclusivamente ao estabelecimento credenciado; (Origem: PRT MS/GM 111/2016, Art. 37, VI)
VI - comercializar medicamentos e fraldas geriátricas com senha diversa daquela que foi conferida exclusivamente ao estabelecimento credenciado; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
VI - dispensar medicamentos e disponibilizar fraldas geriátricas ou absorventes higiênicos com senha diversa daquela que foi conferida exclusivamente ao estabelecimento credenciado; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
VII - firmar convênios e parcerias com empresas, cooperativas e instituições congêneres para operações coletivas no âmbito do PFPB; (Origem: PRT MS/GM 111/2016, Art. 37, VII)
VIII - fazer uso publicitário do PFPB fora das regras definidas neste Anexo; (Origem: PRT MS/GM 111/2016, Art. 37, VIII)
IX - deixar de expor as peças publicitárias que identifiquem o credenciamento ao PFPB, estabelecidas no art. 31; (Origem: PRT MS/GM 111/2016, Art. 37, IX)
X - cadastrar pacientes em nome do PFPB; (Origem: PRT MS/GM 111/2016, Art. 37, X)
XI - entregar medicamentos e/ou correlatos do PFPB fora do estabelecimento, especialmente em domicílio, uma vez que a venda exige a presença do paciente no estabelecimento, munido dos documentos necessários; (Origem: PRT MS/GM 111/2016, Art. 37, XI)
XI - entregar medicamentos e/ou fraldas geriátricas do PFPB fora do estabelecimento, especialmente em domicílio, uma vez que a venda exige a presença do paciente no estabelecimento, munido dos documentos necessários;(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XI - entregar medicamentos, fraldas geriátricas ou absorventes higiênicos fora do estabelecimento, especialmente em domicílio, uma vez que, no âmbito do PFPB, a dispensação e disponibilização exigem a presença do paciente no estabelecimento, munido dos documentos necessários; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XII - deixar de observar as regras do órgão de vigilância sanitária para funcionamento do estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 37, XII)
XIII - permitir que terceiros, exceto nos casos previstos neste Anexo, assinem em nome do beneficiário.; (Origem: PRT MS/GM 111/2016, Art. 37, XIII)
XIV - rasurar quaisquer documentos necessários para a validação da venda dos itens constantes do elenco do programa; (Origem: PRT MS/GM 111/2016, Art. 37, XIV)
XV - receber a prescrição, laudo ou atestado médico com data posterior à autorização consolidada ou sem data de emissão; (Origem: PRT MS/GM 111/2016, Art. 37, XV) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XV - receber prescrição, laudo, atestado médico ou autorização com data posterior à autorização consolidada ou sem data de emissão; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XVI - lançar no sistema de vendas do programa informações divergentes das constantes na prescrição, laudo ou atestado médico e no documento do paciente; (Origem: PRT MS/GM 111/2016, Art. 37, XVI) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XVI - lançar no sistema de vendas do Programa informações divergentes das constantes na prescrição, laudo, atestado médico, autorização ou documento do paciente; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XVII - dispensar medicamentos e/ou correlatos que já tenham sido dispensados ou fornecidos, caso haja esta informação na prescrição, laudo ou atestado médico; (Origem: PRT MS/GM 111/2016, Art. 37, XVII)
XVII - dispensar medicamentos e/ou fraldas geriátricas que já tenham sido dispensados ou fornecidos, caso haja esta informação na prescrição, laudo ou atestado médico; (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XVII - dispensar medicamentos e disponibilizar fraldas geriátricas ou absorventes higiênicos que já tenham sido dispensados ou fornecidos, caso haja essa informação na prescrição, laudo, atestado médico ou autorização; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
XVIII - realizar a substituição do medicamento prescrito em desacordo com a legislação vigente; e (Origem: PRT MS/GM 111/2016, Art. 37, XVIII)
XIX - dispensar ao beneficiário medicamento e/ou correlato contendo o código de barras diverso daquele informado no sistema autorizador de vendas. (Origem: PRT MS/GM 111/2016, Art. 37, XIX)
XIX - dispensar ao beneficiário medicamento e/ou fraldas geriátricas contendo o código de barras diverso daquele informado no sistema autorizador de vendas. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
XIX - dispensar e disponibilizar ao beneficiário medicamentos, fraldas geriátricas ou absorventes higiênicos contendo código de barras diverso daquele informado no sistema autorizador de vendas. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 38. O DAF/SCTIE/MS suspenderá preventivamente os pagamentos e/ou a conexão com os Sistemas DATASUS sempre que detectar indícios ou notícias de irregularidade(s) na execução do PFPB pelos estabelecimentos. (Origem: PRT MS/GM 111/2016, Art. 38)
§ 1º O estabelecimento com suspeita de prática irregular será notificado pelo DAF/SCTIE/MS a apresentar, no prazo de 15 (quinze) dias, documentos e esclarecimentos sobre os fatos averiguados. (Origem: PRT MS/GM 111/2016, Art. 38, § 1º)
§ 2º Apresentados ou não os esclarecimentos e documentos pelo estabelecimento no prazo indicado no § 1º e verificando-se que não foram sanados os indícios ou notícias de irregularidades, o DAF/SCTIE/MS solicitará ao DENASUS a instauração de procedimento para averiguação dos fatos. (Origem: PRT MS/GM 111/2016, Art. 38, § 2º)
§ 3º Em casos excepcionais, o DAF/SCTIE/MS poderá solicitar ao DENASUS a instauração de procedimento para averiguação, antes que seja oportunizado à empresa um prazo para apresentar esclarecimentos. (Origem: PRT MS/GM 111/2016, Art. 38, § 3º)
Art. 39. O DAF/SCTIE/MS emitirá relatório fundamentado sobre o descredenciamento do estabelecimento, que será deferido pela Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS), sem prejuízo da imposição das penalidades previstas no art. 87 da Lei nº 8.666, de 1993, nas seguintes hipóteses: (Origem: PRT MS/GM 111/2016, Art. 39)
I - após o recebimento do relatório conclusivo do procedimento instaurado pelo DENASUS; ou (Origem: PRT MS/GM 111/2016, Art. 39, I)
II - constatadas irregularidades e os documentos constantes nos autos demonstrem autoria e materialidade. (Origem: PRT MS/GM 111/2016, Art. 39, II)
Parágrafo Único. O DAF/SCTIE/MS poderá, ainda, quando julgar cabível, encaminhar cópia dos autos à Polícia Federal e ao Ministério Público Federal para a adoção das providências pertinentes, tendo em vista a atuação desses órgãos na apuração das infrações penais em detrimento de bens, serviços e interesses da União. (Origem: PRT MS/GM 111/2016, Art. 39, Parágrafo Único)
Art. 40. Após relatório conclusivo do DENASUS, o estabelecimento deverá recolher aos cofres públicos o débito correspondente ao valor repassado pelo Ministério da Saúde nas autorizações consideradas irregulares, sem prejuízo da multa prevista no art. 42. (Origem: PRT MS/GM 111/2016, Art. 40)
Art. 41. Ao estabelecimento com decisão de descredenciamento que pretender pleitear a liquidação de eventual competência pendente, caberá apresentar requerimentos por escrito assinado com firma reconhecida do representante legal ao DAF/SCTIE/MS, no prazo de 15 (quinze) dias, a contar da publicação de descredenciamento no DOU. (Origem: PRT MS/GM 111/2016, Art. 41)
Art. 42. O descumprimento de qualquer das regras estabelecidas no presente instrumento ensejará a aplicação de multa de até 10% (dez por cento), calculada sobre o montante das vendas efetuadas no âmbito do PFPB, referente aos últimos 3 (três) meses completos das autorizações consolidadas, e/ou bloqueio da conexão com os Sistemas DATASUS, por um prazo de 3 (três) a 6 (seis) meses. (Origem: PRT MS/GM 111/2016, Art. 42)
§ 1º Caso o estabelecimento tenha aderido ao PFPB há menos de 90 (noventa) dias, o cálculo será realizado levando-se em consideração todas as vendas efetuadas desde a data da publicação da sua adesão. (Origem: PRT MS/GM 111/2016, Art. 42, § 1º)
§ 2º Os estabelecimentos deverão encaminhar o comprovante de pagamento da multa no prazo de 30 (trinta) dias, a contar do recebimento da notificação. (Origem: PRT MS/GM 111/2016, Art. 42, § 2º)
§ 3º Quando houver multa, os estabelecimentos poderão solicitar a dedução do valor correspondente de eventual pagamento pendente. (Origem: PRT MS/GM 111/2016, Art. 42, § 3º)
Art. 43. O estabelecimento que for descredenciado por motivo de irregularidades somente poderá solicitar nova adesão ao PFPB Aqui Tem Farmácia Popular após o período de 2 (dois) anos, a contar da publicação do descredenciamento no DOU. (Origem: PRT MS/GM 111/2016, Art. 43)
Art. 43. O estabelecimento que for descredenciado por motivo de irregularidades somente estará apto a participar de novo processo de credenciamento ao PFPB - Aqui Tem Farmácia Popular após o período de 2 (dois) anos, a contar da publicação do descredenciamento no DOU, devendo atender, obrigatoriamente: (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
I - aos critérios previstos no instrumento convocatório, nos termos dos §§2º e 3º do art. 5º deste Anexo; e (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
II - a comprovação do pagamento dos valores referentes a ressarcimentos e multas. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º O descredenciamento de qualquer filial, por motivo de irregularidades, enseja a punição de toda a pessoa jurídica, matriz e filiais, nos termos do "caput". (Origem: PRT MS/GM 111/2016, Art. 43, § 1º) (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Excetua-se do disposto no "caput" os casos de incorporação ou fusão de empresas já credenciadas, mediante autorização prévia do DAF/SCTIE/MS, cujo CNPJ não tenha sido descredenciado em um período inferior a 2 (dois) anos e o responsável legal comprovar que não houve qualquer alteração quanto à localização do estabelecimento. (Origem: PRT MS/GM 111/2016, Art. 43, § 2º)
§ 3º A penalidade prevista no "caput" estende-se ao proprietário ou empresário individual, aos sócios empresários e, ainda, ao farmacêutico responsável à época em que foram praticadas as irregularidades que ocasionaram o descredenciamento. (Origem: PRT MS/GM 111/2016, Art. 43, § 3º)
§ 3º A penalidade prevista no caput estende-se ao proprietário ou empresário individual e a todos os sócios da sociedade empresarial à época em que foram praticadas as irregularidades que ocasionaram o descredenciamento.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 4º Após o prazo estabelecido no "caput" o representante legal poderá solicitar ao DAF/SCTIE/MS nova adesão por meio de requerimento assinado e com firma reconhecida, que deverá conter os dados da empresa, juntamente com os comprovantes de pagamento dos ressarcimentos e multas, quando houver, para análise e deliberação deste Departamento. (Origem: PRT MS/GM 111/2016, Art. 43, § 4º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Subseção VI
Do Processamento Eletrônico das Autorizações das Dispensações de Medicamentos e Correlatos (ADM)
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção I, Subeção VI)
Subseção VI
Do Processamento Eletrônico das Autorizações das Dispensações de Medicamentos e das Fraldas Geriátricas (ADM)
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Subseção VI
Do Processamento Eletrônico das Autorizações das Dispensações de Medicamentos e das Disponibilizações de Fraldas Geriátricas e Absorventes Higiênicos (ADM)
(Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 44. O processamento eletrônico das ADM é composto de três fases, nas quais o estabelecimento credenciado envia dados ao Sistema Autorizador referente à transação que, por sua vez, verifica as informações constantes em sua base de dados e retorna à verificação dos dados. (Origem: PRT MS/GM 111/2016, Art. 44)
Parágrafo Único. Após o envio de dados pelo estabelecimento credenciado em cada uma das fases do processamento eletrônico da ADM, o Sistema Autorizador verificará as informações constantes em sua base de dados e retornará à verificação dos dados. (Origem: PRT MS/GM 111/2016, Art. 44, Parágrafo Único)
Art. 45. A primeira fase do processo eletrônico só poderá ser realizada mediante a utilização de solução de segurança fornecida pelo Ministério da Saúde, nas seguintes condições: (Origem: PRT MS/GM 111/2016, Art. 45)
I - a solução de segurança será responsável pela identificação da estação de trabalho (computador) e da transação; (Origem: PRT MS/GM 111/2016, Art. 45, I)
II - a identificação da transação é obtida através da solução de segurança; e (Origem: PRT MS/GM 111/2016, Art. 45, II)
III - cada estação de trabalho (computador) deve ser identificada e cadastrada junto ao Ministério da Saúde para a realização da dispensação, conforme orientações a seguir: (Origem: PRT MS/GM 111/2016, Art. 45, III)
a) o cadastramento é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 111/2016, Art. 45, III, a)
b) as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 111/2016, Art. 45, III, b)
c) o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 111/2016, Art. 45, III, c)
Parágrafo Único. É de responsabilidade do estabelecimento a instalação, configuração e integração da solução de segurança. (Origem: PRT MS/GM 111/2016, Art. 45, Parágrafo Único)
Art. 46. Todas as fases do processo eletrônico só poderão ser realizadas mediante autenticação eletrônica do atendente com as seguintes determinações: (Origem: PRT MS/GM 111/2016, Art. 46)
I - o cadastramento de todos os atendentes é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 111/2016, Art. 46, I)
II - as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 111/2016, Art. 46, II)
III - o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 111/2016, Art. 46, III)
Art. 47. Na primeira fase do processo eletrônico, o estabelecimento informará os seguintes dados: (Origem: PRT MS/GM 111/2016, Art. 47)
I - código da solicitação; (Origem: PRT MS/GM 111/2016, Art. 47, I)
II - CNPJ do estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 47, II)
III - CPF do paciente; (Origem: PRT MS/GM 111/2016, Art. 47, III)
IV - CRM/RMS do médico que emitiu a prescrição; (Origem: PRT MS/GM 111/2016, Art. 47, IV)
V - Unidade Federativa que emitiu o CRM/RMS do médico prescritor; (Origem: PRT MS/GM 111/2016, Art. 47, V)
VI - data de emissão da prescrição; (Origem: PRT MS/GM 111/2016, Art. 47, VI)
VII - identificador da transação; (Origem: PRT MS/GM 111/2016, Art. 47, VII)
VIII - lista de medicamentos e correlatos, na qual para cada item deverá ser informado: (Origem: PRT MS/GM 111/2016, Art. 47, VIII)
VIII - lista de medicamentos e fraldas geriátricas, na qual para cada item deverá ser informado:(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
VIII - lista de medicamentos, fraldas geriátricas e absorventes higiênicos, na qual, para cada item, deverá ser informado: (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
a) código de barras da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 111/2016, Art. 47, VIII, a)
a) código de barras da apresentação do medicamento e fraldas geriátricas;(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
a) código de barras da apresentação do medicamento, fralda geriátrica e absorvente higiênico; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
b) quantidade solicitada, em unidade conforme definida pelo Programa; (Origem: PRT MS/GM 111/2016, Art. 47, VIII, b)
c) valor unitário do medicamento e correlato; e (Origem: PRT MS/GM 111/2016, Art. 47, VIII, c)
c) valor unitário do medicamento e fraldas geriátricas; e (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
c) valor unitário do medicamento, da fralda geriátrica e do absorvente higiênico; e (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
d) quantidade diária prescrita. (Origem: PRT MS/GM 111/2016, Art. 47, VIII, d)
IX - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 47, IX)
X - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 47, X)
XI - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 47, XI)
XII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 47, XII)
Art. 48. Na segunda fase, após ter recebido a confirmação da primeira fase, o estabelecimento deve informar ao Sistema Autorizador os dados que fazem parte do processo de autorização, quais sejam: (Origem: PRT MS/GM 111/2016, Art. 48)
I - código da solicitação enviado na primeira fase; (Origem: PRT MS/GM 111/2016, Art. 48, I)
II - número da pré-autorização gerado pelo Sistema Autorizador e recebido pelo estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 48, II)
III - número do documento fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 48, III)
IV - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 48, IV)
V - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 48, V)
VI - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 48, VI)
VII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 48, VII)
§ 1º O Sistema Autorizador confirmará os medicamentos e correlatos autorizados ou uma mensagem e código de erro em casos de não autorização. (Origem: PRT MS/GM 111/2016, Art. 48, § 1º)
§ 1º O Sistema Autorizador confirmará os medicamentos e fraldas geriátricas autorizados ou uma mensagem e código de erro em casos de não autorização. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 1º O sistema autorizador de vendas confirmará os medicamentos, as fraldas geriátricas e os absorventes higiênicos autorizados ou uma mensagem e código de erro em casos de não autorização. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 2º Os códigos de retorno do sistema autorizador estão disponíveis na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 48, § 2º)
§ 3º As autorizações realizadas com mais de um medicamento e/ou correlato retornarão com a mesma autorização. (Origem: PRT MS/GM 111/2016, Art. 48, § 3º)
§ 3º As autorizações realizadas com mais de um medicamento e/ou fraldas geriátricas retornarão com a mesma autorização. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
§ 3º As autorizações realizadas com mais de um medicamento, fraldas geriátricas e absorventes higiênicos retornarão com a mesma autorização. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 49. Na terceira e última fase, o estabelecimento confirmará o recebimento da pré-autorização e enviará os seguintes dados: (Origem: PRT MS/GM 111/2016, Art. 49)
I - número da pre-autorização; (Origem: PRT MS/GM 111/2016, Art. 49, I)
II - número do documento fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 49, II)
III - lista de medicamentos e correlatos autorizados com as seguintes informações: (Origem: PRT MS/GM 111/2016, Art. 49, III)
III - lista de medicamentos e fraldas geriátricas autorizados com as seguintes informações: (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
III - lista de medicamentos, fraldas geriátricas e absorventes higiênicos autorizados, com as seguintes informações: (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
a) código de barras da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 111/2016, Art. 49, III, a)
a) código de barras da apresentação do medicamento e das fraldas geriátricas;(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
a) código de barras da apresentação dos medicamentos, das fraldas geriátricas e dos absorventes higiênicos; (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
b) quantidade autorizada em UP; (Origem: PRT MS/GM 111/2016, Art. 49, III, b)
c) valor da parcela do Ministério da Saúde informado pelo Sistema Autorizador; e (Origem: PRT MS/GM 111/2016, Art. 49, III, c)
d) valor da parcela do paciente informada pelo Sistema Autorizador. (Origem: PRT MS/GM 111/2016, Art. 49, III, d)
IV - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 49, IV)
V - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 49, V)
VI - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 49, VI)
VII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 49, VII)
Parágrafo Único. O estabelecimento receberá confirmação e finalização do processo de autorização da dispensação dos medicamentos e dos correlatos. (Origem: PRT MS/GM 111/2016, Art. 49, Parágrafo Único)
Parágrafo Único. O estabelecimento receberá confirmação e finalização do processo de autorização da dispensação dos medicamentos e das fraldas geriátricas. (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
Parágrafo único. O estabelecimento receberá confirmação e finalização do processo de autorização da dispensação dos medicamentos e da disponibilização das fraldas geriátricas e absorventes higiênicos. (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
Art. 50. Para eventual estorno de autorizações já efetuadas, serão necessários os seguintes dados: (Origem: PRT MS/GM 111/2016, Art. 50)
I - número da autorização; (Origem: PRT MS/GM 111/2016, Art. 50, I)
II - número do documento fiscal; (Origem: PRT MS/GM 111/2016, Art. 50, II)
III - CNPJ do estabelecimento; (Origem: PRT MS/GM 111/2016, Art. 50, III)
IV - lista de medicamentos e correlatos, na qual para cada item deverá ser informado: (Origem: PRT MS/GM 111/2016, Art. 50, IV)
IV - lista de medicamentos e fraldas geriátricas, na qual para cada item deverá ser informado:(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - lista de medicamentos, fraldas geriátricas e absorventes higiênicos, na qual, para cada item, deverá ser informado: (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024) (Revogada pela PRT GM/MS nº 3.073 de 15.01.2024)
a) código de barras da apresentação do medicamento e correlato; e (Origem: PRT MS/GM 111/2016, Art. 50, IV, a)
a) código de barras da apresentação do medicamento e fraldas geriátricas; e (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
a) código de barras da apresentação do medicamento, das fraldas geriátricas e dos absorventes higiênicos; e (Redação dada pela PRT GM/MS nº 3.073 de 15.01.2024)
b) quantidade a ser estornada. (Origem: PRT MS/GM 111/2016, Art. 50, IV, b)
V - "login" da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 50, V)
VI - senha da farmácia e drogaria; (Origem: PRT MS/GM 111/2016, Art. 50, VI)
VII - "login" do atendente da farmácia e drogaria; e (Origem: PRT MS/GM 111/2016, Art. 50, VII)
VIII - senha do atendente da farmácia e drogaria. (Origem: PRT MS/GM 111/2016, Art. 50, VIII)
Art. 51. As orientações para configuração da conexão do sistema eletrônico das farmácias e drogarias com o Sistema Autorizador se dará pelo envio de correio eletrônico juntamente com o usuário e senha provisórios para o endereço fornecido pelo estabelecimento no momento do cadastro no PFPB. (Origem: PRT MS/GM 111/2016, Art. 51)
Art. 52. Na página eletrônica do PFPB, estão disponíveis informações técnicas do Programa, bem como do processamento por meio do sistema eletrônico. (Origem: PRT MS/GM 111/2016, Art. 52)
Seção II
Da Dispensação dos Medicamentos e Correlatos nas Unidades da Rede Própria do PFPB
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção II)
Seção II
Da Dispensação dos Medicamentos nas Unidades da Rede Própria do PFPB
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 53. A dispensação de medicamentos e correlatos na Rede Própria do PFPB ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação descritos nos Anexos 3 e 4 do Anexo LXXVII e de acordo com o Manual de Procedimentos Operacionais Padrão da FIOCRUZ e pelo Manual Básico. (Origem: PRT MS/GM 111/2016, Art. 53)
Art. 53. A dispensação de medicamentos na Rede Própria do PFPB ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação descritos nos Anexos 3 e 4 do Anexo LXXVII e de acordo com o Manual de Procedimentos Operacionais Padrão da FIOCRUZ e pelo Manual Básico.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. A dispensação dos medicamentos para hipertensão, diabetes mellitus e asma ocorrerá por meio do sistema de vendas DATASUS, observados os procedimentos estabelecidos na Subseção II da Seção I do Capítulo II. (Origem: PRT MS/GM 111/2016, Art. 53, Parágrafo Único)
Seção III
Do Modelo de Gestão da Rede Própria
(Origem: PRT MS/GM 111/2016, CAPÍTULO II, Seção III)
Art. 54. O PFPB realizado em ação conjunta entre o Ministério da Saúde e a Fundação Oswaldo Cruz (FIOCRUZ), será coordenado por um Conselho Gestor, vinculado diretamente à SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 54)
Parágrafo Único. O Conselho Gestor do PFPB terá a seguinte composição: (Origem: PRT MS/GM 111/2016, Art. 54, Parágrafo Único)
I - três representantes da SCTIE/MS, sendo um deles o Diretor do DAF/SCTIE/MS, que o coordenará; e (Origem: PRT MS/GM 111/2016, Art. 54, Parágrafo Único, I)
II - três representantes indicados pela Presidência da FIOCRUZ. (Origem: PRT MS/GM 111/2016, Art. 54, Parágrafo Único, II)
Art. 55. As atividades do PFPB serão desenvolvidas de acordo com a Lei nº 10.858, de 13 de abril de 2004, pela FIOCRUZ, por meio da Gerência Técnica e da Gerência Administrativa do PFPB e pelo Ministério da Saúde, por meio da SCTIE/MS, sob a responsabilidade do DAF/SCTIE/MS. (Origem: PRT MS/GM 111/2016, Art. 55)
Art. 56. Ao Conselho Gestor do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 111/2016, Art. 56)
I - aprovar anualmente o Plano de Metas e o Plano de Desenvolvimento; (Origem: PRT MS/GM 111/2016, Art. 56, I)
II - aprovar anualmente o Relatório de Gestão do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, II)
III - monitorar a execução orçamentária e a movimentação financeira; (Origem: PRT MS/GM 111/2016, Art. 56, III)
IV - acompanhar as propostas de convênios com instituições públicas ou privadas que visem apoiar o desenvolvimento do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, IV)
V - aprovar o Manual Básico do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, V)
VI - orientar e participar da formulação de indicadores de resultados e do impacto do PFPB; (Origem: PRT MS/GM 111/2016, Art. 56, VI)
VII - sugerir a habilitação de parceiros e a celebração de convênios que se façam necessárias, não previstas ou contempladas nas normas e requisitos estabelecidos; e (Origem: PRT MS/GM 111/2016, Art. 56, VII)
VIII - propor o elenco de medicamentos e/ou correlatos e a definição do preço de dispensação a ser disponibilizado pelo PFPB. (Origem: PRT MS/GM 111/2016, Art. 56, VIII)
VIII - propor o elenco de medicamentos e a definição do preço de dispensação a ser disponibilizado pelo PFPB.(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 57. À Gerência Técnica do PFPB compete: (Origem: PRT MS/GM 111/2016, Art. 57)
I - monitorar a qualidade dos serviços prestados pelas unidades vinculadas ao PFPB; (Origem: PRT MS/GM 111/2016, Art. 57, I)
II - coordenar as ações de formação e capacitação de recursos humanos para o desenvolvimento das atividades; (Origem: PRT MS/GM 111/2016, Art. 57, II)
III - coordenar as ações de atenção e de informação ao usuário, aos profissionais de saúde e aos parceiros; (Origem: PRT MS/GM 111/2016, Art. 57, III)
IV - promover a avaliação permanente da lista de produtos e serviços disponibilizados; e (Origem: PRT MS/GM 111/2016, Art. 57, IV)
V - coordenar a elaboração de manuais e procedimentos operacionais referentes a todas as atividades técnicas e às ações desenvolvidas nas farmácias. (Origem: PRT MS/GM 111/2016, Art. 57, V)
Art. 58. À Gerência Administrativa do PFPB compete: (Origem: PRT MS/GM 111/2016, Art. 58)
I - dar suporte à instalação e à manutenção de unidades mediante a celebração de convênios ou parcerias entre o Ministério da Saúde, a FIOCRUZ, os Estados, o Distrito Federal, os Municípios E Instituições; (Origem: PRT MS/GM 111/2016, Art. 58, I)
II - acompanhar e monitorar o gerenciamento das farmácias do PFPB; (Origem: PRT MS/GM 111/2016, Art. 58, II)
III - participar do planejamento de aquisição de produtos, de reposição de estoques de produtos, outros insumos materiais, equipamentos e contratação de serviços necessários para a implantação das unidades do PFPB; (Origem: PRT MS/GM 111/2016, Art. 58, III)
IV - acompanhar os processos de logística referentes à guarda, ao transporte e à distribuição de medicamentos e correlatos, insumos diversos, materiais e equipamentos das unidades do PFPB; e (Origem: PRT MS/GM 111/2016, Art. 58, IV)
IV - acompanhar os processos de logística referentes à guarda, ao transporte e à distribuição de medicamentos, materiais e equipamentos das unidades do PFPB; e (Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
V - aprovar os projetos das instalações e áreas físicas das farmácias a serem implantadas pelos Estados, Distrito Federal, Municípios e entidades conveniadas, visando adequação ao disposto no Manual Básico do PFPB. (Origem: PRT MS/GM 111/2016, Art. 58, V)
Art. 59. Ao DAF/SCTIE/MS compete: (Origem: PRT MS/GM 111/2016, Art. 59)
I - estabelecer mecanismos de controle e monitoramento da implementação, do desenvolvimento e dos resultados do PFPB; e (Origem: PRT MS/GM 111/2016, Art. 59, I)
II - supervisionar, por meio de suas coordenações, as seguintes ações: (Origem: PRT MS/GM 111/2016, Art. 59, II)
a) instrução dos processos administrativos de habilitação de Estados, Distrito Federal e Municípios e pela celebração de convênios com as instituições autorizadas; (Origem: PRT MS/GM 111/2016, Art. 59, II, a)
b) instrução dos processos administrativos de habilitação de empresas parceiras; (Origem: PRT MS/GM 111/2016, Art. 59, II, b)
c) emissão de pareceres sobre as solicitações de habilitações de Estados, Distrito Federal e Municípios, segundo procedimentos e critérios definidos no Manual Básico do PFPB; (Origem: PRT MS/GM 111/2016, Art. 59, II, c)
d) emissão de pareceres sobre as solicitações de celebração de convênios com instituições autorizadas, segundo procedimentos e critérios definidos no Manual Básico do PFPB; e (Origem: PRT MS/GM 111/2016, Art. 59, II, d)
e) emissão de pareceres sobre as solicitações de credenciamento de empresas parceiras. (Origem: PRT MS/GM 111/2016, Art. 59, II, e)
Art. 60. As despesas decorrentes do PFPB incidirão sobre as Ações Programáticas de Manutenção e Funcionamento das Farmácias Populares, a saber: 10.303.2015.20YR e 10.303.2015.20YS. (Origem: PRT MS/GM 111/2016, Art. 60)
CAPÍTULO III
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 111/2016, CAPÍTULO III)
Art. 61. A qualquer tempo, o representante legal do estabelecimento ou seu respectivo procurador poderá requerer seu descredenciamento junto ao PFPB, mediante o envio de documento assinado e com firma reconhecida, contendo os dados da empresa, sendo que o requerimento só será deferido caso não haja notícias ou indícios de irregularidades. (Origem: PRT MS/GM 111/2016, Art. 61)
Parágrafo Único. O estabelecimento descredenciado a pedido, na forma do "caput", somente poderá solicitar nova adesão ao PFPB após 6 (seis) meses, contados da data da publicação do descredenciamento no DOU. (Origem: PRT MS/GM 111/2016, Art. 61, Parágrafo Único)
Art. 62. O Ministério da Saúde manterá informações e orientações sistemáticas sobre a operação do PFPB na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 62)
§ 1º As definições estratégicas, bem como as normas para adesão e manutenção do PFPB, instalação e gestão das unidades, repasses de recursos fundo a fundo, celebração de convênios, monitoramento, avaliação e controle estão previstas no "Programa Farmácia Popular do Brasil - Manual Básico", na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 62, § 1º)
§ 2º As farmácias e drogarias credenciadas deverão seguir as normas de procedimento constantes no "Manual de Orientações às Farmácias e Drogarias Credenciadas no Aqui Tem Farmácia Popular" na página eletrônica do PFPB. (Origem: PRT MS/GM 111/2016, Art. 62, § 2º)
Art. 63. As despesas decorrentes da execução do art. 21, III incidirão sobre a Ação Programática 10.303.2015.20YS.0001 - Manutenção e Funcionamento do Programa Farmácia Popular do Brasil pelo sistema copagamento. (Origem: PRT MS/GM 937/2017, Art. 2º)
Art. 63. As despesas decorrentes da execução da Seção I do Capítulo II desta portaria incidirão sobre a ação programática 10.303.5017.20YR e 10.303.5017.20YS. (Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
ANEXO 1 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA (Origem: PRT MS/GM 111/2016, Anexo 1)
ANEXO 1 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA
(Redação dada pela PRT GM/MS n° 739 de 27.03.2018)
(Redação dada pela PRT GM/MS n° 739 de 27.03.2018)
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA - GRATUIDADE
(Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
(Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
ANEXO 1 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR INDICADOS PARA CONTRACEPÇÃO, HIPERTENSÃO ARTERIAL, DIABETES MELLITUS, ASMA E OSTEOPOROSE - (GRATUIDADE)
(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ANEXO 1 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR INDICADOS PARA CONTRACEPÇÃO, HIPERTENSÃO ARTERIAL, DIABETES MELLITUS, ASMA E OSTEOPOROSE - (GRATUIDADE)
(Redação dada pela PRT GM/MS n° 675 de 27.06.2023 - Republicação)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ANEXO 1 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR INDICADOS PARA CONTRACEPÇÃO, HIPERTENSÃO ARTERIAL, DIABETES MELLITUS, ASMA, OSTEOPOROSE, DISLIPIDEMIA, RINITE, DOENÇA DE PARKINSON E GLAUCOMA - (MODALIDADE GRATUIDADE)
(Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
| INDICAÇÃO | Unidade | Unidade da Federação | ||||||||||||||||||||||||||
| Hipertensão arterial | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Atenolol 25 mg | 1 (um) comprimido | R$ 0,10 | R$ 0,11 | R$ 0,09 | R$ 0,11 | R$ 0,10 | R$ 0,11 | R$ 0,10 | R$ 0,10 | R$ 0,11 | R$ 0,11 | R$ 0,10 | R$ 0,10 | R$ 0,09 | R$ 0,11 | R$ 0,11 | R$ 0,11 | R$ 0,11 | R$ 0,12 | R$ 0,11 | R$ 0,10 | R$ 0,10 | R$ 0,10 | R$ 0,10 | R$ 0,09 | R$ 0,11 | R$ 0,08 | R$ 0,10 |
| Bensilato de Anlodipino 5 mg | 1 (um) comprimido | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,21 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 | R$ 0,20 |
| Captopril 25 mg | 1 (um) comprimido | R$ 0,10 | R$ 0,11 | R$ 0,09 | R$ 0,12 | R$ 0,11 | R$ 0,11 | R$ 0,10 | R$ 0,10 | R$ 0,10 | R$ 0,12 | R$ 0,09 | R$ 0,10 | R$ 0,08 | R$ 0,13 | R$ 0,10 | R$ 0,11 | R$ 0,11 | R$ 0,12 | R$ 0,11 | R$ 0,10 | R$ 0,10 | R$ 0,11 | R$ 0,10 | R$ 0,09 | R$ 0,10 | R$ 0,08 | R$ 0,10 |
| Cloridrato de Propranolol 40 mg | 1 (um) comprimido | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,07 | R$ 0,08 | R$ 0,08 | R$ 0,07 | R$ 0,07 | R$ 0,07 | R$ 0,08 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,07 | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,06 | R$ 0,07 |
| Espironolactona 25 mg | 1 (um) comprimido | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 | R$ 0,29 |
| Furosemida 40 mg | 1 (um) comprimido | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 |
| Hidroclorotiazida 25 mg | 1 (um) comprimido | R$ 0,06 | R$ 0,06 | R$ 0,05 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,05 | R$ 0,06 | R$ 0,05 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,06 | R$ 0,05 | R$ 0,06 | R$ 0,05 | R$ 0,06 |
| Losartana Potássica 50 mg | 1 (um) comprimido | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,17 | R$ 0,16 | R$ 0,18 | R$ 0,20 | R$ 0,16 | R$ 0,19 | R$ 0,19 | R$ 0,16 | R$ 0,16 | R$ 0,14 | R$ 0,19 | R$ 0,16 | R$ 0,18 | R$ 0,19 | R$ 0,20 | R$ 0,21 | R$ 0,17 | R$ 0,16 | R$ 0,15 | R$ 0,18 | R$ 0,16 | R$ 0,18 | R$ 0,15 | R$ 0,16 |
| Maleato Enalapril 10 mg | 1 (um) comprimido | R$ 0,16 | R$ 0,18 | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,19 | R$ 0,18 | R$ 0,17 | R$ 0,17 | R$ 0,19 | R$ 0,15 | R$ 0,17 | R$ 0,14 | R$ 0,20 | R$ 0,16 | R$ 0,19 | R$ 0,19 | R$ 0,20 | R$ 0,18 | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,17 | R$ 0,14 | R$ 0,19 | R$ 0,13 | R$ 0,17 |
| Succinato de Metoprolol 25 mg | 1 (um) comprimido | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,70 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 | R$ 0,69 |
| Diabetes mellitus | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Cloridrato de Metformina 500 mg | 1 (um) comprimido | R$ 0,14 | R$ 0,14 | R$ 0,13 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,13 | R$ 0,13 | R$ 0,13 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,15 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,13 | R$ 0,14 | R$ 0,13 | R$ 0,14 | R$ 0,13 | R$ 0,14 |
| Cloridrato de Metformina 500 mg - Ação Prolongada | 1 (um) comprimido | R$ 0,23 | R$ 0,24 | R$ 0,22 | R$ 0,23 | R$ 0,23 | R$ 0,24 | R$ 0,23 | R$ 0,23 | R$ 0,23 | R$ 0,25 | R$ 0,23 | R$ 0,23 | R$ 0,24 | R$ 0,24 | R$ 0,24 | R$ 0,24 | R$ 0,24 | R$ 0,25 | R$ 0,25 | R$ 0,23 | R$ 0,24 | R$ 0,23 | R$ 0,23 | R$ 0,22 | R$ 0,23 | R$ 0,22 | R$ 0,23 |
| Cloridrato de Metformina 850 mg | 1 (um) comprimido | R$ 0,15 | R$ 0,16 | R$ 0,14 | R$ 0,17 | R$ 0,15 | R$ 0,16 | R$ 0,15 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,15 | R$ 0,15 | R$ 0,14 | R$ 0,16 | R$ 0,16 | R$ 0,15 | R$ 0,16 | R$ 0,17 | R$ 0,16 | R$ 0,16 | R$ 0,15 | R$ 0,14 | R$ 0,15 | R$ 0,15 | R$ 0,16 | R$ 0,14 | R$ 0,15 |
| Glibenclamida 5mg | 1 (um) comprimido | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,09 | R$ 0,07 | R$ 0,07 | R$ 0,07 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,09 | R$ 0,08 | R$ 0,08 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,08 | R$ 0,07 | R$ 0,08 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, frasco-ampola 10 ml | 1 (um) frasco/ampola 10ml | R$ 21,40 | R$ 21,80 | R$ 20,10 | R$ 21,80 | R$ 21,60 | R$ 21,70 | R$ 22,60 | R$ 22,00 | R$ 22,00 | R$ 23,50 | R$ 22,40 | R$ 22,40 | R$ 19,60 | R$ 22,50 | R$ 22,20 | R$ 21,80 | R$ 21,60 | R$ 23,90 | R$ 25,70 | R$ 21,80 | R$ 22,10 | R$ 21,20 | R$ 22,20 | R$ 20,00 | R$ 21,80 | R$ 20,30 | R$ 21,70 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, frasco-ampola 5 ml | 1 (um) frasco/ampola 5ml | R$ 10,70 | R$ 10,90 | R$ 10,05 | R$ 10,90 | R$ 10,80 | R$ 10,85 | R$ 11,30 | R$ 11,00 | R$ 11,00 | R$ 11,75 | R$ 11,20 | R$ 11,20 | R$ 9,80 | R$ 11,25 | R$ 11,10 | R$ 10,90 | R$ 10,80 | R$ 11,95 | R$ 12,85 | R$ 10,90 | R$ 11,05 | R$ 10,60 | R$ 11,10 | R$ 10,00 | R$ 10,90 | R$ 10,15 | R$ 10,85 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, refil 1,5ml (carpule) | 1 (um) refil 1,5ml | R$ 3,21 | R$ 3,27 | R$ 3,02 | R$ 3,27 | R$ 3,24 | R$ 3,26 | R$ 3,39 | R$ 3,30 | R$ 3,30 | R$ 3,53 | R$ 3,36 | R$ 3,36 | R$ 2,94 | R$ 3,38 | R$ 3,33 | R$ 3,27 | R$ 3,24 | R$ 3,59 | R$ 3,86 | R$ 3,27 | R$ 3,32 | R$ 3,18 | R$ 3,33 | R$ 3,00 | R$ 3,27 | R$ 3,05 | R$ 3,26 |
| Insulina Humana NPH 100 UI/ml - suspensão injetável, refil 3ml (carpule) | 1 (um) refil 3ml | R$ 6,42 | R$ 6,54 | R$ 6,03 | R$ 6,54 | R$ 6,48 | R$ 6,51 | R$ 6,78 | R$ 6,60 | R$ 6,60 | R$ 7,05 | R$ 6,72 | R$ 6,72 | R$ 5,88 | R$ 6,75 | R$ 6,66 | R$ 6,54 | R$ 6,48 | R$ 7,17 | R$ 7,71 | R$ 6,54 | R$ 6,63 | R$ 6,36 | R$ 6,66 | R$ 6,00 | R$ 6,54 | R$ 6,09 | R$ 6,51 |
| Insulina humana NPH 100UI/mL | 1 (um) mililitro | R$ 2,14 | R$ 2,18 | R$ 2,01 | R$ 2,18 | R$ 2,16 | R$ 2,17 | R$ 2,26 | R$ 2,20 | R$ 2,20 | R$ 2,35 | R$ 2,24 | R$ 2,24 | R$ 1,96 | R$ 2,25 | R$ 2,22 | R$ 2,18 | R$ 2,16 | R$ 2,39 | R$ 2,57 | R$ 2,18 | R$ 2,21 | R$ 2,12 | R$ 2,22 | R$ 2,00 | R$ 2,18 | R$ 2,03 | R$ 2,17 |
| Insulina Humana Regular 100 UI/ml, solução injetável, frasco-ampola 10 ml | 1 (um) frasco/ampola 10ml | R$ 21,50 | R$ 21,80 | R$ 19,90 | R$ 22,00 | R$ 21,60 | R$ 21,80 | R$ 22,50 | R$ 22,00 | R$ 22,00 | R$ 23,70 | R$ 22,30 | R$ 22,30 | R$ 19,70 | R$ 22,20 | R$ 21,70 | R$ 21,90 | R$ 21,70 | R$ 23,70 | R$ 25,60 | R$ 21,90 | R$ 22,40 | R$ 21,40 | R$ 22,30 | R$ 20,20 | R$ 21,80 | R$ 20,40 | R$ 21,80 |
| Insulina Humana Regular 100 UI/ml, solução injetável, frasco-ampola 5 ml | 1 (um) frasco/ampola 5ml | R$ 10,75 | R$ 10,90 | R$ 9,95 | R$ 11,00 | R$ 10,80 | R$ 10,90 | R$ 11,25 | R$ 11,00 | R$ 11,00 | R$ 11,85 | R$ 11,15 | R$ 11,15 | R$ 9,85 | R$ 11,10 | R$ 10,85 | R$ 10,95 | R$ 10,85 | R$ 11,85 | R$ 12,80 | R$ 10,95 | R$ 11,20 | R$ 10,70 | R$ 11,15 | R$ 10,10 | R$ 10,90 | R$ 10,20 | R$ 10,90 |
| Insulina humana regular 100UI/mL | 1 (um) mililitro | R$ 2,15 | R$ 2,18 | R$ 1,99 | R$ 2,20 | R$ 2,16 | R$ 2,18 | R$ 2,25 | R$ 2,20 | R$ 2,20 | R$ 2,37 | R$ 2,23 | R$ 2,23 | R$ 1,97 | R$ 2,22 | R$ 2,17 | R$ 2,19 | R$ 2,17 | R$ 2,37 | R$ 2,56 | R$ 2,19 | R$ 2,24 | R$ 2,14 | R$ 2,23 | R$ 2,02 | R$ 2,18 | R$ 2,04 | R$ 2,18 |
| Insulina Humana Regular 100UI/ml, solução injetável, refil 1,5ml (carpules) | 1 (um) refil 1,5ml | R$ 3,23 | R$ 3,27 | R$ 2,99 | R$ 3,30 | R$ 3,24 | R$ 3,27 | R$ 3,38 | R$ 3,30 | R$ 3,30 | R$ 3,56 | R$ 3,35 | R$ 3,35 | R$ 2,96 | R$ 3,33 | R$ 3,26 | R$ 3,29 | R$ 3,26 | R$ 3,56 | R$ 3,84 | R$ 3,29 | R$ 3,36 | R$ 3,21 | R$ 3,35 | R$ 3,03 | R$ 3,27 | R$ 3,06 | R$ 3,27 |
| Insulina Humana Regular 100UI/ml, solução injetável, refil 3ml (carpules) | 1 (um) refil 3ml | R$ 6,45 | R$ 6,54 | R$ 5,97 | R$ 6,60 | R$ 6,48 | R$ 6,54 | R$ 6,75 | R$ 6,60 | R$ 6,60 | R$ 7,11 | R$ 6,69 | R$ 6,69 | R$ 5,91 | R$ 6,66 | R$ 6,51 | R$ 6,57 | R$ 6,51 | R$ 7,11 | R$ 7,68 | R$ 6,57 | R$ 6,72 | R$ 6,42 | R$ 6,69 | R$ 6,06 | R$ 6,54 | R$ 6,12 | R$ 6,54 |
| Asma | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Brometo de Ipratrópio 0,02 mg | 1 (uma) dose | R$ 0,14 | R$ 0,13 | R$ 0,14 | R$ 0,14 | R$ 0,13 | R$ 0,14 | R$ 0,13 | R$ 0,13 | R$ 0,13 | R$ 0,14 | R$ 0,13 | R$ 0,13 | R$ 0,14 | R$ 0,13 | R$ 0,13 | R$ 0,13 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,14 | R$ 0,13 | R$ 0,13 | R$ 0,13 | R$ 0,13 | R$ 0,14 |
| Brometo de Ipratrópio 0,25 mg | 1 (um) mililitro | R$ 0,42 | R$ 0,46 | R$ 0,42 | R$ 0,42 | R$ 0,44 | R$ 0,47 | R$ 0,45 | R$ 0,45 | R$ 0,46 | R$ 0,48 | R$ 0,43 | R$ 0,47 | R$ 0,42 | R$ 0,49 | R$ 0,45 | R$ 0,45 | R$ 0,49 | R$ 0,48 | R$ 0,47 | R$ 0,44 | R$ 0,45 | R$ 0,45 | R$ 0,45 | R$ 0,44 | R$ 0,45 | R$ 0,43 | R$ 0,44 |
| Dipropionato de Beclometasona 200 mcg/cápsula - Administração pulmonar, cápsulas inalantes | 1 (uma) cápsula | R$ 0,35 | R$ 0,35 | R$ 0,34 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,35 | R$ 0,37 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,35 | R$ 0,37 | R$ 0,38 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,35 | R$ 0,36 | R$ 0,35 |
| Dipropionato de Beclometasona 200 mcg/dose - Administração pulmonar, inalador doseado | 1 (uma) dose | R$ 0,35 | R$ 0,35 | R$ 0,34 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,35 | R$ 0,37 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,35 | R$ 0,37 | R$ 0,38 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,36 | R$ 0,35 | R$ 0,35 | R$ 0,36 | R$ 0,35 |
| Diproprionato de Beclometasona 250 mcg | 1 (uma) dose | R$ 0,21 | R$ 0,21 | R$ 0,20 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,22 | R$ 0,21 | R$ 0,21 | R$ 0,22 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,23 | R$ 0,23 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,21 | R$ 0,20 | R$ 0,21 | R$ 0,20 | R$ 0,21 |
| Diproprionato de Beclometasona 50 mcg | 1 (uma) dose | R$ 0,16 | R$ 0,16 | R$ 0,15 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,17 | R$ 0,16 | R$ 0,16 | R$ 0,15 | R$ 0,16 | R$ 0,15 | R$ 0,16 | R$ 0,16 | R$ 0,17 | R$ 0,18 | R$ 0,16 | R$ 0,14 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,16 | R$ 0,15 |
| Sulfato de Salbutamol 100 mcg | 1 (uma) dose | R$ 0,09 | R$ 0,09 | R$ 0,08 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,10 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,10 | R$ 0,10 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 | R$ 0,09 |
| Sulfato de Salbutamol 5 mg | 1 (um) mililitro | R$ 1,55 | R$ 1,56 | R$ 1,50 | R$ 1,56 | R$ 1,56 | R$ 1,56 | R$ 1,55 | R$ 1,56 | R$ 1,56 | R$ 1,60 | R$ 1,56 | R$ 1,56 | R$ 1,61 | R$ 1,56 | R$ 1,57 | R$ 1,56 | R$ 1,56 | R$ 1,63 | R$ 1,64 | R$ 1,56 | R$ 1,56 | R$ 1,54 | R$ 1,56 | R$ 1,53 | R$ 1,56 | R$ 1,54 | R$ 1,56 |
| Contracepção | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Enantato de noretisterona50 mg + valerato de estradiol 5 mg, ampola | 1 (uma) ampola | R$ 14,00 | R$ 14,00 | R$ 13,88 | R$ 13,88 | R$ 14,00 | R$ 13,88 | R$ 13,77 | R$ 13,77 | R$ 13,77 | R$ 13,88 | R$ 13,88 | R$ 13,77 | R$ 13,77 | R$ 14,00 | R$ 13,88 | R$ 13,88 | R$ 14,24 | R$ 14,00 | R$ 14,12 | R$ 14,12 | R$ 13,83 | R$ 13,77 | R$ 13,77 | R$ 13,88 | R$ 14,35 | R$ 13,88 | R$ 13,88 |
| Noretisterona 0,35 mg, comprimido - cartela com 35 comprimidos | 1 (uma) cartela | R$ 7,38 | R$ 7,38 | R$ 7,32 | R$ 7,32 | R$ 7,38 | R$ 7,32 | R$ 7,25 | R$ 7,25 | R$ 7,25 | R$ 7,32 | R$ 7,32 | R$ 7,25 | R$ 7,25 | R$ 7,38 | R$ 7,32 | R$ 7,32 | R$ 7,50 | R$ 7,38 | R$ 7,44 | R$ 7,44 | R$ 7,29 | R$ 7,25 | R$ 7,25 | R$ 7,32 | R$ 7,56 | R$ 7,32 | R$ 7,32 |
| Etinilestradiol 0,03 mg + levonorgestrel 0,15 mg, comprimido - cartela com 21 comprimidos | 1 (uma) cartela | R$ 6,36 | R$ 6,36 | R$ 6,31 | R$ 6,31 | R$ 6,36 | R$ 6,31 | R$ 6,26 | R$ 6,26 | R$ 6,26 | R$ 6,31 | R$ 6,31 | R$ 6,26 | R$ 6,26 | R$ 6,36 | R$ 6,31 | R$ 6,31 | R$ 6,47 | R$ 6,36 | R$ 6,42 | R$ 6,42 | R$ 6,28 | R$ 6,26 | R$ 6,26 | R$ 6,31 | R$ 6,52 | R$ 6,31 | R$ 6,31 |
| Acetato de medroxiprogesterona 150 mg, ampola | 1 (uma) ampola | R$ 18,17 | R$ 18,17 | R$ 18,01 | R$ 18,01 | R$ 18,17 | R$ 18,01 | R$ 17,86 | R$ 17,86 | R$ 17,86 | R$ 18,01 | R$ 18,01 | R$ 17,86 | R$ 17,86 | R$ 18,17 | R$ 18,01 | R$ 18,01 | R$ 18,47 | R$ 18,17 | R$ 18,32 | R$ 18,32 | R$ 17,94 | R$ 17,86 | R$ 17,86 | R$ 18,01 | R$ 18,62 | R$ 18,01 | R$ 18,01 |
| Osteoporose | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Alendronato de Sódio 70 mg | 1 (um) comprimido | R$ 0,68 | R$ 0,68 | R$ 0,68 | R$ 0,68 | R$ 0,68 | R$ 0,68 | R$ 0,67 | R$ 0,67 | R$ 0,67 | R$ 0,68 | R$ 0,68 | R$ 0,67 | R$ 0,67 | R$ 0,68 | R$ 0,68 | R$ 0,68 | R$ 0,69 | R$ 0,68 | R$ 0,69 | R$ 0,69 | R$ 0,67 | R$ 0,67 | R$ 0,67 | R$ 0,68 | R$ 0,70 | R$ 0,68 | R$ 0,68 |
| Dislipidemia | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Sinvastatina 10 mg comprimido | 1 (um) comprimido | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,17 |
| Sinvastatina 20 mg comprimido | 1 (um) comprimido | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,18 | R$ 0,17 | R$ 0,17 |
| Sinvastatina 40 mg comprimido | 1 (um) comprimido | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,29 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,28 | R$ 0,29 | R$ 0,28 | R$ 0,28 |
| Rinite | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Budesonida 32 mcg/dose - Administração tópica nasal doseada | 1 (uma) dose | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,20 | R$ 0,19 | R$ 0,20 | R$ 0,20 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,19 | R$ 0,20 | R$ 0,19 | R$ 0,19 |
| Budesonida 50 mcg/dose - Administração tópica nasal doseada | 1 (uma) dose | R$ 0,33 | R$ 0,33 | R$ 0,32 | R$ 0,32 | R$ 0,33 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,33 | R$ 0,32 | R$ 0,32 | R$ 0,33 | R$ 0,33 | R$ 0,33 | R$ 0,33 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,32 | R$ 0,34 | R$ 0,32 | R$ 0,32 |
| Dipropionato de Beclometasona 50 mcg/dose - Administração tópica nasal doseada | 1 (uma) dose | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 | R$ 0,17 |
| Doença de Parkinson | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Carbidopa 25 mg + Levodopa 250 mg | 1 (um) comprimido | R$ 1,02 | R$ 1,02 | R$ 1,01 | R$ 1,01 | R$ 1,02 | R$ 1,01 | R$ 1,00 | R$ 1,00 | R$ 1,00 | R$ 1,01 | R$ 1,01 | R$ 1,00 | R$ 1,00 | R$ 1,02 | R$ 1,01 | R$ 1,01 | R$ 1,04 | R$ 1,02 | R$ 1,03 | R$ 1,03 | R$ 1,01 | R$ 1,00 | R$ 1,00 | R$ 1,01 | R$ 1,05 | R$ 1,01 | R$ 1,01 |
| Cloridrato de Benserazida 25 mg + Levodopa 100 mg | 1 (um) comprimido | R$ 1,50 | R$ 1,50 | R$ 1,49 | R$ 1,49 | R$ 1,50 | R$ 1,49 | R$ 1,47 | R$ 1,47 | R$ 1,47 | R$ 1,49 | R$ 1,49 | R$ 1,47 | R$ 1,47 | R$ 1,50 | R$ 1,49 | R$ 1,49 | R$ 1,52 | R$ 1,50 | R$ 1,51 | R$ 1,51 | R$ 1,48 | R$ 1,47 | R$ 1,47 | R$ 1,49 | R$ 1,54 | R$ 1,49 | R$ 1,49 |
| Glaucoma | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Maleato de Timolol 0,25% - Solução Oftalmológica | 1 (um) mililitro | R$ 0,98 | R$ 0,98 | R$ 0,97 | R$ 0,97 | R$ 0,98 | R$ 0,97 | R$ 0,96 | R$ 0,96 | R$ 0,96 | R$ 0,97 | R$ 0,97 | R$ 0,96 | R$ 0,96 | R$ 0,98 | R$ 0,97 | R$ 0,97 | R$ 0,99 | R$ 0,98 | R$ 0,98 | R$ 0,98 | R$ 0,96 | R$ 0,96 | R$ 0,96 | R$ 0,97 | R$ 1,00 | R$ 0,97 | R$ 0,97 |
| Maleato de Timolol 0,50% - Solução Oftalmológica | 1 (um) mililitro | R$ 1,18 | R$ 1,18 | R$ 1,17 | R$ 1,17 | R$ 1,18 | R$ 1,17 | R$ 1,16 | R$ 1,16 | R$ 1,16 | R$ 1,17 | R$ 1,17 | R$ 1,16 | R$ 1,16 | R$ 1,18 | R$ 1,17 | R$ 1,17 | R$ 1,20 | R$ 1,18 | R$ 1,19 | R$ 1,19 | R$ 1,17 | R$ 1,16 | R$ 1,16 | R$ 1,17 | R$ 1,21 | R$ 1,17 | R$ 1,17 |
| Dignidade Menstrual | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Absorvente higiênico | 1 (uma) unidade | R$ 0,54 | R$ 0,54 | R$ 0,51 | R$ 0,54 | R$ 0,49 | R$ 0,50 | R$ 0,51 | R$ 0,49 | R$ 0,48 | R$ 0,51 | R$ 0,50 | R$ 0,50 | R$ 0,46 | R$ 0,50 | R$ 0,50 | R$ 0,48 | R$ 0,50 | R$ 0,52 | R$ 0,50 | R$ 0,50 | R$ 0,50 | R$ 0,47 | R$ 0,55 | R$ 0,48 | R$ 0,51 | R$ 0,54 | R$ 0,49 |
(Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
ANEXO 2 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 111/2016, Anexo 2)
ANEXO 2 DO ANEXO LXXVII
ELENCO DO AQUI TEM FARMÁCIA POPULAR - COPAGAMENTO
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
|
||||
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - COPAGAMENTO
(Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
(Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022) |
|||
(Redação dada pela PRT GM/MS nº 3.677 de 29.09.2022)
ANEXO 2 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - COPAGAMENTO
(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
ANEXO 2 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - MODALIDADE COPAGAMENTO
(Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
| INDICAÇÃO | Unidade | ||
| Incontinência | Valor de referência por tira | Valor máximo para pagamento pelo MS | |
| Fralda geriátrica | 1 (uma) unidade | R$ 0,71 | R$ 0,64 |
| Diabetes mellitus associada a Doença cardiovascular | Valor de referência por unidade farmacotécnica | Valor máximo para pagamento pelo MS | |
| Dapagliflozina 10mg | 1 (um) comprimido | R$ 3,20 | R$ 2,88 |
(Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
ANEXO 3 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA (Origem: PRT MS/GM 111/2016, Anexo 3)
ANEXO 3 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
It. |
MEDICAMENTO |
APRESENTAÇÃO |
UNIDADE DE CADASTRO |
PREÇO DE DISPENSAÇÃO (R$) |
1 |
Acetato de medroxiprogesterona |
150 mg/mL |
Ampola |
1,24 |
2 |
Aciclovir |
200 mg/comp |
Comprimido |
0,28 |
3 |
Ácido Acetilsalicílico |
500 mg/comp |
Comprimido |
0,035 |
4 |
Ácido Acetilsalicílico |
100 mg/comp |
Comprimido |
0,03 |
5 |
Ácido Fólico |
5 mg/comp |
Comprimido |
0,054 |
6 |
Albendazol |
400 mg/comp mast |
Comprimido |
0,56 |
7 |
Alendronato de Sódio |
70 mg/comp |
Comprimido |
0,37 |
8 |
Alopurinol |
100 mg/comp |
Comprimido |
0,08 |
9 |
Amiodarona (Cloridrato) |
200 mg/comp |
Comprimido |
0,2 |
10 |
Amitriptilina(Cloridrato) |
25 mg/comp |
Comprimido |
0,22 |
11 |
Amoxicilina |
500 mg/cap |
Cápsula |
0,19 |
12 |
Azitromicina |
500 mg/comp |
Comprimido |
2,64 |
13 |
Benzilpenicilina Benzatina |
1.200.000 UI - pó p/sus. inj. |
Frasco-ampola |
1,5 |
14 |
Benzilpenicilina Procaína+Potássica |
300.000 + 100.000 UI - pó/sus. inj. |
Frasco-ampola |
1,5 |
15 |
Biperideno (Cloridrato) |
2 mg/comp |
Comprimido |
0,073 |
16 |
Carbamazepina |
200 mg/comp |
Comprimido |
0,13 |
17 |
Carbidopa + Levodopa |
25 mg + 250 mg/comp |
Comprimido |
0,48 |
18 |
Cefalexina(Cloridrato ou Sal Sódico) |
500 mg/cap |
Cápsula |
0,4 |
19 |
Ciprofloxacino |
500 mg/comp |
Comprimido |
0,38 |
20 |
Cloreto de Sódio 0,9% |
9 mg/mL - sol. nasal |
Frasco |
0,95 |
21 |
Clorpromazina |
25 mg/comp |
Comprimido |
0,1 |
22 |
Clorpromazina |
100 mg/comp |
Comprimido |
0,125 |
23 |
Dexclorfeniramina(Maleato) |
2 mg/comp |
Comprimido |
0,06 |
24 |
Dexclorfeniramina(Maleato) |
0,4 mg/sol. oral |
Frasco 120 mL |
2,07 |
25 |
Diazepam |
5 mg/comp. sulcado |
Comprimido |
0,04 |
26 |
Diazepam |
10 mg/comp. sulcado |
Comprimido |
0,08 |
27 |
Digoxina |
0,25 mg/comp |
Comprimido |
0,06 |
28 |
Dipirona |
500 mg/mL gts |
Frasco 10 mL |
0,7 |
29 |
Enantato de Noretisterona+Valerato de Estradiol |
50 mg + 5 mg/inj |
Seringa 1 mL |
1,13 |
30 |
Eritromicina (Estolato) |
125 mg/5 mL - susp. oral |
Frasco 60 mL |
2,3 |
31 |
Eritromicina (Estolato) |
500 mg/comp/cap |
Comprimido |
0,54 |
32 |
Etinilestradiol+Levonorgestrel |
0,03 mg + 0,15 mg/comp |
Cartela c/ 21 cápsulas |
0,42 |
33 |
Fenitoína |
100 mg/comp |
Comprimido |
0,1 |
34 |
Fenobarbital |
100 mg/comp |
Comprimido |
0,06 |
35 |
Fluconazol |
100 mg/rev |
Cápsula |
0,95 |
36 |
Fluconazol |
150 mg/rev |
Cápsula |
0,95 |
37 |
Fluoxetina (Cloridrato) |
20 mg/comp |
Comprimido |
0,06 |
38 |
Haloperidol |
1 mg/comp |
Comprimido |
0,08 |
39 |
Haloperidol |
5 mg/comp |
Comprimido |
0,12 |
40 |
Haloperidol |
2 mg/mL - sol. oral |
Frasco 20 mL |
1,94 |
41 |
Ibuprofeno |
300 mg/comp |
Comprimido |
0,16 |
42 |
Levonorgestrel |
0,75 mg/comp |
Comprimido |
3,47 |
43 |
Loratadina |
10 mg/comp |
Comprimido |
0,05 |
44 |
Metoclopramida (Cloridrato) |
10 mg/comp |
Comprimido |
0,04 |
45 |
Metoclopramida (Cloridrato) |
4 mg/mL - sol. oral |
Frasco 10 mL |
0,75 |
46 |
Metronidazol |
250 mg/comp |
Comprimido |
0,1 |
47 |
Miconazol (Nitrato) |
2% - loção |
Frasco 30 mL |
1,86 |
48 |
Miconazol (Nitrato) |
2% - pó |
Frasco 30 mL |
4,95 |
49 |
Mononitrato de Isossorbida |
20 mg/comp |
Comprimido |
0,1 |
50 |
Nistatina |
100.000 UI/mL - susp. oral |
Frasco 30 mL |
3,62 |
51 |
Noretisterona |
0,35 mg/comp |
Cartela c/ 35 comprimidos |
0,5 |
52 |
Omeprazol |
20 mg/cap |
Cápsula |
0,23 |
53 |
Paracetamol |
500 mg/comp |
Comprimido |
0,09 |
54 |
Paracetamol |
200 mg/mL - sol. oral gts |
Frasco 10 mL |
0,85 |
55 |
Paracetamol |
200mg/mL - sol. oral gts |
Frasco 15 mL |
1,27 |
56 |
Prednisona |
20 mg/comp |
Comprimido |
0,18 |
57 |
Prednisona |
5 mg/comp |
Comprimido |
0,08 |
58 |
Prometazina (Cloridrato) |
25 mg/comp |
Comprimido |
0,12 |
59 |
Sais p/ Reidratação Oral |
pó p/sol. oral |
Envelope 27,9 gramas |
0,6 |
60 |
Sinvastatina |
20 mg/comp |
Comprimido |
0,38 |
61 |
Sulfametoxazol + Trimetoprima |
400 mg + 80 mg/comp |
Comprimido |
0,08 |
62 |
Sulfato Ferroso |
40 mg Fe(II)/comp. rev. |
Comprimido |
0,04 |
63 |
Sulfato Ferroso |
25 mg/mL Fe(II) - sol. oral |
Frasco 30 mL |
0,75 |
64 |
Valproato de Sódio |
50 mg/mL - xpe |
Frasco 100 mL |
4,05 |
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 4 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL, DIABETES MELLITUS E ASMA (Origem: PRT MS/GM 111/2016, Anexo 4)
ANEXO 4 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL E DIABETES MELLITUS
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
It. |
MEDICAMENTO |
APRESENTAÇÃO |
UNIDADE DE CADASTRO |
PREÇO DE DISPENSAÇÃO (R$) |
1 |
Atenolol |
25 mg/comp |
Comprimido |
0 |
2 |
Captopril |
25 mg/comp. sulcado |
Comprimido |
0 |
3 |
Enalapril |
10 mg/comp |
Comprimido |
0 |
4 |
Enalapril |
20 mg/comp |
Comprimido |
0 |
5 |
Furosemida |
40 mg/comp |
Comprimido |
0 |
6 |
Glibenclamida |
5 mg/comp |
Comprimido |
0 |
7 |
Hidroclorotiazida |
25 mg/comp |
Comprimido |
0 |
8 |
Losartana |
50 mg/comp |
Comprimido |
0 |
9 |
Metformina |
500 mg/comp |
Comprimido |
0 |
10 |
Metformina |
850 mg/comp |
Comprimido |
0 |
11 |
Metildopa |
250 mg/comp. rev |
Comprimido |
0 |
12 |
Propranolol (Cloridrato) |
40 mg/comp |
Comprimido |
0 |
13 |
Verapamil(Cloridrato) |
80 mg/comp |
Comprimido |
0 |
(Redação dada pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 5 DO ANEXO LXXVII
MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 111/2016, Anexo 5)
MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR

ANEXO 6 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - GRATUIDADE BOLSA FAMÍLIA
(Redação dada pela PRT GM/MS nº 675 de 07.06.2023)
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ANEXO 6 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - MODALIDADE GRATUIDADE BOLSA FAMÍLIA
(Redação dada pela PRT GM/MS n° 4.811 de 04.07.2024)
| INDICAÇÃO | Unidade | Unidade da Federação | ||||||||||||||||||||||||||
| Incontinência | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Fralda geriátrica | 1 (uma) unidade | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 | R$ 2,14 |
| Diabetes mellitus associada a Doença cardiovascular | AC | AL | AM | AP | BA | CE | DF | ES | GO | MA | MG | MS | MT | PA | PB | PE | PI | PR | RJ | RN | RO | RR | RS | SC | SE | SP | TO | |
| Dapagliflozina 10mg | 1 (um) comprimido | R$ 6,40 | R$ 6,40 | R$ 6,35 | R$ 6,35 | R$ 6,40 | R$ 6,35 | R$ 6,30 | R$ 6,30 | R$ 6,30 | R$ 6,35 | R$ 6,35 | R$ 6,30 | R$ 6,30 | R$ 6,40 | R$ 6,35 | R$ 6,35 | R$ 6,51 | R$ 6,40 | R$ 6,46 | R$ 6,46 | R$ 6,32 | R$ 6,30 | R$ 6,30 | R$ 6,35 | R$ 6,56 | R$ 6,35 | R$ 6,35 |
ANEXO 7 DO ANEXO LXXVII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR - DIGNIDADE MENSTRUAL
(Revogado pela PRT GM/MS nº 675 de 07.06.2023)
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Revogado pela PRT GM/MS nº 675 de 07.06.2023)
ANEXO LXXVIII
NORMAS OPERACIONAIS DO PROGRAMA FARMÁCIA POPULAR DO BRASIL (PFPB) (Origem: PRT MS/GM 184/2011)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 1º Aprovar as normas operacionais do Programa Farmácia Popular do Brasil (PFPB), na forma dos Capítulos, Seções e Anexos abaixo. (Origem: PRT MS/GM 184/2011, Art. 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 184/2011, CAPÍTULO I)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 2º O PFPB consiste na disponibilização de medicamentos e/ou correlatos à população, pelo Ministério da Saúde (MS), por meio dos meios descritos abaixo: (Origem: PRT MS/GM 184/2011, Art. 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - a "Rede Própria", constituída por Farmácias Populares, em parceria com os estados, Distrito Federal, municípios e hospitais filantrópicos; e (Origem: PRT MS/GM 184/2011, Art. 2º, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - o "Aqui Tem Farmácia Popular", constituído por meio de convênios com a rede privada de farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 2º, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 3º Na "Rede Própria", a Fundação Oswaldo Cruz (FIOCRUZ) será a executora das ações inerentes à aquisição, estocagem, comercialização e dispensação dos medicamentos, podendo para tanto firmar convênios com a União, estados, Distrito Federal, municípios e instituições, sob a supervisão direta e imediata do Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 3º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 4º No "Aqui tem Farmácia Popular" a operacionalização do PFPB ocorrerá diretamente entre o Ministério da Saúde e a rede privada de farmácias e drogarias, mediante relação contratual regida pela Lei nº 8.666, de 21 de junho de 1993. (Origem: PRT MS/GM 184/2011, Art. 4º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 5º O elenco de medicamentos e/ou correlatos disponibilizados no âmbito do PFPB, bem como seus valores de referência e preços de dispensação, encontram-se previstos nos Anexos 1, 2, 3, 4 e 5 do Anexo LXXVIII . (Origem: PRT MS/GM 184/2011, Art. 5º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 6º No "Aqui Tem Farmácia Popular" e na "Rede Própria" os medicamentos definidos para o tratamento da hipertensão arterial e/ou diabetes mellitus serão gratuitos aos usuários. (Origem: PRT MS/GM 184/2011, Art. 6º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. Quando os medicamentos para hipertensão arterial e diabetes mellitus forem comercializados com preço de venda menor que o valor de referência definido, o Ministério da Saúde pagará aos estabelecimentos credenciados no "Aqui tem Farmácia Popular" 100% (cem por cento) do valor de venda. (Origem: PRT MS/GM 184/2011, Art. 6º, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 7º Na "Rede Própria" a dispensação dos medicamentos e/ou correlato ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação estabelecidos. (Origem: PRT MS/GM 184/2011, Art. 7º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 8º No "Aqui Tem Farmácia Popular" o MS pagará até 90% (noventa por cento) do valor de referência estabelecido aos demais medicamentos e/ou correlato, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo Ministério da Saúde e o Preço de Venda. (Origem: PRT MS/GM 184/2011, Art. 8º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 9º Para efeitos desta norma consideram-se as seguintes definições: (Origem: PRT MS/GM 184/2011, Art. 9º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - concentrador: empresa terceirizada que já possui a comunicação com o sistema de vendas do Programa e irá prover os serviços, a qual é contratada pelas farmácias e drogarias da rede privada; (Origem: PRT MS/GM 184/2011, Art. 9º, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - medicamento: produto farmacêutico, tecnicamente obtido ou elaborado, que contém um ou mais fármacos juntamente com outras substâncias, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico; (Origem: PRT MS/GM 184/2011, Art. 9º, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - correlato: a substância, produto, aparelho ou acessório não enquadrado nos conceitos de droga, medicamento ou insumo farmacêutico, cujo uso ou aplicação esteja ligado à defesa e proteção da saúde individual ou coletiva, à higiene pessoal ou de ambientes, ou a fins diagnósticos e analíticos, os cosméticos e perfumes, e, ainda, os produtos dietéticos, óticos, de acústica médica, odontológicos e veterinários; (Origem: PRT MS/GM 184/2011, Art. 9º, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - cupom fiscal: documento fiscal emitido em bobina de papel nas operações realizadas pelo equipamento fiscal; (Origem: PRT MS/GM 184/2011, Art. 9º, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - cupom vinculado: documento não-fiscal emitido em bobina de papel nas operações realizadas pelo equipamento fiscal que contém as informações normatizadas referentes as vendas realizadas pelo Programa; (Origem: PRT MS/GM 184/2011, Art. 9º, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - Denominação Comum Brasileira (DCB): denominação do fármaco ou princípio farmacologicamente ativo aprovada pelo órgão federal responsável pela vigilância sanitária; (Origem: PRT MS/GM 184/2011, Art. 9º, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - princípio ativo: substância quimicamente caracterizada, cuja ação farmacológica é conhecida e responsável total ou parcialmente pelos efeitos terapêuticos do medicamento; (Origem: PRT MS/GM 184/2011, Art. 9º, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - unidade de produto (up): fração unitária corresponde a uma unidade farmacotécnica do medicamento ou a fração unitária de produtos correlatos; (Origem: PRT MS/GM 184/2011, Art. 9º, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IX - valor de referência (vr): preço referencial fixado pelo Ministério da Saúde para cada princípio ativo e correlato constante do Programa e definido para cada unidade de produto (up); (Origem: PRT MS/GM 184/2011, Art. 9º, IX) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
X - preço de dispensação - rede própria (pd-rp): valor do medicamento e correlato fixado para as farmácias da rede própria do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 9º, X) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XI - preço de venda - Aqui Tem (pv-at): valor do medicamento e correlato praticado pelas farmácias e drogarias no ato da venda ao paciente, inclusive com eventuais descontos. (Origem: PRT MS/GM 184/2011, Art. 9º, XI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
CAPÍTULO II
DAS NORMAS DE OPERAÇÃO E FUNCIONAMENTO DO AQUI TEM FARMÁCIA POPULAR
(Origem: PRT MS/GM 184/2011, CAPÍTULO II)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção I
DA FINALIDADE
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção I)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 10. O Programa Farmácia Popular do Brasil - Aqui Tem Farmácia Popular tem por objetivo disponibilizar à população por meio da rede privada de farmácias e drogarias os medicamentos e correlatos previamente definidos pelo Ministério da Saúde, nos termos do Anexo 2 do Anexo LXXVIII . (Origem: PRT MS/GM 184/2011, Art. 10) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 11. O MS pagará até 90% (noventa por cento) do valor de referência estabelecido, sendo obrigatório o pagamento pelo paciente da diferença entre o percentual pago pelo MS e o Preço de Venda do medicamento e/ou correlato adquirido. (Origem: PRT MS/GM 184/2011, Art. 11) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 12. Nos casos em que o medicamento e/ou correlato forem comercializados com o preço de venda menor do que o valor de referência definido no Anexo 2 do Anexo LXXVIII , o Ministério da Saúde pagará 90% (noventa por cento) do preço de venda e o paciente a diferença. (Origem: PRT MS/GM 184/2011, Art. 12) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 13. Para o tratamento de hipertensão arterial e/ou diabetes mellitus o Ministério da Saúde pagará 100% (cem por cento) do valor de referência, não cabendo ao usuário o pagamento de qualquer complementação. (Origem: PRT MS/GM 184/2011, Art. 13) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. Quando os medicamentos para hipertensão arterial e diabetes mellitus forem comercializados com preço de venda menor que o valor de referência definido no Anexo 1 do Anexo LXXVIII , o Ministério da Saúde pagará 100% do valor de venda. (Origem: PRT MS/GM 184/2011, Art. 13, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção II
DA ADESÃO AO PROGRAMA
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção II)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 14. Poderão participar do PFPB as farmácias e drogarias que atenderem aos seguintes critérios: (Origem: PRT MS/GM 184/2011, Art. 14) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - requerimento e termo de adesão assinados pelo representante legal da empresa; (Origem: PRT MS/GM 184/2011, Art. 14, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - ficha cadastral preenchida; (Origem: PRT MS/GM 184/2011, Art. 14, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - inscrição no Cadastro Nacional de Pessoas Jurídicas (CNPJ), da Secretaria de Receita Federal do Brasil; (Origem: PRT MS/GM 184/2011, Art. 14, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - registro na junta comercial; (Origem: PRT MS/GM 184/2011, Art. 14, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - autorização de funcionamento emitida pela Agência Nacional de Vigilância Sanitária (ANVISA), ativa e válida, nos termos da Resolução da Diretoria Colegiada (RDC) nº 238, de 27 de dezembro de 2001, ou licença de funcionamento expedida pelo órgão de vigilância sanitária local, regional ou estadual; (Origem: PRT MS/GM 184/2011, Art. 14, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - farmacêutico responsável técnico com Certificado de Regularidade Técnica (CRT) válido e emitido pelo Conselho Regional de Farmácia (CRF); (Origem: PRT MS/GM 184/2011, Art. 14, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - situação de regularidade com a Previdência Social; (Origem: PRT MS/GM 184/2011, Art. 14, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - dispor de equipamento eletrônico habilitado para emissão de cupom fiscal e vinculado para processamento das operações eletrônicas do Programa, conforme detalhamento constante na Seção VII do Capítulo II; (Origem: PRT MS/GM 184/2011, Art. 14, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IX - dispor de sistema de gerenciamento eletrônico capaz de realizar requisições eletrônicas, por meio de interface web; e (Origem: PRT MS/GM 184/2011, Art. 14, IX) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
X - pessoal treinado para atuar no PFPB, de acordo com as normas e procedimentos estabelecidos. (Origem: PRT MS/GM 184/2011, Art. 14, X) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º Ressalvado o disposto no inciso VI deste artigo, é dispensável, para a habilitação, a satisfação das exigências previstas nos arts. 28 a 31 da Lei nº 8.666, de 21 de junho de 1993, por força do disposto em seu art. 32, § 1º. (Origem: PRT MS/GM 184/2011, Art. 14, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Não poderão ser credenciadas novas filiais no programa, cuja matriz esteja passando por processo de auditoria no Departamento Nacional de Auditoria do SUS (DENASUS). (Origem: PRT MS/GM 184/2011, Art. 14, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 15. Após a análise dos documentos, a adesão das farmácias e drogarias ao Programa será autorizada pelo MS, por meio do Departamento de Assistência Farmacêutica e Insumos Estratégicos, da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (DAF/SCTIE/MS), desde que atendidos os seguintes atos: (Origem: PRT MS/GM 184/2011, Art. 15) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - publicação no Diário Oficial da União (DOU); e (Origem: PRT MS/GM 184/2011, Art. 15, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - disponibilização de login e senha para o representante legal das farmácias e drogarias e login e senha para os atendentes para acesso ao Sistema Eletrônico de Autorização de Dispensação de Medicamentos e Correlatos (ADM). (Origem: PRT MS/GM 184/2011, Art. 15, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 16. O login e senha provisórios e definitivos a serem utilizados nas transações do Programa serão enviados para o correio eletrônico indicado pelo estabelecimento credenciado em seu cadastro. (Origem: PRT MS/GM 184/2011, Art. 16) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º Após a publicação da adesão e o cadastro no sistema, o estabelecimento receberá automaticamente um login e senha provisórias que para realizar testes de homologação de conexão entre o seu sistema eletrônico adotado e o Sistema Autorizador do Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 16, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Após a conclusão dos testes de homologação, o estabelecimento deverá solicitar ao Ministério da Saúde o envio da senha e login definitivos para acesso ao ambiente de produção do Sistema Autorizador. (Origem: PRT MS/GM 184/2011, Art. 16, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º A senha definitiva permitirá, além da realização das transações de venda, o acesso ao link disponível em http://www.saude.gov.br/aquitemfarmaciapopular. (Origem: PRT MS/GM 184/2011, Art. 16, § 3º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 17. A(s) senha(s) de acesso ao Sistema Autorizador é exclusiva do estabelecimento, sendo que o seu representante legal assume inteira responsabilidade pelo seu uso de acordo com as normas do Programa. (Origem: PRT MS/GM 184/2011, Art. 17) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 18. O estabelecimento credenciado poderá optar por conexão direta ou conexão indireta por meio de terceiros, no caso, concentrador, permanecendo, ainda assim, de inteira responsabilidade do estabelecimento credenciado o cumprimento de todas as normas do Programa. (Origem: PRT MS/GM 184/2011, Art. 18) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º No caso de opção por conexão indireta, as farmácias e drogarias deverão informar, obrigatoriamente, no ato do cadastro, o CNPJ do concentrador. (Origem: PRT MS/GM 184/2011, Art. 18, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Os concentradores ficam igualmente sujeitos ao cumprimento das regras estabelecidas para o Programa, podendo ser penalizados com o bloqueio da conexão ao sistema de vendas DATASUS. (Origem: PRT MS/GM 184/2011, Art. 18, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 19. A publicação de que trata o art. 15, I configura a relação contratual estabelecida entre o Ministério da Saúde e a empresa, a qual será regida na forma da Lei nº 8.666, de 1993. (Origem: PRT MS/GM 184/2011, Art. 19) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 20. O Requerimento do Termo de Adesão (RTA) terá validade até o dia 30 (trinta) de abril de cada ano. (Origem: PRT MS/GM 184/2011, Art. 20) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º A renovação do RTA não será automática. (Origem: PRT MS/GM 184/2011, Art. 20, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º As farmácias e drogarias que não efetuarem a renovação no prazo estipulado terão a conexão com o sistema de vendas DATASUS bloqueado até sua regularização. (Origem: PRT MS/GM 184/2011, Art. 20, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção III
DA AUTORIZAÇÃO DE COMERCIALIZAÇÃO E DA DISPENSAÇÃO DOS MEDICAMENTOS E CORRELATOS
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção III)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 21. A Autorização de Dispensação de Medicamentos e Correlatos (ADM) será processada por meio eletrônico, em tempo real, com base no código de barras EAN da embalagem do medicamento e/ou do correlato. (Origem: PRT MS/GM 184/2011, Art. 21) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 22. As ADMs serão validadas pelo Ministério da Saúde quando contiverem todas as informações indicadas na Seção VII do Capítulo II, desde que atendidos todos os critérios do PFPB. (Origem: PRT MS/GM 184/2011, Art. 22) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 23. A cada operação, obrigatoriamente, o estabelecimento deve emitir duas vias do cupom fiscal e do cupom vinculado. (Origem: PRT MS/GM 184/2011, Art. 23) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 24. O cupom vinculado, obrigatoriamente, deverá conter as seguintes informações, conforme modelo sugerido no Anexo 5 do Anexo LXXVIII : (Origem: PRT MS/GM 184/2011, Art. 24) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - nome completo do beneficiário ou seu representante legal, por extenso; (Origem: PRT MS/GM 184/2011, Art. 24, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - número do Cadastro de Pessoas Físicas (CPF) do beneficiário ou seu representante legal; (Origem: PRT MS/GM 184/2011, Art. 24, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - assinatura do beneficiário ou seu representante legal; (Origem: PRT MS/GM 184/2011, Art. 24, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - endereço do beneficiário ou espaço para preenchimento; (Origem: PRT MS/GM 184/2011, Art. 24, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - razão social e CNPJ da empresa; (Origem: PRT MS/GM 184/2011, Art. 24, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - nome do responsável legal da empresa; (Origem: PRT MS/GM 184/2011, Art. 24, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - número de autorização do DATASUS; (Origem: PRT MS/GM 184/2011, Art. 24, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - UF e Número de inscrição do médico no Conselho Regional de Medicina (CRM); (Origem: PRT MS/GM 184/2011, Art. 24, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IX - valor total da venda, do subsídio do MS, da parcela a ser paga pelo beneficiário e do custo-zero dos medicamentos para hipertensão arterial e diabetes melittus; (Origem: PRT MS/GM 184/2011, Art. 24, IX) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
X - data da compra; (Origem: PRT MS/GM 184/2011, Art. 24, X) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XI - nome do medicamento, apresentação e/ou correlato; (Origem: PRT MS/GM 184/2011, Art. 24, XI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XII - código de barras do medicamento e/ou correlato; (Origem: PRT MS/GM 184/2011, Art. 24, XII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XIII - posologia diária ou prescrição diária; (Origem: PRT MS/GM 184/2011, Art. 24, XIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XIV - quantidade autorizada; (Origem: PRT MS/GM 184/2011, Art. 24, XIV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XV - saldo atual (conforme posologia ou prescrição diária); (Origem: PRT MS/GM 184/2011, Art. 24, XV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XVI - data da próxima compra; (Origem: PRT MS/GM 184/2011, Art. 24, XVI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XVII - identificação do operador da transação; e (Origem: PRT MS/GM 184/2011, Art. 24, XVII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XVIII - número da Ouvidoria do Ministério da Saúde para consultas ou denúncias (0800 61 136). (Origem: PRT MS/GM 184/2011, Art. 24, XVIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 25. O paciente, obrigatoriamente, deve assinar o cupom vinculado, sendo que uma via deve ser mantida pelo estabelecimento e a outra entregue ao paciente. (Origem: PRT MS/GM 184/2011, Art. 25) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 26. O estabelecimento deve manter por 5 (cinco) anos as vias assinadas dos cupons vinculados e cupons fiscais arquivadas em ordem cronológica de emissão, que deverão ser disponibilizados sempre que necessário. (Origem: PRT MS/GM 184/2011, Art. 26) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 27. Para a comercialização e a dispensação dos medicamentos e/ou correlatos no âmbito do PFPB, as farmácias e drogarias devem obrigatoriamente observar as seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 27) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - apresentação pelo paciente, de documento no qual conste o seu número de CPF, e sua fotografia; (Origem: PRT MS/GM 184/2011, Art. 27, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - apresentação de prescrição médica, no caso de medicamentos, ou prescrição, laudo ou atestado médico, no caso de correlatos, com as seguintes informações: (Origem: PRT MS/GM 184/2011, Art. 27, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
a) número de inscrição do médico no CRM, assinatura e carimbo médico e endereço do consultório; (Origem: PRT MS/GM 184/2011, Art. 27, II, a) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
b) data da expedição da prescrição médica; e (Origem: PRT MS/GM 184/2011, Art. 27, II, b) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
c) nome e endereço residencial do paciente. (Origem: PRT MS/GM 184/2011, Art. 27, II, c) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º As farmácias e drogarias deverão providenciar uma cópia da prescrição, laudo ou atestado médico apresentado pelo paciente no ato da compra e mantê-la por 5 (cinco) anos para apresentação sempre que for solicitado. (Origem: PRT MS/GM 184/2011, Art. 27, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Caberá as farmácias e drogarias manter por um prazo de 5 (cinco) anos para apresentação, sempre que necessário, as notas fiscais de aquisição dos medicamentos e/ou correlatos do PFPB junto aos fornecedores. (Origem: PRT MS/GM 184/2011, Art. 27, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 28. Para os medicamentos do Programa, as prescrições terão validade de 120 (cento e vinte) dias, a partir de sua emissão, exceto para os contraceptivos, cuja validade é de 12 (doze) meses. (Origem: PRT MS/GM 184/2011, Art. 28) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. As vendas posteriores aos períodos fixados no caput deste artigo devem necessariamente ser realizadas mediante a apresentação de nova prescrição. (Origem: PRT MS/GM 184/2011, Art. 28, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 29. O quantitativo do medicamento solicitado deve corresponder à posologia mensal compatível com os consensos de tratamento da doença para o qual é indicado e a dispensação deve obedecer os limites definidos pelo Programa. (Origem: PRT MS/GM 184/2011, Art. 29) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º Nos casos das prescrições que ultrapassam a quantidade mensal estabelecida, o interessado deverá enviar ao DAF/SCTIE/MS, a receita contendo os dados do usuário (nome, endereço e CPF) juntamente com um relatório feito pelo médico, classificando a patologia com o seu CID, justificando dessa forma a prescrição. (Origem: PRT MS/GM 184/2011, Art. 29, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º A autorização para a dispensação de medicamentos que ultrapassar a quantidade mensal (extra-teto) terá validade de 120 (cento e vinte) dias, podendo ser renovada por meio do envio da documentação atualizada ao Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 29, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 30. Para a comercialização de Fralda Geriátrica no âmbito do PFPB, as farmácias e drogarias obrigatoriamente devem observar as seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 30) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - disponibilizar fraldas geriátricas para incontinência de produtores que cumpram os requisitos técnicos estabelecidos pela Portaria nº 1480/GM/MS, de 31 de dezembro de 1990, e nº 10/RDC/ANVISA, de 21 de outubro de 1999; (Origem: PRT MS/GM 184/2011, Art. 30, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - para a dispensação de fraldas geriátricas para incontinência, o paciente deverá ter idade igual ou superior a 60 (sessenta) anos; e (Origem: PRT MS/GM 184/2011, Art. 30, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - apresentação, pelo paciente, de documento no qual conste seu número de CPF, e sua fotografia. (Origem: PRT MS/GM 184/2011, Art. 30, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 31. Para as Fraldas Geriátricas do PFPB, as prescrições, laudos ou atestados médicos terão validade de 120 (cento e vinte) dias, a partir de sua emissão, podendo a retirada ocorrer a cada 10 (dez) dias, ficando limitado a 4 (quatro) unidades/dia de fralda. (Origem: PRT MS/GM 184/2011, Art. 31) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. As vendas posteriores ao período fixado no caput deste artigo devem necessariamente ser realizadas mediante a apresentação de nova prescrição/laudo/atestado médico. (Origem: PRT MS/GM 184/2011, Art. 31, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 32. Fica dispensada a obrigatoriedade da presença física do paciente, titular da prescrição, laudo ou atestado médico, quando se enquadrar nas seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 32) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - incapacidade nos termos dos art. 3º e 4º do Código Civil, desde que comprovado; e (Origem: PRT MS/GM 184/2011, Art. 32, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - pessoas idosas, com idade igual ou superior a 60 (sessenta) anos. (Origem: PRT MS/GM 184/2011, Art. 32, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º A dispensação dos medicamentos e/ou correlatos, nos casos previstos no art. 32, incisos I e II do Anexo LXXVIII , somente será realizada mediante apresentação dos seguintes documentos: (Origem: PRT MS/GM 184/2011, Art. 32, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - do paciente, titular da receita; CPF, RG ou certidão de nascimento; e (Origem: PRT MS/GM 184/2011, Art. 32, § 1º, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - do representante legal, o qual assumirá, juntamente com o estabelecimento, as responsabilidades pela efetivação da transação: CPF e RG. (Origem: PRT MS/GM 184/2011, Art. 32, § 1º, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Considera-se representante legal aquele que for: (Origem: PRT MS/GM 184/2011, Art. 32, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - declarado por sentença judicial; (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - portador de instrumento público de procuração que outorgue plenos poderes ou poderes específicos para aquisição de medicamentos e/ou correlatos junto ao programa; (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - portador de instrumento particular de procuração com reconhecimento de firma, que autorize a compra de medicamentos e/ou correlatos junto ao programa; e (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - portador de identidade civil que comprove a dependência do menor de idade, titular da receita médica. (Origem: PRT MS/GM 184/2011, Art. 32, § 2º, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º As farmácias e drogarias deverão providenciar uma cópia da documentação prevista no § 1º e § 2º deste artigo no ato da compra e mantê-la por 5 (cinco) anos para apresentação sempre que for solicitada. (Origem: PRT MS/GM 184/2011, Art. 32, § 3º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 4º Aos usuários comprovadamente analfabetos, será aceita a digital no Cupom Vinculado, desde que o próprio paciente compareça ao estabelecimento credenciado para a aquisição dos medicamentos e/ou correlatos do PFPB, devendo uma cópia do RG do paciente ser providenciada pelo estabelecimento e arquivada por 5 (cinco) anos. (Origem: PRT MS/GM 184/2011, Art. 32, § 4º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção IV
DO PAGAMENTO PELO MINISTÉRIO DA SAÚDE
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção IV)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 33. O Ministério da Saúde efetuará os pagamentos para as farmácias e drogarias credenciados no mês subsequente, após o processamento das Autorizações de Dispensação de Medicamentos e Correlatos (ADM), validadas no mês anterior. (Origem: PRT MS/GM 184/2011, Art. 33) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 34. Para estabelecimentos matriz e filiais, os valores devidos serão agrupados e os pagamentos serão efetuados exclusivamente para a empresa matriz. (Origem: PRT MS/GM 184/2011, Art. 34) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 35. Os pagamentos serão efetuados em contas específicas abertas pelo Fundo Nacional de Saúde nos valores atestados pelo Diretor do DAF/SCTIE/MS, e observadas as normas próprias da administração financeira pública. (Origem: PRT MS/GM 184/2011, Art. 35) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 36. O atesto dos pagamentos terá por base as informações geradas pelo Sistema Autorizador DATASUS. (Origem: PRT MS/GM 184/2011, Art. 36) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 37. Para fins de verificação pelo estabelecimento credenciado, estará disponível em http://www.saude.gov.br/aquitemfarmaciapopular, os relatórios das transações realizadas, bem como as transações rejeitadas no processamento. (Origem: PRT MS/GM 184/2011, Art. 37) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção V
DA IDENTIDADE VISUAL E DA PUBLICIDADE DO PROGRAMA
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção V)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 38. As farmácias e drogarias credenciadas deverão obrigatoriamente exibir em seus estabelecimentos peças publicitárias que identifiquem o credenciamento ao PFPB, indicadas a seguir: (Origem: PRT MS/GM 184/2011, Art. 38) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - adesivo anti-falsificação fornecido pelo MS, sendo proibido sua reprodução, e que deverá ser utilizado próximo ao caixa de pagamento; (Origem: PRT MS/GM 184/2011, Art. 38, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - banner produzido pelo estabelecimento credenciado de acordo com as normas de publicidade do PFPB, a ser afixado na frente do estabelecimento credenciado; e (Origem: PRT MS/GM 184/2011, Art. 38, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - tabela contendo os valores de referência contidos nos Anexos 1 e 2 do Anexo LXXVIII , disponível em http://www.saude.gov.br/aquitemfarmaciapopular. (Origem: PRT MS/GM 184/2011, Art. 38, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º A logomarca do "Aqui Tem Farmácia Popular" não pode ser alterada e é obrigatório o uso do slogan ou marca do Governo Federal, vinculada à logomarca, bem como a inscrição do "Ministério da Saúde". (Origem: PRT MS/GM 184/2011, Art. 38, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º É proibida a publicidade em domicílio de paciente ou o uso do nome do PFPB e das peças publicitárias fornecidas pelo Ministério da Saúde em qualquer tipo de manifestação diversa das previstas neste Anexo. (Origem: PRT MS/GM 184/2011, Art. 38, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º Não é permitido vincular o PFPB a outras marcas, promoções e/ou demais produtos do estabelecimento credenciado. (Origem: PRT MS/GM 184/2011, Art. 38, § 3º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 39. Os estabelecimentos habilitados somente poderão utilizar material publicitário e fazer campanha publicitária quando iniciar as vendas, seguindo as diretrizes definidas pelo Ministério da Saúde no Manual de Diretrizes para Aplicação em Peças Publicitárias específico do Programa, disponível em http://www.saude.gov.br/aquitemfarmaciapopular. (Origem: PRT MS/GM 184/2011, Art. 39) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 40. Não é permitido às farmácias e drogarias não-credenciadas, descredenciadas ou apenas "em fase de credenciamento" exibirem publicidade referente ao PFPB, uma vez que somente o processo de credenciamento não garante que o mesmo será aprovado. (Origem: PRT MS/GM 184/2011, Art. 40) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 41. O não-cumprimento das normas de publicidade do PFPB sujeitará o estabelecimento às penalidades previstas na Seção VI do Capítulo II. (Origem: PRT MS/GM 184/2011, Art. 41) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção VI
DO CONTROLE, DO MONITORAMENTO E DAS PENALIDADES
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção VI)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 42. As transações das empresas serão verificadas mensalmente, ou quando houver necessidade, segundo os dados processados pelo Sistema Autorizador de Vendas, para controle e monitoramento do Programa. (Origem: PRT MS/GM 184/2011, Art. 42) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 43. O Ministério da Saúde solicitará ao estabelecimento credenciado, sempre que necessário, a prestação de informações detalhadas sobre as suas operações, cópia das prescrições, laudos ou atestados médicos, das notas fiscais, dos cupons fiscais e vinculados, amostra de material publicitário e demais documentos comprobatórios das autorizações realizadas, as quais deverão ser encaminhadas no prazo máximo de 10 (dez) dias. (Origem: PRT MS/GM 184/2011, Art. 43) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 44. O descumprimento de qualquer das regras dispostas neste Anexo e nos Anexos 1, 2, 3, 4 e 5 do Anexo LXXVIII pelas farmácias e drogarias caracteriza prática de irregularidade no âmbito do PFPB, sendo consideradas situações irregulares, dentre outras: (Origem: PRT MS/GM 184/2011, Art. 44) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - comercializar e dispensar medicamentos e/ou correlatos fora da estrita observância das regras de execução do PFPB, dispostas neste Anexo; (Origem: PRT MS/GM 184/2011, Art. 44, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - deixar de exigir a prescrição, laudo ou atestado médico, a apresentação do CPF e a assinatura do titular do CPF no cupom vinculado; (Origem: PRT MS/GM 184/2011, Art. 44, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - deixar de cobrar do paciente o pagamento da sua parcela referente à compra do(s) medicamento(s) e/ou correlato(s), salvo para as dispensações de medicamentos indicados para hipertensão arterial e diabetes mellitus que poderá atingir até 100% (cem por cento) do vr; (Origem: PRT MS/GM 184/2011, Art. 44, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - comercializar e dispensar medicamentos e/ou correlatos do Programa em nome de terceiros, conforme disposto no art. 32; (Origem: PRT MS/GM 184/2011, Art. 44, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - estornar a venda cancelada ou irregular, com prazo superior a 7 (sete) dias da consolidação da transação; (Origem: PRT MS/GM 184/2011, Art. 44, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - comercializar medicamentos e correlatos com senha diversa daquela que foi conferida exclusivamente ao estabelecimento credenciado; (Origem: PRT MS/GM 184/2011, Art. 44, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - firmar convênios e parcerias com empresas, cooperativas e instituições congêneres para operações coletivas no âmbito do PFPB; (Origem: PRT MS/GM 184/2011, Art. 44, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - fazer uso publicitário do PFPB fora das regras definidas neste Anexo; (Origem: PRT MS/GM 184/2011, Art. 44, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IX - deixar de expor as peças publicitárias que identifiquem o credenciamento ao PFPB, estabelecidas no art. 38; (Origem: PRT MS/GM 184/2011, Art. 44, IX) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
X - cadastrar pacientes em nome do PFPB fora do estabelecimento, especialmente, em domicílio; (Origem: PRT MS/GM 184/2011, Art. 44, X) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XI - entregar medicamentos e/ou correlatos do PFPB fora do estabelecimento, especialmente em domicílio, uma vez que a venda exige a presença do paciente no estabelecimento, munido dos documentos necessários; (Origem: PRT MS/GM 184/2011, Art. 44, XI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XII - deixar de observar as regras do órgão de vigilância sanitária para funcionamento do estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 44, XII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XIII - permitir que pessoa distinta do titular da receita ou seu procurador legal assine em nome do paciente, o que poderá caracterizar falsidade ideológica; (Origem: PRT MS/GM 184/2011, Art. 44, XIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XIV - rasurar quaisquer documentos necessários para a validação da venda dos itens constantes do elenco do programa; (Origem: PRT MS/GM 184/2011, Art. 44, XIV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XV - receber a prescrição, laudo ou atestado médico com data posterior a autorização consolidada; (Origem: PRT MS/GM 184/2011, Art. 44, XV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XVI - lançar no sistema de vendas do programa, informações divergentes das constantes na prescrição, laudo ou atestado médico e no documento do paciente; (Origem: PRT MS/GM 184/2011, Art. 44, XVI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XVII - dispensar medicamentos e/ou correlatos cuja prescrição, laudo ou atestado médico que já tiverem sido dispensados ou fornecidos, cuja comprovação se dê por meio da presença de carimbo com a inscrição fornecido; e (Origem: PRT MS/GM 184/2011, Art. 44, XVII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XVIII - realizar a substituição do medicamento prescrito em desacordo com a legislação vigente. (Origem: PRT MS/GM 184/2011, Art. 44, XVIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. O DAF/SCTIE/MS poderá, a qualquer tempo, requisitar os documentos que comprovam a regularidade das farmácias e drogarias junto ao órgão de vigilância sanitária. (Origem: PRT MS/GM 184/2011, Art. 44, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 45. O DAF/SCTIE/MS suspenderá preventivamente os pagamentos e/ou a conexão com os Sistemas DATASUS sempre que detectar indícios ou notícias de irregularidade(s) na execução do PFPB pelos estabelecimentos. (Origem: PRT MS/GM 184/2011, Art. 45) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º A empresa com suspeita de prática irregular será notificada pelo DAF/SCTIE/MS a apresentar, no prazo de 15 (quinze) dias, esclarecimentos e documentos sobre os fatos averiguados. (Origem: PRT MS/GM 184/2011, Art. 45, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Com base na documentação apresentada pelo estabelecimento e não sanadas os indícios ou notícias de irregularidades, o DAF/SCTIE/MS solicitará ao DENASUS a instauração de procedimento para averiguação dos fatos. (Origem: PRT MS/GM 184/2011, Art. 45, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º Em casos excepcionais, o DAF/SCTIE/MS poderá solicitar ao DENASUS a instauração de procedimento para averiguação dos fatos, antes que seja oportunizado à empresa um prazo para apresentar esclarecimentos. (Origem: PRT MS/GM 184/2011, Art. 45, § 3º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 46. Recebido o relatório conclusivo do procedimento instaurado pelo DENASUS, o DAF/SCTIE/MS, no prazo de 15 (quinze) dias, decidirá sobre o descredenciamento do estabelecimento, sem prejuízo da imposição das penalidades previstas no art. 87 da Lei nº 8.666, de 1993. (Origem: PRT MS/GM 184/2011, Art. 46) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. O DAF/SCTIE/MS poderá, ainda, caso julgar cabível, encaminhar o relatório conclusivo dos trabalhos do DENASUS à Policia Federal e ao Ministério Público para a adoção das providências pertinentes, tendo em vista a atuação desses órgãos na apuração das infrações penais em detrimento de bens, serviços e interesses da União. (Origem: PRT MS/GM 184/2011, Art. 46, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 47. Decidido pelo cancelamento, o estabelecimento será notificado para recolher aos cofres públicos o débito correspondente ao valor repassado pelo Ministério da Saúde nas transações consideradas irregulares, no prazo de 15 (quinze) dias, sem prejuízo da multa prevista no art. 49. (Origem: PRT MS/GM 184/2011, Art. 47) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º Caso o valor não seja recolhido no prazo fixado no caput, será instaurada Tomada de Contas Especial pelo Ministério da Saúde. (Origem: PRT MS/GM 184/2011, Art. 47, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Em conformidade com os ditames da Lei nº 10.522, de 19 de julho de 2002, será realizada a inscrição do nome da empresa no Cadastro Informativo de Créditos não Quitados do Setor Público Federal (CADIN), sem prejuízo do ajuizamento da pertinente ação de cobrança pela Procuradoria da Fazenda Nacional. (Origem: PRT MS/GM 184/2011, Art. 47, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 48. Ao estabelecimento com decisão de cancelamento definitivo que pretender pleitear a liquidação de eventual competência pendente caberá apresentar requerimentos por escrito ao DAF/SCTIE/MS, no prazo de 15 (quinze) dias, a contar da publicação de cancelamento. (Origem: PRT MS/GM 184/2011, Art. 48) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. Recebido o requerimento, o DAF/SCTIE/MS solicitará a realização de nova auditoria pelo DENASUS no estabelecimento, o qual apurará o montante a ser liquidado, nos termos da legislação vigente. (Origem: PRT MS/GM 184/2011, Art. 48, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 49. O descumprimento de qualquer das regras estabelecidas no presente instrumento ensejará à aplicação de multa de até 10% (dez por cento), calculada sobre o montante das vendas efetuadas no âmbito do PFPB referente ao último trimestre das transações consolidadas. (Origem: PRT MS/GM 184/2011, Art. 49) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. Caso o estabelecimento tenha aderido ao Programa em um prazo menor que 90 (noventa) dias, o cálculo será realizado levando-se em consideração as vendas efetuadas desde a data da publicação da sua adesão. (Origem: PRT MS/GM 184/2011, Art. 49, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 50. O estabelecimento e suas filiais, que forem descredenciado por motivo de irregularidades, se tiver interesse, somente poderá aderir ao Programa Farmácia Popular do Brasil/CoPagamento, novamente, após um período superior a 2 (dois) anos do cancelamento do contrato. (Origem: PRT MS/GM 184/2011, Art. 50) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. A penalidade prevista no caput se estende ao proprietário ou empresário individual, aos sócios empresários e, ainda, o farmacêutico responsável à época em que foram praticadas as irregularidades que ocasionaram o cancelamento da empresa detentora do Cadastro Nacional de Pessoa Jurídica (CNPJ) utilizado para a adesão ao Programa, que porventura pretenda abrir outro estabelecimento ou fazer novo cadastro para fins de adesão ao Programa. (Origem: PRT MS/GM 184/2011, Art. 50, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção VII (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
DO PROCESSAMENTO ELETRÔNICO DAS AUTORIZAÇÕES DAS DISPENSAÇÕES DE MEDICAMENTOS E CORRELATOS
(Origem: PRT MS/GM 184/2011, CAPÍTULO II, Seção VII)
Art. 51. O processamento eletrônico da Autorização de Dispensação de Medicamentos e Correlatos (ADM) é composto de três fases, onde em cada uma das fases, o estabelecimento credenciado envia dados ao Sistema Autorizador referente à transação que, por sua vez, verificará as informações constantes em sua base de dados e retornará à verificação dos dados. (Origem: PRT MS/GM 184/2011, Art. 51) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 52. A primeira fase do processo eletrônico só poderá ser realizada mediante a utilização de solução de segurança fornecida pelo Ministério da Saúde nas seguintes condições: (Origem: PRT MS/GM 184/2011, Art. 52) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - a solução de segurança será responsável pela identificação da estação de trabalho (computador) e da transação; (Origem: PRT MS/GM 184/2011, Art. 52, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - a identificação da transação é obtida através da solução de segurança; (Origem: PRT MS/GM 184/2011, Art. 52, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - cada estação de trabalho (computador) deve ser identificada e cadastrada junto ao Ministério da Saúde para realização da dispensação, conforme orientações a seguir: (Origem: PRT MS/GM 184/2011, Art. 52, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
a) o cadastramento é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 52, III, a) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
b) as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 184/2011, Art. 52, III, b) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
c) o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 184/2011, Art. 52, III, c) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º É de responsabilidade do estabelecimento a instalação, configuração e integração da solução de segurança. (Origem: PRT MS/GM 184/2011, Art. 52, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º O descumprimento dos requisitos previstos neste artigo invializará a venda. (Origem: PRT MS/GM 184/2011, Art. 52, § 2º) (com redação dada pela PRT MS/GM 726/2011) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 53. Todas as fases do processo eletrônico só poderão ser realizadas mediante autenticação eletrônica do atendente com as seguintes determinações: (Origem: PRT MS/GM 184/2011, Art. 53) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - o cadastramento de todos os atendentes é de responsabilidade das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 53, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - as farmácias e drogarias são responsáveis pelas informações fornecidas; e (Origem: PRT MS/GM 184/2011, Art. 53, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - o cadastramento deve ser realizado exclusivamente pela internet. (Origem: PRT MS/GM 184/2011, Art. 53, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 54. Na primeira fase do processo eletrônico, o estabelecimento informará os seguintes dados: (Origem: PRT MS/GM 184/2011, Art. 54) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - código da solicitação; (Origem: PRT MS/GM 184/2011, Art. 54, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - CNPJ do estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 54, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - CPF do paciente; (Origem: PRT MS/GM 184/2011, Art. 54, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - CRM do médico que emitiu a prescrição; (Origem: PRT MS/GM 184/2011, Art. 54, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - unidade federativa que emitiu o CRM do médico prescritor; (Origem: PRT MS/GM 184/2011, Art. 54, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - data de emissão da prescrição; (Origem: PRT MS/GM 184/2011, Art. 54, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - identificador da transação; (Origem: PRT MS/GM 184/2011, Art. 54, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - lista de medicamentos e correlatos, na qual para cada item deverá ser informado: (Origem: PRT MS/GM 184/2011, Art. 54, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
a) código de barras EAN da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, a) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
b) quantidade solicitada, em unidade conforme definida pelo Programa; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, b) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
c) valor unitário do medicamento e correlato; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, c) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
d) quantidade diária prescrita; (Origem: PRT MS/GM 184/2011, Art. 54, VIII, d) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IX - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 54, IX) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
X - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 54, X) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XI - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 54, XI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
XII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 54, XII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 55. Na segunda fase, após ter recebido a confirmação da primeira fase, o estabelecimento deve informar ao Sistema Autorizador os dados que fazem parte do processo de autorização. Os dados são: (Origem: PRT MS/GM 184/2011, Art. 55) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - código da solicitação, enviado na primeira fase; (Origem: PRT MS/GM 184/2011, Art. 55, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - número da pré-autorização gerado pelo Sistema Autorizador e recebido pelo estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 55, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - número do cupom fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 55, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 55, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 55, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 55, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 55, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 1º O Sistema Autorizador confirmará os medicamentos e correlatos autorizados ou uma mensagem e código de erro em casos de não autorização. (Origem: PRT MS/GM 184/2011, Art. 55, § 1º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 2º Os códigos de retorno do sistema autorizador estão disponíveis em www.saude.gov.br/aquitemfarmaciapopular e também no endereço eletrônico do PFPB. (Origem: PRT MS/GM 184/2011, Art. 55, § 2º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
§ 3º As transações realizadas com mais de um medicamento e/ou correlato retornarão com a mesma autorização. (Origem: PRT MS/GM 184/2011, Art. 55, § 3º) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 56. Na terceira e última fase, o estabelecimento confirmará o recebimento da pré-autorização e enviará os seguintes dados: (Origem: PRT MS/GM 184/2011, Art. 56) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - número da pré-autorização; (Origem: PRT MS/GM 184/2011, Art. 56, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - número do cupom fiscal gerado pelo estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 56, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - lista de medicamentos e correlatos autorizados com as seguintes informações: (Origem: PRT MS/GM 184/2011, Art. 56, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
a) código de barras (EAN) da apresentação do medicamento e do correlato; (Origem: PRT MS/GM 184/2011, Art. 56, III, a) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
b) quantidade autorizada em unidades de produto (up); (Origem: PRT MS/GM 184/2011, Art. 56, III, b) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
c) valor da parcela do MS informado pelo Sistema Autorizador; (Origem: PRT MS/GM 184/2011, Art. 56, III, c) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
d) valor da parcela do paciente informada pelo Sistema Autorizador; (Origem: PRT MS/GM 184/2011, Art. 56, III, d) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 56, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 56, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 56, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 56, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. O estabelecimento receberá confirmação e finalização do processo de autorização da dispensação dos (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
edicamentos e dos correlatos. (Origem: PRT MS/GM 184/2011, Art. 56, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 57. Para eventual estorno de transações já efetuadas serão necessários os seguintes dados: (Origem: PRT MS/GM 184/2011, Art. 57) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - número da autorização; (Origem: PRT MS/GM 184/2011, Art. 57, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - número do cupom fiscal; (Origem: PRT MS/GM 184/2011, Art. 57, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - CNPJ do estabelecimento; (Origem: PRT MS/GM 184/2011, Art. 57, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - lista de medicamentos e correlatos, na qual para cada item deverá ser informado:(Origem:PRT MS/GM 184/2011, Art. 57,V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
a) código de barras EAN da apresentação do medicamento e correlato; e (Origem: PRT MS/GM 184/2011, Art. 57, IV, a) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
b) quantidade a ser estornada. (Origem: PRT MS/GM 184/2011, Art. 57, IV, b) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - login das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 57, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - senha das farmácias e drogarias; (Origem: PRT MS/GM 184/2011, Art. 57, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - login do atendente das farmácias e drogarias; e (Origem: PRT MS/GM 184/2011, Art. 57, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - senha do atendente das farmácias e drogarias. (Origem: PRT MS/GM 184/2011, Art. 57, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 58. A configuração da conexão do sistema eletrônico das farmácias e drogarias com o Sistema Autorizador se dará pelo envio automático de mensagem eletrônica com o usuário e senha para o endereço fornecido pelo estabelecimento no momento do cadastro no Programa. (Origem: PRT MS/GM 184/2011, Art. 58) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 59. Em http://www.saude.gov.br/aquitemfarmaciapopular, estão disponíveis informações técnicas do Programa, bem como do processamento por meio do sistema eletrônico. (Origem: PRT MS/GM 184/2011, Art. 59) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
CAPÍTULO III
DAS NORMAS DE OPERAÇÃO E FUNCIONAMENTO DA REDE PRÓPRIA
(Origem: PRT MS/GM 184/2011, CAPÍTULO III)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção I
DA DISPENSAÇÃO DOS MEDICAMENTOS E CORRELATOS NAS UNIDADES DA REDE PRÓPRIA DO PROGRAMA FARMÁCIA POPULAR
(Origem: PRT MS/GM 184/2011, CAPÍTULO III, Seção I)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 60. A dispensação de medicamentos e correlatos na Rede Própria do PFPB ocorrerá mediante o ressarcimento correspondente, tão somente, aos custos de produção ou aquisição, distribuição e dispensação, conforme valores de dispensação descritos no Anexo 2 do Anexo LXXVIII . (Origem: PRT MS/GM 184/2011, Art. 60) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. A dispensação de que trata o caput ocorrerá de acordo com o Manual de Procedimentos Operacionais Padrão e pelo Manual Básico. (Origem: PRT MS/GM 184/2011, Art. 60, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 61. Os medicamentos para o tratamento de hipertensão arterial e diabetes mellitus serão dispensados gratuitamente pelas unidades do Programa. (Origem: PRT MS/GM 184/2011, Art. 61) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 62. Os procedimentos para dispensação dos medicamentos para o tratamento de hipertensão arterial e diabetes mellitus ocorrerão por meio do sistema de vendas DATASUS, de acordo com as regras definidas na Seção III do Capítulo II: (Origem: PRT MS/GM 184/2011, Art. 62) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - apresentação pelo paciente, de documento no qual conste o número de CPF, e sua fotografia; (Origem: PRT MS/GM 184/2011, Art. 62, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - apresentação de prescrição dentro do prazo de validade de 120 (cento e vinte) dias a partir de sua emissão; e (Origem: PRT MS/GM 184/2011, Art. 62, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - o quantitativo de medicamento dispensado deve corresponder à posologia mensal compatível com os consensos de tratamento da doença para o qual é indicado e a dispensação deve obedecer os limites definidos pelo PFPB. (Origem: PRT MS/GM 184/2011, Art. 62, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Seção II
MODELO DE GESTÃO DA REDE PRÓPRIA
(Origem: PRT MS/GM 184/2011, CAPÍTULO III, Seção II)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 63. O PFPB realizado em ação conjunta entre o Ministério da Saúde e a Fundação Oswaldo Cruz (FIOCRUZ), será coordenado por um Conselho Gestor, vinculado diretamente à SCTIE/MS. (Origem: PRT MS/GM 184/2011, Art. 63) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Parágrafo Único. O Conselho Gestor do PFPB terá a seguinte composição: (Origem: PRT MS/GM 184/2011, Art. 63, Parágrafo Único) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - três representantes da SCTIE/MS, sendo um deles o Diretor do DAF/SCTIE/MS, que o coordenará; e (Origem: PRT MS/GM 184/2011, Art. 63, Parágrafo Único, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - três representantes indicados pela Presidência da FIOCRUZ. (Origem: PRT MS/GM 184/2011, Art. 63, Parágrafo Único, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 64. As atividades do PFPB serão desenvolvidas de acordo com a Lei nº 10.858, de 13 de abril de 2004, pela FIOCRUZ, por meio da Gerência Técnica e da Gerência Administrativa do Programa Farmácia Popular do Brasil e pelo Ministério da Saúde, por meio da SCTIE/MS, sob a responsabilidade do DAF/SCTIE/MS. (Origem: PRT MS/GM 184/2011, Art. 64) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 65. Ao Conselho Gestor do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 184/2011, Art. 65) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - aprovar anualmente o Plano de Metas e o Plano de Desenvolvimento; (Origem: PRT MS/GM 184/2011, Art. 65, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - aprovar anualmente o Relatório de Gestão do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - monitorar a execução orçamentária e a movimentação financeira; (Origem: PRT MS/GM 184/2011, Art. 65, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - acompanhar as propostas de convênios com instituições públicas ou privadas que visem apoiar o desenvolvimento do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - aprovar o Manual Básico do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VI - orientar e participar da formulação de indicadores de resultados e do impacto do PFPB; (Origem: PRT MS/GM 184/2011, Art. 65, VI) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VII - sugerir a habilitação de parceiros e a celebração de convênios que se façam necessárias, não-previstas ou contempladas nas normas e requisitos estabelecidos; e (Origem: PRT MS/GM 184/2011, Art. 65, VII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
VIII - propor o elenco de medicamentos e/ou correlatos, e definição do preço de dispensação a ser disponibilizado pelo PFPB. (Origem: PRT MS/GM 184/2011, Art. 65, VIII) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 66. À Gerência Técnica do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 184/2011, Art. 66) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - monitorar a qualidade dos serviços prestados pelas unidades vinculadas ao PFPB; (Origem: PRT MS/GM 184/2011, Art. 66, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - coordenar as ações de formação e capacitação de recursos humanos para o desenvolvimento das atividades; (Origem: PRT MS/GM 184/2011, Art. 66, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - coordenar as ações de atenção e de informação ao usuário, aos profissionais de saúde e aos parceiros; (Origem: PRT MS/GM 184/2011, Art. 66, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - promover a avaliação permanente da lista de produtos e serviços disponibilizados; e (Origem: PRT MS/GM 184/2011, Art. 66, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - coordenar a elaboração de manuais e procedimentos operacionais referentes a todas as atividades técnicas e às ações desenvolvidas nas farmácias. (Origem: PRT MS/GM 184/2011, Art. 66, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 67. À Gerência Administrativa do Programa Farmácia Popular do Brasil compete: (Origem: PRT MS/GM 184/2011, Art. 67) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - dar suporte à instalação e à manutenção de unidades mediante a celebração de convênios ou parceria entre o Ministério da Saúde, a FIOCRUZ e os Municípios, os Estados, o Distrito Federal e Instituições; (Origem: PRT MS/GM 184/2011, Art. 67, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - acompanhar e monitorar o gerenciamento das farmácias do PFPB; (Origem: PRT MS/GM 184/2011, Art. 67, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
III - participar do planejamento de aquisição de produtos, de reposição de estoques de produtos, outros insumos materiais, equipamentos e contratação de serviços necessários para implantação das unidades do PFPB; (Origem: PRT MS/GM 184/2011, Art. 67, III) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
IV - acompanhar os processos de logística referentes à guarda, ao transporte e à distribuição de medicamentos e correlatos, insumos diversos, materiais e equipamentos das unidades do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 67, IV) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
V - aprovar os projetos das instalações e áreas físicas das farmácias a serem implantadas pelos municípios, estados, Distrito Federal e entidades conveniadas, visando adequação ao disposto no Manual Básico do Programa Farmácia Popular do Brasil. (Origem: PRT MS/GM 184/2011, Art. 67, V) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 68. Ao DAF/SCTIE/MS compete: (Origem: PRT MS/GM 184/2011, Art. 68) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
I - estabelecer mecanismos de controle e monitoramento da implementação, do desenvolvimento e dos resultados do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 68, I) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
II - supervisionar por meio de suas coordenações, as seguintes ações: (Origem: PRT MS/GM 184/2011, Art. 68, II) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
a) instrução dos processos administrativos de habilitação de municípios, estados e Distrito Federal e pela celebração de convênios com as instituições autorizadas; (Origem: PRT MS/GM 184/2011, Art. 68, II, a) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
b) instrução dos processos administrativos de habilitação de empresas parceiras, nos termos deste Anexo; (Origem: PRT MS/GM 184/2011, Art. 68, II, b) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
c) emissão dos pareceres sobre as solicitações de habilitações de Municípios, Estados e Distrito Federal segundo procedimentos e critérios definidos no Manual Básico do PFPB; (Origem: PRT MS/GM 184/2011, Art. 68, II, c) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
d) emissão dos pareceres sobre as solicitações de celebração de convênios com instituições autorizadas, segundo procedimentos e critérios definidos no Manual Básico do PFPB; e (Origem: PRT MS/GM 184/2011, Art. 68, II, d) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
e) emissão dos pareceres sobre as solicitações de credenciamento de empresas parceiras nos termos deste Anexo. (Origem: PRT MS/GM 184/2011, Art. 68, II, e) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 69. As definições estratégicas, bem como as normas para adesão e manutenção do PFPB, instalação e gestão das Unidades, repasses de recursos fundo a fundo, celebração de convênios, monitoramento, avaliação e controle estão previstas no "Programa Farmácia Popular do Brasil - Manual Básico", disponível em http://bvsms.saude.gov.br/bvs/publicacoes/PROGRAMA_FARMACIA_POPULAR.pdf. (Origem: PRT MS/GM 184/2011, Art. 70) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
CAPÍTULO IV
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 184/2011, CAPÍTULO IV)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 70. Eventuais conflitos decorrentes da relação contratual firmada no âmbito PFPB, não resolvidos pela via administrativa, serão dirimidos pela Justiça Federal da 1ª Região, Circunscrição Judiciária do Distrito Federal (Origem: PRT MS/GM 184/2011, Art. 71) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 71. A qualquer tempo, o estabelecimento poderá requerer por intermédio de Ofício com os dados da empresa, assinado com firma reconhecida, a sua exclusão do PFPB, que se efetivará no prazo máximo de 30 (trinta) dias. (Origem: PRT MS/GM 184/2011, Art. 72) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Art. 72. O MS manterá informações e orientações sistemáticas sobre a operação do PFPB em http://www.saude.gov.br/aquitemfarmaciapopular, em que constará inclusive o Anexo LXXVIII. (Origem: PRT MS/GM 184/2011, Art. 73) (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 1 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS DO AQUI TEM FARMÁCIA POPULAR PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL E DIABETES MELLITUS (Origem: PRT MS/GM 184/2011, Anexo 1)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Hipertensão Arterial (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Diabetes Mellitus (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 2 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS E CORRELATOS DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 184/2011, Anexo 2)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Contracepção (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Dislipidemia (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Asma (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Rinite (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Doença de Parkinson (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Osteoporose (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Glaucoma (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Indicação: Incontinência (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 3 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS E CORRELATOS DA REDE PRÓPRIA (Origem: PRT MS/GM 184/2011, Anexo 3)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
|
|||||
* Disponíveis nas unidades do Programa a partir de 15 de março de 2011. (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 4 DO ANEXO LXXVIII
ELENCO DE MEDICAMENTOS DA REDE PRÓPRIA PARA O TRATAMENTO DE HIPERTENSÃO ARTERIAL E DIABETES MELLITUS (Origem: PRT MS/GM 184/2011, Anexo 4)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
* Disponível nas unidades do Programa a partir de 15 de março de 2011 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO 5 DO ANEXO LXXVIII
MODELO DE CUPOM VINCULADO DO AQUI TEM FARMÁCIA POPULAR (Origem: PRT MS/GM 184/2011, Anexo 5)
(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
----------------------------------------
MINISTÉRIO DA SAÚDE - FARMÁCIA POPULAR NÃO É DOCUMENTO FISCAL(Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
----------------------------------------
RAZÃO SOCIAL (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
C.N.P.J. : 99.999.999/9999-99 Autorização M.S. : 999.999.999.999.999 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Valor Total Venda : R$ xxxxxx Valor Total M.S. : R$ xxxxxx Valor Total Benef.: R$ xxxxxx Valor hipertensão/: R$ 0,00 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
diabetes (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
CRM/UF : XXX-UF (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
NOME Rep. Legal: DADOS DO VENDEDOR (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Código: 167892 Nome do Vendedor: (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
DADOS DO BENEFICIÁRIO (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
NOME Nº C.P.F. (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Endereço: (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
----------------------------------------
----------------------------------------
----------------------------------------
----------------------------------------
HISTÓRICO DE AUTORIZAÇÕES VIGENTES (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
----------------------------------------
CÓD. BARRAS MEDICAMENTO (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
COMPR POS AUT SAL V.MS V.BEN PROX.COM (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
----------------------------------------
NÚMERO DO EAN NOME DO MEDICAMENTO 12/08 3 60 30 9,00 1,00 12/09 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
NÚMERO DO EAN NOME DO MEDICAMENTO 12/08 3 60 30 9,00 1,00 12/09 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
NÚMERO DO EAN NOME DO MEDICAMENTO 12/08 3 60 30 9,00 1,00 12/09 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ESPAÇO RESERVADO PARA MENSAGEM M.S. ESPAÇO RESERVADO PARA MENSAGEM M.S. ESPAÇO RESERVADO (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
PARA MENSAGEM M.S. ESPAÇO RESERVADO PARA MENSAGEM M.S. (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
Disque Denúncia: 0800 61 136 (Revogado pela PRT GM/MS nº 2.898 de 03.11.2021)
ANEXO LXXIX
INSTRUÇÃO NORMATIVA DE VIGILÂNCIA EM SAÚDE DO TRABALHADOR NO SUS (Origem: PRT MS/GM 3120/1998, Anexo 1)
1 - Apresentação
O avanço gradual, quantitativo e qualitativo da institucionalização das práticas de Saúde do Trabalhador, no setor saúde em todo o Brasil, reflete a consolidação da área como objeto indiscutível da saúde pública. E, por assim dizer, objeto, também, das políticas públicas direcionadas, em todos os níveis do Sistema Único de Saúde (SUS), para a prevenção dos agravos à saúde da população trabalhadora.
O conjunto de elementos deflagradores do avanço institucional, em relação à questão da Saúde do Trabalhador no SUS, compõe-se do aspecto legislativo, calcado na Lei nº 8.080, de 19 de setembro de 1990, e em diversas Constituições Estaduais e Municipais, na luta pela saúde desenvolvida pelos trabalhadores e suas organizações sindicais, passando pelo crescente comprometimento dos técnicos, ao nível dos serviços e universidades.
A presente Instrução Normativa pretende, de uma forma sucinta, fornecer subsídios básicos para o desenvolvimento de ações de Vigilância em Saúde do Trabalhador, no âmbito do Sistema Único de Saúde Parte do pressuposto que o sistema de saúde, embora deva ser preservado nas suas peculiaridades regionais que impliquem um respeito às diversas culturas e características populacionais, por ser único, também deve manter linhas mestras de atuação, especialmente pela necessidade de se compatibilizarem instrumentos, bancos de informações e intercâmbio de experiências.
As recomendações aqui apresentadas são fruto de alguns anos de discussão acumulada e extraída de diversas experiências de vigilância em saúde do trabalhador, em vários estados e municípios de todo o País. Trata-se de uma primeira aproximação normativa não só com os Programas Estaduais e Municipais de Saúde do Trabalhador, já instalados e em fase de instalação, mas, também com as estruturas de atenção à saúde das Secretarias Estaduais e Municipais, especialmente nas áreas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária.
A possibilidade de traduzir a capilaridade institucional do setor saúde em instâncias efetoras de mudança dos perfis de morbidade e mortalidade, resultantes da relação trabalho-ambiente-consumo e saúde, pressupõe um comprometimento das estruturas de atenção à saúde, em especial as de vigilância e fiscalização em saúde.
O objetivo da Instrução Normativa é, em suma, o de poder instrumentalizar minimamente os setores responsáveis pela vigilância e defesa da saúde, nas Secretarias de Estados e Municípios, de forma a incorporarem em suas práticas mecanismos de análise e intervenção sobre os processos e os ambientes de trabalho.
A abordagem de vigilância em saúde do trabalhador, considerada na Instrução Normativa, implica a superação dos limites conceituais e institucionais, tradicionalmente estruturados nos serviços de saúde, das ações dissociadas de vigilância epidemiológica e sanitária.
Além disso, nas ações de vigilância e fiscalização sanitária, propriamente ditas, implica-se transpor o objeto usual - o produto/consumidor - de forma a considerar, igualmente, como objeto, o processo/trabalhador/ambiente.
Dessa forma, a vigilância em saúde do trabalhador calca-se no modelo epidemiológico de pesquisa dos agravos, nos diversos níveis da relação entre o trabalho e a saúde, agregando ao universo da avaliação e análise a capacidade imediata da intervenção sobre os fatores determinantes dos danos à saúde.
Devido à sua concepção mais abrangente de saúde, relacionada ao processo de produção, capaz de lidar com a diversidade, a complexidade e o surgimento de novas formas de adoecer, a vigilância em saúde do trabalhador ultrapassa o aspecto normativo tratado pela fiscalização tradicional.
Em razão dessas implicações, a vigilância em saúde do trabalhador pressupõe uma rede de articulações que passa, fundamentalmente, pelos trabalhadores e suas organizações, pela área de pesquisa e formação de recursos humanos e pelas áreas de assistência e reabilitação.
Finalmente, levando-se em consideração o fato de ser uma área ainda em construção dentro do SUS, pretende-se que esta Instrução Normativa possa ser aprimorada, com a maior brevidade, uma vez utilizada pela rede de serviços, assim como se constitui na primeira de uma série de publicações normativas e orientadoras, relacionadas a temas específicos em saúde do trabalhador.
2 - Conceituação básica
A Vigilância em Saúde do Trabalhador compreende uma atuação contínua e sistemática, ao longo do tempo, no sentido de detectar, conhecer, pesquisar e analisar os fatores determinantes e Condicionantes dos agravos à saúde relacionados aos processos e ambientes de trabalho, em seus aspectos tecnológico, social, organizacional e epidemiológico, com a finalidade de planejar, executar e avaliar intervenções sobre esses aspectos, de forma a eliminá-los ou controlá-los.
A Vigilância em Saúde do Trabalhador compõe um conjunto de práticas sanitárias, articuladas supra-setorialmente, cuja especificidade está centrada na relação da saúde com o ambiente e os processos de trabalho e nesta com a assistência, calcado nos princípios da vigilância em saúde, para a melhoria das condições de vida e saúde da população.
A Vigilância em Saúde do Trabalhador não constitui uma área desvinculada e independente da vigilância em saúde como um todo mas, ao contrário, pretende acrescentar ao conjunto de ações da vigilância em saúde estratégias de produção de conhecimentos e mecanismos de intervenção sobre os processos de produção, aproximando os diversos objetos comuns das práticas sanitárias àqueles oriundos da relação entre o trabalho e a saúde.
3 - Princípios
A Vigilância em Saúde do Trabalhador pauta-se nos princípios do Sistema Único de Saúde, em consonância com os Sistemas Nacionais de Vigilância Sanitária e de Vigilância Epidemiológica, articulada com a área assistencial.
Além disso, tendo em vista a complexidade e a abrangência do objeto da vigilância, guarda peculiaridades que transpõem os limites setoriais da saúde, implicando a ampliação de sua abordagem.
Como princípios, esquematicamente, pode-se considerar:
3.1 - Universalidade: todos os trabalhadores, independentemente de sua localização, urbana ou rural, de sua forma de inserção no mercado de trabalho, formal ou informal, de seu vínculo empregatício, público ou privado, autônomo, doméstico, aposentado ou demitido são objeto e sujeitos da Vigilância em Saúde do Trabalhador.
3.2 - Integralidade das ações: o entendimento de atenção integral à saúde do trabalhador, compreendendo a assistência e recuperação dos agravos, os aspectos preventivos implicando intervenção sobre seus fatores determinantes em nível dos processos de trabalho e a promoção da saúde que implicam ações articuladas com os próprios trabalhadores e suas representações. A ênfase deve ser dirigida ao fato de que as ações individuais/curativas articulam-se com as ações coletivas, no âmbito da vigilância, considerando que os agravos à saúde do trabalhador são absolutamente preveníveis.
3 3 - Pluriinstitucionalidade: articulação, com formação de redes e sistemas, entre as instâncias de vigilância em saúde do trabalhador e os centros de assistência e reabilitação, as universidades e centros de pesquisa e as instituições públicas com responsabilidade na área de saúde do trabalhador consumo e ambiente.
3 4 - Controle social incorporação dos trabalhadores e das suas organizações, principalmente as sindicais, em todas as etapas da vigilância em saúde do trabalhador, compreendendo sua participação na identificação das demandas, no planejamento, no estabelecimento de prioridades e adoção de estratégias, na execução das ações, no seu acompanhamento e avaliação e no controle da aplicação de recursos.
3 5 - Hierarquização e descentralização: consolidação do papel do município e dos distritos sanitários como instância efetiva de desenvolvimento das ações de vigilância em saúde do trabalhador integrando os níveis estadual e nacional do Sistema Único de Saúde, no espectro da ação, em função de sua complexidade.
3.6 - Interdisciplinaridade: a abordagem multiprofissional sobre o objeto da vigilância em saúde do trabalhador deve contemplar os saberes técnicos, com a concorrência de diferentes áreas do conhecimento e, fundamentalmente, o saber operário, necessários para o desenvolvimento da ação.
3.7 - Pesquisa-intervenção: o entendimento de que a intervenção, no âmbito da- vigilância em saúde do trabalhador, é o deflagrador de um processo contínuo, ao longo do tempo, em que a pesquisa é sua parte indissolúvel, subsidiando e aprimorando a própria intervenção.
3.8 - O caráter transformador: a intervenção sobre os fatores determinantes e condicionantes dos problemas de saúde relacionados aos processos e ambientes de trabalho com o entendimento de que a vigilância em saúde do trabalhador, sob a lógica do controle social e da transparência das ações, pode ter na intervenção um caráter proponente de mudanças dos processos de trabalho, a partir das análises tecnológica, ergonômica, organizacional e ambiental efetuadas pelo coletivo de instituições, sindicatos, trabalhadores e empresas, inclusive, superando a própria legislação.
4 - Objetivos:
De forma esquemática pode-se dizer que a vigilância em saúde do trabalhador tem como objetivos:
a - conhecer a realidade de saúde da população trabalhadora, independentemente da forma de inserção no mercado de trabalho e do vínculo trabalhista estabelecido, considerando:
a1 - a caracterização de sua forma de adoecer e morrer em função da sua relação com o processo de trabalho;
a2 - o levantamento histórico dos perfis de morbidade e mortalidade em função da sua relação com o processo de trabalho;
a3 - a avaliação do processo, do ambiente e das condições em que o trabalho se realiza, identificando os riscos e cargas de trabalho a que está sujeita, nos seus aspectos tecnológicos ergonômicos e organizacionais já conhecidos;
a4 - a pesquisa e a análise de novas e ainda desconhecidas formas de adoecer e morrer em decorrência do trabalho;
b - intervir nos fatores determinantes de agravos à saúde da população trabalhadora, visando eliminá-los ou, na sua impossibilidade, atenuá-los e controlá-los, considerando:
b1 - a fiscalização do processo, do ambiente e das condições em que o trabalho se realiza, fazendo cumprir, com rigor, as normas e legislações existentes, nacionais ou mesmo internacionais quando relacionadas à promoção da saúde do trabalhador;
b2 - a negociação coletiva em saúde do trabalhador, além dos preceitos legais estabelecidos, quando se impuser a transformação do processo, do ambiente e das condições em que o trabalho se realiza, não prevista normativamente;
c - avaliar o impacto das medidas adotadas para a eliminação, atenuação e controle dos fatores determinantes de agravos à saúde, considerando:
c1 - a possibilidade de transformar os perfis de morbidade e mortalidade;
c2 - o aprimoramento contínuo da qualidade de vida no trabalho;
d - subsidiar a tomada de decisões dos órgãos competentes, nas três esferas de governo considerando:
d1 - o estabelecimento de políticas públicas, contemplando a relação entre o trabalho e a saúde no campo de abrangência da vigilância em saúde;
d2 - a interveniência, junto às instâncias do Estado e da sociedade, para o aprimoramento das normas legais existentes e para a criação de novas normas legais em defesa da saúde dos trabalhadores;
d3 - o planejamento das ações e o estabelecimento de suas estratégias;
d4 - a participação na estruturação de serviços de atenção à saúde dos trabalhadores; d5 - a participação na formação, capacitação e treinamento de recursos humanos com interesse na área;
e - estabelecer sistemas de informação em saúde do trabalhador, junto às estruturas existentes no setor saúde, considerando:
e1 - a criação de bases de dados comportando todas as informações oriundas do processo de vigilância e incorporando as informações tradicionais já existentes;
e2 - a divulgação sistemática das informações analisadas e consolidadas.
5 - Estratégias
A vigilância em saúde do trabalhador, como um conjunto de práticas sanitárias contínuas, calcada, entre outros princípios, na interdisciplinaridade, na pluriinstitucionalidade, no controle social, balizada na configuração do Sistema Único de Saúde, e tendo como imagem-objetivo a melhoria da qualidade de vida no trabalho, pressupõe o estabelecimento de estratégias operacionais para alcançá-Ia.
Embora cada Estado, Região ou Município, guardadas suas características, deva buscar a melhor forma de estabelecer suas próprias estratégias de vigilância, alguns pressupostos podem ser considerados como aplicáveis ao conjunto do SUS. Dentre os passos que podem ser estabelecidos na estratégia de operacionalização das ações, buscando manter uma lógica seqüencial de consolidação da vigilância, pode-se destacar:
5.1 - Onde já existam estruturas, estaduais e municipais, de saúde do trabalhador - Programas, Coordenações, Divisões, Gerências, Centros, Núcleos - promover e/ou aprofundar a relação institucional com as estruturas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária, buscando a superação da dicotomia existente em suas práticas, em que o objeto de ação da vigilância, em geral, não contempla o processo de produção e sua relação com a saúde dos trabalhadores. Com este intuito, recomenda-se a constituição de equipes multiprofissionais para a execução de ações interdisciplinares e pluriinstitucionais.
5.2 - Recomenda-se a criação de comissão, na forma colegiada, com a participação de trabalhadores, suas organizações sindicais e instituições públicas com responsabilidades em saúde do trabalhador, vinculada organicamente ao SUS e subordinada aos Conselhos Estaduais e Municipais de Saúde, com a finalidade de assessorá-lo na definição de políticas, no estabelecimento de diretrizes e prioridades, e no acompanhamento e avaliação da execução das ações de saúde do trabalhador.
5.3 - Dada a abrangência e as dificuldades operacionais de se implementarem, simultaneamente, ações de vigilância em todos os ambientes de trabalho, em um dado município ou região, faz-se necessário o planejamento dessas ações com o estabelecimento de prioridades, visando a intervenções de impacto, com efeitos educativos e disciplinadores sobre o setor. Para tanto, recomenda-se a adoção de alguns critérios como:
- Base Sindical: Uma vez que um determinado sindicato de trabalhadores, com alguma tradição de luta pela saúde identifique e encaminhe situações-problema, junto à estrutura de vigilância, desencadeia-se uma ação integrada que visa atuar não apenas na empresa denunciada, mas nas principais empresas abrangidas por aquela categoria de trabalhadores. O investimento da ação nesta base deve considerar a capacidade de reprodutibilidade, a partir do sindicato em questão e para o movimento sindical como um todo, numa dada região. - Ramo Produtivo: Consiste na atuação em todas as empresas com o mesmo perfil produtivo, capaz de se constituir em fonte de risco para a saúde, preponderantes numa dada região, independente da capacidade de mobilização dos sindicatos envolvidos. A utilização deste critério pode se dar por avaliação epidemiológica dos casos notificados, denúncias sucessivas ou análise dos processos produtivos. O investimento da ação, neste caso, visa à mudança dos processos de forma integrada, sem a punição de uma empresa em particular, mas intervindo em todas as empresas daquele setor e, em especial, nas que apresentam grande concentração de trabalhadores, sempre buscando a atuação conjunta com os sindicatos das categorias expostas.
- Território: Consiste na intervenção por varredura, em pequena área geográfica previamente delimitada (setor censitário, distrito de saúde, bairro, distrito industrial etc.), de todos os processos produtivos capazes de gerar dano à saúde. O investimento da ação, neste caso, visa abranger todos os trabalhadores, ao longo do tempo, a despeito de sua forma de inserção no mercado de trabalho e seu vínculo de emprego, a partir da elaboração de mapas dos processos produtivos, de modo a estabelecer um perfil de risco à saúde dos trabalhadores.
- Epidemiológico (evento-sentinela): Consiste na intervenção nas empresas, a partir de agravos à saúde dos trabalhadores que podem representar um problema coletivo, ainda não detectado, e mesmo um problema epidemiológico relevante. mas submerso A intervenção dirige-se à maior ou às maiores empresas considerando os aspectos potenciais de freqüência elou gravidade dos eventos-sentinela.
É importante salientar que os critérios acima não obedecem à ordem de hierarquia e tampouco são excludentes, podendo ser utilizados de forma combinada.
5.4 - Como estratégia de consolidação das ações de vigilância em saúde do trabalhador é fundamental que os Estados e os Municípios contemplem o tema na revisão de seus códigos de saúde.
6 - Metodologia
Considerando os objetivos da vigilância em saúde do trabalhador - conhecer a realidade para transformá-la, buscando um aprimoramento da qualidade de vida no trabalho, é necessário que se adotem metodologias capazes de estabelecer um diagnóstico situacional, dentro do princípio da pesquisa-intervenção, e capazes, ainda, de avaliar de modo permanente os seus resultados no sentido da; mudanças pretendidas.
Nesta linha, podem-se observar alguns pressupostos de caráter metodológico, compreendendo:
6.1 - Fase preparatória: Uma vez identificada a demanda, com base nas estratégias relacionadas, o planejamento da ação pressupõe uma fase preparatória, em que a equipe busca conhecer, com o maior aprofundamento possível, o(s) processo(s), o ambiente e as condições de trabalho do local onde será realizada a ação.
A preparação deve ser efetuada por meio de análise conjunta com os trabalhadores da(s) empresa(s) - objeto da vigilância e dos representantes sindicais daquela(s) categoria(s), tendo por objetivo não só aprofundar o conhecimento sobre o objeto da vigilância, através de seu saber operário mas, principalmente, traçar estratégias de desenvolvimento da ação. Deve-se lançar mão, ainda nesta fase, de consulta bibliográfica especializada e das informações locais disponíveis acerca do caso em questão.
6.2 - A intervenção (inspeção/fiscalização sanitária)
A intervenção, realizada em conjunto com os representantes dos trabalhadores, de outras instituições, e sob a responsabilidade administrativa da equipe da Secretaria Estadual e/ou Municipal de Saúde, deverá considerar, na inspeção sanitária em saúde do trabalhador, a observância das normas e legislações que regulamentam a relação entre o trabalho e a saúde, de qualquer origem, especialmente na esfera da saúde, do trabalho, da previdência, do meio ambiente e das internacionais ratificadas pelo Brasil.
Além disso, é.preciso considerar os aspectos passíveis de causar dano à saúde, mesmo que não estejam previstos nas legislações, considerando-se não só a observação direta por parte da equipe de situações de risco à saúde como, também, as questões subjetivas referidas pelos trabalhadores na relação de sua saúde com o trabalho realizado.
Os instrumentos administrativos de registro da ação, de exigências e outras medidas são os mesmos utilizados pelas áreas de Vigilância/Fiscalização Sanitária, tais como os Termos de Visita, Notificação, Intimação, Auto de Infração etc.
6.3 - Análise dos processos
Uma forma importante de considerar a capacidade potencial de adoecer no processo, no ambiente ou em decorrência das condições em que o trabalho se realiza é utilizar instrumentos que inventariem o processo produtivo e a sua forma de organização. Os instrumentos metodológicos, a serem estabelecidos no âmbito do SUS, devem ser entregues no ato da inspeção, para serem preenchidos pela empresa, e o Roteiro de Vigilância, construído e aplicado pela equipe, no momento da ação, é outra forma de conhecer os processos.
6.4 - Inquéritos
Como proposta metodológica de investigação, no mesmo tempo da intervenção, podem-se organizar inquéritos, por meio da equipe interdisciplinar e de representantes sindicais e/ou dos trabalhadores, aplicando questionários ao conjunto dos trabalhadores, contemplando a sua percepção da relação entre trabalho e saúde, a morbidade referida (sinais e sintomas objetivos e subjetivos), a vivência com o acidente e o quase acidente de trabalho (incidente crítico), consigo e com os companheiros, e suas sugestões para a transformação do processo, do ambiente e das condições em que o trabalho se realiza.
6.5 - Mapeamento de riscos
Podem-se utilizar algumas técnicas de mapeamento de riscos dos processos produtivos, de forma gradualmente mais complexa, à medida que a intervenção se consolide e as mudanças vão ocorrendo, sempre com a participação dos trabalhadores na sua elaboração.
Uma das técnicas que deve ser utilizada, especialmente em casos de acidentes graves e fatais, é a metodologia de árvore de causas para a investigação dos fatores determinantes do evento, que será objeto de publicação posterior.
Com a concorrência interdisciplinar, na equipe, de profissionais de áreas diversas e à medida que os trabalhadores se apropriem de novos conhecimentos acerca do tema, aprofunda-se a investigação, por intermédio da utilização de técnicas mais sofisticadas.
É importante mapear, além dos riscos tradicionalmente reconhecidos, as chamadas cargas de trabalho e as formas de desgaste do trabalhador.
6.6 - Estudos epidemiológicos
Os estudos epidemiológicos clássicos, tais como os seccionais, de coorte e caso controle, podem ser aplicados sempre que se identificar sua necessidade, igualmente com a concorrência, na equipe interdisciplinar de técnicos das universidades e centros de pesquisa; como assessores da equipe.
6.7 - Acompanhamento do processo
A intervenção implica a confecção de um relatório detalhado, incorporando o conjunto de informações coletadas, elaborado pela equipe, com a participação dos trabalhadores, servindo como parâmetro de avaliações futuras.
Em razão do ritmo de implementação das medidas, avalia-se a necessidade do envolvimento de outras instâncias como, por exemplo, o Ministério Público, com o objetivo de garantir as mudanças requeridas.
Cabe ressaltar que o entendimento da intervenção deve ser o de um processo de acompanhamento e avaliação, ao longo do tempo, em que se deve buscar a negociação com as diversas instâncias, objetivando o aprimoramento da qualidade de vida no trabalho.
7 - Informações básicas
As informações de interesse para as ações em saúde do trabalhador, atualmente disponíveis, limitam-se à avaliação do perfil de morbi-mortalidade da população em geral, sem lograr o conhecimento sistemático dos riscos e o dimensionamento da população trabalhadora a eles exposta, que permitam a análise e a intervenção sobre seus determinantes. É pensando na necessidade de se avançar nesse conhecimento para fins de intervenção e prevenção efetivas dos agravos relacionados ao trabalho, que foi definido o elenco de informações aqui apresentadas. sem perder a perspectiva de ser acrescidas outras de interesse local, regional ou mesmo nacional, à medida que o sistema de informações em saúde do trabalhador se estruture e se consolide.
7.1 - Informações acerca da mortalidade
As informações de mortalidade serão coletadas principalmente a partir da Declaração de Óbito, por intermédio do Sistema de Informações sobre Mortalidade (SIM). Cada Município deverá investir na melhoria da qualidade dos dados da Declaração de Óbito e, sempre que possível, cruzar com outras informações disponíveis, principalmente a Comunicação de Acidente de Trabalho (CAT), da Previdência Social.
7.2 - Informações acerca da morbidade
As informações de morbidade podem ser obtidas de diversas fontes, tais como a Ficha Individual de Notificação de Agravos referente às doenças incluídas no Sistema de .Notificação de Agravos Notificáveis (SINAN), a Comunicação de Acidente do Trabalho (CAT), normalmente utilizada para os trabalhadores do mercado formal de trabalho, regido pela Consolidação das Leis Trabalhistas (CLT); as fichas, prontuários e outros documentos oriundos dos atendimentos ambulatoriais (SIA/SUS) e de internações (SIH/SUS) na rede de serviços de saúde.
Os Estados e os Municípios poderão definir eventos-sentinela a ser notificados, incluindo-os no SINAN. Essa definição deverá ter por referência a análise do parque produtivo local ou a suspeita da existência de um agravo não diagnosticado como relacionado ao trabalho. A análise dos eventos-sentinela constituir-se-á em atividade complementar ao sistema de informações, particularmente neste momento em que o diagnóstico de doenças é muito reduzido. Observar, por exemplo, excessos de mortes ou morbidade por alguns tipos de cânceres ou de achados laboratoriais (leucopenias, anemias) que possam estar ocorrendo em grupos específicos de trabalhadores.
7.3 - Informações relativas às atividades e aos processos produtivos
Essas informações deverão ser obtidas à medida que os Estados e os Municípios executem e implantem as ações de vigilância.
Consideram-se, neste caso, Cadastros de Estabelecimentos, Relatórios de Inspeção, Termos de Notificação e Fichas de Vigilância.
Outras informações, utilizando os bancos de dados da RAIS e do IBGE, também poderão ser incorporadas, devendo ser desagregadas, por Município, para que possam ser adequadas aos níveis locais.
Outras fontes de informação que deverão ser utilizadas, à medida que o sistema se capacite para tal, são as dos serviços médicos e de segurança e higiene industrial de empresas, do Anexo I da CIPA (Norma Regulamentadora nº 5, Portaria nº 3.214/78, MTb), dos sindicatos, das associações patronais, dos serviços/institutos de medicina legal, de associações e entidades civis (associações de moradores, grupos ecológicos, culturais), de outros órgãos da administração pública (DETRAN, secretarias de proteção ambiental, de indústria e comércio, do trabalho etc). Devem ser considerados ainda estudos epidemiológicos e resultados de pesquisas de interesse da área de saúde do trabalhador, como fonte de informações.
Um maior detalhamento acerca da criação de bancos de dados e adequação das informações em saúde do trabalhador aos Sistemas de Informação existentes, considerando, entre outros, a coleta, o fluxo, o processamento, a análise e a divulgação das informações, será efetuado em publicação posterior.
Os Estados e os Municípios poderão acrescentar outras informações e metodologias que julgarem pertinentes, inclusive sugerindo sua incorporação em âmbito nacional nas publicações subseqüentes.
8 - Considerações finais
A construção do Sistema Único de Saúde pressupõe um esforço permanente na afirmação de seus princípios e na ampliação das redes solidárias institucionais com a sociedade organizada.
Dentro do SUS, a área de saúde do trabalhador emerge como um desafio a mais, no sentido de se proverem os meios necessários para atender com primazia o que, a partir de 1988, com a Constituição Federal, passou a ser atribuição precípua das Secretarias de Saúde de Estados e Municípios: a Vigilância em Saúde do Trabalhador.
É preciso considerar, contudo, as dificuldades inerentes ao sistema de saúde, cujas práticas tradicionais, de há muito enraizadas: não dispõem de mecanismos ágeis de adequação às novas necessidades, determinadas pela lei e, mesmo, ansiadas pela sociedade.
Com este intuito, a Instrução Normativa de Vigilância em Saúde do Trabalhador pretende ser um instrumento capaz de ser um móvel de sensibilização e de ampliação das redes solidárias de construção da área especificá e do próprio Sistema Único de Saúde.
Nesta perspectiva, pretende-se, ainda, com esta Instrução Normativa, iniciar uma série de publicações temáticas afins, entre as quais se destacam as questões dos Agrotóxicos, dos Sistemas de Informações, da Investigação de Acidentes de Trabalho, das Intoxicações por Metais Pesados, dos Agravos de Caráter Ergonômico, das Pneumopatias de Origem Ocupacional.
Instrução Normativa de Vigilância em Saúde do Trabalhador no SUS
1 - Apresentação
O avanço gradual, quantitativo e qualitativo da institucionalização das práticas de Saúde do Trabalhador, no setor saúde em todo o Brasil, reflete a consolidação da área como objeto indiscutível da saúde pública. E, por assim dizer, objeto, também, das políticas públicas direcionadas, em todos os níveis do Sistema Único de Saúde (SUS), para a prevenção dos agravos à saúde da população trabalhadora.
O conjunto de elementos deflagradores do avanço institucional, em relação à questão da Saúde do Trabalhador no SUS, compõe-se do aspecto legislativo, calcado na Lei nº 8.080, de 19 de setembro de 1990, e em diversas Constituições Estaduais e Municipais, na luta pela saúde desenvolvida pelos trabalhadores e suas organizações sindicais, passando pelo crescente comprometimento dos técnicos, ao nível dos serviços e universidades.
A presente Instrução Normativa pretende, de uma forma sucinta, fornecer subsídios básicos para o desenvolvimento de ações de Vigilância em Saúde do Trabalhador, no âmbito do SUS parte do pressuposto que o sistema de saúde, embora deva ser preservado nas suas peculiaridades regionais que impliquem um respeito às diversas culturas e características populacionais, por ser único, também deve manter linhas mestras de atuação, especialmente pela necessidade de se compatibilizarem instrumentos, bancos de informações e intercâmbio de experiências.
As recomendações aqui apresentadas são fruto de alguns anos de discussão acumulada e extraída de diversas experiências de vigilância em saúde do trabalhador, em vários estados e municípios de todo o País. Trata-se de uma primeira aproximação normativa não só com os Programas Estaduais e Municipais de Saúde do Trabalhador, já instalados e em fase de instalação, mas, também com as estruturas de atenção à saúde das Secretarias Estaduais e Municipais, especialmente nas áreas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária.
A possibilidade de traduzir a capilaridade institucional do setor saúde em instâncias efetoras de mudança dos perfis de morbidade e mortalidade, resultantes da relação trabalho-ambiente-consumo e saúde, pressupõe um comprometimento das estruturas de atenção à saúde, em especial as de vigilância e fiscalização em saúde.
O objetivo da Instrução Normativa é, em suma, o de poder instrumentalizar minimamente os setores responsáveis pela vigilância e defesa da saúde, nas Secretarias de Estados e Municípios, de forma a incorporarem em suas práticas mecanismos de análise e intervenção sobre os processos e os ambientes de trabalho.
A abordagem de vigilância em saúde do trabalhador, considerada na Instrução Normativa, implica a superação dos limites conceituais e institucionais, tradicionalmente estruturados nos serviços de saúde, das ações dissociadas de vigilância epidemiológica e sanitária.
Além disso, nas ações de vigilância e fiscalização sanitária, propriamente ditas, implica-se transpor o objeto usual - o produto/consumidor - de forma a considerar, igualmente, como objeto, o processo/trabalhador/ambiente.
Dessa forma, a vigilância em saúde do trabalhador calca-se no modelo epidemiológico de pesquisa dos agravos, nos diversos níveis da relação entre o trabalho e a saúde, agregando ao universo da avaliação e análise a capacidade imediata da intervenção sobre os fatores determinantes dos danos à saúde.
Devido à sua concepção mais abrangente de saúde, relacionada ao processo de produção, capaz de lidar com a diversidade, a complexidade e o surgimento de novas formas de adoecer, a vigilância em saúde do trabalhador ultrapassa o aspecto normativo tratado pela fiscalização tradicional.
Em razão dessas implicações, a vigilância em saúde do trabalhador pressupõe uma rede de articulações que passa, fundamentalmente, pelos trabalhadores e suas organizações, pela área de pesquisa e formação de recursos humanos e pelas áreas de assistência e reabilitação.
Finalmente, levando-se em consideração o fato de ser uma área ainda em construção dentro do SUS, pretende-se que esta Instrução Normativa possa ser aprimorada, com a maior brevidade, uma vez utilizada pela rede de serviços, assim como se constitui na primeira de uma série de publicações normativas e orientadoras, relacionadas a temas específicos em saúde do trabalhador.
2 - Conceituação básica
A Vigilância em Saúde do Trabalhador compreende uma atuação contínua e sistemática, ao longo do tempo, no sentido de detectar, conhecer, pesquisar e analisar os fatores determinantes e condicionantes dos agravos à saúde relacionados aos processos e ambientes de trabalho, em seus aspectos tecnológico, social, organizacional e epidemiológico, com a finalidade de planejar, executar e avaliar intervenções sobre esses aspectos, de forma a eliminá-los ou controlá-los.
A Vigilância em Saúde do Trabalhador compõe um conjunto de práticas sanitárias, articuladas suprassetorialmente, cuja especificidade está centrada na relação da saúde com o ambiente e os processos de trabalho e nesta com a assistência, calcado nos princípios da vigilância em saúde, para a melhoria das condições de vida e saúde da população.
A Vigilância em Saúde do Trabalhador não constitui uma área desvinculada e independente da vigilância em saúde como um todo mas, ao contrário, pretende acrescentar ao conjunto de ações da vigilância em saúde estratégias de produção de conhecimentos e mecanismos de intervenção sobre os processos de produção, aproximando os diversos objetos comuns das práticas sanitárias àqueles oriundos da relação entre o trabalho e a saúde.
3 - Princípios
A Vigilância em Saúde do Trabalhador pauta-se nos princípios do SUS, em consonância com os Sistemas Nacionais de Vigilância Sanitária e de Vigilância Epidemiológica, articulada com a área assistencial.
Além disso, tendo em vista a complexidade e a abrangência do objeto da vigilância, guarda peculiaridades que transpõem os limites setoriais da saúde, implicando a ampliação de sua abordagem.
Como princípios, esquematicamente, pode-se considerar:
3.1 - Universalidade: todos os trabalhadores, independentemente de sua localização, urbana ou rural, de sua forma de inserção no mercado de trabalho, formal ou informal, de seu vínculo empregatício, público ou privado, autônomo, doméstico, aposentado ou demitido são objeto e sujeitos da Vigilância em Saúde do Trabalhador.
3.2 - Integralidade das ações: o entendimento de atenção integral à saúde do trabalhador, compreendendo a assistência e recuperação dos agravos, os aspectos preventivos implicando intervenção sobre seus fatores determinantes em nível dos processos de trabalho e a promoção da saúde que implicam ações articuladas com os próprios trabalhadores e suas representações. A ênfase deve ser dirigida ao fato de que as ações individuais/curativas articulam-se com as ações coletivas, no âmbito da vigilância, considerando que os agravos à saúde do trabalhador são absolutamente preveníveis.
3 3 - Pluriinstitucionalidade: articulação, com formação de redes e sistemas, entre as instâncias de vigilância em saúde do trabalhador e os centros de assistência e reabilitação, as universidades e centros de pesquisa e as instituições públicas com responsabilidade na área de saúde do trabalhador consumo e ambiente.
3 4 - Controle social incorporação dos trabalhadores e das suas organizações, principalmente as sindicais, em todas as etapas da vigilância em saúde do trabalhador, compreendendo sua participação na identificação das demandas, no planejamento, no estabelecimento de prioridades e adoção de estratégias, na execução das ações, no seu acompanhamento e avaliação e no controle da aplicação de recursos.
3 5 - Hierarquização e descentralização: consolidação do papel do município e dos distritos sanitários como instância efetiva de desenvolvimento das ações de vigilância em saúde do trabalhador integrando os níveis estadual e nacional do SUS, no espectro da ação, em função de sua complexidade.
3.6 - Interdisciplinaridade: a abordagem multiprofissional sobre o objeto da vigilância em saúde do trabalhador deve contemplar os saberes técnicos, com a concorrência de diferentes áreas do conhecimento e, fundamentalmente, o saber operário, necessários para o desenvolvimento da ação.
3.7 - Pesquisa-intervenção: o entendimento de que a intervenção, no âmbito da vigilância em saúde do trabalhador, é o deflagrador de um processo contínuo, ao longo do tempo, em que a pesquisa é sua parte indissolúvel, subsidiando e aprimorando a própria intervenção.
3.8 - O caráter transformador: a intervenção sobre os fatores determinantes e condicionantes dos problemas de saúde relacionados aos processos e ambientes de trabalho com o entendimento de que a vigilância em saúde do trabalhador, sob a lógica do controle social e da transparência das ações, pode ter na intervenção um caráter proponente de mudanças dos processos de trabalho, a partir das análises tecnológica, ergonômica, organizacional e ambiental efetuadas pelo coletivo de instituições, sindicatos, trabalhadores e empresas, inclusive, superando a própria legislação.
4 - Objetivos:
De forma esquemática pode-se dizer que a vigilância em saúde do trabalhador tem como objetivos:
a - conhecer a realidade de saúde da população trabalhadora, independentemente da forma de inserção no mercado de trabalho e do vínculo trabalhista estabelecido, considerando:
a1 - a caracterização de sua forma de adoecer e morrer em função da sua relação com o processo de trabalho;
a2 - o levantamento histórico dos perfis de morbidade e mortalidade em função da sua relação com o processo de trabalho;
a3 - a avaliação do processo, do ambiente e das condições em que o trabalho se realiza, identificando os riscos e cargas de trabalho a que está sujeita, nos seus aspectos tecnológicos ergonômicos e organizacionais já conhecidos;
a4 - a pesquisa e a análise de novas e ainda desconhecidas formas de adoecer e morrer em decorrência do trabalho;
b - intervir nos fatores determinantes de agravos à saúde da população trabalhadora, visando eliminá-los ou, na sua impossibilidade, atenuá-los e controlá-los, considerando:
b1 - a fiscalização do processo, do ambiente e das condições em que o trabalho se realiza, fazendo cumprir, com rigor, as normas e legislações existentes, nacionais ou mesmo internacionais quando relacionadas à promoção da saúde do trabalhador;
b2 - a negociação coletiva em saúde do trabalhador, além dos preceitos legais estabelecidos, quando se impuser a transformação do processo, do ambiente e das condições em que o trabalho se realiza, não prevista normativamente;
c - avaliar o impacto das medidas adotadas para a eliminação, atenuação e controle dos fatores determinantes de agravos à saúde, considerando:
c1 - a possibilidade de transformar os perfis de morbidade e mortalidade;
c2 - o aprimoramento contínuo da qualidade de vida no trabalho;
d - subsidiar a tomada de decisões dos órgãos competentes, nas três esferas de governo considerando:
d1 - o estabelecimento de políticas públicas, contemplando a relação entre o trabalho e a saúde no campo de abrangência da vigilância em saúde;
d2 - a interveniência, junto às instâncias do Estado e da sociedade, para o aprimoramento das normas legais existentes e para a criação de novas normas legais em defesa da saúde dos trabalhadores;
d3 - o planejamento das ações e o estabelecimento de suas estratégias;
d4 - a participação na estruturação de serviços de atenção à saúde dos trabalhadores;
d5 - a participação na formação, capacitação e treinamento de recursos humanos com interesse na área;
e - estabelecer sistemas de informação em saúde do trabalhador, junto às estruturas existentes no setor saúde, considerando:
e1 - a criação de bases de dados comportando todas as informações oriundas do processo de vigilância e incorporando as informações tradicionais já existentes;
e2 - a divulgação sistemática das informações analisadas e consolidadas.
5 - Estratégias
A vigilância em saúde do trabalhador, como um conjunto de práticas sanitárias contínuas, calcada, entre outros princípios, na interdisciplinaridade, na pluriinstitucionalidade, no controle social, balizada na configuração do SUS, e tendo como imagem-objetivo a melhoria da qualidade de vida no trabalho, pressupõe o estabelecimento de estratégias operacionais para alcançá-Ia.
Embora cada Estado, Região ou Município, guardadas suas características, deva buscar a melhor forma de estabelecer suas próprias estratégias de vigilância, alguns pressupostos podem ser considerados como aplicáveis ao conjunto do SUS. Dentre os passos que podem ser estabelecidos na estratégia de operacionalização das ações, buscando manter uma lógica sequencial de consolidação da vigilância, pode-se destacar:
5.1 - Onde já existam estruturas, estaduais e municipais, de saúde do trabalhador - Programas, Coordenações, Divisões, Gerências, Centros, Núcleos - promover e/ou aprofundar a relação institucional com as estruturas de Vigilância Epidemiológica, Vigilância Sanitária e Fiscalização Sanitária, buscando a superação da dicotomia existente em suas práticas, em que o objeto de ação da vigilância, em geral, não contempla o processo de produção e sua relação com a saúde dos trabalhadores. Com este intuito, recomenda-se a constituição de equipes multiprofissionais para a execução de ações interdisciplinares e pluriinstitucionais.
5.2 - Recomenda-se a criação de comissão, na forma colegiada, com a participação de trabalhadores, suas organizações sindicais e instituições públicas com responsabilidades em saúde do trabalhador, vinculada organicamente ao SUS e subordinada aos Conselhos Estaduais e Municipais de Saúde, com a finalidade de assessorá-lo na definição de políticas, no estabelecimento de diretrizes e prioridades, e no acompanhamento e avaliação da execução das ações de saúde do trabalhador.
5.3 - Dada a abrangência e as dificuldades operacionais de se implementarem, simultaneamente, ações de vigilância em todos os ambientes de trabalho, em um dado município ou região, faz-se necessário o planejamento dessas ações com o estabelecimento de prioridades, visando a intervenções de impacto, com efeitos educativos e disciplinadores sobre o setor. Para tanto, recomenda-se a adoção de alguns critérios como:
- Base Sindical: Uma vez que um determinado sindicato de trabalhadores, com alguma tradição de luta pela saúde identifique e encaminhe situações-problema, junto à estrutura de vigilância, desencadeia-se uma ação integrada que visa atuar não apenas na empresa denunciada, mas nas principais empresas abrangidas por aquela categoria de trabalhadores. O investimento da ação nesta base deve considerar a capacidade de reprodutibilidade, a partir do sindicato em questão e para o movimento sindical como um todo, numa dada região.
- Ramo Produtivo: Consiste na atuação em todas as empresas com o mesmo perfil produtivo, capaz de se constituir em fonte de risco para a saúde, preponderantes numa dada região, independente da capacidade de mobilização dos sindicatos envolvidos. A utilização deste critério pode se dar por avaliação epidemiológica dos casos notificados, denúncias sucessivas ou análise dos processos produtivos. O investimento da ação, neste caso, visa à mudança dos processos de forma integrada, sem a punição de uma empresa em particular, mas intervindo em todas as empresas daquele setor e, em especial, nas que apresentam grande concentração de trabalhadores, sempre buscando a atuação conjunta com os sindicatos das categorias expostas.
- Território: Consiste na intervenção por varredura, em pequena área geográfica previamente delimitada (setor censitário, distrito de saúde, bairro, distrito industrial etc.), de todos os processos produtivos capazes de gerar dano à saúde. O investimento da ação, neste caso, visa abranger todos os trabalhadores, ao longo do tempo, a despeito de sua forma de inserção no mercado de trabalho e seu vínculo de emprego, a partir da elaboração de mapas dos processos produtivos, de modo a estabelecer um perfil de risco à saúde dos trabalhadores.
- Epidemiológico (evento-sentinela): Consiste na intervenção nas empresas, a partir de agravos à saúde dos trabalhadores que podem representar um problema coletivo, ainda não detectado, e mesmo um problema epidemiológico relevante, mas submerso. A intervenção dirige-se à maior ou às maiores empresas considerando os aspectos potenciais de frequência elou gravidade dos eventos-sentinela.
É importante salientar que os critérios acima não obedecem à ordem de hierarquia e tampouco são excludentes, podendo ser utilizados de forma combinada.
5.4 - Como estratégia de consolidação das ações de vigilância em saúde do trabalhador é fundamental que os estados e os municípios contemplem o tema na revisão de seus códigos de saúde.
6 - Metodologia
Considerando os objetivos da vigilância em saúde do trabalhador - conhecer a realidade para transformá-la, buscando um aprimoramento da qualidade de vida no trabalho, é necessário que se adotem metodologias capazes de estabelecer um diagnóstico situacional, dentro do princípio da pesquisa-intervenção, e capazes, ainda, de avaliar de modo permanente os seus resultados no sentido das mudanças pretendidas.
Nesta linha, podem-se observar alguns pressupostos de caráter metodológico, compreendendo:
6.1 - Fase preparatória: Uma vez identificada a demanda, com base nas estratégias relacionadas, o planejamento da ação pressupõe uma fase preparatória, em que a equipe busca conhecer, com o maior aprofundamento possível, o(s) processo(s), o ambiente e as condições de trabalho do local onde será realizada a ação.
A preparação deve ser efetuada por meio de análise conjunta com os trabalhadores da(s) empresa(s) - objeto da vigilância e dos representantes sindicais daquela(s) categoria(s), tendo por objetivo não só aprofundar o conhecimento sobre o objeto da vigilância, através de seu saber operário mas, principalmente, traçar estratégias de desenvolvimento da ação. Deve-se lançar mão, ainda nesta fase, de consulta bibliográfica especializada e das informações locais disponíveis acerca do caso em questão.
6.2 - A intervenção (inspeção/fiscalização sanitária)
A intervenção, realizada em conjunto com os representantes dos trabalhadores, de outras instituições, e sob a responsabilidade administrativa da equipe da Secretaria Estadual e/ou Municipal de Saúde, deverá considerar, na inspeção sanitária em saúde do trabalhador, a observância das normas e legislações que regulamentam a relação entre o trabalho e a saúde, de qualquer origem, especialmente na esfera da saúde, do trabalho, da previdência, do meio ambiente e das internacionais ratificadas pelo Brasil.
Além disso, é.preciso considerar os aspectos passíveis de causar dano à saúde, mesmo que não estejam previstos nas legislações, considerando-se não só a observação direta por parte da equipe de situações de risco à saúde como, também, as questões subjetivas referidas pelos trabalhadores na relação de sua saúde com o trabalho realizado.
Os instrumentos administrativos de registro da ação, de exigências e outras medidas são os mesmos utilizados pelas áreas de Vigilância/Fiscalização Sanitária, tais como os Termos de Visita, Notificação, Intimação, Auto de Infração etc.
6.3 - Análise dos processos
Uma forma importante de considerar a capacidade potencial de adoecer no processo, no ambiente ou em decorrência das condições em que o trabalho se realiza é utilizar instrumentos que inventariem o processo produtivo e a sua forma de organização. Os instrumentos metodológicos, a serem estabelecidos no âmbito do SUS, devem ser entregues no ato da inspeção, para serem preenchidos pela empresa, e o Roteiro de Vigilância, construído e aplicado pela equipe, no momento da ação, é outra forma de conhecer os processos.
6.4 - Inquéritos
Como proposta metodológica de investigação, no mesmo tempo da intervenção, podem-se organizar inquéritos, por meio da equipe interdisciplinar e de representantes sindicais e/ou dos trabalhadores, aplicando questionários ao conjunto dos trabalhadores, contemplando a sua percepção da relação entre trabalho e saúde, a morbidade referida (sinais e sintomas objetivos e subjetivos), a vivência com o acidente e o quase acidente de trabalho (incidente crítico), consigo e com os companheiros, e suas sugestões para a transformação do processo, do ambiente e das condições em que o trabalho se realiza.
6.5 - Mapeamento de riscos
Podem-se utilizar algumas técnicas de mapeamento de riscos dos processos produtivos, de forma gradualmente mais complexa, à medida que a intervenção se consolide e as mudanças vão ocorrendo, sempre com a participação dos trabalhadores na sua elaboração.
Uma das técnicas que deve ser utilizada, especialmente em casos de acidentes graves e fatais, é a metodologia de árvore de causas para a investigação dos fatores determinantes do evento, que será objeto de publicação posterior.
Com a concorrência interdisciplinar, na equipe, de profissionais de áreas diversas e à medida que os trabalhadores se apropriem de novos conhecimentos acerca do tema, aprofunda-se a investigação, por intermédio da utilização de técnicas mais sofisticadas.
É importante mapear, além dos riscos tradicionalmente reconhecidos, as chamadas cargas de trabalho e as formas de desgaste do trabalhador.
6.6 - Estudos epidemiológicos
Os estudos epidemiológicos clássicos, tais como os seccionais, de coorte e caso controle, podem ser aplicados sempre que se identificar sua necessidade, igualmente com a concorrência, na equipe interdisciplinar de técnicos das universidades e centros de pesquisa; como assessores da equipe.
6.7 - Acompanhamento do processo
A intervenção implica a confecção de um relatório detalhado, incorporando o conjunto de informações coletadas, elaborado pela equipe, com a participação dos trabalhadores, servindo como parâmetro de avaliações futuras.
Em razão do ritmo de implementação das medidas, avalia-se a necessidade do envolvimento de outras instâncias como, por exemplo, o Ministério Público, com o objetivo de garantir as mudanças requeridas.
Cabe ressaltar que o entendimento da intervenção deve ser o de um processo de acompanhamento e avaliação, ao longo do tempo, em que se deve buscar a negociação com as diversas instâncias, objetivando o aprimoramento da qualidade de vida no trabalho.
7 - Informações básicas
As informações de interesse para as ações em saúde do trabalhador, atualmente disponíveis, limitam-se à avaliação do perfil de morbi-mortalidade da população em geral, sem lograr o conhecimento sistemático dos riscos e o dimensionamento da população trabalhadora a eles exposta, que permitam a análise e a intervenção sobre seus determinantes. É pensando na necessidade de se avançar nesse conhecimento para fins de intervenção e prevenção efetivas dos agravos relacionados ao trabalho, que foi definido o elenco de informações aqui apresentadas, sem perder a perspectiva de ser acrescidas outras de interesse local, regional ou mesmo nacional, à medida que o sistema de informações em saúde do trabalhador se estruture e se consolide.
7.1 - Informações acerca da mortalidade
As informações de mortalidade serão coletadas principalmente a partir da Declaração de Óbito, por intermédio do Sistema de Informações sobre Mortalidade (SIM). Cada Município deverá investir na melhoria da qualidade dos dados da Declaração de Óbito e, sempre que possível, cruzar com outras informações disponíveis, principalmente a Comunicação de Acidente de Trabalho (CAT), da Previdência Social.
7.2 - Informações acerca da morbidade
As informações de morbidade podem ser obtidas de diversas fontes, tais como a Ficha Individual de Notificação de Agravos referente às doenças incluídas no Sistema de .Notificação de Agravos Notificáveis (SINAN), a CAT, normalmente utilizada para os trabalhadores do mercado formal de trabalho, regido pela Consolidação das Leis Trabalhistas (CLT); as fichas, prontuários e outros documentos oriundos dos atendimentos ambulatoriais (SIA/SUS) e de internações (SIH/SUS) na rede de serviços de saúde.
Os estados e os municípios poderão definir eventos-sentinela a ser notificados, incluindo-os no SINAN. Essa definição deverá ter por referência a análise do parque produtivo local ou a suspeita da existência de um agravo não diagnosticado como relacionado ao trabalho. A análise dos eventos-sentinela constituir-se-á em atividade complementar ao sistema de informações, particularmente neste momento em que o diagnóstico de doenças é muito reduzido. Observar, por exemplo, excessos de mortes ou morbidade por alguns tipos de cânceres ou de achados laboratoriais (leucopenias, anemias) que possam estar ocorrendo em grupos específicos de trabalhadores.
7.3 - Informações relativas às atividades e aos processos produtivos
Essas informações deverão ser obtidas à medida que os estados e os municípios executem e implantem as ações de vigilância.
Consideram-se, neste caso, Cadastros de Estabelecimentos, Relatórios de Inspeção, Termos de Notificação e Fichas de Vigilância.
Outras informações, utilizando os bancos de dados da RAIS e do IBGE, também poderão ser incorporadas, devendo ser desagregadas, por Município, para que possam ser adequadas aos níveis locais.
Outras fontes de informação que deverão ser utilizadas, à medida que o sistema se capacite para tal, são as dos serviços médicos e de segurança e higiene industrial de empresas, do Anexo I da CIPA (Norma Regulamentadora nº 5, Portaria nº 3.214/78, MTb), dos sindicatos, das associações patronais, dos serviços/institutos de medicina legal, de associações e entidades civis (associações de moradores, grupos ecológicos, culturais), de outros órgãos da administração pública (Detran), secretarias de proteção ambiental, de indústria e comércio, do trabalho etc). Devem ser considerados ainda estudos epidemiológicos e resultados de pesquisas de interesse da área de saúde do trabalhador, como fonte de informações.
Um maior detalhamento acerca da criação de bancos de dados e adequação das informações em saúde do trabalhador aos Sistemas de Informação existentes, considerando, entre outros, a coleta, o fluxo, o processamento, a análise e a divulgação das informações, será efetuado em publicação posterior.
Os estados e os municípios poderão acrescentar outras informações e metodologias que julgarem pertinentes, inclusive sugerindo sua incorporação em âmbito nacional nas publicações subsequentes.
8 - Considerações finais
A construção do SUS pressupõe um esforço permanente na afirmação de seus princípios e na ampliação das redes solidárias institucionais com a sociedade organizada.
Dentro do SUS, a área de saúde do trabalhador emerge como um desafio a mais, no sentido de se proverem os meios necessários para atender com primazia o que, a partir de 1988, com a Constituição Federal, passou a ser atribuição precípua das Secretarias de Saúde de Estados e Municípios: a Vigilância em Saúde do Trabalhador.
É preciso considerar, contudo, as dificuldades inerentes ao sistema de saúde, cujas práticas tradicionais, de há muito enraizadas: não dispõem de mecanismos ágeis de adequação às novas necessidades, determinadas pela lei e, mesmo, ansiadas pela sociedade.
Com este intuito, a Instrução Normativa de Vigilância em Saúde do Trabalhador pretende ser um instrumento capaz de ser um móvel de sensibilização e de ampliação das redes solidárias de construção da área especificá e do próprio SUS.
Nesta perspectiva, pretende-se, ainda, com esta Instrução Normativa, iniciar uma série de publicações temáticas afins, entre as quais se destacam as questões dos Agrotóxicos, dos Sistemas de Informações, da Investigação de Acidentes de Trabalho, das Intoxicações por Metais Pesados, dos Agravos de Caráter Ergonômico, das Pneumopatias de Origem Ocupacional.
ANEXO LXXX
LISTA DE DOENÇAS RELACIONADAS AO TRABALHO (Origem: PRT MS/GM 1339/1999, Anexo 1)
(Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
AGENTES ETIOLÓGICOS OU FATORES DE RISCO DE NATUREZA OCUPACIONAL E DOENÇAS CAUSALMENTE RELACIONADAS COM OS RESPECTIVOS AGENTES OU FATORES DE RISCO (DENOMINADAS E CODIFICADAS SEGUNDO A CID-10)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DOENÇAS INFECCIOSAS E PARASITÁRIAS RELACIONADAS COM O TRABALHO (Grupo I da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
NEOPLASIAS (TUMORES) RELACIONADOS COM O TRABALHO (GRUPO II da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
DOENÇAS DO SANGUE E DOS ÓRGÃOS HEMATOPOÉTICOS RELACIONADAS COM O TRABALHO (Grupo III da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
|
- Radiações ionizantes (W88.-) (Quadro 24) |
|
- Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
|
- Cloreto de Vinila (X46.-)(Quadro 13) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
|
- Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Derivados do Fenol, Pentaclorofenol, Hidroxibenzonitrilo (X49.-; XZ57.5) |
|
- Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
|
DOENÇAS ENDÓCRINAS, NUTRICIONAIS E METABÓLICAS RELACIONADAS COM O TRABALHO (Grupo IV da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Hidrocarbonetos halogenados (Clorobenzeno e seus derivados) (X46.-; Z57.5) (Quadro 13) - Tiuracil (X49.-; Z57.5) - Tiocinatos (X49.-; Z57.5) - Tiuréia (X49.-; Z57.5) |
|
TRANSTORNOS MENTAIS E DO COMPORTAMENTO RELACIONADOS COM O TRABALHO (Grupo V da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
-Substâncias asfixiantes: CO, H2S, etc. (seqüela) (X47.-; Z57.5) (Quadro 17) -Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) |
|
- Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) |
|
Transtorno Cognitivo Leve (F06.7) |
- Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
Transtorno Orgânico de Personalidade (F07.0) Outros transtornos de personalidade e de comportamento decorrentes de doença, lesão ou disfunção cerebral (F07.8) |
- Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
- Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
|
-Circunstância relativa às condições de trabalho (Y96) |
|
- Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
|
Estado de "Stress" Pós-Traumático (F43.1) |
-Circunstância relativa às condições de trabalho (Y96) |
- Tricloroetileno, Tetracloroetileno, Tricloroetano e outros solventes orgânicos halogenados (X46.-; Z57.5) (Quadro 13) - Brometo de Metila (X46.-; Z57.4 e Z57.5) (Quadro 13) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) - Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
|
-Circunstância relativa às condições de trabalho (Y96) |
|
- Outras dificuldades físicase mentais relacionadas com o trabalho (Z56.6) |
- Outras dificuldades físicas e mentais relacionadas com o trabalho (Z56.6) |
DOENÇAS DO SISTEMA NERVOSO RELACIONADAS COM O TRABALHO (Grupo VI da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Tetracloroetano (X46.-; Z57.5) (Quadro 13) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) -Outros solventes orgânicos neurotóxicos (X46.-; X49.-; Z57.5) |
|
- Cloreto de metileno (Diclorometano) e outros solventes halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) |
|
(Inclui "Anosmia") |
- Sulfeto de hidrogênio (X49.-; Z57.5) (Quadro 17) |
Síndrome do Túnel do Carpo (G56.0) Outras Lesões do Nervo Mediano: Síndrome do Pronador Redondo (G56.1) Síndrome do Canal de Guyon (G56.2) Lesão do Nervo Cubital (ulnar): Sindrome do Túnel Cubital (G56.2) Lesão do Nervo Radial (G56.3) Outras Mononeuropatias dos Membros Superiores: Compressão do Nervo Supraescapular (G56.8) |
|
Lesão do Nervo Poplíteo Lateral (G57.3) |
|
- Chumbo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Fósforo (X48.-; X49.-; Z57.4 e Z57.5) (Quadro 12) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) - n-Hexano (X46.-; Z57.5) (Quadro 13) - Metil-n-Butil Cetona (MBK) (X46.-; Z57.5) |
|
- Chumbo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Hidrocarbonetos alifáticos ou aromáticos (seus derivados halogenados neurotóxicos) (X46.-; Z57.5) (Quadro 13) - Mercúrio e seus derivados tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) |
|
-Chumbo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Solventes orgânicos halogenados neurotóxicos (X46.-; Z57.5) (Quadro 13) -Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) -Substâncias asfixiantes: CO, H2S, etc. (seqüela) (X47.-; Z57.5) (Quadro 17) - Sulfeto de Carbono (X49.-; Z57.5) (Quadro 19) |
DOENÇAS DO OLHO E ANEXOS RELACIONADAS COM O TRABALHO (Grupo VII da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Radiações Ionizantes (W88.-; Z57.1) (Quadro 24) - Cimento (X49.-; Z57.2) |
|
- Berílio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 4) - Flúor e seus compostos tóxicos (X49.-) (Quadro 11) - Iodo (X49.-; Z57.5) (Quadro 14) - Cloreto de etila (X46.-; Z57.5) (Quadro 13) - Tetracloreto de carbono (X46.-; Z57.5) (Quadro 13) - Outros solventes halogenados tóxicos (X46.-; Z57.4 e Z57.5) (Quadro 13) - Ácido sulfídrico (Sulfeto de hidrogênio) (X49.-; Z57.5) (Quadro 17) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Radiações Ultravioletas (W89; Z57.1 - Acrilatos (X49.-; Z57.5) - Cimento (X49.-; Z57.2) - Enzimas de origem animal, vegetal ou bacteriana (X44.-; Z57.2) - Furfural e Álcoól Furfurílico (X45.-; Z57.5) - Isocianatos orgânicos (X49.-; Z57.5) - Selênio e seus compostos (X49.-; Z57.5) |
|
- Ácido sulfídrico (Sulfeto de hidrogênio) (X49.-; Z57.5) (Quadro 17) - Radiações ionizantes (W88.-; Z57.1) (Quadro 24) - Radiações Infravermelhas (W90.-; Z57.1)} - Radiações Ultravioletas (W89.-; Z57.1) |
|
- Radiações Infravermelhas (W90.-; Z57.1) |
|
- Cloreto de metileno (Diclorometano) e outros solventes clorados neurotóxicos (X46.-; Z57.5) (Quadro 13) - Tetracloreto de carbono (X46.-; Z57.5) (Quadro 13) - Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) -Metanol (X45.-; Z57.5) |
|
- Cloreto de metileno e outros solventes clorados neurotóxicos (X46.-; Z57.5) (Quadro 13) |
DOENÇAS DO OUVIDO RELACIONADAS COM O TRABALHO (Grupo VIII da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Pressão atmosférica inferior à pressão padrão (W94.-; Z57.8) |
|
- Pressão atmosférica inferior à pressão padrão (W94.-; Z57.8) |
|
- "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) |
|
-Solventes orgânicos otoneurotóxicos (X46.-; Z57.8) (Quadro 13) |
|
Otalgia (H92.0), Otorréia (H92.1) ou Otorragia (H92.2) |
|
- "Ar Comprimido" (W94.-; Z57.8) (Quadro 23) |
|
- Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-; Z57.8) |
|
- Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-) |
|
- Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-; Z57.8) |
|
- Alterações na pressão atmosférica ou na pressão da água no ambiente (W94.-; Z57.8) |
DOENÇAS DO SISTEMA CIRCULATÓRIO RELACIONADAS COM O TRABALHO (Grupo IX da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
-Exposição ocupacional ao Ruído (Z57.0; X42.-) (Quadro 21) -Problemas relacionados com o emprego e com o desemprego (Z56.-) |
|
- Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) - Nitroglicerina e outros ésteres do ácido nítrico (X49.-; Z57.5) - Problemas relacionados com o emprego e com o desemprego (Z56.-) |
|
-Sulfeto de Carbono (X49.-; Z57.5)(Quadro 19) -Nitroglicerina e outros ésteres do ácido nítrico (X49.-; Z57.5) -Problemas relacionados com o emprego e com o desemprego (Z56.-) |
|
-Monóxido de Carbono (X47.-; Z57.5) (Quadro 17.1) -Outros agentes potencialmente causadores de arritmia cardíaca (Z57.5) |
|
-Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) -Derivados halogenados dos hidrocarbonetos alifáticos (X46.-; Z57.5) (Quadro 13) -Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) -Monóxido de Carbono (X47.-; Z57.5) (Quadro 17.1) -Agrotóxicos organofosforados e carbamatos (X48; Z57.4) (Quadros 12 e 27) -Exposição ocupacional a Cobalto (X49.-; Z57.5) -Nitroglicerina e outros ésteres do ácido nítrico (X49.-; Z57.5) -Problemas relacionados com o emprego e com o desemprego (Z56.-) |
|
Doença Ateroesclerótica do Coração (I25.1) |
|
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) - Trabalho em baixas temperaturas (frio) (W93.-; Z57.6) |
|
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) - Trabalho em baixas temperaturas (frio) (W93.-; Z57.6) |
DOENÇAS DO SISTEMA RESPIRATÓRIO RELACIONADAS COM O TRABALHO (Grupo X da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Iodo (X49.-; Z57.5)(Quadro 14) |
|
- Iodo (X49.-; Z57.5)(Quadro 14) |
|
-Cromo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 10) -Poeiras de algodão, linho, cânhamo ou sisal (Z57.2) (Quadro 26) -Acrilatos (X49.-; Z57.5) -Aldeído fórmico e seus polímeros (X49.-; Z57.5) -Aminas aromáticas e seus derivados (X49.-; Z57.5) -Anidrido ftálico (X49.-; Z57.5) -Azodicarbonamida (X49.-; Z57.5) -Carbetos de metais duros: cobalto e titânio (Z57.2) -Enzimas de origem animal, vegetal ou bacteriano (X44.-; Z57.3) -Furfural e Álcoól Furfurílico (X45.-; Z57.5) -Isocianatos orgânicos (X49.-; Z57.5) -Níquel e seus compostos (X49.-; Z57.5) -Pentóxido de vanádio (X49.-; Z57.5) -Produtos da pirólise de plásticos, cloreto de vinila, teflon (X49.-; Z57.5) -Sulfitos, bissulfitos e persulfatos (X49.-; Z57.5) -Medicamentos: macrólidos; ranetidina; penicilina e seus sais; cefalosporinas (X44.-; Z57.3) -Proteínas animais em aerossóis (Z57.3) -Outras substâncias de origem vegetal (cereais, farinhas, serragem, etc.) (Z57.2) -Outras susbtâncias químicas sensibilizantes da pele e das vias respiratórias (X49.-; Z57.2) (Quadro 27) |
|
- Cloro gasoso (X47.-; Z57.5)(Quadro 9) - Cromo e seus compostos tóxicos (X49.-) (Quadro 10) - Gás de flúor e Fluoreto de Hidrogênio (X47.-; Z57.5) (Quadro 11) - Amônia (X47.-; Z57.5) - Anidrido sulfuroso (X49.-; Z57.5) - Cimento (Z57.2) - Fenol e homólogos (X46.-; Z57.5) - Névoas de ácidos minerais (X47.-; Z57.5) - Níquel e seus compostos (X49.-; Z57.5) - Selênio e seus compostos (X49.-; Z57.5) |
|
- Iodo (X49.-; Z57.5)(Quadro 14) |
|
- Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Cromo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 10) - Soluções e aeoressóis de Ácido Cianídrico e seus derivados (X47.-; Z57.5) (Quadro17) |
|
- Cromo e seus compostos tóxicos (X49.-; Z57.5) (Quadro 10) |
|
- Exposição ocupacional a poeiras de algodão, linho, cânhamo ou sisal (Z57.2-) (Quadro 26) - Amônia (X49.-; Z57.5) - Anidrido sulfuroso (X49.-; Z57.5) - Névoas e aerossóis de ácidos minerais (X47.-; Z57.5) - Exposição ocupacional a poeiras de carvão mineral (Z57.2) |
|
- Exposição ocupacional a poeiras de sílica-livre (Z57.2) (Quadro 18) |
|
- Exposição ocupacional a poeiras de carbetos de metais duros (Cobalto, Titânio, etc.) (Z57.2) - Exposição ocupacional a rocha fosfática (Z57.2) - Exposição ocupacional a poeiras de alumina (Al2O3) ("Doença de Shaver") (Z57.2) |
|
Bissinose (J66.0), devidas a outras poeiras orgânicas especificadas (J66.8) |
|
Pulmão do Granjeiro (ou Pulmão do Fazendeiro) (J67.0) Bagaçose (J67.1); Pulmão dos Criadores de Pássaros (J67.2) Suberose (J67.3) Pulmão dos Trabalhadores de Malte (J67.4) Pulmão dos que Trabalham com Cogumelos (J67.5) Doença Pulmonar Devida a Sistemas de Ar Condicionado e de Umidificação do Ar (J67.7) Pneumonites de Hipersensibilidade Devidas a Outras Poeiras Orgânicas (J67.8) Pneumonite de Hipersensibilidade Devida a Poeira Orgânica não especificada (Alveolite Alérgica Extrínseca SOE; Pneumonite de Hipersensibilidade SOE (J67.0) |
- Exposição ocupacional a outras poeiras orgânicas (Z57.2) |
- Bromo (X49.-; Z57.5)(Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5)(Quadro 6) - Gás Cloro (X47.-; Z57.5) (Quadro 9) - Flúor ou seus compostos tóxicos (X47.-; Z57.5) (Quadro 11) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) -Iodo (X49.-; Z57.5) (Quadro 14) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Cianeto de hidrogênio (X47.-; Z57.5) (Quadro 17) |
|
- Bromo (X49.-; Z57.5)(Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Gás Cloro (X47.-; Z57.5) (Quadro 9) - Flúor e seus compostos (X47.-; Z57.5) (Quadro 11) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) - Iodo (X49.-; Z57.5) (Quadro 14) - Cianeto de hidrogênio (X47.-; Z57.5) (Quadro 17) |
|
- Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Gás Cloro (X47.-; Z57.5)(Quadro 9) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) - Iodo (X49.-; Z57.5)(Quadro 14) - Cianeto de hidrogênio (X47.-; Z57.5) (Quadro 17) - Amônia (X49.-; Z57.5) |
|
- Berílio e seus compostos (X49.-; Z57.5) (Quadro 4) - Bromo (X49.-; Z57.5)(Quadro 5) - Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) - Gás Cloro (X47.-; Z57.5) (Quadro 9) - Flúor e seus compostos (X47.-; Z57.5) (Quadro 11) - Solventes halogenados irritantes respiratórios (X46.-; Z57.5) (Quadro 13) - Iodo (X49.-; Z57.5)(Quadro 14) - Manganês e seus compostos tóxicos (X49.-; Z57.5) (Quadro 15) - Cianeto de hidrogênio (X47.-; Z57.5)(Quadro 17) - Ácido Sulfídrico (Sulfeto de hidrogênio) (X47.-; Z57.5) (Quadro 17) - Carbetos de metais duros (X49.-; Z57.5) - Amônia (X49.-; Z57.5) - Anidrido sulfuroso (X49.-; Z57.5) - Névoas e aerossóis de ácidos minerais (X47.-; Z57.5) - Acrilatos (X49.-; Z57.5) - Selênio e seus compostos (X49.-; Z57.5) |
|
- Exposição ocupacional a poeiras de Sílica livre (Z57.2) (Quadro 18) |
DOENÇAS DO SISTEMA DIGESTIVO RELACIONADAS COM O TRABALHO (Grupo XI da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
-Exposição ocupacional a outras névoas ácidas (X47.-; Z57.5) |
|
-Exposição ocupacional a metais: Cobre, Níquel, Prata (X47.-; Z57.5) |
|
- Bromo (X49.-; Z57.5) (Quadro 12. - Mercúrio e seus compostos tóxicos (X49.-; Z57.5) (Quadro 16) |
|
-Cádmio ou seus compostos (X49.-; Z57.5) (Quadro 6) -Radiações ionizantes (W88.-; Z57.1) (Quadro 24) |
|
Doença Tóxica do Fígado, com Necrose Hepática (K71.1) Doença Tóxica do Fígado, com Hepatite Aguda (K71.2) Doença Tóxica do Fígado com Hepatite Crônica Persistente (K71.3) Doença Tóxica do Fígado com Outros Transtornos Hepáticos (K71.8) |
-Hexaclorobenzeno (HCB) (X48.-; Z57.4 e Z57.5) - Bifenilas policloradas (PCBs) (X49.-; Z57.4 e Z57.5) -Tetraclorodibenzodioxina (TCDD) (X49.-) |
-Cloreto de Vinila (X46.-; Z57.5) (Quadro 13) -Tório (X49.-; Z57.5) |
DOENÇAS DA PELE E DO TECIDO SUBCUTÂNEO RELACIONADAS COM O TRABALHO (Grupo XII da CID-10)
- Hidrocarbonetos alifáticos ou aromáticos (seus derivados tóxicos) (Z57.5) (Quadro 13) - Microorganismos e parasitas infecciosos vivos e seus produtos tóxicos (Z57.5) (Quadro 25) - Outros agentes químicos ou biológicos que afetem a pele, não considerados em outras rubricas (Z57.5) (Quadro 27) |
|
- Mercúrio e seus compostos tóxicos (Z57.5) (Quadro 16) |
|
- Fósforo ou seus produtos tóxicos (Z57.5) (Quadro 12) - Iodo (Z57.5) (Quadro 14) - Alcatrão, Breu, Betume, Hulha Mineral, Parafina ou resíduos dessas substâncias (Z57.8) (Quadro 20) - Borracha (Z57.8) (Quadro 27) - Inseticidas (Z57.5) (Quadro 27) - Plásticos (Z57.8) (Quadro 27) |
|
-Hidrocarbonetos aromáticos ou alifáticos ou seus derivados halogenados tóxicos (Z57.5) (Quadro 13) |
|
- Berílio e seus compostos tóxicos (Z57.5) (Quadro 4) - Bromo (Z57.5) (Quadro 5) - Cromo e seus compostos tóxicos (Z57.5) (Quadro 10) - Flúor ou seus compostos tóxicos (Z57.5) (Quadro 11) - Fósforo (Z57.5) (Quadro 12) |
|
Dermatite por Fotocontato (Dermatite de Berloque) (L56.2) Urticária Solar (L56.3) Outras Alterações Agudas Especificadas da Pele devidas a Radiação Ultravioleta (L56.8) Outras Alterações Agudas da Pele devidas a Radiação Ultravioleta, sem outra especificação (L56.9) |
|
Ceratose Actínica (L57.0) Outras Alterações: Dermatite Solar, "Pele de Fazendeiro", "Pele de Marinheiro" (L57.8) |
|
Radiodermatite Aguda (L58.0) Radiodermatite Crônica (L58.1) Radiodermatite, não especificada (L58.9) Afecções da pele e do tecido conjuntivo relacionadas com a radiação, não especificadas (L59.9) |
|
- Hexaclorobenzeno (X46.; Z57.5) (Quadro 13) - Derivados do fenol, pentaclorofenol e do hidrobenzonitrilo (X49,-; Z57.4 e Z57.5) (Quadro 27) - Policloretos de Bifenila (PCBs) (X49.-; Z57.4 e Z57.5) (Quadro 27) |
|
- Clorobenzeno e Diclorobenzeno (X46.-; Z57.4 e Z57.5)(Quadro 13) - Alcatrão, Breu, Betume, Hulha Mineral, Parafina, Creosoto, Piche, Coaltar ou resíduos dessas substâncias (Z57.8) (Quadro 20) - Antraceno e Dibenzoantraceno (Z57.5) (Quadro 20) - Bismuto (X44.-; Z57.5) (Quadro 27) - Citostáticos (X44.-; Z57.5) (Quadro 27) - Compostos nitrogenados: Ácido nítrico, Dinitrofenol (X49.-; Z57.5) (Quadro 27) - Naftóis adicionados a corantes (X49,-; Z57.5) (Quadro 27) - Óleos de corte (Z57.5) (Quadro 27) - Parafenilenodiamina e seus derivados (X49.-; Z47.5) (Quadro 27) - Poeira de determinadas madeiras (Z57.3) (Quadro 27) - Quinino e seus derivados (Z57.5) (Quadro 27) - Sais de ouro (X44.-; Z57.5) (Quadro 27) - Sais de prata (Seqüelas de Dermatite Crônica de Contato) (X44.-; Z57.5) (Quadro 27) |
|
- Hidroquinona e ésteres derivados (X49.-; Z57.5) (Quadro 27) - Monometil éter de hidroquinona (MBEH) (X49.-; Z57.5) (Quadro 27) - para-Aminofenol (X49.-; Z57.5) (Quadro 27) - para-Butilfenol (X49.-; Z57.5) (Quadro 27) - para-Cresol (X49.-; Z57.5) (Quadro 27) - Catecol e Pirocatecol (X49.-; Z57.5) (Quadro 27) - Clorofenol (X46.-; Z57.4 e Z57.5)(Quadro 27) |
|
Eritema Pérnio |
-Frio (X31.-; W93.-; Z57.6) (Quadro 27) |
-Frio (X31.-; W93.-; Z57.6) (Quadro 27) |
DOENÇAS DO SISTEMA OSTEOMUSCULAR E DO TECIDO CONJUNTIVO, RELACIONADAS COM O TRABALHO (Grupo XIII da CID- 10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
|
Cervicalgia (M54.2) Ciática (M54.3) Lumbago com Ciática (M54.4) |
-Ritmo de trabalho penoso (Z56.3) - Condições difíceis de trabalho (Z56.5) |
Dedo em Gatilho (M65.3) Tenossinovite do Estilóide Radial (De Quervain) (M65.4) Outras Sinovites e Tenossinovites (M65.8) Sinovites e Tenossinovites, não especificadas (M65.9) |
- Ritmo de trabalho penoso (Z56.3) - Condições difíceis de trabalho (Z56.5) |
Sinovite Crepitante Crônica da mão e do punho (M70.0) Bursite da Mão (M70.1) Bursite do Olécrano (M70.2) Outras Bursites do Cotovelo (M70.3) Outras Bursites Pré-rotulianas (M70.4) Outras Bursites do Joelho (M70.5) Outros transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão (M70.8);Transtorno não especificado dos tecidos moles, relacionados com o uso, o uso excessivo e a pressão (M70.9). |
- Ritmo de trabalho penoso (Z56.3) - Condições difíceis de trabalho (Z56.5) |
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
|
Capsulite Adesiva do Ombro (Ombro Congelado, Periartrite do Ombro) (M75.0) Síndrome do Manguito Rotatório ou Síndrome do Supraespinhoso (M75.1) Tendinite Bicipital (M75.2) Tendinite Calcificante do Ombro (M75.3) Bursite do Ombro (M75.5) Outras Lesões do Ombro (M75.8) Lesões do Ombro, não especificadas (M75.9) |
- Ritmo de trabalho penoso (Z56) - Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
Epicondilite Medial (M77.0) Epicondilite lateral ("Cotovelo de Tenista") Mialgia (M79.1) |
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) |
|
-Fósforo e seus compostos (Sesquissulfeto de Fósforo) (X49.-; Z57.5) (Quadro 12) |
|
Osteonecrose devida a drogas (M87.1) Outras Osteonecroses secundárias (M87.3) |
- Vibrações localizadas (W43.-; Z57.7) (Quadro 22) - Radiações ionizantes (Z57.1) (Quadro 24) |
e outras Osteocondro-patias especificadas (M93.8) |
DOENÇAS DO SISTEMA GÊNITO-URINÁRIO RELACIONADAS COM O TRABALHO (Grupo XIV da CID-10) (Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
- Chumbo ou seus compostos tóxicos (X49.-; Z57.5) (Quadro 8) - Mercúrio e seus compostos tóxicos (X49.-; Z57.4 e Z57.5) (Quadro 16) |
|
- Radiações ionizantes (W88.-: Z57.1) (Quadro 24) - Chlordecone (X48.-; Z57.4) - Dibromocloropropano (DBCP) (X48.-; Z57.4 e Z57.5) - Calor (trabalho em temperaturas elevadas) (Z57.6) |
TRAUMATISMOS, ENVENENAMENTOS E ALGUMAS OUTRAS CONSEQÜÊNCIAS DE CAUSAS EXTERNAS, RELACIONADOS COM O TRABALHO - (Grupo XIX da CID-10)(Reprostinado pela PRT GM/MS n° 2.384 de 08.09.2020)
|
|
|
|
|
ANEXO LXXX
(Anexo referente ao Art. 423)
(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
LISTA DE DOENÇAS RELACIONADAS AO TRABALHO
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho*
*A exposição aos agentes e/ou fatores de risco podem desencadear doenças relacionadas ao trabalho
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
||
|
||
|
||
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
LISTA B - Doenças Relacionadas ao Trabalho com respectivos Agentes e/ou Fatores de Risco
(Redação dada pela PRT GM/MS n° 1.999 de 27.11.2023)
Capítulo I - Algumas doenças infecciosas e parasitárias
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo II - Neoplasias (tumores)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
Capítulo III - Doenças do sangue e dos órgãos hematopoiéticos e alguns transtornos imunitários
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo IV - Doenças endócrinas nutricionais e metabólicas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo V - Transtornos mentais e comportamentais
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo VI - Doenças do sistema nervoso
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Capítulo VII - Doenças do olho e anexos
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo VIII - Doenças do ouvido e da apófise mastoide
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo IX - Doenças do aparelho circulatório
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo X - Doenças do aparelho respiratório
|
|
|
|
|
|
|
|
|
|
||
|
||
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
||
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo XI - Doenças do aparelho digestivo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo XII - Doenças da pele e do tecido subcutâneo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo XIII - Doenças do sistema osteomuscular e do tecido conjuntivo
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo XIV - Doenças do aparelho geniturinário
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Capítulo XIX - Intoxicações exógenas
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Anexo LXXX
LISTA DE DOENÇAS RELACIONADAS AO TRABALHO
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho*
*A exposição aos agentes e/ou fatores de risco podem desencadear doenças relacionadas ao trabalho
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho (Parte I) |
||
| Agentes e/ou Fatores de Risco Físicos | CID10 | Doença Relacionada ao Trabalho |
Níveis de pressão sonora elevados no trabalho |
H83.3 | Efeitos do ruído sobre o ouvido interno |
| I10 | Hipertensão essencial (primária) |
|
Radiações ionizantes - iodo radioativo - incluindo iodo-131 em atividades de trabalho |
C08 | Neoplasia maligna de outras glândulas salivares maiores e as não especificadas |
| C40 | Neoplasia maligna dos ossos e cartilagens articulares dos membros |
|
| C41 | Neoplasia maligna dos ossos e das cartilagens articulares de outras localizações e de localizações não especificadas |
|
| C49 | Neoplasia maligna do tecido conjuntivo e de outros tecidos moles |
|
| C73 | Neoplasia maligna da glândula tireoide |
|
Radiações ionizantes - plutônio em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C40 | Neoplasia maligna dos ossos e cartilagens articulares dos membros |
|
| C41 | Neoplasia maligna dos ossos e das cartilagens articulares de outras localizações e de localizações não especificadas |
|
Radiações ionizantes - produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e produtos de seu decaimento em atividades de trabalho |
C82 | Linfoma não-Hodgkin, folicular (nodular) |
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Radiações ionizantes - rádio-222 e produtos de seu decaimento em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Radiações ionizantes - rádio-224 e produtos de seu decaimento em atividades de trabalho |
C40 | Neoplasia maligna dos ossos e cartilagens articulares dos membros |
| C41 | Neoplasia maligna dos ossos e das cartilagens articulares de outras localizações e de localizações não especificadas |
|
Radiações ionizantes - rádio-226 e/ou rádio-228, e produtos de seu decaimento em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| C31 | Neoplasia maligna dos seios da face |
|
| C40 | Neoplasia maligna dos ossos e cartilagens articulares dos membros |
|
| C41 | Neoplasia maligna dos ossos e das cartilagens articulares de outras localizações e de localizações não especificadas |
|
Radiações ionizantes -radônio em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Radiações ionizantes - raios-X e/ou gama em atividades de trabalho |
C08 | Neoplasia maligna de outras glândulas salivares maiores e as não especificadas |
| C15 | Neoplasia maligna do esôfago |
|
| C16 | Neoplasia maligna do estômago |
|
| C18 | Neoplasia maligna do cólon |
|
| C20 | Neoplasia maligna do reto |
|
| C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
|
| C25 | Neoplasia maligna do pâncreas |
|
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C40 | Neoplasia maligna dos ossos e cartilagens articulares dos membros |
|
| C41 | Neoplasia maligna dos ossos e das cartilagens articulares de outras localizações e de localizações não especificadas |
|
| C44 | Outras neoplasias malignas da pele |
|
| C50 | Neoplasia maligna da mama |
|
| C56 | Neoplasia maligna de ovário |
|
| C61 | Neoplasia maligna da próstata |
|
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
| C67 | Neoplasia maligna da bexiga |
|
| C71 | Neoplasia maligna do encéfalo |
|
| C72 | Neoplasia maligna da medula espinhal, dos nervos cranianos e de outras partes do sistema nervoso central |
|
| C73 | Neoplasia maligna da glândula tireoide |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Radiações ionizantes tório-232 e produtos de seu decaimento em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| C23 | Neoplasia maligna da vesícula biliar |
|
| C25 | Neoplasia maligna do pâncreas |
|
| C61 | Neoplasia maligna da próstata |
|
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
Radiações ionizantes em atividades de trabalho |
D46 | Síndromes Mielodisplásicas |
| D61.2 | Anemia Aplástica devida a outros agentes externos |
|
| D61.9 | Anemia aplástica não especificada |
|
| D69 | Púrpura e outras afecções hemorrágicas |
|
| D70 | Agranulocitose |
|
| D72.8 | Outros transtornos especificados dos glóbulos brancos |
|
| G62.8 | Outras polineuropatias especificadas |
|
| H01.0 | Blefarite |
|
| H10 | Conjuntivite |
|
| H16 | Ceratite |
|
| H28 | Catarata e outros transtornos do cristalino em doenças classificadas em outra parte |
|
| J70.0 | Manifestações pulmonares agudas devidas à radiação |
|
| J70.1 | Manifestações pulmonares crônicas e outras, devidas a radiação |
|
| K52 | Outras gastroenterites e colites não-infecciosas |
|
| L58 | Radiodermatite |
|
| L58.0 | Radiodermatite aguda |
|
| L58.1 | Radiodermatite crônica |
|
| L58.9 | Radiodermatite, não especificada |
|
| L59.9 | Afecções da pele e do tecido subcutâneo relacionadas com a radiação, não especificadas |
|
| M87 | Osteonecrose |
|
| M87.1 | Osteonecrose devida a drogas |
|
| M87.3 | Outras osteonecroses secundárias |
|
| N46 | Infertilidade masculina |
|
| N97 | Infertilidade feminina |
|
| T66 | Efeitos não especificados de radiação |
|
Radiações não ionizantes (campos eletromagnéticos de radiofrequência - incluindo os provenientes de telefone sem fio) em atividades de trabalho |
C71 | Neoplasia maligna do encéfalo |
| C72 | Neoplasia maligna da medula espinhal, dos nervos cranianos e de outras partes do sistema nervoso central |
|
Radiações não ionizantes (infravermelha) em atividades de trabalho |
C43 | Melanoma maligno da pele |
| H11.0 | Pterígio |
|
| H16 | Ceratite |
|
| H16.2 | Ceratoconjuntivite |
|
| H26 | Outras cataratas |
|
| H28 | Catarata e outros transtornos do cristalino em doenças classificadas em outra parte |
|
| L55 | Queimadura solar |
|
| L56.3 | Urticária solar |
|
| L57.0 | Ceratose actínica |
|
Radiações não ionizantes (micro-ondas) em atividades de trabalho |
H26 | Outras cataratas |
Radiações não ionizantes (ultravioleta) em atividades de trabalho |
C00 | Neoplasia maligna do lábio |
| C43 | Melanoma maligno da pele |
|
| C44 | Outras neoplasias malignas da pele |
|
| C69 | Neoplasia maligna do olho e anexos |
|
| H10 | Conjuntivite |
|
| H11.0 | Pterígio |
|
| H16 | Ceratite |
|
| H16.2 | Ceratoconjuntivite |
|
| H26 | Outras cataratas |
|
| H28 | Catarata e outros transtornos do cristalino em doenças classificadas em outra parte |
|
| L55 | Queimadura solar |
|
| L56 | Outras alterações Agudas da Pele devidas a radiação ultravioleta |
|
| L56.2 | Dermatite por fotocontato (Dermatite do berloque) |
|
| L56.3 | Urticária solar |
|
| L57.0 | Ceratose actínica |
|
Radiações não ionizantes em atividades de trabalho |
L57.8 | Outras alterações da pele devidas a exposição crônica à radiação não-ionizante |
Trabalho em altas temperaturas |
L50.2 | Urticária devida a frio e a calor |
| N46 | Infertilidade masculina |
|
| T67 | Efeitos do calor e da luz |
|
Trabalho em baixas temperaturas |
I73.0 | Síndrome de Raynaud |
| I73.8 | Outras doenças vasculares periféricas especificadas |
|
| L50.2 | Urticária devida a frio e a calor |
|
| T33 | Geladura superficial |
|
| T34 | Geladura com necrose de tecidos |
|
Umidade em atividades de trabalho |
L60 | Afecções das unhas |
Variação de pressão ambiental no trabalho |
H65.9 | Otite média não-supurativa, não especificada |
| H72 | Perfuração da membrana do tímpano |
|
| H83.0 | Labirintite |
|
| H93.8 | Outros transtornos especificados do ouvido |
|
| M90.3 | Osteonecrose em "mal dos caixões" |
|
| T70.0 | Otite barotraumática |
|
| T70.1 | Sinusite barotraumática |
|
| T70.3 | Mal dos caixões [doença de descompressão] |
Vibração em atividades de trabalho |
I73.0 | Síndrome deRaynaud |
| I73.8 | Outras doenças vasculares periféricas especificadas |
|
| M16 | Coxartrose [artrose do quadril] |
|
| M17 | Gonartrose [artrose do joelho] |
|
| M19 | Outras artroses |
|
| M50 | Transtornos dos discos cervicais |
|
| M50.0 | Transtorno do disco cervical com mielopatia |
|
| M50.1 | Transtorno do disco cervical com radiculopatia |
|
| M50.2 | Outro deslocamento de disco cervical |
|
| M50.3 | Outra degeneração de disco cervical |
|
| M50.8 | Outros transtornos de discos cervicais |
|
| M50.9 | Transtorno não especificado de disco cervical |
|
| M51 | Outros transtornos de discos intervertebrais |
|
| M51.0 | Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
|
| M51.1 | Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
|
| M51.2 | Outros deslocamentos discais intervertebrais especificados |
|
| M51.3 | Outra degeneração especificada de disco intervertebral, |
|
| M51.8 | Outros transtornos especificados de discos intervertebrais |
|
| M53.1 | Síndrome cervicobraquial |
|
| M54 | Dorsalgia |
|
| M54.2 | Cervicalgia |
|
| M54.3 | Ciática |
|
| M54.4 | Lumbago com ciática |
|
| M54.5 | Dor lombar baixa |
|
| M70 | Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão |
|
| M72.0 | Fibromatose de fáscia palmar [Dupuytren] |
|
| M75 | Lesões do ombro |
|
| M75.0 | Capsulite adesiva do ombro |
|
| M75.1 | Síndrome do manguito rotador |
|
| M75.2 | Tendinite bicipital |
|
| M75.3 | Tendinite calcificante do ombro |
|
| M75.5 | Bursite do ombro |
|
| M75.8 | Outras lesões do ombro |
|
| M75.9 | Lesão não especificada do ombro |
|
| M77 | Outras entesopatias |
|
| M77.0 | Epicondilite medial |
|
| M77.1 | Epicondilite lateral |
|
| M77.8 | Outras entesopatias não classificadas em outra parte |
|
| M79.8 | Outros transtornos especificados dos tecidos moles |
|
| M84.3 | Fratura de fadiga("stress") não classificadas em outra parte |
|
| M87.1 | Osteonecrose devida a drogas |
|
| M87.3 | Outras osteonecroses secundárias |
|
| M93.1 | Doença de Kienböck do adulto |
|
| M93.8 | Outras osteocondropatias, especificadas |
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho (Parte II)
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| Agentes e/ou Fatores de Risco Químicos | CID10 | Doença Relacionada ao Trabalho |
1,2-dicloropropano em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
1,3-butadieno em atividades de trabalho |
C82 | Linfoma não-Hodgkin, folicular (nodular) |
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
2-mercaptobenzotiazol em atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD) em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C49 | Neoplasia maligna do tecido conjuntivo e de outros tecidos moles |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
Ácido aristolóquico em atividades de trabalho |
C65 | Neoplasia maligna da pelve renal |
| C66 | Neoplasia maligna dos ureteres |
|
Ácido cianídrico e seus derivados (soluções e aerossóis) em atividades de trabalho |
J34.0 | Abscesso, furúnculo e antraz do nariz |
| J40 | Bronquite não especificada como aguda ou crônica |
|
| G40.1 | Epilepsia e síndromes epilépticas sintomáticas definidas por sua localização (focal) (parcial) com crises parciais simples |
|
Ácido diclorofenoxiacético (2, 4-D) em atividades de trabalho |
C82 | Linfoma não-Hodgkin, folicular (nodular) |
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Ácido perfluorooctanoico em atividades de trabalho |
C62 | Neoplasia maligna dos testículos |
| C64 | Neoplasia maligna do rim, exceto pelve renal |
Ácido sulfídrico (sulfeto de hidrogênio) em atividades de trabalho |
H10 | Conjuntivite |
| H16 | Ceratite |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| T59.6 | Efeito tóxico do ácido sulfídrico |
|
Ácido sulfúrico em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
|
| K03.2 | Erosão dentária |
|
Ácidos corrosivos e substâncias semelhantes em atividades de trabalho |
T54.2 | Efeito tóxico de ácidos corrosivos e substâncias semelhantes |
Ácidos orgânicos em atividades de trabalho |
E04.9 | Bócio não-tóxico, não especificado |
| J40 | Bronquite não especificada como aguda ou crônica |
|
Acrilamida em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
Acrilatos em atividades de trabalho |
H10 | Conjuntivite |
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
Adesivos em atividades de trabalho |
L23.1 | Dermatite alérgica de contato devida a adesivos |
Aflatoxina em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
Agentes imunoalérgicos de origem animal e vegetal em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
Agentes químicos cáusticos e/ou tóxicos em atividades de trabalho |
J02.9 | Faringite aguda não especificada |
| J04.2 | Laringotraqueíte aguda |
|
| J37.1 | Laringotraqueíte crônica |
|
Agentes químicos corrosivos em atividades de trabalho |
T54 | Efeito tóxico de corrosivos |
Agentes químicos e/ou físicos e/ou biológicos que afetem a pele em atividades de trabalho |
L08.9 | Infecção localizada da pele e do tecido subcutâneo, não especificada |
| L50.6 | Urticária de contato |
|
Agentes químicos provenientes da produção de alumínio em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C67 | Neoplasia maligna da bexiga |
|
Agentes químicos usados no processo de produção de álcool isopropílico em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| C31 | Neoplasia maligna dos seios da face |
|
Agentes químicos usados na produção de auramina em atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
Agentes químicos usados na produção de magenta em atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
Agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização |
C15 | Neoplasia maligna do esôfago |
| C16 | Neoplasia maligna do estômago |
|
| C32 | Neoplasia maligna da laringe |
|
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C61 | Neoplasia maligna da próstata |
|
| C67 | Neoplasia maligna da bexiga |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Agentes químicos usados na produção e beneficiamento de tecidos em atividades de trabalho |
C15 | Neoplasia maligna do esôfago |
| C16 | Neoplasia maligna do estômago |
|
| C32 | Neoplasia maligna da laringe |
|
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C61 | Neoplasia maligna da próstata |
|
| C67 | Neoplasia maligna da bexiga |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Agrotóxicos em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C44 | Outra neoplasia maligna da pele |
|
| C50 | Neoplasia maligna da mama |
|
| C61 | Neoplasia maligna da próstata |
|
| C62 | Neoplasia maligna dos testículos |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| E03 | Outros hipotireoidismos |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| G11.1 | Ataxia cerebelar de início precoce |
|
| G21.2 | Parkinsonismo secundário devido a outros agentes externos |
|
| G25.2 | Outras formas especificadas de tremor |
|
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
| H91.0 | Perda de audição ototóxica |
|
| I49 | Outras arritmias cardíacas |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
|
| L25.9 | Dermatite de contato não especificada, de causa não especificada |
|
| L50.0 | Urticária alérgica |
|
| T60 | Efeito tóxico de pesticidas |
|
| T60.0 | Efeito tóxico de inseticidas organofosforados e carbamatos |
|
| T60.1 | Efeito tóxico de inseticidas halogenados |
|
| T60.2 | Efeito tóxico de outros inseticidas |
|
| T60.4 | Efeito tóxico de rodenticidas |
|
| T60.8 | Efeito tóxico de outros pesticidas |
|
Alcaloides em atividades de trabalho |
J45 | Asma |
Alcatrão de carvão e seus resíduos em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C44 | Outras neoplasias malignas da pele |
|
| C67 | Neoplasia maligna da bexiga |
|
| L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
|
| L81.4 | Outras formas de hiperpigmentação pela melanina |
|
Álcoois e derivados em atividades de trabalho |
F18 | Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
| H46 | Neurite óptica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J42 | Bronquite crônica não especificada |
|
| T51.8 | Efeito tóxico de outros álcoois |
|
Álcool etílico em atividades de trabalho |
T51.0 | Efeito tóxico do etanol |
Álcool metílico em atividades de trabalho |
T51.1 | Efeito tóxico do metanol |
Álcool propílico em atividades de trabalho |
T51.2 | Efeito tóxico do 2-propanol |
Aldeído fórmico e seus polímeros em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J45 | Asma |
|
Alimentos em atividades de trabalho |
L23.6 | Dermatite alérgica de contato devida a alimentos em contato com a pele |
| L24.6 | Dermatite de contato por irritantes devida a alimentos em contato com a pele |
|
Amidos, anidridos e derivados em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Aminas aromáticas e seus derivados em atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
| D74 | Metemoglobinemia |
|
| D74.8 | Outras metemoglobinemias |
|
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| N30.0 | Cistite aguda |
|
Amônia em atividades de trabalho |
J31.0 | Rinite crônica |
| J31.2 | Faringite crônica |
|
| J42 | Bronquite crônica não especificada |
|
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
Anidrido ftálico em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Anidrido sulfuroso em atividades de trabalho |
J31.0 | Rinite crônica |
| J31.2 | Faringite crônica |
|
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
Anilina em atividades de trabalho |
N97 | Infertilidade feminina |
Antibióticos em atividades de trabalho |
T36 | Intoxicação por antibióticos sistêmicos |
Antimônio e seus compostos em atividades de trabalho |
D59.8 | Outras anemias hemolíticas adquiridas |
| J40 | Bronquite não especificada como aguda ou crônica |
|
Antraceno e dibenzoantraceno em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Arsênio e seus compostos em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C44 | Outras neoplasias maligna da pele |
|
| C61 | Neoplasia maligna da próstata |
|
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
| C67 | Neoplasia maligna da bexiga |
|
| D59 | Anemia hemolítica adquirida |
|
| F02.8 | Demência em outras doenças específicas classificadas em outros locais |
|
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
| G92 | Encefalopatia tóxica |
|
| H01.0 | Blefarite |
|
| H10 | Conjuntivite |
|
| H16 | Ceratite |
|
| H91.0 | Perda de audição ototóxica |
|
| I49 | Outras arritmias cardíacas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J34.0 | Abscesso, furúnculo e antraz do nariz |
|
| J34.8 | Outros transtornos especificados do nariz e dos seios paranasais |
|
| J42 | Bronquite crônica não especificada |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| K12.1 | Outras formas de estomatite |
|
| K52 | Outras gastroenterites e colites não-infecciosas |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| K76.6 | Hipertensão portal |
|
| L24.5 | Dermatite de contato por irritantes devida a outros produtos químicos |
|
| L80 | Vitiligo |
|
| L81.4 | Outras formas de hiperpigmentação pela melanina |
|
| L81.5 | Leucodermia, não classificada em outra parte |
|
| L85.1 | Ceratose adquirida [ceratodermia] palmar e plantar |
|
| N17 | Insuficiência renal aguda |
|
| T57.0 | Efeito tóxico do arsênico e seus compostos |
Asbesto ou amianto em atividades de trabalho |
C16 | Neoplasia maligna do estômago |
| C18 | Neoplasia maligna do cólon |
|
| C20 | Neoplasia maligna do reto |
|
| C32 | Neoplasia maligna da laringe |
|
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| C45 | Mesotelioma |
|
| C56 | Neoplasia maligna de ovário |
|
| I34.8 | Outros transtornos não-reumáticos da valva mitral |
|
| J61 | Pneumoconiose devida a amianto [asbesto] e outras fibras minerais |
|
| J90 | Derrame pleural não classificado em outra parte |
|
| J92 | Placas pleurais |
|
Atividades de pintura |
C45 | Mesotelioma |
Azatioprina em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
Azodicarbonamida em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Bases (álcalis) cáusticas(os) e substâncias semelhantes em atividades de trabalho |
T54.3 | Efeito tóxico de bases (álcalis) cáusticas(os) e substâncias semelhantes |
Benzeno em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| D46 | Síndromes mielodisplásicas |
|
| D59.4 | Outras anemias hemolíticas não-autoimunes |
|
| D61.2 | Anemia aplástica devida a outros agentes externos |
|
| D61.9 | Anemia aplástica não especificada |
|
| D69 | Púrpura e outras afecções hemorrágicas |
|
| D70 | Agranulocitose |
|
| D72.8 | Outros transtornos especificados dos glóbulos brancos |
|
| L24.2 | Dermatite de contato por irritantes devida a solventes |
|
| N97 | Infertilidade feminina |
|
| T52.1 | Efeito tóxico do benzeno |
|
Benzeno em atividades de trabalho (derivados nitrados e aminados) |
D59 | Anemia hemolítica adquirida |
| D59.2 | Anemia hemolítica não-auto-imune induzida por drogas |
|
| D74 | Metemoglobinemia |
|
Berílio e seus compostos em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| H10 | Conjuntivite |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| L24.5 | Dermatite de contato por irritantes devida a outros produtos químicos |
|
| L92.3 | Granuloma de corpo estranho da pele e do tecido subcutâneo |
|
| T56.7 | Efeito tóxico do berilo e seus compostos |
|
Betume e seus resíduos em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
|
| L81.4 | Outras formas de hiperpigmentação pela melanina |
|
Bis clorometil éter e clorometil metil éter em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Bifenilas policloradas (PCB) em atividades de trabalho |
C43 | Melanoma maligno da pele |
| C50 | Neoplasia maligna da mama |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| L70.8 | Outras formas de acne |
|
Bismuto em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Borracha em atividades de trabalho |
L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
Breu e/ou carvão mineral e/ou piche e/ou coaltar e/ou resíduos dessas substâncias em atividades de trabalho |
L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
| L81.4 | Outras formas de hiperpigmentação pela melanina |
Brometo de metila em atividades de trabalho |
F05.0 | Delirium não superposto a uma demência, assim descrito |
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| G25.2 | Outras formas especificadas de tremor |
|
| H46 | Neurite óptica |
|
| H83.0 | Labirintite |
|
| H93.8 | Outros transtornos especificados do ouvido |
|
Bromo em atividades de trabalho |
F13.2 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
| J02.9 | Faringite aguda não especificada |
|
| J04.2 | Laringotraqueíte aguda |
|
| J32 | Sinusite Crônica |
|
| J37.1 | Laringotraqueíte crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| K12.1 | Outras formas de estomatite |
|
| L24.5 | Dermatite de contato por irritantes devida a outros produtos químicos |
|
Butadieno em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Cádmio e seus compostos em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C61 | Neoplasia maligna da próstata |
|
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
| G52.0 | Transtornos do nervo olfatório |
|
| J34.0 | Abscesso, furúnculo e antraz do nariz |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| J98.2 | Enfisema intersticial |
|
| K52 | Outras gastroenterites e colites não-infecciosas |
|
| M83.5 | Outras osteomalácias do adulto induzidas por drogas |
|
| N14.3 | Nefropatia induzida por metais pesados |
|
| T56.3 | Cádmio e seus compostos |
|
Carboneto de silício em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Carbonetos de metais duros em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| J63.8 | Pneumoconiose devida a outras poeiras inorgânicas especificadas |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
Carbonetos metálicos de tungstênio sintetizados em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| J63.8 | Pneumoconiose devida a outras poeiras inorgânicas especificadas |
|
Carvão em atividades de trabalho (gaseificação de) |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Catecol e pirocatecol em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Cetonas em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
| G92 | Encefalopatia tóxica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| L24.2 | Dermatite de contato por irritantes devida a solventes |
|
| T52.4 | Efeito tóxico de cetonas |
|
Clordecona em atividades de trabalho |
N46 | Infertilidade masculina |
Chumbo e seus compostos tóxicos em atividades de trabalho |
D55.8 | Outras anemias devidas a transtornos enzimáticos |
| D64 | Outras anemias |
|
| E03 | Outros hipotireoidismos |
|
| F02.8 | Demência em outras doenças específicas classificadas em outros locais |
|
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
| G92 | Encefalopatia tóxica |
|
| H46 | Neurite óptica |
|
| H49.0 | Paralisia do terceiro par [oculomotor] |
|
| H91.0 | Perda de audição ototóxica |
|
| I10 | Hipertensão essencial (primária) |
|
| I49 | Outras arritmias cardíacas |
|
| K59.8 | Outros transtornos funcionais especificados do intestino |
|
| M10.1 | Gota induzida pelo chumbo |
|
| M19 | Outras artroses |
|
| N14.3 | Nefropatia induzida por metais pesados |
|
| N18 | Insuficiência renal crônica |
|
| N46 | Infertilidade masculina |
|
| T56.0 | Efeito tóxico do chumbo e seus compostos |
|
Chumbo em atividades de trabalho (compostos inorgânicos) |
C16 | Neoplasia maligna do estômago |
Cianetos e/ou nitrila (acrilonitrila, outros) em atividades de trabalho |
G40.1 | Epilepsia e síndromes epilépticas sintomáticas definidas por sua localização (focal) (parcial) com crises parciais simples |
| J40 | Bronquite não especificada como aguda ou crônica |
|
| G92 | Encefalopatia tóxica |
|
Cianeto de hidrogênio (ácido cianídrico) em atividades de trabalho |
J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| T57.3 | Efeito tóxico do cianeto de hidrogênio (ácido cianídrico) |
|
Ciclofosfamida em atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
Ciclosporina em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
Citostáticos em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Cloreto de carbono ou fósforo em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Cloreto de etila em atividades de trabalho |
H10 | Conjuntivite |
| T33 | Geladura superficial |
|
| T34 | Geladura com necrose de tecidos |
|
Cloreto de vinila em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| D69 | Púrpura e outras afecções hemorrágicas |
|
| I73.0 | Síndrome de Raynaud |
|
| I73.8 | Outras doenças vasculares periféricas especificadas |
|
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| K76.6 | Hipertensão portal |
|
| M89.5 | Osteolise |
|
| T57.8 | Efeito tóxico de outras substâncias inorgânicas especificadas |
|
Cloro gasoso em atividades de trabalho |
F13.2 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| T59.4 | Efeito tóxico do cloro gasoso |
|
Clorobenzeno e/ou diclorobenzeno, e seus derivados em atividades de trabalho |
E03 | Outros hipotireoidismos |
| E80.2 | Outras porfirias |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| L81.4 | Outras formas de hiperpigmentação pela melanina |
|
Clorofenol em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Clorofluorcarbono em atividades de trabalho |
T53.5 | Efeito tóxico do clorofluorcarbono |
Clorofórmio em atividades de trabalho |
K71 | Doença hepática tóxica |
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| T53.1 | Efeito tóxico do clorofórmio |
|
Cobalto em atividades de trabalho |
I49 | Outras arritmias cardíacas |
| J84 | Outras doenças pulmonares intersticiais |
|
Cobre e seus compostos em atividades de trabalho |
K03.7 | Alterações pós-eruptivas da cor dos tecidos duros dos dentes |
| T56.4 | Efeito tóxico do cobre e seus compostos |
|
Combinação de toluenos alfa-clorados e cloreto de benzoila em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Combustível de biomassa (principalmente madeira) em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Compostos corrosivos orgânicos em atividades de trabalho |
T54.1 | Efeito tóxico de outros compostos corrosivos orgânicos |
Compostos nitrogenados (ácido nítrico, dinitrofenol) em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Corantes em atividades de trabalho |
L23.4 | Dermatite alérgica de contato devida a corantes |
Cosméticos em atividades de trabalho |
L23.2 | Dermatite alérgica de contato devida a cosméticos (fabricação/manipulação) |
| L24.3 | Dermatite de contato por irritantes devida a cosméticos |
|
Creosoto em atividades de trabalho |
C44 | Outras formas de neoplasias malignas da pele |
| L81.4 | Outras formas de hiperpigmentação pela melanina |
Cromo e seus compostos tóxicos em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J34.0 | Abscesso, furúnculo e antraz do nariz |
|
| J34.8 | Outros transtornos especificados do nariz e dos seios paranasais |
|
| J45 | Asma |
|
| L08.9 | Infecção localizada da pele e do tecido subcutâneo, não especificada |
|
| L23.0 | Dermatite alérgica de contato devida a metais |
|
| L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
|
| L24.5 | Dermatite de contato por irritantes devida a outros produtos químicos |
|
| L98.4 | Úlcera crônica da pele, não classificada em outra parte |
|
| T56.2 | Efeito tóxico do cromo e seus compostos |
|
Cromo hexavalente e seus compostos em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| C31 | Neoplasia maligna dos seios da face |
|
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
Derivados do fenol, do pentaclorofenol e do hidrobenzonitrilo em atividades de trabalho |
D70 | Agranulocitose |
| L70.8 | Outras formas de acne |
|
Derivados organometálicos (chumbo tetraetila, metil-mercúrio, organoestanho) em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| G92 | Encefalopatia tóxica |
|
Destilação do carvão mineral (hulha) em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
Detergentes em atividades de trabalho |
L24.0 | Dermatite de contato por irritantes devida a detergentes |
Diazinona em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Dibromocloropropano em atividades de trabalho |
N46 | Infertilidade masculina |
Dicloroacetileno e/ou diisocianato em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Diclorometano e/ou cloreto de metileno em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| G25.9 | Doenças extrapiramidais e transtornos dos movimentos, não especificados |
|
| H46 | Neurite óptica |
|
| T53.4 | Efeito tóxico do diclorometano |
|
Dióxido de enxofre em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Dissulfeto de carbono em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| H46 | Neurite óptica |
|
| H49.0 | Paralisia do terceiro par [oculomotor] |
|
| H52.5 | Transtornos da acomodação |
|
| H91.0 | Perda de audição ototóxica |
|
| I20 | Angina pectoris |
|
| I21 | Infarto agudo do miocárdio |
|
| I25.1 | Doença ateroesclerótica do coração |
|
| I67.2 | Aterosclerose cerebral |
|
| I70 | Ateroesclerose |
|
| T65.4 | Efeito tóxico do dissulfeto de carbono |
Drogas em atividades de trabalho |
L23.3 | Dermatite alérgica de contato devida a drogas em contato com a pele |
| L24.4 | Dermatite de contato por irritantes devida a drogas em contato com a pele |
|
Fundição de ferro e aço em atividades de trabalho (emissões do processo) |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Fornos de coque em atividades de trabalho (emissões provenientes) |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Exaustão de motores a diesel em atividades de trabalho (emissões provenientes) |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C67 | Neoplasia maligna da bexiga |
|
Enzimas de origem animal, vegetal ou bacteriana em atividades de trabalho |
H10 | Conjuntivite |
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| L98.4 | Úlcera crônica da pele, não classificada em outra parte |
|
Erionita em atividades de trabalho |
C45 | Mesotelioma |
Ésteres orgânicos e derivados em atividades de trabalho |
F18 | Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
Estireno em atividades de trabalho |
C82 | Linfoma não-Hodgkin, folicular (nodular) |
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
Éter de petróleo (benzina) em atividades de trabalho |
F18 | Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
| J40 | Bronquite não especificada como aguda ou crônica |
|
Éter dietílico diclorado em atividades de trabalho |
J45 | Asma |
Fabricação de eletrodo de carbono em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Fármacos antineoplásicos em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Fenol e homólogos em atividades de trabalho |
J31.0 | Rinite crônica |
| J31.2 | Faringite crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| T54.0 | Efeito tóxico do fenol e homólogos do fenol |
|
Fibras artificiais e minerais em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Fluoreto de hidrogênio em atividades de trabalho (gás) |
J31.0 | Rinite crônica |
| J31.2 | Faringite crônica |
|
Flúor ou seus compostos tóxicos em atividades de trabalho |
H10 | Conjuntivite |
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| L24.5 | Dermatite de contato por irritantes devida a outros produtos químicos |
|
| M85.1 | Fluorose esquelética |
|
Fluoreto gasoso e/ou ácido fluorídrico em atividades de trabalho |
T59.5 | Efeito tóxico do fluoreto gasoso e ácido fluorídrico |
Fluoroedenita em atividades de trabalho |
C45 | Mesotelioma |
Formaldeído em atividades de trabalho |
C11 | Neoplasia maligna da nasofaringe |
| C30.0 | Neoplasia maligna da cavidade nasal |
|
| C31 | Neoplasia maligna dos seios da face |
|
| C67 | Neoplasia maligna da bexiga |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificados |
|
| C95 | Leucemia de tipo celular não especificado |
|
| J45 | Asma |
|
| T59.2 | Efeito tóxico de formaldeído |
|
Fósforo e seus compostos em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
| J40 | Bronquite não especificada como aguda ou crônica |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
|
| L24.5 | Dermatite de contato por irritantes devida a outros produtos químicos |
|
| M83.5 | Outras osteomalácias do adulto induzidas por drogas |
|
| M87 | Osteonecrose |
|
| M87.1 | Osteonecrose devida a drogas |
|
| M87.3 | Outras osteonecroses secundárias |
|
| T57.1 | Efeito tóxico do fósforo e seus compostos |
|
Fuligem em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C44 | Outras neoplasias malignas da pele |
|
| C67 | Neoplasia maligna da bexiga |
|
Fumos de solda em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
Furfural e álcool furfurílico em atividades de trabalho |
H10 | Conjuntivite |
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Gás mostarda em atividades de trabalho |
C32 | Neoplasia maligna da laringe |
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
Gases anestésicos em atividades de trabalho |
G92 | Encefalopatia tóxica |
Gases, fumaças e vapores em atividades de trabalho (outros) |
T59 | Efeito tóxico de outros gases, fumaças e vapores |
| T59.8 | Efeito tóxico de outros gases, fumaças e vapores especificados |
Glicóis e derivados em atividades de trabalho |
H55 | Nistagmo e outros movimentos irregulares do olho |
| J40 | Bronquite não especificada como aguda ou crônica |
|
| T52.3 | Efeito tóxico de glicóis |
|
Hexaclorobenzeno (HCB) em atividades de trabalho |
K71 | Doença hepática tóxica |
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
Hidrocarbonetos alifáticos e/ou aromáticos e/ou seus derivados tóxicos em atividades de trabalho |
H30 | Inflamação coriorretiniana |
| L08.9 | Infecção localizada da pele e do tecido subcutâneo, não especificada |
|
Hidrocarbonetos alifáticos em atividades de trabalho (derivados halogenados) |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
| G92 | Encefalopatia tóxica |
|
| I46 | Parada cardíaca |
|
| I49 | Outras arritmias cardíacas |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| L24.2 | Dermatite de Contato por Irritantes devida a Solventes |
|
| N00 | Síndrome nefrítica aguda |
|
| N17 | Insuficiência renal aguda |
|
| T53 | Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos |
|
| T53.6 | Efeito tóxico de outros derivados halogênicos de hidrocarbonetos alifáticos |
|
| T53.9 | Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos não especificados |
|
Hidrocarbonetos alifáticos em atividades de trabalho (derivados nítricos) |
J40 | Bronquite não especificada como aguda ou crônica |
Hidrocarbonetos aromáticos em atividades de trabalho (derivados halogenados) |
L24.2 | Dermatite de contato por irritantes devida a solventes |
| G92 | Encefalopatia tóxica |
|
| L70.8 | Outras formas de acne |
|
| L81.8 | Outros transtornos especificados da pigmentação |
|
| T53 | Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos |
|
| T53.7 | Efeito tóxico de derivados halogênicos de hidrocarbonetos aromáticos |
|
| T53.9 | Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos não especificados |
|
Hidrocarbonetos clorados em atividades de trabalho |
G53 | Transtornos dos nervos cranianos em doenças classificadas em outra parte |
Hidrocarbonetos policíclicos aromáticos em atividades de trabalho |
L24.1 | Dermatite de contato por irritantes devida a óleos e gorduras |
Hidrocarbonetos provenientes do processo de refino de petróleo em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Hidroquinona e ésteres derivados em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Hormônios sintéticos em atividades de trabalho |
T38 | Intoxicação por hormônios, seus substitutos sintéticos e seus antagonistas não classificados em outra parte |
Iodo em atividades de trabalho |
F13.2 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
| H10 | Conjuntivite |
|
| J02.9 | Faringite aguda não especificada |
|
| J04.2 | Laringotraqueíte aguda |
|
| J32 | Sinusite crônica |
|
| J37.1 | Laringotraqueíte crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
|
| L70.8 | Outras formas de acne |
|
Isocianatos orgânicos em atividades de trabalho |
H10 | Conjuntivite |
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Látex em atividades de trabalho |
J45 | Asma |
Manganês e seus compostos tóxicos em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| G21.2 | Parkinsonismo secundário devido a outros agentes externos |
|
| H30 | Inflamação coriorretiniana |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| T57.2 | Efeito tóxico do manganês e seus compostos |
|
Material particulado e poluição do ar atmosférico em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
Mercúrio e seus compostos tóxicos em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F07.1 | Síndrome pós-encefalítica |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| G11.1 | Ataxia cerebelar de início precoce |
|
| G25.2 | Outras formas especificadas de tremor |
|
| G25.9 | Doenças extrapiramidais e transtornos dos movimentos, não especificados |
|
| G53 | Transtornos dos nervos cranianos em doenças classificadas em outra parte |
|
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
| G92 | Encefalopatia tóxica |
|
| H46 | Neurite óptica |
|
| H91.0 | Perda de audição ototóxica |
|
| I49 | Outras arritmias cardíacas |
|
| K05.1 | Gengivite crônica |
|
| K12.1 | Outras formas de estomatite |
|
| L23.0 | Dermatite alérgica de contato devida a metais |
|
| N03 | Síndrome nefrítica crônica |
|
| N14.3 | Nefropatia induzida por metais pesados |
|
| N97 | Infertilidade feminina |
|
| T56.1 | Efeito tóxico do mercúrio e seus compostos |
|
Metais tóxicos em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| T56 | Efeito tóxico de metais |
|
| T56.8 | Efeitos tóxicos de outros metais |
|
| T56.9 | Efeito tóxico do metal, não especificado |
|
Metanol em atividades de trabalho |
H46 | Neurite óptica |
Metil-n-butil cetona (MBK) em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
Micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos em atividades de trabalho |
L08.9 | Infecção localizada da pele e do tecido subcutâneo, não especificada |
Molibdênio em atividades de trabalho |
M10 | Gota |
Monocloroetileno em atividades de trabalho |
T57.8 | Efeito tóxico de outras substâncias inorgânicas especificadas |
Monometil éter de hidroquinona (MBEH) em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Monóxido de carbono em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| G92 | Encefalopatia tóxica |
|
| H91.0 | Perda de audição ototóxica |
|
| I20 | Angina pectoris |
|
| I21 | Infarto agudo do miocárdio |
|
| I46 | Parada cardíaca |
|
| I49 | Outras arritmias cardíacas |
|
| T58 | Efeito tóxico do monóxido de carbono |
|
N, N-dimetilformamida em atividades de trabalho |
C62 | Neoplasia maligna dos testículos |
Naftóis adicionados a corantes em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Névoas ácidas em atividades de trabalho |
C32 | Neoplasia maligna da laringe |
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J32 | Sinusite crônica |
|
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| K03.2 | Erosão dentária |
|
Névoas de cádmio ou seus compostos em atividades de trabalho |
K03.7 | Alterações pós-eruptivas da cor dos tecidos duros dos dentes |
Névoas de fluoretos ou seus compostos tóxicos em atividades de trabalho |
K03.2 | Erosão dentária |
Névoas de óleos de corte em atividades de trabalho |
J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
N-hexano em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
Níquel e seus compostos em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| C31 | Neoplasia maligna dos seios da face |
|
| C34 | Neoplasia maligna dos brônquios e dos pulmões |
|
| J30.3 | Outras rinites alérgicas |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
| K03.7 | Alterações pós-eruptivas da cor dos tecidos duros dos dentes |
|
| L23.0 | Dermatite alérgica de contato devida a metais |
|
Nitroderivados e aminoderivados do benzeno e seus homólogos em atividades de trabalho |
T65.3 | Efeito tóxico de nitroderivados e aminoderivados do benzeno e seus homólogos |
Nitrogênio em atividades de trabalho (compostos inorgânicos) |
J40 | Bronquite não especificada como aguda ou crônica |
Nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho |
G44.1 | Cefaleia vascular, não classificada em outra parte |
| I20 | Angina pectoris |
|
| I21 | Infarto agudo do miocárdio |
|
| I49 | Outras arritmias cardíacas |
|
Óleo de xisto em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
Óleo mineral não tratado em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
Óleos de corte em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Óleos e gorduras de origem mineral ou sintéticos em atividades de trabalho |
L24.1 | Dermatite de contato por Irritantes devida a óleos e gorduras |
| L72.8 | Outras formas de cistos foliculares da pele e do tecido subcutâneo |
|
Ósmio e seus derivados em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Outras substâncias especificadas em atividades de trabalho |
T65.8 | Efeito tóxico de outras substâncias especificadas |
Óxido de etileno em atividades de trabalho |
C50 | Neoplasia maligna da mama |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras formas de leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| G62.2 | Polineuropatia devida a outros agentes tóxicos |
|
Ozônio e/ou ozoneto e/ou peróxidos em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Para-aminofenol em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Para-butilfenol em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Para-cresol em atividades de trabalho |
L80 | Vitiligo |
| L81.5 | Leucodermia, não classificada em outra parte |
|
Parafenilenodiamina e seus derivados em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Pentóxido de vanádio em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Percloroetileno e outros agentes usados nos processos de limpeza à seco em atividades de trabalho |
C15 | Neoplasia maligna do esôfago |
| C67 | Neoplasia maligna da bexiga |
|
Pigmentos e solventes usados nos processos de impressão em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
| C67 | Neoplasia maligna da bexiga |
|
Plásticos em atividades de trabalho |
L23.5 | Dermatite alérgica de contato devida a outros produtos químicos |
Poeira da cana-de-açúcar em atividades de trabalho |
J67.1 | Bagaçose |
Poeira de algodão em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J45 | Asma |
|
| J66 | Doenças das vias aéreas devida a poeiras orgânicas específicas |
|
| J66.0 | Bissinose |
|
Poeira de alumínio em atividades de trabalho |
J63.0 | Aluminose (do pulmão) |
Poeira de cânhamo em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J45 | Asma |
|
| J66 | Doenças das vias aéreas devida a poeiras orgânicas específicas |
|
| J66.2 | Canabinose |
|
Poeira de cimento em atividades de trabalho |
H01.0 | Blefarite |
| H10 | Conjuntivite |
|
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
Poeira de calcário e/ou gesso e/ou cal em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Poeira de cortiça em atividades de trabalho |
J67.3 | Suberose |
Poeira de estanho em atividades de trabalho |
J63.5 | Estanhose |
Poeira de ferro em atividades de trabalho |
J63.4 | Siderose |
Poeira de linho em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J45 | Asma |
|
| J66 | Doenças das vias aéreas devida a poeiras orgânicas específicas |
|
| J66.1 | Doença dos cardadores de linho |
|
Poeira de talco em atividades de trabalho |
J62.0 | Pneumoconiose devida a pó de talco |
Poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos em atividades de trabalho |
J67 | Pneumonite de hipersensibilidade devida a poeiras orgânicas |
| J67.0 | Pulmão de fazendeiro |
|
| J67.2 | Pulmão dos criadores de pássaros |
|
| J67.4 | Pulmão dos trabalhadores do malte |
|
| J67.5 | Pulmão dos que trabalham com cogumelos |
|
| J67.7 | Doença pulmonar devida aos sistemas de ar condicionado e de umidificação do ar |
|
| J67.8 | Pneumonites de Hipersensibilidade Devidas a Outras Poeiras Orgânicas |
|
| J67.9 | Pneumonite de hipersensibilidade devida a poeira orgânica não especificada |
|
Poeiras da indústria do couro em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| C31 | Neoplasia maligna dos seios da face |
|
Poeiras de sisal em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J45 | Asma |
|
| J66 | Doenças das vias aéreas devida a poeiras orgânicas específicas |
|
| J66.8 | Doenças das vias aéreas devida a outras poeiras orgânicas específicas |
|
Poeiras de berílio e seus compostos tóxicos em atividades de trabalho |
J63.2 | Beriliose |
Poeiras de carboneto (carbeto) de rocha fosfática, de alumina, de zircônio em atividades de trabalho |
J63.8 | Pneumoconiose devida a outras poeiras inorgânicas especificadas |
Poeiras de carvão mineral em atividades de trabalho |
J44 | Outras doenças pulmonares obstrutivas crônicas |
| J60 | Pneumoconiose dos mineiros de carvão |
|
| J99.1 | Transtornos respiratórios em outras doenças sistêmicas do tecido conjuntivo classificadas em outra parte [Síndrome de Caplan] |
|
| M05.3 | Artrite reumatoide com comprometimento de outros órgãos e sistemas [Síndrome de Caplan] |
Poeiras de madeira em atividades de trabalho |
C11 | Neoplasia maligna da nasofaringe |
| C14 | Neoplasia maligna de outras localizações e de localizações mal definida, do lábio, cavidade oral e faringe |
|
| C30.0 | Neoplasia maligna da cavidade nasal |
|
| C31 | Neoplasia maligna dos seios da face |
|
| L81.4 | Outras formas de hiperpigmentação pela melanina |
|
Poeiras minerais em atividades de trabalho (outras) |
J44 | Outras doenças pulmonares obstrutivas crônicas |
Poeiras orgânicas da indústria do mobiliário em atividades de trabalho |
C31 | Neoplasia maligna dos seios da face |
Colas e solventes usados nas atividades de carpintaria e marcenaria em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| C31 | Neoplasia maligna dos seios da face |
|
Poeiras de metais duros em atividades de trabalho |
J63 | Pneumoconiose devida a outras poeiras inorgânicas |
Poeiras de sílica livre cristalina em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| J44 | Outras doenças pulmonares obstrutivas crônicas |
|
| J60 | Pneumoconiose dos mineiros de carvão |
|
| J62.8 | Pneumoconiose devida a outras poeiras que contenham sílica |
|
| J65 | Pneumoconiose associada com tuberculose |
|
| J99.1 | Transtornos respiratórios em outras doenças sistêmicas do tecido conjuntivo classificadas em outra parte [Síndrome de Caplan] |
|
| M05.3 | Artrite reumatoide com comprometimento de outros órgãos e sistemas [Síndrome de Caplan] |
|
Poeiras não especificadas em atividades de trabalho |
J65 | Pneumoconiose associada com tuberculose |
Poeiras orgânicas em atividades de trabalho |
C30.0 | Neoplasia maligna da cavidade nasal |
| J67 | Pneumonite de hipersensibilidade devida a poeiras orgânicas |
|
| J67.0 | Pulmão de fazendeiro |
|
| J67.2 | Pulmão dos criadores de pássaros |
|
| J67.4 | Pulmão dos trabalhadores do malte |
|
| J67.5 | Pulmão dos que trabalham com cogumelos |
|
| J67.7 | Doença pulmonar devida aos sistemas de ar condicionado e de umidificação do ar |
|
| J67.8 | Pneumonites de hipersensibilidade devidas a outras poeiras orgânicas |
|
| J67.9 | Pneumonite de hipersensibilidade devida a poeira orgânica não especificada |
|
Poeiras, gases e vapores de diferentes origens em atividades de trabalho |
H01.1 | Dermatoses não infecciosas da pálpebra |
Policlorofenóis ou seus sais de sódio em atividades de trabalho |
C49 | Neoplasia maligna do tecido conjuntivo e de outros tecidos moles |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Prata em atividades de trabalho |
K03.7 | Alterações pós-eruptivas da cor dos tecidos duros dos dentes |
Produção de eletrodo de carvão em atividades de trabalho; |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
Pirólise de plásticos e teflon em atividades de trabalho (produtos) |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Proteínas animais em aerossóis em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J45 | Asma |
|
Quinino e seus derivados em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Resina epóxi em atividades de trabalho |
J45 | Asma |
Sais de ouro em atividades de trabalho |
L81.4 | Outras formas de hiperpigmentação pela melanina |
Sais de prata em atividades de trabalho |
H11.1 | Degenerações e depósitos de conjuntiva |
| L81.4 | Outras formas de hiperpigmentação pela melanina |
Selênio e seus compostos em atividades de trabalho |
H10 | Conjuntivite |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
Solventes em atividades de trabalho |
L60 | Afecções das unhas |
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
Solventes clorados neurotóxicos em atividades de trabalho |
H46 | Neurite óptica |
Solventes halogenados em atividades de trabalho |
G25.9 | Doenças extrapiramidais e transtornos dos movimentos, não especificados |
| G50 | Transtornos do nervo trigêmeo |
|
| H10 | Conjuntivite |
|
| J68.0 | Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
|
| J68.1 | Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
|
| J68.3 | Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores outras |
|
| J68.4 | Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
Solventes orgânicos em atividades de trabalho |
C34 | Neoplasia maligna dos brônquios e dos pulmões |
| C67 | Neoplasia maligna da bexiga |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| G25.2 | Outras formas especificadas de tremor |
|
| G92 | Encefalopatia tóxica |
|
| H91.0 | Perda de audição ototóxica |
|
| T52 | Efeitos tóxicos de Solventes Orgânicos |
|
| T52.8 | Efeito tóxico de outros solventes orgânicos |
|
Substâncias asfixiantes em atividades de trabalho (outras) |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
Substância corrosiva, não especificada em atividades de trabalho |
T54.9 | Efeito tóxico de substância corrosiva, não especificada |
Substâncias de origem vegetal (cereais, farinhas, serragem etc.) em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J45 | Asma |
|
Substâncias inorgânicas em atividades de trabalho |
T57 | Efeito tóxico de outras substâncias inorgânicas |
| T57.8 | Efeito tóxico de outras substâncias inorgânicas especificadas |
|
Substâncias químicas sensibilizantes da pele e das vias respiratórias em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Sulfato de tálio em atividades de trabalho |
G92 | Encefalopatia tóxica |
Sulfeto de carbono em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
Sulfeto de hidrogênio em atividades de trabalho |
F02.8 | Demência em outras doenças específicas classificadas em outros locais |
| F05.0 | Delirium não superposto a uma demência, assim descrito |
|
| G52.0 | Transtornos do nervo olfatório |
|
| G92 | Encefalopatia tóxica |
|
| J40 | Bronquite não especificada como aguda ou crônica |
|
Sulfitos e/ou bissulfitos e/ou persulfatos em atividades de trabalho |
J30.3 | Outras rinites alérgicas |
| J31.0 | Rinite crônica |
|
| J31.2 | Faringite crônica |
|
| J45 | Asma |
|
Tabaco e nicotina em atividades de trabalho |
T65.2 | Efeito tóxico do tabaco e da nicotina (Doença da Folha Verde do Tabaco) |
Tálio e seus compostos em atividades de trabalho |
G62.2 | Polineuropatia devida a outros agentes tóxicos |
| G92 | Encefalopatia tóxica |
|
| L63 | Alopécia areata |
|
| N14.3 | Nefropatia induzida por metais pesados |
|
Tetracloroetileno em atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| T53.3 | Efeito tóxico do tetracloroetileno |
|
Terpenos e/ou vanádio, e seus compostos, em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
Tetracloreto de carbono em atividades de trabalho |
H10 | Conjuntivite |
| H46 | Neurite óptica |
|
| K71 | Doença hepática tóxica |
|
| K71.1 | Doença hepática tóxica com necrose hepática |
|
| K71.2 | Doença hepática tóxica com hepatite aguda |
|
| K71.3 | Doença hepática tóxica com hepatite crônica persistente |
|
| K71.6 | Doença hepática tóxica com hepatite não classificada em outra parte |
|
| K71.8 | Doença hepática tóxica com outros transtornos do fígado |
|
| T53.0 | Efeito tóxico do tetracloreto de carbono |
|
Tetracloroetano em atividades de trabalho |
G25.2 | Outras formas especificadas de tremor |
Tiocianatos em atividades de trabalho |
E03 | Outros hipotireoidismos |
Tiouracil em atividades de trabalho |
E03 | Outros hipotireoidismos |
Tioureia em atividades de trabalho |
E03 | Outros hipotireoidismo |
Tolueno e outros solventes aromáticos neurotóxicos em atividades de trabalho |
F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| H91.0 | Perda de audição ototóxica |
|
| T52.2 | Efeito tóxico de homólogos do benzeno |
|
Tório em atividades de trabalho |
K76.6 | Hipertensão portal |
Tricloroetileno em atividades de trabalho |
C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
| C64 | Neoplasia maligna do rim, exceto pelve renal |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
| F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
|
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
| G50 | Transtornos do nervo trigêmeo |
|
| H46 | Neurite óptica |
|
| H91.0 | Perda de audição ototóxica |
|
| T53.2 | Efeito tóxico do tricloroetileno |
|
Tricloroetano e outros solventes orgânicos halogenados neurotóxicos em atividades de trabalho |
F06 | Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
| F06.7 | Transtorno cognitivo leve |
|
| F07 | Transtornos de personalidade e do comportamento devidos a doença, a lesão e a disfunção cerebral |
|
| F09 | Transtorno mental orgânico ou sintomático não especificado |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F48.0 | Neurastenia |
|
Xileno em atividades de trabalho |
H91.0 | Perda de audição ototóxica |
| J40 | Bronquite não especificada como aguda ou crônica |
|
| T52.2 | Efeito tóxico de homólogos do benzeno |
|
Zinco e seus compostos em atividades de trabalho |
J40 | Bronquite não especificada como aguda ou crônica |
| T56.5 | Efeito tóxico do zinco e seus compostos |
|
Plantas ou manipulação de plantas em atividades de trabalho |
L23.7 | Dermatite alérgica de contato devido a plantas, exceto alimentos |
| L24.7 | Dermatite de contato por irritantes devido a plantas, exceto alimentos |
|
Mordedura ou picadura de serpente e/ou outros répteis e/ou escorpião e/ou aranha e/ou outros artrópodes e/ou peixe e/ou outros animais marinhos e/ou outros animais venenosos não especificados em atividades de trabalho |
T63 | Efeito tóxico de contato com animais venenosos |
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho (Parte III)
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| Agentes e/ou Fatores de Risco Biológicos | CID10 | Doença Relacionada ao Trabalho |
Agentes biológicos do tipo vírus não classificados em outras partes em atividades de trabalho |
A98 | Outras febres hemorrágicas por vírus, não classificadas em outra parte |
Ancylostomaem atividades de trabalho (espécies) |
B76 | Ancilostomíase |
| B76.0 | Ancilostomose |
|
Arbovírus da Mayaro (MAYV) em atividades de trabalho |
A93.8 | Febres virais especificadas transmitidas por artrópodes (Febre de Mayaro); Outras |
Aspergillusem atividades de trabalho (espécies) |
B44 | Aspergilose |
Bacillus anthracisem atividades de trabalho |
A22 | Carbúnculo |
Bactérias e fungos causadores de micetoma em atividades de trabalho |
B47 | Micetoma |
Borrelia burgdorferiem atividades de trabalho |
A69.2 | Doença de Lyme |
Brucellaem atividades de trabalho (espécies) |
A23 | Brucelose |
Burkholderia malleiem atividades de trabalho |
A24.0 | Mormo |
Candida albicanse outras espécies do mesmo gênero, potencialmente patogênicas em atividades de trabalho sob condições de umidade e irritação mecânica |
B37 | Candidíase |
Chlamydia psittaciouChlamydia pneumoniaeem atividades de trabalho |
A70 | Infecções causadas porClamídia psittaci(Febre dos papagaios, Ornitose, Psitacose) |
Chlamydia trachomatisem atividades de trabalho |
A71 | Tracoma |
Clostridium tetaniem atividades de trabalho |
A35 | Outros tipos de tétano |
Coccidioides immitisem atividades de trabalho |
B38 | Coccidioidomicose |
Coronavírus SARS-CoV-2 em atividades de trabalho |
B34.2 | Infecção por coronavírus de localização não especificada |
Coxiella burnetiiem atividades de trabalho |
A78 | Febre Q |
Cryptococcus neoformans(ouFilobasidiella neoformans) em atividades de trabalho |
B45 | Criptococose |
Ecchinococcusem atividades de trabalho (espécies) |
B67 | Equinococose |
Entamoeba histolyticaem atividades de trabalho |
A06 | Amebíase |
Erysipelothrix rhusiopathiaeem atividades de trabalho |
A26 | Erisipelóide |
Francisella tularensisem atividades de trabalho |
A21 | Tularemia |
Fungos do gêneroEpidermophyton, MicrosporumeTrichophytondurante atividades de trabalho em temperatura elevada e umidade |
B35 | Dermatofitose |
Fungos durante atividades de trabalho em temperatura elevada e umidade, exceto aqueles dos gênerosEpidermophyton, MicrosporumeTrichophyton |
B36 | Outras micoses superficiais |
Hantavírus em atividades de trabalho |
B33.4 | Síndrome (cardio-)pulmonar por Hantavírus [SPH] [SCPH] |
Herpes simples tipo 1 (HVS-1) em atividades de trabalho |
B00 | Infecções pelo vírus do herpes [herpes simples] |
| C46 | Sarcoma de Kaposi |
|
Histoplasma capsulatum em atividades de trabalho |
B39 | Histoplasmose |
Leishmania braziliensisem atividades de trabalho |
B55 | Leishmaniose |
| B55.1 | Leishmaniose cutânea |
|
| B55.2 | Leishmaniose cutâneo-mucosa |
|
Leptospira icterohaemorrhagiaee outras espéciesLesptospiraem atividades de trabalho |
A27 | Leptospirose |
Meningococo em atividades de trabalho |
A39 | Infecção meningocócica |
Mosquito (Aedes aegypti),transmissor do arbovírus da Chikungunya (CHIKV), em atividades de trabalho |
A92.0 | Febre de Chikungunya |
Mosquito(Aedes aegypti), transmissor do arbovírus da Dengue, em atividades de trabalho |
A90 | Dengue [Dengue Clássico] |
Mosquito (Aedes aegypti), transmissor do arbovírus da Zika, em atividades de trabalho |
U06.9 | Doença pelo Zika vírus, não especificada |
Mosquito transmissor do arbovírus da Febre Amarela em atividades de trabalho |
A95 | Febre Amarela |
Mycobacterium tuberculosis(Bacilo de Koch) ouMycobacterium bovisem atividades de trabalho |
A15 | Tuberculose respiratória, com confirmação bacteriológica e histológica |
| A16 | Tuberculose das vias respiratórias, sem confirmação bacteriológica ou histológica |
|
| A17 | Tuberculose do sistema nervoso |
|
| A18 | Tuberculose de outros órgãos |
|
| A19 | Tuberculose miliar |
|
Neisseria meningitidisem atividades de trabalho |
G01 | Meningite em doenças bacterianas classificadas em outra parte |
Onchocercaem atividades de trabalho (espécies) |
B73 | Oncocercose |
Papilomavírus em atividades de trabalho |
B07 | Verrugas de origem viral |
Papilomavírus humano tipos 5 e/ou 8 em atividades de trabalho |
C44 | Outras neoplasias malignas da pele |
Papilomavírus humano tipo 16 em atividades de trabalho |
C06 | Neoplasia maligna de outras partes e de partes não especificadas da boca |
| C09 | Neoplasia maligna da amígdala |
|
| C14 | Neoplasia maligna de outras localizações e de localizações mal definida, do lábio, cavidade oral e faringe |
|
| C21 | Neoplasia maligna do ânus e do canal anal |
|
| C32 | Neoplasia maligna da laringe |
|
| C52 | Neoplasia maligna da vagina |
|
| C53 | Neoplasia maligna de colo do útero |
|
| C60 | Neoplasia maligna de pênis |
|
Papilomavírus humano tipo 18 em atividades de trabalho |
C06 | Neoplasia maligna de outras partes e de partes não especificadas da boca |
| C21 | Neoplasia maligna do ânus e do canal anal |
|
| C51 | Neoplasia maligna da vulva |
|
| C53 | Neoplasia maligna de colo do útero |
|
| C60 | Neoplasia maligna de pênis |
|
Papilomavírus humano tipo 26 e/ou 31 e/ou 35 e/ou 39 e/ou 45 e/ou 51 e/ou 52 e/ou 53 e/ou 56 e/ou 58 e/ou 59 e/ou 66 e/ou 67 e/ou 68 e/ou 70 e/ou 73 e/ou 82 em atividades de trabalho |
C53 | Neoplasia maligna de colo do útero |
Papilomavírus humano tipo 33 em atividades de trabalho |
C21 | Neoplasia maligna do ânus e do canal anal |
| C51 | Neoplasia maligna da vulva |
|
| C53 | Neoplasia maligna de colo do útero |
|
Paracoccidioides brasiliensisem atividades de trabalho |
B41 | Paracoccidioidomicose |
Plasmodiumem atividades de trabalho (espécie não especificada do gênero) |
B54 | Malária não especificada |
Plasmodium falciparumem atividades de trabalho |
B50 | Malária por Plasmodium falciparum |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Plasmodium malariaeem atividades de trabalho |
B52 | Malária por Plasmodium malariae |
Plasmodium vivaxem atividades de trabalho |
B51 | Malária por Plasmodium vivax |
Plasmodiumdiferente damalariae,vivaxefalciparum, ou outros protozoários em atividades de trabalho (espécies) |
B53 | Outras formas de malária confirmadas por exames parasitológicos |
Poliovírus em atividades de trabalho |
A80 | Poliomielite aguda |
Rickettsiaem atividades de trabalho |
A79 | Outras rickettsioses |
Rickettsia rickettsii, e outras espécies deRickettsia, em atividades de trabalho |
A77 | Febre maculosa [rickettsioses transmitidas por carrapatos] |
Sarcoptes scabieiem atividades de trabalho |
B86 | Escabiose [sarna] |
Schistosomaem atividades de trabalho (espécies) |
B65 | Esquistossomose [bilharziose] [Schistosomíase] |
Schistosoma haematobiumem atividades de trabalho |
C67 | Neoplasia maligna da bexiga |
Sporothrix schenkiiem atividades de trabalho |
B42 | Esporotricose |
Streptococcus suisem atividades de trabalho |
A40.8 | Outras septicemias estreptocócicas |
| G00.2 | Meningite estreptocócica |
|
Toxocara canis e/ou Toxocara catiem atividades de trabalho |
B83.0 | Larva migrans visceral |
Treponema pallidumem atividades de trabalho |
A65 | Sífilis não-venérea |
Trypanosoma cruziem atividades de trabalho |
B57 | Doença de Chagas |
Vírus da Hepatite A (HAV) em atividades de trabalho |
B15 | Hepatite aguda A |
Vírus da Hepatite B (HBV) em atividades de trabalho |
B16 | Hepatite aguda B |
| C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
Vírus da Hepatite C (HCV) em atividades de trabalho |
B17 | Outras hepatites virais agudas |
| C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Vírus da Hepatite E (HEV) em atividades de trabalho |
B17 | Outras hepatites virais agudas |
Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho |
B20 | Doença pelo vírus da imunodeficiência humana [HIV], resultando em doenças infecciosas e parasitárias |
| B21 | Doença pelo vírus da imunodeficiência humana [HIV], resultando em neoplasias malignas |
|
| B22 | Doença pelo vírus da imunodeficiência humana [HIV] resultando em outras doenças especificadas |
|
| B23 | Doença pelo vírus da imunodeficiência humana [HIV] resultando em outras doenças |
|
| B24 | Doença pelo vírus da imunodeficiência humana [HIV] não especificada |
|
| C21 | Neoplasia maligna do ânus e do canal anal |
|
| C22 | Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
|
| C44 | Outras neoplasias malignas da pele |
|
| C46 | Sarcoma de Kaposi |
|
| C51 | Neoplasia maligna da vulva |
|
| C52 | Neoplasia maligna da vagina |
|
| C53 | Neoplasia maligna de colo do útero |
|
| C60 | Neoplasia maligna de pênis |
|
| C69 | Neoplasia maligna do olho e anexos |
|
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Vírus da raiva em atividades de trabalho |
A82 | Raiva |
Vírus da rubéola em atividades de trabalho |
B06 | Rubéola |
Vírus do sarampo em atividades de trabalho |
B05 | Sarampo |
Vírus Epstein-Barr em atividades de trabalho |
C11 | Neoplasia maligna da nasofaringe |
| C82 | Linfoma não-Hodgkin, folicular (nodular) |
|
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Vírus influenza em atividades de trabalho |
J11 | Influenza [gripe] devida a vírus não identificado |
| J11.1 | Influenza [gripe] com outras manifestações respiratórias, devida a vírus não identificado |
Vírus linfotrópico de células T humanas tipo 1 em atividades de trabalho |
C82 | Linfoma não-Hodgkin, folicular (nodular) |
| C83 | Linfoma não-Hodgkin difuso |
|
| C84 | Linfomas de células T cutâneas e periféricas |
|
| C85 | Linfoma não-Hodgkin de outros tipos e de tipo não especificado |
|
| C91 | Leucemia linfoide |
|
| C92 | Leucemia mieloide |
|
| C93 | Leucemia monocítica |
|
| C94 | Outras leucemias de células de tipo especificado |
|
| C95 | Leucemia de tipo celular não especificado |
|
Vírus não especificado da hepatite em atividades de trabalho |
B18 | Hepatite viral crônica |
| B19 | Hepatite viral não especificada |
|
| D89.1 | Crioglobulinemia |
|
Vírus Orf em atividades de trabalho |
B08.0 | Infecções por ortopoxvírus |
Vírus Varicela-zoster (VVZ) em atividades de trabalho |
B01 | Varicela [Catapora] |
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho (Parte IV)
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| Agentes e/ou Fatores de Risco | CID10 | Doença Relacionada ao Trabalho |
Ambiente de trabalho com iluminação ausente ou deficiente. |
H55 | Nistagmo e outros movimentos irregulares do olho |
Aplicação de força (Biomecânica do trabalho) |
I83 | Varizes dos membros inferiores |
| M16 | Coxartrose [artrose do quadril] |
|
| M17 | Gonartrose [artrose do joelho] |
|
| M50 | Transtornos dos discos cervicais |
|
| M50.0 | Transtorno do disco cervical com mielopatia |
|
| M50.1 | Transtorno do disco cervical com radiculopatia |
|
| M50.2 | Outro deslocamento de disco cervical |
|
| M50.3 | Outra degeneração de disco cervical |
|
| M50.8 | Outros transtornos de discos cervicais |
|
| M50.9 | Transtorno não especificado de disco cervical |
|
| M51 | Outros transtornos de discos intervertebrais |
|
| M51.0 | Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
|
| M51.1 | Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
|
| M51.2 | Outros deslocamentos discais intervertebrais especificados |
|
| M51.3 | Outra degeneração especificada de disco intervertebral |
|
| M51.8 | Outros transtornos especificados de discos intervertebrais |
|
| M53.1 | Síndrome cervicobraquial |
|
| M54 | Dorsalgia |
|
| M54.2 | Cervicalgia |
|
| M54.3 | Ciática |
|
| M54.4 | Lumbago com ciática |
|
| M54.5 | Dor lombar baixa |
|
| M65 | Sinovites e tenossinovites |
|
| M65.4 | Tenossinovite estilóide radial [de Quervain] |
|
| M65.8 | Outras sinovites e tenossinovites |
|
| M65.9 | Tenossinovites, não especificadas |
|
| M72.0 | Fibromatose de fáscia palmar [Dupuytren] |
|
| M75 | Lesões do ombro |
|
| M75.0 | Capsulite adesiva do ombro |
|
| M75.1 | Síndrome do manguito rotador |
|
| M75.2 | Tendinite bicipital |
|
| M75.3 | Tendinite calcificante do ombro |
|
| M75.5 | Bursite do ombro |
|
| M75.8 | Outras lesões do ombro |
|
| M75.9 | Lesão não especificada do ombro |
|
| M77 | Outras entesopatias |
|
| M77.0 | Epicondilite medial |
|
| M77.1 | Epicondilite lateral |
|
| M77.8 | Outras entesopatias não classificadas em outra parte |
|
| M79.8 | Outros transtornos especificados dos tecidos moles |
|
| M84.3 | Fratura de fadiga ("stress") não classificada em outra parte |
|
Manipulação manual de carga (Biomecânica do trabalho) |
I83 | Varizes dos membros inferiores |
| K40 | Hérnia inguinal |
|
| K41 | Hérnia femoral |
|
| K42 | Hérnia umbilical |
|
| K43 | Hérnia ventral |
|
| K44 | Hérnia diafragmática |
|
| K45 | Outras hérnias abdominais |
|
| K46 | Hérnia abdominal não especificada |
|
| M16 | Coxartrose [artrose do quadril] |
|
| M17 | Gonartrose [artrose do joelho] |
|
| M47.8 | Outras espondiloses |
|
| M50 | Transtornos dos discos cervicais |
|
| M50.0 | Transtorno do disco cervical com mielopatia |
|
| M50.1 | Transtorno do disco cervical com radiculopatia |
|
| M50.2 | Outro deslocamento de disco cervical |
|
| M50.3 | Outra degeneração de disco cervical |
|
| M50.8 | Outros transtornos de discos cervicais |
|
| M50.9 | Transtorno não especificado de disco cervical |
|
| M51 | Outros transtornos de discos intervertebrais |
|
| M51.0 | Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
|
| M51.1 | Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
|
| M51.2 | Outros deslocamentos discais intervertebrais especificados |
|
| M51.3 | Outra degeneração especificada de disco intervertebral |
|
| M51.8 | Outros transtornos especificados de discos intervertebrais |
|
| M53.1 | Síndrome cervicobraquial |
|
| M54 | Dorsalgia |
|
| M54.2 | Cervicalgia |
|
| M54.3 | Ciática |
|
| M54.4 | Lumbago com ciática |
|
| M54.5 | Dor lombar baixa |
Movimentos articulares repetitivos (Biomecânica do trabalho) |
G54.0 | Transtornos do plexo braquial |
| G56 | Mononeuropatias dos membros superiores |
|
| G56.0 | Síndrome do túnel do carpo |
|
| G56.1 | Outras lesões do nervo mediano |
|
| G56.2 | Lesões do nervo cubital [ulnar] |
|
| G56.3 | Lesão do nervo radial |
|
| G56.8 | Outras mononeuropatias dos membros superiores |
|
| G57.3 | Lesão do nervo poplíteo lateral |
|
| K07.6 | Transtornos da articulação temporomandibular |
|
| M16 | Coxartrose [artrose do quadril] |
|
| M17 | Gonartrose [artrose do joelho] |
|
| M50 | Transtornos dos discos cervicais |
|
| M50.0 | Transtorno do disco cervical com mielopatia |
|
| M50.1 | Transtorno do disco cervical com radiculopatia |
|
| M50.2 | Outro deslocamento de disco cervical |
|
| M50.3 | Outra degeneração de disco cervical |
|
| M50.8 | Outros transtornos de discos cervicais |
|
| M50.9 | Transtorno não especificado de disco cervical |
|
| M51 | Outros transtornos de discos intervertebrais |
|
| M51.0 | Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
|
| M51.1 | Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
|
| M51.2 | Outros deslocamentos discais intervertebrais especificados |
|
| M51.3 | Outra degeneração especificada de disco intervertebral |
|
| M51.8 | Outro transtornos especificados de discos intervertebrais |
|
| M53.1 | Síndrome cervicobraquial |
|
| M54 | Dorsalgia |
|
| M54.2 | Cervicalgia |
|
| M54.3 | Ciática |
|
| M54.4 | Lumbago com ciática |
|
| M54.5 | Dor lombar baixa |
|
| M65 | Sinovites e tenossinovites |
|
| M65.3 | Dedo em gatilho |
|
| M65.4 | Tenossinovite estilóide radial [de Quervain] |
|
| M65.8 | Outras sinovites e tenossinovites |
|
| M65.9 | Tenossinovites, não especificadas |
|
| M70 | Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão |
|
| M70.0 | Sinovite crepitante crônica da mão e do punho |
|
| M70.1 | Bursite da mão |
|
| M70.2 | Bursite do olécrano |
|
| M70.3 | Outras bursites do cotovelo |
|
| M70.4 | Bursite pré-patelar |
|
| M70.5 | Outras bursites do joelho |
|
| M70.8 | Transtornos dos tecidos moles relacionados com o uso, uso excessivo e pressão; outros |
|
| M70.9 | Transtorno não especificado dos tecidos moles relacionados com o uso, uso excessivo e pressão. |
|
| M72.0 | Fibromatose de fáscia palmar [Dupuytren] |
|
| M75 | Lesões do ombro |
|
| M75.0 | Capsulite adesiva do ombro |
|
| M75.1 | Síndrome do manguito rotador |
|
| M75.2 | Tendinite bicipital |
|
| M75.3 | Tendinite calcificante do ombro |
|
| M75.5 | Bursite do ombro |
|
| M75.8 | Outras lesões do ombro |
|
| M75.9 | Lesão não especificada do ombro |
|
| M77 | Outas entesopatias |
|
| M77.0 | Epicondilite medial |
|
| M77.1 | Epicondilite lateral |
|
| M77.8 | Outras entesopatias não classificadas em outra parte |
|
| M79.8 | Outris transtornos especificados dos tecidos moles |
|
| M84.3 | Fratura de fadiga ("stress") não classificada em outra parte |
Ortostatismo prolongado (Biomecânica do trabalho) |
I83 | Varizes dos membros inferiores |
Posições forçadas (Biomecânica do trabalho) |
G54.0 | Transtornos do plexo braquial |
| G56 | Mononeuropatias dos membros superiores |
|
| G56.0 | Síndrome do túnel do carpo |
|
| G56.1 | Outras lesões do nervo mediano |
|
| G56.2 | Lesões do nervo cubital [ulnar] |
|
| G56.3 | Lesão do nervo radial |
|
| G56.8 | Outras mononeuropatias dos membros superiores |
|
| G57.3 | Lesão do nervo poplíteo lateral |
|
| M16 | Coxartrose [artrose do quadril] |
|
| M17 | Gonartrose [artrose do joelho] |
|
| M23.3 | Outros transtornos de menisco |
|
| M50 | Transtornos dos discos cervicais |
|
| M50.0 | Transtorno do disco cervical com mielopatia |
|
| M50.1 | Transtorno do disco cervical com radiculopatia |
|
| M50.2 | Outro deslocamento de disco cervical |
|
| M50.3 | Outra degeneração de disco cervical |
|
| M50.8 | Outros transtornos de discos cervicais |
|
| M50.9 | Transtorno não especificado de disco cervical |
|
| M51 | Outros transtornos de discos intervertebrais |
|
| M51.0 | Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
|
| M51.1 | Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
|
| M51.2 | Outros deslocamentos discais intervertebrais especificados |
|
| M51.3 | Outra degeneração especificada de disco intervertebral |
|
| M51.8 | Outros transtornos especificados de discos intervertebrais |
|
| M53.1 | Síndrome cervicobraquial |
|
| M54 | Dorsalgia |
|
| M54.2 | Cervicalgia |
|
| M54.3 | Ciática |
|
| M54.4 | Lumbago com ciática |
|
| M54.5 | Dor lombar baixa |
|
| M65 | Sinovites e tenossinovites |
|
| M65.3 | Dedo em gatilho |
|
| M65.4 | Tenossinovite estilóide radial [de Quervain] |
|
| M65.8 | Outras sinovites e tenossinovites |
|
| M65.9 | Tenossinovites, não especificadas |
|
| M70 | Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão, de origem ocupacional |
|
| M70.0 | Sinovite crepitante crônica da mão e do punho |
|
| M70.1 | Bursite da mão |
|
| M70.2 | Bursite do olécrano |
|
| M70.3 | Outras bursites do cotovelo |
|
| M70.4 | Bursite pré-patelar |
|
| M70.5 | Outras bursites do joelho |
|
| M70.8 | Transtornos dos tecidos moles relacionados com o uso, uso excessivo e pressão; outros |
|
| M70.9 | Transtorno não especificado dos tecidos moles relacionados com o uso, uso excessivo e pressão. |
|
| M72.0 | Fibromatose de fáscia palmar [Dupuytren] |
|
| M75 | Lesões do ombro |
|
| M75.0 | Capsulite adesiva do ombro |
|
| M75.1 | Síndrome do manguito rotador |
|
| M75.2 | Tendinite bicipital |
|
| M75.3 | Tendinite calcificante do ombro |
|
| M75.5 | Bursite do ombro |
|
| M75.8 | Outras lesões do ombro |
|
| M75.9 | Lesão não especificada do ombro |
|
| M77 | Outras entesopatias |
|
| M77.0 | Epicondilite medial |
|
| M77.1 | Epicondilite lateral |
|
| M77.8 | Outras entesopatias não classificadas em outra parte |
|
| M79.8 | Outros transtornos especificados dos tecidos moles |
|
| M84.3 | Fratura de fadiga ("stress") não classificada em outra parte |
|
Pressão e/ou fricção da pele (Biomecânica do trabalho) |
L84 | Calos e calosidades |
Traumatismos das unhas (Biomecânica do trabalho) |
L60 | Afecções das unhas |
Trabalho com sobrecarga vocal associada e/ou agravada por: |
J04.2 | Laringotraqueíte aguda |
| J37.1 | Laringotraqueíte crônica |
|
| J38 | Doenças das cordas vocais e da laringe não classificadas em outra parte |
|
| J38.2 | Nódulos das cordas vocais |
|
R49 |
Distúrbios da voz |
|
J37.1 |
Laringotraqueíte crônica |
|
J38 |
Doenças das cordas vocais e da laringe não classificadas em outra parte |
|
J38.2 |
Nódulos das cordas vocais |
|
R49 |
Distúrbios da voz |
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho (Parte V)
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
Agentes e/ou Fatores de Risco Psicossociais no Trabalho |
CID10 |
Doença Relacionada ao Trabalho |
Fatores psicossociais relacionados a: Gestão organizacional: Deficiências na administração de recursos humanos, que incluem estilo de comando, modalidades de pagamento e contratação [terceirização, trabalho intermitente, microempreendedor individual, pejotização e uberização], participação, acesso a integração e treinamento, serviços de assistência social, mecanismos de avaliação de desempenho e estratégias para gerenciar mudanças que afetam as pessoas, entre outros. Características das relações sociais no trabalho: Deficiência no clima das relações, coesão e qualidade das interações, inclusive trabalho em equipe, assédio psicológico, entre outros. Conteúdo das tarefas do trabalho: Exigências de carga mental (velocidade, complexidade, atenção, profundidade, variedade e restrição de tempo); o próprio conteúdo da tarefa que é definida através do nível de responsabilidade direta (por bens, pela segurança de outros, por informações confidenciais, pela vida e saúde de outros, por orientação e resultados); demandas emocionais (pelo atendimento ao cliente); especificação de sistemas de controle e definição de funções, entre outros. Condições do ambiente de trabalho: Deficiência em aspectos físicos (temperatura, ruído, iluminação, ventilação, vibração); químicos; biológicos; projeto de trabalho e saneamento, como fatores psicossociais agravantes ou coadjuvantes. Interação pessoa-tarefa: Avaliar a relevância do conhecimento e das habilidades que a pessoa possui em relação às demandas da tarefa, os níveis de iniciativa e autonomia permitidos e de reconhecimento, bem como a identificação da pessoa com a tarefa e com a organização. Jornada de trabalho: Problemas na organização e duração da jornada de trabalho; existência ou ausência de pausas durante o dia, diferente da hora das refeições; trabalho em turno e noturno; tipo e frequência de rotação dos turnos; número e frequência de horas extras mensais e duração e frequência de intervalos semanais; Trabalho intermitente. Violência e Assédio moral/sexual: Violência física ou psicológica relacionada a aspectos do trabalho.
|
F10 | Transtornos mentais e comportamentais devidos ao uso de álcool |
| F11 | Transtornos mentais e comportamentais devidos ao uso de opiáceos |
|
| F12 | Transtornos mentais e comportamentais devidos ao uso de canabinóides |
|
| F13 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos |
|
| F13.2 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
|
| F14 | Transtornos mentais e comportamentais devidos ao uso da cocaína |
|
| F15 | Transtornos mentais e comportamentais devidos ao uso de outros estimulantes, inclusive a cafeína |
|
| F16 | Transtornos mentais e comportamentais devidos ao uso de alucinógenos |
|
| F17 | Transtornos mentais e comportamentais devidos ao uso de fumo |
|
| F18 | Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
|
| F19 | Transtornos mentais e comportamentais devidos ao uso de múltiplas drogas e ao uso de outras substâncias psicoativas |
|
| F22 | Transtornos delirantes persistentes |
|
| F23 | Transtornos psicóticos agudos e transitórios |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F41 | Outros transtornos ansiosos |
|
| F43 | Reações ao "stress" grave e transtornos de adaptação |
|
| F43.1 | Estado de "stress" pós-traumático |
|
| F43.2 | Transtornos de adaptação |
|
| F45 | Transtornos somatoformes |
|
| F48.0 | Neurastenia |
|
| F48.8 | Outros transtornos neuróticos especificados |
|
| F51.2 | Transtorno do ciclo vigília-sono devido a fatores não-orgânicos |
|
| G45.9 | Isquemia cerebral transitória não especificada |
|
| G47.2 | Distúrbios do ciclo vigília-sono |
|
| I10 | Hipertensão essencial (primária) |
|
| I20 | Angina pectoris |
|
| I21 | Infarto agudo do miocárdio |
|
| I67.4 | Encefalopatia hipertensiva |
|
| K27 | Úlcera péptica de localização não especificada |
|
| M65 | Sinovites e tenossinovites |
|
| M65.3 | Dedo em gatilho |
|
| M65.4 | Tenossinovite estilóide radial [de Quervain] |
|
| M65.8 | Outras sinovites e tenossinovites |
|
| M65.9 | Tenossinovites, não especificadas |
|
| M70 | Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão, de origem ocupacional |
|
| M70.0 | Sinovite crepitante crônica da mão e do punho |
|
| M70.1 | Bursite da mão |
|
| M70.2 | Bursite do olécrano |
|
| M70.3 | Outras bursites do cotovelo |
|
| M70.4 | Bursite pré-patelar |
|
| M70.5 | Outras bursites do joelho |
|
| M70.8 | Transtornos dos tecidos moles relacionados com o uso, uso excessivo e pressão; outros |
|
| M70.9 | Transtorno não especificado dos tecidos moles relacionados com o uso, uso excessivo e pressão. |
|
| M72.0 | Fibromatose de fáscia palmar [Dupuytren] |
|
| M75 | Lesões do ombro |
|
| M75.0 | Capsulite adesiva do ombro |
|
| M75.1 | Síndrome do manguito rotador |
|
| M75.2 | Tendinite bicipital |
|
| M75.3 | Tendinite calcificante do ombro |
|
| M75.5 | Bursite do ombro |
|
| M75.8 | Outras lesões do ombro |
|
| M75.9 | Lesão não especificada do ombro |
|
| M77 | Outras entesopatias |
|
| M77.0 | Epicondilite medial |
|
| M77.1 | Epicondilite lateral |
|
| M77.8 | Outras entesopatias não classificadas em outra parte |
|
| M79.8 | Outros transtornos especificados dos tecidos moles |
|
| X60-X84 | Lesões autoprovocadas intencionalmente (Suicídio) |
|
| Z73.0 | Esgotamento (Burnout) |
|
Fatores psicossociais relacionados a: Risco de morte e trauma no trabalho: amputações e esmagamentos, queimaduras, choques elétricos de alta tensão, acidentes de trânsito, queda de alturas, explosões, afogamentos e outros; assaltos, assaltos/ataques à integridade física, entre outros |
F10 | Transtornos mentais e comportamentais devidos ao uso de álcool |
| F11 | Transtornos mentais e comportamentais devidos ao uso de opiáceos |
|
| F12 | Transtornos mentais e comportamentais devidos ao uso de canabinóides |
|
| F13 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos |
|
| F13.2 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
|
| F14 | Transtornos mentais e comportamentais devidos ao uso da cocaína |
|
| F15 | Transtornos mentais e comportamentais devidos ao uso de outros estimulantes, inclusive a cafeína |
|
| F16 | Transtornos mentais e comportamentais devidos ao uso de alucinógenos |
|
| F17 | Transtornos mentais e comportamentais devidos ao uso de fumo |
|
| F18 | Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
|
| F19 | Transtornos mentais e comportamentais devidos ao uso de múltiplas drogas e ao uso de outras substâncias psicoativas |
|
| F22 | Transtornos delirantes persistentes |
|
| F23 | Transtornos psicóticos agudos e transitórios |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F41 | Outros transtornos ansiosos |
|
| F43 | Reações ao "stress" grave e transtornos de adaptação |
|
| F43.1 | Estado de "stress" pós-traumático |
|
| F43.2 | Transtornos de adaptação |
|
| F45 | Transtornos somatoformes |
|
| F48.0 | Neurastenia |
|
| F48.8 | Outros transtornos neuróticos especificados |
|
| F51.2 | Transtorno do ciclo vigília-sono devido a fatores não-orgânicos |
|
| G45.9 | Isquemia cerebral transitória não especificada |
|
| G47.2 | Distúrbios do ciclo vigília-sono |
|
| I10 | Hipertensão essencial (primária) |
|
| I20 | Angina pectoris |
|
| I21 | Infarto agudo do miocárdio |
|
| I67.4 | Encefalopatia hipertensiva |
|
| K27 | Úlcera péptica de localização não especificada |
|
| X60-X84 | Lesões autoprovocadas intencionalmente (Suicídio) |
|
| Z73.0 | Esgotamento (Burnout) |
Fatores psicossociais relacionados a: Jornada de trabalho: Problemas na organização e duração da jornada de trabalho; existência ou ausência de pausas durante o dia, diferente da hora das refeições; trabalho em turno e noturno; tipo e frequência de rotação dos turnos; número · e frequência de horas extras mensais e duração e frequência de intervalos semanais; Trabalho intermitente |
I46 | Parada cardíaca |
| I60 | Hemorragia subaracnóide |
|
| I61 | Hemorragia intracerebral |
|
| I63 | Infarto cerebral |
|
| I64 | Acidente vascular cerebral, não especificado como hemorrágico ou isquêmico |
|
Fatores psicossociais relacionados a jornada de trabalho (Trabalho em turnos; Trabalho noturno) |
E11 | Diabetes mellitus não insulino-dependente |
| E66 | Obesidade |
|
| E88.8 | Outros distúrbios metabólicos não especificados |
|
Fatores psicossociais relacionados a jornada de trabalho (Trabalho noturno) |
C18 | Neoplasia maligna do cólon |
| C20 | Neoplasia maligna do reto |
|
| C50 | Neoplasia maligna da mama |
|
| C61 | Neoplasia maligna da próstata |
|
Desemprego |
F10 | Transtornos mentais e comportamentais devidos ao uso de álcool |
| F11 | Transtornos mentais e comportamentais devidos ao uso de opiáceos |
|
| F12 | Transtornos mentais e comportamentais devidos ao uso de canabinóides |
|
| F13 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos |
|
| F13.2 | Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
|
| F14 | Transtornos mentais e comportamentais devidos ao uso da cocaína |
|
| F15 | Transtornos mentais e comportamentais devidos ao uso de outros estimulantes, inclusive a cafeína |
|
| F16 | Transtornos mentais e comportamentais devidos ao uso de alucinógenos |
|
| F17 | Transtornos mentais e comportamentais devidos ao uso de fumo |
|
| F18 | Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
|
| F19 | Transtornos mentais e comportamentais devidos ao uso de múltiplas drogas e ao uso de outras substâncias psicoativas |
|
| F22 | Transtornos delirantes persistentes |
|
| F23 | Transtornos psicóticos agudos e transitórios |
|
| F32 | Episódios depressivos |
|
| F33 | Transtorno depressivo recorrente |
|
| F41 | Outros transtornos ansiosos |
|
| F43 | Reações ao "stress" grave e transtornos de adaptação |
|
| F43.2 | Transtornos de adaptação |
|
| F45 | Transtornos somatoformes |
|
| F48.0 | Neurastenia |
|
| F48.8 | Outros transtornos neuróticos especificados |
|
| F51.2 | Transtorno do ciclo vigília-sono devido a fatores não-orgânicos |
|
| G45.9 | Isquemia cerebral transitória não especificada |
|
| G47.2 | Distúrbios do ciclo vigília-sono |
|
| I10 | Hipertensão essencial (primária) |
|
| I20 | Angina pectoris |
|
| I21 | Infarto agudo do miocárdio |
|
| I67.4 | Encefalopatia hipertensiva |
|
| K27 | Úlcera péptica de localização não especificada |
|
| X60-X84 | Lesões autoprovocadas intencionalmente (Suicídio) |
LISTA A - Agentes e/ou Fatores de Risco com respectivas Doenças Relacionadas ao Trabalho (Parte VI)
Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
Agentes e/ou Fatores de Risco Outros |
CID10 |
Doença Relacionada ao Trabalho |
Sequela de acidente de trabalho com traumatismo cranioencefálico. |
F05.0 | Delirium não superposto a uma demência, assim descrito |
| F07.1 | Síndrome pós-encefalítica |
|
Complicação evolutiva das pneumoconioses graves, principalmente silicose. |
I27.9 | Cardiopatia pulmonar não especificada |
Sequela de acidente de trabalho com trauma ósseo |
M93.1 | Doença de Kienböck do Adulto |
| M93.8 | Outras osteocondropatias, especificadas |
LISTA B - Doenças Relacionadas ao Trabalho com respectivos Agentes e/ou Fatores de Risco
(Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
Capítulo I - Algumas doenças infecciosas e parasitárias (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
A06 |
Amebíase |
• Exposição a Entamoeba histolytica em atividades de trabalho. |
A15 |
Tuberculose respiratória, com confirmação bacteriológica e histológica |
• Exposição a Mycobacterium tuberculosis (Bacilo de Koch) ou Mycobacterium bovis em atividades de trabalho. |
A16 |
Tuberculose das vias respiratórias, sem confirmação bacteriológica ou histológica |
• Exposição a Mycobacterium tuberculosis (Bacilo de Koch) ou Mycobacterium bovis em atividades de trabalho. |
A17 |
Tuberculose do sistema nervoso |
• Exposição a Mycobacterium tuberculosis (Bacilo de Koch) ou Mycobacterium bovis em atividades de trabalho. |
A18 |
Tuberculose de outros órgãos |
• Exposição a Mycobacterium tuberculosis (Bacilo de Koch) ou Mycobacterium bovis em atividades de trabalho. |
A19 |
Tuberculose miliar |
• Exposição a Mycobacterium tuberculosis (Bacilo de Koch) ou Mycobacterium bovis em atividades de trabalho. |
A21 |
Tularemia |
• Exposição a Francisella tularensis em atividades de trabalho. |
A22 |
Carbúnculo |
• Exposição a Bacillus anthracis em atividades de trabalho. |
A23 |
Brucelose |
• Exposição a espécies de Brucella em atividades de trabalho. |
A24.0 |
Mormo |
• Exposição a Burkholderia mallei em atividades de trabalho |
A26 |
Erisipelóide |
• Exposição a Erysipelothrix rhusiopathiae em atividades de trabalho. |
A27 |
Leptospirose |
• Exposição a Leptospira icterohaemorrhagiae, e outras espécies Lesptospira em atividades de trabalho. |
A35 |
Outros tipos de tétano |
• Exposição a Clostridium tetani em atividades de trabalho. |
A39 |
Infecção meningocócica |
• Exposição a meningococo em atividades de trabalho. |
A40.8 |
Outras septicemias estreptocócicas |
• Exposição a Streptococcus suis em atividades de trabalho. |
A65 |
Sífilis não-venérea |
• Exposição aTreponema pallidum em atividades de trabalho. |
A69.2 |
Doença de Lyme |
• Exposição aBorrelia burgdorferi em atividades de trabalho. |
A70 |
Infecções causadas porClamídia psittaci(Febre dos papagaios, Ornitose, Psitacose) |
• Exposição a Chlamydia psittaci ou Chlamydia pneumoniaeem atividades de trabalho. |
A71 |
Tracoma |
• Exposição aChlamydia trachomatis em atividades de trabalho. |
A77 |
Febre maculosa [rickettsioses transmitidas por carrapatos] |
• Exposição a Rickettsia rickettsii, e outras espécies de Rickettsia ematividades de trabalho. |
A78 |
Febre Q |
• Exposição a Coxiella burnetii em atividades de trabalho. |
A79 |
Outras rickettsioses |
• Exposição a Rickettsia em atividades de trabalho. |
A80 |
Poliomielite aguda |
• Exposição a poliovírus em atividades de trabalho. |
A82 |
Raiva |
• Exposição a vírus da raiva em atividades de trabalho. |
A90 |
Dengue [Dengue Clássico] |
• Exposição a mosquito (Aedes aegypti), transmissor do arbovírus da Dengue em atividades de trabalho. |
A92.0 |
Febre de Chikungunya |
• Exposição a mosquito (Aedes aegypti), transmissor do arbovírus da Chikungunya (CHIKV) em atividades de trabalho. |
A93.8 |
Febres virais especificadas transmitidas por artrópodes (Febre de Mayaro); Outras |
• Exposição a arbovírus da Mayaro (MAYV) em atividades de trabalho. |
A95 |
Febre Amarela |
• Exposição a mosquito transmissor do arbovírus da Febre Amarela em atividades de trabalho. |
A98 |
Outras febres hemorrágicas por vírus, não classificadas em outra parte |
• Exposição a agentes biológicos do tipo vírus não classificados em outras partes em atividades de trabalho. |
B00 |
Infecções pelo vírus do herpes [herpes simples] |
• Exposição a vírus Herpes simples tipo 1 (HVS-1) em atividades de trabalho. |
B01 |
Varicela [Catapora] |
• Exposição a vírus varicela zoster (VVC)em atividades de trabalho. |
B05 |
Sarampo |
• Exposição a vírus do sarampo em atividades de trabalho. |
B06 |
Rubéola |
• Exposição a vírus da rubéola em atividades de trabalho. |
B07 |
Verrugas de origem viral |
• Exposição a papilomavírus em atividades de trabalho. |
B08.0 |
Outras infecções por ortopoxvírus |
• Exposição a vírus Orf em atividades de trabalho. |
B15 |
Hepatite aguda A |
• Exposição a vírus da hepatite A (HAV) em atividades de trabalho. |
B16 |
Hepatite aguda B |
• Exposição a vírus da hepatite B (HBV) em atividades de trabalho. |
B17 |
Outras hepatites virais agudas |
• Exposição a vírus da hepatite C (HCV) e/ou vírus da hepatite E (HEV) em atividades de trabalho. |
B18 |
Hepatite viral crônica |
• Exposição a vírus não especificado da hepatite em atividades de trabalho. |
B19 |
Hepatite viral não especificada |
• Exposição a vírus não especificado da hepatite em atividades de trabalho. |
B20 |
Doença pelo vírus da imunodeficiência humana [HIV], resultando em doenças infecciosas e parasitárias |
• Exposição a Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
B21 |
Doença pelo vírus da imunodeficiência humana [HIV], resultando em neoplasias malignas |
• Exposição a Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
B22 |
Doença pelo vírus da imunodeficiência humana [HIV] resultando em outras doenças especificadas |
• Exposição a Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
B23 |
Doença pelo vírus da imunodeficiência humana [HIV] resultando em outras doenças |
• Exposição a Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
B24 |
Doença pelo vírus da imunodeficiência humana [HIV] não especificada |
• Exposição a Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
B33.4 |
Síndrome (cardio-pulmonar) por Hantavírus [SPH] [SCPH] |
• Exposição a hantavírus em atividades de trabalho. |
B35 |
Dermatofitose |
• Exposição a fungos do gênero Epidermophyto, Microsporum e Trichophytondurante atividades de trabalho em temperatura elevada e umidade. |
B36 |
Outras micoses superficiais |
• Exposição a fungos durante atividades de trabalho em temperatura elevada e umidade, exceto aqueles dos gêneros Epidermophyton, Microsporum e Trichophyton. |
B37 |
Candidíase |
• Exposição a Candida albicanse outras espécies do mesmo gênero, potencialmente patogênicas em atividades de trabalho, sob condições de umidade e irritação mecânica. |
B38 |
Coccidioidomicose |
• Exposição a Coccidioides immitisem atividades de trabalho. |
B39 |
Histoplasmose |
• Exposição a Histoplasma capsulatumem atividades de trabalho. |
B41 |
Paracoccidioidomicose |
• Exposição a Paracoccidioides brasiliensisem atividades de trabalho. |
B42 |
Esporotricose |
• Exposição a Sporothrix schenkiiem atividades de trabalho. |
B44 |
Aspergilose |
• Exposição as espécies de Aspergillus em atividades de trabalho |
B45 |
Criptococose |
• Exposição a Cryptococcus neoformans ou Filobasidiella neoformans em atividades de trabalho. |
B47 |
Micetoma |
• Exposição a bactérias e fungos causadores de micetoma em atividades de trabalho. |
B50 |
Malária por Plasmodium falciparum |
• Exposição a Plasmodium falciparum em atividades de trabalho. |
B51 |
Malária por Plasmodium vivax |
• Exposição a Plasmodium vivax em atividades de trabalho. |
B52 |
Malária por Plasmodium malariae |
• Exposição a Plasmodium malariae em atividades de trabalho. |
B53 |
Outras formas de malária confirmadas por exames parasitológicos |
• Exposição a espécies do Plasmodium diferentes damalariae, vivaxefalciparum, ou outros protozoários, em atividades de trabalho. |
B54 |
Malária não especificada |
• Exposição a espécie não especificada do gênero Plasmodium em atividades de trabalho. |
B55 |
Leishmaniose |
• Exposição a Leishmania braziliensis em atividades de trabalho. |
B55.1 |
Leishmaniose cutânea |
• Exposição a Leishmania braziliensisem atividades de trabalho. |
B55.2 |
Leishmaniose cutâneo-mucosa |
• Exposição a Leishmania braziliensisem atividades de trabalho. |
B57 |
Doença de Chagas |
• Exposição a Trypanosoma cruziem atividade de trabalho. |
B65 |
Esquistossomose [bilharziose] [Schistosomíase] |
• Exposição a espécies de Schistosomaem atividades de trabalho. |
B67 |
Equinococose |
• Exposição a espécies de Ecchinococcusem atividades de trabalho. |
B73 |
Oncocercose |
• Exposição a espécies de Onchocercaem atividades de trabalho. |
B76 |
Ancilostomíase |
• Exposição a espécies de Ancylostomaem atividades de trabalho. |
B76.0 |
Ancilostomose |
• Exposição a espécies de Ancylostomaem atividades de trabalho. |
B83.0 |
Larvamigrans visceral |
• Exposição aToxocara canise/ouToxocara catiem atividades de trabalho. |
B86 |
Escabiose [sarna] |
• Exposição aSarcoptes scabieiem atividades de trabalho. |
U06.9 |
Doença pelo Zika vírus, não especificada |
• Exposição a mosquito (Aedes aegypti), transmissor do arbovírus da Zika em atividades de trabalho. |
B34.2 |
Infecção por coronavírus de localização não especificada |
• Exposição a SARS-CoV-2 em atividades de trabalho |
Capítulo II - Neoplasias (tumores) (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
C00 |
Neoplasia maligna do lábio |
• Exposição a radiações não ionizantes (ultravioleta) em atividades de trabalho. |
C06 |
Neoplasia maligna de outras partes e de partes não especificadas da boca |
• Exposição a papilomavírus humano tipo 16 e/ou 18 em atividades de trabalho. |
C08 |
Neoplasia maligna de outras glândulas salivares maiores e as não especificadas |
• Exposição a radiações ionizantes (raios-X e/ou gama; e/ou iodo radioativo, incluindo iodo-131) em atividades de trabalho. |
C09 |
Neoplasia maligna da amígdala |
• Exposição a papilomavírus humano tipo 16 em atividades de trabalho. |
C11 |
Neoplasia maligna da nasofaringe |
• Exposição a formaldeído e/ou poeiras de madeira e/ou vírus Epstein-Barr em atividades de trabalho. |
C14 |
Neoplasia maligna de outras localizações e de localizações mal definida, do lábio, cavidade oral e faringe |
• Exposição a poeiras de madeira e/ou papilomavírus humano tipo 16 em atividades de trabalho. |
C15 |
Neoplasia maligna do esôfago |
• Exposição a percloroetileno e outros agentes usados nos processos de limpeza à seco; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho; • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. |
C16 |
Neoplasia maligna do estômago |
• Exposição a agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou asbesto ou amianto; e/ou compostos inorgânicos do chumbo; e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho; • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. |
C18 |
Neoplasia maligna do cólon |
• Exposição a asbesto ou amianto em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. • Jornada de trabalho em turno noturno |
C20 |
Neoplasia maligna do reto |
• Exposição a asbesto ou amianto em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. • Jornada de trabalho em turno noturno |
C21 |
Neoplasia maligna do ânus e do canal anal |
• Exposição a papilomavírus humano tipo 16 e/ou 18 e/ou 33 e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho |
C22 |
Neoplasia maligna do fígado e das vias biliares intra-hepáticas |
• Exposição a aflatoxina; e/ou cloreto de vinila; e/ou 1,2-dicloropropano; e/ou arsênio e seus compostos; e/ou agrotóxicos organoclorados (DDT); e/ou tricloroetileno; e/ou diclorometano em atividades de trabalho. • Exposição a radiações ionizantes (plutônio e/ou tório-232 e seus produtos de decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. |
• Exposição a vírus da hepatite B (HBV); e/ou vírus da hepatite C (HCV); e/ou vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
||
C23 |
Neoplasia maligna da vesícula biliar |
• Exposição a radiações ionizantes (tório-232 e seus produtos de decaimento) em atividades de trabalho. |
C25 |
Neoplasia maligna do pâncreas |
• Exposição a radiações ionizantes (tório-232 e seus produtos de decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. |
C30.0 |
Neoplasia maligna da cavidade nasal |
• Exposição a agentes químicos usados no processo de produção de álcool isopropílico; e/ou cromo hexavalente e seus compostos; e/ou formaldeído; e/ou níquel e seus compostos; e/ou poeiras da indústria do couro; e/ou poeiras de madeira; e/ou colas e solventes usados nas atividades de carpintaria e marcenaria; e/ou poeiras orgânicas, em atividades de trabalho. • Exposição a radiações ionizantes (rádio-226 e/ou rádio-228, e produtos de seu decaimento) em atividades de trabalho. |
C31 |
Neoplasia maligna dos seios da face |
• Exposição a agentes químicos usados no processo de produção de álcool isopropílico; e/ou cromo hexavalente e seus compostos; e/ou formaldeído; e/ou níquel e seus compostos; e/ou poeiras da indústria do couro; e/ou poeiras de madeira; e/ou colas e solventes usados nas atividades de carpintaria e marcenaria; e/ou poeiras orgânicas da indústria do mobiliário, em atividades de trabalho. • Exposição a radiações ionizantes (rádio-226 e rádio-228, e seus produtos do decaimento) em atividades de trabalho. |
C32 |
Neoplasia maligna da laringe |
• Exposição a asbesto ou amianto; e/ou névoas ácidas; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou gás mostarda, e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho; • Exposição a papilomavírus humano tipo 16 em atividades de trabalho. |
C34 |
Neoplasia maligna dos brônquios e dos pulmões |
• Exposição a agentes químicos provenientes da produção de alumínio; e/ou arsênio e seus compostos; e/ou asbesto ou amianto; e/ou berílio e seus compostos; e/ou bis clorometil éter e clorometil metil éter; e/ou cádmio e seus compostos; e/ou cromo hexavalente e seus compostos; e/ou gaseificação de carvão; e/ou alcatrão de carvão; e/ou emissões proveniente dos fornos de coque; e/ou emissões provenientes da exaustão de motores a diesel; e/ou emissões do processo de fundição de ferro e aço; e/ou fármacos antineoplásicos MOPP (mistura de vincristina-prednisona-nitrogênio-mostarda-procarbazina); e/ou níquel e seus compostos; e/ou material particulado e poluição do ar atmosférico; e/ou solventes orgânicos; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou
|
C40 |
Neoplasia maligna dos ossos e cartilagens articulares dos membros |
• Exposição a radiações ionizantes (rádio-224 e/ou rádio-226 e/ou rádio-228, e seus produtos de decaimento; e/ou plutônio; e/ou raios-X e/ou gama; e/ou iodo radioativo, incluindo iodo-131) em atividades de trabalho. |
C41 |
Neoplasia maligna dos ossos e das cartilagens articulares de outras localizações e de localizações não especificadas |
• Exposição a radiações ionizantes (rádio-224 e/ou rádio-226 e/ou rádio-228, e seus produtos de decaimento; e/ou plutônio, raios-X e/ou gama; e/ou iodo radioativo, incluindo iodo-131) em atividades de trabalho. |
C43 |
Melanoma maligno da pele |
• Exposição a bifenilas policloradas (PCB) em atividades de trabalho. • Exposição a radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
C44 |
Outras neoplasia maligna da pele |
• Exposição a arsênio e seus compostos; e/ou alcatrão de carvão; e/ou fuligem; e/ou destilação do carvão mineral (hulha); e/ou óleo mineral não tratado; e/ou óleo de xisto; e/ou creosoto; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou azatioprina; e/ou ciclosporina; e/ou agrotóxicos organofosforados (parationa) em atividades de trabalho. • Exposição a radiações não ionizantes (ultravioleta); e/ou radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. • Exposição a Vírus da Imunodeficiência Humana (HIV); e/ou papilomavírus humano tipos 5 e/ou 8, em atividades de trabalho. |
C45 |
Mesotelioma |
• Exposição a asbesto ou amianto; e/ou erionita; e/ou fluoroedenita em atividades de trabalho; e/ou atividades de pintura. |
C46 |
Sarcoma de Kaposi |
• Exposição a herpes simples tipo 1 (HVS-1) e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
C49 |
Neoplasia maligna do tecido conjuntivo e de outros tecidos moles |
• Exposição a 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou policlorofenóis ou seus sais de sódio em atividades de trabalho. • Exposição a radiações ionizantes (iodo radioativo, incluindo iodo-131) em atividades de trabalho. |
C50 |
Neoplasia maligna da mama |
• Exposição a agrotóxicos organoclorados (dieldrin); e/ou óxido de etileno; e/ou bifenilas policloradas (PCB) em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. • Jornada de trabalho em turno noturno. |
C51 |
Neoplasia maligna da vulva |
• Exposição a papilomavírus humano tipo 18 e/ou 33 e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
C52 |
Neoplasia maligna da vagina |
• Exposição a papilomavírus humano tipo 16 e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
C53 |
Neoplasia maligna de colo do útero |
• Exposição a papilomavírus humano tipo 16 e/ou 18 e/ou 26 e/ou 31 e/ou 33 e/ou 35 e/ou 39 e/ou 45 e/ou 51 e/ou 52 e/ou 53 e/ou 56 e/ou 58 e/ou 59 e/ou 66 e/ou 67 e/ou 68 e/ou 70 e/ou 73 e/ou 82 e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
C56 |
Neoplasia maligna de ovário |
• Exposição a asbesto ou amianto em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. |
C60 |
Neoplasia maligna de pênis |
• Exposição a papilomavírus humano tipo 16 e/ou 18; e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
C61 |
Neoplasia maligna da próstata |
• Exposição a arsênio e seus compostos; e/ou cádmio e seus compostos; e/ou agrotóxicos organofosforados (malationa); e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama; e/ou tório-232 e seus produtos de decaimento) em atividades de trabalho. • Jornada de trabalho em turno noturno. |
C62 |
Neoplasia maligna dos testículos |
• Exposição a agrotóxicos organoclorados (DDT); e/ou N, N-dimetilformamida; e/ou ácido perfluorooctanoico em atividades de trabalho. |
C64 |
Neoplasia maligna do rim, exceto pelve renal |
• Exposição a tricloroetileno; e/ou arsênio e seus compostos; e/ou cádmio e seus compostos; e/ou ácido perfluorooctanoico; e/ou pigmentos e solventes usados nos processos de impressão; e/ou fumos de solda em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama; e/ou tório-232 e produtos de seu decaimento) em atividades de trabalho. |
C65 |
Neoplasia maligna da pelve renal |
• Exposição a ácido aristolóquico em atividades de trabalho. |
C66 |
Neoplasia maligna dos ureteres |
• Exposição a ácido aristolóquico em atividades de trabalho. |
C67 |
Neoplasia maligna da bexiga |
• Exposição a arsênio e seus compostos; e/ou agentes químicos decorrentes da produção de alumínio; e/ou agentes químicos usados na produção de magenta; e/ou agentes químicos usados na produção de auramina; e/ou solventes orgânicos; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou aminas aromáticas (4-aminobifenil; e/ou 2-naftilamina; e/ou 4-cloro-orto-toluidina; e/ou orto-toluidina; e/ou benzidina; e/ou toluidina); e/ou alcatrão de carvão; e/ou percloroetileno e outros agentes usados nos processos de limpeza à seco; e/ou emissões provenientes da exaustão de motores a diesel; e/ou formaldeído e outras substâncias químicas usadas em produtos cosméticos para cabelos; e/ou 2-mercaptobenzotiazol; e/ou pigmentos e solventes usados nos processos de impressão; e/ou fuligem; e/ou tetracloroetileno; e/ou ciclofosfamida; e/ou agentes químicos usados na produção e beneficiamento de tecido, em atividades de trabalho. • Exposição a radiações ionizantes (raios-X e/ou gama) em atividades de trabalho. • Exposição aSchistosoma haematobiumem atividades de trabalho. |
C69 |
Neoplasia maligna do olho e anexos |
• Exposição a radiações não ionizantes (ultravioleta); e/ou Vírus da Imunodeficiência Humana (HIV) em atividades de trabalho. |
C71 |
Neoplasia maligna do encéfalo |
• Exposição a radiações ionizantes (raios-X e/ou gama); e/ou radiações não ionizantes (campos eletromagnéticos de radiofrequência - incluindo os provenientes de telefone sem fio) em atividades de trabalho. |
C72 |
Neoplasia maligna da medula espinhal, dos nervos cranianos e de outras partes do sistema nervoso central |
• Exposição a radiações ionizantes (raios-X e/ou gama); e/ou radiações não ionizantes (campos eletromagnéticos de radiofrequência - incluindo os provenientes de telefone sem fio) em atividades de trabalho. |
C73 |
Neoplasia maligna da glândula tireoide |
• Exposição a radiações ionizantes (raios-X e/ou gama; e/ou iodo radioativo - incluindo iodo-131) em atividades de trabalho. |
C82 |
Linfoma não-Hodgkin, folicular (nodular) |
• Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C83 |
Linfoma não-Hodgkin difuso | • Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C84 |
Linfomas de células T cutâneas e periféricas | • Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C85 |
Linfoma não-Hodgkin de outros tipos e de tipo não especificado | • Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C91 |
Leucemia linfoide | • Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C92 |
Leucemia mieloide |
• Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C93 |
Leucemia monocítica |
• Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C94 |
Outras leucemias de células de tipo especificado |
• Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
C95 |
Leucemia de tipo celular não especificado |
• Exposição a benzeno; e/ou agrotóxicos organoclorados (lindano, pentaclorofenol, DDT) e organofosforados (diazinona, malationa); e/ou glicina substituída (glifosato); e/ou 1,3-butadieno; e/ou formaldeído; e/ou diclorometano; e/ou cloreto de metileno; e/ou agentes químicos usados no processo de produção da borracha, incluindo processo de vulcanização; e/ou óxido de etileno; e/ou solventes orgânicos; e/ou hidrocarbonetos provenientes do processo de refino de petróleo; e/ou bifenilas policloradas (PCB); e/ou policlorofenóis ou seus sais de sódio; e/ou estireno; e/ou tricloroetileno; e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fármacos antineoplásicos (azatioprina, bussulfano, clorambucila, ciclofosfamida, ciclosporina, etoposido com cisplatina e bleomicina, biscloroetil nitrosoureia - BCNU, melfalano, mitroxantona, mostarda nitrogenada, MOPP, semustina (metil-CCNU), teniposido, tiotepa, treossulfano); e/ou ácido diclorofenoxiacético (2,4-D); e/ou agentes químicos usados na produção e beneficiamento de tecidos, em atividades de trabalho. • Exposição a radiações ionizantes (produtos de fissão, incluindo estrôncio-90; e/ou fósforo-32; e/ou tório-232 e os produtos de seu decaimento; e/ou raios-X e/ou gama) em atividades de trabalho. • Exposição a vírus da hepatite C (HCV); e/ou Vírus da Imunodeficiência Humana (HIV); e/ou vírus da hepatite B (HBV); e/ou vírus linfotrópico de células T humanas tipo 1; e/ou vírus Epstein-Barr; e/ou Plasmodium falciparum em atividades de trabalho. |
Capítulo III - Doenças do sangue e dos órgãos hematopoiéticos e alguns transtornos imunitários (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
D46 |
Síndromes mielodisplásicas |
• Exposição a benzeno em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
D55.8 |
Outras anemias devidas a transtornos enzimáticos |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. |
D59 |
Anemia hemolítica adquirida |
Exposição a derivados nitrados e aminados do benzeno; e/ou arsênio e seus compostos em atividades de trabalho. |
D59.2 |
Anemia hemolítica não-auto-imune induzida por drogas |
• Exposição a derivados nitrados e aminados do benzeno em atividades de trabalho. |
D59.4 |
Outras anemias hemolíticas não-autoimunes |
• Exposição a benzeno em atividades de trabalho. |
D59.8 |
Outras anemias hemolíticas adquiridas |
• Exposição a antimônio e seus compostos em atividades de trabalho. |
D61.2 |
Anemia aplástica devida a outros agentes externos |
• Exposição a benzeno em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
D61.9 |
Anemia aplástica não especificada |
• Exposição a benzeno em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
D64 |
Outras anemias |
• Exposição a chumbo e seus compostos em atividades de trabalho. |
D69 |
Púrpura e outras afecções hemorrágicas |
• Exposição a benzeno; e/ou cloreto de vinila em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
D70 |
Agranulocitose |
• Exposição a benzeno; e/ou derivados do fenol, do pentaclorofenol e do hidroxibenzonitrilo em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
D72.8 |
Outros transtornos especificados dos glóbulos brancos |
• Exposição a benzeno em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
D74 |
Metemoglobinemia |
• Exposição a aminas aromáticas e seus derivados; e/ou derivados nitrados e aminados do benzeno em atividades de trabalho. |
D74.8 |
Outras metemoglobinemias |
• Exposição a aminas aromáticas e seus derivados em atividades de trabalho. |
D89.1 |
Crioglobulinemia |
• Exposição a vírus não especificado da hepatite em atividades de trabalho. |
Capítulo IV - Doenças endócrinas nutricionais e metabólicas (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
E03 |
Outros hipotireoidismos |
• Exposição a chumbo e seus compostos tóxicos; e/ou clorobenzeno e seus derivados; e/ou tiouracil; e/ou tiocianatos; e/ou tioureia; e/ou agrotóxicos organoclorados (DDT) em atividades de trabalho. |
E04.9 |
Bócio não-tóxico, não especificado |
• Exposição a ácidos orgânicos em atividades de trabalho. |
E11 |
Diabetes mellitus não insulinodependente |
• Jornada de trabalho (Trabalho em turnos; Trabalho noturno). |
E66 |
Obesidade |
• Jornada de trabalho (Trabalho em turnos; Trabalho noturno). |
E80.2 |
Outras porfirias |
• Exposição a clorobenzeno e seus derivados em atividades de trabalho. |
E88.8 |
Outros distúrbios metabólicos não especificados |
• Jornada de trabalho (Trabalho em turnos; Trabalho noturno). |
Capítulo V - Transtornos mentais e comportamentais (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
F02.8 |
Demência em outras doenças específicas classificadas em outros locais |
• Exposição a manganês e seus compostos tóxicos; e/ou monóxido de carbono; e/ou sulfeto de hidrogênio; e/ou outras substâncias asfixiantes; e/ou dissulfeto de carbono; e/ou metais tóxicos; e/ou mercúrio; e/ou chumbo e seus compostos tóxicos; e/ou arsênio; e/ ou derivados organometálicos (chumbo tetraetila e organoestanho) em atividades de trabalho. |
F05.0 |
Delirium não superposto a uma demência, assim descrito |
• Exposição a brometo de metila; e/ou dissulfeto de carbono; e/ou monóxido de carbono; e/ou sulfeto de hidrogênio; e/ou outras substâncias asfixiantes; e/ou metais tóxicos; e/ou manganês e seus compostos tóxicos; e/ou mercúrio; e/ou chumbo e seus compostos tóxicos; e/ou arsênio; e/ou derivados organometálicos (chumbo tetraetila e organoestanho) em atividades de trabalho. • Sequela de acidente de trabalho com traumatismo cranioencefálico. |
F06 |
Outros transtornos mentais devidos à lesão e disfunção cerebral e a doença física |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou chumbo e seus compostos tóxicos; e/ou tricloroetileno; e/ou tetracloroetileno; e/ou tricloroetano e outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou solventes orgânicos, em atividades de trabalho. |
F06.7 |
Transtorno cognitivo leve |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou chumbo e seus compostos tóxicos; e/ou tricloroetileno; e/ou tetracloroetileno; e/ou tricloroetano e outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou solventes orgânicos, em atividades de trabalho. |
F07 |
Transtornos de personalidade e do comportamento devidos à doença, a lesão e a disfunção cerebral |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou tricloroetileno; e/ou tetracloroetileno; e/ou tricloroetano e outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou solventes orgânicos; e/ou chumbo e seus compostos tóxicos em atividades de trabalho. |
F07.1 |
Síndrome pós-encefalítica |
• Exposição a mercúrio e seus compostos, em atividades de trabalho. • Sequela de acidente de trabalho com traumatismo cranioencefálico. |
F09 |
Transtorno mental orgânico ou sintomático não especificado |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou tricloroetileno e/ou tetracloroetileno e/ou tricloroetano e/ou outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou solventes orgânicos; e/ou chumbo e seus compostos tóxico em atividades de trabalho. |
F10 |
Transtornos mentais e comportamentais devidos ao uso de álcool |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F11 |
Transtornos mentais e comportamentais devidos ao uso de opiáceos |
Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F12 |
Transtornos mentais e comportamentais devidos ao uso de canabinóides |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F13 |
Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
F13.2 |
Transtornos mentais e comportamentais devidos ao uso de sedativos e hipnóticos - síndrome de dependência |
• Exposição a bromo e/ou cloro e/ou iodo em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
F14 |
Transtornos mentais e comportamentais devidos ao uso da cocaína |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F15 |
Transtornos mentais e comportamentais devidos ao uso de outros estimulantes, inclusive a cafeína |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F16 |
Transtornos mentais e comportamentais devidos ao uso de alucinógenos |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
F17 |
Transtornos mentais e comportamentais devidos ao uso de fumo |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
F18 |
Transtornos mentais e comportamentais devidos ao uso de solventes voláteis |
• Exposição a álcoois e derivados; e/ou ésteres orgânicos; e/ou éter de petróleo (benzina) em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F19 |
Transtornos mentais e comportamentais devidos ao uso de múltiplas drogas e ao uso de outras substâncias psicoativas |
Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F22 |
Transtornos delirantes persistentes |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F23 |
Transtornos psicóticos agudos e transitórios |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F32 |
Episódios depressivos |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou chumbo e seus compostos tóxicos; e/ou tricloroetileno e/ou tetracloroetileno e/ou tricloroetano e/ou outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou • dissulfeto de carbono; e/ou outros solventes orgânicos; e/ou agrotóxicos, em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F33 |
Transtorno depressivo recorrente |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou chumbo e seus compostos tóxicos; e/ou tricloroetileno e/ou tetracloroetileno e/ou tricloroetano e/ou outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou outros solventes orgânicos; e/ou agrotóxicos, em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F41 |
Outros transtornos ansiosos |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F43 |
Reações ao "stress" grave e transtornos de adaptação |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F43.1 |
Estado de"stress" pós-traumático |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. |
F43.2 |
Transtornos de adaptação |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F45 |
Transtornos somatoformes |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F48.0 |
Neurastenia |
• Exposição a tolueno e outros solventes aromáticos neurotóxicos; e/ou tricloroetileno; e/ou tetracloroetileno; e/ou tricloroetano e outros solventes orgânicos halogenados neurotóxicos; e/ou brometo de metila; e/ou manganês e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou solventes orgânicos; e/ou chumbo e seus compostos tóxicos, em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F48.8 |
Outros transtornos neuróticos especificados |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
F51.2 |
Transtorno do ciclo vigília-sono devido a fatores não-orgânicos |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. • Desemprego. |
X60 - X84 |
Lesões autoprovocadas intencionalmente (Suicídio) |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
Z73.0 |
Esgotamento (Burnout) |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho. |
Capítulo VI - Doenças do sistema nervoso (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
G00.2 |
Meningite estreptocócica |
• Exposição aStreptococcus suisem atividades de trabalho. |
G01 |
Meningite em doenças bacterianas classificadas em outra parte |
• Exposição aNeisseria meningitidisem atividades de trabalho. |
G11.1 |
Ataxia cerebelar de início precoce |
• Exposição a mercúrio e seus compostos tóxicos; e/ou agrotóxicos organofosforados em atividades de trabalho. |
G21.2 |
Parkinsonismo secundário devido a outros agentes externos |
• Exposição a manganês e seus compostos tóxicos; e/ou agrotóxicos em atividades de trabalho. |
G25.2 |
Outras formas especificadas de tremor |
• Exposição a brometo de metila; e/ou tetracloroetano; e/ou mercúrio e seus compostos tóxicos; e/ou outros solventes orgânicos; e/ou agrotóxicos neurotóxicos em atividades de trabalho. |
G25.9 |
Doenças extrapiramidais e transtornos dos movimentos, não especificados |
• Exposição a mercúrio e seus compostos tóxicos; e/ou diclorometano; e/ou cloreto de metileno; e/ou solventes halogenados, em atividades de trabalho. |
G40.1 |
Epilepsia e síndromes epilépticas sintomáticas definidas por sua localização (focal) (parcial) com crises parciais simples |
• Exposição a ácido cianídrico; e/ou cianetos; e/ou nitrila (acrilonitrila, e outros) em atividades de trabalho. |
G44.1 |
Cefaleia vascular, não classificada em outra parte |
• Exposição a ésteres do ácido nítrico em atividades de trabalho. |
G45.9 |
Isquemia cerebral transitória não especificada |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
G47.2 |
Distúrbios do ciclo vigília-sono |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
G50 |
Transtornos do nervo trigêmeo |
• Exposição a tricloroetileno e outros solventes halogenados neurotóxicos em atividades de trabalho. |
G52.0 |
Transtornos do nervo olfatório |
Exposição a cádmio ou seus compostos; e/ou sulfeto de hidrogênio em atividades de trabalho. |
G53 |
Transtornos dos nervos cranianos em doenças classificadas em outra parte |
• Exposição a mercúrio e seus compostos; e/ou hidrocarbonetos clorados em atividades de trabalho. |
G54.0 |
Transtornos do plexo braquial |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56 |
Mononeuropatias dos membros superiores |
Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.0 |
Síndrome do túnel do carpo |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.1 |
Outras lesões do nervo mediano |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.2 |
Lesões do nervo cubital [ulnar] |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.3 |
Lesão do nervo radial |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.8 |
Outras mononeuropatias dos membros superiores |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G57.3 |
Lesão do nervo poplíteo lateral |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G62.2 |
Polineuropatia devida a outros agentes tóxicos |
• Exposição a arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou fósforo; e/ou sulfeto de carbono; e/ou n-hexano; e/ou metil-n-butil cetona (MBK); e/ou acrilamida; e/ou álcoois; e/ou cetonas; e/ou agrotóxicos; e/ou derivados halogenados dos hidrocarbonetos alifáticos; e/ou ésteres orgânicos; e/ou mercúrio e seus compostos; e/ou tálio e seus compostos; e/ou óxido de etileno em atividades de trabalho. |
G62.8 |
Outras polineuropatias especificadas |
• Exposição a radiações ionizantes em atividades de trabalho. |
G92 |
Encefalopatia tóxica |
• Exposição a arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou derivados halogenados de hidrocarbonetos alifáticos e/ou aromáticos; e/ou mercúrio e seus derivados tóxicos; e/ou cetonas; e/ou solventes orgânicos; e/ou gases anestésicos; e/ou monóxido de carbono; e/ou sulfeto de hidrogênio; e/ou cianetos; e/ou derivados organometálicos (metil-mercúrio, chumbo tetraetila, estanho orgânico); e/ou sulfato de tálio; e/ou tálio em atividades de trabalho. |
Capítulo VII - Doenças do olho e anexos (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
H01.0 |
Blefarite |
• Exposição a arsênio e seus compostos; e/ou poeira de cimento em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
H01.1 |
Dermatoses não infecciosas da pálpebra |
• Exposição a poeiras, gases e vapores de diferentes origens em atividades de trabalho. |
H10 |
Conjuntivite |
• Exposição a arsênio e seus compostos; e/ou berílio e seus compostos tóxicos; e/ou flúor ou seus compostos tóxicos; e/ou iodo; e/ou cloreto de etila; e/ou tetracloreto de carbono; e/ou solventes halogenados; e/ou ácido sulfídrico (sulfeto de hidrogênio); e/ou acrilatos; e/ou poeira de cimento; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou selênio e seus compostos em atividades de trabalho. • Exposição a radiações ionizantes; e/ou radiações não ionizantes (ultravioleta) em atividades de trabalho. |
H11.0 |
Pterígio |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H11.1 |
Degenerações e depósitos de conjuntiva |
• Exposição a sais de prata em atividades de trabalho. |
H16 |
Ceratite |
• Exposição a arsênio e seus compostos; e/ou ácido sulfídrico (sulfeto de hidrogênio) em atividades de trabalho. • Exposição a radiações ionizantes; e/ou radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H16.2 |
Ceratoconjuntivite |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H26 |
Outras cataratas |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha e/ou micro-ondas) em atividades de trabalho. |
H28 |
Catarata e outros transtornos do cristalino em doenças classificadas em outra parte |
• Exposição a radiações ionizantes; e/ou radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H30 |
Inflamação coriorretiniana |
• Exposição a manganês e seus compostos tóxicos; e/ou hidrocarbonetos aromáticos (naftalina, benzeno) em atividades de trabalho. |
H46 |
Neurite Óptica |
• Exposição a brometo de metila; e/ou diclorometano; e/ou cloreto de metileno; e/ou solventes clorados neurotóxicos; e/ou tetracloreto de carbono; e/ou dissulfeto de carbono; e/ou metanol; e/ou álcoois e derivados; e/ou chumbo e seus compostos; e/ou tricloroetileno; e/ou mercúrio e seus compostos em atividades de trabalho. |
H49.0 |
Paralisia do terceiro par [oculomotor] |
• Exposição a dissulfeto de carbono; e/ou chumbo e seus compostos em atividades de trabalho. |
H52.5 |
Transtornos da acomodação |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
H55 |
Nistagmo e outros movimentos irregulares do olho |
• Exposição a glicóis e derivados em atividades de trabalho. • Ambiente de trabalho com iluminação ausente ou deficiente. |
Capítulo VIII - Doenças do ouvido e da apófise mastoide (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
H65.9 |
Otite média não-supurativa, não especificada |
• Variação de pressão ambiental no trabalho. |
H72 |
Perfuração da membrana do tímpano |
• Variação de pressão ambiental no trabalho. |
H83.0 |
Labirintite |
• Exposição a brometo de metila, em atividades de trabalho. • Variação de pressão ambiental no trabalho. |
H83.3 |
Efeitos do ruído sobre o ouvido interno |
• Exposição a níveis de pressão sonora elevados no trabalho. |
H91.0 |
Perda de audição ototóxica |
• Exposição a xileno; e/ou tolueno e outros solventes aromáticos neurotóxicos; e/ou solventes orgânicos; e/ou monóxido de carbono; e/ou arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou tricloroetileno, e/ou agrotóxicos, em atividades do trabalho. |
H93.8 |
Outros transtornos especificados do ouvido |
• Exposição a brometo de metila em atividades de trabalho. • Variação de pressão ambiental no trabalho. |
T70.0 |
Otite barotraumática |
• Variação de pressão ambiental no trabalho. |
T70.1 |
Sinusite barotraumática |
• Variação de pressão ambiental no trabalho. |
T70.3 |
Mal dos caixões [doença de descompressão] |
• Variação de pressão ambiental no trabalho. |
Capítulo IX - Doenças do aparelho circulatório (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou fatores de Risco |
I10 |
Hipertensão essencial (primária) |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. • Exposição a níveis de pressão sonora elevados no trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
I20 |
Angina pectoris |
• Exposição a monóxido de carbono; e/ou dissulfeto de carbono; e/ou nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego |
I21 |
Infarto agudo do miocárdio |
• Exposição a monóxido de carbono; e/ou dissulfeto de carbono; e/ou nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego |
I25.1 |
Doença ateroesclerótica do coração |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
I27.9 |
Cardiopatia pulmonar não especificada |
• Complicação evolutiva das pneumoconioses graves, principalmente silicose. |
I34.8 |
Outros transtornos não-reumáticos da valva mitral |
• Exposição a asbesto ou amianto em atividades de trabalho. |
I46 |
Parada cardíaca |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos; e/ou monóxido de carbono em atividades de trabalho. • Fatores psicossociais relacionados à jornada de trabalho. |
I49 |
Outras arritmias cardíacas |
• Exposição a arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou derivados halogenados dos hidrocarbonetos alifáticos; e/ou mercúrio e seus compostos tóxicos; e/ou monóxido de carbono; e/ou agrotóxicos organofosforados e carbamatos; e/ou cobalto; e/ou nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho. |
I60 |
Hemorragia subaracnóide |
• Fatores psicossociais relacionados à jornada de trabalho. |
I61 |
Hemorragia intracerebral |
• Fatores psicossociais relacionados à jornada de trabalho. |
I63 |
Infarto cerebral |
• Fatores psicossociais relacionados à jornada de trabalho. |
I64 |
Acidente vascular cerebral, não especificado como hemorrágico ou isquêmico |
• Fatores psicossociais relacionados à jornada de trabalho. |
I67.2 |
Aterosclerose cerebral |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
I67.4 |
Encefalopatia hipertensiva |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
I70 |
Ateroesclerose |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
I73.0 |
Síndrome de raynaud |
• Exposição a cloreto de vinila em atividades de trabalho. • Exposição a vibração e/ou trabalho em baixas temperaturas. |
I73.8 |
Outras doenças vasculares periféricas especificadas |
• Exposição a cloreto de vinila em atividades de trabalho. • Exposição a vibração e/ou trabalho em baixas temperaturas. |
I83 |
Varizes dos membros inferiores |
• Biomecânica do trabalho com: ortostatismo prolongado; e/ou aplicação de força e/ou manipulação manual de carga. |
Capítulo X - Doenças do aparelho respiratório (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
J02.9 |
Faringite aguda não especificada |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. |
J04.2 |
Laringotraqueíte aguda |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J11 |
Influenza [gripe] devida a vírus não identificado |
• Exposição ao vírus influenza em atividades de trabalho. |
J11.1 |
Influenza [gripe] com outras manifestações respiratórias, devida a vírus não identificado |
• Exposição ao vírus influenza em atividades de trabalho. |
J30.3 |
Outras rinites alérgicas |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros, como cobalto e titânio; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou agentes imunoalérgicos de origem animal e vegetal; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas; e/ou proteínas animais em aerossóis; e/ou outras substâncias de origem vegetal (cereais, farinhas, serragem, etc.); e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias em atividades de trabalho. |
J31.0 |
Rinite crônica |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros, como cobalto e titânio; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias; e/ou arsênio e seus compostos; e/ou cloro gasoso; e/ou cromo e seus compostos tóxicos; e/ou flúor; e/ou gás de fluoreto de hidrogênio; e/ou amônia; e/ou anidrido sulfuroso; e/ou poeira de cimento; e/ou fenol e homólogos; e/ou névoas ácidas; e/ou selênio e seus compostos em atividades de trabalho. |
J31.2 |
Faringite crônica |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros, como cobalto e titânio; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias; e/ou arsênio e seus compostos; e/ou cloro gasoso; e/ou flúor; e/ou gás de fluoreto de hidrogênio; e/ou amônia; e/ou anidrido sulfuroso; e/ou poeira de cimento; e/ou fenol e homólogos; e/ou névoas ácidas; e/ou selênio e seus compostos em atividades de trabalho. |
J32 |
Sinusite crônica |
• Exposição a bromo; e/ou iodo; e/ou névoas ácidas em atividades de trabalho. |
J34.0 |
Abscesso, furúnculo e antraz do nariz |
• Exposição a arsênio e seus compostos; e/ou cádmio ou seus compostos; e/ou cromo e seus compostos tóxicos; e/ou soluções e aerossóis de ácido cianídrico e seus derivados em atividades de trabalho. |
J34.8 |
Outros transtornos especificados do nariz e dos seios paranasais |
• Exposição a arsênio e seus compostos; e/ou cromo e seus compostos tóxicos em atividades de trabalho. |
J37.1 |
Laringotraqueíte crônica |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J38 |
Doenças das cordas vocais e da laringe não classificadas em outra parte |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J38.2 |
Nódulos das cordas vocais |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J40 |
Bronquite não especificada como aguda ou crônica |
• Exposição a ácido sulfúrico; e/ou zinco e seus compostos; e/ou selênio e seus compostos; e/ou dióxido de enxofre; e/ou cádmio e seus compostos; e/ou poeira de cimento; e/ou poeira de calcário e/ou gesso e/ou cal; e/ou fumos de solda; e/ou ácidos orgânicos; e/ou ácido cianídrico; e/ou cianetos e/ou nitrila; e/ou álcoois e derivados; e/ou aldeído fórmico e seus polímeros; e/ou amidos, anidridos e derivados; e/ou antimônio e seus compostos; e/ou berílio e seus compostos; e/ou bromo; e/ou cloro; e/ou iodo; e/ou butadieno; e/ou cetonas; e/ou cloreto de carbono ou fósforo; e/ou compostos inorgânicos do nitrogênio; e/ou compostos inorgânicos do fósforo; e/ou derivados halogenados e/ou nítricos dos hidrocarbonetos alifáticos; e/ou dicloroacetileno e/ou diisocianatos; e/ou ésteres orgânicos e derivados; e/ou éter de petróleo (benzina); e/ou fenol e homólogos; e/ou fibras artificiais e minerais; e/ou flúor ou seus compostos tóxicos; e/ou glicóis e derivados; e/ou sulfeto de hidrogênio; e/ou ósmio e seus derivados; e/ou ozônio, ozoneto e peróxidos; e/ou estireno; e/ou terpenos, vanádio e seus compostos; e/ou xileno em atividades de trabalho. |
J42 |
Bronquite crônica não especificada |
• Exposição a arsênio e seus compostos; e/ou amônia; e/ou álcoois em atividades de trabalho. |
J44 |
Outras doenças pulmonares obstrutivas crônicas |
• Exposição a cloro gasoso; e/ou poeiras de sílica livre cristalina; e/ou poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal; e/ou amônia; e/ou anidrido sulfuroso; e/ou névoas ácidas; e/ou poeiras de carvão mineral; e/ou poeiras minerais em atividades de trabalho. |
J45 |
Asma |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros (cobalto e titânio); e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos: macrolídeos, ranitidina, penicilina e seus sais, cefalosporinas; e/ou proteínas animais em aerossóis; e/ou outras substâncias de origem vegetal (cereais, farinhas, serragem, etc.); e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias; e/ou formaldeído; e/ou resina epóxi; e/ou látex; e/ou alcaloide; e/ou éter dietílico diclorado em atividades de trabalho. |
J60 |
Pneumoconiose dos mineiros de carvão |
• Exposição a poeiras de carvão mineral; e/ou poeiras de sílica livre cristalina em atividades de trabalho. |
J61 |
Pneumoconiose devida a amianto [asbesto] e outras fibras minerais |
• Exposição a asbesto ou amianto em atividades de trabalho. |
J62.0 |
Pneumoconiose devida a pó de talco |
• Exposição a poeira de talco em atividades de trabalho. |
J62.8 |
Pneumoconiose devida a outras poeiras que contenham sílica |
• Exposição a poeiras de sílica livre cristalina em atividades de trabalho. |
J63 |
Pneumoconiose devida a outras poeiras inorgânicas |
• Exposição a poeiras de metais duros em atividades de trabalho. |
J63.0 |
Aluminose (do pulmão) |
• Exposição a poeira de alumínio em atividades de trabalho. |
J63.2 |
Beriliose |
• Exposição a poeiras de berílio e seus compostos tóxicos em atividades de trabalho. |
J63.4 |
Siderose |
• Exposição a poeira de ferro em atividades de trabalho. |
J63.5 |
Estanhose |
• Exposição a poeira de estanho em atividades de trabalho. |
J63.8 |
Pneumoconiose devida a outras poeiras inorgânicas especificadas |
• Exposição a poeiras de carbonetos metálicos de tungstênio sintetizados; e/ou de carbonetos de metais duros; e/ou de rocha fosfática, de alumina, de zircônio em atividades de trabalho. |
J65 |
Pneumoconiose associada com tuberculose |
• Exposição a poeiras de sílica livre cristalina; e/ou poeiras não especificadas, em atividades de trabalho. |
J66 |
Doenças das vias aéreas devida a poeiras orgânicas específicas |
• Exposição a poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal em atividades de trabalho. |
J66.0 |
Bissinose |
• Exposição a poeira de algodão em atividades de trabalho. |
J66.1 |
Doença dos cardadores de linho |
• Exposição a poeira de linho em atividades de trabalho. |
J66.2 |
Canabinose |
• Exposição a poeira de cânhamo em atividades de trabalho. |
J66.8 |
Doenças das vias aéreas devida a outras poeiras orgânicas específicas |
• Exposição a poeira de sisal, entre outras, em atividades de trabalho. |
J67 |
Pneumonite de hipersensibilidade devida a poeiras orgânicas |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.0 |
Pulmão de fazendeiro |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou poeiras orgânicas em atividades de trabalho. |
J67.1 |
Bagaçose |
• Exposição a poeira da cana-de-açúcar em atividades de trabalho. |
J67.2 |
Pulmão dos criadores de pássaros |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.3 |
Suberose |
• Exposição a poeira de cortiça em atividades de trabalho. |
J67.4 |
Pulmão dos trabalhadores do malte |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.5 |
Pulmão dos que trabalham com cogumelos |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.7 |
Doença pulmonar devida aos sistemas de ar condicionado e de umidificação do ar |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.8 |
Pneumonites de hipersensibilidade devidas a outras poeiras orgânicas |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.9 |
Pneumonite de hipersensibilidade devida a poeira orgânica não especificada |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J68.0 |
Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
• Exposição a berílio e seus compostos tóxicos; e/ou bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou flúor ou seus compostos tóxicos; e/ou solventes; e/ou iodo; e/ou manganês e seus compostos tóxicos; e/ou cianeto de hidrogênio; e/ou névoas de óleos de corte em atividades de trabalho. |
J68.1 |
Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
• Exposição a berílio e seus compostos tóxicos; e/ou bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou flúor ou seus compostos tóxicos; e/ou solventes halogenados; e/ou iodo; e/ou manganês e seus compostos tóxicos; e/ou cianeto de hidrogênio; e/ou agrotóxicos (carbamatos, dipiridilos, fosfetos metálicos, halocarbonetos, organofosforados, piretroides) em atividades de trabalho. |
J68.3 |
Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
• Exposição a bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou solventes halogenados; e/ou iodo; e/ou cianeto de hidrogênio; e/ou amônia; e/ou ácido sulfúrico em atividades de trabalho. |
J68.4 |
Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
• Exposição a arsênio e seus compostos; e/ou berílio e seus compostos; e/ou bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou flúor ou seus compostos tóxicos; e/ou solventes halogenados; e/ou iodo; e/ou manganês e seus compostos tóxicos; e/ou cianeto de hidrogênio; e/ou ácido sulfídrico (sulfeto de hidrogênio); e/ou carbonetos de metais duros; e/ou amônia; e/ou anidrido sulfuroso; e/ou névoas ácidas; e/ou acrilatos; e/ou selênio e seus compostos em atividades de trabalho. |
J70.0 |
Manifestações pulmonares agudas devidas à radiação |
• Exposição a radiações ionizantes em atividades de trabalho. |
J70.1 |
Manifestações pulmonares crônicas e outras, devidas a radiação |
• Exposição a radiações ionizantes em atividades de trabalho. |
J84 |
Outras doenças pulmonares intersticiais |
• Exposição a cobalto em atividades de trabalho. |
J90 |
Derrame pleural não classificado em outra parte |
• Exposição a asbesto ou amianto em atividades de trabalho. |
J92 |
Placas pleurais |
• Exposição a asbesto ou amianto em atividades de trabalho. |
J98.2 |
Enfisema intersticial |
• Exposição a cádmio ou seus compostos em atividades de trabalho. |
J99.1 |
Transtornos respiratórios em outras doenças sistêmicas do tecido conjuntivo classificadas em outra parte [Síndrome de Caplan] |
• Exposição a poeiras de carvão mineral; e/ou poeiras de sílica livre cristalina em atividades de trabalho. |
R49 |
Distúrbios da Voz |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
Capítulo XI - Doenças do aparelho digestivo (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
K03.2 |
Erosão dentária |
• Exposição a névoas de fluoretos ou seus compostos tóxicos; e/ou névoas ácidas; e/ou ácido sulfúrico em atividades de trabalho. |
K03.7 |
Alterações pós-eruptivas da cor dos tecidos duros dos dentes |
• Exposição a névoas de cádmio ou seus compostos; e/ou cobre; e/ou níquel; e/ou prata em atividades de trabalho. |
K05.1 |
Gengivite crônica |
• Exposição a mercúrio e seus compostos tóxicos em atividades de trabalho. |
K07.6 |
Transtornos da articulação temporomandibular |
• Biomecânica do trabalho com movimentos articulares repetitivos |
K12.1 |
Outras formas de estomatite |
• Exposição a arsênio e seus compostos; e/ou bromo; e/ou mercúrio e seus compostos tóxicos em atividades de trabalho. |
K27 |
Úlcera péptica de localização não especificada |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego |
K40 |
Hérnia inguinal |
• Biomecânica do trabalho com manipulação manual de carga. |
K41 |
Hérnia femoral |
• Biomecânica do trabalho com manipulação manual de carga. |
K42 |
Hérnia umbilical |
• Biomecânica do trabalho com manipulação manual de carga. |
K43 |
Hérnia ventral |
• Biomecânica do trabalho com manipulação manual de carga. |
K44 |
Hérnia diafragmática |
• Biomecânica do trabalho com manipulação manual de carga. |
K45 |
Outras hérnias abdominais |
• Biomecânica do trabalho com manipulação manual de carga. |
K46 |
Hérnia abdominal não especificada |
• Biomecânica do trabalho com manipulação manual de carga. |
K52 |
Outras gastroenterites e colites não-infecciosas |
• Exposição a arsênio e seus compostos; e/ou cádmio ou seus compostos em atividades de trabalho; • Exposição a radiações ionizantes em atividades de trabalho. |
K59.8 |
Outros transtornos funcionais especificados do intestino |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. |
K71 |
Doença hepática tóxica |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.1 |
Doença hepática tóxica com necrose hepática |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.2 |
Doença hepática tóxica com hepatite aguda |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.3 |
Doença hepática tóxica com hepatite crônica persistente |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.6 |
Doença hepática tóxica com hepatite não classificada em outra parte |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.8 |
Doença hepática tóxica com outros transtornos do fígado |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K76.6 |
Hipertensão portal |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou tório em atividades de trabalho. |
Capítulo XII - Doenças da pele e do tecido subcutâneo (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
L08.9 |
Infecção localizada da pele e do tecido subcutâneo, não especificada |
• Exposição a cromo e seus compostos tóxicos; e/ou derivados tóxicos de hidrocarbonetos alifáticos e/ou aromáticos; e/ou micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou agentes químicos e/ou físicos e/ou biológicos que afetem a pele em atividades de trabalho. |
L23.0 |
Dermatite alérgica de contato devida a metais |
• Exposição a cromo e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou níquel e seus compostos em atividades de trabalho. |
L23.1 |
Dermatite alérgica de contato devida a adesivos |
• Exposição a adesivos em atividades de trabalho. |
L23.2 |
Dermatite alérgica de contato devida a cosméticos (fabricação/manipulação) |
• Exposição a cosméticos em sua manipulação/fabricação em atividades de trabalho. |
L23.3 |
Dermatite alérgica de contato devida a drogas em contato com a pele |
• Exposição a drogas em atividades de trabalho. |
L23.4 |
Dermatite alérgica de contato devida a corantes |
• Exposição a corantes em atividades de trabalho. |
L23.5 |
Dermatite alérgica de contato devida a outros produtos químicos |
• Exposição a cromo e seus compostos tóxicos; e/ou fósforo ou seus produtos tóxicos; e/ou iodo; e/ou alcatrão; e/ou breu e/ou betume e/ou carvão mineral e/ou resíduos dessas substâncias; e/ou borracha; e/ou agrotóxicos; e/ou plásticos em atividades de trabalho. |
L23.6 |
Dermatite alérgica de contato devida a alimentos em contato com a pele |
• Exposição a alimentos em sua fabricação/manipulação em atividades de trabalho. |
L23.7 |
Dermatite alérgica de contato devido a plantas, exceto alimentos |
• Manipulação de plantas em atividades de trabalho. |
L24.0 |
Dermatite de contato por irritantes devida a detergentes |
• Exposição a detergentes em atividades de trabalho. |
L24.1 |
Dermatite de contato por irritantes devida a óleos e gorduras |
• Exposição a óleos e gorduras; e/ou hidrocarbonetos policíclicos aromáticos em atividades de trabalho. |
L24.2 |
Dermatite de contato por irritantes devida a solventes |
• Exposição a benzeno; e/ou derivados halogenados dos hidrocarbonetos aromáticos e/ou alifáticos; e/ou cetonas em atividades de trabalho. |
L24.3 |
Dermatite de contato por irritantes devida a cosméticos |
• Exposição a cosméticos em atividades de trabalho. |
L24.4 |
Dermatite de contato por irritantes devida a Drogas em contato com a pele |
• Exposição a drogas em atividades de trabalho. |
L24.5 |
Dermatite de contato por irritantes devida a outros produtos químicos |
• Exposição a arsênio e seus compostos; e/ou berílio e seus compostos tóxicos; e/ou bromo; e/ou cromo e seus compostos tóxicos; e/ou flúor ou seus compostos tóxicos; e/ou fósforo em atividades de trabalho. |
L24.6 |
Dermatite de contato por irritantes devida a alimentos em contato com a pele |
Exposição a alimentos em atividades de trabalho. |
L24.7 |
Dermatite de contato por irritantes devido a plantas, exceto alimentos |
• Exposição a plantas em atividades de trabalho. |
L25.9 |
Dermatite de contato não especificada, de causa não especificada |
• Exposição a agrotóxicos (organoclorados, organofosforados e carbamatos) em atividades de trabalho. |
L50.0 |
Urticária alérgica |
• Exposição a agrotóxicos em atividades de trabalho. |
L50.2 |
Urticária devida a frio e a calor |
Exposição a temperaturas extremas (altas ou baixas) em atividades de trabalho. |
L50.6 |
Urticária de Contato |
• Exposição a agentes químicos e/ou físicos e/ou biológicos que afetem a pele em atividades de trabalho. |
L55 |
Queimadura solar |
• Exposição a radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
L56 |
Outras alterações agudas da pele devidas a radiação ultravioleta |
• Exposição a radiação não ionizante (ultravioleta) em atividades de trabalho. |
L56.2 |
Dermatite por fotocontato (Dermatite de Berloque) |
• Exposição a radiação não ionizante (ultravioleta) em atividades de trabalho. |
L56.3 |
Urticária solar |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha) em atividades de trabalho. |
L57.0 |
Ceratose actínica |
• Exposição a radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
L57.8 |
Outras alterações da pele devidas a exposição crônica à radiação não-ionizante |
Exposição a radiações não ionizantes em atividades de trabalho. |
L58 |
Radiodermatite |
• Exposição a radiações ionizantes em atividades de trabalho. |
L58.0 |
Radiodermatite aguda |
• Exposição a radiações ionizantes em atividades de trabalho. |
L58.1 |
Radiodermatite crônica |
• Exposição a radiações ionizantes em atividades de trabalho. |
L58.9 |
Radiodermatite, não especificada |
• Exposição a radiações ionizantes em atividades de trabalho. |
L59.9 |
Afecções da pele e do tecido subcutâneo relacionadas com a radiação, não especificadas |
• Exposição a radiações ionizantes em atividades de trabalho. |
L60 |
Afecções das unhas |
• Exposição solventes em atividades de trabalho; • Exposição a umidade em atividades de trabalho; • Biomecânica do trabalho com traumatismos das unhas. |
L63 |
Alopecia areata |
• Exposição a tálio e seus compostos em atividades de trabalho. |
L70.8 |
Outras formas de acne |
• Exposição a derivados halogenados dos hidrocarbonetos aromáticos (monoclorobenzeno, monobromobenzeno, hexaclorobenzeno); e/ou derivados do fenol, do pentaclorofenol e do hidrobenzonitrilo; e/ou bifenilas policloradas (PCB); e/ou iodo em atividades de trabalho. |
L72.8 |
Outras formas de cistos foliculares da pele e do tecido subcutâneo |
• Exposição a óleos e gorduras de origem mineral ou sintéticos em atividades de trabalho. |
L80 |
Vitiligo |
Exposição a arsênio e seus compostos; e/ou hidroquinona e ésteres derivados; e/ou monometil éter de hidroquinona (MBEH); e/ou para-aminofenol; e/ou para-butilfenol; e/ou para-cresol; e/ou catecol e pirocatecol; e/ou clorofenol em atividades de trabalho. |
L81.4 |
Outras formas de hiperpigmentação pela melanina |
• Exposição a arsênio e seus compostos; e/ou clorobenzeno e/ou diclorobenzeno; e/ou alcatrão; e/ou betume; e/ou carvão mineral; e/ou creosoto, e/ou breu; e/ou piche e/ou coaltar e/ou resíduos dessas substâncias; e/ou antraceno e dibenzoantraceno; e/ou bismuto; e/ou citostáticos; e/ou compostos nitrogenados (ácido nítrico, dinitrofenol); e/ou naftóis adicionados a corantes; e/ou óleos de corte; e/ou parafenilenodiamina e seus derivados; e/ou poeiras de madeira; e/ou quinino e seus derivados; e/ou sais de ouro; e/ou sais de prata em atividades de trabalho. |
L81.5 |
Leucodermia, não classificada em outra parte |
• Exposição a arsênio e seus compostos; e/ou hidroquinona e ésteres derivados; e/ou monometil éter de hidroquinona (MBEH); e/ou para-aminofenol; e/ou para-butilfenol; e/ou para-cresol; e/ou catecol e pirocatecol; e/ou clorofenol em atividades de trabalho. |
L81.8 |
Outros transtornos especificados da pigmentação |
• Exposição a derivados halogenados dos hidrocarbonetos aromáticos (monocloro-benzeno, monobromo-benzeno, hexaclorobenzeno) em atividades de trabalho. |
L84 |
Calos e calosidades |
• Biomecânica do trabalho com pressão e/ou fricção da pele. |
L85.1 |
Ceratose adquirida [ceratodermia] palmar e plantar |
• Exposição a arsênio e seus compostos em atividades de trabalho. |
L92.3 |
Granuloma de corpo estranho da pele e do tecido subcutâneo |
• Exposição a berílio e seus compostos em atividades de trabalho. |
L98.4 |
Úlcera crônica da pele, não classificada em outra parte |
Exposição a cromo e seus compostos tóxicos; e/ou enzimas de origem animal, vegetal ou bacteriana em atividades de trabalho. |
T33 |
Geladura superficial |
• Exposição a cloreto de etila em atividades de trabalho. • Exposição a baixas temperaturas no trabalho. |
T34 |
Geladura com necrose de tecidos |
• Exposição a cloreto de etila em atividades de trabalho. • Exposição a baixas temperaturas no trabalho. |
Capítulo XIII - Doenças do sistema osteomuscular e do tecido conjuntivo (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
M05.3 |
Artrite reumatoide com comprometimento de outros órgãos e sistemas [Síndrome de Caplan] |
• Exposição a poeiras de carvão mineral; e/ou poeiras de sílica livre cristalina em atividades de trabalho. |
M10 |
Gota |
• Exposição a molibdênio em atividades de trabalho. |
M10.1 |
Gota induzida pelo chumbo |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. |
M16 |
Coxartrose [artrose do quadril] |
• Biomecânica do trabalho com: aplicação de força; e/ou manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas. • Exposição a vibração em atividades de trabalho. |
M17 |
Gonartrose [artrose do joelho] |
• Biomecânica do trabalho com: aplicação de força; e/ou manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas. • Exposição a vibração em atividades de trabalho. |
M19 |
Outras artroses |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. • Exposição a vibração em atividades de trabalho. |
M23.3 |
Outros transtornos de menisco |
• Biomecânica do trabalho com posições forçadas. |
M47.8 |
Outras espondiloses |
• Biomecânica do trabalho com manipulação manual de carga. |
M50 |
Transtornos dos discos cervicais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.0 |
Transtorno do disco cervical com mielopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.1 |
Transtorno do disco cervical com radiculopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.2 |
Outro deslocamento de disco cervical |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.3 |
Outra degeneração de disco cervical |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.8 |
Outros transtornos de discos cervicais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.9 |
Transtorno não especificado de disco cervical |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51 |
Outros transtornos de discos intervertebrais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.0 |
Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.1 |
Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.2 |
Outros deslocamentos discais intervertebrais especificados |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.3 |
Outra degeneração especificada de disco intervertebral |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. Exposição a vibração em atividades de trabalho. |
M51.8 |
Outros transtornos especificados de discos intervertebrais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M53.1 |
Síndrome cervicobraquial |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54 |
Dorsalgia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.2 |
Cervicalgia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.3 |
Ciática |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.4 |
Lumbago com ciática |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.5 |
Dor lombar baixa |
Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M65 |
Sinovites e tenossinovites |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.3 |
Dedo em gatilho |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.4 |
Tenossinovite estilóide radial [de Quervain] |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.8 |
Outras sinovites e tenossinovites |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.9 |
Tenossinovites, não especificadas |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70 |
Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho |
M70.0 |
Sinovite crepitante crônica da mão e do punho |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.1 |
Bursite da mão |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.2 |
Bursite do Olécrano |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.3 |
Outras bursites do cotovelo |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.4 |
Bursite pré-patelar |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.5 |
Outras bursites do joelho |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.8 |
Transtornos dos tecidos moles relacionados com o uso, uso excessivo e pressão; outros |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.9 |
Transtorno não especificado dos tecidos moles relacionados com o uso, uso excessivo e pressão. |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M72.0 |
Fibromatose de fáscia palmar [Dupuytren] |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75 |
Lesões do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.0 |
Capsulite Adesiva do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.1 |
Síndrome do manguito rotador |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.2 |
Tendinite bicipital |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.3 |
Tendinite Calcificante do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.5 |
Bursite do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.8 |
Outras lesões do ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.9 |
Lesão não especificada do ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77 |
Outras entesopatias |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77.0 |
Epicondilite medial |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77.1 |
Epicondilite lateral |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77.8 |
Outras entesopatias não classificadas em outra parte |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M79.8 |
Outros transtornos especificados dos tecidos moles |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M83.5 |
Outras osteomalácias do adulto induzidas por drogas |
• Exposição a cádmio ou seus compostos; e/ou fósforo e seus compostos em atividades de trabalho. |
M84.3 |
Fratura de fadiga ("stress") não classificada em outra parte |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força; • Exposição a vibração em atividades de trabalho. |
M85.1 |
Fluorose esquelética |
Exposição a flúor ou seus compostos tóxicos em atividades de trabalho. |
M87 |
Osteonecrose |
• Exposição a fósforo e seus compostos em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
M87.1 |
Osteonecrose devida a drogas |
• Exposição a fósforo e seus compostos em atividades de trabalho. • Exposição a vibração e/ou radiações ionizantes em atividades de trabalho. |
M87.3 |
Outras osteonecroses secundárias |
• Exposição a fósforo e seus compostos em atividades de trabalho. • Exposição a vibração e/ou radiações ionizantes em atividades de trabalho. |
M89.5 |
Osteolise |
• Exposição a cloreto de vinila em atividades de trabalho. |
M90.3 |
Osteonecrose em "mal dos caixões" |
• Variação de pressão ambiental no trabalho. |
M93.1 |
Doença de Kienböck do Adulto |
• Exposição a vibração em atividade de trabalho. • Sequela de acidente de trabalho com trauma ósseo |
M93.8 |
Outras osteocondropatias, especificadas |
• Exposição a vibração em atividade de trabalho. • Sequela de acidente de trabalho com trauma ósseo |
Capítulo XIV - Doenças do aparelho geniturinário (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
N00 |
Síndrome nefrítica aguda |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
N03 |
Síndrome nefrítica crônica |
• Exposição a mercúrio e seus compostos tóxicos em atividades de trabalho. |
N14.3 |
Nefropatia induzida por metais pesados |
• Exposição a cádmio ou seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou tálio e seus compostos em atividades de trabalho. |
N17 |
Insuficiência renal aguda |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos; e/ou arsênio e seus compostos tóxicos em atividades de trabalho. |
N18 |
Insuficiência renal crônica |
• Exposição a chumbo e seus compostos em atividades de trabalho. |
N30.0 |
Cistite aguda |
• Exposição a aminas aromáticas e seus derivados em atividades de trabalho. |
N46 |
Infertilidade masculina |
• Exposição a chumbo e seus compostos tóxicos; e/ou clordecona; e/ou dibromocloropropano em atividades de trabalho. • Exposição a radiações ionizantes e/ou altas temperaturas em atividades de trabalho. |
N97 |
Infertilidade feminina |
• Exposição a anilina; e/ou benzeno; e/ou mercúrio e seus compostos em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
Capítulo XIX - Intoxicações exógenas (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
T36 |
Intoxicação por antibióticos sistêmicos |
• Exposição a antibióticos em atividades de trabalho |
T38 |
Intoxicação por hormônios, seus substitutos sintéticos e seus antagonistas não classificados em outra parte |
• Exposição a hormônios sintéticos em atividades de trabalho |
T51.0 |
Efeito tóxico do etanol |
• Exposição a álcool etílico em atividades de trabalho. |
T51.1 |
Efeito tóxico do metanol |
• Exposição a álcool metílico em atividades de trabalho. |
T51.2 |
Efeito tóxico do 2-propanol |
• Exposição a álcool propílico em atividades de trabalho. |
T51.8 |
Efeito tóxico de outros álcoois |
• Exposição a outros álcoois em atividades de trabalho. |
T52 |
Efeitos tóxicos de Solventes Orgânicos |
• Exposição a solventes orgânicos em atividades de trabalho. |
T52.1 |
Efeito tóxico do benzeno |
• Exposição a benzeno em atividades de trabalho. |
T52.2 |
Efeito tóxico de homólogos do benzeno |
• Exposição a tolueno e/ou xileno em atividades de trabalho. |
T52.3 |
Efeito tóxico de glicóis |
• Exposição a glicóis em atividades de trabalho. |
T52.4 |
Efeito tóxico de cetonas |
• Exposição a cetonas em atividades de trabalho. |
T52.8 |
Efeito tóxico de outros solventes orgânicos |
• Exposição a solventes orgânicos em atividades de trabalho. |
T53 |
Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos e/ou aromáticos em atividades de trabalho. |
T53.0 |
Efeito tóxico do tetracloreto de carbono |
• Exposição a tetracloreto de carbono em atividades de trabalho. |
T53.1 |
Efeito tóxico do clorofórmio |
• Exposição a clorofórmio em atividades de trabalho. |
T53.2 |
Efeito tóxico do tricloroetileno |
• Exposição a tricloroetileno em atividades de trabalho. |
T53.3 |
Efeito tóxico do tetracloroetileno |
• Exposição a tetracloroetileno em atividades de trabalho. |
T53.4 |
Efeito tóxico do diclorometano |
• Exposição a diclorometano em atividades de trabalho. |
T53.5 |
Efeitos tóxicos do clorofluorcarbono |
Exposição a clorofluorcarbono em atividades de trabalho. |
T53.6 |
Efeito tóxico de outros derivados halogênicos de hidrocarbonetos alifáticos |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
T53.7 |
Efeito tóxico de derivados halogênicos de hidrocarbonetos aromáticos |
• Exposição a derivados halogenados dos hidrocarbonetos aromáticos em atividades de trabalho. |
T53.9 |
Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos não especificados |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos e/ou aromáticos não especificados em atividades de trabalho. |
T54 |
Efeito tóxico de corrosivos |
• Exposição a agentes químicos corrosivos em atividades de trabalho. |
T54.0 |
Efeito tóxico do fenol e homólogos do fenol |
• Exposição a fenol e homólogos em atividades de trabalho. |
T54.1 |
Efeito tóxico de outros compostos corrosivos orgânicos |
• Exposição a outros compostos corrosivos orgânicos em atividades de trabalho. |
T54.2 |
Efeito tóxico de ácidos corrosivos e substâncias semelhantes |
• Exposição a ácidos corrosivos e substâncias semelhantes em atividades de trabalho. |
T54.3 |
Efeito tóxico de bases (álcalis) cáusticas(os) e substâncias semelhantes |
• Exposição a bases (álcalis) cáusticas(os) e substâncias semelhantes em atividades de trabalho. |
T54.9 |
Efeito tóxico de substância corrosiva, não especificada |
• Exposição a substância corrosiva, não especificada em atividades de trabalho. |
T56 |
Efeito tóxico de metais |
• Exposição a metais tóxicos em atividades de trabalho. |
T56.0 |
Efeito tóxico do chumbo e seus compostos |
• Exposição a chumbo e seus compostos em atividades de trabalho. |
T56.1 |
Efeito tóxico do mercúrio e seus compostos |
• Exposição a mercúrio e seus compostos em atividades de trabalho. |
T56.2 |
Efeito tóxico do cromo e seus compostos |
• Exposição a cromo e seus compostos em atividades de trabalho. |
T56.3 |
Efeito tóxico do cádmio e seus compostos |
• Exposição a cádmio e seus compostos em atividades de trabalho. |
T56.4 |
Efeito tóxico do cobre e seus compostos |
• Exposição a cobre e seus compostos em atividades de trabalho. |
T56.5 |
Efeito tóxico do zinco e seus compostos |
• Exposição a zinco e seus compostos em atividades de trabalho. |
T56.7 |
Efeito tóxico do berilo e seus compostos |
• Exposição a berílio e seus compostos em atividades de trabalho. |
T56.8 |
Efeitos tóxicos de outros metais |
• Exposição a metais tóxicos em atividades de trabalho. |
T56.9 |
Efeito tóxico do metal, não especificado |
• Exposição a metais tóxicos em atividades de trabalho. |
T57 |
Efeito tóxico de outras substâncias inorgânicas |
• Exposição a substâncias inorgânicas em atividades de trabalho. |
T57.0 |
Efeito tóxico do arsênico e seus compostos |
Exposição a arsênio e seus compostos em atividades de trabalho. |
T57.1 |
Efeito tóxico do fósforo e seus compostos |
• Exposição a fósforo e seus compostos em atividades de trabalho. |
T57.2 |
Efeito tóxico do manganês e seus compostos |
• Exposição a manganês e seus compostos em atividades de trabalho. |
T57.3 |
Efeito tóxico do cianeto de hidrogênio (ácido cianídrico) |
• Exposição a cianeto de hidrogênio (ácido cianídrico) em atividades de trabalho. |
T57.8 |
Efeito tóxico de outras substâncias inorgânicas especificadas |
• Exposição a cloreto de vinila; e/ou monocloroetileno; e/ou outras substâncias inorgânicas especificadas em atividades de trabalho. |
T58 |
Efeito tóxico do monóxido de carbono |
• Exposição a monóxido de carbono em atividades de trabalho. |
T59 |
Efeito tóxico de outros gases, fumaças e vapores |
• Exposição a outros gases, fumaças e vapores em atividades de trabalho. |
T59.2 |
Efeito tóxico de formaldeído |
• Exposição a formaldeído em atividades de trabalho. |
T59.4 |
Efeito tóxico do cloro gasoso |
• Exposição a cloro gasoso em atividades de trabalho. |
T59.5 |
Efeito tóxico do fluoreto gasoso e ácido fluorídrico |
• Exposição a fluoreto gasoso e/ou ácido fluorídrico em atividades de trabalho. |
T59.6 |
Efeito tóxico do ácido sulfídrico |
• Exposição a ácido sulfídrico (sulfeto de hidrogênio) em atividades de trabalho. |
T59.8 |
Efeito tóxico de outros gases, fumaças e vapores especificados |
• Exposição a gases, fumaças e vapores em atividades de trabalho. |
T60 |
Efeito tóxico de pesticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.0 |
Efeito tóxico de inseticidas organofosforados e carbamatos |
• Exposição a agrotóxicos organofosforados e/ou carbamatos em atividades de trabalho. |
T60.1 |
Efeito tóxico de inseticidas halogenados |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.2 |
Efeito tóxico de outros inseticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.4 |
Efeito tóxico de rodenticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.8 |
Efeito tóxico de outros pesticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T63 |
Efeito tóxico de contato com animais venenosos |
• Mordedura ou picadura de serpente; e/ou outros répteis; e/ou escorpião; e/ou aranha; e/ou outros artrópodes; e/ou peixe; e/ou outros animais marinhos; e/ou outros animais venenosos não especificados em atividades de trabalho. |
T65.2 |
Efeito tóxico do tabaco e da nicotina (Doença da Folha Verde do Tabaco) |
• Exposição a tabaco e nicotina em atividades de trabalho. |
T65.3 |
Efeito tóxico de nitroderivados e aminoderivados do benzeno e seus homólogos |
• Exposição a nitroderivados e aminoderivados do benzeno e seus homólogos em atividades de trabalho. |
T65.4 |
Efeito tóxico do dissulfeto de carbono |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
T65.8 |
Efeito tóxico de outras substâncias especificadas |
• Exposição a outras substâncias especificadas em atividades de trabalho. |
T66 |
Efeitos não especificados de radiação |
• Exposição a radiações ionizantes em atividades de trabalho. |
T67 |
Efeitos do calor e da luz |
• Exposição a altas temperaturas no trabalho. |
Capítulo VI - Doenças do sistema nervoso (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
G00.2 |
Meningite estreptocócica |
• Exposição a Streptococcus suisem atividades de trabalho. |
G01 |
Meningite em doenças bacterianas classificadas em outra parte |
• Exposição a Neisseria meningitidisem atividades de trabalho. |
G11.1 |
Ataxia cerebelar de início precoce |
• Exposição a mercúrio e seus compostos tóxicos; e/ou agrotóxicos organofosforados em atividades de trabalho. |
G21.2 |
Parkinsonismo secundário devido a outros agentes externos |
• Exposição a manganês e seus compostos tóxicos; e/ou agrotóxicos em atividades de trabalho. |
G25.2 |
Outras formas especificadas de tremor |
• Exposição a brometo de metila; e/ou tetracloroetano; e/ou mercúrio e seus compostos tóxicos; e/ou outros solventes orgânicos; e/ou agrotóxicos neurotóxicos em atividades de trabalho. |
G25.9 |
Doenças extrapiramidais e transtornos dos movimentos, não especificados |
• Exposição a mercúrio e seus compostos tóxicos; e/ou diclorometano; e/ou cloreto de metileno; e/ou solventes halogenados, em atividades de trabalho. |
G40.1 |
Epilepsia e síndromes epilépticas sintomáticas definidas por sua localização (focal) (parcial) com crises parciais simples |
• Exposição a ácido cianídrico; e/ou cianetos; e/ou nitrila (acrilonitrila, e outros) em atividades de trabalho. |
G44.1 |
Cefaleia vascular, não classificada em outra parte |
• Exposição a ésteres do ácido nítrico em atividades de trabalho. |
G45.9 |
Isquemia cerebral transitória não especificada |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
G47.2 |
Distúrbios do ciclo vigília-sono |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
G50 |
Transtornos do nervo trigêmeo |
• Exposição a tricloroetileno e outros solventes halogenados neurotóxicos em atividades de trabalho. |
G52.0 |
Transtornos do nervo olfatório |
• Exposição a cádmio ou seus compostos; e/ou sulfeto de hidrogênio em atividades de trabalho. |
G53 |
Transtornos dos nervos cranianos em doenças classificadas em outra parte |
• Exposição a mercúrio e seus compostos; e/ou hidrocarbonetos clorados em atividades de trabalho. |
G54.0 |
Transtornos do plexo braquial |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56 |
Mononeuropatias dos membros superiores |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.0 |
Síndrome do túnel do carpo |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.1 |
Outras lesões do nervo mediano |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.2 |
Lesões do nervo cubital [ulnar] |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.3 |
Lesão do nervo radial |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G56.8 |
Outras mononeuropatias dos membros superiores |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G57.3 |
Lesão do nervo poplíteo lateral |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. |
G62.2 |
Polineuropatia devida a outros agentes tóxicos |
• Exposição a arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou fósforo; e/ou sulfeto de carbono; e/ou n-hexano; e/ou metil-n-butil cetona (MBK); e/ou acrilamida; e/ou álcoois; e/ou cetonas; e/ou agrotóxicos; e/ou derivados halogenados dos hidrocarbonetos alifáticos; e/ou ésteres orgânicos; e/ou mercúrio e seus compostos; e/ou tálio e seus compostos; e/ou óxido de etileno em atividades de trabalho. |
G62.8 |
Outras polineuropatias especificadas |
• Exposição a radiações ionizantes em atividades de trabalho. |
G92 |
Encefalopatia tóxica |
• Exposição a arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou derivados halogenados de hidrocarbonetos alifáticos e/ou aromáticos; e/ou mercúrio e seus derivados tóxicos; e/ou cetonas; e/ou solventes orgânicos; e/ou gases anestésicos; e/ou monóxido de carbono; e/ou sulfeto de hidrogênio; e/ou cianetos; e/ou derivados organometálicos (metil-mercúrio, chumbo tetraetila, estanho orgânico); e/ou sulfato de tálio; e/ou tálio em atividades de trabalho. |
Capítulo VII - Doenças do olho e anexos (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
H01.0 |
Blefarite |
• Exposição a arsênio e seus compostos; e/ou poeira de cimento em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
H01.1 |
Dermatoses não infecciosas da pálpebra |
• Exposição a poeiras, gases e vapores de diferentes origens em atividades de trabalho. |
H10 |
Conjuntivite |
• Exposição a arsênio e seus compostos; e/ou berílio e seus compostos tóxicos; e/ou flúor ou seus compostos tóxicos; e/ou iodo; e/ou cloreto de etila; e/ou tetracloreto de carbono; e/ou solventes halogenados; e/ou ácido sulfídrico (sulfeto de hidrogênio); e/ou acrilatos; e/ou poeira de cimento; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou selênio e seus compostos em atividades de trabalho. • Exposição a radiações ionizantes; e/ou radiações não ionizantes (ultravioleta) em atividades de trabalho. |
H11.0 |
Pterígio |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H11.1 |
Degenerações e depósitos de conjuntiva |
• Exposição a sais de prata em atividades de trabalho. |
H16 |
Ceratite |
• Exposição a arsênio e seus compostos; e/ou ácido sulfídrico (sulfeto de hidrogênio) em atividades de trabalho. • Exposição a radiações ionizantes; e/ou radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H16.2 |
Ceratoconjuntivite |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H26 |
Outras cataratas |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha e/ou micro-ondas) em atividades de trabalho. |
H28 |
Catarata e outros transtornos do cristalino em doenças classificadas em outra parte |
• Exposição a radiações ionizantes; e/ou radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
H30 |
Inflamação coriorretiniana |
• Exposição a manganês e seus compostos tóxicos; e/ou hidrocarbonetos aromáticos (naftalina, benzeno) em atividades de trabalho. |
H46 |
Neurite Óptica |
• Exposição a brometo de metila; e/ou diclorometano; e/ou cloreto de metileno; e/ou solventes clorados neurotóxicos; e/ou tetracloreto de carbono; e/ou dissulfeto de carbono; e/ou metanol; e/ou álcoois e derivados; e/ou chumbo e seus compostos; e/ou tricloroetileno; e/ou mercúrio e seus compostos em atividades de trabalho. |
H49.0 |
Paralisia do terceiro par [oculomotor] |
• Exposição a dissulfeto de carbono; e/ou chumbo e seus compostos em atividades de trabalho. |
H52.5 |
Transtornos da acomodação |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
H55 |
Nistagmo e outros movimentos irregulares do olho |
• Exposição a glicóis e derivados em atividades de trabalho. • Ambiente de trabalho com iluminação ausente ou deficiente. |
Capítulo VIII - Doenças do ouvido e da apófise mastoide (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
H65.9 |
Otite média não-supurativa, não especificada |
• Variação de pressão ambiental no trabalho. |
H72 |
Perfuração da membrana do tímpano |
• Variação de pressão ambiental no trabalho. |
H83.0 |
Labirintite |
• Exposição a brometo de metila, em atividades de trabalho. • Variação de pressão ambiental no trabalho. |
H83.3 |
Efeitos do ruído sobre o ouvido interno |
• Exposição a níveis de pressão sonora elevados no trabalho. |
H91.0 |
Perda de audição ototóxica |
• Exposição a xileno; e/ou tolueno e outros solventes aromáticos neurotóxicos; e/ou solventes orgânicos; e/ou monóxido de carbono; e/ou arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou dissulfeto de carbono; e/ou tricloroetileno, e/ou agrotóxicos, em atividades do trabalho. |
H93.8 |
Outros transtornos especificados do ouvido |
• Exposição a brometo de metila em atividades de trabalho. • Variação de pressão ambiental no trabalho. |
T70.0 |
Otite barotraumática |
• Variação de pressão ambiental no trabalho. |
T70.1 |
Sinusite barotraumática |
• Variação de pressão ambiental no trabalho. |
T70.3 |
Mal dos caixões [doença de descompressão] |
• Variação de pressão ambiental no trabalho. |
Capítulo IX - Doenças do aparelho circulatório (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou fatores de Risco |
I10 |
Hipertensão essencial (primária) |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. • Exposição a níveis de pressão sonora elevados no trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
I20 |
Angina pectoris |
• Exposição a monóxido de carbono; e/ou dissulfeto de carbono; e/ou nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego |
I21 |
Infarto agudo do miocárdio |
• Exposição a monóxido de carbono; e/ou dissulfeto de carbono; e/ou nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego |
I25.1 |
Doença ateroesclerótica do coração |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
I27.9 |
Cardiopatia pulmonar não especificada |
• Complicação evolutiva das pneumoconioses graves, principalmente silicose. |
I34.8 |
Outros transtornos não-reumáticos da valva mitral |
• Exposição a asbesto ou amianto em atividades de trabalho. |
I46 |
Parada cardíaca |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos; e/ou monóxido de carbono em atividades de trabalho. • Fatores psicossociais relacionados à jornada de trabalho. |
I49 |
Outras arritmias cardíacas |
• Exposição a arsênio e seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou derivados halogenados dos hidrocarbonetos alifáticos; e/ou mercúrio e seus compostos tóxicos; e/ou monóxido de carbono; e/ou agrotóxicos organofosforados e carbamatos; e/ou cobalto; e/ou nitroglicerina e outros ésteres do ácido nítrico em atividades de trabalho. |
I60 |
Hemorragia subaracnóide |
• Fatores psicossociais relacionados à jornada de trabalho. |
I61 |
Hemorragia intracerebral |
• Fatores psicossociais relacionados à jornada de trabalho. |
I63 |
Infarto cerebral |
• Fatores psicossociais relacionados à jornada de trabalho. |
I64 |
Acidente vascular cerebral, não especificado como hemorrágico ou isquêmico |
• Fatores psicossociais relacionados à jornada de trabalho. |
I67.2 |
Aterosclerose cerebral |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
I67.4 |
Encefalopatia hipertensiva |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego. |
I70 |
Ateroesclerose |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
I73.0 |
Síndrome de raynaud |
• Exposição a cloreto de vinila em atividades de trabalho. • Exposição a vibração e/ou trabalho em baixas temperaturas. |
I73.8 |
Outras doenças vasculares periféricas especificadas |
• Exposição a cloreto de vinila em atividades de trabalho. • Exposição a vibração e/ou trabalho em baixas temperaturas. |
I83 |
Varizes dos membros inferiores |
• Biomecânica do trabalho com: ortostatismo prolongado; e/ou aplicação de força e/ou manipulação manual de carga. |
Capítulo X - Doenças do aparelho respiratório (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
J02.9 |
Faringite aguda não especificada |
Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. |
J04.2 |
Laringotraqueíte aguda |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J11 |
Influenza [gripe] devida a vírus não identificado |
• Exposição ao vírus influenza em atividades de trabalho. |
J11.1 |
Influenza [gripe] com outras manifestações respiratórias, devida a vírus não identificado |
• Exposição ao vírus influenza em atividades de trabalho. |
J30.3 |
Outras rinites alérgicas |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros, como cobalto e titânio; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou agentes imunoalérgicos de origem animal e vegetal; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas; e/ou proteínas animais em aerossóis; e/ou outras substâncias de origem vegetal (cereais, farinhas, serragem, etc.); e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias em atividades de trabalho. |
J31.0 |
Rinite crônica |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros, como cobalto e titânio; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias; e/ou arsênio e seus compostos; e/ou cloro gasoso; e/ou cromo e seus compostos tóxicos; e/ou flúor; e/ou gás de fluoreto de hidrogênio; e/ou amônia; e/ou anidrido sulfuroso; e/ou poeira de cimento; e/ou fenol e homólogos; e/ou névoas ácidas; e/ou selênio e seus compostos em atividades de trabalho. |
J31.2 |
Faringite crônica |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros, como cobalto e titânio; e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos como macrolídeos, ranitidina, penicilina e seus sais, e cefalosporinas e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias; e/ou arsênio e seus compostos; e/ou cloro gasoso; e/ou flúor; e/ou gás de fluoreto de hidrogênio; e/ou amônia; e/ou anidrido sulfuroso; e/ou poeira de cimento; e/ou fenol e homólogos; e/ou névoas ácidas; e/ou selênio e seus compostos em atividades de trabalho. |
J32 |
Sinusite crônica |
• Exposição a bromo; e/ou iodo; e/ou névoas ácidas em atividades de trabalho. |
J34.0 |
Abscesso, furúnculo e antraz do nariz |
• Exposição a arsênio e seus compostos; e/ou cádmio ou seus compostos; e/ou cromo e seus compostos tóxicos; e/ou soluções e aerossóis de ácido cianídrico e seus derivados em atividades de trabalho. |
J34.8 |
Outros transtornos especificados do nariz e dos seios paranasais |
• Exposição a arsênio e seus compostos; e/ou cromo e seus compostos tóxicos em atividades de trabalho. |
J37.1 |
Laringotraqueíte crônica |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J38 |
Doenças das cordas vocais e da laringe não classificadas em outra parte |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J38.2 |
Nódulos das cordas vocais |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
J40 |
Bronquite não especificada como aguda ou crônica |
• Exposição a ácido sulfúrico; e/ou zinco e seus compostos; e/ou selênio e seus compostos; e/ou dióxido de enxofre; e/ou cádmio e seus compostos; e/ou poeira de cimento; e/ou poeira de calcário e/ou gesso e/ou cal; e/ou fumos de solda; e/ou ácidos orgânicos; e/ou ácido cianídrico; e/ou cianetos e/ou nitrila; e/ou álcoois e derivados; e/ou aldeído fórmico e seus polímeros; e/ou amidos, anidridos e derivados; e/ou antimônio e seus compostos; e/ou berílio e seus compostos; e/ou bromo; e/ou cloro; e/ou iodo; e/ou butadieno; e/ou cetonas; e/ou cloreto de carbono ou fósforo; e/ou compostos inorgânicos do nitrogênio; e/ou compostos inorgânicos do fósforo;e/ou derivados halogenados e/ou nítricos dos hidrocarbonetos alifáticos; e/ou dicloroacetileno e/ou diisocianatos; e/ou ésteres orgânicos e derivados; e/ou éter de petróleo (benzina); e/ou fenol e homólogos; e/ou fibras artificiais e minerais; e/ou flúor ou seus compostos tóxicos; e/ou glicóis e derivados; e/ou sulfeto de hidrogênio; e/ou ósmio e seus derivados; e/ou ozônio, ozoneto e peróxidos; e/ou estireno; e/ou terpenos, vanádio e seus compostos; e/ou xileno em atividades de trabalho. |
J42 |
Bronquite crônica não especificada |
• Exposição a arsênio e seus compostos; e/ou amônia; e/ou álcoois em atividades de trabalho. |
J44 |
Outras doenças pulmonares obstrutivas crônicas |
• Exposição a cloro gasoso; e/ou poeiras de sílica livre cristalina; e/ou poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal; e/ou amônia; e/ou anidrido sulfuroso; e/ou névoas ácidas; e/ou poeiras de carvão mineral; e/ou poeiras minerais em atividades de trabalho. |
J45 |
Asma |
• Exposição a carbonetos metálicos de tungstênio sintetizados; e/ou cromo e seus compostos tóxicos; e/ou poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal; e/ou acrilatos; e/ou aldeído fórmico e seus polímeros; e/ou aminas aromáticas e seus derivados; e/ou anidrido ftálico; e/ou azodicarbonamida; e/ou carbonetos de metais duros (cobalto e titânio); e/ou enzimas de origem animal, vegetal ou bacteriana; e/ou furfural e álcool furfurílico; e/ou isocianatos orgânicos; e/ou níquel e seus compostos; e/ou pentóxido de vanádio; e/ou cloreto de vinila; e/ou produtos da pirólise de plásticos e teflon; e/ou sulfitos, bissulfitos e persulfatos; e/ou medicamentos: macrolídeos, ranitidina, penicilina e seus sais, cefalosporinas; e/ou proteínas animais em aerossóis; e/ou outras substâncias de origem vegetal (cereais, farinhas, serragem, etc.); e/ou outras substâncias químicas sensibilizantes da pele e das vias respiratórias; e/ou formaldeído; e/ou resina epóxi; e/ou látex; e/ou alcaloide; e/ou éter dietílico diclorado em atividades de trabalho. |
J60 |
Pneumoconiose dos mineiros de carvão |
• Exposição a poeiras de carvão mineral; e/ou poeiras de sílica livre cristalina em atividades de trabalho. |
J61 |
Pneumoconiose devida a amianto [asbesto] e outras fibras minerais |
• Exposição a asbesto ou amianto em atividades de trabalho. |
J62.0 |
Pneumoconiose devida a pó de talco |
• Exposição a poeira de talco em atividades de trabalho. |
J62.8 |
Pneumoconiose devida a outras poeiras que contenham sílica |
• Exposição a poeiras de sílica livre cristalina em atividades de trabalho. |
J63 |
Pneumoconiose devida a outras poeiras inorgânicas |
• Exposição a poeiras de metais duros em atividades de trabalho. |
J63.0 |
Aluminose (do pulmão) |
• Exposição a poeira de alumínio em atividades de trabalho. |
J63.2 |
Beriliose |
• Exposição a poeiras de berílio e seus compostos tóxicos em atividades de trabalho. |
J63.4 |
Siderose |
• Exposição a poeira de ferro em atividades de trabalho. |
J63.5 |
Estanhose |
• Exposição a poeira de estanho em atividades de trabalho. |
J63.8 |
Pneumoconiose devida a outras poeiras inorgânicas especificadas |
• Exposição a poeiras de carbonetos metálicos de tungstênio sintetizados; e/ou de carbonetos de metais duros; e/ou de rocha fosfática, de alumina, de zircônio em atividades de trabalho. |
J65 |
Pneumoconiose associada com tuberculose |
• Exposição a poeiras de sílica livre cristalina; e/ou poeiras não especificadas, em atividades de trabalho. |
J66 |
Doenças das vias aéreas devida a poeiras orgânicas específicas |
• Exposição a poeiras de algodão e/ou linho e/ou cânhamo e/ou sisal em atividades de trabalho. |
J66.0 |
Bissinose |
• Exposição a poeira de algodão em atividades de trabalho. |
J66.1 |
Doença dos cardadores de linho |
• Exposição a poeira de linho em atividades de trabalho. |
J66.2 |
Canabinose |
• Exposição a poeira de cânhamo em atividades de trabalho. |
J66.8 |
Doenças das vias aéreas devida a outras poeiras orgânicas específicas |
• Exposição a poeira de sisal, entre outras, em atividades de trabalho. |
J67 |
Pneumonite de hipersensibilidade devida a poeiras orgânicas |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.0 |
Pulmão de fazendeiro |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou poeiras orgânicas em atividades de trabalho. |
J67.1 |
Bagaçose |
• Exposição a poeira da cana-de-açúcar em atividades de trabalho. |
J67.2 |
Pulmão dos criadores de pássaros |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.3 |
Suberose |
• Exposição a poeira de cortiça em atividades de trabalho. |
J67.4 |
Pulmão dos trabalhadores do malte |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.5 |
Pulmão dos que trabalham com cogumelos |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.7 |
Doença pulmonar devida aos sistemas de ar condicionado e de umidificação do ar |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.8 |
Pneumonites de hipersensibilidade devidas a outras poeiras orgânicas |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J67.9 |
Pneumonite de hipersensibilidade devida a poeira orgânica não especificada |
• Exposição a poeiras contendo micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou outras poeiras orgânicas em atividades de trabalho. |
J68.0 |
Bronquite e pneumonite devida a produtos químicos, gases, fumaças e vapores |
• Exposição a berílio e seus compostos tóxicos; e/ou bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou flúor ou seus compostos tóxicos; e/ou solventes; e/ou iodo; e/ou manganês e seus compostos tóxicos; e/ou cianeto de hidrogênio; e/ou névoas de óleos de corte em atividades de trabalho. |
J68.1 |
Edema pulmonar devido a produtos químicos, gases, fumaças e vapores |
• Exposição a berílio e seus compostos tóxicos; e/ou bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou flúor ou seus compostos tóxicos; e/ou solventes halogenados; e/ou iodo; e/ou manganês e seus compostos tóxicos; e/ou cianeto de hidrogênio; e/ou agrotóxicos (carbamatos, dipiridilos, fosfetos metálicos, halocarbonetos, organofosforados, piretroides) em atividades de trabalho. |
J68.3 |
Afecções respiratórias agudas e subagudas devidas a produtos químicos, gases, fumaças e vapores; outras |
• Exposição a bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou solventes halogenados; e/ou iodo; e/ou cianeto de hidrogênio; e/ou amônia; e/ou ácido sulfúrico em atividades de trabalho. |
J68.4 |
Afecções respiratórias crônicas devidas a produtos químicos, gases, fumaças e vapores |
• Exposição a arsênio e seus compostos; e/ou berílio e seus compostos; e/ou bromo; e/ou cádmio ou seus compostos; e/ou cloro gasoso; e/ou flúor ou seus compostos tóxicos; e/ou solventes halogenados; e/ou iodo; e/ou manganês e seus compostos tóxicos; e/ou cianeto de hidrogênio; e/ou ácido sulfídrico (sulfeto de hidrogênio); e/ou carbonetos de metais duros; e/ou amônia; e/ou anidrido sulfuroso; e/ou névoas ácidas; e/ou acrilatos; e/ou selênio e seus compostos em atividades de trabalho. |
J70.0 |
Manifestações pulmonares agudas devidas à radiação |
• Exposição a radiações ionizantes em atividades de trabalho. |
J70.1 |
Manifestações pulmonares crônicas e outras, devidas a radiação |
• Exposição a radiações ionizantes em atividades de trabalho. |
J84 |
Outras doenças pulmonares intersticiais |
• Exposição a cobalto em atividades de trabalho. |
J90 |
Derrame pleural não classificado em outra parte |
• Exposição a asbesto ou amianto em atividades de trabalho. |
J92 |
Placas pleurais |
• Exposição a asbesto ou amianto em atividades de trabalho. |
J98.2 |
Enfisema intersticial |
• Exposição a cádmio ou seus compostos em atividades de trabalho. |
J99.1 |
Transtornos respiratórios em outras doenças sistêmicas do tecido conjuntivo classificadas em outra parte [Síndrome de Caplan] |
• Exposição a poeiras de carvão mineral; e/ou poeiras de sílica livre cristalina em atividades de trabalho. |
R49 |
Distúrbios da Voz |
• Exposição a bromo; e/ou iodo; e/ou agentes químicos cáusticos e/ou tóxicos, em atividades de trabalho. • Trabalho com sobrecarga vocal associada e/ou agravada por: • Fatores psicossociais relacionados à característica e à organização do trabalho: jornada de trabalho prolongada, sobrecarga, acúmulo de atividades ou de funções, ausência de pausas e de locais de descanso durante a jornada, falta de autonomia, ritmo de trabalho acelerado para o cumprimento de metas, trabalho sob forte pressão, insatisfação com o trabalho ou com a remuneração, postura e equipamentos inadequados, dificuldade de acesso à hidratação e aos sanitários, dentre outros não especificados. • Fatores relacionados ao ambiente de trabalho: pressão sonora acima dos níveis de conforto, acústica desfavorável, mobiliário e recursos materiais inadequados ou insuficientes, desconforto e choque térmico, má qualidade do ar, ventilação inadequada do ambiente, baixa umidade, exposição a produtos químicos irritativos de vias aéreas superiores (solventes, vapores metálicos, gases asfixiantes) e presença de poeira ou fumaça no local de trabalho, dentre outros não especificados. |
Capítulo XI - Doenças do aparelho digestivo (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
K03.2 |
Erosão dentária |
• Exposição a névoas de fluoretos ou seus compostos tóxicos; e/ou névoas ácidas; e/ou ácido sulfúrico em atividades de trabalho. |
K03.7 |
Alterações pós-eruptivas da cor dos tecidos duros dos dentes |
• Exposição a névoas de cádmio ou seus compostos; e/ou cobre; e/ou níquel; e/ou prata em atividades de trabalho. |
K05.1 |
Gengivite crônica |
• Exposição a mercúrio e seus compostos tóxicos em atividades de trabalho. |
K07.6 |
Transtornos da articulação temporomandibular |
• Biomecânica do trabalho com movimentos articulares repetitivos |
K12.1 |
Outras formas de estomatite |
• Exposição a arsênio e seus compostos; e/ou bromo; e/ou mercúrio e seus compostos tóxicos em atividades de trabalho. |
K27 |
Úlcera péptica de localização não especificada |
• Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho e/ou risco de morte e trauma no trabalho; • Desemprego |
K40 |
Hérnia inguinal |
• Biomecânica do trabalho com manipulação manual de carga. |
K41 |
Hérnia femoral |
• Biomecânica do trabalho com manipulação manual de carga. |
K42 |
Hérnia umbilical |
• Biomecânica do trabalho com manipulação manual de carga. |
K43 |
Hérnia ventral |
• Biomecânica do trabalho com manipulação manual de carga. |
K44 |
Hérnia diafragmática |
• Biomecânica do trabalho com manipulação manual de carga. |
K45 |
Outras hérnias abdominais |
• Biomecânica do trabalho com manipulação manual de carga. |
K46 |
Hérnia abdominal não especificada |
• Biomecânica do trabalho com manipulação manual de carga. |
K52 |
Outras gastroenterites e colites não-infecciosas |
• Exposição a arsênio e seus compostos; e/ou cádmio ou seus compostos em atividades de trabalho; • Exposição a radiações ionizantes em atividades de trabalho. |
K59.8 |
Outros transtornos funcionais especificados do intestino |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. |
K71 |
Doença hepática tóxica |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.1 |
Doença hepática tóxica com necrose hepática |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.2 |
Doença hepática tóxica com hepatite aguda |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.3 |
Doença hepática tóxica com hepatite crônica persistente |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.6 |
Doença hepática tóxica com hepatite não classificada em outra parte |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K71.8 |
Doença hepática tóxica com outros transtornos do fígado |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou clorobenzeno; e/ou tetracloreto de carbono; e/ou clorofórmio; e/ou solventes halogenados; e/ou hexaclorobenzeno (HCB); e/ou bifenilas policloradas (PCB); e/ou 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD); e/ou fósforo e seus compostos; e/ou derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
K76.6 |
Hipertensão portal |
• Exposição a arsênio e seus compostos; e/ou cloreto de vinila; e/ou tório em atividades de trabalho. |
Capítulo XII - Doenças da pele e do tecido subcutâneo (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
L08.9 |
Infecção localizada da pele e do tecido subcutâneo, não especificada |
• Exposição a cromo e seus compostos tóxicos; e/ou derivados tóxicos de hidrocarbonetos alifáticos e/ou aromáticos; e/ou micro-organismos e parasitas infecciosos vivos e seus produtos tóxicos; e/ou agentes químicos e/ou físicos e/ou biológicos que afetem a pele em atividades de trabalho. |
L23.0 |
Dermatite alérgica de contato devida a metais |
• Exposição a cromo e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou níquel e seus compostos em atividades de trabalho. |
L23.1 |
Dermatite alérgica de contato devida a adesivos |
• Exposição a adesivos em atividades de trabalho. |
L23.2 |
Dermatite alérgica de contato devida a cosméticos (fabricação/manipulação) |
• Exposição a cosméticos em sua manipulação/fabricação em atividades de trabalho. |
L23.3 |
Dermatite alérgica de contato devida a drogas em contato com a pele |
• Exposição a drogas em atividades de trabalho. |
L23.4 |
Dermatite alérgica de contato devida a corantes |
• Exposição a corantes em atividades de trabalho. |
L23.5 |
Dermatite alérgica de contato devida a outros produtos químicos |
• Exposição a cromo e seus compostos tóxicos; e/ou fósforo ou seus produtos tóxicos; e/ou iodo; e/ou alcatrão; e/ou breu e/ou betume e/ou carvão mineral e/ou resíduos dessas substâncias; e/ou borracha; e/ou agrotóxicos; e/ou plásticos em atividades de trabalho. |
L23.6 |
Dermatite alérgica de contato devida a alimentos em contato com a pele |
• Exposição a alimentos em sua fabricação/manipulação em atividades de trabalho. |
L23.7 |
Dermatite alérgica de contato devido a plantas, exceto alimentos |
• Manipulação de plantas em atividades de trabalho. |
L24.0 |
Dermatite de contato por irritantes devida a detergentes |
• Exposição a detergentes em atividades de trabalho. |
L24.1 |
Dermatite de contato por irritantes devida a óleos e gorduras |
• Exposição a óleos e gorduras; e/ou hidrocarbonetos policíclicos aromáticos em atividades de trabalho. |
L24.2 |
Dermatite de contato por irritantes devida a solventes |
• Exposição a benzeno; e/ou derivados halogenados dos hidrocarbonetos aromáticos e/ou alifáticos; e/ou cetonas em atividades de trabalho. |
L24.3 |
Dermatite de contato por irritantes devida a cosméticos |
• Exposição a cosméticos em atividades de trabalho. |
L24.4 |
Dermatite de contato por irritantes devida a Drogas em contato com a pele |
• Exposição a drogas em atividades de trabalho. |
L24.5 |
Dermatite de contato por irritantes devida a outros produtos químicos |
• Exposição a arsênio e seus compostos; e/ou berílio e seus compostos tóxicos; e/ou bromo; e/ou cromo e seus compostos tóxicos; e/ou flúor ou seus compostos tóxicos; e/ou fósforo em atividades de trabalho. |
L24.6 |
Dermatite de contato por irritantes devida a alimentos em contato com a pele |
• Exposição a alimentos em atividades de trabalho. |
L24.7 |
Dermatite de contato por irritantes devido a plantas, exceto alimentos |
• Exposição a plantas em atividades de trabalho. |
L25.9 |
Dermatite de contato não especificada, de causa não especificada |
• Exposição a agrotóxicos (organoclorados, organofosforados e carbamatos) em atividades de trabalho. |
L50.0 |
Urticária alérgica |
• Exposição a agrotóxicos em atividades de trabalho. |
L50.2 |
Urticária devida a frio e a calor |
• Exposição a temperaturas extremas (altas ou baixas) em atividades de trabalho. |
L50.6 |
Urticária de Contato |
• Exposição a agentes químicos e/ou físicos e/ou biológicos que afetem a pele em atividades de trabalho. |
L55 |
Queimadura solar |
• Exposição a radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
L56 |
Outras alterações agudas da pele devidas a radiação ultravioleta |
• Exposição a radiação não ionizante (ultravioleta) em atividades de trabalho. |
L56.2 |
Dermatite por fotocontato (Dermatite de Berloque) |
• Exposição a radiação não ionizante (ultravioleta) em atividades de trabalho. |
L56.3 |
Urticária solar |
• Exposição a radiação não ionizante (ultravioleta e/ou infravermelha) em atividades de trabalho. |
L57.0 |
Ceratose actínica |
• Exposição a radiações não ionizantes (ultravioleta e/ou infravermelha) em atividades de trabalho. |
L57.8 |
Outras alterações da pele devidas a exposição crônica à radiação não-ionizante |
• Exposição a radiações não ionizantes em atividades de trabalho. |
L58 |
Radiodermatite |
• Exposição a radiações ionizantes em atividades de trabalho. |
L58.0 |
Radiodermatite aguda |
• Exposição a radiações ionizantes em atividades de trabalho. |
L58.1 |
Radiodermatite crônica |
• Exposição a radiações ionizantes em atividades de trabalho. |
L58.9 |
Radiodermatite, não especificada |
• Exposição a radiações ionizantes em atividades de trabalho. |
L59.9 |
Afecções da pele e do tecido subcutâneo relacionadas com a radiação, não especificadas |
• Exposição a radiações ionizantes em atividades de trabalho. |
L60 |
Afecções das unhas |
• Exposição solventes em atividades de trabalho; • Exposição a umidade em atividades de trabalho; • Biomecânica do trabalho com traumatismos das unhas. |
L63 |
Alopecia areata |
• Exposição a tálio e seus compostos em atividades de trabalho. |
L70.8 |
Outras formas de acne |
• Exposição a derivados halogenados dos hidrocarbonetos aromáticos (monoclorobenzeno, monobromobenzeno, hexaclorobenzeno); e/ou derivados do fenol, do pentaclorofenol e do hidrobenzonitrilo; e/ou bifenilas policloradas (PCB); e/ou iodo em atividades de trabalho. |
L72.8 |
Outras formas de cistos foliculares da pele e do tecido subcutâneo |
• Exposição a óleos e gorduras de origem mineral ou sintéticos em atividades de trabalho. |
L80 |
Vitiligo |
• Exposição a arsênio e seus compostos; e/ou hidroquinona e ésteres derivados; e/ou monometil éter de hidroquinona (MBEH); e/ou para-aminofenol; e/ou para-butilfenol; e/ou para-cresol; e/ou catecol e pirocatecol; e/ou clorofenol em atividades de trabalho. |
L81.4 |
Outras formas de hiperpigmentação pela melanina |
• Exposição a arsênio e seus compostos; e/ou clorobenzeno e/ou diclorobenzeno; e/ou alcatrão; e/ou betume; e/ou carvão mineral; e/ou creosoto, e/ou breu; e/ou piche e/ou coaltar e/ou resíduos dessas substâncias; e/ou antraceno e dibenzoantraceno; e/ou bismuto; e/ou citostáticos; e/ou compostos nitrogenados (ácido nítrico, dinitrofenol); e/ou naftóis adicionados a corantes; e/ou óleos de corte; e/ou parafenilenodiamina e seus derivados; e/ou poeiras de madeira; e/ou quinino e seus derivados; e/ou sais de ouro; e/ou sais de prata em atividades de trabalho. |
L81.5 |
Leucodermia, não classificada em outra parte |
• Exposição a arsênio e seus compostos; e/ou hidroquinona e ésteres derivados; e/ou monometil éter de hidroquinona (MBEH); e/ou para-aminofenol; e/ou para-butilfenol; e/ou para-cresol; e/ou catecol e pirocatecol; e/ou clorofenol em atividades de trabalho. |
L81.8 |
Outros transtornos especificados da pigmentação |
• Exposição a derivados halogenados dos hidrocarbonetos aromáticos (monocloro-benzeno, monobromo-benzeno, hexaclorobenzeno) em atividades de trabalho. |
L84 |
Calos e calosidades |
• Biomecânica do trabalho com pressão e/ou fricção da pele. |
L85.1 |
Ceratose adquirida [ceratodermia] palmar e plantar |
• Exposição a arsênio e seus compostos em atividades de trabalho. |
L92.3 |
Granuloma de corpo estranho da pele e do tecido subcutâneo |
• Exposição a berílio e seus compostos em atividades de trabalho. |
L98.4 |
Úlcera crônica da pele, não classificada em outra parte |
• Exposição a cromo e seus compostos tóxicos; e/ou enzimas de origem animal, vegetal ou bacteriana em atividades de trabalho. |
T33 |
Geladura superficial |
• Exposição a cloreto de etila em atividades de trabalho. • Exposição a baixas temperaturas no trabalho. |
T34 |
Geladura com necrose de tecidos |
• Exposição a cloreto de etila em atividades de trabalho. • Exposição a baixas temperaturas no trabalho. |
Capítulo XIII - Doenças do sistema osteomuscular e do tecido conjuntivo (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
M05.3 |
Artrite reumatoide com comprometimento de outros órgãos e sistemas [Síndrome de Caplan] |
• Exposição a poeiras de carvão mineral; e/ou poeiras de sílica livre cristalina em atividades de trabalho. |
M10 |
Gota |
• Exposição a molibdênio em atividades de trabalho. |
M10.1 |
Gota induzida pelo chumbo |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. |
M16 |
Coxartrose [artrose do quadril] |
• Biomecânica do trabalho com: aplicação de força; e/ou manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas. • Exposição a vibração em atividades de trabalho. |
M17 |
Gonartrose [artrose do joelho] |
• Biomecânica do trabalho com: aplicação de força; e/ou manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas. • Exposição a vibração em atividades de trabalho. |
M19 |
Outras artroses |
• Exposição a chumbo e seus compostos tóxicos em atividades de trabalho. • Exposição a vibração em atividades de trabalho. |
M23.3 |
Outros transtornos de menisco |
• Biomecânica do trabalho com posições forçadas. |
M47.8 |
Outras espondiloses |
• Biomecânica do trabalho com manipulação manual de carga. |
M50 |
Transtornos dos discos cervicais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.0 |
Transtorno do disco cervical com mielopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.1 |
Transtorno do disco cervical com radiculopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.2 |
Outro deslocamento de disco cervical |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.3 |
Outra degeneração de disco cervical |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.8 |
Outros transtornos de discos cervicais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M50.9 |
Transtorno não especificado de disco cervical |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51 |
Outros transtornos de discos intervertebrais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.0 |
Transtornos de discos lombares e de outros discos intervertebrais com mielopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.1 |
Transtornos de discos lombares e de outros discos intervertebrais com radiculopatia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.2 |
Outros deslocamentos discais intervertebrais especificados |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.3 |
Outra degeneração especificada de disco intervertebral |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M51.8 |
Outros transtornos especificados de discos intervertebrais |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M53.1 |
Síndrome cervicobraquial |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54 |
Dorsalgia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.2 |
Cervicalgia |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.3 |
Ciática |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.4 |
Lumbago com ciática |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M54.5 |
Dor lombar baixa |
• Biomecânica do trabalho com: manipulação manual de carga; e/ou movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. |
M65 |
Sinovites e tenossinovites |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.3 |
Dedo em gatilho |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.4 |
Tenossinovite estilóide radial [de Quervain] |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou |
violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
||
M65.8 |
Outras sinovites e tenossinovites |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M65.9 |
Tenossinovites, não especificadas |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas e/ou aplicação de força. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70 |
Transtornos dos tecidos moles relacionados com o uso, o uso excessivo e a pressão |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho |
M70.0 |
Sinovite crepitante crônica da mão e do punho |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.1 |
Bursite da mão |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.2 |
Bursite do Olécrano |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.3 |
Outras bursites do cotovelo |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.4 |
Bursite pré-patelar |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.5 |
Outras bursites do joelho |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.8 |
Transtornos dos tecidos moles relacionados com o uso, uso excessivo e pressão; outros |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M70.9 |
Transtorno não especificado dos tecidos moles relacionados com o uso, uso excessivo e pressão. |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M72.0 |
Fibromatose de fáscia palmar [Dupuytren] |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75 |
Lesões do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.0 |
Capsulite Adesiva do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.1 |
Síndrome do manguito rotador |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.2 |
Tendinite bicipital |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.3 |
Tendinite Calcificante do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.5 |
Bursite do Ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.8 |
Outras lesões do ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M75.9 |
Lesão não especificada do ombro |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77 |
Outras entesopatias |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77.0 |
Epicondilite medial |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77.1 |
Epicondilite lateral |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M77.8 |
Outras entesopatias não classificadas em outra parte |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho. |
M79.8 |
Outros transtornos especificados dos tecidos moles |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força. • Exposição a vibração em atividades de trabalho. • Fatores psicossociais relacionados a: gestão organizacional; e/ou contexto da organização do trabalho; e/ou característica das relações sociais no trabalho; e/ou conteúdo das tarefas do trabalho; e/ou condição do ambiente de trabalho; e/ou interação pessoa-tarefa; e/ou jornada de trabalho; e/ou violência e assédio moral/sexual no trabalho; e/ou discriminação no trabalho |
M83.5 |
Outras osteomalácias do adulto induzidas por drogas |
• Exposição a cádmio ou seus compostos; e/ou fósforo e seus compostos em atividades de trabalho. |
M84.3 |
Fratura de fadiga ("stress") não classificada em outra parte |
• Biomecânica do trabalho com: movimentos articulares repetitivos; e/ou posições forçadas; e/ou aplicação de força; • Exposição a vibração em atividades de trabalho. |
M85.1 |
Fluorose esquelética |
• Exposição a flúor ou seus compostos tóxicos em atividades de trabalho. |
M87 |
Osteonecrose |
• Exposição a fósforo e seus compostos em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
M87.1 |
Osteonecrose devida a drogas |
• Exposição a fósforo e seus compostos em atividades de trabalho. • Exposição a vibração e/ou radiações ionizantes em atividades de trabalho. |
M87.3 |
Outras osteonecroses secundárias |
• Exposição a fósforo e seus compostos em atividades de trabalho. • Exposição a vibração e/ou radiações ionizantes em atividades de trabalho. |
M89.5 |
Osteolise |
• Exposição a cloreto de vinila em atividades de trabalho. |
M90.3 |
Osteonecrose em "mal dos caixões" |
• Variação de pressão ambiental no trabalho. |
M93.1 |
Doença de Kienböck do Adulto |
• Exposição a vibração em atividade de trabalho. • Sequela de acidente de trabalho com trauma ósseo |
M93.8 |
Outras osteocondropatias, especificadas |
• Exposição a vibração em atividade de trabalho. • Sequela de acidente de trabalho com trauma ósseo |
Capítulo XIV - Doenças do aparelho geniturinário (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
N00 |
Síndrome nefrítica aguda |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
N03 |
Síndrome nefrítica crônica |
• Exposição a mercúrio e seus compostos tóxicos em atividades de trabalho. |
N14.3 |
Nefropatia induzida por metais pesados |
• Exposição a cádmio ou seus compostos; e/ou chumbo e seus compostos tóxicos; e/ou mercúrio e seus compostos tóxicos; e/ou tálio e seus compostos em atividades de trabalho. |
N17 |
Insuficiência renal aguda |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos; e/ou arsênio e seus compostos tóxicos em atividades de trabalho. |
N18 |
Insuficiência renal crônica |
• Exposição a chumbo e seus compostos em atividades de trabalho. |
N30.0 |
Cistite aguda |
• Exposição a aminas aromáticas e seus derivados em atividades de trabalho. |
N46 |
Infertilidade masculina |
• Exposição a chumbo e seus compostos tóxicos; e/ou clordecona; e/ou dibromocloropropano em atividades de trabalho. • Exposição a radiações ionizantes e/ou altas temperaturas em atividades de trabalho. |
N97 |
Infertilidade feminina |
• Exposição a anilina; e/ou benzeno; e/ou mercúrio e seus compostos em atividades de trabalho. • Exposição a radiações ionizantes em atividades de trabalho. |
Capítulo XIX - Intoxicações exógenas (Redação dada pela PRT GM/MS n° 5.674 de 01.11.2024)
| CID10 | Doença Relacionada ao Trabalho | Agentes e/ou Fatores de Risco |
T36 |
Intoxicação por antibióticos sistêmicos |
• Exposição a antibióticos em atividades de trabalho |
T38 |
Intoxicação por hormônios, seus substitutos sintéticos e seus antagonistas não classificados em outra parte |
• Exposição a hormônios sintéticos em atividades de trabalho |
T51.0 |
Efeito tóxico do etanol |
• Exposição a álcool etílico em atividades de trabalho. |
T51.1 |
Efeito tóxico do metanol |
• Exposição a álcool metílico em atividades de trabalho. |
T51.2 |
Efeito tóxico do 2-propanol |
• Exposição a álcool propílico em atividades de trabalho. |
T51.8 |
Efeito tóxico de outros álcoois |
• Exposição a outros álcoois em atividades de trabalho. |
T52 |
Efeitos tóxicos de Solventes Orgânicos |
• Exposição a solventes orgânicos em atividades de trabalho. |
T52.1 |
Efeito tóxico do benzeno |
• Exposição a benzeno em atividades de trabalho. |
T52.2 |
Efeito tóxico de homólogos do benzeno |
• Exposição a tolueno e/ou xileno em atividades de trabalho. |
T52.3 |
Efeito tóxico de glicóis |
• Exposição a glicóis em atividades de trabalho. |
T52.4 |
Efeito tóxico de cetonas |
• Exposição a cetonas em atividades de trabalho. |
T52.8 |
Efeito tóxico de outros solventes orgânicos |
• Exposição a solventes orgânicos em atividades de trabalho. |
T53 |
Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos e/ou aromáticos em atividades de trabalho. |
T53.0 |
Efeito tóxico do tetracloreto de carbono |
• Exposição a tetracloreto de carbono em atividades de trabalho. |
T53.1 |
Efeito tóxico do clorofórmio |
• Exposição a clorofórmio em atividades de trabalho. |
T53.2 |
Efeito tóxico do tricloroetileno |
• Exposição a tricloroetileno em atividades de trabalho. |
T53.3 |
Efeito tóxico do tetracloroetileno |
• Exposição a tetracloroetileno em atividades de trabalho. |
T53.4 |
Efeito tóxico do diclorometano |
• Exposição a diclorometano em atividades de trabalho. |
T53.5 |
Efeitos tóxicos do clorofluorcarbono |
• Exposição a clorofluorcarbono em atividades de trabalho. |
T53.6 |
Efeito tóxico de outros derivados halogênicos de hidrocarbonetos alifáticos |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos em atividades de trabalho. |
T53.7 |
Efeito tóxico de derivados halogênicos de hidrocarbonetos aromáticos |
• Exposição a derivados halogenados dos hidrocarbonetos aromáticos em atividades de trabalho. |
T53.9 |
Efeito tóxico de derivados halogênicos de hidrocarbonetos alifáticos e aromáticos não especificados |
• Exposição a derivados halogenados dos hidrocarbonetos alifáticos e/ou aromáticos não especificados em atividades de trabalho. |
T54 |
Efeito tóxico de corrosivos |
• Exposição a agentes químicos corrosivos em atividades de trabalho. |
T54.0 |
Efeito tóxico do fenol e homólogos do fenol |
• Exposição a fenol e homólogos em atividades de trabalho. |
T54.1 |
Efeito tóxico de outros compostos corrosivos orgânicos |
• Exposição a outros compostos corrosivos orgânicos em atividades de trabalho. |
T54.2 |
Efeito tóxico de ácidos corrosivos e substâncias semelhantes |
• Exposição a ácidos corrosivos e substâncias semelhantes em atividades de trabalho. |
T54.3 |
Efeito tóxico de bases (álcalis) cáusticas(os) e substâncias semelhantes |
• Exposição a bases (álcalis) cáusticas(os) e substâncias semelhantes em atividades de trabalho. |
T54.9 |
Efeito tóxico de substância corrosiva, não especificada |
• Exposição a substância corrosiva, não especificada em atividades de trabalho. |
T56 |
Efeito tóxico de metais |
• Exposição a metais tóxicos em atividades de trabalho. |
T56.0 |
Efeito tóxico do chumbo e seus compostos |
• Exposição a chumbo e seus compostos em atividades de trabalho. |
T56.1 |
Efeito tóxico do mercúrio e seus compostos |
• Exposição a mercúrio e seus compostos em atividades de trabalho. |
T56.2 |
Efeito tóxico do cromo e seus compostos |
• Exposição a cromo e seus compostos em atividades de trabalho. |
T56.3 |
Efeito tóxico do cádmio e seus compostos |
• Exposição a cádmio e seus compostos em atividades de trabalho. |
T56.4 |
Efeito tóxico do cobre e seus compostos |
• Exposição a cobre e seus compostos em atividades de trabalho. |
T56.5 |
Efeito tóxico do zinco e seus compostos |
• Exposição a zinco e seus compostos em atividades de trabalho. |
T56.7 |
Efeito tóxico do berilo e seus compostos |
• Exposição a berílio e seus compostos em atividades de trabalho. |
T56.8 |
Efeitos tóxicos de outros metais |
• Exposição a metais tóxicos em atividades de trabalho. |
T56.9 |
Efeito tóxico do metal, não especificado |
• Exposição a metais tóxicos em atividades de trabalho. |
T57 |
Efeito tóxico de outras substâncias inorgânicas |
• Exposição a substâncias inorgânicas em atividades de trabalho. |
T57.0 |
Efeito tóxico do arsênico e seus compostos |
• Exposição a arsênio e seus compostos em atividades de trabalho. |
T57.1 |
Efeito tóxico do fósforo e seus compostos |
• Exposição a fósforo e seus compostos em atividades de trabalho. |
T57.2 |
Efeito tóxico do manganês e seus compostos |
• Exposição a manganês e seus compostos em atividades de trabalho. |
T57.3 |
Efeito tóxico do cianeto de hidrogênio (ácido cianídrico) |
• Exposição a cianeto de hidrogênio (ácido cianídrico) em atividades de trabalho. |
T57.8 |
Efeito tóxico de outras substâncias inorgânicas especificadas |
• Exposição a cloreto de vinila; e/ou monocloroetileno; e/ou outras substâncias inorgânicas especificadas em atividades de trabalho. |
T58 |
Efeito tóxico do monóxido de carbono |
• Exposição a monóxido de carbono em atividades de trabalho. |
T59 |
Efeito tóxico de outros gases, fumaças e vapores |
• Exposição a outros gases, fumaças e vapores em atividades de trabalho. |
T59.2 |
Efeito tóxico de formaldeído |
• Exposição a formaldeído em atividades de trabalho. |
T59.4 |
Efeito tóxico do cloro gasoso |
• Exposição a cloro gasoso em atividades de trabalho. |
T59.5 |
Efeito tóxico do fluoreto gasoso e ácido fluorídrico |
• Exposição a fluoreto gasoso e/ou ácido fluorídrico em atividades de trabalho. |
T59.6 |
Efeito tóxico do ácido sulfídrico |
• Exposição a ácido sulfídrico (sulfeto de hidrogênio) em atividades de trabalho. |
T59.8 |
Efeito tóxico de outros gases, fumaças e vapores especificados |
• Exposição a gases, fumaças e vapores em atividades de trabalho. |
T60 |
Efeito tóxico de pesticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.0 |
Efeito tóxico de inseticidas organofosforados e carbamatos |
• Exposição a agrotóxicos organofosforados e/ou carbamatos em atividades de trabalho. |
T60.1 |
Efeito tóxico de inseticidas halogenados |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.2 |
Efeito tóxico de outros inseticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.4 |
Efeito tóxico de rodenticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T60.8 |
Efeito tóxico de outros pesticidas |
• Exposição a agrotóxicos em atividades de trabalho. |
T63 |
Efeito tóxico de contato com animais venenosos |
• Mordedura ou picadura de serpente; e/ou outros répteis; e/ou escorpião; e/ou aranha; e/ou outros artrópodes; e/ou peixe; e/ou outros animais marinhos; e/ou outros animais venenosos não especificados em atividades de trabalho. |
T65.2 |
Efeito tóxico do tabaco e da nicotina (Doença da Folha Verde do Tabaco) |
• Exposição a tabaco e nicotina em atividades de trabalho. |
T65.3 |
Efeito tóxico de nitroderivados e aminoderivados do benzeno e seus homólogos |
• Exposição a nitroderivados e aminoderivados do benzeno e seus homólogos em atividades de trabalho. |
T65.4 |
Efeito tóxico do dissulfeto de carbono |
• Exposição a dissulfeto de carbono em atividades de trabalho. |
T65.8 |
Efeito tóxico de outras substâncias especificadas |
• Exposição a outras substâncias especificadas em atividades de trabalho. |
T66 |
Efeitos não especificados de radiação |
• Exposição a radiações ionizantes em atividades de trabalho. |
T67 |
Efeitos do calor e da luz |
• Exposição a altas temperaturas no trabalho. |
ANEXO LXXXI
PRINCÍPIOS GERAIS E CONDIÇÕES PARA O ADEQUADO ACOMPANHAMENTO PRÉ-NATAL (Origem: PRT MS/GM 569/2000, Anexo 1)
PRINCÍPIOS GERAIS E CONDIÇÕES PARA O ADEQUADO ACOMPANHAMENTO PRÉ-NATAL
Para a realização de um adequado acompanhamento pré-natal e assistência à gestante e à puérpera, o município deverá, por meio das unidades integrantes de seu sistema de saúde, desenvolver esta modalidade assistencial em conformidade com os princípios gerais e condições estabelecidas no presente documento, realizando as seguintes atividades:
I - Atividades
1-Realizar a primeira consulta de pré-natal até o 4° mês de gestação;
2-Garantir os seguintes procedimentos:
2.1-Realização de, no mínimo, 06 (seis) consultas de acompanhamento pré-natal, sendo, preferencialmente, uma no primeiro trimestre, duas no segundo e três no terceiro trimestre da gestação;
2.2-Realização de 01 (uma) consulta no puerpério, até 42 dias após o nascimento;
2.3-Realização dos seguintes exames laboratoriais:
a - ABO-Rh, na primeira consulta;
b - VDRL, um exame na primeira consulta e um na 30ª semana da gestação;
c - Urina rotina, um exame na primeira consulta e um na 30ª semana da gestação;
d - Glicemia de jejum, um exame na primeira consulta e um na 30ª semana da gestação;
e - HB/Ht, na primeira consulta.
2.4- Oferta de Testagem anti-HIV, com um exame na primeira consulta, naqueles municípios com população acima de 50 mil habitantes;
2.5-Aplicação de vacina antitetânica dose imunizante, segunda, do esquema recomendado ou dose de reforço em mulheres já imunizadas;
2.6-Realização de atividades educativas;
2.7-Classificação de risco gestacional a ser realizada na primeira consulta e nas subsequentes;
2.8-Garantir às gestantes classificadas como de risco, atendimento ou acesso à unidade de referência para atendimento ambulatorial e/ou hospitalar à gestação de alto risco.
II - Avaliação da Assistência Pré-natal .
Para avaliar a efetividade da assistência pré-natal oferecida, a partir dos dados disponíveis nos sistemas nacionais de informações em saúde o município e o estado devem utilizar, no mínimo, os seguintes indicadores:
1-Indicadores de Processo
1.1-Percentual de gestantes que se inscreveram no programa e realizaram a 1ª consulta até o quarto mês, em relação à população-alvo (número de gestantes existentes ou estimado pelo número de nascidos vivos do município);
1.2-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal;
1.3-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal e a consulta de puerpério;
1.4-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal e todos os exames básicos;
1.5-Percentual de gestantes inscritas que realizaram 06 (seis) consultas de pré-natal, a consulta de puerpério e todos os exames básicos;
1.6-Percentual de gestantes inscritas que receberam a dose imunizante da vacina antitetânica.
1.7-Percentual de gestantes inscritas que realizaram seis (06) consultas de pré-natal, a consulta de puerpério, todos os exames básicos; o teste anti-HIV, a dose imunizante da vacina antitetânica.
2. Indicadores de Resultado
2.1-Percentual de Recém-nascidos com diagnóstico de sífilis congênita em relação ao total dé recém-nascidos vivos do município.
2.2- Percentual de Recém-nascido com tétano neonatal, em relação ao total de recém-nascidos vivos do município
3-Indicadores de Impacto
3.1-Coeficiente de incidência de sífilis congênita no município comparando com o do ano anterior;
3.2-Coeficiente de incidência de tétano neonatal no município comparando com o do ano anterior;
3.3-Razão de mortalidade materna no município comparando com o do ano anterior;
3.4-Coeficiente de mortalidade neonatal precoce no município comparando com o do ano anterior:
3.5- Coeficiente de mortalidade neonatal tardia, no município comparando com o do ano anterior;
3.6- Coeficiente de mortalidade neonatal total no município comparando com o do ano anterior.
ANEXO LXXXII
PRINCÍPIOS GERAIS E CONDIÇÕES PARA A ADEQUADA ASSISTÊNCIA AO PARTO (Origem: PRT MS/GM 569/2000, Anexo 2)
PRINCÍPIOS GERAIS E CONDIÇÕES PARA A ADEQUADA ASSISTÊNCIA AO PARTO
A humanização da Assistência Obstétrica e Neonatal é condição para o adequado acompanhamento do parto e puerpério. Receber com dignidade a mulher e o recém-nascido é uma obrigação das unidades. A adoção de práticas humanizadas e seguras implica a organização das rotinas, dos procedimentos e da estrutura física, bem como a incorporação de condutas acolhedoras e não-intervencionistas.
Para a adequada assistência à mulher e ao recém-nascido no momento do parto, todas as Unidades Integrantes do SUS têm como responsabilidades:
1.atender a todas as gestantes que as procurem;
2. garantir a internação de todas as gestantes atendidas e que dela necessitem;
3. estar vinculada à Central de Regulação Obstétrica e Neonatal de modo a garantir a internação da parturiente nos casos de demanda excedente;
4. transferir a gestante e ou o neonato em transporte adequado, mediante vaga assegurada em outra unidade, quando necessário;
5. estar vinculada a uma ou mais unidades que prestam assistência pré-natal, conforme determinação do gestor local;
6. garantir a presença de pediatra na sala de parto;
7. realizar o exame de VDRL na mãe;
8. admitir a visita do pai sem restrição de horário;
9. garantir a realização das seguintes atividades:
-Realização de partos normais e cirúrgicos, e atendimento a intercorrências obstétricas:
-recepcionar e examinar as parturientes;
-assistir as parturientes em trabalho de parto;
-assegurar a execução dos procedimentos pré-anestésicos e anestésicos;
-proceder à lavagem e antissepsia cirúrgica das mãos;
-assistir a partos normais;
-realizar partos cirúrgicos;
-assegurar condições para que as parturientes tenham direito a acompanhante durante a internação, desde que a estrutura física assim permita;
-assistir ao abortamento incompleto, utilizando, preferencialmente, aspiração manual intra-uterina (AMIU);
-prestar assistência médica e de enfermagem ao recém-nascido;
-elaborar relatórios médico e enfermagem e fazer registro de parto;
-registrar a evolução do trabalho de parto em partograma;
-proporcionar cuidados no pós-anestésico e no pós-parto;
-garantir o apoio diagnóstico necessário
10. dispor dos recursos humanos, físicos, materiais e técnicos necessários à adequada assistência ao parto.
ANEXO LXXXIII
FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES DO SISPRENATAL E IDENTIFICAÇÃO DA GESTANTE (Origem: PRT MS/GM 570/2000, Anexo 1)

ANEXO LXXXIV
FICHA DE REGISTRO DIÁRIO DOS ATENDIMENTOS DAS GESTANTES DO SISPRENATAL(Origem: PRT MS/GM570/2000,Anexo 2)

ANEXO LXXXV
QUANTITATIVO DE CENTROS DE REFERÊNCIA EM TRATAMENTO DA DOR CRÔNICA - POR ESTADO (Origem: PRT MS/GM 1319/2002, Anexo 1)
| Estado | Quantitativo de Centros |
| ACRE | 01 |
| ALAGOAS | 03 |
| AMAPÁ | 01 |
| AMAZONAS | 03 |
| BAHIA | 13 |
| CEARÁ | 08 |
| DISTRITO FEDERAL | 02 |
| ESPÍRITO SANTO | 03 |
| GOIÁS | 05 |
| MARANHÃO | 06 |
| MATO GROSSO | 02 |
| MATO GROSSO DO SUL | 03 |
| MINAS GERAIS | 18 |
| PARÁ | 06 |
| PARAÍBA | 03 |
| PARANÁ | 10 |
| PERNAMBUCO | 08 |
| PIAUÍ | 03 |
| RIO DE JANEIRO | 15 |
| RIO GRANDE DO NORTE | 03 |
| RIO GRANDE DO SUL | 10 |
| RONDÔNIA | 01 |
| RORAIMA | 01 |
| SANTA CATARINA | 05 |
| SÃO PAULO | 38 |
| SERGIPE | 02 |
| TOCANTINS | 01 |
| BRASIL | 174 |
|---|
Observação: A estes quantitativos deverão ser agregados os 167 CACON atualmente cadastrados em todo o País.
ANEXO LXXXVI
DAS REGRAS E CRITÉRIOS PARA O CREDENCIAMENTO DE INSTITUIÇÕES E PARA APRESENTAÇÃO, RECEBIMENTO, ANÁLISE, APROVAÇÃO, EXECUÇÃO, ACOMPANHAMENTO, PRESTAÇÃO DE CONTAS E AVALIAÇÃO DE RESULTADOS DE PROJETOS NO ÂMBITO DO PROGRAMA NACIONAL DE APOIO À ATENÇÃO ONCOLÓGICA (PRONON) E DO PROGRAMA NACIONAL DE APOIO À ATENÇÃO DA SAÚDE DA PESSOA COM DEFICIÊNCIA (PRONAS/PCD) (Origem: PRT MS/GM 1550/2014)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I)
Art. 1º Ficam definidas as regras e os critérios para o credenciamento de instituições e para apresentação, recebimento, análise, aprovação, execução, acompanhamento, prestação de contas e avaliação de resultados de projetos no âmbito do Programa Nacional de Apoio à Atenção Oncológica (Pronon) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (Pronas/PCD). (Origem: PRT MS/GM 1550/2014, Art. 1º)
Art. 2º Para efeito deste Anexo, considera-se: (Origem: PRT MS/GM 1550/2014, Art. 2º)
I - acessibilidade e desenho universal: a acessibilidade é a possibilidade e condição de alcance, percepção e entendimento para a utilização com segurança e autonomia de edificações, espaço, mobiliário, equipamento urbano e elementos, observados os critérios técnicos da ABNT NBR 9050:2015, sendo que os princípios do desenho universal ampliam a compreensão das diferenças de habilidades e de interações com objetos e espaços, visando: (Origem: PRT MS/GM 1550/2014, Art. 2º, I)
a) eliminar barreiras arquitetônicas e comunicacionais; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, a)
b) promover o acesso, respeitando as capacidades individuais; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, b)
c) atender aos diferentes níveis de compreensão dos indivíduos; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, c)
d) promover legibilidade espacial e informativa; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, d)
e) prevenir riscos, ofertando ao usuário segurança física e psicológica para ocupar e atuar no espaço; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, e)
f) promover o menor desgaste físico, mental e emocional possível; e (Origem: PRT MS/GM 1550/2014, Art. 2º, I, f)
g) garantir adequada ergonomia, considerando a flexibilidade dos espaços, capacidades e funcionalidades dos usuários, instituindo espaços livres de barreiras físicas, comunicacionais e atitudinais e promovendo o acesso e a mobilidade para todo tipo de usuário, principalmente para pessoas com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 2º, I, g)
II - capacidade técnico-operativa da instituição: aptidão do proponente de executar, de forma específica e eficiente, o projeto proposto, devendo ser comprovada por meio de informações anexas ao projeto, que esclareçam as características, propriedades e habilidades do proponente, dos membros ou de terceiros associados envolvidos diretamente na execução do projeto apresentado; (Origem: PRT MS/GM 1550/2014, Art. 2º, II)
III - captação de recursos: meio pelo qual a própria instituição buscará recursos com os doadores para financiamento de projetos; (Origem: PRT MS/GM 1550/2014, Art. 2º, III)
IV - conta captação: conta bloqueada para movimentação pela instituição, na qual os doadores e patrocinadores depositam os recursos para os projetos; (Origem: PRT MS/GM 1550/2014, Art. 2º, IV)
V - conta movimento: conta de livre movimentação pela instituição; (Origem: PRT MS/GM 1550/2014, Art. 2º, V)
VI - doador: pessoa física ou jurídica que financiará projetos e que obterá benefício de renúncia fiscal; (Origem: PRT MS/GM 1550/2014, Art. 2º, VI)
VII - educação permanente em saúde: proposta político-pedagógica que coloca o cotidiano do trabalho ou da formação em constante análise, construindo espaços coletivos para a reflexão e avaliação dos atos produzidos no cotidiano, de forma que o objeto de transformação é o sujeito no processo de trabalho, orientado para melhoria da qualidade da atenção à saúde, voltada a transformar e qualificar o trabalhador da saúde, e que engloba o aperfeiçoamento, a capacitação e o treinamento; (Origem: PRT MS/GM 1550/2014, Art. 2º, VII)
VIII - fase de apresentação de projeto: etapa em que a instituição credenciada apresenta projeto de modo detalhado para análise pelo Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 2º, VIII)
IX - fase de credenciamento: etapa inicial em que as instituições proponentes enviam ao Ministério da Saúde requerimento e documentos solicitando participação no Pronon ou no Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 2º, IX)
X - formação profissional: conjunto de atividades que visa à aquisição de conhecimentos, capacidades, atitudes e formas de comportamento exigidos para o exercício das funções próprias de uma profissão ou grupo de profissões em qualquer ramo de atividade econômica; (Origem: PRT MS/GM 1550/2014, Art. 2º, X)
XI - instituição: pessoa jurídica de direito privado, associativa ou fundacional, sem fins lucrativos, interessada em desenvolver ações e serviços no âmbito do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 2º, XI)
XII - manutenção ou conservação: conjunto de atividades que visa assegurar capacidade plena e condições de funcionamento contínuo, seguro e confiável dos sistemas e instalações da edificação, preservando-lhes as características, desempenho técnico e bom estado de conservação; (Origem: PRT MS/GM 1550/2014, Art. 2º, XII)
XIII - pesquisa clínica: sinônimo de ensaio clínico, ou seja, envolve pessoas que se oferecem para participar de investigações conduzidas cuidadosamente com o objetivo de descobrir melhores formas de tratar, prevenir, diagnosticar e compreender doenças humanas, e que inclui ensaios que testam novos tratamentos e terapias, bem como estudos de história natural de longo prazo, que fornecem informações valiosas sobre a progressão da doença; (Origem: PRT MS/GM 1550/2014, Art. 2º, XIII)
XIV - pesquisa epidemiológica: estudos epidemiológicos observacionais, como coorte, caso-controle e estudos transversais; (Origem: PRT MS/GM 1550/2014, Art. 2º, XIV)
XV - pesquisa experimental: pesquisa básica, pesquisas pré-clínicas, inclusive projetos que englobem pesquisa e desenvolvimento de produtos inovadores; (Origem: PRT MS/GM 1550/2014, Art. 2º, XV)
XVI - pesquisa socioantropológica: pesquisa que tem por objetivo principal conhecer o modo de vida de uma determinada comunidade, a fim de determinar quais problemas ou dificuldades enfrentam e o impacto desses problemas para a saúde e qualidade de vida; (Origem: PRT MS/GM 1550/2014, Art. 2º, XVI)
XVII - portaria de aprovação de projeto e autorização para captação de recursos: ato do Ministério da Saúde que torna pública a aprovação de projetos e autoriza o início da captação de recursos para o projeto; (Origem: PRT MS/GM 1550/2014, Art. 2º, XVII)
XVIII - portaria de credenciamento: ato do Ministério da Saúde que torna público o credenciamento das instituições, para que participem do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 2º, XVIII)
XIX - prestação de serviços médico-assistenciais: qualquer ação ou serviço que tenha como objetivo/objeto a prestação direta de assistência na área da saúde ou de apoio à saúde para a pessoa com câncer e/ou com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 2º, XIX)
XX - reforma: obras de conservação ou manutenção que não acarretem supressão ou acréscimo de área construída, tais como demolição e construção de paredes internas, pinturas, reparos em revestimentos, substituição de materiais de revestimento de piso, parede ou forro, substituição do tipo de telha ou manutenção da cobertura do bem, manutenção de instalações elétricas, instalações hidrossanitárias, rede de dados, substituição de esquadrias e obras de adequação para acessibilidade de acordo com critérios e parâmetros técnicos observados na ABNT NBR 9050:2015; (Origem: PRT MS/GM 1550/2014, Art. 2º, XX)
XXI - reparos: conjunto de operações para corrigir danos incipientes e de pequena repercussão, em bens móveis, imóveis ou equipamentos; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXI)
XXII - serviços de apoio à saúde: programas e ações de caráter intersetorial que atuam na fronteira do campo clínico e social, com o objetivo de ampliar, estimular e manter as capacidades funcionais, a integralidade do cuidado em reabilitação/habilitação, a autonomia, inclusão, inserção e participação social da pessoa com deficiência, por meio de práticas esportivas, terapias assistidas por animais, produção cultural e artística e de capacitação/habilitação para o trabalho; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXII)
XXIII - Sistema Nacional de Pesquisa de Custos e Índices da Construção Civil (SINAPI): cálculo realizado mensalmente pelo Instituto Brasileiro de Geografia e Estatística (IBGE), por meio de convênio com a Caixa Econômica Federal, que tem como objetivo a produção de informações de custos e índices de forma sistematizada e com abrangência nacional, visando à elaboração e avaliação de orçamentos, como também acompanhamento de custos; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIII)
XXIV - tecnologia assistiva: área do conhecimento, de característica interdisciplinar, que engloba produtos, recursos, metodologias, estratégias, práticas e serviços que objetivam promover a funcionalidade, relacionada à atividade e participação de pessoas com deficiência, incapacidades ou mobilidade reduzida, visando sua autonomia, independência, qualidade de vida e inclusão social, e que se dividem nas seguintes categorias: (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV)
a) auxílios para a vida diária e vida prática; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, a)
b) comunicação aumentativa e alternativa; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, b)
c) recursos de acessibilidade ao computador; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, c)
d) sistemas de controle de ambiente; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, d)
e) projetos arquitetônicos para acessibilidade; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, e)
f) órteses e próteses; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, f)
g) adequação postural; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, g)
h) auxílios de mobilidade; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, h)
i) auxílios para qualificação de habilidade visual e recursos que ampliam a informação a pessoas com baixa visão ou cegas; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, i)
j) auxílios para ampliação da habilidade auditiva e para autonomia na comunicação de pessoas com déficit auditivo e surdez; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, j)
k) adaptações em veículos; e (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, k)
l) esporte e lazer; (Origem: PRT MS/GM 1550/2014, Art. 2º, XXIV, l)
XXV - terapia assistida por animais (TAA): terapia focada nos benefícios da relação homem-animal, que tem como objetivos ampliar, estimular e manter as capacidades funcionais, a integralidade do cuidado em reabilitação/habilitação, a autonomia, a inclusão, a inserção e a participação social da pessoa com deficiência, por meio da inserção do animal em atividades terapêuticas; e (Origem: PRT MS/GM 1550/2014, Art. 2º, XXV)
XXVI - termo de compromisso: instrumento jurídico a ser celebrado entre o Ministério da Saúde e a instituição, o qual estabelecerá direitos e obrigações para a execução dos respectivos projetos no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 2º, XXVI)
Seção I
Do Programa Nacional de Apoio à Atenção Oncológica (Pronon)
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I, Seção I)
Art. 3º O Pronon tem a finalidade de captar e canalizar recursos para a prevenção e o combate ao câncer. (Origem: PRT MS/GM 1550/2014, Art. 3º)
Parágrafo Único. A prevenção e o combate ao câncer englobam a promoção da informação, a pesquisa, o rastreamento, o diagnóstico, o tratamento, os cuidados paliativos e a reabilitação referentes às neoplasias malignas e afecções correlatas. (Origem: PRT MS/GM 1550/2014, Art. 3º, Parágrafo Único)
Art. 4º O Pronon será implementado mediante incentivo fiscal a ações e serviços de atenção oncológica, desenvolvidos por instituições de prevenção e combate ao câncer. (Origem: PRT MS/GM 1550/2014, Art. 4º)
Parágrafo Único. Para efeito deste Anexo, consideram-se instituições de prevenção e combate ao câncer as pessoas jurídicas de direito privado, associativas ou fundacionais, sem fins lucrativos: (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único)
I - certificadas como Entidades Beneficentes de Assistência Social, na forma da Lei nº 12.101, de 27 de novembro de 2009; (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único, I)
II - qualificadas como Organizações Sociais (OS), na forma da Lei nº 9.637, de 15 de maio de 1998; ou (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único, II)
III - qualificadas como Organizações da Sociedade Civil de Interesse Público (OSCIP), na forma da Lei nº 9.790, de 23 de março de 1999. (Origem: PRT MS/GM 1550/2014, Art. 4º, Parágrafo Único, III)
Art. 5º As ações e os serviços de atenção oncológica a serem apoiados com recursos captados por meio do Pronon compreendem os seguintes campos de atuação: (Origem: PRT MS/GM 1550/2014, Art. 5º)
I - a prestação de serviços médico-assistenciais; (Origem: PRT MS/GM 1550/2014, Art. 5º, I)
II - a formação, o treinamento e o aperfeiçoamento de recursos humanos em todos os níveis; e (Origem: PRT MS/GM 1550/2014, Art. 5º, II)
III - a realização de pesquisas clínicas, epidemiológicas e experimentais. (Origem: PRT MS/GM 1550/2014, Art. 5º, III)
Art. 6º Para fins do disposto no art. 5º, são áreas prioritárias para execução das ações e serviços de atenção oncológica: (Origem: PRT MS/GM 1550/2014, Art. 6º)
I - prestação de serviços médico-assistenciais voltados à atenção/cuidado da pessoa com câncer, principalmente as ações voltadas ao diagnóstico e estadiamento da doença, ao tratamento cirúrgico, quimioterápico e radioterápico, e aos cuidados paliativos; (Origem: PRT MS/GM 1550/2014, Art. 6º, I)
II - prestação de serviços desenvolvidos em casas de apoio quando estes estabelecimentos tiverem como público-alvo as pessoas com câncer; (Origem: PRT MS/GM 1550/2014, Art. 6º, II)
III - apoio à prestação de serviços de saúde por meio da adequação da ambiência dos estabelecimentos; (Origem: PRT MS/GM 1550/2014, Art. 6º, III)
IV - desenvolvimento de projetos de educação permanente e formação de recursos humanos direcionados a profissionais que atuem na área de saúde em todos os níveis de atenção, especialmente: (Origem: PRT MS/GM 1550/2014, Art. 6º, IV)
a) formação técnica na área de radioterapia; (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, a)
b) formação de nível superior na área de radioterapia (físico-médico e radioterapeuta); (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, b)
c) educação permanente na área de cuidados paliativos; e (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, c)
d) educação permanente na área de oncologia pediátrica; (Origem: PRT MS/GM 1550/2014, Art. 6º, IV, d)
V - realização de pesquisas para o desenvolvimento de novos métodos custo-efetivos para diagnóstico e terapêutica em câncer; (Origem: PRT MS/GM 1550/2014, Art. 6º, V)
VI - realização de pesquisas epidemiológicas, descritivas e analíticas, dos vários tipos de câncer existentes; (Origem: PRT MS/GM 1550/2014, Art. 6º, VI)
VII - realização de pesquisa e desenvolvimento de inovações, tecnologias e/ou produtos para prevenção, diagnóstico e/ou tratamento de câncer; (Origem: PRT MS/GM 1550/2014, Art. 6º, VII)
VIII - realização de pesquisas básicas e pré-clínicas que levem ao desenvolvimento de novos métodos diagnósticos ou terapêuticos em oncologia; (Origem: PRT MS/GM 1550/2014, Art. 6º, VIII)
IX - desenvolvimento de bancos de tumores; e (Origem: PRT MS/GM 1550/2014, Art. 6º, IX)
X - realização de pesquisas para avaliação de políticas, serviços, programas e ações de saúde em oncologia. (Origem: PRT MS/GM 1550/2014, Art. 6º, X)
Seção II
Do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (Pronas/PCD)
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I, Seção II)
Art. 7º O Pronas/PCD tem a finalidade de captar e canalizar recursos destinados a estimular e desenvolver ações de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência. (Origem: PRT MS/GM 1550/2014, Art. 7º)
Parágrafo Único. As ações de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência de que trata o "caput" se destinam à pesquisa, à promoção da informação e da saúde, identificação e diagnóstico precoce, tratamento, reabilitação/habilitação, uso terapêutico de tecnologias assistivas e projetos intersetoriais de apoio à saúde voltados às pessoas com deficiência física, auditiva, visual, intelectual, múltipla, pessoas com ostomia e com transtorno do espectro do autismo. (Origem: PRT MS/GM 1550/2014, Art. 7º, Parágrafo Único)
Art. 8º O Pronas/PCD será implementado mediante incentivo fiscal a ações e serviços de atenção à saúde da pessoa com deficiência, desenvolvidos por pessoas jurídicas de direito privado sem fins lucrativos, que se destinam ao tratamento de deficiências físicas, auditivas, visuais, intelectuais, múltiplas, pessoas com ostomia e com transtorno do espectro do autismo. (Origem: PRT MS/GM 1550/2014, Art. 8º)
Parágrafo Único. Consideram-se instituições de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência as pessoas jurídicas de direito privado, associativas ou fundacionais, sem fins lucrativos: (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único)
I - certificadas como Entidades Beneficentes de Assistência Social, na forma da Lei nº 12.101, de 2009; (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, I)
II - qualificadas como OS, na forma da Lei nº 9.637, de 1998; (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, II)
III - qualificadas como OSCIP, na forma da Lei nº 9.790, de 1999; ou (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, III)
IV - que prestem atendimento direto e gratuito às pessoas com deficiência e que sejam cadastradas no Sistema Nacional de Cadastro Nacional de Estabelecimentos de Saúde (SCNES) do Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 8º, Parágrafo Único, IV)
Art. 9º As ações e os serviços de atenção à saúde da pessoa com deficiência apoiados com as doações captadas por meio do Pronas/PCD compreendem os seguintes campos de atuação: (Origem: PRT MS/GM 1550/2014, Art. 9º)
I - serviços médico-assistenciais; (Origem: PRT MS/GM 1550/2014, Art. 9º, I)
II - formação, treinamento e aperfeiçoamento de recursos humanos em todos os níveis; e (Origem: PRT MS/GM 1550/2014, Art. 9º, II)
III - realização de pesquisas clínicas, epidemiológicas, experimentais e socioantropológicas. (Origem: PRT MS/GM 1550/2014, Art. 9º, III)
Art. 10. Para fins do disposto no art. 9º, consideram-se áreas prioritárias para execução das ações e serviços de promoção à saúde e de reabilitação/habilitação da pessoa com deficiência: (Origem: PRT MS/GM 1550/2014, Art. 10)
I - prestação de serviços médico-assistenciais e de apoio à saúde da pessoa com deficiência, especialmente voltados a: (Origem: PRT MS/GM 1550/2014, Art. 10, I)
a) qualificação de serviços de saúde, por meio da adequação da ambiência de estabelecimentos, levando em consideração os princípios do desenho universal e os critérios técnicos da ABNT NBR 9050:2015, estabelecendo, assim, espaços de uso democrático onde todas as pessoas, inclusive aquelas com deficiência física, sensorial e/ou intelectual, tenham condições iguais de uso, compreensão e expressão; (Origem: PRT MS/GM 1550/2014, Art. 10, I, a)
b) reabilitação/habilitação da pessoa com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, I, b)
c) diagnóstico diferencial da pessoa com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, I, c)
d) identificação e estimulação precoce das deficiências; (Origem: PRT MS/GM 1550/2014, Art. 10, I, d)
e) adaptação, inserção e reinserção da pessoa com deficiência no trabalho; (Origem: PRT MS/GM 1550/2014, Art. 10, I, e)
f) ampliação, estimulação e manutenção das capacidades funcionais por meio de práticas esportivas; (Origem: PRT MS/GM 1550/2014, Art. 10, I, f)
g) ampliação, estimulação e manutenção das capacidades funcionais por meio de terapia assistida por animais (TAA); e (Origem: PRT MS/GM 1550/2014, Art. 10, I, g)
h) ampliação, estimulação e manutenção das capacidades funcionais por meio de produção artística e cultural; (Origem: PRT MS/GM 1550/2014, Art. 10, I, h)
II - desenvolvimento de projetos de educação permanente, formação e capacitação de recursos humanos da área de saúde, especialmente voltadas: (Origem: PRT MS/GM 1550/2014, Art. 10, II)
a) à formação técnica e capacitação em ortopedia técnica; (Origem: PRT MS/GM 1550/2014, Art. 10, II, a)
b) ao uso de tecnologia assistiva no campo da reabilitação/habilitação; (Origem: PRT MS/GM 1550/2014, Art. 10, II, b)
c) ao acolhimento, manejo e desenvolvimento de ações de cuidado à saúde da pessoa com deficiência, no âmbito da atenção básica, especializada, hospitalar e de urgência e emergência; (Origem: PRT MS/GM 1550/2014, Art. 10, II, c)
d) ao diagnóstico diferencial no campo da deficiência, especialmente em doenças raras, deficiência intelectual e transtornos do espectro do autismo; (Origem: PRT MS/GM 1550/2014, Art. 10, II, d)
e) ao uso da Classificação Internacional de Funcionalidade (CIF); e (Origem: PRT MS/GM 1550/2014, Art. 10, II, e)
f) ao uso de tecnologia de órtese robotizada de marcha (aparelho para tração ortopédica) e sua aplicação terapêutica em pacientes com lesão neurológica; (Origem: PRT MS/GM 1550/2014, Art. 10, II, f)
III - desenvolvimento de projetos de pesquisas clínicas, epidemiológicas, experimentais e socioantropológicas, especialmente voltadas: (Origem: PRT MS/GM 1550/2014, Art. 10, III)
a) aos novos métodos diagnósticos e de tratamento em reabilitação/habilitação às pessoas com deficiência e que sejam custo-efetivos; (Origem: PRT MS/GM 1550/2014, Art. 10, III, a)
b) ao uso da CIF e sua aplicabilidade no campo da saúde para as pessoas com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, III, b)
c) ao uso de tecnologias assistivas na reabilitação/habilitação das pessoas com deficiência, em especial que envolvam protocolos e diretrizes clínicas de órteses, próteses e meios auxiliares de locomoção; (Origem: PRT MS/GM 1550/2014, Art. 10, III, c)
d) aos métodos diagnósticos e terapêuticos da pessoa com deficiência, especialmente em doenças raras, deficiência intelectual e transtornos do espectro do autismo; (Origem: PRT MS/GM 1550/2014, Art. 10, III, d)
e) à avaliação de políticas, serviços, programas e ações de saúde especializados em reabilitação/habilitação; (Origem: PRT MS/GM 1550/2014, Art. 10, III, e)
f) às pesquisas básicas e pré-clínicas com potencial de translação para a saúde das pessoas com deficiências; (Origem: PRT MS/GM 1550/2014, Art. 10, III, f)
g) às pesquisas em neurociências com impacto na saúde das pessoas com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 10, III, g)
h) às pesquisas socioantropológicas sobre as deficiências; (Origem: PRT MS/GM 1550/2014, Art. 10, III, h)
i) às pesquisas epidemiológicas sobre os diversos tipos de deficiência; e (Origem: PRT MS/GM 1550/2014, Art. 10, III, i)
j) às pesquisas e desenvolvimento de inovações, tecnologias, dispositivos e/ou produtos de tecnologia assistiva, especialmente de órteses, próteses e meios auxiliares de locomoção (OPM). (Origem: PRT MS/GM 1550/2014, Art. 10, III, j)
Art. 11. O Ministério da Saúde poderá atualizar anualmente a relação de áreas prioritárias de que tratam os arts. 6º e 10 do Anexo LXXXVI para execução de ações e serviços de atenção oncológica e reabilitação no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 11)
Seção III
Do Comitê Gestor do Pronon e do Pronas/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO I, Seção III)
Art. 12. Fica instituído, no âmbito do Ministério da Saúde, o Comitê Gestor do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 12) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
Art. 13. O Comitê Gestor do Pronon e do Pronas/PCD será composto por representantes, titulares e suplentes, dos seguintes órgãos e entidades: (Origem: PRT MS/GM 1550/2014, Art. 13) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
I - 1 (um) representante da Secretaria-Executiva(SE/MS), que o coordenará; (Origem: PRT MS/GM 1550/2014, Art. 13, I) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
II - 2 (dois) representantes da Secretaria de Atenção à Saúde (SAS/MS), representando a atenção oncológica e a atenção à pessoa com deficiência; (Origem: PRT MS/GM 1550/2014, Art. 13, II) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
III - 1 (um) representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, III) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
IV - 1 (um) representante da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, IV) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
V - 1 (um) representante da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, V) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
VI - 1 (um) representante do Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA/SAS/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, VI) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
VII - 1 (um) representante do Instituto Nacional de Traumatologia e Ortopedia (INTO/SAS/MS); (Origem: PRT MS/GM 1550/2014, Art. 13, VII) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
VIII - 1 (um) representante do Conselho Nacional de Saúde (CNS), oriundo da representação das entidades e dos movimentos sociais nacionais de usuários do SUS; (Origem: PRT MS/GM 1550/2014, Art. 13, VIII) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
X - 1 (um) representante do Conselho Nacional de Secretários de Saúde (CONASS); e (Origem: PRT MS/GM 1550/2014, Art. 13, IX) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
X - 1 (um) representante do Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS). (Origem: PRT MS/GM 1550/2014, Art. 13, X) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
§ 1º Os representantes, titulares e suplentes, serão indicados pelos dirigentes máximos dos respectivos órgãos e entidades à SE/MS, no prazo de 30 (trinta) dias, contado da data de publicação da Portaria nº 1550/GM/MS, de 29 de julho de 2014. (Origem: PRT MS/GM 1550/2014, Art. 13, § 1º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
§ 2º O Comitê Gestor do Pronon e do Pronas/PCD reunir-se-á em plenária ordinariamente uma vez por trimestre, extraordinariamente, mediante convocação da SE/MS e quando ocorrer a deliberação de que trata o art. 53, § 3º . (Origem: PRT MS/GM 1550/2014, Art. 13, § 2º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
§ 3º O membro do Comitê Gestor do Pronon e do Pronas/PCD declarará formalmente, em ata, eventual conflito de interesses entre suas atividades profissionais e o tema objeto de deliberação do colegiado, sendo que, presente o conflito de interesses, abster-se-á de participar da discussão e da deliberação. (Origem: PRT MS/GM 1550/2014, Art. 13, § 3º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
§ 4º O Comitê Gestor do Pronon e do Pronas/PCD poderá constituir Grupos de Trabalho (GT), por meio de ato da SE/MS, para o cumprimento de finalidades específicas. (Origem: PRT MS/GM 1550/2014, Art. 13, § 4º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
Art. 14. Compete ao Comitê Gestor do Pronon e do Pronas/PCD: (Origem: PRT MS/GM 1550/2014, Art. 14) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
I - reavaliar, de ofício ou a requerimento, a definição das áreas prioritárias para execução das ações e serviços de atenção à pessoa com câncer e de atenção à pessoa com deficiência e, ser for o caso, propor alteração ao Ministro de Estado da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 14, I) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
II - deliberar, de ofício ou a requerimento, sobre a priorização de projetos submetidos às áreas técnicas, considerando os recursos da renúncia fiscal disponíveis para o exercício; (Origem: PRT MS/GM 1550/2014, Art. 14, II) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
III - definir parâmetros para aprovação, acompanhamento e prestação de contas dos projetos; (Origem: PRT MS/GM 1550/2014, Art. 14, III) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
IV - definir a sistemática de monitoramento e avaliação do Pronon e do Pronas/PCD e formular proposições para os seus aprimoramentos; (Origem: PRT MS/GM 1550/2014, Art. 14, IV) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
V - deliberar quanto ao descredenciamento de instituição com projeto em execução; e (Origem: PRT MS/GM 1550/2014, Art. 14, V) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
VI - deliberar sobre os casos omissos. (Origem: PRT MS/GM 1550/2014, Art. 14, VI) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
CAPÍTULO II
DAS COMPETÊNCIAS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO II)
Art. 15. Compete à SE/MS: (Origem: PRT MS/GM 1550/2014, Art. 15)
I - realizar a gestão administrativa do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 15, I)
II - receber e analisar a documentação de credenciamento enviada pelas instituições; (Origem: PRT MS/GM 1550/2014, Art. 15, II)
III - solicitar adequações ou complementações à documentação apresentada pelas instituições quando do credenciamento; (Origem: PRT MS/GM 1550/2014, Art. 15, III)
IV - analisar, de ofício ou a requerimento, o processo de descredenciamento da instituição; (Origem: PRT MS/GM 1550/2014, Art. 15, IV)
V - verificar, a qualquer tempo, a manutenção da qualificação da instituição e da regularidade fiscal, tributária e com a seguridade social; (Origem: PRT MS/GM 1550/2014, Art. 15, V)
VI - solicitar a abertura da Conta Captação e da Conta Movimento junto à instituição financeira oficial; (Origem: PRT MS/GM 1550/2014, Art. 15, VI)
VII - acompanhar a implementação e execução dos procedimentos acordados no Termo de Cooperação Técnica com a instituição financeira oficial; (Origem: PRT MS/GM 1550/2014, Art. 15, VII)
VIII - monitorar saldos e extratos da Conta Captação e da Conta Movimento; (Origem: PRT MS/GM 1550/2014, Art. 15, VIII)
IX - publicar, em meio oficial, os atos administrativos decorrentes das análises efetuadas no âmbito do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 15, IX)
X - elaborar e enviar a Declaração de Benefícios Fiscais (DBF) à Secretaria da Receita Federal do Brasil; (Origem: PRT MS/GM 1550/2014, Art. 15, X)
XI - apoiar, quanto à análise financeira, os demais órgãos do Ministério da Saúde na elaboração dos pareceres técnicos de projetos que preveem a realização de reformas; (Origem: PRT MS/GM 1550/2014, Art. 15, XI)
XII - analisar os aspectos contábeis e financeiros das prestações de contas dos projetos; e (Origem: PRT MS/GM 1550/2014, Art. 15, XII)
XIII - divulgar relatório de avaliação e acompanhamento das ações e serviços no âmbito do Pronon e do Pronas/PCD, nos termos do § 3º do art. 8º da Lei nº 12.715, de 2012. (Origem: PRT MS/GM 1550/2014, Art. 15, XIII)
XIV - autorizar o Fundo Nacional de Saúde (FNS) a realizar as operações financeiras envolvendo transferências de saldo entre Contas Captação e Contas Movimento, remanejamento de recursos entre projetos e estornos para regularização de depósitos equivocados. (Origem: PRT MS/GM 1550/2014, Art. 15, XIV) (dispositivo acrescentado pela PRT MS/GM 1575/2015)
XV - resolver os casos omissos. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
Parágrafo único. No caso da parte inicial do inciso XIV, o Fundo Nacional de Saúde transferirá para a Conta Movimento a totalidade do saldo disponível na Conta Captação na data da efetiva realização da transferência, incluídos os valores eventualmente acrescidos aos recursos captados em virtude das aplicações financeiras de que trata o art. 82. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
Art. 16. Compete aos demais órgãos do Ministério da Saúde: (Origem: PRT MS/GM 1550/2014, Art. 16)
I - analisar, diligenciar e emitir parecer técnico conclusivo sobre os projetos encaminhados pela SE/MS, referente aos seus respectivos campos de atuação; (Origem: PRT MS/GM 1550/2014, Art. 16, I)
II - apresentar em reunião do Comitê Gestor do Pronon e do Pronas/PCD a análise preliminar dos projetos, para fins de priorização daqueles que terão aprovação final, considerando os recursos da renúncia fiscal disponíveis para o exercício; (Origem: PRT MS/GM 1550/2014, Art. 16, II) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
III - avaliar pedidos de remanejamento de rubricas e adequação do projeto em função de captação inferior ou superior ao inicialmente planejado e aprovado, emitindo parecer conclusivo; (Origem: PRT MS/GM 1550/2014, Art. 16, III)
IV - acompanhar e avaliar a execução dos projetos; (Origem: PRT MS/GM 1550/2014, Art. 16, IV)
V - emitir parecer técnico conclusivo referente à avaliação física e financeira dos projetos; (Origem: PRT MS/GM 1550/2014, Art. 16, V)
VI - emitir parecer conclusivo das prestações de contas, para fins de encerramento dos projetos, abrangendo a análise contábil e financeira feita pela Secretaria-Executiva e a avaliação da execução física feita pela área; (Origem: PRT MS/GM 1550/2014, Art. 16, VI)
VII - elaborar relatório de avaliação e acompanhamento das ações e serviços no âmbito do Pronon e do Pronas/PCD, nos termos do § 3º do art. 8º da Lei nº 12.715, de 2012. (Origem: PRT MS/GM 1550/2014, Art. 16, VII)
CAPÍTULO III
DO CREDENCIAMENTO E DO DESCREDENCIAMENTO
(Origem: PRT MS/GM 1550/2014, CAPÍTULO III)
Seção I
Do Credenciamento das Instituições ao Pronon e ao Pronas/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO III, Seção I)
Art. 17. As instituições interessadas em participar do desenvolvimento de ações e serviços no âmbito do Pronon e do Pronas/PCD deverão obter prévio credenciamento perante o Ministério da Saúde, mediante requerimento específico para cada um dos programas, conforme modelos constantes dos Anexos 1 e 2 do Anexo LXXXVI , devidamente preenchido e assinado pelo dirigente da instituição e acompanhado da seguinte documentação: (Origem: PRT MS/GM 1550/2014, Art. 17)
I - comprovação da qualificação da instituição, através de: (Origem: PRT MS/GM 1550/2014, Art. 17, I)
a) cópia da portaria vigente que certifica a Entidade Beneficente de Assistência Social ou comprovação do protocolo de renovação tempestivo do Certificado de Entidade Beneficente de Assistência Social (CEBAS), nos termos da Lei nº 12.101, de 2009; (Origem: PRT MS/GM 1550/2014, Art. 17, I, a)
b) documento que comprove a qualificação como OS, nos termos da Lei nº 9.637, de 1998; (Origem: PRT MS/GM 1550/2014, Art. 17, I, b)
c) documento que comprove a qualificação como OSCIP, nos termos da Lei nº 9.790, de 1999; ou (Origem: PRT MS/GM 1550/2014, Art. 17, I, c)
d) comprovante de cadastro no SCNES e apresentação de declaração do gestor local atestando o atendimento direto e gratuito às pessoas com deficiência, quando o requerimento for de credenciamento junto ao Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 17, I, d)
II - cópia autenticada do estatuto ou contrato social vigente e respectivas alterações posteriores, ambos registrados em cartório; (Origem: PRT MS/GM 1550/2014, Art. 17, II)
III - cópia autenticada do comprovante de domicílio da sede da instituição; (Origem: PRT MS/GM 1550/2014, Art. 17, III)
IV - comprovante de inscrição e de situação cadastral no Cadastro Nacional da Pessoa Jurídica (CNPJ); (Origem: PRT MS/GM 1550/2014, Art. 17, IV)
V - cópia autenticada do RG e do CPF do dirigente da instituição; (Origem: PRT MS/GM 1550/2014, Art. 17, V)
VI - cópia autenticada da ata de eleição da atual diretoria ou do termo de posse de seus dirigentes, registrados em cartório; (Origem: PRT MS/GM 1550/2014, Art. 17, VI)
VII - comprovante de regularidade com o Fundo de Garantia por Tempo de Serviço (FGTS) e com o Instituto Nacional de Seguridade Social (INSS); (Origem: PRT MS/GM 1550/2014, Art. 17, VII)
VIII - Certidão Negativa Conjunta de Débitos Relativos a Tributos Federais e à Dívida Ativada da União: (Origem: PRT MS/GM 1550/2014, Art. 17, VIII)
a) da Procuradoria-Geral da Fazenda Nacional; (Origem: PRT MS/GM 1550/2014, Art. 17, VIII, a)
b) do Cadastro de Entidades Privadas Sem Fins Lucrativos Impedidas (CEPIM) da Controladoria-Geral da União; e (Origem: PRT MS/GM 1550/2014, Art. 17, VIII, b)
c) do Cadastro Informativo de Créditos não Quitados do Setor Público Federal (CADIN). (Origem: PRT MS/GM 1550/2014, Art. 17, VIII, c)
§ 1º Se o requerimento for apresentado por procurador, deverá constar, adicionalmente, cópia autenticada do RG e do CPF do outorgado e procuração com firma reconhecida, que contenha poderes que não configurem qualquer tipo de intermediação vedado pelo art. 11 da Lei nº 12.715, de 2012. (Origem: PRT MS/GM 1550/2014, Art. 17, § 1º)
§ 2º As informações de que trata o "caput" e suas atualizações são de inteira responsabilidade da instituição interessada, que deverá prestar todas as informações ao Ministério da Saúde, tempestivamente, quando solicitado. (Origem: PRT MS/GM 1550/2014, Art. 17, § 2º)
§ 3º A regularidade fiscal, tributária e com a seguridade social deverá ser mantida por todo o período de execução dos projetos, podendo a sua comprovação ser exigida a qualquer tempo pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 17, § 3º)
§ 4º Caso necessário, poderão ser requisitados outros documentos que comprovem ou complementem as informações prestadas na fase de credenciamento, devendo a instituição interessada responder à diligência de complementação e adequação em até 20 (vinte) dias, contados da data da notificação. (Origem: PRT MS/GM 1550/2014, Art. 17, § 4º)
IX - indicação da agência de relacionamento da instituição financeira oficial a qual a instituição participante dos programas encontra-se vinculada. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
Art. 18. O requerimento de que trata o "caput" do art. 17 será enviado ao Ministério da Saúde por meio de carta com Aviso de Recebimento (AR) ou SEDEX ou entregue diretamente no Protocolo Central do Ministério da Saúde, constando como destinatário "Ministério da Saúde - Pronon ou Pronas/PCD - Esplanada dos Ministérios, Bloco G, Protocolo Central, CEP 70058-900 Brasília - DF". (Origem: PRT MS/GM 1550/2014, Art. 18)
Parágrafo Único. Os requerimentos de credenciamento no Pronon e no Pronas/PCD deverão ser apresentados à Secretaria-Executiva do Ministério da Saúde no período de 1º de junho a 31 de julho de cada ano, para fins de submissão de projetos no exercício fiscal subsequente. (Origem: PRT MS/GM 1550/2014, Art. 18, § 1º) (com redação dada pela PRT MS/GM 275/2016)
Art. 19. São hipóteses de indeferimento do pedido de credenciamento: (Origem: PRT MS/GM 1550/2014, Art. 19)
I - apresentação incompleta da documentação ou fora dos prazos previstos neste Anexo; (Origem: PRT MS/GM 1550/2014, Art. 19, I)
II - requerimento perante órgão ou setor incompetente; (Origem: PRT MS/GM 1550/2014, Art. 19, II)
III - realizado por quem não seja legitimado; e (Origem: PRT MS/GM 1550/2014, Art. 19, III)
IV - se houver fundadas dúvidas quanto à veracidade das informações e dos documentos apresentados. (Origem: PRT MS/GM 1550/2014, Art. 19, IV)
Parágrafo Único. A decisão de indeferimento do pedido de credenciamento nas hipóteses de que trata o "caput" será devidamente justificada, nos termos do art. 50 da Lei nº 9.784, de 29 de janeiro de 1999. (Origem: PRT MS/GM 1550/2014, Art. 19, Parágrafo Único)
Art. 20. O credenciamento da instituição junto ao Pronon e ao Pronas/PCD servirá como prévia habilitação para os anos subsequentes, podendo ser apresentados projetos no prazo regulamentar previsto neste Anexo. (Origem: PRT MS/GM 1550/2014, Art. 20)
Art. 21. A SE/MS publicará no Diário Oficial da União (DOU) os resultados dos pedidos de credenciamento das instituições interessadas em participar do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 21)
§ 1º Caberá recurso à SE/MS da decisão de indeferimento, no prazo de 10 (dez) dias, contado da data da publicação de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 21, § 1º)
§ 2º Acolhidas as razões do recurso, será publicada portaria de credenciamento em favor da instituição recorrente, no prazo de 10 (dez) dias. (Origem: PRT MS/GM 1550/2014, Art. 21, § 2º)
§ 3º Não será conhecido recurso interposto fora do prazo de que trata o § 1º. (Origem: PRT MS/GM 1550/2014, Art. 21, § 3º)
Seção II
Do Descredenciamento das Instituições Junto ao Pronon e ao Pronas/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO III, Seção II)
Art. 22. As instituições serão descredenciadas junto ao Pronon e ao Pronas/PCD, por meio de portaria da SE/MS, nas seguintes hipóteses: (Origem: PRT MS/GM 1550/2014, Art. 22)
I - for declarada inabilitada, nos termos do art. 12 do Decreto nº 7.988, de 17 de abril de 2013; (Origem: PRT MS/GM 1550/2014, Art. 22, I)
II - perder a qualificação de Entidade Beneficente de Assistência Social, de OS ou de OSCIP; (Origem: PRT MS/GM 1550/2014, Art. 22, II)
III - perder a característica de prestação de atendimento direto e gratuito às pessoas com deficiência ou deixar de atualizar o cadastro no SCNES, no âmbito do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 22, III)
IV - perder a condição de regularidade fiscal, tributária ou com a seguridade social, previstas no art. 17, incisos VII e VIII II do Anexo LXXXVI ; (Origem: PRT MS/GM 1550/2014, Art. 22, IV)
IV - perder a condição de regularidade fiscal, tributária ou com a seguridade social, previstas no art. 17, incisos VII e VIII, do Anexo LXXXVI; (Origem: PRT MS/GM 1550/2014, Art. 22, IV) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
V - omitir-se de atualizar o Ministério da Saúde sobre as informações de que trata o art. 17 e de enviar o documento de que trata o art. 64, parágrafo único; e (Origem: PRT MS/GM 1550/2014, Art. 22, V)
VI - informar em duplicidade o registro de procedimentos nos sistemas de informação do Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 22, VI)
§ 1º A instituição descredenciada perderá o direito de apresentar projetos no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 22, § 1º)
§ 2º Após o descredenciamento, a instituição poderá apresentar novo requerimento de credenciamento, nos termos do art. 17, para fazer jus à apresentação de novos projetos, desde que o descredenciamento não tenha sido proferido com base no inciso I. (Origem: PRT MS/GM 1550/2014, Art. 22, § 2º)
§ 3º Os projetos aprovados de instituições que foram descredenciadas, cuja execução não tenha sido iniciada, serão considerados reprovados, devendo a SE/MS tornar sem efeito a portaria de aprovação do projeto e de autorização para captação de recursos, em relação àquele projeto. (Origem: PRT MS/GM 1550/2014, Art. 22, § 3º)
§ 4º Serão submetidos à análise e deliberação do Comitê Gestor do Pronon e do Pronas/PCD os casos de descredenciamento de instituições que possuírem projeto em execução. (Origem: PRT MS/GM 1550/2014, Art. 22, § 4º)
§ 4º Os casos de descredenciamento de instituições que possuírem projeto em execução serão objeto de análise pela SE/MS. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 5º Caberá recurso à SE/MS da decisão de descredenciamento, no prazo de 10 (dez) dias, contado da data da publicação da portaria de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 22, § 5º)
§ 5º Caberá recurso da decisão de descredenciamento, no prazo de 10 (dez) dias, contado da data de publicação da Portaria de que trata o caput. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 6º Acolhidas as razões do recurso, será publicada portaria de recredenciamento em favor da instituição recorrente, no prazo de 10 (dez) dias. (Origem: PRT MS/GM 1550/2014, Art. 22, § 6º)
§ 7º Não será conhecido recurso interposto fora do prazo de que trata o § 5º. (Origem: PRT MS/GM 1550/2014, Art. 22, § 7º)
CAPÍTULO IV
DOS PROJETOS NO ÂMBITO DO PRONON E DO PRONAS/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV)
Seção I
Da Apresentação de Projetos
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I)
Art. 23. Os projetos somente poderão ser apresentados para avaliação e aprovação pelo Ministério da Saúde por instituições previamente credenciadas a participar do desenvolvimento de ações e serviços no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 23)
Art. 24. A participação das instituições na realização de projetos referentes ao Pronon e ao Pronas/PCD não poderá ocorrer em prejuízo de suas atividades prestadas ao SUS, não podendo compreender o quantitativo executado ou em execução: (Origem: PRT MS/GM 1550/2014, Art. 24)
I - por meio de contratos, convênios e instrumentos congêneres firmados com órgãos e entidades integrantes do SUS; e (Origem: PRT MS/GM 1550/2014, Art. 24, I)
II - para obtenção do Certificado de Entidade Beneficente de Assistência Social, que trata a Lei nº 12.101, de 2009. (Origem: PRT MS/GM 1550/2014, Art. 24, II)
§ 1º Os projetos não poderão solicitar o custeio dos serviços já realizados na instituição, tampouco o pagamento de profissionais que já atuam no local, exceto nos casos em que houver a necessidade e possibilidade de se aumentar a carga horária desses profissionais com vistas a permitir a execução das atividades relativas ao objeto proposto no projeto. (Origem: PRT MS/GM 1550/2014, Art. 24, § 1º)
§ 2º Em nenhuma hipótese será admitida contratação de profissionais para execução de atividades que não apresentem relação com o objeto do projeto. (Origem: PRT MS/GM 1550/2014, Art. 24, § 2º)
§ 3º A instituição será responsável por garantir que as atividades descritas no plano de trabalho sejam novas ou adicionais às já realizada e que não serão cobradas ao SUS. (Origem: PRT MS/GM 1550/2014, Art. 24, § 3º)
§ 1º Na eventualidade de não atingimento do teto de recursos disponíveis para renúncia fiscal no exercício, considerando os projetos apresentados e aprovados no período a que se refere o "caput", o Ministério da Saúde poderá abrir nova etapa para recebimento de projetos no período de 15 a 31 de agosto de cada ano. (Origem: PRT MS/GM 1550/2014, Art. 25, § 1º)
§ 2º O valor de cada projeto apresentado no âmbito do Pronon e do Pronas/PCD está limitado a até 5% (cinco por cento) do valor global máximo destinado para dedução fiscal, estabelecido anualmente em ato conjunto do Ministério da Saúde e do Ministério da Fazenda. (Origem: PRT MS/GM 1550/2014, Art. 25, § 2º)
§ 3º Cada projeto deverá ser enquadrado exclusivamente em uma das ações e serviços de que tratam os arts. 5º e 9º do Anexo LXXXVI . (Origem: PRT MS/GM 1550/2014, Art. 25, § 3º)
Art. 24. A participação das instituições na realização de projetos referentes ao Pronon e ao Pronas/PCD não poderá ocorrer em prejuízo de suas atividades prestadas ao SUS, não podendo compreender o quantitativo executado ou em execução: (Origem: PRT MS/GM 1550/2014, Art. 24) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
I - por meio de contratos, convênios e instrumentos congêneres firmados com órgãos e entidades integrantes do SUS; e (Origem: PRT MS/GM 1550/2014, Art. 24, I) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
II - para obtenção do Certificado de Entidade Beneficente de Assistência Social, que trata a Lei nº 12.101, de 2009. (Origem: PRT MS/GM 1550/2014, Art. 24, II) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 1º Os projetos não poderão solicitar o custeio dos serviços já realizados na instituição, tampouco o pagamento de profissionais que já atuam no local, exceto nos casos em que houver a necessidade e possibilidade de se aumentar a carga horária desses profissionais com vistas a permitir a execução das atividades relativas ao objeto proposto no projeto. (Origem: PRT MS/GM 1550/2014, Art. 24, § 1º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 2º Em nenhuma hipótese será admitida contratação de profissionais para execução de atividades que não apresentem relação com o objeto do projeto. (Origem: PRT MS/GM 1550/2014, Art. 24, § 2º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 3º A instituição será responsável por garantir que as atividades descritas no plano de trabalho sejam novas ou adicionais às já realizada e que não serão cobradas ao SUS. (Origem: PRT MS/GM 1550/2014, Art. 24, § 3º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Art. 25. A instituição credenciada poderá apresentar até 3 (três) projetos por ano, por programa, os quais deverão ser protocolados na Secretaria-Executiva do Ministério da Saúde no prazo de até 45 (quarenta e cinco) dias, a partir da publicação do ato conjunto do Ministério da Saúde e do Ministério da Fazenda, que estabelece anualmente o valor global máximo destinado para dedução fiscal. (Origem: PRT MS/GM 1550/2014, Art. 25) (com redação dada pela PRT MS/GM 275/2016)
Art. 25. A instituição credenciada poderá apresentar até 3 (três) projetos por ano, por programa, os quais deverão ser protocolados na Secretaria-Executiva do Ministério da Saúde no prazo de até 45 (quarenta e cinco) dias, a partir da publicação do ato conjunto do Ministério da Saúde e do Ministério da Fazenda, que estabelece anualmente o valor global máximo destinado para dedução fiscal. (Origem: PRT MS/GM 1550/2014, Art. 25) (com redação dada pela PRT MS/GM 275/2016) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Art. 25. A instituição credenciada poderá apresentar até 3 (três) projetos por ano, por programa, os quais deverão ser protocolados na SE/MS no prazo de até 45 (quarenta e cinco) dias, a partir da publicação da portaria de que trata o caput do art. 25-A. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 1º Na eventualidade de não atingimento do teto de recursos disponíveis para renúncia fiscal no exercício, considerando os projetos apresentados e aprovados no período a que se refere o "caput", o Ministério da Saúde poderá abrir nova etapa para recebimento de projetos no período de 15 a 31 de agosto de cada ano. (Origem: PRT MS/GM 1550/2014, Art. 25, § 1º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 2º O valor de cada projeto apresentado no âmbito do Pronon e do Pronas/PCD está limitado a até 5% (cinco por cento) do valor global máximo destinado para dedução fiscal, estabelecido anualmente em ato conjunto do Ministério da Saúde e do Ministério da Fazenda. (Origem: PRT MS/GM 1550/2014, Art. 25, § 2º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 3º Cada projeto deverá ser enquadrado exclusivamente em uma das ações e serviços de que tratam os arts. 5º e 9º do Anexo LXXXVI. (Origem: PRT MS/GM 1550/2014, Art. 25, § 3º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Art. 25-A. O Secretário-Executivo do Ministério da Saúde, por meio de portaria a ser publicada em cada exercício financeiro, preferencialmente na competência de janeiro de cada ano, definirá os critérios pelos quais serão classificados os projetos apresentados naquele exercício que venham a ser aprovados no mérito pelas Secretarias Finalísticas. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 1º Os projetos aprovados definitivamente, tanto no mérito quanto no enquadramento nos limites financeiros disponíveis, serão ordenados em listas classificatórias, a serem publicadas pelo SE/MS no Diário Oficial da União (DOU) após a publicação do ato conjunto de que trata o § 5º do art. 16 do Decreto nº 7.988, de 2013, segundo a pontuação atingida por cada projeto após a aplicação dos critérios de que trata o caput. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 2º Para fins de aprovação definitiva dos projetos e elaboração das listas classificatórias de que trata o § 1º, na hipótese de insuficiência de limite financeiro para todos os projetos aprovados no mérito no exercício financeiro pelas Secretarias Finalísticas, o indeferimento de que trata o art. 53 incidirá sobre os projetos que apresentem menor pontuação segundo os critérios de que trata o caput. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 3º A Portaria de que trata o caput também conterá a estimativa do valor máximo que cada projeto poderá apresentar, nos termos do § 2º do art. 25. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 4º Caso a estimativa de que trata o § 3º não seja confirmada pelo ato de que trata o § 5º do art. 15 do Decreto nº 7.988, de 17 de abril de 2013, a instituição deverá apresentar projeto de readequação para menor, ao qual serão aplicados os prazos e procedimentos previstos no art. 69, naquilo em que for compatível, sob pena de indeferimento. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
Art. 26. Cada projeto apresentado no âmbito do Pronon e do Pronas/PCD conterá: (Origem: PRT MS/GM 1550/2014, Art. 26)
I - requerimento de apresentação de projeto devidamente preenchido, conforme modelo constante do Anexo 3 do Anexo LXXXVI , especificando: (Origem: PRT MS/GM 1550/2014, Art. 26, I)
a) uma das ações ou serviços a serem executados no âmbito do respectivo programa; (Origem: PRT MS/GM 1550/2014, Art. 26, I, a)
b) a descrição da estrutura física e de recursos materiais e humanos a serem utilizados para a execução do projeto; (Origem: PRT MS/GM 1550/2014, Art. 26, I, b)
c) a estimativa de recursos financeiros para início e término da execução do projeto; e (Origem: PRT MS/GM 1550/2014, Art. 26, I, c)
d) o cronograma de sua execução, observado o prazo máximo estabelecido no § 1º; (Origem: PRT MS/GM 1550/2014, Art. 26, I, d)
II - cópia do ato que deferiu o seu pedido de credenciamento nos termos do art. 21; (Origem: PRT MS/GM 1550/2014, Art. 26, II)
III - declaração de responsabilidade, conforme o modelo constante do Anexo 4 do Anexo LXXXVI , e de capacidade técnico-operativa, conforme o modelo constante do Anexo 5 do Anexo LXXXVI , para o cumprimento do objeto e dos objetivos contratados e execução físico-financeira das atividades necessárias; (Origem: PRT MS/GM 1550/2014, Art. 26, III)
IV - comprovação de anuência prévia favorável ao projeto pelos gestores estadual e/ou municipal de saúde do SUS, a depender de sua abrangência e do alcance das ações propostas nessas esferas de gestão, respeitada a legislação vigente; e (Origem: PRT MS/GM 1550/2014, Art. 26, IV)
V - declaração de comprometimento a submeter o projeto à apreciação dos comitês de ética, da Agência Nacional de Vigilância Sanitária (ANVISA) e da Comissão Técnica Nacional de Biossegurança (CTNBio), quando for o caso, e de somente iniciar a execução do projeto após enviar ao Ministério da Saúde comprovante(s) de ter obtido as necessárias autorizações éticas e sanitárias para realizar o estudo. (Origem: PRT MS/GM 1550/2014, Art. 26, V)
§ 1º O prazo para execução do projeto poderá ser de até 24 (vinte e quatro) meses, exceto quando se tratar de projetos de pesquisa, hipótese em que o prazo de execução poderá ser de até 36 (trinta e seis) meses. (Origem: PRT MS/GM 1550/2014, Art. 26, § 1º)
§ 2º O cronograma de execução do projeto deverá apresentar o tempo de sua execução em meses, considerando-se o seu início a partir da data de liberação dos recursos da Conta Captação para a Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 26, § 2º)
§ 3º A comprovação da capacidade técnico-operativa da instituição será aceita pelo Ministério da Saúde na condição de que o objeto a ser executado no projeto apresentado seja próprio das atividades regulares e habituais desenvolvidas pela instituição proponente. (Origem: PRT MS/GM 1550/2014, Art. 26, § 3º)
§ 4º Serão exigidos todos os documentos pertinentes ao enquadramento do projeto ao campo de atuação pretendido. (Origem: PRT MS/GM 1550/2014, Art. 26, § 4º)
Art. 27. O projeto deverá apresentar orçamento detalhado, contendo todos os custos envolvidos para alcance dos objetivos, informando a natureza das despesas e as categorias dos gastos. (Origem: PRT MS/GM 1550/2014, Art. 27)
§ 1º O orçamento poderá ser apresentado utilizando-se o modelo constante do Anexo 6 do Anexo LXXXVI , ou adaptado, conforme necessidade do objeto e das ações a serem executadas. (Origem: PRT MS/GM 1550/2014, Art. 27, § 1º)
§ 2º As despesas referentes aos serviços de elaboração do projeto e de captação de recursos deverão ser detalhadas na planilha de custos do projeto, sendo obrigatório o seu destaque em relação aos demais itens de despesas. (Origem: PRT MS/GM 1550/2014, Art. 27, § 2º)
§ 3º A elaboração do projeto e a captação de recursos poderão ser realizadas por profissionais contratados para este fim, desde que as despesas somadas não ultrapassem 5% (cinco por cento) do valor total previsto para o projeto, limitada ao teto de R$ 50.000,00 (cinquenta mil reais). (Origem: PRT MS/GM 1550/2014, Art. 27, § 3º)
Art. 28. Serão admitidas como despesas administrativas: (Origem: PRT MS/GM 1550/2014, Art. 28)
I - material de consumo para escritório; (Origem: PRT MS/GM 1550/2014, Art. 28, I)
II - locação de imóvel para atender os objetivos do projeto durante a sua execução; (Origem: PRT MS/GM 1550/2014, Art. 28, II)
III - serviços de postagens e correios; (Origem: PRT MS/GM 1550/2014, Art. 28, III)
IV - transporte e deslocamento de pessoal administrativo; (Origem: PRT MS/GM 1550/2014, Art. 28, IV)
V - conta de telefone, de água, de luz e de internet; (Origem: PRT MS/GM 1550/2014, Art. 28, V)
VI - honorários de pessoal administrativo, serviços contábeis e advocatícios contratados para execução do projeto e respectivos encargos sociais; e (Origem: PRT MS/GM 1550/2014, Art. 28, VI)
VII - outras despesas administrativas restritas, indispensáveis à execução dos projetos, assim consideradas pelo Ministério da Saúde, desde que especificadas no projeto e no seu respectivo orçamento. (Origem: PRT MS/GM 1550/2014, Art. 28, VII)
§ 1º As despesas de que trata o "caput" deverão ser apresentadas de forma detalhada, no demonstrativo orçamentário do projeto, não podendo ser apresentadas apenas de forma global. (Origem: PRT MS/GM 1550/2014, Art. 28, § 1º)
§ 2º São de responsabilidade da instituição as retenções e os recolhimentos relativos a impostos, tributos e contribuições que incidirem sobre os valores pagos pelos serviços contratados para a execução do projeto, observada a legislação específica vigente. (Origem: PRT MS/GM 1550/2014, Art. 28, § 2º)
Subseção I
Dos Projetos de Prestação de Serviços Médico-Assistenciais
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção I)
Art. 29. No caso de projetos de prestação de serviços médico-assistenciais, além do disposto nos arts. 23, 24, , 26, 27 e 28 do Anexo LXXXVI , a instituição deverá: (Origem: PRT MS/GM 1550/2014, Art. 29)
Art. 29. No caso de projetos de prestação de serviços médico-assistenciais, além do disposto nos arts. 23 a 28 do Anexo LXXXVI, a instituição deverá: (Origem: PRT MS/GM 1550/2014, Art. 29) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
I - possuir estrutura física e capacidade técnico-operativa para o seu desenvolvimento; (Origem: PRT MS/GM 1550/2014, Art. 29, I)
II - apresentar manifestação de que o projeto está adequado à Política Nacional para a Prevenção e Controle do Câncer ou à Política Nacional de Saúde da Pessoa com Deficiência e a declaração favorável da respectiva direção do SUS à sua execução; (Origem: PRT MS/GM 1550/2014, Art. 29, II)
III - garantir que as ações que forem passíveis de regulação devem, obrigatoriamente, estar incluídas formalmente na regulação do gestor que deu a anuência ao projeto; (Origem: PRT MS/GM 1550/2014, Art. 29, III)
IV - apresentar documentos que comprovem o efetivo atendimento das normas de vigilância sanitária; (Origem: PRT MS/GM 1550/2014, Art. 29, IV)
V - comprovar cadastro prévio no SCNES; e (Origem: PRT MS/GM 1550/2014, Art. 29, V)
VI - estar habilitada em oncologia pelo Ministério da Saúde, quando os projetos tratarem de ações e serviços relacionados à alta complexidade em oncologia. (Origem: PRT MS/GM 1550/2014, Art. 29, VI)
Parágrafo Único. No caso de serviços de apoio à saúde, não será necessária a comprovação da inscrição no SCNES. (Origem: PRT MS/GM 1550/2014, Art. 29, Parágrafo Único)
Art. 30. A instituição que apresentar projetos prevendo a realização de ações e serviços constantes da relação dos procedimentos regulados pela Central Nacional de Regulação de Alta Complexidade (CNRAC) poderá, mediante habilitação específica para fins do Pronon ou do Pronas/PCD, ser autorizada a realizar tais procedimentos com regulação pela referida Central, observadas a vigência e as exigências referentes ao credenciamento ou habilitação, conforme as especificidades dos projetos. (Origem: PRT MS/GM 1550/2014, Art. 30)
Art. 31. A prestação de serviços médico-assistenciais no âmbito dos projetos referentes ao Pronon e ao Pronas/PCD deverá ser registrada no sistema de Comunicação de Informação Hospitalar e Ambulatorial (CIHA), conforme os procedimentos constantes em normas específicas. (Origem: PRT MS/GM 1550/2014, Art. 31)
§ 1º O CIHA será o sistema oficial para verificação, acompanhamento, avaliação e prestação de contas das ações e serviços que o proponente se comprometeu a realizar no projeto. (Origem: PRT MS/GM 1550/2014, Art. 31, § 1º)
§ 2º É vedado o registro das ações e serviços desenvolvidos no âmbito do Pronon e do Pronas/PCD em outros sistemas de informação do Ministério da Saúde, sendo, portanto, impedidos de serem cobrados de outras formas às instâncias gestoras do SUS. (Origem: PRT MS/GM 1550/2014, Art. 31, § 2º)
§ 3º Na hipótese de duplicidade de registro de procedimentos, a instituição poderá ser descredenciada e inabilitada para a apresentação de projetos no âmbito do Pronon e/ou do Pronas, durante os 3 (três) anos seguintes. (Origem: PRT MS/GM 1550/2014, Art. 31, § 3º)
Subseção II
Dos Projetos de Pesquisa
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção II)
Art. 32. Nos projetos de pesquisa, a instituição deverá possuir infraestrutura física e capacidade técnico-operativa para o seu desenvolvimento, sendo, porém, permitida parceria com instituições de ensino e pesquisa para complementá-las. (Origem: PRT MS/GM 1550/2014, Art. 32)
Parágrafo Único. Em nenhuma hipótese será permitida a transferência de recursos captados por meio do Pronon e do Pronas/PCD às instituições de ensino e pesquisa ou a profissionais vinculados a estas instituições em virtude da parceria de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 32, Parágrafo Único)
Subseção III
Dos Projetos de Formação, Capacitação e Aperfeiçoamento de Recursos Humanos
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção III)
Art. 33. Nos projetos de formação, capacitação e aperfeiçoamento de recursos humanos, além do disposto nos arts. 23, 24, , 26, 27 e 28 do Anexo LXXXVI , a instituição deverá: (Origem: PRT MS/GM 1550/2014, Art. 33)
Art. 33. Nos projetos de formação, capacitação e aperfeiçoamento de recursos humanos, além do disposto nos arts. 23 a 28 do Anexo LXXXVI, a instituição deverá: (Origem: PRT MS/GM 1550/2014, Art. 33) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
I - enviar projeto pedagógico, justificando a atividade pretendida em acordo com o objeto final da instituição, devendo conter objetivos gerais e específicos que irão mensurar o atingimento dos resultados esperados; (Origem: PRT MS/GM 1550/2014, Art. 33, I)
II - encaminhar o currículo do responsável pela instituição e/ou do profissional que irá desenvolver a formação, a capacitação e o aperfeiçoamento; e (Origem: PRT MS/GM 1550/2014, Art. 33, II)
III - apresentar de forma detalhada o conteúdo, a carga-horária, o público-alvo, a metodologia a ser aplicada, a modalidade empregada e os recursos instrucionais e pedagógicos a serem utilizados. (Origem: PRT MS/GM 1550/2014, Art. 33, III)
Subseção IV
Dos Projetos que Preveem a Realização de Reformas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção IV)
Art. 34. Para execução dos projetos, somente será permitida a realização de despesas com obras em imóveis, no âmbito do Pronon e do Pronas/PCD, se referentes a reformas, incluindo-se ações de conservação, manutenção e reparos, ficando vedada a realização de investimentos com ampliação e construção de imóveis. (Origem: PRT MS/GM 1550/2014, Art. 34)
Art. 35. É necessária a apresentação de declaração firmada pelo responsável técnico da obra de que a planilha orçamentária apresenta quantitativos compatibilizados com o respectivo projeto de engenharia e de que os custos estão de acordo com as tabelas do SINAPI. (Origem: PRT MS/GM 1550/2014, Art. 35)
Parágrafo Único. Os custos também poderão ser apresentados, em caso de impossibilidade de uso da tabela SINAPI, a partir: (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único)
I - de pesquisa de preços com no mínimo 3 (três) propostas; (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, I)
II - de informações disponibilizadas por órgãos de classe e entidades profissionais, tais como o Sindicato da Indústria da Construção Civil (Sinduscon), o Instituto de Arquitetos do Brasil (IAB), o CREA e o CAU; (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, II)
III - de informações do Informativo Sistema Boletim de Custos (SBC); ou (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, III)
IV - do Sistema de Custos de Obra e Serviços de Engenharia (SCO) da Fundação Getúlio Vargas (FGV). (Origem: PRT MS/GM 1550/2014, Art. 35, Parágrafo Único, IV)
Subseção V
Dos Projetos que Preveem a Aquisição de Equipamentos e Materiais Permanentes
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção V)
Art. 36. As instituições deverão apresentar informações detalhadas sobre os equipamentos e materiais permanentes que serão adquiridos, de forma a permitir ao analista técnico avaliar a viabilidade técnica de instalação e operação dos equipamentos, bem como a sustentabilidade desses, conforme modelo constante do Anexo 7 do Anexo LXXXVI . (Origem: PRT MS/GM 1550/2014, Art. 36)
Parágrafo Único. Os equipamentos e materiais permanentes deverão constar nas relações de itens disponibilizadas pelo Fundo Nacional de Saúde, exceto quando vinculados a projetos de pesquisa clínica, experimental e de inovação tecnológica. (Origem: PRT MS/GM 1550/2014, Art. 36, Parágrafo Único)
Art. 37. Os equipamentos e materiais permanentes adquiridos para fins de projetos de pesquisa e que necessitem de importação deverão obedecer ao disposto em normas específicas da ANVISA. (Origem: PRT MS/GM 1550/2014, Art. 37)
Art. 38. Nos projetos que envolverem a aquisição ou produção de equipamentos e/ou materiais permanentes com recursos captados por meio do Pronon e do Pronas/PCD, o equipamento e/ou material permanente será revertido, ao final do projeto, mediante doação, ao patrimônio do ente federativo que anuiu com a realização do projeto, conforme o modelo de Termo de Doação constante do Anexo 8 do Anexo LXXXVI . (Origem: PRT MS/GM 1550/2014, Art. 38)
§ 1º O ente federativo beneficiário da doação de que trata o "caput" poderá utilizar os equipamentos e materiais permanentes em seus órgãos ou estabelecimentos públicos de assistência à saúde ou de ensino e pesquisa ou realizar a cessão de seu uso para entidades filantrópicas que atuam de forma complementar ao SUS, para atendimento de usuários do SUS. (Origem: PRT MS/GM 1550/2014, Art. 38, § 1º)
§ 2º A documentação comprobatória da formalização da doação de que trata "caput" deverá ser encaminhada ao Ministério da Saúde juntamente com o relatório final de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 38, § 2º)
§ 3º A instituição interessada em permanecer com os equipamentos e materiais permanentes após o término da execução do projeto deverá: (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º)
I - nos 30 (trinta) dias anteriores ao término do projeto, solicitar à Secretaria de Saúde do ente federativo que anuiu com a realização do projeto a manutenção do uso do equipamento e/ou material permanente; (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º, I)
II - firmar termo de compromisso a ser assinado com o gestor do SUS que anuiu com a realização do projeto, de modo a assumir a continuar utilizar o equipamento e/ou material permanente na prestação de ações e serviços de saúde aos usuários do SUS, sob pena de devolução dos bens à respectiva direção do SUS; e (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º, II)
III - no caso de manutenção do equipamento na instituição que executou o projeto, manter essa informação no SCNES. (Origem: PRT MS/GM 1550/2014, Art. 38, § 3º, III)
§ 4º No caso de projeto de pesquisa que preveja a aquisição de equipamentos que não possuam registro ou cadastro junto à ANVISA, a destinação desses seguirá as normas sanitárias em vigor. (Origem: PRT MS/GM 1550/2014, Art. 38, § 4º)
Art. 39. Para definição dos custos de aquisição dos equipamentos e materiais permanentes, deverá ser consultado o Sistema de Informação e Gerenciamento de Equipamentos e Materiais (SIGEM) do Fundo Nacional de Saúde. (Origem: PRT MS/GM 1550/2014, Art. 39)
Parágrafo Único. No caso de equipamentos importados, para os quais não haja referência de preços no SIGEM, a instituição apresentará documentação comprobatória do preço praticado no mercado nacional e internacional, quando for o caso. (Origem: PRT MS/GM 1550/2014, Art. 39, Parágrafo Único)
Subseção VI
Dos Projetos que Preveem Aquisição de Medicamentos, Kits Diagnósticos, Materiais Médico-Hospitalares, Órteses, Próteses e Outros Produtos para a Saúde
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção VI)
Art. 40. Os projetos poderão prever a aquisição de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e de outros produtos para saúde, observando o seu objeto. (Origem: PRT MS/GM 1550/2014, Art. 40)
§ 1º Os medicamentos adquiridos no âmbito do projeto deverão estar listados na Relação Nacional de Medicamentos Essenciais (RENAME), exceto quando se tratar de medicamento utilizado no tratamento do câncer, especialmente aqueles utilizados para quimioterapia, que deverão ser registrados na ANVISA. (Origem: PRT MS/GM 1550/2014, Art. 40, § 1º)
§ 2º Para fins de pesquisa, será permitida a importação de produtos de que trata o "caput" e que não atendam às exigências do §1º, cuja importação sem necessidade de cadastro ou registro deve obedecer ao disposto na legislação específica. (Origem: PRT MS/GM 1550/2014, Art. 40, § 2º)
§ 3º Não será permitida a previsão de medicamentos cuja aquisição seja realizada de forma centralizada pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 40, § 3º)
§ 4º Os medicamentos utilizados em projetos de pesquisa também estarão sujeitos aos regulamentos dos programas de acesso expandido, uso compassivo e fornecimento de medicamentos pós-estudos, disposto em regulamento específico da ANVISA. (Origem: PRT MS/GM 1550/2014, Art. 40, § 4º)
Art. 41. Os medicamentos, materiais médico-hospitalares, kits diagnósticos, órteses e próteses adquiridos que não foram utilizados serão doados, ao término do projeto, ao ente federativo que anuiu com a realização do projeto, para a utilização em estabelecimentos públicos de assistência à saúde, de ensino e pesquisa ou para uso por entidades filantrópicas que atuam de forma complementar ao SUS, para atendimento dos usuários do sistema. (Origem: PRT MS/GM 1550/2014, Art. 41)
§ 1º A documentação comprobatória da formalização da doação de que trata o "caput" será encaminhada ao Ministério da Saúde juntamente com o relatório final de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 41, § 1º)
§ 2º A instituição executora que atue de forma complementar ao SUS interessada em permanecer com os produtos de que trata o "caput" após o término da execução do projeto deverá: (Origem: PRT MS/GM 1550/2014, Art. 41, § 2º)
I - nos 30 (trinta) dias anteriores ao término do projeto, solicitar à Secretaria de Saúde do ente federativo que anuiu com a realização do projeto a manutenção do uso dos produtos; e (Origem: PRT MS/GM 1550/2014, Art. 41, § 2º, I)
II - firmar termo de compromisso a ser firmado com o gestor do SUS que anuiu com a realização do projeto de que assume a obrigação de continuar a utilizar os produtos de que trata o "caput" na prestação de ações e serviços de saúde aos usuários do SUS, sob pena de devolução do bem à respectiva direção do sistema. (Origem: PRT MS/GM 1550/2014, Art. 41, § 2º, II)
Art. 42. Para apresentação dos preços de aquisição de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e outros produtos para a saúde, a instituição deverá utilizar o Banco de Preços em Saúde (BPS) e o Sistema Integrado de Administração de Serviços Gerais (SIASG). (Origem: PRT MS/GM 1550/2014, Art. 42)
Parágrafo Único. O acesso ao relatório de preços constantes no SIASG poderá ser realizado utilizando funcionalidade específica do BPS. (Origem: PRT MS/GM 1550/2014, Art. 42, Parágrafo Único)
Subseção VII
Dos Projetos que Preveem Comodato ou Cessão de Uso de Bens Imóveis ou Equipamentos
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção I, Subeção VII)
Art. 43. Os projetos que preveem comodato ou cessão de uso de bens imóveis ou equipamentos somente poderão incluir no orçamento as despesas de conservação dos bens imóveis ou dos equipamentos, por se tratarem de empréstimo de natureza gratuita. (Origem: PRT MS/GM 1550/2014, Art. 43)
Parágrafo Único. A comprovação do empréstimo dos bens imóveis ou dos equipamentos na modalidade de comodato ou cessão de uso deverá ser feita mediante a apresentação de cópia autenticada do respectivo contrato. (Origem: PRT MS/GM 1550/2014, Art. 43, Parágrafo Único)
Seção II
Das Vedações
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção II)
Art. 44. É vedada a previsão de despesas: (Origem: PRT MS/GM 1550/2014, Art. 44)
I - a título de taxa de administração ou similar; (Origem: PRT MS/GM 1550/2014, Art. 44, I)
II - em benefício de servidor ou empregado público, integrante do quadro de pessoal de órgão ou entidade pública da administração direta ou indireta de qualquer esfera governamental, por serviços de consultoria ou assistência técnica, salvo nas hipóteses previstas em leis específicas e na Lei de Diretrizes Orçamentárias (LDO); (Origem: PRT MS/GM 1550/2014, Art. 44, II)
III - em favor de clubes e associações de servidores públicos ou entidades congêneres; (Origem: PRT MS/GM 1550/2014, Art. 44, III)
IV - que resultarem em vantagem financeira ou material para o doador, nos termos da Lei nº 12.715, de 2012; (Origem: PRT MS/GM 1550/2014, Art. 44, IV)
V - com ações e serviços de captação que excedam o limite estabelecido no art. 27, § 3º ; (Origem: PRT MS/GM 1550/2014, Art. 44, V)
VI - com recepções, festas, coquetéis, serviços de bufê ou similares, excetuados os gastos com refeições dos profissionais ou com ações educativas, quando necessário à consecução dos objetivos do projeto; (Origem: PRT MS/GM 1550/2014, Art. 44, VI)
VII - referentes à compra de passagens em primeira classe ou classe executiva, salvo em caso de necessidade justificada, para pessoas com deficiência ou mobilidade reduzida; (Origem: PRT MS/GM 1550/2014, Art. 44, VII)
VIII - com taxas bancárias, multas, juros ou correção monetária, inclusive referentes a pagamentos ou recolhimentos fora dos prazos; e (Origem: PRT MS/GM 1550/2014, Art. 44, VIII)
IX - para custeio de ações e serviços médico-assistenciais, já executados pelo proponente para atenção às pessoas no âmbito do SUS. (Origem: PRT MS/GM 1550/2014, Art. 44, IX)
Art. 45. É vedada a apresentação de projeto por pessoa jurídica de direito privado que, respectivamente, seja ou tenha como dirigentes, administradores, controladores ou membros de seus conselhos: (Origem: PRT MS/GM 1550/2014, Art. 45)
I - agente político de Poder ou do Ministério Público, tanto quanto dirigente de órgão ou entidade da administração pública, de qualquer esfera governamental, ou respectivo cônjuge ou companheiro, bem como parente em linha reta, colateral ou por afinidade, até o terceiro grau; e (Origem: PRT MS/GM 1550/2014, Art. 45, I)
II - servidor público do Ministério da Saúde ou de suas entidades vinculadas, bem como seus respectivos cônjuges, companheiros e parentes em linha reta, colateral ou por afinidade, até o terceiro grau. (Origem: PRT MS/GM 1550/2014, Art. 45, II)
Art. 46. É vedada a contratação de pessoa física ou jurídica para apresentar-se como representante legal da instituição junto ao Pronon e ao Pronas, fato que configura intermediação, com exceção do disposto no art. 81, parágrafo único. (Origem: PRT MS/GM 1550/2014, Art. 46)
Seção III
Da Análise do Projeto
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção III)
Art. 47. A SE/MS encaminhará o projeto ao órgão do Ministério da Saúde competente para realizar a análise técnico-financeira no prazo de 10 (dez) dias, contado da data de autuação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 47)
Art. 48. O órgão do Ministério da Saúde competente realizará a análise técnico-financeira do projeto e emitirá parecer técnico conclusivo no prazo de 40 (quarenta) dias, contado da data de recebimento do projeto. (Origem: PRT MS/GM 1550/2014, Art. 48)
§ 1º O órgão do Ministério da Saúde competente poderá solicitar diretamente à instituição, por meio de correio eletrônico, a complementação ou adequação do projeto, com inclusão de informações não mencionada nos Anexos 1, 2, 3, 4, 5, 6, 7, 8, 9 e 10 do Anexo LXXXVI , que deverá ser apresentada pela instituição no prazo de 10 (dez) dias, contado da data do recebimento da notificação. (Origem: PRT MS/GM 1550/2014, Art. 48, § 1º)
§ 2º Na ocorrência da situação de que trata o § 1º, o prazo de que trata o "caput" ficará suspenso até a data de recebimento das informações adicionais. (Origem: PRT MS/GM 1550/2014, Art. 48, § 2º)
Art. 49. O parecer técnico conclusivo será redigido de forma clara, concisa e tecnicamente coerente, em conformidade com o modelo constante do Anexo 9 do Anexo LXXXVI , devendo manifestar-se quanto à adequação do projeto às políticas do Ministério da Saúde, e será conclusivo sobre a aprovação total, parcial ou reprovação, devidamente fundamentada, devendo conter: (Origem: PRT MS/GM 1550/2014, Art. 49)
I - descrição sobre a relevância do projeto, a sua adequação às ações prioritárias definidas pelo Ministério da Saúde e o seu potencial de contribuição para melhoria da execução, gestão e qualificação das ações e serviços de atenção à pessoa com câncer ou de reabilitação; (Origem: PRT MS/GM 1550/2014, Art. 49, I)
II - análise sobre o preenchimento completo e correto do requerimento de apresentação de projeto, conforme o modelo constante do Anexo 3 do Anexo LXXXVI ; (Origem: PRT MS/GM 1550/2014, Art. 49, II)
III - análise quanto ao enquadramento do projeto à Lei nº 12.715, de 2012, e às demais normas aplicáveis ao Pronon e ao Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 49, III)
IV - análise da adequação do projeto e da instituição aos mecanismos do Pronon e do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 49, IV)
V - análise das planilhas orçamentárias e dos documentos técnicos exigidos da instituição; (Origem: PRT MS/GM 1550/2014, Art. 49, V)
VI - avaliação da capacidade técnico-operacional para execução do projeto apresentado; (Origem: PRT MS/GM 1550/2014, Art. 49, VI)
VII - análise da adequação entre o objeto a ser executado e os produtos resultantes; (Origem: PRT MS/GM 1550/2014, Art. 49, VII)
VIII - análise da adequação das estratégias de ação aos objetivos, assinalando-se claramente no parecer se as etapas previstas são necessárias ou suficientes a sua realização e se são compatíveis com os prazos e custos previstos; (Origem: PRT MS/GM 1550/2014, Art. 49, VIII)
IX - verificação do enquadramento do projeto nos campos de atuação estabelecidos nos arts. 5º e 9º do Anexo LXXXVI ; e (Origem: PRT MS/GM 1550/2014, Art. 49, IX)
X - verificação da compatibilidade dos custos previstos com os preços praticados no mercado nacional e internacional, quando for o caso. (Origem: PRT MS/GM 1550/2014, Art. 49, X)
Parágrafo Único. O parecer técnico conclusivo será homologado pelo titular do órgão do Ministério da Saúde competente. (Origem: PRT MS/GM 1550/2014, Art. 49, Parágrafo Único)
Art. 50. São hipóteses para reprovação do projeto e consequente arquivamento do processo: (Origem: PRT MS/GM 1550/2014, Art. 50)
I - apresentação incompleta ou em desacordo com a documentação exigida por meio deste Anexo; (Origem: PRT MS/GM 1550/2014, Art. 50, I)
II - apresentação intempestiva de resposta à diligência prevista no art. 48, § 1º ; (Origem: PRT MS/GM 1550/2014, Art. 50, II)
III - existência de dúvidas fundamentadas quanto à veracidade dos documentos e das informações apresentadas; (Origem: PRT MS/GM 1550/2014, Art. 50, III)
IV - não observância das disposições da Lei nº 12.715, de 2012, do Decreto nº 7.988, de 2013, deste Anexo e demais normas que regem o Pronon e o Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 50, IV)
V - objeto e/ou cronograma idênticos ao de outro projeto já apresentado no mesmo ano fiscal; (Origem: PRT MS/GM 1550/2014, Art. 50, V)
VI - reapresentação de projeto similar arquivado ou já analisado e indeferido pelo Ministério da Saúde, no mesmo ano fiscal; e (Origem: PRT MS/GM 1550/2014, Art. 50, VI)
VII - fracionamento de outro projeto ativo, na medida em que seu objeto ou ação principal estejam nele contidas, podendo resultar em prejuízo para o alcance dos objetivos do projeto como um todo. (Origem: PRT MS/GM 1550/2014, Art. 50, VII)
Art. 51. A avaliação dos valores dos itens apresentados em cada uma das rubricas orçamentárias levará em conta os valores constantes do SIGEM, do BPS, do Sistema Integrado de Administração de Serviços Gerais (SIASG), do SINAPI, além de outros sistemas de informação que possam servir de referência para definição de preços e custos de ações e serviços de saúde. (Origem: PRT MS/GM 1550/2014, Art. 51)
§ 1º Quando os itens não estiverem relacionados nos sistemas descritos no "caput", os valores deverão representar a opção de maior economicidade, com base na cotação prévia realizada pela instituição de, no mínimo, 3 (três) orçamentos com preços praticados no mercado. (Origem: PRT MS/GM 1550/2014, Art. 51, § 1º)
§ 2º Caso não seja possível obter o número de cotações de que trata o § 1º, a instituição deverá apresentar justificativa circunstanciada, observados os princípios da impessoalidade e da moralidade. (Origem: PRT MS/GM 1550/2014, Art. 51, § 2º)
Art. 52. Após a manifestação do titular do órgão do Ministério da Saúde competente, o projeto e o parecer técnico conclusivo serão encaminhados à SE/MS. (Origem: PRT MS/GM 1550/2014, Art. 52)
Art. 53. O cumprimento de todos os requisitos dispostos neste Anexo não garante a aprovação do projeto, que dependerá, ainda, da consonância com as Redes de Atenção à Saúde, com as prioridades do Ministério da Saúde e com o limite financeiro destinado ao Pronon e ao Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 53)
Parágrafo único. A aplicação do limite financeiro de que trata o caput será realizada nos termos do § 2º do art. 25-A, após a publicação do valor global máximo das deduções de que trata o art. 16, § 5º do Decreto nº 7.988, de 2013. (Redação dada pela PRT GM/MS nº 695 de 06.04.2020)
§ 1º A aprovação final dos projetos será feita pelo Comitê Gestor do Pronon e do Pronas/PCD, a partir do parecer técnico conclusivo emitido para cada projeto e da consonância do projeto com as prioridades definidas por meio deste Anexo e com a Política Nacional para a Prevenção e Controle do Câncer e com a Política Nacional de Saúde da Pessoa com Deficiência. (Origem: PRT MS/GM 1550/2014, Art. 53, § 1º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
§ 2º A SE/MS enviará documento contendo o conjunto de resumos de projetos com parecer favorável dos órgãos do Ministério da Saúde competentes aos membros do Comitê Gestor do Pronon e do Pronas/PCD, para conhecimento prévio, em até 5 (cinco) dias, contados do prazo final de conclusão dos pareceres técnicos conclusivos. (Origem: PRT MS/GM 1550/2014, Art. 53, § 2º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
§ 3º O Comitê Gestor do Pronon e do Pronas/PCD deliberará sobre a aprovação dos projetos em reunião realizada em, no máximo, 10 (dez) dias após o envio do documento de que trata o §2º. (Origem: PRT MS/GM 1550/2014, Art. 53, § 3º) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
Seção IV
Da Publicação do Resultado da Análise Técnica
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IV, Seção IV)
Art. 54. Em caso de aprovação do projeto, caberá à SE/MS providenciar a publicação da portaria de aprovação do projeto e de autorização para captação de recursos em favor da instituição contemplada, no prazo de 5 (cinco) dias. (Origem: PRT MS/GM 1550/2014, Art. 54)
Art. 55. A portaria de aprovação de projetos e de autorização para captação de recursos conterá, no mínimo: (Origem: PRT MS/GM 1550/2014, Art. 55)
I - o número de registro do projeto no SIPAR; (Origem: PRT MS/GM 1550/2014, Art. 55, I)
II - o título do projeto; (Origem: PRT MS/GM 1550/2014, Art. 55, II)
III - a razão social da instituição e o respectivo CNPJ; (Origem: PRT MS/GM 1550/2014, Art. 55, III)
IV - o valor aprovado para captação de doações; (Origem: PRT MS/GM 1550/2014, Art. 55, IV)
V - os prazos de captação e de execução; e (Origem: PRT MS/GM 1550/2014, Art. 55, V)
VI - o extrato do projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 55, VI)
§ 1º A instituição ficará vinculada aos termos do projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 55, § 1º)
§ 2º Em caso de ocorrência de fato novo ou constatação de erro material que interfira na aprovação do projeto, o Ministério da Saúde poderá tornar sem efeito, no todo ou em parte, a portaria de aprovação de projeto e de autorização para captação de recursos, respeitados os direitos adquiridos em relação a metas ou etapas já executadas. (Origem: PRT MS/GM 1550/2014, Art. 55, § 2º)
Art. 56. Da publicação do resultado de que trata o art. 54, caberá recurso, no prazo de 5 (cinco) dias, contado da data de publicação da portaria, à autoridade que proferiu o parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 56)
§ 1º O recurso será encaminhado à SE/MS, que encaminhará à autoridade recorrida, no prazo de 5 (cinco) dias, contado da data de recebimento. (Origem: PRT MS/GM 1550/2014, Art. 56, § 1º)
§ 2º A área técnica fará análise do pedido e encaminhará à SE/MS, no prazo de 10 (dez) dias, contados da data de recebimento do recurso, e, na hipótese de reforma da decisão, será providenciada pela SE/MS a publicação de portaria de aprovação de projeto e de autorização para captação de recursos em favor da instituição contemplada ou de manutenção da decisão quanto à reprovação total ou parcial, no prazo de 5 (cinco) dias, contado do recebimento da decisão reformada. (Origem: PRT MS/GM 1550/2014, Art. 56, § 2º)
§ 3º Recursos intempestivos não serão conhecidos pela SE/MS. (Origem: PRT MS/GM 1550/2014, Art. 56, § 3º)
CAPÍTULO V
DAS DOAÇÕES
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V)
Art. 57. As doações no âmbito do Pronon e do Pronas/PCD poderão assumir as seguintes espécies de atos gratuitos: (Origem: PRT MS/GM 1550/2014, Art. 57)
I - transferência de quantias em dinheiro; (Origem: PRT MS/GM 1550/2014, Art. 57, I)
II - transferência de bens móveis ou imóveis; (Origem: PRT MS/GM 1550/2014, Art. 57, II)
III - comodato ou cessão de uso de bens imóveis ou equipamentos; (Origem: PRT MS/GM 1550/2014, Art. 57, III)
IV - realização de despesas com reformas; e (Origem: PRT MS/GM 1550/2014, Art. 57, IV)
V - fornecimento de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e outros produtos para a saúde. (Origem: PRT MS/GM 1550/2014, Art. 57, V)
Parágrafo Único. Os doadores deverão observar a regulamentação expedida pela Secretaria da Receita Federal do Brasil sobre os procedimentos a serem adotados para fruição dos benefícios fiscais relativos ao Imposto sobre a Renda das Pessoas Físicas e Jurídicas, nas doações efetuadas diretamente ao Pronon e ao Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 57, Parágrafo Único)
Art. 58. As informações relativas às doações a projetos do Pronon e do Pronas/PCD são de envio obrigatório pelo Ministério da Saúde à Secretaria da Receita Federal do Brasil, por meio do Programa Gerador da Declaração de Benefícios Fiscais (DBF), conforme instrução normativa da Receita Federal do Brasil. (Origem: PRT MS/GM 1550/2014, Art. 58)
Seção I
Da Transferência de Quantias em Dinheiro e da Abertura e Movimentação das Contas Correntes
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção I)
Art. 59. Os recursos financeiros captados no âmbito do Pronon e do Pronas/PCD serão depositados em conta bancária bloqueada, denominada Conta Captação, e geridas em conta de livre movimentação, denominada Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 59)
§ 1º As contas de que trata o "caput" serão vinculadas a cada projeto e serão abertas pelo Ministério da Saúde em instituição financeira oficial. (Origem: PRT MS/GM 1550/2014, Art. 59, § 1º)
§ 2º O Ministério da Saúde divulgará no Portal Saúde os dados das contas, em até 10 (dez) dias, contados da data de publicação da portaria de aprovação de projeto e de autorização para captação de recursos. (Origem: PRT MS/GM 1550/2014, Art. 59, § 2º)
§ 3º Somente poderão ser depositados na Conta Captação recursos de fontes relacionadas ao mecanismo de incentivo fiscal. (Origem: PRT MS/GM 1550/2014, Art. 59, § 3º)
§ 4º Competirá exclusivamente à instituição zelar para que não seja depositados na Conta Captação recursos oriundos de outras fontes não relacionadas ao mecanismo de renúncia fiscal. (Origem: PRT MS/GM 1550/2014, Art. 59, § 4º)
§ 5º Durante o acompanhamento da execução do projeto, o Ministério da Saúde poderá, motivadamente e a fim de garantir sua regularidade: (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º)
I - determinar o recolhimento parcial ou integral dos recursos constantes da Conta Captação; (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º, I)
II - bloquear a Conta Captação e a movimentação da Conta Movimento; e (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º, II)
III - providenciar a movimentação de recursos da Conta Captação e da Conta Movimento para a Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 59, § 5º, III)
§ 6º Após o prazo de captação ou quando for captada a integralidade dos recursos previstos no projeto, o Ministério da Saúde providenciará o bloqueio da Conta Captação. (Origem: PRT MS/GM 1550/2014, Art. 59, § 6º)
§ 7º Competirá ao Ministério da Saúde providenciar junto à instituição financeira oficial o encerramento de contas após o término da vigência do Termo de Compromisso ou no caso de equívoco de sua abertura. (Origem: PRT MS/GM 1550/2014, Art. 59, § 7º)
Art. 60. Os recursos financeiros oriundos de doação somente poderão ser captados após a publicação da portaria de aprovação de projeto e de autorização para captação de recursos de que trata o art. 54. (Origem: PRT MS/GM 1550/2014, Art. 60)
§ 1º Os recursos serão depositados na Conta Captação por meio de depósito identificado, com a informação obrigatória do CPF ou do CNPJ dos depositantes, ou, desde que tenha sido identificados os depositantes, por Transferência Eletrônica Disponível (TED) ou Documento de Operação de Crédito (DOC), com a informação da modalidade dos depósitos (doação). (Origem: PRT MS/GM 1550/2014, Art. 60, § 1º)
§ 2º Competirá à instituição esclarecer aos doadores quanto à forma de depósito na Conta Captação, informando as opções disponíveis, nos termos do § 1º. (Origem: PRT MS/GM 1550/2014, Art. 60, § 2º)
§ 3º Na hipótese do § 3º, o Ministério da Saúde comunicará o fato à Secretaria da Receita Federal do Brasil, para eventual fiscalização tributária. (Origem: PRT MS/GM 1550/2014, Art. 60, § 4º)
§ 3º Depósitos equivocados na Conta Captação, quando devidamente identificados e justificados, poderão ter o estorno autorizado pelo Ministério da Saúde, para o devido ajuste, desde que o pedido da instituição ocorra em data prévia à celebração do Termo de Compromisso e seja protocolado até o dia 28 de fevereiro do exercício fiscal seguinte à doação equivocadamente realizada. (Origem: PRT MS/GM 1550/2014, Art. 60, § 3º) (com redação dada pela PRT MS/GM 1575/2015) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 4º Depósitos equivocados na Conta Captação, quando devidamente identificados e justificados, poderão ter o estorno autorizado pelo Ministério da Saúde, para o devido ajuste, desde que o pedido da instituição ocorra em data prévia à celebração do Termo de Compromisso e seja protocolado até o dia 28 de fevereiro do exercício fiscal seguinte à doação equivocadamente realizada. (Origem: PRT MS/GM 1550/2014, Art. 60, § 3º) (com redação dada pela PRT MS/GM 1575/2015)
§ 4º Na hipótese do § 3º, o Ministério da Saúde comunicará o fato à Secretaria da Receita Federal do Brasil, para eventual fiscalização tributária. (Origem: PRT MS/GM 1550/2014, Art. 60, § 4º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Art. 61. Para a efetivação da abertura de contas correntes, além dos demais requisitos previstos neste Anexo, a instituição autorizará a instituição financeira oficial, em caráter irrevogável e irretratável, a cumprir as determinações do Ministério da Saúde relativas às movimentações financeiras. (Origem: PRT MS/GM 1550/2014, Art. 61)
Art. 61-A. Os registros necessários para a regularização das Contas Captação e Conta Movimento abertas em instituição financeira oficial deverão ser efetuados no prazo máximo de até 30 (trinta) dias contados da abertura das contas, observadas as normas do Banco Central do Brasil. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
Parágrafo único. A não realização da regularização cadastral de que trata o caput implicará: (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
I - no caso da Conta Captação, a impossibilidade de transferência dos recursos desta conta para a Conta Movimento; e (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
II - no caso da Conta Movimento, a impossibilidade de movimentação dos recursos depositados nesta conta. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
Art. 62. O Ministério da Saúde e a instituição firmarão Termo de Compromisso, cujo prazo máximo de vigência será igual ao prazo de início da vigência do projeto até a última apresentação das demonstrações contábeis e do parecer conclusivo de que trata o art. 92, parágrafo único, e que regulará as obrigações entre as partes, especialmente quanto ao projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 62)
Parágrafo Único. O Ministério da Saúde convocará o representante legal da instituição para assinatura do Termo de Compromisso, depois de comprovada a captação de 100% (cem por cento) dos recursos previstos nos respectivos orçamentos. (Origem: PRT MS/GM 1550/2014, Art. 62, Parágrafo Único)
Art. 63. As Contas Movimento somente poderão ser operadas após a regularização cadastral, pelos respectivos titulares, na agência bancária da instituição financeira oficial onde tenham sido abertas, de acordo com as normas vigentes do Banco Central do Brasil, e depois da autorização do Ministério da Saúde para que a instituição financeira oficial repasse os recursos da Conta Captação para a Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 63)
Art. 63. As Contas Movimento somente poderão ser operadas após a regularização cadastral de que trata o art. 61-A e depois da autorização do Ministério da Saúde para que a instituição financeira oficial repasse os recursos da Conta Captação para a Conta Movimento. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
Art. 64. Caberá à instituição emitir recibo em favor do doador, assinado por pessoa competente, em três vias, para cada depósito efetuado na Conta Captação, observados os requisitos estabelecidos pela Secretaria da Receita Federal do Brasil, e conforme os modelos constantes do Anexo 10 do Anexo LXXXVI sendo: (Origem: PRT MS/GM 1550/2014, Art. 64)
I - a primeira via para o doador; (Origem: PRT MS/GM 1550/2014, Art. 64, I)
II - a segunda via para o Ministério da Saúde; e (Origem: PRT MS/GM 1550/2014, Art. 64, II)
III - a terceira via para controle da própria instituição. (Origem: PRT MS/GM 1550/2014, Art. 64, III)
Parágrafo Único. A instituição encaminhará ao Ministério da Saúde, no prazo de até 20 (vinte) dias, ofício discriminando os números de ordem e os valores dos recibos emitidos, juntamente com os respectivos recibos. (Origem: PRT MS/GM 1550/2014, Art. 64, Parágrafo Único)
Art. 65. O desbloqueio dos recursos financeiros depositados na Conta Captação para fins de início da execução do projeto será condicionado à assinatura e publicação do Termo de Compromisso. (Origem: PRT MS/GM 1550/2014, Art. 65)
Art. 66. É vedada a captação de recursos de entidades vinculadas à instituição proponente. (Origem: PRT MS/GM 1550/2014, Art. 66)
Art. 67. Os recursos captados não poderão ser aplicados em atividades não integrantes do projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 67)
Art. 68. Somente poderão ser iniciadas as execuções dos projetos depois de captados 100% (cem por cento) dos recursos previstos nos respectivos orçamentos. (Origem: PRT MS/GM 1550/2014, Art. 68)
§ 1º A instituição não poderá ressarcir-se de despesas efetuadas em data anterior à celebração do Termo de Compromisso, exceto para captação de recursos e elaboração de projeto. (Origem: PRT MS/GM 1550/2014, Art. 68, § 1º)
§ 2º Para fins de verificação da captação de 100% (cem por cento) dos recursos previstos no orçamento, serão consideradas todas as doações recebidas a título das espécies previstas no art. 57. (Origem: PRT MS/GM 1550/2014, Art. 68, § 2º)
§ 3º As instituições terão o prazo de 90 (noventa) dias para captação dos recursos previstos no art. 59, podendo este prazo ser prorrogável, por mais 30 (trinta) dias, por meio de solicitação formal da instituição, devidamente justificada, antes de findar o prazo final de captação, observado o término do exercício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 68, § 3º)
§ 4º A liberação dos recursos para a Conta Movimento e, portanto, a autorização para início da execução do projeto, estará condicionada à apresentação dos recibos nos casos de doações previstas nos incisos II a V do art. 57, quando houver. (Origem: PRT MS/GM 1550/2014, Art. 68, § 5º)
§ 1º Somente após o prazo de captação previsto no art. 68, § 3º , a instituição executora poderá apresentar ao Ministério da Saúde a proposta de readequação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 69, § 1º)
§ 2º A proposta de readequação será enviada à SE/MS que, no prazo de 10 (dez) dias, remeterá ao órgão do Ministério da Saúde Competente. (Origem: PRT MS/GM 1550/2014, Art. 69, § 2º)
§ 3º O órgão do Ministério da Saúde que aprovou o projeto terá o prazo de 30 (trinta) dias do recebimento da proposta de readequação para emitir parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 69, § 3º)
§ 4º Após o recebimento do parecer técnico conclusivo, a SE/MS providenciará a publicação de Portaria com a divulgação do resultado da análise dos projetos de readequação, no prazo de 10 (dez) dias, contado do recebimento do parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 69, § 4º)
§ 5º Caso a instituição não apresente a readequação do projeto no prazo estabelecido no "caput" ou caso a readequação seja reprovada, os recursos captados deverão ser recolhidos à Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 69, § 5º)
Art. 68. Somente poderão ser iniciadas as execuções dos projetos depois de captados 100% (cem por cento) dos recursos previstos nos respectivos orçamentos. (Origem: PRT MS/GM 1550/2014, Art. 68) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 1º A instituição não poderá ressarcir-se de despesas efetuadas em data anterior à celebração do Termo de Compromisso, exceto para captação de recursos e elaboração de projeto. (Origem: PRT MS/GM 1550/2014, Art. 68, § 1º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 2º Para fins de verificação da captação de 100% (cem por cento) dos recursos previstos no orçamento, serão consideradas todas as doações recebidas a título das espécies previstas no art. 57. (Origem: PRT MS/GM 1550/2014, Art. 68, § 2º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 3º As instituições terão o prazo de 90 (noventa) dias para captação dos recursos previstos no art. 59, podendo este prazo ser prorrogável, por mais 30 (trinta) dias, por meio de solicitação formal da instituição, devidamente justificada, antes de findar o prazo final de captação, observado o término do exercício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 68, § 3º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020) (Revogado pela PRT GM/MS n° 3.314 de 12.03.2024)
§ 4º A liberação dos recursos para a Conta Movimento e, portanto, a autorização para início da execução do projeto, estará condicionada à apresentação dos recibos nos casos de doações previstas nos incisos II a V do art. 57, quando houver. (Origem: PRT MS/GM 1550/2014, Art. 68, § 5º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Art. 69. Caso não haja a captação integral dos recursos financeiros no prazo previsto no art. 68, § 3º , desde que tenham sido captados pelo menos 60% dos recursos, a instituição enviará, no prazo de 30 (trinta) dias contados do término do período de captação de recursos, readequação das ações previstas no projeto aprovado ao valor total obtido na captação, mediante aprovação prévia do Ministério da Saúde, para fins de execução dos recursos financeiros. (Origem: PRT MS/GM 1550/2014, Art. 69) (com redação dada pela PRT MS/GM 1575/2015)
§ 1º A proposta de readequação de que trata o "caput" será enviada à SE/MS que, no prazo de 10 (dez) dias, remeterá ao órgão do Ministério da Saúde competente. (Origem: PRT MS/GM 1550/2014, Art. 70, § 1º)
§ 2º O órgão do Ministério da Saúde que aprovou o projeto terá o prazo de 30 (trinta) dias do recebimento da proposta de readequação para emitir parecer técnico conclusivo em relação à readequação de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 70, § 2º)
§ 3º Após receber o parecer técnico de que trata o § 2º, a SE/MS providenciará a publicação de portaria com a divulgação do resultado da análise das readequações do projeto, no prazo máximo de 10 (dez) dias, contado do recebimento do parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 70, § 3º)
§ 4º Os recursos captados remanescentes serão recolhidos na forma do art. 88. (Origem: PRT MS/GM 1550/2014, Art. 70, § 4º)
Art. 69. Caso não haja a captação integral dos recursos financeiros no prazo previsto no art. 68, § 3º , desde que tenham sido captados pelo menos 60% dos recursos, a instituição enviará, no prazo de 30 (trinta) dias contados do término do período de captação de recursos, readequação das ações previstas no projeto aprovado ao valor total obtido na captação, mediante aprovação prévia do Ministério da Saúde, para fins de execução dos recursos financeiros. (Origem: PRT MS/GM 1550/2014, Art. 69) (com redação dada pela PRT MS/GM 1575/2015) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 1º Somente após o prazo de captação previsto no art. 68, § 3º , a instituição executora poderá apresentar ao Ministério da Saúde a proposta de readequação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 69, § 1º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 2º A proposta de readequação será enviada à SE/MS que, no prazo de 10 (dez) dias, remeterá ao órgão do Ministério da Saúde Competente. (Origem: PRT MS/GM 1550/2014, Art. 69, § 2º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 3º O órgão do Ministério da Saúde que aprovou o projeto terá o prazo de 30 (trinta) dias do recebimento da proposta de readequação para emitir parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 69, § 3º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 4º Após o recebimento do parecer técnico conclusivo, a SE/MS providenciará a publicação de Portaria com a divulgação do resultado da análise dos projetos de readequação, no prazo de 10 (dez) dias, contado do recebimento do parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 69, § 4º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 5º Caso a instituição não apresente a readequação do projeto no prazo estabelecido no "caput" ou caso a readequação seja reprovada, os recursos captados deverão ser recolhidos à Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 69, § 5º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Art. 70. A instituição poderá enviar, no prazo de 30 (trinta) dias contados do término do período de captação de recursos, readequação para maior do orçamento do projeto aprovado, em até 20% (vinte por cento), a critério do Ministério da Saúde, na hipótese da captação de recursos realizada ser superior ao orçamento previsto no projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 70) (com redação dada pela PRT MS/GM 1575/2015)
Art. 70. A instituição poderá enviar, no prazo de 30 (trinta) dias contados do término do período de captação de recursos, readequação para maior do orçamento do projeto aprovado, em até 20% (vinte por cento), a critério do Ministério da Saúde, na hipótese da captação de recursos realizada ser superior ao orçamento previsto no projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 70) (com redação dada pela PRT MS/GM 1575/2015) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 1º A proposta de readequação de que trata o "caput" será enviada à SE/MS que, no prazo de 10 (dez) dias, remeterá ao órgão do Ministério da Saúde competente. (Origem: PRT MS/GM 1550/2014, Art. 70, § 1º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 2º O órgão do Ministério da Saúde que aprovou o projeto terá o prazo de 30 (trinta) dias do recebimento da proposta de readequação para emitir parecer técnico conclusivo em relação à readequação de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 70, § 2º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 3º Após receber o parecer técnico de que trata o § 2º, a SE/MS providenciará a publicação de portaria com a divulgação do resultado da análise das readequações do projeto, no prazo máximo de 10 (dez) dias, contado do recebimento do parecer técnico conclusivo. (Origem: PRT MS/GM 1550/2014, Art. 70, § 3º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 4º Os recursos captados remanescentes serão recolhidos na forma do art. 88. (Origem: PRT MS/GM 1550/2014, Art. 70, § 4º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
Seção II
Da Transferência de Bens Móveis e Imóveis
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção II)
Art. 71. A transferência de bens móveis ou imóveis será feita diretamente aos órgãos e entidades públicas integrantes da administração pública direta e indireta da União, estados, Distrito Federal e municípios. (Origem: PRT MS/GM 1550/2014, Art. 71)
§ 1º A instituição participante do Pronon e do Pronas/PCD deverá obter aceitação do gestor local do SUS para as providências de transferência do bem para a administração pública. (Origem: PRT MS/GM 1550/2014, Art. 71, § 1º)
§ 2º A instituição poderá fazer uso do bem durante a vigência do projeto. (Origem: PRT MS/GM 1550/2014, Art. 71, § 2º)
§ 3º Somente será admitida a doação de bens móveis novos. (Origem: PRT MS/GM 1550/2014, Art. 71, § 3º)
§ 4º Na doação de bens móveis, o doador deverá apresentar a nota fiscal dos bens. (Origem: PRT MS/GM 1550/2014, Art. 71, § 4º)
Art. 72. Na hipótese de doação de bens imóveis, o doador deverá considerar como valor dos bens doados o constante da última Declaração de Bens e Direitos da Declaração de Ajuste Anual ou valor pago no caso de bens adquiridos no mesmo ano da doação, que não poderá ultrapassar o valor de mercado. (Origem: PRT MS/GM 1550/2014, Art. 72)
Seção III
Da Realização de Despesas com Reformas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção III)
Art. 73. No caso de despesas com reformas, executadas a título de doação, a comprovação será feita mediante a apresentação de notas fiscais, contrato de prestação de serviço ou de recibos devidamente assinados com a perfeita identificação da fonte pagadora, do beneficiário e discriminação a que se refere o pagamento. (Origem: PRT MS/GM 1550/2014, Art. 73)
Seção IV
Da Doação de Medicamentos, Kits Diagnósticos, Materiais Médico-Hospitalares, Órteses, Próteses e Outros Produtos para a Saúde
(Origem: PRT MS/GM 1550/2014, CAPÍTULO V, Seção IV)
Art. 74. As doações de medicamentos, kits diagnósticos, materiais médico-hospitalares, órteses, próteses e outros produtos para saúde somente poderão ser feitas por pessoas jurídicas e com apresentação de nota fiscal dos produtos doados. (Origem: PRT MS/GM 1550/2014, Art. 74)
§ 1º O prazo de validade dos produtos, quando for o caso, não poderá ser inferior a 12 (doze) meses. (Origem: PRT MS/GM 1550/2014, Art. 74, § 1º)
§ 2º O preço unitário dos produtos doados constante da nota fiscal não poderá exceder o preço incluído no orçamento aprovado, baseado nos sistemas de informação de que trata o art. 39. (Origem: PRT MS/GM 1550/2014, Art. 74, § 2º)
Seção V
Do remanejamento de recursos entre projetos no âmbito do Pronon e do Pronas/PCD
(Origem: PRT MS/GM 1550/2014, Seção I-A) (dispositivo acrescentado pela PRT MS/GM 1575/2015)
Art. 75. Será facultado à SE/MS remanejar recursos entre Contas Captação de diferentes projetos da mesma entidade credenciada no âmbito do Pronon e do Pronas/PCD, mediante solicitação formal da instituição credenciada e sem que acarrete prejuízos ao incentivador quanto ao benefício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 70-A)
§ 1º O remanejamento de que trata o "caput" somente poderá ser solicitado caso ambos os projetos sejam exclusivamente do Pronon ou exclusivamente do Pronas/PCD, após o encerramento do período de captação de recursos e previamente ao envio da readequação do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 1º)
§ 2º O projeto a ser beneficiado fará jus aos recursos remanejados até o limite de 20% (vinte por cento) a maior do valor aprovado por meio de portaria de aprovação do projeto e de autorização para captação de recursos de que trata o art. 54. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 3º)
§ 3º A instituição deverá apresentar readequação do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado em até 30 (trinta) dias contados do efetivo remanejamento de recursos. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 4º)
§ 4º É dispensada apresentação de readequação do projeto cedente do qual serão remanejados os recursos, quando a solicitação de remanejamento de recursos referir-se a valores que excedam o percentual máximo disposto no § 1º , podendo o remanejamento ocorrer em qualquer fase de execução do projeto cedente, excetuando-se saldo remanescente ao fim de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 5º)
§ 5º Quando os recursos captados não atingirem o percentual mínimo do § 1º , os recursos do projeto cedente também poderão ser remanejados, respeitando-se o limite disposto no § 3º e as vedações do art. 76, restando, no entanto, reprovado o projeto cedente e devendo-se recolher eventual saldo remanescente nos termos do art. 77. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 6º)
§ 6º Caso a instituição não observe os prazos do § 4º ou caso a readequação seja reprovada pelo órgão do Ministério da Saúde competente, os recursos remanejados deverão ser recolhidos à Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 7º)
§ 7º A SE/MS dará conhecimento ao Comitê Gestor do Pronon e do Pronas/PCD sobre os efetivos remanejamentos de recursos, em reunião ordinária subsequente, ou, se for o caso, em reunião extraordinária. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 8º)
§ 8º Excepcionalmente para os projetos apresentados em 2014 e 2015, o remanejamento de que trata o "caput" poderá ser solicitado após o encerramento do período de captação de recursos e previamente à celebração do termo de compromisso do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado, observados os termos dos §§ 3º e 4º. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 2º) (com redação dada pela PRT MS/GM 823/2016)
Art. 75. Será facultado à SE/MS remanejar recursos entre Contas Captação de diferentes projetos da mesma entidade credenciada no âmbito do Pronon e do Pronas/PCD, mediante solicitação formal da instituição credenciada e sem que acarrete prejuízos ao incentivador quanto ao benefício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 70-A) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 1º O remanejamento de que trata o "caput" somente poderá ser solicitado caso ambos os projetos sejam exclusivamente do Pronon ou exclusivamente do Pronas/PCD, após o encerramento do período de captação de recursos e previamente ao envio da readequação do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 1º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 2º Excepcionalmente para os projetos apresentados em 2014 e 2015, o remanejamento de que trata o "caput" poderá ser solicitado após o encerramento do período de captação de recursos e previamente à celebração do termo de compromisso do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado, observados os termos dos §§ 3º e 4º. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 2º) (com redação dada pela PRT MS/GM 823/2016) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 3º O projeto a ser beneficiado fará jus aos recursos remanejados até o limite de 20% (vinte por cento) a maior do valor aprovado por meio de portaria de aprovação do projeto e de autorização para captação de recursos de que trata o art. 54. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 3º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 4º A instituição deverá apresentar readequação do projeto cedente do qual serão remanejados os recursos e do projeto a ser beneficiado em até 30 (trinta) dias contados do efetivo remanejamento de recursos. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 4º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 5º É dispensada apresentação de readequação do projeto cedente do qual serão remanejados os recursos, quando a solicitação de remanejamento de recursos referir-se a valores que excedam o percentual máximo disposto no art. 70, podendo o remanejamento ocorrer em qualquer fase de execução do projeto cedente, excetuandose saldo remanescente ao fim de execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 5º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 6º Quando os recursos captados não atingirem o percentual mínimo do art. 69, os recursos do projeto cedente também poderão ser remanejados, respeitandose o limite disposto no § 3º e as vedações do art. 76, restando, no entanto, reprovado o projeto cedente e devendo-se recolher eventual saldo remanescente nos termos do art. 77. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 6º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 7º Caso a instituição não observe os prazos do § 4º ou caso a readequação seja reprovada pelo órgão do Ministério da Saúde competente, os recursos remanejados deverão ser recolhidos à Conta Única do Tesouro Nacional. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 7º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
§ 8º A SE/MS dará conhecimento ao Comitê Gestor do Pronon e do Pronas/PCD sobre os efetivos remanejamentos de recursos, em reunião ordinária subsequente, ou, se for o caso, em reunião extraordinária. (Origem: PRT MS/GM 1550/2014, Art. 70-A, § 8º) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020) (Revogado pela PRT GM/MS nº 695 de 06.04.2020)
Art. 76. É vedado o remanejamento de recursos entre projetos quando: (Origem: PRT MS/GM 1550/2014, Art. 70-B)
I - não forem observados os critérios do art. 75; (Origem: PRT MS/GM 1550/2014, Art. 70-B, I)
II - o projeto cedente do qual serão remanejados os recursos e o projeto a ser beneficiado não pertencerem ambos ao Pronon ou ao Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 70-B, II)
III - o projeto cedente do qual serão remanejados os recursos e o projeto a ser beneficiado forem apresentados por instituições credenciadas com CNPJ distintos; (Origem: PRT MS/GM 1550/2014, Art. 70-B, III)
IV - o projeto cedente restar economicamente inviabilizado nos termos do § 1º ; (Origem: PRT MS/GM 1550/2014, Art. 70-B, IV)
IV - o projeto cedente restar economicamente inviabilizado nos termos do art. 69; (Origem: PRT MS/GM 1550/2014, Art. 70-B, IV) (Retificado pelo DOU Seção 1, Página 185, do dia 12.03.2020)
V - o projeto cedente do qual serão remanejados os recursos e o projeto a ser beneficiado não forem apresentados no mesmo ano fiscal; e (Origem: PRT MS/GM 1550/2014, Art. 70-B, V)
VI - tratar-se de saldo remanescente ao fim de execução de projeto. (Origem: PRT MS/GM 1550/2014, Art. 70-B, VI)
Art. 77. Quando não houver possibilidade de remanejamento, os recursos serão devolvidos à Conta Única do Tesouro Nacional por meio de Guia de Recolhimento da União (GRU), sem prejuízo ao incentivador quanto ao benefício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 70-C)
Art. 78. A SE/MS publicará Portaria com o resultado da análise da solicitação de remanejamento de recursos no prazo de 20 (vinte) dias contados da data de protocolo da solicitação no Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 70-D)
Art. 79. Do indeferimento do remanejamento de recursos de que trata o art. 75, caberá recurso, no prazo de 5 (cinco) dias contados da notificação da instituição credenciada, à autoridade que proferiu a decisão, que, se não a reconsiderar no prazo de 5 (cinco) dias, o encaminhará à autoridade superior. (Origem: PRT MS/GM 1550/2014, Art. 70-E)
CAPÍTULO VI
DA EXECUÇÃO DOS PROJETOS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VI)
Art. 80. Os recursos da Conta Movimento serão destinados exclusivamente ao pagamento das despesas constantes do projeto aprovado, devendo sua movimentação se realizar por meio de qualquer operação bancária autorizada pelo Banco Central do Brasil, desde que fique identificada sua destinação e, no caso de pagamento, o credor. (Origem: PRT MS/GM 1550/2014, Art. 75)
Parágrafo Único. Fica vedado, em qualquer hipótese, o saque em espécie. (Origem: PRT MS/GM 1550/2014, Art. 75, Parágrafo Único)
Art. 81. Nenhuma aplicação dos recursos poderá ser efetuada mediante intermediação. (Origem: PRT MS/GM 1550/2014, Art. 76)
Parágrafo Único. Não configura intermediação a contratação de serviços de: (Origem: PRT MS/GM 1550/2014, Art. 76, Parágrafo Único)
I - elaboração de projetos de ações ou serviços para a obtenção de doação; e (Origem: PRT MS/GM 1550/2014, Art. 76, Parágrafo Único, I)
II - captação de recursos. (Origem: PRT MS/GM 1550/2014, Art. 76, Parágrafo Único, II)
Art. 82. Nas hipóteses previstas em Lei, Regulamento ou nesta Portaria, impõe-se a aplicação dos recursos no mercado financeiro, a qual deverá ser feita, obrigatoriamente, em fundo de aplicação financeira de curto prazo ou em operação de mercado aberto, lastreada em título da dívida pública federal. (Origem: PRT MS/GM 1550/2014, Art. 77)
Art. 82. Os recursos financeiros creditados nas Conta Captação e Conta Movimento serão aplicados automaticamente pela instituição financeira oficial em conta poupança. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
§ 1º O titular da Conta Movimento deverá, no momento da regularização cadastral de que trata o art. 61-A, optar por manter os recursos aplicados em: (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
a) conta poupança; ou (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
b) fundos de aplicação financeira de curto prazo, lastreados em títulos da dívida pública federal, com resgates automáticos, indicados pela instituição financeira oficial. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
§ 2º Caberá à instituição participante o acompanhamento dos depósitos, certificando-se de que todos os recursos captados estejam em conta poupança ou aplicados em fundos de aplicação financeira, sendo sua responsabilidade a reposição do equivalente aos rendimentos da conta poupança pelo período de não aplicação dos recursos. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
§ 3° Os rendimentos obtidos em função das aplicações financeiras de que trata este artigo: (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
I - quando incidentes sobre a Conta Captação: (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
a) serão apurados apenas ao término do período de captação dos recursos; e (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
b) não serão computados no cálculo dos montantes captados para fins de apuração da captação integral ou captação mínima para fins de readequação do projeto de que trata os art. 68 e 69, respectivamente; e (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
II - quando incidentes sobre a Conta Movimento: (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
a) serão apurados mensalmente e constituirão receita do projeto ao qual esteja vinculada; (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
b) serão utilizados em ações do projeto aprovado para a obtenção do melhor resultado para a execução do projeto, a critério da instituição, que deverá justificar a escolha realizada na apresentação da prestação de contas; e (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
c) não poderão ser utilizados em despesas administrativas, despesas de elaboração dos projetos e captação de recursos, salvo quando devidamente fundamentado e expressamente autorizado pelo Ministério da Saúde. (Redação dada pela PRT GM/MS nº 751 de 08.04.2020)
Parágrafo Único. Os rendimentos obtidos em função das aplicações financeiras de que trata o "caput" deverão ser utilizados exclusivamente nas ações do projeto aprovado, estando sujeitos às mesmas condições de prestação de contas exigidas para os recursos incentivados, devendo o proponente justificar, quando da apresentação das prestações de contas, a ação escolhida, tendo como critério a obtenção do melhor resultado para a execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 77, Parágrafo Único) (Revogado pela PRT GM/MS n° de 1.484 de 03.06.2020)
Art. 83. Cada lançamento efetuado a débito na Conta Movimento deverá corresponder a um comprovante de sua regular aplicação no projeto aprovado. (Origem: PRT MS/GM 1550/2014, Art. 78)
Art. 84. A instituição não poderá realizar pagamentos anteriores à celebração do Termo de Compromisso ou posteriores ao prazo de execução do projeto aprovado, sob pena de ressarcimento e demais penalidades previstas na legislação vigente. (Origem: PRT MS/GM 1550/2014, Art. 79)
Art. 85. Os documentos comprobatórios das despesas serão emitidos única e exclusivamente em nome da instituição beneficiária. (Origem: PRT MS/GM 1550/2014, Art. 80)
Parágrafo Único. A instituição registrará o número do processo administrativo referente ao projeto aprovado no âmbito do Pronon ou do Pronas/PCD em todos os documentos que comprovem as despesas. (Origem: PRT MS/GM 1550/2014, Art. 80, Parágrafo Único)
Art. 86. O Ministério da Saúde decidirá sobre eventual pedido de prorrogação de prazo para a execução do projeto, uma única vez, desde que fundamentado e apresentado pelo proponente em até 60 (sessenta) dias antes de encerrar o prazo inicialmente previsto para sua execução. (Origem: PRT MS/GM 1550/2014, Art. 81)
Art. 87. Quaisquer alterações no Plano de Trabalho do projeto autorizado serão submetidas à apreciação do órgão do Ministério da Saúde competente, com justificativas necessárias. (Origem: PRT MS/GM 1550/2014, Art. 82)
Parágrafo Único. O órgão do Ministério da Saúde competente terá o prazo de 10 (dez) dias para se manifestar formalmente acerca da alteração de que trata o "caput". (Origem: PRT MS/GM 1550/2014, Art. 82, Parágrafo Único)
Art. 88. Os recursos deverão ser recolhidos à Conta Única do Tesouro Nacional, por meio de Guia de Recolhimento da União (GRU), sem prejuízo ao doador quanto ao benefício fiscal, quando: (Origem: PRT MS/GM 1550/2014, Art. 83)
I - a instituição se negar a celebrar o Termo de Compromisso junto ao Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 83, I)
II - a instituição for considerada inabilitada, nos termos do art. 12 do Decreto nº 7.988, de 2013; (Origem: PRT MS/GM 1550/2014, Art. 83, II)
III - a instituição for descredenciada, nos termos do art. 22; (Origem: PRT MS/GM 1550/2014, Art. 83, III)
IV - houver impossibilidade de readequação do projeto; (Origem: PRT MS/GM 1550/2014, Art. 83, IV)
V - houver saldo remanescente em relação ao orçamento do projeto; (Origem: PRT MS/GM 1550/2014, Art. 83, V)
VI - houver saldo remanescente ao fim da execução do projeto; e (Origem: PRT MS/GM 1550/2014, Art. 83, VI)
VII - em caso de reprovação, parcial ou final, da execução do projeto. (Origem: PRT MS/GM 1550/2014, Art. 83, VII)
§ 1º Os recursos da Conta Captação e da Conta Movimento deverão ser recolhidos pela instituição beneficiária à Conta Única do Tesouro Nacional, no prazo de até 30 (trinta) dias, da notificação emitida pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 83, § 1º)
§ 2º O comprovante do recolhimento de saldo remanescente deverá ser apresentado juntamente com a prestação de contas do projeto, quando for o caso. (Origem: PRT MS/GM 1550/2014, Art. 83, § 2º)
CAPÍTULO VII
DO MONITORAMENTO, DA PRESTAÇÃO DE CONTAS E DA AVALIAÇÃO TÉCNICA
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII)
Seção I
Do Monitoramento
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII, Seção I)
Art. 89. As doações captadas pelas instituições no âmbito do Pronon e do Pronas/PCD são recursos públicos e estão sujeitas a acompanhamento, prestação de contas e avaliação técnica. (Origem: PRT MS/GM 1550/2014, Art. 84)
§ 1º A não aplicação sem justa causa ou aplicação incorreta dos recursos no âmbito do Pronon e do Pronas/PCD poderá ensejar instauração de Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 84, § 1º)
§ 2º As instituições deverão permitir e facilitar aos representantes do Ministério da Saúde o acesso a toda documentação, dependências e locais do projeto, a fiscalização por meio de auditorias, vistorias "in loco" e demais diligências de acompanhamento, que serão realizadas diretamente pelo Ministério da Saúde, por suas entidades vinculadas, ou mediante parceria com outros órgãos federais, estaduais e municipais. (Origem: PRT MS/GM 1550/2014, Art. 84, § 2º)
§ 3º A unidade executora do projeto será a própria instituição, que se responsabilizará integralmente por todos os atos, contratos e obrigações referentes à execução do projeto, não podendo atribuir a terceiros as atividades principais objeto do projeto, conforme previsto no plano de trabalho aprovado pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 84, § 3º)
§ 4º As diligências previstas no § 2º serão registradas em relatório de monitoramento do projeto, que integrará os autos do processo administrativo. (Origem: PRT MS/GM 1550/2014, Art. 84, § 4º)
§ 5º Caso necessário, o órgão do Ministério da Saúde responsável pelo acompanhamento e fiscalização do projeto poderá notificar a instituição a prestar esclarecimentos no prazo de 20 (vinte) dias. (Origem: PRT MS/GM 1550/2014, Art. 84, § 5º)
§ 6º O Ministério da Saúde determinará a suspensão do projeto, verificada a omissão da instituição no atendimento às diligências ou decorrido o prazo do § 5º sem o devido atendimento da notificação, e adotará as demais providências necessárias para a apuração de responsabilidade e o ressarcimento dos prejuízos ao erário. (Origem: PRT MS/GM 1550/2014, Art. 84, § 6º)
Seção II
Da Prestação de Contas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII, Seção II)
Art. 90. Será responsabilidade das instituições comprovar a correta aplicação dos recursos financeiros recebidos ao final do desenvolvimento das ações e serviços realizado no âmbito dos projetos, ou anualmente, se o projeto for executado em um período superior a 1 (um) ano. (Origem: PRT MS/GM 1550/2014, Art. 85)
Parágrafo Único. A apuração de eventuais ajustes contábeis no projeto observará a vigência do Termo de Compromisso em que está inserido, não sendo permitido remanejamento de saldo financeiro ou de qualquer outro recurso para eventual Termo de Compromisso subsequente. (Origem: PRT MS/GM 1550/2014, Art. 85, Parágrafo Único)
Art. 91. O relatório de execução do projeto, equivalente à prestação de contas, conterá informações sobre o conteúdo e o valor das atividades previstas e executadas e as demais informações acerca do desempenho físico-financeiro do projeto em relação ao respectivo projeto aprovado pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 86)
Parágrafo Único. O relatório de execução do projeto será enviado ao Ministério da Saúde por meio de carta com Aviso de Recebimento (AR) ou SEDEX ou entregue diretamente no Protocolo Central do Ministério da Saúde, contando como destinatário "Ministério da Saúde - Pronon ou Pronas/PCD - Esplanada dos Ministérios, Bloco G, Protocolo Central, CEP 70058-900 Brasília- DF". (Origem: PRT MS/GM 1550/2014, Art. 86, Parágrafo Único)
Art. 92. Os relatórios de execução dos projetos deverão estar acompanhados de demonstrações contábeis e financeiras, submetidas a parecer conclusivo de auditoria independente, realizada por instituição credenciada perante o respectivo Conselho Regional de Contabilidade (CRC). (Origem: PRT MS/GM 1550/2014, Art. 87)
Parágrafo Único. As demonstrações contábeis do projeto e o relatório de auditoria serão apresentados anualmente até o dia 30 de abril de cada ano de execução o projeto, juntamente com o relatório de execução, bem como no ano seguinte ao último exercício fiscal em que houve execução do projeto, devendo ser instruídos com os seguintes documentos: (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único)
I - relatório de cumprimento do objeto, no qual serão discriminados os resultados esperados e atingidos, os objetivos previstos e alcançados e os custos estimados e reais; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, I)
II - relatório final de execução físico-financeira; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, II)
III - relatório de execução de receitas e despesas; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, III)
IV - relação de pagamentos; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, IV)
V - cópia do extrato da conta bancária específica, desde o dia do recebimento dos recursos até a data do último pagamento; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, V)
VI - demonstrativo de rendimentos das aplicações; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, VI)
VII - comprovante de recolhimento dos recursos não aplicados, mediante Guia de Recolhimento da União (GRU), quando houver; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, VII)
VIII - comprovante de transferência dos recursos não utilizados da Conta Movimento para Conta Captação, quando houver; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, VIII)
IX - cópia dos documentos comprobatórios das despesas da prestação de contas; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, IX)
X - relação de bens adquiridos ou produzido com recursos do Pronon ou do Pronas/PCD; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, X)
XI - fotografias e reportagens que comprovem a execução do projeto; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XI)
XII - relação de equipamentos e materiais permanentes adquiridos para as atividades do projeto, contendo o número e/ou identificação do projeto e controlados em inventário físico específico; (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XII)
XIII - informações lançadas no CIHA; e (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XIII)
XIV - comprovante de encerramento da Conta Movimento. (Origem: PRT MS/GM 1550/2014, Art. 87, Parágrafo Único, XIV)
Art. 93. Na ocasião da apresentação de relatório de auditoria e das demonstrações contábeis, a instituição poderá apresentar retificação ao relatório anual de execução do projeto referente ao mesmo exercício fiscal. (Origem: PRT MS/GM 1550/2014, Art. 88)
Art. 94. É responsabilidade da instituição, efetuar a retenção e os recolhimentos de impostos e contribuições que incidirem sobre os recursos movimentados, serviços contratados e obrigações decorrentes de relações de trabalho. (Origem: PRT MS/GM 1550/2014, Art. 89)
Art. 95. Cabe à instituição emitir comprovantes em favor dos doadores, bem como manter o controle documental das receitas e despesas do projeto, pelo prazo de 5 (cinco) anos, contado da aprovação da prestação de contas, à disposição do Ministério da Saúde e dos órgãos de controle e fiscalização, caso seja instado a apresenta-las, respeitada a regulamentação da Secretaria da Receita Federal do Brasil. (Origem: PRT MS/GM 1550/2014, Art. 90)
§ 1º As faturas, recibos, notas fiscais, cheques emitidos e quaisquer outros documentos abrangidos por este artigo deverão conter a discriminação dos serviços contratados e dos produtos adquiridos, o número de registro no SIPAR e o nome do projeto. (Origem: PRT MS/GM 1550/2014, Art. 90, § 1º)
§ 2º Caso não haja possibilidade do prestador de serviços informar eletronicamente o número de registro no SIPAR e o nome do projeto, caberá ao representante legal da instituição declará-los expressamente no próprio documento. (Origem: PRT MS/GM 1550/2014, Art. 90, § 2º)
Seção III
Da Análise da Prestação de Contas
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VII, Seção III)
Art. 96. Caberá ao órgão do Ministério da Saúde que emitiu o parecer técnico conclusivo favorável à aprovação do projeto realizar a análise das atividades executadas, com emissão de parecer conclusivo do relatório em até 90 (noventa) dias, contados da data de recebimento. (Origem: PRT MS/GM 1550/2014, Art. 91)
§ 1º A análise dos aspectos contábeis e financeiros das prestações de contas dos projetos será feita pelo Fundo Nacional de Saúde e a emissão do parecer conclusivo, incluindo a avaliação da execução física, pelo órgão do Ministério que emitiu o parecer conclusivo de aprovação do projeto. (Origem: PRT MS/GM 1550/2014, Art. 91, § 1º)
§ 2º Para fins de elaboração do parecer de que trata o "caput", o órgão do Ministério da Saúde competente poderá solicitar quaisquer informações necessárias à instituição participante, que deverá responder em até 15 (quinze) dias contados de sua notificação, por meio de correio eletrônico, caso em que o prazo previsto no "caput" ficará suspenso até a data de recebimento dessas informações. (Origem: PRT MS/GM 1550/2014, Art. 91, § 2º)
§ 3º A ausência de manifestação da instituição no prazo previsto no § 1º poderá implicar a reprovação do relatório. (Origem: PRT MS/GM 1550/2014, Art. 91, § 3º)
Art. 97. O parecer de prestação de contas abordará, no mínimo, os seguintes aspectos: (Origem: PRT MS/GM 1550/2014, Art. 92)
I - confirmação da apresentação dos documentos relacionados no art. 92, parágrafo único referente à análise da execução do objeto e dos objetivos do projeto; (Origem: PRT MS/GM 1550/2014, Art. 92, I)
II - comparação entre os resultados esperados e os atingidos pelo projeto; e (Origem: PRT MS/GM 1550/2014, Art. 92, II)
III - outros aspectos considerados relevantes pelo Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 92, III)
§ 1º Caso o parecer conclua pelo descumprimento do objeto, a área técnica deverá indicar as metas ou as atividades descumpridas, recomendando a devolução dos recursos correspondentes. (Origem: PRT MS/GM 1550/2014, Art. 92, § 1º)
§ 2º Em caso de descumprimento integral do objeto, atestado no parecer de avaliação técnica, fica dispensada a análise financeira da prestação de contas. (Origem: PRT MS/GM 1550/2014, Art. 92, § 2º)
§ 3º Quando as contas e demais documentos comprobatórios do cumprimento do objeto do projeto não forem apresentados no prazo estipulado no art. 92, parágrafo único, o Ministério da Saúde registrará a inadimplência da instituição e a notificará, uma única vez, para que regularize a prestação de contas em 30 (trinta) dias, sob pena de reprovação. (Origem: PRT MS/GM 1550/2014, Art. 92, § 3º)
§ 4º Para elaboração do parecer a que se refere este artigo, o Ministério da Saúde poderá: (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º)
I - valer-se de informações, documentos ou outros elementos obtidos junto a autoridades públicas; (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º, I)
II - solicitar quaisquer informações, documentos ou outros elementos que julgar necessários; e (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º, II)
III - diligenciar a instituição para que apresente informações, documentos e outros esclarecimentos que julgar necessários para que possa avaliar a prestação de contas. (Origem: PRT MS/GM 1550/2014, Art. 92, § 4º, III)
Art. 98. Os pareceres técnicos serão submetidos à autoridade máxima do órgão do Ministério da Saúde competente, para decisão de aprovação, aprovação com ressalvas ou reprovação. (Origem: PRT MS/GM 1550/2014, Art. 93)
§ 1º O projeto será considerado aprovado integralmente quando o parecer técnico atestar a aplicação regular dos recursos e indicar que o projeto teve avaliação técnica satisfatória. (Origem: PRT MS/GM 1550/2014, Art. 93, § 1º)
§ 2º O projeto será considerado aprovado com ressalvas quando, apesar de regulares as contas, tiver obtido avaliação técnica insatisfatória com fundamento nos aspectos do art. 97, desde que não resulte em prejuízo ao erário ou descumprimento do objeto. (Origem: PRT MS/GM 1550/2014, Art. 93, § 2º)
§ 3º O projeto será considerado reprovado quando: (Origem: PRT MS/GM 1550/2014, Art. 93, § 3º)
I - o objeto tenha sido descumprido, conforme atestado no parecer de avaliação técnica; ou (Origem: PRT MS/GM 1550/2014, Art. 93, § 3º, I)
II - a prestação de contas não seja considerada regular, ainda que o resultado do parecer de avaliação técnica tenha sido favorável quanto ao cumprimento do objeto. (Origem: PRT MS/GM 1550/2014, Art. 93, § 3º, II)
§ 4º A omissão na prestação de contas também é causa de reprovação, podendo ser sanada se apresentada até o julgamento da Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 93, § 4º)
Art. 99. O ato de aprovação, aprovação com ressalva ou reprovação poderá ser revisto de ofício pela autoridade máxima do órgão do Ministério da Saúde competente, a qualquer tempo, de forma justificada. (Origem: PRT MS/GM 1550/2014, Art. 94)
Art. 100. Caberá à SE/MS providenciar a publicação do resultado da análise da prestação de contas. (Origem: PRT MS/GM 1550/2014, Art. 95)
Art. 101. Quando a decisão for pela reprovação da prestação de contas, será assinalado o prazo de 30 (trinta) dias à instituição para recolhimento dos recursos que tenham sido irregularmente aplicados, atualizados desde a captação, pelo índice oficial da caderneta de poupança. (Origem: PRT MS/GM 1550/2014, Art. 96)
§ 1º As notificações para o recolhimento de que trata este artigo poderão ser expedidas com aviso de recebimento ou outra forma que assegure a ciência do interessado, sem prejuízo de notificação por correspondência eletrônica. (Origem: PRT MS/GM 1550/2014, Art. 96, § 1º)
§ 2º Esgotado o prazo sem o cumprimento das exigências ou solicitação de parcelamento de débito, caberá ao Ministério da Saúde providenciar a comunicação ao órgão de controle interno para instauração de Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 96, § 2º)
Art. 102. Quando a decisão for pela aprovação com ressalva em virtude de execução parcial do projeto, a decisão de que trata o art. 93 assinalará prazo de 30 (trinta) dias à instituição para recolhimento dos recursos remanescentes à Conta Única do Tesouro Nacional, incluídos os rendimentos da aplicação financeira, caso o proponente não os tenha recolhido espontaneamente na forma do art. 92, parágrafo único, VII. (Origem: PRT MS/GM 1550/2014, Art. 97)
Art. 103. A instituição poderá interpor recurso perante a SE/MS, que encaminhará à autoridade recorrida, no prazo máximo de 5 (cinco) dias, contados de seu recebimento. (Origem: PRT MS/GM 1550/2014, Art. 98)
§ 1º Se houver reformulação da decisão, será providenciada a publicação pela SE/MS de Portaria com o resultado da reanálise da prestação de contas, no prazo de 10 (dez) dias. (Origem: PRT MS/GM 1550/2014, Art. 98, § 1º)
§ 2º Se a autoridade recorrida mantiver a decisão, esta encaminhará o recurso à autoridade superior para apreciação, no prazo de 5 (cinco) dias. (Origem: PRT MS/GM 1550/2014, Art. 98, § 2º)
§ 3º Recursos intempestivos não serão conhecidos pela SE/MS. (Origem: PRT MS/GM 1550/2014, Art. 98, § 3º)
§ 4º A interposição de recurso não obsta as providências decorrentes de eventual Tomada de Contas Especial. (Origem: PRT MS/GM 1550/2014, Art. 98, § 4º)
CAPÍTULO VIII
DO ATO DE INABILITAÇÃO DAS INSTITUIÇÕES PARTICIPANTES DO PRONON E DO PRONAS/PCD
(Origem: PRT MS/GM 1550/2014, CAPÍTULO VIII)
Art. 104. Após avaliados os relatórios de execução dos projetos e em caso de execução de má qualidade ou de inexecução parcial ou completa das ações e serviços previstos no projeto, o Ministério da Saúde poderá inabilitar, por até 3 (três) anos, a instituição destinatária de recursos e participante do Pronon ou do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 99)
Parágrafo Único. O Ministério da Saúde divulgará em meio oficial as instituições consideradas inabilitadas, com o respectivo prazo de inabilitação para participar do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 99, Parágrafo Único)
Art. 105. Para fins do disposto no art. 104, são critérios para a inabilitação da instituição destinatária: (Origem: PRT MS/GM 1550/2014, Art. 100)
I - dolo ou má-fé; (Origem: PRT MS/GM 1550/2014, Art. 100, I)
II - violação da dignidade da pessoa humana; (Origem: PRT MS/GM 1550/2014, Art. 100, II)
III - prejuízo à saúde ou à vida do cidadão; (Origem: PRT MS/GM 1550/2014, Art. 100, III)
IV - descumprimento de normas éticas ou legais; (Origem: PRT MS/GM 1550/2014, Art. 100, IV)
V - descumprimento da política definida para o setor no Plano Nacional de Saúde e nas diretrizes do Ministério da Saúde; (Origem: PRT MS/GM 1550/2014, Art. 100, V)
VI - prejuízo ao erário; (Origem: PRT MS/GM 1550/2014, Art. 100, VI)
VII - uso do projeto com intuito lucrativo; (Origem: PRT MS/GM 1550/2014, Art. 100, VII)
VIII - prejuízo das finalidades institucionais desenvolvidas pelo SUS; (Origem: PRT MS/GM 1550/2014, Art. 100, VIII)
IX - prestação de informações incompletas, distintas ou falsas em relação às solicitadas pelo Ministério da Saúde para análise e acompanhamento do projeto; e (Origem: PRT MS/GM 1550/2014, Art. 100, IX)
X - concessão a doador de vantagem de qualquer espécie ou bem em razão da doação. (Origem: PRT MS/GM 1550/2014, Art. 100, X)
Art. 106. Constatada a ocorrência de execução de má qualidade ou de inexecução parcial ou completa das ações e serviços previstos no projeto, o órgão do Ministério da Saúde responsável pelo acompanhamento do projeto notificará a instituição para que, no prazo de até 10 (dez) dias, se manifeste. (Origem: PRT MS/GM 1550/2014, Art. 101)
§ 1º Depois do recebimento das informações prestadas pela instituição: (Origem: PRT MS/GM 1550/2014, Art. 101, § 1º)
I - caso entenda que não tenha ocorrido quaisquer dos fatos suscitados, o órgão do Ministério da Saúde responsável analisará a possibilidade de concessão, mediante decisão motivada, de novo prazo, no máximo de 6 (seis) meses, para que o projeto seja devidamente executado; ou (Origem: PRT MS/GM 1550/2014, Art. 101, § 1º, I)
II - caso entenda que tenha ocorrido quaisquer dos fatos suscitados, o órgão do Ministério da Saúde responsável notificará novamente a instituição, com indicação do evento, para que, no prazo de 10 (dez) dias, apresente sua manifestação. (Origem: PRT MS/GM 1550/2014, Art. 101, § 1º, II)
§ 2º Na hipótese do inciso II do § 1º, prestadas as informações pela instituição, o órgão do Ministério da Saúde responsável decidirá, de forma motivada, pela ocorrência ou não do fato e: (Origem: PRT MS/GM 1550/2014, Art. 101, § 2º)
I - caso decida pela inocorrência do fato, aplicará o disposto no inciso I do § 1º; e (Origem: PRT MS/GM 1550/2014, Art. 101, § 2º, I)
II - caso decida pela ocorrência do fato, inabilitará a instituição destinatária, por até 3 (três) anos, observados critérios de razoabilidade e proporcionalidade e a gravidade do fato ocorrido. (Origem: PRT MS/GM 1550/2014, Art. 101, § 2º, II)
Art. 107. Caberá recurso para o Ministro de Estado da Saúde, da decisão de que trata o art. 106, § 2º , II, no prazo de 15 (quinze) dias, contado da notificação da instituição destinatária. (Origem: PRT MS/GM 1550/2014, Art. 102)
CAPÍTULO IX
DA TOMADA DE CONTAS ESPECIAL
(Origem: PRT MS/GM 1550/2014, CAPÍTULO IX)
Art. 108. A instauração do processo de Tomada de Contas Especial se fará conforme as normas específicas em vigor, visando à apuração dos fatos, identificação dos responsáveis, quantificação do dano e obtenção do ressarcimento, sendo levada a efeito pelo órgão competente do Ministério da Saúde ou, na sua omissão, por determinação da Controladoria-Geral da União (CGU) ou do Tribunal de Contas da União (TCU). (Origem: PRT MS/GM 1550/2014, Art. 103)
Art. 109. Havendo instauração de Tomada de Contas Especial, o registro de seus atos será realizado no Sistema Integrado de Administração Financeira do Governo Federal (SIAFI), para consulta pública. (Origem: PRT MS/GM 1550/2014, Art. 104)
CAPÍTULO X
DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 1550/2014, CAPÍTULO X)
Art. 110. Constitui infração ao disposto na Lei nº 12.715, de 2012, no Decreto nº 7.988, de 2013, e neste Anexo o recebimento pelo doador de vantagem financeira ou bem, em razão da doação. (Origem: PRT MS/GM 1550/2014, Art. 105)
Art. 111. Em caso de má execução ou inexecução parcial ou total do projeto desenvolvido no âmbito do Pronon ou do Pronas/PCD, além do disposto no art. 106, a instituição ficará sujeita às demais responsabilizações cabíveis. (Origem: PRT MS/GM 1550/2014, Art. 106)
Art. 112. A dedução do imposto sobre a renda dos valores correspondentes às doações no âmbito do Pronon e do Pronas/PCD e a aplicação e movimentação dos recursos financeiros de que tratam os Capítulos IV e V do Decreto nº 7.988, de 2013, serão cumpridas pelas entidades observando-se, ainda, regras complementares do Ministério da Fazenda instituídas, conforme o caso, isoladamente ou em conjunto com o Ministério da Saúde. (Origem: PRT MS/GM 1550/2014, Art. 107)
Art. 113. Aplicam-se aos procedimentos previstos neste Anexo as disposições da Lei nº 9.784, de 1999, em especial quanto aos prazos, recursos e comunicação de atos e decisões. (Origem: PRT MS/GM 1550/2014, Art. 108)
Art. 114. Ato do Ministro de Estado da Saúde disporá sobre o patrocínio com finalidade promocional no âmbito do Pronon e do Pronas/PCD. (Origem: PRT MS/GM 1550/2014, Art. 109)
ANEXO 1 DO ANEXO LXXXVI
REQUERIMENTO DE CREDENCIAMENTO AO PROGRAMA NACIONAL DE APOIO À ATENÇÃO ONCOLÓGICA (PRONON) (Origem: PRT MS/GM 1550/2014, Anexo 1)
| I - INFORMAÇÕES DA INSTITUIÇÃO | ||
|---|---|---|
| Razão Social: | ||
| CNPJ: | CNES: | Data de fundação da instituição: |
| Endereço: | ||
| Bairro: | Município: | UF: |
| CEP: | Fone: | FAX: |
| E-mail: | ||
| Nome do dirigente da instituição: | ||
| Procurador (se aplicável): | ||
| Qualificação da Instituição:( ) CEBAS-Saúde ( ) CEBAS-MDS ( ) CEBAS-MEC ( ) Organização Social ( ) OSCIP | ||
| II REQUERIMENTO | ||
| O representante legal da supracitada instituição vem requerer o credenciamento no Programa Nacional de Apoio à Atenção Oncológica (PRONON), como etapa prévia à apresentação de projetos, em conformidade com a Lei n° 12.715/2012 e demais legislação regulamentadora. Local e dataAssinatura do dirigente da instituição ____________________________________________ Nome do dirigente da instituição |
||
ANEXO 2 DO ANEXO LXXXVI
REQUERIMENTO DE CREDENCIAMENTO NO PROGRAMA NACIONAL DE APOIO À ATENÇÃO DA SAÚDE DA PESSOA COM DEFICIÊNCIA (PRONAS/PCD) (Origem: PRT MS/GM 1550/2014, Anexo 2)
| I - INFORMAÇÕES DA INSTITUIÇÃO | ||
|---|---|---|
| Razão Social: | ||
| Endereço: | ||
| Bairro: | Município: | UF: |
| CEP: | Fone: | FAX: |
| E-mail: | ||
| Nome do dirigente da instituição: | ||
| Procurador (se aplicável): | ||
| Qualificação da Instituição:[ ] CEBAS - Saúde [ ] CEBAS - MDS [ ] CEBAS - MEC [ ] Organização Social [ ] OSCIP[ ] Declaração de prestação de atendimento direto e gratuito e cadastro no SCNES | ||
| II - REQUERIMENTO | ||
| O representante legal da supracitada instituição vem requerer o credenciamento no Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), como etapa prévia à apresentação de projetos, em conformidade com a Lei n° 12.715/2012 e demais legislação regulamentadora. Local e dataAssinatura do dirigente da instituição ____________________________________________ Nome do dirigente da instituição |
||
ANEXO 3 DO ANEXO LXXXVI
APRESENTAÇÃO DE PROJETOS REFERENTES AO PROGRAMA NACIONAL DE APOIO À ATENÇÃO ONCOLÓGICA (PRONON) OU AO PROGRAMA NACIONAL DE APOIO À ATENÇÃO DA SAÚDE DA PESSOA COM DEFICIÊNCIA (PRONAS/PCD) (Origem: PRT MS/GM 1550/2014, Anexo 3)
A - INFORMAÇÕES DA INSTITUIÇÃO
| Programa: [ ] PRONON [ ] PRONAS/PCD | Portaria de credenciamento: n° e data | ||
| Razão Social: | |||
| CNPJ: | |||
| Endereço: | |||
| Bairro: | Município: | ||
| CEP: | Fone: | ||
| Procurador (se aplicável): | |||
B - DO PROJETO
O projeto congrega o conjunto mínimo de conceitos e instrumentos de gerenciamento, imprescindíveis para o monitoramento, avaliação e prestação de contas da execução físico-financeira.
| B.1 - INFORMAÇÕES GERAIS DO PROJETO | |
| 2.1 Título do Projeto: | |
| 2.2 Valor total do Projeto: | |
| 2.3 Prazo de execução (em meses): | |
| B.2 - DA(S) AÇÕES E SERVIÇOS DE ONCOLOGIA E REABILITAÇÃO | |
| De acordo com os artigos 5º e 9º desta Portaria, registrar o campo de atuação pretendida. Assinalar apenas uma única opção | |
| ( ) Prestação de serviços médico-assistenciais; | ( ) realização de pesquisas clínicas, epidemiológicas e experimentais. |
| ( ) Formação, treinamento e aperfeiçoamento de recursos humanos em todos os níveis; | |
| B.3 - ÁREA(S) PRIORITÁRIA(S) DO PRONON (De acordo com o artigo 6º) *Preenchimento exclusivo para projeto apresentados no âmbito do Programa Nacional de Apoio à Atenção Oncológica (PRONON). Neste item, descrever, de forma resumida, a área prioritária de que trata o projeto, considerando as opções citadas no Art. 6º. |
| B.4 - ÁREA(S) PRIORITÁRIA(S) DO PRONAS/PCD (De acordo com o artigo 10) *Preenchimento exclusivo para projeto apresentados no âmbito do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD). |
| Nesse item, descrever, de forma resumida, a área prioritária de que trata o projeto, considerando as opções citadas no Art. 10. |
| B.5 - INFORMAÇÕES ESPECÍFICAS DO PROJETO DE ASSISTÊNCIA E CAPACITAÇÃO |
| Descrição do projeto: |
a) Descrever o(s) objetivo(s) do projeto considerando as áreas prioritárias de sua aplicação; b) Apresentar a justificativa e aplicabilidade do projeto; c) Descrever os equipamentos, as ações e os serviços de saúde atualmente realizados em nível ambulatorial e hospitalar que apresentem relação com o objetivo do projeto, a fim de demonstrar as ações inovadoras a que o projeto se propõe; |
d) Descrever a estrutura física (ambientes e equipamentos) a ser utilizada e os recursos humanos a serem empregados na execução do projeto; e) Descrever a abrangência do projeto quanto a: - dimensão geográfica, com indicação de UF/município beneficiário; - população que será beneficiada com a execução do projeto; - instituições que serão beneficiadas com o projeto, quando houver, com indicação do número do CNES e/ou CNPJ. |
f) Descrever o número de vagas ofertadas, quando aplicável; g) Descrever os resultados esperados, decorrentes da execução do projeto, suas metas a serem atingidas e respectivos indicadores (conforme quadro abaixo); Resultado* Indicador** Meta*** |
* Os resultados devem apresentar coerência com o objetivo do projeto. ** Definir as variáveis que serão utilizadas para construção do indicador e apresentar método de cálculo. *** As metas devem ser quantitativas e devem considerar um prazo determinado. h) Apresentar o plano de atividades para execução do projeto (conforme quadro abaixo); |
ATIVIDADE DATA DE INÍCIO DATA DO FIM VALOR ESTIMADO (R$) - quando aplicável |
i) Descrever as atividades de monitoramento da execução do projeto; j) Quando aplicável, descrever formas de disseminação dos resultados do projeto, tais como: eventos científicos, oficinas, material de divulgação/publicação, entre outras formas; l) No caso do projeto envolver reforma, deverão ser atendidos os requisitos previstos nesta Portaria; m) Demais informações relevantes em conformidade com as especificidades da área de atuação e do projeto. |
| B.6 - INFORMAÇÕES ESPECÍFICAS DO PROJETO DE PESQUISA |
| Descrição do projeto: |
a) Informações gerais do projeto: a.1) Título do projeto; a.2) Pesquisador principal, com a identificação do nome, telefone e e-mail; a.3) Valor total do projeto; |
a.4) Período de execução. b)Informações específicas do projeto. b.1) Submeter protocolo de pesquisa com: i - Introdução: apresentar conceitos, antecedentes científicos que justifiquem a pesquisa. Relatar o estado atual do conhecimento sobre o assunto, por meio de uma revisão bibliográfica. Deve-se finalizar com a |
proposição do problema a ser estudado, evidenciado pela revisão apresentada. Recomenda-se a utilização de referências com forte poder de evidência científica; ii - Justificativa: explicar a relevância no desenvolvimento do estudo proposto, comentando repercussão científica, médica e/ou social dos resultados, além da sua viabilidade; iii - Hipótese: são possíveis respostas ao problema da pesquisa e orientam a busca de novas informações; iv - Objetivo Geral: define, esclarece e revela o foco de interesse da pesquisa; |
v - Objetivos Específicos: definem os diferentes pontos a serem abordados, visando verificar as hipóteses e concretizar o objetivo geral; vi - Procedimentos Metodológicos: conjunto de métodos e técnicas utilizadas para a realização de uma pesquisa. Deve incluir: - Desenho do estudo: tipo do estudo a ser realizado, como observacional, experimental, exploratório, descritivo, analítico, longitudinais, transversais, pesquisa básica, ensaios clínicos, epidemiológicos, revisão sistemática, estudo de campo e outros. |
- Participantes de pesquisa e tamanho amostral: critérios de inclusão e exclusão, informações necessárias ao cálculo do tamanho amostral, o valor obtido e as referências bibliográficas utilizadas. - Descrição do local do estudo. - Planejamento do estudo: descrever a sequência lógica de execução, técnicas utilizadas, testes e exames, quando couber. - Materiais e equipamentos: descrever a infraestrutura disponível e o aparato experimental necessário para a realização do estudo |
- Análise dos dados: descrever métodos, técnicas, testes estatísticos e/ou programas computacionais utilizados para trabalhar os dados obtidos. vii - Resultados esperados: descrever detalhadamente o que se almeja com o estudo, em consonância com as hipóteses previamente estabelecidas; viii - Aspectos éticos: descrever quais serão os procedimentos éticos adotados, em conformidade com as diretrizes e regulamentações vigentes; ix - Cronograma de atividades: planejar o estudo em meses, sendo recomendada a utilização do modelo de Gráfico Gantt; e |
x - Referências: indicar, segundo normas da ABNT, lista das publicações e documentos consultados e citados ao longo do texto. c) Descrever os resultados anuais esperados, decorrentes da execução do projeto, seus indicadores e respectivas metas a serem atingidas; d) Descrever os produtos gerados com a execução do projeto, seus indicadores e metas; e) Descrever as atividades de monitoramento e de avaliação e seus respectivos valores; |
f) Descrever a abrangência do projeto quanto a: i - população e/ou instituição beneficiada, seja diretamente - que receberá a intervenção do projeto - seja indiretamente - que poderá se beneficiar dos resultados do projeto, com indicação de n° CNES; ii - dimensão geográfica, com indicação de UF/município beneficiário; e iii - número de vagas ofertadas, quando aplicável. |
g) Quando aplicável, descrever formas de disseminação dos resultados do projeto, tais como: eventos científicos, oficinas, material de divulgação/publicação, dentre outras formas; h) Apresentar Organograma e Quadro de Atribuições, bem como currículo Lattes, para os principais atores envolvidos no projeto, incluindo a equipe executora e ressaltando a formação e experiências relevantes ao projeto; i) Apresentar o Plano de Atividades do Projeto com as seguintes especificações: i - descrição da atividade; ii - definição da data de início e fim de cada atividade; iii - descrição do indicador da atividade; iv - unidade de medida; v - metas quantitativas; e vi - valor estimado de cada atividade (anexar memória de cálculo) e total. j) Demais informações relevantes em conformidade com as especificidades da área de atuação e do projeto |
ANEXO 4 DO ANEXO LXXXVI
MODELO DE DECLARAÇÃO DE RESPONSABILIDADE (Origem: PRT MS/GM 1550/2014, Anexo 4)
| ATESTADO DE RESPONSABILIDADE TÉCNICA |
| Eu, NOME DO REPRESENTANTE LEGAL DA INSTITUIÇÃO CREDENCIADA, CPF Nº XXXX, sob Portaria nº xxxxx ATESTO, para fins de apresentação de projetos no âmbito do PRONON OU PRONAS/PCD do Ministério da Saúde, que o(a) INSTITUIÇÃO CREDENCIADA, inscrito(a) no CNPJ sob o nº XXXXX, situado(a) à ENDEREÇO COMPLETO com CEP, apresenta capacidade técnica e operacional para o desenvolvimento do Projeto "TÍTULO DO PROJETO", em atendimento ao disposto no Art. XX, da Portaria GM/MS nº XXX de XX de XXX de 2014, considerando as experiências na execução de projeto(s)/ação(es) na(s) área(s) XXXXXX, conforme DOCUMENTO ANEXO. |
ANEXO 5 DO ANEXO LXXXVI
MODELO DE DECLARAÇÃO DE CAPACIDADE TÉCNICO-OPERATIVA (Origem: PRT MS/GM 1550/2014, Anexo 5)
| DECLARAÇÃO DE CAPACIDADE OPERACIONAL |
| Declaramos, para os devidos fins que a instituição XXXXX, credenciada pela Portaria XXX de xx de xxxxx de 201x, inscrita no CNPJ sob o Nº XXXXXXXX estabelecida no [endereço da instituição XXXXXXX], possui capacidade técnica e operacional necessárias para a realização do projeto intitulado "XXXXXXXXXX" apresentado para execução no âmbito do PRONON ou PRONAS/PCD. |
| Local e Data. |
| [Nome do Representante Legal]Instituição XXXXX |
| * Enviar em papel timbrado da instituição |
ANEXO 6 DO ANEXO LXXXVI
MODELO DE ORÇAMENTO (Origem: PRT MS/GM 1550/2014, Anexo 6)
| DEMONSTRATIVO DA PROJEÇÃO DAS DESPESAS - PRONON OU PRONAS/PCD VALOR DO PROJETO: R$ XXX | |||
| CUSTOS DIRETOS DO PROJETO | |||
| NATUREZA | DESCRIÇÃO | PREVISÃO DE DESPESAS (R$) | % SOBRE O VALOR TOTAL DO PROJETO |
| CUSTEIO | Diárias | ||
| Passagens | |||
| Serviço de terceiros - Pessoa Física- serviço de captação de recursos- serviço de elaboração de projeto | |||
| Serviço de terceiros - Pessoa Jurídica- serviço de captação de recursos- serviço de elaboração de projeto | |||
| Material de Consumo | |||
| Consultoria | |||
| Coordenação | |||
| Outros (especificar) | |||
| CUSTOS INDIRETOS DO PROJETO | |||
| CAPITAL | Imobilizado Tangível | ||
| Obras (reformas) e Instalações | |||
| Equipamentos e Material Permanente | |||
| Equipamentos de Informática | |||
| Outros (especificar) | |||
| Imobilizado - Intangível (especificar) | |||
| TOTAL | |||
ANEXO 7 DO ANEXO LXXXVI
FORMULÁRIO DE INFORMAÇÕES COMPLEMENTARES PARA PROPOSTAS QUE PREVEEM A AQUISIÇÃO DE EQUIPAMENTOS E MATERIAIS PERMANENTES NO ÂMBITO DO PRONON E DO PRONAS/PCD (Origem: PRT MS/GM 1550/2014, Anexo 7)
FORMULÁRIO DE INFORMAÇÕES COMPLEMENTARES PARA PROPOSTAS QUE PREVEEM A AQUISIÇÃO DE EQUIPAMENTOS E MATERIAIS PERMANENTES NO ÂMBITO DO PRONON E DO PRONAS/PCD
| 1.Dados Institucionais | |
| Razão Social: | |
| Projeto:( ) PRONON( ) PRONAS/PCD | Nº DO SIPAR do Projeto: |
| 2.Responsável pela instituição | |
| Nome: | |
| Cargo: | Telefone: |
| E-mail para contato: | |
| 3.Infraestrutura | |
| 3.1 Os ambientes possuem áreas físicas adequadas em conformidade com a regulação do Ministério da Saúde, para a instalação e uso dos equipamentos e materiais permanentes solicitados? ( ) Sim ( ) Não, mas a reforma necessária está contemplada neste projeto ( ) Não possui área física |
|
| 3.2 Existem meios de acesso (pontos de desembarque, rampas, portas de acesso, corredores, etc.) para permitir a entrada e a instalação dos equipamentos de grande porte/volume? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.3 O estabelecimento possui Sistema de Aterramento de acordo com as normas vigentes (NBRs) aplicáveis? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.4 O estabelecimento possui Sistema de Proteção contra Descargas Atmosféricas (Pára-raios), de acordo com as normas vigentes (NBRs) aplicáveis? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.5 O estabelecimento possui Sistema de estabilização eletrônico de tensão? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.6 O estabelecimento possui gerador de energia elétrica? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.7 Os ambientes onde os equipamentos que possuem necessidade de climatização, possuem esse sistema? ( ) Sim ( ) Não ( ) Não se aplica |
|
| 3.8 No caso de pleito de equipamentos que emitem radiações ionizantes, o estabelecimento possui estrutura de radioproteção de acordo com as normas vigentes aplicáveis? ( ) Sim ( ) Não ( ) Não se aplica a este projeto |
|
| 3.9 O estabelecimento dispõe de recursos humanos capacitados para a gerência e manutenção dos equipamentos e materiais permanentes dos equipamentos pleiteados? ( ) Sim, para gerência e manutenção ( ) Sim, para gerência, a manutenção é terceirizada ( ) Não, o serviço é terceirizado (gerência e manutenção) |
||||||
| ( ) Não se aplica | ||||||
| 3.10 Para os equipamentos de maior complexidade, estão sendo previstos contratos de manutenção externa? ( ) Sim ( ) Não ( ) Não se aplica |
||||||
| 3.11 Caso tenha respondido SIM a questão anterior, detalhe o tipo de contrato: ( ) Manutenção preventiva + Manutenção corretiva (somente mão-de-obra) ( ) Manutenção preventiva + Manutenção corretiva + Peças ( ) Manutenção preventiva + Manutenção corretiva + Peças + Acessórios |
||||||
| ( ) Não sei responder | ||||||
| 3.12 O estabelecimento dispõe de profissionais capacitados e habilitados para a operação do(s) equipamento(s) solicitado(s)? ( ) Sim ( ) Não, devendo capacitar profissionais disponíveis no estabelecimento, antes da aquisição ( ) Não, sem previsão de dispor de um programa de contratação |
||||||
| 4. Resíduos Sólidos de Serviços de Saúde (RSS) | ||||||
| 4.1 O estabelecimento possui um Plano de Gerenciamento de Resíduos Sólidos, conforme normas vigentes aplicáveis? ( ) Sim ( ) Em desenvolvimento ( ) Em fase de implantação |
||||||
| ( ) Não possui | ||||||
| 5. Resíduos Sólidos de Serviços de Saúde (RSS) | ||||||
| Item | Identificação do equipamento | Especificação técnica do equipamento | Quant. | Modalidade | Valorunitário (R$) | Valor total (R$) |
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
( ) Aquisição |
||||||
ANEXO 8 DO ANEXO LXXXVI
MODELO DE TERMO DE DOAÇÃO (Origem: PRT MS/GM 1550/2014, Anexo 8)
TERMO DE DOAÇÃO QUE ENTRE SI CELEBRAM A "INSTITUIÇÃO BENEFICIÁRIA XXXXX" E "INSTITUIÇÃO DONATÁRIA XXXXX"
Pelo presente instrumento, a Entidade de Saúde (sede e/ou filial) <NOME>, por intermédio da <Gerência/Superintendência/presidência> com sede xxxxxxxxxxxx, inscrita no CNPJ sob nº xx.xxx.xxx/xxx-xx, ora designado DOADOR, neste ato representado na forma do seu Estatuto por <nome.>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº <xxx.xxx.xxx-xx> e RG nº <xxxxxxx>, expedido pela xxx/xx, e de outro lado, a entidade beneficiada, <NOME>, inscrita no CNPJ/MF xxxxxxxxxx, com sede xxxxxxx, doravante denominado DONATÁRIO, neste ato representada por <nome>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº xxxxxxxxx e RG nº xxxxxxx, expedido pela xxx/xx, e de acordo com os autos do Processo nº <25000.xxxxxx/20xx-xx>,com fundamento na Lei nº 12.715, de 17 de setembro de 2012, no Decreto nº 7.988, de 17 de abril de 201, na nova Portaria GM/MS nº xxxxxx/2013, têm entre si celebrar o presente TERMO DE DOAÇÃO, sob a forma e condições constantes das seguintes CLÁUSULAS:
CLÁUSULA PRIMEIRA - DO OBJETO
O presente instrumento tem por objeto a Doação dos bens móveis e imóveis, relacionados no anexo deste Termo, tendo por finalidade a utilização pelo DONATÁRIO, na continuidade das ações e serviços de assistência à saúde da população, visando a melhoria da produção e qualidade dos procedimentos da atenção oncológica e/ou da atenção da saúde da pessoa com deficiência, assim como o aperfeiçoamento e expansão da capacidade operacional do Sistema Único de Saúde.
CLÁUSULA SEGUNDA - DAS OBRIGAÇÕES
O DONATÁRIO compromete-se a destinar os bens, objeto deste instrumento à execução de ações de saúde, conforme o disposto no art . Xxxx da nova Portaria nº xxxxxx/GM/MS de 2013.
PARÁGRAFO PRIMEIRO - O DONATÁRIO, em observância à cláusula Primeira e Segunda do presente termo, responsabiliza-se por:
a) manter em funcionamento e assumir custo operacional de acordo com parâmetros firmados pelo Ministério da Saúde;
b) adquirir equipamentos complementares, materiais permanentes e de consumo, necessários à implantação e operacionalização dos serviços objeto deste Termo;
c) efetuar manutenção preventiva e corretiva, após o término da garantia do equipamento doado;
d) manter atualizado os dados da Instituição prestadora de serviço ao SUS no Cadastro Nacional de Entidade de Saúde (CNES); e
e) é de responsabilidade do DONATÁRIO, prover treinamento aos seus colaboradores para utilização correta do(s) equipamento(s) doado(s), bem como a obtenção de todas as licenças necessárias para operação dos bens.
Parágrafo único. O anexo é parte integrante e indissociável deste Termo.
CLÁUSULA TERCEIRA - DAS DESPESAS
Os custos com remoção e instalação do equipamento e/ou material permanente serão arcados pela donatária.
CLÁUSULA QUARTA- DO RECEBIMENTO
O DONATÁRIO, por intermédio deste instrumento, atesta, plena e irrestritamente, o recebimento de todos os bens arrolados no anexo deste Termo.
CLÁUSULA QUINTA - DAS SANÇÕES ADMINISTRATIVAS
Em caso de constatação, pelo Ministério da Saúde ou pelos órgãos de controle externo, quanto a não utilização do bem doado para os fins e forma a que se propõe a presente DOAÇÃO, poderá ser promovida à revogação deste Termo, com comunicação prévia ao Ministério da Saúde, sem direito de indenização ao DONATÁRIO.
CLÁUSULA SEXTA - DA PUBLICAÇÃO
Incumbirá à entidade beneficiária providenciar a publicação do extrato deste Termo na Imprensa Oficial, até o quinto dia útil d o mês seguinte ao de sua assinatura, para ocorrer no prazo de 20 (vinte) dias daquela data.
CLÁUSULA SÉTIMA - DO FORO
Fica eleito o Foro da Seção Judiciária XXXX, com exclusão de qualquer outro, por mais privilegiado que seja para dirimir quaisquer dúvidas oriundas do presente Termo de Doação.
E, por estarem de pleno acordo, as partes assinam este Termo em três vias de igual teor e forma, que depois de lido e achado conforme para um só efeito, é assinado pelos partícipes na presença de 2 (duas) testemunhas, igualmente signatárias.
Local e data.
Pelo Doador Pelo Donatário
Nome: Nome:
Cargo : Cargo :
TESTEMUNHAS
Nome: Nome:
CPF: CPF:
ANEXO AO TERMO DE DOAÇÃO
| Programa Nacional de Apoio à Atenção Oncológica (PRONON) Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD) |
| Projeto: |
| Nº do Processo Ministério da Saúde: |
Dados do Doador:
| Entidade: | |||
| Nome do Representante: | |||
| Cargo: | |||
| RG: | CPF: | ||
| Endereço: | |||
| CEP: | Cidade/UF: | Telefone: | Fax: |
Dados do Donatário:
| Entidade: | |||
| Nome do Representante: | |||
| Cargo: | |||
| RG: | CPF: | ||
| Endereço: | |||
| CEP: | Cidade/UF: | Telefone: | Fax: |
| Descrição | Preço Unitário (R$) | Qtde | Preço Total (R$) |
ANEXO 9 DO ANEXO LXXXVI
MODELO DE PARECER TÉCNICO CONCLUSIVO (Origem: PRT MS/GM 1550/2014, Anexo 9)
MODELO DE PARECER TÉCNICO CONCLUSIVO
| PARECER TÉCNICO n° | Data: |
| SIPAR | [ ] PRONON [ ] PRONAS/PCD |
| Nome do projeto: | |
| Área de atuação: | |
| Razão social: | |
| CNPJ: | |
| Valor aprovado: R$ | |
| Prazo de execução aprovado: | |
| I - DO RESUMO DO PROJETO:a) descrever o objeto; eb) descrever o objetivo | |
| II - DA ANÁLISE TÉCNICA:a) descrever a relevância do projeto, a sua adequação às ações prioritárias definidas pelo Ministério da Saúde e o seu potencial de contribuição para melhoria da execução, gestão e qualificação das ações e serviços de atenção oncológica ou de reabilitação.b) verificar o completo e correto preenchimento do requerimento de apresentação de projeto do ANEXO III; | |
| c) analisar quanto ao enquadramento do projeto à Lei nº 12.715/2012, e às demais normativas do PRONON e do PRONAS/PCD;d) verificar a adequação do projeto e da instituição aos mecanismos dos programas;e) verificar as planilhas orçamentárias e os documentos técnicos exigidos da instituição; ef) verificar a duplicidade da proposta apresentada a qualquer modalidade de financiamento no âmbito do PRONON e do PRONAS/PCD | |
| g) aferir a capacidade técnica-operacional para execução do projeto apresentado;h) verificar a adequação entre o objeto a ser executado e os produtos resultantes, mediante indicadores para avaliação final do projeto;i) verificar a adequação das estratégias de ação aos objetivos, assinalando-se, claramente, no parecer, se as etapas previstas são necessárias ou suficientes à sua realização e se são compatíveis com os prazos e custos previstos; | |
| j) verificar o enquadramento do projeto nos campos de atuação estabelecidos no art. 6 e no 10;k) destacar a repercussão local, regional, nacional e internacional do projeto, conforme o caso;l) indicar os impactos e desdobramentos positivos ou negativos do projeto, no âmbito social ou outro considerado relevante;m) ressaltar a contribuição para o desenvolvimento da área ou segmento em que se insere o projeto analisado; | |
| n) verificar a compatibilidade dos custos previstos com os preços praticados no mercado regional da produção, destacando-os; eo) verificar o atendimento aos critérios e limites de custos estabelecidos pelo Ministério da Saúde. | |
| III - DA CONCLUSÃO: | |
| [ ] Aprovado [ ] Reprovado [ ] Em Diligência | |
| Assinaturas | |
ASPECTO PARA AVALIAÇÃO DO PROJETO
| Aspectos a serem observados para avaliação do mérito | Nota Máxima | Peso |
Tempo de experiência da instituição, em relação à área a que se refere a proposta |
10 | 1 |
Experiência em relação ao tema dos responsáveis pelo projeto |
10 | 2 |
Descrição dos objetivos clara e articulada com as ações previstas e as propostas do projeto |
10 | 2 |
Qualidade da metodologia para o alcance dos objetivos |
10 | 2 |
Metodologia e conteúdo com abordagem multiprofissional |
10 | 2 |
Viabilidade do projeto em relação ao cronograma de execução |
10 | 3 |
Metas e indicadores de monitoramento e avaliação das ações coerentes com as propostas no projeto |
10 | 2 |
Abrangência do projeto em regiões que apresentem vazios assistenciais |
10 | 4 |
ANEXO 10 DO ANEXO LXXXVI
MODELOS DE RECIBO (Origem: PRT MS/GM 1550/2014, Anexo 10)
MODELOS DE RECIBO
| MODELO DE RECIBO I Transferência de Quantias em Dinheiro |
|||||
|---|---|---|---|---|---|
| LOGO DA INSTITUIÇÃO |
|
||||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: |
NÚMERO DE ORDEM: |
|||
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||||
| DADOS DA PARTICIPAÇÃO | |||||
| 01. TIPO DA OPERAÇÃO: Transferência de Quantias em Dinheiro | |||||
| 02. VALOR DA DOAÇÃO: R$____________________Por extenso:____________________________________________________________ | |||||
| 03.BANCO: | 04. N° DA AGÊNCIA: | 05. N.º CONTA CORRENTE | 06. DATA DO RECEBIMENTO DA DOAÇÃO | ||
| DADOS DO DOADOR | |||||
| 7. NOME: | |||||
| 8. CNPJ/CPF: | 9. ENDEREÇO: |
||||
| 10. CIDADE: | 11. UF: |
12. CEP: |
13. TELEFONE: |
||
| 14. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica): | |||||
| DADOS DO PROJETO | |||||
| 15. [ ] PRONON 16. [ ] PRONAS/PCD | |||||
| 17. TÍTULO DO PROJETO: | |||||
| 18. Nº SIPAR DO PROJETO: | |||||
| 19. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||||
| 20. INSTITUIÇÃO PROPONENTE: | 21. CNPJ |
||||
| 22. ENDEREÇO: | 23. TELEFONE: |
||||
| 24. CIDADE: | 25. UF: |
26. CEP: |
|||
| DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO | |||||
| 27. NOME: | |||||
| 28. CPF: | 29. CARGO: |
30. TELEFONE: |
|||
| 31. LOCAL/DATA: | 32. ASSINATURA E CARIMBO |
||||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |||
| MODELO DE RECIBO II Transferência de Bens Movéis e Imóveis |
|||
|---|---|---|---|
| LOGO DA INSTITUIÇÃO | |||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: | NÚMERO DE ORDEM: | |
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||
| DADOS DA PARTICIPAÇÃO | |||
| 01. TIPO DA OPERAÇÃO: Transferência de Bens: (__) Movéis(__) Imóveis | |||
| 02. VALOR DA DOAÇÃO: Bens Móveis R$____________________ Por extenso:______________________ Bens Imóveis R$____________________ Por extenso:_______________________ |
|||
| 03. Documentação comprobatória - Bem Móveis (vide Anexo I) 04. Documentação comprobatória - Bens Imóveis (vide Anexo II) |
|||
| DADOS DO DOADOR | |||
|---|---|---|---|
| 5. NOME: | |||
| 6. CNPJ/CPF: | 7. ENDEREÇO: | ||
| 8. CIDADE: | 9. UF: | 10. CEP: | 11. TELEFONE: |
| 12. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica) | |||
| DADOS DO PROJETO | |||
|---|---|---|---|
| 13. [ ] PRONON 14. [ ] PRONAS/PCD | |||
| 15. TÍTULO DO PROJETO: | |||
| 16. Nº SIPAR DO PROJETO: | |||
| 17. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||
| 18. INSTITUIÇÃO PROPONENTE | 19. CNPJ: | ||
| 20. ENDEREÇO: | 21. TELEFONE: | ||
| 22. CIDADE: | 23. UF: | 24. CEP: | |
| DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO | |||||
|---|---|---|---|---|---|
| 25. NOME: | |||||
| 26. CPF: | 27. CARGO: | 28. TELEFONE: | |||
| 29. LOCAL/DATA | 30. ASSINATURA E CARIMBO | ||||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |||
(Anexo A) |
|||||
| Guia de Transferência de Bens Móveis | |||||
| Descrição do Bem | Especificação (nome e características) | Quantidade | Valor (R$) | Estado e Conservação Avaliação do bem | |
| (_)sim (anexar Laudo de Avaliação) (_)não |
|||||
| - Laudo de Avaliação deve conter: Nome do(s) avaliador(es) CPF: CNPJ: | |||||
| Endereço do(s) avaliador(es) - Última Declaração do IR | |||||
| (Anexo B) Documentação comprobatória - Bens Imóveis - Documentação de Transferência de Bem Imóveis, registrado em cartório - Certidão de feitos ajuizados, comprovando a existência ou não de ações contra o imóvel. - Registro e Escritura do Imóvel - Regularidade dos impostos/despesas do Imóvel |
|||||
| MODELO DE RECIBO III Comodato ou cessão de uso de bens imóveis ou equipamentos |
|||
|---|---|---|---|
| LOGO DA INSTITUIÇÃO | |||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: | NÚMERO DE ORDEM: | |
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||
| DADOS DA PARTICIPAÇÃO |
|---|
| 03. TIPO DA OPERAÇÃO: (__) Comodato de Equipamentos (__) Cessão de Uso de Bens Imóveis |
| 04. VALOR DA DOAÇÃO: R$____________________ Comodato de Equipamentos R$____________________ Por extenso:________________________________________________ Cessão de Uso de Bens Imóveis R$___________________ Por extenso:__________________________________ |
| 03. Documentação comprobatória - Comodato de Equipamentos (vide Anexo I) 04. Documentação comprobatória - Cessão de Uso de Bens Imóveis (vide Anexo II) |
| DADOS DO DOADOR | |||
|---|---|---|---|
| 5. NOME: | |||
| 6. CNPJ/CPF: | 7. ENDEREÇO: | ||
| 8. CIDADE: | 9. UF: | 10. CEP: | 11. TELEFONE: |
| 12. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica): | |||
| DADOS DO PROJETO | |||
|---|---|---|---|
| 13. [ ] PRONON 14. [ ] PRONAS/PCD | |||
| 15. TÍTULO DO PROJETO: | |||
| 16. Nº SIPAR DO PROJETO: | |||
| 17. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||
| 18. INSTITUIÇÃO PROPONENTE: | 19. CNPJ | ||
| 20. ENDEREÇO: | 21. TELEFONE: | ||
| 22. CIDADE: | 23. UF: | 24. CEP: | |
| DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO | |||
| 25. NOME: | |||
| 26. CPF: | 27. CARGO: | 28. TELEFONE: | |
| 29. LOCAL/DATA | 30. ASSINATURA E CARIMBO | ||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |
(Anexo A) Comodato de equipamentos (Anexo B) |
|||
| - Contrato de Cessão de Uso de Bens Imóveis - especificar a garantia dos equipamentos, observando a vigência do projeto. - Documentos que comprovam o atendimento às normas sanitárias. |
| MODELO DE RECIBO IV Fornecimento de material de consumo, hospitalar ou clínico, de medicamentos ou de produtos de alimentação |
|||
|---|---|---|---|
| LOGO DA INSTITUIÇÃO | |||
| RECIBO EM FAVOR DO DOADOR PRONON - PRONAS/PCD | ANO CALENDÁRIO DA DOAÇÃO: | NÚMERO DE ORDEM: | |
| Recebemos a importância, abaixo especificada, como participação no Programa Nacional de Apoio à Atenção Oncológica (PRONON) e do Programa Nacional de Apoio à Atenção da Saúde da Pessoa com Deficiência (PRONAS/PCD), conforme estabelecido no art. 6º da Lei nº 12.715, de 17 de setembro de 2012, e IN nº 1.311, de 31 de dezembro de 2012, da Receita Federal do Brasil. | |||
DADOS DA PARTICIPAÇÃO
| 05. TIPO DA OPERAÇÃO: (__) fornecimento de material de consumo hospitalar; (__) fornecimento de material de consumo cliníco; (__) fornecimento de medicamentos; e
|
| 06. VALOR DA DOAÇÃO:- fornecimento de material de consumo hospitalar R$____________________ Por extenso:_____________ - fornecimento de material de consumo clínico R$____________________ Por extenso:____________________________________________________ - fornecimento de medicamentos R$____________________ Por extenso:______________ - fornecimento de produtos de alimentação R$____________________ Por extenso: |
03. Documentação comprobatória para o tipo de operação vide Anexos |
DADOS DO DOADOR
| 4. NOME: | |||
| 5. CNPJ/CPF: | 6. ENDEREÇO: | ||
| 7. CIDADE: | 8. UF: | 9. CEP: | 10. TELEFONE: |
| 11. NOME DO DIRIGENTE MÁXIMO DA EMPRESA DOADORA (no caso de Pessoa Jurídica): | |||
DADOS DO PROJETO
| 12. [ ] PRONON 13. [ ] PRONAS/PCD | |||
| 14. TÍTULO DO PROJETO: | |||
| 15. Nº SIPAR DO PROJETO: | |||
| 16. PORTARIA DE AUTORIZAÇÃO DE CAPTAÇÃO DE RECURSOS: | |||
| 17. INSTITUIÇÃO PROPONENTE: | 18. CNPJ: | ||
| 19. ENDEREÇO: | 20. TELEFONE: | ||
| 21. CIDADE: | 22. UF: | 23. CEP: | |
DADOS DO FUNCIONÁRIO RESPONSÁVEL PELO PREENCHIMENTO
| 24. NOME: | |||
| 25. CPF: | 26. CARGO: | 27. TELEFONE: | |
| 28. LOCAL/DATA | 29. ASSINATURA E CARIMBO | ||
| 1ª VIA - DOADOR | 2ª VIA - MINISTÉRIO DA SAÚDE | 3ª VIA - INSTITUIÇÃO PROPONENTE | |
| (Anexo A) Fornecimento de material de consumo hospitalar ou clínico/ Medicamentos/Produtos de alimentação |
|||
| - Contrato de Fornecimento - Ordem de Fornecimento – Nota Fiscal/Fatura |
|||
| Material de consumo hospitalar ou clínico | ||||
| Item | Especificação sucinta | Quantidade | Preço Unitário (em R$) | Preço Total (em R$) |
ANEXO LXXXVII
CRITÉRIOS E INDICAÇÕES PARA AUTOMONITORAMENTO DA GLICEMIA CAPILAR (Origem: PRT MS/GM 2583/2007, Anexo 1)
ANEXO
1. INTRODUÇÃO
O diabetes mellitus é uma doença crônica, caracterizada pelo comprometimento do metabolismo da glicose, cujo controle glicêmico inadequado resulta no aparecimento das graves complicações que reduzem a expectativa de vida e comprometem a qualidade de vida do portador desta doença.
As intervenções terapêuticas do diabetes visam ao rigoroso controle da glicemia e de outras condições clínicas no sentido de prevenir ou retardar a progressão da doença para as complicações crônicas micro e macrovasculares, assim como evitar complicações agudas, em especial a cetoacidose e o estado hiperglicêmico hiperosmolar. Essas intervenções objetivam minimizar os efeitos adversos do tratamento, garantir adesão do paciente às medidas terapêuticas e garantir o bem estar do paciente e de sua família.
Um programa de cuidado integral ao diabetes mellitus deve ter como prioridades estratégicas: a prevenção primária da doença com ações sobre os fatores de risco, a detecção precoce, o tratamento adequado que permita modificar a evolução da doença, previna as complicações e melhore a qualidade de vida dos portadores.
Essas estratégias devem ser coordenadas e integradas, levando em conta tanto ações de base populacional como aquelas sobre os grupos de risco e as de características individuais; devem ser custo-efetivas e fundamentadas em evidências científicas.
A organização do cuidado integral deve estar centrada na pessoa que vive com diabetes, em sua família e incluir a comunidade; deve ser planejada levando em conta os diversos aspectos do cuidado, as circunstâncias e os recursos locais.
A abordagem terapêutica deve ser multiprofissional, incluindo a assistência farmacêutica, o monitoramento da glicemia e outros parâmetros clínicos, planejamento da atividade física e orientação dietética. A participação do paciente e seu envolvimento constante e harmonioso com a equipe de saúde é fundamental para que as recomendações sejam seguidas e o tratamento, efetivo.
As duas abordagens fundamentais para avaliar o controle glicêmico são: a medida da Hemoglobina Glicada (A1c) e o automonitoramento da glicemia capilar (AMGC); ambas fornecem informações fundamentais e complementares para um tratamento adequado.
2. AUTOMONITORAMENTO DA GLICEMIA CAPILAR
O automonitoramento do nível de glicose do sangue por intermédio da medida da glicemia capilar é considerado uma ferramenta importante para seu controle, sendo parte integrante do autocuidado das pessoas com diabetes mellitus insulino-dependentes, aí compreendidos os portadores de diabetes mellitus tipo 1 (DM1), diabetes mellitus tipo 2 (DM2) que usam insulina e diabetes gestacional (DG).
2.1. Critérios para inclusão dos pacientes:
-o automonitoramento da glicemia capilar não deve ser considerado como uma intervenção isolada;
-sua necessidade e finalidade devem ser avaliadas pela equipe de saúde de acordo com o plano terapêutico global, que inclui intervenções de mudança de estilo de vida e medicamentos;
-deve estar integrado ao processo terapêutico e, sobretudo, ao desenvolvimento da autonomia do portador para o autocuidado por intermédio da Educação em Saúde;
-a indicação deve ser reavaliada e regulada a depender dos diversos estágios da evolução da doença, acordado com o paciente que deve ser capacitado a interpretar os resultados do AMGC e fazer as mudanças apropriadas nas dosagens da insulina;
-o AMGC deve ser oferecido de forma continuada para os pacientes selecionados de acordo com circunstâncias pessoais e quadro clínico e esses devem receber suporte continuado da equipe para garantir a eficácia do processo; a instrução inicial e a reinstrução periódica a respeito da monitorização da glicemia;
-o uso de medidores (glicosímetros) e de tiras reagentes deve ser individualizado e atender às necessidades do paciente; e
-a amostra do sangue deve ser colhida na ponta dos dedos da mão, acessado com picada de lancetas, daí ser também chamada de glicemia em "ponta do dedo".
2.2. Indicações do automonitoramento
O AMGC deve ser incentivado nos pacientes que usam insulina associado às estratégias de Educação em Saúde que visem aumentar a autonomia do portador para o autocuidado e essas ações devem ser incorporadas na rotina das unidades de saúde.
Não existem evidências científicas suficientes que o automonitoramento rotineiro da glicemia capilar nos pacientes diabéticos tipo 2 em terapia com hipoglicemiantes orais seja custo-efetivo para o melhor controle da glicemia. Nesses casos, a glicemia capilar pode ser realizada na própria unidade de saúde por ocasião das visitas regulares de avaliação definidas pela equipe conforme protocolo instituído.
A freqüência do AMGC deve ser determinada individualmente, dependente da situação clínica, do plano terapêutico, do esquema de utilização da insulina, do grau de informação e compromisso do paciente para o autocuidado e da sua capacidade de modificar sua medicação a partir das informações obtidas.
A freqüência diária recomendada em média deve ser três a quatro vezes ao dia.
Os portadores de diabetes tipo 1 e os que usam múltiplas injeções diárias de insulina podem fazer a glicemia de "ponta de dedo" 3 a 4 vezes ao dia e em horários de ocorrência de maior descontrole glicêmico permitindo ajustes individualizados da insulina; essas medidas incluem uma antes (pré-prandial) e 2 horas após as refeições (pós-prandial) e ao deitar. O teste à noite é importante para a prevenção de hipoglicemias noturnas.
Para os que usam insulina e agentes hipoglicemiantes orais e praticam exercício, o AMGC antes, durante e, especialmente, horas após o exercício pode contribuir para estabelecer o nível de resposta à atividade física. Essa informação pode ser usada para fazer ajustes nas doses e/ou na ingestão de carboidratos e evitar alterações glicêmicas significativas, sobretudo a hipoglicemia.
2.3. Avaliação e controle
A reavaliação das habilidades para o autocuidado, para o uso adequado das informações colhidas com o teste e da exatidão e precisão dos resultados oferecidos pelos glicosímetros devem ser feitas pelo menos anualmente ou quando houver discordância entre o controle glicêmico e/ou quadro clínico e as leituras obtidas. Para isso, os resultados do teste com o glicosímetro devem ser comparados com os da glicemia em jejum de laboratório medido simultaneamente.
O paciente deve fazer o registro dos resultados das glicemias capilares na freqüência estabelecida pela equipe e este deve estar disponível quando dos retornos agendados e registrados nos prontuários.
Outro fator a ser reavaliado é a freqüência e a constância da realização da glicemia capilar em "ponta do dedo"; essas são influenciadas pelo desconforto causado pelo alto número de terminações nervosas presentes neste local o que pode afetar a adesão do paciente. Alguns trabalhos recentes apresentam sítios alternativos para glicemia capilar, porém são pouco utilizados.
ANEXO LXXXVIII
TERMO DE COMPROMISSO ENTRE O MINISTÉRIO DA SAÚDE E O ESTADO PARA ADESÃO AO PROGRAMA DE VALORIZAÇÃO DO PROFISSIONAL DA ATENÇÃO BÁSICA (Origem: PRT MS/GM 568/2013, Anexo 2)
TERMO DE COMPROMISSO ENTRE O MINISTÉRIO DA SAÚDE E O ESTADO __________________, PARA ADESÃO AO PROGRAMA DE VALORIZAÇÃO DO PROFISSIONAL DA ATENÇÃO BÁSICA (PROVAB).
O Ministério da Saúde, CNPJ nº 00.394.544/0002-66, doravante denominado simplesmente MS, neste ato representado pelo Ministro de Estado da Saúde, ALEXANDRE ROCHA SANTOS PADILHA, e o ESTADO ____________, neste ato representado por ______________, (qualificação), considerando a Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações, que institui o PROGRAMA DE VALORIZAÇÃO DO PROFISSIONAL DA ATENÇÃO BÁSICA, doravante denominado PROVAB, resolvem CELEBRAR o presente Termo de Compromisso, mediante as cláusulas e condições seguintes:
CLÁUSULA PRIMEIRA - DO OBJETO
O presente Termo de Compromisso tem por objeto pleitear a habilitação ao recebimento dos recursos financeiros previstos na Portaria GM/MS nº XXX de 2013, de custeio para manutenção e execução das atividades das Coordenações Estaduais e do Distrito Federal ao PROVAB, que visa o estímulo e a valorização do profissional de saúde que atue em equipes no âmbito da Atenção Básica e na Estratégia de Saúde da Família, conforme previsto no art. 1º, da Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações.
CLÁUSULA SEGUNDA - DOS COMPROMISSOS COM A POLÍTICA NACIONAL DE ATENÇÃO BÁSICA
O gestor Estadual de saúde deverá orientar seus trabalhos em atendimento às exigências dispostas na Portaria nº 2.488/GM/MS, de 21 de outubro de 2011, da Política Nacional de Atenção Básica, notadamente no que se refere aos princípios e diretrizes gerais da atenção básica e a infraestrutura existente.
CLÁUSULA TERCEIRA - DAS OBRIGAÇÕES DO ESTADO
Para consecução do objeto estabelecido neste Termo de Compromisso, o ESTADO deverá atender os seguintes aspectos relativos à Gestão estadual do PROVAB e apoio aos municípios participantes do Programa:
a) Compor a Comissão de Coordenação Estadual do PROVAB e indicar o Coordenador Estadual;
b) Disponibilizar infraestrutura para o funcionamento da Comissão de Coordenação Estadual do PROVAB, bem como para as atividades do Coordenador Estadual do programa, prevendo deslocamentos eventuais aos municípios;
c) Auxiliar a Comissão de Coordenação Estadual do PROVAB no acompanhamento dos profissionais inseridos nos municípios e nas eventuais situações de remanejamento dos médicos;
d) Apoiar na fiscalização do cumprimento de carga horária dos médicos nas equipes de saúde da família;
e) Promover articulação da Comissão de Coordenação Estadual do PROVAB com a Comissão Permanente de Integração Ensino-Serviço (CIES) e o Conselho Estadual de Saúde (CES);
f) Incentivar a adesão das equipes de saúde da família com médicos participantes do PROVAB no Programa de Melhoria da Qualidade e do Acesso (PMAQ), no Programa de Requalificação de Unidades Básicas de Saúde (Requalifica UBS) e no e-SUS Atenção Básica;
g) Incentivar a implantação dos núcleos de telessaúde nos municípios;
h) Promover Fóruns de Educação Permanente em Saúde, com vistas à integração Ensino Serviço;
CLÁUSULA QUARTA - DAS OBRIGAÇÕES DO MINISTÉRIO DA SAÚDE
Constituem obrigações do Ministério da Saúde:
a) Coordenar em âmbito Nacional o programa e indicar representante para compor Comissão Coordenadora estadual do PROVAB ;
b) Selecionar, conforme edital público, os profissionais aptos a participar do PROVAB, nos termos do inciso I do art. 2º da Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações;
c) Garantir o pagamento da bolsa do trabalhador-estudante do PROVAB, obedecendo a legislação vigente e edital específico a ser publicado;
d) Garantir a inclusão dos profissionais do PROVAB em curso de especialização em Saúde da Família sob responsabilidade das universidades públicas participantes do Sistema Universidade Aberta do Sistema Único de Saúde (UNA-SUS);
e) Instalar e manter os Núcleos de Telessaúde, onde houver necessidade, nas instituições que forem responsáveis pela supervisão dos profissionais participantes do PROVAB e nas unidades básicas de saúde selecionadas pelo Programa;
f) Selecionar as instituições responsáveis pela supervisão e avaliação;
g) Expedir certificado de participação para os profissionais de saúde aprovados no PROVAB, conforme o disposto no art. 10 da Portaria Interministerial nº 2.087/MS/MEC, de 1º de setembro de 2011 e suas alterações;
h) Promover a troca de experiência entre UNA-SUS, Instituições Supervisoras e estados, através de oficinas regionais de trabalho;
i) Garantir o monitoramento e avaliação do PROVAB;
j) Promover a integração com a Política Nacional de Educação Permanente em Saúde;
CLÁUSULA QUINTA - DA VIGÊNCIA
O presente Termo terá vigência por um ano a contar da data de sua assinatura, podendo ser prorrogado mediante celebração de aditivo.
CLÁUSULA SEXTA - DAS ALTERAÇÕES
As eventuais alterações ao presente compromisso serão realizadas por meio de Termo Aditivo acordado entre os partícipes.
CLÁUSULA SÉTIMA - DA PUBLICAÇÃO
O presente Termo deverá ser publicado em extrato no Diário Oficial da União, as expensas do MS.
CLÁUSULA OITAVA - DA RESOLUÇÃO DE CONFLITOS
Eventuais conflitos, dúvidas ou controvérsias decorrentes da interpretação e execução do presente Termo de Compromisso serão dirimidos administrativamente pelos partícipes.
E, por estarem de pleno acordo, as partes assumem os compromissos elencados acima, sem prejuízo de quaisquer outros que visem uma gestão democrática e que promovam a qualidade do trabalho, a promoção de saúde do trabalhador e a valorização dos profissionais de saúde, e firmam o presente Termo de Compromisso, na presença das testemunhas abaixo, para que produza seus jurídicos e legais efeitos.
Brasília, ______ de ____________ de 2013.
ALEXANDRE ROCHA SANTOS PADILHA ___________________Estado
Ministro de Estado da Saúde
TESTEMUNHAS: NOME:___________________________________________
RG:__________________________
NOME:___________________________________________
RG:__________________________
ANEXO LXXXIX
MUNICÍPIOS CONTEMPLADOS NA ETAPA II DO PROGRAMA DE QUALIFICAÇÃO E ESTRUTURAÇÃO DA GESTÃO DO TRABALHO E DA EDUCAÇÃO NO SUS (Origem: PRT MS/GM 2261/2006, Anexo 1)
| Municípios | População | Postos de Trabalho Públicos |
|---|---|---|
| Bahia | ||
| Feira de Santana | 511.153 | 2.666 |
| Vitória da Conquista | 277.659 | 1.915 |
| Ilhéus | 221.468 | 1.160 |
| Camaçarí | 181.223 | 1.542 |
| Ceará | ||
| Caucaia | 285.094 | 1.018 |
| Espírito Santo | ||
| Vila Velha | 378.553 | 1.236 |
| Serra | 361.328 | 2.039 |
| Cariacica | 344.457 | 1.156 |
| Colatina | 108.004 | 1.090 |
| Goiás | ||
| Anápolis | 302.822 | 1.162 |
| Maranhão | ||
| Imperatriz | 231.659 | 1.441 |
| Minas Gerais | ||
| Contagem | 573.870 | 2.726 |
| Uberlândia | 555.606 | 4.499 |
| Juiz de Fora | 485.500 | 4.025 |
| Betim | 361.710 | 4.031 |
| Montes Claros | 330.009 | 3.003 |
| Uberaba | 270.176 | 2.738 |
| Governador Valadares | 253.863 | 1.349 |
| Barbacena | 119.870 | 1.185 |
| Pará | ||
| Santarém | 269.961 | 1.017 |
| Paraíba | ||
| Campina Grande | 368.792 | 2.770 |
| Paraná | ||
| Londrina | 473.741 | 4.448 |
| Maringá | 308.260 | 2.207 |
| Cascavel | 266.604 | 1.507 |
| Pernambuco | ||
| Jaboatão dos Guararapes | 619.845 | 1.571 |
| Olinda | 378.649 | 1.833 |
| Paulista | 282.811 | 1.029 |
| Caruaru | 269.826 | 2.512 |
| Petrolina | 241.283 | 1.535 |
| Rio de Janeiro | ||
| São Gonçalo | 936.239 | 3.431 |
| Duque de Caxias | 819.096 | 4.088 |
| Nova Iguaçu | 804.044 | 3.265 |
| Niterói | 468.897 | 8.987 |
| São João de Meriti | 459.084 | 1.621 |
| Campos dos Goytacazes | 419.427 | 3.813 |
| Petrópolis | 299.131 | 2.401 |
| Volta Redonda | 250.884 | 2.367 |
| Itaboraí | 205.857 | 1.163 |
| Nova Friburgo | 175.987 | 1.331 |
| Nilópolis | 151.937 | 1.071 |
| Macaé | 147.940 | 1.046 |
| Itaguaí | 89.546 | 1.115 |
| Rio Grande do Norte | ||
| Mossoró | 222.587 | 1.989 |
| Rio Grande do Sul | ||
| Pelotas | 334.779 | 1.767 |
| Santa Maria | 258.128 | 3.128 |
| São Leopoldo | 203.942 | 1.031 |
| Rio Grande | 192.274 | 1.014 |
| Santa Catarina | ||
| Joinville | 469.362 | 3.215 |
| São José | 188.668 | 2.583 |
| São Paulo | ||
| Guarulhos | 1.188.206 | 5.302 |
| Campinas | 1.018.781 | 9.052 |
| São Bernardo do Campo | 758.430 | 2.758 |
| Osasco | 686.799 | 4.544 |
| Santo André | 662.444 | 1.650 |
| São José dos Campos | 578.617 | 3.028 |
| Sorocaba | 539.877 | 3.597 |
| Ribeirão Preto | 534.944 | 8.112 |
| Santos | 418.199 | 4.158 |
| Mauá | 391.119 | 1.673 |
| São José do Rio Preto | 389.781 | 1.169 |
| Diadema | 378.057 | 1.581 |
| Carapicuiba | 369.303 | 1.982 |
| Moji das Cruzes | 353.378 | 2.047 |
| Piracicaba | 349.610 | 2.025 |
| Bauru | 338.344 | 2.799 |
| São Vicente | 317.712 | 1.059 |
| Taubaté | 259.247 | 1.916 |
| Barueri | 239.697 | 1.171 |
| Sumaré | 219.311 | 1.469 |
| Marília | 212.017 | 1.712 |
| Presidente Prudente | 198.794 | 1.288 |
| Americana | 194.250 | 1.169 |
| Araçatuba | 176.025 | 1.041 |
| Ferraz de Vasconcelos | 161.113 | 1.469 |
| Itapecerica da Serra | 147.540 | 2.599 |
| Itu | 146.739 | 1.915 |
| Franco da Rocha | 117.282 | 1.277 |
| Botucatu | 115.418 | 3.338 |
| Cubatão | 115.272 | 1.047 |
| Assis | 91.886 | 1.333 |
| Caieiras | 84.254 | 1.310 |
| Lins | 68.929 | 1.031 |
| Fonte: Pesquisa IBGE/AMS, 2002. | ||
ANEXO XC
MUNICÍPIOS CONTEMPLADOS NA ETAPA III DO PROGRAMA DE QUALIFICAÇÃO E ESTRUTURAÇÃO DA GESTÃO DO TRABALHO E DA EDUCAÇÃO NO SUS (Origem: PRT MS/GM 2261/2006, Anexo 2)
| Municípios | População | Postos de Trabalho Públicos |
|---|---|---|
| Acre | ||
| Cruzeiro do Sul | 75.399 | 745 |
| Alagoas | ||
| Arapiraca | 195.200 | 770 |
| Amapá | ||
| Santana | 92.190 | 792 |
| Amazonas | ||
| Coari | 78.615 | 574 |
| Itacoatiara | 77.517 | 637 |
| Bahia | ||
| Itabuna | 201.296 | 898 |
| Juazeiro | 193.136 | 507 |
| Jequié | 148.186 | 905 |
| Alagoinhas | 135.448 | 761 |
| Lauro de Freitas | 131.494 | 662 |
| Barreiras | 126.885 | 658 |
| Porto Seguro | 120.479 | 543 |
| Paulo Afonso | 100.509 | 634 |
| Candeias | 80.368 | 771 |
| Serrinha | 73.511 | 538 |
| Itaberaba | 61.052 | 530 |
| Ceará | ||
| Juazeiro do Norte | 227.774 | 792 |
| Maracanau | 188.882 | 680 |
| Sobral | 166.543 | 673 |
| Crato | 110.378 | 736 |
| Maranguape | 94.796 | 518 |
| Iguatú | 89.654 | 741 |
| Quixadá | 72.979 | 552 |
| Crateús | 72.618 | 532 |
| Quixeramobim | 59.195 | 503 |
| Espírito Santo | ||
| Cachoeiro de Itapemirim | 187.643 | 599 |
| Linhares | 118.315 | 731 |
| São Mateus | 97.313 | 701 |
| Barra de São Francisco | 38.351 | 546 |
| Goiás | ||
| Aparecida de Goiânia | 400.412 | 817 |
| Luziânia | 166.413 | 626 |
| Rio Verde | 127.347 | 585 |
| Planaltina | 87.304 | 523 |
| Itumbiara | 84.210 | 685 |
| Jataí | 80.647 | 555 |
| Maranhão | ||
| Caxias | 142.296 | 924 |
| Timon | 138.715 | 761 |
| Codó | 113.314 | 500 |
| Barra do Corda | 77.992 | 574 |
| Mato Grosso | ||
| Várzea Grande | 236.932 | 723 |
| Rondonópolis | 160.971 | 745 |
| Cáceres | 86.430 | 596 |
| Mato Grosso do Sul | ||
| Dourados | 176.693 | 803 |
| Minas Gerais | ||
| Ribeirão das Neves | 288.605 | 679 |
| Ipatinga | 225.642 | 908 |
| Santa Luzia | 203.989 | 539 |
| Sete Lagoas | 201.436 | 961 |
| Divinópolis | 197.141 | 815 |
| Ibirité | 155.301 | 756 |
| Poços de Caldas | 145.968 | 665 |
| Patos de Minas | 132.369 | 906 |
| Teófilo Otoni | 128.386 | 508 |
| Varginha | 117.504 | 655 |
| Itabira | 103.478 | 631 |
| Passos | 102.315 | 550 |
| Ubá | 92.586 | 626 |
| Alfenas | 72.737 | 523 |
| Manhuaçú | 70.631 | 539 |
| Nova Lima | 69.247 | 617 |
| Pará | ||
| Ananindeua | 450.905 | 931 |
| Marabá | 186.003 | 954 |
| Castanhal | 147.643 | 645 |
| Cametá | 102.664 | 513 |
| Itaituba | 95.719 | 521 |
| Altamira | 81.942 | 599 |
| Tucuruí | 81.372 | 766 |
| Paraíba | ||
| Patos | 96.002 | 997 |
| Sousa | 62.839 | 594 |
| Paraná | ||
| Ponta Grossa | 290.818 | 926 |
| Foz do Iguaçu | 286.285 | 933 |
| São José dos Pinhais | 235.476 | 782 |
| Guarapuava | 162.754 | 607 |
| Paranaguá | 138.635 | 736 |
| Pinhais | 114.122 | 656 |
| Apucarana | 113.000 | 548 |
| Araucária | 107.450 | 660 |
| Pernambuco | ||
| Cabo de Santo Agostinho | 163.493 | 816 |
| Camaragibe | 140.577 | 812 |
| Garanhuns | 123.591 | 882 |
| Vitória de Santo Antão | 121.972 | 669 |
| Igarassu | 87.861 | 772 |
| Goiana | 74.027 | 674 |
| Arcoverde | 63.962 | 530 |
| Limoeiro | 56.916 | 788 |
| Palmares | 55.002 | 512 |
| Salgueiro | 53.338 | 564 |
| Piauí | ||
| Parnaíba | 138.530 | 735 |
| Picos | 71.975 | 843 |
| Floriano | 55.850 | 590 |
| Rio de Janeiro | ||
| Belford Roxo | 464.386 | 729 |
| Magé | 222.930 | 554 |
| Barra Mansa | 173.715 | 653 |
| Cabo Frio | 148.091 | 946 |
| Teresópolis | 145.123 | 571 |
| Angra dos Reis | 132.899 | 894 |
| Resende | 112.876 | 793 |
| Araruama | 92.445 | 595 |
| São Pedro da Aldeia | 71.453 | 552 |
| Saquarema | 58.369 | 563 |
| Arraial do Cabo | 25.504 | 543 |
| Casimiro de Abreu | 24.799 | 559 |
| Carmo | 15.603 | 580 |
| São Sebastião do Alto | 8.627 | 804 |
| Rio Grande do Norte | ||
| Parnamirim | 149.575 | 859 |
| São José de Mipibú | 37.652 | 510 |
| Santa Cruz | 32.363 | 541 |
| Rio Grande do Sul | ||
| Caxias do Sul | 388.740 | 760 |
| Canoas | 321.027 | 729 |
| Novo Hamburgo | 248.569 | 729 |
| Viamão | 246.377 | 540 |
| Alvorada | 200.967 | 501 |
| Passo Fundo | 179.346 | 843 |
| Sapucaia do Sul | 129.998 | 761 |
| Cachoeirinha | 115.415 | 814 |
| Erechim | 94.435 | 552 |
| Alegrete | 86.630 | 526 |
| Esteio | 83.900 | 510 |
| Rondônia | ||
| Jiparaná | 110.448 | 694 |
| Vilhena | 60.295 | 504 |
| Santa Catarina | ||
| Blumenau | 281.993 | 830 |
| Criciúma | 180.188 | 893 |
| Lages | 163.489 | 937 |
| Chapecó | 161.391 | 608 |
| Itajaí | 158.790 | 641 |
| São Paulo | ||
| Jundiaí | 337.233 | 644 |
| Itaquaquecetuba | 316.721 | 503 |
| Franca | 309.888 | 857 |
| Guarujá | 286.953 | 671 |
| Embu | 228.616 | 672 |
| Praia Grande | 222.000 | 632 |
| Taboão da Serra | 212.870 | 903 |
| São Carlos | 207.098 | 543 |
| Jacareí | 202.407 | 588 |
| Araraquara | 191.899 | 997 |
| Rio Claro | 180.373 | 588 |
| Cotia | 165.826 | 567 |
| São Caetano do Sul | 136.364 | 827 |
| Mojiguaçú | 133.737 | 650 |
| Ribeirão Pires | 112.382 | 505 |
| Catanduva | 111.955 | 620 |
| Salto | 101.601 | 505 |
| Itanhaém | 82.503 | 700 |
| Bebedouro | 77.674 | 608 |
| Pirassununga | 68.153 | 692 |
| Paulínia | 57.253 | 828 |
| São José do Rio Pardo | 52.306 | 555 |
| São Joaquim da Barra | 43.865 | 620 |
| Pariqueraaçu | 19.466 | 527 |
| Casa Branca | 27.403 | 958 |
| Santa Rita do Passa Quatro | 26.954 | 844 |
| Sergipe | ||
| Itabaiana | 81.666 | 579 |
| Tocantins | ||
| Araguaina | 122.450 | 799 |
| Fonte: Pesquisa IBGE/AMS, 2002. | ||
ANEXO XCI
MODELO DE OFÍCIO DE ENCAMINHAMENTO DE PROJETO (Origem: PRT MS/GM 2261/2006, Anexo 3)
Modelo de Ofício de Encaminhamento de Projeto
... [timbre da secretaria de saúde] ...
Ofício nº ...... [número do ofício] ...
... [município] ..., de ... [data] ...
Ao Senhor
... [nome completo] ...
Secretário de Gestão do Trabalho e da Educação na Saúde do Ministério da Saúde
Assunto: Encaminhamento de Projeto de Fortalecimento da Gestão do Trabalho e da Educação na Saúde
Senhor Secretário.
1. Encaminho, para análise e homologação, o Projeto de Fortalecimento da Gestão do Trabalho e da Educação na Saúde da
ecretaria de Saúde do Distrito Federal (ou Estado de .... [denominação] .... ou Município de ..... [denominação] ....).
2. Como anexo do individuado projeto, também segue a Declaração de Adesão, Alimentação e Atualização do INFORSUS. Atenciosamente,
... [nome completo] ...
Secretário de Saúde do Distrito Federal
(ou do Estado de ... [denominação] ... ou Município de ... [denominação] ...)
ANEXO XCII
MODELO DE DECLARAÇÃO DE ADESÃO, ALIMENTAÇÃO E ATUALIZAÇÃO DO INFORSUS (Origem: PRT MS/GM 2261/2006, Anexo 4)
Modelo de Declaração de Adesão, Alimentação e Atualização do INFORSUS
... [timbre da secretaria de saúde] ...
Declaração de Adesão, Alimentação e atualização do INFORSUS Declaro que, imediatamente após o início do funcionamento do Sistema Nacional de Informações de Recursos Humanos do Sistema Único de Saúde (INFORSUS), a Secretaria de Saúde do Distrito Federal (ou Estado de ... [denominação] ... ou Município de ... [deNominação] ...) promoverá os atos necessários para se integrar ao mencionado sistema. Declaro, ainda, que a Secretaria promoverá a alimentação e atualização dos dados requeridos, observando a periodicidade que vier a ser estabelecida.
[nome completo]
Secretário de Saúde do Distrito Federal
(ou do Estado de ... [denominação] ... ou Município de ... [denominação] ...)
ANEXO XCIII
DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SISTEMA ÚNICO DE SAÚDE (PROADI-SUS) (Origem: PRT MS/GM 2814/2014)
CAPÍTULO I
DAS DISPOSIÇÕES PRELIMINARES
(Origem: PRT MS/GM 2814/2014, CAPÍTULO I)
Art. 1º Ficam estabelecidos as regras e os critérios para a formalização, apresentação, análise, aprovação, monitoramento e avaliação dos projetos no âmbito do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (PROADI-SUS), bem como sua sistemática de gestão e fluxo processual. (Origem: PRT MS/GM 2814/2014, Art. 1º)
Parágrafo Único. O ciclo de gestão do PROADI-SUS obedecerá à periodicidade trienal, respeitado o exercício fiscal. (Origem: PRT MS/GM 2814/2014, Art. 1º, Parágrafo Único)
Art. 2º A entidade de saúde de reconhecida excelência estará apta a apresentar Projetos de Apoio no âmbito do PROADI-SUS dentre as seguintes áreas de atuação: (Origem: PRT MS/GM 2814/2014, Art. 2º)
I - estudos de avaliação e incorporação de tecnologia: projetos de realização de estudos de avaliação e incorporação de tecnologias; revisão sistemática de literatura; meta-análise de estudos clínicos; estudos clínicos; desenvolvimento de pesquisas e tecnologias úteis ao SUS para fins de diagnóstico, tratamento ou controle de doenças e promoção da qualidade de vida, buscando impacto nos determinantes de saúde com recorte étnico-racial e de gênero; (Origem: PRT MS/GM 2814/2014, Art. 2º, I)
II - capacitação de recursos humanos: projetos para realização de cursos; seminários; palestras; formação e capacitação em serviços destinados à qualificação de profissionais de saúde/gestão de serviços, de acordo com as necessidades identificadas pelos gestores do SUS e Política Nacional de Educação na Saúde, em consonância com as diretrizes traçadas pela Secretaria de Gestão do Trabalho e da Educação na Saúde - SGTES/MS; (Origem: PRT MS/GM 2814/2014, Art. 2º, II)
III - pesquisas de interesse público em saúde: projetos para realização de pesquisas relacionadas à promoção e à recuperação da saúde, prevenção de doenças e agravos; monitoramento; avaliação; mensuração de resultados de políticas/programas de saúde com recorte étnico-racial e de gênero; e (Origem: PRT MS/GM 2814/2014, Art. 2º, III)
IV - desenvolvimento de técnicas e operação de gestão em serviços de saúde: desenvolvimento e implantação de técnicas operacionais, sistemas e tecnologias da informação alinhadas com a gestão de serviços de saúde vinculados ao SUS; da racionalização de custos e ampliação da eficiência operacional dos serviços e sistemas regionais, com o desenvolvimento de controle de doenças no âmbito populacional, avançando nas metodologias estruturadas em torno de metas em qualidade de vida e saúde, incluindo, se necessário, a compra de materiais, desenvolvimento de softwares e equipamentos requeridos para a melhor operação das áreas acima referidas, bem como a efetivação de adequações físicas e de instalações necessárias a essas incorporações. (Origem: PRT MS/GM 2814/2014, Art. 2º, IV)
Art. 3º O Projeto de Apoio a ser apresentado deverá destacar a relevância, a adequação aos temas e objetivos prioritários a serem definidos por meio de ato específico do Ministério da Saúde e o seu potencial de contribuição para a governança do SUS. (Origem: PRT MS/GM 2814/2014, Art. 3º)
Art. 4º A entidade de saúde interessada em apresentar projetos no âmbito do PROADI-SUS deverá ser previamente certificada como entidade de reconhecida excelência pelo Ministério da Saúde, nos termos previstos no art. 11 "caput" da Lei nº 12.101/2009. (Origem: PRT MS/GM 2814/2014, Art. 4º)
Parágrafo Único. Os critérios e requisitos a serem estabelecidos para o reconhecimento de excelência de que trata o "caput" serão previstos em ato específico publicado pelo Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 4º, Parágrafo Único)
CAPÍTULO II
DAS COMPETÊNCIAS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II)
Seção I
Das Secretarias do Ministério da Saúde
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II, Seção I)
Art. 5º Compete à Secretaria-Executiva do Ministério da Saúde (SE/MS): (Origem: PRT MS/GM 2814/2014, Art. 5º)
I - realizar a gestão administrativa dos Projetos de Apoio, centralizando, coordenando e monitorando o fluxo dos seguintes documentos: (Origem: PRT MS/GM 2814/2014, Art. 5º, I)
a) carta consulta; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, a)
b) Projeto de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, b)
c) relatórios semestral, anual e final de atividades do Projeto de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, c)
d) pareceres técnicos das Secretarias e entidades competentes vinculadas ao Ministério da Saúde responsáveis pela análise, monitoramento e avaliação dos projetos; (Origem: PRT MS/GM 2814/2014, Art. 5º, I, d)
e) Termos Aditivos ao Termo de Ajuste; e (Origem: PRT MS/GM 2814/2014, Art. 5º, I, e)
f) Termos Aditivos e apostilamentos aos Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 5º, I, f)
II - preparar relatório sobre as cartas-consulta apresentadas pelas entidades de saúde de reconhecida excelência e os projetos demandados pelas Secretarias e entidades vinculadas do Ministério da Saúde, para análise do Comitê de Avaliação e deliberação do Comitê Gestor do PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 5º, II)
III - elaborar e formalizar Termos de Ajuste, Aditivo e apostilamento aos Projetos de Apoio, conforme as necessidades, em interlocução com as Secretarias e entidades vinculadas responsáveis pelos projetos; (Origem: PRT MS/GM 2814/2014, Art. 5º, III)
IV - coordenar o Comitê de Avaliação do PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 5º, IV)
V - subsidiar o Comitê Gestor do PROADI-SUS na aprovação dos relatórios finais dos Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 5º, V)
VI - publicar portaria com os temas e objetivos prioritários definidos para o triênio; (Origem: PRT MS/GM 2814/2014, Art. 5º, VI)
VII - expedir a certidão prevista no art. 55; e (Origem: PRT MS/GM 2814/2014, Art. 5º, VII)
VIII - promover a articulação entre as Secretarias do Ministério da Saúde e entidades vinculadas envolvidas na execução dos Projetos de Apoio e as entidades de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 5º, VIII)
Art. 6º Compete às Secretarias do Ministério da Saúde e às entidades vinculadas: (Origem: PRT MS/GM 2814/2014, Art. 6º)
I - demandar Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 6º, I)
II - analisar e emitir parecer técnico sobre as cartas-consulta, devendo observar os seguintes critérios: (Origem: PRT MS/GM 2814/2014, Art. 6º, II)
a) o modelo constante do Anexo 2 do Anexo XCIII ; e (Origem: PRT MS/GM 2814/2014, Art. 6º, II, a)
b) os temas e objetivos prioritários definidos na Portaria publicada pela SE/MS, na forma do art. 3º. (Origem: PRT MS/GM 2814/2014, Art. 6º, II, b)
III - analisar, diligenciar e emitir parecer técnico conclusivo sobre os Projetos de Apoio encaminhados pela SE/MS, referente aos seus respectivos campos de atuação; (Origem: PRT MS/GM 2814/2014, Art. 6º, III)
IV - monitorar a execução e avaliar os resultados e a prestação de contas dos Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 6º, IV)
V - emitir parecer técnico conclusivo referente à execução física e financeira dos Projetos de apoio; e (Origem: PRT MS/GM 2814/2014, Art. 6º, V)
VI - emitir parecer técnico conclusivo relativo à suspensão ou ao cancelamento de Projetos de Apoio em execução, para submissão ao Comitê de Avaliação do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 6º, VI)
Seção II
Do Comitê de Avaliação do PROADI-SUS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II, Seção II)
Art. 7º O Comitê de Avaliação do PROADI-SUS será composto por representantes dos seguintes órgãos do Ministério da Saúde, entidades vinculadas, órgãos colegiados e entidades de saúde de reconhecida excelência: (Origem: PRT MS/GM 2814/2014, Art. 7º)
I - 1 (um) da Secretaria-Executiva (SE/MS), que o coordenará; (Origem: PRT MS/GM 2814/2014, Art. 7º, I)
II - 2 (dois) da Secretaria de Atenção à Saúde (SAS/MS), sendo 01 (um) do Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde (DCEBAS/SAS/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, II)
III - 01 (um) da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, III)
IV - 01 (um) da Secretaria de Gestão Estratégica e Participativa (SGEP/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, IV)
V - 01 (um) da Secretaria de Gestão do Trabalho e da Educação na Saúde (SGTES/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, V)
VI - 01 (um) da Secretaria de Vigilância em Saúde (SVS/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, VI)
VII - 01 (um) da Secretaria Especial de Saúde Indígena (SESAI/MS); (Origem: PRT MS/GM 2814/2014, Art. 7º, VII)
VIII - 01 (um) da Agência Nacional de Saúde Suplementar (ANS); (Origem: PRT MS/GM 2814/2014, Art. 7º, VIII)
IX - 01(um) da Agência Nacional de Vigilância Sanitária (ANVISA); (Origem: PRT MS/GM 2814/2014, Art. 7º, IX)
X - 01 (um) do Conselho Nacional de Saúde (CNS); (Origem: PRT MS/GM 2814/2014, Art. 7º, X)
XI - 01 (um) do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 2814/2014, Art. 7º, XI)
XII - 01 (um) do Conselho Nacional de Secretarias Municipais de Saúde (CONASEMS) e; (Origem: PRT MS/GM 2814/2014, Art. 7º, XII)
XIII - 01 (um) representante das entidades de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 7º, XIII)
§ 1º Os representantes, titulares e suplentes, serão indicados ao Ministro de Estado da Saúde pela autoridade superior das respectivas Secretarias do Ministério da Saúde e entidades vinculadas, bem como pela presidência do CNS, CONASS, CONASEMS e pelo conjunto das entidades de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 7º, § 1º)
§ 2º O membro do Comitê de Avaliação do PROADI-SUS declarará formalmente, em ata, eventual conflito de interesses entre suas atividades profissionais e o tema objeto de deliberação do colegiado, sendo que, presente o conflito de interesses, abster-se-á de participar da discussão e da deliberação. (Origem: PRT MS/GM 2814/2014, Art. 7º, § 2º)
Art. 8º Compete ao Comitê de Avaliação do PROADI-SUS elaborar relatórios prévios que subsidiem as decisões a serem tomadas pelo Comitê Gestor do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 8º)
§ 1º Todos os processos que demandarem atuação do Comitê Gestor do PROADI-SUS serão previamente encaminhados ao Comitê de Avaliação do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 8º, § 1º)
§ 2º O Comitê de Avaliação do PROADI-SUS poderá constituir Grupos de Trabalho (GT) para o cumprimento de finalidades específicas. (Origem: PRT MS/GM 2814/2014, Art. 8º, § 2º)
§ 3º O Comitê de Avaliação do PROADI-SUS reunir-se-á em plenária ordinariamente uma vez por trimestre e, extraordinariamente, mediante convocação do Ministro de Estado da Saúde, a qualquer momento, sempre com antecedência de pelo menos 5 (cinco) dias úteis em relação às reuniões do Comitê Gestor. (Origem: PRT MS/GM 2814/2014, Art. 8º, § 3º)
Seção III
Do Comitê Gestor do PROADI-SUS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO II, Seção III)
Art. 9º O Comitê Gestor do PROADI-SUS será composto pelas seguintes autoridades: (Origem: PRT MS/GM 2814/2014, Art. 9º)
I - Ministro de Estado da Saúde; (Origem: PRT MS/GM 2814/2014, Art. 9º, I)
II - Presidente do CONASS; e (Origem: PRT MS/GM 2814/2014, Art. 9º, II)
III - Presidente do CONASEMS. (Origem: PRT MS/GM 2814/2014, Art. 9º, III)
Parágrafo Único. As autoridades enumeradas no "caput" poderão fazer-se representar por delegação. (Origem: PRT MS/GM 2814/2014, Art. 9º, Parágrafo Único)
Art. 10. Compete ao Comitê Gestor do PROADI-SUS: (Origem: PRT MS/GM 2814/2014, Art. 10)
I - definir os temas e objetivos prioritários; (Origem: PRT MS/GM 2814/2014, Art. 10, I)
II - aprovar as cartas-consulta; (Origem: PRT MS/GM 2814/2014, Art. 10, II)
III - definir a Secretaria do Ministério da Saúde ou entidade vinculada competente para realizar a análise e acompanhamento de cada projeto constante de Cartas-consulta aprovadas; (Origem: PRT MS/GM 2814/2014, Art. 10, III)
IV - aprovar os Projetos de Apoio demandados; (Origem: PRT MS/GM 2814/2014, Art. 10, IV)
V - avaliar os resultados dos Projetos de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 10, V)
VI - formular proposições para aprimoramento do PROADI-SUS; e (Origem: PRT MS/GM 2814/2014, Art. 10, VI)
VII - analisar e deliberar acerca dos casos omissos. (Origem: PRT MS/GM 2814/2014, Art. 10, VII)
Parágrafo Único. O Comitê Gestor reunir-se-á em plenária ordinariamente uma vez por trimestre e, extraordinariamente, mediante convocação do Ministro de Estado da Saúde, a qualquer momento. (Origem: PRT MS/GM 2814/2014, Art. 10, Parágrafo Único)
CAPÍTULO III
DO TERMO DE AJUSTE
(Origem: PRT MS/GM 2814/2014, CAPÍTULO III)
Art. 11. A entidade de saúde de reconhecida excelência apta a apresentar projetos no âmbito do PROADI-SUS poderá firmar Termo de Ajuste com o Ministério da Saúde, o qual disciplinará os direitos e obrigações entre as partes, objetivando a elaboração, a execução, a prestação de contas e a avaliação dos projetos no âmbito do programa. (Origem: PRT MS/GM 2814/2014, Art. 11)
§ 1º O Termo de Ajuste deverá ser firmado em consonância com os temas e objetivos prioritários definidos em Portaria publicada pela SE/MS, observado o valor estimado da isenção tributária a ser obtida pela entidade de saúde de reconhecida excelência no triênio e observado o modelo do Anexo 1 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 11, § 1º)
§ 2º A Portaria SE/MS a que se refere o § 1º será publicada no ano anterior ao início do triênio, até 30 de junho. (Origem: PRT MS/GM 2814/2014, Art. 11, § 2º)
§ 3º Após firmado o Termo de Ajuste, a entidade de saúde de reconhecida excelência estará apta a apresentar Projetos de Apoio, que serão formalizados em processos administrativos independentes e vinculados ao Termo de Ajuste, respeitado o triênio de vigência e o limite das isenções tributárias. (Origem: PRT MS/GM 2814/2014, Art. 11, § 3º)
Art. 12. São cláusulas necessárias aos Termos de Ajustes firmados entre o Ministério da Saúde e a entidade de saúde de reconhecida excelência: (Origem: PRT MS/GM 2814/2014, Art. 12)
I - o objeto, em consonância com os temas e objetivos prioritários referentes ao respectivo triênio; (Origem: PRT MS/GM 2814/2014, Art. 12, I)
II - o prazo de vigência do Termo de Ajuste, o qual deverá ficar adstrito à vigência do respectivo triênio; (Origem: PRT MS/GM 2814/2014, Art. 12, II)
III - o valor estimado da isenção tributária a ser usufruída pela entidade de saúde de reconhecida excelência no triênio; (Origem: PRT MS/GM 2814/2014, Art. 12, III)
IV - os direitos, obrigações e responsabilidades das partes, especialmente a obrigatoriedade da entidade de saúde de apresentar, regularmente e sempre que requerida, ao Ministério da Saúde as informações e documentos exigidos, com a devida atualização, nos termos do regulamento vigente para o PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 12, IV)
V - a definição dos dados e informações confidenciais considerados como direito à intimidade das pessoas, sigilo profissional e intelectual, os quais deverão estar em estrita observância à legislação pertinente; (Origem: PRT MS/GM 2814/2014, Art. 12, V)
VI - a obrigação da prestação de contas nos termos deste Anexo; (Origem: PRT MS/GM 2814/2014, Art. 12, VI)
VII - o monitoramento e a avaliação dos Projetos de Apoio vinculados ao Termo de Ajuste; (Origem: PRT MS/GM 2814/2014, Art. 12, VII)
VIII - as vedações impostas às partes; (Origem: PRT MS/GM 2814/2014, Art. 12, VIII)
IX - as hipóteses de rescisão; (Origem: PRT MS/GM 2814/2014, Art. 12, IX)
X - o prazo de publicação; (Origem: PRT MS/GM 2814/2014, Art. 12, X)
XI - a indicação do foro para dirimir as dúvidas decorrentes da execução dos projetos vinculados ao Termo de Ajuste; e (Origem: PRT MS/GM 2814/2014, Art. 12, XI)
XII - a competência do Comitê Gestor do PROADI-SUS para decidir acerca de casos omissos. (Origem: PRT MS/GM 2814/2014, Art. 12, XII)
Parágrafo Único. O valor total da isenção tributária apurada no exercício fiscal anterior, comprovado por meio do Balanço Patrimonial, deverá ser informado, anualmente, ao Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 12, Parágrafo Único)
Art. 13. O Termo de Ajuste deverá dispor ainda sobre: (Origem: PRT MS/GM 2814/2014, Art. 13)
I - a observância dos requisitos previstos nas normas de ética em pesquisa vigentes; (Origem: PRT MS/GM 2814/2014, Art. 13, I)
II - a disponibilização dos recursos materiais instrucionais na rede mundial de computadores para entidades públicas e privadas, sem fins lucrativos e certificadas como beneficentes, mediante licença de uso de interesse do SUS, vedado o uso privado e comercial; (Origem: PRT MS/GM 2814/2014, Art. 13, II)
III - a divulgação e a publicidade dos produtos decorrentes da realização do projeto de apoio, previamente aprovadas pelo Ministério da Saúde, cujos textos deverão ser apresentados no idioma oficial do país, bem como deverão conter menção à parceria firmada com o Ministério da Saúde no âmbito do PROADI-SUS, de acordo com a Lei nº 12.101, de 2009; (Origem: PRT MS/GM 2814/2014, Art. 13, III)
IV - a obrigatoriedade do respeito às normas de editoração do Ministério da Saúde, quando resultar do projeto algum tipo de publicação; (Origem: PRT MS/GM 2814/2014, Art. 13, IV)
V - a previsão de publicação de artigos científicos em outros idiomas com fins de divulgação dos produtos decorrentes da realização do projeto de apoio, que não substituirá a entrega de relatório contendo metodologia detalhada e conjunto dos resultados obtidos em vernáculo; e (Origem: PRT MS/GM 2814/2014, Art. 13, V)
VI - a previsão de participação e apresentação de trabalhos (parciais ou completos) em eventos nacionais e internacionais, cujos textos deverão ser apresentados no idioma oficial do país para ciência da Secretaria competente ou entidade vinculada ao Ministério da Saúde, e deverão conter menção à parceria firmada no âmbito do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 13, VI)
Parágrafo Único. A titularidade dos direitos patrimoniais advindos das pesquisas científicas, dos programas desenvolvidos, bem como dos resultados tecnológicos decorrentes dos recursos do projeto de apoio referentes ao PROADI-SUS será do Ministério da Saúde, respeitados os direitos morais do autor quando da finalização do projeto, nos termos da Lei nº 9.610, de 19 de fevereiro de 1998. (Origem: PRT MS/GM 2814/2014, Art. 13, Parágrafo Único)
Art. 14. O Termo de Ajuste será assinado pelo Ministro de Estado da Saúde e pelo representante legal da entidade de saúde de reconhecida excelência até o dia 31 de agosto do exercício fiscal anterior ao início da sua vigência. (Origem: PRT MS/GM 2814/2014, Art. 14)
§ 1º O extrato do Termo de Ajuste publicado no Diário Oficial da União (DOU) conterá: (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único)
I - numeração sequencial e exclusiva para o PROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, I)
II - o número de registro no Sistema Integrado de Protocolo e Arquivo (SIPAR) do Ministério da Saúde; (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, II)
III - a qualificação das partes; (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, III)
IV - o objeto e a finalidade do Termo de Ajuste; e (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, IV)
V - o valor de isenção previsto para o triênio. (Origem: PRT MS/GM 2814/2014, Art. 14, Parágrafo Único, V)
§ 2º O valor previsto da isenção das contribuições sociais deverá ser estimado com base no exercício fiscal anterior ao da celebração do Termo de Ajuste, ou através de projeção econômica com justificativa e memória de cálculo apresentadas pela entidade de excelência, devendo a variação anual do Termo de Ajuste ser ajustada mediante Termos Aditivos durante sua vigência. (Origem: PRT MS/GM 2814/2014, Art. 14, § 1º)
§ 3º O valor total dos projetos executados não poderá ser inferior ao valor da isenção das contribuições sociais usufruídas previstas no Termo de Ajuste, em observância ao disposto no § 2º do art. 11 da Lei nº 12.101, de 2009, considerando-se, nesse caso, o conjunto de Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 14, § 2º)
§ 4º As despesas executadas em desacordo ao estabelecido no art. 14, § 3º são de responsabilidade exclusiva da entidade de saúde, vedada a possibilidade de serem relacionadas ao valor das contribuições sociais usufruídas. (Origem: PRT MS/GM 2814/2014, Art. 14, § 3º)
Art. 15. O Termo de Ajuste poderá ser alterado, no decorrer de sua vigência, mediante celebração de Termo Aditivo, com as devidas justificativas e comprovações, nos seguintes casos: (Origem: PRT MS/GM 2814/2014, Art. 15)
I - alteração da qualificação da entidade de saúde e/ou do seu representante legal; (Origem: PRT MS/GM 2814/2014, Art. 15, I)
II - atualização ou alteração do valor estimado de isenção a ser usufruída pela entidade de saúde; (Origem: PRT MS/GM 2814/2014, Art. 15, II)
III - modificação dos direitos, das obrigações e das responsabilidades das partes; e (Origem: PRT MS/GM 2814/2014, Art. 15, III)
IV - retificação da redação das cláusulas inicialmente previstas no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 15, IV)
Art. 16. O Termo de Ajuste poderá ser rescindido nos seguintes casos: (Origem: PRT MS/GM 2814/2014, Art. 16)
I - a pedido da entidade de saúde de reconhecida excelência; (Origem: PRT MS/GM 2814/2014, Art. 16, I)
II - pela superveniência de norma legal com ele incompatível; e (Origem: PRT MS/GM 2814/2014, Art. 16, II)
III - pela inobservância de qualquer de suas cláusulas. (Origem: PRT MS/GM 2814/2014, Art. 16, III)
§ 1º No caso do inciso I, a entidade de saúde de reconhecida excelência permanecerá obrigada à execução dos Projetos de Apoio que estejam em andamento. (Origem: PRT MS/GM 2814/2014, Art. 16, § 1º)
§ 2º Nos casos dos incisos II e III do "caput", a rescisão do Termo de Ajuste será precedida de notificação formal e fundamentada, garantida a apresentação de defesa no prazo de 10 (dez) dias. (Origem: PRT MS/GM 2814/2014, Art. 16, § 2º)
CAPÍTULO IV
DO PROJETO DE APOIO
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV)
Art. 17. Uma vez firmado o Termo de Ajuste, a entidade de saúde de reconhecida excelência poderá apresentar Projetos de Apoio, considerando-se os temas e objetivos prioritários a que tenha aderido no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 17)
Parágrafo Único. O somatório dos valores dos Projetos de Apoio apresentados e aprovados deve corresponder ao montante de isenção tributária constante do Termo de Ajuste firmado entre a entidade de saúde de reconhecida excelência e o Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 17, Parágrafo Único)
Seção I
Dos Projetos Demandados
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção I)
Art. 18. As Secretarias do Ministério da Saúde e entidades vinculadas, sob aprovação do Comitê Gestor do PROADI-SUS, poderão demandar Projetos de Apoio, na forma do Anexo IV, de acordo com os temas e objetivos prioritários a que tenha aderido a entidade de saúde de reconhecida excelência no Termo de Ajuste firmado. (Origem: PRT MS/GM 2814/2014, Art. 18)
§ 1º A entidade de saúde deverá manifestar-se quanto à viabilidade técnico-financeira em apresentar Projeto de Apoio demandado pelo Ministério da Saúde, no prazo de até 15 (quinze) dias, a contar da data de recebimento da proposta de projeto demandado, nos termos do Anexo 4 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 18, § 1º)
§ 2º Caso haja viabilidade técnico-financeira para apresentação de Projeto de Apoio demandado pelo Ministério da Saúde, nos termos do §1º, a entidade de saúde deverá protocolar, na Secretaria- Executiva/MS, no prazo de até 45 (quarenta e cinco) dias, Projeto de Apoio conforme Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 18, § 2º)
§ 3º Em caso de inviabilidade técnico-financeira para apresentação de Projeto de Apoio demandado, a entidade de saúde de reconhecida excelência deverá justificar a inviabilidade declarada. (Origem: PRT MS/GM 2814/2014, Art. 18, § 3º)
Seção II
Da Carta Consulta
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção II)
Art. 19. A proposta de Projeto de Apoio será formalizada por intermédio de carta-consulta apresentada pela entidade de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 19)
Parágrafo Único. A carta-consulta será protocolada na Secretaria-Executiva do Ministério da Saúde (SE/MS) e será submetida, no prazo de até 5 (cinco) dias contados da data do protocolo, à Secretaria ou entidade vinculada competente para análise e emissão de parecer conclusivo. (Origem: PRT MS/GM 2814/2014, Art. 19, Parágrafo Único)
Art. 20. A Secretaria ou entidade vinculada competente emitirá parecer técnico no prazo de 15 (quinze) dias, nos moldes do Anexo 3 do Anexo XCIII , e o encaminhará à SE/MS para compor a análise do Comitê de Avaliação e posterior deliberação Comitê Gestor. (Origem: PRT MS/GM 2814/2014, Art. 20)
Parágrafo Único. Caso o parecer técnico não seja emitido no prazo previsto no "caput", o Comitê de Avaliação do PROADI-SUS poderá proceder à análise direta da carta-consulta. (Origem: PRT MS/GM 2814/2014, Art. 20, Parágrafo Único)
Art. 21. O Comitê Gestor deliberará acerca da aprovação ou reprovação das cartas-consulta na reunião ordinária subsequente ao seu recebimento, ou, em caso de urgência definida pelo Ministro de Estado da Saúde, em reunião extraordinária. (Origem: PRT MS/GM 2814/2014, Art. 21)
Art. 22. A SE/MS dará conhecimento à entidade de saúde acerca do resultado da deliberação da carta-consulta pelo Comitê Gestor no prazo de 05 (cinco) dias contados do seu recebimento. (Origem: PRT MS/GM 2814/2014, Art. 22)
Seção III
Da Apresentação de Projetos de Apoio
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção III)
Art. 23. Aprovada a carta-consulta, a entidade de saúde de reconhecida excelência apresentará o Projeto de Apoio proposto no prazo de até 45 (quarenta e cinco) dias, contados da data da notificação da aprovação da proposta. (Origem: PRT MS/GM 2814/2014, Art. 23)
§ 1º O Projeto de Apoio será apresentado nos moldes definidos no Anexo 5 do Anexo XCIII e será protocolado na SE/MS. (Origem: PRT MS/GM 2814/2014, Art. 23, § 1º)
§ 2º Nos casos de projetos referentes à realização de pesquisa, a entidade de saúde de reconhecida excelência enviará versão digital do Projeto de Apoio ao Comitê de Ética em Pesquisa (CEP) ou ao Comitê de Ética no Uso de Animais (CEUA). (Origem: PRT MS/GM 2814/2014, Art. 23, § 2º)
§ 3º A ausência de manifestação da entidade de saúde de reconhecida excelência previsto no "caput" implicará a necessidade de apresentação de nova carta-consulta. (Origem: PRT MS/GM 2814/2014, Art. 23, § 3º)
Art. 24. A SE/MS tramitará o Projeto de Apoio apresentado à Secretaria ou entidade vinculada competente, no prazo de 5 (cinco) dias contados da data do protocolo. (Origem: PRT MS/GM 2814/2014, Art. 24)
Art. 25. A análise técnica e financeira do Projeto de Apoio, recomendando ou não sua aprovação, será realizada por meio de parecer conclusivo da Secretaria ou entidade vinculada competente, no prazo de 45 (quarenta e cinco) dias, contados da data de recebimento e observado o modelo contido no Anexo 6 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 25)
Parágrafo Único. O prazo previsto no "caput" poderá ser prorrogado em até 15 (quinze) dias, a critério da unidade administrativa responsável pela análise. (Origem: PRT MS/GM 2814/2014, Art. 25, Parágrafo Único)
Art. 26. A Secretaria ou entidade vinculada competente poderá solicitar à entidade de saúde de reconhecida excelência complementação ao Projeto de Apoio apresentado, incluindo outras informações não mencionadas no Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 26)
§ 1º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de 15 (quinze) dias, contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 26, § 1º)
§ 2º A ausência de manifestação da entidade de saúde de reconhecida excelência previsto no § 1º implicará a não aprovação do Projeto de Apoio e o consequente arquivamento do processo. (Origem: PRT MS/GM 2814/2014, Art. 26, § 2º)
Art. 27. O parecer conclusivo da Secretaria ou entidade vinculada competente, devidamente aprovado pelo Secretário ou dirigente máximo da entidade, será tramitado à SE/MS no prazo de 5 (cinco) dias contados da aprovação final. (Origem: PRT MS/GM 2814/2014, Art. 27)
Art. 28. A SE/MS notificará a entidade de saúde de reconhecida excelência acerca da aprovação ou não do Projeto de Apoio, no prazo de 5 (cinco) dias contados da data de recebimento do processo. (Origem: PRT MS/GM 2814/2014, Art. 28)
Parágrafo Único. Será publicado extrato do Projeto de Apoio no DOU, contendo as seguintes informações: (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único)
I - numeração do Termo de Ajuste a que esteja vinculado; (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, I)
II - o número de registro no SIPAR; (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, II)
III - a qualificação das partes; (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, III)
IV - o objeto e a finalidade do Projeto de Apoio; e (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, IV)
V - e o valor de isenção previsto para a execução do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 28, Parágrafo Único, V)
Art. 29. Os Projetos de Apoio a serem executados no âmbito do PROADI-SUS que envolverem o desenvolvimento e/ou aperfeiçoamento de Soluções de Tecnologia da Informação deverão observar os princípios e diretrizes estabelecidos na Política Nacional de Informação e Informática em Saúde (PNIIS) e no Plano Diretor de Tecnologia da Informação do Ministério da Saúde (PDTI-MS), e serão encaminhados ao do Comitê de Informação e Informática em Saúde do Ministério da Saúde (CIINFO/MS) para ciência. (Origem: PRT MS/GM 2814/2014, Art. 29)
§ 1º Para os fins previstos no "caput", os projetos que envolverem o desenvolvimento e/ou aperfeiçoamento de Soluções de Tecnologia da Informação serão objeto de análise técnica pelo Departamento de Informática do SUS (DATASUS). (Origem: PRT MS/GM 2814/2014, Art. 29, § 1º)
§ 2º A SE/MS encaminhará os projetos referidos no "caput" ao DATASUS após o recebimento do processo vindo da Secretaria ou entidade vinculada competente, observado o prazo previsto no art. 24. (Origem: PRT MS/GM 2814/2014, Art. 29, § 2º)
§ 3º O DATASUS emitirá parecer técnico no prazo de 15 (quinze) dias contados do recebimento do processo, que será então restituído à SE/MS. (Origem: PRT MS/GM 2814/2014, Art. 29, § 3º)
§ 4º Caberá ao DATASUS dar ciência do Projeto de Apoio de que trata este artigo ao Comitê de Informação e Informática em Saúde do Ministério da Saúde (CIINFO/MS). (Origem: PRT MS/GM 2814/2014, Art. 29, § 4º)
Art. 30. No Projeto de Apoio que envolver a aquisição de equipamento e/ou materiais permanentes deverá constar o órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa destinatário da doação dos bens adquiridos, os quais deverão ser registrados no patrimônio do órgão ou estabelecimento beneficiário quando da finalização do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 30)
§ 1º A documentação comprobatória da formalização da doação ao órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa deverá ser encaminhada em conjunto com o Relatório Anual referente ao último ano de vigência do projeto de apoio, conforme modelo constante do Anexo 7 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 30, § 1º)
§ 2º Quando finalizado o Projeto de Apoio, os equipamentos e/ou materiais permanentes utilizados em sua execução poderão ser destinados para uso em outro Projeto de Apoio que esteja sob a responsabilidade da mesma entidade de saúde de reconhecida excelência, desde que haja aprovação prévia da Secretaria ou entidade vinculada competente e do órgão ou estabelecimento beneficiário, indicado quando da elaboração do novo Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 30, § 2º)
§ 3º A aprovação prévia de que trata o § 2º deverá ser solicitada em até 90 (noventa) dias antes do término do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 30, § 3º)
§ 4º Os equipamentos e/ou materiais permanentes advindos de Projetos de Apoio findados deverão estar previstos no plano de trabalho do novo Projeto de Apoio sem previsão de custos relativos a sua aquisição e já indicada a propriedade do beneficiário. (Origem: PRT MS/GM 2814/2014, Art. 30, § 4º)
§ 5º No caso de projeto de pesquisa que preveja a aquisição de equipamentos que não possuam registro ou cadastro junto à ANVISA, a destinação desses seguirá as normas sanitárias em vigor. (Origem: PRT MS/GM 2814/2014, Art. 30, § 5º)
Seção IV
Das Alterações dos Projetos de Apoio
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IV, Seção IV)
Art. 31. A entidade de saúde de reconhecida excelência poderá requerer à SE/MS alterações aos Projetos de Apoio durante a sua execução. (Origem: PRT MS/GM 2814/2014, Art. 31)
§ 1º O requerimento de alteração do Projeto de Apoio deverá conter informações suficientes para análise de mérito pela Secretaria ou entidade vinculada competente e responsável pelo monitoramento e avaliação, em especial: (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º)
I - justificativa para alteração de valor; (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º, I)
II - prorrogação ou redução de vigência do projeto; e (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º, II)
III - proposta de readequação da execução físico-financeira e os respectivos cronogramas de atividades e desembolsos, quando couber. (Origem: PRT MS/GM 2814/2014, Art. 31, § 1º, III)
§ 2º A alteração do valor despendido no Projeto de Apoio deverá observar o disposto no § 2º do art. 11 da Lei nº 12.101, de 2009, considerando-se, nesse caso, o valor estimado da isenção tributária previsto no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 31, § 2º)
§ 3º É vedado à entidade de saúde de reconhecida excelência executar despesas em Projeto de Apoio sem a prévia autorização do Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 31, § 3º)
§ 4º As despesas executadas em desacordo ao estabelecido no §3º são de responsabilidade exclusiva da entidade de saúde, vedada a possibilidade de serem relacionadas ao montante da isenção tributária prevista no Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 31, § 4º)
Art. 32. A SE/MS tramitará os requerimentos de alteração dos Projetos de Apoio, no prazo de 5 (cinco) dias contados da data de seu recebimento, para análise e emissão de parecer técnico conclusivo pela Secretaria ou entidade vinculada compete e responsável pelo monitoramento e avaliação do Projeto, para emissão de parecer técnico conclusivo no prazo de 45 (quarenta e cinco) dias, contados da data de tramitação. (Origem: PRT MS/GM 2814/2014, Art. 32)
§ 1º A Secretaria ou entidade vinculada competente poderá solicitar à entidade de saúde de reconhecida excelência complementação ao requerimento de alteração do Projeto de Apoio, incluindo outras informações não mencionadas no Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 32, § 1º)
§ 2º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de 10 (dez) dias, contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 32, § 2º)
Art. 33. A SE/MS dará conhecimento à entidade de saúde de reconhecida excelência acerca da aprovação ou não da alteração requerida, no prazo de 5 (cinco) dias contados a partir da data de seu recebimento do processo. (Origem: PRT MS/GM 2814/2014, Art. 33)
Art. 34. O requerimento de alteração do Projeto de Apoio deverá ser apresentado com prazo que viabilize a sua análise e aprovação ainda dentro da vigência do Projeto de Apoio, considerados os prazos de análise e encaminhamento previstos nesta Seção. (Origem: PRT MS/GM 2814/2014, Art. 34)
Art. 35. As alterações do Projeto de Apoio serão promovidas por Termo Aditivo aprovado pela Secretaria ou entidade vinculada competente e publicado no DOU, observado o modelo constante do Anexo 5 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 35)
§ 1º Fica dispensada a formalização de Termo Aditivo nas alterações aos Projetos de Apoio que digam respeito exclusivamente a: (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º)
I - alteração de cronograma físico-financeiro de execução do Projeto de Apoio, incluída redução de vigência; (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º, I)
II - inclusão ou exclusão de recursos financeiros no Projeto de Apoio, em decorrência de alterações de mercado, devidamente justificadas e confirmadas pela Secretaria ou entidade vinculada competente, que exijam o reequilíbrio econômico-financeiro, desde que mantido idêntico o objeto definido no Projeto; e (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º, II)
III - correção de erros materiais. (Origem: PRT MS/GM 2814/2014, Art. 35, § 1º, III)
§ 2º Nos casos previstos no §1º, a alteração será promovida por simples apostilamento, definido como o registro da alteração no Projeto de Apoio formalizado. (Origem: PRT MS/GM 2814/2014, Art. 35, § 2º)
CAPÍTULO V
DO MONITORAMENTO E AVALIAÇÃO DOS PROJETOS DE APOIO
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V)
Seção I
Do Monitoramento
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção I)
Art. 36. O processo de monitoramento do Projeto de Apoio será realizado pela Secretaria ou entidade vinculada competente com o objetivo de resguardar a adequada execução do plano de trabalho aprovado, podendo contar com visitas ou inspeções "in loco" e podendo ensejar a determinação de reorientação de ações, caso se entenda pelo descumprimento do plano de trabalho. (Origem: PRT MS/GM 2814/2014, Art. 36)
§ 1º Em caso de determinação de reorientação de ações, as medidas tomadas pela entidade de saúde de reconhecida excelência serão informadas no próximo relatório de atividades a ser apresentado. (Origem: PRT MS/GM 2814/2014, Art. 36, § 1º)
§ 2º A Secretaria ou entidade vinculada competente poderá solicitar auxílio do Conselho Nacional de Secretários de Saúde (CONASS) ou do Conselho Nacional de Secretarias Municipais de Saúde para realização de diligências que julgue necessárias, observado o modelo constante do Anexo 5 do Anexo XCIII , no que couber. (Origem: PRT MS/GM 2814/2014, Art. 36, § 2º)
Seção II
Da Avaliação
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção II)
Art. 37. A prestação de contas e avaliação dos Projetos de Apoio ocorrerá mediante a apresentação, pela entidade de saúde de reconhecida excelência à SE/MS, de relatórios semestrais, anuais e final relativos a cada Projeto, conforme modelos dos Anexos 9, 10 e 11 do Anexo XCIII , sem prejuízo de outras informações que venham a ser solicitadas pelas Secretarias ou entidades vinculadas competentes. (Origem: PRT MS/GM 2814/2014, Art. 37)
Subseção I
Do Relatório Semestral de Atividades
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção II, Subeção I)
Art. 38. O relatório semestral de atividades compreenderá o período de 1º de janeiro a 30 de junho de cada ano e será apresentado pela entidade de saúde de reconhecida excelência até 31 de agosto do mesmo ano considerado, contendo, no mínimo, informações sobre: (Origem: PRT MS/GM 2814/2014, Art. 38)
I - o conteúdo das atividades previstas e executadas; e (Origem: PRT MS/GM 2814/2014, Art. 38, I)
II - o desempenho físico do Projeto de Apoio em relação ao previsto no plano de trabalho, observado o disposto no Anexo 9 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 38, II)
§ 1º O relatório semestral de atividades deverá ser protocolado pela entidade de saúde na SE/MS, que, no prazo de 5 (cinco) dias contados do protocolo, o remeterá à Secretaria ou à entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 38, § 1º)
§ 2º A Secretaria ou entidade vinculada competente emitirá, no prazo de 30 (trinta) dias contados do recebimento do processo, parecer de recomendação sobre o conteúdo do relatório semestral, com apontamentos e indicação de medidas corretivas reputadas necessárias à devida execução do Projeto de Apoio, quando couber. (Origem: PRT MS/GM 2814/2014, Art. 38, § 2º)
§ 3º Para fins de elaboração do parecer de que trata o § 2º, a Secretaria ou entidade vinculada competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão do parecer de recomendação ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 38, § 3º)
§ 4º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 3º, o parecer de recomendação será emitido com as informações que constem do processo, sabendo-se que o não atendimento de apontamentos e medidas corretivas indicadas pela Secretaria ou entidade vinculada competente poderá ensejar a reprovação do relatório anual de atividades do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 38, § 4º)
Art. 39. A SE/MS dará conhecimento à entidade de saúde acerca do parecer de recomendação em até 5 (cinco) dias contados do recebimento proveniente da Secretaria ou entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 39)
Subseção II
Do Relatório Anual de Atividades
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção II, Subeção II)
Art. 40. O relatório anual de atividades compreenderá o período de 1º de janeiro a 31 de dezembro de cada ano e será apresentado pela entidade de saúde de reconhecida excelência até 30 de abril do ano seguinte, contendo, no mínimo, informações sobre: (Origem: PRT MS/GM 2814/2014, Art. 40)
I - o conteúdo e o valor das atividades previstas e executadas; e (Origem: PRT MS/GM 2814/2014, Art. 40, I)
II - demais informações acerca dos desempenhos físico e financeiro do Projeto de Apoio em relação ao previsto no plano de trabalho, observado o disposto nos Anexos 9 e 10 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 40, II)
Parágrafo Único. O relatório anual de atividades será apresentado acompanhado de parecer de auditoria independente, contratada pela entidade de saúde de reconhecida excelência em contrato específico para cada Projeto ou para o conjunto de Projetos de Apoio vinculados ao Termo de Ajuste daquela entidade. (Origem: PRT MS/GM 2814/2014, Art. 40, Parágrafo Único)
Art. 41. O relatório anual de atividades será acompanhado, no mínimo, dos seguintes documentos: (Origem: PRT MS/GM 2814/2014, Art. 41)
I - relação de equipamentos, incluindo os de informática, e materiais permanentes adquiridos para as atividades do Projeto de Apoio, com o número e/ou identificação do Projeto para controle em inventário físico específico e com as respectivas notas fiscais comprobatórias da aquisição; (Origem: PRT MS/GM 2814/2014, Art. 41, I)
II - relação de serviços contratados para execução das atividades do Projeto de Apoio, arrolada em tabela separada, discriminando a personalidade jurídica do fornecedor, sua identificação, breve descrição dos serviços prestados e respectivos valores dispendidos, com as respectivas notas fiscais; (Origem: PRT MS/GM 2814/2014, Art. 41, II)
III - os demonstrativos de resultados por centro de custos, quando pertinente; e (Origem: PRT MS/GM 2814/2014, Art. 41, III)
IV - relatório técnico-científico do projeto de pesquisa, quando for o caso, conforme Anexo 12 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 41, IV)
Parágrafo Único. Quando se tratar da contratação de pessoa jurídica para atuação em mais de um Projeto de Apoio, com emissão de única nota fiscal, a entidade de saúde de reconhecida excelência deverá discriminar, nos respectivos relatórios anuais, os valores dispendidos por Projeto, juntando-se cópia da nota fiscal em todos os relatórios anuais de que fizer parte. (Origem: PRT MS/GM 2814/2014, Art. 41, Parágrafo Único)
Art. 42. A apuração de eventuais ajustes contábeis no Projeto de Apoio deverá observar a vigência do Termo de Ajuste, não sendo permitido remanejamento de saldo financeiro ou de qualquer outro recurso para o Termo de Ajuste subsequente. (Origem: PRT MS/GM 2814/2014, Art. 42)
Art. 43. O relatório anual de atividades será protocolado pela entidade de saúde de reconhecida excelência na SE/MS, que, no prazo de 5 (cinco) dias contados da data do protocolo, o remeterá à Secretaria ou à entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 43)
Art. 44. A Secretaria ou entidade vinculada competente realizará análise técnica e econômico-financeira das atividades executadas, com auxílio da SE/MS quando necessário, para, no prazo de até 45 (quarenta e cinco) dias a contar da data do recebimento do processo, emitir parecer técnico conclusivo, que analisará os aspectos técnicos das execuções física e financeira do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 44)
§ 1º Para fins de elaboração do parecer de que trata o "caput", a Secretaria ou entidade vinculada competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão dos pareceres ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 44, § 1º)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer conclusivo será emitido com as informações que constem do processo, sabendo-se que o não atendimento de apontamentos e medidas corretivas indicadas pela Secretaria ou entidade vinculada competente quando do parecer de recomendação do relatório semestral poderá ensejar a reprovação do relatório anual de atividades do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 44, § 2º)
Art. 45. Em caso de reprovação do relatório anual de atividades, o Projeto de Apoio correspondente será excluído do Termo de Ajuste, sem prejuízo de se considerar executados os recursos aplicados em resultados obtidos com a execução até o momento da primeira notificação que tenha indicado a necessidade de apontamentos e medidas corretivas. (Origem: PRT MS/GM 2814/2014, Art. 45)
Parágrafo Único. O valor anual que for considerado como não executado em razão da reprovação do relatório anual de atividades, bem como os valores remanescentes, quando houver, deverá ser objeto de novo Projeto de Apoio ou de inclusão em Projeto já em curso, com vistas à observância do emprego total do valor de isenção tributária constante do Termo de Ajuste. (Origem: PRT MS/GM 2814/2014, Art. 45, Parágrafo Único)
Art. 46. A SE/MS dará conhecimento à entidade de saúde de reconhecida excelência acerca do parecer de análise do relatório anual de atividades em até 5 (cinco) dias contados do recebimento do processo. (Origem: PRT MS/GM 2814/2014, Art. 46)
Seção III
Do Relatório Final de Atividades
(Origem: PRT MS/GM 2814/2014, CAPÍTULO V, Seção III)
Art. 47. Ao final do triênio de vigência do Termo de Ajuste, a entidade de saúde de reconhecida excelência apresentará relatório final de atividades de cada Projeto de Apoio executado, de forma a contemplar: (Origem: PRT MS/GM 2814/2014, Art. 47)
I - as informações relativas ao conteúdo e ao valor das atividades previstas e executadas de forma discriminada e por exercício fiscal; e (Origem: PRT MS/GM 2814/2014, Art. 47, I)
II - as informações acerca do desempenho físico e financeiro do Projeto em relação ao previsto no plano de trabalho, de acordo com o modelo constante do Anexo XI. (Origem: PRT MS/GM 2814/2014, Art. 47, II)
§ 1º O relatório final de atividades será apresentado no mesmo prazo do relatório anual de atividades referente ao último ano do triênio. (Origem: PRT MS/GM 2814/2014, Art. 47, § 1º)
§ 2º Nos Projetos referentes ao desenvolvimento de pesquisas, a entidade de saúde deverá encaminhar, ao término das atividades do Projeto de Apoio, relatório técnico-científico do projeto de pesquisa em versão impressa e digital conforme Anexo 11 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 47, § 2º)
Art. 48. O relatório final de atividades será protocolado pela entidade de saúde de reconhecida excelência na SE/MS, que, no prazo de 5 (cinco) dias contados da data do protocolo, o remeterá à Secretaria ou à entidade vinculada competente. (Origem: PRT MS/GM 2814/2014, Art. 48)
Art. 49. A Secretaria ou entidade vinculada competente emitirá parecer técnico conclusivo do relatório final do Projeto, no prazo de 90 (noventa) dias a contar da data de sua tramitação, momento em que serão analisadas as execuções física e financeira do projeto, com apoio da SE/MS, quando necessário. (Origem: PRT MS/GM 2814/2014, Art. 49)
§ 1º Para fins de elaboração do parecer de que trata o "caput", a Secretaria ou entidade vinculada competente poderá solicitar informações e diligências necessárias à entidade de saúde de reconhecida excelência, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão dos pareceres ficará suspenso. (Origem: PRT MS/GM 2814/2014, Art. 49, § 1º)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer conclusivo será emitido com as informações que constem do processo. (Origem: PRT MS/GM 2814/2014, Art. 49, § 2º)
§ 3º Admitir-se-á uma margem de execução de 10% (dez por cento) para mais ou para menos com relação ao valor total do Projeto de Apoio, sem que seja necessária autorização prévia do Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 49, § 3º)
§ 4º No caso de diferença a menor, a entidade de saúde de reconhecida excelência deverá viabilizar a inclusão do valor faltante em algum dos Projetos de Apoio vinculados ao Termo de Ajuste, de modo a garantir que o valor total empregado no conjunto dos Projetos não seja inferior ao valor da isenção das contribuições sociais usufruída, observados os fluxos e prazos previstos Anexo XCIII. (Origem: PRT MS/GM 2814/2014, Art. 49, § 4º)
CAPÍTULO VI
DOS PROJETOS ASSISTENCIAIS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO VI)
Art. 50. A entidade de saúde de reconhecida excelência poderá aplicar até 30% (trinta por cento) do valor da isenção usufruída em prestação de serviços públicos de saúde ambulatoriais e hospitalares ao SUS, mediante pacto com o gestor local do SUS. (Origem: PRT MS/GM 2814/2014, Art. 50)
§ 1º A prestação de serviços de saúde ambulatoriais e hospitalares no âmbito do PROADI-SUS constará do Termo de Ajuste firmado entre a entidade de saúde de reconhecida excelência e o Ministério da Saúde e não será remunerada pelo SUS. (Origem: PRT MS/GM 2814/2014, Art. 50, § 1º)
§ 2º A entidade de saúde deverá apresentar ao gestor local do SUS plano de trabalho com previsão de atendimento e detalhamento de custos, os quais não poderão exceder o valor por ela efetivamente despendido. (Origem: PRT MS/GM 2814/2014, Art. 50, § 2º)
Art. 51. A prestação de serviços de saúde ambulatoriais e hospitalares será apresentada por meio de carta-consulta a ser apresentada pela entidade de saúde de reconhecida excelência, conforme Anexo 1 do Anexo XCIII , a ser analisada pelo Comitê de Avaliação e aprovada pelo Comitê Gestor do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 51)
Art. 52. Aprovada a Carta-Consulta, o Projeto Assistencial deverá ser apresentado no prazo de 60 (sessenta) dias e será acompanhada de Declaração de Anuência do gestor local do SUS, dando ciência e concordando com os termos deste Anexo, na forma do Anexo 8 do Anexo XCIII . (Origem: PRT MS/GM 2814/2014, Art. 52)
§ 1º A responsabilidade pelo acompanhamento, monitoramento, avaliação e prestação de contas dos Projetos Assistenciais caberá ao gestor local do SUS que anuiu com o referido Projeto. (Origem: PRT MS/GM 2814/2014, Art. 52, § 1º)
§ 2º Aplicam-se aos Projetos Assistenciais, naquilo que couber, os dispositivos previstos neste Anexo para os Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 52, § 2º)
Art. 53. A prestação de serviços públicos de saúde de que trata este Capítulo deverá ser comprovada para fins de obtenção do CEBAS-saúde, observada a regulamentação respectiva. (Origem: PRT MS/GM 2814/2014, Art. 53)
Art. 54. Projetos Assistenciais que prevejam a realização de procedimentos de alta complexidade constantes da relação dos procedimentos regulados pela Central Nacional de Regulação de Alta Complexidade (CNRAC) conterão previsão expressa acerca da necessária regulação pela referida Central, observadas as vigências do respectivo Termo de Ajuste ou Termo Aditivo e as exigências referentes ao credenciamento ou habilitação conforme as especificidades dos Projetos. (Origem: PRT MS/GM 2814/2014, Art. 54)
CAPÍTULO VII
DA UTILIZAÇÃO DA ISENÇÃO FISCAL DECORRENTE DA EXECUÇÃO DOS PROJETOS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO VII)
Art. 55. Quando da análise dos relatórios anuais dos Projetos de Apoio, a SE/MS expedirá certidão que atesta o valor anual executado dos Projetos pelas entidades de saúde de reconhecida excelência, de acordo com os pareceres conclusivos elaborados pelas Secretarias ou entidades vinculadas competentes e pelos gestores locais de saúde. (Origem: PRT MS/GM 2814/2014, Art. 55)
§ 1º Nos dois primeiros anos do triênio, a SE/MS admitirá uma margem de execução de até 10% (dez por cento) para menos com relação ao valor total da isenção gozada pela entidade de saúde de reconhecida excelência no exercício fiscal a que se refere a certidão a ser expedida. (Origem: PRT MS/GM 2814/2014, Art. 55, § 1º)
§ 2º A certidão de que trata o "caput" será emitida até 31 de outubro do exercício fiscal subsequente e será enviada às respectivas entidades de saúde de reconhecida excelência e ao Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde (DCEBAS/SAS/MS), em até 5 (cinco) dias após sua emissão. (Origem: PRT MS/GM 2814/2014, Art. 55, § 2º)
Art. 56. A isenção fiscal apurada anualmente deverá ser comprovada por meio de relatório de auditoria, acompanhado dos seguintes demonstrativos contábeis: (Origem: PRT MS/GM 2814/2014, Art. 56)
I - Balanço Patrimonial; (Origem: PRT MS/GM 2814/2014, Art. 56, I)
II - Demonstração do Resultado do Exercício Fiscal; (Origem: PRT MS/GM 2814/2014, Art. 56, II)
III - Demonstração da Mutação de Patrimônio; (Origem: PRT MS/GM 2814/2014, Art. 56, III)
IV - Demonstração de Fluxo de Caixa; (Origem: PRT MS/GM 2814/2014, Art. 56, IV)
V - Notas Explicativas; e (Origem: PRT MS/GM 2814/2014, Art. 56, V)
VI - Demonstrativo de Execução Financeira do Projeto. (Origem: PRT MS/GM 2814/2014, Art. 56, VI)
Art. 57. No último exercício fiscal do Termo de Ajuste, caso o valor despendido no conjunto de Projetos de Apoio e Projetos Assistenciais de prestação de serviços públicos de saúde ambulatoriais e hospitalares ao SUS vinculados ao Termo de Ajuste seja inferior ao valor da isenção das contribuições sociais usufruída, as entidades deverão compensar a diferença até o término do prazo de validade de sua certificação, desde que tenham aplicado, no mínimo, 70% (setenta por cento) do valor usufruído anualmente com a isenção das contribuições sociais nos Projetos de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 57)
CAPÍTULO VIII
DO SISTEMA DE GESTÃO DE PROJETOS DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SUS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO VIII)
Art. 58. Fica instituído o Sistema de Gestão dos Projetos do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (SISPROADI-SUS), como o sistema oficial de gestão dos projetos de apoio apresentados ao PROADI-SUS, sob a supervisão da Secretaria-Executiva do Ministério da Saúde em parceria com o DATASUS. (Origem: PRT MS/GM 2814/2014, Art. 58)
§ 1º Os atos e procedimentos relativos aos processos no âmbito do PROADI-SUS deverão ser registrados pelo Ministério da Saúde, entidades vinculadas e pelas entidades de saúde de reconhecida excelência por meio do SISPROADI-SUS, nos termos deste Anexo. (Origem: PRT MS/GM 2814/2014, Art. 58, § 1º)
§ 2º Até que seja possível a utilização plena do SISPROADI-SUS para gestão dos processos no âmbito do PROADI-SUS, toda documentação deverá ser protocolada e tramitada fisicamente. (Origem: PRT MS/GM 2814/2014, Art. 58, § 2º)
Art. 59. Caberá à SE/MS: (Origem: PRT MS/GM 2814/2014, Art. 59)
I - fazer a gestão do SISPROADI-SUS, observado o disposto neste Anexo; (Origem: PRT MS/GM 2814/2014, Art. 59, I)
II - zelar pelas informações geradas no SISPROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 59, II)
III - articular internamente no Ministério da Saúde ou com órgãos dos Governos Federal, Estadual e Municipal, a integração do SISPROADI-SUS com outros sistemas de informações, quando necessário; (Origem: PRT MS/GM 2814/2014, Art. 59, III)
IV - acompanhar no SISPROADI-SUS o andamento dos projetos durante todo o fluxo processual; (Origem: PRT MS/GM 2814/2014, Art. 59, IV)
V - realizar o treinamento e divulgar informações de interesse dos usuários do Sistema; e (Origem: PRT MS/GM 2814/2014, Art. 59, V)
VI - auxiliar o DATASUS, as Secretarias e entidades vinculadas competentes e as entidades de saúde de reconhecida excelência na implantação do SISPROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 59, VI)
Art. 60. Ato específico do Ministro de Estado da Saúde definirá os procedimentos e fluxos do SISPROADI-SUS, especialmente para: (Origem: PRT MS/GM 2814/2014, Art. 60)
I - disponibilizar endereço eletrônico do SISPROADI-SUS na rede mundial de computadores; (Origem: PRT MS/GM 2814/2014, Art. 60, I)
II - zelar pela segurança e armazenamento das informações cadastradas e/ou geradas pelo SISPROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 60, II)
III - garantir a publicidade e a transparência das informações do SISPROADI-SUS; (Origem: PRT MS/GM 2814/2014, Art. 60, III)
IV - realizar a integração do SISPROADI-SUS com outros sistemas de informações; e (Origem: PRT MS/GM 2814/2014, Art. 60, IV)
V - disponibilizar central de atendimento ao usuário do SISPROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 60, V)
Art. 61. Todos os atos referentes à submissão, análise, aprovação, celebração, execução, acompanhamento, alteração, prestação de contas e fiscalização dos Termos de Ajustes, Cartas-consulta, Projetos de Apoio e Projetos Assistenciais referentes ao triênio 2015-2017 e posteriores deverão ser registrados no SISPROADI-SUS, observado o art. 58, § 2º . (Origem: PRT MS/GM 2814/2014, Art. 61)
CAPÍTULO IX
DOS RECURSOS ADMINISTRATIVOS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO IX)
Art. 62. Caberá recurso dirigido à autoridade que proferiu a decisão, com efeito suspensivo: (Origem: PRT MS/GM 2814/2014, Art. 62)
I - da decisão que não aprovar Projeto de Apoio; (Origem: PRT MS/GM 2814/2014, Art. 62, I)
II - da decisão que não aprovar o pedido de alteração de Projeto de Apoio; e (Origem: PRT MS/GM 2814/2014, Art. 62, II)
III - da decisão que não aprovar o relatório anual de atividades do Projeto de Apoio. (Origem: PRT MS/GM 2814/2014, Art. 62, III)
Art. 63. O prazo para interposição de recurso será de 10 (dez) dias, contados da notificação da entidade de saúde de reconhecida excelência. (Origem: PRT MS/GM 2814/2014, Art. 63)
Art. 64. Caso a autoridade que proferiu a decisão recorrida não a reconsiderar no prazo de 10 (dez) dias, de forma fundamentada, o recurso será encaminhado ao Comitê de Avaliação do PROADI-SUS, para análise e posterior encaminhamento ao Comitê Gestor do PROADI-SUS, para deliberação final. (Origem: PRT MS/GM 2814/2014, Art. 64)
Art. 65. Aplicam-se a este Capítulo, supletivamente, as regras constantes no Capítulo XV da Lei nº 9.784, de 29 de janeiro de 1999, que regula o processo administrativo no âmbito da Administração Pública Federal. (Origem: PRT MS/GM 2814/2014, Art. 65)
CAPÍTULO X
DA APROVAÇÃO DAS MINUTAS E DA PUBLICIDADE
(Origem: PRT MS/GM 2814/2014, CAPÍTULO X)
Art. 66. As minutas do Termo de Ajuste e dos Projetos de Apoio, bem como dos respectivos Termos Aditivos, serão submetidas previamente à Consultoria Jurídica junto ao Ministério da Saúde para emissão de parecer, que deverá ser emitido no prazo máximo de 20 (vinte) dias a contar da data do seu recebimento. (Origem: PRT MS/GM 2814/2014, Art. 66)
Parágrafo Único. Caso o prazo previsto no "caput" seja descumprido, o processo poderá retomar seu curso, a critério do DESID/SE/MS, sem prejuízo de manifestação posterior da Consultoria Jurídica junto ao Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 66, Parágrafo Único)
Art. 67. A eficácia dos Termos de Ajuste, Projetos de Apoio e respectivos Termos Aditivos ficará condicionada à publicação dos respectivos extratos no Diário Oficial da União, o que será providenciada pelo Ministério da Saúde, no prazo de até 20 (vinte) dias a contar da respectiva assinatura do documento. (Origem: PRT MS/GM 2814/2014, Art. 67)
CAPÍTULO XI
DISPOSIÇÕES GERAIS E TRANSITÓRIAS
(Origem: PRT MS/GM 2814/2014, CAPÍTULO XI)
Art. 68. As entidades de saúde de reconhecida excelência poderão solicitar à SE/MS, com a devida exposição da finalidade e da aplicabilidade dos dados, a disponibilização dos bancos de dados provenientes de Projetos de Apoio desenvolvidos por outra entidade de saúde de reconhecida excelência, conforme política de segurança da informação e de acordo com as normas internas do Ministério da Saúde. (Origem: PRT MS/GM 2814/2014, Art. 68)
Art. 69. Os prazos previstos neste Anexo começam a correr a partir da data da notificação oficial da entidade de saúde de reconhecida excelência, por documento ou por publicação na imprensa oficial, ou do recebimento do processo nas Secretarias e entidades vinculadas ao Ministério da Saúde, excluindo-se da contagem o dia do começo e incluindo-se o do vencimento. (Origem: PRT MS/GM 2814/2014, Art. 69)
Parágrafo Único. Considera-se prorrogado o prazo até o primeiro dia útil seguinte se o vencimento cair em dia em que não houver expediente ou este for encerrado antes da hora normal. (Origem: PRT MS/GM 2814/2014, Art. 69, Parágrafo Único)
Art. 70. No último ano do triênio, as cartas-consulta e os pedidos de alteração de Projetos de Apoio deverão ser apresentados até 15 de maio, com vistas a viabilizar o cumprimento dos prazos definidos neste Anexo. (Origem: PRT MS/GM 2814/2014, Art. 70)
§ 1º Excepcionalmente, a entidade de saúde de reconhecida excelência poderá apresentar carta-consulta e/ou pedido de alteração de Projeto de Apoio entre 16 de maio e 31 de agosto do último ano do triênio, caso em que a aprovação ficará a critério do Comitê Gestor do PROADI-SUS. (Origem: PRT MS/GM 2814/2014, Art. 70, § 1º)
§ 2º Em caso de aprovação pelo Comitê Gestor na forma do §1º, os prazos de tramitação e análise pelas Secretarias e entidades vinculadas competentes ficam reduzidos pela metade, considerando-se a metade o próximo número inteiro. (Origem: PRT MS/GM 2814/2014, Art. 70, § 2º)
ANEXO XCIII
DO PROGRAMA DE APOIO AO DESENVOLVIMENTO
INSTITUCIONAL DO SISTEMA ÚNICO DE SAÚDE - PROADISUS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO I
DAS DISPOSIÇÕES PRELIMINARES
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 1º Ficam estabelecidas as regras e os critérios para apresentação, análise, aprovação, monitoramento e prestação de contas de projetos de apoio e para a prestação de serviços ambulatoriais e hospitalares no âmbito do Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde - PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 2º A entidade de saúde que se proponha a realizar projetos de apoio e prestar serviços ambulatoriais e hospitalares referentes ao PROADI-SUS deverá ser previamente reconhecida como de excelência pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O reconhecimento de excelência de que trata o caput deverá estar em conformidade com o estabelecido: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - na Lei nº 12.101, de 27 de novembro de 2009; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - na Lei Complementar nº 187, de 16 de dezembro de 2021; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
II - no Decreto nº 8.242, de 23 de maio de 2014; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - no Decreto nº 11.791, de 21 de novembro de 2023; e (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
III - em ato específico do Ministério da Saúde que defina os
critérios e os requisitos para comprovação de efetiva capacidade institucional
da entidade de saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - no Capítulo VIII-A deste Anexo, que dispõe sobre os procedimentos específicos, a forma de aferição da capacidade institucional em cada área de atuação e os mecanismos de supervisão da manutenção do cumprimento dos requisitos técnicos para o reconhecimento de excelência das entidades de saúde no âmbito do Proadi-SUS. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2° O reconhecimento de excelência terá validade de três
anos contados da publicação da portaria que defere o requerimento da
entidade de saúde, permitidas renovações por igual período. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º O reconhecimento de excelência terá validade de cinco anos, contados da data de publicação da decisão de deferimento no Diário Oficial da União - DOU. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 3° O protocolo do requerimento de renovação servirá como prova da excelência da entidade de saúde até o julgamento do processo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO II
DAS COMPETÊNCIAS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção I
Do Comitê Gestor do PROADI-SUS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 3º O Comitê Gestor do PROADI-SUS é instância colegiada
decisória composta pelas seguintes autoridades: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 3º Fica recriado o Comitê Gestor do Proadi-SUS, instância colegiada decisória composta pelas seguintes autoridades: (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
I - Ministro de Estado da Saúde, que o presidirá; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - Presidente do Conselho Nacional de Secretários de Saúde - CONASS; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - Presidente do Conselho Nacional de Secretarias Municipais de Saúde - CONASEMS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º As autoridades enumeradas no caput poderão fazer-se representar por delegação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A participação no Comitê Gestor do PROADI-SUS será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º Nos impedimentos, afastamentos ou ausências do seu presidente, o Comitê Gestor será presidido pelo Secretário-Executivo do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 4º Os dirigentes máximos das respectivas áreas técnicas do Ministério da Saúde e entidades vinculadas e os representante das entidades de saúde de reconhecida excelência poderão ser convidados para subsidiar as decisões a serem tomadas pelo Comitê Gestor, sem direito a voto. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 5º O Comitê Gestor do PROADI-SUS poderá criar Grupos de Trabalho-GT específicos para subsidiar o exercício de suas competências. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 6º Os membros do GT serão designados pelo Comitê Gestor, mediante registro em ata de reunião, observados os seguintes critérios: (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
I - cada GT poderá ter no máximo 7 (sete) membros; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
II - o GT deverá ser temporário, com duração não superior a 1 (um) ano; e (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
III - limitado a 3 (três) GT's em funcionamento simultaneamente. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 7º A participação no GT será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 8º Os membros do GT serão designados pelo presidente do Comitê Gestor. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 9º O membro do GT declarará formalmente eventual conflito de interesse entre suas atividades profissionais e o tema objeto de deliberação do colegiado e deverá abster de participar da discussão técnica. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Art. 4º Compete ao Comitê Gestor do PROADI-SUS: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - deliberar sobre as propostas apresentadas de projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - deliberar sobre a aprovação dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - deliberar sobre as propostas de prestação de serviços ambulatoriais e hospitalares ao SUS não remunerado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - deliberar, com base em parecer de recomendação da área técnica, sobre a interrupção dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - formular proposições para o aprimoramento do PROADI-
SUS; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - formular proposições para o aprimoramento do Proadi-SUS; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
VI - deliberar acerca dos casos omissos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - deliberar acerca dos casos omissos; e (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
VII - deliberar sobre o reconhecimento de excelência nas fases de concessão, cancelamento e pedido de reconsideração. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º O Comitê Gestor reunir-se-á em plenária ordinariamente, pelo menos uma vez por trimestre, e, extraordinariamente, mediante convocação de seu presidente, a qualquer momento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Por meio de registro em ata de reunião, o Comitê Gestor
do PROADI-SUS poderá determinar ao Comitê Técnico do PROADISUS
o cumprimento de finalidade específica. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2.467 de 17.09.2019)
§ 3º A Secretaria-Executiva - SE/MS funcionará como secretaria administrativa do Comitê Gestor do PROADI-SUS, auxiliando nas atividades da instância colegiada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º As deliberações do Comitê Gestor do PROADI-SUS
serão tomadas por maioria, presentes todos os membros, e serão
formalizadas por meio de atas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º As deliberações do Comitê Gestor do Proadi-SUS serão tomadas por consenso, presentes todos os membros, e serão formalizadas por meio de atas. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 5º Serão discutidas nas reuniões ordinárias do Comitê Gestor do Proadi-SUS as propostas e projetos de apoio que tenham sido protocoladas com antecedência de, pelo menos, 15 (quinze) dias úteis da data da reunião. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Seção II
Do Comitê Técnico do PROADI-SUS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 5º O Comitê Técnico do PROADI-SUS é instância colegiada
de assessoramento técnico do Comitê Gestor do PROADISUS,
constituído pelos seguintes representantes: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
I - um da Secretaria-Executiva - SE/MS, que o coordenará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
II - dois da Secretaria de Atenção à Saúde - SAS/MS, sendo,
pelo menos, um do Departamento de Certificação de Entidades Beneficentes
de Assistência Social em Saúde - DCEBAS/SAS/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
III - um da Secretaria de Ciência, Tecnologia e Insumos
Estratégicos - SCTIE/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
IV - um da Secretaria de Gestão Estratégica e Participativa -
SGEP/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
V - um da Secretaria de Gestão do Trabalho e da Educação
na Saúde - SGTES/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
VI - um da Secretaria de Vigilância em Saúde - SVS/MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
VII - um da Secretaria Especial de Saúde Indígena - SESAI/
MS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
VIII - um da Agência Nacional de Saúde Suplementar -
ANS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
IX - um da Agência Nacional de Vigilância Sanitária - ANVISA; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
X - um do Conselho Nacional de Saúde - CNS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
XI - um do Conselho Nacional de Secretários de Saúde -
CONASS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
XII - um do Conselho Nacional de Secretarias Municipais de
Saúde - CONASEMS; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
XIII - um representante das entidades de saúde de reconhecida
excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 1º Os representantes, titulares e suplentes, serão indicados
pelos dirigentes máximos das respectivas áreas técnicas e entidades à
SE/MS, no prazo de trinta dias contados da data de publicação desta
Portaria. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 2º A SE/MS publicará portaria de designação dos representantes
do Comitê Técnico do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 3º O membro do Comitê Técnico do PROADI-SUS declarará
formalmente, em ata, eventual conflito de interesses entre suas
atividades profissionais e o tema objeto de deliberação do colegiado,
sendo que, presente o conflito de interesses, abster-se-á de participar
da discussão e da deliberação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 4º A participação no Comitê Técnico do PROADI-SUS
será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
Art. 6º Compete ao Comitê Técnico do PROADI-SUS subsidiar
as decisões a serem tomadas pelo Comitê Gestor do PROADISUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 1º Com exceção das propostas de projetos de apoio e de
prestação de serviços ambulatoriais e hospitalares, todas as demandas
e processos que exigirem a deliberação do Comitê Gestor do PROADI-SUS serão previamente encaminhados ao Comitê Técnico do
PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 2º O Comitê Técnico do PROADI-SUS poderá designar,
por meio de registro em ata de reunião, representantes para compor
Grupos de Trabalho - GT para o cumprimento de finalidades específicas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 3º O Comitê Técnico do PROADI-SUS reunir-se-á em
plenária ordinariamente, pelo menos uma vez por trimestre, e, extraordinariamente,
mediante convocação de seu coordenador, a qualquer
momento, sempre com antecedência de, pelo menos, cinco dias úteis em relação às reuniões do Comitê Gestor. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 4º As deliberações do Comitê Técnico do PROADI-SUS
serão tomadas por maioria, presente a maioria absoluta dos membros,
cabendo ao coordenador a decisão final em caso de empate, e serão
formalizadas por meio de atas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
Seção III
Das Secretarias do Ministério da Saúde e Entidades Vinculadas
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 7º Compete à SE/MS: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - realizar a gestão administrativa do PROADI-SUS, centralizando, coordenando e monitorando o fluxo referente a: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
a) requerimentos de concessão ou de renovação do reconhecimento de excelência das entidades de saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
b) Termos de Ajuste e respectivos Termos Aditivos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
c) propostas de projetos de apoio para encaminhamento à deliberação do Comitê Gestor; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
d) projetos de apoio e documentos correlatos; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
e) propostas de prestação de serviços ambulatoriais e hospitalares e documentos correlatos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - notificar as entidades de saúde quanto à emissão de
pareceres técnicos e às deliberações do Comitê Gestor do PROADISUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - notificar as entidades de saúde quanto à deliberação de que trata o inciso I do art. 4º; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
III - apoiar administrativamente o Comitê Gestor e o Comitê
Técnico do PROADI-SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - apoiar administrativamente o Comitê Gestor do Proadi-SUS; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
IV - atestar o valor anual executado com projetos de apoio pelas entidades de saúde de reconhecida excelência e expedir a certidão prevista no art. 39 desta Portaria; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - promover a articulação entre as Secretarias do Ministério da Saúde, as autarquias federais e fundações públicas vinculadas ao Ministério da Saúde e as entidades de saúde de reconhecida excelência; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - notificar as entidades de saúde a prestar esclarecimentos a qualquer tempo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - consolidar o rol de projetos de apoio e respectivos pareceres recomendativos, autorizados pelo secretário ou autoridade equivalente das autarquias e fundações públicas vinculadas, para submissão ao Comitê Gestor do Proadi-SUS, para deliberação sobre a aprovação, nos termos do art. 24. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Art. 8º Compete às áreas técnicas, representadas pelas demais secretarias do Ministério da Saúde: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - analisar, diligenciar e emitir parecer técnico recomendativo aos projetos de apoio referentes aos seus respectivos campos de atuação, para subsidiar o Comitê Gestor do PROADI-SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - analisar, diligenciar e autorizar as solicitações de alteração dos planos de trabalho dos projetos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - monitorar a execução dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - emitir parecer técnico conclusivo ao Relatório de Prestação de Contas Anual referente à execução física e financeira dos projetos de apoio e, ao final do projeto, avaliar os resultados alcançados; V - apreciar a solicitação de destinação de equipamentos e/ou materiais permanentes; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - emitir parecer técnico recomendativo relativo à interrupção de projetos de apoio, para subsidiar a deliberação do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - notificar as entidades de saúde a prestar esclarecimentos sobre o projeto de apoio a qualquer tempo. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Parágrafo único. Às autarquias federais e fundações públicas vinculadas ao Ministério da Saúde caberão atuar nos termos do caput, respeitadas suas respectivas áreas de competência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO III
DO TERMO DE AJUSTE
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 9º A entidade de saúde de reconhecida excelência firmará Termo de Ajuste com o Ministério da Saúde, o qual disciplinará os direitos e obrigações entre as partes referentes aos projetos de apoio e à prestação de serviços ambulatoriais e hospitalares ao SUS não remunerado no âmbito do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A celebração do Termo de Ajuste é condição necessária para a apresentação de projetos de apoio e para a prestação de serviços ambulatoriais e hospitalares ao SUS não remunerado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A entidade de saúde de reconhecida excelência que celebrar Termo de Ajuste com o Ministério da Saúde, nos termos do Capítulo III desta Portaria, deverá apresentar projetos de apoio ou planos de trabalho para prestação de serviços ambulatoriais e hospitalares em até cento e vinte dias da publicação do extrato do respectivo Termo de Ajuste no Diário Oficial da União. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° O Termo de Ajuste deve estar em consonância com o valor estimado da isenção tributária a ser obtida pela entidade de saúde de reconhecida excelência para o triênio de vigência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 10. São cláusulas necessárias ao Termo de Ajuste: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o objeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o prazo de vigência do Termo de Ajuste, que será de até três anos, o qual deverá ficar limitado ao período remanescente do triênio do PROADI-SUS, admitida uma única prorrogação por igual período; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - o valor estimado da isenção tributária a ser usufruída pela entidade de saúde de reconhecida excelência durante a vigência do Termo de Ajuste; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - os direitos, obrigações e responsabilidades das partes, especialmente a obrigatoriedade de a entidade de saúde de reconhecida excelência apresentar, regularmente e sempre que requerida, as informações e os documentos, com a devida atualização, exigidos pelo Ministério da Saúde, suas autarquias ou fundações públicas vinculadas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a definição dos dados e informações confidenciais considerados como direito à intimidade das pessoas, sigilo profissional e intelectual, os quais deverão estar em estrita observância à legislação pertinente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - o monitoramento e a avaliação dos projetos de apoio vinculados ao Termo de Ajuste, nos termos do art. 8º; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a obrigação da prestação de contas nos termos desta Portaria; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a prestação de serviços ambulatoriais e hospitalares, se for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - as vedações impostas às partes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - as hipóteses de rescisão; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - o prazo de publicação do extrato do termo de ajuste; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - a indicação do foro da sede do Ministério da Saúde para dirimir as dúvidas decorrentes da execução dos projetos vinculados ao Termo de Ajuste; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIII - a competência do Comitê Gestor do PROADI-SUS para decidir acerca de casos omissos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. O valor total da isenção tributária apurada no exercício fiscal anterior, comprovado por meio de demonstração contábil, deverá ser informado, anualmente, ao Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 11 O Termo de Ajuste deverá dispor ainda sobre: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - a observância aos requisitos previstos nas normas de ética em pesquisas vigentes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a disponibilização dos recursos materiais instrucionais na rede mundial de computadores para entidades públicas e privadas, sem fins lucrativos e certificadas como beneficentes, mediante licença de uso de interesse do SUS, vedado o uso privado e comercial; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a divulgação e a publicidade dos produtos decorrentes da realização do projeto de apoio, previamente aprovadas pelo Ministério da Saúde, bem como menção à parceria firmada com o Ministério da Saúde no âmbito do PROADI-SUS, de acordo com a Lei nº 12.101, de 2009; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a obrigatoriedade do respeito às normas de editoração do Ministério da Saúde, quando algum tipo de publicação resultar do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a previsão de publicação de artigos científicos em outros idiomas com fins de divulgação dos produtos decorrentes da realização do projeto de apoio, que não substituirá a entrega de relatório contendo metodologia detalhada e conjunto dos resultados obtidos em vernáculo; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a previsão de participação e apresentação de trabalhos (parciais ou completos) em eventos nacionais e internacionais e menção à parceria firmada no âmbito do PROADI-SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a previsão de doação dos bens permanentes adquiridos, nos termos do art. 32; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a previsão de que as despesas executadas que excedam o valor da isenção das contribuições sociais usufruída são de responsabilidade exclusiva da entidade de saúde de reconhecida excelência, vedada a possibilidade de serem computadas no valor da isenção das contribuições sociais usufruída; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a previsão de vedação de executar despesas em projeto de apoio que não tenham sido previstas no plano de trabalho ou no requerimento de alteração do projeto de apoio e previamente aprovadas pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A titularidade dos direitos patrimoniais advindos das pesquisas científicas, dos programas desenvolvidos, bem como dos resultados tecnológicos decorrentes dos recursos do projeto de apoio referentes ao PROADI-SUS será do Ministério da Saúde, respeitados os direitos morais do autor, nos termos da Lei nº 9.610, de 19 de fevereiro de 1998, e de outras normas aplicáveis. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Todos os produtos deverão ser apresentados previamente à divulgação para ciência e aprovação do Ministério da Saúde, na língua oficial do país. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 12 Os Termos de Ajuste serão submetidos previamente à Consultoria Jurídica junto ao Ministério da Saúde para emissão de parecer. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° As entidades de saúde de reconhecida excelência deverão apresentar solicitação para celebração ou prorrogação do Termo de Ajuste até 31 de agosto do exercício fiscal anterior ao início do triênio do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º O Ministério da Saúde terá o prazo de até cento e vinte dias para decidir sobre a solicitação de prorrogação prevista no parágrafo § 1º. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° No último ano de vigência dos Termos de Ajuste, os projetos de apoio e de prestação de serviços ambulatoriais e hospitalares para o triênio subsequente poderão ser autorizados e aprovados pelo Comitê Gestor do PROADI-SUS, condicionados à prévia celebração do Termo de Ajuste e desde que o início da execução dos projetos de apoio e dos serviços ocorra somente no exercício fiscal subsequente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A publicação do extrato de Termo de Ajuste no Diário Oficial da União, que é condição indispensável para sua eficácia, será providenciada pelo Ministério da Saúde até o quinto dia útil do mês seguinte ao de sua assinatura, para ocorrer no prazo de até vinte dias daquela data, e conterá: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - numeração sequencial e exclusiva para o PROADISUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o número de registro no Sistema Eletrônico de Informações (SEI) do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a qualificação das partes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - o objeto e a finalidade do Termo de Ajuste; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o valor de isenção estimado para o triênio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º O valor da isenção das contribuições sociais deverá ser estimado com base no exercício fiscal anterior ao da celebração do Termo de Ajuste ou mediante projeção econômica com justificativa e memória de cálculo apresentadas pela entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6º O valor total executado dos projetos de apoio e dos serviços ambulatoriais e hospitalares ao SUS não poderá ser inferior ao valor da isenção das contribuições sociais usufruída, em observância ao disposto no § 2º do art. 11 da Lei nº 12.101, de 2009. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º As despesas executadas que excedam o valor da isenção das contribuições sociais usufruída são de responsabilidade exclusiva da entidade de saúde de reconhecida excelência, vedada a possibilidade de serem computadas no valor da isenção das contribuições sociais usufruída. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 13 O Termo de Ajuste poderá ser alterado, no decorrer de sua vigência, mediante celebração de Termo Aditivo, com as devidas justificativas e comprovações. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A atualização do valor estimado da isenção a ser usufruída pela entidade de saúde de reconhecida excelência será formalizada anualmente por meio de apostilamento ao Termo de Ajuste, em consonância com os termos do parágrafo único do art. 10. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 14 O Termo de Ajuste poderá ser rescindido nos seguintes casos: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - a pedido da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - na hipótese de revogação ou de não renovação do reconhecimento de excelência da entidade de saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - quando houver superveniência de norma legal com ele incompatível; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - na hipótese de inobservância de qualquer de suas cláusulas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º No caso do inciso I do caput, a entidade de saúde de reconhecida excelência permanecerá obrigada à execução dos projetos de apoio que estejam em andamento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Nos casos dos incisos II, III e IV do caput, a rescisão do Termo de Ajuste será precedida de notificação formal e fundamentada, garantida a apresentação de defesa no prazo de dez dias. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO IV
DA APRESENTAÇÃO E APROVAÇÃO DOS PROJETOS
DE APOIO
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 15 A apresentação de propostas de projetos de apoio poderá ser realizada pelas entidades de reconhecida excelência, pelas áreas técnicas, pelo CONASS e pelo CONASEMS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A proposta deverá ser apresentada à SE/MS com antecedência
de, pelo menos, cinco dias úteis em relação às reuniões do
Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
§ 2° A proposta de projeto de apoio deverá conter, no mínimo: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o nome do órgão ou entidade proponente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a entidade de saúde de reconhecida excelência executora do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a área técnica responsável pelo projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a área de atuação pretendida; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o título do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - os objetivos do projeto, inclusive aquele(s) do Plano Nacional de Saúde ao(s) qual(is) o projeto se vinculará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a abrangência territorial; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a justificativa e a relevância do projeto para o SUS; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a proposta sumarizada do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - o período de execução estimado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - a estimativa orçamentária preliminar; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - as informações adicionais e os anexos, quando necessários. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° A recomendação ou a autorização para apresentação de
projeto de apoio originário, respectivamente, do Comitê Técnico ou do Comitê Gestor do PROADI-SUS deverá fazer menção, no mínimo,
aos itens dispostos nos incisos I a VIII do § 2° deste artigo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º A autorização para apresentação de projeto de apoio originário do Comitê Gestor do Proadi-SUS deverá fazer menção, no mínimo, aos itens dispostos nos incisos I a VIII do § 2º deste artigo. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Seção I
Da Apresentação dos Projetos de Apoio
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 16 A entidade de saúde de reconhecida excelência somente poderá protocolar o projeto de apoio após a autorização do Comitê Gestor do PROADI-SUS de que trata o inciso I do art. 4°. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° Os projetos de apoio serão protocolados na SE/MS, que os formalizará em processos administrativos independentes, respeitando-se a vigência do Termo de Ajuste ao qual será vinculado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° Nos casos de projetos referentes à realização de pesquisa, a entidade de saúde de reconhecida excelência enviará versão digital do projeto de apoio ao Comitê de Ética em Pesquisa - CEP ou ao Comitê de Ética no Uso de Animais - CEUA. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 17 Os projetos de apoio deverão ser classificados em, pelo menos, um dos objetivos do Plano Nacional de Saúde e em uma das seguintes áreas de atuação, destacando-se a relevância e o potencial de contribuição do projeto para a governança do SUS: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - estudos de avaliação e incorporação de tecnologia: projetos de desenvolvimento de estudos de avaliação e incorporação de tecnologias; revisão sistemática de literatura; meta-análise de estudos clínicos; estudos clínicos; desenvolvimento de pesquisas e tecnologias úteis ao SUS para fins de diagnóstico, tratamento ou controle de doenças e promoção da qualidade de vida, buscando impacto nos determinantes de saúde com recorte étnico-racial e de gênero; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - capacitação de recursos humanos: projetos para realização de cursos; seminários; palestras; formação e capacitação em serviços destinados à qualificação de profissionais de saúde/gestão de serviços, de acordo com as necessidades identificadas pelos gestores do SUS e Política Nacional de Educação na Saúde, em consonância com as diretrizes traçadas pelo Ministério da Saúde; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - pesquisas de interesse público em saúde: projetos para realização de pesquisas relacionadas à promoção e à recuperação da saúde, prevenção de doenças e agravos; monitoramento; avaliação; mensuração de resultados de políticas/programas de saúde com recorte étnico-racial e de gênero; ou (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - desenvolvimento de técnicas e operação de gestão em serviços de saúde: desenvolvimento e implantação de técnicas operacionais, sistemas e tecnologias da informação e avaliação de projetos alinhados com a gestão de serviços de saúde vinculados ao SUS; da racionalização de custos e ampliação da eficiência operacional dos serviços e sistemas regionais, com o desenvolvimento de controle de doenças no âmbito populacional, avançando nas metodologias estruturadas em torno de metas em qualidade de vida e saúde, incluindo, se necessário, a compra de materiais, desenvolvimento de softwares e equipamentos requeridos para a melhor operação das áreas acima referidas, bem como a efetivação de adequações físicas e de instalações necessárias a essas incorporações. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 18 Os projetos de apoio apresentados pelas entidades de saúde de reconhecida excelência deverão conter, no mínimo, a seguinte estrutura: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - as informações da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a área de atuação do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a justificativa; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - os objetivos, inclusive aquele(s) do Plano Nacional de Saúde ao(s) qual(is) o projeto se vinculará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a metodologia; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - o cronograma de entregas, atividades e marcos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a previsão, com orçamento destacado, dos eventos anuais de avaliação dos resultados parciais e/ou finais dos projetos de apoio, conforme disposto no caput do artigo 27; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - o orçamento por plano de contas e orçamento por entregas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - o plano de gestão de riscos do projeto de apoio; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - as informações adicionais e os anexos, quando necessário. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 19. A entidade de saúde de reconhecida excelência deverá observar critérios de economicidade e prever o uso racional dos recursos públicos na proposta orçamentária do projeto, cujos parâmetros de custos estarão previstos no Manual Técnico de Elaboração, Análise e Prestação de Contas dos Projetos PROADI-SUS, conforme caput do art. 46. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. É vedada a terceirização pelas entidades de saúde das atividades de gestão do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção II
Da Análise e Aprovação dos Projetos de Apoio
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 20 A análise técnica e financeira do projeto de apoio, recomendando a aprovação, aprovação parcial ou reprovação, será realizada pela área técnica, no prazo de trinta dias contados da data de recebimento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 21 O parecer recomendativo de análise técnica e financeira do projeto de apoio, a ser emitido pelas áreas técnicas deverá conter, no mínimo, a seguinte estrutura: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o nome da Secretaria do Ministério da Saúde, da Autarquia Federal ou da Fundação Pública vinculada ao Ministério da Saúse responsável pelo projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o departamento responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a coordenação-geral responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - os dados do projeto, referenciando o título, área de atuação, vigência, data da reunião do Comitê Gestor do PROADISUS que aprovou a proposta do projeto, valor estimado total e por ano; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a análise da justificativa; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a análise dos objetivos, inclusive aquele(s) do Plano Nacional de Saúde ao(s) qual(is) o projeto se vinculará; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a análise da metodologia e do cronograma de entregas, atividades e marcos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a análise dos orçamentos por plano de contas e por entregas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - a análise do plano de gestão de riscos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - recomendação de aprovação, aprovação com ressalvas ou reprovação; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - o valor a ser executado, quando couber. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 22 A área técnica poderá solicitar à entidade de saúde de
reconhecida excelência complementação ao projeto de apoio apresentado,
incluindo outras informações não mencionadas no art. 18
desta Portaria. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 22. A área técnica poderá solicitar à entidade de saúde de reconhecida excelência complementação das informações ao projeto de apoio apresentado, incluindo outras informações não mencionadas no art. 18, sendo permitida a realização de até 3 (três) diligências. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 1º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de quinze dias contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer técnico será emitido com as informações que constem do processo, devendo ser consignado o não atendimento da solicitação de informações indicadas pela área técnica. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 23 Os projetos de apoio a serem executados no âmbito do PROADI-SUS que envolverem o desenvolvimento e/ou aperfeiçoamento de soluções de Tecnologia da Informação deverão observar os princípios e as diretrizes estabelecidos pelo Departamento de Informática do SUS - DATASUS/SE/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. Para os fins previstos no caput, os projetos de apoio que envolverem o desenvolvimento e/ou aperfeiçoamento de soluções de Tecnologia da Informação serão objeto de análise técnica pelo DATASUS/SE/MS, que emitirá parecer técnico no prazo de quinze dias contados do recebimento do processo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 24 O projeto de apoio e o parecer recomendativo, devidamente chancelado pelo Secretário ou autoridade equivalente das autarquias e fundações públicas vinculadas, serão submetidos ao Comitê Gestor do PROADI-SUS para deliberação sobre a aprovação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A autorização para início da execução do
projeto de apoio ocorrerá com a publicação pela SE/MS, no Diário
Oficial da União, de extrato de projeto de apoio, contendo as seguintes
informações: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A autorização para início da execução do projeto de apoio ocorrerá com a publicação pela SE/MS, no Diário Oficial da União - DOU, de extrato de projeto de apoio aprovado, contendo as seguintes informações: (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
I - o número do Termo de Ajuste a que será vinculado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - número do Termo de Ajuste a que será vinculado; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
II - o número de registro no Sistema Eletrônico de Informações
- SEI; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - número de registro no Sistema Eletrônico de Informações - SEI; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
III - a razão social da entidade de saúde de reconhecida
excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - razão social da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
IV - o título do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - título do projeto; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
V - o objetivo do projeto de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - objetivo do projeto de apoio; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
VI - o período de execução; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - período de execução; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
VII - o valor a ser despendido com o projeto de apoio, que
corresponderá à parcela da isenção das contribuições sociais usufruída;
e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - valor a ser despendido com o projeto de apoio, que corresponderá à parcela da isenção das contribuições sociais usufruída; e (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
VIII - o parecer técnico de aprovação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - parecer técnico de aprovação. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 2º Os projetos de apoio não aprovados pelo Comitê Gestor do Proadi-SUS serão objeto de publicação no DOU por meio de extrato, contendo as informações básicas acerca do projeto apresentado e o resultado da deliberação do Comitê Gestor. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
CAPÍTULO V
DAS ALTERAÇÕES DOS PROJETOS DE APOIO, MONITORAMENTO,
AVALIAÇÃO DOS RESULTADOS E PRESTAÇÃO
DE CONTAS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção I
Das Alterações dos Projetos de Apoio
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 25 Durante a execução do projeto de apoio, a entidade de saúde de reconhecida excelência poderá requerer alterações do projeto de apoio, devendo protocolar, na SE/MS, requerimento em prazo que viabilize a análise e aprovação ainda na vigência do projeto, considerando-se os demais prazos previstos nesta Seção. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O requerimento de alteração do projeto de apoio deverá conter informações suficientes para análise da área técnica, que emitirá parecer técnico conclusivo no prazo de trinta dias contados do recebimento do processo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A área técnica poderá solicitar à entidade de saúde de
reconhecida excelência complementação das informações apresentadas
no requerimento de alteração do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A área técnica poderá solicitar à entidade de saúde de reconhecida excelência complementação das informações apresentadas no requerimento de alteração do projeto de apoio, permitidas até 3 (três) diligências. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 3º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de quinze dias contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º O acréscimo ou supressão de valor solicitado nas alterações do projeto de apoio que não ultrapassar vinte por cento do seu valor originário será objeto de decisão da área técnica competente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º O acréscimo ou supressão de valor solicitado nas alterações do projeto de apoio que ultrapassar o limite de vinte por cento do valor originário do projeto deverá ser submetido à deliberação do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6° Deverá ser republicado o extrato do projeto de apoio quando forem aprovadas alterações nos itens dispostos no art. 24. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º É vedado à entidade de saúde de reconhecida excelência executar despesas em projeto de apoio que não tenham sido previstas no plano de trabalho ou no requerimento de alteração do projeto de apoio e previamente aprovadas pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 8º As despesas executadas em desacordo com o estabelecido no § 7º são de responsabilidade exclusiva da entidade de saúde de reconhecida excelência, vedada a possibilidade de serem computadas no montante da isenção tributária prevista no Termo de Ajuste. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção II
Do Monitoramento dos Projetos de Apoio
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 26 O monitoramento do projeto de apoio será realizado pela área técnica competente, com o objetivo de resguardar a adequada execução do plano de trabalho aprovado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A entidade de saúde de reconhecida excelência deverá permitir e facilitar a fiscalização, vistoria in loco, acesso a documentação, dependências e locais do projeto e demais diligências de acompanhamento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso necessário, a área técnica responsável pelo acompanhamento e monitoramento do projeto de apoio poderá notificar a entidade de saúde de reconhecida excelência a prestar esclarecimentos no prazo de quinze dias. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º As ações de monitoramento e as diligências previstas no § 1º serão registradas em relatórios de monitoramento, pelo menos duas vezes ao ano, que integrarão os autos do processo administrativo e acompanharão o desempenho físico do projeto de apoio em relação ao previsto no plano de trabalho, podendo ensejar a proposição de medidas corretivas e de reorientação das ações para que se atinja o melhor resultado do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º Em caso de determinação de medidas corretivas e de reorientação de ações que exijam alteração do projeto de apoio, a entidade de saúde de reconhecida excelência deverá apresentar requerimento de alteração do projeto de apoio no prazo de quinze dias contados da notificação do Relatório de Monitoramento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5° Os ajustes e medidas decorrentes das medidas corretivas e das reorientações de ações serão registrados no Relatório de Monitoramento subsequente e informados detalhadamente, pela entidade de saúde de reconhecida excelência, no Relatório de Prestação de Contas Anual. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6° O descumprimento das medidas corretivas e das reorientações de ações poderá dar causa à reprovação da prestação decontas anual. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção III
Da Avaliação dos Resultados dos Projetos de Apoio
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 27 Os resultados parciais e/ou finais dos projetos de apoio serão objeto de avaliação anual, em evento específico, cujo orçamento deverá constar dos planos de trabalho dos respectivos projetos de apoio, nos termos do inciso VIII do art. 18. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A SE/MS consolidará em relatório as avaliações realizadas no evento referido no caput, que subsidiará a emissão do parecer técnico conclusivo de prestação de contas anual, conforme disposto no inciso IX do § 1º do art. 30. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Seção IV
Da Prestação de Contas Anual
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 28 A prestação de contas dos projetos de apoio ocorrerá mediante a apresentação à SE/MS, pela entidade de saúde de reconhecida excelência, de Relatório de Prestação de Contas Anual específico para cada projeto de apoio, sem prejuízo de outras informações que venham a ser solicitadas pelas áreas técnicas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° O Relatório de Prestação de Contas Anual compreenderá o período de 1º de janeiro a 31 de dezembro de cada ano e será apresentado pela entidade de saúde de reconhecida excelência à SE/MS, até 30 de abril do ano seguinte, contendo, no mínimo, as seguintes informações e documentos: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - as informações da entidade de saúde de reconhecida excelência; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o sumário executivo do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a execução das entregas previstas e realizadas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a execução financeira prevista e realizada; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - as perspectivas sobre execução das entregas, execução financeira e os riscos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a aplicabilidade dos resultados do projeto, quando da apresentação do último Relatório de Prestação de Contas Anual do projeto; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - as informações adicionais, quando for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - os anexos, quando necessário; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a relação de equipamentos, incluindo os de informática, e materiais permanentes adquiridos para as atividades do projeto de apoio, com o número e/ou identificação do projeto para controle em inventário físico específico e com a relação das respectivas notas fiscais comprobatórias da aquisição; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - a relação de serviços contratados para execução das atividades do projeto de apoio, arrolada em tabela separada, discriminando a natureza jurídica do fornecedor, sua identificação, breve descrição dos serviços prestados e respectivos valores despendidos, com a relação das respectivas notas fiscais; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - o relatório técnico-científico do projeto de pesquisa, quando for o caso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° O Relatório de Prestação de Contas Anual será acompanhado de parecer de auditoria independente, contratada pela entidade de saúde de reconhecida excelência em contrato específico para cada projeto de apoio ou para o conjunto de projetos de apoio vinculados ao Termo de Ajuste daquela entidade. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° Quando se tratar da contratação de pessoa jurídica para atuação em mais de um projeto de apoio, com emissão de única nota fiscal, a entidade de saúde de reconhecida excelência deverá discriminar, nos respectivos Relatórios de Prestação de Contas Anuais, os valores despendidos por projeto. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A documentação comprobatória da formalização da doação ao órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa deverá ser encaminhada pela entidade de saúde de reconhecida excelência em conjunto com o Relatório de Prestação de Contas Anual referente ao último ano de vigência do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 29 A apuração de eventuais ajustes contábeis no projeto de apoio deverá observar a vigência do Termo de Ajuste, não sendo permitido remanejamento de saldo financeiro ou de qualquer outro recurso para o Termo de Ajuste subsequente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 30 A área técnica competente realizará análise técnica e econômico-financeira das atividades executadas no projeto de apoio, para, no prazo de até sessenta dias a contar da data do recebimento do processo, emitir parecer técnico conclusivo, com a aprovação do Secretário ou autoridade equivalente das autarquias e fundações públicas vinculadas. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O parecer técnico conclusivo previsto no caput deverá conter, no mínimo, a seguinte estrutura: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o nome da Secretaria do Ministério da Saúde, da autarquia federal ou da fundação pública vinculada ao Ministério Saúde responsável pelo projeto de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - o departamento responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - a coordenação-geral responsável ou equivalente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a análise do sumário executivo do projeto de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a análise das entregas realizadas em relação às entregas previstas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a análise da execução financeira das entregas realizadas em relação às entregas previstas; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a análise das perspectivas do projeto quanto à execução do cronograma e à gestão dos riscos; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - a análise do relatório de avaliação anual dos resultados parciais e/ou finais do projeto de apoio, conforme disposto no parágrafo único do artigo 27; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
X - a análise da aplicabilidade dos resultados do projeto de apoio, quando da apresentação do último Relatório de Prestação de Contas Anual do projeto de poio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XI - a análise do relatório técnico-científico do projeto de pesquisa, quando for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XII - a verificação da relação de equipamentos e materiais permanentes adquiridos para o projeto de apoio, conforme inciso IX do § 1º do art. 28; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIII - a verificação da relação de serviços contratados para o projeto de apoio, conforme inciso X do § 1º do art. 28; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XIV - outras considerações adicionais, quando for o caso; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XV - a conclusão pela aprovação, aprovação com ressalvas ou reprovação; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
XVI - o valor de execução aprovado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Para fins de elaboração do parecer de que trata o caput,
a área técnica competente poderá solicitar informações e diligências
necessárias à entidade de saúde de reconhecida excelência, que deverá
responder em até quinze dias contados de sua notificação, caso
em que o prazo para emissão dos pareceres ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Para fins de elaboração do parecer de que trata o caput, a área técnica competente poderá solicitar informações à entidade de saúde de reconhecida excelência, permitidas até 3 (três) diligências, que deverá responder em até 15 (quinze) dias contados de sua notificação, caso em que o prazo para emissão dos pareceres ficará suspenso. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 3º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 2º, o parecer conclusivo será emitido com as informações que constem do processo, sabendo-se que o não atendimento das medidas corretivas e de reorientação de ações indicadas pela área técnica competente em Relatório de Monitoramento poderá ensejar a aprovação parcial ou a reprovação do Relatório de Prestação de Contas Anual do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º Em caso de aprovação parcial ou reprovação do Relatório de Prestação de Contas Anual, poderão ser considerados executados os recursos aplicados em resultados obtidos com a execução até o momento da notificação que tenha indicado a necessidade de medidas corretivas ou de reorientação de ações, ou até outro marco posterior determinado pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º Com o objetivo de absorver eventuais intercorrências ou externalidades, poderá ser admitida, na prestação de contas do último exercício fiscal de vigência do projeto, desde que devidamente justificada, uma margem de execução de até quinze por cento para mais ou para menos, em relação ao valor total publicado do projeto de apoio, sem que seja necessária autorização prévia do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6º Não será admitida a margem de que trata o § 5º na hipótese de a alteração do valor decorrer de execução do projeto em desacordo com o plano de trabalho previamente aprovado. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º O disposto no § 5º será objeto de análise e deverá constar do parecer técnico conclusivo emitido pela área técnica competente, nos termos do caput. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 8º Na hipótese de o projeto de apoio utilizar a margem de execução prevista no § 5º, o parecer técnico conclusivo de que trata o § 7º será submetido à deliberação do Comitê Gestor do PROADISUS, no prazo de sessenta dias contados da data de emissão do referido parecer. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 9º Os valores que forem considerados como não executados em razão da aprovação parcial ou da reprovação do Relatório de Prestação de Contas Anual, bem como os valores remanescentes, quando houver, deverão ser objeto de novo projeto de apoio ou de inclusão em projeto já em curso, com vistas à observância do emprego total do valor da isenção tributária usufruída. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 31 Caso o valor despendido no conjunto de projetos de apoio e de prestação de serviços de saúde ambulatoriais e hospitalares ao SUS vinculados ao Termo de Ajuste seja inferior ao valor da isenção das contribuições sociais usufruída, as entidades de saúde de reconhecida excelência deverão compensar a diferença até o término do prazo de validade de sua certificação, desde que tenham aplicado, no mínimo, setenta por cento do valor usufruído anualmente com a isenção das contribuições sociais. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º Para fins do caput, deve ser considerado o prazo de validade da certificação vigente na data da decisão que consignou que o valor despendido no conjunto de projetos vinculados ao Termo de Ajuste foi inferior ao da isenção das contribuições sociais usufruída, observado, ainda, o disposto no art. 24, § 2º, da Lei nº 12.101, de 2009. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º No caso de glosas ou não execução de valores que impliquem na necessidade de complementação prevista no caput, as entidades de saúde de reconhecida excelência poderão realizar a complementação mediante realização de novos projetos ou adição de valores a projetos já existentes, nos termos dos § § 4º e 5º do art. 25 do Decreto nº 8.242, de 23 de maio de 2014. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 32. No projeto de apoio que envolver a aquisição de equipamentos e/ou materiais permanentes, a entidade de saúde de reconhecida excelência deverá, em até sessenta dias antes do término do projeto de apoio, protocolar documento dirigido ao Ministério da Saúde indicando o órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa que propõe como destinatário da doação dos bens adquiridos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A celebração da doação de que trata o caput deverá ser precedida da análise da área técnica, nos termos do art. 25, após a qual os referidos bens deverão ser registrados no patrimônio do órgão ou estabelecimento beneficiário. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A documentação comprobatória da formalização da doação ao órgão ou estabelecimento público de assistência à saúde ou de ensino e pesquisa deverá ser encaminhada em conjunto com o Relatório de Prestação de Contas Anual referente ao último ano de vigência do projeto de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º Quando finalizado o projeto de apoio, os equipamentos e/ou materiais permanentes utilizados em sua execução poderão ser destinados para uso em outro projeto de apoio que esteja sob a responsabilidade da mesma entidade de saúde de reconhecida excelência, desde que haja aprovação prévia da área técnica competente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A aprovação prévia de que trata o § 3º deverá ser solicitada em até sessenta dias antes do término do projeto de apoio em cuja execução os equipamentos e/ou materiais permanentes estão sendo utilizados. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 5º Os equipamentos e/ou materiais permanentes advindos de projetos de apoio findados deverão estar previstos no plano de trabalho do novo projeto de apoio, sem previsão de custos relativos à sua aquisição e, ao final do projeto, deverão observar as regras do caput deste artigo. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 6º Nas hipóteses em que houver impedimento técnico ou legal para a doação de equipamentos ou materiais permanentes, a entidade de saúde de reconhecida excelência deverá apresentar, em até sessenta dias antes do término do projeto de apoio, as devidas justificativas da inviabilidade de destinação, para análise e manifestação da área técnica competente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 7º No caso de projeto de pesquisa clínica que preveja a aquisição de equipamentos que sejam isentos de registro ou cadastro junto à Agência Nacional de Vigilância Sanitária - ANVISA nos termos da legislação aplicável, a destinação desses equipamentos seguirá as normas sanitárias em vigor. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO VI
DA PRESTAÇÃO DE SERVIÇOS AMBULATORIAIS E
HOSPITALARES
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 33 A entidade de saúde de reconhecida excelência poderá aplicar até trinta por cento do valor da isenção das contribuições sociais usufruídas na prestação de serviços de saúde ambulatoriais e hospitalares ao SUS não remunerados, compreendida como o conjunto de ações e serviços de assistência direta realizada em consultórios, ambulatórios, hospitais, prontos-socorros ou outros locais de promoção da saúde, incluindo atendimentos para fins de diagnóstico, prevenção, terapia, recuperação e internação. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° É expressamente vedada, na prestação dos serviços de saúde ambulatoriais e hospitalares, a previsão de: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - realização de obras e reformas de infraestrutura física; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - aquisição de equipamentos e materiais permanentes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - terceirização da gestão na prestação de serviços ambulatoriais e hospitalares; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - execução de ações de estudos de avaliação e incorporação de tecnologia, capacitação de recursos humanos, pesquisas de interesse público em saúde e desenvolvimento de técnicas e operação de gestão em serviços de saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 34 As entidades de saúde de reconhecida excelência
deverão protocolar na SE/MS propostas de prestação de serviços de
saúde ambulatoriais e hospitalares ao SUS não remunerados, com
memória de cálculo detalhada dos custos propostos, as quais serão
submetidas à análise da Secretaria de Atenção à Saúde - SAS/MS,
que, no prazo de trinta dias, emitirá parecer de recomendação para
deliberação do Comitê Gestor do PROADI-SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 34. As entidades de saúde de reconhecida excelência deverão protocolar na SE/MS propostas de prestação de serviços de saúde ambulatoriais e hospitalares ao SUS não remunerados, com memória de cálculo detalhada dos custos propostos, as quais serão submetidas à análise da Secretaria de Atenção Especializada à Saúde - SAES/MS ou Secretaria de Atenção Primária à Saúde - SAPS/MS, que, no prazo de trinta dias, emitirá parecer de recomendação para deliberação do Comitê Gestor do Proadi-SUS. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 1º O parecer referido no caput deverá conter análise detalhada dos custos propostos para a prestação de serviços ambulatoriais e hospitalares, considerando as melhores práticas, a expertise e a otimização dos recursos pelas entidades de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º No caso de realização de prestação de serviços ambulatoriais e hospitalares em locais onde não exista prévia operação da entidade de saúde, o referencial a ser empregado são as práticas realizadas pelo gestor local da referida região. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 35 Após a autorização do Comitê Gestor do PROADISUS, nos termos do inciso III do art. 4°, a entidade de saúde de reconhecida excelência pactuará com o gestor local do SUS, mediante instrumento específico, plano de trabalho com a previsão de atendimentos e detalhamento de custos, publicando-se, em sequência, extrato dos serviços contratados no Diário Oficial respectivo, especificando, no mínimo: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - o Termo de Ajuste do PROADI-SUS a que esteja vinculado; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - as partes contratantes; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - o objeto do contrato; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - o período de execução; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - o valor previsto para a execução dos serviços a serem prestados, que corresponderá à parcela da isenção das contribuições sociais usufruída, observado o limite previsto no caput do art. 33. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O prazo da pactuação referido no caput é de sessenta dias após o recebimento de notificação da SE/MS pela entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º A entidade de saúde deverá encaminhar à SE/MS extrato publicado do respectivo instrumento de pactuação, bem como o plano de trabalho aprovado e respectivo parecer conclusivo emitido pelo gestor local do SUS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O gestor local do SUS deverá dar ciência à respectiva
Comissão Intergestores Bipartite - CIB do plano de trabalho pactuado
com a entidade de saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O gestor local do SUS dará ciência ao respectivo conselho de saúde local do plano de trabalho pactuado com a entidade de saúde e à Comissão Intergestores Bipartite - CIB, nos casos de projetos de atuação regional. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Art. 36 A análise técnica e financeira do plano de trabalho caberá ao gestor local do SUS, que poderá solicitar à entidade de saúde de reconhecida excelência complementação do plano de trabalho apresentado, incluindo outras informações que se fizerem necessárias. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A entidade de saúde de reconhecida excelência deverá enviar as informações solicitadas no prazo de quinze dias contados da data do recebimento da solicitação, hipótese em que o prazo para emissão do parecer conclusivo ficará suspenso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a entidade de saúde de reconhecida excelência não encaminhe as informações solicitadas no prazo previsto no § 1º, o parecer técnico será emitido com as informações que constem no processo, devendo-se dar destaque ao não atendimento da solicitação de informações. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° A comprovação dos custos dos serviços de saúde pactuados poderá ser exigida a qualquer tempo, mediante apresentação dos documentos necessários. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 37 A responsabilidade pelo monitoramento e análise da prestação de contas dos serviços de saúde ambulatoriais e hospitalares caberá ao gestor local do SUS, conforme a pactuação realizada. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1° A entidade de saúde de reconhecida excelência deverá informar a produção na forma estabelecida nas demais normativas vigentes do Ministério da Saúde, com observação de não geração de créditos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2° A entidade de saúde deverá apresentar à SE/MS declaração fornecida pelo gestor local do SUS atestando os valores executados e os resultados obtidos com as atividades complementares normatizadas pelo § 4º do art. 11 da Lei nº 12.101, de 2009. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3° Os relatórios previstos no caput deverão ser acompanhados de demonstrações contábeis e financeiras submetidas a parecer conclusivo de auditoria independente, realizada por instituição credenciada perante o Conselho Regional de Contabilidade. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4° A SE/MS encaminhará os documentos de que trata o §
2° para a SAS/MS, para fins de acompanhamento e fiscalização dos
serviços prestados. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 4º A SE/MS encaminhará os documentos de que trata o § 2º para a SAES/MS ou SAPS/MS, para fins de acompanhamento e fiscalização dos serviços prestados. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Art. 38 A prestação de serviços de saúde ambulatoriais e hospitalares de que trata este Capítulo deverá ser comprovada para fins de obtenção do CEBAS-saúde, observada a regulamentação respectiva. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 39 A prestação de serviços de saúde ambulatoriais e hospitalares que preveja a realização de procedimentos de alta complexidade constantes da relação dos procedimentos regulados pela Central Nacional de Regulação de Alta Complexidade (CNRAC) conterá previsão expressa acerca da necessária regulação pela referida Central, observadas as vigências do respectivo Termo de Ajuste e as exigências referentes ao credenciamento ou habilitação conforme as especificidades dos projetos. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO VII
DA CERTIFICAÇÃO DA EXECUÇÃO DOS RECURSOS
DE ISENÇÃO FISCAL
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 40 Quando da emissão dos pareceres conclusivos referentes aos Relatórios de Prestação de Contas Anual, a SE/MS atestará e expedirá certidão referente ao valor anual efetivamente executado pelas entidades de saúde de reconhecida excelência com os projetos de apoio. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A certidão de que trata o caput será enviada às respectivas entidades de saúde de reconhecida excelência e ao
Departamento de Certificação de Entidades Beneficentes de Assistência
Social em Saúde - DCEBAS/SAS/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A certidão de que trata o caput será enviada às respectivas entidades de saúde de reconhecida excelência e ao Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde - DCEBAS/SAES/MS. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
CAPÍTULO VIII
DOS RECURSOS ADMINISTRATIVOS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 41 Das decisões proferidas pelo Comitê Gestor do PROADI-SUS caberá pedido de reconsideração, sem efeito suspensivo, para análise e deliberação final, como última instância administrativa. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º O prazo para interposição do pedido de reconsideração é de dez dias contados da notificação da entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Havendo justo receio de prejuízo de difícil ou incerta reparação decorrente da execução, o Comitê Gestor do PROADI-SUS poderá, de ofício ou a pedido, dar efeito suspensivo ao pedido de reconsideração. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º O Comitê Técnico do PROADI-SUS deverá elaborar
subsídios técnicos para subsidiar a deliberação final do Comitê Gestor
do PROADI-SUS nos pedidos de reconsideração. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º As áreas técnicas e entidades vinculadas ao Ministério da Saúde deverão, respeitados os seus respectivos campos de atuação, elaborar manifestação técnica para subsidiar a deliberação final do Comitê Gestor do Proadi-SUS nos pedidos de reconsideração. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 4º O pedido de reconsideração deverá ser protocolado na SE/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art 42. Das decisões proferidas por outras autoridades ou órgãos no âmbito do PROADI-SUS caberá recurso, sem efeito suspensivo,
dirigido à autoridade ou órgão que proferiu a decisão. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 42. Das decisões proferidas no âmbito do Proadi-SUS acerca da análise de prestação de contas caberá recurso, sem efeito suspensivo, dirigido à autoridade ou órgão que proferiu a decisão. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 1º O prazo para interposição do recurso é de dez dias contados da notificação da entidade de saúde de reconhecida excelência. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a autoridade ou órgão que proferiu a decisão
recorrida não a reconsidere no prazo de cinco dias, de forma fundamentada,
o recurso será submetido ao Comitê Técnico do PROADI-SUS, para elaboração de subsídios técnicos e posterior encaminhamento
ao Comitê Gestor do PROADI-SUS, para análise e deliberação
final, como última instância administrativa. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Caso a autoridade que proferiu a decisão recorrida não a reconsidere no prazo de 5 (cinco) dias, de forma fundamentada, o recurso será submetido ao Comitê Gestor do Proadi-SUS, acompanhado das razões do recorrido, para análise e deliberação final, como última instância administrativa. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 3º Havendo justo receio de prejuízo de difícil ou incerta
reparação decorrente da execução, a autoridade ou órgão que proferiu
a decisão recorrida ou o Comitê Gestor do PROADI-SUS poderá, de
ofício ou a pedido, dar efeito suspensivo ao recurso. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 3º Havendo justo receio de prejuízo de difícil ou incerta reparação decorrente da execução, a autoridade que proferiu a decisão recorrida ou o Comitê Gestor do Proadi-SUS poderá, de ofício ou a pedido, dar efeito suspensivo ao recurso. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
§ 4º O recurso deverá ser protocolados na SE/MS. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 43 A autoridade ou órgão competente para julgar o recurso ou pedido de reconsideração não o conhecerá quando interposto: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - fora do prazo; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - perante órgão incompetente; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - por quem não seja legitimado; ou (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - após exaurida a esfera administrativa. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 44. Aplicam-se a este Capítulo, subsidiariamente, as regras constantes no Capítulo XV da Lei nº 9.784, de 29 de janeiro de 1999. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
CAPÍTULO VIII-A
DO RECONHECIMENTO DE EXCELÊNCIA DAS ENTIDADES DE SAÚDE
(Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-A. A entidade de saúde que se proponha a realizar projetos no âmbito do Proadi-SUS, conforme estabelecido no art. 7º, inciso IV, da Lei Complementar nº 187, de 16 de dezembro de 2021, deverá ser previamente reconhecida como de excelência pelo Ministério da Saúde, nos termos do Decreto nº 11.791, de 21 de novembro de 2023. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-B. A entidade de saúde poderá solicitar o reconhecimento de excelência para uma ou mais áreas de atuação estabelecidas no art. 14 da Lei Complementar nº 187, de 16 de dezembro de 2021, a saber: (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
I - estudos de avaliação e incorporação de tecnologias; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
II - capacitação de recursos humanos; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
III - pesquisas de interesse público em saúde; ou (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
IV - desenvolvimento de técnicas e operação de gestão em serviços de saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Seção I
Da Comissão de Avaliação de Excelência das Entidades de Saúde
(Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-C. Fica instituída a Comissão de Avaliação de Excelência das Entidades de Saúde, de caráter permanente, com a competência de verificar o cumprimento dos requisitos técnicos para o reconhecimento de excelência das entidades de saúde no âmbito do Proadi-SUS, nos termos do art. 38 do Decreto nº 11.791, de 21 de novembro de 2023. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º Os trabalhos da Comissão serão realizados por meio de análise dos documentos apresentados pela entidade, de vistoria no estabelecimento e de emissão de pareceres recomendativos com avaliação quanto ao cumprimento ou não dos requisitos de que trata o caput. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º O registro das atividades realizadas pela Comissão será formalizado por meio de processo específico no Sistema Eletrônico de Informações - SEI do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-D A Comissão de Avaliação de Excelência das Entidades de Saúde será composta por representantes dos seguintes órgãos e entidades do Ministério da Saúde: (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
I - um representante da Secretaria-Executiva, que a coordenará; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
II - um representante da Secretaria de Atenção Primária à Saúde; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
III - um representante da Secretaria de Atenção Especializada à Saúde; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
IV - um representante da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
V - um representante da Secretaria de Gestão do Trabalho e da Educação na Saúde; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
VI - um representante da Secretaria de Vigilância em Saúde e Ambiente; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
VII - um representante da Secretaria de Informação e Saúde Digital; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
VIII - um representante da Secretaria de Saúde Indígena; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
IX - um representante da Agência Nacional de Saúde Suplementar; e (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
X - um representante da Agência Nacional de Vigilância Sanitária. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º Cada membro da Comissão terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º Os membros da Comissão e respectivos suplentes serão indicados pelos dirigentes máximos dos órgãos ou entidades que representam e designados pelo Secretário-Executivo do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 3º A secretaria executiva da Comissão será exercida pelo Departamento de Cooperação Técnica e Desenvolvimento em Saúde da Secretaria-Executiva do Ministério da Saúde, que prestará apoio técnico-administrativo necessário ao funcionamento de suas atividades. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 4º Poderão participar das reuniões da Comissão, como convidados especiais, sem direito a voto, representantes de outros órgãos ou entidades, públicos ou privados, bem como pesquisadores e especialistas em assuntos afetos ao tema em discussão, cuja presença pontual seja considerada necessária ao cumprimento do disposto nesta Seção. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-E. A Comissão de Avaliação de Excelência das Entidades de Saúde se reunirá, em caráter ordinário, semestralmente e, em caráter extraordinário, sempre que convocada pela sua coordenação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º As reuniões da Comissão serão realizadas por meio de videoconferência, nos termos do Decreto nº 10.416, de 7 de julho de 2020. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º O quórum de reunião da Comissão é de maioria absoluta dos membros, e o quórum de aprovação é de maioria simples. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 3º A participação na Comissão será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Seção II
Do requerimento do reconhecimento de excelência
(Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-F. O requerimento de concessão ou renovação do reconhecimento de excelência deverá ser apresentado pela entidade à Secretaria-Executiva do Ministério da Saúde, no qual serão indicadas as áreas de atuação pretendidas para desenvolvimento de projetos no âmbito do Proadi-SUS, de acordo com o art. 44-B deste Capítulo. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º O requerimento de concessão poderá ser apresentado a qualquer tempo, devendo ser assinado pelo representante legal da instituição e acompanhado de documentação que comprove a efetiva capacidade da entidade para o desenvolvimento de projetos no âmbito do Proadi-SUS, em conformidade com os requisitos técnicos definidos no Decreto nº 11.791, de 21 de novembro de 2023, e discriminada no Anexo 13 a deste Anexo. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º A entidade poderá requerer acréscimo de área de atuação ao reconhecimento de excelência vigente, acompanhado da documentação de comprovação correspondente às áreas pretendidas. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 3º A aprovação de novas áreas de atuação não modificará o prazo de validade do reconhecimento de excelência já concedido à entidade de saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 4º Para renovação do requerimento do reconhecimento de excelência, a entidade deverá protocolar a solicitação no decorrer dos trezentos e sessenta e cinco dias anteriores ao término de sua validade. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 5º A entidade de saúde poderá solicitar o acréscimo de áreas de atuação juntamente com o requerimento de renovação de reconhecimento de excelência. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 6º O requerimento de renovação do reconhecimento de excelência protocolado antes do prazo previsto no § 4º não será conhecido. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 7º O requerimento de renovação do reconhecimento de excelência protocolado após o prazo previsto no § 4º será considerado requerimento originário. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-G. A participação de entidades de saúde em projetos do Proadi-SUS não poderá ocorrer em prejuízo das atividades beneficentes prestadas ao SUS. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º A entidade que prestar serviços ao SUS deverá apresentar declaração de manutenção da prestação de serviços, juntamente com a ratificação do gestor local, onde houver contratualização. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º Será realizada supervisão periódica para verificação da manutenção da prestação dos serviços ao SUS. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Seção III
Da avaliação de excelência das entidades de saúde
(Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-H. O requerimento e a documentação apresentados pela entidade de saúde, até 31 de dezembro de cada ano, serão apreciados pela Comissão de Avaliação de Excelência das Entidades de Saúde até o final do primeiro semestre do ano subsequente ao ano de apresentação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-I. A avaliação da entidade de saúde não estará limitada aos documentos discriminados no Anexo 13 a este Anexo, podendo ser necessária a apresentação de outras comprovações, conforme disposto no "Manual de Avaliação para Reconhecimento de Excelência de Entidades de Saúde". (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º A Comissão de Avaliação de Excelência das Entidades de Saúde poderá solicitar complementação de documentação, bem como informações e esclarecimentos à entidade de saúde, permitidas até três diligências, que deverão ser respondidas em até quinze dias, contados da respectiva notificação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º Caso a entidade de saúde não responda às diligências no prazo de que trata o § 1º, o parecer será emitido com as informações constantes do processo, devendo ser consignado o não atendimento da solicitação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-J. Os critérios para avaliação dos requisitos técnicos, bem como as premissas e a forma de comprovação, estarão discriminados no "Manual de Avaliação para Reconhecimento de Excelência de Entidades de Saúde", a ser disponibilizado no sítio eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Parágrafo único. O manual de que trata o caput poderá ser atualizado anualmente e terá aplicação no exercício subsequente. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-K. O reconhecimento de excelência às entidades de saúde será concedido por área de atuação, segundo disposto no art. 44-B e conforme o cumprimento dos critérios para avaliação dos requisitos técnicos previstos no art. 38 do Decreto nº 11.791, de 21 de novembro de 2023. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Parágrafo único. Com base na regularidade da documentação apresentada pela entidade de saúde e no disposto no Manual de Avaliação para Reconhecimento de Excelência de Entidades de Saúde, a Comissão de Avaliação de Excelência das Entidades de Saúde poderá realizar visita in loco para confirmação do cumprimento dos requisitos técnicos exigidos. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-L. Poderão obter o reconhecimento de excelência as entidades de saúde que atenderem, no mínimo, a 80% (oitenta por cento) dos critérios avaliativos referentes aos requisitos técnicos comuns e 80% (oitenta por cento) dos critérios avaliativos referentes aos requisitos técnicos específicos de cada área de atuação pleiteada, conforme dispostos no Decreto nº 11.791, de 21 de novembro de 2023. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-M. O parecer recomendativo da Comissão de Avaliação de Excelência das Entidades de Saúde será submetido ao Comitê Gestor do Proadi-SUS para deliberação sobre o reconhecimento de excelência da entidade de saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º A decisão do Comitê Gestor do Proadi-SUS sobre a concessão ou renovação do reconhecimento de excelência será publicada no DOU por meio de portaria do Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º Da decisão do Comitê Gestor do Proadi-SUS que indeferir requerimento de concessão ou renovação do reconhecimento de excelência caberá pedido de reconsideração, no prazo de dez dias contados da publicação da decisão, que terão os seguintes efeitos: (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
I - devolutivo, na hipótese de indeferimento do requerimento de concessão; ou (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
II - devolutivo e suspensivo, na hipótese de indeferimento do requerimento de renovação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Seção IV
Da validade, da supervisão e do cancelamento do reconhecimento de excelência
(Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-N. O reconhecimento de excelência terá validade de cinco anos, contados da data de publicação da decisão de deferimento no DOU. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Parágrafo único. O reconhecimento de excelência permanecerá válido até a data da decisão administrativa definitiva sobre o requerimento de renovação tempestivamente apresentado. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-O. A validade do reconhecimento de excelência condiciona-se à manutenção dos requisitos que a ensejaram, cabendo à Comissão de Avaliação de Excelência das Entidades de Saúde a supervisão e o acompanhamento, que poderão ser realizados por meio de solicitação de informações e documentos, visitas in loco, de auditorias ou cumprimento de diligências, observado o contraditório e a ampla defesa. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º A Comissão de Avaliação aprovará um plano de trabalho anual para fins de supervisão das entidades de reconhecida excelência contendo, no mínimo: (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
I - o escopo da supervisão; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
II - o método a ser utilizado; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
III - os critérios de elegibilidade das entidades a serem supervisionadas; e (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
IV - as metas a serem cumpridas na supervisão. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º A entidade de reconhecida excelência será notificada do início do processo de supervisão e para apresentação, no prazo de trinta dias contados da data da notificação, dos documentos de comprovação da manutenção dos requisitos técnicos que ensejaram o reconhecimento. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 3º A entidade que, no momento do reconhecimento de excelência, declarar a prestação de serviços ao SUS, nos termos do art. 44-G, deverá apresentar documentação comprobatória da manutenção dos serviços. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 4º A verificação do descumprimento dos requisitos técnicos durante o processo de supervisão poderá ensejar o cancelamento total ou parcial do reconhecimento de excelência, conforme as seguintes hipóteses: (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
I - o descumprimento do percentual mínimo de critérios avaliativos dos requisitos técnicos comuns a todas as áreas resultará no cancelamento total do reconhecimento de excelência; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
II - o descumprimento do percentual mínimo de critérios avaliativos dos requisitos técnicos específicos resultará no cancelamento total do reconhecimento, caso a entidade de saúde tenha o reconhecimento de excelência em apenas uma área de atuação; (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
III - o descumprimento do percentual mínimo de critérios avaliativos dos requisitos técnicos específicos para todas as áreas de atuação ensejará o cancelamento total do reconhecimento, caso a entidade de saúde tenha o reconhecimento de excelência para mais de uma área de atuação; ou (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
IV - o descumprimento do percentual mínimo de critérios avaliativos dos requisitos técnicos específicos de uma área ou mais áreas de atuação, desde que não descumpra em todas, ensejará o cancelamento do reconhecimento somente para as áreas de atuação onde houve o descumprimento, caso a entidade de saúde tenha o reconhecimento de excelência para mais de uma área de atuação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-P. O parecer de supervisão emitido pela Comissão de Avaliação de Excelência das Entidades de Saúde que contenha recomendação de cancelamento do reconhecimento de excelência será submetido ao Comitê Gestor do Proadi-SUS para deliberação. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º A decisão do Comitê Gestor do Proadi-SUS sobre o cancelamento do reconhecimento de excelência será publicada no DOU, por meio de portaria do Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º Da decisão do Comitê Gestor do Proadi-SUS que cancelar o reconhecimento de excelência caberá pedido de reconsideração, com efeito suspensivo, no prazo de dez dias contados da publicação da decisão no DOU, para análise e deliberação final, como última instância administrativa. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 3º A decisão de cancelamento total do reconhecimento de Excelência será enviada ao Departamento de Certificação de Entidades Beneficentes de Assistência Social em Saúde da Secretaria de Atenção Especializada à Saúde. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
Art. 44-Q Os projetos em execução pela entidade de saúde que tiver o reconhecimento de excelência cancelado deverão ser encerrados, sendo garantido o prazo de sessenta dias para desmobilização. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 1º O prazo para desmobilização poderá ser prorrogado por decisão do Comitê Gestor do Proadi-SUS, caso seja identificado justo receio de prejuízo ou incerta reparação decorrente do encerramento. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
§ 2º No caso de cancelamento parcial do reconhecimento de excelência, somente deverão ser desmobilizados os projetos da área de atuação objeto do cancelamento. (Redação dada pela PRT GM/MS n° 5.483 de 08.10.2024)
CAPÍTULO IX
DISPOSIÇÕES FINAIS E TRANSITÓRIAS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 45 As entidades de saúde de reconhecida excelência poderão solicitar à SE/MS, com a devida exposição da finalidade e da aplicabilidade dos dados, a disponibilização dos bancos de dados provenientes de projetos de apoio desenvolvidos por outra entidade de saúde de reconhecida excelência, conforme política de segurança da informação e de acordo com as normas internas do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 46 A SE/MS disponibilizará em meio eletrônico, em até
sessenta dias da publicação desta Portaria, Manual Técnico de Elaboração,
Análise e Prestação de Contas dos Projetos PROADI-SUS,
com diretrizes, orientações e informações complementares para: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 46 A SE/MS disponibilizará, em meio eletrônico, o Manual Técnico de Elaboração, Análise e Prestação de Contas dos Projetos PROADI-SUS, com diretrizes, orientações e informações complementares para: (Redação dada pela PRT GM/MS n° 2.976 de 18.09.2018)
I - a proposição e a apresentação dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
II - a elaboração dos pareceres recomendativos dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - as solicitações e análises das alterações dos projetos de apoio; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IV - a elaboração dos Relatórios de Monitoramento; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
V - a apresentação do Relatório de Prestação de Contas Anual; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VI - a elaboração do parecer de prestação de contas anual; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VII - a sistemática de avaliação dos resultados dos projetos de apoio, nos termos do art. 27; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
VIII - a elaboração de Termos de Doação, para atendimento ao disposto no art. 32; e (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
IX - demais ações necessárias para cumprimento da presente Portaria. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 47 Os prazos previstos nesta Portaria começam a vigorar a partir da data da notificação da entidade de saúde de reconhecida excelência ou do recebimento do processo nas áreas técnicas, excluindo-se da contagem o dia do começo e incluindo-se o do vencimento. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 1º A notificação a que se refere o caput será feita: (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - via postal, com Aviso de Recebimento - AR; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
I - por meio eletrônico que assegure a ciência do destinatário; (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
II - diretamente ao destinatário, mediante termo de recebimento; (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
III - por meio eletrônico que assegure a ciência do destinatário;
ou (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017) (Revogado pela PRT GM/MS nº 2467 de 17.09.2019)
IV - por publicação na imprensa oficial, apenas na hipótese de ter sido frustrada tentativa de notificação feita na forma dos incisos I ou III. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
§ 2º Considera-se prorrogado o prazo até o primeiro dia útil seguinte, se o vencimento cair em dia em que não houver expediente ou este for encerrado antes do horário normal. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Art. 48 Todos os atos pendentes e os efeitos de projetos de apoio já aprovados passam a ser regidos pelas disposições desta Portaria, respeitado o ato jurídico perfeito. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
Parágrafo único. A avaliação dos resultados finais dos projetos de apoio, em evento específico, previsto no art. 27, não se aplicará aos projetos referentes ao triênio 2015-2017. (Redação dada pela PRT GM/MS nº 2467 de 17.09.2019)
Art. 49 O disposto no § 1° do art. 12 desta Portaria referente à solicitação de prorrogação de Termo de Ajuste não se aplica ao triênio vigente. (Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 1 DO ANEXO XCIII
MINUTA DE TERMO DE AJUSTE (Origem: PRT MS/GM 2814/2014, Anexo 1)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
MINUTA DE TERMO DE AJUSTE
TERMO DE AJUSTE QUE ENTRE SI CELEBRAM A UNIÃO, POR INTERMÉDIO DO MINISTÉRIO DA SAÚDE, E XXXXXXX, PARA IMPLANTAR E EXECUTAR PROJETOS NO ÂMBITO DO PROGRAMA DE APOIO AO DESENVOLVIMENTO INSTITUCIONAL DO SISTEMA ÚNICO DE SAÚDE (PROADI-SUS).
A UNIÃO, por intermédio do MINISTÉRIO DA SAÚDE, inscrito sob o CNPJ nº 00.530.493/0001-71, situado na Esplanada dos Ministérios, Bloco G, edifício Sede, Brasília-DF, neste ato representado pelo Ministro de Estado da Saúde, ARTHUR CHIORO nomeado pelo Decreto de XX de XXXX de XXX, portador do CPF/MF nº XXXXXXX e RG nº XXXXXX, expedida pelo XXXXX, doravante denominado MINISTÉRIO e a <ENTIDADE DE SAÚDE> , inscrito no CNPJ sob o nº XXXXXXX, situado na XXXXXXX, habilitada pela Portaria nº <____>/GM/MS, de __ de _____ de_____, neste ato representada por seu Presidente XXXXXXX, portador do CPF/MF nº XXXXXXX e RG nº XXXXXX, expedido pela XXXXXX, doravante denominada ENTIDADE DE SAÚDE, celebram o presente Termo, com fulcro nas disposições da Lei nº 12.101, de 27 de novembro de 2009, do Decreto nº 8.242, de 23 de maio de 2014, da Portaria nº XXX/GM/MS, de xx de xxxxx de 2014, da Portaria n°XX/SE/MS, de XX de XXXX de 2014, e nas demais disposições normativas em vigor, legislação superveniente e em especial as que regem a matéria, mediante as cláusulas e condições a seguir:
CLÁUSULA PRIMEIRA - DO OBJETO
O presente termo tem por objeto a adesão da ENTIDADE DE SAÚDE ao Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde (PROADI-SUS) no triênio XXXX/XXXX, a partir de Projetos de Apoio a serem apresentados nos seguintes temas de interesse:
ESPAÇO RESERVADO PARA LISTAGEM DOS TEMAS DE INTERESSE DA ENTIDADE, CONFORME A PORTARIA SE/MS A QUE SE REFIRA
SUBCLÁUSULA ÚNICA - Os Projetos de Apoio, na medida em que forem aprovados, serão vinculados ao presente Termo de Ajuste, respeitado o triênio de vigência e o limite das isenções tributárias.
CLÁUSULA SEGUNDA - DO PRAZO DE VIGÊNCIA
Este Termo de Ajuste vigerá a partir da data da sua assinatura até XXXX, prazo este improrrogável.
CLÁUSULA TERCEIRA - DA PREVISÃO DE RECURSOS
O valor estimado da isenção tributária relativa às contribuições sociais da ENTIDADE DE SAÚDE para o triênio XXXX/XXXX é de R$ XXXX (XXXXXX).
SUBCLÁUSULA PRIMEIRA - O somatório do valor dos Projetos de Apoio a serem aprovados e vinculados ao presente Termo de Ajuste não poderá ser superior ao valor estimado da isenção tributária indicada nesta Cláusula.
SUBCLÁUSULA SEGUNDA - A ENTIDADE DE SAÚDE informará ao Ministério da Saúde, anualmente, o valor total de isenção tributária apurado no exercício fiscal anterior, comprovado por meio do Balanço Patrimonial.
CLÁUSULA QUARTA - DOS DIREITOS, OBRIGAÇÕES E RESPONSABILIDADES DOS PARTÍCIPES
I - Compete ao MINISTÉRIO:
a) monitorar, acompanhar e avaliar os Projetos de Apoio que integrarão o presente Termo de Ajuste, no tocante a sua execução física e financeira, inclusive por meio de visitas técnicas;
b) analisar as respectivas prestações de contas dos Projetos de Apoio que integrarem o presente Termo de Ajuste, de acordo com as regras e critérios vigentes no Regulamento do PROADI-SUS;
c) adotar as medidas necessárias para o aperfeiçoamento e desenvolvimento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos projetos;
d) solicitar à ENTIDADE DE SAÚDE que adote as medidas necessárias para o aperfeiçoamento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos projetos; e
e) inserir todas as informações referentes a monitoramento, acompanhamento, avaliação e análise, bem como informações pertinentes à prestação de contas dos projetos, em sistema informatizado de gestão do PROADI-SUS, quando implantado e disponível.
II - Compete à ENTIDADE DE SAÚDE:
a) desenvolver e executar os Projetos de Apoio de acordo com os valores e conteúdos aprovados no plano de trabalho;
b) adotar as medidas necessárias para o aperfeiçoamento e desenvolvimento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos Projetos de Apoio;
c) solicitar ao MINISTÉRIO que adote as medidas necessárias ao aperfeiçoamento do PROADI-SUS, especialmente quanto ao processo de elaboração, monitoramento, acompanhamento, avaliação e prestação de contas dos projetos;
d) protocolar/inserir os relatórios de prestação de contas a serem endereçados à Secretaria-Executiva/MS, conforme Cláusula Capítulo V da Portaria nº XXX/GM/MS, de XX de XXXX de 2014;
e) manter à disposição do MINISTÉRIO, pelo prazo mínimo de 10 anos, o conjunto de documentos relacionados aos Projetos de Apoio vinculados ao presente Termo de Ajuste;
f) apresentar, sempre que solicitado pelo MINISTÉRIO, informações ou detalhamento referente aos Projetos de Apoio, suas prestações de contas com documentação comprobatória, inclusive e especialmente os contratos relacionados ou ações a eles vinculados;
g) permitir e facilitar aos representantes do MINISTÉRIO o acesso aos locais de execução dos projetos, o exame da documentação produzida e a vistoria dos bens adquiridos no bojo de Projetos de Apoio vinculados ao presente Termo de Ajuste;
h) destinar dotação orçamentária específica da imunidade tributária usufruída para a aquisição de diárias e passagens para servidores/colaboradores do Ministério da Saúde realizarem visitas técnicas de monitoramento e avaliação, de acordo com instrumento de planejamento a ser pactuado, aplicando-se as normas do Decreto nº 5992/2006 e respectivas alterações, no que couber, e atentando-se às vedações da Lei 8.112/1990, quer se trate de servidores ou agente/colaborador no desempenho das atribuições em referência, devendo constar na prestação de contas dos projetos com a documentação comprobatória;
i) inserir o logotipo do MINISTÉRIO e do PROADI-SUS em material de divulgação e apresentação dos produtos vinculados aos Projetos de Apoio;
j) inserir todas as informações referentes ao Projeto de Apoio, inclusive relatórios de prestação de contas e atendimento de diligências, em sistema informatizado de gestão do PROADI-SUS, quando implantado e disponível; e
k) providenciar que textos de trabalhos, parciais e completos, a serem apresentados em eventos nacionais e internacionais contenham indicação expressa de execução no âmbito do PROADI-SUS e sejam apresentados em Língua Portuguesa à Secretaria ou entidade vinculada competente para acompanhamento do Projeto de Apoio respectivo.
SUBCLÁUSULA PRIMEIRA - Caso não seja possível a utilização plena do Sistema de Gestão de Projetos do Programa de Apoio ao Desenvolvimento Institucional do SUS (SISPROADI-SUS) para registro e tramitação dos atos e procedimentos relativos aos processos no âmbito do PROADI-SUS, o MINISTÉRIO e a ENTIDADE DE SAÚDE deverão valer-se da apresentação e tramitação física dos processos.
SUBCLÁUSULA SEGUNDA - Fica estabelecido que as obrigações legais decorrentes de eventuais contratações, celebração de convênios ou outras formas de ajuste, necessárias à consecução do objeto deste são de inteira responsabilidade da ENTIDADE DE SAÚDE, não possuindo assim qualquer vínculo com o MINISTÉRIO.
CLÁUSULA QUINTA - DOS DADOS E INFORMAÇÕES CONFIDENCIAIS
A execução dos Projetos de Apoio vinculados ao presente Termo de Ajuste que prevejam a transferência de dados dos sistemas nacionais de informação do MINISTÉRIO (partícipe divulgador) à ENTIDADE (partícipe receptor) será regida pelas regras e obrigações estabelecidas nesta cláusula, sobretudo no tocante a informações confidenciais e dados sensíveis.
SUBCLÁUSULA PRIMEIRA - DAS DEFINIÇÕES
a) Denominam-se dados ou informações confidenciais os dados considerados como direito à intimidade das pessoas e segredo profissional, incluindo-se os dados sensíveis e as informações proprietárias das subsidiárias de cada um dos partícipes, bem como de suas sociedades afiliadas, parceiros comerciais, provedores de dados e clientes. As Informações Confidenciais poderão ser escritas, orais, gravadas, ou contidas em fita, base de dados ou em qualquer outra mídia eletrônica ou mecânica. Toda informação confidencial é fornecida "no estado em que se encontra" e sem qualquer garantia, expressa, implícita ou não, em relação à precisão ou execução de tais Informações Confidenciais.
b) Informações Confidenciais não devem incluir informações que:
i. já eram de conhecimento do partícipe receptor antes da divulgação da informação;
ii. estejam ou tenham entrado em domínio público sem violação do presente Termo de Ajuste ou conduta ilícita do partícipe receptor;
iii. tenham sido legitimamente recebidas por um terceiro partícipe sem violação do presente Termo de Ajuste;
iv. tenham sido aprovadas para liberação por autorização por escrito da parte divulgadora; ou
v. cuja divulgação seja exigida mediante ordem final e definitiva de um órgão governamental ou tribunal competente, desde que o partícipe divulgador tenha sido devidamente informado da pendência e que tenha tido oportunidade para contestá-la.
c) Entende-se por dados sensíveis:
i. informação pessoalmente identificável relativa aos dados de indivíduos menores de idade;
ii. números de identificação pessoal com o nome associado;
iii. nome de solteiro da mãe com o nome associado;
iv. número da licença de motorista ou de qualquer outro documento de identificação governamental com o nome associado;
v. número de telefone identificado como não listado ou não publicado;
vi. cartão de crédito, de débito, ou número de contas bancárias com o nome associado e/ou com qualquer PIN ou código de acesso necessário;
vii. informações de saúde de identificação pessoal;
viii. informações financeiras ou de folha de pagamento incluindo número de identificação de funcionário;
ix. qualquer tipo de informação que figurar como direito à intimidade das pessoas e segredo profissional; e
x. qualquer outra informação assinalada como Dado Sensível ou cuja natureza claramente assim o indique.
SUBCLÁUSULA SEGUNDA - A responsabilidade assumida pela ENTIDADE, quanto à confidencialidade dos dados, é extensiva a terceiros que venham a ser contratados na execução dos Projetos de Apoio, exigindo-se da ENTIDADE que garanta esse compromisso de qualquer terceiro contratado, direta ou indiretamente.
SUBCLÁUSULA TERCEIRA - As obrigações contidas nesta Cláusula Quinta aplicam-se a todo dado confidencial e sensível divulgado pelos partícipes entre si, incluindo, sem limitação, todos os preços, listas de endereços, dados de propriedade industrial, modelo(s) de dados, integradores de dados, regras de negócio e quaisquer adaptadores relacionados, projetos de produtos, capacidades, especificações, código de programação, sistema de software e processos, informações sobre técnicas, negócios, planos de marketing e estratégias de produtos atuais e futuros, qualquer relatório de análise ou resultados de testes de qualquer produto, bem como a identidade dos atuais e potenciais clientes, provedores de dados e fornecedores.
SUBCLÁUSULA QUARTA - Cada um dos partícipes deve assegurar que qualquer Dado Sensível esteja criptografado em nível tal que a parte possa aceitar e transmitir ou dividir em dois ou mais arquivos físicos ou de dados, conforme o caso, com as chaves de identificação fornecidas ao partícipe receptor de tal forma que nenhum arquivo em si contenha Dados Sensíveis previamente à transmissão ou expedição de tais Dados Sensíveis ao outro partícipe, por meio de uma rede pública ou em meios físicos.
SUBCLÁUSULA QUINTA - DAS OBRIGAÇÕES COMUNS
a) Os partícipes concordam em manter as Informações Confidenciais em estrita confidencialidade e a não divulgar tais Informações Confidenciais a nenhum terceiro ou a usá-las para nenhum propósito que não aqueles autorizados pela outra parte;
b) Os partícipes concordam que irão empregar todas as medidas razoáveis para proteger as Informações Confidenciais da outra parte de divulgação desautorizada ou inadvertida, incluindo sem limitação todas as medidas que os partícipes adotariam para proteger suas próprias informações que consideram proprietárias;
c) Os partícipes devem divulgar as correspondentes Informações Confidenciais apenas para aqueles funcionários e contratados que tenham a necessidade de tomar conhecimento e somente na extensão necessária para possibilitar aos partícipes executarem adequadamente suas respectivas responsabilidades para com a outra e, no caso de qualquer teste de produto, somente para aqueles empregados que estejam diretamente envolvidos com o teste de tal produto;
d) Nenhum dos partícipes deve usar as Informações Confidenciais da outra parte para o "benchmark" de tais Informações Confidenciais contra produtos ou serviços oferecidos por terceiros (incluindo, sem limitação, produtos e/ou serviços oferecidos por subcontratados ou terceiros prestadores de serviço do partícipe receptor); e
e) Os partícipes comprometem-se a assegurar o compromisso individual de seus respectivos funcionários, prepostos e contratados com os termos do presente Termo de Ajuste.
SUBCLÁUSULA SEXTA - DAS OBRIGAÇÕES DA ENTIDADE
a) As Informações Confidenciais não devem ser traduzidas em outro formato ou idioma, decompiladas ou submetidas à engenharia reversa sem o consentimento prévio do partícipe divulgador;
b) Nenhuma cópia das Informações Confidenciais deverá ser feita pelo partícipe receptor, exceto quando necessária para a execução de serviços relativos às Informações Confidenciais de acordo com a solicitação do partícipe divulgador;
c) Mediante solicitação por escrito do partícipe divulgador, a qualquer momento, o partícipe requerido, por opção do partícipe divulgador, deve destruir ou devolver ao partícipe divulgador todas as fitas, disquetes ou outra mídia na qual as Informações Confidenciais do partícipe divulgador estejam armazenadas, e todas as respectivas cópias, se houver;
d) Caso seja solicitada pelo partícipe divulgador a destruição de qualquer Informação Confidencial, o partícipe receptor deve, dentro de 5 (cinco) dias úteis após a destruição, entregar ao partícipe divulgador um documento certificando que a destruição foi realizada; e
e) O partícipe receptor ou terceiros subcontratados devem manter obrigação de proteger a confidencialidade de todo dado e Informação Confidencial, mesmo após a rescisão do Termo de Ajuste, não podendo tais dados confidenciais ser revelados em nenhuma hipótese, em especial, aqueles considerados Dados Sensíveis.
SUBCLÁUSULA SÉTIMA - Cada partícipe deve ser considerado como depositário dos dados e Informações Confidenciais, incluindo todas as patentes, direitos autorais, desenhos, "mask work", marca, marca de serviço, segredos comerciais e quaisquer outros direitos de propriedade e interesses nela, e tanto a ENTIDADE quanto o MINISTÉRIO concordam que nada contido neste Termo de Ajuste deve ser interpretado como concessão de direitos, por licença ou outro, a qualquer Informação Confidencial divulgada nos termos do presente Termo.
SUBCLÁUSULA OITAVA - Fica estabelecido que caso haja qualquer divulgação de informação confidencial causada seja por ação ou por omissão da ENTIDADE, não poderá ser atribuída ao MINISTÉRIO nenhuma responsabilidade perante terceiros prejudicados, sendo de inteira responsabilidade da ENTIDADE a reparação.
SUBCLÁUSULA NONA - O MINISTÉRIO ao ter conhecimento da divulgação de qualquer informação confidencial ainda que seja parcial, a fim de atenuar eventual prejuízo e ou nova ocorrência, na razão das consequências que naquele ou nesse caso vierem a ocorrer, notificará a ENTIDADE para proceder:
a) no prazo máximo de 30 (trinta) dias, a correção dos motivos que resultaram na falta; e
b) a eventual reparação, quando for o caso, sob pena de ficar caracterizado como motivo para a suspensão ou encerramento da execução do respectivo Projeto de Apoio.
CLÁUSULA SEXTA - DA PRESTAÇÃO DE CONTAS
A prestação de contas dos Projetos de Apoio vinculados a este Termo de Ajuste deverá seguir o disposto na Portaria atualmente vigente, normas complementares e demais condições acordadas neste instrumento.
SUBCLÁUSULA PRIMEIRA - Admitir-se-á uma margem de execução de 10% (dez por cento) pra mais ou para menos com relação ao valor total do Projeto de Apoio, sem que seja necessária autorização prévia do MINISTÉRIO.
SUBCLÁUSULA SEGUNDA - No caso de diferença a menor, a ENTIDADE deverá viabilizar a inclusão do valor faltante em algum dos Projetos de Apoio vinculados ao presente Termo de Ajuste, de modo a garantir que o valor total empregado no conjunto dos Projetos não seja inferior ao valor da isenção das contribuições sociais usufruída, observado o disposto na Portaria vigente, sem prejuízo das devidas justificativas e respectiva anuência do MINISTÉRIO.
CLÁUSULA SÉTIMA - DO MONITORAMENTO E AVALIAÇÃO
A execução deste Termo de Ajuste e dos Projetos de Apoio que lhe sejam vinculados será acompanhada, avaliada e fiscalizada, em conformidade com o disposto nas regras e critérios previstos na Portaria do Ministério da Saúde vigente, normas complementares e demais condições acordadas neste instrumento.
CLAUSULA OITAVA - DAS VEDAÇÕES
I - Ao MINISTÉRIO é vedado:
a) alterar o objeto, total ou parcialmente, de Projetos de Apoio vinculados ao presente Termo de Ajuste sem a anuência expressa da ENTIDADE; e
b) deixar de se manifestar frente a solicitação de informações ou sobre informe produzido pela ENTIDADE em até 90 dias, se outro prazo não tiver sido expressamente fixado.
II - À ENTIDADE é vedado:
c) utilizar o recurso financeiro para fins distintos dos aprovados originalmente nos Projetos de Apoio;
d) transferir a terceiros a gestão dos Projetos de Apoio;
e) transferir a terceiros obrigações ora assumidas;
f) executar despesas em data anterior ou posterior à vigência de cada Projeto de Apoio ou de suas alterações, observadas as normas vigentes, sob pena de desaprovação parcial da prestação de contas respectiva; e
g) repassar a terceiros os produtos adquiridos e/ou desenvolvidos em razão do presente Termo de Ajuste, ou parte deles, sem prévia autorização do MINISTÉRIO.
CLÁUSULA NONA - DA RESERVA DE PROPRIEDADE INTELECTUAL E DAS REGRAS REFERENTES ÀS PUBLICAÇÕES DE MATERIAL PRODUZIDO NO ÂMBITO DO PRESENTE TERMO DE AJUSTE
Os bancos de dados provenientes de Projetos de Apoio vinculados ao presente Termo de Ajuste deverão garantir o sigilo e a confidencialidade dos sujeitos de pesquisa envolvidos, bem como obedecer aos demais requisitos previstos nas normas vigentes de ética em pesquisa.
SUBCLÁUSULA PRIMEIRA. A disponibilização dos recursos materiais instrucionais na rede mundial de computadores para entidades públicas e privadas sem fins lucrativos e certificadas como beneficentes de assistência social será feita mediante licença de uso de interesse do SUS, com vedação expressa do o uso privado e comercial.
SUBCLÁUSULA SEGUNDA. Os recursos materiais instrucionais decorrentes dos Projetos de Apoio vinculados ao presente Termo de Ajuste deverão ser disponibilizados na rede mundial de computadores para entidades públicas e privadas, sem fins lucrativos e certificadas como beneficentes, mediante licença de uso.
SUBCLÁUSULA TERCEIRA. A divulgação e a publicidade dos produtos decorrentes da execução de Projetos de Apoio vinculados ao presente Termo de Ajuste deverão ser previamente aprovadas pelo MINISTÉRIO, bem como deverão conter menção à parceria firmada no âmbito do PROADI-SUS, de acordo com a Lei nº 12.101, de 2009. (
SUBCLÁUSULA QUARTA. A publicação resultante de Projetos de Apoio vinculados ao presente Termo de Ajuste, bem como seus produtos de divulgação, deverá seguir a política editorial do MINISTÉRIO.
SUBCLÁUSULA QUINTA. Todos os produtos didáticos, editoriais e de divulgação desenvolvidos no âmbito dos Projetos de Apoio vinculados ao presente Termo de Ajuste deverão ser disponibilizados na Biblioteca Virtual em Saúde do MINISTÉRIO (BVS-MS), de forma gratuita e em texto integral, de acordo com os critérios da política editorial do MINISTÉRIO, no prazo de até 01 (um) ano após o encerramento do projeto em que tenham sido produzidos.
SUBCLÁUSULA SEXTA. A impossibilidade de cumprimento do prazo previsto na subcláusula quinta deverá ser formalmente justificada pela ENTIDADE, cabendo ao MINISTÉRIO acatar ou não a justificativa, no prazo máximo de sessenta dias.
SUBCLÁUSULA SÉTIMA. Vencido o prazo de 01 (um) ano fixado na subcláusula quinta e caso não seja acatada a justificativa apresentada conforme a subcláusula sexta, a ENTIDADE terá o prazo de trinta dias, a partir do recebimento da notificação, para o cumprimento da obrigação.
SUBCLÁUSULA OITAVA. O descumprimento pela ENTIDADE das obrigações previstas nas subcláusulas quinta, sexta e sétima ensejará a não-aprovação do Projeto de Apoio respectivo.
CLÁUSULA DÉCIMA - DA TITULARIDADE DOS BENS PATRIMONIAIS
SUBCLÁUSULA PRIMEIRA - No Projeto de Apoio que envolver a aquisição de equipamento e/ou material permanente, deverá constar o órgão e/ou entidade pública do SUS destinatário dos bens remanescentes na data da extinção do Projeto de Apoio.
SUBCLÁUSULA SEGUNDA - Para comprovação do dispositivo anterior, a ENTIDADE deverá apresentar ao final do Projeto de Apoio a formalização da doação do equipamento e/ou material permanente adquirido com os recursos do projeto ao seu destinatário, conforme Modelo disponível no anexo da Portaria vigente.
SUBCLÁSULA TERCEIRA - Caso constate o não cumprimento da obrigação prevista na subcláusula primeira, o MINISTÉRIO notificará a ENTIDADE, que terá o prazo máximo de 30 (trinta) dias para o saneamento, sem o que não será considerado encerrado o respectivo Projeto de Apoio.
CLÁUSULA DÉCIMA PRIMEIRA - DOS ADITAMENTOS
Termo de Ajuste poderá ser aditado na forma prevista na Portaria do Ministro de Estado da Saúde vigente como regulamento do PROADI-SUS.
CLÁUSULA DÉCIMA SEGUNDA - DA RESCISÃO
O presente Termo poderá ser rescindido nas hipóteses e na forma previstas na Portaria do Ministro de Estado da Saúde vigente como regulamento do PROADI-SUS
CLÁUSULA DÉCIMA TERCEIRA - DOS CASOS OMISSOS
Os casos omissos serão submetidos ao Comitê Gestor do PROADI-SUS, na forma previstas na Portaria do Ministro de Estado da Saúde vigente como regulamento do PROADI-SUS.
SUBCLÁUSULA ÚNICA. Caso a ENTIDADE não se conforme com a decisão do Comitê Gestor, o caso será submetido à Câmara de Conciliação e Arbitragem da Administração Federal - CCAF, órgão integrante da Advocacia-Geral da União, nos termos do Ato Regimental nº 5, de 27/09/2007 e alterações promovidas pelo Ato Regimental nº 2, de 9/4/2009.
CLÁUSULA DÉCIMA QUARTA - DA PUBLICAÇÃO
A Secretaria-Executiva do Ministério da Saúde providenciará a publicação do presente Termo de Ajuste no Diário Oficial da União, no prazo de 20 (vinte) dias contados da data de sua assinatura.
CLÁUSULA DECIMA QUINTA - DO FORO
Fica eleito o foro da Justiça Federal, Seção Judiciária do Distrito Federal, com exclusão de qualquer outro, por mais privilegiado que seja, para dirimir quaisquer questões oriundas do presente Termo de Ajuste.
E, para firmeza, validade e eficácia do que foi acordado, lavrou-se o presente instrumento em 2 (duas) vias de igual teor e forma, que após lido e achado conforme para um só efeito, é assinado pelos partícipes na presença de 2 (duas) testemunhas, igualmente signatárias.
Brasília, de de 2014.
ARTHUR CHIORO
XXXXX
Ministro de Estado da Saúde
Presidente XXXX
_____________________
_____________________
Nome:
CPF:
TESTEMUNHAS:
_____________________
_____________________
Nome:
CPF:
'ANEXO 2 DO ANEXO do Anexo XCIII
MODELO PARA APRESENTAÇÃO DE CARTA CONSULTA AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 2)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
ANEXO 3 DO ANEXO XCIII
MODELO DE FORMULÁRIO DE ANÁLISE DA CARTA CONSULTA (Origem: PRT MS/GM 2814/2014, Anexo 3)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
( ) Sim ( ) Não Se sim, qual? ( ) Estudos de Avaliação de Incorporação de Tecnologia ( ) Capacitação de Recursos Humanos ( ) Pesquisas de Interesse Público ( ) Técnicas e Operação de Gestão em Serviços de Saúde O modelo de apresentação da carta consulta (Anexo I) está obrigatória e devidamente preenchida com: * Descrição do tema ou objetivo prioritário relacionado à consulta; ( ) Sim ( ) Não Se sim, qual(is)? ( ) Promoção do acesso, qualidade, integralidade e cuidado em rede ( ) Financiamento e Gestão do SUS ( ) Inovação Científica e Tecnológica ( ) Desenvolvimento dos Profissionais e Trabalhadores do SUS * Descrição resumida da proposta do(s) possível(is) projeto(s) referente ao tema ou objetivo prioritário, contendo o objeto e resultados esperados; ( ) Sim ( ) Não * Apresentação da justificativa e aplicabilidade da proposição, ressaltando sua relevância para as políticas de saúde institucionalizadas no âmbito do Sistema Único de Saúde; ( ) Sim ( ) Não * Indicação do valor total estimado do(s) projeto(s) a ser(em) apresentados; ( ) Sim ( ) Não * Indicação da abrangência geográfica e/ou populacional do(s) projeto(s). ( ) Sim ( ) Não NECESSIDADE DE ENVOLVIMENTO DO GESTOR LOCAL DO SUS O desenvolvimento do(s) projeto(s) objeto(s) desta carta consulta depende do envolvimento do gestor local do SUS (Secretário Municipal e/ou Estadual de Saúde)? ( ) Sim ( ) Não |
A proposta da carta consulta fere algum princípio (universalidade, integralidade e equidade) do SUS ou está em desacordo com as políticas e diretrizes de saúde em âmbito federal (Plano Nacional de Saúde)? ( ) Sim ( ) Não Na referida proposta está compreendida a busca da redução das desigualdades regionais relativas ao acesso aos bens e serviços de saúde? ( ) Sim ( ) Não É observada na carta consulta o objetivo de fortalecimento da integração regional em rede de serviços da saúde e com outras políticas de inclusão social? ( ) Sim ( ) Não É possível associar o objeto da carta consulta à relação de complementaridade com investimentos realizados nas redes de atenção à saúde? ( ) Sim ( ) Não A indicação da abrangência do projeto está coerente com os princípios da universalidade e equidade do Sistema Único de Saúde? Caso negativo, existe alguma sugestão de melhoria para a abrangência do projeto? ( ) Sim ( ) Não |
( ) Sim ( ) Não Podem ocorrer conflitos de interesse na possível execução do objeto da carta consulta apresentada? Se sim, justifique. ( ) Sim ( ) Não _____________________________________ É necessário melhor direcionamento do objeto proposto? Se sim, descreva. ( ) Sim ( ) Não _______________________________________________________________________ Há indicação para que a formulação do projeto seja realizada em conjunto com as equipes técnicas do Ministério da Saúde, CONASS e/ou CONASEMS? ( ) Sim ( ) Não Quais benefícios o possível projeto, objeto desta carta consulta, poderá contribuir para o desenvolvimento institucional do SUS? Liste-os. ________________________________________________________________________ |
( ) Aprovação ( ) Não Aprovação Descreva as considerações quanto à sugestão acima selecionada. _____________________________________________________ Qual unidade deverá acompanhar a execução do projeto proposto pela referida carta-consulta? ______________________________________________________ Deverá ter o suporte de outra(s) unidade(s) para o acompanhamento do projeto? Qual(is)? ______________________________________________________ Brasília, de de |
|
ANEXO 4 DO AENXO XCIII
MODELO PARA APRESENTAÇÃO DE PROPOSTA DE PROJETO DEMANDADO (Origem: PRT MS/GM 2814/2014, Anexo 4)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
( ) Estudos de Avaliação de Incorporação de Tecnologia ( ) Capacitação de Recursos Humanos ( ) Pesquisas de Interesse Público ( ) Técnicas e Operação de Gestão em Serviços de Saúde 2. A proposta está relacionada à: ( ) Promoção do acesso, qualidade, integralidade e cuidado em rede ( ) Financiamento e Gestão do SUS ( ) Inovação Científica e Tecnológica ( ) Desenvolvimento dos Profissionais e Trabalhadores do SUS 3. Descrição resumida do projeto, destacando sua relevância para as políticas de saúde do SUS. ___________________________________________________________________________ 4. Objetivo e resultados esperados. ___________________________________________________________________________ 5. Especificar a abrangência geográfica e/ou populacional do projeto. ___________________________________________________________________________ 6. Estimar o tempo necessário para execução do projeto. _________________________________________________ 7. Indicar se há necessidade de pactuação com Gestor Municipal e/ou Estadual para a realização do projeto. ___________________________________________________________________________ Nome e Qualificação do Técnico De Acordo: Nome e Qualificação do Coordenador e identificação da Coordenação De Acordo: Nome e Qualificação do Coordenador-Geral e identificação Coordenação-Geral De acordo. Encaminhe-se ao Departamento de Economia da Saúde, Investimentos e Desenvolvimento (DESID-SE) para conhecimento e providências. Nome e Qualificação do Diretor e identificação do Departamento |
ANEXO 5 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE PROJETOS REFERENTES AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 5)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
MODELO PARA APRESENTAÇÃO DE PROJETOS REFERENTES AO PROADI-SUS
A - INFORMAÇÕES GERAIS
B - PLANO DE TRABALHO
O Plano de Trabalho congrega o conjunto mínimo de conceitos e instrumentos de gerenciamento, imprescindíveis para o monitoramento, avaliação e prestação de contas da execução físico-financeira do projeto de apoio ao PROADI-SUS
De acordo com o artigo 11 da Lei nº 12.101, de 27 de novembro de 2009, e do artigo 2º desta Portaria, registrar a área de atuação pretendida. ( ) Estudos de Avaliação e Incorporação de Tecnologia ( ) Capacitação de Recursos Humanos ( ) Pesquisas de Interesse Público em Saúde ( ) Desenvolvimento de Técnicas e Operação de Gestão em Serviços de Saúde B.2 - INFORMAÇÕES GERAIS DO PROJETO 2.1. Título do Projeto 2.2. Valor total do Projeto 2.3. Período de execução 2.4. Indicação de Secretaria competente ou entidade vinculada ao Ministério da Saúde responsável pelo monitoramento e avaliação. B.3. INFORMAÇÕES ESPECÍFICAS DO PROJETO 3.1. Descrição do projeto, mencionando sua aplicabilidade no desenvolvimento institucional do SUS: a) Descrever sucintamente o objeto do projeto; b) Apresentar justificativa e aplicabilidade da proposição, ressaltando sua relevância para as políticas de saúde institucionalizadas no âmbito do SUS; c) Apresentar análise da situação inicial, incluindo: análise de problemas, análise de objetivos e análise dos atores interessados; Especificar o planejamento do projeto descrevendo-o de acordo com a Matriz de Planejamento e seus respectivos conceitos, conforme Anexo III, bem como definindo e descrevendo os seguintes elementos: c.1) Descrever o objetivo proposto de desenvolvimento do SUS e seus indicadores; c.2) Descrever os objetivos específicos do projeto, seus indicadores e metas; c.3) Descrever as fases ou etapas do projeto, quando aplicável; c.4) Descrever os resultados semestrais e anuais esperados, decorrentes da execução do projeto, seus indicadores e respectivas metas a serem atingidas; c.5) Descrever os produtos gerados com a execução do projeto, seus indicadores e metas, quando aplicável; c.6) Descrever as principais atividades de intervenção vinculadas aos resultados esperados, seus prazos de execução e valores, conforme apresentado nos cronogramas de atividades e de desembolsos; c.7) Descrever as atividades de monitoramento e de avaliação e seus respectivos valores, atentando-se à c efinição do Item 1.5 do Anexo em referência; e c.8) Apresentar indicadores de avaliação de resultado e impacto que permitam avaliar as mudanças no SUS decorrentes da execução do projeto, bem como, quando pertinente, demais indicadores para o monitoramento e a avaliação do projeto. d) Descrever a abrangência do projeto quanto a: d.1) população e/ou instituição beneficiada, seja diretamente - que receberá a intervenção do projeto, seja indiretamente, que poderá se beneficiar dos resultados do projeto, com indicação de n° CNES; d.2) dimensão geográfica, com indicação de UF/município beneficiário; e d.3) número de vagas ofertadas, quando aplicável. e) Descrever detalhadamente o método a ser empregado para atingir os objetivos propostos, quando aplicável; f) Apresentar mecanismos e instrumentos para avaliação dos resultados, abrangendo a percepção do beneficiário, quando pertinente, com dados quantitativos e qualitativos; g) Descrever formas de disseminação dos resultados do projeto, tais como: eventos científicos, oficinas, material de divulgação/publicação, ferramentas de apoio ao desenvolvimento institucional do SUS, quando aplicáveis; h) Descrever cálculo de tamanho de amostra e número de instituições envolvidas no caso de projetos multicêntricos; j) Apresentar Organograma e Quadro de Atribuições para os principais atores envolvidos no projeto (funções, atribuições e principais tarefas), incluindo a equipe executora e ressaltando a formação e experiências relevantes ao projeto; k) Apresentar Plano de Comunicação, conforme as necessidades específicas do projeto, devendo ser formalizado com os seguintes elementos: k.1) os requisitos de comunicação das partes interessadas; k.2) as informações que serão comunicadas, inclusive formato, conteúdo e nível de detalhes; k.3) a pessoa responsável pela comunicação das informações; k.4) a pessoa ou os grupos que receberão as informações; k.5) os métodos ou tecnologias usados para transmitir as informações, como por exemplo: relatórios de monitoramento semestrais ou anuais, relatórios específicos, e-mails, sistemas informatizados, publicações, comunicados à imprensa etc.; k.6) a frequência da comunicação e os prazos; k.7) o método para atualizar e refinar o Plano de Comunicação conforme o projeto se desenvolve e avança; e k.8) glossário da terminologia comum. l) Apresentar o Plano de Atividades, conforme a Matriz de Planejamento do Projeto e as seguintes especificações: l.1) interdependências básicas entre as atividades; l.2) estimativa de duração de cada uma das atividades, levando em conta a quantidade e disponibilidade de recursos (humanos, materiais e financeiros) do projeto; l.3) definição da data de início e fim de cada atividade, levando em conta as estimativas realizadas e as dependências identificadas; e l.4) definição dos responsáveis pelas atividades. m) Demais informações relevantes em conformidade com as especificidades da área de atuação e do projeto. 3.2. Descrição do orçamento do projeto. a) Descrever detalhadamente o orçamento do projeto, ordenando os gastos em custeio e capital, discriminando por elemento de despesa; b) Especificamente aos gastos direcionados a recursos humanos, deve-se estabelecer o valor por hora trabalhada, bem como a quantidade de horas despendidas por cada integrante da equipe; e c) Ao final, deve-se consolidar o orçamento conforme modelo abaixo |
CRONOGRAMA SEMESTRAL DE ATIVIDADES |
|||||||
B.4.2 - Cronograma de Desembolso: previsão de desembolso de recursos financeiros, em conformidade com a proposta de execução das metas estabelecidas, de acordo com o Plano de Atividades apresentado.
CRONOGRAMA DE DESEMBOLSO FINANCEIRO DAS ATIVIDADES
Observação :
1) Para cada resultado e/ou produto deve ser apresentado um cronograma de desembolso por atividade de intervenção: Resultado 1, Resultado (...), Resultado "m", ou então, Produto 1, Produto (...), Produto "m".
2) Além dos cronogramas de desembolso por atividade de intervenção, deve ser apresentado um cronograma de desembolso por atividade de monitoramento e avaliação;
3) As atividades podem ser desagregadas em subatividades, para as quais não é obrigatória a apresentação de cronograma de desembolso.
(*) A expressão "Am.n", onde "m" significa índice do resultado ou produto e "n" o índice de atividade.
Data: ___/__/______
Assinatura do Responsável
Cargo : |
MATRIZ DE PLANEJAMENTO E MONITORAMENTO DO PROJETO
DA INTERVENÇÃO |
COMPROVAÇÃO |
IMPORTANTES |
||||||||||||||||||||||
Indicadores |
||||||||||||||||||||||||
(...): |
||||||||||||||||||||||||
(...): |
||||||||||||||||||||||||
OBSERVAÇÃO
A tabela acima é meramente ilustrativa e para fins didáticos. Assim sendo, as informações requeridas não precisam ser apresentadas no formato da tabela.
DEFINIÇÕES:
1. ESTRUTURA ANALÍTICA DO PROJETO (lógica da intervenção)
1.1. Objetivo do Projeto. Este é o objetivo ou o efeito esperado da intervenção, descrevendo-se a nova situação que se visa alcançar com a realização do projeto. Deve expressar as mudanças de estado que serão provocadas na situação do público-alvo pelos resultados do projeto, ao seu final. Pressupõe-se que, sem essa mudança, as melhorias que um projeto pode prover não teriam sustentabilidade, ou seja, não haveria desenvolvimento, entendido como um processo de transformação e melhoria ao longo do tempo.
O objetivo do projeto deve estar relacionado a um objetivo de desenvolvimento do SUS, que orienta a atuação do projeto dentro do contexto do PROADI-SUS, considerando as áreas de atuação e os temas e objetivos prioritários.
1.2 e 1.3. Resultados das Atividades e Produtos (entregas do projeto). Um projeto cria entregas ou resultados exclusivos. Um resultado pode estar relacionado a um ou mais produtos. Entende-se por produto um bem ou serviço produzido, ou seja, um resultado mensurável e verificável do trabalho.
Os resultados e produtos descrevem o escopo do projeto, ou seja, aquilo que é gerenciável pelo projeto e que é de responsabilidades da entidade executora. Enquanto o Objetivo do Projeto é um efeito desejado, mas que foge do controle e da responsabilidade direta da entidade, o alcance dos resultados e produtos tem que ser gerenciado de tal forma que pode ser atribuído aos esforços do projeto.
Quando o projeto apresentar resultados que possam ser subdivididos em produtos, cada resultado deve estar relacionado a um ou mais produtos, devendo o projeto trazer registrado na sua decomposição hierárquica todos os principais produtos relacionados a cada resultado.
Alguns projetos podem estar subdivididos em fases ou etapas de modo a oferecer melhor controle gerencial. A transição de uma fase para outra geralmente envolve e é definida por alguma forma de transferência técnica ou entrega, ou seja, produtos. O término e a aprovação de um ou mais produtos caracteriza uma fase do projeto. Assim sendo, é comum que um objetivo do projeto seja subdividido em fases ou etapas com produtos e atividades específicos. Nesse caso, a cada fase ou etapa deve corresponder um resultado, subdividido ou não em produtos.
Os principais resultados e produtos devem estar ligados às atividades de intervenção.
1.4. Atividades Principais de Intervenção e seus respectivos recursos e custos estimados. De acordo com os resultados e produtos que se deseja entregar, devem ser definidas quais são as atividades necessárias para sua consecução. Para cada resultado ou produto, conforme as especificidades da decomposição hierárquica apontadas no item acima, uma série de atividades principais deve ser elaborada. Têm que haver atividades suficientes e necessárias a fim de se alcançar um determinado resultado ou produto. Se as atividades previstas não forem suficientes, os resultados não poderão ser alcançados e se não forem necessárias, significa que o projeto desperdiça recursos.
Para cada atividade desenvolvida, seja de intervenção ou de monitoramento/avaliação, devem ser apresentados os recursos (pessoas, equipamentos e insumos) necessários à sua realização, quando solicitado pelo Ministério da Saúde por ocasião da prestação de contas, inclusive com detalhamento das quantidades e custos unitários dos recursos de cada atividade.
As atividades podem ser desagregadas em subatividades, para as quais não é obrigatória a apresentação dos recursos utilizados e dos custos incorridos.
Ressalta-se que apesar de não constar na Matriz de Planejamento do Projeto, é fundamental que, além das atividades de intervenção e seus respectivos recursos e custos, sejam definidas as Atividades de Monitoramento e Avaliação. Assim sendo, os projetos deverão apresentar as principais atividades de monitoramento e avaliação, seus respectivos prazos e recursos/custos.
Considera-se que o monitoramento é uma função contínua que deve buscar identificar o progresso do Projeto rumo aos resultados desejados ou eventuais obstáculos de execução que venham a dificultar o alcance dos resultados e/ou objetivos.
Considera-se que a avaliação deve buscar verificar não só o alcance dos resultados, mas também o alcance da mudança desejada, expondo as lições apreendidas e as recomendações para o futuro, além da identificação e disseminação de boas práticas.
2. INDICADORES OBJETIVAMENTE COMPROVÁVEIS
Um indicador é uma situação ou característica que serve como sinal comprobatório de outro fato. Os indicadores devem ser especificados baseados em fatos e evidências, considerando as seguintes questões:
O público-alvo: quem é beneficiado?
A quantidade: quanto?
A qualidade: quão bem?
O período: quando e quanto tempo?
A localização: onde?
As funções dos indicadores são: caracterizar mais detalhadamente os objetivos e resultados, estabelecendo o quê e quanto se pretende alcançar, e fornecer uma base para o monitoramento e a avaliação do projeto. Os indicadores se diferenciam de acordo com os níveis lógicos do projeto. Os resultados, que são os produtos pelos quais a gerência do projeto se responsabiliza, exigem indicadores de monitoramento:descrevem os produtos em termos do que será feito, o quanto, quando e quão bem. Esses indicadores têm que estar coerentes com as entradas, ou seja, as atividades e os recursos aplicados.
Por outro lado, o objetivo do projeto e o objetivo de desenvolvimento expressam efeitos esperados e, portanto, os seus indicadores são de efeitos, sejam efeitos diretos e indiretos, respectivamente. Eles indicam as mudanças esperadas. Dado a complexidade, quase sempre é necessário um conjunto de indicadores para medir cada um dos efeitos. A título de ilustração, podem-se considerar os seguintes tipos de indicadores:
Objetivo Imediato Resultados (saídas) Atividades Recursos (entradas) |
Efeito Produtos (benefícios) Processos Custos |
3. FONTES DE COMPROVAÇÃO
Onde se encontram as informações e os dados dos indicadores, ou seja, os locais e os documentos que poderão ser utilizados para verificar o conteúdo dos indicadores. Fontes podem ser estatísticas oficiais, pesquisas de opinião pública para os indicadores de efeito e são geralmente documentos produzidos pelo próprio sistema de informações gerenciais do projeto para os resultados. Considera-se fundamental que fontes adequadas existam e sejam confiáveis.
4. SUPOSIÇÕES IMPORTANTES
É uma espécie de análise de riscos do projeto. Suposições são fatores, externos ou internos ao projeto, considerados verdadeiros, reais ou certos, para fins de planejamento. Os fatores externos escapam à influência direta da gerência do projeto nos Hospitais de Excelência, estando mais ligados às condições ambientais sob o âmbito de atuação do Ministério da Saúde. Por isso, essas condições, além das internas ao projeto, devem estar claras desde o princípio, a fim de garantir-se que as ações necessárias serão implementadas pelo Ministério da Saúde, visando ao atingimento dos objetivos do projeto.
A inclusão de uma suposição importante depende de sua avaliação. Em primeiro lugar, ela tem que ser valiosa para o êxito do projeto. Segundo, tem que existir certo grau de risco de ela não ocorrer. E, terceiro, se for identificado que ela é relevante, mas pouco provável de ocorrer, significa que o êxito do projeto está em jogo e, consequentemente, a estratégia de intervenção deve ser mudada.
ANEXO 6 DO ANEXO XCIII
MODELO DE PARECER TÉCNICO PARA ANÁLISE DE PROJETO (Origem: PRT MS/GM 2814/2014, Anexo 6)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
(Nome da SECRETARIA COMPETENTE OU ENTIDADE VINCULADA AO MS) |
|---|
Título do projeto: Data de início: Data de encerramento: Número do Protocolo: |
Ciclo: XXXX - XXXX Valor estimado ano 01: Valor estimado ano 02: |
Área(s) e subárea(s) de atuação: |
Tema(s) e objetivo(s) prioritário(s): ? |
Prazo de Atendimento: Número do Parecer: ____________/Ano. |
Análise da lógica de intervenção (Objetivos, Resultados, Produtos, Atividades de Intervenção, Atividades de Monitoramento e Avaliação): |
Análise dos Custos: |
( ) Aprovação ( ) Não Aprovação |
Unidade indicada para acompanhamento: (SC/EV indicada para acompanhamento conjunto) Anexos: |
Nome e Qualificação do Coordenador e identificação da Coordenação |
Nome e Qualificação do Coordenador-Geral e identificação Coordenação-Geral |
Nome e Qualificação do Diretor e identificação do Departamento |
ANEXO 7 DO ANEXO XCIII
MODELO DE TERMO DE DOAÇÃO (Origem: PRT MS/GM 2814/2014, Anexo 7)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
MODELO DE TERMO DE DOAÇÃO
TERMO DE DOAÇÃO QUE ENTRE SI CELEBRAM A SOCIEDADE HOSPITAL "NOME" E "ENTIDADE DONATÁRIA"
Pelo presente instrumento, a Entidade de Saúde <NOME>, por intermédio da <Gerência/Superintendência> com sede xxxxxxxxxxxx, inscrita no CNPJ sob nº xx.xxx.xxx/xxx-xx, ora designado DOADOR, neste ato representado na forma do seu Estatuto por <nome.>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº <xxx.xxx.xxx-xx> e RG nº <xxxxxxx>, expedido pela xxx/xx, e de outro lado, a entidade beneficiada, <NOME>, inscrita no CNPJ/MF xxxxxxxxxx, com sede xxxxxxx, doravante denominado DONATÁRIO, neste ato representada por <nome>, <cargo>, <nacionalidade>, <profissão>, portador do CPF/MF nº xxxxxxxxx e RG nº xxxxxxx, expedido pela xxx/xx, e de acordo com o Termo de Ajuste nº <xx/xxx>, constantes no autos do Processo nº <25000.xxxxxx/20xx-xx>, com fundamento na Portaria GM/MS nº xxxxx, de xxxx de abril de xxxxx, no Decreto nº 99.658, de 30 de outubro de 1990, alterado pelo Decreto nº 4.245, de 23 de maio de 2002, têm entre si acordado o presente TERMO DE DOAÇÃO, sob a forma e condições constantes das seguintes CLÁUSULAS:
CLÁUSULA PRIMEIRA - DO OBJETO - O presente instrumento tem por objeto a Doação dos bens, relacionados no anexo, parte integrante e indissociável deste Termo, tendo por finalidade a utilização pelo DONATÁRIO, na continuidade das ações e serviços de assistência à saúde da população, visando a melhoria da produção e qualidade dos procedimentos de atendimento, assim como o aperfeiçoamento e expansão da capacidade operacional do Sistema Único de Saúde.
SUBCLÁUSULA ÚNICA - O bem doado terá o seu valor residual considerado no momento da baixa do ativo.
CLÁUSULA SEGUNDA - Em se tratando de DOAÇÃO, o DONATÁRIO compromete-se a destinar os bens, objeto deste instrumento à execução de ações de saúde, sendo estes para sua utilização pelo órgão ou entidade beneficiária, conforme os dispostos no art. Xxxx da Portaria GM/MS nº xxxxxx nas subcláusulas 1º, 2º e 3º da Cláusula quinta do Termo de Ajuste nº <xx/xxx>
CLÁUSULA TERCEIRA - O DONATÁRIO, em observância à cláusula Primeira e Segunda do presente termo, responsabiliza-se por:
a) manter em funcionamento e assumir o custo operacional de acordo com parâmetros firmados pelo Ministério da Saúde;
b) adquirir equipamentos complementares, materiais permanentes e de consumo, necessários à implantação e operacionalização dos serviços objeto deste termo.;
c) efetuar manutenção preventiva e corretiva, após o término da garantia do equipamento doado;
d) manter atualizado os dados da Instituição prestadora de serviço ao SUS no Cadastro Nacional de Entidade de Saúde - CNES.
CLÁUSULA QUARTA - Os custos com remoção e instalação do equipamento e/ou material permanente no <donatária> serão arcados pelo DOADOR.
CLÁUSULA QUINTA - É de responsabilidade do DONATÁRIO, prover treinamento aos seus colaboradores para utilização correta do(s) equipamento(s) doado(s), bem como a obtenção de todas as licenças necessárias para operação dos bens.
CLÁUSULA SEXTA - O DONATÁRIO, por intermédio deste instrumento, atesta, plena e irrestritamente, o recebimento de todos os bens arrolados no Anexo deste Termo.
CLÁUSULA SÉTIMA - Em caso de constatação, pelo Ministério da Saúde ou pelos órgãos de controle externo, de não utilização do bem doado para os fins e forma a que se propõe a presente DOAÇÃO, poderá ser promovida à revogação parcial ou total deste termo, realocando-se o bem a outro estabelecimento público de saúde ou a outra instituição de ensino e pesquisa, conforme determinado pelo Ministério da Saúde, sem direito de indenização pelo DONATÁRIO.
CLÁUSULA OITAVA - Fica eleito o Foro da Seção Judiciária xxxx, com exclusão de qualquer outro, por mais privilegiado que seja, para dirimir quaisquer dúvidas oriundas do presente Termo de Doação.
E por estarem de pleno acordo, as partes assinam este Termo em três vias de igual teor e forma, que após lido e achado conforme para um só efeito, é assinado pelos partícipes na presença de 2 (duas) testemunhas, igualmente signatárias.
Local , .....de ...............de 20....
Pelo Hospital de Excelência
Nome:
Cargo:
TESTEMUNHAS:
Nome:
CPF:
Pelo Donatário
Nome:
Cargo :
TESTEMUNHAS:
Nome:
CPF:
ANEXO AO TERMO DE DOAÇÃO
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
Dados do Doador:
Dados do Donatário:
ANEXO 8 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE DECLARAÇÃO DE ANUÊNCIA DO GESTOR LOCAL(Origem:PRT MS/GM2814/2014,Anexo8)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
MODELO PARA APRESENTAÇÃO DE DECLARAÇÃO DE ANUÊNCIA DO GESTOR LOCAL
DECLARAÇÃO DE ANUÊNCIA
Eu, ____________________na qualidade de gestor local do SUS, portador do RG n.º ____________ e CPF n.º ____________com endereço funcional situado _________________cidade: ______uf:____telefone(xx) ________, e-mail: _________, declaro para os devidos fins, que a entidade de saúde de reconhecida excelência, _______________________apresentou o projeto assistencial "_________________________", vinculado a Carta Consulta n.º _________, aprovada pelo Comitê Gestor do PRAODI-SUS em ___/___/__, a ser desenvolvido pela a respectiva entidade em parceria com a Secretaria Municipal de Saúde de XXXXXX, cuja vigência estender-se-á de xxxx de xxxx de xxxx à xxxx de xxxxx de xxxxx.
Ressalta-se que o projeto apresentado encontra-se em consonância com as exigências previstas na Lei n.º 12.101 de 27 de novembro de 2009, bem como nos termos da Portaria que regulamenta o PROADISUS.
Sendo assim, APROVO o projeto assistencial apresentado, uma vez que, atende a necessidade de interesse local quanto à prestação de serviços ambulatoriais e hospitalares do Sistema Único de Saúde. __________________________________
Nome
Cargo
ANEXO 9 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE RELATÓRIO SEMESTRAL DE ATIVIDADES DO PROJETO REFERENTE AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 9)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
- Indicar nominalmente as entidades beneficiárias, quando aplicável. (Referente item 3.1, "e.1" do Plano de Trabalho); e - Indicar o número de alunos que concluíram o curso ofertado, relacionando-os com a entidade beneficiaria e respectivo n° CNES, quando aplicável.(Referente ao Anexo VII, item 1.5 da Matriz de Planejamento, e item 3.1, "q", do Plano de Trabalho. - Indicar as atividades desenvolvidas quanto à disseminação da informação, de forma qualitativa e quantitativa (eventos, publicações técnico-científicas,boletins informativos, revistas, etc.), quando aplicável; - Apresentar a avaliação dos resultados obtidos junto aos beneficiários nas seguintes situações: - Avaliação pelos alunos (apresentação consolidada), em caso de projetos que envolvam capacitação de recursos humanos; - Avaliação do gestor local e /ou regional e diretor da instituição em caso de projetos que envolvam técnicas e operação de gestão em serviços de saúde; - Aceite do CEP/CONE na fase inicial, em caso de projetos que envolvam projetos de pesquisa de interesse público e estudos de avaliação e incorporação de tecnologia, quando aplicável. - Indicar a entrada de novos parceiros, se houver; - Indicar dificuldades relevantes encontradas durante a execução do projeto que impactaram direta e indiretamente no alcance das metas estabelecidas e se será necessária uma alteração no projeto em razão disso; - Mencionar outros resultados alcançados pelo projeto que não se enquadrem nas classificações anteriores; e - Descrever outras informações relevantes. |
||
Data: ___/__/______
Assinatura do Responsável
ANEXO 10 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE RELATÓRIO ANUAL DE ATIVIDADES DO PROJETO REFERENTE AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 10)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
- Mencionar outros resultados alcançados pelo projeto que não se enquadrem nas classificações anteriores; e - Descrever outras informações relevantes. |
|||||||||
Data: ___/__/______
Assinatura do Responsável
ANEXO 11 DO ANEXO XCIII
MODELO PARA APRESENTAÇÃO DE RELATÓRIO FINAL DE ATIVIDADES DO PROJETO REFERENTE AO PROADI-SUS (Origem: PRT MS/GM 2814/2014, Anexo 11)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
( ) Ano II ______ ( ) Ano III ______ |
|||||||||||
(Termo Aditivo ao Termo de Ajuste) (B) |
|||||||||||
- Indicar nominalmente as entidades beneficiárias, quando aplicável. (Referente item 3.1, "e.1" do Plano de Trabalho). - Indicar o número de alunos que concluíram o curso ofertado, relacionando-os com a entidade beneficiaria e respectivo n° CNES, quando aplicável.(Referente ao Anexo VII, item 1.5 da Matriz de Planejamento, e item 3.1, "q", do Plano de Trabalho. |
|||||||||||
- Apresentar a avaliação dos resultados obtidos junto aos beneficiários nas seguintes situações: - Avaliação pelos alunos (apresentação consolidada), em caso de projetos que envolvam capacitação de recursos humanos; |
|||||||||||
- Aceite do CEP/CONEna fase inicial, em caso de projetos que envolvam projetos de pesquisa de interesse público e estudos de avaliação e incorporação de tecnologia, quando aplicável. - Indicar a entrada de novos parceiros, caso haja. |
|||||||||||
- Apresentar relatório técnico-científico contendo: a) Resumo estruturado (até 5.000 caracteres); b) Problema de pesquisa; c) Fundamentação teórica; d) Objetivos; e) Procedimentos metodológicos; f) Conjunto dos resultados obtidos; g) Discussão (interpretação dos resultados a partir da fundamentação teórica apresentada); h) Conclusões/Recomendações |
|||||||||||
Data: ___/__/______
Assinatura do Responsável
ANEXO 12 DO ANEXO XCIII
MODELO PARA ELABORAÇÃO DE PARECER TÉCNICO DOS RELATÓRIOS DE ATIVIDADES DOS PROJETOS (Origem: PRT MS/GM 2814/2014, Anexo 12)
(Revogado pela PRT GM/MS n° 3.362 de 08.12.2017)
SECRETARIA ___________ DEPARTAMENTO _________________ COORDENAÇÃO-GERAL __________________________ |
INTERESSADO: inserir o hospital interessado |
|
Trata-se da análise do Relatório Anual de Atividades de "xxxx", registrado sob SIPAR 25000.000000/yyyy-00 e Relatório de Auditoria "xxxx", registrado sob SIPAR 25000.000000/yyyy-00, referente ao Projeto de Apoio ao PROADI-SUS "X"(inserir o nome do projeto) |
Apresentar descrição resumida dos objetivos gerais e específicos do projeto pactuado com o Ministério, ressaltando se houve ou há necessidade de alterações nos objetivos inicialmente pactuados. |
2.1 Execução Física |
a. As atividades foram executadas de acordo com o cronograma inicialmente e com a qualidade requerida/esperada? b. Descrever as dificuldades e obstáculos encontrados na execução física. c. Descrever as principais conquistas e avanços obtidos com a execução física obtida. d. O projeto atingiu seus objetivos? e. O projeto atingiu suas metas físicas (resultados e produtos)?f. Relatar se houve ou se haverá necessidade de reprogramação do cronograma de atividades, sem impactar nos objetivos e/ou resultados finais esperados. g. Informar se houve ou se haverá necessidade de alteração do plano de trabalho; h. Informar se houve ou se haverá necessidade de aditivo de prazo (observar nos projetos com prazo inferior a três anos) |
A execução financeira do projeto é apresentada por meio de dois relatórios inter-relacionados: o Relatório Anual de Atividades e o Relatório de Auditoria Independente da execução do projeto |
O Relatório de Auditoria Independente demonstra a opinião dos auditores quanto à prestação de contas do projeto, se ela apresenta adequadamente os gastos incorridos pelo hospital no respectivo exercício financeiro, de acordo com os registros contábeis do hospital, devendo estar claro que esses gastos foram auditados pela empresa de Auditoria Independente. |
a. Os gastos estão discriminados e comprovados no Relatório de Auditoria Independente? b. Há necessidade de maior especificação e/ou comprovação das despesas apresentadas no orçamento consolidado? É importante que as despesas estejam suficientemente especificadas e comprovadas, quer seja no orçamento consolidado, quer seja na forma de informações adicionais, devendo-se considerar como critério de relevância para a especificação/comprovação, a magnitude dos gastos de cada item de despesa |
Ao final, deve-se apresentar um breve resumo da situação da execução financeira com relação ao previsto no plano de trabalho, ressaltando a ocorrência de aditivos financeiros |
Valor anual aprovado (projeto inicial): R$ Valor anual aprovado (projeto aditado): R$ |
Valor executado apresentado (relatório de auditoria): R$ Valor executado aprovado: R$ |
Nesse item devem constar todas as diligências levantadas no item anterior e que devem ser atendidas pelo hospital com vistas à emissão de parecer conclusivo Caso trate-se de um parecer em prosseguimento a um primeiro parecer de diligência, deve-se informar se as diligências anteriormente apontadas foram respondidas pelo hospital. |
b. Aprovação do Sistema CEP/CONEP; c. Outros. |
Na conclusão, deve estar claro se o presente trata-se de parecer conclusivo (final) ou de parecer de diligência |
Caso se trate de parecer de diligência, sugere-se o texto abaixo: "Diante do exposto, sugere-se o atendimento das recomendações/pendências apresentadas no item 3, com vistas à emissão de parecer conclusivo." |
PARECER FAVORÁVEL (de aprovação sem restrições ou ressalvas) Caso se trate de parecer conclusivo, se este for favorável, sugerem-se os textos abaixo: |
PARECER DESFAVORÁVEL (de reprovação dos relatórios de prestação de contas) Caso a Coordenação-Geral seja desfavorável à aprovação do Relatório Anual, deve justificar e demostrar que foi respeitado o princípio do contraditório e da ampla defesa, tendo realizado todas as diligências possíveis junto ao hospital. |
De Acordo: Nome e Qualificação do Coordenador e identificação da Coordenação |
Nome e Qualificação do Coordenador-Geral e identificação Coordenação-Geral |
Nome e Qualificação do Diretor e identificação do Departamento |
ANEXO 13 DO ANEXO XCIII
DOCUMENTAÇÃO A SER APRESENTADA PELA ENTIDADE DE SAÚDE PARA A COMPROVAÇÃO DA EFETIVA CAPACIDADE INSTITUCIONAL PARA A EXECUÇÃO DE PROJETOS NO ÂMBITO DO PROADI-SUS
(Redação dada pela PRT GM/MS n° 3.362 de 08.12.2017)
| I - comuns a todas as áreas de atuação: | |
| Requisitos | Forma de comprovação |
| a) possuir mecanismos de governança para gestão de projetos, de processos, de pessoas e de riscos e para responsabilidade socioambiental; | - Projeto institucional voltado ao desenvolvimento de atividades nas linhas de atuação do Proadi-SUS. - Estatuto social. - Portfólio de projetos do hospital nos últimos dois anos. - Documento com estrutura de governança do hospital. - Protocolos e procedimentos de gestão de riscos. - Programas e ações socioambientais. |
| b) possuir plano de avaliação interna de qualidade atualizado e implementado; | - Plano de Avaliação Interna da Qualidade vigente; - Relatório de avaliação pela Organização Nacional de Acreditação - ONA. - Relatório final de avaliação de acreditação - Joint Commission International. - Relatórios de avaliação de outras entidades. |
| c) possuir instrumentos de cooperação com gestor local do SUS; | - Cópia de instrumento(s) de cooperação firmados com gestor(es) do SUS. |
| d) possuir escritório de projetos com estrutura física e tecnológica e equipe técnica qualificada; | - Comprovação de existência de escritório de projetos ou equivalente instituído. - Descrição da equipe técnica do escritório de projetos, incluindo informações sobre currículos e certificações. |
| e) dispor de portfólio de iniciativas concluídas e em andamento, compatíveis com as áreas de atuação propostas; | - Planos de trabalho aprovados. - Relatório de progresso dos projetos. |
| f) monitorar e avaliar indicadores para a melhoria de processos e resultados relacionados com as suas áreas de prestação de serviços de saúde; e | - Planos de melhoria de qualidade. - Protocolos e procedimentos para aprimoramento de processos. |
| g) possuir as comissões assessoras obrigatórias previstas na legislação. | - Documentos comprobatórios de instituição e funcionamento das comissões obrigatórias previstas em legislação. |
| II - específicos para as seguintes áreas de atuação: | |
| a) estudos de avaliação e incorporação de tecnologia: | |
| Requisitos | Forma de comprovação |
| 1. possuir política institucional para o desenvolvimento de atividades de avaliação de tecnologias em áreas da saúde; | - Documento que comprove a política institucional voltada ao desenvolvimento de atividades de avaliação de tecnologias em áreas da saúde. |
| 2. possuir infraestrutura, própria ou obtida por meio de parceria com outras instituições de ensino e pesquisa, que viabilize o desenvolvimento de atividades regulares de estudos de avaliação e incorporação de tecnologias em saúde; | - Documentos referentes à estrutura física e instalações, inventário com lista de equipamentos. - Documento comprobatório de parceria que viabilize acesso a infraestrutura. - Documento de vinculação do Núcleo de Avaliação de Tecnologias em Saúde - NATS à Rede Nacional de Avaliação de Tecnologias em Saúde - REBRATS e outras redes de Avaliação de Tecnologias em Saúde - ATS. |
| 3. monitorar e avaliar indicadores para a melhoria de processos e resultados de estudos de avaliação e incorporação de tecnologias em saúde; | - Relatório com lista de indicadores, monitoramento periódico de indicadores em avaliação. - Relatórios de qualidades, procedimentos operacionais, e/ou manual institucional. - Documentos técnicos de monitoramento do horizonte tecnológico, relatórios, alertas e informes de monitoramento de horizonte tecnológico - MHT e de pós incorporação, como avaliação de desempenho de tecnologias. |
| 4. dar transparência às ações e aos resultados dos estudos de avaliação e incorporação de tecnologias em saúde; | - Documentos comprobatórios, publicações em revistas científicas, relatórios técnicos e/ou outros documentos hábeis a dar divulgação, pelo hospital, dos resultados de seus estudos ou justificativas para a não divulgação, tais como a impossibilidade de divulgação por se tratar de documento preparatório cuja decisão ainda não foi publicada. |
| 5. dispor, em seu quadro funcional, de profissionais com titulação de doutor, reconhecida na forma prevista na legislação aplicável, que se responsabilizem pelos projetos de avaliação e incorporação de tecnologias em saúde; e | - Lista de profissionais doutores do quadro de ensino e pesquisa da instituição e respectivos currículos. |
| 6. possuir produção científica de profissionais de seu quadro funcional publicada em periódicos científicos de alto impacto, na área de avaliação e incorporação de tecnologias em saúde. | - Portfólio contendo produção científica publicada em periódicos científicos de alto impacto, participação em eventos científicos na forma de apresentação de trabalhos, cursos, workshops, oficinas, mesas e palestras, com links de acesso público ou cópia da produção científica ou comprovante de aceito de publicação em periódicos científicos e certificados de participação; - Documento técnico contendo as diretrizes clínicas e relatórios de estudo para elaboração de diretrizes. |
| b) pesquisas de interesse público em saúde: | |
| Requisitos | Forma de comprovação |
| 1. possuir política institucional para a realização de pesquisas de interesse público em saúde, que inclua a geração do conhecimento técnico e científico e a aplicação de boas práticas de pesquisas clínicas; | - Documentos que comprovem a política institucional voltada ao desenvolvimento de atividades de pesquisa científica. |
| 2. possuir infraestrutura, própria ou obtida por meio de parceria com outras instituições de ensino e pesquisa, que viabilize o desenvolvimento de atividades regulares de pesquisas científicas de interesse público em saúde; | - Documentos referentes à estrutura física e instalações, inventário com lista de equipamentos; - Documento comprobatório de parceria que viabilize acesso a infraestrutura. |
| 3. monitorar e avaliar indicadores para a melhoria de processos e resultados de pesquisas de interesse público em saúde; | - Relatórios de qualidade, procedimentos operacionais, protocolo e/ou manual institucional. |
| 4. dar transparência às ações e aos resultados de pesquisas de interesse público em saúde realizadas ou patrocinadas pela entidade; | - Publicações, relatórios, página eletrônica da instituição. |
| 5. dispor, em seu quadro funcional, de profissionais com titulação de doutor, reconhecida na forma prevista na legislação aplicável, que se responsabilizem pelos projetos de pesquisa de interesse público em saúde; e | - Lista de profissionais doutores do quadro de ensino e pesquisa da instituição e respectivos currículos. |
| 6. possuir produção científica com interesse público em saúde, de profissionais de seu quadro funcional, publicada em periódicos científicos de alto impacto; | - Portfólio contendo produção científica publicada em periódicos científicos de alto impacto, com links de acesso público ou cópia da produção científica ou comprovante de aceito de publicação em periódicos científicos. |
| c) capacitação de recursos humanos: | |
| Requisitos | Forma de comprovação |
| 1. possuir infraestrutura necessária para a realização de atividades presenciais ou virtuais de formação de recursos humanos, que propiciem, inclusive, a realização de atividades práticas para a aplicação do conhecimento; | - Relatório com evidências fotográficas e/ou videográficas comprobatórias da infraestrutura do hospital relacionada às atividades de formação na área da saúde. |
| 2. realizar práticas de treinamento em serviço, inclusive para a formação de preceptores; | - Plano político pedagógico. |
| 3. promover eventos científicos; | - Registros de eventos realizados nos últimos três anos. |
| 4. possuir programa de residência médica e multidisciplinar ou similar em especialidades prioritárias estabelecidas pelo Ministério da Saúde, credenciado pela Comissão Nacional de Residência Médica ou pela Comissão Nacional de Residência Multiprofissional em Saúde; | - Registro de credenciamento junto à Comissão Nacional de Residência Médica - CNRM e à Comissão Nacional de Residência Multiprofissional em Saúde - CNRMS. |
| 5. monitorar e avaliar a execução dos programas de residência; | - Relatórios de monitoramento e avaliação. - Perfil dos ingressos. - Indicadores. |
| 6. possuir programa de estágio de graduação em curso da área de saúde; | - Plano político pedagógico. |
| 7. possuir programa de cursos de aperfeiçoamento reconhecidos por associações de especialidades; | - Certificados emitidos pelo hospital validados pelas associações de especialidades. |
| 8. dispor de acesso a bases de conhecimento na área de saúde por meio de diferentes dispositivos; e | - Documentos comprobatórios da disponibilidade de acesso às bases de conhecimento na área da saúde. |
| 9. adotar metodologias com fundamento nas diretrizes estabelecidas pelo Ministério da Saúde para a educação permanente em saúde no SUS, com ênfase na integração ensino-serviço-comunidade; e | - Plano político pedagógico. |
| d) desenvolvimento de técnicas e operação de gestão em serviços de saúde: | |
| Requisitos | Forma de comprovação |
| 1. executar atividades permanentes de qualificação da gestão e da segurança do paciente; | - Ato e outras documentações formais referentes à instituição do Núcleo de Segurança do Paciente (NSP) do serviço de saúde. - Registro de preenchimento anual do Formulário de Avaliação Nacional das Práticas de Segurança do Paciente (LimeSurvey) da Anvisa. - Relatórios de pesquisa da Avaliação da Cultura de Segurança Hospitalar. |
| 2. possuir protocolos de acesso dos pacientes aos serviços de saúde, pactuados com o gestor local; | - Protocolos de acesso, de referência e de contra referência. |
| 3. adotar boas práticas de gestão da admissão de pacientes em conformidade com as políticas de atenção hospitalar, de segurança do paciente e de humanização do SUS estabelecidas pelo Ministério da Saúde; | - Manuais. - Registros de treinamento. - Fluxos estruturados da admissão dos pacientes. - Protocolos e fluxos assistenciais de acolhimento às vítimas de violências. |
| 4. desenvolver atividades de vigilância epidemiológica, hemovigilância, farmacovigilância, tecnovigilância em saúde e vigilância em saúde dos trabalhadores do hospital; | - Protocolos e procedimentos para prevenção e controle de infecção hospitalar. - Protocolos e procedimentos para a notificação compulsória imediata (NCI) de doenças e agravos em até 24 (vinte e quatro) horas. - Relatório de notificação compulsória semanal (NCS) de doenças e agravos. - Perfil de morbimortalidade da instituição documentado, atualizado e publicado na intranet e/ou internet .- Atos e outras documentações formais referentes à instituição da CCIH do serviço de saúde. - Relatórios e indicadores relacionados à hemovigilância e farmacovigilância. - Relatórios de gestão do serviço de saúde. - Planos e protocolos referentes à vigilância em saúde do trabalhador. |
| 5. desenvolver atividades de telessaúde, em conformidade com a legislação aplicável; | - Documento com a política institucional relacionada à telessaúde. - Relação da equipe multidisciplinar envolvida nos serviços de telessaúde. - Plano de capacitação da equipe. |
| 6. possuir plano de segurança do paciente em serviços de saúde atualizado e implementado, em conformidade com a legislação aplicável; | - Plano de segurança do paciente atualizado e implementado com, pelo menos, três indicadores de segurança aferidos. |
| 7. desenvolver iniciativas que promovam a integração e a cooperação técnica entre os serviços da entidade de saúde e a rede do SUS; e | - Documentações ou instrumentos que comprovem a cooperação técnica entre a instituição e o SUS. |
| 8. possuir sistema de aferição da satisfação de seus trabalhadores e dos usuários. | - Pesquisa de satisfação. - Plano de melhoria dos resultados da pesquisa, Indicadores. |
ANEXO XCIV
ESTRATÉGIAS DE AÇÃO DO PROGRAMA NACIONAL PARA QUALIFICAÇÃO, PRODUÇÃO E INOVAÇÃO EM EQUIPAMENTOS E MATERIAIS DE USO EM SAÚDE NO COMPLEXO INDUSTRIAL DA SAÚDE (Origem: PRT MS/GM 375/2008, Anexo 1)
ESTRATÉGIAS DE AÇÃO DO PROGRAMA NACIONAL PARA QUALIFICAÇÃO, PRODUÇÃO E INOVAÇÃO EM EQUIPAMENTOS E MATERIAIS DE USO EM SAÚDE NO COMPLEXO INDUSTRIAL DA SAÚDE:
As estratégias do Programa Nacional para Qualificação, Produção e Inovação em Equipamentos e Materiais de Uso em Saúde no Complexo Industrial da Saúde, consistem no apoio, fomento e execução de ações e projetos voltados às áreas de:
I - Fomento ao Desenvolvimento Tecnológico, Produção e Inovação;
II - Regulação (em parceria com a Anvisa e o Inmetro);
III - Cooperação Técnica e Econômica;
IV - Compras Governamentais; e
V - Atração de Investimentos.
1 - Fomento ao Desenvolvimento Tecnológico, Produção e Inovação (em parceria com o BNDES e FINEP):
Apoio a programas e projetos de apoio tecnológico ao setor produtivo quanto a:
- obtenção de certificações internacionais e superação de barreiras técnicas, visando à exportação;
adequação de produtos a normas técnicas;
- adequação de processos produtivos; e
- ampliação da capacidade de diferenciação de produtos e inovação de processos.
Rede de Integração de tecnologias utilizadas em produtos médicos objetivando:
- monitorar as demandas tecnológicas do setor de produtos médicos e identificar em outros setores industriais quem pode suprir tais demandas; e
- apoiar projetos entre empresas fornecedoras e ICT's, para integração de tecnologias visando ao desenvolvimento de novos produtos e processo produtivos.
stimular a formação e a capacitação de recursos humanos na área de Engenharia Biomédica:
- Gestão da P, D & I;
- Segurança e Gerenciamento de Riscos em Tecnologia Médica;
- Boas Práticas de Fabricação de Produtos Médicos;
Avaliação Tecnológica de Produtos Médicos;
- Certificação, Ensaios e Qualificação Produtos Médicos;
- Treinamento em Operação e Segurança de Equipamentos Médico-Hospitalares; e
- Gerenciamento da Inovação de Tecnologias Médicas. Estabelecer mecanismos e programas para transferência de tecnologias estratégicas ao SUS:
- mapeamento das tecnologias estratégicas ao SUS;
- identificação e consolidação de parcerias estratégicas com institutos de tecnologia no Brasil e no exterior;
- estimular a implantação de centros de P,D&I no País; e
- fomentar programas e projetos que objetivem a transferência de tecnologias a empresas brasileiras.
2 - Regulação (em parceria com a Anvisa e o Inmetro): Ampliar a capacidade laboratorial para:
- equipamentos de radiodiagnóstico;
- compatibilidade eletromagnética de equipamentos médicos;
- segurança e desempenho de equipamentos médicos; e
- implantes ortopédicos.
Normalização de Produtos Médicos:
- internalização de normas técnicas internacionais aplicáveis a produtos médicos;
- acompanhamento do desenvolvimento de normas técnicas internacionais;
- uso da certificação Inmetro como instrumento para a garantia da qualidade de produtos de uso em saúde; e
- promover condições para que as empresas operem em conformidade com os regulamentos da Anvisa.
3 - Cooperação Técnica e Econômica:
- firmar termo de cooperação técnica com instituições internacionais visando à formação de recursos humanos e transferência de tecnologia; e
- articular com BNDES, FINEP e outros bancos oficiais, programas para o setor de equipamentos e materiais de uso em saúde.
4 - Compras Governamentais:
- avaliação do modelo de Tratamento Especial e Diferenciado para Países em Desenvolvimento - TED, em especial a compensação comercial, industrial ou tecnológica nas compras governamentais civis (OFFSET) em licitações internacionais; e
- estabelecer políticas e mecanismos para "Encomendas Tecnológicas" de produtos estratégicos.
5 - Atração de Investimentos:
- definir uma política para a atração de investimentos com base em modelos internacionais de sucesso;
- mapeamento dos países mais atrativos para investimento nos diversos segmentos do complexo produtivo;
- levantamento dos fundos internacionais (investimentos, subvenções, venture capital, seed money, joint venture, offset, etc.); e
- estimular o uso das Leis do Bem e da Inovação e identificar possibilidades de se desenvolver outros mecanismos de subvenção para o setor produtivo.
ANEXO XCV
DOS CRITÉRIOS PARA A DEFINIÇÃO DA LISTA DE PRODUTOS ESTRATÉGICOS PARA O SUS E DO ESTABELECIMENTO DAS PARCERIAS PARA O DESENVOLVIMENTO PRODUTIVO (PDP) E DOS RESPECTIVOS PROCESSOS DE SUBMISSÃO, INSTRUÇÃO, DECISÃO, TRANSFERÊNCIA E ABSORÇÃO DE TECNOLOGIA, AQUISIÇÃO DE PRODUTOS ESTRATÉGICOS PARA O SUS NO ÂMBITO DAS PDP E O RESPECTIVO MONITORAMENTO E AVALIAÇÃO (Origem: PRT MS/GM 2531/2014)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO I)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 1º Ficam estabelecidos as diretrizes e os critérios para a definição da lista de produtos estratégicos para o Sistema Único de Saúde (SUS) e o estabelecimento das Parcerias para o Desenvolvimento Produtivo (PDP) e disciplina os respectivos processos de submissão, instrução, decisão, transferência e absorção de tecnologia, aquisição de produtos estratégicos para o SUS no âmbito das PDP e o respectivo monitoramento e avaliação. (Origem: PRT MS/GM 2531/2014, Art. 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 2º Para efeitos deste Anexo, são adotados os seguintes conceitos: (Origem: PRT MS/GM 2531/2014, Art. 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - Parceria para o Desenvolvimento Produtivo (PDP): parcerias que envolvem a cooperação mediante acordo entre instituições públicas e entre instituições públicas e entidades privadas para desenvolvimento, transferência e absorção de tecnologia, produção, capacitação produtiva e tecnológica do País em produtos estratégicos para atendimento às demandas do SUS; (Origem: PRT MS/GM 2531/2014, Art. 2º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - produtos estratégicos para o SUS: produtos necessários ao SUS para ações de promoção, prevenção e recuperação da saúde, com aquisições centralizadas ou passíveis de centralização pelo Ministério da Saúde e cuja produção nacional e de seus insumos farmacêuticos ativos ou componentes tecnológicos críticos são relevantes para o CEIS; (Origem: PRT MS/GM 2531/2014, Art. 2º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - lista de produtos estratégicos para o SUS: relação de produtos estratégicos para o SUS que define as prioridades anuais para a apresentação de propostas de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 2º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - Complexo Econômico-Industrial da Saúde (CEIS): sistema produtivo da saúde que contempla as indústrias farmacêuticas, de base química e biotecnológica, os produtos para a saúde, tais como equipamentos e materiais, e os serviços de saúde; (Origem: PRT MS/GM 2531/2014, Art. 2º, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - instituição pública: órgão ou entidade da Administração Pública, Direta ou Indireta, de uma das três esferas do governo, que atue em pesquisa, desenvolvimento ou produção de medicamentos, soros, vacinas ou produtos para a saúde; (Origem: PRT MS/GM 2531/2014, Art. 2º, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - entidade privada: pessoa jurídica de direito privado, não integrante da Administração Pública, Direta ou Indireta, que seja detentora, desenvolvedora, possua licença da tecnologia a ser transferida ou que seja responsável pela produção de uma etapa da cadeia produtiva no País; (Origem: PRT MS/GM 2531/2014, Art. 2º, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - núcleo tecnológico: conjunto de conhecimentos tecnológicos que capacita seu detentor a reproduzir, desenvolver, aprimorar e transferir a tecnologia dos produtos objetos de PDP; (Origem: PRT MS/GM 2531/2014, Art. 2º, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - inovação: introdução de novidade ou aperfeiçoamento no ambiente produtivo ou social que resulte em novos produtos, processos ou serviços; (Origem: PRT MS/GM 2531/2014, Art. 2º, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - verticalização: conjunto de etapas, unidades e sistemas produtivos que determinam o grau de internalização da cadeia produtiva do produto objeto de PDP no País; (Origem: PRT MS/GM 2531/2014, Art. 2º, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - Insumo Farmacêutico Ativo (IFA): substância química ou biológica ativa, fármaco, droga ou matéria-prima que tenha propriedades farmacológicas com finalidade medicamentosa, utilizada para diagnóstico, prevenção ou tratamento, empregada para modificar ou explorar sistemas fisiológicos ou estados patológicos, em benefício do paciente, cuja produção seja importante para o domínio do núcleo tecnológico pelo País no âmbito do CEIS; (Origem: PRT MS/GM 2531/2014, Art. 2º, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - componente tecnológico crítico: insumo, produto ou processo da cadeia produtiva das indústrias de produtos em saúde, de uso preventivo, terapêutico e diagnóstico, cuja produção seja importante para o domínio do núcleo tecnológico pelo País no âmbito do CEIS; (Origem: PRT MS/GM 2531/2014, Art. 2º, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XII - portabilidade tecnológica: capacidade técnica e gerencial de transferência de determinada tecnologia pela entidade privada ou instituição pública que a detém para outra instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 2º, XII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIII - Processo Produtivo Básico (PPB): conjunto mínimo de operações no estabelecimento produtor que caracteriza a efetiva industrialização de determinado produto; (Origem: PRT MS/GM 2531/2014, Art. 2º, XIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIV - termo de compromisso: documento firmado entre a instituição pública, que se responsabiliza pelo investimento, desenvolvimento, transferência e absorção de tecnologia de produtos estratégicos para o SUS, e o Ministério da Saúde, que se responsabiliza pela aquisição dos produtos objetos da PDP, contendo em anexo declaração de concordância com o referido documento subscrita pelos parceiros privados; e (Origem: PRT MS/GM 2531/2014, Art. 2º, XIV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XV - internalização da tecnologia: finalização do processo de desenvolvimento, transferência e absorção de tecnologia objeto da PDP pela instituição pública, tornando-a detentora de todas as informações que garantam o domínio tecnológico e apta à portabilidade tecnológica para o atendimento das demandas do SUS. (Origem: PRT MS/GM 2531/2014, Art. 2º, XV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 3º São objetivos das PDP: (Origem: PRT MS/GM 2531/2014, Art. 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - ampliar o acesso da população a produtos estratégicos e diminuir a vulnerabilidade do SUS; (Origem: PRT MS/GM 2531/2014, Art. 3º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - reduzir as dependências produtiva e tecnológica para atender as necessidades de saúde da população brasileira a curto, médio e longo prazos, seguindo os princípios constitucionais do acesso universal e igualitário às ações e aos serviços de saúde; (Origem: PRT MS/GM 2531/2014, Art. 3º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - racionalizar o poder de compra do Estado, mediante a centralização seletiva dos gastos na área da saúde, com vistas à sustentabilidade do SUS e à ampliação da produção no País de produtos estratégicos; (Origem: PRT MS/GM 2531/2014, Art. 3º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - proteger os interesses da Administração Pública e da sociedade ao buscar a economicidade e a vantajosidade, considerando-se preços, qualidade, tecnologia e benefícios sociais; (Origem: PRT MS/GM 2531/2014, Art. 3º, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - fomentar o desenvolvimento tecnológico e o intercâmbio de conhecimentos para a inovação no âmbito das instituições públicas e das entidades privadas, contribuindo para o desenvolvimento do CEIS e para torná-las competitivas e capacitadas; (Origem: PRT MS/GM 2531/2014, Art. 3º, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - promover o desenvolvimento e a fabricação em território nacional de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 3º, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - buscar a sustentabilidade tecnológica e econômica do SUS a curto, médio e longo prazos, com promoção de condições estruturais para aumentar a capacidade produtiva e de inovação do País, contribuir para redução do déficit comercial do CEIS e garantir o acesso à saúde; e (Origem: PRT MS/GM 2531/2014, Art. 3º, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - estimular o desenvolvimento da rede de produção pública no País e do seu papel estratégico para o SUS. (Origem: PRT MS/GM 2531/2014, Art. 3º, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO II
DA LISTA DE PRODUTOS ESTRATÉGICOS PARA O SUS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO II)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 4º A lista de produtos estratégicos para o SUS é composta por produtos pertencentes aos seguintes grupos: (Origem: PRT MS/GM 2531/2014, Art. 4º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - Grupo 1: fármacos; (Origem: PRT MS/GM 2531/2014, Art. 4º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - Grupo 2: medicamentos; (Origem: PRT MS/GM 2531/2014, Art. 4º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - Grupo 3: adjuvantes; (Origem: PRT MS/GM 2531/2014, Art. 4º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - Grupo 4: hemoderivados e hemocomponentes; (Origem: PRT MS/GM 2531/2014, Art. 4º, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - Grupo 5: vacinas; (Origem: PRT MS/GM 2531/2014, Art. 4º, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - Grupo 6: soros; (Origem: PRT MS/GM 2531/2014, Art. 4º, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - Grupo 7: produtos biológicos ou biotecnológicos de origem humana, animal ou recombinante; (Origem: PRT MS/GM 2531/2014, Art. 4º, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - Grupo 8: produtos para a saúde, tais como equipamentos e materiais de uso em saúde; (Origem: PRT MS/GM 2531/2014, Art. 4º, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - Grupo 9: produtos para diagnóstico de uso "in vitro"; e (Origem: PRT MS/GM 2531/2014, Art. 4º, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - Grupo 10: "software" embarcado no dispositivo médico ou utilizado na transmissão de dados em saúde, na recuperação, reconstrução e processamento de sinais e imagens ou na comunicação entre dispositivos. (Origem: PRT MS/GM 2531/2014, Art. 4º, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Poderão ser incluídos na lista de produtos estratégicos para o SUS os produtos e bens que compõem os programas estratégicos desenvolvidos no âmbito do Ministério da Saúde, ainda que não previstos nos grupos de que trata o "caput". (Origem: PRT MS/GM 2531/2014, Art. 4º, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 5º O Ministério da Saúde definirá, anualmente, a lista de produtos estratégicos para o SUS em conformidade com as recomendações expedidas pelo Grupo Executivo do Complexo Industrial da Saúde (GECIS). (Origem: PRT MS/GM 2531/2014, Art. 5º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º A lista de que trata o "caput" será editada por ato do Ministro de Estado da Saúde e observará o disposto nos arts. 4º e 6º do Anexo XCV . (Origem: PRT MS/GM 2531/2014, Art. 5º, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º O Ministério da Saúde poderá efetuar consultas específicas a órgãos e entidades, públicas e privadas, além de especialistas no tema, e consultas públicas antes de definir a lista de produtos estratégicos para o SUS, sem prejuízo das recomendações expedidas pelo GECIS, conforme disciplinado no Decreto nº 7.807, de 17 de setembro de 2012. (Origem: PRT MS/GM 2531/2014, Art. 5º, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 6º A lista de produtos estratégicos de que trata o art. 5º será definida considerando-se: (Origem: PRT MS/GM 2531/2014, Art. 6º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - necessariamente os seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 6º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) importância do produto para o SUS, conforme as políticas e os programas de promoção, prevenção e recuperação da saúde; (Origem: PRT MS/GM 2531/2014, Art. 6º, I, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) aquisição centralizada do produto pelo Ministério da Saúde ou passível de centralização; e (Origem: PRT MS/GM 2531/2014, Art. 6º, I, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) interesse de produção nacional do produto e de seus insumos farmacêuticos ativos ou componentes tecnológicos críticos relevantes para o CEIS; e (Origem: PRT MS/GM 2531/2014, Art. 6º, I, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - adicionalmente pelo menos um dos seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 6º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) alto valor de aquisição para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 6º, II, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) dependência expressiva de importação do produto para os programas e ações de promoção, prevenção e assistência à saúde no âmbito do SUS nos últimos 3 (três) anos; (Origem: PRT MS/GM 2531/2014, Art. 6º, II, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) incorporação tecnológica recente no SUS; e (Origem: PRT MS/GM 2531/2014, Art. 6º, II, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) produto negligenciado ou com potencial risco de desabastecimento. (Origem: PRT MS/GM 2531/2014, Art. 6º, II, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Sem prejuízo do disposto no "caput", o Ministro de Estado da Saúde poderá alterar, a qualquer tempo, a lista de produtos estratégicos para o SUS, de forma justificada, após consulta ao GECIS. (Origem: PRT MS/GM 2531/2014, Art. 6º, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º O potencial risco de desabastecimento, de que trata a alínea "d" do inciso II, estará configurado quando existir registro de desabastecimento no país justificado pela área finalística do Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 6º, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º O produto estratégico para o SUS que seja objeto de processo de transferência de tecnologia no âmbito de PDP em curso constará no portal do Ministério da Saúde e somente será contemplado na definição anual da lista de produtos estratégicos para o SUS se for possível a execução de nova PDP relativa ao mesmo produto, considerando-se as propostas de projeto de PDP anteriormente aprovadas. (Origem: PRT MS/GM 2531/2014, Art. 6º, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 7º Os produtos estratégicos para o SUS poderão ser objeto de medidas e iniciativas voltadas para pesquisa, desenvolvimento, transferência de tecnologia, inovação e produção nacional, com a finalidade de contribuir para o fortalecimento do CEIS e para ampliação do seu acesso pela população. (Origem: PRT MS/GM 2531/2014, Art. 7º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 8º A lista de produtos estratégicos para o SUS encontra-se no portal do Ministério da Saúde, disponível por meio do endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 8º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO III
DOS SUJEITOS PARTICIPANTES DA PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO III)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 9º Os sujeitos participantes da PDP poderão ser: (Origem: PRT MS/GM 2531/2014, Art. 9º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - instituição pública, individualmente ou conjuntamente a outras instituições públicas, com vistas a possibilitar segurança, portabilidade tecnológica, agilidade e dinamicidade no processo de pesquisa, desenvolvimento, absorção tecnológica e inovação; e (Origem: PRT MS/GM 2531/2014, Art. 9º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - entidade privada, individualmente ou conjuntamente a outras entidades privadas, com vistas a possibilitar segurança, portabilidade tecnológica, agilidade e dinamicidade no processo de transferência de tecnologia. (Origem: PRT MS/GM 2531/2014, Art. 9º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO IV
DO PROCESSO
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 10. O processo para o estabelecimento de PDP possui as seguintes fases: (Origem: PRT MS/GM 2531/2014, Art. 10) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - proposta de projeto de PDP: fase de submissão e análise da viabilidade da proposta e, em caso de aprovação, celebração do termo de compromisso entre o Ministério da Saúde e a instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 10, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - projeto de PDP: início da fase de implementação da proposta de projeto de PDP aprovada e do termo de compromisso; (Origem: PRT MS/GM 2531/2014, Art. 10, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - PDP: início da fase de execução do desenvolvimento do produto, transferência e absorção de tecnologia de forma efetiva e celebração do contrato de aquisição do produto estratégico entre o Ministério da Saúde e a instituição pública; e (Origem: PRT MS/GM 2531/2014, Art. 10, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - internalização de tecnologia: fase de conclusão do desenvolvimento, transferência e absorção da tecnologia objeto da PDP em condições de produção do produto objeto de PDP no País e portabilidade tecnológica por parte da instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 10, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. O fluxograma do processo de estabelecimento das PDP está previsto no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 10, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Seção I
Da Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 11. A proposta de projeto de PDP será elaborada considerando-se a lista vigente de produtos estratégicos para o SUS. (Origem: PRT MS/GM 2531/2014, Art. 11) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A proposta de projeto PDP seguirá o modelo de projeto executivo previsto no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 11, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 12. A proposta de projeto de PDP será apresentada por meio de expediente físico pela instituição pública ao Ministério da Saúde, especificamente à Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS). (Origem: PRT MS/GM 2531/2014, Art. 12) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 13. A proposta de projeto de PDP deverá ser formalizada pela instituição pública junto à SCTIE/MS entre 1º de janeiro e 30 de abril. (Origem: PRT MS/GM 2531/2014, Art. 13) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Esclarecimentos em relação à elaboração da proposta de projeto de PDP poderão ocorrer por meio de reuniões técnicas, e-mail ou expedientes físicos entre as instituições públicas e entidades privadas e o Ministério da Saúde a qualquer tempo, exceto durante o período de análise das propostas e de recursos administrativos. (Origem: PRT MS/GM 2531/2014, Art. 13, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º Os resultados das avaliações das propostas de projeto de PDP serão divulgados nas reuniões do GECIS realizadas após o período de que trata o "caput". (Origem: PRT MS/GM 2531/2014, Art. 13, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º O calendário anual de reuniões do GECIS será divulgado concomitantemente com a divulgação da lista de produtos estratégicos para o SUS, devendo a pauta das reuniões do GECIS ser divulgada com antecedência mínima de 7 (sete) dias da realização da reunião. (Origem: PRT MS/GM 2531/2014, Art. 13, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 4º Em caso de propostas de projeto de PDP apresentadas no mesmo período e que versem sobre o mesmo produto estratégico para o SUS, a sua avaliação será feita de forma conjunta e respectivos resultados divulgados simultaneamente. (Origem: PRT MS/GM 2531/2014, Art. 13, § 4º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 5º É facultada a abertura de novo período para apresentação de propostas de projeto de PDP, mediante divulgação no portal eletrônico do Ministério da Saúde, em caso excepcional de relevante interesse de saúde pública e de forma justificada pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 13, § 5º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Subseção I
Das Diretrizes e dos Requisitos para a Elaboração de Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção I)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 14. A elaboração de proposta de projeto de PDP observará as seguintes diretrizes: (Origem: PRT MS/GM 2531/2014, Art. 14) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - quanto aos sujeitos participantes, serão indicadas de forma pormenorizada: (Origem: PRT MS/GM 2531/2014, Art. 14, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) a instituição pública responsável pela absorção da tecnologia e fabricação do produto ao final da fase de internalização de tecnologia da PDP; (Origem: PRT MS/GM 2531/2014, Art. 14, I, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) a entidade privada detentora ou desenvolvedora da tecnologia do produto, que será responsável pela transferência da tecnologia à instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 14, I, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) a instituição pública ou entidade privada desenvolvedora nacional e produtora local do insumo farmacêutico ativo (IFA) ou componente tecnológico crítico; e (Origem: PRT MS/GM 2531/2014, Art. 14, I, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) a motivação para a escolha das entidades privadas participantes da PDP pelas instituições públicas; (Origem: PRT MS/GM 2531/2014, Art. 14, I, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - quanto ao objeto, será informado: (Origem: PRT MS/GM 2531/2014, Art. 14, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) os produtos constantes da lista de produtos estratégicos para o SUS que serão objeto do desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP; (Origem: PRT MS/GM 2531/2014, Art. 14, II, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) as especificações dos produtos que serão objeto do desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP, conforme definido em ato do Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 14, II, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) o prazo de vigência da PDP e o cronograma de sua implementação, observadas as disposições deste Anexo; (Origem: PRT MS/GM 2531/2014, Art. 14, II, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - quanto à propriedade intelectual: (Origem: PRT MS/GM 2531/2014, Art. 14, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) a pesquisa, o desenvolvimento e a fabricação dos produtos a serem adquiridos no âmbito da PDP seguirão a legislação vigente; e (Origem: PRT MS/GM 2531/2014, Art. 14, III, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) devem ser informados os números dos documentos das patentes concedidas ou em processamento no país, relacionados à produção e transferência de tecnologia do produto objeto de PDP, indicando seus respectivos titulares e a sua vigência; (Origem: PRT MS/GM 2531/2014, Art. 14, III, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - quanto aos cronogramas do projeto executivo: (Origem: PRT MS/GM 2531/2014, Art. 14, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) o prazo de vigência da PDP será proposto de acordo com a complexidade tecnológica para a internalização da tecnologia no País, respeitado o limite máximo de 10 (dez) anos; (Origem: PRT MS/GM 2531/2014, Art. 14, IV, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) as atividades prévias ao registro do produto na Agência Nacional de Vigilância Sanitária (ANVISA), referentes à implementação do projeto de PDP, constarão do cronograma, detalhando-se os prazos previstos para a conclusão e os responsáveis pela execução de cada item do cronograma; (Origem: PRT MS/GM 2531/2014, Art. 14, IV, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) o cronograma apresentado para as fases de estabelecimento de PDP deve ser detalhado, contendo cronogramas físico e financeiro compatíveis com a evolução das atividades e com a necessidade dos recursos, atendendo-se, no mínimo, aos itens apontados no modelo de projeto executivo; e (Origem: PRT MS/GM 2531/2014, Art. 14, IV, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) identificação do início de cada uma das fases do processo de estabelecimento da PDP e respectivas atividades; (Origem: PRT MS/GM 2531/2014, Art. 14, IV, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - quanto à documentação para registro e certificação: (Origem: PRT MS/GM 2531/2014, Art. 14, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) os registros do produto objeto da PDP pela instituição pública e entidade privada na ANVISA e as alterações pós-registro constarão no cronograma da PDP para desenvolvimento, transferência e absorção de tecnologia, com indicação da Resolução da ANVISA a ser seguida a depender do produto; e (Origem: PRT MS/GM 2531/2014, Art. 14, V, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) o cronograma de obtenção do registro ou renovação de licenças e certificados, quando aplicável, incluindo-se o Certificado de Boas Práticas de Fabricação (CBPF), junto à ANVISA será apresentado no projeto executivo para cada sujeito participante público e privado; (Origem: PRT MS/GM 2531/2014, Art. 14, V, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - quanto ao grau de integração produtiva: (Origem: PRT MS/GM 2531/2014, Art. 14, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) previsão da internalização da tecnologia pela instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 14, VI, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) em caso de utilização, no início do projeto, de IFA ou de componente tecnológico crítico internacional, devem ser apontados os fabricantes e locais de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 14, VI, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) demonstração de que a entidade privada praticará um grau de integração produtiva em território nacional pertinente com a produção nacional do produto objeto da PDP, sendo que: (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
1. para produtos de síntese química e síntese mista, o projeto deve contemplar a verticalização nacional de etapas produtivas significativas para o parque produtivo nacional farmoquímico e a garantia de acesso da instituição pública ao conhecimento tecnológico, incluindo-se o Arquivo Mestre da Droga (AMD); (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c, 1) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
2. para produtos biológicos, obrigatoriedade de garantia da transferência do Banco de Células Mestre além dos conhecimentos tecnológicos requeridos para produção do produto no País; e (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c, 2) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
3. para produtos em saúde, o projeto deve contemplar a produção do componente tecnológico crítico, aplicando-se, no que couber, as regras de origem ou o PPB, respeitando-se, quando for o caso, a dificuldade para a produção no País de componentes de uso não específico para a área da saúde como, por exemplo, os componentes microeletrônicos; e (Origem: PRT MS/GM 2531/2014, Art. 14, VI, c, 3) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) garantia de acesso ao conhecimento integral da tecnologia objeto de PDP a ser transferida por meio de processos de capacitação no País e, quando aplicável, no exterior; (Origem: PRT MS/GM 2531/2014, Art. 14, VI, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - quanto ao processo de produção: (Origem: PRT MS/GM 2531/2014, Art. 14, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) o projeto deve proporcionar o desenvolvimento do CEIS e apresentar as condições para tornar a instituição pública apta a produzir o produto objeto da PDP; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) deverá ser apresentado o fluxo de produção planejado detalhadamente, envolvendo-se, no que se refere à infraestrutura: (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
1. a estrutura física necessária, com indicação se as plantas produtivas dos parceiros envolvidos possuem projetos de investimento; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b, 1) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
2. as condições apropriadas para execução do projeto, englobando-se instalações, procedimentos, processos e recursos organizacionais; e (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b, 2) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
3. quando necessárias adequações na infraestrutura, serão especificados pela instituição pública, no projeto executivo, os recursos necessários, os valores orçados e a previsão de conclusão dos investimentos críticos para a viabilização da PDP por parte de todos os parceiros; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, b, 3) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) os equipamentos necessários para o processo de produção e controle de qualidade do produto e dos insumos serão descritos no projeto executivo da PDP, informando-se a capacidade nominal, se os parceiros já possuem os referidos equipamentos ou previsão de sua aquisição e a previsão de gastos com o respectivo detalhamento sobre as fontes de recursos; e (Origem: PRT MS/GM 2531/2014, Art. 14, VII, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) os recursos humanos necessários para execução do processo de gestão, de desenvolvimento e absorção tecnológica e garantia da qualidade do projeto serão relacionados, indicando-se o número, a formação e a qualificação necessária; (Origem: PRT MS/GM 2531/2014, Art. 14, VII, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - quanto à proposta de preço de venda e estimativa da capacidade de oferta: (Origem: PRT MS/GM 2531/2014, Art. 14, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) serão apresentadas propostas com os valores unitários anuais em termos nominais e a capacidade de oferta anual do produto para o período do projeto; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) os preços propostos serão compatíveis com os praticados pelo SUS e, quando necessário, aos preços de mercados internacionais dos países contemplados pela Câmara de Regulação do Mercado de Medicamentos (CMED), considerando os princípios da econonomicidade e da vantajosidade; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) serão apresentados preços em escala decrescente dos valores, em bases reais, que serão consideradas em função da variação do Índice Nacional de Preços ao Consumidor Amplo (IPCA) ou índices setoriais de preços e, no que couber, a taxa de variação cambial, respeitando a regulação da CMED; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) para a proposta de preços e estimativa da capacidade de oferta, serão utilizadas como fonte de dados: (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
1. os preços médios praticados pela Administração Pública e registrados nos bancos de dados oficiais, quais sejam o Banco de Preço em Saúde (BPS) e o Sistema Integrado de Administração de Serviços Gerais (SIASG); (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 1) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
2. o preço praticado na última aquisição do produto pelo Ministério da Saúde, conforme extratos publicados no Diário Oficial da União (DOU), no caso de ser produto de aquisição centralizada; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 2) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
3. o valor de repasse estabelecido em portaria específica do Ministério da Saúde ou os valores unitários definidos na Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais do SUS, utilizando-se, como referência, o período de 1 (um) ano anterior à apresentação da proposta de projeto de PDP no caso de produtos de aquisição não centralizada; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 3) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
4. as atas de registros de preços do endereço eletrônico do Portal de Compras do Governo Federal e os sistemas nacionais de informações de saúde do SUS, para os demais produtos de aquisição não centralizada; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 4) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
5. os preços médios praticados no mercado e registrados nos bancos de dados oficiais nacionais e internacionais e utilizados pela Administração Pública, tais como o Sistema de Acompanhamento de Mercado de Medicamentos (SAMMED) da CMED, o Sistema de Apoio à Elaboração de Projetos de Investimentos em Saúde (SOMASUS) do Ministério da Saúde, o Fundo Rotatório da Organização Pan-Americana da Saúde (OPAS) e o Fundo Global de Luta contra AIDS, Tuberculose e Malária; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 5) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
6. os preços definidos pela CMED, de acordo com a legislação vigente; e (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 6) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
7. os preços médios praticados no mercado internacional de países contemplados pela CMED para definição de preços de entrada de novos produtos, quando se tratar de produtos inovadores; e (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, d, 7) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
e) para produtos com prazo de expiração de patente a ocorrer durante as fases do projeto executivo, será apresentado estudo com as projeções de redução de preços compatíveis com o novo patamar de mercado; (Origem: PRT MS/GM 2531/2014, Art. 14, VIII, e) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - quanto ao balanço de divisas, será avaliado pela instituição pública proponente o impacto da importação do produto acabado, insumos farmacêuticos ativos, componentes tecnológicos críticos e intermediários, apresentando-se o balanço de divisas e a economia de divisas anual estimada durante as fases de estabelecimento da PDP, informando-se a metodologia de cálculo utilizada; (Origem: PRT MS/GM 2531/2014, Art. 14, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - quanto à análise de risco da PDP, a instituição pública proponente a apresentará conforme modelo de projeto executivo previsto no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br; e (Origem: PRT MS/GM 2531/2014, Art. 14, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - quanto aos investimentos necessários para concretização do projeto, estes serão factíveis à capacidade e fonte de financiamento informadas. (Origem: PRT MS/GM 2531/2014, Art. 14, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Em relação aos sujeitos participantes da PDP de que trata o inciso I do "caput", serão apresentadas cópias dos seguintes documentos comprobatórios: (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - do Cadastro Nacional da Pessoa Jurídica (CNPJ); (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - do endereço da planta produtiva; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - do alvará sanitário; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - da autorização de funcionamento e/ou autorização especial de funcionamento; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - do CBPF ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - termo de aprovação emitido pela vigilância sanitária local do projeto de construção, ampliação e/ou reforma da estrutura física; e (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - registro sanitário do produto objeto da PDP concedido pela ANVISA em nome dos sujeitos participantes da PDP. (Origem: PRT MS/GM 2531/2014, Art. 14, § 1º, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º Caso não seja possível a apresentação dos documentos elencados nos termos do § 1º com a proposta de projeto de PDP, deverão ser apresentados o cronograma para sua obtenção junto aos órgãos e entidades competentes e justificativas fundamentadas, de acordo com o processo de investimento, de desenvolvimento, absorção e transferência de tecnologia, para fins de análise das instâncias de avaliação da proposta. (Origem: PRT MS/GM 2531/2014, Art. 14, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º Os sujeitos participantes de que trata o inciso I do "caput" firmarão declaração conjunta de concordância com todos os termos da proposta de projeto de PDP apresentada, inclusive em relação às informações contidas no projeto executivo, a qual também constará do rol de documentos que compõe a citada proposta. (Origem: PRT MS/GM 2531/2014, Art. 14, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 4º As condições de usos adicionais do Banco de Células Mestre referentes ao produto objeto de PDP poderão ser definidas mediante acordo entre os sujeitos participantes da PDP. (Origem: PRT MS/GM 2531/2014, Art. 14, § 4º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Subseção II
Das Instâncias de Avaliação da Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção II)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 15. A análise e a avaliação da proposta de projeto de PDP serão realizadas pelas Comissões Técnicas de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 15) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 16. Compete às Comissões Técnicas de Avaliação: (Origem: PRT MS/GM 2531/2014, Art. 16) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - emitir relatório quanto à proposta de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 16, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - sugerir prazos, critérios e condicionantes específicos para execução do projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 16, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - avaliar o grau de integração produtiva em território nacional proposto para a produção nacional do produto; (Origem: PRT MS/GM 2531/2014, Art. 16, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - avaliar a economicidade e vantajosidade da proposta de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 16, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - verificar se os prazos do desenvolvimento e absorção tecnológica, incluindo-se as etapas regulatórias, são compatíveis com o cronograma proposto; (Origem: PRT MS/GM 2531/2014, Art. 16, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - avaliar a possibilidade e a viabilidade de execução de mais de uma PDP relativas ao mesmo produto, visando-se estimular a concorrência e diminuir a vulnerabilidade do SUS, indicando, quando for o caso, a factibilidade de mais de um projeto por produto, seja por questões sanitárias, de escala técnica, econômica ou pelos investimentos requeridos; e (Origem: PRT MS/GM 2531/2014, Art. 16, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - outras competências que lhe foram atribuídas nos termos deste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 16, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 17. As Comissões Técnicas de Avaliação serão compostas por membros dos seguintes órgãos e entidades: (Origem: PRT MS/GM 2531/2014, Art. 17) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - do Ministério da Saúde: (Origem: PRT MS/GM 2531/2014, Art. 17, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) 1 (um) da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); e (Origem: PRT MS/GM 2531/2014, Art. 17, I, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) 1 (um) de cada Secretaria cujas competências estejam relacionadas ao objeto da proposta de projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 17, I, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - 1 (um) do Ministério da Indústria, Comércio Exterior e Serviços; (Origem: PRT MS/GM 2531/2014, Art. 17, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - 1 (um) do Ministério da Ciência, Tecnologia, Inovações e Comunicações; (Origem: PRT MS/GM 2531/2014, Art. 17, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - 1 (um) do Banco Nacional de Desenvolvimento Econômico e Social (BNDES); (Origem: PRT MS/GM 2531/2014, Art. 17, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - 1 (um) da FINEP - Inovação e Pesquisa; e (Origem: PRT MS/GM 2531/2014, Art. 17, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - 1 (um) da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2531/2014, Art. 17, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Cada membro titular terá um suplente, que o substituirá em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 2531/2014, Art. 17, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A Coordenação de cada Comissão Técnica de Avaliação será exercida pelo representante da SCTIE/MS. (Origem: PRT MS/GM 2531/2014, Art. 17, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º Os membros, titulares e suplentes, serão indicados pelos dirigentes máximos de seus respectivos órgãos e entidades ao Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 17, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 4º A participação dos órgãos e entidades elencadas nos incisos II a VI do "caput" será formalizada após resposta a convite a eles encaminhado pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 17, § 4º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 5º Ato do Secretário de Ciência, Tecnologia e Insumos Estratégicos constituirá a Comissão Técnica de Avaliação, com definição de seu objeto e prazo de duração. (Origem: PRT MS/GM 2531/2014, Art. 17, § 5º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 6º Cada Comissão Técnica de Avaliação poderá avaliar uma ou mais propostas de projeto de PDP, a depender do objeto definido nos termos do ato de que trata o art. 17, § 5º . (Origem: PRT MS/GM 2531/2014, Art. 17, § 6º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 7º A Coordenação da Comissão poderá convidar representantes de outros órgãos e entidades, públicas ou privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária para o cumprimento do disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 17, § 7º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 8º Os representantes e especialistas de que trata o art. 17, § 7º assinarão termo de confidencialidade e declaração de inexistência de conflito de interesse para participarem das atividades para as quais foram convidados pela Coordenação da Comissão. (Origem: PRT MS/GM 2531/2014, Art. 17, § 8º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 18. Compete ao Comitê Deliberativo: (Origem: PRT MS/GM 2531/2014, Art. 18) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - analisar e validar os relatórios das Comissões Técnicas de Avaliação; (Origem: PRT MS/GM 2531/2014, Art. 18, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - aprovar ou reprovar as propostas de projeto de PDP, mediante parecer conclusivo; (Origem: PRT MS/GM 2531/2014, Art. 18, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - definir os prazos, critérios e condicionantes específicos para execução das propostas de projetos de PDP, dos projetos de PDP e das PDP; (Origem: PRT MS/GM 2531/2014, Art. 18, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - analisar e validar o grau de integração produtiva em território nacional do produto objeto de PDP para aplicação das regras previstas neste Anexo; (Origem: PRT MS/GM 2531/2014, Art. 18, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - analisar e validar os prazos do desenvolvimento e absorção tecnológica, incluindo-se as etapas regulatórias, compatíveis com o cronograma proposto; (Origem: PRT MS/GM 2531/2014, Art. 18, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - estabelecer as condições de economicidade e vantajosidade da PDP; (Origem: PRT MS/GM 2531/2014, Art. 18, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - indicar, motivadamente, a necessidade de submissão das propostas de projeto de PDP à nova avaliação por Comissão Técnica de Avaliação "ad hoc", cujos membros serão designados mediante ato do Secretário de Ciência, Tecnologia e Insumos Estratégicos, com definição de seu objeto e prazo de duração; e (Origem: PRT MS/GM 2531/2014, Art. 18, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - outras competências que lhe forem atribuídas nos termos deste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 18, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Os membros da Comissão Técnica de Avaliação "ad hoc" de que trata o inciso VII assinarão termo de confidencialidade e declaração de inexistência de conflito de interesse para fins de análise das propostas de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 18, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 19. O Comitê Deliberativo será composto por membros dos seguintes órgãos: (Origem: PRT MS/GM 2531/2014, Art. 19) (com redação dada pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - 1 (um) do Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 19, I) (com redação dada pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - 1 (um) do Ministério da Indústria, Comércio Exterior e Serviços; (Origem: PRT MS/GM 2531/2014, Art. 19, II) (com redação dada pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - 1 (um) do Ministério da Ciência, Tecnologia, Inovações e Comunicações; e (Origem: PRT MS/GM 2531/2014, Art. 19, III) (com redação dada pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - 1 (um) da Agência Nacional de Vigilância Sanitária (ANVISA). (Origem: PRT MS/GM 2531/2014, Art. 19, IV) (dispositivo acrescentado pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Cada membro titular terá um suplente, que o substituirá em seus impedimentos eventuais ou permanentes. (Origem: PRT MS/GM 2531/2014, Art. 19, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A coordenação do Comitê Deliberativo será exercida pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 19, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º Os membros, titulares e suplentes, serão indicados pelos dirigentes máximos de seus respectivos órgãos e entidade ao Ministério da Saúde e serão distintos daqueles que compõem as Comissões Técnicas de Avaliação. (Origem: PRT MS/GM 2531/2014, Art. 19, § 3º) (com redação dada pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 4º A participação dos órgãos elencados nos incisos II, III e IV do 'caput' será formalizada após resposta a convite a eles encaminhado pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 19, § 4º) (com redação dada pela PRT MS/GM 1020/2015) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 5º Ato do Ministro de Estado da Saúde constituirá o Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 19, § 5º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 6º A Coordenação do Comitê poderá convidar representantes de outros órgãos e entidades, públicas ou privadas, bem como especialistas em assuntos relacionados ao tema, cuja presença seja considerada necessária para o cumprimento do disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 19, § 6º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 7º Os representantes e especialistas de que trata o art. 19, § 6º assinarão termo de confidencialidade e declaração de inexistência de conflito de interesse para participarem das atividades para as quais foram convidados pela Coordenação do Comitê. (Origem: PRT MS/GM 2531/2014, Art. 19, § 7º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 20. As funções dos membros das Comissões Técnicas de Avaliação, das Comissões Técnicas de Avaliação "ad hoc" e do Comitê Deliberativo não serão remuneradas e seu exercício será considerado serviço público relevante. (Origem: PRT MS/GM 2531/2014, Art. 20) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 21. O Comitê Deliberativo elaborará o seu regimento interno e o das Comissões Técnicas de Avaliação, a serem aprovados por ato do Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 21) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A Comissão Técnica de Avaliação "ad hoc" terá suas atividades disciplinadas pelo regimento interno da Comissão Técnica de Avaliação. (Origem: PRT MS/GM 2531/2014, Art. 21, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Subseção III
Dos Critérios de Análise de Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção III)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 22. Serão considerados na análise de mérito da proposta de projeto de PDP os seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 22) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - atendimento das diretrizes e dos requisitos previstos no art. 14; (Origem: PRT MS/GM 2531/2014, Art. 22, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - objetivos da proposta consoantes com as políticas públicas desenvolvidas no SUS para promoção, prevenção e atenção à saúde; (Origem: PRT MS/GM 2531/2014, Art. 22, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - importância da PDP para redução da vulnerabilidade econômica e tecnológica do SUS, bem como contribuição para o desenvolvimento científico, tecnológico e socioeconômico do País; (Origem: PRT MS/GM 2531/2014, Art. 22, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - ausência ou insuficiência de produção nacional ou risco de desabastecimento do produto acabado, IFA ou componente tecnológico crítico, contribuindo para a integração produtiva no âmbito do CEIS e para a redução do déficit comercial em saúde; (Origem: PRT MS/GM 2531/2014, Art. 22, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - clareza do objetivo geral a ser alcançado, dos objetivos específicos e das etapas ou produtos que, no conjunto, definam o que se quer alcançar com a PDP; (Origem: PRT MS/GM 2531/2014, Art. 22, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - adequação do cronograma à complexidade da tecnologia envolvida e aos requisitos regulatórios e sanitários; (Origem: PRT MS/GM 2531/2014, Art. 22, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - racionalidade dos investimentos previstos, com indicação da fonte, cronogramas físico e financeiro compatíveis com a evolução das atividades e com a necessidade dos recursos; (Origem: PRT MS/GM 2531/2014, Art. 22, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - observância da legislação de propriedade intelectual em vigor; (Origem: PRT MS/GM 2531/2014, Art. 22, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - grau de integração produtiva compatível com o produto objeto de PDP e o desenvolvimento do parque produtivo nacional; (Origem: PRT MS/GM 2531/2014, Art. 22, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - potencial da instituição pública em relação a recursos humanos necessários para execução do projeto, área produtiva instalada ou projeto de adequação de área aprovado pela instância de financiamento, compatibilidade da natureza do projeto com as atividades executadas pela instituição pública e capacidade da instituição absorver a tecnologia do parceiro; (Origem: PRT MS/GM 2531/2014, Art. 22, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - correta delimitação das habilidades e competências das entidades privadas e das instituições públicas, linhas produtivas necessárias e existentes em cada planta fabril, análise de risco e prazo de vigência apresentados; (Origem: PRT MS/GM 2531/2014, Art. 22, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XII - compatibilidade de execução e obtenção das previsões de registro e certificações perante os órgãos e entidades competentes; (Origem: PRT MS/GM 2531/2014, Art. 22, XII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIII - projeção de balanço de divisas e de economia anual gerada para o SUS nas aquisições do produto tendo em vista a última aquisição realizada pelo Sistema; (Origem: PRT MS/GM 2531/2014, Art. 22, XIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIV - presença no projeto de planejamento de capacitação para a inovação, treinamentos da instituição pública pelos parceiros para absorção e transferência da tecnologia e desenvolvimento das plataformas produtiva e de conhecimento no País; e (Origem: PRT MS/GM 2531/2014, Art. 22, XIV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XV - aceitação integral do processo e metodologias de monitoramento e avaliação definidos neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 22, XV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Serão priorizadas as propostas distintas de projetos de PDP, pelos mesmos parceiros, que envolvam produtos de alto valor e produtos para doenças e populações negligenciadas de interesse do Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 22, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 23. Os seguintes critérios de desempate serão utilizados quando o número de propostas de projetos de PDP aprovadas quanto ao mérito, nos termos do art. 22, para o mesmo produto for superior ao número de propostas cabíveis para aprovação, de acordo com as questões sanitárias e de viabilidades técnica e econômica: (Origem: PRT MS/GM 2531/2014, Art. 23) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - adequação dos produtos e processos aos requerimentos dos programas e ações do Ministério da Saúde, visando atender às necessidades do SUS e da população; (Origem: PRT MS/GM 2531/2014, Art. 23, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - instituição pública com linha de produção adequada para o produto objeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - investimentos aplicados pelo parceiro privado para execução do projeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - menor prazo para internalização da tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 23, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - proposta de preço que tenha potencial de maior economia para o Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 23, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - Autorização de Funcionamento e Autorização de Funcionamento Especial, quando aplicável, ativas para o parceiro privado produtor do produto acabado; (Origem: PRT MS/GM 2531/2014, Art. 23, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - Autorização de Funcionamento e Autorização de Funcionamento Especial, quando aplicável, ativas para o parceiro privado produtor do insumo farmacêutico ativo (IFA) ou componente tecnológico crítico; (Origem: PRT MS/GM 2531/2014, Art. 23, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - CBPF válido para a linha de produção do produto objeto da proposta de PDP para a instituição pública ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 23, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - CBPF válido para a linha de produção do produto objeto de PDP para o parceiro privado produtor do produto acabado ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 23, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - CBPF válido para a linha de produção do produto objeto de PDP para o parceiro privado produtor do insumo farmacêutico ativo ou componente tecnológico crítico ou relatório de inspeções sanitárias com a comprovação de condições de fabricação; (Origem: PRT MS/GM 2531/2014, Art. 23, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - apresentação adicional de inovação relacionada ao produto objeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XII - contribuição relativa da tecnologia para o desenvolvimento do CEIS; (Origem: PRT MS/GM 2531/2014, Art. 23, XII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIII - entidade privada com linha de produção no País adequada para o produto objeto de PDP; (Origem: PRT MS/GM 2531/2014, Art. 23, XIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIV - desenvolvimento tecnológico do produto objeto de PDP realizado no País; e (Origem: PRT MS/GM 2531/2014, Art. 23, XIV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XV - contribuição para o equilíbrio competitivo e tecnológico do mercado. (Origem: PRT MS/GM 2531/2014, Art. 23, XV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 24. Serão considerados na análise da divisão de responsabilidades de instituições públicas, em casos de aprovação de mais de uma proposta de projeto de PDP para um mesmo produto, os seguintes critérios: (Origem: PRT MS/GM 2531/2014, Art. 24) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - estímulo à concorrência no mercado; (Origem: PRT MS/GM 2531/2014, Art. 24, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - capacidade instalada para oferta do produto; (Origem: PRT MS/GM 2531/2014, Art. 24, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - capacidade programada de acordo com o projeto de construção, ampliação e/ou reforma da estrutura física para oferta do produto conforme cronograma da proposta; (Origem: PRT MS/GM 2531/2014, Art. 24, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - demanda do SUS; e (Origem: PRT MS/GM 2531/2014, Art. 24, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - equilíbrio econômico-financeiro do projeto. (Origem: PRT MS/GM 2531/2014, Art. 24, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Subseção IV
Da Instrução do Processo Administrativo de Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção IV)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 25. Caberá à SCTIE/MS a instrução do processo administrativo da proposta de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 25) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 26. As propostas de projetos de PDP protocoladas na SCTIE/MS serão autuadas como processo e, em seguida, encaminhadas ao Departamento do Complexo Industrial e Inovação em Saúde (DECIIS/SCTIE/MS) por meio de despacho do Secretário de Ciência, Tecnologia e Insumos Estratégicos. (Origem: PRT MS/GM 2531/2014, Art. 26) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Antes da remessa dos autos ao DECIIS/SCTIE/MS, o Secretário de Ciência, Tecnologia e Insumos Estratégicos classificará as informações constantes da proposta de projeto de PDP em grau de sigilo nos termos da Portaria nº 1.583/GM/MS, de 19 de julho de 2012. (Origem: PRT MS/GM 2531/2014, Art. 26, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 27. O DECIIS/SCTIE/MS encaminhará o processo para a Coordenação-Geral de Base Química e Biotecnológica (CGBQB/DECIIS/SCTIE/MS) ou a Coordenação-Geral de Equipamentos e Materiais para a Saúde (CGEMS/DECIIS/SCTIE/MS), a depender da área temática do produto, para fins de análise da proposta. (Origem: PRT MS/GM 2531/2014, Art. 27) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 28. A Coordenação-Geral de que trata o art. 27, que seja responsável pela análise da proposta, elaborará nota técnica a fim de verificar se a proposta de projeto de PDP atendeu todos os requisitos e orientações constantes do modelo de projeto executivo de que trata o art. 11, parágrafo único. (Origem: PRT MS/GM 2531/2014, Art. 28) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 29. A proposta de projeto de PDP será restituída pela Coordenação-Geral responsável ao DECIIS/SCTIE/MS e, em seguida, enviada ao Secretário de Ciência, Tecnologia e Insumos Estratégicos, incluindo-se a nota técnica de que trata o art. 28, para fins de avaliação e adoção das medidas necessárias para efetivação das competências do Ministério da Saúde previstas nos arts. 19 e 28 do Anexo XCV . (Origem: PRT MS/GM 2531/2014, Art. 29) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 30. Após ser constituída a Comissão Técnica de Avaliação, a SCTIE/MS lhe encaminhará a proposta de projeto de PDP e a nota técnica de que trata o art. 28 para fins do disposto no art. 16. (Origem: PRT MS/GM 2531/2014, Art. 30) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 31. Após trâmite pela Comissão Técnica de Avaliação, a proposta de projeto de PDP, incluindo-se os respectivos documentos produzidos no âmbito da SCTIE/MS e da própria Comissão, será encaminhada para o Comitê Deliberativo para fins do disposto no art. 18. (Origem: PRT MS/GM 2531/2014, Art. 31) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Subseção V
Do Processo de Avaliação e Decisório da Proposta de Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção I, Subeção V)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 32. A instituição pública será convocada pela SCTIE/MS para apresentação oral da proposta de projeto de PDP perante as Comissões Técnicas de Avaliação e, quando couber, perante o Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 32) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Somente a instituição pública participará da apresentação oral da proposta, devendo responder aos questionamentos das Comissões Técnicas de Avaliação e do Comitê Deliberativo quanto à proposta de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 32, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 33. A Comissão Técnica de Avaliação analisará a proposta de projeto de PDP e poderá demandar à instituição pública ajustes no seu conteúdo para adequação ao disposto no art. 14. (Origem: PRT MS/GM 2531/2014, Art. 33) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º A proposta de projeto de PDP reajustada pela instituição pública nos termos do "caput" deverá ser enviada à SCTIE/MS no prazo máximo de 15 (quinze) dias após o recebimento da comunicação formal de que trata o "caput". (Origem: PRT MS/GM 2531/2014, Art. 33, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A proposta de projeto de PDP será analisada pela Comissão Técnica de Avaliação, que emitirá relatório com parecer final a ser encaminhado, com trâmite pela SCTIE/MS, ao Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 33, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 34. Após recebimento dos documentos de que trata o art. 33, o Comitê Deliberativo adotará as medidas previstas no art. 18. (Origem: PRT MS/GM 2531/2014, Art. 34) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 35. As propostas de projetos de PDP aprovadas pelo Comitê Deliberativo serão formalizadas por meio de termos de compromisso subscritos pela instituição pública e pelo Ministério da Saúde, por meio da SCTIE/MS, e declaração de concordância pelos parceiros privados anexa ao termo de compromisso. (Origem: PRT MS/GM 2531/2014, Art. 35) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Os termos de compromisso serão subscritos e anunciados em reuniões do GECIS até o final do ano em que foram apresentadas as respectivas propostas de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 35, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 36. O extrato do termo de compromisso da proposta de projeto de PDP aprovada será publicado no Diário Oficial da União (DOU). (Origem: PRT MS/GM 2531/2014, Art. 36) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 37. Após assinatura do termo de compromisso, o DECIIS/SCTIE/MS enviará cópia do ato à instituição pública e à ANVISA, incluindo-se cópia dos documentos produzidos pela SCTIE/MS, Comissão Técnica de Avaliação e Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 37) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 38. As propostas de projetos de PDP que não forem aprovadas pelo Comitê Deliberativo serão comunicadas pelo Ministério da Saúde, por meio da SCTIE/MS, à instituição pública proponente, com a respectiva motivação. (Origem: PRT MS/GM 2531/2014, Art. 38) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 39. É facultado à instituição pública o direito de interposição de recurso administrativo em face da decisão de reprovação da proposta de projeto de PDP, com fundamento em razões de legalidade e de mérito, em única e última instância, dirigido ao Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 39) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º É de dez dias o prazo para interposição do recurso administrativo, sem efeito suspensivo, contado a partir da divulgação da decisão no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 39, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º O recurso administrativo será encaminhado pelo Gabinete do Ministro (GM/MS) para a SCTIE/MS para elaboração de manifestação técnica que, em seguida, o remeterá para a Consultoria Jurídica (CONJUR/MS) para elaboração de manifestação jurídica a fim de subsidiar o julgamento pelo Ministro de Estado da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 39, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º Em caso de provimento do recurso administrativo, a proposta de projeto de PDP será encaminhada à SCTIE/MS para reavaliação por nova Comissão Técnica de Avaliação e pelo Comitê Deliberativo, observando-se o mesmo fluxo processual previsto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 39, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 40. A relação das propostas de projeto de PDP que não forem aprovadas, com a respectiva motivação, será divulgada no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br. (Origem: PRT MS/GM 2531/2014, Art. 40) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 41. A aprovação das propostas de projeto de PDP não vincula o Ministério da Saúde ao financiamento de investimentos e custeio de despesas nas instituições públicas. (Origem: PRT MS/GM 2531/2014, Art. 41) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 42. Os regimentos internos das Comissões Técnicas de Avaliação e do Comitê Deliberativo definirão em caráter complementar os ritos, prazos, documentação, metodologia a ser utilizada para ponderação dos critérios de análise e competências para o processo de avaliação e decisório das propostas de projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 42) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Seção II
Do Projeto de PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção II)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 43. Após a assinatura do termo de compromisso, inicia-se a fase do projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 43) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 44. Na fase do projeto de PDP, o atendimento dos compromissos, responsabilidades e condicionantes do projeto ficará a cargo da instituição pública e da entidade privada. (Origem: PRT MS/GM 2531/2014, Art. 44) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 45. Até o início da fase de PDP, a instituição pública e a entidade privada formalizarão acordo ou contrato de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP com observância dos critérios, diretrizes e orientações deste Anexo, sem interveniência do Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 45) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A existência do acordo ou contrato de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP e a sua apresentação ao Ministério da Saúde pela instituição pública é requisito para a formalização do primeiro fornecimento do produto objeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 45, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 46. Qualquer necessidade de alteração do cronograma do projeto de PDP será apresentada oficialmente pela instituição pública, com justificativas fundamentadas, à SCTIE/MS para sua apreciação e, quando referente aos aspectos regulatórios sanitários, pelo Comitê Técnico Regulatório (CTR) da ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 46) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A SCTIE/MS e, quando pertinente, o CTR da ANVISA decidirão sobre o pedido, "ad referendum" do Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 46, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 47. A instituição pública poderá apresentar proposta de alteração dos seus parceiros envolvidos no projeto de PDP, com as respectivas justificativas fundamentadas, à SCTIE/MS para sua apreciação, pela Comissão Técnica de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 47) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A decisão sobre o pedido competirá ao Comitê Deliberativo, que decidirá pelo envio ou não de nova proposta de projeto de PDP para avaliação pela Comissão Técnica de Avaliação e pelo referido Comitê. (Origem: PRT MS/GM 2531/2014, Art. 47, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 48. A instituição pública poderá apresentar proposta de alteração das tecnologias do projeto de PDP, com as respectivas justificativas fundamentadas, à SCTIE/MS para sua apreciação, pela Comissão Técnica de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 48) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Fica o Comitê Deliberativo autorizado a definir, em ato próprio, as hipóteses em que as propostas de alteração das tecnologias do projeto de PDP poderão ser avaliadas apenas pela SCTIE/MS ou pela SCTIE/MS e pela Comissão Técnica de Avaliação. (Origem: PRT MS/GM 2531/2014, Art. 48, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 49. Os pedidos de alterações de cronograma, parceiros ou tecnologia serão respondidos oficialmente pela SCTIE/MS ao requerente. (Origem: PRT MS/GM 2531/2014, Art. 49) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 50. O fornecimento de informações quanto à execução do projeto de PDP para o Ministério da Saúde será realizado pela instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 50) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A instituição pública encaminhará, em caráter ordinário, relatório de acompanhamento quadrimestral para o Ministério da Saúde, que ficará disponível para avaliação pelos Comitês Técnicos de Avaliação e pelo Comitê Deliberativo, observadas a Lei nº 12.527, de 18 de novembro de 2011, o Decreto nº 7.724, de 16 de maio de 2012, e a Portaria nº 1.583/GM/MS, de 19 de julho de 2012. (Origem: PRT MS/GM 2531/2014, Art. 50, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Seção III
Da PDP
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção III)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 51. A PDP inicia-se com a demonstração ao Ministério da Saúde pela instituição pública do início da etapa de desenvolvimento, transferência e absorção de tecnologia, capacitação industrial e tecnológica, em conjunto com o primeiro fornecimento do produto objeto de PDP ao Ministério da Saúde pela instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 51) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º O ano 1 (um) da PDP se iniciará a partir da publicação do instrumento específico para o primeiro fornecimento do produto objeto da PDP pela instituição pública ao Ministério da Saúde no DOU. (Origem: PRT MS/GM 2531/2014, Art. 51, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A instituição pública encaminhará, em caráter ordinário, relatório de acompanhamento quadrimestral para o Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 51, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 52. A aquisição do produto objeto de PDP pelo Ministério da Saúde se dará apenas depois de cumpridas todas as etapas descritas nas Seções I e II do Capítulo IV do Anexo XCV e com a demonstração pela instituição pública do início da etapa de desenvolvimento, transferência e absorção de tecnologia, capacitação industrial e tecnológica. (Origem: PRT MS/GM 2531/2014, Art. 52) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Para projetos de PDP relativos ao mesmo produto, a PDP que atender primeiramente ao estabelecido no "caput" e ter capacidade de suprimento poderá ser responsável pelo fornecimento da demanda total do Ministério da Saúde até que as outras PDP atendam ao estabelecido no "caput" e se inicie a divisão de responsabilidades aprovada para cada projeto de PDP. (Origem: PRT MS/GM 2531/2014, Art. 52, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º O produto objeto de PDP atenderá as apresentações, especificações, formas e quantitativos demandados pelo Ministério da Saúde, respeitando-se a regulação sanitária. (Origem: PRT MS/GM 2531/2014, Art. 52, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º A definição de centralização da aquisição do produto deverá ocorrer mediante pactuação prévia na Comissão Intergestores Tripartite (CIT). (Origem: PRT MS/GM 2531/2014, Art. 52, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 53. Para a primeira aquisição, o registro sanitário do produto objeto da PDP poderá ser da instituição pública ou da entidade privada, desde que esteja em processo comprovado de desenvolvimento, transferência e absorção de tecnologia, nos termos do inciso XXXII do artigo 24 da Lei nº 8.666, de 21 de junho de 1993. (Origem: PRT MS/GM 2531/2014, Art. 53) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º No caso do produto possuir registro sanitário em nome da entidade privada e estar em processo de transferência de tecnologia, a instituição pública deverá possuir todas as informações técnicas e cópia de inteiro teor do dossiê do referido registro aprovado pela ANVISA, assim como a documentação requerida para sua eventual atualização. (Origem: PRT MS/GM 2531/2014, Art. 53, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º Da primeira aquisição do produto objeto da PDP, a instituição pública terá o prazo de 60 (sessenta) dias para apresentar à ANVISA o pedido de registro, em seu nome, do produto objeto da PDP, nos termos da Resolução da Diretoria Colegiada (RDC) nº 31/ANVISA, de 29 de maio de 2014, e da RDC nº 43/ANVISA, de 19 de setembro de 2014, quando aplicáveis, e demais regulamentações da ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 53, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º A instituição pública terá o prazo de 30 (trinta) dias, contados do término do prazo de que trata o art. 53, § 2º , para encaminhar ao Ministério da Saúde a cópia do protocolo da referida documentação apresentada junto à ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 53, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 54. Após 1 (um) ano da primeira aquisição do produto objeto da PDP, o Ministério da Saúde apenas efetuará novas aquisições mediante comprovação pela instituição pública de que possui o registro sanitário do referido produto junto à ANVISA e da evolução das etapas de desenvolvimento, transferência e absorção de tecnologia, conforme cronograma aprovado no projeto executivo e eventuais alterações. (Origem: PRT MS/GM 2531/2014, Art. 54) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 55. A aquisição do produto objeto da PDP se dará entre o Ministério da Saúde e a instituição pública, por meio de instrumento específico, e será realizada após observância e reanálise dos seguintes itens: (Origem: PRT MS/GM 2531/2014, Art. 55) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - quanto à capacidade de atendimento: (Origem: PRT MS/GM 2531/2014, Art. 55, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) serão verificadas as condições técnicas da instituição pública, junto à entidade privada, de entregar o produto nos quantitativos, termos e condições preconizados pelas áreas finalísticas do Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 55, I, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) será verificada a capacidade da instituição pública de fornecer o produto nas apresentações e formas farmacêuticas e nas especificações técnicas solicitadas pelo Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 55, I, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - será considerada a demanda do Ministério da Saúde à época de aquisição do produto objeto de PDP; e (Origem: PRT MS/GM 2531/2014, Art. 55, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - quanto aos preços, economicidade e vantajosidade: (Origem: PRT MS/GM 2531/2014, Art. 55, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) os preços estabelecidos para a aquisição de produto objeto da PDP considerarão o aporte tecnológico associado à internalização da produção e serão decrescentes em termos reais, podendo sofrer variação, nos períodos e na forma da legislação pertinente, de forma a levar em conta a flutuação nos preços médios de mercado nacionais e internacionais, a variação de preços medidas pelo IPCA ou por indicadores oficiais setoriais, a variação da taxa cambial quando envolver importações no período de transferência, considerando-se economias e sistemas de saúde similares aos do Brasil e, no que couber, as normas e critérios adotados pela CMED; (Origem: PRT MS/GM 2531/2014, Art. 55, III, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) considerar-se-á na avaliação de preços, quando cabível, as estimativas de valores de mercado para produtos que estejam próximos ao período de expiração da patente e a redução relevante de preços de mercado decorrente de estratégias de competição das empresas; e (Origem: PRT MS/GM 2531/2014, Art. 55, III, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) a economicidade e vantajosidade do processo deve ser analisada tendo como referência as orientações estabelecidas no art. 14, VIII. (Origem: PRT MS/GM 2531/2014, Art. 55, III, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º A análise de preços referenciada na proposta de projeto da PDP servirá como referencial para definição do preço de aquisição a ser praticado pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 55, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A Secretaria do Ministério da Saúde responsável pela execução do instrumento específico de aquisição do produto objeto da PDP junto à instituição pública deverá, em conjunto com a Secretaria-Executiva (SE/MS), realizar a análise de preços a serem praticados com o apoio técnico da SCTIE/MS, em procedimento administrativo distinto do processo de PDP. (Origem: PRT MS/GM 2531/2014, Art. 55, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 56. O processo administrativo de aquisição do produto objeto da PDP observará a legislação vigente e conterá toda a documentação necessária para comprovação da existência e regularidade da PDP, inclusive o extrato do termo de compromisso publicado no DOU e os documentos citados nesta Seção. (Origem: PRT MS/GM 2531/2014, Art. 56) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A aquisição do produto objeto da PDP será efetuada mediante a celebração de contrato plurianual compatível com o cronograma da PDP, respeitando-se a legislação vigente. (Origem: PRT MS/GM 2531/2014, Art. 56, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 57. Verificada a capacidade de fornecimento, pela instituição pública, do produto objeto da PDP e para fins de sua aquisição, a SCTIE/MS encaminhará os seguintes documentos à Secretaria do Ministério da Saúde responsável pela sua aquisição: (Origem: PRT MS/GM 2531/2014, Art. 57) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - cópia da página do DOU contendo a publicação da Resolução da ANVISA referente à concessão do registro sanitário do produto objeto da PDP; (Origem: PRT MS/GM 2531/2014, Art. 57, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - cópia do CBPF do local de fabricação constante do registro sanitário; (Origem: PRT MS/GM 2531/2014, Art. 57, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - cópia do extrato do termo de compromisso; e (Origem: PRT MS/GM 2531/2014, Art. 57, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - nota técnica elaborada pela SCTIE/MS contendo, no mínimo, os seguintes itens: (Origem: PRT MS/GM 2531/2014, Art. 57, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) instituição pública e entidade privada envolvida na PDP; (Origem: PRT MS/GM 2531/2014, Art. 57, IV, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) objeto e objetivo da PDP, especificando-se o produto envolvido, as apresentações, a forma farmacêutica e o estágio da transferência de tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 57, IV, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) prazo previsto pela instituição pública para a internalização da tecnologia; e (Origem: PRT MS/GM 2531/2014, Art. 57, IV, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) declaração dos sujeitos participantes de concordância de atendimento dos objetivos do projeto para desenvolvimento, transferência e absorção de tecnologia nos termos deste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 57, IV, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A Secretaria do Ministério da Saúde responsável pela aquisição do produto objeto da PDP poderá requerer da SCTIE/MS, caso seja de sua posse ou competência, outras informações e documentos que sejam necessários para a devida instrução do procedimento de aquisição. (Origem: PRT MS/GM 2531/2014, Art. 57, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 58. A proposta de alteração do cronograma da PDP, quando iniciado o processo de aquisição, será apresentada oficialmente pela instituição pública, com justificativas fundamentadas, à SCTIE/MS. (Origem: PRT MS/GM 2531/2014, Art. 58) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Caso a proposta de alteração impactar na ampliação do período de aquisição de produto objeto da PDP conforme previsto no cronograma vigente, a SCTIE/MS encaminhará a proposta à Comissão Técnica de Avaliação e ao Comitê Deliberativo para avaliação e à Secretaria-Executiva do Ministério da Saúde (SE/MS) para decisão. (Origem: PRT MS/GM 2531/2014, Art. 58, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Seção IV
Da Internalização da Tecnologia
(Origem: PRT MS/GM 2531/2014, CAPÍTULO IV, Seção IV)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 59. Após finalização da PDP e concluído o processo de desenvolvimento, transferência e absorção de tecnologia pela instituição pública e entidade privada, as aquisições do produto que foi objeto de PDP não serão mais realizadas sob o rito disciplinado na Seção anterior. (Origem: PRT MS/GM 2531/2014, Art. 59) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Nos casos previstos de impossibilidade das instituições públicas suprirem integralmente a demanda do Ministério da Saúde, proceder-se-á a processo licitatório para complementariedade do quantitativo necessário ao SUS. (Origem: PRT MS/GM 2531/2014, Art. 59, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 60. Comprovada a internalização de tecnologia, a instituição pública poderá, com a devida motivação analisada pelo Ministério da Saúde, transferir a tecnologia objeto de PDP a outra instituição pública para fins de atendimento às necessidades do SUS. (Origem: PRT MS/GM 2531/2014, Art. 60) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO V
DO MONITORAMENTO E AVALIAÇÃO
(Origem: PRT MS/GM 2531/2014, CAPÍTULO V)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 61. Cada PDP será monitorada de forma contínua desde o projeto de PDP até a internalização da tecnologia para fins de verificação dos avanços esperados no processo produtivo, desenvolvimento, transferência e absorção de tecnologia. (Origem: PRT MS/GM 2531/2014, Art. 61) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 62. O monitoramento e a avaliação dos projetos de PDP e das PDP observará a ocorrência ou não do: (Origem: PRT MS/GM 2531/2014, Art. 62) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - cumprimento do cronograma da PDP estabelecido no projeto executivo; e (Origem: PRT MS/GM 2531/2014, Art. 62, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - cumprimento das obrigações e responsabilidades definidas durante as fases do processo para o estabelecimento de PDP. (Origem: PRT MS/GM 2531/2014, Art. 62, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 63. O monitoramento técnico da capacitação, das atividades tecnológicas e produtivas, do projeto executivo e seu cronograma, do processo técnico de transferência de tecnologia e do desenvolvimento das capacidades da instituição pública para o novo patamar tecnológico, no âmbito da PDP, será realizado pela SCTIE/MS, com participação da ANVISA, mediante a atuação dos CTR, e com base em instrumentos e metodologias específicas, envolvendo-se as seguintes dimensões: (Origem: PRT MS/GM 2531/2014, Art. 63) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - monitoramento técnico da capacitação e atividades tecnológicas e produtivas requeridas para a regulação sanitária, a cargo da ANVISA, mediante a atuação dos CTR, e com base em instrumentos e metodologias específicas; (Origem: PRT MS/GM 2531/2014, Art. 63, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - monitoramento do projeto executivo, do processo técnico de transferência e de absorção de tecnologia e do desenvolvimento das capacidades da instituição pública para o novo patamar tecnológico, com base em instrumentos e metodologias específicas, sendo subsidiado pelas atividades previstas no inciso I do "caput", a cargo da SCTIE/MS; (Origem: PRT MS/GM 2531/2014, Art. 63, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - análise de relatórios de acompanhamento enviados quadrimestralmente pela instituição pública ao Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 63, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - realização de visitas técnicas anuais conjuntas nas unidades fabris públicas e privadas pelo Ministério da Saúde e ANVISA. (Origem: PRT MS/GM 2531/2014, Art. 63, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 64. Os projetos de PDP e as PDP que estejam em desacordo com requisitos, critérios, diretrizes e orientações estabelecidos e sejam identificados pelos mecanismos de monitoramento e avaliação instituídos neste Anexo serão suspensos pela SCTIE/MS para posterior análise das Comissões Técnicas de Avaliação e decisão do Comitê Deliberativo quanto à sua: (Origem: PRT MS/GM 2531/2014, Art. 64) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - reestruturação: se for verificada a inobservância dos requisitos, critérios, diretrizes e orientações estabelecidos neste Anexo que comprometa os objetivos da PDP; ou (Origem: PRT MS/GM 2531/2014, Art. 64, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - extinção: (Origem: PRT MS/GM 2531/2014, Art. 64, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) se for efetuado dano à Administração Pública ou sua utilização em desacordo com os objetivos previstos neste Anexo; ou (Origem: PRT MS/GM 2531/2014, Art. 64, II, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) se for descumprido de modo relevante e com risco de irreversibilidade o cronograma estabelecido na PDP, inclusive para efetivação do desenvolvimento, transferência e absorção de tecnologia em condições de portabilidade, sem justificativa de fatores alheios aos esforços dos participantes. (Origem: PRT MS/GM 2531/2014, Art. 64, II, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º A suspensão de que trata o "caput" será comunicada pela SCTIE/MS à Secretaria do Ministério da Saúde responsável pela execução do instrumento específico de aquisição do produto objeto da PDP junto à instituição pública. (Origem: PRT MS/GM 2531/2014, Art. 64, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A adoção das medidas previstas neste artigo não exclui a aplicação de outras sanções e penalidades previstas na legislação vigente. (Origem: PRT MS/GM 2531/2014, Art. 64, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 65. A instituição pública e a entidade privada ficarão sujeitas a medidas administrativas e judiciais, além de sanções previstas em lei e nos contratos firmados, no caso de PDP que tenha iniciada a aquisição de produtos pelo Ministério da Saúde e a transferência de tecnologia para a instituição pública não seja efetivada, especialmente quando verificado eventual dano ao erário. (Origem: PRT MS/GM 2531/2014, Art. 65) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Ficam ressalvadas do disposto no "caput" as situações de caso fortuito, força maior ou outras hipóteses devidamente fundamentadas de acordo com a legislação vigente, aprovadas pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 65, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO VI
DAS RESPONSABILIDADES INSTITUCIONAIS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO VI)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 66. O Ministério da Saúde é responsável por: (Origem: PRT MS/GM 2531/2014, Art. 66) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - elaborar e revisar a lista de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 66, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - pactuar, junto à Comissão Intergestores Tripartite (CIT), a viabilidade de centralização de aquisição de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 66, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - estimular as instituições públicas a apresentarem propostas de projetos de PDP que se enquadrem na lista de produtos estratégicos para o SUS; (Origem: PRT MS/GM 2531/2014, Art. 66, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - estimular as entidades privadas a participarem das iniciativas que favoreçam o investimento, o desenvolvimento tecnológico, a inovação e a geração de renda e emprego no Brasil de produtos estratégicos para o SUS, mediante sua participação em PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - receber e formalizar as propostas de projeto de PDP, com inclusão de sua manifestação técnica, quando couber, para fins de análise das Comissões Técnicas de Avaliação e discussão e decisão pelo Comitê Deliberativo; (Origem: PRT MS/GM 2531/2014, Art. 66, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - fornecer apoio técnico e administrativo para a realização das atividades das Comissões Técnicas de Avaliação e Comitê Deliberativo; (Origem: PRT MS/GM 2531/2014, Art. 66, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - celebrar o termo de compromisso de cada projeto de PDP aprovado; (Origem: PRT MS/GM 2531/2014, Art. 66, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - monitorar e avaliar os projetos de PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - participar das reuniões do CTR e requerer informações e documentos, inclusive reuniões, da instituição pública e da entidade privada para acompanhamento da implementação do projeto de PDP e sugestão de estratégias para cumprimento; (Origem: PRT MS/GM 2531/2014, Art. 66, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - participar da fase de PDP e cumprir as responsabilidades e obrigações previstas na referida fase; e (Origem: PRT MS/GM 2531/2014, Art. 66, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - divulgar no portal do Ministério da Saúde, disponível no endereço eletrônico www.saude.gov.br, as informações públicas referentes às PDP, contendo, no mínimo, os seguintes dados: (Origem: PRT MS/GM 2531/2014, Art. 66, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
a) leis, decretos, portarias e resoluções relacionadas às PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, XI, a) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
b) modelo de projeto executivo de PDP; (Origem: PRT MS/GM 2531/2014, Art. 66, XI, b) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
c) modelo de relatório de acompanhamento a ser apresentado pela instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 66, XI, c) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
d) relação anual de propostas de projeto de PDP em análise, aprovadas ou não aprovadas; e (Origem: PRT MS/GM 2531/2014, Art. 66, XI, d) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
e) relação anual de projetos de PDP e PDP e respectivos "status" de implementação e execução; e (Origem: PRT MS/GM 2531/2014, Art. 66, XI, e) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
f) relação de produtos de PDP cuja aquisição foi iniciada pelo Ministério da Saúde via PDP, com cópia do extrato de publicação no DOU. (Origem: PRT MS/GM 2531/2014, Art. 66, XI, f) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. Para monitoramento e avaliação do projeto de PDP e da PDP, o Ministério da Saúde contará com o apoio dos órgãos e entidades da Administração Pública. (Origem: PRT MS/GM 2531/2014, Art. 66, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 67. A ANVISA é responsável por: (Origem: PRT MS/GM 2531/2014, Art. 67) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - concluir as análises requeridas no âmbito dos projetos de PDP e de PDP para registro e alteração pós-registro em até 60 (sessenta) dias da data do requerimento; (Origem: PRT MS/GM 2531/2014, Art. 67, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - priorizar, nos termos das normas sanitárias vigentes, as análises requeridas dos produtos objetos das PDP; (Origem: PRT MS/GM 2531/2014, Art. 67, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - acompanhar, dentro das atividades do CTR, o atendimento ao cronograma para obtenção de registro sanitário do medicamento ou produto para a saúde, bem como as alterações pós-registro, para os produtores públicos e privados participantes de uma PDP, em consonância com o termo de compromisso aprovado, desde que atendam todas as normas e exigências sanitárias, acordado formalmente com a SCTIE/MS e demais Secretarias do Ministério da Saúde cujo produto faça parte de seus programas e ações; (Origem: PRT MS/GM 2531/2014, Art. 67, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - acompanhar o cronograma de obtenção ou renovação do CBPF, em consonância com o termo de compromisso aprovado, desde que atendam todas as normas e exigências sanitárias, acordado formalmente com a SCTIE/MS e demais Secretarias do Ministério da Saúde cujo produto faça parte de seus programas e ações; (Origem: PRT MS/GM 2531/2014, Art. 67, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - apoiar a SCTIE/MS com atividades de monitoramento e avaliação do desenvolvimento técnico dos projetos de PDP para atender os requisitos sanitários de qualidade e de internalização da produção no País, utilizando metodologias adequadas para este fim; (Origem: PRT MS/GM 2531/2014, Art. 67, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - realizar visitas técnicas anuais nas unidades fabris das instituições públicas e privadas, integrantes das PDP, junto ao Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 67, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - monitorar tecnicamente a capacitação e as atividades tecnológicas e produtivas requeridas para a regulação sanitária dos produtores públicos e privados, de modo a subsidiar a internalização produtiva e tecnológica do produto objeto da PDP, mediante a atuação dos CTR e outras atividades proativas em que a ANVISA possa contribuir para seus resultados; e (Origem: PRT MS/GM 2531/2014, Art. 67, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - participar das Comissões Técnicas de Avaliação das propostas de projetos de PDP. (Origem: PRT MS/GM 2531/2014, Art. 67, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 68. A instituição pública proponente e executora da PDP é responsável por: (Origem: PRT MS/GM 2531/2014, Art. 68) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - elaborar e apresentar a proposta de projeto de PDP em observância aos critérios, requisitos, diretrizes e orientações deste Anexo, contendo, no mínimo, os dados solicitados conforme modelo de projeto executivo; (Origem: PRT MS/GM 2531/2014, Art. 68, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - demonstrar a capacidade produtiva, os equipamentos e os recursos humanos necessários para execução do projeto de PDP na instituição pública, efetuando as adequações pertinentes para efetivação da transferência de tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 68, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - realizar a análise de risco do projeto; (Origem: PRT MS/GM 2531/2014, Art. 68, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - enviar o projeto executivo de PDP à SCTIE/MS para análise, atendendo os prazos definidos neste Anexo; (Origem: PRT MS/GM 2531/2014, Art. 68, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - apresentar oralmente a proposta de projeto de PDP para as Comissões Técnicas de Avaliação e Comitê Deliberativo, após manifestação formal do Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 68, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - celebrar o termo de compromisso com o Ministério da Saúde; (Origem: PRT MS/GM 2531/2014, Art. 68, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - celebrar contratos ou outros instrumentos jurídicos com colaboradores e parceiros do projeto de PDP, seguindo os critérios e orientações deste Anexo e as premissas integrantes do termo de compromisso celebrado, sem prejuízos do acréscimo de outras condições necessárias ao bom atendimento do interesse público, em observância à legislação pertinente; (Origem: PRT MS/GM 2531/2014, Art. 68, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - peticionar o dossiê de registro do produto junto à ANVISA conforme normativos específicos da referida entidade e cronograma estabelecido; (Origem: PRT MS/GM 2531/2014, Art. 68, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - garantir, junto a seu parceiro privado, a internalização da produção nacional do IFA, componente tecnológico crítico e, quando aplicável, o atendimento à regra de origem e/ou PPB; (Origem: PRT MS/GM 2531/2014, Art. 68, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - acompanhar, monitorar e avaliar as ações desempenhadas pela entidade privada para a transferência de tecnologia e para o efetivo cumprimento do cronograma técnico-regulatório; (Origem: PRT MS/GM 2531/2014, Art. 68, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - participar ativamente do desenvolvimento dos produtos junto à entidade privada, acompanhando todo ciclo tecnológico; (Origem: PRT MS/GM 2531/2014, Art. 68, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XII - realizar treinamentos para sua equipe, coordenada junto aos parceiros privados, a fim de absorver os conhecimentos necessários para a efetiva transferência de tecnologia do produto objeto da PDP, sendo a sua efetividade prática avaliada periodicamente, os registros dos treinamentos mantidos e os cronogramas oficializados ao Ministério da Saúde, estando disponíveis durante as visitas técnicas; (Origem: PRT MS/GM 2531/2014, Art. 68, XII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIII - participar das visitas técnicas na entidade privada em conjunto com o Ministério da Saúde e a ANVISA; (Origem: PRT MS/GM 2531/2014, Art. 68, XIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIV - solicitar as priorizações de análise junto à ANVISA após petição de registro ou alteração pós-registro; (Origem: PRT MS/GM 2531/2014, Art. 68, XIV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XV - cumprir o cronograma do projeto de PDP definido, comunicando e justificando ao Ministério da Saúde qualquer alteração necessária; (Origem: PRT MS/GM 2531/2014, Art. 68, XV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XVI - enviar ao Ministério da Saúde, especificamente à SCTIE/MS, relatórios de acompanhamento quadrimestrais para os projetos de PDP aprovados, demostrando as atividades do projeto executadas, em andamento e previstas, apresentando justificativas fundamentadas em caso de alteração do cronograma apresentado no projeto executivo; (Origem: PRT MS/GM 2531/2014, Art. 68, XVI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XVII - colaborar e fornecer a documentação necessária para a visita técnica do Ministério da Saúde e ANVISA na instituição pública; (Origem: PRT MS/GM 2531/2014, Art. 68, XVII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XVIII - participar das reuniões do CTR e do Ministério da Saúde, sempre que requerida; (Origem: PRT MS/GM 2531/2014, Art. 68, XVIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIX - celebrar instrumento específico com o Ministério da Saúde para fornecimento de produtos no âmbito da PDP, respeitando as legislações pertinentes e os termos deste Anexo; e (Origem: PRT MS/GM 2531/2014, Art. 68, XIX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XX - garantir o fornecimento e entrega dos produtos conforme quantitativo e cronograma definidos pelo Ministério da Saúde. (Origem: PRT MS/GM 2531/2014, Art. 68, XX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Parágrafo Único. A escolha e as relações contratuais com a entidade privada são de inteira responsabilidade da instituição pública produtora celebrante da PDP, inclusive com relação à sua qualificação e à avaliação da regularidade de sua situação legal e idoneidade. (Origem: PRT MS/GM 2531/2014, Art. 68, Parágrafo Único) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 69. Para participar da proposta de projeto de PDP, do projeto de PDP e da PDP, a entidade privada deverá: (Origem: PRT MS/GM 2531/2014, Art. 69) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
I - participar da proposta de projeto de PDP em observância aos critérios, requisitos, diretrizes e orientações deste Anexo, contendo, no mínimo, os dados solicitados conforme modelo de projeto executivo; (Origem: PRT MS/GM 2531/2014, Art. 69, I) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
II - demonstrar a capacidade produtiva, os equipamentos e os recursos humanos necessários para participação no projeto de PDP, efetuando as adequações pertinentes para efetivação da transferência de tecnologia; (Origem: PRT MS/GM 2531/2014, Art. 69, II) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
III - celebrar contratos ou outros instrumentos jurídicos com a instituição pública e parceiros privados do projeto de PDP, seguindo os critérios, requisitos, diretrizes e orientações deste Anexo e as premissas integrantes do termo de compromisso celebrado, sem prejuízos do acréscimo de outras condições necessárias ao bom atendimento do interesse público, em observância à legislação pertinente; (Origem: PRT MS/GM 2531/2014, Art. 69, III) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IV - garantir no projeto executivo, na esfera de sua responsabilidade, a internalização da produção nacional do IFA, componente tecnológico crítico e, quando aplicável, o atendimento à regra de origem e/ou PPB; (Origem: PRT MS/GM 2531/2014, Art. 69, IV) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
V - garantir a transferência de tecnologia e o efetivo cumprimento do cronograma técnico-regulatório sob sua responsabilidade; (Origem: PRT MS/GM 2531/2014, Art. 69, V) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VI - participar ativamente do desenvolvimento dos produtos junto à instituição pública e aos parceiros privados; (Origem: PRT MS/GM 2531/2014, Art. 69, VI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VII - realizar treinamentos a fim de transferir os conhecimentos necessários para o efetivo desenvolvimento e transferência de tecnologia do produto objeto da PDP, efetuando os registros dos treinamentos e os cronogramas oficializados ao Ministério da Saúde, estando disponíveis durante as visitas técnicas; (Origem: PRT MS/GM 2531/2014, Art. 69, VII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
VIII - receber visitas técnicas periódicas das equipes do Ministério da Saúde e da ANVISA, em consonância com as metodologias utilizadas, colaborando e fornecendo a documentação necessária; (Origem: PRT MS/GM 2531/2014, Art. 69, VIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
IX - peticionar, quando couber, o dossiê de registro do produto e alterações pós-registro junto à ANVISA, conforme sua regulamentação específica; (Origem: PRT MS/GM 2531/2014, Art. 69, IX) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
X - cumprir o cronograma do projeto de PDP aprovado, definindo junto ao parceiro público a possibilidade de qualquer alteração nele necessária; (Origem: PRT MS/GM 2531/2014, Art. 69, X) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XI - informar periodicamente à instituição pública, conforme cronograma definido, as atividades do projeto executadas, em andamento e previstas, auxiliando a instituição pública na elaboração dos relatórios de acompanhamento quadrimestrais e das justificativas fundamentadas em caso de alteração do cronograma e enviando à instituição pública documentos sobre o andamento do projeto e das atividades inerentes para sua efetivação, visando o atendimento do interesse público e das suas finalidades, entre as quais se incluem a transferência de tecnologia, a garantia de fornecimento e a produção local do insumo; (Origem: PRT MS/GM 2531/2014, Art. 69, XI) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XII - garantir o fornecimento e entrega dos produtos conforme quantitativo e cronograma definidos pela instituição pública para atender as demandas do Ministério da Saúde; e (Origem: PRT MS/GM 2531/2014, Art. 69, XII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
XIII - firmar a declaração conjunta de concordância aos termos da proposta de projeto de PDP, conforme disposto no art. 14, § 3º , e a declaração de concordância anexa ao termo de compromisso, nos termos do art. 35. (Origem: PRT MS/GM 2531/2014, Art. 69, XIII) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
CAPÍTULO VII
DAS DISPOSIÇÕES FINAIS
(Origem: PRT MS/GM 2531/2014, CAPÍTULO VII)
(Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 70. As orientações, critérios, requisitos, diretrizes e formas de monitoramento e avaliação definidos neste Anexo são aplicáveis, no que couber, às PDP vigentes. (Origem: PRT MS/GM 2531/2014, Art. 70) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 1º Fica concedido o prazo de 180 (cento e oitenta) dias, a partir da data de publicação da Portaria nº 2531/GM/MS, de 12 de novembro de 2014, para adequação pelas instituições públicas e entidades privadas, no que couber, das PDP em vigor ao disposto no "caput". (Origem: PRT MS/GM 2531/2014, Art. 70, § 1º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 2º A SCTIE/MS efetuará a classificação das PDP vigentes conforme as fases de estabelecimento de PDP previstas no art. 10. (Origem: PRT MS/GM 2531/2014, Art. 70, § 2º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 3º Para as PDP vigentes de pesquisa e desenvolvimento que estejam em fase de desenvolvimento, transferência e absorção de tecnologia, a instituição pública poderá solicitar à SCTIE/MS a sua adequação para enquadramento como projeto de PDP ou PDP, nos termos deste Anexo, para fins de análise pela Comissão Técnica de Avaliação e pelo Comitê Deliberativo. (Origem: PRT MS/GM 2531/2014, Art. 70, § 3º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
§ 4º As propostas de projeto de PDP em tramitação no Ministério da Saúde nos termos da Portaria nº 837/GM/MS, de 18 de abril de 2012, e ainda não avaliadas pelas Comissões Gestoras serão restituídas pela SCTIE/MS às instituições proponentes para fins de adequação ao regramento disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 70, § 4º) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 71. Na hipótese de existência de contratos vigentes entre o Ministério da Saúde e as instituições públicas para aquisição de produtos estratégicos até a data de publicação da Portaria nº 2531/GM/MS, de 12 de novembro de 2014, os referidos contratos serão adequados, no que couber, ao regramento disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 71) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 72. Na hipótese de existência de acordo ou contrato de desenvolvimento, transferência e absorção de tecnologia do produto objeto da PDP entre as instituições públicas e as entidades privadas até a data de publicação da Portaria nº 2531/GM/MS, de 12 de novembro de 2014, os referidos acordos contratos serão adequados, no que couber, ao regramento disposto neste Anexo. (Origem: PRT MS/GM 2531/2014, Art. 72) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
Art. 73. Até a edição da nova lista de produtos estratégicos para o SUS de que trata o art. 7º, permanecerá vigente a lista definida nos termos do art. 6º da Portaria nº 3.089/GM/MS, de 11 de dezembro de 2013. (Origem: PRT MS/GM 2531/2014, Art. 74) (Revogado pela PRT GM/MS n° 4.472 de 20.06.2024)
ANEXO XCVI
PROGRAMA NACIONAL DE COMPETITIVIDADE EM VACINAS (INOVACINA) (Origem: PRT MS/GM 972/2006, Anexo 1)
PROGRAMA NACIONAL DE COMPETITIVIDADE EM VACINAS (INOVACINA)
Este Programa, gerado no âmbito do INOVAÇÂO EM SAÚDE/ FIOCRUZ, consta de quatro componentes:
A) Definição de políticas e organização da produção.
B) Modernização do parque produtivo.
C) Avaliação e regulação.
D) Desenvolvimento e inovação.
Esta versão do Programa “Inovacina” resume as conclusões de amplo processo de discussão em Oficinas de Trabalho, envolvendo os diversos setores, que se desenvolveu a partir da apresentação de textos produzidos por especialistas. Em cada componente são indicados “Propósitos”, “Objetivos” e “Instrumentos”. Expressam a síntese das discussões e as opiniões implícitas devem ser creditadas ao coletivo de gestores, produtores e acadêmicos que participaram do processo. Foram quase duzentos participantes providos de interesse (“stakeholders”), compondo o que se tem internacionalmente chamado a hélice tripla (“triple helix”). Em “Instrumentos” são detalhadas as propostas de ação concreta em cada componente.
COMPONENTE A:
Definição de políticas e organização da produção
PROPÓSITOS
1. Estabelecer o Programa Nacional de Competitividade em Vacinas (INOVACINA), coordenado pelo Ministério da Saúde (MS).
2. Estabelecer um espaço estratégico e permanente de discussão e definição de políticas, indicando nichos para cada instituição produtora, no âmbito do Programa.
3. Investir nos mecanismos de coordenação e de formação de rede inter-institucional, propiciando a formação de consórcio para integração dos produtores e incentivando-os a adotar estrutura jurídica que garanta uma maior flexibilidade e autonomia, facilitando a integração e a cooperação.
4. Fortalecer a capacidade produtiva nacional, para atender à demanda de vacinas essenciais para o Programa Nacional de Imunizações (PNI).
5. Promover mudanças na atual modalidade de financiamento da produção de imunobiológicos, empregando o poder de compra do Ministério da Saúde como instrumento de regulação de preços.
OBJETIVOS
1. Contribuir na definição das políticas científica, tecnológica, industrial e sanitária na área de vacinas e imunizações.
2. Dinamizar o crescimento do segmento, aumentando a sua capacidade tecnológica e o sinergismo entre os produtores públicos, garantindo competitividade e auto-sustentabilidade tecnológica e econômica do Programa.
3. Garantir a integração entre os atores do processo, coordenando as diversas etapas do desenvolvimento dos projetos específicos de vacinas e propiciando a utilização da plena capacidade instalada e de pessoal, visando à redução dos custos fixos de produção para suprir as necessidades nacionais e favorecer a exportação.
4. Garantir o aproveitamento das potencialidades de cada produtor, o aumento das possibilidades de negócio e a eliminação das restrições legais para exportação, propiciando ainda a internalização de vacinas que incorporem tecnologia avançada.
5. Fortalecer o entendimento das peculiaridades do setor de vacinas, propiciando a melhoria do fluxo de recursos financeiros, propor mudança no mecanismo de preços praticado pelo governo, pleiteando a obtenção de um excedente para investimentos que permitam atingir a auto-suficiência.
6. Estreitar o relacionamento dos produtores com o Ministério da Saúde, garantindo a prioridade da área e a regularidade nos desembolsos.
7. Melhorar a capacitação de pesquisadores e tecnologistas na pesquisa básica, desenvolvimento tecnológico, ensaios clínicos, propriedade intelectual, produção e gestão de projetos na perspectiva da inovação, incluindo a formação e a capacitação de pessoal estratégico (multidisciplinar) em vacinas, particularmente na engenharia de processos e nas funções de regulação.
8. Atuar no sentido de garantir a melhoria do regime de contratação de pessoal para continuidade e preservação dos grupos.
INSTRUMENTOS
1. Formalizar o Programa, contendo as estratégias e as proposições resultantes das Oficinas de Trabalho realizadas pelo “Projeto Inovação/FIOCRUZ”, e estabelecendo mecanismos regulares de consulta dos Ministérios entre si, com a Câmara Técnica e os produtores.
2. Propor o financiamento da FINEP e do BNDES para produtores públicos e modelos alternativos de financiamento que permitam a garantia de transferência de recursos financeiros.
3. Providenciar instrumentos legais (portarias) criando o INOVACINA e a Câmara Técnica de Imunobiológicos e nomeando os seus componentes.
4. Lançamento formal do Programa, pelo Presidente da República.
5. Levar o Programa ao conhecimento do Conselho Nacional de Saúde, da CIT e do Congresso Nacional, além de divulgá-lo amplamente à sociedade pela mídia.
6. Publicar livro com todas as contribuições e conclusões.
7. Incluir o Programa na agenda do Mercosul.
8. Definir o modelo jurídico institucional que formalize a integração em redes de cooperação e propiciar a utilização pelos participantes de Modelo Integrado de Gestão e de controle dos custos.
9. Solicitar a utilização de bolsas RHAE em instituições públicas produtoras e propor mecanismos especiais para fixação de doutores na área, além de incentivar a formação de programas de pós-graduação, incluindo a temática do desenvolvimento e a produção de imunobiológicos.
10. Propor uma série de medidas que garantam a consolidação do Programa, entre elas:
a) buscar orientação legal para utilizar o poder de compra do Ministério da Saúde em área de interesse público estratégico;
b) pleitear a alocação na área de vacinas de recursos dos Fundos Setoriais de Saúde, de Biotecnologia e de outras fontes como QUALISUS, fundações estaduais etc.,
c) propor a criação de Fundo de Capital de Giro, capitalizado pelo governo para o caso de falta de regularidade no fluxo de recursos;
d) buscar a utilização de Fundações pela maior flexibilidade nas compras;
e) integrar os esforços dos fóruns de competitividade do MDIC relacionados com a produção de fármacos e biotecnologia; e
f) acompanhar os trabalhos do Congresso Nacional na regulamentação das leis de “Inovação” e da “Parcerias Público Privado (PPP)”.
COMPONENTE B:
Modernização e Certificação do parque produtivo
PROPÓSITOS
1. Avaliar as necessidades de modernização em cada nicho.
2. Viabilizar a modernização das instalações de cada nicho.
3. Fortalecer o sistema nacional de controle de qualidade em vacinas e implantar sistema de garantia de qualidade.
OBJETIVOS
1. Garantir a qualidade da produção local para atender às necessidades internas (qualitativas e quantitativas), substituindo importações e propiciando ingresso no mercado mundial.
2. Aumentar a competitividade externa dos produtores nacionais, visando à superação das barreiras sanitárias para exportação.
3. Garantir a certificação das plantas industriais no âmbito do INOVACINA, com medidas que fortaleçam o sistema de controle e garantia de qualidade das vacinas produzidas.
INSTRUMENTOS
1. Implementar infra-estrutura para cumprimento das BPF (GMP) adequadas ao padrão internacional e propícias ao desenvolvimento de novas vacinas.
2. Garantir a aquisição para substituir equipamentos obsoletos e atingir porte tecnológico.
3. Definir fontes de financiamento e garantir o planejamento para a alocação dos recursos.
4. Viabilizar a articulação dos produtores com o BNDES, a FINEP e os programas de investimento do MS e dos Estados.
5. Pleitear a eliminação das restrições impostas ao financiamento das instituições públicas produtoras de bens e serviços pelos órgãos públicos de fomento.
6. Elaborar Plano de Certificação, pela ANVISA e a OMS, de cada produto e de cada planta no âmbito do Programa, detalhando etapas e custos.
7. Utilizar produtor âncora para capacitação dos profissionais de outras instituições no processo de certificação.
8. Garantir compras compartilhadas ou centralizadas, no âmbito do Programa, de produtos e serviços a um custo menor.
9. Integrar-se no esforço de constituição de um Sistema de Controle e Garantia de Qualidade para os produtos incluídos no Programa
COMPONENTE C: Avaliação e Regulação
PROPÓSITOS
1. Estabelecer infra-estrutura nacional para ensaios (clínicos e não-clínicos) de imunobiológicos (Rede Brasileira de Ensaios);
2. Buscar a incorporação da propriedade intelectual nas estratégias de desenvolvimento, gestão e produção;
3. Desencadear processo de discussão visando à adaptação da legislação regulatória de imunobiológicos à realidade brasileira.
OBJETIVOS
1. Fortalecer as atividades de ensaios (pré-clínicos, clínicos e epidemiológicos) em instituições públicas.
2. Difundir a discussão da importância da propriedade intelectual entre pesquisadores e produtores.
3. Desencadear ações visando à construção de conceitos que possam vir a mudar a legislação sobre ensaios clínicos e pré-clínicos e as exigências para registro de imunobiológicos.
INSTRUMENTOS
1. Promover seminários de âmbito nacional para discutir proposta de um programa para o desenvolvimento de ensaios (pré- clínicos, clínicos e epidemiológicos) dos imunobiológicos desenvolvidos no âmbito do Programa.
2. Retomar e formalizar os contatos já existentes entre instituições públicas que têm participado em Ensaios de Vacinas produzidas pelos produtores públicos nacionais.
3. Propor e desenvolver um projeto completo para a Rede Brasileira de Ensaios de Vacinas, no âmbito do Programa;
4. Estabelecer contato com centros do exterior envolvidos no esforço de realização de ensaios clínicos independentes, com financiamento exclusivamente público ou de instituições filantrópicas, à semelhança da “European Science Foundation” com seu “Pan-European Clinical Trials”.
5. Estabelecer relacionamento com as instâncias nacionais que se têm preocupado com a questão da propriedade intelectual para orientar os produtores a trabalhar com vacinas patenteadas a partir de acordo comercial ou licença, compatíveis com o TRIPS.
6. Estabelecer mecanismo permanente de consulta aos bancos de patentes de produtos que possam ser incluídos no Programa.
7. Desenvolver mecanismos para fortalecer as áreas de gestão de tecnologia das instituições participantes, incluindo a Propriedade Intelectual, com vistas a patentear os resultados do desenvolvimento de produtos e processos no âmbito do Programa.
8. Promover estudos visando a uma Consulta Pública para revisão da legislação de registro dos produtos gerados no âmbito do Programa.
COMPONENTE D: Desenvolvimento e Inovação
PROPÓSITOS
1. Incorporar a inovação na estratégia das organizações, visando ao desenvolvimento autônomo (e/ou à internalização) de tecnologias mais avançadas com alto valor agregado.
2. Definir um conjunto de vacinas prioritárias, incluindo adjuvantes e plataformas de aplicação de cada vacina.
3. Selecionar nichos tecnológicos prioritários, formação de redes e fortalecimento das instituições âncora.
OBJETIVOS
1. Articular as ações de saúde com ações de competitividade, elaborando uma agenda de pesquisa em vacinas com base nas prioridades públicas explícitas da política nacional de saúde.
2. Garantir a coordenação das atividades no âmbito do Programa, integrando pesquisa básica, desenvolvimento tecnológico, ensaios clínico-epidemiológicos, produção, regulamentação e mercado, levando em conta que as parcerias mudam em cada etapa.
3. Definir as rotas tecnológicas e a coordenação das atividades do ciclo de desenvolvimento dos produtos.
4. Estimular a criação de empresas autônomas de biotecnologia e o desenvolvimento desse setor nas organizações envolvidas no programa, especialmente, não apenas nas âncoras.
INSTRUMENTOS
1. Capacitar os produtores para o estabelecimento de estratégias competitivas de inovação e de penetração no mercado internacional.
2. Realizar estudos (custo-benefício, carga de doença, epidemiológicos pós-licenciamento) para orientar a definição das prioridades.
3. Identificar os principais gargalos para o desenvolvimento de cada vacina.
4. Contemplar sempre a transferência de tecnologia (internalização) como alternativa possível de desenvolvimento dos produtos.
5. Definir os cronogramas e as responsabilidades para cada produto proposto no âmbito do Programa.
6. Propor a adoção de incentivos financeiros para os produtores como garantia para o esforço de desenvolvimento de novas vacinas: incentivos fiscais; cartas-compromisso garantindo a aquisição do produto;financiamento para os grupos de gestão de projetos e das redes; criação de uma “alíquota de inovação” (o preço do produto vendido para o MS acrescido de um percentual de inovação); e inclusão nos orçamentos dos produtores de elemento capaz de assegurar o esforço de P&D etc.
ANEXO XCVII
TERMO DE ADESÃO (Origem: PRT MS/GM 1708/2013, Anexo 2)
Termo de Adesão
(MODELO EM PAPEL TIMBRADO)
UF:
Município (se for o caso):
Secretaria Municipal/Estadual de Saúde de
_________________
A Secretaria Municipal/ Estadual de Saúde de _______________, representada pelo seu Secretário Municipal/Estadual de Saúde, solicita adesão ao Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS), nos termos definidos pela Portaria nº , de de 2013, assumindo as responsabilidades expressas nos compromissos das metas definidas pelo Programa, visando induzir o aperfeiçoamento das ações de vigilância em saúde.
(local), ____, de ______________ de 2013.
__________________________________
GESTOR(A) MUNICIPAL/ ESTADUAL
(Nome e assinatura)
ANEXO XCVIII
METAS E INDICADORES PACTUADOS NO ÂMBITO DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (Origem: PRT MS/GM 2778/2014, Anexo 1)
I - Municípios e Distrito Federal
1. Meta: 90% (noventa por cento) de registros de óbitos alimentados no Sistema de Informações sobre Mortalidade (SIM) até 60 (sessenta) dias após o final do mês de ocorrência. Indicador: proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 (sessenta) dias após o final do mês de ocorrência.
2. Meta: 90% (noventa por cento) de registros de nascidos vivos alimentados no Sinasc até 60 (sessenta) dias após o final do mês de ocorrência.
Indicador: proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 (sessenta) dias após o final do mês de ocorrência.
3. Meta: 80% (oitenta por cento) ou mais de Salas de Vacina com alimentação mensal no SI-PNI, por Município.
Indicador: proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por Município.
4. Meta: 100% (cem por cento) das vacinas do calendário básico de vacinação da criança com a cobertura vacinal preconizada.
Indicador: proporção de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas.
5. Meta: 90% (noventa por cento) do número de análises obrigatórias para o parâmetro coliformes totais realizadas.
Indicador: Proporção de análises realizadas para o parâmetro Coliformes Totais em água para consumo humano.
6. Meta: 50 (cinquenta) semanas epidemiológicas com, pelo menos, uma notificação (positiva, negativa ou de surto), no período de um ano.
Indicador: número de semanas epidemiológicas com informações no Sinan.
7. Meta: 80% (oitenta por cento) de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 (sessenta) dias a partir da data de notificação. Indicador: proporção de casos de doenças de notificação compulsória imediata (DNCI) encerrados em até 60 (sessenta) dias após notificação.
8. Meta: 70% (setenta por cento) dos casos de malária com tratamento iniciado em até 48 (quarenta e oito) horas a partir do início dos sintomas.
Indicador: proporção de casos de malária que iniciaram tratamento em até 48 (quarenta e oito) horas a partir do início dos sintomas.
9. Meta: 4 (quatro) ciclos, dos 6 (seis) preconizados, com mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados para controle vetorial da dengue.
Indicador: número de ciclos que atingiram mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados para controle vetorial da dengue.
10. Meta: 80% (oitenta por cento) dos contatos intradomiciliares dos casos novos de hanseníase, nos anos das coortes, examinados.
Indicador: proporção de contatos intradomiciliares de casos novos de hanseníase examinados.
11. Meta: 80% (oitenta por cento) dos contatos dos casos novos de tuberculose pulmonar bacílífera examinados.
Indicador: proporção de contatos de casos novos de tuberculose pulmonar bacilífera examinados.
12. Meta: 2 (dois) testes de sífilis por gestante.
Indicador: número de testes de sífilis por gestante.
13. Meta: 15% (quinze por cento) de ampliação no número de testes de HIV realizados em relação ao ano anterior.
Indicador: número de testes de HIV realizado.
14. Meta: 90% (noventa por cento) das notificações de agravos e doenças relacionados ao trabalho com o campo "ocupação" preenchido.
Indicador: proporção de preenchimento do campo "ocupação" nas notificações de agravos e doenças relacionados ao trabalho.
II - Estados Ampliar o número de Municípios que alcançam as metas listadas acima.
Metas e Indicadores Pactuados no âmbito do Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS) a partir de 2018
Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Municípios e Distrito Federal Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
1. Meta: 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
2. Meta: 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
3. Meta: 80% de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
4. Meta: 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 1 ano de idade - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ªdose) - e para crianças de 1 ano de idade - Tríplice viral (1ª dose). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de vacinas selecionadas que compõem o Calendário Nacional de Vacinação para crianças menores de 1 ano de idade (Pentavalente - 3ª dose, Poliomielite - 3ª dose, Pneumocócica 10 valente - 2ª dose) e para crianças de 1 ano de idade (tríplice viral - 1ª dose) - com coberturas vacinais preconizadas. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
5. Meta: 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Percentual de amostras analisadas para o residual de agente desinfetante em água para consumo humano (parâmetro: cloro residual livre, cloro residual combinado ou dióxido de cloro). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
6. Meta: 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias, a partir da data de notificação. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
7. Meta: 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para os casos importados). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de casos de malária que iniciaram tratamento em tempo oportuno. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
8. Meta: 4 ciclos de visita domiciliar, dos 6 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
9. Meta: 82% dos contatos dos casos novos de hanseníase, nos anos das coortes, examinados. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de contatos examinados de casos novos de hanseníase diagnosticados nos anos das coortes. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
10. Meta: 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
11. Meta: 2 testes de sífilis por gestante. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Número de testes de sífilis por gestante. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
12. Meta 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Número de testes de HIV realizado. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
13. Meta: 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido de acordo com o código da Classificação Brasileira de Ocupações (CBO). Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
14. Meta: 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
Indicador: Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
ANEXO XCIX
CADERNO DE INDICADORES DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (Origem: PRT MS/GM 2778/2014, Anexo 2)
Indicador 1 - Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 (sessenta) dias após o final do mês de ocorrência.
Indicador 2 - Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 (sessenta) dias após o final do mês de ocorrência.
|
|
- Os parâmetros adotados para estipular o volume esperado de registros de nascidos vivos para os municípios serão definidos com base no desempenho de cada Secretariamunicipal, no que se refere à captação desses eventos nos últimos 3 (três) anos estatísticos encerrados e publicados, conforme os seguintes estratos: I - Municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada adequada, terão o número de nascidos vivos esperados em cada mês calculado a partir do número de registros informados ao Sistema de Informação nos últimos 4 (quatro) anos, projetado por regressão linear simples para o ano em curso; II - Municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada inadequada, terão o número de nascidos vivos esperados em cada mês calculado a partir da aplicação da Taxa Bruta de Natalidade considerada minimamente adequada sobre a população estimada para o Município no ano corrente e, na sua ausência, para o ano anterior. O Ministério da Saúde emitirá anualmente Nota Técnica, apontando: a) em que estrato se enquadra cada Município para as finalidades que preconizam os incisos I e II acima; e b) toda a memória de cálculo do número de nascimentos esperados por ano e por mês, por Município. - A Secretaria de Vigilância em Saúde disponibiliza o número de nascidos vivos esperados por Município no seguinte endereço: http://svs.aids.gov.br/cgiae/sinasc/ no item documentação. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 3 - Proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por município.
Denominador: Número de salas de vacinas do município constante do cadastro do SI-PNI em junho de 2012. Fator de multiplicação: 100. |
|
- Em municípios até 10.000 habitantes, a alimentação do SI-PNI poderá ocorrer no nível central da Secretaria Municipal de Saúde, com a identificação das Salas de Vacinas correspondentes. - Os dados para a avaliação desse indicador levarão em conta o quantitativo de salas de vacinas existentes no Cadastro do Sistema de Informação de Avaliação do Programa Nacional de Imunizações (SIAPI) em junho de 2012, que subsidiou a elaboração da Portaria GM/MS nº 2.363/2012. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 4 - Proporção de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas.
CV BCG-ID = Numerador: nº de doses aplicadas de BCG < 1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Rotavírus Humano (VORH) = Numerador: nº de 2ª doses aplicadas de VORH <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Pentavalente (DTHib HeB) = Numerador: nº de 3ª doses aplicadas de Pentavalente (DTHib HeB) em <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Vacina contra Poliomielite= Numerador: nº de 3ª doses aplicadas de Vacina contra Poliomielite em <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Pneumocócica Conjugada 10v (PnC10v) = Numerador: nº de 3ª doses aplicadas de vacina Pneumocócica Conjugada 10v (PnC10v) em <1ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Meningocócica Conjugada C (MnC) = Numerador: nº de 2ª doses aplicadas de vacina Meningocócica Conjugada C (MnC) em <1 ano de idade. Denominador: população <1 ano de idade. Fator de multiplicação: 100. Vacina Febre Amarela= Numerador: nº de doses da vacina febre amarela em menores de um ano de idade Denominador: população <1 ano de idade. Fator de multiplicação: 100. Aplica-se aos Municípios que fazem parte da Área com Recomendação de Vacinação da Febre Amarela. Tríplice viral = Numerador: nº de doses da vacina Tríplice viral em crianças de 1 ano de idade. Denominador: população 1 ano de idade. Fator de multiplicação: 100. Vacina Tetra viral - 95% Numerador: nº de doses da vacina Tetra viral em crianças de 1 ano de idade. Denominador: população 1 ano de idade. Fator de multiplicação: 100. Influenza = Numerador: nº de doses de vacina Influenza na população de 6 meses < 5 anos de idade. Denominador: população 6 meses < 5anos idade. Fator de multiplicação: 100. Passo 2: calcular a proporção de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas: Numerador: número de vacinas do Calendário Básico de Vacinação da Criança com coberturas vacinais alcançadas, de acordo com as normas do PNI. Denominador: total de vacinas do Calendário Básico de Vacinação da Criança. Fator de multiplicação: 100. |
|
- Em menores de um ano de idade: a) BCG-ID ³90%; b) Vacina Oral de Rotavírus Humano (VORH) ³90%; c) Pentavalente (DTHib HepB) ³95%; d) Vacina contra Poliomielite ³95% (no segundo semestre de 2012, o esquema vacinal passou a utilizar a vacina inativada poliomielite para a 1ª dose (2 meses) epara a 2ª dose (4 meses) e a vacina oral poliomielite para a 3ª dose (6 meses), com reforço aos 15 meses). e) Pneumocócica Conjugada (PnC10v) ³95%; f) Vacina Meningocócica Conjugada C (MnC) ³95%; e g) Vacina Febre Amarela =100%. - Em crianças de um ano de idade: a) Vacina tríplice viral ³95%; e b) Vacina tetra viral ³95%. - Em crianças de 6 meses a <5 anos de idade (CV em campanha anual): Influenza (INF) ³ 80%. Considerar o mês de agosto para avaliação da cobertura vacinal da influenza para o ano em curso. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 5 - Proporção de análises realizadas para o parâmetro Coliformes Totais em água para consumo humano
Denominador: total de amostras obrigatórias para o parâmetro coliformes totais. Fator de multiplicação: 100. |
|
Nesse sentido, orienta-se que o responsável pela vigilância da qualidade da água para consumo humano colete as amostras de água e envie para análise no laboratório de referência. Posteriormente, o responsável pela vigilância deverá inserir os resultados no Sistema de Informação de Vigilância da Qualidade da Água para Consumo Humano (Sisagua). O indicador permite avaliar a eficiência do processo de tratamento, bem como a integridade do sistema de distribuição e canalização. Vale salientar que para as fontes de água utilizadas para consumo humano e que não possuem tratamento, quando detectada a presença de coliformes totais e, tendo em vista a avaliação do atendimento ao padrão microbiológico da água para consumo humano, ressalta-se a necessidade de análise para verificação da presença de Escherichia coli (E. coli). Quando confirmada a positividade para E. coli, medidas corretivas devem ser adotadas, junto ao responsável pelo abastecimento de água ou à população, para garantir que a água atenda os valores de referências estabelecidos pela Portaria nº 2.914/GM/MS ,de 2011. - O número de análises obrigatórias para o parâmetro coliformes totais está previsto na Diretriz Nacional de Vigilância da Qualidade da Água para Consumo Humano, disponível no site da SVS, no seguinte endereço: http://u.saude.gov.br/images/pdf/2014/maio/30/Diretriz-Nacional-do-Plano-de-amostragem-da-Vigilancia-da-qualidade-da-agua-para- consumo-humano.pdf |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 6 - Número de semanas epidemiológicas com informações no Sinan.
- Permite que as três esferas de gestão do SUS possam responder oportunamente às mudanças na situação epidemiológica, com base em relatórios, recomendações einformações públicas para toda a rede de serviços de saúde, levando a medidas de intervenção adequadas. |
|
- A presença dessas informações indica que a vigilância em saúde local está ativa no monitoramento de doenças de notificação compulsória e, no caso de ausência de casos naquela semana, notifica negativamente às demais esferas. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 7 - Proporção de casos de doenças de notificação compulsória imediata (DNCI) encerrados em até 60 (sessenta) dias após notificação.
Denominador: total de registros de DNCI, por unidade de residência, notificados no período da avaliação. Fator de multiplicação: 100. |
|
Antraz pneumônico, Arenavírus, Botulismo, Cólera, Dengue (óbitos), Ebola, Eventos adversos graves ou óbitos pós-vacinação, Febre amarela, Febre de chikungunya, Febre do niloocidental e outras arboviroses de importância em saúde pública, Febre maculosa e outras riquetisioses, Febre purpúrica brasileira, Influenza humana produzida por novo subtipo viral, Lassa, Malária na região extra Amazônica, Marburg, Síndrome da Paralisia Flácida Aguda, Peste, Raiva humana, Rubéola, Sarampo, Síndrome da rubéola congênita, Síndrome respiratória aguda grave associada a coronavírus, Tularemia e Varíola. - Município que não possui registro no Sinan de, pelo menos, uma das doenças de notificação imediata citadas, no ano de análise, não pontua para o PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 8 - Proporção de casos de malária que iniciaram tratamento em até 48h a partir do início dos sintomas.
- Orienta o planejamento das ações para garantir acesso oportuno ao diagnóstico e tratamento de malária. |
|
Denominador: número total de casos de malária sintomáticos por local de notificação, excluídas Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado. Fator de multiplicação: 100. Para processamento dos dados no Sivep-Malária, utilizar os dados disponíveis na base NOTIPOXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: NOTIPO14.dbf); contar número de registros, agrupados por Município (MUN_NOT) ou por unidade da federação (UF_NOT), sendo ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, calcular o percentual de registros com intervalo menor ou igual a 2 dias (48h) em relação ao total de registros selecionados. Para processamento dos dados no Sinan, utilizar os dados disponíveis na base MALANXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: MALAN14.dbf). Contar número de registros, agrupados por Município (ID_MUNICIP) ou por unidade da federação (SG_UF_NOT), sendo AT_LAMINA ? 3 e AT_SINTOMA = 1. Para cada registro criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRATA menos DT_SIN_PRI). Em seguida calcular o percentual de registros com intervalo menor ou igual a 2 dias em relação ao total de registros selecionados. |
|
Sistema de Informação de Agravos de Notificação (Sinan), para os demais Estados. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEV E-mail: dagvs@saude.gov.br |
Indicador 9 - Número de ciclos que atingiram mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados para controle vetorial da dengue.
Numerador: número de imóveis visitados em cada um dos ciclos de visitas domiciliares de rotina para o controle da dengue. Denominador: número de imóveis da base do Reconhecimento Geográfico (RG) atualizado. Fator de multiplicação: 100. 2º passo - Soma do número de ciclos com mínimo de 80% (oitenta por cento) de cobertura de imóveis visitados. |
|
Sistema de Informação do Programa Nacional de Controle da Dengue (SISPNCD). Sistema próprio do Estado ou Município. OBS.: Os Municípios possuem, em âmbito local, os dados referentes ao indicador aqui tratado, registrados no SISFAD, ou no SISPNCD, ou em planilhaseletrônicas próprias, formatadas para a identificação das visitas domiciliares realizadas, por ciclo. A consolidação nacional desses dados, sempre que necessária, será feita por meio de planilha do excel, preenchida pelas SES, com base nos dados levantados junto aos Municípios, e enviada ao Programa Nacional de Controle da Dengue via Formsus. |
|
- O método de cálculo deverá ser aplicado em cada ciclo para verificação da cobertura dos imóveis visitados. A cobertura mínima em cada ciclo deverá ser de 80% (oitenta por cento) dos imóveis. - Não deve ser considerada a média dos ciclos. - O Reconhecimento Geográfico (RG) deve ser atualizado de modo que o número de imóveis visitados não seja maior que o número de imóveis existentes, evitando coberturas acima de 100%. - Os imóveis visitados pelos Agentes Comunitários de Saúde (ACS) e, posteriormente, pelos Agentes de Controle de Endemias (ACE), a título de complementação, deverão ser registrados apenas como uma única vez. - O Município classificado como "Não infestado", em decorrência da pesquisa entomológica, não é obrigado a realizar visitas domiciliares para controle da dengue. Ele desenvolve outras ações de vigilância. Nesse caso, pontua no PQA-VS. Mas, se o Município nessa situação apresentar registro autóctone da doença no Sinan será considerado "Infestado" e deverá realizar as visitas domiciliares, conforme preconizado, para pontuar no PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 10 - Proporção de contatos intradomiciliares de casos novos de hanseníase examinados.
Denominador: total de contatos intradomiciliares dos casos novos de hanseníase registrados, por local de residência atual e diagnosticados nos anos das coortes - Paucibacilar e Multibacilar. Fator de multiplicação: 100. Processar os dados no TABWIN, de acordo com os seguintes passos: 1º passo - Tabulação Paucibacilar |
||
Modo Entrada: Caso Novo Tipo de Saída: Marcar todos exceto ERRO DE DIAGNÓSTICO e TRANSFERÊNCIAS 1 Class Oper Atual: PAUCIBACILAR (PB) |
||
Contato Examinado |
||
Suprimir Colunas Zeradas |
||
Modo Entrada: Caso Novo Tipo de Saída: Marcar todos exceto ERRO DEDIAGNÓSTICO e TRANSFERÊNCIAS Class Oper Atual: MULTIBACILAR (MB) Esq TeraAtual: PQT/MB/12 DOSES |
||
Altere o nome da coluna "Contato Registrado" clicando com o lado direito do mouse no título e adicione MB e ano diagnóstico selecionado (ex. Contato Registrado MB 2012). Repita a mesma ação para "Contato Examinado". Salvar como "Coorte contatos MB" para uso no 3º passo 3º Passo - Soma dos resultados obtidos nos passos anteriores: Numerador: número de contatos Paucibacilares Examinados Número de contatos Multibacilares Examinados. Denominador: número de contatos Paucibacilares Registrados Número de contatos Multibacilares registrados. Com a tabela de Coorte Contatos MB aberta no Tabwin, clique no Menu Arquivo INCLUIR TABELA, localizar a tabela "coorte contatos PB", salva anteriormente, e fazer a inclusão. No Menu OPERAÇÕES, clique em SOMAR e selecione com a tecla Ctrl e mouse os Contatos Registrados PB e Contatos Registrados MB e clique em OK, será criada uma nova coluna SOMA. Para renomear a coluna clique em cima do título com lado direito do mouse e altere o nome para Contatos Registrados PB MB, repita a mesma operação para Contatos Examinados PB MB. No Menu QUADRO, em ELIMINAR COLUNA, selecione todas exceto Contatos Registrados PB MB e Contatos Examinados PB MB. 4º passo - Cálculo do indicador: Proporção de contatos intradomiciliares de casos novos de hanseníase nos anos das coortes, examinados. Para realizar o cálculo, clique em CALCULAR INDICADOR no Menu OPERAÇÕES e selecione: Numerador: Contatos Examinados PB MB Denominador: Contatos Registrados PB MB Escala por: 100 Casas decimais: 1 Título da coluna: Altere para % de Contatos Examinados PB MB |
||
- Para fins operacionais, considera-se contato intradomiciliar toda e qualquer pessoa que resida ou tenha residido com o doente de hanseníase nos últimos cinco anos. - O exame dos contatos consiste no exame dermatoneurológico de todos os contatos intradomiciliares dos casos novos detectados, independentemente da classificação operacionale do repasse de orientações sobre período de incubação, transmissão e sinais e sintomas precoces da hanseníase. - A vacina BCG-ID (Bacilo de Calmette-Guërin) deverá ser aplicada nos contatos intradomiciliares sem presença de sinais e sintomas de hanseníase no momento da avaliação, independentemente de serem contatos de casos Paucibacilares (PB) ou Multibacilares (MB). - A aplicação da vacina BCG depende da história vacinal e segue as recomendações da normatização vigente. - A avaliação dos contatos intradomiciliares de casos novos de hanseníase diagnosticados nos anos das coortes foi adotada por considerar que o período de tratamento é também o tempo em que as equipes de saúde dispõem para examinar os contatos intradomiciliares dos casos novos de hanseníase. - As coortes são compostas de contatos intradomiciliares dos casos novos Paucibacilares, diagnosticados no ano anterior ao da avaliação e de contatos intradomiciliares dos casos novos Multibacilares diagnosticados dois anos antes à avaliação, semelhante às coortes para a avaliação da cura. Por exemplo: para a avaliação dos contatos examinados de 2014 será considerado os casos novos PB diagnosticados no ano de 2013 e os casos novos MB diagnosticados em 2012. - Ressalta-se que continua fundamental o empenho das equipes de saúde para que a vigilância dos contatos seja realizada oportunamente. - Para os Municípios que apresentaram casos novos de hanseníase no período da análise e que não registraram contatos, a meta deste indicador será considerada como não cumprida. - Município que não possui registro de casos novos de hanseníase nos anos das coortes no Sinan, entre residentes de seu território, não pontua para o PQA-VS. |
||
Departamento de Vigilância de Doenças Transmissíveis - DEVIT E-mail: dagvs@saude.gov.br |
||
Indicador 11 - Proporção de contatos de casos novos de tuberculose pulmonar bacilífera examinados.
Denominador: número de contatos registrados dos casos novos pulmonares bacilíferos, no período e local de residência avaliado. Fator de multiplicação: 100. |
|
Contatos menores de cinco anos, pessoas com HIV-aids e portadores de condições de alto risco devem ser considerados prioritários no processo de avaliação de contatos e tratamento 2. O controle de contato deve ser realizado, fundamentalmente, pela atenção primária. Para os Municípios que apresentaram caso novo de tuberculose pulmonar bacilífera no período da análise e que não registraram contatos, a meta deste indicador será considerada como não cumprida. Município que não possui registro, no Sinan, de casos novos pulmonares bacilíferos de residentes em seu território, não pontua para o PQA-VS. 1 WHO. Implementing the WHO StoTB strategy: a handbook for national tuberculosis control programmes. Geneva, 2008. 2 BRASIL. Manual de recomendações para o controle da tuberculose no Brasil. Ministério da Saúde, Secretaria de Vigilância em Saúde. - Brasília: Ministério da Saúde, 2011. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 12 - Número de testes de sífilis por gestante.
Denominador: número de partos hospitalares do SUS, por ano e Município de residência da gestante. Observações:1 . para o numerador considerar a quantidade aprovada, por município de residência, os seguintes procedimentos ambulatoriais: 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE;0214010082 TESTE RAPIDO PARA SIFILIS EM GESTANTE. 2. para o denominador considerar o total de AIH aprovadas de gestantes, por Município de residência, nos seguintes procedimentos: 0310010039 PARTO NORMAL; 0310010047 PARTO NORMAL EM GESTACAO DE ALTO RISCO; 0411010026 PARTO CESARIANO EM GESTACAO DE ALTO RISCO; 0411010034 PARTO CESARIANO; e, 0411010042 PARTO CESARIANO C/ LAQUEADURA TUBARIA. |
|
Denominador: Sistema de Informações Hospitalares do SUS (SIH/SUS). |
|
- Desde janeiro de 2014, foi adotado o Boletim de Procedimentos Ambulatoriais Individualizado (BPA-i), no SIA-SUS, para o procedimento 0202031179 VDRL P/ DETECCAO DE SÍFILIS EM GESTANTE, o que passou a permitir o registro do Município de residência da gestante. - Para o processamento "ano", considerar o período de janeiro a dezembro. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 13 - Número de testes de HIV realizado.
Observação: Considerar a "quantidade aprovada" dos seguintes procedimentos ambulatoriais: 0202030296 PESQUISA DE ANTICORPOS ANTI-HIV-1 (WESTERN BLOT); 0202030300 PESQUISA DE ANTICORPOS ANTI-HIV-1 HIV-2 (ELISA); 0202031020 PESQUISA DE HIV-1 POR IMUNOFLUORESCENCIA; 0214010040 TESTE RAPIDO PARA DETECCAO DE HIV EM GESTANTE; e, 0214010058 TESTE RÁPIDO PARA DETECÇÃO DE INFECÇÃO PELO HIV. |
|
- Os testes rápidos de HIV são comprados e disponibilizados pelo Ministério da saúde; os insumos para os demais exames são adquiridos por Estadose Municípios. - Todas as unidades de saúde do SUS estão aptas a solicitar o teste de HIV e sua realização pode ser feita em qualquer laboratório do sistema e da rede privada. - Para o processamento "ano", considerar o período de janeiro a dezembro. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Indicador 14 - Proporção de preenchimento do campo "ocupação" nas notificações de agravos e doenças relacionados ao trabalho.
Denominador: número total de casos de agravos e doenças relacionados ao trabalho notificados, em determinado ano e local de residência do caso. Fator de multiplicação: 100. |
|
a) acidente com exposição a material biológico relacionado ao trabalho; b) acidente de trabalho grave (graves, fatais e em crianças e adolescentes); c) câncer relacionado ao trabalho; d) dermatoses ocupacionais; e) lesão por esforço repetitivo/distúrbios osteomusculares relacionados ao trabalho (LER/DORT); f) perda auditiva induzida por ruído - PAIR relacionada ao trabalho; g) pneumoconioses relacionadas ao trabalho; h) transtornos mentais relacionados ao trabalho; e i) intoxicação exógena relacionada ao trabalho. Município que não possui registro de notificação de agravos e doenças relacionados ao trabalho em seu território, no Sinan, não pontua para o PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
Caderno de Metas e Indicadores do Programa de Qualificação das Ações de Vigilância em Saúde (PQA-VS) a partir de 2018
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 1 - Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência.
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência. |
| Relevância do Indicador | - As informações de mortalidade do SIM são cada vez mais utilizadas para a formulação de políticas públicas e monitoramento de eventos estratégicos (mortalidade infantil, fetal, materna e mulheres em idade fértil), nas esferas federal, estadual e municipal. Por esse motivo, a oportunidade da notificação é fundamental. |
| Método de Cálculo | Numerador: Total de óbitos notificados até 60 dias após o final do mês de ocorrência, por local de residência.Denominador: Total de óbitos esperados (estimados).Fator de multiplicação: 100. |
| Fonte | Sistema de Informações sobre Mortalidade (SIM). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no SIM dos registros de óbito deve ser feita de forma regular e constante durante todo o ano.- Dentre todos os óbitos, a alimentação no SIM dos óbitos fetais, infantis e maternos deve ser priorizada, conforme preconizado na Portaria de Consolidação nº 1/GM/MS, de 28 de setembro de 2017, Capítulo VI, Seção I, Artigo nº 402 e Artigo nº 413. |
| - Quanto ao número de óbitos esperados, serão utilizados os mesmos parâmetros da Portaria nº 47/SVS/MS, de 03 de maio de 2016, adaptados para o contexto do PQA-VS. Assim, o método será aplicado a todos os municípios, inclusive para os menores de 30.000 habitantes.- Os municípios novos, bem como aqueles dos quais esses se desmembraram, deverão receber um tratamento provisório no monitoramento deste indicador, durante 4 | |
| (quatro) anos, a contar da data de instalação de fato (separação administrativa), para viabilizar a construção de série histórica, que permita estimar os volumes esperados de óbitos de seus residentes.- A Secretaria de Vigilância em Saúde disponibiliza o número de óbitos esperados por município no seguinte endereço: http://svs.aids.gov.br/cgiae/sim/ no item documentação. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 2 - Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência. |
| Relevância do Indicador | - As informações dos nascimentos do Sinasc são cada vez mais utilizadas para a formulação de políticas públicas e monitoramento de eventos estratégicos (como número de consultas de pré-natal, percentual de cesáreas desnecessárias), nas esferas federal, estadual e municipal. Por esse motivo, a oportunidade da notificação é fundamental. |
| Método de Cálculo | Numerador: Total de nascidos vivos notificados no Sinasc até 60 dias após o final do mês de ocorrência por local de residência.Denominador: Total de nascidos vivos esperados (estimados).Fator de multiplicação: 100. |
| Fonte | Sistema de Informações sobre Nascidos Vivos (Sinasc). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de março do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no Sinasc dos registros de nascimento deve ser feita de forma regular e constante durante todo o ano.- Quanto ao número de nascidos vivos esperados, serão utilizados os mesmos parâmetros da Portaria nº 47/SVS/MS, de 03 de maio de 2016, adaptados para o contexto do PQA-VS. Assim, o método será aplicado a todos os municípios, inclusive para os menores de 30.000 habitantes.- O Ministério da Saúde emitirá anualmente Nota Técnica, apontando: a) em que estrato se enquadra cada município para as finalidades que preconizam os incisos I e |
| II acima; e b) toda a memória de cálculo do número de nascimentos esperados por ano e por mês, por município.- Os municípios novos, bem como aqueles dos quais esses se desmembraram, deverão receber um tratamento provisório no monitoramento deste indicador, durante 4 (quatro) anos, a contar da data de instalação de fato (separação administrativa), para viabilizar a construção de série histórica, que permita estimar os volumes esperados de óbitos de seus residentes. | |
| - A Secretaria de Vigilância em Saúde irá disponibilizar o número de nascidos vivos esperados por município no seguinte endereço: http://svs.aids.gov.br/cgiae/sinasc/ no item documentação. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 3 - Proporção de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 80% de salas de vacina com alimentação mensal das doses de vacinas aplicadas e da movimentação mensal de imunobiológicos, no sistema oficial de informação do Programa Nacional de Imunizações de dados individualizados, por residência. |
| Relevância do Indicador | - Permite monitorar a quantidade de salas de vacina do município que alimentam o sistema de informação de dados individualizados por residência regularmente (mensalmente), como fonte de informação dos dados de vacinação, para análise mais precisa dos dados de cobertura vacinal e controle da movimentação dos imunobiológicos. |
| Método de Cálculo | Numerador: Número de salas de vacina do município com alimentação mensal, no sistema de informação de dados individualizados por residência, das doses de vacinas aplicadas e da movimentação dos imunobiológicos (Registro do Vacinado / Movimentação de Imunobiológico).Denominador: Número de salas de vacina ativas no município, constantes do cadastro do sistema de informação do PNI, no período avaliado.Fator de multiplicação: 100. |
| Fonte | Sistema oficial de informação do Programa Nacional de Imunizações (Relatórios/Gestão da Informação, com dados individualizados por residência, e movimentação de imunobiológicos). |
| Periodicidade dos dados para monitoramento e avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Recomenda-se que a alimentação do sistema de informação seja feita na sala de vacina. Caso não seja possível, poderá ser realizada em outro setor da própria Unidade de Saúde, onde estiver localizada a sala de vacina, ou na sede da Secretaria Municipal de Saúde, caso não haja condições na Unidade de Saúde.- Os dados para a avaliação desse indicador levarão em conta o quantitativo de salas de vacinas existentes no Cadastro do Sistema de Informação do Programa Nacional de Imunizações (SIPNI). |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 4: Proporção de vacinas selecionadas que compõem o Calendário Nacional de Vacinação para crianças menores de 1 ano de idade (Pentavalente - 3ª dose, Poliomielite - 3ª dose, Pneumocócica 10 valente - 2ª dose) e para crianças de 1 ano de idade (tríplice viral - 1ª dose) - com coberturas vacinais preconizadas. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 1 ano de idade - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) - e para crianças de 1 ano de idade - Tríplice viral (1ª dose). |
| Relevância do Indicador | Estimular a vigilância das coberturas vacinais, com objetivo de manter altas coberturas e realização de ações que proporcione o alcance dessas metas, com intuito de manter a população protegida de doenças imunopreveníveis pelas seguintes vacinas:Pentavalente, que previne a difteria, tétano, coqueluche (DTP) e infecções por Haemophilus influenza tipo B e hepatite B, e é utilizada como indicador para comparação em âmbito internacional devido ao componente DTP; |
| Pneumocócica 10-valente, que previne as infecções causadas pelo pneumococo, responsável por doenças com elevadas cargas de morbidade e mortalidade;Poliomielite, para a prevenção da doença do mesmo nome, em fase de erradicação global; e,Tríplice viral, para a prevenção do sarampo e rubéola, doenças com compromisso de eliminação na região das Américas. | |
| Método de Cálculo | Numerador: Total das vacinas selecionadas que alcançaram a cobertura vacinal preconizada.Denominador: 4 vacinas selecionadas - Pentavalente, Pneumocócica 10-valente, Poliomielite e Tríplice viral.Fator de multiplicação: 100. |
| Fontes | Numerador: Sistema oficial de informação do Programa Nacional de Imunizações (Sipni).Denominador: Sistema de Informação de Nascidos Vivos (Sinasc). |
| Periodicidade dos dados para monitoramento e avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A idade adequada para aplicação de cada vacina selecionada obedecerá ao Calendário Nacional de Vacinação, publicado pelo Ministério da Saúde nos termos da Lei nº 6.259, de 30 de outubro de 1975, regulamentada pelo Decreto nº 78.231, de 12 de agosto de 1976, atualizado por notas informativas específicas. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 5 - Percentual de amostras analisadas para o residual de agente desinfetante em água para consumo humano (parâmetro: cloro residual livre, cloro residual combinado ou dióxido de cloro). (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante. |
| Relevância do Indicador | - Permite avaliar a implementação do monitoramento do teor de residual desinfetante na água utilizada para consumo humano, o que possibilita avaliar o atendimento do teor mínimo exigido para evitar a recontaminação da água tratada. |
| Método de Cálculo | Numerador: Número de amostras de água analisadas para o residual de agente desinfetante - RAD (parâmetros: cloro residual livre, cloro residual combinado ou dióxido de cloro).Denominador: Total de amostras obrigatórias para o RAD.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Vigilância da Qualidade da Água para Consumo Humano (Sisagua). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A verificação do quantitativo de amostras analisadas para RAD permite avaliar se o monitoramento dos parâmetros está sendo realizado conforme preconizado na Diretriz Nacional do Plano de Amostragem do Vigiagua.- A aplicação de agente desinfetante para inativação de organismos patogênicos é uma exigência da norma de potabilidade brasileira, que prevê, ainda, a necessidade |
| de manutenção de teor mínimo de residual de desinfetante em toda a extensão da rede de distribuição para prevenir uma possível recontaminação.- Os produtos químicos derivados de cloro são os mais empregados, em virtude do poder de manutenção de um residual desinfetante na água do sistema de distribuição. A Portaria de Consolidação nº 5/GM/MS, de 28 de setembro de 2017, Anexo XX, em seu Artigo 34, determina a manutenção de teor mínimo de cloro residual livre, cloro residual combinado ou de dióxido de cloro em toda a extensão do sistema de distribuição (reservatórios e rede).- Em função da fácil degradação das formas de cloro na água, a análise do residual do agente desinfetante deve ser realizada em campo, logo após a coleta, de forma a | |
| garantir um resultado mais fidedigno.- Quando verificado o não atendimento aos valores de referências preconizados na Portaria de Consolidação nº 5/GM/MS, de 28 de setembro de 2017, Anexo XX, na sua integralidade, medidas corretivas devem ser adotadas pelo responsável pelo abastecimento de água, para garantir o cumprimento dos valores de referências estabelecidos na portaria.- O número de análises obrigatórias para os parâmetros que medem os residuais de agentes desinfetantes está previsto na Diretriz Nacional de Vigilância da Qualidade | |
| da Água para Consumo Humano, disponível no site da SVS, no seguinte endereço:(http://portalarquivos.saude.gov.br/images/pdf/2016/junho/06/diretriz-nacional-plano-amostragem-agua.pdf)- O indicador refere-se ao quantitativo de análises de residual de agente desinfetante (RAD) para inferir sobre a qualidade da água consumida pela população. | |
| Todavia, para o planejamento adequado da amostragem, faz-se necessário que todas as formas de abastecimento existentes sejam identificadas e cadastradas no Sisagua, possibilitando avaliar as informações sobre o abastecimento de água de toda a população do município para o ano de referência. O percentual de cobertura de abastecimento é obtido a partir dos dados gerados pelo relatório de cobertura de abastecimento do Sisagua e calculado pela fórmula:% Pop.cadastrada= Pop.abast.SAA + Pop.abast.apenas SAC + Pop.abast.apenas SAI x 100 | |
| População município (IBGE)- A caracterização da forma de abastecimento de água para consumo humano, também auxilia: (i) a identificação de vulnerabilidades; (ii) a tomada de decisão dos gestores do SUS; e (iii) a elaboração de políticas públicas relacionadas ao tema. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 6 - Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias, a partir da data de notificação. |
| Relevância do Indicador | - Este indicador representa a capacidade de detecção de eventos de saúde pública e qualifica a informação, sendo relevante, pois envolve todos as doenças e agravos que são de notificação compulsória imediata nacional, cujas medidas de prevenção e controle estão previstas.- Permite avaliar e monitorar a capacidade de resolução das investigações de casos registrados e a atualização do Sinan. |
| Método de Cálculo | Numerador: Total de registros de DNCI, por unidade de residência, encerrados dentro de 60 dias a partir da data de notificação.Denominador: Total de registros de DNCI, por unidade de residência, notificados no período da avaliação.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Para este indicador, foram definidas, em virtude de sua magnitude e relevância, os seguintes eventos e doenças de notificação imediata nacional, listados na Portaria de Consolidação nº 4/GM/MS, de 28 de setembro de 2017, Anexo V, Capítulo I (págs. 341 e 342):Antraz pneumônico, Arenavírus, Botulismo, Cólera, Dengue (óbitos), Ebola, Febre amarela, Febre do Nilo ocidental e outras arboviroses de importância em saúde |
| pública, Febre maculosa e outras riquetisioses, Febre purpúrica brasileira, Hantavirose, Influenza humana produzida por novo subtipo viral, Lassa, Malária na região extra Amazônica, Marburg, Poliomielite por poliovírus selvagem, Peste, Óbito com suspeita de doença pelo vírus Zika, Óbito com suspeita de Febre de Chikungunya, Raiva humana, Rubéola, Sarampo, Síndrome de paralisia flácida aguda, Tularemia, Varíola e outras emergências de saúde pública.- É importante ressaltar que a Síndrome de Rubéola Congênita e a Síndrome Respiratória Aguda Grave por Coronavírus estão listadas na referida portaria, mas não | |
| terão seus dados processados na tabulação desse indicador, pelos motivos a seguir citados. No primeiro caso, o tempo de encerramento é de 180 dias, porque, para a confirmação ou descarte do caso suspeito pelo critério laboratorial, é necessário coletar a primeira amostra de espécimes clínicos para identificação viral no nascimento da criança e, depois, a segunda amostra, aos 6 meses de vida, com o objetivo de avaliar a excreção viral dessa criança. No segundo caso, essa síndrome é notificada ao CIEVS Nacional, através do Notifica, que utiliza e-mail ou formulário eletrônico Formsus e não por meio do Sinan. | |
| - As doenças listadas (DNCI) devem ser notificadas em 24 horas e registradas no Sinan no prazo de 7 dias.- No caso de epidemias de Dengue, Zika e Chinkungunya, a prioridade é investigar os óbitos, que são de notificação imediata.- Recomenda-se que os municípios alimentem regularmente a base de dados nacional, de acordo com as normativas vigentes, e que também utilizem seus dados locais, de forma a dar melhor visibilidade à dinâmica de seu quadro epidemiológico, em tempo oportuno, propiciando, quando necessária, a implementação de | |
| medidas de intervenção adequadas.Município que não possuir registro no Sinan de, pelo menos, uma das doenças de notificação imediata citadas, no ano de análise, não pontua para o PQA-VS. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 7 - Proporção de casos de malária que iniciaram tratamento em tempo oportuno. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para os casos importados). |
| Relevância do Indicador | - Permite avaliar a oportunidade da entrega de tratamento antimalárico, o que contribui para a redução da transmissão, morbidade e mortalidade pela doença.- Orienta o planejamento das ações para garantir acesso oportuno ao diagnóstico e tratamento de malária. |
| Método de Cálculo | Numerador: Número total de casos autóctones de malária, notificados em determinado município, sob tratamento em até 48 horas, após o início dos primeiros sintomas, somado ao número total de casos importados de malária, notificados em determinado município, sob tratamento em até 96 horas, após o início dos primeiros sintomas, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado.Denominador: Número total de casos de malária sintomáticos por local de notificação, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do |
| ano considerado.Fator de multiplicação: 100.Para processamento dos dados no Sivep-Malária, utilizar os dados disponíveis na base NOTIPOXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: NOTIPO14.dbf):Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE o mesmo município avaliado, ID_LVC = 2 e SINTOMAS = | |
| 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas).Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE diferente do município avaliado, sendo ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA | |
| menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados.Somar esses dois valores.Dividir pelo número total de registros, agrupados por município (MUN_NOT), sendo ID_LVC = 2 e SINTOMAS = 1.Para processamento dos dados no Sinan, utilizar os dados disponíveis na base MALANXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: MALAN14.dbf): | |
| Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF o mesmo município avaliado, AT_LAMINA ¹ 3 e AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRATA menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas).Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF diferente do município avaliado, AT_LAMINA¹3 e | |
| AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRATA menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados.Somar esses dois valores.Dividir pelo número total de registros, agrupados por município (ID_MUNICIP), sendo AT_LAMINA¹3 e AT_SINTOMA = 1. | |
| Fontes | Sistema de Informação de Vigilância Epidemiológica da Malária (Sivep-Malária), para Região Amazônica (estados da Região Norte, Maranhão e Mato Grosso).Sistema de Informação de Agravos de Notificação (Sinan), para os demais Estados. |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 30 de abril do ano posterior ao da avaliação. |
| Informações adicionais | Município que não possuir registro de notificação de casos de malária em seu território no Sivep-Malária ou no Sinan, de acordo com sua localização, não pontua para o PQA-VS. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 8 - Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 4 ciclos de visita domiciliar, dos 6 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. |
| Relevância do Indicador | Evidencia o conjunto de imóveis localizados em áreas infestadas pelo vetor e o quantitativo que realmente foi visitado pelos agentes de controle de endemias, preferencialmente em articulação com os agentes comunitários de saúde, em cada ciclo. |
| Método de Cálculo | 1º passo - Cobertura por cicloNumerador: número de imóveis visitados em cada um dos ciclos de visitas domiciliares de rotina para o controle das ArbovirosesDenominador: número de imóveis existentes na base do Reconhecimento Geográfico (RG) atualizado.Fator de multiplicação: 100.2º passo - Soma do número de ciclos com mínimo de 80% de cobertura de imóveis visitados. |
| Fontes | A consolidação nacional desses dados, será feita por meio de planilha de Excel, preenchida pelas SES, com base nos dados levantados junto aos municípios, e enviada ao Programa Nacional de Controle da Dengue via Formsus, ou por meio de formulário preenchido via Formsus.OBS.: Os municípios possuem, em âmbito local, os dados referentes ao indicador aqui tratado, registrados no SISPNCD, ou em planilhas eletrônicas próprias, formatadas para a identificação das visitas domiciliares realizadas, por ciclo. No entanto, a forma de envio para o nível central será conforme exposta acima. |
| Data para avaliação | Data para processamento dos dados da base nacional para avaliação final: 31 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Imóveis a serem trabalhados - As ações de controle vetorial da dengue devem ser realizadas, prioritariamente, em imóveis situados em áreas urbanas ou povoadas com características urbanas, de municípios que apresentem infestação domiciliar pelo Aedes aegypti, persistente, no mínimo, por 1 ano ou com histórico de transmissão. Opcionalmente, em grandes centros urbanos, as visitas de rotina a edifícios podem ser restritas à área comum e a apartamentos ao nível do solo.- O método de cálculo deverá ser aplicado em cada ciclo para verificação da cobertura dos imóveis visitados. A cobertura mínima em cada ciclo deverá ser de 80% |
| dos imóveis.- Não deve ser considerada a média dos ciclos.- O Reconhecimento Geográfico (RG) deve ser atualizado de modo que o número de imóveis visitados não seja maior que o número de imóveis existentes, evitando coberturas acima de 100%. | |
| - Os imóveis visitados pelos Agentes Comunitários de Saúde (ACS) e, posteriormente, pelos Agentes de Controle de Endemias (ACE), a título de complementação, deverão ser registrados apenas como uma única vez.- O município classificado como "Não infestado", em decorrência da pesquisa entomológica, não é obrigado a realizar visitas domiciliares para controle da dengue, pois desenvolve outras ações de vigilância. Nesse caso, pontua no PQA-VS. Mas, se o município nessa situação apresentar registro autóctone da doença no Sinan será considerado "Infestado" e deverá realizar as visitas domiciliares, conforme preconizado, para pontuar no PQA-VS. | |
| - Em decorrência do aumento dos casos de microcefalia foi decretado, ao final de 2015, estado de Emergência em Saúde Pública de Importância Nacional - ESPIN, o que ocasionou a intensificação das ações de controle de vetor, como consequência houve o aumento um ciclo de visitas, totalizando 7 ciclos preconizados para o ano de 2016. Com o fim da ESPIN, o número preconizado de ciclos segue o padrão comum recomendado de 6 ciclos. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 9 - Proporção de contatos examinados de casos novos de hanseníase diagnosticados nos anos das coortes. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 82% dos contatos dos casos novos de sanseníase, nos anos das coortes, examinados. | |
| Relevância do Indicador | - Mede a capacidade dos serviços em realizar a vigilância de contatos, de casos novos de hanseníase, para aumento da detecção precoce de casos novos e da interrupção da cadeia de transmissão. | |
| Método de Cálculo | Numerador: Número de contatos dos casos novos de hanseníase examinados, por local de residência atual e diagnosticados nos anos das coortes – Paucibacilar e Multibacilar. |
|
| Linha | UF Res Atual ou Mun Res AT | |
| Coluna | Não Ativa | |
| Incremento | Frequência | |
| Contato Registrado | ||
| Contato Examinado | ||
| Desmarcar: | Suprimir Linhas Zeradas | |
| Suprimir Colunas Zeradas | ||
| Seleções Disponíveis | Ano Diagnóstico: Subtrair 1 ao ano de avaliação | |
| Modo Entrada: Caso Novo | ||
| Tipo de Saída: Marcar todos exceto: Erro de DIAGÓSTICO e TRANSFERÊNCIAS 1 |
||
| Class Oper Atual: PAUCIBACILAR (PB) | ||
| Est Terap Atual: PQT/PB/6 DOSES | ||
| Não Classificados | Marcar: Ignorar | |
1 Para avaliação Municipal, desmarcar transferências para outros municípios, outros estados e outros países. Para avaliação regional, desmarcar transferências para outros municípios fora da regional correspondente, outros estados e outros países. |
||
| Linha | UF Res Atual ou Mun Res AT | |
| Coluna | Não Ativa | |
| Incremento | Frequência | |
| Contato Registrado | ||
| Contato Examinado | ||
| Desmarcar: | Suprimir Linhas Zeradas | |
| Suprimir Colunas Zeradas | ||
| Seleções Disponíveis | Ano Diagnóstico: subtrair 2 ao ano de avaliação (ex. se o ano da avaliação for 2018, selecionar o ano diagnóstico 2016) | |
| Modo Entrada: Caso Novo | ||
| Tipo de Saída: Marcar todos exceto: Erro de DIAGÓSTICO e TRANSFERÊNCIAS 1 |
||
| Class Oper Atual: MULTIBACILAR (MB) | ||
| Est Terap Atual: PQT/MB/12 DOSES | ||
| Não Classificados | Marcar: Ignorar | |
1 Para avaliação Municipal, desmarcar transferências para outros municípios, outros estados e outros países. Para avaliação regional, desmarcar transferências para outros municípios fora da regional correspondente, outros estados e outros países. |
||
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). | |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação. | |
| Informações adicionais | - A investigação epidemiológica dos contatos tem por finalidade a descoberta de casos novos entre aqueles que convivem ou conviveram com o doente e suas possíveis fontes de infecção.- Recomenda-se o exame dos contatos domiciliares e sociais (Portaria de Consolidação nº 2/GM/MS, de 28 de setembro de 2017, Anexo VI, Artigos 1º ao 3º). Entretanto, para o efeito de registro no Boletim de Acompanhamento e no Sinan, considerar os contatos domiciliares, que são todas as pessoas que residam ou | |
| tenham residido com o doente de hanseníase.- O exame dos contatos consiste no exame dermatoneurológico de todos os contatos dos casos novos detectados, independentemente da classificação operacional e na orientação quanto ao período de incubação, transmissão e sinais e sintomas precoces da hanseníase.- A vacina BCG-ID (Bacilo de Calmette-Guërin) deverá ser aplicada nos contatos sem presença de sinais e sintomas de hanseníase no momento da avaliação, independentemente de serem contatos de casos Paucibacilares (PB) ou Multibacilares (MB). | ||
| - A aplicação da vacina BCG depende da história vacinal e segue as recomendações da normatização vigente.- A avaliação dos contatos de casos novos de hanseníase diagnosticados nos anos das coortes foi adotada por considerar que o período de tratamento é também o tempo em que as equipes de saúde dispõem para examinar os contatos.- As coortes são compostas de contatos dos casos novos Paucibacilares, diagnosticados no ano anterior ao da avaliação, e de contatos dos casos novos Multibacilares, | ||
| diagnosticados dois anos antes à avaliação, semelhante às coortes para a avaliação da cura. Por exemplo: para a avaliação dos contatos examinados de 2018 será considerado os casos novos PB diagnosticados no ano de 2017 e os casos novos MB diagnosticados em 2016.- Ressalta-se a relevância do empenho das equipes de saúde para que a vigilância dos contatos seja realizada oportunamente.- Para os municípios que apresentaram casos novos de hanseníase no período da análise e que não registraram contatos, a meta deste indicador será considerada como | ||
| não cumprida.- Município que não possuir registro de casos novos de hanseníase nos anos das coortes no Sinan, entre residentes de seu território, não pontua para o PQA-VS. | ||
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Vigilância de Doenças Transmissíveis - DEVITE-mail: dagvs@saude.gov.br | |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 10 - Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados. |
| Relevância do Indicador | - Permite prevenir o adoecimento e diagnosticar precocemente caso de doença ativa nessa população1. |
| Método de Cálculo | Numerador: Número de contatos examinados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados.Denominador: Número de contatos registrados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação (dados parciais relativos ao ano da avaliação). |
| Informações adicionais | - Entende-se como contato toda pessoa que convive, no mesmo ambiente, com o caso índice, no momento do diagnóstico da TB. Esse convívio pode acontecer em casa ou em ambiente de trabalho, instituições de longa permanência, escola e outros.- Contatos menores de cinco anos, pessoas com HIV-aids e portadores de condições de alto risco devem ser considerados prioritários no processo de avaliação de contatos e tratamento1. |
| - O controle de contato deve ser realizado, fundamentalmente, pela atenção primária.- Para os municípios que não apresentaram casos novos de tuberculose pulmonar com confirmação laboratorial no período da análise, este indicador será considerado como não se aplica para efeito da avaliação de cumprimento de metas (ou seja, esse indicador não deverá ser considerado para o cálculo de cumprimento de metas).- Vale ressaltar a importância da identificação do caso suspeito, do diagnóstico da doença, da notificação do caso e do acompanhamento do paciente ao longo de todo | |
| tratamento, visando o desfecho cura e a obtenção da quebra de transmissão da doença.- Para os municípios que apresentaram caso de tuberculose pulmonar com confirmação laboratorial no período da análise e que não registraram contatos, a meta deste indicador deve ser considerada como não cumprida.1 BRASIL. Manual de recomendações para o controle da tuberculose no Brasil. Ministério da Saúde, Secretaria de Vigilância em Saúde. - Brasília: Ministério da Saúde, 2011. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 11 - Número de testes de sífilis por gestante. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 2 testes de sífilis por gestante. |
| Relevância do Indicador | - Como indicador de concentração, ajuda a expressar a qualidade do pré-natal, uma vez que a sífilis pode ser diagnosticada na gestante em dois momentos: durante a gestação e, também, durante o parto.- O tratamento da gestante reduz a probabilidade de transmissão vertical da sífilis e, consequentemente, a sífilis congênita. |
| Método de Cálculo | Numerador: Número de testes realizados para o diagnóstico da sífilis em gestantes, por ano e município de residência da gestante.Denominador: Número de partos hospitalares do SUS, por ano e município de residência da gestante.Observações:1. Para o numerador, considerar a quantidade aprovada, por município de residência, dos seguintes procedimentos ambulatoriais: |
| 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE;0214010082 TESTE RAPIDO PARA SIFILIS EM GESTANTE.2. Para o denominador, considerar o total de AIH aprovadas de gestantes, por município de residência, nos seguintes procedimentos:0310010039 PARTO NORMAL; | |
| 0310010047 PARTO NORMAL EM GESTACAO DE ALTO RISCO;0310010055 PARTO NORMAL EM CENTRO DE PARTO NORMAL (CPN);0411010026 PARTO CESARIANO EM GESTACAO DE ALTO RISCO;0411010034 PARTO CESARIANO; e, | |
| 0411010042 PARTO CESARIANO C/ LAQUEADURA TUBARIA. | |
| Fontes | Numerador: Sistema de Informações Ambulatoriais do SUS (SIA/SUS).Denominador: Sistema de Informações Hospitalares do SUS (SIH/SUS). |
| Dados para avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de maio do ano posterior ao da avaliação (dados parciais, no caso do denominador). |
| Informações adicionais | - Desde janeiro de 2014, foi adotado o Boletim de Procedimentos Ambulatoriais Individualizado (BPA-i), no SIA-SUS, para o procedimento 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE, o que passou a permitir o registro do município de residência da gestante.- Para o processamento "ano", considerar o período de janeiro a dezembro. |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 12 - Número de testes de HIV realizado. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior. |
| Relevância do Indicador | - Permite avaliar a oportunidade do diagnóstico do HIV. |
| Método de Cálculo | Número de testes realizados para o diagnóstico de HIV, por ano e município de residência.Observação: Considerar a "quantidade aprovada" dos seguintes procedimentos ambulatoriais:0202030296 PESQUISA DE ANTICORPOS ANTI-HIV-1 (WESTERN BLOT);0202030300 PESQUISA DE ANTICORPOS ANTI-HIV-1 + HIV-2 (ELISA); |
| 0202031020 PESQUISA DE HIV-1 POR IMUNOFLUORESCENCIA;0214010040 TESTE RAPIDO PARA DETECCAO DE HIV EM GESTANTE; e,0214010058 TESTE RÁPIDO PARA DETECÇÃO DE INFECÇÃO PELO HIV. | |
| Fonte | Sistema de Informações Ambulatoriais (SIA/SUS). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de maio do ano posterior ao da avaliação. |
| Informações adicionais | - O diagnóstico oportuno do HIV tem influência tanto na qualidade de vida das pessoas vivendo com HIV/aids, quanto na transmissão do vírus.- Os testes rápidos de HIV são comprados e disponibilizados pelo Ministério da saúde; os insumos para os demais exames são adquiridos por estados e municípios.- Todas as unidades de saúde do SUS estão aptas a solicitar o teste de HIV e sua realização pode ser feita em qualquer laboratório do sistema e da rede privada.- Para o processamento "ano", considerar o período de janeiro a dezembro |
| - Devem ser computados todos os testes realizados (testes rápidos e laboratoriais). | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 13 - Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido de acordo com o código da Classificação Brasileira de Ocupações (CBO). |
| Relevância do Indicador | - Identifica as ocupações que apresentam maiores incidências de agravos relacionados ao trabalho, possibilitando a definição de ações de promoção, prevenção, vigilância e assistência, de forma mais adequada. |
| Método de Cálculo para os Agravos | Numerador: Número de notificações de agravos com o campo "Ocupação" preenchido de acordo com o código da Classificação Brasileira de Ocupações (CBO) correspondente, na versão disponibilizada pelo Sinan, excluindo-se campo preenchido como ignorado, em determinado ano e local de notificação do caso.Denominador: Número total de casos de agravos relacionados ao trabalho notificados, em determinado ano e local de notificação.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para monitoramento e avaliação | Data para processamento dos dados das bases nacionais para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - Relação de agravos:a. Acidente com exposição a material biológico relacionado ao trabalho;b. Acidente de trabalho grave (graves, fatais e em crianças e adolescentes);c. Intoxicação exógena relacionada ao Trabalho. |
| - Município que não possuir registro de notificação de agravos relacionados ao trabalho em seu território, no Sinan, não pontua para o PQA-VS.- A versão atualmente disponibilizada pelo Sinan corresponde à tabela oficial de Classificação Brasileira de Ocupações (CBO) 2002, adaptada pelo DATASUS. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
Indicador 14 - Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. (Redação dada pela PRT GM/MS nº 1520 de 30.05.2018)
| Meta | 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. |
| Relevância do Indicador | - A violência é considerada uma questão de saúde pública mundial, o que torna necessária a ampliação de estratégias que interfiram nesse quadro. No Brasil, esse agravo representa a terceira causa de morte entre crianças de 0 a 9 anos de idade, passando a ocupar a primeira posição na população de 10 a 49 anos, decrescendo para a sexta posição entre os idosos (60 ou mais anos de idade). As vítimas, comumente, adquirem sequelas, permanentes ou não, que podem levar à incapacidade |
| para o trabalho ou para outras atividades rotineiras, ao absenteísmo, a custos com o pagamento de pensões e de tratamentos de saúde, configurando um importante problema de saúde pública. Nesse contexto, o Ministério da Saúde implementou o Sistema de Vigilância de Violências e Acidentes (VIVA/Sinan), como forma de sistematizar as informações sobre os casos de violências e permitir o cuidado intersetorial às vítimas. Dados gerados por esse sistema são demandados por vários setores do Ministério da Saúde e também por outros ministérios, bem como organizações não governamentais e imprensa. Desse modo, a qualidade dos dados é | |
| primordial para garantir uma análise fidedigna desse problema de saúde.- As características étnico-raciais de uma população constituem-se de variáveis de importância social e epidemiológica no estudo das análises de situação de saúde e, em especial, das desigualdades em saúde. Conhecê-las assume importância estratégica para a promoção da equidade no Sistema Único de Saúde (SUS), na qualidade dos serviços de saúde, na elaboração de políticas públicas e na identificação das doenças e agravos predominantes nos diferentes grupos que compõem a sociedade brasileira. Além disso, a informação "cor ou raça/etnia" possibilita ao SUS cumprir um de seus princípios fundamentais, a Equidade, ou seja, o compromisso de | |
| oferecer a todos os cidadãos e cidadãs um tratamento igualitário e, ao mesmo tempo, atender às necessidades que cada situação apresenta.- É um dado que pode orientar as intervenções nas populações específicas e o aprimoramento do campo raça/cor nos sistemas de informação de saúde, que é de responsabilidade dos trabalhadores e gestores dos serviços de saúde públicos e privados.- É fundamental a apropriação dos dados epidemiológicos pelos profissionais de saúde. Quer esses dados permaneçam nos serviços, quer sejam enviados aos diversos | |
| sistemas de informação, eles devem ser utilizados como instrumento capaz de indicar as ações necessárias para garantir a adequação da vigilância, da prevenção e da atenção dispensadas à saúde da população, respeitando-se as especificidades e fortalecendo a promoção da Cultura da Paz.- Sendo assim, é de suma importância melhorar a qualidade do preenchimento desses dados, em especial do campo raça/cor, que permite melhor caracterização da pessoa que sofreu violência. | |
| Método de Cálculo | Numerador: Total de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida, por município de notificação.Denominador: Total de casos notificados por município de notificação.Fator de multiplicação: 100. |
| Fonte | Sistema de Informação de Agravos de Notificação (Sinan). |
| Dados para avaliação | Data para processamento dos dados da base nacional para avaliação final: 15 de abril do ano posterior ao da avaliação. |
| Informações adicionais | - A alimentação no VIVA/Sinan dos registros de notificações de violência interpessoal e autoprovocada deve ser feita de forma regular e constante durante todo o ano.- O objetivo desse indicador é melhorar a informação das notificações de violências e acidentes em sua totalidade, através do incentivo ao melhor preenchimento do |
| campo raça/cor e das demais variáveis.- Será considerada não válida a informação de raça/cor quando o campo estiver em branco ou com a opção "Ignorado".- Município que não possuir registro de notificação de violência interpessoal e autoprovocada em seu território, no VIVA/Sinan, não pontua para o PQA-VS. | |
| Responsável pelo Monitoramento e Avaliação no Ministério da Saúde | Secretaria de Vigilância em SaúdeDepartamento de Gestão da Vigilância em Saúde - DEGEVSE-mail: dagvs@saude.gov.br |
(Redação dada pela PRT GM/MS nº 1520 de 30.05.2018
ANEXO C
METAS E INDICADORES PACTUADOS NO ÂMBITO DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (PQA-VS). (Origem: PRT MS/GM 2984/2016, Anexo 1) (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Metas e Indicadores a partir do ano de 2017: (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Municípios e Distrito Federal (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
1. Meta: 90% de registros de óbitos alimentados no SIM até 60 dias após o final do mês de ocorrência.
Indicador: Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
2. Meta: 90% de registros de nascidos vivos alimentados no Sinasc até 60 dias após o final do mês de ocorrência. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador: Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência.
3. Meta: 80% de Salas de Vacina com alimentação mensal no SI-PNI, por município.
Indicador: Proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por município. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
4. Meta: 100% das vacinas selecionadas com cobertura vacinal de 95% de crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose). Indicador: Proporção de vacinas selecionadas do Calendário Nacional de Vacinação para crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose) - com cobertura vacinal preconizada. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
5. Meta: 75% do número de análises obrigatórias realizadas para o residual de agente desinfetante.
Indicador: Percentual de amostras analisadas para o Residual de Agente Desinfetante em água para consumo humano (cloro residual livre, cloro residual combinado ou dióxido de cloro). (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
6. Meta: 50 semanas epidemiológicas com, pelo menos, uma notificação (positiva, negativa ou de surto), no período de um ano. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador: Número de semanas epidemiológicas com informações no Sinan.
7. Meta: 80% de casos das doenças de notificação compulsória imediata registrados no Sinan encerradas em até 60 dias a partir da data de notificação.
Indicador: Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
8. Meta: 70% dos casos de malária com tratamento iniciado em tempo oportuno (até 48 horas a partir do início dos sintomas para os casos autóctones e em até 96 horas a partir do início dos sintomas para
os casos importados).
Indicador: Proporção de casos de malária que iniciaram tratamento em tempo oportuno. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
9. Meta: 4 ciclos, dos 7 preconizados, com mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue.
Indicador: Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
10. Meta: 80% dos contatos dos casos novos de hanseníase, nos anos das coortes, examinados.
Indicador: Proporção de contatos examinados de casos novos de hanseníase. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
11. Meta: 70% dos contatos dos casos novos de tuberculose pulmonar com confirmação laboratorial examinados.
Indicador: Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
12. Meta: 2 testes de sífilis por gestante.
Indicador: Número de testes de sífilis por gestante. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
13. Meta: 15% de ampliação no número de testes de HIV realizados em relação ao ano anterior.
Indicador: Número de testes de HIV realizado. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
14. Meta: 95% das notificações de agravos relacionados ao trabalho com o campo "Ocupação" preenchido.
Indicador: Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
15. Meta: 95% de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida.
Indicador: Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
ANEXO CI
CADERNO DE METAS E INDICADORES DO PROGRAMA DE QUALIFICAÇÃO DAS AÇÕES DE VIGILÂNCIA EM SAÚDE (PQA-VS) (Origem: PRT MS/GM 2984/2016, Anexo 2) (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Metas e Indicadores a partir do ano de 2017:
Indicador 1 - Proporção de registros de óbitos alimentados no SIM em relação ao estimado, recebidos na base federal em até 60 dias após o final do mês de ocorrência. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Denominador: Total de óbitos esperados (estimados). Fator de Multiplicação: 100. |
|
|
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 2 - Proporção de registros de nascidos vivos alimentados no Sinasc em relação ao estimado, recebidos na base federal até 60 dias após o final do mês de ocorrência. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
- Os parâmetros adotados para estipular o volume esperado de registros de nascidos vivos para os municípios serão definidos com base no desempenho de cada Secretaria Municipal, no que se refere à captação desses eventos nos últimos 3 (três) anos estatísticos encerrados e publicados, conforme os seguintes estratos: I - municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada adequada, terão o número de nascidos vivos esperados em cada mês calculado a partir do número de registros informados ao Sistema de Informação nos últimos 4 (quatro) anos, projetado por regressão linear simples para o ano em curso; II - municípios, cuja Taxa Bruta de Natalidade Média no último triênio seja considerada inadequada, terão o número de nascidos vivos esperados em cada mês calculado a partir da aplicação da Taxa Bruta de Natalidade considerada minimamente adequada (*) sobre a população estimada para o município no ano corrente e, na sua ausência, para o ano anterior, levando-se em conta também, para qualquer situação, os parâmetros adotados para corrigir (**), para fins de monitoramento, o volume de registros de nascidos vivos esperados por municípios no prazo de até 60 (sessenta) dias após o mês de ocorrência, calculados conforme definições a seguir: (*) Parâmetros mínimos de adequação da Taxas Brutas de Natalidade, segundo região e porte populacional: I - Para a Região Norte, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 14,2 em municípios menores de 50 mil habitantes, e 14,0 em municípios de 50 mil ou mais habitantes. II - Para a Região Nordeste, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 13,2 em municípios menores de 50 mil habitantes, e 12,8 em municípios de 50 mil ou mais habitantes. III - Para a Região Sudeste, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 10,5 em municípios menores de 50 mil habitantes, e 11,5 em municípios de 50 mil ou mais habitantes. IV - Para a Região Sul, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 10,0 em municípios menores de 50 mil habitantes, e 12,1 em municípios de 50 mil ou mais habitantes. V - Para a Região Centro-oeste, são parâmetros mínimos de adequação Taxas Brutas de Natalidade maiores ou iguais a 10,7 em municípios menores de 50 mil habitantes, e 13,8 em municípios de 50 mil ou mais habitantes. (**) Parâmetros adotados para corrigir, para fins de monitoramento, o volume de registros de nascidos vivos esperados por Municípios no prazo de até 60 (sessenta) dias após o mês de ocorrência, calculados conforme definições a seguir: I - Se a razão entre o número médio de nascidos vivos observados no triênio e o número de nascidos vivos esperados a partir da aplicação do parâmetro mínimo de adequação da Taxa Bruta de Natalidade sobre a população local for menor que 40%, o número de nascidos vivos esperados deve ser corrigido para 40% do que é projetado pela Taxa Bruta de Natalidade de adequação mínima. II - Se a razão entre o número médio de nascidos vivos observados no triênio e o número de nascidos vivos esperados a partir da aplicação do parâmetro mínimo de adequação da Taxa Bruta de Natalidade sobre a população local corresponder a um valor entre 40 e 89%, o número de nascidos vivos esperados deve ser acrescido de 10% do que é projetado pela Taxa Bruta de Natalidade de adequação mínima. III - Se razão entre o número médio de óbitos observados no triênio e o número de óbitos esperados a partir da aplicação do parâmetro mínimo de adequação da Taxa Bruta de Natalidade sobre a população local for maior ou igual a 90%, o número de nascidos vivos esperados deve ser aquele que é projetado pela Taxa Bruta de Natalidade de adequação mínima, sem correção. IV - Se o parâmetro para o cálculo do número esperado de nascidos vivos são os dados diretos do Sinasc, o número de nascidos vivos esperados deve ser aquele que é projetado pela regressão linear simples a partir da série histórica do sistema nos últimos 4 (quatro) anos, sem correção. V - Após a definição das metas anuais, feita pela aplicação dos critérios acima estabelecidos nos itens I a IV, deve-se compará-las com as metas do ano anterior, e todo município que apresente uma variação positiva entre um ano e outro de mais de 15% no número de nascidos vivos a serem coletados, a meta deve ser truncada em um aumento de 15%. - O Ministério da Saúde emitirá anualmente Nota Técnica, apontando: a) em que estrato se enquadra cada município para as finalidades que preconizam os incisos I e II acima; e b) toda a memória de cálculo do número de nascimentos esperados por ano e por mês, por município. - Os municípios novos, bem como aqueles dos quais esses se desmembraram, deverão receber um tratamento provisório no monitoramento deste indicador, durante 4 (quatro) anos, a contar da data de instalação de fato (separação administrativa), para viabilizar a construção de série histórica, que permita estimar os volumes esperados de óbitos de seus residentes. - A Secretaria de Vigilância em Saúde irá disponibilizar o número de nascidos vivos esperados por município no seguinte endereço: http://svs.aids.gov.br/cgiae/sinasc/ no item documentação |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 3 - Proporção de Salas de Vacina com alimentação mensal no Sistema de Informação do Programa Nacional de Imunizações (SI-PNI), por município. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Denominador: Número de salas de vacinas do município constante do cadastro do SI-PNI em junho de 2012. Fator de multiplicação: 100. |
|
- Em municípios até 10.000 habitantes, a alimentação do SI-PNI poderá ocorrer no nível central da Secretaria Municipal de Saúde, com a identificação das Salas de Vacinas correspondentes. - Os dados para a avaliação desse indicador levarão em conta o quantitativo de salas de vacinas existentes no Cadastro do Sistema de Informação de Avaliação do Programa Nacional de Imunizações (SIAPI) em junho de 2012, que subsidiou a elaboração da Portaria nº 2.363/GM/MS, de 2012. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 4 - Proporção de vacinas selecionadas do Calendário Nacional de Vacinação para crianças menores de 2 anos - Pentavalente (3ª dose), Pneumocócica 10-valente (2ª dose), Poliomielite (3ª dose) e Tríplice viral (1ª dose) - com cobertura vacinal preconizada. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
- a vacina Pentavalente, que previne a difteria, tétano, coqueluche e infecções por Haemophilus influenzae tipo B e hepatite B; - a vacina Pneumocócica 10-valente, que previne as infecções causadas pelo pneumococo, responsável por doenças com elevadas cargas de morbidade e mortalidade; - a vacina poliomielite, para a prevenção da doença do mesmo nome, em fase de erradicação global; e, - a vacina tríplice viral, para a prevenção do sarampo e rubéola, doenças com compromisso de eliminação na região das Américas |
|
Denominador: 4 vacinas selecionadas - Pentavalente, Pneumocócica 10-valente, Poliomielite e Tríplice viral. Fator de multiplicação: 100. |
|
Saúde nos termos da Lei nº 6.259, de 30 de outubro de 1975, regulamentada pelo Decreto nº 78.231, de 12 de agosto de 1976, bem como através de notas informativas |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 5 - Percentual de amostras analisadas para o Residual de Agente Desinfetante em água para consumo humano (cloro residual livre, cloro residual combinado ou dióxido de cloro). (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Denominador: Total de amostras obrigatórias para o Residual de Agente Desinfetante (cloro residual livre, cloro residual combinado ou dióxido de cloro). Fator de multiplicação: 100. |
|
- O agente desinfetante tem a função de destruir ou inativar organismos patogênicos que possam estar presentes na água e, dessa forma, prevenir a propagação de doenças de veiculação hídrica. - Esse indicador possui importante papel para prevenção de agravos à saúde humana e seu monitoramento possibilita identificar situações nas quais a concentração encontra-se fora da faixa preconizada. - Os produtos químicos derivados de cloro são os mais empregados, em virtude do poder de manutenção de um residual desinfetante na água do sistema de distribuição. O Artigo 34 da Portaria n° 2.914/ GM/MS, de 2011, determina a manutenção de teor mínimo de cloro residual livre, cloro residual combinado ou de dióxido de cloro em toda a extensão do sistema de distribuição (reservatórios e rede). - Em função da fácil degradação das formas de cloro na água, a análise do residual do agente desinfetante deve ser realizada em campo logo após a coleta, de forma a garantir um resultado mais fidedigno. - Quando o não atendimento aos valores de referências preconizados na Portaria n° 2.914/ GM/MS, de 2011, for confirmado, medidas corretivas devem ser adotadas, junto ao responsável pelo abastecimento de água ou à população, para garantir que o cumprimento dos valores de referências estabelecidos na portaria. - O número de análises obrigatórias para os parâmetros que medem os residuais de agentes desinfetantes está previsto na Diretriz Nacional de Vigilância da Qualidade da Água para Consumo Humano, disponível no site da SVS, no seguinte endereço: (http://portalsaude.saude.gov.br/images/pdf/2016/junho/06/diretriz-nacional-plano-amostragem-agua.pdf) |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 6 - Número de semanas epidemiológicas com informações no Sinan. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
- Permite vigilância ativa de doenças e agravos de notificação compulsória, principalmente frente às situações de epidemias ou alteração do padrão epidemiológico. - Permite que as três esferas de gestão do SUS possam responder oportunamente às mudanças na situação epidemiológica, com base em relatórios, recomendações e informações públicas para toda a rede de serviços de saúde, levando a medidas de intervenção adequadas. |
|
- A presença dessas informações indica que a vigilância em saúde local está ativa no monitoramento de doenças de notificação compulsória e, no caso de ausência de casos naquela semana, notifica negativamente às demais esferas |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 7 - Proporção de casos de doenças de notificação compulsória imediata nacional (DNCI) encerrados em até 60 dias após notificação. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
- Permite avaliar e monitorar a capacidade de resolução das investigações de casos registrados e a atualização do Sinan. |
|
Denominador: Total de registros de DNCI, por unidade de residência, notificados no período da avaliação. Fator de multiplicação: 100. |
|
Antraz pneumônico, Arenavírus, Botulismo, Cólera, Dengue (óbitos), Ebola, Febre amarela, Febre do Nilo ocidental e outras arboviroses deimportância em saúde pública, Febre maculosa e outras riquetisioses, Febre purpúrica brasileira, Hantavirose, Influenza humana produzida por novo subtipo viral, Lassa, Malária na região extra Amazônica, Marburg, Polimielite por poliovírus selvagem, Peste, Óbito com suspeita de doença pelo vírus Zika, Óbito com suspeita de Febre de Chikungunya, Raiva humana, Rubéola, Sarampo, Síndrome de Paralisia flácida aguda, Síndrome da rubéola congênita, Síndrome respiratória aguda grave associada a coronavírus, Tularemia, Varíola e outras emergências de saúde pública. - As doenças listadas (DNCI) devem ser notificadas em 24 horas e registradas no Sinan no prazo de 7 dias. - No caso de epidemias de Dengue, Zika e Chinkungunya, a prioridade é investigar os óbitos: apenas esses é que são de notificação imediata. - Município que não possuir registro no Sinan de, pelo menos, uma das doenças de notificação imediata citadas, no ano de análise, não pontua para o PQA-VS. |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 8 - Proporção de casos de malária que iniciaram tratamento em tempo oportuno. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
do início dos sintomas para os casos importados). |
|
Denominador: Número total de casos de malária sintomáticos por local de notificação, excluídas as Lâminas de Verificação de Cura (LVC), na data de referência do ano considerado. Fator de multiplicação: 100. Para processamento dos dados no Sivep-Malária, utilizar os dados disponíveis na base NOTIPOXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: NOTIPO14.dbf): Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE o mesmo município avaliado, ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas). Contar o número de registros, agrupados por município de notificação (MUN_NOT), sendo MUN_INFE diferente do município avaliado, sendo ID_LVC = 2 e SINTOMAS = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DT_TRATA menos DT_SINTO). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados. Somar esses dois valores. Dividir pelo número total de registros, agrupados por município (MUN_NOT), sendo ID_LVC = 2 e SINTOMAS = 1. Para processamento dos dados no Sinan, utilizar os dados disponíveis na base MALANXX.dbf, sendo XX igual ao ano da base de dados com 2 dígitos (Ex: MALAN14.dbf): Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF o mesmo município avaliado, AT_LAMINA diferente 3 e AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRAT A menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 2 dias (48 horas). Contar o número de registros, agrupados por município de notificação (ID_MUNICIP), sendo COMUNINF diferente do município avaliado, AT_LAMINA diferente 3 e AT_SINTOMA = 1. Para cada registro, criar uma variável que informa o intervalo em dias entre o início dos primeiros sintomas e o início do tratamento (DTRAT A menos DT_SIN_PRI). Em seguida, somar o número de registros com intervalo menor ou igual a 4 dias (96 horas) em relação ao total de registros selecionados. Somar esses dois valores. Dividir pelo número total de registros, agrupados por município (ID_MUNICIP), sendo AT_LAMINA diferente 3 e AT_SINTOMA = 1 |
|
Sistema de Informação de Agravos de Notificação (Sinan), para os demais Estados. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEV E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 9 - Número de ciclos que atingiram mínimo de 80% de cobertura de imóveis visitados para controle vetorial da dengue. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Numerador: Número de imóveis visitados em cada um dos ciclos de visitas domiciliares de rotina para o controle da dengue. Denominador: Número de imóveis da base do Reconhecimento Geográfico (RG) atualizado. Fator de multiplicação: 100. 2º passo - Soma do número de ciclos com mínimo de 80% de cobertura de imóveis visitados. |
|
Sistema de Informação da Vigilância da Febre Amarela e Dengue (SISFAD). Sistema de Informação do Programa Nacional de Controle da Dengue (SISPNCD). Sistema próprio do estado ou município. OBS.: Os municípios possuem, em âmbito local, os dados referentes ao indicador aqui tratado, registrados no SISFAD, ou no SISPNCD, ou em planilhas eletrônicas próprias, formatadas para a identificação das visitas domiciliares realizadas, por ciclo. A consolidação nacional desses dados, sempre que necessária, será feita por meio de planilha do excel, preenchida pelas SES, com base nos dados levantados junto aos municípios, e enviada ao Programa Nacional de Controle da Dengue via Formsus. |
|
- O método de cálculo deverá ser aplicado em cada ciclo para verificação da cobertura dos imóveis visitados. A cobertura mínima em cada ciclo deverá ser de 80% dos imóveis. - Não deve ser considerada a média dos ciclos. - O Reconhecimento Geográfico (RG) deve ser atualizado de modo que o número de imóveis visitados não seja maior que o número de imóveis existentes, evitando coberturas acima de 100%. - Os imóveis visitados pelos Agentes Comunitários de Saúde (ACS) e, posteriormente, pelos Agentes de Controle de Endemias (ACE), a título de complementação, deverão ser registrados apenas como uma única vez. - O município classificado como "Não infestado", em decorrência da pesquisa entomológica, não é obrigado a realizar visitas domiciliares para controle da dengue. Ele desenvolve outras ações de vigilância. Nesse caso, pontua no PQA-VS. Mas, se o município nessa situação apresentar registro autóctone da doença no Sinan será considerado "Infestado" e deverá realizar as visitas domiciliares, conforme preconizado, para pontuar no PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 10 - Proporção de contatos examinados de casos novos de hanseníase. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
|
|
- Recomenda-se o exame dos contatos domiciliares, de vizinhança e sociais. Entretanto, para o efeito de registro no Boletim de Acompanhamento e no Sinan, considerar os contatos domiciliares, que são todas as pessoas que residam ou tenham residido com o doente de hanseníase. - O exame dos contatos consiste no exame dermatoneurológico de todos os contatos dos casos novos detectados, independentemente da classificação operacional e do repasse de orientações sobre período de incubação, transmissão e sinais e sintomas precoces da hanseníase. - A vacina BCG-ID (Bacilo de Calmette-Guërin) deverá ser aplicada nos contatos sem presença de sinais e sintomas de hanseníase no momento da avaliação, independentemente de serem contatos de casos Paucibacilares (PB) ou Multibacilares (MB). - A aplicação da vacina BCG depende da história vacinal e segue as recomendações da normatização vigente. - A avaliação dos contatos de casos novos de hanseníase diagnosticados nos anos das coortes foi adotada por considerar que o período de tratamento é também o tempo em que as equipes de saúde dispõem para examinar os contatos dos casos novos de hanseníase. - As coortes são compostas de contatos dos casos novos Paucibacilares, diagnosticados no ano anterior ao da avaliação, e de contatos dos casos novos Multibacilares, diagnosticados dois anos antes à avaliação, semelhante às coortes para a avaliação da cura. Por exemplo: para a avaliação dos contatos examinados de 2017 será considerado os casos novos PB diagnosticados no ano de 2016 e os casos novos MB diagnosticados em 2015. - Ressalta-se a relevância do empenho das equipes de saúde para que a vigilância dos contatos seja realizada oportunamente. - Para os municípios que apresentaram casos novos de hanseníase no período da análise e que não registraram contatos, a meta deste indicador será considerada como não cumprida. - Município que não possuir registro de casos novos de hanseníase nos anos das coortes no Sinan, entre residentes de seu território, não pontua para o PQA-VS. |
|
Departamento de Vigilância de Doenças Transmissíveis - DEVIT E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 11 - Proporção de contatos examinados de casos novos de tuberculose pulmonar com confirmação laboratorial. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Denominador: Número de contatos registrados dos casos novos pulmonares com confirmação laboratorial, no período e local de residência avaliados. Fator de multiplicação: 100. |
|
- Contatos menores de cinco anos, pessoas com HIV-aids e portadores de condições de alto risco devem ser considerados prioritários no processo de avaliaçãode contatos e tratamento1. - O controle de contato deve ser realizado, fundamentalmente, pela atenção primária. - Para os municípios que não apresentaram casos novos de tuberculose pulmonar com confirmação laboratorial no período da análise, este indicador será considerado como não se aplica para efeito da avaliação de cumprimento de metas (ou seja, esse indicador não deverá ser considerado para o cálculo de cumprimento de metas). - Vale ressaltar a importância da identificação do caso suspeito, do diagnóstico da doença, da notificação do caso e do acompanhamento do paciente ao longo de todo tratamento, visando o desfecho cura e a obtenção da quebra de transmissão da doença. - Para os municípios que apresentaram caso de tuberculose pulmonar com confirmação laboratorial no período da análise e que não registraram contatos, a meta deste indicador deve ser considerada como não cumprida. ¹BRASIL. Manual de recomendações para o controle da tuberculose no Brasil. Ministério da Saúde, Secretaria de Vigilância em Saúde. - Brasília: Ministério da Saúde, 2011. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 12 - Número de testes de sífilis por gestante. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
gestação e, também, durante o parto. - O tratamento da gestante reduz a probabilidade de transmissão vertical da sífilis e, consequentemente, a sífilis congênita. |
|
Denominador: Número de partos hospitalares do SUS, por ano e município de residência da gestante. Observações: 1. Para o numerador considerar a quantidade aprovada, por município de residência, dos seguintes procedimentos ambulatoriais: 0202031179 VDRL P/ DETECCAO DE SIFILIS EM GESTANTE; 0214010082 TESTE RAPIDO PARA SIFILIS EM GESTANTE. 2. Para o denominador considerar o total de AIH aprovadas de gestantes, por município de residência, nos seguintes procedimentos: 0310010039 PARTO NORMAL; 0310010047 PARTO NORMAL EM GESTACAO DE ALTO RISCO; 0310010055 PARTO NORMAL EM CENTRO DE PARTO NORMAL (CPN); 0411010026 PARTO CESARIANO EM GESTACAO DE ALTO RISCO; 0411010034 PARTO CESARIANO; e, 0411010042 PARTO CESARIANO C/ LAQUEADURA TUBARIA |
|
Denominador: Sistema de Informações Hospitalares do SUS (SIH/SUS). |
|
- Para o processamento "ano", considerar o período de janeiro a dezembro. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 13 - Número de testes de HIV realizado. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Observação: Considerar a "quantidade aprovada" dos seguintes procedimentos ambulatoriais: 0202030296 PESQUISA DE ANTICORPOS ANTI-HIV-1 (WESTERN BLOT); 0202030300 PESQUISA DE ANTICORPOS ANTI-HIV-1 + HIV-2 (ELISA); 0202031020 PESQUISA DE HIV-1 POR IMUNOFLUORESCENCIA; 0214010040 TESTE RAPIDO PARA DETECCAO DE HIV EM GESTANTE; e, 0214010058 TESTE RÁPIDO PARA DETECÇÃO DE INFECÇÃO PELO HIV. |
|
- Os testes rápidos de HIV são comprados e disponibilizados pelo Ministério da saúde; os insumos para os demais exames são adquiridos por estados e municípios. - Todas as unidades de saúde do SUS estão aptas a solicitar o teste de HIV e sua realização pode ser feita em qualquer laboratório do sistema e da rede privada. - Para o processamento "ano", considerar o período de janeiro a dezembro |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 14 - Proporção de preenchimento do campo "ocupação" nas notificações de agravos relacionados ao trabalho. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Denominador: Número total de casos de agravos relacionados ao trabalho notificados, em determinado ano e local de ocorrência. Fator de multiplicação: 100. |
|
a. Acidente com exposição a material biológico relacionado ao trabalho; b. Acidente de trabalho Grave (graves, fatais e em crianças e adolescentes); c. Intoxicação Exógena relacionada ao Trabalho. - Município que não possuir registro de notificação de agravos relacionados ao trabalho em seu território, no Sinan, não pontua para o PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
Indicador 15 - Proporção de notificações de violência interpessoal e autoprovocada com o campo raça/cor preenchido com informação válida. (Revogado pela PRT GM/MS n° 232 de 09.01.2023)
|
|
Denominador: Total de casos notificados por município de notificação. Fator de multiplicação: 100. |
|
- O objetivo desse indicador é melhorar a informação das notificações de violências e acidentes em sua totalidade, através do incentivo ao melhor preenchimento do campo raça/cor e das demais variáveis. - Será considerada não válida a informação de raça/cor quando o campo estiver em branco ou com a opção "Ignorado". - Município que não possuir registro de notificação de violência interpessoal e autoprovocada em seu território, no VIVA/Sinan, não pontua para o PQA-VS. |
|
Departamento de Gestão da Vigilância em Saúde - DEGEVS E-mail: dagvs@saude.gov.br |
(Revogado pela PRT GM/MS n° 232 de 09.01.2023)
ANEXO CII
DO PLANEJAMENTO, EXECUÇÃO E AVALIAÇÃO DAS AÇÕES DE VIGILÂNCIA E ASSISTÊNCIA À SAÚDE EM EVENTOS DE MASSA
Art. 1º Ficam definidas, no âmbito do Sistema Único de Saúde (SUS), as responsabilidades das esferas de gestão e estabelecidas as Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa. (Origem: PRT MS/GM 1139/2013, Art. 1º)
TÍTULO I
DAS DISPOSIÇÕES INICIAIS
(Origem: PRT MS/GM 1139/2013, TÍTULO I)
CAPÍTULO I
DA FINALIDADE E DA ABRANGÊNCIA
(Origem: PRT MS/GM 1139/2013, TÍTULO I, CAPÍTULO I)
Art. 2º As Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa têm por finalidade prevenir e mitigar os riscos à saúde a que está exposta a população envolvida em eventos de massa, a partir da definição de responsabilidades dos gestores do SUS, da saúde suplementar e do estabelecimento de mecanismos de controle e coordenação de ação durante todas as fases de desenvolvimento dos eventos com foco nas ações de atenção à saúde, incluindo promoção, proteção e vigilância e assistência à Saúde. (Origem: PRT MS/GM 1139/2013, Art. 2º)
Art. 3º As Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa se aplicam a todas as esferas de gestão do SUS e às respectivas autarquias a elas vinculadas. (Origem: PRT MS/GM 1139/2013, Art. 3º)
CAPÍTULO II
DAS DEFINIÇÕES
(Origem: PRT MS/GM 1139/2013, TÍTULO I, CAPÍTULO II)
Art. 4º Para efeito de planejamento, execução e avaliação das ações de vigilância e assistência à saúde em eventos de massa, são adotados os seguintes conceitos: (Origem: PRT MS/GM 1139/2013, Art. 4º)
I - Evento de Massa (EM): atividade coletiva de natureza cultural, esportiva, comercial, religiosa, social ou política, por tempo pré-determinado, com concentração ou fluxo excepcional de pessoas, de origem nacional ou internacional, e que, segundo a avaliação das ameaças, das vulnerabilidades e dos riscos à saúde pública exijam a atuação coordenada de órgãos de saúde pública da gestão municipal, estadual e federal e requeiram o fornecimento de serviços especiais de saúde, públicos ou privados (Sinonímia: grandes eventos, eventos especiais, eventos de grande porte); (Origem: PRT MS/GM 1139/2013, Art. 4º, I)
II - organizador de evento: pessoa física ou jurídica, de direito público ou privado, civil ou militar, responsável pelo planejamento e realização do evento de massa; (Origem: PRT MS/GM 1139/2013, Art. 4º, II)
III - autoridade sanitária: órgão ou agente público competente da área da saúde, com atribuição legal no âmbito da vigilância e da atenção à saúde; (Origem: PRT MS/GM 1139/2013, Art. 4º, III)
IV - autoridade fiscalizadora competente: agente público competente da vigilância sanitária e da saúde suplementar, com poder de polícia administrativo; (Origem: PRT MS/GM 1139/2013, Art. 4º, IV)
V - agente público regulador: autoridade pública sanitária, delegada pelo Gestor Local, que tem como função realizar a articulação entre os diversos níveis assistenciais do sistema de saúde, visando melhor resposta para as necessidades do paciente, ou seja, Médico Regulador da Central de Regulação das Urgências e/ou Central de Regulação de Leitos e/ou Complexo Regulatório; (Origem: PRT MS/GM 1139/2013, Art. 4º, V)
VI - Centro Integrado de Operações Conjuntas da Saúde (Ciocs): unidade operacional de trabalho de caráter extraordinário e temporário, com arquitetura integrada para a gestão das ações do setor saúde, nos âmbitos da vigilância e assistência, que visa o compartilhamento de informações em saúde; para apoiar as decisões durante os eventos de massa e monitorar os incidentes relacionados a saúde; (Origem: PRT MS/GM 1139/2013, Art. 4º, VI)
VII - Plano Operativo do Evento de Massa: documento voltado à preparação dos serviços e das equipes do SUS que contém o conjunto de atividades a serem desenvolvidas nas fases pré, durante e pós-evento, definidas de acordo com as necessidades de prevenção e mitigação de riscos e com base na avaliação do cenário de risco, alinhado aos planos de emergência e de contingência; (Origem: PRT MS/GM 1139/2013, Art. 4º, VII)
VIII - Plano de Emergência em Saúde: matriz operacional e institucional de resposta rápida, coordenada e efetiva a qualquer emergência em saúde pública, que tem a função de proteger a saúde da população, reduzir o impacto dos eventos e limitar a progressão de uma crise, reduzir a morbimortalidade e os impactos de emergências em saúde pública; e (Origem: PRT MS/GM 1139/2013, Art. 4º, VIII)
IX - Plano de Contingência: alinhado ao Plano de Emergência e específico por tipo de evento, como desastres naturais, surtos epidêmicos, acidentes com múltiplas vítimas e acidentes Químicos, Biológicos, Radiológicos e Nucleares (QBRN). (Origem: PRT MS/GM 1139/2013, Art. 4º, IX)
CAPÍTULO III
DAS RESPONSABILIDADES
(Origem: PRT MS/GM 1139/2013, TÍTULO I, CAPÍTULO III)
Art. 5º São responsabilidades das autoridades sanitárias avaliar e aprovar o planejamento e acompanhar a execução das atividades propostas pelos organizadores de eventos relativos à prevenção, mitigação de riscos e o projeto de provimento de serviços de saúde para os atendimentos à população envolvida no evento de massa. (Origem: PRT MS/GM 1139/2013, Art. 5º)
Art. 6º A Agência Nacional de Vigilância Sanitária (ANVISA) regulamentará sobre as responsabilidades do organizador do evento, dentro do escopo de suas competências. (Origem: PRT MS/GM 1139/2013, Art. 6º)
Art. 7º A Agência Nacional de Saúde Suplementar (ANS) editará regulamentos específicos de assistência à saúde suplementar relacionados a eventos de massa, em especial, referentes à garantia do acesso ao atendimento de urgência e emergência. (Origem: PRT MS/GM 1139/2013, Art. 7º)
Art. 8º A coordenação das ações relativas à vigilância e assistência à saúde em eventos de massa é responsabilidade do ente municipal, devendo ser compartilhada com os demais gestores do SUS, quando extrapolar os limites de competência e capacidade municipal, conforme as disposições das Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa e outros atos normativos complementares. (Origem: PRT MS/GM 1139/2013, Art. 8º)
§ 1º Nos eventos designados de interesse estadual a coordenação é compartilhada pelos gestores estaduais e municipais. (Origem: PRT MS/GM 1139/2013, Art. 8º, § 1º)
§ 2º Nos eventos designados de interesse nacional a coordenação é compartilhada entre os gestores municipais, estaduais e o Ministério da Saúde. (Origem: PRT MS/GM 1139/2013, Art. 8º, § 2º)
Art. 9º São previamente designados como eventos de massa de interesse nacional aqueles definidos pelo governo federal, por meio de ato específico. (Origem: PRT MS/GM 1139/2013, Art. 9º)
Art. 10. Adicionalmente, no âmbito da saúde, outros eventos podem ser definidos como de interesse nacional, podendo ser utilizados os critérios relacionados abaixo: (Origem: PRT MS/GM 1139/2013, Art. 10)
I - eventos internacionais com organização do governo brasileiro; (Origem: PRT MS/GM 1139/2013, Art. 10, I)
II - eventos onde se estima um grande fluxo de estrangeiros; (Origem: PRT MS/GM 1139/2013, Art. 10, II)
III - eventos internacionais com participação de mais de um chefe de Estado; (Origem: PRT MS/GM 1139/2013, Art. 10, III)
IV - eventos que ocorram concomitantemente mais de uma região geográfica; e (Origem: PRT MS/GM 1139/2013, Art. 10, IV)
V - eventos que excedam capacidade de resposta de determinada unidade federada.(Origem:PRT MS/GM 1139/2013,Art. 10, V)
Art. 11. Fica a cargo dos Estados declarar os eventos de interesse estadual, cabendo a Comissão Intergestores Bipartite definir os critérios a serem considerados para essa qualificação. (Origem: PRT MS/GM 1139/2013, Art. 11)
TÍTULO II
DAS DIRETRIZES NACIONAIS PARA PLANEJAMENTO, EXECUÇÃO E AVALIAÇÃO DAS AÇÕES DE SAÚDE EM EVENTOS DE MASSA
(Origem: PRT MS/GM 1139/2013, TÍTULO II)
CAPÍTULO I
DO PLANEJAMENTO
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO I)
Art. 12. O planejamento do setor saúde deve envolver as áreas de vigilância e assistência à saúde e estar articulados com os demais entes públicos e setor privado envolvidos com o evento de massa, particularmente com os organizadores dos eventos. (Origem: PRT MS/GM 1139/2013, Art. 12)
Art. 13. A atuação do SUS deve estar organizada em um Plano Operativo, específico para cada evento, alinhado aos Planos de Emergência em Saúde e de Contingência. (Origem: PRT MS/GM 1139/2013, Art. 13)
§ 1º Para elaboração do Plano Operativo tratado no caput deste artigo, as autoridades sanitárias devem considerar os documentos e as informações fornecidos pelo organizador do evento, com atenção aos seguintes pontos: (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º)
I - caracterização do evento; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, I)
II - avaliação dos riscos do evento de acordo com a população envolvida no evento de massa; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, II)
III - definição dos responsáveis nas áreas de interesse à saúde; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, III)
IV - fluxos de comunicação; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, IV)
V - oferta de produtos e serviços de interesse à saúde; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, V)
VI - projeto de provimento de serviços de saúde; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, VI)
VII - planejamento das ações em situações de urgência e emergência; (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, VII)
VIII - monitoramento dos riscos durante o evento; e (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, VIII)
IX - demais ações exigidas em legislação específica. (Origem: PRT MS/GM 1139/2013, Art. 13, § 1º, IX)
§ 2º A caracterização dos eventos de massa e a avaliação dos riscos devem incluir os fatores e critérios descritos, respectivamente, no Anexos 1 e 2 do Anexo CII . (Origem: PRT MS/GM 1139/2013, Art. 13, § 2º)
§ 3º Quando o organizador do evento for um ente público ou a natureza e complexidade do evento exigir, os incisos V, VI e VII deverão ser objeto de pactuação regional. (Origem: PRT MS/GM 1139/2013, Art. 13, § 3º)
Art. 14. O planejamento do setor saúde, entre outras questões, deve contemplar: (Origem: PRT MS/GM 1139/2013, Art. 14)
I - avaliação dos riscos associados aos eventos e identificação das medidas de gerenciamento prioritárias; (Origem: PRT MS/GM 1139/2013, Art. 14, I)
II - explicitação das responsabilidades de cada esfera de gestão do SUS envolvida; (Origem: PRT MS/GM 1139/2013, Art. 14, II)
III - identificação dos entes públicos e setor privado que devem ser envolvidos no trabalho a ser desenvolvido pelo setor saúde; (Origem: PRT MS/GM 1139/2013, Art. 14, III)
IV - definição de fluxos de comunicação e pontos de contato estratégicos; (Origem: PRT MS/GM 1139/2013, Art. 14, IV)
V - articulação da RAS, inclusive laboratorial, para garantia do acesso da população envolvida no evento de massa nos planos de emergência e contingência; (Origem: PRT MS/GM 1139/2013, Art. 14, V)
VI - identificação da interface com outros planos de ação e ou de emergência; (Origem: PRT MS/GM 1139/2013, Art. 14, VI)
VII - ações de prevenção e promoção da saúde; (Origem: PRT MS/GM 1139/2013, Art. 14, VII)
VIII - ações de comunicação e educação em saúde; e (Origem: PRT MS/GM 1139/2013, Art. 14, VIII)
IX - monitoramento e avaliação das ações de vigilância e assistência à saúde. (Origem: PRT MS/GM 1139/2013, Art. 14, IX)
Parágrafo Único. Deve ser dada especial atenção aos riscos que alteram o padrão epidemiológico das doenças transmissíveis ou que impactam a rotina dos serviços de saúde. (Origem: PRT MS/GM 1139/2013, Art. 14, Parágrafo Único)
Art. 15. De acordo com a avaliação de risco e dimensão do evento, deve ser prevista no planejamento das ações do SUS a ativação do Ciocs. (Origem: PRT MS/GM 1139/2013, Art. 15)
Art. 16. Sempre que aplicável, as ações planejadas e os fluxos de comunicação definidos devem ser testados antes do início do evento de massa, com destaque nos seguintes pontos: (Origem: PRT MS/GM 1139/2013, Art. 16)
I - avaliação do funcionamento de novas atividades e estruturas; (Origem: PRT MS/GM 1139/2013, Art. 16, I)
II - teste do fluxo da informação avaliando se a mesma tem a destinação correta; (Origem: PRT MS/GM 1139/2013, Art. 16, II)
III - avaliação da capacidade de interlocução com os atores estratégicos; e (Origem: PRT MS/GM 1139/2013, Art. 16, III)
IV - teste da capacidade de resposta. (Origem: PRT MS/GM 1139/2013, Art. 16, IV)
Parágrafo Único. A realização de simulados a partir dos agravos mais prováveis é uma estratégia importante para o teste da capacidade de resposta do setor saúde. (Origem: PRT MS/GM 1139/2013, Art. 16, Parágrafo Único)
CAPÍTULO II
DA EXECUÇÃO
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO II)
Seção I
Da Vigilância em Saúde
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO II, Seção I)
Art. 17. As ações da vigilância em saúde devem ser executadas em observância ao Plano Operativo, sendo direcionadas às medidas de gerenciamento dos seguintes riscos: (Origem: PRT MS/GM 1139/2013, Art. 17)
I - ambientais; (Origem: PRT MS/GM 1139/2013, Art. 17, I)
II - epidemiológicos; e (Origem: PRT MS/GM 1139/2013, Art. 17, II)
III - relacionados ao uso ou consumo de produtos e serviços de interesse à saúde. (Origem: PRT MS/GM 1139/2013, Art. 17, III)
Art. 18. Em relação as medidas de gerenciamento dos riscos vinculados a agravos e doenças transmissíveis, deve-se dar atenção aos seguintes pontos: (Origem: PRT MS/GM 1139/2013, Art. 18)
I - vacinação dos trabalhadores de setores de linha de frente, de acordo com as orientações do Programa Nacional de Imunização; (Origem: PRT MS/GM 1139/2013, Art. 18, I)
II - intensificar as ações e os mecanismos de notificação em estabelecimentos de saúde públicos e privados, melhorando a oportunidade da notificação de eventos de importância em saúde pública por meio de canais institucionais; e (Origem: PRT MS/GM 1139/2013, Art. 18, II)
III - estabelecer mecanismos simplificados para notificação de casos e surtos pelos profissionais dos hotéis, com o objetivo de receber informações oportunas sobre eventos de saúde pública que ocorrerem na rede hoteleira durante o evento de massa. (Origem: PRT MS/GM 1139/2013, Art. 18, III)
Art. 19. Como medida de gerenciamento dos riscos associados ao uso e consumo de produtos e serviços, a autoridade fiscalizadora competente deve avaliar os estabelecimentos fornecedores dos serviços e produtos. (Origem: PRT MS/GM 1139/2013, Art. 19)
Art. 20. O organizador do evento deve ser informado sobre os resultados da fiscalização a fim de adotar medidas suplementares às sanções fiscais aplicadas pela vigilância sanitária. (Origem: PRT MS/GM 1139/2013, Art. 20)
Art. 21. A vigilância sanitária deve desenvolver estratégias específicas para controle do comércio ambulante de produto, em observância à legislação local específica e incluindo, quando aplicável, ações de orientação aos responsáveis pelas estruturas temporárias. (Origem: PRT MS/GM 1139/2013, Art. 21)
Art. 22. Caso o evento demande grande fluxo de turistas, as ações de fiscalização de infraestrutura e serviços nos pontos de entrada e meios de transporte, devem ser intensificadas. (Origem: PRT MS/GM 1139/2013, Art. 22)
Art. 23. Quando a organização do evento de massa exigir o envio de produtos procedentes do exterior, devem ser observados os requisitos específicos para o controle sanitários de bens e produtos, conforme disposto em legislação específica. (Origem: PRT MS/GM 1139/2013, Art. 23)
Art. 24. Deve ser reforçado o acompanhamento dos eventos de saúde pública de importância nacional e internacional; o monitoramento dos alertas e a captura de notícias, na mídia nacional e internacional, mantendo-se fluxo contínuo de informação com as demais áreas da saúde a fim de permitir respostas rápidas às eventuais doenças, agravos e riscos identificados. (Origem: PRT MS/GM 1139/2013, Art. 24)
Art. 25. O Ciocs deve observar os fluxos e procedimentos pré-estabelecidos, com envio de informações e resposta às emergências de saúde publica. (Origem: PRT MS/GM 1139/2013, Art. 25)
Seção II
Da Assistência à Saúde
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO II, Seção II)
Art. 26. Previamente ao evento, a autoridade sanitária da área de assistência à saúde, em articulação com a autoridade fiscalizadora competente, deve avaliar e acompanhar a execução do projeto de provimento dos serviços de saúde elaborado pelo organizador de evento, de acordo com o mapeamento de risco do evento, a fim de garantir a: (Origem: PRT MS/GM 1139/2013, Art. 26)
I - existência de posto médico avançado, fixo ou de campanha, com estrutura, insumos e medicamentos para: (Origem: PRT MS/GM 1139/2013, Art. 26, I)
a) acolhimento com classificação de risco; (Origem: PRT MS/GM 1139/2013, Art. 26, I, a)
b) observação; (Origem: PRT MS/GM 1139/2013, Art. 26, I, b)
c) pequenas cirurgias; (Origem: PRT MS/GM 1139/2013, Art. 26, I, c)
d) estabilização; e (Origem: PRT MS/GM 1139/2013, Art. 26, I, d)
e) suporte básico e avançado de vida. (Origem: PRT MS/GM 1139/2013, Art. 26, I, e)
II - retaguarda de ambulâncias na proporção adequada de unidades suporte básico (USB) e de unidades de suporte avançado (USA) por posto médico; e (Origem: PRT MS/GM 1139/2013, Art. 26, II)
III - distribuição espacial obedecendo aos critérios de acesso e segurança. (Origem: PRT MS/GM 1139/2013, Art. 26, III)
Art. 27. Deve ser definida a grade assistencial junto aos organizadores do evento, às operadoras de planos de saúde suplementar e aos gestores do SUS, a fim de estabelecer a responsabilidade na atenção à saúde e regulação do acesso da população envolvida aos pontos de atenção. (Origem: PRT MS/GM 1139/2013, Art. 27)
Art. 28. A Rede de Urgência, a retaguarda hospitalar dos municípios sede e da região, e a Hemorrede devem estar preparadas em conformidade com os Planos de Emergência e de Contingência do evento de massa. (Origem: PRT MS/GM 1139/2013, Art. 28)
Art. 29. Deve ser garantida a manutenção do tratamento do público com doenças renais e hematológicas crônicas. (Origem: PRT MS/GM 1139/2013, Art. 29)
Art. 30. As equipes de resposta da Força Nacional do SUS (FN-SUS) devem ser mantidas de prontidão para atuação, conforme disposto em regulamento específico. (Origem: PRT MS/GM 1139/2013, Art. 30)
Art. 31. Deve ser avaliada a efetividade e operacionalização das atividades de assistência à saúde de responsabilidade do organizador do evento, além de monitorada a situação das portas de entrada das urgências e retaguarda da Rede Hospitalar referenciada com informação em tempo real. (Origem: PRT MS/GM 1139/2013, Art. 31)
Parágrafo Único. Dentre as ações previstas no caput deste artigo, deve-se incluir o acompanhamento da informação dos registros dos atendimentos realizados. (Origem: PRT MS/GM 1139/2013, Art. 31, Parágrafo Único)
Art. 32. O responsável médico do evento e o agente público regulador devem trabalhar de forma articulada a fim de garantir a integração da regulação dos serviços contratados pela organização do evento com a regulação dos serviços públicos e da saúde suplementar para o acesso do público envolvido aos serviços de forma equânime, adequada e em tempo oportuno. (Origem: PRT MS/GM 1139/2013, Art. 32)
CAPÍTULO III
DA AVALIAÇÃO
(Origem: PRT MS/GM 1139/2013, TÍTULO II, CAPÍTULO III)
Art. 33. A avaliação da atuação da saúde na fase pós-evento deve ser desenvolvida com o propósito de identificar as oportunidades de melhoria e promover o aprimoramento da atuação governamental, direcionando os recursos para as capacidades que devem ser fortalecidas e subsidiando o planejamento de eventos futuros. (Origem: PRT MS/GM 1139/2013, Art. 33)
§ 1º Recomenda-se consultar a opinião de atores externos sobre os resultados do trabalho, particularmente os atores governamentais com interface e os organizadores do evento. (Origem: PRT MS/GM 1139/2013, Art. 33, § 1º)
§ 2º O relatório final da avaliação deve ser compartilhado com todas as áreas relacionadas com a vigilância e assistência à saúde em eventos de massa e disponibilizados nos endereços eletrônicos institucionais. (Origem: PRT MS/GM 1139/2013, Art. 33, § 2º)
TÍTULO III
DAS DISPOSIÇÕES FINAIS E TRANSITÓRIAS
(Origem: PRT MS/GM 1139/2013, TÍTULO III)
Art. 34. Fica instituído o Comitê de Eventos de Massa (CEM) do Ministério da Saúde com a seguinte composição: (Origem: PRT MS/GM 1139/2013, Art. 35)
I - 1 (um) representante da Secretaria-Executiva; (Origem: PRT MS/GM 1139/2013, Art. 35, I)
II - 1 (um) representante Secretaria de Atenção à Saúde; (Origem: PRT MS/GM 1139/2013, Art. 35, II)
III - 1 (um) representante Secretaria de Vigilância em Saúde; (Origem: PRT MS/GM 1139/2013, Art. 35, III)
IV - 1 (um) representante da Secretaria de Gestão Estratégica e Participativa; (Origem: PRT MS/GM 1139/2013, Art. 35, IV)
V - 1(um) da Fundação Oswaldo Cruz (FIOCRUZ); (Origem: PRT MS/GM 1139/2013, Art. 35, V)
VI - 1 (um) do Conselho Nacional de Secretários de Saúde (CONASS); (Origem: PRT MS/GM 1139/2013, Art. 35, VI)
VII - 1 (um) do Conselho Nacional de Secretários Municipais de Saúde(CONASEMS);(Origem: PRT MS/GM 1139/2013,Art. 35,
VII)
VIII - 1 (um) representante Agência Nacional de Vigilância Sanitária; e (Origem: PRT MS/GM 1139/2013, Art. 35, VIII)
IX - 1 (um) representante Agência Nacional de Saúde Suplementar. (Origem: PRT MS/GM 1139/2013, Art. 35, IX)
§ 1º A coordenação executiva do CEM será realizada pela SE, que fornecerá em conjunto com a SVS, SAS e a ANVISA os apoios técnico e administrativo necessários para o seu funcionamento. (Origem: PRT MS/GM 1139/2013, Art. 35, § 1º)
§ 2º Os representantes titulares e os respectivos suplentes serão indicados pelos dirigentes dos respectivos órgãos e entidades à coordenação executiva do CEM. (Origem: PRT MS/GM 1139/2013, Art. 35, § 2º)
§ 3º O CEM poderá convocar representantes de órgãos e entidades, públicas e privadas, além de especialistas nos assuntos relacionados às suas atividades, quando entender necessário para o cumprimento dos objetivos previstos nas Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa. (Origem: PRT MS/GM 1139/2013, Art. 35, § 3º)
§ 4º O CEM poderá instituir grupos de trabalho para a execução de atividades específicas que entender necessárias para o cumprimento do disposto nas Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa. (Origem: PRT MS/GM 1139/2013, Art. 35, § 4º)
Art. 35. As funções dos membros do CEM não serão remuneradas e seu exercício será considerado de relevante interesse público. (Origem: PRT MS/GM 1139/2013, Art. 36)
Art. 36. É competência do CEM: (Origem: PRT MS/GM 1139/2013, Art. 37)
I - estabelecer diretrizes complementares àquelas definidas nas Diretrizes Nacionais para Planejamento, Execução e Avaliação das Ações de Vigilância e Assistência à Saúde em Eventos de Massa, ações estratégicas e metas para a preparação das ações de saúde; (Origem: PRT MS/GM 1139/2013, Art. 37, I)
II - acompanhar a implementação das ações de preparação da saúde; e (Origem: PRT MS/GM 1139/2013, Art. 37, II)
III - subsidiar o Ministério da Saúde com informações para sua participação nas instâncias do governo federal relativas a eventos de massa. (Origem: PRT MS/GM 1139/2013, Art. 37, III)
ANEXO 1 DO ANEXO CII
FATORES FATORES PARA CARACTERIZAÇÃO DE UM EVENTO DE MASSA
Os eventos de massa apresentam características bastante distintas quando comparados, conforme finalidade, localização, idade e tipo de público, dentre outros fatores. O quadro abaixo separa os fatores em categorias e descreve situações específicas que exigem especial atenção. Esse quadro é genérico e foi criado com o objetivo de apoiar a caracterização dos eventos de massa. Em algumas situações, a avaliação do evento de massa pode apontar para a necessidade de aplicação de outros fatores e situações.
O processo de caracterização do evento deve ser realizado caso a caso.
I - Natureza do evento:
Religioso, esportivo, artístico, dentre outros.
II - Tempo de duração do evento;
III - Atores envolvidos:
a) Perfil estimado dos atores envolvidos: organizadores, trabalhadores contratados, trabalhadores voluntários, imprensa, população envolvida (número estimado, grupo etário, gênero, nacionalidade, características culturais e outras);
b) Número estimado de atores envolvidos de outras regiões do país ou exterior;
c) História pregressa relacionada aos atores envolvidos nos eventos anteriores, quando houver; e
d) Local e condição de acomodação;
IV - Local do evento:
a) Características do local e da estrutura onde o evento de massa será realizado; e
b) Características sanitárias e ambientais das áreas influenciadas pelo evento que podem ter relação com a ocorrência de doenças transmissíveis;
V - Época de realização do evento
a) Condições meteorológicas
b) Doenças sazonais, de natureza infecciosa ou não
c) Contexto epidemiológico do sistema local;
VI - Capacidade básica estabelecida dos serviços de vigilância e distância do evento;
a) Possibilidade de ocorrência de situações contidas na lista de eventos de notificação compulsória imediata de acordo com a legislação vigente.
PARA CARACTERIZAÇÃO DE UM EVENTO DE MASSA (Origem: PRT MS/GM 1139/2013, Anexo 1)
ANEXO 2 DO ANEXO CII
CRITÉRIOS PARA AVALIAÇÃO DO RISCO EM EVENTOS DE MASSA (Origem: PRT MS/GM 1139/2013, Anexo 2)
CRITÉRIOS PARA AVALIAÇÃO DO RISCO EM EVENTOS DE MASSA
Os riscos associados a um evento de massa podem variar de acordo com as características intrínsecas e extrínsecas ao próprio evento. Na Figura 1, são ilustradas como as características do evento podem impactar na saúde do público envolvido.
Figura 1 - Relação entre a característica do evento com o risco.
| Característica do evento | Consideração sobre o impacto à saúde |
| Condições ambientais | Temperatura ambiental (muito alta ou muito baixa) Umidade ambiental e precipitações (chuvas favorecem acidentes) |
| Tipo e quantidade de público | Alta concentração de pessoas, favorecendo a transmissão de doenças e ocorrência de acidentes. Tipo do público (concentração de grupo mais suscetível a doenças ou mesmo grupos com tendências a atos violentos). Relação entre a população do município e o público estimado que pode estressar a capacidade de resposta e atendimento instalada. |
| Duração do evento | Eventos longos aumentam a exposição a riscos. |
| Tipo de evento | Externo (Aumento do tempo exposição ao sol ou temperaturas baixas) Interno (concentração de pessoas e aumento de exposição) |
| Consumo de alimentos e bebidas alcoólicas | O consumo de alimentos inclui o risco de surtos de doenças transmitidas por alimentos e o uso de álcool pode favorecer comportamentos violentos, além de outros riscos inerentes |
| Condições de trabalho | Excesso de tempo de trabalho, sem descanso. Área de aguardo inadequada. Exposição por longos períodos de tempo a fatores ambientais desfavoráveis. (altas temperaturas ou temperaturas muito baixas). Estresse por cobrança no cumprimento de metas. |
No processo de avaliação devem ser listados todos os riscos associados aos eventos de massa, incluindo aqueles com baixa probabilidade de ocorrência. Exemplos de riscos associados a eventos de massa estão apresentados na Figura 2.
Figura 2 - Principais riscos associados a eventos de massa.
| Categoria do risco | Risco à saúde |
| Doenças Infecciosas | Doenças Transmitidas por Alimentos. Doenças endêmicas. Doenças respiratórias |
| Danos físicos | Fraturas, cortes e queimaduras |
| Danos associados a terrorismo | Danos decorrentes do uso de substâncias químicas, agentes biológicos e material radioativo |
| Danos relacionados ao comportamento ou condições do público | Danos associados ao consumo de álcool. Danos associados ao consumo de drogas. Ataques cardíacos. Crises de asma |
| Danos relacionados ao ambiente | Danos associados à exposição solar ou baixas temperaturas. Picadas ou ferimentos associados a animais. Reações alérgicas |
| Danos relacionados às atividades laborais | Desenvolvimento de atividades laborais sem o devido uso de EPC e EPI. Exposição do trabalhador a riscos de qualquer natureza para desempenho das atividades laborais. Danos associados a acidentes graves e fatais. Danos associados a acidentes envolvendo crianças e adolescentes. Danos associados ao uso de álcool e drogas. Danos associados a assédio moral e sexual. |
Depois de sua identificação, os riscos devem ser classificados segundo a sua probabilidade de ocorrência e severidade. Correlacionando-se a probabilidade e severidade, pode-se obter a relevância do risco para o evento de massa em análise.
Anexo CIII
Do Comitê Interinstitucional de Farmacovigilância de Vacinas e outros Imunobiológicos - CIFAVI
(Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 1º Fica instituído o Comitê Interinstitucional de Farmacovigilância de Vacinas e outros Imunobiológicos - CIFAVI, no âmbito da Secretaria de Vigilância em Saúde - SVS/MS. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 1º O CIVAFI tem como objetivo avaliar os aspectos técnicos e científicos de eventos adversos decorrentes do uso de vacinas, observadas as competências dos órgãos públicos responsáveis pelas ações de farmacovigilância. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 2º O disposto neste Anexo não se aplica aos eventos adversos relacionados com ensaios clínicos de vacina. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 2º Para efeitos desta Portaria, entende-se por: (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
I - farmacovigilância: processo de detecção, avaliação, compreensão, prevenção e comunicação de eventos adversos pós-vacinação ou de qualquer outro problema relacionado à vacina ou à imunização; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
II - evento adverso pós-vacinação: qualquer ocorrência médica indesejada após a vacinação, não possuindo necessariamente uma relação causal com o uso de uma vacina ou outro imunobiológico (imunoglobulinas e soros heterólogos); (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
III - evento adverso grave: qualquer evento clinicamente relevante que: (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
a) requeira hospitalização; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
b) possa comprometer o paciente ocasionando risco de morte e que exija intervenção clínica imediata para evitar o óbito; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
c) cause disfunção significativa ou incapacidade permanente; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
d) resulte em anomalia congênita; ou (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
e) ocasione o óbito; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
IV - evento adverso inusitado: aquele não identificado anteriormente e decorrente de problemas ligados à qualidade do produto; e (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
V - evento adverso raro: aquele cuja frequência seja menor que 0,1%. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 3º Compete ao CIFAVI: (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
I - avaliar e investigar técnica e cientificamente, inclusive quanto à causalidade, os casos de evento adverso pós-vacinação grave, raro ou inusitado; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
II - realizar a revisão dos eventos adversos pós-vacinação avaliados pelos estados, municípios e Distrito Federal, a fim de determinar se são eventos graves, raros ou inusitados e verificar a necessidade de conduzir estudos especiais; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
III - acompanhar o monitoramento e a investigação de eventos adversos pósvacinação; (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
IV - elaborar parecer quando solicitado por órgão competente; e (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
V - elaborar seu regimento interno. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 1º O disposto neste Anexo não exime a competência estabelecida aos estados, municípios e Distrito Federal no âmbito do Sistema Nacional de Vigilância de Eventos Adversos Pós-Vacinação (SNVEAPV) ou no e-SUS Notifica. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 2º Para o exercício das competências previstas neste artigo, deverá ser observado o disposto no "Manual de Vigilância Epidemiológica de Eventos Adversos PósVacinação", disponível no endereço eletrônico http://bvsms.saude.gov.br/bvs/publicacoes/manual_vigilancia_epidemiologica_eventos_ vacinacao_4ed.pdf. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 4º O CIFAVI é composto por representantes dos seguintes órgãos e entidades: (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
I - 3 (três) do Ministério da Saúde, sendo, pelo menos, 2 (dois) da Secretaria de Vigilância em Saúde (SVS/MS); (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
II - três da Agência Nacional de Vigilância Sanitária (ANVISA); e (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
III - 1 (um) da Fundação Oswaldo Cruz (FIOCRUZ), por meio do Instituto Nacional de Controle de Qualidade em Saúde (INCQS/FIOCRUZ). (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 1º Pelo menos um dos representantes da SVS/MS deverá ser da área responsável pelo Programa Nacional de Imunizações e será o coordenador do Comitê. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 2º Cada membro do CIFAVI terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 3º Os membros do CIFAVI e respectivos suplentes serão indicados pelos titulares dos órgãos e entidades que representam e designados pelo Coordenador do Comitê. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 4º Poderão ser convidados para participar das reuniões do CIFAVI consultores ad hoc com reconhecida capacidade técnica na área de farmacovigilância, sem direito a voto. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 5º O CIFAVI se reunirá em caráter ordinário mensalmente e em caráter extraordinário sempre que necessário por convocação de seu Coordenador. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 1º O quórum de reunião do CIFAVI é de quatro membros e as decisões serão tomadas por consenso. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
§ 2º As reuniões do CIFAVI poderão ser feitas presencialmente ou por meio de videoconferência. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 6º A Secretaria-Executiva do CIFAVI será exercida pela SVS/MS. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Art. 7º A participação no CIFAVI será considerada prestação de serviço público relevante, não remunerada. (Redação dada pela PRT GM/MS nº 1.143 de 04.06.2021)
Anexo [1] do Anexo CIII
[DO PROGRAMA DE PROTEÇÃO E PROMOÇÃO DA SAÚDE MENSTRUAL]
(Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022)
Art. 1º Esse Anexo dispõe sobre as ações do Programa de Proteção e Promoção da Saúde Menstrual e institui incentivo financeiro para assegurar a oferta gratuita de absorventes higiênicos femininos e ações educativas relativas à saúde menstrual no âmbito do Sistema Único de Saúde - SUS. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 2º A Lei nº 14.214 de 6 de outubro de 2021 institui o Programa de Proteção e Promoção da Saúde Menstrual, que constitui estratégia para promoção da saúde e atenção à higiene e possui os seguintes objetivos: (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
I - combater a precariedade menstrual identificada como a falta de acesso a produtos de higiene e a outros itens necessários ao período da menstruação feminina ou a falta de recursos que possibilitem a sua aquisição; (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
II - oferecer garantia de cuidados básicos de saúde e desenvolver meios para a inclusão das mulheres em ações e programas de proteção à saúde menstrual. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 3º São eixos de ação para a implementação do Programa de Proteção e Promoção da Saúde Menstrual: (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
I - oferecer acesso gratuito a absorventes higiênicos femininos às mulheres em situação de precariedade menstrual; e (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
II - realizar ações educativas, individuais e coletivas, de promoção da saúde e prevenção de doenças, planejamento familiar e sexualidade responsável. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 4º São beneficiárias do Programa de Proteção e Promoção da Saúde Menstrual: (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
I - estudantes de baixa renda, matriculadas nos níveis de ensino fundamental, médio, Educação de Jovens e Adultos -EJA e ensino profissional, em escolas pactuadas na adesão ao Programa Saúde na Escola (PSE) com percentual mínimo de 50% dos estudantes de famílias beneficiárias do Programa Auxílio Brasil, conforme Portaria Interministerial n º 1.055 de 25 de abril de 2017; (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
II - mulheres em situação de rua ou em situação de vulnerabilidade social extrema, cadastradas em equipe de Consultório na Rua homologada pelo Ministério da Saúde, observados os critérios do Programa Previne Brasil; e (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
III - adolescentes internadas em unidades de cumprimento de medida socioeducativa, cadastradas em uma equipe Saúde da Família ou equipe de Atenção Primária, observados os critérios do Programa Previne Brasil. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 5º Fica instituído o incentivo financeiro para apoio às ações no âmbito do Programa de Proteção e Promoção da Saúde Menstrual que será transferido na modalidade fundo a fundo pelo Fundo Nacional de Saúde aos municípios e ao Distrito Federal em parcela única, anualmente. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
§ 1º O incentivo financeiro será disponibilizado pelo Bloco de Manutenção das Ações e Serviços Públicos de Saúde, conforme art. 3º da Portaria de consolidação nº 6, de 28 de setembro de 2017. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
§ 2º O valor do incentivo financeiro será de: (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
I - R$ 36,00 (trinta e seis reais) por estudante de baixa renda matriculada nos níveis de ensino Fundamental, Médio, Educação de Jovens e Adultos (EJA) e Ensino Profissional, em escolas aderidas no Programa Saúde na Escola (PSE) com mais de 50% dos estudantes de famílias beneficiárias do Programa Auxílio Brasil; (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
II - R$ 36,00 (trinta e seis reais) por mulheres cadastradas em equipe de Consultório na Rua homologada pelo Ministério da Saúde, observados os critérios do Programa Previne Brasil; e (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
III - R$ 36,00 (trinta e seis reais) por adolescente internada em unidades de cumprimento de medidas socioeducativas, cadastrada em uma equipe Saúde da Família ou equipe de Atenção Primária, observados os critérios do Programa Previne Brasil. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Parágrafo único. O incentivo financeiro de que trata o caput é uma ação do Programa de Proteção e Promoção da Saúde Menstrual, e será calculado com base nas informações registradas Programa Saúde na Escola (PSE) e Sistema Nacional de Atendimento Socioeducativo (SINASE). (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 6º O Programa de Proteção e Promoção da Saúde Menstrual será monitorado anualmente pelo Departamento dos Ciclos da Vida da Secretaria de Atenção Primária a Saúde por meio do indicador "número de atividades coletivas de educação em saúde - saúde sexual e reprodutiva", o qual será considerado pelo número de Atividades Coletivas registrados na ficha do Sistema de Informação em Saúde para a Atenção Primária (e-SUS APS). (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Parágrafo único. Este indicador já é contemplado nos registros do e-SUS APS e se refere as ações educativas realizadas pelas equipes de saúde da atenção primária e engloba as ações realizadas às populações descritas no Art. 4º. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 7º O Fundo Nacional de Saúde adotará as medidas necessárias para o repasse por meio de processo autorizativo encaminhado pela Secretaria de Atenção Primária à Saúde. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
§ 1º A prestação de contas sobre a aplicação do incentivo financeiro de que trata o art. 5º deverá ser realizada por meio do Relatório Anual de Gestão (RAG) do respectivo ente federativo, nos termos da Lei nº 8.142, de 28 de dezembro de 1990. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
§ 2º Nos casos em que for verificado que os recursos financeiros transferidos pelo Fundo Nacional de Saúde foram executados, total ou parcialmente, em objeto distinto ao originalmente pactuado, aplicar-se-á o regramento disposto na Lei Complementar nº 141, de 3 de janeiro de 2012, e no Decreto nº 7.827, de 16 de outubro de 2012. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Art. 8º Os recursos financeiros de que trata esta Portaria são oriundos das dotações orçamentárias consignadas ao Ministério da Saúde, devendo onerar o Programa de Trabalho 10.301.5019.219A - Plano Orçamentário 000A, mediante disponibilidade orçamentária e financeira do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 4.072 de 23.11.2022) (Revogado pela PRT GM/M n° 3.076 de 15.01.2024)
Anexo 2 do Anexo CIII
Do Programa Médicos pelo Brasil
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
CAPÍTULO I
DISPOSIÇÕES GERAIS
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 1º Este Anexo dispõe sobre as diretrizes para a execução do Programa Médicos pelo Brasil, instituído pela Lei nº 13.958, de 18 de dezembro de 2019. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 2º Para fins de execução do Programa Médicos pelo Brasil, consideram-se:(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - locais de difícil provimento: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) municípios de pequeno tamanho populacional, baixa densidade demográfica e distância relevante de centros urbanos, nos termos de ato do Ministro de Estado da Saúde, conforme classificação estabelecida pelo Instituto Brasileiro de Geografia e Estatística (IBGE); e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) Distritos Sanitários Especiais Indígenas (DSEIs), comunidades remanescentes de quilombos ou comunidades ribeirinhas, incluídas as localidades atendidas por unidades fluviais de saúde, nos termos de ato do Ministro de Estado da Saúde;(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - locais de alta vulnerabilidade: localidades com alta proporção de pessoas cadastradas nas Equipes de Saúde da Família e que recebem benefício financeiro do Programa Bolsa Família (PBF), Benefício de Prestação Continuada (BPC) ou benefício previdenciário no valor máximo de 2 (dois) salários-mínimos, nos termos de ato do Ministro de Estado da Saúde;(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - municípios elegíveis: municípios aptos para participação no Programa Médicos pelo Brasil, considerando a metodologia de priorização e elegibilidade estabelecida em ato específico do Ministério da Saúde;(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IV - municípios aderidos: municípios elegíveis que firmaram Termo de Adesão e Compromisso com o Ministério da Saúde para recebimento de médicos por meio do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
V - municípios descredenciados: municípios desligados do Programa, por uma das seguintes razões:(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) em virtude de aplicação de penalidade pelo Ministério da Saúde, em processo no qual se verificou o descumprimento das obrigações assumidas pelo município; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) por solicitação de resilição por parte do município, ante o desinteresse em prosseguir na relação contratual; ou(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
c) quando, após a revisão prevista no § 2º do art. 5º deste Anexo, o município deixar de ostentar as condicionantes para elegibilidade ao Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VI - municípios elegíveis e não aderidos: municípios que constam da relação de municípios elegíveis, contudo ainda não optaram pela adesão ao Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VII - Termo de Adesão e Compromisso do município: instrumento jurídico celebrado entre a União, por meio do Ministério da Saúde, e o município, de natureza declaratória e constitutiva, no qual conterá, de forma expressa, a adesão do ente federativo ao Programa Médicos pelo Brasil, especificando as obrigações e os direitos; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VIII - médico bolsista: denominação do médico com registro em Conselho Regional de Medicina (CRM) selecionado para realizar o curso de formação previsto no inciso II do art. 27 da Lei nº 13.958, de 2019, na modalidade de integração ensino-serviço, até a conclusão do processo seletivo público, a qual se dá com a aprovação em prova final escrita como especialista em medicina de família e comunidade, que o habilita à contratação pela Agência para o Desenvolvimento da Atenção Primária à Saúde (Adaps), no regime celetista; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IX - médico contratado: médico de família e comunidade contratado pela Adaps no regime celetista para realização de atividades assistenciais nos municípios aderidos; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
X - tutor médico: médico especialista em medicina de família e comunidade ou em clínica médica contratado pela Adaps mediante processo seletivo público para exercer a função de tutor de grupos de médicos bolsistas; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XI - médico participante: médico bolsista, médico contratado ou tutor médico; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XII - instituição de ensino superior: instituição de ensino superior, pública ou privada, contratada pela Adaps conforme Manual do Regulamento das Licitações, Compras e Contratações da Adaps, observando-se os princípios que regem a Administração Pública, para ministrar aos médicos bolsistas o curso de formação de que trata o art. 27, § 2º, da Lei nº 13.958, de 2019. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 3º Para efeitos deste Anexo, equipara-se: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - a município: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) o Distrito Sanitário Especial Indígena (DSEI); (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) o Distrito Estadual de Fernando de Noronha, localizado no estado de Pernambuco; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
c) o Distrito Federal; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - a gestor municipal: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) o gestor do DSEI; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) o gestor do Distrito Estadual de Fernando de Noronha, estado de Pernambuco; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
c) o gestor do Distrito Federal. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
CAPÍTULO II
DA EXECUÇÃO DO PROGRAMA MÉDICOS PELO BRASIL
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 4º O Programa Médicos pelo Brasil será executado pela Adaps, sob a orientação técnica e a supervisão do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 5º Os municípios elegíveis para participação no Programa Médicos pelo Brasil serão definidos por meio de metodologia de priorização e elegibilidade estabelecida em ato específico do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 1º A relação dos municípios elegíveis e a quantidade de vagas por município elegível serão publicizadas por ato do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º A metodologia deverá ser revisada em até 5 (cinco) anos, observado o disposto nos incisos II e III do art. 2º da Lei nº 13.958, de 2019. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 3º A relação dos municípios elegíveis e o quantitativo máximo de vagas poderão ser revisados anualmente, mediante atualização dos critérios e dos indicadores adotados pela metodologia, observado o interesse público. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 4º A revisão dos municípios elegíveis de que dispõe o § 3º poderá ser realizada, extraordinariamente, em período inferior a 1 (um) ano, quando houver modificação expressiva nos critérios e nos indicadores adotados, ou desde que aprovada pelo Conselho Deliberativo da Adaps. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 5º O quantitativo máximo de vagas definido para o Programa servirá de subsídio para pactuação de metas do contrato de gestão formalizado entre o Ministério da Saúde e a Adaps e não obriga a Agência a contratar médicos para todas as vagas contratualizadas. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
CAPÍTULO III
DAS COMPETÊNCIAS
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 6º Compete ao Ministério da Saúde: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - estabelecer a metodologia a ser utilizada na definição dos municípios elegíveis para participação no Programa Médicos pelo Brasil, considerando como critério de priorização e elegibilidade os locais de difícil provimento ou de alta vulnerabilidade; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - definir a relação dos municípios elegíveis para participação no Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - estabelecer o quantitativo de vagas por município elegível para provimento de médicos no âmbito do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IV - estabelecer os requisitos e os procedimentos para a participação dos municípios no Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
V - analisar e aprovar as manifestações de interesse em aderir ao Programa apresentadas pelos municípios elegíveis; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VI - definir e divulgar o quantitativo máximo de vagas destinadas aos municípios elegíveis; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VII - elaborar e publicar editais para que os municípios elegíveis e não aderidos possam manifestar o seu interesse em aderir ao Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VIII - celebrar os Termos de Adesão e Compromisso com os municípios elegíveis ao Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IX - decidir sobre o descredenciamento de municípios do Programa, garantido o devido processo legal; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
X - definir e divulgar as formas de participação dos usuários do Programa Médicos pelo Brasil na avaliação dos serviços prestados e do cumprimento de metas; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XI - definir os termos do contrato de gestão a ser firmado com a Adaps e seus aditivos, com a finalidade de execução do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XII - aprovar, anualmente, o orçamento apresentado pela Adaps para a execução das atividades previstas no contrato de gestão;
XIII - propor, na lei orçamentária anual, os créditos a serem transferidos à Adaps para a execução das atividades previstas no contrato de gestão; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XIV - transferir à Adaps os créditos previstos no contrato de gestão, de acordo com o cronograma de desembolso estabelecido no ajuste, observados os valores aprovados na lei orçamentária anual e a existência de limite financeiro-orçamentário; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XV - instituir comissão responsável pelo acompanhamento e pela avaliação periódica dos resultados alcançados com a execução do contrato de gestão celebrado com a Adaps, com base nos indicadores pactuados no contrato de gestão, para aferição de seu desempenho na execução do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XVI - garantir o acesso da Adaps à base de dados de serviços de saúde e a outros sistemas do Sistema Único de Saúde (SUS) que tenham relação com os locais de atuação dos médicos no âmbito do Programa, com o registro de informações quanto às atividades assistenciais na Atenção Primária à Saúde, observado o disposto na Lei nº 13.709, de 14 de agosto de 2018 (Lei Geral de Proteção de Dados Pessoais - LGPD); (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XVII - apoiar a Adaps, nos limites de sua competência, quanto ao provimento dos meios necessários à consecução dos objetivos e metas definidos no contrato de gestão; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XVIII - elaborar normas gerais acerca do Programa Médicos pelo Brasil. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 7º Compete à Adaps a execução do Programa Médicos pelo Brasil, sob a orientação técnica e a supervisão do Ministério da Saúde e em consonância com o Plano Nacional de Saúde, observando as diretrizes e as competências fixadas na Lei nº 13.958, de 2019, e nos atos normativos expedidos pelo Ministério da Saúde: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - disciplinar, por meio de ato normativo interno, as matérias de sua competência relacionadas ao Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - promover a seleção de profissionais médicos nos termos estabelecidos pela Lei nº 13.958, de 2019, e pelos atos normativos expedidos pelo Ministério da Saúde, a fim de viabilizar a implementação do Programa Médicos pelo Brasil, observando os princípios que regem a Administração Pública; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - desenvolver, no âmbito do Programa Médicos pelo Brasil, atividades de ensino, pesquisa e extensão, em especial a promoção do curso de formação de que trata o inciso II do art. 27 da Lei nº 13.958, de 2019, que poderá ser objeto de contratação externa, considerando, no processo formativo, o componente assistencial, por meio da integração ensino e serviço; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IV - coordenar, disciplinar, acompanhar e fiscalizar as ações de aperfeiçoamento dos médicos participantes do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
V - promover o desenvolvimento e a incorporação de tecnologias assistenciais que venham a aumentar a efetividade da atuação dos profissionais médicos participantes do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VI - avaliar, periodicamente, em conjunto com o Ministério da Saúde, a pertinência e a consistência dos indicadores e metas de desempenho constantes do Programa de Trabalho pactuado, propondo, com as devidas justificativas, alterações, inclusões e exclusões necessárias; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VII - avaliar, anualmente, por meio de sistema estruturado que permita o acompanhamento histórico dos resultados, os níveis de satisfação: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) do gestor municipal que tenha recebido médicos do Programa Médicos pelo Brasil; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) dos médicos participantes, em relação à sua atividade, levando em conta o sistema de tutoria e a Unidade Básica de Saúde em que estejam alocados; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VIII - acompanhar, de forma sistematizada e em conformidade com as formas de participação estabelecidas pelo Ministério da Saúde, a experiência dos usuários do Programa Médicos pelo Brasil, em relação à avaliação dos serviços prestados; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IX - estabelecer painel de monitoramento quanto às metas pactuadas e demais pontos de atenção pela aplicação dos indicadores estabelecidos para o Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
X - alcançar as metas de desempenho institucional e cumprir os objetivos estabelecidos no Programa de Trabalho aprovado, considerando as ações do Programa Médicos pelo Brasil; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XI - disponibilizar canal de comunicação oficial da Agência que permita o esclarecimento de dúvidas, bem como a oitiva de sugestões, reclamações e denúncias, com observância do disposto na Lei nº 12.527, de 18 de novembro de 2011; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XII - disponibilizar, tempestivamente, as informações que lhe forem solicitadas pelo Ministério da Saúde relativas à execução do Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XIII - apoiar os municípios participantes do Programa Médicos pelo Brasil nas ações que visam garantir o adequado desempenho do médico participante na Atenção Primária à Saúde, bem como fiscalizar, de forma concorrente com o município, o cumprimento da execução pelo médico da carga horária de 40 (quarenta) horas semanais, no que se refere às atividades assistenciais, ressalvadas as especificidades das Equipes de Saúde da Família ribeirinhas, fluviais e indígenas, no que tange à distribuição da carga horária; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XIV - realizar estudo acerca dos impactos da participação dos municípios no Programa Médicos pelo Brasil, a cada 5 (cinco) anos, cujos resultados deverão ser entregues ao Ministério da Saúde, observados os padrões de produção de textos acadêmicos no País. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 8º Compete aos municípios participantes do Programa Médicos pelo Brasil, sem prejuízo de demais responsabilidades definidas em lei, nos editais específicos, no Termo de Adesão e Compromisso e em outras normas do Programa: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - atuar em cooperação com os demais entes federativos e a Adaps, no âmbito de sua competência, para as ações de execução do Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - adotar as providências necessárias à realização das ações previstas no Termo de Adesão e Compromisso firmado com o Ministério da Saúde; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - inserir os médicos participantes do Programa nas Equipes de Saúde da Família compatíveis com a carga horária destinada às atividades de assistência, observadas as normativas do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IV - inscrever o médico participante do Programa, recebido pelo município, no Sistema de Cadastro Nacional de Estabelecimentos de Saúde (SCNES) e identificá-lo na respectiva Equipe de Saúde da Família em que atuará, no prazo máximo de 72 (setenta e duas horas), após o início das atividades do médico participante do Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
V - realizar o envio periódico das informações assistenciais registradas localmente no Sistema de Informação em Saúde para a Atenção Básica (SISAB); (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VI - apoiar os médicos tutores e médicos bolsistas contratados pela Adaps nas regulares e periódicas visitas de tutoria; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VII - recepcionar os médicos tutores e médicos bolsistas; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VIII - contribuir com o processo de planejamento e programação de atividades de tutoria presencial a serem ofertadas aos médicos bolsistas, de maneira pactuada com o Ministério da Saúde e com a Adaps; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IX - comunicar à Adaps: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) no prazo de 72 (setenta e duas) horas, a ocorrência de infrações praticadas pelo médico participante, previstas neste Anexo, no Termo de Adesão e Compromisso ou em outros atos normativos do Programa, e, no prazo máximo de 10 (dez) dias corridos, da data da ciência dos fatos, informações e documentos necessários à devida instrução de processo administrativo; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) no prazo máximo de 3 (três) dias corridos, qualquer ocorrência de afastamento dos médicos que estejam alocados no município; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
X - manter os dados do gestor municipal atualizados no sistema eletrônico da Adaps e no Ministério da Saúde, enquanto estiver vinculado ao Programa; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XI - fornecer condições de infraestrutura e ambiência adequadas para o exercício das atividades dos médicos participantes do Programa, tais como: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) ambientes adequados com segurança e higiene; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) fornecimento de equipamentos necessários e instalações sanitárias; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
c) demais exigências e especificações estabelecidas na Política Nacional de Atenção Básica (PNAB); (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XII - exercer, concomitantemente com a Adaps, a fiscalização da execução da carga horária de 40 (quarenta) horas semanais pelos médicos participantes do Programa, ressalvadas as especificidades das Equipes de Saúde da Família ribeirinhas e fluviais e das equipes multidisciplinares de saúde indígena, no que tange à distribuição da carga horária, encaminhando, na forma e no prazo a serem definidos pela Adaps, informações acerca do cumprimento da carga horária desses profissionais; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XIII - dispensar ao médico participante do Programa o mesmo tratamento conferido aos demais integrantes das Equipes de Saúde da Família, exceto no que diz respeito ao direito trabalhista; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XIV - fornecer ao Ministério da Saúde e à Adaps dados fidedignos e atualizados acerca da infraestrutura disponível na Atenção Primária à Saúde em seu território, sempre que requeridos. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
XV - pagar, como ajuda de custo mensal ao médico bolsista lotado no município, o valor em pecúnia de R$ 1.100,00 (mil e cem reais). (Redação dada pela PRT GM/MS mº 3.193 de 02.08.2022)
Parágrafo único. Os municípios que aderirem ao Programa deverão observar as normas internas de organização da Adaps, no que diz respeito à execução do Programa Médicos pelo Brasil. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
CAPÍTULO IV
DA PARTICIPAÇÃO DOS MUNICÍPIOS NO PROGRAMA MÉDICOS PELO BRASIL
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 9º Após a publicação da relação dos municípios elegíveis prevista no art. 5º deste Anexo, o Ministério da Saúde publicará edital estabelecendo as condições para manifestação de interesse, as obrigações e os deveres das partes, bem como minuta do Termo de Adesão e Compromisso, que deverá ser assinado pelo gestor municipal. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. O Ministério da Saúde poderá a qualquer tempo abrir prazo para que os municípios elegíveis e não aderidos possam manifestar interesse na adesão. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Seção I
Do Termo de Adesão e Compromisso a ser celebrado com o município
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 10. O Termo de Adesão e Compromisso a ser celebrado com o município observará os ditames das normas brasileiras vigentes, em especial a Lei nº 13.958, de 2019, e o presente Anexo, e conterá, no mínimo: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - os direitos e os deveres de cada parte contratante; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - a vigência do contrato pelo prazo de 5 (cinco) anos; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - as penalidades em caso de infração. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 11. A rescisão do Termo de Adesão e Compromisso poderá ocorrer: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - em virtude de aplicação de penalidade pelo Ministério da Saúde, em processo no qual se verificou o descumprimento das obrigações assumidas pelo município; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - por resilição a pedido do município, que deverá ocorrer de forma justificada; ou, (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - quando, após a revisão prevista no § 2º do art. 5º deste Anexo, o município deixar de ostentar as condicionantes para elegibilidade ao Programa Médicos pelo Brasil. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. Em caso de resilição a pedido do município, o Ministério da Saúde oficiará o Presidente do Legislativo Municipal e o Ministério Público Estadual. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 12. O Termo de Adesão e Compromisso será celebrado uma vez a cada 5 (cinco) anos. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. O Termo de Adesão e Compromisso poderá ser aditado em caso de situação de emergência em saúde, estado de calamidade pública ou interesse público. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Seção II
Da aplicação de penalidades aos municípios
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 13. O descumprimento das obrigações assumidas pelos municípios enseja a aplicação das seguintes penalidades: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - advertência; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - bloqueio de vaga; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - descredenciamento do município do Programa Médicos pelo Brasil. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. As penalidades de que trata o caput serão aplicadas fundamentadamente pela Secretaria de Atenção primária à Saúde, de acordo com as peculiaridades do caso concreto, a gravidade e a natureza das infrações, assegurado o direito ao contraditório e à ampla defesa. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 14. A penalidade de advertência poderá ser aplicada ao município que deixar de cumprir qualquer obrigação constante neste Anexo, na Lei nº 13.958, de 2019, no Termo de Adesão e Compromisso ou em qualquer outro ato normativo vinculado ao Programa Médicos pelo Brasil, que não constituir infração punida com bloqueio de vaga e descredenciamento do município. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 15. A penalidade de bloqueio de vaga poderá ser aplicada nas hipóteses de o município: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - ter sido punido por duas vezes com penalidade de advertência, durante o período de um ano, contado da aplicação da primeira penalidade; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - deixar de validar a alocação do médico encaminhado pela Adaps no município, caso atenda aos requisitos para tanto. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 1º A penalidade de bloqueio de vaga poderá ser aplicada de forma imediata, nos casos em que cabe a aplicação da penalidade de advertência, a depender da gravidade dos efeitos da conduta no caso concreto. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º A penalidade de bloqueio de vaga poderá abranger, preferencialmente, as vagas sem ocupação no momento da aplicação da penalidade e, subsidiariamente, as vagas que se encontram ocupadas pelos médicos participantes, da seguinte forma: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) nos casos de bloqueio de vagas ocupadas: com manutenção em atividade do médico participante alocado na vaga, ficando bloqueada para futura alocação após sua desocupação, enquanto perdurar o bloqueio, ou transferência para outro município do médico participante alocado na vaga, permanecendo bloqueada, enquanto perdurar o bloqueio; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) nos casos de bloqueio de vagas não ocupadas, estas não serão disponibilizadas para ocupação, enquanto perdurar o bloqueio. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 3º A penalidade de bloqueio de vaga terá o prazo máximo de duração de 6 (seis) meses, podendo ser estendida caso perdure a situação ensejadora da aplicação da penalidade, mediante decisão fundamentada da Secretaria de Atenção Primária à Saúde. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 4º Cabe à Adaps dispor sobre transferência dos médicos participantes nos casos bloqueio de vagas ocupadas. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 16. A penalidade de descredenciamento do município poderá ser aplicada nas seguintes hipóteses: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - caso o município tenha sido penalizado por duas vezes com penalidade de bloqueio de vaga, durante o período de um ano, contado da aplicação da primeira penalidade; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - deixar de regularizar a situação que ensejou a aplicação da penalidade de advertência ou bloqueio de vaga, no prazo concedido pela Secretaria de Atenção Primária à Saúde, considerando a gravidade da conduta. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 1º A penalidade de descredenciamento do município consiste na rescisão automática da sua participação no Programa, cabendo a Adaps dispor sobre transferência dos médicos participantes que estiverem ali alocados para outros municípios participantes do Programa. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º O município que for penalizado com o descredenciamento não poderá retornar ao Programa, no prazo de um ano, após a decisão final administrativa. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 17. Instaurado processo administrativo para apuração de possível descumprimento de obrigações, o Ministério da Saúde notificará o município para que, no prazo de 5 (cinco) dias, apresente manifestação por escrito acerca dos fatos alegados. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 1º A notificação de que trata o caput será encaminhada ao município por meio do endereço eletrônico cadastrado pelo gestor no sistema eletrônico do Programa Médicos pelo Brasil. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º O prazo de 5 (cinco) dias será contado, de modo contínuo, do primeiro dia útil seguinte ao envio da notificação para o endereço eletrônico do gestor, considerando-se prorrogado até o primeiro dia útil seguinte se o seu vencimento cair em dia não útil. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 3º Transcorrido o prazo para manifestação do município, com ou sem resposta, o Ministério da Saúde decidirá sobre a penalidade aplicada, podendo, a depender da gravidade da infração, antes da aplicação das penalidades previstas neste Anexo, recomendar ao gestor municipal a adoção de providências para a regularização da situação. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 4º O Ministério da Saúde notificará, via endereço eletrônico, a sua decisão aos envolvidos. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 5º Na hipótese em que decidir pela recomendação de regularização da situação antes da aplicação das penalidades previstas neste Anexo, o município terá o prazo de até 15 (quinze) dias corridos, a contar da intimação, para atender a recomendação e comprovar a regularização da situação. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 6º O prazo de que trata o § 5º poderá ser prorrogado uma única vez, por igual período, desde que devidamente justificado pelo município. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 7º Decorrido o prazo de que trata o § 5º sem que haja cumprimento da recomendação com comprovação da regularização da situação, o Ministério da Saúde dará seguimento ao processo, podendo, fundamentadamente, decidir pela aplicação da penalidade. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 8º Na hipótese de aplicação da penalidade de descredenciamento do município, o médico participante deverá ser transferido para outro município aderido ao Programa Médicos pelo Brasil, preferencialmente na mesma unidade da federação do município descredenciado e em município de mesmo perfil de difícil provimento médico ou de alta vulnerabilidade que o município descredenciado. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
CAPÍTULO V
DA SELEÇÃO E DOS REQUISITOS PARA PARTICIPAÇÃO DOS MÉDICOS NO PROGRAMA
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 18. A seleção dos profissionais médicos para o Programa Médicos pelo Brasil será realizada pela Adaps, mediante processo seletivo público que observe os princípios da Administração Pública, bem como as regras descritas na Lei nº 13.958, de 2019, neste Anexo e no respectivo edital de seleção. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 19. No âmbito do Programa Médicos pelo Brasil serão selecionados os seguintes profissionais: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - médicos de família e comunidade; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - tutores médicos. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 1º É requisito para inscrição no processo seletivo para médico de família e comunidade, o registro regular em Conselho Regional de Medicina. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º A contratação de médicos tutores para o Programa Médicos pelo Brasil será realizada mediante processo seletivo público para os profissionais especialistas em medicina de família e comunidade ou em clínica médica, nos termos previstos no edital da seleção. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 20. O edital de seleção dos médicos e tutores médicos do Programa Médicos pelo Brasil conterá as especificidades de cada cargo e trará os requisitos de classificação dos aprovados, a remuneração, as atribuições, observando-se os parâmetros legais e o disposto neste Anexo. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. No edital, poderão ser exigidos requisitos não contemplados neste Anexo, desde que comprovado e descrito de forma expressa o interesse público perseguido. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 21. A remuneração dos profissionais participantes do Programa Médicos pelo Brasil será regulamentada por ato da Adaps, conforme determinação legal. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 22. Os médicos participantes do Programa Médicos pelo Brasil, quer estejam no curso de formação, quer tenham sido contratados, não terão qualquer vínculo trabalhista com a União ou com o município em que forem alocados. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 23. O médico participante será alocado pela Adaps, observando-se as vagas disponíveis e a sua classificação no processo seletivo. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. Quando do estudo para a publicação de edital para contratação de médicos, compete à Adaps diligenciar junto ao Ministério da Saúde e do município aderido, no sentido de verificar a quantidade de Equipes de Saúde da Família e a necessidade de recebimento do médico pelo ente municipal. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Seção I
Do curso de formação
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 24. O curso de formação será ofertado aos candidatos que forem aprovados na primeira fase do processo seletivo para médico de família e comunidade, conforme inciso I do art. 27 da Lei nº 13.958, de 2019, dentro do número de vagas ofertadas no edital, e terá a duração de 2 (dois) anos, assim entendida a conclusão em 24 (vinte e quatro) meses, ininterruptos ou não. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 25. O curso de formação abrangerá atividades de ensino, pesquisa e extensão, além do componente assistencial, mediante integração entre ensino e serviço, exclusivamente na Atenção Primária à Saúde, no âmbito do SUS. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 26. As atividades práticas do curso de formação serão desenvolvidas em Unidades Básicas de Saúde, sob supervisão e avaliação dos tutores médicos da Adaps, os quais estarão alocados em municípios estratégicos que possibilitem o recebimento dos médicos bolsistas de municípios da mesma região. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Parágrafo único. O médico tutor deverá ser responsável pelo conjunto de no máximo 7 (sete) médicos bolsistas do Programa. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 27. As matérias que envolvem o curso de formação e que não forem tratadas neste Anexo ou em outro ato normativo expedido pelo Ministério da Saúde serão de competência da Adaps, em acordo com a instituição de ensino superior. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Seção II
Dos direitos e deveres dos médicos bolsistas participantes do curso de formação
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 28. São direitos dos médicos bolsistas do curso de formação: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - receber bolsa-formação, cujo valor constará no edital da seleção; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - receber o mesmo tratamento dispensado aos demais membros da equipe em que estiver atuando, salvo no que diz respeito às questões trabalhistas; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - recesso, conforme definido pela Adaps, após oitiva do gestor do município em que o médico estiver alocado; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IV - afastar-se das atividades, por período não inferior a 120 (cento e vinte) dias, para a médica bolsista, para gozo de licença-maternidade, em caso de nascimento de filho ou adoção; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
V - afastar-se das atividades práticas, pelo prazo de 5 (cinco) dias, para o médico bolsista, para gozo de licença-paternidade, em caso de nascimento ou adoção de filho; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VI - afastar-se de suas atividades práticas, pelo prazo de até 15 (quinze) dias, para tratamento de saúde. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VII - receber, exclusivamente do município em que estiver alocado, a título de ajuda de custo mensal, o valor em pecúnia de R$ 1.100,00 (mil e cem reais). (Redação dada pela PRT GM/MS mº 3.193 de 02.08.2022)
§ 1º O recesso de que trata o inciso III será contado para a conclusão do curso, não configurando suspensão do curso de formação. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º No período de licença-maternidade de que trata o inciso IV, o curso de formação e o pagamento da bolsa-formação ficarão suspensos, e o período de licença não será contabilizado para a conclusão do curso de formação. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 3º No caso do inciso IV, a médica que ainda não tiver direito ao salário-maternidade, pago pela Previdência Social, poderá optar por continuar suas atividades junto ao Programa, após a liberação médica. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 4º No afastamento para licença-paternidade de que trata o inciso V, não haverá suspensão do curso de formação, ficando as atividades práticas e teóricas suspensas. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 5º No caso do inciso V, não haverá suspensão do curso de formação e da bolsa-formação, e as atividades teóricas deverão ser repostas ao médico bolsista pela instituição de ensino na qual estiver matriculado. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 6º No caso de afastamento por motivo de tratamento de saúde do médico bolsista por período superior a 15 dias: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
a) as atividades teóricas e práticas e o pagamento da bolsa-formação serão suspensos; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
b) o tempo de afastamento não contará para a conclusão do curso de formação; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
c) o médico deverá recorrer à Previdência Social, considerando o seu vínculo como segurado obrigatório do Regime Geral de Previdência Social (RGPS), na condição de contribuinte individual, nos termos do § 6º do art. 27 da Lei nº 13.958, de 2019.
§ 7º As demais licenças, como em caso de morte de dependente legal e casamento, serão resolvidas pela Adaps, observada a regra de suspensão do curso de formação e do pagamento da bolsa-formação na hipótese de licença por período superior a 15 (quinze) dias. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 8º As questões inerentes às atividades teóricas, no período de suspensão do curso de formação, serão resolvidas pela Adaps, em conjunto com a instituição de ensino parceira a qual o médico estiver vinculado. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 9º. O pagamento da bolsa-formação está condicionado ao efetivo exercício das atividades pelo médico, ressalvados os casos de afastamentos excepcionados no presente Anexo, sendo autorizado o desconto de faltas injustificadas. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 29. São deveres dos médicos bolsistas participantes do curso de formação: (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
I - exercer com zelo e dedicação as atividades assistenciais, bem como as atividades do curso de formação; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
II - observar as leis e as normas regulamentares vigentes; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
III - cumprir as instruções, as orientações e as regras definidas pelo tutor médico, pelo gestor municipal, pelas instituições de ensino superior e pela Adaps; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IV - atender com presteza e urbanidade os usuários do SUS; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
V - zelar pela economia dos insumos aplicados à atividade assistencial e pela conservação do patrimônio público; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VI - cumprir a carga horária fixada, nos termos deste Anexo, para as atividades do Programa Médicos pelo Brasil, conforme definido pela Adaps; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VII - tratar de forma respeitosa os gestores do Programa Médicos pelo Brasil, em todos os níveis, bem como os demais profissionais, sejam eles da área da saúde ou administrativos; (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
VIII - levar ao conhecimento do tutor médico e da Adaps eventuais dúvidas quanto às atividades de ensino e serviço, bem como as irregularidades de que tiver ciência em razão dessas atividades; e (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
IX - registrar as informações das suas atividades assistenciais no sistema de informação da Atenção Primária à Saúde disponibilizado, nos prazos determinados pela Adaps. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 1º É vedado ao médico bolsista receber valores ou vantagens de qualquer espécie, em razão de suas atividades no Programa Médicos pelo Brasil, diversas daquelas previstas para o Programa. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
§ 2º A Adaps deverá designar outros deveres para os médicos participantes, sempre com fulcro no interesse público e observado o estabelecido neste Anexo. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 30. As hipóteses de transferência dos médicos bolsistas serão disciplinadas pela Adaps. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 31. O descumprimento de deveres pelos médicos bolsistas redundará em aplicação de penalidades aplicáveis aos médicos bolsistas, nos moldes de ato interno a ser definido pela Adaps. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Seção III
Dos direitos e deveres dos médicos contratados e tutores médicos
(Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 32. Os direitos e deveres dos médicos de família e comunidade efetivos e tutores médicos contratados pela Adaps estão preconizados na legislação trabalhista e nas normas expedidas pela Adaps. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 33. As hipóteses de transferência dos médicos de família e comunidade e tutores médicos contratados pela Adaps deverão observar o disposto na legislação trabalhista e nas normas expedidas pela Adaps. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Art. 34. As penalidades aplicáveis aos médicos contratados e tutores médicos da Adaps serão objeto de normativo interno da Adaps, observado o regime estabelecido na Consolidação das Leis do Trabalho. (Redação dada pela PRT GM/MS nº 3.353 de 02.12.2021)
Anexo 3 do Anexo CIII
MODELO DE DECLARAÇÃO DE CONFLITO DE INTERESSES - CTA-QUALISUS CARDIO
(Redação dada pela PRT GM/MS nº 1.099 de 12.05.2022)
INFORMAÇÕES PESSOAIS (todos os campos são de preenchimento obrigatório)
Nome completo: __________________________________________________
CPF: ____________________________________________________________
Telefone: ________________________________________________________
E-mail: __________________________________________________________
CONFLITO DE INTERESSES
1 - Você tem algum interesse financeiro ou de outra espécie no tema discutido que possa ser considerado como um conflito de interesse real, potencial ou aparente?
[ ] SIM
[ ] NÃO
Se SIM, favor especificar: ____________________________________________________________________
2 - Você tem ou teve, nos últimos 5 (cinco) anos, vínculo profissional ou outro tipo de relação com alguma entidade diretamente envolvida na produção, manufatura, distribuição ou venda de produto para a saúde utilizado no diagnóstico ou tratamento das doenças em pauta?
[ ] SIM
[ ] NÃO
Se SIM, favor especificar o tipo de interesse:
[ ] Pessoal
[ ] Comercial
[ ] Acadêmico
[ ] Político
[ ] Financeiro
Ainda se SIM, favor incluir o nome o nome da empresa ou indústria: _________________________________
3 - Você tem ou teve, nos últimos 5 (cinco) anos, vínculo profissional ou outro tipo de relação com alguma organização não-governamental (ONG) ou outra instituição destinada à defesa de interesses de pacientes com as doenças em pauta?
[ ] SIM
[ ] NÃO
Se SIM, favor especificar, incluindo o nome da instituição: _________________________________________
4 - Você tem ou teve, nos últimos 5 (cinco) anos, patrocínio de empresa de produtos para a saúde ou de indústria farmacêutica para a realização de estudos experimentais subvencionados ou para a publicação de texto científico em periódico ou para inscrição, transporte ou hospedagem para participação em congresso científico ou eventos similares relacionados com as doenças em pauta?
[ ] SIM
[ ] NÃO
Se SIM, favor especificar, incluindo o nome da empresa ou indústria: ________________________________
5 - Você presta ou prestou, nos últimos 5 (cinco) anos, serviço, tal como consultoria ou apresentação de produto, ou recebeu algum outro tipo de apoio institucional por empresa de produtos para a saúde ou de indústria farmacêutica relacionados com as doenças em pauta?
[ ] SIM
[ ] NÃO
Se SIM, favor incluir o nome o nome da empresa ou indústria: ______________________________________
6 - Você está diretamente representando os interesses de alguma entidade?
[ ] SIM
[ ] NÃO
Se SIM, favor especificar a sua relação com a entidade:
[ ] Proprietário(a)
[ ] Sócio(a)
[ ] Outra
Ainda se SIM, favor indicar o nome da entidade: ________________________________________________
7 - Há mais algum fato que possa afetar sua objetividade ou independência nesta Câmara Técnica Assessora?
[ ] SIM
[ ] NÃO
Se SIM, favor especificar: ____________________________________________________________________
Declaro que as informações prestadas são verdadeiras e que nenhuma outra situação de conflito de interesses real ou potencial é conhecida por mim. Comprometo-me a comunicar quaisquer mudanças nas circunstâncias.
_________________________________________________________________
(Município) (UF) (Data) (Assinatura)
ANEXO CIV
Do Programa de Qualidade no Processo de Doação e Transplantes (QUALIDOT)
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
ANEXO CIV
Do Incremento Financeiro para Qualidade do Sistema Nacional de Transplantes
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
CAPÍTULO I
DISPOSIÇÕES PRELIMINARES
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO I
DAS DISPOSIÇÕES PRELIMINARES
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 1º Este Anexo institui o Programa de Qualidade no Processo de Doação e Transplantes (QUALIDOT), no âmbito do Sistema Único de Saúde (SUS), com a finalidade de promover a melhoria da qualidade assistencial e o alcance de metas no processo de doação e transplantes. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 1º Este Anexo institui o incremento Financeiro para Qualidade do Sistema Nacional de Transplantes com a finalidade de promover a melhoria da qualidade assistencial e o aumento do volume de transplantes realizados no âmbito do Sistema Único de Saúde - SUS. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 2º São objetivos do QUALIDOT: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 2º São objetivos do incremento: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - avaliar o desempenho dos hospitais integrantes do Sistema Nacional de Transplantes (SNT), a partir da análise multicritério composta por indicadores relativos ao volume, à qualidade e à segurança da assistência prestada; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
I - estimular a qualidade dos serviços integrantes do Sistema Nacional de Transplantes - SNT, a partir da remuneração diferenciada para os centros que alcancem as metas estipuladas nos indicadores de desempenho relativos à volumetria e à sobrevida pós-transplante; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - estabelecer custeio diferenciado para a realização de procedimentos de doação e transplantes de órgãos e células, em conformidade com o desempenho aferido. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
II - apoiar, por meio de capacitações e tutorias, a melhoria dos processos de qualidade assistencial nos centros de menor desempenho, para que alcancem os indicadores de desempenho. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 3º São eixos de ações do QUALIDOT: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 3º São diretrizes do incremento: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - o diagnóstico situacional, o monitoramento e a avaliação da rede; (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
I - o diagnóstico situacional, o monitoramento e a avaliação da rede; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - a definição de modelo de custeio diferenciado, condicionado ao desempenho aferido por estabelecimento de saúde participante; (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
II - a definição de modelo de custeio diferenciado, condicionado ao desempenho aferido. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - o fortalecimento dos processos de gestão, com ênfase na organização dos processos de trabalho e no aprimoramento da qualidade assistencial; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
IV - a educação em saúde e a capacitação de profissionais e gestores, com vistas à qualificação assistencial. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 4º Os serviços que fizerem adesão ao incremento assumem responsabilidade para com: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - o fortalecimento da qualidade nos processos de gestão, com ênfase na organização dos processos de trabalho e no aprimoramento assistencial; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - a educação em saúde e a capacitação de profissionais e gestores com vistas à qualificação assistencial; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - o fortalecimento das ações institucionais relativas à segurança do paciente; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
IV - a promoção da saúde do trabalhador. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
CAPÍTULO II
DOS REQUISITOS PARA PARTICIPAÇÃO NO QUALIDOT
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO II
DA ADESÃO AO INCREMENTO FINANCEIRO
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 4º A participação no QUALIDOT ocorrerá por meio de adesão dos estabelecimentos interessados, com a aprovação prévia das Centrais Estaduais de Transplantes e das Secretarias Estaduais de Saúde (SES). (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Parágrafo único. Para fins do disposto no caput, a adesão dos hospitais ao QUALIDOT será válida pelo período de um ciclo, correspondente a 2 (dois) anos de duração. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 5º Somente estarão aptos à adesão ao QUALIDOT os hospitais com atividade transplantadora de, no mínimo, 2 (dois) anos. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 5º Estão aptos à adesão ao incremento financeiro os serviços regularmente habilitados com, pelo menos, 2 (dois) anos consecutivos e ininterruptos de atividade transplantadora no âmbito do SUS. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 6º Para a adesão ao QUALIDOT, os hospitais deverão comprovar, documentalmente, os seguintes requisitos: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 6º A participação ocorrerá por meio de requerimento, o qual deverá ser aprovado pelas Centrais Estaduais de Transplantes, pelas Secretarias Estaduais de Saúde SES, além de homologado na Comissão Intergestores Bipartite - CIB. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 1º A solicitação de adesão ao incremento deverá observar o modelo constante do Anexo 3. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 2º As Centrais Estaduais de Transplantes deverão analisar e validar a documentação apresentada pelos serviços antes do encaminhamento para análise e aprovação da Secretaria Estadual de Saúde, a quem incumbe apresentar a solicitação para discussão e homologação na CIB. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 3º Após a discussão e homologação na CIB, as Secretarias Estaduais de Saúde deverão retornar a solicitação à Central Estadual de Transplantes para o encaminhamento à Coordenação-Geral do Sistema Nacional de Transplantes no Ministério da Saúde, por meio do Sistema de Apoio à Implementação de Políticas em Saúde - SAIPS. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - cumprimento do disposto: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
a) na Política Nacional de Regulação do SUS, prevista no Anexo XXVI da Portaria de Consolidação GM/MS nº 02, de 28 de setembro de 2017, que tem como premissa a interface entre as Centrais de Regulação e o Núcleo Interno de Regulação (NIR), por meio de documento que comprove a existência e funcionamento do NIR; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
b) no Programa Nacional de Segurança do Paciente (PNSP), previsto no Capítulo VIII do Título I da Portaria da Consolidação nº 5, de 28 de setembro de 2017, por meio de documento que comprove a existência e o funcionamento do Núcleo de Segurança do Paciente - NSP; (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
II - alcance das metas quantitativas relativas às consultas de avaliação pré e pós-transplantes, de acordo com os parâmetros de necessidade definidos pelo gestor estadual de saúde, por meio de declaração da respectiva SES; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
III - no caso dos hospitais transplantadores de medula óssea, realização de coleta de células-tronco hematopoéticas para atendimento à demanda do Registro Brasileiro de Doadores Voluntários de Medula Óssea (REDOME), por meio de solicitação de relatório anual, que deverá ser fornecido pelo REDOME/INCA/MS. Parágrafo único. Para fins do disposto no inciso II do caput, caso não haja definição de parâmetros pelo gestor estadual de saúde, serão utilizados, como referência, parâmetros nacionais. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 7º Os estabelecimentos interessados deverão encaminhar a documentação de que trata o art. 6º à Central Estadual de Transplantes para aprovação e posterior envio à SES. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 7º As solicitações de adesão ao incremento financeiro serão analisadas pela Coordenação-Geral do Sistema Nacional de Transplantes considerando os parâmetros constantes deste Anexo. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 1º A Coordenação-Geral do Sistema Nacional de Transplantes poderá reclassificar a solicitação apresentada caso a classificação proposta esteja em desconformidade com os parametros do Anexo 2 ou com o disposto no art. 9º deste Anexo. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 2º Após a análise de que trata o caput, em caso de deferimento, o Secretário de Atenção Especializada à Saúde do Ministério da Saúde editará Portaria de homologação da adesão no Diário Oficial da União - DOU. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 3º O incremento financeiro será implementado após a publicação da Portaria de que trata o § 2º. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Parágrafo único. A SES deverá analisar e validar a documentação apresentada e, em seguida, encaminhar a solicitação ao Ministério da Saúde, por meio do Sistema de Apoio à Implementação de Políticas de Saúde (SAIPS). (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 8º A solicitação de adesão ao QUALIDOT será analisada pela Coordenação-Geral do Sistema Nacional de Transplantes (CGSNT/DAET/SAES/MS), considerando os parâmetros constantes neste Anexo e na portaria de que trata o § 1º do art. 9º. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Parágrafo único. Após a análise de que trata o caput, será publicada portaria de homologação da adesão no Diário Oficial da União (DOU), com a relação dos estabelecimentos classificados. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO III
DA CLASSIFICAÇÃO DOS ESTABELECIMENTOS NO QUALIDOT
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO III
DA CLASSIFICAÇÃO DOS SERVIÇOS
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 8º A adesão ao incremento financeiro pelos serviços participantes se dará em cinco níveis, a saber, "A", "B", "C", "D" e "E", a partir de classificação feita de forma individual e por modalidade de transplante. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Parágrafo único. Os indicadores e metas utilizados para fins de classificação poderão ser ampliados futuramente, de forma a considerar os avanços tecnológicos, a qualidade da informação e o aprimoramento dos processos de assistência, bem como o monitoramento e a avaliação do Ministério da Saúde, das Secretarias Estaduais e Municipais de Saúde e de sua rede de serviços. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 9º Os hospitais participantes do QUALIDOT serão classificados em 5 (cinco) níveis, sendo estes A, B, C, D e E. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 9º A classificação de cada modalidade de serviço dos níveis "A" a "E" ocorrerá de acordo com os resultados aferidos nos indicadores, conforme parâmetros constantes do Anexo 2 deste Anexo, atendendo aos seguintes requisitos: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - Nível "A": serviços de saúde que realizam transplantes e que alcancem o total de 30 (trinta) pontos na avaliação de resultados dos indicadores; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - Nível "B": serviços de saúde que realizam transplantes e que alcancem pontuação entre 25 (vinte e cinco) e 29 (vinte e nove) pontos na avaliação de resultados dos indicadores; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - Nível "C": serviços de saúde que realizam transplantes e que alcancem pontuação entre 20 (vinte) e 24 (vinte e quatro) pontos na avaliação de resultados dos indicadores; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
IV - Nível "D": serviços de saúde que realizam transplantes e que alcancem pontuação entre 15 (quinze) e 19 (dezenove) pontos na avaliação de resultados dos indicadores; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
V - Nível "E": serviços de saúde que realizam transplantes e que alcancem pontuação entre nove e 14 (quatorze) pontos na avaliação de resultados dos indicadores. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Parágrafo único. A Portaria que classifica os serviços possui validade por prazo indeterminado, até que haja a necessidade de reclassificação do serviço, para nível superior ou inferior, na forma do art. 12, conforme monitoramento anual realizado de acordo com o Capítulo IV deste Anexo. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 1º Os critérios e indicadores específicos de classificação, nos níveis elencados no caput, serão estabelecidos para cada ciclo, em portaria a ser editada pelo Ministro de Estado da Saúde. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 2º Os critérios e indicadores de que trata o § 1º serão reavaliados a cada ciclo, de forma a considerar os avanços na qualidade da informação e o aprimoramento dos processos de monitoramento e avaliação do Ministério da Saúde, das Secretarias Estaduais e Municipais de Saúde e de sua rede de serviços. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 10. Os hospitais poderão ser reclassificados ou desabilitados no curso do ciclo, nos seguintes casos: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 10. Será concedido incremento financeiro aos serviços classificados nos procedimentos relacionados ao transplante de órgãos sólidos e medula óssea, e ao tratamento de intercorrências pós- transplante e acompanhamento pré e pós-transplante, conforme códigos constantes do Anexo 1, nos seguintes percentuais: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - por solicitação de nova autorização ou descredenciamento de modalidade de transplantes de órgãos sólidos ou de medula óssea; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
I - Nível "A": 80% (oitenta por cento); (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - se a CGSNT/DAET/SAES/MS constatar descumprimento dos requisitos considerados para a classificação. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
II - Nível "B": 70% (setenta por cento); (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - Nível "C": 60% (sessenta por cento); (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
IV - Nível "D": 50% (cinquenta por cento); e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
V - Nível "E": 40% (quarenta por cento). (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Parágrafo único. A adesão ao QUALIDOT poderá ser renovada a cada ciclo, mediante o envio de nova solicitação, nos termos dispostos no Capítulo II. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Parágrafo único. As adequações nos sistemas de informação do SUS relacionadas ao incremento financeiro serão definidas em ato específico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 11. Será concedido incentivo financeiro aos hospitais classificados no QUALIDOT sobre os valores dos procedimentos relacionados ao processo de doação e transplantes de órgãos sólidos e medula óssea e de tratamento de intercorrências póstransplante e acompanhamento pré e pós-transplante, constantes no Anexo CIV, nos seguintes percentuais: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
I - estabelecimento de saúde de nível A: 65% (sessenta e cinco por cento); (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
II - estabelecimento de saúde de nível B: 60% (sessenta por cento); (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
III - estabelecimento de saúde de nível C: 50% (cinquenta por cento); (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
IV - estabelecimento de saúde de nível D: 40% (quarenta por cento); e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
V - estabelecimento de saúde de nível E: 30% (trinta por cento). (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
CAPÍTULO IV
DO MONITORAMENTO DO QUALIDOT
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO IV
DO MONITORAMENTO DOS SERVIÇOS PARTICIPANTES
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 11. O monitoramento dos serviços participantes será realizado pelas Centrais Estaduais de Transplantes em ciclo de um ano, por meio, dentre outras, das seguintes atividades: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - análise periódica de execução dos procedimentos relacionados ao incremento, por meio de dados constantes dos sistemas do SUS; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - realização de vistorias técnicas, por meio amostra, para fins de verificação da adequação da coleta e do registro dos dados que compõem os indicadores objeto da classificação; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - análise de documentos e informações, que poderão ser solicitados aos serviços participantes a qualquer tempo. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 1º Sem prejuízo do monitoramento e da avaliação realizados pelas Centrais Estaduais de Transplantes, a Coordenação-Geral do Sistema Nacional de Transplantes, no âmbito de sua competência,acompanhará o controle do cumprimento dos critérios, parâmetros e indicadores estabelecidos por este Anexo. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 2º O monitoramento avaliará, dentre outros aspectos, a sobrevida dos pacientes transplantados durante o ano anterior, considerando a sobrevida no período de 30 (trinta) dias e 1 (um) ano após a cirurgia do transplante. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 12. O monitoramento do QUALIDOT será realizado pela SAES/MS, por meio, entre outras, das seguintes atividades: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 12. No monitoramento anual, as Centrais Estaduais de Transplante deverão acompanhar a classificação dos serviços, a partir dos critérios contidos no Anexo 2 e observando as seguintes diretrizes: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - análise periódica de execução dos procedimentos relacionados ao Programa, por meio de dados constantes nos sistemas do SUS; (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
I - os serviços que permanecerem classificados no respectivo nível remanescerão com sua classificação inalterada, independentemente de solicitação; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - realização de visitas técnicas, por meio de base amostral, para fins de verificação da adequação da coleta e do registro dos dados que compõem os indicadores objeto da classificação; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
II - os serviços que melhorarem os seus resultados e aumentarem a sua classificação deverá o solicitar a reclassificação para o novo nível alcançado; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - análise de documentos e informações, que poderão ser solicitados aos estabelecimentos participantes a qualquer tempo. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
III - poderão perder a classificação os serviços que não cumprirem os requisitos respectivos, incluindo nos casos de: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
a) mudança no alcance dos indicadores estabelecidos; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
b) solicitação de descredenciamento da modalidade de transplante de órgãos sólidos; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
c) solicitação de descredenciamento da modalidade de transplante de células tronco- hematopoiéticas. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Parágrafo único. Sem prejuízo do monitoramento e da avaliação realizados pela SAES/MS, os entes estaduais e distrital, por meio das Centrais de Transplantes, realizarão, no âmbito de suas competências, o controle do cumprimento dos critérios, parâmetros e indicadores estabelecidos por este Anexo e pela portaria de que trata o § 1º do art. 9º. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 1º Na hipótese do inciso III do caput, as Centrais Estaduais de Transplantes deverão informar à CIB os serviços que não alcançarem classificação igual ou superior ao nível aderido, para análise e pactuação de plano de ajuste, baseado em: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - auditoria da Central Estadual de Transplante; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - identificação de pontos de melhoria; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - propostas de ajustes. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 2º Pactuado o plano de ajuste na CIB, poderá a Secretaria Estadual de Saúde respectiva encaminhá-lo para a Coordenação-Geral do Sistema Nacional de Transplantes para avaliação e aprovação. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 3º Aprovado o plano pela Coordenação- Geral do Sistema Nacional de Transplantes, o incremento será mantido na mesma classificação no ano seguinte à análise, ficando tal órgão incumbido de acompanhar e apoiar a execução do planejamento em questão. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
§ 4º O não cumprimento do plano implicará a reclassificação do serviço, podendo acarretar a perda do direito ao incremento financeiro caso não sejam alcançados os requisitos para enquadramento no nível "E". (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 13. Os serviços que aderirem ao incremento Financeiro do transplante deverá o receber o apoio do Núcleo de Segurança do Paciente - NSP institucional, durante toda a jornada do paciente na instituição. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Parágrafo único. O NSP será avaliado nos ciclos de monitoramento do incremento, sem prejuízo da possibilidade de se configurar, futuramente, em um indicador de qualidade da assistência do serviço, para os fins deste Anexo. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
CAPÍTULO V
DISPOSIÇÕES FINAIS
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
CAPÍTULO V
DAS DISPOSIÇÕES FINAIS
(Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 13. Os recursos orçamentários objeto desta Portaria correrão por conta do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.302.5018.8585 - Atenção à Saúde da População para Procedimentos em Média e Alta Complexidade - Plano Orçamentário 0005 (Fundo de Ações Estratégicas e Compensação - FAEC). (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 14. A não adesão ao QUALIDOT por parte dos hospitais com atividade transplantadora não implicará prejuízo: (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
Art. 14. Os recursos orçamentários objeto desta Portaria correrão por conta do orçamento do Ministério da Saúde, devendo onerar o Programa de Trabalho 10.302.5018.8585 - Atenção à Saúde da População para Procedimentos em Média e Alta Complexidade - Plano Orçamentário 0005 (Fundo de Ações Estratégicas e Compensação - FAEC). (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - às autorizações atuais para a realização de procedimentos de doação e transplantes de órgãos, tecidos e células; (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
II - à inscrição de pacientes em lista e distribuição de órgãos, tecidos e células; e (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
II - ao financiamento dos procedimentos de doação e transplantes de órgãos, tecidos e células nos valores da Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais do SUS. (Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022) (Revogado pela PRT GM/MS n° 1.262 de 12.09.2023)
Art. 15. A não adesão ao incremento financeiro por parte dos serviços com atividade transplantadora não implicará prejuízo: (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
I - às autorizações atuais para a realização de procedimentos de doação e transplante de órgãos, tecidos e células; (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
II - à inscrição de pacientes em lista de espera de órgãos, tecidos e células; e (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
III - ao financiamento dos procedimentos de doação e transplante de órgãos, tecidos e células nos valores da Tabela de Procedimentos, Medicamentos, Órteses, Próteses e Materiais Especiais do SUS. (Redação dada pela PRT GM/MS n° 1.262 de 12.09.2023)
ANEXO 3 DO ANEXO CIV
PROCEDIMENTOS SOBRE OS QUAIS INCIDIRÁ O INCENTIVO FINANCEIRO
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Redação dada pela PRT GM/MS nº 3.264 de 11.08.2022)
ANEXO 1 DO ANEXO CIV
PROCEDIMENTOS INCLUÍDOS
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.01.07.012-5 - EXAMES PARA INCLUSÃO EM LISTA DE CANDIDATOS A TRANSPLANTE DE PÂNCREAS |
Descrição |
Consiste na realização do conjunto dos seguintes exames, para inclusão em lista de espera de candidatos a transplante que envolva pâncreas, conforme protocolo estabelecido em regulamento técnico: Exames Gerais - dosagem de cloreto, dosagem de colesterol HDL, dosagem de colesterol LDL, dosagem de colesterol total, dosagem de fosfatase alcalina, dosagem de proteínas totais e frações, dosagem de magnésio, dosagem de sódio, dosagem de potássio, glicemia, dosagem de creatinina, dosagem de alanina amino-transferase (ALT), dosagem de aspartato amino-transferase (AST), dosagem de gama-glutamil-transferase (Gama GT), gasometria, contagem de plaquetas, determinação de tempo e atividade da protrombina (TAP), prova de retração do coágulo, dosagem de antígeno prostático específico (PSA), urinálise, clearance de creatinina, exame microbiológico a fresco (direto), exame parasitológico de fezes, tipagem sanguínea ABO, hemograma completo, sorologia Anti-HIV, Anti-HTLV I e II, HBsAg, Anti-HBc, Anti-HBs, Anti-HCV, Anti ilhota, Anti insulina, Anti GAD, imunofluorescência para doença de chagas, imunofluorescência para citomegalovírus IgG e IgM, imunofluorescência para toxoplasmose IgG e IgM, VDRL, imunofluorescência para lues e teste da caminhada de 6 minutos. Exames Específicos - dosagem de amilase, dosagem de hemoglobina glicosilada, teste de tolerância à insulina / hipoglicemiantes orais, dosagem de peptídeo C, ultra-sonografia com doppler colorido de vasos (somente em vasculopatas e idosos), cintilografia do miocárdio/ ecocardiograma com dobutamina/angio TC coronariana, radiografia de tórax (PA + lateral), ultrassonografia de abdome total, esofagogastroduodenoscopia, cateterismo cardíaco, avaliação urodinâmica completa. Este procedimento só pode ser registrado uma única vez e não se aplica a candidato que já se encontra em lista para transplante. Os exames que integram o conjunto não podem ser registrados em nenhum outro instrumento de registro do SUS. |
Complexidade |
Alta Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
02 - BPA (Individualizado) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 1.165,11 |
Total Ambulatorial |
R$ 1.165,11 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
CBO |
2212-05 - Biomédico |
2252-20 - Médico cirurgião do aparelho digestivo |
|
Habilitação |
24.04 - Transplante de Pâncreas |
Incremento |
24.41 - Incremento Financeiro SNT Pâncreas Nível A (80% SA) |
CID |
E106 - Diabetes Mellitus insulino-dependente - com outras complicações especificadas |
Origem |
05.01.07.006-0 |
RENASES |
144 - Transplante |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
| Procedimento | 05.01.07.013-3 - EXAMES PARA INCLUSÃO EM LISTA DE CANDIDATOS A TRANSPLANTE DE RIM |
| Descrição | Consiste na realização do conjunto dos seguintes exames, para inclusão em lista de espera de candidatos a transplante renal, conforme protocolo estabelecido em regulamento técnico: exames gerais - dosagem de cloreto, dosagem de colesterol HDL, dosagem de colesterol LDL, dosagem de colesterol total, dosagem de fosfatase alcalina, dosagem de proteínas totais e frações, dosagem de magnésio, dosagem de sódio, dosagem de potássio, glicemia, dosagem de creatinina, dosagem de alanina amino-transferase (ALT), dosagem de aspartato amino-transferase (AST), dosagem de gama-glutamil-transferase (Gama GT), gasometria, hemograma completo, determinação de tempo e atividade da protrombina (TAP), prova de retração do coágulo, dosagem de antígeno prostático específico (PSA), dosagem de amilase, dosagem de hemoglobina glicosilada, dosagem de alfa-fetoproteína, urinálise, clearance de creatinina, exame microbiológico a fresco (direto), exame parasitológico de fezes, tipagem sanguínea ABO, sorologia anti-HIV, Anti-HTLV I e II, HBsAg, Anti-HBc, Anti-HBs, Anti-HCV, pesquisa de anticorpos IgM e IgG contra o vírus epstein-barr, imunofluorescência para doença de chagas, imunofluorescência para citomegalovírus IgG e IgM, imunofluorescência para toxoplasmose IgG e IgM, VDRL, imunofluorescência para lues, ultra-sonografia com doppler colorido de vasos (somente em vasculopatas e idosos), esofagogastroduodenoscopia, radiografia de tórax (PA + lateral), ultra-sonografia de abdome total, ultra-sonografia de aparelho urinário, avaliação urodinâmica completa, ecocardiografia transtorácica, cateterismo cardíaco (exclusivamente em idosos, cardiopatas ou diabéticos). Este procedimento só pode ser registrado uma única vez e não se aplica a candidato que já se encontra em lista para transplante. os exames que integram o conjunto não podem ser registrados em nenhum outro instrumento de registro do SUS. |
Complexidade |
Alta Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
02 - BPA (Individualizado) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 1.165,11 |
Total Ambulatorial |
R$ 1.165,11 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
CBO |
2212-05 - Biomédico |
Habilitação |
24.08 - Transplante de Rim |
Incremento |
24.46 - Incremento Financeiro SNT Rim Nível A (80% SA) |
CID |
I120 - Doença renal hipertensiva com insuficiência renal |
Origem |
05.01.07.006-0 |
RENASES |
144 - Transplante |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.01.07.014-1 - EXAMES PARA INCLUSÃO EM LISTA DE CANDIDATOS A TRANSPLANTE DE PULMÃO |
Descrição |
Consiste na realização do conjunto dos seguintes exames, para inclusão em lista de espera de candidatos a transplante de pulmão, conforme protocolo estabelecido em regulamento técnico: exames gerais - dosagem de cloreto, dosagem de colesterol total, dosagem de colesterol HDL, dosagem de colesterol LDL, dosagem de fosfatase alcalina, dosagem de proteínas totais e frações, dosagem de magnésio, dosagem de sódio, dosagem de potássio, glicemia, dosagem de creatinina, dosagem de alanina amino-transferase (ALT), dosagem de aspartato amino-transferase (AST), dosagem de gama-glutamil-transferase (Gama GT), gasometria, hemograma completo, determinação de tempo e atividade da protrombina (TAP), prova de retração do coágulo, dosagem de antígeno prostático específico (PSA), urinálise, clearance de creatinina, exame parasitológico de fezes, exame microbiológico a fresco (direto), tipagem sanguínea ABO, sorologia Anti-HIV, Anti- HTLV I e II, HBsAg, Anti-HBc, Anti-HBs, Anti-HCV, imunofluorescência para doença de chagas, imunofluorescência para citomegalovírus IgG e IgM, imunofluorescência para toxoplasmose IgG e IgM, VDRL, imunofluorescência para lues, Pesquisa de anticorpos IgM e IgG contra o vírus epstein-barr,teste da caminhada de 6 minutos. ultra-sonografia com doppler colorido de vasos (somente em vasculopatas e idosos),esofagogastroduodenoscopia, radiografia de tórax (PA em inspiração e expiração + lateral), ultra-sonografia de abdome total, ecocardiografia transtorácica, ultra-sonografia de tórax (extracardíaca), tomografia computadorizada de tórax, espirografia c/ determinação do volume residual, prova de função pulmonar completa c/ broncodilatador, cateterismo cardíaco (exclusivamente em idosos, cardiopatas ou diabéticos), este procedimento só pode ser registrado uma única vez e não se aplica a candidato que já se encontra em lista para transplante. Os exames que integram o conjunto não podem ser registrados em nenhum outro instrumento de registro do SUS. |
Complexidade |
Alta Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
02 - BPA (Individualizado) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 1.165,11 |
Total Ambulatorial |
R$ 1.165,11 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
CBO |
2212-05 - Biomédico |
Habilitação |
24.10 - Transplante de Pulmão |
Incremento |
24.56 - Incremento Financeiro SNT Pulmão Nível A (80% SA) |
CID |
E84.0 - Fibrose cística |
Origem |
05.01.07.006-0 |
RENASES |
144 - Transplante |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.006-6 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE MEDULA ÓSSEA - AUTOGÊNICO |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de células-tronco hematopoéticas, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
CBO |
2234-05 - Farmacêutico |
Categoria CBO |
2231 - Médicos |
Serviço Especializado |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.01 - Transplante de Medula Óssea - Autogênico |
Incremento |
24.36 - Incremento Financeiro SNT TMO Nível A (80% SA) |
CID |
Z948 - Outros órgãos e tecidos transplantados |
Origem |
05.06.01.002-3; |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.007-4 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE MEDULA ÓSSEA - ALOGÊNICO APARENTADO |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de celulas-tronco hematopoéticas, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.02 - Transplante de Medula Óssea - Alogênico Aparentado |
Incremento |
24.36 - Incremento Financeiro SNT TMO Nível A (80% SA) |
CID |
Z948 - Outros órgãos e tecidos transplantados |
Origem |
05.06.01.002-3; |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.008-2 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE MEDULA ÓSSEA - ALOGÊNICO NÃO APARENTADO |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de células-tronco hematopoéticas, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.03 - Transplante de Medula Óssea - Alogênico Não Aparentado |
Incremento |
24.36 - Incremento Financeiro SNT TMO Nível A (80% SA) |
CID |
Z948 - Outros órgãos e tecidos transplantados |
Origem |
05.06.01.002-3; |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.009-0 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE PÂNCREAS |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de pâncreas, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 016 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.04 - Transplante de Pâncreas |
Incremento |
24.41 - Incremento Financeiro SNT Pâncreas Nível A (80% SA) |
CID |
Z948 - Outros órgãos e tecidos transplantados |
Origem |
05.06.01.002-3 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.010-4 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE RIM |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de rim, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.08 - Transplante de Rim |
Incremento |
24.46 - Incremento Financeiro SNT Rim Nível A (80% SA) |
CID |
Z94.0 - Rim transplantado |
Origem |
05.06.01.002-3; |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.011-2 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE FÍGADO |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de fígado, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.09 - Transplante de Fígado |
| Incremento | 24.51 - Incremento Financeiro SNT Fígado Nível A (80% SA) |
CID |
Z94.4 - Fígado transplantado |
Origem |
05.06.01.002-3; |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.012-0 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE PULMÃO |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de pulmão, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
CBO |
2234-05 - Farmacêutico |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.10 - Transplante de Pulmão |
Incremento |
24.56 - Incremento Financeiro SNT Pulmão Nível A (80% SA) |
CID |
Z94.2 - Pulmão transplantado |
Origem |
05.06.01.002-3; |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.013-9 - ACOMPANHAMENTO DE PACIENTE PÓS-TRANSPLANTE DE CORAÇÃO |
Descrição |
Consiste no acompanhamento clínico do paciente transplantado de coração, mensalmente no primeiro ano após o transplante e bimestralmente a partir do segundo ano. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
CBO |
2234-05 - Farmacêutico |
Categoria CBO |
2231 - Médicos |
Serviço/Classificação |
149 - Transplante / 014 - Acompanhamento de paciente transplantado |
Habilitação |
24.11 - Transplante de Coração |
Incremento |
24.61 - Incremento Financeiro SNT Coração Nível A (80% SA) |
CID |
Z94.1 - Coração transplantado |
Origem |
05.06.01.002-3 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas ; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.014-7 - ACOMPANHAMENTO DE DOADOR VIVO PÓS-DOAÇAO DE RIM |
Descrição |
Consiste no acompanhamento clínico do doador vivo após doação de rim. O acompanhamento deve-se dar duas vezes no primeiro ano da doação e, após, anualmente. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
18 Ano(s) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Incremento |
24.46 - Incremento Financeiro SNT Rim Nível A (80% SA) |
CID |
Z524 - Doador de rim |
Origem |
05.06.01.003-1 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.015-5 - ACOMPANHAMENTO DE DOADOR VIVO PÓS-DOAÇAO DE FÍGADO |
Descrição |
Consiste no acompanhamento clínico do doador vivo após doação de parte de fígado. O acompanhamento deve-se dar duas vezes no primeiro ano da doação e, após, anualmente. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
18 Ano(s) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Incremento |
24.51 - Incremento Financeiro SNT Fígado Nível A (80% SA) |
CID |
Z526 - Doador de fígado |
Origem |
05.06.01.003-1 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.016-3 - ACOMPANHAMENTO DE DOADOR VIVO PÓS-DOAÇAO DE PULMÃO |
Descrição |
Consiste no acompanhamento clínico do doador vivo após doação de parte de pulmão. O acompanhamento deve-se dar duas vezes no primeiro ano da doação e, após, anualmente. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
18 Ano(s) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
009 - Exige CNS; 014 - Admite APAC de Continuidade; |
Categoria CBO |
2231 - Médicos |
Incremento |
24.56 - Incremento Financeiro SNT Pulmão Nível A (80% SA) |
CID |
Z528 - Doador de outros órgãos ou tecidos |
Origem |
05.06.01.003-1 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.017-1 - ACOMPANHAMENTO DE PACIENTES NO PRÉ TRANSPLANTE DE PÂNCREAS |
Descrição |
Consiste em consulta anual realizada por médico, para avaliação e acompanhamento pré-transplante de candidatos a transplante de pâncreas. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
80 Ano(s) |
CBO |
2234-15 - Farmacêutico analista clínico |
Categoria CBO |
2231 - Médicos |
Incremento |
24.41 - Incremento Financeiro SNT Pâncreas Nível A (80% SA) |
CID |
Z048 - Exame e observação por outras razões especificadas |
Origem |
05.06.01.004-0 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.018-0 - ACOMPANHAMENTO DE PACIENTES NO PRÉ TRANSPLANTE DE RIM |
Descrição |
Consiste em consulta anual realizada por médico, para avaliação e acompanhamento pré-transplante de candidatos a transplante de rim. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
80 Ano(s) |
CBO |
2234-15 - Farmacêutico analista clínico |
Categoria CBO |
2231 - Médicos |
Incremento |
24.46 - Incremento Financeiro SNT Rim Nível A (80% SA) |
CID |
Z048 - Exame e observação por outras razões especificadas |
Origem |
05.06.01.004-0 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.019-8 - ACOMPANHAMENTO DE PACIENTES NO PRÉ TRANSPLANTE DE FÍGADO |
Descrição |
Consiste em consulta anual realizada por médico, para avaliação e acompanhamento pré-transplante de candidatos a transplante de fígado. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mes(es) |
Idade Máxima |
80 Ano(s) |
CBO |
2234-15 - Farmacêutico analista clínico |
Categoria CBO |
2231 - Médicos |
Incremento |
24.51 - Incremento Financeiro SNT Fígado Nível A (80% SA) |
CID |
Z048 - Exame e observação por outras razões especificadas |
Origem |
05.06.01.004-0 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.020-1 - ACOMPANHAMENTO DE PACIENTES NO PRÉ TRANSPLANTE DE PULMÃO |
Descrição |
Consiste em consulta anual realizada por médico, para avaliação e acompanhamento pré-transplante de candidatos a transplante de pulmão. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
80 Ano(s) |
CBO |
2234-15 - Farmacêutico analista clínico |
Categoria CBO |
2231 - Médicos |
Incremento |
24.56 - Incremento Financeiro SNT Pulmão Nível A (80% SA) |
CID |
Z048 - Exame e observação por outras razões especificadas |
Origem |
05.06.01.004-0 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.01.021-0 - ACOMPANHAMENTO DE PACIENTES NO PRÉ TRANSPLANTE DE CORAÇÃO |
Descrição |
Consiste em consulta anual realizada por médico, para avaliação e acompanhamento pré-transplante de candidatos a transplante de coração. |
Complexidade |
Média Complexidade |
Modalidade |
01 - Ambulatorial |
Instrumento de Registro |
06 - APAC (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 135,00 |
Total Ambulatorial |
R$ 135,00 |
Serviço Hospitalar (SH) |
R$ 0,00 |
Serviço Profissional (SP) |
R$ 0,00 |
Total Hospitalar |
R$ 0,00 |
Sexo |
Ambos |
Quantidade Máxima |
1 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
80 Ano(s) |
CBO |
2234-15 - Farmacêutico analista clínico |
Categoria CBO |
2231 - Médicos |
Incremento |
24.61 - Incremento Financeiro SNT Coração Nível A (80% SA) |
CID |
Z048 - Exame e observação por outras razões especificadas |
Origem |
05.06.01.004-0 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
Procedimento |
05.06.02.013-4 - TRATAMENTO DE INTERCORRENCIA PÓS TRANSPLANTE DE PÂNCREAS - PÓS TRANSPLANTE CRÍTICO |
Descrição |
Tratamento clínico de paciente internado por complicação relacionada ao transplante de pâncreas, que demande tempo prolongado de internação na vigência de complicações. o valor deste procedimento não inclui diária de UTI, medicação antifúngica e antiviral. |
Complexidade |
Alta Complexidade |
Modalidade |
02 - Hospitalar |
Instrumento de Registro |
03 - AIH (Proc. Principal) |
Tipo de Financiamento |
04 - Fundo de Ações Estratégicas e Compensações (FAEC) |
Sub-tipo de Financiamento |
0032 - Transplantes de órgãos, tecidos e células |
Serviço Ambulatorial (SA) |
R$ 0,00 |
Total Ambulatorial |
R$ 0,00 |
Serviço Hospitalar (SH) |
R$ 213,81 |
Serviço Profissional (SP) |
R$ 91,67 |
Total Hospitalar |
R$ 305,48 |
Sexo |
Ambos |
Quantidade Máxima |
30 |
Pontos |
200 |
Idade Mínima |
0 Mês(es) |
Idade Máxima |
130 Ano(s) |
Atributos Complementares |
007 - Permanência por dia |
Especialidade do Leito |
01 - Cirúrgico; 03 - Clínico; 07 - Pediátricos; |
CBO |
2251-03 - Médico infectologista |
Habilitação |
24.04 - Transplante de pâncreas |
Incremento |
24.41 - Incremento Financeiro SNT Pâncreas Nível A (80% SH/SP) |
CID |
A410 - Septicemia por staphylococcus aureus |
Origem |
05.06.02.008-8 |
RENASES |
048 - Acompanhamento e Tratamento de Doenças ou Condições Clínicas Crônicas; 144 - Transplantes; |
(Redação dada pela PRT GM/MS n° 766 de 14.09.2023)
ANEXO CV
DO PROGRAMA NACIONAL DE ACESSO À ÁGUA POTÁVEL EM TERRAS INDÍGENAS - PNATI
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
CAPÍTULO I
DAS DISPOSIÇÕES PRELIMINARES
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 1º Este Anexo institui o Programa Nacional de Acesso à Água Potável em Terras Indígenas - PNATI, com a finalidade de universalizar o acesso à água potável em comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena, na quantidade e qualidade adequadas, visando à melhoria da saúde dessa população. Parágrafo único. Para fins do disposto no caput, considera-se universalização a ampliação progressiva do acesso de todas as comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena à água potável. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 2º São objetivos do PNATI: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - ampliar o acesso à água potável em comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - promover o controle da qualidade da água para consumo humano nas comunidades de que trata o inciso I, por meio de tratamento e monitoramento adequados; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - contribuir para a melhoria da saúde, da qualidade de vida e das condições ambientais da população indígena; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IV - adotar mecanismos de planejamento, fiscalização e avaliação da prestação de serviços de abastecimento de água potável em comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena, com base em critérios técnicos e na participação social.
CAPÍTULO II
DAS DIRETRIZES
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 3º São diretrizes do PNATI: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - orientar ações de promoção do acesso à água potável em terras indígenas, observando a previsão orçamentária, a execução financeira e o planejamento dos Distritos Sanitários Especiais Indígenas - DSEI; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - adotar estratégias que assegurem a intersetorialidade das ações de universalização do acesso à água potável, de acordo com os critérios estabelecidos na Política Nacional de Atenção à Saúde dos Povos Indígenas - PNASPI; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - planejar, anualmente, ações de acesso e de controle da qualidade da água para o consumo humano no âmbito dos DSEI; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IV - estabelecer ações de capacitação gerencial e técnica dos profissionais para manuseio e conservação das infraestruturas de abastecimento de água potável implementadas e revitalizadas em comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
V - promover ações continuadas de educação em saneamento, saúde, higiene e uso consciente da água nas comunidades indígenas de que trata o inciso IV; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
VI - criar e consolidar soluções tecnológicas e mecanismos de acesso à água potável e controle da água para consumo humano, considerando as especificidades dos DSEI; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
VII - promover o monitoramento e a avaliação das ações mencionadas nos incisos I a V, garantindo a adoção de medidas corretivas e subsídios para possíveis revisões do Programa. Parágrafo único. As ações do PNATI deverão buscar a integração com outros planos setoriais correlatos e com planos municipais, estaduais e regionais de promoção do acesso à água potável, com o reconhecimento das particularidades do contexto indígena. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
CAPÍTULO III
DO PLANEJAMENTO
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Seção I
Das metas do PNATI
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 4º A implementação das ações de ampliação do acesso à água potável em comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena será definida por metas do PNATI, nacionais e distritais, de curto, médio e longo prazos, observando a sua compatibilidade com os demais planos e políticas públicas da União, dos estados e dos municípios. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Parágrafo único. As metas de que trata o caput são assim definidas temporalmente: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - metas de curto prazo: 0 (zero) a 4 (quatro) anos; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - metas de médio prazo: 4 (quatro) a 12 (doze) anos; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - metas de longo prazo: 12 (doze) a 20 (vinte) anos. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 5º As metas do PNATI, nacionais e distritais, serão estabelecidas pelo Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde e deverão observar os seguintes critérios: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - elaboração do diagnóstico situacional do acesso à água potável em comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena, realizado por meio de informações levantadas pelos DSEI; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - levantamento do perfil epidemiológico com base em informações fornecidas pelos DSEI e validadas pelo Departamento de Atenção Primária à Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - estabelecimento da média anual da capacidade operacional de execução das ações necessárias ao alcance das metas definidas e indicadas por cada DSEI; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IV - disponibilidade orçamentária e financeira prevista na ação orçamentária 21CJ da Secretaria Especial de Saúde Indígena do Ministério da Saúde e metas do Plano Plurianual e da Lei Orçamentária Anual. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Parágrafo único. A Coordenação-Geral de Planejamento, Orçamento e Monitoramento da Execução Financeira da Secretaria Especial de Saúde Indígena do Ministério da Saúde será responsável pela descentralização de recursos para atendimento às ações do PNATI, devendo considerar os critérios descritos nos incisos III e IV. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Seção II
Do Plano de Execução Distrital - PED
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 6º Os DSEI serão responsáveis pela elaboração do Plano de Execução Distrital - PED, documento que contemplará as ações do PNATI, a serem implementadas anualmente, visando alcançar as metas distritais. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 7º O PED contemplará as ações de que trata o art. 9º e deverá conter, minimamente: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - número de habitantes por aldeia; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - perfil epidemiológico por aldeia; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - ordem de prioridade das aldeias a serem atendidas; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IV - tipo de acesso logístico à aldeia, se terrestre, fluvial ou aéreo; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
V - tipo de mobilidade da aldeia, se sedentária, nômade ou seminômade; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
VI - localização geográfica das comunidades selecionadas e priorizadas para implantação de infraestrutura de abastecimento de água potável; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
VII - indicação da solução tecnológica escolhida para implantação de infraestrutura de abastecimento de água potável; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
VIII - valor estimado por infraestrutura implantada; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IX - valor estimado total; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
X - ordem de prioridades apresentadas no Plano Distrital de Saúde Indígena - PDSI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Parágrafo único. A ordem de prioridade mencionada no inciso III deverá observar os seguintes critérios: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - aldeia com maior número de habitantes sem acesso à água potável; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - aldeia com pior perfil epidemiológico de doenças relacionadas ao saneamento inadequado; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - aldeias priorizadas no PDSI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 8º O planejamento do PED deverá observar o Plano de Contratações Anual - PCA. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 1º O DSEI enviará o PED para aprovação até o mês de junho do ano de planejamento do PCA. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 2º O Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde analisará e aprovará o PED até o fim do mês de agosto do ano de planejamento do PCA. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
CAPÍTULO IV
DA EXECUÇÃO
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 9º A execução do PNATI se dará nos seguintes eixos de ação: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - implantação, reforma e ampliação das infraestruturas de abastecimento de água potável para consumo humano e das soluções alternativas coletivas de abastecimento de água potável para consumo humano; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - controle da qualidade da água para consumo humano; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - capacitação profissional e educação permanente em saneamento, saúde e uso consciente da água; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IV - manutenção e gestão das infraestruturas de abastecimento de água potável e soluções de que trata o inciso I. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 10. A Coordenação de Análise e Elaboração de Projetos de Infraestrutura e Saneamento da Secretaria Especial de Saúde Indígena do Ministério da Saúde, após o envio do PED por parte dos DSEI, elaborará projetos de engenharia de infraestrutura de abastecimento de água potável, considerando as prioridades estabelecidas no Plano. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 1º A elaboração de projetos de que trata o caput se dará de forma regionalizada e será concentrada no nível central, visando ao desenvolvimento de projetos de arquitetura, engenharia e geologia no âmbito dos 34 (trinta e quatro) DSEI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 2º A Coordenação de Análise e Elaboração de Projetos de Infraestrutura e Saneamento da Secretaria Especial de Saúde Indígena do Ministério da Saúde criará projetos de referência e disponibilizará documentos padronizados para os DSEI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 3º Os DSEI serão responsáveis por realizar o levantamento de campo para fornecimento das informações necessárias à elaboração dos projetos. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 4º Após a elaboração dos projetos, os DSEI serão responsáveis pelo processo de aquisição de materiais e pelo acompanhamento das obras. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 5º O Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde monitorará o andamento das obras a partir de medições das etapas enviadas pelos DSEI, via Sistema Eletrônico de Informações - SEI, conforme cronograma físico-financeiro da obra. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 11. O controle da qualidade da água compreenderá a implantação de laboratórios nos polos-base dos DSEI para realização de análises de baixa complexidade da qualidade da água destinada ao consumo humano. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 1º Serão observados como parâmetros sentinelas o pH, turbidez, cor, cloro, coliformes totais e Escherichea coli. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 2º A coleta da amostra de água para análise será realizada por profissional do DSEI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 3º As análises da qualidade da água serão realizadas por profissional capacitado para essa finalidade. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 12. Os dados resultantes das análises de que trata o art. 11 deverão ser encaminhados, mensalmente, ao Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 13. Caso sejam identificadas inconformidades ou inconsistências na operação das infraestruturas de abastecimento de água potável para consumo humano e na implementação das soluções alternativas individuais ou coletivas de abastecimento de água potável para consumo humano, os DSEI deverão aplicar ações resolutivas ou de contingência. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 1º Na hipótese prevista no caput, antes de qualquer medida corretiva, deve ser realizada análise da qualidade da água para consumo humano. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 2º A partir da confirmação do resultado, o DSEI deverá implementar ações corretivas de acordo com as inconformidades ou inconsistências detectadas, observado o princípio da economicidade. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 14. A Secretaria Especial de Saúde Indígena do Ministério da Saúde, com apoio dos DSEI, promoverá, anualmente, ações de capacitação das equipes envolvidas no Programa, contemplando: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - uso e operação das infraestruturas de abastecimento de água potável; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - procedimento de coleta, manuseio, acondicionamento, logística e análise da qualidade da água; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - outras ações relacionadas à melhoria do acesso qualitativo da água. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Parágrafo único. O Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde definirá o conteúdo das ações de capacitação e prestará auxílio para a sua realização. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 15. Os DSEI deverão orientar as comunidades indígenas acerca do uso sustentável da água e seu consumo dentro dos padrões de potabilidade. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 16. Os DSEI serão responsáveis pela manutenção das infraestruturas de abastecimento de água potável sistemas já implantadas, devendo evitar a descontinuidade do fornecimento de água potável às comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena. Parágrafo único. A descontinuidade do serviço implicará responsabilização de quem der causa à situação. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
CAPÍTULO V
DO MONITORAMENTO E DA AVALIAÇÃO
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 17. Os DSEI serão responsáveis pela elaboração do Relatório de Acompanhamento Distrital - RAD, que deverá ser enviado ao Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde, trimestralmente, para acompanhamento das ações realizadas no período. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 1º O RAD deverá conter, no mínimo, os seguintes indicadores: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
I - cobertura de abastecimento de água potável nas aldeias indígenas e previsão do: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
a) número de infraestruturas de abastecimentos de água potável implantadas; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
b) número de infraestruturas de abastecimentos de água potável reformadas e/ou ampliadas; e c) número de pessoas beneficiadas com acesso à água potável; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
II - cobertura de abastecimento de água potável nas aldeias indígenas, segundo a existência de tratamento de água, observando: a) número de infraestruturas de abastecimentos de água potável com tratamento adequado; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
b) número de infraestruturas de abastecimentos de água potável com monitoramento da qualidade da água; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
c) população coberta com o controle da qualidade da água para consumo humano (tratamento e monitoramento); (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
III - parâmetros básicos da qualidade da água em amostras coletadas em infraestrutura de abastecimento de água potável, apresentando: a) número de aldeias monitoradas; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
b) número de amostras de água dentro do padrão; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
c) número de notificações de doenças de veiculação hídrica; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
IV - perfil epidemiológico das aldeias, com: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
a) número de notificações e óbitos associados a doenças provocadas por saneamento ambiental inadequado; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
b) número de notificações e óbitos associados a doenças de veiculação hídrica; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
c) identificação de surtos ou emergências de saúde pública; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
V - capacitação profissional e educação permanente em saneamento, saúde e uso consciente da água, com: (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
a) número de capacitações do corpo técnico do Serviço de Edificações e Saneamento da Saúde Indígena - Sesani; (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
b) número de capacitações dos agentes indígenas de saneamento e dos agentes indígenas de saúde; e (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
c) número de ações educativas. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 2º Todas as informações do RAD deverão estar acompanhadas da indicação do local, da aldeia e do polo-base. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 3º A ausência de qualquer informação exigida deverá ser justificada. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 4º Caso o Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde identifique inconformidades após a análise do RAD, o documento será devolvido ao DSEI para as devidas adequações. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 5º O modelo do RAD será disponibilizado pelo Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 18. O PNATI será avaliado anualmente, por meio da elaboração do Relatório de Acompanhamento Anual - RAA, pela Secretaria Especial de Saúde Indígena do Ministério da Saúde, com base nos indicadores apresentados no RAD. Parágrafo único. Os indicadores apresentados no RAD serão utilizados para verificação do cumprimento das metas do Programa. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 19. O RAA será confeccionado pelo Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde e contemplará as informações apresentadas no RAD de cada DSEI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 1º Após a análise dos indicadores, o Departamento de Projetos e Determinantes Ambientais da Saúde Indígena da Secretaria Especial de Saúde Indígena do Ministério da Saúde observará o cumprimento ou não das metas do Programa estabelecidas para cada DSEI, de forma a propor correções a serem implementadas no PED subsequente. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
§ 2º As correções deverão ser informadas ao DSEI até o fim do mês de fevereiro do ano subsequente. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 20. O PNATI será revisado a cada 4 (quatro) anos, por meio da realização de encontros nacionais e ouvindo os atores envolvidos na gestão do Programa, com o objetivo de discutir as metas para os próximos 4 (quatro) anos, bem como as estratégias de execução a serem adotadas e os resultados a serem alcançados. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
CAPÍTULO VI
DAS DISPOSIÇÕES FINAIS
(Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 21. Os DSEI serão responsáveis pelo compartilhamento das informações pertinentes ao PNATI com a Secretaria Especial de Saúde Indígena do Ministério da Saúde. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 22. A Secretaria Especial de Saúde Indígena do Ministério da Saúde desenvolverá metodologias e instrumentos para possibilitar a geração de relatórios a partir dos dados compartilhados e de outras bases disponíveis. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 23. O planejamento do PDSI considerará as metas previstas no PNATI. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
Art. 24. Os Conselhos Distritais de Saúde Indígena acompanharão o PNATI, visando à melhoria do acesso à água potável nas comunidades indígenas atendidas pelo Subsistema de Atenção à Saúde Indígena. (Redação dada pela PRT GM/MS nº 3.958 de 10.11.2022)
ANEXO CVI
DO FÓRUM DE ARTICULAÇÃO COM A SOCIEDADE CIVIL - FAS
(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 1º Fica instituído o Fórum de Articulação com a Sociedade Civil - FAS, com objetivo de assessorar o Grupo Executivo do Complexo Econômico-Industrial da Saúde - Geceis - nas propostas de iniciativas e de ações voltadas ao fortalecimento das políticas públicas no âmbito do Complexo Econômico-Industrial da Saúde - Ceis - e de estabelecer a atuação articulada e colaborativa de que trata o § 3º do art. 5º do Decreto nº 11.464, de 3 de abril de 2023.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Parágrafo único. O FAS tem caráter consultivo e não deliberativo, sendo instrumento para articulação e colaboração com o Geceis.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 2º Compete ao FAS:(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
I - emitir ao Geceis posicionamentos e recomendações sobre políticas públicas, de modo democrático e participativo; e(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
II - prestar informações sobre matérias de seu conhecimento ao Geceis.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 3º Além dos órgãos e entidades elencados nos incisos I a VI do art. 5º do Decreto nº 11.464, de 2023, o FAS será composto por:(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
I - representantes das instâncias colegiadas, deliberativas e permanentes do Sistema Único de Saúde - SUS;(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
II - representantes de entidades do setor industrial e de serviços de saúde, nacional e regional, que atuem na produção e inovação, bem como em informação e conectividade em saúde;(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
III - representantes das centrais sindicais dos trabalhadores;(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
IV - representantes de instituições de ensino e de pesquisa acadêmica que contribuam diretamente para o desenvolvimento do Ceis; e(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
V - atores considerados relevantes e com representatividade para o Ceis, previstos em ato da Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 4º Os órgãos e entidades que se enquadrarem em pelo menos um dos incisos do art. 3º deverão manifestar o interesse de participar do FAS à Secretaria-Executiva do Geceis.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Parágrafo único. Compete ao Secretário de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde deliberar acerca dos pleitos de participação e definir, mediante ato específico, as entidades que compõem o FAS, conforme critérios de conveniência, oportunidade e representatividade, a partir do enquadramento em um dos incisos do art. 3º desta Portaria.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 5º Os membros do FAS serão indicados pelos titulares dos órgãos ou entidades que representam e designados por ato da Ministra de Estado da Saúde.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
§ 1º Cada órgão ou entidade do FAS terá um suplente, que o substituirá em suas ausências e impedimentos.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
§ 2º Os membros do FAS poderão, a qualquer tempo, propor a substituição de seus respectivos representantes.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 6º O FAS se reunirá, presencialmente, mediante convocação do Geceis, não havendo distinção entre reuniões ordinárias e extraordinárias, com qualquer número de membros presentes.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 7º A Secretaria-Executiva do Geceis coordenará as atividades do FAS, no âmbito dos objetivos do Geceis, preservando o foco na produção e inovação em saúde.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
§ 1º A Secretaria-Executiva do Geceis poderá convidar entidades, autoridades, cientistas e técnicos nacionais ou estrangeiros para colaborar nas atividades do FAS.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
§ 2º Cabe ao Departamento do Complexo Econômico-Industrial da Saúde da Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde prestar o apoio técnico e administrativo necessário às atividades do FAS.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 8º A participação no FAS será considerada prestação de serviço público relevante, não remunerada.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
Art. 9º Além da articulação e cooperação por intermédio do FAS, os órgãos e entidades elencados no art. 5º do Decreto nº 11.464, de 2023, poderão participar, em caráter consultivo e sem direito a voto, de grupos técnicos do Geceis em temas específicos, definidos pela sua Secretaria-Executiva.(Redação dada pela PRT GM/MS nº 900 de 19.07.2023)
ANEXO CVII
DA IMPLEMENTAÇÃO DA ESTRATÉGIA NACIONAL DE DESENVOLVIMENTO DO COMPLEXO ECONÔMICO-INDUSTRIAL DA SAÚDE
(Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 1º Este Anexo estabelece as regras para a implementação da Estratégia Nacional de Desenvolvimento do Complexo Econômico-Industrial da Saúde no âmbito do Ministério da Saúde.(Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 2º A Estratégia Nacional de Desenvolvimento do Complexo Econômico-Industrial da Saúde será orientada pelos desafios em saúde e pelas soluções produtivas e tecnológicas para o Sistema Único de Saúde - SUS - e terá por finalidade viabilizar a consecução dos objetivos específicos estabelecidos no art. 7º da Resolução CNDI/MDIC nº 1, de 6 de julho de 2023. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
§ 1º Compreendem-se como:(Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
I - desafios em saúde para o SUS: problemas em saúde, doenças e agravos priorizados em razão de vulnerabilidades tecnológicas e produtivas ou impacto econômico que afetem o acesso à saúde ou a sustentabilidade do SUS; e (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
II - soluções produtivas e tecnológicas para o SUS: plataformas, rotas, produtos ou serviços tecnológicos necessários para execução de políticas públicas, ações, medidas, mecanismos, iniciativas e programas nacionais de promoção, prevenção, diagnóstico, tratamento e reabilitação da saúde. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
§ 2º As soluções produtivas e tecnológicas, de que trata o inciso II do § 1º, são consideradas estratégicas para o SUS para efeito da dispensa de licitação nos termos do art. 75 da Lei nº 14.133, de 1º de abril de 2021. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 3º A implementação da Estratégia Nacional para o Desenvolvimento do Complexo Econômico-Industrial da Saúde ocorrerá por meio de programas e instrumentos observando as seguintes diretrizes: (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
I - transformação produtiva e tecnológica necessária para a redução da vulnerabilidade do SUS; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
II - fortalecimento da produção local de bens e serviços capazes de dar suporte à preparação e ao enfrentamento de emergências e necessidades do SUS; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
III - promoção de iniciativas para estimular a pesquisa, o desenvolvimento, absorção e a incorporação de tecnologias e produtos em saúde; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
IV - estímulo à inovação e à produção local por meio do uso do poder de compra do Estado e de outros instrumentos de políticas públicas que favoreçam o investimento e o desenvolvimento do Complexo Econômico-Industrial da Saúde - Ceis; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
V - articulação e convergência interinstitucional para potencializar ações no âmbito do Ceis; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VI - fortalecimento de um ambiente regulatório que estimule a produção e a inovação no país, contribuindo para o acesso universal a saúde; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VII - enfrentamento dos desafios em saúde por meio de soluções produtivas e tecnológicas para o SUS; e (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VIII - garantia de estabilidade institucional para favorecer o investimento e a inovação no Ceis. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Parágrafo único. A implementação da Estratégia Nacional para o Desenvolvimento do Complexo Econômico-Industrial da Saúde se dará de forma articulada com o Grupo Executivo do Complexo Econômico-Industrial da Saúde - Geceis, instituído pelo Decreto nº 11.464, de 3 de abril de 2023. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 4º A Estratégia Nacional para o Desenvolvimento do Complexo Econômico-Industrial da Saúde incluirá, dentre outros, os seguintes programas: (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
I - Programa de Parcerias para o Desenvolvimento Produtivo - PDP: tem por objetivo orientar o esforço nacional de investimento em inovação e produção, público e privado, por meio de transferências tecnológicas de produtos estratégicos para a redução das vulnerabilidades do SUS e ampliação do acesso à saúde; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
II - Programa de Desenvolvimento e Inovação Local - PDIL: tem por finalidade promover o desenvolvimento local de soluções inovadoras voltadas aos desafios em saúde a fim de reduzir da vulnerabilidade produtiva e tecnológica, à promoção da sustentabilidade do SUS e à ampliação do acesso à saúde; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
III - Programa para Preparação em Vacinas, Soros e Hemoderivados - PPVACSH: tem por finalidade estimular a produção nacional de tecnologias necessárias à ampliação do acesso e à garantia do abastecimento de vacinas, soros e hemoderivados, viabilizando a promoção e a coordenação dos investimentos e iniciativas na produção pública, em parceria com o setor privado, podendo, quando couber, utilizar os instrumentos do programa de PDP, do PDIL ou outros similares; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
IV - Programa de Produção e Desenvolvimento Tecnológico para Populações e Doenças Negligenciadas - PPDN: tem por finalidade estimular a produção nacional de tecnologias necessárias para ampliar o acesso à prevenção, diagnóstico e tratamento de população e doenças negligenciadas como problema de saúde pública e de equidade, viabilizando a promoção e a coordenação dos investimentos e iniciativas na produção pública, em parceria com o setor privado, podendo, quando couber, utilizar os instrumentos do programa de PDP, do PDIL ou outros similares; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
V - Programa de Modernização e Inovação na Assistência - PMIA: tem por objetivo estimular a produção e a inovação local no âmbito do Ceis mediante a promoção da modernização e da inovação na assistência das instituições que prestam serviços ao SUS, podendo estabelecer mecanismos de incentivos e de compromissos para adesão ao programa; e (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VI - Programa para Ampliação e Modernização de Infraestrutura do Complexo Econômico-Industrial da Saúde - PDCEIS: tem por objetivo o desenvolvimento da infraestrutura do Ceis de forma a viabilizar a capacidade produtiva, tecnológica e de inovação necessárias à execução dos demais programas. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Parágrafo único. Os instrumentos e programas serão instituídos por atos específicos do Ministro de Estado da Saúde e estarão sujeitos às seguintes condicionalidades: (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
I - estabelecimento de mecanismos de monitoramento do desenvolvimento e da transferência de tecnologia para efeitos de compromissos das instituições apoiadas; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
II - apresentação, pelas instituições participantes, de programa de governança, profissionalização e de integridade; e (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
III - apresentação de programa de sustentabilidade ambiental das tecnologias incorporadas na atividade produtiva. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 5º Os instrumentos e os programas observarão os objetivos definidos no art. 3º do Decreto nº 11.715, de 26 de setembro de 2023, que institui a Estratégia Nacional para o Desenvolvimento do Complexo Econômico-Industrial da Saúde. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 6º Os desafios em saúde abarcarão necessariamente as vulnerabilidades tecnológicas e produtivas que afetem a sustentabilidade do SUS e serão definidos considerando pelo menos um dos seguintes critérios: (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
I - impacto sobre a resiliência, preparação e capacidade de enfrentamento de emergências sanitárias; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
II - risco para a soberania nacional e segurança sanitária decorrentes da dependência produtiva e tecnológica; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
III - alto grau de incidência e prevalência; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
IV - impacto sobre populações e doenças negligenciadas ou acometidas por doenças raras; e (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
V - apoio a iniciativas relacionadas com a saúde global por meio de acordos de cooperação internacionais, especialmente para viabilizar o acesso dos países da América Latina e da África aos produtos e às tecnologias em saúde. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 7º As soluções produtivas e tecnológicas para o SUS devem buscar a superação dos desafios em saúde e adicionalmente atender a pelo menos um dos seguintes critérios: (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
I - ampliar o acesso à prevenção, ao diagnóstico, ao tratamento ou à reabilitação; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
II - promover a sustentabilidade econômica do SUS; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
III - contribuir para a redução da dependência de importações; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
IV - promover o desenvolvimento tecnológico e a produção local; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
V - mitigar o risco de desabastecimento; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VI - desenvolver alternativas para produtos e tecnologias em saúde descontinuadas ou obsoletas; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VII - contribuir para a preparação de situações de emergência sanitária e para saúde global, especialmente, para América Latina e África; (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
VIII - desenvolver sistemas produtivos inovadores ou tecnologias portadoras de futuro; e (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
IX - contribuir para a transição digital e ecológica no âmbito do Ceis. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 8º Os desafios em saúde e as soluções produtivas e tecnológicas para o SUS serão determinados por ato da Ministra de Estado da Saúde e divulgados no portal eletrônico do Ministério da Saúde, ouvindo as recomendações do Geceis. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Parágrafo único. Cabe à Secretaria de Ciência, Tecnologia, Inovação e Complexo da Saúde do Ministério da Saúde coordenar as ações visando à decisão ministerial de que trata o caput, com a colaboração da Comissão Permanente do Complexo Econômico-Industrial da Saúde - CPCEIS. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
Art. 9º As ações desenvolvidas no escopo deste Anexo serão feitas de modo cooperativo com o Geceis. (Redação dada pela PRT GM/MS nº 1.354 de 27.09.2023)
ANEXO CVII[A]
EXECUÇÃO, CRITÉRIOS, PROCEDIMENTOS E MONITORAMENTO DA DISPONIBILIZAÇÃO GRATUITA DE ABSORVENTES HIGIÊNICOS E OUTRAS AÇÕES DO PROGRAMA DE PROTEÇÃO E PROMOÇÃO DA SAÚDE E DIGNIDADE MENSTRUAL NO ÂMBITO DO MINISTÉRIO DA SAÚDE
(Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 1º Este Anexo dispõe sobre a execução, os critérios, os procedimentos e o monitoramento da disponibilização gratuita de absorventes higiênicos e outras ações do Programa de Proteção e Promoção da Saúde e Dignidade Menstrual, instituído pela Lei nº 14.214, de 6 de outubro de 2021, e regulamentado pelo Decreto nº 11.432, de 8 de março de 2023, no âmbito do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Parágrafo único. São pessoas beneficiárias do Programa de Proteção e Promoção da Saúde e Dignidade Menstrual, para os fins deste Anexo: (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
I - que estejam, cumulativamente: (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
a) matriculadas na rede pública de ensino estadual, municipal ou federal, nas etapas do ensino fundamental ou do ensino médio, em todas as modalidades de ensino; e (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
b) pertençam a famílias que estejam inscritas no Cadastro Único para Programas Sociais - CadÚnico e sejam classificadas como de baixa renda nos termos do Decreto nº 11.016, de 29 de março de 2022; (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
II - estejam registradas no CadÚnico, em qualquer das seguintes categorias: (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
a) em situação de rua; ou (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
b) em situação de pobreza, conforme o critério estabelecido da Medida Provisória nº 1.164, de 2 de março de 2023, ou da lei em que for convertida, observando-se as atualizações monetárias estabelecidas em decreto; e (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
III - estejam em cumprimento de medidas socioeducativas, cadastradas no Sistema Nacional de Atendimento Socioeducativo - Sinase. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 2º A disponibilização gratuita de absorventes higiênicos pelo Ministério da Saúde observará a viabilidade técnica e operacional da Pasta, bem como sua disponibilidade orçamentária. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Parágrafo único. A disponibilização de que trata o caput observará os seguintes parâmetros: (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
I - quantitativo de 20 (vinte) unidades de absorventes higiênicos por pessoa que menstrua por ciclo menstrual, considerando cinco dias de menstruação regular e uso de quatro unidades de absorventes por dia de menstruação; (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
II - ciclo menstrual de 28 (vinte e oito dias); e (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
III - idade fértil de 10 (dez) a 49 (quarenta e nove) anos. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 3º O Programa Farmácia Popular do Brasil - PFPB será um dos meios de acesso a absorventes higiênicos gratuitos pelas pessoas beneficiárias elencadas nos incisos I e II do parágrafo único do art. 1º deste Anexo. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
§ 1º Para ter acesso gratuito a absorventes higiênicos nos estabelecimentos credenciados no âmbito do PFPB, a pessoa beneficiária deverá emitir documento de autorização de disponibilização por meio da plataforma ConecteSUS, cuja validade será de 180 (cento e oitenta) dias, contados a partir de sua emissão, sendo desnecessário apresentar prescrição médica, laudo ou atestado. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
§ 2º O documento de autorização de disponibilização de que trata o § 1º deverá ser apresentado ao estabelecimento credenciado no âmbito do PFPB em formato impresso ou digital pela pessoa beneficiária ou seu representante constituído conforme as regras do PFPB, sempre em conjunto com o CPF e documento oficial de identificação com foto. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
§ 3º A verificação das pessoas beneficiárias de que trata o caput será realizada por meio da base de dados do CadÚnico, a ser disponibilizada pelo Ministério do Desenvolvimento e Assistência Social, Família e Combate à Fome. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
§ 4º Detalhamento sobre os parâmetros e requisitos de acesso ao programa abordados neste artigo poderá o ser apresentados pelas ferramentas e instrumentos de implementação e comunicação do Programa Dignidade Menstrual e Programa Farmácia Popular do Brasil. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 4º O Ministério da Saúde estudará e articulará com o Ministério dos Direitos Humanos e da Cidadania a criação de ações específicas voltadas às pessoas que estejam cumprindo medidas socioeducativas em regime de internação em estabelecimento educacional, dentre as referidas no inciso IV do art. 3º da Portaria Interministerial MS/MM/MJSP/MDS/MEC/MDHC nº 729, de 2023. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 5º O Programa de Proteção e Promoção da Saúde e Dignidade Menstrual será monitorado, no âmbito do Ministério da Saúde, da seguinte forma: (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
I - a oferta gratuita de absorventes higiênicos será monitorada pela Secretaria de Atenção Primária à Saúde por meio dos relatórios de disponibilização de absorventes produzidos pela área responsável pelo PFPB e do acompanhamento da quantidade de pessoas elegíveis ao Programa de Proteção e Promoção da Saúde e Dignidade Menstrual, de acordo com as bases de dados disponibilizadas pelo Ministério do Desenvolvimento e Assistência Social, Família e Combate à Fome; (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
II - o eixo da comunicação e publicidade será monitorado pela Secretaria de Atenção Primária à Saúde em conjunto com a Assessoria de Comunicação do Ministério da Saúde, sendo esta responsável pela realização de campanhas publicitárias, ações de combate à desinformação e disponibilização de conteúdos gráficos; e (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
III - o eixo da formação de agentes públicos será monitorado pela Secretaria de Gestão do Trabalho e da Educação na Saúde em conjunto com a Secretaria de Atenção Primária à Saúde, áreas técnicas responsáveis pelo planejamento e execução de cursos e ações de educação em saúde. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Parágrafo único. O disposto neste artigo não altera as regras e os procedimentos próprios de monitoramento do PFPB. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 6º Os recursos financeiros de que trata o § 1º do art. 3º deste Anexo correrão por conta do orçamento do Ministério da Saúde, devendo onerar a Funcional Programática 10.303.5017.20YR - Manutenção e Funcionamento do Programa Farmácia Popular do Brasil pelo Sistema de Gratuidade. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
Art. 7° Os recursos financeiros de que tratam os demais dispositivos deste Anexo correrão por conta do orçamento do Ministério da Saúde, devendo onerar a Funcional Programática 10.301.5019.219A - Piso de Atenção Primária à Saúde, no Plano Orçamentário PO - OOOA - Incentivo para Ações Estratégicas, mediante disponibilidade orçamentária e financeira. (Redação dada pela PRT GM/MS n° 3.076 de 15.01.2024)
ANEXO CVIII
DO PROGRAMA SUS DIGITAL
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Seção I
Dos objetivos
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 1º O Programa SUS Digital tem por objetivo geral promover a transformação digital no âmbito do Sistema Único de Saúde - SUS para ampliar o acesso da população às suas ações e serviços, com vistas à integralidade e resolubilidade da atenção à saúde. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Parágrafo único. A transformação digital no SUS aplica-se ao campo da saúde como um todo, incluindo a atenção integral à saúde, a vigilância em saúde, a formação e educação permanente dos trabalhadores e profissionais de saúde, a gestão do SUS em seus diversos níveis e esferas, e o planejamento, monitoramento, avaliação, pesquisa, desenvolvimento e inovação em saúde, mas sem se restringir a estes. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 2º São objetivos específicos do Programa SUS Digital: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - fomentar o uso apropriado, ético e crítico de novas tecnologias digitais no SUS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - apoiar a proposição de soluções digitais colaborativas e livres que melhorem a oferta de serviços, a gestão do cuidado pelos profissionais de saúde e a qualidade da atenção à saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - incentivar a formação e educação permanente em saúde digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - promover a sensibilização, conscientização e engajamento para uso das tecnologias digitais e tratamento adequado de dados pelos atores do SUS, fomentando o letramento digital e a cultura da saúde digital e da proteção de dados pessoais; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
V - ampliar a maturidade digital no SUS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VI - fortalecer a participação social e o protagonismo do cidadão na criação de soluções digitais inovadoras no campo da saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VII - fortalecer o ecossistema de saúde digital no SUS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VIII - contribuir com o desenvolvimento de um ambiente colaborativo para o aprimoramento da gestão do SUS, por meio da transformação digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IX - promover a interoperabilidade de dados em saúde; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
X - reduzir a iniquidade no acesso às soluções e serviços de saúde digital nas diferentes regiões do país. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Seção II
Do objeto e da abrangência
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 3º O Programa SUS Digital tem por objeto a saúde digital, com abordagem multidisciplinar e escopo na intersecção entre tecnologia, informação e saúde, incorporando software, hardware e serviços como parte do processo de transformação digital. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Parágrafo único. Para efeitos do Programa, a saúde digital engloba, dentre outros, sistemas de informação interoperáveis, registro eletrônico de dados de saúde, aplicação da ciência de dados, inteligência artificial, telemedicina, telessaúde, aplicações móveis de saúde, dispositivos vestíveis, robótica aplicada, medicina personalizada e internet das coisas, voltados ao setor de saúde. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Seção III
Dos conceitos
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 4º Para os fins do Programa SUS Digital, considera-se: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - cultura de saúde digital: conjunto de valores, atitudes, comportamentos e práticas relacionados ao uso de tecnologias digitais no campo da saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - dado pessoal sensível de saúde: dado relativo à saúde de um titular de dados ou à atenção à saúde a ele prestada que revele informações sobre sua saúde física ou mental no presente, passado ou futuro; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - ecossistema de saúde digital: sistema complexo e interconectado, incluindo objetos técnicos, técnicas e tecnologias, organizados em base física (conectividade, equipamentos e dispositivos auxiliares), estruturas (redes, sistemas e bases de dados), instrumentos (prontuário eletrônico, registro autoaplicado e protocolos), processos operacionais (programas, aplicativos e rotinas) e aplicações de técnicas digitais para solução de problemas ou intervenções em situações de saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - Índice Nacional de Maturidade em Saúde Digital - INMSD: representação dos resultados de métricas utilizadas para o diagnóstico, monitoramento e avaliação da maturidade digital, incluindo os indicadores de maior importância para demonstrar a sustentabilidade das ações e serviços de saúde digital; (Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
IV - Índice Nacional de Maturidade em Saúde Digital (INMSD): representação dos resultados de métricas utilizadas para o diagnóstico, monitoramento e avaliação da maturidade digital, incluindo os indicadores de maior importância para demonstrar a sustentabilidade das ações e serviços de saúde digital, conforme disposto no Capítulo III-A deste Anexo; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
V - Laboratório de Inovação em Saúde Digital: ambiente interinstitucional conformado em rede, integrativo e colaborativo, voltado à promoção, ao fomento e ao desenvolvimento de soluções inovadoras para o fortalecimento do ecossistema de saúde e transformação digital no SUS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VI - maturidade digital: grau de organização, coordenação, interoperabilidade e integração digital dos processos de trabalho e gestão do cuidado em saúde, na adoção de tecnologias e automação de processos, de forma a identificar oportunidades de melhoria e estabelecer um norte para a transformação digital; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VII - saúde digital: conjunto de saberes, técnicas, práticas, atitudes, modos de pensar e valores relacionados ao uso de tecnologias digitais em saúde e ao crescimento do espaço digital. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
CAPÍTULO II
DAS DIRETRIZES DO PROGRAMA
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 5º As ações e projetos decorrentes do Programa SUS Digital serão desenvolvidos de acordo com as seguintes diretrizes: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - universalidade e equidade no acesso aos produtos e serviços de saúde digital, em todos os níveis de atenção à saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - protagonismo do cidadão nas decisões sobre produtos e serviços de saúde digital, entendendo suas necessidades e oferecendo valor por meio de serviços de alta qualidade, simples, ágeis e personalizados, com atenção à experiência do usuário; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - reconhecimento da Rede Nacional de Dados em Saúde - RNDS como a plataforma digital de interoperabilidade, inovação, informação e serviços de saúde para todo o Brasil, em benefício de cidadãos, usuários, comunidades, gestores, profissionais, trabalhadores e organizações de saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - indução à interoperabilidade dos sistemas de informação em saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
V - incentivo à gestão democrática e participativa; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VI - transparência ativa na disponibilização de dados e informações que viabilizem o acompanhamento e a participação da sociedade no controle social dos serviços e políticas de saúde digital, com cooperação entre os entes federados; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VII - uso das tecnologias da informação e comunicação para apoio à descentralização das atividades de saúde, observando as especificidades regionais e locais; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VIII - reconhecimento do acesso a internet de qualidade como essencial à promoção da inclusão digital e à redução das desigualdades no acesso às tecnologias da informação e comunicação necessárias à efetivação da saúde digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IX - garantia do uso seguro da informação, observadas as regras sobre proteção de dados pessoais previstas na legislação; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
X - conjugação dos recursos financeiros, tecnológicos e materiais da União, estados, Distrito Federal e municípios para a transformação digital do SUS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
XI - priorização da inclusão da saúde digital na formação e educação permanente em saúde dos profissionais e trabalhadores de saúde do SUS; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
XII - associação das ações de saúde digital do Programa SUS Digital ao modelo de atenção à saúde do SUS, de forma a orientar sua consecução. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
CAPÍTULO III
DA OPERACIONALIZAÇÃO DO PROGRAMA
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 6º O Programa SUS Digital será executado pela União, estados, Distrito Federal e municípios, podendo incluir a participação de instituições de ensino superior, institutos tecnológicos e instituições de pesquisa. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 7º O Programa SUS Digital será desenvolvido em três etapas: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - etapa 1: planejamento; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - etapa 2: implementação das ações de transformação para a saúde digital; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - etapa 3: avaliação. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 1º Na etapa 1, os estados, Distrito Federal e municípios poderão manifestar interesse na elaboração dos Planos de Ação de Transformação para a Saúde Digital - PA Saúde Digital, a partir da realização de diagnóstico situacional e da aplicação do INMSD. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 2º A etapa 2 consiste na implementação dos respectivos PA Saúde Digital, elaborados na forma da etapa 1. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 3º A etapa 3 consiste na avaliação das ações implementadas decorrentes do Programa, tendo como referência o INMSD. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 4º O INMSD deverá ser pactuado na Comissão Intergestores Tripartite - CIT e divulgado mediante ato específico da Ministra de Estado da Saúde, de forma a subsidiar o desenvolvimento do PA Saúde Digital. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 5º Portarias específicas do Ministério da Saúde darão início e regulamentarão cada uma das etapas de que trata o caput, incluindo respectivas regras de financiamento, acompanhamento, avaliação e prestação de contas. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 8º As ações, estratégias e planos de ação de transformação digital decorrentes do Programa SUS Digital deverão estar baseadas em um ou mais dos seguintes eixos de atuação: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - eixo 1: cultura de saúde digital, formação e educação permanente em saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - eixo 2: soluções tecnológicas e serviços de saúde digital no âmbito do SUS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - eixo 3: interoperabilidade, análise e disseminação de dados e informações de saúde. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 1º O eixo 1 abrange iniciativas como: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - formação e educação permanente em saúde digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - fortalecimento do ecossistema de saúde digital, por meio da promoção de inovação aberta, da estruturação de rede colaborativa para o compartilhamento de experiências, conhecimentos, cultura e práticas entre os atores e da cocriação com cidadãos e a sociedade civil organizada; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - fortalecimento do uso de estudos e evidências para incorporação de tecnologias digitais em saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - fomento à cultura da proteção de dados pessoais e sensíveis de saúde; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
V - qualificação dos registros em saúde. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 2º O eixo 2 abrange iniciativas como: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - apoio à informatização do SUS e adoção de prontuários eletrônicos que atendam aos padrões de interoperabilidade da RNDS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - suporte à melhoria da infraestrutura para os sistemas digitais e de conectividade; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - fortalecimento dos mecanismos de segurança de acesso aos sistemas, dados e informações de saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - indução da estruturação e do funcionamento de soluções tecnológicas e serviços de saúde digital no âmbito dos estabelecimentos e serviços de saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
V - fortalecimento da saúde digital para atendimento à saúde das populações negligenciadas, vulneráveis e isoladas geograficamente e dos povos originários; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VI - ampliação da oferta de telemedicina e telessaúde no âmbito do SUS em território nacional. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 3º O eixo 3 abrange iniciativas como: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - promoção da interoperabilidade de dados de saúde com a RNDS; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - gestão e governança no compartilhamento de dados de saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - elaboração de estudos técnicos, diretrizes e protocolos, análise e disseminação de dados para subsidiar estratégias de saúde digital e inovação em saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - padronização dos modelos de informação nacionais, bem como dos vocabulários e terminologias em saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
V - promoção da disseminação de dados e informações em saúde, mantendo-se a confidencialidade, privacidade, proteção de dados e segurança da informação de saúde pessoal; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VI - preservação da autenticidade, integridade, rastreabilidade e qualidade da informação em saúde. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 9º Os serviços de telemedicina e telessaúde a serem ofertados no âmbito do SUS, como parte e integrados ao Programa SUS Digital, deverão seguir as normas estabelecidas na Seção I do Capítulo I do Título IV desta Portaria. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
CAPÍTULO III-A
DO ÍNDICE NACIONAL DE MATURIDADE EM SAÚDE DIGITAL - INMSD
(Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Seção I
Disposições Gerais
(Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-A O INMSD é a representação dos resultados de métricas utilizadas para o diagnóstico, monitoramento e avaliação da maturidade em saúde digital de estados, municípios e do Distrito Federal. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-B São objetivos do INMSD: (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
I - oferecer uma avaliação abrangente e equitativa do panorama de saúde digital, considerando a diversidade geográfica e as desigualdades presentes no Brasil; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
II - impulsionar a integração efetiva da tecnologia na saúde, para promover a equidade e aprimorar a qualidade dos serviços em todo o território nacional; e (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
III - gerar evidências para apoiar estados, Distrito Federal e municípios na elaboração dos seus Planos de Ação de Transformação para a Saúde Digital. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-C O INMSD será obtido a partir das respostas apresentadas pelos estados, Distrito Federal e municípios às perguntas elencadas em questionário disponibilizado pela Secretaria de Informação e Saúde Digital do Ministério da Saúde (SEIDIGI/MS). (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Parágrafo único. O questionário de que trata o caput, o material de apoio com as orientações de preenchimento e o método de cálculo do INMSD serão disponibilizados aos gestores dos estados, Distrito Federal e municípios por meio de link e chave de acesso encaminhados via endereço eletrônico. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-D O questionário do INMSD de que trata o art. 9º-C será composto por sete domínios que contemplam as seguintes temáticas relacionadas à Saúde Digital: (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
I - Gestão e Governança em Saúde Digital: aborda um conjunto de lideranças, estratégias, políticas e regras para: (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
a) promover, orientar, monitorar, avaliar e regular a participação colaborativa dos diferentes atores da saúde; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
b) orientar, normatizar e inovar a saúde digital seguindo os princípios da privacidade e confidencialidade dos dados de saúde; e
c) garantir o adequado planejamento e financiamento para os projetos de transformação digital no Sistema Único de Saúde (SUS); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
II - Formação e Desenvolvimento profissional: aborda estratégias e práticas para melhorar as habilidades em saúde digital dos profissionais, incluindo educação técnica, competências interdisciplinares, atualização científica, gestão de conhecimento e adaptação às mudanças tecnológicas, de forma a contribuir para uma gestão de saúde mais integrada e eficaz, impactando diretamente a qualidade do SUS; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
III - Sistemas e Plataformas de Interoperabilidade: aborda sistemas, serviços e funcionalidades da saúde digital e a importância da interoperabilidade de dados para qualificação da informação de saúde que impactam na garantia da continuidade do cuidado do cidadão, na vigilância em saúde, nos processos de tomada de decisão de gestores e outros processos e serviços, sem comprometer a segurança e privacidade do paciente; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
IV - Telessaúde e Serviços Digitais: aborda a utilização de dispositivos de Tecnologia da Informação e Comunicações (TIC) para o desenvolvimento de serviços de telessaúde que promovam a integralidade e a continuidade da assistência e do cuidado em saúde entre todos os níveis das Redes de Atenção à Saúde no âmbito do SUS, podendo ser realizadas por meio de teleconsultoria síncrona e/ou assíncrona, teletriagem, teleconsulta, teleinterconsulta, telediagnóstico, telemonitoramento, teleorientação, teleducação, segunda opinião formativa (SOF) e telerregulação; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
V - Infoestrutura: aborda a base tecnológica e organizacional que suporta o gerenciamento eficaz das informações, incluindo acesso à informação e gestão do conhecimento, garantindo a produção, integridade, armazenamento, segurança e uso eficiente de dados e terminologias clínicas; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
VI - Monitoramento, Avaliação e Disseminação de Informações Estratégicas: aborda o processo de monitoramento e avaliação em saúde digital, o compartilhamento de informações importantes de forma estratégica e a utilização dos instrumentos de planejamento eficazes para orientar o desenvolvimento e implementação dessas tecnologias; e
VII - Infraestrutura e Segurança: aborda a infraestrutura tecnológica e os aspectos de segurança necessários para suportar os sistemas de informação de saúde, incluindo garantia da conectividade, segurança da informação, armazenamento de dados, infraestrutura física, equipamentos e arquitetura de sistemas e serviços. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Parágrafo único. Os sete domínios elencados nos incisos do caput serão desdobrados em subdomínios que contemplam questões de respostas obrigatórias pelos estados, Distrito Federal e municípios. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-E A SEIDIGI/MS é responsável por coletar, armazenar e analisar as respostas dos estados, Distrito Federal e municípios e realizar o cálculo do INMSD. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-F O resultado do INMSD será apresentado em valores decimais nas escalas entre 0 (zero) e 1 (um), de modo que 0 (zero) é o menor estágio de maturidade em saúde digital e 1 (um) o maior estágio. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Seção II
Do Comitê Consultivo do INMSD
(Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-G Fica instituído o Comitê Consultivo do Índice Nacional de Maturidade em Saúde Digital (CC-INMSD), órgão de caráter consultivo, com objetivo de assessorar a SEIDIGI/MS no aperfeiçoamento do INMSD e no acompanhamento da sua aplicação e evolução contínua. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-H Compete ao CC-INMSD: (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
I - assessorar a SEIDIGI/MS nas questões técnicas, estratégicas e operacionais relacionadas ao INMSD; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
II - propor iniciativas para viabilizar e aprimorar o instrumento e sua aplicação; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
III - acompanhar o processo de aplicação e comunicação do INMSD; e (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
IV - colaborar com a análise e avaliação dos resultados. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-I O CC-INMSD terá a seguinte composição: (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
I - um representante do Departamento de Informação e Informática do Sistema Único de Saúde (DATASUS/SEIDIGI/MS), que o coordenará; (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
II - um representante do Gabinete da Secretaria de Informação e Saúde Digital (SEIDIGI); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
III - um representante do Departamento de Saúde Digital e Inovação (DESD/SEIDIGI/MS); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
IV - um representante do Departamento de Monitoramento, Avaliação e Disseminação de Informações Estratégicas em Saúde (DEMAS/SEIDIGI/MS); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
V - um representante do Conselho Nacional de Secretários de Saúde (CONASS); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
VI - um representante do Conselho Nacional de Secretarias Municipais de Saúde (Conasems); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
VII - um representante da Organização Pan-Americana da Saúde (OPAS); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
VIII - um representante do Núcleo de Informação e Coordenação do Ponto BR (Nic.br); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
IX - um representante da Rede Nacional de Ensino e Pesquisa (RNP); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
X - um representante da Agência Nacional de Vigilância Sanitária (Anvisa); (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
XI - um representante da Agência Nacional de Saúde Suplementar (ANS); e (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
XII - um representante da Fundação Oswaldo Cruz (Fiocruz). (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 1º Cada membro do CC-INMSD terá um suplente, que o substituirá em suas ausências e impedimentos. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 2º Os membros do CC-INMSD e respectivos suplentes, serão indicados pelos dirigentes máximos dos respectivos órgãos, unidades e entidades à coordenação do CC-INMSD e designados por ato da Secretária de Informação e Saúde Digital do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 3º Poderão participar das reuniões do CC-INMSD, como convidados e sem direito a voto, representantes de outros órgãos e entidades, públicos ou privados, bem como especialistas em assuntos afetos ao tema em discussão, cuja participação seja considerada necessária ao cumprimento do disposto nesta Seção. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 4º A Secretaria de Governo Digital do Ministério da Gestão e Inovação (SGD/MGI) participará das reuniões do CC-INMSD na condição de membro convidado especial, na forma do § 3º. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 5º O CC-INMSD se reunirá, ordinariamente, a cada dois meses e, extraordinariamente, sempre que convocado pela sua coordenação. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 6º O quórum de reunião do CC-INMSD é de maioria dos membros e suas deliberações ocorrerão por maioria simples dos membros presentes. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 7º O Coordenador do CC-INMSD terá o voto de qualidade em caso de empate nas deliberações. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
§ 8º Os membros que se encontrarem no Distrito Federal se reunirão presencialmente ou por meio de videoconferência e os membros que se encontrarem em outras localidades poderão participar das reuniões por videoconferência. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-J A Secretaria-Executiva do CC-INMSD será exercida pela Coordenação-Geral de Inovação e Informática em Saúde (CGIIS/DATASUS/SEIDIGI/MS), que prestará o apoio técnico, logístico e administrativo necessário ao desenvolvimento dos trabalhos do Comitê. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
Art. 9º-K A participação no CC-INMSD será considerada prestação de serviço público relevante e não remunerada. (Redação dada pela PRT GM/MS n° 3.727 de 21.05.2024)
CAPÍTULO IV
DA COORDENAÇÃO E GOVERNANÇA DO PROGRAMA
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 10. O Comitê Gestor de Saúde Digital - CGSD é a instância deliberativa do Programa SUS Digital, conforme art. 244-H da Portaria de Consolidação GM/MS nº 1, de 28 de setembro de 2017, com funções normativas, diretivas, de monitoramento e de avaliação. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 1º A coordenação executiva do Programa SUS Digital compete ao Ministério da Saúde, por meio da Secretaria de Informação e Saúde Digital. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
§ 2º A governança do Programa SUS Digital será realizada no âmbito da CIT para os aspectos operacionais, financeiros e administrativos da gestão compartilhada do SUS. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 11. Compete ao Ministério da Saúde: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - propor à CIT os requisitos de adesão ao Programa SUS Digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - avaliar o cumprimento dos requisitos dos aderentes ao Programa SUS Digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - desenvolver e apoiar ações de educação permanente com foco nas especificidades do Programa SUS Digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - elaborar, publicar e divulgar atos normativos e orientações para adesão e homologação da adesão ao Programa; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
V - exercer a coordenação executiva do Programa SUS Digital, por meio da Secretaria de Informação e Saúde Digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VI - propor ao CGSD metodologias de monitoramento e avaliação do Programa SUS Digital, de forma articulada e pactuada com os estados e municípios; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VII - articular e estabelecer parcerias com órgãos governamentais e não governamentais, nacionais e internacionais, setoriais e multissetoriais, bem como com a sociedade civil organizada, para o fortalecimento das ações do Programa SUS Digital; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
VIII - apoiar a implementação das iniciativas do Programa SUS Digital nos estados, municípios e Distrito Federal. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 12. Compete aos estados: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - planejar, executar, monitorar e avaliar as ações de caráter estadual pactuadas no âmbito do Programa SUS Digital; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - desenvolver e apoiar ações de educação permanente com foco nas especificidades do Programa SUS Digital no respectivo âmbito estadual; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - prestar apoio e cooperação técnica aos municípios e serviços sob sua gestão, no âmbito do Programa; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - coordenar ações que promovam o desenvolvimento das instâncias públicas de informação e tecnologia afetas ao Programa SUS Digital, no respectivo âmbito estadual. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 13. Compete aos municípios: (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
I - planejar, executar, monitorar e avaliar as ações de caráter municipal e regional pactuadas no âmbito do Programa SUS Digital, em articulação com os planos municipais, estaduais e regionais de saúde; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
II - desenvolver e apoiar ações de educação permanente com foco nas especificidades do Programa SUS Digital no respectivo âmbito municipal; (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
III - prestar apoio e cooperação técnica às equipes e serviços em seu território ou de outros municípios, com vistas à execução das ações decorrentes do Programa SUS Digital; e (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
IV - coordenar ações que promovam o desenvolvimento das instâncias públicas de informação e tecnologia afetas ao Programa SUS Digital, no respectivo âmbito municipal. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 14. Compete ao Distrito Federal executar as atribuições de estados e municípios em seu âmbito territorial. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
CAPÍTULO V
DAS DISPOSIÇÕES FINAIS
(Redação dada pela PRT GM/MS n° 3.232 de
01.03.2024)
Art. 15. O Ministério da Saúde, por meio da Secretaria de Informação e Saúde Digital, publicará "Manual Instrutivo do Programa SUS Digital", com as orientações para execução de cada etapa do Programa e suas respectivas ações. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Art. 16. As disposições relativas a monitoramento, prestação de contas e financiamento, além de outras análogas, constarão das portarias de que trata o § 5º do art. 7º deste Anexo. (Redação dada pela PRT GM/MS n° 3.232 de 01.03.2024)
Anexo CIX
DO PROGRAMA DE DESENVOLVIMENTO E INOVAÇÃO LOCAL - PDIL
(Redação dada pela PRT GM/MS n° 4.473
de 20.06.2024)
Art. 1º Fica instituído o Programa de Desenvolvimento e Inovação Local - PDIL, com a finalidade de promover o desenvolvimento da produção e inovação local voltados aos desafios em saúde, a sustentabilidade e resiliência do Sistema Único de Saúde - SUS e a ampliação do acesso à saúde, a fim de reduzir a vulnerabilidade produtiva e tecnológica do SUS. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Parágrafo único. São elegíveis para o PDIL as soluções produtivas e tecnológicas para o SUS que atendam aos objetivos definidos neste Anexo e que constem na Matriz de Desafios Produtivos e Tecnológicos em Saúde estabelecida por ato da Ministra de Estado da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 2º Para os fins deste anexo, consideram-se: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - alianças estratégicas em saúde: parcerias estabelecidas para cooperação podendo envolver empresas públicas e privadas, Instituições Científicas, Tecnológicas e de Inovação - ICTs, instituições públicas, entidades privadas sem fins lucrativos e startups com o propósito de empreender projetos de benefícios mútuos, a partir da união de recursos tangíveis e intangíveis, voltadas para atividades de Pesquisa e Desenvolvimento - P&D que objetivem a geração de soluções produtivas e tecnológicas para o SUS, além da transferência e da difusão de tecnologias em saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - Comissão Técnica de Avaliação - CTA: instância colegiada instituída no âmbito do Complexo Econômico-Industrial da Saúde - Ceis, que tem, dentre suas atribuições, a de analisar e avaliar as propostas de projetos do PDIL; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - Comitê Deliberativo - CD: instância colegiada instituída no âmbito do Complexo Econômico-Industrial da Saúde - Ceis, de caráter deliberativo, que aprova ou reprova as propostas de projetos do PDIL, cujo assessoramento técnico é prestado pela Comissão Técnica de Avaliação CTA; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - desafios em saúde para o SUS: problemas em saúde, doenças e agravos priorizados em razão de vulnerabilidades tecnológicas e produtivas ou impacto econômico que afetem o acesso à saúde ou a sustentabilidade do SUS constantes na Matriz de Desafios Produtivos e Tecnológicos em Saúde, estabelecida por ato da Ministra de Estado da Saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
V - desenvolvimento e inovação local: desenvolvimento e inovação realizados em território brasileiro para viabilizar a produção no País; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VI - inovação local: introdução de novidade ou aperfeiçoamento no ambiente produtivo e social que resulte em novos produtos, serviços ou processos ou que compreenda a agregação de novas funcionalidades ou características a produto, serviço ou processo já existente que possa resultar em melhorias e em efetivo ganho de qualidade ou desempenho para produção no País; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VII - nível de maturidade tecnológica: métrica que permite ordenar e comparar o desenvolvimento de tecnologias quanto ao estágio de desenvolvimento; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VIII - tecnologias em saúde: fármacos, biofármacos, medicamentos, imunobiológicos, terapias avançadas, vacinas, soros, hemoderivados, fitoterápicos, fitofármacos, intermediários, dispositivos médicos e componentes tecnológicos críticos, diagnóstico in vitro, tecnologias digitais de informação e conectividade, entre outras, aplicadas à saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IX - Tecnologias Digitais de Informação e Conectividade - TDIC: desenvolvimento, inovação e produção de ferramentas que facilitem a comunicação, processamento e transmissão de informações por meio eletrônico com o propósito de melhorar a saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
X - transformação digital: aproveitamento do potencial das tecnologias digitais para promover o desenvolvimento econômico e social sustentável e inclusivo, com inovação, aumento de competitividade e de produtividade por meio da digitalização dos processos produtivos e capacitação para o ambiente digital; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
XI - transformação ecológica: transformação de paradigma cultural, político e econômico da organização social da produção baseada no bioma, em prol de relações sustentáveis com o território e a natureza, gerando melhor qualidade de vida para suas populações. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 3º São objetivos do PDIL: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - promover a produção no Brasil no âmbito do Complexo Econômico-Industrial da Saúde - Ceis e em consonância com a Matriz de Desafios Produtivos e Tecnológicos em Saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - induzir e fomentar o desenvolvimento tecnológico, territorial e a inovação local para ampliar o acesso à saúde e reduzir a vulnerabilidade tecnológica do SUS; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - promover ações de capacitação para Instituições Científicas, Tecnológicas e de Inovação - ICTs, produtores públicos, entidades privadas sem fins lucrativos, startups e empresas públicas e privadas acerca do processo de desenvolvimento, registro, produção e incorporação de tecnologias no SUS; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - contribuir para a transformação digital e ecológica e para a sustentabilidade do Ceis. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 4º Caberá ao Ministério da Saúde, por intermédio do PDIL: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - atuar em articulação com as instituições integrantes do Grupo Executivo do Complexo Econômico-Industrial da Saúde - Geceis e do Fórum de Articulação com a Sociedade - FAS; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - alavancar o desenvolvimento tecnológico, produtivo e a inovação local; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - estimular o aprimoramento do ambiente regulatório como indutor do desenvolvimento tecnológico e da inovação para o Ceis; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - direcionar o fomento para projetos e ações que visem induzir o desenvolvimento de soluções produtivas e tecnológicas para o SUS, relacionadas na Matriz de Desafios Produtivos e Tecnológicos em Saúde; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
V - promover o estabelecimento de alianças estratégicas no âmbito do Ceis para o desenvolvimento de soluções produtivas e tecnológicas para o SUS, relacionadas na Matriz de Desafios Produtivos e Tecnológicos em Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 5º O PDIL poderá ser implementado mediante fomento de projetos de inovação local, por intermédio de convênios, termos de execução descentralizada - TED, encomendas tecnológicas, contratos públicos para solução inovadora, acordos de compensação tecnológica e outros instrumentos correlatos. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º A celebração dos projetos de PDIL estará sujeita à prévia disponibilidade orçamentária de recursos do orçamento da União, destinados ao Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º Os instrumentos firmados no âmbito do PDIL, conforme o caput deste artigo, deverão observar os requisitos, as regras, os procedimentos e as penalidades previstas na legislação vigente. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 3º Sem prejuízo do caput, é facultado ao Ministério da Saúde, contratar durante o período de até dez anos, contados da finalização da solução, o fornecimento de tecnologias ou produtos resultantes do PDIL, cumpridas as etapas e exigências preconizadas no art. 23 deste Anexo. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 4º A contratação de que trata o § 3º deverá considerar a demanda do SUS e os princípios da economicidade e da vantajosidade, ficando condicionada aos requisitos, regras e procedimentos previstos na legislação pertinente. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 6º A proposta de projeto deverá ser elaborada considerando os desafios em saúde e as soluções produtivas e tecnológicas para o SUS, constantes na Matriz de Desafios Produtivos e Tecnológicos em Saúde, e apresentada em conformidade com o modelo disponibilizado no sítio eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º Não serão analisadas as propostas de projetos de PDIL recebidas fora do prazo estabelecido. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º O período de submissão de propostas será divulgado pelo Ministério da Saúde em seu sítio eletrônico oficial, com antecedência mínima de trinta dias corridos do prazo final de submissão. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 3º A proposta de projeto submetida deverá ter como objeto a tecnologia ou o produto a ser desenvolvido ou em desenvolvimento, em aderência às plataformas tecnológicas ou aos produtos constantes como soluções na Matriz de Desafios Produtivos e Tecnológicos em Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 4º Após o encerramento do prazo de recebimento das propostas não será admitida a retificação de propostas ou a apresentação de informações adicionais, ressalvados os casos em que haja solicitação de esclarecimentos pelas instâncias colegiadas de avaliação e deliberação, nos termos do § 3º do art. 11. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 5º A proposta de projeto de PDIL será submetida por meio disponibilizado pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 6º As informações constantes nas propostas de projetos de PDIL revestem-se de sigilo industrial e comercial, conforme art. 22 da Lei nº 12.527, de 18 de novembro de 2011, e outras legislações vigentes. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 7º Quaisquer informações adicionais relativas ao sigilo da proposta devem ser informadas pelo proponente no ato da submissão. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 7º As propostas de projetos deverão ser submetidas por instituição pública, ICT ou entidade privada sem fins lucrativos. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Parágrafo único. O proponente previsto no caput poderá estabelecer alianças estratégicas em saúde em cooperação com outras instituições públicas, ICTs ou entidades privadas sem fins lucrativos, empresas públicas ou privadas e startups. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 8º O proponente deverá apresentar os seguintes elementos na proposta de projeto: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - identificação da proponente; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - identificação dos parceiros na aliança estratégica em saúde, quando couber; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - objeto do projeto descrevendo a tecnologia ou o produto a ser desenvolvido ou em desenvolvimento em aderência às soluções da Matriz de Desafios Produtivos e Tecnológicos em Saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - objetivos, as metas e os indicadores de avaliação do projeto; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
V - justificativa do projeto, incluindo escolha da tecnologia e benefício clínico ou para o sistema de saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VI - comprovação do nível de maturidade tecnológica; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VII - cronograma de execução das etapas do projeto contendo a indicação de como se dará a comprovação do cumprimento de cada etapa de desenvolvimento tecnológico e o plano detalhado de aplicação dos recursos; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VIII - as contrapartidas para o SUS, que poderão compreender e não se limitando a: cotitularidade da propriedade intelectual para o Ministério da Saúde ou para a instituição pública; percepção de direitos econômicos; transferência de tecnologia e de conhecimento; ou gratuidade de serviços ou produtos; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IX - programa de governança, profissionalização e integridade da proponente; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
X - impactos social, econômico, territorial, tecnológico da tecnologia em saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
XI - iniciativas e ações de sustentabilidade ambiental; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
XII - políticas antirracistas, de igualdade de gênero e de promoção da diversidade; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
XIII - plano de gerenciamento de risco. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Parágrafo único. Somente serão aceitos os projetos que contenham contrapartidas, na forma do inciso VIII do caput deste artigo, que garantam a disponibilidade da tecnologia para o SUS em caso de êxito no seu desenvolvimento. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 9º Caberá à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, por meio do Departamento do Complexo Econômico-Industrial da Saúde e Inovação para o SUS, gerir o PDIL no âmbito do Ministério da Saúde, devendo, entre outras atribuições: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - providenciar o recebimento das propostas de projetos, segundo cronograma previamente definido e publicado no sítio eletrônico oficial da Pasta; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - realizar a apreciação prévia das propostas de projetos de desenvolvimento e inovação local submetidos ao PDIL, inclusive quanto ao cumprimento dos requisitos previstos no art. 8º deste Anexo; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - definir o instrumento jurídico adequado à proposta nos termos do art. 5º deste Anexo; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - proceder à análise técnico-econômica do plano detalhado de aplicação para a realização de investimentos de acordo com o instrumentos definido conforme inciso III; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
V - propor ajustes para atingir os objetivos traçados; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VI - instruir o processo administrativo para análise e avaliação pela Comissão Técnica de Avaliação - CTA e pelo Comitê Deliberativo - CD; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VII - instruir o processo recursal. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º O Departamento do Complexo Econômico-Industrial da Saúde e Inovação para o SUS poderá convidar para participar da avaliação das propostas de projetos: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - profissionais de notório saber na matéria; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - especialistas de outros órgãos e entidades da administração pública; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - representantes de outros departamentos da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - representantes de outras secretarias do Ministério da Saúde, indicados pelos membros da Comissão Consultiva Permanente para o Complexo Econômico-Industrial da Saúde - CPCEIS. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º As pessoas convidadas para participar da avaliação das propostas de projetos, conforme previsto no § 1º deste artigo, deverão firmar termo de confidencialidade e declarar eventual conflito de interesse relativo às propostas de projeto, seu proponente ou aos parceiros da aliança estratégica em saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 10. Após a apreciação prévia pelo Departamento do Complexo Econômico-Industrial da Saúde e Inovação para o SUS, a CTA instituída no âmbito do Complexo Econômico-Industrial da Saúde, realizará a análise e a avaliação das propostas de projetos habilitadas, elaborando parecer para deliberação pelo CD. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 11. O proponente e demais parceiros da aliança estratégica em saúde poderão ser convocadas pela Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde para apresentação oral da proposta de projeto de PDIL perante a CTA, ficando facultada a presença dos membros do CD. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deve definir cronograma de apresentação oral, resguardando o compromisso dos participantes com o sigilo das propostas. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º No caso da apresentação oral de que trata o caput, as informações prestadas não podem ser divergentes daquelas apresentadas na proposta de projeto de PDIL. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 3º A CTA, durante a apresentação oral das propostas de projetos de PDIL, poderá solicitar esclarecimentos e ajustes adicionais referentes à proposta apresentada. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 12. Após análise, as propostas serão avaliadas em duas etapas: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - quanto ao mérito, sendo eliminadas as que não obtiverem nota mínima prevista no regimento interno do CD ou que não cumprirem os requisitos do art. 8º; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - classificatória. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º Cabe à CTA emitir parecer com recomendação de análise de mérito e classificação das propostas de projeto para submissão ao CD. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º Os critérios das avaliações de que trata o caput deverão ser ponderados pela CTA, conforme disposto em seu regimento interno, para deliberação pelo CD. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 13. São critérios para avaliação do mérito da proposta de projeto de PDIL: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - adequação do cronograma de execução das etapas do projeto e plano detalhado de aplicação dos recursos; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - capacidade tecnológica e produtiva da proponente e dos parceiros para execução da proposta de projeto, considerando as capacitações existentes e os investimentos previstos pelos parceiros; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - disponibilidade de recursos humanos qualificados para a execução do projeto, considerando as capacitações existentes e os investimentos previstos pelos parceiros; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - caráter inovador, benefício clínico ou benefício para o sistema de saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
V - relevância das contrapartidas para o SUS; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VI - previsão de outras fontes de recursos para viabilizar o projeto; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VII - razoabilidade técnica-econômica do plano detalhado de aplicação. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 14. As propostas de projetos de PDIL serão classificadas de acordo com os seguintes critérios: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - competência e experiência dos parceiros na inserção de tecnologias ou produtos inseridos no mercado, incluindo os investimentos em andamento; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - experiência dos parceiros com a incorporação de produtos ao SUS, quando couber, incluindo os investimentos em andamento na gestão tecnológica em saúde; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - maior nível de maturidade tecnológico; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - propostas de projetos que já foram apoiadas pelo Ministério da Saúde ou por outros órgãos da administração pública, em etapas anteriores de desenvolvimento tecnológico; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
V - propostas de projetos que contribuam para a ampliação da capacidade tecnológica e de inovação para atendimento ao Programa para Preparação em Vacinas, Soros e Hemoderivados - PPVACSH ou ao Programa de Produção e Desenvolvimento Tecnológico para Populações e Doenças Negligenciadas - PPDN; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VI - competência e experiência da proponente e dos parceiros no desenvolvimento de solução produtiva e tecnológica vinculada ao tema específico das propostas de projetos; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
VII - impactos social, econômico, territorial, tecnológico e ambiental da tecnologia em saúde e eventuais ações que possam potencializar os impactos positivos ou mitigar os impactos negativos. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 15. Após recebimento do processo instruído com o parecer técnico da CTA, o CD deverá fazer a deliberação quanto à aprovação ou à reprovação das propostas e respectiva classificação, conforme disposto neste Anexo e em seu regimento interno. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 16. O resultado da avaliação das propostas de projetos deverá ser divulgado no sítio eletrônico do Ministério da Saúde em até trinta dias após deliberação do CD. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Parágrafo único. Os documentos relacionados ao processo administrativo de análise, avaliação e deliberação serão encaminhados aos proponentes. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 17. É facultado ao proponente a interposição de recurso administrativo, contra o resultado da seleção da proposta de projeto do PDIL, com fundamento em razões de legalidade e de mérito, dirigido à Ministra de Estado da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º O recurso administrativo de que trata o caput deverá ser interposto pelo proponente, no prazo de até dez dias corridos, contados a partir da publicação do resultado da decisão sobre a aprovação ou não da proposta de projeto do PDIL. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º A instrução do processo para o juízo de admissibilidade previsto no caput será realizada pela Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 18. O recurso administrativo admitido, após instrução do processo, deverá ser encaminhado pela Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde à Comissão Técnica de Avaliação Recursal - CTA Recursal, constituída por meio de ato da Ministra de Estado da Saúde, para análise do mérito do recurso no prazo de trinta dias corridos, prorrogáveis por igual período, contados a partir do recebimento do processo. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Parágrafo único. A CTA Recursal deverá avaliar, conforme seu regimento interno, o mérito do recurso conforme solicitação do proponente e emitir parecer quanto ao seu eventual provimento. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 19. Os pareceres exarados pela CTA Recursal deverão ser encaminhados ao CD para deliberação quanto ao provimento ou não dos recursos interpostos, conforme disposto em seu regimento interno. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 20. O recurso e os pareceres exarados poderão ser encaminhados à Consultoria Jurídica junto ao Ministério da Saúde para elaboração de manifestação jurídica, a fim de subsidiar a decisão final da Ministra de Estado da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 21. O resultado dos recursos administrativos que receberam provimento pela Ministra de Estado da Saúde e a relação dos projetos aprovados serão publicizados no Diário Oficial da União - DOU e no sítio eletrônico do Ministério da Saúde em até trinta dias corridos, prorrogáveis por igual período, a contar da data da decisão final da Ministra de Estado da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 22. Os projetos de PDIL aprovados deverão ser formalizados por meio da assinatura de instrumento jurídico específico em uma das modalidades previstas no art. 5º deste Anexo, subscrito pelo(s) representante(s) legal(is) do proponente e pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Parágrafo único. O extrato do instrumento firmado deverá ser publicado pelo Ministério da Saúde no DOU e divulgado no sítio eletrônico oficial. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 23. O Departamento do Complexo Econômico-Industrial e de Inovação para o SUS deverá realizar o monitoramento e a avaliação dos resultados dos projetos quanto: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - ao processo de desenvolvimento da tecnologia, de acordo com as etapas previstas no projeto; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - à etapa regulatória a ser cumprida junto às autoridades competentes, em conformidade com a especificidade da tecnologia; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - à capacidade de produção local da tecnologia ou produto para o SUS; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - à incorporação no SUS. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 1º Os projetos apoiados no âmbito do PDIL serão monitorados por meio dos seguintes instrumentos e ações, entre outros: (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
I - análise dos relatórios situacionais; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
II - análise dos relatórios de prestação de contas; (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
III - visitas técnicas in loco, quando pertinentes, para acompanhamento do desenvolvimento do projeto; e (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
IV - análise de quaisquer outros produtos ou entregas relativas à condução do projeto com vista à incorporação no SUS, a interesse da administração pública. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 2º Incumbe à área técnica do Ministério da Saúde responsável pelo financiamento definir, no instrumento respectivo, a periodicidade do monitoramento do projeto apoiado, de acordo com a sua complexidade, sendo necessária a emissão de documento técnico de monitoramento, bem como a definição da frequência da realização de visitas técnicas, se for o caso. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
§ 3º Para fins de cumprimento do disposto no caput deste artigo, o Departamento do Complexo Econômico-Industrial da Saúde e de Inovação para o SUS poderá consultar a Agência Nacional de Vigilância Sanitária - ANVISA e a Comissão Nacional de Incorporação de Saúde - CONITEC sobre questões atinentes às suas respectivas competências. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 24. Os resultados dos projetos sujeitos à propriedade intelectual serão regidos de acordo com a legislação vigente. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 25. Os produtos oriundos do PDIL poderão ser priorizados nas etapas de registro e de análise de incorporação no SUS junto aos órgãos competentes. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 26. Na hipótese de identificação de malversação de recurso público, ocorrida com dolo, fraude ou erro grosseiro, o proponente responderá pelo respectivo ressarcimento, sem prejuízo da suspensão de repasses futuros, restituição ao erário dos investimentos realizados pelo Ministério da Saúde, suspensão temporária de participação em novas rodadas de submissão de propostas no âmbito do PDIL ou de impedimento de licitar e contratar no âmbito da administração federal e de outras sanções legais eventualmente cabíveis. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Art. 27. A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde poderá disponibilizar orientações para a submissão das propostas de projetos no âmbito do PDIL em guias e manuais operacionais. (Redação dada pela PRT GM/MS n° 4.473 de 20.06.2024)
Anexo CX
DO PROGRAMA DE PARCERIAS PARA O DESENVOLVIMENTO PRODUTIVO - PDP
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 1º Fica instituído o Programa de Parcerias para o Desenvolvimento Produtivo - PDP, que tem por objetivo orientar o esforço nacional de investimento em inovação e produção, público e privado, por meio de transferências tecnológicas de produtos estratégicos para a redução da vulnerabilidade do Sistema Único da Saúde - SUS e ampliação do acesso à saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 2º Para efeito deste Anexo, são adotadas as seguintes definições: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - arranjo produtivo e tecnológico: arranjo entre os parceiros da PDP, com possibilidade de participação de Entidade Privada - EP, Instituição Pública - IP ou Instituição Científica, Tecnológica e de Inovação - ICT, que contemple as responsabilidades de cada parte, especialmente quanto a produção nacional do Insumo Farmacêutico Ativo - IFA, Componente Tecnológico Crítico - CTC ou Dispositivo Tecnológico - DT e do produto objeto da parceria, sob liderança de IP ou ICT, sozinhas ou conjuntamente, na forma do art. 5º, visando a absorção por estas das competências tecnológicas associadas à solução produtiva; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - Comissão Técnica de Avaliação - CTA: instância colegiada instituída no âmbito do Complexo Econômico-Industrial da Saúde - Ceis, que tem dentre suas atribuições a de analisar e avaliar as PDP em suas diferentes fases; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - Comitê Deliberativo - CD: instância colegiada instituída no âmbito do Ceis, de caráter deliberativo, cujo assessoramento técnico é prestado pela CTA; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - Comitê Técnico Regulatório: instância de orientação em relação aos aspectos regulatório-sanitários referentes a tecnologias e produtos de interesse para o SUS instituída no âmbito da ANVISA; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - Componente Tecnológico Crítico - CTC: insumo, produto ou processo da cadeia produtiva, cujo domínio produtivo e tecnológico seja relevante para o país; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - desafios em saúde para o SUS: problemas em saúde, doenças e agravos previstos na Matriz de Desafios Produtivos e Tecnológicos em Saúde, estabelecida por ato da Ministra da Saúde, e priorizados em razão de vulnerabilidades tecnológicas e produtivas ou impacto econômico que afetem o acesso à saúde ou a sustentabilidade do SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - Dispositivo Tecnológico - DT: dispositivo associado à forma farmacêutica, requerido para a utilização da tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - entidade detentora ou desenvolvedora do insumo farmacêutico ativo - IFA ou do DT associado à forma farmacêutica: pessoa jurídica de direito público ou privado, nacional ou internacional, que detenha a tecnologia ou seja responsável pelo desenvolvimento nacional e produção local do IFA, ou do DT associado à forma farmacêutica, quando aplicável; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - Entidade Privada - EP: pessoa jurídica de direito privado, nacional ou internacional que tenha responsabilidade definida no processo de transferência de tecnologia para a produção local, podendo, simultaneamente, atuar como receptora e transferidora da tecnologia em um mesmo projeto de PDP, conforme arranjo produtivo estabelecido; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - Entidade Receptora da Tecnologia: IP, ICT ou EP responsável pela absorção da tecnologia e produção local; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - Entidade Transferidora da Tecnologia: pessoa jurídica de direito público ou privado, nacional ou internacional, desenvolvedora ou detentora da tecnologia e que seja responsável pela transferência de tecnologia para produção local; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - Instituição Científica, Tecnológica e de Inovação - ICT: órgão ou entidade da administração pública direta ou indireta ou pessoa jurídica de direito privado sem fins lucrativos legalmente constituída sob as leis brasileiras, com sede e foro no País, que inclua em sua missão institucional ou em seu objetivo social ou estatutário a pesquisa básica ou aplicada de caráter científico ou tecnológico ou o desenvolvimento de novos produtos, serviços ou processos; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIII - Instituição Pública - IP: órgão ou entidade da Administração Pública, Direta ou Indireta, de esfera federal, estadual, municipal ou distrital, que atue em pesquisa, desenvolvimento ou produção local; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIV - Insumo Farmacêutico Ativo - IFA: qualquer substância introduzida na formulação de uma forma farmacêutica que, quando administrada em um paciente, atua como ingrediente ativo, podendo exercer atividade farmacológica ou outro efeito direto no diagnóstico, cura, tratamento ou prevenção de uma doença, podendo ainda afetar a estrutura e funcionamento do organismo humano;
XV - internalização da tecnologia: absorção da tecnologia, de forma que torne a(s) ERT detentoras das competências e habilidades que assegurem a fabricação do(s) produto(s) e IFA/CTC contemplado(s) no Projeto Executivo em território nacional, conforme arranjo produtivo aprovado, e as tornem aptas à portabilidade tecnológica para o atendimento das demandas do SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVI - Núcleo Tecnológico: conjunto de conhecimentos tecnológicos que capacita seu detentor a reproduzir, desenvolver, aprimorar e transferir a tecnologia dos produtos objetos de PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVII - Parcerias para o Desenvolvimento Produtivo - PDP: parcerias que envolvem a cooperação mediante acordo entre instituição(ões) pública(s) e/ou ICT(s) e entidade(s) privada(s) para desenvolvimento, transferência e absorção de tecnologia, capacitação produtiva e tecnológica do País visando a produção local de tecnologias e produtos estratégicos para atendimento às demandas do SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVIII - plataforma produtiva: linha produtiva instalada, certificada pelo órgão competente e destinada ao processo de fabricação de produtos, intermediários e insumos, constituindo uma estrutura multipropósito ou dedicada a um produto, quando aplicável; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIX - plataforma tecnológica: conjunto de competências tecnológicas ou produtivas especializadas para desenvolvimento ou fabricação de produtos ou serviços tecnológicos afins, resultado de experiência e de conhecimento acumulados; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XX - portabilidade tecnológica: capacidade técnica e gerencial de transferência de determinada tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXI - Projeto Executivo: documento apresentado por IP ou ICT, contendo proposta de projeto de PDP, em acordo com a Subseção I da Seção I do Capítulo IV deste Anexo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXII - soluções produtivas e tecnológicas para o SUS: plataformas, rotas, produtos ou serviços tecnológicos necessários para execução de políticas públicas, ações, medidas, mecanismos, iniciativas e programas nacionais de promoção, prevenção, diagnóstico, tratamento e reabilitação da saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXIII - Tecnologias Digitais de Informação e Conectividade: desenvolvimento, inovação e produção de ferramentas que facilitem a comunicação, processamento e transmissão de informações por meio eletrônico com o propósito de melhorar a saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXIV - Termo de Compromisso: ajuste firmado entre o Ministério da Saúde, IP/ICT e parceiros da PDP, que visa o estabelecimento da PDP e que contenha, no mínimo, cláusulas de obrigações das partes envolvidas, condições para aquisições do produto objeto da PDP, garantia de produção local, direitos de propriedade intelectual e sanções; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXV - transformação digital: aproveitamento do potencial das tecnologias digitais para promover o desenvolvimento econômico e social sustentável e inclusive, com inovação, aumento de competitividade e de produtividade por meio da digitalização dos processos produtivos e capacitação para o ambiente digital; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXVI - transformação ecológica: transformação de paradigma cultural, político e econômico da organização social da produção baseada no bioma, em prol de relações sustentáveis com o território e a natureza, gerando melhor qualidade de vida para suas populações; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXVII - verticalização: conjunto de etapas, unidades e sistemas produtivos que determinam o grau de internalização da cadeia produtiva do produto objeto de PDP no País. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 3º São objetivos das PDP: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - ampliar o acesso da população brasileira à saúde, por meio do desenvolvimento nacional do Ceis e da absorção de tecnologias, plataformas tecnológicas, insumos estratégicos, serviços e processos produtivos para a redução das vulnerabilidades do SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - utilizar o poder de compra do Estado de forma a promover a produção local para superação dos desafios produtivos e tecnológicos e ampliar o acesso à saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - fortalecer parcerias público privadas em atividades de produção e inovação de produtos, IFA, CTC e DT, para atender as demandas do SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - reduzir as dependências produtiva e tecnológica para atender as necessidades de saúde da população brasileira a curto, médio e longo prazos, seguindo os princípios constitucionais do acesso universal e igualitário às ações e aos serviços de saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - induzir o desenvolvimento científico, tecnológico e produtivo no âmbito do Ceis, estimulando a rede de produção pública e privada no País e suas ações estratégicas para o SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - desenvolver e consolidar plataformas tecnológicas e produtivas no Ceis para promover o desenvolvimento, inovação e fabricação de tecnologias, produtos e serviços estratégicos para o SUS em território nacional e em âmbito regional com países da América Latina e África; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - promover o desenvolvimento e a fabricação em território nacional de tecnologias, insumos farmacêuticos, produtos e serviços estratégicos para o SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - contribuir para a preparação e o enfrentamento de emergências e necessidades de saúde global; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - contribuir para a transformação ecológica e digital do Ceis. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO II
DOS PRODUTOS E SERVIÇOS ELEGÍVEIS PARA PDP
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 4º São elegíveis para PDP as soluções produtivas e tecnológicas para o SUS elencadas na Matriz de Desafios Produtivos e Tecnológicos em Saúde, estabelecida por ato da Ministra da Saúde e que atendam aos seguintes requisitos: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - registro sanitário no país ou perspectiva de submissão do registro em até trinta e seis meses, a partir da data de submissão da proposta de projeto, para objetos de PDP sujeitos à Vigilância Sanitária; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - ausência de restrição patentária que impacte o arranjo proposto ou perda da restrição em até trinta e seis meses, a partir da data de submissão da proposta de projeto; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - aquisição centralizada ou passível de centralização, ou aquisição por meio de programas, medidas, iniciativas e ações específicas coordenadas pelo Ministério da Saúde, no âmbito do Ceis; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - elevada dependência de importações ou previsão de descontinuação do produto no país. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Para efeito do art. 75, incisos XII e XVI da Lei nº 14.133, de 1º de abril de 2021, os produtos da Matriz de Desafios Produtivos e Tecnológicos em Saúde são considerados estratégicos para o SUS. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO III
DOS PARTICIPANTES DA PDP
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 5º Os participantes da PDP poderão ser: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - Instituição Pública - IP - ou Instituição Científica, Tecnológica e de Inovação - ICT proponentes do projeto, individual ou conjuntamente a outras instituições públicas ou ICT; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - Entidade privada - EP desenvolvedora, detentora, transferidora ou receptora da tecnologia, individualmente ou conjuntamente a outras entidades privadas. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A entidade privada nacional poderá, simultaneamente, atuar como receptora e transferidora da tecnologia em um mesmo projeto de PDP, conforme arranjo produtivo estabelecido. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Caso a ICT tenha estrutura tecnológica constituída, em termos de sua capacidade de absorção, desenvolvimento e transferência de tecnologia de produtos e serviços do Ceis, e em acordo com a legislação vigente, a não participação da IP no arranjo produtivo, de forma excepcional, deverá ser justificada. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Para as PDP de Dispositivos Médicos, a proponente poderá associar-se a uma unidade fabril privada no País para fins de produção em escala suficiente para atender à demanda, sendo a IP/ICT considerada a fabricante legal, conforme legislação sanitária vigente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º Organismos internacionais, fundações de apoio ou demais organizações sem fins lucrativos podem fazer parte do projeto, de forma complementar, desde que tenham responsabilidades definidas no arranjo produtivo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 5º As proponentes do projeto devem realizar seleção transparente de parceiros, respeitando os princípios do art. 37 da Constituição Federal de 1988, em particular, os da publicidade, legalidade e moralidade, como também o previsto na Lei nº 14.133, de 2021, na Lei nº 13.303, de 2016, e observando a legislação aplicável à natureza jurídica das instituições proponentes, justificando quando sua realização for inviável. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO IV
DO PROCESSO
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 6º O processo para estabelecimento de PDP abrange as seguintes fases: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - Fase I - proposta de projeto de PDP: fase de submissão da proposta de projeto pela IP/ICT, análise pelo Ministério da Saúde, CTA e CD, e publicação do resultado; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - Fase II - projeto de PDP: fase de preparação para a execução da transferência de tecnologia entre os parceiros, incluindo-se a realização de treinamentos e conclusão do desenvolvimento do produto para a absorção do conhecimento científico e tecnológico envolvido na parceria; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - Fase III - PDP: fase em que há transferência de tecnologia contemplando o processo de internalização da tecnologia e produção e fornecimento do produto objeto de PDP pela IP/ICT, conforme cronograma previamente estabelecido; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - Fase IV - Verificação da Internalização da Tecnologia: fase de verificação da conclusão da transferência e absorção da tecnologia objeto da PDP, conforme previsto no Projeto Executivo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. As fases terão os seguintes marcos temporais: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - Fase I: tem início após a finalização do período de submissão da proposta de projeto e finaliza com a publicação do resultado, no caso de rejeição, ou do extrato do Termo de Compromisso, no caso de aprovação; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - Fase II: tem início com a publicação do extrato do Termo de Compromisso no Diário Oficial da União (DOU), pelo Ministério da Saúde e finaliza com a publicação do instrumento de formalização da primeira aquisição do produto; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - Fase III: tem início com a publicação do instrumento de formalização da primeira aquisição do produto pelo Ministério da Saúde, e finaliza após decorrido o prazo aprovado pelas instâncias colegiadas para internalização da tecnologia; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - Fase IV: tem início imediatamente após o encerramento da Fase III e finaliza com a publicação no Diário Oficial da União - DOU do extrato do termo de deliberação de internalização da tecnologia. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Seção I
Da Proposta de Projeto de PDP - Fase I
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 7º A proposta de projeto de PDP deverá ser elaborada considerando as soluções produtivas e tecnológicas para o SUS e observando os critérios de elegibilidade para PDP e apresentada em conformidade com o modelo disponível no portal eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O período de submissão de propostas será divulgado pelo Ministério da Saúde em seu sítio eletrônico com antecedência mínima de trinta dias do encerramento do prazo respectivo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Não serão analisadas as propostas de projetos de PDP recebidas fora do prazo estabelecido. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Após o encerramento do prazo de recebimento das propostas não será admitida a retificação de propostas ou a apresentação de informações adicionais, ressalvados os casos em que haja solicitação pelas instâncias colegiadas de avaliação e deliberação, nos termos do art. 14, §3º. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º Os parceiros do projeto de PDP podem solicitar esclarecimentos à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde em relação aos procedimentos para elaboração da proposta em qualquer tempo, exceto durante o período de análise das propostas e de recursos administrativos pelas instâncias colegiadas de avaliação e deliberação. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Subseção I
Das Diretrizes e dos Requisitos para a Elaboração de Proposta de Projeto de PDP
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 8º A proposta de projeto de PDP deverá dispor, no mínimo, sobre os seguintes elementos: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - objeto, de acordo com as soluções produtivas e tecnológicas para o SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - parceiros envolvidos, suas qualificações para a execução da proposta e o modo de sua seleção; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - arranjo produtivo e tecnológico; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - identificação das etapas do processo produtivo, com a previsão de quais serão internalizadas e executadas por cada ERT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - propriedade intelectual, contratos de exclusividade ou acordos comerciais, incluindo informações sobre a eventual existência de acordos ou outras restrições para o licenciamento ou acesso à tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - registro e certificação do produto objeto da PDP, caso sujeito à Vigilância Sanitária; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - cronograma das Fases II e III; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - processo de produção; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - planejamento de capacitação técnico-operacional; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - internalização da tecnologia pela ERT, incluindo as competências tecnológicas; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - estimativa de preço; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - capacidade econômico-financeira para ofertar o produto e internalizar a tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIII - investimentos, incluindo a necessidade de construção, reforma, ampliação ou adequação regulatória de instalações produtivas de todos os parceiros; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIV - plano de gerenciamento de riscos; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XV - produção local de insumos da cadeia de suprimentos, além do produto IFA/CTC/DT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVI - impactos científicos, tecnológicos, sociais, econômicos e territoriais; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVII - programa de governança, profissionalização e integridade; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVIII - iniciativas e ações de sustentabilidade ambiental; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIX - políticas antirracistas, de igualdade de gênero e de promoção da diversidade. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O cronograma da Fase II e da Fase III deverá ser proposto de acordo com a complexidade tecnológica, respeitando os limites de três anos e dez anos respectivamente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Para as PDP de Dispositivos Médicos o prazo da Fase III será de, no máximo, cinco anos, podendo ser estendido por mais cinco anos nos casos em que houver previsão, no Projeto Executivo, de inovações incrementais com foco no ganho terapêutico ou diagnóstico. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º A proponente deverá justificar o preço proposto considerando o valor do produto e da tecnologia. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º Os preços propostos deverão ser compatíveis com os praticados em contratações realizadas no âmbito do SUS anteriormente à celebração da parceria, em pesquisa de preço feita nos termos da legislação federal pertinente, e, quando couber, os preços de mercados internacionais dos países contemplados pela Câmara de Regulação do Mercado de Medicamentos - CMED, considerando os princípios da economicidade e da vantajosidade. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 5º No caso de produtos não incorporados, para submissão do projeto executivo poderão ser considerados os preços de mercados internacionais dos países contemplados pela CMED, devendo haver, após a incorporação, o ajuste dos valores para que sejam compatíveis com os preços de aquisição no âmbito do SUS, obtidos na forma do § 4º. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 6º Os preços deverão ser decrescentes ao longo da Fase III, de acordo com a complexidade tecnológica. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 7º A proposta de projeto de PDP deverá apresentar estimativa de preço e capacidade de oferta do produto com IFA/CTC/DT importado e nacional, devendo ser apresentado separadamente o valor do IFA importado e nacional na composição do preço; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 8º A proposta de projeto de PDP deverá apresentar estudo de viabilidade técnico-econômico e indicação de capacidade produtiva viável para o produto objeto da PDP, bem como IFA, CTC, DT. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 9º Os representantes legais dos parceiros da PDP deverão firmar declaração conjunta de concordância com todos os termos da proposta de projeto apresentada, a qual deverá constar, obrigatoriamente, a relação de documentos que compõem a referida proposta. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 9º A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde divulgará guia para elaboração e submissão de proposta de projeto de PDP no portal eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Subseção II
Das Competências Tecnológicas
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 10. A proposta de projeto deverá contemplar o acesso integral ao conhecimento e à tecnologia de produção detalhada do produto objeto de PDP pela(s) ERT, incluindo-se, dentre outros, métodos analíticos, processos, especificações de insumos essenciais e de equipamentos críticos, e todo o suporte técnico necessário à absorção, reprodutibilidade e domínio tecnológico para a internalização da tecnologia e produção nacional, conforme Projeto Executivo aprovado. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º É obrigatória a apresentação do grau de verticalização nacional do IFA/CTC/DT que está sendo proposto, acompanhado de estudo de viabilidade técnico-econômico e indicação de capacidade produtiva viável para cada intermediário e para o IFA/CTC/DT. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Os casos de inviabilidade de produção local ou regional de algum dos intermediários da cadeia produtiva devem ser justificados a fim de que possam ser avaliados pela CTA e pelo CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Para produtos biotecnológicos, é obrigatória a previsão da transferência e do acesso irrestrito ao Banco de Células Mestre - BCM, ou equivalente, para IP/ICT/ERT, em quantidade suficiente para assegurar a transferência dos conhecimentos tecnológicos requeridos para produção do Banco de Células de Trabalho - BCT, ou equivalente, incluindo insumos e tecnologias críticas que garantam a integralidade da produção nacional pela IP/ICT/ERT, informando-se a quantidade e a previsão de autonomia, em número de lotes. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º Para Tecnologias Digitais de Informação e Conectividade, o projeto proposto deverá contemplar o domínio do núcleo tecnológico. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 5º Para produtos de síntese química e síntese mista, o projeto deverá contemplar a verticalização nacional de etapas produtivas significativas para o parque produtivo nacional farmoquímico e a garantia de acesso da IP/ICT/ERT ao conhecimento tecnológico, incluindo-se o Arquivo Mestre da Droga (AMD). (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 6º Os arranjos produtivos propostos poderão envolver parceiros no âmbito da América Latina e África para fortalecer a cadeia produtiva regional. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Subseção III
Da Submissão e Avaliação da Proposta de Projeto de PDP
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 11. As propostas de projetos de PDP deverão ser submetidas por meio disponibilizado pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º As propostas apresentadas na forma do caput serão autuadas no Sistema Eletrônico de Informações - SEI pela Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º As informações constantes nas propostas de projetos de PDP revestem-se de sigilo industrial e comercial, nos termos do art. 22 da Lei nº 12.527, de 18 de novembro de 2011. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Quaisquer informações adicionais relativas ao sigilo da proposta devem ser informadas e justificadas pela proponente no ato da submissão. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 12. As propostas de projeto de PDP submetidas em desacordo com o disposto no Capítulo II deste Anexo, com o prazo de submissão ou com o modelo estabelecido pelo Ministério da Saúde não serão recebidas ou encaminhadas para análise pelas instâncias colegiadas. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá formalizar ao proponente o não enquadramento da proposta ao rito estabelecido por este Anexo, na forma do caput. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 13. A análise e avaliação das propostas de projetos de PDP regularmente recebidas será realizada pela Comissão Técnica de Avaliação - CTA e pelo Comitê Deliberativo - CD, instituídos no âmbito do Complexo Econômico-Industrial da Saúde - Ceis. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A análise e avaliação das propostas de projeto será agrupada a partir dos desafios em saúde, conforme definidos na Matriz de Desafios Produtivos e Tecnológicos em Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Os regimentos internos da CTA e do CD deverão definir, em caráter complementar, os ritos, prazos, documentação e metodologia a serem utilizados para ponderação dos critérios de análise e competências no processo de avaliação e decisão relativos às PDP, observado o disposto neste anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Caberá à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde a instrução do processo administrativo da proposta de projeto de PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 14. A IP/ICT e EP deverão ser convocadas pela Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde para apresentação oral da proposta de projeto de PDP perante a CTA e, sendo facultativa a presença dos membros do CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá definir cronograma de apresentação, resguardando o sigilo das propostas. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º No caso da apresentação oral de que trata o caput, as informações prestadas não poderão ser divergentes daquelas apresentadas no Projeto Executivo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Durante a apresentação oral das propostas de projetos de PDP, a CTA poderá solicitar esclarecimentos adicionais aos parceiros da Proposta de Projeto de PDP referentes à proposta apresentada, os quais deverão constar em ata ou em relatório de análise. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 15. Após análise, as propostas serão avaliadas em duas etapas: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - quanto ao mérito, sendo eliminadas as que não obtiverem nota mínima prevista no regimento interno da CTA; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - classificatória. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º Cabe à CTA emitir parecer com recomendação de análise de mérito e classificação das propostas de projeto de PDP para submissão ao CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Os critérios das avaliações de que trata o caput deverão ser ponderados pela CTA, conforme disposto em seu regimento interno, para deliberação pelo CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 16. A avaliação de mérito da proposta de projeto de PDP deverá considerar os seguintes critérios: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - adequação do cronograma à complexidade da tecnologia envolvida e aos requisitos regulatórios e sanitários; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - previsão de internalização da tecnologia, considerando: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
a) internalização da tecnologia com produção nacional; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
b) produção nacional do IFA, CTC ou DT associado à forma farmacêutica. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - capacidade produtiva e tecnológica da instituição proponente e das empresas parceiras; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - racionalidade dos investimentos previstos, com indicação da fonte, cronograma compatível com a evolução das atividades e com a necessidade dos recursos; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - projeção de economia gerada para o SUS nas aquisições do produto objeto da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - programa de governança, profissionalização e integridade; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - políticas antirracistas, de igualdade de gênero e de promoção da diversidade; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - disponibilidade de recursos humanos para a viabilização do projeto; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - contribuição para outros mercados, de forma adicional, especialmente voltados à saúde global, após atendida a demanda do SUS; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - contribuição para fortalecimento da cadeia de suprimento local. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 17. Os seguintes critérios deverão ser utilizados para classificar as propostas de projetos de PDP: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - menor prazo para internalização da tecnologia e produção pela IP/ICT, conforme arranjo produtivo proposto; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - histórico de internalização de produtos objeto de PDP ao portfólio da IP/ICT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - previsão de investimento público para execução da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - investimentos aplicados pela entidade privada para execução da PDP que contribuam para o desenvolvimento regional ou nacional; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - disponibilidade das plataformas tecnológicas, produtivas certificadas e compatíveis com o projeto proposto e atividades executadas pela proponente; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - menor proposta de preço global, considerando preço inicial, representatividade da escala decrescente dos valores e a viabilidade do projeto; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - apresentação de soluções produtivas e tecnológicas para o SUS adicionais à transferência de tecnologia, com sinergia para tecnologias futuras; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - menor prazo para produção com IFA, CTC ou DT nacional; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - alinhamento ao Programa de Produção e Desenvolvimento Tecnológico para Populações e Doenças Negligenciadas - PPDN - ou Programa para Preparação em Vacinas, Soros e Hemoderivados - PPVACSH; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - desenvolvimento tecnológico realizado, integral ou parcialmente, no País, com aporte de recurso público; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - impactos científicos, tecnológicos, sociais, econômicos, territoriais e ambientais; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - grau de verticalização de etapas produtivas do(s) IFA, CTC ou DT associado(s) à forma farmacêutica para o parque fabril nacional. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 18. Emitida recomendação pela CTA, o CD deverá deliberar quanto à aprovação ou à reprovação das propostas, conforme disposto em seu regimento interno. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 19. No caso de viabilidade de mais de uma proposta de projeto de PDP para o mesmo produto, a demanda do Ministério da Saúde poderá ser dividida conforme critérios estabelecidos pelo CD dispostos em seu regimento interno. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 20. O resultado preliminar da avaliação das propostas de projetos de PDP deverá ser divulgado no portal eletrônico do Ministério da Saúde, em até trinta dias após deliberação pelo CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Os documentos relacionados ao processo administrativo de avaliação e deliberação e monitoramento serão encaminhados aos parceiros da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Subseção IV
Dos Recursos
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 20. É facultado ao proponente a interposição de recurso administrativo em face ao resultado da avaliação da proposta de projeto de PDP, com fundamento em razões de legalidade e de mérito, dirigido à Ministra de Estado da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. O recurso administrativo de que trata o caput deverá ser interposto pelo proponente, no prazo de dez dias corridos, contados a partir da publicação do resultado da avaliação da proposta de projeto de PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 21. O recurso administrativo deverá ser encaminhado à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde para instrução do processo e posterior envio à CTA recursal, constituída por meio de ato da Ministra de Estado da Saúde, para análise do mérito do recurso, no prazo de trinta dias, prorrogáveis por igual período. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 22. A CTA recursal deverá avaliar o mérito do recurso conforme solicitação da proponente e emitir parecer quanto ao seu eventual provimento. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. A recomendação de provimento de recurso administrativo deve incluir sugestão de reclassificação das propostas. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 23. Após recebimento do processo de que trata o art. 22, o CD deverá deliberar quanto ao provimento ou não do recurso, conforme disposto em seu regimento interno. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Deferido o recurso, além da aprovação de nova classificação, poderá o CD realizar nova divisão da demanda do Ministério da Saúde, seguindo os critérios previstos no seu regimento interno. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 24. O recurso e os pareceres exarados poderão ser encaminhados para a Consultoria Jurídica para elaboração de manifestação jurídica, a fim de subsidiar a decisão final da Ministra de Estado da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 25. A divulgação do resultado final dos recursos administrativos que receberam provimento pela Ministra de Estado da Saúde ocorrerá pelo portal eletrônico do Ministério da Saúde no prazo de trinta dias contados a partir da decisão, prorrogáveis por igual período. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Subseção VI
Dos Resultados
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 26. O Ministério da Saúde deverá divulgar o resultado final da avaliação das propostas de projetos de PDP por meio de Portaria publicada no DOU e no portal eletrônico do Ministério. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. A motivação da rejeição das propostas de projeto de PDP que não forem aprovadas deverá ser divulgada no portal eletrônico do Ministério da Saúde, em até trinta dias da divulgação do resultado no DOU. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 27. Os projetos de PDP aprovados deverão ser formalizados por meio da assinatura do Termo de Compromisso subscrito pelos representantes legais dos parceiros da PDP e pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º Após assinatura do termo de compromisso, a Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde enviará cópia do termo aos parceiros da PDP e à ANVISA. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Os projetos de PDP para o mesmo produto deverão ter Termo de Compromisso distintos e deverão ser monitorados individualmente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 28. O extrato do Termo de Compromisso relativo à proposta de projeto de PDP aprovada deverá ser publicado pelo Ministério da Saúde no DOU e ser mantido no seu portal eletrônico em local de fácil acesso dedicado a informações sobre PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 29. A aprovação das propostas de projeto de PDP não vincula o Ministério da Saúde à obrigação do financiamento das demandas de investimentos que porventura possam ser identificadas pelas proponentes, incluindo despesas de custeio para execução dos projetos. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Seção II
Do Projeto de PDP - Fase II
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 30. Os parceiros da PDP deverão firmar acordo que estabeleça mecanismos de execução conjunta, consultas, intercâmbios de informações, documentos e ações com vistas à implementação do projeto de PDP, com observância dos critérios, diretrizes e orientações deste Anexo, sem interveniência do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O proponente deverá publicar extrato do acordo de que trata o caput: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - no DOU, no caso de órgão ou entidade da Administração Pública Federal; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - no Diário Oficial Estadual, Municipal ou Distrital respectivo, no caso de órgão ou entidade da Administração Pública de outra esfera federativa; ou (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - em jornal de grande circulação, no caso de ICT de natureza privada. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A cópia do extrato publicado do acordo firmado entre os parceiros, na forma do § 1º, deverá ser encaminhada ao Ministério da Saúde em até cento e oitenta dias corridos após a publicação do extrato do Termo de Compromisso no DOU. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º O acordo estabelecido deverá prever sanções para caso de descumprimento pelas partes. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 31. O fornecimento de informações e documentos quanto à execução do projeto de PDP para o Ministério da Saúde deverá ser realizado pela IP/ICT. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º Durante a Fase II, a Instituição Pública ou ICT deverá encaminhar relatório de acompanhamento semestral para o Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Os relatórios de acompanhamento deverão ser encaminhados, impreterivelmente, até o último dia útil dos meses de junho e dezembro e seguirão o modelo disponibilizado no portal eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 32. A PDP será automaticamente suspensa após finalização do prazo aprovado para a Fase II, para reavaliação quanto a viabilidade de continuidade do projeto pela CTA e pelo CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. A suspensão não se aplica às PDP que tenham apresentado propostas de alterações do cronograma da Fase II durante o período de vigência e que esteja em processo de análise pela CTA e CD, a qual permanecerá em Fase II até que haja deliberação do CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 33. O contrato de transferência de tecnologia do produto objeto da PDP deverá ser estabelecido entre todos os parceiros da PDP, sem interveniência do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O proponente deverá publicar extrato do contrato de que trata o caput: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - no DOU, no caso de órgão ou entidade da Administração Pública Federal; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - no Diário Oficial Estadual, Municipal ou Distrital respectivo, no caso de órgão ou entidade da Administração Pública e outra esfera federativa; ou (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - em jornal de grande circulação, no caso de ICT de natureza privada. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A apresentação do extrato de publicação do contrato de transferência de tecnologia, na forma do § 1º, ao Ministério da Saúde pela IP/ICT é requisito obrigatório para início da Fase III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º O contrato estabelecido deve prever a transferência integral da tecnologia, conforme previsto no projeto executivo aprovado e suas eventuais alterações, incluindo todas as competências tecnológicas previstas no art. 10 deste Anexo, responsabilidade das partes e sanções para caso de descumprimento, especialmente quanto ao não cumprimento do cronograma previsto. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º O contrato deverá ser compatível com o Termo de Compromisso e a norma de regência da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 5º Antes do início da fase III, os projetos passarão por nova análise da CTA e do CD para revisão dos elementos da PDP, considerando, dentre outros, atualizações de preço e demanda do produto objeto da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Seção III
PDP - Fase III
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 34. São requisitos para o início da Fase III: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - incorporação do produto ao SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - aquisição conforme o art. 4º, inciso III deste Anexo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - registro sanitário do produto objeto da PDP sujeito à Vigilância Sanitária; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - Certificado de Boas Práticas de Fabricação (CBPF) vigente do local de fabricação da IP/ICT ou EP do produto objeto da PDP sujeito à Vigilância Sanitária; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - publicação do extrato do contrato de transferência de tecnologia entre todos os parceiros da PDP; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - apresentação de atualização acerca da propriedade intelectual pelo proponente, na forma do art. 8º, inciso V, evidenciando inexistência de impedimentos para a aquisição do produto pelo Ministério da Saúde no âmbito da parceria. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. O inciso I não é obrigatório para as tecnologias não sujeitas ao processo de incorporação. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 35. Para a primeira aquisição, a titularidade do registro sanitário do produto objeto da PDP sujeito à Vigilância Sanitária poderá ser das ERT ou da ETT, desde que esteja em processo comprovado de desenvolvimento, transferência e absorção de tecnologia, nos termos do incisos XII e XVI do art. 75 da Lei nº 14.133/2021. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º No caso do produto objeto da PDP possuir registro sanitário em nome da ETT, a IP/ICT/ERT deverá dispor de todas as informações técnicas e cópia de inteiro teor do dossiê do referido registro aprovado pela ANVISA e Carta de Adequação de Dossiê de Insumo Farmacêutico Ativo (Cadifa) quando aplicável, assim como a documentação requerida para sua eventual atualização. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A IP/ICT deverá apresentar pedido de registro à ANVISA, em seu nome, do produto objeto da PDP, nos termos da legislação sanitária vigente, no prazo de até cento e vinte dias da primeira aquisição do produto objeto da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º A IP/ICT deverá encaminhar ao Ministério da Saúde a cópia do protocolo da referida documentação apresentada junto à ANVISA em até trinta dias, contados do término do prazo de que trata o § 2º deste artigo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 36. A aquisição do produto objeto de PDP pelo Ministério da Saúde deverá ocorrer somente se cumpridas todas as etapas descritas nas Seções I e II do Capítulo IV deste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. O produto objeto de PDP deverá atender as apresentações, especificações, formas e quantitativos demandados pelo Ministério da Saúde, assim como a regulação sanitária. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 37. Para as PDP referentes ao mesmo produto, a aquisição deverá ser realizada respeitando-se os percentuais estabelecidos para cada PDP, conforme deliberação do Comitê Deliberativo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º Nos casos em que uma PDP atender primeiro os requisitos para a Fase III esta será responsável pelo fornecimento da demanda total do Ministério da Saúde até que as outras PDP atendam aos requisitos para a Fase III e se inicie a divisão de responsabilidades aprovada para cada projeto, condicionada à capacidade de fornecimento e vantajosidade. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Nos casos de aumento do percentual previsto para o período de aquisição da PDP vigente em Fase III, o valor inicialmente previsto deve ser readequado, considerando o ganho de escala. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 38. Após a primeira aquisição do produto objeto de PDP sujeito à Vigilância Sanitária, no âmbito da PDP, o Ministério da Saúde deverá efetuar novas aquisições somente mediante: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - comprovação pelos mecanismos de monitoramento previstos neste Anexo de que a IP/ICT possui o registro sanitário do referido produto junto à ANVISA; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - cumprimento das atividades previstas no cronograma, evidenciando a transferência e absorção de tecnologia, capacitação industrial e tecnológica. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 39. No caso de produtos com PDP em Fase III que cumpram os requisitos estabelecidos neste Anexo o Ministério da Saúde deverá realizar as aquisições no âmbito das parcerias vigentes e em condições de fornecimento. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O Ministério da Saúde não realizará aquisições de produtos com fundamento em PDP suspensas ou extintas ou em desacordo com o projeto executivo aprovado nos termos deste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Caso haja instrumento contratual de aquisição vigente, as obrigações assumidas deverão ser cumpridas pelas partes, respeitando-se o cronograma de entrega estabelecido. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 40. A aquisição do produto objeto da PDP se dará a partir das demandas das Secretarias do Ministério da Saúde responsáveis, e será realizada após análise dos seguintes itens: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - capacidade de atendimento: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
a) verificação da capacidade da IP/ICT de fornecer o produto objeto da PDP nas apresentações, formas farmacêuticas e nas especificações técnicas solicitadas pelo Ministério da Saúde; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
b) verificação das condições técnicas e operacionais da IP/ICT para entregar o produto objeto da PDP nos quantitativos, termos e condições preconizados pelas áreas demandantes do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - demanda do Ministério da Saúde à época de aquisição do produto objeto da PDP; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - preços, economicidade e vantajosidade, considerando as seguintes diretrizes: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
a) na ocorrência de álea extraordinária que impacte em mudanças nas condições econômicas, competitivas e tecnológicas, o preço proposto poderá ser ajustado para manutenção da vantajosidade, economicidade e sustentabilidade da parceria; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
b) o ajuste anual pode considerar a variação de preços médios dos mercados nacional e internacional dos países contemplados pela CMED, e a variação de preços medida pelo índice nacional de preço ao consumidor amplo (IPCA) e pode, no que couber, considerar as normas e critérios adotados pela CMED; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
c) nos casos de aumento do percentual previsto para o período de aquisição, o valor inicialmente previsto deve ser renegociado, considerando o ganho de escala. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Cabe à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, em conjunto com a Secretaria Executiva, o estabelecimento de mecanismos de monitoramento dos preços dos produtos objeto de PDP no mercado, de forma a contribuir na avaliação dos preços de produtos objeto de PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 41. O processo administrativo de aquisição do produto objeto da PDP deverá observar a legislação vigente, bem como conter todas as informações necessárias para comprovação da regularidade da PDP quanto ao desenvolvimento, transferência e absorção da tecnologia. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A aquisição do produto objeto da PDP poderá ser efetuada mediante a celebração de contrato plurianual compatível com o cronograma da PDP contemplando previsão de sanções relacionadas quanto ao descumprimento das responsabilidades definidas no Projeto Executivo e Termo de Compromisso para a etapa referente ao período do contrato. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º O contrato plurianual de que trata o § 1º deve conter cláusulas de sanções em caso de descumprimento das responsabilidades e atividades previstas para o período de vigência do instrumento de aquisição, conforme Projeto Executivo e Termo de Compromisso, respeitando a legislação vigente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 42. As Secretarias do Ministério da Saúde responsáveis pelas aquisições dos produtos objetos de PDP deverão realizar consulta à área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, responsável pelo monitoramento da PDP, quanto ao estágio e à evolução da transferência de tecnologia da PDP, para subsidiar cada processo de aquisição. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 43. A área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, responsável pelo monitoramento da PDP, deverá encaminhar às Secretarias do Ministério da Saúde responsáveis pelas aquisições, os seguintes documentos: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - endereço eletrônico para acesso ao registro sanitário do produto objeto da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - endereço eletrônico para acesso ao CBPF do local de fabricação constante do registro sanitário e/ou da sua publicação no DOU; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - endereço eletrônico para acesso à publicação do extrato do Contrato de Transferência de Tecnologia; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - nota técnica contendo, no mínimo, os seguintes critérios: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
a) parceiros da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
b) objeto da PDP, especificando-se o produto, as apresentações, a forma farmacêutica e as especificações técnicas; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
c) objetivo da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
d) prazo previsto pela IP/ICT para a internalização da tecnologia (duração da Fase III); (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
e) estágio atual da transferência de tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
f) estimativa de preço e capacidade de oferta, conforme disposto no Projeto Executivo; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
g) situação patentária do produto objeto da PDP, incluindo-se o IFA/CTC/DT, quando aplicável. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. As Secretarias do Ministério da Saúde responsáveis pelas aquisições dos produtos, objetos da PDP, poderão requerer à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, caso seja de sua posse ou competência, outras informações e documentos que sejam necessários para a devida instrução do procedimento de aquisição.
Art. 44. Durante a Fase III, a IP/ICT deverá encaminhar relatório de acompanhamento quadrimestral para o Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Os relatórios de acompanhamento deverão ser encaminhados, impreterivelmente, até o último dia útil dos meses relativos a cada quadrimestre da PDP, a contar do início da fase III e seguirão o modelo disponibilizado no portal eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 45. A produção nacional do produto objeto da PDP sujeito à Vigilância Sanitária com IFA, CTC nacional ou DT nacional para fornecimento ao Ministério da Saúde deverá ocorrer durante a Fase III, sob pena de aplicação das sanções previstas no Capítulo VIII. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O fornecimento do produto com IFA/CTC/DT nacional deverá iniciar em até 80% do tempo destinado a Fase III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º É obrigatória a inclusão imediata do IFA/CTC/DT nacional no registro do produto objeto de PDP a partir do desenvolvimento e disponibilidade. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º A submissão da alteração pós-registro para inclusão da IP/ICT, quando cabível, como local de fabricação deverá ocorrer no mínimo doze meses antes da finalização da Fase III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º A fabricação do produto objeto da PDP pela IP/ICT deverá ocorrer na Fase III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 46. Ao final da Fase III, a IP/ICT deverá assegurar a internalização da tecnologia, incluindo as competências tecnológicas, o domínio tecnológico e a produção nacional do produto objeto de PDP, em acordo com arranjo produtivo aprovado. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Seção IV
Verificação da Internalização da Tecnologia - Fase IV
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 47. A Fase IV, em que deverá haver a verificação pelo Ministério da Saúde da internalização da tecnologia pela IP/ICT, inicia-se imediatamente após o término da Fase III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. A Fase IV de que trata o caput tem duração máxima de vinte e quatro meses. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 48. A verificação da internalização da tecnologia deverá contemplar todas as atividades estabelecidas e itens propostos no Projeto Executivo aprovado. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 49. Em até noventa dias após a finalização da Fase III, a IP/ICT deverá encaminhar ao Ministério da Saúde o Relatório de Transferência e Internalização da Tecnologia do produto objeto da PDP contendo documentos que comprovem a internalização da tecnologia e a produção nacional do produto objeto da PDP, com IFA/CTC/DT nacional e o domínio produtivo e tecnológico pela IP/ICT, conforme arranjo produtivo aprovado. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A IP/ICT deverá comprovar ser detentora de registro do produto, fabricante, ou fabricante legal do produto objeto de PDP, de acordo com a legislação sanitária vigente e disposições desse Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º O relatório deverá vir acompanhado de Declaração Conjunta de Conclusão de Transferência e Internalização de Tecnologia assinada por todos os parceiros da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º O relatório deverá seguir o modelo disponibilizado no portal eletrônico do Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 50. Para verificação da internalização da tecnologia in loco, a área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde responsável pelo monitoramento deverá realizar visita técnica às Entidades Transferidoras da Tecnologia), e elaborar o Relatório de Verificação da Transferência e Internalização da Tecnologia. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 51. Após recebimento do Relatório de Transferência e Internalização da Tecnologia de que trata o art. 49 e emissão do Relatório de Verificação da Transferência e Internalização da Tecnologia de que trata o art. 50, a área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde responsável pelo monitoramento da parceria deverá elaborar nota técnica e encaminhar os documentos para análise e manifestação da CTA e do CD, conforme prazos regimentais estabelecidos. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O CD poderá recomendar ao Ministério da Saúde a aplicação de sanções, nos termos do Capítulo VIII deste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º O CD poderá recomendar, quando necessário, período de operação da instituição pública ou ICT assistida pela Entidade Transferidora da Tecnologia visando promover a competitividade da produção pública e dos insumos farmacêuticos ativos após a transferência de tecnologia, observado o prazo definido no parágrafo único do art. 47. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 52. Após avaliação da CTA e deliberação do CD concluindo pela comprovação da internalização da tecnologia, a Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá publicar, no DOU, extrato do termo de deliberação de internalização da tecnologia do produto objeto de PDP, sendo este o marco de encerramento da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Após publicação do extrato do termo de deliberação de internalização da tecnologia do produto objeto de PDP, a parceria será considerada concluída, inclusive para fins de monitoramento. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 53. A instituição pública ou ICT que concluir a PDP de acordo com as metas estabelecidas e cronograma de transferência de tecnologia poderá propor nova PDP na mesma plataforma tecnológica a fim de assegurar a oferta de produtos estratégicos para o SUS e racionalizar os investimentos realizados em plataformas produtivas e tecnológicas. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º O produto proposto deverá cumprir os critérios de elegibilidade para a PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A aprovação da parceria deverá ser avaliada pela CTA e deliberada pelo CD, nos termos definidos neste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 54. Após início da Fase IV, as aquisições de produtos objeto de PDP poderão ser avaliadas de acordo com políticas públicas para a produção local, visando a redução da vulnerabilidade do SUS, nos termos da legislação vigente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO V
DAS RESPONSABILIDADES INSTITUCIONAIS
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 55. O Ministério da Saúde é responsável por: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - elaborar, publicar e atualizar a Matriz de Desafios Produtivos e Tecnológicos em Saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - estimular as IP/ICT a apresentarem propostas de projetos de PDP alinhadas às plataformas tecnológicas do Ceis; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - estimular as EP a participarem das iniciativas que favoreçam o investimento, o desenvolvimento tecnológico, a inovação e a geração de emprego e renda no Brasil; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - receber e analisar as propostas de projeto de PDP (Fase I); (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - participar e fornecer apoio técnico e administrativo para a realização das atividades da CTA e do CD; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - celebrar e formalizar o Termo de Compromisso de cada proposta de projeto de PDP aprovada; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - publicar o extrato do Termo de Compromisso de cada proposta de projeto de PDP aprovada; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - realizar visitas técnicas nas unidades fabris dos parceiros da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - requerer informações e documentos junto à ANVISA, necessários para acompanhamento da PDP, a fim de subsidiar visitas técnicas, reuniões da CTA e do CD; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - organizar e coordenar as reuniões da equipe técnica de monitoramento; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - monitorar e avaliar as parcerias, desde o projeto de PDP (Fase II), até a internalização da tecnologia (Fase IV); (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - elaborar documentos técnicos referentes ao monitoramento das parcerias; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIII - participar das reuniões do Comitê Técnico Regulatório; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIV - realizar as aquisições dos produtos objeto de PDP de Fase III vigentes, de acordo com os critérios e diretrizes estabelecidos neste Anexo;
XV - divulgar, no portal eletrônico do Ministério da Saúde, as informações públicas referentes às PDP, contendo, no mínimo, os seguintes critérios: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
a) leis, decretos, portarias, resoluções e demais instrumentos normativos; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
b) modelos de Projeto Executivo, relatório de acompanhamento e relatório de transferência e internalização da tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
c) propostas de projeto de PDP em análise, aprovadas ou reprovadas; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
d) relação de PDP e seus respectivos estágios; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
e) aquisições de produtos objeto de PDP com endereço para acesso à publicação do ato; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVI - aplicar sanções. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 56. Cabe à Anvisa, na forma da legislação: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - coordenar o Comitê Técnico Regulatório; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - realizar as análises requeridas no âmbito dos projetos de PDP e durante as etapas de execução da PDP em relação ao registro e alteração pós-registro, conforme prazos da legislação vigente; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - priorizar, conforme normativo específico vigente, as análises requeridas dos produtos objeto de PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - apoiar a Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, fornecendo informações técnicas regulatório-sanitárias nas atividades de monitoramento e avaliação do desenvolvimento tecnológico e produtivo dos projetos das PDP para atender aos requisitos sanitários para produção no País; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - participar da CTA. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 57. A IP/ICT proponente e executora da PDP é responsável por: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - elaborar e submeter a proposta de projeto de PDP, conforme modelo do Projeto Executivo, em observância aos critérios, requisitos, diretrizes e orientações deste Anexo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - apresentar, oralmente, a proposta de projeto de PDP, após convite formal do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - demonstrar a capacidade produtiva, os equipamentos e os recursos humanos necessários para execução do projeto de PDP, efetuando as adequações pertinentes para execução da transferência de tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - realizar gerenciamento de risco e estudo de viabilidade técnico-econômica do projeto; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - celebrar o Termo de Compromisso juntamente com o Ministério da Saúde e os demais parceiros da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - celebrar acordos, contratos ou outros instrumentos jurídicos com parceiros do projeto de PDP, seguindo os critérios e orientações deste Anexo e as premissas do Termo de Compromisso celebrado, sem prejuízo do acréscimo de outras condições necessárias ao atendimento do interesse público, em observância à legislação vigente; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - peticionar o dossiê de registro e alterações pós-registro do produto objeto de PDP junto à ANVISA, conforme legislação vigente e cronograma estabelecido; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - solicitar priorização de análise junto à ANVISA, nos termos da legislação vigente; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - encaminhar ao Ministério da Saúde a cópia do protocolo do peticionamento da solicitação de registro do produto objeto de PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - garantir a internalização das competências tecnológicas, conforme arranjo produtivo estabelecido; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - participar ativamente do desenvolvimento do produto objeto de PDP junto à EP, acompanhando todo o ciclo tecnológico e regulatório-sanitário; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - realizar treinamentos para sua equipe, coordenada junto às entidades privadas, a fim de absorver os conhecimentos necessários para a execução da transferência de tecnologia do produto objeto da PDP;
XIII - reunir provas documentais de absorção do conhecimento tecnológico envolvido na parceria; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIV - participar das visitas técnicas na(s) EP parceira(s) nacionais e internacionais, em conjunto com o Ministério da Saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XV - cumprir o cronograma da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVI - enviar à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde relatórios de acompanhamento das PDP vigentes, demostrando as atividades executadas, em andamento e previstas; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVII - apresentar o estágio das PDP vigentes e, quando requerida, documentação comprobatória durante a visita técnica na IP/ICT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVIII - participar das reuniões do Comitê Técnico Regulatório e com a equipe técnica de monitoramento do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIX - celebrar instrumento específico com o Ministério da Saúde para fornecimento de produtos no âmbito da PDP, respeitando a legislação vigente e os termos deste Anexo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XX - garantir o fornecimento e a entrega dos produtos, conforme quantitativo e cronograma previamente pactuados junto ao Ministério da Saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXI - ao final da transferência de tecnologia, ter cumprido as atividades previstas e executado todas as etapas de fabricação do produto objeto da PDP, conforme arranjo produtivo aprovado no Projeto Executivo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXII - elaborar e enviar ao Ministério da Saúde o Relatório de Transferência e Internalização da Tecnologia das PDP em Fase IV; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXIII - firmar a Declaração Conjunta de Concordância aos Termos da Proposta de Projeto Executivo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXIV - apresentar, durante a Fase IV, a Declaração Conjunta de Conclusão de Transferência e Internalização da Tecnologia assinada pelos parceiros da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXV - realizar seleção de parceiros, respeitando os princípios do art. 37 da Constituição Federal de 1988, em particular, os da publicidade, legalidade e moralidade; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XXVI - garantir a transparência do processo seletivo e a integridade dos parceiros selecionados. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A seleção e as relações contratuais com a EP são de inteira responsabilidade da IP/ICT celebrante da PDP, inclusive com relação à sua qualificação e à avaliação da regularidade de sua situação legal e idoneidade. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A IP/ICT deverá apresentar informações adicionais relativas ao sigilo da proposta no ato da submissão, se necessário. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 58. A EP é responsável por: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - participar da elaboração da proposta de projeto de PDP, em observância aos critérios, requisitos, diretrizes e orientações deste Anexo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - demonstrar a capacidade produtiva para produto, IFA, CTC/DT, equipamentos e recursos humanos, financeiros e orçamentários necessários para execução do projeto de PDP, bem como comprovar ser detentor da propriedade intelectual necessária para o projeto de PDP ou possuir legítimo direito para sua utilização, efetuando as adequações pertinentes para execução da transferência de tecnologia; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - celebrar o Termo de Compromisso juntamente com o Ministério da Saúde e a IP/ICT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - celebrar acordos, contratos ou outros instrumentos jurídicos com parceiros do projeto de PDP, seguindo os critérios e orientações deste Anexo e as premissas integrantes do Termo de Compromisso celebrado, sem prejuízo do acréscimo de outras condições necessárias ao atendimento do interesse público, em observância à legislação vigente; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - garantir, na esfera da sua responsabilidade, a internalização da produção nacional do IFA, e quando aplicável, a internalização da produção nacional do DT associado à forma farmacêutica ou do CTC, conforme grau de verticalização previsto no Projeto Executivo aprovado; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - garantir a transferência de tecnologia e o efetivo cumprimento do cronograma técnico-regulatório sob sua responsabilidade; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - compartilhar o desenvolvimento do produto objeto de PDP com a IP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - realizar treinamentos, capacitação e suporte técnico, a fim de transferir os conhecimentos necessários para o efetivo desenvolvimento e execução da transferência de tecnologia do produto objeto da PDP à IP/ICT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - receber visitas técnicas das equipes do Ministério da Saúde e parceiros públicos (IP/ICT); (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - peticionar o dossiê de registro e alterações pós-registro do produto objeto de PDP junto à ANVISA, conforme legislação vigente e cronograma estabelecido; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - cumprir o cronograma da PDP, pactuando com todos os parceiros da PDP a possibilidade de qualquer alteração necessária, sob pena de imposição das sanções administrativas previstas em contrato e na legislação vigente, sem prejuízo da responsabilização pelos danos causados em virtude do seu descumprimento; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - informar periodicamente à IP/ICT, conforme cronograma definido, as atividades executadas, em andamento e previstas, incluindo-se dados de propriedade intelectual, auxiliando a IP/ICT na elaboração dos relatórios de acompanhamento e das justificativas fundamentadas em caso de alteração do cronograma e enviando à IP/ICT documentos sobre o andamento do projeto e das atividades inerentes para sua efetivação, entre as quais se incluem a transferência de tecnologia, a garantia de fornecimento e a produção nacional das competências tecnológicas, incluindo o IFA/CTC e, quando aplicável, DT associado à forma farmacêutica; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIII - garantir o fornecimento e a entrega do produto objeto de PDP, conforme quantitativo e cronograma pactuados pela IP/ICT para atender as demandas do Ministério da Saúde; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XIV - participar ativamente com a IP/ICT e o Ministério da Saúde na elaboração e divulgação de informações quanto aos produtos objeto de PDP distribuídos na rede SUS; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XV - firmar a Declaração Conjunta de Concordância aos Termos da Proposta de Projeto de PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVI - emitir, juntamente com IP/ICT, a Declaração Conjunta de Conclusão de Transferência e Internalização da Tecnologia assinada pelos parceiros da PDP; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XVII - comunicar ao Ministério da Saúde e aos demais parceiros da PDP a descontinuação da fabricação ou comercialização do produto com antecedência mínima de trezentos e sessenta dias. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO VI
MONITORAMENTO E AVALIAÇÃO
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 59. Cada PDP deverá ser monitorada de forma contínua desde o projeto de PDP (Fase II) até a internalização da tecnologia (Fase IV), para fins de verificação dos avanços no processo de produção, desenvolvimento, transferência e absorção de tecnologia. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 60. O monitoramento e a avaliação das PDP deverão observar os critérios: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - cumprimento do cronograma da PDP; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - cumprimento das obrigações e responsabilidades definidas no Termo de Compromisso e no Projeto Executivo aprovado. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 61. O monitoramento técnico das atividades tecnológicas e produtivas e da execução do cronograma aprovado deverá ser realizado pela área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde poderá estabelecer acordos com instituições públicas com expertise na área visando subsidiar o monitoramento das PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º As instituições públicas de que trata o § 1º deverão firmar termo de confidencialidade e sigilo, bem como declaração de inexistência de conflitos de interesse. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 62. Os instrumentos e metodologias específicas para o monitoramento técnico da PDP deverão compreender as seguintes dimensões: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - monitoramento das atividades de registro, pós-registro, certificação de boas práticas de fabricação, do processo técnico de transferência e de absorção de tecnologia e do desenvolvimento das capacidades da instituição pública ou ICT para o novo patamar tecnológico, visando o cumprimento do cronograma de execução da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - análise de relatórios de acompanhamento; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - informações de caráter técnico-regulatório fornecidas e discutidas no âmbito do Comitê Técnico Regulatório; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - informações referentes ao desenvolvimento, transferência e absorção de tecnologia; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - informações referentes a reuniões e visitas técnicas realizadas pelo Ministério da Saúde nas unidades fabris públicas e privadas. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º As visitas técnicas às IP/ICT e EP nacionais deverão ocorrer, no mínimo uma vez a cada ano, durante a vigência das Fases II e III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º As visitas técnicas às EP internacionais deverão ocorrer, no mínimo, uma vez durante a Fase III, sendo facultativa a sua realização na Fase II. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 63. A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá emitir notificação aos parceiros da PDP quando os mecanismos de monitoramento e de avaliação identificarem que a parceria estiver em desacordo com os requisitos, critérios, diretrizes e orientações estabelecidos neste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 64. Os parceiros das PDP estarão sujeitos a notificação em caso de: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - não execução das ações previstas no projeto aprovado; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - não efetuação das adequações propostas ou requeridas para o desenvolvimento, efetivação da transferência e absorção de tecnologia e produção pública nacional do produto objeto da PDP, conforme previsto no projeto aprovado; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - não participação ativa no desenvolvimento, transferência e absorção de tecnologia e produção pública nacional do produto objeto da PDP, da internalização da produção nacional do IFA, CTC ou DT associado à forma farmacêutica; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - não realização de treinamentos para sua equipe, coordenados conjuntamente, a fim de absorver os conhecimentos necessários para o desenvolvimento e efetiva transferência e absorção de tecnologia do produto objeto da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - não envio ao Ministério da Saúde, especificamente à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, de relatórios de acompanhamento que demonstrem as atividades executadas, em andamento e previstas e, em caso de atraso do cronograma apresentar justificativas fundamentadas; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - não observância da legislação vigente e dos termos deste Anexo, bem como dos instrumentos jurídicos celebrados com o Ministério da Saúde para fornecimento de produtos no âmbito da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - alteração no projeto em desacordo com as diretrizes estabelecidas no Capítulo VII; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - atraso, reiterado, na entrega do produto objeto da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - rescisão de acordo ou contrato, após ter sido realizada aquisição do produto objeto da PDP pelo Ministério da Saúde; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - outras hipóteses de interesse público. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 65. O CD, a qualquer tempo, poderá recomendar à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde a emissão de notificação e a aplicação de sanções para as PDP que estejam em desacordo com este Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 66. Os parceiros da PDP, após recebimento da notificação de que trata o art. 64, terão prazo de até trinta dias para apresentar à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, manifestação formal, com vistas a sanar a motivação da notificação. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A manifestação dos parceiros da PDP deverá ser analisada pela área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde, em até trinta dias, contados do seu recebimento. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º As PDP cujas justificativas e ajustes não forem admitidos pela área técnica responsável pelo monitoramento da PDP serão encaminhadas para a Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde com recomendação de suspensão. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 67. A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá fazer a comunicação oficial da suspensão aos parceiros da PDP e concederá prazo de trinta dias corridos, contados a partir da data de recebimento, para manifestação formal. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá comunicar às Secretarias do Ministério da Saúde responsáveis pela execução dos instrumentos de aquisição dos produtos objetos das PDP e à Secretaria Executiva sobre a suspensão da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A manifestação dos parceiros da PDP deverá ser analisada pela área técnica da Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde responsável pelo monitoramento da PDP por meio de nota técnica, que será encaminhada juntamente com toda a documentação à CTA. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 68. A suspensão de PDP interrompe a contagem de tempo aprovada para a respectiva fase. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. A suspensão de que trata o caput não interrompe as atividades de monitoramento e avaliação estabelecidas no Capítulo VI deste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 69. A CTA deverá avaliar e recomendar a reestruturação ou a extinção da parceria suspensa e encaminhará parecer técnico e a respectiva motivação para deliberação do CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 70. Poderão ser reestruturadas as parcerias em que se verificar a possibilidade de reversão dos fatos que motivaram a suspensão, de forma a atender os requisitos, critérios, diretrizes e orientações estabelecidos neste Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 71. Deverão ser extintas as parcerias em que se comprovem: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - dano à Administração Pública ou sua utilização em desacordo com os objetivos previstos neste Anexo; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - impossibilidade de reversão dos fatos e problemas identificados durante o monitoramento; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - falta de interesse de continuidade por parte da IP/ICT, mediante justificativa fundamentada; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - obsolescência tecnológica ou descontinuidade do uso pelo SUS; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - outras hipóteses de interesse público. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde deverá comunicar às Secretarias do Ministério da Saúde, responsáveis pela execução dos instrumentos específicos de aquisição dos produtos objetos das parcerias, à Secretaria Executiva e à Anvisa, sobre a extinção da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º O extrato do termo de deliberação de extinção da PDP será publicado no DOU pelo Ministério da Saúde. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO VII
ALTERAÇÕES
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 72. A IP/ICT, em comum acordo com os demais parceiros da PDP, poderá apresentar para a Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde proposta de alteração de PDP em Fase II e III. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 73. A proposta de alteração deverá ser encaminhada à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde com justificativa fundamentada, para posterior avaliação pela CTA e pelo CD quanto à alteração: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - de entidades privadas envolvidas na parceria, em comum acordo, observando o estabelecido no Capítulo III; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - de IP/ICT, desde que haja mais de uma IP/ICT parceira na PDP, conforme estabelecido no Termo de Compromisso; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - da tecnologia do produto objeto da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IV - da tecnologia de produção do IFA ou CTC/DT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
V - do grau de verticalização do IFA ou CTC/DT; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VI - da capacidade de oferta; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VII - do preço; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
VIII - da apresentação, concentração do fármaco e/ou forma farmacêutica; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
IX - de cronograma; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
X - de objeto, nos casos em que os parceiros da PDP introduzirem no mercado produto relacionado ao objeto da PDP com inovação incremental, observados os critérios de elegibilidade da PDP; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XI - do percentual da demanda da PDP, nos casos em que houver percentual não alocado; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
XII - da especificação do produto. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º A alteração do percentual da demanda deverá contemplar análise de impacto sobre outras PDP estabelecidas, quando cabível, bem como demonstrar vantajosidade econômica da proposta. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º As alterações que envolvam aspectos regulatórios e sanitários deverão ser analisadas no âmbito do Comitê Técnico Regulatório, para subsidiar a avaliação da CTA e do CD. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Alterações de cronograma que impactem no prazo das Fases II ou III da PDP deverão ser analisadas pela CTA e deliberação do CD, observados os prazos estabelecidos no art. 8º, § 1º deste Anexo.Oxe (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 74. As hipóteses de alteração das PDP serão restritas ao disposto no Capítulo VII. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º Nas PDP de Dispositivos Médicos, o prazo da Fase III poderá ser estendido em função de alterações por inovação incremental com foco no ganho terapêutico ou diagnóstico, limitado a dez anos. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º Os prazos estabelecidos no art. 8º, § 1º deste Anexo poderão ser estendidos conforme análise da CTA e deliberação do CD para mitigar situações de vulnerabilidade de saúde pública, não podendo exceder, em tempo, 25% do período inicialmente aprovado. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 75. O resultado da solicitação de alteração deverá ser encaminhado oficialmente pela Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde aos parceiros da PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
CAPÍTULO VIII
SANÇÕES E SUAS APLICABILIDADES
(Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 76. Os parceiros da PDP ficarão sujeitos a medidas administrativas e judiciais, além de sanções previstas em lei e nos contratos firmados, assegurados o contraditório e a ampla defesa, de acordo com as responsabilidades definidas no Projeto Executivo e Termo de Compromisso. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º No caso de descumprimento deste Anexo e dos instrumentos jurídicos firmados, sem prejuízo de eventuais sanções que poderão ser aplicadas, a parte infratora deverá prestar esclarecimentos às demais partes. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A(s) IP/ICT e a(s) EP serão responsáveis em relação a eventuais sanções aplicáveis, devendo as partes responderem pelo não cumprimento das obrigações assumidas, conforme o Projeto Executivo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º Ficam ressalvadas do disposto no caput as situações de caso fortuito, força maior ou outras hipóteses congêneres fundamentadas de acordo com a legislação vigente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 77. Pela inexecução total ou parcial do Termo Compromisso, o Ministério da Saúde deverá, assegurados o contraditório e a ampla defesa, aplicar as seguintes sanções a quaisquer dos parceiros da PDP: (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
I - advertência; (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
II - multa; e (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
III - suspensão temporária de participação em novas PDP. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 1º As sanções previstas nos incisos I e III do caput poderão ser aplicadas, isolada ou cumulativamente, com a sanção prevista no inciso II. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 2º A sanção prevista no inciso II do caput deste artigo, calculada na forma do contrato de aquisição, não poderá ser inferior a 0,5% nem superior a 30% do valor do contrato celebrado, nos termos do § 3º do art. 156, da Lei nº 14.133, de 1º de abril de 2021. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 3º A multa de que trata o inciso II será aplicada nos termos do § 2º do art. 41 e proporcional ao não cumprimento das obrigações assumidas, conforme o Projeto Executivo e Termo de Compromisso, considerando, dentre outros parâmetros, a tecnologia, o custo de desenvolvimento e produção, o grau de concorrência, o ganho social da inovação e o mercado relevante. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 4º A multa que trata o inciso II poderá ser convertida em medidas compensatórias, estabelecida em instrumento específico a ser ajustado entre as partes, respeitando os Princípios da Finalidade Administrativa, Consensualidade, Proporcionalidade e Motivação. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 5º A conversão de multa que trata o § 4º é medida discricionária e será efetivada segundo os critérios de conveniência e oportunidade da Administração, não constituindo direito subjetivo do infrator. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 6º As sanções previstas nos incisos II e III do caput poderão ser precedidas por advertência, quando couber. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 7º A suspensão de que trata o inciso III ficará vigente até que seja regularizada a motivação da suspensão. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
§ 8º A suspensão de que trata o inciso III não terá efeitos sobre a participação da parte penalizada em licitações. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 78. Caberá à Secretaria de Ciência, Tecnologia e Inovação e do Complexo Econômico-Industrial da Saúde a aplicação de sanção. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Parágrafo único. Considerando as competências do Comitê Deliberativo, o comitê poderá recomendar sanções para as parcerias que estiverem em desacordo com este Anexo. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 79. A adoção das medidas previstas no Capítulo VIII não exclui a aplicação de outras sanções e penalidades previstas na legislação vigente. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Art. 80. Das sanções caberá recurso, nos termos da Lei nº 9.784, de 29 de janeiro de 1999. (Redação dada pela PRT GM/MS n° 4.472 de 21.06.2024)
Anexo CXI
PROGRAMA NACIONAL DE PROMOÇÃO, PROTEÇÃO E APOIO À AMAMENTAÇÃO
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO I
DAS DISPOSIÇÕES GERAIS
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 1º Fica instituído o Programa Nacional de Promoção, Proteção e Apoio à Amamentação, com a finalidade de fortalecer, organizar e qualificar a implementação das ações de promoção, proteção e apoio à amamentação de forma articulada no âmbito das Redes de Atenção à Saúde; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 2º Para os fins do Programa Nacional de Promoção, Proteção e Apoio à Amamentação considera-se: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - amamentação: quando a criança recebe leite materno diretamente da mama ou extraído, ou leite humano de Banco de Leite Humano, independentemente de receber ou não outros alimentos; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - amamentação exclusiva: quando a criança recebe somente leite materno, direto da mama ou extraído, ou leite humano de Bancos de Leite Humano, sem outros líquidos ou sólidos, com exceção de gotas ou xaropes contendo vitaminas, sais de reidratação oral, minerais ou medicamentos. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 3º São objetivos do Programa Nacional de Promoção, Proteção e Apoio à Amamentação: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - incentivar o início da amamentação na primeira hora de vida; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - aumentar a prevalência da amamentação exclusiva nos primeiros 6 (seis) meses de vida e da amamentação por 2 (dois) anos de vida ou mais; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - fomentar a transversalidade das ações de promoção, proteção e apoio à amamentação, como foco: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
a) na Política Nacional de Segurança Alimentar e Nutricional - PNSAN, de que trata o Decreto nº 7.272, de 25 de agosto de 2010; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
b) na Política Nacional de Alimentação e Nutrição - PNAN, na Política Nacional de Atenção Integral à saúde da Criança - PNAISC, na Política Nacional de Promoção da Saúde - PNPS e Política Nacional de Atenção Básica - PNAB, disciplinadas na Portaria de Consolidação MS nº 2, de 28 de setembro de 2017; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - garantir o direito à amamentação das mulheres trabalhadoras, estudantes, com atenção especial às lactantes em situação de vulnerabilidade; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - disseminar e monitorar a aplicação da Norma Brasileira de Comercialização de alimentos para lactentes e crianças na primeira infância, bicos, chupetas e mamadeiras - NBCAL; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - fomentar ações de promoção, proteção e apoio à amamentação no âmbito da Atenção Primária à Saúde, maternidades e demais pontos da Rede de Atenção à Saúde - RAS; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VII - fortalecer a Rede de Bancos de Leite Humano como estratégia de segurança alimentar e nutricional, por meio da ampliação do número de Bancos de Leite Humano e aumento da captação de doadoras de leite materno; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - desenvolver ações de educação permanente em saúde voltadas a profissionais de saúde e gestores para implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IX - fomentar o desenvolvimento de soluções inovadoras para promoção, proteção e apoio à amamentação; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
X - promover, proteger e apoiar a amamentação em estado de emergência, calamidade pública e desastres naturais.(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO II
DOS PRINCÍPIOS E DIRETRIZES
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 4º São princípios do Programa de Promoção, Proteção e apoio à Amamentação: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - amamentação como direito humano; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - acesso universal à saúde; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - equidade em saúde; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - integralidade do cuidado; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - transversalidade da promoção, proteção e apoio à amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - segurança alimentar e nutricional com foco em crianças em situação de risco e vulnerabilidade social e individual; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VII - humanização da atenção; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - gestão participativa e controle social. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 5º São diretrizes do Programa Nacional de Promoção, Proteção e Apoio à Amamentação: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - promoção, proteção e apoio à amamentação de forma articulada e integrada à linha de cuidado voltada à saúde materna e infantil, considerando a centralidade da Atenção Primária à Saúde como coordenadora do cuidado; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - desenvolvimento de ações intersetoriais, visando à promoção, proteção e apoio à amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - gestão interfederativa das ações de saúde voltadas à amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - reconhecimento dos determinantes sociais em saúde e da interseccionalidade entre raça, cor, etnia, classe, orientação sexual, identidade de gênero, deficiências, assim como aspectos culturais e as vulnerabilidades sociais nas ações de promoção, proteção e apoio à amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - qualificação da força de trabalho do SUS; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - apoio à pesquisa e à incorporação das evidências científicas. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO III
DA OPERACIONALIZAÇÃO DO PROGRAMA
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 6º O Programa Nacional de Promoção, Proteção e Apoio à Amamentação será executado pela União, estados, Distrito Federal e municípios. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 7º São componentes do Programa: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - a Iniciativa Hospital Amigo da Criança - IHAC, que tem por objetivo promover boas práticas de atenção ao parto e nascimento e da amamentação por meio da sensibilização de gestores dos estabelecimentos que realizam partos; qualificação dos profissionais destes serviços de saúde; e avaliação e monitoramento do cumprimento dos critérios de habilitação da IHAC; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - a Estratégia Nacional para Promoção do Aleitamento Materno e Alimentação Complementar Saudável no SUS - Estratégia Amamenta e Alimenta Brasil - EAAB, cujo objetivo é estimular as ações de promoção, proteção e apoio à amamentação na Atenção Primária à Saúde, por meio da qualificação do processo de trabalho das equipes da APS; da articulação com as maternidades de referência para garantir vinculação das gestantes, orientação e apoio contínuos à amamentação; e registro das atividades de promoção da amamentação e das práticas de alimentação infantil no sistema de informação da Atenção Primária vigente; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - a Ação Mulher Trabalhadora que Amamenta - MTA que objetiva proteger e apoiar a amamentação no ambiente de trabalho, por meio do estímulo à adoção das seguintes medidas: ampliação da licença maternidade, implantação de creches e de salas de apoio à amamentação nos locais de trabalho; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - a Rede Brasileira de Bancos de Leite Humano (rBLH) que tem por objetivo organizar o processo de coleta, processamento, controle de qualidade e distribuição de leite humano para unidades neonatais e oferecer assistência direta à amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - a Norma Brasileira de Comercialização de Alimentos para Lactentes e Crianças de Primeira Infância, Bicos Chupetas e Mamadeiras (NBCAL) cujo objetivo é proteger a amamentação e promover a alimentação adequada e saudável, por meio da regulamentação da promoção comercial e rotulagem de alimentos e produtos destinados a crianças de até 3 anos; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - a Atenção humanizada ao recém-nascido de baixo peso - Método Canguru que objetiva qualificar o cuidado ao recém-nascido e à sua família, com foco em bebês prematuros e de baixo peso, por meio do aprimoramento dos processos de trabalho das equipes e integração dos serviços da atenção hospitalar e da atenção primária à saúde; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VII - as ações de comunicação e mobilização social para promover a amamentação e a doação de leite humano; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - outras ações pactuadas pelos entes federados. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO IV
DAS COMPETÊNCIAS DA GESTÃO INTERFEDERATIVA
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 8º Compete ao Ministério da Saúde: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - coordenar, em âmbito nacional, a implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação, em cooperação com os gestores de saúde dos estados, municípios e Distrito Federal; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - implementar e monitorar o Programa Nacional de Promoção Proteção e Apoio à Amamentação em nível nacional, observados os princípios e diretrizes do Sistema Único de Saúde - SUS; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - elaborar as normas e documentos orientadores para a implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação e os planos, programas, ações e projetos dela decorrentes; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - elaborar e disponibilizar material e conteúdo didático e informativo, com o objetivo de promover um entendimento amplo e acurado sobre a amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - realizar o alinhamento das ações e serviços de saúde nos instrumentos de planejamento e gestão públicos, considerando as prioridades e especificidades regionais, estaduais e municipais; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - desenvolver e fomentar ações de mobilização social, informação, educação e comunicação visando à divulgação das ações do Programa Nacional de Promoção, Proteção e Apoio à Amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VII - promover e fomentar articulação intrasetorial, intersetorial e interinstitucional, de forma transversal com os diversos atores envolvidos na temática da amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - apoiar técnica e institucionalmente os estados, municípios e Distrito Federal no processo de implantação do Programa Nacional de Promoção, Proteção e Apoio Amamentação, considerando as necessidades específicas de saúde dos respectivos territórios; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IX - desenvolver e apoiar ações de qualificação de profissionais e educação permanente para a promoção, proteção e apoio à amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
X - monitorar e avaliar os indicadores de amamentação por meio dos sistemas de informação vigentes; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
XI - apoiar e fomentar a realização de pesquisas para subsidiar as ações estratégicas no âmbito do Programa Nacional de Promoção, Proteção e Apoio à Amamentação. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Parágrafo único. O Comitê Nacional de Amamentação - CNAM, de que dispõe os arts. 156-A a 156-I desta Portaria de Consolidação, de caráter permanente e consultivo, prestará assessoramento à Coordenação-Geral de Atenção à Saúde das Crianças, Adolescentes e Jovens do Departamento de Gestão do Cuidado Integral da Secretaria de Atenção Primária à Saúde na implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 9º Compete aos Estados e ao Distrito Federal: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - coordenar e implantar o Programa Nacional de Promoção, Proteção e Apoio à Amamentação no âmbito do seu território, observando as diretrizes do Ministério da Saúde e promovendo as adequações necessárias às suas especificidades locais; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - acompanhar e monitorar as ações estratégicas do Programa Nacional de Promoção, Proteção e Apoio à Amamentação em nível estadual, observados os princípios e diretrizes do SUS; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - articular, em parceria com os gestores municipais de saúde, o alinhamento das ações e serviços de saúde para promoção do aleitamento materno no Plano Estadual de Saúde; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - promover articulação intrasetorial, intersetorial e interinstitucional com vistas à implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação em nível local; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - apoiar técnica e institucionalmente os municípios e regiões de saúde no processo de gestão, planejamento, execução, monitoramento e avaliação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação, considerando as necessidades específicas de saúde dos respectivos territórios; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VI - desenvolver e fomentar ações de mobilização social, informação, educação e comunicação no âmbito estadual, visando à divulgação das ações do Programa Nacional de Promoção, Proteção e Apoio à Amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
VIII - desenvolver e apoiar ações de educação permanente dos profissionais de saúde para a promoção, proteção e apoio à amamentação; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IX - monitorar e avaliar os indicadores e metas relativas à amamentação, por meio dos sistemas de informação vigentes. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Parágrafo único. Os Estados e o Distrito Federal poderão instituir colegiados locais, instâncias consultivas, para assessorar o gestor local na operacionalização do Programa Nacional de Promoção, Proteção e Apoio à Amamentação. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 10. Compete aos Municípios: (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
I - implantar as ações estratégicas do Programa Nacional de Promoção, Proteção e Apoio à Amamentação no âmbito do seu território, observando as diretrizes do Ministério da Saúde e as estaduais, conforme o caso, promovendo as adequações necessárias às suas especificidades locais; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
II - promover articulação intrasetorial, intersetorial e interinstitucional em busca de parcerias que favoreçam a implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação, no âmbito municipal; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
III - prestar cooperação técnica às equipes de saúde, visando à implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação; (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
IV - desenvolver e apoiar ações de educação permanente dos profissionais de saúde para a promoção, proteção e apoio à amamentação; e (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
V - monitorar e avaliar os indicadores e metas relativas à amamentação, por meio dos sistemas de informação vigentes. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Parágrafo único. Os Municípios poderão instituir colegiados locais, instâncias consultivas, para assessorar o gestor local na operacionalização do Programa Nacional de Promoção, Proteção e Apoio à Amamentação. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO V
DO MONITORAMENTO E AVALIAÇÃO
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 11. O processo de monitoramento do Programa Nacional de Promoção, Proteção e Apoio à Amamentação será realizado pela Coordenação-Geral de Atenção à Saúde das Crianças, dos Adolescentes e Jovens, por meio da análise periódica da implementação das ações estratégicas relacionadas ao Programa, com base nos dados e informações dos sistemas de informação em saúde vigentes. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Parágrafo único. Sem prejuízo do monitoramento e da avaliação realizados pela Coordenação-Geral de Atenção à Saúde das Crianças, dos Adolescentes, os Municípios, os Estados e o Distrito Federal realizarão, no âmbito de suas competências, o controle da implementação das ações estratégicas relacionadas ao Programa. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
CAPÍTULO VI
DISPOSIÇÕES FINAIS
(Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 12. Os componentes do Programa Nacional de Promoção, Proteção e Apoio à Amamentação implementados no âmbito da Rede de Atenção à Saúde serão financiados de acordo com as normativas vigentes. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)
Art. 13. O Ministério da Saúde, por meio da Secretaria de Atenção Primária à Saúde, publicará em sua Biblioteca Virtual de Saúde o manual com as orientações para a implementação do Programa Nacional de Promoção, Proteção e Apoio à Amamentação. (Redação dada pela PRT GM/MS n° 5.427 de 02.10.2024)